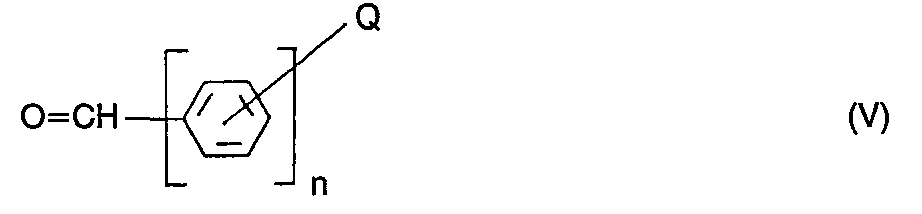EP0000346B1 - Chinoxalinverbindungen, Verfahren zu deren Herstellung, deren Verwendung zum Weisstönen organischer Materialien und damit weissgetönte Materialien - Google Patents
Chinoxalinverbindungen, Verfahren zu deren Herstellung, deren Verwendung zum Weisstönen organischer Materialien und damit weissgetönte Materialien Download PDFInfo
- Publication number
- EP0000346B1 EP0000346B1 EP78100253A EP78100253A EP0000346B1 EP 0000346 B1 EP0000346 B1 EP 0000346B1 EP 78100253 A EP78100253 A EP 78100253A EP 78100253 A EP78100253 A EP 78100253A EP 0000346 B1 EP0000346 B1 EP 0000346B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- alkyl
- denotes
- chlorine
- formula
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired
Links
- 239000000463 material Substances 0.000 title claims description 11
- 238000000034 method Methods 0.000 title claims description 8
- 239000011368 organic material Substances 0.000 title description 8
- 238000004519 manufacturing process Methods 0.000 title description 3
- 125000001567 quinoxalinyl group Chemical class N1=C(C=NC2=CC=CC=C12)* 0.000 title 1
- -1 morpholino, piperidino, piperazino, pyrrolidino Chemical group 0.000 claims description 80
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 36
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 36
- 239000000460 chlorine Substances 0.000 claims description 28
- 229910052801 chlorine Inorganic materials 0.000 claims description 28
- 229910052739 hydrogen Inorganic materials 0.000 claims description 25
- 239000001257 hydrogen Substances 0.000 claims description 25
- 150000002431 hydrogen Chemical class 0.000 claims description 22
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 19
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 14
- 125000001424 substituent group Chemical group 0.000 claims description 14
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 13
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 13
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims description 12
- 125000005605 benzo group Chemical group 0.000 claims description 12
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 7
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 7
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 6
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 6
- 229910052794 bromium Inorganic materials 0.000 claims description 6
- 239000003795 chemical substances by application Substances 0.000 claims description 6
- 125000005504 styryl group Chemical group 0.000 claims description 6
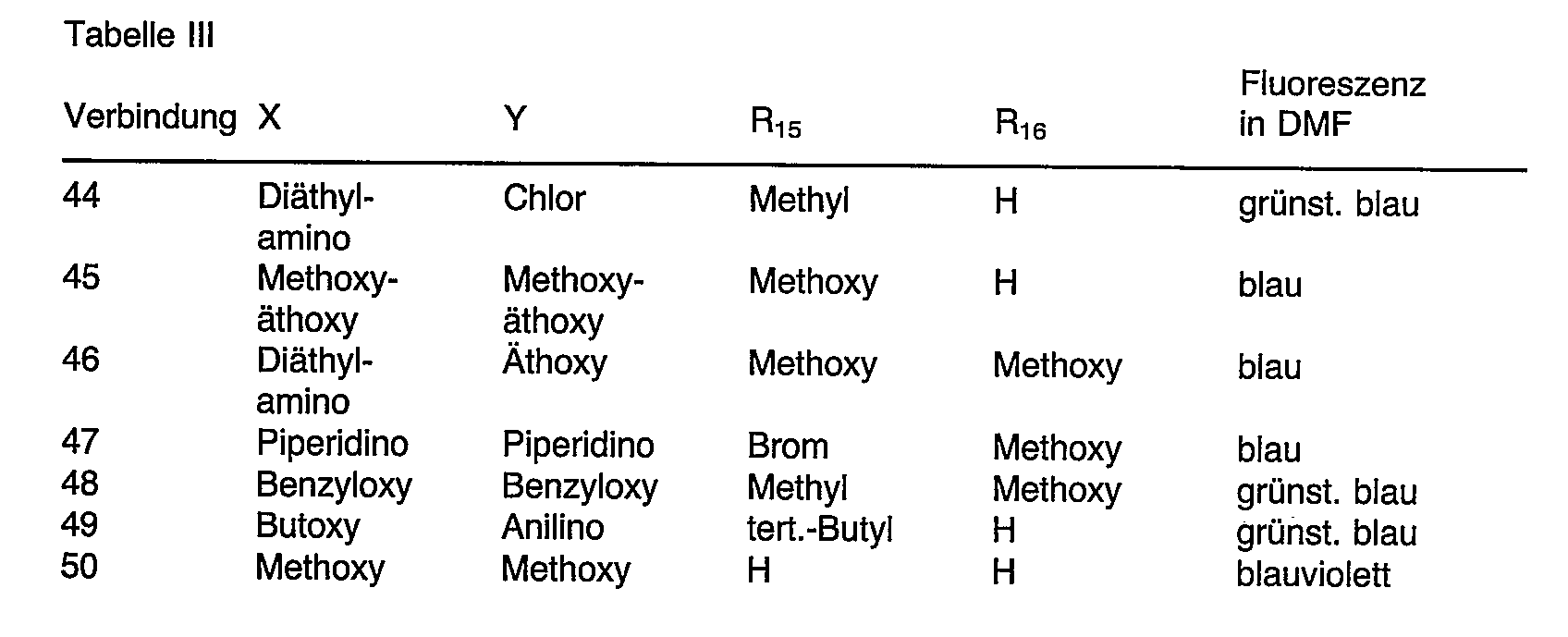
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 5
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 5
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 5
- 229910052736 halogen Inorganic materials 0.000 claims description 5
- 150000002367 halogens Chemical class 0.000 claims description 5
- 125000004442 acylamino group Chemical group 0.000 claims description 4
- 125000003342 alkenyl group Chemical group 0.000 claims description 4
- 125000003545 alkoxy group Chemical group 0.000 claims description 4
- 125000000217 alkyl group Chemical group 0.000 claims description 4
- 125000004104 aryloxy group Chemical group 0.000 claims description 4
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 claims description 4
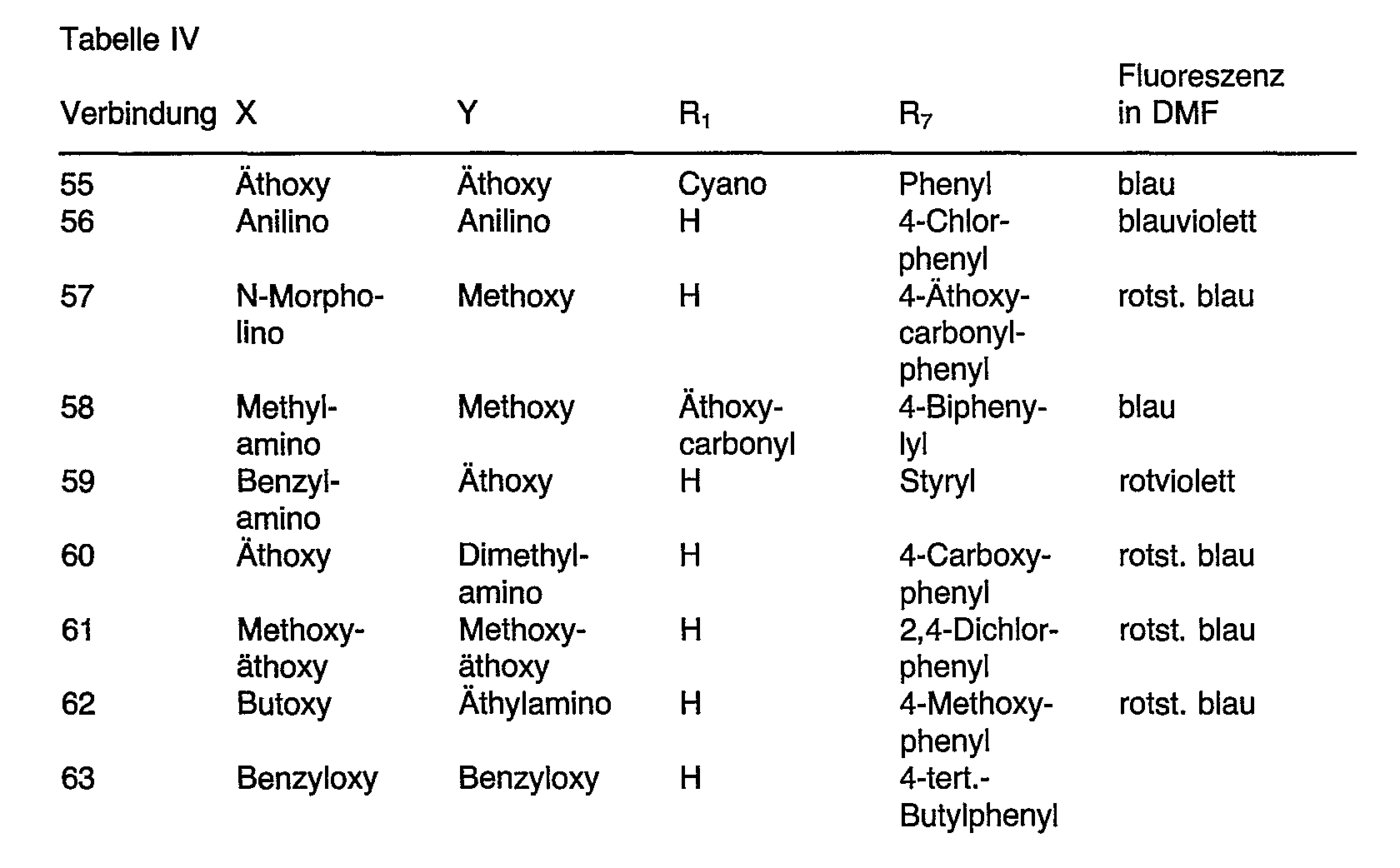
- 125000000000 cycloalkoxy group Chemical group 0.000 claims description 4
- 239000003960 organic solvent Substances 0.000 claims description 4
- 238000002360 preparation method Methods 0.000 claims description 4
- 230000002087 whitening effect Effects 0.000 claims description 4
- 125000001359 1,2,3-triazol-4-yl group Chemical group [H]N1N=NC([*])=C1[H] 0.000 claims description 3
- 125000004505 1,2,4-oxadiazol-5-yl group Chemical group O1N=CN=C1* 0.000 claims description 3
- 125000001305 1,2,4-triazol-3-yl group Chemical group [H]N1N=C([*])N=C1[H] 0.000 claims description 3
- 125000001414 1,2,4-triazol-5-yl group Chemical group [H]N1N=C([H])N=C1[*] 0.000 claims description 3
- 125000004509 1,3,4-oxadiazol-2-yl group Chemical group O1C(=NN=C1)* 0.000 claims description 3
- 125000004521 1,3,4-thiadiazol-2-yl group Chemical group S1C(=NN=C1)* 0.000 claims description 3
- 125000004317 1,3,5-triazin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=N1 0.000 claims description 3
- 125000004174 2-benzimidazolyl group Chemical group [H]N1C(*)=NC2=C([H])C([H])=C([H])C([H])=C12 0.000 claims description 3
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 claims description 3
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 claims description 3
- 125000003282 alkyl amino group Chemical group 0.000 claims description 3
- 125000004414 alkyl thio group Chemical group 0.000 claims description 3
- 125000001769 aryl amino group Chemical group 0.000 claims description 3
- 125000004663 dialkyl amino group Chemical group 0.000 claims description 3
- 125000003037 imidazol-2-yl group Chemical group [H]N1C([*])=NC([H])=C1[H] 0.000 claims description 3
- 125000004284 isoxazol-3-yl group Chemical group [H]C1=C([H])C(*)=NO1 0.000 claims description 3
- 125000004499 isoxazol-5-yl group Chemical group O1N=CC=C1* 0.000 claims description 3
- 125000001624 naphthyl group Chemical group 0.000 claims description 3
- 125000004287 oxazol-2-yl group Chemical group [H]C1=C([H])N=C(*)O1 0.000 claims description 3
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims description 3
- 125000004353 pyrazol-1-yl group Chemical group [H]C1=NN(*)C([H])=C1[H] 0.000 claims description 3
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 claims description 3
- 125000000437 thiazol-2-yl group Chemical group [H]C1=C([H])N=C(*)S1 0.000 claims description 3
- 229910052760 oxygen Inorganic materials 0.000 claims description 2
- 125000004260 quinazolin-2-yl group Chemical group [H]C1=NC(*)=NC2=C1C([H])=C([H])C([H])=C2[H] 0.000 claims description 2
- 125000004546 quinazolin-4-yl group Chemical group N1=CN=C(C2=CC=CC=C12)* 0.000 claims description 2
- 229910052717 sulfur Inorganic materials 0.000 claims description 2
- 238000006482 condensation reaction Methods 0.000 claims 2
- 125000002485 formyl group Chemical class [H]C(*)=O 0.000 claims 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims 1
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 94
- 150000001875 compounds Chemical class 0.000 description 36
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 30
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 20
- 239000000047 product Substances 0.000 description 19
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 18
- 239000000243 solution Substances 0.000 description 18
- 239000000203 mixture Substances 0.000 description 16
- 239000013078 crystal Substances 0.000 description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 9
- 150000001299 aldehydes Chemical class 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 239000008096 xylene Substances 0.000 description 9
- 0 *c1c(*)nc(cc(C=O)cc2)c2n1 Chemical compound *c1c(*)nc(cc(C=O)cc2)c2n1 0.000 description 8
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 8
- 229920002678 cellulose Polymers 0.000 description 8
- 239000003599 detergent Substances 0.000 description 8
- 239000000835 fiber Substances 0.000 description 8
- 229920000642 polymer Polymers 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 239000001913 cellulose Substances 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 6
- 238000004132 cross linking Methods 0.000 description 6
- VKYKSIONXSXAKP-UHFFFAOYSA-N hexamethylenetetramine Chemical compound C1N(C2)CN3CN1CN2C3 VKYKSIONXSXAKP-UHFFFAOYSA-N 0.000 description 6
- 239000004753 textile Substances 0.000 description 6
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 6
- 239000004952 Polyamide Substances 0.000 description 5
- 239000000654 additive Substances 0.000 description 5
- 238000001035 drying Methods 0.000 description 5
- 238000004043 dyeing Methods 0.000 description 5
- 239000004744 fabric Substances 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 229920002647 polyamide Polymers 0.000 description 5
- 239000002244 precipitate Substances 0.000 description 5
- 239000011541 reaction mixture Substances 0.000 description 5
- 238000001953 recrystallisation Methods 0.000 description 5
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- HGINCPLSRVDWNT-UHFFFAOYSA-N Acrolein Chemical compound C=CC=O HGINCPLSRVDWNT-UHFFFAOYSA-N 0.000 description 4
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- 239000003513 alkali Substances 0.000 description 4
- 238000001816 cooling Methods 0.000 description 4
- 239000012043 crude product Substances 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 238000010438 heat treatment Methods 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 230000007935 neutral effect Effects 0.000 description 4
- 238000006068 polycondensation reaction Methods 0.000 description 4
- 229920000728 polyester Polymers 0.000 description 4
- 238000006116 polymerization reaction Methods 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 4
- BDZBKCUKTQZUTL-UHFFFAOYSA-N triethyl phosphite Chemical compound CCOP(OCC)OCC BDZBKCUKTQZUTL-UHFFFAOYSA-N 0.000 description 4
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 4
- 125000004769 (C1-C4) alkylsulfonyl group Chemical group 0.000 description 3
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 description 3
- RJBHLGAIPOSNBE-UHFFFAOYSA-N 4-(1,3-benzoxazol-2-yl)benzaldehyde Chemical compound C1=CC(C=O)=CC=C1C1=NC2=CC=CC=C2O1 RJBHLGAIPOSNBE-UHFFFAOYSA-N 0.000 description 3
- LWUBGAGJHJXVDJ-UHFFFAOYSA-N 6-(bromomethyl)-2,3-dimethoxyquinoxaline Chemical compound C1=C(CBr)C=C2N=C(OC)C(OC)=NC2=C1 LWUBGAGJHJXVDJ-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- KAKZBPTYRLMSJV-UHFFFAOYSA-N Butadiene Chemical compound C=CC=C KAKZBPTYRLMSJV-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical compound CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 230000000996 additive effect Effects 0.000 description 3
- 238000004061 bleaching Methods 0.000 description 3
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 239000007859 condensation product Substances 0.000 description 3
- 239000000975 dye Substances 0.000 description 3
- 150000002191 fatty alcohols Chemical class 0.000 description 3
- 239000002421 finishing Substances 0.000 description 3
- 230000026030 halogenation Effects 0.000 description 3
- 238000005658 halogenation reaction Methods 0.000 description 3
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 3
- 239000005457 ice water Substances 0.000 description 3
- 239000004922 lacquer Substances 0.000 description 3
- 239000004745 nonwoven fabric Substances 0.000 description 3
- 239000000049 pigment Substances 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 229920002554 vinyl polymer Polymers 0.000 description 3
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- KTMIUHDXNNFVFP-UHFFFAOYSA-N 2,3-diethoxyquinoxaline-6-carbaldehyde Chemical compound C1=C(C=O)C=C2N=C(OCC)C(OCC)=NC2=C1 KTMIUHDXNNFVFP-UHFFFAOYSA-N 0.000 description 2
- BIIWJFYGLPHSKR-UHFFFAOYSA-N 2,3-dimethoxyquinoxaline-6-carbaldehyde Chemical compound C1=C(C=O)C=C2N=C(OC)C(OC)=NC2=C1 BIIWJFYGLPHSKR-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- GOUHYARYYWKXHS-UHFFFAOYSA-N 4-formylbenzoic acid Chemical compound OC(=O)C1=CC=C(C=O)C=C1 GOUHYARYYWKXHS-UHFFFAOYSA-N 0.000 description 2
- WNKQDGLSQUASME-UHFFFAOYSA-N 4-sulfophthalic acid Chemical compound OC(=O)C1=CC=C(S(O)(=O)=O)C=C1C(O)=O WNKQDGLSQUASME-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 2
- 244000025254 Cannabis sativa Species 0.000 description 2
- 235000011777 Corchorus aestuans Nutrition 0.000 description 2
- 235000010862 Corchorus capsularis Nutrition 0.000 description 2
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 2
- IMROMDMJAWUWLK-UHFFFAOYSA-N Ethenol Chemical compound OC=C IMROMDMJAWUWLK-UHFFFAOYSA-N 0.000 description 2
- 239000000899 Gutta-Percha Substances 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 240000002636 Manilkara bidentata Species 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- 239000000020 Nitrocellulose Substances 0.000 description 2
- 240000000342 Palaquium gutta Species 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical compound ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 2
- 125000002252 acyl group Chemical group 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 235000016302 balata Nutrition 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- YACLQRRMGMJLJV-UHFFFAOYSA-N chloroprene Chemical compound ClC(=C)C=C YACLQRRMGMJLJV-UHFFFAOYSA-N 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 239000003431 cross linking reagent Substances 0.000 description 2
- 239000007857 degradation product Substances 0.000 description 2
- 150000001993 dienes Chemical class 0.000 description 2
- 239000002270 dispersing agent Substances 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 229920001971 elastomer Polymers 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 238000005530 etching Methods 0.000 description 2
- 239000002657 fibrous material Substances 0.000 description 2
- 239000010408 film Substances 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 239000011888 foil Substances 0.000 description 2
- 229920000588 gutta-percha Polymers 0.000 description 2
- 235000010299 hexamethylene tetramine Nutrition 0.000 description 2
- 239000004312 hexamethylene tetramine Substances 0.000 description 2
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical compound CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 2
- 239000010985 leather Substances 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- UAEPNZWRGJTJPN-UHFFFAOYSA-N methylcyclohexane Chemical compound CC1CCCCC1 UAEPNZWRGJTJPN-UHFFFAOYSA-N 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 238000000465 moulding Methods 0.000 description 2
- 229920001220 nitrocellulos Polymers 0.000 description 2
- 239000000123 paper Substances 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 229920000515 polycarbonate Polymers 0.000 description 2
- 229920000139 polyethylene terephthalate Polymers 0.000 description 2
- 239000005020 polyethylene terephthalate Substances 0.000 description 2
- 229920000151 polyglycol Polymers 0.000 description 2
- 239000010695 polyglycol Substances 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000005060 rubber Substances 0.000 description 2
- 239000000344 soap Substances 0.000 description 2
- 238000009987 spinning Methods 0.000 description 2
- KZNICNPSHKQLFF-UHFFFAOYSA-N succinimide Chemical compound O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- CYTQBVOFDCPGCX-UHFFFAOYSA-N trimethyl phosphite Chemical compound COP(OC)OC CYTQBVOFDCPGCX-UHFFFAOYSA-N 0.000 description 2
- NLVXSWCKKBEXTG-UHFFFAOYSA-N vinylsulfonic acid Chemical compound OS(=O)(=O)C=C NLVXSWCKKBEXTG-UHFFFAOYSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- ZYECOAILUNWEAL-NUDFZHEQSA-N (4z)-4-[[2-methoxy-5-(phenylcarbamoyl)phenyl]hydrazinylidene]-n-(3-nitrophenyl)-3-oxonaphthalene-2-carboxamide Chemical compound COC1=CC=C(C(=O)NC=2C=CC=CC=2)C=C1N\N=C(C1=CC=CC=C1C=1)/C(=O)C=1C(=O)NC1=CC=CC([N+]([O-])=O)=C1 ZYECOAILUNWEAL-NUDFZHEQSA-N 0.000 description 1
- 125000006729 (C2-C5) alkenyl group Chemical group 0.000 description 1
- LGXVIGDEPROXKC-UHFFFAOYSA-N 1,1-dichloroethene Chemical compound ClC(Cl)=C LGXVIGDEPROXKC-UHFFFAOYSA-N 0.000 description 1
- MYRTYDVEIRVNKP-UHFFFAOYSA-N 1,2-Divinylbenzene Chemical compound C=CC1=CC=CC=C1C=C MYRTYDVEIRVNKP-UHFFFAOYSA-N 0.000 description 1
- APQXWKHOGQFGTB-UHFFFAOYSA-N 1-ethenyl-9h-carbazole Chemical compound C12=CC=CC=C2NC2=C1C=CC=C2C=C APQXWKHOGQFGTB-UHFFFAOYSA-N 0.000 description 1
- UWSAFTDEEVGSAC-UHFFFAOYSA-N 2,3-dichloro-6-methylquinoxaline Chemical compound N1=C(Cl)C(Cl)=NC2=CC(C)=CC=C21 UWSAFTDEEVGSAC-UHFFFAOYSA-N 0.000 description 1
- VLACLKWCHQHLHP-UHFFFAOYSA-N 2,3-dimethoxy-6-methylquinoxaline Chemical compound C1=C(C)C=C2N=C(OC)C(OC)=NC2=C1 VLACLKWCHQHLHP-UHFFFAOYSA-N 0.000 description 1
- OXHWXGDYGAVRHI-UHFFFAOYSA-N 2,3-dioxo-1,4-dihydroquinoxaline-6-carbaldehyde Chemical compound N1C(=O)C(=O)NC2=CC(C=O)=CC=C21 OXHWXGDYGAVRHI-UHFFFAOYSA-N 0.000 description 1
- YJDFGVFSSDEVQT-UHFFFAOYSA-N 2-(2-methylphenyl)-1,3-benzoxazole Chemical compound CC1=CC=CC=C1C1=NC2=CC=CC=C2O1 YJDFGVFSSDEVQT-UHFFFAOYSA-N 0.000 description 1
- OEPOKWHJYJXUGD-UHFFFAOYSA-N 2-(3-phenylmethoxyphenyl)-1,3-thiazole-4-carbaldehyde Chemical compound O=CC1=CSC(C=2C=C(OCC=3C=CC=CC=3)C=CC=2)=N1 OEPOKWHJYJXUGD-UHFFFAOYSA-N 0.000 description 1
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 1
- RZUQTQOUFSRKAZ-UHFFFAOYSA-N 2-[4-[bis(ethylperoxy)phosphorylmethyl]phenyl]-4-phenyltriazole Chemical compound C1=CC(CP(=O)(OOCC)OOCC)=CC=C1N1N=C(C=2C=CC=CC=2)C=N1 RZUQTQOUFSRKAZ-UHFFFAOYSA-N 0.000 description 1
- PUBYGSCAJFKBEA-UHFFFAOYSA-N 2-[4-[bis(ethylperoxy)phosphorylmethyl]phenyl]-5,6-dimethoxybenzotriazole Chemical compound C1=CC(CP(=O)(OOCC)OOCC)=CC=C1N1N=C2C=C(OC)C(OC)=CC2=N1 PUBYGSCAJFKBEA-UHFFFAOYSA-N 0.000 description 1
- FLKWSCVWUHSNDF-UHFFFAOYSA-N 2-[4-[bis(methylperoxy)phosphorylmethyl]phenyl]-1,3-benzoxazole Chemical compound C1=CC(CP(=O)(OOC)OOC)=CC=C1C1=NC2=CC=CC=C2O1 FLKWSCVWUHSNDF-UHFFFAOYSA-N 0.000 description 1
- OCYRCDXKFQMEDX-UHFFFAOYSA-N 4-(4-methyl-5-phenyltriazol-2-yl)benzaldehyde Chemical compound CC1=NN(C=2C=CC(C=O)=CC=2)N=C1C1=CC=CC=C1 OCYRCDXKFQMEDX-UHFFFAOYSA-N 0.000 description 1
- DYLHFWYJRDXQQJ-UHFFFAOYSA-N 4-(5-chloro-1,3-benzoxazol-2-yl)benzaldehyde Chemical compound N=1C2=CC(Cl)=CC=C2OC=1C1=CC=C(C=O)C=C1 DYLHFWYJRDXQQJ-UHFFFAOYSA-N 0.000 description 1
- VFEMGCYLSAPIBC-UHFFFAOYSA-N 4-[5-(2-phenylphenyl)-1,3,4-oxadiazol-2-yl]benzaldehyde Chemical compound C1=CC(C=O)=CC=C1C1=NN=C(C=2C(=CC=CC=2)C=2C=CC=CC=2)O1 VFEMGCYLSAPIBC-UHFFFAOYSA-N 0.000 description 1
- QAYQOARPTBPKMR-UHFFFAOYSA-N 4-formyl-2-methoxybenzoic acid Chemical compound COC1=CC(C=O)=CC=C1C(O)=O QAYQOARPTBPKMR-UHFFFAOYSA-N 0.000 description 1
- ISDBWOPVZKNQDW-UHFFFAOYSA-N 4-phenylbenzaldehyde Chemical group C1=CC(C=O)=CC=C1C1=CC=CC=C1 ISDBWOPVZKNQDW-UHFFFAOYSA-N 0.000 description 1
- KBDRASPHSDZOJP-UHFFFAOYSA-N 6-(bromomethyl)-2,3-dichloroquinoxaline Chemical compound C1=C(CBr)C=C2N=C(Cl)C(Cl)=NC2=C1 KBDRASPHSDZOJP-UHFFFAOYSA-N 0.000 description 1
- LZCXUNAKXQKLMG-UHFFFAOYSA-N 6-(bromomethyl)-2,3-diethoxyquinoxaline Chemical compound C1=C(CBr)C=C2N=C(OCC)C(OCC)=NC2=C1 LZCXUNAKXQKLMG-UHFFFAOYSA-N 0.000 description 1
- PGJZUYGLNWGGGA-UHFFFAOYSA-N 6-[bis(ethylperoxy)phosphorylmethyl]-2,3-dibutoxyquinoxaline Chemical compound C1=C(CP(=O)(OOCC)OOCC)C=C2N=C(OCCCC)C(OCCCC)=NC2=C1 PGJZUYGLNWGGGA-UHFFFAOYSA-N 0.000 description 1
- CXTIDBDXFAQVQM-UHFFFAOYSA-N 6-[bis(methylperoxy)phosphorylmethyl]-2,3-dimethoxyquinoxaline Chemical compound N1=C(OC)C(OC)=NC2=CC(CP(=O)(OOC)OOC)=CC=C21 CXTIDBDXFAQVQM-UHFFFAOYSA-N 0.000 description 1
- UFFRSDWQMJYQNE-UHFFFAOYSA-N 6-azaniumylhexylazanium;hexanedioate Chemical compound [NH3+]CCCCCC[NH3+].[O-]C(=O)CCCCC([O-])=O UFFRSDWQMJYQNE-UHFFFAOYSA-N 0.000 description 1
- OSRARURJYPOUOV-UHFFFAOYSA-N 6-methylquinoxaline Chemical class N1=CC=NC2=CC(C)=CC=C21 OSRARURJYPOUOV-UHFFFAOYSA-N 0.000 description 1
- RSWGJHLUYNHPMX-UHFFFAOYSA-N Abietic-Saeure Natural products C12CCC(C(C)C)=CC2=CCC2C1(C)CCCC2(C)C(O)=O RSWGJHLUYNHPMX-UHFFFAOYSA-N 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- 235000012766 Cannabis sativa ssp. sativa var. sativa Nutrition 0.000 description 1
- 235000012765 Cannabis sativa ssp. sativa var. spontanea Nutrition 0.000 description 1
- ZZQUMSVZBTVNGH-UHFFFAOYSA-N Cc(cc1)ccc1-[n]1nc2c3ccccc3ccc2n1 Chemical compound Cc(cc1)ccc1-[n]1nc2c3ccccc3ccc2n1 ZZQUMSVZBTVNGH-UHFFFAOYSA-N 0.000 description 1
- 240000000491 Corchorus aestuans Species 0.000 description 1
- 240000004792 Corchorus capsularis Species 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- VQTUBCCKSQIDNK-UHFFFAOYSA-N Isobutene Chemical compound CC(C)=C VQTUBCCKSQIDNK-UHFFFAOYSA-N 0.000 description 1
- 229920000877 Melamine resin Polymers 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 229920002292 Nylon 6 Polymers 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N Propene Chemical compound CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Chemical compound CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 229920001131 Pulp (paper) Polymers 0.000 description 1
- 229920000297 Rayon Polymers 0.000 description 1
- KHPCPRHQVVSZAH-HUOMCSJISA-N Rosin Natural products O(C/C=C/c1ccccc1)[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 KHPCPRHQVVSZAH-HUOMCSJISA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- QYKIQEUNHZKYBP-UHFFFAOYSA-N Vinyl ether Chemical compound C=COC=C QYKIQEUNHZKYBP-UHFFFAOYSA-N 0.000 description 1
- RSWGJHLUYNHPMX-ONCXSQPRSA-N abietic acid Chemical compound C([C@@H]12)CC(C(C)C)=CC1=CC[C@@H]1[C@]2(C)CCC[C@@]1(C)C(O)=O RSWGJHLUYNHPMX-ONCXSQPRSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 150000003926 acrylamides Chemical class 0.000 description 1
- 150000001253 acrylic acids Chemical class 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 229910001854 alkali hydroxide Inorganic materials 0.000 description 1
- 229910001860 alkaline earth metal hydroxide Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000003302 alkenyloxy group Chemical group 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 125000005138 alkoxysulfonyl group Chemical group 0.000 description 1
- 229920000180 alkyd Polymers 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 1
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 125000005098 aryl alkoxy carbonyl group Chemical group 0.000 description 1
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 1
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 1
- 150000007514 bases Chemical class 0.000 description 1
- 239000003788 bath preparation Substances 0.000 description 1
- WARCRYXKINZHGQ-UHFFFAOYSA-N benzohydrazide Chemical compound NNC(=O)C1=CC=CC=C1 WARCRYXKINZHGQ-UHFFFAOYSA-N 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical class C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 235000019400 benzoyl peroxide Nutrition 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000007844 bleaching agent Substances 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 238000005282 brightening Methods 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- CODNYICXDISAEA-UHFFFAOYSA-N bromine monochloride Chemical compound BrCl CODNYICXDISAEA-UHFFFAOYSA-N 0.000 description 1
- 235000009120 camo Nutrition 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 235000013877 carbamide Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 239000011111 cardboard Substances 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 229920003086 cellulose ether Polymers 0.000 description 1
- 235000005607 chanvre indien Nutrition 0.000 description 1
- 239000007806 chemical reaction intermediate Substances 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 125000004239 chinazolin-2-yl group Chemical group [H]C1=NC(*)=NC2=C([H])C([H])=C([H])C([H])=C12 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- QKSIFUGZHOUETI-UHFFFAOYSA-N copper;azane Chemical compound N.N.N.N.[Cu+2] QKSIFUGZHOUETI-UHFFFAOYSA-N 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 1
- FHADSMKORVFYOS-UHFFFAOYSA-N cyclooctanol Chemical compound OC1CCCCCCC1 FHADSMKORVFYOS-UHFFFAOYSA-N 0.000 description 1
- 125000001887 cyclopentyloxy group Chemical group C1(CCCC1)O* 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 239000003822 epoxy resin Substances 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 125000002573 ethenylidene group Chemical group [*]=C=C([H])[H] 0.000 description 1
- 238000006266 etherification reaction Methods 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- HDNHWROHHSBKJG-UHFFFAOYSA-N formaldehyde;furan-2-ylmethanol Chemical compound O=C.OCC1=CC=CO1 HDNHWROHHSBKJG-UHFFFAOYSA-N 0.000 description 1
- 150000003948 formamides Chemical class 0.000 description 1
- 239000007849 furan resin Substances 0.000 description 1
- 239000003292 glue Substances 0.000 description 1
- 238000010559 graft polymerization reaction Methods 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 210000004209 hair Anatomy 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 1
- KGZJRXKGJRJKCB-UHFFFAOYSA-N hanf Chemical compound C=1C=CC=CC=1CC(C(=O)NC(CCCNC(N)=N)C(=O)NC(CC=1C=CC(O)=CC=1)C(O)=O)NC(=O)C(CO)NC(=O)C(CC(N)=O)NC(=O)C(CS)NC(=O)CNC(=O)C(CC(C)C)NC(=O)CNC(=O)C(CO)NC(=O)C(CCC(N)=O)NC(=O)C(C)NC(=O)CNC(=O)C(C(C)CC)NC(=O)C(CCCNC(N)=N)NC(=O)C(CC(O)=O)NC(=O)C(CCSC)NC(=O)C(CCCNC(N)=N)NC(=O)CNC(=O)CNC(=O)C(NC(=O)C(CS)NC(=O)C(CO)NC(=O)C(CO)NC(=O)C(CCCNC(N)=N)NC(=O)C(CCCNC(N)=N)NC(=O)C(CC(C)C)NC(=O)C(N)CO)CC1=CC=CC=C1 KGZJRXKGJRJKCB-UHFFFAOYSA-N 0.000 description 1
- 239000012760 heat stabilizer Substances 0.000 description 1
- 239000011487 hemp Substances 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 238000005470 impregnation Methods 0.000 description 1
- 238000001746 injection moulding Methods 0.000 description 1
- 239000004413 injection moulding compound Substances 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 238000010409 ironing Methods 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- 239000008274 jelly Substances 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 125000005395 methacrylic acid group Chemical class 0.000 description 1
- GYNNXHKOJHMOHS-UHFFFAOYSA-N methyl-cycloheptane Natural products CC1CCCCCC1 GYNNXHKOJHMOHS-UHFFFAOYSA-N 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- KKFHAJHLJHVUDM-UHFFFAOYSA-N n-vinylcarbazole Chemical compound C1=CC=C2N(C=C)C3=CC=CC=C3C2=C1 KKFHAJHLJHVUDM-UHFFFAOYSA-N 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-N naphthalene-1-sulfonic acid Chemical class C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-N 0.000 description 1
- 239000000025 natural resin Substances 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000003973 paint Substances 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 229920001568 phenolic resin Polymers 0.000 description 1
- 239000005011 phenolic resin Substances 0.000 description 1
- 125000003170 phenylsulfonyl group Chemical class C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 1
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 1
- 150000004714 phosphonium salts Chemical group 0.000 description 1
- 125000001476 phosphono group Chemical group [H]OP(*)(=O)O[H] 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920006324 polyoxymethylene Polymers 0.000 description 1
- 229920006295 polythiol Polymers 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000004627 regenerated cellulose Substances 0.000 description 1
- 238000007142 ring opening reaction Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 229920002050 silicone resin Polymers 0.000 description 1
- ODZPKZBBUMBTMG-UHFFFAOYSA-N sodium amide Chemical compound [NH2-].[Na+] ODZPKZBBUMBTMG-UHFFFAOYSA-N 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 150000003440 styrenes Chemical class 0.000 description 1
- 125000005017 substituted alkenyl group Chemical group 0.000 description 1
- 125000005415 substituted alkoxy group Chemical group 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 229960002317 succinimide Drugs 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical class NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical class [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 239000012209 synthetic fiber Substances 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 239000000606 toothpaste Substances 0.000 description 1
- KHPCPRHQVVSZAH-UHFFFAOYSA-N trans-cinnamyl beta-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OCC=CC1=CC=CC=C1 KHPCPRHQVVSZAH-UHFFFAOYSA-N 0.000 description 1
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical class C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 229920001567 vinyl ester resin Polymers 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000002023 wood Substances 0.000 description 1
- 210000002268 wool Anatomy 0.000 description 1
- 150000007934 α,β-unsaturated carboxylic acids Chemical class 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/645—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having two nitrogen atoms as the only ring hetero atoms
- C07F9/6509—Six-membered rings
- C07F9/650952—Six-membered rings having the nitrogen atoms in the positions 1 and 4
- C07F9/650994—Six-membered rings having the nitrogen atoms in the positions 1 and 4 condensed with carbocyclic rings or carbocyclic ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D241/00—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings
- C07D241/36—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings condensed with carbocyclic rings or ring systems
- C07D241/38—Heterocyclic compounds containing 1,4-diazine or hydrogenated 1,4-diazine rings condensed with carbocyclic rings or ring systems with only hydrogen or carbon atoms directly attached to the ring nitrogen atoms
- C07D241/40—Benzopyrazines
- C07D241/44—Benzopyrazines with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the hetero ring
Definitions
- non-chromophoric substituents are halogen, optionally substituted alkyl, optionally substituted alkenyl, aryl, aralkyl, optionally substituted alkoxy, alkoxycarbonyl, optionally substituted aminocarbonyl, cyano, alkylsulfonyl, alkoxysulfonyl, optionally substituted aminosulfonyl, acyl, acylamino, hydroxy, aryloxy, aralkyloxy, Alkenyloxy, aryloxycarbonyl, aralkyloxycarbonyl, carboxy or acyloxy.
- Alkyl is in particular C 1 -C 4 -alkyl, which can be monosubstituted by hydroxy, C 1 -C 4 -alkoxy, cyano, carboxy, C 1 -C 4 -alkoxycarbonyl, aminocarbonyl, chlorine or bromine or trifluoromethyl.
- Alkenyl is in particular C 2 -C 5 alkenyl, which can be monosubstituted by hydroxy, C 1 -C 4 alkoxy, cyano, carboxy, C 1 -C 4 alkoxycarbonyl, chlorine or bromine.
- Halogen is especially fluorine, chlorine and bromine, preferably chlorine.
- Aryl is in particular phenyl optionally substituted by C 1 -C 4 alkyl, trifluoromethyl, chlorine, bromine carboxy, cyano, C 1 -C 4 alkoxycarbonyl or C 1 -C 4 alkoxy.
- Aralkyl is in particular phenyl-C 1 -C 4 -alkyl, which can be substituted by chlorine, methyl or methoxy in the phenyl core.
- Cycloalkyloxy is especially cyclopentyloxy and cyclohexyloxy.
- Acyl is especially C 1 -C 4 alkylcarbonyl, Ci-C 4 alkylsulfonyl, optionally substituted by methyl, methoxy or chlorine-substituted benzoyl or optionally substituted by methyl, methoxy or chlorine-substituted benzenesulfonyl.
- aminocarbonyl and aminosulfonyl radicals are, in particular, C 1 -C 4 alkyl, phenyl or phenyl C 1 -C 4 alkyl optionally substituted by methyl, methoxy or chlorine.
- solvents for example hydrocarbons such as toluene or xylene or alcohols such as methanol, ethanol, isopropanol, butanol, glycol, glycol ethers such as 2-methoxyethanol; Hexanol, cyclohexanol, cyclooctanol, furthermore ethers such as diisopropyl ether, dioxane, tetrahydrofuran, furthermore formamides or N-methylpyrrolidone.
- Dipolar organic solvents such as dimethylformamide and dimethyl sulfoxide are particularly suitable.
- Strongly basic compounds are suitable as condensing agents, such as alkali or alkaline earth metal hydroxides, alkali or alkaline earth amides and alkali or alkaline earth metal alcoholates, for example potassium hydroxide, sodium hydroxide, potassium tert-butoxide, sodium amide or sodium methylate, furthermore the alkali compounds of dimethyl sulfoxide and alkali metal hydroxide and optionally alkali metal hydroxide . It is preferably carried out in the temperature range from 0 to 100 ° C.
- the organic materials in question can be in a wide variety of processing states (raw materials, semi-finished or finished products) and physical states. They can be in the form of a wide variety of shaped structures, i.e. H. so z. B. predominantly three-dimensionally expanded bodies such as blocks, plates, profiles, pipes, injection moldings or various workpieces, chips or granules, foams; predominantly two-dimensional bodies such as films, foils, lacquers, tapes, coatings, impregnations and coatings or predominantly one-dimensional bodies such as threads, fibers, flakes, bristles, wires.
- processing states raw materials, semi-finished or finished products
- physical states can be in the form of a wide variety of shaped structures, i.e. H. so z.
- B. predominantly three-dimensionally expanded bodies such as blocks, plates, profiles, pipes, injection moldings or various workpieces, chips or granules, foams; predominantly two-dimensional bodies such as films, foils, lacquers, tapes, coating
- Said materials can also exist in unshaped states in the most varied of homogeneous and inhomogeneous forms of distribution and physical states, e.g. B. as powders, solutions, emulsions, dispersions, latices (examples: lacquer solutions, polymer dispersions, brine, jelly, putty, pastes, waxes, adhesives and fillers, etc.).
- Fiber materials can be in the form of endless threads, staple fibers, flakes, extrudates, textile threads, yarns, twists, non-woven fabrics, felts, wadding, flocking structures, or as textile fabrics or textile composites, knitted fabrics, and as paper, cardboard or paper pulp, etc.
- the compounds to be used according to the invention are also important for the treatment of textile organic materials, in particular textile fabrics. If fibers, which can be in the form of staple fibers or endless fibers, in the form of strands, fabrics, knitted fabrics, nonwovens, flocked substrates or composites, are to be tinted white according to the invention, this is advantageously done in an aqueous medium in which the compounds in question are in finely divided form (Suspension, optionally solution). If necessary, dispersants can be added during the treatment, such as. B.
- soaps polyglycol ether of fatty alcohols, fatty amines or alkylphenols, cellulose sulfite waste liquor or condensation products of optionally alkylated naphthalenesulfonic acids with formaldehyde. It proves particularly useful to work in neutral, weakly alkaline or acid bath. It is also advantageous if the treatment is carried out at elevated temperatures of approximately 50 to 100 ° C., for example at the boiling point of the bath or in the vicinity thereof (approximately 90 ° C.). Solutions in organic solvents are also suitable for the refinement according to the invention, as is practiced in dyeing practice in the so-called solvent dyeing (pad heat-fixing application, pull-out dyeing process in drum dyeing machines), for example for polyamide and polyester substrates.
- solvent dyeing pad heat-fixing application, pull-out dyeing process in drum dyeing machines
- the new white toners to be used according to the invention can furthermore be added to or incorporated into the materials before or during their shaping.
- they can be added to the molding compound or injection molding compound in the production of films, foils, tapes or moldings dissolve, disperse or otherwise ensure a homogeneous fine distribution in the spinning mass or before spinning.
- the whiteners can also be added to the starting substances, reaction mixtures or intermediates for the production of fully or semi-synthetic organic materials, i.e. also before or during the chemical reaction, for example in the case of polycondensation (also including precondensates), in the case of polymerization (also including prepolymers) or one Polyaddition.
- the new whiteners can of course also be used wherever organic materials of the type indicated above are combined with inorganic materials in any form (typical examples: detergents, white pigments in organic substances).
- the new white-tinting substances are characterized by particularly good heat resistance, light fastness and migration resistance.
- the amount of new white toners to be used according to the invention can vary within wide limits. Even with very small quantities, in certain cases e.g. B. those of 0.001 wt .-%, a clear and durable effect can be achieved. However, amounts of up to about 0.5% by weight and more can also be used. For most practical purposes, amounts between 0.01 and 0.2% by weight are preferably of interest.
- the compounds of the formula given at the outset can be used as scintillators, for various purposes of a photographic nature, such as for electrophotographic reproduction or for supersensitization.
- the combined treatment is advantageously carried out with the help of appropriate, stable preparations.
- Such preparations are characterized in that they contain white-tinting compounds of the general formula given at the outset, as well as dispersants, detergents, carriers, dyes, pigments or finishing agents.
- the heat treatment in the dry state is then advantageously carried out at temperatures between 120 and 225 ° C., for example by heating in a drying chamber, by ironing in the specified temperature interval or also by treatment with dry, superheated steam.
- the drying and dry heat treatment can also be carried out immediately one after the other or combined in a single operation.
- the dimethoxyphosphonomethyl compound of the formula used is manufactured in the following way:
- a solution of 1 mol of sodium methylate in 1 liter of methanol is added dropwise to a suspension of 106.5 g (0.5 mol) of 2,3-dichloro-6-methylquinoxaline in 1 liter of methanol at 20 to 30 ° C. in the course of one hour.
- the mixture is stirred at 40 ° C. for 5 hours and the solvent is distilled off in vacuo.
- the residue is mixed with 1 liter of water and filtered off after cooling. 95.6 g (94% of theory) of colorless crystals with a melting point of 81 ° C. and recrystallized from methanol of 81 to 82 ° C. are obtained.
- 2- (4-Formylphenyl) benzoxazole was prepared in a known manner by bromination of 2-tolylbenzoxazole and subsequent reaction with hexamethylenetetramine in acetic acid.
- the compound is purified by recrystallization from dimethylformamide.
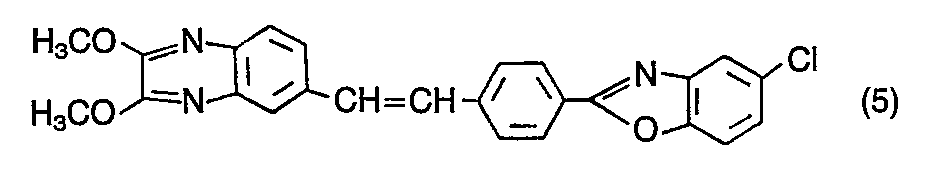
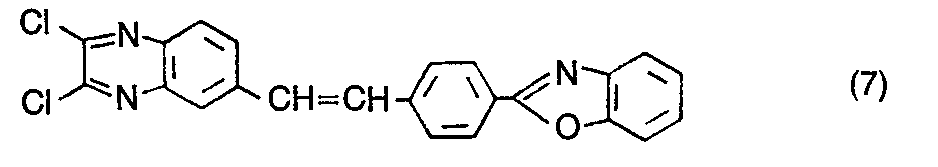
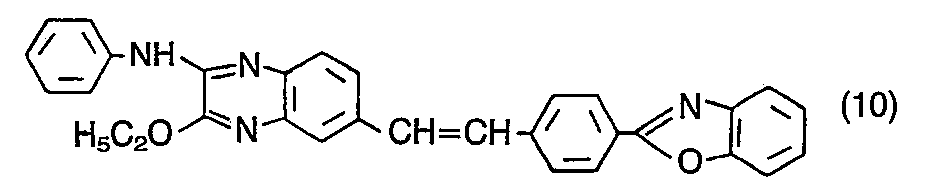
- the compound of the formula is obtained in an analogous manner from the compound of the formula (7) by reaction with a) aniline and b) sodium ethylate in the form of yellow crystals, which are recrystallized from chlorobenzene and show a strong blue fluorescence in dimethylformamide.
- the aldehyde of the formula also becomes analogous with the melting point 186 ° C in 65% yield.
- Example 7 Analogously to Example 7, the compound of the formula is obtained from the aldehyde (28) and the corresponding phosphonate as yellow crystals, which are recrystallized from xylene and fluoresce greenish blue in dimethylformamide.
- Example 7 Analogously to Example 7, the compound of the formula is obtained from 2,3-dimethoxy-6-formylquinoxaline and 5,6-dimethoxy-2- (4-diethoxyphosphonomethylphenyl) -2H-benzotriazole as pale yellow crystals that show blue fluorescence in dimethylformamide.
- Example 1 the compound of the formula is obtained from 5-biphenylyl-2- (4-formylphenyl) -1,3,4-oxdiazole and 2,3-dibutoxy-6-diethoxyphosphonomethylquinoxaline in 80% yield in the form of light yellow crystals, which are recrystallized from xylene and fluoresce reddish blue in dimethylformamide.
- the compound of the formula is obtained from 2,3-diethoxy-6-formyl-quinoxaline and 2-methoxy-4-formylbenzoic acid as pale yellow crystals, which show a reddish blue fluorescence in dimethylformamide.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Description
-
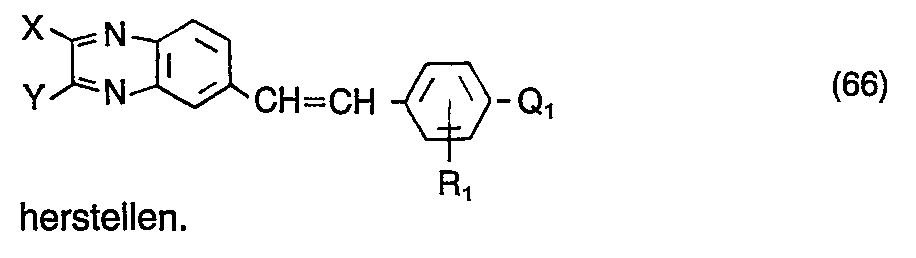
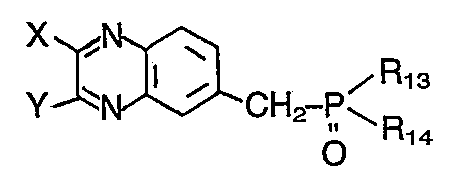
- X und Y Wasserstoff, Halogen, Alkyl, Aralkyl, Alkenyl, Hydroxy, Amino, Alkoxy, Aralkoxy, Cycloalkoxy, Aryloxy, Alkylmercapto, Alkylamino, Dialkylamino, Morpholino, Piperidino, Piperazino, Pyrrolidino, Acylamino oder Arylamino,
- Q Wasserstoff, Pyrazol-1-yl, Oxazol-2-yl, Benzoxazol-2-yl, Naphthoxazol-2-yl, 1,2,4-Oxadiazol-5-yl, 1,3,4-Oxadiazol-2-yl, Isoxazol-3-yl, Isoxazol-5-yl, Thiazol-2-yl, Benzthiazol-2-yl, 1,3,4-Thiadiazol-2-yl, Imidazol-2-yl, Benzimidazol-2-yl, 1,2,3-Triazol-2-yl, 1,2,3-Triazol-4-yl, 1,2,4-Triazol-3-yl, 1,2,4-Triazol-5-yl, 1,3,5-Triazin-2-yl, 2H-Benzotriazol-2-yl, 2H-Naph- thotriazol-2-yl, 1,2,3,4-Tetrazol-5-yl, 1,2,3,4-Tetrazol-1-yl, Benzo[b]-furan-2-yl, Naphtho[2,1-b]-furan-2-yl, Benzo[b]-thiophen-2-yl, Naphtho[2,1-b]-thiophen-2-yl, Pyrimidin-2-yl, Pyridin-2-yl, Chinazolin-4-yl oder Chinazolin-2-yl und
- n 1 oder 2 bedeuten, wobei die Substituenten X, Y, Q und die übrigen cyclischen Reste durch für Weißtöner übliche nicht-chromophore Substituenten weiter substituiert sein können. Vorzugsweise ist n 1.
- Nicht-chromophore Substituenten sind beispielsweise Halogen, gegebenenfalls substituiertes Alkyl, gegebenenfalls substituiertes Alkenyl, Aryl, Aralkyl, gegebenenfalls substituiertes Alkoxy, Alkoxycarbonyl, gegebenenfalls substituiertes Aminocarbonyl, Cyan, Alkylsulfonyl, Alkoxysulfonyl, gegebenenfalls substituiertes Aminosulfonyl, Acyl, Acylamino, Hydroxy, Aryloxy, Aralkyloxy, Alkenyloxy, Aryloxycarbonyl, Aralkyloxycarbonyl, Carboxy oder Acyloxy.
- Alkyl ist insbesondere C1-C4-Alkyl, das durch Hydroxy, C1-C4-Alkoxy, Cyan, Carboxy, C1-C4-Alkoxycarbonyl, Aminocarbonyl, Chlor oder Brom monosubstituiert sein kann oder Trifluormethyl.
- Alkenyl ist insbesondere C2-C5-Alkenyl, das durch Hydroxy, C1-C4-Alkoxy, Cyan, Carboxy, C1-C4-Alkoxycarbonyl, Chlor oder Brom monosubstituiert sein kann.
- Halogen ist insbesondere Fluor, Chlor und Brom, vorzugsweise Chlor. Aryl ist insbesondere gegebenenfalls durch C1-C4-Alkyl, Trifluormethyl, Chlor, Brom Carboxy, Cyan, C1-C4-Alkoxycarbonyl oder C1-C4-Alkoxy substituiertes Phenyl.
- Aralkyl ist insbesondere Phenyl-C1-C4-Alkyl, das im Phenylkem noch durch Chlor, Methyl oder Methoxy substituiert sein kann.
-
- R Wasserstoff oder C,-C4-Alkyl und
- m eine ganze Zahl von 1 bis 20 bedeutet.
- Cycloalkyloxy ist insbesondere Cyclopentyloxy und Cyclohexyloxy.
- Acyl ist insbesondere C1-C4-Alkylcarbonyl, Ci-C4-Alkylsulfonyl, gegebenenfalls durch Methyl, Methoxy oder Chlor substituiertes Benzoyl oder gegebenenfalls durch Methyl, Methoxy oder Chlor substituiertes Benzolsulfonyl.
- Als Substituenten der Aminocarbonyl- und Aminosulfonylreste kommen insbesondere C1-C4-Alkyl, gegebenenfalls durch Methyl, Methoxy oder Chlor substituiertes Phenyl oder Phenyl-C1-C4-alkyl in Frage.
-
- X1 und Y1 Wasserstoff, Chlor, C1-C4-Alkylamino, Di-C1-C4-Alkylamino, Morpholino, Piperidino, gegebenenfalls durch Methyl, Methoxy oder Chlor substituiertes Phenylamino oder einen Rest der Formel
- R1 Wasserstoff, Chlor, C1-C4-Alkyl, C1-C4-Alkoxy, C1-C4-Alkoxycarbonyl oder Cyano,
- R2 Wasserstoff, C1-C4-Alkyl, Benzyl oder Phenyl, q eine ganze Zahl von 0 bis 7 und
- Q1 Chlor, Brom, Cyano, Carboxy, C1-C4-Alkoxycarbonyl oder einen Rest der Formel
- R3 Wasserstoff, Chlor, C1-C4-Alkyl, Phenyl-C1-C3- alkyl, Cyclohexyl, Phenyl, C1-C4-Alkoxy, C1-C4-Alkylsulfonyl, C1-C4-Alkoxycarbonyl, Cyan oder Carboxy oder zusammen mit R4 einen gegebenenfalls durch 1 bis 4 Methylgruppen substituierten ankondensierten 1-Cyclopenteno-, 1-Cyclohexeno- oder Benzoring,
- R4 Wasserstoff, Chlor oder Methyl oder zusammen mit R3 einen gegebenenfalls durch 1 bis 4 Methylgruppen substituierten ankondensierten 1-Cyclopenteno-, 1-Cyclohexeno- oder Benzoring,
- R5 C1-C4-Alkyl, Phenyl oder Styryl oder zusammen mit R6 einen gegebenenfalls durch C1-C4-Alkyl, Cl-C4-Alkoxy oder Chlor substituierten ankondensierten Benzoring oder ankondensiertes Naphtho,
- R6 Wasserstoff, C1-C4-Alkyl oder Phenyl oder zusammen mit R5 einen gegebenenfalls durch Ci-C4-Alkyl, C1-C4-Alkoxy oder Chlor substituierten ankondensierten Benzoring oder ankondensiertes Naphtho,
- R7 gegebenenfalls durch C1-C4-Alkyl, C1-C4-Alkoxy, C1-C4-Alkoxycarbonyl, Cyan oder Chlor substituiertes Phenyl, Styryl, Biphenylyl oder Naphthyl,
- R8 Wasserstoff, C1-C4-Alkyl, C1-C4-Alkoxy, C1-C4-Alkoxycarbonyl, Cyan oder einen gegebenenfalls durch C1-C4-Alkoxycarbonyl, Cyan oder Chlor substituierten Benzoxazol-2-yl-Rest,
- Z O, S oder NR9 und
- Rg Wasserstoff, C1-C4-Alkyl, Acetyl, Benzoyl, Benzyl oder Phenyl bedeuten.
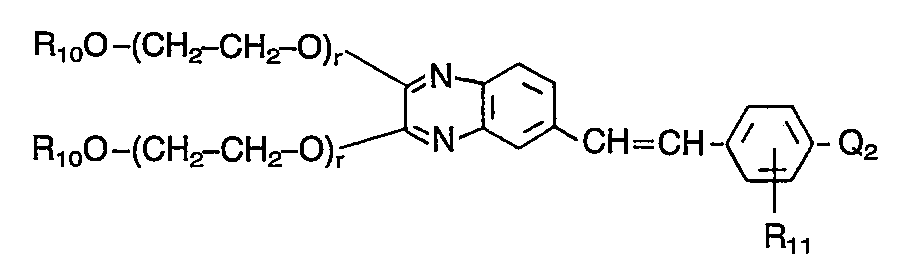
- Besonders wertvolle Verbindungen entsprechen der Formel
-
- R10 C1-C4-Alkyl,
- R11 Wasserstoff oder Cyan,
- r eine ganze Zahl von 0 bis 2,
- Q2 einen Rest der Formeln
- R12 Wasserstoff, Chlor, C1-C4-Alkyl, Phenyl-C1-C3-alkyl, Cyclohexyl, Phenyl, C1-C4-Alkoxy, C1-C4-Alkylsulfonyl, C1-C4-Alkoxycarbonyl, Cyan oder Carboxy bedeuten und
- R5, R6 und R7 die vorstehend genannte Bedeutung haben.
- Die erfindungsgemäßen Fluoreszenzfarbstoffe lassen sich auf verschiedenen Wegen herstellen. Vorzugsweise kondensiert man
- a) eine Phosphono-Verbindung der Formel
- X und Y die vorstehend genannte Bedeutung haben und der Benzolring weitere nicht-chromophore Substituenten aufweisen kann,
- R13 und R14 C1-C4-Alkoxy, C5-C6-Cycloalkoxy, Phenoxy oder Phenyl bedeuten, mit einem Aldehyd der Formel
- Q und n die vorstehend genannte Bedeutung besitzen und der Benzolring weitere nicht-chromophore Substituenten aufweisen kann, oder
- b) eine Phosphono-Verbindung der Formel
- Q, R13, R14 und n die vorstehend genannte Bedeutung besitzen und der Benzolring durch nicht-chromophore Substituenten substituiert sein kann, mit einem Aldehyd der Formel
- X und Y die vorstehend genannte Bedeutung haben und der Benzolring durch nicht-chromophore Substituenten substituiert sein kann, in organischen Lösungsmitteln in Gegenwart basischer Kondensationsmittel.
- Q, R13, R14 und n die vorstehend genannte Bedeutung besitzen und der Benzolring durch nicht-chromophore Substituenten substituiert sein kann, mit einem Aldehyd der Formel
- Als Lösungsmittel wählt man vorteilhaft indifferente Lösungsmittel, beispielsweise Kohlenwasserstoffe wie Toluol oder Xylol oder Alkohole wie Methanol, Äthanol, Isopropanol, Butanol, Glykol, Glykoläther wie 2-Methoxyäthanol; Hexanol, Cyclohexanol, Cyclooctanol, ferner Äther wie Diisopropyläther, Dioxan, Tetrahydrofuran, weiterhin Formamide oder N-Methylpyrrolidon. Besonders geeignet sind dipolare organische Lösungsmittel wie Dimethylformamid und Dimethylsulfoxid.
- Als Kondensationsmittel kommen stark basische Verbindungen in Betracht wie Alkali- oder Erdalkalimetallhydroxide, Alkali- oder Erdalkaliamide und Alkali- oder Erdalkalimetallalkoholate, beispielsweise Kaliumhydroxid, Natriumhydroxid, Kalium-tert.-butylat, Natriumamid oder Natriummethylat, ferner die Alkaliverbindungen des Dimethylsulfoxids und Alkalihydride sowie gegebenenfalls Alkalimetalldispersionen. Man arbeitet bevorzugt im Temperaturbereich von 0 bis 100° C.
- Die erfindungsgemäßen Verbindungen werden ebenfalls erhalten, wenn man
- c) anstelle der Phosphonoverbindungen (IV) und (VI) die entsprechenden quartären PhosphoniumSalze, beispielsweise die Triphenylphosphonium-Salze, einsetzt und diese nach Wittig über die Stufe der Phosphorylene mit den Aldehyden (V) und (VII) kondensiert oder
- d) die entsprechenden Aldehydanile in Dimethylformamid nach Siegrist in Gegenwart von basischen Kondensationsmitteln mit den 6-Methylchinoxalinen umsetzt.
- An den Reaktionsprodukten der vorstehenden Verfahren können noch weitere an sich bekannte Umwandlungen vorgenommen werden wie Halogenierungen, funktionelle Abwandlungen, von Carboxylgruppen, Einführung von Chlormethylgruppen oder Austausch von Halogenatomen gegen Cyanogruppen.
- Die erfindungsgemäßen Verbindungen sind aufgrund ihrer Absorption im ultravioletten Bereich und ihrer Fluoreszenz geeignet zum Weißtönen der verschiedensten synthetischen, halbsynthetischen und natürlichen organischen hochmolekularen Materialien, wie sie im folgenden einzeln angegeben sind.
- I. Synthetische organische hochmolekulare Materialien:
- a) Polymerisationsprodukte auf Basis mindestens eine polymerisierbare Kohlenstoff-Kohlenstoff-Doppelbindung enthaltender organischer Verbindungen, d. h. deren Homo- oder Copolymerisate sowie deren Nachbehandlungsprodukte wie beispielsweise Vernetzungs-, Pfropfungs- oder Abbauprodukte, Polymerisat-Verschnitte, usw., wofür beispielsweise genannt seien: Polymerisate auf Basis von a,ß-ungesättigten Carbonsäuren, insbesondere von Acrylverbindungen (wie z. B. Acrylestern, Acrylsäuren, Acrylnitril, Acrylamiden und deren Derivaten oder deren Methacryl-Analoga), von Olefin-Kohlenwasserstoffen (wie z. B. Aethylen, Propylen, Isobutylen, Styrole, Diene wie besonders Butadien, Isopren, d. h. also auch Kautschuke und kautschukähnliche Polymerisate, ferner sogenannte ABS-Polymerisate), Polymerisate auf Basis von Vinyl- und Vinyliden-Verbindungen (wie z.B. Vinylestem, Vinylchlorid, Vinylsulfonsäure, Vinyl- äther, Vinylalkohol, Vinylidenchlorid, Vinylcarbazol), von halogenierten Kohlenwasserstoffen (Chloropren, nachhalogenierte Aethylene), von ungesättigten Aldehyden und Ketonen (z. B. Acrolein usw.), von Allylverbindungen usw., Pfropfpolymerisationsprodukte (z. B. durch Aufpfropfen von Vinylmonomeren), Vemetzungsprodukte (beispielsweise mittels bi- oder mehrfunktionellen Vernetzern wie Divinylbenzol, mehrfunktionelle Allylverbindungen oder Bisacrylverbindungen) oder durch partiellen Abbau (Hydrolyse, Depolymerisation) oder Modifizierung reaktiver Gruppierungen (z. B. Veresterung, Verätherung, Halogenierung, Selbstvernetzung) erhältlich sind.
- b) Andere Polymerisationsprodukte wie z. B. durch Ringöffnung erhältlich, z. B. Polyamide vom Polycaprolactam-Typ, ferner Formaldehyd-Polymerisate oder Polymere, die sowohl über Polyaddition als auch Polykondensation erhältlich sind, wie Polyäther, Polythioäther, Polyacetale, Thioplaste.
- c) Polykondensationsprodukte oder Vorkondensate auf Basis von bi- oder polyfunktionellen Verbindungen mit kondensationsfähigen Gruppen, deren Homo- und Mischkondensationsprodukte sowie Produkte der Nachbehandlung, wofür beispielsweise genannt seien: Polyester, gesättigte (z. B. Polyäthylenterephthalat) oder ungesättigte (z. B. Maleinsäure-Dialkohol-Polykondensate sowie deren Vernetzungsprodukte mit anpolymerisierbaren Vinylmonomeren), unverzweigte sowie verzweigte (auch auf Basis höherwertiger Alkohole, wie z. B. Alkydharze); Polyamide (z. B. Hexamethylendiamin-adipat), Maleinatharze, Melaminharze, Phenolharze, Anilinharze, Furanharze, Carbamidharze bzw. auch deren Vorkondensate und analog gebaute Produkte, Polycarbonate, Silikonharze und andere.
- d) Polyadditionsprodukte wie Polyurethane (vernetzt und unvemetzt), Epoxydharze.
- II. Halbsynthetische organische Materialien wie z. B. Celluloseester bzw. Mischester (Acetat, Propionat), Nitrocellulose, Celluloseäther, regenerierte Cellulose (Viskose, Kupferammoniak-Cellulose) oder deren Nachbehandlungsprodukte, Casein-Kunststoffe.
- III. Natürliche organische Materialien animalischen oder vegetabilischen Ursprungs, beispielsweise auf Basis von Cellulose oder Proteinen, wie Wolle, Baumwolle, Seide, Bast, Jute, Hanf, Felle und Haare, Leder, Holzmassen in feiner Verteilung, Naturharze (wie Kolophonium, insbesondere Lackharze), ferner Kautschuk, Guttapercha, Balata, sowie deren Nachbehandlungs- und Modifizierungsprodukte (z. B. durch Härtung, Vemetzung oder Pfropfung), Abbauprodukte (z. B. durch Hydrolyse, Depolymerisation), durch Abwandlung reaktionsfähiger Gruppen erhältliche Produkte (z. B. durch Acylierung, Halogenierung, Vernetzung usw.).
- Die in Betracht kommenden organischen Materialien können in den verschiedenartigsten Verarbeitungszuständen (Rohstoffe, Halbfabrikate oder Fertigfabrikate) und Aggregatzuständen vorliegen. Sie können einmal in Form der verschiedenartigsten geformten Gebilde vorliegen, d. h. also z. B. vorwiegend dreidimensional ausgedehnte Körper wie Blökke, Platten, Profile, Rohre, Spritzgußformlinge oder verschiedenartigste Werkstücke, Schnitzel oder Granulate, Schaumstoffe; vorwiegend zweidimensional ausgebildete Körper wie Filme, Folien, Lacke, Bänder, Überzüge, Imprägnierungen und Beschichtungen oder vorwiegend eindimensional ausgebildete Körper wie Fäden, Fasern, Flocken, Borsten, Drähte. Die besagten Materialien können andererseits auch in ungeformten Zuständen in den verschiedenartigsten homogenen und inhomogenen Verteilungsformen und Aggregatzuständen vorliegen, z. B. als Pulver, Lösungen, Emulsionen, Dispersionen, Latices (Beispiele: Lacklösungen, Polymerisat-Dispersionen, Sole, Gelee, Kitte, Pasten, Wachse, Kleb- und Spachtelmassen usw.).
- Fasermaterialien können als endlose Fäden, Stapelfasern, Flocken, Strangware, textile Fäden, Garne, Zwirne, Faservliese, Filze, Watten, Beflockungs-Gebilde oder als textile Gewebe oder textile Verbundstoffe, Gewirke sowie als Papier, Pappen oder Papiermassen usw. vorliegen.
- Den erfindungsgemäß anzuwendenden Verbindungen kommt auch Bedeutung für die Behandlung von textilen organischen Materialien, insbesondere textilen Geweben, zu. Sofern Fasern, welche als Stapelfasern oder endlose Fasern, in Form von Strangen, Geweben, Gewirken, Vliesen, beflockten Substraten oder Verbundstoffen vorliegen können, erfindungsgemäß weiß zu tönen sind, so geschieht dies mit Vorteil in wässerigem Medium, worin die betreffenden Verbindungen in feinverteilter Form (Suspension, gegebenenfalls Lösung) vorliegen. Gegebenenfalls können bei der Behandlung Dispergiermittel zugesetzt werden, wie z. B. Seifen, Polyglykol- äther von Fettalkoholen, Fettaminen oder Alkylphenolen, Cellulosesulfitablauge oder Kondensationsprodukte von gegebenenfalls alkylierten Napthalinsulfonsäuren mit Formaldehyd. Als besonders zweckmäßig erweist es sich, in neutralem, schwach alkalischem oder saurem Bade zu arbeiten. Ebenso ist es vorteilhaft, wenn die Behandlung bei erhöhten Temperaturen von etwa 50 bis 100° C, beispielsweise bei Siedetemperatur des Bades oder in deren Nähe (etwa 90° C) erfolgt. Für die erfindungsgemäße Veredelung kommen auch Lösungen in organischen Lösungsmitteln in Betracht, wie dies in der Färbereipraxis in der sogenannten Lösungsmittelfärberei (Foulard-Thermofixierapplikation, Ausziehfärbeverfahren in Trommelfärbemaschinen) beispielsweise für Polyamid- und Polyester-Substrate praktiziert wird.
- Die erfindungsgemäß zu verwendenden neuen Weißtöner können ferner den Materialien vor oder während deren Verformung zugesetzt bzw. einverleibt werden. So kann man sie beispielsweise bei der Herstellung von Filmen, Folien, Bändern oder Formkörpern der Pressmasse oder Spritzgußmasse beifügen oder vor dem Verspinnen in der Spinnmasse lösen, dispergieren oder anderweitig für eine homogene Feinverteilung sorgen. Die Weißtöner können auch den Ausgangssubstanzen, Reaktionsgemischen oder Zwischenprodukten zur Herstellung voll-oder halbsynthetischer organischer Materialien zugesetzt werden, also auch vor oder während der chemischen Umsetzung, beispielsweise bei einer Polykondensation (also auch Vorkondensaten), bei einer Polymerisation (also auch Prepolymeren) oder einer Polyaddition.
- Die neuen Weißtöner können selbstverständlich auch überall dort eingesetzt werden, wo organische Materialien der oben angedeuteten Art mit anorganischen Materialien in irgendeiner Form kombiniert werden (typische Beispiele: Waschmittel, Weißpigmente in organischen Substanzen).
- Die neuen weißtönenden Substanzen zeichnen sich durch besonders gute Hitzebeständigkeit, Lichtechtheit und Migrierbeständigkeit aus.
- Die Menge der erfindungsgemäß zu verwendenden neuen Weißtöner, bezogen auf das weiß zu tönende Material, kann in weiten Grenzen schwanken. Schon mit sehr geringen Mengen, in gewissen Fällen z. B. solchen von 0,001 Gew.-%, kann ein deutlicher und haltbarer Effekt erzielt werden. Es können aber auch Mengen bis zu etwa 0,5 Gew.-% und mehr zur Anwendung gelangen. Für die meisten praktischen Belange sind vorzugsweise Mengen zwischen 0,01 und 0,2 Gew.-% von Interesse.
- Die neuen als Weißtöner dienenden Verbindungen können beispielsweise auch wie folgt eingesetzt werden:
- a) In Mischungen mit Farbstoffen oder Pigmenten oder als Zusatz zu Färbebädern, Druck-, Ätz- oder Reservepasten. Ferner auch zur Nachbehandlung von Färbungen, Drucken oder Ätzdrucken.
- b) In Mischungen mit sogenannten "Carriern", Antioxydantien, Lichtschutzmitteln, Hitzestabilisatoren, chemischen Bleichmitteln oder als Zusatz zu Bleichbädern.
- c) In Mischung mit Vernetzern, Appreturmitteln wie Stärke oder synthetisch zugänglichen Appreturen. Die erfindungsgemäßen Erzeugnisse können vorteilhaft auch den zur Erzielung einer knitterfesten Ausrüstung benützten Flotten zugesetzt werden.
- d) In Kombination mit Waschmitteln. Die Waschmittel und Aufhellmittel können den zu benützenden Waschbädern getrennt zugefügt werden. Es ist auch vorteilhaft, Waschmittel zu verwenden, die die Weißtöner beigemischt enthalten. Als Waschmittel eignen sich beispielsweise Seifen, Salze von Sulfonatwaschmitteln, wie z. B. von sulfonierten an 2-Kohlenstoffatom durch höhere Alkylreste substituierten Benzimidazolen, ferner Salze von Monocarbonsäureestern der 4-Sulfophthalsäure mit höheren Fettalkoholen, weiterhin Salze von Fett-Alkoholsulfonaten, Alkylarylsulfonsäuren oder Kondensationsprodukten von höheren Fettsäuren mit aliphatischen Oxy- oder Aminosulfonsäuren. Ferner können nicht-ionogene Waschmittel herangezogen werden, z. B. Polyglykol- äther, die sich von Äthylenoxid und höheren Fettalkoholen, Alkylphenolen oder Fettaminen ableiten.
- e) In Kombination mit polymeren Trägermaterialien (Polymerisations-, Polykondensations- oder Polyadditionsprodukten), in welche die Weißtöner gegebenenfalls neben anderen Substanzen in gelöster oder dispergierter Form eingelagert sind, z. B. bei Beschichtungs-, Imprägnier- oder Bindemitteln (Lösungen, Dispersionen, Emulsionen), Textilien, Vliese, Papier, Leder.
- f) Als Zusätze zu den verschiedensten industriellen Produkten, um dieselben marktfähiger zu machen oder Nachteile in der Gebrauchsfähigkeit zu vermeiden, z. B. als Zusatz zu Leimen, Klebemitteln, Zahnpasten, Anstrichstoffen usw.
- g) In Kombination mit anderen, weißtönend wirkenden Substanzen (z. B. zwecks Nuancen-Veränderung).
- h) In Spinnbadpräparationen, d. h. als Zusätze zu Spinnbädern wie sie zur Gleitfähigkeitsverbesserung für die Weiterverarbeitung von Synthese-Fasern verwendet werden.
- Die Verbindungen der eingangs angegebenen Formel lassen sich als Scintillatoren, für verschiedene Zwecke photographischer Art, wie für die elektrophotographische Reproduktion oder zur Supersensibilisierung verwenden.
- Wird das Weißtönverfahren mit anderen Behandlungs- oder Veredelungsmethoden kombiniert, so erfolgt die kombinierte Behandlung vorteilhaft mit Hilfe entsprechender beständiger Präparate. Solche Präparate sind dadurch gekennzeichnet, daß sie weißtönende Verbindungen der eingangs angegebenen allgemeinen Formel sowie Dispergiermittel, Waschmittel, Carrier, Farbstoffe, Pigmente oder Appreturmittel enthalten.
- Bei Behandlung von einer Reihe von Fasersubstraten, z. B. von Polyesterfasern, mit den erfindungsgemäßen Weißtönern verfährt man zweckmäßig dergestalt, daß man diese Fasern mit den wässerigen Dispersionen der Weißtöner bei Temperaturen unter 75° C, z. B. bei Raumtemperatur, imprägniert und einer trockenen Wärmebehandlung bei Temperaturen über 100° C unterwirft, wobei es sich im allgemeinen empfiehlt, das Fasermaterial vorher noch bei mäßig erhöhter Temperatur, z. B. bei mindestens 60° C bis etwa 100° C, zu trocknen. Die Wärmebehandlung in trockenem Zustande erfolgt dann vorteilhaft bei Temperaturen zwischen 120 und 225° C, beispielsweise durch Erwärmen in einer Trockenkammer, durch Bügeln im angegebenen Temperaturintervall oder auch durch Behandeln mit trockenem, überhitztem Wasserdampf. Die Trocknung und trokkene Wärmebehandlung können auch unmittelbar nacheinander ausgeführt oder in einen einzigen Arbeitsgang zusammengelegt werden.
- Zu einer Lösung von 22,3 g (0,1 Mol) 2-(4-Formyl- phenyl)-benzoxazol und 31,2 g (0,1 Mol) 2,3-Di- methoxy-6-dimethoxy-phosphonomethylchinoxalin in 300 ml Dimethylformamid gibt man innerhalb von 20 Minuten portionsweise 12 g (0,22 Mol) Natriummethylat. Man läßt 4 Stunden bei 50° C rühren, trägt das Reaktionsgemisch dann auf 1 I Eiswasser aus und stellt mit Essigsäure auf pH 4 bis 5. Nach dem Abkühlen wird der gelbliche Niederschlag abgesaugt, mit Wasser und Methanol gewaschen und getrocknet. Man erhält so 28,5 g (70% der Theorie) an Rohprodukt der Formel
-
- Zu einer Suspension von 106,5 g (0,5 Mol) 2,3-Dichlor-6-methylchinoxalin in 1 I Methanol tropft man bei 20 bis 30° C innerhalb einer Stunde eine Lösung von 1 Mol Natriummethylat in 1 I Methanol. Man rührt 5 Stunden bei 40° C und destilliert das Lösungsmittel im Vakuum ab. Der Rückstand wird mit 1 I Wasser versetzt und nach dem Abkühlen abfiltriert. Man erhält 95,6 g (94% der Theorie) farblose Kristalle vom Schmp. 81° C, aus Methanol umkristallisiert 81 bis 82° C.
- Zu einer Lösung von 40,8 g (0,2 Mol) 2,3-Dimeth- oxy-6-methyl-chinoxalin und 0,2 g Dibenzoylperoxid in 300 ml wasserfreiem Tetrachlorkohlenstoff gibt man bei 60° C portionsweise innerhalb von 20 Minuten eine Mischung aus 35,6 g (0,2 Mol) N-Bromsuccinimid und 0,2 g Azoisobutyronitril und rührt bei Rückflußtemperatur 4 Stunden. Danach wird das Succinimid abfiltriert, der Filterkuchen mit heißem Tetrachlorkohlenstoff nachgewaschen und das Filtrat bis fast zur Trockne eingedampft. Der Rückstand wird abfiltriert und mit Petroläther (40 bis 80° C) gewaschen. Man erhält 41,4 g (73% der Theorie) Brommethylverbindung vom Schmp. 149° C.
- 70,6 g (0,25 Mol) rohes 2,3-Dimethoxy-6-bromme- thylchinoxalin werden unter Rühren mit 185 g Trimethylphosphit unter einer Stickstoffatmosphäre langsam auf 140° C erwärmt und dann 4 Stunden bei dieser Temperatur gerührt. Anschließend wird der größte Teil des überschüssigen Trimethylphosphits im Vakuum abdestilliert und der Rückstand mit 100 ml Cyclohexan versetzt. Man kühlt auf 0° C und läßt das Produkt auskristallisieren. Man erhält 66,5 g (86% der Theorie) farblose Kristalle vom Schmp. 1140 C, die aus Methylcyclohexan umkristallisiert bei 114 bis 115° C schmelzen.
-
- Die Herstellung von 2-(4-Formylphenyl)-benzoxazol erfolgte in bekannter Weise durch Bromierung von 2-Tolylbenzoxazol und nachfolgender Umsetzung mit Hexamethylentetramin in Essigsäure.
-
- In gleicher Weise wie in Beispiel 1 erhält man aus 25,7 g (0,1 Mol) 5-Chlor-2-(4-formylphenyl)-benzoxazol und 31,2 g (0,1 Mol) 2,3-Dimethoxy-6-dimethoxy- phosphonomethylchinoxalin, 33,9 g (76% der Theorie) der Verbindung der Formel
- Zu einer Suspension von 38 g (0,2 Mol) 2,3-Dihy- droxy-6-formylchinoxalin (hergestellt aus 2,3-Dichlor-6-brommethyl-chinoxalin und 5%iger Salpetersäure) und 63,5 g (0,2 Mol) 2-(4-Dimethoxyphosphonome- thylphenyl)-benzoxazol in 500 ml Dimethylformamid gibt man innerhalb von 30 Minuten portionsweise 24 g (0,44 Mol) Natriummethylat. Man läßt 5 Stunden bei 50° C rühren, trägt das Reaktiongsgemisch auf 1,5 1 Eiswasser aus und stellt mit konzentrierter Salzsäure auf pH 2 bis 3. Der gelbliche Niederschlag wird abgesaugt, mit Wasser gewaschen und getrocknet. Man erhält 63 g (83% der Theorie) der Verbindung, die in einer der möglichen tautomeren Formen der Formel
- Die Verbindung wird durch Umkristallisieren aus Dimethylformamid gereinigt.
- Das Rohprodukt der Formel (6) wird mit der fünffachen Menge an Thionylchlorid und katalytischen Mengen Dimethylformamid 4 Stunden unter Rückfluß gekocht, wonach das überschüssige Thionylchlorid im Vakuum abdestilliert wird. Der Rückstand wird mit Eiswasser gewaschen und abfiltriert. Man erhält 62,3 g (75% der Theorie) der Verbindung der Formel
- Zu einer Lösung von 46,9 g (0,1 Mol) der Verbindung der Formel (8) in 200 ml Dimethylformamid gibt man tropfenweise 18 g 30%ige Natriummethylat-Lösung und rührt bei 30 bis 40° C 3 Stunden. Danach wird das Reaktionsgemisch auf 500 ml Wasser ausgetragen. Der Niederschlag wird abfiltriert, mit Wasser gewaschen und getrocknet. Man erhält 40 g (86% der Theorie) hellgelbes Kristallpulver der Verbindung der Formel
-
-
- 31,1 g (0, 11 Mol) 2,3-Dimethoxy-6-brommethylchin- oxalin, 56 g Triäthylphosphit und 100 ml Dimethylformamid werden 4 Stunden auf 120 bis 150° C erhitzt. Danach destilliert man im Vakuum das überschüssige Triäthylphosphit und die Hauptmenge Dimethylformamid ab. Der Rückstand und 26,3 g (0,1 Mol) 2-(4-Formylphenyl)-4-methyl-5-phenyl-2H-1,2,3-triazol werden in 250 ml Dimethylformamid gelöst und tropfenweise mit 39,6 g 30%iger Natriummethylatlösung versetzt. Man rührt 3 Stunden bei 50° C, verdünnt mit 250 ml Methanol und stellt mit Essigsäure auf pH 7. Nach Abkühlen auf 0° C wird der hellgelbe Niederschlag abgesaugt, mit Methanol gewaschen, getrocknet und aus Xylol umkristallisiert. Man erhält 28,5 g (63% der Theorie) der Verbindung der Formel
- 24,6 g (0,1 Moi) 2,3-Diäthoxy-6-formylchinoxalin und 37,1 g (0,1 Mol) 2-(4-Diäthoxyphosphonomethyl- phenyl)-4-phenyl-2H-1,2,3-triazol werden in 250 ml Dimethylformamid gerührt und bei Raumtemperatur mit 36 g 30%iger Natriummethylatlösung versetzt. Unter starker Violettfärbung erwärmt sich das Reaktionsgemisch auf 30° C. Man rührt 5 Stunden bei ca. 50° C, verdünnt hierauf mit 200 ml Methanol und stellt mit Essigsäure auf pH 7. Nach dem Abfiltrieren, Waschen mit Methanol und Trocknen erhält man 39,4 g (85% der Theorie) fahlgelbe Kristalle der Verbindung der Formel
-
- 31,1 g (0,1 Mol) rohes 2,3-Diäthoxy-6-brommethyl- chinoxalin werden mit 15,5 g (0,11 Mol) Hexamethylentetramin in 100 ml Chloroform 4 Stunden unter Rückfluß gekocht. Danach destilliert man 50 ml Chloroform ab, kühlt und fügt 50 ml Aceton hinzu. Nach Abfiltrieren bekommt man 40,2 g Urotropinsalz, das in 100 ml 50%iger Essigsäure 2 Stunden am Rückfluß erhitzt wird. Mit ca. 10 bis 20 ml konzentrierter Salzsäure wird die Lösung auf pH 3 gestellt, nach kurzem Aufkochen auf 0° C abgekühlt und mit 500 ml Wasser versetzt. Der ausgefallene Niederschlag wird abfiltriert, mit Wasser neutral gewaschen und getrocknet. Man erhält 16 g (73,3% der Theorie) farblose Kristalle, die nach dem Umkristallisieren aus Methylglykol bei 163° C schmilzen.
-
-
-
-
-
- 31,2 g (0,11 Mol) 2,3-Dimethoxy-6-brommethyl- chinoxalin, 56 g Triäthylphosphit und 100 ml Dimethylformamid werden 4 Stunden bei 120 bis 150° C verrührt. Danach destilliert man im Vakuum das überschüssige Triäthylphosphit und die Hauptmenge des Dimethylformamids ab. Der Rückstand und 15 g (0,1 Mol) 4-Formylbenzoesäure werden in 200 ml Dimethylformamid suspendiert. Dazu tropft man innerhalb von 20 Minuten 36 g 30%ige Natriummethylatlösung und rührt die Reaktionsmischung 3 Stunden bei 50° C. Danach wird abgekühlt, auf 500 ml Wasser ausgetragen und mit konzentrierter Salzsäure auf pH 2 bis 3 gestellt. Nach dem Abfiltrieren, Waschen mit Wasser und Trocknen erhält man 28,5 g (85% der Theorie) hellgelbe Kristalle der Formel
- 33,6 g (0,1 Mol) Rohprodukt der vorstehend beschriebenen Verbindung (51) werden mit 30 g Thionylchlorid und 2 g Dimethylformamid in 150 ml Xylol in das Säurechlorid überführt. Dann werden portionsweise 15 g (0,11 Mol) Benzoesäurehydrazid eingetragen. Nach dem Abklingen der Reaktion bringt man die Mischung langsam auf Rückflußtemperatur und kocht 3 Stunden. Dann wird abgekühlt und mit Wasserdampf destilliert. Man erhält so 35,2 g (81 % der Theorie) der Verbindung der Formel
- Gemäß Beispiel 1 erhält man aus 5-Biphenylyl-2-(4-formylphenyl)-1,3,4-oxdiazol und 2,3-Dibutoxy-6- diäthoxyphosphonomethylchinoxalin die Verbindung der Formel
-
- Zu einer Lösung von 31,2 g (0,1 Mol) 2,3-Dimeth- oxy-6-dimethoxyphosphonomethylchinoxalin und 18,2 g (0,1 Mol) 4-Formylbiphenyl in 200 ml Dimethylformamid tropft man innerhalb von 20 Minuten 36 g 30%ige Natriummethylatlösung und läßt 5 Stunden bei 50° C rühren. Dann verdünnt man mit 100 ml Methanol und stellt mit Essigsäure auf pH 4 bis 5. Nach dem Abkühlen auf 0° C, Abfiltrieren und Trocknen erhält man 25,8 g (70% der Theorie) Rohprodukt der Formel
-
-
Claims (7)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19772730644 DE2730644A1 (de) | 1977-07-07 | 1977-07-07 | Fluoreszenz-farbstoffe |
| DE2730644 | 1977-07-07 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0000346A1 EP0000346A1 (de) | 1979-01-24 |
| EP0000346B1 true EP0000346B1 (de) | 1980-01-09 |
Family
ID=6013331
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP78100253A Expired EP0000346B1 (de) | 1977-07-07 | 1978-06-28 | Chinoxalinverbindungen, Verfahren zu deren Herstellung, deren Verwendung zum Weisstönen organischer Materialien und damit weissgetönte Materialien |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US4184977A (de) |
| EP (1) | EP0000346B1 (de) |
| JP (1) | JPS5417933A (de) |
| DE (2) | DE2730644A1 (de) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4297234A (en) * | 1979-05-17 | 1981-10-27 | Ciba-Geigy Corporation | Benzoxazolyl-stilbenes |
| US4346016A (en) * | 1980-04-23 | 1982-08-24 | Ciba-Geigy Corporation | 6-Styrylquinoxalines, and their use as fluorescent brighteners |
| JPH0636370B2 (ja) * | 1984-01-24 | 1994-05-11 | 日本電信電話株式会社 | リチウム二次電池用電解液 |
| AU3905800A (en) * | 1999-03-23 | 2000-10-09 | Pyramid Productions, Inc. | Body coating composition |
| US6723445B2 (en) | 2001-12-31 | 2004-04-20 | Canon Kabushiki Kaisha | Organic light-emitting devices |
| JP4780372B2 (ja) * | 2005-03-02 | 2011-09-28 | 独立行政法人産業技術総合研究所 | キノキサリンジオン誘導体及びその製造方法並びにその用途 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH484918A (de) * | 1965-10-28 | 1970-01-31 | Ciba Geigy | Verfahren zur Herstellung heterocyclischer, Aethylendoppelbindungen enthaltender Verbindungen |
| CH540247A (de) * | 1967-04-21 | 1973-09-28 | Ciba Geigy Ag | Verfahren zur Herstellung von heterocyclischen, Asthylendoppelbindungen enthaltenden Verbindungen |
| US3684729A (en) * | 1969-10-02 | 1972-08-15 | Robert J Tuite | Brightener compositions |
| BE758359A (fr) * | 1969-11-03 | 1971-04-16 | Bayer Ag | Eclaicissants de la serie des oxadiazolylstyrylbenzotriazols |
| US3872114A (en) * | 1971-02-05 | 1975-03-18 | Hoechst Ag | Benzofurane derivatives, process for their manufacture and their use as optical brighteners |
| GB1457005A (en) * | 1972-11-20 | 1976-12-01 | Pfizer | 2-substituted-3-aminoquinoxalines |
| CH305975A4 (de) * | 1975-03-11 | 1977-08-15 |
-
1977
- 1977-07-07 DE DE19772730644 patent/DE2730644A1/de not_active Withdrawn
-
1978
- 1978-06-28 EP EP78100253A patent/EP0000346B1/de not_active Expired
- 1978-06-28 DE DE7878100253T patent/DE2857515D1/de not_active Expired
- 1978-07-05 JP JP8104078A patent/JPS5417933A/ja active Pending
- 1978-07-05 US US05/922,186 patent/US4184977A/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| DE2730644A1 (de) | 1979-01-25 |
| DE2857515D1 (en) | 1980-02-14 |
| EP0000346A1 (de) | 1979-01-24 |
| JPS5417933A (en) | 1979-02-09 |
| US4184977A (en) | 1980-01-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE1594834B1 (de) | Optische Aufhellmittel | |
| US4167628A (en) | Novel benzoxazole compounds | |
| EP0003784A1 (de) | Distyryl-Verbindungen, sowie deren Herstellung und Verwendung als Weisstöner und Laserfarbstoff | |
| DE1294923B (de) | Optische Aufhellmittel | |
| EP0136259B1 (de) | 4-Heterocyclylvinyl-4'-styryl-biphenyle | |
| EP0030917B1 (de) | Optische Aufheller aus Bis-styrylbenzolverbindungen, Verfahren zu deren Herstellung und deren Verwendung | |
| DE1594861B2 (de) | Verfahren zum stufenweisen Blei chen von Cellulosematerial | |
| EP0000346B1 (de) | Chinoxalinverbindungen, Verfahren zu deren Herstellung, deren Verwendung zum Weisstönen organischer Materialien und damit weissgetönte Materialien | |
| DE2712686C2 (de) | 4-Triazinyl-4'-benzoxazolyl- bzw. 4'-phenyl-stilben-derivate | |
| DE1794400C3 (de) | Verwendung von 4,4'-disubstituierten Stilbenderivaten als optische Aufhellungsmittel | |
| DE2535612A1 (de) | Neue stilbenverbindungen | |
| DE2535613A1 (de) | Neue stilbenverbindungen | |
| EP0009095B1 (de) | 1,3,4-Oxadiazolon(2)-Verbindungen, Verfahren zu deren Herstellung und deren Verwendung als optische Aufheller | |
| EP0002042A1 (de) | Diamino-1,3,5-triazinylstilbenverbindungen, Verfahren zu deren Herstellung und ihre Verwendung als optische Aufheller | |
| EP0020298B1 (de) | Benzoxazolyl-Stilbene, Verfahren zu ihrer Herstellung und ihre Verwendung zum optischen Aufhellen von organischen Materialien | |
| DE2060288A1 (de) | Neue Bis-aroxazolyl-Verbindungen,Verfahren zu deren Herstellung und deren Verwendung | |
| DE2309614A1 (de) | Azolverbindungen, verfahren zu deren herstellung und deren verwendung | |
| DE2331444A1 (de) | Neue styryl-benzoxazole, verfahren zu deren herstellung und ihre verwendung als optische aufhellungsmittel | |
| DE2650456A1 (de) | Fluoreszenzfarbstoffe | |
| DE2535615A1 (de) | Verfahren zur herstellung von styrolderivaten, neue styrolderivate und deren verwendung als optische aufhellmittel | |
| DE2609421A1 (de) | Neue benzoxazol-styryle | |
| CH532629A (de) | Verfahren zum optischen Aufhellen mit neuen Bis-aroxazolyl-Verbindungen | |
| DE2554027A1 (de) | Neue triazolverbindungen | |
| DE2712409A1 (de) | Neue 4-(v-triazolyl)-styrylverbindungen | |
| EP0022491A1 (de) | Neue Stilbenverbindungen, Verfahren zu deren Herstellung und deren Verwendung als optische Aufheller |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Designated state(s): CH DE FR GB |
|
| 17P | Request for examination filed | ||
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Designated state(s): CH DE FR GB |
|
| REF | Corresponds to: |
Ref document number: 2857515 Country of ref document: DE Date of ref document: 19800214 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19830701 Year of fee payment: 6 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19840526 Year of fee payment: 7 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19850228 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19870303 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Effective date: 19881117 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19890622 Year of fee payment: 12 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: CH Effective date: 19900630 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |