DK153404B - Fremgangsmaade til fremstilling af imidazobenzodiazepiner eller salte deraf - Google Patents
Fremgangsmaade til fremstilling af imidazobenzodiazepiner eller salte deraf Download PDFInfo
- Publication number
- DK153404B DK153404B DK138682A DK138682A DK153404B DK 153404 B DK153404 B DK 153404B DK 138682 A DK138682 A DK 138682A DK 138682 A DK138682 A DK 138682A DK 153404 B DK153404 B DK 153404B
- Authority
- DK
- Denmark
- Prior art keywords
- formula
- compound
- acid
- methylene chloride
- nitro
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims description 11
- 238000004519 manufacturing process Methods 0.000 title 1
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 39
- 150000001875 compounds Chemical class 0.000 claims description 16
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 claims description 9
- 150000003839 salts Chemical class 0.000 claims description 8
- 238000002360 preparation method Methods 0.000 claims description 7
- -1 4-phenyl-piperazin-1-yl Chemical group 0.000 claims description 6
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 claims description 6
- 150000007522 mineralic acids Chemical class 0.000 claims description 5
- 150000007524 organic acids Chemical class 0.000 claims description 5
- 150000001412 amines Chemical class 0.000 claims description 4
- 229910052757 nitrogen Inorganic materials 0.000 claims description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 4
- 235000005985 organic acids Nutrition 0.000 claims description 4
- 125000000217 alkyl group Chemical group 0.000 claims description 3
- 125000004432 carbon atom Chemical group C* 0.000 claims description 3
- 238000006243 chemical reaction Methods 0.000 claims description 3
- 229910052739 hydrogen Inorganic materials 0.000 claims description 3
- 239000001257 hydrogen Substances 0.000 claims description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 2
- KLNFAMGHSZQYHR-UHFFFAOYSA-N imidazo[4,5-i][1,2]benzodiazepine Chemical class C1=CC=NN=C2C3=NC=NC3=CC=C21 KLNFAMGHSZQYHR-UHFFFAOYSA-N 0.000 claims description 2
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 2
- 125000000587 piperidin-1-yl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 2
- 229910052736 halogen Inorganic materials 0.000 claims 2
- 150000002367 halogens Chemical class 0.000 claims 2
- 150000002431 hydrogen Chemical class 0.000 claims 1
- 239000002904 solvent Substances 0.000 claims 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 18
- 239000002253 acid Substances 0.000 description 5
- 125000005843 halogen group Chemical group 0.000 description 5
- 125000004182 2-chlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(*)C([H])=C1[H] 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 239000003960 organic solvent Substances 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 229910052731 fluorine Inorganic materials 0.000 description 3
- 239000011737 fluorine Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 125000004195 4-methylpiperazin-1-yl group Chemical group [H]C([H])([H])N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- HHLFWLYXYJOTON-UHFFFAOYSA-N glyoxylic acid Chemical compound OC(=O)C=O HHLFWLYXYJOTON-UHFFFAOYSA-N 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 239000000932 sedative agent Substances 0.000 description 2
- 230000001624 sedative effect Effects 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- GUJAGMICFDYKNR-UHFFFAOYSA-N 1,4-benzodiazepine Chemical compound N1C=CN=CC2=CC=CC=C12 GUJAGMICFDYKNR-UHFFFAOYSA-N 0.000 description 1
- PVOAHINGSUIXLS-UHFFFAOYSA-N 1-Methylpiperazine Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 1
- SVUOLADPCWQTTE-UHFFFAOYSA-N 1h-1,2-benzodiazepine Chemical compound N1N=CC=CC2=CC=CC=C12 SVUOLADPCWQTTE-UHFFFAOYSA-N 0.000 description 1
- ONOBXDPYDHTSBQ-UHFFFAOYSA-N 2,3,4,7-tetrahydro-1h-diazepine Chemical compound C1CC=CCNN1 ONOBXDPYDHTSBQ-UHFFFAOYSA-N 0.000 description 1
- SHZFVLZWUVDCEN-UHFFFAOYSA-N 2-hydroxypropane-1,2,3-tricarboxylic acid;oxalic acid Chemical compound OC(=O)C(O)=O.OC(=O)CC(O)(C(O)=O)CC(O)=O SHZFVLZWUVDCEN-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- IZYKFSZYKIUTTE-UHFFFAOYSA-N 5-(2-chlorophenyl)-7-nitro-1,3-dihydro-1,4-benzodiazepine-2-thione Chemical compound C12=CC([N+](=O)[O-])=CC=C2NC(=S)CN=C1C1=CC=CC=C1Cl IZYKFSZYKIUTTE-UHFFFAOYSA-N 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 230000002921 anti-spasmodic effect Effects 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 229940049706 benzodiazepine Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 239000000812 cholinergic antagonist Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229910000043 hydrogen iodide Inorganic materials 0.000 description 1
- 230000000147 hypnotic effect Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 239000003158 myorelaxant agent Substances 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
Description
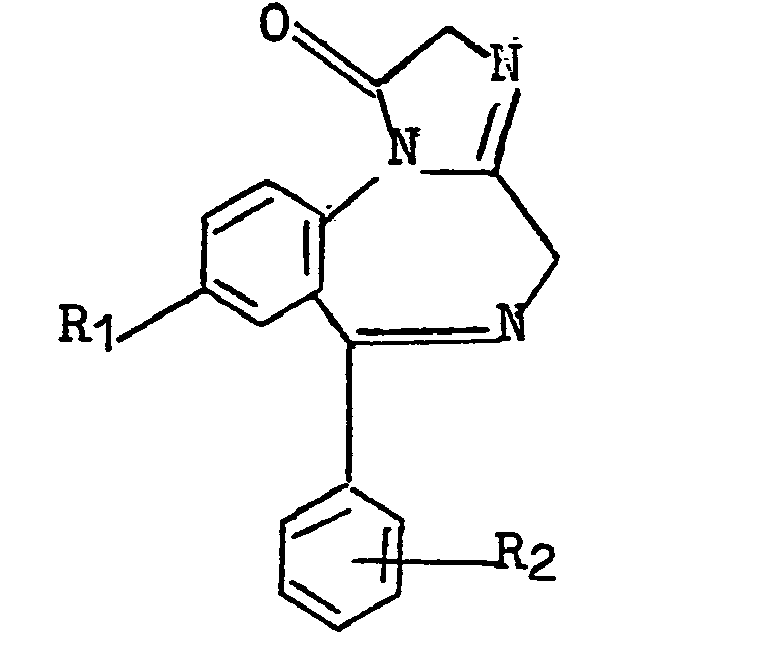
Opfindelsen angår en hidtil ukendt fremgangsmåde til fremstilling af imidazobenzodiazepiner med den almene formel I
(I) hvor R^ betegner et hydrogenatom, et halogenatom, en nitrogruppe eller en trifluormethylgruppe, Rg betegner et hydrogen- eller halogenatom, og R^ og R^ sammen med det nitrogenatom, hvortil de er knyttet, betegner 4-alkylpiperazin-l-yl, 4-eycloalkylalkylpiperazin-l-yl, 4-phenylpiperazin-l-yl eller piperidino, eller deres additionssalte med uorganiske eller organiske syrer# I formlen I samt i det følgende gælder: - Mr R^ betegner et halogenatom, drejer det sig fortrinsvis om et fluor-, chlor- eller bromatom, især et chlor-atom, - Mr Rg betegner et halogenatom, drejer det sig fortrinsvis om et fluor-, chlor- eller bromatom, især et fluoreller chloratom. Mr Rg betegner et halogenatom er det desuden fortrinsvis i o-stillingen.
- Mr Rj og R^ sammen med det nitrogenatom, hvortil de er knyttet, betegner 4-alkylpiperazin-l-yl, drejer det sig fortrinsvis om 4-methylpiperazin-l-yl, 4-ethylpiperazin-l-yl eller 4-propylpiperazin-l-yl, især 4-methylpiperazin-l-yl.
- Mr R^ og R^ sammen med det nitrogenatom, hvortil de er knyttet, betegner 4-cycloalkylalkyl-piperazin-l-yl, drejer det sig fortrinsvis om cycloalkyl med 3-6 carbonatomer såsom cyclopropyl, cyclobutyl eller cyclopentyl# Blandt 4-cycloalkylalkylpiperazin-l-ylgrupperne skal især nævnes 4-cyclopropylmethylpiperazin-l-yl.
Additionssaltene med uorganiske eller organiske syrer kan f.eks# være de salte, som dannes med saltsyre, hy-drogenbromidsyre, hydrogeniodidsyre, salpetersyre, svovlsyre, phosphorsyre, propionsyre, eddikesyre, myresyre, benzoesyre, maleinsyre, fumarsyre, ravsyre, vinsyre, citronsyre, oxalsyre, glyoxylsyre, asparaginsyre og alkansulfonsyrer såsom methansulfonsyre og aryIsulfonsyrer såsom benzensulfonsyre.
Forbindelserne med den almene formel I og deres salte samt en fremgangsmåde til fremstilling af disse er beskrevet i Qansk fremlæggelsesskrift nr. 141 250. So.n det fremgår af dette skrift, har forbindelserne med den almene formel I interessante sedative, hypnotiske, angstdæmpende, beroligende, krampedæmpende og muskelafslappende egenskaber.
Ben hidtil ukendte fremgangsmåde ifølge opfindelsen muliggør fremstillingen af forbindelserne med formlen I med gode udbytter i et mindre antal trin end i de fremgangsmåder, som er beskrevet i det nævnte danske fremlæggal sesskrift.
Formålet med den foreliggende opfindelse er således at anvise en hidtil ukendt fremgangsmåde til fremstilling af forbindelserne med den almene formel I samt deres additionssalte med uorganiske eller organiske syrer, og denne fremgangsmåde er ejendommelig ved, at man omsætter en forbindelse med formlen II
(II)
hvor R^ °S ¾ kar sam®e betydning som ovenfor, med en amin med formlen III
%
(Ill) hvor ale betegner en alkylgruppe med 1-3 carbonatomer, og og R^ har samme betydning som ovenfor, i et organisk opløsningsmiddel til opnåelse af den ønskede forbindelse med formlen I, som man om ønsket kan omdanne til salt.
Under foretrukne betingelser for udførelse af fremgangsmåden ifølge opfindelsen udføres omsætningen af forbindelsen med formlen II med forbindelsen med formlen III i et organisk opløsningsmiddel såsom methylenchlorid og i nærværelse af en amin såsom triethylamin.
Add i ti ons s alt ene- med- syre- af forbindelserne- med- formlen I kah fremstilles, idet man omsætter disse forbindelser med formlen I med en støkiometrisk mængde af en uorganisk eller organisk syre. Reaktionen udføres fortrinsvis i et organisk opløsningsmiddel eller en blanding af organiske opløsningsmidler såsom alkoholer, f.eks. methanol eller ethanol, eller alkylhalogenider som f.eks. methylenchlorid.
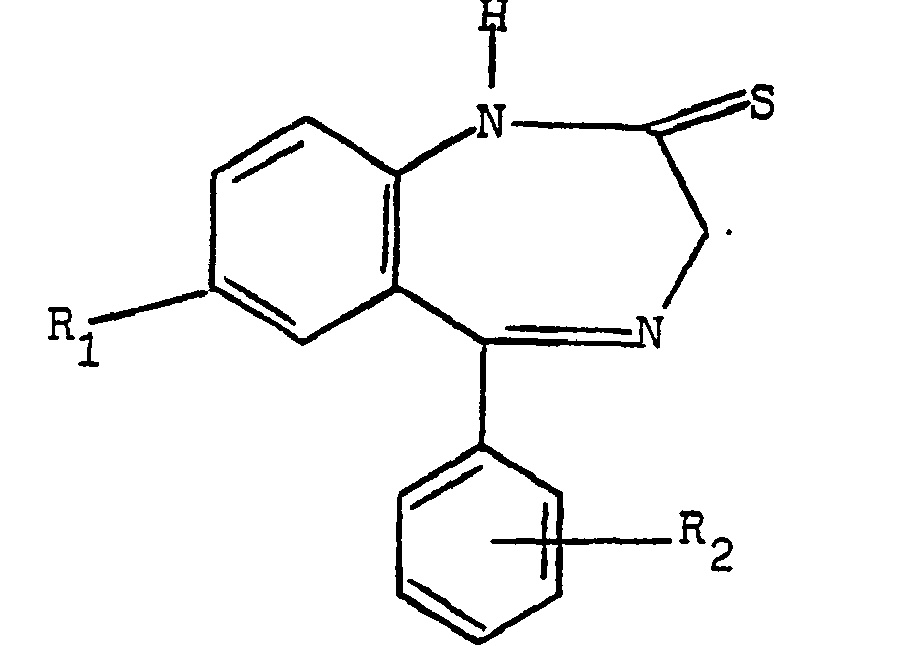
Som angivet i dansk fremlæggslsesskrift nr. 141.250 kan forbindelserne med formlen II fremstilles ud fra en forbindelse med formlen IV
(IV)
hvor Rj og Rg har samme betydning som ovenfor, ved omsætning med glycin til opnåelse af en forbindelse med formlen V
(v) hvor og Eg har samme betydning som ovenfor, som man de-hydratiserer til opnåelse af forbindelsen med formlen II.
Dehydratiseringen kan med fordel udføres ved h^ælp af et carbodiimid såsom dicyclohexylcarbodiimid.
Forbindelserne med formlen III kan, når de ikke er kendte, fremstilles ved omsætning af en forbindelse med formlen VI
(VI) hvor E^ og E^ har samme betydning som ovenfor med en alkyl« ketal af dimethylformamid. It eksempel på en sådan præparation er anført nedenfor i den eksperimentelle del.
Nedenstående eksempel illustrerer fremgangsmåden ifølge opfindelsen.
Eksempel.
8-nitro-1.2-dihydro-2-(N-methylpiperazin-l-yl)-methylen-6--(o-ohlorphenyl)-lH.4H-imidazo/l«2-a7 /1.4/benzodiazepin-l-on. Trin A: 2-oarboxymethylamino-7-nitro-5-(o«chlorphenyl)-3H-/1,4 _7benzodiazepin.
I 3 liter afmineraliseret vand indfører man 1,360 kg glycin og derefter gradvis 1,450 kg natriumbiearbonat. Man omrører 30 minutter ved stuetemperatur og indfører 15 liter ethanol og derefter i løbet af ca. 5 minutter 3 kg 7-nitro--l,3-dihydro-5-(o-chlorphenyl)-2H-/i,4/benzodiazepin-2-thion.
Man opvarmer til tilbagesvaling i 1 time 30 minutter, destillerer under formindsket tryk og tilsætter 15 liter af-mineraliseret vand ad to gange og derpå 7,5 liter methylen-chlorid, hvorpå man skiller faserne. Man genekstraherer den vandige fase med tre gange 6 liter methylenchlorid, vasker derpå methylenchloridfaserne med vand og forener alle vandige faser. Man tilsætter 18 liter methylenchlorid og ved 0-5°C 1,3 liter 22° Bé saltsyre. Man får en methylenchloridopløsning af 2-carboxymethylamino-7-nitro-5-(o-chlorphenyl)-3H--/Ij-^/benzodiazepin, som man umiddelbart benytter i det følgende trin.
Trin B: 8-nitro-1.2-dih.vdro-6-(o-ohlorphen.vl)-lH.4H-imidazo-/l,2-a//i,4/benzodiazepin-l-on.
Til den ovenfor fremstillede methylenchloridopløs-ning af 2-carboxymethylamino-7-nitro-5-(o~ehlorphenyl)-3H-/1,4/benzodiazepin sætter man ved 5°C i løbet af oa. 2 minutter en opløsning af 1,865 kg dicyclohexylcarbodiimid i 3 liter methylenchlorid, hvorpå man omrører i 30 minutter.
Man lader henstå natten over, hvorpå man suger fra.
Man vasker to gange med 3 liter methylenchlorid og får methy-lenchloridopløsningen af 8-nitro-l,2-dihydro-6-(o-chlorphe-nyl)-lH,4H-imidazo/l,2-a//I,4/benzodiazepini-l-on, som man umiddelbart benytter i det næste trin.
Trin Qg. 8-nitro-l,2-dih.ydro-2-(H-methylpiperazin-l-yl)-meth.y°· len-6-(o-ohlorph eny1)-IH,4H-imid azo fl,2-a7/1,4/-benzodiazepin-l-on.
Til methylenchloridopløsningen af 8-nitro-l,2-dihydro--6-(o-chlorpheny1)-lH,4H-imid az o/l,2-a//l, 4/benzod iazepin--1-on fremstillet ovenfor sætter man i løbet af ca. 5 minutter og ved stuetemperatur 650 g triethylamin og derpå 2,4 kg af en opløsning af dimethylketal af N-formyl-H-methylpipera-zin, hvis fremstilling er angivet nedenfor.
Man omrører 1 time 30 minutter, inddamper til tørhed under formindsket tryk og tilsætter 6 liter ethanol. Man de-stillerer, idet man holder niveauet konstant ved tilsætning af ethanol indtil opnåelsen af dampe ved 78°C, hvorpå man af= køler til 0-2°C, omrører i 2 timer og suger fra. Man vasker med ethanol og får 4,260 kg råprodukt, som man renser ved be= handling med aktivkul og derefter med ethanol. Der fås endelig 3,362 kg 8-nitro-l,2-dihydro-2-(IT-methylpiperazin-l-yl)« -me thy len-6 - (o-ch lo r ph eny 1) -IH, 4H-imi d az o/l, 2 -a//i, 4/benz o -diazepin-l-on.
Forbindelsen er identisk med den, som er beskrevet i eksempel 28 i ovennævnte danske fremlæggelsesskrift, udbytte 79,8%.
Opløsningen af dimethylketal af H-formyl-N-methyl-piperazin kan fremstilles som følger: I 2 kg dimethylketal af dimethylfomnamid indfører man 3,3 kg N-methylpiperazin, og man opvarmer til tilbagesva-ling i 15 timer. Man afdestillerer uomsat U-methylpiperazin under formindsket tryk, omrører 1 time under formindsket tryk ved 115-120°C og afkøler derpå til 20°C. Der fås 3,920 kg af en brun opløsning af dimethylketal af U-formyl-U-methylpipe-razin.
Claims (2)
1, Fremgangsmåde til fremstilling af imidazobenzo-diazepiner med den almene formel I
(I) hvor R^ betegner hydrogen, halogen, nitro eller trifluorme-thyl, R2 betegner hydrogen eller halogen, og R^ og R^ sammen med det nitrogenatom, hvortil de er knyttet, betegner 4-al~ kylpiperazin-l-yl, 4-cycloalkylalkylpiperazin-l-yl, 4-phenyI-piperazin-l-yl eller piperidino, eller deres additionssalte med uorganiske eller organiske syrer, kendetegnet ved, at man omsætter en forbindelse med formlen II
(II) hvor R^ og Rg har samme betydning som ovenfor, med en amin med formlen
hvor alc betegner en alkylgruppe med 1-3 carbonatomer, og R^ og R^ har samme betydning som ovenfor, i et organisk (III) opløsningsmiddel til opnåelse af den ønskede forbindelse med formlen I, som man om ønsket kan omdanne til salt.
2. Fremgangsmåde ifølge krav 1, kendetegnet ved, at omsætningen af forbindelsen med formlen II med forbindelsen med formlen III udføres i methylenchlorid og i nærværelse af en amin såsom triethylamin.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8106171A FR2502621B1 (da) | 1981-03-27 | 1981-03-27 | |
| FR8106171 | 1981-03-27 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| DK138682A DK138682A (da) | 1982-09-28 |
| DK153404B true DK153404B (da) | 1988-07-11 |
| DK153404C DK153404C (da) | 1988-11-21 |
Family
ID=9256708
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DK138682A DK153404C (da) | 1981-03-27 | 1982-03-26 | Fremgangsmaade til fremstilling af imidazobenzodiazepiner eller salte deraf |
Country Status (17)
| Country | Link |
|---|---|
| JP (1) | JPS57169483A (da) |
| AU (1) | AU549222B2 (da) |
| CA (1) | CA1175823A (da) |
| CH (1) | CH651565A5 (da) |
| DE (1) | DE3211243A1 (da) |
| DK (1) | DK153404C (da) |
| ES (1) | ES509284A0 (da) |
| FI (1) | FI71152C (da) |
| FR (1) | FR2502621B1 (da) |
| GB (1) | GB2095674B (da) |
| HU (1) | HU185092B (da) |
| IT (1) | IT1147917B (da) |
| MA (1) | MA19416A1 (da) |
| NL (1) | NL193246C (da) |
| PT (1) | PT74669B (da) |
| SE (2) | SE448731B (da) |
| ZA (1) | ZA821141B (da) |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3872090A (en) * | 1972-07-12 | 1975-03-18 | Boehringer Sohn Ingelheim | 3-(amino-methylene)-5-phenyl-1,4-benzodiazepin-2-ones |
| IL48888A (en) * | 1975-02-15 | 1979-03-12 | Roussel Uclaf | 2-aminomethylene-1,2-dihydro-6-phenyl-1h-imidazo(1,2-a)(1,4) benzodiazepin-1-ones, process for their preparation andpharmaceutical compositions incorporating them |
-
1981
- 1981-03-27 FR FR8106171A patent/FR2502621B1/fr not_active Expired
-
1982
- 1982-01-19 SE SE8200271A patent/SE448731B/sv not_active IP Right Cessation
- 1982-01-19 SE SE8200271D patent/SE8200271L/xx not_active Application Discontinuation
- 1982-02-03 ES ES509284A patent/ES509284A0/es active Granted
- 1982-02-22 ZA ZA821141A patent/ZA821141B/xx unknown
- 1982-02-26 AU AU80947/82A patent/AU549222B2/en not_active Expired
- 1982-03-18 MA MA19621A patent/MA19416A1/fr unknown
- 1982-03-19 IT IT48036/82A patent/IT1147917B/it active
- 1982-03-23 NL NL8201208A patent/NL193246C/nl not_active IP Right Cessation
- 1982-03-24 JP JP57045728A patent/JPS57169483A/ja active Pending
- 1982-03-25 FI FI821058A patent/FI71152C/fi not_active IP Right Cessation
- 1982-03-26 PT PT74669A patent/PT74669B/pt unknown
- 1982-03-26 DE DE19823211243 patent/DE3211243A1/de active Granted
- 1982-03-26 CA CA000399537A patent/CA1175823A/fr not_active Expired
- 1982-03-26 GB GB8208933A patent/GB2095674B/en not_active Expired
- 1982-03-26 CH CH1896/82A patent/CH651565A5/fr not_active IP Right Cessation
- 1982-03-26 HU HU82939A patent/HU185092B/hu not_active IP Right Cessation
- 1982-03-26 DK DK138682A patent/DK153404C/da not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| GB2095674B (en) | 1984-10-10 |
| FR2502621B1 (da) | 1983-10-28 |
| PT74669A (fr) | 1982-04-01 |
| IT8248036A0 (it) | 1982-03-19 |
| DE3211243A1 (de) | 1982-10-07 |
| NL8201208A (nl) | 1982-10-18 |
| ES8302712A1 (es) | 1983-01-16 |
| NL193246C (nl) | 1999-04-02 |
| FI71152B (fi) | 1986-08-14 |
| CH651565A5 (fr) | 1985-09-30 |
| GB2095674A (en) | 1982-10-06 |
| ZA821141B (en) | 1983-01-26 |
| HU185092B (en) | 1984-11-28 |
| FI821058L (fi) | 1982-09-28 |
| IT1147917B (it) | 1986-11-26 |
| PT74669B (fr) | 1985-01-08 |
| CA1175823A (fr) | 1984-10-09 |
| DE3211243C2 (da) | 1993-05-19 |
| FR2502621A1 (da) | 1982-10-01 |
| SE8200271L (sv) | 1982-09-28 |
| SE448731B (sv) | 1987-03-16 |
| FI71152C (fi) | 1986-11-24 |
| DK153404C (da) | 1988-11-21 |
| MA19416A1 (fr) | 1982-10-01 |
| DK138682A (da) | 1982-09-28 |
| NL193246B (nl) | 1998-12-01 |
| AU549222B2 (en) | 1986-01-23 |
| AU8094782A (en) | 1982-09-30 |
| JPS57169483A (en) | 1982-10-19 |
| ES509284A0 (es) | 1983-01-16 |
| FI821058A0 (fi) | 1982-03-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Chern et al. | Studies on quinazolines. 5. 2, 3-Dihydroimidazo [1, 2-c] quinazoline derivatives: a novel class of potent and selective. alpha. 1-adrenoceptor antagonists and antihypertensive agents | |
| PL165502B1 (pl) | Sposób wytwarzania nowych pochodnych aminopirymidyny PL PL PL PL PL | |
| DD231355A5 (de) | Verfahren zur herstellung von neuen 2-phenyl-unidazolen | |
| NO855196L (no) | Analogifremgangsmaate for fremstilling av terapeutisk aktive imidazoderivater. | |
| HU229430B1 (en) | 4-oxo-3,5-dihydro-4h-pyridazino[4,5-b]-indole-1-acetamide derivatives, process for their preparation and pharmaceutical compositions containing them | |
| JPH0240067B2 (da) | ||
| DK153404B (da) | Fremgangsmaade til fremstilling af imidazobenzodiazepiner eller salte deraf | |
| DE2508543A1 (de) | Verfahren zur herstellung von imidazo- und pyrimido eckige klammer auf 2,1-b eckige klammer zu -chinazolinen und neue chinazoline | |
| JPS62135464A (ja) | フエニルピペラジン誘導体 | |
| US4495187A (en) | Method of using [1,2,4]triazolo[4,3-a]quinoxaline-4-amine derivatives as antidepressant and antifatigue agents | |
| DE2508333A1 (de) | Triazolo eckige klammer auf 4,3-a eckige klammer zu chinazoline | |
| JPH0363273A (ja) | ピリドベンゾインドール、その製造方法及びそれを含有する組成物 | |
| FI66380B (fi) | Foerfarande foer framstaellning av nya antireproduktiva 1,2,4-triazolo(5,1-a)isoindoler -isokinoliner och -bensazepiner | |
| DK141626B (da) | Fremgangsmåde til fremstilling af quinazoliner. | |
| Bishop et al. | Synthesis and reactions of [1, 2, 4] triazolo [1, 5-a] pyrimidinium-2-aminides | |
| CS217964B2 (en) | Method of making the 3-/1-pyrazolyle-/paridazin derivatives | |
| US4180578A (en) | 2,4-Diamino-5-(4'-methylthio)benzylpyrimidenes, compounds, compositions and method of use | |
| SK18492000A3 (sk) | Spôsob prípravy 3(2h)-pyridazinón-4-substituovaných amino-5-chlórderivátov | |
| CN111606910A (zh) | 一种抗肿瘤药物Sapanisertib的合成工艺 | |
| DE2119375A1 (de) | as-Triazino(5,6-b)indole | |
| JP7416842B2 (ja) | 縮合多環式化合物の調製方法 | |
| JPH033674B2 (da) | ||
| CH681300A5 (da) | ||
| JP5079809B2 (ja) | (3−アルキル−5−ピペリジン−1−イル−3,3a−ジヒドロ−ピラゾロ[1,5−a]ピリミジン−7−イル)−アミノ誘導体および中間体の合成のための方法および合成のための中間体 | |
| JP5611207B2 (ja) | 二環式複素環の立体選択的調製方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUP | Patent expired | ||
| PUP | Patent expired |