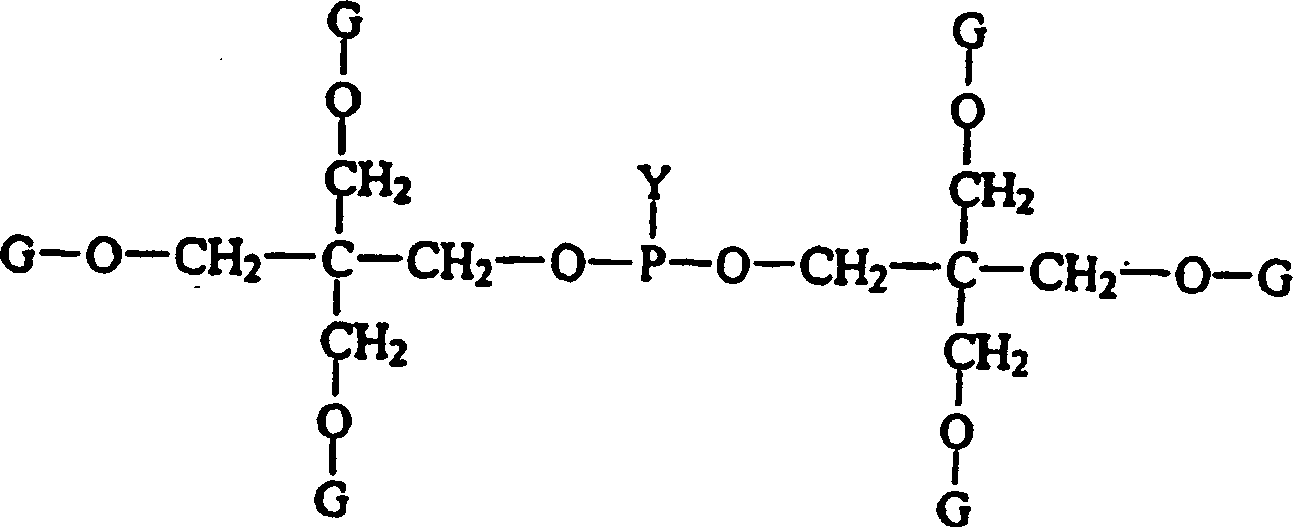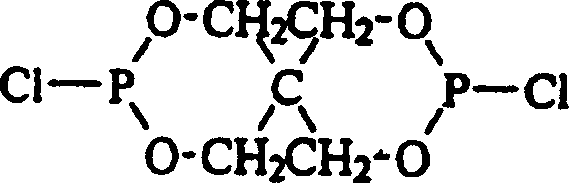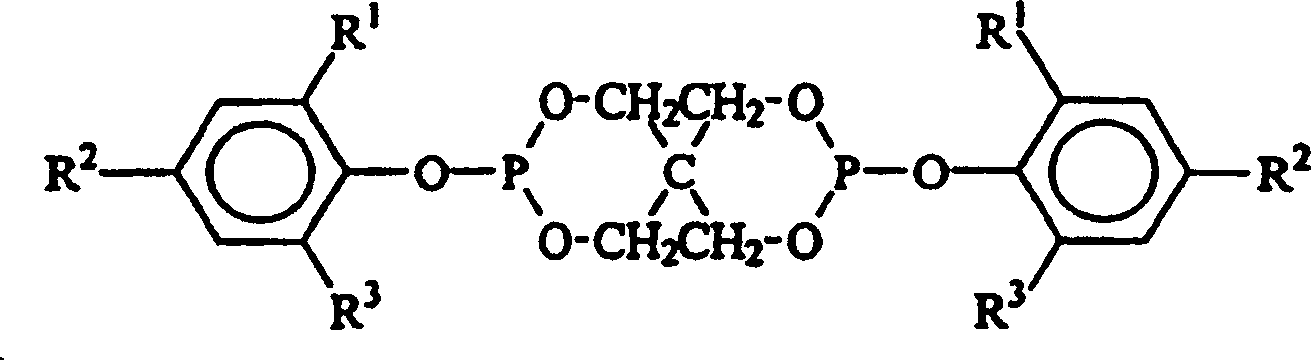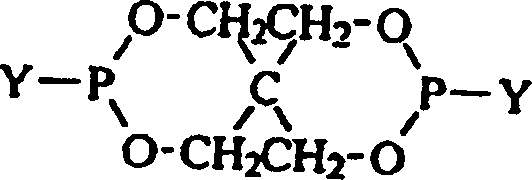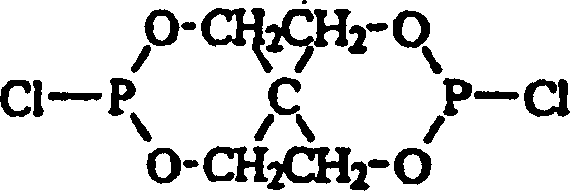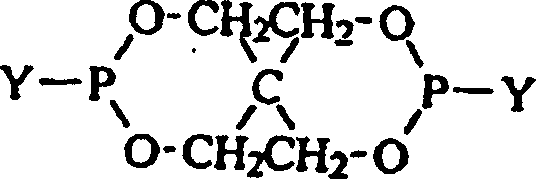DE69918077T2 - Verfahren zur herstellung von spirobisphosphiten - Google Patents
Verfahren zur herstellung von spirobisphosphiten Download PDFInfo
- Publication number
- DE69918077T2 DE69918077T2 DE69918077T DE69918077T DE69918077T2 DE 69918077 T2 DE69918077 T2 DE 69918077T2 DE 69918077 T DE69918077 T DE 69918077T DE 69918077 T DE69918077 T DE 69918077T DE 69918077 T2 DE69918077 T2 DE 69918077T2
- Authority
- DE
- Germany
- Prior art keywords
- butyl
- hydrogen
- amyl
- pentyl
- bis
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000004519 manufacturing process Methods 0.000 title description 7
- 238000000034 method Methods 0.000 claims abstract description 36
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims abstract description 30
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 28
- 239000001257 hydrogen Substances 0.000 claims abstract description 28
- 239000011541 reaction mixture Substances 0.000 claims abstract description 18
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 claims abstract description 15
- 229910052753 mercury Inorganic materials 0.000 claims abstract description 15
- 150000002989 phenols Chemical class 0.000 claims abstract description 9
- 238000010438 heat treatment Methods 0.000 claims abstract description 4
- -1 t-hexyl Chemical group 0.000 claims description 69
- UOCJDOLVGGIYIQ-PBFPGSCMSA-N cefatrizine Chemical group S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)[C@H](N)C=2C=CC(O)=CC=2)CC=1CSC=1C=NNN=1 UOCJDOLVGGIYIQ-PBFPGSCMSA-N 0.000 claims description 23
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 23
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 22
- 150000002431 hydrogen Chemical class 0.000 claims description 17
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 16
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 16
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 16
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 16
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 16
- 239000002904 solvent Substances 0.000 claims description 14
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 10
- 150000001412 amines Chemical class 0.000 claims description 8
- 229910052736 halogen Inorganic materials 0.000 claims description 6
- 150000002367 halogens Chemical class 0.000 claims description 5
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 3
- 229910052801 chlorine Inorganic materials 0.000 claims description 3
- 239000000460 chlorine Substances 0.000 claims description 3
- 238000010792 warming Methods 0.000 claims 1
- 238000006243 chemical reaction Methods 0.000 abstract description 35
- WXZMFSXDPGVJKK-UHFFFAOYSA-N pentaerythritol Chemical compound OCC(CO)(CO)CO WXZMFSXDPGVJKK-UHFFFAOYSA-N 0.000 abstract description 16
- 239000000203 mixture Substances 0.000 abstract description 7
- 125000004435 hydrogen atom Chemical group [H]* 0.000 abstract 1
- 150000008301 phosphite esters Chemical class 0.000 abstract 1
- 125000003003 spiro group Chemical group 0.000 abstract 1
- 150000001875 compounds Chemical class 0.000 description 32
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 27
- OJMIONKXNSYLSR-UHFFFAOYSA-N phosphorous acid Chemical compound OP(O)O OJMIONKXNSYLSR-UHFFFAOYSA-N 0.000 description 17
- AQSJGOWTSHOLKH-UHFFFAOYSA-N phosphite(3-) Chemical class [O-]P([O-])[O-] AQSJGOWTSHOLKH-UHFFFAOYSA-N 0.000 description 15
- 239000003054 catalyst Substances 0.000 description 12
- 238000005886 esterification reaction Methods 0.000 description 10
- 150000004820 halides Chemical class 0.000 description 10
- 239000006227 byproduct Substances 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 8
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 7
- ICKWICRCANNIBI-UHFFFAOYSA-N 2,4-di-tert-butylphenol Chemical compound CC(C)(C)C1=CC=C(O)C(C(C)(C)C)=C1 ICKWICRCANNIBI-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 6
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 5
- 238000006073 displacement reaction Methods 0.000 description 5
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 5
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 5
- 239000008096 xylene Substances 0.000 description 5
- 125000003118 aryl group Chemical group 0.000 description 4
- 238000002425 crystallisation Methods 0.000 description 4
- 230000008025 crystallization Effects 0.000 description 4
- GXURZKWLMYOCDX-UHFFFAOYSA-N 2,2-bis(hydroxymethyl)propane-1,3-diol;dihydroxyphosphanyl dihydrogen phosphite Chemical class OP(O)OP(O)O.OCC(CO)(CO)CO GXURZKWLMYOCDX-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 3
- 230000032050 esterification Effects 0.000 description 3
- 230000003301 hydrolyzing effect Effects 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 239000003960 organic solvent Substances 0.000 description 3
- 229910052698 phosphorus Inorganic materials 0.000 description 3
- 239000011574 phosphorus Substances 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 0 C*(*Oc(c(P)cc(C)c1)c1O)O Chemical compound C*(*Oc(c(P)cc(C)c1)c1O)O 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- ZJIPHXXDPROMEF-UHFFFAOYSA-N dihydroxyphosphanyl dihydrogen phosphite Chemical class OP(O)OP(O)O ZJIPHXXDPROMEF-UHFFFAOYSA-N 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 229910000039 hydrogen halide Inorganic materials 0.000 description 2
- 239000012433 hydrogen halide Substances 0.000 description 2
- FAIAAWCVCHQXDN-UHFFFAOYSA-N phosphorus trichloride Chemical compound ClP(Cl)Cl FAIAAWCVCHQXDN-UHFFFAOYSA-N 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- RGASRBUYZODJTG-UHFFFAOYSA-N 1,1-bis(2,4-ditert-butylphenyl)-2,2-bis(hydroxymethyl)propane-1,3-diol dihydroxyphosphanyl dihydrogen phosphite Chemical class OP(O)OP(O)O.C(C)(C)(C)C1=C(C=CC(=C1)C(C)(C)C)C(O)(C(CO)(CO)CO)C1=C(C=C(C=C1)C(C)(C)C)C(C)(C)C RGASRBUYZODJTG-UHFFFAOYSA-N 0.000 description 1
- AIBRSVLEQRWAEG-UHFFFAOYSA-N 3,9-bis(2,4-ditert-butylphenoxy)-2,4,8,10-tetraoxa-3,9-diphosphaspiro[5.5]undecane Chemical compound CC(C)(C)C1=CC(C(C)(C)C)=CC=C1OP1OCC2(COP(OC=3C(=CC(=CC=3)C(C)(C)C)C(C)(C)C)OC2)CO1 AIBRSVLEQRWAEG-UHFFFAOYSA-N 0.000 description 1
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- GVQXVEWHRFPTKO-UHFFFAOYSA-N P(OP(O)O)(Cl)Cl.OCC(CO)(CO)CO Chemical compound P(OP(O)O)(Cl)Cl.OCC(CO)(CO)CO GVQXVEWHRFPTKO-UHFFFAOYSA-N 0.000 description 1
- 239000000370 acceptor Substances 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 238000007701 flash-distillation Methods 0.000 description 1
- 238000004817 gas chromatography Methods 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 150000002440 hydroxy compounds Chemical class 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 239000002952 polymeric resin Substances 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 230000002277 temperature effect Effects 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6564—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms
- C07F9/6571—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms having phosphorus and oxygen atoms as the only ring hetero atoms
- C07F9/6574—Esters of oxyacids of phosphorus
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6564—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms
- C07F9/6571—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms having phosphorus and oxygen atoms as the only ring hetero atoms
- C07F9/6574—Esters of oxyacids of phosphorus
- C07F9/65746—Esters of oxyacids of phosphorus the molecule containing more than one cyclic phosphorus atom
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
Description
- Gebiet der Erfindung
- Diese Erfindung betrifft ein Verfahren zur Herstellung von organischen Phosphiten, insbesondere Spirobisphosphiten. In einer besonders bevorzugten Ausführungsform betrifft diese Erfindung ein Verfahren zur Herstellung von Bis(dialkylphenyl)pentaerythritdiphosphiten.
- Hintergrund der Erfindung
- Organische Phosphite werden bei der Stabilisierung einer großen Vielfalt von polymeren Systemen verwendet. Es sind viele verschiedene Phosphite zur Verwendung entweder allein oder in Kombination mit anderen Stabilisatoren vorgeschlagen worden. Derartige Phosphite und ihre Nützlichkeiten sind in den U.S. Patenten Nr. 4,371,647, 4,656,302, 4,705,879, 5,126,475, 5,141,975 und 5,438,086 beschrieben. Die Bedeutung organischer Phosphite als Stabilisatoren hat zu der Entwicklung einer Vielfalt von speziellen organischen Phosphiten geführt, die eine verbesserte Wirksamkeit für die Stabilisierung aufweisen.
- Sterisch gehinderte organische Phosphite und insbesondere die Phosphite, die auf Pentaerythrit basieren und Alkyl-, Aryl- oder Alkyl-substituierte Arylgruppen enthalten, worin die Substitution aus der Gruppe ausgewählt ist, die aus t-Butyl, t-Amyl, t-Hexyl, t-Cyclohexyl, t-Pentyl und t-Octyl besteht, sind aufgrund ihrer erhöhten hydrolytischen Stabilität, Leichtigkeit der Handhabung und Kompatibilität mit einer großen Vielfalt von polymeren Systemen besonders wünschenswerte Verbindungen. Die Bis(2,4-di-tert-butylphenyl)pentaerythritdiphosphite sind wegen ihrer verbesserten hydrolytischen Stabilität gegenüber anderen Alkyl-substituierten Phosphiten sowie ihrer erhöhten Kompatibilität mit einigen polymeren Harzen, insbesondere Polyolefinen, ebenfalls besonders bevorzugt.
- Die organischen Diphosphite werden im Allgemeinen unter Verwendung von Verfahren hergestellt, welche Reaktionen zwischen den geeigneten Hydroxy-Verbindungen und Phosphor(III)-trihalogeniden, z. B. Phosphor(III)-trichlorid, beinhalten. Derartige Verfahren und andere nützliche Verfahren sind in den U.S. Patenten Nr. 3,839,556, 4,116,926, 4,290,976, 4,440,696 und 4,492,661 beschrieben. Die Leichtigkeit des Ersatzes der Halogenide am Phosphor(III)-trihalogenid nimmt ab, wenn jeweils ein Halogenid ersetzt wird. Beispielsweise reagieren bei der Herstellung von Bis(aryl)pentaerythritdiphosphiten die Pentaerythrithydroxyle leicht mit einem Phosphor(III)-trihalogenid, um ein Bis(disubstituiertes)halogenophosphit zu liefern (d. h. ein disubstituiertes Diphosphorohalidit-Zwischenprodukt). Die Verdrängung der dritten Halogengruppe ist weniger als quantitativ und weist eine beträchtlich langsamere Geschwindigkeit auf. Zusätzlich ist die Verdrängung der dritten Halogengruppe durch ein sterisch gehindertes Phenol sogar noch schwieriger und erfordert erhöhte Temperaturen und/oder die Verwendung eines Katalysators.
- Um die Reaktionsgeschwindigkeit und den Grad der Beendigung der Verdrängung des dritten Halogenids mit einer sterisch gehinderten Einheit zu erhöhen, sind allgemein verschiedene Techniken im Stand der Technik verwendet worden. Diese Techniken umfassen: Erhöhen der Reaktionsmischungstemperatur und Verwendung von Halogenwasserstoff-Akzeptoren, z. B. Aminen. Derartige Techniken sind in den U.S. Patenten Nr. 3,281,506, 4,237,075, 4,312,818, 4,440,696 und 4,894,481 beschrieben.
- Die GB-A-2041938 offenbart ein Verfahren zur Herstellung von Phenol-freien aromatischen Polyphosphiten durch Umsetzung einer disubstituierten Pentaerythrit-Verbindung, in welcher der Substituent Halogen, Amino, Dialkylamino, Anilino, Morpholino oder Methylanilino ist, mit einer Bis(gehinderten phenolischen)-Verbindung durch Erwärmen unter verringertem Druck.
- Im Allgemeinen haben im Fall von Diphosphiten, die von Pentaerythrit abstammen, die Verfahren des Standes der Technik unerwünschte Produktmischungen zum Ergebnis, die Käfigstrukturen einschließen, in denen drei der Hydroxyle an einem einzigen Pentaerythrit mit einem Phosphor(III)-trihalogenid reagiert haben. Zusätzlich werden auch verschiedene Polyphosphit-Verbindungen gebildet, was zu niedrigen Umwandlungen in das gewünschte Produkt führt. Die resultierende Phosphit-Mischung, die ein Halogenophosphit enthält, ist äußerst schwierig zu reinigen, und das rückständige Halogenophosphit kann zu Säure-Verunreinigungen führen, welche die Langzeitstabilität des gewünschten organischen Phosphits beeinflussen. Es ist deshalb offensichtlich, dass weiterhin ein Bedarf an verbesserten Verfahren zur Herstellung von Bis(dialkylphenyl)pentaerythritdiphosphiten und insbesondere Bis(2,4-di-tert-butylphenyl)pentaerythritdiphosphit besteht, welche die oben erwähnten Schwierigkeiten überwinden.
- Zusammenfassung der Erfindung
- Die vorliegende Erfindung betrifft ein neues Verfahren zur Herstellung von organischen Spirobisphosphiten aus Bis(halogenophosphiten) und Hydroxyl-haltigen Verbindungen, bevorzugt sterisch gehinderten Phenolen, worin Vakuum verwendet wird, um die Veresterungsreaktion zwischen den Bis(halogenophosphiten) und Hydroxyl-haltigen Verbindungen anzutreiben.
-
-
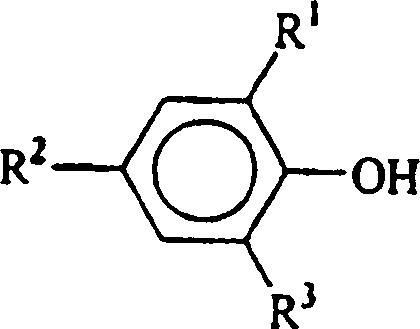
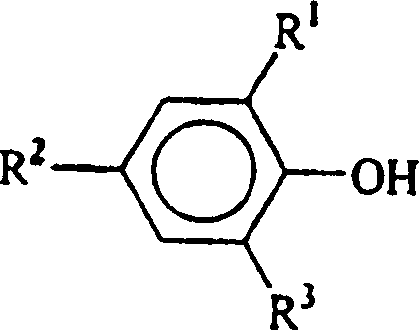
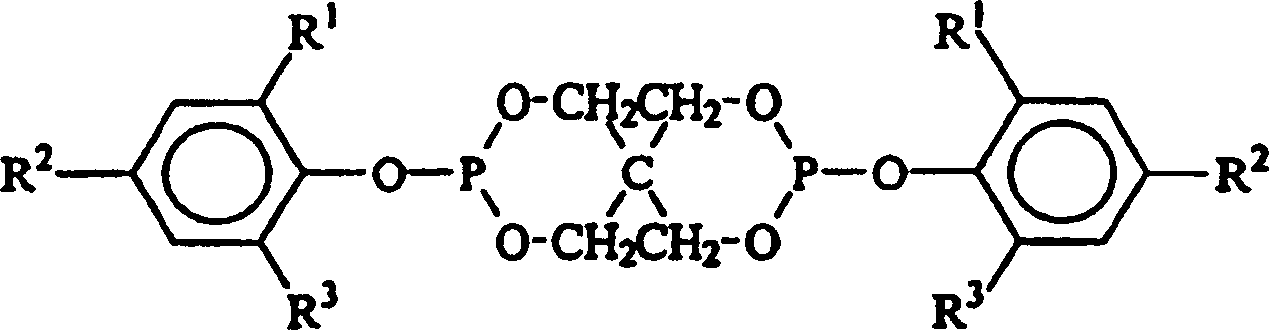
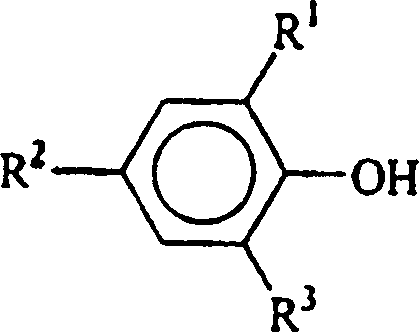
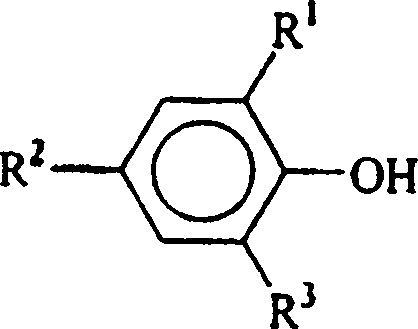
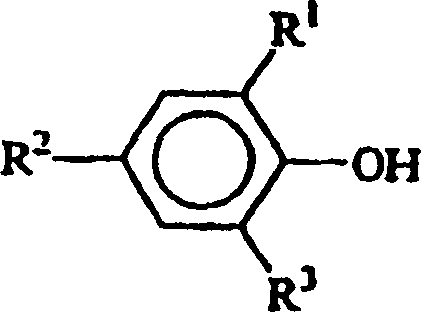
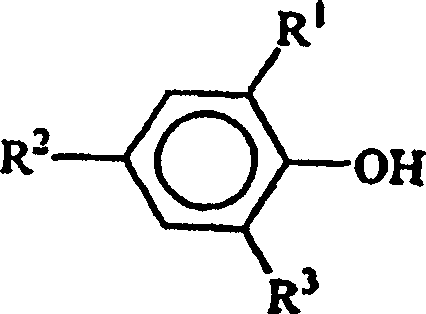
- In einer dritten Ausführungsform der vorliegenden Erfindung ist die Hydroxyl-haltige Verbindung ein Phenol der allgemeinen Formel: in der R1, R2 und R3 jeweils unabhängig aus der Gruppe ausgewählt sind, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht.
- In einer vierten Ausführungsform der vorliegenden Erfindung ist die Hydroxyl-haltige Verbindung ein Phenol der allgemeinen Formel: in der R1, R2 und R3 jeweils unabhängig aus der Gruppe ausgewählt sind, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, mit der Maßgabe, dass mindestens eines von R1 und R2 t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl oder t-Octyl ist.
- In einer fünften Ausführungsform der vorliegenden Erfindung ist die Hydroxyl-haltige Verbindung ein Phenol der allgemeinen Formel: in der R1, R2 und R3 jeweils unabhängig aus der Gruppe ausgewählt sind, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, mit der Maßgabe, dass mindestens eines von R1 und R2 t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl oder t-Octyl ist und R3 Wasserstoff ist.
-
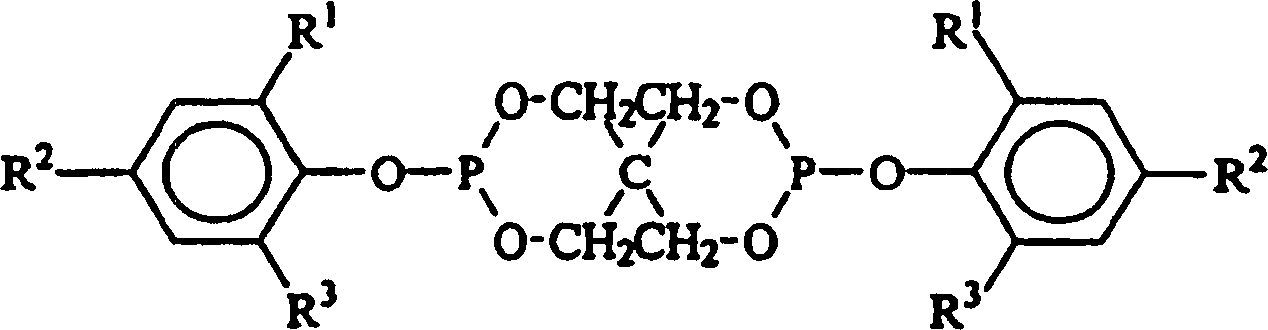
- In einer siebten Ausführungsform der vorliegenden Erfindung weist das organische Spirobisphosphit die Formel: auf, in der jedes R1, R2 und R3 unabhängig aus der Gruppe ausgewählt ist, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht.
- In einer achten Ausführungsform der vorliegenden Erfindung weisen die organischen Spirobisphosphite die Formel: auf, in der jedes R1, R2 und R3 unabhängig aus der Gruppe ausgewählt ist, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, mit der Maßgabe, dass mindestens eines von R1 und R2 t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl oder t-Octyl ist.
- In einer neunten Ausführungsform der vorliegenden Erfindung weisen die organischen Spirobisphosphite die Formel: auf, in der jedes R1 und R2 unabhängig aus der Gruppe ausgewählt ist, die aus Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, und R3 Wasserstoff ist.
-
- In einer elften Ausführungsform der vorliegenden Erfindung wird ein Vakuum von mindestens 508 mbar (15 Inch Quecksilber) an der Veresterungsreaktion zwischen dem Bis(halogenophosphit) und der Hydroxyl-haltigen Verbindung angelegt.
- In einer zwölften Ausführungsform der vorliegenden Erfindung wird ein Vakuum von mindestens 847 mbar (25 Inch Quecksilber) an der Veresterungsreaktion zwischen dem Bis(halogenophosphit) und der Hydroxyl-haltigen Verbindung angelegt.
- In einer dreizehnten Ausführungsform der vorliegenden Erfindung ist die Reaktionsmischung, welche das Bis(halogenophosphit) und die Hydroxyl-haltige Verbindung enthält, im wesentlichen frei von Veresterungskatalysatoren.
- In einer vierzehnten Ausführungsform der vorliegenden Erfindung hat die Umwandlung der organischen Spirobisphosphite der Formel: in der jedes R1 und R2 unabhängig aus der Gruppe ausgewählt sind, die aus Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, und R3 Wasserstoff ist, eine Ausbeute von mindestens 84% zum Ergebnis.
- In einer fünfzehnten Ausführungsform der vorliegenden Erfindung wird die Umwandlung in die organischen Spirobisphosphite aus den Bis(halogenophosphiten) und der Hydroxyl-haltigen Verbindung bei einer Reaktionstemperatur von 30°C bis 140°C vorgenommen.
- In einer sechszehnten Ausführungsform der vorliegenden Erfindung ist die Reaktionsmischung, welches das Bis(halogenophosphit) und die Hydroxyl-haltige Verbindung enthält, im Wesentlichen frei von Veresterungskatalysatoren und wird bei einer Temperatur von weniger als 80°C gehalten.
- Diese und andere Ausführungsformen der vorliegenden Erfindung werden dem Fachmann mit der Offenbarung der vorliegenden Erfindung offenkundig.
- Detaillierte Beschreibung der Erfindung
- Die vorliegende Erfindung betrifft Verfahren zur Herstellung organischer Spirobisphosphite der Formel: in der jedes R1, R2 und R3 unabhängig aus der Gruppe ausgewählt ist, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht. Allgemein werden organische Phosphite typisch durch Umsetzung eines Phosphor(III)-trihalogenids, z. B. Phosphor(III)-trichlorid, mit Hydroxyl-haltigen Verbindungen erzeugt, wobei die Halogenide an dem Phosphor(III)-trihalogenid durch die Hydroxyl-haltigen Verbindungen verdrängt werden. Die Leichtigkeit der Substitution durch die Hydroxyl-haltigen Verbindungen hängt zumindest teilweise von dem sterischen Volumen der Hydroxyl-haltigen Verbindungen ab. Wenn die Hydroxyl-haltige Verbindung eine geringe sterische Anforderung aufweist (d. h. die Hydroxyl-haltige Verbindung keine sterisch gehinderte Hydroxyl-haltige Verbindung ist), ist die Verdrängung der Halogenide etwas statistisch. Wenn jedoch die sterische Anforderung der Hydroxyl-haltigen Verbindung zunimmt, kann eine erhöhte Selektivität erhalten werden, um weniger substituierte Halogenophosphite zu erzielen. Bei der Verdrängung der ersten zwei Halogenide am Phosphor(III)-trihalogenid sind die Reaktionen im Allgemeinen leicht und verlaufen unabhängig von den sterischen Begrenzungen der Hydroxyl-haltigen Verbindung ohne das Erfordernis für Katalyse bis zur Beendigung.
- Bei der Verdrängung der dritten Halogenid-Einheit aus dem disubstituierten Phosphorhalogenid wird der Grad der Umwandlung in das trisubstituierte Phosphit nachteilig durch sterische Berücksichtigungen sowohl des disubstituierten Phosphorhalogenids als auch der Hydroxyl-haltigen Verbindung beeinflusst. Katalysatoren, einschließlich Aminen, werden in der Technik häufig verwendet, um den Grad der Umwandlung in das trisubstituierte Phosphit zu erhöhen. Leider haben Amin-Katalysatoren Aminhalogenidsalz-Verunreinigungen in der gewünschten Spirobisphosphit-Verbindung zum Ergebnis, und es müssen Reinigungsschritte vorgenommen werden, um das Salz zu entfernen.
- Die Erhöhung der Reaktionstemperatur ist ebenfalls in der Technik bekannt, um ein Antreiben der Reaktion zur Beendigung zu unterstützen. Im Fall von Spirobisphosphiten, die von Pentaerythrit abstammen, führt die Erhöhung der Temperatur über 80°C zur Zunahme der Konzentration an Nebenprodukten der allgemeinen Formel: worin Y Halogen oder eine andere gute Abgangsgruppe ist und jedes G unabhängig ein Phosphor oder Wasserstoff sein kann. Wenn G ein Phosphor ist, sind verschiedene Polyphosphit-Verbindungen möglich. Diese Nebenprodukte und andere ähnliche Nebenprodukte sind schwierig aus der gewünschten Spirobisphosphit-Verbindung zu entfernen und sind dem gemäß äußerst unerwünscht.
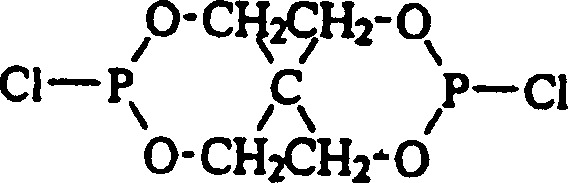
- Es war ziemlich überraschend, zu entdecken, dass die Verwendung von Vakuum die Veresterungsreaktion zwischen dem Bis(halogenophosphit) der allgemeinen Formel: in der Y ein Halogen, bevorzugt Chlor, ist und dem Phenol der allgemeinen Formel: in der R1, R2 und R3 jeweils unabhängig aus der Gruppe ausgewählt sind, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, leicht die Veresterungsreaktion antreiben kann.
- Allgemein ist bei organischen Phosphiten die Verdrängung des dritten Halogenids beträchtlich langsamer als die Verdrängung der anderen Halogenide, jedoch verläuft die Verdrängung häufig so, dass hohe Umwandlungen in das trisubstituierte organo-substituierte Phosphit geliefert werden. Im Fall von Pentaerythritdichlorodiphosphit ist die Reaktion mit 2,4-Di-tert-butylphenol äußerst langsam und verläuft nur bis zu einer Beendigung von etwa 30% nach mehr als 10 Stunden, wenn weder Vakuum noch ein Katalysator verwendet werden. Überraschend führt unter den gleichen Reaktionsbedingungen das Anlegen eines Vakuums von mindestens 339 mbar (10 Inch Quecksilber), vorzugsweise mindestens 508 mbar (15 Inch Quecksilber) und am bevorzugtesten mindestens 677 mbar (20 Inch Quecksilber) an der Reaktionsmischung zu einer mindestens 75%-igen Umwandlung innerhalb von etwa 8 Stunden. Die Größenordnung der Zunahme der Umwandlung ist ziemlich überraschend, wenn sie mit einer Kontrolle verglichen wird, die kein Vakuum verwendet. Darüber hinaus können hohe Umwandlungen ohne die Verwendung von Amin-Katalysatoren und die damit einhergehenden Aminhalogenid-Salze, die aus dem Produkt entfernt werden müssen, erzielt werden. Es ist auch möglich, eine Kombination von Vakuum und Katalysator zu verwenden, um sogar noch höhere und schnellere Umwandlungen zu erzielen, allerdings mit der Notwendigkeit der Entfernung der Katalysator-Nebenprodukte. Es sollte klar sein, dass in einer bevorzugten Ausführungsform der vorliegenden Erfindung die Veresterungsreaktion im Wesentlichen frei von und bevorzugter frei von Veresterungskatalysatoren durchgeführt wird.
- Die Reaktion zwischen Pentaerythrit und Phosphortrihalogenid unter Bildung eines Pentaerythritbisphosphorohalidit-Zwischenprodukts kann mit oder ohne Verwendung eines Lösungsmittels durchgeführt werden. Typisch wird PCl3 verwendet, obwohl andere Phosphorhalogenide oder -derivate verwendet werden können. Im Allgemeinen wird PCl3 zu dem Pentaerythrit gegeben, oder alternativ kann der Pentaerythrit zu PCl3 gegeben werden. Vorzugsweise wird das PCl3 zu dem Pentaerythrit gegeben, wobei die Reaktionsmischung bei einer Temperatur von etwa 5 bis 50°C gehalten wird. Die Reaktion ist in Abwesenheit eines Lösungsmittels exotherm, aber eine temperaturmäßigende Wirkung wird durch die Kühlwirkung der heftigen HCl-Entwicklung erzeugt. Demgemäß kann durch wirksame Steuerung der Zugabe von PCl3 die Reaktion in einem Temperaturbereich zwischen etwa 5 und 15°C selbst-regulierend gemacht werden. Eine langsamere Zugabe begünstigt niedrigere Temperaturen, und es wird bevorzugt, die Reaktionsmischung während der Zugabe zu kühlen. Die Steuerung der Reaktionstemperatur trägt dazu bei, die oben erwähnten Nebenprodukte zu minimieren. Ein leichter Überschuss über stöchiometrische Mengen an PCl3 wird üblicherweise verwendet.
- Wenn ein Lösungsmittel verwendet wird, ist es wichtig, dass das Lösungsmittel gegenüber den Reaktionsbestandteilen und Nebenprodukten neutral ist. Typische Lösungsmittel umfassen beispielsweise Toluol, Heptan, Xylol, Methylenchlorid, Chloroform und Benzol sowie Kohlenwasserstoff-Lösungsmittel wie ISOPAR und NORPAR. Bevorzugte Lösungsmittel sind Methylenchlorid, Heptan oder Xylol. Die Menge an Lösungsmittel kann in großem Maß variieren, abhängig von einer Anzahl von Variablen einschließlich beispielsweise des Reaktoraufbaus und der Rührfähigkeit. Die Bestimmung einer genauen Menge an Lösungsmittel wird ohne übermäßige Experimente leicht bestimmt.
- Diese Reaktion kann zur Beendigung angetrieben werden, und das rückständige Halogenid-Nebenprodukt, wie HCl, kann gegebenenfalls durch sanftes Anheben der Temperatur des Produkts auf Raumtemperatur bis etwa 50°C entfernt werden. Jegliches verwendete Lösungsmittel wird im Allgemeinen mindestens teilweise entfernt, typisch durch Anlegen eines Vakuums, um eine vollständige Entfernung des Halogenwasserstoff-Nebenprodukts sicherzustellen, um ein Pentaerythritbisphosphorohalidit-Zwischenprodukt zu liefern.
- Man lässt als nächstes das Pentaerythritbisphosphorohalidit-Zwischenprodukt mit einer Hydroxy-substituierten Verbindung reagieren, was das gewünschte trisubstituierte organische Phosphit liefert. Die Reaktion zwischen dem Pentaerythritbisphosphorohalidit-Zwischenprodukt und der Hydroxy-substituierten Verbindung kann in demselben Reaktionsgefäß durchgeführt werden, das verwendet wurde, um das Phosphorohalidit-Zwischenprodukt zu erzeugen, indem man lediglich die Hydroxy-substituierte Verbindung einführt, gefolgt vom Anlegen des Vakuums an dem Reaktor. Zusätzlich kann die Farbe des Phosphit- Endprodukts durch die Zugabegeschwindigkeit des Pentaerythritbisphosphorohalidit-Zwischenprodukts gesteuert werden, wobei eine langsamere Zugabegeschwindigkeit zu weniger Farbe im Phosphit-Endprodukt führt. Eine geeignete Zugabegeschwindigkeit kann leicht durch Farbbestimmung des Endprodukts festgelegt werden und hängt auch von Faktoren wie den genauen Reaktionsbedingungen, Verhältnissen der Bestandteile und der verwendeten Ausrüstung ab. Ungeachtet der Reihenfolge der Zugabe wird die Reaktion im Allgemeinen bei einer geeigneten Temperatur zwischen etwa 20 und etwa 175°C und bevorzugt zwischen etwa 60 und etwa 155°C durchgeführt. Der Druck des Systems wird bei einem Vakuum von mindestens 339 mbar (10 Inch Quecksilber), vorzugsweise mindestens 508 mbar (15 Inch Quecksilber) und am bevorzugtesten mindestens 847 mbar (27 Inch Quecksilber) zu Atmosphärendruck gehalten. Man nimmt an, dass der Zweck des Vakuums darin besteht, die Entfernung des Chlorwasserstoffs aus der Reaktionsmischung während der Veresterungsreaktion zu unterstützen. Typische Reaktionszeiten bis zur wesentlichen Beendigung sind bis zu 24 Stunden. Vorzugsweise werden die Temperatur- und Druckbedingungen so gewählt, dass sie die maximale Produktmenge innerhalb einer Zeitspanne von etwa 8 bis etwa 12 Stunden liefern.
- Es geschieht bei der Reaktion des Pentaerythritbisphosphorohalidits und der Hydroxy-substituierten Verbindung, dass, wenn ein Amin-Katalysator verwendet wird, das entsprechende Ammoniumhydrogenchlorid-Salz zwischen dem polymeren Amin und dem Chlorwasserstoff-Nebenprodukt (Chlorid wird hierin beschrieben, da PCl3 das am häufigsten verwendete Ausgangs-Halogenophosphit ist) gebildet wird. Ein weiterer unerwarteter Vorteil der Verwendung von Vakuum ist, dass das Salz aus der Reaktionsmischung eliminiert wird, was auch ein Vorteil unter einem Verfahrensgesichtspunkt ist. Deshalb sollte es klar sein, dass die vorliegende Erfindung ein Verfahren einschließt, das im Wesentlichen und vorzugsweise frei von Amin-Katalysator ist.
- Die Endverhältnisse der Reaktanten sind zumindest ungefähr stöchiometrisch. Es ist häufig wünschenswert, mit mindestens einem leichten stöchiometrischen Überschuss eines der Reaktanten zu arbeiten, um dazu beizutragen, die Reaktion so weit wie möglich zur Beendigung anzutreiben. Es ist häufig vorteilhaft, ein Molverhältnis von 2,0 oder mehr der phenolischen Verbindung zum Bis(halogenophosphit) zu verwenden. In einer bevorzugten Ausführungsform liegt das Verhältnis von phenolischer Verbindung zu Bis(halogenophosphit) im Bereich von etwa 2 bis etwa 2,5 zu 1.
- Das Reaktionsprodukt kann in einem organischen Lösungsmittel gelöst und filtriert werden, um alle festen Materialien zu entfernen. Das Lösungsmittel kann durch Entspannungsdestillation oder eine andere Lösungsmittelentfernungstechnik entfernt werden, oder alternativ kann das Phosphit-Produkt durch Kristallisation oder Fällung aus einem organischen Lösungsmittel isoliert werden. Typische organische Lösungsmittel umfassen Hexan, Heptan, Octan, Isopropylalkohol, Acetonnitril, Toluol, NORPAR, ISOPAR und dergleichen. Das Phosphit-Produkt kann auch unter Verwendung von Schmelzkristallisationstechniken oder Kombinationen von Schmelzkristallisation und Lösungsmittelkristallisation und/oder Fällung gereinigt werden.
- Wenn der Phosphit-Stabilisator in kristalliner Form isoliert wird, zieht die vorliegende Erfindung in Betracht, dass er in fester amorpher Form verwendet werden kann. Die amorphe Phosphit-Verbindung wird durch rasches Abkühlen der Schmelze des Phosphits gebildet. Eine derartige Schmelze kann eine Mischung des Phosphits und von Polyamin sein, die rasch abgekühlt wird, um eine feste amorphe Phosphit-Zusammensetzung zu bilden. Die amorphe Natur der Zusammensetzung erhöht die hydrolytische Stabilität der festen Zusammensetzung, verglichen mit einer kristallinen Zusammensetzung, welche die gleichen Bestandteile enthält.
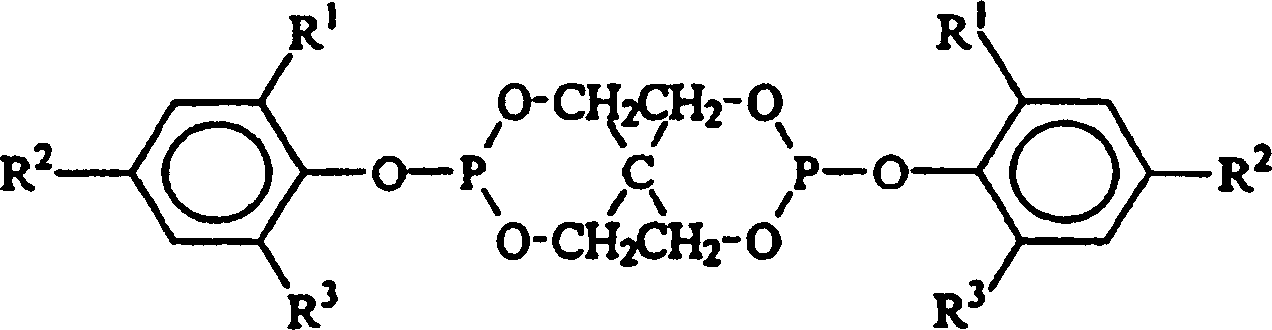
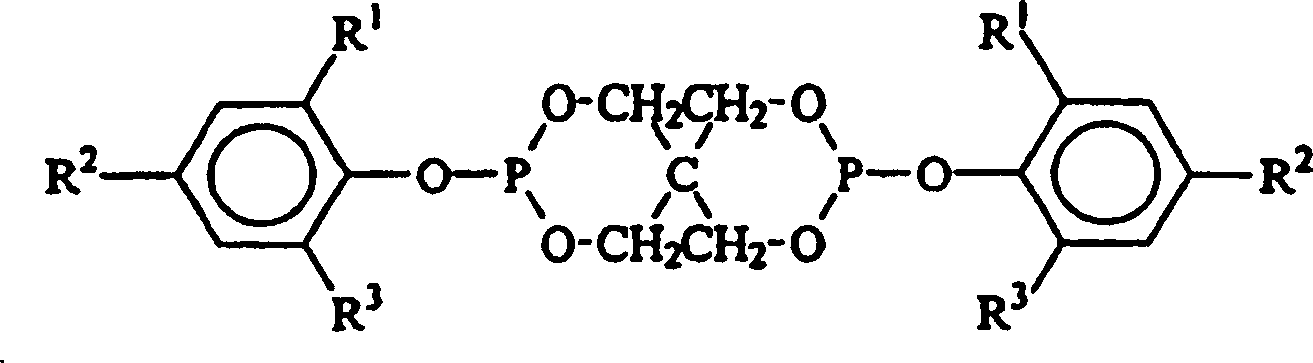
- Die Phosphite, die durch das Verfahren der vorliegenden Erfindung hergestellt werden, umfassen alle organischen Phosphite, die von Pentaerythrit und einer Hydroxyl-haltigen Verbindung abstammen, bei der es sich um ein Phenol der allgemeinen Formel: handelt, in der R1, R2 und R3 jeweils unabhängig aus der Gruppe ausgewählt sind, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht. Besonders bevorzugte Phosphite sind jedoch sterisch gehinderte Spirobisphosphite, in denen die Hydroxyl-haltige Verbindung ein Phenol der allgemeinen Formel: ist, in der R1, R2 und R3 jeweils unabhängig aus der Gruppe ausgewählt sind, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, mit der Maßgabe, dass mindestens eines von R1 und R2 t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl oder t-Octyl ist und R3 Wasserstoff ist. Bei der Durchführung der vorliegenden Erfindung weist ein besonders bevorzugtes organisches Spirobisphosphit die Formel: auf, worin R1 und R2 jeweils t-Butyl sind und R3 Wasserstoff ist.
- Damit der Fachmann besser in der Lage ist, die Erfindung durchzuführen, werden die folgenden Beispiele zur Erläuterung und nicht zur Beschränkung angegeben.
- Beispiele
- Allgemeines Verfahren
- Ein Reaktionsgefäß wurde mit 2,4-Di-t-butylphenol (0,22 Mol) und Xylol (14 Gramm) beschickt und unter Inertatmosphäre auf etwa 60°C erwärmt. Ein Bis(halogenophosphit) der allgemeinen Formel: wurde dazugegeben (0,10 Mol in 26 Gramm Xylol), und die Reaktionsmischung wurde etwa 10 Stunden bei etwa 60 bis 80°C gehalten. Der Grad der Produktumwandlung in das trisubstituierte Phosphit wurde durch Gaschromatographie gemessen. Das End-Phosphit wurde aus Acetonitril oder Isopropylalkohol kristallisiert. Das resultierende Phosphit wies die Formel: auf, in der R1 und R2 jeweils t-Butyl sind und R3 Wasserstoff ist. Die Ausbeute betrug 28,7%, bezogen auf die Menge an Bis(halogenophosphit).
- Vakuumverfahren
- Das allgemeine Verfahren wurde mit der zusätzlichen Maßnahme durchgeführt, dass ein Vakuum von 847 mbar (25 Inch Quecksilber) nach Zugabe der Bis(halogenophosphit)/Xylol-Lösung angelegt wurde. Nach etwa 8 Stunden wurde das gleiche resultierende Phosphit mit einer Ausbeute von 76,5%, bezogen auf die Menge an Bis(halogenophosphit), erhalten.
- Das obige Beispiel demonstriert die unerwartete hohe Umwandlung, die mit der Verwendung eines Vakuums, das an die Reaktionsmischung angelegt wird, erhalten werden kann. Diese Ergebnisse sind unerwartet, da HCl unter den Reaktionsbedingungen sehr flüchtig ist, so dass man erwarten würde, dass das Anlegen eines Vakuums wenig Auswirkung auf die Umwandlungsrate hat.
Claims (11)
- Verfahren zur Herstellung eines organischen Spirobisphosphits der Formel: in der jedes R1, R2 und R3 unabhängig aus der Gruppe ausgewählt ist, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, wobei das Verfahren das Erwärmen einer Reaktionsmischung, die ein Bis(halogenophosphit) der allgemeinen Formel: in der Y ein Halogen ist, und eine phenolische Verbindung der allgemeinen Formel: enthält, in der R1, R2 und R3 jeweils unabhängig aus der Gruppe ausgewählt sind, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, und das Anlegen eines Vakuums von mindestens 339 mbar (10 Inch Quecksilber) umfasst.
- Verfahren nach Anspruch 1, in dem das Bis(halogenophosphit) die allgemeine Formel: aufweist, in der R1, R2 und R3 jeweils unabhängig aus der Gruppe ausgewählt ist, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht.
- Verfahren nach Anspruch 1, in dem die phenolische Verbindung die allgemeine Formel: aufweist, in der jedes R1, R2 und R3 unabhängig aus der Grupep ausgewählt ist, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, mit der Maßgabe, dass mindestens eines von R1 und R2 t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl oder t-Octyl ist und R3 Wasserstoff ist.
- Verfahren nach Anspruch 1, in dem das Spirobisphosphit die allgemeine Formel: aufweist, in der jedes R1, R2 und R3 unabhängig aus der Gruppe ausgewählt ist, die aus Wasserstoff, Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl und t-Octyl besteht, mit der Maßgabe, dass mindestens eines von R1 und R2 t-Butyl, t-Amyl, t-Hexyl, Cyclohexyl, Cumyl, t-Pentyl oder t-Octyl ist und R3 Wasserstoff ist.
- Verfahren nach Anspruch 1, in dem das Verfahren weiter das Erwärmen des Bis(halogenophosphits), der phenolischen Verbindung und des polymeren Amins in einem Lösungsmittel umfasst.
- Verfahren nach Anspruch 1, in dem ein Vakuum von mindestens 508 mbar (15 Inch Quecksilber) an der Reaktionsmischung angelegt wird.
- Verfahren nach Anspruch 1, in dem ein Vakuum von mindestens 847 mbar (25 Inch Quecksilber) an der Reaktionsmischung angelegt wird.
- Verfahren zur Herstellung eines organischen Spirobisphosphits der Formel: in der R1 und R2 jeweils 2,4-Di-tert-butyl sind und R3 Wasserstoff ist, wobei das Verfahren das Erwärmen einer Reaktionsmischung, die ein Bis(halogenophosphit) der Formel: in der Y für Chlor steht, und eine phenolische Verbindung der Formel: enthält, in der R1 und R2 jeweils t-Butyl sind und R3 Wasserstoff ist, und das Anlegen eines Vakuums von mindestens 339 mbar (10 Inch Quecksilber) an der Reaktionsmischung umfasst.
- Verfahren nach Anspruch 9, in dem die Temperatur der Reaktionsmischung zwischen 30°C und 140°C gehalten wird.
- Verfahren nach Anspruch 9, in dem ein Vakuum von mindestens 508 mbar (15 Inch Quecksilber) an der Reaktionsmischung angelegt wird.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/048,369 US5919966A (en) | 1998-03-26 | 1998-03-26 | Process for the preparation of spiro bis-phosphites |
| US48369 | 1998-03-26 | ||
| PCT/US1999/005206 WO1999048900A1 (en) | 1998-03-26 | 1999-03-10 | Process for the preparation of spiro bisphosphites |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69918077D1 DE69918077D1 (de) | 2004-07-22 |
| DE69918077T2 true DE69918077T2 (de) | 2004-10-14 |
Family
ID=21954204
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69918077T Expired - Lifetime DE69918077T2 (de) | 1998-03-26 | 1999-03-10 | Verfahren zur herstellung von spirobisphosphiten |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US5919966A (de) |
| EP (1) | EP1066299B1 (de) |
| JP (1) | JP4272814B2 (de) |
| KR (1) | KR100622744B1 (de) |
| AT (1) | ATE269346T1 (de) |
| DE (1) | DE69918077T2 (de) |
| ES (1) | ES2221369T3 (de) |
| WO (1) | WO1999048900A1 (de) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5917076A (en) * | 1998-04-16 | 1999-06-29 | General Electric Company | Process for the preparation of spiro bis-phosphites using finely ground pentaerythritol |
| US6426429B1 (en) | 2000-08-11 | 2002-07-30 | General Electric Company | Process for the preparation of hindered phosphites |
| US7442732B2 (en) * | 2005-03-29 | 2008-10-28 | Crompton Corporation | Hindered amine light stabilizers comprising neoalkanediol phosphites |
| CN1948321B (zh) * | 2005-10-11 | 2010-04-28 | 上海化学试剂研究所 | 双(2,4-二枯基苯基)季戊四醇双亚磷酸酯的制备方法 |
| WO2011040287A1 (ja) * | 2009-10-01 | 2011-04-07 | 大八化学工業株式会社 | 環状アルキレンホスホロハリダイトおよび環状リン酸エステルの製造方法 |
| KR102684992B1 (ko) | 2018-10-11 | 2024-07-16 | 에스케이온 주식회사 | 리튬 이차전지 전해액 및 이를 포함하는 리튬 이차전지 |
| CN111606953A (zh) * | 2020-07-02 | 2020-09-01 | 浙江万盛股份有限公司 | 一种季戊四醇型双磷酸酯的制备方法 |
Family Cites Families (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3056823A (en) * | 1956-05-31 | 1962-10-02 | Hooker Chemical Corp | Transesterification process for making trialiphatic phosphite esters |
| US3281381A (en) * | 1958-06-17 | 1966-10-25 | Hooker Chemical Corp | Reaction products of pentaerythritol and phosphites as vinyl chloride stabilizer |
| US3039993A (en) * | 1960-05-10 | 1962-06-19 | Weston Chemical Corp | Polyethylene stabilizers |
| US3281506A (en) * | 1962-08-31 | 1966-10-25 | Hooker Chemical Corp | Secondary phosphites and process for manufacture thereof |
| US3364285A (en) * | 1963-05-18 | 1968-01-16 | Agfa Ag | Process for the production of spirocyclic phosphoric acid esters |
| US3415906A (en) * | 1964-05-29 | 1968-12-10 | Hooker Chemical Corp | Phosphite phospholane and phosphorinane compounds |
| US3342767A (en) * | 1964-06-10 | 1967-09-19 | Ferro Corp | Vinyl chloride resins containing cyclic phosphites |
| US3305526A (en) * | 1964-07-07 | 1967-02-21 | Weston Chemical Corp | Phenoxy phosphite polymers |
| US3467733A (en) * | 1965-11-26 | 1969-09-16 | Hooker Chemical Corp | Cyclic esters of phosphorus and a process for the preparation thereof |
| US3488407A (en) * | 1965-11-26 | 1970-01-06 | Hooker Chemical Corp | Cyclic esters of phosphorus |
| US3441633A (en) * | 1965-12-03 | 1969-04-29 | Weston Chemical Corp | Cyclic phosphites |
| US3558554A (en) * | 1966-06-09 | 1971-01-26 | Yoshitomi Pharmaceutical | Oxidatively stable polyolefin composition |
| US3482002A (en) * | 1966-07-27 | 1969-12-02 | Hooker Chemical Corp | Phosphorus acid-carboxylic acid anhydrides |
| US3714302A (en) * | 1969-07-08 | 1973-01-30 | Borg Warner | Preparation of neoalkyl phenyl phosphite |
| US3845168A (en) * | 1970-01-16 | 1974-10-29 | Weston Chemical Corp | Trimethylol propane phosphite |
| US4024049A (en) * | 1975-01-07 | 1977-05-17 | Nalco Chemical Company | Mono and di organophosphite esters as crude oil antifoulants |
| NL7506988A (nl) * | 1975-06-12 | 1976-12-14 | Akzo Nv | Organische trifosfieten met verbeterde hydrolyti- sche stabiliteit. |
| US4067903A (en) * | 1975-10-04 | 1978-01-10 | Basf Aktiengesellschaft | Manufacture of arylamines |
| US4440696A (en) * | 1977-08-08 | 1984-04-03 | Ciba-Geigy Corporation | Process for producing triarylphosphites |
| DE2860898D1 (en) * | 1977-08-08 | 1981-11-05 | Ciba Geigy Ag | Process for the preparation of triarylphosphites |
| US4492661A (en) * | 1977-08-08 | 1985-01-08 | Ciba-Geigy Corporation | Process for producing triarylphosphites |
| US4196117A (en) * | 1978-01-03 | 1980-04-01 | Ciba-Geigy Corporation | Alkylated 1,1'-biphenyl-2,2'-diyl phosphites and stabilized compositions |
| US4276233A (en) * | 1978-11-02 | 1981-06-30 | General Electric Company | Hindered phenol phosphites |
| CA1136152A (en) * | 1979-02-05 | 1982-11-23 | Ingenuin Hechenbleikner | Process for preparing aromatic polyphosphites |
| US4237075A (en) * | 1979-06-05 | 1980-12-02 | Mobil Oil Corporation | Formamide catalysts for reacting phosphorus halides with thiols |
| US4322530A (en) * | 1980-02-22 | 1982-03-30 | W. R. Grace & Co. | Alkylation of polyamines |
| JPS56152863A (en) * | 1980-04-28 | 1981-11-26 | Adeka Argus Chem Co Ltd | Synthetic resin composition |
| US4407765A (en) * | 1980-07-02 | 1983-10-04 | Stauffer Chemical Company | Synthesis of organic phosphate-phosphonates |
| DE3025377C2 (de) * | 1980-07-04 | 1983-06-23 | Bayer Ag, 5090 Leverkusen | Verfahren zur Herstellung von Benzolphosphonsäurediphenylester |
| US4318845A (en) * | 1980-11-24 | 1982-03-09 | Ciba-Geigy Corporation | Alkanolamine esters of 1,1'-biphenyl-2,2'-diyl-and alkylidene-1,1'-biphenyl-2,2'-diyl-cyclic phosphites |
| US4656302A (en) * | 1985-03-08 | 1987-04-07 | Koppers Company, Inc. | Tris-(3-hydroxy-4,6-di-t-alkylphenyl) phosphites |
| US4705879A (en) * | 1986-01-13 | 1987-11-10 | Koppers Company, Inc. | Long-chain alkylresorcinol phosphites |
| US4724056A (en) * | 1987-03-05 | 1988-02-09 | Stauffer Chemical Company | Pollution-free process for making trialkyl phosphites |
| US4786329A (en) * | 1987-09-09 | 1988-11-22 | The Dow Chemical Company | Asphalt compositions containing anti-stripping additives prepared from amines or polyamines and phosphonates |
| US4894481A (en) * | 1988-07-05 | 1990-01-16 | Ethyl Corporation | Method of making cyclic aryl chlorophosphites |
| US4882374A (en) * | 1989-02-06 | 1989-11-21 | Eastman Kodak Company | Dioxaphosphorinane compounds and polyolefin compositions sabilized therewith |
| US5235086A (en) * | 1989-08-15 | 1993-08-10 | Ciba-Geigy Corporation | Process for the preparation of tris(2,4-ditert-butylphenyl)phosphite |
| US5254709A (en) * | 1989-12-08 | 1993-10-19 | Uniroyal Chemical Company, Inc. | Method for preparing stearically hindered aryl phosphites |
| DE3942787A1 (de) * | 1989-12-23 | 1991-06-27 | Hoechst Ag | Verfahren zur herstellung hydrolysestabiler organischer phosphite |
| US5141975A (en) * | 1991-06-07 | 1992-08-25 | General Electric Company | Thermoplastic compositions containing hydrolytically stable phosphites |
| DE59310187D1 (de) * | 1992-10-05 | 2001-08-16 | Ciba Sc Holding Ag | Verfahren zur Stabilisierung dreiwertiger Phosphorverbindungen mit Aminen |
| EP0635514B1 (de) * | 1993-07-22 | 1999-05-12 | General Electric Company | Neo-Diol Phosphite als Polymer-Stabilisatoren |
| KR100413583B1 (ko) * | 1993-08-30 | 2004-05-10 | 도버 케미칼 코포레이션 | 가수분해안정성펜타에리트리톨디포스파이트 |
| EP0702019A1 (de) * | 1994-09-16 | 1996-03-20 | General Electric Company | Flüssige Neo-Diol Phosphite als Polymer-Stabilisatoren |
| US5468895A (en) * | 1994-10-19 | 1995-11-21 | General Electric Company | Amine stabilized amorphous phosphite |
-
1998
- 1998-03-26 US US09/048,369 patent/US5919966A/en not_active Expired - Lifetime
-
1999
- 1999-03-10 KR KR1020007010619A patent/KR100622744B1/ko not_active Expired - Fee Related
- 1999-03-10 WO PCT/US1999/005206 patent/WO1999048900A1/en not_active Ceased
- 1999-03-10 DE DE69918077T patent/DE69918077T2/de not_active Expired - Lifetime
- 1999-03-10 AT AT99911278T patent/ATE269346T1/de not_active IP Right Cessation
- 1999-03-10 ES ES99911278T patent/ES2221369T3/es not_active Expired - Lifetime
- 1999-03-10 EP EP99911278A patent/EP1066299B1/de not_active Expired - Lifetime
- 1999-03-10 JP JP2000537883A patent/JP4272814B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| KR20010034667A (ko) | 2001-04-25 |
| US5919966A (en) | 1999-07-06 |
| ATE269346T1 (de) | 2004-07-15 |
| EP1066299A1 (de) | 2001-01-10 |
| DE69918077D1 (de) | 2004-07-22 |
| KR100622744B1 (ko) | 2006-09-13 |
| WO1999048900A1 (en) | 1999-09-30 |
| ES2221369T3 (es) | 2004-12-16 |
| JP4272814B2 (ja) | 2009-06-03 |
| EP1066299B1 (de) | 2004-06-16 |
| JP2002507620A (ja) | 2002-03-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0708109B1 (de) | Verfahren zur Herstellung phosphorhaltiger Dicarbonsäuren | |
| DE69918077T2 (de) | Verfahren zur herstellung von spirobisphosphiten | |
| EP0075697B1 (de) | Verfahren zur Herstellung von gegebenenfalls polymeren Organosilanestern mit Polyolen | |
| EP0435071B1 (de) | Verfahren zur Herstellung hydrolysestabiler organischer Phosphite | |
| DE3783941T2 (de) | Verfahren zur herstellung von fluessigen triarylthiophosphat-mischungen. | |
| EP0159294B1 (de) | Verfahren zur Herstellung cyclischer Phosphorigsäureester | |
| DE2643474C2 (de) | Verfahren zur Herstellung von Phosphitchloriden | |
| DE69903145T2 (de) | Herstellung von spirobis-phosphiten aus feingemahlenem pentaerythritol | |
| DE2643442C2 (de) | Verfahren zur Herstellung von Phosphitchloriden | |
| DE3134363C2 (de) | ||
| DE69809516T2 (de) | Verbessertes Herstellungsverfahren für Phosphite | |
| DE60105171T2 (de) | Verfahren zur herstellung von gehinderten phosphiten | |
| EP0130439B1 (de) | Verfahren zur Herstellung von Derivaten der Vinylphosphon-, oder Vinylpyrophosphonsäure | |
| EP0537197B1 (de) | Verfahren zur herstellung von phosphonigsäure-arylester- halogeniden | |
| EP0568012B1 (de) | Bisphosphinoalkane | |
| DD233373A5 (de) | Verfahren zur herstellung von imidazolidinderivaten | |
| DE2140298A1 (de) | Verfahren zur Herstellung von Dihalo genvinylphosphorodichlondaten | |
| EP0061106A2 (de) | Verfahren zur Herstellung von Oligophosphonsäuren bzw. Oligophosphinsäuren, ihren Salzen und/oder Estern sowie neue Phosphonsäurederivate | |
| EP0003553B1 (de) | Verfahren zur Herstellung von O,S-Dialkylthiophosphorsäurechloriden | |
| DE1198374B (de) | Verfahren zur Herstellung von Thionophosphor-saeure-O-phenyl-O, O-dialkylestern mit niederen Alkylgruppen | |
| AT292017B (de) | Verfahren zur Herstellung von substituierten Vinylestern von Phosphorsäuren | |
| DD260071A5 (de) | Verfahren zur herstellung von 0-alkyl-s,s-dialkyl-di-thiophosphaten | |
| DE2064107A1 (de) | Verfahren zur Herstellung von Cephem-4-carbonsäureestern | |
| EP0748812A1 (de) | Neue Oxaphosphorine und Verfahren zu ihrer Herstellung | |
| DE10156292A1 (de) | Verfahren zur Herstellung von Organodiphosphoniten |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |