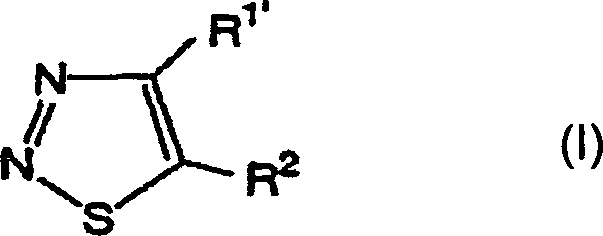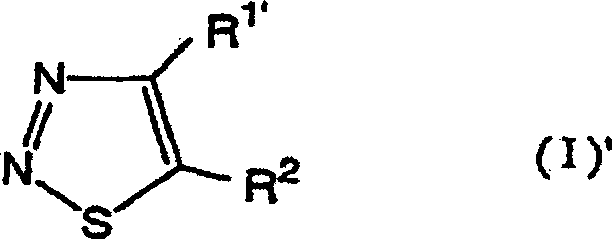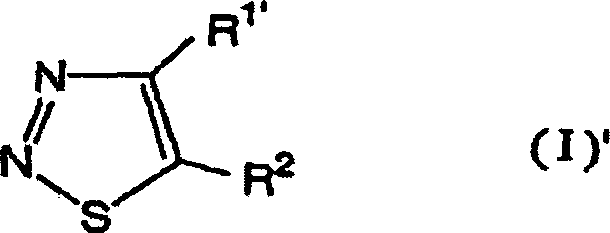-
Die vorliegende Erfindung bezieht
sich auf 1,2,3-Thiadiazolderivate, Mittel zur Bekämpfung von
Pflanzenkrankheiten, welche diese Verbindungen als Wirkstoff enthalten,
und ein Verfahren zum Verwenden derselben.
-
Stand der
Technik
-
In JP-A-54-9272 sind 1,2,3-Thiadiazol-5-carbonsäurederivate,
ein Verfahren zum Herstellen dieser Verbindungen und Zusammensetzungen
mit herbiziden und das Pflanzenwachstum regelnden Aktivitäten, welche
diese Verbindungen enthalten, offenbart. Ferner ist im kanadischen
Patent Nr. 947297, JP-A-55-141476 und JP-A-56-108776 offenbart,
dass Benzoxazinderivate als Herbizid brauchbar sind. WO-A-96/29871
offenbart ein Mittel zur Bekämpfung
von landwirtschaftlichen Krankheiten, das spezifische 1,2,3-Thiadiazolderivate
umfasst.
-
Die Mikroorganismen und Eumyceten,
welche mit Fungiziden bekämpft
werden sollen, sind gekennzeichnet durch einen schnellen Wechsel
der Generationen und das Problem der Resistenz gegenüber Fungiziden
ist schon lange erörtert
worden. Somit ist es erwünscht,
ein neues Fungizid mit einer ausgezeichneten Wirkung zu entwickeln.
-
Offenbarung
der Erfindung
-
Mit dem Ziel, ein neues Mittel zur
Bekämpfung
von Pflanzenkrankheiten zu entwickeln, haben die Erfinder der vorliegenden
Erfindung sorgfältig
ausgearbeitete Untersuchungen durchgeführt und herausgefunden, dass
die 1,2,3-Thiadiazolderivate der vorliegenden Erfindung, die durch
die allgemeine Formel (I) wiedergegeben werden, als Mittel zur Bekämpfung von
Pflanzenkrankheiten brauchbar sind. Auf der Grundlage dieses Befunds
ist die vorliegende Erfindung zustande gebracht worden.
-
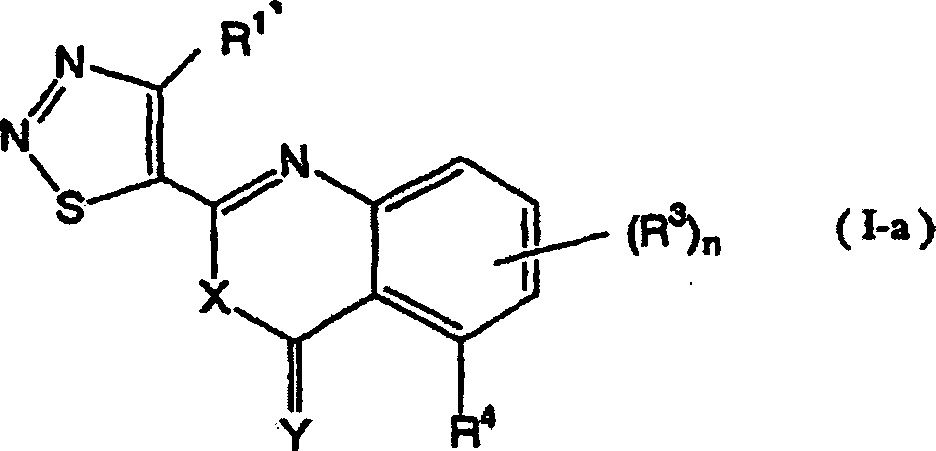
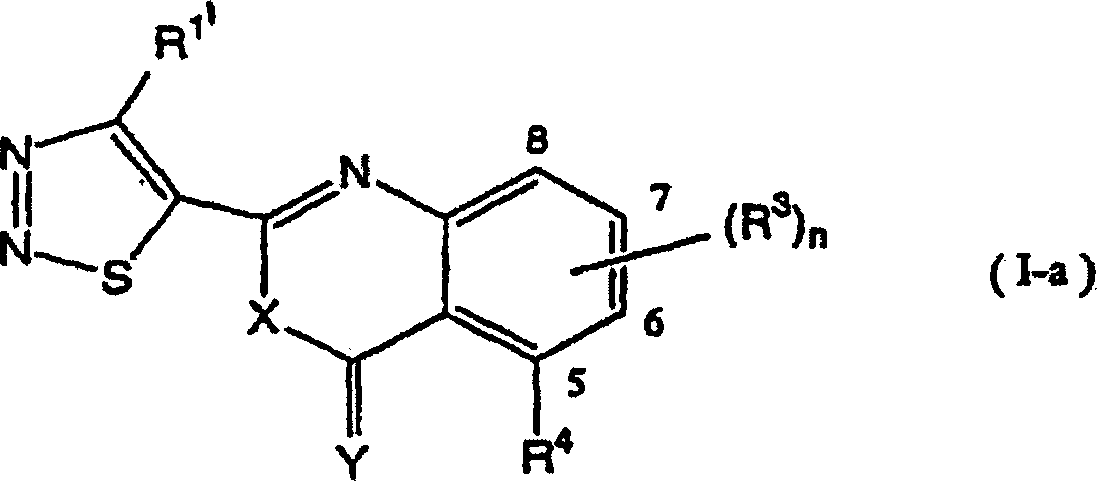
Als typische Verbindungen der vorliegenden
Erfindung können
die 1,2,3-Thiadiazolverbindungen angegeben werden, die durch die
folgende allgemeine Formel (I-a) wiedergegeben werden:
worin R
1', R
3, R
4, n, X und Y
wie nachstehend definiert sind.
-
Das heißt, die vorliegende Erfindung
bezieht sich auf 1,2,3-Thiadiazolderivate, die durch die folgende allgemeine
Formel (I) wiedergegeben werden, ein Mittel zur Bekämpfung von
Pflanzenkrankheiten, welches diese Verbindungen als Wirkstoff enthält, und
ein Verfahren zum Verwenden desselben:
[worin R
1' ein Wasserstoffatom,
eine (C
1-C
6)-Alkylgruppe,
eine Halogen-(C
1-C
6)-alkylgruppe
oder eine (C
3-C
6)-Cycloalkylgruppe
bedeutet; und R
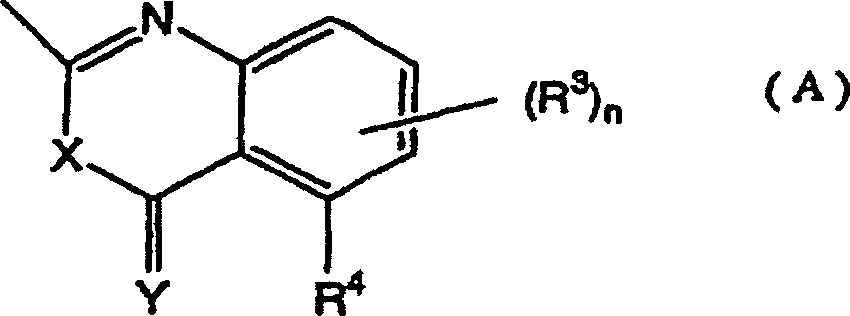
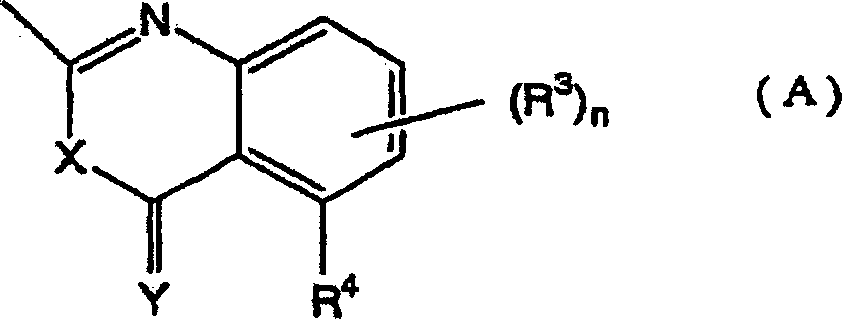
2 die folgende Formel (A)
bedeutet:
(worin R
3,
welche gleich oder verschieden sein können, ein Halogenatom, eine
Cyanogruppe, eine Nitrogruppe, eine Hydroxylgruppe, eine (C
1-C
6)-Alkylgruppe,
eine Halogen-(C
1-C
6)-alkylgruppe,
eine (C
1-C
6)-Alkoxygruppe,
eine Halogen-(C
1-C
6)-akoxygruppe
oder eine Carboxylgruppe bedeuten, n eine ganze Zahl von 0 bis 3
bedeutet und R
4 ein Wasserstoffatom, ein
Halogenatom, eine Cyanogruppe, eine Nitrogruppe, eine Hydroxylgruppe,
eine (C
1-C
6)-Alkylgruppe,
eine Halogen-(C
1-C
6)-alkylgruppe,
eine (C
1-C
6)-Alkoxygruppe, eine
Halogen-(C
1-C
6)-akoxygruppe
oder eine Carboxylgruppe bedeutet, ferner R
3 oder
R
3 und R
4 zusammen
mit einem Kohlenstoffatom der angrenzenden Phenylgruppe einen (C
5-C
6)-Alkenylenring
bilden können
und X und Y gleich oder verschieden sein können und ein Sauerstoffatom
oder ein Schwefelatom bedeuten).
-
Die vorliegende Erfindung stellt
außerdem
bevorzugte Ausführungsformen
der Formel (I)' bereit:
[worin R
1' ein Wasserstoffatom,
eine (C
1-C
6)-Alkylgruppe,
eine Halogen-(C
1-C
6)-alkylgruppe
oder eine (C
3-C
6)-Cycloalkylgruppe
bedeutet; und R
2 eine Gruppe der Formel
(A) bedeutet:
(worin R
3,
welche gleich oder verschieden sein können, ein Halogenatom, eine
Hydroxylgruppe, eine (C
1-C
6)-Alkylgruppe,
eine (C
1-C
6)-Alkoxygruppe,
eine Nitrogruppe oder eine Carboxylgruppe bedeuten, n eine ganze
Zahl von 0 bis 3 bedeutet, R
4 ein Halogenatom,
eine Hydroxylgruppe, eine (C
1-C
6)-Alkylgruppe,
eine (C
1-C
6)-Alkoxygruppe,
eine Nitrogruppe oder eine Carboxylgruppe bedeutet und X und Y gleich
oder verschieden sein können
und mehr bevorzugte Verbindungen sind die 1,2,3-Thiadiazolderivate der
Formel (I)', worin R
1' eine
(C
2-C
6)-Alkylgruppe
oder eine Cyclo-(C
3-C
6)-alkylgruppe
bedeutet, R
2 die Formel (A) bedeutet, in
welcher R
3 gleich oder verschieden sein
können
und ein Halogenatom oder eine (C
1-C
6)-Alkylgruppe bedeuten, n eine ganze Zahl
von 0 bis 1 bedeutet, R
4 ein Wasserstoffatom,
ein Halogenatom oder eine (C
1-C
6)-Alkylgruppe bedeutet
und X und Y Sauerstoffatome bedeuten.
-
Beste Art der Durchführung der
Erfindung
-
Die Definition der allgemeinen Formel
(I), welche die 1,2,3-Thiadiazolderivate der vorliegenden Erfindung
wiedergibt, wird nachstehend erläutert,
in welcher "n-" normal bedeutet, "i-" iso bedeutet, "s-" sekundär bedeutet
und "t-" tertiär bedeutet.
In der Definition der allgemeinen Formel (I) bedeutet der Begriff "Halogenatom" ein Chloratom, Bromatom,
Iodatom oder Fluoratom. Der Begriff (C1-C6)-Alkylgruppe bedeutet eine geradkettige
oder verzweigte Alkylgruppe mit 1 bis 6 Kohlenstoffatomen wie etwa
Methyl, Ethyl, n-Propyl, i-Propyl, n-Butyl, i-Butyl, s-Butyl, t-Butyl,
n-Pentyl, Neopentyl, n-Hexyl.
-
Der Begriff "Halogen-(C1-C6)-alkylgruppe" bedeutet eine geradkettige oder verzweigte
Alkylgruppe mit 1 bis 6 Kohlenstoffatomen, welche mit wenigstens
einem, gleichen oder verschiedenen Halogenatomen substituiert sein
kann. Zu Beispielen dafür
gehören
Chlormethyl, Difluormethyl, Trifluormethyl, Brommethyl, 2-Bromethyl,
1,2-Dichlorpropyl, 2,2,3,3,3-Pentafluorpropyl, 2,3-Dibrombutyl,
4-Iodbutyl, Chlorhexyl.
-
Der Begriff "(C1-C6)-Alkoxygruppe" bedeutet eine geradkettige oder verzweigte
Alkoxygruppe mit 1 bis 6 Kohlenstoffatomen. Zu Beispielen dafür gehören Methoxy,
Ethoxy, i-Propoxy und dergleichen.
-
Der Begriff "(C3-C6)-Cycloalkylgruppe" bedeutet eine cyclische Alkylgruppe
mit 3 bis 6 Kohlenstoffatomen, wobei zu Beispielen dafür Cyclopropyl,
Cyclobutyl, Cyclopentyl, Cyclohexyl und dergleichen gehören.
-
Der Begriff "(C1-C6)-Alkoxygruppe" bedeutet eine geradkettige oder verzweigte
Alkoxygruppe mit 1 bis 6 Kohlenstoffatomen, wobei zu Beispielen
dafür Methoxy,
Ethoxy, i-Propoxy und dergleichen gehören.
-
Der Begriff "Halogen-(C1-C6)-alkoxygruppe" bedeutet eine geradkettige oder verzweigte
Alkoxygruppe mit 1 bis 6 Kohlenstoffatomen, welche mit wenigstens
einem, gleichen oder verschiedenen Halogenatomen substituiert sein
können.
Zu Beispielen dafür
gehören
Trifluormethoxy, 2-Chlorethoxy, 4-Bromethoxy, 4-Iodhexyl und dergleichen.
-
In der vorliegenden Erfindung sind
die folgenden Verbindungen bevorzugt:
-
An R1' sind bevorzugte
Substituenten (C1-C6)-Alkylgruppen
und besonders bevorzugte Substituenten sind (C1-C3)-Alkylgruppen.
-
Wenn R2 durch
die Formel (A) wiedergegeben wird, sind bevorzugte Substituenten
solche, bei denen n Null ist und R4 ein
Wasserstoffatom oder ein Halogenatom ist.
-
In der allgemeinen Formel (I) der
vorliegenden Erfindung können
die 1,2,3-Thiadiazolderivate, die durch die allgemeine Formel (I-a)
wiedergegeben werden, gemäß den nachstehend
erwähnten
Herstellungsverfahren 1 und 2 oder dergleichen hergestellt werden.
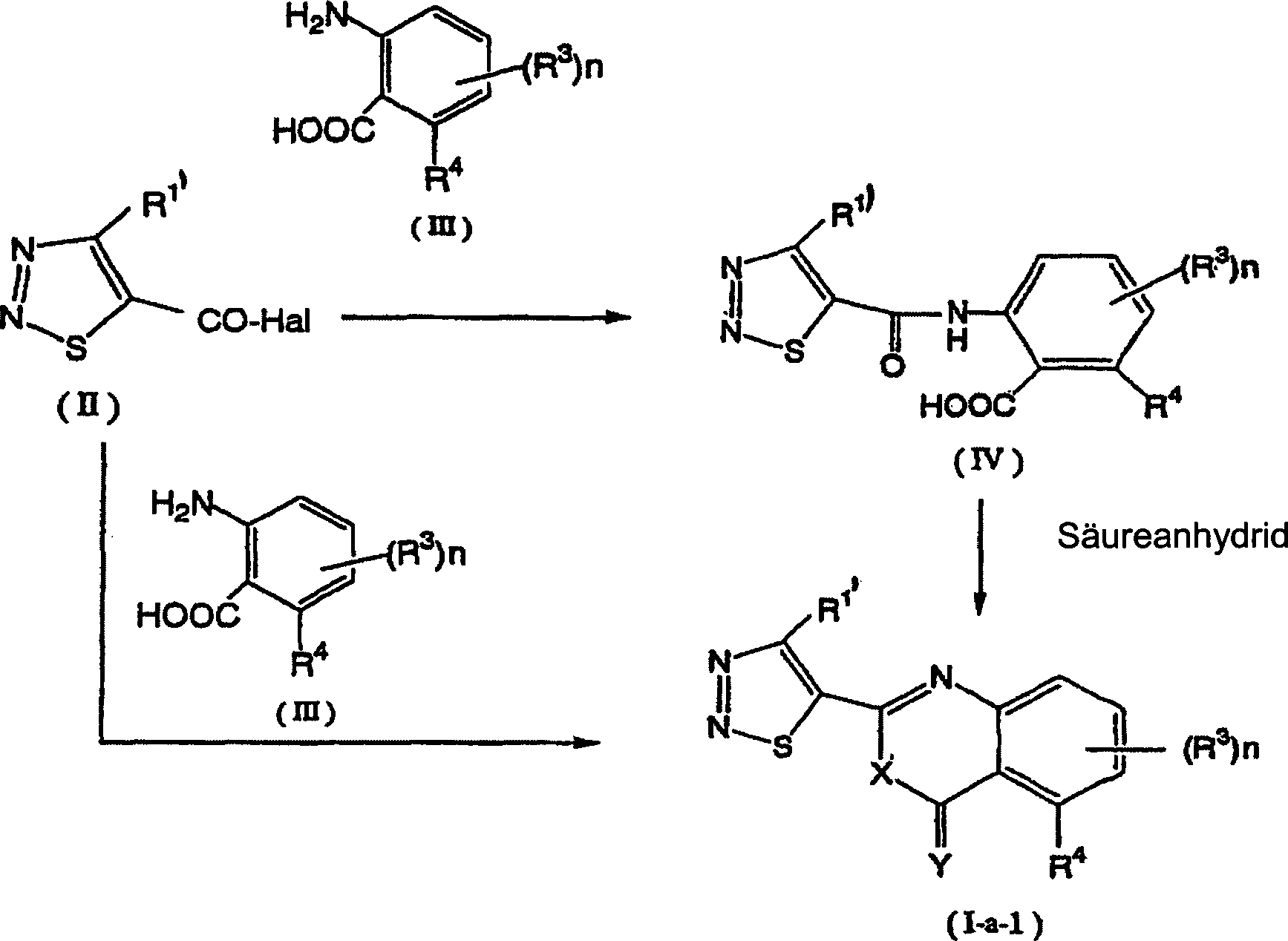
Herstellungsverfahren 1: Wenn R
2 die Formel
(A) bedeutet und X und Y Sauerstoffatome sind
worin
R
1',
R
3, R
4 und n wie
vorstehend definiert sind und Hal ein Halogenatom bedeutet.
-
Das 1,2,3-Thiadiazolderivat, das
durch die allgemeine Formel (I-a-1) wiedergegeben wird, kann durch Umsetzen
einer 1,2,3-Thiadiazolverbindung, die durch die allgemeine Formel
(II) wiedergegeben wird, mit einer Anthranilsäureverbindung, die durch die
allgemeine Formel (III) wiedergegeben wird, in Gegenwart eines inerten
Lösungsmittels
und einer Base unter Bildung einer Verbindung, die durch die allgemeine
Formel (IV) wiedergegeben wird, Isolieren der Verbindung (IV) und
anschließend
Umsetzen der Verbindung (IV) mit einem Säureanhydrid hergestellt werden.
-
Alternativ ist es auch möglich, die
Verbindung, die durch die allgemeine Formel (I-a-1) wiedergegeben wird,
direkt durch Umsetzen einer 1,2,3-Thiadiazolverbindung, die durch
die allgemeine Formel (II) wiedergegeben wird, mit einer Anthranilsäureverbindung,
die durch die allgemeine Formel (III) wiedergegeben wird, in Gegenwart
eines inerten Lösungsmittels
und einer Base herzustellen.
-
1-1. Allgemeine Formel
(II) → allgemeine
Formel (IV)
-
Das in dieser Reaktion verwendete
inerte Lösungsmittel
kann ein beliebiges inertes Lösungsmittel sein,
sofern es nicht das Fortschreiten dieser Reaktion merklich behindert.
Zu Beispielen für
das inerte Lösungsmittel
gehören
Alkohole wie Methanol, Ethanol, Propanol, Butanol und dergleichen;
aromatische Kohlenwasserstoffe wie Benzol, Toluol, Xylol und dergleichen;
halogenierte Kohlenwasserstoffe wie Dichlormethan, Chloroform, Tetrachlorkohlenstoff,
Chlorbenzol und dergleichen; Ester wie Ethylacetat und dergleichen;
Nitrile wie Acetonitril, Benzonitril und dergleichen; acyclische
Ether wie Methylcellosolve, Diethylether und dergleichen; cyclische
Ether wie Dioxan, Tetrahydrofuran und dergleichen; Sulfolan, Dimethylsulfon,
Dimethylsulfoxid, Wasser und dergleichen. Diese inerten Lösungsmittel
können
entweder allein oder in Form eines Gemisches aus zwei oder mehr
verwendet werden.
-
Als die in dieser Reaktion verwendete
Base können
anorganische Basen und organische Basen erwähnt werden. Zu den anorganischen
Basen gehören
Alkalimetallhydroxide wie Natriumhydroxid, Kaliumhydroxid und dergleichen,
Alkalimetallcarbonate und dergleichen. Zu den organischen Basen
gehören
tertiäre Amine
wie Triethylamin und dergleichen und Pyridine. Diese Basen können in
einer Menge verwendet werden, die zweckmäßig in dem Bereich von einer äquimolaren
Menge bis zu molaren Überschussmengen,
bezogen auf das 1,2,3-Thiadiazol, das durch die allgemeine Formel
(II) wiedergegeben wird, ausgewählt
wird.
-
Die Reaktionstemperatur kann eine
Temperatur sein, die im Bereich von Raumtemperatur bis zum Siedepunkt
des verwendeten inerten Lösungsmittels
liegt. Wenngleich die Reaktionsdauer mit dem Maßstab der Reaktion und der
Reaktionstemperatur variiert, beträgt sie von einigen Minuten
bis 48 Stunden.
-
Nach der Beendigung der Reaktion
wird die durch die allgemeine Formel (IV) wiedergegebene Verbindung
aus dem Reaktionssystem, welches das gewünschte Produkt enthält, isoliert
und es kann eine Reinigung durchgeführt werden, falls dies gewünscht wird.
Alternativ kann das Reaktionsgemisch direkt in dem nachfolgenden
Reaktionsschritt verwendet werden, ohne die Verbindung der allgemeinen
Formel (IV) zu isolieren.
-
Die durch die allgemeine Formel (II)
wiedergegebene Verbindung kann gemäß dem Verfahren hergestellt
werden, das in JP-A-8-325110 beschrieben ist.
-
1-2. Allgemeine Formel
(IV) → allgemeine
Formel (I-a-1)
-
Diese Reaktion ist eine Cyclisierungsreaktion.
Wenn der Reaktant (Säureanhydrid)
in einer Überschussmenge
verwendet wird, kann das Säureanhydrid
dazu gebracht werden, dass es nicht nur als Reaktant, sondern auch
als inertes Lösungsmittel
dient.
-
Die Reaktionstemperatur kann im Bereich
von Raumtemperatur bis zum Siedepunkt des verwendeten inerten Lösungsmittels
liegen. Es ist bevorzugt, die Reaktion in der Siedetemperaturzone
des verwendeten inerten Lösungsmittels
durchzuführen.
-
Wenngleich die Reaktionsdauer mit
dem Maßstab
und der Temperatur der Reaktion variieren kann, beträgt sie von
einigen Minuten bis 48 Stunden.
-
Nach der Beendigung der Reaktion
wird das 1,2,3-Thiadiazolderivat, das durch die allgemeine Formel (I-a-1)
wiedergegeben wird, aus dem Reaktionssystem, das das gewünschte Produkt
enthält,
auf herkömmliche
Weise isoliert. Falls es gewünscht
wird, kann eine Reinigung durchgeführt werden.
-
1-3. Allgemeine Formel
(II) → allgemeine
Formel (I-a-1)
-
Gemäß dieser Reaktion kann das
1,2,3-Thiadiazolderivat, das durch die allgemeine Formel (I-a-1) wiedergegeben
wird, auf die gleiche Weise wie in Reaktion 1-1 hergestellt werden.
Eine direkte Herstellung kann durch Verlängern der Reaktionsdauer durchgeführt werden.
-
Herstellungsverfahren 2: Wenn R
2 die Formel (A) bedeutet und X und Y Schwefelatome
sind
worin
R
1, R
3, R
4 und n wie vorstehend definiert sind.
-
Ein 1,2,3-Benzothiadiazolderivat,
das durch die allgemeine Formel (I-a-2) wiedergegeben wird, kann durch
Umsetzen eines 1,2,3-Thiadiazolderivats, das durch die allgemeine
Formel (I-a-1) wiedergegeben wird, mit einem Schwefelungsmittel
wie dem Lauesson-Reagenz, P4S10 oder
dergleichen in Gegenwart eines inerten Lösungsmittels hergestellt werden.
-
Das inerte Lösungsmittel, welches in dieser
Reaktion verwendet werden kann, ist das gleiche wie die in dem Herstellungsverfahren
1-1 verwendeten Lösungsmittel.
-
Die Menge des Schwefelungsmittels
wie des Lauesson-Reagenzes, P4S10 oder
dergleichen kann zweckmäßigerweise
im Bereich von einer äquimolaren
Menge, bezogen auf das 1,2,3-Thiadiazolderivat der allgemeinen Formel
(I-a-1), bis zu einer großen Überschussmenge
ausgewählt
werden. Vorzugsweise wird das Schwefelungsmittel in einer großen Überschussmenge
verwendet.
-
Die Reaktionstemperatur liegt im
Bereich von Raumtemperatur bis zu der Siedetemperaturzone des verwendeten
inerten Lösungsmittels.
Wenngleich die Reaktionsdauer mit dem Maßstab und der Temperatur der
Reaktion schwanken kann, beträgt
sie von einigen Minuten bis 48 Stunden.
-
Nach der Beendigung der Reaktion
wird die durch die allgemeine Formel (I-a-2) wiedergegebene Verbindung
aus dem Reaktionssystem, welches das gewünschte Produkt enthält, auf
die übliche
Weise isoliert. Falls es gewünscht
wird, kann eine Reinigung durchgeführt werden.
-
Dieses Herstellungsverfahren kann
gemäß der Beschreibung
von Heterocycles, 19, 2093 (1882) usw. in die Praxis umgesetzt werden.
-
Nun werden nachstehend typische Beispiele
für die
1,2,3-Thiadiazolderivate, die durch die allgemeine Formel (I) wiedergegeben
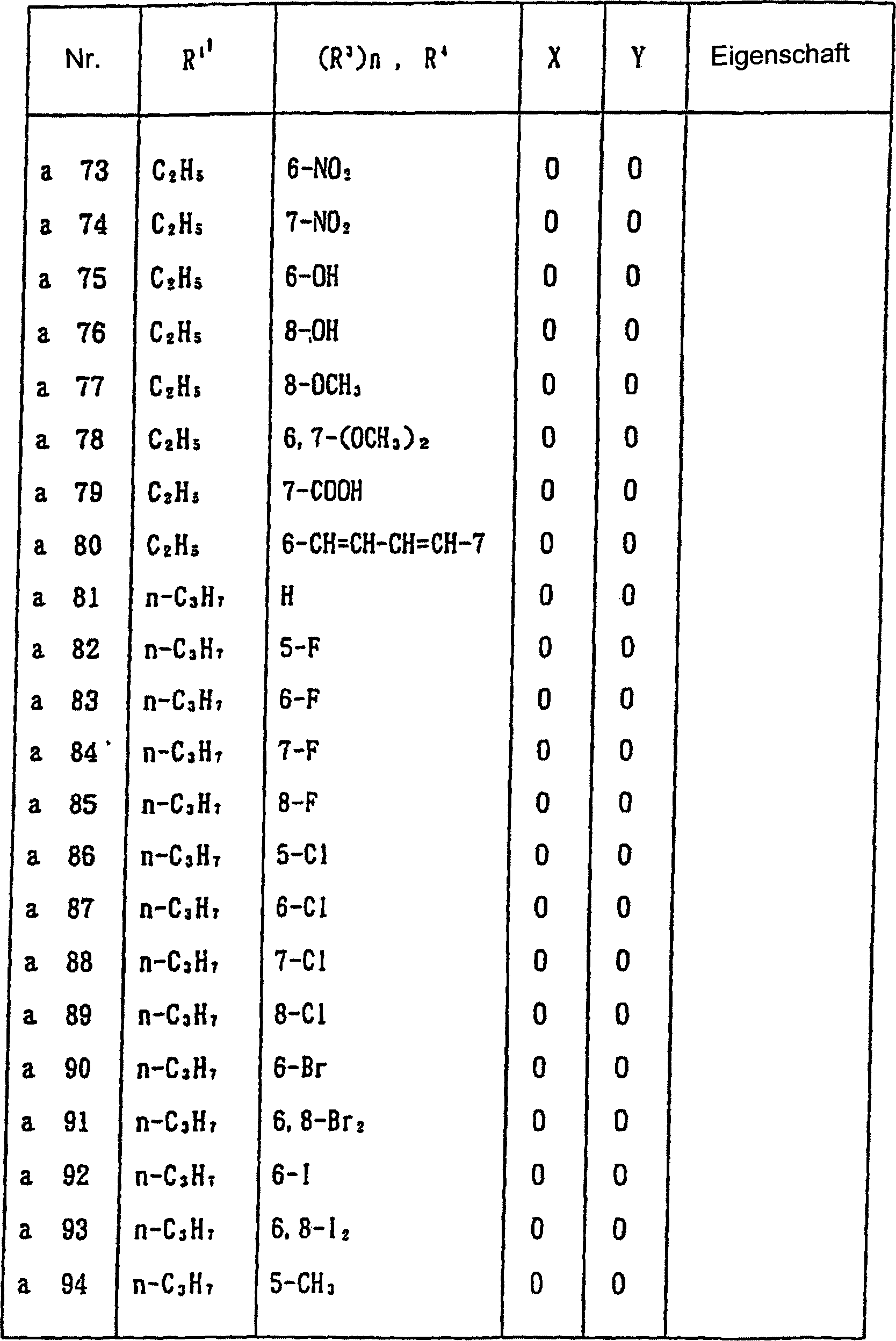
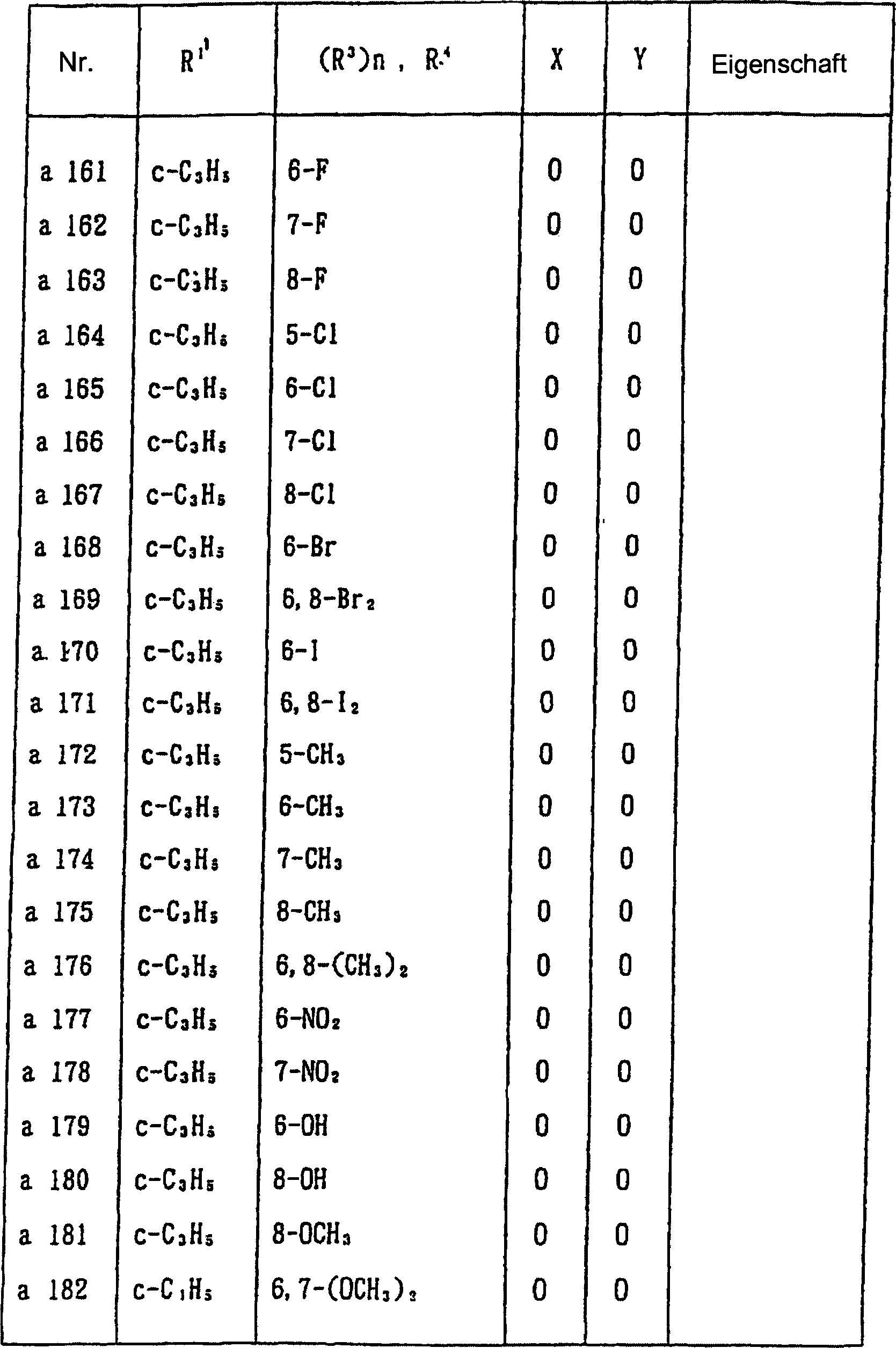
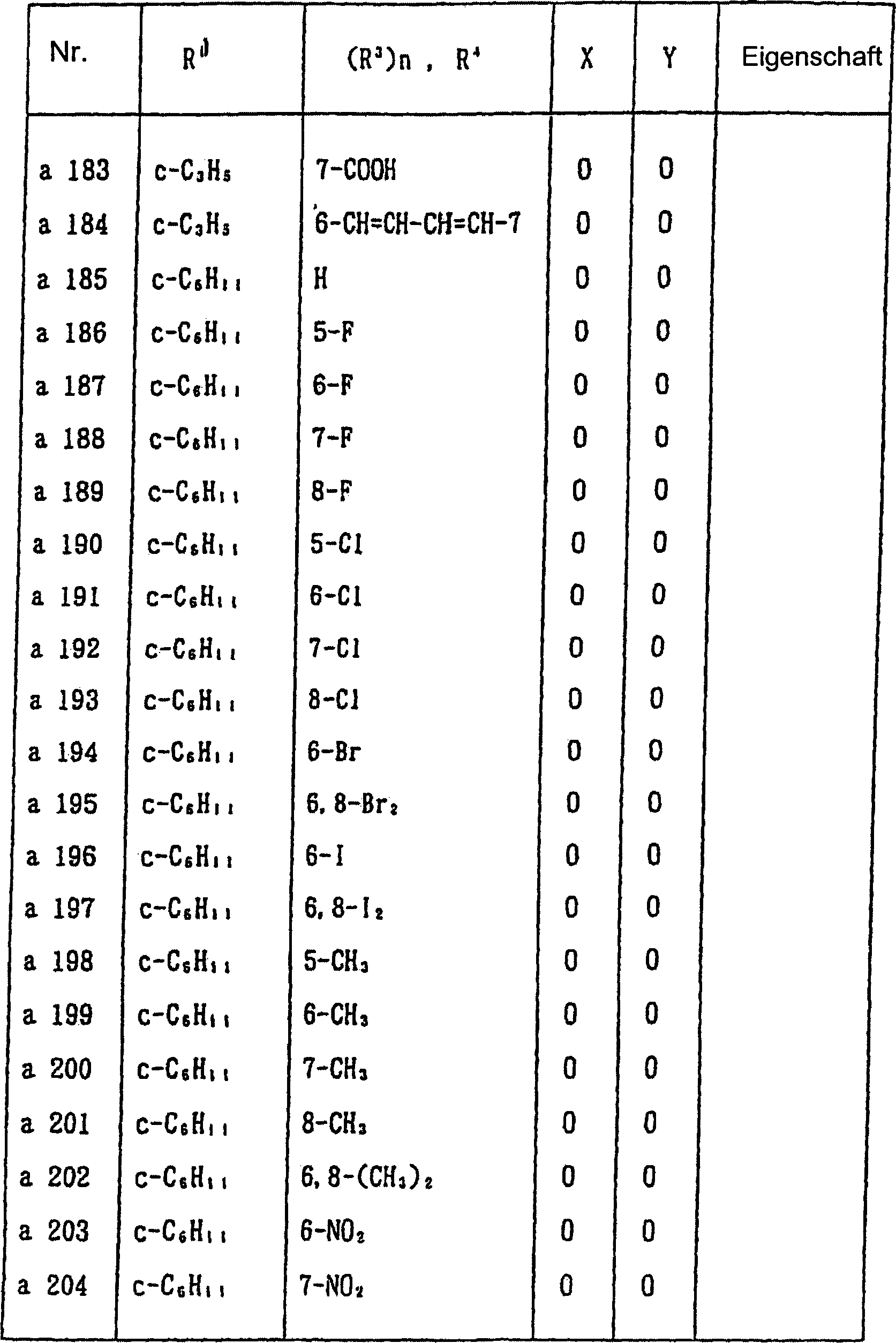
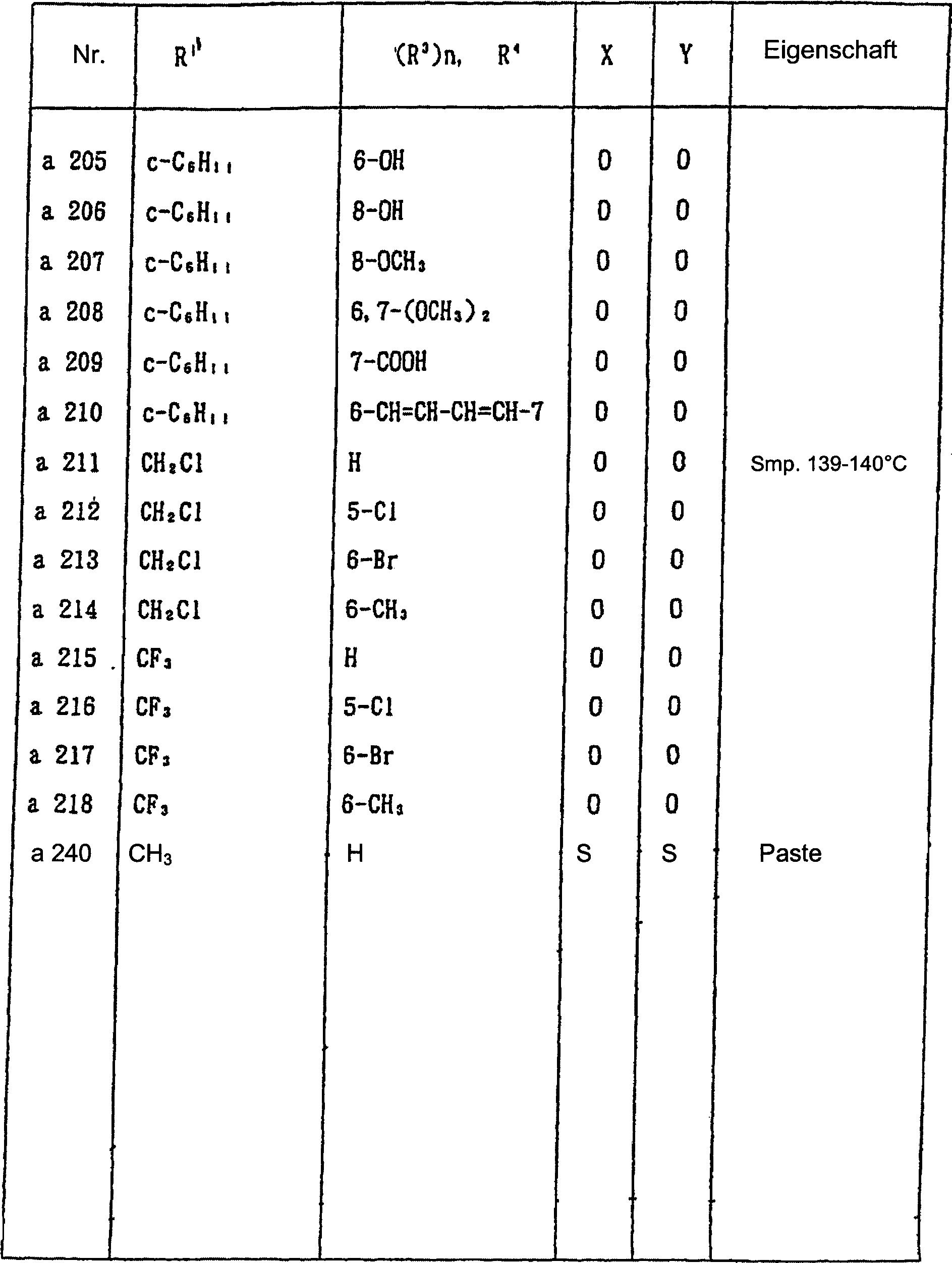
werden, gezeigt. In Tabelle 1 sind die durch die allgemeine Formel
(I-a) wiedergegebenen Verbindungen gezeigt.
-
-
-
-
-
-
-
-
-
-
-
-
-
In Tabelle 1 bedeutet "c-" eine alicyclische
monocyclische Kohlenwasserstoffgruppe. In einigen der Verbindungen
war die Eigenschaft pastenartig. Magnetische Kernresonanzdaten von
diesen Verbindungen sind nachstehend gezeigt.
-
-
In der Tabelle bedeutet TMS Tetramethylsilan.
-
Die durch die allgemeine Formel (I)
wiedergegebenen 1,2,3-Thiadiazolderivate sind als Mittel zur Bekämpfung von
Pflanzenkrankheiten brauchbar und sie weisen eine sehr starke Bekämpfungswirkung
gegen verschiedene Krankheiten auf. Zu speziellen Beispielen für die Krankheiten,
gegen welche die Verbindungen der vorliegenden Erfindung eine ausgeprägte Wirkung
aufweisen, gehören
Reisbräune
(Pyricularia oryzae), Blattscheidenbrand des Reises (Rhizoctonia
solani), Helminthosporium-Blattfleckenkrankheit des Reises (Cochiobolus
miyabeanus), Echter Mehltau von verschiedenen Wirtspflanzen wie
Echter Mehltau von Gerste und Weizen (Erysiphe graminis), Haferkronenrost
(Puccinia coronata), Halmrost von anderen Pflanzen, Kraut- und Fruchtfäule der
Tomate (Phytophthora infestans), Kraut- und Fruchtfäule von
anderen Pflanzen, Kraut- und Fruchtfäule oder Phytophthorafäule von
verschiedenen Pflanzen wie Falscher Mehltau der Gurke (Pseudoperonospora
cubensis), Falscher Mehltau der Weinrebe (Plasmopara viticola) usw.,
Apfelschorf Venturia inaegualis), Alternaria-Blattfleckenkrankheit
des Apfels (Alternaria mali), Schwarzfleckenkrankheit der Birne
(Alternaria kikuchiana), Citrus-Melanose (Diaporthe citri), Bakterienkrankheiten
durch die Gattung Pseudomonas wie Eckige Blattfleckenkrankheit der
Gurke (Pseudomonas syringae pv. lachrymans) und Bakterienwelke der Tomate
(Pseudomonas solanacearum), Bakterienkrankheiten durch die Gattung
Xanthomonas wie Adernschwärze
des Kohls (Xanthomonas campestris), Bakterieller Blattbrand des
Reises (Xanthomonas oryzae) und Citruskrebs (Xanthomonas citri)
und Bakterienkrankheiten durch die Gattung Erwinia wie Bakterielle Weichfäule des
Kohls (Erwinia carotovora) und Viruskrankheiten wie Tabakmosaik
(Tabakmosaikvirus) usw.
-
Das Mittel zur Bekämpfung von
Pflanzenkrankheiten der vorliegenden Erfindung, welches das 1,2,3-Thiadiazolderivat,
das durch die allgemeine Formel (I) wiedergegeben wird, als Wirkstoff
enthält,
weist eine ausgeprägte
Bekämpfungswirkung
gegen die vorstehend erwähnten
Krankheiten auf, welche die Nutzpflanzen von Reisfeldern, die Nutzpflanzen
von Hochlandfeldern, Obstgewächse,
Gemüse
und andere Nutzpflanzen und Blumen befallen. Deshalb können die
gewünschten
Wirkungen des Mittels zur Bekämpfung
von landwirtschaftlichen und gartenbaulichen Krankheiten der vorliegenden
Erfindung erhalten werden durch Anwenden des Mittels zur Bekämpfung von
Krankheiten auf das Reisfeldwasser, Stängel und Blätter oder den Boden des Reisfeldes
oder Hochlandfeldes, auf Obstbäume,
Gemüse,
andere Nutzpflanzen, Blumen und Zierpflanzen zu der Jahreszeit,
zu der erwartet wird, dass die Krankheiten auftreten, vor ihrem
Auftreten oder zu dem Zeitpunkt, da ihr Auftreten bestätigt ist.
-
Im Allgemeinen wird das Mittel zur
Bekämpfung
von Pflanzenkrankheiten der vorliegenden Erfindung verwendet, nachdem
es gemäß einer üblichen
Weise zur Herstellung von Agrochemikalien in einer herkömmlich verwendbaren
Form zubereitet wurde.
-
Das heißt, das 1,2,3-Thiadiazolderivat
der vorliegenden Erfindung, das durch die allgemeine Formel (I)
wiedergegeben wird, und gegebenenfalls ein Hilfsstoff werden mit
einem geeigneten inerten Träger
in einem passenden Verhältnis
vermischt und in einer geeigneten Zubereitungsform wie einer Suspension,
Emulsion, Lösung,
einem Spritzpulver, Granulat, Stäubemittel,
einer Tablette oder dergleichen durch Auflösung, Abtrennung, Dispersion,
Vermischen, Imprägnieren,
Adsorption oder Adhäsion
zubereitet.
-
Der in der vorliegenden Erfindung
verwendete inerte Träger
kann entweder fest oder flüssig
sein. Als das feste Trägermaterial
können
Sojabohnenmehl, Getreidemehl,. Holzmehl, Rindenmehl, Sägemehl,
pulverisierte Tabakstängel,
pulverisierte Walnussschalen, Kleie, Cellulosepulver, Extraktionsrückstände von
Gemüsen,
pulverförmige
synthetische Polymere oder Harze, Tone (z. B. Kaolin, Bentonit,
saure Tonerde usw.), Talkumsorten (z. B. Talkum, Pyrophyllit usw.),
Silicamaterialien (z. B. Diatomeenerde, Siliciumdioxidsand, Glimmer,
Quarzpulver, d. h. synthetische hochdispergierte Kieselsäure, die
auch als fein verteiltes Kieselsäuregel oder
hydratisierte Kieselsäure
bezeichnet wird, wobei einige der im Handel erhältlichen Produkte davon Calciumsilicat
als Hauptkomponente enthalten), Aktivkohle, Schwefelpulver, Bimsstein,
calcinierte Diatomeenerde, gemahlener Ziegelstein, Flugasche, Sand,
Calciumcarbonatpulver, Calciumphosphatpulver und andere anorganische
oder mineralische Pulver, chemische Dünge mittel (z. B. Ammoniumsulfat,
Ammoniumphosphat, Ammoniumnitrat, Harnstoff, Ammoniumchlorid usw.)
und Kompost genannt werden. Diese festen Träger können allein oder als Gemisch
davon verwendet werden.
-
Das flüssige Trägermaterial wird ausgewählt aus
solchen, welche eine Löslichkeit
an sich aufweisen oder solchen, welche keine Löslichkeit an sich aufweisen,
aber im Stande sind, einen Wirkstoff mit Hilfe eines Hilfsstoffs
zu dispergieren. Die folgenden sind typische Beispiele für den flüssigen Träger, welcher
allein oder als Gemisch davon verwendet werden kann. Wasser; Alkohole
wie Methanol, Ethanol, Isopropanol, Butanol, Ethylenglycol und dergleichen;
Ketone wie Aceton, Methylethylketon, Methylisobutylketon, Diisobutylketon, Cyclohexanon
und dergleichen; Ether wie Ethylether, Dioxan, Cellosolve, Dipropylether,
Tetrahydrofuran und dergleichen; aliphatische Kohlenwasserstofte
wie Kerosin, Mineralöle
und dergleichen, aromatische Kohlenwasserstofte wie Benzol, Toluol,
Xylol, Solventnaphtha, Alkylnaphthalin und dergleichen; halogenierte
Kohlenwasserstoffe wie Dichlorethan, Chloroform, Tetrachlorkohlenstoff,
Chlorbenzole und dergleichen; Ester wie Ethylacetat, Düsopropylphthalat,
Dibutylphthalat, Dioctylphthalat und dergleichen; Amide wie Dimethylformamid,
Diethylformamid, Dimethylacetamid und dergleichen; Nitrile wie Acetonitril
und dergleichen; Dimethylsulfoxid; usw.
-
Die folgenden sind typische Beispiele
für andere
Hilfsstoffe, welche je nach dem Zweck verwendet werden und allein
oder in einigen Fällen
in Kombination oder überhaupt
nicht verwendet werden können.
-
Zum Zweck des Emulgierens, Dispergierens,
Solubilisierens und/oder Benetzens eines Wirkstoffs wird ein oberflächenaktiver
Stoff verwendet. Als der oberflächenaktive
Stoff können
Polyoxyethylenalkylether, Polyoxyethylenalkylarylether, Polyoxyethylenester
von höheren
Fettsäuren,
Polyoxyethylenresinate, Polyoxyethylensorbitanmonolaurat, Polyoxyethylensorbitanmonooleat,
Alkylarylsulfonate, Naphthalinsulfonsäurekondensate, Ligninsulfonate,
Schwefelsäureestersalze
von höheren
Alkoholen usw. als Beispiele genannt werden.
-
Ferner kann zum Zweck des Stabilisierens,
Klebrigmachens und/oder Bindens einer Dispersion eines Wirkstoffs
ein Hilfsstoff wie Casein, Gelatine, Stärke, Methylcellulose, Carboxymethylcellulose,
Gummi arabicum, Polyvinylalkohol, Terpentinöl, Kleieöl, Bentonit, Ligninsulfonat
und dergleichen verwendet werden.
-
Zum Zweck der Verbesserung der Fließfähigkeit
eines festen Produkts können
Hilfsstoffe wie Wachs, Stearinsäuresalze,
Alkylester von Phosphorsäure
usw. verwendet werden.
-
Hilfsstoffe wie Naphthalinsulfonsäurekondensate,
Polykondensate von Phosphaten usw. können als Peptisiermittel für dispergierbare
Produkte verwendet werden.
-
Hilfsstoffe wie Siliconöle können auch
als Entschäumungsmittel
verwendet werden.
-
Der Wirkstoffgehalt kann je nach
Bedarf variiert werden. Zum Beispiel beträgt in Stäubemitteln und Granulaten der
geeignete Gehalt davon 0,01 bis 50 Gew.-%. In emulgierbarem Konzentrat
und Spritzpulver ist ebenfalls ein Wirkstoftgehalt von 0,01 bis
50 Gew.-% geeignet.
-
Das Mittel zur Bekämpfung von
Pflanzenkrankheiten der vorliegenden Erfindung wird verwendet, um verschiedene
Krankheiten zu bekämpfen,
indem seine für
die Bekämpfung
der Krankheit wirksame Menge entweder so, wie es ist, oder in Form
einer Verdünnung
oder Suspension in einer passenden Menge an Wasser oder dergleichen
auf eine Nutzpflanze, auf der das Auftreten der Krankheiten erwartet
wird, oder auf eine Stelle, an der das Auftreten der Krankheiten
unerwünscht
ist, aufgetragen wird. Zum Beispiel kann zum Bekämpfen der Krankheiten von Wasserreis
das Mittel zur Bekämpfung
der Krankheit durch das Verfahren der Unterwasseranwendung auf ein
reguläres
Reisfeld, die Anwendung auf ein Reisanzuchtbeet, das Beizen von
Saatgut zum direkten Einsäen
in ein überflutetes
Reisfeld oder eine Saatgutdesinfektion verwendet werden. Um die Krankheiten
von Weizen und Gerste zu bekämpfen,
kann das Mittel zur Bekämpfung
von Pflanzenkrankheiten der vorliegenden Erfindung auf die Halme
oder Blätter
gesprüht
werden oder mit dem Ziel einer Absorption durch die Wurzeln auf
den Boden aufgebracht werden.
-
Die Anwendungsdosis des Mittels zur
Bekämpfung
von Pflanzenkrankheiten der vorliegenden Erfindung kann in Abhängigkeit
von verschiedenen Faktoren wie dem Zweck, der zu bekämpfenden
Krankheit, dem Wachstumsstadium der Nutzpflanze, der Anfälligkeit
für das
Auftreten der Krankheit, dem Wetter, Umweltbedingungen, der Zubereitungsform,
dem Anwendungsverfahren, dem Ort der Anwendung und dem Zeitpunkt der
Anwendung schwanken. Sie kann jedoch je nach dem Zweck passend im
Bereich von 0,1 Gramm bis 10 Kilogramm, bezogen auf den Wirkstoff,
pro 10 Ar ausgewählt
werden.
-
Es ist auch möglich, das Mittel zur Bekämpfung von
Pflanzenkrankheiten der vorliegenden Erfindung in Mischung mit anderen
Mitteln zur Bekämpfung
von Pflanzenkrankheiten zu verwenden, um das Spektrum der bekämpfbaren
Krankheiten und den Zeitraum, in dem eine wirksame Anwendung möglich ist,
zu erweitern oder um die Dosis zu verringern.
-
Typische Beispiele, Rezepturbeispiele
und Testbeispiele der 1,2,3-Thiadiazolderivate, die durch die allgemeine
Formel (I) wiedergegeben werden, sind nachstehend gezeigt.
-
Beispiel
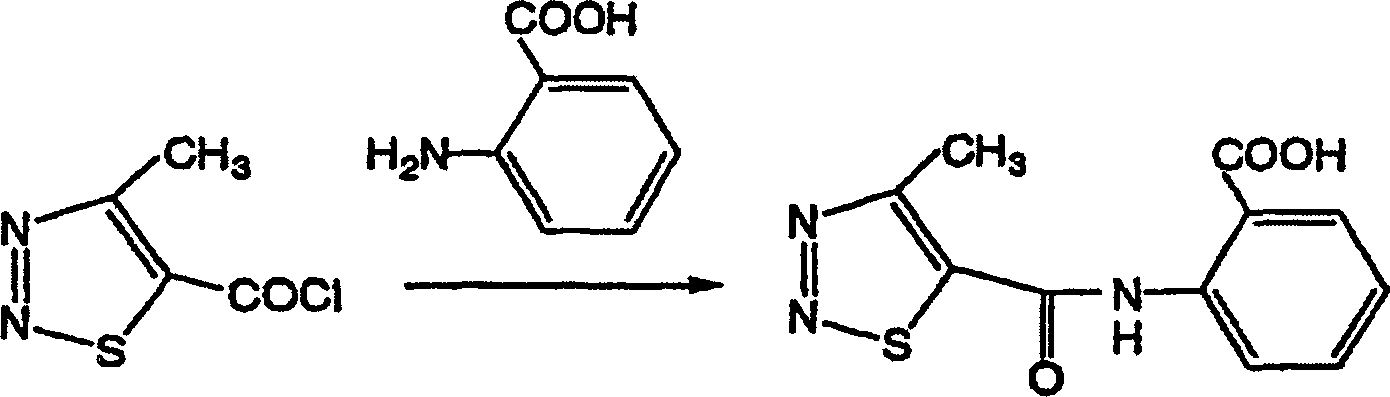
1-1. Herstellung von 2-(4-Methyl-1,2,3-thiadiazol-5-yl-carbonylamino)benzoesäure
-
In 50 ml Wasser wurden 1,2 g (31
mmol) Natriumhydroxid und 4,2 g (31 mmol) Anthranilsäure gelöst. Während die
Lösung
mit Eis gekühlt
wurde, wurden 5 g (31 mmol) 4-Methyl-1,2,3-thiadiazol-5-carbonsäurechlorid über einen
Zeitraum von 30 Minuten tropfenweise dazugegeben.
-
Nach dem Zutropfen wurde das resultierende
Gemisch bei Raumtemperatur 30 Minuten unter Rühren umgesetzt. Nachdem die
Reaktion beendet war, wurde das aus dem Reaktionsgemisch abgeschiedene
kristalline Produkt durch Filtration gesammelt und mit Methanol
und Ethylacetat gewaschen. So wurden 7,1 g der gewünschten
Verbindung erhalten.
Eigenschaft: Schmelzpunkt 223°C; Ausbeute:
87%
-
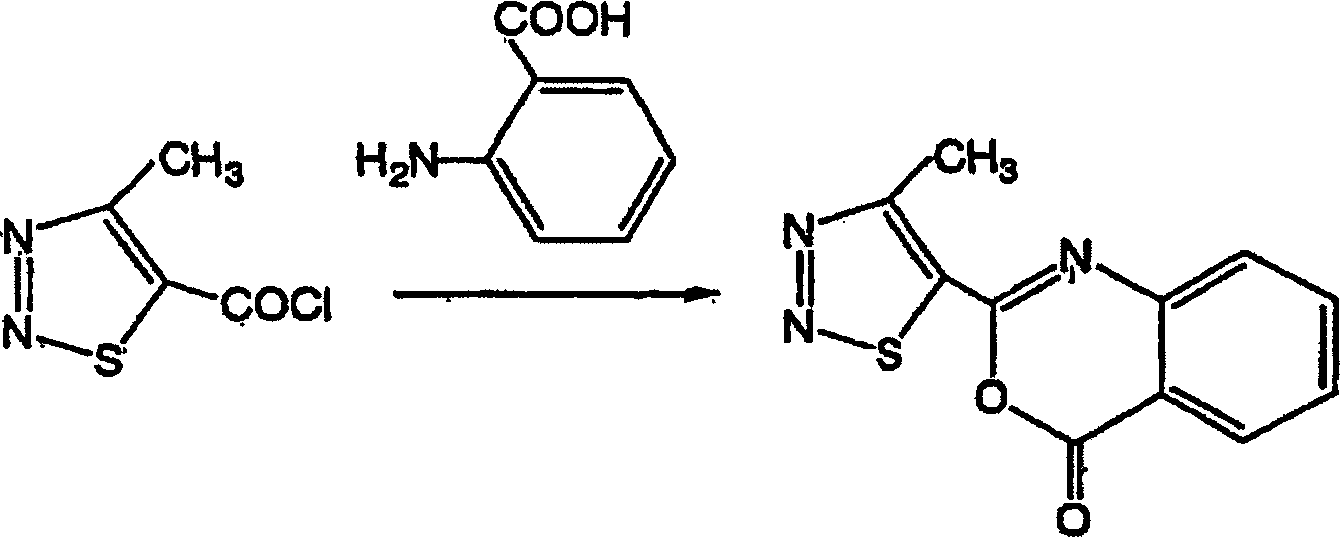
Beispiel
1-2: Herstellung von 2-(4-Methyl-1,2,3-thiadiazol-5-yl)-4H-4-oxo-3,1-benzoxazin (Verbindung
Nr. a27)
-
Zu 5 g (19 mmol) der in 1-1 erhaltenen
2-(4-Methyl-1,2,3-thiadiazol-5-yl-carbonylamino)benzoesäure wurden
50 ml Essigsäureanhydrid
zugegeben. Das resultierende Gemisch wurde durch Erhitzen zum Rückfluss
2 Stunden umgesetzt. Nachdem die Reaktion beendet war, wurde das
Reaktionsgemisch auf Raumtemperatur gekühlt, und das resultierende
kristalline Produkt wurde durch Filtration gesammelt und mit Methanol und
Ethylacetat gewaschen. So wurden 4 g der gewünschten Verbindung erhalten.
Eigenschaft:
Schmelzpunkt 161°C;
Ausbeute: 86%
-
Beispiel
2. Herstellung von 2-(4-Methyl-1,2,3-thiadiazol-5-yl)-4H-4-oxo-3,1-benzoxazin (Verbindung
Nr. a27)
-
In 30 ml Tetrahydrofuran wurden 10
g (99 mmol) Triethylamin und 5,7 g (42 mmol) Anthranilsäure gelöst. Während die
resultierende Lösung
mit Eis gekühlt
wurde, wurden 6,8 g (35 mmol) 4-Methyl-1,2,3-thiadiazol-5-carbonsäurechlorid,
gelöst
in 10 ml Tetrahydrofuran, über
einen Zeitraum von 15 Minuten dazugetropft. Nach dem Zutropfen wurde
das resultierende Gemisch bei Raumtemperatur 15 Stunden unter Rühren umgesetzt.
Nachdem die Reaktion beendet war, wurde Wasser zu dem Reaktionsgemisch
zugegeben, das gewünschte
Produkt wurde mit Ethylacetat extrahiert und die organische Schicht
wurde nacheinander mit verdünnter
Chlorwasserstoffsäure,
einer gesättigten
wässrigen
Lösung
von Natriumhydrogencarbonat und einer gesättigten wässrigen Lösung von Natriumchlorid gewaschen, über wasserfreiem
Natriumsulfat getrocknet und unter vermindertem Druck konzentriert.
Die Reinigung des Rückstands
durch Silicagelsäulenchromatografie
unter Verwendung eines 3 : 1-Gemisches aus Hexan und Ethylacetat
ergab 1,8 g der gewünschten
Verbindung.
Ausbeute: 18
-
Beispiel
3. Herstellung von 2-(4-Methyl-1,2,3-thiadiazol-5-yl)-4H-4-thioxo-3,1-benzothiazin (Verbindung
Nr. a240)
-
In 15 ml Toluol wurden 1 g (4 mmol)
2-(4-Methyl-1,2,3-thiadiazol-5-yl)-4H-4-oxo-3,1-benzoxazin und 5 g Lauesson-Reagenz
suspendiert und das resultierende Gemisch wurde 10 Stunden durch
Erhitzen zum Rückfluss
umgesetzt. Nachdem die Reaktion beendet war, wurde das Reaktionsgemisch
zusammen mit Ether filtriert, um Niederschläge zu entfernen, und das Filtrat
wurde unter vermindertem Druck konzentriert. Die Reinigung des Rückstands
durch Silicagelsäulenchromatografie
unter Verwendung eines 4 : 1-Gemisches aus Hexan und Ethylacetat
ergab 0,16 g (Ausbeute 14%) der gewünschten Verbindung.
-
Nun werden nachstehend typische Formulierungsbeispiele
und Testbeispiele der vorliegenden Erfindung angegeben.
-
In den Formulierungsbeispielen bedeuten "Teile" Gewichtsteile. Formulierungsbeispiel
1
| jede
in Tabelle 1 aufgeführte
Verbindung | 50
Teile |
| Xylol | 40
Teile |
| Gemisch
aus Polyoxyethylennonylphenylether und Calciumalkylbenzolsulfonat | 10
Teile |
-
Ein emulgierbares Konzentrat wurde
durch einheitliches Vermischen der vorstehenden Inhaltsstoffe zum
Herbeiführen
einer Auflösung
hergestellt. Formulierungsbeispiel
2
| jede
in Tabelle 1 aufgeführte
Verbindung | 3
Teile |
| Tonerdepulver | 82
Teile |
| Diatomeenerdepulver | 15
Teile |
-
Ein Stäubemittel wurde durch einheitliches
Vermischen und Mahlen der vorstehenden Inhaltsstoffe hergestellt.
Formulierungsbeispiel
3
| jede
in Tabelle 1 aufgeführte
Verbindung | 5
Teile |
| gemischtes
Pulver aus Bentonit und Tonerde | 90
Teile |
| Calciumligninsulfonat | 5
Teile |
-
Ein Granulat wurde hergestellt durch
einheitliches Vermischen der vorstehenden Inhaltsstofte und Verkneten
des resultierenden Gemisches zusammen mit einer geeigneten Menge
an Wasser, gefolgt von einer Granulierung und Trocknen. Formulierungsbeispiel
4
| jede
in Tabelle 1 aufgeführte
Verbindung | 20
Teile |
| Gemisch
aus Kaolin und synthetischer hochdispergierter Kieselsäure | 75
Teile |
| Gemisch
aus Polyoxyethylennonylphenylether und Calciumalkylbenzolsulfonat | 5
Teile |
-
Ein Spritzpulver wurde durch einheitliches
Vermischen und Mahlen der vorstehenden Inhaltsstoffe hergestellt.
-
Testbeispiel 1. Reisbräune-Bekämpfungstest
durch Unterwasseranwendung
-
Reispflanzen im 5- bis 6-Blattstadium,
die in einem 1/10000 Ar-Topf kultiviert wurden, wurden einer Unterwasseranwendung
einer Chemikalie, die jede in Tabelle 1 aufgeführte Verbindung als Wirkstoff
enthielt, in einer Dosierung von 200 g/10 a, bezogen auf den Wirkstoff,
ausgesetzt. Nachdem sie 1 Woche in einem Treibhaus standen, wurden
die Pflanzen mit einer Suspension von Sporen des Reisbräunepilzes
(Pyricularia oryzae) durch Aufsprühen beimpft.
-
Nach der Beimpfung wurden die Pflanzen
1 Tag in einer feuchten Kammer und anschließend 6 Tage in einem Treibhaus
stehen gelassen, so dass sich die Krankheit ausreichend entwickeln
konnte. Anschließend wurden
Schäden
an jedem Blatt gezählt
und anschließend
mit denen auf der unbehandelten Parzelle verglichen und der Bekämpfungsgrad
wurde berechnet, wobei die Wirkung gemäß dem folgenden Kriterium bewertet
wurde.
| Wirkung | Bekämpfungsgrad
(%) |
| A | 100–95 |
| B | 94–85 |
| C | 84–60 |
| D | 59–0 |
-
Als Ergebnis des vorstehenden Testes
wurde festgestellt, dass die in Tabelle 1 aufgeführten Verbindungen eine ausgeprägte Reisbräune-bekämpfende
Wirkung haben. Von diesen Verbindungen wurden die folgenden Verbindungen
mit C oder höher
bewertet: a27, a33, a55, a107. Insbesondere wurden die folgenden mit
A bewertet: a27, a33, a55, a107.