DE69722500T2 - Carbodiimide enthaltende Polyurethanharze - Google Patents
Carbodiimide enthaltende Polyurethanharze Download PDFInfo
- Publication number
- DE69722500T2 DE69722500T2 DE69722500T DE69722500T DE69722500T2 DE 69722500 T2 DE69722500 T2 DE 69722500T2 DE 69722500 T DE69722500 T DE 69722500T DE 69722500 T DE69722500 T DE 69722500T DE 69722500 T2 DE69722500 T2 DE 69722500T2
- Authority
- DE
- Germany
- Prior art keywords
- diisocyanate
- carbodiimide
- polyurethane resin
- modified
- unmodified
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 229920005749 polyurethane resin Polymers 0.000 title claims description 58
- 150000001718 carbodiimides Chemical class 0.000 title claims description 8
- 125000005442 diisocyanate group Chemical group 0.000 claims description 68
- 150000002009 diols Chemical class 0.000 claims description 20
- VPKDCDLSJZCGKE-UHFFFAOYSA-N carbodiimide group Chemical group N=C=N VPKDCDLSJZCGKE-UHFFFAOYSA-N 0.000 claims description 11
- IQPQWNKOIGAROB-UHFFFAOYSA-N isocyanate group Chemical group [N-]=C=O IQPQWNKOIGAROB-UHFFFAOYSA-N 0.000 claims description 11
- 238000000034 method Methods 0.000 claims description 7
- 239000005058 Isophorone diisocyanate Substances 0.000 claims description 3
- RYEVPEDOQVMHIY-UHFFFAOYSA-N N=C=O.N=C=O.CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1 Chemical compound N=C=O.N=C=O.CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1 RYEVPEDOQVMHIY-UHFFFAOYSA-N 0.000 claims description 3
- 125000002723 alicyclic group Chemical group 0.000 claims description 3
- 125000004432 carbon atom Chemical group C* 0.000 claims description 3
- NIMLQBUJDJZYEJ-UHFFFAOYSA-N isophorone diisocyanate Chemical compound CC1(C)CC(N=C=O)CC(C)(CN=C=O)C1 NIMLQBUJDJZYEJ-UHFFFAOYSA-N 0.000 claims description 3
- NNOZGCICXAYKLW-UHFFFAOYSA-N 1,2-bis(2-isocyanatopropan-2-yl)benzene Chemical compound O=C=NC(C)(C)C1=CC=CC=C1C(C)(C)N=C=O NNOZGCICXAYKLW-UHFFFAOYSA-N 0.000 claims description 2
- 125000001931 aliphatic group Chemical group 0.000 claims description 2
- HYJYJUIGMPZFDK-UHFFFAOYSA-N N=C=O.N=C=O.CCC(CC)C1=CC=CC=C1 Chemical compound N=C=O.N=C=O.CCC(CC)C1=CC=CC=C1 HYJYJUIGMPZFDK-UHFFFAOYSA-N 0.000 claims 1
- 238000006243 chemical reaction Methods 0.000 description 18
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 15
- DNIAPMSPPWPWGF-UHFFFAOYSA-N monopropylene glycol Natural products CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 13
- 230000015572 biosynthetic process Effects 0.000 description 10
- 239000003054 catalyst Substances 0.000 description 10
- 238000003786 synthesis reaction Methods 0.000 description 10
- 230000007062 hydrolysis Effects 0.000 description 9
- 238000006460 hydrolysis reaction Methods 0.000 description 9
- UPMLOUAZCHDJJD-UHFFFAOYSA-N 4,4'-Diphenylmethane Diisocyanate Chemical compound C1=CC(N=C=O)=CC=C1CC1=CC=C(N=C=O)C=C1 UPMLOUAZCHDJJD-UHFFFAOYSA-N 0.000 description 8
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 8
- 239000000654 additive Substances 0.000 description 7
- 239000010408 film Substances 0.000 description 7
- 239000012948 isocyanate Substances 0.000 description 7
- 150000002513 isocyanates Chemical class 0.000 description 7
- 239000000203 mixture Substances 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 6
- -1 Lace Substances 0.000 description 6
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- 230000000996 additive effect Effects 0.000 description 6
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 6
- 229920005906 polyester polyol Polymers 0.000 description 6
- 229920002635 polyurethane Polymers 0.000 description 6
- 239000004814 polyurethane Substances 0.000 description 6
- 239000004970 Chain extender Substances 0.000 description 5
- 230000000052 comparative effect Effects 0.000 description 5
- 235000013772 propylene glycol Nutrition 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- 239000001361 adipic acid Substances 0.000 description 4
- 235000011037 adipic acid Nutrition 0.000 description 4
- CDQSJQSWAWPGKG-UHFFFAOYSA-N butane-1,1-diol Chemical compound CCCC(O)O CDQSJQSWAWPGKG-UHFFFAOYSA-N 0.000 description 4
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- YMKWWHFRGALXLE-UHFFFAOYSA-N 4-methyl-1-phenyl-2,3-dihydro-1$l^{5}-phosphole 1-oxide Chemical compound C1CC(C)=CP1(=O)C1=CC=CC=C1 YMKWWHFRGALXLE-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 238000001125 extrusion Methods 0.000 description 3
- RRAMGCGOFNQTLD-UHFFFAOYSA-N hexamethylene diisocyanate Chemical compound O=C=NCCCCCCN=C=O RRAMGCGOFNQTLD-UHFFFAOYSA-N 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000000155 melt Substances 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 230000002194 synthesizing effect Effects 0.000 description 3
- 229920002803 thermoplastic polyurethane Polymers 0.000 description 3
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 2
- FKTHNVSLHLHISI-UHFFFAOYSA-N 1,2-bis(isocyanatomethyl)benzene Chemical compound O=C=NCC1=CC=CC=C1CN=C=O FKTHNVSLHLHISI-UHFFFAOYSA-N 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 239000005057 Hexamethylene diisocyanate Substances 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- WERYXYBDKMZEQL-UHFFFAOYSA-N butane-1,4-diol Chemical compound OCCCCO WERYXYBDKMZEQL-UHFFFAOYSA-N 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- JBKVHLHDHHXQEQ-UHFFFAOYSA-N epsilon-caprolactam Chemical compound O=C1CCCCCN1 JBKVHLHDHHXQEQ-UHFFFAOYSA-N 0.000 description 2
- 239000011261 inert gas Substances 0.000 description 2
- QQVIHTHCMHWDBS-UHFFFAOYSA-N isophthalic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- BDJRBEYXGGNYIS-UHFFFAOYSA-N nonanedioic acid Chemical compound OC(=O)CCCCCCCC(O)=O BDJRBEYXGGNYIS-UHFFFAOYSA-N 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- WLJVNTCWHIRURA-UHFFFAOYSA-N pimelic acid Chemical compound OC(=O)CCCCCC(O)=O WLJVNTCWHIRURA-UHFFFAOYSA-N 0.000 description 2
- 238000006116 polymerization reaction Methods 0.000 description 2
- 229920006264 polyurethane film Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- CXMXRPHRNRROMY-UHFFFAOYSA-N sebacic acid Chemical compound OC(=O)CCCCCCCCC(O)=O CXMXRPHRNRROMY-UHFFFAOYSA-N 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000007711 solidification Methods 0.000 description 2
- 230000008023 solidification Effects 0.000 description 2
- TYFQFVWCELRYAO-UHFFFAOYSA-N suberic acid Chemical compound OC(=O)CCCCCCC(O)=O TYFQFVWCELRYAO-UHFFFAOYSA-N 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical compound C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 description 1
- VGHSXKTVMPXHNG-UHFFFAOYSA-N 1,3-diisocyanatobenzene Chemical compound O=C=NC1=CC=CC(N=C=O)=C1 VGHSXKTVMPXHNG-UHFFFAOYSA-N 0.000 description 1
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Substances OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 1
- ALQLPWJFHRMHIU-UHFFFAOYSA-N 1,4-diisocyanatobenzene Chemical compound O=C=NC1=CC=C(N=C=O)C=C1 ALQLPWJFHRMHIU-UHFFFAOYSA-N 0.000 description 1
- CDMDQYCEEKCBGR-UHFFFAOYSA-N 1,4-diisocyanatocyclohexane Chemical compound O=C=NC1CCC(N=C=O)CC1 CDMDQYCEEKCBGR-UHFFFAOYSA-N 0.000 description 1
- KZFJYCRQWKWYJE-UHFFFAOYSA-N 1,4-dimethyl-2,3-dihydro-1$l^{5}-phosphole 1-oxide Chemical compound CC1=CP(C)(=O)CC1 KZFJYCRQWKWYJE-UHFFFAOYSA-N 0.000 description 1
- SBJCUZQNHOLYMD-UHFFFAOYSA-N 1,5-Naphthalene diisocyanate Chemical compound C1=CC=C2C(N=C=O)=CC=CC2=C1N=C=O SBJCUZQNHOLYMD-UHFFFAOYSA-N 0.000 description 1
- ATOUXIOKEJWULN-UHFFFAOYSA-N 1,6-diisocyanato-2,2,4-trimethylhexane Chemical compound O=C=NCCC(C)CC(C)(C)CN=C=O ATOUXIOKEJWULN-UHFFFAOYSA-N 0.000 description 1
- IOSIDVPNBKUUFA-UHFFFAOYSA-N 1-ethyl-2,3-dihydro-1$l^{5}-phosphole 1-oxide Chemical compound CCP1(=O)CCC=C1 IOSIDVPNBKUUFA-UHFFFAOYSA-N 0.000 description 1
- WCTWAAFIWRIEKH-UHFFFAOYSA-N 1-ethyl-4-methyl-2,3-dihydro-1$l^{5}-phosphole 1-oxide Chemical compound CCP1(=O)CCC(C)=C1 WCTWAAFIWRIEKH-UHFFFAOYSA-N 0.000 description 1
- IUUONVQOMMQAEH-UHFFFAOYSA-N 1-methyl-2,3-dihydro-1$l^{5}-phosphole 1-oxide Chemical compound CP1(=O)CCC=C1 IUUONVQOMMQAEH-UHFFFAOYSA-N 0.000 description 1
- RTBFRGCFXZNCOE-UHFFFAOYSA-N 1-methylsulfonylpiperidin-4-one Chemical compound CS(=O)(=O)N1CCC(=O)CC1 RTBFRGCFXZNCOE-UHFFFAOYSA-N 0.000 description 1
- YUQUHJGNZFFDAA-UHFFFAOYSA-N 1-phenyl-2,3-dihydro-1$l^{5}-phosphole 1-oxide Chemical compound C=1C=CC=CC=1P1(=O)CCC=C1 YUQUHJGNZFFDAA-UHFFFAOYSA-N 0.000 description 1
- LTMRRSWNXVJMBA-UHFFFAOYSA-L 2,2-diethylpropanedioate Chemical compound CCC(CC)(C([O-])=O)C([O-])=O LTMRRSWNXVJMBA-UHFFFAOYSA-L 0.000 description 1
- IOTUOULZCAHGBG-UHFFFAOYSA-N 2,4-diisocyanato-1-pentan-3-ylbenzene Chemical compound CCC(CC)C1=CC=C(N=C=O)C=C1N=C=O IOTUOULZCAHGBG-UHFFFAOYSA-N 0.000 description 1
- BBBUAWSVILPJLL-UHFFFAOYSA-N 2-(2-ethylhexoxymethyl)oxirane Chemical compound CCCCC(CC)COCC1CO1 BBBUAWSVILPJLL-UHFFFAOYSA-N 0.000 description 1
- YSUQLAYJZDEMOT-UHFFFAOYSA-N 2-(butoxymethyl)oxirane Chemical compound CCCCOCC1CO1 YSUQLAYJZDEMOT-UHFFFAOYSA-N 0.000 description 1
- IMSODMZESSGVBE-UHFFFAOYSA-N 2-Oxazoline Chemical compound C1CN=CO1 IMSODMZESSGVBE-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- HDONYZHVZVCMLR-UHFFFAOYSA-N N=C=O.N=C=O.CC1CCCCC1 Chemical compound N=C=O.N=C=O.CC1CCCCC1 HDONYZHVZVCMLR-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- UKLDJPRMSDWDSL-UHFFFAOYSA-L [dibutyl(dodecanoyloxy)stannyl] dodecanoate Chemical compound CCCCCCCCCCCC(=O)O[Sn](CCCC)(CCCC)OC(=O)CCCCCCCCCCC UKLDJPRMSDWDSL-UHFFFAOYSA-L 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N anhydrous glutaric acid Natural products OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 239000002981 blocking agent Substances 0.000 description 1
- 230000005587 bubbling Effects 0.000 description 1
- OZCRKDNRAAKDAN-UHFFFAOYSA-N but-1-ene-1,4-diol Chemical compound O[CH][CH]CCO OZCRKDNRAAKDAN-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000002485 combustion reaction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- KQWGXHWJMSMDJJ-UHFFFAOYSA-N cyclohexyl isocyanate Chemical compound O=C=NC1CCCCC1 KQWGXHWJMSMDJJ-UHFFFAOYSA-N 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 239000012975 dibutyltin dilaurate Substances 0.000 description 1
- KORSJDCBLAPZEQ-UHFFFAOYSA-N dicyclohexylmethane-4,4'-diisocyanate Chemical compound C1CC(N=C=O)CCC1CC1CCC(N=C=O)CC1 KORSJDCBLAPZEQ-UHFFFAOYSA-N 0.000 description 1
- KIQKWYUGPPFMBV-UHFFFAOYSA-N diisocyanatomethane Chemical compound O=C=NCN=C=O KIQKWYUGPPFMBV-UHFFFAOYSA-N 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- SZXQTJUDPRGNJN-UHFFFAOYSA-N dipropylene glycol Chemical compound OCCCOCCCO SZXQTJUDPRGNJN-UHFFFAOYSA-N 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 239000000806 elastomer Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- XYIBRDXRRQCHLP-UHFFFAOYSA-N ethyl acetoacetate Chemical compound CCOC(=O)CC(C)=O XYIBRDXRRQCHLP-UHFFFAOYSA-N 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- ACCCMOQWYVYDOT-UHFFFAOYSA-N hexane-1,1-diol Chemical compound CCCCCC(O)O ACCCMOQWYVYDOT-UHFFFAOYSA-N 0.000 description 1
- NAQMVNRVTILPCV-UHFFFAOYSA-N hexane-1,6-diamine Chemical compound NCCCCCCN NAQMVNRVTILPCV-UHFFFAOYSA-N 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000001746 injection moulding Methods 0.000 description 1
- 125000000654 isopropylidene group Chemical group C(C)(C)=* 0.000 description 1
- 150000003951 lactams Chemical class 0.000 description 1
- 239000002649 leather substitute Substances 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- AYLRODJJLADBOB-QMMMGPOBSA-N methyl (2s)-2,6-diisocyanatohexanoate Chemical compound COC(=O)[C@@H](N=C=O)CCCCN=C=O AYLRODJJLADBOB-QMMMGPOBSA-N 0.000 description 1
- 239000012778 molding material Substances 0.000 description 1
- 150000002762 monocarboxylic acid derivatives Chemical class 0.000 description 1
- WHIVNJATOVLWBW-UHFFFAOYSA-N n-butan-2-ylidenehydroxylamine Chemical compound CCC(C)=NO WHIVNJATOVLWBW-UHFFFAOYSA-N 0.000 description 1
- SLCVBVWXLSEKPL-UHFFFAOYSA-N neopentyl glycol Chemical compound OCC(C)(C)CO SLCVBVWXLSEKPL-UHFFFAOYSA-N 0.000 description 1
- OEIJHBUUFURJLI-UHFFFAOYSA-N octane-1,8-diol Chemical compound OCCCCCCCCO OEIJHBUUFURJLI-UHFFFAOYSA-N 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- UWJJYHHHVWZFEP-UHFFFAOYSA-N pentane-1,1-diol Chemical compound CCCCC(O)O UWJJYHHHVWZFEP-UHFFFAOYSA-N 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920000166 polytrimethylene carbonate Polymers 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- AOHJOMMDDJHIJH-UHFFFAOYSA-N propylenediamine Chemical compound CC(N)CN AOHJOMMDDJHIJH-UHFFFAOYSA-N 0.000 description 1
- KIDHWZJUCRJVML-UHFFFAOYSA-N putrescine Chemical compound NCCCCN KIDHWZJUCRJVML-UHFFFAOYSA-N 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 239000011342 resin composition Substances 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000007151 ring opening polymerisation reaction Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 239000000565 sealant Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- DVKJHBMWWAPEIU-UHFFFAOYSA-N toluene 2,4-diisocyanate Chemical compound CC1=CC=C(N=C=O)C=C1N=C=O DVKJHBMWWAPEIU-UHFFFAOYSA-N 0.000 description 1
- ZIBGPFATKBEMQZ-UHFFFAOYSA-N triethylene glycol Chemical compound OCCOCCOCCO ZIBGPFATKBEMQZ-UHFFFAOYSA-N 0.000 description 1
- 239000006097 ultraviolet radiation absorber Substances 0.000 description 1
- 238000004804 winding Methods 0.000 description 1
- 125000002256 xylenyl group Chemical class C1(C(C=CC=C1)C)(C)* 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/70—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the isocyanates or isothiocyanates used
- C08G18/72—Polyisocyanates or polyisothiocyanates
- C08G18/77—Polyisocyanates or polyisothiocyanates having heteroatoms in addition to the isocyanate or isothiocyanate nitrogen and oxygen or sulfur
- C08G18/78—Nitrogen
- C08G18/79—Nitrogen characterised by the polyisocyanates used, these having groups formed by oligomerisation of isocyanates or isothiocyanates
- C08G18/797—Nitrogen characterised by the polyisocyanates used, these having groups formed by oligomerisation of isocyanates or isothiocyanates containing carbodiimide and/or uretone-imine groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/02—Polymeric products of isocyanates or isothiocyanates of isocyanates or isothiocyanates only
- C08G18/025—Polymeric products of isocyanates or isothiocyanates of isocyanates or isothiocyanates only the polymeric products containing carbodiimide groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/08—Processes
- C08G18/0895—Manufacture of polymers by continuous processes
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/08—Processes
- C08G18/09—Processes comprising oligomerisation of isocyanates or isothiocyanates involving reaction of a part of the isocyanate or isothiocyanate groups with each other in the reaction mixture
- C08G18/095—Processes comprising oligomerisation of isocyanates or isothiocyanates involving reaction of a part of the isocyanate or isothiocyanate groups with each other in the reaction mixture oligomerisation to carbodiimide or uretone-imine groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/08—Processes
- C08G18/10—Prepolymer processes involving reaction of isocyanates or isothiocyanates with compounds having active hydrogen in a first reaction step
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/28—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the compounds used containing active hydrogen
- C08G18/30—Low-molecular-weight compounds
- C08G18/32—Polyhydroxy compounds; Polyamines; Hydroxyamines
- C08G18/3203—Polyhydroxy compounds
- C08G18/3206—Polyhydroxy compounds aliphatic
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/28—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the compounds used containing active hydrogen
- C08G18/30—Low-molecular-weight compounds
- C08G18/32—Polyhydroxy compounds; Polyamines; Hydroxyamines
- C08G18/3225—Polyamines
- C08G18/3228—Polyamines acyclic
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/70—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the isocyanates or isothiocyanates used
- C08G18/72—Polyisocyanates or polyisothiocyanates
- C08G18/721—Two or more polyisocyanates not provided for in one single group C08G18/73 - C08G18/80
- C08G18/725—Combination of polyisocyanates of C08G18/78 with other polyisocyanates
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Manufacturing & Machinery (AREA)
- Polyurethanes Or Polyureas (AREA)
Description
- Hintergrund der Erfindung
- 1. Fachgebiet der Erfindung
- Die Erfindung betrifft ein neuartiges Polyurethanharz. Genauer gesagt betrifft die vorliegende Erfindung ein Polyurthanharz, das Carbodiimidgruppen in der Molekülkette enthält und eine über einen langen Zeitraum hinweg stabile Wasserfestigkeit zeigt.
- 2. Stand der Technik
- Polyurethanharze weisen eine hohe Elastizität auf und finden verschiedenartige Anwendungen, wie zum Beispiel Formprodukten, Schnüren, Beschichtungsfilmen etc. Allerdings sind sie von minderwertiger chemischer Beständigkeit, Wärme- und Wasserfestigkeit und werden daher nicht bei Anwendungen eingesetzt, bei denen diese Eigenschaften erforderlich sind, wie zum Beispiel bei Schläuchen und Dichtungen von Kraftfahrzeugmotoren und deren Peripherie.
- Von den verschiedenen Polyurethanharzen enthalten die Polyester-Polyurethanharze, die aus einem Polyesterpolyol erhalten werden, eine hohe Anzahl von Esterbindungen im Molekül, weshalb bei Anwendung unter Hochtemperatur- und hochfeuchten Bedingungen eine Hydrolyse der Esterbindungen und dadurch eine Reduktion des Molekulargewichts eintritt, was die Festigkeit und das Elastizitätsmodul verschlechtern kann.
- Um die oben genannten Probleme der Polyurethanharze, die durch Hydrolyse der Esterbindungen und der daraus folgenden Reduktion des Molekulargewichts entstehen, zu mildern, wurde die Beigabe eines Zusatzstoffes zum Polyurethanharz vorgeschlagen. Ein Beispiel dafür ist die Zugabe von Epoxy, Oxazolin, Carbodiimid oder ähnlichem zu einem Polyurethanharz, um dadurch die durch Hydrolyse des Polyurethanharzes entstandene Carboxylgruppe einzufangen und die Haltbarkeit des Polyurethanharzes zu verlängern.
- Da allerdings der Zusatzstoff dem Polyurethan einfach nur zugesetzt wird, blutet dieser Zusatzstoff an die Oberfläche des Polyurethanharzes aus; wird der Zusatzstoff einem Polyurethanharz zugegeben, das in Kontakt mit einem Lösungsmittel oder einem Öl kommt, so wird er durch das Lösungsmittel oder Öl extrahiert, was die Wirkung von Lösungsmittel oder Öl und die Hydrolysebeständigkeit des Polyurethanharzes verschlechtert. Daher ist die Wirkung der Zugabe des oben genannten Zusatzstoffes zum Polyurethanharz, um die Hydrolysebeständigkeit zu erhöhen, nicht völlig zufriedenstellend.
- Da der oben genannte Zusatzstoff im allgemeinen ein pulverförmiger Feststoff mit einem hohen Schmelzpunkt ist, ist darüber hinaus ein sehr kompliziertes Gerät und relativ lange Zeit erforderlich, um ihn im Polyurethanharz zu dispergieren.
- Aufgabe und Zusammenfassung der Erfindung
- Die Aufgabe der vorliegenden Erfindung besteht in der Beseitigung der oben genannten Nachteile des Stands der Technik und in der Bereitstellung eines Polyurethanharzes, das Carbodiimid-Bindungen in der Molekülkette enthält und das eine über einen langen Zeitraum hinweg stabile Hydrolysebeständigkeit ohne Verlust der Carbodiimid-Bindungen im Molekül und eine verbesserte Wärmebeständigkeit aufweist.
- Gemäß der vorliegenden Erfindung wird ein Polyurethanharz bereitgestellt, das aus einer Diol-Komponente und einer Diisocyanat-Komponente mittels eines herkömmlichen Verfahrens erhalten wird, wobei die Diisocyanat-Komponente umfasst: mindestens eine Art von unmodifiziertem Diisocyanat, und mindestens eine Art von Carbodiimid-modifiziertem aromatischem Diisocyanat, das an einer oder beiden der Ortho-Positionen der beiden Isocyanat-Gruppen einen aliphatischen, alicyclischen oder aromatischen Substituenten aus einem oder mehreren Kohlenstoffatomen aufweist, und wobei das Molverhältnis von unmodifiziertem Diisocyanat zu Carbodiimidmodifiziertem aromatischem Diisocyanat 35–0,1 : 1 beträgt.
- Gemäß der vorliegenden Erfindung wird außerdem ein Polyurethanharz bereitgestellt, das aus einer Diol-Komponente und einer Diisocyanat-Komponente mittels eines herkömmlichen Verfahrens erhalten wird, wobei die Diisocyanat-Komponente umfasst:
mindestens eine Art von unmodifiziertem Diisocyanat, und
mindestens eine Art von Carbodiimid-modifiziertem aliphatischen Diisocyanat, wobei mindestens einer der beiden Kohlenstoffe, die jeweils mit einer Isocyanat-Gruppe verbunden sind, di- oder trisubstituiert ist und das Molverhältnis von unmodifiziertem Diisocyanat zu Carbodiimid-modifiziertem aliphatischen Diisocyanat 35–0,1 : 1 beträgt. - Ausführliche Beschreibung der Erfindung
- Die vorliegende Erfindung wird im folgenden ausführlich beschrieben.
- Wie oben erwähnt, wird das Polyurethanharz der vorliegenden Erfindung aus einer Diol-Komponente und einer Diisocyanat-Komponente mittels eines herkömmlichen Verfahrens erhalten. Die Diol-Komponente als dem ersten Bestandteil des Polyurethanharzes kann ein beliebiges Diol sein, sofern es herkömmlicherweise zur Herstellung eines Polyurethanharzes verwendet wird. Beispiele für das Diol sind gesättigte oder ungesättigte niedermolekulare Glycole wie Ethylenglycol, 1,2- Propandiol, 1,3-Propandiol, 1,4-Butandiol, Neopentylglycol, Pentandiol, Hexandiol, Octandiol, 1,4-Butendiol, Diethylenglycol, Triethylenglycol, Dipropylenglycol und ähnliches; Alkylgylcidylether wie n-Butylglycidylether, 2-Ethylhexylglycidylether und ähnliches; Polyesterpolyole, wie durch Dehydrieren und Kondensieren eines Monocarbonsäure-Glycidiylalkoholesters (zum Beispiel Versatinsäure-Glycidylalkoholester) und einer dibasischen Säure oder eines Anhydrids davon erhalten (zum Beispiel Adipinsäure, Phthalsäure, Isophthalsäure, Terephthalsäure, Maleinsäure, Fumarsäure, Succinsäure, Oxalsäure, Malonsäure, Glutarsäure, Pimelinsäure, Suberinsäure, Azelainsäure, Sebacinsäure oder Dimersäure); und Polyesterpolyole, wie durch ringöffnende Polymerisation einer cyclischen Esterverbindung erhalten.
- Das Polyurethanharz der vorliegenden Erfindung unterscheidet sich nicht von herkömmlichen Urethanharzen, da es ebenfalls aus einer Diol-Komponente und einer Diisocyanat-Komponente zusammengesetzt ist. Allerdings ist das vorliegende Polyurethanharz dadurch gekennzeichnet, dass die Diisocyanat-Komponente als dem zweiten Bestandteil des Harzes mindestens eine Art von unmodifiziertem Diisocyanat und mindestens eine Art von Carbodiimid-modifiziertem Diisocyanat umfasst.
- In der offengelegten Japanischen Patentanmeldung Nr. 5-302050 ist eine Druckfarbe unter Verwendung einer Urethanharz-Zusammensetzung beschrieben, bestehend aus einem Polyol, einem Carbodiimid-modifizierten Diisocyanat, einem Kettenverlängerer etc. Das in der Literatur beschriebene Urethanharz verwendet allerdings als der Isocyanat-Komponente lediglich ein Carbodiimid-modifiziertes Diisocyanat und weist daher ein niedriges Elastizitätsmodul auf, wie in den später beschriebenen Vergleichsbeispielen gezeigt, und somit keine zufriedenstellenden Eigenschaften bei Anwendung als allgemeines Elastomer, Formmaterial, Kunstleder, Dichtmittel oder Film.
- Das unmodifizierte Diisocyanat, einer der zweiten Bestandteile des vorliegenden Polyurethanharzes, kann jegliches unmodifizierte Diisocyanat sein, sofern es herkömmlicherweise zur Herstellung des Polyurethanharzes verwendet wird. Beispiele für das unmodifizierte Diisocyanat sind 1,5-Naphthylendiisocyanat, 4,4'- Diphenylmethandiisocyanat, 4,4'-Diphenyldimethylmethandiisocyanat, 4,4'-Dibenzyldiisocyanat, Dialkyldiphenylmethandiisocyanat, 1,3-Phenylendiisocyanat, 1,4-Phenylendiisocyanat, Toluylendiisocyanat, Butan-1,4-diisocyanat, Hexamethylendiisocyanat, Isopropylendiisocyanat, Naphthylendiisocyanat, Methylendiisocyanat, 2,2,4-Trimethylhexamethylendiisocyanat, Cyclohexan-1,4-diisocyanat, Xylylendiisocyanat, hydriertes Xylylendiisocyanat, Isophorondüsocyanat, Lysindiisocyanat, Dicyclohexylmethan-4,4'-diisocyanat, 1,3-Bis(isocyanatmethyl)-cyclohexan, Methylcyclohexandiisocyanat, m-Tetramethylxylylendiisocyanat, 2,4,6-Triisopropylbenzoldiisocyanat, Isopropyliden-bis(4-cyclohexylisocyanat) und Tolidindiisocyanat.
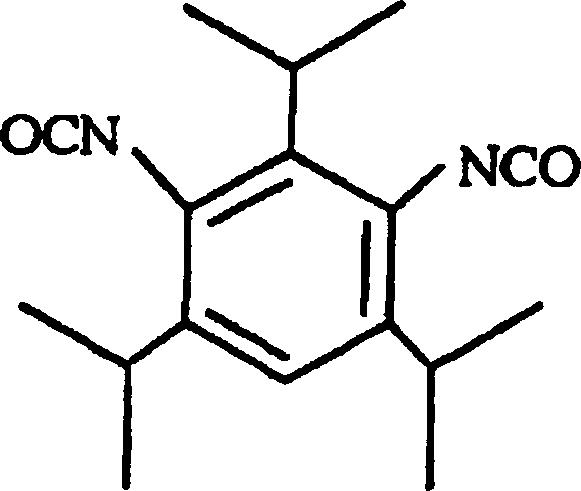
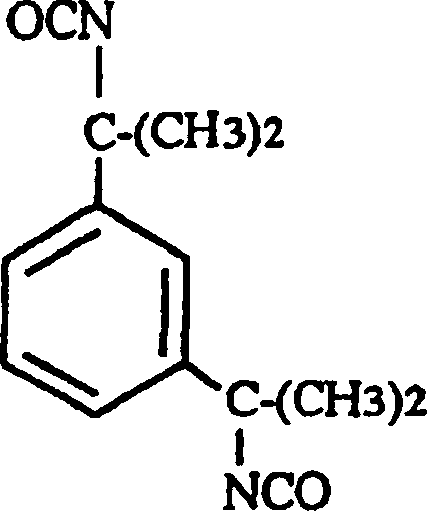
- Das Carbodiimid-modifizierte Diisocyanat, welches der andere des zweiten Bestandteils des vorliegenden Polyurethanharzes ist, umfasst ein Carbodiimidmodifiziertes aromatisches Diisocyanat von hoher sterischer Hinderung, das an einer oder beiden der Ortho-Positionen der beiden Isocyanat-Gruppen einen aliphatischen, alicyclischen oder aromatischen Substituenten von ein oder mehreren Kohlenstoffatomen aufweist. Spezifische Beispiele für ein derartiges Carbodiimid-modifiziertes aromatisches Diisocyanat sind abgeleitet von einem Diisocyanat, gewählt aus der Gruppe, bestehend aus 2,4,6-Triisopropylbenzoldiisocyanat, wie dargestellt durch die folgende Formel:
-
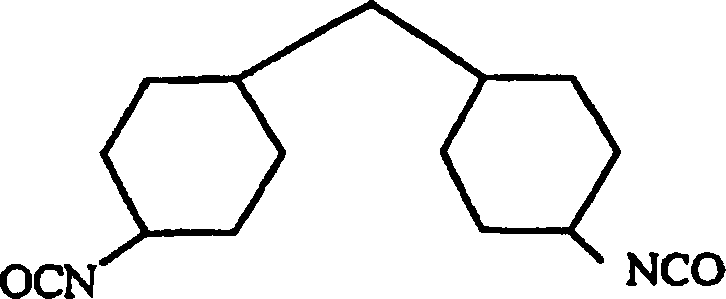
- Das Carbodiimid-modifizierte Diisocyanat, welches den anderen des zweiten Bestandteils des vorliegenden Polyurethanharzes darstellt, umfasst auch ein Carbodiimid-modifiziertes aliphatisches Diisocyanat, worin zumindest einer der beiden Kohlenstoffe, die jeweils mit einer Isocyanatgruppe verbunden sind, di- oder trisubstituiert ist. Zu spezifischen Beispielen für solch ein Carbodiimid-modifiziertes aliphatisches Diisocyanat zählen solche, die von einem Diisocyanat abgeleitet sind, gewählt aus der Gruppe, bestehend aus 4,4'-Dicyclohexylmethandiisocyanat, wie dargestellt durch die folgende Formel:
-
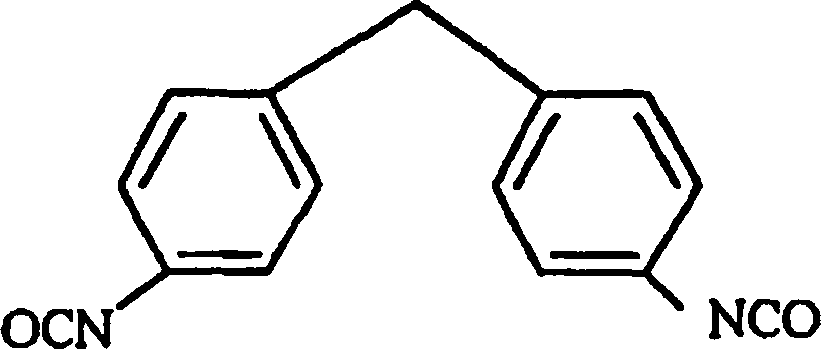
- Die oben genannten Diisocyanate können einzeln oder in Gemischen von zwei oder mehreren Verbindungen verwendet werden. Wo allerdings ein aromatisches Diisocyanat von geringer sterischer Hinderung oder ein aliphatisches Diisocyanat, bei dem die mit einer Isocyanat-Gruppe verbundene(n) Kohlenstoffe) monosubstituiert oder unsubstituiert ist, zum Beispiel 4,4'-Diphenylmethandiisocyanat, wie dargestellt durch die folgende Formel: oder Hexamethylendiisocyanat, wie dargestellt durch OCN-(CH2)6-NCO, ist der Erhalt eines Carbodiimid-modifizierten Diisocyanats, das bei der vorliegenden Erfindung verwendbar ist, unmöglich, da eine Vernetzung zwischen den Carbodiimid-Gruppen oder eine Uretonimin-Vernetzung zwischen Carbodiimid und Isocyanat stattfindet, was zu Verdickung und Verfestigung führen kann.
- Das Carbodiimid-modifizierte Diisocyanat kann aus oben genanntem Diisocyanat mittels einer Reaktion unter Verwendung eines Carbodiimidisations-Katalysators synthetisiert werden.
- Der Carbodiimidisations-Katalysator besteht vorzugsweise in einer organischen Phosphor-artigen Verbindung, ganz besonders in Phospholenoxid angesichts seiner Aktivität. Spezifische Beispiele dafür sind 3-Methyl-1-phenyl-2-phospholen-1-oxid, 3-Methyl-1-ethyl-2-phospholen-1-oxid, 1,3-Dimethyl-2-phospholen-1-oxid, 1-Phenyl-2-phospholen-1-oxid, 1-Ethyl-2-phospholen-1-oxid, 1-Methyl-2-phospholen-1-oxid und deren Isomere mit Doppelbindungen. Von diesen ist 3-Methyl-1-phenyl-2-phospholen-1-oxid, welches im Handel erhältlich ist, besonders bevorzugt.
- Das Carbodiimid-modifizierte Diisocyanat kann mittels eines bekannten Verfahrens hergestellt werden. Zum Beispiel kann es durch Zugabe zu oben genanntem Diisocyanat des oben erwähnten Katalysators in einer Menge von 0,1–10 Gew.-% (bei Vernachlässigung der Wirtschaftlichkeit ist auch eine größere Menge möglich), vorzugsweise 0,5–5 Gew.-%, bezogen auf das Diisocyanat, in Gegenwart oder Abwesenheit eines gegenüber dem Isocyanat inerten Lösungsmittels, in einem Inertgas-(zum Beispiel Stickstoff)-Strom oder bei Sprudeln des Inertgases durch das Lösungsmittel und Rühren des Gemisch bei 120–200°C, um eine Kohlendioxid-Entweichung und eine Kondensation zu erreichen.
- Die Rate der Carbodiimidisation variiert in Abhängigkeit von der Art des verwendeten Diisocyanats, wobei eine zu hohe Rate die Kontrolle des Polymerisationsgrades erschwert. Daher wird die Reaktion vorzugsweise bei einer geeigneten Menge an Katalysator und einer geeigneten Reaktionstemperatur vorgenommen. Zum Beispiel kann bei der Carbodiimid-Modifikation eines aliphatischen Diisocyanats die Menge an Katalysator 0,1–10 Gew.-%, bevorzugt 0,5–5 Gew.-%, und die Reaktionstemperatur 120–200°C betragen; bei der Carbodiimid-Modifikation eines aromatischen Diisocyanats kann die Menge an Katalysator 0,01–5 Gew.-%, bevorzugt 0,05–1 Gew.-%, und die Reaktionstemperatur 50–180°C betragen.
- Das derart hergestellte Carbodiimid-modifizierte Diisocyanat weist vorzugsweise 1–20, bevorzugter 1–15 Carbodiimid-Gruppen auf, da ein solches Carbodiimidmodifiziertes Diisocyanat einen niedrigen Schmelzpunkt und eine geringe Viskosität besitzt und leicht mit anderen Materialien für das Polyurethanharz dispergiert oder vermengt werden kann.
- Das Polyurethanharz der vorliegenden Erfindung kann durch Umsetzen der oben genannten Diol-Komponente und der oben genannten Diisocyanat-Komponente, umfassend mindestens eine Art von unmodifiziertem Diisocyanat und mindestens eine Art von Carbodiimid-modifiziertem Diisocyanat, gemäß einem herkömmlichen Verfahren hergestellt werden.
- Die obige Urethanisation wird bei 20–200°C, bevorzugt 60–150°C, vorgenommen. Da es sich bei dieser Urethanisation um eine exotherme Reaktion handelt, ist eine exakte Kontrolle der Reaktionstemperatur schwierig. Ist allerdings die Reaktionstemperatur zu gering, so ist die Reaktionsrate klein und ein langer Zeitraum dafür erforderlich. Ist die Reaktionstemperatur zu hoch, so wird die Reaktionsrate zu groß und findet eine ungenügende Vermengung statt, was eine ungleichmäßige Reaktion und Zerstörung (Verbrennung) des entstandenen Polyurethanharzes bewirken kann.
- Ist die Urethanisationsrate klein, so ist die Verwendung eines herkömmlichen Urethanisations-Katalysators, zum Beispiel eines Amins (zum Beispiel Triethylendiamin) oder eine Organotins (zum Beispiel Dibutylzinndilaurat), in einer Menge von 0,001–1 Gew.-%, bezogen auf das gebildete Polyurethanharz, möglich. Außerdem ist zum Zeitpunkt der Synthese die Verwendung mindestens einer Art von Lösungsmittel, wie zum Beispiel von Dimethylformamid (DMF), Tetrahydrofuran (THF), Methylethylketon (MEK), Toluol oder ähnlichem, möglich.
- Außerdem ist (1) das Umsetzen einer Diol-Komponente mit einer Diisocyanat-Komponente zum Synthetisieren eines Isocyanatgruppe-terminierten Vorpolymers und das Anhängen an das Vorpolymer eines Kettenverlängerers, bestehend aus einem Diol (zum Beispiel Butandiol, Ethylenglycol oder Propylen-glycol) oder eines Diamins (zum Beispiel Ethylendiamin, Propylendiamin, Triethylendiamin, Butylendiamin oder Hexylendiamin), oder (2) das Umsetzen einer Diol-Komponente mit einem unmodifizierten Diisocyanat zum Synthetisieren eines Hydroxylgruppeterminierten Vorpolymers und das Anhängen eines Carbodiimid-modifizierten Diisocyanats an das Vorpolymer, oder (3) das Umsetzen einer Diol-Komponente mit einem unmodifizierten Diisocyanat zum Synthetisieren eines Hydroxylgruppeterminierten Vorpolymers, das Umsetzen des Vorpolymers mit einem Carbodiimidmodifizieten Diisocyanat und das Anhängen eines Kettenverlängerers an das Reaktionsprodukt, möglich.
- Außerdem ist (1) das Umsetzen einer Diol-Komponente mit einem Carbodiimidmodifizierten Diisocyanat zum Synthetisieren eines Hydroxylgruppe-terminierten Vorpolymers und das Umsetzen des Vorpolymers mit einem unmodifizierten Diisocyanat möglich oder (2) das Umsetzen einer Diol-Komponente mit einem Carbodiimid-modifizierten Diisocyanat zum Synthetisieren eines Hydroxylgruppeterminierten Vorpolymers, das Umsetzen des Vorpolymers mit einem unmodifizierten Diisocyanat zum Synthetisieren eines Isocyanatgruppe-terminierten Vorpolymers und das Anhängen eines Kettenverlängerers an das Vorpolymer, oder (3) das Umsetzen einer Diol-Komponente mit einem Carbodiimid-modifizierten Diisocyanat und einer Diol-Komponente mit einem unmodifizierten Diisocyanat zum Synthetisieren eines Hydroxylgruppe-terminierten Vorpolymers und eines Isocyanatgruppe-terminierten Vorpolymers und das Mischen der beiden Vorpolymere, oder (4) das Umsetzen einer Diol-Komponente mit einem Carbodiimid-modifizierten Diisocyanat und einer Diol-Komponente mit einem unmodifizierten Diisocyanat zum Synthetisieren eines Hydroxylgruppe-terminierten Vorpolymers und eines Isocyanatgruppe-terminierten Vorpolymers, das Mischen der beiden Vorpolymere und das Anhängen eines Kettenverlängerers an das Gemisch, möglich.
- Außerdem ist das Zugeben eines Carbodiimid-modifizierten Diisocyanats oder eines Isocyanatgruppe-terminierten Vorpolymers, eines bekannten Isocyanat-Blockiermittels wie Phenol (zum Beispiel Phenol oder Xylenol), aliphatischer Alkohol (zum Beispiel Methanol, Ethanol, Isopropanol oder Cyclohexylalkohol), Oxim (zum Beispiel Methylethylketoxim), Amin, Amid, Imid, Lactam (zum Beispiel ε-Caprolactam), Dicarbonyl-Verbindung (zum Beispiel Diethylmalonat oder Ethylacetoacetat) oder ähnliches zum Blockieren der Isocyanatgruppe und das Erhitzen des resultierenden Produkts mit einem Hydroxylgruppe-terminierten Vorpolymer und einem Kettenverlängerer (zum Beispiel bifunktioneller oder höherer Alkohol oder Amin) zum Regenerieren des Isocyanats und das Umsetzen mit einer Hydroxylgruppe zum Synthetisieren eines Polyurethans möglich.
- Bei obiger Reaktion ist die Zugabe einer geeigneten Menge eines Carbodiimidisations-Katalysators zum Urethanisationssystem möglich, um einen Teil der im System verbliebenen Isocyanatgruppen zu Carbodiimidgruppen umzuwandeln und dadurch Carbodiimid-Bindungen in das Molekül des gebildeten Polyurethanharzes einzuführen.
- Bei obiger Reaktion differiert die Menge an Carbodiimidisations-Katalysator in Abhängigkeit vom Gehalt an Isocyanatgruppe im umzusetzenden Material, der Art und Menge des verwendeten Urethanisations-Katalysators und der angewandten Urethanisationstemperatur.
- Beim wie oben erzeugten vorliegenden Polyurethanharz kann das Molverhältnis von unmodifiziertem Diisocyanat zu Carbodiimid-modifiziertem Diisocyanat zum Beispiel 35–0,1 : 1, bevorzugt 10–0,5 : 1 betragen. Übersteigt der Gehalt an unmodifiziertem Diisocyanat die Obergrenze, so weist das resultierende Polyurethanharz eine geringe Hydrolysebeständigkeit auf; liegt der Gehalt unterhalb der Untergrenze, so ist der Erhalt eines Polyurethanharz von hoher Elastizität unmöglich.
- Beim vorliegenden Polyurethanharz beträgt der Gehalt an Carbodiimidgruppen, wie von mindestens einer Art von Carbodiimid-modifiziertem Diisocyanat beigesteuert, vorzugsweise 1 × 10–2 bis 1 × 10–6 Mol, bevorzugter 1 × 10–3 bis 1 × 10–5 Mol pro g des Polyurethanharzes. Liegt der Gehalt an Carbodiimidgruppen unter der Untergrenze, so weist das resultierende Polyurethanharz eine geringe Hydrolysebeständigkeit auf; liegt der Gehalt an Carbodiimidgruppen über der Obergrenze, so zeigt das resultierende Polyurethanharz eine zu geringe Elastizität, was den Erhalt eines zufriedenstellenden Polyurethanharzes unmöglich macht.
- Beim vorliegenden Polyurethanharz kann das Molekulargewicht zum Beispiel 5.000– 200.000 und der Index (NCO/OH) zum Beispiel 0,8–1,5, vorzugsweise 1,0–1,1, betragen.
- Das vorliegende Polyurethanharz wird als eine Substanz erhalten, die bei atmosphärischer Temperatur fest ist, sofern kein Lösungsmittel bei der Herstellung verwendet wird. Daher kann es nach Lösen in einem Lösungsmittel in Form dieser Lösung oder nach dem Mahlen in Form eines Pulvers verwendet werden; oder kann unter Verwendung eines Extruders oder einer Spritzgießmaschine bei 150–250°C, bevorzugt 170–200°C, zum Erhalt eines Produkts geformt oder gespritzt werden. Selbstverständlich kann das Polyurethanharz auch vor der Verfestigung in einen Extruder oder ähnliches eingebracht werden, worin es zur Vervollständigung der Urethanisation schmelzgeknetet wird.
- Während der Herstellung des vorliegenden Polyurethanharzes ist die problemlose Zugabe bekannter Zusatzstoffe wie eines Oxidationshemmers, Ultraviolett-Absorptionsmittels, Lichtstabilisators und ähnliches möglich.
- Die vorliegende Erfindung wird im folgenden anhand von Beispielen ausführlicher beschrieben.
- Synthese der Carbodiimid-modifizierten Diisocyanate
- Synthesebeispiel 1
- In einen separierbaren 500-ml-Kolben, ausgestattet mit einem Kondensationsrohr, wurden 200 g 4,4'-Dicyclohexylmethandiisocyanat und 1 g 3-Methyl-1-phenyl-2-phospholen-1-oxid eingebracht. Diese wurden unter Verwendung eines mechanischen Rührers in einem Stickstoffstrom bei 185°C über 3 Stunden hinweg zum Erhalt eines Carbodiimid-modifizierten Diisocyanats mit einem mittleren Molekulargewicht von 480 und einem mittleren Polymerisationsgrad von n = 1 gerührt.
- Synthesebeispiele 2 bis 36
- Die in Tabelle 1 gezeigten Carbodiimid-modifizierten Diisocyanate wurden unter Durchführung desselben Vorgangs wie im Synthesebeispiel 1 erhalten, mit der Ausnahme, dass die Reaktionszeit und das Diisocyanat verändert wurden. Übrigens betrug in den Synthesebeispielen 19 bis 36 die Katalysatormenge 0,3%.
- Synthese der Polyurethanharze
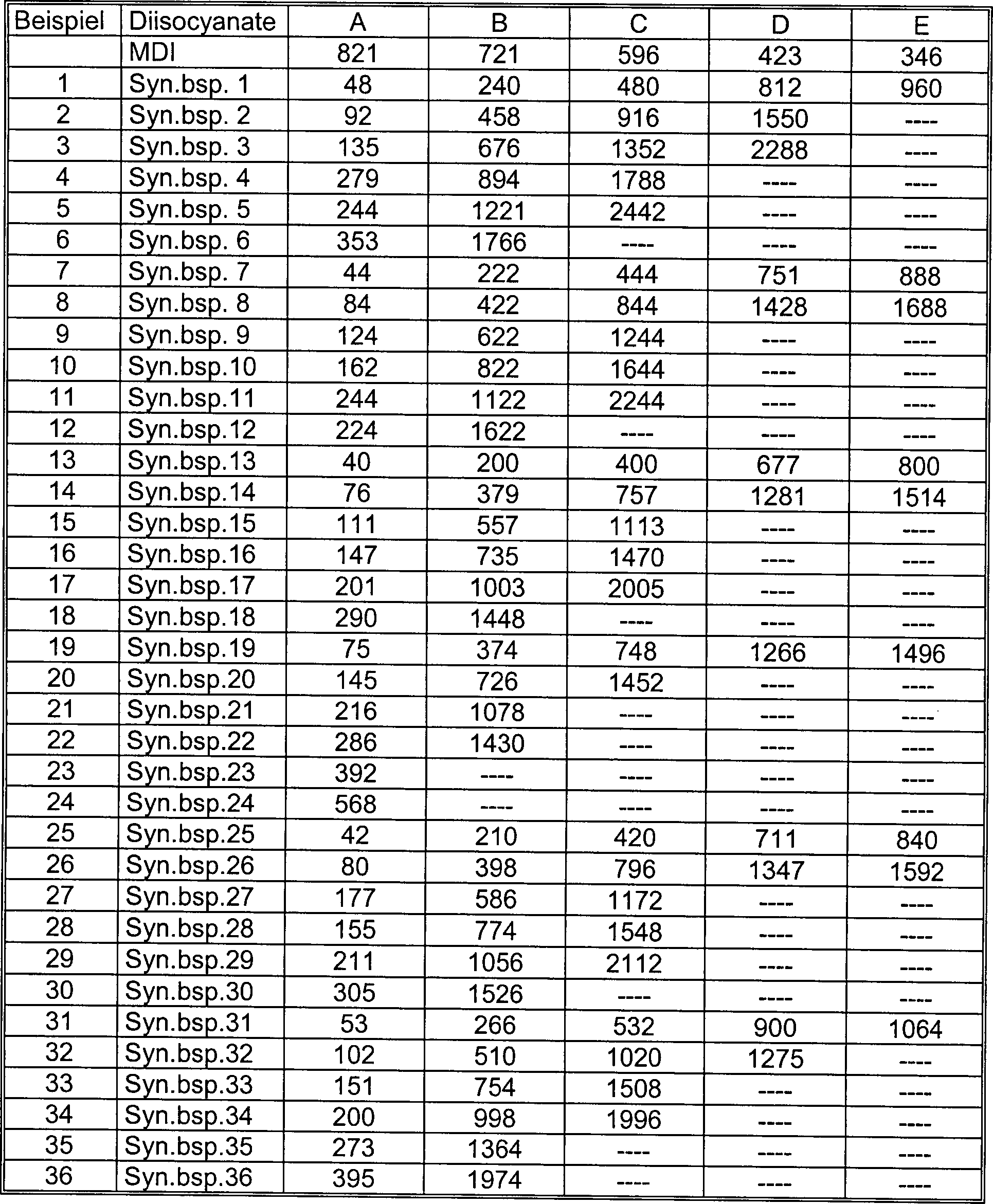
- Beispiele 1A bis 36B
- 2.113 g eines Polyesterpolyols mit einem mittleren Molekulargewicht von 2.113, bestehend aus Adipinsäure/Ethylenglycol/Propylenglycol, wurden 4,4'-Diphenylmethandiisocyanat und eines der in Synthesebeispielen 1 bis 36 erhaltenen Carbodiimid-modifizierten Diisocyanate in den in Tabelle 2 jeweils gezeigten Mengen zugegeben. Jedes Gemisch wurde einer Reaktion bei 80°C für 5 Stunden zum Erhalt verschiedener Vorpolymere unterzogen. Eines der Vorpolymere und 200 g Butandiol wurden unter Verwendung eines Schmelzextrusionsreaktors umgesetzt; das resultierende Polyurethan wurde bei einer Endtemperatur von 185°C unter Verwendung einer T-Düse mit einer Dicke von 250 μm zum Erhalt verschiedener Filme extrudiert; jeder Film wurde mit einer Wickelmaschine aufgerollt.
- In Tabellen 2–4 bezieht sich MDI auf 4,4'-Diphenylmethandiisocyanat; Beispiel 1A bedeutet zum Beispiel, dass in der Spalte A der Tabelle 2 821 g an 4,4'-Diphenylmethandiisocyanat und 48 g des Carbodiimid-modifizierten Diisocyanats aus Synthesebeispiel 1 verwendet wurden.
- Vergleichsbeispiel 1
- 2.113 g eines Polyesterpolyols mit einem mittleren Molekulargewicht von 2.113, bestehend aus Adipinsäure/Ethylenglycol/Propylenglycol, wurden 846 g an 4,4'-Diphenylmethandiisocyanat zugegeben. Das Gemisch wurde einer Reaktion bei 80°C für 5 Stunden zum Erhalt eines Vorpolymers unterzogen. Das Vorpolymer und 200 g Butandiol wurden unter Verwendung eines Schmelzextrusionsreaktors umgesetzt; das resultierende Polyurethan wurde bei einer Endtemperatur von 185°C unter Verwendung einer T-Düse mit einer Dicke von 250 μm zum Erhalt eines Films extrudiert; der Film wurde mittels eines Wickelgeräts aufgerollt.
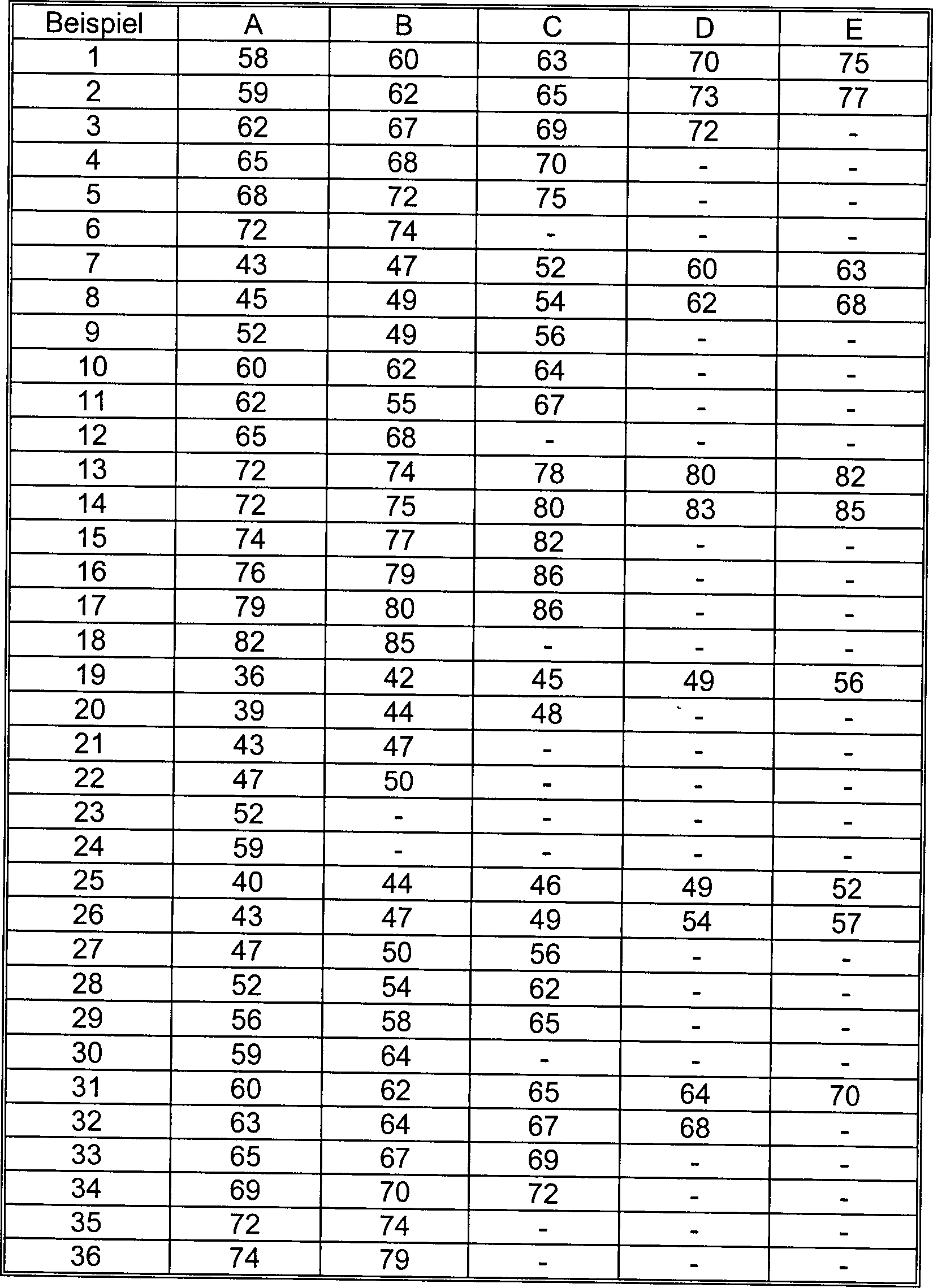
- Hydrolysetest
- Jeder der in Beispielen 1A bis 36B und Vergleichsbeispiel 1 erhaltenen Polyurethanfilme wurde einer Stanzung zum Erhalt von Teststücken in Hantelform unterzogen. Jedes Teststück wurde in Wasser mit 95°C eingetaucht, am 15. Tag danach herausgenommen und auf die Beibehaltung der Zugfestigkeit gemessen (%). Die Ergebnisse sind in Tabelle 3 gezeigt. Übrigens brach der Polyurethanfilm aus Vergleichsbeispiel 1.
- Synthese der Polyurethanharze
- Vergleichsbeispiele 2 bis 10
- 2.113 eines Polyesterpolyols mit einem mittleren Molekulargewicht von 2.113, bestehend aus Adipinsäure/Ethylenglycol/Propylenglycol, wurde ein in Tabelle 4 gezeigtes Carbodiimid-modifiziertes Diisocyanat in einer in Tabelle 4 gezeigten Menge zugegeben. Das Gemisch wurde einer Reaktion bei 80°C für 5 Stunden zum Erhalt eines Vorpolymers unterzogen. Das Vorpolymer und 200 g Butandiol wurden unter Verwendung eines Schmelzextrusionsreaktors umgesetzt; das resultierende Polyurethan wurde bei einer Endtemperatur von 185°C unter Verwendung einer T-Düse mit einer Dicke von 250 μm extrudiert. Allerdings wiesen alle erhaltenen Polyurethane eine geringe Elastizität auf und konnten nicht zur Form eines Films extrudiert werden.
- Wie aus obigem ersichtlich, wird mit der vorliegenden Erfindung ein Polyurethanharz mit Carbodiimid-Bindungen in der Molekülkette bereitgestellt, welches eine über einen langen Zeitraum hinweg stabile Wasserfestigkeit zeigt.
Claims (8)
- Polyurethanharz, hergestellt aus einer Diol-Komponente und einer Diisocyanat-Komponente mittels eines herkömmlichen Verfahrens, wobei die Diisocyanat-Komponente umfasst: mindestens eine Art von unmodifiziertem Diisocyanat, und mindestens eine Art von Carbodiimid-modifiziertem aromatischem Diisocyanat, welches, an einer oder beiden der Ortho-Positionen der beiden Isocyanat-Gruppen, einen aliphatischen, alicyclischen oder aromatischen Substituenten aus ein oder mehreren Kohlenstoffatomen aufweist, und wobei das Molverhältnis von unmodifiziertem Diisocyanat zu Carbodiimidmodifiziertem aromatischem Diisocyanat 35–0,1 : 1 beträgt.
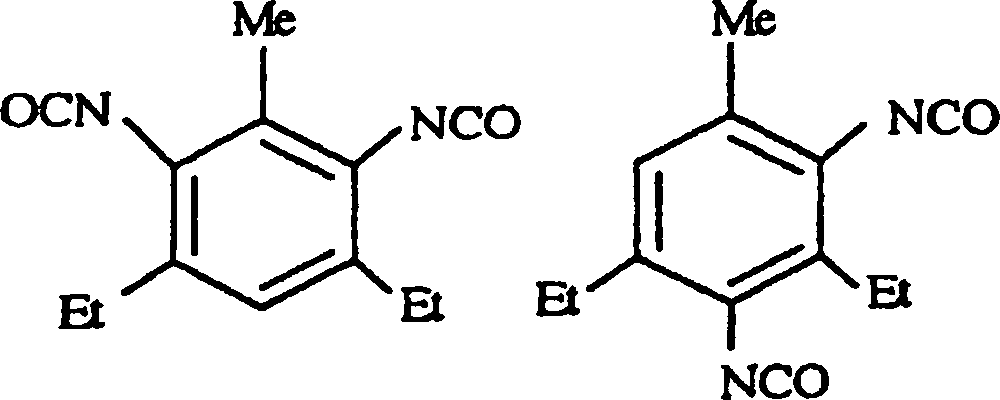
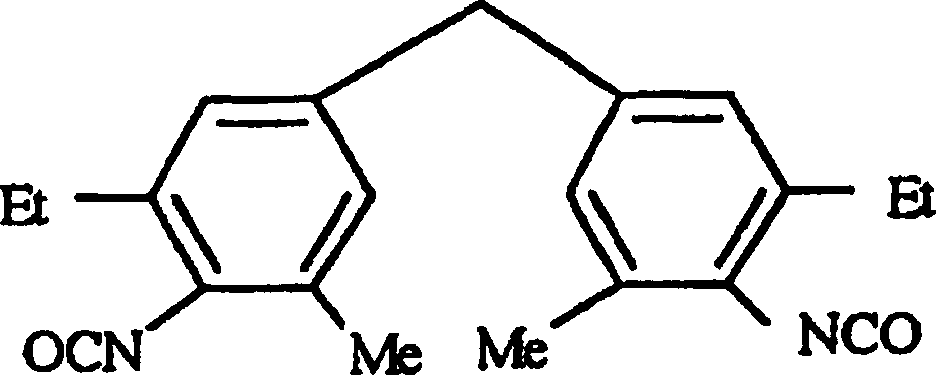
- Polyurethanharz nach Anspruch 1, wobei das Carbodiimid-modifzierte aromatische Diisocyanat von einem Diisocyanat abgeleitet ist, das gewählt ist aus der Gruppe, bestehend aus 2,4,6-Triisopropylbenzoldiisocyanat, Diethyltoluylendiisocyanat und 3,3'-Ethyl-5,5'-methyl-4,4'diphenylmethandiisocyanat.
- Polyurethanharz nach Anspruch 1, wobei die Menge an Carbodiimid-Gruppe, die im Carbodiimid-modifizierten aromatischen Diisocyanat enthalten ist, 1 × 10–2 bis 1–10–6 Mol pro g des Polyurethanharzes beträgt.
- Polyurethanharz nach Anspruch 1, wobei das Carbodiimid-modifizierte aromatische Diisocyanat 1–20 Carbodiimid-Gruppen aufweist.
- Polyurethanharz, hergestellt aus einer Diol-Komponente und einer Diisocyanat-Komponente mittels eines herkömmlichen Verfahrens, wobei die Diisocyanat-Komponente umfasst: mindestens eine Art von unmodifiziertem Diisocyanat, und mindestens eine Art von Carbodiimid-modifiziertem aliphatischem Diisocyanat, wobei mindestens einer der beiden Kohlenstoffe, die jeweils mit einer Isocyanatgruppe verbunden sind, di- oder tri-substituiert ist, und wobei das Molverhältnis von unmodifiziertem Diisocyanats zu Carbodiimidmodifiziertem aromatischem Diisocyanat 35–0,1 : 1 beträgt.
- Polyurethanharz nach Anspruch 5, wobei das Carbodiimid-modifizierte aromatische Diisocyanat von einem Diisocyanat abgeleitet ist, das gewählt ist aus der Gruppe, bestehend aus 4,4'-Dicyclohexylmethandiisocyanat, Tetramethylxylylendiisocyanat und Isophorondiisocyanat.
- Polyurethanharz nach Anspruch 5, wobei die Menge an Carbodiimid-Gruppe, die im Carbodiimid-modifizierten aromatischen Diisocyanat enthalten ist, 1 × 10–2 bis 1–10–6 Mol pro g des Polyurethanharzes beträgt.
- Polyurethanharz nach Anspruch 5, wobei das Carbodiimid-modifizierte aromatische Diisocyanat 1–20 Carbodiimid-Gruppen aufweist.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP10459996A JP3733170B2 (ja) | 1996-04-02 | 1996-04-02 | ポリウレタン樹脂 |
| JP10459996 | 1996-04-02 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69722500D1 DE69722500D1 (de) | 2003-07-10 |
| DE69722500T2 true DE69722500T2 (de) | 2004-05-06 |
Family
ID=14384896
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69722500T Expired - Fee Related DE69722500T2 (de) | 1996-04-02 | 1997-03-19 | Carbodiimide enthaltende Polyurethanharze |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US6153718A (de) |
| EP (1) | EP0799843B1 (de) |
| JP (1) | JP3733170B2 (de) |
| KR (1) | KR100461621B1 (de) |
| DE (1) | DE69722500T2 (de) |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6063890A (en) * | 1998-07-01 | 2000-05-16 | Basf Corporation | Polycarbodiimide polymers and their use as adhesive intermediate layers in automotive coatings |
| DE50004222D1 (de) * | 1999-07-02 | 2003-12-04 | Rhein Chemie Rheinau Gmbh | Katalysator-System für die NCO/OH-Reaktion (Polyurethanbildung) |
| TW200427884A (en) * | 2002-12-12 | 2004-12-16 | Nisshin Spinning | Blended woven or knitted fabrics containing polyurethane elastic fibers and process for the production thereof |
| WO2007048145A2 (en) | 2005-10-21 | 2007-04-26 | Entrotech, Inc. | Protective sheets, articles, and methods |
| DE102006024112A1 (de) | 2006-05-19 | 2007-11-22 | Eckold Gmbh & Co Kg | Matrize zum mechanischen Fügen |
| US8545960B2 (en) | 2006-10-23 | 2013-10-01 | Entrotech, Inc. | Articles comprising protective sheets and related methods |
| JP4916007B2 (ja) | 2007-03-01 | 2012-04-11 | 三洋化成工業株式会社 | スラッシュ成形用樹脂粉末組成物及び成形品 |
| US10035932B2 (en) | 2007-09-25 | 2018-07-31 | Aero Advanced Paint Technology, Inc. | Paint replacement films, composites therefrom, and related methods |
| US10981371B2 (en) | 2008-01-19 | 2021-04-20 | Entrotech, Inc. | Protected graphics and related methods |
| CN102428114A (zh) | 2009-05-15 | 2012-04-25 | 莱茵化学莱瑙有限公司 | 用于制备碳二亚胺的方法 |
| EP2388284A1 (de) * | 2010-05-21 | 2011-11-23 | Rhein Chemie Rheinau GmbH | Biobasierte Carbodiimide, ein Verfahren zu deren Herstellung und deren Verwendung |
| WO2013072310A1 (de) | 2011-11-17 | 2013-05-23 | Basf Se | Additive zur hydrolysestabilisierung von polykondensaten |
| EP2660258A1 (de) * | 2012-05-03 | 2013-11-06 | Rhein Chemie Rheinau GmbH | Neue Carbodiimid-haltige Zusammensetzungen, ein Verfahren zu deren Herstellung und deren Verwendung |
| EP2660259A1 (de) | 2012-05-03 | 2013-11-06 | Rhein Chemie Rheinau GmbH | Neue Carbodiimid-haltige Zusammensetzungen, ein Verfahren zu deren Herstellung und deren Verwendung |
| DE102012223670A1 (de) * | 2012-12-19 | 2014-06-26 | Tesa Se | Wiederablösbarer Haftklebestreifen |
| KR20160038139A (ko) * | 2014-09-29 | 2016-04-07 | (주)엘지하우시스 | 코팅용 조성물 및 이를 적용한 자동차 시트 |
| CN105778026B (zh) * | 2014-12-25 | 2018-11-20 | 上海华峰新材料研发科技有限公司 | 含位阻的碳化二亚胺类低聚物及其制备方法和应用 |
| JP2017115106A (ja) | 2015-12-25 | 2017-06-29 | 株式会社クレハ | 組成物、ダウンホールツール用組成物、ダウンホールツール用分解性ゴム部材、ダウンホールツール、及び坑井掘削方法 |
| US10058502B2 (en) | 2015-12-31 | 2018-08-28 | L'oreal | Nail polish compositions |
| KR102504518B1 (ko) | 2016-09-20 | 2023-02-27 | 엔트로테크 아이엔씨 | 결함이 감소된 도막 아플리케, 물품 및 방법 |
| JP6984838B2 (ja) * | 2016-12-27 | 2021-12-22 | 日清紡ケミカル株式会社 | カルボキシル基含有水性樹脂組成物、成形体、及びポリカルボジイミド化合物の製造方法 |
| CN110431178B (zh) | 2017-05-25 | 2021-02-02 | 株式会社吴羽 | 井下工具用橡胶组合物以及井下工具用构件 |
| JP6947468B2 (ja) * | 2017-08-28 | 2021-10-13 | 日清紡ケミカル株式会社 | ポリカルボジイミド化合物及び熱硬化性樹脂組成物 |
| CN120271790A (zh) * | 2025-06-06 | 2025-07-08 | 上海朗亿功能材料有限公司 | 一种含碳二亚胺的聚氨酯及其制备方法和应用 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2522901A1 (de) * | 1975-05-23 | 1976-12-09 | Basf Ag | Waermealterungsbestaendige polybutylenterephthalat-formmassen |
| CH623066A5 (de) * | 1976-05-11 | 1981-05-15 | Ciba Geigy Ag | |
| EP0002754B1 (de) * | 1977-12-30 | 1983-05-18 | Ciba-Geigy Ag | Neue Polyalkylpiperidinderivate von s-Triazinen, ihre Verwendung zum Stabilisieren von Kunststoffen und die so stabilisierten Kunststoffe |
| US4419294A (en) * | 1982-03-08 | 1983-12-06 | American Cyanamid Company | Carbodiimide oligomers of tertiary aliphatic isocyanates |
| US4696959A (en) * | 1983-09-26 | 1987-09-29 | Ppg Industries, Inc. | Modified piperidines as ultraviolet light stabilizers |
| US5099027A (en) * | 1987-08-12 | 1992-03-24 | Ppg Industries, Inc. | 2(2-hydroxyphenyl)2H-benzotriazole compounds and homopolymers or copolymers thereof |
| DE4018184A1 (de) * | 1990-06-07 | 1991-12-12 | Bayer Ag | Verfahren zur stabilisierung von estergruppen enthaltenden kunststoffen |
| JPH059252A (ja) * | 1991-07-03 | 1993-01-19 | Nisshinbo Ind Inc | ポリカルボジイミドパルプ及びその製造方法 |
| DE4126359A1 (de) * | 1991-08-09 | 1993-02-11 | Basf Ag | Oligomere carbodiimide |
| JP3165971B2 (ja) * | 1991-12-26 | 2001-05-14 | 日清紡績株式会社 | ポリテトラメチルキシリレンカルボジイミド |
| JP3165972B2 (ja) * | 1991-12-27 | 2001-05-14 | 日清紡績株式会社 | 高分子量ポリカルボジイミド溶液の製造方法 |
| US5352400A (en) * | 1992-04-29 | 1994-10-04 | E. I. Du Pont De Nemours And Company | Carbodiimides and processes therefor |
| US5357021A (en) * | 1993-07-21 | 1994-10-18 | Basf Corporation | Reactive carbodimide compositions |
| JPH0827092A (ja) * | 1994-07-15 | 1996-01-30 | Nisshinbo Ind Inc | ウレア変性カルボジイミド及びその製造方法 |
-
1996
- 1996-04-02 JP JP10459996A patent/JP3733170B2/ja not_active Expired - Fee Related
-
1997
- 1997-03-19 EP EP97104707A patent/EP0799843B1/de not_active Expired - Lifetime
- 1997-03-19 DE DE69722500T patent/DE69722500T2/de not_active Expired - Fee Related
- 1997-04-02 KR KR1019970012179A patent/KR100461621B1/ko not_active Expired - Fee Related
-
1999
- 1999-06-23 US US09/338,508 patent/US6153718A/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| EP0799843B1 (de) | 2003-06-04 |
| KR100461621B1 (ko) | 2005-10-21 |
| DE69722500D1 (de) | 2003-07-10 |
| JP3733170B2 (ja) | 2006-01-11 |
| JPH09272726A (ja) | 1997-10-21 |
| KR970072654A (ko) | 1997-11-07 |
| US6153718A (en) | 2000-11-28 |
| EP0799843A1 (de) | 1997-10-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69722500T2 (de) | Carbodiimide enthaltende Polyurethanharze | |
| DE3151802C2 (de) | ||
| DE69204022T2 (de) | Feuchtigkeitshärtende auf Urethan basierende Dichtungsmasse. | |
| DE3856125T2 (de) | Hitzehärtbares Urethan-Elastomer | |
| EP0154768B1 (de) | Verfahren zur Herstellung von Polyurethanen, Polyurethane mit aromatischen Aminoendgruppen und ihre Verwendung | |
| WO2009065513A1 (de) | Polyurethan-/polyharnstoff-elastomers auf basis von 2,4'-diphenylmethandiisocyanat-prepolymeren und ihre herstellung | |
| DE2437889C3 (de) | Polyurethan-Elastomere und ihre Herstellung | |
| EP0001057B1 (de) | Verfahren zur Verbesserung der Vergilbungsbeständigkeit von Polyurethanen | |
| DE3426875A1 (de) | Verfahren zur herstellung von polyurethan | |
| DE2316454A1 (de) | Polyurethan-polyharnstoff-elastomere | |
| DE2516970C2 (de) | Hochtemperaturbeständige, thermoplastische Polyurethanelastomere und Verfahren zu ihrer Herstellung | |
| DE2604657A1 (de) | Haerter fuer polyurethan-reaktionsgemische | |
| DE1105157B (de) | Verfahren zur Herstellung von hochmolekularen vernetzten Kunststoffen aus Saeurehydraziden und Isocyanaten | |
| DE19512789A1 (de) | Thermoplastisches Polyurethanharz mit breiter Gummizustandsregion und Verfahren zur Herstellung desselben | |
| DE2216112C2 (de) | Verwendung von Zusammensetzungen auf der Basis von Polyurethanen, die durch Umsetzung von w,w'Diisocyanaten und Diolen erhalten worden sind als Klebstoffe | |
| DE2527991A1 (de) | Polyurethanloesungen | |
| DE2708820A1 (de) | Thermoplastische polyurethan-elastomere | |
| DE2521841C2 (de) | Verfahren zum Abdichten und Ausfüllen von Fugen und zum Beschichten von Oberflächen | |
| DE2500921B2 (de) | Verfahren zur Herstellung von Polyurethanlösungen | |
| DE19637375A1 (de) | Uretdiongruppenhaltige Polyisocyanate, ein Verfahren zu ihrer Herstellung sowie deren Verwendung | |
| DE2442763B2 (de) | Verfahren zur Herstellung von thermoplastischen und elastischen Polyurethanen | |
| DE2252107B2 (de) | Verfahren zur Herstellung von Polyurethanen | |
| EP4370500B1 (de) | Aromatische carbodiimide, verfahren zu deren herstellung und deren verwendung | |
| EP0017060B2 (de) | Verfahren zur Herstellung von Polyurethan-Elastomeren | |
| DE3889961T2 (de) | Polyisocyanatkomposition. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |