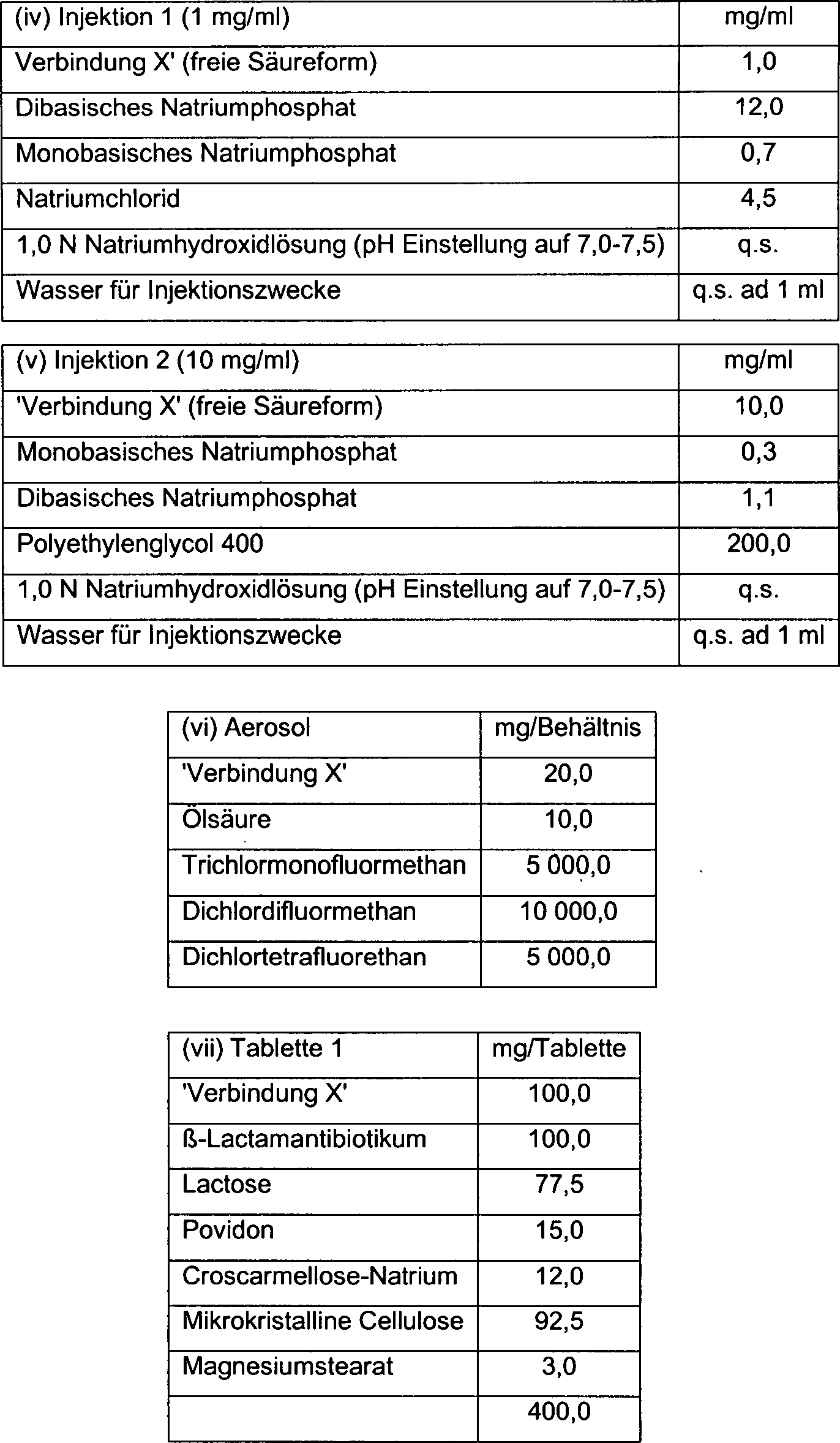
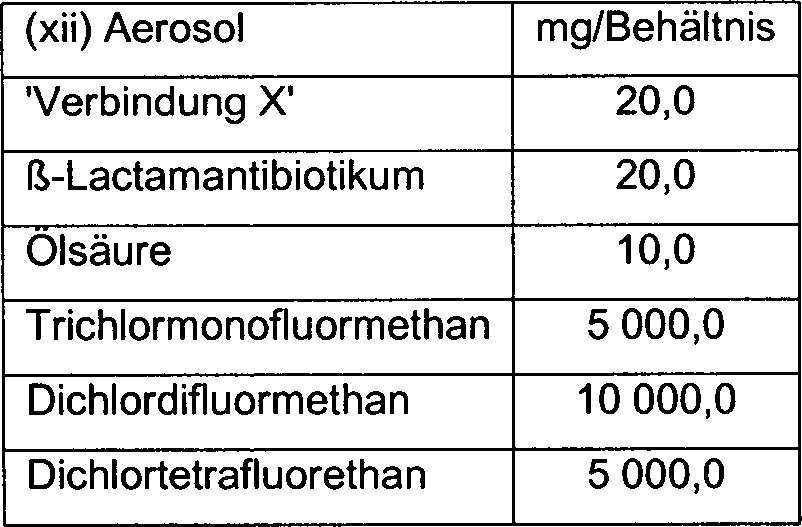
DE60214740T2 - 3-substituierte 7-alkylidene-3-cephem-4-carbonsäuren als beta-lactamase inhibitoren - Google Patents
3-substituierte 7-alkylidene-3-cephem-4-carbonsäuren als beta-lactamase inhibitoren Download PDFInfo
- Publication number
- DE60214740T2 DE60214740T2 DE60214740T DE60214740T DE60214740T2 DE 60214740 T2 DE60214740 T2 DE 60214740T2 DE 60214740 T DE60214740 T DE 60214740T DE 60214740 T DE60214740 T DE 60214740T DE 60214740 T2 DE60214740 T2 DE 60214740T2
- Authority
- DE
- Germany
- Prior art keywords
- compound according
- alkyl
- alkanoyloxy
- aryl
- heterocyclyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000003781 beta lactamase inhibitor Substances 0.000 title description 15
- 229940126813 beta-lactamase inhibitor Drugs 0.000 title description 15
- 150000001875 compounds Chemical class 0.000 claims abstract description 82
- 150000003839 salts Chemical class 0.000 claims abstract description 20
- 239000003782 beta lactam antibiotic agent Substances 0.000 claims abstract description 15
- 239000002132 β-lactam antibiotic Substances 0.000 claims abstract description 15
- 229940124586 β-lactam antibiotics Drugs 0.000 claims abstract description 15
- 102000006635 beta-lactamase Human genes 0.000 claims abstract description 14
- 108090000204 Dipeptidase 1 Proteins 0.000 claims abstract description 11
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 9
- 230000000694 effects Effects 0.000 claims abstract description 7
- 241000124008 Mammalia Species 0.000 claims abstract description 6
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 4
- 208000035143 Bacterial infection Diseases 0.000 claims abstract description 3
- 208000022362 bacterial infectious disease Diseases 0.000 claims abstract description 3
- 150000003952 β-lactams Chemical class 0.000 claims abstract description 3
- -1 hydroxy, cyano, cyanato, nitro, mercapto Chemical class 0.000 claims description 103
- 239000000203 mixture Substances 0.000 claims description 29
- 229910052739 hydrogen Inorganic materials 0.000 claims description 21
- 239000001257 hydrogen Substances 0.000 claims description 18
- 125000003118 aryl group Chemical group 0.000 claims description 17
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 14
- 125000000623 heterocyclic group Chemical group 0.000 claims description 14
- 125000004423 acyloxy group Chemical group 0.000 claims description 12
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 claims description 10
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 8
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 claims description 8
- 125000000027 (C1-C10) alkoxy group Chemical group 0.000 claims description 7
- 125000006374 C2-C10 alkenyl group Chemical group 0.000 claims description 7
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 7
- 239000003814 drug Substances 0.000 claims description 7
- 125000001424 substituent group Chemical group 0.000 claims description 7
- 229910052736 halogen Inorganic materials 0.000 claims description 6
- 150000002367 halogens Chemical class 0.000 claims description 6
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 229910052760 oxygen Inorganic materials 0.000 claims description 6
- 125000001589 carboacyl group Chemical group 0.000 claims description 5
- 125000005843 halogen group Chemical group 0.000 claims description 5
- 125000006413 ring segment Chemical group 0.000 claims description 5
- 125000005862 (C1-C6)alkanoyl group Chemical group 0.000 claims description 4
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 claims description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 4
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 4
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 4
- 150000002431 hydrogen Chemical class 0.000 claims description 4
- 229920006395 saturated elastomer Polymers 0.000 claims description 4
- 229910052717 sulfur Inorganic materials 0.000 claims description 4
- 239000011593 sulfur Substances 0.000 claims description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 3
- 125000005842 heteroatom Chemical group 0.000 claims description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 3
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 3
- 239000001301 oxygen Substances 0.000 claims description 3
- 150000002978 peroxides Chemical class 0.000 claims description 3
- 125000000446 sulfanediyl group Chemical group *S* 0.000 claims description 3
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 claims description 3
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims description 2
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 claims description 2
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 2
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 claims description 2
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 2
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 2
- CIUQDSCDWFSTQR-UHFFFAOYSA-N [C]1=CC=CC=C1 Chemical compound [C]1=CC=CC=C1 CIUQDSCDWFSTQR-UHFFFAOYSA-N 0.000 claims description 2
- 125000004104 aryloxy group Chemical group 0.000 claims description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 2
- 125000004122 cyclic group Chemical group 0.000 claims description 2
- 238000013160 medical therapy Methods 0.000 claims description 2
- 229910052757 nitrogen Inorganic materials 0.000 claims description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 2
- 125000004043 oxo group Chemical group O=* 0.000 claims description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 2
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 claims description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 2
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims 1
- JCXJVPUVTGWSNB-UHFFFAOYSA-N Nitrogen dioxide Chemical class O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 claims 1
- 125000004432 carbon atom Chemical group C* 0.000 claims 1
- 238000000034 method Methods 0.000 abstract description 28
- 230000015572 biosynthetic process Effects 0.000 abstract description 11
- 238000003786 synthesis reaction Methods 0.000 abstract description 10
- 239000000543 intermediate Substances 0.000 abstract description 4
- 230000008569 process Effects 0.000 abstract description 2
- 230000002708 enhancing effect Effects 0.000 abstract 1
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 36
- 238000002360 preparation method Methods 0.000 description 36
- 239000000243 solution Substances 0.000 description 24
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 20
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 19
- 238000006243 chemical reaction Methods 0.000 description 17
- 239000011734 sodium Substances 0.000 description 17
- 239000000460 chlorine Substances 0.000 description 16
- 239000007788 liquid Substances 0.000 description 14
- 239000004480 active ingredient Substances 0.000 description 11
- 239000012074 organic phase Substances 0.000 description 11
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 10
- 238000010511 deprotection reaction Methods 0.000 description 10
- 235000019439 ethyl acetate Nutrition 0.000 description 10
- 102000004190 Enzymes Human genes 0.000 description 9
- 108090000790 Enzymes Proteins 0.000 description 9
- 230000003115 biocidal effect Effects 0.000 description 9
- 125000006239 protecting group Chemical group 0.000 description 9
- 150000002148 esters Chemical class 0.000 description 8
- 239000000843 powder Substances 0.000 description 8
- 229910052708 sodium Inorganic materials 0.000 description 8
- 239000007787 solid Substances 0.000 description 8
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 7
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 7
- 239000012267 brine Substances 0.000 description 7
- 239000002552 dosage form Substances 0.000 description 7
- LULAYUGMBFYYEX-UHFFFAOYSA-N metachloroperbenzoic acid Natural products OC(=O)C1=CC=CC(Cl)=C1 LULAYUGMBFYYEX-UHFFFAOYSA-N 0.000 description 7
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 7
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- 108020004256 Beta-lactamase Proteins 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 5
- LSQZJLSUYDQPKJ-NJBDSQKTSA-N amoxicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=C(O)C=C1 LSQZJLSUYDQPKJ-NJBDSQKTSA-N 0.000 description 5
- 229960003022 amoxicillin Drugs 0.000 description 5
- 239000003242 anti bacterial agent Substances 0.000 description 5
- 239000002775 capsule Substances 0.000 description 5
- 229910052799 carbon Inorganic materials 0.000 description 5
- 239000003112 inhibitor Substances 0.000 description 5
- LSQZJLSUYDQPKJ-UHFFFAOYSA-N p-Hydroxyampicillin Natural products O=C1N2C(C(O)=O)C(C)(C)SC2C1NC(=O)C(N)C1=CC=C(O)C=C1 LSQZJLSUYDQPKJ-UHFFFAOYSA-N 0.000 description 5
- 239000012071 phase Substances 0.000 description 5
- 239000000741 silica gel Substances 0.000 description 5
- 229910002027 silica gel Inorganic materials 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 5
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 5
- 150000001204 N-oxides Chemical class 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 150000001412 amines Chemical class 0.000 description 4
- 238000004440 column chromatography Methods 0.000 description 4
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical group C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 244000005700 microbiome Species 0.000 description 4
- 231100000252 nontoxic Toxicity 0.000 description 4
- 230000003000 nontoxic effect Effects 0.000 description 4
- 230000003647 oxidation Effects 0.000 description 4
- 238000007254 oxidation reaction Methods 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 3
- 125000005865 C2-C10alkynyl group Chemical group 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 229930182555 Penicillin Natural products 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 3
- 229960000723 ampicillin Drugs 0.000 description 3
- 239000008346 aqueous phase Substances 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 239000012043 crude product Substances 0.000 description 3
- 125000005982 diphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 239000003480 eluent Substances 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 125000001072 heteroaryl group Chemical group 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 229940126085 β‑Lactamase Inhibitor Drugs 0.000 description 3
- GCZOCVAKBHTGOL-ROMZVAKDSA-N (6r,7r)-7-[[(2z)-2-(2-amino-1,3-thiazol-4-yl)-2-(2-carboxypropan-2-yloxyimino)acetyl]amino]-8-oxo-3-(pyridin-1-ium-1-ylmethyl)-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate;hydrate Chemical compound O.S([C@@H]1[C@@H](C(N1C=1C([O-])=O)=O)NC(=O)\C(=N/OC(C)(C)C(O)=O)C=2N=C(N)SC=2)CC=1C[N+]1=CC=CC=C1 GCZOCVAKBHTGOL-ROMZVAKDSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 2
- HZZVJAQRINQKSD-UHFFFAOYSA-N Clavulanic acid Natural products OC(=O)C1C(=CCO)OC2CC(=O)N21 HZZVJAQRINQKSD-UHFFFAOYSA-N 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 241000588914 Enterobacter Species 0.000 description 2
- 241000588697 Enterobacter cloacae Species 0.000 description 2
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 2
- 229930091371 Fructose Natural products 0.000 description 2
- 239000005715 Fructose Substances 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NPYPAHLBTDXSSS-UHFFFAOYSA-N Potassium ion Chemical compound [K+] NPYPAHLBTDXSSS-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 238000006619 Stille reaction Methods 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- UMNSDNIEDPVJEL-IQHZPMLTSA-N benzhydryl (6r)-3-bromo-8-oxo-7-[(2-phenylacetyl)amino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound C1([C@@H]2N(C1=O)C(=C(CS2)Br)C(=O)OC(C=1C=CC=CC=1)C=1C=CC=CC=1)NC(=O)CC1=CC=CC=C1 UMNSDNIEDPVJEL-IQHZPMLTSA-N 0.000 description 2
- OEWRITFYXKDEFQ-IQHZPMLTSA-N benzhydryl (6r)-3-chloro-8-oxo-7-[(2-phenylacetyl)amino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound C1([C@@H]2N(C1=O)C(=C(CS2)Cl)C(=O)OC(C=1C=CC=CC=1)C=1C=CC=CC=1)NC(=O)CC1=CC=CC=C1 OEWRITFYXKDEFQ-IQHZPMLTSA-N 0.000 description 2
- QCQRMIMXPOUYDB-IQHZPMLTSA-N benzhydryl (6r)-3-iodo-8-oxo-7-[(2-phenylacetyl)amino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound C1([C@@H]2N(C1=O)C(=C(CS2)I)C(=O)OC(C=1C=CC=CC=1)C=1C=CC=CC=1)NC(=O)CC1=CC=CC=C1 QCQRMIMXPOUYDB-IQHZPMLTSA-N 0.000 description 2
- HJWNSDRQCLUYAG-XCWJXAQQSA-N benzhydryl (6r)-7-amino-3-bromo-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound S([C@@H]1C(C(N11)=O)N)CC(Br)=C1C(=O)OC(C=1C=CC=CC=1)C1=CC=CC=C1 HJWNSDRQCLUYAG-XCWJXAQQSA-N 0.000 description 2
- BYPHSRGQSFWOOC-XCWJXAQQSA-N benzhydryl (6r)-7-amino-3-chloro-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound S([C@@H]1C(C(N11)=O)N)CC(Cl)=C1C(=O)OC(C=1C=CC=CC=1)C1=CC=CC=C1 BYPHSRGQSFWOOC-XCWJXAQQSA-N 0.000 description 2
- WWWMUHLJLNUGLX-XCWJXAQQSA-N benzhydryl (6r)-7-amino-3-iodo-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound S([C@@H]1C(C(N11)=O)N)CC(I)=C1C(=O)OC(C=1C=CC=CC=1)C1=CC=CC=C1 WWWMUHLJLNUGLX-XCWJXAQQSA-N 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- QYIYFLOTGYLRGG-GPCCPHFNSA-N cefaclor Chemical compound C1([C@H](C(=O)N[C@@H]2C(N3C(=C(Cl)CS[C@@H]32)C(O)=O)=O)N)=CC=CC=C1 QYIYFLOTGYLRGG-GPCCPHFNSA-N 0.000 description 2
- 229960005361 cefaclor Drugs 0.000 description 2
- CZTQZXZIADLWOZ-CRAIPNDOSA-N cefaloridine Chemical compound O=C([C@@H](NC(=O)CC=1SC=CC=1)[C@H]1SC2)N1C(C(=O)[O-])=C2C[N+]1=CC=CC=C1 CZTQZXZIADLWOZ-CRAIPNDOSA-N 0.000 description 2
- 229960003866 cefaloridine Drugs 0.000 description 2
- 229960004261 cefotaxime Drugs 0.000 description 2
- AZZMGZXNTDTSME-JUZDKLSSSA-M cefotaxime sodium Chemical compound [Na+].N([C@@H]1C(N2C(=C(COC(C)=O)CS[C@@H]21)C([O-])=O)=O)C(=O)\C(=N/OC)C1=CSC(N)=N1 AZZMGZXNTDTSME-JUZDKLSSSA-M 0.000 description 2
- 229960000484 ceftazidime Drugs 0.000 description 2
- NNULBSISHYWZJU-LLKWHZGFSA-N ceftizoxime Chemical compound N([C@@H]1C(N2C(=CCS[C@@H]21)C(O)=O)=O)C(=O)\C(=N/OC)C1=CSC(N)=N1 NNULBSISHYWZJU-LLKWHZGFSA-N 0.000 description 2
- 229960001991 ceftizoxime Drugs 0.000 description 2
- JFPVXVDWJQMJEE-IZRZKJBUSA-N cefuroxime Chemical compound N([C@@H]1C(N2C(=C(COC(N)=O)CS[C@@H]21)C(O)=O)=O)C(=O)\C(=N/OC)C1=CC=CO1 JFPVXVDWJQMJEE-IZRZKJBUSA-N 0.000 description 2
- 229960001668 cefuroxime Drugs 0.000 description 2
- ZAIPMKNFIOOWCQ-UEKVPHQBSA-N cephalexin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@@H]3N(C2=O)C(=C(CS3)C)C(O)=O)=CC=CC=C1 ZAIPMKNFIOOWCQ-UEKVPHQBSA-N 0.000 description 2
- 229940106164 cephalexin Drugs 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 239000007958 cherry flavor Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 238000003818 flash chromatography Methods 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000006210 lotion Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 125000002757 morpholinyl group Chemical group 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 150000002960 penicillins Chemical class 0.000 description 2
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 229960002292 piperacillin Drugs 0.000 description 2
- WCMIIGXFCMNQDS-IDYPWDAWSA-M piperacillin sodium Chemical compound [Na+].O=C1C(=O)N(CC)CCN1C(=O)N[C@H](C=1C=CC=CC=1)C(=O)N[C@@H]1C(=O)N2[C@@H](C([O-])=O)C(C)(C)S[C@@H]21 WCMIIGXFCMNQDS-IDYPWDAWSA-M 0.000 description 2
- ABVRVIZBZKUTMK-JSYANWSFSA-M potassium clavulanate Chemical compound [K+].[O-]C(=O)[C@H]1C(=C/CO)/O[C@@H]2CC(=O)N21 ABVRVIZBZKUTMK-JSYANWSFSA-M 0.000 description 2
- 229910001414 potassium ion Inorganic materials 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 229910001415 sodium ion Inorganic materials 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 150000003457 sulfones Chemical class 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 238000001308 synthesis method Methods 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- URAYPUMNDPQOKB-UHFFFAOYSA-N triacetin Chemical compound CC(=O)OCC(OC(C)=O)COC(C)=O URAYPUMNDPQOKB-UHFFFAOYSA-N 0.000 description 2
- 125000004306 triazinyl group Chemical group 0.000 description 2
- WJKHJLXJJJATHN-UHFFFAOYSA-N triflic anhydride Chemical compound FC(F)(F)S(=O)(=O)OS(=O)(=O)C(F)(F)F WJKHJLXJJJATHN-UHFFFAOYSA-N 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- ZUBXPSDFPQTKQN-ZCFIWIBFSA-N (6r)-3-hydroxy-5-thia-1-azabicyclo[4.2.0]oct-2-en-8-one Chemical compound S1CC(O)=CN2C(=O)C[C@H]21 ZUBXPSDFPQTKQN-ZCFIWIBFSA-N 0.000 description 1
- FZEVMBJWXHDLDB-ZCFIWIBFSA-N (6r)-5-thia-1-azabicyclo[4.2.0]oct-2-en-8-one Chemical compound S1CC=CN2C(=O)C[C@H]21 FZEVMBJWXHDLDB-ZCFIWIBFSA-N 0.000 description 1
- QFKJDVQYIXVZLI-ZCFIWIBFSA-N (6r)-7,8-dioxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound OC(=O)C1=CCS[C@@H]2C(=O)C(=O)N12 QFKJDVQYIXVZLI-ZCFIWIBFSA-N 0.000 description 1
- BIBDCOCSEPMDQL-TYZXPVIJSA-N (6r)-8-oxo-4-[(2-phenylacetyl)amino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound C([C@H]1S2)C(=O)N1C(C(=O)O)=CC2NC(=O)CC1=CC=CC=C1 BIBDCOCSEPMDQL-TYZXPVIJSA-N 0.000 description 1
- VGNCBRNRHXEODV-XXVHXNRLSA-N (6r,7r)-1-[(4s,5r)-4-acetyloxy-5-methyl-3-methylidene-6-phenylhexyl]-6-dodecoxy-4,7-dihydroxy-2,8-dioxabicyclo[3.2.1]octane-3,4,5-tricarboxylic acid Chemical compound C([C@@H](C)[C@H](OC(C)=O)C(=C)CCC12[C@H](O)[C@H](C(O2)(C(O)=O)C(O)(C(O1)C(O)=O)C(O)=O)OCCCCCCCCCCCC)C1=CC=CC=C1 VGNCBRNRHXEODV-XXVHXNRLSA-N 0.000 description 1
- LHNIIDJCEODSHA-OQRUQETBSA-N (6r,7r)-3-[(e)-2-(2,4-dinitrophenyl)ethenyl]-8-oxo-7-[(2-thiophen-2-ylacetyl)amino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound N([C@H]1[C@H]2SCC(=C(N2C1=O)C(=O)O)\C=C\C=1C(=CC(=CC=1)[N+]([O-])=O)[N+]([O-])=O)C(=O)CC1=CC=CS1 LHNIIDJCEODSHA-OQRUQETBSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- 125000006039 1-hexenyl group Chemical group 0.000 description 1
- 125000006023 1-pentenyl group Chemical group 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- SCVJRXQHFJXZFZ-KVQBGUIXSA-N 2-amino-9-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-KVQBGUIXSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- 125000006040 2-hexenyl group Chemical group 0.000 description 1
- KPGXRSRHYNQIFN-UHFFFAOYSA-N 2-oxoglutaric acid Chemical compound OC(=O)CCC(=O)C(O)=O KPGXRSRHYNQIFN-UHFFFAOYSA-N 0.000 description 1
- 125000006024 2-pentenyl group Chemical group 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- 125000006041 3-hexenyl group Chemical group 0.000 description 1
- WZRJTRPJURQBRM-UHFFFAOYSA-N 4-amino-n-(5-methyl-1,2-oxazol-3-yl)benzenesulfonamide;5-[(3,4,5-trimethoxyphenyl)methyl]pyrimidine-2,4-diamine Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1.COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 WZRJTRPJURQBRM-UHFFFAOYSA-N 0.000 description 1
- 125000006042 4-hexenyl group Chemical group 0.000 description 1
- 125000006043 5-hexenyl group Chemical group 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 206010053555 Arthritis bacterial Diseases 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 208000031729 Bacteremia Diseases 0.000 description 1
- 241000167854 Bourreria succulenta Species 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 101100189378 Caenorhabditis elegans pat-3 gene Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229930186147 Cephalosporin Natural products 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 241000588923 Citrobacter Species 0.000 description 1
- 206010011409 Cross infection Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 101000740462 Escherichia coli Beta-lactamase TEM Proteins 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 230000005526 G1 to G0 transition Effects 0.000 description 1
- 244000258271 Galium odoratum Species 0.000 description 1
- 235000008526 Galium odoratum Nutrition 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- 208000004575 Infectious Arthritis Diseases 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 206010033078 Otitis media Diseases 0.000 description 1
- 206010034133 Pathogen resistance Diseases 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 108010087702 Penicillinase Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- GOOHAUXETOMSMM-UHFFFAOYSA-N Propylene oxide Chemical compound CC1CO1 GOOHAUXETOMSMM-UHFFFAOYSA-N 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 241000607720 Serratia Species 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 206010048038 Wound infection Diseases 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 150000001413 amino acids Chemical group 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 239000012300 argon atmosphere Substances 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 229940098164 augmentin Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 150000007514 bases Chemical class 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000002618 bicyclic heterocycle group Chemical group 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000006189 buccal tablet Substances 0.000 description 1
- 125000004063 butyryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 150000005323 carbonate salts Chemical class 0.000 description 1
- 150000007942 carboxylates Chemical group 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 229940124587 cephalosporin Drugs 0.000 description 1
- 150000001780 cephalosporins Chemical class 0.000 description 1
- 235000019693 cherries Nutrition 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 238000013375 chromatographic separation Methods 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- HZZVJAQRINQKSD-PBFISZAISA-N clavulanic acid Chemical compound OC(=O)[C@H]1C(=C/CO)/O[C@@H]2CC(=O)N21 HZZVJAQRINQKSD-PBFISZAISA-N 0.000 description 1
- 229960003324 clavulanic acid Drugs 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 229940047766 co-trimoxazole Drugs 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 125000003074 decanoyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000006612 decyloxy group Chemical group 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 150000008049 diazo compounds Chemical class 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 229960003276 erythromycin Drugs 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 230000008570 general process Effects 0.000 description 1
- 125000005908 glyceryl ester group Chemical group 0.000 description 1
- 239000001087 glyceryl triacetate Substances 0.000 description 1
- 235000013773 glyceryl triacetate Nutrition 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 125000000268 heptanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000003104 hexanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000003707 hexyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000000937 inactivator Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- SKRDXYBATCVEMS-UHFFFAOYSA-N isopropyl nitrite Chemical compound CC(C)ON=O SKRDXYBATCVEMS-UHFFFAOYSA-N 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- XMGQYMWWDOXHJM-UHFFFAOYSA-N limonene Chemical compound CC(=C)C1CCC(C)=CC1 XMGQYMWWDOXHJM-UHFFFAOYSA-N 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 125000001402 nonanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005187 nonenyl group Chemical group C(=CCCCCCCC)* 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- HDKCVDHYIIKWFM-UHFFFAOYSA-K octanoate;rhodium(3+) Chemical compound [Rh+3].CCCCCCCC([O-])=O.CCCCCCCC([O-])=O.CCCCCCCC([O-])=O HDKCVDHYIIKWFM-UHFFFAOYSA-K 0.000 description 1
- 125000002801 octanoyl group Chemical group C(CCCCCCC)(=O)* 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000007968 orange flavor Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 239000003973 paint Substances 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 101150101567 pat-2 gene Proteins 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 229950009506 penicillinase Drugs 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 125000001325 propanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 201000001223 septic arthritis Diseases 0.000 description 1
- 208000013223 septicemia Diseases 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 201000009890 sinusitis Diseases 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- AWUCVROLDVIAJX-GSVOUGTGSA-N sn-glycerol 3-phosphate Chemical compound OC[C@@H](O)COP(O)(O)=O AWUCVROLDVIAJX-GSVOUGTGSA-N 0.000 description 1
- 239000000344 soap Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 239000007892 solid unit dosage form Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 229940086735 succinate Drugs 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 229960005404 sulfamethoxazole Drugs 0.000 description 1
- JLKIGFTWXXRPMT-UHFFFAOYSA-N sulphamethoxazole Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1 JLKIGFTWXXRPMT-UHFFFAOYSA-N 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- LPQZKKCYTLCDGQ-WEDXCCLWSA-N tazobactam Chemical compound C([C@]1(C)S([C@H]2N(C(C2)=O)[C@H]1C(O)=O)(=O)=O)N1C=CN=N1 LPQZKKCYTLCDGQ-WEDXCCLWSA-N 0.000 description 1
- 229960003865 tazobactam Drugs 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 229960002622 triacetin Drugs 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- JHQWTRCLYUFMSJ-UHFFFAOYSA-M triphenyl(pyridin-2-ylmethyl)phosphanium;chloride;hydrochloride Chemical compound Cl.[Cl-].C=1C=CC=CC=1[P+](C=1C=CC=CC=1)(C=1C=CC=CC=1)CC1=CC=CC=N1 JHQWTRCLYUFMSJ-UHFFFAOYSA-M 0.000 description 1
- 208000019206 urinary tract infection Diseases 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 238000009777 vacuum freeze-drying Methods 0.000 description 1
- 125000003774 valeryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000003039 volatile agent Substances 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D501/00—Heterocyclic compounds containing 5-thia-1-azabicyclo [4.2.0] octane ring systems, i.e. compounds containing a ring system of the formula:, e.g. cephalosporins; Such ring systems being further condensed, e.g. 2,3-condensed with an oxygen-, nitrogen- or sulfur-containing hetero ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Cephalosporin Compounds (AREA)
Description
- Hintergrund der Erfindung
- Der wichtigste Mechanismus der mikrobiellen Resistenz gegenüber β-Lactamantibiotika ist die bakterielle Produktion von β-Lactamasen, Enzyme, die die β-Lactamantibiotika, wie Penicilline und Cephalosporine, hydrolytisch zerstören. Diese Art von Resistenz kann horizontal durch Plasmide, die zur schnellen Verbreitung der Resistenz fähig sind, nicht nur an andere Vertreter desselben Stamms, sondern sogar an andere Arten übertragen werden. Aufgrund dieses so schnellen Gentransfers kann ein Patient mit unterschiedlichen Organismen infiziert werden, die alle dieselbe β-Lactamase besitzen.
- β-Lactamaseenzyme sind in vier molekulare Klassen eingeteilt worden: A, B, C und D basierend auf der Aminosäuresequenz. Die Klasse A, die RTEM und die β-Lactamase von Staphylococcus aureus umfasst, die Klasse C, die die von P-99 Enterobacter cloacae stammende umfasst und die Klasse D sind Serinhydrolasen. Die Klasse A Enzyme haben ein Molekulargewicht von etwa 29 kDa und hydrolysieren vorzugsweise Penicilline. Die Klasse B Lactamasen sind Metalloenzyme und haben ein breiteres Substratprofil als die Proteine in den anderen Klassen. Die Klasse C Enzyme umfassen die chromosomalen Cephalosporinasen von Gram-negativen Bakterien und haben Molekulargewichte von etwa 39 kDa. Die kürzlich bekannt gewordenen Klasse D Enzyme zeigen ein einzigartiges Substratprofil, das sich signifikant sowohl von der Klasse A als auch Klasse C unterscheidet.
- Die Klasse C Cephalosporinasen sind insbesondere für die Resistenz von Gram-negativen Bakterien gegenüber einer Vielzahl an traditionellen und neu entworfenen Antibiotika verantwortlich. Die Enterobacter Arten, die ein Klasse C Enzym besitzen, sind jetzt die drittgrößte Ursache für nosokomiale Infektionen in den Vereinigten Staaten. Die Klasse an Enzymen hat oft schlechte Affinitäten für Inhibitoren der Klasse A Enzyme, wie Clavulansäure, einem herkömmlich verschriebenen Inhibitor und herkömmliche in vitro Inaktivatoren, wie 6-β-Iodpenicillinat.
- Eine Strategie, diese sich schnell entwickelnde bakterielle Resistenz zu überwinden ist die Synthese und Verabreichung von β-Lacatamaseinhibitoren. Häufig haben β-Lactamaseinhibitoren selbst keine antibiotische Aktivität und werden daher zusammen mit einem Antibiotikum verabreicht. Ein Beispiel für ein solches synergistisches Gemisch ist das unter dem Handelsnamen Augmentin verkaufte Produkt (Amoxicillin, Kaliumclavulanat), das das Antibiotikum Amoxicillin und den β-Lactamaseinhibitor Kaliumclavulanat enthält.
- J.D. Buynak et al., J. Med. Chem. 1995, 38, 1022–1034 beschreiben, dass von bestimmten 7-Alkylidencephalosporansäuren festgestellt wurde, dass sie eine β-Lactamaseinhibitoraktivität besitzen.
- Die WO 96 17 849 A beschreibt eine Gattung an 7-Alylidencephalosporansäurederivaten und dass bestimmte der 7-Alkylidencephalosporansäuren eine beta-Lactamaseinhibitoraktivität besitzen.
- Die WO 00 63 213 A beschreibt, dass bestimmte 3-substituierte 7-Alkylidencephalosporansäurederivate eine beta-Lactamaseinhibitoraktivität aufweisen. Sie beschreibt auch eine Gattung an 2-substituierten 7-Alkylidencephalosporansäurederivaten mit einem breiter definierten 3-Substituenten.
- J. D. Buynak et al., Bioorg. Med. Chem. Lett. 2000, 10, 847–851 beschreiben bestimmte 2-substituierte 7-Alkylidincephame und ihre Evaluierung als beta-Lactamaseinhibitoren.
- J.D. Buynak et al. Bioorg. Med. Chem. Lett. 2000, 10, 853–857 beschreiben die Evaluierung von bestimmten 3-substituierten 7-Alkylidencephalosporansäurederivaten als β-Lactamaseinhibitoren.
- G.V. Chrichlow et al., Biochemistry 2001, 40, 6233–6239 diskutieren einen möglichen Wirkmechanismus als β-Lactamaseinhibitor eines 7-Alkylidencephalosporansäurederivats, das einen -CH=CHCO-NH2 Substituenten an der Position 3 trägt.
- Es besteht ein konstanter Bedarf für neue β-Lactamaseinhibitoren und insbesondere für β-Lactamaseinhibitoren, die zusammen mit einem β-Lactamantibiotikum verabreicht werden.
- Kurze Beschreibung der Zeichnungen
- Die
1 bis6 erläutern die Herstellung der repräsentativen Verbindungen der Erfindung. - Zusammenfassung der Erfindung
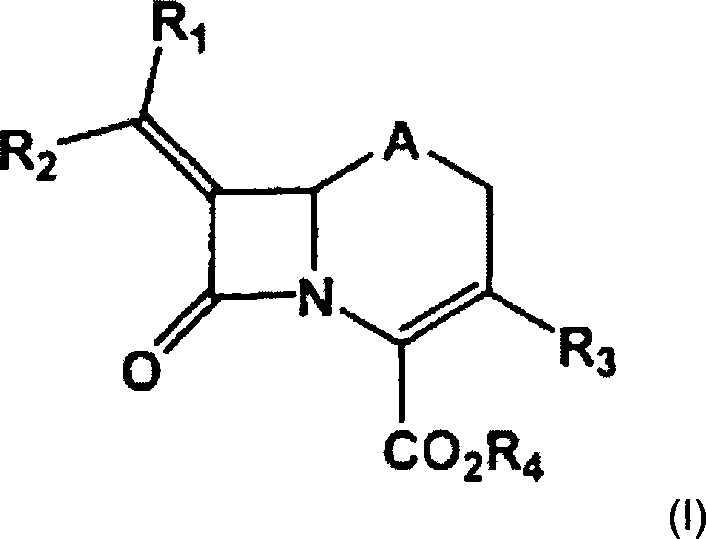
- Die Erfindung liefert eine Verbindung der Formel (I) worin
R1 und R2 jeweils unabhängig stehen für Wasserstoff, (C1-C10)-Alkyl, (C2-C10)-Alkenyl, (C2-C10)-Alkinyl, (C3-C8)-Cycloalkyl, (C1-C10)-Alkoxy, (C1-C10)-Alkanoyl, (C1-C10)-Alkanoyloxy, (C1-C10)-Alkoxycarbonyl, Aryl, Heterocyclyl, Halogen, Cyano, Nitro, -COORe, -C(=O)NRfRg, -OC(=O)NRfRg, NRfRg oder -S(O)nRh,
R3 für -S(O)nRh steht,
R4 für Wasserstoff steht,
A für Thio, Sulfinyl oder Sulfonyl steht,
jedes n unabhängig für 0, 1 oder 2 steht,
jedes Re unabhängig für Wasserstoff oder (C1-C10)Alkyl steht,
jedes Rf und Rg unabhängig für Wasserstoff, (C1-C10)-Alkyl, (C1-C10)-Alkoxy, Phenyl, Benzyl, Phenethyl, (C1-C10)-Alkanoyl oder -C(=O)NRfRg stehen, worin Rf und Rg einen Ring bilden, der optional ein Stickstoffatom im Ring -NRe- enthält,
jedes Rh unabhängig für (C1-C10)-Alkyl oder Aryl steht, und
worin jedes (C1-C10)-Alkyl, (C2-C10)-Alkenyl, (C2-C10)-Alkinyl, (C3-C8)-Cycloalkyl, (C1-C10)-Alkoxy, (C1-C10)-Alkanoyl, (C1-C10)-Alkanoyloxy oder (C1-C10)-Alkoxycarbonyl von R1 oder R2 optional substituiert ist durch einen oder mehrere Substituenten, die unabhängig ausgewählt sind aus Halogen, Hydroxy, Cyano, Cyanato, Nitro, Mercapto, Oxo, Aryl, Heterocyclyl, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C1-C6)-Alkoxy, (C1-C6)-Alkanoyl, (C1-C6)-Alkanoyloxy, Aryl-(C1-C6)-alkanoyloxy, Halogen-(C1-C6)-alkanoyloxy, Heterocyclyl-(C1-C6)- alkanoyloxy, Aryloxy, (Heterocyclyl)oxy, (C3-C8)-Cycloalkyl, -COORe, -C(=O)NRfRg oder- OC(=O)N-RfRg,
worin jedes Aryl optional substituiert ist durch einen oder mehrere Substituenten, die unabhängig ausgewählt sind aus Halogen, Hydroxy, Cyano, Trifluormethyl, Nitro, Trifluormethoxy, (C1-C6)-Alkyl, (C1-C6)-Alkanoyl, (C1-C6)-Alkanoyloxy, (C1-C6)-Alkoxycarbonyl, -COORe, -C(=O)NRfRg oder- OC(=O)NRfRg oder ein pharmazeutisch annehmbares Salz hiervon. - Die Erfindung liefert auch eine pharmazeutische Zusammensetzung, die eine Verbindung der Formel (I) oder ein pharmazeutisch annehmbares Salz hiervon in Kombination mit einem pharmazeutisch annehmbaren Verdünnungsmittel oder Träger umfasst, wie auch eine pharmazeutische Zusammensetzung, die ferner ein β-Lactamantibiotikum umfasst.
- Die Erfindung liefert auch eine Verbindung der Formel (I) zur Verwendung in der medizinischen Therapie (vorzugsweise zur Verwendung bei der Hemmung einer β-Lactamase bei einem Säuger oder zur Behandlung einer β-Lactam-resistenten Bakterieninfektion bei einem Säuger) wie auch die Verwendung einer Verbindung der Formel (I) zur Herstellung eines Arzneimittels, das zur Hemmung einer β-Lactamase bei einem Menschen brauchbar ist.
- Die Erfindung liefert auch Verfahren und Zwischenprodukte, die hierin beschrieben sind, welche zur Herstellung von β-Lactamaseinhibitoren der Formel (I) brauchbar sind.
- Die Verbindungen der Formel (I) sind als β-Lactamaseinhibitoren für therapeutische Anwendungen brauchbar. Sie sind auch brauchbar als pharmakologische Werkzeuge zu in vitro oder in vivo Studien, um den Mechanismus der Antibiotikaresistenz zu untersuchen, bei der Identifizierung anderer therapeutischer antibiotischer Mittel oder β-Lactamaseinhibitoren zu helfen, zu identifizieren, welche β-Lactamasen von einem gegebenen Mikroorganismus exprimiert werden oder selektiv ein oder mehrere β-Lactamasen in einem Mikroorganismus hemmen.
- Detaillierte Beschreibung der Erfindung
- Die folgenden Definitionen werden verwendet, falls nichts anderes beschrieben ist: Halogen steht für Fluor, Chlor, Brom oder Iod. Alkyl, Alkoxy, Alkenyl und dergleichen bezeichnen sowohl gerade als auch verzweigte Gruppen. Aryl steht für einen Phenylrest oder einen ortho-fusionierten bicyclischen carbocyclischen Rest mit etwa 9 bis 10 Ringatomen, worin zumindest ein Ring aromatisch ist. Heterocyclus steht für ein sechs- bis zehngliedriges ungesättigtes oder gesättigtes mono-, bi- oder tricyclisches Ringsystem, das Kohlenstoff und 1, 2, 3 oder 4 Heteroatome umfasst, die aus der Gruppe ausgewählt sind, welche aus Nicht-Peroxidsauerstoff, Schwefel und N(X) besteht, worin X jeweils fehlt oder für H, O, C1-C4 Alkyl, Phenyl oder Benzyl steht. Der Ausdruck "Heterocyclus" umfasst "Heteroaryl", das für einen Rest steht, der über ein Ringkohlenstoff eines monocyclischen aromatischen Rings gebunden ist, der 5 oder 6 Ringatome, die aus Kohlenstoff bestehen, oder 1 bis 4 Heteroatome enthält, die jeweils aus der Gruppe ausgewählt sind, die besteht aus einem Nicht-Peroxidsauerstoff, Schwefel und N(X), worin X jeweils fehlt oder für H, O, C1-C4 Alkyl, Phenyl oder Benzyl steht, wie auch ein Rest eines ortho-fusionierten bicyclischen Heterocyclus mit etwa 8 bis 10 Ringatomen, der hieraus abgeleitet ist, insbesondere ein Benzderivat oder einer, der durch Fusion eines Propylen-, Trimethylen- oder Tetramethylendirests hieran abgeleitet wird. Ein bevorzugtes Heteroaryl ist beispielsweise ein Pyridylrest.
- Das Ausdruck "Erhöhung" der Aktivität eines β-Lactamantibiotikums meint die Verbesserung oder Erhöhung der antibiotischen Aktivität des Vergleichs in einer statistisch messbaren und signifikanten Weise in Hinblick auf die Aktivität, die von der Verbindung in Abwesenheit der erfindungsgemäßen Verbindung gezeigt wird.
- Die Buchstaben "BH" oder "bhl" stehen für einen Benzhydrylester.
- Der Fachmann erkennt, dass erfindungsgemäße Verbindungen, die ein chirales Zentrum aufweisen, existieren können und in optisch aktiven und razemischen Formen isoliert werden können. Einige Verbindungen können einen Polymorphismus zeigen. Es ist verständlich, dass die vorliegende Erfindung alle razemischen, optisch aktiven, polymorphen oder stereoisomeren Formen oder Gemische hiervon einer erfindungsgemäßen Verbindung umfasst, die brauchbare hierin beschriebene Eigenschaften besitzt, wobei es in der Technik gut bekannt ist, wie man optisch aktive Formen herstellt (beispielsweise durch Auftrennung der razemischen Form durch Umkristallisationstechniken, durch Synthese aus optisch aktiven Ausgangsmaterialien, durch chirale Synthese oder durch chromatographische Trennung mittels einer chiralen stationären Phase) und wie man die hemmende Aktivität auf die β-Lactamase mittels des hierin beschriebenen Standardtests oder mittels anderer ähnlicher Tests bestimmt, die in der Technik gut bekannt sind.
- Spezifische Bedeutungen, die im folgenden für Reste, Substituenten und Bereiche angegeben sind, sind nur zur Erläuterung und schließen nicht andere definierte Werte oder andere Werte innerhalb der definierten Bereiche für die Reste und Substituenten aus.
- Insbesondere kann C1-C6 Alkyl für Methyl, Ethyl, Propyl, Isopropyl, Butyl, Iso-butyl, sek-Butyl, Pentyl, 3-Pentyl oder Hexyl stehen, C1-C10 Alkyl kann für Methyl, Ethyl, Propyl, Isopropyl, Butyl, iso-Butyl, sec-Butyl, Pentyl, 3-Pentyl, Hexyl, Heptyl, Octyl, Nonyl oder Decyl stehen, C3-C8 Cycloalkyl kann für Cyclopropyl, Cyclobutyl, Cyclopentyl, Cyclohexyl, Cycloheptyl oder Cyclooctyl stehen, C1-C10 Alkoxy kann für Methoxy, Ethoxy, Propoxy, Isopropoxy, Butoxy, iso-Butoxy, sec-Butoxy, Pentoxy, 3-Pentoxy, Hexyloxy, Heptyloxy, Octyloxy, Nonyloxy oder Decyloxy stehen, C1-C6 Alkoxy kann für Methoxy, Ethoxy, Propoxy, Isopropoxy, Butoxy, iso-Butoxy, sec-Butoxy, Pentoxy, 3-Pentoxy, oder Hexyloxy stehen, C2-C10 Alkenyl kann für Vinyl, 1-Propenyl, 2-Propenyl, 1-Butenyl, 2-Butenyl, 3-Butenyl, 1-Pentenyl, 2-Pentenyl, 3-Pentenyl, 4-Pentenyl, 1-Hexenyl, 2-Hexenyl, 3-Hexenyl, 4-Hexenyl, 5-Hexenyl, 1-Heptenyl, 2-Heptenyl, 3-Heptenyl, 4-Heptenyl, 5-Heptenyl, 6-Heptenyl, 1-Octenyl, 2-Octenyl, 3-Octenyl, 4-Octenyl, 5-Octenyl, 6-Octenyl, 7-Octenyl, 1-Nonenyl, 2-Nonenyl, 3-Nonenyl, 4-Nonenyl, 5-Nonenyl, 6-Nonenyl, 7-Nonenyl, 8-Nonenyl, 1-Decenyl, 2-Decenyl, 3-Decenyl, 4-Decenyl, 5-Decenyl, 6-Decenyl, 7-Decenyl, 8-Decenyl oder 9-Decenyl stehen, C2-C10 Alkinyl kann für Ethinyl,1-Propinyl, 2-Propinyl, 1-Butinyl, 2-Butinyl, 3-Butinyl,1-Pentinyl, 2-Pentinyl, 3-Pentinyl, 4-Pentinyl, 1-Hexinyl, 2-Hexinyl, 3-Hexinyl, 4-Hexinyl, 5-Hexinyl, 1-Heptinyl, 2-Heptinyl, 3-Heptinyl, 4-Heptinyl, 5-Heptinyl, 6-Heptinyl, 1-Octinyl, 2-Octinyl, 3-Octinyl, 4-Octinyl, 5-Octinyl, 6-Octinyl, 7-Octinyl, 1-Noninyl, 2-Noninyl, 3-Noninyl, 4-Noninyl, 5-Noninyl, 6-Noninyl, 7-Noninyl, 8-Noninyl, 1-Decinyl, 2-Decinyl, 3-Decinyl, 4-Decinyl, 5-Decinyl, 6-Decinyl, 7-Decinyl, 8-Decinyl oder 9-Decinyl stehen, C1-C10 Alkanoyl kann für Acetyl, Propanoyl, Butanoyl, Pentanoyl, Hexanoyl, Heptanoyl, Octanoyl, Nonanoyl oder Decanoyl stehen, C1-C10 Alkoxycarbonyl kann für Methoxycarbonyl, Ethoxycarbonyl, Propoxycarbonyl, Isopropoxycarbonyl, Butoxycarbonyl, Pentoxycarbonyl, Hexyloxycarbonyl, Heptyloxycarbonyl, Octyloxycarbonyl, Nonyloxycarbonyl oder Decyloxycarbonyl stehen, C1-C10 Alkanoyloxy kann für Formyloxy, Acetoxy, Propanoyloxy, Butanoyloxy, Isobutanoyloxy, Pentanoyloxy, Hexa noyloxy, Heptanoyloxy, Octanoyloxy, Nonanoyloxy oder Decanoyloxy stehen, Aryl kann für Phenyl, Indenyl oder Naphthyl stehen, Heterocyclus kann für Benztriazolyl, Triazinyl, Oxazoyl, Isoxazolyl, Oxazolidinoyl, Isoxazolidinoyl, Thiazolyl, Isothiazoyl, Pyrazolyl, Imidazolyl, Pyrrolyl, Pyrazinyl, Pyridinyl, Morpholinyl, Chinolinyl, Isochinolinyl, Indolyl, Pyrimidinyl, Piperidinyl, Pyrrolidinyl, Morpholinyl, Thiomorpholinyl oder Piperazinyl stehen und Heteroaryl kann beispielsweise für Furyl, Imidazolyl, Triazolyl, Triazinyl, Oxazoyl, Isoxazoyl, Thiazolyl, Isothiazoyl, Pyrazolyl, Pyrrolyl, Pyrazinyl, Tetrazolyl, Methyl-1H-tetrazol-5-yl, Pyridyl (oder dessen N-Oxid), Thienyl, Pyrimidinyl (oder dessen N-Oxid), Indolyl, Isochinolyl (oder dessen N-Oxid) oder Chinolyl (oder dessen N-Oxid stehen).
- Insbesondere steht A für Sulfonyl (-SO2-).
- Insbesondere steht R1 für Aryl, einen Heterocyclus oder -COORe.
- Insbesondere steht R1 für 2-Pyridyl oder -COORe.
- Insbesondere steht R2 für Wasserstoff.
- Insbesondere steht R3 für S(O)2Rh'.
- Insbesondere steht R3 für S(O)2Rh', worin Rh für Methyl oder Phenyl steht.
- Insbesondere steht R3 für SRh'.
- Insbesondere steht R3 für SRh', worin Rh für Methyl oder Phenyl steht.
- Eine weitere spezifische Verbindung ist eine der Formel (I), worin A für Sulfonyl (-SO2-) steht, R1 für 2-Pyridyl, Carboxy oder tert-Butoxycarbonyl steht, R2 für Wasserstoff steht und R3 für Wasserstoff -SPh oder -SO2Ph steht oder ein pharmazeutisch annehmbares Salz hiervon.
- Eine spezifischere Verbindung der Formel (I) ist ein pharmazeutisch annehmbares Salz, das aus einer Carbonsäure der Formel (I) gebildet wird, worin R4 für Wasserstoff steht. Vor allem bevorzugt ist ein Salz, worin R4 durch ein Natrium oder Kaliumion ersetzt wurde. Der Ausdruck pharmazeutisch annehmbare Salze umfasst auch Polysalze (beispielsweise Di- oder Trisalze) einer Verbindung der Formel (I).
- Verfahren und neue Zwischenprodukte, die zur Herstellung der Verbindungen der Formel (I) brauchbar sind, werden als weitere Ausführungsformen der Erfindung bereitgestellt und werden durch die folgenden Verfahren erläutert, worin die Bedeutungen der allgemeinen Reste wie oben angegeben sind, falls nichts anderes erwähnt wird.
- Repräsentative Verbindungen werden hergestellt, wie dies in den
1 bis3 beschrieben ist. Im Handel erhältliches 3-Hydroxy-3-cephem 1 wird in die Halogenide 3a, 3b und 3c unter Verwendung des Verfahrens von Farina (Farina et al. J. Org. Chem. 54, 4962–4966 (1989)) umgewandelt. Die Phenylacetylgruppe wird durch die Behandlung mit PCl5 unter Bildung jeweils der freien Amine 4a, 4b und 4c entfernt. Diese werden in die entsprechenden 7-Oxo-3-cepheme und anschließend zu den 7-(2'-Pyridylmethyliden)-3-cephemen 5a, 5b und 5c umgewandelt. Diese werden leicht zu den entsprechenden Sulfonen nach der Behandlung mit überschüssigem mCPBA und des ungeschützten Carboxylats an der Position 4 durch Behandlung mit TFA (gefolgt von der Neutralisation mit Bicarbonat) unter Bildung der entsprechenden Natriumsalze 7a, 7b und 7c oxidiert. - Das Iodid 6c ist auch zur Herstellung von anderen C3 substituierten Analoga durch Stille Kupplungsreaktionen mit ausgewählten Organostannanen brauchbar, wie dies in
2 gezeigt ist. Solche Reaktionen führen zur Herstellung von repräsentativen C3 Sulfiden, die auch wie in2 geschützt sind. Die C3 Sulfide 8a und 8b können auch in die entsprechenden C3 Sulfonylverbindungen oxidiert werden und unter Bildung der entsprechenden Natriumsalze von den Schutzgruppen befreit werden, wie dies in3 gezeigt ist. - Unter Verwendung von Verfahren, die zu den hierin beschriebenen ähnlich sind, wie auch durch Standardsynthesetechniken können die Verbindungen der Formel (I) hergestellt werden.
- Pharmazeutisch annehmbare Salze der Verbindungen der Formel (I), worin R4 durch ein pharmazeutisch annehmbares Kation ersetzt wird (beispielsweise ein Natrium- oder Kaliumion) können bequem aus einer entsprechenden Verbindung der Formel (I), worin R4 für Wasserstoff steht, durch Umsetzung mit einer geeigneten Base hergestellt werden.
- Ein brauchbares Zwischenprodukt zur Herstellung einer Verbindung der Formel (I), worin R4 für Wasserstoff steht, ist eine entsprechende Verbindung, worin R4 durch eine geeignet entfernbare Carboxyschutzgruppe ersetzt ist. Solche Schutzgruppen sind in der Technik gut bekannt, siehe beispielsweise T.W. Greene, P.G.M. Wutz "Protecting Groups in Organic Synthesis", 2. Ausgabe, 1991, New York, John Wiley & Sons, Inc. Bevorzugte Schutzgruppen umfassen C1-C10 Alkyl, C2-C10 Alkenyl, C3-C8 Cycloalkyl, C2-C10 Alkinyl, Aryl, Benzyl oder Benzhydryl. Daher liefert die Erfindung Verbindungen der Formel (I), worin R1, R2 und R3 eine der hierin definierten Bedeutungen, besonderen Bedeutungen oder bevorzugten Bedeutungen aufweisen und worin R4 für C1-C10 Alkyl, C2-C10 Alkenyl, C3-C8 Cycloalkyl, C2-C10 Alkinyl Aryl, Benzyl und Benzhydryl steht.
- Eine Verbindung der Formel (I), worin A für Sulfonyl (-SO2-) steht, kann durch Oxidation einer entsprechenden Verbindung der Formel (I) hergestellt werden, worin A für Thio (-S-) steht, beispielsweise druch meta-Chlorperbenzoesäure (mCPBA).
- Eine Verbindung der Formel (I), worin A für Sulfinyl (-SO-) steht, kann durch Oxidation einer entsprechenden Verbindung der Formel (I), worin A für Thio (-S-) steht, mittels eines Äquivalents eines annehmbaren Oxidationsmittels, beispielsweise mCPBA, hergestellt werden.
- Eine Verbindung der Formel (I), worin R3 für -SRh steht, kann durch Kombination einer entsprechenden Verbindung der Formel (I), worin R3 für Halogen steht, mit einem Organostannan der Formel (Ra)Sn-R3 und einem Katalysator unter Bildung der Verbindung der Formel (I) hergestellt werden. Demnach liefert die Erfindung auch ein Verfahren zur Herstellung einer Verbindung der Formel (I), worin R3 für -SRh steht und R4 für Wasserstoff steht, das umfasst: Kombination einer entsprechenden Verbindung der Formel (I), worin R3 für Halogen steht und R4 für eine Schutzgruppe steht mit einem Organostannan der Formel (Ra)3Sn-R3 und einem Katalysator unter Bildung einer Verbindung der Formel (I), worin R3 für -SRh steht und R4 für eine Schutzgruppe steht und Entfernung der Schutzgruppe R4 unter Bildung der Verbindung der Formel (I), worin R3 für -SRh steht und R4 für Wasserstoff steht. In einer Ausführungsform umfasst der Katalysator Palladium (beispielsweise Pd2(dba)2). In einer weiteren Ausführungsform steht Ra für Methyl, Ethyl, Propyl oder Butyl.
- Viele der in den oben beschriebenen Syntheseverfahren verwendeten Ausgangsmaterialien sind im Handel erhältlich oder werden in der wissenschaftlichen Literatur beschrieben. Es kann erwünscht sein, optional eine Schutzgruppe während aller beschriebenen Syntheseverfahren oder Teilen der oben beschriebenen Syntheseverfahren zu verwenden. Solche Schutzgruppen und Verfahren zu ihrer Einführung und Entfernung sind in der Technik gut bekannt. Siehe T.W. Greene, P.G.M. Wuts, "Protecting Groups in Organic Synthesis", 2. Ausgabe, 1991, New York, John Wiley & Sons, Inc.
- In Fällen, in denen die Verbindungen ausreichend basisch oder sauer sind, um stabile, nichttoxische Säure- und Basenadditionssalze zu verwenden, kann die Verabreichung der Verbindungen als Salze geeignet sein. Beispiele für pharmazeutisch annehmbare Salze sind organische Säureadditionssalze, die mit Säuren gebildet werden, die ein physiologisch annehmbares Anion bilden, beispielsweise Tosylat, Methansulfonat, Acetat, Citrat, Malonat, Tartrat, Succinat, Benzoat, Ascorbat, α-Ketoglutarat und α-Glycerophosphat. Geeignete anorganische Salze können auch gebildet werden, einschließlich Hydrochlorid-, Sulfat-, Nitrat-, Bicarbonat- und Carbonatsalze.
- Pharmazeutisch annehmbare Salze können mittels Standardverfahren erhalten werden, die in der Technik gut bekannt sind, beispielsweise durch Umsetzung einer ausreichend basischen Verbindung, wie einem Amin, mit einer geeigneten Säure, die ein physiologisch annehmbares Anion ergibt. Es können auch Alkalimetall (beispielsweise Natrium, Kalium oder Lithium) oder Erdalkalimetallsalze (beispielsweise Calcium) von Carbonsäuren hergestellt werden.
- Die Verbindungen der Formel (I) können als pharmazeutische Zusammensetzungen formuliert und einem Säugerwirt, wie einem Patienten auf eine Vielzahl an Formen verabreicht werden, die an einen ausgewählten Verabreichungsweg angepasst sind, das heißt durch orale, parenterale, intravenöse, intramuskuläre, topische oder subkutane Wege.
- Daher können die vorliegenden Verbindungen systemisch verabreicht werden, beispielsweise oral in Kombination mit einem pharmazeutisch annehmbaren Träger, wie einem inerten Verdünnungsmittel oder einem assimilierbaren essbaren Träger. Sie können in Hart- oder Weichgelatinekapseln eingeschlossen werden, können zu Tabletten verpresst werden oder direkt in das Nahrungsmittel der Patientennahrung eingearbeitet werden. Zur oralen therapeutischen Verabreichung kann der Wirkstoff mit einem oder mehreren Hilfsstoffen kombiniert und in Form von essbaren Tabletten, bukalen Tabletten, Pastillen, Kapseln, Elixieren, Suspensionen, Sirupen, Obladen und dergleichen kombiniert werden. Solche Zusammensetzungen und Präparationen sollten zumindest 0,1 % Wirkstoff enthalten. Der Prozentsatz der Zusammensetzungen und Präparationen kann natürlich variiert werden und kann bequemerweise zwischen etwa 2 und etwa 60 % des Gewichts einer gegebenen Einheitsdosierungsform betragen. Die Menge an Wirkstoff in solchen therapeutisch brauchbaren Zusammensetzungen ist so ausgelegt, dass eine wirksame Dosismenge erhalten wird.
- Die Tabletten, Pastillen, Pillen, Kapseln und dergleichen können auch das folgende enthalten: Bindemittel, wie Traganth, Akaziengummi, Maisstärke oder Gelatine, Hilfsstoffe, wie Dicalciumphosphat, ein Zerfallshilfsmittel, wie Maisstärke, Kartoffelstärke, Alginsäure und dergleichen, ein Gleitmittel, wie Magnesiumstearat und ein Süßungsmittel, wie Saccharose, Fructose, Lactose oder Aspartam oder einen Geschmacksstoff, wie Pfefferminze, Waldmeister oder Kirscharoma können zugegeben werden. Wenn die Einheitsdosierungsform eine Kapsel ist, kann sie zusätzlich zu Materialien des obigen Typs einen flüssigen Träger, wie ein Pflanzenöl oder ein Polyethylenglycol enthalten. Verschiedene andere Materialien können als Beschichtungen oder als andere Modifikation der physikalischen Form der festen Einheitsdosierungsform vorkommen. Beispielsweise können Tabletten, Pillen oder Kapseln mit Gelatine, Wachs, Schellack oder Zucker und dergleichen beschichtet werden. Ein Sirup oder Elixir kann den Wirkstoff, die Saccharose oder Fructose als Süßungsmittel, Methyl- und Propylparabene als Konservierungsstoffe, einen Farbstoff und einen Geschmacksstoff enthalten, wie Kirsch- oder Orangengeschmack. Natürlich sollte jedes Material, das zur Herstellung der Einheitsdosierungsform verwendet wird, pharmazeu tisch annehmbar und im wesentlichen in den verwendeten Mengen nicht toxisch sein. Zusätzlich kann der Wirkstoff in verzögert freisetzende Präparationen und Vorrichtungen eingearbeitet werden.
- Der Wirkstoff kann auch intravenös oder intraperitoneal durch Infusion oder Injektion verabreicht werden. Lösungen des Wirkstoffs oder dessen Salze können in Wasser optional im Gemisch mit einem nicht-toxischen Tensid hergestellt werden. Dispersionen können auch in Glycerin, flüssigen Polyethylenglycolen, Triacetin und Gemischen hiervon und in Ölen hergestellt werden. Unter normalen Lagerbedingungen und Verwendung können diese Präparationen ein Konservierungsmittel enthalten, um das Wachstum der Mikroorganismen zu verhindern.
- Die pharmazeutischen Dosierungsformen, die zur Injektion oder Infusion geeignet sind, können sterile wässrige Lösungen oder Dispersionen oder sterile Pulver sein, die den Wirkstoff umfassen, und zur unmittelbaren Herstellung von sterilen injizierbaren oder infundierbaren Lösungen oder Dispersionen angepasst sind, welche optional in Liposomen verkapselt werden können. In allen Fällen sollte die schließliche Dosierungsform steril, flüssig und unter den Bedingungen der Herstellung und Lagerung stabil sein. Der flüssige Träger oder das Vehikel kann ein Lösemittel oder ein flüssiges Dispersionsmedium sein, das beispielsweise Wasser, Ethanol, ein Polyol (beispielsweise Glycerin, Propylenglycol, flüssige Polyethylenglycole und dergleichen), pflanzliche Öle, nicht-toxische Glycerylester und geeignete Gemische hiervon umfasst. Die geeignete Fluidität kann beispielsweise durch die Bildung von Liposomen, durch die Aufrechterhaltung der erforderlichen Partikelgröße im Fall von Dispersionen oder durch die Verwendung von Tensiden aufrechterhalten werden. Die Verhinderung der Einwirkung von Mikroorganismen kann durch verschiedene antibakterielle und antimykotische Mittel erreicht werden, beispielsweise Parabene, Chlorbutanol, Phenol, Sorbinsäure, Thimerosal und dergleichen. In vielen Fällen ist es bevorzugt, isotonische Mittel miteinzuarbeiten, beispielsweise Zucker, Puffer oder Natriumchlorid. Eine verlängerte Absorption der injizierbaren Zusammensetzungen kann durch Mittel in den Zusammensetzungen herbeigeführt werden, die die Absorption verzögern, beispielsweise Aluminiummonostearat und Gelatine.
- Sterile injizierbare Lösungen werden durch die Einarbeitung des Wirkstoffs in der erforderlichen Menge in das geeignete Lösemittel mit verschiedenen der oben aufgeführten anderen Inhaltsstoffe, wie dies erforderlich ist, hergestellt, wonach eine Filtersterilisation erfolgt. Im Fall der sterilen Pulver zur Herstellung von sterilen injizierbaren Lösungen sind die bevorzugten Herstellverfahren Vakuumtrocknungs- und Gefriertrocknungsverfahren, die ein Pulver des Wirkstoffs plus einen zusätzlich erwünschten Inhaltsstoff ergibt, der in den vorher sterilfiltrierten Lösungen enthalten ist.
- Zur topischen Verabreichung können die vorliegenden Verbindungen in reiner Form verabreicht werden, das heißt wenn sie Flüssigkeiten sind. Jedoch ist es im allgemeinen erwünscht, sie auf die Haut als Zusammensetzungen oder Formulierungen in Kombination mit einem dermatologisch annehmbaren Träger zu verabreichen, der ein Feststoff oder eine Flüssigkeit sein kann.
- Brauchbare feste Träger umfassen fein verteilte Feststoffe, wie Talkum, Ton, mikrokristalline Cellulose, Silica, Aluminiumoxid und dergleichen. Brauchbare feste Träger umfassen Wasser, Alkohole oder Glycole oder Wasser-Alkohol/Glycol-Mischungen, worin die vorliegenden Verbindungen in wirksamen Mengen gelöst oder dispergiert werden können, optional mit Hilfe von nicht-toxischen Tensiden. Adjuvantien, wie Duftstoffe und zusätzliche antimikrobielle Mittel können zugegeben werden, um die Eigenschaften für eine gegebene Verwendung zu optimieren. Die entstehenden flüssigen Zusammensetzungen können von Absorptionskissen verabreicht werden, zur Imprägnierung von Bandagen und anderen Stof fen verwendet werden oder auf den betroffenen Bereich mittels Pumpsprays oder Aerosolsprays gesprüht werden.
- Verdicker, wie synthetische Polymere, Fettsäuren, Fettsäuresalze und Ester, Fettalkohole, modifizierte Cellulosen oder modifizierte Mineralmaterialien können auch mit flüssigen Trägern unter Bildung von verteilbaren Pasten, Gelen, Salben, Seifen und dergleichen zur direkten Auftragung auf die Haut des Anwenders verwendet werden.
- Beispiele für brauchbare dermatologische Zusammensetzungen, die zur Abgabe der erfindungsgemäßen Verbindungen auf die Haut verwendet werden können, sind in Jacquet et al (
US 4 608 392 A ), Geria (US 4 992 478 A ), Smith et al. (US 4 559 157 A ) und Wortzman (US 4 820 508 A ) beschrieben. - Die vorliegenden Zusammensetzungen können auch in geeigneten Formen zur Absorption durch die Mukosamembranen der Nase und des Rachens oder von Bronchialgeweben hergestellt werden und können bequemerweise die Form von Pulver- oder Flüssigsprays oder Inhalationsmitteln, Longetten, Rachenpinselungen etc. annehmen. Zur Medikation der Augen oder der Ohren können die Präparationen als einzelne Kapseln, in flüssiger oder halbfester Form dargestellt werden oder können als Tropfen etc. verwendet werden. Topische Anwendungen können in hydrophobe oder hydrophile Grundlagen als Salben, Cremes, Lotionen, Lacke, Pulver etc. formuliert werden.
- In der Tiermedizin kann die Zusammensetzung beispielsweise als Intra-Brustpräparation in entweder langwirkenden oder schnell freisetzenden Grundlagen formuliert werden.
- Brauchbare Dosierungen der erfindungsgemäßen Verbindungen können durch den Vergleich ihrer in vitro Aktivität und in vivo Aktivität in Tiermodellen bestimmt werden. Verfahren zur Extrapolation von wirksamen Dosierungen in Mäusen und anderen Tieren bis hin zum Menschen sind in der Technik bekannt, siehe beispielsweise
US 4 938 949 A . - Im allgemeinen beträgt die Konzentration der erfindungsgemäßen Verbindungen in einer flüssigen Zusammensetzung, wie einer Lotion, etwa 0,1 bis 25 Gewichtsprozent, vorzugsweise etwa 0,5 bis 10 Gewichtsprozent. Die Konzentration in einer halbfesten oder festen Zusammensetzung, wie einem Gel oder einem Pulver, beträgt etwa 0,1 bis 5 Gewichtsprozent, vorzugsweise etwa 0,5 bis 2,5 Gewichtsprozent.
- Die Zusammensetzungen können pro Einheitsdosierungsform, ob flüssig oder fest, 0,1% bis 99% des Wirkstoffs (die vorliegenden 7-Vinylidencephalosporine und optional ein Antibiotikum) enthalten, wobei der bevorzugte Bereich etwa 10 bis 60 % beträgt. Die Zusammensetzung enthält im allgemeinen etwa 15 mg bis etwa 1500 mg an Wirkstoffgewicht auf der Grundlage des Gesamtgewichts der Formulierung, wobei es im allgemeinen bevorzugt ist, eine Dosierungsmenge im Bereich von etwa 250 mg bis 1000 mg zu verwenden. Bei der parenteralen Verabreichung besteht die Einheitsdosierung gewöhnlich aus der reinen Verbindung in einer leicht angesäuerten sterilen Wasserlösung oder in Form eines löslichen Pulvers, das aufgelöst werden soll. Einzeldosierungen zur Injektion, Infusion oder Einnahme können erfindungsgemäß 1 bis 3 Mal am Tag verabreicht werden, um Mengen von etwa 0,5 bis 50 mg/kg bei Erwachsenen zu erreichen.
- Die Erfindung liefert eine pharmazeutische Zusammensetzung, die eine wirksame Menge einer Verbindung der Formel (I), wie dies oben beschrieben ist, oder ein pharmazeutisch annehmbares Salz hiervon, und einen pharmazeutisch annehmbaren Träger enthält. Die Erfindung liefert auch eine pharmazeutische Zusammensetzung, die eine wirksame Menge einer Verbindung der Formel (I), wie dies oben beschrieben ist, oder ein pharmazeutisch annehmbares Salz hiervon, ein β-Lactamantibiotikum und einen pharmazeutisch annehmbaren Träger umfasst. Die vorliegenden Zusammensetzungen werden vorzugsweise in einer Form präsentiert, die zur Verabreichung in den Gastrointestinaltrakt geeignet ist.
- Es ist jedes β-Lactamantibiotikum zur Verwendung in der pharmazeutischen Zusammensetzung der Erfindung geeignet. β-Lactamantibiotika, die in der Technik gut bekannt sind, umfassen jene, die von R.B. Morin und M. Gorin, Herausgeber, Academic Press, New York, 1982, Band 1 bis 3 beschrieben sind. Bevorzugte β-Lactamantibiotika, die zur Verwendung in der pharmazeutischen Zusammensetzung der Erfindung geeignet sind, umfassen β-Lactamantibiotika, die vorzugsweise durch β-Lactamaseenzyme der Klasse A und Klasse C deaktiviert werden, beispielsweise Amoxicillin, Piperacillin, Ampicillin, Ceftizoxim, Cefotaxim, Cefuroxim, Cephalexin, Cefaclor, Cephaloridin und Ceftazidin.
- Die Fähigkeit einer erfindungsgemäßen Verbindung als β-Lactamaseinhibitor zu fungieren, kann mittels des im folgenden beschriebenen Tests oder mittels anderer Tests beschrieben werden, die in der Technik bekannt sind. Es werden repräsentative Verbindungen der Formel I als Inhibitoren der Klasse C β-Lactamase von Enterobacter cloacae P-99, einer Cephalosporinase und TEM-1, einer Penicillinase durch relative HK50 Analyse evaluiert. Der HK50 Wert steht für die Konzentration des Inhibitors, der zur Bewirkung von 50 % Verlust der Aktivität des freien Enzyms erforderlich ist. Der HK50 Wert jeder Verbindung wird auf eine Weise bestimmt, die zu der folgenden ähnlich ist: Nach einer Inkubation für 10 Minuten einer verdünnten Lösung aus Enzym (2,56 nM) und Inhibitor (< 0,64 mM) wird ein 50 μl Aliquot dieses Inkubationsgemisches dann weiter in 1 ml Nitrocefinlösung verdünnt und die Hydrolyserate wird während einer Periode von 1 Minute bestimmt, wobei die Absorption des Nitrocephins als Funktion der Zeit verfolgt wird. Zusätzlich werden die HK50 Werte von Tazobactam als relative Kontrollen bestimmt. Es werden die Daten für repräsentative Verbindungen der Formel (I) in der folgenden Tabelle 1 gezeigt.
- Die vorliegenden β-Lactamaseinhibitoren der Formel (I) sind besonders zur Behandlung von Infektionen brauchbar, die mit Enterobacter, Citrobacter und Serratia assoziiert sind. Diese Bakterien haben die Fähigkeit, sich an Epithelzellen der Blase oder Niere zu heften (wobei sie Harnwegsinfektionen verursachen) und sind gegenüber mehreren Antibiotika resistent, einschließlich Amoxicillin und Ampicillin.
- Die vorliegenden β-Lactamaseinhibitoren der Formel (I) sind auch zur Behandlung von Infektionen brauchbar, die mit hochresistenten Pneumokokken assoziiert sind. Solche Erkrankungen umfassen Otitis media, Sinusitis, Meningitis (sowohl bei Kindern und Erwachsenen), Bakterämie und septische Arthritis. Resistente Pneumokokkenstämme sind in vielen Teilen der Welt aufgetreten. Beispielsweise sind in Ungarn 58 % von S. pneumoniae gegenüber Penicillin resistent und 70 % der Kinder, die mit S. pneumoniae kolonisiert sind, tragen resistente Stämme, die auch gegenüber Tetracyclin, Erythromycin, Trimethoprin/Sulfamethoxazol (TMP/SMX) und 30 % gegenüber Chloramphenicol resistent sind. Kiebsiella pneumoniae (resistent gegenüber der Bildung von β-Lactamase) haben im Krankenhaus Ausbrüche von Wundinfektion und Septikämie verursacht.
- Andere Merkmale der Erfindung werden im Verlauf der folgenden Beschreibungen von beispielsgemäßen Ausführungsformen ersichtlich, die zur Erläuterung der Erfindung bereitgestellt werden und diese nicht beschränken sollen.
- Beispiele 1–4 (
1 ): Herstellung der Verbindung 2 - Diphenylmethyl-7-phenylacetamido-3-(trifluorsulfonyloxy)-3-cephem-4-carboxylat (2)
- Diese Verbindung und die folgenden Halogenide werden gemäß dem Verfahren von Farina (Farina et al. J. Org. Chem. 54, 4962–4966 (1989) hergestellt. Eine Lösung aus Benzhydryl-3-hydroxy-7-(phenylacetamido)ceph-3-em (1, 41 g, 84 mmol, kommerziell von Otsuka Chemical Corp. erhältlich) in wasserfreiem CH2Cl2 (600 ml) wird auf –78°C gekühlt und mit trockenem Diisopropylethylamin (15,6 ml, 90 mmol) und Trifluormethansulfonsäureanhydrid (14,3 ml, 85 mmol) behandelt. Das Gemisch wird dann bei –78°C für 20 min gerührt. Die Lösung wird dann durch die Zugabe von 1 l an trockenem CH2Cl2 verdünnt und das Kühlbad wird entfernt. Die organische Phase wird mit Wasser (2 × 1 l) und Kochsalzlösung (1 × 500 ml) gewaschen. Dann wird sie über Na2SO4 getrocknet und unter Bildung des gewünschtren Triflats (2) als nicht ganz weißes amorphes Pulver konzentriert. Ausbeute: 43,5 g (85 %). 1H NMR (CDCl3, 400 MHz) δ: 3,42 (d, J = 18 Hz, 1H), 3,70–3,63 (m, 2H), 3,75 (d, J = 18 Hz, 1H), 5,03 (d, J = 5 Hz, 1H), 5,91–5,87 (m, 1H), 6,02 (d, J = 8,7 Hz, 1H), 6,98 (s, 1H), 7,51–7,24 (m, 15H).
- Herstellung der Verbindungen 3a–3c: Allgemeines Verfahren zur Synthese der Diphenylmethyl-3-halo-7-(phenylacetamido)-3-cephem-4-carboxylate (3a, 3b und 3c)
- Zu einer Lösung des Triflats 2 (10 mmol) in wasserfreiem THF (100 ml) wird frisches wasserfreies LiX (25 mmol) gegeben und die Reaktion kann unter Argon für 24–36 h rühren, während der Fortschritt gemäß 1H NMR verfolgt wird. Nachdem die Reaktion vollständig ist, werden Wasser (200 ml) und EtOAc (200 ml) zugegeben und die organische Phase wird mit Wasser (2 × 100 ml), gefolgt von Kochsalzlösung (1 × 100 ml) gewaschen und über Na2SO4 getrocknet. Ein Eindampfen des Lösemittels ergibt den rohen 3-Halogen-3-cephem-4-carboxylatester, der weiter durch Säulenchromatographie auf Silicagel gereinigt wird.
Diphenylmethyl-3-chlor-7-(phenylacetamido)-3-cephem-4-carboxylat (3a) Ausbeute: 90 %. 1H NMR (CDCl3, 400 MHz) δ: 3,43 (d, J = 18,5 Hz, 1H), 3,64–3,57 (m, 2H), 3,74 (d, J = 18,5 Hz, 1H), 4,99 (d, J = 5 Hz, 1H), 5,84–5,81 (m, 1H), 6,24 (d, J = 9 Hz, 1H), 6,97 (s, 1H), 7,39–7,24 (m, 15H).
Diphenylmethyl-3-brom-7-(phenylacetamido)-3-cephem-4-carboxylat (3b) Ausbeute: 88 %. 1H NMR (CDCl3, 400 MHz) δ 3,64–3,56 (m, 3H), 3,83 (d, J = 18 Hz, 1H), 5,02 (d, J = 5 Hz, 1H), 5,81–5,78 (m, 1H), 6,21 (d, J = 9 Hz, 1H), 6,97 (s, 1H), 7,41–7,25 (m, 15H).
Diphenylmethyl-3-iod-7-(phenylacetamido)-3-cephem-4-carboxylat (3c) Ausbeute: 72 %. 1H NMR (CDCl3, 400 MHz) δ: 3,67–3,56 (m, 2H), 3,70 (d, J = 18,5 Hz, 1H), 3,84 (d, J = 18,5 Hz, 1H), 5,04 (d, J = 5 Hz, 1H), 5,85–5,81 (m, 1H), 6,16 (d, J = 9 Hz, 1H), 6,96 (s, 1H), 7,41–7,24 (m, 15H). - Herstellung der Verbindungen 4a–4c: Allgemeines Verfahren zur Synthese der Diphenylmethyl-3-halo-7-amino-3-cephem-4-carboxylate (4a, 4b und 4c)
- Zu einer gekühlten Lösung (0°C) aus PCl5 (25 mmol) in trockenem CH2Cl2 wird trockenes Pyridin (25 mmol) langsam gegeben, während die Reaktion mit einem Eisbad gekühlt wird. Die Reaktion kann bei dieser Temperatur für 1 h rühren. Das geeignete Phenylacetamido-3-cephem-4-carboxylat (3a, 3b oder 3c) wird dann in einer Portion zugegeben und die Reaktion kann für 1,5 h bei derselben Temperatur weiterrühren. Das Reaktionsgemisch wird dann auf –78°C gekühlt und MeOH (30 ml) wird langsam zugegeben und die Reaktion wird für eine weitere Stunde gerührt. Das Reaktionsgemisch kann sich dann langsam erwärmen, bis eine Temperatur zwischen –10 und 0°C erreicht ist. Wasser (30 ml) wird dann zugegeben und die Lösung wird unter Vakuum zur Entfernung des CH2Cl2 und des Großteils an MeOH konzentriert. Zu dem verbleibenden Rückstand werden EtOAc (150 ml) und Wasser (100 ml) gegeben und die Wasserphase wird durch die Zugabe von NaHCO3 basisch gemacht. Die organische Phase wird dann abgetrennt und die wässrige Phase wird weiter mit EtOAc (1 × 50 ml) extrahiert. Die vereinigte organische Phase wird mit Wasser (1 × 100 ml) gefolgt von Kochsalzlösung (1 × 100 ml) gewaschen. Die organische Phase wird dann über Na2SO4 getrocknet und unter Vakuum konzentriert. Das rohe Produkt wird weiter durch Säulenchromatographie mittels eines Gemisches aus EtOAc und CH2Cl2 als Eluent gereinigt.
Diphenylmethyl-3-chlor-7-amino-3-cephem-4-carboxylat (4a) Ausbeute: 74 %. 1H NMR (CDCl3, 400 MHz) δ 1,74 (br s, 2H), 3,48 (d, J = 18,5 Hz, 1H), 3,8 (d, J = 18,5 Hz, 1H), 4,75 (d, J = 5,0 Hz, 1H), 4,98 (d, J = 5,0 Hz, 1H), 7,00 (s; 1H), 7,57–7,26 (m, 10H).
Diphenylmethyl-3-brom-7-amino-3-cephem-4-carboxylat (4b) Ausbeute: 72 %. 1H NMR (CDCl3, 400 MHz) δ: 1,74 (br s, 2H), 3,62 (d, J = 18 Hz, 1H), 3,88 (d, J = 18 Hz, 1H), 4,75 (d, J = 5,0 Hz, 1H), 5,00 (d, J = 5,0 Hz, 1H), 7,00 (s, 1H), 7,44–7,25 (m, 10H).
Diphenylmethyl-3-iod-7-amino-3-cephem-4-carboxylat (4c) Ausbeute: 76 %. 1H NMR (CDCl3, 400 MHz) δ: 1,75 (br s, 2H), 3,76 (d, J = 18,5 Hz, 1H), 3,90 (d, J = 18,5 Hz, 1H), 4,75 (d, J = 5 Hz, 1H), 5,04 (d, J = 5,0 Hz, 1H), 7,00 (s, 1H), 7,467,26 (m, 10H). - Herstellung der Verbindungen 5a–5c: Allgemeines Verfahren zur Synthese der Diphenylmethyl-3-halo-7-(2'-pyridylmethyliden)-3-cephem-4-carboxylate (5a, 5b und 5c) aus Aminen (4a, 4b und 4c).
- Zu einer Lösung aus Triphenyl-(2-pyridylmethyl)phosphoniumchloridhydrochlorid (20 mmol, Aldrich Chemical Co.) in wasserfreiem THF (150 ml) wird Kalium-tert-butoxid (15 mmol) gegeben. Diese Aufschlämmung wird dann bei Raumtemperatur für 2 h gerührt, um das Wittig Reagenz zu erhalten.
- Auf getrennte Weise werden zu einer Lösung des Amins (4, 20 mmol) in EtOAc (200 ml), katalytische Trifluoressigsäure (200 μl) und Isopropylnitrit (eine Lösung aus 30 bis 50 % in CH2Cl2, hergestellt gemäß dem Verfahren von Blacklock et al., J. Org. Chem., 54, 3907–3913 (1989)) gegeben. Nachdem die Reaktion vollständig ist (etwa 5 min, verfolgt gemäß TLC), wird das EtOAc unter Vakuum entfernt und die entstehenden 7-Diazo-3-cephen-4-carboxylate werden vollständig unter Hochvakuum getrocknet. Diese Diazoverbindung wird dann sofort in wasserfreiem Benzol (200 ml) und Propylenoxid (25 ml) gelöst und mit einer katalytischen Menge an Rhodiumoctanoat (0,5 g) behandelt. Bei der Reaktion wird eine Gasentwicklung beobachtet. Nach der Vollständigkeit dieser Gasentwicklung, wird das Benzollösemittel unter Vakuum entfernt und der verbleibende Feststoff (7-Oxo-3-cephem-4-carboxylat) wird in trockenem CH2Cl2 (200 ml) gelöst. Diese Lösung wird dann auf –78°C gekühlt.
- Die Lösung des vorher erwähnten Wittig Reagenzes wird dann langsam (mittels einer Kanüle) zu dieser kalten (–78°C) Lösung des Ketons gegeben und die Reaktion wird bei dieser Temperatur für 30 min gerührt. Dann wird eine gesättigte wässrige Lösung aus NH4Cl zugegeben und das Reaktionsgemisch wird langsam auf Raumtemperatur unter Rühren erwärmt. Die Phasen werden getrennt und die wässrige Phase wird mit einer zusätzlichen Portion aus CH2Cl2 extrahiert. Die vereinigten organischen Phasen werden mit Wasser (1 × 100 ml) und Kochsalzlösung (1 × 100 ml) gewaschen und über Na2SO4 getrocknet. Das rohe Produkt wird durch Säulenchromatographie (Silicagel) mittels eines Gemisches aus EtOAc und CH2Cl2 als Eluent gereinigt.
Diphenylmethyl-3-chlor-7-(2'-pyridylmethyliden)-3-cephem-4-carboxylat (5a) Gesamtausbeute (drei Schritte aus 4a): 35 %. 1H NMR (CDCl3, 400 MHz) δ: 3,54 (d, J = 18,5 Hz, 1H), 3,96 (d, J = 18,5 Hz, 1H), 5,71 (s, 1H), 7,03 (s, 1H), 7,41–7,28 (m, 13H), 7,76 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,76 (d, J = 4 Hz, 1H).
Diphenylmethyl-3-brom-7-(2'-pyridyliethyliden)-3-cephem-4-carboxylat (5b) Gesamtausbeute (drei Schritte aus 4b): 35 %. 1H NMR (CDCl3, 400 MHz) δ 3,59 (d, J = 18,5 Hz, 1H), 3,95 (d, J = 18,5 Hz, 1H) 5,73 (d, J = Hz, 1H), 7,05 (s, 1H), 7,47–7,26 (m, 13H), 7,77 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,76 (d, J = 4 Hz, 1H).
Diphenylmethyl-3-iod-7-(2'-pyridylmethyliden)-3-cephem-4-carboxylat (5c) Gesamtausbeute (drei Schritt aus 4a): 33 %. 1H NMR (CDCl3, 400 MHz) δ 3,70 (d, J = 18,5 Hz, 1H), 3,94 (d, J = 18,5 Hz, 1H), 5,76 (s, 1H), 7,06 (s, 1H), 7,42–7,26 (m, 13H), 7,73 (t von d, J = 1,6 und 7,7 Hz, 1H), 8,71 (d, J = 4,0 Hz, 1H). - Herstellung der Verbindungen 6a–6c: Allgemeines Verfahren zur Bildung der Diphenylmethyl-1,1-dioxo-3-halo-7-(2'-pyridylmethyliden)-3-cephem-4-carboxylate (6a, 6b und 6c) mittels Oxidation mit mCPBA
- Zu einer Lösung aus Sulfid (5) in CH2Cl2 (15 ml) wird mCPBA (2,5 mmol) gegeben und die Reaktion wird für 20 min bei RT gerührt. Eine gesättigte wässrige Lösung aus Na2SO3 wird dann zugegeben und die Phasen werden getrennt. Die organische Phase wird mit wässrigem NaHCO3 (1 × 25 ml), Wasser (1 × 25 ml) und Kochsalzlösung (1 × 25 ml) gewaschen. Die organische Phase wird dann über Na2SO4 getrocknet, konzentriert und das rohe Produkt wird weiter durch Blitzsäulenchromatographie (Silicagel) mittels eines Gemisches aus EtOAc und CH2Cl2 als Eluent gereinigt.
Diphenylmethyl-3-chlor-1,1-dioxo-7-(2'-pyridylmethyliden)-3-cephem-4-carboxylat (6a) Ausbeute: 72 %. 1H NMR (CDCl3, 400 MHz) δ 4,04 (d, J = 18 Hz, 1H), 4,23 (d, J = 18 Hz, 1H), 5,93 (s, 1H), 7,03 (s, 1H), 7,39–7,31 (m, 13H), 7,73 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,66 (d, J = 4 Hz, 1H).
Diphenylmethyl-3-brom-1,1-dioxo-7-(2'-pyridylmethyliden)-3-cephem-4-carboxylat (6b) Ausbeute : 75 %. 1H NMR (CDCl3, 400 MHz) δ 4,10 (d, J = 18 Hz, 1H), 4,34 (d von t, J = 18 Hz, 1H), 5,95 (s, 1H), 7,04 (s, 1H), 7,47–7,3 (m, 13H), 7,73 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,67 (d, J = 4 Hz, 1H).
Diphenylmethyl-3-iod-1,1-dioxo-7-(2'-pyridylmethyliden)-3-cephem-4-carboxylat (6c) Ausbeute: 78 %. 1H NMR (CDCl3, 400 MHz) δ 8,66 (d, J = 4,0 Hz, 1H), 7,71 (t von d, J = 1,6 und 7,7 Hz, 1H), 7,49–7,25 (m, 13H), 7,03 (s, 1H), 5,96 (s, 1H), 4,38 (d, J = 18 Hz, 1H), 4,18 (d, J = 18 Hz, 1H). 13C NMR (CDCl3, 400 MHz) δ 160,3, 160,2 150,4, 150,2, 138,9, 138,6, 137,0, 132,7, 130,9, 128,6, 128,5, 128,4, 128,2, 128,0, 127,5, 127,2, 126,6, 126,4, 125,3, 80,5, 74,1, 64,2.
HRMS berechnet für C26H19IN2O5S [M + H]+ 599,0138, beobachtet 599,0135. - Herstellung der Verbindungen 7a–7c: Allgemeines Verfahren zur Schutzgruppenabspaltung der Benzhydrylester
- Eine Lösung des geeigneten Benzhydrylesters (0,1 mmol) in trockenem Anisol (3,0 mmol) wird in einem Eissalzbad gekühlt und Trifluoressigsäure (12,0 mmol) wird langsam mittels einer Spritze unter Argonatmosphäre zugegeben. Nach 20 Minuten werden die flüchtigen Komponenten unter Vakuum entfernt und der Rückstand wird in EtOAc (5 ml) gelöst. Die EtOAc Phase wird mit wässrigem NaHCO3 (2 × 0,15 mmol in 4 ml H2O) gelöst. Die vereinigten Wasserphasen werden direkt auf eine Chromatographiesäule (hochporöses Polymer, MCl Gel, CHP20P Mitsubishi Chemical Corp., White Plains NY, etwa 75 bis 150 ml Harz) gegeben und das Produkt wird mit 5 % EtOH in entionisiertem Wasser eluiert. Die Ausbeute beträgt typischerweise zwischen 60 bis 80%.
Herstellung von: Natrium-3-chlor-1,1-dioxo-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (7a). Die Herstellung erfolgt aus dem Ester 7a gemäß dem oben für die Schutzgruppenabspaltung der Benzhydrylester beschriebenen allgemeinen Verfahren. 1H NMR (D2O, 400 MHz) δ: 6,28 (s, 1H), 7,44–7,34 (m, 1H), 7,48 (s, 1H), 7,62–7,59 (m, 1H), 7,84 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,55 (d, J = 4,0 Hz, 1H).
Herstellung von: Natrium-3-brom-1,1-dioxo-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (7b). Die Herstellung erfolgt aus dem Ester 7b gemäß dem oben für die Schutzgruppenabspaltung der Benzhydrylester beschriebenen allgemeinen Verfahren. 1H NMR (D2O, 400 MHz) δ: 6,29 (s, 1H), 7,45–7,35 (m, 1H), 7,49 (s, 1H), 7,6–7,57 (m, 1H), 7,85 (t von d, J = 1,6 und 7,7 Hz, 1H), 8,56 (d, J = 4,0 Hz, 1H).
Herstellung von: Natrium-1,1-dioxo-3-iod-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (7c). Die Herstellung erfolgt aus dem Ester 7c gemäß dem oben für die Schutzgruppenabspaltung der Benzhydrylester beschriebenen allgemeinen Verfahren. 1H NMR (D2O, 400 MHz) δ: 6,29 (d, J = 1 Hz, 1H), 7,33–7,30 (m, 1H), 7,45 (d, J = 1 Hz, 1H), 7,65–7,61 (m, 1H), 7,83 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,54 (d, J = 4,0 Hz, 1H). - Beispiele 1–2 (
2 ) - Herstellung der Verbindungen 8a–8b: Allgemeines Verfahren für die Stille Kupplungen des Iodids 6c mit Organostannanen zur Herstellung der Verbindungen 8a–8b.
- Zu einer Lösung der Verbindung 6c (72 mg, 0,12 mmol) in wasserfreiem THF werden das geeignete Organostannan (0,11 mmol, beispielsweise Bu3Sn-R3) und Pd2(dba)3 (5 mg, 0,011 mmol) unter einer Ar Atmosphäre gegeben. Das Reaktionsgemisch wird bei 65°C für 2,5 h gerührt und durch 1H NMR verfolgt. Nachdem die Reaktion vollständig ist, wird das Lösemittel unter verringertem Druck entfernt und das Produkt wird in CH2Cl2 gelöst. Die Lösung wird dann mit Wasser (10 ml) und Kochsalzlösung (10 ml) gewaschen. Die organische Phase wird konzentriert und durch Säulenchromatographie (Silicagel) gereinigt.
Diphenylmethyl-1,1-dioxo-3-methylsulfanyl-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (8a) Ausbeute: 67 %. 1H NMR (CDCl3, 400 MHz) δ: 2,35 (s, 3H), 3,98 (d, J = 15,5 Hz, 1H), 4,18 (d, J = 15,5 Hz, 1H), 5,72 (d, J = 1 Hz, 1H), 6,97 (s, 1H), 7,4–7,26 (m, 13H), 7,71 (t von d, J = 1,6 und 7,7 Hz, 1H), 8,66 (d, J = 4 Hz, 1H).
Diphenylmethyl-1,1-dioxo-3-phenylsulfanyl-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (8b) Ausbeute: 72 %. 1H NMR (CDCl3, 400 MHz) δ: 8,63 (d, J = 3,9 Hz, 1H), 7,71 (t von d, J = 1,6 und 7,7 Hz, 1H), 7,53–7,26 (m, 19H), 7,02 (s, 1H), 5,75 (s, 1H), 3,75 (d, J = 15, 6 Hz, 1H), 3,59 (d, J = 15,6 Hz, 1H). - Herstellung der Verbindungen 9a–9b: Die Verbindungen 9a-9b werden aus den Verbindungen 8a–8b gemäß den Allgemeinen Verfahren zur Schutzgruppenabspaltung der oben beschriebenen Benzhydrylester hergestellt.
- Beispiel 1: Natrium-1,1-dioxo-3-methylsulfanyl-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (9a).
- Die Herstellung erfolgt aus dem Ester 8a gemäß dem oben für die Schutzgruppenabspaltung der Benzhydrylester beschriebenen allgemeinen Verfahren. 1H NMR (D2O, 400 MHz) δ: 2,2 (s, 3H), 6,17 (s, 1H), 7,42–7,36 (m, 2H), 7,43 (s, 1H), 7,61–7,58 (m, 1H), 7,81 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,52 (d, J = 4,0 Hz, 1H).
- Beispiel 2: Natrium-1,1-dioxo-3-phenylsulfanyl-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (9b).
- Die Herstellung erfolgt aus dem Ester 8b gemäß dem oben für die Schutzgruppenabspaltung der Benzhydrylester beschriebenen allgemeinen Verfahren. 1H NMR (D2O, 400 MHz) δ: 6,32 (d, J = 1 Hz, 1H), 7,42–7,33 (m, 6H), 7,46 (s, 1H), 7,6–7,58 (m, 1H), 7,81 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,51 (d, J = 4,0 Hz, 1H).
- Beispiele 3 und 4 (
3 ) - Herstellung der Verbindungen 10a und 10b: Allgemeines Verfahren zur Oxidation des Schwefels an der Position 3 der Verbindung 8a und 8b zur Herstellung der entsprechenden Sulfone an der Position 3 (10a und 10b).
- Zu einer Lösung des Sulfids (8a oder 8b, 0,1 mmol) in CH2Cl2 (5 ml) wird mCPBA (0,4 mmol) gegeben und das Reaktionsgemisch wird bei Raumtemperatur gerührt, bis die Reaktion vollständig ist (mittels TLC verfolgt, etwa 8 h). Die Reaktion wird dann durch die Zugabe einer gesättigten Lösung aus NaHSO3 gestoppt. Die Phasen werden getrennt und die wässrige Phase wird mit einer zusätzlichen Portion an CH2Cl2 (1 × 20 ml) extrahiert. Die vereinigten organischen Phasen werden mit NaHCO3 (1 × 20 ml), Wasser (1 × 20 ml) und Kochsalzlösung (1 × 20 ml) gewaschen. Die organische Phase wird dann über Na2SO4 getrocknet, unter Vakuum konzentriert und durch Blitzchromatographie (Silicagel) gereinigt.
Diphenylmethyl-1,1-dioxo-3-methylsulfonyl-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (10a) Ausbeute: 81 %. 1H NMR (CDCl3, 400 MHz) δ 2,81 (s, 3H), 3,84 (d, J = 18,5 Hz, 1H), 4,34 (d, J = 18,5 Hz, 1H), 6,08 (s, 1H), 7,03 (s, 1H), 7,43–7,3 (m, 13H), 7,74 (t von d, J = 1,6 Hz und 7,7 Hz, 1H), 8,69 (d, J = 4 Hz, 1H).
Diphenylmethyl-1,1-dioxo-3-phenylsulfonyl-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (10b) Ausbeute: 75 %. 1H NMR (CDCl3, 400 MHz) δ 3,48 (d, J = 18 Hz, 1H), 4,16 (d, J = 18 Hz, 1H), 5,94 (s, 1H), 7,05 (s, 1H), 7,44–7,19 (m, 17H), 7,75–7,71 (m, 2H), 8,61 (d, J = 4 Hz, 1H). - Herstellung der Verbindungen 11a und 11b: Die Verbindungen 11a und 11b werden aus den Verbindungen 10a und 10b gemäß des für die Schutzgruppenabspaltung der Benzhydrylester oben beschriebenen Allgemeinen Verfahrens, hergestellt.
- Beispiel 3: Natrium-1,1-dioxo-3-methylsulfonyl-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (11a). Die Herstellung erfolgt aus dem Ester 10a gemäß des für die Schutzgruppenabspaltung der Benzhydrylester oben beschriebenen Allgemeinen Verfahrens.
-
- 1H NMR (D2O, 400 MHz) δ: 3,2 (s, 3H), 4,53 (d, J = 17,6 Hz, 1H), 4,32 (d, J = 17,6 Hz, 1H), 6,41 (s, 1H), 7,49–7,40 (m, 1H), 7,66–7,58 (m, 2H), 7,86 (t von d, J = 1,6 und 7,6 Hz, 1H), 8,60 (d, J = 4,0 Hz, 1H),
- Beispiel 4: Natrium-1,1-dioxo-3-phenylsulfonyl-7-(2'-pyridylmethylidin)-3-cephem-4-carboxylat (11b). Die Herstellung erfolgt aus dem Ester 10b gemäß des für die Schutzgruppenabspaltung der Benzhydrylester oben beschriebenen Allgemeinen Verfahrens.
-
- 1H NMR (D2O, 400 MHz) δ: 6,33 (s, 1H), 7,40–7,39 (m, 1H), 7,62–7,54 (m, 6H), 7,71 (m, 1H), 7,83 (t von d, J = 1,6 und 7,6 Hz, 1H), 8,55 (d, J = 4,0 Hz, 1H).
- Die obigen Formulierungen können gemäß den im pharmazeutischen Fachgebiet gut bekannten herkömmlichen Verfahren erhalten werden. "β-Lactamantibiotikum" kann jede Verbindung sein, die antibiotische Eigenschaften aufweist (beispielsweise Amoxicillin, Piperacillin, Ampicillin, Ceftizoxim, Cefotaxim, Cefuroxim, Cephalexin, Cefaclor, Cephaloridin oder Ceftazidin). Ebenso werden spezifische Mengen an "Verbindung X" und "β-Lactamantibiotikum" in den oben angegebenen Beispielen gezeigt, dabei ist es selbstverständlich, dass die Verbindungen in jedem Verhältnis vorliegen können, in dem die schließliche Formulierung die gewünschten Antibiotikumeigenschaften aufweist.
Claims (12)
- Verbindung der Formel (I) worin R1 und R2 jeweils unabhängig stehen für Wasserstoff, (C1-C10)-Alkyl, (C2-C10)-Alkenyl, (C2-C10)-Alkinyl, (C3-C8)-Cycloalkyl, (C1-C10)-Alkoxy, (C1-C10)-Alkanoyl, (C1-C10)-Alkanoyloxy, (C1-C10)-Alkoxycarbonyl, Aryl, Heterocyclyl, Halogen, Cyano, Nitro, -COORe, -C(=O)NRfRg, -OC(=O)NRfRg, NRfRg oder -S(O)nRh, R3 für -S(O)nRh steht, R4 für Wasserstoff steht, A für Thio, Sulfinyl oder Sulfonyl steht, jedes n unabhängig für 0, 1 oder 2 steht, jedes Re unabhängig für Wasserstoff oder (C1-C10)Alkyl steht, jedes Rf und Rg unabhängig für Wasserstoff, (C1-C10)-Alkyl, (C1-C10)-Alkoxy, Phenyl, Benzyl, Phenethyl, (C1-C10)-Alkanoyl oder -C(=O)NRfRg steht, worin Rf und Rg einen Ring bilden, der optional ein Stickstoffatom im Ring -NRe- enthält, jedes Rh unabhängig für (C1-C10)-Alkyl oder Aryl steht, und worin jedes (C1-C10)-Alkyl, (C2-C10)-Alkenyl, (C2-C10)-Alkinyl, (C3-C8)-Cycloalkyl, (C1-C10)-Alkoxy, (C1-C10)-Alkanoyl, (C1-C10)-Alkanoyloxy oder (C1-C10)-Alkoxycarbonyl von R1 oder R2 optional substituiert ist durch einen oder mehrere Substituenten, die unabhängig ausgewählt sind aus Halogen, Hydroxy, Cyano, Cyanato, Nitro, Mercapto, Oxo, Aryl, Heterocyclyl, (C2-C6)-Alkenyl, (C2-C6)-Alkinyl, (C1-C6)-Alkoxy, (C1-C6)-Alkanoyl, (C1-C6)-Alkanoyloxy, Aryl-(C1-C6)-alkanoyloxy, Halogen-(C1-C6)-alkanoyloxy, Heterocyclyl-(C1-C6)-alkanoyloxy, Aryloxy, (Heterocyclyl)oxy, (C3-C8)-Cycloalkyl, -COORe, -C(=O)NRfRg oder- OC(=O)NRfRg, worin Heterocyclyl für ein 6 bis 10 gliedriges ungesättigtes oder gesättigtes mono-, di- oder tricyclisches Ringsystem steht, das Kohlenstoffatome und 1, 2, 3 oder 4 Heteroatome enthält, die aus der Gruppe ausgewählt sind, welche besteht aus nicht peroxidischem Sauerstoff, Schwefel und N(X), worin jedes X fehlt oder für H, O, (C1-C4)-Alkyl, Phenyl oder Benzyl steht, worin Aryl für einen Phenylrest oder einen ortho-verschmolzenenen bicyclischen carbocyclischen Rest mit neun bis zehn Ringatomen steht, worin wenigstens ein Ringatom aromatisch ist, und worin jedes Aryl optional substituiert ist durch einen oder mehrere Substituenten, die unabhängig ausgewählt sind aus Halogen, Hydroxy, Cyano, Trifluormethyl, Nitro, Trifluormethoxy, (C1-C6)-Alkyl, (C1-C6)-Alkanoyl, (C1-C6)-Alkanoyloxy, (C1-C6)-Alkoxycarbonyl, -COORe, -C(=O)NRfRg oder- OC(=O)NRfRg oder ein pharmazeutisch annehmbares Salz hiervon.
- Verbindung nach Anspruch 1, worin R1 für Aryl, Heterocyclyl oder -COORe steht.
- Verbindung nach Anspruch 1, worin R1 für 2-Pyridyl oder -COORe steht.
- Verbindung nach Anspruch 1, worin R2 für Wasserstoff steht.
- Verbindung nach Anspruch 1, worin A für Sulfonyl steht.
- Verbindung nach Anspruch 1, worin A für Sulfonyl steht, R1 für 2-Pyridyl, Carboxy oder tert-Butoxycarbonyl steht, R2 für Wasserstoff steht und R3 für -SPh oder -SO2Ph steht, oder ein pharmazeutisch annehmbares Salz hiervon.
- Pharmazeutische Zusammensetzung, die eine Verbindung nach einem der Ansprüche 1 bis 6 oder ein pharmazeutisch annehmbares Salz hiervon und einen pharmazeutisch annehmbaren Träger enthält.
- Zusammensetzung nach Anspruch 7, die weiter ein β-Lactamantibiotikum enthält.
- Verwendung einer Verbindung nach einem der Ansprüche 1 bis 6 bei der Herstellung eines Arzneimittels zur Hemmung einer β-Lactamase in einem Säuger.
- Verwendung einer Verbindung nach einem der Ansprüche 1 bis 6 bei der Herstellung eines Arzneimittels zur Erhöhung der Aktivität eines β-Lactamantibiotikums in einem Säuger.
- Verwendung einer Verbindung nach einem der Ansprüche 1 bis 6 bei der Herstellung eines Arzneimittels zur Behandlung einer Bakterieninfektion bei einem Säuger, die gegen ein β-Lactam resistent ist.
- Verbindung nach einem der Ansprüche 1 bis 6 zur Verwendung bei einer medizinischen Therapie.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US30740301P | 2001-07-24 | 2001-07-24 | |
| US307403P | 2001-07-24 | ||
| PCT/US2002/023613 WO2003020732A2 (en) | 2001-07-24 | 2002-07-24 | 7-alkylidene-3-substituted-3-cephem-4-carboxylates as beta-lactamase inhibitors. |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE60214740D1 DE60214740D1 (en) | 2006-10-26 |
| DE60214740T2 true DE60214740T2 (de) | 2007-10-04 |
Family
ID=23189607
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE60214740T Expired - Fee Related DE60214740T2 (de) | 2001-07-24 | 2002-07-24 | 3-substituierte 7-alkylidene-3-cephem-4-carbonsäuren als beta-lactamase inhibitoren |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US6916801B2 (de) |
| EP (1) | EP1430060B1 (de) |
| JP (1) | JP2005502687A (de) |
| AT (1) | ATE339424T1 (de) |
| AU (1) | AU2002353768A1 (de) |
| CA (1) | CA2454413A1 (de) |
| DE (1) | DE60214740T2 (de) |
| ES (1) | ES2272795T3 (de) |
| WO (1) | WO2003020732A2 (de) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2178301T3 (es) | 1997-12-29 | 2002-12-16 | Res Corp Technologies Inc | Derivados del acido penicilanico 2-beta-sustituido-6-alquilideno como inhibidores de la beta-lactama. |
| US6407091B1 (en) | 1999-04-15 | 2002-06-18 | Research Corporation Technologies, Inc. | β-lactamase inhibiting compounds |
| US6544555B2 (en) | 2000-02-24 | 2003-04-08 | Advancis Pharmaceutical Corp. | Antibiotic product, use and formulation thereof |
| US20020068078A1 (en) | 2000-10-13 | 2002-06-06 | Rudnic Edward M. | Antifungal product, use and formulation thereof |
| AU2002353768A1 (en) | 2001-07-24 | 2003-03-18 | Alamx, L.L.C. | 7-alkylidene-3-substituted-3-cephem-4-carboxylates as beta-lactamase inhibitors. |
| US7022691B2 (en) | 2002-04-04 | 2006-04-04 | John D. Buynak | Inhibitors of serine and metallo-β-lactamases |
| US7833998B2 (en) * | 2003-08-25 | 2010-11-16 | Revaax Pharmaceuticals, Llc | Oral neurotherapeutic cephalosporin sulfoxide and sulfone-containing compositions |
| US8299051B2 (en) * | 2008-05-13 | 2012-10-30 | Southern Methodist University | Beta-lactamase inhibitory compounds |
| KR20110095898A (ko) | 2008-11-20 | 2011-08-25 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 유기 화합물의 플루오르화 |
| EP2697204B1 (de) | 2011-04-12 | 2017-03-08 | President and Fellows of Harvard College | Fluorierung organischer verbindungen |
| US9273083B2 (en) | 2012-09-26 | 2016-03-01 | President And Fellows Of Harvard College | Nickel fluorinating complexes and uses thereof |
| CN103387584B (zh) * | 2013-07-17 | 2015-02-25 | 盐城开元医药化工有限公司 | 一种7-氨基-3-氯-3-头孢环-4-羧酸的合成方法 |
| WO2015058047A2 (en) | 2013-10-18 | 2015-04-23 | President And Fellows Of Harvard College | Fluorination of organic compounds |
| CN105254648B (zh) * | 2015-11-13 | 2018-04-03 | 广东温氏大华农生物科技有限公司 | 一种头孢维星及其钠盐的合成方法 |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4053468A (en) | 1976-02-25 | 1977-10-11 | Smithkline Corporation | Process for preparing 7-oxo cephalosporins and 6-oxo penicillins |
| IT1193922B (it) | 1979-02-24 | 1988-08-31 | Erba Farmitalia | Agenti antibatterici ed inibitori di beta -lattamasi e loro preparazione |
| ZA80993B (en) | 1979-02-24 | 1981-02-25 | Erba Farmitalia | -lactam-containing antibacterial agents and -lactamase inhibitors and preparation thereof |
| GB2076812A (en) | 1980-05-22 | 1981-12-09 | Ciba Geigy Ag | Penam-dioxide compounds, processes for their manufacture, and their use |
| DE3173613D1 (en) | 1980-07-04 | 1986-03-13 | Fujisawa Pharmaceutical Co | 7-oxo-cephalosporins and 6-oxo-penicillins, their analogues and process for their preparation |
| CA1180005A (en) | 1980-10-24 | 1984-12-27 | Solange Adam-Molina | .beta.-LACTAMS |
| ZA826687B (en) | 1981-09-14 | 1983-07-27 | Pfizer | Beta-lactamase inhibiting 2-beta-substituted-2-alpha-methyl 5(r)penam-3-alpha-carboxylic acid 1,1-dioxides and intermediates therefor |
| US4559157A (en) | 1983-04-21 | 1985-12-17 | Creative Products Resource Associates, Ltd. | Cosmetic applicator useful for skin moisturizing |
| LU84979A1 (fr) | 1983-08-30 | 1985-04-24 | Oreal | Composition cosmetique ou pharmaceutique sous forme aqueuse ou anhydre dont la phase grasse contient un polyether oligomere et polyethers oligomeres nouveaux |
| PT79893B (en) | 1984-01-30 | 1987-02-03 | Pfizer | Process for preparing 6-(substituted)methylenepenicillanic and 6-(substituted)hydroxymethylpenicilanic and derivatives thereof |
| US4826833A (en) | 1984-01-30 | 1989-05-02 | Pfizer Inc. | 6-(Substituted)methylene-penicillanic and 6-(substituted)hydroxymethylpenicillanic acids and derivatives thereof |
| DE3584015D1 (de) | 1984-01-30 | 1991-10-17 | Pfizer | 6-(substituierte) methylen-penicillansaeure und 6-(substituierte) hydroxymethyl-penicillansaeure und deren derivate. |
| EP0170192B1 (de) | 1984-07-30 | 1992-05-13 | Merck & Co. Inc. | Penicillin-Derivate als entzündungshemmende und degenerierungskämpfende Arzneimittel |
| JPS62198687A (ja) | 1986-02-27 | 1987-09-02 | Taiho Yakuhin Kogyo Kk | 2β−置換チオメチルペニシリン誘導体 |
| US4861768A (en) | 1986-02-27 | 1989-08-29 | Taiho Pharmaceutical Company, Limited | 2 β-substituted thiomethylpenicillin derivatives and their preparation and use |
| US4820508A (en) | 1987-06-23 | 1989-04-11 | Neutrogena Corporation | Skin protective composition |
| JP2603082B2 (ja) | 1987-09-07 | 1997-04-23 | 大塚化学株式会社 | ペニシラン酸誘導体の製造法 |
| US4992478A (en) | 1988-04-04 | 1991-02-12 | Warner-Lambert Company | Antiinflammatory skin moisturizing composition and method of preparing same |
| US4938949A (en) | 1988-09-12 | 1990-07-03 | University Of New York | Treatment of damaged bone marrow and dosage units therefor |
| IT1227462B (it) | 1988-11-04 | 1991-04-11 | Glaxo Spa | Procedimento di preparazione di 6-ossopenicillanati |
| TW383308B (en) | 1993-08-24 | 2000-03-01 | Hoffmann La Roche | 2-beta-alkenyl penam sulfones as beta-lactamase inhibitors |
| US5597817A (en) | 1994-12-09 | 1997-01-28 | Southern Methodist University | 7-vinylidene cephalosporins and methods of using the same |
| US5629306A (en) * | 1994-12-09 | 1997-05-13 | Research Corporation Technologies, Inc. | 7-alkylidene cephalosporanic acid derivatives and methods of using the same |
| US5760027A (en) | 1996-12-06 | 1998-06-02 | Research Corporation Technologies, Inc. | Use of 7-alkylidene cephalosporins to inhibit elastase activity |
| ES2178301T3 (es) | 1997-12-29 | 2002-12-16 | Res Corp Technologies Inc | Derivados del acido penicilanico 2-beta-sustituido-6-alquilideno como inhibidores de la beta-lactama. |
| AU773013B2 (en) | 1999-04-15 | 2004-05-13 | Research Corporation Technologies, Inc. | Beta-lactamase inhibiting compounds |
| US6391855B1 (en) * | 1999-06-02 | 2002-05-21 | Adherex Technologies, Inc. | Compounds and methods for modulating junctional adhesion molecule-mediated functions |
| AU2002353768A1 (en) * | 2001-07-24 | 2003-03-18 | Alamx, L.L.C. | 7-alkylidene-3-substituted-3-cephem-4-carboxylates as beta-lactamase inhibitors. |
-
2002
- 2002-07-24 AU AU2002353768A patent/AU2002353768A1/en not_active Abandoned
- 2002-07-24 AT AT02789149T patent/ATE339424T1/de not_active IP Right Cessation
- 2002-07-24 US US10/202,405 patent/US6916801B2/en not_active Expired - Fee Related
- 2002-07-24 JP JP2003525002A patent/JP2005502687A/ja active Pending
- 2002-07-24 DE DE60214740T patent/DE60214740T2/de not_active Expired - Fee Related
- 2002-07-24 EP EP02789149A patent/EP1430060B1/de not_active Expired - Lifetime
- 2002-07-24 ES ES02789149T patent/ES2272795T3/es not_active Expired - Lifetime
- 2002-07-24 WO PCT/US2002/023613 patent/WO2003020732A2/en not_active Ceased
- 2002-07-24 CA CA002454413A patent/CA2454413A1/en not_active Abandoned
-
2005
- 2005-05-10 US US11/126,061 patent/US7488724B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| ATE339424T1 (de) | 2006-10-15 |
| WO2003020732A3 (en) | 2003-05-22 |
| US20060074065A1 (en) | 2006-04-06 |
| CA2454413A1 (en) | 2003-03-13 |
| WO2003020732A2 (en) | 2003-03-13 |
| EP1430060B1 (de) | 2006-09-13 |
| AU2002353768A1 (en) | 2003-03-18 |
| US6916801B2 (en) | 2005-07-12 |
| US7488724B2 (en) | 2009-02-10 |
| EP1430060A2 (de) | 2004-06-23 |
| JP2005502687A (ja) | 2005-01-27 |
| DE60214740D1 (en) | 2006-10-26 |
| US20030092696A1 (en) | 2003-05-15 |
| ES2272795T3 (es) | 2007-05-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE60214740T2 (de) | 3-substituierte 7-alkylidene-3-cephem-4-carbonsäuren als beta-lactamase inhibitoren | |
| DE69103490T2 (de) | Cephalosporinderivate mit in der Lage 3 eine Thioalkylthiogruppe. | |
| EP0251330B1 (de) | Cephalosporinderivate, Verfahren zu ihrer Herstellung sowie entsprechende pharmazeutische Präparate | |
| US20060178357A1 (en) | Chphalosporin-derived mercaptans as inhibitors of serine and metallo-beta-lactamases | |
| EP0640607B1 (de) | 2-Beta-Alkenyl-penem-Sulfonverbindungen als beta- Lactamase-Hemmer | |
| DE69805975T2 (de) | 2-beta-substituierte-6-alkylidenpenizillansäure-derivate als beta-laktamase inhibitoren | |
| DE3789720T2 (de) | Cephalosporinverbindungen. | |
| DE60029023T2 (de) | Beta-Lactamase hemmende Verbindungen | |
| DE69532820T2 (de) | 7-alkyliden cephalosporansäuren und deren verwendungen | |
| DE69532032T2 (de) | Pharmazeutische formulierung, die ein beta-lactamase hemmendes penem in kombination mit einem beta-laktam-antibiotikum enthalten und ihre verwendung zur behandlung von bakteriellen infektionen | |
| DE69230415T2 (de) | Cephalosporinverbindungen und ihre pharmazeutische Präparate | |
| AT395590B (de) | 2-methoxymethylpenemverbindungen, verfahren zu deren herstellung und sie enthaltende pharmazeutische zusammensetzungen | |
| DE3882676T2 (de) | 6-(substituiertes methylen)peneme. | |
| EP0322810A2 (de) | Cephalosporinderivate | |
| DE2715038A1 (de) | Neue antibakterielle verbindungen | |
| DE3833693A1 (de) | Stabile oxapenem-3-carbonsaeuren und ihre verwendung als ss-lactamasehemmer | |
| DE3888127T2 (de) | 6-(Substituiertes Methylen)peneme. | |
| US6407091B1 (en) | β-lactamase inhibiting compounds | |
| DD149528A5 (de) | Verfahren zur herstellung von neuen beta-lactam-verbindungen | |
| US20030216372A1 (en) | Inhibitors of serine and metallo-beta-lactamases | |
| DE2710979A1 (de) | Lactame, verfahren zu ihrer herstellung und diese verbindungen enthaltende mittel | |
| DE2846713A1 (de) | Cephalosporine, ihre herstellung und sie enthaltende arzneimittel | |
| EP1359153B1 (de) | Beta-Lactamase hemmende Verbindungen | |
| DE2409949A1 (de) | Penicillansaeure- und cephalosporansaeure-derivate, verfahren zu deren herstellung und diese verbindungen enthaltende antibaktericide zubereitungen | |
| DE3200427A1 (de) | Neue organische verbindung, verfahren zu ihrer herstellung und ihre verwendung |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8328 | Change in the person/name/address of the agent |
Representative=s name: KROHER, STROBEL RECHTS- UND PATENTANWAELTE, 80336 |
|
| 8339 | Ceased/non-payment of the annual fee |