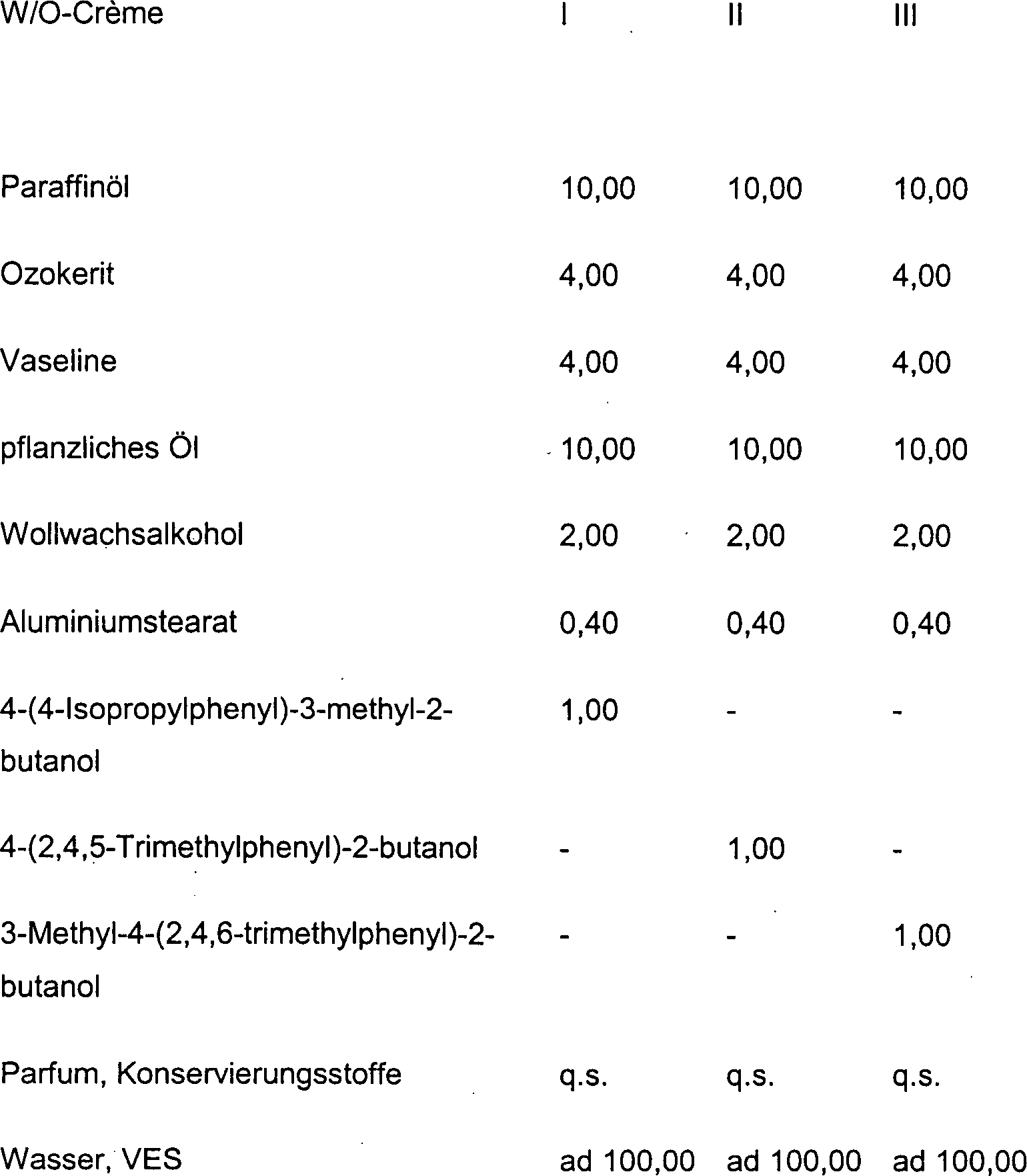
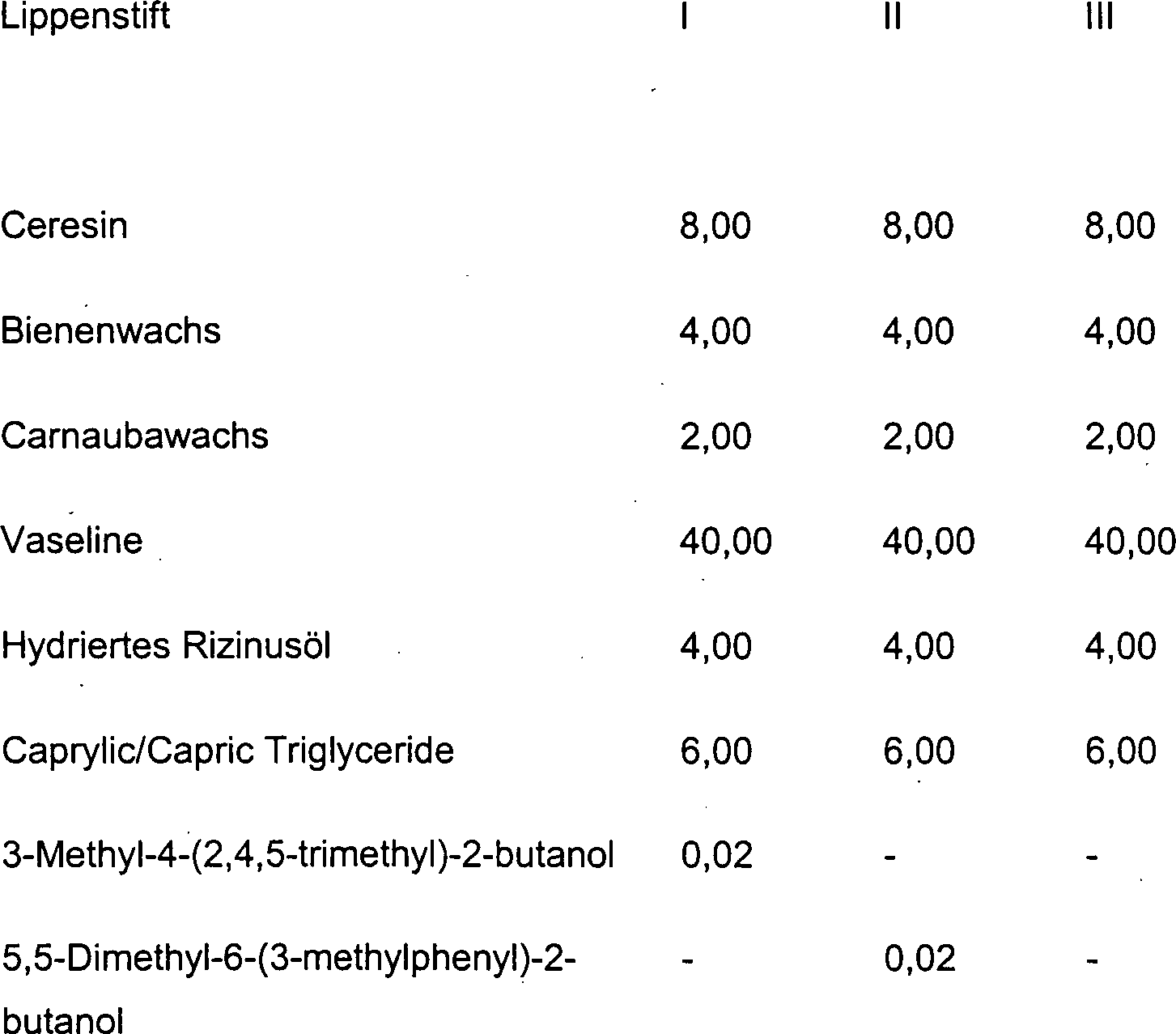
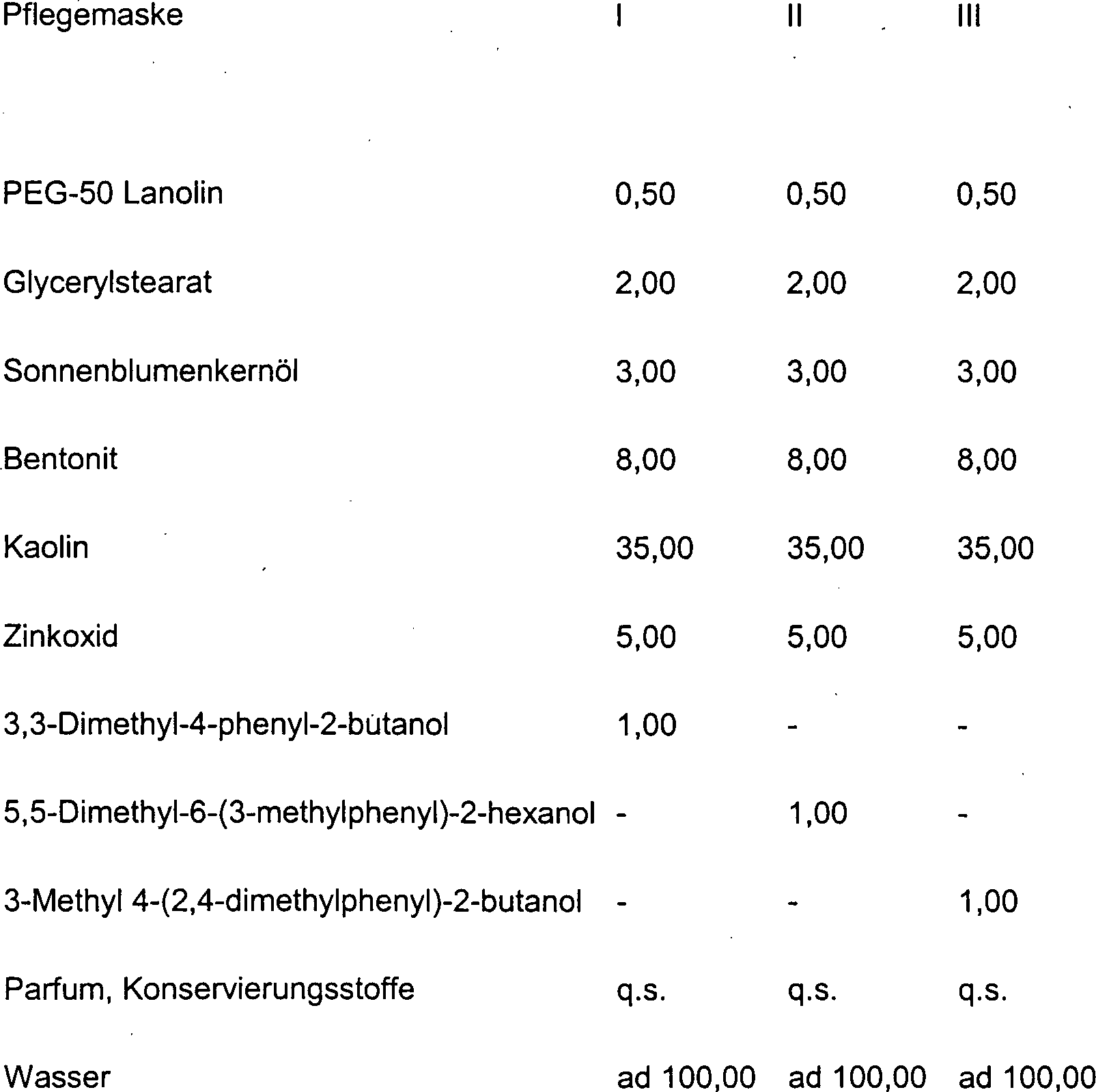
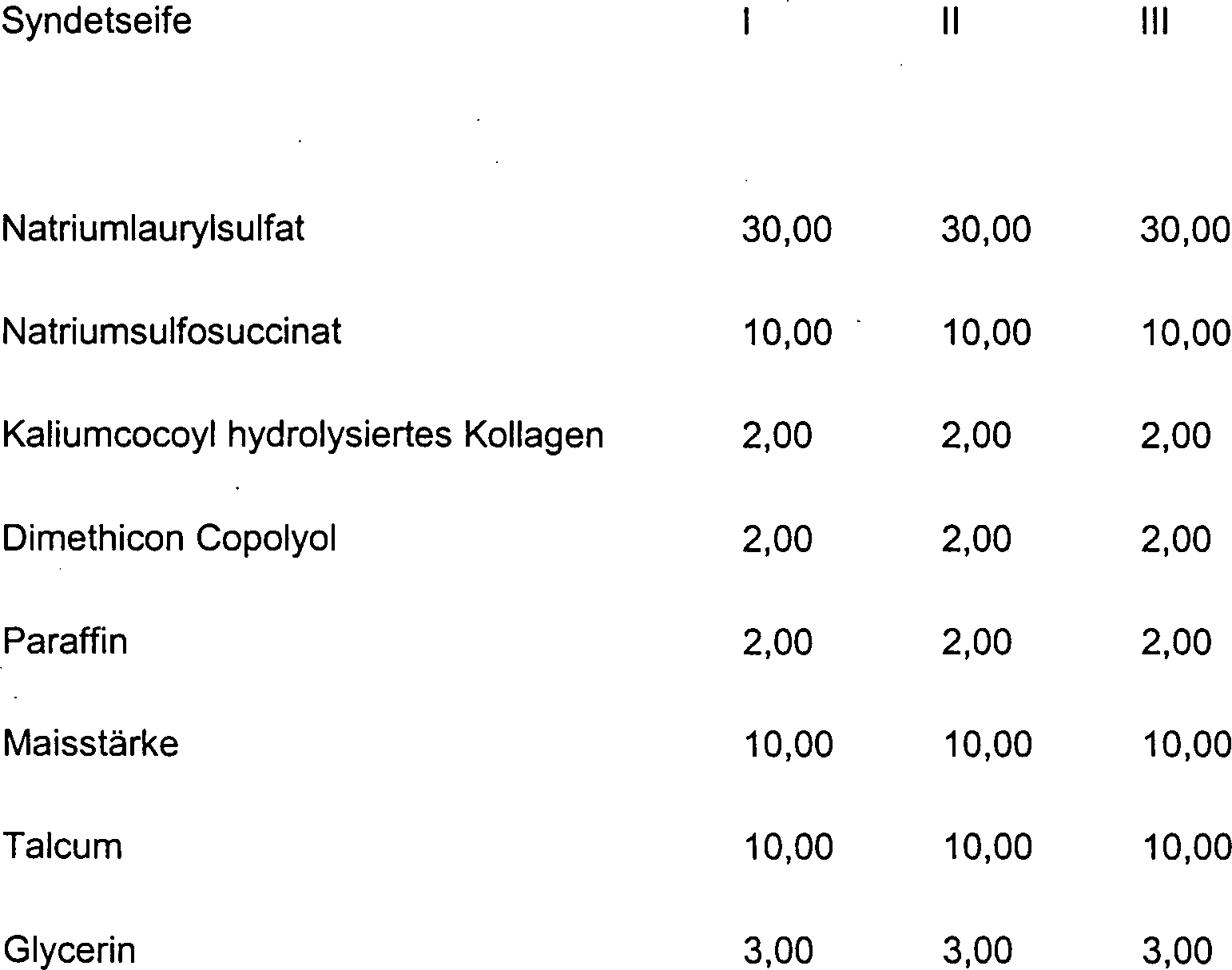
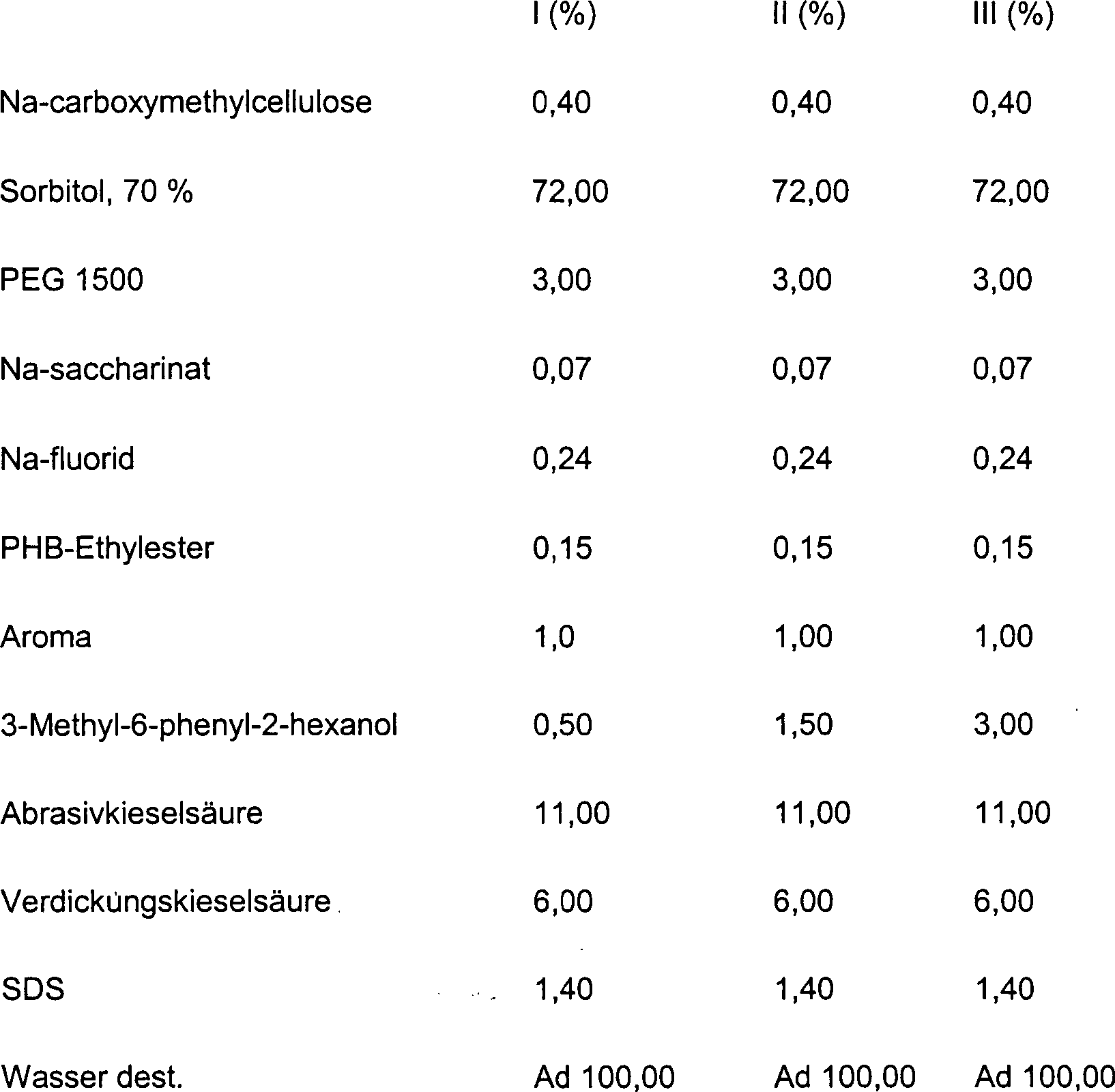
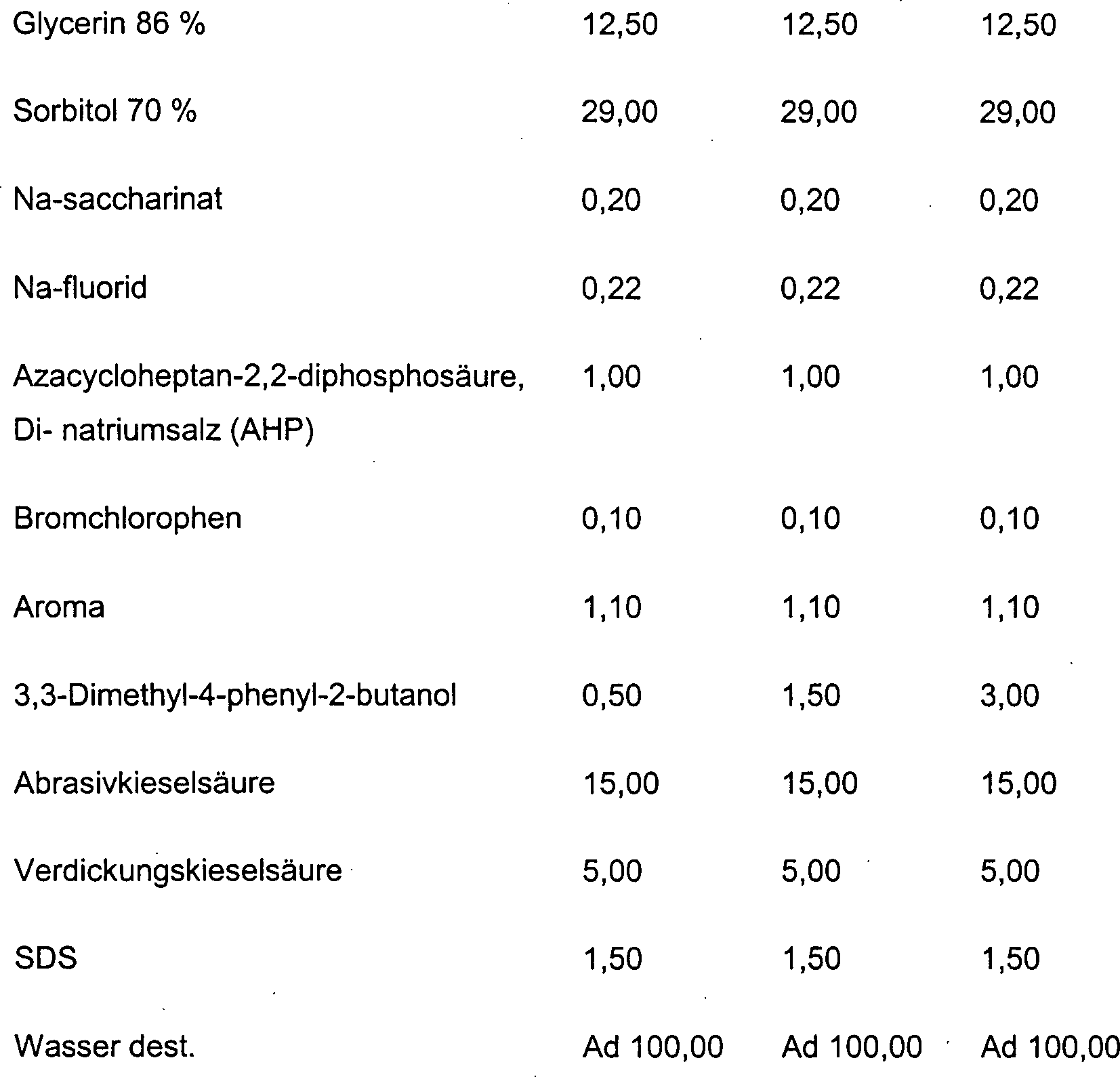
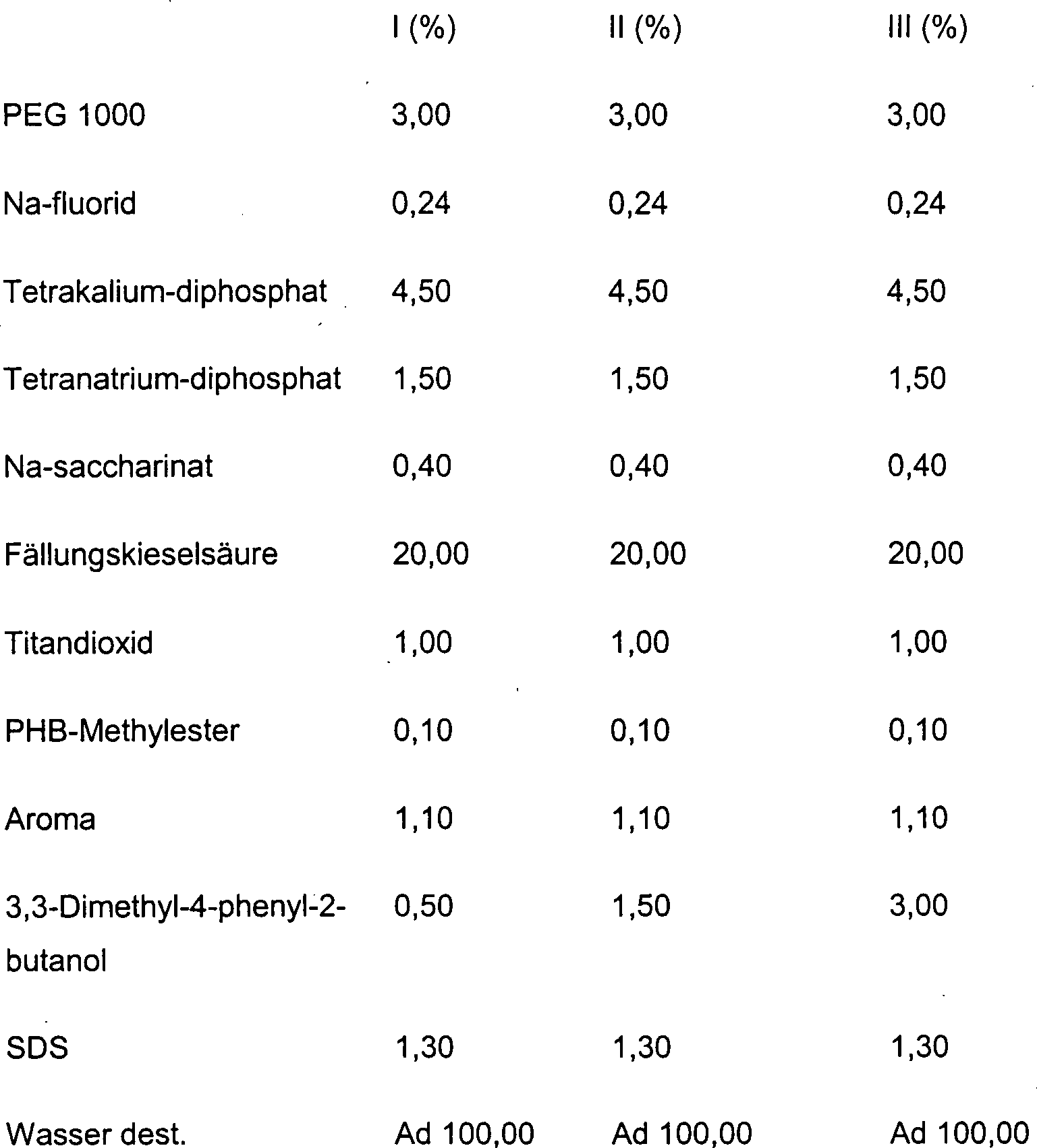
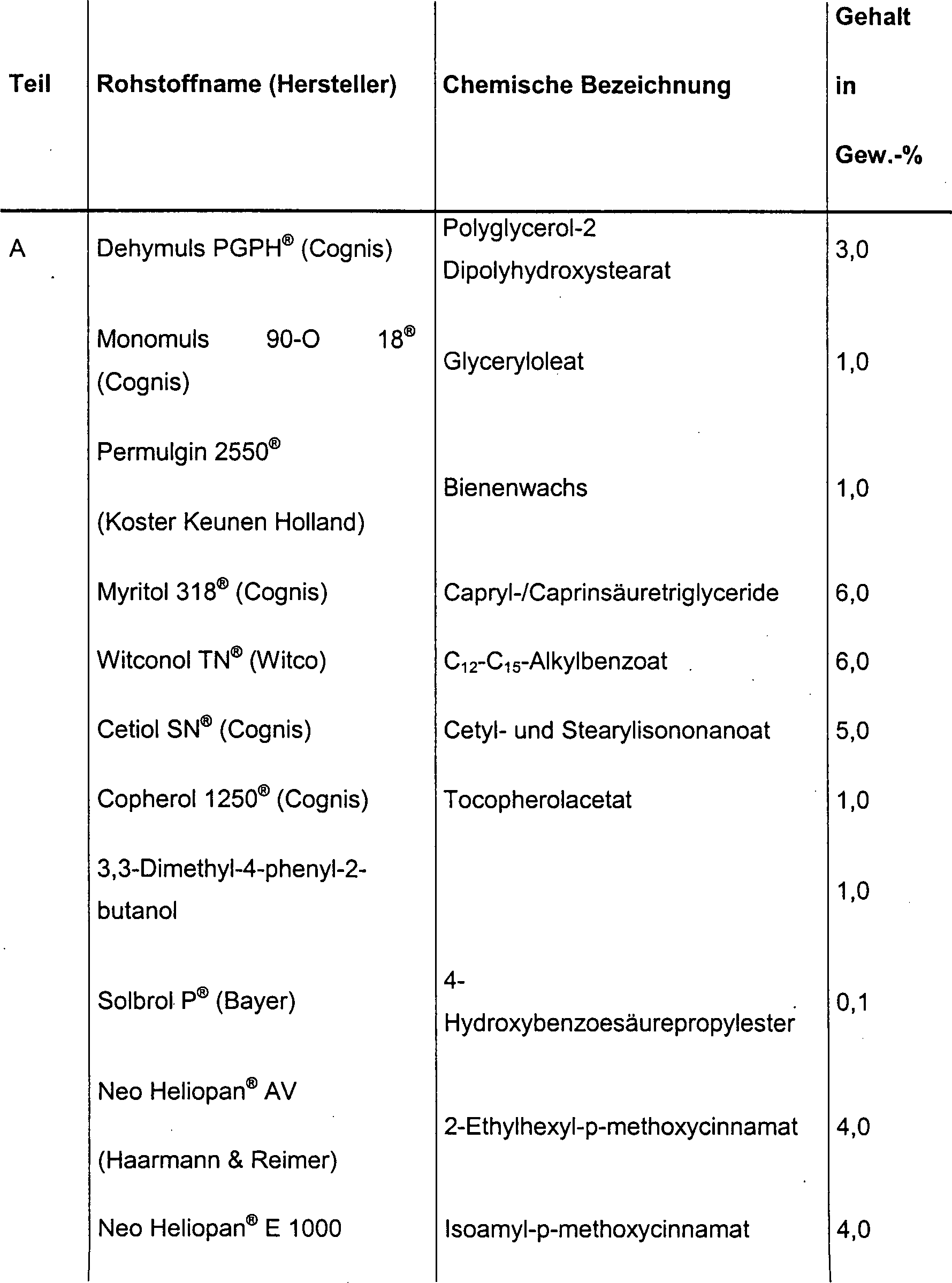
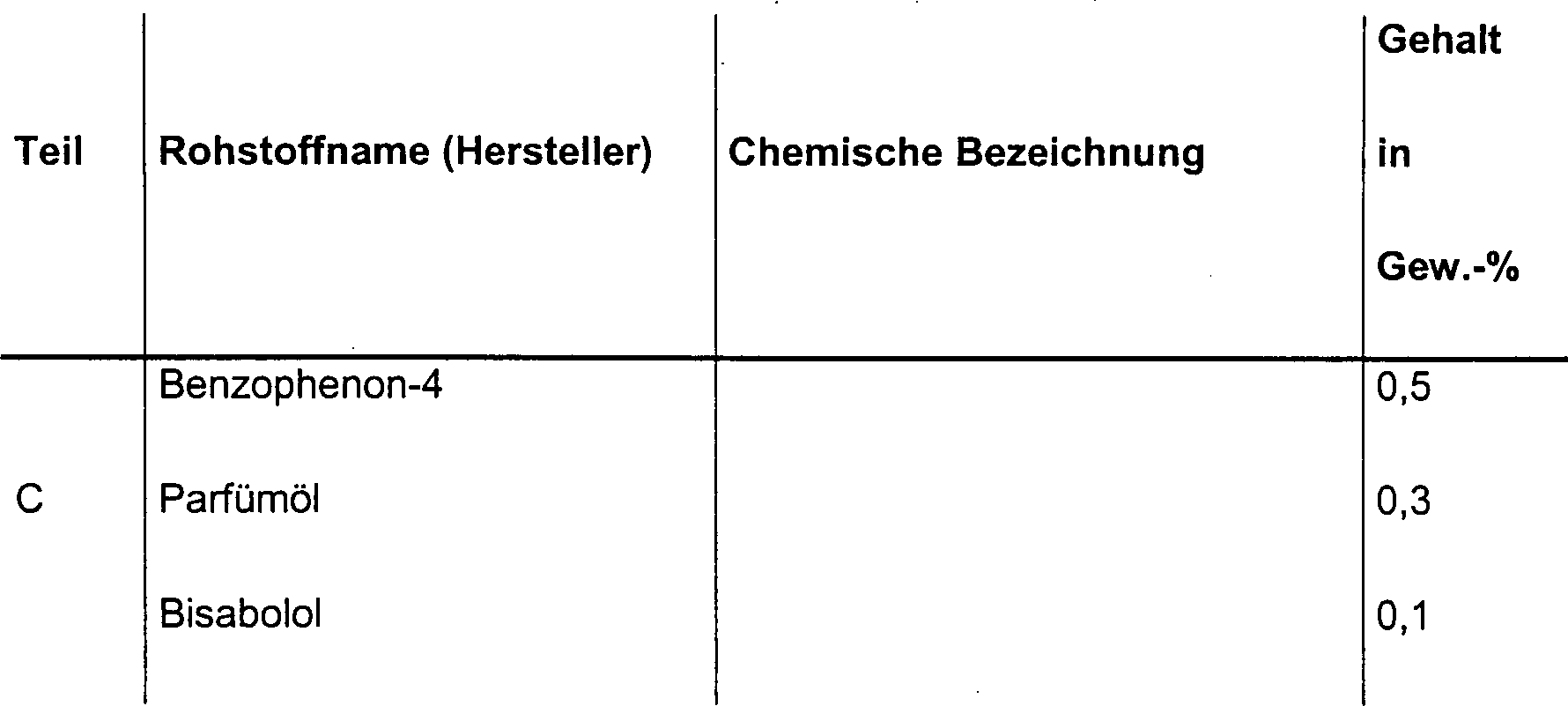
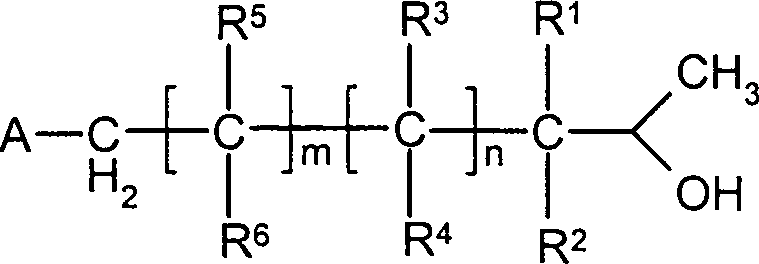
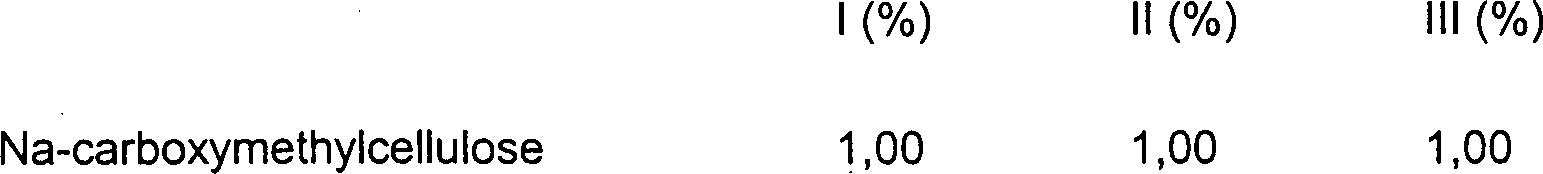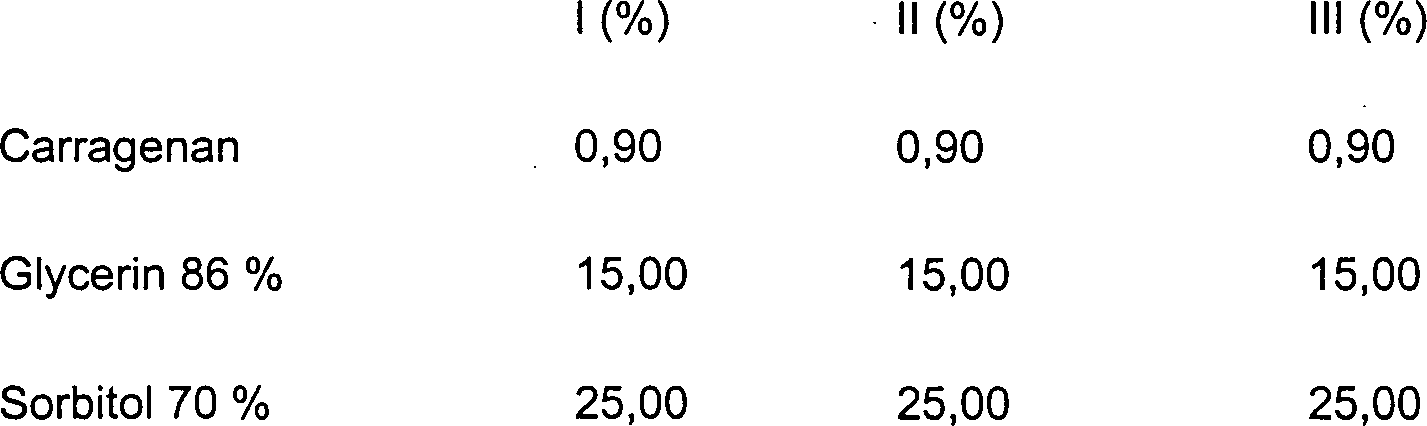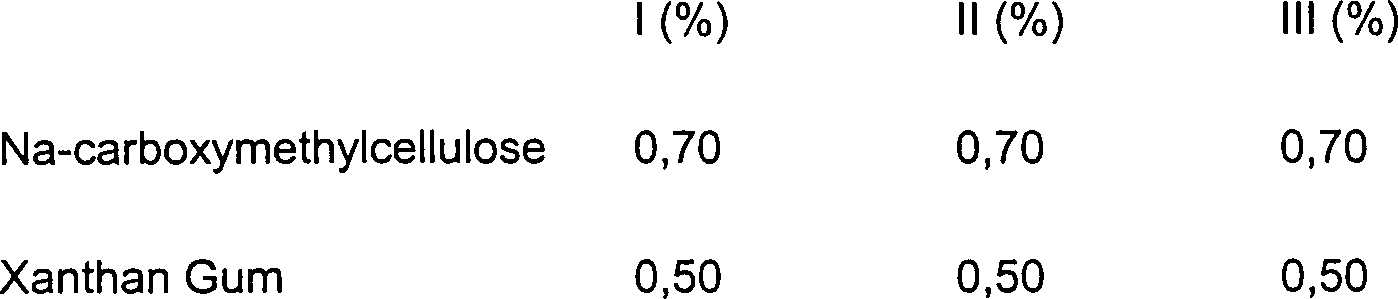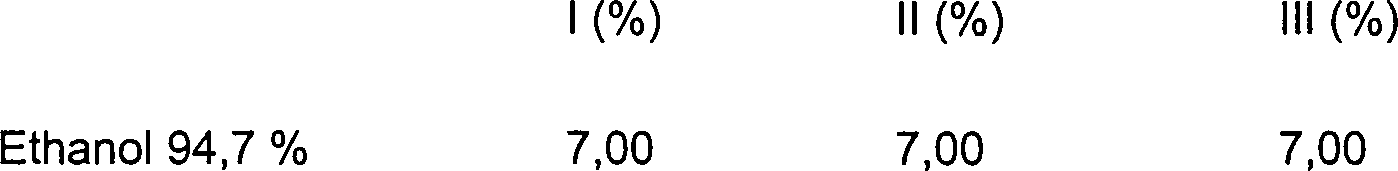DE10330697A1 - Sekundäre Alkohole als antimikrobielle Wirkstoffe - Google Patents
Sekundäre Alkohole als antimikrobielle Wirkstoffe Download PDFInfo
- Publication number
- DE10330697A1 DE10330697A1 DE2003130697 DE10330697A DE10330697A1 DE 10330697 A1 DE10330697 A1 DE 10330697A1 DE 2003130697 DE2003130697 DE 2003130697 DE 10330697 A DE10330697 A DE 10330697A DE 10330697 A1 DE10330697 A1 DE 10330697A1
- Authority
- DE
- Germany
- Prior art keywords
- compound
- gram
- formula
- butanol
- methyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 239000004599 antimicrobial Substances 0.000 title claims description 10
- 150000003333 secondary alcohols Chemical class 0.000 title description 21
- 150000001875 compounds Chemical class 0.000 claims abstract description 61
- 241000192125 Firmicutes Species 0.000 claims abstract description 36
- 239000004480 active ingredient Substances 0.000 claims abstract description 12
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims abstract description 8
- 239000001257 hydrogen Substances 0.000 claims abstract description 7
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 7
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 5
- 238000002360 preparation method Methods 0.000 claims description 60
- 239000000203 mixture Substances 0.000 claims description 48
- 239000002537 cosmetic Substances 0.000 claims description 31
- 206010006326 Breath odour Diseases 0.000 claims description 28
- 239000000126 substance Substances 0.000 claims description 22
- 241000894006 Bacteria Species 0.000 claims description 15
- 238000009472 formulation Methods 0.000 claims description 14
- 230000000845 anti-microbial effect Effects 0.000 claims description 13
- 238000000034 method Methods 0.000 claims description 8
- 208000002874 Acne Vulgaris Diseases 0.000 claims description 7
- 208000035985 Body Odor Diseases 0.000 claims description 7
- 206010040904 Skin odour abnormal Diseases 0.000 claims description 7
- 206010000496 acne Diseases 0.000 claims description 7
- 241001453443 Rothia <bacteria> Species 0.000 claims description 6
- BTANRVKWQNVYAZ-UHFFFAOYSA-N 2-butanol Substances CCC(C)O BTANRVKWQNVYAZ-UHFFFAOYSA-N 0.000 claims description 5
- DMIZIBWQMYRQRH-UHFFFAOYSA-N 3-methyl-4-(2,4,6-trimethylphenyl)butan-2-ol Chemical compound CC(O)C(C)CC1=C(C)C=C(C)C=C1C DMIZIBWQMYRQRH-UHFFFAOYSA-N 0.000 claims description 4
- ZARDVRFCJZLWGT-UHFFFAOYSA-N 3-methyl-4-(4-propan-2-ylphenyl)butan-2-ol Chemical compound CC(C)C1=CC=C(CC(C)C(C)O)C=C1 ZARDVRFCJZLWGT-UHFFFAOYSA-N 0.000 claims description 4
- DFROWHWEKZRSDU-UHFFFAOYSA-N 3-methyl-4-[4-(2-methylpropyl)phenyl]butan-2-ol Chemical compound CC(C)CC1=CC=C(CC(C)C(C)O)C=C1 DFROWHWEKZRSDU-UHFFFAOYSA-N 0.000 claims description 4
- KVBTVZIPYCAQPO-UHFFFAOYSA-N 4-(2,4,5-trimethylphenyl)butan-2-ol Chemical compound CC(O)CCC1=CC(C)=C(C)C=C1C KVBTVZIPYCAQPO-UHFFFAOYSA-N 0.000 claims description 4
- PXJIQFNNTRNCMA-UHFFFAOYSA-N 4-(2,4-dimethylphenyl)-3-methylbutan-2-ol Chemical compound CC(O)C(C)CC1=CC=C(C)C=C1C PXJIQFNNTRNCMA-UHFFFAOYSA-N 0.000 claims description 4
- AZHHTPCTRQWIEZ-UHFFFAOYSA-N 4-(2,4-dimethylphenyl)butan-2-ol Chemical compound CC(O)CCC1=CC=C(C)C=C1C AZHHTPCTRQWIEZ-UHFFFAOYSA-N 0.000 claims description 4
- RWXUXDSDYIZFKH-UHFFFAOYSA-N 4-(3,4-dimethylphenyl)-3-methylbutan-2-ol Chemical compound CC(O)C(C)CC1=CC=C(C)C(C)=C1 RWXUXDSDYIZFKH-UHFFFAOYSA-N 0.000 claims description 4
- TYAGLQZKFKQDIQ-UHFFFAOYSA-N 4-(3,4-dimethylphenyl)butan-2-ol Chemical compound CC(O)CCC1=CC=C(C)C(C)=C1 TYAGLQZKFKQDIQ-UHFFFAOYSA-N 0.000 claims description 4
- 241000186394 Eubacterium Species 0.000 claims description 4
- 206010061217 Infestation Diseases 0.000 claims description 3
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 claims description 2
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 claims description 2
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 claims description 2
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 claims description 2
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 claims description 2
- 241000186046 Actinomyces Species 0.000 claims description 2
- 241000186044 Actinomyces viscosus Species 0.000 claims description 2
- 241000186146 Brevibacterium Species 0.000 claims description 2
- 241000186162 Brevibacterium epidermidis Species 0.000 claims description 2
- 229940126657 Compound 17 Drugs 0.000 claims description 2
- 241000186216 Corynebacterium Species 0.000 claims description 2
- 241000186245 Corynebacterium xerosis Species 0.000 claims description 2
- 241000186427 Cutibacterium acnes Species 0.000 claims description 2
- 241000191946 Kytococcus sedentarius Species 0.000 claims description 2
- 241001180676 Lachnoanaerobaculum saburreum Species 0.000 claims description 2
- 241000192041 Micrococcus Species 0.000 claims description 2
- 241000191938 Micrococcus luteus Species 0.000 claims description 2
- 241001494429 Mogibacterium timidum Species 0.000 claims description 2
- 241000186429 Propionibacterium Species 0.000 claims description 2
- 241000157939 Rothia mucilaginosa Species 0.000 claims description 2
- 241000191940 Staphylococcus Species 0.000 claims description 2
- 241000191963 Staphylococcus epidermidis Species 0.000 claims description 2
- 241000192087 Staphylococcus hominis Species 0.000 claims description 2
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 claims description 2
- 241001494424 [Eubacterium] brachy Species 0.000 claims description 2
- 241001494431 [Eubacterium] nodatum Species 0.000 claims description 2
- 229940125797 compound 12 Drugs 0.000 claims description 2
- 229940126543 compound 14 Drugs 0.000 claims description 2
- 229940055019 propionibacterium acne Drugs 0.000 claims description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 40
- -1 norbornan-2-yl Chemical group 0.000 description 40
- 238000005481 NMR spectroscopy Methods 0.000 description 20
- 235000019645 odor Nutrition 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 16
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerol Natural products OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 15
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- 150000001298 alcohols Chemical class 0.000 description 11
- 150000002148 esters Chemical class 0.000 description 11
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 10
- 238000005160 1H NMR spectroscopy Methods 0.000 description 10
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 10
- 239000000839 emulsion Substances 0.000 description 10
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 230000000694 effects Effects 0.000 description 9
- 239000000499 gel Substances 0.000 description 9
- 150000003839 salts Chemical class 0.000 description 9
- 238000011282 treatment Methods 0.000 description 9
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 8
- 125000005037 alkyl phenyl group Chemical group 0.000 description 8
- 239000000194 fatty acid Substances 0.000 description 8
- 239000006210 lotion Substances 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- 125000001424 substituent group Chemical group 0.000 description 8
- 239000000654 additive Substances 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 239000002781 deodorant agent Substances 0.000 description 7
- 235000014113 dietary fatty acids Nutrition 0.000 description 7
- 229930195729 fatty acid Natural products 0.000 description 7
- 239000003921 oil Substances 0.000 description 7
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 6
- 208000032139 Halitosis Diseases 0.000 description 6
- 239000006096 absorbing agent Substances 0.000 description 6
- 239000000443 aerosol Substances 0.000 description 6
- 230000000844 anti-bacterial effect Effects 0.000 description 6
- 239000003963 antioxidant agent Substances 0.000 description 6
- 235000006708 antioxidants Nutrition 0.000 description 6
- 235000011187 glycerol Nutrition 0.000 description 6
- 230000009965 odorless effect Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 5
- 239000013543 active substance Substances 0.000 description 5
- 125000000129 anionic group Chemical group 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 239000007921 spray Substances 0.000 description 5
- 239000002562 thickening agent Substances 0.000 description 5
- 239000000606 toothpaste Substances 0.000 description 5
- GISVICWQYMUPJF-UHFFFAOYSA-N 2,4-Dimethylbenzaldehyde Chemical compound CC1=CC=C(C=O)C(C)=C1 GISVICWQYMUPJF-UHFFFAOYSA-N 0.000 description 4
- POQJHLBMLVTHAU-UHFFFAOYSA-N 3,4-Dimethylbenzaldehyde Chemical compound CC1=CC=C(C=O)C=C1C POQJHLBMLVTHAU-UHFFFAOYSA-N 0.000 description 4
- LROJZZICACKNJL-UHFFFAOYSA-N Duryl aldehyde Chemical compound CC1=CC(C)=C(C=O)C=C1C LROJZZICACKNJL-UHFFFAOYSA-N 0.000 description 4
- 150000002170 ethers Chemical class 0.000 description 4
- 150000004665 fatty acids Chemical class 0.000 description 4
- 239000000796 flavoring agent Substances 0.000 description 4
- 235000019634 flavors Nutrition 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 210000004400 mucous membrane Anatomy 0.000 description 4
- 235000013772 propylene glycol Nutrition 0.000 description 4
- 239000002453 shampoo Substances 0.000 description 4
- 229940034610 toothpaste Drugs 0.000 description 4
- 239000001993 wax Substances 0.000 description 4
- 239000011787 zinc oxide Substances 0.000 description 4
- HIKRJHFHGKZKRI-UHFFFAOYSA-N 2,4,6-trimethylbenzaldehyde Chemical compound CC1=CC(C)=C(C=O)C(C)=C1 HIKRJHFHGKZKRI-UHFFFAOYSA-N 0.000 description 3
- JLIZAYDEBJYVNP-UHFFFAOYSA-N 3-methyl-4-(2,4,5-trimethylphenyl)butan-2-ol Chemical compound CC(O)C(C)CC1=CC(C)=C(C)C=C1C JLIZAYDEBJYVNP-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 3
- 239000004904 UV filter Substances 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 230000000996 additive effect Effects 0.000 description 3
- 230000001476 alcoholic effect Effects 0.000 description 3
- 150000001299 aldehydes Chemical class 0.000 description 3
- RWZYAGGXGHYGMB-UHFFFAOYSA-N anthranilic acid Chemical compound NC1=CC=CC=C1C(O)=O RWZYAGGXGHYGMB-UHFFFAOYSA-N 0.000 description 3
- 244000052616 bacterial pathogen Species 0.000 description 3
- 235000015218 chewing gum Nutrition 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000005068 cooling lubricant Substances 0.000 description 3
- WTWBUQJHJGUZCY-UHFFFAOYSA-N cuminaldehyde Chemical compound CC(C)C1=CC=C(C=O)C=C1 WTWBUQJHJGUZCY-UHFFFAOYSA-N 0.000 description 3
- 230000006735 deficit Effects 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 238000001125 extrusion Methods 0.000 description 3
- 239000003925 fat Substances 0.000 description 3
- 235000019197 fats Nutrition 0.000 description 3
- 150000002191 fatty alcohols Chemical class 0.000 description 3
- 239000003205 fragrance Substances 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- 230000003020 moisturizing effect Effects 0.000 description 3
- BTFQKIATRPGRBS-UHFFFAOYSA-N o-tolualdehyde Chemical compound CC1=CC=CC=C1C=O BTFQKIATRPGRBS-UHFFFAOYSA-N 0.000 description 3
- 239000002304 perfume Substances 0.000 description 3
- 229920001296 polysiloxane Polymers 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 102000004196 processed proteins & peptides Human genes 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- LOIYMIARKYCTBW-UHFFFAOYSA-N urocanic acid Chemical compound OC(=O)C=CC1=CNC=N1 LOIYMIARKYCTBW-UHFFFAOYSA-N 0.000 description 3
- 150000003722 vitamin derivatives Chemical class 0.000 description 3
- CRDAMVZIKSXKFV-FBXUGWQNSA-N (2-cis,6-cis)-farnesol Chemical compound CC(C)=CCC\C(C)=C/CC\C(C)=C/CO CRDAMVZIKSXKFV-FBXUGWQNSA-N 0.000 description 2
- 239000000260 (2E,6E)-3,7,11-trimethyldodeca-2,6,10-trien-1-ol Substances 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 2
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 2
- ISDGWTZFJKFKMO-UHFFFAOYSA-N 2-phenyl-1,3-dioxane-4,6-dione Chemical compound O1C(=O)CC(=O)OC1C1=CC=CC=C1 ISDGWTZFJKFKMO-UHFFFAOYSA-N 0.000 description 2
- IAJOMAOJYMUXLS-UHFFFAOYSA-N 3-methyl-4-(2-methylphenyl)butan-2-ol Chemical compound CC(O)C(C)CC1=CC=CC=C1C IAJOMAOJYMUXLS-UHFFFAOYSA-N 0.000 description 2
- LXPWGAZYJHUWPM-UHFFFAOYSA-N 4-(2-methylpropyl)benzaldehyde Chemical compound CC(C)CC1=CC=C(C=O)C=C1 LXPWGAZYJHUWPM-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- BPYKTIZUTYGOLE-IFADSCNNSA-N Bilirubin Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1 BPYKTIZUTYGOLE-IFADSCNNSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 244000062730 Melissa officinalis Species 0.000 description 2
- 235000010654 Melissa officinalis Nutrition 0.000 description 2
- CQOVPNPJLQNMDC-UHFFFAOYSA-N N-beta-alanyl-L-histidine Natural products NCCC(=O)NC(C(O)=O)CC1=CN=CN1 CQOVPNPJLQNMDC-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- 239000007868 Raney catalyst Substances 0.000 description 2
- NPXOKRUENSOPAO-UHFFFAOYSA-N Raney nickel Chemical compound [Al].[Ni] NPXOKRUENSOPAO-UHFFFAOYSA-N 0.000 description 2
- 229910000564 Raney nickel Inorganic materials 0.000 description 2
- VYGQUTWHTHXGQB-FFHKNEKCSA-N Retinol Palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C VYGQUTWHTHXGQB-FFHKNEKCSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- ULUAUXLGCMPNKK-UHFFFAOYSA-N Sulfobutanedioic acid Chemical class OC(=O)CC(C(O)=O)S(O)(=O)=O ULUAUXLGCMPNKK-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- XEFQLINVKFYRCS-UHFFFAOYSA-N Triclosan Chemical compound OC1=CC(Cl)=CC=C1OC1=CC=C(Cl)C=C1Cl XEFQLINVKFYRCS-UHFFFAOYSA-N 0.000 description 2
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- 239000003082 abrasive agent Substances 0.000 description 2
- ANVAOWXLWRTKGA-XHGAXZNDSA-N all-trans-alpha-carotene Chemical compound CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1C(C)=CCCC1(C)C ANVAOWXLWRTKGA-XHGAXZNDSA-N 0.000 description 2
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 2
- 229940061720 alpha hydroxy acid Drugs 0.000 description 2
- 150000001280 alpha hydroxy acids Chemical class 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- 239000003212 astringent agent Substances 0.000 description 2
- 239000003788 bath preparation Substances 0.000 description 2
- BLFLLBZGZJTVJG-UHFFFAOYSA-N benzocaine Chemical compound CCOC(=O)C1=CC=C(N)C=C1 BLFLLBZGZJTVJG-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000000861 blow drying Methods 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 150000001746 carotenes Chemical class 0.000 description 2
- 235000005473 carotenes Nutrition 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 229940112822 chewing gum Drugs 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 229940000033 dermatological agent Drugs 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 238000004821 distillation Methods 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- UVCJGUGAGLDPAA-UHFFFAOYSA-N ensulizole Chemical compound N1C2=CC(S(=O)(=O)O)=CC=C2N=C1C1=CC=CC=C1 UVCJGUGAGLDPAA-UHFFFAOYSA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- RRAFCDWBNXTKKO-UHFFFAOYSA-N eugenol Chemical group COC1=CC(CC=C)=CC=C1O RRAFCDWBNXTKKO-UHFFFAOYSA-N 0.000 description 2
- 229930002886 farnesol Natural products 0.000 description 2
- 229940043259 farnesol Drugs 0.000 description 2
- 239000006260 foam Substances 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 150000002431 hydrogen Chemical class 0.000 description 2
- 238000005984 hydrogenation reaction Methods 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 239000001023 inorganic pigment Substances 0.000 description 2
- NNPPMTNAJDCUHE-UHFFFAOYSA-N isobutane Chemical compound CC(C)C NNPPMTNAJDCUHE-UHFFFAOYSA-N 0.000 description 2
- 125000000468 ketone group Chemical group 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000000865 liniment Substances 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 244000005706 microflora Species 0.000 description 2
- 210000000214 mouth Anatomy 0.000 description 2
- 210000002200 mouth mucosa Anatomy 0.000 description 2
- 239000002324 mouth wash Substances 0.000 description 2
- 239000002736 nonionic surfactant Substances 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- 125000003835 nucleoside group Chemical group 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- QUAMTGJKVDWJEQ-UHFFFAOYSA-N octabenzone Chemical compound OC1=CC(OCCCCCCCC)=CC=C1C(=O)C1=CC=CC=C1 QUAMTGJKVDWJEQ-UHFFFAOYSA-N 0.000 description 2
- WWZKQHOCKIZLMA-UHFFFAOYSA-N octanoic acid Chemical compound CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 239000004014 plasticizer Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229920005862 polyol Chemical class 0.000 description 2
- 150000003077 polyols Chemical class 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 150000003138 primary alcohols Chemical class 0.000 description 2
- 239000003380 propellant Substances 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- NPCOQXAVBJJZBQ-UHFFFAOYSA-N reduced coenzyme Q9 Natural products COC1=C(O)C(C)=C(CC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)C)C(O)=C1OC NPCOQXAVBJJZBQ-UHFFFAOYSA-N 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 210000003296 saliva Anatomy 0.000 description 2
- 239000000344 soap Substances 0.000 description 2
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 2
- 235000021286 stilbenes Nutrition 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- MGSRCZKZVOBKFT-UHFFFAOYSA-N thymol Chemical compound CC(C)C1=CC=C(C)C=C1O MGSRCZKZVOBKFT-UHFFFAOYSA-N 0.000 description 2
- CRDAMVZIKSXKFV-UHFFFAOYSA-N trans-Farnesol Natural products CC(C)=CCCC(C)=CCCC(C)=CCO CRDAMVZIKSXKFV-UHFFFAOYSA-N 0.000 description 2
- LOIYMIARKYCTBW-OWOJBTEDSA-N trans-urocanic acid Chemical compound OC(=O)\C=C\C1=CNC=N1 LOIYMIARKYCTBW-OWOJBTEDSA-N 0.000 description 2
- 229960003500 triclosan Drugs 0.000 description 2
- XMUJIPOFTAHSOK-UHFFFAOYSA-N undecan-2-ol Chemical compound CCCCCCCCCC(C)O XMUJIPOFTAHSOK-UHFFFAOYSA-N 0.000 description 2
- 235000019155 vitamin A Nutrition 0.000 description 2
- 239000011719 vitamin A Substances 0.000 description 2
- 229940045997 vitamin a Drugs 0.000 description 2
- 238000010792 warming Methods 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- 229910052725 zinc Inorganic materials 0.000 description 2
- GNLJBJNONOOOQC-UHFFFAOYSA-N $l^{3}-carbane;magnesium Chemical compound [Mg]C GNLJBJNONOOOQC-UHFFFAOYSA-N 0.000 description 1
- OIQXFRANQVWXJF-ACCUITESSA-N (2e)-2-benzylidene-4,7,7-trimethylbicyclo[2.2.1]heptan-3-one Chemical compound CC1(C)C2CCC1(C)C(=O)\C2=C\C1=CC=CC=C1 OIQXFRANQVWXJF-ACCUITESSA-N 0.000 description 1
- DBSABEYSGXPBTA-RXSVEWSESA-N (2r)-2-[(1s)-1,2-dihydroxyethyl]-3,4-dihydroxy-2h-furan-5-one;phosphoric acid Chemical compound OP(O)(O)=O.OC[C@H](O)[C@H]1OC(=O)C(O)=C1O DBSABEYSGXPBTA-RXSVEWSESA-N 0.000 description 1
- PDHSAQOQVUXZGQ-JKSUJKDBSA-N (2r,3s)-2-(3,4-dihydroxyphenyl)-3-methoxy-3,4-dihydro-2h-chromene-5,7-diol Chemical compound C1([C@H]2OC3=CC(O)=CC(O)=C3C[C@@H]2OC)=CC=C(O)C(O)=C1 PDHSAQOQVUXZGQ-JKSUJKDBSA-N 0.000 description 1
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 1
- AALXZHPCKJILAZ-UHFFFAOYSA-N (4-propan-2-ylphenyl)methyl 2-hydroxybenzoate Chemical compound C1=CC(C(C)C)=CC=C1COC(=O)C1=CC=CC=C1O AALXZHPCKJILAZ-UHFFFAOYSA-N 0.000 description 1
- OJERVTGBPHDZJG-DHZHZOJOSA-N (4e)-5,9-dimethyldeca-4,8-dien-2-one Chemical compound CC(C)=CCC\C(C)=C\CC(C)=O OJERVTGBPHDZJG-DHZHZOJOSA-N 0.000 description 1
- LYFDNQZGOHRKNK-FMIVXFBMSA-N (5e)-6,10-dimethylundeca-5,9-dien-2-ol Chemical compound CC(O)CC\C=C(/C)CCC=C(C)C LYFDNQZGOHRKNK-FMIVXFBMSA-N 0.000 description 1
- OYHQOLUKZRVURQ-NTGFUMLPSA-N (9Z,12Z)-9,10,12,13-tetratritiooctadeca-9,12-dienoic acid Chemical compound C(CCCCCCC\C(=C(/C\C(=C(/CCCCC)\[3H])\[3H])\[3H])\[3H])(=O)O OYHQOLUKZRVURQ-NTGFUMLPSA-N 0.000 description 1
- AFDXODALSZRGIH-QPJJXVBHSA-N (E)-3-(4-methoxyphenyl)prop-2-enoic acid Chemical compound COC1=CC=C(\C=C\C(O)=O)C=C1 AFDXODALSZRGIH-QPJJXVBHSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- KSEBMYQBYZTDHS-HWKANZROSA-M (E)-Ferulic acid Natural products COC1=CC(\C=C\C([O-])=O)=CC=C1O KSEBMYQBYZTDHS-HWKANZROSA-M 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical class C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- NWGAAWUUGRXXSC-UHFFFAOYSA-N 1-(2-hydroxypropoxy)propan-2-yl 2-hydroxybenzoate Chemical compound CC(O)COCC(C)OC(=O)C1=CC=CC=C1O NWGAAWUUGRXXSC-UHFFFAOYSA-N 0.000 description 1
- KBKGPMDADJLBEM-UHFFFAOYSA-N 1-(4-pentylphenyl)ethanone Chemical compound CCCCCC1=CC=C(C(C)=O)C=C1 KBKGPMDADJLBEM-UHFFFAOYSA-N 0.000 description 1
- PWMWNFMRSKOCEY-UHFFFAOYSA-N 1-Phenyl-1,2-ethanediol Chemical compound OCC(O)C1=CC=CC=C1 PWMWNFMRSKOCEY-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- LALVCWMSKLEQMK-UHFFFAOYSA-N 1-phenyl-3-(4-propan-2-ylphenyl)propane-1,3-dione Chemical compound C1=CC(C(C)C)=CC=C1C(=O)CC(=O)C1=CC=CC=C1 LALVCWMSKLEQMK-UHFFFAOYSA-N 0.000 description 1
- ZXDDPOHVAMWLBH-UHFFFAOYSA-N 2,4-Dihydroxybenzophenone Chemical compound OC1=CC(O)=CC=C1C(=O)C1=CC=CC=C1 ZXDDPOHVAMWLBH-UHFFFAOYSA-N 0.000 description 1
- HSMMDRNFKHECNY-UHFFFAOYSA-N 2-(2,3-dihydroxypropyl)-2-ethylhexanoic acid;2,3-dimethoxy-3-phenylprop-2-enoic acid Chemical compound CCCCC(CC)(C(O)=O)CC(O)CO.COC(C(O)=O)=C(OC)C1=CC=CC=C1 HSMMDRNFKHECNY-UHFFFAOYSA-N 0.000 description 1
- YEAYGXLRPMKZBP-UHFFFAOYSA-N 2-(2-hydroxyethylamino)ethanol;3-(4-methoxyphenyl)prop-2-enoic acid Chemical compound OCCNCCO.COC1=CC=C(C=CC(O)=O)C=C1 YEAYGXLRPMKZBP-UHFFFAOYSA-N 0.000 description 1
- SBASXUCJHJRPEV-UHFFFAOYSA-N 2-(2-methoxyethoxy)ethanol Chemical group COCCOCCO SBASXUCJHJRPEV-UHFFFAOYSA-N 0.000 description 1
- YHCGGLXPGFJNCO-UHFFFAOYSA-N 2-(2H-benzotriazol-4-yl)phenol Chemical class OC1=CC=CC=C1C1=CC=CC2=C1N=NN2 YHCGGLXPGFJNCO-UHFFFAOYSA-N 0.000 description 1
- LYLOSUMZZKYEDT-UHFFFAOYSA-N 2-[4-(4,6-disulfo-1h-benzimidazol-2-yl)phenyl]-1h-benzimidazole-4,6-disulfonic acid Chemical compound OS(=O)(=O)C1=CC(S(O)(=O)=O)=C2NC(C3=CC=C(C=C3)C=3NC4=C(C=C(C=C4N=3)S(=O)(=O)O)S(O)(=O)=O)=NC2=C1 LYLOSUMZZKYEDT-UHFFFAOYSA-N 0.000 description 1
- UFXVNSSPBAMMNK-UHFFFAOYSA-N 2-[[4,6-bis(2-carboxyanilino)-1,3,5-triazin-2-yl]amino]benzoic acid Chemical compound OC(=O)C1=CC=CC=C1NC1=NC(NC=2C(=CC=CC=2)C(O)=O)=NC(NC=2C(=CC=CC=2)C(O)=O)=N1 UFXVNSSPBAMMNK-UHFFFAOYSA-N 0.000 description 1
- RJFAYQIBOAGBLC-UHFFFAOYSA-N 2-amino-4-methylselanyl-butanoic acid Chemical compound C[Se]CCC(N)C(O)=O RJFAYQIBOAGBLC-UHFFFAOYSA-N 0.000 description 1
- JGUMTYWKIBJSTN-UHFFFAOYSA-N 2-ethylhexyl 4-[[4,6-bis[4-(2-ethylhexoxycarbonyl)anilino]-1,3,5-triazin-2-yl]amino]benzoate Chemical compound C1=CC(C(=O)OCC(CC)CCCC)=CC=C1NC1=NC(NC=2C=CC(=CC=2)C(=O)OCC(CC)CCCC)=NC(NC=2C=CC(=CC=2)C(=O)OCC(CC)CCCC)=N1 JGUMTYWKIBJSTN-UHFFFAOYSA-N 0.000 description 1
- NPSJHQMIVNJLNN-UHFFFAOYSA-N 2-ethylhexyl 4-nitrobenzoate Chemical compound CCCCC(CC)COC(=O)C1=CC=C([N+]([O-])=O)C=C1 NPSJHQMIVNJLNN-UHFFFAOYSA-N 0.000 description 1
- 239000004808 2-ethylhexylester Substances 0.000 description 1
- RFVNOJDQRGSOEL-UHFFFAOYSA-N 2-hydroxyethyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCO RFVNOJDQRGSOEL-UHFFFAOYSA-N 0.000 description 1
- DRTBYQJIHFSKDT-UHFFFAOYSA-N 2-methyl-5-phenylpentan-1-ol Chemical compound OCC(C)CCCC1=CC=CC=C1 DRTBYQJIHFSKDT-UHFFFAOYSA-N 0.000 description 1
- 239000001431 2-methylbenzaldehyde Substances 0.000 description 1
- GGHBKCSNURXPNB-UHFFFAOYSA-N 2-n,4-n,6-n-triphenyl-1,3,5-triazine-2,4,6-triamine Chemical class N=1C(NC=2C=CC=CC=2)=NC(NC=2C=CC=CC=2)=NC=1NC1=CC=CC=C1 GGHBKCSNURXPNB-UHFFFAOYSA-N 0.000 description 1
- QCDWFXQBSFUVSP-UHFFFAOYSA-N 2-phenoxyethanol Chemical compound OCCOC1=CC=CC=C1 QCDWFXQBSFUVSP-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- ODJQKYXPKWQWNK-UHFFFAOYSA-N 3,3'-Thiobispropanoic acid Chemical compound OC(=O)CCSCCC(O)=O ODJQKYXPKWQWNK-UHFFFAOYSA-N 0.000 description 1
- WMJBVALTYVXGHW-UHFFFAOYSA-N 3,3-diphenylprop-2-enoic acid Chemical class C=1C=CC=CC=1C(=CC(=O)O)C1=CC=CC=C1 WMJBVALTYVXGHW-UHFFFAOYSA-N 0.000 description 1
- FUDSTWAOSUDFKD-UHFFFAOYSA-N 3-Desmethyl-5-deshydroxyscleroin Chemical compound OC1=C(O)C(OC)=CC=C1C(=O)C1=CC=CC=C1 FUDSTWAOSUDFKD-UHFFFAOYSA-N 0.000 description 1
- QJZYHAIUNVAGQP-UHFFFAOYSA-N 3-nitrobicyclo[2.2.1]hept-5-ene-2,3-dicarboxylic acid Chemical compound C1C2C=CC1C(C(=O)O)C2(C(O)=O)[N+]([O-])=O QJZYHAIUNVAGQP-UHFFFAOYSA-N 0.000 description 1
- GWXXFGWOWOJEEX-UHFFFAOYSA-N 4,4,4-trihydroxy-1-phenylbutan-1-one Chemical compound OC(CCC(=O)C1=CC=CC=C1)(O)O GWXXFGWOWOJEEX-UHFFFAOYSA-N 0.000 description 1
- MSHFRERJPWKJFX-UHFFFAOYSA-N 4-Methoxybenzyl alcohol Chemical compound COC1=CC=C(CO)C=C1 MSHFRERJPWKJFX-UHFFFAOYSA-N 0.000 description 1
- ALYNCZNDIQEVRV-PZFLKRBQSA-N 4-amino-3,5-ditritiobenzoic acid Chemical compound [3H]c1cc(cc([3H])c1N)C(O)=O ALYNCZNDIQEVRV-PZFLKRBQSA-N 0.000 description 1
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical class NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 1
- NSAOIAYLNQLPAZ-UHFFFAOYSA-N 4-hydroxy-5-(2-hydroxy-4-methoxy-5-sulfobenzoyl)-2-methoxybenzenesulfonic acid;sodium Chemical compound [Na].[Na].C1=C(S(O)(=O)=O)C(OC)=CC(O)=C1C(=O)C1=CC(S(O)(=O)=O)=C(OC)C=C1O NSAOIAYLNQLPAZ-UHFFFAOYSA-N 0.000 description 1
- 125000004861 4-isopropyl phenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- CNPUBJUFTRFISW-UHFFFAOYSA-N 5-(2-ethylhexoxy)-2-[4-[4-(2-ethylhexoxy)-2-hydroxyphenyl]-1,3,5-triazin-2-yl]phenol Chemical compound OC1=CC(OCC(CC)CCCC)=CC=C1C1=NC=NC(C=2C(=CC(OCC(CC)CCCC)=CC=2)O)=N1 CNPUBJUFTRFISW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 1
- 108010085443 Anserine Proteins 0.000 description 1
- 240000007087 Apium graveolens Species 0.000 description 1
- 235000015849 Apium graveolens Dulce Group Nutrition 0.000 description 1
- 235000010591 Appio Nutrition 0.000 description 1
- XHVAWZZCDCWGBK-WYRLRVFGSA-M Aurothioglucose Chemical compound OC[C@H]1O[C@H](S[Au])[C@H](O)[C@@H](O)[C@@H]1O XHVAWZZCDCWGBK-WYRLRVFGSA-M 0.000 description 1
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 1
- GWZYPXHJIZCRAJ-UHFFFAOYSA-N Biliverdin Natural products CC1=C(C=C)C(=C/C2=NC(=Cc3[nH]c(C=C/4NC(=O)C(=C4C)C=C)c(C)c3CCC(=O)O)C(=C2C)CCC(=O)O)NC1=O GWZYPXHJIZCRAJ-UHFFFAOYSA-N 0.000 description 1
- RCNSAJSGRJSBKK-NSQVQWHSSA-N Biliverdin IX Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(\C=C/2C(=C(C)C(=C/C=3C(=C(C=C)C(=O)N=3)C)/N\2)CCC(O)=O)N1 RCNSAJSGRJSBKK-NSQVQWHSSA-N 0.000 description 1
- JMGZEFIQIZZSBH-UHFFFAOYSA-N Bioquercetin Natural products CC1OC(OCC(O)C2OC(OC3=C(Oc4cc(O)cc(O)c4C3=O)c5ccc(O)c(O)c5)C(O)C2O)C(O)C(O)C1O JMGZEFIQIZZSBH-UHFFFAOYSA-N 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- 108010087806 Carnosine Proteins 0.000 description 1
- 229910052684 Cerium Inorganic materials 0.000 description 1
- NPBVQXIMTZKSBA-UHFFFAOYSA-N Chavibetol Natural products COC1=CC=C(CC=C)C=C1O NPBVQXIMTZKSBA-UHFFFAOYSA-N 0.000 description 1
- ACTIUHUUMQJHFO-UHFFFAOYSA-N Coenzym Q10 Natural products COC1=C(OC)C(=O)C(CC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UHFFFAOYSA-N 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- ZAKOWWREFLAJOT-CEFNRUSXSA-N D-alpha-tocopherylacetate Chemical compound CC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C ZAKOWWREFLAJOT-CEFNRUSXSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 208000001840 Dandruff Diseases 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- GHKOFFNLGXMVNJ-UHFFFAOYSA-N Didodecyl thiobispropanoate Chemical compound CCCCCCCCCCCCOC(=O)CCSCCC(=O)OCCCCCCCCCCCC GHKOFFNLGXMVNJ-UHFFFAOYSA-N 0.000 description 1
- 239000003508 Dilauryl thiodipropionate Substances 0.000 description 1
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical class [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 1
- 239000002656 Distearyl thiodipropionate Substances 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241001673391 Entandrophragma candollei Species 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- FPVVYTCTZKCSOJ-UHFFFAOYSA-N Ethylene glycol distearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCOC(=O)CCCCCCCCCCCCCCCCC FPVVYTCTZKCSOJ-UHFFFAOYSA-N 0.000 description 1
- 244000165918 Eucalyptus papuana Species 0.000 description 1
- 239000005770 Eugenol Substances 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 238000003747 Grignard reaction Methods 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- IMQLKJBTEOYOSI-GPIVLXJGSA-N Inositol-hexakisphosphate Chemical compound OP(O)(=O)O[C@H]1[C@H](OP(O)(O)=O)[C@@H](OP(O)(O)=O)[C@H](OP(O)(O)=O)[C@H](OP(O)(O)=O)[C@@H]1OP(O)(O)=O IMQLKJBTEOYOSI-GPIVLXJGSA-N 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- SLRNWACWRVGMKD-UHFFFAOYSA-N L-anserine Natural products CN1C=NC(CC(NC(=O)CCN)C(O)=O)=C1 SLRNWACWRVGMKD-UHFFFAOYSA-N 0.000 description 1
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 1
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 1
- LEVWYRKDKASIDU-IMJSIDKUSA-N L-cystine Chemical compound [O-]C(=O)[C@@H]([NH3+])CSSC[C@H]([NH3+])C([O-])=O LEVWYRKDKASIDU-IMJSIDKUSA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 102000010445 Lactoferrin Human genes 0.000 description 1
- 108010063045 Lactoferrin Proteins 0.000 description 1
- UPYKUZBSLRQECL-UKMVMLAPSA-N Lycopene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1C(=C)CCCC1(C)C)C=CC=C(/C)C=CC2C(=C)CCCC2(C)C UPYKUZBSLRQECL-UKMVMLAPSA-N 0.000 description 1
- JEVVKJMRZMXFBT-XWDZUXABSA-N Lycophyll Natural products OC/C(=C/CC/C(=C\C=C\C(=C/C=C/C(=C\C=C\C=C(/C=C/C=C(\C=C\C=C(/CC/C=C(/CO)\C)\C)/C)\C)/C)\C)/C)/C JEVVKJMRZMXFBT-XWDZUXABSA-N 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- 125000003047 N-acetyl group Chemical group 0.000 description 1
- YBGZDTIWKVFICR-JLHYYAGUSA-N Octyl 4-methoxycinnamic acid Chemical compound CCCCC(CC)COC(=O)\C=C\C1=CC=C(OC)C=C1 YBGZDTIWKVFICR-JLHYYAGUSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- WYWZRNAHINYAEF-UHFFFAOYSA-N Padimate O Chemical compound CCCCC(CC)COC(=O)C1=CC=C(N(C)C)C=C1 WYWZRNAHINYAEF-UHFFFAOYSA-N 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- IMQLKJBTEOYOSI-UHFFFAOYSA-N Phytic acid Natural products OP(O)(=O)OC1C(OP(O)(O)=O)C(OP(O)(O)=O)C(OP(O)(O)=O)C(OP(O)(O)=O)C1OP(O)(O)=O IMQLKJBTEOYOSI-UHFFFAOYSA-N 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 241000210053 Potentilla elegans Species 0.000 description 1
- KNAHARQHSZJURB-UHFFFAOYSA-N Propylthiouracile Chemical compound CCCC1=CC(=O)NC(=S)N1 KNAHARQHSZJURB-UHFFFAOYSA-N 0.000 description 1
- UVMRYBDEERADNV-UHFFFAOYSA-N Pseudoeugenol Natural products COC1=CC(C(C)=C)=CC=C1O UVMRYBDEERADNV-UHFFFAOYSA-N 0.000 description 1
- VYGQUTWHTHXGQB-UHFFFAOYSA-N Retinol hexadecanoate Natural products CCCCCCCCCCCCCCCC(=O)OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C VYGQUTWHTHXGQB-UHFFFAOYSA-N 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- 229910004298 SiO 2 Inorganic materials 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical class [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 241000194019 Streptococcus mutans Species 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 239000003490 Thiodipropionic acid Substances 0.000 description 1
- 102000002933 Thioredoxin Human genes 0.000 description 1
- 239000005844 Thymol Substances 0.000 description 1
- 229910010413 TiO 2 Inorganic materials 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- 229920001938 Vegetable gum Polymers 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- QCWXUUIWCKQGHC-UHFFFAOYSA-N Zirconium Chemical compound [Zr] QCWXUUIWCKQGHC-UHFFFAOYSA-N 0.000 description 1
- GLLSGHWYBGERSE-UHFFFAOYSA-N [2-(hydroxymethoxy)phenyl]-phenylmethanone;sodium Chemical compound [Na].OCOC1=CC=CC=C1C(=O)C1=CC=CC=C1 GLLSGHWYBGERSE-UHFFFAOYSA-N 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000005575 aldol reaction Methods 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 150000004996 alkyl benzenes Chemical class 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 150000008051 alkyl sulfates Chemical class 0.000 description 1
- OENHQHLEOONYIE-UKMVMLAPSA-N all-trans beta-carotene Natural products CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C OENHQHLEOONYIE-UKMVMLAPSA-N 0.000 description 1
- 150000004347 all-trans-retinol derivatives Chemical class 0.000 description 1
- 235000003903 alpha-carotene Nutrition 0.000 description 1
- 239000011795 alpha-carotene Substances 0.000 description 1
- ANVAOWXLWRTKGA-HLLMEWEMSA-N alpha-carotene Natural products C(=C\C=C\C=C(/C=C/C=C(\C=C\C=1C(C)(C)CCCC=1C)/C)\C)(\C=C\C=C(/C=C/[C@H]1C(C)=CCCC1(C)C)\C)/C ANVAOWXLWRTKGA-HLLMEWEMSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910000323 aluminium silicate Inorganic materials 0.000 description 1
- NNCOOIBIVIODKO-UHFFFAOYSA-N aluminum;hypochlorous acid Chemical compound [Al].ClO NNCOOIBIVIODKO-UHFFFAOYSA-N 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 239000002280 amphoteric surfactant Substances 0.000 description 1
- 239000003945 anionic surfactant Substances 0.000 description 1
- MYYIAHXIVFADCU-QMMMGPOBSA-N anserine Chemical compound CN1C=NC=C1C[C@H](NC(=O)CC[NH3+])C([O-])=O MYYIAHXIVFADCU-QMMMGPOBSA-N 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 230000001857 anti-mycotic effect Effects 0.000 description 1
- 230000001166 anti-perspirative effect Effects 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- 239000002543 antimycotic Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000003213 antiperspirant Substances 0.000 description 1
- 239000002216 antistatic agent Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 150000003934 aromatic aldehydes Chemical class 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 150000005840 aryl radicals Chemical class 0.000 description 1
- 235000010385 ascorbyl palmitate Nutrition 0.000 description 1
- 229940071097 ascorbyl phosphate Drugs 0.000 description 1
- 229960001799 aurothioglucose Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 239000003899 bactericide agent Substances 0.000 description 1
- 235000012216 bentonite Nutrition 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 150000008366 benzophenones Chemical class 0.000 description 1
- 150000001565 benzotriazoles Chemical class 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 125000001743 benzylic group Chemical group 0.000 description 1
- 235000013734 beta-carotene Nutrition 0.000 description 1
- 239000011648 beta-carotene Substances 0.000 description 1
- TUPZEYHYWIEDIH-WAIFQNFQSA-N beta-carotene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2=CCCCC2(C)C TUPZEYHYWIEDIH-WAIFQNFQSA-N 0.000 description 1
- 229960002747 betacarotene Drugs 0.000 description 1
- 210000000941 bile Anatomy 0.000 description 1
- 239000003613 bile acid Substances 0.000 description 1
- QBUVFDKTZJNUPP-UHFFFAOYSA-N biliverdin-IXalpha Natural products N1C(=O)C(C)=C(C=C)C1=CC1=C(C)C(CCC(O)=O)=C(C=C2C(=C(C)C(C=C3C(=C(C=C)C(=O)N3)C)=N2)CCC(O)=O)N1 QBUVFDKTZJNUPP-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- SODJJEXAWOSSON-UHFFFAOYSA-N bis(2-hydroxy-4-methoxyphenyl)methanone Chemical compound OC1=CC(OC)=CC=C1C(=O)C1=CC=C(OC)C=C1O SODJJEXAWOSSON-UHFFFAOYSA-N 0.000 description 1
- FQUNFJULCYSSOP-UHFFFAOYSA-N bisoctrizole Chemical compound N1=C2C=CC=CC2=NN1C1=CC(C(C)(C)CC(C)(C)C)=CC(CC=2C(=C(C=C(C=2)C(C)(C)CC(C)(C)C)N2N=C3C=CC=CC3=N2)O)=C1O FQUNFJULCYSSOP-UHFFFAOYSA-N 0.000 description 1
- 238000004061 bleaching Methods 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 238000005282 brightening Methods 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 238000011095 buffer preparation Methods 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- HOWJQLVNDUGZBI-UHFFFAOYSA-N butane;propane Chemical compound CCC.CCCC HOWJQLVNDUGZBI-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 1
- FNAQSUUGMSOBHW-UHFFFAOYSA-H calcium citrate Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O FNAQSUUGMSOBHW-UHFFFAOYSA-H 0.000 description 1
- CQOVPNPJLQNMDC-ZETCQYMHSA-N carnosine Chemical compound [NH3+]CCC(=O)N[C@H](C([O-])=O)CC1=CNC=N1 CQOVPNPJLQNMDC-ZETCQYMHSA-N 0.000 description 1
- 229940044199 carnosine Drugs 0.000 description 1
- 235000021466 carotenoid Nutrition 0.000 description 1
- 150000001747 carotenoids Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 1
- 239000003093 cationic surfactant Substances 0.000 description 1
- 230000001364 causal effect Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- GWXLDORMOJMVQZ-UHFFFAOYSA-N cerium Chemical compound [Ce] GWXLDORMOJMVQZ-UHFFFAOYSA-N 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol group Chemical group [C@@H]1(CC[C@H]2[C@@H]3CC=C4C[C@@H](O)CC[C@]4(C)[C@H]3CC[C@]12C)[C@H](C)CCCC(C)C HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 1
- 229940114081 cinnamate Drugs 0.000 description 1
- 150000001851 cinnamic acid derivatives Chemical class 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 238000005354 coacervation Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 235000017471 coenzyme Q10 Nutrition 0.000 description 1
- ACTIUHUUMQJHFO-UPTCCGCDSA-N coenzyme Q10 Chemical compound COC1=C(OC)C(=O)C(C\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CCC=C(C)C)=C(C)C1=O ACTIUHUUMQJHFO-UPTCCGCDSA-N 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 230000007797 corrosion Effects 0.000 description 1
- 238000005260 corrosion Methods 0.000 description 1
- 150000001907 coumarones Chemical class 0.000 description 1
- 229940097362 cyclodextrins Drugs 0.000 description 1
- OOTFVKOQINZBBF-UHFFFAOYSA-N cystamine Chemical compound CCSSCCN OOTFVKOQINZBBF-UHFFFAOYSA-N 0.000 description 1
- 229940099500 cystamine Drugs 0.000 description 1
- 229960002433 cysteine Drugs 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 229960003067 cystine Drugs 0.000 description 1
- ZAKOWWREFLAJOT-UHFFFAOYSA-N d-alpha-Tocopheryl acetate Natural products CC(=O)OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C ZAKOWWREFLAJOT-UHFFFAOYSA-N 0.000 description 1
- 238000004042 decolorization Methods 0.000 description 1
- 239000013530 defoamer Substances 0.000 description 1
- 239000003241 dermatological agent Substances 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- NZZIMKJIVMHWJC-UHFFFAOYSA-N dibenzoylmethane Chemical class C=1C=CC=CC=1C(=O)CC(=O)C1=CC=CC=C1 NZZIMKJIVMHWJC-UHFFFAOYSA-N 0.000 description 1
- 235000019304 dilauryl thiodipropionate Nutrition 0.000 description 1
- 230000003467 diminishing effect Effects 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- HNPSIPDUKPIQMN-UHFFFAOYSA-N dioxosilane;oxo(oxoalumanyloxy)alumane Chemical compound O=[Si]=O.O=[Al]O[Al]=O HNPSIPDUKPIQMN-UHFFFAOYSA-N 0.000 description 1
- 238000002845 discoloration Methods 0.000 description 1
- PWWSSIYVTQUJQQ-UHFFFAOYSA-N distearyl thiodipropionate Chemical compound CCCCCCCCCCCCCCCCCCOC(=O)CCSCCC(=O)OCCCCCCCCCCCCCCCCCC PWWSSIYVTQUJQQ-UHFFFAOYSA-N 0.000 description 1
- 235000019305 distearyl thiodipropionate Nutrition 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000005553 drilling Methods 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 239000003792 electrolyte Chemical class 0.000 description 1
- HEOCBCNFKCOKBX-SDNWHVSQSA-N enzacamene Chemical compound C1=CC(C)=CC=C1\C=C/1C(=O)C2(C)CCC\1C2(C)C HEOCBCNFKCOKBX-SDNWHVSQSA-N 0.000 description 1
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 1
- 229960002217 eugenol Drugs 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 210000002468 fat body Anatomy 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- KSEBMYQBYZTDHS-HWKANZROSA-N ferulic acid Chemical compound COC1=CC(\C=C\C(O)=O)=CC=C1O KSEBMYQBYZTDHS-HWKANZROSA-N 0.000 description 1
- 235000001785 ferulic acid Nutrition 0.000 description 1
- 229940114124 ferulic acid Drugs 0.000 description 1
- KSEBMYQBYZTDHS-UHFFFAOYSA-N ferulic acid Natural products COC1=CC(C=CC(O)=O)=CC=C1O KSEBMYQBYZTDHS-UHFFFAOYSA-N 0.000 description 1
- 239000000834 fixative Substances 0.000 description 1
- 239000004872 foam stabilizing agent Substances 0.000 description 1
- 238000005187 foaming Methods 0.000 description 1
- 239000004088 foaming agent Substances 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- VZCCETWTMQHEPK-UHFFFAOYSA-N gamma-Linolensaeure Natural products CCCCCC=CCC=CCC=CCCCCC(O)=O VZCCETWTMQHEPK-UHFFFAOYSA-N 0.000 description 1
- VZCCETWTMQHEPK-QNEBEIHSSA-N gamma-linolenic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/CCCCC(O)=O VZCCETWTMQHEPK-QNEBEIHSSA-N 0.000 description 1
- 235000020664 gamma-linolenic acid Nutrition 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 229960002733 gamolenic acid Drugs 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 125000005908 glyceryl ester group Chemical group 0.000 description 1
- 229940100608 glycol distearate Drugs 0.000 description 1
- 229940100242 glycol stearate Drugs 0.000 description 1
- 125000003147 glycosyl group Chemical group 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000036074 healthy skin Effects 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 239000004021 humic acid Substances 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 239000002973 irritant agent Substances 0.000 description 1
- 239000001282 iso-butane Substances 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- CSSYQJWUGATIHM-IKGCZBKSSA-N l-phenylalanyl-l-lysyl-l-cysteinyl-l-arginyl-l-arginyl-l-tryptophyl-l-glutaminyl-l-tryptophyl-l-arginyl-l-methionyl-l-lysyl-l-lysyl-l-leucylglycyl-l-alanyl-l-prolyl-l-seryl-l-isoleucyl-l-threonyl-l-cysteinyl-l-valyl-l-arginyl-l-arginyl-l-alanyl-l-phenylal Chemical compound C([C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 CSSYQJWUGATIHM-IKGCZBKSSA-N 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229940078795 lactoferrin Drugs 0.000 description 1
- 235000021242 lactoferrin Nutrition 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- AGBQKNBQESQNJD-UHFFFAOYSA-M lipoate Chemical compound [O-]C(=O)CCCCC1CCSS1 AGBQKNBQESQNJD-UHFFFAOYSA-M 0.000 description 1
- 235000019136 lipoic acid Nutrition 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 235000012661 lycopene Nutrition 0.000 description 1
- 229960004999 lycopene Drugs 0.000 description 1
- OAIJSZIZWZSQBC-GYZMGTAESA-N lycopene Chemical compound CC(C)=CCC\C(C)=C\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C=C(/C)CCC=C(C)C OAIJSZIZWZSQBC-GYZMGTAESA-N 0.000 description 1
- 239000001751 lycopene Substances 0.000 description 1
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- MJVGBKJNTFCUJM-UHFFFAOYSA-N mexenone Chemical compound OC1=CC(OC)=CC=C1C(=O)C1=CC=C(C)C=C1 MJVGBKJNTFCUJM-UHFFFAOYSA-N 0.000 description 1
- 244000000010 microbial pathogen Species 0.000 description 1
- 230000002906 microbiologic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 235000019426 modified starch Nutrition 0.000 description 1
- 229940051866 mouthwash Drugs 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 description 1
- FMJSMJQBSVNSBF-UHFFFAOYSA-N octocrylene Chemical compound C=1C=CC=CC=1C(=C(C#N)C(=O)OCC(CC)CCCC)C1=CC=CC=C1 FMJSMJQBSVNSBF-UHFFFAOYSA-N 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- 125000001117 oleyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000003605 opacifier Substances 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000003960 organic solvent Chemical class 0.000 description 1
- DXGLGDHPHMLXJC-UHFFFAOYSA-N oxybenzone Chemical compound OC1=CC(OC)=CC=C1C(=O)C1=CC=CC=C1 DXGLGDHPHMLXJC-UHFFFAOYSA-N 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- 229940098695 palmitic acid Drugs 0.000 description 1
- 125000001312 palmitoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 235000010603 pastilles Nutrition 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 210000003800 pharynx Anatomy 0.000 description 1
- 229960005323 phenoxyethanol Drugs 0.000 description 1
- LYKRPDCJKSXAHS-UHFFFAOYSA-N phenyl-(2,3,4,5-tetrahydroxyphenyl)methanone Chemical compound OC1=C(O)C(O)=CC(C(=O)C=2C=CC=CC=2)=C1O LYKRPDCJKSXAHS-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 239000000467 phytic acid Substances 0.000 description 1
- 235000002949 phytic acid Nutrition 0.000 description 1
- 229940068041 phytic acid Drugs 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920000151 polyglycol Polymers 0.000 description 1
- 239000010695 polyglycol Substances 0.000 description 1
- 235000020777 polyunsaturated fatty acids Nutrition 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- XATKDVHSLQMHSY-UHFFFAOYSA-N propan-2-yl 3-(4-methoxyphenyl)prop-2-enoate Chemical compound COC1=CC=C(C=CC(=O)OC(C)C)C=C1 XATKDVHSLQMHSY-UHFFFAOYSA-N 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960002662 propylthiouracil Drugs 0.000 description 1
- 239000003223 protective agent Substances 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000002787 reinforcement Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 229940108325 retinyl palmitate Drugs 0.000 description 1
- 235000019172 retinyl palmitate Nutrition 0.000 description 1
- 239000011769 retinyl palmitate Substances 0.000 description 1
- IKGXIBQEEMLURG-BKUODXTLSA-N rutin Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@@H]1OC[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](OC=2C(C3=C(O)C=C(O)C=C3OC=2C=2C=C(O)C(O)=CC=2)=O)O1 IKGXIBQEEMLURG-BKUODXTLSA-N 0.000 description 1
- 229960004555 rutoside Drugs 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 229940058287 salicylic acid derivative anticestodals Drugs 0.000 description 1
- 150000003872 salicylic acid derivatives Chemical class 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 235000003441 saturated fatty acids Nutrition 0.000 description 1
- 150000004671 saturated fatty acids Chemical class 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 230000001235 sensitizing effect Effects 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 229930004725 sesquiterpene Natural products 0.000 description 1
- 150000004354 sesquiterpene derivatives Chemical class 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000002639 sodium chloride Nutrition 0.000 description 1
- 238000007711 solidification Methods 0.000 description 1
- 230000008023 solidification Effects 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000001694 spray drying Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 150000001629 stilbenes Chemical class 0.000 description 1
- 239000000021 stimulant Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- AGGIJOLULBJGTQ-UHFFFAOYSA-N sulfoacetic acid Chemical class OC(=O)CS(O)(=O)=O AGGIJOLULBJGTQ-UHFFFAOYSA-N 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 125000005555 sulfoximide group Chemical group 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- CXVGEDCSTKKODG-UHFFFAOYSA-N sulisobenzone Chemical compound C1=C(S(O)(=O)=O)C(OC)=CC(O)=C1C(=O)C1=CC=CC=C1 CXVGEDCSTKKODG-UHFFFAOYSA-N 0.000 description 1
- 230000000475 sunscreen effect Effects 0.000 description 1
- 239000000516 sunscreening agent Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 229960002663 thioctic acid Drugs 0.000 description 1
- 235000019303 thiodipropionic acid Nutrition 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229960000790 thymol Drugs 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 229930003799 tocopherol Natural products 0.000 description 1
- 239000011732 tocopherol Substances 0.000 description 1
- 229940042585 tocopherol acetate Drugs 0.000 description 1
- 125000002640 tocopherol group Chemical class 0.000 description 1
- 235000019149 tocopherols Nutrition 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- QURCVMIEKCOAJU-UHFFFAOYSA-N trans-isoferulic acid Natural products COC1=CC=C(C=CC(O)=O)C=C1O QURCVMIEKCOAJU-UHFFFAOYSA-N 0.000 description 1
- ZCIHMQAPACOQHT-ZGMPDRQDSA-N trans-isorenieratene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/c1c(C)ccc(C)c1C)C=CC=C(/C)C=Cc2c(C)ccc(C)c2C ZCIHMQAPACOQHT-ZGMPDRQDSA-N 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-O triethanolammonium Chemical class OCC[NH+](CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-O 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 229940040064 ubiquinol Drugs 0.000 description 1
- QNTNKSLOFHEFPK-UPTCCGCDSA-N ubiquinol-10 Chemical compound COC1=C(O)C(C)=C(C\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CC\C=C(/C)CCC=C(C)C)C(O)=C1OC QNTNKSLOFHEFPK-UPTCCGCDSA-N 0.000 description 1
- 229940035936 ubiquinone Drugs 0.000 description 1
- 235000021122 unsaturated fatty acids Nutrition 0.000 description 1
- 150000004670 unsaturated fatty acids Chemical class 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 239000000052 vinegar Substances 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 239000000341 volatile oil Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 229910052726 zirconium Inorganic materials 0.000 description 1
- OENHQHLEOONYIE-JLTXGRSLSA-N β-Carotene Chemical compound CC=1CCCC(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C OENHQHLEOONYIE-JLTXGRSLSA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N31/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic oxygen or sulfur compounds
- A01N31/04—Oxygen or sulfur attached to an aliphatic side-chain of a carbocyclic ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C33/00—Unsaturated compounds having hydroxy or O-metal groups bound to acyclic carbon atoms
- C07C33/18—Monohydroxylic alcohols containing only six-membered aromatic rings as cyclic part
- C07C33/20—Monohydroxylic alcohols containing only six-membered aromatic rings as cyclic part monocyclic
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Dentistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Plant Pathology (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Pest Control & Pesticides (AREA)
- Agronomy & Crop Science (AREA)
- Cosmetics (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Beschrieben wird die Verwendung einer Verbindung der Formel I DOLLAR F1 als Wirkstoff gegen Gram-positive Bakterien, worin DOLLAR A m und n unabhängig voneinander 0 und 1 bedeuten, DOLLAR A R·1· bis R·6· unabhängig voneinander Wasserstoff oder Methyl bedeuten und DOLLAR A A eine Phenylgruppe, die gegebenenfalls mit weiteren C¶1¶- bis C¶5¶-Alkylsubstiuenten substituiert ist, eine Norboran-2-yl- oder eine Pinan-3-yl-Gruppe ist.
Description
- Die vorliegende Erfindung betrifft die Verwendung bestimmter sekundärer Alkohole als Wirkstoffe gegen Gram-positive Bakterien, wie sie insbesondere ursächlich sind für (a) Körpergeruch, (b) unreine Haut und/oder Akne sowie (c) Mundgeruch und/oder schlechten Atem. Einige der erfindungsgemäß einsetzbaren Verbindungen sind dabei neu, ebenso wie die Zubereitungen, in denen sie eingesetzt werden.
- Der gesunde warmblütige Organismus, insbesondere die gesunde menschliche Haut und Schleimhaut, ist mit einer Vielzahl nicht pathogener Mikroorganismen besiedelt. Diese sogenannte Mikroflora der Haut bzw. Schleimhaut ist nicht nur unschädlich, sie stellt einen wichtigen Schutz zur Abwehr opportunistischer oder pathogener Keime dar. Andere Mikroorganismen können dagegen den Zustand der gesunden Haut und Schleimhaut, z.B. auch ihren Geruch, maßgeblich beeinflussen.
- Es besteht ein ständiger Bedarf an Substanzen und Mitteln mit antimikrobiellen Eigenschaften. Insbesondere werden dabei antimikrobielle Wirkstoffe gesucht, deren antibakterielles Spektrum (Antibiogramm) Gram-positive Bakterien umfasst. Es ist bereits bekannt, dass bestimmte Alkohole antimikrobiell wirksam sind. In der Praxis eingesetzt werden bislang vor Allem primäre Alkohole wie z. B. Farnesol, ein primärer Sesquiterpenalkohol. Farnesol und andere primäre Alkohole mit antimikrobiellen Eigenschaften besitzen jedoch ein sensibilisierendes und allergenisierendes Potential, so dass ihr Einsatz in zunehmenden Maße nicht mehr toleriert wird.
- Es war deshalb die primäre Aufgabe der vorliegenden Erfindung, Verbindungen anzugeben, welche gegen Gram-positive Bakterien wirksam sind. Darüber hinaus sollten die anzugebenden Verbindungen einen allenfalls geringen Eigengeruch besitzen, leicht in antibakterielle Zubereitungen einzuarbeiten sein, in den üblichen kosmetischen Formulierungen ebenso wie unter den erforderlichen anwendungstechnischen Bedingungen stabil sein, gut zugänglich sein, d. h. durch einfache chemische Reaktionen herstellbar sein, sowie gut verträglich sein, d. h. bei ihrer Anwendung keine unvertretbare Beeinträchtigung der Gesundheit bewirken.
- Die vorgenannte Aufgabe wird gelöst durch die Verwendung einer Verbindung der Formel I als Wirkstoff gegen Gram-positive Bakterien worin
m und n unabhängig voneinander 0 und 1 bedeuten,
R1 bis R6 unabhängig voneinander Wasserstoff oder Methyl bedeuten und
A eine Phenylgruppe, die gegebenenfalls mit weiteren C1- bis C5-Alkylsubstituenten substituiert ist, eine Norbornan-2-yl- oder eine Pinan-3-yl-Gruppe ist. - Vorzugsweise ist mindestens eine in der erfindungsgemäß einzusetzenden Verbindung der Formel I vorhandene Gruppe R1 bis R6 Methyl (d. h. falls m = n = 0 einer der Substituenten R1 oder R2; falls m = 0 und n = 1 einer der Substituenten R1, R2, R3 und R4; falls m = 1 und n = 0 einer der Substituenten R1, R2, R5 und R6), falls A eine Phenylgruppe oder eine monoalkylsubstituierte Phenylgruppe ist.
- Bei den erfindungsgemäß einzusetzenden Alkoholen handelt es sich um sekundäre Alkohole, die einen Arylrest (Gruppe A) umfassen. Die Einsetzbarkeit der Verbindungen der Formel I zur Bekämpfung Gram-positiver Bakterien ergab sich nicht aus dem Stand der Technik.
- J. Agric. Food Chem. 1993 (41), 2447–2450 (Kubo et al.) offenbart zwar, dass bestimmte sekundäre Alkohole wie 2-Undecanol und Geranylacetol gegen Streptococcus mutans (ein Gram-positives Bakterium) wirksam sind, und in einer jüngeren Veröffentlichung in Bioorg. Med. Chem. 1995 (3), 873–880 (Kubo et al.) werden ergänzend Angaben zur antimikrobiellen Wirksamkeit sekundärer Alkohole gegen eine Reihe Gram-positiver Bakterien offenbart, doch es findet sich kein Hinweis auf die Einsetzbarkeit von sekundären Alkoholen, die unter die Formel I fallen.
- WO 01/85120 A1 betrifft zwar die Verwendung des sekundären Alkohols 6,10-Dimethyl-5,9-undecadien-2-ol als antimikrobieller Wirkstoff, gibt aber ebenfalls keinen Hinweis auf die Einsetzbarkeit von sekundären Alkoholen, welche unter die Formel I fallen.
-
DE 100 25 124 A1 beschreibt Wirkstoffkombinationen, die einen Glycerinmonoalkylether sowie einen Aryl-substiuierten Alkohol umfassen. Es ist dabei nicht ausgeschlossen, dass der Glycerinmonoalkylether mit einem sekundären Aryl-substituierten Alkohol kombiniert wird, besonders bevorzugt sind jedoch die primären Alkohole Phenoxyethanol, Anisalkohol und 2-Methyl-5-phenyl-pentan-1-ol sowie der tertiäre Alkohol Phenyl-dimethylethylcarbonol. Nicht offenbart wird, dass Aryl-substituierte Alkohole alleine eine Wirkung gegen Gram-positive Bakterien entfalten können, und dies gilt insbesondere für Aryl-substituierte sekundäre Alkohole. - Die
US 4,006,218 (Sipos) offenbart die Verwendung bestimmter Phenylalkanole, unter denen sich auch sekundäre Alkohole befinden, als Verstärker (potentiator) der antimikrobiellen Wirkung eines antimikrobiellen Agents. Es wird kein Hinweis gegeben auf eine eigene antimikrobielle Wirksamkeit der zum Zwecke der Verstärkung eingesetzten Phenylalkanole. - Die
EP 0 919 607 A2 offenbart Additive zur physikalischen und/oder mikrobiologischen Stabilisierung der flüssigen oder viskosen Zusammensetzung eines Schmierstoffs, wobei das Additiv ein aromatischer Alkohol ist, der auch sekundär sein kann. Nicht offenbart wird jedoch, gegen welche Keime das Additiv wirksam sein soll; ganz allgemein angegeben wird allerdings, dass Kühlschmierstoffzusammensetzungen mikrobiologisch stabilisiert werden. Da nun aber Kühlschmierstoffe üblicherweise nur von Bakterien besiedelt werden, die Gram-negativ sind, ergibt sich aus derEP 0 919 607 A2 zumindest kein Hinweis darauf, dass die als Additiv zur Stabilisierung von Kühlschmierstoffen einsetzbaren aromatischen Alkohole eine antibakterielle Wirkung gegen Gram-positive Bakterien besitzen. - Schließlich sei noch auf die
DE 4 447 361 A1 hingewiesen, welche die Verwendung primärer Arylalkylalkohole als antimikrobielle Wirkstoffe offenbart. - Wie sich bereits aus der vorstehenden Würdigung verschiedener Veröffentlichungen ergibt, wurden in den letzten Jahrzehnten zahlreiche Untersuchungen zur antimikrobiellen Wirksamkeit von Alkoholen durchgeführt. Es ist deshalb äußerst überraschend, dass bislang noch nicht erkannt wurde, dass die erfindungsgemäß einzusetzenden Verbindungen der Formel I eine ganz hervorragende Wirksamkeit gegenüber Gram-positiven Bakterien besitzen. Für den Einsatz in der Praxis sind die Verbindungen der Formel I dabei besonders geeignet, weil sie allenfalls einen geringen Eigengeruch besitzen und durch einfache chemische Reaktionen herstellbar sind. Die sekundären Alkohole der Formel I sind als Wirkstoffe gegen Gram-positive Bakterien insbesondere in kosmetischen, mundhygienischen und/oder dermatologischen Zubereitungen einsetzbar.
- Wenngleich die vorliegende Erfindung ganz allgemein die Verwendung einer Verbindung der Formel I mit den eingangs genannten Bedeutungen der Substituenten als Wirkstoff gegen Gram-positive Bakterien betrifft, ist es doch besonders bevorzugt, die Verbindung der Formel I gegen Gram-positive Bakterien einzusetzen, die aus der Gruppe ausgewählt sind, die aus (a) Körpergeruch verursachenden, (b) unreine Haut und/oder Akne verursachenden und (c) Mundgeruch und/oder schlechten Atem verursachenden Bakterien besteht.
- Dem Fachmann sind die Gram-positiven Bakterien bekannt, welche für die unangenehmen Körperzustände gemäß (a)–(c) verantwortlich sind.
- Gram-positive Bakterien, die Körpergeruch verursachen, sind Bakterien z. B. aus den Gattungen Corynebacterium, Staphylococcus, Micrococcus und Brevibacterium, insbesondere Corynebacterium xerosis, Staphylococcus epidermidis und Staphylococcus hominis, Micrococcus luteus und/oder Micrococcus sedentarius und Brevibacterium epidermidis.
- Gram-positive Bakterien, die unreine Haut und/oder Akne verusachen, sind beispielsweise Bakterien der Gattung Propionibacterium, insbesondere Propionibacterium acnes.
- Gram-positive Bakterien, die Mundgeruch und/oder schlechten Atem verursachen, sind beispielsweise Bakterien der Gattungen Actinomyces, Eubacterium, Rothia und Stomatococcus, insbesondere Actinomyces viscosus, Eubacterium brachy, Eubacterium nodatum, Eubacterium saburreum, Eubacterium timidum und Eubacterium yurrii, sowie Rothia denticariosus und Stomatococcus mucilaginosus.
- Die sekundären Alkohole der Formel (I) harmonieren mit einer Vielzahl üblicher kosmetischer Hilfs- und Zusatzstoffe. Die Verbindungen der Formel I können deshalb in die verschiedensten Darreichungsformen und Zubereitungen eingearbeitet werden. Auf die Haut zu applizierende Zubereitungen, die Verbindungen der Formel I enthalten, sind in der Lage, die Zahl der Gram-positiven Bakterien, die für das jeweilige Phänomen bzw. die jeweilige Beeinträchtigung gemäß obiger Aufzählung (a) bis (c) verantwortlich sind, zu reduzieren, wobei die Mikroflora der kontaktierten Haut geschont wird. Zubereitungen, welche die Verbindungen der Formel I enthalten, zeichnen sich regelmäßig durch eine gute Hautverträglichkeit aus, sofern keiner der sonstigen in der Zubereitung enthaltenen Bestandteile eine Unverträglichkeit verursacht.
- Die vorstehenden Bemerkungen gelten insbesondere für Desodorantien, speziell solche gegen Körpergeruch und Mundgeruch, welche die sekundären Alkohole der Formel I enthalten. Derartige Desodorantien besitzen eine gute Hautverträglichkeit (inklusive Schleimhautverträglichkeit) und zeigen – eine ausreichende Dosierung der erfindungsgemäß einzusetzenden Verbindung der Formel I vorausgesetzt – eine Wirksamkeit über einen längeren Zeitraum, und zwar in der Größenordnung von mindestens einem halben Tag, ohne dass ihre Wirkung spürbar nachlässt.
- Unter den Verbindungen der Formel I sind diejenigen bevorzugt, für die gilt: m + n = 0 oder 2. Diese Verbindungen besitzen eine besonders hohe Wirkung gegenüber Gram-positiven Bakterien.
- Weiter bevorzugt sind Verbindungen der Formel I, die zumindest drei, vorzugsweise zumindest vier CH3-Gruppen besitzen, denn auch diese sind regelmäßig besonders wirksam gegenüber Gram-positiven Bakterien.
- Vorzugsweise ist in den erfindungsgemäß einzusetzenden Verbindungen der Formel I die Gruppe A Phenyl, 2-Methylphenyl, 3-Methylphenyl, 4-Methylphenyl, 4-Isopropylphenyl, 4-tert-Butylphenyl, 4-Isobutylphenyl, 2,4-Dimethylphenyl, 3,4-Dimethylphenyl, 2,5-Dimethylphenyl, 2,4,5-Trimethylphenyl, 2,4,6-Trimethylphenyl, Norbornan-2-yl oder Pinan-3-yl, wobei wiederum vorzugsweise mindestens eine der Gruppen R1 bis R6 Methyl ist, falls A Phenyl oder ein monoalkylsubstiuiertes Phenyl ist.
-
- Unter diesen besonders bevorzugten Verbindungen sind 4-(2,4,5-Trimethylphenyl)-2-butanol (Verbindung 14), 3-Methyl-4-(2,4,5-trimethylphenyl)-2-butanol (Verbindung 4), 4-(4-Isopropylphenyl)-3-methyl-2-butanol (Verbindung 11), 4-(4-Isobutylphenyl)-3-methyl-2-butanol (Verbindung 6), 3-Methyl-4-(2,4,6-trimethylphenyl)-2-butanol (Verbindung 8), 4-(3,4-Dimethylphenyl)-3-methyl-2-butanol (Verbindung 17), 4-(3,4-Dimethylphenyl)-2-butanol (Verbindung 18), 4-(2,4-Dimethylphenyl)-3-methyl-2-butanol (Verbindung 12), 4-(2,4-Dimethylphenyl)-2-butanol (Verbindung 13), neu.
- Die genannten antimikrobiellen Eigenschaften der erfindungsgemäß einzusetzenden sekundären Alkohole der Formel (I) beziehen sich dabei auf alle diastereomeren und, soweit zutreffend, enantiomeren Formen sowie beliebige Mischungen davon.
- Die Erfindung betrifft auch Verfahren zur Bekämpfung Gram-positiver Bakterien, wobei die Bakterien mit einer antimikrobiell wirksamen Menge einer Verbindung der Formel I oder einer Mischung von zumindest zwei unterschiedlichen Verbindungen der Formel I kontaktiert werden. Für die Verbindungen der Formel I gelten dabei die eingangs genannten Bedeutungen der Substituenten, wobei natürlich auch die Angaben zu den besonders bevorzugten Verbindungen der Formel I weiterhin zutreffen.
- Gemäß einem verwandten Aspekt betrifft die Erfindung auch ein Verfahren zur Bekämpfung von (a) durch Gram-positive Bakterien verursachtem Körpergeruch (b) durch Gram-positive Bakterien verursachte unreiner Haut und/oder Akne und/oder (c) durch Gram-positive Bakterien verursachtem Mundgeruch und/oder schlechtem Atem, wobei die Gram-positiven Bakterien mit einer antimikrobiell wirksamen Menge einer Verbindung der Formel I oder einer Mischung von zumindest zwei unterschiedlichen Verbindungen der Formel I kontaktiert werden. Auch insoweit gelten die bereits eingangs genannten Bedeutungen der Substituenten und die Ausführungen zu den bevorzugten Verbindungen der Formel I.
- Zum Zwecke der Kontaktierung wird die Verbindung der Formel I üblicherweise flächig auf den Bereich der Haut (inklusive Schleimhaut) des menschlichen und tierischen Körpers appliziert, der von den zu bekämpfenden Gram-positiven Bakterien befallen ist. Die Form der Applikation hängt dabei entscheidend von der Darreichungsform der einzusetzenden Verbindung der Formel I ab (siehe dazu unten). Wenngleich das erfindungsgemäße Verfahren in der Regel kosmetischen Zwecken dienen wird, ist auch in manchen Fällen ein therapeutischer Zweck vorhanden. Der Begriff „Bekämpfung" umfasst dabei sowohl die Behandlung bereits existierender Beeinträchtigungen (insbesondere durch unerwünschte, bakteriell verursachte Gerüche) als auch die entsprechende Prophylaxe.
- Die Herstellung der erfindungsgemäß einzusetzenden sekundären Alkohole der Formel I worin R1 = H und m, n = 0 ist, gelingt nach Schema 1.
- Die Herstellung der erfindungsgemäß einzusetzenden sekundären Alkohole der Formel (I) worin R1 = H; R3 = H und m = 0,1 ist, gelingt nach Schema 2
- Die Herstellung der erfindungsgemäß einzusetzenden sekundären Alkohole der Formel (I) worin R1 = H; R3 = H ; R5 = H ist, gelingt nach Schema 3
- Durch eine Aldolreaktion eines geeigneten Aldehydes mit einem Methylketon wird zunächst ein α,β-ungesättigtes Keton hergestellt (J. March, Advanced Organic Chemistry, 4th ed., J. Wiley, New York, 1992, S. 937–944). In einem nachfolgenden Schritt werden die Doppelbindung und die Ketogruppe hydriert. Gegebenenfalls kann auch zunächst nur die Doppelbindung hydriert und dann die Ketogruppe reduziert werden (J. March, Advanced Organic Chemistry, 4th ed., J. Wiley, New York, 1992, S. 771–783; 910–920).
- Ein geeigneter Aldehyd wird in einer Grignard-Reaktion mit einem Methylmagnesiumhalogenid umgesetzt (J. March, Advanced Organic Chemistry, 4th ed., J. Wiley, New York, 1992, S. 920–931). Bei enthaltenen Doppelbindungen können die entsprechenden gesättigten Verbindungen durch katalytische Hydrierung erhalten werden (Schema 4).
- Erfindungsgemäße Zubereitungen, insbesondere kosmetische, mundhygienische und dermatologische Zubereitungen, umfassen eine antibakteriell wirksame Menge einer Verbindung der Formel I (wobei die vorstehenden Angaben zu den Substituenten und den bevorzugten Verbindungen entsprechend gelten), sowie zumindest einen weiteren Bestandteil, der für eine z. B. kosmetische, mundhygienische oder dermatologische Zubereitung typisch ist. In diesem Zusammenhang sei mit Blick auf die bereits diskutierte
EP 0 919 607 A2 darauf hingewiesen, dass die erfindungsgemäßen Zubereitungen üblicherweise nicht als Schmierstoff für die mechanische Bearbeitung bzw. Verarbeitung von Werkstoffen eingesetzt werden können. Insbesondere enthalten die erfindungsgemäßen Zubereitungen in der Regel keinen Korrosionsinhibitor (organische Bohrverbindungen), keinen EP-Wirkstoff (Schwefel- und Phosphor-Additive), keinen Entschäumer, keinen Formaldehydabspalter und keine Borsäure. - Die erfindungsgemäß zu verwendenden Verbindungen der Formel I können auch eingesetzt werden, um den Verderb organischer Substanzen und Zubereitungen, insbesondere den Verderb kosmetischer, dermatologischer und mundhygienischer Zubereitungen, durch den Befall mit Gram-positiven Bakterien zu verhindern. In einem entsprechenden erfindungsgemäßen Verfahren zum Verhindern des Befalls einer kosmetischen und therapeutischen Formulierung mit Gram-positiven Bakterien wird die Formulierung mit einer antibakteriell wirksamen Menge einer oder mehrerer Verbindungen der Formel I vermischt, wobei die oben gemachten Ausführungen zu den Substituenten und den bevorzugt einzusetzenden Verbindungen der Formel I entsprechend gelten. Vorzugsweise werden die Verbindungen der Formel I in einer Konzentration von 0,05–10 Gew.-% eingesetzt, bezogen auf die Gesamtmasse der Substanz oder Formulierung.
- Die sekundären Alkohole der Formel (I) harmonieren – wie erwähnt – mit einer großen Vielzahl an üblichen kosmetischen Hilfs- und Zusatzstoffen, und zwar vor allem auch deshalb, weil die Verbindungen der Formel (I) keinen bzw. nur einen sehr geringen Eigengeruch aufweisen. Dies gilt insbesondere für die in desodorierend oder antitranspirierend wirkenden Formulierungen üblichen Parfümbestandteile. Auch die Kombination von Adstringentien, vorwiegend Aluminiumsalzen wie Aluminiumhydroxychlorid, mit den erfindungsgemäß antimikrobiell wirksamen Stoffen der Formel (I) in ein und derselben Zusammensetzung ist vorteilhaft.
- Es können ein oder mehrere antimikrobiell wirksame Verbindungen der Formel (I) in Zubereitungen eingesetzt werden. Der Gesamtgehalt an erfindungsgemäßen sekundären Alkoholen liegt üblicherweise im Bereich von 0,005 bis 50 Gew.-%, bevorzugt im Bereich von 0,01 bis 20 Gew.-%, besonders bevorzugt 0,1 bis 5 Gew.-% an den erfindungsgemäßen Verbindungen, und ganz besonders bevorzugt 0,5 bis 3 Gew.-%, bezogen auf das Gesamtgewicht der Zubereitung.
- Die Verbindungen der Formel (I) werden bevorzugt in kosmetischen, mundhygienischen oder dermatologischen Zubereitungen eingesetzt.
- Die erfindungsgemäßen Verbindungen lassen sich ohne Schwierigkeiten in gängige kosmetische, mundhygienische oder dermatologische Zubereitungen einarbeiten, vorteilhaft in Pumpsprays, Aerosolsprays, Cremes, Salben, Tinkturen, Lotionen, Zahnpasten, Mundwässer, Zahngele, Nagelpflegeprodukte (z.B. Nagellacke, Nagellackentferner, Nagelbalsame) und dergleichen.
- Die erfindungsgemäßen Verbindungen können auch mikroverkapselt, sprühgetrocknet, als Einschluß-Komplexe oder als Extrusions-Produkte vorliegen und in dieser Form verwendet und beispielsweise in Formulierungen eingearbeitet werden.
- Gegebenenfalls können die Eigenschaften der derart modifizierten Wirkstoffe durch sogenanntes "Coaten" mit geeigneten Materialien im Hinblick auf eine gezieltere Freisetzung weiter optimiert werden, wozu vorzugsweise wachsartige Kunststoffe wie z.B. Polyvinylalkohol verwendet werden.
- Die Mikroverkapselung der Wirkstoffe kann beispielsweise durch das sogenannte Koazervationsverfahren mit Hilfe von Kapselmaterialien z.B. aus polyurethan-artigen Stoffen oder Weichgelatine, erfolgen. Die sprühgetrockneten Wirkstoffe können beispielsweise durch Sprühtrocknung einer den Wirkstoff enthaltenden Emulsion, bzw. Dispersion hergestellt werden, wobei als Trägerstoffe modifizierte Stärken, Proteine, Dextrin und pflanzliche-Gummen verwendet werden können. Einschluß-Komplexe können z.B: durch Eintragen von Dispersionen von dem Wirkstoff und Cyclodextrinen oder Harnstoffderivaten in ein geeignetes Lösungsmittel, z.B. Wasser, hergestellt werden. Extrusions-Produkte können durch Verschmelzen der Wirkstoffe mit einem geeigneten wachsartigen Stoff und durch Extrusion mit nachfolgender Erstarrung, ggf. in einem geeigneten Lösungsmittel, z.B. Isopropanol, erfolgen.
- Es ist auch möglich und gegebenenfalls vorteilhaft, die erfindungsgemäß einzusetzenden Verbindungen der Formel (I) mit anderen kosmetischen, mundhygienischen und/oder dermatologischen Wirkstoffen zu kombinieren, beispielsweise mit anderen antimikrobiell, antimycotisch bzw. antiviral wirksamen Stoffen.
- Erfindungsgemäße Zubereitungen können Hilfsstoffe enthalten, wie sie üblicherweise in kosmetischen oder therapeutischen Zubereitungen verwendet werden, z.B. Konservierungsmittel, Abrasiva, anitbakterielle Mittel, entzündungshemmende Mittel, irritationsverhindernde Mittel, irritationshemmende Mittel, antimikrobielle Mittel, Antioxidantien, Adstringentien, antiseptische Mittel, Antistatika, Binder, Puffer, Trägermaterialien, Chelatbildnder, Zellstimulantien, reinigende Mittel, pflegende Mittel, oberflächenaktive Substanzen, deodorierende Mittel, Weichmacher, Bakterizide, Emulgatoren, Enzyme, ätherische Öle, Filmbildner, Fixateure, Schaumbildner, Schaumstabilisatoren, Substanzen zum Verhindern des Schäumens, Schaumbooster, gelierende Mittel, gelbildende Mittel, feuchtigkeitsspendende Mittel, anfeuchtende Substanzen, feuchthaltende Substanzen, bleichende Mittel, optisch aufhellende Mittel, schmutzabweisende Mittel, reibungsverringernde Mittel, Gleitmittel, Trübungsmittel, deckfähige Mittel, Glanzmittel, Polymere, Pulver, Proteine, abschleifende Mittel, Silicone, hautberuhigende Mittel, hautreinigende Mittel, hautpflegende Mittel, hautheilende Mittel, kühlende Mittel, hautkühlende Mittel, wärmende Mittel, hautwärmende Mittel, Stabilisatoren, UV-absorbierende Mittel, UV-Filter, suspendierende Mittel, Verdickungsmittel, Vitamine, Öle, Wachse, Fette, Phospholipide, gesättigte Fettsäuren, ein- oder mehrfach ungesättigte Fettsäuren, α-Hydroxysäuren, Polyhydroxyfettsäuren, Verflüssiger, Farbstoffe, farbschützende Mittel, Pigmente, Aromen, Geschmackstoffe, Parfums, Riechstoffe oder andere übliche Bestandteile solcher Zubereitungen wie Alkohole, Polyole, Elektrolyte, organische Lösungsmittel oder Silikonderivate.
- Riech- und Geschmackstoffe, die sich mit den sekundären Alkoholen der Formel (I) in kosmetischen, mundhygienischen oder dermatologischen Zubereitungen kombinieren lassen, finden sich beispielsweise in Bauer, Garbe, Surburg, Common Fragrance and Flavor Materials, Wiley-VCH, 4. Aufl., 2001 oder in S. Arctander, Perfume and Flavor Chemicals, Vol. I und II, Montclair, N. J., 1969, Selbstverlag.
- Darüber hinaus können erfindungsgemäße Zubereitungen zudem UV-Absorber (UV-Filter) wie z.B. Neo Heliopane® zum Schutz vor Sonneneinstrahlung enthalten. Geeignete Lichtschutzmittel sind z.B. organische UV-Absorber aus der Klasse der 4-Aminobenzoesäure und Derivate, Salicylsäure-Derivate, Benzophenon-Derivate, Dibenzoylmethan-Derivate, Diphenylacrylate, 3-Imidazol-4-yl-acrylsäure und deren Ester, Benzofuran-Derivate, Benzylidenmalonat-Deriva-te, polymere UV-Absorber, enthaltend einen oder mehrere Silizium-organische Reste, Zimtsäure-Derivate, Campher-Derivate, Trianilino-s-Triazin-Derivate, 2-Hydroxyphenylbenzotriazol-Derivate, 2-Phenylbenzimidazol-5-sulfonsäure und deren Salze, Anthranilsäure-menthylester, Benzotriazolderivate.
- Die Liste der nachfolgend genannten UV-Absorber, die vorteilhaft in erfindungsgemäßen Zubereitungen eingesetzt werden können, soll selbstverständlich nicht limitierend sein: 4-Aminobenzoesäure, 4-Aminobenzoesäureethylester, 4-Dimethylaminobenzoesäure-2-ethylhexylester, 4-Aminobenzoesäureglycerinester, Salicylsäure-homomenthylester (Homosalate), Salicylsäure-2-ethylhexylester, Triethanolamin-salicylat, 4-Isopropylbenzylsalicylat, Anthranilsäurementhylester, Diisopropyl-zimtsäureethylester, p-Methoxyzimtsäure-2-ethylhexylester, Diisopropylzimt-säuremethylester, p-Methoxyzimtsäureisoamylester, p-Methoxyzimtsäure-diethanolaminsalz, p-Methoxyzimtsäure-isopropylester, 2-Ethylhexyl-2-cyano-3,3-diphenylacrylat, Ethyl-2-cyano-3,3'-diphenylacrylat, 2-Phenylbenzimidazol-5-sul-fonsäure und deren Salze, 3-(4'-Trimethylammonium)-benzyliden-bornan-2-on-methylsulfat, Terephthalyliden-dibornansulfonsäure und Salze, 4-t-Butyl-4'-me-thoxydibenzoylmethan, β-Imidazol-4(5)-acrylsäure (Urocaninsäure), 2-Hydroxy-4-methoxybenzophenon, 2-Hydroxy-4-methoxybenzophenon-5-sulfonsäure, Di-hydroxy-4-methoxybenzophenon, 2,4-Dihydroxybenzophenon, Tetrahydroxyben-zophenon, 2,2'-Dihydroxy-4,4'-dimethoxybenzophenon, 2-Hydroxy-4-n-octoxy-benzophenon, 2-Hydroxy-4-methoxy-4'-methylbenzophenon, 3-(4'-Sulfo)benzyl-idenbornan-2-on und deren Salze, 3-(4'-Methylbenzyliden)campher, 3-Benzyl-idencampher, 3,3'-(1,4-Phenylenedimethine)-bis-(7,7-dimethyl-2-oxo-bicyclo-[2.2.1]heptane-1-methansulfonsäure und deren Salze, 4-Isopropyldibenzoyl-methan, 2,4,6-Trianilino-(p-carbo-2'-ethylhexyl-1'-oxy)-1,3,5-triazin, Phenylen-1,4-bis-(2-benzimidazyl)-3,3'-5,5'-tetrasulfonsäure und deren Salze, besonders die entsprechenden Natrium, Kalium- oder Trierthanolammonium-Salze, insbesondere das Dinatriumsalz, 2,2'-(1,4-Phenylen)-bis-(1H-benzimidazol-4,6-disulfonsäure), Mononatriumsalz, N-[(2 und 4)-[2-(oxoborn-3-yliden)methyl]ben-zyl]-acrylamid-Polymer, Phenol, 2-(2H-benzotriazol-2-yl)-4-methyl-6-(2-methyl-3(1,3,3,3-tetramethyl-1-(trimethylsilyl)-oxy)-disiloxyanyl)-propyl), 4,4'-[(6-[4-(1,1-Dimethyl)-aminocarbonyl)- phenylamino]-1,3,5-triazin-2,4-diyl)diimino]-bis-(benzoesäure-2-ethylhexylester), 2,2'-Methylen-bis-(6-(2H-benztriazol-2-yl)-4-1,1,3,3-tetramethylbutyl)-phenol), 2,4-bis-[4-(2-ethylhexyloxy)-2-hydroxyphenyl]-1,3,5-triazin, Benzylidenmalonat-Polysiloxan, Glyceryl-ethylhexanoatdimethoxy-cinnamat, Dinatrium-2,2'-dihydroxy-4,4'-dimethoxy-5,5'-disulfo-benzophenon, Dipropylenglykolsalicylat, Natriumhydroxymethoxybenzophenon-sulfonat, 4,4',4-(1,3,5-Triazin-2,4,6-triyltriimino)-tris-benzoesäure-tris(2-ethylhexylester), 2,4-Bis-[{(4-(2-Ethyl-hexyloxy)-2-hydroxy}-phenyl]-6-(4-methoxyphenyl)-1,3,5-triazin, 2,4-Bis-[{(4-(3-sulfonato)-2-hydroxy-propyloxy)-2-hydroxy}-phenyl]-6-(4-methoxyphenyl)-1,3,5-triazin-Natriumsalz, 2,4-Bis-[{(3-(2-Propyloxy)-2-hy-droxy-propyloxy)-2-hydroxy}-phenyl]-6-(4-methoxy-phenyl)-1,3,5-triazin, 2,4-Bis-[{4-(2-Ethyl-hexyloxy)-2-hydroxy}-phenyl]-6-[4-(2-methoxyethyl-carbonyl)-phenyl-amino]-1,3,5-triazin, 2,4-Bis-[{4-(3-(2-propyloxy)-2-hydroxy-propyloxy)-2-hydro-xy}-phenyl]-6-[4-(2-ethylcarboxyl)-phenylamino]-1,3,5-triazin, 2,4-Bis-[{4-(2-Ethyl-hexyloxy)-2-hydroxy}-phenyl]-6-(1-methyl-pyrrol-2-yl-)-1,3,5-triazin, 2,4-Bis-[{4-tris-(trimethylsiloxy-silylpropyloxy)-2-hydroxy}-phenyl]-6-(4-methoxyphenyl)-1,3,5-triazin, 2,4-Bis-[{4-(2''-Methylpropenyloxy)-2-hydroxy}-phenyl]-6-(4-me-thoxyphenyl)-1,3,5-triazin, 2,4-Bis-[{4-(1',1',1',3'5',5',5'-Heptamethylsiloxy-2''-methyl-propyloxy)-2-hydroxy}-phenyl]-6-(4-methoxyphenyl)-1,3,5-triazin.
- Die Menge nicht-partikulärer UV-Absorber (eine oder mehrere Verbindungen) in erfindungsgemäßen Zubereitungen beträgt vorzugsweise 0,001 bis 30 Gew.-%, Die Gesamtmenge der Filtersubstanzen beträgt vorzugsweise 0,1 bis 30 Gew.-%, besonders bevorzugt 0,2 bis 10 Gew.-%, insbesondere 0,5 bis 8 Gew.-%, bezogen auf das Gesamtgewicht der Zubereitung.
- Es können darüber hinaus partikuläre UV-Filter oder anorganische Pigmente eingesetzt werden, die gegebenenfalls hydrophobisiert sein können, wie die Oxide des Titans (TiO2), Zinks (ZnO), Eisens (Fe2O3), Zirkoniums (ZrO2), Siliciums (SiO2), Mangans (z.B. MnO), Aluminiums (Al2O3), Cers (z.B. Ce2O3) und/oder Mischungen davon.
- Für kosmetische und/oder dermatologische Anwendungen geeigneten und/oder gebräuchlichen Antioxidantien können in den erfindungsgemäßen Zubereitungen verwendet werden.
- Vorteilhaft werden die Antioxidantien gewählt aus der Gruppe bestehend aus Aminosäuren (z.B. Glycin, Histidin, Tyrosin, Tryptophan) und deren Derivate, Imidazole (z.B. Urocaninsäure) und deren Derivate, Peptide wie D,L-Carnosin, D-Carnosin, L-Carnosin und deren Derivate (z.B. Anserin), Carotinoide, Carotine (z.B. α-Carotin, β-Carotin, Lycopin) und deren Derivate, Liponsäure und deren Derivate (z.B. Dihydroliponsäure), Aurothioglucose, Propylthiouracil und andere Thiole (z.B. Thioredoxin, Glutathion, Cystein, Cystin, Cystamin und deren Glycosyl-, N-Acetyl-, Methyl-, Ethyl-, Propyl-, Amyl-, Butyl- und Lauryl-, Palmitoyl-, Oleyl-, γ-Linoleyl-, Cholesteryl- und Glycerylester) sowie deren Salze, Dilaurylthiodipropionat, Distearylthiodipropionat, Thiodipropionsäure und deren Derivate (Ester, Ether, Peptide, Lipide, Nukleotide, Nukleoside und Salze) sowie Sulfoximinverbindungen (z.B. Buthioninsulfoximine, Homocysteinsulfoximin, Buthioninsulfone, Penta-, Hexa-, Heptathioninsulfoximin) in sehr geringen verträglichen Dosierungen (z.B. pmol bis μmol/kg), ferner (Metall)-Chelatoren (z.B. α-Hydroxyfettsäuren, Palmitinsäure, Phytinsäure, Lactoferrin), α-Hydroxysäuren (z.B. Zitronensäure, Milchsäure, Apfelsäure), Huminsäure, Gallensäure, Gallenextrakte, Bilirubin, Biliverdin, EDTA, EGTA und deren Derivate, ungesättigte Fettsäuren und deren Derivate (z.B. γ-Linolensäure, Linolsäure, Ölsäure), Folsäure und deren Derivate, Ubichinon und Ubichinol und deren Derivate, Vitamin C und Derivate (z.B.
- Ascorbylpalmitat, Mg-Ascorbylphosphat, Ascorbylacetat), Tocopherole und Derivate (z.B. Vitamin E-acetat), Vitamin A und Derivate (Vitamin A-palmitat) sowie Konyferylbenzoat des Benzoeharzes, Rutinsäure und deren Derivate, Ferulasäure und deren Derivate, Butylhydroxytoluol, Butylhydroxyanisol, Nordihydroguajakharzsäure, Nordihydroguajaretsäure, Trihydroxybutyrophenon, Harnsäure und deren Derivate, Mannose und deren Derivate, Zink und dessen Derivate (z.B. ZnO, ZnSO4) Selen und dessen Derivate (z.B. Selenmethionin), Stilbene und deren Derivate (z.B. Stilbenoxid, Trans-Stilbenoxid) und die erfindungsgemäß geeigneten Derivate (Salze, Ester, Ether, Zucker, Nukleotide, Nukleoside, Peptide und Lipide) dieser genannten Wirkstoffe. Die vorstehende Aufstellung ist nicht limitierend.
- Die Menge der Antioxidantien (eine oder mehrere Verbindungen) in erfindungsgemäßen Zubereitungen beträgt vorzugsweise 0,001 bis 30 Gew.-%, besonders bevorzugt 0,05 bis 20 Gew.-%, insbesondere 1 bis 10 Gew.-%, bezogen auf das Gesamtgewicht der Zubereitung.
- Sofern Vitamin E und/oder dessen Derivate das oder die Antioxidantien darstellen, ist es vorteilhaft, deren jeweilige Konzentration aus dem Bereich von 0,001 bis 10 Gew.-%, bezogen auf das Gesamtgewicht der Zubereitung, zu wählen.
- Sofern Vitamin A, bzw. Vitamin-A-Derivate, bzw. Carotine bzw. deren Derivate das oder die Antioxidantien darstellen, ist es vorteilhaft, deren jeweilige Konzentration aus dem Bereich von 0,001 bis 10 Gew.-%, bezogen auf das Gesamtgewicht der Zubereitung, zu wählen.
- Beispiele für oberflächenaktive Substanzen, die in erfindungsgemäßen Zubereitungen vorteilhaft verwendet werden können, sind herkömmliche Seifen, z.B. Fettsäuresalze des Natriums, Alkylsulfate, Alkylethersulfate, Alkan- und Alkylbenzolsulfonate, Sulfoacetate, Sulfobetaine, Sarcosinate, Amidosulfobetaine, Sulfosuccinate, Sulfobernsteinsäure halbester, Alkylethercarboxylate, Eiweiß-Fettsäure-Kondensate, Alkylbetaine und Amidobetaine, Fettsäurealkanolamide, Polyglycolether-Derivate.
- Die oberflächenaktive Substanz kann in einer Konzentration zwischen 1 Gew.-% und 50 Gew.-% in dem Shampoonierungsmittel, bzw. der Wasch-, Dusch- oder Badezubereitung, vorliegen.
- Erfindungsgemäße kosmetische und dermatologische Zubereitungen können in verschiedenen Formen vorliegen, wie sie z.B. üblicherweise für diesen Typ von Zubereitungen eingesetzt werden. So können sie z.B. eine Lösung, eine Emulsion vom Typ Wasser-in-Öl (W/O) oder vom Typ Öl-in-Wasser (O/W), oder eine multiple Emulsion, beispielsweise vom Typ Wasser-in-Öl-in-Wasser (W/O/W), ein Gel, eine Hydrodispersion, einen festen Stift oder auch ein Aerosol darstellen.
- Sofern die erfindungsgemäße kosmetische oder dermatologische Zubereitung eine Lösung oder Lotion darstellt, können als Lösungsmittel verwendet werden:
- – Wasser oder wässrige Lösungen;
- – Öle, wie Triglyceride der Caprin- oder der Caprylsäure, vorzugsweise aber Rizinusöl;
- – Fette, Wachse und andere natürliche und synthetische Fettkörper, vorzugsweise Ester von Fettsäuren mit Alkoholen niedriger C-Zahl, z.B. mit Isopropanol, Propylenglykol oder Glycerin, oder Ester von Fettalkoholen mit Alkansäuren niedriger C-Zahl oder mit Fettsäuren;
- – Alkohole, Diole oder Polyole niedriger C-Zahl, sowie deren Ether, vorzugsweise Ethanol, Isopropanol, Propylenglykol, Glycerin, Ethylenglykol, Ethylenglykolmonoethyl- oder -monobutylether, Propylenglykolmonomethyl, -monoethyl- oder -monobutylether, Diethylenglykolmonomethyl- oder -monoethylether und analoge Produkte.
- Insbesondere werden Gemische der vorstehend genannten Lösungsmittel verwendet. Bei alkoholischen Lösungsmitteln kann Wasser ein weiterer Bestandteil sein.
- Erfindungsgemäße Zubereitungen sind oft vorzugsweise Emulsionen und enthalten z.B. die genannten Fette, Öle, Wachse und anderen Fettkörper, sowie Wasser und einen Emulgator, wie er üblicherweise für einen solchen Typ der Formulierung verwendet wird.
- Erfindungsgemäße Zubereitungen können als Gele vorliegen und enthalten dann üblicherweise Alkohole niedriger C-Zahl, z.B. Ethanol, Isopropanol, 1,2-Propandiol, Glycerin und Wasser bzw. ein vorstehend genanntes Öl in Gegenwart eines Verdickungsmittels, das bei ölig-alkoholischen Gelen vorzugsweise Siliciumdioxid oder ein Aluminiumsilikat, bei wäßrig-alkoholischen oder alkoholischen Gelen vorzugsweise ein Polyacrylat ist.
- Erfindungsgemäße kosmetische und dermatologische Zubereitungen können als Gele vorliegen, die neben mindestens einer erfindungsgemäßen Verbindung und dafür üblicherweise verwendeten Lösungsmitteln noch organische Verdickungsmittel, z.B. Gummiarabikum, Xanthangummi, Natriumalginat, Cellulose-Derivate, vorzugsweise Methylcellulose, Hydroxymethylcellulose, Hydroxyethylcellulose, Hydroxypropylcellulose, Hydroxypropylmethylcellulose oder anorganische Verdickungsmittel, z.B. Aluminiumsilikate wie beispielsweise Bentonite, oder ein Gemisch aus Polyethylenglykol und Polyethylenglykolstearat oder -distearat, enthalten. Das Verdickungsmittel ist im Gel z.B. in einer Menge zwischen 0,1 und 30 Gew.-%, bevorzugt zwischen 0,5 und 15 Gew.-%, enthalten.
- Erfindungsgemäße Zubereitungen können in Form fester Stifte vorliegen und enthalten dann z.B. natürliche oder synthetische Wachse, Fettalkohole oder Fettsäureester. Bevorzugt werden Lippenpflegestifte sowie desodorierende Stifte ("Deo-Sticks").
- Als Treibmittel für erfindungsgemäße, aus Aerosolbehältern versprühbare erfindungsgemäße kosmetische oder dermatologische Zubereitungen sind die üblichen bekannten leichtflüchtigen, verflüssigten Treibmittel, z.B. Kohlenwasserstoffe (Propan, Butan, Isobutan) geeignet, die allein oder in Mischung miteinander eingesetzt werden können. Auch Druckluft ist vorteilhaft zu verwenden.
- Es ist oft vorteilhaft, erfindungsgemäße Zubereitungen abzupuffern. Vorteilhaft ist ein pH-Bereich von 3,5–7,5. Besonders günstig ist es, den pH-Wert in einem Bereich von 4,0–6,5 zu wählen.
- Die erfindungsgemäßen kosmetischen, mundhygienischen und/oder dermatologischen Zubereitungen können zur Behandlung der Haut, der Haare sowie Zähne und Mundschleimhaut im Sinne einer dermatologischen Behandlung oder einer Behandlung im Sinne der pflegenden Kosmetik dienen. Sie können aber auch in Schminkprodukten in der dekorativen Kosmetik oder in der Mundhygiene eingesetzt werden.
- Zur Anwendung werden die erfindungsgemäßen kosmetischen, mundhygienischen und/oder dermatologischen Formulierungen in der für Kosmetika und Dermatika üblichen Weise auf die Haut, auf die Zähne, das Zahnfleisch sowie die Mundschleimhaut und Zunge und/oder die Haare in ausreichender Menge aufgebracht.
- Unter Mundhygieneprodukten (mundhygienischen Zubereitungen) werden in der vorliegenden Erfindung die dem Fachmann geläufigen Formulierungen zur Reinigung und Pflege der Mundhöhle und des Rachenraumes sowie zur Erfrischung des Atems verstanden. Bekannte und gebräuchliche mundhygienische Formulierungen sind sowohl Cremes, Gele, Pasten, Schäume, Emulsionen, Suspensionen, Areosole, Sprays als auch Kapseln, Granulate, Pastillen, Tabletten, Bonbons oder Kaugummis, ohne dass diese Aufzählung an Darreichungsformen bzgl. der Einsatzmöglichkeiten limitierend ist. Solche Formulierungen dienen dazu, Zahnsubstanz und Mundhöhle zu reinigen und zu pflegen sowie den Atem zu erfrischen.
- Werden die erfindungsgemäß zu verwendenden sekundären Alkohole der Formel (I) in Deodorantien eingearbeitet, so können diese Deodorantien beispielsweise flüssig als Aerosol-Spray, Pump-Spray, Gel, Roll-on und dergleichen oder auch als feste Zubereitung wie beispielsweise als Stift oder Puder vorliegen.
- Ebenfalls vorteilhaft sind solche kosmetischen und/oder dermatologischen Zubereitungen, die in der Form eines Sonnenschutzmittels vorliegen. Vorteilhaft enthalten diese zusätzlich mindestens einen UVA-Filter und/oder mindestens einen UVB-Filter und/oder mindestens ein anorganisches Pigment.
- Bei erfindungsgemäßen Zubereitungen zur Behandlung der Haare handelt es sich beispielsweise um Shampoonierungsmittel, Zubereitungen, die beim Spülen der Haare vor oder nach der Shampoonierung, vor oder nach der Dauerwellbehandlung, vor oder nach der Färbung oder Entfärbung der Haare angewendet werden, um Zubereitungen zum Fönen oder Einlegen der Haare, Zubereitungen zum Färben oder Entfärben, um eine Frisier- und Behandlungslotion, einen Haarlack oder um Dauerwellmittel. In einer bevorzugte Ausführungsform handelt es sich bei den Zubereitungen um Mittel gegen Kopfschuppen, wie beispielsweise Antischuppenshampoos.
- Erfindungsgemäße kosmetische Zubereitungen, die ein Shampoonierungsmittel oder eine Wasch-, Dusch- oder Badezubereitung darstellen, enthalten vorzugsweise mindestens eine anionische, nicht-ionische oder amphotere oberflächenaktive Substanz oder Gemische daraus.
- Liegt eine erfindungsgemäße kosmetische oder dermatologische Zubereitung in Form einer Lotion vor, die ausgespült und z.B. vor oder nach der Entfärbung, vor oder nach der Shampoonierung, zwischen zwei Shampoonierungsschritten, vor oder nach der Dauerwellbehandlung angewendet wird, so handelt es sich dabei z.B. um wässrige oder wässrig-alkoholische Lösungen, die gegebenenfalls oberflächenaktive Substanzen enthalten, bevorzugt nicht-ionische oder kationische oberflächenaktive Substanzen, deren Konzentration zwischen 0,1 und 10 Gew.-%, vorzugsweise zwischen 0,2 und 5 Gew.-%, liegen kann. Diese kosmetische oder dermatologische Zubereitung kann auch ein Aerosol mit den üblicherweise dafür verwendeten Hilfsmitteln darstellen.
- Eine erfindungsgemäße kosmetische Zubereitung in Form einer Lotion, die nicht ausgespült wird, insbesondere eine Lotion zum Einlegen der Haare, eine Lotion, die beim Fönen der Haare verwendet wird, eine Frisier- und Behandlungslotion, stellt im allgemeinen eine wässrige, alkoholische oder wässrig-alkoholische Lösung dar und enthält mindestens ein kationisches, anionisches, nicht-ionisches oder amphoteres Polymer oder auch Gemische derselben.
- Erfindungsgemäße kosmetische und dermatologische Zubereitungen zur Behandlung und Pflege der Haare können als Emulsionen vorliegen, die vom nicht-ionischen oder anionischen Typ sind. Nicht-ionische Emulsionen enthalten dabei neben Wasser Öle oder Fettalkohole, die beispielsweise polyethoxyliert oder polypropoxyliert sein können, oder auch Gemische aus den beiden organischen Komponenten. Diese Emul sionen enthalten gegebenenfalls kationische oberflächenaktive Substanzen. Anionische Emulsionen sind vorzugsweise vom Typ einer Seife und enthalten mindestens eine erfindungsgemäße ethoxylierte oder propoxylierte organische Verbindung mit anionischem oder nicht-ionischem Charakter.
- Die folgenden Beispiele sollen die Verkörperungen der vorliegenden Erfindungen verdeutlichen. Prozentangaben beziehen sich stets auf Gewichtsprozent, sofern nicht andere Angaben gemacht werden.
- 1. Herstellung sekundärer Alkohole der Formel I:
- 1.1 4-(Alkylphenyl)-butan-2-ole:
- Allgemeine Vorschrift:
- In einem 2-l Rührkolben werden 290,4 g (5 mol) Aceton, 330 g Wasser und 13,3 g (0,33 mol) Natriumhydroxid vorgelegt. Der aromatische Aldehyd (2,5 mol) wird in 100 g Aceton gelöst und in 1 h dosiert. Nach 90-minütigem Nachrühren bei 25°C wird Eissessig neutralisiert und das überschüssige Aceton bei Normaldruck abdestilliert. Der Rückstand wird 2mal mit 200 ml Toluol extrahiert. Die Organische Phase wird abgetrennt und mit Wasser gewaschen. Der nach Abdestillieren des Toluols verbleibende Rückstand wird zur Isolierung des 4-(Alkylphenyl)-3-buten-2-ons destilliert. 1 mol des erhaltenen 4-(Alkylphenyl)-3-buten-2-on wird in 300 ml Ethanol in Gegenwart von 3 Gew.-% Raney Nickel bei einer Temperatur von 20–40°C und einem Wasserstoffdruck von 10 bis 20 bar hydriert. Nach Aufnahme der theoretisch berechneten Wasserstoffmenge wird die Hydrierung abgebrochen, der Katalysator abfiltriert und der Ansatz vom Lösungsmittel befreit. Das als Rückstand erhaltene 4-(Alkylphenyl)butan-2-ol wird destillativ gereinigt.
- 1.2. 4-(Alkylphenyl)-3-methyl-butan-2-ole
- Allgemeine Vorschrift:
- In einem 2-l Rührkolben werden 433 g (6 mol) Methylethylketon sowie 1,5 mol des aromatischen Aldehyds vorgelegt und auf 60°C erwärmt. Innerhalb von 1.5h werden 100g 50%iger Schwefelsäure zudosiert. Nach 4-6h Nachrühren bei 60-65°C wird abgekühlt, mit Natriumbicarbonat-Lösung neutralisiert und das überschüssige Methylethylketon bei Normaldruck abdestilliert. Der Rückstand wird zweimal mit 200 ml Toluol extrahiert. Die organische Phase wird abgetrennt und mit Wasser gewaschen. Der nach Abdestillieren des Toluols verbleibende Rückstand wird zur Isolierung des 4-(Alkylphenyl)-3-methyl-buten-2-ons destilliert. 1 mol des erhaltenen 4-(Alkylphenyl)-3-buten-2-on wird in 300 ml Ethanol in Gegenwart von 3 Gew.-% Raney Nickel bei einer Temperatur von 180°C und einem Wasserstoffdruck von 10 bis 20 bar hydriert. Nach Aufnahme der theoretisch berechneten Wasserstoffmenge wird die Hydrierung abgebrochen, der Katalysator abfiltriert und der Ansatz vom Lösungsmittel befreit. Das als Rückstand erhaltene 4-(Alkylphenyl)butan-2-ol wird destillativ gereinigt.
- Auf diese Weise wurden beispielsweise erhalten:
- a) 4-(2,4,5-Trimethylphenyl)-2-butanol aus 2,4,5-Trimethylbenzaldehyd: 1H NMR (200 MHz; CDCl3, δ ppm): 1.24 (d, J = 6,2 Hz, 3H), 1.62-1.75 (m, 2H), 2,19 (s, 6H), 2.25 (s, 3H), 2.50-2.76 (m, 2H), 3.77 (sext., J = 6,2 Hz, 1H), 6.91 (s, 2H). 13C NMR (200 MHz; CDCl3, δ ppm): 18.6, 19.10, 19.18, 23.56, 29.03, 39.90, 67.83, 130.11, 131.51, 132.85, 133.74, 133.79, 137.33. Geruch: Sehr geringe Intensität; leicht Reseda-artig nach Styrolylalkohol.
- b) 3-Methyl-4-(2-methylphenyl)-2-butanol aus 2-Methylbenzaldehyd: 1H NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,4:1): 0.88 (d, J = 6,77 Hz, 3H), 1.21 (d, J = 6,38 Hz, 3H), 1.34 (d, J = 5,27 Hz, 1H), 1.70-1.88 (m, 1H), 2.29 (dd, J = 13,5 Hz, J = 9,74 Hz, 1H), 2.32 (s, 3H), 2.83 (dd, J = 13,5 Hz, J = 5,7 Hz, 1H), 3.71-3.85 (m, 1H), 7.10-7.14 (m, 4H). 13C NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,4:1): 13.59; 19.47, 19.56, 36.30, 40.27, 70.41, 125.77, 129.94, 130.12 (2C), 136.14, 139.16. Geruch: Fast geruchlos, leicht citrisch
- c) 4-(4-Isopropylphenyl)-3-methyl-2-butanol aus 4-Isopropylbenzaldehyd: 1H NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,3:1): 0.86 (d, J = 6,84 Hz, 3H), 1.21 (d, J = 6,39 Hz, 3H), 1.24 (d, J = 6.92 Hz, 6H), 1.70-1.88 (m, 1H), 2.32 (dd, J = 13,4 Hz, J = 9,3 Hz, 1H), 2,77 (hept., J = 6,98 Hz, 1H), 2.82 (dd, J = 13,4 Hz, J = 5,92 Hz, 1H), 3.62-3.92 (m, 1H), 7.0-7.20 (m, 4H). 13C NMR (200 MHz; CDCl3; δ ppm, Isomerengemisch 1,3:1): 13.62, 20.39, 24.04 (2C), 33.61, 38.79, 41.68, 70.21, 126.11, 126.13, 128.90 (2C), 138.27, 146.06. Geruch: Fast geruchlos, leicht wäßrig-citrisch
- d) 4-(4-Isobutylphenyl)-3-methyl-2-butanol aus 4-Isobutylbenzaldehyd: 1H NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,07:1): 0.86 (d, J = 6,81 Hz, 3H), 0.89 (d, J = 6.6 Hz, 6H), 1.21 (d, J = 6,31 Hz, 3H), 1.70-1.88 (m, 1H), 1.70-1.95 (m, 1H), 2.32 (dd, J = 13,4 Hz, J = 9,3 Hz, 1H), 2.44 (d, J = 7,13 Hz, 2H), 2,78 (dd, J = 13.4 Hz, J = 9,4 Hz, 1H), 3.62- 3.92 (m, 1H), 7.0-7.20 (m, 4H). 13C NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,07:1): 13.56, 20.46, 22.36 (2C), 30.21, 38.88, 41.71, 44.99, 70.28, 128.70, 128.85, 128.86 (2C), 138.10, 138.95. Geruch: Schwach rosig, citrisch
- e) 3-Methyl-4-(2,4,5-trimethylphenyl)-2-butanol aus 2,4,5-Trimethylbenzaldehyd: 1H NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,1:1): 0.87 (d, J = 6,8 Hz, 3H), 1.22 (d, J = 6,3 Hz, 3H), 1.66-1.88 (m, 1H), 2.20 (s, 9H), 2.2-2.3 (m, 1H), 2.6-2.8 (m, 1H), 3.70-3.82 (m, 1H), 6.8 (s, 1 N), 6.9 (s, 1H). 13C NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,1:1): 14.64, 18.91, 19.19 (2C), 19.64, 35.84, 41.16, 71.77, 131.22, 131.52, 133.29, 133.38, 133.72, 136.37. Geruch: Fast geruchlos, leicht blumig, zimartig
- f) 3-Methyl-4-(2,4,6-trimethylphenyl)-2-butanol aus 2,4,6-Trimethylbenzaldehyd: H NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,1:1): 0.86 (d, J = 6,9 Hz, 3H), 1.25 (d, J = 6,3 Hz, 3H), 1.70-1.90 (m, 1H), 2,24 (s, 3H), 2.29 (s, 6H), 2.42 (dd, J = 13.6 Hz, J = 9,7 Hz, 1H), 2.8 (dd, J = 13,6 Hz, J = 9,7 Hz, 1H), 3.70-3.82 (m, 1H), 6.8 (s, 2H). 13C NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,1:1): 14.60, 20.34, 20.41 (2C), 20.75, 31.57, 40.81, 72.33, 128.85, 128.94, 134.78, 134.84, 136.47, 136.59. Geruch: Leicht schwach frisch, Selleri
- g) 4-(3,4-Dimethylphenyl)-3-methyl-2-butanol aus 3,4-Dimethylbenzaldehyd 1H NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,1:1): 0.86 (d, J = 6,8 Hz, 3H), 1.19 (d, J = 6,41 Hz, 3H), 1.70-1.86 (m, 1H), 2.23 (s, 6H), 2.33 (dd, J = 13,3 Hz, J = 8,8 Hz, 1H), 2.72-2.80 (m, 1H), 3,66-3.76 (m, 1H), 6.7-7.1 (m, 3H). 13C NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,1:1): 14.56, 19.27, 19.73; 20.36, 38.73, 41.73, 70.25, 126.38, 129.35, 130.34, 133.66, 136.13, 138.26. Geruch: Leicht Rosig, etwas lactonig
- h) 4-(3,4-Dimethylphenyl)-2-butanol aus 3,4-Dimethylbenzaldehyd 1H NMR (200 MHz; CDCl3, δ ppm): 1.22 (d, J = 6,1 Hz, 3H), 1.68-1.80 (m, 2H), 2.22 (s, 3H), 2.23 (s, 3H), 2.45-2.80 (m, 2H), 3.82 (sext. J = 6,1 Hz, 1H), 6.90-7.10 (m, 3H). 13C NMR (200 MHz; CDCl3, δ ppm): 19.26, 19.72, 23.48, 31.61, 40.95, 67.43, 125.58, 129.50, 129.62, 133.72, 136.31, 139.33 Geruch: Geruchlos
- i) 4-(2,4-Dimethylphenyl)-3-methyl-2-butanol aus 2,4-Dimethylbenzaldehyd 1H NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,1:1): 0.87 (d, J = 6,5 Hz, 3H), 1.22 (d, J = 6,3 Hz, 3H), 1.70-1.86 (m, 1H), 2.28 (s, 6H), 2.36 (dd, J = 13,4 Hz, J = 8,9 Hz, 1H), 2.86 (dd, J = 13,5 Hz, J = 8,9 Hz, 1H), 3,66-3.82 (m, 1H), 6.7-7.06 (m, 3H). 13C NMR (200 MHz; CDCl3, δ ppm, Isomerengemisch 1,1:1): 14.57, 19.44, 19.64, 20.86, 35.87, 40.97, 71.74, 126.19, 129.81, 130.95, 135.18, 136.00, 138.02. Geruch: Fast geruchlos, uncharakteristisch
- j) 4-(2,4-Dimethylphenyl)-2-butanol aus 2,4-Dimethylbenzaldehyd 1H NMR (200 MHz; CDCl3, δ ppm): 1.24 (d, J = 6,2 Hz, 3H), 1.65-1.75 (m, 2H), 2.28 (s, 6H), 2.45-2.80 (m, 2H), 3.86 (sext. J = 6,1 Hz), 6.90-7.10 (m, 3H). 13C NMR (200 MHz; CDCl3, δ ppm): 19.16, 20.85, 23.53, 29.03, 39.69, 67.68, 126.48, 128.58, 130.89, 135.19, 135.54, 137.02. Geruch: Fast geruchlos, uncharakteristisch
- 2. MHK-Werte
- 2.1 Bestimmung der minimalen Hemmkonzentration
- Die minimale Hemmkonzentration (MHK) der beanspruchten Substanzen wurde im Reihenverdünnungstest (H. Brandis, G. Pulverer: Lehrbuch der Medizinischen Mikrobiologie. 6. Neubearbeitete Auflage, Gustav Fischer Verlag Stuttgart, 1988; Seite 200ff.) gegen verschiedene kosmetisch relevante Keime bestimmt. Der Test wurde auf das Mikrotiterplattenformat übertragen und als MHK-Wert die Konzentration bestimmt, bei der nach 16 Stunden Inkubation bei der Wellenlänge von 620 nm kein signifikanter Anstieg der Trübung gegenüber den Kontrollen beobachtet wurde.
- Die Ergebnisse sind in Tabelle 2 dargestellt.
- 2.2 In-vitro Test zur Mundgeruchsreduktion
- Der Test beruht auf der Arbeit von Goldberg und Rosenberg (Production of Oral Malodor in an in vitro System, S. Goldberg and M. Rosenberg, pp. 143–150, in: Bad Breath- A multidisciplinary Approach, Eds: D. van Steenberghe, M. Rosenberg, Leuven University Press, 1996) und wurde zur besseren Reproduzierbarkeit angepaßt.
- Ein steriles Flüssigmedium, das mit frischem Morgenspeichel angeimpft wird, wird für einige Tage bei 37°C in einer Coy-Box bebrütet und anschließend von einem Prüferpanel abgerochen.
- Es hat sich ein intensiver, typischer Mundgeruch gebildet. Nicht angeimpfte Kontrollen haben nur einen schwachen Mediengeruch. Als Kontrolle für die Tests wurde Triclosan® in einer Konzentration von 0,05 % dazugegeben. Die angeimpften Röhrchen hatten nach der Inkubation den gleichen Geruch wie die nichtangeimpften Röhrchen.
- Die Verwendung von typischen Aromastoffen für Oral Care Anwendungen, zeigte bei Einsatz von 0,1% Konzentrationen im Test zumeist einen sehr unangenehmen Mischgeruch, der aus der Mischung des Mundgeruchs mit dem Aromastoff entstand. Teilweise war der Aromastoff nicht mehr wahrnehmbar, da er offenbar durch die Mikroorganismen des Speichels abgebaut wurde.
- Bei Einsatz der in Tabelle 2 beschriebenen Substanzen konnte bis zu den angegebenen minimalen Wirkkonzentrationen kein Geruch analog zu Triclosan festgestellt werden.
- Andere als antimikrobiell wirksam bekannte Aromastoffe wie Eugenol und Thymol unterdrückten bei 0,1 % Einsatzkonzentration ebenfalls die Mundgeruchsbildung, hatten aber den Nachteil des sehr deutlichen Eigengeruch.
- Analog zur MHK wird unter der minimalen Wirkkonzentration (MWK) im vorliegenden Falle die minmale Konzentration verstanden, bei der die Bildung von Mundgeruch gehemmt wird.
- Die durch Zusammenmischung der jeweiligen Bestandteile erhaltene flüssige Phase wird zusammen mit einem Propan-Butan-Gemisch (2:7) im Verhältnis 39:61 in Aerosolbehälter abgefüllt.
- Für Teil A wurden alle Substanzen bis auf das Zinkoxid auf 85°C erhitzt und das Zinkoxid in der Mischung sorgfältig dispergiert. Die Komponenten des Teils B wurde gemischt, auf 85°C erhitzt und unter Rühren zu Teil A gegeben. Zu der Mischung aus den Teilen A und B wurde Teil C zugegeben und anschließend die Mischung mit einem Dispergierwerkzeug homogenisiert.
Claims (13)
- Verwendung einer Verbindung der Formel I als Wirkstoff gegen Gram-positive Bakterien, worin m und n unabhängig voneinander 0 und 1 bedeuten, R1 bis R6 unabhängig voneinander Wasserstoff oder Methyl bedeuten und A eine Phenylgruppe, die gegebenenfalls mit weiteren C1- bis C5-Alkylsubstituenten substituiert ist, eine Norboran-2-yl- oder eine Pinan-3-yl-Gruppe ist.
- Verwendung nach Anspruch 1, wobei mindestens eine in der Verbindung vorhandene Gruppe R1 bis R6 Methyl ist, falls A eine Phenylgruppe oder eine monoalkylsubstituierte Phenylgruppe ist.
- Verwendung nach einem der vorangehenden Ansprüche, wobei die Gram-positiven Bakterien ausgewählt sind aus der Gruppe, die besteht aus: (a) Körpergeruch verursachenden, (b) unreine Haut und/oder Akne verursachenden, (c) Mundgeruch und/oder schlechten Atem verursachenden Bakterien.
- Verwendung nach einem der vorangehenden Ansprüche, wobei die Gram-positiven Bakterien ausgewählt sind aus der Gruppe von Körpergeruch verursachenden Bakterien, die aus Bakterien der Gattungen Corynebacterium, Staphylococcus, Micrococcus und Brevibacterium besteht, insbesondere Corynebacterium xerosis, Staphylococcus epidermidis, Staphylococcus hominis, Micrococcus luteus, Micrococcus sedentarius und Brevibacterium epidermidis.
- Verwendung nach einem der Ansprüche 1–3, wobei die Gram-positiven Bakterien ausgewählt sind aus der Gruppe von unreine Haut und/oder Akne verursachenden Bakterien der Gattung Propionibacterium, insbesondere Propionibacterium acnes.
- Verwendung nach einem der Ansprüche 1–3, wobei die Gram-positiven Bakterien ausgewählt sind aus der Gruppe von Mundgeruch und/oder schlechten Atem verursachenden Bakterien der Gattungen Actinomyces, Eubacterium, Rothia und Stomatococcus, insbesondere Actinomyces viscosus, Eubacterium brachy, Eubacterium nodatum, Eubacterium saburreum, Eubacterium timidum Eubacterium yurrii, Rothia denticariosus und Stomatococcus mucilaginosus.
- Verwendung nach einem der vorangehenden Ansprüche, wobei für die Verbindung der Formel I zusätzlich gilt: m + n = 0 oder 2.
- Verwendung nach einem der vorangehenden Ansprüche, wobei die Verbindung der Formel I zumindest drei CH3-Gruppen besitzt.
- Verfahren zur Bekämpfung Gram-positiver Bakterien, wobei die Bakterien mit einer antimikrobiell wirksamen Menge einer Verbindung der Formel I gemäß Anspruch 1 oder einer Mischung von zumindest zwei unterschiedlichen Verbindungen der Formel I gemäß Anspruch 1 kontaktiert werden.
- Verfahren zur Bekämpfung von (a) durch Gram-positive Bakterien verursachtem Körpergeruch (b) durch Gram-positive Bakterien verursachte unreiner Haut und/oder Akne und/oder (c) durch Gram-positive Bakterien verursachtem Mundgeruch und/oder schlechten Atem, wobei die Gram-positiven Bakterien mit einer antimikrobiell wirksamen Menge einer Verbindung der Formel I gemäß Anspruch 1 oder einer Mischung von zumindest zwei unterschiedlichen Verbindungen der Formel 1 gemäß Anspruch 1 kontaktiert werden.
- 4-(2,4,5-Trimethylphenyl)-2-butanol (Verbindung 14), 3-Methyl-4-(2,4,5-timethylphenyl)-2-butanol (Verbindung 4), 4-(4-Isopropylphenyl)-3-methyl-2-butanol (Verbindung 11), 4-(4-Isobutylphenyl)-3-methyl-2-butanol (Verbindung 6), 3-Methyl-4-(2,4,6-trimethylphenyl)-2-butanol (Verbindung 8), 4-(3,4-Dimethylphenyl)-3-methyl-2-butanol (Verbindung 17), 4-(3,4-Dimethylphenyl)-2-butanol (Verbindung 18), 4-(2,4-Dimethylphenyl)-3-methyl-2-butanol (Verbindung 12), 4-(2,4-Dimethylphenyl)-2-butanol (Verbindung 13).
- Zubereitung, umfassend eine antibakteriell wirksame Menge einer Verbindung nach Anspruch 11, sowie zumindest einen weiteren Bestandteil.
- Verfahren zum Verhindern des Befalls einer kosmetischen Substanz oder Formulierung mit grampositiven Bakterien, wobei die Substanz oder Formulierung mit einer antibakteriell wirksamen Menge einer oder mehrerer Verbindungen der Formel I nach Anspruch 1 vermischt wird.
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE2003130697 DE10330697A1 (de) | 2003-07-08 | 2003-07-08 | Sekundäre Alkohole als antimikrobielle Wirkstoffe |
| PCT/EP2004/051078 WO2005004601A1 (de) | 2003-07-08 | 2004-06-09 | Sekundäre alkohole als antimikrobielle wirkstoffe |
| EP04741770A EP1651037A1 (de) | 2003-07-08 | 2004-06-09 | Sekundäre alkohole als antimikrobielle wirkstoffe |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE2003130697 DE10330697A1 (de) | 2003-07-08 | 2003-07-08 | Sekundäre Alkohole als antimikrobielle Wirkstoffe |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| DE10330697A1 true DE10330697A1 (de) | 2005-02-03 |
Family
ID=33559952
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE2003130697 Withdrawn DE10330697A1 (de) | 2003-07-08 | 2003-07-08 | Sekundäre Alkohole als antimikrobielle Wirkstoffe |
Country Status (3)
| Country | Link |
|---|---|
| EP (1) | EP1651037A1 (de) |
| DE (1) | DE10330697A1 (de) |
| WO (1) | WO2005004601A1 (de) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2168570A2 (de) | 2008-09-30 | 2010-03-31 | Symrise GmbH & Co. KG | Extrakte von Isochrysis sp. |
| EP2193785A2 (de) | 2008-12-05 | 2010-06-09 | Symrise GmbH & Co. KG | Extrakte von Tetraselmis sp. für kosmetische und therapeutische Zwecke |
| EP3045161A1 (de) | 2015-01-18 | 2016-07-20 | Symrise AG | Aktive Zusammensetzung enthaltend 1,2-Hexandiol und 1,2-Octandiol |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102005012476A1 (de) * | 2005-03-16 | 2006-09-21 | Henkel Kgaa | Inhibitoren von Staphylococcus hominis in Deodorantien und Antitranspirantien |
| DE102008043586A1 (de) | 2007-11-12 | 2009-05-14 | Symrise Gmbh & Co. Kg | Riechstoffakkorde zur Bekämpfung der Wahrnehmung von Körpergeruch |
| EP2133102B1 (de) | 2008-03-19 | 2014-12-03 | Symrise AG | Geruchsreduzierende Stoffe |
| EP2307357A1 (de) | 2008-05-30 | 2011-04-13 | Symrise AG | L-methyl-n-(2-hydroxyphenyl)carbamat |
| WO2009101216A2 (en) | 2009-04-28 | 2009-08-20 | Symrise Gmbh & Co. Kg | Omega-cyclohexylalkan-1-oles and use thereof as antimicrobial actives to combat body odor |
| DE102009027778A1 (de) * | 2009-07-16 | 2011-01-20 | Henkel Ag & Co. Kgaa | Kosmetische und dermatologisch-topische Zusammensetzungen mit haarwuchsminimierender oder -inhibierender Wirkung |
| EP2662434B2 (de) | 2012-05-10 | 2023-08-16 | Symrise AG | Verwendung bestimmter Verbindungen zum Verstärken von Gerüchen |
| JP5789642B2 (ja) * | 2013-07-02 | 2015-10-07 | 花王株式会社 | 刺激感緩和剤 |
| JP6362690B2 (ja) | 2013-11-08 | 2018-07-25 | フイルメニツヒ ソシエテ アノニムFirmenich Sa | フローラルな香りを有するアルコール |
| EP2966159B1 (de) | 2014-07-07 | 2017-02-22 | Symrise AG | Mischungen mit angereichten E-Isomeren von ungesättigten makrocyclischen Moschusverbindungen |
| EP2966158B2 (de) | 2014-07-07 | 2024-03-13 | Symrise AG | Isomerenmischungen von ungesättigten makrocyclischen Moschusverbindungen |
| WO2020098901A1 (de) | 2018-11-12 | 2020-05-22 | Symrise Ag | Verwendung von 1-ethyl-4,4-dimethyl-cyclohexan-derivaten als duftstoffe |
| JP7231728B2 (ja) | 2018-11-13 | 2023-03-01 | シムライズ アーゲー | スズランノートを有する賦香成分 |
| WO2020125993A1 (en) | 2018-12-20 | 2020-06-25 | Symrise Ag | Alicyclic musk fragrance compounds |
| CN116997317A (zh) | 2021-03-19 | 2023-11-03 | 弗门尼舍有限公司 | 抗微生物加香消费品 |
| EP4519244A1 (de) | 2022-05-03 | 2025-03-12 | Symrise AG | Neue riechstoffverbindungen |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4006218A (en) * | 1974-07-08 | 1977-02-01 | Johnson & Johnson | Potentiated medicaments |
| DE4124664A1 (de) * | 1991-07-25 | 1993-01-28 | Henkel Kgaa | Antimikrobiell wirksame gemische |
-
2003
- 2003-07-08 DE DE2003130697 patent/DE10330697A1/de not_active Withdrawn
-
2004
- 2004-06-09 EP EP04741770A patent/EP1651037A1/de not_active Withdrawn
- 2004-06-09 WO PCT/EP2004/051078 patent/WO2005004601A1/de not_active Ceased
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2168570A2 (de) | 2008-09-30 | 2010-03-31 | Symrise GmbH & Co. KG | Extrakte von Isochrysis sp. |
| US10463891B2 (en) | 2008-09-30 | 2019-11-05 | Symrise Ag | Extracts of Isochrysis sp. |
| US12128257B2 (en) | 2008-09-30 | 2024-10-29 | Symrise Ag | Extracts of Isochrysis sp |
| EP2193785A2 (de) | 2008-12-05 | 2010-06-09 | Symrise GmbH & Co. KG | Extrakte von Tetraselmis sp. für kosmetische und therapeutische Zwecke |
| US9445988B2 (en) | 2008-12-05 | 2016-09-20 | Symrise Ag | Extracts of Tetraselmis sp |
| EP3348255A1 (de) | 2008-12-05 | 2018-07-18 | Symrise AG | Extrakte der tetraselmis sp. für kosmetische und therapeutische zwecke |
| EP3045161A1 (de) | 2015-01-18 | 2016-07-20 | Symrise AG | Aktive Zusammensetzung enthaltend 1,2-Hexandiol und 1,2-Octandiol |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1651037A1 (de) | 2006-05-03 |
| WO2005004601A1 (de) | 2005-01-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE10330697A1 (de) | Sekundäre Alkohole als antimikrobielle Wirkstoffe | |
| EP2455157B1 (de) | Lösungsvermittler für kosmetische zubereitungen | |
| JP5763048B2 (ja) | 皮膚刺激低下剤としてトランス−tert−ブチルシクロヘキサノールを含む組成物 | |
| JP6828136B2 (ja) | 抗菌組成物 | |
| JP2022036981A (ja) | 化粧品ブレンド | |
| EP1008586B1 (de) | Oligomere Diarylbutadiene | |
| KR101669663B1 (ko) | 화장품 조성물의 안정화 | |
| DE69720111T2 (de) | Vorläufer von Duftstoffen | |
| JP6896732B2 (ja) | 安定な味および匂いを有する組成物 | |
| JP6918694B2 (ja) | 化粧品配合物におけるuvフィルターのための可溶化剤 | |
| WO2002038537A1 (de) | Neue indanylidenverbindungen | |
| KR20170063993A (ko) | 화장료 조성물 | |
| EP1954831A2 (de) | Ahr-mediatoren | |
| DE202021004519U1 (de) | Zusammensetzungen, die ein oder mehrere (Bio)-Alkandiole mit Antioxidantien enthalten | |
| EP1725520A2 (de) | Formulierungshilfsmittel (aminopropansäure derivative) in kosmetischen oder dermatologischen zubereitungen | |
| KR20180120787A (ko) | 미용 조성물의 안정화 | |
| EP1539128B1 (de) | Verwendung von substanzen zum schutz der haut | |
| EP1776351A1 (de) | Uv-filter | |
| DE202021004361U1 (de) | Multifunktionelle Mischungen, die mehrere (Bio)-Alkandiole enthalten | |
| EP2094641B1 (de) | Dialkylcarbonate von verzweigten alkoholen und ihre verwendung | |
| JP6802163B2 (ja) | 炭水化物部分エステルを含有する組成物 | |
| CN106102707B (zh) | 用于化妆品配制剂中的uv过滤剂的增溶剂 | |
| WO2005037239A2 (de) | Verwendung einer verbindung aus der gruppe der heterodiazole oder eines salzes der verbindung, die verbindung oder das salz enthaltende kosmetische oder therapeutische formulierung, die verbindung oder das salz als therapeutisches mittel sowie das salz selbst | |
| DE69923505T2 (de) | Oximcarbonsäure Derivate | |
| DE102009029630A1 (de) | Antimikrobielle Amide |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8139 | Disposal/non-payment of the annual fee |