-
TRIPHENYLENSILANWIRTE
-
Die beanspruchte Erfindung wurde durch, im Namen von und/oder in Verbindung mit einer oder mehreren der folgenden Parteien eines gemeinsamen Universitätsforschungsabkommens gemacht: die Mitglieder des Verwaltungsrats der University of Michigan, der Princeton University, der University of Southern California und der Universal Display Corporation. Das Abkommen war zum und vor dem Zeitpunkt, an dem die beanspruchte Erfindung gemacht wurde, in Kraft, und die beanspruchte Erfindung wurde als ein Ergebnis der Aktivitäten im Rahmen des Abkommens gemacht.
-
GEBIET DER ERFINDUNG
-
Die Erfindung betrifft Verbindungen die zur Verwendung als Wirtsmaterialien in OLEDs geeignet sind, insbesondere Verbindungen, die Arylgerman- und Arylsilangruppen umfassen.
-
HINTERGRUND
-
Optoelektronische Vorrichtungen, die organische Materialien nutzen, werden aus einer Anzahl von Gründen immer wünschenswerter. Viele der Materialien, die zur Herstellung solcher Vorrichtungen verwendet werden, sind relativ kostengünstig, wodurch organische optoelektronische Vorrichtungen potenziell Kostenvorteile gegenüber anorganischen Vorrichtungen besitzen. Darüber hinaus können die inhärenten Eigenschaften von organischen Materialien, wie beispielsweise ihre Flexibilität, diese für bestimmte Anwendungen, wie beispielsweise die Fertigung auf einem flexiblen Substrat, besonders geeignet machen. Beispiele für organische optoelektronische Vorrichtungen umfassen organische Leuchtdioden (OLEDs, Organic Light Emitting Diodes), organische Fototransistoren, organische Fotovoltaikzellen und organische Fotodetektoren. Bei OLEDs können die organischen Materialien Leistungsvorteile gegenüber herkömmlichen Materialien aufweisen. Beispielsweise kann die Wellenlänge, bei der eine organische lichtemittierende Schicht Licht emittiert, in der Regel leicht mit geeigneten Dotierstoffen eingestellt werden.
-
OLEDs nutzen dünne organische Filme, die Licht emittieren, wenn Spannung an der Vorrichtung angelegt wird. OLEDs werden eine zunehmend interessantere Technologie für den Einsatz in Anwendungen wie beispielsweise Flachbildschirme, Beleuchtung und Hintergrundbeleuchtung. Mehrere OLED-Materialien und -Konfigurationen werden in den
US-Pat. Nrn. 5,844,363 ,
6,303,238 und
5,707,745 beschrieben, die hier durch Bezugnahme in ihrer Gesamtheit aufgenommen werden.
-
Eine Anwendung für phosphoreszierende emittierende Moleküle ist ein Vollfarbbildschirm. Industrienormen für einen solchen Bildschirm fordern Pixel, die geeignet sind, bestimmte Farben zu emittieren, die als „gesättigte” Farben bezeichnet werden. Insbesondere fordern diese Normen gesättigte rote, grüne und blaue Pixel. Farbe kann unter Verwendung der CIE-Koordinaten, die aus dem Stand der Technik wohl bekannt sind, gemessen werden.
-
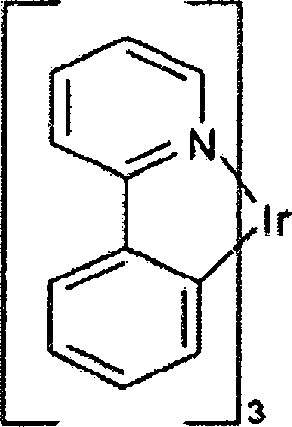
Ein Beispiel für ein grün emittierendes Molekül ist Tris(2-phenylpyridin)iridium, als Ir(ppy)
3 bezeichnet, welches die folgende Struktur aufweist:
-
In dieser und in den nachfolgenden Figuren zeigen wir hier die dative Bindung von Stickstoff an Metall (hier Ir) als eine gerade Linie.
-
Wie hier verwendet, beinhaltet der Begriff „organisch” polymere Materialien sowie niedermolekulare organische Materialien, die verwendet werden können, um organische optoelektronische Vorrichtungen zu fertigen. „Kleines Molekül” bezieht sich auf jedes organische Material, das kein Polymer ist und „kleine Moleküle” können tatsächlich ziemlich groß sein. Kleine Moleküle können in einigen Fällen sich wiederholende Einheiten enthalten. Die Verwendung einer langkettigen Alkylgruppe als Substituent beispielsweise entfernt ein Molekül nicht aus der Klasse der „kleine Moleküle”. Kleine Moleküle können auch in Polymere aufgenommen werden, zum Beispiel als eine seitenständige Gruppe an einem Polymerrückgrat oder als Teil des Rückgrats. Kleine Moleküle können auch als Kerneinheit eines Dendrimers dienen, das aus einer Reihe von chemischen Schalen, die auf der Kerneinheit aufbauen, besteht. Die Kerneinheit eines Dendrimers kann ein fluoreszierender oder phosphoreszierender Kleinmolekül-Emitter sein. Ein Dendrimer kann eine „kleines Molekül” sein, und es wird angenommen, dass alle Dendrimere, die derzeit auf dem Gebiet der OLEDs verwendet werden, kleine Moleküle sind.
-
Wie hier verwendet, bedeutet „oben” am weitesten entfernt von dem Substrat, während „unten” am nächsten zu dem Substrat bedeutet. Wenn eine erste Schicht als „angeordnet über” einer zweiten Schicht beschrieben wird, ist die erste Schicht weiter entfernt von dem Substrat angeordnet. Es können sich auch andere Schichten zwischen der ersten und der zweiten Schicht befinden, außer es ist angegeben, dass die erste Schicht „in Kontakt mit” der zweiten Schicht steht. Zum Beispiel kann eine Kathode als „angeordnet über” einer Anode beschrieben werden, obwohl es verschiedene dazwischen liegende organische Schichten gibt.
-
Wie hier verwendet, bedeutet „in Lösung verarbeitbar”, fähig sein, in einem flüssigen Medium gelöst oder dispergiert zu werden oder in einem solchen transportiert und/oder aus diesem abgeschieden zu werden, entweder in Form einer Lösung oder einer Suspension.
-
Ein Ligand kann als „fotoaktiv” bezeichnet werden, wenn angenommen wird, dass der Ligand direkt zu den fotoaktiven Eigenschaften eines emittierenden Materials beiträgt. Ein Ligand kann als „Hilfs”ligand („ancillary”) bezeichnet werden, wenn angenommen wird, dass der Ligand nicht zu den fotoaktiven Eigenschaften eines emittierenden Materials beiträgt, obwohl ein Hilfsligand möglicherweise die Eigenschaften eines fotoaktiven Liganden verändert.
-
Wie hier verwendet und wie dies allgemein von einem Fachmann auf dem Gebiet verstanden wird, ist ein erstes „höchstes besetztes Molekülorbital”(HOMO, Highest Occupied Molecular Orbital)- oder „niedrigstes unbesetztes Molekülorbital”(LUMO, Lowest Unoccupied Molecular Orbital)-Energieniveau „größer als” oder „höher als” ein zweites HOMO- oder LUMO-Energieniveau, wenn das erste Energieniveau näher an dem Vakuumenergieniveau liegt. Da Ionisierungspotentiale (IP) als negative Energie relativ zu einem Vakuumniveau gemessen werden, entspricht ein höheres HOMO-Energieniveau einem IP mit einem kleineren absoluten Wert (ein IP, das weniger negativ ist). In ähnlicher Weise entspricht ein höheres LUMO-Energieniveau einer Elektronenaffinität (EA) mit einem kleineren Absolutwert (eine EA, die weniger negativ ist). In einem herkömmlichen Energieniveaudiagramm, in dem sich das Vakuumniveau oben befindet, ist das LUMO-Energieniveau eines Materials höher als das HOMO-Energieniveau des gleichen Materials. Ein „höheres” HOMO- oder LUMO-Energieniveau erscheint näher am oberen Ende eines solchen Diagramms als ein „niedrigeres” HOMO- oder LUMO-Energieniveau.
-
Wie hier verwendet und wie dies allgemein von einem Fachmann auf dem Gebiet verstanden würde, ist eine erste Austrittsarbeit „größer als” oder „höher als” eine zweite Austrittsarbeit, wenn die erste Austrittsarbeit einen höheren Absolutwert besitzt. Weil Austrittsarbeiten in der Regel als negative Zahlen bezogen auf Vakuumniveau gemessen werden, bedeutet dies, dass eine „höhere” Austrittsarbeit negativer ist. In einem herkömmlichen Energieniveaudiagramm, mit dem Vakuumniveau am oberen Ende, wird eine „höhere” Austrittsarbeit als in Abwärtsrichtung weiter entfernt vom Vakuumniveau dargestellt. Somit folgen die Definitionen von HOMO- und LUMO-Energieniveaus einer anderen Konvention als die Austrittsarbeiten.
-
Weitere Einzelheiten über OLEDs und die oben beschriebenen Definitionen können in dem
US-Pat. Nr. 7,279,704 gefunden werden, das hier durch Bezugnahme in seiner Gesamtheit aufgenommen wird.
-
ZUSAMMENFASSUNG DER ERFINDUNG
-
In einem Aspekt wird eine Verbindung mit der folgenden Formel I bereitgestellt:
-
In der Verbindung der Formel I sind Ar und Ar' unabhängig voneinander ausgewählt aus der Gruppe bestehend aus Phenyl, Biphenyl, Naphthalin, Dibenzothiophen und Dibenzofuran, welche optional weiter substituiert sind. Z ist ausgewählt aus Si und Ge. L ist eine Einfachbindung oder umfasst eine Aryl- oder Heteroarylgruppe mit 5–20 Kohlenstoffatomen, die optional weiter substituiert ist. A ist eine Gruppe, die direkt an Z gebunden ist und ausgewählt ist aus der Gruppe bestehend aus Triphenylen, Tetraphenylen, Pyren, Naphthalin, Fluoranthen, Chrysen, Phenanthren, Azatriphenylen, Azatetraphenylen, Azapyren, Azanaphthalin, Azafluoranthen, Azachrysen, Azaphenanthren und Kombinationen davon, welche optional weiter mit einer oder mehreren Gruppen ausgewählt aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Aryl, Aryloxy und Kombinationen davon substituiert sind.
-
B enthält eine Gruppe ausgewählt aus der Gruppe bestehend aus Carbazol, Dibenzofuran, Dibenzothiophen, Dibenzoselenophen, Azacarbazol, Azadibenzofuran, Azadibenzothiophen, Azadibenzoselenophen und Kombinationen davon, welche optional weiter mit einer oder mehreren Gruppen ausgewählt aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon substituiert sind, und worin die Substitution optional an die Carbazol-, Dibenzofuran-, Dibenzothiophen-, Dibenzoselenophen-, Azacarbazol-, Azadibenzofuran-, Azadibenzothiophen- oder Azadibenzoselenophengruppe kondensiert ist.
-
Gemäß einem Aspekt ist A
wobei K
1 bis K
12 unabhängig voneinander ausgewählt sind aus N und C-R', und wobei R' ausgewählt ist aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Aryl, Aryloxy und Kombinationen davon.
-
Gemäß einem Aspekt ist B ausgewählt aus der Gruppe bestehend aus Folgenden:
wobei X
1–X
15 unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus N und C-R'', wobei R'' ausgewählt ist aus einer Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon, und wobei Y
1 und Y
2 unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus O, S und Se.
-
Gemäß einem Aspekt ist A ausgewählt aus der Gruppe bestehend aus Folgenden:
-
Gemäß einem Aspekt ist A ausgewählt aus der Gruppe bestehend aus Folgenden:
-
Gemäß einem Aspekt ist B ausgewählt aus der Gruppe bestehend aus Folgenden:
wobei Y
1 ausgewählt ist aus der Gruppe bestehend aus O, S und Se, wobei R ausgewählt ist aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon.
-
Gemäß einem Aspekt wird L unabhängig ausgewählt aus der Gruppe bestehend aus Folgenden:
-
Gemäß einem Aspekt ist A Triphenylen. Gemäß einem anderen Aspekt ist A Pyren. Gemäß einem Aspekt sind Ar und Ar' Phenyl. Gemäß einem Aspekt ist L Phenyl.
-
Gemäß einem Aspekt ist die Verbindung ausgewählt aus der Gruppe bestehend aus Verbindung 1–Verbindung 35.
-
Gemäß einem Aspekt wird eine erste Vorrichtung bereitgestellt. Die erste Vorrichtung umfasst eine organische lichtemittierende Vorrichtung, welche ferner eine Anode, eine Kathode und eine organische Schicht, die zwischen der Anode und der Kathode angeordnet ist, umfasst, die eine Verbindung mit der Formel I umfasst:
-
In der Verbindung der Formel I sind Ar und Ar' unabhängig voneinander ausgewählt aus der Gruppe bestehend aus Phenyl, Biphenyl, Naphthalin, Dibenzothiophen und Dibenzofuran, welche optional weiter substituiert sind. Z ist aus Si und Ge ausgewählt. L ist eine Einfachbindung oder umfasst eine Aryl- oder Heteroarylgruppe mit 5–20 Kohlenstoffatomen, die optional weiter substituiert ist. A ist eine Gruppe, die direkt an Z gebunden ist und ausgewählt ist aus der Gruppe bestehend aus Triphenylen, Tetraphenylen, Pyren, Naphthalin, Fluoranthen, Chrysen, Phenanthren, Azatriphenylen, Azatetraphenylen, Azapyren, Azanaphthalin, Azafluoranthen, Azachrysen, Azaphenanthren und Kombinationen davon, welche optional weiter mit einer oder mehreren Gruppen ausgewählt aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Aryl, Aryloxy und Kombinationen davon substituiert sind.
-
B enthält eine Gruppe ausgewählt aus der Gruppe bestehend aus Carbazol, Dibenzofuran, Dibenzothiophen, Dibenzoselenophen, Azacarbazol, Azadibenzofuran, Azadibenzothiophen, Azadibenzoselenophen und Kombinationen davon, welche optional weiter mit einer oder mehreren Gruppen ausgewählt aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon substituiert sind, und wobei die Substitution optional an die Carbazol-, Dibenzofuran-, Dibenzothiophen-, Dibenzoselenophen-, Azacarbazol-, Azadibenzofuran-, Azadibenzothiophen- oder Azadibenzoselenophengruppe kondensiert ist.
-
Gemäß einem Aspekt ist die organische Schicht eine Emissionsschicht und die Verbindung der Formel I ist ein Wirt. Gemäß einem anderen Aspekt umfasst die organische Schicht weiter einen emittierenden Dotierstoff.
-
Gemäß einem Aspekt ist der emittierende Dotierstoff ein Übergangsmetallkomplex, der mindestens einen Liganden ausgewählt aus der Gruppe bestehend aus Folgenden aufweist:
wobei R
a, R
b und R
c für Mono-, Di-, Tri oder Tetra-Substitutionen stehen können, wobei R
a, R
b und R
c unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon; und wobei zwei benachbarte Substituenten von R
a, R
b und R
c optional verbunden sind, um einen kondensierten Ring zu bilden.
-
Gemäß einem Aspekt weist der emittierende Dotierstoff die Formel
auf, wobei D ein 5- oder 6-gliedriger carbozyklischer oder heterozyklischer Ring ist, wobei R
1, R
2 und R
3 unabhängig voneinander für Mono-, Di-, Tri oder Tetra-Substitution stehen, wobei jedes von R
1, R
2 und R
3 unabhängig voneinander ausgewählt ist aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon, wobei R
1 optional mit Ring D verbunden sein kann, wobei n 1, 2 oder 3 ist und wobei X-Y ein anderer Ligand ist.
-
Gemäß einem Aspekt umfasst die Vorrichtung ferner eine zweite organische Schicht, die eine nicht-emittierende Schicht ist, und die Verbindung mit der Formel I ist ein Material in der zweiten organischen Schicht.
-
Gemäß einem anderen Aspekt ist die zweite organische Schicht eine Sperrschicht und die Verbindung mit der Formel I ist ein Sperrmaterial in der zweiten organischen Schicht. Gemäß einem Aspekt ist die zweite organische Schicht eine Elektronentransportschicht, und die Verbindung mit der Formel I ist ein elektronentransportierendes Material in der zweiten organischen Schicht.
-
Gemäß einem Aspekt ist die erste Vorrichtung ein Konsumartikel. Gemäß einem anderen Aspekt ist die erste Vorrichtung eine organische lichtemittierende Vorrichtung. Gemäß einem Aspekt umfasst die erste Vorrichtung eine Leuchtfläche.
-
KURZE BESCHREIBUNG DER ZEICHNUNGEN
-
1 zeigt eine organische lichtemittierende Vorrichtung.
-
2 zeigt eine invertierte organische lichtemittierende Vorrichtung, die keine separate Elektronentransportschicht aufweist.
-
3 zeigt eine Verbindung der Formel I.
-
4 zeigt eine beispielhafte Vorrichtung, die Verbindungen der Formel I enthält.
-
5 zeigt die Differentialscanningkalorimetrie-Scans für ausgewählte Verbindungen der Formel I und für ausgewählte Vergleichsverbindungen.
-
AUSFÜHRLICHE BESCHREIBUNG
-
In der Regel umfasst eine OLED mindestens eine organische Schicht, die zwischen einer Anode und einer Kathode angeordnet ist und elektrisch mit diesen verbunden ist. Wenn ein Strom angelegt wird, injiziert die Anode Löcher und die Kathode injiziert Elektronen in die organische Schicht bzw. organischen Schichten. Die injizierten Löcher und Elektronen wandern jeweils zur entgegengesetzt geladenen Elektrode. Wenn sich ein Elektron und ein Loch an dem gleichen Molekül befinden, wird ein „Exziton”, ein lokalisiertes Elektron-Loch-Paar, das einen angeregten Energiezustand aufweist, gebildet. Licht wird emittiert, wenn das Exziton über einen photoemissiven Mechanismus relaxiert. In einigen Fällen kann das Exziton an einem Excimer oder an einem Exciplex lokalisiert sein. Nichtstrahlende Mechanismen, wie beispielsweise thermische Relaxation, können auch auftreten, werden jedoch in der Regel als unerwünscht angesehen.
-
Die ersten OLEDs verwendeten emittierende Moleküle, die Licht aus ihren Singulettzuständen („Fluoreszenz”) emittierten, wie zum Beispiel in dem
US-Pat. Nr. 4,769,292 offenbart, das durch Bezugnahme in seiner Gesamtheit aufgenommen wird. Fluoreszenzemission erfolgt in der Regel in einem Zeitraum von weniger als 10 Nanosekunden.
-
In jüngerer Zeit wurden OLEDs vorgestellt, die emittierende Materialien aufweisen, die Licht aus Triplettzuständen („Phosphoreszenz”) emittieren.
Baldo et al., „Highly Efficient Phosphoreszent Emission from Organic Electroluminescent Devices", Nature, Band 395, 151–154, 1998; („Baldo-I”) und
Baldo et al., „Very high-efficiency green organic light-emitting devices based an electrophosphorescence", Appl. Phys. Lett., Band 75, Nr. 3, 4–6 (1999) („Baldo-II”), die durch Bezugnahme in ihrer Gesamtheit aufgenommen werden. Phosphoreszenz wird ausführlicher in dem
US-Pat. Nr. 7,279,704 in den Spalten 5–6, die durch Bezugnahme aufgenommen werden, beschrieben.
-
1 zeigt eine organische lichtemittierende Vorrichtung
100. Die Figuren sind nicht notwendigerweise maßstabsgetreu gezeichnet. Vorrichtung
100 kann ein Substrat
110, eine Anode
115, eine Lochinjektionsschicht
120, eine Lochtransportschicht
125, eine Elektronensperrschicht
130, eine Emissionsschicht
135, eine Lochsperrschicht
140, eine Elektronentransportschicht
145, eine Elektroneninjektionsschicht
150, eine Schutzschicht
155 und eine Kathode
160 beinhalten. Kathode
160 ist eine Verbundkathode, die eine erste leitende Schicht
162 und eine zweite leitende Schicht
164 aufweist. Vorrichtung
100 kann durch Abscheiden der beschriebenen Schichten in dieser Reihenfolge hergestellt werden. Die Eigenschaften und Funktionen dieser verschiedenen Schichten sowie beispielhafte Materialien werden ausführlicher in
US 7,279,704 in Spalten 6–10 beschrieben, die durch Bezugnahme aufgenommen werden.
-
Für jede dieser Schichten stehen weitere Beispiele zur Verfügung. Zum Beispiel wird eine flexible und transparente Substrat-Anode-Kombination in dem
US-Pat. Nr. 5,844,363 offenbart, das durch Bezugnahme in seiner Gesamtheit aufgenommen wird. Ein Beispiel für eine p-dotierte Lochtransportschicht ist m-MTDATA, dotiert mit F.sub.4-TCNQ in einem Molverhältnis von 50:1, wie in der US-Patentanmeldung Nr. 2003/0230980 offenbart, die durch Bezugnahme in ihrer Gesamtheit aufgenommen wird. Beispiele für Emissions- und Wirtsmaterialien werden in dem
US-Pat. Nr. 6,303,238 an Thompson et al. offenbart, das durch Bezugnahme in seiner Gesamtheit aufgenommen wird. Ein Beispiel für eine n-dotierte Elektronentransportschicht ist mit Li in einem Molverhältnis von 1:1 dotiertes BPhen, wie in der US-Patentanmeldung Nr. 2003/0230980 offenbart wird, die durch Bezugnahme in ihrer Gesamtheit aufgenommen wird.
US-Pat. Nrn. 5,703,436 und
5,707,745 , die durch Bezugnahme in ihrer Gesamtheit aufgenommen werden, offenbaren Beispiele von Kathoden, einschließlich Verbundkathoden, die eine dünne Metallschicht, wie beispielsweise Mg:Ag, mit einer darüber liegenden transparenten, elektrisch leitfähigen, durch Sputtern abgeschiedenen ITO-Schicht aufweisen. Die Theorie und die Verwendung von Sperrschichten wird ausführlicher in dem
US-Pat. Nr. 6,097,147 und der US-Patentanmeldungsveröffentlichung Nr. 2003/0230980 beschrieben, die durch Bezugnahme in ihrer Gesamtheit aufgenommen werden. Beispiele für Injektionsschichten werden in der US-Patentanmeldungsveröffentlichung Nr. 2004/0174116 bereitgestellt, die durch Bezugnahme in ihrer Gesamtheit aufgenommen wird. Eine Beschreibung von Schutzschichten kann in der US-Patentanmeldungsveröffentlichung Nr. 2004/0174116 gefunden werden, die durch Bezugnahme in ihrer Gesamtheit aufgenommen wird.
-
2 zeigt eine invertierte OLED 200. Die Vorrichtung beinhaltet ein Substrat 210, eine Kathode 215, eine Emissionsschicht 220, eine Lochtransportschicht 225 und eine Anode 230. Vorrichtung 200 kann durch Abscheiden der beschriebenen Schichten in dieser Reihenfolge hergestellt werden. Da die häufigste OLED-Konfiguration eine Kathode aufweist, die über der Anode angeordnet ist, und Vorrichtung 200 Kathode 215 aufweist, die unter Anode 230 angeordnet ist, kann Vorrichtung 200 als eine „invertierte” OLED bezeichnet werden. Materialien, die ähnlich denen sind, die mit Bezug auf Vorrichtung 100 beschrieben wurden, können in den entsprechenden Schichten der Vorrichtung 200 verwendet werden. 2 liefert ein Beispiel dafür, wie einige Schichten aus der Struktur der Vorrichtung 100 weggelassen werden können.
-
Die einfache, in den 1 und 2 veranschaulichte, Schichtstruktur wird als nicht beschränkendes Beispiel bereitgestellt, und es versteht sich, dass Ausführungsformen der Erfindung in Verbindung mit einer großen Vielfalt von anderen Strukturen verwendet werden können. Die konkreten Materialien und Strukturen, die beschrieben werden, sind beispielhafter Natur, und es können andere Materialien und Strukturen verwendet werden. Funktionale OLEDs können durch unterschiedliche Kombinationen der verschiedenen Schichten erhalten werden, oder Schichten können je nach Design, Leistung und Kostenfaktoren ganz weggelassen werden. Andere Schichten, die nicht konkret beschrieben werden, können ebenfalls eingeschlossen werden. Es können Materialien verwendet werden, die nicht eigens beschrieben werden. Obwohl viele der hier bereitgestellten Beispiele verschiedene Schichten als ein einziges Material umfassend beschreiben, versteht es sich, dass Kombinationen von Materialien, wie beispielsweise eine Mischung aus Wirt und Dotierstoff, oder allgemeiner eine Mischung, verwendet werden können. Auch können die Schichten verschiedene Unterschichten aufweisen. Die Bezeichnungen, die den verschiedenen Schichten hier gegebenen werden, sollen nicht streng beschränkend sein. Zum Beispiel transportiert Lochtransportschicht 225 in Vorrichtung 200 Löcher und injiziert Löcher in Emissionsschicht 220 und kann als eine Lochtransportschicht oder eine Lochinjektionsschicht beschrieben werden. Gemäß einer Ausführungsform kann eine OLED als eine zwischen einer Kathode und einer Anode angeordnete „organische Schicht” aufweisend beschrieben werden. Diese organische Schicht kann eine einzelne Schicht aufweisen oder kann ferner mehrere Schichten aus verschiedenen organischen Materialien aufweisen, wie zum Beispiel mit Bezug auf 1 und 2 beschrieben wird.
-
Es können auch Strukturen und Materialien verwendet werden, die nicht konkret beschrieben werden, wie beispielsweise OLEDs, die aus Polymermaterialien (PLEDs) bestehen, wie beispielsweise in dem
US-Pat. Nr. 5,247,190 an Friend et al. offenbart, das durch Bezugnahme in seiner Gesamtheit aufgenommen wird. Als weiteres Beispiel können OLEDs, die eine einzige organische Schicht aufweisen, verwendet werden. OLEDs können gestapelt werden, wie zum Beispiel in dem
US-Pat. Nr. 5,707,745 an Forrest et al. beschrieben, das durch Bezugnahme in seiner Gesamtheit aufgenommen wird. Die OLED-Struktur kann von der einfachen, in
1 und
2 veranschaulichten Schichtstruktur abweichen. Zum Beispiel kann das Substrat eine abgewinkelte reflektierende Oberfläche zur Verbesserung der Auskopplung beinhalten, wie beispielsweise eine Mesa-Struktur, wie in dem
US-Pat. Nr. 6,091,195 an Forrest et al. beschrieben, und/oder eine Pit-Struktur, wie in dem
US-Pat. Nr. 5,834,893 an Bulovic et al. beschrieben, die durch Bezugnahme in ihrer Gesamtheit aufgenommen werden.
-
Falls nicht anders angegeben, kann jede der Schichten der verschiedenen Ausführungsformen durch jedes geeignete Verfahren abgeschieden werden. Für die organischen Schichten umfassen bevorzugte Verfahren thermisches Verdampfen, Tintenstrahl, wie in
US-Pat. Nrn. 6,013,982 und
6,087,196 beschrieben, die durch Bezugnahme in ihrer Gesamtheit aufgenommen werden, organische Gasphasenabscheidung (OVPD), wie beispielsweise in dem
US-Pat. Nr. 6,337,102 an Forrest et al. beschrieben, das durch Bezugnahme in seiner Gesamtheit aufgenommen wird, und Abscheiden durch organische Dampf-Jet-Druck (OVJP), wie beispielsweise in der US-Patentanmeldung Serien-Nr. 10/233,470 beschrieben, die durch Bezugnahme in ihrer Gesamtheit aufgenommen wird. Andere geeignete Abscheideverfahren umfassen Spin-Coating und andere lösungsbasierte Prozesse. Lösungsbasierte Prozesse werden bevorzugt in Stickstoff oder einer inerten Atmosphäre durchgeführt. Für die anderen Schichten umfassen bevorzugte Verfahren thermische Verdampfung. Bevorzugte Strukturierungsverfahren umfassen Abscheidung durch eine Maske, Kaltschweißen, wie beispielsweise in
US-Pat. Nrn. 6,294,398 und
6,468,819 beschrieben, die durch Bezugnahme in ihrer Gesamtheit aufgenommen werden, und Strukturieren in Verbindung mit einigen der Abscheidungsverfahren, wie beispielsweise Tintenstrahl und OVJD. Andere Verfahren können ebenfalls verwendet werden. Die Materialien, die abgeschieden werden sollen, können modifiziert werden, um sie mit einem bestimmten Abscheideverfahren kompatibel zu machen. Beispielsweise können bei kleinen Molekülen Substituenten, wie beispielsweise Alkyl- und Arylgruppen, verzweigt oder unverzweigt, vorzugsweise mit mindestens 3 Kohlenstoffen, verwendet werden, um ihre Fähigkeit zur Verarbeitung in Lösung zu verbessern. Substituenten mit 20 Kohlenstoffatomen oder mehr können verwendet werden, und 3–20 Kohlenstoffe stellt einen bevorzugten Bereich dar. Materialien mit asymmetrischen Strukturen können eine bessere Verarbeitbarkeit in Lösung aufweisen als solche mit symmetrischen Strukturen, weil asymmetrische Materialien eine geringere Neigung zur Rekristallisation aufweisen können. Dendrimer-Substituenten können verwendet werden, um die Fähigkeit kleiner Moleküle zur Verarbeitung in Lösung zu verbessern.
-
Vorrichtungen, die gemäß Ausführungsformen der Erfindung gefertigt werden, können in einer Vielzahl von Konsumartikeln aufgenommen werden, einschließlich Flachbildschirmen, Computer-Monitoren, medizinischen Monitoren, Fernsehern, Reklametafeln, Lichtern für Innen- oder Außenbeleuchtung und/oder Signalgebung, Heads-up-Displays, voll transparenten Displays, flexiblen Displays, Laserdruckern, Telefonen, Mobiltelefonen, persönlichen digitalen Assistenten (PDAs), Laptops, Digitalkameras, Camcorder, Suchern, Mikro-Displays, Fahrzeugen, einer großflächigen Wand-, Theater- oder Stadionanzeige oder einem Zeichen. Verschiedene Steuermechanismen können verwendet werden, um Vorrichtungen, die gemäß der vorliegenden Erfindung hergestellt werden, zu steuern, einschließlich Passivmatrix und Aktivmatrix. Viele der Vorrichtungen sind für die Verwendung in einem Temperaturbereich, der für den Menschen angenehm ist, bestimmt, wie beispielsweise 18 Grad C bis 30 Grad C und besonders bevorzugt bei Raumtemperatur (20–25 Grad C).
-
Die Materialien und hier beschriebenen Strukturen können Anwendungen in Vorrichtungen finden, die nicht OLEDs sind. Zum Beispiel können andere optoelektronische Vorrichtungen, wie beispielsweise organische Solarzellen und organischen Fotodetektoren, sich der Materialien und Strukturen bedienen. Allgemeiner gesagt können organische Vorrichtungen, wie beispielsweise organische Transistoren, sich der Materialien und Strukturen bedienen.
-
Die Begriffe Halo, Halogen, Alkyl, Cycloalkyl, Alkenyl, Alkinyl, Arylalkyl, heterozyklische Gruppe, Aryl, aromatische Gruppe und Heteroaryl sind aus dem Stand der Technik bekannt und werden in
US 7,279,704 in Spalten 31–32 definiert, die hier durch Bezugnahme aufgenommen werden.
-
Gemäß einer Ausführungsform wird eine Verbindung mit der folgenden Formel I bereitgestellt:
-
In der Verbindung der Formel I sind Ar und Ar' unabhängig voneinander ausgewählt aus der Gruppe bestehend aus Phenyl, Biphenyl, Naphthalin, Dibenzothiophen und Dibenzofuran, welche optional weiter substituiert sind. Z ist aus Si und Ge ausgewählt. L ist eine Einfachbindung oder umfasst eine Aryl- oder Heteroarylgruppe mit 5–20 Kohlenstoffatomen, welche optional weiter substituiert ist. A ist eine Gruppe, die direkt an Z gebunden ist und ausgewählt ist aus der Gruppe bestehend aus Triphenylen, Tetraphenylen, Pyren, Naphthalin, Fluoranthen, Chrysen, Phenanthren, Azatriphenylen, Azatetraphenylen, Azapyren, Azanaphthalin, Azafluoranthen, Azachrysen, Azaphenanthren und Kombinationen davon, welche optional weiter mit einer oder mehreren Gruppen ausgewählt aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Aryl, Aryloxy und Kombinationen davon substituiert sind.
-
B enthält eine Gruppe ausgewählt aus der Gruppe bestehend aus Carbazol, Dibenzofuran, Dibenzothiophen, Dibenzoselenophen, Azacarbazol, Azadibenzofuran, Azadibenzothiophen, Azadibenzoselenophen und Kombinationen davon, welche optional weiter mit einer oder mehreren Gruppen ausgewählt aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon substituiert sind, und wobei die Substitution optional an die Carbazol-, Dibenzofuran-, Dibenzothiophen-, Dibenzoselenophen-, Azacarbazol-, Azadibenzofuran-, Azadibenzothiophen- oder Azadibenzoselenophengruppe kondensiert ist.
-
Eine „Aryl”-Gruppe ist eine aromatische Gruppe, die ganz aus Kohlenstoff besteht, die einen oder mehrere kondensierte Ringe beinhalten kann. Lediglich als Beispiel und ohne Einschränkung können beispielhafte Arylgruppen Phenyl, Naphthalin, Phenanthren, Corannulen usw. sein. Eine „Heteroaryl”-Gruppe ist eine „Aryl”-Gruppe, die mindestens ein Heteroatom enthält. Lediglich als Beispiel und ohne Einschränkung können beispielhafte Heteroarylgruppen Pyridin, Chinolin, Phenanthrolin, Azacorannulen usw. sein. Sowohl „Aryl”- und „Heteroaryl”-Gruppen können mehrere Anbindungspunkte aufweisen, die sie an andere Fragmente binden.
-
Die Bezeichnung „Aza” in den oben beschriebenen Fragmenten, d. h. Azadibenzofuran, Azadibenzothiophen usw. bedeutet, dass eine oder mehrere der CH-Gruppen in dem jeweiligen Fragment durch ein Stickstoffatom ersetzt werden kann bzw. können, beispielsweise und ohne Einschränkung umfasst Azatriphenylen sowohl Dibenzo[f,h]chinoxalin und Dibenzo[f,h]chinolin. Für einen Fachmann auf dem Gebiet sind andere Stickstoffanaloga der vorstehend beschriebenen Azaderivate leicht ersichtlich, und sämtlichen derartigen Analoga sollen durch die Begriffe, wie hier dargelegt, eingeschlossen werden.
-
Es versteht sich, dass, wenn ein Molekülfragment als ein Substituent oder auf andere Weise an eine andere Einheit gebunden beschrieben wird, seine Bezeichnung als diejenige eines Fragments geschrieben werden kann (z. B. Naphthyl, Dibenzofuryl) oder als diejenige des gesamten Moleküls (z. B. Naphthalin, Dibenzofuran). Wie hier verwendet, werden diese unterschiedlichen Arten der Bezeichnung eines Substituenten oder angehängten Fragments als gleichwertig betrachtet.
-
Wie hier verwendet werden Fragmente, die die Struktur
enthalten, als DBX-Gruppen bezeichnet, d. h. Dibenzo-X
1, wobei X
1 eines der hier beschriebenen Atome oder der hier beschriebenen Gruppen ist. In der DBX-Gruppe können A
1–A
8 Kohlenstoff oder Stickstoff umfassen.
-
Die hier offenbarten neuartigen Verbindungen enthalten zwei deutlich unterschiedliche Gruppen, polyzyklischen aromatischen Kohlenwasserstoff, wie die triphenylen-/pyrenbasierte Gruppe A, und die DBX- oder carbazolbasierte Gruppe B, die mit einem Silan- oder German-Spacer verbunden sind, was zu einer asymmetrischen Struktur führt. Diese Verbindungen besitzen eine Reihe von vorteilhaften Eigenschaften, wenn sie in OLED-Vorrichtungen eingesetzt werden. Erstens besitzen Triphenylen und Pyren hervorragende Ladungstransportfähigkeiten, während DBX und Carbazol für Elektron- und Lochinjektion von benachbarten Schichten geeignete LUMO- und HOMO-Niveaus besitzen. Die Kombination von Triphenylen/Pyren und DBX oder Carbazol ergibt Verbindungen, die für sowohl Ladungsinjektion als auch -transport hervorragend geeignet sind. Weitere Derivatisierung dieser Gruppen kann die hervorragenden Ladungsinjektions- und Transporteigenschaften aufrecht erhalten und sogar verbessern. Zweitens unterbrechen die Silan- und German-Spacer die Konjugation zwischen den Gruppen A und B, behalten die hohen Triplettenergien der einzelnen Gruppen in dem gesamten Molekül bei und verringern somit wirksam Quenchen und ermöglichen die Verwendung von Verbindungen der Formel I mit hohen Triplettenergie-Emittern.
-
Die Verbindungen der Formel I weisen zusätzliche Vorteile gegenüber bekannten symmetrischen Analoga auf, da Verbindungen der Formel I weniger kristallisationsanfällig sind. Infolgedessen besitzen Verbindungen der Formel I eine verbesserte Filmgleichmäßigkeit, von der angenommen wird, ohne an eine Theorie gebunden zu sein, dass sie ein Ergebnis der Verringerung der Phasentrennung zwischen den Emittern und Wirtsmaterialien in OLEDs ist. Die neuartigen Verbindungen der Formel I können verwendet werden, um die Leistungsparameter der OLED-Vorrichtung, wie beispielsweise Emissionsspektrumlinienform, Wirkungsgrad und Lebensdauer, zu verbessern. Ferner neigen Verbindungen der Formel I in der Regel auch dazu in organischen Lösungsmitteln, wie beispielsweise Toluol, Xylol und 3-Phenoxytoluol löslich zu sein und sind der Verarbeitung in Lösung zugänglich, was für kostengünstige Beleuchtungsanwendungen sehr wünschenswert ist.
-
Gemäß einer Ausführungsform ist A
wobei K
1 bis K
12 unabhängig voneinander ausgewählt sind aus N und C-R', und wobei R' ausgewählt ist aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Aryl, Aryloxy und Kombinationen daraus.
-
Gemäß einer Ausführungsform ist B ausgewählt aus der Gruppe bestehend aus:
wobei X
1–X
15 unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus N und C-R'', worin R'' ausgewählt ist aus einer Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon, und wobei Y
1 und Y
2 unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus O, S und Se. Die gestrichelten Linien in den hier offenbarten chemischen Strukturen stehen für eine Bindung durch eine beliebige Position auf dieser Gruppe, die eine Einfachbindung mit einem anderen Atom zu bilden vermag.
-
Gemäß einer Ausführungsform ist A ausgewählt aus der Gruppe bestehend aus:
-
Gemäß einer Ausführungsform ist A ausgewählt aus der Gruppe bestehend aus:
-
Gemäß einer Ausführungsform ist B ausgewählt aus der Gruppe bestehend aus:
wobei Y
1 ausgewählt ist aus der Gruppe bestehend aus O, S und Se, wobei R ausgewählt ist aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon.
-
Gemäß einer Ausführungsform ist L unabhängig ausgewählt aus der Gruppe bestehend aus:
-
Gemäß einer Ausführungsform ist A Triphenylen. Gemäß einer weiteren Ausführungsform ist A Pyren. Gemäß einer Ausführungsform sind Ar und Ar' Phenyl. Gemäß einer Ausführungsform ist L Phenyl.
-
Gemäß einer Ausführungsform ist die Verbindung ausgewählt aus der Gruppe bestehend aus:
-
Die Strukturen der hier beschriebenen Vergleichsverbindungen sind wie folgt:
-
Tabelle 1 listet die Triplettenergieniveaus für Verbindung 1–4 und Vergleichsverbindungen CC-1 und CC-3 auf. Die Triplettenergie wurde aus dem Maximum der 0-0 Schwingungsbande höchster Energie der Phosphoreszenz-Spektren, die in 10
–4 M Lösung der entsprechenden Verbindung in 2-Methyltetrahydrofuran bei 77 K aufgenommen wurden, bestimmt. Während Vergleichsverbindung CC-3, in welcher Triphenylen mit Dibenzothiophen über eine Benzoleinheit verbunden ist, eine Triplettenergie von 2,64 eV aufweist, weist Verbindung 1 der Formel I, in welcher eine Silaneinheit zwischen Triphenylen und dem Rest des aromatischen Systems eingeschoben ist, eine viel höhere Triplettenergie von 2,86 eV auf. Dies legt nahe, dass die Einführung einer Silangruppe in der Lage ist, eine hohe Triplettenergie von Triphenylen aufrechtzuerhalten. Dies wird auch durch die Ergebnisse der Verbindungen 2–4 und CC-1 unterstützt. Eine hohe Triplettenergie ist für die Wirtsmaterialien erforderlich, um blauen Phosphoreszenzemitter aufzunehmen. TABELLE 1: Ausgewählte Triplettenergieniveaus für die Verbindungen der Formel I und Vergleichsverbindungen
| Verbindung | Triplettenergie, eV |
| Verbindung 1 | 2,86 |
| Verbindung 2 | 2,86 |
| Verbindung 3 | 2,86 |
| Verbindung 4 | 2,86 |
| CC-1 | 2,88 |
| CC-3 | 2,64 |
-
Tabelle 2 listet die HOMO/LUMO-Energieniveaus für ausgewählte Verbindungen der Formel I und Vergleichsverbindung CC-1. Die HOMO/LUMO-Niveaus wurden durch differentielle Puls-Voltametrie in DMF-Lösungen bei einer Konzentration von 10
–3 M mit 0,1 M Tetrabutylammonium Hexafluorophosphat als Leitsalz bestimmt. Eine Glaskohlenstoffplatte, ein Platindraht und ein Silberdraht werden als Arbeits-, Gegen- bzw. Pseudo-Bezugselektroden verwendet. Bei jeder Messung wird Ferrocen als interner Standard in die Lösung gegeben. Das erhaltene Oxidationspotential (E
ox) und Reduktionspotential (E
red), eingestellt auf Ferrocen, werden verwendet, um die HOMO/LUMO-Niveaus als –4,8 eV – qE
ox bzw. –4,8 eV – qE
red zu berechnen, wo q die Elektronladung ist. Sämtliche Verbindungen weisen LUMO-Niveaus bei etwa –2,1 eV auf, die für die Elektroneninjektion aus benachbarten Elektronentransportschichten geeignet sind. Obwohl Vergleichsverbindung CC-1 ein HOMO-Niveau unterhalb von –6,00 eV, was der Messgrenze entspricht, aufweist, konnten die HOMO-Niveaus für die Verbindungen der Formel I durch Variation der B-Gruppe eingestellt werden. So stellte man tatsächlich fest, dass die HOMO-Niveaus der Verbindungen 3, 4 und 5 bei –5,67, –5,55 bzw. –5,41 eV liegen. Man beachte, dass diese HOMO-Niveaus unterhalb der üblicherweise verwendeten Triplettemitter liegen, was ein effizientes Loch-Trapping im Vorrichtungsbetrieb ermöglicht. TABELLE 2: Ausgewählte HOMO/LUMO-Energieniveaus für Verbindungen der Formel I und Vergleichsverbindungen
| Verbindung | HOMO, eV | LUMO, eV |
| Verbindung 1 | < –6,00 | –2,08 |
| Verbindung 2 | < –6,00 | –2,06 |
| Verbindung 3 | –5,67 | –2,08 |
| Verbindung 4 | –5,55 | –2,07 |
| Verbindung 5 | –5,41 | –2,04 |
| CC-1 | < –6,00 | –2,05 |
-
5 zeigt die Differentialscanningkalorimetrie(DSC)-Kurven für ausgewählte Verbindungen der Formel I sowie für Vergleichsverbindungen CC-1 und CC-2. Proben wurden unter Vakuum bei einem Druck von weniger als 10–5 Torr thermisch verdampft und in einer Zone, die 100°C kälter als die Verdampfungszone war, kondensiert. Die kondensierten Proben wurden allmählich auf Raumtemperatur abgekühlt, bevor sie der DSC-Messung unterzogen wurden, wobei die angegebenen Scans beim ersten Erhitzen bei 10°C/min unter Stickstoffatmosphäre aufgezeichnet wurden. Verbindungen der Formel I mit asymmetrischen Strukturen sind amorph mit stabiler morphologischer Stabilität. Während des Aufheizens von 30°C auf 330°C unterliegen die Verbindungen 1, 3 und 4 Glasübergängen bei 103, 101 bzw. 144°C, ohne dass eine Kristallisation oder ein Schmelzen eintritt. Verbindung 2 zeigt einen kleinen Schmelzpeak bei 212°C mit einer geringen Schmelzenthalpie von 2 J/g aufgrund zurückgebliebener Kristalle, die in einer amorphen Hauptmasse eingebettet sind. Andererseits tritt bei CC-1 mit einer symmetrischen Struktur ein ausgeprägter Schmelzpeak bei 243°C mit einer Schmelzenthalpie von 58 J/g auf, was das Vorliegen von signifikanten Kristallen nahelegt. Weiterhin ist CC-2, das eine einfache an Triphenylen gebundene Triphenylsilylgruppe aufweist, hochkristallin mit einem Schmelzpeak bei 207°C begleitet von einer Schmelzenthalpie von 75 J/g. Beim Scan beim ersten Erhitzen durchläuft CC-2 tatsächlich keine Glasübergangstemperatur, was das Fehlen einer amorphen Phase und vollständige Kristallinität nahelegt. Diese DSC-Ergebnisse zeigten, dass die asymmetrische Struktur gemäß dieser Erfindung wirksam bei der Unterdrückung von Kristallisation ist und einer stabilen amorphen Morphologie förderlich ist, was sich positiv auf die Betriebsstabilität von Vorrichtungen auswirkt.
-
Gemäß einer Ausführungsform wird eine erste Vorrichtung bereitgestellt. Die erste Vorrichtung umfasst eine organische lichtemittierende Vorrichtung, welche ferner eine Anode, eine Kathode und eine organische Schicht, die zwischen der Anode und der Kathode angeordnet ist, umfasst, die eine Verbindung mit der Formel I umfasst:
-
In der Verbindung der Formel I sind Ar und Ar' unabhängig voneinander ausgewählt aus der Gruppe bestehend aus Phenyl, Biphenyl, Naphthalin, Dibenzothiophen und Dibenzofuran, welche optional weiter substituiert sind. Z ist ausgewählt aus Si und Ge. L ist eine Einfachbindung oder umfasst eine Aryl- oder Heteroarylgruppe mit 5–20 Kohlenstoffatomen, welche optional weiter substituiert ist. A ist eine Gruppe, die direkt an Z gebunden ist und ausgewählt ist aus der Gruppe bestehend aus Triphenylen, Tetraphenylen, Pyren, Naphthalin, Fluoranthen, Chrysen, Phenanthren, Azatriphenylen, Azatetraphenylen, Azapyren, Azanaphthalin, Azafluoranthen, Azachrysen, Azaphenanthren und Kombinationen davon, welche optional weiter mit einer oder mehreren Gruppen ausgewählt aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Aryl, Aryloxy und Kombinationen davon substituiert sind.
-
B enthält eine Gruppe ausgewählt aus der Gruppe bestehend aus Carbazol, Dibenzofuran, Dibenzothiophen, Dibenzoselenophen, Azacarbazol, Azadibenzofuran, Azadibenzothiophen, Azadibenzoselenophen und Kombinationen davon, welche optional weiter mit einer oder mehreren Gruppen ausgewählt aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon substituiert sind, und wobei die Substitution optional an die Carbazol-, Dibenzofuran-, Dibenzothiophen-, Dibenzoselenophen-, Azacarbazol-, Azadibenzofuran-, Azadibenzothiophen der Azadibenzoselenophengruppe kondensiert ist.
-
Gemäß einer Ausführungsform ist die organische Schicht eine Emissionsschicht und die Verbindung der Formel I ist ein Wirt. Gemäß einem anderen Aspekt umfasst die organische Schicht ferner einen emittierenden Dotierstoff.
-
Gemäß einer Ausführungsform ist der emittierende Dotierstoff ein Übergangsmetallkomplex, der mindestens einen Liganden ausgewählt aus der Gruppe bestehend aus Folgenden aufweist:
wobei R
a, R
b und R
c für Mono-, Di-, Tri oder Tetra-Substitutionen stehen können, wobei R
a, R
b und R
c unabhängig voneinander ausgewählt sind aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogen, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon; und wobei zwei benachbarte Substituenten von R
a, R
b und R
c optional verbunden sind, um einen kondensierten Ring zu bilden.
-
Gemäß einer Ausführungsform weist der emittierende Dotierstoff die Formel
auf, wobei D ein 5- oder 6-gliedriger carbozyklischer oder heterozyklischer Ring ist, wobei R
1, R
2 und R
3 unabhängig voneinander für Mono-, Di-, Tri oder Tetra-Substitution stehen, wobei jeder von R
1, R
2 und R
3 unabhängig voneinander ausgewählt ist aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon, wobei R
1 optional mit Ring D verbunden sein kann, wobei n 1, 2 oder 3 ist und wobei X-Y ein anderer Ligand ist.
-
Gemäß einer Ausführungsform umfasst die Vorrichtung ferner eine zweite organische Schicht, die eine nicht-emittierende Schicht ist, und die Verbindung mit der Formel I ist ein Material in der zweiten organischen Schicht.
-
Gemäß einer anderen Ausführungsform ist die zweite organische Schicht eine Sperrschicht, und die Verbindung mit der Formel I ist ein Sperrmaterial in der zweiten organischen Schicht. In einer Ausführungsform ist die zweite organische Schicht eine Elektronentransportschicht, und die Verbindung mit der Formel I ist ein elektronentransportierendes Material in der zweiten organischen Schicht.
-
Gemäß einer Ausführungsform ist die erste Vorrichtung ein Konsumartikel. Gemäß einer anderen Ausführungsform ist die erste Vorrichtung eine organische lichtemittierende Vorrichtung. Gemäß einer Ausführungsform umfasst die erste Vorrichtung eine Leuchtfläche.
-
Beispiele für Vorrichtungen
-
Die nachfolgend beschriebenen beispielhaften Vorrichtungen können die Verbindungen der Formel I vorteilhaft nutzen, und sollen nicht beschränkend sein. Die Strukturen der Materialien, die in den Beispielen für die Vorrichtungen verwendet werden, werden nachfolgend dargestellt:
-
Alle beispielhaften Vorrichtungen wurden durch thermisches Verdampfen im Hochvakuum (< 10–7 Torr) (VTE) gefertigt. Die Anodenelektrode besteht aus 800 Å Indium-Zinn-Oxid (ITO). Die Kathode bestand aus 10 Å LiF, gefolgt von 1000 Å Al. Unmittelbar nach der Fertigung werden alle Vorrichtungen in einer Stickstoff-Glovebox (< 1 ppm H2O und O2) mit einem Glasdeckel verkapselt und mit einem Epoxidharz versiegelt, und der Verpackung wurde ein Trockenmittel beigegeben.
-
Der organische Stapel der OLED-Vorrichtung, die in den Beispielen und vergleichenden Vorrichtungsbeispielen verwendet werden, weist die folgende Struktur auf: von der ITO-Oberfläche ausgehend, 100 Å LG101 (käuflich erworben von LG Chem) als Lochinjektionsschicht, 300 Å NPD als Lochtransportschicht (HTL), 300 Å einer Verbindung der Formel I (oder Vergleichsverbindung CC-1 oder CC2), dotiert mit 15 Gewichtsprozent Dotierstoff D, als Emissionsschicht (EML), 50 Å Verbindung BL als Sperrschicht (BL) und 400 Å Alq als Elektronentransportschicht (ETL). Eine schematische beispielhafte Vorrichtungsstruktur ist in
4 dargestellt. TABELLE 3: Zusammenfassung von Vorrichtungsdaten
| | | | | 1931 CIE | | bei 1000 nits | bei 20 mA/cm2 |
| Beispiel | Wirt | Dotierstoff | BL | x | y | λmax
[nm] | LE
[cd/A] | EQE
[%] | PE
[Im/W] | LT80%
[h] |
| Vorrichtungsbeispiel 1 | Verbindung
1 | Dotierstoff
D | Verbindung
BL | 0,173 | 0,3913 | 474 | 44,7 | 19,8 | 24 | 11,4 |
| Vorrichtungsbeispiel 2 | Verbindung
3 | Dotierstoff
D | Verbindung
BL | 0,1737 | 0,3887 | 474 | 44 | 19,5 | 23,4 | 16,0 |
| Vorrichtungsbeispiel 3 | Verbindung
4 | Dotierstoff
D | Verbindung
BL | 0,1781 | 0,4034 | 476 | 44,3 | 19,2 | 22,9 | 24,2 |
| vergleichendes Vorrichtungsbeispiel 1 | CC-1 | Dotierstoff
D | Verbindung
BL | 0,1803 | 0,3877 | 474 | 23,7 | 10,5 | 10,3 | 18,5 |
| vergleichendes Vorrichtungsbeispiel 2 | CC-2 | Dotierstoff
D | Verbindung
BL | 0,1853 | 0,3986 | 474 | 24,3 | 10,5 | 9,8 | 0,01 |
-
Tabelle 3 enthält eine Zusammenfassung der Vorrichtungsdaten. Die Lichtausbeute (LE, luminous efficiency), externe Quantenausbeute (EQE, external quantum efficiency) und Leistungswirkungsgrad (PE, power efficiency) wurden bei 1000 nits gemessen, während die Lebensdauer (LT80%) als die Zeit definiert wurde, die die Vorrichtung benötigte, um auf 80% ihrer ursprünglichen Leuchtdichte unter einer konstanten Stromdichte von 20 mA/cm2 abzusinken. Im Vergleich zu den auf Vergleichsbeispielen basierten Vorrichtungen, d. h. vergleichende Vorrichtungsbeispiele 1 und 2, zeigen die auf Verbindungen der Formel I basierten Vorrichtungen, d. h. Vorrichtungsbeispiele 1 bis 3, eine zweifache Verbesserung hinsichtlich der Effizienz der Vorrichtung (LE, EQE und PE) bei Erhaltung vergleichbarer oder sogar verlängerter Betriebslebensdauern. Die Verbesserung der Leistungsfähigkeit der Vorrichtung ist auf verbesserte Ladungsinjektion und verbesserten Ladungstransport der asymmetrischen Verbindungen der Formel I zurückzuführen, was den Ausgleich von Ladungsströmen unterstützt. Ohne an eine Theorie gebunden zu sein, wird angenommen, dass die ausgeglichenen Elektron/Loch-Ströme die Ladungsrekombinationszone erweitern, wodurch ein hoher Wirkungsgrad bei hoher Helligkeit durch Unterdrücken oder Reduzieren des Exziton-Quenchings bewahrt wird. Eine erweiterte Ladungsrekombinationszone verlängert auch die Lebensdauer der Vorrichtung, indem einer größeren Population von Molekülen ermöglicht wird, am Ladungstransport, an der Exzitonbildung und an der Lichtemission teilzunehmen. Basierend auf den in Tabelle 2 angegebenen HOMO/LUMO-Niveaus können Verbindungen der Formel I auch in der Lochsperrschicht verwendet werden. Da Verbindungen der Formel I sowohl als Wirte als auch als lochsperrende Materialien in den Lochsperrschichten dienen können, wird erwartet, dass die Aufnahme von Verbindungen der Formel I in optische Vorrichtungen die Fertigungskosten der Vorrichtungen reduziert.
-
KOMBINATION MIT ANDEREN MATERIALIEN
-
Die hier als für eine bestimmte Schicht in einer organischen lichtemittierenden Vorrichtung brauchbar beschriebenen Materialien können in Kombination mit einer Vielzahl anderer, in der Vorrichtung vorhandenen Materialien, verwendet werden. Zum Beispiel können hier offenbarte emittierende Dotierstoffe in Verbindung mit einer Vielzahl von Wirten, Transportschichten, Sperrschichten, Injektionsschichten, Elektroden und anderen eventuell vorhandenen Schichten verwendet werden. Die nachstehend beschriebenen oder genannten Materialien sind nicht beschränkende Beispiele von Materialien, die in Kombination mit den hier offenbarten Verbindungen brauchbar sein können, und ein Fachmann auf dem Gebiet kann leicht die Literatur zu Rate ziehen, um andere Materialien, die in Kombination brauchbar sein können, zu identifizieren.
-
HIL/HTL:
-
Ein lochinjizierendes/-transportierendes Material, das in der vorliegenden Erfindung verwendet werden soll, ist nicht besonders beschränkt, und jede beliebige Verbindung kann verwendet werden, so lange die Verbindung typischerweise als lochinjizierendes/-transportierendes Material verwendet wird. Beispiele für das Material umfassen, ohne darauf beschränkt zu sein: ein Phthalocyanin- oder Porphyrinderivat; ein aromatisches Aminderivat; ein Indolocarbazolderivat; ein fluorkohlenwasserstoffhaltiges Polymer; ein Polymer mit Leitfähigkeitdotierstoffen; ein leitfähiges Polymer, wie beispielsweise PEDOT/PSS; ein selbstorganisierendes Monomer abgeleitet aus Verbindungen, wie beispielsweise Phosphonsäure und Silanderivaten; ein Metalloxidderivat, wie beispielsweise MoOx; eine halbleitende organische Verbindung vom p-Typ, wie beispielsweise 1,4,5,8,9,12-Hexaazatriphenylenhexacarbonitril; ein Metallkomplex und eine vernetzbare Verbindung.
-
Beispiele für in HIL oder HTL verwendete aromatische Aminderivate umfassen, ohne darauf beschränkt zu sein, die folgenden allgemeinen Strukturen:
-
Jedes von Ar1 bis Ar9 ist ausgewählt aus der Gruppe bestehend aromatischen zyklischen Kohlenwasserstoffverbindungen, wie beispielsweise Benzol, Biphenyl, Triphenyl, Triphenylen, Naphthalin, Anthracen, Phenalen, Phenanthren, Fluoren, Pyren, Chrysen, Perylen, Azulen; der Gruppe bestehend aus aromatischen heterozyklischen Verbindungen, wie beispielsweise Dibenzothiophen, Dibenzofuran, Dibenzoselenophen, Furan, Thiophen, Benzofuran, Benzothiophen, Benzoselenophen, Carbazol, Indolocarbazol, Pyridylindol, Pyrrolodipyridin, Pyrazol, Imidazol, Triazol, Oxazol, Thiazol, Oxadiazol, Oxatriazol, Dioxazol, Thiadiazol, Pyridin, Pyridazin, Pyrimidin, Pyrazin, Triazin, Oxazin, Oxathiazin, Oxadiazin, Indol, Benzimidazol, Indazol, Indoxazin, Benzoxazol, Benzisoxazol, Benzothiazol, Chinolin, Isochinolin, Cinnolin, Chinazolin, Chinoxalin, Naphthyridin, Phthalazin, Pteridin, Xanthen, Acridin, Phenazin, Phenothiazin, Phenoxazin, Benzofuropyridin, Furodipyridin, Benzothienopyridin, Thienodipyridin, Benzoselenophenopyridin und Selenophenodipyridin; und der Gruppe bestehend aus 2–10 zyklischen Struktureinheiten, die Gruppen der gleichen Art oder unterschiedlicher Arten sind, ausgewählt aus der aromatischen zyklischen Kohlenwasserstoffgruppe und der aromatischen heterozyklischen Gruppe, und die miteinander direkt oder über mindestens einem von Sauerstoffatom, Stickstoffatom, Schwefelatom, Siliciumatom, Phosphoratom, Boratom, einer kettenförmigen Struktureinheit und der aliphatischen zyklischen Gruppe gebunden sind. Wobei jedes Ar weiter durch einen Substituenten ausgewählt aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon substituiert ist.
-
Gemäß einem Aspekt sind Ar
1 bis Ar
9 unabhängig voneinander ausgewählt aus der Gruppe bestehend aus:
-
k ist eine ganze Zahl von 1 bis 20; X1 bis X8 sind C (einschließlich CH) oder N; Ar1 besitzt die gleiche Gruppe wie oben definiert.
-
Beispiele für in HIL oder HTL verwendete Metallkomplexe umfassen, ohne darauf beschränkt zu sein, die der folgenden allgemeinen Formel:
-
M ist ein Metall mit einem Atomgewicht größer als 40; (Y1–Y2) ist ein zweizähniger Ligand, Y1 und Y2 sind unabhängig voneinander ausgewählt aus C, N, O, P und S; L ist ein Hilfsligand; m ist eine ganze Zahl von 1 bis zur maximalen Anzahl von Liganden, die an das Metall gebunden sein kann; und m + n ist die maximale Anzahl von Liganden, die an das Metall gebunden sein kann.
-
Gemäß einem Aspekt ist (Y1–Y2) ein 2-Phenylpyridinderivat.
-
Gemäß einem anderen Aspekt ist (Y1–Y2) ein Carbenligand.
-
Gemäß einem anderen Aspekt ist M ausgewählt aus Ir, Pt, Os und Zn.
-
Gemäß einem anderen Aspekt weist der Metallkomplex ein kleinstes Oxidationspotential in Lösung versus Fc+/Fc-Paar von weniger als etwa 0,6 V auf.
-
Wirt:
-
Die lichtemittierende Schicht der organischen EL-Vorrichtung der vorliegenden Erfindung enthält bevorzugt mindestens einen Metallkomplex als lichtemittierendes Material und kann ein Wirtsmaterial, das den Metallkomplex als Dotierstoffmaterial verwendet, enthalten. Beispiele für das Wirtsmaterial sind nicht besonders beschränkt, und beliebige Metallkomplexe oder organische Verbindungen können verwendet werden, solange die Triplettenergie des Wirts größer als diejenige des Dotierstoffs ist. Während die nachfolgende Tabelle Wirtsmaterialien als bevorzugt für Vorrichtungen, die verschiedene Farben emittieren, kategorisiert, kann jedes beliebige Wirtsmaterial mit irgendeinem Dotierstoff verwendet werden, solange die Triplettkriterien erfüllt sind.
-
Vorzugsweise weisen Beispiele von Metallkomplexen, die als Wirt verwendet werden, die folgende allgemeine Formel auf:
-
M ist ein Metall; (Y3–Y4) ist ein zweizähniger Ligand, Y3 und Y4 sind unabhängig voneinander ausgewählt aus C, N, O, P und S; L ist ein Hilfsligand; m ist eine ganze Zahl von 1 bis zur maximalen Anzahl von Liganden, die an das Metall gebunden sein kann; und m + n ist die maximale Anzahl von Liganden, die an das Metall gebunden sein kann.
-
Gemäß einem Aspekt sind die Metallkomplexe Folgende:
(O-N) ist ein zweizähniger Ligand, an den Metall über die Atome O und N koordiniert.
-
Gemäß einem anderen Aspekt ist M ausgewählt aus Ir und Pt.
-
Gemäß einem anderen Aspekt ist (Y3–Y4) ein Carbenligand.
-
Beispiele für organische Verbindungen, die als Wirt verwendet werden, sind ausgewählt aus der Gruppe bestehend aus aromatischen zyklischen Kohlenwasserstoffverbindungen, wie beispielsweise Benzol, Biphenyl, Triphenyl, Triphenylen, Naphthalin, Anthracen, Phenalen, Phenanthren, Fluoren, Pyren, Chrysen, Perylen, Azulen; der Gruppe bestehend aus aromatischen heterozyklischen Verbindungen, wie beispielsweise Dibenzothiophen, Dibenzofuran, Dibenzoselenophen, Furan, Thiophen, Benzofuran, Benzothiophen, Benzoselenophen, Carbazol, Indolocarbazol, Pyridylindol, Pyrrolodipyridin, Pyrazol, Imidazol, Triazol, Oxazol, Thiazol, Oxadiazol, Oxatriazol, Dioxazol, Thiadiazol, Pyridin, Pyridazin, Pyrimidin, Pyrazin, Triazin, Oxazin, Oxathiazin, Oxadiazin, Indol, Benzimidazol, Indazol, Indoxazin, Benzoxazol, Benzisoxazol, Benzothiazol, Chinolin, Isochinolin, Cinnolin, Chinazolin, Chinoxalin, Naphthyridin, Phthalazin, Pteridin, Xanthen, Acridin, Phenazin, Phenothiazin, Phenoxazin, Benzofuropyridin, Furodipyridin, Benzothienopyridin, Thienodipyridin, Benzoselenophenopyridin und Selenophenodipyridin; und der Gruppe bestehend aus 2 bis 10 zyklischen Struktureinheiten, die Gruppen der gleichen Art oder unterschiedlicher Arten sind, ausgewählt aus der aromatischen zyklischen Kohlenwasserstoffgruppe und der aromatischen heterozyklischen Gruppe, und die miteinander direkt oder über mindestens einen von Sauerstoffatom, Stickstoffatom, Schwefelatom, Siliciumatom, Phosphoratom, Boratom, einer kettenförmigen Struktureinheit und der aliphatischen zyklischen Gruppe gebunden sind. Wobei jede Gruppe weiter durch einen Substituenten ausgewählt aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon substituiert ist.
-
Gemäß einem Aspekt enthält eine Wirtsverbindung mindestens eine der folgenden Gruppen im Molekül:
-
R1 bis R7 sind unabhängig voneinander ausgewählt aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäuren, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon, wenn es Aryl oder Heteroaryl ist, ist es ähnlich definiert wie die oben genannten Ar.
-
k ist eine ganze Zahl von 0 bis 20.
-
X1 bis X8 sind ausgewählt aus C (einschließlich CH) oder N.
Z1 und Z2 sind ausgewählt aus NR1, O oder S.
-
HBL:
-
Eine Lochsperrschicht (HBL) kann verwendet werden, um die Anzahl der Löcher und/oder Exzitonen zu reduzieren, die die Emissionsschicht verlassen. Verglichen mit einer ähnlichen Vorrichtung ohne eine Sperrschicht kann das Vorhandensein einer solchen Sperrschicht in einer Vorrichtung zu wesentlich höheren Wirkungsgraden führen. Auch kann eine Sperrschicht verwendet werden, um Emissionen auf einen gewünschten Bereich einer OLED zu beschränken.
-
Gemäß einem Aspekt enthält eine in HBL verwendete Verbindung das gleiche Molekül oder die gleichen funktionellen Gruppen wie oben für einen Wirt beschrieben.
-
Gemäß einem anderen Aspekt enthält eine in HBL verwendete Verbindung mindestens eine der folgenden Gruppen im Molekül:
-
k ist eine ganze Zahl von 0 bis 20; L ist ein Hilfsligand, m ist eine ganze Zahl von 1 bis 3.
-
ETL:
-
Eine Elektronentransportschicht (ETL) kann ein Material umfassen, das zum Transportieren von Elektronen fähig ist. Eine Elektronentransportschicht kann intrinsisch (undotiert) oder dotiert sein. Dotieren kann eingesetzt werden, um die Leitfähigkeit zu verbessern. Beispiele für das ETL-Material sind nicht besonders beschränkt, und jeder beliebige Metallkomplex oder jede beliebige organische Verbindung kann verwendet werden, solange sie typischerweise verwendet werden, um Elektronen zu transportieren.
-
Gemäß einem Aspekt enthält eine in ETL verwendete Verbindung mindestens eine der folgenden Gruppen im Molekül:
-
R1 ist ausgewählt aus der Gruppe bestehend aus Wasserstoff, Deuterium, Halogenid, Alkyl, Cycloalkyl, Heteroalkyl, Arylalkyl, Alkoxy, Aryloxy, Amino, Silyl, Alkenyl, Cycloalkenyl, Heteroalkenyl, Alkinyl, Aryl, Heteroaryl, Acyl, Carbonyl, Carbonsäure, Ester, Nitril, Isonitril, Sulfanyl, Sulfinyl, Sulfonyl, Phosphino und Kombinationen davon, wenn es Aryl oder Heteroaryl ist, ist es ähnlich definiert wie die oben genannten Ar.
-
Ar1 bis Ar3 sind ähnlich definiert wie die oben genannten Ar.
-
k ist eine ganze Zahl von 0 bis 20 ist.
-
X1 bis X8 sind ausgewählt aus C (einschließlich CH) oder N.
-
Gemäß einem anderen Aspekt enthalten die in ETL verwendeten Metallkomplexe, ohne darauf beschränkt zu sein, die folgende allgemeine Formel:
-
(O-N) oder (N-N) ist ein zweizähniger Ligand, an den Metall über die Atome O, N oder N, N koordiniert; L ist ein Hilfsligand; m ist eine ganze Zahl von 1 bis zur maximalen Anzahl von Liganden, die an das Metall gebunden sein können.
-
Bei allen oben erwähnten Verbindungen, die in jeder Schicht der OLED-Vorrichtung verwendet werden, können die Wasserstoffatome teilweise oder vollständig deuteriert sein.
-
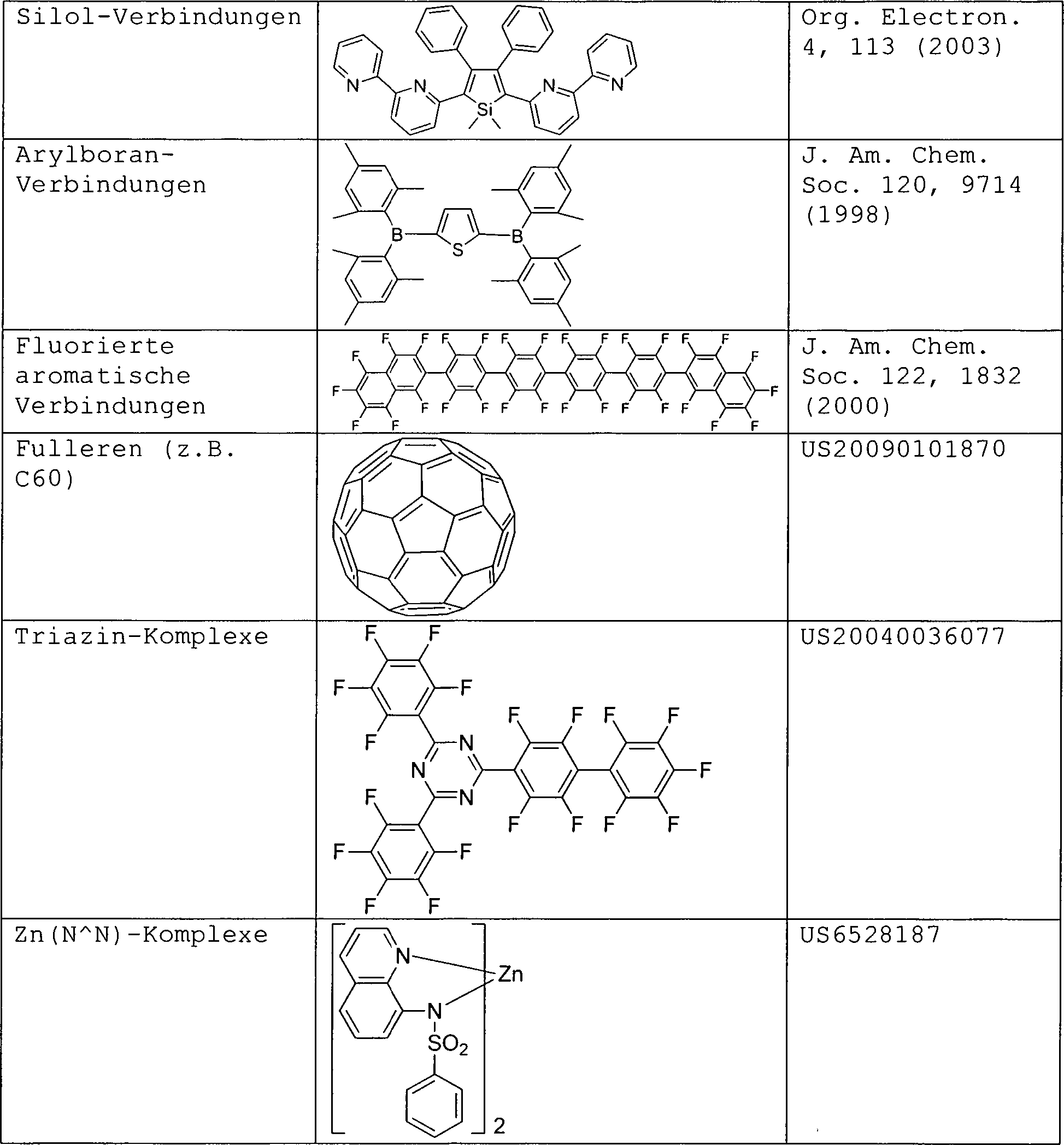
Zusätzlich zu und/oder in Kombination mit den hier offenbarten Materialien können viele Lochinjektionsmaterialien, lochtransportierende Materialien, Wirtsmaterialien, Dotiermaterialien, Exziton-/Lochsperrschichtmaterialien, elektronentransportierende und elektroneninjizierende Materialien in einer OLED verwendet werden. Nicht beschränkende Beispiele der Materialien, die in einer OLED in Kombination mit hier offenbarten Materialien verwendet werden können, sind nachfolgend in Tabelle 4 aufgeführt. Tabelle 4 listet nicht beschränkende Klassen von Materialien, nicht beschränkende Beispiele für Verbindungen für jede Klasse und Literaturverweise, die das Material offenbaren. TABELLE 4
-
EXPERIMENTELLER TEIL
-
Chemische Abkürzungen in diesem Dokument werden wie folgt verwendet: dba steht für Dibenzylidenaceton, EtOAc steht für Ethylacetat, dppf steht für 1,1'-Bis(diphenylphosphino)ferrocen, DCM steht für Dichlormethan, SPhos steht für Dicyclohexyl(2',6'-dimethoxy[1,1'-biphenyl]-3-yl)phosphin, THF steht für Tetrahydrofuran. Die Synthese von Verbindung 1
-
In eine Suspension von 2-Bromtriphenylen (7,28 g, 23,70 mmol) in Ether (50 ml) wurde n-Butyllithium-Lösung in Hexan (14,81 ml, 23,70 mmol) bei –78°C tropfenweise zugegeben. Die Suspension wurde allmählich auf 0°C erwärmt und 3 Stunden gerührt, um eine Lösung von Triphenylenyllithium zu ergeben. In einem separaten Kolben wurde eine Lösung von 3-Bromphenyllithium durch tropfenweise Zugabe von n-Butyllithium-Lösung in Hexan (14,81 ml, 23,70 mmol) zu einer Lösung von 1,3-Dibrombenzol (2,87 ml, 23,70 mmol) in Ether (50 ml) hergestellt. Die Lösung wurde bei dieser Temperatur 2,5 Stunden lang gerührt, bevor sie einer Lösung von Dichlordiphenylsilan (4,88 ml, 23,70 mmol) in Ether (30 ml) bei –78°C zugegeben wurde. Nach weiterem zweistündigem Rühren wurde die oben hergestellte Triphenylenyllithium-Lösung tropfenweise in den Kolben mit dem Dichlorphenylsilan gegeben. Man ließ das Reaktionsgemisch langsam auf Raumtemperatur erwärmen und rührte über Nacht. Das Gemisch wurde mit Wasser gelöscht, und die organische Phase wurde isoliert. Nach Abziehen des Lösungsmittels wurde der Rückstand durch Säulenchromatografie an Kieselgel mit Hexan/DCM (85/15, Vol./Vol.) als Elutionsmittel gereinigt und ergab (3-Bromphenyl)diphenyl(triphenylen-2-yl)silan (8,5 g, 75%) als ein weißes Pulver.
-
-
Eine Lösung von Dibenzo[b,d]thiophen-4-ylboronsäure (1,573 g, 6,90 mmol), (3-Bromphenyl)diphenyl(triphenylen-2-yl) silan (3, 5,30 mmol), Pd
2(dba)
3 (0,097 g, 0,106 mmol), SPhos (0,087 g, 0,212 mmol) und K
3PO
4 (3,38 g, 15,91 mmol) in Toluol (50 ml) und Wasser (7 ml) wurde bei 100°C unter Stickstoff über Nacht gerührt. Nach Abkühlen auf Raumtemperatur wurde die organische Phase isoliert, die wässrige Phase wurde mit DCM extrahiert und die vereinigte organische Lösung wurde über Na
2SO
4 getrocknet. Nach Abziehen des Lösungsmittels wurde der Rückstand durch Säulenchromatografie an Kieselgel mit Hexan/Dichlormethan (9/1 bis 8,5/1,5, Vol./Vol.) als Elutionsmittel gereinigt und ergab Verbindung 1 (2,4 g, 68%) als einen weißen Feststoff. Die Synthese von Verbindung 2
-
Eine Lösung von (3-Bromphenyl)diphenyl(triphenylen-2-yl)silan (2,9 g, 5,13 mmol), Dibenzo[b,d]furan-4-ylboronsäure (1,196 g, 5,64 mmol), Pd
2(dba)
3 (0,094 g, 0,10 mmol), SPhos (90 mg, 0,22 mmol) und K
3PO
4 (2,72 g, 12,82 mmol) in Toluol (150 ml) und Wasser (10 ml) wurde unter Stickstoff über Nacht unter Rückfluss erhitzt. Nach Abziehen des Lösungsmittels wurde der Rückstand durch Säulenchromatografie an Kieselgel mit Hexan/DCM (4/1, Vol./Vol.) als Elutionsmittel gereinigt und ergab Verbindung 2 (1,5 g, 44%) als einen weißen Feststoff. Die Synthese von Verbindung 3
-
Ein Gemisch aus (3-Bromphenyl)diphenyl(triphenylen-2-yl)silan (3,52 g, 6,22 mmol), 9H-Carbazol (1,249 g, 7,47 mmol), Pd
2(dba)
3 (0,114 g, 0,124 mmol), SPhos (0,102 g, 0,249 mmol) und Natrium-tert-butoxid (1,794 g, 18,67 mmol) in m-Xylol (100 ml) wurde unter Stickstoff über Nacht unter Rückfluss erhitzt. Nach dem Abkühlen auf Raumtemperatur wurde es durch einen Celite
®-Pfropfen filtriert. Die organische Lösung wurde eingeengt, und der Rückstand wurde durch Säulenchromatografie an Kieselgel mit Hexan/DCM (85/15, Vol./Vol.) als Elutionsmittel und Fällung in Methanol gereinigt und ergab Verbindung 3 (3,5 g, 86%) als ein weißes Pulver. Die Synthese von Verbindung 4
-
Ein Gemisch aus (3-Bromphenyl)diphenyl(triphenylen-2-yl)silan (3 g, 5,30 mmol), 9H-3,9'-Bicarbazol (2,116 g, 6,37 mmol), Pd
2(dba)
3 (0,097 g, 0,106 mmol), SPhos (0,087 g, 0,212 mmol) und Natrium-tert-butoxid (1,529 g, 15,91 mmol) in m-Xylol (100 ml) wurde unter Stickstoff bei 165°C über Nacht unter Rückfluss erhitzt. Nach dem Abkühlen auf Raumtemperatur wurde dieses durch einen kurzen Celite
®-Pfropfen filtriert. Nach Abziehen des Lösungsmittels wurde der Rückstand durch Säulenchromatografie an Kieselgel mit Hexan/DCM (8/2 bis 3/1, Vol./Vol.) als Elutionsmittel gereinigt und ergab Verbindung 4 (4,0 g, 92%) als einen weißen Feststoff. Die Synthese von Verbindung 5
-
Eine Lösung von (3-Bromphenyl)diphenyl(triphenylen-2-yl)silan (2,5 g, 4,42 mmol), 9-Phenyl-9H,9'H-3,3'-Bicarbazol (1,806 g, 4,42 mmol), Pd
2(dba)
3 (0,081 g, 0,088 mmol), SPhos (0,073 g, 0,177 mmol) und Natrium-tert-butoxid (1,274 g, 13,26 mmol) in m-Xylol (80 ml) wurde unter Stickstoff über Nacht unter Rückfluss erhitzt. Nach dem Abkühlen auf Raumtemperatur wurde diese durch einen kurzen Celite
®-Pfropfen durchgeleitet. Nach Abziehen des Lösungsmittels wurde der Rückstand durch Säulenchromatografie an Kieselgel mit Hexan/DCM (4/1 bis 3/2, Vol./Vol.) als Elutionsmittel gereinigt und ergab Verbindung 5 als ein weißes Pulver. Die Synthese von Vergleichsverbindung 1 (CC-1)
-
2-Bromtriphenylen (3,4 g, 11,1 mmol) wurde in Et
2O (100 mL) gelöst und auf –78°C gekühlt, bevor n-BuLi (4,9 ml, 12,1 mmol) tropfenweise zugegeben wurde. Das Reaktionsgemisch wurde langsam auf 0°C erwärmen lassen und 30 Minuten lang gerührt, bevor es erneut auf –78°C abgekühlt wurde. Diphenyldichlorsilan (1,1 ml, 5,3 mmol) in 20 ml Et
2O wurde tropfenweise zu dem Reaktionsgemisch gegeben. Nach langsamem Erwärmen auf Raumtemperatur über Nacht wurde das dickflüssige Gemisch 3 h unter Rückfluss erhitzt. Nach dem Abkühlen auf Raumtemperatur wurde 300 ml Wasser unter schnellem Rühren zugegeben und der Niederschlag wurde aus dem zweiphasigen Gemisch abfiltriert und mit Et
2O gewaschen. Der Feststoff wurde in DCM gelöst und durch einen Silikagel-Pfropfen auf einer Fritte filtriert. Entfernen des Lösungsmittels ergab CC-1 (2,4 g, 72%) als einen weißen Feststoff. Die Synthese von Vergleichsverbindung 2 (CC-2)
-
2-Bromtriphenylen (5,5 g, 14,3 mmol) wurde in THF (50 ml) gelöst und auf –78°C abgekühlt, bevor n-BuLi (5,7 ml, 14,3 mmol) tropfenweise zugegeben wurde. Das Reaktionsgemisch wurde langsam auf –30°C erwärmen lassen, bevor es erneut auf –78°C abgekühlt wurde. Chlortriphenylsilan (3,8 g, 13,0 mmol) wurde in 20 ml THF gelöst und tropfenweise zu dem Reaktionsgemisch gegeben, das man anschließend langsam über Nacht auf Raumtemperatur erwärmen ließ und noch 2 h lang auf 40°C erwärmte. Nach dem Abkühlen auf Raumtemperatur wurde das Reaktionsgemisch mit MeOH und NH4Cl (aq.) gelöscht, dreimal mit EtOAc (50 ml) extrahiert, getrocknet und am Rotationsverdampfer eingeengt und ergab 7,8 g eines gelben Feststoffs. Das Rohmaterial wurde an Kieselgel mit Hexan/DCM (9/1, Vol./Vol.) als Elutionsmittel chromatografiert. Rekristallisation aus DCM/Hexan ergab CC-2 (5,5 g, 87%) als einen weißen kristallinen Feststoff.
-
Es versteht sich, dass die verschiedenen hier beschriebenen Ausführungsformen lediglich beispielhafter Natur sind, und den Umfang der Erfindung nicht beschränken sollen. Zum Beispiel können viele der hier beschriebenen Materialien und Strukturen durch andere Materialien und Strukturen ersetzt werden, ohne vom Geist der Erfindung abzuweichen. Für einen Fachmann auf dem Gebiet ist ersichtlich, dass die vorliegende Erfindung, wie beansprucht, daher Abweichungen von den hier beschriebenen konkreten Beispielen und bevorzugten Ausführungsformen enthalten kann. Es versteht sich, dass verschiedene Theorien, warum die Erfindung funktioniert, nicht beschränkend sein sollen.
-
ZITATE ENTHALTEN IN DER BESCHREIBUNG
-
Diese Liste der vom Anmelder aufgeführten Dokumente wurde automatisiert erzeugt und ist ausschließlich zur besseren Information des Lesers aufgenommen. Die Liste ist nicht Bestandteil der deutschen Patent- bzw. Gebrauchsmusteranmeldung. Das DPMA übernimmt keinerlei Haftung für etwaige Fehler oder Auslassungen.
-
Zitierte Patentliteratur
-
- US 5844363 [0004, 0044]
- US 6303238 [0004, 0044]
- US 5707745 [0004, 0044, 0047]
- US 7279704 [0014, 0042, 0043, 0051]
- US 4769292 [0041]
- US 5703436 [0044]
- US 6097147 [0044]
- US 5247190 [0047]
- US 6091195 [0047]
- US 5834893 [0047]
- US 6013982 [0048]
- US 6087196 [0048]
- US 6337102 [0048]
- US 6294398 [0048]
- US 6468819 [0048]
-
Zitierte Nicht-Patentliteratur
-
- Baldo et al., „Highly Efficient Phosphoreszent Emission from Organic Electroluminescent Devices”, Nature, Band 395, 151–154, 1998 [0042]
- Baldo et al., „Very high-efficiency green organic light-emitting devices based an electrophosphorescence”, Appl. Phys. Lett., Band 75, Nr. 3, 4–6 (1999) [0042]