CN112209845A - 低粘度低反应活性的聚天门冬氨酸酯、其制备方法及涂料 - Google Patents
低粘度低反应活性的聚天门冬氨酸酯、其制备方法及涂料 Download PDFInfo
- Publication number
- CN112209845A CN112209845A CN202010989412.8A CN202010989412A CN112209845A CN 112209845 A CN112209845 A CN 112209845A CN 202010989412 A CN202010989412 A CN 202010989412A CN 112209845 A CN112209845 A CN 112209845A
- Authority
- CN
- China
- Prior art keywords
- product
- ester
- acid ester
- low
- polyaspartic acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C229/00—Compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C229/02—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C229/04—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being acyclic and saturated
- C07C229/24—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being acyclic and saturated having more than one carboxyl group bound to the carbon skeleton, e.g. aspartic acid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C227/00—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C227/04—Formation of amino groups in compounds containing carboxyl groups
- C07C227/06—Formation of amino groups in compounds containing carboxyl groups by addition or substitution reactions, without increasing the number of carbon atoms in the carbon skeleton of the acid
- C07C227/08—Formation of amino groups in compounds containing carboxyl groups by addition or substitution reactions, without increasing the number of carbon atoms in the carbon skeleton of the acid by reaction of ammonia or amines with acids containing functional groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C227/00—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C227/14—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton from compounds containing already amino and carboxyl groups or derivatives thereof
- C07C227/18—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton from compounds containing already amino and carboxyl groups or derivatives thereof by reactions involving amino or carboxyl groups, e.g. hydrolysis of esters or amides, by formation of halides, salts or esters
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09D—COATING COMPOSITIONS, e.g. PAINTS, VARNISHES OR LACQUERS; FILLING PASTES; CHEMICAL PAINT OR INK REMOVERS; INKS; CORRECTING FLUIDS; WOODSTAINS; PASTES OR SOLIDS FOR COLOURING OR PRINTING; USE OF MATERIALS THEREFOR
- C09D175/00—Coating compositions based on polyureas or polyurethanes; Coating compositions based on derivatives of such polymers
- C09D175/02—Polyureas
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Wood Science & Technology (AREA)
- Paints Or Removers (AREA)
Abstract
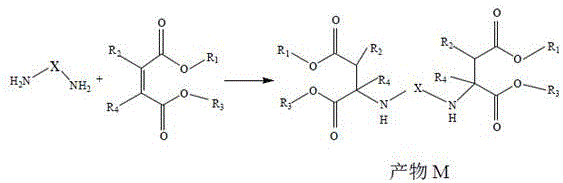
本发明公开了一种低粘度低反应活性的聚天门冬氨酸酯,涉及聚天门冬氨酸酯制备的技术领域,反应式A:不饱和酯R1OOC(R2)C=C(R4)‑COOR3与多元伯氨X‑(NH2)2进行迈克尔加成反应,得到聚天门冬氨酸酯产物M;反应式B:产物M与一元醇R5OH进行酯交换反应,得到聚天门冬氨酸酯产物N。其中,R1和R3可以相同或不同,表示在100℃以上对异氰酸酯基团呈惰性的有机基团,R2和R4可以相同或不同,表示氢或在100℃以上对异氰酸酯基团呈惰性的有机基团;X为表示在100℃以上对异氰酸酯基呈惰性的有机基团;反应式A中不饱和双键与伯氨基的摩尔比为1‑1.05,R5OH为含有8‑24个碳原子的一元醇。本发明制备的聚天门冬氨酸酯产物N延迟了树脂的凝胶化时间,提高产物N与多异氰酸酯混合物的可操作性。
Description
技术领域
本发明涉及聚天门冬氨酸酯制备的技术领域,更具体地说,它涉及一种低粘度低反应活性的聚天门冬氨酸酯、其制备方法及涂料。
背景技术
聚天门冬氨酸酯树脂是由伯氨与马来酸酯经过迈克尔加成合成的树脂,是近年来开发的一种新型位阻胺,这种类型树脂通常与异氰酸酯制备得到双组份涂料、板材组合物。
在实际制备涂料的过程中,主要是将大量的聚天门冬氨酸酯树脂与适配的异氰酸酯结合,对于无溶剂的条件下,组合物极易粘度极易变大,且在搅拌过程中混合的物料会产生大量的热,加速了混合物的凝胶化时间,当聚天门冬氨酸酯树脂与异氰酸酯混合的粘度达到2000cps时,便不能应用。
现有的聚天门冬氨酸酯树脂与异氰酸酯混合物的凝胶化时间一般在3-60min,对于高固体份涂料与无溶剂涂料而言,可操作的时间仅有几分钟到二十几分钟,之后混合物的粘度就会大于2000cps,使用者需要在粘度小于2000 cps时进行施工,可操作的时间过短,还需要特殊设备进行施工,施工过程较为繁琐。
发明内容
针对现有技术存在的不足,本发明的第一个目的在于提供一种低粘度低反应活性聚天门冬氨酸酯,其具有低粘度和低反应活性的优点。
一种低粘度低反应活性的聚天门冬氨酸酯,
不饱和酯R1OOC(R2)C=C(R4)-COOR3与多元伯氨X-(NH2)2进行迈克尔加成反应,反应式A:
在催化剂条件下,将反应式A中的产物M与一元醇R5OH进行酯交换反应,反应式B:
其中,R1和R3可以相同或不同,表示在100℃以上对异氰酸酯基团呈惰性的有机基团,R2和R4可以相同或不同,表示氢或在100℃以上对异氰酸酯基团呈惰性的有机基团;
X为表示在100℃以上对异氰酸酯基呈惰性的有机基团;
反应式A中,不饱和双键与伯氨基的摩尔比为1-1.05;
R5OH为含有m个碳原子的一元醇,m的数值为8-24;
P1、P2、P3、P4中至少有一个为R5。
通过采用上述技术方案,不饱和酸酯与伯氨经过迈克尔加成反应生成聚天门冬氨酸酯的产物M,在催化剂的条件下,产物M与碳原子个数为m的一元醇进行酯交换反应,得到产物N。经试验数据证明,得到产物M的粘度大于产物N的粘度,经过酯交换后产物M的粘度降低。通过酯交换反应增加了聚天门冬氨酸酯产物M中有机官能团(至少一个R1、R2、R3和R4)中官能团的长度,聚天门冬氨酸酯产物N相对于聚天门冬氨酸酯产物M增大了体积,分子空间位阻增大,降低了与脂肪类异氰酸酯反应速度,延长了凝胶化时间,提高了施工的可操作时间,即使用普通的施工方式也能够进行操作,具有重要的工业应用前景。
优选的,所述反应式B中羟基与酯键反应的摩尔比例值为k,其中0<k≤1。
通过采用上述技术方案,当控制反应B式中羟基与酯基反应的比例k在0和1之间,得到了反应活性低和凝胶化时间长的产物N;若k大于1,一元醇过量,残留的醇会催化聚天门冬氨酸树脂与异氰酸酯反应,使得粘度增长变化过快。
优选的,所述一元醇中碳原子个数为10-16,优选为10-14。
通过采用上述技术方案,制备得到的聚天门冬氨酸酯产物N的粘度和凝胶时间更符合生产应用。
优选的,所述一元醇为辛醇、壬醇、癸醇、十一碳醇、十二碳醇、十三碳醇、十四碳醇、十五碳醇、十六碳醇、十七碳醇、十八碳醇、十九碳醇、二十碳醇、二十一碳醇、二十二碳醇、二十三碳醇、二十四碳醇、苯甲醇、苯乙醇、苯丙醇、苯丁醇、苯戊醇、苯己醇、环己基甲醇、环己基乙醇、环己基丙醇、环己基丁醇、格尔伯特醇其中一种或几种组合物。
通过采用上述技术方案,采用上述一元醇与产物M进行酯交换反应生成产物N,得到的产物N相对于产物M,分子空间位阻增大,降低了反应活性,延长了凝胶化时间。
优选的,所述反应式B中羟基与酯键的比例值k为0.15-0.75。
通过采用上述技术方案,在反应步骤B中,当羟基与酯键的比例值k为0.15-0.75,得到聚天门冬氨酸酯产物N的粘度和凝胶化时间更符合工业生产应用。
优选的,所述多元伯胺包括乙二胺、1,2-和1,3-丙二胺、2-甲基-1,2-丙二胺、2,2-二甲基-1,3-丙二胺、1,3-和1,4-丁二胺、1,3-和1,5-戊二胺、2-甲基-1,5-戊二胺、1,6-己二胺、2,5-二甲基-2,5-己二胺、2,2,4-和/或2,4,4-三甲基-1,6-己二胺、1,7-庚二胺、1,8-辛二胺、1,9-壬二胺、1,10-癸二胺、1,11-十一烷二胺、1,12-十二烷二胺、1-氨基-3-氨基甲基-3,5,5-三甲基环己烷、2,4-和/或2,6-六氢亚甲苯基二胺、2,4’-和/或4,4’-二氨基-二环己基甲烷、3,3’-二烷基-4,4’-二氨基-二环己基甲烷(例如3,3’-二甲基-4,4’-二氨基-二环己基甲烷和3,3’-二乙基-4,4’-二氨基-二环己基甲烷)、1,3-和/或1,4-环己二胺、1,3-双(甲基氨基)-环己烷、1,8-对-薄荷烷二胺其中一种或几种组合物。
优选的,所述不饱和酯包括马来酸和富马酸的二甲酯、二乙酯、二正丙酯、二异丙酯、二正丁酯、二异丁酯中一种或几种组合物;所述催化剂为钛化合物、锡化合物、锌化合物、锑化合物和铅化合物其中一种或几种组合物。
本发明的第二个目的在于提供一种低粘度低反应活性聚天门冬氨酸酯的制备方法。
(1) 产物M的制备:
向烧瓶中加入多元伯氨,开启搅拌,加热至45℃,滴加不饱和酯并通入氮气保护,升温至60-90℃,冷却后得到聚天门冬氨酸酯树脂,聚天门冬氨酸酯树脂在傅里叶红外光谱中无伯氨吸收峰;
(2) 产物N的制备:
在步骤(1)得到的产物M中加入一元醇,加入催化剂,在真空下,升温至50-300℃,得到低粘度的聚天门冬氨酸酯树脂,称为产物N。
优选的,所述步骤(2)中酯交换温度为80-200℃,优选为100-150℃。
本发明的第三个目的在于提供一种低粘度低反应活性聚天门冬氨酸酯的应用,所述聚天门冬氨酸酯产物N用于涂覆在设备和地坪的表面。
通过采用上述技术方案,由产物N制备涂料用于机械和地坪表面防腐的施工可操作时间长,制备得到的地坪或机械漆膜表面状态较佳。
综上所述,本发明至少具有以下一种有益效果:
第一、本发明中优选采用酯交换反应,通过将得到的聚天门冬氨酸酯树脂产物M与8-24碳原子数的一元醇发生酯交换反应,形成了体积较大的聚天门冬酯树脂,分子的空间位阻增大,增加了聚天门冬氨酸酯树脂中酯基的大小,进一步降低了与多异氰酸酯反应的速度,延迟了树脂的凝胶时间,提高了聚天门冬氨酸酯树脂与多异氰酸酯混合物的可操作性,对于制备高固含或无溶剂涂料极其有利。
第二、本发明中通过设定多元伯氨与不饱和二元酸酯的反应条件,限定多元伯氨与不饱和二元酸酯中,R1、R2、R3、R4和X的特性,不饱和双键与伯氨基团的摩尔比,并通过酯交换反应,聚天门冬氨酸酯树脂的粘度降低了39.3%—65.5%,树脂的凝胶时间增加了7.7-16.6倍,由35min最长可延迟到580min,显著提高了聚天门冬氨酸酯树脂与多异氰酸酯混合物的可操作性。
第三、本发明制备得到聚天门冬氨酸酯的产物N反应步骤简单,易操作,可以大批量进行生产,对于涂料的研究和进一步发展具有重要的工业应用意义,值得大力推广。
具体实施方式
下面将结合本发明实施例中的表格,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在理解本发明的发明构思前提下所获得的其他实施例,都属于本发明保护的范围内。
胺值测试:高氯酸-冰醋酸法。
测定凝胶化时间:使用SHYODU GEL TIMER MODEL100凝胶时间测定仪在25℃,52%湿度下测试。
粘度测试:采用GB/T12008.8-1992测试标准,采用旋转粘度计进行测试。
在本申请中的实施例和对比例中产物M均采用深圳飞扬骏研新材料股份有限公司市售的F420树脂;反应B式得到的反应产物除了产物N,还有包含R1、R2、R3和R4其中一种或几种组合物混合的一元醇。
在本申请中不饱和酯包括马来酸和富马酸的二甲酯、二乙酯、二正丙酯、二异丙酯、二正丁酯、二异丁酯中一种或其几种组合物。本发明选用马来酸二乙酯进行示例说明。
多异氰酸酯采用六亚甲基二异氰酸酯基聚异氰酸酯,本申请以生产厂家为万华化学集团股份有限公司,型号为HT-600的多异氰酸酯进行示例说明,六亚甲基二异氰酸酯基聚异氰酸酯也可以选用其他生产厂家和型号。
另外在本申请中,在反应B式中,酯交换反应采用钛化合物、锡化合物、锌化合物、锑化合物和铅化合物催化剂,例如丁氧钛(IV)、钛酸异丙酯、四氯化钛、四(2-乙基己基)-钛酸酯、氧化锡(IV)、氧化二丁基锡、氧化二辛基锡、二月桂酸二丁基锡、二月桂酸二辛基锡、辛酸亚锡、氧化氢氧化丁基锡、氢氧化辛基锡、氧化锌(IV)、氧化锌(II)、苯酚铅和乙酸铅。
在本申请中,低粘度与低反应活性是相对于未改性前树脂的粘度与反应活性,经过本申请中反应A和反应B式的步骤,改性的树脂产物N反应活性都会比原树脂产物M的粘度、反应活性低。
(一)低粘度低反应活性聚天门冬氨酸酯树脂的制备方法
实施例1
(1)产物M的制备:向三口烧瓶中加入210g的4,4’-二氨基-二环己基甲烷,开启搅拌,加热至45℃,用滴液漏斗滴加350g马来酸二乙酯并通入氮气保护,滴加3h,升温至70℃恒温保持48h,冷却后得到聚天门冬氨酸酯树脂,得到F420树脂,F420树脂在傅里叶红外光谱中无伯氨吸收峰;
(2) 产物N的制备:在554g步骤(1)得到的F420树脂中加入270g十八烷醇,加入0.4g钛酸四异丙酯,在200pa真空度下,升温至100℃反应1h,升温至115℃反应3h,130℃反应2h,得到低粘度的聚天门冬氨酸酯树脂,称为产物N,测试产物N的粘度和胺值;
(3)称取步骤(2)中50g产物N与24.6g多异氰酸酯HT600混合,测定混合物的凝胶化时间。
对比例1
对比例1与实施例1不同之处在于:省去步骤(2),将50gF420树脂直接与34.6g多异氰酸酯HT600反应,其余与实施例1相同。
实施例2
实施例2与实施例1的不同之处在于:在步骤(2)中是将270g十八烷醇替换为242g十六烷醇;在步骤(3)中多异氰酸酯HT600的质量为25.5g,其余条件与实施例1相同。
实施例3
实施例3与实施例1的不同之处在于:在步骤(2)中是将270g十八烷醇替换为214g十四烷醇;在步骤(3)中多异氰酸酯HT600的质量为26.5g,其余条件与实施例1相同。
实施例4
实施例4与实施例1的不同之处在于:在步骤(2)中是将270g十八烷醇替换为158g癸醇;在步骤(3)中多异氰酸酯HT600的质量为28.8g,其余条件与实施例1相同。
表1 对比例1和实施例1-4中产物M和产物N的物性,酯交换反应温度以及产物N与多异氰酸酯HT600的凝胶化时间
从表1中试验数据显示,实施例1-4相对对比例1,产物M经过一元醇酯交换得到了产物N,相较于粘度值为1220 cps的产物M,产物N的粘度值在500-740cps之间,产物N的粘度值明显下降;同时,相较于产物M与多异氰酸酯HT600的反应,产物N与多异氰酸酯HT600的混合凝胶化时间,由35min延长至355-400min,相较于产物M,得到了低粘度的聚天门冬氨酸酯产物N,显著地降低了聚天门冬氨酸酯与多异氰酸酯HT600的反应活性。低粘度低反应活性的聚天门冬氨酸酯产物N,延迟了树脂的凝胶时间,提高了聚天门冬氨酸酯与多异氰酸酯HT600混合物的可操作性。
实施例1-4中我们分别采用了十八烷醇、十六烷醇、十四烷醇和癸醇与产物M进行酯交换反应,得到的产物N粘度均显著下降,产物N分子的空间位阻增大,降低了产物N的反应活性,显著地增加了与多异氰酸酯HT600反应混合凝胶化时间。经试验证明,采用辛醇与产物M进行酯交换反应,也可以得到低粘度的聚天门冬氨酸酯,说明了产物M与一元醇进行酯交换反应时,直链一元醇碳原子个数在大于8均可得到低粘度低反应活性的聚天门冬氨酸酯。另外由直链一元饱和脂肪醇与产物M反应得到低粘度低反应活性的聚天门冬氨酸酯的产物N,制备的高固含或无溶剂涂料时不易变色。
同时,在试验研究一元碳醇的反应中,还采用了二十四烷醇进行研究,在与实施例1中条件相同下,在反应B中用二十四烷醇代替十八烷醇,采用二十四烷醇与产物M进行酯交换反应得到产物N,产物N的粘度也明显降低,但从二十四烷醇的易得性及工业化生产考虑,仅采用二十四烷醇做实验性研究。
实施例5
(1)产物M的制备:向三口烧瓶中加入210g的4,4’-二氨基-二环己基甲烷,开启搅拌,加热至45℃下通过滴液漏斗滴加350g马来酸二乙酯并通入氮气保护,滴加3h,升温至70℃恒温保持48h,冷却后得到聚天门冬氨酸酯树脂,得到F420树脂,F420树脂在傅里叶红外光谱中无伯氨吸收峰;
(2)产物N的制备:在554g步骤(1)得到的F420树脂中加入162g十八烷醇,加入0.4g钛酸四异丙酯,在200pa真空度下,升温至100℃反应1h,升温至115℃反应3h,130℃反应2h,得到低粘度的聚天门冬氨酸酯树脂,称为产物N,测试产物N的粘度和胺值;
(3)称取步骤(2)中50g产物N与27.8g多异氰酸酯HT600混合,测定混合物的凝胶化时间。
实施例6
(1)产物M的制备:向三口烧瓶中加入210g的4,4’-二氨基-二环己基甲烷,开启搅拌,加热至45℃下通过滴液漏斗滴加350g马来酸二乙酯并通入氮气保护,滴加3h,升温至70℃恒温保持48h,冷却后得到聚天门冬氨酸酯树脂,得到F420树脂,F420树脂在傅里叶红外光谱中无伯氨吸收峰;
(2)产物N的制备:在554g步骤(1)得到的F420树脂中加入474g癸醇,加入0.4g钛酸四异丙酯,在200pa真空度下,升温至100℃反应1h,升温至115℃反应3h,130℃反应2h,得到低粘度的聚天门冬氨酸酯树脂,称为产物N,测试产物N的粘度和胺值;
(3)称取步骤(2)中50g产物N与21.5g多异氰酸酯HT600混合,测定混合物的凝胶化时间。
实施例7
(1)产物M的制备:向三口烧瓶中加入210g的4,4’-二氨基-二环己基甲烷,开启搅拌,加热至45℃下通过滴液漏斗滴加350g马来酸二乙酯并通入氮气保护,滴加3h,升温至70℃恒温保持48h,冷却后得到聚天门冬氨酸酯树脂,得到F420树脂,F420树脂在傅里叶红外光谱中无伯氨吸收峰;
(2)产物N的制备:在554g步骤(1)得到的F420树脂中加入632g癸醇,加入0.4g钛酸四异丙酯,在200pa真空度下,升温至100℃反应1h,升温至115℃反应3h,130℃反应2h,得到低粘度的聚天门冬氨酸酯树脂,称为产物N,测试产物N的粘度和胺值;
(3)称取步骤(2)中50g产物N与19g多异氰酸酯HT600混合,测定混合物的凝胶化时间。
表2 实施例1,5-7中产物M和产物N的各物性,酯交换反应温度以及产物N与多异氰酸酯HT600的凝胶化时间
实施例1和实施例5-7对比了羟基与酯键的比例的变化,羟基与酯键的比值k小于等于1的条件下,得到产物N的粘度都有显著地下降,与多异氰酸酯HT600混合凝胶化时间明显地增加。在相同的一元醇和反应条件下,改变k值大小,k值越大,对应的凝胶化时间越长。
经试验证明,当k值大于1时,一元醇过量,经过反应B式后,残留的醇会催化聚天门冬氨酸树脂与多异氰酸酯HT600反应,使得到的产物N的粘度增长过快,不利聚天门冬氨酸酯树脂与多异氰酸酯HT600混合物的操作。
实施例8
(1)产物M的制备:向三口烧瓶中加入210g的4,4’-二氨基-二环己基甲烷,开启搅拌,加热至45℃,通过滴液漏斗滴加350g马来酸二乙酯并通入氮气保护,滴加3h,升温至70℃恒温保持48h,冷却后得到聚天门冬氨酸酯树脂,得到F420树脂,F420树脂在傅里叶红外光谱中无伯氨吸收峰;
(2)产物N的制备:在554g步骤(1)得到的F420树脂中加入270g十八烷醇,加入0.4g钛酸四异丙酯,在200pa真空度下,升温至100℃反应8h,得到低粘度的聚天门冬氨酸酯树脂,称为产物N,测试产物N的粘度和胺值;
(3)称取步骤(2)中50g产物N与24.6g多异氰酸酯HT600混合,测定混合物的凝胶化时间。
实施例9
(1) 产物M的制备:向的三口烧瓶中加入210g的4,4’-二氨基-二环己基甲烷,开启搅拌,加热至45℃,通过滴液漏斗滴加350g马来酸二乙酯,滴加3h,升温至70℃恒温保持48h,冷却后得到聚天门冬氨酸酯树脂,得到F420树脂,F420树脂在傅里叶红外光谱中无伯氨吸收峰;
(2)产物N的制备:在554g步骤(1)得到的F420树脂中加入270g十八烷醇,加入0.4g钛酸四异丙酯,在200pa真空度下,升温至150℃反应3h,得到低粘度的聚天门冬氨酸酯树脂,称为产物N,测试产物N的粘度和胺值;
(3)称取步骤(2)中50g产物N与24.6g多异氰酸酯HT600混合,测定混合物的凝胶化时间。
表3 实施例1,8,9中产物M和产物N的各物性,酯交换反应温度以及产物N与多异氰酸酯HT600的凝胶化时间
在表3中,实施例1、8和9,产物M与十八烷醇进行酯交换反应时,改变了反应时的温度值,温度分阶段进行,或者保持一定时间的温度值时,均可以得到粘度相近的产物N,即保持B反应的温度在100℃和150℃之间均可以得到低粘度低反应活性的聚天门冬氨酸酯。
综上所述,实施例1-9中的产物N相对于对比例1中的产物M,产物M经过酯交换反应后显著地降低了产物N聚天门冬氨酸酯树脂的粘度与反应活性,粘度降低了39.3%—65.5%,树脂的凝胶时间由35min最长可延迟到580min,增加了7.7-16.6倍,明显提高了聚天门冬氨酸酯树脂与多异氰酸酯HT600混合的可操作性,对于制备高固含或无溶剂涂料极其有利,具有非常高的应用价值。
(二)聚天门冬氨酸酯树脂制备得到涂料的应用
在应用例1-2和应用对比例1-2中,消泡剂、有机硅消泡剂和流平剂采用下述生产厂家和产品型号,也可以选用其他生产厂家和产品型号。
消泡剂:生产厂家为毕克化学有限公司,产品型号为BYK1790。
有机硅消泡剂:生产厂家为毕克化学有限公司,产品型号为BYK085。
流平剂:生产厂家为毕克化学有限公司,产品型号为BYK354。
应用例1
在应用例中,在实施例1中制备得到99.1g产物N中加入0.3g消泡剂、0.2g有机硅消泡剂和0.2g流平剂混合均匀,并向其加入48.8g HT600混合后,得到无溶剂自流平清漆,使用涂布器将清漆涂覆在马口铁板,厚度为100μm,涂料初始混合粘度为660cps,粘度增长至2000cps时间为65min,邵氏硬度在75D。
应用例2
在本应用例中,在实施例1中制备得到99.1g产物N中加入0.3g消泡剂、0.2g有机硅消泡剂和0.2g流平剂混合均匀,并加入48.8g HT600混合后,得到无溶剂自流平清漆,使用涂布器将清漆涂覆在地坪上,厚度为100μm,涂料初始混合粘度为660cps,粘度增长至2000cps时间为65min,邵氏硬度在75D。
应用对比例1
在本应用对比例中,在99.1gF420树脂中加入0.3g消泡剂、0.2g有机硅消泡剂和0.2g流平剂混合均匀,并加入68.6g HT600混合后,得到无溶剂自流平清漆,使用涂布器将清漆涂覆在马口铁板,厚度为100μm,涂料初始混合粘度为1045cps,粘度增长至2000cps时间为13min,邵氏硬度在81D。
应用对比例2
在本应用对比例中,在99.1gF420树脂中加入0.3g消泡剂、0.2g有机硅消泡剂和0.2g流平剂混合均匀,并加入68.6g HT600混合后,得到无溶剂自流平清漆,使用涂布器将清漆涂覆在地坪上,厚度为100μm,涂料初始混合粘度为1045cps,粘度增长至2000cps时间为13min,邵氏硬度在81D。
在应用例1和应用对比例1中,分别制备自流平清漆,涂覆在马口铁板上,在达到相同的粘度2000cps的条件下,应用对比例1中粘度变化时间仅为13min,可操作性时间非常短,需要在较短时间内完成施工,而应用例1中增长时间可达65min,显著提高了可操作时间,使用方便;同样地,在应用例2和应用对比例2中,应用例2的可操作时间也长于应用对比例2中的粘度变化时间13min,且测试的邵氏硬度均在满足应用的范围内。
本具体实施例仅仅是对本发明的解释,其并不是对本发明的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本发明的权利要求范围内都受到专利法的保护。
Claims (10)
1.一种低粘度低反应活性的聚天门冬氨酸酯,其特征在于:
不饱和酯R1OOC(R2)C=C(R4)-COOR3与多元伯氨X-(NH2)2进行迈克尔加成反应,反应式A:
在催化剂条件下,将反应式A中的产物M与一元醇R5OH进行酯交换反应,反应式B:
其中,R1和R3可以相同或不同,表示在100℃以上对异氰酸酯基团呈惰性的有机基团,R2和R4可以相同或不同,表示氢或在100℃以上对异氰酸酯基团呈惰性的有机基团;
X为表示在100℃以上对异氰酸酯基呈惰性的有机基团;
反应式A中,不饱和双键与伯氨基的摩尔比为1-1.05;
R5OH为含有m个碳原子的一元醇,m的数值为8-24;
P1、P2、P3、P4中至少有一个为R5。
2.根据权利要求1所述的低粘度低反应活性的聚天门冬氨酸酯,其特征在于:所述反应式B中羟基与酯键反应的摩尔比例值为k,其中0<k≤1。
3.根据权利要求1所述的低粘度低反应活性的聚天门冬氨酸酯,其特征在于:所述一元醇中碳原子个数为10-16,优选为10-14。
4.根据权利要求1所述的低粘度低反应活性的聚天门冬氨酸酯,其特征在于:所述一元醇为辛醇、壬醇、癸醇、十一碳醇、十二碳醇、十三碳醇、十四碳醇、十五碳醇、十六碳醇、十七碳醇、十八碳醇、十九碳醇、二十碳醇、二十一碳醇、二十二碳醇、二十三碳醇、二十四碳醇、苯甲醇、苯乙醇、苯丙醇、苯丁醇、苯戊醇、苯己醇、环己基甲醇、环己基乙醇、环己基丙醇、环己基丁醇、格尔伯特醇其中一种或几种组合物。
5.根据权利要求2所述的低粘度低反应活性的聚天门冬氨酸酯,其特征在于:所述反应式B中羟基与酯键的比例值k为0.15-0.75。
6.根据权利要求1所述的低粘度低反应活性的聚天门冬氨酸酯,其特征在于:所述多元伯胺包括乙二胺、1,2-和1,3-丙二胺、2-甲基-1,2-丙二胺、2,2-二甲基-1,3-丙二胺、1,3-和1,4-丁二胺、1,3-和1,5-戊二胺、2-甲基-1,5-戊二胺、1,6-己二胺、2,5-二甲基-2,5-己二胺、2,2,4-和/或2,4,4-三甲基-1,6-己二胺、1,7-庚二胺、1,8-辛二胺、1,9-壬二胺、1,10-癸二胺、1,11-十一烷二胺、1,12-十二烷二胺、1-氨基-3-氨基甲基-3,5,5-三甲基环己烷、2,4-和/或2,6-六氢亚甲苯基二胺、2,4’-和/或4,4’-二氨基-二环己基甲烷、3,3’-二烷基-4,4’-二氨基-二环己基甲烷(例如3,3’-二甲基-4,4’-二氨基-二环己基甲烷和3,3’-二乙基-4,4’-二氨基-二环己基甲烷)、1,3-和/或1,4-环己二胺、1,3-双(甲基氨基)-环己烷、1,8-对-薄荷烷二胺其中一种或几种组合物。
7.根据权利要求1所述的低粘度低反应活性的聚天门冬氨酸酯,其特征在于:所述不饱和酯包括马来酸和富马酸的二甲酯、二乙酯、二正丙酯、二异丙酯、二正丁酯、二异丁酯中一种或几种组合物;
所述催化剂为钛化合物、锡化合物、锌化合物、锑化合物和铅化合物其中一种或几种组合物。
8.权利要求1-7中任一项所述的低粘度低反应活性的聚天门冬氨酸酯的制备方法,其特征在于:
(1) 产物M的制备:
向烧瓶中加入多元伯氨,开启搅拌,加热至45℃,滴加不饱和酯并通入氮气保护,升温至60-90℃,冷却后得到聚天门冬氨酸酯树脂,聚天门冬氨酸酯树脂在傅里叶红外光谱中无伯氨吸收峰;
(2) 产物N的制备:
在步骤(1)得到的产物M中加入一元醇,加入催化剂,在真空下,升温至50-300℃,得到低粘度的聚天门冬氨酸酯树脂,称为产物N。
9.根据权利要求8所述的制备方法,其特征在于:所述步骤(2)中酯交换温度为80-200℃,优选为100-150℃。
10.一种涂料,其特征在于:包含权利要求1-7任意一项所述的一种低粘度低反应活性的聚天门冬氨酸酯产物N,用于涂覆在设备和地坪的表面。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202010989412.8A CN112209845A (zh) | 2020-09-18 | 2020-09-18 | 低粘度低反应活性的聚天门冬氨酸酯、其制备方法及涂料 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202010989412.8A CN112209845A (zh) | 2020-09-18 | 2020-09-18 | 低粘度低反应活性的聚天门冬氨酸酯、其制备方法及涂料 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN112209845A true CN112209845A (zh) | 2021-01-12 |
Family
ID=74050141
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202010989412.8A Pending CN112209845A (zh) | 2020-09-18 | 2020-09-18 | 低粘度低反应活性的聚天门冬氨酸酯、其制备方法及涂料 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN112209845A (zh) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113354682A (zh) * | 2021-04-02 | 2021-09-07 | 姜山 | 一种无卤阻燃聚天门冬氨酸酯及其制备方法和应用 |
| CN114315621A (zh) * | 2021-12-30 | 2022-04-12 | 深圳飞扬骏研新材料股份有限公司 | 一种脂肪族仲胺基酯树脂及其制备方法 |
| CN115181487A (zh) * | 2022-06-30 | 2022-10-14 | 星地元新材料股份有限公司 | 一种混凝土地面龟裂纹高分子修复剂 |
| FR3139568A1 (fr) * | 2022-09-12 | 2024-03-15 | Arkema France | Procédé de préparation d’une résine aminosuccinique à faible indice d’amine |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111303368A (zh) * | 2020-04-22 | 2020-06-19 | 深圳飞扬骏研新材料股份有限公司 | 一种水性聚天门冬氨酸酯树脂及其制备方法 |
| CN111363460A (zh) * | 2020-03-18 | 2020-07-03 | 深圳飞扬骏研新材料股份有限公司 | 喷涂用环保免烘烤罩光清漆、制备方法及固化材料 |
| CN111620789A (zh) * | 2020-06-12 | 2020-09-04 | 深圳市前海博扬研究院有限公司 | 一种天门冬氨酸酯树脂的制备方法 |
-
2020
- 2020-09-18 CN CN202010989412.8A patent/CN112209845A/zh active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111363460A (zh) * | 2020-03-18 | 2020-07-03 | 深圳飞扬骏研新材料股份有限公司 | 喷涂用环保免烘烤罩光清漆、制备方法及固化材料 |
| CN111303368A (zh) * | 2020-04-22 | 2020-06-19 | 深圳飞扬骏研新材料股份有限公司 | 一种水性聚天门冬氨酸酯树脂及其制备方法 |
| CN111620789A (zh) * | 2020-06-12 | 2020-09-04 | 深圳市前海博扬研究院有限公司 | 一种天门冬氨酸酯树脂的制备方法 |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113354682A (zh) * | 2021-04-02 | 2021-09-07 | 姜山 | 一种无卤阻燃聚天门冬氨酸酯及其制备方法和应用 |
| CN114315621A (zh) * | 2021-12-30 | 2022-04-12 | 深圳飞扬骏研新材料股份有限公司 | 一种脂肪族仲胺基酯树脂及其制备方法 |
| CN115181487A (zh) * | 2022-06-30 | 2022-10-14 | 星地元新材料股份有限公司 | 一种混凝土地面龟裂纹高分子修复剂 |
| FR3139568A1 (fr) * | 2022-09-12 | 2024-03-15 | Arkema France | Procédé de préparation d’une résine aminosuccinique à faible indice d’amine |
| WO2024056688A1 (fr) * | 2022-09-12 | 2024-03-21 | Arkema France | Procédé de préparation d'une résine aminosuccinique à faible indice d'amine |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN112209845A (zh) | 低粘度低反应活性的聚天门冬氨酸酯、其制备方法及涂料 | |
| JP4624509B2 (ja) | シラン改変ポリウレタン樹脂、その製造方法および湿分硬化性樹脂としてのその使用 | |
| EP0531249B1 (en) | Novel coating compositions which may be ambient cured | |
| JP3681077B2 (ja) | ポリイソシアネート/ポリアミン混合物及びポリウレア被膜の製造におけるその用途 | |
| JP5275032B2 (ja) | 軟質塗膜を製造するための二成分系 | |
| CA1266942A (en) | Urethane resins containing hydrolyzable moieties from organosilane compounds | |
| CN105793327B (zh) | 金属化的多面体低聚倍半硅氧烷催化剂组合物的合成及用途 | |
| AU2012298508B2 (en) | Coating composition and use thereof | |
| JP2018509483A (ja) | 尿素結合と末端アルコキシシランとを有するポリマーを含有する2成分シロキサン系コーティング | |
| JP4435551B2 (ja) | ポリアスパルテート混合物およびその製造方法と用途 | |
| JPH11505872A (ja) | ポリアセトアセテート、架橋剤、及びオルガノシランを含む塗料組成物 | |
| JPH06500585A (ja) | 湿分硬化性アルコキシシラン末端ポリウレタン | |
| JP4163782B2 (ja) | 尿素基とアルコキシシラン基とを有する化合物 | |
| TWI276630B (en) | Novel silane coupling agent and method for manufacturing the same | |
| CN100537684C (zh) | 端氨基聚天冬氨酸酯及其制造方法 | |
| JPH06228295A (ja) | アミノ官能性ポリエステル樹脂 | |
| JP2022066853A (ja) | ポリアスパラティック塗料組成物、塗膜、及び塗装物品 | |
| JP4130583B2 (ja) | Hdi系ブロックポリイソシアネート | |
| CN104356020B (zh) | 一种酰胺基酯及其合成方法、应用 | |
| Gao et al. | UV-curing of hyperbranched polyurethane acrylate-polyurethane diacrylate/SiO 2 dispersion and TGA/FTIR study of cured films | |
| CN112209842B (zh) | 一种多胺的合成方法及多胺 | |
| JP2005089466A (ja) | アスパルテートの調製方法 | |
| TW201139481A (en) | Polyurethane resin | |
| JP4435694B2 (ja) | 末端環状ウレア/反応性シラン基含有湿分硬化型ポリエーテルウレタンの製造方法 | |
| JP3184328B2 (ja) | 硬化性樹脂組成物および該組成物から形成された硬化樹脂膜 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |