CN103189391A - 新抗原结合蛋白 - Google Patents
新抗原结合蛋白 Download PDFInfo
- Publication number
- CN103189391A CN103189391A CN2011800533015A CN201180053301A CN103189391A CN 103189391 A CN103189391 A CN 103189391A CN 2011800533015 A CN2011800533015 A CN 2011800533015A CN 201180053301 A CN201180053301 A CN 201180053301A CN 103189391 A CN103189391 A CN 103189391A
- Authority
- CN
- China
- Prior art keywords
- seq
- antigen
- binding proteins
- sequence shown
- cancer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/72—Increased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Abstract
本发明涉及与HER3受体结合的抗原结合蛋白,如抗体;编码所述抗原结合蛋白的多核苷酸;包含所述抗原结合蛋白的药物组合物;以及制备方法。本发明还涉及所述抗原结合蛋白在与乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、胃癌、黑素瘤和其它过表达HER3的癌症相关的疾病的治疗或预防中的用途。
Description
相关申请
本申请要求2010年9月3日提交的美国临时专利申请No.61/379,840和2011年2月8日提交的美国临时专利申请No.61/440,460的权益。以上提到的申请通过引用全部并入本文。
技术领域
本文涉及与HER3受体结合的抗原结合蛋白,例如抗体;编码所述抗原结合蛋白的多核苷酸;包含所述抗原结合蛋白的药物组合物;以及制备方法。本文还涉及所述抗原结合蛋白在与多种癌症相关的疾病的治疗或预防中的用途。
背景技术
HER3(又称为ErbB3)(SEQ ID NO:21)是四种结构上相关的受体酪氨酸激酶(包括ErbB/HER蛋白家族或者表皮生长因子受体(EGFR)家族的受体)中的一种。这些受体由含有大约620个氨基酸的胞外区、单一跨膜区和胞质酪氨酸激酶结构域构成。每个家族成员的胞外区由四个子结构域构成,即L1、S1(CR1)、L2和S2(CR2),其中“L”代表富含亮氨酸的重复结构域,“CR”蛋白代表富含半胱氨酸的区。这些受体的活化一般需要配体诱导的受体二聚体化。HER3在该家族中的独特之处在于它具有配体(神经调节蛋白(Neuregulin)-1,NRG;Heregulin,HRG;见表1)结合结构域,但由于激酶结构域中的某些氨基酸变化而不具备本身的酪氨酸激酶活性。因此,它可以结合配体,然而作为单体,它不能通过蛋白磷酸化将信号传递到细胞内。但它能与具有激酶活性的其他EGF受体家族成员形成异二聚体(例如HER1/HER3、HER2/HER3、HER3/HER4),以形成有活性的能够进行信号转导的部分。特别值得一提的是与HER2的配对,因为HER2/HER3组合看起来具有通过各种胞内途径(包括PI3K/pAKT途径)放大信号的最高潜能。当HER3与HER2形成二聚体时,得到的信号转导复合体可以被针对HER2成分的诸如帕妥珠单抗(pertuzumab)等抗体破坏。此外,当与HER2共表达时,HER3对HRG的亲和力提高。近年,逐渐认识到HER3与其他细胞表面受体(包括那些HER家族以外的受体,例如c-MET)的相互作用是对某些抗癌剂抗性的重要规避机制。已对编码HER3不同异形体的替代转录剪接变体进行了虽不完全的表征。一种异形体由于缺少膜内区被分泌到细胞外。该形式可以是通过把配体与膜结合形式隔离开从而调节后者的活性。HER3与其他受体的异二聚体化导致重要的细胞生长和存活途径被活化。因此,这些途径的有控制的表达和活化对于生物体的正常生长是必需的,任何损伤都可以导致疾病。
HER蛋白家族的四个成员在被一个亚组的可以生长因子配体活化时能够形成同源二聚体、异二聚体和更高阶的寡聚体。以下表1列出了HER受体家族的已知配体。
表1
在小鼠中,丢失ErbB家族任何成员的信号转导都会导致包括肺、皮肤、心脏和大脑的器官的缺陷,造成胚胎期死亡。另一方面,过度的ErbB/HER信号转导与多种实体瘤类型的发展有关。在许多人类癌症中都发现了ErbB-1(EGFR/HER1)和ErbB-2(HER2),它们的过度信号转导可以是这些肿瘤发展和恶化的关键因素。例如,EGFR在许多癌症,包括肺和结肠的癌症中被过表达。诸如西妥昔单抗(cetuximab)、吉非替尼(gefitinib)、埃罗替尼(erlotinib)等药物被用于抑制该受体在这些情景中的活性。在乳腺癌中HER2基因被扩增,蛋白过表达。当前乳腺癌是使用赫赛汀、它莫西芬(tamoxifen)和拉帕替尼(lapatinib)等治疗。癌症治疗中一个日渐严重的问题是丧失对这些疗法的敏感性,这也是需要更多新的有效的治疗方法的主要原因。HER3基因的扩增和/或其蛋白的过表达在大量癌症中都有报导。近年,研究显示对例如吉非替尼的获得性抗性与HER3的活性过高有关。这与将HER3磷酸化的c-MET的获得性过表达有关,而磷酸化的HER3随之激活PI3K/Akt途径(关键的细胞生长/存活途径)。
HER3受体(SEQ ID NO:21)具有独特的属性,在由HER受体家族介导的细胞信号转导途径中占据关键的地位。也有越来越多的暗示表明它参与了对常用癌症治疗剂的抗性机制。由于它缺少具有功能的激酶结构域,不能与常规的小分子成药。但是作为依靠与其他细胞表面受体的相互作用来执行它在各种关键的生长、存活和分化途径中的活性的细胞表面受体,它是生物制药上的一个有吸引力的目标物。
因此,需要针对HER3受体的治疗性抗体和利用这样的抗体来治疗癌症的方法。
发明概述
本文的一个方面是能够特异结合HER3受体的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:2、SEQ IDNO:3和SEQ ID NO:4的氨基酸序列有超过75%的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:6、SEQ ID NO:7和SEQ ID NO:8的氨基酸序列有75%或以上的序列同一性。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:23,SEQ IDNO:24和SEQ ID NO:25的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:27、SEQ ID NO:28和SEQ ID NO:29的氨基酸序列有75%或以上的序列同一性。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:45、SEQ IDNO:46和SEQ ID NO:47的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:49、SEQ ID NO:50和SEQ ID NO:51的氨基酸序列有75%或以上的序列同一性。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:31、SEQ IDNO:32和SEQ ID NO:33的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:35、SEQ ID NO:36和SEQ ID NO:37的氨基酸序列有75%或以上的序列同一性。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:10、SEQ IDNO:11和SEQ ID NO:12的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:12、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:18、SEQ ID NO:19和SEQ ID NO:20的氨基酸序列有75%或以上的序列同一性。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:1所示的氨基酸序列的重链可变区序列;和具有SEQ ID NO:5所示的氨基酸序列的轻链可变区序列。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:22所示的氨基酸序列的重链可变区序列;和具有SEQ IDNO:26所示的氨基酸序列的轻链可变区序列。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:44所示的氨基酸序列的重链可变区序列;和具有SEQ IDNO:48所示的氨基酸序列的轻链可变区序列。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:30所示的氨基酸序列的重链可变区序列;和具有SEQ IDNO:34所示的氨基酸序列的轻链可变区序列。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:9所示的氨基酸序列的重链可变区序列;和具有选自SEQ IDNO:13所示的氨基酸序列和SEQ ID NO:17所示的氨基酸序列的轻链可变区序列。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:30所示的氨基酸序列的重链可变区序列;和具有SEQ IDNO:57所示的氨基酸序列的轻链可变区序列。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其特异结合包含SEQ ID NO:21中的氨基酸残基184-329的肽链结构域。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其特异结合包含SEQ ID NO:21中的氨基酸残基330-495的肽链结构域。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:2所示的氨基酸序列的CDRH1;具有SEQ ID NO:3所示的氨基酸序列的CDRH2;具有SEQ ID NO:4所示的氨基酸序列的CDRH3;具有SEQ ID NO:6所述的氨基酸序列的CDRL1;具有SEQ ID NO:7所示的氨基酸序列的CDRL2;和具有SEQ ID NO:8所示的氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:23所示的氨基酸序列的CDRH1;具有SEQ ID NO:24所示的氨基酸序列的CDRH2;具有SEQ ID NO:25所示的氨基酸序列的CDRH3;具有SEQ ID NO:27所述的氨基酸序列的CDRL1;具有SEQ ID NO:28所示的氨基酸序列的CDRL2;和具有SEQ ID NO:29所示的氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:31所示的氨基酸序列的CDRH1;具有SEQ ID NO:32所示的氨基酸序列的CDRH2;具有SEQ ID NO:33所示的氨基酸序列的CDRH3;具有SEQ ID NO:35所述的氨基酸序列的CDRL1;具有SEQ ID NO:36所示的氨基酸序列的CDRL2;和具有SEQ ID NO:37所示的氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:45所示的氨基酸序列的CDRH1;具有SEQ ID NO:46所示的氨基酸序列的CDRH2;具有SEQ ID NO:47所示的氨基酸序列的CDRH3;具有SEQ ID NO:49所述的氨基酸序列的CDRL1;具有SEQ ID NO:50所示的氨基酸序列的CDRL2;和具有SEQ ID NO:51所示的氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:10所示的氨基酸序列的CDRH1;具有SEQ ID NO:11所示的氨基酸序列的CDRH2;具有SEQ ID NO:12所示的氨基酸序列的CDRH3;具有SEQ ID NO:14所述的氨基酸序列的CDRL1;具有SEQ ID NO:15所示的氨基酸序列的CDRL2;和具有SEQ ID NO:16所示的氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:10所示的氨基酸序列的CDRH1;具有SEQ ID NO:11所示的氨基酸序列的CDRH2;具有SEQ ID NO:12所示的氨基酸序列的CDRH3;具有SEQ ID NO:18所述的氨基酸序列的CDRL1;具有SEQ ID NO:19所示的氨基酸序列的CDRL2;和具有SEQ ID NO:20所示的氨基酸序列的CDRL3。
本文还提供了分离的核酸;表达载体;重组宿主细胞;产生抗原结合蛋白的方法;药物组合物;癌症治疗方法;用途;和制备与本文这些方面相关的全部抗原结合蛋白的方法。
本文的另一方面是抗原结合蛋白,其包含具有SEQ ID NO:100所示的氨基酸序列中的氨基酸残基20-466的重链序列;和具有SEQ ID NO:104所示的氨基酸序列中的氨基酸残基20-238的轻链序列。
本文的另一方面是抗原结合蛋白,其包含具有SEQ ID NO:102所示的氨基酸序列中的氨基酸残基20-466的重链序列;和具有SEQ ID NO:104所示的氨基酸序列中的氨基酸残基20-238的轻链序列。
本文的另一方面是分离的核酸,所述核酸编码SEQ ID NO:100所示的氨基酸序列中的氨基酸残基20-466。
本文的另一方面是分离的核酸,所述核酸编码SEQ ID NO:104所示的氨基酸序列中的氨基酸残基20-238。
本文的另一方面是分离的核酸,所述核酸编码SEQ ID NO:102所示的氨基酸序列中的氨基酸残基20-466。
附图简述
图1.在BxPC3胰腺癌细胞中,抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制。
图2.在CHL-1黑素瘤细胞中,抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制。
图3.在N87胃癌细胞中,抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制。
图4.在SK-BR-3乳腺癌细胞中,抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制。
图5.在BT-474乳腺癌细胞中,抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制。
图6.在MCF-7乳腺癌细胞中,抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制。
图7.在BxPC3胰腺癌细胞中,抗HER3抗体对heregulin诱导的人Akt磷酸化的抑制。
图8.在CHL-1黑素瘤细胞中,抗HER3抗体对heregulin诱导的人Akt磷酸化的抑制。
图9.在N87胃癌细胞中,抗HER3抗体对heregulin诱导的人Akt磷酸化的抑制。
图10.在SK-BR-3乳腺癌细胞中,抗HER3抗体对heregulin诱导的人Akt磷酸化的抑制。
图11.在SK-BR-3乳腺癌细胞中,抗HER3抗体对表皮生长因子(EGF)诱导的人HER3受体磷酸化的抑制。
图12.在SK-BR-3乳腺癌细胞中,抗HER3抗体对乙胞素诱导的人HER3受体磷酸化的抑制。
图13.在用表皮生长因子受体(EGFR)和HER3转导的CHO细胞中,抗HER3抗体对heregulin诱导的异二聚体形成和人HER3受体磷酸化的抑制。
图14.在用HER2和HER3转导的CHO细胞中,抗HER3抗体对heregulin诱导的异二聚体形成和人HER3受体磷酸化的抑制。
图15.在用HER4和HER3转导的CHO细胞中,抗HER3抗体对heregulin诱导的异二聚体形成和人HER3受体磷酸化的抑制。
图16.在癌细胞系中,抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制(Phospho-HER3ELISA IC50值)。
图17.小鼠1D9抗体(M5.1D9.1F5)结合全长人HER3ECD和人HER3结构域III。
图18.小鼠15D5抗体(M5.15D5.2A1.1H10)结合全长人HER3ECD和人HER3结构域II。
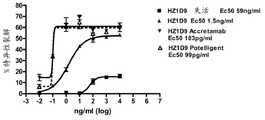
图19.人源化1D9POTELLIGENTTM抗体结合全长人HER3ECD和人HER3结构域III。
图20.人源化1D9ACCRETAMABTM抗体结合全长人HER3ECD和人HER3结构域III。
图21.人源化1D9抗体结合全长人HER3ECD和人HER3结构域III。
图22.(a)通过流式细胞术分析评估的小鼠1D9抗体(M5.1D9.1F5)对人MCF-7乳腺癌细胞上的HER3的识别。(b)通过流式细胞术分析评估的小鼠1D9抗体(M5.1D9.1F5)对人BxPC3胰腺癌细胞上的HER3的识别。
图23.(a)通过流式细胞术分析评估的人源化1D9抗体、人源化ACCRETAMABTM1D9抗体和人源化POTELLIGENTTM抗体对人CHL-1黑素瘤细胞上的HER3的识别。(b)通过流式细胞术分析评估的人源化1D9抗体、人源化ACCRETAMABTM1D9抗体和人源化POTELLIGENTTM抗体对人BxPC3胰腺癌细胞上的HER3的识别。
图24.小鼠1D9抗体(M5.1D9.1F5)和小鼠15D5抗体(M5.15D5.2A1.1H10)抑制heregulin诱导的BxPC3胰腺癌细胞增殖。
图25.小鼠1D9抗体(M5.1D9.1F5)和小鼠15D5抗体(M5.15D5.2A1.1H10)抑制heregulin诱导的MCF-7乳腺癌细胞增殖。
图26.人源化1D9ACCRETAMABTM抗体和小鼠1D9抗体抑制heregulin诱导的BxPC3胰腺癌细胞增殖。
图27.小鼠1D9抗体(M5.1D9.1F5)、小鼠15D5抗体(M5.15D5.2A1)、小鼠24H5抗体(M5.24H5.C2)、嵌合1D9抗体和嵌合15D5抗体抑制heregulin诱导的BxPC3胰腺癌细胞侵袭。
图28.小鼠15D5抗体(M5.15D5.2A1.H10)和人源化1D9抗体诱导人CHL-1黑素瘤细胞中受体的内化。
图29.(a)小鼠1D9抗体(M5.1D9.1F5)与B16F10细胞上表达的小鼠HER3交叉反应。(b)小鼠24H5抗体(M5.24H5.C2)与B16F10细胞上表达的小鼠HER3交叉反应。(c)小鼠15D5抗体(M5.15D5.1C1)与B16F10细胞上表达的小鼠HER3交叉反应。
图30.小鼠抗HER3mAb-鼠1D9抗体在B16F10同系肿瘤模型中的效力。经i.v.大剂量注射小鼠B16F10黑素瘤细胞的C57BL/6小鼠,用同种型对照、小鼠Her3mAb(m1D9)或GEMZARTM(吉西他滨)处理来评估对肿瘤细胞在肺中定植的影响。同种型对照和m1D9在B16F10注射后的第3天(25或50mg/kg,i.p.)和第7和11天(5或25mg/kg,i.p.)给予。GEMZARTM只在第3天给予(20mg/kg,i.v.)。第20天采集肺测量湿重。用m1D9进行的处理导致与同种型对照相比肺重量发生剂量-依赖性下降(p<0.01;带有杜纳事后检验(Dunnett's post test)的单因素ANOVA)。NTB=不携带肿瘤的小鼠。
图31.小鼠抗HER3mAb-鼠15D5抗体在B16F10同系肿瘤模型中的效力。经i.v.大剂量注射小鼠B16F10黑素瘤细胞的C57BL/6小鼠,用同种型对照、小鼠Her3mAb(m15D5)或GEMZARTM处理来评估对肿瘤细胞在肺中定植的影响。同种型对照和m15D5在B16F10注射后的第3天(25或50mg/kg,i.p.)和第7和11天(5或25mg/kg,i.p.)给予。GEMZARTM只在第3天给予(20mg/kg,i.v.)。第20天采集肺测量湿重。用GEMZARTM和m15D5进行的处理导致肺重量更低,但是只有25/5mg/kg m15D5与同种型对照相比是统计学上显著的(p<0.05;带有杜纳事后检验的单因素ANOVA)。NTB=不携带肿瘤的小鼠。
图32.小鼠抗HER3mAb-鼠1D9抗体在CHL-1异种移植模型中的效力。用小鼠抗HER3mAb-m1D9以5-100mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的CHL-1肿瘤生长下降。植入后第24和27天观察到与同种型对照相比,剂量依赖性和统计学显著的下降(*p<0.05;***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图33.小鼠抗HER3mAb-鼠15D5抗体在CHL-1异种移植模型中的效力。用小鼠抗HER3mAb-m15D5以5-100mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的CHL-1肿瘤生长下降。植入后第20、24和27天观察到与同种型对照相比,剂量依赖性和统计学显著的下降(*p<0.05;***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图34.小鼠抗HER3mAb-鼠1D9抗体在BxPC3异种移植模型中的效力。用小鼠抗HER3mAb-m1D9以0.5-50mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的BxPC3肿瘤生长有剂量依赖性和统计学显著的下降(*p<0.01;***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图35.小鼠抗HER3mAb-鼠15D5抗体在BxPC3异种移植模型中的效力。用小鼠抗HER3mAb-m15D5以0.5-50mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的BxPC3肿瘤生长有剂量依赖性和统计学显著的下降(*p<0.01;***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图36.小鼠抗HER3mAb-鼠1D9抗体在NCI-N87异种移植模型中的效力。用m1D9以75或100mg/kg i.p.每周两次处理导致与载体对照相比N87肿瘤生长下降。作为同种型对照的小鼠IgG2b观察到类似的下降(**p<0.01;***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图37.小鼠抗HER3mAb-鼠15D5抗体在NCI-N87异种移植模型中的效力。用m15D5以75或100mg/kg i.p.每周两次处理导致与载体或同种型对照相比更低的N87肿瘤体积;但差别不是统计学显著的。
图38.小鼠抗HER3mAb-嵌合1D9抗体在CHL-1异种移植模型中的效力。用嵌合抗HER3mAb-Ch1D9以5-50mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的CHL-1肿瘤生长下降。植入后第24和27天观察到与同种型对照相比,剂量依赖性和统计学显著的下降(*p<0.05;***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图39.人源化抗HER3mAb-人源化15D5抗体在CHL-1异种移植模型中的效力。用人源化抗HER3mAb-h15D5以5-50mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的CHL-1肿瘤生长下降。植入后第24和27天观察到与同种型对照相比,剂量依赖性和统计学显著的下降(*p<0.05;**p<0.01,***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图40.人源化抗HER3mAb-人源化1D9RR抗体在CHL-1异种移植模型中的效力。用人源化1D9RR以5-50mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的CHL-1肿瘤生长下降。植入后第29和34天与同种型对照相比,所有剂量水平的肿瘤生长下降类似,都是统计学显著的(***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图41.人源化1D9RR ACCRETAMABTM在CHL-1异种移植模型中的效力。用人源化1D9RR ACCRETAMABTM以5-50mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的CHL-1肿瘤生长下降。植入后第29和34天与同种型对照相比,所有剂量水平的肿瘤生长下降类似,都是统计学显著的(***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图42.人源化1D9RR POTELLIGENTTM在CHL-1异种移植模型中的效力。用人源化1D9RR POTELLIGENTTM以5-50mg/kg i.p.每周两次处理导致CB-17SCID小鼠中的CHL-1肿瘤生长下降。植入后第29和34天与同种型对照相比,肿瘤生长下降是剂量依赖性的并且是统计学显著的(***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图43.嵌合抗HER3mAb-嵌合1D9抗体在BxPC3异种移植模型(皮下植入)中的效力。用嵌合抗HER3mAb-ch1D9以0.5-50mg/kg i.p.每周两次处理CB-17SCID小鼠来评估对BxPC3肿瘤生长的影响。与同种型对照相比,0.5、5和50mg/kg处理组在植入后第33天,50mg/kg组在植入后第36天观察到剂量依赖性和统计学显著的肿瘤生长下降(**p<0.01;***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图44.人源化抗HER3mAb-人源化15D5抗体在BxPC3异种移植模型(皮下植入)中的效力。用人源化抗HER3mAb-h15D5以0.5-50mg/kg i.p.每周两次处理CB-17SCID小鼠来评估对BxPC3肿瘤生长的影响。与同种型对照相比,50mg/kg组在植入后第33和36天观察到肿瘤生长下降(**p<0.01;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图45.人源化1D9RR抗体在BxPC3异种移植模型(皮下植入)中的效力。将h1D9RR以0.5-50mg/kg每周两次给予带有BxPC3肿瘤的CB-17SCID小鼠以确定对肿瘤细胞生长的影响。在20mg/kg组中观察到的肿瘤体积下降到第36天恢复到同种型对照的水平(*p<0.05;***p<0.001;带有Bonferroni事后检验的双因素ANOVA重复测量分析)。
图46.嵌合1D9抗体和人源化15D5抗体在BxPC3异种移植模型(原位植入)中的效力。BxPC3胰腺癌片段被原位植入到雌性CB-17SCID小鼠的胰腺中。一旦肿瘤体积达到80-100mm3时,将HER3mAbs-h15D5和Ch1D9以50mg/kg每周两次给药。以一周的间隔通过超声(Vevo Image Analysis)确定肿瘤体积。与同种型对照相比,用抗HER3mAbs进行的处理导致植入后第5、6和7周时肿瘤生长显著下降(**p<0.01;***p<0.001;带有Bonferroni事后检验比较的双因素ANOVA)。
图47.人源化1D9RR抗体和多种变体在NCI-N87异种移植模型中的效力。将指示的人源化HER3mAbs(人源化1D9RR抗体、人源化1D9RRPOTELLIGENTTM抗体和人源化1D9RR ACCRETAMABTM抗体)以50mg/kg每周两次i.p.给予CB-17SCID小鼠以确定对N87肿瘤细胞生长的影响。与同种型对照相比,h1D9RR POTELLIGENTTM组在第37天,h1D9RRACCRETAMABTM组在第44天观察到统计学显著的肿瘤体积下降(*p<0.05;带有Bonferroni事后检验比较的双因素ANOVA)。
图48.使用HER3转导的HEK293作为靶细胞,人PBL作为效应细胞(供体2126)的ADCC分析。
图49.使用CHL-1细胞作为靶细胞,人PBL作为效应细胞(供体2126)的ADCC分析。
图50.使用HER3转导的HEK293作为靶细胞,食蟹猴PBL作为效应细胞(70-105)的ADCC分析。
图51.使用HER3转导的HEK293作为靶细胞,食蟹猴PBL作为效应细胞(70-113)的ADCC分析。
图52.使用CHL-1作为靶细胞,食蟹猴PBL作为效应细胞(70-105)的ADCC分析。
图53.使用CHL-1作为靶细胞,食蟹猴PBL作为效应细胞(70-113)的ADCC分析。
图54.使用HER3BACMAMTM转导的HEK293靶细胞和CALBIOCHEMTM兔补体进行的CDC分析。
图55.X射线晶体结构显示人HER3ECD结构域III(SEQ ID NO:66;共结晶片段)和鼠1D9轻链可变区以及鼠1D9重链可变区(在共结晶的来源于鼠1D9抗体的Fab中)之间的氨基酸接触。
发明详述
本文提供了抗原结合蛋白和相关主题。
术语“HER3”和“HER3受体”用于本文可以互换使用,是指下述之一:全长未加工过的HER3前体形式;由翻译后C末端结构域的切割得到的成熟HER3;潜伏和非潜伏(活性)形式。术语“HER3”和“HER3受体”用于本文还指任何保留了HER3受体相关一或多个生物活性的HER3受体片段和变体。
HER3受体的全长未加工前体形式包含有或没有信号序列的形成成熟蛋白的前肽和C-末端结构域。这个形式又称为多聚蛋白。HER3受体前体可以以单体或者同二聚体存在。
成熟HER3是从HER3前体蛋白的C末端切割下来的蛋白,又称为C端结构域。成熟HER3可以以单体、同二聚体或者处于HER3潜伏复合体中的形式存在。根据情况,成熟HER3可以在这些不同形式的组合之间建立平衡。
HER3前肽是在切割信号序列之后,从HER3前体蛋白的N端结构域切割下来的多肽。前肽又称为潜伏相关肽(LAP)。HER3前肽能够非共价地结合成熟HER3上的前肽结合结构域。
HER3受体抗原结合蛋白可以与HER3受体的前体、成熟、单体、二聚体、潜伏和活性形式中的任何一种或者任何组合发生结合。抗原结合蛋白可以结合单体和/或二聚体形式的成熟HER3受体。抗原结合蛋白可以结合处于与前肽和/或卵泡抑素形成的复合体中的HER3受体。替代地,抗原结合蛋白可以结合处于与HER2受体或其他HER3相互作用受体(例如HER3的异二聚体)形成的复合体中的HER3受体。
术语“抗原结合蛋白”用于本文是指分离的抗体、抗体片段、抗原结合片段和其他蛋白构建物(例如结构域),它们能够结合HER3受体(SEQ ID NO:21);包含SEQ ID NO:21中氨基酸残基184-329的HER3受体的结构域II;或者包含SEQ ID NO:21中氨基酸残基330-495的HER3受体的结构域III。
术语“抗体”用于本文在最广义上指具有免疫球蛋白样结构域的分子,包括单克隆、重组、多克隆、嵌合、人源化、双特异性和异源偶联(heteroconjugate)抗体,例如单克隆抗体/结构域抗体偶联物;单可变结构域;抗原结合片段;免疫学上有效的片段;单链Fv;双体;TANDABSTM等(关于替代“抗体”格式的总结参见Holliger et al.,Nature Biotechnology,Vol23,No.9:1126-1136(2005))。
术语“单可变结构域”用于本文是指独立于不同可变区或结构域,特异结合抗原或表位的抗原结合蛋白可变结构域(例如VH、VHH、VL)。
术语“结构域抗体”或者“dAb”用于本文可以认为与能够结合抗原的“免疫球蛋白单可变结构域”相同。免疫球蛋白单可变结构域可以是人抗体可变结构域,但也包括来自其他物种的单抗体可变结构域,例如啮齿类(例如WO00/29004中公开的)、护士鲨和骆驼科VHH dAbs。骆驼科VHH是来源于包括骆驼、大羊驼、羊驼、单峰驼和原驼的种的免疫球蛋白单可变结构域多肽,这些种产生的重链抗体天然不带有轻链。这类VHH结构域可以根据本领域已有的标准技术进行人源化,这类结构域被认为是“结构域抗体”。本文中,VH包括骆驼科VHH结构域。NARV是在软骨鱼类,包括护士鲨中鉴定到的另一种类型的免疫球蛋白单可变结构域。这些结构域又称为新抗原受体可变区(Novel Antigen Receptor variable region)(一般缩写为V(NAR)或NARV)。更多细节参见Mol.Immunol.44,656-665(2006)和US20050043519A,所述文献通过引用并入本文。
本文中,术语“结构域”是指具有独立于蛋白其余部分的三级结构的折叠蛋白结构。通常,结构域负责蛋白的独特功能特性,在许多情况中,可以添加、去除或者转移给其他蛋白而不丢失蛋白其余部分和/或结构域的功能。术语“免疫球蛋白单可变结构域”用于本文是包含抗体可变结构域特征性序列的折叠多肽结构域。因此包括完整的抗体可变结构域;和经过改造的可变结构域,例如其中的一或多个环已被不是抗体可变结构域特征性的序列取代,或者被截短的抗体可变结构域或者包含N或C末端延伸;以及至少保留了全长结构域的结合活性和特异性的可变结构域折叠片段。结构域可以独立于不同可变区或结构域地结合抗原或表位。
术语“表位结合结构域”是指独立于不同V区或结构域,特异结合抗原或表位的结构域。可以是结构域抗体(dAb),例如人、骆驼或者鲨鱼免疫球蛋白单可变结构域;或者可以是选自下述的支架的衍生物的结构域:CTLA-4(Evibody);脂钙蛋白;蛋白A衍生分子,例如蛋白A的Z结构域(Affibody,SpA)、A结构域(Avimer/Maxibody);热休克蛋白,例如GroEL和GroES;转铁蛋白(trans-body);锚重复序列蛋白(ankyrin repeatprotein)(DARPin);肽适体;C型凝集素结构域(Tetranectin);人γ-晶状体蛋白和人泛素(affilins);PDZ结构域;蝎毒素,人蛋白酶抑制剂的kunitz型结构域;和纤连蛋白(adnectin),所述结构域经过蛋白工程化以便实现对天然配体之外的配体的结合。
可以通过在非抗体蛋白支架,例如结构域上安排一或多个CDRs来提供抗原结合片段。结构域可以是结构域抗体,或者是选自下述的支架的衍生物的结构域:CTLA-4(Evibody);脂钙蛋白;蛋白A衍生分子,例如蛋白A的Z结构域(Affibody,SpA)、A结构域(Avimer/Maxibody);热休克蛋白,例如GroEL和GroES;转铁蛋白(trans-body);锚重复序列蛋白(ankyrin repeatprotein)(DARPin);肽适体;C型凝集素结构域(Tetranectin);人γ-晶状体蛋白和人泛素(affilins);PDZ结构域;蝎毒素,人蛋白酶抑制剂的kunitz型结构域;和纤连蛋白(adnectin);所述结构域经过蛋白工程化以便实现对天然配体之外的抗原(例如HER3受体)的结合。
CTLA-4(细胞毒性T淋巴细胞相关抗原4)是主要在CD4+T细胞上表达的CD28家族受体。它的胞外结构域含有一个类似可变结构域的Ig折叠。对应抗体CDRs的环可以取代为异源序列从而赋予不同的结合性能。经过工程化具有不同结合特异性的CTLA-4分子又被称为Evibodies。更多细节参见Journalof Immunological Methods248(1-2),31-45(2001)。
脂钙蛋白是转运小疏水分子,例如类固醇、后胆色素类、维甲酸类和脂质的一个胞外蛋白家族。它们具有刚性折叠的二级结构,锥体结构开放末端的多个环经过改造可以结合不同靶抗原。Anticalins大小在160-180个氨基酸之间,来源于脂钙蛋白。更多细节参见Biochim Biophys Acta1482:337-350(2000)、US7250297B1和US20070224633。
Affibody是来源于金黄色葡萄球菌蛋白A的支架,其经过改造可以结合抗原。该结构域由大约58个氨基酸的三个螺旋束构成。通过表面残基随机化已经形成了文库。更多细节参见Protein Eng.Des.Sel.17,455-462(2004)和EP1641818A1。
Avimers是来自A结构域支架家族的多结构域蛋白。大约35个氨基酸的天然结构域处于明确的二硫键结合的结构。通过对A结构域家族展示的天然变异进行重排可以产生多样性。更多细节参见Nature Biotechnology23(12),1556-1561(2005)和Expert Opinion on Investigational Drugs16(6),909-917(June2007)。
转铁蛋白说单体形式的血清转运糖蛋白。转铁蛋白可以经过改造,通过在宽容的表面环中插入肽序列来结合不同靶抗原。经过工程化的转铁蛋白支架的例子包括Trans-body。更多细节参见J.Biol.Chem274,24066-24073(1999)。
设计的锚蛋白重复蛋白(DARPins)来源于锚蛋白,锚蛋白是介导膜整合蛋白附着到细胞骨架上的一个蛋白家族。单个锚蛋白重复是由两个螺旋和一个转角构成的33残基基元。它们通过将每个重复中第一个螺旋和转角的残基随机化的改造,可以结合不同靶抗原。通过提高模块数量可以增加它们的结合界面(一种亲和力成熟的方法)。更多细节参见J.Mol.Biol.332,489-503(2003)、PNAS100(4),1700-1705(2003)、J.Mol.Biol.369,1015-1028(2007)和US20040132028A1。
纤连蛋白是经过改造可以结合抗原的支架。Adnectins由III型人纤连蛋白(FN3)的15个重复单位中第10个结构域的天然氨基酸序列骨架构成。三明治一端的三个环经过工程化可以使Adnectin能够特异识别感兴趣的治疗目标。更多细节参见Protein Eng.Des.Sel.18,435-444(2005)、US20080139791、WO2005056764和US6818418B1。
肽适体是组合识别分子,通常由恒定支架蛋白构成,典型的是含有插入在活性位点的受压制的可变肽环的硫氧还蛋白(TrxA)。更多细节参见ExpertOpin.Biol.Ther.5,783-797(2005)。
微体来源于含有3-4个半胱氨酸键长25-50个氨基酸的天然微蛋白(microproteins),微蛋白的例子包括KalataB1、芋螺毒素(conotoxin)和扭结菌素(knottins)。微蛋白有一个环,可以经过改造包含最多25个氨基酸而不影响微蛋白整体折叠情况。更多关于工程化的扭结菌素结构域的细节参见WO2008098796。
其他表位结合结构域包括曾被作为支架以构建有不同靶抗原结合特性的蛋白,包括人-晶状体蛋白和人泛素(affilins)、人蛋白酶抑制的kunitz型结构域、Ras结合蛋白AF-6的PDZ结构域、蝎毒素(北非蝎毒素charybdotoxin)、C型凝集素结构域(tetranectins)在Handbook of Therapeutic Antibodies(2007,Stefan Dubel编辑)的第7章Non-Antibody Scaffolds和Protein Science15:14-27(2006)中有综述。本文的表位结合结构域可以来自这些替代蛋白结构域中的任何一种。
抗原结合片段或免疫有效片段可以包含部分重链或轻链可变序列。所述片段至少长5、6、8或10个氨基酸。替代地,片段至少长15、至少20、至少50、至少75或者至少100个氨基酸。
术语“特异结合”用于本文与抗原结合蛋白有关时,意味着所述抗原结合蛋白与HER3受体以及HER3受体内的独特结构域或者独特氨基酸序列结合,而对其他(例如无关)蛋白没有或者只有不明显的结合。但是这个术语不排除抗原结合蛋白可以还与密切相关的分子(例如HER2受体)有交叉反应性。本文描述的抗原结合蛋白结合HER3受体的亲和力比它们与密切相关的分子(例如HER2受体)的亲和力高至少2、5、10、50、100或1000倍。
本文提供的范围包括所述特定范围内的所有数值以及特定范围端点的数值。
抗原结合蛋白-HER3相互作用的结合亲和力(KD)可以是1mM或以下,100nM或以下,10nM或以下,2nM或以下或者1nM或以下。替代地,KD可以在5和10nM之间,或者1和2nM之间。KD可以在1pM和500pM之间,或者500pM和1nM之间。抗原结合蛋白的结合亲和力是通过结合常数(Ka)和解离常数(Kd)确定的(KD=Kd/Ka)。结合亲和力可以通过BIACORETM测量,例如通过将测试抗体捕获到包被蛋白A的传感器表面并将HER3受体流过这个表面。替代地,可以通过FORTEBIOTM测量结合亲和力,例如将测试抗体受体捕获到包被蛋白A的针上并将HER3受体流过这个表面。
Kd可以是1x10-3Ms-1或以下、1x10-4Ms-1或以下,或者1x10-5Ms-1或以下。Kd可以在1x10-5Ms-1和1x10-4Ms-1之间;或者1x10-4Ms-1和1x10-3Ms-1之间。较慢的Kd可以导致抗原结合蛋白-配体复合体的解离缓慢和配体的中和提高。表2提供了本文描述的抗原结合蛋白的示范性结合亲和力和相关数据。
表2
表2中,“鼠15D5抗体”是指SEQ ID NO:1-8所示的包含可变重链、可变轻链、补体决定区和框架区的单克隆抗体;“人源化15D5抗体”是指SEQID NO:22-29所示的包含可变重链、可变轻链、补体决定区和框架区的单克隆抗体;“鼠1D9抗体”是指SEQ ID NO:44-51所示的包含可变重链、可变轻链、补体决定区和框架区的单克隆抗体;“人源化1D9抗体”是指SEQ IDNO:30-37所示的包含可变重链、可变轻链、补体决定区和框架区的单克隆抗体。具体来说表2中的“人源化1D9”单克隆抗体包含SEQ ID NO:30显示的重链可变区氨基酸序列,SEQ ID NO:57显示的可变轻链氨基酸序列,以及SEQ ID NO:30-33和SEQ ID NO:35-37中显示的相应补体决定区。
术语“ECD”意味着胞外结构域,对于HER3可以是指包含HER3异形体结构域I、II、III和IV的肽链,例如具有SEQ ID NO:21显示的氨基酸序列的肽链。
术语“中和”用于本文意味着体外或体内情况下,HER3的生物活性在有本文描述的抗原结合蛋白时,比没有所述抗原结合蛋白时降低了。中和可以但不限于是由于下述中的一或多个原因:阻断HER3与其配体的结合;阻止HER3被其配体活化;HER3受体或者配体被下调;干扰受体采取“活性”(例如信号转导型)构象的能力;阻断受体同聚、异聚体、或者寡聚的能力;或者以其他方式影响受体活性或者效应功能。
HER3受体活性的测量包括,但不限于下述方法:确定在应答配体等等时,磷酸化受体(pHER3)水平、磷酸化AKT(pAKT)水平、HER3和HER(或其他)受体家族成员之间形成的复合体;PI3Kinase、ERK2、c-Jun或PYK2活性的减少;HER3表达肿瘤细胞系的增殖;所述细胞系在软琼脂中生长的能力(克隆生长);所述细胞系的跨膜迁移。
生物活性的减少或抑制可以是部分或全部的。中和性抗原结合蛋白可以将HER3受体的活性相对没有所述抗原结合蛋白的HER3活性,中和至少20%、30%、40%、50%、55%、60%、65%、70%、75%、80%、82%、84%、86%、88%、90%、92%、94%、95%、96%、97%、98%、99%或100%。在功能分析中,IC50是使生物反应减少最大值50%时的浓度。
可以利用本领域技术人员已知的一或多种分析法,或者按照本文描述来确定或测量中和。例如,可以在夹心ELISA、BIACORETM、FMAT、FORTEBIOTM或者类似的体外分析来评估抗原结构域与HER3的结合。
可以利用基于LISA的受体结合分析,通过测量在有抗原结合蛋白时HER3受体与固定在板上的它的配体(神经调节蛋白1和神经调节蛋白2)来确定抗原结合蛋白的中和活性。
替代地,可以利用基于细胞的受体结合分析,通过测量对受体结合、下游信号转导和基因活化的抑制来确定抗原结合蛋白的中和活性。
体内中和的确定可以利用多种不同分析方法在动物中进行,所述动物表现出HER3介导的功能和/或信号转导方面(例如磷酸化HER3(pHER3)、磷酸化AKT(pAKT)、HER3和HER(或其他)受体家族成员之间复合体的形成下降;PI3Kinase、ERK2、c-Jun或PYK2活性的下降)任何一种或者组合的变化;还可以通过测量抗原结合蛋白阻止、减少或者以其他方式消除例如肿瘤异种移植模型中的肿瘤细胞生长的能力。
术语“效应功能”用于本文是指抗体依赖性细胞介导的细胞毒活性(ADCC)和补体依赖性细胞毒活性(CDC)介导的反应、Fc介导的吞噬作用和经由FcRn受体的抗体循环中的一或多种。抗体恒定区和各种Fc受体(FcR)之间的相互作用被认为能够介导抗体的效应功能。重要的生物效应可以是效应功能的结果,特别是抗体依赖性细胞细胞毒活性(ADCC)、补体固定(补体依赖性细胞毒性或者CDC),吞噬作用(抗体依赖性细胞介导的吞噬作用或者ADCP)和抗体的半衰期/清除。通常,介导效应功能的能力需要抗体与抗原的结合,不是所有抗体都能介导每个效应功能。
效应功能可以通过多种方式来测量,包括通过FcγRIII结合自然杀伤细胞或者通过FcγRI结合单核细胞/巨噬细胞来测量ADCC效应功能。例如本发明的抗体或抗原结合片段在自然杀伤细胞检测中相对等同的野生型抗体或抗原结合片段进行测量时,具有提高的ADCC效应功能。在Shields et al,2001The Journal of Biological Chemistry,Vol.276,p6591-6604;Chappel et al,1993The Journal of Biological Chemistry,Vol268,p25124-25131;Lazar et al,2006PNAS,103;4005-4010中可以找到这类分析法的例子。确定CDC功能的分析方法的例子在1995J Imm Meth184:29-38中有描述。
根据需要的效应性能,可以对抗体的重链恒定区进行各种修饰。基本缺乏功能a)通过经典途径活化补体;和b)介导抗体依赖性细胞细胞毒的人恒定区包括IgG4恒定区和IgG2恒定区。含有特定突变的IgG1恒定区有不同报道说明对Fc受体的结合下降,因此ADCC和CDC降低(Duncan et al.Nature1988,332;563-564;Lund et al.J.Immunol.1991,147;2657-2662;Chappel et al.PNAS1991,88;9036-9040;Burton and Woof,Adv.Immunol.1992,51;1-84;Morgan et al.,Immunology1995,86;319-324;Hezareh et al.,J.Virol.2001,75(24);12161-12168)。含有特定突变或者残基Asn297上的糖基化发生改变的人IgG1恒定区被描述对Fc受体的结合增强。这些在某些情况中表现出对ADCC和CDC的加强(Lazar et al.PNAS2006,103;4005-4010;Shields et al.J Biol Chem2001,276;6591-6604;Nechansky et al.Mol Immunol,2007,44;1815-1817)。
对于IgG抗体,包括ADCC和ADCP的效应功能是通过重链恒定区与位于免疫细胞表面的Fcγ受体家族的相互作用介导的。在人中,这些包括FcγRI(CD64)、FcγRII(CD32)和FcγRIII(CD16)。抗体与抗原之间的相互作用和Fc/Fcγ复合体的形成诱发一系列效应,包括细胞毒、免疫细胞活化、吞噬作用和炎性细胞因子的释放。恒定区中的特定取代(包括S239D/I332E)已知可以提高重链恒定区对某些Fc受体的亲和力,从而增强抗体的效应功能性(Lazar et al.PNAS2006)。对本领域技术人员显而易见的术语“来源于”用于本文不仅是为了限定物质的物理来源,也是为了明确与所述物质在结构上相同的但不是起源于提到的来源的物质。因此“可见于供体抗体的残基”不必须是由供体抗体纯化的。
“分离的”是指分子(例如抗原结合蛋白或核酸)被从自然界中可以发现它的环境中移走。例如,分子被和它正常情况下在自然界中一起存在的物质纯化分开。例如,样品中的分子质量是总质量的95%。
术语“表达载体”用于本文意味着可以用来将感兴趣的核酸导入细胞(例如真核细胞或原核细胞)或者无细胞表达系统的分离的核酸,所述无细胞表达系统是可以将感兴趣的核酸序列表达为肽链(例如蛋白)。这类表达载体可以是例如包含目的核酸的粘粒、质粒、病毒序列、转座子和线性核酸。表达载体一经被导入细胞或无细胞表达系统(例如,网织红细胞裂解物),即可由转录/翻译机制产生目的核酸所编码的蛋白。本文范围内的表达载体可以提供真核或原核表达的必要元件,包括病毒启动子引导的载体,例如CMV启动子引导的载体(例如pcDNA3.1、pCEP4和它们的衍生物)、杆状表达表达载体、果蝇表达载体和由哺乳动物基因启动子引导的表达载体,例如人Ig基因启动子。其他例子包括原核表达载体,例如T7启动子引导的载体(例如pET41)、乳糖启动子引导的载体和阿拉伯糖基因启动子引导的载体。本领域技术人员能够识别许多其他的合适表达载体和表达系统。
术语“重组宿主细胞”用于本文意味着细胞包含在导入该细胞前分离的目的核酸序列。例如目的核酸序列可以处于表达载体中,而细胞可以是原核或真核细胞。示范性的真核细胞是哺乳动物细胞,例如但不限于COS-1、COS-7、HEK293、BHK21、CHO、BSC-1、HepG2、653、SP2/0、NS0、293、HeLa、骨髓瘤、淋巴瘤细胞或它们的任何衍生物。最优选的真核细胞是HEK293、NS0、SP2/0或CHO细胞。大肠杆菌是示范性的原核细胞。根据本文的重组细胞可以是通过转染、细胞融合、永生化或其他本领域熟知的程序生成的。转染到细胞内的目的核酸序列,例如表达载体,可以是染色体外的或者稳定地整合到细胞的染色体中。
“嵌合抗体”是指这样一类工程化抗体,其含有来源于供体抗体的天然可变区(轻链和重链)连接着来源于受体抗体的轻链和重链恒定区。
“人源化抗体”是指这样一类工程化抗体,其具有来源于非人供体免疫球蛋白的CDRs,分子中来源于免疫球蛋白的其余部分来源于一或多个人免疫球蛋白。此外,框架支持残基可以被改变以保存结合亲和力(参见例如Queenet al.Proc.Natl Acad Sci USA,86:10029-10032(1989),Hodgson,et al.,Bio/Technology,9:421(1991))。合适的人受体抗体可以是通过与供体抗体的核酸和氨基酸序列的同源性,从常规数据库选择的受体抗体,例如KABATTM数据库、Los Alamos数据库和Swiss Protein数据库。具有与供体抗体框架区的(基于氨基酸的)同源性的特点的人抗体可以适用于提供插入供体CDRs的重链恒定区和/或重链可变框架区。可以通过类似的方式选择能够贡献轻链恒定区或可变框架区的合适受体抗体。应指出,受体抗体重链和轻链不需要起源于相同的受体抗体。现有技术中描述了制备这类人源化抗体的多种方式,参见例如EP-A-0239400和EP-A-054951。
术语“供体抗体”是指给第一免疫球蛋白同伴贡献可变区、CDRs或其他功能片段或其类似物的氨基酸序列的抗体。因此供体提供了改变的免疫球蛋白编码区,导致表达的发生改变的抗体具有供体抗体的特征性抗原特异性和中和活性。
术语“受体抗体”是指对供体抗体是异源的抗体,它给第一免疫球蛋白同伴贡献编码重链和/或轻链框架区和/或重链和/或轻链恒定区的所有(或者任何部分)氨基酸序列。人抗体可以是受体抗体。
术语“VH”和“VL”用于本文分别是指抗原结合蛋白的重链可变区和轻链可变区。
“CDRs”定义为抗原结合蛋白的互补决定区氨基酸序列。这些是免疫球蛋白重链和轻链的超变区。免疫球蛋白的可变部分中有三个重链和三个轻链CDRs(或者CDR区)。因此,“CDRs”用于本文是指所有三种重链CDRs、所有三种轻链CDRs、所有重链和轻链CDRs,,或者至少一个CDR,其中所述至少一个CDR是CDRH3。
贯穿本说明书中,可变结构域序列和全长抗体序列中的氨基酸残基按照Kabat编号系统进行了编号。同样,实施例中使用的术语“CDR”、“CDRL1”、“CDRL2”、“CDRL3”、“CDRH1”、“CDRH2”、“CDRH3”也是按照Kabat编号系统。更多信息,参见Kabat,et al.,SEQUENCES OF PROTEINS OFIMMUNOLOGICAL INTEREST,4th Ed.,U.S.Department of Health andHuman Services,National Institutes of Health(1987)。
对本领域技术人员显而易见的,对可变结构域序列和全长抗体序列中的氨基酸残基有替代的编号系统。对CDR序列也有替代的编号系统,例如Chothia,et al.(1989)Nature342:877-883中提出的。抗体的结构和蛋白折叠可以意味着其他残基被认为是CDR序列的一部分,本领域技术人员会如此理解。
其他可供技术人员使用的CDR序列的编号系统包括“AbM”(Universityof Bath)和“接触”(University College London)方法。可以确定使用Kabat、Chothia、AbM和接触法中的至少两种的最小重叠区来提供“最小结合单位”。最小结合单位可以是CDR的一个分部分。
以下表3代表利用每个编号系统给每个CDR或结合单位的一个定义。表3中使用了Kabat编号方案将可变结构域的氨基酸序列编号。应当指出根据所使用的个别出版物,一些CDR定义可以不同。
表3
本文中,术语“抗原结合部位”是指抗原结合蛋白上能够特异结合抗原的部位。它可以是单个结构域(例如,表位结合结构域)或单链Fv(ScFv)结构域或者可以是象标准抗体中看到的那样的配对VH/VL结构域。
术语“表位”用于本文是指抗原中与抗原结合蛋白的特定结合结构域进行接触的部分。表位可以是线性的,包含来自抗原的基本为线性的氨基酸序列。替代地,表位可以是构象的或者不连续的。例如,构象表位包含需要含有结构性限制元件的氨基酸残基。不联系表位包含被其他序列分开的氨基酸残基,即在抗原的一级序列中不是连续的序列。在抗原三级和四级结构的环境中,不连续表位的残基互相足够接近以至于可以被抗原结合蛋白所结合。
对于核苷酸和氨基酸序列,术语“相同的”或者“序列同一性”表明当两个核酸或两个氨基酸序列通过合适的插入或缺失被最优化对位配列并比较时,它们之间的相同程度。
两个序列之间的同一性百分比是在考虑为了能够将两个序列进行最佳比对而引入的空位的数量、每个空位的长度的情况下,序列共有的相同位点数量的函数(即%同一性=相同位点数量/位点总数量乘以100)。可以利用数学算法,按照以下描述来完成两个序列之间的序列比较和同一性百分比确定。
两个核苷酸序列之间的同一性百分比可以利用GCG软件包中的GAP程序,使用NWSgapdna.CMP矩阵,空位权重40、50、60、70或80,和长度权重1、2、3、4、5或6来确定。两个核苷酸或氨基酸序列之间的同一性百分比还可以利用Meyers,et al.,Comput.Appl.Biosci.,4:11-17(1988)中的算法(该算法已被并入ALIGN程序(2.0版本)),使用PAM120残基权重表、空位长度罚分12和空位罚分4来确定。此外,两个氨基酸序列之间的同一性百分比可以利用Needleman,et al.,J.Mol.Biol.48:444-453(1970)算法(已被并入GCG软件包中的GAP程序中),使用Blossum62矩阵或者PAM250矩阵,空位权重16、14、12、10、8、6或4,和长度权重1、2、3、4、5或6来确定。
作为例子,多核苷酸序列可以与参照多核苷酸序列相同,即与参照序列100%相同;或者与参照序列相比,它可以包含最多某个整数的核苷酸改变,例如至少50、60、70、75、80、85、90、95、98或99%相同。这类改变选自至少一个核苷酸缺失、取代(包括转换和颠换)或插入,其中所述改变可以发生在参照核苷酸序列的5'或3'末端位点;或者发生在那些末端位点之间的任何位置,单独地散布在参照序列中的核苷酸之间,或者处于参照序列中的一或多个连续群中。确定核苷酸改变的数量可以通过将本文描述的参照多核苷酸中核苷酸总数乘以对应的同一性百分比(除以100),然后从所述参照多核苷酸序列的核苷酸总数中减去这个得数,或者:
nn≤xn-(xn·y),
其中nn是核苷酸改变的数量;xn是本文描述的参照多核苷酸序列中的核苷酸总数(示范性参照多核苷酸序列参见“序列表”中的核酸序列);y对于50%是0.50、对于60%是0.60、对于70%是0.7、对于80%是0.8、对于85%是0.85、对于90%是0.9、对于95%是0.95、对于98%是0.98、对于99%是0.99或者对于100%是1.00。·表示乘号,其中在从xn减去之前将xn和y的任何非整数得数舍到最近的整数。
同样,多肽序列可以与本文描述的多肽参照序列(示范性参照多肽序列参见“序列表”中的氨基酸序列)相同,即100%相同;或者与参照序列相比,它可以包含最多某个整数的氨基酸改变,从而使%同一性小于100%,例如至少50、60、70、75、80、85、90、95、98或99%相同。这类改变选自至少一个氨基酸缺失、取代(包括保守性和非保守性取代)或插入,其中所述改变可以发生在参照多肽序列的氨基或羧基端位点;或者发生在那些末端位点之间的任何位置,单独地散布在参照序列中的氨基酸之间,或者处于参照序列中的一或多个连续群中。对于给定%同一性,确定氨基酸改变的数量可以通过将多肽参照序列所编码的多肽序列中的氨基酸总数乘以对应的同一性百分比(除以100),然后从本文描述的多肽参照序列(参见例如SEQ IDNOs:1-21)中的所述氨基酸总数中减去这个得数,或者:
na≤xa-(xa·y),
其中na是氨基酸改变的数量;xa是参照多肽序列中的核苷酸总数;y对于50%是0.50、对于60%是0.60、对于70%是0.7、对于80%是0.8、对于85%是0.85、对于90%是0.9、对于95%是0.95、对于98%是0.98、对于99%是0.99或者对于100%是1.00;·表示乘号,其中在从xa减去之前将xa和y的任何非整数得数舍到最近的整数。
%同一性可以在整个序列长度上确定。按照本文的定义,术语“75%以上相同”包括75%、80%、85%、95%和99%以上的同一性以及这个范围内所有的离散值和离散的子范围。
术语“肽”、“多肽”和“蛋白质”各自指包含两个或以上氨基酸残基的分子。肽可以是单体或多聚体。
本领域的共识是某些氨基酸取代被认为是“保守性的”。氨基酸根据常见的侧链性能被划分为几个组,在组内进行的保持了抗原结合蛋白所有或者基本所有结合亲和力的取代被认为是保守性取代。参见表4。本文公开的抗原结合蛋白可以包含这类“保守性”氨基酸取代。
表4
| 侧链 | 成员 |
| 疏水 | met,ala,val,leu,ile |
| 中性亲水 | cys,ser,thr |
| 酸性 | asp,glu |
| 碱性 | asn,gln,his,lys,arg |
| 影响链取向的残基 | gly,pro |
| 芳香族 | trp,tyr,phe |
本文的一个方面是特异结合HER3的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:2、SEQ ID NO:3和SEQ ID NO:4的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:6、SEQ ID NO:7和SEQID NO:8的氨基酸序列有75%或以上的序列同一性。优选本文的抗原结合蛋白包含至少一个CDRH3,例如来自小鼠的CDRH3,或者本文公开的人源化1D9、15D5、22A5单克隆抗体。
本文还提供了特异结合HER3的抗原结合蛋白,其中所述抗原结合蛋白选自嵌合抗体和人源化抗体。
本文还提供了能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:2所示的CDR氨基酸序列、SEQ ID NO:3所示的CDR氨基酸序列和SEQ ID NO:4所示的CDR氨基酸序列;其包含的轻链可变区具有SEQ ID NO:6所述的CDR氨基酸序列、SEQ ID NO:7所示的CDR氨基酸序列和SEQ ID NO:8所示的CDR氨基酸序列。
本文还提供了抗原结合蛋白,其特异结合包含SEQ ID NO:21中氨基酸残基184-329的肽链结构域。SEQ ID NO:21中的氨基酸残基184–329包含HER3的结构域II。HER3的结构域II参与二聚体的形成,例如异二聚体化。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:23、SEQ ID NO:24和SEQ ID NO:25的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:27、SEQ ID NO:28和SEQ ID NO:29的氨基酸序列有75%或以上的序列同一性。
本文还提供了能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:23所示的CDR氨基酸序列、SEQ ID NO:24所示的CDR氨基酸序列和SEQ ID NO:25所示的CDR氨基酸序列;其包含的轻链可变区具有SEQ ID NO:27所述的CDR氨基酸序列、SEQ ID NO:28所示的CDR氨基酸序列和SEQ ID NO:29所示的CDR氨基酸序列。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:45、SEQ ID NO:46和SEQ ID NO:47的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:49、SEQ ID NO:50和SEQ ID NO:51的氨基酸序列有75%或以上的序列同一性。
本文还提供了能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:45所示的CDR氨基酸序列、SEQ ID NO:46所示的CDR氨基酸序列和SEQ ID NO:47所示的CDR氨基酸序列;和/或其包含的轻链可变区具有SEQ ID NO:49所述的CDR氨基酸序列、SEQ ID NO:50所示的CDR氨基酸序列和SEQ ID NO:51所示的CDR氨基酸序列。
本文还提供了抗原结合蛋白,其特异结合包含SEQ ID NO:21中氨基酸残基330-495的肽链结构域。SEQ ID NO:21中的氨基酸残基330–495包含HER3的结构域III。HER3的结构域III参与HER3受体对配体的结合。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:31、SEQ ID NO:32和SEQ ID NO:33的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:35、SEQ ID NO:36和SEQ ID NO:37的氨基酸序列有75%或以上的序列同一性。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:31所示的CDR氨基酸序列、SEQ ID NO:32所示的CDR氨基酸序列和SEQ ID NO:33所示的CDR氨基酸序列;和/或其包含的轻链可变区具有SEQ ID NO:35所述的CDR氨基酸序列、SEQ ID NO:36所示的CDR氨基酸序列和SEQ ID NO:37所示的CDR氨基酸序列。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含重链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:10、SEQ IDNO:11和SEQ ID NO:12的氨基酸序列有75%以上的序列同一性;和/或轻链可变区,所述轻链可变区有至少一个CDR与选自SEQ ID NO:12、SEQ ID NO:7和SEQ ID NO:8、SEQ ID NO:18、SEQ ID NO:19和SEQ ID NO:20的氨基酸序列有75%或以上的序列同一性。
本文还提供了能够特异结合HER3受体的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:10所示的CDR氨基酸序列、SEQ ID NO:11所示的CDR氨基酸序列、SEQ ID NO:12所示的CDR氨基酸序列;其包含的轻链可变区或者具有SEQ ID NO:12所述的CDR氨基酸序列、SEQ ID NO:7所示的CDR氨基酸序列和SEQ ID NO:8所示的CDR氨基酸序列,或者具有SEQ ID NO:18所述的CDR氨基酸序列、SEQ ID NO:19所示的CDR氨基酸序列和SEQ ID NO:20所示的CDR氨基酸序列。
本文还提供了能够特异结合HER3并抑制二聚体的形成的抗原结合蛋白,其包含SEQ ID NO:21所示的氨基酸序列。正如本领域技术人员可以理解的,对二聚体形成的抑制可以通过检测在有和没有本文所述抗原结合蛋白的情况下的二聚体含量来确定。这种二聚体形成分析是本领域公知的,包括例如基于共沉淀的分析或者双杂交分析。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:1所示的氨基酸序列,轻链可变区具有SEQ ID NO:5所示的氨基酸序列。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:22所示的氨基酸序列,轻链可变区具有SEQ ID NO:26所示的氨基酸序列。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:44所示的氨基酸序列,轻链可变区具有SEQ ID NO:48所示的氨基酸序列。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:30所示的氨基酸序列,轻链可变区具有SEQ ID NO:34所示的氨基酸序列。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:9所示的氨基酸序列,其轻链可变区具有选自SEQ IDNO:13所示的氨基酸序列和SEQ ID NO:17所示的氨基酸序列。
本文的另一方面是能够特异结合HER3的抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:30所示的氨基酸序列,轻链可变区具有SEQ ID NO:57所示的氨基酸序列。
本文还提供了编码本文描述的抗原结合蛋白的分离的核酸。
本文还提供了分离的核酸,包含选自SEQ ID NO:38所示的核酸序列和SEQ ID NO:39所示的核酸序列中的至少一个核酸。
本文还提供了分离的核酸,包含选自SEQ ID NO:59所示的核酸序列和SEQ ID NO:60所示的核酸序列中的至少一个核酸。
本文还提供了分离的核酸,包含选自SEQ ID NO:40所示的核酸序列和SEQ ID NO:41所示的核酸序列中的至少一个核酸。
本文还提供了分离的核酸,包含选自SEQ ID NO:52所示的核酸序列和SEQ ID NO:53所示的核酸序列中的至少一个核酸。
本文还提供了分离的核酸,包含选自SEQ ID NO:42所示的核酸序列和SEQ ID NO:43所示的核酸序列中的至少一个核酸。
本文还提供了分离的核酸,包含选自SEQ ID NO:42所示的核酸序列和SEQ ID NO:58所示的核酸序列中的至少一个核酸。
本文还提供了分离的核酸,包含选自SEQ ID NO:54所示的核酸序列、SEQ ID NO:55所示的核酸序列和SEQ ID NO:56所示的核酸序列中的至少一个核酸。
本文还提供了分离的核酸,包含选自SEQ ID NO:63所示的核酸序列、SEQ ID NO:64所示的核酸序列和SEQ ID NO:65所示的核酸序列中的至少一个核酸。
本文还提供了包含本文描述的分离的核酸的表达载体。
本文还提供了重组宿主细胞,其包含含有本文描述的分离的核酸的表达载体。
本文还提供了制备能够特异结合HER3的抗原结合蛋白的方法,包括的步骤是培养包含含有本文描述的分离的核酸的表达载体的重组细胞;和回收抗原结合蛋白。
本文还提供了药物组合物,其包含本文描述的抗原结合蛋白和药学上可接受的载体。
本文还提供了治疗受试者中癌症的方法,包括将本文描述的抗原结合蛋白以治疗有效量给予受试者的步骤,受试者中的癌症从而得到治疗。
本文还提供了治疗哺乳动物中癌症的方法,包括给予治疗有效量的文中所述抗原结合蛋白。
在本文所述方法的另一方面,哺乳动物是人。
在本文所述方法的另一方面,癌症选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
在一个实施方案中,还提供了本文描述的抗原结合蛋白用于乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤的治疗。
本文还提供了治疗受试者中癌症的方法,包括步骤a)鉴定患有选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤的患者;和b)将治疗有效量的本文描述的抗原结合蛋白给予受试者,受试者中的癌症从而得到治疗。
本文还提供了治疗方法,进一步包含步骤c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基184-329的蛋白。这类确定可以通过利用多种不同技术和试剂对完整癌细胞或者这类细胞的制品(例如裂解物或者免疫组织化学IHC制品)做出;其中所述试剂是例如能够特异结合包含SEQ IDNO:21中氨基酸残基184-329的肽链结构域的抗原结合蛋白,或者是对编码SEQ ID NO:21中氨基酸残基184-329的核酸序列特异的核酸引物或探针。这类确定可以通过利用例如流式细胞术(包括荧光活化细胞分析(FACS))、ELISA、Southern印迹、Northern印迹或者核酸微阵列分析做出。这类确定可以相对合适的阳性和阴性对照或者在以前收集的数据组(例如,SEQ IDNO:21中氨基酸残基184-329在特定细胞或组织类型中的平均表达情况)的基础上做出。
本文还提供了治疗方法,其中蛋白包含SEQ ID NO:21中显示的氨基酸序列。本文所述治疗方法可以进一步包括确定至少一个来自所述受试者的肿瘤细胞是否含有编码SEQ ID NO:21或其一部分(例如HER3的结构域II或者结构域III)的基因的扩增,或者编码SEQ ID NO:21或其一部分的RNA转录物的扩增。
本文还提供了治疗方法,进一步包含步骤c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基330-495的蛋白。这类确定可以通过利用多种不同技术和试剂对完整癌细胞或者这类细胞的制品(例如裂解物或者免疫组织化学IHC制品)做出;其中所述试剂是例如能够特异结合SEQ ID NO:21中氨基酸残基330-495的抗原结合蛋白,或者是对编码SEQ ID NO:21中氨基酸残基330-495的核酸序列特异的核酸引物或探针。这类确定可以通过利用例如流式细胞术(包括荧光活化细胞分析(FACS))、ELISA、Southern印迹、Northern印迹或者核酸微阵列分析做出。这类确定可以相对合适的阳性和阴性对照或者在以前收集的数据组(例如,SEQ ID NO:21中氨基酸残基330-495在特定细胞或组织类型中的平均表达情况)的基础上做出。
本文还提供了本文描述的物质,例如抗原结合蛋白,在制备治疗选自下述的状况的药物中的用途:乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
本文还涉及治疗或者减轻癌症严重程度的方法,所述癌症选自:脑(神经胶质瘤)、胶质母细胞瘤、班佐综合征(Bannayan-Zonana syndrome)、考登病(Cowden disease)、Lhermitte-Duclos病、乳腺癌、炎性乳腺癌、维尔姆斯瘤(Wilm's tumor)、尤文氏肉瘤(Ewing's sarcoma)、横纹肌肉瘤、室管膜瘤、髓母细胞瘤、结肠、头颈、肾、肺、肝、黑素瘤、卵巢、胰腺、前列腺、肉瘤、骨肉瘤、巨细胞瘤、甲状腺、淋巴母细胞T细胞白血病、慢性髓原白血病(chronic myelogenous leukemia)、慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴母细胞白血病、急性髓原白血病、慢性中性粒细胞性白血病、急性淋巴母细胞T细胞白血病、浆细胞瘤、免疫母细胞性大细胞白血病、套细胞白血病、多发性骨髓瘤成巨核细胞性白血病、多发性骨髓瘤、急性成巨核细胞性白血病、原髓细胞白血病、红白血病、恶性淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、淋巴母细胞性T细胞淋巴瘤、伯奇氏淋巴瘤(Burkitt’slymphoma)、滤泡性淋巴瘤、神经母细胞瘤、膀胱癌、尿路上皮癌、肺癌、外阴癌、宫颈癌、子宫内膜癌、肾癌、间皮瘤、食道癌、唾液腺癌、肝细胞癌、胃癌、鼻咽癌、口腔癌、口部癌症(cancer of the mouth)、GIST(肠胃道基质细胞瘤)和睾丸癌。
本文的另一方面是能够特异结合包含SEQ ID NO:21中氨基酸184-329的肽链结构域的抗原结合蛋白。
本文的另一方面是能够特异结合包含SEQ ID NO:21中氨基酸330-495的肽链结构域的抗原结合蛋白。
本文还提供了制备能够特异结合HER3的抗原结合蛋白的方法,包括步骤a)培养包含含有本文描述的分离的核酸的表达载体的重组宿主细胞,其中重组宿主细胞中编码α-1,6-岩藻糖基转移酶的FUT8基因已被失活;和b)回收抗原结合蛋白,从而产生了抗原结合蛋白。这类制备抗原结合蛋白的方法可以利用BioWa,Inc.(Princeton,NJ)提供的POTELLIGENTTM技术系统来进行,所述技术系统中的CHOK1SV细胞缺少FUT9基因的活性拷贝,因此产生的单克隆抗体相对带有活性FUT8基因的细胞中产生的同样单克隆抗体,抗体依赖性细胞介导的细胞毒(ADCC)活性增强。POTELLIGENTTM技术系统的各方面在US7214775、US6946292、WO0061739和WO0231240中有描述,这些文献均通过引用并入本文。本领域技术人员还能认识到其他合适的系统。此外,重组宿主细胞表达的抗原结合蛋白的回收方法是本领域熟知的,包括基于亲和力的层析法、离子交换层析和基于大小排阻的层析。
本文的抗原结合蛋白还可以提供为抗体-药物偶联物(ADC)的形式。抗原结合蛋白可以经由蛋白酶可切割的肽连接分子与化疗药物偶联。Auristatins是这类化疗剂的一个例子。合适的auristatins的例子包括单甲基auristatinE(MMAE)和单甲基auristatin F(MMAF)。文中描述了其他合适的化疗剂。本领域技术人员能够识别出其他合适的化疗剂。还可以通过将化疗剂经由反应基团形成的化学键与抗原结合蛋白连接起来从而制备偶联物。
本文还提供了制备能够特异结合HER3的抗原结合蛋白的方法,其中重组宿主细胞是CHOK1SV细胞。
本文还提供了能够特异结合HER3的抗原结合蛋白,所述蛋白是由本文的制备抗原结合蛋白的方法产生的。
本文还提供了制备能够特异结合HER3的抗原结合蛋白的方法,包括步骤a)培养包含含有本文所述分离的核酸的表达载体的重组宿主细胞,其中所述表达载体包含Fc核酸序列,其编码的嵌合Fc结构域具有IgG1和IgG3Fc结构域的氨基酸残基;和b)回收抗原结合蛋白,从而产生抗原结合蛋白。这类产生抗原结合蛋白的方法可以利用BioWa,Inc.(Princeton,NJ)和KyowaHakko Kogyo(now,Kyowa Hakko Kirin Co.,Ltd.)Co.,Ltd.提供的COMPLEGENTTM技术系统来进行。所述技术系统中的重组宿主细胞包含表达载体,表达载体中编码具有IgG1和IgG3Fc结构域氨基酸的嵌合Fc结构域的Fc核酸序列与抗体重链融合在一起;重组宿主细胞表达产生的抗原结合蛋白相对缺少所述嵌合Fc结构域的其他相同的单克隆抗体,其补体依赖性细胞毒(CDC)活性增强。COMPLEGENTTM技术系统的各方面在WO2007011041和US20070148165中有描述,所述文献通过引用并入本文。在本文的方法中,还可以通过给IgG链的Fc区引入序列特定的突变来提高CDC活性。本领域技术人员可以识别出其他合适的系统。
本文还提供了产生能够特异结合HER3的抗原结合蛋白的方法,其中Fc核酸序列与选自SEQ ID NO:40所示的核酸序列和SEQ ID NO:42所示的核酸序列的核酸符合读框地融合在一起。这类产生抗原结合蛋白的方法可以利用BioWa,Inc.(Princeton,NJ)提供的ACCRETAMABTM技术系统来进行,该系统结合了POTELLIGENTTM和COMPLEGENTTM技术系统,产生的抗原结合蛋白的ADCC和CDC活性相对缺少Fc结构域的其他都相同的单克隆抗体都被提高。
本文还提供了产生能够特异结合HER3的抗原结合蛋白的方法,包括步骤a)培养含有表达载体的重组宿主细胞,所述表达载体含有本文描述的分离的核酸,所述表达载体还包含编码具有IgG1和IgG3Fc结构域氨基酸残基的嵌合Fc结构域的Fc核酸序列,其中重组宿主细胞中的编码α-1,6-岩藻糖基转移酶的FUT8基因已被失活;和b)回收抗原结合蛋白,从而在具有活性FUT8基因的细胞中产生抗原结合蛋白。
本文还提供了产生能够特异结合HER3的抗原结合蛋白的方法,其中Fc核酸序列与选自SEQ ID NO:40所示的核酸序列和SEQ ID NO:42所示的核酸序列的核酸符合读框地融合在一起。
本文还提供了治疗受试者中癌前状态的方法,包括将治疗有效量的本文描述的抗原结合蛋白给予受试者,从而受试者中的癌前状态得以治疗。
本文还提供了治疗受试者中癌前状态的方法,包括步骤a)鉴定有癌前状态的受试者;和b)将治疗有效量的本文的抗原结合蛋白给予受试者,从而受试者中的癌前状态得以治疗。
本文还提供了治疗受试者中癌前状态的方法,进一步包括步骤c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基184-329的蛋白。
本文还提供了治疗受试者中癌前状态的方法,其中蛋白包含SEQ ID NO:21所示的氨基酸序列。
本文还提供了治疗受试者中癌前状态的方法,进一步包括步骤c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基330-495的蛋白。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:2所示氨基酸序列的CDRH1、具有SEQ ID NO:3所示氨基酸序列的CDRH2、具有SEQ ID NO:4所示氨基酸序列的CDRH3、具有SEQID NO:6所示氨基酸序列的CDRL1、具有SEQ ID NO:7所示氨基酸序列的CDRL2和具有SEQ ID NO:8所示氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:23所示氨基酸序列的CDRH1、具有SEQ ID NO:24所示氨基酸序列的CDRH2、具有SEQ ID NO:25所示氨基酸序列的CDRH3、具有SEQ ID NO:27所示氨基酸序列的CDRL1、具有SEQ ID NO:28所示氨基酸序列的CDRL2和具有SEQ ID NO:29所示氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:31所示氨基酸序列的CDRH1、具有SEQ ID NO:32所示氨基酸序列的CDRH2、具有SEQ ID NO:33所示氨基酸序列的CDRH3、具有SEQ ID NO:35所示氨基酸序列的CDRL1、具有SEQ ID NO:36所示氨基酸序列的CDRL2和具有SEQ ID NO:37所示氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:45所示氨基酸序列的CDRH1、具有SEQ ID NO:46所示氨基酸序列的CDRH2、具有SEQ ID NO:47所示氨基酸序列的CDRH3、具有SEQ ID NO:49所示氨基酸序列的CDRL1、具有SEQ ID NO:50所示氨基酸序列的CDRL2和具有SEQ ID NO:51所示氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:10所示氨基酸序列的CDRH1、具有SEQ ID NO:11所示氨基酸序列的CDRH2、具有SEQ ID NO:12所示氨基酸序列的CDRH3、具有SEQ ID NO:14所示氨基酸序列的CDRL1、具有SEQ ID NO:15所示氨基酸序列的CDRL2和具有SEQ ID NO:16所示氨基酸序列的CDRL3。
本文的另一方面是能够特异结合HER3受体的抗原结合蛋白,其包含具有SEQ ID NO:10所示氨基酸序列的CDRH1、具有SEQ ID NO:11所示氨基酸序列的CDRH2、具有SEQ ID NO:12所示氨基酸序列的CDRH3、具有SEQ ID NO:18所示氨基酸序列的CDRL1、具有SEQ ID NO:19所示氨基酸序列的CDRL2和具有SEQ ID NO:20所示氨基酸序列的CDRL3。
本文还提供了用于药品的如本文描述的药物组合物。
本文还提供了用于治疗乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤的如本文描述的药物组合物。
本文的能够特异结合HER3的抗原结合蛋白可以是抗体,例如单克隆抗体。文中描述了几个这种示范性的抗体,包括鼠的15D5、1D9和22A5单克隆抗体,以及人源化的15D5和1D9单克隆抗体。表位作图法显示15D5单克隆抗体能够结合HER3的结构域II,并且能抑制或干扰HER3和其他受体(例如象表1列举的那些)之间的配体诱导性受体二聚体化。这些包括,但不限于:HER2和其他HER家族受体、c-MET和其他酪氨酸激酶或细胞表面受体。对HER3与这些受体相互作用的能力的抑制或者干扰即可抑制或消除HER3依赖性的受体介导的细胞信号转导过程或途径。
表位作图还显示1D9单克隆抗体结合HER3的结构域III来抑制HER3配体结合和异二聚体的形成。
本文公开的能够特异结合HER3的抗原结合蛋白可以结合并中和HER3受体(又称为ErbB3)(SEQ ID NO:21),并且与参照抗体竞争结合HER3受体,所述参照抗体包含SEQ ID NO:1或9的重链可变区序列和SEQ ID NO:5、13或17的轻链可变区序列。能够特异结合HER3的抗原结合蛋白,例如小鼠和人源化15D5单克隆抗体可以结合HER3受体的结构域II(SEQ ID NO:21的残基184-329),但不能结合结构域I(SEQ ID NO:21的残基20-183)、III(SEQID NO:21的氨基酸残基330-495)或者IV(HER3受体(SEQ ID NO:21)SEQID NO:21的氨基酸残基496-643)。HER3受体的结构域II是重要的形成受体二聚体的界面,因此本文描述的两个抗原结合蛋白是候选的二聚体化抑制剂。能够特异结合HER3的抗原结合蛋白,例如鼠和人源化1D9抗体,还可以结合结构域III从而防止配体结合到HER3受体上。本文公开的能够特异结合HER3的抗原结合蛋白还能与文中描述的小鼠或人源化15D5、1D9或22A5单克隆抗体竞争。
本文所述的抗原结合蛋白或者包含抗原结合蛋白的药物组合物还可以用于治疗患有过度增殖或HER3相关疾病的受试者的方法中,所述疾病是例如基于多种因素(例如HER3表达)的癌症。这类肿瘤或癌症可以选自,但不限于乳腺癌、卵巢癌、胃肠癌、前列腺癌、膀胱癌、胰腺癌、胃癌、子宫内膜癌、肺癌、肾癌、头颈癌、神经胶质瘤、黑素瘤和非黑素瘤皮肤癌,以及其他皮肤癌和其他表达或过表达HER3的癌症。抗原结合蛋白还可以用于检测对靶向EGFR的疗法(例如抑制HER2/HER3异二聚体化的AG1478-曲妥珠单抗(trastuzumab)组合或帕妥珠单抗)有反应的HER3阳性癌症。参见例如Lee-Hoeflich et al.,68Cancer.Res.5875(2008)和Emlet et al.,94Br.J.Cancer1144(2006)。此外,以下群体的人可以得益于本文:1)抗HER2mAb抗性的患者,2)抗HER2mAb-无法使用的患者,3)抗HER1(EGFR)mAb抗性或者无法使用的患者,和4)患有酪氨酸激酶(小分子)-抗性肿瘤的患者。本文的抗原结合蛋白可以单独用于单一疗法,或者用于组合疗法中,后一种情况中试剂与此文本中另外说明的其他试剂一起给予。本文提供的方法可以导致受试者中的恶性肿瘤被抑制或退化;患者存活期、肿瘤进展的时间延长或者患者生活质量提高,其中这类方法包括将治疗有效量的抗原结合蛋白单独地或者与文中限定的其他特定试剂组合地给予的步骤。
曲妥珠单抗emtansine,又称为曲妥珠单抗-DM1或者曲妥珠单抗-MCC-DM1(缩写为T-DM1)是由抗体曲妥珠单抗(赫赛汀TM)与细胞毒素mertansine(DM1)连接构成的抗体-药物偶联物。其结构为:
本文的另一个实施方案是治疗哺乳动物中癌症的方法,包括将治疗有效量的本文所述抗原结合蛋白与至少一种文中描述的其他试剂一起给药。这类试剂在本文的例如59-78页有描述。
在另一个实施方案中,所述至少一种其他试剂选自曲妥珠单抗、帕妥珠单抗和T-DM1。
本文的抗原结合蛋白还可以用于治疗患有肿瘤的患者,所述肿瘤选自但不限于乳腺癌、卵巢癌、胃肠癌、前列腺癌、膀胱癌、胰腺癌、胃癌、子宫内膜癌、肺癌、肾癌、头颈癌、神经胶质瘤、黑素瘤和非黑素瘤皮肤癌,以及其他表达或过表达HER3的癌症。
本文的抗原结合蛋白还可以用于治疗乳腺癌、卵巢癌、胃肠癌、前列腺癌、膀胱癌、胰腺癌、胃癌、子宫内膜癌、肺癌、肾癌、头颈癌、神经胶质瘤、黑素瘤和非黑素瘤皮肤癌,以及其他表达或过表达HER3的癌症。
抗原结合蛋白可以结合并中和HER3受体,并且与参照抗体竞争结合HER3受体,所述参照抗体包含SEQ ID NO:1或9的重链可变区序列和SEQID NO:5、13或17的轻链可变区序列。
替代地,抗原结合蛋白抗原结合并中和HER3受体,并且与参照抗体竞争结合HER3受体,所述参照抗体包含SEQ ID NO:1或9的重链可变区序列和SEQ ID NO:5、13或17的轻链可变区序列。在一些实施方案中,抗原结合蛋白不能结合HER2受体。
参照抗体可以包含以下重链和轻链组合:(1)鼠15D5抗体(M5.15D5.2A1.1H10;鼠单克隆抗体;包含SEQ ID NOs:1和5);(2)鼠22A5抗体(M5.22A5.1G6.1C10;鼠单克隆抗体;包含SEQ ID NOs:9、13和17);(3)人源化15D5抗体(人源化单克隆抗体;包含SEQ ID NO:s22和26);(4)人源化1D9抗体(人源化单克隆抗体;包含SEQ ID NO:s30和34);(5)鼠1D9抗体(鼠单克隆抗体;包含SEQ ID NO:s44和48);(6)人源化1D9RR(又被称为人源化1D9_E抗体,人源化单克隆抗体;包含SEQ ID NO:s30和57)。第二抗体,小鼠22A5抗体,含有两个轻链可变结构域(SEQ ID NOs;13和17),因此可以形成不同的重链和轻链组合。参照抗体还可以包括下表17中描述的抗体。
抗原结合蛋白和参照抗体之间的竞争可以通过竞争ELISA来确定。竞争中和HER3可以通过下述中的一种或者组合来确定:通过例如ELISA、FMAT或者BIACORETM确定的对结合HER3的竞争;对HER3与神经调节蛋白1和神经调节蛋白2配体的抑制的竞争;以及对在基于A204细胞的检测中导致荧光素酶表达的抑制细胞信号转导的竞争。竞争性抗原结合蛋白可以结合相同的表位、有重叠的表位,或者位于参照抗体所结合的表位的近邻的表位。
抗原结合蛋白可以不显著结合HER3肽片段或人工肽序列。抗原结合蛋白与HER3肽片段或者人工肽序列的结合可以不到抗原结合蛋白与肽的结合的1:1-1:10比率范围。
抗原结合蛋白和HER3受体肽片段或人工肽序列之间是否有结合可以通过ELISA或者还原条件下的SDA PAGE来确定。例如,可以通过还原性SDSPAGE确定抗原结合蛋白与线性全长HER3受体序列之间是否有结合。
本文还提供了结合并中和HER3受体的抗原结合蛋白,其包含SEQ IDNOs:4、15或20的CDRH3或者它的变体CDR。
抗原结合蛋白还可以包含任何组合方式的一或多个CDRs,或者所有CDRs,所述CDRs选自:CDRH1(SEQ ID NOs:2、10或31)、CDRH2(SEQ IDNOs:3、11或32)、CDRH3(SEQ ID NO:4、12或33)、CDRL1(SEQ ID NO:6、14、18或35)、CDRL2(SEQ ID NO:7、15、19或36)和CDRL3(SEQ ID NO:8、16、20或37);或者它们的变体。
例如,抗原结合蛋白可以包含CDRH3(SEQ ID NO:4、12或33)和CDRH1(SEQ ID NOs:2、10或31)或者它们的变体。抗原结合蛋白可以包含CDRH3(SEQ ID NO:4、12或33)和CDRH2(SEQ ID NOs:3、11或32)或者它们的变体。抗原结合蛋白可以包含CDRH1(SEQ ID NOs:2、10或31)、CDRH2(SEQ ID NOs:3、11或32)和CDRH3(SEQ ID NO:4、12或33)或者它们的变体。
抗原结合蛋白可以包含CDRL1(SEQ ID NO:6、14、18或35)和CDRL2(SEQ ID NO:7、15、19或36)或者它们的变体。抗原结合蛋白可以包含CDRL2(SEQ ID NO:7、15、19或36)和CDRL3(SEQ ID NO:8、16、20或37)或者它们的变体。抗原结合蛋白可以包含CDRL1(SEQ ID NO:6、14、18或35)、CDRL2(SEQ ID NO:7、15、19或36)和CDRL3(SEQ ID NO:8、16、20或37)或者它们的变体。
抗原结合蛋白可以包含CDRH3(SEQ ID NO:4、12或33)和CDRL3(SEQ ID NO:8、16、20或37)或者它们的变体。抗原结合蛋白可以包含CDRH3(SEQ ID NO:4、12或33)、CDRH2(SEQ ID NOs:3、11或32)和CDRL3(SEQ ID NO:8、16、20或37)或者它们的变体。抗原结合蛋白可以包含CDRH3(SEQ ID NO:4、12或33)、CDRH2(SEQ ID NOs:3、11或32),CDRL2(SEQ ID NO:7、15、19或36)和CDRL3(SEQ ID NO:8、16、20或37)或者它们的变体。
抗原结合蛋白可以包含CDRH1(SEQ ID NOs:2、10或31)、CDRH2(SEQID NOs:3、11或32)、CDRH3(SEQ ID NO:4、12或33)、CDRL1(SEQ ID NO:6、14、18或35)、CDRL2(SEQ ID NO:7、15、19或36)和CDRL3(SEQ ID NO:8、16、20或37)或者它们的变体。
本文还提供了结合并中和HER3受体的抗原结合蛋白,其中所述抗原结合蛋白是嵌合或人源化抗体,包含SEQ ID NO:1、9或30的可变结构域序列的相应CDRH3或者变体CDRH3。
嵌合或人源化抗原结合蛋白可以还包含选自SEQ ID NO:1,SEQ ID NO:9,SEQ ID NO:30的可变结构域序列中的一或多个或者全部相应CDRs,或者它们的变体CDR。
例如,抗原结合蛋白可以包含相应的CDRH3和相应的CDRH1或者它们的变体。抗原结合蛋白可以包含相应的CDRH3和相应的CDRH2或者它们的变体。替代地,抗原结合蛋白可以包含相应的CDRH1、相应的CDRH2和相应的CDRH3或者它们的变体。
抗原结合蛋白可以包含相应的CDRL1和相应的CDRL2,或者它们的变体。此外,抗原结合蛋白可以包含相应的CDRL2和相应的CDRL3,或者它们的变体。抗原结合蛋白还可以包含相应的CDRL1、相应的CDRL2和相应的CDRL3,或者它们的变体。
抗原结合蛋白可以包含相应的CDRH3和相应的CDRL3,或者它们的变体。抗原结合蛋白可以包含相应的CDRH3、相应的CDRH2和相应的CDRL3,或者它们的变体。替代地,抗原结合蛋白可以包含相应的CDRH3、相应的CDRH2、相应的CDRL2和相应的CDRL3,或者它们的变体。
抗原结合蛋白可以包含相应的CDRH1、相应的CDRH2、相应的CDRH3、相应的CDRL1、相应的CDRL2和相应的CDRL3,或者它们的变体。
相应CDRs可以借助Kabat(1987)、Chothia(1989)、AbM或接触法来限定。表3可以找到每个方法的一个定义,应用到SEQ ID NO:1、9或30的参照重链可变结构域和SEQ ID NO:5、13、17或35的轻链可变结构域来确定相应的CDR。
例如,抗原结合蛋白可以包含结合单位CDR H3和结合单位CDR H1,或者它们的变体。抗原结合蛋白可以包含结合单位CDR H3和结合单位CDRH2,或者它们的变体。抗原结合蛋白可以包含结合单位CDR H1、结合单位CDR H2和结合单位CDR H3;或者它们的变体。
抗原结合蛋白可以包含结合单位CDR L1和结合单位CDR L2,或者它们的变体。抗原结合蛋白可以包含结合单位CDR L2和结合单位CDR L3,或者它们的变体。抗原结合蛋白可以包含结合单位CDR L1、结合单位CDRL2和结合单位CDR L3,或者它们的变体。
抗原结合蛋白可以包含结合单位CDR H3和结合单位CDR L3,或者它们的变体。替代地,抗原结合蛋白可以包含结合单位CDR H3、结合单位CDRH2和结合单位CDR L3,或者它们的变体。抗原结合蛋白可以包含结合单位CDR H3、结合单位CDR H2、结合单位CDR L2和结合单位CDR L3,或者它们的变体。
抗原结合蛋白可以包含结合单位CDR H1、结合单位CDR H2、结合单位CDR H3、结合单位CDR L1、结合单位CDR L2和结合单位CDR L3,或者它们的变体。
CDR变体或变体结合单位包含至少一个氨基酸被改造的氨基酸序列,其中所述改造可以是氨基酸序列的化学或者部分改变(例如不超过10个氨基酸),所述改造使得变体保持未经改造的序列的化学特性。例如,变体是功能变体,能够结合并中和HER3。CDR氨基酸序列的部分改变可以是一到多个氨基酸的缺失或取代,或者添加或插入一到多个氨基酸,或者它们的组合(例如不超过10个氨基酸)。CDR变体或结合单位变体可以含有氨基酸序列中任何组合的1、2、3、4、5或6个氨基酸取代、添加或缺失。CDR变体或结合单位变体可以含有氨基酸序列中任何组合的1、2或3个氨基酸取代、插入或缺失。氨基酸残基中的取代可以是保守性取代,例如将一个疏水氨基酸取代为替代的疏水氨基酸。例如,亮氨酸可以取代为缬氨酸或异亮氨酸。
正如通过ED50展示的,包含所述CDRs、相应CDRs、变体CDRs、结合单位或者变体结合单位的抗原结合蛋白可以表现出结合HER3的能力,是本文描述的参照抗体的能力的10倍或者5倍以内。ED50所展示的结合HER3的能力可以通过ELISA检验来进行。
抗原结合蛋白可以含有或者不含有在氨基酸位点54的从天冬酰胺(N)到天冬氨酸(D)或者谷氨酰胺(Q)的取代。抗原结合蛋白变体可以含有或不含有在氨基酸位点91的从半胱氨酸(C)到丝氨酸(S)的取代。
这里描述的CDRs、相应CDRs、变体CDRs或者结合单位中的一或多个可以处于人框架中,例如作为人源化或者嵌合可变结构域。
人源化重链可变结构域可以在受体抗体框架中包含序列表中描述的CDRs、相应CDRs、结合单位或者它们的变体,所述受体抗体框架与SEQ IDNO:1和9中人可变结构域序列有75%或以上、80%或以上、85%或以上、90%或以上、95%或以上、98%或以上、99%或以上或者100%的同一性。人源化轻链可变结构域可以在受体抗体框架中包含SEQ ID NOs:6、7、8、14、15、16、18、19或20中列出的CDRs、相应CDRs、结合单位或者它们的变体,所述受体抗体框架有75%或以上、80%或以上、85%或以上、90%或以上、95%或以上、98%或以上、99%或以上或者100%的同一性。
抗原结合蛋白可变重链可以含有位于位点28的丝氨酸(S)氨基酸残基和/或位于位点105的苏氨酸(T)氨基酸残基。抗原结合蛋白可变轻链可以含有位于位点16的精氨酸(R)氨基酸残基和/或位于位点71的酪氨酸(Y)氨基酸残基和/或位点100的丙氨酸(A)氨基酸残基。例如,抗原结合蛋白可以包含位于可变重链位点28的丝氨酸(S)和可变轻链位点71的酪氨酸(Y)。
本文还提供了能够特异结合并中和HER3的抗原结合蛋白,其包含以下重链和轻链可变区组合中的任意一种:(1)鼠15D5抗体(M5.15D5.2A1.1H10;鼠单克隆抗体;包含SEQ ID NOs:1和5);(2)鼠22A5抗体(M5.22A5.1G6.1C10;鼠单克隆抗体;包含SEQ ID NOs:9、13和17);(3)人源化15D5抗体(人源化单克隆抗体;包含SEQ ID NO:s22和26);(4)人源化1D9抗体(人源化单克隆抗体;包含SEQ ID NO:s30和34);(5)鼠1D9抗体(鼠单克隆抗体;包含SEQ ID NO:s44和48);(6)人源化1D9RR(又被称为人源化1D9_E抗体,人源化单克隆抗体;包含SEQ ID NO:s30和57)。
任何重链可变区可以与合适的人恒定区组合。任何轻链可变区可以与合适的恒定区组合。
正如ED50展示的,以上描述的抗原结合蛋白(例如带有通过化学修饰和/或插入、缺失或取代一或多个氨基酸残基得到的部分序列改变的变体;或者那些与上述序列中的任何一个有75%或以上、80%或以上、85%或以上、90%或以上、95%或以上、98%或以上、99%或以上或者100%的同一性的)表现出结合HER3的能力,所述能力是下述抗体表现出的能力的10倍或5倍以内:(1)M515D52A11H10(鼠单克隆抗体;包含SEQ ID NOs:1和5);(2)M5_22A51G61C10(鼠单克隆抗体;包含SEQ ID NOs:9、13和17);(3)人源化15D5(人源化单克隆抗体;包含SEQ ID NO:s22和26);(4)人源化1D9(人源化单克隆抗体;包含SEQ ID NO:s30和34);(5)鼠1D9(鼠单克隆抗体;包含SEQ ID NO:s44和48);(6)人源化1D9_E(人源化单克隆抗体;包含SEQ IDNO:s30和57)。由ED50展示的结合HER3的能力可以通过ELISA检验来进行。
本文描述的抗原结合蛋白可以不能结合HER3受体的肽片段。所述HER3受体的肽片段可以是HER3序列中由最多14个氨基酸构成的任何片段。HER3肽片段可以是线性的。HER3肽片段可以是HER3受体序列的任何片段,包括全长序列,其中所述序列是线性的。
抗原结合蛋白和HER3肽片段或人工肽序列之间是否存在结合可以通过ELISA或者通过还原条件下的SDS PAGE来确定。例如,可以通过还原性(即变性)SDS PAGE来确定抗原结合蛋白与线性全长HER3序列是否有结合。
本文描述的抗原结合蛋白所结合的HER3受体的表位可以是构象或者不连续表位。本文描述的抗原结合蛋白可以不是结合HER3受体上的线性表位。例如,抗原结合蛋白可以不是结合HER3受体的还原或者变性样品。构象或不连续表位可以与HER3受体结合部位是相同的、相似的或者有重叠的。当HER3受体处于成熟形式和作为与另一个受体分子形成的二聚体的一部分时,表位可以是可以接近的。当HER3受体处于成熟形式和正如描述的作为与其他HER3受体结合分子形成的四聚体的一部分时,表位可以也是可以接近的。表位可以分布在两个HER3受体多肽上。这种类型的不连续表位可以包含来自每个HER3受体分子的序列。所述序列可以就二聚体的三级和四级结构来说,互相足够靠近从而形成表位和被抗原结合蛋白结合。构象和/或不连续表位可以通过已知方法,例如CLIPSTM(Pepscan Systems)来鉴定。
抗原结合蛋白在人或者鼠动物模型体内有至少6小时、至少1天、至少2天、至少3天、至少4天、至少5天、至少7天或者至少9天的半寿期。
对抗体Fc效应子部分进行的突变性改变可以用于改变FcRn和抗体之间相互作用的亲和力,从而调节抗体的周转。抗体在体内的半寿期可以被延长。这对于患者群体是有益的,因为体内IC50维持的时间更长就使得能够达到最大剂量和最大给剂频率。
抗原结合蛋白所结合的HER3受体多肽可以是重组多肽。HER3受体可以处于溶液中,或者附着在固体表面。例如,HER3受体可以附着在珠子,例如磁珠上。此外,HER3受体可以是生物素化的。偶联到HER3受体上的生物素分子可以用于通过与固体表面上的生物素链霉亲和素偶联将HER3固定在固体表面。
抗原结合蛋白可以来源于大鼠、小鼠、灵长类动物(例如,食蟹猴、旧大陆猴或类人猿)或者人。抗原结合蛋白可以是人源化或嵌合抗体。
抗原结合蛋白可以包含恒定区,其可以是任何同种型或亚型。恒定区可以是IgG同种型的,例如IgG1、IgG2、IgG3、IgG4或者它们的变体。抗原结合蛋白恒定区可以是IgG1。
抗原结合蛋白可以包含一或多个选自突变的恒定结构域的改造,从而使抗体具有增强的效应功能/ADCC和/或补体活化。合适的改造的例子在Shields,et al.,J.Biol.Chem.(2001)276:6591-6604、Lazar,et al.,PNAS(2006)103:4005-4010以及US6737056、WO2004063351和WO2004029207中有描述。
抗原结合蛋白可以包含糖基化特性改变的恒定结构域,从而使抗体具有增强的效应功能/ADCC和/或补体活化。合适的制备具有糖基化特性改变的抗原结合蛋白的方法在WO2003/011878、WO2006/014679和EP1229125中有描述。
本文还提供了编码本文描述的抗原结合蛋白的核酸分子。所述核酸分子可以包含编码重链可变或全长序列的序列,以及轻链可变或全长序列的序列。替代地,编码本文描述的抗原结合蛋白的核酸分子可以包含编码重链可变或全长序列的序列、或者轻链可变或全长序列的序列。
本文还提供了包含本文描述的核酸分子的表达载体。还提供了包含本文描述的表达载体的重组宿主细胞。
可以在合适的宿主细胞中产生本文描述的抗原结合蛋白。生产本文描述的抗原结合蛋白的方法包括培养文中所述的宿主细胞和回收抗原结合蛋白的步骤。重组的转化、转染或转导宿主细胞可以包含至少一个表达盒,其中所述表达盒包含编码文中所述抗原结合蛋白的重链的多核苷酸,还包含编码文中所述抗原结合蛋白的轻链的多核苷酸。替代地,重组的转化、转染或转导宿主细胞可以包含至少一个表达盒,其中第一表达盒包含编码文中所述抗原结合蛋白的重链的多核苷酸;还包含第二表达盒,含有编码文中所述抗原结合蛋白的轻链的多核苷酸。稳定转化宿主细胞可以包含含有一或多个表达盒的载体,所述表达盒编码文中所述抗原结合蛋白的重链和/或轻链。例如这样的宿主细胞可以包含编码轻链的第一载体和编码重链的第二载体。
宿主细胞可以是真核的,例如哺乳动物细胞。这类细胞系的例子包括CHO或NS0。宿主细胞可以在培养基,例如无血清培养基中进行培养。宿主细胞可以将抗原结合蛋白分泌到培养基中。相对所述含有抗原结合蛋白的培养基,抗原结合蛋白可以被纯化到至少95%或以上(例如98%或以上)。在不同培养基组合物和室温条件下培养细胞的方法是本领域技术人员熟知的。
可以提供含有抗原结合蛋白和药学上可接受的载体的药物组合物。可以提供包含药物组合物和使用说明的试剂盒。为了方便,所述试剂盒包含预先确定量的试剂和使用说明。
抗体结构
完整抗体
来自多数脊椎动物的抗体的轻链可以根据恒定区的氨基酸分配到κ和λ两类中的一个。根据其重链恒定区的氨基酸序列,可以将人抗体分配到5个不同类型-IgA、IgD、IgE、IgG和IgM。IgG和IgA可以进一步划分为亚型:IgG1、IgG2、IgG3和IgG4;以及IgA1和IgA2。对于有至少IgG2a、IgG2b的小鼠和大鼠存在种变体。
可变区中更保守的部分被称为框架区(FR)。完整重链和轻链的可变结构域每个包含通过三个CDRs连接的四个FR。每个链中的CDRs被FR区保持在附近,并与来自其他链的CDRs一起帮助形成抗体的抗原结合部位。
恒定区不直接参与抗体与抗原的结合,但表现出多种效应功能,例如参与抗体依赖性细胞介导的细胞毒性(ADCC)、经由与Fcγ受体的结合的吞噬作用、经由新生儿Fc受体(FcRn)的半寿期/清除率,和经由补体级联中C1q成分的补体依赖性细胞毒性。
人IgG2恒定区根据报道基本缺乏通过经典途径活化补体,或者介导抗体依赖性细胞介导的细胞毒性的能力。IgG4恒定区根据报道缺乏通过经典途径活化补体的能力,并且只能微弱地介导抗体依赖性细胞介导的细胞毒性。基本缺少这些效应功能的抗体可以被称为“非溶”抗体。
人抗体
可以通过本领域技术人员已知的许多方法来产生人抗体。利用人骨髓瘤或小鼠-人种间骨髓瘤细胞系,通过杂交瘤方法可以制备人抗体。参见Kozbor(1984)J.Immunol133,3001,and Brodeur,单克隆抗体PRODUCTIONTECHNIQUES AND APPLICATIONS,51-63(Marcel Dekker Inc,1987)。替代的方法包括使用噬菌体文库或者转基因小鼠,两种方法均利用到人可变区库(参见Winter(1994)Annu.Rev.Immunol12:433-455;Green(1999)J.Immunol.Methods231:11-23)。
目前有几个转基因小鼠株可供使用,其中它们的小鼠免疫球蛋白基因座被人免疫球蛋白基因节段代替(参见Tomizuka(2000)PNAS97:722-727;Fishwild(1996)Nature Biotechnol.14:845-851;Mendez(1997)Nature Genetics,15:146-156)。当受到抗原攻击时,这些小鼠能够产生人抗体库,从中可以选择出感兴趣的抗体。
噬菌体展示技术被用于产生人抗原结合蛋白(及其片段),参见McCafferty(1990)Nature348:552-553和Griffiths,et al.,EMBO13:3245-3260(1994)。
亲和成熟技术(Marks Bio/technol(1992)10:779-783)可用于提高结合亲和力,其中提高一级人抗体的亲和力是通过用天然变体顺序代替H和L链可变区,并基于提高的结合亲和力进行筛选。现在还有该项技术的改型,例如“表位印迹”。参见例如WO93/06213;Waterhouse(1993)Nucl.Acids Res.21:2265-2266。
嵌合和人源化抗体
嵌合抗体一般是利用重组DNA方法产生的。采用常规程序(例如通过使用能够特异结合编码抗体H和L链的基因的寡核苷酸探针),分离编码抗体的DNA(例如cDNA)并进行测序。分离后,将DNA放入表达载体,然后载体被转染到否则不会产生免疫球蛋白的宿主细胞(例如大肠杆菌、COS细胞、CHO细胞或骨髓瘤细胞)中来实现抗体的合成。可以通过将人L和H链的编码序列取代为相应的非人(例如鼠)H和L恒定区对DNA进行改造。参见例如Morrison(1984)PNAS81:6851。
通过将非人(例如鼠)抗体(“供体”抗体)的只有CDRs部分移植到人框架(“受体框架”)或恒定区上使得免疫原性大大下降,从而生成人源化抗体(参见Jones,et al.(1986)Nature321:522-525和Verhoeyen,et al.(1988)Science239:1534-1536)。但是,CDR移植本身可以不会造成抗原结合性被完全保持,如果想要恢复显著的抗原结合亲和力,经常发现需要将供体抗体的一些框架残基(有时被称为“回复突变”)保留在人源化分子中(参见Queen,et al.(1989)PNAS86:10,029-10,033:Co,et al.(1991)Nature351:501-502)。这种情况中,为了提供人框架(FR),从数据库中选择显示出与非人供体抗体有最大序列同源性的人可变区。可以由人共有序列或者个别人抗体进行人FRs的选择。需要时,可以将供体抗体的关键残基取代到人受体框架中以便保留CDR构象。可以利用抗体的计算机建模来帮助鉴定这类对结构重要的残基。参见WO99/48523。
替代地,可以通过“镶饰”过程实现人源化。对独特人和鼠免疫球蛋白重链和轻链可变区进行的统计学分析显示人海鼠抗体中暴露残基的确切模式是不同的,多数个别表面位点对少数几个不同残基有很强的偏爱(参见Padlan,et al.(1991)Mol.Immunol.28:489-498和Pedersen,et al.(1994)J.Mol.Biol.235:959-973)。因此,有可以通过替换框架区中与人抗体中通常见到的不同的暴露残基来减少非人Fv的免疫原性。因为蛋白抗原性可以与表面可接近性相关,替换表面残基可以就足以使小鼠可变区对于人免疫系统是“不可见的”(参见Mark,et al.(1994)in Handbook of Experimental PharmacologyVol.113:The pharmacology of monoclonal antibodies,Springer-Verlag,105-134)。该人源化过程被称为“镶饰”是因为只有抗体表面被改变,而支持性残基未受影响。其他的替代方法包括WO04/006955中提出的以及HUMANEERINGTM(Kalobios)程序,它利用了细菌表达系统产生序列上与人种系相近的抗体(Alfenito-M Advancing Protein Therapeutics January2007,SanDiego,California)。
双特异性抗原结合蛋白
双特异性抗原结合蛋白是对至少两个不同表位有结合特异性的抗原结合蛋白。制备这类抗原结合蛋白的方法是本领域已知的。传统上,双特异性抗原结合蛋白的重组产生是基于两个免疫球蛋白H链-L链对的共表达,其中两个H链有不同的结合特异性。参见Millstein,et al.(1983)Nature305:537-539、WO93/08829和Traunecker,et al.(1991)EMBO10:3655-3659。由于H和L链的随机搭配,产生的可以是十种不同抗体结构的混合物,其中只有一种具有所需的结合特异性。替代方法包括将具有所需结合特异性的可变结构域融合到包含至少部分铰链区的重链恒定区CH2和CH3区上。含有轻链结合所必需的位点的CH1区可以在至少一个融合中有。将编码这些融合的DNA(如果需要的话,还有L链)插入不同的表达载体,然后共转染到合适的宿主生物中。但也可以将两个或者全部三个链的编码序列插入到一个表达载体中。在一个方法中,双特异性抗体由一个臂中的具有第一结合特异性的H链,和另一个臂中提供第二结合特异性的H-L链对构成。参见WO94/04690,还可参见Suresh,et al.(1986)Methods in Enzymology121:210。
抗原结合片段
不含恒定区的片段缺少通过经典途径激活补体或者介导抗体依赖性细胞介导的细胞毒性的能力。传统上,这类片段是通过完整抗体经例如木瓜蛋白酶消化的蛋白水解产生的(参见,例如WO94/29348),但也可以由重组转化宿主细胞直接产生。对于ScFv的产生,参见Bird,et al.(1988)Science242:423-426。此外,可以利用如下描述的各种工程化技术来产生抗原结合片段。
Fv片段的两个链看来比Fab片段具有更低的相互作用能量。为了稳定VH和VL结构域的结合,尝试过给它们连接上肽(Bird,et al.(1988)Science242:423-426;Huston,et al.(1988)PNAS85(16):5879-5883)、二硫键(Glockshuber,etal.(1990)Biochemistry29:1362-1367)和“knob in hole”突变(Zhu,et al.(1997)Protein Sci.,6:781-788)。ScFv片段可以通过本领域技术人员熟知的方法来产生,参见Whitlow,et al.(1991)Methods Companion Methods Enzymol,2:97-105和Huston,et al.(1993)Int.Rev.Immunol10:195-217。ScFv可以在细菌细胞(例如大肠杆菌)或者真核细胞中产生。ScFv的一个缺点是产物的单价性,这排除了通过多价结合可以得到的增加的亲合力和它们的半寿期短。克服这些问题的尝试包括由含有额外的C短半胱氨酸的ScFv经化学偶联(Adams,et al.(1993)Can.Res53:4026-4034;和McCartney,et al.(1995)ProteinEng.8:301-314)或者由含有未配对的C端半胱氨酸残基的ScFv经自发定点二聚体化(参见Kipriyanov,et al.(1995)Cell.Biophys26:187-204)产生二价(ScFv')2。替代地,可以通过将肽连接分子缩短到3-12个残基,迫使ScFv形成多聚体,以形成“双体(diabodies)”,参见Holliger,et al.(1993)PNAS90:6444-6448。进一步缩小连接分子可以导致ScFv三聚体(“三体”,参见Kortt,et al.(1997)Protein Eng10:423-433)和四聚体(“四体”,参见Le Gall,etal.(1999)FEBS Lett,453:164-168)。二价ScFv分子的构建还可以通过与蛋白二聚体化基元的基因融合来实现,从而形成“微型抗体(miniantibodies)”(参见Pack,et al.(1992)Biochemistry31:1579-1584)和“微体(minibodies)”(参见Hu,et al.(1996)Cancer Res.56:3055-3061)。还可以通过将两个ScFv单元经第三个肽连接分子连接起来形成ScFv-Sc-Fv串联体((ScFV)2),参见Kurucz,et al.(1995)J.Immol.154:4576-4582。双特异性双体可以通过两个单链融合产物的非共价结合产生,由来自一个抗体的VH结构域通过短的连接分子与另一个抗体的VL结构域相连构成,参见Kipriyanov,et al.(1998)Int.J.Can77:763-772。可以通过引入二硫键或者如上所述的“knob in hole”突变,或者通过形成单链双体(ScDb)(其中两个杂交ScFv片段通过肽连接分子相连)来增加这类双特异性双体的稳定性,参见Kontermann,et al.(1999)J.Immunol.Methods226:179-188。还通过例如ScFv片段与IgG分子的CH3结构域的融合或者经由铰链区与Fab片段的融合形成了四价双特异性分子。参见Coloma,et al.(1997)Nature Biotechnol.15:159-163。替代地,已经通过双特异性单链双体的融合产生了四价双特异性分子(参见Alt,et al.(1999)FEBS Lett454:90-94。较小的四价双特异性分子的形成还可以通过由含有螺旋-环-螺旋基元的连接分子将ScFv-ScFv串联体二聚体化(DiBi微型抗体,参见Muller,et al.(1998)FEBS Lett432:45-49),或者通过包含四个抗体可变结构域(VH和VL)的单链分子以防止分子内配对的方向的二聚体化(串联双链抗体,参见Kipriyanov,et al.(1999)J.Mol.Biol.293:41-56)。可以通过Fab'片段的化学偶联或者通过经由亮氨酸拉链的异二聚体化形成双特异性F(ab')2片段(参见Shalaby,et al.(1992)J.Exp.Med.175:217-225和Kostelny,et al.(1992),J.Immunol.148:1547-1553)。还有分离的VH和VL结构域(Domantis plc)。参见US6,248,516、US6,291,158和US6,172,197。
异源偶联抗体
异源偶联抗体是利用任何方便的交联方法形成的由两个共价连接的抗体构成的抗体。参见例如US4,676,980。
其他改造
本文的抗原结合蛋白可以包含增强或改变它们的效应功能的其他改造。抗体Fc区与各种Fc受体(FcγR)之间的相互作用被认为能够介导抗体的效应功能,包括抗体依赖性细胞介导的细胞毒性(ADCC)、补体固定、吞噬作用和抗体的半寿期/清除。根据需要的性能,可以对抗体的Fc区进行各种改造。例如,EP0629240和EP0307434中详细描述了Fc区中能够使本来的溶解性抗体变为非溶解性的特定突变。或者可以给抗体引入一个补救受体结合表位来提高血清半寿期。参见US5,739,277。人Fcγ受体包括FcγR(I)、FcγRIIa、FcγRIIb、FcγRIIIa和新生儿FcRn。Shields,et al.(2001)J.Biol.Chem276:6591-6604显示有一组共同的IgG1残基参与了结合所有FcγRs,而FcγRII和FcγRIII使用的是这个共同残基组之外的不同位点。有一群IgG1残基在被改变为丙氨酸时,与所有FcγRs的结合下降:Pro-238、Asp-265、Asp-270、Asn-297和Pro-239。它们都位于IgG CH2结构域中,聚集在连接CH1和CH2的铰链附近。FcγRI只使用所述共同的IgG1残基组进行结合,而FcγRII和FcγRIII除了共同组,还与不同的残基相互作用。一些残基的改变只降低与FcγRII(例如Arg-292)或FcγRIII(例如Glu-293)的结合。一些变体显示出与FcγRII或FcγRIII的结合提高,但不影响与其他受体的结合(例如Ser-267Ala提高了与FcγRII的结合,但不影响与FcγRIII的结合)。其他变体呈现出与FcγRII或FcγRIII的结合提高,而对其他受体的结合下降(例如Ser-298Ala提高了与FcγRIII的结合,但降低了与FcγRII的结合)。对于FcγRIIIa,最佳结合IgG1变体组合了在Ser-298、Glu-333和Lys-334的丙氨酸取代。新生儿FcRn受体被认为参与抗体清除和跨越组织的胞转作用(参见Junghans(1997)Immunol.Res16:29-57和Ghetie,et al.(2000)Annu.Rev.Immunol.18:739-766)。经确定能够与人FcRn直接相互作用的人IgG1残基包括Ile253、Ser254、Lys288、Thr307、Gln311、Asn434和His435。发生在这部分描述的位点中的任何一个的取代都可以增加抗体的血清半寿期和/或改变效应性能。
其他改造包括抗体的糖基化变体。已知抗体恒定区中保守位点上的糖基化对抗体功能有深远的影响,特别是诸如上文中描述过的那些效应功能。参见例如Boyd,et al.(1996)Mol.Immunol.32:1311-1318。考虑了其中一或多个碳水化合物部分被添加、取代、缺失或修饰的抗体或其抗原结合片段的糖基化变体。引入天冬酰胺-X-丝氨酸或者天冬酰胺-X-苏氨酸基元形成了一个潜在的碳水化合物部分的酶附着部位,因此可以用于操纵抗体的糖基化。在Raju,et al.(2001)Biochemistry40:8868-8876中,利用β-1,4-半乳糖基转移酶和/或α-2,3唾液酸转移酶,经由再次半乳糖基化和/或唾液酸化的过程,提高了TNFR-IgG免疫粘附素的末端唾液酸化。提高末端唾液酸化被认为能够延长免疫球蛋白的半寿期。与多数糖蛋白一样,抗体通常是产生为糖形混合物。这种混合物在抗体是在真核,特别是哺乳动物细胞中产生时尤其明显。已经建立了多种方法来生产限定的糖形。参见Zhang,et al.(2004)Science303:371:Sears,et al.(2001)Science291:2344;Wacker,et al.(2002)Science298:1790;Davis,et al.(2002)Chem.Rev.102:579;Hang,et al.(2001)Acc.Chem.Res34:727。本文描述的抗体(例如,IgG同种型的抗体,例如IgG1)可以包含明确数量的糖形(例如,7个或以下,例如5个或以下,例如两个或一个)。
抗体可以偶联非蛋白的聚合物,例如聚乙二醇(PEG)、聚丙二醇或者聚氧化烯。蛋白与PEG的偶联是提高蛋白半寿期,以及降低蛋白的抗原性和免疫原性的成熟技术。用完整抗体以及Fab'片段考察了分子量和形式(线性或分支的)不同的PEGylation的用途。参见Koumenis et al.,(2000)Int.J.Pharmaceut.198:83-95。
生产方法
可以在转基因生物中,例如山羊(参见Pollock,et al.(1999)J.Immunol.Methods231:147-157)、鸡(参见Morrow(2000)Genet.Eng.News20:1-55)、小鼠(参见Pollock,et al.)或植物(参见Doran(2000)Curr.Opinion Biotechnol.11:199-204;Ma(1998)Nat.Med.4:601-606;Baez,et al.(2000)BioPharm13:50-54;Stoger,et al.(2000)Plant Mol.Biol.42:583-590)中生产抗原结合蛋白。
抗原结合蛋白还可以通过化学合成来产生。但抗原结合蛋白一般是利用本领域技术人员熟知的重组细胞培养技术产生的。将编码抗原结合蛋白的多核苷酸分离并插入能够复制的载体(例如质粒)以便进一步克隆(扩增)或表达。一个表达系统是谷氨酸合成酶系统(例如Lonza Biologics销售的),特别是宿主细胞是CHO或NS0。利用常规程序(例如寡核苷酸探针)容易地分离编码抗原结合蛋白的多核苷酸并进行测序。可以使用的载体包括质粒、病毒、噬菌体、转座子、微小染色体,一般是使用质粒。通常,这类载体还包含协助表达的信号序列、复制原点、一或多个标记基因、增强子元件、与抗原结合蛋白多核苷酸可操纵地连接的启动子和转录终止序列。可以将编码轻链和重链的多核苷酸插入单独的载体中,通过例如转化、转染、电穿孔或者转导同时或者顺序地导入相同的宿主细胞,或者如果需要,在所述导入前,将重链和轻链插入同一个载体中。
在宿主细胞转染密码子优化的基因比转染野生型序列时产生的蛋白总水平更高的情况下,可以采用密码子优化。已经公开了几种这类方法(Nakamura,et al.(1996)Nucleic Acids Research24:214-215;W098/34640;W097/11086)。由于遗传密码的冗余性,本文公开的那些多核苷酸的替代(特别是为了在给定宿主细胞中表达而进行了密码子优化的),也可以编码文中所述抗原结合蛋白。可以对本文的抗原结合蛋白的密码子使用进行改造,以便适应宿主细胞的密码子偏向性,从而增加转录物和/或产物产量(例如Hoekema,et al.,(1987),Mol Cell Biol7(8):2914-24)。密码子的选择可以根据与表达所用宿主细胞的合适相容性。
信号序列
抗原结合蛋白可以产生为和异源信号序列形成的融合蛋白,所述信号序列在成熟蛋白的N端有特异切割位点。信号序列应当能被宿主细胞识别和加工。对于原核宿主细胞,信号序列可以是例如碱性磷酸酶、青霉素酶或热稳定肠毒素II前导序列。对于酵母分泌,信号序列可以是例如酵母转化酶前导、α因子前导或酸性磷酸酶前导序列。参见例如WO90/13646。在哺乳动物细胞系统中,病毒分泌前导(例如单纯疱疹病毒gD信号)和天然免疫球蛋白信号序列可以是合适的。一般来说,信号序列与编码抗原结合蛋白的DNA符合读框地连接。
复制原点
复制原点是本领域公知的,其中pBR322适合多数革兰氏阴性细菌,2μ质粒用于多数酵母,各种病毒复制原点(例如SV40、多瘤表达、腺病毒、VSV或BPV)适合多数哺乳动物细胞。通常,哺乳动物表达载体不需要复制原点成分,但可以使用SV40,因为它含有早期启动子。
选择标记
典型的选择基因编码的蛋白(a)赋予对抗生素或其他毒素的抗性,例如青霉素、新霉素、氨甲蝶呤或四环素,或者(b)补偿营养缺陷或者提供复合培养基中没有的营养物,或者(c)两者的组合。选择方案可以包含遏制宿主细胞的生长。已经成功转化了编码抗原结合蛋白的基因的细胞由于共同递送的选择标记所赋予的例如药物抗性,能够存活。一个例子是DHFR选择标记,其中在有氨甲蝶呤的情况下培养转化子。细胞可以在有甲氨喋呤量逐渐增加的情况下培养,以便扩增外源目的基因的拷贝数。CHO细胞是进行DHFR选择的特别有用的细胞系。另一个例子是谷氨酸合成酶表达系统(LonzaBiologics)。用于酵母的选择基因的例子是trp1基因。参见Stinchcomb,etal.(1979)Nature282:38.
启动子
用于表达抗原结合蛋白的适宜启动子与编码抗原结合蛋白的DNA/多核苷酸可操纵地连接。用于原核宿主的启动子包括phoA启动子、β-内酰胺酶和乳糖启动子系统、碱性磷酸酶、色氨酸和杂交启动子,例如Tac。适合酵母细胞表达的启动子包括3-磷酸甘油酸激酶或其他糖酵解酶,例如烯醇酶、3磷酸甘油醛脱氢酶、己糖激酶、丙酮酸脱羧酶、磷酸果糖激酶、葡萄糖6磷酸异构酶、3-磷酸甘油酸变位酶和葡糖激酶。诱导型的酵母启动子包括乙醇脱氢酶2、异细胞色素C、酸性磷酸酶、金属硫蛋白和负责氮代谢或麦芽糖/半乳糖利用的酶。
用于在哺乳动物细胞系统中进行表达的启动子包括病毒启动子,例如多瘤、禽痘病毒和腺病毒(例如2型腺病毒)、牛乳头瘤病毒、鸟类肉瘤病毒、巨细胞病毒(特别是立即早期基因启动子)、逆转录病毒、乙肝病毒、肌动蛋白、rous肉瘤病毒(RSV)启动子,和早期或晚期猴病毒40。当然,启动子的选择要根据它们与表达所用宿主细胞有合适的相容性。第一质粒可以包含RSV和/或SV40和/或CMV启动子、编码轻链可变区(VL)的DNA、κC区,以及新霉素和氨苄青霉素抗性选择标记;第二质粒包含RSV或SV40启动子、编码重链可变区(VH)的DNA、编码γ1恒定区的DNA、DHFR和氨苄青霉素抗性标记。
增强子元件
合适情况下,例如在高等真核细胞中进行表达时,可以使用与启动子元件可操纵连接的增强子元件。哺乳动物增强子序列包括来自珠蛋白、弹性蛋白酶、清蛋白、胎儿蛋白和胰岛素的增强子元件。替代地,可以使用来自真核细胞病毒的增强子,例如SV40增强子(位于bp100-270)、巨细胞病毒早期启动子增强子、多瘤病毒增强子、杆状病毒增强子或者鼠IgG2a基因座(参见WO04/009823)。增强子可以位于载体上相对启动子上游的位点。替代地,增强子可以位于其他地方,例如位于非翻译区或者多聚腺苷酸化信号的下游。增强子的选择和定位根据它们与表达所用宿主细胞有合适的相容性。
多聚腺苷酸化/终止
在真核系统中,多聚腺苷酸化信号与编码抗原结合蛋白的DNA/多核苷酸可操纵地连接。这类信号一般位于开放读框的3’。在哺乳动物系统中,非限制性的例子包括来源于生长激素、延伸因子-1α和病毒(例如SV40)基因的信号或者逆转录病毒长末端重复。在酵母系统中,多聚腺苷酸化/终止信号的非限制性例子包括来源于磷酸甘油酸激酶(PGK)和乙醇脱氢酶1(ADH)基因的那些。原核系统中一般不需要多聚腺苷酸化信号,而是通常采用更短的更明确的终止子序列。多聚腺苷酸化/终止序列的选择要根据与表达所用宿主细胞的合适相容性。
用于提高产量的其他方法/元件
除了以上描述的,可以采用其他特征来提高产量,包括染色质重塑元件、内含子和宿主细胞特异性密码子修饰。
宿主细胞
适用于克隆或表达编码抗原结合蛋白的载体的宿主细胞是原核细胞、酵母或高等真核细胞。合适的原核细胞包括真细菌,例如肠杆菌科,例如埃希氏菌属、例如大肠杆菌(例如ATCC31,446、31,537、27,325);肠杆菌属;欧文氏菌属;克雷伯氏菌(Klebsiella Proteus);沙门氏菌属,例如鼠伤寒沙门氏菌;沙雷氏菌属,例如粘质沙雷氏菌;和志贺氏菌属;以及芽孢杆菌属,例如枯草芽孢杆菌和地衣芽孢杆菌(参见DD266710);假单胞菌属,例如铜绿假单胞菌和链霉菌。对于酵母宿主细胞,包括酿酒酵母、粟酒裂殖酵母、克鲁维酵母(例如ATCC16,045、12,424、24178、56,500)、耶氏酵母(EP402,226)、巴斯德毕赤氏酵母(EP183070,还可参见Peng,et al.(2004)J.Biotechnol.108:185-192)、假丝酵母、瑞氏木霉(EP244234)、青霉、弯颈霉属(Tolypocladium),还考虑了曲霉宿主,例如构巢曲霉和黑曲霉。
高等真核宿主细胞包括哺乳动物细胞,例如COS-1(ATCC No.CRL1650)、COS-7(ATCC CRL1651)、人胚胎肾细胞系293、幼仓鼠肾细胞(BHK)(ATCC CRL.1632)、BHK570(ATCC NO:CRL10314)、293(ATCCNO.CRL1573)、中国仓鼠卵巢细胞CHO(例如CHO-K1,ATCC NO:CCL61、DHFR-CHO细胞系,例如DG44(参见Urlaub,et al.(1986)Somatic Cell Mol.Genet.12:555-556),特别是那些适应悬浮培养的CHO细胞系,小鼠支持细胞、猴肾细胞、非洲绿猴肾细胞(ATCC CRL-1587)、HELA细胞、犬肾细胞(ATCC CCL34)、人肺细胞(ATCC CCL75)、Hep G2和黑素瘤或者淋巴瘤细胞,例如NS0(参见US5,807,715)、Sp2/0、Y0。
还可以将这样的宿主细胞进一步工程化或者适应化以便改进抗原结合蛋白的质量、功能和/或产量。非限制性例子包括特异修饰(例如糖基化)酶和蛋白折叠伴侣的表达。
细胞培养方法
转化了编码抗原结合蛋白的载体的宿主细胞可以通过本领域技术人员已知的任何方法来培养。宿主细胞可以培养中转瓶、滚瓶或者中空纤维系统中,但对于大规模生产,悬浮培养特别适用搅拌釜反应器。可以利用例如鼓泡搅拌器、隔板或者低剪切叶轮使搅拌釜适应通气。对于鼓泡塔和气升式反应器,可以使用空气或氧气泡直接通气。对宿主细胞培养在无血清培养基中的情况,给培养基补充细胞保护剂,例如Pluronic F-68来防止由于通气过程造成的细胞损伤。根据宿主细胞的特点,或者使用微载体作为锚着依赖性细胞系的生长底物,或者使细胞适应悬浮培养(典型做法)。宿主细胞,特别是无脊椎动物宿主细胞的培养,可以利用多种操作模式,例如分批补料式、重复分批培养(参见Drapeau,et al.(1994)Cytotechnology15:103-109)、延长的分批培养或灌注培养。虽然重组转化哺乳动物宿主细胞可以在含有血清的培养基,例如胎牛血清(FCS)中培养,这类宿主细胞培养在合成的无血清培养基(例如Keen,et al.(1995)Cytotechnology17:153-163中公开的),或者诸如ProCHO-CDM或UltraCHOTM(Cambrex NJ,USA)的商品培养基中,需要时补充能量来源,例如葡萄糖和合成生长因子,例如重组胰岛素。宿主细胞的无血清培养可以需要这些细胞培养在无血清的情况下生长。一个适应方法是将这样的宿主细胞培养在含有血清的培养基中,然后反复将80%的培养基换成无血清培养基,从而使得宿主细胞学会适应无血清的条件(参见例如Scharfenberg,et al.(1995)in ANIMAL CELL TECHNOLOGY:DEVELOPMENTS TOWARDS THE21ST CENTURY(Beuvery,et al.,eds,619-623,Kluwer Academic publishers)。
分泌到培养基中抗原结合蛋白可以利用多种技术来回收和纯化,以提供适合预期用途的纯度。例如,用于治疗人患者的抗原结合蛋白要求至少95%的纯度,更经常是98%或99%或者更高的纯度(与粗培养基相比)。来自培养基的细胞碎片通常利用离心,和随后的对上清液的净化步骤(例如利用微滤、超滤和/或深度过滤)来去除。多种其他技术,例如透析和凝胶电泳以及层析技术,例如羟磷灰石(HA)、亲和层析(任选包含诸如多聚组氨酸的亲和标签系统)和/或疏水相互作用层析(HIC,参见US5,429,746)可供使用。抗体经过多个澄清步骤后,可以利用蛋白A或G亲和层析来捕获。可以进一步进行层析步骤,例如离子交换和/或HA层析、阴离子或阳离子交换、大小排阻层析和硫酸铵沉淀。还可以采用各种病毒去除步骤(例如,使用DV-20滤器的纳米过滤)。这些不同步骤后,提供的是包含至少75mg/ml或以上、或者100mg/ml或以上的抗原结合蛋白的纯化(例如单克隆)制品。这样的制品基本不含凝聚形式的抗原结合蛋白。
细菌系统可以用于抗原结合片段的表达。这类片段可以定位到细胞周质以内的胞内,或者分泌到胞外。不溶的蛋白可以根据本领域技术人员已知的方法,提取并重新折叠形成活性蛋白,参见Sanchez,et al.(1999)J.Biotechnol.72:13-20和Cupit,et al.(1999)Lett Appl Microbiol29:273-277。
脱酰胺是一个去除酰胺功能团的化学反应。在生物化学中,该反应对蛋白质的降解很重要,因为它会破坏氨基酸天冬酰胺和谷氨酰胺的含酰胺侧链。脱酰胺反应被认为是会限制蛋白有效寿命的因素之一,它们还是生产治疗性蛋白过程中发生的最常见翻译后修饰之一。例如,曾有关于重组人DNAse和重组可溶性CD4体外或体内生物活性下降或丧失的报道,而其他重组蛋白似乎不受影响。本文描述的抗原结合蛋白结合HER3的能力似乎不被诱发脱酰胺的胁迫条件所影响。因此本文描述的抗原结合蛋白的生物活性和它们的有效寿命不可以受到脱酰胺的影响。
药物组合物
本文描述的抗原结合蛋白的纯化制品可以并入药物组合物以用于治疗文中描述的人类疾病、紊乱和状况。术语“疾病”、“紊乱”和“状况”在文中可以交换使用。所述药物组合物可以用于治疗HER3受体参与的或者中和HER3受体活性是有益的疾病。包含治疗有效量文中所述抗原结合蛋白的药物组合物可以用于治疗对HER3受体被中和有反应的疾病。
药物制品可以包含与药学上可接受的载体组合的抗原结合蛋白。抗原结合蛋白可以单独给予或者作为药物组合物的一部分给予。
一般来说,这类组合物包含药学实践中已知的和使用的药学上可接受的载体。参见例如REMINGTONS PHARMACEUTICAL SCIENCES,16thedition(1980)Mack Publishing Co。这类载体的例子包括无菌载体,例如盐水、林格溶液或葡萄糖溶液,任选与合适的缓冲液将pH缓冲到5到8的范围。
药物组合物可以通过注射或者连续输注(例如静脉内、腹膜内、皮内、皮下、肌肉内或者门静脉内)来给予。这样的组合物应当不含可见的颗粒物质。药物组合物可以包含1mg-10g的抗原结合蛋白,例如5mg-1g的抗原结合蛋白。替代地,组合物可以包含5mg-500mg的抗原结合蛋白,例如5mg-50mg。
制备这类药物组合物的方法是本领域技术人员熟知的。单位剂量形式的药物组合物中可以包含1mg-10g抗原结合蛋白,任选和使用说明。根据本领域技术人员熟知的或者对他们显而易见的方法,可以将药物组合物冻干(冷冻干燥)以便在给药前进行重构。抗体有IgG1同种型的情况下,可以给药物组合物加入铜的螯合剂,例如柠檬酸盐(例如柠檬酸钠)或EDTA或组氨酸以减少铜介导的该同种型抗体的降解。参见EP0612251。药物组合物可以还包含助溶剂,例如精氨酸、去污剂/抗凝聚剂(例如聚山梨醇酯80),和用惰性气体,例如氮气来代替小瓶上部空隙的氧气。
给予抗原结合蛋白的有效量和治疗方案通常是根据经验决定的,可以取决于某些因素,例如患者的年龄、体重和健康状况和待治疗的疾病或紊乱。这些因素在主治医师的权限内。选择合适剂量的指南可以在例如Smith,etal.(1977)ANTIBODIES IN人DIAGNOSIS AND THERAPY,Raven Press,New York中找到。
给予受试者的抗原结合蛋白的剂量通常在1μg/kg-150mg/kg、0.1mg/kg-100mg/kg、0.5mg/kg-50mg/kg、1-25mg/kg或者1-10mg/kg受试者体重。例如,剂量可以是10mg/kg、30mg/kg或者60mg/kg。剂量还可以是10mg/kg-110mg/mg、15mg/kg-25mg/kg或者15mg/kg-100mg/kg。抗原结合蛋白可以经例如肠胃外、皮下、静脉内或者肌肉内给予。剂量可以是这些剂量范围中的任何离散子范围。
如果需要,治疗组合物的有效每日剂量可以分为两个、三个、四个、五个、六个或者更多个亚剂量在一天内按照合适的间隔以单位剂量形式分开给予。
给剂可以通过在2-24个小时的时间段内缓慢连续输注,例如2-12小时或者2-6小时。这样的给药可以导致毒副作用减少。
根据需要可以重复给剂一或多次,例如每天三次、一天一次、两天一次、一周一次、两周一次、一月一次、每3月一次、每6月一次或者每12个月一次。抗原结合蛋白可以通过维持疗法给予,例如每周一次,共6个月或更长。抗原结合蛋白可以通过间歇疗法给予,例如给药3-6个月,然后3-6个月没有给药,然后再给予抗原结合蛋白3-6个月,如此循环。
例如,剂量可以皮下给予,每14或28天一次,给药的每天以多个子剂量的形式给予。
可以通过给药后,利用靶向抗HER3抗原结合蛋白的抗独特型抗体测量生物样品中循环的抗HER3抗原结合蛋白的量来确定或者调节剂量。可以按照能够有效下调受试者中HER3活性的量和持续时间来给予抗原结合蛋白。
可以按照将疗法靶向到特定部位的方式来给予抗原结合蛋白。例如可以将抗原结合蛋白局部注射到肌肉内,例如骨骼肌内。
抗原结合蛋白可以与一或多个其他有治疗活性的试剂组合使用,所述试剂是例如其他受体酪氨酸激酶的抗体或小分子抑制剂,例如但不限于其他HER家族成员、c-Met、IGF-1R、受体配体(血管内皮生长因子(VEGF))、细胞毒性剂(例如多柔比星)、顺铂或卡铂、细胞因子或者抗肿瘤剂。后者的例子包括,但不限于抗体或免疫调节蛋白;来自有丝分裂抑制剂、激酶抑制剂、烷化剂、抗代谢物、嵌入抗生素、生长因子抑制剂、细胞周期抑制剂、酶、拓扑异构酶抑制剂、组蛋白脱乙酰酶抑制剂的小分子抑制剂或化疗剂;抗生存剂(anti–survival agents);生物反应调节剂;抗激素(例如抗雄性激素)和抗血管新生药物。当抗肿瘤剂是放射时,可以用内部(近距离放射疗法BT)或者外部(外照射放疗:EBRT)放射源来实现治疗。本文的抗体可以通过任何类型的机制(包括化学键、疏水相互作用、静电相互作用等)与化疗剂或者放射性同位素按照本文或者WO2007/077028(其全部公开内容通过引用并入本文)的描述进行偶联。
本文的抗体可以与其他有治疗活性的试剂组合使用以治疗文中描述的疾病。这种组合可以用于治疗HER3受体参与的疾病或者中和HER3受体有益处的基本。
当抗原结合蛋白与其他有治疗活性的试剂组合使用时,个体成分可以通过任何方便的途径,一起或者分开、顺序或者同时在单独的或者组合的药物制剂中给药。如果分开或者顺序给药,抗原结合蛋白和有治疗活性的试剂可以按照任何顺序给予。
以上提及的组合可以处于单一药物制剂的形式,包含如上限定的组合,任选和药学上可接受的载体或赋形剂。这类药学上可接受的载体或赋形剂是本领域公知的,包括WO2007//077028(全部公开内容通过引用并入本文)中公开的那些。此外,文中确认的任何其他参考文献的全部公开内容均通过引入并入本文。
当组合在相同制剂中时,可以理解这些成分必须稳定并且互相之间和制剂其他成分之间都要相容,可以成剂用于给药。当分开成剂时,可以按照任何方便的机型来提供,例如,以本领域已知的抗原结合蛋白的剂型。
当与第二治疗活性剂组合抗相同疾病时,每个成分的剂量可以与单独使用抗原结合蛋白时的不同。本领域技术人员容易知道合适的剂量。
抗原结合蛋白和治疗活性剂可以协同作用。换句话说,将抗原结合蛋白和治疗活性剂组合给药对文中描述的疾病、紊乱或状况的效应大于单独每种成分的效应总和。
本文中术语“有效量”意味着能够在组织、系统、动物或人中引发例如研究人员或者临床医师寻求的生物或医学反应的药物或药剂的量。药剂可以引发一种以上的生物或医学反应。并且,术语“治疗有效量”意味着任何这样的用量,所述量与未接受该量的相应受试者相比,导致但不限于疾病、紊乱或副作用的痊愈、防止或缓解,或者疾病或紊乱的进展速度下降。该术语的范围还包括能够增强正常生理功能的量和能够在患者中引起某生理功能从而加强或者协助第二药剂的治疗效果的量。
本文中术语“癌症”、“赘生瘤(neoplasm)”和“肿瘤”可以互换使用,以单数或者复数形式是指经历了恶性转化的细胞,使它们对宿主生物有致病性。原代癌细胞(即,从靠近恶性转化的部位获得的细胞)可以通过成熟技术,特别是组织学检验与非癌变细胞容易地区分。本文中的癌细胞的定义不仅包括原代癌细胞,还有来源于癌细胞前代的任何细胞。这包括转移的癌细胞、和来源于癌细胞的体外培养和细胞系。当提到通常表明是固体瘤的癌症类型时,“可临床检测的”肿瘤是可以例如通过诸如CAT扫描、MR成像、X射线、超声或触诊的程序根据肿瘤块检测到的,和/或由于来自患者的样品中一或多个癌症特异性抗原的表达而可以检测到的。肿瘤可以是生血肿瘤,例如血细胞等的肿瘤,意味着液态瘤。基于这类肿瘤的临床状况的具体例子包括白血病,例如慢性髓细胞性白血病或急性髓细胞性白血病;骨髓瘤,例如多发性骨髓瘤;淋巴瘤等。
本文中的术语“治疗”及其语法变形意味着治疗性疗法。对于具体状况,治疗意味着(1)缓解状况的一或多个生物学表现;(2)干扰(a)导致或者参与所述状况中的生物级联中的一或多个点,或者(b)状况中的一或多个生物学表现;(3)缓解与所述状况或治疗有关的一或多个症状、效果或副作用;(4)减慢状况的进展或者状况的一或多个生物学表现;或者(5)防止状况的一或多个生物学表现的开始。还考虑了预防性疗法。技术人员可以理解“防止”不是一个绝对术语。在医学上,“防止”理解为将药物预防性地给予以便基本消除某个状况或它的生物学表现的可能性或严重性,或者延迟这种状况或其生物学表现的开始。预防性疗法是合适的,例如当受试者被认为发生癌症的风险高时,例如受试者有很强的癌症家族史或者受试者层接触过致癌剂。
在本文的方法中,抗原结合蛋白可以“共同给药”意味着文中描述的抗原结合蛋白和其他已知对癌症治疗有用的活性成分(包括化疗和放疗)的同时给药或者任何分开的顺序给药方式。本文中,术语其他活性成分包括当给予需要癌症或关节炎治疗的患者时,已知或者表现出有益性能的任何化合物或治疗剂。优选地,如果给药不是同时的,化合物是时间上很接近地给予的。此外,化合物是否以相同的剂量形式给予不重要,例如一个化合物可以表面给药,另一个化合物可以经口给予。
一般来说,任何对易感性肿瘤有活性的抗赘生瘤剂可以在本文所述的癌症治疗中共同给药。这类试剂的例子可以在Cancer Principles and Practice ofOncology by V.T.Devita and S.Hellman(editors),6th edition(February15,2001),Lippincott Williams&Wilkins Publishers中找到。本领域技术人员应当能根据药物的具体特点和涉及的癌症,识别出哪个试剂组合是有用的。本文中有用的典型抗瘤剂包括,但不限于抗微管剂,例如二萜和长春花碱;铂配合物;烷化剂,例如氮芥、氧氮磷环类、烷基磺酸酯、亚硝基脲和三氮烯;抗生素剂,例如蒽环类、放射霉素和博莱霉素;拓扑异构酶II抑制剂,例如表鬼臼毒素;抗代谢物,例如嘌呤和嘧啶类似物和抗叶酸化合物;拓扑异构酶I抑制剂,例如喜树碱;激素和技术类似物;信号转导途径抑制剂;非受体酪氨酸激酶血管生成抑制剂;免疫治疗剂;促凋亡剂和细胞周期信号转导抑制剂。
用于与本文的抗原结合蛋白组合给药或共同给药的其他活性成分(抗瘤剂)的例子是化疗剂。以下对这类化疗剂和那些与本文的抗原结合蛋白组合在组合物中的其他类别治疗剂的例子进行了描述。
抗微管剂或抗有丝分裂剂是阶段特异的试剂,其在细胞周期的M或有丝分裂期抗肿瘤细胞的微管。抗微管剂的例子包括,但不限于二萜和长春化碱类。
来自天然来源的二萜是在细胞周期中G2/M期发挥作用的抗癌剂。据信二萜通过结合微管的β微管蛋白亚基来稳定该蛋白。然后该蛋白的解体似乎受到抑制,则有丝分裂被遏制,随后细胞死亡。二萜的例子包括,但不限于紫杉醇和它的类似物多西紫杉醇.
紫杉醇(paclitaxel),5β,20-环氧-1,2α,4,7β,10β,13α-六-羟基紫杉烷-11-烯-9-酮4,10-二乙酸酯2-苯甲酸酯13[(2R,3S)-N-苯甲酰-3-苯基异丝氨酸]酯;是从太平洋紫杉Taxus brevifolia分离的天然二萜产物,以注射液TAXOLTM销售。它是萜类中紫杉烷家族的成员。其于1971年首次由Wani等(J.Am.Chem,Soc.,93:2325.1971)分离,作者们通过化学和X射线晶体法确定了它的结构。紫杉醇活性的一个机制与它能够结合微管蛋白,从而抑制癌细胞生长有关。Schiff et al.,Proc.Natl,Acad,Sci.USA,77:1561-1565(1980);Schiff etal.,Nature,277:665-667(1979);Kumar,J.Biol,Chem,256:10435-10441(1981)。关于某些紫杉醇衍生物的合成和抗癌活性的综述,参见:D.G.I.Kingston etal.,Studies in Organic Chemistry vol.26,entitled“New trends in NaturalProducts Chemistry1986”,Attaur-Rahman,P.W.Le Quesne,Eds.(Elsevier,Amsterdam,1986)pp219-235。
紫杉醇在美国已被批准用于治疗难治性卵巢癌(Markman et al.,YaleJournal of Biology and Medicine,64:583,1991;McGuire et al.,Ann.lntem,Med.,111:273,1989)和乳腺癌(Holmes et al.,J.Nat.Cancer Inst.,83:1797,1991)。它还是治疗皮肤赘生瘤(Einzig et.al.,Proc.Am.Soc.Clin.Oncol.,20:46)和头颈癌(Forastire et.al.,Sem.Oncol.,20:56,1990)的潜在候选化合物。该化合物还显示出治疗多囊性肾病(Woo et.al.,Nature,368:750.1994)、肺癌和疟疾的潜能。用紫杉醇对患者的治疗导致与阈值(50nM)以上浓度持续给剂有关的骨髓抑制(multiple cell lineages,Ignoff,R.J.et.al,CancerChemotherapy Pocket Guide,1998)(Kearns,C.M.et.al.,Seminars in Oncology,3(6)p.16-23,1995)。
多西紫杉醇(docetaxel),(2R,3S)-N-羧基-3-苯基异丝氨酸,N-叔丁基酯,13[5β-20-环氧-1,2α,4,7β,10β,13α-六羟基紫杉烷-11-烯-9-酮4-乙酸酯2-苯甲酸,三水]酯;以注射液TAXOTERETM销售。多西紫杉醇显示可以用于乳腺癌的治疗。多西紫杉醇是紫杉醇q.v.的半合成衍生物,利用从欧洲紫杉的针叶中提取的天然前体10-脱乙酰-浆果赤霉素III制备的。多西紫杉醇的剂量限制毒性是嗜中性白血球减少。
长春花碱类(vinca alkaloids)是来源于长春花植物的阶段特异性抗赘生瘤试剂。长春花碱类通过与微管蛋白的特异结合,作用于细胞周期的M期(有丝分裂)。结果,结合的微管蛋白分子不能聚合形成微管。住转移中有丝分裂被遏制,随后发生细胞死亡。长春花碱类的例子包括,但不限于长春碱、长春新碱和长春瑞滨。
长春碱(vinblastine)(硫酸长春碱(vincaleukoblastine sulfate))以注射液VELBANTM销售。虽然它可以可以作为多种实体瘤的二线疗法,它主要显示出治疗睾丸癌和各种淋巴瘤(包括霍奇金病)的可以;和淋巴细胞性和组织细胞性淋巴瘤。长春碱的剂量限制副作用是骨髓抑制。
长春新碱(22-氧-硫酸长春新碱)以注射液ONCOVINTM销售。长春新碱显示出治疗急性白血病的可能,还可用于霍奇金和非霍奇金恶性淋巴瘤的治疗方案。秃头症候神经系统效应是长春新碱的最常见副作用,还有更少的几率发生骨髓抑制和胃肠道粘膜炎。
长春瑞滨(3’,4’-二脱氢-4’-脱氧-C’-norvincaleukoblastine[R-(R*,R*)-2,3-二羟基丁二酸盐(1:2)(盐)])以酒石酸长春瑞滨的注射液(NAVELBINETM)销售,是半合成的长春花碱类。长春瑞滨显示出作为各种实体瘤,特别是非小细胞肺癌、晚期乳腺癌和激素难治性前列腺癌中的单一药剂或者与其他化疗剂(顺铂)组合。长春瑞滨的最常见剂量限制副作用是骨髓抑制。
铂配合物是与DNA有相互作用的非阶段特异性抗癌剂。铂配合物进入肿瘤细胞,发生水合作用,与DNA形成链内和链间交联,给肿瘤带来不利的生物效应。铂配合物的例子包括,但不限于顺铂和卡铂。
顺铂(顺-二氯二氨铂)以注射液PLATINOLTM销售。顺铂主要显示可以治疗转移性睾丸和卵巢癌以及膀胱癌。顺铂的主要剂量限制副作用是肾毒性和耳毒性,前者可以通过水合和利尿来控制。
卡铂(铂,二氨[1,1-环丁烷二羧酸(2-)-O,O’])以注射液PARAPLATINTM销售。卡铂主要显示在完全卵巢恶性肿瘤中的一线和二线治疗。骨髓抑制是卡铂的剂量限制毒性。
烷化剂是非阶段特异性抗癌剂和亲电试剂。一般来说,烷化剂通过烷基化与DNA经由DNA分子的亲核部分(例如磷酸、氨基、巯基、羟基、羧基和咪唑基团)形成共价键。这样的烷化破坏核酸的功能导致细胞死亡。烷化剂的例子包括,但不限于氮芥,例如环磷酰胺、美法仑和苯丁酰氮芥;烷基磺酸盐,例如白消安;亚硝基脲,例如卡氮芥;以及三氮烯,例如达卡巴嗪。
环磷酰胺(2-[双(2-氯乙基)氨基]-四氢-2H-1,3,2-氧氮磷杂环己烷-2-氧化物一水合物)以注射液或片剂CYTOXANTM销售。环磷酰胺显示能够作为治疗恶性淋巴瘤、多发性骨髓瘤和白血病的单一试剂或者与其他化疗剂组合。脱发、恶心、呕吐和白血病减少是环磷酰胺的最常见剂量限制副作用。
美法仑(4-[双(2-氯乙基)氨基]-L-苯丙氨酸盐酸)以注射液或片剂ALKERANTM销售。美法仑显示可以缓解治疗多发性骨髓瘤和非可切除的卵巢上皮癌。骨髓抑制是美法仑最常见的剂量限制副作用。
苯丁酸氮芥(4-[双(2-氯乙基)氨基]苯丁酸)以LEUKERANTM片剂销售。苯丁酸氮芥限制可以用于缓解治疗慢性淋巴性白血病和恶性淋巴瘤,例如淋巴肉瘤、巨滤泡性淋巴瘤和霍奇金病。骨髓抑制是最常见的剂量限制副作用。
白消安(1,4-丁二醇二甲基磺酰酯)以MYLERANTM片剂销售。白消安显示可以用于慢性骨髓性白血病的缓解治疗。骨髓抑制是白消安最常见的剂量限制副作用。
卡氮芥(1,3-双(2-氯乙基)-1-亚硝基脲)以冻干物质的单个小管BiCNUTM销售。卡氮芥显示可以作为脑瘤、多发性骨髓瘤、霍奇金病和非霍奇金淋巴瘤的缓解治疗中的单一试剂或者与其他试剂组合。卡氮芥最常见的剂量限制副作用是延迟的骨髓抑制。
达卡巴嗪(5-(3,3-二甲基-1-三氮烯)-咪唑-4-羧酰胺)以物质的单个小管DTIC-DomeTM销售。达卡巴嗪显示可以用于治疗转移性恶性黑素瘤,以及与其他试剂组合用于霍奇金病的二线治疗。恶心、呕吐和厌食是达卡巴嗪最常见的剂量限制性副作用。
抗肿瘤抗生素是能够结合或嵌入DNA的非阶段特异性试剂。一般来说,这种作用产生稳定的DNA复合体或者链断裂,破坏核酸的正常功能,导致细胞死亡。抗肿瘤抗生素的例子包括,但不限于放线菌素,例如更生霉素(dactinomycin);蒽环类抗生素,例如柔红比星(daunorubicin)和多柔比星(doxorubicin);以及博莱霉素。
更生霉素(又被称为放线菌素D)以可注射形式COSMEGENTM销售。更生霉素显示可用于治疗Wilm’s肿瘤和横纹肌肉瘤.恶心、呕吐和厌食是更生霉素最常见的剂量限制性副作用。
柔红比星((8S-顺式-)-8-乙酰-10-[(3-氨基-2,3,6-三脱氧-α-L-来苏己吡喃基)氧]-7,8,9,10-四氢-6,8,11-三羟基-1-甲氧基-5,12并四苯二酮盐酸盐)以注射形式DAUNOXOMETM或者注射形式CERUBIDINETM销售。柔红比星显示可用于诱导缓解治疗急性非淋巴细胞性白血病和晚期HIV相关卡波西氏肉瘤。骨髓抑制是柔红比星最常见的剂量限制性副作用。
多柔比星((8S,10S)-10-[(3-氨基-2,3,6-三脱氧-α-L-来苏己吡喃基)氧]-8-乙醇酰,7,8,9,10-四氢-6,8,11-三羟基-1-甲氧基-5,12并四苯二酮盐酸盐)以可注射形式RUBEXTM或ADRIAMYCIN RDFTM销售。多柔比星显示主要用于治疗急性淋巴母细胞性白血病和急性髓母细胞性白血病,但也可以作为治疗某些实体瘤和淋巴瘤的成分。多柔比星的最常见剂量限制副作用是骨髓抑制。
博莱霉素是从轮丝链霉菌菌株分离的细胞毒性糖蛋白抗生素混合物,以BLENOXANETM销售。博莱霉素显示可以作为单一试剂或者与其他试剂组合用于鳞状细胞癌、淋巴瘤和睾丸癌的缓和治疗。肺和皮肤毒性是博莱霉素最常见的剂量限制副作用。
拓扑异构酶II抑制剂包括,但不限于表鬼臼毒素.
表鬼臼毒素(epipodophyllotoxin)是来源于毒参茄(mandrake)的阶段特异性的抗肿瘤剂。表鬼臼毒素一般通过与拓扑异构酶II和DNA形成三级复合体,导致DNA链断裂影响细胞周期中S和G2期的细胞。链断裂累积,随后引起细胞死亡。表鬼臼毒素的例子包括,但不限于依托泊苷和替尼泊苷。
依托泊苷(4’-去甲基-表鬼臼毒素9[4,6-0-(R)-乙叉双香豆素-β-D-吡喃葡萄糖苷])以注射液或胶囊VePESIDTM销售,常被称为VP-16。依托泊苷显示可以作为单一试剂或者与其他化疗剂组合用于治疗睾丸癌和非小细胞肺癌。骨髓抑制是最常见的依托泊苷的副作用。白细胞减少的发生一般比血小板减少严重。
替尼泊苷(4’-去甲基-表鬼臼毒素9[4,6-0-(R)-噻吩亚甲基-β-D-吡喃葡萄糖苷])以注射液VUMONTM销售,常被称为VM-26。替尼泊苷显示可以作为单一试剂或者与其他化疗剂组合用于治疗儿童的急性白血病。骨髓抑制是替尼泊苷最常见的剂量限制副作用。替尼泊苷可以诱发白细胞减少和血小板减少。
抗代谢型肿瘤剂(Antimetabolite neoplastic agents)是阶段特异性的抗肿瘤剂,通过抑制DNA合成或者通过抑制嘌呤或嘧啶碱基的合成从而限制DNA合成作用于细胞周期的S期(DNA合成)。因此,S期不能进展,造成细胞死亡。抗代谢型肿瘤剂的例子包括,但不限于氟尿嘧啶、氨甲蝶呤、阿糖胞苷、巯基嘌呤、硫脲嘌呤和吉西他滨。
5-氟尿嘧啶(5-氟-2,4-(1H,3H)嘧啶二酮)以氟尿嘧啶销售。给予5-氟尿嘧啶导致胸苷酸合成的抑制,并且会并入RNA和DNA。结果一般是细胞死亡。5-氟尿嘧啶显示可以作为单一试剂或者与其他化疗剂组合用于治疗乳腺癌、结肠癌、直肠癌、胃癌和胰腺癌。骨髓抑制和粘膜炎是5-氟尿嘧啶的剂量限制副作用。其他氟嘧啶类似物包括5-氟脱氧尿嘧啶(氟尿苷)和5-氟脱氧尿嘧啶单磷酸盐。
阿糖胞苷(4-氨基-1-β-D-阿拉伯呋喃糖-2(1H)-嘧啶酮)以CYTOSAR-UTM销售,常被称为Ara-C。据信,阿糖胞苷通过给正在延长的DNA链引入末端阿糖胞苷,从而抑制DNA链延伸而显示出S期细胞周期特异性。阿糖胞苷显示可以作为单一试剂或者与其他化疗剂组合用于治疗急性白血病。其他胞苷类似物包括5-氮胞苷和2’,2’-二氟脱氧胞嘧啶(吉西他滨)。阿糖胞苷会诱发白细胞减少,血小板减少和粘膜炎。
巯基嘌呤(1,7-二氢-6H-嘌呤-6-巯基一水合物)以PURINETHOLTM销售。巯基嘌呤通过一种尚未确定的机制抑制DNA合成,从而表现出在S期的细胞时期特异性。巯基嘌呤显示可以作为单一试剂或者与其他化疗剂组合用于治疗急性白血病。骨髓抑制和胃肠道粘膜炎是高剂量巯基嘌呤的预期副作用。有用的巯基嘌呤类似物是硫唑嘌呤。
硫脲嘌呤(2-氨基-1,7-二氢-6H-嘌呤-6-硫酮)以TABLOIDTM销售。硫脲嘌呤通过一种尚未确定的机制抑制DNA合成,从而表现出在S期的细胞时期特异性。硫脲嘌呤显示可以作为单一试剂或者与其他化疗剂组合用于治疗急性白血病。骨髓抑制,包括白细胞减少、血小板减少和贫血,是最常见的硫脲嘌呤给药的剂量限制副作用。但也有胃肠道副作用发生,可以会限制剂量。其他嘌呤类似物包括喷司他丁(pentostatin)、赤羟壬基腺嘌呤(erythrohydroxynonyladenine)、磷酸氟达拉滨(fludarabine phosphate)和克拉屈滨(cladribine)。
吉西他滨(2’-脱氧-2’,2’-二氟胞嘧啶盐酸盐(β-异构体))以GEMZARTM销售。吉西他滨通过阻断细胞跨越G1/S界线进展而表现出S期的细胞时期特异性。吉西他滨表现出可以与顺铂组合治疗局部晚期非小细胞肺癌,和单独治疗局部晚期胰腺癌。骨髓移植,包括白细胞减少、血小板减少和贫血,是吉西他滨给药最常见的剂量限值副作用。
氨甲喋呤(N-[4[[(2,4-二氨基-6-蝶啶)甲基]甲氨基]苯甲酰基)-L-谷氨酸)以氨甲喋呤钠销售。氨甲蝶呤通过抑制嘌呤核苷酸和胸苷酸合成所需要的二氢叶酸还原酶,抑制DNA的合成、修复和/或复制,从而表现出S期的细胞时期特异性。氨甲蝶呤显示出可以作为单一试剂或者与其他化疗剂组合用于治疗绒毛膜癌、脑膜白血病、非霍奇金淋巴瘤以及乳腺癌、头颈癌、卵巢癌和膀胱癌。骨髓抑制(白细胞减少、血小板减少和贫血)和粘膜炎是氨甲蝶呤给药的预期副作用。
喜树碱类,包括喜树碱和喜树碱衍生物是作为拓扑异构酶I抑制剂销售或开发的。喜树碱类细胞毒性被认为与拓扑异构酶I抑制活性有关。喜树碱类的例子包括,但不限于依立替康(irinotecan)、拓扑替康(topotecan)和以下描述的7-(4-甲基哌嗪-亚甲基)-10,11-亚乙二氧-20-喜树碱的各种光学形式。
依立替康HCl((4S)-4,11-二乙基-4-羟基-9-[(4-哌啶基哌啶piperidinopiperidino)羰氧]-1H-吡喃并[3’,4’,6,7]中氮茚并[1,2-b]喹啉-3,14(4H,12H)-二酮盐酸)以注射液CAMPTOSARTM销售。
依立替康是喜树碱的衍生物,它和它的活性代谢物SN-38一起结合拓扑异构酶I–DNA复合体。据信细胞毒性是由于拓扑异构酶I:DNA:irintecan或者SN-38三重复合体与复制酶之间的相互作用造成的不可修复的双链断裂。依立替康显示出可以用于治疗结肠或直肠的转移性癌症。盐酸依立替康的剂量限制副作用是骨髓抑制,包括嗜中性白血球减少和GI效应,包括腹泻。
拓扑替康HCl((S)-10-[(二甲基氨基)甲基]-4-乙基-4,9-二羟基-1H-吡喃并[3’,4’,6,7]中氮茚并[1,2-b]喹啉-3,14-(4H,12H)-二酮单盐酸盐)以注射液HYCAMTINTM销售。拓扑替康是喜树碱的衍生物,它结合拓扑异构酶I–DNA复合体并阻止拓扑异构酶I在应答DNA分子的扭转应变时造成的单链断裂的重新连接。拓扑替康显示出可以用于卵巢的转移性癌和小细胞肺癌的二线治疗。盐酸拓扑替康的剂量限制副作用是骨髓抑制,主要是嗜中性白血球减少。
同样很有趣的是目前正在开发的以下分子式A的喜树碱衍生物,包括外消旋混合物(R,S)形式和R和S对映体:
化学名称是“7-(4-甲基哌嗪-亚甲基)-10,11-亚乙二氧基-20(R,S)-喜树碱(外消旋混合物)或者“7-(4-甲基哌嗪-亚甲基)-10,11-亚乙二氧基-20(R)-喜树碱(R对映体)或者“7-(4-甲基哌嗪-亚甲基)-10,11-亚乙二氧基-20(S)-喜树碱(S对映体)。美国专利6,063,923、5,342,947、5,559,235、5,491,237和1997年11月24日提交的待审的美国专利申请08/977,217中描述了这类化合物和相关化合物以及制备方法。
激素和激素类似物是治疗癌症的有用化合物,其中激素和癌症的生长和/或不生长有关。可用于癌症治疗的激素和激素类似物的例子包括,但不限于肾上腺皮质类固醇类,例如强的松和泼尼松龙,可用于儿童治疗恶性淋巴瘤和急性白血病;氨苯哌啶酮和其他芳香化酶抑制剂,例如阿那曲唑(anastrozole)、来曲唑(letrazole)、伏氯唑(vorazole)和依西美坦(exemestane),可用于治疗肾上腺皮质癌和含有雌激素受体的激素依赖性乳腺癌;孕酮,例如醋酸甲地孕酮,可用于治疗激素依赖性乳腺癌和子宫内膜癌;雌激素、雄激素和抗雄激素,例如氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、醋酸环丙氯地孕酮(cyproterone acetate)和5α-还原酶,例如非那雄胺(finasteride)和度他雄胺(dutasteride),可用于治疗前列腺癌和良性前列腺增生;抗雌激素,例如它莫西芬、托瑞米芬(toremifene)、雷洛昔芬(raloxifene)、屈洛昔芬(droloxifene)、iodoxyfene,以及象美国专利5,681,835,5,877,219和6,207,716中描述的那些选择性雌激素受体调节剂(SERMS),可用于治疗激素依赖性乳腺癌和其他易感性癌症;以及促性腺激素释放激素(GnRH)及其类似物,它们刺激促黄体生成素(LH)和/或促卵泡生成素(FSH)的释放,可用于治疗前列腺癌,例如LHRH激动剂和拮抗剂,例如醋酸戈舍瑞林(goserelin acetate)和亮丙瑞林(luprolide)。
信号转导途径抑制剂是那些阻断或者抑制引起细胞内发生变化的化学过程的抑制剂。本文中,这类变化是细胞增殖或分化。可用于本发明的信号转导抑制剂包括受体酪氨酸激酶、非受体酪氨酸激酶、SH2/SH3阻断剂、丝氨酸/苏氨酸激酶、磷脂酰肌醇-3激酶、肌醇信号转导和Ras癌基因的抑制剂。
几种蛋白酪氨酸激酶能够催化参与调节细胞生长的不同蛋白中的特定酪氨酸残基的磷酸化。这类蛋白酪氨酸激酶可以泛泛地分为受体或非受体型激酶。
受体酪氨酸激酶是跨膜蛋白,含有胞外配体结合结构域、跨膜结构域和酪氨酸激酶结构域。受体酪氨酸激酶参与细胞生长的调节,通常被命名为生长因子受体。许多这些激酶的不恰当或者失控活化(即由于过表达或者突变造成的异常的激酶生长因子受体活性)已被证明会导致细胞生长失控。相应地,发现这类激酶的异常活性与恶性组织生长有关。因此这些激酶的抑制剂可以提供癌症的治疗方法。生长因子受体包括,例如表皮生长因子受体(EGFr)、血小板来源的生长因子受体(PDGFr)、erbB2、erbB4、血管内皮生长因子受体(VEGFr)、含有免疫球蛋白样和表皮生长因子同源结构域(TIE-2)的酪氨酸激酶、胰岛素生长因子–I(IGFI)受体、巨噬细胞集落刺激因子(cfms)、BTK、ckit、cmet、成纤维细胞生长因子(FGF)受体、Trk受体(TrkA、TrkB和TrkC)、ephrin(eph)受体和RET原癌基因。几种生长受体抑制剂正在开发中,包括配体拮抗剂、抗体、酪氨酸激酶抑制剂和反义寡核苷酸。生长因子受体和抑制生长因子受体的功能的试剂在例如Kath,John C.,Exp.Opin.Ther.Patents(2000)10(6):803-818;Shawver et al DDT Vol2,No.2February1997和Lofts,F.J.et al,“Growth factor receptors as targets”,New MolecularTargets for Cancer Chemotherapy,ed.Workman,Paul and Kerr,David,CRCpress1994,London中有描述。
酪氨酸激酶(不是生长因子受体激酶)被命名为非受体型酪氨酸激酶。用于本发明的可以作为抗癌药物的目标物或者潜在目标物的非受体型酪氨酸激酶包括cSrc、Lck、Fyn、Yes、Jak、cAbl、FAK(粘着斑激酶)、Brutons酪氨酸激酶和Bcr-Abl。这类非受体型激酶和抑制非受体型酪氨酸激酶功能的试剂在Sinh,S.and Corey,S.J.,(1999)Journal of Hematotherapy and Stem CellResearch8(5):465–80和Bolen,J.B.,Brugge,J.S.,(1997)Annual review ofImmunology.15:371-404中有讨论。
SH2/SH3结构域阻断物是破坏多种酶或适体蛋白中SH2或SH3结构域结合的阻断剂,包括PI3-K p85亚基、Src家族激酶、适体分子(Shc、Crk、Nck、Grb2)和Ras-GAP。Smithgall,T.E.(1995),Journal of Pharmacological andToxicological Methods.34(3)125-32中讨论了SH2/SH3结构域作为抗癌药物的目标物。
丝氨酸/苏氨酸激酶抑制剂包括:MAP激酶级联阻断剂,包括Raf激酶(rafk)、有丝分裂原或细胞外调节蛋白激酶(MEKs)和细胞外调节蛋白激酶(ERKs)的阻断剂;以及蛋白激酶C家族成员阻断剂,包括PKCs(α、β、γ、ε、μ、λ、ι、δ)、IkB激酶家族(IKKa,IKKb)、PKB家族激酶、akt激酶家族成员和TGFβ受体激酶的阻断剂。这类丝氨酸/苏氨酸激酶及其抑制剂在Yamamoto,T.,Taya,S.,Kaibuchi,K.,(1999),Journal of Biochemistry.126(5)799-803;Brodt,P,Samani,A.,and Navab,R.(2000),BiochemicalPharmacology,60.1101-1107;Massague,J.,Weis-Garcia,F.(1996)CancerSurveys.27:41-64;Philip,P.A.,and Harris,A.L.(1995),Cancer Treatment andResearch.78:3-27;Lackey,K.et al Bioorganic and Medicinal ChemistryLetters,(10),2000,223-226;美国专利6,268,391和Martinez-Iacaci,L.,et al,Int.J.Cancer(2000),88(1),44-52中有描述。
磷脂酰肌醇-3激酶家族成员抑制剂,包括PI3激酶、ATM、DNA-PK和Ku的阻断剂,可以用于本发明。这类激酶在Abraham,R.T.(1996),CurrentOpinion in Immunology.8(3)412-8;Canman,C.E.,Lim,D.S.(1998),Oncogene17(25)3301-3308;Jackson,S.P.(1997),International Journal of Biochemistry andCell Biology.29(7):935-8和Zhong,H.et al,Cancer res,(2000)60(6),1541-1545中讨论过。
本文中同样感兴趣的是肌醇信号转导抑制剂,例如磷脂C阻断剂和肌醇类似物。这些信号抑制剂在Powis,G.,and Kozikowski A.,(1994)NewMolecular Targets for Cancer Chemotherapy ed.,Paul Workman and David Kerr,CRC press1994,London中有描述。
另一组信号转导途径抑制剂是Ras癌基因抑制剂。这类抑制剂包括法尼基转移酶(farnesyltransferase)、牛儿基牛儿醇转移酶(geranyl-geranyltransferase)和CAAX蛋白酶的抑制剂,以及反义寡核苷酸、核酶和免疫疗法。这类抑制剂显示出能够阻断含有野生型突变体ras的细胞中的ras活化,因此可以作为抗增殖剂。Scharovsky,O.G.,Rozados,V.R.,Gervasoni,S.I.Matar,P.(2000),Journal of Biomedical Science.7(4)292-8;Ashby,M.N.(1998),CurrentOpinion in Lipidology.9(2)99–102和BioChim.Biophys.Acta,(19899)1423(3):19-30中讨论过Ras癌基因抑制。
受体激酶配体结合的抗体拮抗剂也可以作为信号转导抑制剂。这组信号转导途径抑制剂包括使用受体酪氨酸激酶的胞外配体结合结构域的人源化抗体。例如Imclone C225EGFR特异性抗体(参见Green,M.C.et al,Monoclonal Antibody Therapy for Solid Tumors,Cancer Treat.Rev.,(2000),26(4),269-286);赫赛汀TMerbB2抗体(参见Tyrosine Kinase Signalling inBreast cancer:erbB Family Receptor Tyrosine Kniases,Breast cancer Res.,2000,2(3),176-183)和2CB VEGFR2特异性抗体(参见Brekken,R.A.et al,SelectiveInhibition of VEGFR2Activity by a monoclonal Anti-VEGF antibody blockstumor growth in mice,Cancer Res.(2000)60,5117-5124)。
非受体型激酶血管生成抑制剂也可以用于本发明。血管生成相关VEGFR和TIE2的抑制剂在以上关于信号转导抑制讨论过(两个受体都是受体型酪氨酸激酶)。血管生成与erbB2/EGFR信号转导有关,因为erbB2和EGFR的抑制剂显示能够抑制血管生成,主要是VEGF表达。相应地,非受体型酪氨酸激酶抑制剂可以与本文的化合物联用。例如,抗VEGF抗体不能识别VEGFR(受体型酪氨酸激酶),但能结合配体;能够抑制血管生成的整合蛋白(alphav beta3)的小分子抑制剂;内皮抑素和血管抑素(非RTK)可以也会被证明能与公开的化合物联用(参见Bruns CJ et al(2000),Cancer Res.,60:2926-2935;Schreiber AB,Winkler ME,and Derynck R.(1986),Science,232:1250-1253;Yen L et al.(2000),Oncogene19:3460-3469)。
免疫治疗方案中使用的试剂可以也可以与本文的抗原结合蛋白组合。有多种免疫学策略可以产生免疫反应。这些策略通常属于肿瘤疫苗接种的范畴。利用小分子抑制剂,通过组合抑制信号转导途径可以极大地提高免疫学方法的效率。Reilly RT et al.(2000),Cancer Res.60:3569-3576和Chen Y,Hu D,Eling DJ,Robbins J,and Kipps TJ.(1998),Cancer Res.58:1965-1971中有关于抗erbB2/EGFR的免疫学/肿瘤疫苗手段的讨论。
促细胞凋亡方案中使用的试剂(例如bcl-2反义寡核苷酸)可以也可以用于本发明的组合中。Bcl-2蛋白家族的成员可以阻断细胞凋亡。因此bcl-2的上调与化学抗性有关联。研究显示表皮生长因子(EGF)刺激bcl-2家族的抗细胞凋亡成员(即mcl-1)。因此,设计用于下调肿瘤中bcl-2的表达的策略显示出临床上的益处,目前处于第II/III期临床试验,也就是Genta's G3139bcl-2反义寡核苷酸。这类使用bcl-2的反义寡核苷酸的促细胞凋亡策略在Water JSet al.(2000),J.Clin.Oncol.18:1812-1823和Kitada S et al.(1994),Antisense Res.Dev.4:71-79中讨论过。
细胞周期信号转导抑制剂抑制参与细胞周期调控的分子。一个被称为周期蛋白依赖性激酶(CDKs)的蛋白激酶家族以及它们与被称为周期蛋白的蛋白家族的相互作用调控着真核细胞的细胞周期的进展。不同周期蛋白/CDK复合体的协调活化和灭活是正常细胞周期进展所需要的。目前正在开发多种细胞周期信号转导抑制剂。例如,在Rosania et al,Exp.Opin.Ther.Patents(2000)10(2):215-230中描述了包括CDK2、CDK4和CDK6的周期蛋白依赖性激酶以及它们的抑制剂。此外,p21WAF1/CIP1被描述为周期蛋白依赖性激酶(Cdks)的强力和通用抑制剂(Ball et al.,Progress in Cell Cycle Res.,3:125(1997))。那些已知能够诱导p21WAF1/CIP1的表达的化合物显示参与细胞增殖的抑制,因此具有肿瘤抑制活性(Richon et al.,Proc.Nat Acad.Sci.U.S.A.97(18):10014-10019(2000)),被包括在细胞周期信号转导抑制剂中。组蛋白去乙酰化酶(HDAC)抑制剂显示参与p21WAF1/CIP1的转录活化(Vigushin et al.,Anticancer Drugs,13(1):1-13(Jan2002)),是适合本文使用的细胞周期信号转导抑制剂。
这类HDAC抑制剂的例子包括:
1.
伏立诺他(Vorinostat),包括其药学上可接受的盐。Marks et al.,NatureBiotechnology25,84to90(2007);Stenger,Community Oncology4,384-386(2007).
伏立诺他具有以下化学结构和名称:
2.罗米地辛(Romidepsin),包括其药学上可接受的盐。Vinodhkumar等,Biomedicine&Pharmacotherapy62(2008)85-93。
罗米地辛具有以下化学结构和名称:
氧杂-12,13-二硫杂-5,8,20,23-四氮杂双环[8.7.6]诱虫-16-烯-3,6,9,19,22-戊酮。
3.帕比司他(Panobinostat),包括其药学上可接受的盐。Drugs of theFuture32(4):315-322(2O07).
帕比司他具有以下化学结构和名称:
-(2E)-N-羟基-3-[4-({[2-(2-甲基-1H-吲哚-3-基)乙基]氨基}甲基)苯基]丙烯酰胺。
4.丙戊酸,包括其药学上可接受的盐。Gottlicher,等,EMBOJ.20(24):6969-6978(2001).
丙戊酸具有以下化学结构和名称:
2-丙戊酸。
5.Mocetinostat(MGCD0103),包括其药学上可接受的盐。Balasubramanian等,Cancer Letters280:211-221(2009).
Mocetinostat具有以下化学结构和名称
N-(2-氨基苯)-4-[[(4-吡啶-3-基嘧啶-2-基)氨基]甲基]苯甲酰胺。
Bertrand European Journal of Medicinal Chemistry45,(2010)2095-2116中包括了这类HDAC抑制剂的其他例子,特别是以下引用的表3中的化合物。
本文的癌症治疗方法还包括将本文所述抗原结合蛋白和/或其药学上可接受的盐、水合物、溶剂或前药和至少一种抗肿瘤剂共同给药,其中所述抗肿瘤剂是例如选自抗微管剂、铂配合物、烷化剂、抗生素试剂、拓扑异构酶II抑制剂、抗代谢物、拓扑异构酶I抑制剂、激素和激素类似物、信号转导途径抑制剂、非受体型酪氨酸激酶血管生成抑制剂、免疫治疗剂、促细胞凋亡剂和细胞周期信号转导抑制剂。本文的抗原结合蛋白可以与MEK抑制剂组合使用,例如例如N-{3-[3-环丙基-5-(2-氟-4-碘-苯胺)-6,8-二甲基-2,4,7-三氧-3,4,6,7-四氢-2H-吡啶并[4,3-d]嘧啶-1-基]苯基}乙酰胺或者它的药学上可接受的盐或溶剂(包括二甲基亚砜溶剂),该MEK抑制剂在国际申请日2005年6月10日的国际申请PCT/JP2005/011082中公开并要求保护,其国际公开号为WO2005/121142,国际公开日为2005年12月22日,该申请通过引用并入。N-{3-[3-环丙基-5-(2-氟-4-碘-苯胺)-6,8-二甲基-2,4,7-三氧-3,4,6,7-四氢-2H-吡啶并[4,3-d]嘧啶-1-基]苯基}乙酰胺可以按照2006年1月19日公开的美国专利公开US2006/0014768中的描述进行制备,该申请的全部公开内容通过引用并入本文。本文的抗原结合蛋白可以与B-Raf抑制剂组合使用,例如N-{3-[5-(2-氨基-4-嘧啶基)-2-(1,1-二甲基乙基)-1,3-噻唑-4-基]-2-氟苯基}-2,6-二氟苯磺酰胺或者它的药学上可接受的盐,所述B-Raf抑制剂在国际申请日2009年5月4日的国际申请PCT/US2009/042682中公开并请求保护,该申请的全部公开内容通过引入并入本文。N-{3-[5-(2-氨基-4-嘧啶基)-2-(1,1-二甲基乙基)-1,3-噻唑-4-基]-2-氟苯基}-2,6-二氟苯磺酰胺可以按照国际申请PCT/US2009/042682中的描述制备。本文的抗原结合蛋白可以与Akt抑制剂组合使用,例如例如N-{(1S)-2-氨基-1-[(3-氟苯基)甲基]乙基}-5-氯-4-(4-氯-1-甲基-1H-吡唑-5-基)-2-噻吩甲酰胺或者它的药学上可接受的盐,所述抑制剂在国际申请日2008年2月7日的国际申请PCT/US2008/053269中公开并请求保护,该申请国际公开日为2008年8月14日,国际公开号为WO2008/098104,该申请的全部公开内容通过引用并入本文。N-{(1S)-2-氨基-1-[(3-氟苯基)甲基]乙基}-5-氯-4-(4-氯-1-甲基-1H-吡唑-5-基)-2-噻吩甲酰胺是实施例96中的化合物,可以按照国际申请PCT/US2008/053269中的描述制备。N-{(1S)-2-氨基-1-[(3-氟苯基)甲基]乙基}-5-氯-4-(4-氯-1-甲基-1H-吡唑-5-基)-2-噻吩甲酰胺处于盐酸盐的形式。该盐形式可以由本领域技术人员根据国际申请PCT/US2010/022323(国际申请日为2010年1月28日)中的描述来制备。
帕唑帕尼(Pazopanib)是另一种可以与本文的抗原结合蛋白共同给药的组合物。以VOTRIENTTM销售的帕唑帕尼是酪氨酸激酶抑制剂(TKI)。帕唑帕尼以盐酸盐存在,其化学名称为5-[[4-[(2,3-二甲基-2H-吲唑-6-基)甲氨基]-2-嘧啶基]氨基]-2-甲基苯磺酰胺盐酸盐。帕唑帕尼已被批准用于晚期肾细胞癌患者的治疗。
利妥昔单抗是另一种可以与本文的抗原结合蛋白共同给药的组合物。利妥昔单抗是以RITUXANTM和MABTHERATM销售的嵌合单克隆抗体。利妥昔单抗结合B细胞上的CD20,导致细胞凋亡。利妥昔单抗经静脉内给药,已被批准用于治疗类风湿性关节炎和B细胞非霍奇金淋巴瘤。
Ofatumumab是另一种可以与本文的抗原结合蛋白共同给药的组合物。Ofatumumab是以ARZERRATM销售的完全人单克隆抗体。Ofatumumab与B细胞上的CD20结合,用于治疗氟达拉滨(Fludara)和阿仑单抗(alemtuzumab)(Campath)难以治疗的成年人慢性淋巴细胞白血病(CLL,一种白细胞的癌症)。
mTOR抑制剂可以与本文的抗原结合蛋白共同给药。mTOR抑制剂包括,但不限于雷帕霉素(rapamycin)和雷帕霉素类似物、RAD001或依维莫司(everolimus)(Afinitor)、CCI-779或西罗莫司(temsirolimus)、AP23573、AZD8055、WYE-354、WYE-600、WYE-687和Pp121。
蓓萨罗丁(Bexarotene)是另一种可以与本文的抗原结合蛋白共同给药的组合物。蓓萨罗丁以TargretinTM销售,是类视黄素的亚类中的成员,能够选择性地激活类视黄素X受体(RXRs)。这些类视黄素受体具有与视黄酸受体(RARs)不同的生物活性。其化学名称为4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘)次乙基]苯甲酸。蓓萨罗丁被用于给那些用至少一种其他药物不能成功治疗的患者治疗皮肤T细胞淋巴瘤(CTCL,一种皮肤癌)。
索拉非尼(Sorafenib)是另一种可以与本文的抗原结合蛋白共同给药的组合物。索拉非尼的商品名为NexavarTM,属于多激酶抑制剂这类药物。它的化学名称为4-[4-[[4-氯-3-(三氟甲基)苯基]氨甲酰氨基]苯氧基]-N-甲基-吡啶-2-氨甲酰。索拉非尼被用于治疗晚期肾细胞癌(一种从肾脏开始的癌症)。索拉非尼还被用于治疗不能手术切除的肝细胞癌(一种不能通过手术治疗的肝癌)。
本文提供了治疗癌症的方法。本文所述方法治疗的癌症可以选自:脑(神经胶质瘤)、胶质母细胞瘤、班佐综合征、考登病、Lhermitte-Duclos病、乳腺癌、炎性乳腺癌、维尔姆斯瘤、尤文氏肉瘤、横纹肌肉瘤、室管膜瘤|、髓母细胞瘤、结肠、头颈、肾、肺、肝、黑素瘤、卵巢、胰腺、前列腺、肉瘤、骨肉瘤、巨细胞瘤、甲状腺、淋巴母细胞T细胞白血病、慢性髓原白血病、慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴母细胞白血病、急性髓原白血病、慢性中性粒细胞性白血病、急性淋巴母细胞T细胞白血病、浆细胞瘤、免疫母细胞性大细胞白血病、套细胞白血病、多发性骨髓瘤成巨核细胞性白血病、多发性骨髓瘤、急性成巨核细胞性白血病、原髓细胞白血病、红白血病、恶性淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、淋巴母细胞性T细胞淋巴瘤、伯奇氏淋巴瘤、滤泡性淋巴瘤、神经母细胞瘤、膀胱癌、尿路上皮癌、肺癌、外阴癌、宫颈癌、子宫内膜癌、肾癌、间皮瘤、食道癌、唾液腺癌、肝细胞癌、胃癌、鼻咽癌、口腔癌、口部癌症、GIST(肠胃道基质细胞瘤)和睾丸癌。
本文的方法中的癌前状况可以是宫颈上皮内瘤样病变、意义不明的单克隆免疫球蛋白病(MGUS)、骨髓增生异常综合征、再生障碍性贫血、宫颈病变、皮痣(黑素瘤前)、前列腺上皮内(导管内)瘤变(PIN)、原位导管内癌(DCIS)、结肠息肉和严重的肝炎或者肝硬化。
药物组合物可以包含抗原结合蛋白与其他药物,任选使用说明组成的试剂盒。为了方便,试剂盒可以包含预先确定量的试剂和使用说明。
术语“个体”、“受试者”和“患者”在文中可以互换使用。受试者通常是人。受试者还可以是哺乳动物,例如小鼠、大鼠或者灵长类动物(例如绢毛猴或猴)。受试者可以是非人动物。抗原结合蛋白还有兽医用途。接受治疗的受试者可以是农场动物,例如牛奶或者公牛、绵羊、猪、牛、山羊或马,或者可以是家畜,例如狗或猫。动物可以是任何年龄或者是成熟的成年动物。当受试者是实验室动物(例如小鼠、大鼠或者灵长类动物)时,可以将动物处理从而诱发与乳腺、卵巢、前列腺或膀胱癌症有关的疾病或状况。
处置可以是治疗性、预防性(prophylactic或preventative)的。受试者应当是需要所述处置的。需要处置的受试者除了未来可以发病的个体,还包括已经患有某个疾病的个体。
因此,本文描述的抗原结合蛋白可以用于预防性处置。这种情况下,将本文描述的抗原结合蛋白给予个体以便防止或者延迟疾病的一或多个症状的开始。受试者可以是没有症状的。受试者可以有患病的遗传倾向。将预防有效量的抗原结合蛋白给予个体。预防有效量是能够防止或者延迟疾病的一或多个症状开始的量。
文中描述的抗原结合蛋白还可以用于治疗方法。术语“治疗”用于文中涵盖对疾病的至少一方面或者症状的缓解、减轻或者防止。例如,文中描述的抗原结合蛋白可以用于缓解或者减少文中描述的疾病的一或多个方面或者症状。
文中描述的抗原结合蛋白以有效量用于治疗、预防或者防止性处置。文中所述抗原结合蛋白的治疗有效量是能够有效缓解或减少疾病的一或多个方面或症状的量。文中描述的抗原结合蛋白还可以用于处置、防止或者治愈文中描述的疾病。
文中描述的抗原结合蛋白对受试者的健康可以有整体上的有益效果,例如可以延长受试者的预期寿命。
文中描述的抗原结合蛋白不需要带来完全的愈合,或者消除疾病的所有症状或者表现才构成可行的治疗处置。正如相关领域认可的,用做治疗剂的药物可以减轻给定疾病状态的严重性,但不需要能消除疾病的所有表现才被认为是有用的治疗剂。同样地,预防性给予的处置不需要能完全有效防止疾病的开始才构成可行的预防剂。只要能减少疾病的影响(例如通过减少疾病症状的数量或者严重程度,或者通过提高另一种处置的效果,或者通过产生另一种有益效果),或者减少疾病在受试者中发生或恶化的可能性(例如通过延迟疾病的开始),就足够了。
紊乱、疾病或状况包括乳腺癌、卵巢癌、前列腺癌和膀胱癌。所述疾病可以与高水平HER3相关。本文描述的抗原结合蛋白可以用于调整HER3的水平和/或HER3的活性。
有用的诊断方法
本文描述的抗原结合蛋白可以用于诊断目的,体外或体内检测生物样品中的HER3。例如抗HER3抗原结合蛋白,例如可以利用小鼠或人源化15D5单克隆抗体来检测培养细胞、组织或血清中的HER3。组织可以首先从人或动物体取出(例如,活检样品)。可以采用常规的免疫检测法,包括ELISA、Western印迹、免疫组织化学或者免疫沉淀。
通过建立HER3的存在或者水平与疾病之间的相关性,本领域技术人员可以诊断相关疾病。此外,个体中检测到HER3水平增加可以指示患者群体会对本文描述的抗原结合蛋白治疗有回应。检测到HER3水平、功能或信号转导能力的下降可以指示用本文描述的抗原结合蛋白处理的受试者中肿瘤体积下降的生物效应。
抗原结合蛋白可以提供为诊断试剂盒的形式,包含一或多个抗原结合蛋白、可检测的标记以及试剂盒使用说明。为了方便,试剂盒可以包含预先确定量的试剂和使用说明。
基因疗法
可以将编码文中所述抗原结合蛋白的核酸分子给予有需要的受试者。核酸分子可以表达位于合适支架或结构域中的CDRs、可变结构域或者全长抗体。核酸分子可以包含在能够在人或动物细胞中表达的载体中。核酸分子或载体可以和药学上可接受的赋形剂和/或一或多种治疗活性剂一起配制用于给药。
本文另一方面是抗原结合蛋白,包含的重链序列含有SEQ ID NO:100显示的氨基酸序列中的氨基酸残基20-466;轻链含有SEQ ID NO:104显示的氨基酸序列中的氨基酸残基20-238。
本文还提供了文中描述的包含岩藻糖化聚糖的抗原结合蛋白。
本文还提供了文中描述的抗原结合蛋白,其中的岩藻糖化聚糖选自G0、G2、G0F、G2F、G1、Man5、G1F和G1F’。
本文还提供了文中描述的抗原结合蛋白,其包含非岩藻糖化的聚糖。
本文还提供了文中描述的抗原结合蛋白,其中的非岩藻糖化的聚糖选自G0、G2、G1和Man5。
本文的另一方面是这样的抗原结合蛋白,所述蛋白包含的重链序列含有SEQ ID NO:102显示的氨基酸序列中的氨基酸残基20-466;包含的轻链序列含有SEQ ID NO:104显示的氨基酸序列中的氨基酸残基20-238。
本文的另一方面是分离的核酸,其编码SEQ ID NO:100显示的氨基酸序列中的氨基酸残基20-466。
本文还提供了分离的核酸,其包含SEQ ID NO:101所示的核酸序列。
本文的另一方面是分离的核酸,其编码SEQ ID NO:104显示的氨基酸序列中的氨基酸残基20-238。
本文还提供了分离的核酸,其包含SEQ ID NO:105所示的核酸序列。
本文的另一方面是分离的核酸,其编码SEQ ID NO:102显示的氨基酸序列中的氨基酸残基20-466。
本文还提供了分离的核酸,其包含SEQ ID NO:103所示的核酸序列。
本文还提供了文中描述的重组宿主细胞,其中有编码α-1,6-岩藻糖基转移酶的FUT8基因。
本文还提供了是CHOK1细胞的文中描述的重组宿主细胞。术语CHOK1包括亲代CHOK1细胞和(通过例如基因工程、克隆选择等)来源于该亲代细胞系的任何细胞系的细胞。
本文还提供了文中描述的重组宿主细胞,其中编码α-1,6-岩藻糖基转移酶的FUT8基因已被失活。
本文还提供了产生抗原结合蛋白的方法,包括步骤a)培养包含表达载体的重组宿主细胞,所述表达载体含有编码文中所述抗体重链的分离的核酸,还含有编码文中所述抗体轻链的分离的核酸,其中编码α-1,6-岩藻糖基转移酶的FUT8基因在重组宿主细胞中是有活性的;和b)回收抗原结合蛋白,从而产生抗原结合蛋白。
本文还提供了产生抗原结合蛋白的方法,包括步骤a)培养包含表达载体的重组宿主细胞,所述表达载体含有编码文中所述抗体重链的分离的核酸,还含有编码文中所述抗体轻链的分离的核酸,其中编码α-1,6-岩藻糖基转移酶的FUT8基因在重组宿主细胞中已被失活;和b)回收抗原结合蛋白,从而产生抗原结合蛋白。
本文还提供了文中描述的抗原结合蛋白用于治疗选自下述的状况:乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
实施例
实施例1
1.概述
对小鼠1D9抗体(M5.1D9.1F5)、小鼠15D5抗体(M5.15D5.2A1.1H10)、嵌合1D9抗体和嵌合15D5抗体与全长人HER3胞外结构域(ECD)或其亚结构域的结合进行BIACORETM分析。
2.简介
本实施例的目的是确定小鼠1D9抗体、小鼠15D5抗体、嵌合1D9抗体和嵌合15D5抗体的亲和力。
3.方法
3.1.试验方案
分析在BIACORETM2000仪器(SN#33-0901-2420GE Healthcare)上进行,该仪器在每个新芯片制备前进行并通过了系统测试。全部操作在25°C进行,以HBS-EP(GE Healthcare BR-1006-69/5mM HEPES、150mM NaCl、3.4mMEDTA、0.005%表面活性剂P20,pH7.4)作为工作缓冲液。利用通过伯胺化学性能(NHS/EDC活化的)(GE Healthcare amine coupling kit BR-1000-50)共价偶联在BIACORETMCM5芯片(GE HEalthcare BR-1000-14)上的兔抗小鼠(RAM)IgG(GE Healthcare BR-1008-38)对小鼠单克隆抗体进行分析。嵌合的和人源化的竞争者单克隆抗体利用类似地偶联的抗人Fc特异单克隆抗体(GEHealthcare BR-1008-39)进行分析。每个芯片还制备了带有参照表面,即未偶联捕获抗体的对照。获取使用不同分析物浓度进行的循环的感应曲线图(Sensorgrams)以便进行动力学分析。一个循环由单克隆抗体被捕获在表面上、用流动工作缓冲液进行的短暂稳定期,和随后的限定浓度分析物(ECD或者亚结构域蛋白)发生结合构成。注射与表面结合的分析物(3-4分钟)得到曲线中的结合部分。然后是只有缓冲液的流过(3-4分钟),从而记录解离数据。循环至此结束,注射捕获试剂盒提供的再生溶液(对于RAM是温和的酸性溶液,对于抗人捕获是3M MgCl2)以便除去捕获到的抗体/分析物,但不会显著影响捕获抗体在随后的循环中再进行单克隆抗体的捕获。
亲和力分析的一般方法如下。首先,制备芯片并测试它几个单克隆抗体浓度下捕获的共振单位(RU)。然后执行动力学循环,循环中将单克隆抗体捕获到大概100RU的水平,允许分析蛋白进行结合然后解离,将表面进行再生以除去除了共价偶联的全部蛋白。用捕获试剂盒提供的100mM甘氨酸(pH1.7)再生RAM芯片,抗人芯片用捕获试剂盒提供的3M MgCl2再生。以6种不同的分析蛋白浓度(通常是256nM、128nM、64nM、32nM、16nM和8nM)进行一系列这种循环。在分析蛋白之前进行多轮缓冲液循环以保证循环的一致性,在一些试验中,缓冲液循环被作为“双重参照[.]”。使用的分析物是人全长HER3胞外结构域(ECD)、人HER3胞外部分的独立亚结构域(D1、D2、D3、D4),或者组合的HER3结构域蛋白(D1-2和D2-3)。全部人HER3ECD分析物使用标准技术表达和制备。
在动力学试验循环过程中,模拟物偶联的表面提供参照,将该参照从正在运行(in run)的特异抗体-分析物RU数据中减去以去除缓冲液带来的假象。对动力学曲线组中的每个浓度,从含有分析物的循环的数据中减去只含缓冲液的循环的数据,从而给某些运行做双重参照。使用BIAEVALUATIONTM软件(v.3.2)将这样得到的曲线数据全局拟合1:1朗格缪尔(Langmuir)模型。
3.2.药物和材料
本实施例中所用试剂列表的一部分如下:
鼠1D9抗体(4.77mg/ml)
鼠15D5抗体(4.23mg/ml)
嵌合1D9抗体
嵌合15D5抗体
所有抗体在磷酸缓冲液(pH7.0)中配制和制备。
4.结果
给每个相互作用生成感应曲线图。利用BIAEVALUATIONTM软件,用曲线图进行动力学评估。下表5和表6中列出了运行和动力学参数,包括总体KD。
表5.小鼠1D9抗体(m1D9)和嵌合1D9抗体(Ch1D9)的亲和力
表6.小鼠15D5抗体(m15D5)和嵌合15D5抗体(Ch15D5)的亲和力
5.讨论
生成了抗人HER3胞外结构域的单克隆鼠1D9抗体和鼠15D5抗体。小鼠1D9抗体能够结合全长人HER3ECD和人HER3ECD的亚结构域3。小鼠15D5抗体能够结合全长人HER3ECD和人HER3ECD的亚结构域2。
确定了所有抗体与全长人HER3ECD和选中的人HER3ECD亚结构域相互作用的纳摩尔和次纳摩尔亲和力。小鼠1D9抗体和小鼠15D5抗体有类似的总体亲和力(KD),其中小鼠1D9抗体具有更快的结合率(ka)和解离率(kd)。通过免疫分析和竞争性免疫化学法显示小鼠15D5抗体能够结合人针对HER3ECD的亚结构域2、1-2和2-3,但不能结合亚结构域1、3或4。BIACORETM分析显示HER3ECD的这些部分(即人HER3ECD的亚结构域2、1-2和2-3)的亲和力相对全长人HER3ECD(亚结构域1-4)的亲和力提高。在所有三个含有亚结构域2的人HER3ECD蛋白结构(D2、D1-2和D2-3)中都看到了这样的效果,不希望受到理论的约束,但这可以是因为较小亚结构域蛋白中的结构域2中的表位更容易接近。并且,不希望受到理论的限制,但相信基于结构方面的考虑小鼠15D5抗体很可能对HER3受体的开放构象亲和力更高。这个开放构象已被证明正是受体吸引heregulin配体时的状态。嵌合15D5抗体和嵌合1D9抗体对亲代鼠1D9抗体和鼠15D5抗体保持类似的亲和力。
实施例2
联合X射线晶体学分析和计算机建模预测了小鼠1D9抗体及其变体的结合界面。这些分析还提供了对所观察到的小鼠1D9抗体取得的功能性中和机械学上的理解。建立了这样的复合体的高分辨率结构,所述复合体包含源于鼠1D9抗体的Fab结合人HER3ECD的结构域III。为了实现这一目的,在CHO细胞中表达人HER3ECD的结构域III和小鼠1D9抗体,并通过亲和层析和大小排阻层析纯化。采用标准方法,经木瓜蛋白酶切割产生小鼠1D9抗体的Fab片段。包含源于鼠1D9抗体的Fab结合人HER3ECD的结构域III的复合体是通过将源于鼠1D9抗体的Fab与人HER3ECD的结构域III按照1:1.2的摩尔比率混合产生的。然后将该蛋白混合液浓缩并利用悬滴蒸气扩散法结晶。X射线衍射数据在Argonne National Laboratory的Advanced Photon Source收集。衍射数据用HKL2000软件(HKL Research,Inc.)做了索引和标度。在程序X-PLOR中通过分子替代确定结构。然后对开始生成的分子替代方案在CNS中进行多轮分子动力学细化,并用WINCOOT程序重建。然后生成复合体(包含源于小鼠1D9的Fab结合人HER3ECD的结构域III)的原子坐标文件,并对得到的结构进行分析。
由本项分析确定人HER3ECD结构域III上的表位包含SEQ ID NO:66中的Ile346、Asn350、Gly351、Asp352、Pro353、Trp354、His355、Lys356、Ile357、Pro358和Ala359,其中SEQ ID NO:66可以在包含SEQ ID NO:21的氨基酸残基20-643的片段中找到。参见表7。相互作用残基之间的接触在表7和图55中有描述。
表7.人HER3ECD结构域III和小鼠1D9轻链可变区以及鼠1D9重链可变区之间的氨基酸接触
不希望受到理论的限制,但我们相信根据这个高分辨率晶体结构,小鼠1D9抗体Fab片段专一结合人HER3ECD的结构域III,并且覆盖了一个与HER3ECD开放构象中存在的heregulin结合位点部分重叠的表位。不希望受到理论的限制,我们还认为小鼠1D9抗体Fab能够结合处于闭合构象中的HER3ECD,从而从空间上阻止受体采取二聚体化所需要的伸展构象。我们认为小鼠1D9抗体Fab部分通过阻止人HER3ECD的结构域1采取二聚体化所需要的构象产生它的效果。不希望受到理论的限制,我们进一步认为这里描述的结构效应对小鼠1D9抗体及其变体产生的对HER3活性的强烈抑制也有帮助。
实施例3
利用Rosetta Dock软件(RosettaCommons.org)对小鼠15D5抗体与开发构象中HER3ECD结合之间的相互作用进行了计算结构建模。软件采用的算法的第一阶段执行了刚体Monte Carlo检索,并且利用残基尺度相互作用势将抗原绕抗体表面进行了移动和转动。比对评分引导抗原靠近抗体CDR环。这个低分辨率检索后,利用骨架依赖性旋转异构体组装算法给蛋白骨架添加明显的侧链。然后Monte Carlo-plus-最小化方案通过同时优化侧链构象和刚体位置,有效地从一个小的对接构象空间区域内获得一组局部最小值。对不同的随机起始取向重复该搜索过程以形成105个结构,然后利用范德华力、虚拟溶剂模型和取向依赖性氢键作用能主导的能量函数对这些结构进行排位。保留超过一定打分阈值的前1000个诱饵预测(decoys)。为了提高侧链预测的分辨率,在旋转异构体库中包括了未结合的旋转异构体构象,并使用了对侧链扭转角的基于梯度最小化。在这个高分辨率搜索结束时,利用层次聚类算法根据成对均方根差(rmsd)将200个打分最好的预测聚类。位于聚类阈值以内的结构被指定为一组,每组内打分最低的预测代表该类。
这样得到的小鼠15D5抗体与人HER3ECD结合的模型预测该抗体结合开放构象的HER3ECD并在二聚体化臂附近形成空间位阻。不希望受到理论的限制,这表明小鼠15D5抗体阻断了HER3二聚体化。
实施例4
1.概述
利用分子生物学技术制备并表达了一系列小鼠1D9抗体和鼠15D5抗体的人源化RR变体。然后将这些抗体通过BIACORETM分析它们与全长人HER3胞外结构域(ECD)的结合。
2.简介
本实施例的目的是确定小鼠1D9和15D5抗体的人源化变体的亲和力。
3.方法
3.1.试验方案
3.2.BIACORE
TM
分析
利用BIACORETM分析确定利用分子生物学技术制备并表达的小鼠1D9和鼠15D5抗体的人源化变体的结合亲和力。所述人源化变体是1D9H6L2RR抗体(包含SEQ ID NO:30和SEQ ID NO:57)、1D9H0L7RR抗体(包含SEQ ID NO:67和SEQ ID NO:85)、1D9H2L2RR抗体(包含SEQ ID NO:71和SEQ ID NO:57)、1D9H6L6RR抗体(包含SEQ ID NO:38和SEQ ID NO:83)、1D9H6L3RR抗体(包含SEQ ID NO:30和SEQ ID NO:77)、1D9H3L6RR抗体(包含SEQ ID NO:73和SEQ ID NO:83)、1D9H0L9RR抗体(包含SEQ ID NO:67和SEQ ID NO:87)、1D9H2L6RR抗体(包含SEQ ID NO:71和SEQ ID NO:83)、1D9H6L4RR抗体(包含SEQ ID NO:30和SEQ ID NO:79)、1D9H6L5RR抗体(包含SEQ ID NO:30和SEQ ID NO:81)、1D9H6L0RR抗体(包含SEQ ID NO:30和SEQ ID NO:75)、1D9H3L2RR抗体(包含SEQ ID NO:73和SEQ ID NO:57)、1D9H6L9RR抗体(包含SEQ ID NO:30和SEQ ID NO:87)、15D5H1L3抗体(包含SEQ ID NO:90和SEQ ID NO:98)、15D5H2L2抗体(包含SEQ ID NO:92和SEQ ID NO:96)、15D5H1L1抗体(包含SEQ ID NO:90和SEQ ID NO:26)、15D5H3L1抗体(包含SEQ IDNO:94和SEQ ID NO:26)、15D5H2L1抗体(包含SEQ ID NO:92和SEQ IDNO:26)以及15D5H3L3抗体(包含SEQ ID NO:94和SEQ ID NO:98)。还分析了嵌合15D5抗体(ch15D5)。
利用BIACORETM3000评估这些抗体的结合动力学。将抗体捕获在CM5生物传感器芯片上,所述芯片上已经用提供的偶联缓冲液固定了抗人IgG(Fc specific)BIACORETM(GE Healthcare cat#BR-1008-39)单克隆抗体(9000RU)。全长人HER3ECD浓度以30ul/min的流速注射120s。按照实施例1的描述再生生物传感器芯片。使用BIACORETMEvaluation软件,将数据全局拟合至1:1朗格缪尔模型以确定动力学。用HBS-EP作为工作缓冲液在25°C执行分析运行。
BIACORETM分析方法的基本步骤概括如下:
1)抗人Fc抗体的固定(9000-1000RU;25ug/ml,使用醋酸钠缓冲液(pH5.0));
2)目标抗体的捕获(400ng/ml);
3)分析物与捕获抗体的结合(例如512nM to16nM的HER ECD);
4)分析物的解离(例如,利用缓冲液);
5)BIAcore动力学运行循环步骤:缓冲液、512nM HER3ECD、256nMHER3ECD、128nM HER3ECD、64nM HER3ECD、32nM HER3ECD和16nM HER3ECD。按照实施例1的描述进行缓冲液循环和双重参照;以及
5)用BIACORETM优化缓冲液再生生物传感器芯片。
4.结果与讨论
下表8和表9显示了获得的数据并且显示了在所有相对亲代分子产生的人源化抗体中,人源化1D9RR抗体(H6L2)和人源化15D5抗体(H4L1)看来对全长人HER3ECD的亲和力最好。
表8.人源化1D9RR变体抗体的亲和力
表9.人源化15D5变体抗体的亲和力.
实施例5
1.概述
利用分子生物学技术生成并表达人源化1D9抗体、人源化1D9Fc失活抗体(Fc disabled antibody)、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体。然后通过BIACORETM分析这些抗体与全长人HER3胞外结构域(ECD)、全长大鼠HER3胞外结构域(ECD)和全长食蟹猴HER3胞外结构域(ECD)的结合情况,如下所示。
2.简介
本实施例的目的是确定人源化1D9抗体、人源化1D9Fc失活抗体、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体的亲和力。
3.方法
3.1.试验方案
3.2.BIACORE
TM
分析
利用BIACORETM分析确定人源化1D9抗体、人源化1D9Fc失活抗体、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体的结合亲和力。
蛋白A通过伯胺偶联在CM5芯片上固定达到~1300共振单位(RU’s)的水平,然后将人源化抗体捕获在该芯片上。所有抗体捕获到类似的水平(100-200RU’s)。然后将全长人HER3ECDs以50nM、25nM、12.5nM、6.25nM、3.125nM和1.5625nM如下所示流经芯片。替代地,将全长大鼠HER3ECD或全长食蟹猴ECD以10nM、5nM、2.5nM、1.25nM、0.625nM和0.3125nM流经芯片。按照实施例1使用只有缓冲液的注射给结合曲线做双参照。用10mM甘氨酸缓冲液(pH1.5)再生该表面。使用BIACORETMEvaluation软件将结合数据拟合至1:1模型。运行在BIACORETMT3000上于25°C进行,工作缓冲液使用HBS-EP。
4.结果与讨论
如下所示,以下表10和表11显示了人源化1D9抗体、人源化1D9Fc失活抗体、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体与全长人HER3胞外结构域(ECD)、全长大鼠HER3胞外结构域(ECD)和全长食蟹猴HER3胞外结构域(ECD)结合获得的数据。
表10.人源化1D9抗体、人源化1D9Fc失活抗体、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体的亲和力
| 抗体 | 分析物 | ka(1/Ms) | kd(1/s) | KD(M) |
| 人源化1D9抗体 | 人HER3ECD | 4.1x105 | 1.84x10-3 | 4.5x10-9 |
| 人源化1D9Fc失活抗体 | 人HER3ECD | 2.71x105 | 1.22x10-3 | 4.49x10-9 |
| 人源化1D9ACCRETAMABTM抗体 | 人HER3ECD | 1.13x106 | 2.33x10-3 | 2.06x10-9 |
| 人源化1D9POTELLIGENTTM抗体 | 人HER3ECD | 1.11x106 | 2.23x10-3 | 2.01x10-9 |
| 人源化1D9POTELLIGENTTM抗体 | Rat HER3ECD | 3.26x105 | 1.1x10-3 | 3.37x10-9 |
表11.人源化1D9H6L2Fc失活抗体对全长人HER3ECD、全长大鼠HER3ECD和全长食蟹猴HER3ECD的亲和力
| 抗体 | 分析物 | ka(1/Ms) | kd(1/s) | KD(M) |
| 人源化1D9Fc失活的抗体 | 人HER3ECD | 2.71x105 | 1.22x10-3 | 4.49x10-9 |
| 人源化1D9Fc失活的抗体 | 食蟹猴HER3ECD | 1.09x106 | 1.89x10-3 | 1.73x10-9 |
| 人源化1D9Fc失活的抗体 | Rat HER3ECD | 3.26x105 | 1.1x10-3 | 3.37x10-9 |
对人源化1D9抗体、人源化1D9Fc失活抗体、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM的特性研究显示它们特异结合全长人HER3ECD。根据交叉物种同源性预测,大鼠HER3ECD的结构域III和食蟹猴HER3ECD的结构域III与被人源化1D9抗体及其变体结合的人HER3ECD结构域III的表位有大约95%的同源性。这表明非常有可能有功能交叉反应。与此一致,通过BIACORETM分析评估,人源化1D9Fc失活抗体与全长食蟹猴HER3ECD和全长大鼠HER3ECD的交叉反应水平相当。参见以上表10和表11。
实施例6
1.概述
本实施例显示了1D9抗体(例如小鼠1D9抗体及其人源化变体)和15D5抗体(例如小鼠15D5抗体及其人源化变体)的以下能力:抑制heregulin诱导的HER3磷酸化、降低下游AKT信号转导、作为异二聚体化抑制剂阻止活化的EGFR与HER3形成异二聚体、阻止heregulin诱导的EGFR-HER3、HER2-HER3以及HER4-HER3异二聚体的形成和阻止后续的HER3磷酸化。
2.简介
检验了1D9抗体(例如小鼠1D9抗体及其人源化变体)和15D5抗体(例如小鼠15D5抗体及其人源化变体)的以下能力:抑制heregulin诱导的HER3磷酸化、降低下游AKT信号转导、作为异二聚体化抑制剂阻止活化的EGFR与HER3形成异二聚体、阻止heregulin诱导的EGFR-HER3、HER2-HER3以及HER4-HER3异二聚体的形成和阻止后续的HER3磷酸化。
3.方法
3.1.试验准备
这些研究中使用的模型符合Home Office制定的UK动物管理标准。
3.2.试验方案
3.2.1抗HER3mAbs在癌细胞系中对Heregulin诱导的HER3受体磷酸
化的抑制
大约80%汇合的BxPC3、CHL-1、N87、SK-BR-3、BT-474或MCF-7细胞用胰蛋白酶收集,在10%FBS/培养基中洗涤,以3-5x105细胞/ml重悬于10%FBS/培养基中。以100ul/孔铺在96孔组织培养处理平底板中,于37°C在5%CO2气体中温育。第二天吸去培养基,以无血清培养基代替,温育过夜造成血清饥饿。然后在无血清培养基中准备mAb储液,并制备half log梯度稀释。取10ul mAb储液一式两份加入96孔细胞培养板中以制作8点浓度曲线,并于37°C温育1小时。之后加入10ul HRGβ1至终浓度30或100ng/ml,温育15分钟。吸去培养基,细胞在含有磷酸酶和蛋白酶抑制剂的冷裂解缓冲液中进行裂解,并在冰上晃动30分钟。裂解物立即使用或者冷冻在-80°C,以后在冰上融化用于人Phospho-ErbB3ELISA(R&D Systems目录号DYC1769)。遵照制造商的试验方案进行ELISA。数据分析用GRAPHPADTMPRISMTM软件进行。
3.2.2抗HER3mAbs在癌细胞系中对Heregulin诱导的Akt磷酸化的抑
制
大约80%汇合的BxPC3、CHL-1、N87、SK-BR-3或BT-474细胞用胰蛋白酶收集,在10%FBS/培养基中洗涤,以3-5x105细胞/ml重悬于10%FBS/培养基中。以100ul/孔铺在96孔组织培养处理平底板中,于37°C在5%CO2气体中温育。第二天吸去培养基,以无血清培养基代替,温育过夜造成血清饥饿。第二天在无血清培养基中准备mAb储液,并制备half log梯度稀释液。取10ul mAb储液一式两份加入96孔细胞培养板中以制作8点浓度曲线,并于37°C温育1小时。之后加入10ul HRGB1至终浓度30或100ng/ml,温育15分钟。吸去培养基,细胞在含有磷酸酶和蛋白酶抑制剂的冷裂解缓冲液中进行裂解,并在冰上晃动30分钟。裂解物立即使用或者冷冻在-80°C,以后在冰上融化用于人/小鼠/大鼠Phospho-Akt(S473)Pan SpecificELISA(R&D Systems目录号DYC887B)。遵照制造商的试验方案进行ELISA。数据分析用GRAPHPADTMPRISMTM软件进行。
3.2.3抗HER3mAbs在SK-BR-3乳腺癌细胞中对表皮生长因子或乙胞
素诱导的HER3受体磷酸化的抑制
按照本实施例中3.2.1部分描述的用于人Phospho-ErbB3ELISA(R&DSystems目录号DYC1769)对SK-BR-3细胞进行了分析检验,不同之处仅在于活化配体是表皮生长因子(EGF)或乙胞素,而不是heregulin。
3.2.4在HER家族受体BACMAM
TM
转导的CHO细胞中,对Heregulin
诱导的异二聚体形成和HER3受体磷酸化的抑制
利用PerkinElmer ALPHALISATMassay技术建立了异二聚体化分析,用于检验抗HER3mAb介导的对HER3受体在heregulin-β1刺激后被EGFR、HER2和HER4磷酸化的抑制。试剂根据PerkinElmer实验方案制备。简单来说,将磷酸-酪氨酸特异小鼠mAb(P-Tyr-100Cell Signaling Technology,目录#9411PBS only formulation)偶联到ALPHALISATM受体珠子(PerkinElmer目录#6772002)上。使用10:1偶联重量比率,即将1mg受体珠与100ug抗体偶联48小时。利用30:1的生物素比抗体摩尔比率将商品抗人HER3抗体(R&D Systems MAB3481)生物素化(即每100ug抗体使用7.6ul2mg/ml CHROMALINKTMBiotin354(Sulfo NHS,SoluLinK catalog#B-1007-105))。然后通过在96孔板中,用特异BACMAMTMEGFR+HER3、HER2+HER3和HER4+HER3配对过夜转导中国仓鼠卵巢细胞(3x105细胞/ml)来评估抗HER3mAbs。第二天加入抗HER3mAbs,并于37°C温育1小时。然后加入Heregulin-β1至终浓度100ng/ml,将培养板温育30分钟。然后吸去培养基,细胞在含有磷酸酶和蛋白酶抑制剂的冷裂解缓冲液中进行裂解。裂解物在冰上晃动30分钟,立即使用或者冷冻在-80°C,在冰上融化后进行ALPHALISATM分析。在384孔培养板中,向10ul2.5nM生物素化的抗人ErbB3抗体(R&D Systems MAB3481)加入2.5ul裂解物,室温下温育1小时。然后加入5ul/孔的50ug/ml磷酸-酪氨酸特异小鼠mAb(P-Tyr-100Cell Signaling Technology,目录#9411),在暗处震荡温育1小时。然后加入12.5ul/孔的80ug/ml包被链霉亲和素的供体珠子制品(PerkinElmer目录#6760002),再温育30分钟。在ENVISIONTM2103多标记微孔板检测仪上给培养板读数,数据分析用GRAPHPADTMPRISMTM进行。
3.3.药物和材料
人源化1D9POTELLIGENTTM抗体(12.68mg/ml)
人源化1D9ACCRETAMABTM抗体(7.45mg/ml)
人源化1D9抗体(1.88mg/ml)
人源化1D9Fc失活抗体(3.713mg/ml)
鼠1D9抗体(M5.1D9.1F5;4.77mg/ml)
鼠15D5抗体(3.19mg/ml)
鼠IgG1同种型对照抗体(R&D Systems,500ug/ml目录#MAB002)
鼠IgG2b同种型对照(R&D Systems,500ug/ml目录#MAB004)
人抗疟疾mAb(人同种型对照;5.74mg/ml)
Heregulin-β1(HRGβ1;1.88mg/ml)
3.4.数据分析
本实施例中显示的所有数据代表最少两个试验的平均值。抗体值除以阳性对照heregulin处理细胞值,然后乘以100来计算“%Heregulin对照磷酸HER3”或者“%Heregulin对照磷酸AKT[.]”在表皮生长因子或乙胞素处理的SK-BR-3细胞的情况下,使用表皮生长因子或乙胞素阳性对照处理细胞值进行比较。将个别试验的数据平均,利用GRAPHPADTMPRISMTM分析软件计算IC50值。
4.结果
4.2.1抗HER3抗体在癌细胞中对Heregulin诱导的HER3受体磷酸化的
抑制
抗HER31D9和15D5抗体在BxPC3(图1)、CHL-1(图2)、N87(图3)、SK-BR-3(图4)、BT-474(图5)和MCF-7(图6)癌细胞中抑制了heregulin诱导的HER3磷酸化。所有1D9抗体构建物,包括人源化1D9POTELLIGENTTM抗体和人源化ACCRETAMABTM抗体都显示出强抑制,如表12所示,它们的IC50值在2.5-40.6ng/ml的范围。
表12.抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制。
4.2.2抗HER3mAbs在癌细胞中对Heregulin诱导的Akt磷酸化的抑制
抗HER31D9抗体和15D5抗体在BxPC3(图7)、CHL-1(图8)、N87(图9)和SK-BR-3(图10)癌细胞中降低了heregulin诱导的AKT磷酸化。对AKT磷酸化的最强抑制可见于BxPC3细胞,其中人源化1D9ACCRETAMABTM抗体抑制了heregulin诱导的磷酸–AKT形成,其IC50值为2.6ng/ml(表13)。
表13.抗HER3抗体在BxPC3乳腺癌细胞中对heregulin诱导的AKT磷酸化的抑制
4.2.3抗HER3mAbs在SK-BR-3乳腺癌细胞中对表皮生长因子和乙胞素
诱导的HER3受体磷酸化的抑制
抗HER31D9抗体和15D5抗体在SK-BR-3乳腺癌细胞中抑制表皮生长因子和乙胞素诱导的HER3磷酸化。1D9鼠构建物抑制配体诱导的HER3受体磷酸化,其IC50值约为3ng/ml,无论使用哪种活化配体都如此(表14)。
表14).抗HER3抗体在SK-BR-3乳腺癌细胞中对表皮生长因子(EGF)、乙胞素(BTC)和heregulin诱导的人HER3受体磷酸化的抑制
4.2.4对EGFR、HER2或HER4与HER3BACMAM
TM
组合转导的CHO
细胞中Heregulin诱导的异二聚体形成和HER3受体磷酸化的抑制
抗HER31D9抗体和15D5抗体抑制CHO细胞中heregulin诱导的HER3磷酸化,所述CHO细胞共转导了人HER3受体和EGFR、HER2或HER4受体。这些抗体能够抑制heregulin诱导的EGFR-HER3、HER2-HER3或HER4-HER3异二聚体的形成。表15中列出了IC50值。
表15.抗HER3抗体对heregulin诱导的人HER3受体磷酸化的抑制
5.讨论
HER3受体酪氨酸激酶属于人表皮生长因子受体家族,该家族还包含EGFR(HER1)、HER2和HER4。HER3结合heregulin配体,但自身已丧失激酶活性。它必须与其他家族成员形成二聚体才能使它胞内C端结构域里的酪氨酸残基发生转磷酸化。活化的磷酸化HER3受体造成的后续下游信号转导诱发PI3K/AKT存活途径。
本实施例中的数据显示抗HER31D9抗体和15D5抗体可以抑制heregulin诱导的HER3受体磷酸化。在heregulin刺激前用1D9抗体对癌细胞系的处理导致heregulin诱导的HER3磷酸化被完全抑制。图16显示了不同1D9抗体在不同癌细胞系中抑制HER3磷酸化的IC50值。1D9抗体和15D5抗体处理也使得下游AKT磷酸化被降低。因此,1D9抗体和15D5抗体抑制了heregulin诱导的HER3磷酸化,并且降低了下游AKT信号转导。
表皮生长因子和乙胞素是EGFR的配体,可以诱导EGFR-HER3异二聚体的形成。SK-BR-3乳腺癌细胞当用这两种EGFR配体之一处理时显示出对HER3磷酸化的诱导。用1D9抗体或15D5抗体对SK-BR-3细胞进行的处理抑制了表皮生长因子或乙胞素诱导的HER3磷酸化(图11和图12)。这表明这些抗体具有异二聚体化抑制剂的功能,可以阻止EGFR与HER3形成二聚体。
1D9抗体和15D5抗体特异抑制EGFR-HER3、HER2-HER3或HER4-HER3 heregulin诱导的异二聚体的形成。CHO细胞用HER3和另外仅仅一个能够在形成异二聚体时将HER3转磷酸化的家族成员一起转导。无论是EGFR还是HER2或HER4被作为二聚化伙伴,1D9抗体和15D5抗体都抑制了heregulin诱导的HER3磷酸化(图13、图14和图15)。这表明1D9抗体和15D5抗体能够阻止heregulin诱导的与其他家族成员的异二聚体形成,从而阻止了HER3磷酸化。
实施例7
1.概述
抗人HER3抗体在多个体外分析检验中进行了研究。包括分析这些mAbs与全长HER3ECD和特定HER3结构域结合情况的检测、分析这些mAbs与肿瘤细胞结合的检测、增殖分析、侵袭检验、内化检验和分析这些mAbs交叉物种特异性(鼠和食蟹猴)的检验。评估了小鼠1D9抗体、人源化1D9抗体、人源化1D9POTELLIGENTTM抗体和人源化ACCRETAMABTM抗体。结果显示抗人HER31D9抗体的小鼠和人源化构建物均能识别人全长HER3ECD,并且特异结合HER3ECD的结构域3。这些mAbs以剂量依赖性的方式抑制heregulin诱导的肿瘤细胞增殖。这些mAbs还抑制heregulin诱导的肿瘤细胞侵袭。1D9抗体诱导HER3受体内化到肿瘤细胞中。这些mAbs还与鼠HER3交叉反应。
2.简介
本实施例总结了对抗人HER3抗体进行的体外性能研究。包括小鼠1D9抗体、人源化1D9POTELLIGENTTM抗体和人源化ACCRETAMABTM抗体的数据。详细描述了以下分析的结果:全长人HER3ECD和结构域结合、与肿瘤细胞的结合、增殖、侵袭、内化和交叉特异性(鼠)。
3.方法
3.1HER3全长ECD和结构域结合分析
目的:这些分析的目的是证实人源化1D9 POTELLIGENTTM抗体和人源化1D9 ACCRETAMABTM抗体能够结合全长HER3胞外结构域。分析的另一个目的是证实mAbs也能特异结合HER3结构域III。
使用解离增强镧系荧光免疫分析(DELFIA)来检测抗HER3抗体与HER3胞外结构域(ECD)的结合。DELFIA流程如下:将白色Maxisorp96孔板(Nunc#437796)用溶于0.1M碳酸盐缓冲液(pH9.5)的1ug/ml全长HER-3ECD或HER3结构域I、II、III和IV以100ul/孔在4°C过夜包被。微孔板用溶于TBS的酪蛋白(Thermo Scientific#37532lot#JD121074)封闭。向板中加入无溶剂杂交瘤上清液、或者稀释在Perkin Elmer#4002-0010Assay Buffer中的纯化抗HER3抗体(10ug/ml(或者100ug/ml)至0.01ug/ml),或者最少三个稀释度的PK血清样品(100ul/well)。将这些样品于室温下在微孔板震荡器上温育2小时,或者4°C过夜。使用100ul/孔的抗小鼠Eu抗体(PE DELFIA#AD-0124lot326-949-A,1:1000稀释=50ng/ml)或者Eu标记的抗人IgG二抗(Wallac#1244-33050ug/ml,对纯化抗体1:4,000稀释,对PK测试1:2,000稀释),室温下温育1小时。每个抗体温育步骤后,微孔板用tris缓冲液加上0.05%tween-20(Perkin Elmer#4010-0010)在BIOTEKTM微孔板洗涤仪上洗涤四次。室温下加入100ul/孔的DELFIA增强溶液(Perkin Elmer1244-105)5分钟。然后使用铕时间分辨荧光术(TRF)方案在VICTORTM1420读板仪上给微孔板读数。抗体结合记录为每孔的铕计数。
结果:图17显示了小鼠1D9抗体(M5.1D9.1F5)与全长HER3ECD和与HER3结构域III的特异结合。图18显示了小鼠15D5抗体(M5.15D5.2A1.1H10)与全长HER3ECD和与HER3结构域II的特异结合。图19显示了人源化1D9POTELLIGENTTM抗体与全长HER3ECD和与HER3结构域III的特异结合。图20显示了人源化1D9ACCRETAMABTM抗体与全长HER3ECD和与HER3结构域III的特异结合。图21显示了人源化1D9抗体与全长HER3ECD和与HER3结构域III的特异结合。参见图17、图18、图19、图20和图21。
结论:小鼠1D9抗体(M5.1D9.1F5)特异结合全长HER3ECD和HER3结构域III。小鼠15D5抗体(M5.15D5.2A1.1H10)特异结合全长HER3ECD和HER3结构域II。人源化1D9POTELLIGENTTM抗体特异结合全长HER3ECD和HER3结构域III。人源化1D9ACCRETAMABTM抗体特异结合全长HER3ECD和HER3结构域III。人源化1D9抗体特异结合全长HER3ECD和HER3结构域III。参见图17、图18、图19、图20和图21。
3.2流式细胞术分析中抗人HER3抗体结合人癌细胞系
目的:为了确定抗人HER3抗体与已知是HER3阳性细胞系的人癌细胞系的结合情况。
试剂:
FACS缓冲液:PBS,0.2%BSA,0.1%叠氮化钠
抗体:鼠1D9抗体(M5.1D9.1F5)
人源化1D9抗体
人源化1D9ACCRETAMABTM抗体
人源化1D9POTELLIGENTTM抗体
PE山羊抗小鼠IgG(H+L)–Caltag Laboratories(M30004-4)
山羊抗人IgG ALEXAFLUOR647TM-Invitrogen(A21445)
细胞系:CHL1,BxPC3
方法:向流式细胞术管中加入5x106个细胞,所述细胞来自以前筛选过HER3受体的细胞系。将待测试的每个抗体的剂量反应浓度加入合适的管中。细胞和抗体在冰上保持30分钟。细胞及时用1ml染色缓冲液洗涤1次,然后给合适的管中加入适当的二抗。细胞再在暗处置冰上保持30分钟,然后洗涤并重悬在FACS缓冲液中。在FACSCANTOTM流式细胞仪上对细胞进行分析。
数据分析:分析使用BD Biosciences开发的FACSDIVATM软件进行。利用前向散射光相比(vs)测向散射光对细胞群进行分选(gated),生成荧光强度直方图。
结果:通过相对同种型对照抗体直方图向右的移动,抗体与每个细胞系结合的直方图显示人源化抗HER3mAbs发生特异结合。小鼠1D9抗体(M5.1D9.1F5)结合了MCF7人乳腺癌细胞和BxPC3人胰腺肿瘤细胞上表达的人HER3。参见图22。人源化1D9抗体、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体均结合了CHL-1人黑素瘤细胞和BxPC3人胰腺肿瘤细胞上表达的人HER3。参见图23。
结论:小鼠1D9抗体(M5.1D9.1F5)抗体识别MCF7人乳腺癌细胞和BxPC3人胰腺肿瘤细胞上表达的人HER3。参见图22。人源化1D9抗体、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体都能识别在CHL-1(黑素瘤)和BxPC3(胰腺)人癌细胞系上表达的人HER3。见图23。
3.3M5.1D9对Heregulin诱导的肿瘤细胞增殖的抑制
目的:为了确定任何抗人HER3抗体是否能在MCF7或BxPC3细胞系中抑制heregulin-1β诱导的细胞增殖。
试剂:
完全培养基:RPMI,10%FBS,谷氨酰胺
细胞系:MCF7
BxPC3–ATCC
抗体:鼠15D5抗体(M5.15D5.2A1.1H10)
鼠1D9抗体(M5.1D9.1F5)
鼠24H5抗体(M5.24H5.C2)
人源化1D9抗体
人源化1D9ACCRETAMABTM抗体
人源化1D9POTELLIGENTTM抗体
CellTiter96非放射性细胞增殖检验(MTT)–Promega G4000.
方法:分别将MCF7或BxPC3细胞系1x103或者1x104个细胞/孔加入平底96孔板每个孔中含有10%血清的完全培养基中,37°C温育过夜。移去培养基,以无血清RPMI代替。取10μl待筛选的每种抗体一式四份加入合适的孔中。抗体和细胞于37°C温育1小时。每孔中加入30ng/ml heregulin-1β。对于人源化抗体试验,使用100ng/ml heregulin以便与p-HER3和pAkt分析中使用的条件有可比性。微孔板在37°C温育72小时。使用Promega的MTT试剂盒确定增殖情况,微孔板在ENVISIONTM2103多重标记读板仪上分析,数据在Microsoft EXCELTM中分析。将数据作图为相对抗体浓度的heregulin诱导的生长百分比。
结果:MCF7细胞在应答heregulin-1β时增殖被很好地诱导(大约40%)。但在BxPC3细胞中只有有限的反应(大约10%)。小鼠15D5抗体(M5.15D5.2A1.1H10)和鼠1D9抗体(M5.1D9.1F5)都抑制了heregulin-1β诱导的MCF7细胞增殖。小鼠15D5抗体(M5.15D5.2A1.1H10)和鼠1D9抗体(M5.1D9.1F5)实际上对BxPC3增殖的抑制低于只有细胞的水平。人源化1D9ACCRETAMABTM抗体在BxPC3细胞中显示出与小鼠1D9抗体(M5.1D9.1F5)类似的诱导效力。参见图24、图25和图26。
结论:小鼠15D5抗体(M5.15D5.2A1.1H10)和鼠1D9抗体(M5.1D9.1F5)抑制MCF7和BxPC3细胞增殖的能力相当。参见图24和图25。人源化1D9ACCRETAMABTM抗体抑制BxPC3肿瘤细胞增殖。参见图26。
3.4对肿瘤细胞侵袭的抑制
目的:本项研究的目的是确定任何抗人HER3抗体是否能够在heregulin刺激后抑制肿瘤细胞侵袭.
方法:先前接受过HER家族表达研究的人肿瘤细胞系被用于侵袭分析。BXPC3细胞被证实能够表达HER-2和少一些的HER3。利用TrevigenCULTREXTM细胞侵袭检验(目录号3455-096-K)确定了HER3抗体对BXPC3细胞侵袭的影响。简单来说,将BXPC3细胞生长至60%汇合,血清饥饿过夜,然后用VERSENETM螯合剂(EDTA)和胰蛋白酶从培养瓶中移出。细胞用淬灭缓冲液(RPMI+2%BSA)洗涤,用台盼蓝染料排除法确定活性,将细胞以1百万细胞/ml悬浮在含有FBS或BSA的RPMI培养基中用于该项分析。抗体与细胞在37°C温育1小时,之后加入侵袭板的上部的微孔中。底部微孔含有RPMI培养基+10%非热灭活的FBS。但有一栏底部微孔的确接受了不含FBS的RPMI以便计算随机迁移。发生迁移的细胞用calcein-am标记,底部小室在VICTORTMIV读板仪上读数。荧光(RFU)代表发生迁移的细胞的量。将每个抗体的RFU除以同种型对照抗体的RFU并乘以100得到“%对照侵袭”值。
结果:小鼠1D9抗体(M5.1D9.1F5)、嵌合1D9抗体和嵌合15D5抗体均对BXPC3细胞侵袭有40%的抑制。小鼠15D5抗体(M5.15D5.2A1.1H10)对细胞侵袭有30%的抑制。小鼠1D9抗体(M5.1D9.1F5)对肿瘤细胞侵袭有20%的抑制。参见图27。
结论:小鼠1D9抗体(M5.1D9.1F5)、嵌合1D9抗体和嵌合15D5抗体抑制了肿瘤细胞侵袭。参见图27。
3.5小鼠1D9抗体与人肿瘤细胞的结合导致HER3受体内化
目的:为了确定任何抗人HER3抗体是否能导致HER3受体在被结合时发生内化。
试剂:
染色缓冲液:PBS,0.2%BSA,0.1%叠氮化钠
抗体:IgG1对照–R&D Systems MAB002
IgG2b对照–R&D Systems MAB004
鼠15D5抗体(M5.15D5.2A1.1H10)–(3.19mg/ml)
Hz10–(9.82mg/ml)
人源化1D9抗体–(1.88mg/ml)
二抗:
PE山羊抗小鼠IgG(H+L)–Caltag Laboratories M30004-4
山羊抗人IgG ALEXAFLUOR647TM–Invitrogen A21445
方法:取100μl5x106细胞/ml加入含有10μg抗HER3抗体的流式细胞术分析管中。每种抗体一式两份。每种抗体的一个管子置于冰上,另一个管于37°C温育。两小时后,细胞用1ml染色缓冲液洗涤,并用PE标记的山羊抗小鼠二抗复染30分钟。用1ml染色缓冲液再次洗涤后,在FACSCANTOTM细胞仪上分析细胞。数据分析用BD Biosciences开发的FACSDIVATM软件进行。将细胞群利用前向散射光相比测向散射光分选(gated),生成荧光强度直方图。
结果:筛选小鼠15D5抗体(M5.15D5.2A1.1H10)和人源化1D9抗体是否能使CHL-1细胞上的HER3受体内化。37°C温育后,检测不到抗体表明受体不在细胞表面了。参见图28。
结论:小鼠15D5抗体(M5.15D5.2A1.1H10)和人源化1D9抗体导致HER3受体被结合时发生内化。参见图28。
3.6小鼠1D9抗体与鼠肿瘤细胞上的鼠HER3交叉反应
目的:为了确定任何抗人HER3抗体是否能与鼠HER3阳性细胞系交叉反应。
试剂:
FACS缓冲液:PBS,0.2%BSA,0.1%叠氮化钠
抗体:EGFR–Bioscience44783M
HER2–Bioscience AHO1011
HER3–Upstate05-471
鼠15D5抗体
鼠1D9抗体(M5.1D9.1F5)
鼠24H5抗体(M5.24H5.C2)
细胞系:B16
B16F10
ZENONTM标记试剂盒:
小鼠IgG1PE–Invitrogen Z25021
小鼠IgG1APC–Invitrogen Z25051
小鼠IgG2b APC–Invitrogen Z25151
方法:提供了商品抗人EGFR和HER2抗体。提供了商品HER3抗体(供应商表示可以识别人HER3)。还提供了小鼠15D5抗体、鼠1D9抗体(M5.1D9.1F5)、鼠24H5抗体(M5.24H5.C2)抗体。将这些抗体用ZENONTM标记试剂盒(Invitrogen)标记上PE或APC。将5x106B16或者B16F10鼠黑素瘤细胞加入含有标记过的抗HER3抗体的流式细胞术分析管中。细胞和抗体于暗处在冰上保持30分钟,洗涤并重悬于FACS缓冲液中。然后在FACSCANTOTM流式细胞仪上分析细胞。数据分析用BD Biosciences开发的FACSDIVATM软件进行。将细胞群利用前向散射光相比测向散射光分选(gated),生成荧光强度直方图。
结果:商品化EGFR、HER2和HER3抗体不能识别小鼠细胞表面上的这些受体(数据未显示)。小鼠15D5抗体、小鼠1D9抗体(M5.1D9.1F5)和小鼠24H5抗体(M5.24H5.C2)均能识别B16和B16F10细胞表面上的HER3。参见图29。
结论:小鼠15D5抗体、小鼠1D9抗体(M5.1D9.1F5)和小鼠24H5抗体(M5.24H5.C2)与鼠HER3交叉反应。参见图29。
实施例8
1.概述
人类癌症的小鼠模型被广泛用于临床前情景来展示新抗癌药物的体内活性。本项研究中,在小鼠同系肺定植模型和多个人异种移植模型中对小鼠抗HER3单克隆抗体(mAbs)进行了评估以确定它们的活性并选择领先的候选抗体,用于进一步开发以适用人临床试验。
给C57BL/6小鼠单次i.v.注射B16F10黑素瘤细胞以评价有或没有抗HER3mAb处理时肺内的肺定植。B16F10注射后第3天i.p.给予50mg/kg鼠1D9抗体,第7和11天i.p.给予25mg/kg,导致研究结束时(即B16F10注射后第20天)肺重量显著下降(p<0.001)。鼠15D5抗体也抑制了肿瘤细胞到肺的定植(p<0.05),但较低的25和5mg/kg,i.p.的剂量方案与50/25mg/kg剂量方案相比有更高的活性。随后在异种移植模型中对小鼠1D9和15D5mAbs进行评估,以评价它们抗人肿瘤的活性。
小鼠抗HER3mAbs延迟了植入CB-17SCID小鼠中的晚期HER3+人异种移植的生长。用0.5-100mg/kg,i.p.的鼠1D9抗体或鼠15D5抗体每周两次处理导致CHL-1黑素瘤肿瘤生长发生剂量依赖性和统计学显著的降低(在≥5mg/kg时,p<0.001)。皮下植入CB-17SCID小鼠后观察到了相似的抗BxPC3胰腺肿瘤生长活性(≥5mg/kg时,p<0.001)。
1D9抗体和15D5抗体处于5-50mg/kg的剂量范围时,在CHL-1黑素瘤异种移植模型中保持显著的和剂量依赖性抗肿瘤活性(p<0.001)。而且人源化1D9RR抗体和人源化1D9RR ACCRETAMABTM抗体在5、25和50mg/kg的剂量有显著和同等强力的活性(p<0.001)。
在皮下和原位BxPC3异种移植模型中,50mg/kg嵌合1D9抗体或人源化15D5抗体造成肿瘤生长直至研究终止时被显著抑制(p<0.001),而50mg/kg人源化1D9RR抗体在皮下BxPC3模型中显示出对肿瘤生长的显著(p<0.001)但是短暂的效应。生长抑制持续时间的差别可以是由于每个研究之间的不同(即植入的BxPC3判断的特性不同),仍然展示了基因工程化mAbs抗肿瘤生长的效力。
最后,在NCI-N87胃模型中对人源化1D9RR抗体、人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体的评估表明强化mAbs抗CHL-1黑素瘤异种移植的活性。
2.简介
在本项研究中,评估了鼠亲代或人源化HER3单克隆抗体抗晚期HER3+人异种移植(即CHL-1黑素瘤、BxPC3胰腺和NCI-N87胃肿瘤)的抗肿瘤活性。初步评估中包括了使用小鼠B16F10黑素瘤细胞进行的同系肺定植模型来评价小鼠亲代抗HER3mAbs的活性。
3.方法
3.1.试验准备
这些研究中使用的模型符合Home Office制定的UK动物管理标准。
在重约15-20g的6-8周龄CB-17SCID小鼠(Taconic,Indiana,IN)中进行了人异种移植肿瘤模型研究。研究开始时,小鼠10-12周大。在重约15-20g的6-8周龄C57Bl雌性小鼠中进行了同系肺定植模型研究。
小鼠(B16F10)和人(BxPC3、NCI N87和CHL-1)肿瘤细胞系从细胞库获得。
3.2.试验方案
3.2.1.小鼠B16F10黑素瘤同系模型
给C57BL/6雌性小鼠i.v.注射2x105B16F10细胞。注射肿瘤细胞后第3天i.p.给予25mg/kg小鼠抗HER3抗体或同种型对照,第7和11天i.p.给予25或5mg/kg。注射后第3天i.v.给予GEMZARTM(NDC0002-7502-01;吉西他滨)。第20天将动物安乐死,采集肺测量湿重。
3.2.2.人CHL-1黑素瘤异种移植模型
将MATRIGELTM中的CHL-1细胞(5x105-5×106)皮下(s.c.)注射到CB-17SCID小鼠侧腹。待肿瘤异种移植平均体积达到80-120mm3,将小鼠随机分到治疗组中(n=6小鼠/组),并给予抗HER3mAbs或者同种型对照。每周两次i.p.给予0.5-100mg/kg的剂量。载体处理小鼠作为肿瘤生长的对照组。
用手动卡尺每周测量肿瘤宽度(W)和长度(L),按照以下公式计算肿瘤体积:V=1/2(LxW2)。同种型对照的平均肿瘤体积超过1000mm3时,终止研究。
3.2.3.人BxPC3胰腺异种移植模型:皮下或原位植入
将BxPC3细胞(5×106/小鼠)s.c.注射到作为供体的CB-17SCID小鼠中。当肿瘤体积达到800-1000mm3时,将带有BxPC3肿瘤的供体小鼠安乐死;然后收集肿瘤并分为3mm3的肿瘤片。将新鲜采集的BxPC3肿瘤片经s.c.植入受体小鼠侧腹。在原位模型中,片段经手术植入受体小鼠的胰脏。
待受体小鼠的肿瘤异种移植平均体积达到80-120mm3,将小鼠随机分到治疗组中(n=6小鼠/组),并用抗HER3mAbs或者同种型对照处理。每周两次i.p.(对于皮下植入模型)或者i.v.(对于原位植入模型)给予0.5-100mg/kg的剂量。载体处理小鼠作为肿瘤生长的对照组。
如上所述每周用手动卡尺测量肿瘤体积。在原位模型中,通过超声测量肿瘤,利用VISUAL SONICS VEVOTM770图像分析系统确定体积。
3.2.4.人NCI-N87胃异种移植模型
将NCI-N87细胞以每只动物~1x106细胞植入受体小鼠右侧腹。从供体小鼠收集肿瘤片段,s.c.植入10-12周龄的受体小鼠侧腹。当肿瘤异种移植平均体积达到50-80mm3时,或者在片段植入后第29天开始小鼠抗HER3mAbs处理。肿瘤异种移植平均体积达到80-100mm3时,或者移植后第15天开始基因工程抗HER3处理。
如上所述用手动卡尺测量肿瘤体积。
3.3.药物和材料
下表中列出了本项研究中使用的抗HER3抗体和同种型对照。表中还包括了文中含有的缩写名称。为了给剂,所有抗体在磷酸盐缓冲液(pH7.0)中配方和制备。
表16
3.4.数据分析
给对照和处理组确定组的均值和均值标准误差。将数据作图,对人异种移植模型使用带有Bonferroni事后检验的双因素ANOVA分析,对小鼠原位模型使用带Dunnett’s事后检验的单因素ANOVA分析(GRAPHPADTMPRISMTM软件,v.5)。
4.结果
4.1.小鼠抗HER3mAbs的体内效力
将小鼠1D9抗体和小鼠15D5抗体在小鼠原位模型和多个人异种移植模型中进行评估以证实其抗肿瘤细胞生长的效力。
4.1.1.小鼠B16F10黑素瘤同系模型
抗HER3鼠1D9抗体处理降低了B16F10肿瘤在C57BL/6小鼠肺内的定植。与同种型对照组相比,50/25mg/kg组的肺重量有显著下降(p<0.01)(图30)。用小鼠15D5抗体进行的处理,与同种型对照相比,25/5mg/kg组中肿瘤在肺里的定植也呈现下降(p<0.05;图31)。
4.1.2.人CHL-1黑素瘤异种移植模型
被每周两次i.p.给予5-100mg/kg范围剂量的抗HER3鼠1D9抗体或鼠15D5抗体的CB-17SCID小鼠,与它们的相应同种型对照组相比,人CHL-1肿瘤生长有剂量依赖性和统计学显著的下降(p<0.001)(图32和图33)。
4.1.3.人BxPC3胰腺异种移植模型
被每周两次i.p.给予0.5-50mg/kg剂量的鼠1D9抗体的CB-17SCID小鼠,与同种型对照组相比,BxPC3肿瘤生长有显著下降(≥5mg/kg时,p<0.001)(图36)。同样地,与同种型对照组相比,用小鼠15D5抗体进行的处理在5-50mg/kg组中导致BxPC3肿瘤生长下降(p<0.001)(图35)。
4.1.4.人NCI-N87胃异种移植模型
被每周两次i.p.给予75或100mg/kg鼠1D9抗体的CB-17SCID小鼠与载体对照组相比,肿瘤体积有显著下降(p<0.001)(图36)。图37显示了与载体对照和同种型对照组相比,小鼠15D5抗体对NCI-N87肿瘤生长的影响。
4.2.嵌合的和人源化的抗HER3mAbs的体内效力
制备并评估人源化15D5抗体、嵌合1D9抗体和人源化1D9RR抗体。基于人源化1D9RR抗体在各种体外和体内模型中的活性,采用了进一步工程化来增强IgG1mAb的抗体依赖性细胞介导的细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)作用(人源化1D9RR ACCRETAMABTM抗体),或者只增强CDC(人源化1D9RR POTELLIGENTTM抗体)。以下总结了各种抗体在人异种移植模型中的活性。
4.2.1.人CHL-1异种移植模型
被每周两次i.p.给予5-50mg/kg嵌合1D9抗体的CB-17SCID小鼠与同种型对照组相比,CHL-1肿瘤的生长有剂量依赖性下降。在植入后第24天,25和50mg/kg组中的下降是统计学显著的(p<0.05),植入后第27天,全部处理组中观察到显著下降(p<0.001)(图38)。在人源化15D5抗体处理组中观察到类似的发现(图39)。
人源化H1D9RR抗体、人源化H1D9RR ACCRETAMABTM抗体和人源化H1D9RR POTELLIGENTTM抗体以5-50mg/kg的剂量在CHL-1异种移植模型中进行了评估。人源化H1D9RR抗体、人源化H1D9RRACCRETAMABTM抗体和人源化H1D9RR POTELLIGENTTM抗体的活性特性相似。植入后第29天开始至第34天研究结束,在所有剂量水平都观察到肿瘤生长的显著下降(p<0.001)(图40、图41和图42)。
4.2.2.人BxPC3异种移植模型(皮下和原位植入)
被每周两次i.p.给予0.5-50mg/kg ch1D9的CB-17SCID小鼠,其中的50mg/kg组(p<0.001)以及5和0.5mg/kg组(p<0.01)在皮下BxPC3植入后,从第33天开始肿瘤生长有统计学显著的剂量依赖性下降。50mg/kg组中显著低的肿瘤体积保持到第36天(p<0.001)(图43)。用0.5-50mg/kg h15D5进行的处理导致50mg/kg组中肿瘤生长延迟,在植入后第33天和36天有可检测到的生长(p<0.01)(图44)。图45中显示了用0.5-50mg/kg人源化1D9RR抗体每周两次处理后,观察到的BxPC3肿瘤生长的下降。
在BxPC3手术原位植入模型中对嵌合1D9抗体和人源化15D5抗体进行了评估,该模型被认为比皮下植入能更好地预测临床结果。用50mg/kg嵌合1D9抗体或人源化15D5抗体经i.v.途径每周两次的处理与同种型对照相比,肿瘤生长从植入后第5周至第7周有显著延迟(p<0.01)(图46)。
4.2.3.人NCI-N87胃异种移植模型
在人NCI-N87胃模型中评估了人源化H1D9RR抗体、人源化H1D9RR ACCRETAMABTM抗体和人源化H1D9RR POTELLIGENTTM抗体的抗肿瘤活性。CB-17SCID小鼠每周两次i.p.给予50mg/kg。给予50mg/kg人源化H1D9RR ACCRETAMABTM抗体导致肿瘤体积下降在植入后第44天达到统计学显著性(p<0.05)(图47)。
5.讨论
人类癌症的小鼠模型已被广泛用于临床前情景以证实新抗癌药物的体内活性。本项研究中,在小鼠同系肺定植模型和多个人异种移植模型中对小鼠抗HER3单克隆mAb进行了评估以确定它们的活性并选择领先的候选抗体,用于进一步开发以适用人临床试验。
小鼠抗HER3mAbs导致小鼠B16F10肿瘤细胞在C57BL/6小鼠肺中的定植有显著下降。鼠1D9抗体的有效剂量方案是50/25mg/kg,i.p.,而鼠15D5抗体的25/5mg/kg,i.p.方案比更高剂量水平有更高的效力。这两种小鼠抗HER3mAbs随后在异种移植模型中进行了评估以评价抗人肿瘤的活性。
小鼠抗HER3mAbs延迟了晚期HER3+人异种移植物中已建立的肿瘤的生长。在CHL-1黑素瘤细胞植入后,用鼠1D9抗体或鼠15D5抗体以>5mg/kg的剂量每周两次的处理导致肿瘤生长发生显著的剂量依赖性下降。在皮下BxPC3胰脏异种移植模型中观察到相似的活性。
≥5mg/kg的1D9抗体和15D5抗体在CHL-1黑素瘤异种移植模型中保持剂量依赖性抗肿瘤活性。而且,用人源化1D9RR抗体或人源化1D9RRACCRETAMABTM抗体以5mg/kg进行的处理导致与≥25mg/kg的剂量相当的肿瘤生长延迟。
在皮下和原位BxPC3异种移植模型中,50mg/kg嵌合1D9抗体或人源化15D5抗体造成对肿瘤生长有直至研究结束的显著抑制,而20mg/kg人源化1D9RR抗体显示对皮下BxPC3模型中的肿瘤生长的显著效果。证实了这些抗体抗肿瘤生长的效力。
最后,人源化1D9RR抗体、人源化1D9RR ACCRETAMABTM抗体和人源化1D9RR POTELLIGENTTM抗体在NCI-N87胃模型中的评估表明,与抗CHL-1黑素瘤异种移植的活性相比,显示强化的mAbs的某些活性。
6.结论
用鼠亲代和/或人源化HER3单克隆抗体以0.5-100mg/kg的浓度范围每周两次给剂的疗法能够延迟CHL-1黑素瘤和BxPC3胰腺人异种移植模型中已经建立的HER3+人肿瘤的生长。
实施例9
1.概述
利用抗体依赖性细胞介导的细胞毒(ADCC)检验和补体介导的细胞毒(CDC)检验来评估野生型抗HER3抗体以及这些抗体的强化型的功能。
本实施例描述了用于评估野生型抗体和它们的强化型的功能的体外检验。这些检验方法使用了各种表达HER3的“目标”细胞来评估抗体与其目标结合的能力,然后加入补体或“效应”细胞来评估抗体的功能性Fc区。
2.简介
这些实施例显示了抗HER3“强化抗体”相对非强化的“野生型”抗体,功能性/效力的提高。
3.方法
3.1.试验准备
3.2.试验方案
3.2.1抗体依赖性细胞介导的细胞毒性
纯化的人外周血单核细胞被定性为这些ADCC检验中的效应细胞。简单来说,将用肝素钠采集的人全血使用密度梯度分离离心管(来自AccurateSurgical and Scientific的UNI-SEPMAXTM)纯化。然后将纯化的外周血单核细胞洗涤并重悬在不含酚红+10%FBS的RMPI1640中(1x107细胞/ml,T:E比率为1:50)。然后给HER3受体阳性细胞(HER3BACMAMTM转导的HEK293MSRII或CHL-1细胞)加载铕作为目标细胞。转导细胞作为高度表达HER3的细胞系,而CHL-1细胞作为低表达细胞系。将这些加载过的目标细胞用不含酚红+10%FBS的RMPI1640重悬至8x105细胞/ml。
将几个抗HER3抗体(25ul/孔)加样到96孔圆底板中。然后向含有抗体的微孔板中加入加载了铕的目标细胞(25ul/孔),于37°C和5%CO2温育30分钟。30分钟温育后,将100ul/孔的效应细胞加入微孔板,放回培养箱再温育2小时。特定细胞裂解的测量是通过从该试验微孔板中移出25ul/孔上清,转移到含有100ul/孔DELFIATMenhancement solution的96孔Maxisorp板中进行的。室温下温育5分钟后,然后将板在Wallac VICTORTMV读板仪上利用时间分辨荧光读数。从裂解目标细胞中释放到周围上清(细胞毒性)中的任何铕被测量为荧光单位。将数值转化为特异裂解百分比并用GRAPHPADTMPRISMTM软件作图为相对抗体浓度的特异性裂解百分数。用于计算细胞毒百分比的公式是:
对照孔:向“最大释放量”孔中加入去污剂TRITON XTM的1%溶液以减少细胞死亡和随后铕的释放。另外一些对照孔含有目标细胞,但没有效应细胞以便测量“自发”铕释放水平。
转导:给HEK293MSRII细胞加入合适的moi为100(对应8-15%病毒(v/v))的BACMAMTM病毒(人HER3、食蟹猴HER3或大鼠HER3)24小时。然后用TrypLE从组织培养瓶中移出转导细胞,洗涤几次,加载铕,然后用作ADCC检验中的目标细胞。
猴血:密度梯度分离缓冲液(FICOLLTM)用不含Ca2和Mg2的PBS稀释10%(v/v),之后对猴外周血淋巴细胞(效应细胞)进行密度离心。
按照已有政策在这些研究中使用人血。猴血按照成熟的实施方案获得。这些研究中使用的模型符合US动物管理标准。
3.2.2补体依赖性细胞毒性
这些试验使用了转导hHER3BACMAMTM的HEK293MSR II细胞系作为目标。简单来说,将这些细胞在T175培养瓶中,于37°C和5%CO2下,转导(moi100)大约21小时。然后用TrypLE从瓶上除下附着细胞,洗涤几次,然后以1x105细胞/50ul/孔加样到96孔板中。立即加入25ul/孔的抗人HER3mAbs,于37°C和5%CO2温育30分钟。温育后,向试验板中加入来自CALBIOCHEMTM的20ul/孔兔补体(最终20%),于37°C和5%CO2再温育2小时。细胞活性评估的进行通过用多道移液器给每孔加入100ul的CELLTITER-GLOTM并温和混匀。然后将板在Wallac VICTORTMV读板仪上读取发光信号(活细胞的信号增加)。
3.3.药物和材料
人HER3BACMAMTM
猴(食蟹猴)HER3BACMAMTM
FICOLLTMGE Healthcare#17-1440-02
TRITON X-100TMSigma#T9284
分离管Accurate Surgical&Scientific#UN-10
铕Fluka#207128
96孔圆底板Costar#3799)
96孔平底板Thermo Scientific#436110
人源化1D9Fc失活抗体
人源化1D9抗体
人源化1D9ACCRETAMABTM抗体
人源化1D91D9POTELLIGENTTM抗体
补体CALBIOCHEMTM#234400
CELLTITER GLOTMPromega#G7571
DELFIATMenhancement solution#4001-0010
3.4.数据分析
利用GRAPHPADTMPRISMTM软件做特异性裂解百分比相对抗体浓度的图,并计算EC50值。
4.结果
4.1ADCC检验
从评估人源化1D9抗体(某些情况中被称为HZ1D9或H6L2)、人源化1D9Fc失活抗体、人源化1D9POTELLIGENTTM抗体和人源化1D9ACCRETAMABTM抗体的人PBL ADCC检验得到的结果如图48和图49所示。这些结果是使用HER3BACMAMTM转导的HEK293细胞作为目标细胞,人外周血淋巴细胞作为效应细胞得到的(图48)。同时使用CHL-1细胞作为目标细胞群和相同的人PBL效应细胞进行了这个试验安排(图49)。这些结果清楚地显示了相比野生型(非强化)抗体,这些强化抗体取得了增加的效力和增加的最大裂解。
从评估人源化1D9抗体(某些情况中被称为HZ1D9或H6L2)、人源化1D9Fc失活抗体、人源化1D9POTELLIGENTTM抗体和人源化1D9ACCRETAMABTM抗体的食蟹猴PBL(外周血淋巴细胞)ADCC检验得到的结果如图50和图53所示。这些结果是使用HER3BACMAMTM转导的HEK293细胞作为目标细胞,食蟹猴外周血淋巴细胞作为效应细胞得到的(图50和图51)。同时使用CHL-1细胞作为目标细胞群和相同的食蟹猴PBL效应细胞进行了这个试验安排(图52和图53)。这些结果清楚地显示了相比野生型(非强化)抗体,这些强化抗体取得了增加的效力和增加的最大裂解。
4.2CDC检验
图54中显示的结果是从使用人HER3转导的HEK293目标细胞和兔补体进行的CDC检验得到的。结果显示人源化1D9抗体(某些情况中被称为HZ1D9或H6L2)和人源化1D9POTELLIGENTTM抗体各自带来了类似水平的补体介导的目标细胞裂解。而人源化1D9ACCRETAMABTM抗体在补体介导的裂解方面比在其他抗体中看到的提高了至少10倍。人源化1D9Fc失活抗体未显示任何可测量的补体介导的裂解。
5.讨论
这里提供的结果证实了人源化1D9抗体(例如人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体)的“Fc强化”型在抗体依赖性细胞介导的细胞毒检验和补体依赖性细胞毒检验中都显示出提高的功能。高(ADCC和CDC)和低(ADCC)人HER3表达细胞系以及食蟹猴HER3表达细胞(ADCC)中都证实了这一点。
人效应细胞的数据与在人类群体中可能看到的情况是有关联的,因为这里未使用选择标准,以保证ADCC/CDC反应性。虽然在个体人供体之间看到某些差异(高特异性裂解相比低特异性裂解),“Fc-强化”型抗体一致显示比亲代野生型抗体更高的效力。食蟹猴效应细胞数据允许我们对效应细胞进行定性,而不是将真正的猴用于令人难过的毒性研究中。
总之,人源化1D9ACCRETAMABTM抗体和人源化1D9POTELLIGENTTM抗体均(分别)显示出提高的ADCC和ADCC/CDC功能性。
实施例10
1.概述
小鼠15D5抗体(M5.15D5.2A1.1H10)是能够结合人HER3受体的胞外区结构域II的鼠抗HER3抗体。经免疫组织化学证明该抗体能与冷冻的和福尔马林固定石蜡包埋(FFPE)的人癌组织很好地结合。
2.简介
验证了小鼠15D5抗体(M5.15D5.2A1.1H10)作为评估HER3表达的搭配诊断的潜力。这种搭配诊断可以用于帮助鉴定可以在临床上从抗HER3单克隆抗体疗法受益的患者。搭配mAb可以用于将肿瘤根据它们在肿瘤组织之间HER3表达水平和/或HER3受体表达强度来分类。
本实施例概括了帮助验证小鼠15D5抗体(M5.15D5.2A1.1H10)特异性的一些关键试验。本实施例中的试验检验了小鼠15D5抗体(M5.15D5.2A1.1H10)抗体对HER3和其他HER家族成员(例如HER1、HER2和HER4)的免疫反应性和特异性。本实施例描述了由以下得到的结果:冷冻和福尔马林固定石蜡包埋组织的免疫组织化学;四个HER家族成员(例如HER1、HER2、HER3和HER4)的免疫细胞化学,免疫沉淀;证明特异性的竞争分析以及细胞裂解物和纯化HER3胞外结构域的Western印迹。
3.方法
3.1.试验准备
3.2.试验方案
3.2.1.Her家族成员的Western印迹
HEK293MSRII细胞用HER1、HER2、HER3或HER4BACMAMTM以100的感染复数(moi)在37°C和5%CO2下转导22小时。每个细胞系用维尔烯(versene)收集,用台盼蓝排除染色进行细胞计数。细胞悬液用10mls PBS洗涤后,收集3x107个细胞,加入1ml RIPA裂解液(RIPA裂解液储液:10ml1x RIPA裂解缓冲液+1片mini halt蛋白酶抑制剂)中。然后将该制品涡旋2分钟,离心,将上清液(细胞裂解物)4°C保存。
将细胞裂解物与LDS样品缓冲液和还原剂合并,然后加热至70°C10分钟。待冷却至室温,将裂解物放入QIASHREDDERTM,14,000rpm转2分钟。然后将裂解物上样到4-12%梯度Bis-Tris凝胶的泳道中,电泳分离蛋白。将分开的蛋白转移到硝基纤维素上,然后用含有0.1%Tween-20的封闭溶液温育过夜。室温下加入针对HER1、HER2、HER3或HER4家族成员的一抗5个小时。之后与偶联IR的二抗温育1小时。然后利用LI-CORTMODYSSEYTM图像分析仪器显现印迹。
3.2.2,利用小鼠15D5抗体进行的免疫沉淀
将如上所述由3x107细胞/ml悬浮液制备的200μl裂解物与10ug小鼠15D5抗体(M5.15D5.2A1.1H10)合并,在旋转装置上于4°C保温过夜。然后将抗原-抗体复合物与50μl处理过的固定蛋白A/G树脂(100μl树脂浆)合并,室温下在旋转装置上轻柔混合温育2小时。于4°C在5,000rpm(~1,000xg)离心5分钟收集免疫沉淀物。然后将沉淀物用1ml RIPA缓冲液洗涤4次。将洗过的沉淀物用20ul1X LDS上样缓冲液(100ul RIPA缓冲液、33ul LDS样品缓冲液(4X)、13.3ul还原剂(10X))重悬,样品在100°C沸腾5分钟。样品置冰上冷却后,在5,000rpm(~1,000xg)离心1分钟。然后将这些样品加样到凝胶中(0.4ug/泳道HER3抗原,10ul/泳道HER家族BACMAMTM转导的HEK293MSRII裂解物和20ul/泳道CHL-1细胞裂解物),在200V跑胶大概50分钟。将胶分离蛋白转移到硝酸纤维素是,产生的印迹与商品抗HER3一级mAb(R&D System MAB3482)温育,随后与偶联IR的山羊抗小鼠二抗温育。然后利用LI-CORTMODYSSEYTM图像分析仪器显现印迹。
3.2.3.Her家族成员的免疫细胞化学
将HEK293MSRII细胞用100moi的Her3BACMAMTM在37°C和5%CO2转导24小时。然后用TrypLE收集细胞,将细胞计数并用PBS洗涤。然后在PBS中制备0.5x106细胞/ml悬液,取100ul该悬液加入带有附着的显微镜玻片的Cytospin滤器中。将它们在500rpm转5分钟产生含有50,000个细胞的细胞点。玻片在生物通风橱中干燥过夜,第二天用室温丙酮固定2分钟。干燥2小时后,将玻片包在Saran wrap中,-20°C保存待用于免疫染色。
从-20°C冰柜取出6个玻片,恢复到室温并风干。干后用Pap笔标出每个细胞点给染色形成疏水屏蔽。将玻片放入TBST(Tris盐缓冲液+0.05%TWEEN-20TM)水合10分钟,加入蛋白封闭液中30分钟。将1ug/ml一抗鼠15D5抗体直接加样到玻片上室温下2小时。玻片用TBST洗三次,直接加偶联HRP的抗小鼠二抗室温下2小时。将玻片用TBST每次5分钟,洗三次,然后加入DAB底物2分钟。然后将玻片用水每次5分钟,洗三次,在苏木精中放置2分钟。然后用水将玻片每次5分钟,洗三次,允许玻片干燥完全,然后加上盖片进行观察。
3.2.4.利用HER3胞外结构域II区进行的竞争分析
将HEK293MSRII细胞用100moi的Her3BACMAMTM在37°C和5%CO2转导24小时。温育结束后,用TrypLE收集细胞,将细胞计数并用PBS洗涤。然后将细胞在PBS中重悬到0.5x106细胞/ml悬液,取100ul加入带有附着的显微镜玻片的Cytospin滤器中。将它们在500rpm转5分钟产生含有50,000个细胞的细胞点。玻片在生物通风橱中干燥过夜,第二天用室温丙酮固定2分钟。干燥2小时后,将玻片包在SARANTMwrap中,-20°C保存待用于免疫染色。
从冰柜取出2个玻片,恢复到室温并风干。干后用Pap笔圈出细胞点给染色形成疏水屏蔽。将玻片放入TBST(Tris盐缓冲液+0.05%TWEEN-20TM)水合10分钟,加入蛋白封闭液中30分钟。将1ug/ml的一抗或者1:1摩尔比率的一抗和人HER3结构域II直接加样到玻片上室温2个小时。将玻片用TBST洗三次,并直接加上偶联HRP的抗小鼠二抗室温下1小时。玻片用TBST每次5分钟,洗三次,然后加入DAB底物5分钟。玻片用水每次5分钟,洗三次。允许玻片干燥完全,然后加上盖片进行观察。
3.2.5.HER3胞外结构域的Western印迹
将四个HER3胞外结构域与含有还原剂的LDS(十二烷基硫酸锂)样品缓冲液合并,加热至70°C10分钟。待冷却至室温,将裂解物上样到4-12%梯度Bis-Tris凝胶的泳道中,电泳分离蛋白。将分开的蛋白通过转移到硝基纤维素上产生印迹,然后用含有0.1%Tween-20的封闭溶液温育过夜。然后将印迹与稀释过的鼠15D5抗体(M5.15D5.2A1.1H10)室温下保温2小时。之后印迹与偶联IR的二抗温育1小时。然后利用LI-CORTMODYSSEYTM图像分析仪器显现印迹。
3.2.6.冷冻和FFPE组织的免疫组织化学
将人乳腺癌组织(16943a1d、16945a1o、22687a1p、23110a1k)保存为来自相同切除肿瘤的冷冻和福尔马林固定石蜡包埋(FFPE)样品。
将保存的人乳腺癌组织切片用于HER3受体表达的免疫组织化学(IHC)评估。简单来说,将FFPE组织按照6um切片,使用VARISTAINTMGeminiES Automated Slide Stainer通过一系列二甲苯取代和乙醇步骤脱石蜡和重新水合。利用DECLOAKING CHAMBERTM采用了几个抗原恢复(表位修复)方法以便对各种条件进行比较。在用Tris-0.05%TWEEN-20TM缓冲液进行的洗涤步骤后,将组织与过氧化物酶温育封闭5分钟,然后用蛋白封闭液封闭。给组织切片施加一抗30-60分钟。洗涤步骤后,施加二抗30–60分钟。再一个洗涤步骤后,与DAB(二氨基联苯胺)温育5分钟以显现特异免疫反应性。组织切片然后用水冲洗,用苏木精复染1分钟。用Dako Autostainer System进行单克隆抗体的染色。
将冷冻组织以6微米切片到显微镜玻片上,室温下干燥2小时。然后用丙酮室温下将玻片上的组织切片固定2分钟并干燥。用Tris-0.05%TWEEN-20TM缓冲液洗后,将组织与过氧化物酶温育封闭5分钟,并接受蛋白封闭液。按照以上对FFPE组织的概述继续染色。
3.2.7.多肿瘤TMA的免疫组织化学评价
使用标准或者自动染色方案将玻片染色。将肿瘤切片并脱石蜡。切片与内源过氧化物酶和非特异性抗体结合封闭液温育,进行表位修复,然后与一抗温育。温育之间进行了洗涤步骤。进行了非特异性结合的标准封闭步骤。进行了标准抗原修复技术。对于手工染色,可以按照生产商的指导,利用生物素化的二抗结合ABCTMHRP试剂盒(Vector Laboratories,Inc.),或者ENVISIONTMHRP偶联聚合物试剂盒(Dako North America,Inc.)和二氨基联苯胺底物反应产物使结合可视化。对于自动染色,利用OMNIMAPTMHRP聚合物化学(Ventana Medical Systems,Inc.)实现可视化。用标准的苏木精或者合适情况下用甲基绿核复染技术将切片复染。
3.3.药物和材料
HER1BACMAMTM病毒粒子
人HER2BACMAMTM病毒粒子
人HER3BACMAMTM病毒粒子
人HER4BACMAMTM病毒粒子
LDS样品缓冲液(Invitrogen NP0007)
QIASHREDDERTM(Qiagen79656)
MINI-HALTTM蛋白酶抑制剂(Roche diagnostics13535400)
Western封闭缓冲液(Rockland MB-070)
硝酸纤维素膜(Invitrogen LC2000)
兔抗人ErbB2(人HER2)(Dako A0485)
小鼠抗人EGFR(人HER1)Dako M3563Clone H11
山羊抗小鼠IR-DYE800TM抗体(Rockland610-131-121)
山羊抗兔IR-DYE680TM抗体(Li-Cor Odyssey827-88367)
抗人HER3单克隆抗体(R&D System MAB3482)
Tris盐缓冲液(Dako#S1968)
ENVISIONTMSystem-HRP DAB kit(Dako#K4007)
鼠15D5抗体(M5.15D5.2A1.1H10)(3.19mg/ml)
人HER3结构域II(用于竞争)(1.66mg/ml)
蛋白封闭液(Dako X0909lot10037797)
THERMO SHANDON EZ DOUBLE CYTOFUNNELTM(#A78710005)
VWR SUPERFROST PLUSTM#48311-703
TRYPLETMSelect(Gibco12563-011)
RIPA缓冲液(Sigma R0278)
多肿瘤人组织微阵列(TMA)Hu80357(CAMB12-GSK-TMA-Origene)
4.结果
4.1.1.
对表达四种HER家族成员的细胞裂解物的Western印迹显示鼠15D5抗体(M5.15D5.2A1.1H10)选择性地识别人HER3,而与人HER1、人HER2和人HER4只有很少甚至没有交叉反应。为了证实HER2和HER1的表达并进行比较,还在这些裂解物上测试了抗HER2(Dako)和HER1(Dako)的商品化抗体。结果证实通过对HEK293细胞的转导表达了人HER2和人HER1。结果还显示与抗HER2抗体(Dako)的某些交叉反应性。
4.1.2.
使用人HER3转导的HEK293细胞和CHL-1细胞进行的免疫沉淀试验提供了对高和低HER3表达细胞系进行考察的机会。这些试验显示使用小鼠15D5抗体(M5.15D5.2A1.1H10)或商品化抗HER3抗体(R&D Systems)检测免疫沉淀中的人HER3得到了相似的免疫反应性条带模式。
4.1.3.
使用小鼠15D5抗体(M5.15D5.2A1.1H10)对人HER1、人HER2、人HER3和人HER4BACMAMTM转导的细胞进行的免疫细胞化学分析显示与人HER3有强烈的免疫反应性,而与其他HER家族成员有很少甚至没有免疫反应性。小鼠15D5抗体(M5.15D5.2A1.1H10)优先结合人HER3。
4.1.4.
使用小鼠15D5抗体(M5.15D5.2A1.1H10)或小鼠15D5抗体(M5.15D5.2A1.1H10),组合等摩尔浓度的人HER3结构域II ECD进行的竞争分析显示鼠15D5抗体(M5.15D5.2A1.1H10)免疫反应性被与人HER3结构域II进行的预温育完全阻断。这些结果证实了小鼠15D5抗体(M5.15D5.2A1.1H10)特异结合人HER3受体的胞外结构域II区域。
4.1.5.
对HER3胞外结构域的Western印迹分析证实了小鼠15D5抗体(M5.15D5.2A1.1H10)对人HER3结构域II有特异性,且该抗体对人HER3结构域I、III和IV没有免疫反应性。
4.1.6.
对冷冻和FFPE匹配癌变乳房组织(n=4)进行的免疫组织化学染色显示了一致的染色模式。虽然FFPE组织比冷冻样品更好地保持了结构的完整性,膜染色模式在这两种保存方法之间非常相似。图6显示了在这些冷冻和固定的乳房组织中看到的膜染色的一个代表性照片。
4.1.7.
使用小鼠15D5抗体(M5.15D5.2A1.1H10)评估了多肿瘤阵列(Hu80357)的HER3表达情况,所述阵列含有肿瘤和代表性正常组织。对指示的结肠、前列腺、乳腺、子宫内膜、脑和皮肤肿瘤核心的定性评估均显示出人HER3的表达。一个肾肿瘤样品和一个肺癌样品显示了人HER3表达。最强劲的人HER3表达出现在黑素瘤和前列腺肿瘤样品中。7个黑素瘤和7个前列腺肿瘤样品展示强劲的人HER3表达。8个乳腺癌样品也显示了人HER3表达。正常组织样品显示出比肿瘤样品低得多的信号,但有3个正常结肠样品和1个正常乳房样品显示了中等强度的信号。
5.讨论与总结
本报告中描述的试验证实了小鼠15D5抗体(M5.15D5.2A1.1H10)的灵敏性和特异性。正如文中所述,小鼠15D5抗体(M5.15D5.2A1.1H10)最初是在初步ELISA筛选的基础上,根据它对HER3胞外区域的特异性从一组杂交瘤中选出的。另外还使用BACMAMTM转导的细胞通过Western印迹和免疫细胞化学研究了对HER3的特异性。在这些试验中,人HER3转导的细胞显示出特异免疫反应性,而表达其他人HER家族成员的细胞显示很少甚至没有反应性。小鼠15D5抗体(M5.15D5.2A1.1H10)还被用于免疫沉淀分析中与显示了特异性HER3“拖低(pull-down)”的商品化抗体组合。此外,对人HER3转导细胞的细胞分离制品以及这些细胞的冷冻制品进行的免疫细胞化学检验证实了小鼠15D5抗体(M5.15D5.2A1.1H10)在各项分析中识别HER3,并且在免疫细胞化学检验中能够结合HER3。小鼠15D5抗体(M5.15D5.2A1.1H10)与人HER3受体的结合能够被该抗体与人HER3胞外结构域II区域的预温育阻断,证明了它对该HER3区域的特异性。
在类似的经杆状病毒转导的细胞(经过福尔马林固定和石蜡加工)上,开发了针对小鼠15D5抗体(M5.15D5.2A1.1H10)的另外的免疫组织化学分析方案,进一步证实小鼠15D5抗体(M5.15D5.2A1.1H10)经由IHC检测HER3的能力与细胞制备方式无关。本实施例中描述的试验通过显示在乳腺癌的冷冻和FFPE样品匹配对中人HER3的免疫反应性,强有力地证明了小鼠15D5抗体(M5.15D5.2A1.1H10)行为的跨平台一致性。小鼠15D5抗体(M5.15D5.2A1.1H10)在两种样本制品中检测到的人HER3信号的丰度和相对表达是一样的。使用小鼠15D5抗体(M5.15D5.2A1.1H10)在不同肿瘤类型组上进行的免疫组织化学目标验证研究显示表达存在差异,但在特定肿瘤类型中(例如黑素瘤、前列腺、乳腺癌)有HER3模式和相对丰度的一致性。此外,小鼠15D5抗体(M5.15D5.2A1.1H10)成功地在不同试验方案和染色系统中检测到HER3。这些发现显示了小鼠15D5抗体(M5.15D5.2A1.1H10)可以通过免疫组织化学一贯准确地检测到肿瘤切片中的人HER3,无论试验方案和样本保存方式如何都如此。
小鼠15D5抗体(M5.15D5.2A1.1H10)还能在多种分析方法中特异检测到HER3的胞外结构域。本实施例中还描述了小鼠15D5抗体(M5.15D5.2A1.1H10)尽管有变异,但在这些检验中一致性很好。特别是小鼠15D5抗体(M5.15D5.2A1.1H10)展示出经由免疫组织化学能够高特异性和高灵敏度地检测到组织切片中的人HER3。此外,小鼠15D5抗体(M5.15D5.2A1.1H10)能够利用不同检验方法在相同样品中检测到等同水平的人HER3(表明小鼠15D5抗体(M5.15D5.2A1.1H10)信号和存在的人HER3量之间有直接比例关系)。总之,本实施例中描述的结果展示了小鼠15D5抗体(M5.15D5.2A1.1H10)的性能、特异性和一致性,支持了它适合作为人HER3诊断分析(例如IHC分析)中的抗体试剂。
实施例11
非正式序列表
以下带有下划线的序列部分限定了抗体重链可变和轻链可变部分中的CDR序列或者编码这些CDR序列的核酸序列。例如,在SEQ ID NO:1中,框架和CDRS按顺序从序列的氨基部分到羧基端部分显示为纯文本框架1、带下划线的CDR1、纯文本框架2、待下划线的CDR2、纯文本框架3、带下划线的CDR3和纯文本框架4。斜体部分限定了信号序列。单字母氨基酸代码右侧的星号表示左侧的氨基酸残基是潜在的N-糖基化位点。这个体系用在了例如SEQ ID NO:s5、9、13、17、22、26、30、34、38-43、44、48、57等。还提供了列出了本文公开的各种抗体的细节的表格。参见下表17。
M5_15D5_2A1_1H10_VH
SEQ ID NO:1
EFQLQQSGPELVKPGASVKISCKASGYSFTDYNMNWVKQNNGKSLEWIGGINPNYGT TVYNQKFKGKATLTVDQSSSTAYMQLVSLTSEDSAVYYCARMTTIVPFDYWGQGTTLTVSS
M5_15D5_2A1_1H10_CDRH1
SEQ ID NO:2
DYNMN
M5_15D5_2A1_1H10_CDRH2
SEQ ID NO:3
GINPNYGTTVYNQKFKG
M5_15D5_2A1_1H10_CDRH3
SEQ ID NO:4
MTTIVPFDY
M5_15D5_2A1_1H10_VL
SEQ ID NO:5
DIQMTQTTFSLSASLGDRVTISCRASQDISNYLNWYQQKPDGTVKLLIYYTSTLHSGVPSRFSGSGSGTDYFLTIRNLEEEDIATYFCQQGYTLPWTFGGGTKLDIK
M5_15D5_2A1_1H10_CDRL1
SEQ ID NO:6
RASQDISNYLN
M5_15D5_2A1_1H10_CDRL2
SEQ ID NO:7
YTSTLHS
M5_15D5_2A1_1H10_CDRL3
SEQ ID NO:8
QQGYTLPWT
M5_22A5_1G6_1C10_VH
SEQ ID NO:9
EVQLVESGGGLVKPGGSLKLSCAASGFTFSDYGMHWLRQAPEKGLEWVAYITSGSSEI YYVDTVKGRFTISRDNAKNTLCLQMTSLRSEDTAMYHCARGYGYREGYFDVWGTGTTVTVSS
M5_22A5_1G6_1C10_CDRH1
SEQ ID NO:10
DYGMH
M5_22A5_1G6_1C10_CDRH2
SEQ ID NO:11
YITSGSSEIYYVDTVKG
M5_22A5_1G6_1C10_CDRH3
SEQ ID NO:12
GYGYREGYFDV
M5_22A5_1G6_1C10_VL_LC1
SEQ ID NO:13
DVVMTQTPLTLSVTIGQPASISCKSSQSLLDSDGKTYLNWLLQRPGQSPKRLIYLVSKL DSGVPDRFTGSGSGTDFTLKISRVEAEDLGVYYCWQGTHFPQTFGGGTKLEIK
M5_22A5_1G6_1C10_CDRL1_LC1
SEQ ID NO:14
KSSQSLLDSDGKTYLN
M5_22A5_1G6_1C10_CDRL2_LC1
SEQ ID NO:15
LVSKLDS
M5_22A5_1G6_1C10_CDRL3_LC1
SEQ ID NO:16
WQGTHFPQT
>M5_22A5_1G6_1C10_VL_LC2
SEQ ID NO:17
DIQMTQSPASLSVSVGETVTITCRTSENVYSNLAWYQQKQGRSPQLLVYGATRLPDGVPARFSGSGSGTQYSLKINSLQSEDFGTYYCQLFWGIPLTFGAGTKLELK
M5_22A5_1G6_1C10_CDRL1_LC2
SEQ ID NO:18
RTSENVYSNLA
M5_22A5_1G6_1C10_CDRL2_LC2
SEQ ID NO:19
GATRLPD
M5_22A5_1G6_1C10_CDRL3_LC2
SEQ ID NO:20
QLFWGIPLT
人HER3氨基酸序列
SEQ ID NO:21
MRANDALQVLGLLFSLARGSEVGNSQAVCPGTLNGLSVTGDAENQYQTLYKLYERCEVVMGNLEIVLTGHNADLSFLQWIREVTGYVLVAMNEFSTLPLPNLRVVRGTQVYDGKFAIFVMLNYNTNSSHALRQLRLTQLTEILSGGVYIEKNDKLCHMDTIDWRDIVRDRDAEIVVKDNGRSCPPCHEVCKGRCWGPGSEDCQTLTKTICAPQCNGHCFGPNPNQCCHDECAGGCSGPQDTDCFACRHFNDSGACVPRCPQPLVYNKLTFQLEPNPHTKYQYGGVCVASCPHNFVVDQTSCVRACPPDKMEVDKNGLKMCEPCGGLCPKACEGTGSGSRFQTVDSSNIDGFVNCTKILGNLDFLITGLNGDPWHKIPALDPEKLNVFRTVREITGYLNIQSWPPHMHNFSVFSNLTTIGGRSLYNRGFSLLIMKNLNVTSLGFRSLKEISAGRIYISANRQLCYHHSLNWTKVLRGPTEERLDIKHNRPRRDCVAEGKVCDPLCSSGGCWGPGPGQCLSCRNYSRGGVCVTHCNFLNGEPREFAHEAECFSCHPECQPMEGTATCNGSGSDTCAQCAHFRDGPHCVSSCPHGVLGAKGPIYKYPDVQNECRPCHENCTQGCKGPELQDCLGQTLVLIGKTHLTMALTVIAGLVVIFMMLGGTFLYWRGRRIQNKRAMRRYLERGESIEPLDPSEKANKVLARIFKETELRKLKVLGSGVFGTVHKGVWIPEGESIKIPVCIKVIEDKSGRQSFQAVTDHMLAIGSLDHAHIVRLLGLCPGSSLQLVTQYLPLGSLLDHVRQHRGALGPQLLLNWGVQIAKGMYYLEEHGMVHRNLAARNVLLKSPSQVQVADFGVADLLPPDDKQLLYSEAKTPIKWMALESIHFGKYTHQSDVWSYGVTVWELMTFGAEPYAGLRLAEVPDLLEKGERLAQPQICTIDVYMVMVKCWMIDENIRPTFKELANEFTRMARDPPRYLVIKRESGPGIAPGPEPHGLTNKKLEEVELEPELDLDLDLEAEEDNLATTTLGSALSLPVGTLNRPRGSQSLLSPSSGYMPMNQGNLGESCQESAVSGSSERCPRPVSLHPMPRGCLASESSEGHVTGSEAELQEKVSMCRSRSRSRSPRPRGDSAYHSQRHSLLTPVTPLSPPGLEEEDVNGYVMPDTHLKGTPSSREGTLSSVGLSSVLGTEEEDEDEEYEYMNRRRRHSPPHPPRPSSLEELGYEYMDVGSDLSASLGSTQSCPLHPVPIMPTAGTTPDEDYEYMNRQRDGGGPGGDYAAMGACPASEQGYEEMRAFQGPGHQAPHVHYARLKTLRSLEATDSAFDNPDYWHSRLFPKANAQRT
人源化_15D5_VH氨基酸序列
人源化15D5H4
SEQ ID NO:22
QVQLVQSGAEVKKPGASVKVSCKASGYTFTDYNMNWVRQAPGQGLEWMGGINPNY GTTVYNQKFKGKVTLTVDTSISTAYMELSRLRSDDTAVYYCARMTTIVPFDYWGQGTTVTVSS
人源化_15D5_CDRH1氨基酸序列
SEQ ID NO:23
DYNMN
人源化_15D5_CDRH2氨基酸序列
SEQ ID NO:24
GINPNYGTTVYNQKFKG
人源化_15D5_CDRH3氨基酸序列
SEQ ID NO:25
MTTIVPFDY
人源化_15D5_VL氨基酸序列
人源化15D5L1
SEQ ID NO:26
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSTLHSGVPSRFSGSGSGTDYTFTISSLQPEDIATYYCQQGYTLPWTFGGGTKVEIKR
人源化_15D5_CDRL1氨基酸序列
SEQ ID NO:27
RASQDISNYLN
人源化_15D5_CDRL2氨基酸序列
SEQ ID NO:28
YTSTLHS
人源化_15D5_CDRL3氨基酸序列
SEQ ID NO:29
QQGYTLPWT
人源化_1D9_VH氨基酸序列
SEQ ID NO:30
人源化1D9H6
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMHWVRQAPGQGLEWMGVIDPSD GYSHYNQKFKGKVTLTVDTSISTAYMELSRLRSDDTAVYYCAGGLAGTLDYWGQGTTVTVSS
人源化_1D9_CDRH1氨基酸序列
SEQ ID NO:31
SYWMH
人源化_1D9_CDRH2氨基酸序列
SEQ ID NO:32
VIDPSDGYSHYNQKFKG
人源化_1D9_CDRH3氨基酸序列
SEQ ID NO:33
GLAGTLDY
人源化_1D9_VL氨基酸序列
SEQ ID NO:34
人源化1D9L2
DIQMTQSPSSLSASVGDRVTITCRSSQSIVHSSGNTYLQWFQQKPGKAPKLLIYKVSNR FSGVPSRFSGSGSGTDFTLTISSLQPEDFAVYYCFQGSHVPWTFGQGTKLEIKR
人源化_1D9_CDRL1氨基酸序列
SEQ ID NO:35
RSSQSIVHSSGNTYLQ
人源化_1D9_CDRL2氨基酸序列
SEQ ID NO:36
KVSNRFS
人源化_1D9_CDRL3氨基酸序列
SEQ ID NO:37
FQGSHVPWT
鼠15D5_VH核酸序列
SEQ ID NO:38
GAGTTCCAGCTGCAGCAGAGCGGCCCCGAGCTGGTGAAGCCCGGCGCCAGCGTGAAGATCAGCTGCAAGGCCAGCGGCTACAGCTTCACCGACTACAACATGAACTGGGTGAAGCAGAACAACGGCAAGAGCCTGGAGTGGATCGGCGGCATCAACCCCAACTACGGCACCACCGTGTACAACCAGAAGTTCAAGGGCAAGGCCACCCTGACCGTGGACCAGAGCAGCAGCACCGCCTACATGCAGCTGGTGAGCCTGACCAGCGAGGACAGCGCCGTGTACTACTGCGCCAGGATGACCACCATCGTGCCCTTCGACTACTGGGGCCAGGGCACCACCCTGACCGTGAGCAGC
鼠15D5_VL核酸序列
SEQ ID NO:39
GACATCCAGATGACCCAGACCACCTTCAGCCTGAGCGCCAGCCTGGGCGACAGGGTGACCATCAGCTGCAGGGCCAGCCAGGACATCAGCAACTACCTGAACTGGTACCAGCAGAAGCCCGACGGCACCGTGAAGCTGCTGATCTACTACACCAGCACCCTGCACAGCGGCGTGCCCAGCAGGTTCAGCGGCAGCGGCAGCGGCACCGACTACTTCCTGACCATCAGGAACCTGGAGGAGGAGGACATCGCCACCTACTTCTGCCAGCAGGGCTACACCCTGCCCTGGACCTTCGGCGGCGGCACCAAGCTGGACATCAAG
人源化_15D5_VH核酸序列(细胞)
人源化15D5H4
SEQ ID NO:40
CAGGTCCAGCTCGTGCAGTCTGGGGCCGAGGTGAAGAAACCCGGCGCTAGCGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCGACTACAACATGAACTGGGTGAGGCAGGCCCCCGGCCAGGGCCTGGAGTGGATGGGCGGCATCAACCCCAACTACGGCACCACCGTGTACAACCAGAAGTTCAAGGGCAAGGTGACCCTGACCGTGGACACCAGCATCAGCACCGCCTACATGGAACTGAGCAGGCTGAGGAGCGACGATACCGCCGTGTACTATTGCGCCAGGATGACCACCATCGTGCCCTTCGACTACTGGGGACAGGGCACCACTGTGACAGTGTCAAGC
人源化_15D5_VL核酸序列(细胞)
人源化15D5L1
SEQ ID NO:41
GACATCCAGATGACCCAGTCACCCAGCAGCCTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCAGGGCCAGCCAGGACATCAGCAACTACCTGAACTGGTACCAGCAGAAGCCCGGCAAGGCCCCCAAGCTGCTGATCTACTACACCTCCACCCTGCACAGCGGCGTGCCCTCTAGGTTCTCCGGCAGCGGCAGCGGCACCGACTACACCTTCACCATCAGCAGCCTGCAGCCCGAGGACATCGCCACCTACTATTGCCAGCAGGGCTACACCCTCCCCTGGACTTTCGGAGGCGGCACCAAGGTGGAGATCAAGCGU
人源化_1D9_VH核酸序列(细胞)
人源化1D9H6
SEQ ID NO:42
CAGGTGCAGCTGGTGCAGTCCGGCGCAGAGGTGAAGAAGCCCGGAGCCTCTGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGAGGCAGGCCCCTGGCCAGGGCCTGGAGTGGATGGGCGTGATCGACCCCAGCGACGGGTACAGCCACTACAACCAGAAGTTCAAGGGCAAGGTCACCCTGACCGTGGACACCAGCATCAGCACCGCCTACATGGAACTCAGCAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCGGAGGCCTGGCTGGCACCCTGGATTACTGGGGCCAGGGCACCACAGTGACCGTGAGCAGC
人源化_1D9_VL核酸序列(细胞)
人源化1D9L2
SEQ ID NO:43
GACATCCAGATGACCCAGAGCCCCTCTAGCCTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCAGGAGCAGCCAGAGCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTtCCAGCAGAAACCCGGCAAGGCTCCCAAGCTGCTGATCTACAAGGTGAGCAACAGGTTCAGCGGCGTGCCCTCTCGCTTCTCAGGCAGCGGCTCCGGCACCGATTTCACCCTGACCATCAGCTCACTGCAGCCCGAGGACTTCGCCGTCTACTACTGCTTCCAGGGAAGCCACGTGCCCTGGACTTTTGGCCAGGGCACCAAGCTCGAGATCAAGAGG
鼠_1D9_VH氨基酸序列
SEQ ID NO:44
M5.1D9.1F5VH
QVQLQQPGAELVRPGTSVKLSCKASGYTFTSYWMHWVKQRPGQGLEWIGVIDPSDG YSHYNQKFKGKATLTVDTSSSTAYMQLSSLTSEDSAVYYCAGGLAGTLDYWGQGTTLTVSS
鼠_1D9_CDRH1氨基酸序列
SEQ ID NO:45
SYWMH
鼠_1D9_CDRH2氨基酸序列
SEQ ID NO:46
VIDPSDGYSHYNQKFKG
鼠_1D9_CDRH3氨基酸序列
SEQ ID NO:47
GLAGTLDY
鼠_1D9_VL氨基酸序列
SEQ ID NO:48
M5.1D9.1F5VL
DVLMTQTPLSLPVSLGDQASISCRSSQSIVHSSGNTYLQWFLQKPGQSPKLLISKVSNRF SGVPDRFSGSGSGTDFTLRISRVEAEDLGLYYCFQGSHVPWTFGGGTKLEIK
鼠_1D9_CDRL1氨基酸序列
SEQ ID NO:49
RSSQSIVHSSGNTYLQ
鼠_1D9_CDRL2氨基酸序列
SEQ ID NO:50
KVSNRFS
鼠_1D9_CDRL3氨基酸序列
SEQ ID NO:51
FQGSHVPWT
鼠_1D9_VH核酸序列
SEQ ID NO:52
CAGGTGCAGCTGCAGCAGCCCGGCGCCGAGCTGGTGAGGCCCGGCACCAGCGTGAAGCTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGAAGCAGAGGCCCGGCCAGGGCCTGGAGTGGATCGGCGTGATCGACCCCAGCGACGGCTACAGCCACTACAACCAGAAGTTCAAGGGCAAGGCCACCCTGACCGTGGACACCAGCAGCAGCACCGCCTACATGCAGCTGAGCAGCCTGACCAGCGAGGACAGCGCCGTGTACTACTGCGCCGGCGGCCTGGCCGGCACCCTGGACTACTGGGGCCAGGGCACCACCCTGACCGTGAGCAGC
鼠_1D9_VL核酸序列
SEQ ID NO:53
GACGTGCTGATGACCCAGACCCCCCTGAGCCTGCCCGTGAGCCTGGGCGACCAGGCCAGCATCAGCTGCAGGAGCAGCCAGAGCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTTCCTGCAGAAGCCCGGCCAGAGCCCCAAGCTGCTGATCAGCAAGGTGAGCAACAGGTTCAGCGGCGTGCCCGACAGGTTCAGCGGCAGCGGCAGCGGCACCGACTTCACCCTGAGGATCAGCAGGGTGGAGGCCGAGGACCTGGGCCTGTACTACTGCTTCCAGGGCAGCCACGTGCCCTGGACCTTCGGCGGCGGCACCAAGCTGGAGATCAAG
鼠_22A5_VH核酸序列
SEQ ID NO:54
GAGGTGCAGCTGGTGGAGAGCGGCGGCGGCCTGGTGAAGCCCGGCGGCAGCCTGAAGCTGAGCTGCGCCGCCAGCGGCTTCACCTTCAGCGACTACGGCATGCACTGGCTGAGGCAGGCCCCCGAGAAGGGCCTGGAGTGGGTGGCCTACATCACCAGCGGCAGCAGCGAGATCTACTACGTGGACACCGTGAAGGGCAGGTTCACCATCAGCAGGGACAACGCCAAGAACACCCTGTGCCTGCAGATGACCAGCCTGAGGAGCGAGGACACCGCCATGTACCACTGCGCCAGGGGCTACGGCTACAGGGAGGGCTACTTCGACGTGTGGGGCACCGGCACCACCGTGACCGTGAGCAGC
鼠_22A5_VL核酸序列
SEQ ID NO:55
GACGTGGTGATGACCCAGACCCCCCTGACCCTGAGCGTGACCATCGGCCAGCCCGCCAGCATCAGCTGCAAGAGCAGCCAGAGCCTGCTGGACAGCGACGGCAAGACCTACCTGAACTGGCTGCTGCAGAGGCCCGGCCAGAGCCCCAAGAGGCTGATCTACCTGGTGAGCAAGCTGGACAGCGGCGTGCCCGACAGGTTCACCGGCAGCGGCAGCGGCACCGACTTCACCCTGAAGATCAGCAGGGTGGAGGCCGAGGACCTGGGCGTGTACTACTGCTGGCAGGGCACCCACTTCCCCCAGACCTTCGGCGGCGGCACCAAGCTGGAGATCAAG
鼠_22A5_VL核酸序列
SEQ ID NO:56
GACATCCAGATGACCCAGAGCCCCGCCAGCCTGAGCGTGAGCGTGGGCGAGACCGTGACCATCACCTGCAGGACCAGCGAGAACGTGTACAGCAACCTGGCCTGGTACCAGCAGAAGCAGGGCAGGAGCCCCCAGCTGCTGGTGTACGGCGCCACCAGGCTGCCCGACGGCGTGCCCGCCAGGTTCAGCGGCAGCGGCAGCGGCACCCAGTACAGCCTGAAGATCAACAGCCTGCAGAGCGAGGACTTCGGCACCTACTACTGCCAGCTGTTCTGGGGCATCCCCCTGACCTTCGGCGCCGGCACCAAGCTGGAGCTGAAG
人源化_1D9_E_VL氨基酸序列
SEQ ID NO:57
人源化1D9E L2
DIQMTQSPSSLSASVGDRVTITCRSSQSIVHSSGNTYLQWFQQKPGKAPKLLIYKVSNR FSGVPSRFSGSGSGTDFTLTISSLQPEDFAVYYCFQGSHVPWTFGQGTKLEIKRR
人源化_1D9_E_VL核酸序列(细胞)
SEQ ID NO:58
GACATCCAGATGACCCAGAGCCCCTCTAGCCTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCAGGAGCAGCCAGAGCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTtCCAGCAGAAACCCGGCAAGGCTCCCAAGCTGCTGATCTACAAGGTGAGCAACAGGTTCAGCGGCGTGCCCTCTCGCTTCTCAGGCAGCGGCTCCGGCACCGATTTCACCCTGACCATCAGCTCACTGCAGCCCGAGGACTTCGCCGTCTACTACTGCTTCCAGGGAAGCCACGTGCCCTGGACTTTTGGCCAGGGCACCAAGCTCGAGATCAAGAGGCGT
鼠15D5_VH核酸序列(细胞)
SEQ ID NO:59
GAGTTCCAGCTGCAGCAGTCTGGACCTGAGCTGGTGAAGCCTGGCGCTTCAGTGAAGATATCCTGCAAGGCCTCTGGTTACTCATTTACTGACTACAATATGAACTGGGTGAAACAGAACAATGGAAAGAGCCTTGAGTGGATTGGAGGAATTAATCCTAACTATGGTACTACTGTTTACAATCAGAAGTTCAAGGGCAAGGCCACATTGACTGTAGACCAATCTTCCAGCACAGCCTACATGCAGCTCGTTAGTCTGACATCTGAGGACTCTGCAGTCTATTATTGTGCAAGAATGACCACGATAGTTCCCTTTGACTACTGGGGCCAAGGCACCACTCTCACAGTCTCCTCA
鼠15D5_VL核酸序列(细胞)
SEQ ID NO:60
GATATCCAGATGACACAGACTACATTCTCCCTGTCTGCCTCTCTGGGAGACAGAGTCACCATCAGTTGCAGGGCAAGTCAGGACATTAGTAATTATTTAAACTGGTATCAGCAGAAACCAGATGGAACTGTTAAACTCCTGATCTATTACACATCAACATTACACTCAGGAGTCCCATCAAGATTCAGTGGCAGTGGGTCTGGAACAGATTATTTTCTCACCATTAGGAACCTGGAGGAAGAAGATATTGCCACTTACTTTTGCCAACAGGGTTATACGCTTCCGTGGACGTTCGGTGGAGGCACCAAGTTGGACATCAAA
鼠_1D9_VH核酸序列(细胞)
SEQ ID NO:61
CAGGTCCAACTGCAGCAGCCTGGGGCTGAGCTGGTGAGGCCTGGGACTTCAGTGAAGTTGTCCTGCAAGGCCTCTGGCTACACCTTCACCAGCTACTGGATGCACTGGGTAAAGCAGAGGCCTGGACAAGGCCTTGAGTGGATCGGAGTGATTGATCCTTCTGATGGTTATAGTCACTACAATCAAAAGTTCAAGGGCAAGGCCACTTTGACTGTAGACACATCCTCCAGTACAGCCTACATGCAGCTCAGCAGCCTGACCTCTGAGGACTCTGCGGTCTATTACTGTGCAGGAGGCTTAGCTGGGACGCTTGACTACTGGGGCCAGGGCACCACTCTCACAGTCTCCTCA
鼠_1D9_VL核酸序列(细胞)
SEQ ID NO:62
GATGTTTTGATGACCCAAACTCCACTCTCCCTGCCTGTCAGTCTTGGAGATCAAGCCTCCATCTCTTGCAGATCTAGTCAGAGCATTGTACATAGTTCTGGAAACACCTATTTACAATGGTTCCTGCAGAAACCAGGCCAGTCTCCAAAGCTCCTGATCTCCAAAGTTTCCAACCGATTTTCTGGGGTCCCAGACAGGTTCAGTGGCAGTGGATCAGGGACAGATTTCACACTCAGGATCAGCAGAGTGGAGGCTGAGGATCTGGGACTTTATTACTGCTTTCAAGGTTCACATGTTCCGTGGACGTTCGGTGGAGGCACCAAGTTGGAAATCAAA
鼠_22A5_VH核酸序列(细胞)
SEQ ID NO:63
GAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTAGTGAAGCCCGGAGGGTCCCTGAAACTCTCCTGTGCAGCCTCTGGATTCACTTTCAGTGACTATGGAATGCACTGGCTTCGTCAGGCTCCAGAGAAGGGGCTGGAGTGGGTTGCATACATTACTAGTGGCAGTAGTGAAATCTACTATGTAGACACAGTGAAGGGCCGATTCACCATCTCCAGAGACAATGCCAAGAACACCCTGTGCCTGCAAATGACCAGTCTGAGGTCTGAGGACACGGCCATGTATCACTGTGCAAGGGGCTACGGTTATAGAGAGGGGTACTTCGATGTCTGGGGCACAGGGACCACGGTCACCGTCTCCTCA
鼠_22A5_VL核酸序列(细胞)
SEQ ID NO:64
GATGTTGTGATGACCCAGACTCCACTCACTTTGTCGGTTACCATTGGACAACCAGCCTCCATCTCTTGCAAGTCAAGTCAGAGCCTCTTAGATAGTGATGGAAAGACATATTTGAATTGGTTGTTACAGAGGCCAGGCCAGTCTCCAAAGCGCCTAATCTATCTGGTGTCTAAACTGGACTCTGGAGTCCCTGACAGGTTCACTGGCAGTGGATCAGGGACAGATTTCACACTGAAAATCAGCAGAGTGGAGGCTGAGGATTTGGGAGTTTATTATTGCTGGCAAGGTACACATTTTCCTCAGACGTTCGGTGGAGGCACCAAGCTGGAAATCAAA
鼠_22A5_VL核酸序列(细胞)
SEQ ID NO:65
GACATCCAGATGACTCAGTCTCCAGCCTCCCTATCTGTATCTGTGGGAGAAACTGTCACCATCACATGTCGAACAAGTGAGAATGTTTACAGTAATTTAGCATGGTATCAGCAGAAACAGGGAAGATCTCCTCAGCTCCTGGTCTATGGTGCAACAAGGTTACCAGATGGTGTGCCAGCAAGGTTCAGTGGCAGTGGATCAGGCACACAGTATTCCCTCAAGATCAACAGCCTGCAGTCTGAAGATTTTGGGACTTATTACTGTCAACTTTTTTGGGGTATCCCGCTCACGTTCGGTGCTGGGACCAAGCTGGAGCTGAAA
不含信号序列的人HER3胞外结构域(对应晶体结构)
SEQ ID NO:66
SEVGNSQAVCPGTLNGLSVTGDAENQYQTLYKLYERCEVVMGNLEIVLTGHNADLSFLQWIREVTGYVLVAMNEFSTLPLPNLRVVRGTQVYDGKFAIFVMLNYNTNSSHALRQLRLTQLTEILSGGVYIEKNDKLCHMDTIDWRDIVRDRDAEIVVKDNGRSCPPCHEVCKGRCWGPGSEDCQTLTKTICAPQCNGHCFGPNPNQCCHDECAGGCSGPQDTDCFACRHFNDSGACVPRCPQPLVYNKLTFQLEPNPHTKYQYGGVCVASCPHNFVVDQTSCVRACPPDKMEVDKNGLKMCEPCGGLCPKACEGTGSGSRFQTVDSSNIDGFVNCTKILGNLDFLITGLNGDPWHKIPALDPEKLNVFRTVREITGYLNIQSWPPHMHNFSVFSNLTTIGGRSLYNRGFSLLIMKNLNVTSLGFRSLKEISAGRIYISANRQLCYHHSLNWTKVLRGPTEERLDIKHNRPRRDCVAEGKVCDPLCSSGGCWGPGPGQCLSCRNYSRGGVCVTHCNFLNGEPREFAHEAECFSCHPECQPMEGTATCNGSGSDTCAQCAHFRDGPHCVSSCPHGVLGAKGPIYKYPDVQNECRPCHENCTQGCKGPELQDCLGQTLVLIGKTHLT
人源化1D9H0VH氨基酸序列
SEQ ID NO:67
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMHWVRQAPGQGLEWMGVIDPSD GYSHYNQKFKGRVTMTRDTSISTAYMELSRLRSDDTAVYYCARGLAGTLDYWGQGTTVTVSS
人源化1D9H0VH核酸序列
SEQ ID NO:68
CAGGTGCAGCTGGTGCAGTCCGGCGCAGAGGTGAAGAAGCCCGGAGCCTCTGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGAGGCAGGCCCCTGGCCAGGGCCTGGAGTGGATGGGCGTGATCGACCCCAGCGACGGGTACAGCCACTACAACCAGAAGTTCAAGGGCAGGGTCACCATGACCAGGGACACCAGCATCAGCACCGCCTACATGGAACTCAGCAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCAGGGGCCTGGCTGGCACCCTGGATTACTGGGGCCAGGGCACCACAGTGACCGTGAGCAGC
人源化1D9H1VH氨基酸序列
SEQ ID NO:69
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMHWVRQAPGQGLEWMGVIDPSD GYSHYNQKFKGRVTMTVDTSISTAYMELSRLRSDDTAVYYCARGLAGTLDYWGQGTTVTVSS
人源化1D9H1VH核酸序列
SEQ ID NO:70
CAGGTGCAGCTGGTGCAGTCCGGCGCAGAGGTGAAGAAGCCCGGAGCCTCTGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGAGGCAGGCCCCTGGCCAGGGCCTGGAGTGGATGGGCGTGATCGACCCCAGCGACGGGTACAGCCACTACAACCAGAAGTTCAAGGGCAGGGTCACCATGACCGTGGACACCAGCATCAGCACCGCCTACATGGAACTCAGCAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCAGGGGCCTGGCTGGCACCCTGGATTACTGGGGCCAGGGCACCACAGTGACCGTGAGCAGC
人源化1D9H2VH氨基酸序列
SEQ ID NO:71
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMHWVRQAPGQGLEWMGVIDPSD GYSHYNQKFKGRVTMTRDTSISTAYMELSRLRSDDTAVYYCAGGLAGTLDYWGQGTTVTVSS
人源化1D9H2VH核酸序列
SEQ ID NO:72
CAGGTGCAGCTGGTGCAGTCCGGCGCAGAGGTGAAGAAGCCCGGAGCCTCTGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGAGGCAGGCCCCTGGCCAGGGCCTGGAGTGGATGGGCGTGATCGACCCCAGCGACGGGTACAGCCACTACAACCAGAAGTTCAAGGGCAGGGTCACCATGACCAGGGACACCAGCATCAGCACCGCCTACATGGAACTCAGCAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCGGAGGCCTGGCTGGCACCCTGGATTACTGGGGCCAGGGCACCACAGTGACCGTGAGCAGC
人源化1D9H3VH氨基酸序列
SEQ ID NO:73
QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMHWVRQAPGQGLEWMGVIDPSD GYSHYNQKFKGKVTMTRDTSISTAYMELSRLRSDDTAVYYCARGLAGTLDYWGQGTTVTVSS
人源化1D9H3VH核酸序列
SEQ ID NO:74
CAGGTGCAGCTGGTGCAGTCCGGCGCAGAGGTGAAGAAGCCCGGAGCCTCTGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGAGGCAGGCCCCTGGCCAGGGCCTGGAGTGGATGGGCGTGATCGACCCCAGCGACGGGTACAGCCACTACAACCAGAAGTTCAAGGGCAAGGTCACCATGACCAGGGACACCAGCATCAGCACCGCCTACATGGAACTCAGCAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCAGGGGCCTGGCTGGCACCCTGGATTACTGGGGCCAGGGCACCACAGTGACCGTGAGCAGC
人源化1D9L0VL氨基酸序列
SEQ ID NO:75
DIQMTQSPSSLSASVGDRVTITCRSSQSIVHSSGNTYLQWYQQKPGKAPKLLIYKVSNR FSGVPSRFSGSGSGTDFTLTISSLQPEDFAVYYCFQGSHVPWTFGQGTKLEIKR
人源化1D9L0VL核酸序列
SEQ ID NO:76
GACATCCAGATGACCCAGAGCCCCTCTAGCCTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCAGGAGCAGCCAGAGCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTACCAGCAGAAACCCGGCAAGGCTCCCAAGCTGCTGATCTACAAGGTGAGCAACAGGTTCAGCGGCGTGCCCTCTCGCTTCTCAGGCAGCGGCTCCGGCACCGATTTCACCCTGACCATCAGCTCACTGCAGCCCGAGGACTTCGCCGTCTACTACTGCTTCCAGGGAAGCCACGTGCCCTGGACTTTTGGCCAGGGCACCAAGCTCGAGATCAAGAGG
人源化1D9L3VL氨基酸序列
SEQ ID NO:77
DVQMTQSPSSLSASVGDRVTITCRSSQSIVHSSGNTYLQWYQQKPGKAPKLLIYKVSN RFSGVPSRFSGSGSGTDFTLTISSLQPEDFAVYYCFQGSHVPWTFGQGTKLEIKR
人源化1D9L3VL核酸序列
SEQ ID NO:78
GACGTGCAGATGACCCAGAGCCCCTCTAGCCTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCAGGAGCAGCCAGAGCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTACCAGCAGAAACCCGGCAAGGCTCCCAAGCTGCTGATCTACAAGGTGAGCAACAGGTTCAGCGGCGTGCCCTCTCGCTTCTCAGGCAGCGGCTCCGGCACCGATTTCACCCTGACCATCAGCTCACTGCAGCCCGAGGACTTCGCCGTCTACTACTGCTTCCAGGGAAGCCACGTGCCCTGGACTTTTGGCCAGGGCACCAAGCTCGAGATCAAGAGG
人源化1D9L4VL氨基酸序列
SEQ ID NO:79
DILMTQSPSSLSASVGDRVTITCRSSQSIVHSSGNTYLQWYQQKPGKAPKLLIYKVSNR FSGVPSRFSGSGSGTDFTLTISSLQPEDFAVYYCFQGSHVPWTFGQGTKLEIKR
人源化1D9L4VL核酸序列
SEQ ID NO:80
GACATCCTGATGACCCAGAGCCCCTCTAGCCTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCAGGAGCAGCCAGAGCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTACCAGCAGAAACCCGGCAAGGCTCCCAAGCTGCTGATCTACAAGGTGAGCAACAGGTTCAGCGGCGTGCCCTCTCGCTTCTCAGGCAGCGGCTCCGGCACCGATTTCACCCTGACCATCAGCTCACTGCAGCCCGAGGACTTCGCCGTCTACTACTGCTTCCAGGGAAGCCACGTGCCCTGGACTTTTGGCCAGGGCACCAAGCTCGAGATCAAGAGG
人源化1D9L5VL氨基酸序列
SEQ ID NO:81
DVLMTQSPSSLSASVGDRVTITCRSSQSIVHSSGNTYLQWFQQKPGKAPKLLISKVSNR FSGVPSRFSGSGSGTDFTLTISSLQPEDFAVYYCFQGSHVPWTFGQGTKLEIKR
人源化1D9L5VL核酸序列
SEQ ID NO:82
GACGTGCTGATGACCCAGAGCCCCTCTAGCCTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCAGGAGCAGCCAGAGCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTTCCAGCAGAAACCCGGCAAGGCTCCCAAGCTGCTGATCAGCAAGGTGAGCAACAGGTTCAGCGGCGTGCCCTCTCGCTTCTCAGGCAGCGGCTCCGGCACCGATTTCACCCTGACCATCAGCTCACTGCAGCCCGAGGACTTCGCCGTCTACTACTGCTTCCAGGGAAGCCACGTGCCCTGGACTTTTGGCCAGGGCACCAAGCTCGAGATCAAGAGG
人源化1D9L6VL氨基酸序列
SEQ ID NO:83
DVVMTQSPLSLPVTLGQPASISCRSSQSIVHSSGNTYLQWFQQRPGQSPRRLIYKVSNR FSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPWTFGQGTKLEIKR
人源化1D9L6VL核酸序列
SEQ ID NO:84
GACGTGGTGATGACACAGAGCCCTCTGAGCCTGCCTGTGACCCTGGGCCAGCCCGCCAGCATTAGCTGCAGGAGCAGCCAGTCCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTTCCAGCAGAGGCCCGGCCAGAGCCCCAGGAGGCTGATCTACAAGGTGAGCAACAGGTTCAGCGGCGTGCCCGACAGATTCAGCGGCTCAGGCAGCGGCACCGACTTCACCCTCAAGATCAGCAGGGTGGAGGCCGAGGACGTGGGCGTCTACTACTGCTTCCAGGGGAGCCACGTGCCCTGGACCTTTGGACAGGGCACCAAGCTGGAGATCAAGAGG
人源化1D9L7VL氨基酸序列
SEQ ID NO:85
DVVMTQSPLSLPVTLGQPASISCRSSQSIVHSSGNTYLQWFQQRPGQSPRRLISKVSNRF SGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPWTFGQGTKLEIKR
人源化1D9L7VL核酸序列
SEQ ID NO:86
GACGTGGTGATGACACAGAGCCCTCTGAGCCTGCCTGTGACCCTGGGCCAGCCCGCCAGCATTAGCTGCAGGAGCAGCCAGTCCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTTCCAGCAGAGGCCCGGCCAGAGCCCCAGGAGGCTGATCAGCAAGGTGAGCAACAGGTTCAGCGGCGTGCCCGACAGATTCAGCGGCTCAGGCAGCGGCACCGACTTCACCCTCAAGATCAGCAGGGTGGAGGCCGAGGACGTGGGCGTCTACTACTGCTTCCAGGGGAGCCACGTGCCCTGGACCTTTGGACAGGGCACCAAGCTCGAGATCAAGAGG
人源化1D9L9VL氨基酸序列
SEQ ID NO:87
DVVMTQSPLSLPVTLGQPASISCRSSQSIVHSSGNTYLQWFQQRPGQSPKLLISKVSNRF SGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPWTFGQGTKLEIKR
人源化1D9L9VL核酸序列
SEQ ID NO:89
GACGTGGTGATGACACAGAGCCCTCTGAGCCTGCCTGTGACCCTGGGCCAGCCCGCCAGCATTAGCTGCAGGAGCAGCCAGTCCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTTCCAGCAGAGGCCCGGCCAGAGCCCCAAGCTGCTGATCAGCAAGGTGAGCAACAGGTTCAGCGGCGTGCCCGACAGATTCAGCGGCTCAGGCAGCGGCACCGACTTCACCCTCAAGATCAGCAGGGTGGAGGCCGAGGACGTGGGCGTCTACTACTGCTTCCAGGGGAGCCACGTGCCCTGGACCTTTGGACAGGGCACCAAGCTCGAGATCAAGAGG
人源化15D5H1VH氨基酸序列
SEQ ID NO:90
QFQLVQSGAEVKKPGASVKVSCKASGYSFTDYNMNWVKQAPGQGLEWIGGINPNYG TTVYNQKFKGKATLTVDQSISTAYMELSRLRSDDTAVYYCARMTTIVPFDYWGQGTTVTVSS
人源化15D5H1VH核酸序列
SEQ ID NO:91
CAGTTCCAGCTGGTGCAGAGCGGAGCCGAGGTGAAGAAGCCCGGAGCCAGCGTCAAAGTGAGCTGCAAGGCCTCCGGCTACAGCTTCACCGACTACAACATGAACTGGGTGAAGCAGGCCCCCGGGCAGGGCCTGGAGTGGATCGGCGGCATCAATCCCAACTACGGCACCACCGTGTACAACCAGAAGTTCAAGGGCAAGGCCACCCTGACCGTGGACCAGAGCATCAGCACCGCCTACATGGAACTCAGCAGGCTGAGGAGCGACGATACCGCCGTGTACTACTGCGCTAGGATGACCACCATCGTGCCCTTCGACTATTGGGGCCAGGGCACAACCGTGACTGTGAGCAGC
人源化15D5H2VH氨基酸序列
SEQ ID NO:92
QVQLVQSGAEVKKPGASVKVSCKASGYTFTDYNMNWVKQAPGQGLEWIGGINPNYG TTVYNQKFKGKATLTVDQSISTAYMELSRLRSDDTAVYYCARMTTIVPFDYWGQGTTVTVSS
人源化15D5H2VH核酸序列
SEQ ID NO:93
CAGGTGCAGCTCGTGCAGAGCGGAGCCGAGGTGAAAAAGCCCGGCGCTAGCGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCGACTACAACATGAACTGGGTGAAGCAGGCACCCGGCCAGGGCCTGGAGTGGATCGGCGGCATCAACCCCAACTACGGCACTACCGTCTACAACCAGAAGTTCAAGGGCAAGGCCACCCTGACCGTGGATCAGAGCATCAGCACCGCCTACATGGAACTGTCTAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCAGGATGACCACCATCGTGCCCTTCGACTACTGGGGCCAGGGAACCACAGTCACCGTGAGCAGC
人源化15D5H3VH氨基酸序列
SEQ ID NO:94
QVQLVQSGAEVKKPGASVKVSCKASGYTFTDYNMNWVRQAPGQGLEWMGGINPNY GTTVYNQKFKGKATLTVDQSISTAYMELSRLRSDDTAVYYCARMTTIVPFDYWGQGTTVTVSS
人源化15D5H3VH核酸序列
SEQ ID NO:95
CAGGTGCAGCTGGTCCAGAGCGGAGCCGAGGTGAAAAAGCCCGGCGCAAGCGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCGACTACAACATGAACTGGGTGAGGCAGGCCCCCGGCCAGGGCCTCGAGTGGATGGGAGGCATCAACCCCAACTACGGCACCACCGTGTACAACCAGAAGTTCAAGGGCAAGGCCACCCTGACCGTGGACCAGAGCATCAGCACCGCCTACATGGAACTGAGCAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCAGGATGACCACCATCGTGCCCTTCGACTACTGGGGCCAGGGCACAACCGTGACCGTGTCTAGC
人源化15D5L2VL氨基酸序列
SEQ ID NO:96
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSTLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGYTLPWTFGQGTKLEIKR
人源化15D5L2VL核酸序列
SEQ ID NO:97
GACATCCAGATGACCCAGAGCCCTAGCAGCCTGAGCGCCTCAGTGGGCGATAGGGTGACCATCACCTGCAGGGCCAGCCAGGACATCAGCAACTACCTGAACTGGTACCAGCAGAAGCCCGGGAAGGCCCCCAAGCTGCTGATCTACTACACCTCCACCCTGCACAGCGGCGTGCCCTCAAGGTTCTCCGGCAGCGGCAGCGGCACCGACTACACTCTGACCATCAGCAGCCTCCAGCCCGAGGACTTCGCCACCTACTACTGCCAGCAGGGCTATACCCTGCCCTGGACCTTCGGCCAGGGCACCAAGCTGGAGATTAAGAGG
人源化15D5L3VL氨基酸序列
SEQ ID NO:98
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSTLHSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGYTLPWTFGQGTKLEIKR
人源化15D5L3VL核酸序列
SEQ ID NO:99
GACATCCAGATGACCCAGAGCCCCAGCAGCCTGAGCGCCAGCGTGGGCGATAGGGTGACCATTACCTGCAGGGCCAGCCAGGACATCAGCAACTACCTGAACTGGTACCAGCAGAAGCCCGGCAAGGCCCCCAAGCTGCTGATCTACTACACCTCCACTCTGCACAGCGGCGTGCCCTCTAGGTTCTCCGGCTCAGGCAGCGGAACCGACTTCACCCTGACCATCAGCAGCCTCCAGCCCGAGGACTTCGCCACCTACTACTGCCAGCAGGGCTATACCCTGCCTTGGACCTTCGGCCAGGGCACCAAACTGGAGATCAAGAGG
人源化1D9H6全长重链氨基酸序列(用于在含有活性拷贝FUT8基因的非POTELLIGENTTM系统细胞中表达人源化1D9H6L2抗体,和用于在缺少活性拷贝FUT8基因的POTELLIGENTTM系统CHOK1SV细胞中表达人源化1D9H6L2POTELLIGENTTM抗体)
SEQ ID NO:100
MGWSCIILFLVATATGVHSQVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMHWVRQAPGQGLEWMGVIDPSDGYSHYNQKFKGKVTLTVDTSISTAYMELSRLRSDDTAVYYCAGGLAGTLDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN*STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
人源化1D9H6全长重链核酸序列(用于在含有活性拷贝FUT8基因的非POTELLIGENTTM系统细胞中表达人源化1D9H6L2抗体,和用于在缺少活性拷贝FUT8基因的POTELLIGENTTM系统CHOK1SV细胞中表达人源化1D9H6L2POTELLIGENTTM抗体)。编码MGWSCIILFLVATATGVHS信号序列的部分可以省略。SEQ ID NO:101
ATGGGCTGGTCCTGCATCATCCTGTTTCTGGTGGCCACCGCCACCGGTGTGCACAGCCAGGTGCAGCTGGTGCAGTCCGGCGCAGAGGTGAAGAAGCCCGGAGCCTCTGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGAGGCAGGCCCCTGGCCAGGGCCTGGAGTGGATGGGCGTGATCGACCCCAGCGACGGGTACAGCCACTACAACCAGAAGTTCAAGGGCAAGGTCACCCTGACCGTGGACACCAGCATCAGCACCGCCTACATGGAACTCAGCAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCGGAGGCCTGGCTGGCACCCTGGATTACTGGGGCCAGGGCACCACAGTGACCGTGAGCAGCGCCAGCACCAAGGGCCCCAGCGTGTTCCCCCTGGCGCCCAGCAGCAAGAGCACCAGCGGCGGCACAGCCGCCCTGGGCTGCCTGGTGAAGGACTACTTCCCCGAGCCAGTGACCGTGTCCTGGAACAGCGGAGCCCTGACCAGCGGCGTGCACACCTTCCCAGCTGTCCTGCAGAGCAGCGGCCTGTACAGCCTGAGCAGCGTGGTGACCGTGCCCAGCAGCAGCCTGGGCACCCAGACCTACATCTGTAACGTGAACCACAAGCCCAGCAACACCAAGGTGGACAAGAAGGTGGAGCCCAAGAGCTGTGACAAGACCCACACCTGCCCCCCCTGCCCTGCCCCCGAGCTGCTGGGAGGCCCCAGCGTGTTCCTGTTCCCCCCCAAGCCTAAGGACACCCTGATGATCAGCAGAACCCCCGAGGTGACCTGTGTGGTGGTGGATGTGAGCCACGAGGACCCTGAGGTGAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAATGCCAAGACCAAGCCCAGGGAGGAGCAGTACAACAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGATTGGCTGAACGGCAAGGAGTACAAGTGTAAGGTGTCCAACAAGGCCCTGCCTGCCCCTATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCCAGAGAGCCCCAGGTGTACACCCTGCCCCCTAGCAGAGATGAGCTGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGATGGCAGCTTCTTCCTGTACAGCAAGCTGACCGTGGACAAGAGCAGATGGCAGCAGGGCAACGTGTTCAGCTGCTCCGTGATGCACGAGGCCCTGCACAATCACTACACCCAGAAGAGCCTGAGCCTGTCCCCTGGCAAG
人源化1D9H6COMPLEGENTTM(当用于在含有活性拷贝FUT8基因的非POTELLIGENTTM系统细胞中表达人源化1D9H6L2COMPLEGENTTM抗体时)或者ACCRETAMABTM(当用于在缺少活性拷贝FUT8基因的POTELLIGENTTM系统CHOK1SV细胞中表达人源化1D9H6L2ACCRETAMABTM抗体时)IgG1/IgG3同种型嵌合全长重链氨基酸序列
SEQ ID NO:102
MGWSCIILFLVATATGVHSQVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMHWVRQAPGQGLEWMGVIDPSDGYSHYNQKFKGKVTLTVDTSISTAYMELSRLRSDDTAVYYCAGGLAGTLDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFKWYVDGVEVHNAKTKPREEQFN*STFRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESSGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNIFSCSVMHEALHNHYTQKSLSLSPGK
人源化1D9H6COMPLEGENTTM(当用于在含有活性拷贝FUT8基因的非POTELLIGENTTM系统细胞中表达人源化1D9H6L2COMPLEGENTTM抗体时)或ACCRETAMABTM(当用于在缺少活性拷贝FUT8基因的POTELLIGENTTM系统CHOK1SV细胞中表达人源化1D9H6L2ACCRETAMABTM抗体时)IgG1/IgG3同种型嵌合全长重链核酸序列。编码MGWSCIILFLVATATGVHS信号序列的部分可以省略。SEQ ID NO:103
ATGGGCTGGTCCTGCATCATCCTGTTTCTGGTGGCCACCGCCACCGGTGTGCACAGCCAGGTGCAGCTGGTGCAGTCCGGCGCAGAGGTGAAGAAGCCCGGAGCCTCTGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACTGGATGCACTGGGTGAGGCAGGCCCCTGGCCAGGGCCTGGAGTGGATGGGCGTGATCGACCCCAGCGACGGGTACAGCCACTACAACCAGAAGTTCAAGGGCAAGGTCACCCTGACCGTGGACACCAGCATCAGCACCGCCTACATGGAACTCAGCAGGCTGAGGAGCGACGACACCGCCGTGTACTATTGCGCCGGAGGCCTGGCTGGCACCCTGGATTACTGGGGCCAGGGCACCACAGTGACCGTGAGCAGCGCCAGCACCAAGGGCCCAAGCGTGTTTCCCCTGGCCCCCAGCAGCAAGTCTACCAGCGGCGGCACAGCCGCCCTGGGCTGCCTGGTCAAAGACTACTTCCCCGAGCCCGTCACCGTGAGCTGGAATAGCGGCGCACTGACCAGCGGCGTGCACACCTTTCCCGCCGTGCTGCAGAGCTCAGGCCTGTATAGCCTGAGCAGCGTGGTGACCGTGCCTTCTAGCAGCCTGGGCACCCAGACCTACATCTGCAACGTCAACCACAAGCCCAGCAACACCAAGGTGGACAAGAAAGTGGAGCCCAAGAGCTGCGACAAGACCCACACCTGCCCCCCCTGTCCAGCTCCGGAGCTGCTGGGCGGCCCCAGCGTGTTCCTCTTCCCCCCCAAGCCCAAGGACACCCTGATGATCTCTAGAACCCCCGAGGTGACCTGCGTGGTGGTGGACGTCAGCCACGAAGACCCCGAGGTGCAGTTCAAGTGGTACGTGGACGGGGTGGAGGTGCACAACGCCAAGACTAAGCCCAGGGAGGAGCAGTTCAACTCCACCTTCAGGGTGGTGAGCGTCCTGACCGTGCTGCATCAGGACTGGCTGAACGGCAAGGAGTACAAGTGCAAGGTGAGCAACAAGGCCCTGCCCGCCCCCATCGAGAAGACCATCAGCAAAACCAAGGGCCAGCCTAGGGAACCCCAGGTGTACACCCTGCCCCCCTCCAGGGAGGAGATGACCAAGAACCAGGTGAGCCTCACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATTGCCGTGGAGTGGGAGTCAAGCGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCCATGCTCGATAGCGACGGCAGCTTCTTCCTGTACAGCAAGCTGACCGTGGACAAGAGCCGGTGGCAGCAGGGCAACATCTTCAGCTGCAGCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGAGCCCCGGAAAG
人源化1D9L2全长轻链氨基酸序列(用于与SEQ ID NO:100在含有活性拷贝FUT8基因的非POTELLIGENTTM系统细胞中共表达以产生人源化1D9H6L2抗体;用于与SEQ ID NO:100在缺少活性拷贝FUT8基因的POTELLIGENTTM系统CHOK1SV细胞中共表达以产生人源化1D9H6L2POTELLIGENTTM抗体;用于与SEQ ID NO:102在含有活性拷贝FUT8基因的非POTELLIGENTTM系统细胞中共表达以产生人源化1D9H6L2COMPLEGENTTM抗体;和用于与SEQ ID NO:102在缺少活性拷贝FUT8基因的POTELLIGENTTM系统CHOK1SV细胞中共表达以产生人源化1D9H6L2ACCRETAMABTM抗体)
SEQ ID NO:104
MGWSCIILFLVATATGVHSDIQMTQSPSSLSASVGDRVTITCRSSQSIVHSSGNTYLQWFQQKPGKAPKLLIYKVSNRFSGVPSRFSGSGSGTDFTLTISSLQPEDFAVYYCFQGSHVPWTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
人源化1D9L2全长轻链核酸序列(用于与SEQ ID NO:100在含有活性拷贝FUT8基因的非POTELLIGENTTM系统细胞中共表达以产生人源化1D9H6L2抗体;用于与SEQID NO:100在缺少活性拷贝FUT8基因的POTELLIGENTTM系统CHOK1SV细胞中共表达以产生人源化1D9H6L2POTELLIGENTTM抗体;用于与SEQ ID NO:102在含有活性拷贝FUT8基因的非POTELLIGENTTM系统细胞中共表达以产生人源化1D9H6L2COMPLEGENTTM抗体;和用于与SEQ ID NO:102在缺少活性拷贝FUT8基因的POTELLIGENTTM系统CHOK1SV细胞中共表达以产生人源化1D9H6L2ACCRETAMABTM抗体)。编码MGWSCIILFLVATATGVHS信号序列的部分可以省略。SEQ ID NO:105
ATGGGATGGAGCTGTATCATCCTCTTCTTGGTAGCAACAGCTACAGGTGTCCACTCCGACATCCAGATGACCCAGAGCCCCTCTAGCCTGAGCGCCAGCGTGGGCGACAGGGTGACCATTACCTGCAGGAGCAGCCAGAGCATCGTGCACAGCAGCGGCAACACCTACCTGCAGTGGTTCCAGCAGAAACCCGGCAAGGCTCCCAAGCTGCTGATCTACAAGGTGAGCAACAGGTTCAGCGGCGTGCCCTCTCGCTTCTCAGGCAGCGGCTCCGGCACCGATTTCACCCTGACCATCAGCTCACTGCAGCCCGAGGACTTCGCCGTCTACTACTGCTTCCAGGGAAGCCACGTGCCCTGGACTTTTGGCCAGGGCACCAAGCTCGAGATCAAGCGTACGGTGGCCGCCCCCAGCGTGTTCATCTTCCCCCCCAGCGATGAGCAGCTGAAGAGCGGCACCGCCAGCGTGGTGTGTCTGCTGAACAACTTCTACCCCCGGGAGGCCAAGGTGCAGTGGAAGGTGGACAATGCCCTGCAGAGCGGCAACAGCCAGGAGAGCGTGACCGAGCAGGACAGCAAGGACTCCACCTACAGCCTGAGCAGCACCCTGACCCTGAGCAAGGCCGACTACGAGAAGCACAAGGTGTACGCCTGTGAGGTGACCCACCAGGGCCTGTCCAGCCCCGTGACCAAGAGCTTCAACCGGGGCGAGTGC
表17.抗体详细情况。
至此已对本发明进行了充分描述,对本领域技术人员显而易见的是可以在不脱离所附权利要求的精神或范围的情况下,对发明进行多种改变和完善。
Claims (137)
1.抗原结合蛋白,其包含重链可变区和/或轻链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:2、SEQ ID NO:3和SEQ ID NO:4的氨基酸序列有75%以上的序列同一性;所述轻链可变区有至少一个CDR与选自SEQ ID NO:6、SEQ ID NO:7和SEQ ID NO:8的氨基酸序列有75%或以上的序列同一性。
2.权利要求1所述的抗原结合蛋白,其中所述抗原结合蛋白选自嵌合抗体和人源化抗体。
3.权利要求2所述的抗原结合蛋白,其包含的重链可变区具有SEQ IDNO:2所示的CDR氨基酸序列、SEQ ID NO:3所示的CDR氨基酸序列和SEQID NO:4所示的CDR氨基酸序列;其包含的轻链可变区具有SEQ ID NO:6所述的CDR氨基酸序列、SEQ ID NO:7所示的CDR氨基酸序列和SEQ IDNO:8所示的CDR氨基酸序列。
4.权利要求3所述的抗原结合蛋白,其特异结合包含SEQ ID NO:21中氨基酸残基184-329的肽链结构域。
5.抗原结合蛋白,其包含重链可变区和/或轻链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:23,SEQ ID NO:24和SEQ ID NO:25的氨基酸序列有75%以上的序列同一性;所述轻链可变区有至少一个CDR与选自SEQ ID NO:27、SEQ ID NO:28和SEQ ID NO:29的氨基酸序列有75%或以上的序列同一性。
6.权利要求5所述的抗原结合蛋白,其中所述抗原结合蛋白选自嵌合抗体和人源化抗体。
7.权利要求6所述的抗原结合蛋白,其包含的重链可变区具有SEQ IDNO:23所示的CDR氨基酸序列、SEQ ID NO:24所示的CDR氨基酸序列和SEQ ID NO:25所示的CDR氨基酸序列;其包含的轻链可变区具有SEQ IDNO:27所述的CDR氨基酸序列、SEQ ID NO:28所示的CDR氨基酸序列和SEQ ID NO:29所示的CDR氨基酸序列。
8.权利要求7所述的抗原结合蛋白,其特异结合包含SEQ ID NO:21中氨基酸残基184-329的肽链结构域。
9.抗原结合蛋白,其包含重链可变区和/或轻链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:45、SEQ ID NO:46和SEQ ID NO:47的氨基酸序列有75%以上的序列同一性;所述轻链可变区有至少一个CDR与选自SEQ ID NO:49、SEQ ID NO:50和SEQ ID NO:51的氨基酸序列有75%或以上的序列同一性。
10.权利要求9所述的抗原结合蛋白,其中所述抗原结合蛋白选自嵌合抗体和人源化抗体。
11.权利要求10所述的抗原结合蛋白,其包含的重链可变区具有SEQID NO:45所示的CDR氨基酸序列、SEQ ID NO:46所示的CDR氨基酸序列和SEQ ID NO:47所示的CDR氨基酸序列;和/或其包含的轻链可变区具有SEQ ID NO:49所述的CDR氨基酸序列、SEQ ID NO:50所示的CDR氨基酸序列和SEQ ID NO:51所示的CDR氨基酸序列。
12.权利要求11所述的抗原结合蛋白,其特异结合包含SEQ ID NO:21中氨基酸残基330-495的肽链结构域。
13.抗原结合蛋白,其包含重链可变区和/或轻链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:31、SEQ ID NO:32和SEQ IDNO:33的氨基酸序列有75%以上的序列同一性;所述轻链可变区有至少一个CDR与选自SEQ ID NO:35、SEQ ID NO:36和SEQ ID NO:37的氨基酸序列有75%或以上的序列同一性。
14.权利要求13所述的抗原结合蛋白,其中所述抗原结合蛋白选自嵌合抗体和人源化抗体。
15.权利要求14所述的抗原结合蛋白,其包含的重链可变区具有SEQID NO:31所示的CDR氨基酸序列、SEQ ID NO:32所示的CDR氨基酸序列和SEQ ID NO:33所示的CDR氨基酸序列;和/或其包含的轻链可变区具有SEQ ID NO:35所述的CDR氨基酸序列、SEQ ID NO:36所示的CDR氨基酸序列和SEQ ID NO:37所示的CDR氨基酸序列。
16.权利要求15所述的抗原结合蛋白,其特异结合包含SEQ ID NO:21中氨基酸残基330-495的肽链结构域。
17.抗原结合蛋白,其包含重链可变区和/或轻链可变区,所述重链可变区有至少一个CDR与选自SEQ ID NO:10、SEQ ID NO:11和SEQ IDNO:12的氨基酸序列有75%以上的序列同一性;所述轻链可变区有至少一个CDR与选自SEQ ID NO:12、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:18、SEQ ID NO:19和SEQ ID NO:20的氨基酸序列有75%或以上的序列同一性。
18.权利要求17所述的抗原结合蛋白,其中所述抗原结合蛋白选自嵌合抗体和人源化抗体。
19.权利要求18所述的抗原结合蛋白,其包含的重链可变区具有SEQID NO:10所示的CDR氨基酸序列、SEQ ID NO:11所示的CDR氨基酸序列、SEQ ID NO:12所示的CDR氨基酸序列;其包含的轻链可变区或者具有SEQID NO:12所述的CDR氨基酸序列、SEQ ID NO:7所示的CDR氨基酸序列和SEQ ID NO:8所示的CDR氨基酸序列,或者具有SEQ ID NO:18所述的CDR氨基酸序列、SEQ ID NO:19所示的CDR氨基酸序列和SEQ ID NO:20所示的CDR氨基酸序列。
20.权利要求19所述的抗原结合蛋白,其抑制包含SEQ ID NO:21所示氨基酸序列二聚体的形成。
21.抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:1所示的氨基酸序列,轻链可变区具有SEQ ID NO:5所示的氨基酸序列。
22.抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:22所示的氨基酸序列,轻链可变区具有SEQ ID NO:26所示的氨基酸序列。
23.抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:44所示的氨基酸序列,轻链可变区具有SEQ ID NO:48所示的氨基酸序列。
24.抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:30所示的氨基酸序列,轻链可变区具有SEQ ID NO:34所示的氨基酸序列。
25.抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:9所示的氨基酸序列,其轻链可变区具有选自SEQ ID NO:13所示的氨基酸序列和SEQID NO:17所示的氨基酸序列。
26.抗原结合蛋白,其包含的重链可变区具有SEQ ID NO:30所示的氨基酸序列,轻链可变区具有SEQ ID NO:57所示的氨基酸序列。
27.分离的核酸,其编码权利要求1所述的抗原结合蛋白。
28.权利要求27所述的分离的核酸,其包含选自SEQ ID NO:38所示的核酸序列和SEQ ID NO:39所示的核酸序列中的至少一个核酸。
29.权利要求27所述的分离的核酸,其包含选自SEQ ID NO:59所示的核酸序列和SEQ ID NO:60所示的核酸序列中的至少一个核酸。
30.分离的核酸,其编码权利要求5所述的抗原结合蛋白。
31.权利要求30所述的分离的核酸,其包含选自SEQ ID NO:40所示的核酸序列和SEQ ID NO:41所示的核酸序列中的至少一个核酸。
32.分离的核酸,其编码权利要求9所述的抗原结合蛋白。
33.权利要求32所述的分离的核酸,其包含选自SEQ ID NO:52所示的核酸序列和SEQ ID NO:53所示的核酸序列中的至少一个核酸。
34.权利要求32所述的分离的核酸,其包含选自SEQ ID NO:61所示的核酸序列和SEQ ID NO:62所示的核酸序列中的至少一个核酸。
35.分离的核酸,其编码权利要求13所述的抗原结合蛋白。
36.权利要求35所述的分离的核酸,其包含选自SEQ ID NO:42所示的核酸序列和SEQ ID NO:43所示的核酸序列中的至少一个核酸。
37.分离的核酸,其编码权利要求26所述的抗原结合蛋白。
38.权利要求37所述的分离的核酸,其包含选自SEQ ID NO:42所示的核酸序列和SEQ ID NO:58所示的核酸序列中的至少一个核酸。
39.分离的核酸,其编码权利要求17所述的抗原结合蛋白。
40.权利要求39所述的分离的核酸,其包含选自SEQ ID NO:54所示的核酸序列、SEQ ID NO:55所示的核酸序列和SEQ ID NO:56所示的核酸序列中的至少一个核酸。
41.权利要求39所示的分离的核酸,其包含选自SEQ ID NO:63所示的核酸序列、SEQ ID NO:64所示的核酸序列和SEQ ID NO:65所示的核酸序列中的至少一个核酸。
42.表达载体,其包含权利要求27、28、29、30、31、32、33、34、35、36、37、38、39、40和41中任一项所述的分离的核酸。
43.重组宿主细胞,其包含的表达载体含有权利要求27、28、29、30、31、32、33、34、35、36、37、38、39、40和41中任一项所述的分离的核酸。
44.产生抗原结合蛋白的方法,所述方法的步骤包括培养包含表达载体的重组宿主细胞,所述表达载体含有权利要求27、28、29、30、31、32、33、34、35、36、37、38、39、40和41中任一项所述的分离的核酸;和回收抗原结合蛋白。
45.药物组合物,其包含权利要求1、5、9、13、17、21、22、23、24、25和26中任一项所述的抗原结合蛋白,和药学上可接受的载体。
46.治疗受试者的癌症的方法,所述方法包括将治疗有效量的权利要求1、5、9、13、17、21、22、23、24、25和26中任一项所述的抗原结合蛋白给予受试者的步骤,从而受试者中的癌症得到治疗。
47.治疗受试者的癌症的方法,所述方法包括步骤:
a)鉴定患有癌症的受试者,所述癌症选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤;和
b)将治疗有效量的权利要求22所述的抗原结合蛋白给予受试者,从而受试者的癌症得到治疗。
48.权利要求47所述的方法,还包括步骤:
c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基184-329的蛋白。
49.权利要求48所述的方法,其中所述蛋白包含SEQ ID NO:21中显示的氨基酸序列。
50.治疗受试者中癌症的方法,所述方法包括步骤:
a)鉴定患有癌症的受试者,所述癌症选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤;和
b)将治疗有效量的权利要求24所述的抗原结合蛋白给予受试者,从而受试者的癌症得到治疗。
51.权利要求50所述的方法,还包括步骤:
c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基330-495的蛋白。
52.权利要求51所述的方法,其中所述蛋白包含SEQ ID NO:21中显示的氨基酸序列。
53.权利要求1、5、9、13、17、21、22、23、24、25和26中任一项所述的物质在制备治疗疾病的药物中的用途,所述疾病选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
54.抗原结合蛋白,其特异结合包含SEQ ID NO:21中氨基酸残基184-329的肽链结构域。
55.权利要求54所述的抗原结合蛋白,其中所述抗原结合蛋白选自嵌合抗体和人源化抗体。
56.抗原结合蛋白,其特异结合包含SEQ ID NO:21中氨基酸残基330-495的肽链结构域。
57.权利要求56所述的抗原结合蛋白,其中所述抗原结合蛋白选自嵌合抗体和人源化抗体。
58.产生抗原结合蛋白的方法,所述方法包括步骤:
a)培养包含表达载体的重组宿主细胞,所述表达载体含有权利要求29、35和38中任一项所述的分离的核酸,其中重组宿主细胞中编码α-1,6-岩藻糖基转移酶的FUT8基因已被失活;和
b)回收抗原结合蛋白,
从而产生抗原结合蛋白。
59.权利要求58所述的方法,其中重组宿主细胞是CHOK1SV细胞。
60.通过权利要求58所述的方法产生的抗原结合蛋白。
61.产生抗原结合蛋白的方法,所述方法包括步骤:
a)培养包含表达载体的重组宿主细胞,所述表达载体含有权利要求29、35和38中任一项所述的分离的核酸,其中表达载体包含编码含有IgG1和IgG3Fc结构域氨基酸残基的嵌合Fc结构域的Fc核酸序列;和
b)回收抗原结合蛋白,
从而产生抗原结合蛋白。
62.权利要求61所述的方法,其中Fc核酸序列与选自SEQ ID NO:40所示核酸序列和SEQ ID NO:42所示核酸序列的核酸序列符合读框地融合。
63.通过权利要求62所述的方法产生的抗原结合蛋白。
64.产生抗原结合蛋白的方法,所述方法包括步骤:
a)培养含有表达载体的重组宿主细胞,所述表达载体含有权利要求29、35和38中任一项所述的分离的核酸,表达载体还包含编码含有IgG1和IgG3Fc结构域氨基酸残基的嵌合Fc结构域的Fc核酸序列,其中重组宿主细胞中的编码α-1,6-岩藻糖基转移酶的FUT8基因已被失活;和
b)回收抗原结合蛋白,
从而产生抗原结合蛋白。
65.权利要求64所述的方法,其中Fc核酸序列与选自SEQ ID NO:40所示核酸序列和SEQ ID NO:42所示核酸序列的核酸序列符合读框地融合。
66.权利要求65所述的方法,其中所述重组宿主细胞是CHOK1SV细胞。
67.通过权利要求64所述的方法产生的抗原结合蛋白。
68.治疗受试者中癌前状态的方法,所述方法包括将治疗有效量的权利要求1、5、9、13、17、21、22、23、24、25和26中任一项所述的抗原结合蛋白给予受试者的步骤,从而受试者中的癌前状态得到治疗。
69.治疗受试者的癌前状态的方法,所述方法包括步骤:
a)鉴定有癌前状态的受试者,和
b)将治疗有效量的权利要求22所述的抗原结合蛋白给予受试者,从而受试者的癌前状态得到治疗。
70.权利要求69所述的方法,还包括步骤:
c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基184-329的蛋白。
71.权利要求69所述的方法,其中所述蛋白包含SEQ ID NO:21中显示的氨基酸序列。
72.治疗受试者中癌前状态的方法,所述方法包括步骤:
a)鉴定有癌前状态的受试者;和
b)将治疗有效量的权利要求24所述的抗原结合蛋白给予受试者,从而受试者的癌症得到治疗。
73.权利要求72所述的方法,还包括步骤:
c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基330-495的蛋白。
74.权利要求73所述的方法,其中所述蛋白包含SEQ ID NO:21中显示的氨基酸序列。
75.抗原结合蛋白,其特异结合HER3受体并且包含具有SEQ ID NO:2所示氨基酸序列的CDRH3。
76.抗原结合蛋白,其特异结合HER3受体并且包含具有SEQ ID NO:2所示的氨基酸序列的CDRH1;具有SEQ ID NO:3所示的氨基酸序列的CDRH2;具有SEQ ID NO:4所示的氨基酸序列的CDRH3;具有SEQ ID NO:6所述的氨基酸序列的CDRL1;具有SEQ ID NO:7所示的氨基酸序列的CDRL2;和具有SEQ ID NO:8所示的氨基酸序列的CDRL3。
77.抗原结合蛋白,其特异结合HER3受体并且包含具有SEQ IDNO:23所示的氨基酸序列的CDRH1;具有SEQ ID NO:24所示的氨基酸序列的CDRH2;具有SEQ ID NO:25所示的氨基酸序列的CDRH3;具有SEQ IDNO:27所述的氨基酸序列的CDRL1;具有SEQ ID NO:28所示的氨基酸序列的CDRL2;和具有SEQ ID NO:29所示的氨基酸序列的CDRL3。
78.抗原结合蛋白,其特异结合HER3受体并且包含具有SEQ IDNO:31所示的氨基酸序列的CDRH1;具有SEQ ID NO:32所示的氨基酸序列的CDRH2;具有SEQ ID NO:33所示的氨基酸序列的CDRH3;具有SEQ IDNO:35所述的氨基酸序列的CDRL1;具有SEQ ID NO:36所示的氨基酸序列的CDRL2;和具有SEQ ID NO:37所示的氨基酸序列的CDRL3。
79.抗原结合蛋白,其特异结合HER3受体并且包含具有SEQ IDNO:45所示的氨基酸序列的CDRH1;具有SEQ ID NO:46所示的氨基酸序列的CDRH2;具有SEQ ID NO:47所示的氨基酸序列的CDRH3;具有SEQ IDNO:49所述的氨基酸序列的CDRL1;具有SEQ ID NO:50所示的氨基酸序列的CDRL2;和具有SEQ ID NO:51所示的氨基酸序列的CDRL3。
80.抗原结合蛋白,其特异结合HER3受体并且包含具有SEQ IDNO:10所示的氨基酸序列的CDRH1;具有SEQ ID NO:11所示的氨基酸序列的CDRH2;具有SEQ ID NO:12所示的氨基酸序列的CDRH3;具有SEQ IDNO:14所述的氨基酸序列的CDRL1;具有SEQ ID NO:15所示的氨基酸序列的CDRL2;和具有SEQ ID NO:16所示的氨基酸序列的CDRL3。
81.抗原结合蛋白,其特异结合HER3受体并且包含具有SEQ IDNO:10所示的氨基酸序列的CDRH1;具有SEQ ID NO:11所示的氨基酸序列的CDRH2;具有SEQ ID NO:12所示的氨基酸序列的CDRH3;具有SEQ IDNO:18所述的氨基酸序列的CDRL1;具有SEQ ID NO:19所示的氨基酸序列的CDRL2;和具有SEQ ID NO:20所示的氨基酸序列的CDRL3。
82.权利要求45所述的药物组合物,是用于药品。
83.权利要求45所述的药物组合物,是用于治疗乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
84.治疗哺乳动物中癌症的方法,所述方法包括给予治疗有效量的权利要求1、5、9、13、17、21、22、23、24、25和26中任一项所述的抗原结合蛋白。
85.权利要求84所述的方法,其中所述哺乳动物是人。
86.权利要求84或权利要求85所述的方法,其中所述癌症选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
87.抗原结合蛋白,其包含的重链序列含有SEQ ID NO:100显示的氨基酸序列中的氨基酸残基20-466;其包含的轻链含有SEQ ID NO:104显示的氨基酸序列中的氨基酸残基20-238。
88.权利要求87所述的抗原结合蛋白,其包含岩藻糖化聚糖。
89.权利要求88所述的抗原结合蛋白,其中的岩藻糖化聚糖选自G0、G2、G0F、G2F、G1、Man5、G1F和G1F’。
90.权利要求87所述的抗原结合蛋白,其包含非岩藻糖化的聚糖。
91.权利要求90所述的抗原结合蛋白,其中的非岩藻糖化的聚糖选自G0、G2、G1和Man5。
92.抗原结合蛋白,其包含的重链序列含有SEQ ID NO:102显示的氨基酸序列中的氨基酸残基20-466;包含的轻链序列含有SEQ ID NO:104显示的氨基酸序列中的氨基酸残基20-238。
93.权利要求92所述的抗原结合蛋白,其包含岩藻糖化聚糖。
94.权利要求93所述的抗原结合蛋白,其中的岩藻糖化聚糖选自G0、G2、G0F、G2F、G1、Man5、G1F和G1F’。
95.权利要求92所述的抗原结合蛋白,其包含非岩藻糖化的聚糖。
96.权利要求95所述的抗原结合蛋白,其中的非岩藻糖化的聚糖选自G0、G2、G1和Man5。
97.分离的核酸,其编码SEQ ID NO:100显示的氨基酸序列中的氨基酸残基20-466。
98.权利要求97所述的分离的核酸,其包含SEQ ID NO:101所示的核酸序列。
99.分离的核酸,其编码SEQ ID NO:104显示的氨基酸序列中的氨基酸残基20-238。
100.权利要求99所述的分离的核酸,其包含SEQ ID NO:105所示的核酸序列。
101.分离的核酸,其编码SEQ ID NO:102显示的氨基酸序列中的氨基酸残基20-466。
102.权利要求101所述的分离的核酸,其包含SEQ ID NO:103所示的核酸序列。
103.表达载体,其包含权利要求97、98、99、100、101和102中任一项所述的分离的核酸。
104.重组宿主细胞,其包含的表达载体含有权利要求97、98、99、100、101和102中任一项所述的分离的核酸。
105.权利要求104所述的重组宿主细胞,其中有编码α-1,6-岩藻糖基转移酶的FUT8基因。
106.权利要求105所述的重组宿主细胞,是CHOK1细胞。
107.权利要求104所述的重组宿主细胞,其中所述编码α-1,6-岩藻糖基转移酶的FUT8基因已被失活。
108.权利要求107所述的重组宿主细胞,是CHOK1SV细胞。
109.药物组合物,其包含权利要求87、88、89、90、91、92、93、94、95和96中任一项所述的抗原结合蛋白,和药学上可接受的载体。
110.治疗受试者的癌症的方法,所述方法包括将治疗有效量的权利要求87、88、89、90、91、92、93、94、95和96中任一项所述的抗原结合蛋白给予受试者的步骤,从而受试者中的癌症得到治疗。
111.治疗受试者的癌症的方法,所述方法包括步骤:
a)鉴定患有癌症的受试者,所述癌症选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤;和
b)将治疗有效量的权利要求87、88、89、90、91、92、93、94、95和96中任一项所述的抗原结合蛋白给予受试者,从而受试者的癌症得到治疗。
112.权利要求111所述的方法,还包括步骤:
c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基330-495的蛋白。
113.权利要求112所述的方法,其中所述蛋白包含SEQ ID NO:21中显示的氨基酸序列。
114.权利要求87、88、89、90、91、92、93、94、95和96中任一项所述的物质在制备治疗疾病的药物中的用途,所述疾病选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
115.产生抗原结合蛋白的方法,所述方法包括步骤:
a)培养包含表达载体的重组宿主细胞,所述表达载体包含权利要求97或权利要求98所述的分离的核酸,并且包含权利要求97或权利要求100所述的分离的核酸,其中重组宿主细胞中编码α-1,6-岩藻糖基转移酶的FUT8基因编码具有活性;和
b)回收抗原结合蛋白;
从而产生抗原结合蛋白。
116.权利要求115所述的方法,其中重组宿主细胞是CHOK1细胞。
117.通过权利要求115所述的方法产生的抗原结合蛋白。
118.产生抗原结合蛋白的方法,所述方法包括步骤:
a)培养包含表达载体的重组宿主细胞,所述表达载体包含权利要求97或权利要求98所述的分离的核酸,并且包含权利要求97或权利要求100所述的分离的核酸,其中重组宿主细胞中编码α-1,6-岩藻糖基转移酶的FUT8基因编码已被失活;和
b)回收抗原结合蛋白;
从而产生抗原结合蛋白。
119.权利要求118所述的方法,其中重组宿主细胞是CHOK1SV细胞。
120.通过权利要求118所述的方法产生的抗原结合蛋白。
121.产生抗原结合蛋白的方法,所述方法包括步骤:
a)培养包含表达载体的重组宿主细胞,所述表达载体包含权利要求99或权利要求100所述的分离的核酸,并且包含权利要求101和权利要求102所述的分离的核酸,其中重组宿主细胞中编码α-1,6-岩藻糖基转移酶的FUT8基因编码具有活性;和
b)回收抗原结合蛋白;
从而产生抗原结合蛋白。
122.权利要求121所述的方法,其中重组宿主细胞是CHOK1细胞。
123.通过权利要求121的方法产生的抗原结合蛋白。
124.产生抗原结合蛋白的方法,所述方法包括步骤:
a)培养包含表达载体的重组宿主细胞,所述表达载体包含权利要求99或权利要求100所述的分离的核酸,并且包含权利要求101和权利要求102所述的分离的核酸,其中重组宿主细胞中编码α-1,6-岩藻糖基转移酶的FUT8基因编码已被失活;和
b)回收抗原结合蛋白;
从而产生抗原结合蛋白。
125.权利要求124所述的方法,其中重组宿主细胞是CHOK1SV细胞。
126.通过权利要求124的方法产生的抗原结合蛋白。
127.治疗受试者中癌前状态的方法,所述方法包括将治疗有效量的权利要求87、88、89、90、91、92、93、94、95和96中任一项所述的抗原结合蛋白给予受试者的步骤,从而受试者中的癌前状态得到治疗。
128.治疗受试者的癌前状态的方法,所述方法包括步骤:
a)鉴定有癌前状态的受试者,和
b)将治疗有效量的权利要求87、88、89、90、91、92、93、94、95和96中任一项所述的抗原结合蛋白给予受试者,从而受试者的癌前状态得到治疗。
129.权利要求128所述的方法,还包括步骤:
c)将液体给予受试者。
130.权利要求128所述的方法,还包括步骤:
c)确定所述癌症表达包含SEQ ID NO:21中氨基酸残基330-495的蛋白。
131.权利要求130所述的方法,其中所述蛋白包含SEQ ID NO:21中显示的氨基酸序列。
132.权利要求109所述的药物组合物,是用于药品。
133.权利要求109所述的药物组合物,是用于治疗乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
134.治疗哺乳动物中癌症的方法,所述方法包括给予治疗有效量的权利要求87、88、89、90、91、92、93、94、95和96中任一项所述的抗原结合蛋白。
135.权利要求134所述的方法,其中所述哺乳动物是人。
136.权利要求134或权利要求135所述的方法,其中所述癌症选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤。
137.前述权利要求中任一项所述的抗原结合蛋白,是用于治疗选自乳腺癌、卵巢癌、前列腺癌、膀胱癌、胰腺癌、皮肤癌、胃癌和黑素瘤的状况。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US37984010P | 2010-09-03 | 2010-09-03 | |
| US61/379,840 | 2010-09-03 | ||
| US201161440460P | 2011-02-08 | 2011-02-08 | |
| US61/440,460 | 2011-02-08 | ||
| PCT/US2011/050322 WO2012031198A2 (en) | 2010-09-03 | 2011-09-02 | Novel antigen binding proteins |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103189391A true CN103189391A (zh) | 2013-07-03 |
Family
ID=45773540
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800533015A Pending CN103189391A (zh) | 2010-09-03 | 2011-09-02 | 新抗原结合蛋白 |
Country Status (20)
| Country | Link |
|---|---|
| US (1) | US9085622B2 (zh) |
| EP (1) | EP2611829A4 (zh) |
| JP (1) | JP2013544492A (zh) |
| KR (1) | KR20130101047A (zh) |
| CN (1) | CN103189391A (zh) |
| AU (1) | AU2011295726B2 (zh) |
| BR (1) | BR112013005242A2 (zh) |
| CA (1) | CA2809443A1 (zh) |
| CL (1) | CL2013000566A1 (zh) |
| CO (1) | CO6690769A2 (zh) |
| CR (1) | CR20130128A (zh) |
| EA (1) | EA201390328A1 (zh) |
| MA (1) | MA34555B1 (zh) |
| MX (1) | MX2013002535A (zh) |
| NZ (1) | NZ607680A (zh) |
| PE (1) | PE20140133A1 (zh) |
| SG (2) | SG10201401681PA (zh) |
| TW (1) | TW201302793A (zh) |
| UY (1) | UY33591A (zh) |
| WO (1) | WO2012031198A2 (zh) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105593241A (zh) * | 2013-10-04 | 2016-05-18 | 豪夫迈·罗氏有限公司 | 特异性结合her3的抗体 |
| CN109328077A (zh) * | 2016-06-10 | 2019-02-12 | 德国癌症研究公共权益基金会 | 膜联蛋白的核心结构域及其在抗原递送和接种中的用途 |
| CN110753703A (zh) * | 2017-05-23 | 2020-02-04 | 德国亥姆霍兹慕尼黑中心健康与环境研究中心(有限公司) | 新的cd73抗体、其制备和用途 |
| CN111886024A (zh) * | 2018-03-08 | 2020-11-03 | 东莞凡恩世生物医药有限公司 | 抗tip-1抗体及其用途 |
| CN114787186A (zh) * | 2019-09-27 | 2022-07-22 | 艾吉纳斯公司 | 异二聚体蛋白 |
| CN116286828A (zh) * | 2023-05-12 | 2023-06-23 | 中国人民解放军军事科学院军事医学研究院 | 一种寡聚核酸siRNA及其在制备用于预防和治疗肝癌的药物中的应用 |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| HUE029026T2 (en) | 2009-12-22 | 2017-01-30 | Roche Glycart Ag | Anti-HER3 antibodies and their applications |
| EA036314B1 (ru) | 2010-08-20 | 2020-10-26 | Новартис Аг | Выделенные антитела к рецептору эпидермального фактора роста-3 (her3) и их фрагменты, фармацевтическая композиция, содержащая эти антитела и фрагменты, и их применение для лечения рака |
| DK2797957T3 (da) | 2011-11-23 | 2019-09-23 | Medimmune Llc | Bindingsmolekyler specifikke for her3 og anvendelser deraf |
| EA036739B1 (ru) | 2011-12-05 | 2020-12-15 | Новартис Аг | Антитела к рецептору эпидермального фактора роста 3 (her3) |
| JP2015500830A (ja) * | 2011-12-05 | 2015-01-08 | ノバルティス アーゲー | 上皮細胞増殖因子受容体3(her3)のドメインiiiおよびドメインivに対するher3の抗体 |
| EP2807272A1 (en) * | 2012-01-27 | 2014-12-03 | Ventana Medical Systems, Inc. | Devices and methods for detecting bio-analytes using optically decipherable patterns |
| CN104755500B (zh) | 2012-11-08 | 2020-10-02 | 霍夫曼-拉罗奇有限公司 | 结合HER3 β-发夹的HER3抗原结合蛋白 |
| JP6537970B2 (ja) | 2012-11-08 | 2019-07-03 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | Her3のベータヘアピン及びher4のベータヘアピンに結合する抗her3/her4抗原結合タンパク質 |
| US9180185B2 (en) | 2013-01-11 | 2015-11-10 | Hoffman-La Roche Inc. | Combination therapy of anti-HER3 antibodies |
| WO2015048008A2 (en) | 2013-09-24 | 2015-04-02 | Medimmune, Llc | Binding molecules specific for her3 and uses thereof |
| US10844127B2 (en) | 2014-02-28 | 2020-11-24 | Merus N.V. | Antibodies that bind EGFR and ErbB3 |
| RS61129B1 (sr) * | 2014-02-28 | 2020-12-31 | Merus Nv | Antitelo koje vezuje erbb-2 i erbb-3 |
| US10745490B2 (en) | 2014-04-11 | 2020-08-18 | Celldex Therapeutics, Inc. | Anti-ErbB antibodies and methods of use thereof |
| WO2015164723A1 (en) | 2014-04-25 | 2015-10-29 | The Trustees Of The University Of Pennsylvania | Methods and compositions for treating metastatic breast cancer and other cancers in the brain |
| JP6433511B2 (ja) | 2014-05-14 | 2018-12-05 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | Her3のベータヘアピンに結合する抗her3抗体 |
| EP3160518A4 (en) * | 2014-06-30 | 2018-05-23 | Tarveda Therapeutics, Inc. | Targeted conjugates and particles and formulations thereof |
| WO2016011080A2 (en) * | 2014-07-14 | 2016-01-21 | The Regents Of The University Of California | Crispr/cas transcriptional modulation |
| US10526416B2 (en) | 2014-09-08 | 2020-01-07 | Yeda Research And Development Co. Ltd. | Anti-HER3 antibodies and uses of same |
| WO2016038610A1 (en) | 2014-09-08 | 2016-03-17 | Yeda Research And Development Co. Ltd. | Compositions and methods for treating cancer resistant to a tyrosine kinase inhibitor (tki) |
| WO2016059602A2 (en) * | 2014-10-16 | 2016-04-21 | Glaxo Group Limited | Methods of treating cancer and related compositions |
| MX2018004988A (es) | 2015-10-23 | 2018-11-09 | Merus Nv | Moleculas de union que inhibe el crecimiento de cancer. |
| AU2016343817B2 (en) | 2015-10-28 | 2021-05-27 | Tva (Abc), Llc | SSTR-targeted conjugates and particles and formulations thereof |
| TWI778491B (zh) | 2015-11-30 | 2022-09-21 | 美商輝瑞股份有限公司 | 位點專一性her2抗體藥物共軛體 |
| CN108602890A (zh) | 2015-12-11 | 2018-09-28 | 瑞泽恩制药公司 | 用于减少或预防对egfr和/或erbb3阻滞剂具有抗性的肿瘤生长的方法 |
| US20190091227A1 (en) | 2016-03-15 | 2019-03-28 | Merrimack Pharmaceuticals, Inc. | Methods for treating er+, her2-, hrg+ breast cancer using combination therapies comprising an anti-erbb3 antibody |
| CN106543286A (zh) * | 2016-12-07 | 2017-03-29 | 上海邦耀生物科技有限公司 | 一种去岩藻糖抗her2抗体及其应用 |
| BR112019020508A2 (pt) | 2017-03-31 | 2020-08-04 | Merus N.V. | anticorpos biespecíficos de ligação a erbb-2 e erbb3 para utilização no tratamento de células que possuem um gene de fusão nrg1 |
| JP2020530028A (ja) | 2017-08-09 | 2020-10-15 | メルス ナムローゼ フェンノートシャップ | EGFR及びcMETに結合する抗体 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080124345A1 (en) * | 2005-12-30 | 2008-05-29 | Mike Rothe | Antibodies directed to HER-3 and uses thereof |
| US20080269467A1 (en) * | 2005-12-13 | 2008-10-30 | Barrett Allan | Anti-IL-17 Antibodies |
| CN101627053A (zh) * | 2006-06-12 | 2010-01-13 | 西福根有限公司 | 泛细胞表面受体特异的治疗剂 |
Family Cites Families (235)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5183884A (en) | 1989-12-01 | 1993-02-02 | United States Of America | Dna segment encoding a gene for a receptor related to the epidermal growth factor receptor |
| US6639061B1 (en) | 1999-07-07 | 2003-10-28 | Isis Pharmaceuticals, Inc. | C3′-methylene hydrogen phosphonate oligomers and related compounds |
| US5804396A (en) | 1994-10-12 | 1998-09-08 | Sugen, Inc. | Assay for agents active in proliferative disorders |
| WO1996014864A1 (en) | 1994-11-09 | 1996-05-23 | The Regents Of The University Of California | Immunoliposomes that optimize internalization into target cells |
| CA2589421C (en) | 1996-03-27 | 2012-12-18 | Genentech, Inc. | Erbb3 antibodies |
| EP0896586B2 (en) | 1996-03-27 | 2015-05-20 | Genentech, Inc. | ErbB3 ANTIBODIES |
| US5968511A (en) | 1996-03-27 | 1999-10-19 | Genentech, Inc. | ErbB3 antibodies |
| US5922845A (en) | 1996-07-11 | 1999-07-13 | Medarex, Inc. | Therapeutic multispecific compounds comprised of anti-Fcα receptor antibodies |
| NZ333325A (en) | 1996-07-12 | 2000-06-23 | Genentech Inc | Recombinant chimeric heteromultimer adhesins comprising extracellular domains of ErbB receptors |
| US20020002276A1 (en) | 1997-02-10 | 2002-01-03 | Genentech, Inc. | Chimeric heteromultimer adhesins |
| US6723694B1 (en) | 1997-05-21 | 2004-04-20 | The Children's Medical Center Corp. | Short peptides which selectively modulate intracellular signalling |
| US6416168B1 (en) | 1997-07-15 | 2002-07-09 | Silverbrook Research Pty Ltd | Pump action refill ink jet printing mechanism |
| ZA9811162B (en) | 1997-12-12 | 2000-06-07 | Genentech Inc | Treatment with anti-ERBB2 antibodies. |
| ATE276756T1 (de) | 1998-02-04 | 2004-10-15 | Genentech Inc | Verwendung des heregulins als epithelzellenwachstumsfaktor |
| AU2003203831B2 (en) | 1998-02-04 | 2006-08-10 | Genentech, Inc. | Use of heregulin as an epithelial cell growth factor |
| US20010023241A1 (en) | 1998-02-04 | 2001-09-20 | Sliwkowski Mark X. | Use of heregulin as a growth factor |
| US6417168B1 (en) | 1998-03-04 | 2002-07-09 | The Trustees Of The University Of Pennsylvania | Compositions and methods of treating tumors |
| ES2389387T3 (es) | 1998-03-17 | 2012-10-25 | Genentech, Inc. | Polipéptidos homólogos de VEGF y de BMP1 |
| PT1071700E (pt) | 1998-04-20 | 2010-04-23 | Glycart Biotechnology Ag | Modificação por glicosilação de anticorpos para melhorar a citotoxicidade celular dependente de anticorpos |
| CA2332331A1 (en) | 1998-05-15 | 1999-11-25 | Francisco Robert | Treatment of human tumors with radiation and inhibitors of growth factor receptor tyrosine kinases |
| AU2004200705A1 (en) | 1998-05-15 | 2004-03-18 | Imclone Systems Incorporated | Treatment of human tumors with radiation and inhibitors of growth factor receptor tyrosine kinases |
| ZA200007412B (en) | 1998-05-15 | 2002-03-12 | Imclone Systems Inc | Treatment of human tumors with radiation and inhibitors of growth factor receptor tyrosine kinases. |
| WO2001060397A1 (en) | 2000-02-16 | 2001-08-23 | Genentech, Inc. | Uses of agonists and antagonists to modulate activity of tnf-related molecules |
| EP1126873A1 (en) | 1998-11-07 | 2001-08-29 | Genentech, Inc. | Method for enhancing proliferation of inner ear hair cells using ligands for her2 and/or her3 receptors |
| US7183387B1 (en) | 1999-01-15 | 2007-02-27 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| JP2002544123A (ja) * | 1999-04-14 | 2002-12-24 | スミスクライン・ビーチャム・コーポレイション | エリトロポイエチン受容体抗体 |
| US7534866B2 (en) | 2005-10-19 | 2009-05-19 | Ibc Pharmaceuticals, Inc. | Methods and compositions for generating bioactive assemblies of increased complexity and uses |
| US6710186B2 (en) | 1999-06-14 | 2004-03-23 | Wisconsin Alumni Research Foundation | Oligomers and polymers of di-substituted cyclic imino carboxylic acids |
| AUPQ105799A0 (en) | 1999-06-18 | 1999-07-08 | Victor Chang Cardiac Research Institute, The | Cell growth inhibition |
| US6949245B1 (en) | 1999-06-25 | 2005-09-27 | Genentech, Inc. | Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies |
| HU230586B1 (hu) | 1999-06-25 | 2017-02-28 | Genentech, Inc. | Anti-ErbB antitest/maytansinoid konjugátumok alkalmazása rákos betegségek kezelésére szolgáló gyógyszer előállítására |
| BR122014028365B8 (pt) | 1999-06-25 | 2021-07-06 | Genentech Inc | artigo industrializado compreendendo um primeiro recipiente que compreende uma composição de humab4d5-8 nele contida e um segundo recipiente que compreende uma composição rhumab 2c4 nele contida |
| DE60042693D1 (de) | 1999-08-27 | 2009-09-17 | Genentech Inc | Dosierung für die behandlung mit anti erbb2-antikörpern |
| US7732157B1 (en) | 1999-09-30 | 2010-06-08 | Tumor Biology Investment Group | Soluble epidermal growth factor receptor-like proteins and their uses in cancer detection methods |
| US7390632B2 (en) | 1999-09-30 | 2008-06-24 | Tumor Biology Investment Group, Inc. | Soluble ErbB3 receptor isoforms |
| US7651703B2 (en) | 1999-10-15 | 2010-01-26 | Genentech, Inc. | Injection vehicle for polymer-based formulations |
| WO2001051928A1 (en) | 2000-01-12 | 2001-07-19 | Ventana Medical Systems, Inc. | Method for quantitating a protein by image analysis |
| US7097840B2 (en) | 2000-03-16 | 2006-08-29 | Genentech, Inc. | Methods of treatment using anti-ErbB antibody-maytansinoid conjugates |
| US6632979B2 (en) | 2000-03-16 | 2003-10-14 | Genentech, Inc. | Rodent HER2 tumor model |
| AU2007216733A1 (en) | 2000-04-11 | 2007-09-27 | Genentech, Inc. | Multivalent antibodies and uses therefor |
| NZ521540A (en) | 2000-04-11 | 2004-09-24 | Genentech Inc | Multivalent antibodies and uses therefor |
| FR2807767B1 (fr) | 2000-04-12 | 2005-01-14 | Lab Francais Du Fractionnement | Anticorps monoclonaux anti-d |
| US7255999B2 (en) | 2001-05-21 | 2007-08-14 | Monogram Biosciences, Inc. | Methods and compositions for analyzing proteins |
| AUPQ903400A0 (en) | 2000-07-27 | 2000-08-17 | Oh, Young June | Navigable search engine |
| US6277640B1 (en) | 2000-07-31 | 2001-08-21 | Isis Pharmaceuticals, Inc. | Antisense modulation of Her-3 expression |
| CA2429640C (en) | 2000-11-24 | 2007-02-13 | Carl Freudenberg Kg | Floor mop |
| US20030133939A1 (en) | 2001-01-17 | 2003-07-17 | Genecraft, Inc. | Binding domain-immunoglobulin fusion proteins |
| AU2008200400B2 (en) | 2001-01-17 | 2012-06-07 | Aptevo Research And Development Llc | Binding domain-immunoglobulin fusion proteins |
| EP1228766A1 (en) | 2001-01-31 | 2002-08-07 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | PYK2 phosphorylation by HER3 induces tumor invasion |
| CA2437814C (en) | 2001-02-12 | 2008-05-13 | Medarex, Inc. | Human monoclonal antibodies to fc alpha receptor (cd89) |
| US7638598B2 (en) | 2001-04-06 | 2009-12-29 | The Trustees Of The University Of Pennsylvania | ErbB interface peptidomimetics and methods of use thereof |
| US20040116330A1 (en) | 2001-04-27 | 2004-06-17 | Kenichiro Naito | Preventive/therapeutic method for cancer |
| US7745398B2 (en) | 2001-05-31 | 2010-06-29 | Tumor Biology Investment Group, Inc. | Soluble ErbB3 and treatment of cancer |
| US7744882B2 (en) | 2001-05-31 | 2010-06-29 | Tumor Biology Investment Group, Inc. | Soluble ErbB3 methods of detection and antibodies |
| WO2002102854A2 (en) | 2001-06-20 | 2002-12-27 | Morphosys Ag | Antibodies that block receptor protein tyrosine kinase activation, methods of screening for and uses thereof |
| WO2003001602A2 (en) | 2001-06-21 | 2003-01-03 | Akzo Nobel N.V. | Manufacturing a solar cell foil connected in series via a temporary substrate |
| WO2003011897A1 (en) | 2001-07-27 | 2003-02-13 | The Regents Of The University Of California | Modulation of heregulin and her3 interaction |
| DE10137374A1 (de) | 2001-07-31 | 2003-02-27 | Ipk Inst Fuer Pflanzengenetik | Verfahren zur Herstellung von Arachidonsäure in transgenen Organismen |
| AU2002326531A1 (en) | 2001-08-03 | 2003-02-17 | The Trustees Of The University Of Pennsylvania | Monoclonal antibodies to activated erbb family members and methods of use thereof |
| AU2008200654B2 (en) | 2001-08-09 | 2010-04-29 | Max-Planck-Gesellschaft Zur Forderung Der Wissenschaften E.V. | Inhibitors of HER3 activity |
| EP1283053A1 (en) | 2001-08-09 | 2003-02-12 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Inhibitors of HER3 activity |
| US8877901B2 (en) | 2002-12-13 | 2014-11-04 | Immunomedics, Inc. | Camptothecin-binding moiety conjugates |
| US7591994B2 (en) | 2002-12-13 | 2009-09-22 | Immunomedics, Inc. | Camptothecin-binding moiety conjugates |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| JP4132912B2 (ja) | 2002-03-26 | 2008-08-13 | 日東電工株式会社 | ゲル電解質とその製造方法とその利用 |
| US7919098B2 (en) | 2002-03-26 | 2011-04-05 | Zensun ( Shanghai ) Sci & Tech Co., Ltd. | ErbB-3 based methods and compositions for treating neoplasms |
| US7332585B2 (en) | 2002-04-05 | 2008-02-19 | The Regents Of The California University | Bispecific single chain Fv antibody molecules and methods of use thereof |
| US7332580B2 (en) | 2002-04-05 | 2008-02-19 | The Regents Of The University Of California | Bispecific single chain Fv antibody molecules and methods of use thereof |
| US7323553B2 (en) | 2002-04-26 | 2008-01-29 | Genentech, Inc. | Non-affinity purification of proteins |
| US20050276812A1 (en) | 2004-06-01 | 2005-12-15 | Genentech, Inc. | Antibody-drug conjugates and methods |
| US20040229380A1 (en) | 2002-05-21 | 2004-11-18 | Po-Ying Chan-Hui | ErbB heterodimers as biomarkers |
| US20040229294A1 (en) | 2002-05-21 | 2004-11-18 | Po-Ying Chan-Hui | ErbB surface receptor complexes as biomarkers |
| US20040229293A1 (en) | 2002-05-21 | 2004-11-18 | Po-Ying Chan-Hui | Surface receptor complexes as biomarkers |
| US20040229299A1 (en) | 2002-05-21 | 2004-11-18 | Badal M. Youssouf | Intracellular complexes as biomarkers |
| US20040132097A1 (en) | 2002-06-19 | 2004-07-08 | Bacus Sarah S. | Method for predicting response to epidermal growth factor receptor-directed therapy |
| MXPA05000403A (es) | 2002-07-15 | 2005-07-22 | Genentech Inc | Metodos para identificar tumores que responden al tratamiento con anticuerpos contra erbb2. |
| JP4443407B2 (ja) | 2002-07-25 | 2010-03-31 | アクララ バイオサイエンシーズ, インコーポレイテッド | レセプターオリゴマー形成の検出 |
| GB0225282D0 (en) | 2002-10-31 | 2002-12-11 | Astrazeneca Ab | assay |
| CA2513113A1 (en) | 2003-01-23 | 2004-08-05 | Genentech, Inc. | Methods for producing humanized antibodies and improving yield of antibodies or antigen binding fragments in cell culture |
| BRPI0409554A (pt) | 2003-04-04 | 2006-04-25 | Univ Lausanne | peptacorpo de fusão isolado e recombinante, seqüência de dna, vetor, célula hospedeira, composição farmacêutica e seu uso, kits, método para a produção do peptacorpo de fusão e seqüência de intensificador |
| WO2004094463A2 (en) | 2003-04-18 | 2004-11-04 | University Of Florida Research Foundation, Inc. | Peptide inhibitors of autophosphorylation protein kinases |
| EP2348110B1 (en) | 2003-05-30 | 2013-03-27 | OncoTherapy Science, Inc. | Process for screening a drug response in cancer patients |
| PL1636593T3 (pl) | 2003-06-06 | 2009-08-31 | Genentech Inc | Modulowanie oddziaływania pomiędzy łańcuchem beta HGF i c-met. |
| US20040254108A1 (en) | 2003-06-13 | 2004-12-16 | Jing Ma | Preparation and application of anti-tumor bifunctional fusion proteins |
| AU2004252465A1 (en) | 2003-06-13 | 2005-01-06 | Oncomax Acquisition Corp. | Preparation and application of anti-tumor bifunctional fusion proteins |
| US20050232931A1 (en) | 2003-06-13 | 2005-10-20 | Oncomax Acquisition Corp. | Preparation and application of anti-tumor bifunctional fusion proteins |
| US6836094B1 (en) | 2003-07-01 | 2004-12-28 | International Truck Intellectual Property Company, Llc | Motor vehicle battery disconnect switch circuits |
| US7531649B2 (en) | 2003-07-18 | 2009-05-12 | The Regents Of The University Of California | Aptamers to human epidermal growth factor receptor-3 |
| PT3095793T (pt) | 2003-07-28 | 2020-05-04 | Genentech Inc | Redução da lixiviação de proteína a durante a cromatografia por afinidade com proteína a |
| WO2005013804A2 (en) | 2003-08-05 | 2005-02-17 | Euro-Celtique S.A. | ErbB RECEPTOR METHODS AND KITS FOR MONITORING CHEMOTHERAPY RESISTANCE |
| WO2005014618A2 (en) | 2003-08-08 | 2005-02-17 | Immunomedics, Inc. | Bispecific antibodies for inducing apoptosis of tumor and diseased cells |
| CA2535510C (en) | 2003-08-11 | 2013-10-15 | Monogram Biosciences, Inc. | Detecting and profiling molecular complexes |
| US8399618B2 (en) | 2004-10-21 | 2013-03-19 | Xencor, Inc. | Immunoglobulin insertions, deletions, and substitutions |
| WO2005037071A2 (en) | 2003-10-14 | 2005-04-28 | Monogram Biosciences, Inc. | Receptor tyrosine kinase signaling pathway analysis for diagnosis and therapy |
| CA2543830A1 (en) | 2003-10-27 | 2005-05-19 | Monogram Biosciences, Inc. | Detecting human anti-therapeutic antibodies |
| JP2007510708A (ja) | 2003-11-06 | 2007-04-26 | ファイザー・プロダクツ・インク | 癌の治療における選択的erbB2阻害剤/抗erbB抗体の組合せ |
| US7754441B2 (en) | 2003-11-17 | 2010-07-13 | Genentech, Inc. | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US7235641B2 (en) | 2003-12-22 | 2007-06-26 | Micromet Ag | Bispecific antibodies |
| CA2551813C (en) | 2003-12-24 | 2014-08-12 | Genentech, Inc. | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US8323987B2 (en) | 2004-02-17 | 2012-12-04 | The University Of North Carolina At Chapel Hill | Modulation of epidermal growth factor heterodimer activity |
| JP2007528725A (ja) | 2004-02-20 | 2007-10-18 | ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア | 結合ペルオキシダーゼ模倣物及びその使用 |
| EP1796711A2 (en) | 2004-04-22 | 2007-06-20 | Oregon Health and Science University | Herstatin or intron 8-encoded domain thereof for modulating signaling mediated by igf-1 receptor and erbb receptors |
| WO2005117973A2 (en) | 2004-05-05 | 2005-12-15 | Merrimack Pharmaceuticals, Inc. | Bispecific binding agents for modulating biological activity |
| KR20120133403A (ko) | 2004-06-01 | 2012-12-10 | 도만티스 리미티드 | 증강된 혈청 반감기를 가지는 이특이성 융합 항체 |
| SV2006002143A (es) | 2004-06-16 | 2006-01-26 | Genentech Inc | Uso de un anticuerpo para el tratamiento del cancer resistente al platino |
| WO2006000034A1 (en) | 2004-06-24 | 2006-01-05 | The Walter And Eliza Hall Institute Of Medical Research | Conjugates and therapeutic uses thereof |
| US7560111B2 (en) | 2004-07-22 | 2009-07-14 | Genentech, Inc. | HER2 antibody composition |
| NZ580115A (en) | 2004-09-23 | 2010-10-29 | Genentech Inc | Cysteine engineered antibody light chains and conjugates |
| US20100111856A1 (en) | 2004-09-23 | 2010-05-06 | Herman Gill | Zirconium-radiolabeled, cysteine engineered antibody conjugates |
| WO2006042002A2 (en) | 2004-10-05 | 2006-04-20 | Oregon Health And Science University | Compositions and methods for treating disease |
| DK1817340T3 (da) | 2004-11-12 | 2012-08-13 | Xencor Inc | Fc-varianter med ændret binding til fcrn |
| EP1814883A1 (en) | 2004-11-22 | 2007-08-08 | Vertex Pharmaceuticals Incorporated | Bicyclic inhibitors or rho kinase |
| US7947839B2 (en) | 2004-12-01 | 2011-05-24 | Genentech, Inc. | Heterocyclic-substituted bis-1,8 naphthalimide compounds, antibody drug conjugates, and methods of use |
| US7811562B2 (en) * | 2004-12-03 | 2010-10-12 | Schering Corporation | Biomarkers for pre-selection of patients for anti-IGF1R therapy |
| CN101115849A (zh) | 2004-12-07 | 2008-01-30 | 健泰科生物技术公司 | 选择her抑制剂疗法的患者 |
| WO2006068640A1 (en) | 2004-12-21 | 2006-06-29 | Cell Signaling Technology, Inc. | Protein phosphorylation in egfr-signaling pathways |
| US7807789B2 (en) | 2004-12-21 | 2010-10-05 | Cell Signaling Technology, Inc. | Reagents for the detection of protein phosphorylation in EGFR-signaling pathways |
| CN101098891B (zh) | 2005-01-05 | 2014-05-21 | F-星生物技术研究与开发有限公司 | 分子中互补决定区以外的区域中工程改造了的具有结合特性的合成免疫球蛋白结构域 |
| EP1838730A4 (en) | 2005-01-11 | 2015-04-29 | Molecular Logix Inc | PAN-HER ANTAGONISTS AND METHODS OF USE |
| US7449184B2 (en) | 2005-01-21 | 2008-11-11 | Genentech, Inc. | Fixed dosing of HER antibodies |
| WO2006084018A2 (en) | 2005-02-02 | 2006-08-10 | Monogram Biosciences, Inc. | Methods for determining responsiveness to cancer therapy |
| EP2402374A1 (en) | 2005-02-07 | 2012-01-04 | GlycArt Biotechnology AG | Antigen binding molecules that bind EGFR, vectors encoding same, and uses thereof |
| US7718626B2 (en) | 2005-02-17 | 2010-05-18 | University Of Maryland, Baltimore | ErbB3 binding protein compositions and methods of use |
| CA2599606A1 (en) | 2005-02-23 | 2006-08-31 | Merrimack Pharmaceuticals, Inc. | Bispecific binding agents for modulating biological activity |
| PT1850874E (pt) | 2005-02-23 | 2013-12-02 | Genentech Inc | Extensão de tempo até a progressão da doença ou sobrevivência em pacientes com cancro de ovário usando pertuzumab |
| US7210618B2 (en) | 2005-03-03 | 2007-05-01 | Nokia Corporation | Mobile communication terminal |
| KR20080004480A (ko) | 2005-03-07 | 2008-01-09 | 타게티드 몰레큘라 다이아그노스틱스, 엘엘씨 | 티로신 키나제 억제제 조성물, 그의 제조 방법 및 이를이용한 질병 치료 방법 |
| WO2006096861A2 (en) | 2005-03-08 | 2006-09-14 | Genentech, Inc. | METHODS FOR IDENTIFYING TUMORS RESPONSIVE TO TREATMENT WITH HER DIMERIZATION INHIBITORS (HDIs) |
| EP1874824A4 (en) | 2005-04-06 | 2009-12-30 | Ibc Pharmaceuticals Inc | METHODS OF GENERATING STABLE COMPOUND RELATED COMPLEXES OF HOMODIMERS, HOMOTRATEERS OR DIMER SIZES AND USES THEREOF |
| ES2417065T3 (es) | 2005-04-26 | 2013-08-05 | Trion Pharma Gmbh | Combinación de anticuerpos con glucocorticoides para el tratamiento del cáncer |
| EP1913160A2 (en) | 2005-07-29 | 2008-04-23 | Bayer Healthcare LLC | Diagnostic methods for the prediction of therapeutic success, recurrence free and overall survival in cancer therapy |
| CN101291954B (zh) | 2005-08-26 | 2013-03-27 | 罗氏格黎卡特股份公司 | 具有改变的细胞信号传导活性的修饰的抗原结合分子 |
| US20070172844A1 (en) | 2005-09-28 | 2007-07-26 | University Of South Florida | Individualized cancer treatments |
| EP1931709B1 (en) | 2005-10-03 | 2016-12-07 | Xencor, Inc. | Fc variants with optimized fc receptor binding properties |
| US20090252681A1 (en) | 2005-10-11 | 2009-10-08 | Ablynx N.V. | Nanobodies and Polypeptides Against EGFR and IGF-IR |
| US20110052570A1 (en) | 2005-10-26 | 2011-03-03 | Children's Medical Center Corporation | Method to prognose response to anti-egfr therapeutics |
| EP1792622A1 (en) | 2005-11-11 | 2007-06-06 | GPC Biotech AG | Anti-proliferative combination therapy comprising a platinum-based chemotherapeutic agent and EGFR inhibitors or pyrimidine analogues |
| EP1800695A1 (en) | 2005-12-21 | 2007-06-27 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Immuno-RNA-constructs |
| US7498142B2 (en) | 2006-01-31 | 2009-03-03 | Yeda Research And Development Co., Ltd. | Methods of identifying combinations of antibodies with an improved anti-tumor activity and compositions and methods using the antibodies |
| CA2641026A1 (en) | 2006-02-01 | 2007-08-09 | The Johns Hopkins University | Polypeptide-nucleic acid conjugate for immunoprophylaxis or immunotherapy for neoplastic or infectious disorders |
| WO2007109254A2 (en) | 2006-03-17 | 2007-09-27 | Biogen Idec Ma Inc. | Stabilized polypeptide compositions |
| JP2009532393A (ja) | 2006-04-07 | 2009-09-10 | コペンハーゲン ユニバーシティ | ErbB受容体由来ペプチド断片 |
| KR20090019890A (ko) | 2006-06-05 | 2009-02-25 | 제넨테크, 인크. | Egf 또는 tgf-알파 수준이 상승된 암 환자의 생존 연장 |
| MX363905B (es) | 2006-06-12 | 2019-04-08 | Aptevo Res & Development Llc | Proteinas de union multivalentes monocatenarias con funcion efectora. |
| WO2007145832A2 (en) | 2006-06-13 | 2007-12-21 | Shulman Zachary J | Infant harness support |
| AR062223A1 (es) | 2006-08-09 | 2008-10-22 | Glycart Biotechnology Ag | Moleculas de adhesion al antigeno que se adhieren a egfr, vectores que los codifican, y sus usos de estas |
| US20100316626A1 (en) | 2006-08-11 | 2010-12-16 | The Government Of The United States Of America As Represented By The Secretary | Methods for treatment and diagnosis of psychiatric disorders |
| US10118970B2 (en) | 2006-08-30 | 2018-11-06 | Genentech, Inc. | Multispecific antibodies |
| US8936780B2 (en) | 2006-08-30 | 2015-01-20 | Advanced Cardiovascular Systems, Inc. | Stimuli responsive polyester amide particles |
| AU2007291501B2 (en) | 2006-08-31 | 2012-07-12 | F. Hoffmann-La Roche Ag | Method for the production of insulin-like growth factor-I |
| MX2009003048A (es) | 2006-09-21 | 2009-09-07 | Prometheus Lab Inc | Disposiciones a base de anticuerpo para detectar transductores de multiple señal en celulas circulantes raras. |
| BRPI0717416A2 (pt) | 2006-09-21 | 2013-11-12 | Prometheus Lab Inc | Método para realizar um imunoensaio complexo de alta produtividade, e, arranjo |
| US20080076139A1 (en) | 2006-09-21 | 2008-03-27 | Sharat Singh | Methods and compositions for detecting the activation states of multiple signal transducers in rare circulating cells |
| US20080112961A1 (en) | 2006-10-09 | 2008-05-15 | Macrogenics, Inc. | Identification and Engineering of Antibodies with Variant Fc Regions and Methods of Using Same |
| WO2008069881A2 (en) | 2006-11-06 | 2008-06-12 | Source Precision Medicine, Inc. | Gene expression profiling for identification, monitoring and treatment of melanoma |
| EP2091975A4 (en) | 2006-11-21 | 2013-05-22 | Univ California | ANTIBODIES TO THE EGFR FAMILY, BICE-SPECIFIC ANTIBODIES TO THE EGFR FAMILY AND METHOD FOR THEIR USE |
| WO2008064884A1 (en) | 2006-11-28 | 2008-06-05 | U3 Pharma Gmbh | Activated her3 as a marker for predicting therapeutic efficacy |
| SG177225A1 (en) | 2006-12-01 | 2012-01-30 | Agency Science Tech & Res | Cancer-related protein kinases |
| WO2008140603A2 (en) | 2006-12-08 | 2008-11-20 | Macrogenics, Inc. | METHODS FOR THE TREATMENT OF DISEASE USING IMMUNOGLOBULINS HAVING FC REGIONS WITH ALTERED AFFINITIES FOR FCγR ACTIVATING AND FCγR INHIBITING |
| US8362217B2 (en) | 2006-12-21 | 2013-01-29 | Emd Millipore Corporation | Purification of proteins |
| US8569464B2 (en) | 2006-12-21 | 2013-10-29 | Emd Millipore Corporation | Purification of proteins |
| US20100267933A1 (en) | 2006-12-21 | 2010-10-21 | Moya Wilson | Purification of proteins |
| DE102007001370A1 (de) | 2007-01-09 | 2008-07-10 | Curevac Gmbh | RNA-kodierte Antikörper |
| JP2010516675A (ja) | 2007-01-17 | 2010-05-20 | イミューノメディクス、インコーポレイテッド | 治療薬剤のポリマー担体および疾病部位の抗体に基づく標的化のための認識部分 |
| SI2129396T1 (sl) | 2007-02-16 | 2013-12-31 | Merrimack Pharmaceuticals, Inc. | Protitelesa proti ErbB3 in njihove uporabe |
| PE20090681A1 (es) | 2007-03-02 | 2009-06-10 | Genentech Inc | Prediccion de respuesta a un inhibidor her |
| AR065803A1 (es) | 2007-03-23 | 2009-07-01 | Smithkline Beecham Corp | Uso de un polipeptido de il- 18 humana y un anticuerpo anti- cd para preparar unmedicamento |
| US20100119457A1 (en) | 2007-03-30 | 2010-05-13 | Helmut Lenz | Composition of labeled and non-labeled monoclonal antibodies |
| DK2076289T3 (da) | 2007-04-13 | 2015-02-09 | Dana Farber Cancer Inst Inc | Fremgangsmåder til behandling af cancerresistens over for ErbB-lægemider |
| FR2915115B1 (fr) | 2007-04-23 | 2010-09-10 | Sames Technologies | Organe de pulverisation,dispositif de projection comportant un tel organe,installation de projection et methode de nettoyage d'un tel organe |
| CA2688477C (en) | 2007-06-01 | 2020-12-22 | The Regents Of The University Of California | Multigene prognostic assay for lung cancer |
| WO2008148546A2 (en) | 2007-06-06 | 2008-12-11 | F.Hoffmann-La Roche Ag | Composition of a first non-labeled monoclonal antibody binding to a tumor antigen and a non-cross reactive second monoclonal antibody labeled with a nir fluorescence label |
| WO2009045579A2 (en) | 2007-06-14 | 2009-04-09 | The Regents Of The University Of California | Multimodal imaging probes for in vivo targeted and non-targeted imaging and therapeutics |
| WO2009003082A2 (en) | 2007-06-26 | 2008-12-31 | Vanderbilt University | Immunological compositions as cancer biomarkers and/or therapeutics |
| US20110038865A1 (en) | 2007-06-26 | 2011-02-17 | University Of Miami | Antibody- endostatin fusion protein and its variants |
| US20090053786A1 (en) | 2007-07-09 | 2009-02-26 | Yung-Hsiang Kao | Prevention of disulfide bond reduction during recombinant production of polypeptides |
| KR101553723B1 (ko) | 2007-07-13 | 2015-09-16 | 네스텍 소시에테아노님 | 항체기반 어레이를 사용한 폐 암 치료를 위한 약물 선별법 |
| WO2009023266A1 (en) | 2007-08-14 | 2009-02-19 | Ludwig Institute For Cancer Research | Generation of antibodies to cell-surface receptors and cancer-associated proteins including egfr family members |
| MX2010003099A (es) | 2007-09-21 | 2010-05-17 | Univ California | Interferon de objetivo demuestra actividades potentes apoptoticas y antitumorales. |
| US20110091473A1 (en) | 2007-10-22 | 2011-04-21 | Genmab A/S | Novel antibody therapies |
| JP5620106B2 (ja) | 2007-10-24 | 2014-11-05 | 株式会社糖鎖工学研究所 | 増強されたエフェクター機能を有するポリペプチド |
| ES2545760T3 (es) | 2008-02-25 | 2015-09-15 | Nestec S.A. | Selección de fármacos para terapia del cáncer de mama utilizando matrices de anticuerpos |
| WO2009111707A1 (en) | 2008-03-06 | 2009-09-11 | Genentech, Inc. | Combination therapy with c-met and her antagonists |
| EP2106806A1 (en) | 2008-03-31 | 2009-10-07 | Fraunhofer-Gesellschaft zur Förderung der Angewandten Forschung e.V. | Nanoparticles for targeted delivery of active agents to the lung |
| CA2721093A1 (en) | 2008-04-11 | 2009-10-15 | Merrimack Pharmaceuticals, Inc. | Human serum albumin linkers and conjugates thereof |
| CA2722466A1 (en) | 2008-04-29 | 2009-11-05 | Tariq Ghayur | Dual variable domain immunoglobulins and uses thereof |
| EP2276506A4 (en) | 2008-04-30 | 2014-05-07 | Immunogen Inc | EFFICIENT CONJUGATES AND HYDROPHILIC BINDER |
| WO2009134870A1 (en) | 2008-04-30 | 2009-11-05 | Immunogen, Inc. | Potent cell-binding agent drug conjugates |
| UY31800A (es) | 2008-05-05 | 2009-11-10 | Smithkline Beckman Corp | Metodo de tratamiento de cancer usando un inhibidor de cmet y axl y un inhibidor de erbb |
| WO2010008726A1 (en) | 2008-06-16 | 2010-01-21 | Immunogen Inc. | Novel synergistic effects |
| EP2138511A1 (en) | 2008-06-27 | 2009-12-30 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | HER3 as a determinant for the prognosis of melanoma |
| NZ590074A (en) * | 2008-07-08 | 2012-12-21 | Abbott Lab | Prostaglandin e2 dual variable domain immunoglobulins and uses thereof |
| AU2009273540A1 (en) | 2008-07-25 | 2010-01-28 | Merck Patent Gmbh | Method of determination of receptor binding saturation effected by monoclonal antibodies |
| US8056451B2 (en) | 2008-07-28 | 2011-11-15 | Irwin Industrial Tool Company | Locking pliers |
| US20100033482A1 (en) | 2008-08-11 | 2010-02-11 | Interactive Relighting of Dynamic Refractive Objects | Interactive Relighting of Dynamic Refractive Objects |
| US8623592B2 (en) | 2008-08-15 | 2014-01-07 | Merrimack Pharmaceuticals, Inc. | Methods and systems for predicting response of cells to a therapeutic agent |
| US8080415B2 (en) | 2008-09-26 | 2011-12-20 | Eureka Therapeutics, Inc. | Modified host cells and uses thereof |
| WO2010051530A2 (en) | 2008-10-31 | 2010-05-06 | The General Hospital Corporation | Compositions and methods for delivering a substance to a biological target |
| AU2009308707A1 (en) | 2008-10-31 | 2010-05-06 | Biogen Idec Ma Inc. | LIGHT targeting molecules and uses thereof |
| WO2010059315A1 (en) | 2008-11-18 | 2010-05-27 | Merrimack Pharmaceuticals, Inc. | Human serum albumin linkers and conjugates thereof |
| US20100169729A1 (en) | 2008-12-30 | 2010-07-01 | Datta Shamanna M | Enabling an integrated memory controller to transparently work with defective memory devices |
| WO2010083252A2 (en) | 2009-01-14 | 2010-07-22 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Ratio based biomarkers and methods of use thereof |
| WO2010083463A1 (en) | 2009-01-15 | 2010-07-22 | Laboratory Corporation Of America Holdings | Methods of determining patient response by measurement of her-2 expression |
| WO2010083470A1 (en) | 2009-01-15 | 2010-07-22 | Laboratory Corporation Of America Holdings | Methods of determining patient response by measurement of her-3 |
| PT3903829T (pt) | 2009-02-13 | 2023-06-02 | Immunomedics Inc | Imunoconjugados com uma ligação intracelular clivável |
| WO2010097186A1 (en) | 2009-02-24 | 2010-09-02 | Roche Diagnostic Gmbh | Use of s-erbb-3 as a marker for cancer |
| EP2400984A4 (en) | 2009-02-25 | 2013-01-23 | Merck Sharp & Dohme | HER2 ANTIBODY COMPOSITIONS |
| ES2572728T3 (es) | 2009-03-20 | 2016-06-02 | F. Hoffmann-La Roche Ag | Anticuerpos anti-HER biespecíficos |
| CA2759792A1 (en) | 2009-04-29 | 2010-11-04 | Trellis Bioscience, Inc. | Improved antibodies immunoreactive with heregulin-coupled her3 |
| JP5705836B2 (ja) | 2009-05-29 | 2015-04-22 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | Her2を発現する胃癌患者のher2シグナル伝達のためのモジュレーター |
| US20120213705A1 (en) | 2009-06-22 | 2012-08-23 | Medimmune, Llc | ENGINEERED Fc REGIONS FOR SITE-SPECIFIC CONJUGATION |
| AU2010273319B2 (en) | 2009-07-15 | 2015-01-22 | Nestec S.A. | Drug selection for gastric cancer therapy using antibody-based arrays |
| RU2573894C2 (ru) | 2009-08-06 | 2016-01-27 | Дженентек, Инк. | Способ усовершенствования процесса удаления вирусов при очистке белков |
| US20110039300A1 (en) | 2009-08-10 | 2011-02-17 | Robert Bayer | Antibodies with enhanced adcc functions |
| CA2771744A1 (en) | 2009-08-21 | 2011-02-24 | Merrimack Pharmaceuticals, Inc. | Antibodies against the ectodomain of erbb3 and uses thereof |
| WO2011031840A1 (en) | 2009-09-09 | 2011-03-17 | Quintiles Transnational Corp. | Methods and compositions for the treatment of receptor tyrosine kinase mediated diseases or disorders |
| WO2011044368A1 (en) | 2009-10-07 | 2011-04-14 | Macrogenics, Inc. | Fc region-containing polypeptides that exhibit improved effector function due to alterations of the extent of fucosylation, and methods for their use |
| AU2010303443A1 (en) | 2009-10-09 | 2012-04-19 | Merck Sharp & Dohme Corp. | Generation, characterization and uses thereof of anti-Her 3 antibodies |
| AU2010306774A1 (en) | 2009-10-14 | 2012-05-03 | Merrimack Pharmaceuticals, Inc. | Bispecific binding agents targeting IGF-1R and ErbB3 signalling and uses thereof |
| EP2719708B1 (en) | 2009-11-13 | 2017-10-25 | Daiichi Sankyo Europe GmbH | Material and methods for treating or preventing HER-3 associated diseases |
| US9556249B2 (en) | 2010-02-18 | 2017-01-31 | Genentech, Inc. | Neuregulin antagonists and use thereof in treating cancer |
| US20130225424A1 (en) | 2010-03-03 | 2013-08-29 | Targeted Molecular Diagnostics, Llc | Methods for determining responsiveness to a drug based upon determination of ras mutation and/or ras amplification |
| EA201201186A1 (ru) | 2010-03-11 | 2013-11-29 | Мерримак Фармасьютикалс, Инк. | ИСПОЛЬЗОВАНИЕ ErbB3 ИНГИБИТОРОВ В ЛЕЧЕНИИ ТРИЖДЫ НЕГАТИВНОГО И БАЗАЛЬНО-ПОДОБНОГО ВИДОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ |
| BR112012025730B1 (pt) | 2010-04-09 | 2020-12-08 | Aveo Pharmaceuticals, Inc | anticorpo isolado que se liga ao erbb3 humano, seus usos, seu processo de produção e vetor de expressão |
| WO2011139629A2 (en) | 2010-04-26 | 2011-11-10 | Biogen Idec Ma Inc. | Light targeting molecules and uses thereof |
| EP2569334A4 (en) | 2010-05-13 | 2014-01-22 | Fox Chase Cancer Ct | RECOMBINANT-PRODUCED ANTIBODIES FOR THE TARGETING OF ERBB SIGNALING MOLECULES AND METHOD FOR THEIR USE FOR DISEASE DIAGNOSIS AND TREATMENT |
| WO2011146568A1 (en) | 2010-05-19 | 2011-11-24 | Genentech, Inc. | Predicting response to a her inhibitor |
| EP3546483A1 (en) | 2010-05-20 | 2019-10-02 | Ablynx N.V. | Biological materials related to her3 |
| WO2012103341A1 (en) | 2011-01-27 | 2012-08-02 | Merrimack Pharmaceuticals, Inc. | Treatment of advanced solid stage tumors using anti-erbb3 antibodies |
| WO2012106578A1 (en) | 2011-02-04 | 2012-08-09 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | HIV NEUTRALIZING ANTIBODIES HAVING MUTATIONS IN CONSTANT DOMAIN (Fc) |
| CA2825064C (en) | 2011-02-04 | 2022-08-30 | Genentech, Inc. | Fc variants and methods for their production |
| AU2012214643B2 (en) | 2011-02-07 | 2016-12-15 | Research Development Foundation | Engineered immunoglobulin Fc polypeptides |
| ES2687771T3 (es) | 2011-03-06 | 2018-10-29 | Merck Serono Sa | Líneas de células con bajo nivel de fucosa y sus usos |
| EP3553527A1 (en) | 2011-03-17 | 2019-10-16 | Cernostics, Inc. | Systems and compositions for diagnosing barrett's esophagus and methods of using the same |
-
2011
- 2011-09-01 TW TW100131536A patent/TW201302793A/zh unknown
- 2011-09-02 PE PE2013000314A patent/PE20140133A1/es not_active Application Discontinuation
- 2011-09-02 NZ NZ607680A patent/NZ607680A/en not_active IP Right Cessation
- 2011-09-02 EP EP11822713.1A patent/EP2611829A4/en not_active Withdrawn
- 2011-09-02 BR BR112013005242A patent/BR112013005242A2/pt not_active IP Right Cessation
- 2011-09-02 CN CN2011800533015A patent/CN103189391A/zh active Pending
- 2011-09-02 EA EA201390328A patent/EA201390328A1/ru unknown
- 2011-09-02 KR KR1020137008415A patent/KR20130101047A/ko not_active Application Discontinuation
- 2011-09-02 MA MA35784A patent/MA34555B1/fr unknown
- 2011-09-02 WO PCT/US2011/050322 patent/WO2012031198A2/en active Application Filing
- 2011-09-02 JP JP2013527341A patent/JP2013544492A/ja active Pending
- 2011-09-02 AU AU2011295726A patent/AU2011295726B2/en not_active Ceased
- 2011-09-02 SG SG10201401681PA patent/SG10201401681PA/en unknown
- 2011-09-02 US US13/639,918 patent/US9085622B2/en active Active
- 2011-09-02 SG SG2013013057A patent/SG187930A1/en unknown
- 2011-09-02 MX MX2013002535A patent/MX2013002535A/es unknown
- 2011-09-02 CA CA2809443A patent/CA2809443A1/en not_active Abandoned
- 2011-09-05 UY UY0001033591A patent/UY33591A/es unknown
-
2013
- 2013-02-27 CL CL2013000566A patent/CL2013000566A1/es unknown
- 2013-03-13 CO CO13050512A patent/CO6690769A2/es unknown
- 2013-03-20 CR CR20130128A patent/CR20130128A/es unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080269467A1 (en) * | 2005-12-13 | 2008-10-30 | Barrett Allan | Anti-IL-17 Antibodies |
| US20080124345A1 (en) * | 2005-12-30 | 2008-05-29 | Mike Rothe | Antibodies directed to HER-3 and uses thereof |
| CN101627053A (zh) * | 2006-06-12 | 2010-01-13 | 西福根有限公司 | 泛细胞表面受体特异的治疗剂 |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105593241A (zh) * | 2013-10-04 | 2016-05-18 | 豪夫迈·罗氏有限公司 | 特异性结合her3的抗体 |
| CN109328077A (zh) * | 2016-06-10 | 2019-02-12 | 德国癌症研究公共权益基金会 | 膜联蛋白的核心结构域及其在抗原递送和接种中的用途 |
| CN110753703A (zh) * | 2017-05-23 | 2020-02-04 | 德国亥姆霍兹慕尼黑中心健康与环境研究中心(有限公司) | 新的cd73抗体、其制备和用途 |
| CN110753703B (zh) * | 2017-05-23 | 2024-04-09 | 德国亥姆霍兹慕尼黑中心健康与环境研究中心(有限公司) | 新的cd73抗体、其制备和用途 |
| CN111886024A (zh) * | 2018-03-08 | 2020-11-03 | 东莞凡恩世生物医药有限公司 | 抗tip-1抗体及其用途 |
| CN114787186A (zh) * | 2019-09-27 | 2022-07-22 | 艾吉纳斯公司 | 异二聚体蛋白 |
| CN116286828A (zh) * | 2023-05-12 | 2023-06-23 | 中国人民解放军军事科学院军事医学研究院 | 一种寡聚核酸siRNA及其在制备用于预防和治疗肝癌的药物中的应用 |
| CN116286828B (zh) * | 2023-05-12 | 2023-08-18 | 中国人民解放军军事科学院军事医学研究院 | 一种寡聚核酸siRNA及其在制备用于预防和治疗肝癌的药物中的应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| CL2013000566A1 (es) | 2014-01-24 |
| KR20130101047A (ko) | 2013-09-12 |
| NZ607680A (en) | 2015-02-27 |
| SG10201401681PA (en) | 2014-07-30 |
| EA201390328A1 (ru) | 2013-08-30 |
| TW201302793A (zh) | 2013-01-16 |
| EP2611829A4 (en) | 2014-05-07 |
| MX2013002535A (es) | 2013-06-03 |
| US9085622B2 (en) | 2015-07-21 |
| US20130156779A1 (en) | 2013-06-20 |
| AU2011295726B2 (en) | 2014-11-06 |
| WO2012031198A2 (en) | 2012-03-08 |
| CA2809443A1 (en) | 2012-03-08 |
| PE20140133A1 (es) | 2014-02-09 |
| MA34555B1 (fr) | 2013-09-02 |
| EP2611829A2 (en) | 2013-07-10 |
| AU2011295726A1 (en) | 2013-03-21 |
| CO6690769A2 (es) | 2013-06-17 |
| SG187930A1 (en) | 2013-03-28 |
| CR20130128A (es) | 2013-06-28 |
| WO2012031198A3 (en) | 2012-05-18 |
| BR112013005242A2 (pt) | 2016-06-28 |
| JP2013544492A (ja) | 2013-12-19 |
| UY33591A (es) | 2012-03-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103189391A (zh) | 新抗原结合蛋白 | |
| JP7062704B2 (ja) | アゴニスト性icos結合タンパク質 | |
| KR101721678B1 (ko) | 조건부 활성 항-표피 성장 인자 수용체 항체 및 이의 사용 방법 | |
| CN107531786B (zh) | 抗axl拮抗抗体 | |
| WO2016059602A2 (en) | Methods of treating cancer and related compositions | |
| CN106573979B (zh) | 抗axl抗体 | |
| BR112021005585A2 (pt) | proteínas de ligação a sirpa e métodos de uso das mesmas | |
| CN109311997B (zh) | 抗axl拮抗抗体 | |
| KR20140113912A (ko) | Her3에 특이적인 결합 분자 및 이의 용도 | |
| CN106573980A (zh) | 抗axl抗体 | |
| BR112021004698A2 (pt) | anticorpos anti-tnfrsf9 e usos dos mesmos | |
| US20230295313A1 (en) | Il1rap binding proteins | |
| CN117500833A (zh) | 一种双抗组合及其应用 | |
| JP2023512023A (ja) | 併用療法及びその使用及び方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| AD01 | Patent right deemed abandoned |
Effective date of abandoning: 20161019 |
|
| C20 | Patent right or utility model deemed to be abandoned or is abandoned |