CN102942572A - (r)-n-溴化甲基纳曲酮的晶体形式及其用途 - Google Patents
(r)-n-溴化甲基纳曲酮的晶体形式及其用途 Download PDFInfo
- Publication number
- CN102942572A CN102942572A CN2012103612119A CN201210361211A CN102942572A CN 102942572 A CN102942572 A CN 102942572A CN 2012103612119 A CN2012103612119 A CN 2012103612119A CN 201210361211 A CN201210361211 A CN 201210361211A CN 102942572 A CN102942572 A CN 102942572A
- Authority
- CN
- China
- Prior art keywords
- compound
- composition
- powder diffraction
- ray powder
- peaks
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 CCO[C@](CC1)([C@@](Cc2ccc3*)*(CC4CC4)(CC4)N)[C@]44c2c3O[C@@]4C1=O Chemical compound CCO[C@](CC1)([C@@](Cc2ccc3*)*(CC4CC4)(CC4)N)[C@]44c2c3O[C@@]4C1=O 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/08—Bridged systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/14—Prodigestives, e.g. acids, enzymes, appetite stimulants, antidyspeptics, tonics, antiflatulents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/02—Antidotes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D489/00—Heterocyclic compounds containing 4aH-8, 9 c- Iminoethano-phenanthro [4, 5-b, c, d] furan ring systems, e.g. derivatives of [4, 5-epoxy]-morphinan of the formula:
- C07D489/02—Heterocyclic compounds containing 4aH-8, 9 c- Iminoethano-phenanthro [4, 5-b, c, d] furan ring systems, e.g. derivatives of [4, 5-epoxy]-morphinan of the formula: with oxygen atoms attached in positions 3 and 6, e.g. morphine, morphinone
- C07D489/04—Salts; Organic complexes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D489/00—Heterocyclic compounds containing 4aH-8, 9 c- Iminoethano-phenanthro [4, 5-b, c, d] furan ring systems, e.g. derivatives of [4, 5-epoxy]-morphinan of the formula:
- C07D489/06—Heterocyclic compounds containing 4aH-8, 9 c- Iminoethano-phenanthro [4, 5-b, c, d] furan ring systems, e.g. derivatives of [4, 5-epoxy]-morphinan of the formula: with a hetero atom directly attached in position 14
- C07D489/08—Oxygen atom
Abstract
本发明提供了一种可用作外周μ阿片样物质受体拮抗剂的(R)-N-甲基纳曲酮的新形式及其组合物。
Description
本申请是2008年3月28日提交的申请号为200880017624.7(PCT/US2008/004116)之申请“(R)-N-溴化甲基纳曲酮的晶体形式及其用途”的分案申请。
背景技术
阿片样物质被广泛用于患有晚期癌症和其它晚期疾病的患者中以减轻痛苦。阿片样物质是麻醉药,其活化位于中枢神经系统中的阿片样物质受体以减轻疼痛。然而,阿片样物质还与中枢神经系统以外的受体作用,这导致包括便秘、恶心、呕吐、尿潴留以及严重瘙痒的副作用。最显著的是在胃肠(GI)道中的作用,其中阿片样物质抑制胃排空和肠推进运动的活动性,从而降低肠道运输速度,形成便秘。由于阿片样物质所导致的副作用,其对疼痛的有效性常常受到限制,这些副作用可导致虚弱并常导致患者停止使用阿片样物质止痛剂。
研究表明,除了止痛剂阿片样物质引起副作用以外,内源性阿片样物质化合物和受体也可影响胃肠(GI)道的活动性,并且可参与动物和人中肠道动力和流体经粘膜运输的正常调节(Koch,T.R等,DigestiveDiseases and Sciences 1991,36,712-728;Schuller,A.G.P.等,Society ofNeuroscience Abstracts 1998,24,524,Reisine,T.,and Pasternak,G.,Goodman & Gilman′s The Pharmacological Basis of Therapeutics NinthEdition 1996,521-555以及Bagnol,D.等,Regul.Pept.1993,47,259-273)。因此,内源性化合物和/或受体活性的异常生理水平可导致肠功能障碍。
例如,进行过手术(尤其是腹部手术)的患者常患有特定的肠功能障碍,称为术后(或手术后)肠梗阻,这可能是由于天然阿片样物质水平的波动引起的。同样,近期生产过的女性常患有产后肠梗阻,这被是认为由作为生产应激结果的类似的天然阿片样物质波动引起的。与术后或产后肠梗阻相关的胃肠功能障碍通常可持续3-5天,其中一些严重的病例可持续1周以上。现在,手术后给患者施用阿片样物质止痛剂几乎是普遍选择的,这可加剧肠功能障碍,从而延迟正常肠功能的恢复、延长住院时间并增加医疗护理成本。
已经研究了阿片样物质受体拮抗剂如纳洛酮、纳曲酮和纳美芬,其作为拮抗阿片样物质的不想要的外周作用的方法。然而,这些药剂不仅作用于外周阿片样物质受体,而且还作用于中枢神经系统位点,使得它们有时逆转了阿片样物质的有益止痛作用,或者引起阿片样物质戒断症状。用于控制阿片样物质引起的副作用的优选方法包括施用不易穿过血脑屏障的外周阿片样物质受体拮抗剂化合物。例如,已公开了外周μ阿片样物质受体拮抗剂化合物甲基纳曲酮和相关化合物用于抑制患者中阿片样物质引起的副作用(例如便秘、瘙痒、恶心和/或呕吐)。参见例如美国专利Nos.5,972,954、5,102,887、4,861,781和4,719,215;以及Yuan,C.-S.等.Drug andAlcohol Dependence 1998,52,161。同样,已描述了外周选择性哌啶-N-烷基羧酸酯和3,4-二甲基-4-芳基-哌啶阿片样物质受体拮抗剂可用于治疗阿片样物质引起的副作用便秘、恶心或呕吐以及肠易激综合征和特发性便秘。参见例如美国专利Nos.5,250,542、5,434,171、5,159,081以及5,270,328。
期望以适于给需要治疗任意上述病症的患者施用的形式提供外周μ阿片样物质受体拮抗剂化合物将是理想的。
发明内容
本发明提供了化合物1(一种外周μ阿片样物质受体拮抗剂)的固体形式:
其中相对于氮而言,所述化合物是(R)-构型。本发明还提供了含有这些固体形式的药物组合物和制剂。化合物1及其本发明的固体形式可用于治疗、预防、改善、延迟或减轻与阿片样物质施用相关的副作用的严重程度和/或发生率,所述副作用例如胃肠道功能障碍(例如肠动力抑制、便秘、GI括约肌收缩、恶心、呕吐、胆囊痉挛、阿片样物质肠功能障碍、绞痛)、烦躁不安、瘙痒、尿潴留、呼吸抑制、瞳孔收缩、心血管作用、胸壁强直和咳嗽抑制、应激反应抑制以及与施用麻醉止痛剂有关的免疫抑制等,或者它们的组合。下文中阐述本文中所描述的化合物1及其本发明的固体形式的其它用途。
附图说明
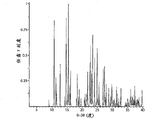
图1A示出了A形式的X射线粉末衍射图。
图1B示出了由150±1°K温度下收集的单晶数据计算得到的A形式的X射线粉末衍射图。
图2示出了A形式的DSC和TG重叠图。
图3示出了无定形化合物1的X射线粉末衍射图。
图4示出了B形式的X射线粉末衍射图。
图5示出了B形式的DSC和TG重叠图。
图6示出了D形式的X射线粉末衍射图。
图7示出了D形式的DSC和TG重叠图。
图8示出了C形式的X射线粉末衍射图,是以在150±1度K的温度下收集的单晶数据计算的。
图9示出了A形式+C形式的混合物的X射线粉末衍射图(择优取向)。
具体实施方式
本发明某些实施方案的详细描述
本发明某些方面的一般性描述
国际专利申请公开WO2006/127899描述了化合物1,即(R)-N-溴化甲基纳曲酮,其具有以下结构:
其中相对于氮而言,所述化合物是(R)-构型。在本发明的某些实施方案中,相对于氮而言,至少约99.6%、99.7%、99.8%、99.85%、99.9%或99.95%的化合物1是(R)-构型。测定样品中存在的(R)-N-溴化甲基纳曲酮的量相对于同一样品中存在的(S)-N-溴化甲基纳曲酮的量的方法详细描述于WO2006/127899中,其在此通过引用全文并入本文。在又一些实施方案中,化合物1包含0.15%或更少的(S)-N-溴化甲基纳曲酮。在又一些实施方案中,化合物1包含0.10%或0.05%或更少的(S)-N-溴化甲基纳曲酮。
化合物1(也称为“(R)-MNTX”)在治疗模型中表现出外周μ阿片样物质受体拮抗剂活性。因此,化合物1可用于拮抗阿片样物质活性的不想要的副作用,包括与阿片样物质止痛剂治疗有关的那些(例如胃肠道作用(例如胃排空延迟,GI道动力改变等)。在本发明的某些实施方案中,化合物1可用于治疗、预防、改善、延迟或减轻与阿片样物质施用相关的副作用的严重程度和/或发生率,所述副作用例如胃肠道功能障碍(例如肠动力抑制、便秘、GI括约肌收缩、恶心、呕吐、胆囊痉挛、阿片样物质肠功能障碍、绞痛)、烦躁不安、瘙痒、尿潴留、呼吸抑制、瞳孔收缩、心血管作用、胸壁强直和咳嗽抑制、应激反应抑制以及与施用麻醉止痛剂有关的免疫抑制等,或者它们的组合。下文中阐述化合物1及其本发明所描述的固体形式的其它用途。
化合物1的固体形式:
已经发现化合物1可以多种固体形式存在。这些形式包括纯晶体形式,称为多晶型物。这些固体形式还包括溶剂化物、水合物和无定形物。化合物1的所有这些固体形式均涵盖在本发明中。在某些实施方案中,本发明提供了化合物1,其作为选自多晶型物、溶剂化物、水合物和无定形化合物1中一种或多种固体形式的混合物。
本文所用的术语“多晶型物”指由特定化学实体得到的不同晶体结构。具体而言,当特定化合物可以一种以上的结构排布进行结晶时,发生多晶型现象。本文所用的术语“溶剂化物”指化学计量或非化学计量的溶剂或溶剂混合物被引入到晶体结构中的晶体形式。类似地,术语“水合物”指化学计量或非化学计量的水被引入到晶体结构中的晶体形式。
在本发明的某些实施方案中,化合物1是作为晶体固体提供的。在一些实施方案中,所述晶体固体基本上不含无定形化合物1。本文所用的术语“基本上不含无定形化合物1”意指固体不含有显著量的无定形化合物1。在本发明的某些实施方案中,术语“基本上不含无定形化合物1”意指固体中至少约95wt%的化合物1是晶体形式。在本发明的另一些某些实施方案中,术语“基本上不含无定形化合物1”意指固体中至少约99wt%的化合物1是晶体形式。
在本发明的某些实施方案中,化合物1是作为纯晶形提供的,因此不含有被引入到晶体结构中的任何水或溶剂。已经发现化合物1可以至少一种纯晶体形式或多晶型物(本文中称为A形式)存在。
在某些实施方案中,本发明提供了化合物1的A形式。在另一些实施方案中,本发明提供了化合物1的A形式,其特征在于其X射线粉末衍射(“XRPD”)图中具有2θ为约20.06度的峰。当用于指本文中所述的任意2θ值度数时,本文所用的术语“约”指所示值±0.2度2θ。
在某些实施方案中,本文所述的2θ度值记到小数点后两位。在另一些实施方案中,本文所述的2θ度值记到小数点后一位。在另一些实施方案中,本文所述的2θ度值没有小数点后位数。应当理解,当术语“约”用于指本文所述的任意2θ度值时,该术语指所示值±0.2度2θ,并且符合该值的所记小数位。
根据另一个实施方案,化合物1的A形式的特征在于在其由150±1°K温度下收集的单晶数据计算得到的XRPD图中具有选自2θ为约13.6、13.9、16.85、17.35、23、23.85、24.7、26.75以及34.75度的一个或多个峰。在另一些实施方案中,化合物1的A形式的特征在于,在其由150±1°K温度下收集的单晶数据计算得到的XRPD图中具有选自2θ为约13.6、13.9、16.85、17.35、23、23.85、24.7、26.75以及34.75度的两个或更多个、或者三个或更多个峰。在另一些实施方案中,化合物1的A形式的特征在于在其由150±1°K温度下收集的单晶数据计算得到的XRPD图中基本上具有选自2θ为约13.6、13.9、16.85、17.35、23、23.85、24.7、26.75以及34.75度的所有峰。
在另一些实施方案中,化合物1的A形式的特征在于在其XRPD图中其基本上具有下表1A中所列出的所有峰。
表1A.A形式的XRPD峰
在又一些实施方案中,化合物1的A形式的特征在于在其XRPD图中其基本上具有下表1B中所列出的所有峰。
表1B.A形式的XRPD峰
在本发明的某些实施方案中,化合物1的A形式的特征在于在其由150±1°K温度下收集的单晶数据计算得到的XRPD图中基本上具有下表1C中所列出的所有峰。
表1C.在150±1°K下所计算的A形式单晶的XRPD峰
根据一个方面,化合物1的A形式具有基本上与图1A中所示相似的XRPD图。本文所用的短语“基本上所有的峰”意指所述化合物在其XRPD中呈现出至少约80%的所列举的峰。在另一些实施方案中,短语“基本上所有的峰”意指所述化合物在其XRPD中呈现出至少约85%、90%、95%、97%、98%或99%的所列举的峰。根据另一些实施方案,化合物1的A形式具有与图1B中所示相似的由在150±1°K温度下收集的单晶数据计算得到的XRPD图。在另一些实施方案中,A形式的特征在于其具有与图2中所示基本上相似的DSC图。
在本发明的某些实施方案中,A形式的特征在于X射线粉末衍射中的代表性峰,这些峰是通过比较B形式、C形式和D形式的标准制备物的X射线衍射图结果来确定的。在一些实施方案中,A形式的特征在于X射线粉末衍射中的代表性峰,这些峰在约1至约30度2θ范围内,是通过比较B形式、C形式和D形式的标准制备物的X射线衍射图结果来确定的。制备化合物1的A形式的方法描述于下文的实施例部分中。
根据另一个实施方案,本发明提供了作为无定形固体的化合物1。无定形化合物1的X射线粉末衍射图示于图3中。无定形固体是本领域普通技术人员众所周知的,通常是利用例如冻干、熔融以及超临界流体沉淀等的方法制得的。制备无定形化合物1的方法描述于下文的实施例部分中。
在某些实施方案中,本发明提供了基本上不含晶体化合物1的无定形化合物1。本文所用的术语“基本上不含晶体化合物1”意指所述化合物不含显著量的晶体化合物1。晶体化合物1包括本文所述的纯晶体形式、溶剂化物和水合物或者可通过制备和/或分离无定形化合物1而得到的化合物1的其它晶体形式。在本发明的某些实施方案中,至少约95wt%的所存在的化合物1是无定形化合物1。在本发明的另一些实施方案中,至少约99wt%的所存在的化合物1是无定形化合物1。
在另一些实施方案中,本发明提供了包含无定形化合物1和化合物1至少一种晶体形式的组合物。化合物1的这些晶体形式包括本文所述的纯晶体形式、溶剂化物和水合物或者可通过制备和/或分离无定形化合物1而得到的化合物1的其它晶体形式。在某些实施方案中,本发明提供了包含无定形化合物1和本文所述的化合物1至少一种晶体形式的组合物。在另一些实施方案中,本发明提供了包含无定形化合物1和选自A形式、B形式、C形式或D形式的化合物1至少一种晶体形式的组合物。
已发现化合物1可以至少两种水合物形式或水合物-溶剂化物混合物形式存在。在本文中,两种这样的形式被称为B形式和D形式。
在某些实施方案中,本发明提供了化合物1的B形式。在某些实施方案中,本发明提供了基本上不含其它形式化合物1的B形式的化合物1。在另一些实施方案中,B形式是化合物1的水合物-甲醇溶剂化物的混合物。根据一个实施方案,B形式的特征在于在其XRPD图中具有选自2θ为约7.9、8.18、20.3、21.44、24.11以及25.12度的一个或多个峰。在某些实施方案中,B形式的特征在于在其XRPD图中具有选自2θ为约7.9、8.18、20.3、21.44、24.11以及25.12度的两个或更多个、或者三个或更多个峰。在另一些实施方案中,B形式的特征在于在其XRPD图中基本上具有选自2θ为约7.9、8.18、20.3、21.44、24.11以及25.12度的所有峰。
在某些实施方案中,化合物1的B形式的特征在于在其XRPD图中基本上具有下表2A中所列出的所有峰。
表2A.B形式的XRPD峰
在另一些实施方案中,化合物1的B形式的特征在于在其XRPD图中基本上具有下表2B中所列出的所有峰。
表2B.B形式的XRPD峰
根据一个方面,化合物1的B形式具有与图4中所示基本上相似的XRPD图。在另一些实施方案中,本发明提供了具有与图5中所示基本上相似的DSC图的化合物1的B形式。
在本发明的某些实施方案中,B形式的特征在于X射线粉末衍射中的代表性峰,这些峰是通过比较A形式、C形式和D形式的标准制备物的X射线衍射图结果来确定的。在一些实施方案中,B形式的特征在于X射线粉末衍射中的代表性峰,这些峰在约1至约30度2θ的范围内,是通过比较A形式、C形式和D形式的标准制备物的X射线衍射图结果来确定的。制备化合物1的B形式的方法描述于下文的实施例部分中。
在某些实施方案中,本发明提供了化合物1的D形式。在另一些实施方案中,本发明提供了基本上不含其它形式化合物1的D形式的化合物1。根据一个实施方案,D形式的特征在于在其XRPD图中具有选自2θ为约7.66、8.42、14.79以及21.06度的一个或多个峰。在某些实施方案中,D形式的特征在于在其XRPD图中具有选自2θ为约7.66、8.42、14.79以及21.06度的两个或更多个、或者三个或更多个峰。在另一些实施方案中,D形式的特征在于在其XRPD图中基本上具有选自2θ为约7.66、8.42、14.79以及21.06度的所有峰。
在某些实施方案中,化合物1的D形式的特征在于在其XRPD图中基本上具有下表3A中所列出的所有峰。
表3A.D形式的XRPD峰
| D形式(°2θ) |
| 7.66 |
| 8.42 |
| 12.85 |
| 13.48 |
| 16.11 |
| 17.53 |
| 18.67 |
| 19.61 |
| 21.06 |
| 21.79 |
| 22.07 |
| 23.25 |
| 24.53 |
| 26.23 |
在另一些实施方案中,化合物1的D形式的特征在于在其XRPD图中基本上具有下表3B中所列出的所有峰。
表3B.D形式的XRPD峰
根据一个方面,化合物1的D形式的具有与图6中所示基本上相似的XRPD图。在另一些实施方案中,本发明提供了具有与图7中所示基本上相似的DSC图的化合物1的D形式。
在本发明的某些实施方案中,D形式的特征在于X射线粉末衍射中的代表性峰,这些峰是通过比较A形式、B形式和C形式的标准制备物的X射线衍射图结果来确定的。在一些实施方案中,D形式的特征在于X射线粉末衍射中的代表性峰,这些峰在约1至约30度2θ的范围内,是通过比较A形式、B形式和C形式的标准制备物的X射线衍射图结果来确定的。制备化合物1的D形式的方法描述于下文的实施例部分中。
已发现化合物1可以溶剂化物的晶体形式存在。在某些实施方案中,本发明提供了化合物1的晶体形式的正丙醇溶剂化物,这在本文中称为C形式。在某些实施方案中,本发明提供了基本上不含其它形式化合物1的C形式的化合物1。根据另一个实施方案,化合物1的C形式的特征在于在其由150±1°K温度下收集的单晶数据计算得到的XRPD图中具有选自2θ为约10.8、12.8、14.8、15.9、16.25、18.5、19.15、22、23.6、24.25、25.7、27.5、28.1、28.9、31.5以及31.75度的一个或多个峰。在某些实施方案中,化合物1的C形式的特征在于在其由150±1°K温度下收集的单晶数据计算得到的XRPD图中具有选自2θ为约10.8、12.8、14.8、15.9、16.25、18.5、19.15、22、23.6、24.25、25.7、27.5、28.1、28.9、31.5以及31.75度的两个或更多个、或者三个或更多个峰。在另一些实施方案中,化合物1的C形式的特征在于在其由150±1°K温度下收集的单晶数据计算得到的XRPD图中基本上具有选自2θ为约10.8、12.8、14.8、15.9、16.25、18.5、19.15、22、23.6、24.25、25.7、27.5、28.1、28.9、31.5以及31.75度的所有峰。
在本发明的某些实施方案中,化合物1的C形式的特征在于在其由150±1°K温度下收集的单晶数据计算得到的XRPD图中基本上具有下表4A中所列出的所有峰。
表4A.150±1°K下由C形式单晶计算得到的XRPD峰
在另一些实施方案中,本发明提供了包含化合物1的A形式和C形式的混合物的组合物。根据另一个实施方案,化合物1的A形式和C形式(择优取向)的混合物的XRPD图具有2θ为约10.58和22.74度的一个或两个峰。本领域普通技术人员公知,“择优取向”指的是当晶体在收集XRPD数据过程中具有排队趋势时出现的现象。该现象常导致在XRPD图中形成较大的峰,本领域技术人员公认这一点。在本发明的某些实施方案中,化合物1的A形式和C形式(择优取向)的混合物的XRPD图基本上具有2θ为约10.58、11.56、13.88、15.42、20.82、21.86、22.74、23.2、24.74以及26.96度的所有峰。
在另一些实施方案中,化合物1的A形式和C形式(择优取向)的混合物的XRPD图基本上具有下表4B中所列出的其XRPD图中的所有峰。
表4B.A形式和C形式(择优取向)的XRPD峰
根据一个方面,化合物1的C形式具有与图8中所示基本上相似的由150±1°K温度下收集的单晶数据计算得到的XRPD图。根据另一个方面,化合物1的A形式和C形式(择优取向)的混合物具有与图9中所示基本上相似的XRPD图。
在本发明的某些实施方案中,C形式的特征在于X射线粉末衍射中的代表性峰,这些峰是通过比较A形式、B形式和D形式的标准制备物的X射线衍射图结果来确定的。在一些实施方案中,C形式的特征在于X射线粉末衍射中的代表性峰,这些峰在约1至约30度2θ的范围内,是通过比较A形式、B形式和D形式的标准制备物的X射线衍射图结果来确定的。制备化合物1的C形式的方法描述于下文的实施例部分中。
在某些实施方案中,本发明提供了化合物1的A形式,其包括化合物1的一种或多种其它固体形式。在另一些实施方案中,本发明提供了化合物1的A形式,其包含化合物1的水合物,化合物1的溶剂化物或无定形化合物2中的一种或多种。在又一些实施方案中,本发明提供了化合物1的A形式,其包含C形式、D形式或无定形中的一种或多种以及任选的B形式。因此,本发明的另一个方面提供了化合物1的组合物。
本文所用的术语“化合物1的组合物”指包含A形式、C形式、D形式和无定形化合物1中的至少两种以及任选B形式的组合物。在另一些实施方案中,化合物1的组合物包含B形式、C形式、D形式和无定形化合物1中的至少两种。在本发明的某些实施方案中,化合物1的组合物包含化合物1的A形式和D形式。在又一些实施方案中,化合物1的组合物包含A形式和无定形化合物1。
可药用组合物
如上文所述,本发明提供了化合物1的新形式,其可用作外周μ阿片样物质受体拮抗剂并且在用于治疗阿片样物质诱导的副作用的临床相关模型中表现出效用。根据本发明的另一个方面,提供了可药用组合物,其包含本文所述的化合物1的本发明形式或化合物1的组合物,并且任选地包含可药用载体、辅药或赋形剂(vehicle)。在本发明的某些实施方案中,这样的可药用组合物任选地还包含一种或多种其它治疗剂。
如上文所述,本发明的可药用组合物还包含可药用载体、辅药或赋形剂,其中本文中所用的可药用载体、辅药或赋形剂包括任意和所有的溶剂、稀释剂或其它液体赋形剂、分散助剂或混悬助剂、表面活性剂、等张剂、增稠剂或乳化剂、防腐剂、固体粘合剂、润滑剂等,如适用于所期望的特定剂型中的那些。Remington′s Pharmaceutical Sciences,Sixteenth Edition,E.W.Martin(Mack Publishing Co.,Easton,Pa.,1980)公开了用于配制可药用组合物的多种载体及用于其制备的已知技术。除了与化合物1的本发明形式或本发明的化合物1的组合物不相容(例如产生任意不想要的生物作用或者以有害方式与可药用组合物的任意其它成分相互作用)的任意常规载体介质以外,其用途均涵盖在本发明的范围之内。可起到可药用载体作用的物质的一些实例包括但不限于离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白(例如人血清白蛋白)、缓冲物质(例如磷酸盐),甘氨酸,山梨酸或山梨酸钾,饱和植物脂肪酸的偏甘油酯混合物,水,盐或电介质,例如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、聚丙烯酸酯、蜡、聚乙烯-聚氧丙烯嵌段聚合物、羊毛脂、糖(例如乳糖、葡萄糖和蔗糖);淀粉(例如玉米淀粉和马铃薯淀粉);纤维素及其衍生物(例如羧甲基纤维素钠、乙基纤维素和醋酸纤维素);粉末化黄蓍胶;麦芽;明胶;滑石;赋形剂(例如可可油和栓剂用蜡);油(例如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油);二醇(例如丙二醇或乙二醇);酯(例如油酸乙酯和月桂酸乙酯);琼脂;缓冲剂(例如氢氧化镁和氢氧化铝);藻酸;无热原水;等张盐水;林格氏液;乙醇和磷酸盐缓冲液以及其它无毒相容的润滑剂(例如十二烷基硫酸钠和硬脂酸镁),以及着色剂、释放剂、包衣剂、甜味剂、调味剂和芳香剂。根据配方人员的判断,防腐剂和抗氧化剂也可存在于组合物中。
定义
本文所用的化合物或可药用组合物的“有效量”可达到所期望的治疗和/或预防作用。“有效量”是化合物或含有化合物的组合物的至少最小量,其足以预防、改善、减轻、延迟或降低与外周μ阿片样物质受体的调节相关之病症的一种或多种症状的严重程度和/或与预防、改善、减轻、延迟或降低与阿片样物质止痛治疗相关的副作用(例如胃肠道功能障碍(例如动力障碍型便秘等)、恶心、呕吐(例如恶心)等)的严重程度。化合物或含有化合物的组合物的“有效量”足以预防、改善、减轻、延迟或降低与异常内源性外周阿片样物质或μ阿片样物质受体活性相关的疾病、相关的症状(例如特发性便秘、肠梗阻等)。
术语“制剂”指用于施用给对象的含有化合物1的本发明形式或化合物1的组合物以及一种或多种赋形剂的制备物。一般而言,特定的药物添加剂是针对各应用,就能达到化合物1的本发明形式或化合物1的组合物的最佳释放、分布和发挥活性的目的而选择的。
本文所用的术语“对象”意指哺乳动物,包括人和动物对象,例如家畜(例如马、狗、猫等)。
本文所用的表述“剂量单位形式”指适用于待治疗患者的药剂的物理上离散的单位。
根据本发明,化合物1的本发明形式或化合物1的组合物可以有效治疗或减轻与外周μ阿片样物质受体之调节有关的疾病的严重程度的任意量和任意施用途径进行施用。所需的准确量随对象而不同,取决于对象的种类、年龄和一般状况、感染的严重程度、具体的药剂、其施用方式等。然而,应当理解的是,化合物1的本发明形式或化合物1的组合物的每日总用量将由主治医生在合理医疗判断的范围内确定。对任意特定的患者或有机体而言,具体的有效剂量水平将取决于多种因素,包括正在治疗的病症和病症的严重程度;所用具体化合物的活性;所用的具体组合物;患者的年龄、体重、一般健康状况、性别和饮食;所用具体化合物的施用时间、施用途径和排泄速度;治疗持续时间;与所用具体化合物相组合或同时施用的药物以及医学领域中众所周知的类似因素。
可通过口服、经鼻、直肠、胃肠外、脑池内、阴道内、腹膜内、表面(通过粉末、软膏或滴剂)、口含等给人和其它动物施用本发明的可药用组合物,取决于正在治疗的感染的严重程度。在某些实施方案中,化合物1的本发明形式或化合物1的组合物可以约0.01mg/kg对象体重/天至约50mg/kg对象体重/天、优选约1mg/kg对象体重/天至约25mg/kg对象体重/天的剂量水平一天一次或多次口服或胃肠外施用以达到所期望的治疗作用。
用于口服或经鼻施用的液体剂型包括但不限于可药用乳剂、微乳、溶液剂、混悬剂、气雾剂、凝胶剂、糖浆和酏剂。除了化合物1的本发明形式或化合物1的组合物以外,所述液体剂型还可包含本领域中常用的惰性稀释剂,例如水或其它溶剂、助溶剂和乳化剂,例如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苄醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、二甲基甲酰胺、油(尤其是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和失水山梨醇脂肪酸酯及其混合物。除了惰性稀释剂以外,口服组合物还可包括辅药,例如润湿剂、乳化剂和助悬剂、甜味剂、调味剂和芳香剂。气雾剂制剂通常包含在生理可接受的水性或非水性溶剂中的活性物质的溶液或微细混悬液,并且通常以无菌形式以单剂量或多剂量存在于密封容器中,所述容器可采取与雾化设备一起使用的试剂盒式或再填充式容器的形式。或者,所述密封容器可以是单位分配设备,例如单剂量鼻吸入器或配备计量阀的气雾剂分配器,所述设备旨在一次性处理已经排出的容器内容物。当剂型包含气雾剂分配器时,其将含有可药用抛射剂。所述气雾剂型还可采取泵式喷雾器的形式。
可根据已知的技术利用合适的分散剂或润湿剂以及助悬剂来配制注射制剂,例如无菌注射水性或油性混悬液。所述无菌注射制剂还可以是在无毒胃肠外可接受的稀释剂或溶剂中的无菌注射溶液、混悬液或乳液,如在1,3-丁二醇中的溶液。其中可使用的可接受赋形剂和溶剂是水、林格氏溶液、U.S.P.和等渗氯化钠溶液。此外,无菌不挥发油通常用作溶剂或助悬介质。为此目的,可使用任意温和的不挥发油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸(例如油酸)可用于制备注射剂。
可例如通过截留细菌的滤器来过滤或在使用之前引入无菌固体组合物形式的灭菌剂来对注射制剂进行灭菌,所述灭菌剂可溶解或分散在无菌水或其它无菌注射介质中。
有利地,本文所述的无定形化合物1具有提高的水溶性。因此,无定形化合物1可用于血管内和肌肉内递送。在某些实施方案中,本发明还涉及用于血管内或肌肉内递送的注射制剂。
为了延长化合物1的本发明形式或本发明化合物1的组合物的作用,通过皮下或肌肉内注射来延缓所述化合物的吸收通常是理想的。这可以通过利用水溶性差的晶体或无定形物质的液体混悬液来实现。那么所述化合物的吸收速度取决于其溶出速度,而溶出速度可依次取决于晶体大小和晶体形式。或者,通过将化合物溶解或混悬在油介质中来实现胃肠外施用的化合物形式的延迟吸收。注射贮库剂型是通过在生物可降解聚合物(例如聚丙交酯-聚乙交酯)中形成化合物的微胶囊基质而制得的。根据化合物与聚合物的比例以及所用具体聚合物的性质,可以控制化合物的释放速度。其它生物可降解聚合物的实例包括聚(原酸酯)和聚(酸酐)。还可通过将化合物包封在与机体组织相容的脂质体或微乳中来制备贮库型注射制剂。
典型的胃肠外组合物由化合物在无菌水性载体或非水性或胃肠外可接受的油中的溶液或混悬液组成,所述载体或油例如聚乙二醇、聚乙烯吡咯烷酮、卵磷脂、花生油或芝麻油。或者,可将溶液冻干,然后在施用之前与合适的溶剂进行重新构建。
用于直肠或阴道施用的组合物通常是栓剂、阴道栓剂(pessary)、阴道片、泡沫剂或灌肠剂的形式。用于直肠或阴道施用的组合物优选是栓剂,其可以通过将化合物1的本发明形式或化合物1的组合物与合适的非刺激性赋形剂或载体(例如可可油、聚乙二醇或栓剂用蜡)相混合而制得,所述赋形剂或载体在环境温度下是固体但是在体温下是液体,从而溶解在直肠或阴道腔中并释放出活性化合物。
用于口服施用的固体剂型包括胶囊、片剂、丸剂、粉末剂和颗粒剂。在这些固体剂型中,化合物1的本发明形式或化合物1的组合物与至少一种惰性可药用赋形剂或载体相混合,所述赋形剂或载体例如柠檬酸钠或磷酸二钙和/或a)填充剂或增量剂(extender),例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;b)粘合剂,例如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和阿拉伯胶;c)保湿剂,例如甘油;d)崩解剂,例如琼脂、碳酸钙、马铃薯或木薯淀粉、藻酸、某些硅酸盐以及碳酸钠;e)溶解延迟剂(solution retarding agent),例如石蜡;f)吸收促进剂,例如季铵盐;g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;h)吸收剂,例如高岭土和膨润土;以及i)润滑剂,例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,以及它们的混合物。在胶囊、片剂和丸剂的情形下,所述剂型还可包含缓冲剂。
适于口含或舌下施用的组合物包括片剂、糖锭和锭剂,其中活性成分与载体(例如糖和阿拉伯胶、黄蓍胶或明胶和甘油)一起配制。
利用赋形剂(例如乳糖或奶糖以及高分子量的聚乙二醇等),还可以使用相似类型的固体组合物作为在软明胶胶囊或硬明胶胶囊中的填充剂。可利用包衣剂和壳衣(例如肠溶包衣和药学配制领域中众所周知的其它包衣剂)来制备固体剂型的片剂、糖锭、胶囊、丸剂和颗粒剂。这些剂型可任选地包含遮光剂,并且还可以是仅仅或优先在肠道某一部分中任选地以延迟方式释放活性成分的组合物。可用的包埋组合物的实例包括聚合物和蜡。利用赋形剂(例如乳糖或奶糖以及高分子量的聚乙二醇等),还可以使用相似类型的固体组合物作为在软明胶胶囊或硬明胶胶囊中的填充剂。
式1化合物的本发明形式或化合物1的组合物还可以是含有一种或多种如上文所述的赋形剂的微囊化形式。可以利用包衣和壳(例如肠溶包衣、控制释放包衣和药物制剂领域众所周知的其它包衣)来制备片剂、糖锭、胶囊、丸剂和颗粒的固体剂型。在这些固体剂型中,可将化合物1的本发明形式或化合物1的组合物与至少一种惰性稀释剂(例如蔗糖、乳糖或淀粉)相混合。在通常实践中,这些剂型还可包含除惰性稀释剂以外的其它物质,例如压片润滑剂和其它压片助剂,比如硬脂酸镁和微晶纤维素。在胶囊、片剂和丸剂的情形下,所述剂型还可包含缓冲剂。它们可任选地包含遮光剂,并且还可以是仅仅或优先在肠道某一部分中任选地以延迟方式释放活性成分的组合物。可使用的包埋组合物的实例包括聚合物和蜡。
可将用于口服施用的组合物设计成使得当其通过消化道时保护活性成分免受降解,例如通过在片剂或胶囊制剂上的外包衣。
在另一个实施方案中,以延时(或“延迟”或“持续”)释放组合物的形式提供化合物1的本发明形式或化合物1的组合物。这种延迟释放组合物包含化合物1的本发明形式或化合物1的组合物以及延迟释放组分。该组合物使得化合物1的本发明形式或化合物1的组合物可以靶向释放到下消化道中;例如释放到小肠、大肠、结肠和/或直肠中。在某些实施方案中,所述包含化合物1的本发明形式或化合物1组合物的延迟释放组合物还包含肠溶包衣或pH依赖性包衣,例如邻苯二甲酸醋酸纤维素和其它邻苯二甲酸酯类(例如邻苯二甲酸聚醋酸乙烯酯、丙烯酸甲酯(Eudragits))。或者,所述延迟释放组合物通过提供pH敏感性的丙烯酸甲酯包衣、pH敏感性的聚合物微球或通过水解降解的聚合物来实现向小肠和/或结肠的控制释放。所述延迟释放组合物可与疏水性或凝胶性赋形剂或包衣一起配制。还可通过被细菌酶消化的包衣(例如直链淀粉或果胶)、pH依赖性聚合物、随时间膨胀的水凝胶塞(Pulsincap)、时间依赖性的水凝胶包衣和/或连接偶氮芳香键的丙烯酸包衣来提供结肠递送。
在某些实施方案中,本发明的延迟释放组合物包含羟丙基甲基纤维素、微晶纤维素和润滑剂。可将化合物1的本发明形式或化合物1组合物、羟丙基甲基纤维素和微晶纤维素的混合物配制成用于口服施用的片剂或胶囊。在某些实施方案中,将所述混合物制粒并压制成片剂。
在另一些实施方案中,以多颗粒制剂形式提供本发明的延缓释放组合物。将化合物1的本发明形式或化合物1组合物与合适的聚合物的混合物制粒以形成包衣的丸粒。在某些实施方案中,首先用非功能性包衣对将所述丸粒进行密封包衣,然后再进行功能性包衣。
本文所用的“非功能性包衣”是不影响药物释放速度的包衣。非功能性包衣的实例包括羟丙基纤维素、羟丙基甲基纤维素或聚乙烯醇。在某些实施方案中,所述非功能性包衣是Clear,其包含羟丙基甲基纤维素和聚乙二醇。
本文所用的术语“功能性包衣”是影响剂型中药物释放速度的包衣。功能性包衣的实例包括乙基纤维素和聚丙烯酸甲酯衍生物(Eudragits)。
本发明化合物用于局部或经皮施用的剂型包括软膏、糊剂、乳膏、洗剂、凝胶剂、粉末、溶液剂、喷雾剂、吸入剂或贴剂。在无菌条件下将活性成分与可药用载体以及任意所需的防腐剂或可能需要的缓冲剂相混合。眼用制剂、滴耳剂以及滴眼剂也涵盖在本发明范围内。此外,本发明还涉及经皮贴剂的用途,所述经皮贴剂具有向机体控制递送化合物的额外的优点。这些剂型可通过将所述化合物溶解或分散在合适的介质中来制得。还可使用吸收促进剂以增加化合物的经皮流量。可通过提供控制速度的膜或将化合物分散在聚合物基质或凝胶中来控制所述速度。
根据施用方法,所述组合物可包含0.1%-99%(w/w),优选0.1%-60%(w/w),更优选0.2%-20%(w/w),最优选0.25%-12%(w/w)的化合物1的本发明形式或化合物1的组合物。
组合产品和组合施用
在某些实施方案中,可单独施用化合物1的本发明形式或化合物1的组合物以治疗本文所述的一种或多种疾病,或者可将其与可用于治疗本文所述的一种或多种疾病的一种或多种其它活性剂相组合(同时或依次)施用。因此,本发明的组合物或其制剂形式可与一种或多种活性剂同时施用、或在其之前施用或在其之后施用。
在某些实施方案中,除了化合物1的本发明形式或化合物1的组合物以外,本发明的组合物还包含一种或多种其它活性剂。所述其它活性剂不是化合物1的本发明形式或化合物1的组合物。在某些实施方案中,本发明提供了一种递送化合物1的本发明形式或化合物1的组合物以及至少一种其它活性剂的制剂。
在一些实施方案中,本发明的制剂同时含有阿片样物质与化合物1的本发明形式或化合物1的组合物。这样的含有阿片样物质与化合物1的本发明形式或化合物1的组合物的组合产品使得可以在减轻疼痛的同时将与阿片样物质相关的副作用降到最低(例如胃肠道作用(例如胃排空延迟、GI道动力性改变)等)。
可用于疼痛治疗的阿片样物质是本领域中已知的。例如,阿片类化合物包括但不限于阿芬太尼、阿尼利定、阿西马朵林、布马佐辛、丁丙诺啡(burprenorphine)、布托啡诺、可待因、地佐辛、二乙酰吗啡(海洛因)、二氢可待因、地芬诺酯、乙基吗啡、非多托嗪、芬太尼、富纳曲胺(funaltrexamine)、氢可酮、氢吗啡酮、左洛啡烷、左醋美沙朵、左啡诺、洛哌丁胺、美吡利啶(哌替啶)、美沙酮、吗啡、吗啡-6-葡糖苷酸、纳布啡、烯丙吗啡、尼可吗啡、阿片、羟考酮、羟吗啡酮、阿片全碱、喷他佐辛、丙吡兰、丙氧芬、瑞芬太尼、舒芬太尼、替利定、曲美布丁和曲马多。在一些实施方案中,所述阿片样物质是选自以下的至少一种阿片样物质:阿芬太尼、丁丙诺啡、布托啡诺、可待因、地佐辛、二氢可待因、芬太尼、氢可酮、氢吗啡酮、左啡诺、美吡利啶(哌替啶)、美沙酮、吗啡、纳布啡、尼可吗啡、羟考酮、羟吗啡酮、阿片全碱、喷他佐辛、丙吡兰、丙氧芬、舒芬太尼和/或曲马多。在本发明的某些实施方案中,所述阿片样物质选自吗啡、可待因、羟考酮、氢可酮、二氢可待因、丙氧芬、芬太尼、曲马多及其混合物。在一个具体实施方案中,所述阿片样物质是洛哌丁胺。在另外一些实施方案中,所述阿片样物质是混合型激动剂,例如布托啡诺。在一些实施方案中,给对象施用一种以上的阿片样物质,例如吗啡和海洛因或美沙酮和海洛因。
本发明的组合型组合物中存在的其它活性剂的量通常不超过含有该其它活性剂作为唯一治疗剂的组合物中所通常施用的量。在本发明的某些实施方案中,其它活性剂的量为含有该化合物作为唯一治疗剂的组合物中所通常存在的量的约50%至100%。
在某些实施方案中,还可将本发明的制剂与用于胃肠道功能障碍的常规治疗一起和/或组合使用,以有助于改善便秘和肠功能障碍。例如,常规治疗包括但不限于肠道的功能性刺激、便软化剂、轻泻药(例如二苯基甲烷轻泻药、通便轻泻药(osmotic laxative)、渗透性轻泻药、盐轻泻药等)、大便成形剂(bulk forming agent)和轻泻药、润滑剂、静脉内水化(intravenous hydration)以及鼻胃管减压。
本发明制剂的用途和试剂盒
如上文所述,本发明提供了可用于拮抗阿片样物质止痛治疗的不想要的副作用(例如胃肠道作用(例如的胃排空延迟、GI道动力性改变)等)的化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂。此外,化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂可用于治疗处于可通过与μ阿片样物质受体结合来改善的疾病状态的对象,或用于其中需要临时性抑制μ阿片样物质受体的任何治疗(例如肠梗阻等)中。在本发明的某些实施方案中,使用制剂的方法是在人对象中。
因此,施用化合物1的本发明形式或化合物1的组合物或其可药用组合物或制剂来治疗、预防、改善、延迟或减轻阿片样物质使用的副作用可能是有利的,所述副作用例如胃肠道功能障碍,例如肠动力的抑制、便秘、GI括约肌收缩、恶心、呕吐、胆痉挛、阿片样物质肠功能障碍、绞痛、烦躁不安、瘙痒症、尿潴留、呼吸抑制、瞳孔收缩、心血管作用、胸壁僵直和咳嗽抑制、应激反应抑制以及与使用麻醉性止痛剂相关的免疫抑制等,或者它们的组合。因此,从生活质量以及减轻长期便秘引起的并发症(例如痔疮、食欲抑制、粘膜破坏、败血症、结肠癌风险以及心肌梗塞)的观点看,对于接受阿片样物质的对象来说,使用化合物1的本发明形式或化合物1的组合物或其可药用组合物或制剂可能是有益的。
在一些实施方案中,化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂可用于施用给接受急性阿片样物质施用的对象。在一些实施方案中,所提供的制剂可用于施用给患有手术后胃肠道功能障碍的患者。
在另外一些实施方案中,化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂还可用于施用给接受长期阿片样物质施用的对象(例如接受阿片样物质治疗的晚期疾病患者,例如AIDS患者、癌症患者、心血管患者;接受用于疼痛控制的长期阿片样物质治疗的对象;接受用于维持阿片样物质戒断的阿片样物质治疗的对象)。在一些实施方案中,所述对象是利用阿片样物质来控制慢性疼痛的对象。在一些实施方案中,所述对象是晚期疾病患者。在另外一些实施方案中,所述对象是接受阿片样物质戒断维持治疗的人。
本文中所述的化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂的替代性或其它用途可以是治疗、减轻、抑制或预防使用阿片样物质的作用,包括例如内皮细胞(例如血管内皮细胞)的异常迁移或增殖、血管生成增加,以及由机会性感染剂(opportunistic infectious agent)(例如绿脓杆菌(Pseudomonas aeruginosa))产生的致死因子的增加。化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂的其它有利用途包括治疗阿片样物质诱导的免疫抑制、抑制血管生成、抑制血管增生、治疗疼痛、治疗炎性病症(例如炎性肠综合征)、治疗感染性疾病和肌肉骨骼系统疾病(例如骨质疏松、关节炎、骨炎、骨膜炎、肌病)以及治疗自身免疫疾病。
在某些实施方案中,化合物1的本发明形式或本发明的化合物1的组合物及其可药用组合物和制剂可用在预防、抑制、减轻、延迟、减少或治疗胃肠道功能障碍的方法中,所述胃肠道功能障碍包括但不限于肠易激综合征;阿片样物质诱导的肠功能障碍;结肠炎;手术后或产后肠梗阻;恶心和/或呕吐;胃动力和排空的减慢;对胃以及小肠和/或大肠推进的抑制;非推进性节段收缩幅度的增加;Oddi括约肌收缩;肛门括约肌张力增加;随直肠膨胀的反射性松弛受损;胃、胆囊、胰腺或肠的分泌减少、从肠内容物吸收水的增加;胃食管反流;胃轻瘫;痉挛(cramping);胃气胀;腹部或上腹部疼痛与不适;便秘;特发性便秘;腹部手术(例如结肠切除术(例如右半结肠切除术、左半结肠切除术、横结肠切除术、全结肠切除术、低位前切除术))后胃肠功能障碍以及口服施用的药物或营养物质的延迟吸收。
化合物1的所提供形式或化合物1的组合物及其可药用组合物和制剂还可用于包括以下病症的治疗:涉及血管生成的癌症、免疫抑制、镰刀型红细胞贫血病、血管损伤以及视网膜病;以及用于与炎症相关疾病(例如肠易激综合征)、免疫抑制、慢性炎症的治疗。
在另一些实施方案中,提供了化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂的兽医应用(例如对家畜(例如马、狗、猫等)的治疗)。因此,涉及所提供的制剂在与上述针对人对象的用途相似的兽医应用中的用途。例如,对马的胃肠道动力的抑制(例如绞痛和便秘)可能对于马来说是致命的。对于马而言,由于绞痛而产生的疼痛可导致诱导死亡的休克,而长期便秘的状况也可导致马死亡。利用外周阿片样物质受体拮抗剂对马进行治疗已经描述于例如2005年1月20日公开的美国专利申请No.20050124657中。
应当理解的是,化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂可用于联合治疗中,也就是说,化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂可在进行一种或多种所期望的其它治疗或医疗过程的同时、之前或之后施用。联合方案中所使用的具体联合治疗(治疗剂或方法)将考虑所期望的治疗剂和/或方法的相容性以及所期望实现的治疗作用。应当理解,所用的治疗可实现针对同一病症的所期望作用(例如,可将制剂与用于治疗同一病症的另一种化合物同时施用),或者它们可实现不同的作用(例如控制任何副作用)。本文所用的通常施用以治疗或预防特定疾病或病症的其它治疗性化合物称为“适用于所治疗的疾病或病症”。
在另外一些实施方案中,化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂以及单位剂量形式可用于制备药物,包括但不限于可用于治疗应用阿片样物质的副作用(例如胃肠道副作用(例如肠动力的抑制、GI括约肌收缩、便秘)、恶心、呕吐、烦躁不安、瘙痒等)的药物或其组合。化合物1的本发明形式或化合物1的组合物及其可药用组合物和制剂可用于制备可用于治疗接受急性阿片样物质治疗的患者(例如接受急性阿片样物质施用的手术后胃肠道功能障碍的患者)或长期使用阿片样物质的对象(例如接受阿片样物质治疗的晚期疾病患者,例如AIDS患者、癌症患者、心血管患者;为控制疼痛而接受长期阿片样物质治疗的对象;或接受阿片样物质治疗来维持阿片样物质戒断的对象)的药物。此外,其可用于制备可用于治疗以下疾病或病症的药物:疼痛,炎性病症例如炎性肠综合征,感染性疾病,肌肉骨骼系统的疾病例如骨质疏松、关节炎、骨炎、骨膜炎、肌病,自身免疫病以及免疫抑制,腹部手术后的术后胃肠功能障碍(例如结肠切除术(例如右半结肠切除术、左半结肠切除术、横结肠切除术、全结肠切除术、低位前切除术)),特发性便秘以及肠梗阻(例如手术后肠梗阻、产后肠梗阻),以及例如涉及血管生成的癌症、慢性炎症和/或慢性疼痛、镰刀型红细胞贫血病、血管损伤以及视网膜病的疾病。
本发明还包括药品包装和/或包含化合物1的本发明形式或化合物1的组合物或其可药用组合物或制剂的试剂盒以及容器(例如箔或塑料包装,或其它合适的容器)。任选地,在这些试剂盒中另外提供使用说明书。
为了更充分地理解本文所述的本发明,提出了下述实施例。应当理解,这些实施例仅仅用于举例说明的目的,不应当解释为以任何方式限制本发明。
本发明每个方面的所有特征都适用于作适当修改后的所有其它方面。
实施例
一般方法
化合物1是根据国际专利申请公开WO2006/127899中详细所述的方法制备的,所述申请在此通过引用全文并入本文。
X射线粉末衍射(XRPD):利用Shimadzu XRD-6000X射线粉末衍射仪和Cu Kα辐射进行X射线粉末衍射(XRPD)分析。仪器配有细长的聚焦X射线管。管电压和电流强度分别设定为40kV和40mA。散度和散射狭缝设定为1°,接受狭缝设定为0.15mm。通过NaI闪烁检测器检测衍射辐射。以3°/分钟(0.4秒/0.02°步幅)从2.5-40°2θ进行θ-2θ连续扫描。分析硅标准物以检查校正仪器。收集数据并利用XRD-6100/7000v.5.0进行分析。通过将样品置于带有硅插入物的铝支架上来准备样品用于分析。
XRPD图分析:利用配有2θ范围为120°的CPS(对弯曲位置灵敏的)检测器的Inel XRG-3000衍射仪进行X射线粉末衍射(XRPD)分析。利用Cu-Kα辐射以0.03°2θ的分辨率收集实时数据。管电压和电流强度分别设定为40kV和30mA。单色器狭缝设定为5mm×160μm或2mm×160μm。显示2.5-40°2θ的图。将样品装进薄壁玻璃毛细管中来准备样品用于分析。将每一毛细管安置在测角器头上,在数据获取过程中所述测角器头被驱动使得毛细管可旋转。分析样品5分钟或10分钟。利用硅参比标准物进行仪器校正。
XRPD图收集:利用Bruker D-8 Discover衍射仪和Bruker的General Area衍射探测系统(GADDS,v.4.1.20)收集XRPD图。利用细聚焦管(40kV,40mA)、镜以及0.5mm的双针孔准直仪产生Cu Kα辐射的入射光束。将样品样本装入毛细管中并固定在平移台上。利用摄像机和激光给目标区域定位以使得在传播图形中与入射光束交叉。将入射光束进行了扫描以优化方位统计。利用光束截止器使低角入射光束的空气散射最小化。利用位于离样品15cm处的Hi-Star面探测器收集衍射图并利用GADDS进行处理。利用0.04°2θ的步长对所述衍射图的GADDS图像的强度进行积分。积分图显示作为2θ的函数的衍射强度。在分析之前,分析硅标准物以校验Si 111峰位置。利用2.1.1版本的Pattern Match软件生成XRPD峰列表。
差示扫描量热法(“DSC”):利用TA Instruments的差示扫描量热计2920进行了差示扫描量热测量。将样品置于铝DSC盘内,精确记录重量。将所述盘用盖子盖上,无卷曲地放置。在氮气吹洗下以10℃/分钟的速度加热样品池,直到250℃或300℃的最终温度。使用铟金属作为校正标准物。所报道的温度为转变最大值。
热重法(“TG”):利用TA Instruments的2950热重分析仪进行了热重分析。将各样品置于铝样品盘中并插入到TG炉中。在氮气下以10℃/分钟的速度给炉加热,直到350℃的最终温度。使用镍和作为校正标准物。
溶液1D1H NMR谱:在环境温度下利用Varian UNITYINOVA-400光谱仪以399.796MHz的1H拉莫尔(Larmor)频率获取溶液1D1H NMR谱。将样品溶解在DMSO-d6中。利用8.2μs的1H脉冲宽度、2.50秒的获取时间、5秒钟的扫描间延迟获取光谱,谱宽为6400Hz,具有32000个数据点,40个辅助添加的扫描。利用Varian VNMR 6.1C软件和131072个点以及0.2Hz的指数型线加宽因子来处理自由感应衰减(FID)以改善信噪比。不完全氘化的DMSO的残留峰在约2.50ppm。约3.3ppm处的相对宽峰是由于水造成的。所述谱以0.0ppm处的内标物四甲基硅烷(TMS)为参照。
实施例1
A形式的制备
将化合物1(54.7mg)溶解在2,2,2-三氟乙醇(2mL)中,通过0.2μm尼龙滤器将溶液过滤到20mL瓶中。将所述20mL瓶置于盛有5mL乙酸乙酯的100mL玻璃罐中。将所述20mL瓶不加盖放置,将所述罐加盖使得发生蒸汽扩散。4天后,在溶液中观察到了单晶。
在150°K下,单斜晶胞参数和计算的体积为: α=90.00°,β=98.868(4)°,γ=90.00°, 其中每个数值是±1.5。对于化合物1而言,A形式的分子量是435.35g/mol,Z=2,因此计算的密度为1.543g/cm3。测定空间群为P21(no.4),这是手性空间群。在室温下显示了化合物1的A形式的单晶,下表5中总结了单元晶胞参数。
表5.A形式的单元晶胞数据
实施例2
B形式的制备
超声下将化合物1(52.8mg)溶解在甲醇(35mL)中,得到澄清溶液。通过0.2μm尼龙滤器(Whatman)过滤所述溶液并利用旋转蒸发仪蒸发(使用环境温度浴)。待样品看上去已经变干后,将其置于旋转蒸发仪上约1小时。得到含有针状和片状双折射球晶的白色固体。当在约45℃进行蒸发时观察到A形式的XRPD图+峰。
实施例3
C形式的制备
超声下将化合物1(321.5mg)溶解在TFE(4.28mL)中。得到澄清的溶液。通过0.2μm尼龙滤器(Whatman)将所述溶液过滤到20mL瓶中。将500μL等份的过滤溶液分配到1特拉姆(dram)的瓶中。将500μL等份的1-丙醇分配到此瓶中直到总共已添加了3mL为止。得到澄清的溶液。将所述溶液于环境条件下放置约1小时。发现样品溶液中混悬有极少量的白色沉淀。然后将其置于冰箱中。5天后得到含有无色固体微粒的澄清溶液。利用吸管将溶液吸出,倒掉,使所述固体于环境条件下在空气中干燥过夜。将含有双折射五角形片状物的样品进行单晶X射线分析。
单斜晶胞参数和计算的体积为: α=90.00°,β=91.899(3)°,γ=90.00°,其中每个数值是±1.5。对于化合物1而言,A形式的分子量是496.45g/mol,Z=2,所得的晶体结构计算密度为1.430g/cm3。测定空间群为P21(no.4),这是手性空间群。C形式的单元晶胞参数总结在下表6中。
表6.C形式的单元晶胞数据
实施例4
D形式的制备
在超声下将无定形化合物1溶解在甲醇(浓度为约5mg/mL)中。得到澄清的溶液。通过0.2μm尼龙滤器(Whatman)过滤所述溶液。快速添加乙酸乙酯至乙酸乙酯∶甲醇的比例为4∶1,促使D形式沉淀。所得的白色固体看上去为非双折射的且是未知的形状。进行缓慢添加乙酸乙酯至相同溶剂比例的实验,得到澄清的溶液。缓慢蒸发溶液,得到含有薄针状双折射球晶的白色固体。在甲苯替代乙酸乙酯的快速蒸发实验中也得到了含有大的双折射针状物的白色固体。
实施例5
无定形化合物1的制备
通过冻干水溶液制备了无定形化合物1。对所述无定形化合物1进行循环DSC实验,测定玻璃转化温度为约23℃。
实施例6
化合物1的多晶型筛选
通过多晶型筛选鉴定本文所述的化合物1的形式。在该筛选中,将化合物1用多种溶剂和条件进行处理以实现结晶或沉淀。该筛选的结果总结在下表7-13中。这些表显示了所用的溶剂和条件、得到的形式(通过XRPD测定)以及晶体习性的描述。在这些表中,所述条件指定为淤浆、FE、SC、FD、CP、RE或SE。这些术语中的每一个均在下文中进行详细定义。
本文所用的术语“碰撞沉淀”(“CP”)指在多种溶剂中制备化合物1的饱和溶液并通过0.2μm尼龙滤器过滤到开口瓶中的方法。在搅拌下分散等份试样的多种反溶剂直到沉淀产生。在一些情形下,将样品置于冰箱或制冷器中以促进沉淀。通过用吸管将溶剂吸出而收集固体,并在分析前于环境条件下在空气中干燥所述固体。
本文所用的术语“冷冻干燥”(“FD”)指在水中制备化合物1的饱和溶液并通过0.2μm尼龙滤器将所述溶液过滤到开口瓶中的一种方法。通过在液氮或干冰浴中旋转并以异丙醇清洗而使所述溶液以薄层形式冷冻在瓶壁上。将含有所述冷冻样品的瓶置于冻干容器(所述冻干容器与Flexi-Dry冻干机相连)中1至3天。在实验过程中将温度维持在-50至-60℃。
术语“快速蒸发”(“FE”)指在多种溶剂中制备化合物1的溶液的一种方法,其中在添加等份试样之间将样品超声。一旦混合物完全溶解(通过视觉观察判断),就通过0.2μm尼龙滤器过滤所述溶液。使过滤的溶液在开口瓶中于环境条件下蒸发。分离出固体并进行分析。
术语“旋转蒸发”(“RE”)指其中在多种有机溶剂中制备化合物1或无定形化合物1的浓溶液并通过0.2μm尼龙滤器过滤到开口瓶或烧瓶中的一种方法。在一些情形下,将过滤溶液的4-5mL等份试样分配在洁净的瓶中,将所述瓶连接到旋转蒸发仪上,将溶剂蒸干。通常,水浴为环境温度,但在某些情形下,将水浴加热至约50℃以促进蒸发。如果在旋转蒸发后样品没有完全干燥,则将所述瓶于25℃的真空烘箱中放置18小时。分离出固体并进行分析。
本文所用的术语“缓慢冷却”(“SC”)指在多种溶剂中于升高的温度下制备化合物1的饱和溶液并通过0.2μm尼龙滤器温热过滤到温热的瓶中的方法。给所述瓶加盖并置于热板上,将所述热板拿掉使得样品于环境温度下缓慢冷却。
术语“缓慢蒸发”(“SE”)指在多种溶剂中制备化合物1的溶液的一种方法,其中在添加等份试样之间将样品超声。一旦混合物完全溶解(通过视觉观察判断),就通过0.2μm尼龙滤器过滤所述溶液。在某些情形下,然后在搅拌下向所述过滤的溶液中加入等份试样的反溶剂。使溶液在覆盖有针孔穿透的铝箔的瓶中于环境条件下蒸发。分离出固体并进行分析。
术语“淤浆实验”指通过在环境温度或升高的温度下将足够的固体添加到给定的溶剂中使得存在未溶解的固体来制备化合物1的混悬液的一种方法。然后于环境温度或升高的温度下将混合物加载到在密封瓶中的轨道式振荡器上7天。通过真空过滤或利用吸管将液相吸出而分离固体,在分析之前于环境条件下在空气中干燥所述固体。
本文所用的术语“蒸汽扩散实验”指在多种溶剂中制备化合物1的浓溶液并通过0.2μm尼龙滤器过滤的一种方法。将过滤的溶液分散到1特拉姆的瓶中,然后将所述瓶置于盛有约2mL反溶剂的20mL瓶中。将所述1特拉姆的瓶不加盖放置,将所述20mL瓶加盖使得形成蒸汽扩散。通过真空过滤收集固体并进行分析。
术语“毛细管结晶技术”指对化合物1进行毛细管多晶型筛选的一种方法。使用了多种结晶技术。下文描述这些技术。使用了X射线粉末衍射性质的毛细管。一旦从结晶试验中观察到固体,就在显微镜下考察它们的双折射和形态。记录任何晶体形状,但是有时固体表现出未知的形态,在一些情形下是由于在毛细管中的堆积或者粒子大小太小造成的。当量足够时,然后通过XRPD分析固体样品,将晶体图彼此进行比较以鉴定新的晶体形式。
术语“CentriVap结晶”(“CentriVap”)指在给定溶剂或溶剂混合物中制备化合物1溶液并通过0.2μm尼龙滤器过滤的一种方法。通过注射器向毛细管填充45μL溶液。将毛细管离心。在减压下利用机械真空泵于Labconco离心蒸发仪中蒸发溶剂。将蒸发仪温度维持在环境温度。
术语“在毛细管中蒸发”(“EC”)指在给定溶剂或溶剂混合物中制备化合物1溶液并通过0.2μm尼龙滤器过滤的一种方法。通过注射器向毛细管填充45μL溶液。将毛细管离心。在环境温度和升高的温度下于开口毛细管中进行蒸发。
术语“在毛细管中的溶剂/反溶剂结晶”指在给定溶剂中制备化合物1溶液并通过0.2μm尼龙滤器过滤的一种方法。向毛细管填充15μL溶液并离心。然后加入30μL反溶剂。将毛细管离心。如果得到澄清的溶液,则将毛细管置于环境条件下以使溶剂蒸发,或在减压下利用机械真空泵于环境条件下在Labconco CentriVap离心蒸发仪中进行蒸发。
术语“在固体或蒸气压力中的蒸气扩散”(“VS”)指毛细管中堆积约1cm化合物1的一种方法。通过将毛细管置于盛有约5mL不同溶剂的高瓶中而使固体暴露于溶剂蒸汽。约14天后除去毛细管。
表7.化合物1的多晶型筛选
表8.蒸汽扩散实验
表9.化合物1的毛细管多晶型筛选
表10.通过溶剂/反溶剂结晶进行化合物1的毛细管多晶型筛选
表11.通过蒸汽压力进行化合物1的毛细管多晶型筛选
表12.无定形化合物1的简化多晶型筛选
表13.无定形化合物1的蒸汽扩散实验
实施例7
A形式在室温下在多种溶剂中的平衡溶解度列于下表14中。在每种情形下,通过将过量化合物置于不同的溶剂中并于环境温度下避光搅拌过夜来测量A形式在室温下的平衡溶解度。在室温下评价了在下述溶剂和缓冲水溶液中的溶解度:甲醇、乙醇、苄醇、二甲基亚砜、注射用水、抑菌水(含有0.9%苄醇)、5%葡萄糖、生理盐水(0.9%NaCl)、pH1.1(甘氨酸HCl)、pH4.2(甘氨酸HCl)、pH7.1(磷酸盐缓冲液)以及pH9.1(甘氨酸)。除非另外指明,所报道的溶解度为最接近的mg/mL。
在模拟人GI道的条件下(pH 1,0.1N HCl,pH 4.5醋酸盐缓冲液,pH 7.1磷酸盐缓冲液,pH 9.0硼酸盐缓冲液)制备另外一系列的溶解度样品。将所有溶液储存于37℃温箱中过夜,然后通过Whatman的0.45μm尼龙注射滤器过滤以除去不溶性物质。通过HPLC分析滤液的强度,结果总结在表14中。
表14.A形式在环境温度下的近似溶解度
N/T=“未测定”
Claims (51)
2.权利要求1的化合物,其特征在于所述化合物在其X射线粉末衍射图中具有选自2θ为约7.9、8.18、20.3、21.44、24.11以及25.12度的一个或多个峰。
3.权利要求2的化合物,其特征在于所述化合物在其X射线粉末衍射图中具有选自2θ为约7.9、8.18、20.3、21.44、24.11以及25.12度的两个或更多个峰。
4.权利要求3的化合物,其特征在于所述化合物在其X射线粉末衍射图中具有选自2θ为约7.9、8.18、20.3、21.44、24.11以及25.12度的三个或更多个峰。
5.权利要求4的化合物,其特征在于所述化合物在其X射线粉末衍射图中基本上具有选自2θ为约7.9、8.18、10.64、11.57、12.68、13.44、13.89、14.38、15.42、16.01、16.39、17.18、19.89、20.79、21.44、21.9、23.35、24.49、24.87、25.53以及29.17度的所有峰。
6.权利要求5的化合物,其特征在于所述化合物在其X射线粉末衍射图中基本上具有选自以下的所有峰:
7.权利要求6的化合物,其特征在于所述化合物具有与图4所示基本上相似的X射线粉末衍射图。
8.化合物1的D形式:
其中所述化合物相对于氮而言是(R)-构型。
9.权利要求8的化合物,其特征在于所述化合物在其X射线粉末衍射图中具有选自2θ为约7.66、8.42、14.79以及21.06度的一个或多个峰。
10.权利要求9的化合物,其特征在于所述化合物在其X射线粉末衍射图中具有选自2θ为约7.66、8.42、14.79以及21.06度的两个或更多个峰。
11.权利要求10的化合物,其特征在于所述化合物在其X射线粉末衍射图中具有选自2θ为约7.66、8.42、14.79以及21.06度的三个或更多个峰。
12.权利要求11的化合物,其特征在于所述化合物在其X射线粉末衍射图中基本上具有选自2θ为约7.66、8.42、12.85、13.48、16.11、17.53、18.67、19.61、21.06、21.79、22.07、23.25、24.53以及26.23度的所有峰。
14.权利要求13的化合物,其特征在于所述化合物具有与图6所示基本上相似的X射线粉末衍射图。
16.权利要求15的化合物,其特征在于所述化合物在其由150±1°K温度下收集的单晶数据计算得到的X射线粉末衍射图中具有选自2θ为约10.8、12.8、14.8、15.9、16.25、18.5、19.15、22、23.6、24.25、25.7、27.5、28.1、28.9、31.5以及31.75度的一个或多个峰。
17.权利要求16的化合物,其特征在于所述化合物在其由150±1°K温度下收集的单晶数据计算得到的X射线粉末衍射图中具有选自2θ为约10.8、12.8、14.8、15.9、16.25、18.5、19.15、22、23.6、24.25、25.7、27.5、28.1、28.9、31.5以及31.75度的两个或更多个峰。
18.权利要求17的化合物,其特征在于所述化合物在其由150±1°K温度下收集的单晶数据计算得到的X射线粉末衍射图中具有选自2θ为约10.8、12.8、14.8、15.9、16.25、18.5、19.15、22、23.6、24.25、25.7、27.5、28.1、28.9、31.5以及31.75度的三个或更多个峰。
19.权利要求18的化合物,其特征在于所述化合物在其由150±1°K温度下收集的单晶数据计算得到的X射线粉末衍射图中基本上具有选自2θ为约10.8、12.8、14.8、15.9、16.25、18.5、19.15、22、23.6、24.25、25.7、27.5、28.1、28.9、31.5以及31.75度的所有峰。
21.权利要求20的化合物,其特征在于所述化合物具有与图8所示基本上相似的由150±1°K温度下收集的单晶数据计算得到的X射线粉末衍射图。
24.权利要求23的组合物,其特征在于所述组合物在其X射线粉末衍射图中具有选自2θ为约10.58和22.74度的一个或两个峰。
25.权利要求24的组合物,其特征在于所述组合物在其X射线粉末衍射图中基本上具有选自2θ为约10.58、11.56、13.88、15.42、20.82、21.86、22.74、23.2、24.74以及26.96度的所有峰。
27.权利要求26的组合物,其特征在于所述组合物具有与图9所示基本上相似的X射线粉末衍射图。
30.权利要求29的组合物,其包含A形式和无定形化合物1。
31.一种组合物,其包含B形式、C形式、D形式和无定形化合物1中的至少两种。
32.一种药物组合物,其包含:
(a)权利要求29的化合物;
(b)权利要求31的组合物,或者
(c)B形式、C形式、D形式或无定形化合物1中的一种或多种,以及任选地药学上可接受的载体、辅药或赋形剂。
33.一种口服制剂,其包含权利要求32的药物组合物。
34.一种口服制剂,其包含核心和肠溶包衣,所述核心含有权利要求32的药物组合物、螯合剂和表面活性剂。
35.权利要求34的制剂,其中所述核心包含球、珠或丸。
36.权利要求35的制剂,其中所述核心还包含载体、粘合剂、填充剂和/或崩解剂。
37.权利要求36的制剂,其还包含粘膜粘附包衣和粘膜粘附释放控制剂,其中所述粘膜粘附包衣包含权利要求32的药物组合物。
38.一种口服制剂,其包含权利要求32的药物组合物,其中所述制剂实现以至少两个独立的部分递送所述化合物,第一部分被递送至胃中,第二部分递送至上段肠道中;
其中所述制剂包含含有权利要求32的药物组合物的核心、含有所述组合物的粘膜粘附包衣和粘膜粘附释放控制剂,以及
其中将所述第一部分递送至胃基本上来自于所述粘膜粘附包衣,将所述第二部分递送至肠基本上来自于所述核心。
39.一种口服制剂,其包含核心和肠溶包衣,所述核心含有权利要求32的药物组合物、螯合剂和表面活性剂。
40.权利要求39的制剂,其中所述核心包含多颗粒、丸粒、颗粒、球或粒子以及至少一种其它赋形剂。
41.权利要求40的制剂,其中所述核心包含填充剂或粘合剂或崩解剂。
42.权利要求41的制剂,其中所述填充剂或粘合剂包括微晶纤维素。
43.权利要求42的制剂,其中所述核心还包含崩解剂。
44.权利要求43的制剂,其中所述崩解剂是交联聚维酮。
45.权利要求44的制剂,其中所制备的核心在胶囊壳内或者被压制成片剂形式。
46.一种减轻接受阿片样物质治疗的对象中阿片样物质治疗的副作用的方法,包括向所述对象施用权利要求32的药物组合物。
47.权利要求46的方法,其特征在于所述病症是由阿片样物质受体活性引起、介导或加剧的。
48.一种减轻对象中内源性阿片样物质活性的作用的方法,包括向所述对象施用一种组合物,所述组合物包含有效量的权利要求32的药物组合物。
49.权利要求48的方法,其中所述由治疗引起的副作用包括选自以下的至少一种作用:肠动力抑制、胃肠功能障碍、便秘、肠动力减弱、嵌塞(impaction)、胃动力减弱、GI括约肌收缩、括约肌张力增加、胃肠动力抑制、胃排空抑制、胃排空延迟、排泄不完全、恶心、呕吐、皮肤潮红、胃气胀、腹胀、出汗、烦躁不安、瘙痒和尿潴留。
50.权利要求49的方法,其中所述对象是接受短期施用阿片样物质的患者或接受长期施用阿片样物质的患者。
51.权利要求50的方法,其中所述由治疗引起的副作用包括选自以下的至少一种病症或疾病:肠梗阻、手术后肠梗阻、瘫痪性肠梗阻、产后肠梗阻、腹部手术后形成的胃肠功能障碍以及特发性便秘。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US92111107P | 2007-03-29 | 2007-03-29 | |
| US60/921,111 | 2007-03-29 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200880017624A Division CN101801979A (zh) | 2007-03-29 | 2008-03-28 | (r)-n-溴化甲基纳曲酮的晶体形式及其用途 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102942572A true CN102942572A (zh) | 2013-02-27 |
Family
ID=39732007
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200880017624A Pending CN101801979A (zh) | 2007-03-29 | 2008-03-28 | (r)-n-溴化甲基纳曲酮的晶体形式及其用途 |
| CN2012103612119A Pending CN102942572A (zh) | 2007-03-29 | 2008-03-28 | (r)-n-溴化甲基纳曲酮的晶体形式及其用途 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200880017624A Pending CN101801979A (zh) | 2007-03-29 | 2008-03-28 | (r)-n-溴化甲基纳曲酮的晶体形式及其用途 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US20100305323A1 (zh) |
| EP (2) | EP3263571B2 (zh) |
| JP (5) | JP2010522756A (zh) |
| CN (2) | CN101801979A (zh) |
| AU (1) | AU2008233133B2 (zh) |
| BR (1) | BRPI0809579B8 (zh) |
| CA (3) | CA2945356C (zh) |
| ES (1) | ES2765811T5 (zh) |
| MX (2) | MX351611B (zh) |
| WO (1) | WO2008121352A2 (zh) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104383542B (zh) | 2003-04-08 | 2017-09-26 | 普罗热尼奇制药公司 | 包含甲基纳曲酮的药物配方 |
| AR057035A1 (es) | 2005-05-25 | 2007-11-14 | Progenics Pharm Inc | SíNTESIS DE (R)-N-METILNALTREXONA, COMPOSICIONES FARMACÉUTICAS Y USOS |
| MX2009010552A (es) | 2007-03-29 | 2009-12-14 | Progenics Pharm Inc | Antagonistas de receptor de opioide periferico y usos de los mismos. |
| AU2008233133B2 (en) | 2007-03-29 | 2014-03-27 | Progenics Pharmaceuticals, Inc. | Crystal forms of (R) -N-methylnaltrexone bromide and uses thereof |
| US8383649B2 (en) * | 2007-07-11 | 2013-02-26 | Mallinckrodt Llc | Crystalline forms of naltrexone methobromide |
| KR101581480B1 (ko) | 2008-02-06 | 2015-12-30 | 프로제닉스 파머슈티컬스, 인코포레이티드 | (r),(r)-2,2'-비스-메틸날트렉손의 제조법 및 용도 |
| AU2013203559B2 (en) * | 2010-03-11 | 2015-12-03 | Wyeth Llc | Oral formulations and lipophilic salts of methylnaltrexone |
| MX349145B (es) | 2010-03-11 | 2017-07-14 | Wyeth Llc * | Formulaciones orales y sales lipofilicas de metilnaltrexona. |
| CN102558190B (zh) * | 2010-12-30 | 2014-10-22 | 天津康鸿医药科技发展有限公司 | (r)-n-溴甲基纳曲酮晶型化合物、其制备方法、组合物及应用 |
| US10485798B2 (en) | 2012-08-22 | 2019-11-26 | Aptapharma Inc. | Methylnaltrexone nasal formulations, methods of making, and use thereof |
| CN106795742B (zh) * | 2014-11-04 | 2019-01-15 | 哈里伯顿能源服务公司 | 可闩锁随钻套管系统和方法 |
| CN105753876A (zh) * | 2014-12-15 | 2016-07-13 | 北大方正集团有限公司 | 一种Delta-7溴甲纳曲酮的制备方法 |
| CN105777766B (zh) * | 2014-12-15 | 2017-11-24 | 北大方正集团有限公司 | Delta‑7溴甲纳曲酮的制备方法 |
| CN105753874A (zh) * | 2014-12-15 | 2016-07-13 | 北大方正集团有限公司 | 一种Delta-7甲基纳曲酮甲酸盐及其制备方法 |
Family Cites Families (269)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1420015B1 (de) * | 1959-10-16 | 1971-08-26 | Boehringer Sohn Ingelheim | 2'-Hydroxy-5,9-dimethyl-6,7-benzomorphane |
| GB1202148A (en) | 1968-03-06 | 1970-08-12 | Sankyo Co | Pharmaceutical compositions |
| US3854480A (en) | 1969-04-01 | 1974-12-17 | Alza Corp | Drug-delivery system |
| US3884916A (en) * | 1971-03-30 | 1975-05-20 | Janssen Pharmaceutica Nv | 2,2-Diaryl-4-(4-aryl-4-hydroxy-piperidino)-butyramides |
| US3714159A (en) * | 1971-03-30 | 1973-01-30 | Janssen Pharmaceutica Nv | 2,2-diaryl-4-(4'-aryl-4'-hydroxy-piper-idino)-butyramides |
| US4025652A (en) | 1975-03-31 | 1977-05-24 | William H. Rorer, Inc. | Amidinoureas |
| US4326074A (en) * | 1972-09-22 | 1982-04-20 | William H. Rorer, Inc. | Amidinoureas |
| US3937801A (en) * | 1973-07-10 | 1976-02-10 | American Home Products Corporation | Reducing the incidence of gastrointestinal side effects during the treatment of inflammatory conditions with antiinflammatory drugs |
| US4060635A (en) | 1975-03-31 | 1977-11-29 | William H. Rorer, Inc. | Amidinoureas for treating diarrhea |
| US4203920A (en) * | 1975-03-31 | 1980-05-20 | William H. Rorer, Inc. | Amidinoureas |
| US4072686A (en) * | 1975-04-16 | 1978-02-07 | G. D. Searle & Co. | 1-(3,3,3-Triarylalkyl)-4-phenyl-piperidinealkanols |
| US4066654A (en) * | 1975-04-16 | 1978-01-03 | G. D. Searle & Co. | 1-triarylalkyl-4-phenyl-4-piperidine carboxylic acids and derivatives |
| US3996214A (en) | 1976-02-23 | 1976-12-07 | G. D. Searle & Co. | 5-(1,1-Diphenyl-4-(cyclic amino) but-2-trans-en-1-yl)-2-alkyl-1,3,4-oxadiazoles and intermediates thereto |
| US4013668A (en) * | 1976-03-10 | 1977-03-22 | G. D. Searle & Co. | 5-(1,1-diphenyl-3-(5- or 6-hydroxy-2-azabicyclo(2.2.2)oct-2-yl)propyl)-2-alkyl-1,3,4-oxadiazoles and related compounds |
| US4012393A (en) * | 1976-03-22 | 1977-03-15 | G. D. Searle & Co. | 2-[5-(CYCLIC AMINO) ETHYL-10,11-DIHYDRO-5H-dibenzo[a,d]-cyclohepten-5- yl]-5 |
| US4115400A (en) | 1976-05-27 | 1978-09-19 | Eli Lilly And Company | 1-Azoniabicyclo[3.1.0]hexanes |
| GB1593191A (en) | 1977-03-23 | 1981-07-15 | Reckitt & Colmann Prod Ltd | Derivatives of morphine |
| US4125531A (en) | 1977-04-18 | 1978-11-14 | G. D. Searle & Co. | 2-Substituted-1-azabicyclo[2.2.2]octanes |
| US4069223A (en) * | 1977-05-02 | 1978-01-17 | G. D. Searle & Co. | 4-Aminomethyl-1-(3,3,3-triarylpropyl)-4-arylpiperidine and derivatives thereof |
| US4116963A (en) | 1977-05-23 | 1978-09-26 | G.D. Searle & Co. | 3,3,3-triarylalkyl-4-phenylalkyl-4-hydroxy piperidines and related compounds |
| US4194045A (en) * | 1977-12-27 | 1980-03-18 | G. D. Searle & Co. | 1-(3,3-Diaryl-3-oxadiazolalkyl)-4-phenyl-4-piperidinomethanols and related compounds |
| IT1096665B (it) | 1978-06-14 | 1985-08-26 | Tecnofarmaci Spa | Composizione farmaceutica per la terapia di stati di frigidita' ed impotenza |
| US4176186A (en) | 1978-07-28 | 1979-11-27 | Boehringer Ingelheim Gmbh | Quaternary derivatives of noroxymorphone which relieve intestinal immobility |
| JPS5535031A (en) * | 1978-09-04 | 1980-03-11 | Shin Etsu Chem Co Ltd | Enteric coating composition |
| US4311833A (en) * | 1979-03-06 | 1982-01-19 | Daicel Chemical Industries Ltd. | Process for preparing ethylcarboxymethylcellulose |
| US4277605A (en) | 1980-03-07 | 1981-07-07 | Bristol-Myers Company | Chemical compounds |
| US4322426A (en) * | 1980-04-28 | 1982-03-30 | E. I. Du Pont De Nemours And Company | 17-Substituted-6-desoxy-7,8-dihydro-6α-methylnoroxymorphone narcotic antagonists |
| US4675189A (en) | 1980-11-18 | 1987-06-23 | Syntex (U.S.A.) Inc. | Microencapsulation of water soluble active polypeptides |
| US4466968A (en) | 1980-11-24 | 1984-08-21 | Dermall, Ltd. | Method for prophylaxis or treatment of emesis and nausea |
| US4427676A (en) * | 1980-12-19 | 1984-01-24 | John Wyeth & Brother Ltd. | Thiomorpholine derivatives |
| US4377568A (en) * | 1981-08-12 | 1983-03-22 | Merck Sharp & Dohme (I.A.) Corp. | Preparation of aqueous alcoholic dispersions of pH sensitive polymers and plasticizing agents and a method of enteric coating dosage forms using same |
| DK150008C (da) | 1981-11-20 | 1987-05-25 | Benzon As Alfred | Fremgangsmaade til fremstilling af et farmaceutisk oralt polydepotpraeparat |
| US4870084A (en) | 1982-03-16 | 1989-09-26 | Pfizer Inc. | Bicyclic benzo fused pyran compounds used for nausea treatment and prevention |
| US4987136A (en) * | 1982-03-16 | 1991-01-22 | The Rockefeller University | Method for controlling gastrointestinal dysmotility |
| DE3381877D1 (de) | 1982-03-16 | 1990-10-18 | Univ Rockefeller | Verwendung von opium antagonisten zur herstellung von arzneimitteln zur behebung gastro-intestinaler stoerungen. |
| US4430327A (en) * | 1982-05-18 | 1984-02-07 | Eli Lilly And Company | Method for treating pregnant females for pain and anxiety |
| US4457907A (en) | 1982-08-05 | 1984-07-03 | Clear Lake Development Group | Composition and method for protecting a therapeutic drug |
| US4533739A (en) | 1982-10-12 | 1985-08-06 | G. D. Searle & Co. | 2-[(Aminophenyl and amidophenyl)amino]-1-azacycloalkanes having antidiarrheal activity |
| US4518433A (en) * | 1982-11-08 | 1985-05-21 | Fmc Corporation | Enteric coating for pharmaceutical dosage forms |
| US4452775A (en) | 1982-12-03 | 1984-06-05 | Syntex (U.S.A.) Inc. | Cholesterol matrix delivery system for sustained release of macromolecules |
| US4462839A (en) | 1983-06-16 | 1984-07-31 | Fmc Corporation | Enteric coating for pharmaceutical dosage forms |
| US4556552A (en) | 1983-09-19 | 1985-12-03 | Colorcon, Inc. | Enteric film-coating compositions |
| DE3474511D1 (en) | 1983-11-01 | 1988-11-17 | Terumo Corp | Pharmaceutical composition containing urokinase |
| US4689332A (en) | 1984-04-09 | 1987-08-25 | Research Corporation | Growth regulation and related applications of opioid antagonists |
| US5266574A (en) | 1984-04-09 | 1993-11-30 | Ian S. Zagon | Growth regulation and related applications of opioid antagonists |
| US4666716A (en) | 1984-09-04 | 1987-05-19 | Richardson-Vicks Inc. | Antidiarrheal compositions and use thereof |
| JPS6229515A (ja) | 1985-07-30 | 1987-02-07 | Shinjiro Tsuji | 硬カプセル剤のフイルムコ−テイング方法 |
| JPH0676314B2 (ja) | 1985-09-30 | 1994-09-28 | 花王株式会社 | 坐剤基剤及び坐剤 |
| US4824853A (en) * | 1985-10-11 | 1989-04-25 | Janssen Pharmaceutica N.V. | α,α-diaryl-4-aryl-4-hydroxy-1-piperidinebutanamide, N-oxides and method of treating diarrhea |
| US4730048A (en) * | 1985-12-12 | 1988-03-08 | Regents Of The University Of Minnesota | Gut-selective opiates |
| US4806556A (en) * | 1985-12-12 | 1989-02-21 | Regents Of The University Of Minnesota | Gut-selective opiates |
| US4861781A (en) | 1986-03-07 | 1989-08-29 | The University Of Chicago | Quaternary derivatives of noroxymorphone which relieve nausea and emesis |
| US4719215A (en) | 1986-03-07 | 1988-01-12 | University Of Chicago | Quaternary derivatives of noroxymorphone which relieve nausea and emesis |
| DE3609073C2 (de) | 1986-03-18 | 1995-08-10 | Hans J Prof Dr Rer Nat Schmitt | Meßeinrichtung zur nichtinvasiven Feststellung peripherer Abfluß- und Durchflußstörungen in menschlichen Extremitäten |
| US4990521A (en) * | 1986-07-03 | 1991-02-05 | Janssen Pharmaceutica | 4-(aroylamino)piperidine-butanimide derivatives |
| EP0319545B1 (en) | 1986-08-28 | 1992-03-18 | Enzacor Properties Limited | Animal growth promotant |
| US5597564A (en) * | 1986-08-28 | 1997-01-28 | Enzacor Properties Limited | Method of administering a microgranular preparation to the intestinal region of animals |
| US4888346A (en) | 1986-10-07 | 1989-12-19 | Bernard Bihari | Method for the treatment of persons infected with HTLV-III (AIDS) virus |
| US4765978A (en) | 1986-12-16 | 1988-08-23 | Schering Corporation | Novel vaginal suppository |
| FR2609632B1 (fr) | 1987-01-21 | 1991-03-29 | Shelly Marc | Nouvelle application therapeutique de la 17-(cyclopropylmethyl)-4,5-epoxy-3,14-dihydroxymorphinon-6-one et les compositions pharmaceutiques destinees a cet usage |
| NL8700842A (zh) | 1987-04-10 | 1988-11-01 | Duphar Int Res | |
| US4891379A (en) * | 1987-04-16 | 1990-01-02 | Kabushiki Kaisha Kobe Seikosho | Piperidine opioid antagonists |
| CA1315689C (en) | 1987-09-03 | 1993-04-06 | Leon I. Goldberg | Quarternary derivatives of noroxymorphone which relieve nausea and emesis |
| ES2051742T3 (es) | 1987-09-10 | 1994-07-01 | Univ Chicago | Derivados cuaternarios de noroxi-morfina que mitigan las nauseas y la emesis. |
| US4912114A (en) * | 1988-03-18 | 1990-03-27 | Sandoz Ltd. | Morphinan derivatives |
| US5312899A (en) * | 1988-06-30 | 1994-05-17 | Biochem Pharma, Inc. | Dermorphin analogs |
| JPH0653683B2 (ja) | 1988-07-14 | 1994-07-20 | ザ ロックフェラー ユニバーシティ | 慢性痛あるいは慢性咳を治療する経口用組成物 |
| EP0352361A1 (en) | 1988-07-29 | 1990-01-31 | The Rockefeller University | Method of treating patients suffering from chronic pain or chronic cough |
| US4999342A (en) * | 1988-08-16 | 1991-03-12 | Ortho Pharmaceutical Corporation | Long lasting contraceptive suppository composition and methods of use |
| US4857533A (en) | 1988-12-15 | 1989-08-15 | Baker Cummins Pharmaceuticals, Inc. | Method of treatment for autoimmune diseases |
| US4863928A (en) | 1989-01-04 | 1989-09-05 | Baker Cummins Pharmaceuticals, Inc. | Method of treatment for arthritic and inflammatory diseases |
| US5102887A (en) | 1989-02-17 | 1992-04-07 | Arch Development Corporation | Method for reducing emesis and nausea induced by the administration of an emesis causing agent |
| US5116868A (en) * | 1989-05-03 | 1992-05-26 | The Johns Hopkins University | Effective ophthalmic irrigation solution |
| US5133974A (en) | 1989-05-05 | 1992-07-28 | Kv Pharmaceutical Company | Extended release pharmaceutical formulations |
| US4965269A (en) | 1989-12-20 | 1990-10-23 | Ab Hassle | Therapeutically active chloro substituted benzimidazoles |
| US5236947A (en) | 1990-02-28 | 1993-08-17 | Jouveinal S.A. | Propanamines, their pharmacological properties and their application as an antidiarrheal |
| JPH0813748B2 (ja) | 1990-04-23 | 1996-02-14 | 帝國製薬株式会社 | 大腸崩壊性ポリペプチド系経口製剤 |
| KR970005839B1 (ko) | 1990-05-11 | 1997-04-21 | 화이자 인코포레이티드 | 상승 치료효과를 얻기 위한 조성물 및 방법 |
| JP3160862B2 (ja) | 1990-11-15 | 2001-04-25 | 雪印乳業株式会社 | 骨強化食品、飼料及び医薬 |
| JPH04230625A (ja) * | 1990-12-27 | 1992-08-19 | Standard Chem & Pharmaceut Corp Ltd | 噴霧乾燥したジクロフェナクナトリウムを含み腸溶性の被覆を有するマイクロカプセルからなる微分散した錠剤組成物の製造方法 |
| DE69231274T2 (de) | 1991-02-25 | 2000-11-30 | Univ Boston | Hyperkinetische bewegungsstörung modulierender opiatrezeptor-antagonist |
| JP2916290B2 (ja) | 1991-03-22 | 1999-07-05 | 帝國製薬株式会社 | 生理活性ポリペプチド含有大腸崩壊経口製剤 |
| US5250542A (en) | 1991-03-29 | 1993-10-05 | Eli Lilly And Company | Peripherally selective piperidine carboxylate opioid antagonists |
| US5159081A (en) | 1991-03-29 | 1992-10-27 | Eli Lilly And Company | Intermediates of peripherally selective n-carbonyl-3,4,4-trisubstituted piperidine opioid antagonists |
| US5270328A (en) | 1991-03-29 | 1993-12-14 | Eli Lilly And Company | Peripherally selective piperidine opioid antagonists |
| CA2064373C (en) | 1991-03-29 | 2005-08-23 | Buddy Eugene Cantrell | Piperidine derivatives |
| US5220017A (en) | 1991-04-10 | 1993-06-15 | Merck & Co., Inc. | Cholecystokinin antagonists |
| WO1993000077A1 (en) * | 1991-06-21 | 1993-01-07 | University Of Cincinnati | Orally administrable therapeutic proteins and method of making |
| US5407686A (en) * | 1991-11-27 | 1995-04-18 | Sidmak Laboratories, Inc. | Sustained release composition for oral administration of active ingredient |
| US5614219A (en) * | 1991-12-05 | 1997-03-25 | Alfatec-Pharma Gmbh | Oral administration form for peptide pharmaceutical substances, in particular insulin |
| US5256154A (en) | 1992-01-31 | 1993-10-26 | Sterling Winthrop, Inc. | Pre-filled plastic syringes and containers and method of terminal sterilization thereof |
| JPH05213763A (ja) | 1992-02-10 | 1993-08-24 | Sanwa Kagaku Kenkyusho Co Ltd | 易吸収活性化カルシウム製剤 |
| DE4294862T1 (de) | 1992-04-10 | 1994-06-09 | Vni Skij I Medicinskich Polime | Pharmazeutische Komposition |
| US5686072A (en) | 1992-06-17 | 1997-11-11 | Board Of Regents, The University Of Texas | Epitope-specific monoclonal antibodies and immunotoxins and uses thereof |
| USRE36547E (en) | 1992-09-21 | 2000-02-01 | Albert Einstein College Of Medicine Of Yeshiva University | Method of simultaneously enhancing analgesic potency and attenuating dependence liability caused by exogenous and endogenous opioid agonists |
| US5512578A (en) * | 1992-09-21 | 1996-04-30 | Albert Einstein College Of Medicine Of Yeshiva University, A Division Of Yeshiva University | Method of simultaneously enhancing analgesic potency and attenuating dependence liability caused by exogenous and endogenous opiod agonists |
| US5580876A (en) | 1992-09-21 | 1996-12-03 | Albert Einstein College Of Medicine Of Yeshiva University, A Division Of Yeshiva University | Method of simultaneously enhancing analgesic potency and attenuating dependence liability caused by morphine and other bimodally-acting opioid agonists |
| US6096756A (en) | 1992-09-21 | 2000-08-01 | Albert Einstein College Of Medicine Of Yeshiva University | Method of simultaneously enhancing analgesic potency and attenuating dependence liability caused by morphine and other bimodally-acting opioid agonists |
| US5472943A (en) | 1992-09-21 | 1995-12-05 | Albert Einstein College Of Medicine Of Yeshiva University, | Method of simultaneously enhancing analgesic potency and attenuating dependence liability caused by morphine and other opioid agonists |
| CA2145985C (en) | 1992-10-28 | 2003-09-16 | Napoleone Ferrara | Vascular endothelial cell growth factor antagonists |
| SG52402A1 (en) * | 1992-12-22 | 1998-09-28 | Univ Cincinnati | Oral administration of immunologically active biomolecules and other therapeutic proteins |
| DE4303214A1 (de) | 1993-02-04 | 1994-08-11 | Wolfgang Marks | Behandlung von Erkrankungen viraler, viroidaler oder onkogener Genese durch Steroid-Saponine oder deren Aglykone |
| US5585348A (en) | 1993-02-10 | 1996-12-17 | Albert Einstein College Of Medicine Of Yeshiva University, A Division Of Yeshiva University | Use of excitatory opioid receptor antagonists to prevent growth factor-induced hyperalgesia |
| US5656290A (en) | 1993-02-26 | 1997-08-12 | The Procter & Gamble Company | Bisacodyl dosage form with multiple enteric polymer coatings for colonic delivery |
| US5391372A (en) * | 1993-06-28 | 1995-02-21 | Campbell; Elizabeth | Methods of treating colic and founder in horses |
| NZ268969A (en) | 1993-07-23 | 1997-06-24 | Toray Industries | Morphinan derivatives and pharmaceutical compositions |
| GB2281205A (en) | 1993-08-24 | 1995-03-01 | Euro Celtique Sa | Oral opioid analgesic |
| SE9303744D0 (sv) * | 1993-11-12 | 1993-11-12 | Astra Ab | Pharmaceutical emulsion |
| US5434171A (en) | 1993-12-08 | 1995-07-18 | Eli Lilly And Company | Preparation of 3,4,4-trisubstituted-piperidinyl-N-alkylcarboxylates and intermediates |
| US6190691B1 (en) * | 1994-04-12 | 2001-02-20 | Adolor Corporation | Methods for treating inflammatory conditions |
| DE69503126T2 (de) | 1994-05-05 | 1998-11-12 | Beckman Instruments Inc | Repetitive oligonukleotide matrix |
| IT1269826B (it) | 1994-05-24 | 1997-04-15 | Paolo Minoia | Uso di antagonisti degli oppiacei e di sali di calcio per la preparazione di medicamenti per il trattamento di forme patologiche endorfino-mediate |
| US5536507A (en) | 1994-06-24 | 1996-07-16 | Bristol-Myers Squibb Company | Colonic drug delivery system |
| US5866154A (en) * | 1994-10-07 | 1999-02-02 | The Dupont Merck Pharmaceutical Company | Stabilized naloxone formulations |
| US5614222A (en) * | 1994-10-25 | 1997-03-25 | Kaplan; Milton R. | Stable aqueous drug suspensions and methods for preparation thereof |
| US5965161A (en) | 1994-11-04 | 1999-10-12 | Euro-Celtique, S.A. | Extruded multi-particulates |
| US5578725A (en) | 1995-01-30 | 1996-11-26 | Regents Of The University Of Minnesota | Delta opioid receptor antagonists |
| ES2094694B1 (es) * | 1995-02-01 | 1997-12-16 | Esteve Quimica Sa | Nueva formulacion farmaceuticamente estable de un compuesto de bencimidazol y su proceso de obtencion. |
| US6096763A (en) | 1995-02-23 | 2000-08-01 | Merck & Co., Inc. | α1a adrenergic receptor antagonists |
| US6025154A (en) * | 1995-06-06 | 2000-02-15 | Human Genome Sciences, Inc. | Polynucleotides encoding human G-protein chemokine receptor HDGNR10 |
| US5714586A (en) * | 1995-06-07 | 1998-02-03 | American Cyanamid Company | Methods for the preparation of monomeric calicheamicin derivative/carrier conjugates |
| US5821219A (en) | 1995-08-11 | 1998-10-13 | Oregon Health Sciences University | Opioid antagonists and methods of their use |
| GB9517001D0 (en) | 1995-08-18 | 1995-10-18 | Denny William | Enediyne compounds |
| US5804595A (en) | 1995-12-05 | 1998-09-08 | Regents Of The University Of Minnesota | Kappa opioid receptor agonists |
| DK0780372T3 (da) | 1995-12-21 | 2002-03-11 | Syngenta Participations Ag | 3-Amino-2-mercaptobenzoesyrederivater samt fremgangsmåder til deres fremstilling |
| KR100469029B1 (ko) | 1996-02-15 | 2005-05-27 | 얀센 파마슈티카 엔.브이. | 세로토닌재흡수억제제의위장효과를극복하기위한5ht4수용체길항제의용도 |
| DE69709646T2 (de) | 1996-03-12 | 2002-08-14 | Alza Corp | Zusammensetzung und dosisform mit einem opioid-antagonisten |
| US6136780A (en) | 1996-03-29 | 2000-10-24 | The Penn State Research Foundation | Control of cancer growth through the interaction of [Met5 ]-enkephalin and the zeta (ζ) receptor |
| US20040024006A1 (en) * | 1996-05-06 | 2004-02-05 | Simon David Lew | Opioid pharmaceutical compositions |
| DE19651551C2 (de) | 1996-12-11 | 2000-02-03 | Klinge Co Chem Pharm Fab | Opioidantagonisthaltige galenische Formulierung |
| US20010036469A1 (en) | 1997-01-13 | 2001-11-01 | Gooberman Lance L. | Opiate antagonist implant and process for preparation therefor |
| US6884879B1 (en) * | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| US6329516B1 (en) | 1997-04-28 | 2001-12-11 | Fmc Corporation | Lepidopteran GABA-gated chloride channels |
| GB9801231D0 (en) * | 1997-06-05 | 1998-03-18 | Merck & Co Inc | A method of treating cancer |
| HU9701081D0 (en) * | 1997-06-23 | 1997-08-28 | Gene Research Lab Inc N | Pharmaceutical composition of antitumoral activity |
| US6525038B1 (en) * | 1997-06-24 | 2003-02-25 | Werner Kreutz | Synergistic compositions for the selective control of tumor tissue |
| US6353004B1 (en) * | 1997-07-14 | 2002-03-05 | Adolor Coporation | Peripherally acting anti-pruritic opiates |
| US6096764A (en) | 1997-08-21 | 2000-08-01 | Eli Lilly And Company | Methods for inhibiting detrimental side-effects due to GnRH of GnRH agonist administration |
| US6099853A (en) | 1997-09-04 | 2000-08-08 | Protein Express | Vaginal suppository vaccine for urogenital infections |
| AU2003204844B2 (en) | 1997-11-03 | 2007-06-07 | Arch Development Corporation | Use of methylnaltrexone and related compounds |
| US6274591B1 (en) * | 1997-11-03 | 2001-08-14 | Joseph F. Foss | Use of methylnaltrexone and related compounds |
| US20030158220A1 (en) | 1997-11-03 | 2003-08-21 | Foss Joseph F. | Use of methylnaltrexone and related compounds to treat chronic opioid use side effects |
| US6559158B1 (en) | 1997-11-03 | 2003-05-06 | Ur Labs, Inc. | Use of methylnaltrexone and related compounds to treat chronic opioid use side affects |
| US5972954A (en) | 1997-11-03 | 1999-10-26 | Arch Development Corporation | Use of methylnaltrexone and related compounds |
| US6777534B1 (en) | 1997-12-09 | 2004-08-17 | Children's Medical Center Corporation | Peptide antagonists of vascular endothelial growth factor |
| WO1999032119A1 (en) | 1997-12-22 | 1999-07-01 | Euro-Celtique, S.A. | Opioid agonist/antagonist combinations |
| EP0930334A1 (en) | 1998-01-16 | 1999-07-21 | Quest International B.V. | Polysaccharide conjugate capable of binding cellulose |
| EP1051493A2 (en) | 1998-01-26 | 2000-11-15 | Unilever Plc | Method for producing antibody fragments |
| GB9802251D0 (en) | 1998-02-03 | 1998-04-01 | Ciba Geigy Ag | Organic compounds |
| PT1068870E (pt) * | 1998-04-03 | 2006-10-31 | Ajinomoto Kk | Agentes antitumorais |
| US6359111B1 (en) * | 1998-05-28 | 2002-03-19 | Neorx Corporation | Opioid receptor targeting |
| HN1999000149A (es) * | 1998-09-09 | 2000-01-12 | Pfizer Prod Inc | Derivados de 4,4-biarilpiperidina |
| US20010010919A1 (en) | 1998-10-13 | 2001-08-02 | David K. Grandy | Opioid antagonists and methods of their use |
| BR9916765A (pt) | 1999-01-05 | 2001-09-25 | Unilever Nv | Processo para produzir um material imunoadsorvente, uso de uma proteìna que é ligada por meio de uma ligação covalente a um fragmento de anticorpo, material imunadsorvente, uso de um material, e, kit de teste diagnóstico |
| ATE276359T1 (de) | 1999-01-19 | 2004-10-15 | Unilever Nv | Verfahren zur herstellung von antikörperfragmenten |
| WO2000046383A2 (en) | 1999-02-05 | 2000-08-10 | Rijksuniversiteit Leiden | Method of modulating metabolite biosynthesis in recombinant cells |
| US6194382B1 (en) | 1999-03-03 | 2001-02-27 | Albert Einstein College Of Medicine Of Yeshiva University | Method and composition for treating irritable bowel syndrome using low doses of opioid receptor antagonists |
| JP4049477B2 (ja) | 1999-03-23 | 2008-02-20 | 大鵬薬品工業株式会社 | 副作用軽減剤 |
| WO2000065057A1 (en) | 1999-04-22 | 2000-11-02 | Unilever Plc | Inhibition of viral infection using monovalent antigen-binding proteins |
| US7129265B2 (en) | 1999-04-23 | 2006-10-31 | Mason R Preston | Synergistic effects of amlodipine and atorvastatin metabolite as a basis for combination therapy |
| US6171620B1 (en) | 1999-04-27 | 2001-01-09 | Health Research, Inc. | Method of enhancing the efficacy of anti-tumor agents |
| AU4564200A (en) | 1999-04-29 | 2000-11-17 | Aventis Pharma S.A. | Method for treating cancer using camptothecin derivatives and 5-fluorouracil |
| US6833349B2 (en) | 1999-06-08 | 2004-12-21 | Regeneron Pharmaceuticals, Inc. | Methods of treating inflammatory skin diseases |
| US20020068712A1 (en) | 1999-07-23 | 2002-06-06 | Troy Stevens | Use of decreasing levels of functional transient receptor potential gene product |
| US20030105121A1 (en) | 1999-07-27 | 2003-06-05 | Bernard Bihari | Method of preventing lipodystrophy syndrome or reversing a pre-existing syndrome in HIV-infected patients being treated with antiretroviral agents |
| AU6322900A (en) | 1999-08-02 | 2001-02-19 | Keygene N.V. | Method for generating resistance against cgmmv in plants, genetic constructs for use in said method, and cgmmv-resistant plants obtained via said method |
| CA2380524A1 (en) | 1999-08-25 | 2001-03-01 | Barrett R. Cooper | Compositions and methods for treating opiate intolerance |
| ES2226886T3 (es) | 1999-08-31 | 2005-04-01 | Grunenthal Gmbh | Forma de administracion de accion retardada que contiene sacarinato de tramadol. |
| US6451806B2 (en) | 1999-09-29 | 2002-09-17 | Adolor Corporation | Methods and compositions involving opioids and antagonists thereof |
| DE60013630T2 (de) | 1999-11-01 | 2005-09-15 | John Cardiff Rhodes | Arzneimittel zur behandlung von darmverstopfung und reizkolon |
| ES2251168T3 (es) * | 1999-11-04 | 2006-04-16 | Institut Gustave Roussy | Agente antiviral en combinacion con radioterapia para el tratamiento del cancer. |
| US6384044B1 (en) | 1999-11-29 | 2002-05-07 | Bernard Bihari | Method of treating cancer of the prostate |
| AU4136901A (en) | 1999-11-29 | 2001-06-18 | Adolor Corporation | Novel methods for the treatment and prevention of dizziness and pruritus |
| DK1244447T3 (da) | 1999-11-29 | 2007-04-23 | Adolor Corp | Nye fremgangsmåder og sammensætninger indeholdende opioider og deres antagonister |
| DK1244448T3 (da) | 1999-11-29 | 2009-08-17 | Adolor Corp | Nye metoder til behandling og forebyggelse af ileus |
| US6469030B2 (en) | 1999-11-29 | 2002-10-22 | Adolor Corporation | Methods for the treatment and prevention of ileus |
| US6545010B2 (en) | 2000-03-17 | 2003-04-08 | Aventis Pharma S.A. | Composition comprising camptothecin or a camptothecin derivative and a platin derivative for the treatment of cancer |
| US20010046968A1 (en) | 2000-03-23 | 2001-11-29 | Zagon Ian S. | Opioid growth factor modulates angiogenesis |
| US6967075B2 (en) * | 2000-04-07 | 2005-11-22 | Schering Corporation | HCV replicase complexes |
| WO2001085257A2 (en) | 2000-05-05 | 2001-11-15 | Pain Therapeutics, Inc. | Opioid antagonist compositions and dosage forms |
| WO2001097843A2 (en) * | 2000-06-22 | 2001-12-27 | University Of Iowa Research Foundation | Methods for enhancing antibody-induced cell lysis and treating cancer |
| EP1175905A1 (en) | 2000-07-24 | 2002-01-30 | Societe Des Produits Nestle S.A. | Nutritional Composition |
| FI116089B (sv) * | 2000-07-27 | 2005-09-15 | Johan Tore Karlstroem | Anordning och förfaranden vid reglar |
| RS50397B (sr) | 2000-07-28 | 2009-12-31 | F. Hoffmann-La Roche Ag., | Farmaceutska smeša |
| NZ507152A (en) * | 2000-09-27 | 2001-06-29 | Hiltive Pty Ltd | Wall cladding assembly with cladding having recesses along opposite sides to engage with flanges of support members |
| AU2002249885A1 (en) | 2000-11-17 | 2002-08-12 | Adolor Corporation | Delta agonist analgesics |
| US6967016B2 (en) | 2000-12-04 | 2005-11-22 | Primagen Holding B.V. | Method of determining therapeutic activity and/or possible side-effects of a medicament |
| MXPA03005135A (es) | 2000-12-13 | 2003-12-04 | Lilly Co Eli | Regimen de tratamiento cronico usando peptidos insulinotropicos similares al glucagon. |
| US6693125B2 (en) * | 2001-01-24 | 2004-02-17 | Combinatorx Incorporated | Combinations of drugs (e.g., a benzimidazole and pentamidine) for the treatment of neoplastic disorders |
| WO2002076472A2 (en) | 2001-03-23 | 2002-10-03 | Shire Biochem Inc. | Pharmaceutical combinations for the treatment of cancer comprising dioxolane nucleoside analogs |
| US20040242523A1 (en) | 2003-03-06 | 2004-12-02 | Ana-Farber Cancer Institue And The Univiersity Of Chicago | Chemo-inducible cancer gene therapy |
| WO2002080987A1 (en) | 2001-04-09 | 2002-10-17 | Progenics Pharmaceuticals, Inc. | Anti-cd19 immunotoxins |
| EP2283845A1 (en) * | 2001-04-26 | 2011-02-16 | pSivida Inc. | Sustained release drug delivery system containing codrugs |
| US20030022909A1 (en) * | 2001-06-05 | 2003-01-30 | University Of Chicago | Use of methylnaltrexone to treat immune suppression |
| US6585997B2 (en) * | 2001-08-16 | 2003-07-01 | Access Pharmaceuticals, Inc. | Mucoadhesive erodible drug delivery device for controlled administration of pharmaceuticals and other active compounds |
| US8012517B2 (en) | 2001-08-31 | 2011-09-06 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Inhibition of angiogenesis and destruction of angiogenic vessels with extracts of noni juice Morinda citrifolia |
| EP2939696B1 (en) | 2001-10-18 | 2016-03-09 | Nektar Therapeutics | Polymer conjugates of opioid antagonists |
| US20030144312A1 (en) | 2001-10-30 | 2003-07-31 | Schoenhard Grant L. | Inhibitors of ABC drug transporters in multidrug resistant cancer cells |
| WO2003037365A1 (en) * | 2001-11-01 | 2003-05-08 | The Johns Hopkins University | Methods and compositions for treating vascular leak using hepatocyte growth factor |
| CA2470519C (en) * | 2001-12-21 | 2009-11-17 | Merck & Co., Inc. | Heteroaryl substituted pyrrole modulators of metabotropic glutamate receptor-5 |
| US20050011468A1 (en) * | 2002-02-04 | 2005-01-20 | Jonathan Moss | Use of methylnaltrexone in treating gastrointestinal dysfunction in equines |
| US20040259898A1 (en) | 2002-02-04 | 2004-12-23 | Jonathan Moss | Use of methylnaltrexone in treating gastrointestinal dysfunction in equines |
| US7074825B2 (en) | 2002-03-07 | 2006-07-11 | Huanbiao Mo | Composition and method for treating cancer |
| WO2003077867A2 (en) | 2002-03-14 | 2003-09-25 | Euro-Celtique, S.A. | Naltrexone hydrochloride compositions |
| US20030191147A1 (en) | 2002-04-09 | 2003-10-09 | Barry Sherman | Opioid antagonist compositions and dosage forms |
| US7355081B2 (en) | 2002-04-17 | 2008-04-08 | The University Of North Carolina At Chapel Hill | Curcumin analogues and uses thereof |
| AU2003232113A1 (en) | 2002-05-10 | 2003-11-11 | Teva Pharmaceutical Industries Ltd. | Novel crystalline forms of gatifloxacin |
| US7329642B2 (en) | 2002-05-17 | 2008-02-12 | Board Of Regents, University Of Texas System | β-2-glycoprotein is an inhibitor of angiogenesis |
| US7012100B1 (en) | 2002-06-04 | 2006-03-14 | Avolix Pharmaceuticals, Inc. | Cell migration inhibiting compositions and methods and compositions for treating cancer |
| US7411067B2 (en) | 2002-06-14 | 2008-08-12 | Teva Pharmaceutical Industries Ltd | Crystalline forms of gatifloxacin |
| US6986901B2 (en) * | 2002-07-15 | 2006-01-17 | Warner-Lambert Company Llc | Gastrointestinal compositions |
| US20040010997A1 (en) * | 2002-07-17 | 2004-01-22 | Oren Close | Guides to align masonry walls defining apertures, and methods of use |
| US7160913B2 (en) * | 2002-09-13 | 2007-01-09 | Thomas Jefferson University | Methods and kit for treating Parkinson's disease |
| US7691374B2 (en) * | 2002-10-23 | 2010-04-06 | Health Research, Inc. | Method for increasing the efficacy of anti-tumor agents by anti-endoglin antibody |
| WO2004043964A2 (en) | 2002-11-08 | 2004-05-27 | Mallinckrodt Inc. | Process for the preparation of quaternary n-alkyl morphinan alkaloid salts |
| WO2004054511A2 (en) | 2002-12-13 | 2004-07-01 | The Regents Of The University Of California | Analgesic combination comprising nalbuphine |
| WO2004054569A1 (en) * | 2002-12-16 | 2004-07-01 | Council Of Scientific And Industrial Research | Pharmaceutical composition containing brevifoliol for use in chemotherapeutic treatment of human beings |
| EP1606275B1 (en) | 2003-03-07 | 2008-08-27 | Eli Lilly And Company | Opioid receptor antagonists |
| US20050004155A1 (en) * | 2003-04-08 | 2005-01-06 | Boyd Thomas A. | Use of methylnaltrexone to treat irritable bowel syndrome |
| AU2004229464A1 (en) | 2003-04-08 | 2004-10-28 | Progenics Pharmaceuticals, Inc. | Combination therapy for constipation comprising a laxative and a peripheral opioid antagonist |
| CN104383542B (zh) | 2003-04-08 | 2017-09-26 | 普罗热尼奇制药公司 | 包含甲基纳曲酮的药物配方 |
| RU2350327C2 (ru) | 2003-04-29 | 2009-03-27 | Ориксиджен Серапьютикс, Инкорпорэйтд | Составы, вызывающие потерю веса |
| US6992193B2 (en) | 2003-06-10 | 2006-01-31 | Adolor Corporation | Sulfonylamino phenylacetamide derivatives and methods of their use |
| US7494979B2 (en) | 2003-06-13 | 2009-02-24 | Ironwood Pharmaceuticals, Inc. | Method for treating congestive heart failure and other disorders |
| DK1644021T3 (da) * | 2003-06-13 | 2012-10-29 | Ironwood Pharmaceuticals Inc | Fremgangsmåder og sammensætninger til behandlingen af gastrointestinale sygdomme |
| AU2003903387A0 (en) | 2003-07-02 | 2003-07-17 | Sirtex Medical Limited | Combination therapy for treatment of neoplasia |
| EP1682006A4 (en) | 2003-10-29 | 2011-01-26 | Physiosonics Inc | METHOD AND DEVICE FOR DETERMINING A MIDDLE LINE OF AN ULTRASONIC LIQUID FLOW |
| US6984403B2 (en) * | 2003-12-04 | 2006-01-10 | Pfizer Inc. | Azithromycin dosage forms with reduced side effects |
| US8946262B2 (en) | 2003-12-04 | 2015-02-03 | Adolor Corporation | Methods of preventing and treating gastrointestinal dysfunction |
| US20070082044A1 (en) * | 2004-03-10 | 2007-04-12 | Trustees Of Tufts College | Synergistic effect of compositions comprising carotenoids selected from lutein, beta-carotene and lycopene |
| TW200533339A (en) | 2004-03-16 | 2005-10-16 | Bristol Myers Squibb Co | Therapeutic synergy of anti-cancer compounds |
| US6946556B1 (en) | 2004-05-21 | 2005-09-20 | Acura Pharmaceuticals, Inc. | Preparation of opioid analgesics by a one-pot process |
| US7094775B2 (en) | 2004-06-30 | 2006-08-22 | Bone Care International, Llc | Method of treating breast cancer using a combination of vitamin D analogues and other agents |
| US7388008B2 (en) * | 2004-08-02 | 2008-06-17 | Ambrilia Biopharma Inc. | Lysine based compounds |
| GB0418046D0 (en) | 2004-08-12 | 2004-09-15 | Prosidion Ltd | Eantioselective process |
| US20060063792A1 (en) * | 2004-09-17 | 2006-03-23 | Adolor Corporation | Substituted morphinans and methods of their use |
| US20060204512A1 (en) | 2004-09-23 | 2006-09-14 | Vasgene Therapeutics, Inc. | Polypeptide compounds for inhibiting angiogenesis and tumor growth |
| WO2006039705A2 (en) | 2004-09-30 | 2006-04-13 | Becton, Dickinson And Company | Method for reducing or eliminating residue in a glass medical container and container made in accordance therewith |
| CN101137378A (zh) | 2005-01-20 | 2008-03-05 | 普罗热尼奇制药公司 | 甲基纳曲酮和相关化合物治疗术后胃肠功能障碍的用途 |
| MX2007010833A (es) | 2005-03-07 | 2009-02-17 | Univ Chicago | Uso de antagonistas opioides para atenuar proliferacion y migracion de células endoteliales. |
| US8524731B2 (en) | 2005-03-07 | 2013-09-03 | The University Of Chicago | Use of opioid antagonists to attenuate endothelial cell proliferation and migration |
| US7399871B2 (en) | 2005-03-08 | 2008-07-15 | Teva Pharmaceutical Industries Ltd. | Crystal forms of (S)-(+)-N,N-dimethyl-3-(1-naphthalenyloxy)-3-(2-thienyl)propanamine oxalate and the preparation thereof |
| CN101208343A (zh) | 2005-04-18 | 2008-06-25 | 诺拉马科公司 | 氢吗啡酮多晶型物 |
| AR057035A1 (es) | 2005-05-25 | 2007-11-14 | Progenics Pharm Inc | SíNTESIS DE (R)-N-METILNALTREXONA, COMPOSICIONES FARMACÉUTICAS Y USOS |
| AR057325A1 (es) * | 2005-05-25 | 2007-11-28 | Progenics Pharm Inc | Sintesis de (s)-n-metilnaltrexona, composiciones farmaceuticas y usos |
| US20080194611A1 (en) | 2005-06-03 | 2008-08-14 | Alverdy John C | Modulation of Cell Barrier Dysfunction |
| WO2007053194A2 (en) | 2005-06-03 | 2007-05-10 | The University Of Chicago | Modulation of cell barrier dysfunction |
| CA2610951A1 (en) | 2005-06-03 | 2006-12-14 | The University Of Chicago | Modulation of microbial pathogen-host cell interactions |
| MX2007015287A (es) | 2005-06-09 | 2008-02-22 | Mallinckrodt Inc | Metodo para separacion y purificacion de naltrexona por cromatografia de preparacion. |
| EP1916241B1 (en) | 2005-06-21 | 2013-06-12 | Ajinomoto Co., Inc. | Crystal of phenylalanine derivative, process for producing the same and use thereof |
| PE20070207A1 (es) * | 2005-07-22 | 2007-03-09 | Genentech Inc | Tratamiento combinado de los tumores que expresan el her |
| CA2627158A1 (en) * | 2005-08-30 | 2007-03-08 | Queen's University At Kingston | Potentiation of the therapeutic action of an opioid receptor agonist and/or inhibition or reversal of tolerance to an opioid receptoi agonists using an ultralow dose of an alpha-2receptor antagonist |
| PL116330U1 (en) | 2005-10-31 | 2007-04-02 | Alza Corp | Method for the reduction of alcohol provoked rapid increase in the released dose of the orally administered opioide with prolonged liberation |
| US20070259939A1 (en) | 2006-05-04 | 2007-11-08 | Accelerated Technologies | Using naltrexone as a multi-purpose health supplement to improve the human condition and preventing multiple diseases and infirmities by stimulating immune system vitality and robustness |
| US20080075771A1 (en) * | 2006-07-21 | 2008-03-27 | Vaughn Jason M | Hydrophilic opioid abuse deterrent delivery system using opioid antagonists |
| TW200815451A (en) | 2006-08-04 | 2008-04-01 | Wyeth Corp | 6-carboxy-normorphinan derivatives, synthesis and uses thereof |
| TWI489984B (zh) | 2006-08-04 | 2015-07-01 | Wyeth Corp | 用於非經腸道傳輸化合物之配方及其用途 |
| TW200817048A (en) * | 2006-09-08 | 2008-04-16 | Wyeth Corp | Dry powder compound formulations and uses thereof |
| FR2906252B1 (fr) | 2006-09-21 | 2008-11-28 | Sanofi Aventis Sa | Procede de preparation d'halogenures de n-aklyl naltrexone |
| CN101678016A (zh) | 2006-11-22 | 2010-03-24 | 普罗基因制药公司 | 4,5-环氧-吗啡烷离子类似物的n-氧化物 |
| MX2009005463A (es) | 2006-11-22 | 2009-08-28 | Progenics Pharm Inc | Proceso para sintetizar analogos cuaternarios de 4,5-epoxi-morfinano y aislar sus n-estereoisomeros. |
| EP2101774A2 (en) | 2006-11-22 | 2009-09-23 | Progenics Pharmaceuticals, Inc. | 7,8-saturated-4,5-epoxy-morphinanium analogs |
| PL2137189T3 (pl) * | 2007-03-06 | 2015-12-31 | SpecGx LLC | Sposób wytwarzania czwartorzędowych N-alkilowych soli alkaloidu morfinanowego |
| MX2009010552A (es) | 2007-03-29 | 2009-12-14 | Progenics Pharm Inc | Antagonistas de receptor de opioide periferico y usos de los mismos. |
| MX2009010515A (es) * | 2007-03-29 | 2009-10-19 | Wyeth Corp | Antagonistas del receptor opioide periferico y usos de los mismos. |
| AU2008233133B2 (en) | 2007-03-29 | 2014-03-27 | Progenics Pharmaceuticals, Inc. | Crystal forms of (R) -N-methylnaltrexone bromide and uses thereof |
| KR101581480B1 (ko) | 2008-02-06 | 2015-12-30 | 프로제닉스 파머슈티컬스, 인코포레이티드 | (r),(r)-2,2'-비스-메틸날트렉손의 제조법 및 용도 |
| CA2676881C (en) | 2008-09-30 | 2017-04-25 | Wyeth | Peripheral opioid receptor antagonists and uses thereof |
| MX349145B (es) | 2010-03-11 | 2017-07-14 | Wyeth Llc * | Formulaciones orales y sales lipofilicas de metilnaltrexona. |
-
2008
- 2008-03-28 AU AU2008233133A patent/AU2008233133B2/en active Active
- 2008-03-28 EP EP17172002.2A patent/EP3263571B2/en active Active
- 2008-03-28 CA CA2945356A patent/CA2945356C/en active Active
- 2008-03-28 CA CA2865389A patent/CA2865389A1/en not_active Abandoned
- 2008-03-28 US US12/593,615 patent/US20100305323A1/en not_active Abandoned
- 2008-03-28 CN CN200880017624A patent/CN101801979A/zh active Pending
- 2008-03-28 MX MX2013012245A patent/MX351611B/es unknown
- 2008-03-28 CN CN2012103612119A patent/CN102942572A/zh active Pending
- 2008-03-28 MX MX2009010550A patent/MX2009010550A/es not_active Application Discontinuation
- 2008-03-28 BR BRPI0809579A patent/BRPI0809579B8/pt active IP Right Grant
- 2008-03-28 CA CA002682129A patent/CA2682129A1/en not_active Abandoned
- 2008-03-28 JP JP2010501013A patent/JP2010522756A/ja active Pending
- 2008-03-28 EP EP08742367A patent/EP2134718A2/en not_active Withdrawn
- 2008-03-28 WO PCT/US2008/004116 patent/WO2008121352A2/en active Application Filing
- 2008-03-28 ES ES17172002T patent/ES2765811T5/es active Active
-
2012
- 2012-11-21 US US13/682,878 patent/US9102680B2/en active Active
-
2014
- 2014-07-25 JP JP2014152252A patent/JP2014240400A/ja active Pending
-
2015
- 2015-08-07 US US14/820,916 patent/US9879024B2/en active Active
-
2016
- 2016-06-22 JP JP2016123222A patent/JP2016196490A/ja active Pending
-
2018
- 2018-04-04 JP JP2018072465A patent/JP2018123150A/ja active Pending
-
2020
- 2020-01-31 JP JP2020014353A patent/JP2020079263A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CA2945356C (en) | 2021-03-23 |
| CA2945356A1 (en) | 2008-10-09 |
| BRPI0809579A8 (pt) | 2019-07-02 |
| US9102680B2 (en) | 2015-08-11 |
| AU2008233133B2 (en) | 2014-03-27 |
| MX351611B (es) | 2017-10-20 |
| US20140004188A1 (en) | 2014-01-02 |
| WO2008121352A2 (en) | 2008-10-09 |
| EP3263571B2 (en) | 2023-08-23 |
| CN101801979A (zh) | 2010-08-11 |
| BRPI0809579B1 (pt) | 2020-09-08 |
| US20100305323A1 (en) | 2010-12-02 |
| JP2016196490A (ja) | 2016-11-24 |
| JP2020079263A (ja) | 2020-05-28 |
| CA2682129A1 (en) | 2008-10-09 |
| ES2765811T5 (es) | 2024-02-27 |
| US9879024B2 (en) | 2018-01-30 |
| JP2010522756A (ja) | 2010-07-08 |
| AU2008233133A1 (en) | 2008-10-09 |
| BRPI0809579A2 (pt) | 2014-09-23 |
| JP2014240400A (ja) | 2014-12-25 |
| EP2134718A2 (en) | 2009-12-23 |
| MX2009010550A (es) | 2009-12-14 |
| ES2765811T3 (es) | 2020-06-11 |
| JP2018123150A (ja) | 2018-08-09 |
| EP3263571B1 (en) | 2019-11-13 |
| WO2008121352A3 (en) | 2009-01-15 |
| CA2865389A1 (en) | 2008-10-09 |
| BRPI0809579B8 (pt) | 2021-05-25 |
| US20160068540A1 (en) | 2016-03-10 |
| EP3263571A1 (en) | 2018-01-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102942572A (zh) | (r)-n-溴化甲基纳曲酮的晶体形式及其用途 | |
| TWI466671B (zh) | 末梢性類鴉片受體拮抗劑及其用途 | |
| CN103951583B (zh) | 一种抑制剂的结晶形式 | |
| CN101790529B (zh) | 作为μ类阿片受体拮抗剂的8-氮杂双环[3.2.1]辛基-2-羟基苯甲酰胺化合物 | |
| CN101287730B (zh) | 哌嗪化合物的葡萄糖醛酸盐 | |
| UA102916C2 (uk) | Композиція на основі кон'югату гідрокодону з бензойною кислотою, похідними бензойної кислоти або гетероарилкарбоновою кислотою, проліки, спосіб лікування від зловживань | |
| CN103889984A (zh) | 4-(8-甲氧基-1-((1-甲氧基丙烷-2-基)-2-(四氢-2H-吡喃-4-基)-1H-咪唑并[4,5-c]喹啉-7-基)-3,5-二甲基异噁唑及其作为溴结构域抑制剂的用途 | |
| CN104703964A (zh) | 取代氨基茚满-和氨基萘满甲酸及其用途 | |
| KR20090034395A (ko) | 운데카프레닐 피로포스페이트 합성효소의 억제제 | |
| TW201208667A (en) | Pharmaceutical combinations | |
| US20170182065A1 (en) | Amorphous onapristone compositions and methods of making the same | |
| JP2014505113A (ja) | 末梢作用性μオピオイドアンタゴニスト | |
| JPH0770013A (ja) | β3 −アドレナリン作動薬として作用する{(7S)−7−[(2R)−2−(3−クロロフェニル)−2−ヒドロキシエチルアミノ]−5,6,7,8−テトラヒドロナフタレン−2−イルオキシ)酢酸及びその薬学的に許容されうる塩、並びにそれらが存在する薬学的組成物及び研究室用試薬 | |
| TW201026646A (en) | Crystalline forms of a 3-carboxypropyl-aminotetralin compound | |
| JP2004508272A (ja) | アセチルコリンエンハンサー | |
| CN103764608A (zh) | 用于治疗炎性肠病的茚衍生物 | |
| AU2014201056A1 (en) | Crystal forms of (r) -n-methylnaltrexone bromide and uses thereof | |
| WO2004024143A1 (ja) | 医薬組成物 | |
| JP2010031063A (ja) | 医薬組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1181767 Country of ref document: HK |
|
| C12 | Rejection of a patent application after its publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20130227 |
|
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: WD Ref document number: 1181767 Country of ref document: HK |