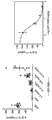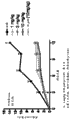CN102762591A - 结合il-23的基于纤连蛋白的支架结构域蛋白质 - Google Patents
结合il-23的基于纤连蛋白的支架结构域蛋白质 Download PDFInfo
- Publication number
- CN102762591A CN102762591A CN2011800100540A CN201180010054A CN102762591A CN 102762591 A CN102762591 A CN 102762591A CN 2011800100540 A CN2011800100540 A CN 2011800100540A CN 201180010054 A CN201180010054 A CN 201180010054A CN 102762591 A CN102762591 A CN 102762591A
- Authority
- CN
- China
- Prior art keywords
- seq
- polypeptide
- sequence
- ring
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/78—Connective tissue peptides, e.g. collagen, elastin, laminin, fibronectin, vitronectin, cold insoluble globulin [CIG]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/39—Connective tissue peptides, e.g. collagen, elastin, laminin, fibronectin, vitronectin, cold insoluble globulin [CIG]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
- A61K47/60—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes the organic macromolecular compound being a polyoxyalkylene oligomer, polymer or dendrimer, e.g. PEG, PPG, PEO or polyglycerol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1034—Isolating an individual clone by screening libraries
- C12N15/1044—Preparation or screening of libraries displayed on scaffold proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2318/00—Antibody mimetics or scaffolds
- C07K2318/20—Antigen-binding scaffold molecules wherein the scaffold is not an immunoglobulin variable region or antibody mimetics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
Abstract
本发明涉及结合白介素23(IL-23),特别为IL-23的p19亚单位的基于纤连蛋白的支架结构域蛋白质。本发明亦涉及创新蛋白质在治疗应用中用于治疗自身免疫疾病的用途。本发明还涉及包含所述蛋白质、编码所述蛋白质或其片段的多核苷酸的细胞,且涉及包含编码所述创新蛋白质的多核苷酸的载体。
Description
发明领域
本发明涉及结合白介素23 (IL-23)、特别为IL-23的p19亚单位的基于纤连蛋白的支架结构域蛋白质。本发明亦涉及创新蛋白质在治疗应用中用于治疗自身免疫疾病的用途。本发明还涉及包含所述蛋白质、编码所述蛋白质或其片段的多核苷酸的细胞,且涉及包含编码所述创新蛋白质的多核苷酸的载体。
引言
IL-23为IL-12异源二聚体细胞因子家族的成员。其含有与IL-12共有的p40亚单位及独特的p19亚单位。IL-23通过由IL-12Rβ1及IL-23R组成的异源二聚体受体复合物发送信号(Aggarwal S等人。Interleukin-23 promotes a distinct CD4 T
cell activation state characterized by the production of interleukin-17. J Biol
Chem.278:1910-4, 2003)。IL-23为用于治疗慢性炎性病症(例如多发性硬化、类风湿性关节炎、牛皮癣及克罗恩病(Crohn's disease))的潜在靶。
基于纤连蛋白的支架(Fibronectin based scaffold)为能发展到结合任一所关注化合物的蛋白质家族。这些蛋白质通常利用衍生自纤连蛋白III型(Fn3)或Fn3-样结构域的支架,以天然或改造抗体(亦即,多克隆抗体、单克隆抗体或单链抗体)所特有的方式起作用,且另外具有结构优势。特别地,这些抗体模拟物的结构已经设计而具有最优选折叠、稳定性及溶解性,甚至在通常导致抗体结构及功能丧失的情况下亦如此。基于纤连蛋白的支架蛋白质的实例为Adnectin (Adnexus,
Bristol-Myers Squibb R&D Company)。
纤连蛋白III型(Fn3)结构域自N-末端至C-末端按顺序包含β或β样链A;环AB;β或β样链B;环BC;β或β样链C;环CD;β或β样链D;环DE;β或β样链E;环EF;β或β样链F;环FG;及β或β样链G。环AB、BC、CD、DE、EF及FG中的任一个或全部均可参与靶结合。BC、DE及FG环在结构与功能两方面皆与免疫球蛋白的互补决定区(CDR)类似。美国专利号7,115,396阐述Fn3结构域蛋白质,其中改变BC、DE及FG环产生高亲和力TNFα结合剂。美国公布号2007/0148126阐述Fn3结构域蛋白质,其中改变BC、DE及FG环产生高亲和力VEGFR2结合剂。
将有利的是,获得用于治疗性治疗自身免疫病症的经改进的纤连蛋白结构域支架蛋白质。产生白介素17(IL-17;“Th17细胞”)的效应T细胞亚群具有高促炎性并诱导严重自身免疫。与Th1及Th2细胞相比,Th17细胞表达不同亚群的细胞因子及趋化因子,包括IL-6、肿瘤坏死因子(TNF)、IL-22、IL-17A及IL-17F以及趋化因子受体CCR6。IL-23通过活化T细胞来促进IL-17产生(Aggarwal
S等人。Interleukin-23 promotes a
distinct CD4 T cell activation state characterized by the production of
interleukin-17. J Biol Chem.278:1910-4, 2003)且为诱导产生IL-17的CD4+ T细胞扩增的关键细胞因子。暴露于IL-23似乎为决定Th17细胞的致病性的关键特征。
发明概述
本申请提供针对人IL-23特异性p19亚单位的AdnectinsTM。本发明的一方面提供包含Fn3结构域的多肽,其中一个或多个溶剂可及环(solvent accessible loop)已被随机化或突变。在一些实施方案中,Fn3结构域为衍生自人纤连蛋白III型结构域的野生型第10模块(module) (10Fn3)的Fn3结构域。在一些实施方案中,本发明的10Fn3多肽与人10Fn3结构域具有至少40%、50%、60%、65%、70%、75%、80%、85%或90%同一性。
在一些实施方案中,一个或多个选自BC、DE及FG的环的长度可相对于相应人纤连蛋白环延长或缩短。
在一些实施方案中,本发明多肽包含纤连蛋白III型第10 (10Fn3)结构域,其中该10Fn3结构域包含环AB;环BC;环CD;环DE;环EF;及环FG;且具有至少一个选自环BC、DE及FG的环且所述环的氨基酸序列相对于人10Fn3结构域中相应环的序列经改变。
在一些实施方案中,本发明多肽包含Fn3结构域,其包含与非环区具有至少80、85、90、95、98、99或100%同一性的氨基酸序列。
在一些实施方案中,本发明蛋白质的BC环包含选自SEQ ID NO: 2-6的氨基酸序列。
在一些实施方案中,本发明蛋白质的DE环包含选自SEQ ID NO: 7-48的氨基酸序列。
在一些实施方案中,本发明蛋白质的FG环包含选自SEQ ID NO: 49-59的氨基酸序列。
在一些实施方案中,10Fn3结构域可以氨基酸取代、插入或缺失开始和/或结束。
在一些实施方案中,本发明蛋白质包含一个来自SEQ ID NO: 2-6中所示的BC环序列的环序列、一个SEQ
ID NO: 7-48中所示的DE环序列及一个SEQ ID NO: 49-59中所示的FG环序列。
在一些实施方案中,本发明蛋白质包含与SEQ ID NO: 2-59中任一个具有至少70、75、80、85、90、95、98、99或100%同一性的BC、DE及FG环氨基酸序列。
在一些实施方案中,抗IL-23 Adnectin包含SEQ ID NO: 60-100中任一个的氨基酸序列。
在一些实施方案中,抗IL-23 Adnectin包含SEQ ID NO: 60-100中任一个的3至96位的Fn3结构域氨基酸序列。
在一些实施方案中,抗IL-23 Adnectin包含与SEQ ID NO: 60-100中任一个具有至少70、75、80、85、90、95、98、99或100%同一性的氨基酸序列。
在一方面,抗IL-23 Adnectin还包含药代动力学(PK)部分。在一些实施方案中,PK部分包含聚乙二醇(PEG)。
在一方面,本申请提供可用于治疗自身免疫疾病的抗IL-23 Adnectin。
在一方面,本发明提供包含纤连蛋白III型第10(10Fn3)结构域及抗IL-23 Adnectin的融合多肽,其中该10Fn3结构域以1 μM或更低的Kd结合至HSA。在某些实施方案中,10Fn3结构域包含与SEQ ID NO: 103具有至少70%同一性的氨基酸序列。在一个实施方案中,10Fn3结构域包含具有SEQ
ID NO: 104中所示氨基酸序列的BC环、具有SEQ ID NO: 105中所示氨基酸序列的DE环及具有SEQ
ID NO: 106中所示氨基酸序列的FG环。在另一实施方案中,10Fn3结构域包含以下中的一个或多个:具有SEQ ID NO: 104中所示氨基酸序列的BC环、具有SEQ
ID NO: 105中所示氨基酸序列的DE环及具有SEQ
ID NO: 106中所示氨基酸序列的FG环。
在一个实施方案中,融合多肽的10Fn3结构域亦结合至以下中的一种或多种:猕猴血清白蛋白(RhSA)、食蟹猴(cynomolgus monkey)血清白蛋白(CySA)或鼠血清白蛋白(MuSA)。在其它实施方案中,10Fn3结构域不与RhSA、CySA或MuSA中的一种或多种交叉反应。
在某些实施方案中,融合多肽的10Fn3结构域以1 μM或更低的Kd结合至HSA。在一些实施方案中,10Fn3结构域以500 nM或更低的Kd结合至HSA。在其它实施方案中,10Fn3结构域以至少200 nM、100
nM、50 nM、20 nM、10
nM或5 nM的Kd结合至HSA。
在其它实施方案中,融合多肽的10Fn3结构域结合至HSA的结构域I或II。在一个实施方案中,10Fn3结构域结合至HSA的结构域I与II二者。在一些实施方案中,10Fn3结构域在5.5至7.4的pH范围下结合至HSA。在其它实施方案中,10Fn3结构域在pH 5.5下以200
nM或更低的Kd结合至HSA。在另一实施方案中,10Fn3结构域在5.5至7.4的pH范围下以至少500
nM、200 nM、100 nM、50
nM、20 nM、10 nM或5
nM的Kd结合至HSA。在一个实施方案中,10Fn3结构域在pH 5.5下以至少500
nM、200 nM、100 nM、50
nM、20 nM、10 nM或5
nM的Kd结合至HSA。
在一些实施方案中,在血清白蛋白存在下融合多肽的血清半衰期为在血清白蛋白不存在下多肽的血清半衰期的至少5倍。在某些实施方案中,在血清白蛋白存在下融合多肽的血清半衰期为在血清白蛋白不存在下多肽的血清半衰期的至少2倍、5倍、7倍、10倍、12倍、15倍、20倍、22倍、25倍、27倍或30倍。在一些实施方案中,血清白蛋白为HSA、RhSA、CySA或MuSA中的任一种。
在某些实施方案中,在血清白蛋白存在下融合多肽的血清半衰期为至少20小时。在某些实施方案中,在血清白蛋白存在下融合多肽的血清半衰期为至少10小时、12小时、15小时、20小时、25小时、30小时、40小时、50小时、75小时、90小时、100小时、110小时、120小时、130小时、150小时、170小时或200小时。在一些实施方案中,在灵长类动物(例如,人或猴)或鼠中观测融合多肽的半衰期。
在任一上述方面及实施方案中,10Fn3结构域包含选自SEQ ID NO: 107、111、115、119及123-143的序列。
附图简述
图1显示本发明抗IL23 Adnectin的全长DNA序列比对。
图2显示如实施例2中所述pBMS2008/ATI001044蛋白质表达载体。
图3显示本发明抗IL23 Adnectin的全长氨基酸序列比对。
图4显示如实施例4中所述抗IL-23
Adnectin抑制PBMC pSTAT3的代表性IC50曲线。
图5显示如实施例4中所述抗IL-23
Adnectin及抗p40单克隆抗体(MAB1510)抑制IL-23依赖性IL-17A的代表性IC50曲线。
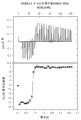
图6显示ATI001045抑制供体228(如实施例4中所述测试的4种供体之一) PBMC中IL-23-诱导的IL-17产生。
图7显示抗IL-23 Adnectin的代表性选择性数据。显示扣除缓冲液的感应图,其说明结合至如实施例4中所述捕获的ATI001016的10
nM IL-23及1 μM IL-12的缔合期及解离期。
图8显示抗IL-23 Adnectin未抑制如实施例4中所述NK-92细胞中IL-12诱导的IFN-γ产生。
图9a显示在如实施例4中所述小鼠药效学模型中ATI001045抑制血清IL-17水平。
图9b显示在如实施例4中所述小鼠药效学模型中比较抗IL-23 Adnectin的抑制活性。
图10a显示如实施例4中所述人IL-23诱导的棘皮症的ATI000934剂量反应。
图10b显示如实施例4中所述人IL-23诱导的棘皮症的ATI001045剂量反应。
图11显示小鼠的体内HSA半衰期。以20
mg/kg(图11A)或50 mg/kg(图11B)将HSA注射至小鼠中。
图12a-d显示小鼠中SABA1-SABA4的半衰期测定。
图13a显示在与HSA共注射时,小鼠中SABA1-4半衰期延长的图表概述。图13b比较食蟹猴与小鼠的数据。
图14A-B显示食蟹猴中SABA1.1及SABA5.1的半衰期测定。
图15显示通过直接结合ELISA测定来测定结合至人、小鼠及大鼠的白蛋白的SABA1.2。
图16显示SABA1.1与HSA化学计量比(stoichiometry)的测定。
图17显示结合至HSA的重组结构域片段的SABA1.2的Biacore分析。
图18显示以1 mpk及10
mpk给药的猴中,SABA1.2的药代动力学概况(profile)。
图19显示以1
mpk经静脉内或皮下给药的猴中,SABA1.2的药代动力学概况。
发明详述
定义:
“多肽”意指无论长度、翻译后修饰或功能,具有两个或更多个氨基酸的任何序列。在本文中,“多肽”、“肽”与“蛋白质”可互换使用。多肽可包括天然氨基酸及非天然氨基酸,例如阐述于美国专利号6,559,126中的那些,该专利通过引用结合到本文中。多肽亦可以多种标准化学方式中的任一种来修饰(例如,氨基酸可用保护基团修饰;可使羧基末端氨基酸成为末端酰氨基;氨基末端残基可用基团修饰以(例如)增强亲油性;或多肽可经化学糖基化或以其它方式修饰以增加稳定性或体内半衰期)。多肽修饰可包括另一结构(例如环状化合物或其它分子)与多肽的连接且亦可包括含有一个或多个呈经改变构型(即,R或S;或L或D)的氨基酸的多肽。本发明肽为衍生自纤连蛋白III型第10结构域的蛋白质,其已被修饰以特异性结合IL-23的p19亚单位且在本文中称为“Adnectin”或“抗IL-23 Adnectin”。
术语“PK”为“药代动力学”的缩写且涵盖化合物的性质,包括(例如)受试者的吸收、分布、代谢及消除。“PK调节蛋白质”或“PK部分”是指当与生物活性分子融合或一起给予时,影响生物活性分子的药代动力学性质的任何蛋白质、肽或部分。PK调节蛋白质或PK部分的实例包括PEG、人血清白蛋白(HSA)结合剂(如美国公开号2005/0287153及2007/0003549中所公开的)、人血清白蛋白、Fc或Fc片段及糖(例如,唾液酸)。
本文中的“氨基酸序列同一性百分比(%)”定义为:在比对各序列及(若需要)引入缺口以达到最大序列同一性百分比后,候选序列中与所选序列中的氨基酸残基相同的氨基酸残基的百分比,且不将任何保守性取代视为序列同一性的一部分。出于测定氨基酸序列同一性百分比目的的比对可用本领域技术范围内的多种方式实现,例如,使用可公开获得的计算机软件,例如BLAST、BLAST-2、ALIGN或Megalign (DNASTAR®)软件。本领域技术人员可确定用于测量比对的合适参数,包括在所比较序列全长范围内达到最大比对所需要的任何算法。
“分离的”多肽为已鉴定并自其天然环境组分中分离和/或回收的多肽。其天然环境的污染组分为可干扰抗体的诊断或治疗用途的物质,且可包括酶、激素及其它蛋白质性溶质或非蛋白质性溶质。在优选实施方案中,可将多肽纯化至(1)大于95%重量的多肽(如通过Lowry方法测定的),且最优选大于99%重量的多肽,(2)通过使用旋杯式序列分析仪足以至少获得N末端或内部氨基酸序列残基的程度,或(3)均质,通过还原或非还原条件下的SDS-PAGE并使用考马斯蓝或优选银染进行。所分离多肽包括重组细胞内的原位多肽,这是因为多肽的天然环境的至少一种组分将不存在。然而,分离的多肽通常可通过至少一个纯化步骤来制备。
氨基酸序列或化合物的“半衰期”通常可定义为在体内(例如)由于天然机制导致的序列或化合物的降解和/或序列或化合物的清除或螯合而使多肽血清浓度降低50%所耗的时间。半衰期可用本身已知的任一方式(例如通过药代动力学分析)来确定。适宜技术应为本领域技术人员所明了,且通常可涉及(例如)以下步骤:向灵长类动物适宜地给予适宜剂量的本发明的氨基酸序列或化合物;以规律间隔收集来自所述灵长类动物的血样或其它样品;测定所述血样中本发明的氨基酸序列或化合物的水平或浓度;及根据由此获得的数据(曲线)计算相对于本发明的氨基酸序列或化合物给药时的初始水平,直至其水平或浓度降低50%所需的时间。可参照例如标准手册,例如Kenneth, A等人, Chemical Stability of
Pharmaceuticals: A Handbook for
Pharmacists以及Lee, P.I.D等人, Pharmacokinetic Analysis: A Practical Approach (1996)。亦可参照Gibaldi,
M等人, Pharmacokinetics,
第2修订版,由Marcel Dekker出版1982)。
半衰期可使用诸如t1/2-α、t1/2-β及曲线下面积(AUC)等参数来表示。在本说明书中,“半衰期的增加”是指这些参数中任一个、这些参数中任两个或所有这三个参数的增加。“半衰期的增加”尤其是指t1/2-β的增加,且有或无t1/2-α和/或AUC或二者的增加。
概述
本申请提供针对人IL-23特异性p19亚单位的Adnectin。为了鉴别IL-23特异性拮抗剂,使用抗p40
mAb将IL-23呈递至Adnectin大型合成文库。针对以下方面对结合至IL-23 p19亚单位的Adnectin进行筛选:与人IL-23的结合、对IL-23/IL-23R相互作用的竞争及对IL-23诱导的T细胞系中的信号转导的抑制。通过降低靶浓度并选择具有缓慢解离速率的抗IL-23 Adnectin使抗IL-23 Adnectin经受进一步选择压力。根据此优化过程,将Adnectin家族确定为具有有利的生物化学及生物物理学性质的IL-23特异性抑制剂。
基于纤连蛋白的支架
本申请的一方面提供包含Fn3结构域的多肽,其中一个或多个溶剂可及环已被随机化或突变。在一些实施方案中,Fn3结构域为衍生自人纤连蛋白III型结构域的野生型第10模块(10Fn3)的Fn3结构域:
已报道多种突变型10Fn3支架。在一方面,Asp 7、Glu 9及Asp
23中的一个或多个被另一氨基酸(例如不带负电荷的氨基酸残基例如Asn、Lys等)替代。已报道与野生型形式相比,这些突变在中性pH下具有促进突变型10Fn3的更大稳定性的作用(参见,PCT公布号WO
02/04523)。已公开了10Fn3支架中多种有益或无作用的额外改变。例如,参见Batori等人,Protein Eng. 2002年12月;15(12):
1015-20;Koide等人,Biochemistry 2001年8月28日;40(34): 10326-33。
变体与野生型10Fn3蛋白质二者的特征在于相同结构,即7个命名为A至G的β链结构域序列及6个连接该7个β链结构域序列的环区(AB环、BC环、CD环、DE环、EF环及FG环)。位于最靠近N-及C末端处的β链可采用溶液中的β样构象。在SEQ ID NO: 1中,AB环对应于残基15-16,BC环对应于残基21-30,CD环对应于残基39-45,DE环对应于残基51-56,EF环对应于残基60-66,且FG环对应于残基76-87(Xu等人,Chemistry & Biology 2002 9:933-942)。
在一些实施方案中,10Fn3多肽可与SEQ ID NO: 1中所示的人10Fn3结构域具有至少40%、50%、60%、65%、70%、75%、80%、85%或90%同一性。在一个或多个所述环中通常可出现许多变化。10Fn3多肽的每一β或β样链可基本上由这样的氨基酸序列组成:其与SEQ ID NO: 1的相应β或β样链的序列具有至少80%、85%、90%、95%或100%同一性,前提为此变化不会破坏生理条件下多肽的稳定性。
在一些实施方案中,本公开内容提供包含纤连蛋白III型第10 (10Fn3)结构域的多肽,其中该10Fn3结构域包含环AB;环BC;环CD;环DE;环EF;及环FG;且具有至少一个选自环BC、DE及FG的环且所述环的氨基酸序列相对于人10Fn3结构域中相应环的序列经改变。在一些实施方案中,改变BC及FG环,在一些实施方案中,改变BC、DE及FG环,即,Fn3结构域包含非天然存在的环。“经改变”意指相对于模板序列(相应人纤连蛋白结构域)氨基酸序列中的一个或多个改变且包括氨基酸添加、缺失及取代。改变氨基酸序列通常可经由核酸编码序列的有意、盲目或自发序列变化来实现,且可通过任一技术(例如PCR、易错PCR或化学DNA合成)来进行。
在一些实施方案中,一个或多个选自BC、DE及FG的环的长度可相对于相应人纤连蛋白环延长或缩短。在一些实施方案中,所述环的长度可延长2-25个氨基酸。在一些实施方案中,所述环的长度可减少1-11个氨基酸。因此,为了优化抗原结合,可在长度上以及序列上改变10Fn3环的长度,以获得最大可能的抗原结合灵活性及亲和力。
在一些实施方案中,多肽包含Fn3结构域,其包含与SEQ ID NO: 1的非环区具有至少80、85、90、95、98、99或100%同一性的氨基酸序列,其中至少一个选自BC、DE及FG的环经改变。在一些实施方案中,经改变BC环具有至多10个氨基酸取代、至多4个氨基酸缺失、至多10个氨基酸插入或其组合。在一些实施方案中,经改变DE环具有至多6个氨基酸取代、至多4个氨基酸缺失、至多13个氨基酸插入或其组合。在一些实施方案中,FG环具有至多12个氨基酸取代、至多11个氨基酸缺失、至多25个氨基酸插入或其组合。
在一些实施方案中,本发明蛋白质的BC环包含选自以下的氨基酸序列:GHYPMHV (SEQ ID NO: 2)、GHYPLHV (SEQ ID NO: 3)、GHYPMHI (SEQ ID NO: 4)、GHYPLHI (SEQ ID NO: 5)及GHYPLHL (SEQ ID NO: 6)。
在一些实施方案中,本发明蛋白质的DE环包含选自以下的氨基酸序列:HRTH(SEQ ID NO: 7)、YYHY(SEQ ID NO: 8)、SKQH (SEQ ID NO: 9)、SNVH (SEQ ID NO: 10)、NRAH (SEQ ID NO: 11)、RKTY(SEQ ID NO: 12)、RSRY (SEQ ID NO: 13)、SRYY (SEQ ID NO: 14)、PHRY (SEQ ID NO: 15)、RSTH (SEQ ID NO: 16)、SRIY (SEQ ID NO: 17)、HQRY (SEQ ID NO: 18)、KQVY (SEQ ID NO: 19)、AHRY (SEQ ID NO: 20)、RSRH (SEQ ID NO: 21)、ARQY (SEQ ID NO: 22)、RTQY (SEQ ID NO: 23)、PRYH (SEQ ID NO: 24)、MRQH (SEQ ID NO: 25)、SRKY (SEQ ID NO: 26)、RQKY (SEQ ID NO: 27)、HAKY(SEQ ID NO: 28)、SNRY (SEQ ID NO: 29)、NTSH (SEQ ID NO: 30)、SQVY (SEQ ID NO: 31)、NRVY (SEQ ID NO: 32)、PRSH (SEQ ID NO: 33)、RTKY (SEQ ID NO: 34)、SRYH (SEQ ID NO: 35)、PRRY(SEQ ID NO: 36)、RQKY (SEQ ID NO: 37)、RYKY (SEQ ID NO: 38)、VPRH (SEQ ID NO: 39)、TPKH (SEQ ID NO: 40)、RSKY (SEQ ID NO: 41)、SRKY (SEQ ID NO: 42)、VPRY (SEQ ID NO: 43)、PRRY (SEQ ID NO: 44)、RMRH (SEQ ID NO: 45)、PPRH (SEQ ID NO: 46)、RQIY (SEQ ID NO: 47)及MRQH(SEQ ID NO: 48)。
在一些实施方案中,本发明蛋白质的FG环包含选自以下的氨基酸序列:YYNEADYSQI (SEQ ID NO: 49)、YYQEYEYRYI (SEQ ID NO: 50)、YYMEEKYAVI (SEQ ID NO: 51)、YYAQENYKEI (SEQ ID NO: 52)、YYKEANYREI (SEQ ID NO: 53)、YYAQEEYHII (SEQ ID NO: 54)、YYKEADYSQI (SEQ ID NO: 55)、YYEQVEYREI (SEQ ID NO: 56)、YYEQPIYATI (SEQ ID NO: 57)、YYEQVEYREI (SEQ ID NO: 58)及YYSEELYKYI (SEQ ID NO: 59)。
10Fn3结构域可始于氨基酸变化。例如,额外MG序列可位于Fn3结构域的N末端处。通常M将被切割掉,在N末端处留下G。在一些实施方案中,序列可位于10Fn3结构域的C末端处。例如,在定点聚乙二醇化中,其中将诸如GSGC (SEQ ID NO: 101)等含有半胱氨酸的接头添加至C末端。或者,天然存在的C末端尾巴的聚乙二醇化,其中通过将Ser改变为Cys使所述尾巴突变以获得含有半胱氨酸的接头EIDKPCQ (SEQ ID NO: 102)。包含GSGC接头的本发明抗IL-23
Adnectin的实例包括ATI001014、ATI001015、ATI001016、ATI001044、ATI001045及ATI001047。ATI000934为包含EIDKPCQ接头的本发明抗IL-23
Adnectin的实例。
在一些实施方案中,本发明蛋白质包含一个来自SEQ ID NO: 2-6中所示的BC环序列的环序列、一个SEQ
ID NO: 7-48中所示的DE环序列及一个SEQ ID NO: 49-59中所示的FG环序列。在一些实施方案中,本发明蛋白质包含与SEQ ID NO: 2-59中任一个具有至少70、75、80、85、90、95、98、99或100%同一性的BC、DE及FG环氨基酸序列。
此外,本领域技术人员将认识到,SEQ ID NO: 2-6中所示的BC环序列共享共有序列基序GHYPX1HX2
(SEQ ID NO: 257),其中X1为M或L,且X2为I或V,且SEQ ID NO: 49-59中所示的FG环序列共享共有序列基序YYX3X3X3X3YX3X3I
(SEQ ID NO: 258),其中X3可为任一氨基酸。因此,将可能生成结合IL-23的其它Adnectin,所述结合利用适合共有序列GHYPX1HX2的BC环和/或利用除明确列于SEQ ID NO: 49-59中的那些以外的其它FG环(其适合模式YYX3X3X3X3YX3X3I)。
在一些实施方案中,抗IL-23 Adnectin包含SEQ ID NO: 60-100中任一个的氨基酸序列。在一些实施方案中,抗IL-23 Adnectin包含SEQ ID NO: 60-100中任一个的3至96位的Fn3结构域氨基酸序列。在一些实施方案中,抗IL-23 Adnectin包含与SEQ
ID NO: 60-100中的任一个具有至少70、75、80、85、90、95、98、99或100%同一性的氨基酸序列。在一些实施方案中,抗IL-23 Adnectin包含与SEQ ID NO: 60-100中任一个的3至96位的氨基酸序列具有至少70、75、80、85、90、95、98、99或100%同一性的氨基酸序列。
在一些实施方案中,抗IL-23 Adnectin可经聚乙二醇化和/或含有his-标签。本文所用ATI000934是指其中环序列与构建体1571G06 (Seq ID 87)的环序列相同的蛋白质,且该蛋白质在C末端处含有残基EIDKPCQ,其中该蛋白质经聚乙二醇化且含有his-标签。ATI001014是指其中环序列与构建体1571G04
(Seq ID 86)的环序列相同的蛋白质,且该蛋白质在C末端处含有GSGC接头,其中该蛋白质经聚乙二醇化且含有his-标签。ATI001015是指其中环序列与构建体1572G06 (Seq ID 91)的环序列相同的蛋白质,且该蛋白质在C末端处含有GSGC接头,其中该蛋白质经聚乙二醇化且含有his-标签。ATI001016是指其中环序列与构建体1490B03 (Seq ID 79)的环序列相同的蛋白质,且该蛋白质在C末端处含有GSGC接头,其中该蛋白质经聚乙二醇化且含有his-标签。ATI001044是指其中环序列与构建体1490B03 (Seq ID 79)的环序列相同的蛋白质,且该蛋白质在C末端处含有GSGC接头,但该蛋白质未经聚乙二醇化且不含有his标签。ATI001045是指其中环序列与构建体1490B03 (Seq ID 79)的环序列相同的蛋白质,且该蛋白质在C末端处含有GSGC接头,其中该蛋白质经聚乙二醇化且不含有his标签。ATI001047是指其中环序列与构建体1571G04 (Seq ID 86)的环序列相同的蛋白质,且该蛋白质在C末端处含有GSGC接头,其中该蛋白质经聚乙二醇化且不含有his标签。
纤连蛋白经由其整联蛋白结合基序“精氨酸-甘氨酸~天冬氨酸”(RGD)天然地结合某些类型的整联蛋白。在一些实施方案中,多肽包含缺乏(RGD)整联蛋白结合基序的10Fn3结构域。
药代动力学部分
在一方面,本申请提供还包含药代动力学(PK)部分的抗IL-23 Adnectin。经改进药代动力学可根据感知性治疗需要来评估。通常期望通过增加蛋白质在给予后在血清中保持可用的时间来增加生物利用度和/或延长剂量之间的时间。在一些情况下,期望提高蛋白质血清浓度随时间的连续性(例如,减小蛋白质血清浓度在给予后不久与下一次给予前不久的差异)。抗IL-23 Adnectin可连接至这样的部分,其相对于未经修饰Adnectin将该多肽在哺乳动物(例如,小鼠、大鼠或人)中的清除率降低3倍以上。经改进药代动力学的其它测量可包括血清半衰期,其通常分为α阶段及β阶段。此两个阶段中的一个或两个可通过添加合适部分来显著改进。
倾向于延缓蛋白质自血液清除的部分(本文中称为“PK部分”)包括聚氧化烯部分例如聚乙二醇、糖(例如唾液酸)及良好耐受的蛋白质部分(例如,Fc、Fc片段、转铁蛋白或血清白蛋白)。Adnectin可融合至白蛋白或白蛋白的片段(部分)或变体,如美国公布号2007/0048282中所述。
在一些实施方案中,PK部分为血清白蛋白结合蛋白,例如阐述于美国公布号2007/0178082及2007/0269422中阐述的那些。
在一些实施方案中,PK部分为血清免疫球蛋白结合蛋白,例如阐述于美国公布号2007/0178082中阐述的那些。
在一些实施方案中,Adnectin包含聚乙二醇(PEG)。一个或多个PEG分子可连接于蛋白质上的不同位置,且此连接可通过与胺、硫醇或其它适宜反应基团反应来实现。胺部分可为(例如)在多肽N末端存在的伯胺或存在于诸如赖氨酸或精氨酸等氨基酸中的胺基团。在一些实施方案中,PEG部分连接于多肽上的位置,该位置选自:a)N末端;b)介于N末端与最N末端β链或β样链之间;c)位于与靶结合位点相对的多肽面上的环;d)介于C末端与最C末端β链或β样链之间;及e)在C末端处。
聚乙二醇化可通过定点聚乙二醇化来实现,其中将适宜反应基团引入蛋白质中以产生其中聚乙二醇化优先发生的位点。在一些实施方案中,对蛋白质进行修饰以在期望位置处引入半胱氨酸残基,从而允许对半胱氨酸进行定点聚乙二醇化。PEG的分子量可大幅度变化且可具支链或为直链。
在一些实施方案中,Adnectin包含Fn3结构域及PK部分。在一些实施方案中,Fn3结构域为10Fn3结构域。在一些实施方案中,相对于仅Fn3结构域,PK部分使多肽的血清半衰期延长多于5、10、20、30、40、50、60、70、80、90、100、120、150、200、400、600、800、1000%或更多。
在一些实施方案中,PK部分为聚合糖。在一些实施方案中,PK部分为聚乙二醇部分。在一些实施方案中,PK部分为血清白蛋白结合蛋白。在一些实施方案中,PK部分为人血清白蛋白。在一些实施方案中,PK部分为血清免疫球蛋白结合蛋白。在一些实施方案中,PK部分为转铁蛋白。在一些实施方案中,PK部分为对血清蛋白质具有特异性的另一Adnectin。
生物物理学及生物化学表征
本申请提供包含结合至IL-23的p19亚单位的Fn3结构域的Adnectin。如表1及实施例4中所示,可在平衡常数(例如解离常数,KD)方面及在动力学常数(例如,结合速率常数(on-rate constant) Kon及解离速率常数(off-rate constant) koff)方面对多肽与靶分子的结合进行评估。Adnectin通常将以小于500 nM、100
nM、10 nM、1 nM、500
pM、200 pM、100 pM的KD结合至靶分子,但可耐受更高KD值,其中Koff足够低或Kon足够高。
本发明的抗IL-23 Adnectin家族的BC、DE及FG环序列以及相应全长SEQ
ID NO呈现于下表1中。
* 亲和力测定方法:根据厂商说明书将抗His抗体mAb050 (RnD Systems, MN)在乙酸盐5.0中稀释至20
μg/mL并在CM5芯片表面(GE Healthcare, Piscataway, NJ)的流动池1及2上固定至约9000 RU。在25℃下在HBS-EP(10 mM Hepes,150 mM NaCl,3
mM EDTA,0.05%表面活性剂P20)中实施所有表面等离振子实验。经2分钟将IL-23注射至抗His mAb捕获的Adnectin上,随后为10分钟的解离阶段。使用Biacore
T100评价软件完成结合特异性的评价。其它详细方法阐述于实施例4中。
其它抗IL-23 Adnectin表征阐述于表2中。
表
2
:抗
IL-23
Adnectin IC50/EC50
(n.d.:未测定)(详细方法阐述于实施例4中)。
核酸
-
蛋白质融合技术
在一方面,本申请提供包含结合IL-23的p19亚单位的纤连蛋白III型结构域的Adnectin。一种快速制作并测试具有特异性结合性质的Fn3结构域的方法为Adnexus,
Bristol-Myers Squibb R&D公司的核酸-蛋白质融合技术。本公开内容利用称为PROfusion的体外表达及标签技术,其采用核酸-蛋白质融合(RNA-及DNA-蛋白质融合)来鉴别对于与蛋白质结合重要的新颖多肽及氨基酸基序。核酸-蛋白质融合技术为使蛋白质共价偶合至其编码遗传信息的技术。关于RNA-蛋白质融合技术及基于纤连蛋白的支架蛋白质文库筛选方法的详细说明,参见Szostak等人,美国专利号6,258,558、6,261,804、6,214,553、6,281,344、6,207,446、6,518,018、6,818,418及Roberts等人,Proc
Natl, Acad. Sci. 94:12297-12302, 1997,其通过引用结合到本文中。
载体及多核苷酸实施方案
可化学合成编码本文所公开各种蛋白质或多肽中任一种的核酸。可选择密码子使用以改进在细胞中的表达。所述密码子使用将取决于所选细胞类型。已针对大肠杆菌(E. coli)及其它细菌、以及哺乳动物细胞、植物细胞、酵母细胞及昆虫细胞研发专门的密码子使用模式。例如,参见Mayfield等人,Proc Natl Acad Sci USA. 2003年1月21日;100(2):438-442; Sinclair等人,Protein Expr Purif. 2002年10月;26(I):96
-105;Connell ND. Curr Opin
Biotechnol. 2001年10月;12(5):446-449;Makrides等人,Microbiol
Rev. 1996年9月;60(3):512-538;及Sharp等人,Yeast.
1991年10月;7(7):657-678。
核酸操纵的一般技术阐述于(例如)以下文献中:Sambrook等人,Molecular Cloning: A Laboratory Manual,第2版,第1至3卷,Cold
Spring Harbor Laboratory Press出版. 1989,或Ausubel, F.等人,Current
Protocols in Molecular Biology (Green Publishing and Wiley-Interscience: New
York出版, 1987)及周期性更新,其通过引用结合到本文中。通常,编码多肽的DNA可操作地连接(operably linked)至衍生自哺乳动物、病毒或昆虫基因的适宜转录或翻译调节元件。所述调节元件包括转录启动子、控制转录的可选操纵基因序列、编码适宜mRNA核糖体结合位点的序列及控制转录及翻译终止的序列。另外纳入在宿主中复制的能力(其一般通过复制起点赋予)及选择基因(以帮助识别转化体)。
本文所述蛋白质不仅可以直接地重组产生,且亦可作为与异源多肽的融合多肽重组产生,该异源多肽优选为信号序列或在成熟蛋白质或多肽的N末端具有特异性切割位点的其它多肽。所选异源信号序列优选为由宿主细胞识别及处理(即通过信号肽酶切割)的异源信号序列。
对于不能识别及处理天然信号序列的原核宿主细胞而言,可用选自(例如)碱性磷酸酶、青霉素酶、lpp、或热稳定肠毒素II前导序列的原核信号序列取代该信号序列。
对于酵母分泌而言,天然信号序列可被以下取代:例如酵母转化酶前导序列、α因子前导序列(包括酵母菌属(Saccharomyces)及克鲁维酵母属(Kluyveromyces)的α-因子前导序列)、或酸性磷酸酶前导序列、白色念珠菌(C. albicans)葡萄糖淀粉酶前导序列、或美国专利5,631,144中所述信号。在哺乳动物细胞表达中,可使用哺乳动物信号序列以及病毒分泌性前导序列,例如单纯疱疹gD信号。此前体区的DNA可与编码蛋白质的DNA符合读框地连接。
表达及克隆载体二者皆含有使载体在一个或多个所选宿主细胞内复制的核酸序列。一般而言,在克隆载体中此序列为使载体独立于宿主染色体DNA复制的序列,且包括复制起点或自主复制序列。对于各种细菌、酵母及病毒而言,所述序列为众所周知。来自质粒pBR322的复制起点适用于大多数革兰氏(Gram)阴性细菌,2微米质粒起点适用于酵母,且各种病毒起点(SV40、多瘤病毒、腺病毒、VSV或BPV)可用于哺乳动物细胞中的克隆载体。一般而言,哺乳动物表达载体不需要复制起点组分(通常可使用SV40起点,仅由于其含有早期启动子)。
表达及克隆载体可含有选择基因,其亦称为可选标记物。典型选择基因编码具有以下性质的蛋白质:(a)赋予对抗生素或其它毒素(例如,氨苄西林(ampicillin)、新霉素、氨甲喋呤或四环素)的抗性,(b)补充营养缺陷型缺乏,或(c)供给不可自复合培养基中获得的关键营养物,例如编码杆菌(Bacilli)的D-丙氨酸消旋酶的基因。
表达及克隆载体通常含有被宿主生物识别且与编码本发明蛋白质(例如,基于纤连蛋白的支架蛋白质)的核酸可操作地连接的启动子。适合与原核宿主一起使用的启动子包括phoA启动子、β-内酰胺酶及乳糖启动子系统、碱性磷酸酶、色氨酸(trp)启动子系统、及杂合启动子(例如tan启动子)。然而,其它已知细菌启动子亦适合。用于细菌系统的启动子亦可含有与编码本发明蛋白质的DNA可操作地连接的Shine-Dalgarno(S.D.)序列。对于真核生物而言,启动子序列亦为已知的。事实上,所有真核基因皆具有富含AT的区,其位于转录起始位点上游约25-30个碱基处。在许多基因的转录起点上游70至80个碱基处存在的另一序列为CNCAAT区,其中N可为任何核苷酸。在大多数真核基因的3'端处为AATAAA序列,其可能为向编码序列3'端添加聚A尾巴的信号。所有这些序列皆适当地插入真核表达载体中。
与酵母宿主一起使用的适宜启动序列的实例包括3-磷酸甘油酸酯激酶或其它糖酵解酶(例如,烯醇化酶、甘油醛-3-磷酸脱氢酶、己糖激酶、丙酮酸脱羧酶、磷酸果糖激酶、葡萄糖-6-磷酸异构酶、3-磷酸甘油酸酯变位酶、丙酮酸激酶、磷酸丙糖异构酶、磷酸葡萄糖异构酶、及葡糖激酶)的启动子。
在哺乳动物宿主细胞中自载体转录可受(例如)以下启动子控制:自病毒(例如多瘤病毒、禽痘病毒、腺病毒(例如腺病毒2)、牛乳头瘤病毒、鸟类肉瘤病毒、巨细胞病毒、逆转录病毒、肝炎-B病毒及最优选猿猴病毒40
(SV40))基因组获得的启动子、自异源哺乳动物启动子(例如,肌动蛋白启动子或免疫球蛋白启动子)获得的启动子、自热激启动子获得的启动子,前提为所述启动子皆与宿主细胞系统相容。
高等真核生物对编码本发明蛋白质的DNA的转录通常可通过将增强子序列插入载体中来增强。当前已知许多增强子序列来自哺乳动物基因(珠蛋白、弹性蛋白酶、白蛋白、α-甲胎蛋白及胰岛素)。然而,通常可使用来自真核细胞病毒的增强子。实例包括复制起点迟侧(late side)上的SV40增强子(bp
100-270)、巨细胞病毒早期启动子增强子、位于复制起点迟侧上的多瘤病增强子及腺病毒增强子。关于激活真核启动子的增强元件亦可参见Yaniv,Nature 297:17-18(1982)。增强子可在肽编码序列的5'或3'位置(但优选位于启动子的5'位点)剪接至载体中。
用于真核宿主细胞(例如酵母、真菌、昆虫、植物、动物、人细胞或来自其它多细胞生物的有核细胞)中的表达载体亦可含有终止转录及稳定mRNA所需的序列。所述序列通常可自真核或病毒DNA或cDNA的5'及(有时)3'未翻译区获得。这些区含有在编码本发明蛋白质的mRNA的未翻译部分中转录为多腺苷酸化片段的核苷酸区段。一种有用转录终止组分为牛生长激素多腺苷酸化区。参见WO 94/11026及本文所公开的表达载体。
重组DNA亦可包括可用于纯化蛋白质的任一类型的蛋白质标签序列。蛋白质标签的实例包括但不限于组氨酸标签、FLAG标签、myc标签、HA标签或GST标签。与细菌、真菌、酵母及哺乳动物细胞宿主一起使用的合适克隆及表达载体可参见Cloning Vectors: A Laboratory
Manual, (Elsevier, New York, 1985),其相关公开内容通过引用结合到本文中。
使用适于宿主细胞的方法将表达构建体引入宿主细胞中,如本领域技术人员所明了的。用于将核酸引入至宿主细胞中的多种方法为本领域已知,其包括但不限于电穿孔;采用氯化钙、氯化铷、磷酸钙、DEAE-葡聚糖或其它物质的转染;微粒轰击;脂转染;及感染(其中载体为感染剂)。
适宜宿主细胞包括原核生物、酵母、哺乳动物细胞或细菌细胞。适宜细菌包括革兰氏阴性或革兰氏阳性生物,例如大肠杆菌或芽孢杆菌(Bacillus
spp)。优选地,亦可使用来自酵母菌属的酵母(例如酿酒酵母(S.
cerevisiae)来产生多肽。亦可采用各种哺乳动物或昆虫细胞培养系统来表达重组蛋白质。用于在昆虫细胞中产生异源蛋白质的杆状病毒系统由Luckow等人综述(Bio/Technology, 6:47, 1988)。适宜哺乳动物宿主细胞系的实例包括内皮细胞、CO8-7猴肾细胞、CV-1、L细胞、C127、3T3、中国仓鼠卵巢(CHO)、人胚胎肾细胞、HeLa、293、293T及BHK细胞系。通过培养适宜宿主/载体系统以表达重组蛋白质来制备经纯化多肽。对于许多应用而言,本文所公开的许多多肽的小尺寸将使在大肠杆菌中的表达为优选表达方法。随后自培养基或细胞提取物纯化蛋白质。
蛋白质产生
宿主细胞用本文所述用于蛋白质产生的表达或克隆载体转化,且在经改进适于诱导启动子、选择转化体、或扩增编码期望序列的基因的常规营养培养基中进行培养。在此处所展示的实例中,用于高通量蛋白质产生(HTPP)及中等规模产生的宿主细胞是BL21 DE3 plysS-细菌菌株。用于产生本发明蛋白质的宿主细胞可在多种培养基中进行培养,例如阐述于以下文献中的那些:Ham等人,Meth. Enz. 58:44(1979);Barites等人,Anal.
Bioehem.102:255 (1980);美国专利号4,767,704、4,657,866、4,927,762、4,560,655、5,122,469、6,048,728、5,672,502或美国专利号Re30,985。亦可以本领域技术人员已知的合适浓度包括任何其它所需补充物。诸如温度、pH等培养条件为先前用于所选表达用宿主细胞的条件,且对本领域普通技术人员为清楚明了的。
本文所公开蛋白质亦可使用细胞翻译系统产生。出于所述目的,必须对编码多肽的核酸进行修饰以允许进行体外转录以产生mRNA并允许mRNA在所用无特定细胞的系统(无真核(例如哺乳动物或酵母)细胞的翻译系统或无原核(例如细菌)细胞的翻译系统)中进行无细胞翻译。
本发明蛋白质亦可通过化学合成(例如,通过阐述于Solid Phase Peptide
Synthesis, 第2版, The
Pierce Chemical Co., Rockford, IL出版. (1984)中的方法)产生。蛋白质的修饰亦可通过化学合成产生。
本发明蛋白质可通过蛋白质化学领域中通常已知的用于蛋白质的分离/纯化方法来纯化。非限制性实例包括萃取、再结晶、盐析(例如,利用硫酸铵或硫酸钠)、离心、透析、超滤、吸附色谱、离子交换色谱、疏水色谱、正相色谱、反相色谱、凝胶过滤、凝胶渗透色谱、亲和色谱、电泳、反流分布或这些方法的任何组合。在纯化后,多肽可更换至不同缓冲液中和/或通过本领域已知多种方法中的任一种(包括但不限于过滤及透析)来浓缩。
经纯化多肽优选至少85%纯、或优选至少95%纯且最优选至少98%纯。无论纯度的确切数值为多少,多肽均足够纯地用作医药产品。
使用平台制造方法来制备抗IL-23 Adnectin。实施例1阐述该制造方法的实例。Adnectin在大肠杆菌中产生。大肠杆菌MG1655细胞用表达载体(pBMS2008/ ATI001044)转化,该表达载体产生作为包涵体的不溶形式的蛋白质。使重组菌株在搅拌发酵罐中生长。发酵结束时,将包涵体收集,溶解并再折叠于制剂中以供纯化。使用马来酰亚胺接头将纯化Adnectin与40 kDa具支链甲氧基PEG缀合。随后将缀合的物质再纯化以去除游离PEG、游离Adnectin及产物相关杂质。对原料药物质(bulk drug substance)实施质量控制测试。
体内治疗用途
在一方面,本申请提供抗IL-23 Adnectin,其可用于治疗自身免疫疾病,例如狼疮(例如,红斑狼疮、狼疮性肾炎)、桥本甲状腺炎(Hashimoto's thyroiditis)、原发性粘液水肿、格雷夫斯病(Graves' disease)、恶性贫血、自身免疫性萎缩性胃炎、阿狄森病(Addison's disease)、糖尿病(例如胰岛素依赖性糖尿病、I型糖尿病)、肺出血-肾炎综合征(Goodpasture's syndrome)、重症肌无力、天疱疮、克罗恩病、交感性眼炎、自身免疫性葡萄膜炎、多发性硬化、自身免疫性溶血性贫血、特发性血小板减少症、原发性胆汁性肝硬化、慢性作用肝炎(chronic action hepatitis)、溃疡性结肠炎、斯耶格伦综合征(Sjogren's syndrome)、风湿性疾病(例如,类风湿性关节炎)、多肌炎、硬皮病及混合性结缔组织病。
本申请亦提供给予受试者抗IL-23 Adnectin的方法。在某些实施方案中,受试者为人。在一些实施方案中,抗IL-23 Adnectin对于哺乳动物、尤其人是药学上可接受的。“药学上可接受的”多肽是指给予动物而无显著不良医疗后果(例如基本上不含内毒素或具有极低内毒素水平)的多肽。
制剂及给药
本申请进一步提供包含本文所述抗IL-23 Adnectin的药学上可接受的组合物,其中该组合物基本上不含内毒素。通过将具有期望纯度的所述Adnectin与可选生理上可接受的载体、赋形剂或稳定剂(Osol, A.编辑,Remington's Pharmaceutical Sciences第16版,(1980))混合来制备包含抗IL-23 Adnectin的治疗制剂以用于储存,所述制剂呈水溶液、冻干或其它干燥制剂的形式。可接受的载体、赋形剂或稳定剂在所用剂量及浓度下对接受者无毒性,且包括缓冲剂,例如磷酸盐、柠檬酸盐及其它有机酸;抗氧化剂,包括抗坏血酸及甲硫氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;及间甲酚);低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯基吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖、及其它碳水化合物,包括葡萄糖、甘露糖或葡聚糖;鳌合剂,例如EDTA;糖,例如蔗糖、甘露醇、海藻糖或山梨醇;形成盐的反离子,例如钠;金属络合物(例如Zn-蛋白质络合物);和/或非离子型表面活性剂,例如吐温、PLURONICS®或聚乙二醇(PEG)。
本发明制剂亦可视需要含有一种以上用于所治疗特定适应症的活性化合物,优选为相互间不产生不利影响的具有互补活性的那些。所述分子适宜以对预期目的有效的量组合地存在。
用于体内给予的制剂必须无菌。这可通过经由无菌过滤膜过滤来容易地实现。
本领域技术人员应了解,各治疗剂的剂量将视药剂特性而定。
对于治疗应用而言,抗IL-23 Adnectin以药学上可接受的剂型给予受试者。其可作为推注经静脉内给予或在一段时间内通过连续输注来给予,或通过皮下途径给予。药学上可接受的适宜载体、稀释剂及赋形剂是熟知的且可通过本领域技术人员根据临床表现证明(warrant)来确定。适宜载体、稀释剂和/或赋形剂的实例包括:(1)Dulbecco磷酸盐缓冲盐水、(2) 0.9%盐水(0.9% w/v NaCl)及(3) 5% (w/v)右旋糖。
本发明方法可在体外、体内或离体实施。
可如上文针对治疗应用所述,以共同给予或序贯给予方式来给予抗IL-23 Adnectin与一种或多种额外治疗剂。本领域技术人员应了解,用于共同给予的药学上可接受的适宜载体、稀释剂及赋形剂将视所给予特定治疗剂的特性而定。
当蛋白质以水性剂型而非冻干剂型存在时,其通常将以约0.1 mg/ml至100 mg/ml的浓度来配制,但允许使用这些范围外的宽变化。对于治疗疾病而言,抗IL-23 Adnectin的合适剂量将取决于:待治疗疾病类型、疾病严重程度及病程、给予Adnectin的目的是预防性还是治疗性、先前疗程、患者临床史及对Adnectin的反应,以及主治医师的决定。蛋白质经一次或经系列治疗适宜地给予患者。
结合血清白蛋白的
Adnectin
(SABA)
的融合物
在某些方面,本申请提供包含抗IL23-Adnectin的融合蛋白,其融合至结合人血清白蛋白的10Fn3结构域(结合血清白蛋白的Adnectin
(10Fn3结构域)或SABA)。所述融合蛋白在白蛋白存在下相对于仅抗IL23-Adnectin具有延长的血清半衰期。
在某些方面,本申请提供包含10Fn3结构域的融合蛋白,该结构域特异性结合血清白蛋白(例如,人血清白蛋白(HSA))以延长融合蛋白的t1/2。
在某些实施方案中,相对于未与SABA缀合时抗IL23-Adnectin的血清半衰期,与SABA融合的抗-IL23-Adnectin的血清半衰期延长。在某些实施方案中,相对于未与SABA缀合时抗IL23-Adnectin的血清半衰期,SABA融合物的血清半衰期长至少20、40、60、80、100、120、150、180、200、400、600、800、1000、1200、1500、1800、1900、2000、2500或3000%。在其它实施方案中,SABA融合物的血清半衰期为当未与SABA融合时抗IL23-Adnectin的血清半衰期的至少1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、10倍、12倍、13倍、15倍、17倍、20倍、22倍、25倍、27倍、30倍、35倍、40倍或50倍。在一些实施方案中,SABA融合物的血清半衰期为至少10小时、15小时、20小时、25小时、30小时、35小时、40小时、50小时、60小时、70小时、80小时、90小时、100小时、110小时、120小时、130小时、135小时、140小时、150小时、160小时或200小时。
因此,本文所述SABA融合分子可用于通过在抗IL23-Adnectin与SABA之间形成融合物来延长抗IL23-Adnectin的半衰期。所述融合分子可用来治疗对IL23的生物活性作出反应的病况。本发明考虑SABA融合分子在由IL-23失调所引起的疾病中的用途。
融合物可通过将抗IL23-Adnectin连接至SABA分子的任一端来形成,即,SABA-抗IL23-Adnectin或抗IL23-Adnectin-SABA排列。
在一方面,本发明提供包含抗IL23-Adnectin的融合蛋白,该抗IL23-Adnectin包含结合血清白蛋白的10Fn3结构域。在例示性实施方案中,本文所述结合血清白蛋白的10Fn3蛋白质以小于3 μM、2.5
μM、2 μM、1.5 μM、1
μM、500 nM、100 nM、50
nM、10 nM、1 nM、500
pM、200 pM、100 pM、50
pM或10 pM的KD结合至HSA。在某些实施方案中,本文所述结合血清白蛋白的10Fn3蛋白质在25℃或37℃下在5.5至7.4的pH范围下以小于3 μM、2.5
μM、2 μM、1.5 μM、1
μM、500 nM、100 nM、50
nM、10 nM、1 nM、500
pM、200 pM、100 pM、50
pM或10 pM的KD结合至HSA。在一些实施方案中,与在7.4或更大的pH下对HSA的结合亲和力相比,本文所述结合血清白蛋白的10Fn3蛋白质在小于7.4的pH下更紧密地结合至HSA。
在某些实施方案中,本文所述包含结合HSA的10Fn3结构域的融合蛋白亦可结合来自猴、大鼠或小鼠中一种或多种的血清白蛋白。在某些实施方案中,本文所述结合血清白蛋白的10Fn3蛋白质以小于3 μM、2.5
μM、2 μM、1.5 μM、1
μM、500 nM、100 nM、50
nM、10 nM、1 nM、500
pM或100 pM的KD结合至猕猴血清白蛋白(RhSA)或食蟹猴血清白蛋白(CySA)。
在某些实施方案中,本文所述包含结合血清白蛋白的10Fn3结构域的融合蛋白结合至HSA的结构域I和/或结构域II。在一个实施方案中,本文所述包含结合血清白蛋白的10Fn3结构域的融合蛋白不结合至HSA的结构域III。
在某些实施方案中,融合蛋白的结合血清白蛋白的10Fn3 (SABA)部分包含与野生型10Fn3结构域(SEQ ID NO: 1)具有至少40%、50%、60%、70%、75%、80%或85%同一性的序列。在一个实施方案中,相对于野生型10Fn3结构域修饰BC、DE或FG环中至少一个。在另一实施方案中,相对于野生型10Fn3结构域修饰BC、DE或FG环中的至少二个。在另一实施方案中,相对于野生型10Fn3结构域修饰BC、DE及FG环中的所有三个。在其它实施方案中,SABA包含与表3中所示26个核心SABA序列中的任一个(即,SEQ ID NO: 103、107、111、115、119及123-143)或表3中所示延伸SABA序列中的任一个(即,SEQ ID NO: 188-215,减去6xHIS标签)具有至少40%、50%、60%、70%、75%、80%、85%、90%或95%同一性的序列。
在某些实施方案中,将核心氨基酸残基固定且在非核心氨基酸残基的残基处进行任何取代、保守取代、缺失或添加。在例示性实施方案中,用多肽替代BC、DE及FG环,所述多肽包含来自下表3中所示HSA结合剂中任一个的BC、DE及FG环序列(即,表3中的SEQ ID NO: 103、107、111、115、119及123-143)。
在某些实施方案中,SABA(例如,如上文所述SABA核心序列或基于其的序列)可经修饰以包含N末端延伸序列和/或C末端延伸序列。例示性延伸序列示于表3中。例如,命名为SABA1.1的SEQ ID NO: 188包含核心SABA 1序列(SEQ
ID NO: 103)与N末端序列MGVSDVPRDLE (SEQ ID NO: 144,命名为AdNT1)及C末端序列EIDKPSQ (SEQ ID NO: 153)。SABA1.1在C末端处还包含His6标签,然而,应了解,His6标签为完全可选的且可位于N-或C末端延伸序列内的任何位置。此外,表3中所提供例示性N-或C末端延伸序列(SEQ
ID NO: 144-163)中的任一种及其变体均可用来修饰表3中所提供的任一给定SABA核心序列。
在其它实施方案中,当设计SABA融合分子时,尾巴序列可视需要与其它已知接头序列(例如,表3中的SEQ
ID NO: 164-187)组合。
缀合接头
SABA融合物可为共价或非共价连接。在一些实施方案中,结合血清白蛋白的10Fn3可直接或经由多肽接头间接连接至抗IL23-Adnectin。连接Fn3的适宜接头为允许单独结构域彼此独立地折叠形成三维结构的那些,该三维结构允许高亲和力结合至靶分子。
本公开内容提供满足这些要求的多个适宜接头,其包括基于甘氨酸-丝氨酸的接头、基于甘氨酸-脯氨酸的接头以及具有氨基酸序列PSTSTST (SEQ ID NO: 184)的接头。本文所述实施例表明,经由多肽接头连接的Fn3结构域保持其靶结合功能。在一些实施方案中,接头为基于甘氨酸-丝氨酸的接头。这些接头包含甘氨酸及丝氨酸残基且长度可介于8-50、10-30及10-20个氨基酸之间。实例包括具有氨基酸序列(GS)7 (SEQ ID NO:
171)、G(GS)6 (SEQ ID NO:
166)及G(GS)7G (SEQ ID NO:
168)的接头。其它接头含有谷氨酸,且包括(例如)(GSE)5 (SEQ ID NO: 173)及GGSE GGSE (SEQ ID NO: 177)。其它例示性甘氨酸-丝氨酸接头包括(GS)4 (SEQ ID NO: 170)、(GGGGS)7 (SEQ ID NO: 179)、(GGGGS)5 (SEQ ID NO: 180)及(GGGGS)3G (SEQ ID NO: 181)。在一些实施方案中,接头为基于甘氨酸-脯氨酸的接头。这些接头包含甘氨酸及脯氨酸残基且长度可为介于3-30、10-30及3-20个氨基酸之间。实例包括具有氨基酸序列(GP)3G (SEQ ID NO: 182)及(GP)5G (SEQ ID NO: 183)的接头。在其它实施方案中,接头可为基于脯氨酸-丙氨酸的接头,其长度介于3-30、10-30及3-20个氨基酸之间。基于脯氨酸丙氨酸的接头的实例包括例如(PA)3 (SEQ ID NO:
185)、(PA)6 (SEQ ID NO:
186)及(PA)9 (SEQ ID NO:
187)。考虑最佳接头长度及氨基酸组成可通过本领域熟知的方法通过常规实验来确定。
在一些实施方案中,本文所述融合物经由具有蛋白酶位点的多肽接头连接,该蛋白酶位点可通过血液或靶组织中的蛋白酶切割。可使用所述实施方案来释放治疗性蛋白质以实现更好的递送或治疗性质或更有效的产生。
可在介于Fn3结构域与多肽接头之间的Fn3结构域的C末端处引入额外接头或间隔物。可在介于Fn3结构域与多肽接头之间的Fn3结构域的N末端处引入额外接头或间隔物。
在一些实施方案中,治疗性部分可直接或经由聚合接头间接连接至SABA。可使用聚合接头来优化改变融合物的各组分间的距离以产生具有以下特性中的一种或多种的蛋白质融合物:1)一个或多个蛋白质结构域在与目的蛋白质结合时的结合空间位阻降低或增加,2)蛋白质稳定性或溶解性增加,3)蛋白质聚集减少,及4)蛋白质的总体亲合力或亲和力增加。
在一些实施方案中,治疗性部分经由生物相容性聚合物(例如聚合糖)连接至SABA。聚合糖可包括可通过血液或靶组织中的酶切割的酶切割位点。可使用所述实施方案来释放治疗性蛋白质以实现更好的递送或治疗性质或更有效的产生。
结合血清白蛋白的
Adnectin
(SABA)
序列的概述
本申请中所提及的许多SABA序列概述于下表3中。除非另有说明,否则所有N末端延伸均以单下划线表示,所有C末端尾巴/延伸均以双下划线表示,且接头序列带有边框。将各核心SABA序列的环区BC、DE及FG加上阴影。
表3. SABA例示性序列的概述
实施例
实施例
1
制造方法
发酵及收获
利用无菌基础培养基来制备生产发酵物(production fermentation)。将小瓶解冻并用来接种含有生长培养基的转移容器。将接种物立即转移至生产发酵物中。在搅拌的同时在34℃的温度下维持培养物并使其生长至OD600达到5-10(1 OD单位为约1×109个细胞/ mL)。在此OD下开始添加进料培养基。发酵继续进行至OD600=25,此时通过添加异丙基β-D-1-硫代半乳糖吡喃糖苷(IPTG)诱导培养物产生Adnectin。容器温度在诱导时自34℃增加至39℃。每小时以无菌方式采样并测试细胞密度。
在9至12小时的诱导发酵后,通过以下方式来准备容器以便收获:使温度降至25℃,添加乙二胺四乙酸(EDTA)至最终浓度为10 mM,通过添加氢氧化钠使pH增至7.8并减慢搅拌。在1小时保持期后,将发酵器内含物排入收集容器中。
包涵体的制备
通过使材料穿过MICROFLUIDIZER®使收获合并物(harvest pool)的细胞破裂,MICROFLUIDIZER®使细胞破裂并释放其内含物。在细胞破裂后,使用碟式离心机(disc stack centrifuge)通过极高离心力在连续过程中将固相与液相分离来收集包涵体。然后用缓冲液将包涵体洗涤两次(20-25℃)并用水(20-25℃)洗涤两次。每次通过离心收集经洗涤包涵体。将经洗涤包涵体回收为浆液。
包涵体的溶解及蛋白质再折叠
将溶解缓冲液添加至包涵体浆液中,随后在室温下搅拌1小时。在此过程期间将OD280=20(总蛋白质)作为目标。
使用两步式稀释法实施蛋白质再折叠。以一份溶解包涵体与半份稀释缓冲液(v/v)的比率将稀释缓冲液添加至溶解包涵体中。通过将溶解包涵体添加至再折叠缓冲液中实施第二次稀释以将OD280=0.7(总蛋白质)作为目标。在室温下搅拌的同时实施稀释。在1小时完全混合后,终止搅拌并使蛋白质溶液在室温下保持过夜。使经溶解及再折叠的Adnectin穿过0.8 μm-0.22
μm滤器并通过A280及RP-HPLC测试蛋白质含量。
纯化及与
PEG
的缀合
将经再折叠及过滤的Adnectin直接装载至阳离子交换(CEX1)柱上进行初始捕获。将已结合材料用洗涤缓冲液洗涤并用50 mM乙酸钠、500 mM氯化钠、1.5%
丙二醇(pH 5.5)洗脱。测定洗出液合并物的纯度、特性、浓度及内毒素。
使用疏水作用色谱(HIC)来进一步纯化来自捕获色谱的洗出液。将CEX1洗出液直接装载至HIC柱上,洗涤并随后用50 mM乙酸钠、30%丙二醇(pH
5.5)洗脱。分析洗出液合并物的纯度、特性及浓度。
随后用40 kDa具支链PEG的马来酰亚胺衍生物(mPEG2-MAL)将经纯化Adnectin直接格式化(format)。在室温下搅拌HIC洗出液并添加mPEG2-MAL。在室温下混合1小时后,将反应混合物在相同温度下孵育过夜。随后在最终CEX柱(CEX2)上处理聚乙二醇化溶液。采样测定蛋白质含量、纯度及内毒素。
用75 mM乙酸将聚乙二醇化溶液的pH及电导率分别调节至4.0及1.0 mS/cm,随后装载于最终阳离子交换柱(CEX2)上以供再纯化。在装载后,用缓冲液洗涤已结合材料并随后用50 mM乙酸钠、25 mM氯化钠(pH
5.0)洗脱。采样测定蛋白质含量、纯度及内毒素。
在配备有具有V型丝网(V-screen)的30
kDa标称分子量截止膜的切向流过滤单元中将CEX2洗出液浓缩至15 mg/mL。使50
mM乙酸钠、25 mM氯化钠(pH 5.0)中的原料药物质穿过0.22
μm滤器并在-80℃下冷冻。
实施例
2
基因、载体及宿主细胞
产生在T7启动子控制下编码蛋白质的质粒以用于菌株构建。使用此质粒DNA来转化感受态大肠杆菌K-12
MG1655细胞(F-λ-, ilvG-rfb-50 rph-1)。将宿主菌株设计为允许在添加IPTG时诱导基因表达。经转化MG1655菌株对卡那霉素具有抗性。蛋白质表达载体示于图2中。使用自板选择的单菌落接种发酵培养物,随后将其分成等分试样并冻结以用作研究细胞库。
实施例
3
生物物理学及生物化学表征
通过若干综合性分析方法来检查本发明蛋白质的结构及质量。
MALDI-MS
通过MALDI分析质谱概况。为了评价对样品进行MALDI分析的准确性,将20个单独的点置于各样品的钢板上并序贯进行分析。总共产生20个谱。
肽图
(peptide
mapping)
使用肽图来确认根据本发明蛋白质以及相应未聚乙二醇化蛋白质的cDNA序列所预测氨基酸序列(一级结构)的正确表达。为了获得完整序列覆盖,采用胰蛋白酶(对Lys及Arg残基的C末端侧进行切割)及内蛋白酶Glu-C(对Glu残基的C末端侧进行切割)来生成两个重叠肽片段组。亦使用肽图来确定共价翻译后修饰,其包括残余N末端甲硫氨酸、二硫桥接(disulfide-bridging)、天冬酰胺的脱酰胺、甲硫氨酸氧化(等)。通过液相色谱质谱(LC-MS)经由分子量及串联质谱(MSMS)鉴别并表征肽,该串联质谱经由碰撞诱导解离(CID)提供部分序列信息。
SDS-PAGE
使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)来显现未聚乙二醇化及聚乙二醇抗IL-23 Adnectin的分子量带型。在具有或无还原剂的样品缓冲液中准备样品。在SDS中加热后,在预制梯度(4-20%)聚丙烯酰胺凝胶上对样品及分子量标记物进行电泳分析。在电泳后,将凝胶固定并使用考马斯蓝染色。目测评估样品带型的等效性。
尺寸排阻色谱
/
多角度光散射
(SECMALS)
使用尺寸排阻色谱(SEC)对单体、高分子量(HMW)及低分子量(LMW)物质进行定量分析。在SEC分离后,通过多角度光散射与示差折光计串联来测定分离物质的分子量。
实施例
4
体外非临床药理学
通过
SPR
测定的
KD
通过表面等离振子共振(SPR)来表征结合特性。以2至4种水平将人IL-23固定在ProteOn XPR (Bio-Rad)芯片表面的一个维度中并暴露于相同SPR芯片表面的另一维度中的6种不同浓度的抗IL-23 Adnectin。这允许在不存在再生时进行动力学测定。在25℃及37℃下使用两块相同芯片进行动力学测定。使用与ProteOn Manager软件拟合的常数参数及Langmuir相互作用模型来实施对动力学参数的评价。
如下表4中所示,在25℃下这些抗IL-23 Adnectin的解离速率缓慢(约10-5
s-1)。甚至在37℃下,解离速率亦接近SPR技术的检测限,因此所报告解离常数测量值可能为低估值。
表
4
:针对直接固定的人
IL-23
的抗
IL-23
Adnectin
的动力学参数
溶液相亲和力
使用动力学排除测定(Kinetic Exclusion Assay,KinExA)来测量ATI001045对人IL-23的溶液亲和力。在一种模式中,对三个浓度中的每一个以一式两份实施hIL-23滴定。相对未结合ATI001045浓度通过以下测量:在人IL-23固体基质上进行捕获,随后用识别Adnectin支架的经荧光标记的抗体进行检测。因技术限制,可测的最低浓度为0.75 nM。因此,尽管表5中所示的整体KD分析给出KD的估计值为51 pM,但在95%置信区间内亲和力可低至个位数的pM或高至150 pM。
表
5
:
ATI001045
的溶液相亲和力测量值
| KD | 51 pM |
| 95%置信区间: | |
| 高Kd | 153 pM |
| 低Kd | 1 pM |
亦可在KinExA中使用替代模式来测量ATI001045及ATI001047对人IL-23的溶液亲和力。对人IL-23的三个(ATI001045)或单一(ATI001047)浓度中的每一个实施Adnectin的一式两份滴定(最低浓度为一式四份)。相对未结合人IL-23浓度通过以下测量:在非聚乙二醇化ATI001045固体基质上进行捕获,随后用识别hIL-23的p40亚单位的经荧光标记的抗体进行检测。表6中所示整体KD分析给出ATI001045的KD为9.4 pM(其中95%置信区间为22 pM-2.4 pM)且ATI001047的KD为36.3 pM(其中95%置信区间为60.1 pM-19.4 pM)。
表
6
:溶液相亲和力测量值
| ATI001045 | ATI001047 | |
| KD | 9.4 pM | 36.33 pM |
| 95%置信区间: | ||
| 高Kd | 22 pM | 60.07 pM |
| 低Kd | 2.4 pM | 19.44 pM |
Kit225
细胞中的
STAT3
磷酸化
Parham等人(“A receptor for the heterodimeric
cytokine IL-23 is composed of IL-12Rbeta1 and a novel cytokine receptor
subunit, IL-23R”, J. Immunol., 168(11):5699-5708 (2002年6月1日))自人IL-2依赖性T细胞系Kit225克隆IL-23R。已通过FACS分析针对IL-12RB1与IL-23R二者的表达对这些细胞进行表征并通过刺激pSTAT3使所述细胞对IL-23作出反应且通过刺激pSTAT4使所述细胞对IL-12作出反应。将Kit225细胞接种至96孔板中并在FBS及IL-2不存在下在37℃下静置3小时。在此孵育后,施用人重组IL-23(或与拮抗剂预孵育1小时的IL-23)并使细胞返回孵育箱中在37℃下保持15分钟以刺激STAT3磷酸化(缩写为p-STAT3)。在96孔板中以一式两份测定每一条件。通过将细胞置于冰上并添加冰冷PBS来终止刺激。最后,依照标准方案使细胞沉淀并裂解且通过ELISA来检测pSTAT3的产生。
刺激用IL-23的最佳浓度为35 pM。通过抗p40单克隆抗体(mAb1510)以及抗p19多克隆抗体(AF1716)的滴定证实IL-23诱导的pSTAT3的抑制。ATI001045、ATI001047、ATI001014及ATI001016具有等效活性且IC50为约300 pM,为抗p19多克隆抗体效价的约150倍,而ATI001015的IC50为约1.2 nM,为抗p19多克隆抗体效价的约40倍。Adnectin ATI000934的效价为ATI001045的1/3,且IC50为1 nM(表7)。
表
7
:抗
IL-23
拮抗剂对
IL-23
诱导的
STAT3
磷酸化的抑制
| pSTAT3 IC50±SD (nM) | |
| ATI001045 | 0.28±0.14 |
| ATI001047 | 0.36 |
| ATI001014 | 0.3±0.1 |
| ATI001015 | 1.24 |
| ATI001016 | 0.3±0.1 |
| ATI000934 | 0.8±0.2 |
| 抗p40 (mAb1510) | 0.19+0.04 |
| 抗p19 (AF1716) | 52±13 |
人
PBMC
中的
STAT3
磷酸化
研发基于次级细胞的确认性测定,其目的在于评价作为原代人细胞中的作用机制的STAT3磷酸化。来自健康供体的外周血单核细胞(PBMC)主要由幼稚及静止天然T细胞组成,所述细胞通常表达低水平IL-23R且当用外源性IL-23刺激时不产生明显反应。然而,用IL-2对幼稚PBMC进行多克隆活化导致幼稚T细胞活化并分化,且随后增加IL-23R表达。这些活化细胞随后对活化STAT途径的外源性IL-23刺激敏感,从而导致STAT3磷酸化。
使用市售抗体(AF1716(抗p19 pAb)及mAb1510(抗p40 mAb),二者均来自R&D
Systems)作为阳性对照来抑制IL-23诱导的STAT3磷酸化。使用来自多个供体的血液在10个单独实验中比较6种Adnectin的抑制活性(概述于表8中)。亚群的例示性数据示于图4中。抗IL-23 Adnectin抑制STAT3磷酸化的效价显著(>150倍)大于抗p19,但与抗p40单克隆抗体的效价的1/5相似。
表
8
:抗
IL-23
拮抗剂对
PBMC
pSTAT3
的抑制
通过小鼠脾细胞产生
IL-23
诱导的细胞因子
利用原代细胞的初始细胞测定设计为评价抗IL-23 Adnectin抑制鼠Th17细胞分泌IL-23依赖性细胞因子的能力。为了区别分析用鼠Th17细胞,用磁珠富集CD4+ T细胞,将其与经辐照脾细胞共培养并在TGF-β和IL-6以及IL-4和IFN-γ的中和抗体存在下用抗CD3活化。在培养6天后,收获极化Th17细胞,将其再接种于96孔板中并用100 ng/ml人IL-23及5 ng/ml鼠IL-2刺激。需要添加IL-2以维持细胞存活力并使得响应于IL-23而稳健地产生细胞因子,但并不强烈诱导IL-17A或IL-22单独产生。由于IL-2诱导低水平细胞因子分泌,因此各样品组均包括仅用IL-2刺激的细胞来作为对照,以得到在不存在IL-23时所产生细胞因子的基线水平。IL-23依赖性反应通过计算IL-2与IL-23组合所诱导细胞因子的水平与仅通过IL-2所诱导的基线水平之间的差来评价。在用IL-2及IL-23再刺激Th17细胞期间添加一定剂量范围的Adnectin以测试其抑制潜能。平行运行一定剂量范围的人抗p40抗体(R&D Systems MAB1510)作为评估IL-23抑制的阳性对照。在96孔板中以一式三份的孔测试每一条件。在4天后,合并一式三份测试中的条件培养基,清除细胞碎片,并通过ELISA测定IL-17A与IL-22二者的浓度。
与仅通过IL-2所诱导的水平相比,用IL-2及IL-23刺激Th17细胞诱导IL-17A的2至3倍增加及IL-22的至少5倍增强。ATI000934、ATI001014、ATI001015、ATI001016、ATI001045及阳性对照抗p40单克隆抗体介导IL-23依赖性IL-17A及IL-22分泌中的剂量依赖性减少。计算每一Adnectin以及抗p40对照抑制IL-17A与IL-22二者分泌的IC50值且将这些数据概述于表9中。所有所测试Adnectin抑制IL-23依赖性IL-17A分泌的效价均为抗p40对照的2倍内且抑制IL-23依赖性IL-22产生的效价均为抗p40对照的2至3倍内。
表
9
:抗
IL-23
Adnectin
对
IL-23
依赖性细胞因子的抑制
通过人
T
细胞产生
IL-23
诱导的细胞因子
通过对来自正常健康供体的经EDTA处理的全血进行密度梯度分离来获得PBMC。自与绵羊红细胞(SRBC)形成玫瑰花环的PBMC的E+部分制备T细胞。在37℃下将T细胞以100,000个细胞/孔平铺于涂布有抗CD3 (OKT, 10 μg/ml)的96孔平底板中且保持1小时并用PBS洗涤。制备含有抗CD28
(9.3, 1 μg/ml)及IL-1β (10 ng/ml)或IL-1β+IL-23 (1 ng/ml)的RPMI-FCS培养基的混合物。已显示此细胞因子的组合可促进人T细胞分化为分泌IL-17的T细胞。将起始浓度为1
μg/ml的ATI001045添加至含有IL-1β+IL-23的混合物中。使用DUOSET®ELISA显影试剂盒(R&D Systems)检测上清液中的IL-17。仅使用IL-1β作为背景,ATI001045以2.0
nM±1.6 nM的EC50(n=4种不同供体)抑制IL-17产生。使用市售抗p40抗体(MAB1510)作为内部对照并以2.2±1.4
nM的EC50 (n=3)抑制IL-17产生。供体228的例示性数据示于图6中。
抗
IL-23 Adnectin
对
IL-23
与
IL-12
的选择性
使用表2中所列Adnectin以及ATI001016来检查对IL-23/IL-12的生物化学选择性。结合分析涉及在经固定抗His抗体上捕获抗IL-23
Adnectin,随后使IL-23或IL-12流过Adnectin。通过比较IL-12 (其浓度为IL-23的100倍)与IL-23的结合信号来评估Adnectin对IL-23的选择性。图7中的例示性数据显示,ATI001016对10 nM人IL-23展示稳健结合(约40
RU),而对于1 μM人IL-12无可检测结合。
NK-92细胞是已知通过分泌IFN-γ以IL-2依赖性方式对IL-12作出反应的人天然杀伤细胞系。通常对细胞进行洗涤以去除IL-2,随后将其接种至96孔板中,之后用25 pM重组人IL-12(或与拮抗剂预孵育的IL-12)处理并再孵育20小时。通过ELISA测定澄清上清液的IFN-γ。
制备表2中所列列举每一Adnectin克隆始于5
μM的4点式、5倍系列稀释液并将其与25
pM IL-12在37℃下一起孵育30分钟,之后添加至NK-92细胞中。将ATI001045及ATI001016始于5 μM的12点式、5倍系列稀释液与25
pM IL-12在37℃下一起孵育30分钟,之后添加至NK-92细胞中。表2中所列举克隆以及ATI001045或ATI001016在任一所测试浓度下均未以可检测程度抑制IFN-γ分泌,表明这些抗IL-23 Adnectin并不抑制IL-12与NK-92细胞表面上受体的相互作用。其似乎与阴性对照及100 nM抗p19多克隆抗体相当。作为阳性对照,抗p40单克隆抗体(mAb1510)以0.07 nM的IC50抑制IL-12诱导的IFN-γ分泌(图8)。
抗
IL-23 Adnectin
在药效学模型中阻断
IL-23
诱导的
IL-17
根据以下计划表经腹膜内(IP)对雌性C57Bl/6小鼠注射重组鼠IL-2及人IL-23。
表
10
:给药及注射计划表
| 时间 =-24 h | 时间 =0 h | 时间 =7 h | 时间 =23 h | |
| 鼠IL-2 | 5 μg | 5 μg | 10 μg | 5 μg |
| 人IL-23 | 0 | 10 μg | 10 μg | 10 μg |
在给予IL-2及IL-23的最后剂量后7-8小时、即时间=30 h时将所有小鼠安乐死。收集血清并通过ELISA测定IL-17及IL-23。
人IL-23结合至小鼠受体并诱导诸如IL-17及IL-22等细胞因子产生。来自经腹膜内(IP)给予IL-2及人IL-23的动物的脾细胞在离体培养中用抗小鼠CD3e刺激时分泌IL-17。在经受表10中所述处理方案的动物血清中可检测出显著水平的IL-17,其中用IL-2对C57Bl/6小鼠实施初免(prime),24小时后,在另外24小时时段内进行IL-2+IL-23的3次双注射。据推测,IL-2多克隆地原位活化并扩增Th群且上调IL-23受体表达。这提供在体内环境中研究药物作用机制及药物浓度与效应之间关系的方法。用抗p40单克隆抗体mAb1510验证该模型(数据未展示)。在8个单独实验中测试5种抗IL-23 Adnectin抑制产生鼠IL-17的能力,其中在8个单独实验中给予IL-2+IL-23的初始剂量前2小时以0.5、0.15、0.05及0.015 mg/kg经皮下给予。ATI001045的例示性剂量反应数据示于图9a中(所计算平均ED50为0.03 mg/kg)。所有所测试抗IL-23
Adnectin均显示对血清中人IL-23鼠IL-17的产生具有剂量依赖性抑制,但各Adnectin的抑制程度可变化。
抗
IL-23 Adnectin
在
IL-23
诱导的皮肤棘皮症模型中的活性
经皮内将IL-23注射至小鼠背部皮肤内或外耳耳廓内以诱导真皮感染及表皮增生(棘皮症)(Zheng, Y., “Interleukin-22, a TH17
cytokine, mediates IL-23-induced dermal inflammation and acanthosis”, Nature, 第445/8卷(2007年2月))。在这些研究中,将重组人IL-23
(rHuIL-23)注射至小鼠耳中以探索异常皮肤IL-23暴露的下游结果。
每隔一天向6至8周龄C57BL/6雌性小鼠的右耳中注射5 μg双链重组人IL-23直至第12天。将PBS注射至对侧耳中作为对照。在一项研究中,在第一次注射IL-23前约2小时开始用ATI001045进行处理,且每周持续3次直至第12天。以0.1、0.3、1、3 mg/kg的剂量经皮下给予ATI001045。在第二次研究中,在IL-23给予前约1小时以1、3或10
mg/kg经腹膜内给予溶媒或ATI000934-123 (1753E02)且之后每周给予3次直至第10天。在第0天及第4天以10 mg/kg经腹膜内给予抗HuIL-12/IL-23
p40抗体(R&D mAb1510)作为阳性对照。每隔一天使用MITUTOYO®(#2412F)游标卡尺测量耳厚度(一英寸的千分之一),之后进行下一次耳注射。通过自每只动物的IL-23注射耳的测量值减去对照耳的值计算耳厚度。在研究结束(ATI001045为第14天而ATI000934为第12天)时,在用CO2气体实施安乐死后,在发际线处切除耳并在H&E染色载玻片上对甲醛固定/石蜡包埋组织进行组织学检查。
总之,在此研究中,1、3及10
mg/kg剂量的ATI000934对IL-23诱导的耳增厚提供相似水平的抑制(图10)。自第5天直到第12天研究结束,包括抗p40组在内的所有处理组的耳厚度均显著(p<0.01 ANOVA/Dunnette's)小于溶媒。第12天,在最后一次剂量后48小时获得末端血浆样品并分析ATI000934的循环水平,其分别测定为11、18、36
μg/ml。
在第12天进行最后一次测量后,进行尸体剖检时收集10只动物/组的耳以供常规组织学检查。尽管给予ATI000934的大多数动物患有棘皮症及真皮浸润,但组织学严重程度评分低于在溶媒处理动物中所观察到的。无明显剂量反应。尽管给予抗p40的所有动物亦患有棘皮症及真皮浸润,但组织学严重程度评分亦低于在溶媒处理动物中所观察到的。
与溶媒(PBS)处理动物相比,自第5天直到第14天,ATI001045(1
mg/kg及3 mg/kg)剂量依赖性减小耳厚度(p<0.01,相对于溶媒ANOVA/Dunnett's,图10)。相比之下,在任一研究日,0.1 mg/kg剂量水平与溶媒处理均不具有统计差异性(p>0.05)。用0.3 mg/kg进行处理提供在第5天、第7天、第9天在统计学上小于溶媒的中间归约(intermediate reduction)。评价在最后一次剂量后48小时所收集血清样品的ATI001045的循环水平,其对于0.1、0.3、1、3 mg/kg的剂量,分别测定为0.698、2.72、8、22.5 μg/ml。组织学分析显示,给予ATI001045导致IL-23诱导的细胞浸润及棘皮症剂量依赖性减少,其与耳厚度评分相关。
实施例
5
:本文所用材料及方法
高通量蛋白质产生
(HTPP)
将所选结合剂克隆至pET9d载体中并转化至大肠杆菌BL21
DE3 plysS细胞中,将所述细胞以24孔形式接种于含有50 μg/mL卡那霉素的5 ml LB培养基中并在37℃下生长过夜。通过吸入200 μl过夜培养物并将其分配于合适孔中来制备5 ml新鲜LB培养基(50
μg/mL卡那霉素)培养物用于诱导表达。使培养物在37℃下生长直至A600为0.6-0.9。在用1
mM异丙基-β-硫代半乳糖苷(IPTG)诱导后,使培养物在30℃下表达6小时并通过在4℃下以2750 g离心10分钟来收获。
通过将细胞沉淀(呈24孔形式)再悬浮于450 μl裂解缓冲液(50
mM NaH2PO4,0.5 M NaCl,1x Complete蛋白酶抑制剂混合物(不含EDTA)(Roche),1 mM PMSF,10
mM CHAPS,40 mM咪唑,1 mg/ml溶菌酶,30
μg/ml DNA酶,2 μg/ml抑肽酶,pH 8.0)中来使其裂解并在室温下振荡1-3小时。将裂解物澄清且通过转移至装配有96孔1.2 ml捕捉板(catch
plate)的96孔Whatman GF/D UNIFILTER®中而重排(re-rack)为96孔形式并通过正压力过滤。将澄清裂解物转移至已用平衡缓冲液(50 mM NaH2PO4,0.5 M NaCl,40
mM咪唑,pH 8.0)平衡的96孔Ni-螯合板中并孵育5分钟。通过正压力去除未结合材料。用洗涤缓冲液1号(50
mM NaH2PO4,0.5 M NaCl,5 mM CHAPS,40
mM咪唑,pH 8.0)以2×0.3 ml/孔洗涤树脂,且通过正压力去除每一洗涤液。在洗脱前,用50 μl洗脱缓冲液(PBS+20
mM EDTA)洗涤各孔,将其孵育5分钟并通过正压力丢弃此次洗涤液。通过向各孔中施加额外的100 μl洗脱缓冲液来洗脱蛋白质。在室温下孵育30分钟后,以200 g将各板离心5分钟并将洗脱蛋白质收集于96孔捕捉板中,所述捕捉板含有在洗脱前添加于洗脱捕捉板底部的5 μl 0.5 M MgCl2。使用总蛋白质测定(BCA)利用SGE作为蛋白质标准品来定量洗脱蛋白质。
基于纤连蛋白的支架蛋白质不溶结合剂的中等规模表达及纯化
对于表达,将所选克隆及之后的HIS6标签克隆至pET9d载体中并在大肠杆菌BL21 DE3 plysS细胞中表达。使用20 ml接种培养物(自单一平铺菌落产生)接种1升含有50
μg/ml卡那霉素及34 μg/ml氯霉素(chloramphenicol)的LB培养基或TB-过夜表达培养基(自动诱导)。在37℃下孵育LB培养基中的培养物直至A600为0.6-1.0,此时用1
mM异丙基-β-硫代半乳糖苷(IPTG)对所述培养物实施诱导并在30℃下生长4小时。将TB-过夜表达培养基中生长的培养物在37℃下孵育5小时,此时使温度降至18℃并生长19小时。通过在4℃下以≥10,000
g离心30分钟来收获培养物。在-80℃下冷冻细胞沉淀。在冰上使用ULTRA-TURRAX®均质器(IKA works)将细胞沉淀再悬浮于25
ml裂解缓冲液(20 mM NaH2PO4,0.5 M NaCl,1x
Complete蛋白酶抑制剂混合物(不含EDTA)(Roche),pH 7.4)中。通过使用M-110S型MICROFLUIDIZER® (Microfluidics)进行高压均质化(≥18,000
psi)来实现细胞裂解。通过在4℃下以≥23,300 g离心30分钟来分离不溶部分。用20 mM磷酸钠/500 mM NaCl (pH 7.4)洗涤自对裂解物离心所回收的不溶沉淀。用超声处理将该沉淀再溶解于在20 mM磷酸钠/500 mM NaCl (pH 7.4)中的6.0 M盐酸胍中,随后在37度下孵育1-2小时。将再溶解沉淀过滤至0.45
μM并装载至用20 mM磷酸钠/500 mM NaCl/6.0 M胍(pH7.4)缓冲液平衡的HISTRAP®柱上。在装载后,用额外25 CV的相同缓冲液洗涤柱。用20 mM磷酸钠/500 mM NaCl/6.0 M胍-HCl (pH 7.4)中的50 mM咪唑洗脱结合蛋白。通过针对50 mM乙酸钠/150 mM NaCl (pH 4.5)或PBS (pH 7.2)进行透析使经纯化蛋白质再折叠。
基于纤连蛋白的支架蛋白质可溶结合剂的中等规模表达及纯化
作为不溶结合剂的纯化的替代,亦可使用可溶结合剂的纯化。对于表达,将所选克隆及之后的HIS6标签克隆至pET9d载体中并在大肠杆菌BL21 DE3 plysS细胞中表达。使用20 ml接种培养物(自单一平铺菌落产生)接种1升含有50
μg/ml卡那霉素及34 μg/ml氯霉素的LB培养基或TB-过夜表达培养基(自动诱导)。在37℃下孵育LB培养基中的培养物直至A600为0.6-1.0,此时用1
mM异丙基-β-硫代半乳糖苷(IPTG)对所述培养物实施诱导并在30℃下生长4小时。将TB-过夜表达培养基中生长的培养物在37℃下孵育5小时,此时使温度降至18℃并生长19小时。通过在4℃下以≥10,000
g离心30分钟来收获培养物。在-80℃下冷冻细胞沉淀。在冰上使用ULTRA-TURRAX®均质器(IKA works)将细胞沉淀再悬浮于25
ml裂解缓冲液(20 mM NaH2PO4,0.5 M NaCl,1x
Complete蛋白酶抑制剂混合物(不含EDTA)(Roche),pH 7.4)中。通过使用M-110S型MICROFLUIDIZER® (Microfluidics)进行高压均质化(≥18,000
psi)来实现细胞裂解。通过在4℃下以≥23,300 g离心30分钟来分离可溶部分。经由0.45 μM滤器使上清液澄清。将澄清裂解物装载至用20 mM磷酸钠/500 mM NaCl (pH 7.4)预平衡的HISTRAP®柱(GE)上。然后用25柱体积的相同缓冲液、之后20柱体积的20 mM磷酸钠/500
mM NaCl/ 25 mM咪唑(pH 7.4)及随后35柱体积的20
mM磷酸钠/500 mM NaCl/ 40 mM咪唑(pH 7.4)洗涤柱。用15柱体积的20 mM磷酸钠/500
mM NaCl/ 500mM咪唑(pH 7.4)洗脱蛋白质,根据A280下的吸光度合并各部分并针对1x PBS, 50 mM Tris, 150 mM
NaCl (pH 8.5)或50 mM NaOAc, 150 mM NaCl (pH
4.5)进行透析。通过以0.22 μM过滤去除任何沉淀。
基于纤连蛋白的支架蛋白质(Adnectin)可用各种尺寸及类型的PEG进行聚乙二醇化。为允许聚乙二醇化,可通过使氨基酸(通常为丝氨酸)单点突变为半胱氨酸对天然存在的残基EIDKPSQ(存在于10FN3蛋白质的C末端处)进行修饰。在单一半胱氨酸残基处对蛋白质进行聚乙二醇化通过以下来实现:使各种马来酰亚胺衍生的PEG形式缀合,将PEG试剂与蛋白质溶液混合并孵育。备选方法为用GSGC接头替换EIDKPSQ尾巴且同样使用半胱氨酸残基进行聚乙二醇化。经由半胱氨酸上的硫醇基与PEG试剂的马来酰亚胺官能团间的迈克尔加成化学反应(Michael-addition chemistry)使含有经工程改造半胱氨酸残基的Adnectin与PEG缀合。简言之,在微酸性至中性条件下以摩尔过量将40 kDa PEG添加至蛋白质溶液中。使反应在在室温下进行2小时至过夜。随后将反应物施加至离子交换柱中以将聚乙二醇化Adnectin与未反应PEG-马来酰亚胺及非聚乙二醇化Adnectin分离。亦可使用SE/HPLC方法。经纯化聚乙二醇Adnectin通常通过SDS-PAGE及尺寸排阻色谱来分析。
实施例
6
候选的结合血清白蛋白的
Adnectin
(SABA)
的筛选及选择
对DNA文库应用称为PROfusion的选择技术(例如,参见Roberts等人,
Proc Natl Acad Sci U S A. 94(23):12297-302, 1997及WO
2008/066752),且将可变区设计为10Fn3的BC、DE及FG环。根据该设计,创建具有大于1013个分子的随机文库,并对HSA的生物素化形式施加选择压力以分离具有期望结合性质的候选的结合血清白蛋白的Adnectin (SABA)。
高通量蛋白质产生
(HTTP)
方法
使用高通量蛋白质产生方法(HTPP)纯化各种结合HSA的Adnectin。将所选结合剂克隆至含有HIS6标签的pET9d载体并转化至大肠杆菌BL21(DE3)pLysS细胞中。将经转化细胞以24孔形式接种于含有50 µg/mL卡那霉素的5 ml LB培养基中并在37℃下生长过夜。通过吸入200 μl过夜培养物并将其分配于合适孔中来制备5 ml新鲜LB培养基(50
μg/mL卡那霉素)培养物用于诱导表达。使培养物在37℃下生长直至A600为0.6-0.9。在用1
mM异丙基-β-硫代半乳糖苷(IPTG)诱导后,使培养物在30℃下再生长4小时并通过在4℃下以3220×g离心10分钟来收获。在80℃下冷冻细胞沉淀。
通过将细胞沉淀(呈24孔形式)再悬浮于450 μl裂解缓冲液(50
mM NaH2PO4,0.5 M NaCl,1x Complete蛋白酶抑制剂混合物(不含EDTA)(Roche),1 mM PMSF,10
mM CHAPS,40 mM咪唑,1 mg/ml溶菌酶,30
μg/ml DNA酶,2 μg/ml抑肽酶,pH 8.0)中来使其裂解并在室温下振荡1小时。将裂解物澄清并通过转移至装配有96孔650 μl捕捉板的96孔Whatman GF/D UNIFILTER®中而重排为96孔形式并以200×g离心5分钟。将澄清裂解物转移至已用平衡缓冲液(50 mM NaH2PO4,0.5 M NaCl,10
mM CHAPS,40 mM咪唑,pH 8.0)平衡的96孔Ni-螯合板中并孵育5
min。去除未结合材料。用洗涤缓冲液1号(50 mM NaH2PO4,0.5 M NaCl,5
mM CHAPS,40 mM咪唑,pH 8.0)以2×0.3
ml/孔洗涤树脂。接下来,用PBS以3×0.3 ml/孔洗涤树脂。在洗脱前,用50
μl洗脱缓冲液(PBS+20 mM EDTA)洗涤各孔,将其孵育5 min并通过真空丢弃此次洗涤液。通过向各孔中再加入100 μl洗脱缓冲液来洗脱蛋白质。在室温下孵育30分钟后,以200×g将各板离心5分钟并将洗脱蛋白质收集于含有5 μl 0.5 M MgCl2的96孔捕捉板中,所述捕捉板附着于Ni-板底部。使用BCA蛋白质测定利用SGE(对照Adnectin)作为蛋白质标准品来定量洗脱蛋白质。SGE Adnectin为野生型10Fn3结构域(SEQ ID NO: 1),其中已用SGE替换整联蛋白结合结构域(第78-80位的氨基酸RGD)。
HSA
、
RhSA
及
MuSA
直接结合
ELISA
对于测定HSA的直接结合剂而言,在4℃下用PBS中的10 μg/mL HSA (Sigma, St. Louis, MO)涂布MaxiSorp板(Nunc
International, Rochester, NY)并过夜,随后在室温下在酪蛋白封闭缓冲液(Thermo Scientific, Rockford,
IL)中封闭1至3小时。对于单点筛选测定而言,将经纯化HTPP Adnectin以1:20稀释于酪蛋白封闭缓冲液中并在室温下使其结合至各孔中的HSA并保持1小时。对于剂量反应测定而言,使用0.1 nM至最多1 µM的范围的浓度。在PBST中实施洗涤以去除未结合Adnectin后,在室温下将以1:2500稀释于酪蛋白封闭缓冲液中的抗His mAb-HRP缀合物(R&D Systems, MN)添加至经结合带His-标签的Adnectin中并保持1小时。通过用PBST洗涤来去除过量缀合物并根据厂商说明书使用TMB检测试剂(BD Biosciences)检测结合的Adnectin。
候选的结合血清白蛋白的
Adnectin
(SABA)
的鉴别
作为针对HSA/RhSA/MuSA结合及生物物理学标准进行筛选的结果,鉴别并选择4种独特的结合血清白蛋白的Adnectin (SABA)以在小鼠中评价其半衰期。为了进行体外及体内表征,对4种SABA实施中等规模产生(midscale)。表3提供26个自PROfusion鉴别的独特SABA核心序列的序列(命名为SABA
1-26)。SABA4具有在中等规模产生之前固定的支架突变。SABA4的支架完美形式为SABA5。在BC、DE及FG环中,SABA4及SABA5具有相同序列。
实施例
7
候选
SABA
的产生及配制
SABA
的中等规模蛋白质产生
将所选SABA及之后His6标签克隆至pET 9d载体中并在大肠杆菌BL21(DE3)pLysS细胞中表达(关于每一带His-标签的SABA序列(命名为SABA1.1、SABA2.1、SABA3.1及SABA5.1),参见表3)。使用20
ml接种培养物(自单一平铺菌落产生)来接种1升含有50
µg/mL卡那霉素的LB培养基。使培养物在37℃下生长直至A600为0.6-1.0。在用1
mM异丙基-β-硫代半乳糖苷(IPTG)诱导后,使培养物在30℃下再生长4小时并通过在4℃下以≥10,000×g离心30分钟来收获。在80℃下冷冻细胞沉淀。在冰上使用ULTRA-TURRAX®均质器(IKA works)将细胞沉淀再悬浮于25
mL裂解缓冲液(20 mM NaH2PO4,0.5 M NaCl,1x
Complete蛋白酶抑制剂混合物(不含EDTA)(Roche),pH 7.4)中。通过使用M-110S型MICROFLUIDIZER® (Microfluidics)进行高压均质化(≥18,000
psi)来实现细胞裂解。通过在4℃下以23,300×g离心30分钟来分离可溶部分。经由0.45
μM滤器使上清液澄清。将澄清裂解物装载至用20 mM NaH2PO4,
0.5 M NaCl (pH 7.4)预平衡的HISTRAP®柱(GE)上。然后用25柱体积的20 mM NaH2PO4, 0.5
M NaCl (pH 7.4)、之后20柱体积的20 mM NaH2PO4, 0.5 M
NaCl, 25 mM咪唑(pH 7.4)及随后35柱体积的20
mM NaH2PO4, 0.5 M NaCl, 40 mM咪唑(pH 7.4)洗涤柱。用15柱体积的20 mM NaH2PO4, 0.5
M NaCl, 500 mM咪唑(pH 7.4)洗脱蛋白质,根据A280下的吸光度合并各部分并针对1x PBS, 50 mM Tris, 150 mM
NaCl (pH 8.5)或50 mM NaOAc, 150 mM NaCl(pH
4.5)进行透析。通过以0.22 μm过滤去除任何沉淀。
中等规模表达及纯化获得高纯度及活性的Adnectin,其以可溶形式表达且自细菌胞质溶胶的可溶部分纯化。在移动相(100 mM NaPO4, 100
mM NaSO4, 150 mM NaCl, pH 6.8)中对SUPERDEX®
200或SUPERDEX® 75 10/30GL (GE
Healthcare)进行SEC分析,显示主要为单体Adnectin。
SABA1.2
的制剂
选择一种特定SABA(SABA1.2
(SEQ ID NO: 180))进行初步制剂筛选。SABA1.2包含10Fn3的“核心1”序列上的(ED)5延伸。对于SABA1.2,鉴定了10
mM琥珀酸、8%山梨醇、5%甘氨酸(pH
6.0)且产物浓度为5 mg/mL的稳定制剂。在此制剂中,蛋白质熔解温度为75℃,如通过差示扫描量热法(DSC)使用1.25 mg/mL的蛋白质浓度所测定的。该制剂提供在4℃及25℃下令人满意的物理及化学稳定性,且初始聚集水平为1.2%。在稳定一个月后,聚集水平极低(在4℃下为1.6%且在25℃下为3.8%)。在5次自-80℃及-20℃转变为环境温度的冻-融循环后,此制剂中的蛋白质亦稳定。另外,在此制剂中,在4℃及环境温度下,SABA1.2可在至少20 mg/mL蛋白质浓度下溶解,而无沉淀或聚集增加。
实施例
8
候选
SABA
的生物物理学表征
尺寸排阻色谱
对得自中等规模方法的候选SABA实施标准尺寸排阻色谱(SEC)。在Agilent 1100或1200 HPLC系统上使用SUPERDEX® 200
10/30或SUPERDEX® 75 10/30柱(GE
Healthcare)对中等规模产生的材料实施SEC,其中在A214 nm及A280 nm下进行UV检测且进行荧光检测(激发=280 nm,发射=350
nm)。采用在SEC柱的合适流速下的100 mM硫酸钠, 100 mM磷酸钠,
150 mM氯化钠的缓冲液(pH 6.8)。使用凝胶过滤标准品(Bio-Rad Laboratories,
Hercules, CA)进行分子量校正。
对中等规模产生的纯化SABA进行SEC的结果显示主要为单体Adnectin且洗出液相对于所示球状凝胶过滤标准品(BioRad)在约10 kDa范围内。
热稳定性
对中等规模产生的SABA实施差示扫描量热法(DSC)分析以确定其相应Tm。在N-DSC II热量计(Calorimetry
Sciences Corp)中通过在3个大气压力下使温度以1度/分钟的速率自5℃斜升(ramp)至95℃来扫描1 mg/ml溶液。相对于以合适缓冲液运行的对照,使用最佳拟合利用Orgin软件(OrginLab公司)分析数据。SEC及DSC分析结果概述于表11中。
表11.对候选SABA进行SEC及DSC分析的概述
实施例
9
结合至血清白蛋白的候选
SABA1
的表征
自HTPP和/或中等规模产生的材料纯化的所选SABA克隆的动力学通过在Biasensor CM5芯片表面上捕获相应血清白蛋白(HSA/RhSA/MuSA)并使一系列浓度的SABA流过参照流动池与所捕获白蛋白二者来确定。另外,结合至白蛋白在pH 5.5至pH 7.4的范围内的各种pH条件下实施。结合HSA的Adnectin SABA2.1、SABA3.1、SABA4.1
(SABA5.1)及SABA1.1与RhSA交叉反应,但不与MuSA交叉反应。SABA2及SABA4结合具有pH敏感性,而克隆SABA3显示与HSA的结合具有低至pH
6.0的pH抗性。SABA1.1符合生物化学标准,其具有低至pH 5.5的pH抗性及亲和力/动力学。
通过Biacore来确定结构域图(domain mapping)。自HTPP和/或中等规模产生的材料纯化的所选SABA克隆通过在Biasensor CM5芯片表面上捕获HSA或构建体并使一系列浓度的SABA流过参照流动池与所捕获白蛋白二者来确定,所述构建体仅由HSA-结构域I和II或HSA-结构域III组成。克隆SABA2和SABA1结合至HSA及HSA-结构域I-II构建体,而非HSA-结构域III构建体。克隆SABA3和SABA4结合至HSA,而非HSA-结构域I-II或HSA-结构域III构建体。结果概述于表12中。
表12.候选SABA(SABA1.1、2.1、3.1及4.1)的结合亲和力及动力学。
实施例
10
候选
SABA
的体内
t1/2
的检查
测定HSA在小鼠中的半衰期以允许在小鼠中评价结合HSA的Adnectin,这是因为结合HSA的Adnectin不与MuSA交叉反应。以20 mg/kg(图11A)及50 mg/kg剂量(图11B)将HSA注射至约6周龄Ncr雌性裸鼠的尾静脉中,并通过ELISA测定注射后间期所取血样中HSA的浓度。以20 mg/kg及50
mg/kg注射至小鼠中的HSA的t1/2分别测定为约24小时及约20小时。
SABA1-4
在小鼠中的半衰期测定
制备结合HSA的克隆SABA1.1、SABA2.1、SABA3.1及SABA4.1的1升大肠杆菌生长物,将其纯化并去除内毒素。将各SABA变体注射至小鼠的尾静脉中,并通过ELISA测定在注射后间期所取血样中的浓度。
比较在约6周龄Ncr雌性裸鼠中存在或不存在HSA时各SABA的药代动力学概况。共注射HSA的小鼠具有与各SABA预混合的HSA(HSA以3至4摩尔过量),这是因为结合克隆对HSA及RhSA具有选择性且不结合小鼠血清白蛋白。SABA1.1在小鼠血浆中的半衰期为0.56小时,而共注射HSA的SABA1.1的半衰期为5.6小时,半衰期增加约10倍(图12A)。SABA2.1在小鼠血浆中的半衰期为0.24小时,而共注射HSA的SABA2.1的半衰期为2.8小时,半衰期增加约12倍(图12B)。SABA3.1在小鼠血浆中的半衰期为0.28小时,而共注射HSA的SABA3.1的半衰期为0.53小时,半衰期增加约2倍(图12C)。SABA4.1在小鼠血浆中的半衰期为0.66小时,而共注射HSA的SABA4的半衰期为4.6小时,半衰期增加约7倍(图12D)。本实施例的概述示于图13A中。
SABA1.1
及
SABA5.1
在食蟹猴中的半衰期测定
在食蟹猴中进行SABA1.1及SABA5.1的3周单剂量概念验证性研究以评估在2只食蟹猴中经静脉内给予1 mg/kg (mpk)剂量的药代动力学。使用基于定量ELISA的测定来评价药代动力学,研发该测定以检测血浆样品中的Adnectin。SABA1.1的半衰期在96-137小时的范围内。SABA5.1的半衰期为约12小时且在ELISA中仅可测量至最长120小时。图14 A及B概述这些克隆的数据并比较食蟹猴的数据。
实施例
11
结合至血清白蛋白的
SABA1
的表征
SABA1.1
及
1.2
结合至
HSA
及
RhSA
在中性pH及25℃下,SABA1.2、即包含(ED)5延伸的“核心1” 10Fn3 (SEQ ID NO: 190)结合至人血清白蛋白(HSA),其中平均缔合速率常数(ka)为8.21E+03 M-1s-1,且平均解离速率常数(kd)为4.43E-04 s-1,所计算平均Kd为55.3 nM(表13)。对于猕猴血清白蛋白(RhSA)而言,所测量平均缔合速率常数为6.6E+03 M-1s-1,且解离速率常数为3.78E-03 s-1,获得580 nM的所计算平均Kd。在最多1 µM下在SABA1.2与小鼠或大鼠血清白蛋白之间不能观测到可测量相互作用(表13及图15)。在37℃下,ka及kd增加介于2至5倍之间,导致对HSA的亲和力增加约2倍且对RhSA的亲和力为1/2(表13)。
表13.在HBS-P缓冲液中结合至白蛋白的SABA1.2的动力学参数。
另外,实施量热滴定以测定SABA1与HSA间的化学计量比。对于此研究而言,使用SABA1.1、即包含His6延伸的“核心1” 10Fn3 (SEQ ID NO: 189)。以8.1 μM的浓度将HSA(10
μl/注射115 μM蛋白质溶液)注射至含有SABA1.1的量热细胞中。在37℃下在PBS缓冲液(pH 7.4)中实施实验。图16显示SABA1.1以1:1化学计量比结合至HSA。
SABA1.2
在低
pH
下有效地结合至
HSA
白蛋白的长半衰期(例如,HSA的t1/2为19天)主要由于以下事实:其通过在存在于内体内的低pH条件下结合至新生儿Fc受体、FcRn而自胞吞途径再循环。如表14中所展示,在内体pH为5.5时,SABA1.2有效地结合HSA,表明SABA1一旦结合至HSA,则其t1/2亦将受益于FcRn再循环机制。
表14.在MES缓冲液中在pH
7.4及5.5下白蛋白结合动力学的比较。
SABA1.2
结合至
HSA
的结构域
I
及
II
,而非结构域
III
使用重组HSA片段将SABA1.2在白蛋白上的结合位点作图定位(map)至N-末端结构域I或II且SABA1.2对结构域III无可检测结合(图17)。由于结构域III为HSA中主要与FcRn相互作用的结构域,因此SABA1.2与FcRn竞争结合HSA的可能性较低,再次提高了全面影响再循环机制以延长半衰期的可能性。
实施例
12
SABA1.2
的体内药理学
在食蟹猴中进行SABA1.2的4周单一剂量毒理学前(pre-toxicology)研究以评估在两种不同剂量水平下的药代动力学及免疫原性。亦在3周单剂量毒理学前研究中评价药代动力学及免疫原性,该研究包括静脉内给药组(administration arm)与皮下给药组二者。另外,在两个单独单剂量毒理学前研究中,使用基于定量ELISA的测定评价SABA1.2在食蟹猴中的药代动力学,研发该测定以检测血浆样品中的SABA1.2。
经静脉内将SABA1.2以1 mpk及10
mpk给予猴。如图18及下文所述参数所显示,Cmx及AUC与剂量大致呈线性增加。使用WINNONLIN®软件实施无房室分析来评价药代动力学参数。SABA1.2在10 mpk下的清除率(CL)为0.15 ml/hr/kg,β期半衰期(t1/2)为143小时,分布体积(Vz)为30 mL/kg,且总药物暴露(AUCall)为5,609,457 hr*nmol/L (表15)。SABA1.2在1 mpk下的清除率(CL)为0.4 ml/hr/kg,半衰期(t1/2)为124小时,分布体积(Vz)为72 mL/kg,且总药物暴露(AUCall)为214,636 hr*nmol/L(表15)。
在经皮下或经静脉内给予SABA1.2后,β期药代动力学概况相似(图19)。使用WINNONLIN®软件实施无房室分析来评价药代动力学参数。SABA1.2在静脉内1 mpk下的清除率(CL)为0.22 ml/hr/kg,β期半衰期(t1/2)为125小时,分布体积(Vz)为40 mL/kg,且总药物暴露(AUCall)为357,993 hr*nmol/L(表15)。SABA1.2在皮下1 mpk下的清除率(CL)为0.32 ml/hr/kg,β期半衰期(t1/2)为134小时,分布体积(Vz)为62 mL/kg,且总药物暴露(AUCall)为251,339 hr*nmol/L(表15)。与静脉内相比,皮下相对生物利用度(F)为0.7。
表15. SABA1.2在猴中的药代动力学参数:
Claims (16)
1. 一种多肽,其包含纤连蛋白III型第10结构域(10Fn3),其中所述10Fn3具有至少一个选自环BC、DE及FG的环且所述环的氨基酸序列相对于人10Fn3结构域中相应环的序列经改变,且其中所述多肽以小于500 nM的KD结合IL-23的p19亚单位。
2. 一种多肽,其包含纤连蛋白III型第10结构域(10Fn3),其中所述10Fn3具有至少一个选自环BC、DE及FG的环且所述环的氨基酸序列相对于人10Fn3结构域中相应环的序列经改变,且其中所述多肽结合IL-23的p19亚单位的结构表位。
3. 权利要求1或2的多肽,其中所述BC环选自SEQ ID NO: 2-6。
4. 权利要求1或2的多肽,其中所述DE环选自SEQ ID NO: 7-48。
5. 权利要求1或2的多肽,其中所述FG环选自SEQ ID NO: 49-59。
6. 权利要求1或2的多肽,其中所述BC、DE或FG环氨基酸序列与SEQ ID NO: 2-59中的任一个具有至少80%同一性。
7. 权利要求1或2的多肽,其中所述多肽氨基酸序列与SEQ ID NO: 60-100中的任一个具有至少90%同一性。
8. 权利要求1或2的多肽,其中所述多肽氨基酸序列与SEQ ID NO: 60-100中的氨基酸3-96具有至少90%同一性。
9. 权利要求1或2的多肽,其中所述BC环序列基序为SEQ ID NO: 257中所示的GHYPX1HX2,其中X1为甲硫氨酸或亮氨酸,且X2为异亮氨酸或缬氨酸。
10. 权利要求1或2的多肽,其中所述FG环序列基序为SEQ ID NO: 258中所示的YYX3X3X3X3YX3X3I,其中X3可为任何氨基酸。
11. 权利要求1或2的多肽,其还包含一个或多个选自以下的药代动力学(PK)部分:聚乙二醇、唾液酸、Fc、Fc片段、转铁蛋白、血清白蛋白、血清白蛋白结合蛋白及血清免疫球蛋白结合蛋白。
12. 权利要求11的多肽,其中所述PK部分为聚乙二醇。
13. 权利要求1或2的多肽,其还包含半胱氨酸接头。
14. 权利要求13的多肽,其中所述半胱氨酸接头选自SEQ ID NO: 101中所示的氨基酸GSGC及SEQ ID NO: 102中所示的EIDKPCQ。
15. 一种药学上可接受的组合物,其包含权利要求1至14中任一项的多肽,其中所述组合物基本上不含内毒素。
16. 一种用于调节Th17细胞的致病性的方法,其包括使权利要求1至14的多肽以有效干扰内源性IL-23与Th17细胞反应的量与IL-23接触。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US30556610P | 2010-02-18 | 2010-02-18 | |
| US61/305566 | 2010-02-18 | ||
| US33070610P | 2010-05-03 | 2010-05-03 | |
| US61/330706 | 2010-05-03 | ||
| PCT/US2011/024959 WO2011103105A1 (en) | 2010-02-18 | 2011-02-16 | Fibronectin based scaffold domain proteins that bind il-23 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102762591A true CN102762591A (zh) | 2012-10-31 |
Family
ID=43901183
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800100540A Pending CN102762591A (zh) | 2010-02-18 | 2011-02-16 | 结合il-23的基于纤连蛋白的支架结构域蛋白质 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US8927693B2 (zh) |
| EP (1) | EP2536757B1 (zh) |
| JP (1) | JP2013520426A (zh) |
| KR (1) | KR20130010461A (zh) |
| CN (1) | CN102762591A (zh) |
| AR (1) | AR080229A1 (zh) |
| AU (1) | AU2011218243A1 (zh) |
| BR (1) | BR112012019881A2 (zh) |
| CA (1) | CA2790329A1 (zh) |
| CL (1) | CL2012002296A1 (zh) |
| EA (1) | EA201270713A1 (zh) |
| HK (1) | HK1179276A1 (zh) |
| MX (1) | MX2012009050A (zh) |
| PE (1) | PE20130041A1 (zh) |
| SG (1) | SG183215A1 (zh) |
| TN (1) | TN2012000372A1 (zh) |
| TW (1) | TWI508736B (zh) |
| WO (1) | WO2011103105A1 (zh) |
| ZA (1) | ZA201206969B (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110621302A (zh) * | 2017-05-03 | 2019-12-27 | 百时美施贵宝公司 | 结合肌生成抑制蛋白的纤连蛋白基支架结构域蛋白质的稳定制剂 |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1946417A (zh) | 2003-12-05 | 2007-04-11 | 阿德内克休斯治疗公司 | 2型血管内皮生长因子受体的抑制剂 |
| EP3156415A1 (en) | 2006-11-22 | 2017-04-19 | Bristol-Myers Squibb Company | Targeted therapeutics based on engineered proteins for tyrosine kinases receptors, including igf-ir |
| CN102007145A (zh) | 2008-02-14 | 2011-04-06 | 百时美施贵宝公司 | 基于结合egfr的工程化蛋白质的靶向治疗剂 |
| JP2011520961A (ja) | 2008-05-22 | 2011-07-21 | ブリストル−マイヤーズ スクイブ カンパニー | 多価フィブロネクチンをベースとする足場ドメインタンパク質 |
| TWI496582B (zh) | 2008-11-24 | 2015-08-21 | 必治妥美雅史谷比公司 | 雙重專一性之egfr/igfir結合分子 |
| JO3244B1 (ar) | 2009-10-26 | 2018-03-08 | Amgen Inc | بروتينات ربط مستضادات il – 23 البشرية |
| TW201138808A (en) * | 2010-05-03 | 2011-11-16 | Bristol Myers Squibb Co | Serum albumin binding molecules |
| CN103180339B (zh) | 2010-05-26 | 2016-04-27 | 百时美施贵宝公司 | 具有改善的稳定性的基于纤连蛋白的支架蛋白质 |
| EP3456740A1 (en) | 2010-11-04 | 2019-03-20 | Boehringer Ingelheim International GmbH | Anti-il-23 antibodies |
| CN103380143B (zh) * | 2010-12-22 | 2016-01-06 | 百时美施贵宝公司 | 结合il-23的基于纤连蛋白的支架结构域蛋白质 |
| PT2697257T (pt) | 2011-04-13 | 2016-12-28 | Bristol Myers Squibb Co | Proteínas de fusão fc compreendendo novos ligantes ou arranjos |
| EP2709669A1 (en) | 2011-05-17 | 2014-03-26 | Bristol-Myers Squibb Company | Methods for maintaining pegylation of polypeptides |
| ES2848531T3 (es) | 2011-05-17 | 2021-08-10 | Bristol Myers Squibb Co | Métodos mejorados para la selección de proteínas de unión |
| JP2015504038A (ja) | 2011-10-31 | 2015-02-05 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 低減した免疫原性を有するフィブロネクチン結合ドメイン |
| WO2013067322A1 (en) * | 2011-11-03 | 2013-05-10 | Stc Biologics, Inc. | Method for determination of pharmacological properties of recombinant proteins |
| US11078265B2 (en) | 2012-05-03 | 2021-08-03 | Boehringer Ingelheim International Gmbh | Anti-IL-23 antibodies |
| CN108409856B (zh) | 2012-09-13 | 2022-03-04 | 百时美施贵宝公司 | 结合至肌生成抑制素的基于纤连蛋白的支架结构域蛋白 |
| CZ2012829A3 (cs) | 2012-11-23 | 2014-06-11 | Biotechnologický Ústav Av Čr, V.V.I. | Polypeptidy pro léčbu autoimunitních chorob založenou na blokaci receptoru pro lidský cytokin IL-23 |
| US20150361159A1 (en) | 2013-02-01 | 2015-12-17 | Bristol-Myers Squibb Company | Fibronectin based scaffold proteins |
| EP3406629B1 (en) * | 2013-02-06 | 2020-06-24 | Bristol-Myers Squibb Company | Fibronectin type iii domain proteins with enhanced solubility |
| EP3299378B1 (en) | 2013-02-12 | 2019-07-31 | Bristol-Myers Squibb Company | High ph protein refolding methods |
| KR20150062352A (ko) * | 2013-11-29 | 2015-06-08 | 일진엘이디(주) | 유전체층을 가진 발광 다이오드 |
| KR20220162886A (ko) * | 2014-03-20 | 2022-12-08 | 브리스톨-마이어스 스큅 컴퍼니 | 혈청 알부민-결합 피브로넥틴 유형 iii 도메인 |
| JP2017524359A (ja) | 2014-07-24 | 2017-08-31 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | Il−23a関連疾患の処置に有用なバイオマーカー |
| EA039598B9 (ru) | 2014-09-03 | 2022-03-10 | Бёрингер Ингельхайм Интернациональ Гмбх | Соединение, нацеленное на ил-23а и фно-альфа, и его применение |
| JP6893504B2 (ja) | 2015-09-23 | 2021-06-23 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 速い解離速度を有する血清アルブミン結合フィブロネクチンタイプiiiドメイン |
| WO2017053619A1 (en) * | 2015-09-23 | 2017-03-30 | Bristrol-Myers Squibb Company | Glypican-3binding fibronectin based scafflold molecules |
| WO2017115828A1 (ja) * | 2015-12-29 | 2017-07-06 | 国立大学法人東京工業大学 | 標的結合ペプチドの安定化方法 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1651575A (zh) * | 2004-09-02 | 2005-08-10 | 中国人民解放军军事医学科学院放射医学研究所 | 抑制纤连蛋白表达的反义寡核苷酸的结构和用途 |
| WO2008103432A1 (en) * | 2007-02-23 | 2008-08-28 | Schering Corporation | Engineered anti-il-23p19 antibodies |
| WO2009083804A2 (en) * | 2007-12-27 | 2009-07-09 | Novartis Ag | Improved fibronectin-based binding molecules and their use |
| WO2009133208A1 (en) * | 2008-05-02 | 2009-11-05 | Novartis Ag | Improved fibronectin-based binding molecules and uses thereof |
Family Cites Families (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| USRE30985E (en) | 1978-01-01 | 1982-06-29 | Serum-free cell culture media | |
| US4560655A (en) | 1982-12-16 | 1985-12-24 | Immunex Corporation | Serum-free cell culture medium and process for making same |
| US4657866A (en) | 1982-12-21 | 1987-04-14 | Sudhir Kumar | Serum-free, synthetic, completely chemically defined tissue culture media |
| US4767704A (en) | 1983-10-07 | 1988-08-30 | Columbia University In The City Of New York | Protein-free culture medium |
| US5672502A (en) | 1985-06-28 | 1997-09-30 | Celltech Therapeutics Limited | Animal cell culture |
| US4927762A (en) | 1986-04-01 | 1990-05-22 | Cell Enterprises, Inc. | Cell culture medium with antioxidant |
| US6048728A (en) | 1988-09-23 | 2000-04-11 | Chiron Corporation | Cell culture medium for enhanced cell growth, culture longevity, and product expression |
| FR2646437B1 (fr) | 1989-04-28 | 1991-08-30 | Transgene Sa | Nouvelles sequences d'adn, leur application en tant que sequence codant pour un peptide signal pour la secretion de proteines matures par des levures recombinantes, cassettes d'expression, levures transformees et procede de preparation de proteines correspondant |
| US5122469A (en) | 1990-10-03 | 1992-06-16 | Genentech, Inc. | Method for culturing Chinese hamster ovary cells to improve production of recombinant proteins |
| PT752248E (pt) | 1992-11-13 | 2001-01-31 | Idec Pharma Corp | Aplicacao terapeutica de anticorpos quimericos e marcados radioactivamente contra antigenios de diferenciacao restrita de linfocitos b humanos para o tratamento do linfoma de celulas b |
| KR100566859B1 (ko) | 1997-01-21 | 2006-04-03 | 제너럴 하스피톨 코포레이션 | Rna-단백질 융합물을 이용한 단백질의 선별 |
| US6261804B1 (en) | 1997-01-21 | 2001-07-17 | The General Hospital Corporation | Selection of proteins using RNA-protein fusions |
| US7115396B2 (en) * | 1998-12-10 | 2006-10-03 | Compound Therapeutics, Inc. | Protein scaffolds for antibody mimics and other binding proteins |
| US6818418B1 (en) | 1998-12-10 | 2004-11-16 | Compound Therapeutics, Inc. | Protein scaffolds for antibody mimics and other binding proteins |
| US20050287153A1 (en) | 2002-06-28 | 2005-12-29 | Genentech, Inc. | Serum albumin binding peptides for tumor targeting |
| EP1268544A2 (en) | 2000-03-31 | 2003-01-02 | Institut Pasteur | Peptides blocking vascular endothelial growth factor (vegf)-mediated angiogenesis, polynucleotides encoding said peptides and methods of use thereof |
| ES2564161T3 (es) | 2000-07-11 | 2016-03-18 | Research Corporation Technologies, Inc | Polipéptidos de anticuerpos artificiales |
| AU2002213251B2 (en) * | 2000-10-16 | 2007-06-14 | Bristol-Myers Squibb Company | Protein scaffolds for antibody mimics and other binding proteins |
| US7696320B2 (en) | 2004-08-24 | 2010-04-13 | Domantis Limited | Ligands that have binding specificity for VEGF and/or EGFR and methods of use therefor |
| CN102584997A (zh) | 2002-11-08 | 2012-07-18 | 埃博灵克斯股份有限公司 | 针对肿瘤坏死因子-α的单结构域抗体及其用途 |
| CN1946417A (zh) | 2003-12-05 | 2007-04-11 | 阿德内克休斯治疗公司 | 2型血管内皮生长因子受体的抑制剂 |
| AU2005211725B2 (en) | 2004-02-09 | 2010-07-15 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| US20070269422A1 (en) | 2006-05-17 | 2007-11-22 | Ablynx N.V. | Serum albumin binding proteins with long half-lives |
| DE102006032337A1 (de) | 2006-07-12 | 2008-01-17 | BSH Bosch und Siemens Hausgeräte GmbH | Verfahren zur Steuerung eines Schleuderablaufes einer Waschmaschine und zur Durchführung des Verfahrens geeignete Waschmaschine |
| EP3156415A1 (en) | 2006-11-22 | 2017-04-19 | Bristol-Myers Squibb Company | Targeted therapeutics based on engineered proteins for tyrosine kinases receptors, including igf-ir |
| JP5337055B2 (ja) * | 2007-02-28 | 2013-11-06 | メルク・シャープ・アンド・ドーム・コーポレーション | 免疫性障害の処置のための組合せ治療 |
| CA2706419A1 (en) * | 2007-11-30 | 2009-06-04 | Glaxo Group Limited | Antigen-binding constructs binding il-13 |
| CN102007145A (zh) * | 2008-02-14 | 2011-04-06 | 百时美施贵宝公司 | 基于结合egfr的工程化蛋白质的靶向治疗剂 |
| TWI496582B (zh) | 2008-11-24 | 2015-08-21 | 必治妥美雅史谷比公司 | 雙重專一性之egfr/igfir結合分子 |
| KR20120057563A (ko) | 2009-03-31 | 2012-06-05 | 노파르티스 아게 | Il-12 수용체 베타l 서부유닛에 대해 특이적인 치료용 항체를 사용하는 조성물 및 방법 |
-
2011
- 2011-02-16 PE PE2012001260A patent/PE20130041A1/es not_active Application Discontinuation
- 2011-02-16 JP JP2012553974A patent/JP2013520426A/ja active Pending
- 2011-02-16 CN CN2011800100540A patent/CN102762591A/zh active Pending
- 2011-02-16 EP EP11708608.2A patent/EP2536757B1/en active Active
- 2011-02-16 SG SG2012058517A patent/SG183215A1/en unknown
- 2011-02-16 US US13/579,204 patent/US8927693B2/en active Active
- 2011-02-16 WO PCT/US2011/024959 patent/WO2011103105A1/en active Application Filing
- 2011-02-16 EA EA201270713A patent/EA201270713A1/ru unknown
- 2011-02-16 AU AU2011218243A patent/AU2011218243A1/en not_active Abandoned
- 2011-02-16 KR KR1020127024171A patent/KR20130010461A/ko not_active Application Discontinuation
- 2011-02-16 BR BR112012019881A patent/BR112012019881A2/pt not_active IP Right Cessation
- 2011-02-16 CA CA2790329A patent/CA2790329A1/en not_active Abandoned
- 2011-02-16 MX MX2012009050A patent/MX2012009050A/es active IP Right Grant
- 2011-02-18 AR ARP110100518A patent/AR080229A1/es unknown
- 2011-02-18 TW TW100105496A patent/TWI508736B/zh not_active IP Right Cessation
-
2012
- 2012-07-23 TN TNP2012000372A patent/TN2012000372A1/en unknown
- 2012-08-17 CL CL2012002296A patent/CL2012002296A1/es unknown
- 2012-09-17 ZA ZA2012/06969A patent/ZA201206969B/en unknown
-
2013
- 2013-06-10 HK HK13106833.3A patent/HK1179276A1/zh not_active IP Right Cessation
-
2014
- 2014-11-25 US US14/553,379 patent/US9714281B2/en active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1651575A (zh) * | 2004-09-02 | 2005-08-10 | 中国人民解放军军事医学科学院放射医学研究所 | 抑制纤连蛋白表达的反义寡核苷酸的结构和用途 |
| WO2008103432A1 (en) * | 2007-02-23 | 2008-08-28 | Schering Corporation | Engineered anti-il-23p19 antibodies |
| WO2009083804A2 (en) * | 2007-12-27 | 2009-07-09 | Novartis Ag | Improved fibronectin-based binding molecules and their use |
| WO2009133208A1 (en) * | 2008-05-02 | 2009-11-05 | Novartis Ag | Improved fibronectin-based binding molecules and uses thereof |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110621302A (zh) * | 2017-05-03 | 2019-12-27 | 百时美施贵宝公司 | 结合肌生成抑制蛋白的纤连蛋白基支架结构域蛋白质的稳定制剂 |
Also Published As
| Publication number | Publication date |
|---|---|
| CL2012002296A1 (es) | 2013-01-11 |
| HK1179276A1 (zh) | 2013-09-27 |
| CA2790329A1 (en) | 2011-08-25 |
| US20150274806A1 (en) | 2015-10-01 |
| PE20130041A1 (es) | 2013-01-28 |
| AU2011218243A1 (en) | 2012-10-04 |
| JP2013520426A (ja) | 2013-06-06 |
| BR112012019881A2 (pt) | 2017-06-27 |
| AR080229A1 (es) | 2012-03-21 |
| EP2536757A1 (en) | 2012-12-26 |
| ZA201206969B (en) | 2015-06-24 |
| US8927693B2 (en) | 2015-01-06 |
| TN2012000372A1 (en) | 2014-01-30 |
| US9714281B2 (en) | 2017-07-25 |
| TW201130501A (en) | 2011-09-16 |
| SG183215A1 (en) | 2012-09-27 |
| WO2011103105A1 (en) | 2011-08-25 |
| MX2012009050A (es) | 2012-09-07 |
| KR20130010461A (ko) | 2013-01-28 |
| EP2536757B1 (en) | 2015-03-25 |
| US20130012436A1 (en) | 2013-01-10 |
| EA201270713A1 (ru) | 2013-01-30 |
| TWI508736B (zh) | 2015-11-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102762591A (zh) | 结合il-23的基于纤连蛋白的支架结构域蛋白质 | |
| JP6941664B2 (ja) | 自己免疫疾患の処置のために調節性t細胞を選択的に活性化させる改変il−2変異体 | |
| CN103380143B (zh) | 结合il-23的基于纤连蛋白的支架结构域蛋白质 | |
| CN103068843B (zh) | 结合pcsk9的基于纤连蛋白的支架域蛋白质 | |
| JP2023055875A (ja) | Hiv融合体を標的とするポリペプチド | |
| WO2021043284A1 (zh) | 一种识别ssx2的高亲和力t细胞受体 | |
| JP2017508446A (ja) | 二機能性融合タンパク質及びその製造方法並びに使用 | |
| WO2022022696A1 (zh) | 一种识别afp的高亲和力tcr | |
| WO2021254458A1 (zh) | 一种识别hpv抗原的高亲和力t细胞受体 | |
| WO2021204287A1 (zh) | 一种识别hpv16的高亲和力tcr | |
| EP2706113B1 (en) | Synthetic peptide capable of inducing expression of type-2 tnf receptor and use thereof | |
| WO2022206860A1 (zh) | 针对afp的t细胞受体 | |
| WO2023005859A1 (zh) | 针对抗原ssx2的高亲和力t细胞受体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20121031 |