CN102215825A - 可直接压制的颗粒状的基于微晶纤维素的赋形剂、其制备方法及应用 - Google Patents
可直接压制的颗粒状的基于微晶纤维素的赋形剂、其制备方法及应用 Download PDFInfo
- Publication number
- CN102215825A CN102215825A CN2009801461591A CN200980146159A CN102215825A CN 102215825 A CN102215825 A CN 102215825A CN 2009801461591 A CN2009801461591 A CN 2009801461591A CN 200980146159 A CN200980146159 A CN 200980146159A CN 102215825 A CN102215825 A CN 102215825A
- Authority
- CN
- China
- Prior art keywords
- excipient
- microcrystalline cellulose
- binding agent
- slurry
- tablet
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/38—Cellulose; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2095—Tabletting processes; Dosage units made by direct compression of powders or specially processed granules, by eliminating solvents, by melt-extrusion, by injection molding, by 3D printing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Inorganic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Medicinal Preparation (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
Abstract
提供一种改进的赋形剂,其包含基本上均匀的可压性颗粒,是一种基于高功能性颗粒状微晶纤维素的赋形剂。该改进的赋形剂包含微晶纤维素和粘合剂以及任选的崩解剂,并且通过将组分的均匀的浆料进行喷雾而形成。与单独成分相比以及与由相同材料形成的传统赋形剂相比,该赋形剂具有增强的流动性/良好的流动特性、优异的/高的可压性以及增强的API负载和混合能力。该改进的赋形剂在成分间具有强的颗粒间结合桥,使得其具有包括显著的开口结构或空孔在内的独特结构形态。这些孔的存在提供了表面粗糙度,是促进与API混合的理想环境。
Description
背景技术
最常用于递送(diliver)药物的方式是片剂,其典型地通过压制适当配制的赋形剂粉末而获得。片剂应该避免缺陷,具有对抗机械冲击的强度,并且应具有化学和物理稳定性以随着时间的流逝和在保存过程中保持物理特性。化学或物理稳定性方面的不期望的改变会导致药物生物利用度方面不能接受的改变。另外,片剂必须以一种可预见且可重现的方式释放药物。本发明涉及一种用于制造药物固体剂型(例如片剂)的新型赋形剂。该新型赋形剂便于与至少一种药物(下面称为活性药物成分(API))混合,并通过直接压片制备法制成片剂。
为了顺利地形成片剂,压片混合物必须能自由地由进料斗流入压片模具中,并且适于压制。由于大多数API的流动性和可压性差,通常将API与不同比例的各种赋形剂混合以赋予所期望的流动性和可压性。典型地,通过下述方法获得可压性混合物:将API与赋形剂例如稀释剂/填充剂、粘合剂/胶粘剂、崩解剂、助流剂/流动促进剂、着色剂以及香料混合。可将这些材料简单混合,或通过常规方法进行湿法或干式制粒。通常在混合结束后,加入润滑赋形剂并将得到的材料压制成片剂。
不幸的是,关于赋形剂与特定API的相容性的一般规律很少。因此,当研制一种片剂制剂以满足特殊的、所期望的特征时,药学科学家们通常必须进行一系列大量的试验,这些实验设计用来确定哪种赋形剂与特定的API物理和化学相容。完成这项工作后,科学家推导出用于一种或多种试验组合物的适当成分。
两种制备片剂的常规方法是干燥混合后进行直接压片的方法以及制粒后进行直接压片的方法。在典型的直接压片过程中,将API与所期望的赋形剂(例如稀释剂/填充剂、粘合剂、崩解剂、助流剂以及着色剂)混合。一旦混合结束后加入润滑赋形剂并将所得材料压制成片剂。
直接压片法受限并且依赖于特定API特性,且进一步依赖于各种赋形剂的组合。因此,通常将赋形剂与API一起制粒来获得令人满意的片剂和/或加快制片速度。制粒的传统方法包括干式制粒、湿式制粒以及喷雾制粒。这些方法的每一种对于通过该方法制备的颗粒均有限制。
干式制粒方法由以下组成:将成分混合形成混合物,将混合物轧辊压制。该方法的限制在于:颗粒没有结实的保持在一起,容易散开。轧辊压制处理还会导致许多赋形剂的可压性降低。
湿式制粒为以下方法:其中在液体粘合剂存在下,赋形剂在混合器系统中粘合在一起,来制备湿颗粒混合物并进行干燥。喷雾制粒为以下方法:其中赋形剂在流化床中粘合在一起。这些方法是分批的方法,其限制了生产速度并且会导致产品间差异。
用这些传统的工艺来制备粉末流动性改进了的颗粒,由此制备物理特性改进了的片剂。但这些工艺耗费大量的时间并且可能与许多API不相容。
为了制备改进的赋形剂进行了多种尝试。Chu等的美国专利No.4,675,188公开了一种可直接压片的无水磷酸氢钙颗粒状赋形剂,其声称具有足以有效地进行直接压片的粒度。根据其公开的内容,磷酸氢钙被脱水,然后与粘合剂一起制粒。得到的最终产品声称为颗粒状无水磷酸氢钙,并且其特征在于至少90%的颗粒大于44微米。该颗粒产品声称对常用的沉淀无水磷酸氢钙进行了改进,常用的沉淀的无水磷酸氢钙是一种精细的、致密的粉末,其在进行直接压片前必须使其与粘合剂例如淀粉发生聚集(agglomerate)。该专利公开的方法由以下组成:用淀粉或其它粘合剂涂覆无水磷酸钙,据称使磷酸钙颗粒彼此粘结形成大的颗粒。但该颗粒产品并不是能普遍应用的赋形剂,因其缺乏其它的必需赋形剂,例如崩解剂,其对于压制后制备药学上可接受的片剂是必需的。
美国专利No.6,746,693公开了一种含有二氧化硅的聚集的微晶纤维素混合物,据说其具有改进的可压性。根据其记载,二氧化硅是提高可压性的关键性成分。该二步的工艺包括:喷雾制粒后进行湿式制粒,但并未提供一种完整的并能普遍应用的赋形剂。
EP 0192173B1公开了一种商业上可获得的赋形剂 由乳糖、交联聚乙烯吡咯烷酮(crospovidone)以及聚乙烯比咯烷酮(povidone)组成。已知由于乳糖固有的不同颗粒形状和形态,其流动性优于微晶纤维素。乳糖和聚乙烯比咯烷酮是水溶性成分,它们能够通过喷雾干燥与第三种非水溶性成分充分混合来制粒。其并没有公开完整并能普遍应用的包含两种以上不溶性成分的赋形剂,或能提高流动性、与各种API的可压性以及不同负载程度的特殊颗粒形态。
因此,药学工业上需要一种完整并且能普遍应用的、可直接压片的颗粒(granular)赋形剂,其除了填充剂以外还由粘合剂和崩解剂组成。所期望的赋形剂还与很宽范围的API具有相容性,具有能提供最佳流动性和可压性的颗粒(particle)形状、大小以及形态。该改进的赋形剂将简化压片并可在直接压片前要求将API和润滑剂一步混合。
药学工业上还需要一种完整并且能普遍应用的、可直接压片的高功能性颗粒赋形剂,其由填充剂和粘合剂组成,但不包含崩解剂。该赋形剂具有下述优势:既适用于干式制粒又适用于湿式制粒,而常规的赋形剂例如微晶纤维素在进行湿式制粒时会失去可压性。
发明内容
本发明一方面涉及一种组合物,其含有约75%~约98%的微晶纤维素、约1%~约10%的至少一种粘合剂以及约1%~约20%的至少一种崩解剂,其中,用SEM观察时所述微晶纤维素、粘合剂和崩解剂无法进行区分,从而形成基本上均匀且基本上为球形的颗粒。
本发明的另一方面涉及一种赋形剂,其含有约75%~约98%的微晶纤维素、约1%~约10%的至少一种粘合剂以及约1%~约20%的至少一种崩解剂,其中,所述赋形剂是通过喷雾含有微晶纤维素、粘合剂和崩解剂的水性浆料形成的。
本发明的另一方面涉及一种制备赋形剂的方法。该方法包括:将微晶纤维素浆料与崩解剂浆料混合,形成微晶纤维素/崩解剂浆料;在水中混合粘合剂,形成粘稠的粘合剂浆料;将粘合剂浆料与微晶纤维素/崩解剂浆料均匀化,形成均匀的浆料;以及将均匀的浆料喷雾干燥制粒,形成基本上均匀且基本上为球形的赋形剂颗粒。
本发明的另一方面涉及一种药物片剂,其含有至少一种活性药物成分和赋形剂。所述赋形剂包括基本上均匀且基本上为球形的颗粒,该颗粒包含微晶纤维素、至少一种粘合剂和至少一种崩解剂。
本发明的另一方面涉及一种制备药物片剂的方法。该方法包括:将至少一种活性药物成分和赋形剂混合并将得到的混合物压片,形成片剂。所述赋形剂包括基本上均匀且基本上为球形的颗粒,该颗粒包含微晶纤维素、至少一种粘合剂和至少一种崩解剂。
本发明的另一方面涉及一种组合物,其包含基本上均匀的颗粒,该颗粒包含约90%~约99%的微晶纤维素以及约1%~约10%的至少一种粘合剂。
本发明的另一方面涉及一种赋形剂,其包含约95%~约99%的微晶纤维素以及约1%~约5%的至少一种粘合剂,其中,所述赋形剂是通过将包含微晶纤维素和粘合剂的水性浆料喷雾干燥制粒而形成的。
本发明的另一方面涉及一种制备赋形剂的方法。该方法包括:将粘合剂在水中混合,形成粘稠的溶液,将微晶纤维素在所述粘稠的溶液中均匀化,形成浆料;以及将该浆料进行喷雾,形成基本上均匀的赋形剂颗粒。
本发明的另一替代方案涉及另一种制备赋形剂的方法。该方法包括:将羟丙基甲基纤维素溶解在水中,形成粘稠的溶液;将微晶纤维素在所述粘稠的溶液中混合并进行均匀化,形成浆料;以及将该浆料进行喷雾,形成基本上均匀的颗粒。
本发明的另一替代方案涉及一种药物片剂,其包含至少一种活性药物成分、崩解剂以及赋形剂。所述赋形剂包含基本上均匀的颗粒,该颗粒包含微晶纤维素和至少一种粘合剂。
本发明的另一替代方案涉及一种制备药物片剂的方法。该方法包括:将至少一种活性药物成分、崩解剂以及赋形剂混合并将得到的混合物进行压片,形成片剂。所述赋形剂包含基本上均匀的颗粒,该颗粒包含微晶纤维素和至少一种粘合剂。
附图说明
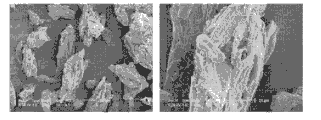
图1示出了本发明按照实施例1制备的改进的赋形剂的SEM显微照片。
图2示出了本发明按照实施例2制备的改进的赋形剂的SEM显微照片。
图3示出了微晶纤维素的SEM显微照片。
图6示出了按照实施例4通过传统的高剪切湿式制粒法制备的赋形剂的SEM显微照片。
图7将按照实施例4通过传统的高剪切湿式制粒制备的赋形剂与本发明按照实施例1、2和3制备的改进的赋形剂在流动性指数方面进行了比较。
图8示出了本发明按照实施例3制备的改进的赋形剂的多个样品的SEM显微照片。
图9示出了62.5%的布洛芬/实施例1的赋形剂/二氧化硅/硬脂酸镁的片剂的溶出曲线。
图10示出了压力(compression)对按照实施例21压制的片剂的片剂硬度和片剂崩解时间的影响。
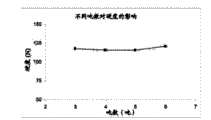
图11示出了不同吨数(tonnage)对按照实施例21压制的片剂的片剂硬度的影响。
图12示出了本发明按照实施例22制备的替代的改进赋形剂的多个样品的SEM显微照片。
图13示出了本发明按照实施例23制备的替代的改进赋形剂的多个样品的SEM显微照片。
图14示出了按照实施例24通过高剪切湿式制粒(HSWG)制备的MCC(98%)-HPMC(2%)的SEM显微照片。
发明详述
提供一种赋形剂,其包含基本上均匀且基本上为球形的颗粒,该赋形剂是一种高度可压制的颗粒状基于微晶纤维素的赋形剂,在此称做“改进的赋形剂”。如本文定义的,“基本上均匀的颗粒”是定义为一种组合物,其中用SEM对所述组合物中的各单独成分进行观察时无法将它们单独区分。与单独成分以及由相同材料形成的传统赋形剂相比,所述改进的赋形剂具有增强的流动性/良好的流动特性、优异的/高的可压性以及增强的API负载和混合能力。
所述改进的赋形剂在成分间具有强的颗粒内结合架桥(bonding bridge),使得其具有包括显著的开口结构或空心孔的独特结构形态。这些孔的存在提供了表面粗糙度,其是促进与API混合的理想环境。优异的混合能力是赋形剂的必需特征,因为其使得片剂能够制备成含有统一量的API。另外,上述改进的赋形剂包含用于制备药学上可接受的片剂所必需的赋形剂(除了任选的润滑剂之外)。
所述改进的赋形剂被设计成:具有使得该赋形剂可直接进行压片的粒度(particle size),所述赋形剂是完整的并且是用于制备药物片剂的普遍应用的赋形剂。认为该赋形剂是完整的,因其包含稀释剂、粘合剂和崩解剂,并且认为该赋形剂是普遍应用的,因其出人意料地与多种API具有相容性。仔细选择和优化所述改进的赋形剂的成分和物理特性以确保其可用于与广泛范围的API配制。
该赋形剂的普遍应用性避免了以往的配制开发中消耗的时间的需求,以往科学家研发多种赋形剂的定制混合物来优化用于特定API的流动性和可压性。令人意外地发现了所述公开的组合物和制备所述改进的赋形剂的方法,提供了一种基本上均匀的、具有高度增加的多孔性的结实(strong)球形颗粒,所述多孔性提供良好的流动性和可压性。典型地,该改进的赋形剂具有约0.1~0.4g/cc的松密度(aerated bulk density)。
用SEM观察时,发现未处理的微晶纤维素(MCC)具有像针一样的形状(如图3所示)。本发明公开的所述改进赋形剂的颗粒形态出乎意料的独特,为基本上均匀的球形结构,并且在颗粒上具有空穴或孔隙以及空孔部分,所述空穴或孔隙以及空孔能够改善API的负载能力。如图1和2所示,术语“基本上均匀的”是指结构中的各单独成分不能通过SEM扫描来明显地区分。这与传统的赋形剂例如(如图4所示)和(如图5所示)不同。这些按照传统方法制备的赋形剂无法形成改进赋形剂的基本上均匀的颗粒形态,而是由易于区分的聚集颗粒粘合而成。在以往和其它公开的方法中形成的颗粒(granular)被观察到是颗粒(particle)简单结合而成的不规则形状的颗粒,其通过单独颗粒的聚集产生。通常,这些聚集的颗粒在运输或粗处理过程中分成单独的成分。尽管该改进赋形剂的连续的球形颗粒包含空孔部分,但在处理和加工过程中非常结实并且不易碎。
在本发明中,将MCC与聚合粘合剂和交联的吸湿性聚合物一起加工,来制备具有高多孔性和强的颗粒内结合的球形颗粒。所述聚合粘合剂选自纤维素聚合物或有机合成聚合物,其在约80℃~120℃具有热稳定性,在约0.5%~约5%wt/vol的水溶液的动力学粘度为约2mPa~约50mPa,水溶性为约0.5%~约5%wt/vol并且约0.5%~约5%wt/vol的水溶液的表面张力为约40dynes/cm~约65dynes/cm。其中,优选的粘合剂包括羟丙基甲基纤维素、羟乙基纤维素、羟丙基纤维素、羧甲基纤维素钠以及聚乙烯基醇-聚乙二醇接枝共聚物(polyvinyl alcohol-polyethylene glycol graft copolymer)以及乙烯基吡咯烷酮-乙酸乙烯酯共聚物。目前,优选羟丙基甲基纤维素(HPMC)。优选交联的吸湿性聚合物崩解剂为交联聚乙烯吡咯烷酮(CPVD)。如图1和2所示,加工而成的颗粒为基本上均匀的组合物的球体,该球体具有多孔部分,这使得球体的至少一部分为空孔部分。所述颗粒是通过浆料混合物的实际的物理结合而制备的,所述浆料混合物在由喷嘴喷出时变成单独的颗粒。多孔性和空孔部分使得API负载和混合能力得到提高。
所述改进的赋形剂具有优异的流动性。一般而言,当颗粒的流动性差时,额外添加助流剂(例如二氧化硅)来改善其流动性。如果粉末的流动性不足,会导致片剂的生产率较差。用本领域公知的Carr法来表征所述改进的赋形剂颗粒,显示出流动性指数超过80,其中流动性指数高于70即表明具有良好的流动性。如实施例6所述,使用Hosokawa粉末测试仪测得实施例1的改进的赋形剂的流动性指数为82,所述Hosokawa粉末测试仪是通过一系列自动化测试利用Carr法来测定粉末特性的测试仪器。图7将按照实施例4通过传统方法制备的赋形剂与本发明的改进的赋形剂在流动性指数方面进行了比较。
如实施例5所述,按照本发明制备的材料的颗粒比按照传统高剪切湿式制粒法制备的类似材料的颗粒的强度高。
如实施例13和15所述,本发明的改进的赋形剂与低至约1%的API或高达约50%API直接混合时通过直接压片能够制备可接受的片剂。这说明本发明制备的材料能普遍应用和使用。通过在组合物中使用助流剂成分,还可实现高于约50%API的使用。
本发明公开的方法是一种新型喷雾干燥制粒法。该新方法由以下组成:在水存在下,将赋形剂的全部三种成分均匀化(homogenized),制成该成分的浆料。在一个非限制性的、用于说明的实施方式中,将MCC浆料与交联聚乙烯吡咯烷酮浆料混合,形成MCC/交联聚乙烯吡咯烷酮浆料。然后将羟丙基甲基纤维素与水混合,形成粘稠的羟丙基甲基纤维素浆料。随后将该羟丙基甲基纤维素浆料与MCC/交联聚乙烯吡咯烷酮浆料进行混合/均匀化,形成均匀的浆料。接着将该均匀化浆料进行喷雾干燥制粒,形成基本上均匀且基本上为球形的赋形剂颗粒。
进行均匀化工序,使两种不溶性成分(MCC和崩解剂)彼此接触并且与粘稠的粘合剂溶液(例如羟丙基甲基纤维素)紧密地粘结在一起。在高温(120℃或更高)下水的高速蒸发以及使所有成分保持在一起的HPMC的局部作用使得颗粒产生独特形状和形态。
相比之下,传统的喷雾干燥法使用一或两种可溶性成分的组合物。实施例4、图6示出了通过传统的湿式制粒法加工的本发明组合物的成分。如实施例1和3所述,由传统的高剪切湿式制粒法制备的由针状易碎颗粒组成的材料不如通过本发明的方法制备的产品一样好。可压性降低致使与按照实施例1制备的所述改进的赋形剂相比,由用传统方法制成的材料压制而成的对照片剂的硬度降低至1.8分之一,见实施例7。颗粒形态通过以下构成:不规则颗粒通过简单的颗粒间架桥(bridges)结合在一起,如图6所示。
所述改进的赋形剂的成分用改进的湿式均匀化/喷雾干燥制粒法进行处理。在该方法中,浆料由两种水不溶性成分(典型地,两种水不溶性成分的组成明显不同)和第三种水溶性成分形成。将得到的浆料制粒成所期望的粒度,典型地大于约50μm,优选为约50μm~约250μm,更优选为约90μm~约150μm。
改进的赋形剂是通过下述方法形成的:将MCC与聚合粘合剂以及交联的吸湿性聚合物崩解剂一起处理或均匀化。在一个实施方式中,赋形剂由约75%~约98%的MCC、以及约1%~约10%粘合剂和约1%~约20%的崩解剂形成。在一个优选实施方式中,赋形剂由约80%~约90%的MCC、约2%~约8%的粘合剂和约3%~约12%的崩解剂形成。在一个更优选实施方式中,赋形剂由约85%~约93%的MCC、约2%~约5%的粘合剂和约10%的崩解剂形成。
已进一步确定,改变MCC和崩解剂与粘合剂的比例会影响最终赋形剂的密度。在一个实施例中,利用HPMC作为粘合剂,5.5%的HPMC制得松密度为0.2g/cc的赋形剂,见实施例2,而2%的HPMC制得松密度为0.3g/cc的赋形剂,见实施例1。松密度的增大意味着多孔性的降低。
所述改进的赋形剂的应用可将制剂开发简化为一系列混合步骤:将API与所述改进的赋形剂(其包含片剂制剂的必需成分、稀释剂、粘合剂和崩解剂)和任选的润滑剂混合。典型地,混合工艺后,通过直接压片(例如通过旋转压片机)压制高质量的片剂。
本文所述称为API的“活性成分”或“活性剂”,是指一或多种具有包括治疗、诊断或预防功效的药学活性的化合物。药物试剂可以以无定形状态、结晶状态或其混合物存在。活性成分可以以下述状态存在:被掩味、或被包肠溶衣或被控制释放。除了不与微晶纤维素相容的API以外,对用于本发明的活性药物成分(API)没有限制。
可用于本发明的适当的活性成分示例包括但并不限于:抗病毒剂,包括但并不限于阿昔洛韦、泛西洛韦;驱肠虫药,包括但并不限于丙硫咪唑;调血脂药,包括但并不限于阿托伐他汀钙、辛伐他汀;血管紧张素转换酶抑制剂包括但并不限于盐酸贝那普利、福辛普利钠;血管紧张素Ⅱ受体拮抗剂,包括但并不限于依贝沙坦、洛沙坦、缬沙坦;抗生素包括但并不限于盐酸强力霉素;抗菌剂包括但并不限于利奈唑胺、甲硝唑、氟哌酸;抗真菌药包括但并不限于特比萘芬;抗微生物剂包括但并不限于环丙沙星、头孢地尼、头孢克肟;抗抑郁药包括但并不限于盐酸丁氨苯丙酮、氟西汀;抗惊厥剂包括但并不限于卡马西平;抗组胺剂包括但并不限于氯雷他定;抗疟药包括但并不限于甲氟喹;抗精神病药包括但并不限于奥氮平;抗凝血剂包括但并不限于华法林;α-肾上腺素能阻断剂包括但并不限于卡维地洛、普萘洛尔;选择性H1-受体拮抗剂包括但并不限于盐酸西替立嗪、非索非那定;组胺H2-受体拮抗剂包括但并不限于西米替丁、法莫替丁、盐酸雷尼替丁、雷尼替丁;抗焦虑剂包括但并不限于地西泮、劳拉西泮;抗惊厥剂包括但并不限于双丙戊酸钠(divalproex sodium)、拉莫三嗪;类固醇II型5a-还原酶抑制剂包括但并不限于非那雄胺;乙酰胆碱酯酶抑制剂包括但并不限于加兰他敏;降血糖药包括但并不限于格列美脲、格列本脲;血管扩张剂包括但并不限于硝酸异山梨酯;钙通道阻滞剂包括但并不限于硝苯地平;胃酸分泌抑制剂包括但并不限于奥美拉唑;止痛剂/解热药包括但并不限于阿斯匹林、对乙酰氨基酚、布洛芬、甲氧萘丙酸钠、羟考酮;勃起机能障碍治疗药(erectile dysfunction)包括但并不限于昔多芬;利尿剂包括但并不限于氢氯噻嗪;维生素包括但并不限于维生素A、维生素B1、维生素B2、维生素B6、维生素B12、维生素C、维生素D、维生素E、维生素K或叶酸。
作为例子,实施例中列举出了含有API的片剂制剂的非限制性实例,具体而言,实施例10-14为对乙酰氨基酚;实施例16为布洛芬;实施例15为甲氧萘丙酸钠;以及实施例21为阿托伐他汀钙。
利用本发明的改进赋形剂制备的片剂还可含有本领域公知的添加剂和/或填充剂。这些添加的成分包括但并不限于赋形剂,例如稀释剂/填充剂、粘合剂/胶粘剂、崩解剂、助流剂/流动促进剂、着色剂以及矫味剂。实施例18示出了采用不同重量、冲和压花(embossing)的片剂制剂的实例;实施例19示出了包衣片剂;实施例20示出了包含填充剂的片剂。
因此,本发明公开的组合物和处理步骤生成改进的赋形剂,其具有新的最终颗粒形态和意想不到的改进的可压性。
在一个替代实施方式中,改进的赋形剂由MCC和粘合剂制成,不含崩解剂(以下称为“替代的改进赋形剂”)。意外地发现:与各级MCC相比,包含MCC和至少一种粘合剂并且按照本发明制成的替代的改进赋形剂具有更好的流动性、更高的可压性。而且,该替代的改进赋形剂通常具有约0.2~0.3g/cc的松密度,和具有一定的糙度的球状颗粒,该糙度使得与各级MCC相比其具有更好的API混合能力。该替代的改进赋形剂既适用于干式制粒又适用于湿式制粒。当采用湿式制粒时,该替代的改进赋形剂不丧失可压性,而各级MCC在进行湿式制粒时通常丧失可压性。
该替代的改进赋形剂是通过上述方法制备的,不添加崩解剂。在一个优选实施方式中,该替代的改进赋形剂包含约90%~约99%的MCC以及约1%~约10%粘合剂;在一个更优选实施方式中,该替代的改进赋形剂包含约95%~约99%MCC以及约1%~约5%粘合剂;在大多数优选的实施方式中,该替代的改进赋形剂包含约97%~约99%MCC以及约1%~约3%粘合剂。
实施例22和23示出了制备该替代的改进赋形剂的方法,分别使用98%MCC/2%HPMC和95%MCC/5HPMC,利用均匀化/喷雾干燥制粒法。实施例24、25和26示出了制备该替代的改进赋形剂的方法,分别使用98%MCC/2%HPMC、95%MCC/5HPMC以及90%MCC/10%HPMC,利用传统的湿式制粒法、高剪切湿式制粒。实施例27公开了在先制剂的制备,一种MCC和HPMC的粉末混合物。实施例28~39示出了替代的改进赋形剂与商业上可获得的MCC的对比试验。正如实施例所述,所述替代的改进赋形剂提供平均粒度100-150微米的均匀球形颗粒。与各级MCC相比,该替代的改进赋形剂具有更好的流动性,并且由于其颗粒的糙度,其具有与API更好的混合能力。该替代实施方式的赋形剂颗粒与通过HSWG制备的具有相似组成的颗粒相比,硬度更高并且在脆性试验中不发生破碎。与MCC相比,该替代实施方式的赋形剂在进行湿式制粒时不丧失可压性。
实施例1:制备本发明的微晶纤维素-2%羟丙基甲基纤维素-交联聚乙烯吡咯烷酮的赋形剂:
改进的赋形剂由85%微晶纤维素、2%羟丙基甲基纤维素以及13%交联聚乙烯吡咯烷酮组成。该赋形剂通过湿式均匀化/喷雾干燥制粒法制备。用于制备赋形剂的装置采用具有盘RPM(disc RPM)为12000-25000的并流盘型喷雾器装置,进料口温度为180-250℃。在混合室中用去离子水将粉末化的MCC转化成浓度为23.3%的浆料。用去离子水在单独的混合室中于60℃将其它成分、HPMC和交联聚乙烯吡咯烷酮也转换为浆料,浓度为5.9%。然后将该MCC浆料转移至装有HPMC/交联聚乙烯吡咯烷酮浆料的室中,并且在40-60℃均匀化1小时制成均一的混合物,均匀化过程中采用循环剪切泵(circulating shear pump)和搅拌器,使得固体悬浮在溶液中,从而形成均一的浆料。然后,在热风存在下,通过旋转喷嘴将浆料混合物进行喷雾干燥,发动机频率为33Hz,出口温度为106-109℃。这构成了制粒步骤。使用旋风分离器除去细粉并收集最终产品得到新型的改进赋形剂。实施例1的赋形剂的SEM显微照片如图1所示。如无特别说明,所有的SEM显微照片均用FEI XL30 ESEM(环境扫描电镜,environmental scanning electron microscope)记录,电压5kV,斑点大小(spot size)3,SE检测器。SEM分析前将样品与铱一起溅射(溅射时间40秒)。
使用粉末测试仪(Hosokawa Micron公司)Model PT-S测定颗粒材料可压性、松密度和振实密度(tapped bulk density)。在测定操作过程中,采用使用Hosokawa粉末测试软件的计算机来控制Hosokawa粉末测试仪,以确保简单使用和数据处理。使用50cc的杯来测定松密度和振实密度。用来测定振实密度的标准叩击次数为180,叩击行程为18mm。基于“粒度分布”测定所收集的数据来计算D50值。用空气喷射筛分装置(air Jet Sieving instrument (Hosokawa Micron System))来测定颗粒材料的粒度分布。采用一组4个筛(270目、200目、100目和60目)。每个筛的筛分时间为60秒,而真空压力(vacuum pressure)保持在10-12in.H2O。样本量为5g。
使用Mettler Toledo Infrared Dryer LP16来测定“干燥失重”(LOD)值。设定温度为120℃,达到恒重后停止分析。
表1
| 粉末特征 | 值 |
| 1.可压性 | 16.1% |
| 2.D50 | 113um |
| 3.松密度 | 0.29g/cc |
| 4.振实密度 | 0.35g/cc |
| 5.LOD | 3.0% |
实施例2:制备本发明的微晶纤维素-5.5%羟丙基甲基纤维素-交联聚乙烯吡咯烷酮赋形剂:
赋形剂由85.5%微晶纤维素、5.5%羟丙基甲基纤维素以及9%交联聚乙烯吡咯烷酮组成。该赋形剂通过湿式均匀化/喷雾干燥制粒法制备。用于制备赋形剂的装置采用具有盘的RPM为12000-25000的并流盘型喷雾器装置,进料口温度为180-250℃。制粒后使用旋风分离器除去细粉。使用去离子水在混合室中将粉末化的MCC转化为浆料,使其浓度为25.1%。其它成分HPMC和交联聚乙烯吡咯烷酮首先被干式混合,然后也用去离子水在单独的混合室中将其转化为浆料,使其浓度为11.4%。随后将MCC浆料转移至装有HPMC/交联聚乙烯吡咯烷酮浆料的室中,并且在40-60℃均匀化1小时制成均一的混合物,均匀化过程使用循环剪切泵和搅拌器,使得固体悬浮在溶液中,从而形成均一的浆料。然后,在热风存在下,通过旋转喷嘴将浆料混合物进行喷雾干燥,发动机频率为40.1Hz,出口温度为106-109℃。这组成了制粒步骤。使用旋风分离器(cyclone)除去细粉并收集最终产品,见图2。
像实施例1那样测定粉末特征。
表2
实施例3
赋形剂由89%微晶纤维素、2%羟丙基甲基纤维素以及9%交联聚乙烯吡咯烷酮组成。该赋形剂通过湿式均匀化/喷雾干燥制粒法制备。用于制备赋形剂的装置采用具有盘的RPM为12000-25000的并流盘型喷雾器装置,进料口温度为180-250℃。制粒后使用旋风分离器除去细粉。关于颗粒赋形剂的制备,首先使用去离子水在混合室中将粉末化的MCC(其由棒状颗粒组成)转化为浆料,使其浓度为23.3%。在一个单独的容器中,将交联聚乙烯吡咯烷酮(corspovidone)加入去离子水中,形成12.4%的浆料。在另一个容器中,将HPMC加入去离子水中,形成7.3%的浆料。将三分之一的MCCc浆料转移至混合罐中,并在连续搅拌下加入所述交联聚乙烯吡咯烷酮浆料的2/5。重复该步骤直到所有的MCC和CPVD浆料都混合在一起。将MCC/CPVD浆料均匀化75分钟。向MCC/CPVD浆料中加入HPMC浆料并将得到的最终混合物均匀化75分钟。在整个混合过程中,使用循环剪切泵和搅拌器来进行均匀化。然后,在热风存在下,通过旋转喷嘴将所得浆料混合物进行喷雾干燥,发动机频率为32.5Hz,出口温度为106-109℃。这构成了制粒步骤。使用旋风分离器除去细粉并收集最终产品。从几个取样得到的产品均匀性如图8所示。
像实施例1那样测定粉末特征。
表3
实施例4:微晶纤维素(89%)-HPMC(2%)-交联聚乙烯吡咯烷酮(9%)的高剪切湿式制粒:
将133.5g微晶纤维素、3.0g羟丙基甲基纤维素和13.5g交联聚乙烯吡咯烷酮置于1L的不锈钢钵中。该不锈钢钵装在GMX.01矢量微高剪切混合机/制粒机(Vector公司)上。以870rpm的叶轮转速和1000rpm的切割速度(chopper speed)将干混合物混合2分钟。使用蠕动泵以16rpm的剂量率(doserate)将70g去离子水(“液体粘合剂”)一滴一滴地加入干混合物中。在添加液体粘合剂的过程中,叶轮转速为700rpm,切割速度为1500rpm。润湿聚集时间(wet massing time)为60秒,在添加液体的过程中,保持相同的叶轮转速和切割速度。制粒后,将湿的颗粒材料放在托盘上于60℃进行干燥。将所得颗粒材料(水分含量2.4%)过30目的筛。通过30目筛的颗粒材料的产量为116.7g(79.3%,参照干燥的原材料和干燥的产品)。见图6。
实施例5:实施例1的赋形剂和按照实施例4通过高剪切湿式制粒得到的材料的颗粒脆性试验:
将75-100g颗粒材料装在4L V-混合器中并振荡2h。收集该颗粒材料并对其进行分析。使用空气喷射筛分装置(Hosokawa Micron System)测定振荡前后颗粒材料的粒度分布。采用一组4个筛(270目、200目、100目和60目)。每个筛的筛分时间为60秒,而真空压力(vacuum pressure)保持在12-14in.H2O。样本量为5g。
表4
实施例6.对实施例1和3的赋形剂以及按照实施例4通过高剪切湿式制粒得到的材料的粉末特征进行比较:
使用粉末测试仪(Hosokawa Micron公司)Model PT-S测定颗粒材料的粉末特征。根据R.L.Carr的证明的方法利用Hosokawa粉末测试仪测定干燥固体的流动性。在测定操作过程中,采用使用Hosokawa粉末测试软件的计算机来控制Hosokawa粉末测试仪,以确保简单使用和数据处理。使用50cc的杯来测定松密度和振实密度。用来测定振实密度的标准叩击次数为180,叩击行程(tapping stroke)为18mm。
表5
实施例7:对使用实施例1的赋形剂和按照实施例4通过高剪切湿式制粒得到的材料制备的对照片剂的硬度-压力特性的比较:
由相应的颗粒材料以不同压力用Carver手动压片机和13mm的模具压片得到大约0.5g的片剂。停留时间(dwell time)为5秒。未添加润滑剂。用Varian的VK200片剂硬度计(BenchsaverTM系列)来测定片剂的硬度。记录在下表中的值为三次测定的平均值。
表6
实施例8:对不同商业来源的微晶纤维素、含有微晶纤维素的商业的共处理的(commercial co-processed)赋形剂以及实施例1、2和3的赋形剂的豪斯纳比率和Carr’s可压性指数(%)的比较:
使用松密度和振实密度可以算出Carr’s可压性指数和豪斯纳比率。Carr’s可压性指数为20-21%或更低的值、和豪斯纳比率为低于1.25的值表明材料具有良好的流动性。
表7
Emcocel90、Avicel PH 102-微晶纤维素的商标
Prosolv 90-硅化的微晶纤维素
实施例9:基于MCC的颗粒赋形剂的对照片剂的崩解时间-硬度:
由相应的颗粒材料以3000lbs-f压力用Carver手动压片机和13mm的模具压片得到大约0.5g的片剂。停留时间为5秒。未添加润滑剂。通过DistekDisintegration System 3100用900mL去离子水在37℃下进行崩解试验。
表8
实施例10 5%对乙酰氨基酚与实施例1的赋形剂的混合物的粉末特征:
将7.9g对乙酰氨基酚与150g实施例1的赋形剂在4L V-混合器中混合1小时30分钟。使用与实施例6相同的方法测定粉末特征。基于与实施例5相似的“粒度分布”测定所收集的数据来计算D50值。
表9
实施例11:30%对乙酰氨基酚与实施例1赋形剂的混合物的粉末特征:
将64.9g对乙酰氨基酚与150g实施例1的赋形剂在4L V-混合器中混合1小时30分钟。使用与实施例6相同的方法测定粉末特征。基于与实施例5相似的“粒度分布”测定所收集的数据来计算D50值。
表10
| 粉末特征 | 值 |
| 1.可压性指数 | 32.9% |
| 2.D50 | 117um |
| 3.松密度 | 0.28g/cc |
| 4.振实密度 | 0.42g/cc |
实施例12.30%布洛芬与实施例1赋形剂的混合物的粉末特征。
将64.3g布洛芬与150g实施例1的赋形剂在4L V-混合器中混合1小时30分钟。使用与实施例6相同的方法测定粉末特征。基于与实施例5相似的“粒度分布”测定所收集的数据来计算D50值。
表11
| 粉末特征 | 值 |
| 1.可压性指数 | 27.6% |
| 2.D50 | 105um |
| 3.松密度 | 0.28g/cc |
| 4.振实密度 | 0.39g/cc |
实施例13.使用按照实施例10制得的粉末混合物制备5%的对乙酰氨基酚片剂:
由相应的颗粒材料以各种压力用Carver手动压片机和13mm的模具压片得到大约0.5g的片剂。停留时间为5秒。未添加润滑剂。用Varian的VK200片剂硬度计(BenchsaverTM系列)来测定片剂的硬度。记录在下表中的值为三次测定的平均值。通过Distek Disintegration System 3100用900mL去离子水在37℃下进行崩解试验。
表12
实施例14.使用按照实施例11制得的粉末混合物制备30%的对乙酰氨基酚片剂:
由相应的颗粒材料以各种压力用Carver手动压片机和13mm的模具压片得到大约0.5g的片剂。停留时间为5秒。未添加润滑剂。用Varian的VK200片剂硬度计(BenchsaverTM系列)来测定片剂的硬度。记录在下表中的值为三次测定的平均值。通过Distek Disintegration System 3100用900mL去离子水在37℃下进行崩解试验。
表13
实施例15.制备50%甲氧萘丙酸钠/实施例3:
将80g甲氧萘丙酸钠与80g实施例3的赋形剂以及800mg(0.5%)无定形二氧化硅(助流剂)在4L V-混合器中混合1小时30分钟。由相应的颗粒材料以各种压力用Carver手动压片机和13mm的模具压片得到大约0.5g的片剂。停留时间为5秒。未添加润滑剂。用Varian的VK200片剂硬度计(BenchsaverTM系列)来测定片剂的硬度。记录在下表中的值为三次测定的平均值。通过Distek Disintegration System 3100用900mL去离子水在37℃下进行崩解试验。
表14
由50%甲氧萘丙酸钠/实施例3的赋形剂制得的片剂的硬度-压力曲线
表15
由50%甲氧萘丙酸钠/实施例3的赋形剂制得的片剂的崩解时间
实施例16
62.5%布洛芬、按照实施例1制备的颗粒赋形剂、二氧化硅以及硬脂酸镁的混合物的压片性研究:
将布洛芬、按照实施例1制备的颗粒赋形剂和二氧化硅(见表16)在V-混合器中以20rpm混合15分钟。将该混合物过30目的筛并在V-混合器中以20rpm与硬脂酸镁混合2分钟。将得到的混合物转移至10冲的(station)旋转压片机(Mini Press II,Globe Pharma)。用10mm的模具和以10%功率(power)操作强制进给系统(force feeder)来压制片剂。表17列出了本研究中采用的压片参数。
表16
表17
实施例17
按照实施例16制备的布洛芬片剂的表征:
按照实施例16制备的布洛芬片剂的特征表现为:片剂重量(表18)、片剂厚度(表19)、片剂硬度(表20)、片剂脆性(表21)、片剂崩解(表22)以及布洛芬的溶出(图9)。
像实施例15那样测定片剂的硬度和崩解。片剂脆性试验用Varian Friabilator按照USP建议的压制的、未包衣片剂的脆性测定方法来进行(见USP<1216>章)。溶出试验按照USP的关于布洛芬片剂的记载来进行。
表18按照实施例16制备的布洛芬片剂的片剂重量(mg)
表19按照实施例16制备的布洛芬片剂的片剂厚度(mm)
表20按照实施例16制备的布洛芬片剂的片剂硬度(kp)
表21按照实施例16制备的布洛芬片剂的片剂脆性
表22按照实施例16制备的布洛芬片剂的片剂崩解时间(秒)
*4片的平均值
实施例18
采用不同片剂重量、冲和压花时按照实施例1的赋形剂与硬脂酸镁的混合物的压片性:
将按照实施例1的赋形剂过40目的筛并将硬脂酸镁过60目的筛,然后用圆筒混合器以20rpm的速度将它们彼此混合2分钟。按照表23制备了2批样品。将第I批的加入润滑剂的混合物再分为4部分,将加入润滑剂的第II批再分为2部分,用16冲的压片机进行压片。压片参数如表24所示。冲(punch)和压花差异的影响见表25。
表23
表24
表25
实施例19
对用实施例1的赋形剂制备的片剂进行包衣:
将由实施例1的赋形剂压制的345g片剂用62.5g 18%的橘色(Colorcon)水混悬液进行包衣。片剂包衣锅采用FREUND ModelHCT-30HI-COATER。将泵的速率设定为3.4g/分钟。进气口温度为80℃,出气口温度为34-36℃,锅的转速为20rpm,空气喷头压力为16psi。
所得包衣片剂无缺陷并且均匀包衣。
实施例20
由实施例1的赋形剂和填充剂组成的混合物的特性:
通过将成分在V-混合器中混合30分钟-1小时,以4∶1、2∶1和1∶1的比例(重量比)制备实施例1的赋形剂与填充剂的混合物。用于本研究的填充剂为:微晶纤维素、喷雾干燥的乳糖和磷酸氢钙。采用与实施例1相同的方法,通过该粒度分布、松密度和振实密度对所得混合物进行表征。在不添加润滑剂的条件下,使用Carver手动压片机和13mm的模具考察压片性。结果分别如表26、27和28所示。
表26实施例1的赋形剂-微晶纤维素混合物的表征
a本研究中使用的MCC为MCC 102RanQ,其具有下述特性:d10=37.4um;d50=94.6um;d90=192.6um;松密度=0.298g/cc;振实密度=0.403g/cc;可压性指数%=26.1。
表27实施例1的赋形剂-喷雾干燥的乳糖混合物的表征
a本研究使用的乳糖是喷雾干燥的Supertab-New Zeeland,其具有下述特性:d10=54.25um;d50=118.65um;d90=195.4um;松密度=0.616g/cc;振实密度=0.762g/cc;%可压性指数=19.2
表28实施例1的赋形剂-磷酸氢钙(DCP)的表征
a本研究使用的DCP是A-TAB(Rhodia),其具有下述特性:d10=60.7um;d50=188.0um;d90=389.0um;松密度=0.753g/cc;振实密度=0.861g/cc;%可压性指数=12.5。
实施例21
使用实施例1的赋形剂的阿托伐他汀钙制剂的压片性研究:
使用16冲压片机制备阿托伐他汀钙(结晶形式)制剂(表29)的3000片的批量大小。压片参数如表30所示。研究了不同压力对片剂硬度和片剂崩解时间的影响(图10)。还研究了不同吨数对硬度的影响(图11)。
表29
表30
实施例22
制备本发明的微晶纤维素-2%羟丙基甲基纤维素赋形剂:
替代的改进赋形剂由98%微晶纤维素和2%羟丙基甲基纤维素组成。该赋形剂通过湿式均匀化/喷雾干燥制粒法制备。用于制备赋形剂的装置为具有盘RPM为12000-25000的盘型并流喷雾器装置,进料口温度为180-250℃。用去离子水将粉末化的MCC转化为浆料,使其浓度为23.58%w/w。在一个单独的浆料罐中,将HPMC与去离子水混合,搅拌并循环(circulated)60-70分钟,使浓度为16.11%w/w。将制备的HPMC浆料加入到MCC浆料中。用5L水冲洗HPMC浆料罐,并将冲洗液加入MCC/HPMC浆料中。对所得混合物进行搅拌、循环(circulated)并均匀化85分钟,制成浆料浓度为23.09%的均匀浆料,使用循环剪切泵和搅拌器保持固体处于悬浮状态。然后,在热风存在下,通过旋转喷嘴将浆料混合物进行喷雾干燥,发动机频率为35Hz,出口温度102-109℃。这构成了制粒步骤。使用旋风分离器除去细粉并收集最终产品,制成替代的改进赋形剂。实施例22的赋形剂的SEM显微照片如图12所示。如无特别说明,所有SEM显微照片均采用FEI XL30ESEM(环境扫描电子显微镜)进行记录,电压5kV,斑点大小3,SE检测器。SEM分析前将样品与铱一起溅射(溅射时间40秒)。
使用粉末测试仪(Hosokawa Micron公司)Model PT-S测定颗粒材料的可压性、松密度和振实密度(表31)。在测定操作过程中,采用使用Hosokawa粉末测试软件的计算机来控制Hosokawa粉末测试仪,以确保简单使用和数据处理。使用50cc的杯来测定松密度和振实密度。用来测定振实密度的标准叩击次数为180,叩击行程(the tapping stroke)为18mm。基于“粒度分布”测定所收集的数据来计算D50值。使用空气喷射筛分装置(Hosokawa Micron System)测定颗粒材料的粒度分布。采用一组4个筛(270目、200目、100目和60目)。每个筛的筛分时间为60秒,真空压力保持在10-12in.H2O。样本量为5g。
使用Mettler Toledo Infrared Dryer LP16来测定“干燥失重”(LOD)值。设定温度为120℃,达到恒重后停止分析。
表31
实施例23
制备本发明的微晶纤维素-5%羟丙基甲基纤维素赋形剂:
该替代的改进赋形剂的实施方式由95%微晶纤维素和5%羟丙基甲基纤维素组成。该赋形剂通过湿式均匀化/喷雾干燥制粒法制备。用于制备赋形剂的装置为具有盘RPM为12000-25000的盘型并流喷雾器装置,进料口温度为180-250℃。用去离子水将粉末化的MCC转化为浆料,使其浓度为23.0%w/w。在一个单独的浆料罐中,将HPMC与去离子水混合,搅拌并循环60-70分钟,使浓度为17.20%w/w。将制备的HPMC浆料加入MCC浆料中。用5L水冲洗HPMC浆料罐,并将冲洗液加入MCC浆料中。将得到的混合物与另外的去离子水一起进行搅拌、循环并均匀化60分钟,制成浓度为22.44%的均匀浆料,使用循环剪切泵和搅拌器保持固体处于悬浮状态。然后,在热风存在下,通过旋转喷嘴将浆料混合物进行喷雾干燥,发动机频率为35Hz,出口温度为104-110℃。这组成了制粒步骤。使用旋风分离器除去细粉并收集最终产品得到新型的改进赋形剂。实施例23的赋形剂的SEM显微照片如图13所示。
如实施例22所述测定粉末特征(表32)。
表32
实施例24
微晶纤维素(98%)-HPMC(2%)的高剪切湿式制粒:
将147g微晶纤维素和3.0g羟丙基甲基纤维素置于1L不锈钢钵中。该不锈钢钵装在GMX.01矢量微高剪切混合机/制粒机(Vector公司)上。以870rpm的叶轮转速和1000rpm的切割速度将干混合物混合2分钟。使用蠕动泵以16rpm的剂量率将70g去离子水(“液体粘合剂”)一滴一滴地加入干混合物中。在添加液体粘合剂的过程中,叶轮转速为700rpm,切割速度为1500rpm。润湿聚集时间(wet massing time)为60秒,在添加液体的过程中,保持相同的叶轮转速和切割速度。制粒后,将湿的颗粒材料放在托盘上于60℃进行干燥。将所得颗粒材料(水分含量2.00%)过30目的筛。通过30目筛的颗粒材料的产量为137.7g(94.1%,参照干的原料和干的产品)。
实施例24的颗粒材料的SEM显微照片见图14。
实施例25
微晶纤维素(95%)-HPMC(5%)的高剪切湿式制粒:
将142.5g微晶纤维素和7.5g羟丙基甲基纤维素置于1L不锈钢钵中。该不锈钢钵装在GMX.01矢量微高剪切混合机/制粒机(Vector公司)上。高剪切湿式制粒工艺如实施例24所述。将所得颗粒材料(水分含量2.95%)过30目的筛。通过30目筛的颗粒材料的产量为113.15g(76.5%,参照干的原料和干的产品)。
实施例26
微晶纤维素(90%)-HPMC(10%)的高剪切湿式制粒:
将135.0g微晶纤维素和15.0g羟丙基甲基纤维素置于1L不锈钢钵中。该不锈钢钵装在GMX.01矢量微高剪切混合机/制粒机(Vector公司)上。高剪切湿式制粒工艺如实施例24所述,区别在于:水(“液体粘合剂”)的添加量为66g。将所得颗粒材料(水分含量4.5%)过30目的筛。通过30目筛的颗粒材料的产量为79.95g(53.1%,参照干的原料和干的产品)。
实施例27
微晶纤维素和羟丙基甲基纤维素的粉末混合物:
将预先设定量(见表33)的微晶纤维素和羟丙基甲基纤维素在V-混合器中混合1小时。
表33
实施例28
将实施例22、23、27a、27b的赋形剂与2种商业品牌的微晶纤维素(Avicel 102和MCC 102-RanQ)的粉末特征进行比较:
使用粉末测试仪(Hosokawa Micron公司)ModelPT-S测定实施例22、23、27a、27b制备的材料和Avicel 102以及MCC102-RanQ的粉末特征(表34和35)。根据R.L.Carr的证明的方法利用Hosokawa粉末测试仪测定干燥固体的流动性。在测定操作过程中,采用使用Hosokawa粉末测试软件的计算机来控制Hosokawa粉末测试仪,以确保简单使用和数据处理。使用50cc的杯来测定松密度和振实密度。用来测定振实密度的标准叩击次数为180,叩击行程为18mm。
表34
按照实施22、23制备的材料和2种商业上可获得的微晶纤维素品牌(Avicel 102;MCC102-RanQ)的粉末特征
表35
按照实施例27a和27b制备的MCC-HPMC粉末混合物的粉末特征
实施例29
将不同商业来源的微晶纤维素以及实施例22和23的豪斯纳比率和Carr’s可压性指数(%)进行比较:
使用松密度和振实密度可以算出Carr’s可压性指数和豪斯纳比率(表36)。Carr’s可压性指数为20-21%或更低的值表明材料具有良好的流动性。
表36
实施例30
实施例23和实施例25的赋形剂的颗粒脆性试验:
对75-100g颗粒材料进行粒度分布分析,然后将其置于4L V-混合器中振荡2h。收集该颗粒材料并再次测定粒度分布(表37)。使用空气喷射筛分装置(Hosokawa Micron System)测定振荡前后颗粒材料的粒度分布。采用一组4个筛(270目、200目、100目和60目)。每个筛的筛分时间为60秒,而真空压力(vacuum pressure)保持在12-14in.H2O。样本量为5g。
表37
实施例31
将分别使用实施例22、实施例23、实施例24和实施例25的赋形剂制备的对照片剂的硬度-压力进行比较(表38):
由相应的赋形剂以不同压力用Carver手动压片机和13mm的模具(die)压片得到大约0.5g的片剂。停留时间为5秒。未添加润滑剂。用Varian的VK200片剂硬度计(BenchsaverTM系列)来测定片剂的硬度。记录在下表中的值为三次测定的平均值。
表38
实施例32
实施例23的赋形剂的高剪切湿式制粒:
将150g按照实施例23制备的赋形剂置于1L不锈钢钵中。该不锈钢钵装在GMX.01矢量微高剪切混合机/制粒机(Vector公司)上。高剪切湿式制粒工艺如实施例24所述。将所得颗粒材料(水分含量3%)过30目的筛。
实施例33
微晶纤维素的高剪切湿式制粒:
将150g微晶纤维素MCC102RanQ置于1L不锈钢钵中。该不锈钢钵装在GMX.01矢量微高剪切混合机/制粒机(Vector公司)上。高剪切湿式制粒工艺如实施例24所述。将所得颗粒材料(水分含量3%)过30目的筛。
实施例34
将分别按照实施例32和实施例33制备的颗粒材料的豪斯纳比率和Carr’s可压性指数(%)进行比较:
使用松密度和振实密度可算出Carr’s可压性指数和豪斯纳比率(表39)。
表39
实施例35
按照实施例32和实施例33制得的颗粒材料的对照片剂各自的片剂硬度、以及它们与MCC 102RanQ和按照实施例23制备的赋形剂的对照片剂的片剂硬度的比较:
由相应的赋形剂以3000lbs-力压力用Carver手动压片机(Carver manual press)和13mm的模具(die)压片得到大约0.5g的片剂。停留时间为5秒。未添加润滑剂。用Varian的VK200片剂硬度计(BenchsaverTM系列)来测定片剂的硬度。记录在表40中的值为4次测定的平均值。
表40
实施例36
由按照实施例22制备的赋形剂和9%崩解剂组成的混合物的粉末特征:
将455.0g实施例22制备的赋形剂与45.0g交联聚乙烯吡咯烷酮(崩解剂)在V-混合器中混合30分钟。像实施例22那样测定粉末特征,结果见表41。
表41
实施例37
按照实施例36制备的赋形剂混合物的压片研究:
将250.0g按照实施例36制备的赋形剂混合物和0.625g硬脂酸镁(润滑剂)在V-混合器中混合2分钟。通过使用10mm模具在10冲旋转压片机(Mini Press II,Globe Pharma)上压制对照片剂。压片机以40%的电动机功率(13.7rpm)操作。压片力1300lbs,排片力(ejection force)为12.9lbs。片剂特征见表42。
表42
*在批次中随机选择25片的平均值
**在批次中随机选择8片的平均值
实施例38
由布洛芬(63%)、按照实施例36制备的混合物以及二氧化硅制成的混合物的粉末特征:
将70.0g布洛芬(20um)、40.57g按照实施例36制备的混合物以及0.54g二氧化硅在V-混合器中混合30分钟。像实施例22那样测定粉末特征,结果见表43。
表43
实施例39
按照实施例38制备的混合物的压片研究:
将100.0g按照实施例38制备的混合物和1.0g硬脂酸镁(润滑剂)在V-混合器中混合2分钟。用10mm模具在10冲旋转压片机(Mini Press II,GlobePharma)上压制布洛芬片剂。压片机以7.0rpm操作。压片力为2600lbs,排片力为53lbs。片剂特征见表44。
表44
*在批次中随机选择25片的平均值
**在批次中随机选择4片的平均值
已对本发明进行了具体描述,在不偏离本发明精神和范围的情况下,本领域技术人员可对发明作出改变。因此,本发明的范围并不受具体实施方式的限制。准确地说,应根据权利要求及与权利要求等同的内容来确定本发明的范围。
如无特别说明,所有的百分比均为重量/重量百分比。
Claims (42)
1.组合物,其包含:
约90%~约99%的微晶纤维素;以及
约1%~约10%至少一种粘合剂;
其中,当用SEM观察时微晶纤维素和粘合剂无法进行区分,从而形成了基本上均匀的颗粒。
2.根据权利要求1所述的组合物,其中,所述组合物包含:
约95%~约99%微晶纤维素;以及
约1%~约5%至少一种粘合剂。
3.根据权利要求1所述的组合物,其中,所述组合物包含:
约97%~约99%微晶纤维素;以及
约1%~约3%至少一种粘合剂。
4.根据权利要求1所述的组合物,其中,所述粘合剂包括羟丙基甲基纤维素。
5.根据权利要求1所述的组合物,其中,所述赋形剂是通过将包含微晶纤维素和粘合剂的水性浆料进行均匀化/喷雾干燥制粒而形成的。
6.根据权利要求1所述的组合物,其中松密度为0.2-0.3g/cc。
7.一种制备赋形剂的方法,其包括:
将粘合剂在水中混合,形成粘稠的溶液;
将微晶纤维素在所述粘稠的溶液中均匀化,形成浆料;以及
将浆料喷雾干燥制粒,形成基本上均匀的赋形剂颗粒;
其中,用SEM观察时所述微晶纤维素和粘合剂无法进行区分。
8.根据权利要求7所述的方法,其中,所述赋形剂包含:
约90%~约99%微晶纤维素;以及
约1%~约10%至少一种粘合剂。
9.根据权利要求7所述的方法,其中,所述赋形剂包含:
约95%~约99%微晶纤维素;以及
约1%~约5%至少一种粘合剂。
10.根据权利要求7所述的方法,其中,所述赋形剂包含:
约97%~约99%微晶纤维素;以及
约1%~约3%至少一种粘合剂。
11.根据权利要求7所述的方法,其中,所述粘合剂包括羟丙基甲基纤维素。
12.一种制备赋形剂的方法,其包括:
将羟丙基甲基纤维素溶解在水中,形成粘稠的溶液;
将微晶纤维素在所述粘稠的溶液中均匀化,形成浆料;
将浆料喷雾干燥制粒,形成基本上均匀的颗粒;
其中,当用SEM观察时所述微晶纤维素与粘合剂无法进行区分。
13.根据权利要求12所述的方法,其中,所述赋形剂包含:
约90%~约99%的微晶纤维素;以及
约1%~约10%羟丙基甲基纤维素。
14.根据权利要求12所述的方法,其中,所述赋形剂包含:
约95%~约99%微晶纤维素;以及
约1%~约5%羟丙基甲基纤维素。
15.根据权利要求12所述的方法,其中,所述赋形剂包含:
约97%~约9%微晶纤维素;以及
约1%~约3%羟丙基甲基纤维素。
16.药物片剂,其包含:
至少一种活性药物成分;
崩解剂;以及
基本上均匀颗粒的赋形剂,该赋形剂包含:
a)微晶纤维素;以及
b)至少一种粘合剂。
17.根据权利要求16所述的片剂,其中,所述赋形剂包含:
约90%~约99%的微晶纤维素;以及
约1%~约10%至少一种粘合剂。
18.根据权利要求16所述的片剂,其中,所述赋形剂包含:
约95%~约99%微晶纤维素;以及
约1%~约5%至少一种粘合剂。
19.根据权利要求16所述的片剂,其中,所述赋形剂包含:
约97%~约99%微晶纤维素;以及
约1%~约3%至少一种粘合剂。
20.根据权利要求16所述的片剂,其中,所述粘合剂包括羟丙基甲基纤维素。
21.一种制备药物片剂的方法,其包括:
将至少一种活性药物成分与崩解剂和基本上均匀颗粒的赋形剂混合,该赋形剂包含:
a)微晶纤维素;和
b)至少一种粘合剂;以及
将得到的混合物压制成片剂。
22.根据权利要求21所述的方法,其中,所述赋形剂包含:
约90%~约99%的微晶纤维素;以及
约1%~约10%至少一种粘合剂。
23.根据权利要求21所述的方法,其中,所述赋形剂包含:
约95%~约99%微晶纤维素;以及
约1%~约5%至少一种粘合剂。
24.根据权利要求21所述的方法,其中,所述赋形剂包含:
约97%~约99%微晶纤维素;以及
约1%~约3%至少一种粘合剂。
25.根据权利要求21所述的方法,其中,所述粘合剂包括羟丙基甲基纤维素。
26.组合物,其包含:
约75%~约98%微晶纤维素;
约1%~约10%至少一种粘合剂;以及
约1%~约20%的至少一种崩解剂;
其中,用SEM观察时所述微晶纤维素、粘合剂和崩解剂无法进行区分,从而形成基本上均匀且基本上为球形的颗粒。
27.根据权利要求26所述的组合物,其中所述组合物包含:
约80%~约90%微晶纤维素;
约2%~约8%的至少一种粘合剂;以及
约3%~约12%至少一种崩解剂。
28.根据权利要求26所述的组合物,其中所述组合物包含:
约85%~约93%微晶纤维素;
约2%~约5%至少一种粘合剂;以及
约10%至少一种崩解剂。
29.根据权利要求26所述的组合物,其中,所述粘合剂包括羟丙基甲基纤维素,所述崩解剂包含交联聚乙烯吡咯烷酮。
30.根据权利要求26所述的组合物,其中,所述赋形剂是通过喷雾含有微晶纤维素、粘合剂和崩解剂的水性浆料形成的。
31.一种制备赋形剂的方法,其包含:
将MCC浆料与崩解剂浆料混合,形成MCC/崩解剂浆料;
将粘合剂在水中混合,形成粘稠的粘合剂浆料;
将粘合剂浆料与MCC/崩解剂浆料进行均匀化,形成均匀的浆料;以及
将均匀的浆料喷雾干燥制粒,形成基本上均匀且基本上为球形的赋形剂颗粒。
32.根据权利要求31所述的方法,其中,所述赋形剂包含:
约75%~约98%微晶纤维素;
约1%~约10%至少一种粘合剂;以及
约1%~约20%的至少一种崩解剂。
33.根据权利要求31所述的方法,其中,所述赋形剂包含:
约80%~约90%微晶纤维素;
约2%~约8%的至少一种粘合剂;以及
约3%~约12%至少一种崩解剂。
34.根据权利要求31所述的方法,其中,所述赋形剂包含:
约85%~约93%微晶纤维素;
约2%~约5%至少一种粘合剂;以及
约10%至少一种崩解剂。
35.根据权利要求31所述的方法,其中,所述粘合剂包括羟丙基甲基纤维素,所述崩解剂包括交联聚乙烯吡咯烷酮。
36.一种制备赋形剂的方法,其包含:
将MCC浆料与交联聚乙烯吡咯烷酮浆料混合,形成MCC/交联聚乙烯吡咯烷酮浆料;
将羟丙基甲基纤维素在水中混合,形成粘稠的羟丙基甲基纤维素浆料;
将羟丙基甲基纤维素浆料与MCC/交联聚乙烯吡咯烷酮浆料进行均匀化,形成均匀的浆料;
将均匀的浆料进行喷雾干燥制粒,形成基本上均匀且基本上为球形的赋形剂颗粒。
37.根据权利要求36所述的方法,其中,所述赋形剂包含:
约75%~约98%微晶纤维素;
约1%~约10%至少一种粘合剂;以及
约1%~约20%的至少一种崩解剂。
38.根据权利要求36所述的方法,其中,所述赋形剂包含:
约80%~约90%微晶纤维素;
约2%~约8%的至少一种粘合剂;以及
约3%~约12%至少一种崩解剂。
39.根据权利要求36所述的方法,其中,所述赋形剂包含:
约85%~约93%微晶纤维素;
约2%~约5%至少一种粘合剂;以及
约10%至少一种崩解剂。
40.一种制备药物片剂的方法,其包括:
将至少一种活性药物成分与根据权利要求26的基本上均匀且基本上为球形颗粒的赋形剂混合;以及
将该混合物压制成片剂。
41.根据权利要求40所述的方法,其中,所述片剂是用旋转压片机制成的。
42.根据权利要求40所述的方法,其还包括对片剂进行包衣。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11602508P | 2008-11-19 | 2008-11-19 | |
| US61/116,025 | 2008-11-19 | ||
| PCT/US2009/064498 WO2010059534A2 (en) | 2008-11-19 | 2009-11-16 | Directly compressible granular microcrystalline cellulose based excipient, manufacturing process and use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102215825A true CN102215825A (zh) | 2011-10-12 |
Family
ID=42077071
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2009801461591A Pending CN102215825A (zh) | 2008-11-19 | 2009-11-16 | 可直接压制的颗粒状的基于微晶纤维素的赋形剂、其制备方法及应用 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20110288146A1 (zh) |
| EP (1) | EP2376067A2 (zh) |
| JP (1) | JP2012509329A (zh) |
| KR (1) | KR20110089180A (zh) |
| CN (1) | CN102215825A (zh) |
| AU (1) | AU2009316812A1 (zh) |
| BR (1) | BRPI0921507A2 (zh) |
| CA (1) | CA2744142A1 (zh) |
| IL (1) | IL212955A0 (zh) |
| MX (1) | MX2011005168A (zh) |
| SG (1) | SG171752A1 (zh) |
| TW (1) | TW201023897A (zh) |
| WO (1) | WO2010059534A2 (zh) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104189915A (zh) * | 2014-07-30 | 2014-12-10 | 上海新亚药业闵行有限公司 | 一种固体制剂预混剂及其制备方法 |
| CN104258411A (zh) * | 2014-09-19 | 2015-01-07 | 安徽山河药用辅料股份有限公司 | 一种硅化微晶纤维素复合辅料及其制备方法 |
| CN106265077A (zh) * | 2015-05-30 | 2017-01-04 | 天士力制药集团股份有限公司 | 一种中药浸膏雾化分散工艺及其制剂 |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101298788B1 (ko) * | 2011-03-15 | 2013-08-22 | 보령제약 주식회사 | 안정성이 개선된 복합제제 |
| JP5879668B2 (ja) * | 2012-04-27 | 2016-03-08 | 日本コーンスターチ株式会社 | 澱粉顆粒の製造方法および口腔内崩壊錠 |
| WO2014159607A1 (en) | 2013-03-14 | 2014-10-02 | Allergen Research Corporation | Manufacture of peanut formulations for oral desensitization |
| US9492535B2 (en) | 2013-03-14 | 2016-11-15 | Aimmune Therapeutics, Inc. | Peanut formulations and uses thereof |
| WO2015187736A1 (en) * | 2014-06-02 | 2015-12-10 | Allergen Research Corporation | Placebo formulations and uses thereof |
| JP6650750B2 (ja) * | 2015-12-22 | 2020-02-19 | アサヒグループ食品株式会社 | 錠剤の製造方法、錠剤原料用顆粒の製造方法、及び錠剤原料用顆粒 |
| CN113966229A (zh) | 2019-05-10 | 2022-01-21 | 爱沐疗法公司 | 用于改善花生过敏患者的生活质量的方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1074228A (zh) * | 1991-12-30 | 1993-07-14 | Fmc有限公司 | 球团化微晶纤维素组合物 |
| WO2002062320A1 (en) * | 2001-02-05 | 2002-08-15 | R.P. Scherer Technologies, Inc. | Methods and compositions for reducing the taste of pharmaceutically active agents |
| CN1473054A (zh) * | 2000-11-06 | 2004-02-04 | ������������ʽ���� | 制剂用纤维素粒子 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3505433A1 (de) * | 1985-02-16 | 1986-08-21 | Basf Ag, 6700 Ludwigshafen | Direkttablettierhilfsmittel |
| US5686107A (en) * | 1995-01-30 | 1997-11-11 | Fmc Corporation | Chewable pharmaceutical tablets |
| DE19628617A1 (de) * | 1996-07-16 | 1998-01-22 | Basf Ag | Direkttablettierhilfsmittel |
| EP1070740B1 (de) * | 1999-07-19 | 2008-01-02 | fit GmbH | Coprozessiertes Polysaccharidprodukt mit unlöslicher Carboxymethylcellulose |
| CN101128186B (zh) * | 2005-02-03 | 2013-07-03 | 奈科明制药有限公司 | 制备含钙组合物的快速湿聚结方法 |
| WO2008020990A1 (en) * | 2006-08-09 | 2008-02-21 | Mallinckrodt Baker, Inc. | New direct compressible excipient blend |
| JP5410290B2 (ja) * | 2006-10-27 | 2014-02-05 | エフ エム シー コーポレーション | 共処理組成物とその製造方法、打錠可能な錠剤処方物、錠剤の製造方法及び錠剤 |
| CN101820863A (zh) * | 2007-10-10 | 2010-09-01 | 马林克罗特贝克公司 | 直接可压制的高功能性颗粒状微晶纤维素基赋形剂、其制备方法和用途 |
-
2009
- 2009-11-16 WO PCT/US2009/064498 patent/WO2010059534A2/en active Application Filing
- 2009-11-16 US US12/998,659 patent/US20110288146A1/en not_active Abandoned
- 2009-11-16 CA CA2744142A patent/CA2744142A1/en not_active Abandoned
- 2009-11-16 KR KR1020117013939A patent/KR20110089180A/ko unknown
- 2009-11-16 MX MX2011005168A patent/MX2011005168A/es not_active Application Discontinuation
- 2009-11-16 JP JP2011537526A patent/JP2012509329A/ja active Pending
- 2009-11-16 BR BRPI0921507A patent/BRPI0921507A2/pt not_active IP Right Cessation
- 2009-11-16 EP EP09752702A patent/EP2376067A2/en not_active Ceased
- 2009-11-16 SG SG2011035789A patent/SG171752A1/en unknown
- 2009-11-16 CN CN2009801461591A patent/CN102215825A/zh active Pending
- 2009-11-16 AU AU2009316812A patent/AU2009316812A1/en not_active Abandoned
- 2009-11-19 TW TW098139345A patent/TW201023897A/zh unknown
-
2011
- 2011-05-17 IL IL212955A patent/IL212955A0/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1074228A (zh) * | 1991-12-30 | 1993-07-14 | Fmc有限公司 | 球团化微晶纤维素组合物 |
| CN1473054A (zh) * | 2000-11-06 | 2004-02-04 | ������������ʽ���� | 制剂用纤维素粒子 |
| WO2002062320A1 (en) * | 2001-02-05 | 2002-08-15 | R.P. Scherer Technologies, Inc. | Methods and compositions for reducing the taste of pharmaceutically active agents |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104189915A (zh) * | 2014-07-30 | 2014-12-10 | 上海新亚药业闵行有限公司 | 一种固体制剂预混剂及其制备方法 |
| CN104189915B (zh) * | 2014-07-30 | 2016-08-10 | 上海新亚药业闵行有限公司 | 一种固体制剂预混剂及其制备方法 |
| CN104258411A (zh) * | 2014-09-19 | 2015-01-07 | 安徽山河药用辅料股份有限公司 | 一种硅化微晶纤维素复合辅料及其制备方法 |
| CN106265077A (zh) * | 2015-05-30 | 2017-01-04 | 天士力制药集团股份有限公司 | 一种中药浸膏雾化分散工艺及其制剂 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2744142A1 (en) | 2010-05-27 |
| EP2376067A2 (en) | 2011-10-19 |
| IL212955A0 (en) | 2011-07-31 |
| JP2012509329A (ja) | 2012-04-19 |
| WO2010059534A3 (en) | 2011-01-20 |
| AU2009316812A1 (en) | 2011-07-07 |
| MX2011005168A (es) | 2011-05-30 |
| US20110288146A1 (en) | 2011-11-24 |
| KR20110089180A (ko) | 2011-08-04 |
| WO2010059534A2 (en) | 2010-05-27 |
| TW201023897A (en) | 2010-07-01 |
| BRPI0921507A2 (pt) | 2016-01-19 |
| SG171752A1 (en) | 2011-07-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102215825A (zh) | 可直接压制的颗粒状的基于微晶纤维素的赋形剂、其制备方法及应用 | |
| US20170112768A1 (en) | Directly compressible granular microcrystalline cellulose based excipient, manufacturing process and use thereof | |
| US20080045548A1 (en) | Pharmaceutical Compositions | |
| CN102215823A (zh) | 直接可压制的基于高功能性颗粒磷酸氢钙的共处理的赋形剂 | |
| EP2207533B1 (en) | Directly compressible high functionality granular microcrystalline cellulose based excipient, manufacturing process and use thereof | |
| WO2007026261A2 (en) | Formulations containing losartan and/or its salts | |
| CN102614185A (zh) | 缬沙坦和氢氯噻嗪的组合物及其制备方法 | |
| CN106994120A (zh) | 一种含有双环取代吡唑酮偶氮类衍生物或其盐的药物组合物及其制备方法 | |
| US20120100211A1 (en) | Material and process for incorporation of low dosage active pharmaceutical ingredients and use thereof | |
| CN100462078C (zh) | 一种复方戊酸雌二醇片及其制备方法 | |
| KR20190003225A (ko) | 함량 균일성 및 안정성이 향상된 바레니클린 옥살산염이 포함된 약제학적 조성물 | |
| CN106552267A (zh) | 米诺膦酸的环糊精包合物及其口服固体制剂的制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| RJ01 | Rejection of invention patent application after publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20111012 |