CN101300071B - 排气净化用催化剂 - Google Patents
排气净化用催化剂 Download PDFInfo
- Publication number
- CN101300071B CN101300071B CN2006800407079A CN200680040707A CN101300071B CN 101300071 B CN101300071 B CN 101300071B CN 2006800407079 A CN2006800407079 A CN 2006800407079A CN 200680040707 A CN200680040707 A CN 200680040707A CN 101300071 B CN101300071 B CN 101300071B
- Authority
- CN
- China
- Prior art keywords
- composite oxides
- exhaust gas
- earth element
- gas purification
- purification catalyst
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/38—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of noble metals
- B01J23/54—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of noble metals combined with metals, oxides or hydroxides provided for in groups B01J23/02 - B01J23/36
- B01J23/56—Platinum group metals
- B01J23/63—Platinum group metals with rare earths or actinides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D53/00—Separation of gases or vapours; Recovering vapours of volatile solvents from gases; Chemical or biological purification of waste gases, e.g. engine exhaust gases, smoke, fumes, flue gases, aerosols
- B01D53/34—Chemical or biological purification of waste gases
- B01D53/92—Chemical or biological purification of waste gases of engine exhaust gases
- B01D53/94—Chemical or biological purification of waste gases of engine exhaust gases by catalytic processes
- B01D53/9445—Simultaneously removing carbon monoxide, hydrocarbons or nitrogen oxides making use of three-way catalysts [TWC] or four-way-catalysts [FWC]
- B01D53/945—Simultaneously removing carbon monoxide, hydrocarbons or nitrogen oxides making use of three-way catalysts [TWC] or four-way-catalysts [FWC] characterised by a specific catalyst
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/20—Metals or compounds thereof
- B01D2255/204—Alkaline earth metals
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/20—Metals or compounds thereof
- B01D2255/204—Alkaline earth metals
- B01D2255/2047—Magnesium
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/20—Metals or compounds thereof
- B01D2255/206—Rare earth metals
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/40—Mixed oxides
- B01D2255/402—Perovskites
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J21/00—Catalysts comprising the elements, oxides, or hydroxides of magnesium, boron, aluminium, carbon, silicon, titanium, zirconium, or hafnium
- B01J21/005—Spinels
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02T—CLIMATE CHANGE MITIGATION TECHNOLOGIES RELATED TO TRANSPORTATION
- Y02T10/00—Road transport of goods or passengers
- Y02T10/10—Internal combustion engine [ICE] based vehicles
- Y02T10/12—Improving ICE efficiencies
Abstract
本发明的目的在于提供含有复合氧化物催化剂和耐热性载体的同时即使在高温且氧浓度高的气氛中使用时也难以产生活性下降的排气净化用催化剂。本发明的排气净化用催化剂,含有复合氧化物催化剂和耐热性载体,其中,所述复合氧化物催化剂含有稀土元素、碱土元素和贵金属,稀土元素的一部分与碱土元素的一部分形成复合氧化物,该复合氧化物与贵金属的一部分形成固溶体,所述耐热性载体负载所述复合氧化物催化剂,并且包含选自由通式AB2O4表示的第一复合氧化物、由通式LMO3表示的钙钛矿结构的第二复合氧化物和由通式X2Y2O7表示的烧绿石结构的第三复合氧化物组成的组中的至少一种复合氧化物。
Description
技术领域
本发明涉及排气净化用催化剂。
背景技术
以往,作为处理汽车排气的排气净化用催化剂,广泛使用在二氧化铈或氧化铝等无机氧化物上负载铂等贵金属的三效催化剂。该三效催化剂中,贵金属起着促进氮氧化物的还原反应以及一氧化碳和烃的氧化反应的作用。另外,无机氧化物起着在增大贵金属的比表面积的同时使反应放热消散而抑制贵金属的烧结的作用。特别是二氧化铈具有储氧能力,可以将前述的还原反应及氧化反应实现最佳。
不过,近年来,汽车等自动推进车辆随着其发动机性能提高,高速行驶的机会增加。此外,为了防止大气污染,排气规定的强化也在进行之中。根据这样的背景,自动推进车辆的排气温度倾向于越来越高。
另外,为了抑制地球变暖,对于自动推进车辆来说,要求二氧化碳排出量减少。因此,在排气净化用催化剂加热到高温的状态下,停止向发动机供给燃料的机会增加。
即,排气净化用催化剂在比以往更高的温度下使用,同时高温下曝露于氧过剩气氛下的机会增加。因此,为了实现在这样的使用气氛下也实现发挥充分性能的排气净化用催化剂,进行了积极的研究开发。
例如,日本特开平5-168926号公报、日本特公平6-75675号公报以及日本特开2000-169148号公报中,记载了提高二氧化铈的热稳定性、抑制其储氧能力等下降。具体而言,日本特开平5-168926号公报中记载了含有铂族元素、活性氧化铝、氧化铈、钡化合物及锆化合物的排气净化用催化剂。日本特公平6-75675号公报中记载了催化剂负载层包含铈氧化物与锆氧化物与催化剂金属,这些铈氧化物及锆氧化物的至少一部分以复合氧化物或固溶体的形式存在的排气净化用催化剂。日本特开2000-169148号公报中记载了由通式:Ce1-(a+b)ZraYbO2-b/2表示的铈类复合氧化物。
另外,日本特开平10-358号公报及日本特开2001-129399号公报中,记载了通过使铂以铂复合氧化物的形式存在,抑制铂烧结。具体而言,日本特开平10-358号公报中,记载了使用含有铂和选自碱土金属元素或IIIA族元素中的一种以上元素的高耐热性复合氧化物的排气净化用催化剂。日本特开2001-129399号公报中记载了在无机氧化物载体上具有含有铂元素和碱土金属元素的铂复合氧化物层,在它们之间介在有金属X(X为选自Mg、Ca、Sr、Ba、La、Ce中的一种以上元素)的氧化物层的排气净化用催化剂。
但是,仅仅单纯提高二氧化铈的热稳定性,在将排气净化用催化剂曝露于高温例如1000℃至1200℃的氧过剩气氛时,铂发生烧结,不能得到充分的活性。另外,为了生成热稳定性优良的铂复合氧化物,高温煅烧是必须的。因此,使用铂复合氧化物的排气净化用催化剂多数比表面积小,活性不充分。
针对该问题,本发明人提出了例如:含有稀土元素和碱土元素和贵金属、稀土元素的一部分与碱土元素的一部分形成复合氧化物、并且该复合氧化物与贵金属的一部分形成固溶体的复合氧化物催化剂。该复合氧化物催化剂单独使用时,即使在高温并且氧浓度高的气氛中使用的情况下也显示优良的活性。但是,该复合氧化物催化剂如果与包含氧化铝的耐热性载体一起使用,则根据情况有可能产生活性下降。
发明内容
本发明的目的在于提供含有复合氧化物催化剂和耐热性载体的同时即使在高温且氧浓度高的气氛中使用时也难以产生活性下降的排气净化用催化剂。
根据本发明的第一方面,提供一种排气净化用催化剂,其具有复合氧化物催化剂和耐热性载体,所述复合氧化物催化剂含有稀土元素、碱土元素和贵金属,稀土元素的一部分与碱土元素的一部分形成复合氧化物,该复合氧化物与贵金属的一部分形成固溶体,所述耐热性载体负载所述复合氧化物催化剂,并且包含选自由通式AB2O4表示的第一复合氧化物、由通式LMO3表示的钙钛矿结构的第二复合氧化物和由通式X2Y2O7表示的烧绿石结构的第三复合氧化物组成的组中的至少一种复合氧化物;并且元素A是碱土元素和/或过渡金属元素,元素B是选自由铝、镁和过渡金属元素组成的组中的至少一种元素且与元素A不同,元素L是稀土元素和/或碱土元素,元素M是铝和/或过渡金属元素,元素X是稀土元素,元素Y是锆和/或钛。
根据本发明的第二方面,提供一种排气净化用催化剂,其具有复合氧化物催化剂和耐热性载体,所述复合氧化物催化剂含有稀土元素、碱土元素、锆和贵金属,稀土元素的一部分与锆的一部分与碱土元素的至少一部分形成复合氧化物,该复合氧化物与贵金属的一部分形成固溶体,所述耐热性载体负载所述复合氧化物催化剂,并且包含选自由通式AB2O4表示的第一复合氧化物、由通式LMO3表示的钙钛矿结构的第二复合氧化物和由通式X2Y2O7表示的烧绿石结构的第三复合氧化物组成的组中的至少一种复合氧化物;并且元素A是碱土元素和/或过渡金属元素,元素B是选自由铝、镁和过渡金属元素组成的组中的至少一种元素并且与元素A不同,元素L是稀土元素和/或碱土元素,元素M是铝和/或过渡金属元素,元素X是稀土元素,元素Y是锆和/或钛。
附图说明
图1是示意地表示本发明的第一实施方式的排气净化用催化剂的图。
图2是示意地表示图1的排气净化用催化剂在高温条件下显示的状态变化的示意图。
图3是示意地表示本发明的第二方式的排气净化用催化剂的图。
图4是表示对于耐久试验后的排气净化用催化剂得到的X射线衍射光谱的图形。
具体实施方式
以下,对本发明的方式进行说明。
图1是示意地表示本发明的第一实施方式的排气净化用催化剂的图。该排气净化用催化剂,是使粒状的复合氧化物催化剂1与粒状的耐热性载体2的混合物聚集而形成的颗粒催化剂,图1中描述了其一部分。
复合氧化物催化剂1包含载体11、部分被覆其表面的复合氧化物12和在载体11上负载的贵金属13a。
载体11含有稀土氧化物作为主要成分,复合氧化物12含有稀土元素与碱土元素的复合氧化物作为主成分。形成该复合氧化物12的稀土元素,与形成载体11的稀土元素相同。另外,复合氧化物12含有与贵金属13a相同的贵金属,形成固溶体。
在此,作为一例,载体11包括二氧化铈(CeO2),复合氧化物12包括由化学式BaCeO3表示的复合氧化物,该复合氧化物所含的贵金属和贵金属13a为铂(Pt)。即,使用铈作为稀土元素,使用钡作为碱土元素,使用铂作为贵金属。另外,上面的复合氧化物与铂的固溶体,可以由化学式Ba(Ce,Pt)O3和/或(Ba,Pt)CeO3表示。
耐热性载体2负载复合氧化物催化剂1。耐热性载体2含有以下的第一至第三复合氧化物的至少一种,典型地,由第一至第三复合氧化物的至少一种构成。
第一复合氧化物,是由通式AB2O4表示的复合氧化物。该通式中,元素A为碱土元素和/或过渡金属元素。另外,元素B为选自由铝和镁和过渡金属元素构成的组中的至少一种元素,并且与元素A不同。第一复合氧化物典型地具有尖晶石结构,但是也可以具有金绿石结构等其它结晶结构。
元素A和B中可以使用的过渡金属元素,可以列举例如:原子序数为21~30范围内的金属元素。作为元素A,可以使用例如:镁、锶、钡等。典型地,元素B为铝、或者元素B的大部分为铝。可以作为元素B的一部分使用铝,作为元素B的另外一部分可以使用铁和/或钴等过渡金属元素。
第二复合氧化物是由通式LMO3表示的钙钛矿结构的复合氧化物。该通式中,L为稀土元素和/或碱土元素,M为铝和/或过渡金属元素。
作为元素L,可以使用例如镧、钕等。作为元素M中可以使用的过渡金属元素,可以列举例如:原子序数21~30范围内的金属元素。典型地,元素M为铝、或者元素M的大部分为铝。作为元素M的一部分可以使用铝、作为元素M的另外一部分可以使用铁和/或钴等过渡金属元素。
第三复合氧化物,是由通式X2Y2O7表示的烧绿石结构的复合氧化物。该通式中,X为稀土元素,Y为锆和/或钛。作为X,可以使用例如:钕、镧等。典型地,元素Y为锆、或者元素Y的大部分为锆。
该排气净化用催化剂,在高温条件下使气氛的组成变化时,显示可逆的状态变化。对于此,参照图2进行说明。
图2是示意地表示图1的排气净化用催化剂在高温条件下显示的状态变化的示意图。图2中,“贫(Lean)”表示的状态,表示在高温条件下曝露于高氧浓度气氛中的情况下,例如停止向发动机供给燃料的情况下,排气净化用催化剂呈现的状态。另一方面,“富(rich)”表示的状态,表示在高温条件下曝露于低氧浓度气氛中的情况下,例如持续向发动机供给大量燃料的情况下,排气净化用催化剂呈现的状态。
图2中“贫”表示的状态,相当于参照图1进行说明的状态。但是,此时,贵金属13a的至少一部分具有被氧化(氧化数增加)的可能性。
在该状态下,主要是贵金属13a对排气净化用催化剂的活性有贡献,复合氧化物12中的铂对活性几乎没有贡献。但是,在排气净化用催化剂呈现“贫”表示的状态的期间,排气中的有害成分(例如,氮氧化物、一氧化碳、烃等)的浓度、即气氛中的有害成分浓度比较低。因此,排气净化用催化剂发挥充分的性能。
高温条件下气氛中的氧浓度如果变低,则排气净化用催化剂从“贫”表示的状态向“富”表示的状态变化。具体而言,铂从复合氧化物12析出,该析出的铂在复合氧化物12的表面形成贵金属13b。
排气净化用催化剂呈现“富”表示的状态的期间,排气中的有害成分浓度比较高。即,“富”表示的状态对应的期间,与“贫”表示的状态对应的期间相比,排气净化用催化剂要求更高活性。
贵金属13b远小于贵金属13a。例如,贵金属13a的尺寸为约数nm,与此相对,贵金属13b的尺寸为约1nm以下。因此,呈现“富”表示的状态的排气净化用催化剂,与呈现“贫”表示的状态的排气净化用催化剂相比,具有高活性。因此,该排气净化用催化剂即使在排气中的有害成分浓度高的情况下也可以发挥充分的性能。
呈现“富”表示的状态的排气净化用催化剂,在高温条件下气氛中的氧浓度如果变高,则向“贫”表示的状态变化。即,形成贵金属13b的铂与复合氧化物形成固溶体。另外,铂与二氧化铈几乎不形成固溶体。
因此,排气净化用催化剂产生可逆的状态变化。另外,该排气净化用催化剂每当从“贫”表示的状态向“富”表示的状态变化时,复合氧化物12的表面形成极微细的贵金属13b。因此,该状态通过产生“富”表示的状态向“贫”表示的状态的变化及其逆变化而重复。自动推进车辆中由于排气中的氧浓度变化比较频繁,因此该排气净化用催化剂在高温下曝露于低氧浓度气氛的情况下,经常显示高活性,发挥充分的性能。
另外,该排气净化用催化剂中,贵金属13a与气氛的组成和温度无关,对排气净化用催化剂的活性有贡献。因此,该排气净化用催化剂在高温下曝露于氧浓度高的气氛的情况下发挥充分的性能,并且即使是初期使用时或低温条件下也可以发挥充分的性能。
另外,该排气净化用催化剂中,如上所述,在高温条件下气氛中的氧浓度如果变高,则贵金属13b与复合氧化物形成固溶体。因此,该排气净化用催化剂在高氧浓度气氛中铂的蒸发损失减少。
另外,耐热性载体2中使用氧化铝时,在1000℃以上的高温环境下产生氧化铝与复合氧化物12的反应。例如,通过氧化铝与复合氧化物12的反应,生成BaAl2O4或生成BaAl2O4和BaCO3。如果产生这样的复合氧化物12的分解反应,则排气净化用催化剂的活性显著下降。
与此相对,上述第一至第三复合氧化物即使在1000℃以上的高温环境中也不产生与复合氧化物催化剂1的反应。因此,该排气净化用催化剂,难以产生由复合氧化物12的分解反应导致的活性下降。即,本实施方式的排气净化用催化剂,即使在高温且氧浓度高的气氛中使用时也难以产生活性下降。
尽管不希望受理论的束缚,但是氧化铝发生与复合氧化物催化剂1的反应,而第一至第三复合氧化物不与复合氧化物催化剂1发生反应,其理由考虑如下:即,第一至第三复合氧化物在碱土元素、稀土元素、过渡金属元素的共存下是非常稳定的物质。
该排气净化用催化剂可以通过例如以下的方法进行制造。
首先,准备含有稀土氧化物为主成分的粉末状载体11,制备其浆料。此时,使用例如水作为分散介质。然后,向该浆料中添加贵金属盐溶液,并将其过滤。接着,依次进行滤饼的干燥和煅烧。由此,使贵金属负载于载体11上。
然后,将负载有贵金属的载体11添加到碱土类盐溶液中。另外,将该浆料加热充分地除去液体。由此,使碱土元素负载于载体11上。
对于使碱土元素负载于载体11上的方法没有特别限制。例如,可以使用在负载有贵金属的载体11中浸渗碱土盐溶液的方法、使用共沉淀的方法、使用碱土金属的醇盐的方法等。
然后,将负载有贵金属和碱土元素的载体11在氧化气氛中进行煅烧。由此,生成稀土元素与碱土元素的复合氧化物,同时,生成该复合氧化物与贵金属的固溶体,从而得到复合氧化物催化剂1。
另外,煅烧温度设定为约700℃至约1100℃的范围内。煅烧温度低时,难以生成复合氧化物。煅烧温度高时,载体11的比表面积下降,伴随于此,难以使贵金属13a良好地分散到载体11上。因此,有时得不到高活性。
然后,将该复合氧化物催化剂1与粉末状的耐热性载体2混合。另外,将该混合物压缩成形,根据需要将成形物粉碎。通过以上步骤,得到颗粒状的排气净化用催化剂。
以下,对本发明的第二实施方式进行说明。
图3是示意地表示本发明的第二实施方式的排气净化用催化剂的图。该排气净化用催化剂,是使粒状的复合氧化物催化剂1与粒状的耐热性载体2的混合物聚集而得到的颗粒催化剂。图3中描述其一部分。
第二实施方式的排气净化用催化剂,除了复合氧化物催化剂1的组成不同以外,与第一实施方式的排气净化用催化剂同样。因此,省略对于耐热性载体2的说明。
第二实施方式的排气净化用催化剂中,复合氧化物催化剂1包含载体11、部分被覆其表面的复合氧化物12a至12c、和在载体11上负载的贵金属13a。
载体11含有稀土元素的氧化物作为主成分。载体11可以进一步含有例如二氧化锆(ZrO2)。载体11可以含有稀土元素与锆的复合氧化物作为主成分。
复合氧化物12a含有稀土元素与碱土元素的复合氧化物作为主成分。复合氧化物12b含有锆与碱土元素的复合氧化物作为主成分。复合氧化物12c含有稀土元素与锆与碱土元素的复合氧化物作为主成分。
复合氧化物12a和12c所含有的稀土元素与载体11所含的稀土元素相同,复合氧化物12a至12c含有相同的碱土元素。另外,复合氧化物12a至12c含有与贵金属13a相同的贵金属,并形成固溶体。
在此,作为一例,设定为:载体11含有二氧化铈作为主成分,复合氧化物12a包含由化学式BaCeO3表示的复合氧化物,复合氧化物12b包含由化学式BaZrO3表示的复合氧化物,复合氧化物12c包含由化学式Ba(Zr,Ce)O3表示的复合氧化物。另外,复合氧化物12a至12c所含有的贵金属和贵金属13a为铂。即,使用铈作为稀土元素,使用钡作为碱土元素,使用铂作为贵金属。另外,复合氧化物12a与铂的固溶体例如可以由化学式Ba(Ce,Pt)O3表示,复合氧化物12b与铂的固溶体例如可以由化学式Ba(Zr,Pt)O3表示,复合氧化物12c与铂的固溶体例如可以由化学式Ba(Zr,Ce,Pt)O3表示。
该排气净化用催化剂,在高温条件下使气氛的组成变化的情况下,显示与第一实施方式的排气净化用催化剂相同的可逆状态变化。另外,该排气净化用催化剂所含有的复合氧化物催化剂1与上述的第一至第三复合氧化物,即使在1000℃以上的高温环境中也不反应。即,本实施方式的排气净化用催化剂,与第一实施方式的排气净化用催化剂同样,即使在高温且氧浓度高的气氛中使用时也难以产生活性下降。
该复合氧化物催化剂1例如可以通过以下的方法进行制造。
首先,准备含有稀土元素与二氧化锆的复合氧化物作为主成分的粉末状的载体11,制备其浆料。此时,例如使用水作为分散介质。然后,在该浆料中添加贵金属盐溶液,并将其过滤。接着,依次进行滤饼的干燥和煅烧。由此,使贵金属负载于载体11上。
然后,将负载有贵金属的载体11添加到碱土类盐溶液中。另外,将该浆料加热从而充分地除去液体。由此,使碱土元素负载于载体11上。
对于使碱土元素负载于载体11上的方法没有特别限制。例如,可以使用在负载有贵金属的载体11中浸渗碱土类盐溶液的方法、使用共沉淀的方法、使用碱土金属的醇盐的方法等。
然后,将负载有贵金属和碱土元素的载体11在氧化气氛中进行煅烧。由此,生成复合氧化物12a至12c,同时,生成这些复合氧化物12a至12c与贵金属的固溶体,从而得到复合氧化物催化剂1。
另外,煅烧温度设定为例如约700℃至约1100℃的范围内。煅烧温度低时,难以生成复合氧化物12a至12c。煅烧温度高时,载体11的比表面积下降,与此相伴,难以使贵金属13a良好地分散到载体11上。因此,有时得不到高活性。
然后,将该复合氧化物催化剂1与粉末状的耐热性载体2混合。另外,将该混合物压缩成形,根据需要将成形物粉碎。通过以上步骤,得到颗粒状的排气净化用催化剂。
第一和第二实施方式的排气净化用催化剂中,复合氧化物催化剂1的含量设定在例如1重量%~99重量%的范围内。
复合氧化物催化剂1负载的全部贵金属中形成固溶体的贵金属所占的比例(以下,称为固溶体形成率),设定在例如10%至80%的范围内。固溶体形成率小时,抑制贵金属的烧结引起的活性下降的效果不充分。固溶体形成率大时,初期活性不充分。
第一及第二实施方式中,是以使用铈作为复合氧化物催化剂1的稀土元素的情况为例进行了说明,但也可以使用其它元素作为稀土元素。例如,可以使用镧、镨、钕等。另外,也可以使用多种稀土元素。
第一及第二实施方式中,使用钡作为复合氧化物催化剂1的碱土元素,但也可以使用钡以外的元素作为该碱土元素。例如,可以使用锶、钙及镁等。另外,也可以使用多种碱土元素。
第一实施方式的排气净化用催化剂中,复合氧化物催化剂1中碱土元素相对于稀土元素的原子比,设定在例如1原子%~80原子%的范围内,典型地设定在10原子%~50原子%的范围内。碱土元素相对于稀土元素的原子比小时,复合氧化物12相对于载体11的体积比小。因此,气氛的组成变动引起的复合氧化物催化剂1的性能恢复不充分。另外,碱土元素相对于稀土元素的原子比过大时,在高温下提高气氛中氧浓度时,有时难以产生贵金属的氧化(氧化数的增加)。因此,此时,在高温下提高气氛中的氧浓度时,难以生成贵金属与复合氧化物的固溶体,其结果,有时容易产生贵金属的烧结。
第二实施方式的排气净化用催化剂中,复合氧化物催化剂1中碱土元素相对于稀土元素与锆之和的原子比,例如在700℃以上、且低于1000℃的高温条件下使用的情况下,例如设定为0.1原子%以上、且小于10原子%,典型地设定为0.3原子%至5原子%的范围内。另外,该原子比,例如在1000℃以上的高温条件下使用的情况下,设定为10原子%以上,典型地设定为20原子%以上。另外,此时,所述的原子比设定为例如100原子%以下,典型地设定为80原子%以下。该原子比小时,复合氧化物12相对于载体11的体积比小。因此,气氛的组成变动引起的复合氧化物催化剂1的性能恢复不充分。另外,该原子比过大时,贵金属13a在复合氧化物催化剂1所负载的全部贵金属中所占的比例变低。因此,在高温且高氧浓度条件下有时得不到充分的催化剂活性。此外,如果该原子比过大,则高温使用时载体11的耐热性下降,其结果,有时容易产生贵金属的烧结。
第一及第二实施方式中使用铂作为贵金属,但是也可以使用铂以外的元素作为贵金属。例如,可以使用钯及铑等铂族元素。另外,可以使用多种贵金属。
复合氧化物催化剂1的贵金属含量,设定在例如0.01重量%至10重量%的范围内,典型地设定在0.1重量%至5重量%的范围内。贵金属含量小时,有时得不到充分的催化剂活性。贵金属含量大时,有时容易产生贵金属的烧结。
以上,以排气净化用催化剂为颗粒催化剂的情况为例进行了说明,但是排气净化用催化剂可以采用各种形态。例如,排气净化用催化剂可以是整体式催化剂。
以下,对本发明的例子进行说明。
(例1)
<复合氧化物催化剂A的制备>
称量硝酸铈[Ce(NO3)3]和硝酸氧锆[ZrO(NO3)2],使铈与锆的原子比为1∶1,将其添加到500mL的去离子水中。充分搅拌后,在室温下向该水溶液中滴加10重量%的氢氧化铵水溶液使产生共沉淀。将该含有沉淀物的水溶液搅拌60分钟,然后过滤。
然后,用去离子水充分洗涤滤饼,并在110℃下使其干燥。将该干燥品在大气环境中在500℃下预焙烧3小时。将得到的预焙烧品用乳钵粉碎,然后在大气环境中在800℃下进行5小时的主焙烧。
对于这样得到的粉末使用X射线衍射计测定衍射光谱。其结果,确认该粉末包括由化学式(Ce,Zr)O2表示的氧化物。另外,该粉末的比表面积为90m2/g。
然后,称量前述的氧化物粉末50g,将其添加到500mL的去离子水中。通过进行10分钟超声波搅拌使氧化物粉末充分分散到去离子水中。接着,在该浆料中添加二硝基二胺铂硝酸溶液。对二硝基二胺铂硝酸溶液的浓度及添加量进行调节,使得在打算制备的复合氧化物催化剂中铂负载量为1重量%。
之后,对该浆料进行抽滤。对滤液进行电感耦合等离子体(ICP)分光分析,其结果,浆料中的铂几乎完全存在于滤饼中。
然后,在110℃下将滤饼干燥12小时。接着,将其在大气中在500℃下煅烧。由此,使铂负载于前述的氧化物上。
之后,使醋酸钡溶解于100mL的去离子水中。然后,称量负载有铂的氧化物50g,将其添加到醋酸钡水溶液中。另外,对醋酸钡水溶液的浓度进行调节,使得在打算制备的复合氧化物催化剂中,钡相对于铈与锆之和的原子比为20.0原子%。
然后,将该浆料加热,除去多余的水分。接着,将其在大气中在1000℃下煅烧3小时。由此,生成含有钡的复合氧化物,同时,生成该复合氧化物与铂的固溶体。以下,将这样得到的粉末称为复合氧化物催化剂A。
然后,对该复合氧化物催化剂A,使用X射线衍射计测定衍射光谱。其结果,该复合氧化物催化剂A含有由化学式BaZrO3表示的复合氧化物和由化学式Ba(Ce,Zr)O3表示的复合氧化物。
另外,取复合氧化物催化剂A的一部分,将其浸渍到维持在室温的10%氟化氢水溶液中12小时。该条件是所述粉末中仅仅含有钡的复合氧化物溶解的条件。接着,过滤该液体,滤液进行ICP分光分析。其结果,从滤液的铂含量可知铂的45%形成固溶体,即固溶体形成率为45%。
<耐热性载体A的制备>
称量醋酸镁[Mg(CH3COO)2·4H2O]和硝酸铝[Al(NO3)3·9H2O]使得镁与铝的原子比为1∶2,将它们添加到去离子水中。在此,将107.2g的醋酸镁和375.1g的硝酸铝添加到2000mL的去离子水中。
充分搅拌后,在室温下向该水溶液中滴加氢氧化铵水溶液使生成共沉淀。将该含有沉淀物的水溶液充分搅拌,然后过滤。另外,该氢氧化铵水溶液是通过将70g的氨溶解于1000mL的去离子水中而进行制备。
然后,将滤饼用去离子水充分洗涤,并在110℃下干燥。该干燥品在大气环境中在600℃下预焙烧3小时。得到的预焙烧品用乳钵粉碎,另外,在大气环境中在1000℃下进行5小时的主焙烧。以下,将这样得到的粉末称为耐热性载体A。
然后,对该耐热性载体A,使用X射线衍射计测定衍射光谱。其结果,确认该耐热性载体A是由化学式MaAl2O4表示的尖晶石。另外,耐热性载体A的比表面积为38m2/g。
<排气净化用催化剂AA的制备>
将10g的复合氧化物催化剂A和10g的耐热性载体A用乳钵均匀混合。然后,将该混合物压缩成形。另外,将该成形物粉碎,得到粒径为约0.5mm至约1.0mm的颗粒状排气净化用催化剂。以下,将该排气净化用催化剂称为排气净化用催化剂AA。
(例2)
<复合氧化物催化剂B的制备>
将醋酸钡和醋酸钙溶解于100mL的去离子水中。除了使用该水溶液代替醋酸钡水溶液以外,通过在复合氧化物催化剂A的说明中同样的方法,制备复合氧化物催化剂粉末。另外,对所述水溶液中的钡及钙的浓度进行调节,使得在打算制备的复合氧化物催化剂中,钡相对于铈与锆之和的原子比和钙相对于铈与锆之和的原子比分别为10.0原子%。以下,将这样得到的粉末称为复合氧化物催化剂B。
然后,对该复合氧化物催化剂B,使用X射线衍射计测定衍射光谱。其结果,该复合氧化物催化剂B含有由化学式BaZrO3表示的复合氧化物、由化学式Ba(Ce,Zr)O3表示的复合氧化物和由化学式CaZrO3表示的复合氧化物。
另外,对于该复合氧化物催化剂B,通过与复合氧化物催化剂A的说明中同样的方法,考察铂的固溶体形成率。其结果,复合氧化物催化剂B中铂的固溶体形成率为38%。
<排气净化用催化剂BA的制备>
除了使用复合氧化物催化剂B代替复合氧化物催化剂A以外,通过与排气净化用催化剂AA的说明中同样的方法,得到颗粒状的排气净化用催化剂。以下,将该排气净化用催化剂称为排气净化用催化剂BA。
(例3)
<复合氧化物催化剂C的制备>
使醋酸钙溶解于100mL的去离子水中。除了使用该水溶液代替醋酸钡水溶液以外,通过复合氧化物催化剂A的说明中同样的方法制备复合氧化物催化剂粉末。另外,对所述水溶液中的钙浓度进行调节,使得打算制备的复合氧化物催化剂中,钙相对于铈与锆之和的原子比为20.0原子%。以下,将这样得到的粉末称为复合氧化物催化剂C。
然后,对该复合氧化物催化剂C,通过X射线衍射计测定衍射光谱。其结果,该复合氧化物催化剂C含有由化学式CaZrO3表示的复合氧化物。
另外,对于该复合氧化物催化剂C,通过与复合氧化物催化剂A的说明中同样的方法,考察铂的固溶体形成率。其结果,复合氧化物催化剂C中铂的固溶体形成率为25%。
<排气净化用催化剂CA的制备>
除了使用复合氧化物催化剂C代替复合氧化物催化剂A以外,通过与排气净化用催化剂AA的说明中同样的方法,得到颗粒状的排气净化用催化剂。以下,将该排气净化用催化剂称为排气净化用催化剂CA。
(例4)
<耐热性载体B的制备>
称量硝酸镧[La(NO3)3·6H2O]和硝酸铝[Al(NO3)3·9H2O]使得镧与铝的原子比为1∶1,将它们添加到去离子水中。在此,将145g的硝酸镧和125g的硝酸铝添加到1500mL的去离子水中。
充分搅拌后,在室温下向该水溶液中滴加氢氧化铵水溶液使其生成共沉淀。将该含有沉淀物的水溶液充分搅拌,然后过滤。另外,该氢氧化铵水溶液进行滴加使得氨的添加量为2mol。
然后,将滤饼用去离子水充分洗涤,并在110℃下干燥。该干燥品在大气环境中在600℃下预焙烧3小时。将得到的预焙烧品用乳钵粉碎,另外,在大气环境中在800℃下进行5小时的主焙烧。以下,将这样得到的粉末称为耐热性载体B。
然后,对该耐热性载体B,使用X射线衍射计测定衍射光谱。其结果,可以确认该耐热性载体B具有由化学式LaAlO3表示的组成的钙钛矿结构。另外,耐热性载体B的比表面积为60m2/g。
<排气净化用催化剂AB的制备>
除了使用耐热性载体B代替耐热性载体A以外,通过与排气净化用催化剂AA的说明中同样的方法,得到颗粒状的排气净化用催化剂。以下,将该排气净化用催化剂称为排气净化用催化剂AB。
(例5)
<耐热性载体C的制备>
称量硝酸钕[Nd(NO3)3·6H2O]和硝酸氧锆[ZrO(NO3)2·2H2O]使得钕与锆的原子比为1∶1,将它们添加到去离子水中。在此,将109.5g的硝酸钕和66.8g的硝酸氧锆添加到1000mL的去离子水中。
充分搅拌后,在室温下向该水溶液中滴加氢氧化铵水溶液使其生成共沉淀。将该含有沉淀物的水溶液充分搅拌,然后过滤。另外,该氢氧化铵水溶液进行滴加使得氨的添加量为3.5mol。
然后,将滤饼用去离子水充分洗涤,并在110℃下干燥。该干燥品在大气环境中在600℃下预焙烧3小时。将得到的预焙烧品用乳钵粉碎,另外,在大气环境中在900℃下进行5小时的主焙烧。以下,将这样得到的粉末称为耐热性载体C。
然后,对该耐热性载体C,使用X射线衍射计测定衍射光谱。其结果,可以确认该耐热性载体C具有由化学式Nd2Zr2O7表示的组成的烧绿石结构。另外,耐热性载体C的比表面积为45m2/g。
<排气净化用催化剂AC的制备>
除了使用耐热性载体C代替耐热性载体A以外,通过与排气净化用催化剂AA的说明中同样的方法,得到颗粒状的排气净化用催化剂。以下,将该排气净化用催化剂称为排气净化用催化剂AC。
(比较例)
<排气净化用催化剂AD的制备>
除了使用市售的氧化铝(比表面积:90m2/g)作为耐热性载体D代替耐热性载体A以外,通过与排气净化用催化剂AA的说明中同样的方法,得到颗粒状的排气净化用催化剂。以下,将该排气净化用催化剂称为排气净化用催化剂AD。
然后,通过以下方法考察这些排气净化用催化剂的耐久性。
首先,将各排气净化用催化剂配置到流通式的耐久试验装置内,使以氮为主成分的气体以1000mL/分钟的流量在催化剂床中流通30分钟。其间,催化剂床温度维持在1050℃。另外,作为在催化剂床中流通的气体,使用在氮气中添加5%氧气的贫气和在氮气中添加10%一氧化碳的富气,这些气体每5分钟进行切换。
然后,将这些排气净化用催化剂配置到常压固定床流通反应装置内。然后,使模型气体的催化剂床中流动的同时,以12℃/分钟的速度将催化剂床温度从100℃升温至500℃,并连续测定其间的排气净化率。另外,作为模型气体,使用与氧化性成分(氧及氮氧化物)和还原性成分(一氧化碳、烃、氢)以化学计量当量的气体。结果如下表所示。
表1
在上表中,“Ba”、“Ce”、“Zr”和“Ca”标记的列中,分别记载了钡、铈、锆、钙在复合氧化物催化剂所含有的铂以外的金属元素中所占的原子比。“Pt”标记的列中记载了铂在复合氧化物催化剂中所占的重量比。“50%净化温度”标记的列中记载了能够净化模型气体中所含有的各成分的50%以上的催化剂床的最低温度,“HC”及“NOx”标记的列中分别记载了烃和氮氧化物的数据。
如该表所示,排气净化用催化剂AA、BA、CA、AB及AC,与排气净化用催化剂AD相比,可以在更低的温度下净化模型气体。从该结果可知,排气净化用催化剂AA、BA、CA、AB及AC与排气净化用催化剂AD相比,耐久性优良。
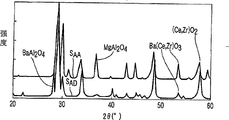
然后,对于耐久试验后的排气净化用催化剂AA及AD,使用X射线衍射计测定衍射光谱。结果如图4所示。
图4是对于耐久试验后的排气净化用催化剂得到的X射线衍射光谱图。图中,横轴表示衍射角,纵轴表示检测强度。另外,图中曲线SAA表示对于耐久试验后的排气净化用催化剂AA得到的X射线衍射光谱,曲线SAD表示对于耐久试验后的排气净化用催化剂AD得到的X射线衍射光谱。
光谱SAA不包含来自由化学式BaAl2O4表示的复合氧化物的峰。与此相对,光谱SAD含有来自由化学式BaAl2O4表示的复合氧化物的峰。另外,虽然未图示,但是,对于耐久试验前的排气净化用催化剂AA及AD得到的光谱均不包含来自由化学式BaAl2O4表示的复合氧化物的峰。
由此可以明确,排气净化用催化剂AD,通过耐久试验复合氧化物催化剂A发生分解,作为分解生成物生成由化学式BaAl2O4表示的复合氧化物。与此相对,排气净化用催化剂AA,不产生由耐久试验引起的复合氧化物催化剂A的分解。
进一步的利益及变形对于本领域的技术人员而言是容易的。因此,本发明在更广泛的方面,不应该由在此所记载的特定的记载或代表性方式所限定。因此,在不脱离由附加的权利要求书范围及其等价物规定的本发明包括的概念的真正意义或范围的范围内,可以进行各种各样的变形。
Claims (8)
1.一种排气净化用催化剂,其具有:
复合氧化物催化剂,所述复合氧化物催化剂含有稀土元素、碱土元素和贵金属,稀土元素的一部分与碱土元素的一部分形成复合氧化物,该复合氧化物与贵金属的一部分形成固溶体,其中所述复合氧化物催化剂负载的全部贵金属中形成固溶体的贵金属所占的比例在10%至80%的范围内;和
耐热性载体,所述耐热性载体负载所述复合氧化物催化剂,并且包含选自由通式AB2O4表示的第一复合氧化物、由通式LMO3表示的钙钛矿结构的第二复合氧化物和由通式X2Y2O7表示的烧绿石结构的第三复合氧化物组成的组中的至少一种复合氧化物;
并且元素A是碱土元素和/或过渡金属元素,元素B是选自由铝、镁和过渡金属元素组成的组中的至少一种元素并且与元素A不同,元素L是稀土元素和/或碱土元素,元素M是铝和/或过渡金属元素,元素X是稀土元素,元素Y是锆和/或钛。
2.权利要求1所述的排气净化用催化剂,其特征在于,所述耐热性载体含有所述第一复合氧化物,所述第一复合氧化物具有尖晶石结构,所述元素B含有铝。
3.权利要求1所述的排气净化用催化剂,其特征在于,所述耐热性载体含有所述第二复合氧化物,所述元素M含有铝。
4.权利要求1所述的排气净化用催化剂,其特征在于,所述耐热性载体含有所述第三复合氧化物,所述元素Y含有锆。
5.一种排气净化用催化剂,其具有:
复合氧化物催化剂,所述复合氧化物催化剂含有稀土元素、碱土元素、锆和贵金属,稀土元素的一部分与锆的一部分与碱土元素的至少一部分形成复合氧化物,该复合氧化物与贵金属的一部分形成固溶体,其中所述复合氧化物催化剂负载的全部贵金属中形成固溶体的贵金属所占的比例在10%至80%的范围内;和
耐热性载体,所述耐热性载体负载所述复合氧化物催化剂,并且包含选自由通式AB2O4表示的第一复合氧化物、由通式LMO3表示的钙钛矿结构的第二复合氧化物和由通式X2Y2O7表示的烧绿石结构的第三复合氧化物组成的组中的至少一种复合氧化物;
并且元素A是碱土元素和/或过渡金属元素,元素B是选自由铝、镁和过渡金属元素组成的组中的至少一种元素并且与元素A不同,元素L是稀土元素和/或碱土元素,元素M是铝和/或过渡金属元素,元素X是稀土元素,元素Y是锆和/或钛。
6.权利要求5所述的排气净化用催化剂,其特征在于,所述耐热性载体含有所述第一复合氧化物,所述第一复合氧化物具有尖晶石结构,所述元素B含有铝。
7.权利要求5所述的排气净化用催化剂,其特征在于,所述耐热性载体含有所述第二复合氧化物,所述元素M含有铝。
8.权利要求5所述的排气净化用催化剂,其特征在于,所述耐热性载体含有所述第三复合氧化物,所述元素Y含有锆。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP370083/2005 | 2005-12-22 | ||
| JP2005370083A JP5216189B2 (ja) | 2005-12-22 | 2005-12-22 | 排ガス浄化用触媒 |
| PCT/JP2006/324460 WO2007072690A1 (ja) | 2005-12-22 | 2006-12-07 | 排ガス浄化用触媒 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN101300071A CN101300071A (zh) | 2008-11-05 |
| CN101300071B true CN101300071B (zh) | 2013-04-24 |
Family
ID=38188471
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2006800407079A Expired - Fee Related CN101300071B (zh) | 2005-12-22 | 2006-12-07 | 排气净化用催化剂 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US7956005B2 (zh) |
| EP (1) | EP1964607A4 (zh) |
| JP (1) | JP5216189B2 (zh) |
| CN (1) | CN101300071B (zh) |
| WO (1) | WO2007072690A1 (zh) |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5216189B2 (ja) * | 2005-12-22 | 2013-06-19 | 株式会社キャタラー | 排ガス浄化用触媒 |
| JP4435750B2 (ja) * | 2006-03-30 | 2010-03-24 | 株式会社キャタラー | 排ガス浄化用触媒及びその製造方法 |
| CN101484240B (zh) * | 2006-07-06 | 2012-10-24 | 卡塔勒公司 | 储氧材料 |
| CN105561996A (zh) * | 2007-02-08 | 2016-05-11 | 大发工业株式会社 | 催化剂组合物 |
| JP4784775B2 (ja) * | 2008-02-20 | 2011-10-05 | 三菱自動車工業株式会社 | 内燃機関の排気浄化装置 |
| EP2322274B1 (en) | 2008-09-02 | 2014-03-12 | Nissan Motor Co., Ltd. | Exhaust gas purifying catalyst and method for producing the same |
| WO2010064497A1 (ja) * | 2008-12-03 | 2010-06-10 | 第一稀元素化学工業株式会社 | 排気ガス浄化触媒、それを用いた排気ガス浄化装置、及び排気ガス浄化方法 |
| EP2436442B1 (en) | 2009-05-27 | 2018-04-11 | Cataler Corporation | Method for manufacturing an exhaust gas-purifying catalyst |
| EP2457653A4 (en) * | 2009-07-24 | 2014-03-19 | Cataler Corp | EMISSION CONTROL CATALYST |
| JP5551518B2 (ja) * | 2010-05-26 | 2014-07-16 | ダイハツ工業株式会社 | 排ガス浄化用触媒およびその製造方法 |
| US8226915B2 (en) * | 2010-11-29 | 2012-07-24 | GM Global Technology Operations LLC | Coated perovskite-based catalysts, catalyst combinations and methods of treating a gas stream |
| JP5833965B2 (ja) * | 2012-04-05 | 2015-12-16 | トヨタ自動車株式会社 | 複合酸化物とその製造方法および排ガス浄化触媒 |
| CN103263928B (zh) * | 2013-05-17 | 2015-10-28 | 南京工业大学 | 一种低中温分解n2o的复合氧化物催化剂及其制备方法 |
| CN105899463B (zh) * | 2014-03-25 | 2018-04-13 | 第一稀元素化学工业株式会社 | 铈-锆系复合氧化物及其制造方法 |
| CN104117349A (zh) * | 2014-07-15 | 2014-10-29 | 温州大学 | 借助雾化乙醇辅助渗透高温热解制备碳纳米管阵列/过渡金属氧化物同轴结构材料的方法 |
| JP6611623B2 (ja) * | 2016-01-21 | 2019-11-27 | 株式会社キャタラー | 排ガス浄化用触媒 |
| US9868087B2 (en) * | 2016-03-31 | 2018-01-16 | Toyota Jidosha Kabushiki Kaisha | Core-shell oxide material, method for producing the same, and catalyst and method for purification of exhaust gas using the core-shell oxide material |
| CN111315476A (zh) * | 2017-11-13 | 2020-06-19 | 三井金属矿业株式会社 | 氮氧化物吸留材料和废气净化用催化剂 |
| WO2020179077A1 (ja) * | 2019-03-07 | 2020-09-10 | 中国電力株式会社 | 燃焼システム |
| CN113841009A (zh) | 2019-03-07 | 2021-12-24 | 中国电力株式会社 | 燃烧系统 |
| EP3936766B1 (en) | 2019-03-07 | 2024-01-17 | The Chugoku Electric Power Co., Inc. | Combustion system having a vanadium oxide denitration catalyst |
| WO2020246140A1 (ja) * | 2019-06-06 | 2020-12-10 | 株式会社村田製作所 | 有機物分解用触媒および有機物分解装置 |
| CN111422839A (zh) * | 2020-04-24 | 2020-07-17 | 苏州星烁纳米科技有限公司 | 一种惰性气体处理装置及制作方法 |
| CN112844381B (zh) * | 2021-02-01 | 2021-12-14 | 四川大学 | 镁铝尖晶石改性的Pt基汽车尾气催化剂及制备方法和应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4921829A (en) * | 1987-12-22 | 1990-05-01 | Kabushiki Kaisha Toyota Chuo Kenkyusho | Catalyst for purifing exhaust gases |
| CN1241988A (zh) * | 1996-12-27 | 2000-01-19 | 阿南化成株式会社 | 锆-铈系复合氧化物及其制造方法以及废气净化用助催化剂 |
| JP2004290723A (ja) * | 2003-03-25 | 2004-10-21 | Toyota Central Res & Dev Lab Inc | 排ガス浄化用触媒 |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4049583A (en) * | 1974-04-25 | 1977-09-20 | E. I. Du Pont De Nemours And Company | Metal oxide catalytic compositions having perovskite crystal structures and containing metals of the platinum group |
| JP2537239B2 (ja) * | 1987-08-28 | 1996-09-25 | エヌ・イーケムキヤツト 株式会社 | 耐熱性に優れた内燃機関排気ガス浄化用触媒及びその製造方法 |
| US5622680A (en) * | 1990-07-25 | 1997-04-22 | Specialites Et Techniques En Traitement De Surfaces-Stts | Post-combustion catalysts |
| JPH04371229A (ja) * | 1991-06-17 | 1992-12-24 | Matsushita Electric Ind Co Ltd | 触媒組成物 |
| JPH0675675A (ja) | 1991-06-24 | 1994-03-18 | Mitsubishi Electric Corp | キーボード |
| JP3144880B2 (ja) * | 1992-02-14 | 2001-03-12 | ダイハツ工業株式会社 | 低温活性に優れた三元触媒の製造方法 |
| JP2581872B2 (ja) | 1992-05-15 | 1997-02-12 | エヌ・イーケムキャット株式会社 | 耐熱性に優れた内燃機関排気ガス浄化用触媒及びその製造方法 |
| JPH0699069A (ja) * | 1992-09-18 | 1994-04-12 | Cataler Kogyo Kk | 排気ガス浄化用触媒 |
| EP0705134B1 (en) * | 1993-06-25 | 1999-04-14 | Engelhard Corporation | Layered catalyst composite |
| US5559073A (en) * | 1994-09-26 | 1996-09-24 | Beijing Huaxia Environmental Protection Company | Pollution control catalyst with mutual protective distributed-active-combinations each including noble-metal-atoms stably structured and protected therein |
| JP3304771B2 (ja) * | 1995-07-20 | 2002-07-22 | トヨタ自動車株式会社 | 排ガス浄化用触媒 |
| US5977017A (en) * | 1996-04-10 | 1999-11-02 | Catalytic Solutions, Inc. | Perovskite-type metal oxide compounds |
| US20010026838A1 (en) * | 1996-06-21 | 2001-10-04 | Engelhard Corporation | Monolithic catalysts and related process for manufacture |
| US6350421B1 (en) * | 1998-08-24 | 2002-02-26 | Dmc2 Degussa Metals Catalysts Cerdec Ag | Nitrogen oxide storage material and nitrogen oxide storing catalyst prepared therefrom |
| JP2000169148A (ja) | 1998-12-02 | 2000-06-20 | Daihatsu Motor Co Ltd | セリウム系複合酸化物 |
| JP3846139B2 (ja) * | 1999-04-22 | 2006-11-15 | トヨタ自動車株式会社 | 排ガス浄化用触媒およびそれを用いた排ガス浄化方法 |
| JP3757715B2 (ja) | 1999-11-09 | 2006-03-22 | トヨタ自動車株式会社 | 排気ガス浄化用触媒 |
| JP2001224963A (ja) * | 2000-02-16 | 2001-08-21 | Nissan Motor Co Ltd | 触媒組成物、その製造方法及びその使用方法 |
| EP1533031B1 (en) * | 2002-07-09 | 2010-04-14 | Daihatsu Motor Co., Ltd. | Catalyst for clarifying exhaust gas |
| JP2004041868A (ja) * | 2002-07-09 | 2004-02-12 | Daihatsu Motor Co Ltd | 排ガス浄化用触媒 |
| US7071141B2 (en) * | 2002-10-24 | 2006-07-04 | Ford Global Technologies, Llc | Perovskite catalyst system for lean burn engines |
| WO2005058490A1 (ja) * | 2003-12-17 | 2005-06-30 | Daihatsu Motor Co.,Ltd. | 触媒組成物 |
| JP4204487B2 (ja) * | 2004-01-21 | 2009-01-07 | 本田技研工業株式会社 | 排ガス浄化触媒及びその製造方法、並びに車用排ガス浄化触媒装置 |
| US20050164879A1 (en) * | 2004-01-28 | 2005-07-28 | Engelhard Corporation | Layered SOx tolerant NOx trap catalysts and methods of making and using the same |
| JP4959129B2 (ja) * | 2004-02-16 | 2012-06-20 | 株式会社キャタラー | 排ガス浄化用触媒 |
| JP5106748B2 (ja) * | 2004-11-08 | 2012-12-26 | 株式会社キャタラー | 排ガス浄化用触媒 |
| JP5216189B2 (ja) | 2005-12-22 | 2013-06-19 | 株式会社キャタラー | 排ガス浄化用触媒 |
-
2005
- 2005-12-22 JP JP2005370083A patent/JP5216189B2/ja not_active Expired - Fee Related
-
2006
- 2006-12-07 WO PCT/JP2006/324460 patent/WO2007072690A1/ja active Application Filing
- 2006-12-07 EP EP06834215A patent/EP1964607A4/en not_active Withdrawn
- 2006-12-07 CN CN2006800407079A patent/CN101300071B/zh not_active Expired - Fee Related
-
2008
- 2008-03-28 US US12/058,654 patent/US7956005B2/en not_active Expired - Fee Related
-
2011
- 2011-04-21 US US13/092,022 patent/US8187996B2/en not_active Expired - Fee Related
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4921829A (en) * | 1987-12-22 | 1990-05-01 | Kabushiki Kaisha Toyota Chuo Kenkyusho | Catalyst for purifing exhaust gases |
| CN1241988A (zh) * | 1996-12-27 | 2000-01-19 | 阿南化成株式会社 | 锆-铈系复合氧化物及其制造方法以及废气净化用助催化剂 |
| JP2004290723A (ja) * | 2003-03-25 | 2004-10-21 | Toyota Central Res & Dev Lab Inc | 排ガス浄化用触媒 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP5216189B2 (ja) | 2013-06-19 |
| WO2007072690A1 (ja) | 2007-06-28 |
| EP1964607A4 (en) | 2011-01-19 |
| US8187996B2 (en) | 2012-05-29 |
| US7956005B2 (en) | 2011-06-07 |
| JP2007167780A (ja) | 2007-07-05 |
| US20110207601A1 (en) | 2011-08-25 |
| US20080182746A1 (en) | 2008-07-31 |
| EP1964607A1 (en) | 2008-09-03 |
| CN101300071A (zh) | 2008-11-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101300071B (zh) | 排气净化用催化剂 | |
| JP4959129B2 (ja) | 排ガス浄化用触媒 | |
| CN101489672B (zh) | 排气净化用催化剂 | |
| EP1729872B1 (en) | Nitrogen oxide storage catalyst | |
| CN101198404B (zh) | 废气净化催化剂 | |
| EP1946834A1 (en) | Catalyst carrier particle, exhaust gas purifying catalyst, and methods for producing those | |
| CN100479920C (zh) | 排气净化催化剂 | |
| EP3708541B1 (en) | Oxygen absorbing and releasing material, catalyst, exhaust gas purifying system, and exhaust gas treatment method | |
| CN101111310B (zh) | 废气净化催化剂 | |
| CN101484240B (zh) | 储氧材料 | |
| CN101410179B (zh) | 废气净化用催化剂及其制造方法 | |
| CN101460243B (zh) | 排气净化用催化剂及其制造方法 | |
| JP5118885B2 (ja) | 酸素吸放出材及びそれを含む排ガス浄化用触媒 | |
| JP2010022892A (ja) | 排ガス浄化用触媒 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20130424 Termination date: 20161207 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |