CAMPO DA INVENÇÃO.
A presente invenção refere-se a um dispositivo polimérico de deposição implantável que é facilmente incorporado no espaço subcutâneo, é removido se surgir a necessidade, e se degrada quando a função de liberação de fármacos está terminada. Um ou múltiplos fármacos podem ser incorporadas. O dispositivo apresenta um grau da flexibilidade fazendo com que o carregamento de fármaco e as propriedades do polímero selecionadas para a matriz possam ser individualmente moldados para que a fármaco possa atender as necessidades específicas do paciente.
ANTECEDENTES DA INVENÇÃO
Os dispositivos implantáveis para liberação de fármacos são co-nhecidos na técnica. O dispositivo é cirurgicamente implantado no corpo de um paciente humano ou veterinário e o fármaco é liberado em uma maneira eficaz. Tais sistemas implantáveis de liberação de fármaco são particularmente úteis para liberar fármacos em taxas seguras durante períodos prolongados de tempo. Os exemplos de implantes de liberação de fármacos deste tipo incluem Norplant®, Lupron Depot®, e Gliadel Wafer®.
Nos sistemas implantáveis de liberação de fármaco conhecidos da técnica o ingrediente ativo é incorporado em um material matriz que é moldado em uma forma cilíndrica de tamanho pequeno o suficiente para permitir a implantação subcutânea via uma agulha oca. Uma desvantagem associada com tais sistemas de liberação é que há um intervalo de tempo entre a implantação e a liberação do fármaco porque os fluidos corporais têm de penetrar o implante e começar a decompor a matriz polimérica. Isto também muitas vezes leva a irregularidades no padrão de liberação.
Além disso, nenhum dos tais sistemas foi projetado para liberar dois ou mais fármacos simultaneamente. A utilidade de um sistema implan- tável de liberação de fármaco seria dramaticamente aumentada quando estivesse disponível. Muitas vezes um estado de doença é mais eficazmente abordado quando o tratamento inclui dois ou mais agentes ativos que possam atuar juntamente em um modo mais abrangente, sinergístico, ou mais brando. Um exemplo disto seria o tratamento ou a prevenção de infecções onde os membros de duas classes diferentes de antibióticos fossem liberados de um sistema de deposição único. A atividade de cada antibiótico visa cepas bacterianas diferentes e dessa maneira fornece uma terapia mais abrangente. Outro exemplo da utilidade estaria na liberação de fármacos a- nalgésícos. A liberação sustentada do analgésico pode fornecer períodos de tempo muito longos sem dor ao paciente, que é uma melhora significativa sobre os picos e os vales das concentrações plasmáticas do fármaco que é inerente à terapia oral. Entretanto, a liberação sustentada de múltiplos fármacos analgésicos que tenham mecanismos separados da ação pode resultar na gestão da dor significativamente melhorada.
Um exemplo bem mais convincente de uma deposição de multi- fármaco pode ser encontrado no tratamento de doenças contagiosas, por exemplo, HIV (Vírus da Imunodeficiência Humana) e HBV (Hepatite B Vírus). A terapia padrão do HIV necessita de um "coquetel" de pelo menos três fármacos. A terapia do HIV com liberação sustentada pode contribuir significativamente para a complacência da terapia (reduzindo o fardo das pílulas) e reduzindo o risco do desenvolvimento de resistência a produtos terapêuticos ativos. O valor desse tipo de terapia também aumentaria se a formulação de liberação sustentada implantável contivesse todos os componentes do coquetel de fármacos em vez de ter uma delas com liberação sustentada e as outras permanecessem como uma terapia oral. Outras doenças contagiosas que se beneficiariam deste tipo de terapia são a malária, a influenza, TB e a Hepatite C. Uma deposição de multifármaco também pode ser usada em uma colocação de pré-exposição de populações de alto risco, por exemplo, profilaxia de pré-exposição da infecção por HIV.
Dissociar a formulação dos dois ativos em processos separados pode melhorar substancialmente a estabilidade, aumentar o carregamento de fármaco de cada, e introduz composicionalmente a flexibilidade onde um fármaco pode ser formulado para liberar mais rápido ou mais devagar ou um fármaco é aumentado ou reduzido na dosagem dependendo da posição do paciente.
A capacidade de remover o dispositivo após a implantação é im-portante já que muitos dos fármacos usados nas aplicações de liberação sustentadas são potentes e podem causar reações severas e mesmo fatais. Mesmo a compressão das micropartículas ou pelotas juntamente em uma unidade como descrito na US2001/0026804 não garante que o dispositivo seja removível já que uma vez que o dispositivo esteja em contato com o meio fisiológico as pelotas ou as micropartículas irão logo se separar umas das outras tornando impossível remove-las completamente. A US2004/0082937 descreve um dispositivo implantável de liberação controlada de um hormônio. O dispositivo compreendendo um substrato com uma multiplicidade de reservatórios em que cada um contém um sistema de liberação que é eletricamente controlável. A US2006/0269475 descreve um polímero com estrutura multicamada possuindo um padrão especial microfabricado predeterminado compreendendo os reservatórios pre-determinados e os canais contendo o fármaco. O polímero com estrutura multicamada é biodegradável, mas tem uma vida útil mais longa do que a duração do produto terapêutico que é liberado. O padrão geométrico da es-trutura do polímero controla a liberação do produto terapêutico enquanto persiste durante a liberação do produto terapêutico. O dispositivo é preparado em camadas que são fundidas juntas em temperatura elevada, que pode causar significante deformação na forma de reservatório levando a alterações significativas no carregamento total do fármaco no dispositivo ou taxa de liberação do fármaco. Além disso, esta aproximação de vazio ou canal do carregamento do dispositivo com o fármaco tem uma capacidade limitada do fármaco.
BREVE DESCRIÇÃO DAS FIGURAS.
Figura 1. A poli(dioxanona) extrudada e tubo usinado a laser. O diâmetro dos orifícios é 50 microns, o número de séries de orifícios é 40, o número de orifícios por linha é 60. O número total de orifícios é 2400. O comprimento total do tubo é 30 mm e o comprimento total do tubo contendo os orifícios é 20 mm. O diâmetro interno do tubo é 3 mm.
Figura 2. . A seção transversal de um tubo de poli(dioxanona) que foi ele- trospinado. A espessura da parede é de 500 microns. O diâmetro interno é de 2 mm.
Figura 3. A superfície de um tubo de poli(dioxanona) que foi eletrospinado. As fibras são aleatoriamente orientadas e o tamanho das aberturas formadas pela rede de fibra está numa faixa de 1 a 20 microns.
Figura 4. Micrografias óticas de micropartículas contendo 70% (p/p) de TMC278 e 30% (p/p) de PLGA 50/50 1A. A ampliação é de 100X.
Figura 5. Micrografia ótica de micropartículas contendo 70% (p/p) de TMC114 e 30% (p/p) de PLGA 50/50 2A. A ampliação é de 500x.
Descrição da Invenção.
A presente invenção se refere a um implante degradável, removível, farmacêutico para liberação sustentada de um ou mais fármacos em um paciente, em que o implante farmacêutico é composto de um tubo com-preendendo uma parede exterior feita de um polímero degradável comple-tamente circundante a uma cavidade, em que a parede exterior tem uma multiplicidade de aberturas e em que a cavidade contém um ou mais conjuntos de micropartículas, cujas micropartículas contêm um agente ativo ou uma combinação de dois ou mais agentes ativos, e em que o tamanho das micropartículas é selecionado de tal modo que a maioria das micropartículas não pode passar pelas aberturas.
O tubo é composto de um polímero degradável. As micropartículas contendo um ingrediente ativo ou uma combinação de dois ou mais in-gredientes ativos e são concebidas de tal modo que elas liberam o ingrediente ativo quando em contato com os fluidos corporais. O polímero degradável do qual o tubo é feito é selecionado de tal modo que ele substancialmen- te não se degrada antes que a liberação do ingrediente ou ingredientes ativos das micropartículas seja substancialmente completa. A seleção do tipo de micropartículas e as suas quantidades relativas são predicadas nas ne-cessidades específicas do paciente.
Tal como aqui utilizado, o termo degradável ou biodegradável significa degradável pelo paciente, em particular um animal, mais particular-mente um ser humano, transportando o implante da presente invenção. O processo de degradação no paciente pode ser, por exemplo, um processo enzimático ou hidrolítico.
Em uma modalidade o tubo contém dois ou mais conjuntos de micropartículas, cada conjunto contém um ingrediente ativo diferente. Isto leva em conta um sistema de multideposição onde uma combinação de fármacos tem de ser administrada. Em uma modalidade específica o sistema de multideposição contém pelo menos dois, e em particular três, agentes anti-HIV e o implante é usado na terapia anti-HIV, que é baseada na administração de uma combinação de agentes anti-HIV.
Assim, uma modalidade da presente invenção se refere a um implante degradável, removível, farmacêutico para liberação sustentada de uma fármaco em um paciente, em que o implante farmacêutico é composto de um tubo compreendendo uma parede exterior feita de um polímero degradável completamente circundante a uma cavidade, em que a parede exterior tem uma multiplicidade de aberturas e em que a cavidade contém um ou mais conjuntos de micropartículas, cujas micropartículas contendo o dito fármaco, e em que o tamanho das micropartículas é selecionado de tal modo que a maioria das micropartículas não pode passar pelas aberturas. Particularmente, a cavidade contém um conjunto de micropartículas, cujas micropartículas contêm o fármaco.
Uma modalidade da presente invenção se refere a um implante degradável, removível, farmacêutico para liberação sustentada de doiss fár-macos em um paciente, em que o implante farmacêutico é composto de um tubo compreendendo uma parede exterior feita de um polímero degradável completamente circundante a uma cavidade, em que a parede exterior tem uma multiplicidade de aberturas e em que a cavidade contém dois conjuntos de micropartículas, cada conjunto de micropartículas contendo um fármaco diferente, e em que o tamanho das micropartículas é selecionado de tal modo que a maioria das micropartículas não pode passar pelas aberturas.
Uma modalidade da presente invenção se refere a um implante degradável, removível, farmacêutico para liberação sustentada de dois ou mais fármacos em um paciente, em que o implante farmacêutico é composto de um tubo compreendendo uma parede exterior feita de um polímero degradável completamente circundante a uma cavidade, em que a parede exterior tem uma multiplicidade de aberturas e em que a cavidade contém um ou mais conjuntos de micropartículas, cujas micropartículas contêm os ditos fármacos, em que o grupo de micropartículas contém todos os fármacos, contém uma combinação de dois ou mais fármacos, mas não todos os fármacos, ou contém uma fármaco, e em que o tamanho das micropartículas é selecionado de tal modo que a maioria das micropartículas não pode passar pelas aberturas. Em uma modalidade, quando o grupo de micropartículas contém todos os fármacos, depois preferivelmente só um conjunto de micropartículas está presente no implante. Em uma modalidade, cada conjunto de micropartículas contém um fármaco diferente.
A parede do tubo contém aberturas para permitir ao fluido fisiológico penetrar a cavidade interior que assim permite o fluido fisiológico para extrair o fármaco ou fármacos das micropartículas e adicionalmente facilitar a difusão do fluido fisiológico carregado com a fármaco do interior do tubo ao exterior. As aberturas são formadas para permitir que o fluido fisiológico possa penetrar, mas são demasiado pequenas para que as micropartículas possam escapar do interior do tubo. Algumas das micropartículas podem deixar o implante, mas o tamanho das aberturas e o tamanho das micropartículas são projetados de tal modo que a maior parte das micropartículas fica presa na cavidade do implante. Uma maior parte das micropartículas estando presas na cavidade do implante significa que pelo menos 85% (p/p) das micropartículas estão presas na cavidade do implante; preferivelmente pelo menos 90% (p/p); mais preferivelmente pelo menos 95% (p/p); mesmo mais preferivelmente pelo menos 98% (p/p) ou 99% (p/p) das micropartículas são presas na cavidade do implante. Em uma modalidade, o tamanho das mi-cropartículas é selecionado de tal modo que as micropartículas não podem passar pelas aberturas.
Onde mais de um conjunto de micropartículas está presente, cada conjunto de micropartículas pode ser projetado para degradar por uma faixa de variação de taxas variando as propriedades do polímero usado na produção de cada uma das micropartículas no conjunto. Isso assegura a liberação de fármacos por uma faixa de variação sustentada de tempo. A taxa de degradação do polímero que compõe o tubo cilíndrico é mais lenta do que a taxa da degradação das micropartículas. Isto assegura que o implante com o seu conteúdo pode ser removido no caso de eventos adversos.
Assim, o implante degradável removível implantável da presente invenção funciona como um sistema de deposição que pode liberar um ou mais ingredientes ativos durante um período de tempo sustentado. O implante da invenção é um tubo perfurado que contém um ou mais conjuntos de micropartículas, cada conjunto de micropartículas contendo um ou mais agentes ativos. A seleção dos tipos de ingredientes ativos a serem liberados bem como a taxa pela qual eles são liberados pode ser moldada às necessidades de um paciente,
O tubo que envolve as micropartículas é composto de um polímero biodegradável biocompatível. É necessário selecionar o material de composição do tubo cuidadosamente, de tal modo que o tubo degrade após as micropartículas terem degradado, isto permite a remoção do sistema de liberação de fármacos no caso de um evento adverso. O polímero biodegradável prontamente rompe em pequenos segmentos quando exposto ao tecido úmido do corpo. Os segmentos depois são absorvidos pelo corpo ou passados pelo corpo. Mais particularmente, os segmentos biodegradados não eliciam a reação crônica permanente do corpo contra um corpo estranho, porque eles são absorvidos pelo corpo ou passados do corpo, de tal modo que nenhum traço permanente ou o resíduo do segmento é conservado pelo corpo. O polímero biodegradável também pode ser mencionado como polí- mero bioabsorvível e ambos os termos podem ser usados de modo alterná- vel dentro do contexto da presente invenção.
Os polímeros adequados biocompatíveis, biodegradáveis, com-preendem o poliéster alifático, poli(aminoácidos), copoli(éter-ésteres), oxala- to de polialquileno, poliamida, poli(iminocarbonatos), poli(ortoésteres), polio- xoésteres, poliamidoésteres, polioxoésteres contendo grupos amina, po- li(anidridos), polifosfazenos, e misturas dos mesmos. Para os objetivos da presente invenção os poliésteres alifáticos incluem, mas não estão limitados a homopolímeros e copolímeros do lactídio (que incluem d-, I- e meso-ácido lático, e d-, I- e meso-lactídio), glicolídio (incluindo o ácido glicólico), a épsi- lon-caprolactona, p-dioxanona (1,4-dioxanona-2), e carbonato de trimetileno. Em uma modalidade, os polímeros biocompatíveis biodegradáveis são copolímeros do lactídio (que incluem d-, I- e meso-ácido lático, e d-, I- e meso- lactídio) e glicolídio (incluindo o ácido glicólico). Em outra modalidade, o polímero biocompatível biodegradável é um homopolímero da poli(dioxanona).
Em uma modalidade o tubo é fabricado por fiação eletrostática. A fiação eletrostática usa uma força elétrica para transformar soluções de polímero em fibras. As fibras giradas são excessivamente finas e são aleatoriamente orientadas em todas as direções. As fibras podem ser giradas em um mandril de tal modo que as fibras sejam continuamente acrescentadas até que um tubo seja construído. O diâmetro do mandril determina o diâmetro interno do tubo, de um ponto de vista prático devendo ser capaz de conter micropartículas suficientes e ser facilmente implantável através de um trocar, o diâmetro do mandril deve variar preferivelmente de 1 a 5 mm.
A espessura das fibras pode ser controlada pela concentração do polímero usado na solução que sofre a fiação eletrostática. Entretanto, uma concentração de polímero mínima é necessária para fibras viáveis e depois de certa concentração de polímero não é mais possível girar fibras viáveis. Embora a faixa de variação possa variar com a viscosidade inerente do polímero, uma faixa de variação típica é de 1 % a 30% (p/v).
Como mencionado acima o desenho do tubo é de tal modo que pode ser removido completo com o seu conteúdo no caso de um evento ad verso. A remoção é realizada apalpando a área da implantação, encontrando o tubo pelo toque, cortando uma pequena incisão na pele adjacente ao tubo e arrancando o tubo através da incisão. Há necessidade de que o tubo tenha as propriedades mecânicas de permanecer intacto durante este processo. A viscosidade inerente do polímero usado para fabricar o tubo é o fator mais critico para influir nas propriedades mecânicas. O faixa de variação da viscosidade inerente para atingir propriedades mecânicas adequadas é preferivelmente de 1,5 a 2,5 dl/g.
A porosidade de um tubo eletrostaticamente girado (as aberturas de um tubo eletrostaticamente girado) é controlada em ampla escala pela espessura das paredes do tubo e pelo diâmetro da fibra girada. As paredes mais grossas são preparadas tendo mais fibras acumuladas no mandril criando uma maior espessura. Devido à orientação aleatória das fibras na rede que é formada conforme mais fibras são acrescentadas, a porosidade total do tubo se reduz. A porosidade é necessária já que fornece um meio de penetração do fluido fisiológico circundante ao tubo para facilitar a difusão do agente ativo ou agentes das micropartículas dentro do mesmo. A porosidade é uma medida dos espaços vazios em um material, e é definida como a fração ou percentagem do volume total ocupado pelos mínimos espaços abertos. Na forma de equação, a porosidade é o volume de vazios divididos pelo volume total expressado como uma fração, entre 0 e 1, ou como uma percentagem, entre 0 e 100 %. Deve haver limites de porosidade já que as micropartículas devem estar contidas dentro do interior do tubo. Alternativa- mente, a porosidade não pode ser minimizada ao ponto que o fluido fisiológico seja impedido de penetrar no interior do tubo. De maneira ideal a porosidade deve variar de 60 a 90% e isto pode ser realizado fabricando tubos com a espessura da parede que variam de 50 a 500 microns. Por exemplo, os poros que variam entre 1 e 20 microns podem ser obtidos com este método. Além disso, a espessura da parede não deve ser tão excessiva que iniba a flexibilidade do tubo.
Alternativamente, o tubo pode ser fabricado por um processo de extrusão seguido da perfuração por raio laser dos orifícios (aberturas) de tamanho predeterminado em um padrão predeterminado. Como descrito a- cima, o polímero que é usado para fabricar o tubo é biodegradável. Um polímero biodegradável preferível é aquele que é macio e por isso flexível. Os exemplos do polímero neste grupo preferível são polí(caprolactona) e po- li(dioxanona). Aqui, a seleção da viscosidade inerente do polímero é a mais importante. A viscosidade inerente deve ser aquela que forneça o polímero a ser facilmente extrudado e facilmente corroído por um raio laser de acordo com um padrão predeterminado. Na química de polímeros a viscosidade intrínseca é relacionada à massa de molar através da equação de Mark- Houwink. Um método prático da determinação da viscosidade intrínseca é com um viscosímetro Ubbelohde. A viscosidade inerente e a viscosidade intrínseca estão estreitamente relacionadas. A viscosidade intrínseca é definida como viscosidade inerente no limite da diluição infinita. Em um gráfico da viscosidade inerente contra a concentração da solução, a intercepção de y (em c = 0) é igual à viscosidade intrínseca. Como no caso do tubo eletros- taticamente girado o tubo deve ter propriedades mecânicas suficientes de modo que possa ser puxado para fora por uma pequena incisão se houver um evento adverso. A viscosidade inerente do polímero influi diretamente nas propriedades mecânicas do tubo. Para cumprir todos destes critérios a faixa de variação da viscosidade inerente do polímero deve variar preferivelmente de 0,5 a 5 dl/g.
Para atingir uma forma parecida a um tubo o polímero é extrudado de uma extrusora ajustada com um molde apropriadamente projetado. Para manter um diâmetro interno constante uma corrente de ar pode ser soprada no centro da tubulação. Alternativamente, a tubulação pode ser extru- dada ao longo de um mandril de um tamanho específico. Gomo no caso do tubo eletrostaticamente girado, o diâmetro interno pode variar de 1 a 5 mm. A espessura mínima da parede é preferivelmente de pelo menos 25 microns; abaixo desse valor a parede não terá integridade mecânica suficiente, e o manejo do tubo seria difícil. A espessura da parede máxima não deve exceder preferivelmente os 500 microns; acima este valor o espaço no interior do tubo será limitado já que o diâmetro total do tubo é limitado por um ajuste confortável no espaço subcutâneo. Além disso, em grandes espessuras da parede, a flexibilidade do tubo será reduzida comprometendo também o con-forto do paciente, e o aumento no caminho de difusão pode reduzir a taxa de difusão do(s) componente(s) ativo(s) desde o interior do tubo. O faixa de va-riação preferida da espessura da parede é de 50 a 500 microns. O diâmetro exterior do tubo não deve exceder preferivelmente 5 mm; acima este valor o implante será demasiado grande para ajustar confortavelmente sob a pele.
Os poros (aberturas) são corroídos através da parede da tubulação utilizando um processo de corrosão com raio laser de baixa energia. O tubo precursor é montado em uma unidade de processamento de raio laser e submetido à energia de um feixe de raio laser de modo a formar um dispositivo implantável possuindo a geometria desejada ou o padrão comunicado ao mesmo. A baixa energia é importante para evitar o aquecimento do polímero que pode resultar na reprodutibilidade reduzida no formato e no diâmetro do poro ou até levar a uma degradação do polímero. Os orifícios ou os poros têm um diâmetro mínimo de 10 microns na superfície externa do tubo, o poro de diâmetro menor que o raio laser pode furar de uma maneira reprodutível. O limite superior do diâmetro pode ser determinado pelo tamanho das partículas. Para evitar a perda da maioria das micropartículas através dos poros é necessário que o diâmetro do poro na superfície interna do tubo seja menos que uma ordem de magnitude maior do que, ou seja, a mesma das micropartículas de diâmetros menores na distribuição de tamanhos de micropartículas usadas na formulação para empacotar o tubo. (Processo de erosão por raio laser pode resultar em poros com um diâmetro na superfície externa do tubo maior do que o diâmetro na superfície interna do tubo). O padrão dos orifícios é comunicado ao dispositivo pelo uso de uma máscara. Uma máscara possuindo a geometria ou o padrão desejados é colocada acima do substrato e um raio de raio laser comunica o padrão desejado para o substrato. A unidade de processamento de raio laser com-preende uma unidade de múltiplo movimento coordenado que move o feixe de raio laser em uma direção e o substrato em outra direção durante o processo de erosão. O feixe de raio laser é projetado através da máscara e a- blações do material bioabsorvível, comunicando assim ao dispositivo a geo-metria ou desenho que corresponde à máscara. Um gás inerte pode ser u- sado no ambiente de corte do raio laser para minimizar ou eliminar os efeitos referentes à umidade e ao oxigênio durante a redução do material por raio laser. Preferivelmente, o feixe de raio laser é também dirigido através de uma lente antes de atingir o material precursor. A lente intensifica o raio e comunica o padrão desejado ou geometria mais precisamente ao substrato. Um homogenizador de raio também pode ser usado para criar uma energia do feixe de raio laser mais uniforme e manter a coerência de energia do feixe de raio laser conforme o raio bate o substrato. A energia de raio pode ser controlada para reduzir o tempo de corte do raio laser.
Os poros também podem ser formados incluindo um semissólido miscível em água e, tensoativo, polímero ou sólido solúvel em água na parede do polímero. Os poros são formados quando a substância miscível ou solúvel em água é lixiviada para fora quando em contato com o meio aquoso. O processo de lixiviação para formar os poros pode ser feito antes da implantação, ou alternativamente pode ocorrer logo após a implantação quando o meio fisiológico entra em contato com a superfície do tubo. As substâncias miscíveis ou solúveis em água adequadas incluindo fosfolipí- dios, ácidos graxos, Tweens, PEG.
As micropartículas carregadas com fármacos são preparadas para encher o interior do tubo. Por micropartícula carregada com fármaco se deseja significar uma partícula compreendendo um fármaco fisicamente introduzida em um polímero e possuindo um tamanho de partícula menor do que 1.000 microns. As micropartículas podem ser microesferas, microcápsu- las, ou microgrânulos. Por microesfera se deseja significar uma micropartícula substancialmente esférica onde a fármaco é uniformemente dissolvida ou aprisionada no polímero. Por microcápsula se deseja significar uma partícula substancialmente esférica onde a fármaco é revestida com um polímero. Por microgrânulo se deseja significar uma micropartícula de forma irregular em que o composto ativo é uniformemente dissolvido ou aprisionado no polímero.
A distribuição de tamanho de partícula das micropartículas prefe-rivelmente varia entre de aproximadamente 1 e 1.000 microns, mais preferi-velmente entre de aproximadamente 10 e de aproximadamente 500 microns, e bem mais preferivelmente entre de aproximadamente 25 e de aproximadamente 250 microns.
O tamanho das micropartículas ou a distribuição de tamanhos de partícula pode ser medido ou determinado por técnicas bem conhecidas para a pessoa versada, tal como, por exemplo, por difração de raio laser ou microscopia. Como indicado acima, o tamanho da micropartícula está prefe-rivelmente ligado ao tamanho das aberturas do tubo, de tal modo que os dois são coordenados para confinar as micropartículas dentro do tubo.
Para minimizar o faixa de variação da distribuição de tamanho de partícula das micropartículas, as micropartículas podem ser peneiradas antes de serem incorporadas nos implantes da presente invenção. Peneirar das micropartículas pode ser realizado usando, por exemplo, as peneiras de rede típicas bem conhecidas para uma pessoa versada.
As micropartículas carregadas de fármaco podem ser preparadas usando qualquer um do grande número de processos conhecidos. O processo preferido, preferido porque ele produz micropartículas com elevadas cargas de fármaco, é o método do disco giratório, tal como o processo descrito na US 7261529. Para acomodar tanto fármaco no espaço menor possível, minimizando o tamanho final do implante, recomenda-se altamente atingir cargas de pelo menos 10% (p/p). As cargas de fármaco de 60 a 80% (p/p) são preferidas. Para preparar as micropartículas, o polímero está tipicamente em solução em um solvente adequado. Os solventes adequados incluem a acetona, o acetato de etila, o clorofórmio, o cloreto de metileno. O fármaco está tipicamente em solução ou suspensão no solvente adequado.
Outro método para preparar micropartículas carregadas do fármaco é o método de emulsão. Para preparar micropartículas usando um método de emulsão, o agente ativo é acrescentado a uma solução orgânica de polímero em um sólido ou em estado de solução. A agitação rápida ou o ultrassom dispersam uniformemente o agente ativo em todas as partes da so- lução de polímero. A solução orgânica é posteriormente vazada em uma so-lução aquosa contendo tensoativo para formar gotículas de polímero dentro da fase aquosa e pela agitação continuamente o solvente orgânico é evaporado. A mistura é depois transferida para um grande tonel de água e a mistura continua extraindo o solvente restante e endurecendo as gotículas em micropartículas. As micropartículas carregadas do fármaco podem ser coletadas por filtração.
O termo fármaco tem o significado de incluir todas as substâncias que afetam a alguma resposta biológica. O termo fármaco abrange fármacos úteis para qualquer mamífero incluindo, mas não limitado a, seres humanos. O termo fármaco incluí, mas não é limitado, às seguintes classes de fármacos: fármacos terapêuticos, fármacos preventivos, e fármacos diagnósticos. Os exemplos de fármacos que podem ser incorporados na matriz de polímero são narcóticos aliviadores da dor, sais de ouro, corticosteroides, hormônios, agentes antimalárica, derivados do indol, fármacos para tratamento de artrite, antibióticos, fármacos de enxofre, fármacos antitumorais, fármacos para controle de vícios, fármacos para controle de peso, fármacos para regulação da tireoide, analgésicos, fármacos anti-hipertensivas, agentes anti-inflamatórios, antitussígenos, antiepiléticos, antidepressivos, agentes antiarrítmicos, vasodilatadores, diuréticos de anti-hipertensivo, agentes anti- diabéticos, anticoagulantes, agentes antituberculares, agentes para o tratamento de psicoses, agentes para tratamento da doença de Alzheimer, agentes para o tratamento de distúrbios ou síndromes do sistema nervoso central, fármacos anti-HIV, agentes anti-TB, agentes para o tratamento da hepatite, agentes para o tratamento da hepatite. A lista acima não tem o significado de ser abrangente e é simplesmente representativa da grande variedade de fármacos que podem ser se incorporados nas micropartículas.
Aqui, os termos fármaco, ativo, agente ativo, ingrediente ativo, composto, composto ativo são usados de modo intercambiáveí.
Uma classe preferível de fármacos é a daquelas usadas no tra-tamento ou na prevenção do HIV, especialmente no tratamento do HIV. Estas incluem inibidores de protease (PI), inibidores da transcriptase reversa de não nucleosídio (NNRTIs), inibidores da transcriptase reversa de nucleo- sídio e nucelotídeo (NRTIs e NtRTIs). Outras classes são inibidores de entrada incluindo inibidores de fusão e inibidores integrase. Para o tratamento do HIV uma assim chamada Terapia Anti-Retroviral Altamente Ativa (HA- ART) é a combinação preferida. Estes tipicamente compreendendo uma cadeia principal de dois inibidores da transcriptase reversa de nucleosídio combinados com um NNRTI ou com um PI. A PI Muitas vezes é combinada com um assim chamado "reforço", tal como o ritonavir.
Uma modalidade se refere a um implante contendo o grupo de micropartículas compreendendo a rilpivirina NNRTI (também referida como "TMC278"), ou um sal farmaceuticamente aceitável dos mesmos, tal como o sal de ácido clorídrico. Preferido é a rilpivirina (=base livre).
Uma modalidade se refere um implante em que um conjunto de micropartículas contém um NRTI e outro conjunto de micropartículas contém um NNRTI.
Uma modalidade se refere um implante em que um conjunto de micropartículas contém um NNRTI e outro conjunto de micropartículas contém um PI.
Outra classe preferível de fármacos é daqueles que são usadas no tratamento da hepatite C. Estas incluem ribavirin, interferon, inibidores de protease do HCV (Hepatite C Vírus), inibidores de polimerase do HCV. Também aqui, as combinações são preferidas.
Uma modalidade se refere a um implante em que as micropartículas contêm pelo menos uma fármaco selecionada de um inibidor de HIV ou um inibidor HCV.
O polímero usado para fabricar as micropartículas é um polímero biocompatível, biodegradável. Polímeros biocompatível biodegradável ade-quados compreendem o poliéster de alifático, poli(aminoácidos), copoli(éter- ésteres), oxalato de polialquileno, poliamida, poli(iminocarbonatos), po- li(ortoésteres), polioxoésteres, poliamidoésteres, polioxoésteres contendo grupos amina, poli(anidridos), polifosfazenos, e misturas dos mesmos. Para os objetivos da presente invenção os poliésteres alifáticos incluem, mas não estão limitados a homopolimeros e copolímeros do lactídio (que incluem d-, I- e meso-ácido lático, e d-, I- e meso-lactídio), glicolídio (incluindo o ácido glicólico), a épsilon-caprolactona, p-dioxanona (1,4-dioxanona-2), e carbonato de trimetileno (1,3-dioxanona-2). Em uma modalidade, o polímero bio- 5 compatível biodegradável são os copolímeros do lactídio (que incluem d-, Ie meso-ácido lático, e d-, I- e meso-lactídio) e glicolídio (incluindo o ácido glicólico). Em outra modalidade, o polímero biocompatível biodegradável é um copolímero de lactídio e glicolídio com uma percentagem molar de lactídio que varia de 85% a 50 %.
Em uma modalidade da presente invenção as micropartículas contêm, além do polímero e uma ou mais fármacos, um tensoativo. Os ten- soativos são utilizados para melhorar a molhabilidade de componentes hi- drofóbicos e eles são moléculas tipicamente anfífílicas que contêm tanto - grupos hidrofílicos como lipofílicos. O número do equilíbrio de hidrofílico- lipofílico (HLB) é usado como uma medida da razão destes grupos. É um valor entre 0 e 60 definindo a afinidade de um tensoativo para água ou óleo. Os números de HLB são calculados para tensoativos não iônicos que usam os pesos moleculares das porções hidrofílicas e hidrofóbicas da molécula, e estes tensoativos têm números nos limites de 0 a 20. Os valores de HLB que 20 se associam com tensoativos iônicos não são calculados mas preferivelmente dão-lhes um valor baseado no seu comportamento de tensoativo relativo ou de comparação.
Os tensoativos com números HLB >10 têm uma afinidade para a água (hidrofílica) e os tensoativos com o número HLB <10 têm uma afini- 25 dade para o óleo (lipofílico).
Os tensoativos incluem tensoativos não iônicos e tensoativos iô-nicos. Os tensoativos iônicos incluindo catiônico, aniônico e tensoativos zwit- teriônicos, tais como os sais de ácido graxo, por exemplo, oleato de sódio, sódio sulfato laurílico, sódio sarcosinato laurílico, sulfossuccinato de dioctila 30 de sódio, sódio miristato, palmitato de sódio, estato de sódio, ricionoleato de sódio e similares; tal como sais de bile, por exemplo, colato de sódio, tauro- colato de sódio, glicocolato de sódio e similares; tal como fosfolipídios, por exemplo, ovo/lecitina de soja, lecitina hidroxilada, lisofosfatidilcolina, fosfati- dilcolina, etanolamína de fosfatidila, glicerol de fosfatidila, serina de fosfatidi- la e similares; tal como ésteres de ácidos fosfóricos, por exemplo, polioxieti- leno-10 de dietanolamônio fosfato de éter oleílico, produtos de esterificaçâo de etoxilados de álcoois graxos ou álcool graxos com ácido fosfórico ou ani- drido; tal como carboxilatos, por exemplo, monoglicerídios succinilados, sódio fumarato estearílico, succinato de hidrogênio de polietileno glicol de es- tearoila, ésteres de ácido de tratárico de mono/diacetilado de mono e díglice- rídios, ésteres de ácido cítrico de mono e diglicerídios, ésteres de gliceril- lacto de ácidos graxos, ésteres lactílicos de ácidos graxos, estearoil-2- lactilato de cálcio/sódio, estearoil lactilato de cálcio/sódio, sais de alginato, alginato de polietileno glicol, carboxilatos de éter e similares; tal como sulfato e sulfonatos, por exemplo, sulfato de alquila de etoxilado, sulfato de benzeno de alquila, sulfonatos de alfa-olefina , isotionatos de acila, tauratos de acila, sulfonatos de éter de gliceril de alquila, sulfossuccinato de octila dissódico, undecilenoamido-MEA-sulfossuccinato dissódico, dissódico e; tal como ten- soativos catiônicos, por exemplo, brometo de triamônio hexadecila, trimetil brometo de amónio decila, trimetil brometo de amónio cetílico, cloreto de amónio de dodecila, sais de benzildimetilamônio de alquila, sais de benzila- mônio de fenoxietoxidimetil de di-isobutila, sais de alquílpiridina, betaínas (betaína laurílica), aminas de etoxilado (polioxietileno-15 amina de coco) e similares.
Os tensoativos preferíveis na presente invenção são tensoativos não iônicos.
Os tensoativos não iônicos adequados que podem ser usados na presente invenção compreendem: a) monoésteres de ácido graxo de polietileno glicol compreendendo ésteres de ácido de láurico, ácido oleico, ácido esteárico, ácido rici- noico e similares com PEG 6, 7, 8, 9, 10, 12, 15, 20, 25, 30, 32, 40, 45, 50, 55, 100, 200, 300, 400, 600 e similares, por exemplo, laurato ou estearato de PEG-6, oleato ou laurato de PEG-7, laurato ou oleato ou estearato de PEG- 8, oleato ou estearato de PEG-9, laurato ou oleato ou estearato de PEG-10, laurato ou oleato ou estearato ou ricionoleato de PEG-12, estearato ou olea- to de PEG-15, laurato ou oleato ou estearato de PEG-20, estearato de PEG- 25, laurato ou oleato ou estearato de PEG-32, estearato de PEG-30, laurato ou oleato ou estearato de PEG-40, estearato de PEG-45, estearato de PEG- 5 50, estearato de PEG-55, oleato ou estearato de PEG-100, oleato de PEG- 200, oleato de PEG-400, oleato de PEG-600; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Cithrol, Algon, Kessco, Lauridac, Mapeg, Cremophor, Emulgante, Nikkol, Myrj, Crodet, Albunol, Lac- tomul); 10 b) diésteres de ácido graxo de polietileno glicol compreendendo diésteres de ácido de láurico, ácido esteárico, ácido palmico, ácido oleico e similares com PEG-8, 10, 12, 20, 32, 400 e similares, por exemplo, dilaurato ou diestearato de PEG-8, dipalmitato de PEG-10, dilaurato ou diestearato ou dioleato de PEG-12, dilaurato ou diestearato ou dilaurato de PEG-20, diolea- 15 to ou diestearato ou dioleato de PEG-32, dioleato ou diestearato PEG-400; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Mapeg, Polyalso, Kessco, Cithrol); c) mistura de mono e diéster de ácido graxo de polietileno glicol e misturas tal como por exemplo mono e dilaurato de PEG 4-150, mono e 20 dioleato de PEG 4-150, mono e diestearato de PEG 4-150 e similares; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Kessco); d) ésteres de ácido graxo de glicerol polietileno glicol tal como, por exemplo, gliceril laurato ou gliceril estearato ou gliceril oleato de PEG-20, 25 gliceril laurato ou gliceril oleato de PEG-30, gliceril laurato de PEG-15, gliceril laurato de PEG-40 e similares; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos comoTagat, Glycerox L, Capmul); e) produtos de transesterificação de óleo pelo álcool compreen-dendo ésteres de álcoois ou poliálcoois, tais como glicerol, propileno glicol, 30 etilenoglicol, propileno glicol, sorbitol, pentaeritritol e similares com óleos naturais e/ou hidrogenados ou vitaminas de óleo e solúveis, tais como-óleo de rícino,-óleo de rícino hidrogenado, vitamina A, a vitamina D, a vitamina E, a vitamina K, um óleo vegetal comestível, por exemplo, óleo de milho, azeite de oliva, óleo de amendoim, óleo de palma, óleo de damasco, óleo de a- mêndoa e similares, tal como PEG-20-óleo de rícino hidrogenado ou glicerí- dios de milho ou glicerídios de amêndoa, PEG-23-óleo de rícino, PEG-25- óleo de rícino hidrogenado ou trioleato, PEG-35-óleo de rícino, PEG-30-óleo de rícino hidrogenado, PEG-38-óleo de rícino, PEG-40-óleo de rícino hidrogenado ou óleo de palma, PEG-45-óleo de rícino hidrogenado, PEG-50-óleo de rícino hidrogenado, PEG-56-óleo de rícino, PEG-60-óleo de rícino hidrogenado ou glicerídios de milho ou glicerídios de amêndoa, PEG-80-óleo de rícino hidrogenado, PEG-100-óleo de rícino hidrogenado, PEG-200-óleo de rícino, PEG-8-glicerídios caprílicos/cápricos, PEG-6-glicerídios capríli- cos/cápricos, lauroil macrogol-32 glicerídio, estearoil macrogol glicerídio, to- coferil PEG-1000 succinato (TPGS); (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Emalex, Cremophor, Emulgante, Eumulgin.Nikkol, Thomley, Simulsol, Cerex, Crovol, Labrasol, Softigen, Ge- lucire, a Vitamina E TPGS); f) Os ácidos graxos poliglicerizados compreendendo ésteres de poliglicerol de ácidos graxos tal como, por exemplo, poligliceril 10 laurato ou oleato ou estearato, poligliceril 10 mono e dioleato, polirricinoleato de poligliceril e similares; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Nikkol Decaglyn, Caprol ou Polymuls); g) derivados de esterol compreendendo derivados de polietileno glicol do esterol, tais como PEG-24-éter de colesterol, PEG-30-colestanol, PEG-25-fito esterol, PEG-30-esterol de soja e similares; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Solulan® ou Nikkol BPSH); h) ésteres de ácido graxo de sorbitano de polietilenoglicol tal como por exemplo PEG-10-laurato de sorbitano, PEG-20-monolaurato de sorbitano ou triestearato de sorbitano ou mono-oleato de sorbitano ou trío- leato de sorbitano ou monoisoestearato de sorbitano ou monopalmiato de sorbitano ou monoestearato de sorbitano, PEG-4-monolaurato de sorbitano, PEG-5-mono-oleato de sorbitano, PEG-6-mono-oleato de sorbitano ou mo- nolaurato de sorbitano ou monoestearato de sorbitano, PEG-8- moπoestearato de sorbitano, PEG-30-tetraoleato de sorbitano, PEG-40 oleato de sorbitano ou tetraoleato de sorbitano, PEG-60 tetraestearato de sorbitano, PEG-80 monolaurato de sorbitano, hexaoleato de sorbitol de PEG (A- tlas G-1086) e similares; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Liposorb, Tween, Dacol MSS, Nikkol, Ema- lex, Atlas); i) éteres de alquila de polietileno glicol tal como, por exemplo, PEG-10 éter oleílico ou éter cetílico ou éter estearílico, PEG-20 éter oleílico ou éter cetílico ou éter estearílico, PEG-9 éter laurílico, PEG-23 éter laurílico (laureth-23), PEG-100 éter estearílico e similares; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Volpo, Brij); j) Ésteres de açúcar tal como, por exemplo, diestearato/ mono- estearatode sacarose, monoestearato ou monopalmitato ou monolaurato de sacarose e similares; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como éster de sucro, crodesta, monolaurato de sacarose); k) Fenóis de alquila de polietileno glicol tal como, por exemplo, PEG-10-100-nonil fenol (Triton X séries), PEG-15-1 OO-éter de octil fenol (Triton N série) e similares; l) Copolímeros em bloco de polioxípolietileno do polioxitileno (po- loxâmeros) tal como, por exemplo, poloxâmero 108, poloxâmero 188, polo- xâmero 237, poloxâmero 288 e similares; (os tensoativos que pertencem a este grupo são, por exemplo, conhecidos como Synperonic PE, Plurônico, Emkalyx, Lutrol®, Supronic, Monolan, Pluracare, Plurodac). Os tensoativos mais preferidos são tensoativos não iônicos com valores de HLB de 20 ou menos. Um tensoativo adequado é o F108 (BASF). Para facilitar o carregamento das micropartículas nos tubos um hidrogel pode ser usado como um ligante para ligar juntamente os conjuntos diferentes de micropartículas antes do carregamento das micropartículas nos tubos. Os ligantes podem ser cuidadosamente selecionados a não só ligar, mas servir de um meio para transportar a umidade para o interior do tubo facilitando a difusão da fármaco particularmente quando as micropartículas são compostas de fármacos hidrofóbicas. Além disso, o ligante pode ser escolhido para realçar de fato a solubilidade de compostos pobremente solúveis em água formulados nas micropartículas. Isto pode ser realizado fornecendo, por exemplo, um ambiente de pH baixo daqueles compostos que são mais solúvel no pH baixo. Alternativamente, o ligante pode ser um polímero que autoemulsiona em um sistema hidratado que fornece um ambiente ten- soativo de fármacos pobremente solúveis em água incorporadas nas micropartículas. Os exemplos alguns de ligantes incluindo albumina, caseína, ceras, amido, amido reticulado, açúcar simples, glicose, polisacarose, o álcool polivinílico, gelatina, celulose modificada, carboximetilcelulose, hidroximetil- celulose, hidroxietílcelulose, hidroxipropilcelulose, hidroxipropil etilcelulose, metil hidroxipropil celulose, carboximetíl celulose de sódio, acetato de celulose, alginato de sódio, ácido hialurônico, derivados de ácidos hialurônicos, pirrolidona polivinílico, ésteres de anidrido de polimaleico, ésteres de polior- to, polietilenoamina, glicol, polietileno glicol, metoxipolietileno glicol, etoxipo- lietileno glicol, óxido de polietileno, poli(1,3 bis (p-carboxifenóxi) anidrido "sebácico-copropano", N,N-dietilaminoacetato, copolímeros em bloco de po- lioxitileno e polioxipolietileno, ácidos poliacrílicos e derivados de ácidos poli- acrílicos, goma guar, goma de alfarrobeira, quitinas, polímeros ou agentes autoemulsificantes. Uma quantidade eficaz do ligante é uma com a viscosidade suficiente para ligar as partículas mas com um baixo teor de sólidos para minimizar a quantidade do espaço que ele necessita no interior do tubo.
Em uma modalidade da presente invenção o próprio hidrogel contém uma ou mais fármacos além do uma ou mais fármacos presentes nas micropartículas. Isto facilita na obtenção de altas concentrações plasmá- ticas iniciais de uma ou mais fármacos.
As micropartículas ou a mistura de micropartícula/hidrogel podem ser introduzidas nos tubos por técnicas manuais ou por técnicas automáticas. As técnicas manuais incluem a transferência de mistura por espátula no tubo. As técnicas automáticas incluem o uso de máquinas de recheio convencionais usadas na indústria farmacêutica.
Para fechar o tubo para fechar completamente a cavidade, as extremidades dos tubos podem ser seladas por calor. Isto pode ser realizado, por exemplo, usando um cautério cirúrgico Bovie de baixa temperatura. Antes de aplicar o calor, uma pequena parte do material de tubulação é primeiro inserida na seção de extremidade da tubulação que é selada e depois o aquecimento é aplicado a área de extremidade local para fazer o material fundir-se; a extremidade pode ser depois apertada à mão para formar um selo. Uma extremidade do tubo é primeiro selada e depois a tubulação é cheia com o teor denominado. Após isto, a extremidade aberta pode ser selada do mesmo modo. Há muitos outros modos possíveis de selar as extremidades. Por exemplo, um selante de calor regular pode ser usado onde a seção da extremidade da tubulação a ser selada é colocada entre as duas abas do selante. A vedação é realizada aplicando calor e pressão ao mesmo tempo. As extremidades também podem ser seladas com cola usando um adesivo adequado; a pouca quantidade do adesivo pode ser colocada dentro da tubulação na área da extremidade e depois aplicar pressão comprimem a ponta da extremidade. Tipicamente um tempo de retenção predeterminado é necessário para formar um selo sólido.
O implante pode ter qualquer forma incluindo, mas não limitado a, um disco, esfera ou cilindro, mas preferivelmente o implante é um cilindro. O tamanho do cilindro pode estar entre 1 e 5 mm no diâmetro e 0,5 e 5 cm no comprimento, mais preferivelmente entre 1 e 4 mm no diâmetro e 1 e 5 cm no comprimento. É particularmente útil na terapia de antivírus, tal como terapia anti-HIV e terapia anti-hepatite.
EXEMPLOS
Exemplo 1.
Uma solução ligante usando poli(ácido acrílico) (PAA) (Aldrich) foi preparada com peso molecular 1,25 milhões de kilodáltons. Três concentrações de solução de hidrogel foram preparadas usando água deionizada para dissolver o polí(ácido acrílico). As concentrações foram 5% (p/p), 0,5% (p/p), 0,25% (p/p). Embora as misturas de micropartículas fossem obtidas com os 3 hidrogéis, a mistura mais fácil trabalhar em termos de não ser de- masiado viscosa para tornar difícil a dispersão da micropartícula no hidrogel e em termos do hidrogel não ser demasiado liquido para o carregamento fácil no tubo foi 0,5% (p/p). O pH de cada hidrogel foi medido usando papel de pH, o pH do hidrogel de 5% esteve entre 2 e 3, outros dois hidrogéis mediram 3.
A mistura de particula/hidrogel pode ser preparada de tal modo que é uma parte hidrogel e duas partes micropartículas e deste modo reduzir ao mínimo do espaço no tubo que é necessário pelo gel e maximizar o espaço interno das micropartículas. As micropartículas compostas de 70% (p/p) de TMC278 e 30% (p/p) poli(ácido co-glicólico- lático) (PLGA) (DLG 5050 1A Surmodics Pharmaceuticals, Birmingham, Alabama) foram preparadas usando o método de disco giratório. Em geral, para preparar partículas que usam o método de disco giratório, um disco do tamanho específico é selecionado e montado em um motor com uma taxa de rotação controlável para controlar a velocidade de disco. O polímero é dissolvido em um solvente adequado, tal como acetona de exemplo, e a fármaco é acrescentada à solução de polímero e agitada. A mistura resultante é alimentada ao disco em uma taxa específica. Conforme o disco gira, a força centrípeta forma gotículas ou partículas na borda exterior do disco. As partículas são dirigidas a um cone de secagem que é pré-ajustado com um gradiente de temperaturas. O solvente é removido das partículas nesta etapa de secagem que faz as partículas endurecerem ou solidificarem e as partículas são coletadas.
Neste exemplo, uma solução de PLGA 4% (p/v) foi preparada em acetona. A velocidade do disco (Southwest Research Institute, San Antonio, TX) foi de 9.250 rpm, o tamanho de disco foi 7,62 cm, a taxa de alimentação foi 45 g/min, a temperatura de saída de cone variou de 45 a 48°C. O TMC278 foi acrescentado na solução de PLGA e agitado por aproximadamente 15 a 20 minutos antes de ser alimentado ao disco. A distribuição de tamanho de partícula foi medida usando um Malvern Mastersizer (Malvern Instruments, Ltd, Worcestershire, Reino Unido). Resultados: dw foi 29 microns, d50 foi 48 microns e d90 foi 69 microns.
Os tubos foram preparados por fiação eletrostática de 120 mg/ml de poli(dioxanona) em hexafluoroisopropanol. O diâmetro interior do tubo foi 3 mm e a espessura da parede foi 500 microns. O comprimento do tubo u- sado foi 2,54 cm. Examinando por microscopia de elétrons (JEOL JSM 5900LV, Tóquio, Japão) a análise dos tubos indicou que as aberturas (poros) na rede formada pelas fibras aleatoriamente orientadas variaram de 1 a 20 microns. Inicialmente, uma extremidade dos tubos foi selada por calor. A vedação de calor foi realizada usando um cautério cirúrgico Bovie de baixa temperatura, Antes da aplicação do calor, uma pequena parte do material da tubulação foi primeiro inserida na seção da extremidade da tubulação que é selada e depois o aquecimento foi aplicado na área de extremidade local para fazer o material fundir; a extremidade foi depois apertada à mão para formar um selo. Após uma extremidade ter sido selada, o tubo foi pesado juntamente com uma pequena parte do material de tubulação que será a- crescentado a outra extremidade do tubo quando esta extremidade for selada por calor (a massa do tubo vazio foi observada) e posteriormente enchido da mistura de micropartícula/hidrogel utilizando uma espátula. O recheio foi seguido pela vedação por calor da segunda extremidade do tubo utilizando o mesmo procedimento que delineado acima (com a adição da pequena par-te). O tubo selado foi pesado. A diferença no peso entre o tubo enchido e não preenchido é igual á massa dos conteúdos. Os detalhes dos conteúdos de cada tubo são resumidos na Tabela 1.
Tabela 1: Tubos eletrostaticamente girados com a mistura micropartícu- a/PAA,
As amostras foram colocadas em um sistema de amostragem Método I utilizando um Testador de Dissolução de Hanson (Hanson Research Corp., Chatsworth, CA) usando vasos de eluição de 500 ml. O meio foi de 500 ml de água destilada e as amostras foram tomadas em 1, 3, 7, 10, e 14 dias. Os dados de liberação são resumidos na Tabela 2. Os experimentos foram realizados a 37°C. Tabela 2: Eluição de TMC278 do gel de poli(ácido acrílico) em tubos eletros- taticamente girados.
A solubilidade de TMC278 dramaticamente aumenta em pH = 2.
Os experimentos de solubilidade demonstram que a solubilidade na água é 950 vezes maior no pH de 2 em relação ao pH 7. O uso de um gel de ligante ácido pode reduzir efetivamente o pH, pode aumentar a taxa da eluição de TMC278 da matriz de polímero. Aumentar a concentração do polímero ácido no gel pode abaixar o pH ainda mais (Tabela 1). Como ilustrado na Tabela 2, as micropartículas dispersas de TMC278 em gel de poli(ácido acrílico) 5% (p/p) onde o pH está entre 2 e 3, resulta em uma quantidade maior de TMC278 que elui das micropartículas em relação às micropartículas de TMC278 dispersas nos hidrogéis menos concentrados, onde o pH é 3.
Exemplo 2.
Um gel de carboximetilcelulose a 3% (p/v) (CMC; Hércules, 7H3SFPH) foi preparado em PBS. Quando preparado em água a viscosidade do gel seria 3.000 a 6.000 cPs. Entretanto a viscosidade do polímero cai em 2/3 quando preparado em uma solução salina devido à sua sensibilidade à força iônica e por isso realmente se mistura prontamente com as micropartículas. As micropartículas compostas de 70% (p/p) de TMC278 e 30% (p/p) poli(ácidos lático-glicólico) (PLGA) (DLG 5050 1A, Surmodics Pharmaceuticals, Birmingham, Alabama) foram preparadas usando o método de disco giratório. Em resumo, 4% (p/v) da solução de polímero foi preparado em acetona. A velocidade de disco e o tamanho foram 9250 rpm e 7,62 cm, res-pectivamente. A taxa de alimentação foi 45 g/min e a temperatura de saída de cone variou de 45 a 48°C. O TMC278 foi acrescentado na solução PLGA e agitado por aproximadamente 15 a 20 minutos antes de ser alimentado ao disco. A distribuição de tamanho de partícula foi medida usando um Malvem Mastersizer (Malvern Instruments, Ltd, Worcestershire, Reino Unido). Os resultados indicaram o dw em 29 microns, o d50 em 48 microns e o d90 em 69 microns. Uma amostra de 2 mg das micropartículas foi misturada com 2 ml do gel de CMC a 3 %. O carregamento total de TMC278 nesta mistura foi 2,25% (p/p).
O poli(ácidos lático-glicólico) com uma razão de molar de 85/15 lactídio/glicolídio foi usado para preparar a tubulação. A tubulação foi extru- dada usando uma linha de extrusão comercial em pequena escala compre-endida de uma extrusora 2,54 cm de parafuso único (Davis Standard), uma calha para resfriamento com água, um puxador e um cortador. Um sistema para medir o diâmetro por raio laser ligado em série também foi usado para monitorar o diâmetro e a circularidade da tubulação. No processo de extrusão, a matéria-prima na forma de resina foi alimentada do funil montado de um topo no reservatório da extrusora onde o parafuso rotatório forçou a resina para frente no reservatório que foi aquecido na temperatura desejável de fusão. Em três zonas de aquecimento da extrusora um perfil de temperatura adequado foi ajustado e mantido. Isto permitiu a resina plástica fundir-se gradualmente conforme era empurrada através do reservatório (risco menor de superaquecimento que pode causar a degradação do polímero).
Na parte dianteira do reservatório, o plástico fundido saiu do pa-rafuso passando através de um conjunto de redes para remover qualquer contaminante no fundido o que também ajudou a estabelecer uma pressão de retorno mais estável. Após passar pela placa separadora o plástico fundido entrou no molde. O molde foi tubular com um mandril no centro para criar uma estrutura anular para criação do perfil tubular. Uma pouca quantidade de ar foi injetada dentro da tubulação de polímero através da ponta do mandril (taxa de fluxo de ar controlada por um controlador de fluxo de ar). O ex- trudato na forma da tubulação foi puxado por um rolo de borracha à jusante através de uma calha de água de resfriamento onde a tubulação foi esfriada e solidificada. À jusante ao puxador havia um cortador onde a tubulação ex- trudada com o tamanho final foi cortada no comprimento predeterminado e coletada. Um sistema de medição de diâmetro por raio laser ligado em série foi instalado após a calha de resfriamento e antes do puxador para medir continuamente em linha e monitorar as dimensões da tubulação extrudada.
O tubo extrudado foi perfurado com orifícios de 10 microns utili-zando um raio laser. Um padrão de orifícios de 20 linhas X 20 colunas foi usado para perfurar a tubulação de polímero. O diâmetro interior do tubo foi 1,5 mm e o diâmetro exterior foi 1,6 mm. Uma amostra de 2,54 cm foi cortada da tubulação e selada por calor em uma extremidade (de acordo com o mesmo procedimento descrito no exemplo 1). Uma amostra de 33,67 mg da a mistura de micropartícula / gel de CMC foi transferida para o tubo perfurado usando uma espátula e a segunda extremidade do tubo foi selada por calor como descrito acima.
A amostra foi colocada em um Sistema de amostragem pelo Método I em um Testador de Dissolução de Hanson (Chatsworth, CA) usando vasos de 500 ml. O meio foi de 500 ml água destilada. As amostras foram tomadas em 1, 3, 7, 10, e 14 dias. Os dados de liberação são resumidos na Tabela 3. Os experimentos foram realizados a 37°C. Tabela 3: Liberação de TMC278 da micropartícula em um tubo perfurado.
Um gel de poli(ácido acrílico) (Aldrich) 0,5% (p/p) foi preparado em água e 400 mg do gel foram misturados com 960 mg de partículas de TMC278. As micropartículas foram compostas de 70% (p/p) de TMC278 e 30% (p/p) poli(ácidos lático-glicólico) (DLG 5050 1A, Surmodics Pharmaceuticals, Birmingham, Alabama) e prepararam de acordo com o procedimento descrito nos Exemplos 1 e 2). A distribuição de tamanho de partícula das 5 micropartículas foi medida como descrito acima; o dw foi 29, d5o = 48 e d90 foi 68 microns. A mistura foi empacotada em um tubo de poli(dioxanona) que foi preparado de acordo com o procedimento descrito no Exemplo 2. O tubo foi perfurado usando tecnologia de raio laser como descrito acima. O tubo tinha 30 mm de comprimento e seções de 5 mm a partir de cada borda fo- 10 ram não perfurados. As perfurações no comprimento de 30 mm na seção do meio foram combinadas em 40 linhas de orifícios e 2400 orifícios por linha. O diâmetro de cada furo foi de 50 microns. A massa do tubo antes do recheio foi 102,01 mg. A massa do tubo que após o recheio foi 190,64 mg (a concentração calculada de TMC278 no tubo foi 43,4 mg).
Mais duas amostras foram preparadas desta maneira, e a massa da mistura de micropartícula/gel no tubo foi 53,7 mg e 46,3 mg, respectiva-mente. A análise de HPLC confirmou os teores de 39,2 mg e 32,1 mg de TMC278 nos respectivos tubos.
Exemplo 4.
Foram preparados tubos eletrostaticamente girados de po- li(dioxanona) usando uma solução de 120 mg/ml de polímero em hexafluo- roisopropanol. A espessura da parede do tubo foi 500 microns. Uma mistura de micropartícula foi preparada usando micropartículas com uma distribuição de tamanhos de partícula de di0 = 29, d50 = 48 e dg0 = 68 microns. A compo- sição das micropartículas foi 70% (p/p) de TMC278 e 30% (p/p) de PLGA 50/50 (0,1 dl/g). Uma amostra de 1200 mg de micropartículas foi misturada com 500 mg de um gel aquoso a 0,5% de poli(ácido acrílico). A massa do tubo de 2 cm de comprimento foi 82,8 mg antes do recheio e 203,0 mg após o recheio.
Exemplo 5.
A mistura de microparticula descrita no Exemplo 4 foi usada para encher um tubo eletrostaticamente girado que foi preparado de uma solu- ção de polidioxanona de 150 mg/ml, como preparado no Exemplo 1. A es-pessura da parede do tubo foi 200 microns. A massa do tubo de 2 cm antes do recheio foi 29,0 mg e após o recheio foi 129,3 mg.
Exemplo 6.
A mistura de microparticula descrita no Exemplo 4 foi usada para encher urn tubo eletrostaticamente girado que foi preparado de uma solução de polidioxanona de 60 mg/ml, como preparado no Exemplo 1. A espessura da parede do tubo foi 500 microns. A massa do tubo de 2 cm antes do recheio foi 55,4 mg e após o recheio foi 151,9 mg.
Exemplo 7.
Dois conjuntos diferentes de micropartículas contendo TMC278 foram preparados. Um conjunto de micropartículas foi preparado usando 4% (p/v) de poli(ácidos lático-glicólico) (DLG 5050 2A, Surmodics Pharmaceuticals, Birmingham, Alabama) em solução de acetona. As micropartículas foram preparadas usando método de disco giratório como descrito no Exemplo 1. A velocidade de disco foi 7.500 rpm e o tamanho de disco foi 7,62 cm. A taxa de alimentação foi 45 g/min e a temperatura de saída de cone foi 45 a 48oC. A maioria das partículas formadas foi variando de 50 a 75 microns, e o carregamento de TMC278 nas partículas foi de 70% (p/p). O segundo conjunto de micropartículas esteve preparado de 4% (p/v) poli(ácidos lático- glicólico) (DLG 5050 1A, 2,5% de contendo (p/p) oligômeros de lactídio- glicolídio (5050 DLG 1CA, Surmodics Pharmaceutics, Birmingham, Alabama) em solução de acetona. O carregamento de TMC278 no segundo conjunto de micropartículas foi também 70% p/p. Estes também foram preparados usando um método de disco giratório. A velocidade de disco foi 9.250 rpm, a taxa de alimentação foi 50 a 55 g/min, e a temperatura de saida de cone foi 45oC. Uma amostra de 519 mg do gel aquoso de poli (ácido acrílico) a 0,5% foi misturada com 606 mg das micropartículas TMC278 preparadas do polímero DLG 5050 2A e 599 mg de partículas TMC278 preparadas com o DLG 5050 1A com DLG acrescentado 1CA. Um tubo de poli(díoxanona) perfurado como descrito no Exemplo 3 foi preenchido com a mistura de microparticula. A massa do tubo vazio foi 85,01 mg e a massa do tubo cheio da mistura de micropartícula foi 211 mg.
Exemplo 8.
Dois conjuntos diferentes de micropartículas foram preparados, um conjunto continha TMC278, um inibidor de transcriptase reversa de não nucleosídio potente para o tratamento do HIV. O segundo conjunto continha TMC114, um inibidor de protease para o tratamento do HIV, também conhecido como darunavir. As micropartículas TMC278 foram preparadas usando o método de disco giratório tal como descrito acima. Para estas partículas, 4% (p/v) de poli(coglicolídio de lactídio) (5050 DLG 1A, Surmodics Pharmaceuticals, Birmingham, Alabama) em solução de acetona com 7,5% (p/v) foi preparado acrescentando poli(coglicolídio de lactídio) oligomérico (5050 DLG 1CA, Surmodics Pharmaceuticals, Birmingham, Alabama). O carregamento de TMC278 em relação ao polímero foi 70% (p/p). Os tamanhos de partículas variaram de 20 a 75 microns.
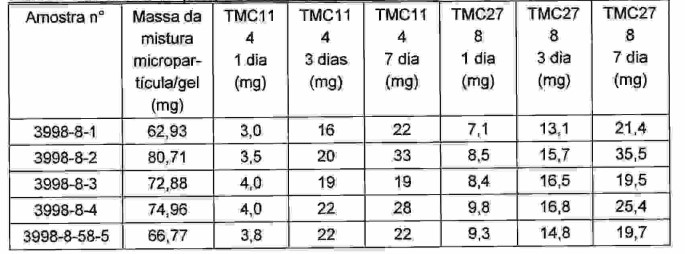
O segundo conjunto de micropartículas foi preparado dissolvendo TMC114 poli(coglicolídio de lactídio) 4% (p/v) (5050 DLG 1A. Surmodics Pharmaceuticals, Birmingham, Alabama) em solução de acetona. A solução de polímero da fármaco foi alimentada para um disco de 7,62 cm que girava em 9.500 rpm por uma taxa de alimentação de 45 g/min. A temperatura de saída de câmara do disco (temperatura de saída de cone) foi de 42 a 45°C, e o carregamento de TMC114 nas micropartículas foi de 70% (p/p). Uma mistura das micropartículas foi preparada com gel aquoso poli(ácido acrílico) 0,5% (p/p) e misturando 507 mg do gel com 502 mg das micropartículas TMC78 e 507 mg das micropartículas TMC114. A mistura de micropartículas foi empacotada em um tubo de poli(dioxanona) extrudado e perfurado (ver Exemplo 3). O padrão de perfurações e o tamanho de perfurações são descritos no Exemplo 3. Como observado antes, o tubo foi inicialmente selado por calor em uma extremidade, preenchido da mistura, e selado por calor na outra extremidade. Cinco amostras diferentes foram preparadas e a taxa de eluição das duas fármacos foi medida (Tabela 4). O meio usado para medir a taxa de eluição foi metanol 90% (v/v) e água 10% (v/v) devido à insolubilidade extrema de TMC278 na água. Tabela 4: Liberação cumulativa de TMC114 e TMC278 das micropartículas retidas em tubos de poli(dioxanona) extrudados e perfurados.
No teste in vivo do tubo eletrostaticamente girado que contém dois conjuntos de micropartículas
Os tubos foram eletrostaticamente girados de uma solução de polidioxanona de 100 mg/ml (IVHFIP = 1,99 dl/g) hexafluoroisopropanol. Um mandril de 4 mm foi usado para fornecer um diâmetro interior consistente de 4 mm. A velocidade rotativa do mandril foi 400 rpm, o faixa de variação de voltagem de carga foi 20/-10 kV, e a taxa de fluxo de bomba foi 10 ml/hora. A espessura da parede resultante foi 500 microns. Os diâmetros de fibra foram 1 a 2 microns e o tamanho de poro médio formado da rede de fibras foi 20 microns como determinado Examinado por Microscopia de Elétrons.
As micropartículas foram preparadas pelo método de disco giratório utilizando uma solução de polímero/acetona com uma concentração variando de 3 a 4% (p/p). Dois conjuntos de micropartículas foram preparados. A composição alvo de um conjunto foi 70% (p/p) de TMC278 e 30% (p/p) de PLGA 50/50 (Lakeshore Biomaterials IVHFIP = 0,79 dl/g). A composição alvo de outro conjunto de micropartículas foi 70% (p/p) do composto I (= composto 14 da W001/25240) e 30% (p/p) de PLGA 50/50 (Biomateriais de Lakeshore IVHFIP = 0,18 dl/g). Este composto I tem a seguinte estrutura e será referido daqui por diante como composto I:
A velocidade de disco variou de 7.300 a 7.500 rpm, as temperaturas de entrada e de saida de cone foram de 56-57°C e 33,5°C, respectivamente. O carregamento de TMC278 e composto I nas respectivas micropartículas foi medido por HPLC, e as concentrações TMC278 e do composto I foram 65% (p/p) e 35% (p/p) respectivamente. A diferença entre a concentração alvo e real do composto I ilustra a maior dificuldade na encapsulação do composto I.
A faixa de variação de tamanho de microparticula foi determinada colocando uma amostra aleatoriamente selecionada na etapa de um mi-croscópio ótico e usando um vernier para medir vários tamanhos das micro-partículas na amostra aleatoriamente selecionada. O faixa de variação de tamanho resultante das micropartículas TMC278 foi de 10 a 100 microns, e aquela das micropartículas do composto I foi de 20 a 100 microns.
A mistura dos dois tipos de micropartículas foi realizada transferindo ambos os conjuntos de micropartículas em um frasco de fundo redondo de vidro de 50 ml e místurando-se com um misturador superior ajustado com uma haste giratória de vidro e pá de teflon. As micropartículas foram misturadas a seco a 100 rpm durante 30 minutos (anteriormente decidiu ser um tempo de mistura suficiente para atingir uma mistura reprodutível homogênea de ambas as micropartículas). Aproximadamente 133 mg da mistura de microparticula foi incorporado em tubos preparados eletrostaticamente usando uma espátula.
Os tubos preparados foram implantados no espaço subcutâneo com base em quatro pesagens de ratos de macho Sprague-Dawley entre 250 e 350 gramas. A dose de TMC278 foi 139 mg/kg e a dose do composto I foi 64 mg/kg. A veia do rabo foi escolhida em pontos de tempo predetermi- nados. As amostras de sangue foram imediatamente centrifugadas para extrair o plasma, o plasma foi analisado para o composto I e para o TMC278 por LC/MS/MS. O limite inferior da quantificação foi 0,4 ng/ml e 2 ng/ml de TMC278 e composto I, respectivamente. Os valores das concentrações plasmáticas testadas em cada tempo que apontam para cada fármaco são tabulados na Tabela 5. Tabela 5: Concentrações plasmáticas de TMC278 e do composto I.
Teste in vivo do tubo extrudado fundido furado com raio laser contendo os dois conjuntos de micropartículas.
Os tubos com o diâmetro interior de 4,5 mm foram extrudados da polidioxanona (IVHRp = 1,99 dl/g) usando de uma extrusora de parafuso único com 19,05 mm ajustada com um molde de tubo. As dimensões do tubo foram monitoradas usando um sistema de medição do diâmetro por raio laser ligado em linha e mantido usando um puxador. Depois da extrusão os tubos foram furados com o raio laser. Na preparação da perfuração com raio laser uma máscara de molde foi preparada para localizar os orifícios há 260 microns um do outro. A microscopia de varredura de elétrons foi usada para dimensionar o diâmetro interno e exterior dos orifícios. Os resultados mostraram que do diâmetro externo foi 100 microns e o diâmetro médio interno de 30 microns. As micropartículas foram preparadas como descrito no Exemplo 9. Aproximadamente 133 mg da mistura de micropartícula foi incorporado nos tubos.
Os tubos preparados foram implantados no espaço subcutâneo com base em quatro pesagem de ratos de macho Sprague-Dawley entre 250 e 350 gramas. A dose de TMC278 foi 139 mg/kg e a dose do composto I foi 64 mg/kg. A veia do rabo foi escolhida em pontos de tempos predeterminados. As amostras de sangue foram imediatamente centrifugadas para extrair o plasma, e o plasma foi analisado para o composto I e TMC278 por 5 LC/MS/MS. O limite inferior da quantificação de TMC278 e do composto I foi de 0,4 ng/ml e 2,0 ng/ml, respectivamente. Os valores das concentrações plasmáticas testadas em cada tempo apontam para cada fármaco e estão registrados na Tabela 6. Tabela 6: Concentrações plasmáticas de TMC278 e do composto I.
Teste in vivo do tubo extrudado fundido furado com raio laser contendo os dois conjuntos de micropartículas formuladas com F108
O tubo extrudado fundido perfurado com raio laser foi preparado como descrito acima no exemplo 10. As micropartículas foram preparadas 15 pelo método de disco giratório utilizando solução de polímero/acetona a 3% (p/p). Dois conjuntos de micropartículas foram preparados. A composição alvo de um conjunto foi 70% (p/p) de TMC278, 20% (p/p) de PLGA 50/50 (Lakeshore Biomaterials IVHFIP = 0.79 dl/g), e 10% (p/p) F108 (BASF). A composição alvo de outro conjunto de micropartículas foi 70% (p/p) compos- 20 to I, 20% (p/p) de PLGA 50/50 (Lakeshore Biomaterials IVHFIP =0.18 dl/g), e 10% (p/p) F108. O F108 foi acrescentado à solução de polímero.
As condições de velocidade de disco e as temperaturas de entrada e saída do cone foram as mesmas utilizadas nos exemplos 9 e 10. As cargas de TMC278 e composto I nas micropartículas foram medidas por H- PLC, as concentrações resultantes foram 61% (p/p) e 50% (p/p) respectiva-mente.
A faixa de variação de tamanho das micropartículas foi determinada selecionando aleatoriamente uma amostra de micropartículas e colo- 5 cando-a na lâmina de um microscópio ótico e usando um vernier para medir os vários tamanhos das micropartículas na amostra aleatoriamente selecionada. O faixa de variação de tamanho das micropartículas do TMC278 e do composto I foi 10 a 100 microns e 20 a 100 microns, respectivamente. As micropartículas foram misturadas como descrito no exemplo 9. Aproxima- 10 damente 133 mg da mistura de microparticula foi incorporado nos tubos u- sando uma espátula para transferir os conteúdos.
Os tubos preparados foram implantados no espaço subcutâneo com base em quatro pesagens de ratos machos Sprague-Dawley entre 250 e 350 gramas. A dose de TMC278 e do composto I foi de 109 mg/kg e 78 15 mg/kg, respectivamente. A veia de rabo foi escolhida em pontos de tempo predeterminados. As amostras de sangue foram imediatamente centrifugadas para extrair o plasma, o plasma foi analisado para o composto I e TMC278 por LC/MS/MS. O limite inferior da quantificação de TMC278 e do composto I foi 0,4 ng/ml e 2 ng/ml, respectivamente. Os resultados das con- 20 centrações plasmáticas testadas de cada ponto de tempo para cada fármaco são mostrados na Tabela 7. Tabela 7: Concentrações plasmáticas de TMC278 e do composto I.









