WO2021241677A1 - 有機発光素子 - Google Patents
有機発光素子 Download PDFInfo
- Publication number
- WO2021241677A1 WO2021241677A1 PCT/JP2021/020163 JP2021020163W WO2021241677A1 WO 2021241677 A1 WO2021241677 A1 WO 2021241677A1 JP 2021020163 W JP2021020163 W JP 2021020163W WO 2021241677 A1 WO2021241677 A1 WO 2021241677A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- organic compound
- light emitting
- organic
- group
- conc
- Prior art date
Links
- 150000002894 organic compounds Chemical class 0.000 claims abstract description 245
- 239000000463 material Substances 0.000 claims abstract description 104
- 230000003111 delayed effect Effects 0.000 claims abstract description 56
- 150000001875 compounds Chemical class 0.000 claims description 102
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 34
- 229910052757 nitrogen Inorganic materials 0.000 claims description 24
- 229910052799 carbon Inorganic materials 0.000 claims description 22
- 125000004429 atom Chemical group 0.000 claims description 19
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 19
- 125000004432 carbon atom Chemical group C* 0.000 claims description 14
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 9
- 229910052717 sulfur Inorganic materials 0.000 claims description 9
- 125000004434 sulfur atom Chemical group 0.000 claims description 9
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 claims description 6
- 229910052796 boron Inorganic materials 0.000 claims description 6
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical group N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 claims description 2
- 230000014509 gene expression Effects 0.000 abstract 1
- 239000010410 layer Substances 0.000 description 226
- 230000004888 barrier function Effects 0.000 description 68
- 125000001424 substituent group Chemical group 0.000 description 63
- 239000010408 film Substances 0.000 description 58
- 239000000758 substrate Substances 0.000 description 31
- 230000032258 transport Effects 0.000 description 30
- -1 diphenylamino group Chemical group 0.000 description 29
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 25
- 230000005525 hole transport Effects 0.000 description 25
- 238000002347 injection Methods 0.000 description 24
- 239000007924 injection Substances 0.000 description 24
- 238000005401 electroluminescence Methods 0.000 description 22
- 150000001721 carbon Chemical group 0.000 description 15
- 239000000203 mixture Substances 0.000 description 15
- 238000007740 vapor deposition Methods 0.000 description 14
- 125000000217 alkyl group Chemical group 0.000 description 13
- 238000000034 method Methods 0.000 description 13
- 239000010409 thin film Substances 0.000 description 13
- 125000004093 cyano group Chemical group *C#N 0.000 description 12
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 12
- 125000003118 aryl group Chemical group 0.000 description 11
- NAWXUBYGYWOOIX-SFHVURJKSA-N (2s)-2-[[4-[2-(2,4-diaminoquinazolin-6-yl)ethyl]benzoyl]amino]-4-methylidenepentanedioic acid Chemical compound C1=CC2=NC(N)=NC(N)=C2C=C1CCC1=CC=C(C(=O)N[C@@H](CC(=C)C(O)=O)C(O)=O)C=C1 NAWXUBYGYWOOIX-SFHVURJKSA-N 0.000 description 10
- 230000005284 excitation Effects 0.000 description 10
- 229910052751 metal Inorganic materials 0.000 description 10
- 239000002184 metal Substances 0.000 description 10
- 239000012044 organic layer Substances 0.000 description 9
- 239000004642 Polyimide Substances 0.000 description 8
- 125000003277 amino group Chemical group 0.000 description 8
- 125000001769 aryl amino group Chemical group 0.000 description 8
- 125000000732 arylene group Chemical group 0.000 description 8
- 150000001555 benzenes Chemical class 0.000 description 8
- 238000006243 chemical reaction Methods 0.000 description 8
- 238000005520 cutting process Methods 0.000 description 8
- 229920001721 polyimide Polymers 0.000 description 8
- 125000004122 cyclic group Chemical group 0.000 description 7
- 238000005538 encapsulation Methods 0.000 description 7
- 125000005549 heteroarylene group Chemical group 0.000 description 7
- 230000007704 transition Effects 0.000 description 7
- 125000003342 alkenyl group Chemical group 0.000 description 6
- 239000003086 colorant Substances 0.000 description 6
- 239000000470 constituent Substances 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 5
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 5
- 238000000576 coating method Methods 0.000 description 5
- 230000000052 comparative effect Effects 0.000 description 5
- 125000001072 heteroaryl group Chemical group 0.000 description 5
- 125000005842 heteroatom Chemical group 0.000 description 5
- 230000000630 rising effect Effects 0.000 description 5
- 238000001228 spectrum Methods 0.000 description 5
- 238000000151 deposition Methods 0.000 description 4
- 125000004431 deuterium atom Chemical group 0.000 description 4
- 125000004986 diarylamino group Chemical group 0.000 description 4
- 239000007772 electrode material Substances 0.000 description 4
- 238000000295 emission spectrum Methods 0.000 description 4
- 238000005530 etching Methods 0.000 description 4
- 239000011521 glass Substances 0.000 description 4
- 230000005283 ground state Effects 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 238000002161 passivation Methods 0.000 description 4
- 238000001296 phosphorescence spectrum Methods 0.000 description 4
- 238000005215 recombination Methods 0.000 description 4
- 230000006798 recombination Effects 0.000 description 4
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 3
- 229910001374 Invar Inorganic materials 0.000 description 3
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 3
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical group C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 229910045601 alloy Inorganic materials 0.000 description 3
- 239000000956 alloy Substances 0.000 description 3
- 238000005229 chemical vapour deposition Methods 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000005336 cracking Methods 0.000 description 3
- 239000000411 inducer Substances 0.000 description 3
- 125000005647 linker group Chemical group 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 238000004544 sputter deposition Methods 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 125000004306 triazinyl group Chemical group 0.000 description 3
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical compound C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 2
- PNEYBMLMFCGWSK-UHFFFAOYSA-N Alumina Chemical compound [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- ATYGWGMPNAEMLZ-UHFFFAOYSA-N N#Cc1cccc(-c2cccc3c4ccccc4[nH]c23)c1C#N Chemical class N#Cc1cccc(-c2cccc3c4ccccc4[nH]c23)c1C#N ATYGWGMPNAEMLZ-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical group C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 2
- JFBZPFYRPYOZCQ-UHFFFAOYSA-N [Li].[Al] Chemical compound [Li].[Al] JFBZPFYRPYOZCQ-UHFFFAOYSA-N 0.000 description 2
- JHYLKGDXMUDNEO-UHFFFAOYSA-N [Mg].[In] Chemical compound [Mg].[In] JHYLKGDXMUDNEO-UHFFFAOYSA-N 0.000 description 2
- 125000003282 alkyl amino group Chemical group 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- SNAAJJQQZSMGQD-UHFFFAOYSA-N aluminum magnesium Chemical compound [Mg].[Al] SNAAJJQQZSMGQD-UHFFFAOYSA-N 0.000 description 2
- 150000007980 azole derivatives Chemical class 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 230000005281 excited state Effects 0.000 description 2
- 238000002189 fluorescence spectrum Methods 0.000 description 2
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 2
- SJCKRGFTWFGHGZ-UHFFFAOYSA-N magnesium silver Chemical compound [Mg].[Ag] SJCKRGFTWFGHGZ-UHFFFAOYSA-N 0.000 description 2
- 125000001434 methanylylidene group Chemical group [H]C#[*] 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 238000000206 photolithography Methods 0.000 description 2
- 238000005424 photoluminescence Methods 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 2
- 229910052710 silicon Inorganic materials 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 230000005469 synchrotron radiation Effects 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 239000012780 transparent material Substances 0.000 description 2
- 125000005580 triphenylene group Chemical group 0.000 description 2
- 238000003631 wet chemical etching Methods 0.000 description 2
- UWRZIZXBOLBCON-VOTSOKGWSA-N (e)-2-phenylethenamine Chemical class N\C=C\C1=CC=CC=C1 UWRZIZXBOLBCON-VOTSOKGWSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical group C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- 125000003363 1,3,5-triazinyl group Chemical group N1=C(N=CN=C1)* 0.000 description 1
- GWYPDXLJACEENP-UHFFFAOYSA-N 1,3-cycloheptadiene Chemical group C1CC=CC=CC1 GWYPDXLJACEENP-UHFFFAOYSA-N 0.000 description 1
- VERMWGQSKPXSPZ-BUHFOSPRSA-N 1-[(e)-2-phenylethenyl]anthracene Chemical compound C=1C=CC2=CC3=CC=CC=C3C=C2C=1\C=C\C1=CC=CC=C1 VERMWGQSKPXSPZ-BUHFOSPRSA-N 0.000 description 1
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical group C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- OYNJAUIAADXAOW-UHFFFAOYSA-N 2,3,5,6-tetra(carbazol-9-yl)benzene-1,4-dicarbonitrile Chemical compound C1=CC=CC=2C3=CC=CC=C3N(C1=2)C1=C(C(=C(C(=C1C#N)N1C2=CC=CC=C2C=2C=CC=CC1=2)N1C2=CC=CC=C2C=2C=CC=CC1=2)C#N)N1C2=CC=CC=C2C=2C=CC=CC1=2 OYNJAUIAADXAOW-UHFFFAOYSA-N 0.000 description 1
- MVWPVABZQQJTPL-UHFFFAOYSA-N 2,3-diphenylcyclohexa-2,5-diene-1,4-dione Chemical class O=C1C=CC(=O)C(C=2C=CC=CC=2)=C1C1=CC=CC=C1 MVWPVABZQQJTPL-UHFFFAOYSA-N 0.000 description 1
- 125000003229 2-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- ZYASLTYCYTYKFC-UHFFFAOYSA-N 9-methylidenefluorene Chemical class C1=CC=C2C(=C)C3=CC=CC=C3C2=C1 ZYASLTYCYTYKFC-UHFFFAOYSA-N 0.000 description 1
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical group C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 1
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 1
- VVJKKWFAADXIJK-UHFFFAOYSA-N Allylamine Chemical class NCC=C VVJKKWFAADXIJK-UHFFFAOYSA-N 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-VVKOMZTBSA-N Dideuterium Chemical group [2H][2H] UFHFLCQGNIYNRP-VVKOMZTBSA-N 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical group C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229910000799 K alloy Inorganic materials 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N N-phenyl amine Natural products NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 1
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical group C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 1
- 229910004205 SiNX Inorganic materials 0.000 description 1
- 229910006404 SnO 2 Inorganic materials 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- SLGBZMMZGDRARJ-UHFFFAOYSA-N Triphenylene Natural products C1=CC=C2C3=CC=CC=C3C3=CC=CC=C3C2=C1 SLGBZMMZGDRARJ-UHFFFAOYSA-N 0.000 description 1
- OWXLRKWPEIAGAT-UHFFFAOYSA-N [Mg].[Cu] Chemical compound [Mg].[Cu] OWXLRKWPEIAGAT-UHFFFAOYSA-N 0.000 description 1
- 238000000862 absorption spectrum Methods 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- 229940051880 analgesics and antipyretics pyrazolones Drugs 0.000 description 1
- 125000005577 anthracene group Chemical group 0.000 description 1
- 150000008425 anthrones Chemical class 0.000 description 1
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 1
- 125000005110 aryl thio group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000001716 carbazoles Chemical class 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 229920001940 conductive polymer Polymers 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- CHVJITGCYZJHLR-UHFFFAOYSA-N cyclohepta-1,3,5-triene Chemical group C1C=CC=CC=C1 CHVJITGCYZJHLR-UHFFFAOYSA-N 0.000 description 1
- ZXIJMRYMVAMXQP-UHFFFAOYSA-N cycloheptene Chemical group C1CCC=CCC1 ZXIJMRYMVAMXQP-UHFFFAOYSA-N 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- MGNZXYYWBUKAII-UHFFFAOYSA-N cyclohexa-1,3-diene Chemical group C1CC=CC=C1 MGNZXYYWBUKAII-UHFFFAOYSA-N 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical group C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000002019 doping agent Substances 0.000 description 1
- 238000000609 electron-beam lithography Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 description 1
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 230000005669 field effect Effects 0.000 description 1
- 150000008376 fluorenones Chemical class 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 230000009477 glass transition Effects 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 125000005553 heteroaryloxy group Chemical group 0.000 description 1
- 125000005226 heteroaryloxycarbonyl group Chemical group 0.000 description 1
- 125000005368 heteroarylthio group Chemical group 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- VVVPGLRKXQSQSZ-UHFFFAOYSA-N indolo[3,2-c]carbazole Chemical class C1=CC=CC2=NC3=C4C5=CC=CC=C5N=C4C=CC3=C21 VVVPGLRKXQSQSZ-UHFFFAOYSA-N 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 229940079865 intestinal antiinfectives imidazole derivative Drugs 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical group C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 238000001459 lithography Methods 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229910001092 metal group alloy Inorganic materials 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 125000004370 n-butenyl group Chemical group [H]\C([H])=C(/[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 150000002829 nitrogen Chemical group 0.000 description 1
- 230000005693 optoelectronics Effects 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 150000004866 oxadiazoles Chemical class 0.000 description 1
- 150000007978 oxazole derivatives Chemical class 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 238000000059 patterning Methods 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical group C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 1
- 150000004986 phenylenediamines Chemical class 0.000 description 1
- XQZYPMVTSDWCCE-UHFFFAOYSA-N phthalonitrile Chemical group N#CC1=CC=CC=C1C#N XQZYPMVTSDWCCE-UHFFFAOYSA-N 0.000 description 1
- 238000001020 plasma etching Methods 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- BITYAPCSNKJESK-UHFFFAOYSA-N potassiosodium Chemical compound [Na].[K] BITYAPCSNKJESK-UHFFFAOYSA-N 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- JEXVQSWXXUJEMA-UHFFFAOYSA-N pyrazol-3-one Chemical class O=C1C=CN=N1 JEXVQSWXXUJEMA-UHFFFAOYSA-N 0.000 description 1
- 150000003219 pyrazolines Chemical class 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical group C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- 238000006862 quantum yield reaction Methods 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical group N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 1
- 150000003252 quinoxalines Chemical class 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 229910052761 rare earth metal Inorganic materials 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N trans-stilbene Chemical class C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- 238000002834 transmittance Methods 0.000 description 1
- 125000004665 trialkylsilyl group Chemical group 0.000 description 1
- 238000007738 vacuum evaporation Methods 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
- H10K50/12—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers comprising dopants
- H10K50/121—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers comprising dopants for assisting energy transfer, e.g. sensitization
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/048—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being five-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/02—Use of particular materials as binders, particle coatings or suspension media therefor
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/401—Organic light-emitting molecular electronic devices
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/20—Delayed fluorescence emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/30—Highest occupied molecular orbital [HOMO], lowest unoccupied molecular orbital [LUMO] or Fermi energy values
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/90—Multiple hosts in the emissive layer
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
- H10K50/12—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers comprising dopants
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/658—Organoboranes
Definitions
- the present invention relates to an organic light emitting device using a delayed fluorescent material.
- organic light emitting elements such as organic electroluminescence elements (organic EL elements).
- organic electroluminescence elements organic electroluminescence elements
- various studies have been conducted to improve the luminous efficiency by newly developing and combining electron transport materials, hole transport materials, host materials, light emitting materials and the like constituting organic electroluminescence elements.
- the delayed fluorescent material is a compound that emits fluorescence when returning from the excited singlet state to the ground state after the inverse intersystem crossing from the excited triplet state to the excited singlet state occurs in the excited state. Fluorescence by such a pathway is called delayed fluorescence because it is observed later than fluorescence from the excited singlet state directly generated from the ground state (normal fluorescence).
- fluorescent fluorescence when a luminescent compound is excited by injection of a carrier, the probability of occurrence of the excited singlet state and the excited triplet state is statistically 25%: 75%, so that the excited singlet state directly generated is used. There is a limit to the improvement of light emission efficiency only by the fluorescence of.
- the delayed fluorescent material not only the excited singlet state but also the excited triplet state can be used for fluorescence emission by the path via the above-mentioned inverse intersystem crossing, so that it is higher than the ordinary delayed fluorescent material. Luminous efficiency will be obtained.
- a benzene derivative having a heteroaryl group such as a carbazolyl group or a diphenylamino group and at least two cyano groups has been proposed, and high light emission efficiency can be obtained with an organic EL element using the benzene derivative as a light emitting layer. It has been confirmed that this was the case (see Patent Document 1). Further, in Non-Patent Document 1, the carbazolyl dicyanobenzene derivative (4CzTPN) is a thermally active delayed fluorescent material, and the organic electroluminescence device using this carbazolyl dicyanobenzene derivative has a high internal EL quantum. It has been reported that efficiency has been achieved.
- Patent Document 1 Patent Document 2, Patent Document 2, and Non-Patent Document 1 report that high luminous efficiency was obtained in an organic electroluminescence device using a delayed fluorescent material.
- Patent Document 2 when the present inventors have produced an organic electroluminescence element according to the descriptions in Patent Document 1 and Patent Document 2, it has been found that it is difficult to secure a sufficient life. It was also found that it is difficult to realize light emission with high color purity at a short wavelength.
- the present inventors have made diligent studies for the purpose of realizing a long life and high color purity in an organic light emitting device using a delayed fluorescent material.
- the present inventors have achieved high color purity by adding a plurality of delayed fluorescent materials, host materials, and light emitting materials that satisfy specific conditions to the light emitting layer. We have found that long-life light emission can be achieved.
- the present invention has been proposed based on such findings, and specifically has the following configuration.
- An organic light emitting element having a light emitting layer containing a first organic compound, a second organic compound, a third organic compound, and a fourth organic compound satisfying the following conditions (a) to (e).
- the second organic compound and the third organic compound are delayed fluorescent materials having different structures from each other.
- An organic light emitting device, wherein the maximum component of light emission from the organic light emitting device is light emission from the fourth organic compound.
- ET1 (2) represents the lowest excited triplet energy of the second organic compound.
- ET1 (3) represents the lowest excited triplet energy of the third organic compound.
- Conc (1) represents the concentration of the first organic compound in the light emitting layer.
- Conc (2) represents the concentration of the second organic compound in the light emitting layer.
- Conc (3) represents the concentration of the third organic compound in the light emitting layer.
- [2] The organic light emitting device according to [1], which further satisfies the following condition (c1).
- ET1 (4) represents the lowest excited triplet energy of the fourth organic compound.
- [3] The organic light emitting device according to [1], which further satisfies the following condition (d1).
- the second organic compound is the difference Delta] E st in energy between the lowest excited triplet state of lowest excited singlet state and 77K is less than 0.3 eV, according to any one of [1] to [5] Organic light emitting element.
- the third organic compound, the difference Delta] E st in energy between the lowest excited triplet state of lowest excited singlet state and 77K is less than 0.3 eV, according to any one of [1] to [6] Organic light emitting element.
- the first organic compound, the second organic compound, and the third organic compound are compounds each independently composed of an atom selected from the group consisting of a carbon atom, a hydrogen atom, and a nitrogen atom [1]. ] To [8].
- the organic light emitting device of the present invention can realize long-life light emission with high color purity.
- the description of the constituent elements described below may be based on typical embodiments and specific examples of the present invention, but the present invention is not limited to such embodiments and specific examples.
- the numerical range represented by using "-" in the present application means a range including the numerical values before and after "-" as the lower limit value and the upper limit value.
- “consisting of” means that it consists only of those described before “consisting of” and does not include anything else.
- the isotope species of hydrogen atoms existing in the molecule of the compound used in the present invention are not particularly limited, and for example, all the hydrogen atoms in the molecule may be 1 H, or some or all of them may be 2 H. (Duterium D) may be used.
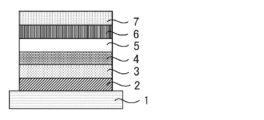
- the organic light emitting element of the present invention has a light emitting layer containing a first organic compound, a second organic compound, a third organic compound and a fourth organic compound. Of these, the second organic compound and the third organic compound are delayed fluorescent materials having different structures from each other. Then, these organic compounds satisfy the following conditions (a) to (e). Conditions (a) E S1 (1)> E S1 (2)> E S1 (4)> E S1 (3) Condition (b) E S1 (2) -E S1 (3) ⁇ 0.30eV Conditions (c) ET1 (1)> ET1 (2)> ET1 (3) Conditions (d) Conc (1)> Conc (2)> Conc (3) Condition (e) Conc (3) ⁇ 20% by weight
- ES1 (1) represents the lowest excited single term energy of the first organic compound
- ES1 (2) represents the lowest excited single term energy of the second organic compound
- ES1 (3) represents the above.
- the lowest excited single term energy of the third organic compound is represented
- ES1 (4) represents the lowest excited single term energy of the fourth organic compound.
- eV is adopted as a unit.
- ET1 (1) represents the lowest excited triplet energy of the first organic compound
- ET1 (2) represents the lowest excited triplet energy of the second organic compound
- ET1 (3) represents the third organic.
- the lowest excited triplet energy of the compound is represented
- ET1 (4) represents the lowest excited triplet energy of the fourth organic compound.
- eV is adopted as a unit.
- Conc (1) represents the concentration of the first organic compound in the light emitting layer
- Conc (2) represents the concentration of the second organic compound in the light emitting layer
- Conc (3) represents the concentration of the third organic compound in the light emitting layer
- Conc (4) represents the concentration of the fourth organic compound in the light emitting layer.
- weight% is adopted as a unit.
- the organic light emitting device of the present invention simultaneously satisfies the condition (a) and the condition (b) for the lowest excited singlet energy. Therefore, the lowest excited singlet energies ES1 (2), ES1 (3), and ES1 (4) of the second organic compound, the third organic compound, and the fourth organic compound are all within the range of 0.3 eV. It is in. E S1 (2) -E S1 ( 3) may be or within the scope of the following 0.27 eV, or in the range of 0.24 eV, or to within the following ranges 0.20 eV.
- E S1 (4) may be closer to either E S1 (2) or E S1 (3), but for example, a compound closer to E S1 (2) than E S1 (3) can be selected.
- E S1 (2) -E S1 ( 4) and E S1 (4) -E S1 ( 3) are all or in 0.25eV within the range, or within the following ranges 0.20 eV, 0.15 eV It can be within the following range.
- E S1 (1) -E S1 ( 2) is or in the range of more than 0.2 eV, or in the range of more than 0.4 eV, can or in a range of more than 0.6 eV, also 1 It can be within the range of .5 eV or less, within the range of 1.2 eV or less, or within the range of 0.8 eV or less.
- the organic light emitting device of the present invention satisfies the relationship of the condition (c) with respect to the minimum excited triplet energy, but it is more preferable that the relationship of the following condition (c1) is also satisfied.
- E T1 (4) -E T1 ( 3) is or in the range of more than 0.01 eV, or in the range of more than 0.03 eV, can or in a range of more than 0.05 eV, also 0 It can be within the range of .3 eV or less, within the range of 0.2 eV or less, or within the range of 0.1 eV or less.
- E T1 (2) -E T1 ( 4) are or in the range of more than 0.01 eV, can or in a range of more than 0.05 eV, also or in the range of 0.3 eV, 0 It can be within the range of .2 eV or less.
- E T1 (1) -E T1 ( 2) is or in the range of more than 0.2 eV, can or in a range of more than 0.4 eV, also or in the range of 0.8 eV, 0 It can be within the range of .6 eV or less.
- the organic light emitting device of the present invention satisfies the relationship between the condition (d) and the condition (e) regarding the concentration of the organic compound in the light emitting layer. It is preferable that the organic light emitting device of the present invention further satisfies the following condition (d1).
- Conc (1) is preferably 30% by weight or more, can be in the range of 50% by weight or more, can be in the range of 65% by weight or more, and can be in the range of 99% by weight or less. , 85% by weight or less, or 75% by weight or less.
- Conc (2) is preferably 10% by weight or more, can be in the range of 20% by weight or more, can be in the range of 30% by weight or more, and can be in the range of 45% by weight or less. , 40% by weight or less, or 35% by weight or less.
- Conc (3) needs to be in the range of 20% by weight or less, preferably 15% by weight or less, and more preferably 10% by weight or less.
- Conc (3) may be in the range of 7% by weight or less, in the range of 0.5% by weight or more, in the range of 1.0% by weight or more, or in the range of 2% by weight or more. It can be in the range of 4% by weight or more.
- Conc (4) is preferably 5% by weight or less, and more preferably 3% by weight or less.
- Conc (4) can be in the range of 1% by weight or less, in the range of 0.5% by weight or less, in the range of 0.01% by weight or more, or in the range of 0.1% by weight. It can be within the above range or within the range of 0.3% by weight or more. It is preferable that the organic light emitting device of the present invention further satisfies the following condition (f).
- Conc (3) / Conc (4) can be in the range of 7 or more, in the range of 9 or more, in the range of 500 or less, in the range of 100 or less, or in the range of 50 or less. Can be within the range of.
- the second organic compound used in the organic light emitting device of the present invention is a delayed fluorescent material.
- the third organic compound is a delayed fluorescent material having a structure different from that of the second organic compound.
- the "delayed fluorescence material" in the present invention means that in an excited state, an intersystem crossing from an excited triplet state to an excited singlet state occurs, and fluorescence (delayed fluorescence) occurs when the excited singlet state returns to the ground state. It is an organic compound that emits light.
- the emission lifetime is measured by a fluorescence lifetime measurement system (such as a streak camera system manufactured by Hamamatsu Photonics)
- a material in which fluorescence with a emission lifetime of 100 ns (nanoseconds) or more is observed is referred to as a delayed fluorescence material.
- the second organic compound is preferably a difference Delta] E ST of the lowest excited triplet energy of the lowest excited singlet energy and 77K is less than 0.3 eV, more preferably less 0.25 eV, below 0.2eV It is more preferably 0.15 eV or less, further preferably 0.1 eV or less, even more preferably 0.07 eV or less, and further preferably 0.05 eV or less.
- Third organic compound is preferably a difference Delta] E ST of the lowest excited triplet energy of the lowest excited singlet energy and 77K is less than 0.3 eV, more preferably less 0.25 eV, below 0.2eV It is more preferably 0.15 eV or less, further preferably 0.1 eV or less, even more preferably 0.07 eV or less, and further preferably 0.05 eV or less. It is more preferably 0.03 eV or less, and particularly preferably 0.01 eV or less.
- the lowest excited singlet energy ( ES1 ) and the lowest excited triplet energy ( ET1 ) of the compound are the values obtained by the following procedure.
- Delta] E ST is a value determined by calculating the E S1 -E T1.
- Minimum excitation singlet energy ( ES1 ) A thin film of the compound to be measured or a toluene solution (concentration 10-5 mol / L) is prepared and used as a sample. The fluorescence spectrum of this sample is measured at room temperature (300K). In the fluorescence spectrum, the vertical axis is light emission and the horizontal axis is wavelength.
- the maximum point having a peak intensity of 10% or less of the maximum peak intensity of the spectrum is not included in the above-mentioned maximum value on the shortest wavelength side, and the value of the gradient closest to the maximum value on the shortest wavelength side is the maximum.
- the tangent line drawn at the point where the value is taken is taken as the tangent line to the rising edge of the phosphorescent spectrum on the short wavelength side.
- the first organic compound is an organic compound having a higher minimum excitation single term energy than the second organic compound, the third organic compound, and the fourth organic compound, and has a function as a host material responsible for carrier transport and a fourth organic compound. It has the function of confining energy in the compound.
- the fourth organic compound efficiently emits energy generated by the recombination of holes and electrons in the molecule and energy received from the first organic compound, the second organic compound, and the third organic compound. Can be converted to.
- the first organic compound is preferably an organic compound having a hole transporting ability and an electron transporting ability, preventing a long wavelength of light emission, and having a high glass transition temperature. Further, in a preferred embodiment of the present invention, the first organic compound is selected from compounds that do not emit delayed fluorescence. The following are preferable compounds that can be used as the first organic compound.
- the second organic compound is a delayed fluorescent material having a smaller minimum excitation singlet energy than the first organic compound and a larger minimum excitation singlet energy than the third organic compound and the fourth organic compound. Further, the second organic compound is a delayed fluorescent material having a lower minimum excited triplet energy than the first organic compound and a larger minimum excited triplet energy than the third organic compound.
- the second organic compound may be any compound that can emit delayed fluorescence under some conditions, and it is not essential for the organic light emitting device of the present invention to emit delayed fluorescence derived from the second organic compound. In the organic light emitting element of the present invention, the second organic compound receives energy from the first organic compound in the excited singlet state and transitions to the excited singlet state.
- the second organic compound may receive energy from the first organic compound in the excited triplet state and transition to the excited triplet state. Since the second organic compound is small Delta] E ST, second organic compound excited triplet state it is easy to reverse intersystem crossing to the second organic compound excited singlet state. The second organic compound in the excited singlet state generated by these paths gives energy to the third organic compound and the fourth organic compound to make these compounds transition to the excited singlet state.
- the following are preferable compounds that can be used as the second organic compound.
- t-Bu represents a tertiary butyl group.
- the third organic compound is a delayed fluorescent material having a lower minimum excited single term energy than the first organic compound, the second organic compound and the fourth organic compound, and has the lowest excited triple term than the first organic compound and the second organic compound. It is a delayed fluorescent material with low energy.
- the third organic compound may be any compound that can emit delayed fluorescence under some conditions, and it is not essential for the organic light emitting device of the present invention to emit delayed fluorescence derived from the third organic compound.
- the third organic compound plays a role of reducing the exciton burden of the second organic compound by transferring a part of the excitons generated by the second organic compound to the third organic compound. Fulfill.
- the concentration of the third organic compound in the light emitting layer of the organic light emitting element of the present invention is smaller than the concentration of the first organic compound and the concentration of the second organic compound, and is 20% by weight or less.
- the solution is used. Due to the chromic effect, the emission wavelength is shortened to a level at which energy can be transferred to the fourth compound. Thereby, the life of the organic light emitting device can be further extended and the desired chromaticity can be realized.
- the minimum excited triplet energy of the third organic compound is smaller than the minimum excited triplet energy of the fourth organic compound.
- the third organic compound receives energy from the fourth organic compound in the excited triplet state and transitions to the excited triplet state. Since the third organic compound has a small Delta] E ST, third organic compound excited triplet state is easy to reverse intersystem crossing to the third organic compound excited singlet state. The third organic compound in the excited singlet state generated by these paths can apply energy to the fourth organic compound to make the fourth organic compound transition to the excited singlet state.
- the following are preferable compounds that can be used as the third organic compound.
- Preferred delayed fluorescent materials include paragraphs 0008 to 0048 and 0995 to 0133 of WO2013 / 154064, paragraphs 0007 to 0047 and 0073 to 985 of WO2013 / 011954, and paragraphs 0007 to 0033 and 0059 to 0066 of WO2013 / 01955.
- WO 2013/081088 paragraphs 0008 to 0071 and 0118 to 0133, Japanese Patent Laid-Open No. 2013-256490, paragraphs 0009 to 0046 and 093 to 0134, Japanese Patent Laid-Open No.
- WO2014 / 136860 WO2014 / 196585, WO2014 / 189122, WO2014 / 168101, WO2015 / 008580, WO2014 / 203840, WO2015 / 002213, WO2015 / 016200, WO2015 / 019725, WO2015 / 072470, WO2015 / 108049, WO2015 / 080182, WO2015 / 072537, WO2015 / 080183, JP2015-129240, WO2015 / 129714, Described in WO2015 / 129715, WO2015 / 133501, WO2015 / 136880, WO2015 / 137244, WO2015 / 137202, WO2015 / 137136, WO2015 / 146541, WO2015 / 159541.
- a light emitting material that emits delayed fluorescence can be preferably adopted. It should be noted that the above publications described in this paragraph are cited here
- a compound represented by the following general formula (1) and emitting delayed fluorescence can be preferably used as the delayed fluorescent material of the present invention.
- a compound represented by the general formula (1) can be adopted as both the second organic compound and the third organic compound.
- X 1 to X 5 represent N or CR.
- R represents a hydrogen atom or a substituent.
- X 1 to X 5 represent CR, they may be the same or different from each other.
- at least one of X 1 to X 5 is CD (where D represents a donor group).
- Z represents an acceptor group
- at least one of X 1 to X 5 is N, Z represents a hydrogen atom or a substituent.
- a particularly preferable compound is a compound represented by the following general formula (2).
- X 1 to X 5 represent N or CR.
- R represents a hydrogen atom or a substituent.
- X 1 to X 5 may be the same or different from each other.
- at least one of X 1 to X 5 is CD (where D represents a donor group).
- the acceptor group represented by Z in the general formula (1) is a group having a property of donating an electron to the ring to which Z is bonded. Can be done.
- the donor group represented by D in the general formula (1) and the general formula (2) is a group having a property of attracting an electron to the ring to which D is bonded, for example, a group having a negative ⁇ p value of Hammett. You can choose from.
- the acceptor group may be referred to as A.
- the “hammet ⁇ p value” is L. P.
- the equilibrium constant of the benzene derivative substituted with, ⁇ represents the reaction constant determined by the type and conditions of the reaction.
- hammet ⁇ p value in the present invention and the numerical value of each substituent, refer to the description of the ⁇ p value in Hansch, C.et.al., Chem.Rev., 91,165-195 (1991). can.
- X 1 to X 5 represent N or CR, but at least one is CD.
- the number of N among X 1 to X 5 is 0 to 4, for example, X 1 and X 3 and X 5 , X 1 and X 3 , X 1 and X 4 , X 2 and X 3 , and X 1.
- X 5 , X 2 and X 4 , only X 1, only X 2, and only X 3 are N.
- the number of CDs is 1 to 5, preferably 2 to 5.
- At least one of X 1 to X 5 may be CA.
- A represents an acceptor group.
- the number of CAs is preferably 0 to 2, and more preferably 0 or 1.
- a cyano group is preferably mentioned as A of CA.
- X 1 to X 5 may be CD or CA independently.
- the two Rs may be coupled to each other to form a cyclic structure.
- the cyclic structure formed by bonding with each other may be an aromatic ring or an alicyclic ring, may contain a hetero atom, and the cyclic structure may be a fused ring having two or more rings. ..
- the hetero atom referred to here is preferably selected from the group consisting of a nitrogen atom, an oxygen atom and a sulfur atom.
- Examples of the cyclic structure formed include a benzene ring, a naphthalene ring, a pyridine ring, a pyridazine ring, a pyrimidine ring, a pyrazine ring, a pyrrol ring, an imidazole ring, a pyrazole ring, an imidazoline ring, an oxazole ring, an isooxazole ring, a thiazole ring, and an iso.
- Examples thereof include thiazole ring, cyclohexadiene ring, cyclohexene ring, cyclopentaene ring, cycloheptatriene ring, cycloheptadiene ring, cycloheptaene ring, furan ring, thiophene ring, naphthylidine ring, quinoxalin ring, quinoline ring and the like. ..
- a ring in which a large number of rings are condensed, such as triphenylene, may be formed.
- the donor group D in the general formula (1) and the general formula (2) is preferably a group represented by the following general formula (3), for example.
- R 11 and R 12 are independently substituted or unsubstituted alkyl groups, substituted or unsubstituted alkenyl groups, substituted or unsubstituted aryl groups, or substituted or unsubstituted heteroaryl groups, respectively.
- R 11 and R 12 may be combined with each other to form an annular structure.
- L represents a single bond, substituted or unsubstituted arylene group, or substituted or unsubstituted heteroarylene group.
- the substituent that can be introduced into the arylene group or heteroarylene group of L may be a group represented by the general formula (1) or the general formula (2), or may be a group represented by the general formula (1) to (6) described later.
- the groups represented by these (1) to (6) may be introduced up to the maximum number of substituents that can be introduced into L. Further, when a plurality of groups represented by the general formulas (1) to (6) are introduced, the substituents thereof may be the same or different from each other.
- * Represents the bond position to the carbon atom (C) constituting the ring skeleton of the ring in the general formula (1) or the general formula (2).
- the "alkyl group” referred to here may be linear, branched or cyclic. Further, two or more of the linear portion, the annular portion and the branched portion may be mixed. The number of carbon atoms of the alkyl group can be, for example, 1 or more, 2 or more, and 4 or more.
- the number of carbon atoms can be 30 or less, 20 or less, 10 or less, 6 or less, and 4 or less.
- Specific examples of the alkyl group include methyl group, ethyl group, n-propyl group, isopropyl group, n-butyl group, isobutyl group, tert-butyl group, n-pentyl group, isopentyl group, n-hexyl group and isohexyl group.
- 2-Ethylhexyl group, n-heptyl group, isoheptyl group, n-octyl group, isooctyl group, n-nonyl group, isononyl group, n-decanyl group, isodecanyl group, cyclopentyl group, cyclohexyl group, cycloheptyl group can be mentioned.
- the alkyl group as a substituent may be further substituted with an aryl group.
- the "alkenyl group" may be linear, branched or cyclic. Further, two or more of the linear portion, the annular portion and the branched portion may be mixed.
- the carbon number of the alkenyl group can be, for example, 2 or more and 4 or more. Further, the number of carbon atoms can be 30 or less, 20 or less, 10 or less, 6 or less, and 4 or less.
- Specific examples of the alkenyl group include ethenyl group, n-propenyl group, isopropenyl group, n-butenyl group, isobutenyl group, n-pentenyl group, isopentenyl group, n-hexenyl group, isohexenyl group and 2-ethylhexenyl group. Can be mentioned.
- the alkenyl group as a substituent may be further substituted with a substituent.
- the "aryl group” and the “heteroaryl group” may be a monocyclic ring or a condensed ring in which two or more rings are condensed.
- the number of fused rings is preferably 2 to 6, and can be selected from, for example, 2 to 4.
- the ring include a benzene ring, a pyridine ring, a pyrimidine ring, a triazine ring, a naphthalene ring, an anthracene ring, a phenanthrene ring, a triphenylene ring, a quinoline ring, a pyrazine ring, a quinoxaline ring, and a naphthylidine ring.
- arylene group or the heteroarylene group examples include a phenyl group, a 1-naphthyl group, a 2-naphthyl group, a 1-anthrasenyl group, a 2-anthrasenyl group, a 9-anthrasenyl group, a 2-pyridyl group, a 3-pyridyl group, and 4 -Pyridyl groups can be mentioned.
- Substituent means a monovalent group that can be substituted with a hydrogen atom, and is not a concept including those that condense.
- the description of the substituent and the preferable range of the general formula (7) described later can be referred to.
- the compound represented by the general formula (3) is preferably a compound represented by any of the following general formulas (4) to (6).
- R 51 to R 60 , R 61 to R 68 , and R 71 to R 78 each independently represent a hydrogen atom or a substituent.
- R 51 to R 60 , R 61 to R 68 , and R 71 to R 78 are groups represented by any of the above general formulas (4) to (6) independently.
- the number of substituents in the general formulas (4) to (6) is not particularly limited. It is also preferable that all are unsubstituted (that is, hydrogen atoms).
- the substituents may be the same or different.
- the substituent is preferably any one of R 52 to R 59 in the case of the general formula (4), and the general formula (5). If this is the case, it is preferably any of R 62 to R 67 , and if it is the general formula (6), it is preferably any of R 72 to R 77.
- X is a divalent oxygen atom having a chain length of 1 atom, a sulfur atom, a substituted or unsubstituted nitrogen atom, a substituted or unsubstituted carbon atom, a substituted or unsubstituted silicon atom, and a carbonyl.
- the description of the substituents in the above general formulas (1) and (2) can be referred to.
- L 12 to L 14 represent a single-bonded, substituted or unsubstituted arylene group, or a substituted or unsubstituted heteroarylene group.
- L 12 to L 14 are preferably single-bonded, substituted or unsubstituted arylene groups.
- the substituent of the arylene group or the heteroarylene group referred to here may be a group represented by the general formulas (1) to (6).
- the groups represented by the general formulas (1) to (6) may be introduced up to the maximum number of substituents that can be introduced into L 11 to L 14. Further, when a plurality of groups represented by the general formulas (1) to (6) are introduced, the substituents thereof may be the same or different from each other.
- * Represents the bond position to the carbon atom (C) constituting the ring skeleton of the ring in the general formula (1) or the general formula (2).
- a compound represented by the following general formula (7) and emitting delayed fluorescence can be particularly preferably used as a delayed fluorescent material.
- a compound represented by the general formula (7) can be adopted as both the second organic compound and the third organic compound.
- both the second organic compound and the third organic compound are compounds containing a dicyanobenzene structure.
- one 0-4 of R 1 ⁇ R 5 represents a cyano group, at least one of R 1 ⁇ R 5 represents a substituted amino group, the remaining R 1 ⁇ R 5 are a hydrogen atom, Alternatively, it represents a substituent other than a cyano group and a substituted amino group.
- the substituted amino group referred to here is preferably a substituted or unsubstituted diarylamino group, and the two aryl groups constituting the substituted or unsubstituted diarylamino group may be linked to each other.
- the linkage may be a single bond (in which case a carbazol ring is formed), -O-, -S-, -N (R 6 )-, -C (R 7 ) (R 8). )-, -Si (R 9 ) (R 10 )-may be made of a linking group.
- R 6 to R 10 represent hydrogen atoms or substituents
- R 7 and R 8 and R 9 and R 10 may be connected to each other to form a cyclic structure.
- the substituted amino group may be any of R 1 to R 5 , for example, R 1 and R 2 , R 1 and R 3 , R 1 and R 4 , R 1 and R 5 , R 2 and R 3 , R 2.
- R 3 and R 4 and R 5 can be substituted amino groups and the like.
- the cyano group may also be any of R 1 to R 5 , for example R 1 , R 2 , R 3 , R 1 and R 2 , R 1 and R 3 , R 1 and R 4 , R 1 and R 5 , R 2 and R 3 , R 2 and R 4 , R 1 and R 2 and R 3 , R 1 and R 2 and R 4 , R 1 and R 2 and R 5 , R 1 and R 3 and R 4 , R 1 And R 3 and R 5 , R 2 and R 3 and R 4 can be cyano groups and the like.
- R 1 to R 5 which are neither a cyano group nor a substituted amino group represent a hydrogen atom or a substituent.
- substituent examples include a hydroxyl group, a halogen atom (for example, a fluorine atom, a chlorine atom, a bromine atom, and an iodine atom), an alkyl group (for example, 1 to 40 carbon atoms), and an alkoxy group (for example, 1 to 40 carbon atoms).
- Alkylthio group for example, 1 to 40 carbon atoms
- aryl group for example, 6 to 30 carbon atoms
- aryloxy group for example, 6 to 30 carbon atoms
- arylthio group for example, 6 to 30 carbon atoms
- heteroaryl group for example, 6 to 30 carbon atoms.
- a ring skeleton constituent atom number 5 to 30 For example, a ring skeleton constituent atom number 5 to 30), a heteroaryloxy group (for example, a ring skeleton constituent atom number 5 to 30), a heteroarylthio group (for example, a ring skeleton constituent atom number 5 to 30), an acyl group (for example, a ring skeleton constituent atom number 1).
- alkenyl group eg carbon number 1-40
- alkynyl group eg carbon number 1-40
- alkoxycarbonyl group eg carbon number 1-40
- aryloxycarbonyl group eg carbon number 1-40
- Heteroaryloxycarbonyl groups eg, 1-40 carbon atoms
- silyl groups eg, trialkylsilyl groups with 1-40 carbon atoms
- nitro groups the groups listed here are further one or more groups listed here.
- a group of substituents A consisting of substituted groups can be mentioned.
- the substituent of the above-mentioned substituent group A can be mentioned, and further, a cyano group and a substituted amino group can also be mentioned.
- a compound represented by the following general formula (8) and emitting delayed fluorescence can also be particularly preferably used as the delayed fluorescent material of the present invention.
- a compound represented by the general formula (8) can be adopted as both the second organic compound and the third organic compound.
- Y 1 , Y 2 and Y 3 either represent a nitrogen atom and the remaining one represents a methine group, or all of Y 1 , Y 2 and Y 3 represent a nitrogen atom.
- Z 1 and Z 2 each independently represent a hydrogen atom or substituent.
- R 11 to R 18 each independently represent a hydrogen atom or a substituent , and at least one of R 11 to R 18 may be a substituted or unsubstituted arylamino group or a substituted or unsubstituted carbazolyl group. preferable.
- the benzene ring constituting the arylamino group and the benzene ring constituting the carbazolyl group may be combined with R 11 to R 18 , respectively to form a single bond or a linking group.
- the compound represented by the general formula (8) contains at least two carbazole structures in the molecule.
- the substituents that Z 1 and Z 2 can take include the above-mentioned substituents of the substituent group A.
- Specific examples of the substituents that can be taken from R 11 to R 18 , the above-mentioned arylamino group and carbazolyl group include the above-mentioned substituent, cyano group, substituted arylamino group and substituted alkylamino group of the substituent group A.
- R 11 and R 12 , R 12 and R 13 , R 13 and R 14 , R 15 and R 16 , R 16 and R 17 , and R 17 and R 18 are coupled to each other to form an annular structure. May be good.
- the compound represented by the general formula (9) is particularly useful.
- Y 1 , Y 2 and Y 3 either represent a nitrogen atom and the remaining one represents a methine group, or all of Y 1 , Y 2 and Y 3 represent a nitrogen atom.
- Z 2 represents a hydrogen atom or a substituent.
- R 11 to R 18 and R 21 to R 28 each independently represent a hydrogen atom or a substituent. At least one of R 11 to R 18 and / or at least one of R 21 to R 28 preferably represent a substituted or unsubstituted arylamino group or a substituted or unsubstituted carbazolyl group.
- the benzene ring constituting the arylamino group and the benzene ring constituting the carbazolyl group may be combined with R 11 to R 18 or R 21 to R 28 to form a single bond or a linking group, respectively.
- substituents that Z 2 can take include the above-mentioned substituents of the substituent group A.
- substituents that can be taken by R 11 to R 18 , R 21 to R 28 , the above arylamino group and the carbazolyl group the substituent, the cyano group and the substituted arylamino group of the above-mentioned substituent group A are described.
- Substituted alkylamino groups can be mentioned.
- R 11 and R 12 , R 12 and R 13 , R 13 and R 14 , R 15 and R 16 , R 16 and R 17 , R 17 and R 18 , R 21 and R 22 , R 22 and R 23 , R 23 and R 24 , R 25 and R 26 , R 26 and R 27 , and R 27 and R 28 may be coupled to each other to form an annular structure.
- R 11 and R 12 , R 12 and R 13 , R 13 and R 14 , R 15 and R 16 , R 16 and R 17 , R 17 and R 18 , R 21 and R 22 , R 22 and R 23 , R 23 and R 24 , R 25 and R 26 , R 26 and R 27 , and R 27 and R 28 may be coupled to each other to form an annular structure.
- the compounds described in Let, 98,083302 (2011) can be
- a compound represented by the following general formula (10) and emitting delayed fluorescence can also be particularly preferably used as the delayed fluorescent material of the present invention.
- the compound represented by the general formula (10) can be adopted as the third organic compound.
- A represents a cyano group or a substituted or unsubstituted triazinyl group.
- R A ⁇ 1 or 2 R E represents an alkyl group, three or four of R A ⁇ R E represents a donor group, the remaining R A ⁇ R E hydrogen atom or deuterium atom show.
- the triazineyl group preferably contains a 1,3,5-triazine ring.
- the substituent of the triazinyl group the description of the substituent in the above general formula (7) can be referred to, and an aryl group is preferable.
- the description and preferable range of the donor group represented by D in the general formula (1) and the general formula (2) can be referred to.
- the general formula (10) has donor groups having different structures from each other.
- a carbazolyl group having a different substitution state exists, and for example, a substituted carbazolyl group and an unsubstituted carbazolyl group may be mixed.
- R A and R B are donor groups of the same structure
- R D and R E may be a donor group having a structure different from that of the R A and R B.
- all the donor groups existing in the general formula (10) may have the same structure.
- the number of alkyl group is one of R A ⁇ R E.
- one of R A ⁇ R E is an alkyl group, four R A ⁇ R E is a donor group.
- one of R A ⁇ R E is an alkyl group, three of R A ⁇ R E is a donor group, and the remainder is a hydrogen atom.
- RC is an alkyl group. A part or all of hydrogen atoms present in the compound represented by the general formula (10) may be substituted with deuterium atoms.
- a compound represented by the following general formula (11) and emitting delayed fluorescence can also be particularly preferably used as the delayed fluorescent material of the present invention.
- the compound represented by the general formula (11) can be adopted as the third organic compound.
- A represents a cyano group or a substituted or unsubstituted triazinyl group.
- 3 ⁇ five R a - R e represents a donor group, the remaining R a - R e represents a hydrogen atom, a deuterium atom, a substituted or unsubstituted alkyl group or a substituted or unsubstituted aryl group, ..
- At least one of the donor group represented by R a ⁇ R e is condensed carbazolyl group.
- the condensed carbazolyl group referred to here means a carbazole-9-yl group in which a ring structure is condensed with at least one of two benzene rings constituting the carbazole ring. Rings may be condensed on both of the two benzene rings. When both are condensed, it is preferable that both have the same skeletal structure after condensation, and more preferably the same structure.
- the position where the ring is not condensed may be substituted, and if it is substituted, the 3-position or 6-position of the carbazole ring is preferably substituted.
- the description of the substituent in the above general formula (7) can be referred to, preferably a substituted or unsubstituted aryl group, particularly preferably a substituted or unsubstituted phenyl group, for example, phenyl.
- a group or a heavy hydrogen substituted phenyl group can be preferably adopted.
- a part or all of hydrogen atoms present in the compound represented by the general formula (11) may be substituted with deuterium atoms.
- a benzofuran-fused carbazole-9-yl group having a carbazole ring fused with a benzofuran ring at the 2nd and 3rd positions and a benzothiophene having a carbazole ring fused with a benzothiophene ring at the 2nd and 3rd positions.
- Examples thereof include a fused carbazole-9-yl group and a sirineden-fused carbazole-9-yl group having a skeleton in which a sirineden ring is condensed at a few positions on the carbazole ring.
- these rings are condensed at the 1st and 2nd positions of the carbazole ring, it is preferable that the hetero atom constituting the condensing ring is bonded at the 2nd position, and when they are condensed at the 2nd and 3rd positions of the carbazole ring, the condensing ring is formed. It is preferable that the constituent hetero atom is bonded at the 3-position, and when the carbazole ring is condensed at the 3rd and 4th positions, the hetero atom constituting the condensing ring is preferably bonded at the 4-position.
- the fourth organic compound is a delayed fluorescent material having a lower minimum excitation singlet energy than the first organic compound and the second organic compound and a higher minimum excitation singlet energy than the third organic compound.
- the organic light emitting device of the present invention emits fluorescence derived from the fourth organic compound. Emissions from the fourth organic compound usually include delayed fluorescence.
- the maximum component of light emission from the organic light emitting device of the present invention is light emission from the fourth organic compound. That is, among the light emitted from the organic light emitting device of the present invention, the amount of light emitted from the fourth organic compound is the largest.
- the fourth organic compound receives energy from the first organic compound and the second organic compound in the excited singlet state and the second organic compound which crosses between the excited triplet states and becomes the excited singlet state, and is excited. Transition to the singlet state. Further, in a preferred embodiment of the present invention, the fourth organic compound receives energy from the third organic compound in the excited singlet state and the third organic compound which crosses between the excited triplet states and becomes the excited singlet state. Receives and transitions to the excited singlet state. The excited singlet state of the resulting fourth organic compound then radiates fluorescence as it returns to the ground state.
- the fluorescent material used as the fourth organic compound is not particularly limited as long as it can receive energy from the first organic compound, the second organic compound, and the third organic compound and emit light, and the emission is fluorescent.
- Either delayed fluorescence or phosphorescence may be included. It is preferable that the emission contains fluorescence or delayed fluorescence, and more preferably, the maximum component of emission from the fourth organic compound is delayed fluorescence.
- the fourth organic compound two or more kinds may be used as long as they satisfy the conditions of the present invention. For example, by using two or more kinds of fourth organic compounds having different emission colors in combination, it becomes possible to emit a desired color. Further, one kind of the fourth compound may be used to emit a single color from the fourth compound.
- the maximum emission wavelength of the compound that can be used as the fourth organic compound is not particularly limited.
- a light emitting material having a maximum emission wavelength in the visible region (380 to 780 nm), a light emitting material having a maximum emission wavelength in the infrared region (780 nm to 1 mm), and the like.
- a fluorescent material having a maximum emission wavelength in the visible region For example, a light emitting material having a maximum emission wavelength in the range of 380 to 570 nm in the region of 380 to 780 nm may be selected and used, or a light emitting material having a maximum emission wavelength in the range of 380 to 500 nm may be selected and used.
- a light emitting material having a maximum emission wavelength in the range of 380 to 480 nm may be selected and used, or a light emitting material having a maximum emission wavelength in the range of 420 to 480 nm may be selected and used.
- the compounds are selected and combined so that there is an overlap between the emission wavelength region of the second organic compound and the absorption wavelength region of the fourth organic compound.
- the following are preferable compounds that can be used as the fourth organic compound.
- Et represents an ethyl group.
- Preferred compound groups include compounds E1 to E5 and derivatives having a skeleton thereof.
- Examples of the derivative include compounds substituted with an alkyl group, an aryl group, a heteroaryl group, and a diarylamino group.
- the light emitting layer of the organic light emitting element of the present invention contains a first organic compound, a second organic compound, a third organic compound, and a fourth organic compound satisfying the conditions (a) to (e).
- the light emitting layer can be configured to contain no compound or metal element that transfers charge or energy, in addition to the first organic compound, the second organic compound, the third organic compound, and the fourth organic compound. Further, the light emitting layer may be composed of only four compounds, that is, a first organic compound, a second organic compound, a third organic compound, and a fourth organic compound.
- the light emitting layer may be composed of only a compound consisting of an atom selected from the group consisting of a carbon atom, a hydrogen atom, a nitrogen atom, a boron atom, an oxygen atom and a sulfur atom.
- the light emitting layer can be composed only of a compound consisting of an atom selected from the group consisting of a carbon atom, a hydrogen atom, a nitrogen atom, a boron atom and an oxygen atom.
- the light emitting layer can be composed only of a compound consisting of an atom selected from the group consisting of a carbon atom, a hydrogen atom, a nitrogen atom, a boron atom and a sulfur atom.
- the light emitting layer can be composed only of a compound consisting of an atom selected from the group consisting of a carbon atom, a hydrogen atom, a nitrogen atom and a boron atom.
- the light emitting layer can be composed only of a compound consisting of an atom selected from the group consisting of a carbon atom, a hydrogen atom and a nitrogen atom, an oxygen atom and a sulfur atom.
- the light emitting layer can be composed only of a compound consisting of an atom selected from the group consisting of a carbon atom, a hydrogen atom and a nitrogen atom.
- the first organic compound, the second organic compound, and the third organic compound contained in the light emitting layer are independently selected from the group consisting of a carbon atom, a hydrogen atom, a nitrogen atom, an oxygen atom, and a sulfur atom. It can also be a compound.
- the first organic compound, the second organic compound, and the third organic compound can each independently be a compound composed of an atom selected from the group consisting of a carbon atom, a hydrogen atom, a nitrogen atom, and an oxygen atom.
- the first organic compound, the second organic compound, and the third organic compound can each independently be a compound composed of an atom selected from the group consisting of a carbon atom, a hydrogen atom, a nitrogen atom, and a sulfur atom.
- the first organic compound, the second organic compound, and the third organic compound can each independently be a compound composed of an atom selected from the group consisting of a carbon atom, a hydrogen atom, and a nitrogen atom.
- the light emitting layer may be formed by co-depositing the first organic compound, the second organic compound, the third organic compound and the fourth organic compound, or the first organic compound, the second organic compound and the third organic compound. And may be formed by a coating method using a solution in which a fourth organic compound is dissolved.
- a light emitting layer When forming a light emitting layer by co-deposited, two or more of the first organic compound, the second organic compound, the third organic compound and the fourth organic compound are mixed in advance and put into a pot or the like to be used as a vapor deposition source.
- a light emitting layer may be formed by co-depositing using a vapor deposition source. For example, by mixing the second organic compound, the third organic compound, and the fourth organic compound in advance to prepare one vapor deposition source, and co-depositing using the vapor deposition source and the vapor deposition source of the first organic compound.
- a light emitting layer may be formed.
- the organic photoluminescence device has a structure in which at least a light emitting layer is formed on a base material.
- the organic electroluminescence device has at least an anode, a cathode, and a structure in which an organic layer is formed between the anode and the cathode.
- the organic layer includes at least a light emitting layer, and may be composed of only a light emitting layer, or may have one or more organic layers in addition to the light emitting layer. Examples of such other organic layers include a hole transport layer, a hole injection layer, an electron barrier layer, a hole barrier layer, an electron injection layer, an electron transport layer, an exciton barrier layer, and the like.
- the hole transport layer may be a hole injection transport layer having a hole injection function
- the electron transport layer may be an electron injection transport layer having an electron injection function.
- 1 shows a specific structural example of the organic electroluminescence device.
- 1 is a substrate
- 2 is an anode
- 3 is a hole injection layer
- 4 is a hole transport layer
- 5 is a light emitting layer
- 6 is an electron transport layer
- 7 is a cathode.
- the organic light emitting element of the present invention is a multi-wavelength light emitting element
- the shortest wavelength light emission can include delayed fluorescence. It is also possible that the shortest wavelength emission does not include delayed fluorescence.
- the organic electroluminescence device of the present invention is held by a substrate, the substrate is not particularly limited and is commonly used in organic electroluminescence devices, such as glass, clear plastic, quartz and silicon. Any material formed by the above may be used.
- the anode of an organic electroluminescence device is manufactured from a metal, alloy, conductive compound or a combination thereof.
- the metal, alloy or conductive compound has a high work function (4 eV or higher).
- the metal is Au.
- the conductive transparent material is selected from CuI, indium tin oxide (ITO), SnO 2 and ZnO.
- an amorphous material capable of forming a transparent conductive film such as IDIXO (In 2 O 3-ZnO), is used.
- the anode is a thin film. In some embodiments, the thin film is made by vapor deposition or sputtering.
- the film is patterned by a photolithography method.
- the pattern may be formed using a mask having a shape suitable for vapor deposition or sputtering on the electrode material.
- a wet film forming method such as a printing method or a coating method is used.
- synchrotron radiation passes through the anode, the anode has a transmittance of greater than 10% and the anode has a sheet resistance of no more than a few hundred ohms per unit area.
- the thickness of the anode is 10-1,000 nm. In some embodiments, the thickness of the anode is 10-200 nm. In some embodiments, the thickness of the anode will vary depending on the material used.
- the cathode is made of an electrode material such as a metal with a low work function (4 eV or less) (referred to as an electron-injected metal), an alloy, a conductive compound or a combination thereof.
- the electrode material is sodium, sodium-potassium alloy, magnesium, lithium, magnesium-copper mixture, magnesium-silver mixture, magnesium-aluminum mixture, magnesium-indium mixture, aluminum-aluminum oxide (Al 2). O 3 ) Selected from mixtures, indium, lithium-aluminum mixtures and rare earth elements.
- a mixture of the electron-injected metal and a second metal which is a stable metal with a higher work function than the electron-injected metal, is used.
- the mixture is selected from a magnesium-silver mixture, a magnesium-aluminum mixture, a magnesium-indium mixture, an aluminum-aluminum oxide (Al 2 O 3 ) mixture, a lithium-aluminum mixture and aluminum.
- the mixture improves electron injection properties and resistance to oxidation.
- the cathode is manufactured by forming the electrode material as a thin film by vapor deposition or sputtering.
- the cathode has a sheet resistance of tens of ohms or less per unit area.
- the cathode has a thickness of 10 nm to 5 ⁇ m.
- the thickness of the cathode is 50-200 nm.
- any one of the anode and cathode of the organic electroluminescence element is transparent or translucent in order to transmit synchrotron radiation.
- the transparent or translucent electroluminescent device improves the light radiance.
- the cathode is formed of the conductive transparent material described above with respect to the anode to form a transparent or translucent cathode.
- the device comprises an anode and a cathode, both of which are transparent or translucent.
- the injection layer is the layer between the electrode and the organic layer. In some embodiments, the injection layer reduces the drive voltage and enhances the light radiance. In some embodiments, the injection layer comprises a hole injection layer and an electron injection layer. The injection layer can be arranged between the anode and the light emitting layer or the hole transport layer, and between the cathode and the light emitting layer or the electron transport layer. In some embodiments, an injection layer is present. In some embodiments, there is no injection layer. The following are examples of preferable compounds that can be used as hole injection materials.
- the barrier layer is a layer capable of preventing charges (electrons or holes) and / or excitons present in the light emitting layer from diffusing outside the light emitting layer.
- the electron barrier layer resides between the light emitting layer and the hole transport layer, preventing electrons from passing through the light emitting layer to the hole transport layer.
- the hole barrier layer exists between the light emitting layer and the electron transport layer to prevent holes from passing through the light emitting layer to the electron transport layer.
- the barrier layer prevents excitons from diffusing outside the light emitting layer.
- the electron barrier layer and the hole barrier layer constitute an exciton barrier layer.
- the term "electron barrier layer" or "exciton barrier layer” includes both an electron barrier layer and a layer having both the functions of an exciton barrier layer.
- Hole barrier layer functions as an electron transport layer. In some embodiments, the hole barrier layer prevents holes from reaching the electron transport layer during electron transport. In some embodiments, the hole barrier layer increases the probability of electron-hole recombination in the light emitting layer.
- the material used for the hole barrier layer may be the same material as described above for the electron transport layer. The following are examples of preferable compounds that can be used for the hole barrier layer.
- the electron barrier layer transports holes.
- the electron barrier layer blocks electrons from reaching the hole transport layer during hole transport.
- the electron barrier layer increases the probability of electron-hole recombination in the light emitting layer.
- the material used for the electron barrier layer may be the same material as described above for the hole transport layer. Specific examples of preferable compounds that can be used as an electron barrier material are given below.
- Exciton barrier layer prevents excitons generated through recombination of holes and electrons in the light emitting layer from diffusing to the charge transport layer. In some embodiments, the exciton barrier layer allows for effective exciton confinement in the light emitting layer. In some embodiments, the light emission efficiency of the device is improved. In some embodiments, the exciton barrier layer is adjacent to the light emitting layers on either the anode side and the cathode side, and on either side of the anode side. In some embodiments, when the exciton barrier layer is present on the anode side, the layer may be present between the hole transport layer and the light emitting layer and adjacent to the light emitting layer.
- the layer when the exciton barrier layer is present on the cathode side, the layer may be present between the light emitting layer and the cathode and adjacent to the light emitting layer.
- a hole injection layer, an electron barrier layer or a similar layer resides between the anode and the exciton barrier layer adjacent to the light emitting layer on the anode side.
- the hole injection layer, electron barrier layer, hole barrier layer or similar layer is present between the cathode and the exciton barrier layer adjacent to the light emitting layer on the cathode side.
- the excited element barrier layer comprises an excited singlet energy and an excited triplet energy, at least one of which is higher than the excited singlet energy and the excited triplet energy of the light emitting material, respectively.
- the hole transport layer contains a hole transport material.
- the hole transport layer is monolayer. In some embodiments, the hole transport layer has multiple layers. In some embodiments, the hole transport material has one of the hole injection or transport properties and the electron barrier properties. In some embodiments, the hole transport material is an organic material. In some embodiments, the hole transport material is an inorganic material. Examples of known hole transport materials that can be used in the present invention are, but are not limited to, triazole derivatives, oxadiazole derivatives, imidazole derivatives, carbazole derivatives, indolocarbazole derivatives, polyarylalkane inducers, pyrazoline derivatives, pyrazolones.
- the hole transport material is selected from porphyrin compounds, aromatic tertiary amine compounds and styrylamine compounds.
- the hole transport material is an aromatic tertiary amine compound. Specific examples of preferable compounds that can be used as hole transport materials are given below.
- Electron transport layer contains an electron transport material.
- the electron transport layer is monolayer.
- the electron transport layer has multiple layers.
- the electron transport material only needs to have the function of transporting the electrons injected from the cathode to the light emitting layer.
- the electron transport material also functions as a hole barrier material.
- electron transport layers examples include, but are not limited to, nitro-substituted fluorene derivatives, diphenylquinone derivatives, thiopyrandioxide derivatives, carbodiimides, fluorenylidene methane derivatives, anthracinodimethanes, anthrone derivatives, and oxadi. Examples thereof include azole derivatives, azole derivatives, azine derivatives or combinations thereof, or polymers thereof.
- the electron transport material is a thiadiazole inducer or a quinoxaline derivative.
- the electron transport material is a polymeric material. Specific examples of preferable compounds that can be used as electron transport materials are given below.
- preferable compounds as materials that can be added to each organic layer are given.
- it may be added as a stabilizing material.
- the light emitting layer is incorporated into the device.
- devices include, but are not limited to, OLED valves, OLED lamps, television displays, computer monitors, mobile phones and tablets.
- the electronic device comprises an OLED having an anode, a cathode, and at least one organic layer comprising a light emitting layer between the anode and the cathode.
- the components described herein can be incorporated into a variety of photosensitive or photoactivating devices, such as OLEDs or optoelectronic devices.
- the construct may be useful for facilitating charge transfer or energy transfer within the device and / or as a hole transport material.
- Examples of the device include an organic light emitting diode (OLED), an organic integrated line (OIC), an organic field effect transistor (O-FET), an organic thin film (O-TFT), an organic light emitting transistor (O-LET), and an organic solar cell. (O-SC), organic optical detectors, organic photoreceivers, organic field-quench devices (O-FQD), light emitting fuel cells (LECs) or organic laser diodes (O-lasers).
- OLED organic light emitting diode
- OIC organic integrated line
- O-FET organic field effect transistor
- OFTFT organic thin film
- O-LET organic light emitting transistor
- O-SC organic solar cell.
- O-SC organic solar cell.
- organic optical detectors organic photoreceivers
- O-FQD organic field-quench devices
- LOCs light emitting fuel cells
- O-lasers organic laser diodes
- the electronic device comprises an OLED comprising an anode, a cathode, and at least one organic layer comprising a light emitting layer between the anode and the cathode.
- the device comprises an OLED of different colors.
- the device comprises an array containing a combination of OLEDs.
- the combination of OLEDs is a combination of three colors (eg RGB).
- the combination of OLEDs is a combination of colors that are neither red nor green nor blue (eg, orange and yellow-green).
- the combination of OLEDs is a combination of two colors, four colors or more.
- the device is A circuit board having a first surface with a mounting surface and a second surface opposite the mounting surface and defining at least one opening.
- At least one OLED that has The housing for the circuit board and An OLED light comprising at least one connector located at the end of the housing, wherein the housing and the connector define a package suitable for mounting in lighting equipment.
- the OLED light has a plurality of OLEDs mounted on a circuit board such that light is emitted in multiple directions.
- some light emitted in the first direction is polarized and emitted in the second direction.
- a reflector is used to polarize the light emitted in the first direction.
- the light emitting layer of the present invention can be used in a screen or display.
- the compounds according to the invention are deposited onto a substrate using steps such as, but not limited to, vacuum evaporation, deposition, vapor deposition or chemical vapor deposition (CVD).
- the substrate is a photoplate structure useful in two-sided etching that provides pixels with a unique aspect ratio.
- the screen also referred to as a mask
- the design of the corresponding artwork pattern allows the placement of very steep, narrow tie bars between pixels in the vertical direction, as well as large, wide-ranging bevel openings in the horizontal direction.
- Pixel internal patterning makes it possible to construct 3D pixel openings with different aspect ratios in the horizontal and vertical directions.
- imaged "stripe" or halftone circles in the pixel area protects the etching in the particular area until these particular patterns are undercut and removed from the substrate. At that time, all the pixel regions are processed at the same etching rate, but the depth varies depending on the halftone pattern.
- By changing the size and spacing of the halftone patterns it is possible to etch with different protection rates within the pixel, allowing for the deep localized etching required to form steep vertical bevels. ..
- the preferred material for the vapor deposition mask is Invar.
- Invar is a metal alloy that is cold-rolled into a long thin sheet at a steel mill. Invar cannot be electrodeposited onto the spin mandrel as a nickel mask.
- a suitable and low-cost method for forming an opening region in a vapor deposition mask is a wet chemical etching method.
- the screen or display pattern is a pixel matrix on a substrate.
- the screen or display pattern is processed using lithography (eg, photolithography and e-beam lithography).
- the screen or display pattern is processed using wet chemical etching.
- the screen or display pattern is processed using plasma etching.
- the OLED display is generally manufactured by forming a large mother panel and then cutting the mother panel in cell panel units. Normally, each cell panel on the mother panel forms a thin film transistor (TFT) having an active layer and a source / drain electrode on a base substrate, a flattening film is applied to the TFT, and a pixel electrode and a light emitting layer are applied. , The counter electrode and the encapsulating layer are formed in order over time, and are formed by cutting from the mother panel.
- TFT thin film transistor
- the OLED display is generally manufactured by forming a large mother panel and then cutting the mother panel in cell panel units.
- each cell panel on the mother panel forms a thin film transistor (TFT) having an active layer and a source / drain electrode on a base substrate, a flattening film is applied to the TFT, and a pixel electrode and a light emitting layer are applied.
- TFT thin film transistor
- the counter electrode and the encapsulating layer are formed in order over time, and are formed by cutting from the mother panel.
- a method of manufacturing an organic light emitting diode (OLED) display is provided, wherein the method is: The process of forming a barrier layer on the base base material of the mother panel, A step of forming a plurality of display units on a cell panel unit on the barrier layer, A step of forming an encapsulation layer on each of the display units of the cell panel, A step of applying an organic film to the interface portion between the cell panels is included.
- the barrier layer is, for example, an inorganic film formed of SiNx, the edges of the barrier layer being coated with an organic film formed of polyimide or acrylic.
- the organic film helps the mother panel to be softly cut in cell panel units.
- the thin film transistor (TFT) layer comprises a light emitting layer, a gate electrode, and a source / drain electrode.
- Each of the plurality of display units may have a thin film transistor (TFT) layer, a flattening film formed on the TFT layer, and a light emitting unit formed on the flattening film, and the interface portion may have a light emitting unit.
- the applied organic film is formed of the same material as the flattening film, and is formed at the same time as the flattening film is formed.
- the light emitting unit is coupled to the TFT layer by a passivation layer, a flattening film in between, and an encapsulating layer that coats and protects the light emitting unit.
- the organic film is not coupled to either the display unit or the encapsulation layer.
- each of the organic film and the flattening film may contain any one of polyimide and acrylic.
- the barrier layer may be an inorganic film.
- the base substrate may be made of polyimide.
- the method further comprises a step of attaching a carrier substrate made of a glass material to the other surface of the base substrate before forming a barrier layer on one surface of the base substrate made of polyimide. It may include a step of separating the carrier substrate from the base substrate prior to cutting along the interface portion.
- the OLED display is a flexible display.
- the passivation layer is an organic film placed on the TFT layer for coating the TFT layer.
- the flattening film is an organic film formed on the passivation layer.
- the flattening film is made of polyimide or acrylic, similar to the organic film formed at the ends of the barrier layer. In some embodiments, the flattening film and the organic film are formed simultaneously during the manufacture of the OLED display. In some embodiments, the organic film may be formed at the edges of the barrier layer, whereby a portion of the organic film is in direct contact with the base substrate and the rest of the organic film is removed. , Surrounding the edge of the barrier layer and in contact with the barrier layer.
- the light emitting layer has a pixel electrode, a counter electrode, and an organic light emitting layer disposed between the pixel electrode and the counter electrode.
- the pixel electrode is connected to a source / drain electrode in the TFT layer.
- an appropriate voltage is formed between the pixel electrode and the counter electrode so that the organic light emitting layer emits light, thereby the image. Is formed.
- the image forming unit having the TFT layer and the light emitting unit will be referred to as a display unit.
- the encapsulation layer that covers the display unit and prevents the penetration of external moisture may be formed in a thin film encapsulation structure in which organic films and inorganic films are alternately laminated.
- the encapsulation layer has a thin film encapsulation structure in which a plurality of thin films are laminated.
- the organic film applied to the interface section is spaced apart from each of the plurality of display units.
- the organic film is formed in such a manner that some of the organic films are in direct contact with the base substrate and the rest of the organic film surrounds the edges of the barrier layer while in contact with the barrier layer. Will be done.
- the OLED display is flexible and uses a flexible base substrate made of polyimide.
- the base substrate is formed on a carrier substrate made of a glass material, which is then separated.
- the barrier layer is formed on the surface of the base substrate opposite the carrier substrate.
- the barrier layer is patterned according to the size of each cell panel. For example, a base substrate is formed on all surfaces of the mother panel, while a barrier layer is formed according to the size of each cell panel, thereby forming a groove in the interface portion between the barrier layers of the cell panel. Each cell panel can be cut along the groove.
- the manufacturing method further comprises the step of cutting along an interface portion, where a groove is formed in the barrier layer, at least a portion of the organic film is formed in the groove, and the groove is formed. Does not penetrate the base substrate.
- the TFT layer of each cell panel is formed and a passivation layer, which is an inorganic film, and a flattening film, which is an organic film, are placed on the TFT layer to cover the TFT layer.
- a polyimide or acrylic flattening film is formed, for example, the groove of the interface portion is covered with an organic film made of polyimide or acrylic, for example. This prevents cracking by allowing the organic film to absorb the impact generated when each cell panel is cut along the groove at the interface section.
- the groove of the interface portion between the barrier layers is covered with an organic film to absorb the impact that can be transmitted to the barrier layer without the organic film, so that each cell panel is softly cut and the barrier layer is used. It may be prevented from cracking.
- the organic film and the flattening film covering the grooves of the interface portion are arranged at intervals from each other.
- the organic film and the flattening film are interconnected as one layer, external moisture may infiltrate into the display unit through the flattening film and the portion where the organic film remains.
- the organic film and the flattening film are spaced apart from each other so that the organic film is spaced apart from the display unit.
- the display unit is formed by the formation of a light emitting unit and the encapsulation layer is placed on the display unit to cover the display unit.
- the carrier base material that supports the base base material is separated from the base base material.
- the carrier substrate is separated from the base substrate due to the difference in the coefficient of thermal expansion between the carrier substrate and the base substrate.
- the mother panel is cut in cell panel units.
- the mother panel is cut along the interface between the cell panels using a cutter.
- the grooves in the interface section where the mother panel is cut are covered with an organic film so that the organic film absorbs the impact during cutting.
- the barrier layer can be prevented from cracking during cutting. In some embodiments, the method reduces the defective rate of the product and stabilizes its quality.
- Another embodiment is a barrier layer formed on a base substrate, a display unit formed on the barrier layer, an encapsulating layer formed on the display unit, and an organic coating applied to the ends of the barrier layer.
- the materials, treatment contents, treatment procedures, etc. shown below can be appropriately changed as long as they do not deviate from the gist of the present invention. Therefore, the scope of the present invention should not be construed as limiting by the specific examples shown below.
- the emission characteristics are evaluated by a source meter (Caseley: 2400 series), a semiconductor parameter analyzer (Agilent Technology: E5273A), an optical power meter measuring device (Newport: 1930C), and an optical spectroscope.
- Each thin film was laminated with a vacuum degree of 1 ⁇ 10-6 Pa on a glass substrate having an anode made of indium tin oxide (ITO) having a film thickness of 100 nm formed by a vacuum vapor deposition method.
- ITO indium tin oxide
- HATCN was formed on ITO to a thickness of 10 nm
- NPD was formed on it to a thickness of 30 nm
- TrisPCz was further formed on it to a thickness of 10 nm.
- compound H3 was formed to a thickness of 3 nm.
- compound H3, compound T10, compound S1 and compound E1 were co-deposited from different vapor deposition sources at the concentrations shown in the table below to form a light emitting layer having a thickness of 30 nm.
- SF3TRZ was formed as a hole barrier layer having a thickness of 10 nm.
- SF3TRZ and Liq were co-deposited from different vapor deposition sources to form an electron transport layer having a thickness of 30 nm.
- SF3TRZ: Liq (weight ratio) was set to 7: 3. Further, Liq was formed to a thickness of 2 nm, and then aluminum (Al) was deposited to a thickness of 100 nm to form a cathode.
- each organic electroluminescence element was prepared by using the compound S2 and the compound S3 as the third compound, respectively. Each of these elements satisfied the conditions (a) to (e). From each of the organic electroluminescence devices of Examples 4 and 5, light emission with high color purity derived from the fourth organic compound is observed, and it is confirmed that the life is longer than that of Comparative Example 1.
- the present invention it is possible to provide an organic light emitting device having a high color purity and a long life. Therefore, the present invention has high industrial applicability.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Optics & Photonics (AREA)
- Plural Heterocyclic Compounds (AREA)
- Electroluminescent Light Sources (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
下記式を満たす第1~4有機化合物を含む発光層を有する有機発光素子は、高い色純度で長寿命な発光を実現することができる。第2、3有機化合物は遅延蛍光材料で、第4有機化合物からの発光量が最大である。ES1は最低励起一重項エネルギー、ET1は最低励起三重項エネルギー、Concは発光層における濃度を表す。 ES1(1)>ES1(2)>ES1(4)>ES1(3) ES1(2)-ES1(3)<0.30eV ET1(1)>ET1(2)>ET1(3) Conc(1)>Conc(2)>Conc(3) Conc(3)≦20重量%
Description
本発明は、遅延蛍光材料を用いた有機発光素子に関する。
有機エレクトロルミネッセンス素子(有機EL素子)などの有機発光素子の発光効率を高める研究が盛んに行われている。特に、有機エレクトロルミネッセンス素子を構成する電子輸送材料、ホール輸送材料、ホスト材料、発光材料などを新たに開発して組み合わせることにより、発光効率を高める研究が種々なされてきている。その中には、遅延蛍光材料を利用した有機発光素子に関する研究も見受けられる。
遅延蛍光材料は、励起状態において、励起三重項状態から励起一重項状態への逆項間交差を生じた後、その励起一重項状態から基底状態へ戻る際に蛍光を放射する化合物である。こうした経路による蛍光は、基底状態から直接生じた励起一重項状態からの蛍光(通常の蛍光)よりも遅れて観測されるため、遅延蛍光と称されている。ここで、例えば、発光性化合物をキャリアの注入により励起した場合、励起一重項状態と励起三重項状態の発生確率は統計的に25%:75%であるため、直接生じた励起一重項状態からの蛍光のみでは、発光効率の向上に限界がある。一方、遅延蛍光材料では、励起一重項状態のみならず、励起三重項状態も上記の逆項間交差を介した経路により蛍光発光に利用することができるため、通常の遅延蛍光材料に比べて高い発光効率が得られることになる。
こうした遅延蛍光材料として、カルバゾリル基等のヘテロアリール基またはジフェニルアミノ基と少なくとも2つのシアノ基を有するベンゼン誘導体が提案され、そのベンゼン誘導体を発光層に用いた有機EL素子で高い発光効率が得られたことが確認されている(特許文献1参照)。
また、非特許文献1では、カルバゾリルジシアノベンゼン誘導体(4CzTPN)が熱活性型遅延蛍光材料であること、また、このカルバゾリルジシアノベンゼン誘導体を用いた有機エレクトロルミネッセンス素子で、高い内部EL量子効率を達成したことが報告されている。
また、非特許文献1では、カルバゾリルジシアノベンゼン誘導体(4CzTPN)が熱活性型遅延蛍光材料であること、また、このカルバゾリルジシアノベンゼン誘導体を用いた有機エレクトロルミネッセンス素子で、高い内部EL量子効率を達成したことが報告されている。
一方、遅延蛍光材料を発光材料として用いるのではなく、アシストドーパントとして発光層に用いることも提案されている(特許文献2参照)。ここでは、ホスト材料と蛍光発光材料の他に、ホスト材料と蛍光発光材料の中間の最低励起一重項エネルギーを有する遅延蛍光材料を発光層に添加することにより、発光効率を改善することが記載されている。
H. Uoyama, et al., Nature 492, 234 (2012)
上記のように、特許文献1、特許文献2および非特許文献1には、遅延蛍光材料を用いた有機エレクトロルミネッセンス素子において、高い発光効率が得られたことが報告されている。しかしながら、本発明者らが、特許文献1や特許文献2の記載にしたがって有機エレクトロルミネッセンス素子を作製したところ、十分な寿命を確保することが難しいことが判明した。また、短波長で色純度が高い発光を実現することも難しいことも判明した。
このような状況下において、本発明者らは、遅延蛍光材料を用いた有機発光素子において、長い寿命と高い色純度を実現することを目的として鋭意検討を進めた。
上記の目的を達成するために鋭意検討を進めた結果、本発明者らは、特定の条件を満たす複数の遅延蛍光材料とホスト材料と発光材料を発光層に添加することにより、高い色純度で長寿命な発光を実現できることを見出した。本発明は、このような知見に基づいて提案されたものであり、具体的に、以下の構成を有する。
[1] 下記条件(a)~(e)を満たす第1有機化合物と第2有機化合物と第3有機化合物と第4有機化合物を含む発光層を有する有機発光素子であって、
前記第2有機化合物および前記第3有機化合物は、互いに構造が異なる遅延蛍光材料であり、
前記有機発光素子からの発光の最大成分は前記第4有機化合物からの発光である、有機発光素子。
条件(a) ES1(1)>ES1(2)>ES1(4)>ES1(3)
条件(b) ES1(2)-ES1(3)<0.30eV
条件(c) ET1(1)>ET1(2)>ET1(3)
条件(d) Conc(1)>Conc(2)>Conc(3)
条件(e) Conc(3)≦20重量%
(上式において、
ES1(1)は前記第1有機化合物の最低励起一重項エネルギーを表す。
ES1(2)は前記第2有機化合物の最低励起一重項エネルギーを表す。
ES1(3)は前記第3有機化合物の最低励起一重項エネルギーを表す。
ES1(4)は前記第4有機化合物の最低励起一重項エネルギーを表す。
ET1(1)は前記第1有機化合物の最低励起三重項エネルギーを表す。
ET1(2)は前記第2有機化合物の最低励起三重項エネルギーを表す。
ET1(3)は前記第3有機化合物の最低励起三重項エネルギーを表す。
Conc(1)は前記発光層における前記第1有機化合物の濃度を表す。
Conc(2)は前記発光層における前記第2有機化合物の濃度を表す。
Conc(3)は前記発光層における前記第3有機化合物の濃度を表す。)
[2] さらに下記条件(c1)を満たす、[1]に記載の有機発光素子。
条件(c1) ET1(1)>ET1(2)>ET1(4)>ET1(3)
(上式において、ET1(4)は前記第4有機化合物の最低励起三重項エネルギーを表す。)
[3] さらに下記条件(d1)を満たす、[1]に記載の有機発光素子。
条件(d1) Conc(1)>Conc(2)>Conc(3)>Conc(4)
(上式において、Conc(4)は前記発光層における前記第4有機化合物の濃度を表す。)
[4] さらに下記条件(f)を満たす、[3]に記載の有機発光素子。
条件(f) Conc(3)/Conc(4)>5
[5] さらに下記条件(e2)を満たす、[1]~[4]のいずれかに記載の有機発光素子。
条件(e2) Conc(4)≦1重量%
[6] 前記第2有機化合物は、最低励起一重項状態と77Kの最低励起三重項状態とのエネルギーの差ΔEstが0.3eV以下である、[1]~[5]のいずれかに記載の有機発光素子。
[7] 前記第3有機化合物は、最低励起一重項状態と77Kの最低励起三重項状態とのエネルギーの差ΔEstが0.3eV以下である、[1]~[6]のいずれかに記載の有機発光素子。
[8] 前記発光層が、炭素原子、水素原子、窒素原子、ホウ素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物のみで構成される、[1]~[7]のいずれか1項に記載の有機発光素子。
[9] 前記第1有機化合物、前記第2有機化合物および前記第3有機化合物が、各々独立に、炭素原子、水素原子および窒素原子からなる群より選択される原子からなる化合物である、[1]~[8]のいずれかに記載の有機発光素子。
[10] 前記第2有機化合物と前記第3有機化合物が、いずれもシアノベンゼン構造を含む、[1]~[9]のいずれかに記載の有機発光素子。
前記第2有機化合物および前記第3有機化合物は、互いに構造が異なる遅延蛍光材料であり、
前記有機発光素子からの発光の最大成分は前記第4有機化合物からの発光である、有機発光素子。
条件(a) ES1(1)>ES1(2)>ES1(4)>ES1(3)
条件(b) ES1(2)-ES1(3)<0.30eV
条件(c) ET1(1)>ET1(2)>ET1(3)
条件(d) Conc(1)>Conc(2)>Conc(3)
条件(e) Conc(3)≦20重量%
(上式において、
ES1(1)は前記第1有機化合物の最低励起一重項エネルギーを表す。
ES1(2)は前記第2有機化合物の最低励起一重項エネルギーを表す。
ES1(3)は前記第3有機化合物の最低励起一重項エネルギーを表す。
ES1(4)は前記第4有機化合物の最低励起一重項エネルギーを表す。
ET1(1)は前記第1有機化合物の最低励起三重項エネルギーを表す。
ET1(2)は前記第2有機化合物の最低励起三重項エネルギーを表す。
ET1(3)は前記第3有機化合物の最低励起三重項エネルギーを表す。
Conc(1)は前記発光層における前記第1有機化合物の濃度を表す。
Conc(2)は前記発光層における前記第2有機化合物の濃度を表す。
Conc(3)は前記発光層における前記第3有機化合物の濃度を表す。)
[2] さらに下記条件(c1)を満たす、[1]に記載の有機発光素子。
条件(c1) ET1(1)>ET1(2)>ET1(4)>ET1(3)
(上式において、ET1(4)は前記第4有機化合物の最低励起三重項エネルギーを表す。)
[3] さらに下記条件(d1)を満たす、[1]に記載の有機発光素子。
条件(d1) Conc(1)>Conc(2)>Conc(3)>Conc(4)
(上式において、Conc(4)は前記発光層における前記第4有機化合物の濃度を表す。)
[4] さらに下記条件(f)を満たす、[3]に記載の有機発光素子。
条件(f) Conc(3)/Conc(4)>5
[5] さらに下記条件(e2)を満たす、[1]~[4]のいずれかに記載の有機発光素子。
条件(e2) Conc(4)≦1重量%
[6] 前記第2有機化合物は、最低励起一重項状態と77Kの最低励起三重項状態とのエネルギーの差ΔEstが0.3eV以下である、[1]~[5]のいずれかに記載の有機発光素子。
[7] 前記第3有機化合物は、最低励起一重項状態と77Kの最低励起三重項状態とのエネルギーの差ΔEstが0.3eV以下である、[1]~[6]のいずれかに記載の有機発光素子。
[8] 前記発光層が、炭素原子、水素原子、窒素原子、ホウ素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物のみで構成される、[1]~[7]のいずれか1項に記載の有機発光素子。
[9] 前記第1有機化合物、前記第2有機化合物および前記第3有機化合物が、各々独立に、炭素原子、水素原子および窒素原子からなる群より選択される原子からなる化合物である、[1]~[8]のいずれかに記載の有機発光素子。
[10] 前記第2有機化合物と前記第3有機化合物が、いずれもシアノベンゼン構造を含む、[1]~[9]のいずれかに記載の有機発光素子。
本発明の有機発光素子は、高い色純度で長寿命な発光を実現できる。
以下において、本発明の内容について詳細に説明する。以下に記載する構成要件の説明は、本発明の代表的な実施態様や具体例に基づいてなされることがあるが、本発明はそのような実施態様や具体例に限定されるものではない。なお、本願において「~」を用いて表される数値範囲は、「~」の前後に記載される数値を下限値および上限値として含む範囲を意味する。また、本願において「からなる」とは、「からなる」の前に記載されるもののみからなり、それ以外のものを含まないことを意味する。また、本発明に用いられる化合物の分子内に存在する水素原子の同位体種は特に限定されず、例えば分子内の水素原子がすべて1Hであってもよいし、一部または全部が2H(デューテリウムD)であってもよい。
(有機発光素子の特徴)
本発明の有機発光素子は、第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物を含む発光層を有する。このうち、第2有機化合物と第3有機化合物は、互いに構造が異なる遅延蛍光材料である。そして、これらの有機化合物は下記条件(a)~(e)を満たす。
条件(a) ES1(1)>ES1(2)>ES1(4)>ES1(3)
条件(b) ES1(2)-ES1(3)<0.30eV
条件(c) ET1(1)>ET1(2)>ET1(3)
条件(d) Conc(1)>Conc(2)>Conc(3)
条件(e) Conc(3)≦20重量%
本発明の有機発光素子は、第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物を含む発光層を有する。このうち、第2有機化合物と第3有機化合物は、互いに構造が異なる遅延蛍光材料である。そして、これらの有機化合物は下記条件(a)~(e)を満たす。
条件(a) ES1(1)>ES1(2)>ES1(4)>ES1(3)
条件(b) ES1(2)-ES1(3)<0.30eV
条件(c) ET1(1)>ET1(2)>ET1(3)
条件(d) Conc(1)>Conc(2)>Conc(3)
条件(e) Conc(3)≦20重量%
本願において、ES1(1)は前記第1有機化合物の最低励起一重項エネルギーを表し、ES1(2)は前記第2有機化合物の最低励起一重項エネルギーを表し、ES1(3)は前記第3有機化合物の最低励起一重項エネルギーを表し、ES1(4)は前記第4有機化合物の最低励起一重項エネルギーを表す。本願では単位としてeVを採用する。
ET1(1)は前記第1有機化合物の最低励起三重項エネルギーを表し、ET1(2)は前記第2有機化合物の最低励起三重項エネルギーを表し、ET1(3)は前記第3有機化合物の最低励起三重項エネルギーを表し、ET1(4)は前記第4有機化合物の最低励起三重項エネルギーを表す。本願では単位としてeVを採用する。
Conc(1)は前記発光層における前記第1有機化合物の濃度を表し、Conc(2)は前記発光層における前記第2有機化合物の濃度を表し、Conc(3)は前記発光層における前記第3有機化合物の濃度を表し、Conc(4)は前記発光層における前記第4有機化合物の濃度を表す。本願では単位として重量%を採用する。
ET1(1)は前記第1有機化合物の最低励起三重項エネルギーを表し、ET1(2)は前記第2有機化合物の最低励起三重項エネルギーを表し、ET1(3)は前記第3有機化合物の最低励起三重項エネルギーを表し、ET1(4)は前記第4有機化合物の最低励起三重項エネルギーを表す。本願では単位としてeVを採用する。
Conc(1)は前記発光層における前記第1有機化合物の濃度を表し、Conc(2)は前記発光層における前記第2有機化合物の濃度を表し、Conc(3)は前記発光層における前記第3有機化合物の濃度を表し、Conc(4)は前記発光層における前記第4有機化合物の濃度を表す。本願では単位として重量%を採用する。
本発明の有機発光素子は、最低励起一重項エネルギーについて条件(a)と条件(b)を同時に満たす。このため、第2有機化合物と第3有機化合物と第4有機化合物の最低励起一重項エネルギーES1(2)、ES1(3)、ES1(4)は、いずれも0.3eVの範囲内にある。ES1(2)-ES1(3)は、0.27eV以下の範囲内にしたり、0.24eV以下の範囲内にしたり、0.20eV以下の範囲内にしたりすることができる。また、0.30eV未満であれば、0.10eV以上の範囲内にしたり、0.14eV以上の範囲内にしたり、0.18eV以上の範囲内にしたりすることができる。
ES1(4)はES1(2)とES1(3)のいずれに近くてもよいが、例えば、ES1(3)よりもES1(2)に近い化合物を選択することができる。ES1(2)-ES1(4)とES1(4)-ES1(3)は、いずれも0.25eV以下の範囲内にしたり、0.20eV以下の範囲内にしたり、0.15eV以下の範囲内にしたりすることができる。また、0.29eV未満であれば、0.01eV以上の範囲内にしたり、0.05eV以上の範囲内にしたり、0.10eV以上の範囲内にしたりすることができる。
ES1(1)-ES1(2)は、0.2eV以上の範囲内にしたり、0.4eV以上の範囲内にしたり、0.6eV以上の範囲内にしたりすることができ、また、1.5eV以下の範囲内にしたり、1.2eV以下の範囲内にしたり、0.8eV以下の範囲内にしたりすることができる。
ES1(4)はES1(2)とES1(3)のいずれに近くてもよいが、例えば、ES1(3)よりもES1(2)に近い化合物を選択することができる。ES1(2)-ES1(4)とES1(4)-ES1(3)は、いずれも0.25eV以下の範囲内にしたり、0.20eV以下の範囲内にしたり、0.15eV以下の範囲内にしたりすることができる。また、0.29eV未満であれば、0.01eV以上の範囲内にしたり、0.05eV以上の範囲内にしたり、0.10eV以上の範囲内にしたりすることができる。
ES1(1)-ES1(2)は、0.2eV以上の範囲内にしたり、0.4eV以上の範囲内にしたり、0.6eV以上の範囲内にしたりすることができ、また、1.5eV以下の範囲内にしたり、1.2eV以下の範囲内にしたり、0.8eV以下の範囲内にしたりすることができる。
本発明の有機発光素子は、最低励起三重項エネルギーについて条件(c)の関係を満たすが、下記条件(c1)の関係も満たすことがより好ましい。
条件(c1) ET1(1)>ET1(2)>ET1(4)>ET1(3)
ET1(4)-ET1(3)は、0.01eV以上の範囲内にしたり、0.03eV以上の範囲内にしたり、0.05eV以上の範囲内にしたりすることができ、また、0.3eV以下の範囲内にしたり、0.2eV以下の範囲内にしたり、0.1eV以下の範囲内にしたりすることができる。
ET1(2)-ET1(4)は、0.01eV以上の範囲内にしたり、0.05eV以上の範囲内にしたりすることができ、また、0.3eV以下の範囲内にしたり、0.2eV以下の範囲内にしたりすることができる。
ET1(1)-ET1(2)は、0.2eV以上の範囲内にしたり、0.4eV以上の範囲内にしたりすることができ、また、0.8eV以下の範囲内にしたり、0.6eV以下の範囲内にしたりすることができる。
条件(c1) ET1(1)>ET1(2)>ET1(4)>ET1(3)
ET1(4)-ET1(3)は、0.01eV以上の範囲内にしたり、0.03eV以上の範囲内にしたり、0.05eV以上の範囲内にしたりすることができ、また、0.3eV以下の範囲内にしたり、0.2eV以下の範囲内にしたり、0.1eV以下の範囲内にしたりすることができる。
ET1(2)-ET1(4)は、0.01eV以上の範囲内にしたり、0.05eV以上の範囲内にしたりすることができ、また、0.3eV以下の範囲内にしたり、0.2eV以下の範囲内にしたりすることができる。
ET1(1)-ET1(2)は、0.2eV以上の範囲内にしたり、0.4eV以上の範囲内にしたりすることができ、また、0.8eV以下の範囲内にしたり、0.6eV以下の範囲内にしたりすることができる。
本発明の有機発光素子は、発光層における有機化合物の濃度について条件(d)および条件(e)の関係を満たす。本発明の有機発光素子は、さらに下記条件(d1)を満たすことが好ましい。
条件(d1) Conc(1)>Conc(2)>Conc(3)>Conc(4)
Conc(1)は30重量%以上であることが好ましく、50重量%以上の範囲内にしたり、65重量%以上の範囲内にしたりすることができ、また、99重量%以下の範囲内にしたり、85重量%以下の範囲内にしたり、75重量%以下の範囲内にしたりすることができる。
Conc(2)は10重量%以上であることが好ましく、20重量%以上の範囲内にしたり、30重量%以上の範囲内にしたりすることができ、また、45重量%以下の範囲内にしたり、40重量%以下の範囲内にしたり、35重量%以下の範囲内にしたりすることができる。
Conc(3)は20重量%以下の範囲内にする必要があり、15重量%以下であることが好ましく、10重量%以下であることがより好ましい。Conc(3)は7重量%以下の範囲内にしたり、また、0.5重量%以上の範囲内にしたり、1.0重量%以上の範囲内にしたり、2重量%以上の範囲内にしたり、4重量%以上の範囲内にしたりすることができる。
Conc(4)は5重量%以下であることが好ましく、3重量%以下であることがより好ましい。Conc(4)は1重量%以下の範囲内にしたり、0.5重量%以下の範囲内にしたりすることができ、また、0.01重量%以上の範囲内にしたり、0.1重量%以上の範囲内にしたり、0.3重量%以上の範囲内にしたりすることができる。
本発明の有機発光素子は、さらに下記条件(f)を満たすことが好ましい。
条件(f) Conc(3)/Conc(4)>5
Conc(3)/Conc(4)は7以上の範囲内にしたり、9以上の範囲内にしたりすることができ、また、500以下の範囲内にしたり、100以下の範囲内にしたり、50以下の範囲内にしたりすることができる。
条件(d1) Conc(1)>Conc(2)>Conc(3)>Conc(4)
Conc(1)は30重量%以上であることが好ましく、50重量%以上の範囲内にしたり、65重量%以上の範囲内にしたりすることができ、また、99重量%以下の範囲内にしたり、85重量%以下の範囲内にしたり、75重量%以下の範囲内にしたりすることができる。
Conc(2)は10重量%以上であることが好ましく、20重量%以上の範囲内にしたり、30重量%以上の範囲内にしたりすることができ、また、45重量%以下の範囲内にしたり、40重量%以下の範囲内にしたり、35重量%以下の範囲内にしたりすることができる。
Conc(3)は20重量%以下の範囲内にする必要があり、15重量%以下であることが好ましく、10重量%以下であることがより好ましい。Conc(3)は7重量%以下の範囲内にしたり、また、0.5重量%以上の範囲内にしたり、1.0重量%以上の範囲内にしたり、2重量%以上の範囲内にしたり、4重量%以上の範囲内にしたりすることができる。
Conc(4)は5重量%以下であることが好ましく、3重量%以下であることがより好ましい。Conc(4)は1重量%以下の範囲内にしたり、0.5重量%以下の範囲内にしたりすることができ、また、0.01重量%以上の範囲内にしたり、0.1重量%以上の範囲内にしたり、0.3重量%以上の範囲内にしたりすることができる。
本発明の有機発光素子は、さらに下記条件(f)を満たすことが好ましい。
条件(f) Conc(3)/Conc(4)>5
Conc(3)/Conc(4)は7以上の範囲内にしたり、9以上の範囲内にしたりすることができ、また、500以下の範囲内にしたり、100以下の範囲内にしたり、50以下の範囲内にしたりすることができる。
本発明の有機発光素子に用いる第2有機化合物は遅延蛍光材料である。また、第3有機化合物は、第2有機化合物とは構造が異なる遅延蛍光材料である。本発明における「遅延蛍光材料」とは、励起状態において、励起三重項状態から励起一重項状態への逆項間交差を生じ、その励起一重項状態から基底状態へ戻る際に蛍光(遅延蛍光)を放射する有機化合物である。本発明では、蛍光寿命測定システム(浜松ホトニクス社製ストリークカメラシステム等)により発光寿命を測定したとき、発光寿命が100ns(ナノ秒)以上の蛍光が観測されるものを遅延蛍光材料と言う。
第2有機化合物は、最低励起一重項エネルギーと77Kの最低励起三重項エネルギーの差ΔESTが0.3eV以下であることが好ましく、0.25eV以下であることがより好ましく、0.2eV以下であることがより好ましく、0.15eV以下であることがより好ましく、0.1eV以下であることがさらに好ましく、0.07eV以下であることがさらにより好ましく、0.05eV以下であることがさらにまた好ましく、0.03eV以下であることがさらになお好ましく、0.01eV以下であることが特に好ましい。
第3有機化合物は、最低励起一重項エネルギーと77Kの最低励起三重項エネルギーの差ΔESTが0.3eV以下であることが好ましく、0.25eV以下であることがより好ましく、0.2eV以下であることがより好ましく、0.15eV以下であることがより好ましく、0.1eV以下であることがさらに好ましく、0.07eV以下であることがさらにより好ましく、0.05eV以下であることがさらにまた好ましく、0.03eV以下であることがさらになお好ましく、0.01eV以下であることが特に好ましい。
ΔESTが小さければ、熱エネルギーの吸収によって励起一重項状態から励起三重項状態に逆項間交差しやすいため、熱活性化型の遅延蛍光材料として機能する。熱活性化型の遅延蛍光材料は、デバイスが発する熱を吸収して励起三重項状態から励起一重項へ比較的容易に逆項間交差し、その励起三重項エネルギーを効率よく発光に寄与させることができる。
第2有機化合物は、最低励起一重項エネルギーと77Kの最低励起三重項エネルギーの差ΔESTが0.3eV以下であることが好ましく、0.25eV以下であることがより好ましく、0.2eV以下であることがより好ましく、0.15eV以下であることがより好ましく、0.1eV以下であることがさらに好ましく、0.07eV以下であることがさらにより好ましく、0.05eV以下であることがさらにまた好ましく、0.03eV以下であることがさらになお好ましく、0.01eV以下であることが特に好ましい。
第3有機化合物は、最低励起一重項エネルギーと77Kの最低励起三重項エネルギーの差ΔESTが0.3eV以下であることが好ましく、0.25eV以下であることがより好ましく、0.2eV以下であることがより好ましく、0.15eV以下であることがより好ましく、0.1eV以下であることがさらに好ましく、0.07eV以下であることがさらにより好ましく、0.05eV以下であることがさらにまた好ましく、0.03eV以下であることがさらになお好ましく、0.01eV以下であることが特に好ましい。
ΔESTが小さければ、熱エネルギーの吸収によって励起一重項状態から励起三重項状態に逆項間交差しやすいため、熱活性化型の遅延蛍光材料として機能する。熱活性化型の遅延蛍光材料は、デバイスが発する熱を吸収して励起三重項状態から励起一重項へ比較的容易に逆項間交差し、その励起三重項エネルギーを効率よく発光に寄与させることができる。
本願における、化合物の最低励起一重項エネルギー(ES1)と最低励起三重項エネルギー(ET1)は、下記の手順により求めた値である。ΔESTはES1-ET1を計算することにより求めた値である。
(1)最低励起一重項エネルギー(ES1)
測定対象化合物の薄膜もしくはトルエン溶液(濃度10-5mol/L)を調製して試料とする。常温(300K)でこの試料の蛍光スペクトルを測定する。蛍光スペクトルは、縦軸を発光、横軸を波長とする。この発光スペクトルの短波側の立ち上がりに対して接線を引き、その接線と横軸との交点の波長値 λedge[nm]を求める。この波長値を次に示す換算式でエネルギー値に換算した値をES1とする。
換算式:ES1[eV]=1239.85/λedge
後述の実施例における発光スペクトルの測定は、励起光源にLED光源(Thorlabs社製、M300L4)を用いて検出器(浜松ホトニクス社製、PMA-12マルチチャンネル分光器 C10027-01)により行った。
(2)最低励起三重項エネルギー(ET1)
最低励起一重項エネルギー(ES1)の測定で用いたのと同じ試料を、液体窒素によって77[K]に冷却し、励起光(300nm)を燐光測定用試料に照射し、検出器を用いて燐光を測定する。励起光照射後から100ミリ秒以降の発光を燐光スペクトルとする。この燐光スペクトルの短波長側の立ち上がりに対して接線を引き、その接線と横軸との交点の波長値λedge[nm]を求める。この波長値を次に示す換算式でエネルギー値に換算した値をET1とする。
換算式:ET1[eV]=1239.85/λedge
燐光スペクトルの短波長側の立ち上がりに対する接線は以下のように引く。燐光スペクトルの短波長側から、スペクトルの極大値のうち、最も短波長側の極大値までスペクトル曲線上を移動する際に、長波長側に向けて曲線上の各点における接線を考える。この接線は、曲線が立ち上がるにつれ(つまり縦軸が増加するにつれ)、傾きが増加する。この傾きの値が極大値をとる点において引いた接線を、当該燐光スペクトルの短波長側の立ち上がりに対する接線とする。
なお、スペクトルの最大ピーク強度の10%以下のピーク強度をもつ極大点は、上述の最も短波長側の極大値には含めず、最も短波長側の極大値に最も近い、傾きの値が極大値をとる点において引いた接線を当該燐光スペクトルの短波長側の立ち上がりに対する接線とする。
(1)最低励起一重項エネルギー(ES1)
測定対象化合物の薄膜もしくはトルエン溶液(濃度10-5mol/L)を調製して試料とする。常温(300K)でこの試料の蛍光スペクトルを測定する。蛍光スペクトルは、縦軸を発光、横軸を波長とする。この発光スペクトルの短波側の立ち上がりに対して接線を引き、その接線と横軸との交点の波長値 λedge[nm]を求める。この波長値を次に示す換算式でエネルギー値に換算した値をES1とする。
換算式:ES1[eV]=1239.85/λedge
後述の実施例における発光スペクトルの測定は、励起光源にLED光源(Thorlabs社製、M300L4)を用いて検出器(浜松ホトニクス社製、PMA-12マルチチャンネル分光器 C10027-01)により行った。
(2)最低励起三重項エネルギー(ET1)
最低励起一重項エネルギー(ES1)の測定で用いたのと同じ試料を、液体窒素によって77[K]に冷却し、励起光(300nm)を燐光測定用試料に照射し、検出器を用いて燐光を測定する。励起光照射後から100ミリ秒以降の発光を燐光スペクトルとする。この燐光スペクトルの短波長側の立ち上がりに対して接線を引き、その接線と横軸との交点の波長値λedge[nm]を求める。この波長値を次に示す換算式でエネルギー値に換算した値をET1とする。
換算式:ET1[eV]=1239.85/λedge
燐光スペクトルの短波長側の立ち上がりに対する接線は以下のように引く。燐光スペクトルの短波長側から、スペクトルの極大値のうち、最も短波長側の極大値までスペクトル曲線上を移動する際に、長波長側に向けて曲線上の各点における接線を考える。この接線は、曲線が立ち上がるにつれ(つまり縦軸が増加するにつれ)、傾きが増加する。この傾きの値が極大値をとる点において引いた接線を、当該燐光スペクトルの短波長側の立ち上がりに対する接線とする。
なお、スペクトルの最大ピーク強度の10%以下のピーク強度をもつ極大点は、上述の最も短波長側の極大値には含めず、最も短波長側の極大値に最も近い、傾きの値が極大値をとる点において引いた接線を当該燐光スペクトルの短波長側の立ち上がりに対する接線とする。
(第1有機化合物)
第1有機化合物は、第2有機化合物、第3有機化合物および第4有機化合物よりも最低励起一重項エネルギーが大きい有機化合物であり、キャリアの輸送を担うホスト材料としての機能や第4有機化合物のエネルギーを該化合物中に閉じ込める機能を有する。これにより、第4有機化合物は、分子内でホールと電子とが再結合することによって生じたエネルギー、および、第1有機化合物、第2有機化合物および第3有機化合物から受け取ったエネルギーを効率よく発光に変換することができる。
第1有機化合物としては、正孔輸送能、電子輸送能を有し、かつ発光の長波長化を防ぎ、なおかつ高いガラス転移温度を有する有機化合物であることが好ましい。また、本発明の好ましい態様では、第1有機化合物は遅延蛍光を放射しない化合物の中から選択する。
以下に、第1有機化合物として用いることができる好ましい化合物を挙げる。
第1有機化合物は、第2有機化合物、第3有機化合物および第4有機化合物よりも最低励起一重項エネルギーが大きい有機化合物であり、キャリアの輸送を担うホスト材料としての機能や第4有機化合物のエネルギーを該化合物中に閉じ込める機能を有する。これにより、第4有機化合物は、分子内でホールと電子とが再結合することによって生じたエネルギー、および、第1有機化合物、第2有機化合物および第3有機化合物から受け取ったエネルギーを効率よく発光に変換することができる。
第1有機化合物としては、正孔輸送能、電子輸送能を有し、かつ発光の長波長化を防ぎ、なおかつ高いガラス転移温度を有する有機化合物であることが好ましい。また、本発明の好ましい態様では、第1有機化合物は遅延蛍光を放射しない化合物の中から選択する。
以下に、第1有機化合物として用いることができる好ましい化合物を挙げる。
(第2有機化合物)
第2有機化合物は、第1有機化合物よりも最低励起一重項エネルギーが小さくて、第3有機化合物や第4有機化合物よりも最低励起一重項エネルギーが大きい遅延蛍光材料である。また、第2有機化合物は、第1有機化合物よりも最低励起三重項エネルギーが小さくて、第3有機化合物よりも最低励起三重項エネルギーが大きい遅延蛍光材料である。第2有機化合物は、何らかの条件下で遅延蛍光を放射しうる化合物であればよく、本発明の有機発光素子において第2有機化合物に由来する遅延蛍光を放射することは必須とされない。本発明の有機発光素子において、第2有機化合物は、励起一重項状態の第1有機化合物からエネルギーを受け取って励起一重項状態に遷移する。また、第2有機化合物は、励起三重項状態の第1有機化合物からエネルギーを受け取って励起三重項状態に遷移してもよい。第2有機化合物はΔESTが小さいことから、励起三重項状態の第2有機化合物は励起一重項状態の第2有機化合物へ逆項間交差しやすい。これらの経路により生じた励起一重項状態の第2有機化合物は、第3有機化合物および第4有機化合物へエネルギーを与えてこれらの化合物を励起一重項状態に遷移させる。
以下に、第2有機化合物として用いることができる好ましい化合物を挙げる。以下の例示化合物の構造式において、t-Buはターシャリーブチル基を表す。
第2有機化合物は、第1有機化合物よりも最低励起一重項エネルギーが小さくて、第3有機化合物や第4有機化合物よりも最低励起一重項エネルギーが大きい遅延蛍光材料である。また、第2有機化合物は、第1有機化合物よりも最低励起三重項エネルギーが小さくて、第3有機化合物よりも最低励起三重項エネルギーが大きい遅延蛍光材料である。第2有機化合物は、何らかの条件下で遅延蛍光を放射しうる化合物であればよく、本発明の有機発光素子において第2有機化合物に由来する遅延蛍光を放射することは必須とされない。本発明の有機発光素子において、第2有機化合物は、励起一重項状態の第1有機化合物からエネルギーを受け取って励起一重項状態に遷移する。また、第2有機化合物は、励起三重項状態の第1有機化合物からエネルギーを受け取って励起三重項状態に遷移してもよい。第2有機化合物はΔESTが小さいことから、励起三重項状態の第2有機化合物は励起一重項状態の第2有機化合物へ逆項間交差しやすい。これらの経路により生じた励起一重項状態の第2有機化合物は、第3有機化合物および第4有機化合物へエネルギーを与えてこれらの化合物を励起一重項状態に遷移させる。
以下に、第2有機化合物として用いることができる好ましい化合物を挙げる。以下の例示化合物の構造式において、t-Buはターシャリーブチル基を表す。
(第3有機化合物)
第3有機化合物は、第1有機化合物、第2有機化合物および第4有機化合物よりも最低励起一重項エネルギーが小さい遅延蛍光材料であり、第1有機化合物および第2有機化合物よりも最低励起三重項エネルギーが小さい遅延蛍光材料である。第3有機化合物は、何らかの条件下で遅延蛍光を放射しうる化合物であればよく、本発明の有機発光素子では第3有機化合物に由来する遅延蛍光を放射することは必須とされない。本発明の有機発光素子において第3有機化合物は、第2有機化合物で生成した励起子の一部を第3有機化合物へエネルギー移動させることにより、第2有機化合物の励起子負担を低減させる役割を果たす。本発明の有機発光素子の発光層における第3有機化合物の濃度は、第1有機化合物の濃度や第2有機化合物の濃度よりも小さく、20重量%以下である。このように第3有機化合物の濃度を抑えるとともに、第2有機化合物と第3有機化合物の最低励起一重項エネルギーの差を0.30eV未満に設定することにより、本発明の好ましい態様では、ソルバトクロミック効果により発光波長が短波長化し、第4化合物へのエネルギー移動が可能な準位になる。それによって、有機発光素子のさらなる長寿命化と望ましい色度を実現することができる。また、本発明の好ましい態様では、第3有機化合物の最低励起三重項エネルギーは、第4有機化合物の最低励起三重項エネルギーよりも小さいことが好ましい。これによって、第3有機化合物は、励起三重項状態の第4有機化合物からエネルギーを受け取って励起三重項状態に遷移する。第3有機化合物はΔESTが小さいことから、励起三重項状態の第3有機化合物は励起一重項状態の第3有機化合物へ逆項間交差しやすい。これらの経路により生じた励起一重項状態の第3有機化合物は、第4有機化合物へエネルギーを与えて第4有機化合物を励起一重項状態に遷移させることができる。
以下に、第3有機化合物として用いることができる好ましい化合物を挙げる。
第3有機化合物は、第1有機化合物、第2有機化合物および第4有機化合物よりも最低励起一重項エネルギーが小さい遅延蛍光材料であり、第1有機化合物および第2有機化合物よりも最低励起三重項エネルギーが小さい遅延蛍光材料である。第3有機化合物は、何らかの条件下で遅延蛍光を放射しうる化合物であればよく、本発明の有機発光素子では第3有機化合物に由来する遅延蛍光を放射することは必須とされない。本発明の有機発光素子において第3有機化合物は、第2有機化合物で生成した励起子の一部を第3有機化合物へエネルギー移動させることにより、第2有機化合物の励起子負担を低減させる役割を果たす。本発明の有機発光素子の発光層における第3有機化合物の濃度は、第1有機化合物の濃度や第2有機化合物の濃度よりも小さく、20重量%以下である。このように第3有機化合物の濃度を抑えるとともに、第2有機化合物と第3有機化合物の最低励起一重項エネルギーの差を0.30eV未満に設定することにより、本発明の好ましい態様では、ソルバトクロミック効果により発光波長が短波長化し、第4化合物へのエネルギー移動が可能な準位になる。それによって、有機発光素子のさらなる長寿命化と望ましい色度を実現することができる。また、本発明の好ましい態様では、第3有機化合物の最低励起三重項エネルギーは、第4有機化合物の最低励起三重項エネルギーよりも小さいことが好ましい。これによって、第3有機化合物は、励起三重項状態の第4有機化合物からエネルギーを受け取って励起三重項状態に遷移する。第3有機化合物はΔESTが小さいことから、励起三重項状態の第3有機化合物は励起一重項状態の第3有機化合物へ逆項間交差しやすい。これらの経路により生じた励起一重項状態の第3有機化合物は、第4有機化合物へエネルギーを与えて第4有機化合物を励起一重項状態に遷移させることができる。
以下に、第3有機化合物として用いることができる好ましい化合物を挙げる。
第2有機化合物および第3有機化合物には、上記以外にも公知の遅延蛍光材料を適宜組み合わせて用いることができる。また、知られていない遅延蛍光材料であっても、用いることが可能である。
好ましい遅延蛍光材料として、WO2013/154064号公報の段落0008~0048および0095~0133、WO2013/011954号公報の段落0007~0047および0073~0085、WO2013/011955号公報の段落0007~0033および0059~0066、WO2013/081088号公報の段落0008~0071および0118~0133、特開2013-256490号公報の段落0009~0046および0093~0134、特開2013-116975号公報の段落0008~0020および0038~0040、WO2013/133359号公報の段落0007~0032および0079~0084、WO2013/161437号公報の段落0008~0054および0101~0121、特開2014-9352号公報の段落0007~0041および0060~0069、特開2014-9224号公報の段落0008~0048および0067~0076、特開2017-119663号公報の段落0013~0025、特開2017-119664号公報の段落0013~0026、特開2017-222623号公報の段落0012~0025、特開2017-226838号公報の段落0010~0050、特開2018-100411号公報の段落0012~0043、WO2018/047853号公報の段落0016~0044に記載される一般式に包含される化合物、特に例示化合物であって、遅延蛍光を放射するものを挙げることができる。また、特開2013-253121号公報、WO2013/133359号公報、WO2014/034535号公報、WO2014/115743号公報、WO2014/122895号公報、WO2014/126200号公報、WO2014/136758号公報、WO2014/133121号公報、WO2014/136860号公報、WO2014/196585号公報、WO2014/189122号公報、WO2014/168101号公報、WO2015/008580号公報、WO2014/203840号公報、WO2015/002213号公報、WO2015/016200号公報、WO2015/019725号公報、WO2015/072470号公報、WO2015/108049号公報、WO2015/080182号公報、WO2015/072537号公報、WO2015/080183号公報、特開2015-129240号公報、WO2015/129714号公報、WO2015/129715号公報、WO2015/133501号公報、WO2015/136880号公報、WO2015/137244号公報、WO2015/137202号公報、WO2015/137136号公報、WO2015/146541号公報、WO2015/159541号公報に記載される発光材料であって、遅延蛍光を放射するものを好ましく採用することができる。なお、この段落に記載される上記の公報は、本明細書の一部としてここに引用している。
好ましい遅延蛍光材料として、WO2013/154064号公報の段落0008~0048および0095~0133、WO2013/011954号公報の段落0007~0047および0073~0085、WO2013/011955号公報の段落0007~0033および0059~0066、WO2013/081088号公報の段落0008~0071および0118~0133、特開2013-256490号公報の段落0009~0046および0093~0134、特開2013-116975号公報の段落0008~0020および0038~0040、WO2013/133359号公報の段落0007~0032および0079~0084、WO2013/161437号公報の段落0008~0054および0101~0121、特開2014-9352号公報の段落0007~0041および0060~0069、特開2014-9224号公報の段落0008~0048および0067~0076、特開2017-119663号公報の段落0013~0025、特開2017-119664号公報の段落0013~0026、特開2017-222623号公報の段落0012~0025、特開2017-226838号公報の段落0010~0050、特開2018-100411号公報の段落0012~0043、WO2018/047853号公報の段落0016~0044に記載される一般式に包含される化合物、特に例示化合物であって、遅延蛍光を放射するものを挙げることができる。また、特開2013-253121号公報、WO2013/133359号公報、WO2014/034535号公報、WO2014/115743号公報、WO2014/122895号公報、WO2014/126200号公報、WO2014/136758号公報、WO2014/133121号公報、WO2014/136860号公報、WO2014/196585号公報、WO2014/189122号公報、WO2014/168101号公報、WO2015/008580号公報、WO2014/203840号公報、WO2015/002213号公報、WO2015/016200号公報、WO2015/019725号公報、WO2015/072470号公報、WO2015/108049号公報、WO2015/080182号公報、WO2015/072537号公報、WO2015/080183号公報、特開2015-129240号公報、WO2015/129714号公報、WO2015/129715号公報、WO2015/133501号公報、WO2015/136880号公報、WO2015/137244号公報、WO2015/137202号公報、WO2015/137136号公報、WO2015/146541号公報、WO2015/159541号公報に記載される発光材料であって、遅延蛍光を放射するものを好ましく採用することができる。なお、この段落に記載される上記の公報は、本明細書の一部としてここに引用している。
下記一般式(1)で表され、遅延蛍光を放射する化合物を、本発明の遅延蛍光材料として好ましく用いることができる。本発明の好ましい実施態様では、第2有機化合物と第3有機化合物として、ともに一般式(1)で表される化合物を採用することができる。
一般式(1)において、X1~X5はNまたはC-Rを表す。Rは水素原子または置換基を表す。X1~X5のうちの2つ以上がC-Rを表すとき、それらのC-Rは互いに同一であっても異なっていてもよい。ただし、X1~X5のうちの少なくとも1つはC-D(ここでいうDはドナー性基を表す)である。X1~X5のすべてがC-Rであるとき、Zはアクセプター性基を表し、X1~X5の少なくとも1つがNであるとき、Zは水素原子または置換基を表す。
一般式(1)で表される化合物の中で特に好ましい化合物は、下記一般式(2)で表される化合物である。
一般式(1)で表される化合物の中で特に好ましい化合物は、下記一般式(2)で表される化合物である。
一般式(2)において、X1~X5はNまたはC-Rを表す。Rは水素原子または置換基を表す。X1~X5のうちの2つ以上がC-Rを表すとき、それらのC-Rは互いに同一であっても異なっていてもよい。ただし、X1~X5のうちの少なくとも1つはC-D(ここでいうDはドナー性基を表す)である。
一般式(1)のZが表す置換基の説明と好ましい範囲については、後述の一般式(7)の置換基の説明と好ましい範囲を参照することができる。一般式(1)のZが表すアクセプター性基は、Zが結合している環に対して電子を供与する性質を有する基であり、例えばハメットのσp値が正の基の中から選択することができる。一般式(1)および一般式(2)のDが表すドナー性基は、Dが結合している環に対して電子を吸引する性質を有する基であり、例えばハメットのσp値が負の基の中から選択することができる。以下において、アクセプター性基をAと称することがある。
ここで、「ハメットのσp値」は、L.P.ハメットにより提唱されたものであり、パラ置換ベンゼン誘導体の反応速度または平衡に及ぼす置換基の影響を定量化したものである。具体的には、パラ置換ベンゼン誘導体における置換基と反応速度定数または平衡定数の間に成立する下記式:
log(k/k0) = ρσp
または
log(K/K0) = ρσp
における置換基に特有な定数(σp)である。上式において、kは置換基を持たないベンゼン誘導体の速度定数、k0は置換基で置換されたベンゼン誘導体の速度定数、Kは置換基を持たないベンゼン誘導体の平衡定数、K0は置換基で置換されたベンゼン誘導体の平衡定数、ρは反応の種類と条件によって決まる反応定数を表す。本発明における「ハメットのσp値」に関する説明と各置換基の数値については、Hansch,C.et.al.,Chem.Rev.,91,165-195(1991)のσp値に関する記載を参照することができる。
ここで、「ハメットのσp値」は、L.P.ハメットにより提唱されたものであり、パラ置換ベンゼン誘導体の反応速度または平衡に及ぼす置換基の影響を定量化したものである。具体的には、パラ置換ベンゼン誘導体における置換基と反応速度定数または平衡定数の間に成立する下記式:
log(k/k0) = ρσp
または
log(K/K0) = ρσp
における置換基に特有な定数(σp)である。上式において、kは置換基を持たないベンゼン誘導体の速度定数、k0は置換基で置換されたベンゼン誘導体の速度定数、Kは置換基を持たないベンゼン誘導体の平衡定数、K0は置換基で置換されたベンゼン誘導体の平衡定数、ρは反応の種類と条件によって決まる反応定数を表す。本発明における「ハメットのσp値」に関する説明と各置換基の数値については、Hansch,C.et.al.,Chem.Rev.,91,165-195(1991)のσp値に関する記載を参照することができる。
一般式(1)および一般式(2)において、X1~X5はNまたはC-Rを表すが、少なくとも1つはC-Dである。X1~X5のうちNの数は、0~4つであり、例えば、X1とX3とX5、X1とX3、X1とX4、X2とX3、X1とX5、X2とX4、X1だけ、X2だけ、X3だけがNである場合を例示することができる。X1~X5のうちC-Dの数は1~5つであり、2~5つであることが好ましい。例えば、X1とX2とX3とX4とX5、X1とX2とX4とX5、X1とX2とX3とX4、X1とX3とX4とX5、X1とX3とX5、X1とX2とX5、X1とX2とX4、X1とX3とX4、X1とX3、X1とX4、X2とX3、X1とX5、X2とX4、X1だけ、X2だけ、X3だけがC-Dである場合を例示することができる。X1~X5のうちの少なくとも1つはC-Aであってもよい。ここでいうAはアクセプター性基を表す。X1~X5のうちC-Aの数は0~2であることが好ましく、0または1であることがより好ましい。C-AのAとして好ましくはシアノ基を挙げることができる。また、X1~X5は各々独立にC-DまたはC-Aであってもよい。
X1~X5のうちの隣り合う2つがC-Rを表すとき、2つのRは互いに結合して環状構造を形成していてもよい。互いに結合して形成する環状構造は芳香環であっても脂肪環であってもよく、またヘテロ原子を含むものであってもよく、さらに環状構造は2環以上の縮合環であってもよい。ここでいうヘテロ原子としては、窒素原子、酸素原子および硫黄原子からなる群より選択されるものであることが好ましい。形成される環状構造の例として、ベンゼン環、ナフタレン環、ピリジン環、ピリダジン環、ピリミジン環、ピラジン環、ピロール環、イミダゾール環、ピラゾール環、イミダゾリン環、オキサゾール環、イソオキサゾール環、チアゾール環、イソチアゾール環、シクロヘキサジエン環、シクロヘキセン環、シクロペンタエン環、シクロヘプタトリエン環、シクロヘプタジエン環、シクロヘプタエン環、フラン環、チオフェン環、ナフチリジン環、キノキサリン環、キノリン環などを挙げることができる。例えばトリフェニレンのように多数の環が縮合した環を形成してもよい。
X1~X5のうちの隣り合う2つがC-Rを表すとき、2つのRは互いに結合して環状構造を形成していてもよい。互いに結合して形成する環状構造は芳香環であっても脂肪環であってもよく、またヘテロ原子を含むものであってもよく、さらに環状構造は2環以上の縮合環であってもよい。ここでいうヘテロ原子としては、窒素原子、酸素原子および硫黄原子からなる群より選択されるものであることが好ましい。形成される環状構造の例として、ベンゼン環、ナフタレン環、ピリジン環、ピリダジン環、ピリミジン環、ピラジン環、ピロール環、イミダゾール環、ピラゾール環、イミダゾリン環、オキサゾール環、イソオキサゾール環、チアゾール環、イソチアゾール環、シクロヘキサジエン環、シクロヘキセン環、シクロペンタエン環、シクロヘプタトリエン環、シクロヘプタジエン環、シクロヘプタエン環、フラン環、チオフェン環、ナフチリジン環、キノキサリン環、キノリン環などを挙げることができる。例えばトリフェニレンのように多数の環が縮合した環を形成してもよい。
一般式(3)において、R11とR12は、各々独立に置換もしくは無置換のアルキル基、置換もしくは無置換のアルケニル基、置換もしくは無置換のアリール基、または置換もしくは無置換のヘテロアリール基を表す。R11とR12は互いに結合して環状構造を形成してもよい。Lは単結合、置換もしくは無置換のアリーレン基、または置換もしくは無置換のヘテロアリーレン基を表す。Lのアリーレン基またはヘテロアリーレン基に導入しうる置換基は、一般式(1)や一般式(2)で表される基であってもよいし、後述する一般式(3)~(6)で表される基であってもよい。これらの(1)~(6)で表される基はLに導入可能な置換基の最大数まで導入されていてもよい。また、一般式(1)~(6)で表される基が複数個導入されている場合は、それらの置換基は互いに同一であっても異なっていてもよい。*は、一般式(1)または一般式(2)における環の環骨格を構成する炭素原子(C)への結合位置を表す。
ここでいう「アルキル基」は、直鎖状、分枝状、環状のいずれであってもよい。また、直鎖部分と環状部分と分枝部分のうちの2種以上が混在していてもよい。アルキル基の炭素数は、例えば1以上、2以上、4以上とすることができる。また、炭素数は30以下、20以下、10以下、6以下、4以下とすることができる。アルキル基の具体例として、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、tert-ブチル基、n-ペンチル基、イソペンチル基、n-ヘキシル基、イソヘキシル基、2-エチルヘキシル基、n-ヘプチル基、イソヘプチル基、n-オクチル基、イソオクチル基、n-ノニル基、イソノニル基、n-デカニル基、イソデカニル基、シクロペンチル基、シクロヘキシル基、シクロヘプチル基を挙げることができる。置換基たるアルキル基は、さらにアリール基で置換されていてもよい。
「アルケニル基」は、直鎖状、分枝状、環状のいずれであってもよい。また、直鎖部分と環状部分と分枝部分のうちの2種以上が混在していてもよい。アルケニル基の炭素数は、例えば2以上、4以上とすることができる。また、炭素数は30以下、20以下、10以下、6以下、4以下とすることができる。アルケニル基の具体例として、エテニル基、n-プロペニル基、イソプロペニル基、n-ブテニル基、イソブテニル基、n-ペンテニル基、イソペンテニル基、n-ヘキセニル基、イソヘキセニル基、2-エチルヘキセニル基を挙げることができる。置換基たるアルケニル基は、さらに置換基で置換されていてもよい。
「アリール基」および「ヘテロアリール基」は、単環であってもよいし、2つ以上の環が縮合した縮合環であってもよい。縮合環である場合、縮合している環の数は2~6であることが好ましく、例えば2~4の中から選択することができる。環の具体例として、ベンゼン環、ピリジン環、ピリミジン環、トリアジン環、ナフタレン環、アントラセン環、フェナントレン環、トリフェニレン環、キノリン環、ピラジン環、キノキサリン環、ナフチリジン環を挙げることができる。アリーレン基またはヘテロアリーレン基の具体例として、フェニル基、1-ナフチル基、2-ナフチル基、1-アントラセニル基、2-アントラセニル基、9-アントラセニル基、2-ピリジル基、3-ピリジル基、4-ピリジル基を挙げることができる。
置換基は、水素原子に置換しうる1価の基を意味しており、縮合するものを含む概念ではない。置換基の説明と好ましい範囲については、後述の一般式(7)の置換基の説明と好ましい範囲を参照することができる。
ここでいう「アルキル基」は、直鎖状、分枝状、環状のいずれであってもよい。また、直鎖部分と環状部分と分枝部分のうちの2種以上が混在していてもよい。アルキル基の炭素数は、例えば1以上、2以上、4以上とすることができる。また、炭素数は30以下、20以下、10以下、6以下、4以下とすることができる。アルキル基の具体例として、メチル基、エチル基、n-プロピル基、イソプロピル基、n-ブチル基、イソブチル基、tert-ブチル基、n-ペンチル基、イソペンチル基、n-ヘキシル基、イソヘキシル基、2-エチルヘキシル基、n-ヘプチル基、イソヘプチル基、n-オクチル基、イソオクチル基、n-ノニル基、イソノニル基、n-デカニル基、イソデカニル基、シクロペンチル基、シクロヘキシル基、シクロヘプチル基を挙げることができる。置換基たるアルキル基は、さらにアリール基で置換されていてもよい。
「アルケニル基」は、直鎖状、分枝状、環状のいずれであってもよい。また、直鎖部分と環状部分と分枝部分のうちの2種以上が混在していてもよい。アルケニル基の炭素数は、例えば2以上、4以上とすることができる。また、炭素数は30以下、20以下、10以下、6以下、4以下とすることができる。アルケニル基の具体例として、エテニル基、n-プロペニル基、イソプロペニル基、n-ブテニル基、イソブテニル基、n-ペンテニル基、イソペンテニル基、n-ヘキセニル基、イソヘキセニル基、2-エチルヘキセニル基を挙げることができる。置換基たるアルケニル基は、さらに置換基で置換されていてもよい。
「アリール基」および「ヘテロアリール基」は、単環であってもよいし、2つ以上の環が縮合した縮合環であってもよい。縮合環である場合、縮合している環の数は2~6であることが好ましく、例えば2~4の中から選択することができる。環の具体例として、ベンゼン環、ピリジン環、ピリミジン環、トリアジン環、ナフタレン環、アントラセン環、フェナントレン環、トリフェニレン環、キノリン環、ピラジン環、キノキサリン環、ナフチリジン環を挙げることができる。アリーレン基またはヘテロアリーレン基の具体例として、フェニル基、1-ナフチル基、2-ナフチル基、1-アントラセニル基、2-アントラセニル基、9-アントラセニル基、2-ピリジル基、3-ピリジル基、4-ピリジル基を挙げることができる。
置換基は、水素原子に置換しうる1価の基を意味しており、縮合するものを含む概念ではない。置換基の説明と好ましい範囲については、後述の一般式(7)の置換基の説明と好ましい範囲を参照することができる。
一般式(4)~(6)において、R51~R60、R61~R68、R71~R78は、各々独立に水素原子または置換基を表す。ここでいう置換基の説明と好ましい範囲については、後述の一般式(7)における置換基の説明と好ましい範囲を参照することができる。R51~R60、R61~R68、R71~R78は、各々独立に上記一般式(4)~(6)のいずれかで表される基であることも好ましい。一般式(4)~(6)における置換基の数は特に制限されない。すべてが無置換(すなわち水素原子)である場合も好ましい。また、一般式(4)~(6)のそれぞれにおいて置換基が2つ以上ある場合、それらの置換基は同一であっても異なっていてもよい。一般式(4)~(6)に置換基が存在している場合、その置換基は一般式(4)であればR52~R59のいずれかであることが好ましく、一般式(5)であればR62~R67のいずれかであることが好ましく、一般式(6)であればR72~R77のいずれかであることが好ましい。
一般式(4)~(6)において、R51とR52、R52とR53、R53とR54、R54とR55、R55とR56、R56とR57、R57とR58、R58とR59、R59とR60、R61とR62、R62とR63、R63とR64、R65とR66、R66とR67、R67とR68、R71とR72、R72とR73、R73とR74、R75とR76、R76とR77、R77とR78は、互いに結合して環状構造を形成していてもよい。環状構造の説明と好ましい例については、上記の一般式(1)および一般式(2)のX1~X5における環状構造の説明と好ましい例を参照することができる。
一般式(6)においてXは連結鎖長が1原子である2価の酸素原子、硫黄原子、置換もしくは無置換の窒素原子、置換もしくは無置換の炭素原子、置換もしくは無置換のケイ素原子、カルボニル基、あるいは、結合鎖長が2原子である2価の置換もしくは無置換のエチレン基、置換もしくは無置換のビニレン基、置換もしくは無置換のo-アリーレン基、または置換もしくは無置換のo-ヘテロアリーレン基を表す。置換基の具体例と好ましい範囲については、上記の一般式(1)および一般式(2)における置換基の記載を参照することができる。
一般式(4)~(6)において、L12~L14は、単結合、置換もしくは無置換のアリーレン基、または置換もしくは無置換のヘテロアリーレン基を表す。L12~L14が表すアリーレン基またはヘテロアリーレン基の説明と好ましい範囲については、Lが表すアリーレン基またはヘテロアリーレン基の説明と好ましい範囲を参照することができる。L12~L14は、単結合、置換もしくは無置換のアリーレン基であることが好ましい。ここでいうアリーレン基やヘテロアリーレン基の置換基は、一般式(1)~(6)で表される基であってもよい。一般式(1)~(6)で表される基はL11~L14に導入可能な置換基の最大数まで導入されていてもよい。また、一般式(1)~(6)で表される基が複数個導入されている場合は、それらの置換基は互いに同一であっても異なっていてもよい。*は、一般式(1)または一般式(2)における環の環骨格を構成する炭素原子(C)への結合位置を表す。
本発明では、下記一般式(7)で表され、遅延蛍光を放射する化合物を、遅延蛍光材料として特に好ましく用いることができる。本発明の好ましい実施態様では、第2有機化合物と第3有機化合物として、ともに一般式(7)で表される化合物を採用することができる。なかでも、第2有機化合物と第3有機化合物がいずれもジシアノベンゼン構造を含む化合物であることが好ましい。
一般式(7)において、R1~R5の0~4つはシアノ基を表し、R1~R5の少なくとも1つは置換アミノ基を表し、残りのR1~R5は水素原子、またはシアノ基と置換アミノ基以外の置換基を表す。
ここでいう置換アミノ基は、置換もしくは無置換のジアリールアミノ基であることが好ましく、置換もしくは無置換のジアリールアミノ基を構成する2つのアリール基は互いに連結していてもよい。連結は、単結合でなされていてよいし(その場合はカルバゾ-ル環が形成される)、-O-、-S-、-N(R6)-、-C(R7)(R8)-、-Si(R9)(R10)-などの連結基でなされていてもよい。ここで、R6~R10は水素原子または置換基を表し、R7とR8、R9とR10は、それぞれ互いに連結して環状構造を形成してもよい。
置換アミノ基はR1~R5のいずれであってもよく、例えばR1とR2、R1とR3、R1とR4、R1とR5、R2とR3、R2とR4、R1とR2とR3、R1とR2とR4、R1とR2とR5、R1とR3とR4、R1とR3とR5、R2とR3とR4、R1とR2とR3とR4、R1とR2とR3とR5、R1とR2とR4とR5、R1とR2とR3とR4とR5を置換アミノ基とすること等ができる。シアノ基もR1~R5のいずれであってもよく、例えばR1、R2、R3、R1とR2、R1とR3、R1とR4、R1とR5、R2とR3、R2とR4、R1とR2とR3、R1とR2とR4、R1とR2とR5、R1とR3とR4、R1とR3とR5、R2とR3とR4をシアノ基とすること等ができる。
シアノ基でも置換アミノ基でもないR1~R5は、水素原子または置換基を表す。ここでいう置換基の例として、ヒドロキシル基、ハロゲン原子(例えばフッ素原子、塩素原子、臭素原子、ヨウ素原子)、アルキル基(例えば炭素数1~40)、アルコキシ基(例えば炭素数1~40)、アルキルチオ基(例えば炭素数1~40)、アリール基(例えば炭素数6~30)、アリールオキシ基(例えば炭素数6~30)、アリールチオ基(例えば炭素数6~30)、ヘテロアリール基(例えば環骨格構成原子数5~30)、ヘテロアリールオキシ基(例えば環骨格構成原子数5~30)、ヘテロアリールチオ基(例えば環骨格構成原子数5~30)、アシル基(例えば炭素数1~40)、アルケニル基(例えば炭素数1~40)、アルキニル基(例えば炭素数1~40)、アルコキシカルボニル基(例えば炭素数1~40)、アリールオキシカルボニル基(例えば炭素数1~40)、ヘテロアリールオキシカルボニル基(例えば炭素数1~40)、シリル基(例えば炭素数1~40のトリアルキルシリル基)、ニトロ基、ここに列挙した基がさらにここに列挙した1以上の基で置換された基からなる置換基群Aを挙げることができる。上記ジアリールアミノ基のアリール基が置換されているときの置換基の好ましい例としても、上記の置換基群Aの置換基を挙げることができ、さらにシアノ基と置換アミノ基も挙げることができる。
一般式(7)に包含される化合物群と化合物の具体例については、本明細書の一部としてここに引用するWO2013/154064号公報の段落0008~0048、WO2015/080183号公報の段落0009~0030、WO2015/129715号公報の段落0006~0019、特開2017-119663号公報の段落0013~0025、特開2017-119664号公報の段落0013~0026を参照することができる。
ここでいう置換アミノ基は、置換もしくは無置換のジアリールアミノ基であることが好ましく、置換もしくは無置換のジアリールアミノ基を構成する2つのアリール基は互いに連結していてもよい。連結は、単結合でなされていてよいし(その場合はカルバゾ-ル環が形成される)、-O-、-S-、-N(R6)-、-C(R7)(R8)-、-Si(R9)(R10)-などの連結基でなされていてもよい。ここで、R6~R10は水素原子または置換基を表し、R7とR8、R9とR10は、それぞれ互いに連結して環状構造を形成してもよい。
置換アミノ基はR1~R5のいずれであってもよく、例えばR1とR2、R1とR3、R1とR4、R1とR5、R2とR3、R2とR4、R1とR2とR3、R1とR2とR4、R1とR2とR5、R1とR3とR4、R1とR3とR5、R2とR3とR4、R1とR2とR3とR4、R1とR2とR3とR5、R1とR2とR4とR5、R1とR2とR3とR4とR5を置換アミノ基とすること等ができる。シアノ基もR1~R5のいずれであってもよく、例えばR1、R2、R3、R1とR2、R1とR3、R1とR4、R1とR5、R2とR3、R2とR4、R1とR2とR3、R1とR2とR4、R1とR2とR5、R1とR3とR4、R1とR3とR5、R2とR3とR4をシアノ基とすること等ができる。
シアノ基でも置換アミノ基でもないR1~R5は、水素原子または置換基を表す。ここでいう置換基の例として、ヒドロキシル基、ハロゲン原子(例えばフッ素原子、塩素原子、臭素原子、ヨウ素原子)、アルキル基(例えば炭素数1~40)、アルコキシ基(例えば炭素数1~40)、アルキルチオ基(例えば炭素数1~40)、アリール基(例えば炭素数6~30)、アリールオキシ基(例えば炭素数6~30)、アリールチオ基(例えば炭素数6~30)、ヘテロアリール基(例えば環骨格構成原子数5~30)、ヘテロアリールオキシ基(例えば環骨格構成原子数5~30)、ヘテロアリールチオ基(例えば環骨格構成原子数5~30)、アシル基(例えば炭素数1~40)、アルケニル基(例えば炭素数1~40)、アルキニル基(例えば炭素数1~40)、アルコキシカルボニル基(例えば炭素数1~40)、アリールオキシカルボニル基(例えば炭素数1~40)、ヘテロアリールオキシカルボニル基(例えば炭素数1~40)、シリル基(例えば炭素数1~40のトリアルキルシリル基)、ニトロ基、ここに列挙した基がさらにここに列挙した1以上の基で置換された基からなる置換基群Aを挙げることができる。上記ジアリールアミノ基のアリール基が置換されているときの置換基の好ましい例としても、上記の置換基群Aの置換基を挙げることができ、さらにシアノ基と置換アミノ基も挙げることができる。
一般式(7)に包含される化合物群と化合物の具体例については、本明細書の一部としてここに引用するWO2013/154064号公報の段落0008~0048、WO2015/080183号公報の段落0009~0030、WO2015/129715号公報の段落0006~0019、特開2017-119663号公報の段落0013~0025、特開2017-119664号公報の段落0013~0026を参照することができる。
また、下記一般式(8)で表され、遅延蛍光を放射する化合物も、本発明の遅延蛍光材料として特に好ましく用いることができる。本発明の好ましい実施態様では、第2有機化合物と第3有機化合物として、ともに一般式(8)で表される化合物を採用することができる。
一般式(8)において、Y1、Y2およびY3は、いずれか2つが窒素原子で残りの1つがメチン基を表すか、または、Y1、Y2およびY3のすべてが窒素原子を表す。Z1およびZ2は、各々独立に水素原子または置換基を表す。R11~R18は、各々独立に水素原子または置換基を表し、R11~R18の少なくとも1つは、置換もしくは無置換のアリールアミノ基、または置換もしくは無置換のカルバゾリル基であることが好ましい。前記アリールアミノ基を構成するベンゼン環、前記カルバゾリル基を構成するベンゼン環は、それぞれR11~R18と一緒になって単結合または連結基を形成してもよい。また、一般式(8)で表される化合物は分子中にカルバゾール構造を少なくとも2つ含む。Z1、Z2が採りうる置換基の例としては、上記の置換基群Aの置換基を挙げることができる。また、R11~R18、上記アリールアミノ基、カルバゾリル基が採りうる置換基の具体例については、上記の置換基群Aの置換基、シアノ基、置換アリールアミノ基、置換アルキルアミノ基を挙げることができる。なお、R11とR12、R12とR13、R13とR14、R15とR16、R16とR17、R17とR18は、互いに結合して環状構造を形成していてもよい。
一般式(8)で表される化合物の中でも、特に一般式(9)で表される化合物が有用である。
一般式(8)で表される化合物の中でも、特に一般式(9)で表される化合物が有用である。
一般式(9)において、Y1、Y2およびY3は、いずれか2つが窒素原子で残りの1つがメチン基を表すか、または、Y1、Y2およびY3のすべてが窒素原子を表す。Z2は、水素原子または置換基を表す。R11~R18およびR21~R28は、各々独立に水素原子または置換基を表す。R11~R18の少なくとも1つ、および/または、R21~R28の少なくとも1つは、置換もしくは無置換のアリールアミノ基、または置換もしくは無置換のカルバゾリル基を表すことが好ましい。前記アリールアミノ基を構成するベンゼン環、前記カルバゾリル基を構成するベンゼン環は、それぞれR11~R18またはR21~R28と一緒になって単結合または連結基を形成してもよい。Z2が採りうる置換基の例としては、上記の置換基群Aの置換基を挙げることができる。また、R11~R18、R21~R28、上記アリールアミノ基、カルバゾリル基が採りうる置換基の具体例については、上記の置換基群Aの置換基、シアノ基、置換アリールアミノ基、置換アルキルアミノ基を挙げることができる。なお、R11とR12、R12とR13、R13とR14、R15とR16、R16とR17、R17とR18、R21とR22、R22とR23、R23とR24、R25とR26、R26とR27、R27とR28は互いに結合して環状構造を形成していてもよい。
一般式(9)に包含される化合物群と化合物の具体例については、本明細書の一部としてここに引用するWO2013/081088号公報の段落0020~0062や、Appl.Phys.Let,98,083302(2011)に記載の化合物を参照することができる。
一般式(9)に包含される化合物群と化合物の具体例については、本明細書の一部としてここに引用するWO2013/081088号公報の段落0020~0062や、Appl.Phys.Let,98,083302(2011)に記載の化合物を参照することができる。
また、下記一般式(10)で表され、遅延蛍光を放射する化合物も、本発明の遅延蛍光材料として特に好ましく用いることができる。本発明の好ましい実施態様では、第3有機化合物として一般式(10)で表される化合物を採用することができる。
一般式(10)において、Aはシアノ基、または置換もしくは無置換のトリアジニル基を表す。RA~REの1つまたは2つはアルキル基を表し、RA~REの3つまたは4つはドナー性基を表し、残りのRA~REは水素原子または重水素原子を表す。
トリアジニル基は1,3,5-トリアジン環を含むものであることが好ましい。トリアジニル基の置換基としては、上記一般式(7)における置換基の説明を参照することができ、好ましくはアリール基である。ドナー性基については、上記一般式(1)および一般式(2)のDが表すドナー性基の説明と好ましい範囲を参照することができる。一般式(10)に存在するドナー性基の一部または全部は、上記一般式(5)で表される置換もしくは無置換のカルバゾリル基であることが好ましい。本発明の好ましい態様では、一般式(10)には互いに構造が異なるドナー性基が存在する。例えば、一般式(10)には置換状態が異なるカルバゾリル基が存在し、例えば置換カルバゾリル基と無置換のカルバゾリル基が混在していてもよい。例えば、RAとRBが同一構造のドナー性基であり、RDとREが、RAとRBとは異なる構造のドナー性基であってもよい。一方、一般式(10)に存在するドナー性基は、すべてが同一構造であってもよい。アルキル基の数はRA~REのうちの1つであることが好ましい。本発明の好ましい態様では、RA~REの1つがアルキル基であり、RA~REの4つがドナー性基である。本発明の別の好ましい態様では、RA~REの1つがアルキル基であり、RA~REの3つがドナー性基であり、残りが水素原子である。本発明の好ましい態様では、RCがアルキル基である。一般式(10)で表される化合物に存在する水素原子の一部または全部は、重水素原子で置換されていてもよい。
トリアジニル基は1,3,5-トリアジン環を含むものであることが好ましい。トリアジニル基の置換基としては、上記一般式(7)における置換基の説明を参照することができ、好ましくはアリール基である。ドナー性基については、上記一般式(1)および一般式(2)のDが表すドナー性基の説明と好ましい範囲を参照することができる。一般式(10)に存在するドナー性基の一部または全部は、上記一般式(5)で表される置換もしくは無置換のカルバゾリル基であることが好ましい。本発明の好ましい態様では、一般式(10)には互いに構造が異なるドナー性基が存在する。例えば、一般式(10)には置換状態が異なるカルバゾリル基が存在し、例えば置換カルバゾリル基と無置換のカルバゾリル基が混在していてもよい。例えば、RAとRBが同一構造のドナー性基であり、RDとREが、RAとRBとは異なる構造のドナー性基であってもよい。一方、一般式(10)に存在するドナー性基は、すべてが同一構造であってもよい。アルキル基の数はRA~REのうちの1つであることが好ましい。本発明の好ましい態様では、RA~REの1つがアルキル基であり、RA~REの4つがドナー性基である。本発明の別の好ましい態様では、RA~REの1つがアルキル基であり、RA~REの3つがドナー性基であり、残りが水素原子である。本発明の好ましい態様では、RCがアルキル基である。一般式(10)で表される化合物に存在する水素原子の一部または全部は、重水素原子で置換されていてもよい。
また、下記一般式(11)で表され、遅延蛍光を放射する化合物も、本発明の遅延蛍光材料として特に好ましく用いることができる。本発明の好ましい実施態様では、第3有機化合物として一般式(11)で表される化合物を採用することができる。
一般式(11)において、Aはシアノ基、または置換もしくは無置換のトリアジニル基を表す。Ra~Reの3~5つはドナー性基を表し、残りのRa~Reは水素原子、重水素原子、置換もしくは無置換のアルキル基、または置換もしくは無置換のアリール基を表す。Ra~Reが表すドナー性基の少なくとも1つは縮環カルバゾリル基である。
ここでいう縮環カルバゾリル基とは、カルバゾール環を構成する2つのベンゼン環の少なくとも一方に環構造が縮合しているカルバゾール-9-イル基を意味する。2つのベンゼン環の両方に環が縮合していてもよい。両方が縮合している場合は、縮合後の骨格構造が両方とも同じであることが好ましく、同一構造であることがより好ましい。環が縮合していない位置は置換されていてもよく、置換されている場合はカルバゾール環の3位または6位が置換されていることが好ましい。置換基としては、上記一般式(7)における置換基の説明を参照することができ、好ましくは置換もしくは無置換のアリール基であり、特に好ましくは置換もしくは無置換のフェニル基であり、例えばフェニル基や重水素置換フェニル基を好ましく採用したりすることができる。一般式(11)で表される化合物に存在する水素原子の一部または全部は、重水素原子で置換されていてもよい。
縮環カルバゾリル基として、カルバゾール環にベンゾフラン環が2,3位で縮合した骨格を有するベンゾフラン縮合カルバゾール-9-イル基、カルバゾール環にベンゾチオフェン環が2,3位で縮合した骨格を有するベンゾチオフェン縮合カルバゾール-9-イル基、カルバゾール環にインドール環が2,3位で縮合した骨格を有するインドール縮合カルバゾール-9-イル基、カルバゾール環にインデン環が2,3位で縮合した骨格を有するインデン縮合カルバゾール-9-イル基、カルバゾール環にシラインデン環が2,3位で縮合した骨格を有するシラインデン縮合カルバゾール-9-イル基を挙げることができる。これらの環がカルバゾール環の1,2位で縮合する場合は縮合する環を構成するヘテロ原子が2位に結合することが好ましく、カルバゾール環の2,3位で縮合する場合は縮合する環を構成するヘテロ原子が3位に結合することが好ましく、カルバゾール環の3,4位で縮合する場合は縮合する環を構成するヘテロ原子が4位に結合することが好ましい。
ここでいう縮環カルバゾリル基とは、カルバゾール環を構成する2つのベンゼン環の少なくとも一方に環構造が縮合しているカルバゾール-9-イル基を意味する。2つのベンゼン環の両方に環が縮合していてもよい。両方が縮合している場合は、縮合後の骨格構造が両方とも同じであることが好ましく、同一構造であることがより好ましい。環が縮合していない位置は置換されていてもよく、置換されている場合はカルバゾール環の3位または6位が置換されていることが好ましい。置換基としては、上記一般式(7)における置換基の説明を参照することができ、好ましくは置換もしくは無置換のアリール基であり、特に好ましくは置換もしくは無置換のフェニル基であり、例えばフェニル基や重水素置換フェニル基を好ましく採用したりすることができる。一般式(11)で表される化合物に存在する水素原子の一部または全部は、重水素原子で置換されていてもよい。
縮環カルバゾリル基として、カルバゾール環にベンゾフラン環が2,3位で縮合した骨格を有するベンゾフラン縮合カルバゾール-9-イル基、カルバゾール環にベンゾチオフェン環が2,3位で縮合した骨格を有するベンゾチオフェン縮合カルバゾール-9-イル基、カルバゾール環にインドール環が2,3位で縮合した骨格を有するインドール縮合カルバゾール-9-イル基、カルバゾール環にインデン環が2,3位で縮合した骨格を有するインデン縮合カルバゾール-9-イル基、カルバゾール環にシラインデン環が2,3位で縮合した骨格を有するシラインデン縮合カルバゾール-9-イル基を挙げることができる。これらの環がカルバゾール環の1,2位で縮合する場合は縮合する環を構成するヘテロ原子が2位に結合することが好ましく、カルバゾール環の2,3位で縮合する場合は縮合する環を構成するヘテロ原子が3位に結合することが好ましく、カルバゾール環の3,4位で縮合する場合は縮合する環を構成するヘテロ原子が4位に結合することが好ましい。
(第4有機化合物)
第4有機化合物は、第1有機化合物および第2有機化合物よりも最低励起一重項エネルギーが小さく、第3有機化合物よりも最低励起一重項エネルギーが大きい遅延蛍光材料である。本発明の有機発光素子では第4有機化合物に由来する蛍光を放射する。第4有機化合物からの発光は通常は遅延蛍光を含む。本発明の有機発光素子からの発光の最大成分は第4有機化合物からの発光である。すなわち、本発明の有機発光素子からの発光のうち、第4有機化合物からの発光量が最大である。第4有機化合物は、励起一重項状態の第1有機化合物、第2有機化合物と、励起三重項状態から逆項間交差して励起一重項状態になった第2有機化合物からエネルギーを受け取って励起一重項状態に遷移する。また本発明の好ましい態様では、第4有機化合物は、励起一重項状態の第3有機化合物と、励起三重項状態から逆項間交差して励起一重項状態になった第3有機化合物からエネルギーを受け取って励起一重項状態に遷移する。生じた第4有機化合物の励起一重項状態は、その後基底状態に戻るときに蛍光を放射する。
第4有機化合物として用いる蛍光材料としては、このように第1有機化合物、第2有機化合物、第3有機化合物からエネルギーを受け取って発光し得るものであれば特に限定されず、発光には蛍光、遅延蛍光、りん光のいずれが含まれていても構わない。好ましいのは、発光に蛍光や遅延蛍光が含まれている場合であり、より好ましいのは第4有機化合物からの発光の最大成分が遅延蛍光である場合である。
第4有機化合物は、本発明の条件を満たすものであれば2種以上を用いてもよい。例えば、発光色が異なる2種以上の第4有機化合物を併用することにより、所望の色を発光させることが可能になる。また、1種類の第4化合物を用いて第4化合物から単色発光させてもよい。
本発明では、第4有機化合物として用いることができる化合物の最大発光波長は特に制限されない。このため、可視領域(380~780nm)に最大発光波長を有する発光材料や赤外領域(780nm~1mm)に最大発光波長を有する発光材料などを適宜選択して使用することが可能である。好ましいのは、可視領域に最大発光波長を有する蛍光材料である。例えば、380~780nmの領域内における最大発光波長が380~570nmの範囲内にある発光材料を選択して用いたり、最大発光波長が380~500nmの範囲内にある発光材料を選択して用いたり、最大発光波長が380~480nmの範囲内にある発光材料を選択して用いたり、最大発光波長が420~480nmの範囲内にある発光材料を選択して用いたりしてもよい。
本発明の好ましい態様では、第2有機化合物の発光波長領域と第4有機化合物の吸収波長領域との間に重なりがあるように、各化合物を選択して組み合わせる。特に、第2有機化合物の発光スペクトルの長波長側のエッジと、第4有機化合物の吸収スペクトルの短波長側のエッジが重なっていることが好ましい。また、第3有機化合物の発光波長領域と第4有機化合物の吸収波長領域との間に重なりがあるように、各化合物を選択して組み合わせることも好ましい。
以下に、第4有機化合物として用いることができる好ましい化合物を挙げる。なお、以下の例示化合物の構造式において、Etはエチル基を表す。
第4有機化合物は、第1有機化合物および第2有機化合物よりも最低励起一重項エネルギーが小さく、第3有機化合物よりも最低励起一重項エネルギーが大きい遅延蛍光材料である。本発明の有機発光素子では第4有機化合物に由来する蛍光を放射する。第4有機化合物からの発光は通常は遅延蛍光を含む。本発明の有機発光素子からの発光の最大成分は第4有機化合物からの発光である。すなわち、本発明の有機発光素子からの発光のうち、第4有機化合物からの発光量が最大である。第4有機化合物は、励起一重項状態の第1有機化合物、第2有機化合物と、励起三重項状態から逆項間交差して励起一重項状態になった第2有機化合物からエネルギーを受け取って励起一重項状態に遷移する。また本発明の好ましい態様では、第4有機化合物は、励起一重項状態の第3有機化合物と、励起三重項状態から逆項間交差して励起一重項状態になった第3有機化合物からエネルギーを受け取って励起一重項状態に遷移する。生じた第4有機化合物の励起一重項状態は、その後基底状態に戻るときに蛍光を放射する。
第4有機化合物として用いる蛍光材料としては、このように第1有機化合物、第2有機化合物、第3有機化合物からエネルギーを受け取って発光し得るものであれば特に限定されず、発光には蛍光、遅延蛍光、りん光のいずれが含まれていても構わない。好ましいのは、発光に蛍光や遅延蛍光が含まれている場合であり、より好ましいのは第4有機化合物からの発光の最大成分が遅延蛍光である場合である。
第4有機化合物は、本発明の条件を満たすものであれば2種以上を用いてもよい。例えば、発光色が異なる2種以上の第4有機化合物を併用することにより、所望の色を発光させることが可能になる。また、1種類の第4化合物を用いて第4化合物から単色発光させてもよい。
本発明では、第4有機化合物として用いることができる化合物の最大発光波長は特に制限されない。このため、可視領域(380~780nm)に最大発光波長を有する発光材料や赤外領域(780nm~1mm)に最大発光波長を有する発光材料などを適宜選択して使用することが可能である。好ましいのは、可視領域に最大発光波長を有する蛍光材料である。例えば、380~780nmの領域内における最大発光波長が380~570nmの範囲内にある発光材料を選択して用いたり、最大発光波長が380~500nmの範囲内にある発光材料を選択して用いたり、最大発光波長が380~480nmの範囲内にある発光材料を選択して用いたり、最大発光波長が420~480nmの範囲内にある発光材料を選択して用いたりしてもよい。
本発明の好ましい態様では、第2有機化合物の発光波長領域と第4有機化合物の吸収波長領域との間に重なりがあるように、各化合物を選択して組み合わせる。特に、第2有機化合物の発光スペクトルの長波長側のエッジと、第4有機化合物の吸収スペクトルの短波長側のエッジが重なっていることが好ましい。また、第3有機化合物の発光波長領域と第4有機化合物の吸収波長領域との間に重なりがあるように、各化合物を選択して組み合わせることも好ましい。
以下に、第4有機化合物として用いることができる好ましい化合物を挙げる。なお、以下の例示化合物の構造式において、Etはエチル基を表す。
好ましい化合物群として、化合物E1~E5およびそれらの骨格を有する誘導体を挙げることができる。誘導体としては、アルキル基、アリール基、ヘテロアリール基、ジアリールアミノ基で置換された化合物を挙げることができる。
(発光層)
本発明の有機発光素子の発光層は、条件(a)~(e)を満たす第1有機化合物と第2有機化合物と第3有機化合物と第4有機化合物を含む。発光層は、第1有機化合物と第2有機化合物と第3有機化合物と第4有機化合物以外に、電荷やエネルギーの授受を行う化合物や金属元素を含まない構成にすることができる。また、発光層は、第1有機化合物と第2有機化合物と第3有機化合物と第4有機化合物の4化合物のみから構成することもできる。さらに発光層は、炭素原子、水素原子、窒素原子、ホウ素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物だけで構成することもできる。例えば、発光層は、炭素原子、水素原子、窒素原子、ホウ素原子および酸素原子からなる群より選択される原子からなる化合物だけで構成することができる。例えば、発光層は、炭素原子、水素原子、窒素原子、ホウ素原子および硫黄原子からなる群より選択される原子からなる化合物だけで構成することができる。例えば、発光層は、炭素原子、水素原子、窒素原子およびホウ素原子からなる群より選択される原子からなる化合物だけで構成することができる。例えば、発光層は、炭素原子、水素原子および窒素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物だけで構成することができる。例えば、発光層は、炭素原子、水素原子および窒素原子からなる群より選択される原子からなる化合物だけで構成することができる。あるいは、発光層に含まれる第1有機化合物、第2有機化合物および第3有機化合物が、各々独立に、炭素原子、水素原子、窒素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物とすることもできる。例えば、第1有機化合物、第2有機化合物および第3有機化合物が、各々独立に、炭素原子、水素原子、窒素原子および酸素原子からなる群より選択される原子からなる化合物とすることができる。例えば、第1有機化合物、第2有機化合物および第3有機化合物が、各々独立に、炭素原子、水素原子、窒素原子および硫黄原子からなる群より選択される原子からなる化合物とすることができる。例えば、第1有機化合物、第2有機化合物および第3有機化合物が、各々独立に、炭素原子、水素原子および窒素原子からなる群より選択される原子からなる化合物とすることができる。
発光層は、第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物を共蒸着することにより形成してもよいし、第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物を溶解させた溶液を用いて塗布法により形成してもよい。共蒸着により発光層を形成するときには、第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物のうちの2つ以上をあらかじめ混合してるつぼ等に入れて蒸着源とし、その蒸着源を用いて共蒸着により発光層を形成してもよい。例えば、第2有機化合物、第3有機化合物および第4有機化合物をあらかじめ混合して1つの蒸着源を作成しておき、その蒸着源と第1有機化合物の蒸着源を用いて共蒸着することにより発光層を形成してもよい。
本発明の有機発光素子の発光層は、条件(a)~(e)を満たす第1有機化合物と第2有機化合物と第3有機化合物と第4有機化合物を含む。発光層は、第1有機化合物と第2有機化合物と第3有機化合物と第4有機化合物以外に、電荷やエネルギーの授受を行う化合物や金属元素を含まない構成にすることができる。また、発光層は、第1有機化合物と第2有機化合物と第3有機化合物と第4有機化合物の4化合物のみから構成することもできる。さらに発光層は、炭素原子、水素原子、窒素原子、ホウ素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物だけで構成することもできる。例えば、発光層は、炭素原子、水素原子、窒素原子、ホウ素原子および酸素原子からなる群より選択される原子からなる化合物だけで構成することができる。例えば、発光層は、炭素原子、水素原子、窒素原子、ホウ素原子および硫黄原子からなる群より選択される原子からなる化合物だけで構成することができる。例えば、発光層は、炭素原子、水素原子、窒素原子およびホウ素原子からなる群より選択される原子からなる化合物だけで構成することができる。例えば、発光層は、炭素原子、水素原子および窒素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物だけで構成することができる。例えば、発光層は、炭素原子、水素原子および窒素原子からなる群より選択される原子からなる化合物だけで構成することができる。あるいは、発光層に含まれる第1有機化合物、第2有機化合物および第3有機化合物が、各々独立に、炭素原子、水素原子、窒素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物とすることもできる。例えば、第1有機化合物、第2有機化合物および第3有機化合物が、各々独立に、炭素原子、水素原子、窒素原子および酸素原子からなる群より選択される原子からなる化合物とすることができる。例えば、第1有機化合物、第2有機化合物および第3有機化合物が、各々独立に、炭素原子、水素原子、窒素原子および硫黄原子からなる群より選択される原子からなる化合物とすることができる。例えば、第1有機化合物、第2有機化合物および第3有機化合物が、各々独立に、炭素原子、水素原子および窒素原子からなる群より選択される原子からなる化合物とすることができる。
発光層は、第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物を共蒸着することにより形成してもよいし、第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物を溶解させた溶液を用いて塗布法により形成してもよい。共蒸着により発光層を形成するときには、第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物のうちの2つ以上をあらかじめ混合してるつぼ等に入れて蒸着源とし、その蒸着源を用いて共蒸着により発光層を形成してもよい。例えば、第2有機化合物、第3有機化合物および第4有機化合物をあらかじめ混合して1つの蒸着源を作成しておき、その蒸着源と第1有機化合物の蒸着源を用いて共蒸着することにより発光層を形成してもよい。
<有機発光素子の層構成>
条件(a)~(e)を満たす第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物を含む発光層を形成することにより、有機フォトルミネッセンス素子(有機PL素子)や有機エレクトロルミネッセンス素子(有機EL素子)などの優れた有機発光素子を提供することができる。
発光層の厚さは例えば1~15nmとしたり、2~10nmとしたり、3~7nmとすることができる。
有機フォトルミネッセンス素子は、基材上に少なくとも発光層を形成した構造を有する。また、有機エレクトロルミネッセンス素子は、少なくとも陽極、陰極、および陽極と陰極の間に有機層を形成した構造を有する。有機層は、少なくとも発光層を含むものであり、発光層のみからなるものであってもよいし、発光層の他に1層以上の有機層を有するものであってもよい。そのような他の有機層として、正孔輸送層、正孔注入層、電子障壁層、正孔障壁層、電子注入層、電子輸送層、励起子障壁層などを挙げることができる。正孔輸送層は正孔注入機能を有した正孔注入輸送層でもよく、電子輸送層は電子注入機能を有した電子注入輸送層でもよい。具体的な有機エレクトロルミネッセンス素子の構造例を図1に示す。図1において、1は基材、2は陽極、3は正孔注入層、4は正孔輸送層、5は発光層、6は電子輸送層、7は陰極を表わす。
本発明の有機発光素子が多波長発光型の有機発光素子であるとき、最も短波長な発光が遅延蛍光を含むものとすることができる。また、最も短波長な発光が遅延蛍光を含まないものとすることもできる。
条件(a)~(e)を満たす第1有機化合物、第2有機化合物、第3有機化合物および第4有機化合物を含む発光層を形成することにより、有機フォトルミネッセンス素子(有機PL素子)や有機エレクトロルミネッセンス素子(有機EL素子)などの優れた有機発光素子を提供することができる。
発光層の厚さは例えば1~15nmとしたり、2~10nmとしたり、3~7nmとすることができる。
有機フォトルミネッセンス素子は、基材上に少なくとも発光層を形成した構造を有する。また、有機エレクトロルミネッセンス素子は、少なくとも陽極、陰極、および陽極と陰極の間に有機層を形成した構造を有する。有機層は、少なくとも発光層を含むものであり、発光層のみからなるものであってもよいし、発光層の他に1層以上の有機層を有するものであってもよい。そのような他の有機層として、正孔輸送層、正孔注入層、電子障壁層、正孔障壁層、電子注入層、電子輸送層、励起子障壁層などを挙げることができる。正孔輸送層は正孔注入機能を有した正孔注入輸送層でもよく、電子輸送層は電子注入機能を有した電子注入輸送層でもよい。具体的な有機エレクトロルミネッセンス素子の構造例を図1に示す。図1において、1は基材、2は陽極、3は正孔注入層、4は正孔輸送層、5は発光層、6は電子輸送層、7は陰極を表わす。
本発明の有機発光素子が多波長発光型の有機発光素子であるとき、最も短波長な発光が遅延蛍光を含むものとすることができる。また、最も短波長な発光が遅延蛍光を含まないものとすることもできる。
以下において、有機エレクトロルミネッセンス素子の各部材および発光層以外の各層について説明する。
基材:
いくつかの実施形態では、本発明の有機エレクトロルミネッセンス素子は基材により保持され、当該基材は特に限定されず、有機エレクトロルミネッセンス素子で一般的に用いられる、例えばガラス、透明プラスチック、クォーツおよびシリコンにより形成されたいずれかの材料を用いればよい。
いくつかの実施形態では、本発明の有機エレクトロルミネッセンス素子は基材により保持され、当該基材は特に限定されず、有機エレクトロルミネッセンス素子で一般的に用いられる、例えばガラス、透明プラスチック、クォーツおよびシリコンにより形成されたいずれかの材料を用いればよい。
陽極:
いくつかの実施形態では、有機エレクトロルミネッセンス装置の陽極は、金属、合金、導電性化合物またはそれらの組み合わせから製造される。いくつかの実施形態では、前記の金属、合金または導電性化合物は高い仕事関数(4eV以上)を有する。いくつかの実施形態では、前記金属はAuである。いくつかの実施形態では、導電性の透明材料は、CuI、酸化インジウムスズ(ITO)、SnO2およびZnOから選択される。いくつかの実施形態では、IDIXO(In2O3-ZnO)などの、透明な導電性フィルムを形成できるアモルファス材料を使用する。いくつかの実施形態では、前記陽極は薄膜である。いくつかの実施形態では、前記薄膜は蒸着またはスパッタリングにより作製される。いくつかの実施形態では、前記フィルムはフォトリソグラフィー方法によりパターン化される。いくつかの実施形態では、パターンが高精度である必要がない(例えば約100μm以上)場合、当該パターンは、電極材料への蒸着またはスパッタリングに好適な形状のマスクを用いて形成してもよい。いくつかの実施形態では、有機導電性化合物などのコーティング材料を塗布しうるとき、プリント法やコーティング法などの湿式フィルム形成方法が用いられる。いくつかの実施形態では、放射光が陽極を通過するとき、陽極は10%超の透過度を有し、当該陽極は、単位面積あたり数百オーム以下のシート抵抗を有する。いくつかの実施形態では、陽極の厚みは10~1,000nmである。いくつかの実施形態では、陽極の厚みは10~200nmである。いくつかの実施形態では、陽極の厚みは用いる材料に応じて変動する。
いくつかの実施形態では、有機エレクトロルミネッセンス装置の陽極は、金属、合金、導電性化合物またはそれらの組み合わせから製造される。いくつかの実施形態では、前記の金属、合金または導電性化合物は高い仕事関数(4eV以上)を有する。いくつかの実施形態では、前記金属はAuである。いくつかの実施形態では、導電性の透明材料は、CuI、酸化インジウムスズ(ITO)、SnO2およびZnOから選択される。いくつかの実施形態では、IDIXO(In2O3-ZnO)などの、透明な導電性フィルムを形成できるアモルファス材料を使用する。いくつかの実施形態では、前記陽極は薄膜である。いくつかの実施形態では、前記薄膜は蒸着またはスパッタリングにより作製される。いくつかの実施形態では、前記フィルムはフォトリソグラフィー方法によりパターン化される。いくつかの実施形態では、パターンが高精度である必要がない(例えば約100μm以上)場合、当該パターンは、電極材料への蒸着またはスパッタリングに好適な形状のマスクを用いて形成してもよい。いくつかの実施形態では、有機導電性化合物などのコーティング材料を塗布しうるとき、プリント法やコーティング法などの湿式フィルム形成方法が用いられる。いくつかの実施形態では、放射光が陽極を通過するとき、陽極は10%超の透過度を有し、当該陽極は、単位面積あたり数百オーム以下のシート抵抗を有する。いくつかの実施形態では、陽極の厚みは10~1,000nmである。いくつかの実施形態では、陽極の厚みは10~200nmである。いくつかの実施形態では、陽極の厚みは用いる材料に応じて変動する。
陰極:
いくつかの実施形態では、前記陰極は、低い仕事関数を有する金属(4eV以下)(電子注入金属と称される)、合金、導電性化合物またはその組み合わせなどの電極材料で作製される。いくつかの実施形態では、前記電極材料は、ナトリウム、ナトリウム-カリウム合金、マグネシウム、リチウム、マグネシウム-銅混合物、マグネシウム-銀混合物、マグネシウム-アルミニウム混合物、マグネシウム-インジウム混合物、アルミニウム-酸化アルミニウム(Al2O3)混合物、インジウム、リチウム-アルミニウム混合物および希土類元素から選択される。いくつかの実施形態では、電子注入金属と、電子注入金属より高い仕事関数を有する安定な金属である第2の金属との混合物が用いられる。いくつかの実施形態では、前記混合物は、マグネシウム-銀混合物、マグネシウム-アルミニウム混合物、マグネシウム-インジウム混合物、アルミニウム-酸化アルミニウム(Al2O3)混合物、リチウム-アルミニウム混合物およびアルミニウムから選択される。いくつかの実施形態では、前記混合物は電子注入特性および酸化に対する耐性を向上させる。いくつかの実施形態では、陰極は、蒸着またはスパッタリングにより電極材料を薄膜として形成させることによって製造される。いくつかの実施形態では、前記陰極は単位面積当たり数百オーム以下のシート抵抗を有する。いくつかの実施形態では、前記陰極の厚は10nm~5μmである。いくつかの実施形態では、前記陰極の厚は50~200nmである。いくつかの実施形態では、放射光を透過させるため、有機エレクトロルミネッセンス素子の陽極および陰極のいずれか1つは透明または半透明である。いくつかの実施形態では、透明または半透明のエレクトロルミネッセンス素子は光放射輝度を向上させる。
いくつかの実施形態では、前記陰極を、前記陽極に関して前述した導電性の透明な材料で形成されることにより、透明または半透明の陰極が形成される。いくつかの実施形態では、素子は陽極と陰極とを含むが、いずれも透明または半透明である。
いくつかの実施形態では、前記陰極は、低い仕事関数を有する金属(4eV以下)(電子注入金属と称される)、合金、導電性化合物またはその組み合わせなどの電極材料で作製される。いくつかの実施形態では、前記電極材料は、ナトリウム、ナトリウム-カリウム合金、マグネシウム、リチウム、マグネシウム-銅混合物、マグネシウム-銀混合物、マグネシウム-アルミニウム混合物、マグネシウム-インジウム混合物、アルミニウム-酸化アルミニウム(Al2O3)混合物、インジウム、リチウム-アルミニウム混合物および希土類元素から選択される。いくつかの実施形態では、電子注入金属と、電子注入金属より高い仕事関数を有する安定な金属である第2の金属との混合物が用いられる。いくつかの実施形態では、前記混合物は、マグネシウム-銀混合物、マグネシウム-アルミニウム混合物、マグネシウム-インジウム混合物、アルミニウム-酸化アルミニウム(Al2O3)混合物、リチウム-アルミニウム混合物およびアルミニウムから選択される。いくつかの実施形態では、前記混合物は電子注入特性および酸化に対する耐性を向上させる。いくつかの実施形態では、陰極は、蒸着またはスパッタリングにより電極材料を薄膜として形成させることによって製造される。いくつかの実施形態では、前記陰極は単位面積当たり数百オーム以下のシート抵抗を有する。いくつかの実施形態では、前記陰極の厚は10nm~5μmである。いくつかの実施形態では、前記陰極の厚は50~200nmである。いくつかの実施形態では、放射光を透過させるため、有機エレクトロルミネッセンス素子の陽極および陰極のいずれか1つは透明または半透明である。いくつかの実施形態では、透明または半透明のエレクトロルミネッセンス素子は光放射輝度を向上させる。
いくつかの実施形態では、前記陰極を、前記陽極に関して前述した導電性の透明な材料で形成されることにより、透明または半透明の陰極が形成される。いくつかの実施形態では、素子は陽極と陰極とを含むが、いずれも透明または半透明である。
注入層:
注入層は、電極と有機層との間の層である。いくつかの実施形態では、前記注入層は駆動電圧を減少させ、光放射輝度を増強する。いくつかの実施形態では、前記注入層は、正孔注入層と電子注入層とを含む。前記注入層は、陽極と発光層または正孔輸送層との間、並びに陰極と発光層または電子輸送層との間に配置することがきる。いくつかの実施形態では、注入層が存在する。いくつかの実施形態では、注入層が存在しない。
以下に、正孔注入材料として用いることができる好ましい化合物例を挙げる。
注入層は、電極と有機層との間の層である。いくつかの実施形態では、前記注入層は駆動電圧を減少させ、光放射輝度を増強する。いくつかの実施形態では、前記注入層は、正孔注入層と電子注入層とを含む。前記注入層は、陽極と発光層または正孔輸送層との間、並びに陰極と発光層または電子輸送層との間に配置することがきる。いくつかの実施形態では、注入層が存在する。いくつかの実施形態では、注入層が存在しない。
以下に、正孔注入材料として用いることができる好ましい化合物例を挙げる。
障壁層:
障壁層は、発光層に存在する電荷(電子または正孔)および/または励起子が、発光層の外側に拡散することを阻止できる層である。いくつかの実施形態では、電子障壁層は、発光層と正孔輸送層との間に存在し、電子が発光層を通過して正孔輸送層へ至ることを阻止する。いくつかの実施形態では、正孔障壁層は、発光層と電子輸送層との間に存在し、正孔が発光層を通過して電子輸送層へ至ることを阻止する。いくつかの実施形態では、障壁層は、励起子が発光層の外側に拡散することを阻止する。いくつかの実施形態では、電子障壁層および正孔障壁層は励起子障壁層を構成する。本明細書で用いる用語「電子障壁層」または「励起子障壁層」には、電子障壁層の、および励起子障壁層の機能の両方を有する層が含まれる。
障壁層は、発光層に存在する電荷(電子または正孔)および/または励起子が、発光層の外側に拡散することを阻止できる層である。いくつかの実施形態では、電子障壁層は、発光層と正孔輸送層との間に存在し、電子が発光層を通過して正孔輸送層へ至ることを阻止する。いくつかの実施形態では、正孔障壁層は、発光層と電子輸送層との間に存在し、正孔が発光層を通過して電子輸送層へ至ることを阻止する。いくつかの実施形態では、障壁層は、励起子が発光層の外側に拡散することを阻止する。いくつかの実施形態では、電子障壁層および正孔障壁層は励起子障壁層を構成する。本明細書で用いる用語「電子障壁層」または「励起子障壁層」には、電子障壁層の、および励起子障壁層の機能の両方を有する層が含まれる。
正孔障壁層:
正孔障壁層は、電子輸送層として機能する。いくつかの実施形態では、電子の輸送の間、正孔障壁層は正孔が電子輸送層に至ることを阻止する。いくつかの実施形態では、正孔障壁層は、発光層における電子と正孔との再結合の確率を高める。正孔障壁層に用いる材料は、電子輸送層について前述したのと同じ材料であってもよい。
以下に、正孔障壁層に用いることができる好ましい化合物例を挙げる。
正孔障壁層は、電子輸送層として機能する。いくつかの実施形態では、電子の輸送の間、正孔障壁層は正孔が電子輸送層に至ることを阻止する。いくつかの実施形態では、正孔障壁層は、発光層における電子と正孔との再結合の確率を高める。正孔障壁層に用いる材料は、電子輸送層について前述したのと同じ材料であってもよい。
以下に、正孔障壁層に用いることができる好ましい化合物例を挙げる。
電子障壁層:
電子障壁層は、正孔を輸送する。いくつかの実施形態では、正孔の輸送の間、電子障壁層は電子が正孔輸送層に至ることを阻止する。いくつかの実施形態では、電子障壁層は、発光層における電子と正孔との再結合の確率を高める。電子障壁層に用いる材料は、正孔輸送層について前述したのと同じ材料であってもよい。
以下に電子障壁材料として用いることができる好ましい化合物の具体例を挙げる。
電子障壁層は、正孔を輸送する。いくつかの実施形態では、正孔の輸送の間、電子障壁層は電子が正孔輸送層に至ることを阻止する。いくつかの実施形態では、電子障壁層は、発光層における電子と正孔との再結合の確率を高める。電子障壁層に用いる材料は、正孔輸送層について前述したのと同じ材料であってもよい。
以下に電子障壁材料として用いることができる好ましい化合物の具体例を挙げる。
励起子障壁層:
励起子障壁層は、発光層における正孔と電子との再結合を通じて生じた励起子が電荷輸送層まで拡散することを阻止する。いくつかの実施形態では、励起子障壁層は、発光層における励起子の有効な閉じ込め(confinement)を可能にする。いくつかの実施形態では、装置の光放射効率が向上する。いくつかの実施形態では、励起子障壁層は、陽極の側と陰極の側のいずれかで、およびその両側の発光層に隣接する。いくつかの実施形態では、励起子障壁層が陽極側に存在するとき、当該層は、正孔輸送層と発光層との間に存在し、当該発光層に隣接してもよい。いくつかの実施形態では、励起子障壁層が陰極側に存在するとき、当該層は、発光層と陰極との間に存在し、当該発光層に隣接してもよい。いくつかの実施形態では、正孔注入層、電子障壁層または同様の層は、陽極と、陽極側の発光層に隣接する励起子障壁層との間に存在する。いくつかの実施形態では、正孔注入層、電子障壁層、正孔障壁層または同様の層は、陰極と、陰極側の発光層に隣接する励起子障壁層との間に存在する。いくつかの実施形態では、励起子障壁層は、励起一重項エネルギーと励起三重項エネルギーを含み、その少なくとも1つが、それぞれ、発光材料の励起一重項エネルギーと励起三重項エネルギーより高い。
励起子障壁層は、発光層における正孔と電子との再結合を通じて生じた励起子が電荷輸送層まで拡散することを阻止する。いくつかの実施形態では、励起子障壁層は、発光層における励起子の有効な閉じ込め(confinement)を可能にする。いくつかの実施形態では、装置の光放射効率が向上する。いくつかの実施形態では、励起子障壁層は、陽極の側と陰極の側のいずれかで、およびその両側の発光層に隣接する。いくつかの実施形態では、励起子障壁層が陽極側に存在するとき、当該層は、正孔輸送層と発光層との間に存在し、当該発光層に隣接してもよい。いくつかの実施形態では、励起子障壁層が陰極側に存在するとき、当該層は、発光層と陰極との間に存在し、当該発光層に隣接してもよい。いくつかの実施形態では、正孔注入層、電子障壁層または同様の層は、陽極と、陽極側の発光層に隣接する励起子障壁層との間に存在する。いくつかの実施形態では、正孔注入層、電子障壁層、正孔障壁層または同様の層は、陰極と、陰極側の発光層に隣接する励起子障壁層との間に存在する。いくつかの実施形態では、励起子障壁層は、励起一重項エネルギーと励起三重項エネルギーを含み、その少なくとも1つが、それぞれ、発光材料の励起一重項エネルギーと励起三重項エネルギーより高い。
正孔輸送層:
正孔輸送層は、正孔輸送材料を含む。いくつかの実施形態では、正孔輸送層は単層である。いくつかの実施形態では、正孔輸送層は複数の層を有する。
いくつかの実施形態では、正孔輸送材料は、正孔の注入または輸送特性および電子の障壁特性のうちの1つの特性を有する。いくつかの実施形態では、正孔輸送材料は有機材料である。いくつかの実施形態では、正孔輸送材料は無機材料である。本発明で使用できる公知の正孔輸送材料の例としては、限定されないが、トリアゾール誘導体、オキサジアゾール誘導剤、イミダゾール誘導体、カルバゾール誘導体、インドロカルバゾール誘導体、ポリアリールアルカン誘導剤、ピラゾリン誘導体、ピラゾロン誘導体、フェニレンジアミン誘導体、アリルアミン誘導体、アミノ置換カルコン誘導体、オキサゾール誘導体、スチリルアントラセン誘導剤、フルオレノン誘導体、ヒドラゾン誘導体、スチルベン誘導体、シラザン誘導体、アニリンコポリマーおよび導電性ポリマーオリゴマー(特にチオフェンオリゴマー)、またはその組合せが挙げられる。いくつかの実施形態では、正孔輸送材料はポルフィリン化合物、芳香族三級アミン化合物およびスチリルアミン化合物から選択される。いくつかの実施形態では、正孔輸送材料は芳香族三級アミン化合物である。以下に正孔輸送材料として用いることができる好ましい化合物の具体例を挙げる。
正孔輸送層は、正孔輸送材料を含む。いくつかの実施形態では、正孔輸送層は単層である。いくつかの実施形態では、正孔輸送層は複数の層を有する。
いくつかの実施形態では、正孔輸送材料は、正孔の注入または輸送特性および電子の障壁特性のうちの1つの特性を有する。いくつかの実施形態では、正孔輸送材料は有機材料である。いくつかの実施形態では、正孔輸送材料は無機材料である。本発明で使用できる公知の正孔輸送材料の例としては、限定されないが、トリアゾール誘導体、オキサジアゾール誘導剤、イミダゾール誘導体、カルバゾール誘導体、インドロカルバゾール誘導体、ポリアリールアルカン誘導剤、ピラゾリン誘導体、ピラゾロン誘導体、フェニレンジアミン誘導体、アリルアミン誘導体、アミノ置換カルコン誘導体、オキサゾール誘導体、スチリルアントラセン誘導剤、フルオレノン誘導体、ヒドラゾン誘導体、スチルベン誘導体、シラザン誘導体、アニリンコポリマーおよび導電性ポリマーオリゴマー(特にチオフェンオリゴマー)、またはその組合せが挙げられる。いくつかの実施形態では、正孔輸送材料はポルフィリン化合物、芳香族三級アミン化合物およびスチリルアミン化合物から選択される。いくつかの実施形態では、正孔輸送材料は芳香族三級アミン化合物である。以下に正孔輸送材料として用いることができる好ましい化合物の具体例を挙げる。
電子輸送層:
電子輸送層は、電子輸送材料を含む。いくつかの実施形態では、電子輸送層は単層である。いくつかの実施形態では、電子輸送層は複数の層を有する。
いくつかの実施形態では、電子輸送材料は、陰極から注入された電子を発光層に輸送する機能さえあればよい。いくつかの実施形態では、電子輸送材料はまた、正孔障壁材料としても機能する。本発明で使用できる電子輸送層の例としては、限定されないが、ニトロ置換フルオレン誘導体、ジフェニルキノン誘導体、チオピランジオキシド誘導体、カルボジイミド、フルオレニリデンメタン誘導体、アントラキノジメタン、アントロン誘導体、オキサジアゾール誘導体、アゾール誘導体、アジン誘導体またはその組合せ、またはそのポリマーが挙げられる。いくつかの実施形態では、電子輸送材料はチアジアゾール誘導剤またはキノキサリン誘導体である。いくつかの実施形態では、電子輸送材料はポリマー材料である。以下に電子輸送材料として用いることができる好ましい化合物の具体例を挙げる。
電子輸送層は、電子輸送材料を含む。いくつかの実施形態では、電子輸送層は単層である。いくつかの実施形態では、電子輸送層は複数の層を有する。
いくつかの実施形態では、電子輸送材料は、陰極から注入された電子を発光層に輸送する機能さえあればよい。いくつかの実施形態では、電子輸送材料はまた、正孔障壁材料としても機能する。本発明で使用できる電子輸送層の例としては、限定されないが、ニトロ置換フルオレン誘導体、ジフェニルキノン誘導体、チオピランジオキシド誘導体、カルボジイミド、フルオレニリデンメタン誘導体、アントラキノジメタン、アントロン誘導体、オキサジアゾール誘導体、アゾール誘導体、アジン誘導体またはその組合せ、またはそのポリマーが挙げられる。いくつかの実施形態では、電子輸送材料はチアジアゾール誘導剤またはキノキサリン誘導体である。いくつかの実施形態では、電子輸送材料はポリマー材料である。以下に電子輸送材料として用いることができる好ましい化合物の具体例を挙げる。
さらに、各有機層に添加可能な材料として好ましい化合物例を挙げる。例えば、安定化材料として添加すること等が考えられる。
有機エレクトロルミネッセンス素子に用いることができる好ましい材料を具体的に例示したが、本発明において用いることができる材料は、以下の例示化合物によって限定的に解釈されることはない。また、特定の機能を有する材料として例示した化合物であっても、その他の機能を有する材料として転用することも可能である。
デバイス:
いくつかの実施形態では、発光層はデバイス中に組み込まれる。例えば、デバイスには、OLEDバルブ、OLEDランプ、テレビ用ディスプレイ、コンピューター用モニター、携帯電話およびタブレットが含まれるが、これらに限定されない。
いくつかの実施形態では、電子デバイスは、陽極、陰極、および当該陽極と当該陰極との間の発光層を含む少なくとも1つの有機層を有するOLEDを含む。
いくつかの実施形態では、本願明細書に記載の構成物は、OLEDまたは光電子デバイスなどの、様々な感光性または光活性化デバイスに組み込まれうる。いくつかの実施形態では、前記構成物はデバイス内の電荷移動またはエネルギー移動の促進に、および/または正孔輸送材料として有用でありうる。前記デバイスとしては、例えば有機発光ダイオード(OLED)、有機集積回線(OIC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光学検出装置、有機光受容体、有機磁場クエンチ(field-quench)装置(O-FQD)、発光燃料電池(LEC)または有機レーザダイオード(O-レーザー)が挙げられる。
いくつかの実施形態では、発光層はデバイス中に組み込まれる。例えば、デバイスには、OLEDバルブ、OLEDランプ、テレビ用ディスプレイ、コンピューター用モニター、携帯電話およびタブレットが含まれるが、これらに限定されない。
いくつかの実施形態では、電子デバイスは、陽極、陰極、および当該陽極と当該陰極との間の発光層を含む少なくとも1つの有機層を有するOLEDを含む。
いくつかの実施形態では、本願明細書に記載の構成物は、OLEDまたは光電子デバイスなどの、様々な感光性または光活性化デバイスに組み込まれうる。いくつかの実施形態では、前記構成物はデバイス内の電荷移動またはエネルギー移動の促進に、および/または正孔輸送材料として有用でありうる。前記デバイスとしては、例えば有機発光ダイオード(OLED)、有機集積回線(OIC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光学検出装置、有機光受容体、有機磁場クエンチ(field-quench)装置(O-FQD)、発光燃料電池(LEC)または有機レーザダイオード(O-レーザー)が挙げられる。
バルブまたはランプ:
いくつかの実施形態では、電子デバイスは、陽極、陰極、当該陽極と当該陰極との間の発光層を含む少なくとも1つの有機層を含むOLEDを含む。
いくつかの実施形態では、デバイスは色彩の異なるOLEDを含む。いくつかの実施形態では、デバイスはOLEDの組合せを含むアレイを含む。いくつかの実施形態では、OLEDの前記組合せは、3色の組合せ(例えばRGB)である。いくつかの実施形態では、OLEDの前記組合せは、赤色でも緑色でも青色でもない色(例えばオレンジ色および黄緑色)の組合せである。いくつかの実施形態では、OLEDの前記組合せは、2色、4色またはそれ以上の色の組合せである。
いくつかの実施形態では、デバイスは、
取り付け面を有する第1面とそれと反対の第2面とを有し、少なくとも1つの開口部を画定する回路基板と、
前記取り付け面上の少なくとも1つのOLEDであって、当該少なくとも1つのOLEDが、陽極、陰極、および当該陽極と当該陰極との間の発光層を含む少なくとも1つの有機層を含む、発光する構成を有する少なくとも1つのOLEDと、
回路基板用のハウジングと、
前記ハウジングの端部に配置された少なくとも1つのコネクターであって、前記ハウジングおよび前記コネクターが照明設備への取付けに適するパッケージを画定する、少なくとも1つのコネクターと、を備えるOLEDライトである。
いくつかの実施形態では、前記OLEDライトは、複数の方向に光が放射されるように回路基板に取り付けられた複数のOLEDを有する。いくつかの実施形態では、第1方向に発せられた一部の光は偏光されて第2方向に放射される。いくつかの実施形態では、反射器を用いて第1方向に発せられた光を偏光する。
いくつかの実施形態では、電子デバイスは、陽極、陰極、当該陽極と当該陰極との間の発光層を含む少なくとも1つの有機層を含むOLEDを含む。
いくつかの実施形態では、デバイスは色彩の異なるOLEDを含む。いくつかの実施形態では、デバイスはOLEDの組合せを含むアレイを含む。いくつかの実施形態では、OLEDの前記組合せは、3色の組合せ(例えばRGB)である。いくつかの実施形態では、OLEDの前記組合せは、赤色でも緑色でも青色でもない色(例えばオレンジ色および黄緑色)の組合せである。いくつかの実施形態では、OLEDの前記組合せは、2色、4色またはそれ以上の色の組合せである。
いくつかの実施形態では、デバイスは、
取り付け面を有する第1面とそれと反対の第2面とを有し、少なくとも1つの開口部を画定する回路基板と、
前記取り付け面上の少なくとも1つのOLEDであって、当該少なくとも1つのOLEDが、陽極、陰極、および当該陽極と当該陰極との間の発光層を含む少なくとも1つの有機層を含む、発光する構成を有する少なくとも1つのOLEDと、
回路基板用のハウジングと、
前記ハウジングの端部に配置された少なくとも1つのコネクターであって、前記ハウジングおよび前記コネクターが照明設備への取付けに適するパッケージを画定する、少なくとも1つのコネクターと、を備えるOLEDライトである。
いくつかの実施形態では、前記OLEDライトは、複数の方向に光が放射されるように回路基板に取り付けられた複数のOLEDを有する。いくつかの実施形態では、第1方向に発せられた一部の光は偏光されて第2方向に放射される。いくつかの実施形態では、反射器を用いて第1方向に発せられた光を偏光する。
ディスプレイまたはスクリーン:
いくつかの実施形態では、本発明の発光層はスクリーンまたはディスプレイにおいて使用できる。いくつかの実施形態では、本発明に係る化合物は、限定されないが真空蒸発、堆積、蒸着または化学蒸着(CVD)などの工程を用いて基材上へ堆積させる。いくつかの実施形態では、前記基材は、独特のアスペクト比のピクセルを提供する2面エッチングにおいて有用なフォトプレート構造である。前記スクリーン(またマスクとも呼ばれる)は、OLEDディスプレイの製造工程で用いられる。対応するアートワークパターンの設計により、垂直方向ではピクセルの間の非常に急な狭いタイバーの、並びに水平方向では大きな広範囲の斜角開口部の配置を可能にする。これにより、TFTバックプレーン上への化学蒸着を最適化しつつ、高解像度ディスプレイに必要とされるピクセルの微細なパターン構成が可能となる。
ピクセルの内部パターニングにより、水平および垂直方向での様々なアスペクト比の三次元ピクセル開口部を構成することが可能となる。更に、ピクセル領域中の画像化された「ストライプ」またはハーフトーン円の使用は、これらの特定のパターンをアンダーカットし基材から除くまで、特定の領域におけるエッチングが保護される。その時、全てのピクセル領域は同様のエッチング速度で処理されるが、その深さはハーフトーンパターンにより変化する。ハーフトーンパターンのサイズおよび間隔を変更することにより、ピクセル内での保護率が様々異なるエッチングが可能となり、急な垂直斜角を形成するのに必要な局在化された深いエッチングが可能となる。
蒸着マスク用の好ましい材料はインバーである。インバーは、製鉄所で長い薄型シート状に冷延された金属合金である。インバーは、ニッケルマスクとしてスピンマンドレル上へ電着することができない。蒸着用マスク内に開口領域を形成するための適切かつ低コストの方法は、湿式化学エッチングによる方法である。
いくつかの実施形態では、スクリーンまたはディスプレイパターンは、基材上のピクセルマトリックスである。いくつかの実施形態では、スクリーンまたはディスプレイパターンは、リソグラフィー(例えばフォトリソグラフィーおよびeビームリソグラフィー)を使用して加工される。いくつかの実施形態では、スクリーンまたはディスプレイパターンは、湿式化学エッチングを使用して加工される。更なる実施形態では、スクリーンまたはディスプレイパターンは、プラズマエッチングを使用して加工される。
いくつかの実施形態では、本発明の発光層はスクリーンまたはディスプレイにおいて使用できる。いくつかの実施形態では、本発明に係る化合物は、限定されないが真空蒸発、堆積、蒸着または化学蒸着(CVD)などの工程を用いて基材上へ堆積させる。いくつかの実施形態では、前記基材は、独特のアスペクト比のピクセルを提供する2面エッチングにおいて有用なフォトプレート構造である。前記スクリーン(またマスクとも呼ばれる)は、OLEDディスプレイの製造工程で用いられる。対応するアートワークパターンの設計により、垂直方向ではピクセルの間の非常に急な狭いタイバーの、並びに水平方向では大きな広範囲の斜角開口部の配置を可能にする。これにより、TFTバックプレーン上への化学蒸着を最適化しつつ、高解像度ディスプレイに必要とされるピクセルの微細なパターン構成が可能となる。
ピクセルの内部パターニングにより、水平および垂直方向での様々なアスペクト比の三次元ピクセル開口部を構成することが可能となる。更に、ピクセル領域中の画像化された「ストライプ」またはハーフトーン円の使用は、これらの特定のパターンをアンダーカットし基材から除くまで、特定の領域におけるエッチングが保護される。その時、全てのピクセル領域は同様のエッチング速度で処理されるが、その深さはハーフトーンパターンにより変化する。ハーフトーンパターンのサイズおよび間隔を変更することにより、ピクセル内での保護率が様々異なるエッチングが可能となり、急な垂直斜角を形成するのに必要な局在化された深いエッチングが可能となる。
蒸着マスク用の好ましい材料はインバーである。インバーは、製鉄所で長い薄型シート状に冷延された金属合金である。インバーは、ニッケルマスクとしてスピンマンドレル上へ電着することができない。蒸着用マスク内に開口領域を形成するための適切かつ低コストの方法は、湿式化学エッチングによる方法である。
いくつかの実施形態では、スクリーンまたはディスプレイパターンは、基材上のピクセルマトリックスである。いくつかの実施形態では、スクリーンまたはディスプレイパターンは、リソグラフィー(例えばフォトリソグラフィーおよびeビームリソグラフィー)を使用して加工される。いくつかの実施形態では、スクリーンまたはディスプレイパターンは、湿式化学エッチングを使用して加工される。更なる実施形態では、スクリーンまたはディスプレイパターンは、プラズマエッチングを使用して加工される。
デバイスの製造方法:
OLEDディスプレイは、一般的には、大型のマザーパネルを形成し、次に当該マザーパネルをセルパネル単位で切断することによって製造される。通常は、マザーパネル上の各セルパネルは、ベース基材上に、活性層とソース/ドレイン電極とを有する薄膜トランジスタ(TFT)を形成し、前記TFTに平坦化フィルムを塗布し、ピクセル電極、発光層、対電極およびカプセル化層、を順に経時的に形成し、前記マザーパネルから切断することにより形成される。
OLEDディスプレイは、一般的には、大型のマザーパネルを形成し、次に当該マザーパネルをセルパネル単位で切断することによって製造される。通常は、マザーパネル上の各セルパネルは、ベース基材上に、活性層とソース/ドレイン電極とを有する薄膜トランジスタ(TFT)を形成し、前記TFTに平坦化フィルムを塗布し、ピクセル電極、発光層、対電極およびカプセル化層、を順に経時的に形成し、前記マザーパネルから切断することにより形成される。
OLEDディスプレイは、一般的には、大型のマザーパネルを形成し、次に当該マザーパネルをセルパネル単位で切断することによって製造される。通常は、マザーパネル上の各セルパネルは、ベース基材上に、活性層とソース/ドレイン電極とを有する薄膜トランジスタ(TFT)を形成し、前記TFTに平坦化フィルムを塗布し、ピクセル電極、発光層、対電極およびカプセル化層、を順に経時的に形成し、前記マザーパネルから切断することにより形成される。
OLEDディスプレイは、一般的には、大型のマザーパネルを形成し、次に当該マザーパネルをセルパネル単位で切断することによって製造される。通常は、マザーパネル上の各セルパネルは、ベース基材上に、活性層とソース/ドレイン電極とを有する薄膜トランジスタ(TFT)を形成し、前記TFTに平坦化フィルムを塗布し、ピクセル電極、発光層、対電極およびカプセル化層、を順に経時的に形成し、前記マザーパネルから切断することにより形成される。
本発明の他の態様では、有機発光ダイオード(OLED)ディスプレイの製造方法を提供し、当該方法は、
マザーパネルのベース基材上に障壁層を形成する工程と、
前記障壁層上に、セルパネル単位で複数のディスプレイユニットを形成する工程と、
前記セルパネルのディスプレイユニットのそれぞれの上にカプセル化層を形成する工程と、
前記セルパネル間のインタフェース部に有機フィルムを塗布する工程と、を含む。
いくつかの実施形態では、障壁層は、例えばSiNxで形成された無機フィルムであり、障壁層の端部はポリイミドまたはアクリルで形成された有機フィルムで被覆される。いくつかの実施形態では、有機フィルムは、マザーパネルがセルパネル単位で軟らかく切断されるように補助する。
いくつかの実施形態では、薄膜トランジスタ(TFT)層は、発光層と、ゲート電極と、ソース/ドレイン電極と、を有する。複数のディスプレイユニットの各々は、薄膜トランジスタ(TFT)層と、TFT層上に形成された平坦化フィルムと、平坦化フィルム上に形成された発光ユニットと、を有してもよく、前記インタフェース部に塗布された有機フィルムは、前記平坦化フィルムの材料と同じ材料で形成され、前記平坦化フィルムの形成と同時に形成される。いくつかの実施形態では、前記発光ユニットは、不動態化層と、その間の平坦化フィルムと、発光ユニットを被覆し保護するカプセル化層と、によりTFT層と連結される。前記製造方法のいくつかの実施形態では、前記有機フィルムは、ディスプレイユニットにもカプセル化層にも連結されない。
マザーパネルのベース基材上に障壁層を形成する工程と、
前記障壁層上に、セルパネル単位で複数のディスプレイユニットを形成する工程と、
前記セルパネルのディスプレイユニットのそれぞれの上にカプセル化層を形成する工程と、
前記セルパネル間のインタフェース部に有機フィルムを塗布する工程と、を含む。
いくつかの実施形態では、障壁層は、例えばSiNxで形成された無機フィルムであり、障壁層の端部はポリイミドまたはアクリルで形成された有機フィルムで被覆される。いくつかの実施形態では、有機フィルムは、マザーパネルがセルパネル単位で軟らかく切断されるように補助する。
いくつかの実施形態では、薄膜トランジスタ(TFT)層は、発光層と、ゲート電極と、ソース/ドレイン電極と、を有する。複数のディスプレイユニットの各々は、薄膜トランジスタ(TFT)層と、TFT層上に形成された平坦化フィルムと、平坦化フィルム上に形成された発光ユニットと、を有してもよく、前記インタフェース部に塗布された有機フィルムは、前記平坦化フィルムの材料と同じ材料で形成され、前記平坦化フィルムの形成と同時に形成される。いくつかの実施形態では、前記発光ユニットは、不動態化層と、その間の平坦化フィルムと、発光ユニットを被覆し保護するカプセル化層と、によりTFT層と連結される。前記製造方法のいくつかの実施形態では、前記有機フィルムは、ディスプレイユニットにもカプセル化層にも連結されない。
前記有機フィルムと平坦化フィルムの各々は、ポリイミドおよびアクリルのいずれか1つを含んでもよい。いくつかの実施形態では、前記障壁層は無機フィルムであってもよい。いくつかの実施形態では、前記ベース基材はポリイミドで形成されてもよい。前記方法は更に、ポリイミドで形成されたベース基材の1つの表面に障壁層を形成する前に、当該ベース基材のもう1つの表面にガラス材料で形成されたキャリア基材を取り付ける工程と、インタフェース部に沿った切断の前に、前記キャリア基材をベース基材から分離する工程と、を含んでもよい。いくつかの実施形態では、前記OLEDディスプレイはフレキシブルなディスプレイである。
いくつかの実施形態では、前記不動態化層は、TFT層の被覆のためにTFT層上に配置された有機フィルムである。いくつかの実施形態では、前記平坦化フィルムは、不動態化層上に形成された有機フィルムである。いくつかの実施形態では、前記平坦化フィルムは、障壁層の端部に形成された有機フィルムと同様、ポリイミドまたはアクリルで形成される。いくつかの実施形態では、OLEDディスプレイの製造の際、前記平坦化フィルムおよび有機フィルムは同時に形成される。いくつかの実施形態では、前記有機フィルムは、障壁層の端部に形成されてもよく、それにより、当該有機フィルムの一部が直接ベース基材と接触し、当該有機フィルムの残りの部分が、障壁層の端部を囲みつつ、障壁層と接触する。
いくつかの実施形態では、前記不動態化層は、TFT層の被覆のためにTFT層上に配置された有機フィルムである。いくつかの実施形態では、前記平坦化フィルムは、不動態化層上に形成された有機フィルムである。いくつかの実施形態では、前記平坦化フィルムは、障壁層の端部に形成された有機フィルムと同様、ポリイミドまたはアクリルで形成される。いくつかの実施形態では、OLEDディスプレイの製造の際、前記平坦化フィルムおよび有機フィルムは同時に形成される。いくつかの実施形態では、前記有機フィルムは、障壁層の端部に形成されてもよく、それにより、当該有機フィルムの一部が直接ベース基材と接触し、当該有機フィルムの残りの部分が、障壁層の端部を囲みつつ、障壁層と接触する。
いくつかの実施形態では、前記発光層は、ピクセル電極と、対電極と、当該ピクセル電極と当該対電極との間に配置された有機発光層と、を有する。いくつかの実施形態では、前記ピクセル電極は、TFT層のソース/ドレイン電極に連結している。
いくつかの実施形態では、TFT層を通じてピクセル電極に電圧が印加されるとき、ピクセル電極と対電極との間に適切な電圧が形成され、それにより有機発光層が光を放射し、それにより画像が形成される。以下、TFT層と発光ユニットとを有する画像形成ユニットを、ディスプレイユニットと称する。
いくつかの実施形態では、ディスプレイユニットを被覆し、外部の水分の浸透を防止するカプセル化層は、有機フィルムと無機フィルムとが交互に積層する薄膜状のカプセル化構造に形成されてもよい。いくつかの実施形態では、前記カプセル化層は、複数の薄膜が積層した薄膜状カプセル化構造を有する。いくつかの実施形態では、インタフェース部に塗布される有機フィルムは、複数のディスプレイユニットの各々と間隔を置いて配置される。いくつかの実施形態では、前記有機フィルムは、一部の有機フィルムが直接ベース基材と接触し、有機フィルムの残りの部分が障壁層の端部を囲む一方で障壁層と接触する態様で形成される。
いくつかの実施形態では、TFT層を通じてピクセル電極に電圧が印加されるとき、ピクセル電極と対電極との間に適切な電圧が形成され、それにより有機発光層が光を放射し、それにより画像が形成される。以下、TFT層と発光ユニットとを有する画像形成ユニットを、ディスプレイユニットと称する。
いくつかの実施形態では、ディスプレイユニットを被覆し、外部の水分の浸透を防止するカプセル化層は、有機フィルムと無機フィルムとが交互に積層する薄膜状のカプセル化構造に形成されてもよい。いくつかの実施形態では、前記カプセル化層は、複数の薄膜が積層した薄膜状カプセル化構造を有する。いくつかの実施形態では、インタフェース部に塗布される有機フィルムは、複数のディスプレイユニットの各々と間隔を置いて配置される。いくつかの実施形態では、前記有機フィルムは、一部の有機フィルムが直接ベース基材と接触し、有機フィルムの残りの部分が障壁層の端部を囲む一方で障壁層と接触する態様で形成される。
一実施形態では、OLEDディスプレイはフレキシブルであり、ポリイミドで形成された柔軟なベース基材を使用する。いくつかの実施形態では、前記ベース基材はガラス材料で形成されたキャリア基材上に形成され、次に当該キャリア基材が分離される。
いくつかの実施形態では、障壁層は、キャリア基材の反対側のベース基材の表面に形成される。一実施形態では、前記障壁層は、各セルパネルのサイズに従いパターン化される。例えば、ベース基材がマザーパネルの全ての表面上に形成される一方で、障壁層が各セルパネルのサイズに従い形成され、それにより、セルパネルの障壁層の間のインタフェース部に溝が形成される。各セルパネルは、前記溝に沿って切断できる。
いくつかの実施形態では、障壁層は、キャリア基材の反対側のベース基材の表面に形成される。一実施形態では、前記障壁層は、各セルパネルのサイズに従いパターン化される。例えば、ベース基材がマザーパネルの全ての表面上に形成される一方で、障壁層が各セルパネルのサイズに従い形成され、それにより、セルパネルの障壁層の間のインタフェース部に溝が形成される。各セルパネルは、前記溝に沿って切断できる。
いくつかの実施形態では、前記の製造方法は、更にインタフェース部に沿って切断する工程を含み、そこでは溝が障壁層に形成され、少なくとも一部の有機フィルムが溝で形成され、当該溝がベース基材に浸透しない。いくつかの実施形態では、各セルパネルのTFT層が形成され、無機フィルムである不動態化層と有機フィルムである平坦化フィルムが、TFT層上に配置され、TFT層を被覆する。例えばポリイミドまたはアクリル製の平坦化フィルムが形成されるのと同時に、インタフェース部の溝は、例えばポリイミドまたはアクリル製の有機フィルムで被覆される。これは、各セルパネルがインタフェース部で溝に沿って切断されるとき、生じた衝撃を有機フィルムに吸収させることによってひびが生じるのを防止する。すなわち、全ての障壁層が有機フィルムなしで完全に露出している場合、各セルパネルがインタフェース部で溝に沿って切断されるとき、生じた衝撃が障壁層に伝達され、それによりひびが生じるリスクが増加する。しかしながら、一実施形態では、障壁層間のインタフェース部の溝が有機フィルムで被覆されて、有機フィルムがなければ障壁層に伝達されうる衝撃を吸収するため、各セルパネルをソフトに切断し、障壁層でひびが生じるのを防止してもよい。一実施形態では、インタフェース部の溝を被覆する有機フィルムおよび平坦化フィルムは、互いに間隔を置いて配置される。例えば、有機フィルムおよび平坦化フィルムが1つの層として相互に接続している場合には、平坦化フィルムと有機フィルムが残っている部分とを通じてディスプレイユニットに外部の水分が浸入するおそれがあるため、有機フィルムおよび平坦化フィルムは、有機フィルムがディスプレイユニットから間隔を置いて配置されるように、相互に間隔を置いて配置される。
いくつかの実施形態では、ディスプレイユニットは、発光ユニットの形成により形成され、カプセル化層は、ディスプレイユニットを被覆するためディスプレイユニット上に配置される。これにより、マザーパネルが完全に製造された後、ベース基材を担持するキャリア基材がベース基材から分離される。いくつかの実施形態では、レーザー光線がキャリア基材へ放射されると、キャリア基材は、キャリア基材とベース基材との間の熱膨張率の相違により、ベース基材から分離される。
いくつかの実施形態では、マザーパネルは、セルパネル単位で切断される。いくつかの実施形態では、マザーパネルは、カッターを用いてセルパネル間のインタフェース部に沿って切断される。いくつかの実施形態では、マザーパネルが沿って切断されるインタフェース部の溝が有機フィルムで被覆されているため、切断の間、当該有機フィルムが衝撃を吸収する。いくつかの実施形態では、切断の間、障壁層でひびが生じるのを防止できる。
いくつかの実施形態では、前記方法は製品の不良率を減少させ、その品質を安定させる。
他の態様は、ベース基材上に形成された障壁層と、障壁層上に形成されたディスプレイユニットと、ディスプレイユニット上に形成されたカプセル化層と、障壁層の端部に塗布された有機フィルムと、を有するOLEDディスプレイである。
いくつかの実施形態では、マザーパネルは、セルパネル単位で切断される。いくつかの実施形態では、マザーパネルは、カッターを用いてセルパネル間のインタフェース部に沿って切断される。いくつかの実施形態では、マザーパネルが沿って切断されるインタフェース部の溝が有機フィルムで被覆されているため、切断の間、当該有機フィルムが衝撃を吸収する。いくつかの実施形態では、切断の間、障壁層でひびが生じるのを防止できる。
いくつかの実施形態では、前記方法は製品の不良率を減少させ、その品質を安定させる。
他の態様は、ベース基材上に形成された障壁層と、障壁層上に形成されたディスプレイユニットと、ディスプレイユニット上に形成されたカプセル化層と、障壁層の端部に塗布された有機フィルムと、を有するOLEDディスプレイである。
以下に実施例を挙げて本発明の特徴をさらに具体的に説明する。以下に示す材料、処理内容、処理手順等は、本発明の趣旨を逸脱しない限り適宜変更することができる。したがって、本発明の範囲は以下に示す具体例により限定的に解釈されるべきものではない。なお、発光特性の評価は、ソースメータ(ケースレー社製:2400シリーズ)、半導体パラメータ・アナライザ(アジレント・テクノロジー社製:E5273A)、光パワーメータ測定装置(ニューポート社製:1930C)、光学分光器(オーシャンオプティクス社製:USB2000)、分光放射計(トプコン社製:SR-3)およびストリークカメラ(浜松ホトニクス(株)製C4334型)を用いて行った。また、以下の実施例と比較例で用いた化合物の最低励起一重項エネルギーES1と最低励起三重項エネルギーET1は、以下の表に示す通りである。
(比較例1および実施例1~3)
膜厚100nmのインジウム・スズ酸化物(ITO)からなる陽極が形成されたガラス基材上に、各薄膜を真空蒸着法にて、真空度1×10-6Paで積層した。まず、ITO上にHATCNを10nmの厚さに形成し、その上にNPDを30nmの厚さに形成し、さらにその上にTrisPCzを10nmの厚さに形成した。次に、化合物H3を3nmの厚さに形成した。さらに化合物H3、化合物T10、化合物S1および化合物E1をそれぞれ下記の表の濃度で異なる蒸着源から共蒸着し、30nmの厚さの発光層を形成した。次に、SF3TRZを10nmの厚さの正孔障壁層として形成した。続いて、SF3TRZとLiqを異なる蒸着源から共蒸着し、30nmの厚さの電子輸送層として形成した。この時、SF3TRZ:Liq(重量比)は7:3とした。さらに、Liqを2nmの厚さに形成し、次いでアルミニウム(Al)を100nmの厚さに蒸着することにより陰極を形成した。以上の手順により、比較例1、実施例1、実施例2、実施例3の4種の有機エレクトロルミネッセンス素子を作製した。なお、実施例1~3における第1有機化合物である化合物H3、第2有機化合物である化合物T10、第3有機化合物である化合物S1および第4有機化合物である化合物E1は、条件(a)~(e)を満たしていた。
膜厚100nmのインジウム・スズ酸化物(ITO)からなる陽極が形成されたガラス基材上に、各薄膜を真空蒸着法にて、真空度1×10-6Paで積層した。まず、ITO上にHATCNを10nmの厚さに形成し、その上にNPDを30nmの厚さに形成し、さらにその上にTrisPCzを10nmの厚さに形成した。次に、化合物H3を3nmの厚さに形成した。さらに化合物H3、化合物T10、化合物S1および化合物E1をそれぞれ下記の表の濃度で異なる蒸着源から共蒸着し、30nmの厚さの発光層を形成した。次に、SF3TRZを10nmの厚さの正孔障壁層として形成した。続いて、SF3TRZとLiqを異なる蒸着源から共蒸着し、30nmの厚さの電子輸送層として形成した。この時、SF3TRZ:Liq(重量比)は7:3とした。さらに、Liqを2nmの厚さに形成し、次いでアルミニウム(Al)を100nmの厚さに蒸着することにより陰極を形成した。以上の手順により、比較例1、実施例1、実施例2、実施例3の4種の有機エレクトロルミネッセンス素子を作製した。なお、実施例1~3における第1有機化合物である化合物H3、第2有機化合物である化合物T10、第3有機化合物である化合物S1および第4有機化合物である化合物E1は、条件(a)~(e)を満たしていた。
製造した各有機エレクトロルミネッセンス素子に通電したところ、第4有機化合物に由来する遅延蛍光の放射が認められ、いずれも15%以上の高い外部量子収率を達成した。各有機エレクトロルミネッセンス素子からの発光は、いずれも第4有機化合物に由来する発光量が最大であり、色純度が高いことが確認された(極大発光波長471nm)。各有機エレクトロルミネッセンス素子について、750cd/m2を実現する駆動電圧と発光強度の経時変化を測定したところ図2に示す結果を得た。発光強度と駆動電圧は初期値を1とした相対値で示している。駆動電圧の経時変化にほとんど差は見られなかったが、寿命は比較例1よりも実施例1~3が明らかに長いことが確認された。また、第3有機化合物の濃度を1重量%から5重量%へと高くするにしたがって寿命が延びることも確認された。
(実施例4~5)
実施例3で用いた化合物S1のかわりに、第3化合物として化合物S2、化合物S3をそれぞれ用いて各有機エレクトロルミネッセンス素子を作製した。これらの各素子は、いずれも条件(a)~(e)を満たしていた。
実施例4および実施例5の各有機エレクトロルミネッセンス素子からは第4有機化合物に由来する高い色純度の発光が認められ、比較例1よりも寿命が長いことが確認される。
実施例3で用いた化合物S1のかわりに、第3化合物として化合物S2、化合物S3をそれぞれ用いて各有機エレクトロルミネッセンス素子を作製した。これらの各素子は、いずれも条件(a)~(e)を満たしていた。
実施例4および実施例5の各有機エレクトロルミネッセンス素子からは第4有機化合物に由来する高い色純度の発光が認められ、比較例1よりも寿命が長いことが確認される。
本発明によれば、高い色純度で長い寿命を有する有機発光素子を提供することが可能である。このため、本発明は産業上の利用可能性が高い。
1 基材
2 陽極
3 正孔注入層
4 正孔輸送層
5 発光層
6 電子輸送層
7 陰極
2 陽極
3 正孔注入層
4 正孔輸送層
5 発光層
6 電子輸送層
7 陰極
Claims (10)
- 下記条件(a)~(e)を満たす第1有機化合物と第2有機化合物と第3有機化合物と第4有機化合物を含む発光層を有する有機発光素子であって、
前記第2有機化合物および前記第3有機化合物は、互いに構造が異なる遅延蛍光材料であり、
前記有機発光素子からの発光の最大成分は前記第4有機化合物からの発光である、有機発光素子。
条件(a) ES1(1)>ES1(2)>ES1(4)>ES1(3)
条件(b) ES1(2)-ES1(3)<0.30eV
条件(c) ET1(1)>ET1(2)>ET1(3)
条件(d) Conc(1)>Conc(2)>Conc(3)
条件(e) Conc(3)≦20重量%
(上式において、
ES1(1)は前記第1有機化合物の最低励起一重項エネルギーを表す。
ES1(2)は前記第2有機化合物の最低励起一重項エネルギーを表す。
ES1(3)は前記第3有機化合物の最低励起一重項エネルギーを表す。
ES1(4)は前記第4有機化合物の最低励起一重項エネルギーを表す。
ET1(1)は前記第1有機化合物の最低励起三重項エネルギーを表す。
ET1(2)は前記第2有機化合物の最低励起三重項エネルギーを表す。
ET1(3)は前記第3有機化合物の最低励起三重項エネルギーを表す。
Conc(1)は前記発光層における前記第1有機化合物の濃度を表す。
Conc(2)は前記発光層における前記第2有機化合物の濃度を表す。
Conc(3)は前記発光層における前記第3有機化合物の濃度を表す。) - さらに下記条件(c1)を満たす、請求項1に記載の有機発光素子。
条件(c1) ET1(1)>ET1(2)>ET1(4)>ET1(3)
(上式において、ET1(4)は前記第4有機化合物の最低励起三重項エネルギーを表す。) - さらに下記条件(d1)を満たす、請求項1に記載の有機発光素子。
条件(d1) Conc(1)>Conc(2)>Conc(3)>Conc(4)
(上式において、Conc(4)は前記発光層における前記第4有機化合物の濃度を表す。) - さらに下記条件(f)を満たす、請求項3に記載の有機発光素子。
条件(f) Conc(3)/Conc(4)>5 - さらに下記条件(e2)を満たす、請求項1~4のいずれか1項に記載の有機発光素子。
条件(e2) Conc(4)≦1重量% - 前記第2有機化合物は、最低励起一重項状態と77Kの最低励起三重項状態とのエネルギーの差ΔEstが0.3eV以下である、請求項1~5のいずれか1項に記載の有機発光素子。
- 前記第3有機化合物は、最低励起一重項状態と77Kの最低励起三重項状態とのエネルギーの差ΔEstが0.3eV以下である、請求項1~6のいずれか1項に記載の有機発光素子。
- 前記発光層が、炭素原子、水素原子、窒素原子、ホウ素原子、酸素原子および硫黄原子からなる群より選択される原子からなる化合物のみで構成される、請求項1~7のいずれか1項に記載の有機発光素子。
- 前記第1有機化合物、前記第2有機化合物および前記第3有機化合物が、各々独立に、炭素原子、水素原子および窒素原子からなる群より選択される原子からなる化合物である、請求項1~8のいずれか1項に記載の有機発光素子。
- 前記第2有機化合物と前記第3有機化合物が、いずれもシアノベンゼン構造を含む、請求項1~9のいずれか1項に記載の有機発光素子。
Priority Applications (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202180038014.0A CN115669265A (zh) | 2020-05-29 | 2021-05-27 | 有机发光元件 |
| JP2022526632A JPWO2021241677A1 (ja) | 2020-05-29 | 2021-05-27 | |
| KR1020227042509A KR20230035234A (ko) | 2020-05-29 | 2021-05-27 | 유기 발광 소자 |
| US17/999,979 US20230209847A1 (en) | 2020-05-29 | 2021-05-27 | Organic light emitting element |
| JP2023523948A JPWO2022249506A1 (ja) | 2020-05-29 | 2021-09-24 | |
| KR1020237041849A KR20240013139A (ko) | 2020-05-29 | 2021-09-24 | 화합물, 발광 재료 및 발광 소자 |
| PCT/JP2021/034975 WO2022249506A1 (ja) | 2020-05-29 | 2021-09-24 | 化合物、発光材料および発光素子 |
| JP2023523947A JPWO2022249505A1 (ja) | 2020-05-29 | 2021-09-24 | |
| CN202180098537.4A CN117412976A (zh) | 2020-05-29 | 2021-09-24 | 化合物、发光材料及发光元件 |
| PCT/JP2021/034974 WO2022249505A1 (ja) | 2020-05-29 | 2021-09-24 | 化合物、発光材料および発光素子 |
| US18/564,003 US20240298538A1 (en) | 2020-05-29 | 2021-09-24 | Compound, light-emitting material, and light-emitting element |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020-094308 | 2020-05-29 | ||
| JP2020094308 | 2020-05-29 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2021241677A1 true WO2021241677A1 (ja) | 2021-12-02 |
Family
ID=78744898
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2021/020163 WO2021241677A1 (ja) | 2020-05-29 | 2021-05-27 | 有機発光素子 |
| PCT/JP2021/034974 WO2022249505A1 (ja) | 2020-05-29 | 2021-09-24 | 化合物、発光材料および発光素子 |
| PCT/JP2021/034975 WO2022249506A1 (ja) | 2020-05-29 | 2021-09-24 | 化合物、発光材料および発光素子 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2021/034974 WO2022249505A1 (ja) | 2020-05-29 | 2021-09-24 | 化合物、発光材料および発光素子 |
| PCT/JP2021/034975 WO2022249506A1 (ja) | 2020-05-29 | 2021-09-24 | 化合物、発光材料および発光素子 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US20230209847A1 (ja) |
| JP (3) | JPWO2021241677A1 (ja) |
| KR (2) | KR20230035234A (ja) |
| CN (2) | CN115669265A (ja) |
| TW (1) | TW202204319A (ja) |
| WO (3) | WO2021241677A1 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023167272A1 (ja) * | 2022-03-04 | 2023-09-07 | 株式会社Kyulux | 有機発光素子、遅延蛍光材料の評価方法、遅延蛍光材料の設計方法、有機発光素子の設計方法、およびプログラム |
| WO2023167271A1 (ja) * | 2022-03-04 | 2023-09-07 | 株式会社Kyulux | 有機発光素子、遅延蛍光材料の評価方法、遅延蛍光材料の設計方法、有機発光素子の設計方法、およびプログラム |
| WO2023167273A1 (ja) * | 2022-03-04 | 2023-09-07 | 株式会社Kyulux | 有機発光素子、遅延蛍光材料の評価方法、遅延蛍光材料の設計方法、有機発光素子の設計方法、およびプログラム |
| WO2024088239A1 (zh) * | 2022-10-28 | 2024-05-02 | 清华大学 | 一种有机化合物及采用该化合物的有机电致发光器 |
| JP7512522B2 (ja) | 2020-09-18 | 2024-07-08 | 三星ディスプレイ株式會社 | 有機エレクトロルミネッセンス素子および光発生方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014157619A1 (ja) * | 2013-03-29 | 2014-10-02 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| WO2018070348A1 (ja) * | 2016-10-13 | 2018-04-19 | シャープ株式会社 | 表示装置およびその製造方法 |
| JP2019186521A (ja) * | 2018-03-30 | 2019-10-24 | キヤノン株式会社 | 有機発光素子、表示装置、撮像装置および照明装置 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5366106B1 (ja) | 2012-04-09 | 2013-12-11 | 国立大学法人九州大学 | 有機発光素子ならびにそれに用いる発光材料および化合物 |
| EP4152910A1 (en) | 2013-08-14 | 2023-03-22 | Kyulux, Inc. | Organic electroluminescent device |
| EP3266772B1 (de) * | 2016-07-06 | 2019-04-24 | Cynora Gmbh | Organische moleküle, insbesondere zur verwendung in optoelektronischen vorrichtungen |
| DE102016113277A1 (de) * | 2016-07-19 | 2018-01-25 | Cynora Gmbh | Organische Moleküle zur Verwendung in optoelektronischen Bauelementen |
| KR102207689B1 (ko) * | 2016-08-24 | 2021-01-25 | 시노라 게엠베하 | 유기 분자, 특히 유기 광전자 디바이스에 사용하기 위한 유기 분자 |
| TWI701237B (zh) * | 2016-08-25 | 2020-08-11 | 德商賽諾拉公司 | 有機分子,特別是用於有機光電器件的有機分子 |
| WO2018237389A1 (en) * | 2017-06-23 | 2018-12-27 | Kyulux Inc. | MATERIAL COMPOSITION FOR USE IN ORGANIC ELECTROLUMINESCENT DIODE |
| CN110759851A (zh) * | 2018-07-25 | 2020-02-07 | 北京鼎材科技有限公司 | 一种有机电致发光材料及其应用 |
| KR20220059485A (ko) * | 2019-09-05 | 2022-05-10 | 가부시키가이샤 큐럭스 | 유기발광 다이오드에 사용하기 위한 물질의 조성물 |
| KR20210050829A (ko) * | 2019-10-29 | 2021-05-10 | 솔브레인 주식회사 | 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20210056495A (ko) * | 2019-11-08 | 2021-05-20 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 및 유기 전계 발광 소자용 방향족 화합물 |
-
2021
- 2021-05-27 CN CN202180038014.0A patent/CN115669265A/zh active Pending
- 2021-05-27 US US17/999,979 patent/US20230209847A1/en active Pending
- 2021-05-27 WO PCT/JP2021/020163 patent/WO2021241677A1/ja active Application Filing
- 2021-05-27 KR KR1020227042509A patent/KR20230035234A/ko unknown
- 2021-05-27 JP JP2022526632A patent/JPWO2021241677A1/ja active Pending
- 2021-05-28 TW TW110119397A patent/TW202204319A/zh unknown
- 2021-09-24 CN CN202180098537.4A patent/CN117412976A/zh active Pending
- 2021-09-24 JP JP2023523948A patent/JPWO2022249506A1/ja active Pending
- 2021-09-24 WO PCT/JP2021/034974 patent/WO2022249505A1/ja active Application Filing
- 2021-09-24 US US18/564,003 patent/US20240298538A1/en active Pending
- 2021-09-24 WO PCT/JP2021/034975 patent/WO2022249506A1/ja active Application Filing
- 2021-09-24 JP JP2023523947A patent/JPWO2022249505A1/ja active Pending
- 2021-09-24 KR KR1020237041849A patent/KR20240013139A/ko unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014157619A1 (ja) * | 2013-03-29 | 2014-10-02 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| WO2018070348A1 (ja) * | 2016-10-13 | 2018-04-19 | シャープ株式会社 | 表示装置およびその製造方法 |
| JP2019186521A (ja) * | 2018-03-30 | 2019-10-24 | キヤノン株式会社 | 有機発光素子、表示装置、撮像装置および照明装置 |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7512522B2 (ja) | 2020-09-18 | 2024-07-08 | 三星ディスプレイ株式會社 | 有機エレクトロルミネッセンス素子および光発生方法 |
| WO2023167272A1 (ja) * | 2022-03-04 | 2023-09-07 | 株式会社Kyulux | 有機発光素子、遅延蛍光材料の評価方法、遅延蛍光材料の設計方法、有機発光素子の設計方法、およびプログラム |
| WO2023167271A1 (ja) * | 2022-03-04 | 2023-09-07 | 株式会社Kyulux | 有機発光素子、遅延蛍光材料の評価方法、遅延蛍光材料の設計方法、有機発光素子の設計方法、およびプログラム |
| WO2023167273A1 (ja) * | 2022-03-04 | 2023-09-07 | 株式会社Kyulux | 有機発光素子、遅延蛍光材料の評価方法、遅延蛍光材料の設計方法、有機発光素子の設計方法、およびプログラム |
| WO2024088239A1 (zh) * | 2022-10-28 | 2024-05-02 | 清华大学 | 一种有机化合物及采用该化合物的有机电致发光器 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20240298538A1 (en) | 2024-09-05 |
| WO2022249506A1 (ja) | 2022-12-01 |
| KR20240013139A (ko) | 2024-01-30 |
| CN115669265A (zh) | 2023-01-31 |
| JPWO2022249505A1 (ja) | 2022-12-01 |
| JPWO2021241677A1 (ja) | 2021-12-02 |
| US20230209847A1 (en) | 2023-06-29 |
| JPWO2022249506A1 (ja) | 2022-12-01 |
| TW202204319A (zh) | 2022-02-01 |
| CN117412976A (zh) | 2024-01-16 |
| KR20230035234A (ko) | 2023-03-13 |
| WO2022249505A1 (ja) | 2022-12-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7418794B2 (ja) | 有機発光素子 | |
| WO2021241677A1 (ja) | 有機発光素子 | |
| WO2021157642A1 (ja) | ホスト材料、組成物および有機発光素子 | |
| WO2023282224A1 (ja) | 有機発光素子およびその設計方法 | |
| WO2022009790A1 (ja) | 有機発光素子 | |
| WO2022168825A1 (ja) | 有機エレクトロルミネッセンス素子、発光組成物の設計方法およびプログラム | |
| JP7152805B1 (ja) | 化合物、組成物、ホスト材料、電子障壁材料および有機発光素子 | |
| WO2022244503A1 (ja) | 有機発光素子 | |
| WO2022230573A1 (ja) | 有機発光素子およびその製造方法 | |
| JP2020077872A (ja) | 電荷輸送材料、化合物および有機発光素子 | |
| WO2022107798A1 (ja) | 有機エレクトロルミネッセンス素子、発光組成物の設計方法およびプログラム | |
| WO2022264857A1 (ja) | 有機発光素子およびその製造方法 | |
| JP2022014426A (ja) | 有機発光素子 | |
| JP7461095B1 (ja) | 有機発光素子、その設計方法およびプログラム | |
| TW202403015A (zh) | 有機發光元件、延遲螢光材料的評價方法、延遲螢光材料的設計方法、有機發光元件的設計方法及程式 | |
| JP2022168813A (ja) | 電荷輸送材料、組成物および有機発光素子 | |
| KR20240069637A (ko) | 화합물, 발광 재료 및 유기 발광 소자 | |
| JP2023069652A (ja) | 化合物、組成物、ホスト材料および有機発光素子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 21813885 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2022526632 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 21813885 Country of ref document: EP Kind code of ref document: A1 |