WO2020196784A1 - 共焦点顕微鏡ユニット及び共焦点顕微鏡 - Google Patents
共焦点顕微鏡ユニット及び共焦点顕微鏡 Download PDFInfo
- Publication number
- WO2020196784A1 WO2020196784A1 PCT/JP2020/013801 JP2020013801W WO2020196784A1 WO 2020196784 A1 WO2020196784 A1 WO 2020196784A1 JP 2020013801 W JP2020013801 W JP 2020013801W WO 2020196784 A1 WO2020196784 A1 WO 2020196784A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- excitation light
- fluorescence
- subunit
- mirror
- confocal microscope
- Prior art date
Links
- 230000003287 optical effect Effects 0.000 claims abstract description 56
- 230000005284 excitation Effects 0.000 claims description 148
- 230000004907 flux Effects 0.000 claims description 12
- 230000004044 response Effects 0.000 claims description 9
- 230000004888 barrier function Effects 0.000 description 14
- 238000003384 imaging method Methods 0.000 description 8
- 238000010586 diagram Methods 0.000 description 7
- 238000001514 detection method Methods 0.000 description 6
- 210000001747 pupil Anatomy 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 239000012141 concentrate Substances 0.000 description 4
- 238000002073 fluorescence micrograph Methods 0.000 description 4
- 238000009434 installation Methods 0.000 description 4
- 238000010226 confocal imaging Methods 0.000 description 3
- 239000000835 fiber Substances 0.000 description 3
- 238000000799 fluorescence microscopy Methods 0.000 description 3
- 238000005086 pumping Methods 0.000 description 3
- 238000004624 confocal microscopy Methods 0.000 description 2
- 125000006850 spacer group Chemical group 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 238000010276 construction Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0036—Scanning details, e.g. scanning stages
- G02B21/0048—Scanning details, e.g. scanning stages scanning mirrors, e.g. rotating or galvanomirrors, MEMS mirrors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6456—Spatial resolved fluorescence measurements; Imaging
- G01N21/6458—Fluorescence microscopy
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0032—Optical details of illumination, e.g. light-sources, pinholes, beam splitters, slits, fibers
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0052—Optical details of the image generation
- G02B21/0064—Optical details of the image generation multi-spectral or wavelength-selective arrangements, e.g. wavelength fan-out, chromatic profiling
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0052—Optical details of the image generation
- G02B21/0076—Optical details of the image generation arrangements using fluorescence or luminescence
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/16—Microscopes adapted for ultraviolet illumination ; Fluorescence microscopes
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B27/00—Optical systems or apparatus not provided for by any of the groups G02B1/00 - G02B26/00, G02B30/00
- G02B27/10—Beam splitting or combining systems
- G02B27/14—Beam splitting or combining systems operating by reflection only
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N2021/6417—Spectrofluorimetric devices
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B26/00—Optical devices or arrangements for the control of light using movable or deformable optical elements
- G02B26/08—Optical devices or arrangements for the control of light using movable or deformable optical elements for controlling the direction of light
- G02B26/0816—Optical devices or arrangements for the control of light using movable or deformable optical elements for controlling the direction of light by means of one or more reflecting elements
- G02B26/0833—Optical devices or arrangements for the control of light using movable or deformable optical elements for controlling the direction of light by means of one or more reflecting elements the reflecting element being a micromechanical device, e.g. a MEMS mirror, DMD
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B27/00—Optical systems or apparatus not provided for by any of the groups G02B1/00 - G02B26/00, G02B30/00
- G02B27/10—Beam splitting or combining systems
- G02B27/14—Beam splitting or combining systems operating by reflection only
- G02B27/145—Beam splitting or combining systems operating by reflection only having sequential partially reflecting surfaces
Definitions
- the present disclosure relates to a confocal microscope unit and a confocal microscope that constitute a confocal microscope.
- a confocal microscope capable of obtaining an optical tomographic image of an observation target specimen with high resolution.
- a microscope connection port connected to a microscope, a stimulation unit that irradiates a sample with light, an observation unit that detects light emitted from the sample, a microscope, a stimulation unit, and an observation unit are described.
- a microscope connection unit including an optical path synthesizer that synthesizes optical paths that are optically connected is disclosed.
- This microscope connection unit uses the same optical system that guides light emitted from multiple light sources, a dichroic mirror for detecting the fluorescence generated in response to each of multiple wavelengths, a confocal pinhole, and a photomultiplier tube. It is held in the observation unit of. In such a configuration, by using excitation light of a plurality of wavelengths and detecting the fluorescence generated accordingly, imaging in a plurality of wavelength regions can be realized with the same device.
- the laser scanner apparatus described in Patent Document 2 below is also known. According to this laser scanner device, two laser beams having different wavelengths focused on a sample are spatially separated, and two emission beams induced by these laser beams are also spatially separated for two detections. Guided toward the vessel.
- the wavelength distribution of fluorescence emitted by a fluorescent substance is generally wide, when observing a sample containing a plurality of fluorescent substances, the wavelength distribution of fluorescence emitted from each fluorescent substance may overlap.
- the fluorescence emitted from such a sample there is a problem that not only the fluorescence from the target fluorescent substance but also the fluorescence from other fluorescent substances is detected by the same detector. Generally, such a problem is called Bleed Through.
- bleed-through is reduced by spatially separating and detecting a plurality of fluorescences using a wedge-shaped dichroic mirror, but confocal using a scan mirror is used. Difficult to apply to microscopes.
- the embodiment has been made in view of such a problem, and an object of the present invention is to provide a confocal microscope unit that enables fluorescence imaging with less bleed-through in a plurality of wavelength regions by a simple configuration.
- the cofocal microscope unit is a cofocal microscope unit that constitutes a cofocal microscope by being attached to a connection port of a microscope having a microscope optical system, and outputs a first excitation light.
- a light source a first aperture member that limits the light beam of the first fluorescence generated from the sample to be observed in response to the first excitation light, and a first aperture member that detects the first fluorescence that has passed through the first aperture member.
- a second subsystem having a second light detector that detects the second fluorescence that has passed through the second aperture member, and the excitation light output from the first and second subunits are combined with the microscope optical system.
- the first and second subsystems are provided with a main housing in which the second subunit is fixed, and the first and second subunits are scanned by the angle of incidence of the first excitation light on the scan mirror. It is arranged in the main housing so as to deviate from the incident angle of the second excitation light on the mirror by a predetermined angle.
- the first excitation light output from the first subunit is scanned onto the sample via the scan mirror, and the first fluorescence generated from the sample accordingly scans the scan mirror. It is incident into the first subunit via the image, and the image is formed on the first diaphragm member in the first subunit and detected by the first photodetector.
- the second excitation light output from the second subunit is scanned onto the sample via the scan mirror, and the second fluorescence generated from the sample accordingly passes through the scan mirror. It is incident in the subunit of 2, and the image is formed on the second diaphragm member in the second subunit and detected by the second photodetector.
- these scan mirrors, the first and second subunits are fixed to the main housing, and the first and second excitation lights are incident on the scan mirror from the first and second subunits. Since the angles are offset from each other by a predetermined angle, the spots of the first and second excitation lights scanned on the sample can be separated, and as a result, the first and second subunits are guided. The first and second fluorescence beams can be separated from each other. This makes it possible to observe a plurality of fluorescent images with reduced bleed-through. In addition, by adopting a configuration in which the sample is scanned by a scan mirror, the overall equipment configuration can be simplified.
- another embodiment of the present disclosure is a confocal microscope comprising the above-mentioned confocal microscope unit and a microscope having a microscope optical system and a connection port to which the confocal microscope unit is attached. According to such a confocal microscope, confocal imaging at a desired excitation wavelength and fluorescence wavelength can be easily performed.
- 6 is a graph showing a one-dimensional light intensity distribution along the X-axis direction of each of the first excitation light and the second excitation light irradiated on the sample M by the confocal microscope 101.
- FIG. 1 is a schematic configuration diagram of a confocal microscope 101 according to the first embodiment.
- the confocal microscope 101 shown in FIG. 1 constitutes a confocal microscope that acquires an image that enables the construction of an optical tomographic image of the sample M to be observed, and the confocal microscope unit 1A is for connecting an external unit of the microscope 50. It is configured to be connected to the connection port P1.
- the confocal microscope unit 1A according to the first embodiment receives excitation light on a sample M arranged on a stage of the microscope 50 or the like via a microscope optical system such as an imaging lens 51 and an objective lens 52 in the microscope 50.
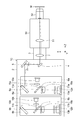
- the confocal microscope unit 1A constitutes the main housing 2, a part of the main housing 2, and has a lens barrel 3 detachably connected to the connection port P1 of the microscope 50, and the main housing 2. It is composed of a scan mirror 4 fixed inside, a fixed mirror 5, first and second subunits 6a to 6b, and a scan lens 7 fixed inside the lens barrel 3.
- a scan mirror 4 fixed inside
- a fixed mirror 5 fixed inside
- first and second subunits 6a to 6b a scan lens 7 fixed inside the lens barrel 3.
- the scan lens 7 in the lens barrel 3 is an optical element having a function of relaying the reflecting surface of the scan mirror 4 to the pupil position of the objective lens 52 and at the same time forming a spot on the primary imaging surface of the microscope optical system of the microscope 50. is there.
- the exit pupils of the scan mirror 4 and the objective lens 52 have a conjugate relationship, that is, an imaging relationship.
- the scan lens 7 irradiates the sample M with the excitation light scanned by the scan mirror 4 by guiding the excitation light to the microscope optical system, and guides the fluorescence generated from the sample M to the scan mirror 4 accordingly.
- the scan mirror 4 in the main housing 2 is, for example, an optical scanning element such as a MEMS (Micro Electro Mechanical System) mirror configured so that the reflector can be tilted in two axes.
- the scan mirror 4 scans the excitation light output from the first and second subunits 6a to 6b on the sample M by continuously changing the reflection angle, and emits fluorescence generated in response to the excitation light. , It has a role of guiding toward the first and second subunits 6a to 6b.
- the fixed mirror 5 is a light reflecting element fixed in the main housing 2, and reflects the excitation light output from the first to second subsystems 6a to 6b toward the scan mirror 4 to reflect the excitation light toward the scan mirror 4.
- the fluorescence reflected by is reflected toward the first and second subsystems 6a to 6b coaxially with the excitation light.
- the first subsystem 6a includes a base plate 8a, a dichroic mirror (first optical mirror) 9a arranged on the base plate 8a, a light source 10a, a collimating lens 15a, a dichroic mirror 11a, a barrier filter 16a, and a condensing lens. It has a 17a, a pinhole plate (first diaphragm member) 12a, and an optical detector (first optical detector) 13a.
- the dichroic mirror 9a is fixed in the fluorescence reflection direction of the fixed mirror 5, and the first excitation light of the wavelength ⁇ 1 irradiated by the first subsystem 6a and the first excitation light of the wavelength range ⁇ 1 generated from the sample M accordingly. It is a beam splitter having a property of reflecting the fluorescence of the above and transmitting light having a wavelength longer than that of the first excitation light and the first fluorescence.
- the dichroic mirror 11a is arranged in the reflection direction of the first fluorescent dichroic mirrors 9a, it passes through the first fluorescence wavelength range [Delta] [lambda] 1, reflects the first excitation light of a shorter wavelength lambda 1 than the wavelength range [Delta] [lambda] 1 It is a beam splitter that has the property of causing.
- the light source 10a is a light emitting element (for example, a laser diode) that outputs a first excitation light (for example, laser light) having a wavelength ⁇ 1 , and the first excitation light is coaxial with the first fluorescence by the dichroic mirror 11a. It is arranged so as to be reflected toward the dichroic mirror 9a.
- the collimating lens 15a converts the first excitation light output from the light source 10a into parallel light.
- the barrier filter 16a is a filter member provided adjacent to the dichroic mirror 11a and cuts noise light other than the first fluorescence transmitted by the dichroic mirror 11a.
- the condensing lens 17a concentrates the first fluorescence transmitted through the barrier filter 16a on the pinhole of the pinhole plate 12a.
- the pinhole plate 12a is a diaphragm member whose pinhole position coincides with the conjugate position of the spot of the first excitation light of the sample M and limits the light flux of the first fluorescence, and together with the light source 10a and the like. It constitutes a cofocal optical system.
- the pinhole plate 12a has a pinhole diameter that can be adjusted from the outside, and the resolution of the image detected by the photodetector 13a and the signal intensity of the image can be changed.
- the detection surface of the photodetector 13a is arranged to face the pinhole plate 12a, and receives and detects the first fluorescence that has passed through the pinhole plate 12a.
- the photodetector 13a is a photomultiplier tube, a photodiode, an avalanche photodiode, an MPPC (Multi-Pixel Photon Counter), an HPD (Hybrid Photo Detector), an area image sensor, or the like.
- the second subunit 6b has the same components as the first subunit 6a.
- the second subsystem 6b includes a base plate 8b, a dichroic mirror (second optical mirror) 9b, a light source 10b, a collimating lens 15b, a dichroic mirror 11b, a barrier filter 16b, a condensing lens 17b, and a pinhole plate ( It has a second diaphragm member) 12b and a light detector (second light detector) 13b.
- the dichroic mirror 9b reflects the second excitation light of the wavelength ⁇ 2 (> ⁇ 1 ) irradiated by the second subunit 6b and the second fluorescence of the wavelength range ⁇ 2 generated from the sample M accordingly, and the second It has the property of transmitting light having a wavelength longer than that of the second excitation light and the second fluorescence.
- the dichroic mirror 9b may be replaced with a simple reflection mirror having no wavelength selectivity.
- the dichroic mirror 11b passes through a second fluorescence wavelength range [Delta] [lambda] 2, has a property of reflecting the second excitation light of a shorter wavelength lambda 2 from the wavelength range [Delta] [lambda] 2.
- the light source 10b is a light emitting element that outputs a second excitation light having a wavelength of ⁇ 2 .
- the collimating lens 15b converts the second excitation light output from the light source 10b into parallel light.
- the barrier filter 16b is a filter member provided adjacent to the dichroic mirror 11b and cuts noise light other than the second fluorescence.
- the condensing lens 17b concentrates the second fluorescence transmitted through the barrier filter 16b on the pinhole of the pinhole plate 12b.
- the pinhole plate 12b is a diaphragm member whose pinhole position is arranged so as to coincide with the conjugate position of the second excitation light spot of the sample M and limits the light flux of the second fluorescence.
- the detection surface of the photodetector 13b is arranged to face the pinhole plate 12b, and receives and detects the second fluorescence that has passed through the pinhole plate 12b.
- the photodetector 13b is a photomultiplier tube, a photodiode, an avalanche photodiode, an MPPC (Multi-Pixel Photon Counter), an HPD (Hybrid Photo Detector), an area image sensor, or the like.
- the Z axis is taken in the direction along the optical axis of the scan lens 7
- the X axis is taken in the direction perpendicular to the Z axis and along the base plates 8a and 8b of the subunits 6a and 6b.
- the Y-axis shall be taken in the direction perpendicular to the axis and the X-axis.
- the first and second subunits 6a and 6b move away from the fixed mirror 5 in this order along the light guide direction (Z-axis direction) of the first and second fluorescence by the scan mirror 4 and the fixed mirror 5.
- the dichroic mirrors 9a and 9b are fixed on the base plate 14 constituting the main housing 2 so as to be arranged in line with each other and on the first and second fluorescence optical paths.
- the second subunit 6b is in a direction (X) substantially perpendicular to the light guide direction of the first fluorescence with respect to the first subunit 6a with reference to the center position of the dichroic mirrors 9a and 9b. It is arranged so as to shift in the axial direction).
- the installation angle of the dichroic mirror 9a is set so that the reflected first excitation light is incident on the center of the reflection surface of the scan mirror 4 via the fixed mirror 5.
- the installation angle of the dichroic mirror 9b is set so that the reflected second excitation light enters the center of the reflecting surface of the scan mirror 4 via the dichroic mirror 9a and the fixed mirror 5.
- the shift amount of the first and second subunits 6a and 6b in the X-axis direction and the installation angles of the two dichroic mirrors 9a and 9b are set so as to satisfy the following conditions. That is, the predetermined angle ⁇ S does not allow the Airy disk of the first excitation light spot incident on the sample M to overlap the Airy disk of the second excitation light spot incident on the sample M. It is set to be an angle.
- the exit pupils of the scan mirror 4 and the objective lens 52 are in a conjugate relationship, the light beams of the first and second excitation lights incident on the center of the reflection surface of the scan mirror 4 are emitted by the objective lens 52. It is incident on the center of the pupil. At that time, the angle of incidence on the objective lens 52 changes according to the imaging magnification of the scan lens 7. Since the objective lens 52 is a telecentric lens, the main rays of the first and second excitation lights are in the direction parallel to the optical axis of the objective lens 52 (Z-axis direction) on the sample M, and the angle of incidence on the exit pupil. The positions of the two excitation light spots shift on the sample M accordingly.
- the angle ⁇ S of the deviation of the incident angle to the scan mirror 4 is equal to or greater than the angle ⁇ Smin calculated by the following equation (3).
- ⁇ Smin arctan ( ⁇ d min / f) / mags... (3) It is calculated by.
- mags is the magnification of the scan lens 7
- f is the focal length of the objective lens 52.
- the diameters of the pinholes of the pinhole plates 12a and 12b of the subunits 6a and 6b are smaller than the values of the air unit (AU 1 , AU 2 ) calculated by the following equations (4) and (5).
- AU 1 mag t ⁇ ⁇ 1 ...
- AU 2 mag t ⁇ ⁇ 2 ... (5)
- mag t indicates the total magnification of the optical system for observing fluorescence.
- Figure 2 shows a first excitation light in the range S 1 and the distribution of the range S 2 of the second excitation light spot Airy disk Airy disks spot on the sample M which is formed by confocal microscopy 101
- FIG. 3 shows a one-dimensional light intensity distribution along the X-axis direction of each of the first excitation light and the second excitation light irradiated on the sample M by the confocal microscope 101.
- the range S 1 of the spot the first and second excitation light is focused on the sample M S 2 is such not to overlap each other, the intensity distribution of the two excitation light on the sample M Separation results in reduced interference between the fluorescence images in the two wavelength regions caused by the two excitation lights.
- the first excitation light output from the first subunit 6a is scanned onto the sample M via the scan mirror 4, and is generated from the sample M accordingly.
- the first fluorescence is incident on the first subunit 6a via the scan mirror 4, and the image is formed on the pinhole plate 12a in the first subunit 6a and detected by the photodetector 13a.
- the second excitation light output from the second subunit 6b is scanned onto the sample M via the scan mirror 4, and the second fluorescence generated from the sample M correspondingly is scanned by the scan mirror 4.
- the confocal microscope 101 is a confocal microscope including the above-mentioned confocal microscope unit 1A and a microscope 50 having a microscope optical system and a connection port P1 to which the confocal microscope unit 1A is attached. According to such a confocal microscope 101, confocal imaging can be easily performed using a microscope 50 which is a general optical microscope.
- the dichroic mirrors 9a and 9b are main so that the deviation of the incident angles of the first and second excitation lights on the scan mirror 4 is a predetermined angle ⁇ S. It is arranged in the housing 2. With such a configuration, the spots of the first and second excitation lights scanned on the sample M can be separated, and as a result, the first and second units 6a and 6b guided to the first and second subunits 6a and 6b can be separated. The beams of the second fluorescence can be separated from each other. This makes it possible to observe a plurality of fluorescent images with reduced bleed-through.
- a predetermined angle ⁇ S is set to an angle such that the Airy disk of the first excitation light and the Airy disk of the second excitation light are separated on the sample M. ..
- the spots of the first and second excitation lights scanned on the sample M can be completely separated.
- the first and second fluorescence beams guided by the first and second subunits 6a and 6b can be completely separated from each other. This makes it possible to observe a plurality of fluorescent images with reduced bleed-through.
- the MEMS mirror is adopted as the scan mirror 4. With such a configuration, the unit can be easily miniaturized.
- the first subunit 6a and the second subunit 6b are fixed to the main housing 2 in a state of being arranged in order along the light guide direction of fluorescence by the scan mirror 4. ing.
- the second excitation light emitted from the second subunit 6b can be emitted toward the sample M on the microscope 50 side via the first subunit 6a, and can be irradiated to the sample M.
- the second fluorescence generated from the sample M can be introduced into the second subunit 6b via the first subunit 6a.
- FIG. 4 is a schematic configuration diagram of the confocal microscope unit 1B according to the second embodiment.
- the confocal microscope unit 1B shown in FIG. 4 differs from the confocal microscope unit 1A of the first embodiment in that it has four subunits.
- the configuration of the confocal microscope unit 1B will be described focusing on the differences from the first embodiment.
- the confocal microscope unit 1B includes first to fourth subunits 6a to 6d in the main housing 2.
- the third subsystem 6c includes a base plate 8c, a dichroic mirror (third optical mirror) 9c, a light source 10c, a collimating lens 15c, a dichroic mirror 11c, a barrier filter 16c, a condensing lens 17c, and a pinhole plate (third). (Aperture member) 12c and a light detector (third light detector) 13c.
- the dichroic mirror 9c reflects the third excitation light of the wavelength ⁇ 3 (> ⁇ 2 ) irradiated by the third subsystem 6c and the third fluorescence of the wavelength range ⁇ 3 generated from the sample M accordingly. It has the property of transmitting light having a wavelength longer than that of the excitation light of No. 3 and the third fluorescence.
- the dichroic mirror 11c is transmitted through the third fluorescence having a wavelength range [Delta] [lambda] 3, has the property of reflecting the third pumping light having a wavelength shorter lambda 3 than the wavelength range [Delta] [lambda] 3.
- the light source 10c is a light emitting element that outputs a third excitation light having a wavelength of ⁇ 3 .
- the collimating lens 15c converts the third excitation light output from the light source 10c into parallel light.
- the barrier filter 16c is a filter member provided adjacent to the dichroic mirror 11c and cuts noise light other than the third fluorescence.
- the condensing lens 17c concentrates the third fluorescence transmitted through the barrier filter 16c on the pinhole of the pinhole plate 12c.
- the pinhole plate 12c is a diaphragm member whose pinhole position is arranged so as to coincide with the conjugate position of the third excitation light spot of the sample M and limits the light flux of the third fluorescence.
- the detection surface of the photodetector 13c is arranged to face the pinhole plate 12c, and receives and detects the third fluorescence that has passed through the pinhole plate 12c.
- the photodetector 13c is a photomultiplier tube, a photodiode, an avalanche photodiode, an MPPC (Multi-Pixel Photon Counter), an HPD (Hybrid Photo Detector), an area image sensor, or the like.
- the fourth subsystem 6d includes a base plate 8d, a total reflection mirror (fourth optical mirror) 9d, a light source 10d, a collimating lens 15d, a dichroic mirror 11d, a barrier filter 16d, a condensing lens 17d, and a pinhole plate (fourth). It has a diaphragm member (4) 12d and a light detector (fourth light detector) 13d.
- the total reflection mirror 9d reflects the fourth excitation light of the wavelength ⁇ 4 (> ⁇ 3 ) emitted by the fourth subunit 6d and the fourth fluorescence of the wavelength range ⁇ 4 generated from the sample M accordingly.
- the dichroic mirror 11d is transmitted through the fourth fluorescence wavelength range [Delta] [lambda] 4, have the property of reflecting the fourth pumping light wavelength shorter lambda 4 than the wavelength range [Delta] [lambda] 4.
- the light source 10d is a light emitting element that outputs a fourth excitation light having a wavelength of ⁇ 4 .
- the collimating lens 15d converts the fourth excitation light output from the light source 10d into parallel light.
- the barrier filter 16d is a filter member provided adjacent to the dichroic mirror 11d and cuts noise light other than the fourth fluorescence.
- the condensing lens 17d concentrates the fourth fluorescence transmitted through the barrier filter 16d on the pinhole of the pinhole plate 12d.
- the pinhole plate 12d is a diaphragm member whose pinhole position is arranged so as to coincide with the conjugate position of the fourth excitation light spot of the sample M and limits the luminous flux of the fourth fluorescence.
- the detection surface of the photodetector 13d is arranged to face the pinhole plate 12d, and receives and detects the fourth fluorescence that has passed through the pinhole plate 12d.
- the photodetector 13d is a photomultiplier tube, a photodiode, an avalanche photodiode, an MPPC (Multi-Pixel Photon Counter), an HPD (Hybrid Photo Detector), an area image sensor, or the like.
- the first to fourth subsystems 6a to 6d are directed away from the fixed mirror 5 in this order along the light guide direction (Z-axis direction) of the first to fourth fluorescence by the scan mirror 4 and the fixed mirror 5.
- the dichroic mirrors 9a to 9c and the total reflection mirrors 9d are fixed in the main housing 2 so as to be aligned with each other and on the first to fourth fluorescent light paths.
- the fourth subunit 6d is arranged so as to shift in the X-axis direction with respect to the third subunit 6c with respect to the center positions of the dichroic mirror 9c and the total reflection mirror 9d.
- the third and fourth subunits 6c and 6d are in the Y-axis direction with respect to the first and second subunits 6a and 6b with reference to the center positions of the dichroic mirrors 9a to 9c and the total reflection mirror 9d. It is also arranged to shift to. Further, the installation angles of the dichroic mirrors 9a to 9c and the total reflection mirror 9d are set so that the first to fourth excitation lights reflected by each of them are incident on the center of the reflection surface of the scan mirror 4. .. By arranging in this way, the incident angles of the two fluorescence incident on the scan mirror 4 from the two adjacent subunits are set so as to deviate from each other by a predetermined angle ⁇ S or more.
- FIG. 5 is a perspective view of the structure for shifting the arrangement of the third and fourth subunits 6c and 6d in the Y-axis direction as viewed from the lens barrel 3 side.
- a structure is adopted in which the flat spacer 21 is arranged on the base plate 14 of the main housing 2 and the third and fourth subunits 6c and 6d are mounted on the spacer 21.
- the third and fourth subunits 6c and 6d can be arranged by shifting the first and second subunits 6a and 6b by a desired width in the Y-axis direction.
- Figure 6 shows the locus of the light beam B 1 to B 4 of the first to fourth excitation light beam incident from the first to fourth sub-units 6a-6d in the confocal microscope unit 1B to the scan mirror 4
- Figure 7 shows the first to fourth pumping light distribution in the range S 1 to S 4 of the Airy disc of the spot on the sample M which is formed by the confocal microscope unit 1B.
- the outer edges of the luminous fluxes B 1 to B 4 of each excitation light beam are shown by solid lines, and the central BCs 1 to BC 4 of the luminous fluxes B 1 to B 4 of each excitation light beam are shown by a dashed line.
- the first to fourth excitation light beams are set to be incident on the center of the incident surface RF of the scan mirror 4, and the first to fourth excitation light beams are incident at different angles. It is set to shift in the two-dimensional direction. Further, since the deviation of the incident angles from each other is set to a predetermined angle ⁇ S or more, the ranges S 1 to S 4 of the airy disks of the first to fourth excitation light spots connected on the sample M overlap each other. It is set so that it does not become.
- the spots of the first to fourth excitation lights scanned on the sample M can be separated, and as a result, the first to fourth spots can be separated.
- the first to fourth fluorescence beams guided by the subunits 6a to 6d can be separated from each other. This makes it possible to observe the fluorescence image in a state where the bleed-through is reduced even if four kinds of excitation wavelengths are used.
- FIG. 8 is a schematic configuration diagram of the confocal microscope unit 1C according to the third embodiment.
- the confocal microscope unit 1C shown in FIG. 8 is different from the confocal microscope unit 1A of the first embodiment in that the arrangement of the dichroic mirrors 9a and 9b on the base plates 8a and 8b of the two subunits 6a and 6b is the same. different.
- the configuration of the confocal microscope unit 1C will be described focusing on the differences from the first embodiment.
- Elements other than the dichroic mirror 9a on the base plate 8a in the first subsystem 6a that is, a light source 10a, a collimating lens 15a, a dichroic mirror 11a, a barrier filter 16a, a condenser lens 17a, a pinhole plate 12a, and light detection.
- the arrangement of the elements including the vessel 13a based on the dichroic mirror 9a is such that the elements other than the dichroic mirror 9b on the base plate 8b in the second subsystem 6b, that is, the light source 10b, the collimating lens 15b, the dichroic mirror 11b, and the barrier.
- the arrangement of the elements including the filter 16b, the condensing lens 17b, the pinhole plate 12b, and the light detector 13b is adjusted to be different from the arrangement based on the dichroic mirror 9b.
- the elements other than the dichroic mirror 9a in the first subunit 6a or the elements other than the dichroic mirror 9b in the second subunit 6b are integrally formed on the base plates 8a and 8b. It is realized by making the posture and its position changeable.
- the incident angle / position of the second excitation light with respect to the dichroic mirror 9b in the unit 6b is the angle of incidence of the first excitation light on the scan mirror 4 and the angle of incidence of the second excitation light on the scan mirror 4. It is set so as to deviate from a predetermined angle ⁇ S.
- the incident angles of the excitation light on the first and second dichroic mirrors 9a and 9b in the first and second subunits 6a and 6b are set. Allows the spots of the first and second excitation lights scanned on the sample M to be separated, resulting in the first and second fluorescence guided to the first and second subunits 6a, 6b. Beams can be separated from each other. This makes it possible to observe fluorescence images at two fluorescence wavelengths with reduced bleed-through.
- a pinhole plate is used as a diaphragm member to form a confocal optical system, but the diaphragm member may be an optical element that limits the luminous flux, for example, a color diaphragm or a fiber core. You may.
- the position of the end face of the fiber core may be the diaphragm position (the position where the luminous flux is limited).
- a laser light source such as a solid-state laser or a diode laser can also be used.
- the position of the beam waist of these laser light sources may be set to the diaphragm position (the position where the luminous flux is limited), and the light source itself plays the role of a diaphragm member.
- a plurality of subunits are arranged in the direction away from the scan mirror 4 side in the order of the shortest wavelength range of the excitation light and the fluorescence to be handled, but they are arranged in the order of the longest wavelength range. You may.
- the characteristics of the dichroic mirrors 9a to 9c reflect the relatively long-wavelength excitation light and fluorescence handled by each of the subsystems 6a to 6c, and the relatively short-wavelength excitation light handled by the other subsystems. And the characteristics are set to transmit fluorescence.
- the spots of the excitation light formed on the sample M are not overlapped between the two subunits of all the subunits 6a to 6d, but between the adjacent subunits. It suffices if the spots are configured so that they do not overlap. For example, between the first subunit 6a and the second subunit 6b, between the second subunit 6b and the third subunit 6c, and between the third subunit 6c and the fourth subunit 6d. It suffices if the spots of the excitation light do not overlap with each other. On the other hand, the spots of excitation light overlap between the first subunit 6a and the third subunit 6c, or between the second subunit 6b and the fourth subunit 6d. May be good.
- the fluorescence of the observation target of one subunit and the fluorescence of the observation target of the other subunit can be easily separated by the dichroic mirror.
- the third and fourth subunits 6c and 6d are Y with respect to the first and second subunits 6a and 6b. It may be arranged without shifting in the axial direction. Even with such a configuration, since two spots of excitation light having close wavelength regions can be separated on the sample M, it is possible to prevent fluorescent beams in a plurality of detected wavelength ranges from affecting each other. It is possible to observe multiple fluorescent images with reduced bleed-through.
- the first subsystem has a first optical mirror that reflects the first excitation light and the first fluorescence and transmits the second excitation light and the second fluorescence.
- the second subsystem has a second optical mirror that reflects the second excitation light and the second fluorescence, and the first optical mirror and the second optical mirror are the first excitation light to the scan mirror.
- the incident angle of the light may be arranged in the main housing so as to deviate from the incident angle of the second excitation light to the scan mirror by a predetermined angle.
- the first subsystem has a first optical mirror that reflects the first excitation light and the first fluorescence and transmits the second excitation light and the second fluorescence, and has a second subsystem.
- the angle of incidence and the angle of incidence of the second excitation light on the second optical mirror are such that the angle of incidence of the first excitation light on the scan mirror is relative to the angle of incidence of the second excitation light on the scan mirror. It may be set so as to deviate from a predetermined angle.
- the spots of the first and second excitation lights scanned on the sample are separated by setting the angle of incidence of the excitation light on the first and second optical mirrors in the first and second subunits.
- the first and second fluorescence beams guided to the first and second subunits can be separated from each other. This makes it possible to observe a plurality of fluorescent images with reduced bleed-through.
- the above-mentioned predetermined angle is an angle such that the Airy disk of the first excitation light and the Airy disk of the second excitation light are separated on the sample.
- the spots of the first and second excitation lights scanned on the sample can be completely separated, and as a result, the first and second subunits guided to the first and second subunits can be separated.
- the beams of the second fluorescence can be completely separated from each other. This makes it possible to observe a plurality of fluorescent images in the absence of bleed-through.
- the scan mirror may be a MEMS mirror.
- the device can be easily miniaturized.
- first subunit and the second subunit are arranged in the main housing in the order of the first subunit and the second subunit along the light guide direction of fluorescence by the scan mirror. It may be fixed. According to such a configuration, the second excitation light emitted from the second subunit can be emitted toward the sample on the microscope side via the first subunit, and from the sample accordingly. The resulting second fluorescence can be introduced into the second subunit via the first subunit. As a result, it is possible to reduce the size of the device that realizes imaging in a plurality of wavelength regions.
- the embodiment uses a confocal microscope unit and a confocal microscope that constitute a confocal microscope, and can realize fluorescence imaging by multiple fluorescence in a state where bleed-through is reduced by a simple configuration.
- M ... sample, P1 ... connection port, ⁇ S ... predetermined angle, 10a to 10d ... light source, 12a to 12d ... pinhole plate (aperture member), 13a to 13d ... optical detector, 6a to 6d ... first to first Subunits of 4, 9a to 9c ... Dycroic mirrors (1st to 3rd optical mirrors), 9d ... Total reflection mirrors (4th optical mirrors), 1A, 1B, 1C ... Confocal microscope unit, 2 ... Main case Body, 3 ... lens barrel, 4 ... scan mirror, 7 ... scan lens, 50 ... microscope, 101 ... confocal microscope.
Landscapes
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Microscoopes, Condenser (AREA)
Abstract
実施形態にかかる共焦点顕微鏡ユニット1Aは、光源10a、ピンホール板12a、及び、光検出器13aを有する第1のサブユニット6aと、光源10b、ピンホール板12b、及び、光検出器13bを有する第2のサブユニット6bと、第1及び第2のサブユニット6a,6bから出力された励起光を、顕微鏡光学系を経由して試料M上を走査させ、励起光に応じて試料Mから生じて顕微鏡光学系によって結像された蛍光を第1及び第2のサブユニット6a,6bに向けて導くスキャンミラー4と、接続ポートP1に取り付け可能に構成され、スキャンミラー4、第1のサブユニット6a、及び第2のサブユニット6bが固定されたメイン筐体2と、を備え、第1のサブユニット6a及び第2のサブユニット6bは、スキャンミラー4への2つの励起光の入射角が、所定の角度θSずれるように、メイン筐体2内に配置される。
Description
本開示は、共焦点顕微鏡を構成する共焦点顕微鏡ユニット及び共焦点顕微鏡に関する。
従来から、観察対象の標本の光学断層像を高解像度で得ることが可能な共焦点顕微鏡が知られている。例えば、下記特許文献1には、顕微鏡に接続される顕微鏡接続ポートと、標本に光を照射する刺激ユニットと、標本から発せられる光を検出する観察ユニットと、顕微鏡と刺激ユニット及び観察ユニットとを光学的に接続する光路を合成する光路合成部とを備える顕微鏡接続ユニットが開示されている。この顕微鏡接続ユニットは、複数の光源から発せられた光を導く光学系、それに応じて発生した蛍光を複数波長ごとに検出するためのダイクロイックミラー、共焦点ピンホール、及び光電子増倍管を、同一の観察ユニット内に有している。このような構成では、複数の波長の励起光を用いてそれに応じて生じる蛍光を検出することにより、同一の装置で複数波長領域でのイメージングが実現される。
また、異なる波長の励起光を用いて蛍光サンプルを画像化する装置としては、下記特許文献2に記載のレーザスキャナ装置も知られている。このレーザスキャナ装置によれば、サンプルに集光される波長の異なる2つのレーザビームが空間的に分離され、それらのレーザビームによって誘起された2つの発光ビームも空間的に分離されて2つの検出器に向けて導光される。
蛍光物質が発する蛍光の波長分布は、一般的に広いため、複数の蛍光物質を含んだサンプルを観察する場合、それぞれの蛍光物質から発せられる蛍光の波長分布が重複することがある。このようなサンプルから発せられる蛍光を同時に検出する際に、目的とした蛍光物質からの蛍光だけでなく、他の蛍光物質からの蛍光も同じ検出器で検出してしまう問題がある。一般的に、このような問題をブリードスルー(Bleed Through)という。
引用文献2に記載のレーザスキャナ装置では、ウェッジ形状のダイクロイックミラーを用いて複数の蛍光を空間的に分離させて検出することで、ブリードスルーを低減しているが、スキャンミラーを用いた共焦点顕微鏡には応用が難しい。
実施形態は、かかる課題に鑑みてなされたものであり、簡易な構成により複数波長領域でのブリードスルーの少ない蛍光イメージングを可能にする共焦点顕微鏡ユニットを提供することを課題とする。
本開示の一形態に係る共焦点顕微鏡ユニットは、顕微鏡光学系を有する顕微鏡の接続ポートに取り付けられることにより、共焦点顕微鏡を構成する共焦点顕微鏡ユニットであって、第1の励起光を出力する光源、第1の励起光に応じて観察対象の試料から生じる第1の蛍光の光束を制限する第1の絞り部材、及び、第1の絞り部材を通過した第1の蛍光を検出する第1の光検出器を有する第1のサブユニットと、第2の励起光を出力する光源、第2の励起光に応じて試料から生じる第2の蛍光の光束を制限する第2の絞り部材、及び、第2の絞り部材を通過した第2の蛍光を検出する第2の光検出器を有する第2のサブユニットと、第1及び第2のサブユニットから出力された励起光を、顕微鏡光学系を経由して試料上を走査させ、励起光に応じて試料から生じる蛍光を第1及び第2のサブユニットに向けて導くスキャンミラーと、接続ポートに取り付け可能に構成され、スキャンミラー、第1のサブユニット、及び第2のサブユニットが固定されたメイン筐体と、を備え、第1のサブユニット及び第2のサブユニットは、スキャンミラーへの第1の励起光の入射角が、スキャンミラーへの第2の励起光の入射角に対して所定の角度ずれるように、メイン筐体内に配置される。
上記一形態によれば、第1のサブユニットから出力された第1の励起光がスキャンミラーを経由して試料上に走査され、それに応じて試料上から生じた第1の蛍光がスキャンミラーを経由して第1のサブユニット内に入射し、第1のサブユニット内の第1の絞り部材にその像が結ばれて第1の光検出器で検出される。加えて、第2のサブユニットから出力された第2の励起光がスキャンミラーを経由して試料上に走査され、それに応じて試料上から生じた第2の蛍光がスキャンミラーを経由して第2のサブユニット内に入射し、第2のサブユニット内の第2の絞り部材にその像が結ばれて第2の光検出器で検出される。ここで、これらのスキャンミラー、第1及び第2のサブユニットは、メイン筐体に固定されており、第1及び第2のサブユニットからスキャンミラーへの第1及び第2の励起光の入射角が互いに所定の角度ずらされているので、試料上に走査される第1及び第2の励起光のスポットを分離することができ、その結果、第1及び第2のサブユニットに導かれる第1及び第2の蛍光のビームを互いに分離することができる。これにより、ブリードスルーを低減した状態で複数の蛍光像の観察が可能にされる。加えて、スキャンミラーにより試料をスキャンする構成を採用することにより、全体の装置構成を簡素化することができる。
あるいは、本開示の他の形態は、上述の共焦点顕微鏡ユニットと、顕微鏡光学系及び共焦点顕微鏡ユニットが取り付けられる接続ポートを有する顕微鏡を備える共焦点顕微鏡である。このような共焦点顕微鏡によれば、所望の励起波長及び蛍光波長における共焦点イメージングを容易に行うことができる。
本開示の一側面によれば、簡易な構成によりブリードスルーを低減した状態で複数蛍光による蛍光イメージングを実現することができる。
以下、添付図面を参照して、本開示の実施形態について詳細に説明する。なお、説明において、同一要素又は同一機能を有する要素には、同一符号を用いることとし、重複する説明は省略する。
[第1実施形態]
図1は、第1実施形態にかかる共焦点顕微鏡101の概略構成図である。図1に示す共焦点顕微鏡101は、観察対象の試料Mの光学断層像の構築を可能とする画像を取得する共焦点顕微鏡を構成し、共焦点顕微鏡ユニット1Aが顕微鏡50の外部ユニット接続用の接続ポートP1に接続されて構成される。第1実施形態にかかる共焦点顕微鏡ユニット1Aは、顕微鏡50内の結像レンズ51、対物レンズ52等の顕微鏡光学系を経由して、顕微鏡50のステージ上等に配置された試料Mに励起光を照射し、その励起光に応じて試料Mから生じた蛍光を、顕微鏡50の顕微鏡光学系を経由して結像および受光(検出)して光学的断層像を生成して出力する装置である。
詳細には、共焦点顕微鏡ユニット1Aは、メイン筐体2と、メイン筐体2の一部を構成し、顕微鏡50の接続ポートP1に着脱可能に接続される鏡筒3と、メイン筐体2内に固定されたスキャンミラー4、固定ミラー5、第1~第2のサブユニット6a~6bと、鏡筒3内に固定されたスキャンレンズ7とを含んで構成される。以下、共焦点顕微鏡ユニット1Aの各構成要素について詳細に説明する。
鏡筒3内のスキャンレンズ7は、スキャンミラー4の反射面を対物レンズ52の瞳位置にリレーすると同時に、顕微鏡50の顕微鏡光学系の1次結像面にスポットを結ぶ機能を有する光学素子である。これにより、スキャンミラー4と対物レンズ52の射出瞳は共役関係つまり結像関係となる。スキャンレンズ7は、スキャンミラー4によって走査された励起光を顕微鏡光学系に導光することにより試料Mに照射させ、それに応じて試料Mから生じた蛍光をスキャンミラー4に導光する。
メイン筐体2内のスキャンミラー4は、例えば、反射板を2軸で傾動可能に構成されたMEMS(Micro Electro Mechanical System)ミラー等の光走査素子である。スキャンミラー4は、反射角度を連続的に変更することにより、第1~第2のサブユニット6a~6bから出力された励起光を試料M上に走査させ、その励起光に応じて生じる蛍光を、第1~第2のサブユニット6a~6bに向けて導く役割を有する。
固定ミラー5は、メイン筐体2内に固定された光反射素子であり、第1~第2のサブユニット6a~6bから出力された励起光をスキャンミラー4に向けて反射させ、スキャンミラー4で反射された蛍光を励起光と同軸で第1~第2のサブユニット6a~6bに向けて反射する。
第1のサブユニット6aは、ベース板8aと、ベース板8a上に配置されたダイクロイックミラー(第1の光学ミラー)9a、光源10a、コリメートレンズ15a、ダイクロイックミラー11a、バリアフィルタ16a、集光レンズ17a、ピンホール板(第1の絞り部材)12a、及び光検出器(第1の光検出器)13aとを有する。
ダイクロイックミラー9aは、固定ミラー5の蛍光の反射方向に固定され、第1のサブユニット6aが照射する波長λ1の第1の励起光及びそれに応じて試料Mから生じる波長範囲Δλ1の第1の蛍光を反射し、第1の励起光及び第1の蛍光よりも長波長の光を透過させる性質を有するビームスプリッタである。ダイクロイックミラー11aは、ダイクロイックミラー9aの第1の蛍光の反射方向に設けられ、波長範囲Δλ1の第1の蛍光を透過し、波長範囲Δλ1より短い波長λ1の第1の励起光を反射させる性質を有するビームスプリッタである。光源10aは、波長λ1の第1の励起光(例えば、レーザ光)を出力する発光素子(例えば、レーザダイオード)であり、第1の励起光がダイクロイックミラー11aによって第1の蛍光と同軸でダイクロイックミラー9aに向けて反射されるように配置される。コリメートレンズ15aは、光源10aから出力された第1の励起光を平行光に変換する。
バリアフィルタ16aは、ダイクロイックミラー11aに隣接して設けられ、ダイクロイックミラー11aによって透過された第1の蛍光以外のノイズ光をカットするフィルタ部材である。集光レンズ17aは、バリアフィルタ16aを透過した第1の蛍光をピンホール板12aのピンホールに集光する。ピンホール板12aは、そのピンホール位置が試料Mの第1の励起光のスポットの共役位置に一致するように配置され、第1の蛍光の光束を制限する絞り部材であり、光源10a等とともに共焦点光学系を構成する。このピンホール板12aは、ピンホールの径を外部から調整可能にされ、光検出器13aによって検出される画像の解像度と画像の信号強度を変更可能とする。
光検出器13aは、その検出面がピンホール板12aに対向して配置され、ピンホール板12aを通過した第1の蛍光を受光および検出する。なお、光検出器13aは、光電子増倍管、フォトダイオード、アバランシェフォトダイオード、MPPC(Multi-Pixel Photon Counter)、HPD(Hybrid Photo Detector)、或いはエリアイメージセンサ等である。
第2のサブユニット6bは、第1のサブユニット6aと同様な構成要素を有する。
すなわち、第2のサブユニット6bは、ベース板8bと、ダイクロイックミラー(第2の光学ミラー)9b、光源10b、コリメートレンズ15b、ダイクロイックミラー11b、バリアフィルタ16b、集光レンズ17b、ピンホール板(第2の絞り部材)12b、及び光検出器(第2の光検出器)13bとを有する。
ダイクロイックミラー9bは、第2のサブユニット6bが照射する波長λ2(>λ1)の第2の励起光及びそれに応じて試料Mから生じる波長範囲Δλ2の第2の蛍光を反射し、第2の励起光及び第2の蛍光よりも長波長の光を透過させる性質を有する。なお、このダイクロイックミラー9bは、波長選択性を有さない単なる反射ミラーに置換されてもよい。ダイクロイックミラー11bは、波長範囲Δλ2の第2の蛍光を透過し、波長範囲Δλ2より短い波長λ2の第2の励起光を反射させる性質を有する。光源10bは、波長λ2の第2の励起光を出力する発光素子である。コリメートレンズ15bは、光源10bから出力された第2の励起光を平行光に変換する。
バリアフィルタ16bは、ダイクロイックミラー11bに隣接して設けられ、第2の蛍光以外のノイズ光をカットするフィルタ部材である。集光レンズ17bは、バリアフィルタ16bを透過した第2の蛍光をピンホール板12bのピンホールに集光する。ピンホール板12bは、そのピンホール位置が試料Mの第2の励起光のスポットの共役位置に一致するように配置され、第2の蛍光の光束を制限する絞り部材である。
光検出器13bは、その検出面がピンホール板12bに対向して配置され、ピンホール板12bを通過した第2の蛍光を受光および検出する。なお、光検出器13bは、光電子増倍管、フォトダイオード、アバランシェフォトダイオード、MPPC(Multi-Pixel Photon Counter)、HPD(Hybrid Photo Detector)、或いはエリアイメージセンサ等である。
上記構成の第1~第2のサブユニット6a~6bの配置について説明する。以下の説明では、スキャンレンズ7の光軸に沿った方向にZ軸をとり、Z軸に垂直で、かつサブユニット6a,6bのベース板8a,8bに沿った方向にX軸をとり、Z軸及びX軸に垂直な方向にY軸をとるものとする。
第1及び第2のサブユニット6a,6bは、スキャンミラー4及び固定ミラー5による第1及び第2の蛍光の導光方向(Z軸方向)に沿って、この順番で固定ミラー5から離れる方向に並ぶように、かつ、第1及び第2の蛍光の光路上にダイクロイックミラー9a,9bが位置するように、メイン筐体2を構成するベース板14上に固定されている。詳細には、第2のサブユニット6bは、第1のサブユニット6aに対して、ダイクロイックミラー9a,9bの中心位置を基準にして、第1の蛍光の導光方向に略垂直な方向(X軸方向)にシフトするように、配置されている。さらに、ダイクロイックミラー9aは、反射する第1の励起光が固定ミラー5を経由してスキャンミラー4の反射面の中心に入射するように、その設置角が設定されている。同様に、ダイクロイックミラー9bは、反射する第2の励起光がダイクロイックミラー9a及び固定ミラー5を経由してスキャンミラー4の反射面の中心に入射するように、その設置角が設定されている。このように配置されることにより、第1の励起光のスキャンミラー4への入射角が、第2の励起光のスキャンミラー4への入射角に対して所定の角度θSずれるように設定される。
上記の第1及び第2のサブユニット6a,6bのX軸方向のシフト量、及び、2つのダイクロイックミラー9a,9bの設置角は、次の条件を満たすように設定される。つまり、上記の所定の角度θSが、試料M上に入射する第1の励起光のスポットのエアリディスクが、試料M上に入射する第2の励起光のスポットのエアリディスクに重ならないような角度となるように設定される。一般に、エアリディスクの径φは、入射する励起光の波長をλと仮定し、対物レンズ52の開口数をNAと仮定すると、下記式(1);
φ=1.22×λ/NA …(1)
により計算される。そのため、2つの励起光のスポットが重ならないようにするための試料M上の第1及び第2の励起光のスポット間のずらし量Δdの最小値Δdminは、下記式(2);
Δdmin=φ1/2+φ2/2,
φ1=1.22×λ1/NA,
φ2=1.22×λ2/NA …(2)
で計算できる。
φ=1.22×λ/NA …(1)
により計算される。そのため、2つの励起光のスポットが重ならないようにするための試料M上の第1及び第2の励起光のスポット間のずらし量Δdの最小値Δdminは、下記式(2);
Δdmin=φ1/2+φ2/2,
φ1=1.22×λ1/NA,
φ2=1.22×λ2/NA …(2)
で計算できる。
ここで、スキャンミラー4と対物レンズ52の射出瞳は共役の関係にあるので、スキャンミラー4の反射面の中心に入射する第1及び第2の励起光のそれぞれの光束は対物レンズ52の射出瞳中心に入射する。その際に、対物レンズ52への入射角は、スキャンレンズ7の結像倍率に従って変わる。対物レンズ52はテレセントリックレンズであるため、試料M上においては第1及び第2の励起光の主光線が対物レンズ52の光軸に平行な方向(Z軸方向)となり、射出瞳への入射角に応じて2つの励起光のスポットの位置が試料M上でシフトする。この2つの励起光のスポットが試料M上で重ならないようにするために、スキャンミラー4への入射角のずれの角度θSが、下記式(3)によって計算される角度θSmin以上となるように設定される。
θSmin=arctan(Δdmin/f)/mags …(3)
で計算される。なお、magsはスキャンレンズ7の倍率、fは対物レンズ52の焦点距離である。
θSmin=arctan(Δdmin/f)/mags …(3)
で計算される。なお、magsはスキャンレンズ7の倍率、fは対物レンズ52の焦点距離である。
また、各サブユニット6a,6bのピンホール板12a、12bのピンホールの径は、下記式(4)及び下記式(5)により計算されるエアリユニット(AU1,AU2)の値より小さく設定される。このように設定することで、蛍光像における波長間のクロストークを有効に防ぐことができる。
AU1=magt×φ1 …(4)
AU2=magt×φ2 …(5)
ここで、magtは、蛍光を観察するための光学系のトータルの倍率を示す。
AU1=magt×φ1 …(4)
AU2=magt×φ2 …(5)
ここで、magtは、蛍光を観察するための光学系のトータルの倍率を示す。
図2には、共焦点顕微鏡101により形成される試料M上の第1の励起光のスポットのエアリディスクの範囲S1及び第2の励起光のスポットのエアリディスクの範囲S2の分布を示し、図3には、共焦点顕微鏡101により試料M上に照射される第1の励起光及び第2の励起光のそれぞれのX軸方向に沿った一次元の光強度分布を示している。このように、試料M上に結ばれる第1及び第2の励起光のスポットの範囲S1,S2が互いに重ならないようにされることで、試料M上における2つの励起光の強度分布が分離され、その結果、2つの励起光によって生じる2つの波長域の蛍光像間の干渉が低減されることになる。
以上説明した共焦点顕微鏡ユニット1Aによれば、第1のサブユニット6aから出力された第1の励起光がスキャンミラー4を経由して試料M上に走査され、それに応じて試料M上から生じた第1の蛍光がスキャンミラー4を経由して第1のサブユニット6a内に入射し、第1のサブユニット6a内のピンホール板12aにその像が結ばれて光検出器13aで検出される。加えて、第2のサブユニット6bから出力された第2の励起光がスキャンミラー4を経由して試料M上に走査され、それに応じて試料M上から生じた第2の蛍光がスキャンミラー4を経由して第2のサブユニット6b内に入射し、第2のサブユニット6b内のピンホール板12bにその像が結ばれて光検出器13bで検出される。ここで、これらのスキャンミラー4、第1及び第2のサブユニット6a,6bは、メイン筐体2に固定されており、第1及び第2のサブユニット6a,6bからスキャンミラー4への第1及び第2の励起光の入射角が互いに所定の角度θSずらされているので、試料M上に走査される第1及び第2の励起光のスポットを分離することができ、その結果、第1及び第2のサブユニット6a,6bに導かれる第1及び第2の蛍光のビームを互いに分離することができる。これにより、ブリードスルーを低減した状態で複数の蛍光像の観察が可能にされる。加えて、スキャンミラー4により試料Mをスキャンする構成を採用することにより、全体の装置構成を簡素化することができる。
あるいは、共焦点顕微鏡101は、上述の共焦点顕微鏡ユニット1Aと、顕微鏡光学系及び共焦点顕微鏡ユニット1Aが取り付けられる接続ポートP1を有する顕微鏡50を備える共焦点顕微鏡である。このような共焦点顕微鏡101によれば、一般的な光学顕微鏡である顕微鏡50を用いて、共焦点イメージングを容易に行うことができる。
上記実施形態にかかる共焦点顕微鏡ユニット1Aにおいては、ダイクロイックミラー9a,9bが、スキャンミラー4への第1及び第2の励起光の入射角のずれが所定の角度θSとなるように、メイン筐体2内に配置されている。このような構成により、試料M上に走査される第1及び第2の励起光のスポットを分離することができ、その結果、第1及び第2のサブユニット6a,6bに導かれる第1及び第2の蛍光のビームを互いに分離することができる。これにより、ブリードスルーを低減した状態で複数の蛍光像の観察が可能にされる。
また、共焦点顕微鏡ユニット1Aにおいては、所定の角度θSが試料M上において第1の励起光のエアリディスクと第2の励起光のエアリディスクとが分離されるような角度に設定されている。このような角度設定により、試料M上に走査される第1及び第2の励起光のスポットを完全に分離することができる。その結果、第1及び第2のサブユニット6a,6bに導かれる第1及び第2の蛍光のビームを互いに完全に分離することができる。これにより、ブリードスルーを低減した状態で複数の蛍光像の観察が可能にされる。
上記実施形態においては、スキャンミラー4はMEMSミラーが採用されている。このような構成により、ユニットの小型化を容易に実現することができる。
また、共焦点顕微鏡ユニット1Aにおいては、第1のサブユニット6aと第2のサブユニット6bとは、スキャンミラー4による蛍光の導光方向に沿って順に並んだ状態でメイン筐体2に固定されている。このような構成により、第2のサブユニット6bから照射された第2の励起光を、第1のサブユニット6aを経由して顕微鏡50側の試料Mに向けて照射することができるとともに、それに応じて試料Mから生じる第2の蛍光を、第1のサブユニット6aを経由して第2のサブユニット6b内に導入することできる。その結果、複数波長領域での共焦点イメージングを実現するユニットの小型化が可能となる。
[第2実施形態]
図4は、第2実施形態にかかる共焦点顕微鏡ユニット1Bの概略構成図である。図4に示す共焦点顕微鏡ユニット1Bは、4つのサブユニットを有する点が第1実施形態の共焦点顕微鏡ユニット1Aと異なる。以下、共焦点顕微鏡ユニット1Bの構成について、第1実施形態との相違点を中心に説明する。
図4は、第2実施形態にかかる共焦点顕微鏡ユニット1Bの概略構成図である。図4に示す共焦点顕微鏡ユニット1Bは、4つのサブユニットを有する点が第1実施形態の共焦点顕微鏡ユニット1Aと異なる。以下、共焦点顕微鏡ユニット1Bの構成について、第1実施形態との相違点を中心に説明する。
すなわち、共焦点顕微鏡ユニット1Bは、メイン筐体2内に第1~第4のサブユニット6a~6dを備えている。
第3のサブユニット6cは、ベース板8cと、ダイクロイックミラー(第3の光学ミラー)9c、光源10c、コリメートレンズ15c、ダイクロイックミラー11c、バリアフィルタ16c、集光レンズ17c、ピンホール板(第3の絞り部材)12c、及び光検出器(第3の光検出器)13cとを有する。
ダイクロイックミラー9cは、第3のサブユニット6cが照射する波長λ3(>λ2)の第3の励起光及びそれに応じて試料Mから生じる波長範囲Δλ3の第3の蛍光を反射し、第3の励起光及び第3の蛍光よりも長波長の光を透過させる性質を有する。ダイクロイックミラー11cは、波長範囲Δλ3の第3の蛍光を透過し、波長範囲Δλ3より短い波長λ3の第3の励起光を反射させる性質を有する。光源10cは、波長λ3の第3の励起光を出力する発光素子である。コリメートレンズ15cは、光源10cから出力された第3の励起光を平行光に変換する。
バリアフィルタ16cは、ダイクロイックミラー11cに隣接して設けられ、第3の蛍光以外のノイズ光をカットするフィルタ部材である。集光レンズ17cは、バリアフィルタ16cを透過した第3の蛍光をピンホール板12cのピンホールに集光する。ピンホール板12cは、そのピンホール位置が試料Mの第3の励起光のスポットの共役位置に一致するように配置され、第3の蛍光の光束を制限する絞り部材である。
光検出器13cは、その検出面がピンホール板12cに対向して配置され、ピンホール板12cを通過した第3の蛍光を受光および検出する。なお、光検出器13cは、光電子増倍管、フォトダイオード、アバランシェフォトダイオード、MPPC(Multi-Pixel Photon Counter)、HPD(Hybrid Photo Detector)、或いはエリアイメージセンサ等である。
第4のサブユニット6dは、ベース板8dと、全反射ミラー(第4の光学ミラー)9d、光源10d、コリメートレンズ15d、ダイクロイックミラー11d、バリアフィルタ16d、集光レンズ17d、ピンホール板(第4の絞り部材)12d、及び光検出器(第4の光検出器)13dとを有する。
全反射ミラー9dは、第4のサブユニット6dが照射する波長λ4(>λ3)の第4の励起光及びそれに応じて試料Mから生じる波長範囲Δλ4の第4の蛍光を反射する。ダイクロイックミラー11dは、波長範囲Δλ4の第4の蛍光を透過し、波長範囲Δλ4より短い波長λ4の第4の励起光を反射させる性質を有する。光源10dは、波長λ4の第4の励起光を出力する発光素子である。コリメートレンズ15dは、光源10dから出力された第4の励起光を平行光に変換する。
バリアフィルタ16dは、ダイクロイックミラー11dに隣接して設けられ、第4の蛍光以外のノイズ光をカットするフィルタ部材である。集光レンズ17dは、バリアフィルタ16dを透過した第4の蛍光をピンホール板12dのピンホールに集光する。ピンホール板12dは、そのピンホール位置が試料Mの第4の励起光のスポットの共役位置に一致するように配置され、第4の蛍光の光束を制限する絞り部材である。
光検出器13dは、その検出面がピンホール板12dに対向して配置され、ピンホール板12dを通過した第4の蛍光を受光および検出する。なお、光検出器13dは、光電子増倍管、フォトダイオード、アバランシェフォトダイオード、MPPC(Multi-Pixel Photon Counter)、HPD(Hybrid Photo Detector)、或いはエリアイメージセンサ等である。
第1~第4のサブユニット6a~6dは、スキャンミラー4及び固定ミラー5による第1~第4の蛍光の導光方向(Z軸方向)に沿って、この順番で固定ミラー5から離れる方向に並ぶように、かつ、第1~第4の蛍光の光路上にダイクロイックミラー9a~9c及び全反射ミラー9dが位置するように、メイン筐体2内に固定される。詳細には、第4のサブユニット6dは、第3のサブユニット6cに対して、ダイクロイックミラー9c及び全反射ミラー9dの中心位置を基準に、X軸方向にシフトするように配置されている。また、第3及び第4のサブユニット6c,6dは、第1及び第2のサブユニット6a,6bに対して、ダイクロイックミラー9a~9c及び全反射ミラー9dの中心位置を基準に、Y軸方向にシフトするようにも配置されている。さらに、ダイクロイックミラー9a~9c及び全反射ミラー9dは、それぞれが反射する第1~第4の励起光がスキャンミラー4の反射面の中心に入射するように、それぞれの設置角が設定されている。このように配置されることにより、隣接する2つのサブユニットからスキャンミラー4に入射する2つの蛍光の入射角が、互いに所定の角度θS以上ずれるように設定される。
図5は、第3及び第4のサブユニット6c,6dの配置をY軸方向にシフトさせるための構造を、鏡筒3側から見た透視図である。このように、本実施形態では、メイン筐体2のベース板14上に平板状のスペーサ21を配置し、そのスペーサ21上に第3及び第4のサブユニット6c,6dを搭載する構造を採用する。このような構造により、第3及び第4のサブユニット6c,6dを第1及び第2のサブユニット6a,6bに対してY軸方向に所望の幅だけシフトさせて配置することができる。
図6には、共焦点顕微鏡ユニット1Bにおける第1~第4のサブユニット6a~6dからスキャンミラー4に入射する第1~第4の励起光ビームの光束B1~B4の軌跡を示し、図7には、共焦点顕微鏡ユニット1Bにより形成される試料M上の第1~第4の励起光のスポットのエアリディスクの範囲S1~S4の分布を示している。図6には、各励起光ビームの光束B1~B4の外縁を実線で示し、各励起光ビームの光束B1~B4の中心BC1~BC4を一点鎖線で示している。共焦点顕微鏡ユニット1Bによれば、第1~第4の励起光ビームがスキャンミラー4の入射面RFの中心に入射するように設定され、第1~第4の励起光ビームが互いに入射角が2次元方向にずれるように設定される。また、互いの入射角のずれが所定の角度θS以上とされることにより、試料M上に結ばれる第1~第4の励起光のスポットのエアリディスクの範囲S1~S4が互いに重ならないように設定される。
上記の第2実施形態に係る共焦点顕微鏡ユニット1Bによれば、試料M上に走査される第1~第4の励起光のスポットを分離することができ、その結果、第1~第4のサブユニット6a~6dに導かれる第1~第4の蛍光のビームを互いに分離することができる。これにより、4種類の励起波長を用いてもブリードスルーを低減した状態で蛍光像の観察が可能にされる。
[第3実施形態]
図8は、第3実施形態にかかる共焦点顕微鏡ユニット1Cの概略構成図である。図8に示す共焦点顕微鏡ユニット1Cは、2つのサブユニット6a,6bのベース板8a,8b上におけるダイクロイックミラー9a,9bの配置が同一である点で第1実施形態の共焦点顕微鏡ユニット1Aと異なる。以下、共焦点顕微鏡ユニット1Cの構成について、第1実施形態との相違点を中心に説明する。
図8は、第3実施形態にかかる共焦点顕微鏡ユニット1Cの概略構成図である。図8に示す共焦点顕微鏡ユニット1Cは、2つのサブユニット6a,6bのベース板8a,8b上におけるダイクロイックミラー9a,9bの配置が同一である点で第1実施形態の共焦点顕微鏡ユニット1Aと異なる。以下、共焦点顕微鏡ユニット1Cの構成について、第1実施形態との相違点を中心に説明する。
第1のサブユニット6a内のベース板8a上におけるダイクロイックミラー9a以外の要素、すなわち、光源10a、コリメートレンズ15a、ダイクロイックミラー11a、バリアフィルタ16a、集光レンズ17a、ピンホール板12a、及び光検出器13aを含む要素のダイクロイックミラー9aを基準にした配置が、第2のサブユニット6b内のベース板8b上におけるダイクロイックミラー9b以外の要素、すなわち、光源10b、コリメートレンズ15b、ダイクロイックミラー11b、バリアフィルタ16b、集光レンズ17b、ピンホール板12b、及び光検出器13bを含む要素のダイクロイックミラー9bを基準にした配置と異なるように調整されている。この調整は、例えば、第1のサブユニット6a内のダイクロイックミラー9a以外の要素、あるいは、第2のサブユニット6b内のダイクロイックミラー9b以外の要素が、ベース板8a,8b上で一体的にその姿勢及びその位置を変更可能にされることで実現される。
詳細には、第1及び第2のサブユニット6a,6bの上記構成により、第1のサブユニット6a内におけるダイクロイックミラー9aに対する第1の励起光の入射角・入射位置、及び、第2のサブユニット6b内におけるダイクロイックミラー9bに対する第2の励起光の入射角・入射位置が、第1の励起光のスキャンミラー4への入射角と第2の励起光のスキャンミラー4への入射角とが所定の角度θSずれるように、設定される。
上記の第2実施形態に係る共焦点顕微鏡ユニット1Cによれば、第1及び第2のサブユニット6a,6bにおける第1及び第2のダイクロイックミラー9a,9bに対する励起光の入射角を設定することにより、試料M上に走査される第1及び第2の励起光のスポットを分離することができ、その結果、第1及び第2のサブユニット6a,6bに導かれる第1及び第2の蛍光のビームを互いに分離することができる。これにより、ブリードスルーを低減した状態で2つの蛍光波長における蛍光像の観察が可能にされる。
以上、本開示の種々の実施形態について説明したが、本開示は上記実施形態に限定されるものではなく、各請求項に記載した要旨を変更しない範囲で変形し、又は他のものに適用したものであってもよい。
上記実施形態は、共焦点光学系を構成するために絞り部材としてピンホール板を用いているが、絞り部材は光束を制限する光学素子であればよく、例えば、色彩絞りやファイバコアなどであってもよい。ファイバ出力タイプの光源を用いる場合、ファイバコア端面の位置を絞り位置(光束が制限される位置)とすればよい。
また、上記実施形態は、固体レーザやダイオードレーザなどのレーザ光源を用いることもできる。この場合、これらのレーザ光源のビームウェストの位置を絞り位置(光束が制限される位置)とすればよく、光源自体が絞り部材の役割を果たすことになる。
上記第1~第3実施形態においては、扱う励起光及び蛍光の波長範囲が短い順番でスキャンミラー4側から離れる方向に複数のサブユニットが配置されていたが、波長範囲が長い順番で配置されてもよい。ただし、この場合、ダイクロイックミラー9a~9cの特性は、各サブユニット6a~6cのそれぞれで扱う比較的長波長の励起光及び蛍光を反射し、他のサブユニットで扱う比較的短波長の励起光及び蛍光を透過するような特性に設定される。
上記第2実施形態においては、全てのサブユニット6a~6dのうちの2つのサブユニット間で試料M上に結ばれる励起光のスポットが重ならないように構成されていたが、隣り合うサブユニット間でスポットが重ならないように構成されていればよい。例えば、第1のサブユニット6aと第2のサブユニット6bとの間、第2のサブユニット6bと第3のサブユニット6cとの間、及び第3のサブユニット6cと第4のサブユニット6dとの間で、励起光のスポットが重ならないように構成されていればよい。これに対して、第1のサブユニット6aと第3のサブユニット6cとの間、あるいは、第2のサブユニット6bと第4のサブユニット6dとの間では、励起光のスポットが重なっていてもよい。この場合であっても、ダイクロイックミラーによって、一方のサブユニットの観察対象の蛍光と他方のサブユニットの観察対象の蛍光とを容易に分離することができる。具体的な構成としては、第2の実施形態にかかる共焦点顕微鏡ユニット1Bにおいては、第3及び第4のサブユニット6c,6dは、第1及び第2のサブユニット6a,6bに対してY軸方向にずらすことなく配置されていてもよい。このような構成でも、波長領域の近い2つの励起光のスポットを試料M上で分離することができるので、検出される複数の波長範囲の蛍光ビームが互いに影響しあうことを防ぐことができ、ブリードスルーを低減した状態で複数の蛍光像の観察が可能にされる。
上記実施形態においては、第1のサブユニットは、第1の励起光及び第1の蛍光を反射し、第2の励起光及び第2の蛍光を透過する第1の光学ミラーを有し、第2のサブユニットは、第2の励起光及び第2の蛍光を反射する第2の光学ミラーを有し、第1の光学ミラー及び第2の光学ミラーが、スキャンミラーへの第1の励起光の入射角が、スキャンミラーへの第2の励起光の入射角に対して所定の角度ずれるように、メイン筐体内に配置されてもよい。これにより、第1及び第2の光学ミラーのメイン筐体内での配置を設定することにより、試料上に走査される第1及び第2の励起光のスポットを分離することができ、その結果、第1及び第2のサブユニットに導かれる第1及び第2の蛍光のビームを互いに分離することができる。これにより、ブリードスルーを低減した状態で複数の蛍光像の観察が可能にされる。
また、第1のサブユニットは、第1の励起光及び第1の蛍光を反射し、第2の励起光及び第2の蛍光を透過する第1の光学ミラーを有し、第2のサブユニットは、第2の励起光及び第2の蛍光を反射する第2の光学ミラーを有し、第1のサブユニット及び第2のサブユニットは、第1の光学ミラーへの第1の励起光の入射角と、第2の光学ミラーへの第2の励起光の入射角とが、スキャンミラーへの第1の励起光の入射角が、スキャンミラーへの第2の励起光の入射角に対して所定の角度ずれるように、設定されてもよい。この場合、第1及び第2のサブユニットにおける第1及び第2の光学ミラーに対する励起光の入射角を設定することにより、試料上に走査される第1及び第2の励起光のスポットを分離することができ、その結果、第1及び第2のサブユニットに導かれる第1及び第2の蛍光のビームを互いに分離することができる。これにより、ブリードスルーを低減した状態で複数の蛍光像の観察が可能にされる。
さらに、上記の所定の角度は、試料上において、第1の励起光のエアリディスクと第2の励起光のエアリディスクとが分離されるような角度である、ことが好適である。このような角度にすれば、試料上に走査される第1及び第2の励起光のスポットを完全に分離することができ、その結果、第1及び第2のサブユニットに導かれる第1及び第2の蛍光のビームを互いに完全に分離することができる。これにより、ブリードスルーがない状態で複数の蛍光像の観察が可能にされる。
上記実施形態においては、スキャンミラーはMEMSミラーであってもよい。この場合、装置の小型化を容易に実現することができる。
また、第1のサブユニットと第2のサブユニットとは、スキャンミラーによる蛍光の導光方向に沿って、第1のサブユニットおよび第2のサブユニットの順で並んだ状態でメイン筐体に固定されてもよい。かかる構成によれば、第2のサブユニットから照射された第2の励起光を、第1のサブユニットを経由して顕微鏡側の試料に向けて照射することができるとともに、それに応じて試料から生じる第2の蛍光を、第1のサブユニットを経由して第2のサブユニット内に導入することできる。その結果、複数波長領域でのイメージングを実現する装置の小型化が可能となる。
実施形態は、共焦点顕微鏡を構成する共焦点顕微鏡ユニット及び共焦点顕微鏡を使用用途とし、簡易な構成によりブリードスルーを低減した状態で複数蛍光による蛍光イメージングを実現できるものである。
M…試料、P1…接続ポート、θS…所定の角度、10a~10d…光源、12a~12d…ピンホール板(絞り部材)、13a~13d…光検出器、6a~6d…第1~第4のサブユニット、9a~9c…ダイクロイックミラー(第1~第3の光学ミラー)、9d…全反射ミラー(第4の光学ミラー)、1A,1B,1C…共焦点顕微鏡ユニット、2…メイン筐体、3…鏡筒、4…スキャンミラー、7…スキャンレンズ、50…顕微鏡、101…共焦点顕微鏡。
Claims (7)
- 顕微鏡光学系を有する顕微鏡の接続ポートに取り付けられることにより、共焦点顕微鏡を構成する共焦点顕微鏡ユニットであって、
第1の励起光を出力する光源、前記第1の励起光に応じて観察対象の試料から生じる第1の蛍光の光束を制限する第1の絞り部材、及び、前記第1の絞り部材を通過した第1の蛍光を検出する第1の光検出器を有する第1のサブユニットと、
第2の励起光を出力する光源、前記第2の励起光に応じて前記試料から生じる第2の蛍光の光束を制限する第2の絞り部材、及び、前記第2の絞り部材を通過した第2の蛍光を検出する第2の光検出器を有する第2のサブユニットと、
前記第1及び第2のサブユニットから出力された励起光を、前記顕微鏡光学系を経由して前記試料上を走査させ、前記励起光に応じて前記試料から生じる蛍光を前記第1及び第2のサブユニットに向けて導くスキャンミラーと、
前記接続ポートに取り付け可能に構成され、前記スキャンミラー、前記第1のサブユニット、及び前記第2のサブユニットが固定されたメイン筐体と、
を備え、
前記第1のサブユニット及び前記第2のサブユニットは、前記スキャンミラーへの前記第1の励起光の入射角が、前記スキャンミラーへの第2の励起光の入射角に対して所定の角度ずれるように、前記メイン筐体内に配置される、
共焦点顕微鏡ユニット。 - 前記第1のサブユニットは、前記第1の励起光及び前記第1の蛍光を反射し、前記第2の励起光及び前記第2の蛍光を透過する第1の光学ミラーを有し、
前記第2のサブユニットは、前記第2の励起光及び前記第2の蛍光を反射する第2の光学ミラーを有し、
前記第1の光学ミラー及び前記第2の光学ミラーが、前記スキャンミラーへの前記第1の励起光の入射角が、前記スキャンミラーへの第2の励起光の入射角に対して所定の角度ずれるように、前記メイン筐体内に配置される、
請求項1に記載の共焦点顕微鏡ユニット。 - 前記第1のサブユニットは、前記第1の励起光及び前記第1の蛍光を反射し、前記第2の励起光及び前記第2の蛍光を透過する第1の光学ミラーを有し、
前記第2のサブユニットは、前記第2の励起光及び前記第2の蛍光を反射する第2の光学ミラーを有し、
前記第1のサブユニット及び前記第2のサブユニットは、前記第1の光学ミラーへの前記第1の励起光の入射角と、前記第2の光学ミラーへの第2の励起光の入射角とが、前記スキャンミラーへの前記第1の励起光の入射角が前記スキャンミラーへの第2の励起光の入射角に対して所定の角度ずれるように、設定される、
請求項1に記載の共焦点顕微鏡ユニット。 - 前記所定の角度は、前記試料上において、前記第1の励起光のエアリディスクと前記第2の励起光のエアリディスクとが分離されるような角度である、
請求項1~3のいずれか1項に記載の共焦点顕微鏡ユニット。 - 前記スキャンミラーはMEMSミラーである、
請求項1~4のいずれか1項に記載の共焦点顕微鏡ユニット。 - 前記第1のサブユニットと前記第2のサブユニットとは、前記スキャンミラーによる前記蛍光の導光方向に沿って、前記第1のサブユニットおよび前記第2のサブユニットの順で並んだ状態で前記メイン筐体に固定されている、
請求項1~5のいずれか1項に記載の共焦点顕微鏡ユニット。 - 請求項1~6のいずれか1項に記載の共焦点顕微鏡ユニットと、
前記顕微鏡光学系及び前記共焦点顕微鏡ユニットが取り付けられる接続ポートを有する顕微鏡を備える、共焦点顕微鏡。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP20777264.1A EP3951468A4 (en) | 2019-03-28 | 2020-03-26 | CONFOCAL SCANNER AND CONFOCAL MICROSCOPE UNIT |
| CN202080024983.6A CN113631980B (zh) | 2019-03-28 | 2020-03-26 | 共聚焦显微镜单元和共聚焦显微镜 |
| JP2021509612A JP7344281B2 (ja) | 2019-03-28 | 2020-03-26 | 共焦点顕微鏡ユニット及び共焦点顕微鏡 |
| US17/442,163 US12078789B2 (en) | 2019-03-28 | 2020-03-26 | Confocal microscope unit and confocal microscope |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019062976 | 2019-03-28 | ||
| JP2019-062976 | 2019-03-28 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2020196784A1 true WO2020196784A1 (ja) | 2020-10-01 |
Family
ID=72608840
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2020/013801 WO2020196784A1 (ja) | 2019-03-28 | 2020-03-26 | 共焦点顕微鏡ユニット及び共焦点顕微鏡 |
| PCT/JP2020/013799 WO2020196783A1 (ja) | 2019-03-28 | 2020-03-26 | 共焦点顕微鏡ユニット及び共焦点顕微鏡 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2020/013799 WO2020196783A1 (ja) | 2019-03-28 | 2020-03-26 | 共焦点顕微鏡ユニット及び共焦点顕微鏡 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US12117600B2 (ja) |
| EP (2) | EP3951466A4 (ja) |
| JP (2) | JP7488253B2 (ja) |
| CN (2) | CN113631980B (ja) |
| WO (2) | WO2020196784A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2022185615A1 (ja) * | 2021-03-03 | 2022-09-09 | 株式会社日立ハイテク | 分光測定装置 |
| WO2022230254A1 (ja) | 2021-04-26 | 2022-11-03 | 浜松ホトニクス株式会社 | 共焦点顕微鏡ユニット、共焦点顕微鏡、及び共焦点顕微鏡ユニットの制御方法 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20230266602A1 (en) * | 2022-02-23 | 2023-08-24 | The Boeing Company | System and method for super-resolution imaging |
| DE102022114257A1 (de) * | 2022-06-07 | 2023-12-07 | Ludwig-Maximilians-Universität München (Körperschaft des öffentlichen Rechts) | Baukastensystem für eine Mikroskopievorrichtung, Mikroskopievorrichtung und Verfahren zum Herstellen einer Mikroskopievorrichtung |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003185927A (ja) * | 2001-12-13 | 2003-07-03 | Olympus Optical Co Ltd | 走査型レーザー顕微鏡 |
| JP2006133499A (ja) * | 2004-11-05 | 2006-05-25 | Shimadzu Corp | 共焦点スキャナ及び共焦点顕微鏡 |
| JP2008203417A (ja) * | 2007-02-19 | 2008-09-04 | Olympus Corp | レーザ顕微鏡 |
| JP2009104136A (ja) | 2007-10-22 | 2009-05-14 | Tecan Trading Ag | 蛍光測定用レーザスキャナ装置 |
| JP2009116082A (ja) * | 2007-11-07 | 2009-05-28 | Nsk Ltd | 光走査ユニット及び観察装置 |
| JP2011090248A (ja) | 2009-10-26 | 2011-05-06 | Olympus Corp | 顕微鏡接続ユニットおよび顕微鏡システム |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5535052A (en) * | 1992-07-24 | 1996-07-09 | Carl-Zeiss-Stiftung | Laser microscope |
| JP3917731B2 (ja) | 1996-11-21 | 2007-05-23 | オリンパス株式会社 | レーザ走査顕微鏡 |
| US7038848B2 (en) * | 2002-12-27 | 2006-05-02 | Olympus Corporation | Confocal microscope |
| JP4939806B2 (ja) | 2003-11-26 | 2012-05-30 | オリンパス株式会社 | レーザ走査型蛍光顕微鏡 |
| JP4409390B2 (ja) | 2004-08-24 | 2010-02-03 | オリンパス株式会社 | 光走査型共焦点観察装置 |
| JP2009198980A (ja) | 2008-02-25 | 2009-09-03 | Nikon Corp | 共焦点顕微鏡 |
| DE102008029458B4 (de) | 2008-06-20 | 2019-02-07 | Carl Zeiss Microscopy Gmbh | Verfahren zum Aufzeichnen von Impulssignalen |
| JP5452180B2 (ja) | 2009-11-13 | 2014-03-26 | オリンパス株式会社 | 顕微鏡装置 |
| JP5056871B2 (ja) | 2010-03-02 | 2012-10-24 | 横河電機株式会社 | 共焦点顕微鏡システム |
| US20130015370A1 (en) | 2011-07-15 | 2013-01-17 | Huron Technologies International In | Confocal fluorescence slide scanner with parallel detection |
| JP5926966B2 (ja) | 2012-01-30 | 2016-05-25 | オリンパス株式会社 | 蛍光観察装置 |
| JP5969803B2 (ja) | 2012-04-23 | 2016-08-17 | オリンパス株式会社 | 顕微鏡装置 |
| DE102014017001A1 (de) | 2014-11-12 | 2016-05-12 | Carl Zeiss Ag | Mikroskop mit geringem Verzeichnungsfehler |
| CN114002197B (zh) * | 2016-02-22 | 2024-07-19 | 株式会社日立高新技术 | 发光检测装置 |
| CN106980174B (zh) * | 2017-02-28 | 2019-04-16 | 浙江大学 | 一种综合性荧光超分辨显微成像装置 |
-
2020
- 2020-03-26 WO PCT/JP2020/013801 patent/WO2020196784A1/ja unknown
- 2020-03-26 EP EP20776340.0A patent/EP3951466A4/en active Pending
- 2020-03-26 EP EP20777264.1A patent/EP3951468A4/en active Pending
- 2020-03-26 US US17/442,238 patent/US12117600B2/en active Active
- 2020-03-26 CN CN202080024983.6A patent/CN113631980B/zh active Active
- 2020-03-26 JP JP2021509611A patent/JP7488253B2/ja active Active
- 2020-03-26 WO PCT/JP2020/013799 patent/WO2020196783A1/ja unknown
- 2020-03-26 CN CN202080025057.0A patent/CN113646686B/zh active Active
- 2020-03-26 JP JP2021509612A patent/JP7344281B2/ja active Active
- 2020-03-26 US US17/442,163 patent/US12078789B2/en active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003185927A (ja) * | 2001-12-13 | 2003-07-03 | Olympus Optical Co Ltd | 走査型レーザー顕微鏡 |
| JP2006133499A (ja) * | 2004-11-05 | 2006-05-25 | Shimadzu Corp | 共焦点スキャナ及び共焦点顕微鏡 |
| JP2008203417A (ja) * | 2007-02-19 | 2008-09-04 | Olympus Corp | レーザ顕微鏡 |
| JP2009104136A (ja) | 2007-10-22 | 2009-05-14 | Tecan Trading Ag | 蛍光測定用レーザスキャナ装置 |
| JP2009116082A (ja) * | 2007-11-07 | 2009-05-28 | Nsk Ltd | 光走査ユニット及び観察装置 |
| JP2011090248A (ja) | 2009-10-26 | 2011-05-06 | Olympus Corp | 顕微鏡接続ユニットおよび顕微鏡システム |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2022185615A1 (ja) * | 2021-03-03 | 2022-09-09 | 株式会社日立ハイテク | 分光測定装置 |
| JP7534984B2 (ja) | 2021-03-03 | 2024-08-15 | 株式会社日立ハイテク | 分光測定装置 |
| WO2022230254A1 (ja) | 2021-04-26 | 2022-11-03 | 浜松ホトニクス株式会社 | 共焦点顕微鏡ユニット、共焦点顕微鏡、及び共焦点顕微鏡ユニットの制御方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP7488253B2 (ja) | 2024-05-21 |
| JPWO2020196783A1 (ja) | 2020-10-01 |
| EP3951468A4 (en) | 2023-01-04 |
| WO2020196783A1 (ja) | 2020-10-01 |
| US20220179185A1 (en) | 2022-06-09 |
| JPWO2020196784A1 (ja) | 2020-10-01 |
| US20220155577A1 (en) | 2022-05-19 |
| US12078789B2 (en) | 2024-09-03 |
| CN113646686A (zh) | 2021-11-12 |
| CN113646686B (zh) | 2023-10-03 |
| EP3951466A1 (en) | 2022-02-09 |
| EP3951468A1 (en) | 2022-02-09 |
| JP7344281B2 (ja) | 2023-09-13 |
| US12117600B2 (en) | 2024-10-15 |
| EP3951466A4 (en) | 2023-01-04 |
| CN113631980B (zh) | 2023-07-28 |
| CN113631980A (zh) | 2021-11-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2020196784A1 (ja) | 共焦点顕微鏡ユニット及び共焦点顕微鏡 | |
| US8873046B2 (en) | Spectroscopic detection device and confocal microscope | |
| US6229635B1 (en) | Light sensing device | |
| US7239384B2 (en) | Laser-scanning fluoroscopy apparatus | |
| US20060187499A1 (en) | Connection unit and optical-scanning fluoroscopy apparatus | |
| JP4899001B2 (ja) | レーザ走査型顕微鏡 | |
| JP2011118264A (ja) | 顕微鏡装置 | |
| JP4818634B2 (ja) | 走査型蛍光観察装置 | |
| JP7344280B2 (ja) | 走査型顕微鏡ユニット | |
| JP5623654B2 (ja) | 共焦点レーザー走査顕微鏡 | |
| US20060050375A1 (en) | Confocal microscope | |
| JP2008164719A (ja) | 走査型共焦点顕微鏡 | |
| JP2011058953A (ja) | 検出装置、それを備えた光学装置 | |
| JP2006195390A (ja) | レーザ走査型蛍光顕微鏡および検出光学系ユニット | |
| JPH0829692A (ja) | 蛍光顕微鏡 | |
| JP7351323B2 (ja) | 共焦点スキャナ、共焦点スキャナシステム、及び共焦点顕微鏡システム | |
| JP6888638B2 (ja) | 光源装置およびこれを備えた測距センサ | |
| JP6753477B2 (ja) | 光源装置およびこれを備えた測距センサ | |
| JP5136294B2 (ja) | 共焦点顕微鏡 | |
| JP4276974B2 (ja) | レーザ走査型観察装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 20777264 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2021509612 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2020777264 Country of ref document: EP Effective date: 20211028 |