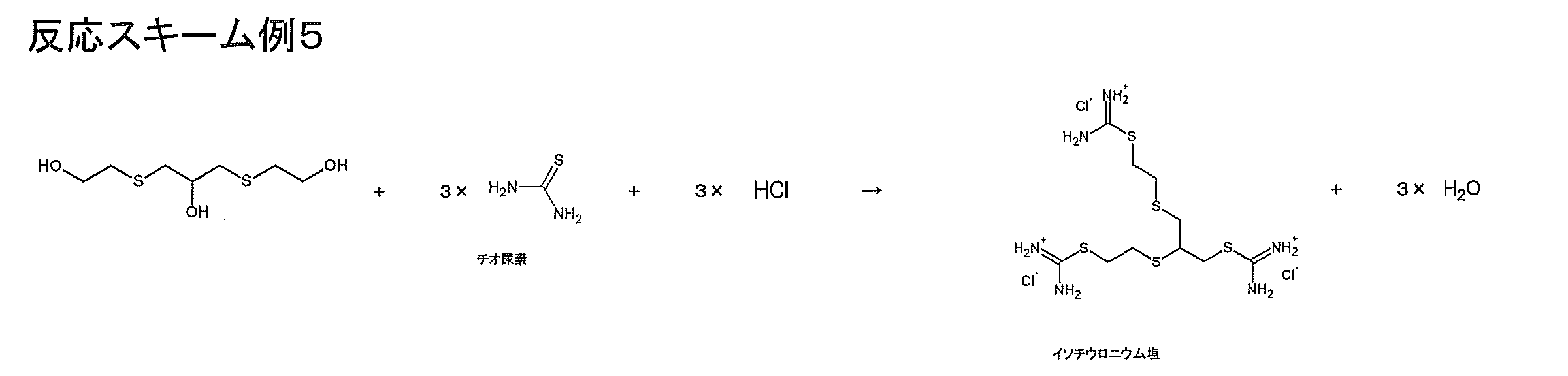WO2018003059A1 - ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 - Google Patents
ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 Download PDFInfo
- Publication number
- WO2018003059A1 WO2018003059A1 PCT/JP2016/069443 JP2016069443W WO2018003059A1 WO 2018003059 A1 WO2018003059 A1 WO 2018003059A1 JP 2016069443 W JP2016069443 W JP 2016069443W WO 2018003059 A1 WO2018003059 A1 WO 2018003059A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- polythiol
- formula
- compound
- polythiol compound
- salt
- Prior art date
Links
- 0 CNCCNC(C*)CNCC(CN=C)NCCNC Chemical compound CNCCNC(C*)CNCC(CN=C)NCCNC 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C319/00—Preparation of thiols, sulfides, hydropolysulfides or polysulfides
- C07C319/14—Preparation of thiols, sulfides, hydropolysulfides or polysulfides of sulfides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C319/00—Preparation of thiols, sulfides, hydropolysulfides or polysulfides
- C07C319/14—Preparation of thiols, sulfides, hydropolysulfides or polysulfides of sulfides
- C07C319/20—Preparation of thiols, sulfides, hydropolysulfides or polysulfides of sulfides by reactions not involving the formation of sulfide groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C335/00—Thioureas, i.e. compounds containing any of the groups, the nitrogen atoms not being part of nitro or nitroso groups
- C07C335/30—Isothioureas
- C07C335/32—Isothioureas having sulfur atoms of isothiourea groups bound to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/08—Processes
- C08G18/16—Catalysts
- C08G18/22—Catalysts containing metal compounds
- C08G18/24—Catalysts containing metal compounds of tin
- C08G18/244—Catalysts containing metal compounds of tin tin salts of carboxylic acids
- C08G18/246—Catalysts containing metal compounds of tin tin salts of carboxylic acids containing also tin-carbon bonds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/28—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the compounds used containing active hydrogen
- C08G18/30—Low-molecular-weight compounds
- C08G18/38—Low-molecular-weight compounds having heteroatoms other than oxygen
- C08G18/3855—Low-molecular-weight compounds having heteroatoms other than oxygen having sulfur
- C08G18/3876—Low-molecular-weight compounds having heteroatoms other than oxygen having sulfur containing mercapto groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G18/00—Polymeric products of isocyanates or isothiocyanates
- C08G18/06—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen
- C08G18/70—Polymeric products of isocyanates or isothiocyanates with compounds having active hydrogen characterised by the isocyanates or isothiocyanates used
- C08G18/72—Polyisocyanates or polyisothiocyanates
- C08G18/74—Polyisocyanates or polyisothiocyanates cyclic
- C08G18/76—Polyisocyanates or polyisothiocyanates cyclic aromatic
- C08G18/7614—Polyisocyanates or polyisothiocyanates cyclic aromatic containing only one aromatic ring
- C08G18/7628—Polyisocyanates or polyisothiocyanates cyclic aromatic containing only one aromatic ring containing at least one isocyanate or isothiocyanate group linked to the aromatic ring by means of an aliphatic group
- C08G18/7642—Polyisocyanates or polyisothiocyanates cyclic aromatic containing only one aromatic ring containing at least one isocyanate or isothiocyanate group linked to the aromatic ring by means of an aliphatic group containing at least two isocyanate or isothiocyanate groups linked to the aromatic ring by means of an aliphatic group having a primary carbon atom next to the isocyanate or isothiocyanate groups, e.g. xylylene diisocyanate or homologues substituted on the aromatic ring
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B1/00—Optical elements characterised by the material of which they are made; Optical coatings for optical elements
- G02B1/04—Optical elements characterised by the material of which they are made; Optical coatings for optical elements made of organic materials, e.g. plastics
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B1/00—Optical elements characterised by the material of which they are made; Optical coatings for optical elements
- G02B1/04—Optical elements characterised by the material of which they are made; Optical coatings for optical elements made of organic materials, e.g. plastics
- G02B1/041—Lenses
Definitions
- the present invention relates to a method for producing a polythiol compound, a method for producing a curable composition, and a method for producing a cured product.
- Polythiol compounds are widely used as synthetic raw materials for obtaining various resins.
- a polythiourethane resin can be synthesized by curing reaction of a polythiol compound with a polyiso (thio) cyanate compound (see, for example, paragraph 0004 of Patent Document 1).
- Japanese Patent No. 5319037 Japanese Patent No. 5319037
- the polythiol compound can be produced using 2-mercaptoethanol as a starting material.
- the present inventors repeatedly examined the production method of the polythiol compound, in the conventional synthesis method of the polythiol compound, (1) Further improvement in yield is required to improve productivity, (2) Reduction in coloring of the produced polythiol compound is required, It became clear that there was a problem.
- One embodiment of the present invention provides a method for producing a polythiol compound capable of producing a polythiol compound with reduced coloring in a high yield.
- one aspect of the present invention relates to the following method for producing a polythiol compound.
- X represents a halogen atom
- Step 4 of obtaining a polythiol salt by hydrolyzing the isothiuronium salt in the presence of a base By reacting the halide represented by the formula (1) with an alkali metal compound selected from the group consisting of alkali metal sulfides and alkali metal hydroxides, the polyol compound represented by the formula (2) and the formula (3
- Step 1 consists of 2-mercaptoethanol: And epihalohydrin: Is a step of reacting.
- the halide represented by the formula (1) can be obtained.
- step 1 the halide represented by the formula (1) can be obtained by the following reaction scheme example 1.
- X in the above epihalohydrin and the formula (1) represents a halogen atom.
- the halogen atom is, for example, a fluorine atom, a chlorine atom, a bromine atom, or an iodine atom, and a chlorine atom and a bromine atom are preferable.
- a halide in which X in formula (1) is a chlorine atom can be obtained.
- step 1 2-mercaptoethanol having a mass-based moisture content of 3000 ppm or less is used as 2-mercaptoethanol.
- the yield of the polythiol compound can be improved, and a polythiol compound with reduced coloring can be provided.
- the water content of 2-mercaptoethanol is preferably 2800 ppm or less, more preferably 2500 ppm or less, still more preferably 2300 ppm or less, still more preferably 2000 ppm or less, and even more preferably 1800 ppm. Or less, even more preferably 1500 ppm or less, even more preferably 1300 ppm or less, and even more preferably 1000 ppm or less.
- the water content of 2-mercaptoethanol can be, for example, 300 ppm or more or 500 ppm or more, but it is preferably as low as possible for improving the yield and reducing the color, so it may be lower than the lower limit exemplified above.
- the following is merely inference by the present inventors, but it is assumed that the water in 2-mercaptoethanol causes the hydrolysis of epihalohydrin, leading to coloring of the final polythiol compound and a decrease in yield. The inventors speculate.
- the use of 2-mercaptoethanol having a low moisture content of 3000 ppm or less can suppress the hydrolysis of epihalohydrin, which contributes to the production of a polythiol compound with reduced coloring in a high yield. They are thinking.
- the above is inference and does not limit the present invention.
- the water content of 2-mercaptoethanol in the present invention and in the present specification is determined by using a water vaporizer in an environment of a temperature of 20 to 25 ° C. and an absolute humidity of 0.8 to 1.2 g / m 3 by the Karl Fischer method. It is a value determined by the measurement to be performed.
- the moisture content measurement by the Karl Fischer method may be performed by a coulometric titration method or a volumetric titration method.
- 2-mercaptoethanol As a method for reducing the water content of 2-mercaptoethanol, for example, one or a combination of two or more methods such as purification by distillation, dehydration with an inorganic salt anhydride such as magnesium sulfate and sodium sulfate, and dehydration with molecular sieve is used. be able to. Thereby, 2-mercaptoethanol having a water content of 3000 ppm or less can be obtained.
- the reaction of 2-mercaptoethanol and epihalohydrin in step 1 is preferably performed in the presence of a catalyst.
- a catalyst Various known catalysts can be used as the catalyst, and a tertiary amine is preferably used.
- a tertiary amine As the tertiary amine, a tertiary alkylamine is preferable.
- preferred tertiary amines include trimethylamine, triethylamine, tripropylamine, tributylamine, N, N-dimethylcyclohexylamine, N, N-dicyclohexylmethylamine and the like, among which triethylamine, tripropylamine Tributylamine is more preferable, and triethylamine and tributylamine are still more preferable.
- reaction temperature in step 1 and the reaction temperature in step 2 to be described later can be, for example, about 0 to 60 ° C.
- the reaction time in step 1 can be, for example, about 0.5 to 10 hours.
- reaction temperature refers to the liquid temperature of the reaction solution, and is also referred to as “internal temperature”.
- step 1 can be performed, for example, as follows. First, 2-mercaptoethanol is mixed to obtain a mixed solution. It is preferable to mix a catalyst here, and it is more preferable to mix a tertiary amine. Moreover, you may add a solvent (for example, alcohol etc.) as needed. Thereafter, epihalohydrin is added to the mixture. It is preferable to add epihalohydrin by dripping into the said liquid mixture. The dropping time can be, for example, about 0.1 to 5 hours, but is not particularly limited. You may stir a liquid mixture as needed during dripping.
- a solvent for example, alcohol etc.
- the epihalohydrin is, for example, in the range of 0.5 to 3.0 mol, preferably 0.7 to 2.0 mol, more preferably 0.9 to 1.1 mol, relative to 1.0 mol of 2-mercaptoethanol. It can be used in proportions and reacted with 2-mercaptoethanol.
- the tertiary amine can be used in an amount of, for example, about 0.005 to 0.1 mol with respect to 1.0 mol of epihalohydrin.
- the above mixed solution may be aged for about 0.5 to 10 hours as necessary after addition of epihalohydrin. During the aging, the mixed solution may be allowed to stand or be stirred.
- one or more tertiary amines can be used as the tertiary amine.
- the amount of tertiary amine in the case of using two or more kinds of tertiary amines means the total content of these two or more kinds of tertiary amines.
- components that can take different structures may be used singly or in combination of two or more. The content when two or more of these components are used refers to the total content of two or more.
- step 2 the halide represented by the formula (1) obtained in step 1 is reacted with an alkali metal compound selected from the group consisting of alkali metal sulfides and alkali metal hydroxides, and the formula (2) ) And a polyol compound selected from the group consisting of the polyol compound represented by formula (3).
- a polyol compound represented by the formula (2) can be obtained by the following reaction scheme example 2. Note that the numerical values described in the following reaction scheme examples are on a molar basis.
- a polyol compound represented by the formula (3) can be obtained by the following reaction scheme example 3.
- the reaction solution containing the target product obtained by the reaction may be used as it is in the next step (Step 2).
- the reaction solution after the reaction can be purified by a known method to isolate the target product or increase the concentration, and then used in the next step.
- the reaction solution after the reaction in Step 1 can be diluted with a solvent (for example, toluene) and used in the next step.
- a solvent for example, toluene
- This 2-mercaptoethanol may be 2-mercaptoethanol which remains unreacted after the reaction in Step 1, and may be added for Step 2.
- the amount of 2-mercaptoethanol when obtaining the polyol compound represented by the formula (3) in the step 2 is, for example, 0.5 to 3.0 with respect to 1.0 mol of the halide represented by the formula (1). Mol, preferably 0.7 to 2.0 mol, more preferably 0.9 to 1.1 mol.
- the water content of the added 2-mercaptoethanol is also preferably 3000 ppm or less, and more preferably within the above-mentioned range with respect to Step 1. preferable.
- the alkali metal atom contained in the alkali metal compound selected from the group consisting of alkali metal sulfide and alkali metal hydroxide is a sodium atom
- the alkali metal atom contained in the alkali metal compound may be another alkali metal atom such as a lithium atom or a potassium atom.
- the alkali metal compound is, for example, 0.2 to 2.0 mol, preferably 0.3 to 1.2 mol, relative to 1.0 mol of the halide represented by the formula (1).
- the alkali metal compound may be in the form of a hydrate.
- the amount for the hydrate shall mean the amount containing hydrated water.
- the alkali metal compound may be used as it is for the reaction in Step 2, or may be used in the form of a solution such as an aqueous solution. In one embodiment, the alkali metal compound solution can be added dropwise to a reaction solution containing a halide represented by the formula (1).
- the dropping time can be, for example, about 0.1 to 5 hours, but is not particularly limited.
- the reaction solution may be stirred as necessary.
- Such a reaction solution may be aged for about 0.5 to 10 hours as necessary after the addition of the alkali metal compound. During the aging, the reaction solution may be left still or stirred.
- Step 3 is a step of obtaining the isothiuronium salt by reacting the polyol compound obtained in Step 2 with thiourea in the presence of an acid.
- the “isothiuronium salt” is a quaternary salt of isothiourea.
- hydrochloric acid for example, when a polyol compound represented by the formula (2) is reacted with thiourea in the presence of an acid, an isothiuronium salt shown in the following reaction scheme example 4 can be obtained.
- Reaction Scheme Example 4 an isothiuronium salt having a skeleton of polythiol compound (5) is shown.
- an isothiuronium salt having a skeleton of polythiol compound (5) and a skeleton of polythiol compound (6) are included.
- At least one isothiuronium salt selected from the group consisting of an isothiuronium salt and an isothiuronium salt having a polythiol compound (7) skeleton can be obtained, and a rearrangement reaction can yield two or three of the above isothiuronium salts. Can be.
- the acid used in step 3 is not limited to hydrogen chloride, and various inorganic acids and organic acids may be used. it can.
- the inorganic acid include hydrogen chloride and sulfuric acid
- examples of the organic acid include formic acid.
- the addition form of an acid is not ask
- the acid concentration in the aqueous solution is not particularly limited, but can be, for example, about 10 to 80% by mass.
- the acid is, for example, 2.0 to 12.0 with respect to 1.0 mol of the polyol compound (in the reaction solution containing two or more kinds of the polyol compounds, the total amount thereof is 1.0 mol).
- the reaction temperature can be, for example, 40 ° C. to reflux temperature, preferably about 90 to 120 ° C.
- the reaction time can be, for example, about 1 to 24 hours.
- Step 4 is a step of obtaining a polythiol salt by hydrolyzing the isothiuronium salt obtained in Step 3 in the presence of a base.
- the polythiol salt obtained here is a thiol having 3 or 4 per molecule in the structure of the polythiol compound represented by formula (4), formula (5), formula (6), or formula (7).
- two or more polythiol salts having different structures can be obtained.
- the polythiol salt is preferably an alkali metal salt of polythiol or an ammonium salt of polythiol.
- the kind of salt can be adjusted with the kind of base used for a hydrolysis.
- the aspect which obtains an alkali metal salt as a salt of the said polythiol is demonstrated below.
- the alkali metal salt of polythiol has a structure in which an alkali metal salt of a thiol group (-SM; M represents an alkali metal atom) is introduced at the molecular end as a result of hydrolysis of the isothiuronium salt obtained in Step 3. Have.
- an alkali metal salt (sodium salt) of polythiol shown in the following reaction scheme example 6 can be obtained.
- the alkali metal salt (sodium salt) of polythiol shown in the following reaction scheme example 7 can be obtained by hydrolyzing the isothiuronium salt having the skeleton of the polythiol compound (4) using sodium hydroxide as a base. .
- the base used in step 4 is not limited to sodium hydroxide, and various bases can be used.
- the base is preferably an inorganic base.
- the inorganic base include sodium hydroxide, potassium hydroxide, ammonia and the like.
- adding as aqueous solution is preferable.
- the isothiuronium salt can be hydrolyzed in the presence of the base with water contained in the aqueous solution.
- the base concentration in the aqueous solution is not particularly limited, but can be, for example, about 10 to 60% by mass.
- the base is, for example, 1.0 to 4.0 mol, preferably 1.0 to 3.0 mol, more preferably 1.2 to 2.0 mol, relative to 1.0 mol of the acid used in Step 3.
- an organic solvent can be added to the reaction liquid containing the above isothiuronium salt after the reaction in Step 3.
- the organic solvent can be optionally added at any stage after the reaction in Step 3.
- the amount of the organic solvent added can be, for example, about 0.2 to 3.0 times the volume of the reaction solution after the reaction in Step 3 on a volume basis.
- the organic solvent include toluene, xylene, chlorobenzene, dichlorobenzene and the like, and toluene is preferable.
- the reaction temperature can be, for example, about 10 to 80 ° C.
- the reaction time can be, for example, about 1 to 10 hours.
- Step 5 is a step of converting the polythiol salt obtained in Step 4 into polythiol with an acid.
- the polythiol compound represented by formula (4) from the group consisting of the polythiol compound represented by formula (4), the polythiol compound represented by formula (5), the polythiol compound represented by formula (6), and the polythiol compound represented by formula (7).
- One or more selected polythiol compounds can be obtained.
- reaction scheme example 8 in which the polythiol sodium salt shown in reaction scheme example 6 is converted to polythiol using hydrogen chloride (HCl) as an acid to obtain a polythiol compound represented by formula (5) is shown below. .
- reaction scheme example 9 which converts the polythiol sodium salt shown in reaction scheme example 6 into polythiol using hydrogen chloride (HCl) as an acid to obtain a polythiol compound represented by formula (4) is shown below. .
- step 5 is not limited to hydrogen chloride, and various inorganic acids and organic acids can be used. Details of the acid used in step 5 are as described for the acid in step 3. Conversion to polythiol by an acid in Step 5 can be preferably performed using an acid as an aqueous solution, and more preferably by acid washing. It is preferable to carry out water washing after the acid washing, and it is more preferred to carry out acid washing twice or more, and to carry out water washing during the acid washing.
- step 5 can be performed, for example, in an environment having an ambient temperature of 10 to 60 ° C., preferably 20 to 45 ° C.
- a step of distilling off the organic solvent from the reaction solution after step 5 may be performed by a known method.
- post-processes such as filtration and distillation can be performed by known methods.
- the above steps can be performed in the air, and can be performed in an atmosphere other than the air, for example, in a nitrogen atmosphere.
- the polythiol compound represented by formula (4), the polythiol compound represented by formula (5), the polythiol compound represented by formula (6), and the polythiol compound represented by formula (7) It can be obtained as a single type or a mixture of two or more types.
- the degree of coloring of the polythiol compound can be evaluated by, for example, the b * value defined in JIS Z8781-4: 2013. The b * value indicates that the smaller the value, the less the coloring.
- a polythiol compound having a b * value of 2.5 or less for example, 0.5 to 2.5
- each polythiol compound may be isolated with a well-known isolation method, and may be used as a synthesis raw material of various resin as a mixture.
- the polythiol compound represented by the formula (4), (5), (6), (7) obtained by the method for producing a polythiol compound according to one embodiment of the present invention is 3 or 4 in one molecule.
- a cured product (polythiourethane resin) obtained by curing reaction of such a polyfunctional polythiol compound with a polyiso (thio) cyanate compound has a high refractive index and a high heat resistance and is preferable for various optical members such as eyeglass lenses. It can have physical properties.
- One embodiment of the present invention relates to a curable composition comprising a polythiol compound obtained by the above production method and a polyiso (thio) cyanate compound. Furthermore, 1 aspect of this invention is related with the hardened
- One embodiment of the present invention provides: A step of producing a polythiol compound by the method of producing a polythiol compound according to one aspect of the present invention, Mixing the produced polythiol compound with a polyiso (thio) cyanate compound to prepare a curable composition; A method for producing a curable composition comprising About.
- a polythiourethane resin useful as a material for an optical member such as an eyeglass lens can be obtained as a cured product.
- the manufacturing method of the said curable composition is demonstrated in detail.
- a curable composition can be prepared by mixing the polythiol compound thus produced with a polyiso (thio) cyanate compound.
- the “polyiso (thio) cyanate compound” is used in a meaning including a polyisocyanate compound and a polyisothiocyanate compound. It should be noted that isocyanate is sometimes referred to as isocyanate, and isothiocyanate is sometimes referred to as isothiocyanate.
- iso (thio) cyanate group is used to include an isocyanate group (—N ⁇ C ⁇ O) and an isothiocyanate group (—N ⁇ C ⁇ S).
- the “polyiso (thio) cyanate compound” is a polyfunctional compound having two or more iso (thio) cyanate groups in one molecule. By curing the polythiol compound and the polyiso (thio) cyanate compound, the thiol group possessed by the polythiol compound reacts with the iso (thio) cyanate group possessed by the polyiso (thio) cyanate compound, resulting in the following bonds in the molecule: : A reaction product having can be obtained.
- Z is an oxygen atom or a sulfur atom.
- X forms the above bond of oxygen atom
- X forms the above bond of sulfur atom.
- a reaction product (resin) containing a plurality of the bonds in one molecule is referred to as “polythiourethane resin”.
- polyiso (thio) cyanate compound various polyiso (thio) cyanate compounds such as an aliphatic polyiso (thio) cyanate compound, an alicyclic polyiso (thio) cyanate compound, and an aromatic polyiso (thio) cyanate compound can be used.
- the number of iso (thio) cyanate groups contained in one molecule of the polyiso (thio) cyanate compound is 2 or more, preferably 2 to 4, and more preferably 2 or 3.
- Specific examples of the polyiso (thio) cyanate compound include various compounds exemplified as a polyiso (thio) cyanate compound in Japanese Patent No. 5319037, paragraph 0052.
- Preferred polyiso (thio) cyanate compounds include hexamethylene diisocyanate, 1,5-pentane diisocyanate, isophorone diisocyanate, bis (isocyanatomethyl) cyclohexane, dicyclohexylmethane diisocyanate, 2,5-bis (isocyanatomethyl) -bicyclo [2 2.1] heptane, 2,6-bis (isocyanatomethyl) -bicyclo [2.2.1] heptane, bis (4-isocyanatocyclohexyl) methane, 1,3-bis (isocyanatomethyl) Aliphatic polyisocyanate compounds such as cyclohexane and 1,4-bis (isocyanatomethyl) cyclohexane; bis (isocyanatomethyl) benzene, m-xylylene diisocyanate, p-xylylene diisocyanate, 1,3-diisocyana
- halogen substituted products such as chlorine-substituted products and bromine-substituted products of the above polyiso (thio) cyanate compounds, alkyl-substituted products, alkoxy-substituted products, nitro-substituted products and prepolymer-modified products with polyhydric alcohols, carbodiimide-modified products, Urea-modified products, burette-modified products, dimerization or trimerization reaction products, and the like can also be used. These compounds may be used alone or in combination of two or more.
- the curable composition can be prepared by mixing the polythiol compound with a polyiso (thio) cyanate compound.
- the curable composition may contain, for example, 40% by mass or more (for example, 40 to 70% by mass) of the polythiol compound with respect to 100% by mass of the total amount of the curable composition.
- one or more other components than the polythiol compound and the polyiso (thio) cyanate compound may be mixed.
- specific examples of such other components include a reaction catalyst for a curing reaction between a polythiol compound and a polyiso (thio) cyanate compound.
- a reaction catalyst for a curing reaction between a polythiol compound and a polyiso (thio) cyanate compound For other components that may be mixed, reference can be made to, for example, Japanese Patent No. 5319037, paragraphs 0055, 0057, and 0058-0064.
- additives generally available as additives for various resins such as polythiourethane resins can be used.
- Preparation of the said curable composition can be performed by mixing the various components demonstrated above simultaneously or sequentially in arbitrary orders.
- the preparation method is not particularly limited, and any known method for preparing a curable composition can be employed without any limitation.
- One embodiment of the present invention provides: A step of producing a curable composition by the method for producing a curable composition according to one aspect of the present invention, A step of curing the produced curable composition to obtain a cured product; A method for producing a cured product comprising About. Below, the manufacturing method of the said hardened
- a polythiourethane resin useful as a material for optical members such as eyeglass lenses can be obtained as a cured product.
- a polythiourethane resin having reduced coloring can be obtained by using the polythiol compound obtained by the method for producing a polythiol compound according to one embodiment of the present invention as a synthesis raw material. It became clear that The degree of coloring of the resin can be evaluated by, for example, the YI value defined in JIS K 7373: 2006. The YI value indicates that the smaller the value, the less the coloring.
- the YI value is less than 2.0 (for example, 1.8 or less, for example, 0.5 to 1.8) ) Polythiourethane resin (cured product).
- the curing reaction between the polythiol compound and the polyiso (thio) cyanate compound can be performed by various curing treatments that can cure the curable composition.
- cast polymerization is preferable for producing a cured product having a lens shape (also referred to as “plastic lens”).
- a curable composition is injected into a cavity of a mold having two molds facing each other with a predetermined interval and a cavity formed by closing the interval, and the curable composition is injected into the cavity.
- a cured product can be obtained by polymerization (curing reaction).
- the mold that can be used for cast polymerization reference can be made, for example, to paragraphs 0012 to 0014 of JP-A-2009-262480 and FIG. In the above publication, a mold in which the interval between two molds is closed with a gasket as a sealing member is shown, but a tape may be used as the sealing member.
- the cast polymerization can be performed as follows.
- the curable composition is injected into the mold cavity from the injection port provided on the side surface of the mold.
- the curable composition is preferably polymerized (curing reaction) by heating, whereby the curable composition is cured, and a cured product in which the internal shape of the cavity is transferred can be obtained.
- the polymerization conditions are not particularly limited, and can be appropriately set according to the composition of the curable composition.
- a mold in which a curable composition is injected into a cavity can be heated at a heating temperature of 20 to 150 ° C. for about 1 to 72 hours, but is not limited to this condition.
- the temperature such as the heating temperature related to the casting polymerization refers to an atmospheric temperature at which the mold is disposed. Further, during heating, the temperature can be increased at an arbitrary temperature increase rate, and the temperature can be decreased (cooled) at an arbitrary temperature decrease rate.
- the cured product inside the cavity is released from the mold. As is usually done in casting polymerization, the cured product can be released from the mold by removing the upper and lower molds forming the cavity and the gasket or tape in any order.
- the cured product released from the mold can be preferably used as a lens base material for spectacle lenses.
- the cured product used as the lens base material of the spectacle lens is usually a primer coating layer for improving impact resistance, an annealing process, a grinding process such as a rounding process, a primer coating layer for improving the surface hardness after release. It can attach
- Moisture content of 2-mercaptoethanol The moisture content of 2-mercaptoethanol used for Step 1 in Examples and Comparative Examples is an environment having a temperature of 20 to 25 ° C. and an absolute humidity of 2 to 5 g / m 3 or less. Then, using a Karl Fischer moisture measuring device (automatic moisture measuring device MKC-610 type manufactured by Kyoto Electronics Co., Ltd.) and a moisture vaporizer (water vaporizing device ADP-611 type manufactured by Kyoto Electronics Industry Co., Ltd.). The 2-mercaptoethanol used in the examples is 2-mercaptoethanol obtained by distilling commercially available 2-mercaptoethanol and adding a molecular sieve to reduce the water content.
- 2-Mercaptoethanol was subjected to Step 1 within one hour after the above moisture content measurement (specifically, mixed with a tertiary amine). Even if the moisture content of 2-mercaptoethanol does not change or changes from the measurement of the moisture content to the time of Step 1, the amount of change is below the detection limit. In a normal working environment or storage environment, even if the moisture content of 2-mercaptoethanol does not change or changes, the amount of change is below the detection limit.
- Example 1 (Process 1) A mixture of 78.1 g (1.0 mol) of 2-mercaptoethanol having a water content shown in Table 1 and 2.0 g of triethylamine was mixed with 92.5 g (1.0 mol) of epichlorohydrin and an internal temperature of 35 to While maintaining the temperature at 40 ° C., the solution was dropped over 1 hour, and aging was performed at an internal temperature of 40 ° C. for 1 hour. The aging described in Examples and Comparative Examples was performed by stirring the reaction solution.
- Step 4 After cooling the reaction solution to room temperature, 400 ml of toluene was added, 600.4 g (4.5 mol) of 30% aqueous sodium hydroxide solution was gradually added, and hydrolysis was performed at an internal temperature of 60 ° C. for 4 hours (step 4).
- Process 5 The reaction solution after Step 4 was allowed to stand to separate into an aqueous layer and an organic layer, and then the organic layer was taken out, and this organic layer was washed successively with 36% hydrochloric acid 100 ml and water 100 ml twice. Toluene in the organic layer after washing was distilled off with a rotary evaporator to obtain the target polythiol compound (transparent liquid) in a yield of 170.5 g (yield 93.0%).
- Example 1 the reactions in Steps 1 to 5 can proceed as shown in Reaction Scheme Examples 1, 2, 4, 6, and 8.
- Reaction scheme example 4 shows an isothiuronium salt having a polythiol compound skeleton represented by formula (5)
- reaction scheme example 6 shows a polythiol alkali metal salt having the same skeleton
- reaction scheme example 8 shows a formula ( The polythiol compound represented by 5) is shown.
- Step 3 the rearrangement reaction occurs as described above, so that the isothiuronium salt having the polythiol compound skeleton represented by formula (5), the formula ( A mixture of an isothiuronium salt having a polythiol compound skeleton represented by 6) and an isothiuronium salt having a polythiol compound skeleton represented by formula (7) can be obtained. ), A polythiol compound represented by formula (6) and a formula (7) It is possible to obtain a mixture of the polythiol compound.
- Example 2 The target polythiol compound (transparent liquid) was obtained in a yield of 171.1 g (yield 93.3%) by the same method as in Example 1 except that 2-mercaptoethanol having a water content shown in Table 1 was used. Obtained.
- Example 3 165.4 g of the target polythiol compound (transparent liquid) was obtained in the same manner as in Example 2 except that 2.0 g of tributylamine was used instead of 2.0 g of triethylamine as the amine used in Step 1. (Yield 90.2%).
- Example 4 The target polythiol compound (transparent) was prepared in the same manner as in Example 2 except that 841.7 g of 30% aqueous potassium hydroxide solution was used instead of 600.4 g of 30% aqueous sodium hydroxide solution as the base used in Step 4. Liquid) was obtained in a yield of 162.8 g (yield 88.8%).
- Example 5 The target polythiol compound (transparent liquid) was prepared in the same manner as in Example 2 except that 137.0 g of epibromohydrin was used instead of 92.5 g of epichlorohydrin as the epihalohydrin used in Step 1. The yield was 157.0 g (yield 85.6%).
- Example 6 The target polythiol compound (transparent liquid) was obtained in a yield of 160.6 g (yield: 87.6%) in the same manner as in Example 1 except that 2-mercaptoethanol having a water content shown in Table 1 was used. Obtained.
- Step 3 To the reaction solution after Step 2, 363.8 g (3.0 mol) of 36% hydrochloric acid and 228.4 g (3.0 mol) of thiourea were added, and the mixture was heated and stirred at an internal temperature of 110 ° C. for 2 hours (Step 3). . After cooling the reaction solution to room temperature, 200 ml of toluene was added, 266.7 g (3.0 mol) of 45% aqueous sodium hydroxide solution was gradually added, and the reaction solution was hydrolyzed at 60 ° C.
- step 4 The reaction solution after Step 4 was allowed to stand to separate into an aqueous layer and an organic layer, and then the organic layer was taken out, and this organic layer was washed successively with 36% hydrochloric acid 100 ml and water 100 ml twice. Toluene in the organic layer after washing was distilled off with a rotary evaporator to obtain 222.4 g (yield 85.4%) of the target polythiol compound (transparent liquid).
- Example 7 the reactions in Steps 1 to 5 can proceed as shown in Reaction Scheme Examples 1, 3, 5, 7, and 9.
- Yield (the above yield / theoretical yield) ⁇ 100.
- the yields of Example 8 and Comparative Example 3 were also calculated in the same manner.
- Example 8 The target polythiol compound (transparent liquid) was obtained in a yield of 214.4 g (yield 82.3%) by the same method as in Example 7 except that 2-mercaptoethanol having a water content shown in Table 1 was used. Obtained.
- Example 9 50.6 parts of xylylene diisocyanate, 0.01 part of dimethyltin dichloride as a curing catalyst, 0.20 part of acidic phosphate ester (JP-506H, manufactured by Johoku Chemical Industry Co., Ltd.), UV absorber (Cipro Kasei) 0.5 part of Seesorve 701) was mixed and dissolved. Furthermore, 49.4 parts of the polythiol compound obtained in Example 1 was added and mixed to obtain a mixed solution. The mixture was degassed at 200 Pa for 1 hour, and then filtered through a PTFE (polytetrafluoroethylene) filter having a pore size of 5.0 ⁇ m.
- PTFE polytetrafluoroethylene
- the filtered mixed solution (curable composition) was poured into a lens mold composed of a glass mold having a diameter of 75 mm, ⁇ 4.00 D or 0.00 D and a tape.
- This mold was put into an electric furnace, gradually heated from 15 ° C. to 120 ° C. over 20 hours, and held for 2 hours for polymerization (curing reaction). After completion of the polymerization, the mold was removed from the electric furnace and released to obtain a cured product (plastic lens).
- the obtained plastic lens was further annealed in an annealing furnace at a furnace temperature of 120 ° C. for 3 hours.
- Example 10 52.0 parts of xylylene diisocyanate, 0.05 part of dimethyltin dilaurate as a curing catalyst, 0.20 part of acidic phosphate ester (JP-506H manufactured by Johoku Chemical Industry Co., Ltd.) as a release agent, UV absorber (Cipro Kasei) 0.5 part of Seesorve 701) was mixed and dissolved. Furthermore, 48.0 parts of the polythiol compound obtained in Example 7 was added and mixed to obtain a mixed solution. The mixture was degassed at 200 Pa for 1 hour, and then filtered through a PTFE (polytetrafluoroethylene) filter having a pore size of 5.0 ⁇ m.
- PTFE polytetrafluoroethylene
- the filtered mixed solution (curable composition) was poured into a lens mold composed of a glass mold having a diameter of 75 mm, ⁇ 4.00 D or 0.00 D and a tape.
- the mold was put into an electric furnace, gradually heated from 30 ° C. to 120 ° C. over 20 hours, and held for 2 hours for polymerization (curing reaction). After completion of the polymerization, the mold was removed from the electric furnace and released to obtain a cured product (plastic lens).
- the obtained plastic lens was further annealed in an annealing furnace at a furnace temperature of 120 ° C. for 3 hours.
- Step 4 of obtaining a polythiol salt; and converting the polythiol salt into a polythiol with an acid Therefore, selected from the group consisting of the polythiol compound represented by formula (4), the polythiol compound represented by formula (5), the polythiol compound represented by formula (6), and the polythiol compound represented by formula (7)
- the manufacturing method of a polythiol compound including the process 5 of obtaining the 1 or more types of polythiol compound which can be provided can be provided.
- a polythiol compound with reduced coloring can be provided in a high yield.
- the alkali metal compound is an alkali metal compound selected from the group consisting of sodium sulfide and sodium hydroxide.
- the polythiol salt is a salt selected from the group consisting of polythiol alkali metal salts and polythiol ammonium salts.
- a curable method comprising the steps of: producing a polythiol compound by the above production method; and preparing the curable composition by mixing the produced polythiol compound with a polyiso (thio) cyanate compound.
- a method of making the composition is also provided.
- a curable composition capable of providing a cured product with reduced coloring can be obtained.
- a method for producing a cured product comprising: a step of producing a curable composition by the above production method; and a step of obtaining a cured product by curing the produced curable composition.
- a cured product with reduced coloring can be provided.
- the curing step is performed by subjecting the curable composition to cast polymerization.
- the cured product is a spectacle lens substrate.
- One embodiment of the present invention is useful in the field of manufacturing various optical members such as eyeglass lenses.
Abstract
質量基準の含水率が3000ppm以下の2-メルカプトエタノールとエピハロヒドリンとを反応させて、式(1)(式(1)中、Xはハロゲン原子を表す)で表されるハロゲン化物を得る工程1;式(1)で表されるハロゲン化物をアルカリ金属硫化物およびアルカリ金属水酸化物からなる群から選択されるアルカリ金属化合物と反応させて式(2)で表されるポリオール化合物および式(3)で表されるポリオール化合物からなる群から選択されるポリオール化合物を得る工程2;上記ポリオール化合物を酸存在下でチオ尿素と反応させてイソチウロニウム塩を得る工程3;上記イソチウロニウム塩を塩基存在下で加水分解することによってポリチオールの塩を得る工程4;ならびに、上記ポリチオールの塩を酸によりポリチオールに転換することによって式(4)で表されるポリチオール化合物、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物からなる群から選択される一種以上のポリチオール化合物を得る工程5を含むポリチオール化合物の製造方法が提供される。
Description
本発明は、ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法に関する。
ポリチオール化合物は、各種樹脂を得るための合成原料として広く用いられている。例えば、ポリチオール化合物をポリイソ(チオ)シアネート化合物と硬化反応することにより、ポリチオウレタン系樹脂を合成することができる(例えば特許文献1の段落0004参照)。
特許第5319037号明細書
特許文献1に記載されているように、ポリチオール化合物は、2-メルカプトエタノールを出発原料として製造することができる。しかるに本発明者らがポリチオール化合物の製造方法について検討を重ねたところ、従来のポリチオール化合物の合成方法には、
(1)生産性向上のためには収率の更なる改善が求められること、
(2)製造されるポリチオール化合物の着色の低減が求められること、
という課題があることが明らかとなった。
(1)生産性向上のためには収率の更なる改善が求められること、
(2)製造されるポリチオール化合物の着色の低減が求められること、
という課題があることが明らかとなった。
本発明の一態様は、着色が低減されたポリチオール化合物を高収率で製造することが可能なポリチオール化合物の製造方法を提供する。
本発明者らは鋭意検討を重ねる中で、ポリチオール化合物の着色および収率低下には、ポリチオール化合物の出発原料である2-メルカプトエタノールに含まれる水分が大きく影響するとの、従来知られていなかった新たな知見を得た。そして本発明者らは、かかる知見に基づき更に鋭意検討を重ねた結果、本発明の一態様にかかるポリチオール化合物の製造方法を見出すに至った。
即ち、本発明の一態様は、以下のポリチオール化合物の製造方法に関する。
質量基準の含水率(以下、単に「含水率」ともいう。)が3000ppm以下の2-メルカプトエタノールと、エピハロヒドリンと、を反応させて、式(1)で表されるハロゲン化物を得る工程1;
[式(1)中、Xはハロゲン原子を表す]
式(1)で表されるハロゲン化物をアルカリ金属硫化物およびアルカリ金属水酸化物からなる群から選択されるアルカリ金属化合物と反応させて、式(2)で表されるポリオール化合物および式(3)で表されるポリオール化合物からなる群から選択されるポリオール化合物を得る工程2;
上記ポリオール化合物を酸存在下でチオ尿素と反応させて、イソチウロニウム塩を得る工程3;
上記イソチウロニウム塩を塩基存在下で加水分解することによって、ポリチオールの塩を得る工程4;ならびに、
上記ポリチオールの塩を酸によりポリチオールに転換することによって、式(4)で表されるポリチオール化合物、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物からなる群から選択される一種以上のポリチオール化合物を得る工程5;
を含む、ポリチオール化合物の製造方法。
質量基準の含水率(以下、単に「含水率」ともいう。)が3000ppm以下の2-メルカプトエタノールと、エピハロヒドリンと、を反応させて、式(1)で表されるハロゲン化物を得る工程1;
式(1)で表されるハロゲン化物をアルカリ金属硫化物およびアルカリ金属水酸化物からなる群から選択されるアルカリ金属化合物と反応させて、式(2)で表されるポリオール化合物および式(3)で表されるポリオール化合物からなる群から選択されるポリオール化合物を得る工程2;
上記イソチウロニウム塩を塩基存在下で加水分解することによって、ポリチオールの塩を得る工程4;ならびに、
上記ポリチオールの塩を酸によりポリチオールに転換することによって、式(4)で表されるポリチオール化合物、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物からなる群から選択される一種以上のポリチオール化合物を得る工程5;
を含む、ポリチオール化合物の製造方法。
本発明の一態様によれば、各種樹脂の合成原料として有用なポリチオール化合物の着色低減および高収率での製造が可能となる。
[ポリチオール化合物の製造方法]
以下、上記の本発明の一態様にかかるポリチオール化合物の製造方法について、更に詳細に説明する。
以下、上記の本発明の一態様にかかるポリチオール化合物の製造方法について、更に詳細に説明する。
即ち、工程1では、下記反応スキーム例1により、式(1)で表されるハロゲン化物を得ることができる。
上記のエピハロヒドリン中および式(1)中のXは、ハロゲン原子を表す。ハロゲン原子は、例えばフッ素原子、塩素原子、臭素原子、ヨウ素原子であり、塩素原子および臭素原子が好ましい。例えば、工程1においてエピハロヒドリンとしてエピクロロヒドリン(X=塩素原子)を用いることにより、式(1)中のXが塩素原子であるハロゲン化物を得ることができる。また、工程1においてエピハロヒドリンとしてエピブロモヒドリン(X=臭素原子)を用いることにより、式(1)中のXが臭素原子であるハロゲン化物を得ることができる。
そして工程1では、2-メルカプトエタノールとして、質量基準の含水率が3000ppm以下の2-メルカプトエタノールを用いる。これにより、ポリチオール化合物の収率を向上することができ、かつ着色が低減されたポリチオール化合物の提供も可能となる。これらの観点から、2-メルカプトエタノールの含水率は、好ましくは2800ppm以下であり、より好ましくは2500ppm以下であり、更に好ましくは2300ppm以下であり、一層好ましくは2000ppm以下であり、より一層好ましくは1800ppm以下であり、更に一層好ましくは1500ppm以下であり、更により一層好ましくは1300ppm以下であり、更になおより一層好ましくは1000ppm以下である。また、2-メルカプトエタノールの含水率は、例えば300ppm以上または500ppm以上であることができるが、収率向上および着色低減のためには低いほど好ましいため、上記で例示した下限を下回ってもよい。なお、以下は本発明者らによる推察に過ぎないが、2-メルカプトエタノール中の水分がエピハロヒドリンの加水分解を引き起こすことが、最終的なポリチオール化合物の着色および収率低下をもたらすのではないかと本発明者らは推察している。これに対し含水率が3000ppm以下である低含水率の2-メルカプトエタノールを用いることによりエピハロヒドリンの加水分解を抑制できることが、着色が低減されたポリチオール化合物を高収率で製造できることに寄与すると本発明者らは考えている。ただし以上は推察であって、本発明を何ら限定するものではない。
本発明および本明細書における2-メルカプトエタノールの含水率とは、カールフィッシャー法により、温度20~25℃および絶対湿度0.8~1.2g/m3の環境下で水分気化装置を用いて行う測定によって求められる値である。カールフィッシャー法による含水率測定は、電量滴定方式で行ってもよく、容量滴定方式で行ってもよい。
2-メルカプトエタノールの含水率低減方法としては、例えば、蒸留による精製、硫酸マグネシウム、硫酸ナトリウム等の無機塩無水物による脱水、モレキュラーシーブによる脱水等の方法の1つまたは2つ以上を組み合わせて用いることができる。これにより、含水率が3000ppm以下の2-メルカプトエタノールを得ることができる。
工程1における2-メルカプトエタノールとエピハロヒドリンとの反応は、好ましくは触媒存在下で行われる。触媒としては、公知の各種触媒を用いることができ、第三級アミンを用いることが好ましい。第三級アミンとしては、第三級アルキルアミンが好ましい。好ましい第三級アミンの具体例としては、トリメチルアミン、トリエチルアミン、トリプロピルアミン、トリブチルアミン、N,N-ジメチルシクロヘキシルアミン、N,N-ジシクロヘキシルメチルアミン等を挙げることができ、中でもトリエチルアミン、トリプロピルアミン、トリブチルアミンがより好ましく、トリエチルアミン、トリブチルアミンが更に好ましい。
工程1における反応温度および後述の工程2における反応温度は、例えば0~60℃程度とすることができる。工程1における反応時間は、例えば0.5~10時間程度とすることができる。なお本発明および本明細書における「反応温度」とは、反応液の液温をいい、「内温」とも記載する。
一態様では、工程1は、例えば次のように行うことができる。まず2-メルカプトエタノールを混合して混合液を得る。ここで触媒を混合することが好ましく、第三級アミンを混合することがより好ましい。また必要に応じて溶媒(例えばアルコール等)を添加してもよい。その後、上記混合液にエピハロヒドリンを添加する。エピハロヒドリンは、上記混合液に滴下することによって添加することが好ましい。滴下時間は、例えば0.1~5時間程度とすることができるが、特に限定されるものではない。滴下中、必要に応じて混合液を撹拌してもよい。エピハロヒドリンは、2-メルカプトエタノール1.0モルに対して、例えば0.5~3.0モル、好ましくは0.7~2.0モル、より好ましくは0.9~1.1モルの範囲の割合で用いて2-メルカプトエタノールと反応させることができる。第三級アミンは、エピハロヒドリン1.0モルに対して、例えば0.005~0.1モル程度の量で使用することができる。上記混合液は、エピハロヒドリンの添加後に必要に応じて0.5~10時間程度熟成させてもよい。熟成中、混合液は静置してもよく撹拌してもよい。なお工程1において、第三級アミンとしては一種または二種以上の第三級アミンを用いることができる。二種以上の第三級アミンを用いる場合の第三級アミン量は、それら二種以上の第三級アミンの合計含有量をいうものとする。本発明および本明細書において、特記しない限り、異なる構造を取り得る成分は一種用いてもよく二種以上を用いてもよい。かかる成分を二種以上用いる場合の含有量は、二種以上の合計含有量をいうものとする。
<工程2>
次に、工程2について説明する。
工程2は、工程1で得られた式(1)で表されるハロゲン化物を、アルカリ金属硫化物およびアルカリ金属水酸化物からなる群から選択されるアルカリ金属化合物と反応させて、式(2)で表されるポリオール化合物および式(3)で表されるポリオール化合物からなる群から選択されるポリオール化合物を得る工程である。
次に、工程2について説明する。
工程2は、工程1で得られた式(1)で表されるハロゲン化物を、アルカリ金属硫化物およびアルカリ金属水酸化物からなる群から選択されるアルカリ金属化合物と反応させて、式(2)で表されるポリオール化合物および式(3)で表されるポリオール化合物からなる群から選択されるポリオール化合物を得る工程である。
例えば、アルカリ金属化合物として硫化ナトリウムを用いる場合を例に取ると、工程2において、下記反応スキーム例2により式(2)で表されるポリオール化合物を得ることができる。なお以下の反応スキーム例に記載の数値は、モル基準である。
また、アルカリ金属化合物として水酸化ナトリウムを用いる場合を例に取ると、工程2において、下記反応スキーム例3により式(3)で表されるポリオール化合物を得ることができる。
工程1の反応後、反応により得られた目的物(工程1においては式(1)で表されるハロゲン化物)を含む反応液をそのまま次工程(工程2)に用いてもよく、工程1の反応後の反応液を公知の方法で精製して目的物を単離するか濃度を高めた後に次工程に用いることもできる。または、工程1の反応後の反応液を溶媒(例えばトルエン等)で希釈して次工程に用いることもできる。以上の点は、工程2~工程4の反応後についても、同様である。上記アルカリ金属化合物としてアルカリ金属水酸化物を用いる態様では、反応スキーム例3で例示されているように、式(3)で表されるポリオール化合物を得るために2-メルカプトエタノールを要する。この2-メルカプトエタノールは、工程1の反応後に未反応で残留した2-メルカプトエタノールであってもよく、工程2のために添加してもよい。工程2において式(3)で表されるポリオール化合物を得る際の2-メルカプトエタノール量は、式(1)で表されるハロゲン化物1.0モルに対して、例えば0.5~3.0モル、好ましくは0.7~2.0モル、より好ましくは0.9~1.1モルの範囲とすることができる。2-メルカプトエタノールを工程2のために反応液に新たに添加する場合、添加される2-メルカプトエタノールの含水率も、3000ppm以下であることが好ましく、工程1に関して上記した範囲にあることがより好ましい。
上記の反応スキーム例2、3では、アルカリ金属硫化物およびアルカリ金属水酸化物からなる群から選択されるアルカリ金属化合物に含まれるアルカリ金属原子がナトリウム原子である例を示した。ただし、上記アルカリ金属化合物に含まれるアルカリ金属原子は、他のアルカリ金属原子、例えばリチウム原子、カリウム原子等であってもよい。上記アルカリ金属化合物は、式(1)で表されるハロゲン化物1.0モルに対して、反応スキーム例2では例えば0.2~2.0モル、好ましくは0.3~1.2モル、より好ましくは0.4~0.6モルの範囲の割合で、反応スキーム例3では例えば0.5~3.0モル、好ましくは0.7~2.0モル、より好ましくは0.9~1.1モルの範囲の割合で用いて式(1)で表されるハロゲン化物と反応させることができる。なお上記アルカリ金属化合物は、水和物の形態であってもよい。水和物についての量は、水和水を含む量をいうものとする。上記アルカリ金属化合物は、工程2の反応のためにそのまま用いてもよく、水溶液等の溶液の形態で用いてもよい。一態様では、上記アルカリ金属化合物の溶液を、式(1)で表されるハロゲン化物を含む反応液へ滴下することによって添加することができる。滴下時間は、例えば0.1~5時間程度とすることができるが、特に限定されるものではない。滴下中、必要に応じて反応液を撹拌してもよい。かかる反応液は、上記アルカリ金属化合物の添加後に必要に応じて0.5~10時間程度熟成させてもよい。熟成中、反応液は静置してもよく撹拌してもよい。
<工程3>
次に、工程3について説明する。
工程3は、工程2で得られた上記ポリオール化合物を酸存在下でチオ尿素と反応させて、イソチウロニウム塩を得る工程である。なお「イソチウロニウム塩」とは、イソチオ尿素の第4級塩である。酸として塩酸を用いる場合を例に取ると、例えば、式(2)で表されるポリオール化合物を酸存在下でチオ尿素と反応させると、下記反応スキーム例4に示すイソチウロニウム塩を得ることができる。なお反応スキーム例4では、ポリチオール化合物(5)の骨格を有するイソチウロニウム塩を示しているが、この反応においては、ポリチオール化合物(5)の骨格を有するイソチウロニウム塩、ポリチオール化合物(6)の骨格を有するイソチウロニウム塩およびポリチオール化合物(7)の骨格を有するイソチウロニウム塩からなる群から選ばれる少なくとも一種のイソチウロニウム塩を得ることができ、転位反応が起こることで、上記イソチウロニウム塩の中の二種または三種が得られ得る。
次に、工程3について説明する。
工程3は、工程2で得られた上記ポリオール化合物を酸存在下でチオ尿素と反応させて、イソチウロニウム塩を得る工程である。なお「イソチウロニウム塩」とは、イソチオ尿素の第4級塩である。酸として塩酸を用いる場合を例に取ると、例えば、式(2)で表されるポリオール化合物を酸存在下でチオ尿素と反応させると、下記反応スキーム例4に示すイソチウロニウム塩を得ることができる。なお反応スキーム例4では、ポリチオール化合物(5)の骨格を有するイソチウロニウム塩を示しているが、この反応においては、ポリチオール化合物(5)の骨格を有するイソチウロニウム塩、ポリチオール化合物(6)の骨格を有するイソチウロニウム塩およびポリチオール化合物(7)の骨格を有するイソチウロニウム塩からなる群から選ばれる少なくとも一種のイソチウロニウム塩を得ることができ、転位反応が起こることで、上記イソチウロニウム塩の中の二種または三種が得られ得る。
また、例えば、式(3)で表されるポリオール化合物を酸存在下でチオ尿素と反応させると、下記反応スキーム例5に示す、ポリチオール化合物(4)の骨格を有するイソチウロニウム塩を得ることができる。
上記反応スキーム例4、5では、酸として塩化水素(HCl)を用いる例を示したが、工程3で用いる酸は塩化水素に限定されるものではなく、各種無機酸および有機酸を用いることができる。無機酸としては塩化水素、硫酸等、有機酸としてはギ酸等を例示できる。酸の添加形態は問わないが、例えば水溶液として添加することができる。上記水溶液における酸濃度は、特に限定されるものではないが、例えば10~80質量%程度とすることができる。工程3において、上記ポリオール化合物1.0モル(二種以上の上記ポリオール化合物を含む反応液においては、それらの合計量1.0モル)に対して、酸は、例えば2.0~12.0モル、好ましくは3.0~8.0モル、チオ尿素は、反応スキーム例4においては例えば3.0~6.0モル、好ましくは4.5~5.5モルの割合で、反応スキーム例5においては例えば2.0~5.0モル、好ましくは3.5~4.5モル用いることができる。工程3において反応温度は、例えば40℃から還流温度、好ましくは90~120℃程度とすることができ、反応時間は、例えば1~24時間程度とすることができる。
<工程4>
次に、工程4について説明する。
工程4は、工程3で得られた上記イソチウロニウム塩を塩基存在下で加水分解することによって、ポリチオールの塩を得る工程である。ここで得られるポリチオールの塩は、式(4)、式(5)、式(6)、または式(7)で表されるポリチオール化合物の構造において1分子中に3個または4個存在するチオール基(-SH)の1個以上のチオール基の水素原子が置換された構造を有する塩である。工程4において、異なる構造の二種以上のポリチオールの塩を得ることもできる。上記ポリチオールの塩は、ポリチオールのアルカリ金属塩またはポリチオールのアンモニウム塩であることが好ましい。塩の種類は、加水分解に用いる塩基の種類によって調整可能である。一例として、上記ポリチオールの塩としてアルカリ金属塩を得る態様について、以下に説明する。
ポリチオールのアルカリ金属塩とは、工程3で得られたイソチウロニウム塩が加水分解された結果、分子末端にチオール基のアルカリ金属塩(-SM;Mはアルカリ金属原子を表す)が導入された構造を有する。例えば、ポリチオール化合物(5)の骨格を有するイソチウロニウム塩を、塩基として水酸化ナトリウムを用いて加水分解することにより、下記反応スキーム例6に示すポリチオールのアルカリ金属塩(ナトリウム塩)を得ることができる。
次に、工程4について説明する。
工程4は、工程3で得られた上記イソチウロニウム塩を塩基存在下で加水分解することによって、ポリチオールの塩を得る工程である。ここで得られるポリチオールの塩は、式(4)、式(5)、式(6)、または式(7)で表されるポリチオール化合物の構造において1分子中に3個または4個存在するチオール基(-SH)の1個以上のチオール基の水素原子が置換された構造を有する塩である。工程4において、異なる構造の二種以上のポリチオールの塩を得ることもできる。上記ポリチオールの塩は、ポリチオールのアルカリ金属塩またはポリチオールのアンモニウム塩であることが好ましい。塩の種類は、加水分解に用いる塩基の種類によって調整可能である。一例として、上記ポリチオールの塩としてアルカリ金属塩を得る態様について、以下に説明する。
ポリチオールのアルカリ金属塩とは、工程3で得られたイソチウロニウム塩が加水分解された結果、分子末端にチオール基のアルカリ金属塩(-SM;Mはアルカリ金属原子を表す)が導入された構造を有する。例えば、ポリチオール化合物(5)の骨格を有するイソチウロニウム塩を、塩基として水酸化ナトリウムを用いて加水分解することにより、下記反応スキーム例6に示すポリチオールのアルカリ金属塩(ナトリウム塩)を得ることができる。
また、ポリチオール化合物(4)の骨格を有するイソチウロニウム塩を、塩基として水酸化ナトリウムを用いて加水分解することにより、下記反応スキーム例7に示すポリチオールのアルカリ金属塩(ナトリウム塩)を得ることができる。
上記反応スキーム例6、7では、塩基として水酸化ナトリウムを用いる例を示したが、工程4で用いる塩基は水酸化ナトリウムに限定されるものではなく、各種塩基を用いることができる。塩基は、好ましくは無機塩基である。無機塩基としては、水酸化ナトリウム、水酸化カリウム、アンモニア等を例示できる。塩基の添加形態は問わないが、水溶液として添加することが好ましい。水溶液として塩基を添加することにより、塩基の存在下、この水溶液に含まれている水により上記イソチウロニウム塩を加水分解することができる。上記水溶液における塩基濃度は、特に限定されるものではないが、例えば 10~60質量%程度とすることができる。塩基は、工程3で用いた酸1.0モルに対して、例えば1.0~4.0モル、好ましくは1.0~3.0モル、より好ましくは1.2~2.0モルの割合で用いることができる。なお工程3の反応後の上記イソチウロニウム塩を含む反応液には、有機溶媒を加えることができる。また有機溶媒は、工程3の反応後のどの段階でも任意に添加することができる。有機溶媒の添加量は、例えば、工程3の反応後の反応液の量に対して、体積基準で0.2~3.0倍量程度とすることができる。有機溶媒としては、例えば、トルエン、キシレン、クロロベンゼン、ジクロロベンゼン等を挙げることができ、トルエンが好ましい。工程4において反応温度は、例えば10~80℃程度とすることができ、反応時間は、例えば1~10時間程度とすることができる。
<工程5>
次に、工程5について説明する。
工程5は、工程4で得られたポリチオールの塩を酸によりポリチオールに転換する工程である。これにより、式(4)で表されるポリチオール化合物、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物からなる群から選択される一種以上のポリチオール化合物を得ることができる。例えば、反応スキーム例6に示したポリチオールナトリウム塩を、酸として塩化水素(HCl)を用いてポリチオールに転換して式(5)で表されるポリチオール化合物を得る反応スキーム例8を、以下に示す。
次に、工程5について説明する。
工程5は、工程4で得られたポリチオールの塩を酸によりポリチオールに転換する工程である。これにより、式(4)で表されるポリチオール化合物、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物からなる群から選択される一種以上のポリチオール化合物を得ることができる。例えば、反応スキーム例6に示したポリチオールナトリウム塩を、酸として塩化水素(HCl)を用いてポリチオールに転換して式(5)で表されるポリチオール化合物を得る反応スキーム例8を、以下に示す。
また、反応スキーム例6に示したポリチオールナトリウム塩を、酸として塩化水素(HCl)を用いてポリチオールに転換して式(4)で表されるポリチオール化合物を得る反応スキーム例9を、以下に示す。
上記反応スキーム例8、9では、酸として塩化水素を用いる例を示したが、工程5で用いる酸は塩化水素に限定されるものではなく、各種無機酸および有機酸を用いることができる。工程5で用いる酸の詳細については、工程3における酸について記載した通りである。工程5における酸によるポリチオールへの転換は、好ましくは酸を水溶液として用いて行うことができ、より好ましくは酸洗浄により行うことができる。酸洗浄の後に水洗浄を行うことが好ましく、酸洗浄を2回またはそれ以上行い、酸洗浄の間に水洗を行うことがより好ましい。工程5を行う環境の雰囲気温度は特に限定されるものではなく、工程5は、例えば雰囲気温度10~60℃、好ましくは20~45℃の環境下で行うことができる。また、いずれかの工程において有機溶媒を用いた場合には、公知の方法で、工程5の後の反応液から有機溶媒を留去する工程を行ってもよい。その他、濾過、蒸留等の後工程を公知の方法で行うこともできる。
上記の各工程は、大気中で行うことができ、大気中以外の雰囲気下、例えば窒素雰囲気下で行うこともできる。
以上記載した工程により、式(4)で表されるポリチオール化合物、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物を一種、または二種以上の混合物として得ることができる。なおポリチオール化合物の着色の程度は、例えば、JIS Z8781-4:2013に規定されているb*値により評価することができる。b*値は、値が小さいほど着色が少ないことを示す。本発明の一態様にかかるポリチオール化合物の製造方法によれば、例えばb*値が2.5以下(例えば0.5~2.5)のポリチオール化合物を得ることができる。また、本発明の一態様にかかるポリチオール化合物の製造方法では、工程1において含水率が3000ppm以下の2-メルカプトエタノールを用いることにより、含水率が3000ppmを超える2-メルカプトエタノールを用いる場合と比べて収率の向上を達成することもできる。上記ポリチオール化合物が二種以上の混合物として得られた場合、公知の単離方法により各ポリチオール化合物を単離してもよく、混合物として各種樹脂の合成原料として用いてもよい。本発明の一態様にかかるポリチオール化合物の製造方法により得られる式(4)、(5)、(6)、(7)で表されるポリチオール化合物は、いずれも1分子中に3個または4個のチオール基を有する多官能ポリチオール化合物である。かかる多官能ポリチオール化合物が、ポリイソ(チオ)シアネート化合物と硬化反応して得られる硬化物(ポリチオウレタン系樹脂)は、高屈折率、高耐熱性等の、眼鏡レンズ等の光学部材として好ましい各種物性を有することができる。
[硬化性組成物および硬化物]
本発明の一態様は、上記製造方法によって得られたポリチオール化合物と、ポリイソ(チオ)シアネート化合物と、を含む硬化性組成物に関する。
更に本発明の一態様は、上記硬化性組成物を硬化した硬化物に関する。
上記硬化性組成物および硬化物については、以下の硬化性組成物の製造方法および硬化物の製造方法に関する記載を参照することができる。
本発明の一態様は、上記製造方法によって得られたポリチオール化合物と、ポリイソ(チオ)シアネート化合物と、を含む硬化性組成物に関する。
更に本発明の一態様は、上記硬化性組成物を硬化した硬化物に関する。
上記硬化性組成物および硬化物については、以下の硬化性組成物の製造方法および硬化物の製造方法に関する記載を参照することができる。
[硬化性組成物の製造方法]
本発明の一態様は、
上記の本発明の一態様にかかるポリチオール化合物の製造方法によりポリチオール化合物を製造する工程と、
製造されたポリチオール化合物をポリイソ(チオ)シアネート化合物と混合して硬化性組成物を調製する工程と、
を含む硬化性組成物の製造方法、
に関する。上記製造方法により得られる硬化性組成物を硬化することにより、硬化物として、眼鏡レンズ等の光学部材の材料として有用なポリチオウレタン系樹脂を得ることができる。以下に、上記硬化性組成物の製造方法について、更に詳細に説明する。
本発明の一態様は、
上記の本発明の一態様にかかるポリチオール化合物の製造方法によりポリチオール化合物を製造する工程と、
製造されたポリチオール化合物をポリイソ(チオ)シアネート化合物と混合して硬化性組成物を調製する工程と、
を含む硬化性組成物の製造方法、
に関する。上記製造方法により得られる硬化性組成物を硬化することにより、硬化物として、眼鏡レンズ等の光学部材の材料として有用なポリチオウレタン系樹脂を得ることができる。以下に、上記硬化性組成物の製造方法について、更に詳細に説明する。
ポリチオール化合物を製造する工程の詳細は、先に本発明の一態様にかかるポリチオール化合物の製造方法について記載した通りである。こうして製造されたポリチオール化合物を、ポリイソ(チオ)シアネート化合物と混合することにより、硬化性組成物を調製することができる。本発明および本明細書において、「ポリイソ(チオ)シアネート化合物」とは、ポリイソシアネート化合物とポリイソチオシアネート化合物とを包含する意味で用いるものとする。なお、イソシアネートはイソシアナートと呼ばれることもあり、イソチオシアネートはイソチオシアナートと呼ばれることもある。また、「イソ(チオ)シアネート基」とは、イソシアネート基(-N=C=O)とイソチオシアネート基(-N=C=S)とを包含する意味で用いるものとする。「ポリイソ(チオ)シアネート化合物」とは、イソ(チオ)シアネート基を1分子中に2個以上有する多官能化合物である。ポリチオール化合物とポリイソ(チオ)シアネート化合物とを硬化反応させることにより、ポリチオール化合物が有するチオール基と、ポリイソ(チオ)シアネート化合物が有するイソ(チオ)シアネート基とが反応し、分子内に以下の結合:
を有する反応生成物を得ることができる。上記において、Zは酸素原子または硫黄原子である。チオール基がイソシアネート基と反応することによりXが酸素原子の上記結合が形成され、イソチオシアネート基と反応することによりXが硫黄原子の上記結合が形成される。本発明および本明細書では、上記結合を1分子中に複数含む反応生成物(樹脂)を、「ポリチオウレタン系樹脂」と記載する。
ポリイソ(チオ)シアネート化合物としては、脂肪族ポリイソ(チオ)シアネート化合物、脂環族ポリイソ(チオ)シアネート化合物、芳香族ポリイソ(チオ)シアネート化合物等の各種ポリイソ(チオ)シアネート化合物を用いることができる。ポリイソ(チオ)シアネート化合物の1分子中に含まれるイソ(チオ)シアネート基の数は、2個以上であり、好ましくは2~4個であり、より好ましくは2個または3個である。ポリイソ(チオ)シアネート化合物の具体例としては、例えば特許第5319037号公報段落0052にポリイソ(チオ)シアナート化合物として例示されている各種化合物を挙げることができる。好ましいポリイソ(チオ)シアネート化合物としては、ヘキサメチレンジイソシアネート、1,5-ペンタンジイソシアネート、イソホロンジイソシアネート、ビス(イソシアナトメチル)シクロヘキサン、ジシクロヘキシルメタンジイソシアネート、2,5-ビス(イソシアナトメチル)-ビシクロ[2.2.1]ヘプタン、2,6-ビス(イソシアナトメチル)-ビシクロ[2.2.1]ヘプタン、ビス(4-イソシアナトシクロへキシル)メタン、1,3-ビス(イソシアナトメチル)シクロヘキサン、1,4-ビス(イソシアナトメチル)シクロヘキサン等の脂肪族ポリイソシアネート化合物;ビス(イソシアナトメチル)ベンゼン、m-キシリレンジイソシアネート、p-キシリレンジイソシアネート、1,3-ジイソシアナトベンゼン、トリレンジイソシアネート、2,4-ジイソシアナトトルエン、2,6-ジイソシアナトトルエン、4,4'-メチレンビス(フェニルイソシアネート)等の芳香族ポリイソシアネート化合物を挙げることができる。更に、上記ポリイソ(チオ)シアネート化合物の塩素置換体、臭素置換体等のハロゲン置換体、アルキル置換体、アルコキシ置換体、ニトロ置換体や多価アルコールとのプレポリマー型変性体、カルボジイミド変性体、ウレア変性体、ビュレット変性体、ダイマー化またはトリマー化反応生成物等も使用できる。これらの化合物は単独で使用してもよく、二種以上を混合して使用してもよい。
上記硬化性組成物は、上記ポリチオール化合物をポリイソ(チオ)シアネート化合物と混合することにより調製することができる。上記硬化性組成物におけるポリチオール化合物とポリイソ(チオ)シアネート化合物との混合割合は、特に限定されないが、例えば、モル比として、ポリチオール化合物に含まれるチオール基/ポリイソ(チオ)シアネート化合物に含まれるイソ(チオ)シアネート基=0.5~3.0の範囲、好ましくは0.6~2.0、更に好ましくは0.8~1.3の範囲とすることができる。混合割合を上記範囲とすることは、高屈折率、高耐熱性等の各種優れた物性を有する硬化物を提供可能な硬化性組成物を得るうえで好ましい。また、一態様では、上記硬化性組成物は、上記ポリチオール化合物を、硬化性組成物全量100質量%に対して、例えば40質量%以上(例えば40~70質量%)含むことができる。
上記硬化性組成物の調製時に、上記ポリチオール化合物およびポリイソ(チオ)シアネート化合物以外の一種以上の他の成分を混合してもよい。そのような他の成分の具体例としては、例えば、ポリチオール化合物とポリイソ(チオ)シアネート化合物との硬化反応の反応触媒等を例示できる。混合してもよい他の成分については、例えば特許第5319037号公報段落0055、0057、0058~0064を参照できる。また、一般にポリチオウレタン系樹脂等の各種樹脂の添加剤として市販されている添加剤の一種以上を用いることもできる。上記硬化性組成物の調製は、以上説明した各種成分を同時に、または任意の順序で順次、混合して行うことができる。調製方法は特に限定されるものではなく、硬化性組成物の調製方法として公知の方法を、何ら制限なく採用することができる。
[硬化物の製造方法]
本発明の一態様は、
上記の本発明の一態様にかかる硬化性組成物の製造方法によって硬化性組成物を製造する工程と、
製造された硬化性組成物を硬化して硬化物を得る工程と、
を含む硬化物の製造方法、
に関する。以下に、上記硬化物の製造方法について、更に詳細に説明する。
本発明の一態様は、
上記の本発明の一態様にかかる硬化性組成物の製造方法によって硬化性組成物を製造する工程と、
製造された硬化性組成物を硬化して硬化物を得る工程と、
を含む硬化物の製造方法、
に関する。以下に、上記硬化物の製造方法について、更に詳細に説明する。
上記硬化性組成物を製造する工程の詳細は、先に本発明の一態様にかかる硬化性組成物の製造方法について記載した通りである。こうして製造された硬化性組成物を硬化することにより、硬化物として、眼鏡レンズ等の光学部材の材料として有用なポリチオウレタン系樹脂を得ることができる。本発明者らの検討によれば、上記の本発明の一態様にかかるポリチオール化合物の製造方法により得られたポリチオール化合物を合成原料として用いることにより、着色が低減されたポリチオウレタン系樹脂が得られることも明らかとなった。樹脂の着色の程度は、例えばJIS K 7373:2006に規定されているYI値により評価することができる。YI値は、値が小さいほど着色が少ないことを示す。本発明の一態様にかかるポリチオール化合物の製造方法により得られたポリチオール化合物を合成原料として用いることにより、例えばYI値が2.0未満(例えば1.8以下、一例として0.5~1.8)のポリチオウレタン系樹脂(硬化物)を得ることができる。
上記ポリチオール化合物とポリイソ(チオ)シアネート化合物との硬化反応は、硬化性組成物を硬化可能な各種硬化処理により行うことができる。例えば、レンズ形状を有する硬化物(「プラスチックレンズ」とも呼ばれる。)を製造するためには、注型重合が好ましい。注型重合では、所定の間隔をもって対向する2つのモールドと、上記間隔を閉塞することにより形成されたキャビティを有する成形型のキャビティへ硬化性組成物を注入し、このキャビティ内で硬化性組成物の重合(硬化反応)を行い硬化物を得ることができる。注型重合に使用可能な成形型の詳細については、例えば特開2009-262480号公報段落0012~0014および同公報の図1を参照できる。なお上記公報では、2つのモールドの間隔を、封止部材としてガスケットにより閉塞した成形型が示されているが、封止部材としてはテープを用いることもできる。
一態様では、注型重合は、次のように行うことができる。硬化性組成物を、成形型側面に設けた注入口から成形型キャビティに注入する。注入後、硬化性組成物を、好ましくは加熱により重合(硬化反応)させることで、硬化性組成物が硬化し、キャビティの内部形状が転写された硬化物を得ることができる。重合条件は、特に限定されるものではなく、硬化性組成物の組成等に応じて適宜設定することができる。一例として、硬化性組成物をキャビティに注入した成形型を、加熱温度20~150℃で1~72時間程度加熱することができるが、この条件に限定されるものではない。なお本発明および本明細書において、注型重合に関する加熱温度等の温度とは、成形型が配置される雰囲気温度をいう。また、加熱中に、任意の昇温速度で昇温することができ、任意の降温速度で降温(冷却)することができる。重合(硬化反応)終了後、キャビティ内部の硬化物を成形型から離型する。注型重合において通常行われているように、キャビティを形成している上下モールドとガスケットまたはテープを任意の順序で取り外すことにより、硬化物を成形型から離型することができる。成形型から離型された硬化物は、好ましくは、眼鏡レンズのレンズ基材として用いることができる。なお眼鏡レンズのレンズ基材として用いられる硬化物は、通常、離型後に、アニーリング、丸め工程等の研削工程、研磨工程、耐衝撃性を向上させるためのプライマーコート層、表面硬度を上げるためのハードコート層等のコート層形成工程等の後工程に付すことができる。更に、反射防止層、撥水層等の各種機能性層を、レンズ基材上に形成することができる。これらの工程については、いずれも公知技術を何ら制限なく適用することができる。こうして、レンズ基材が上記硬化物である眼鏡レンズを得ることができる。更に、この眼鏡レンズをフレームに取り付けることにより、眼鏡を得ることができる。
次に、本発明を実施例により更に詳細に説明するが、本発明は実施例に示す態様に限定されるものではない。以下に記載の操作および評価は、特記しない限り、大気中室温下(20~25℃程度)で行った。また、以下に記載の%、部は、特記しない限り質量基準である。
実施例における各種物性の評価は、以下の方法により行った。
(1)2-メルカプトエタノールの含水率
実施例、比較例において工程1に付すために用いる2-メルカプトエタノールの含水率を、温度20~25℃および絶対湿度2~5g/m3以下の環境下で、カールフィッシャー水分測定装置(京都電子工業株式会社製自動水分測定装置MKC-610型)および水分気化装置(京都電子工業株式会社製水分気化装置ADP-611型)を用いて測定した。実施例で用いた2-メルカプトエタノールは、市販の2-メルカプトエタノールを蒸留し、モレキュラーシーブを添加して含水率を低減させた2-メルカプトエタノールである。
2-メルカプトエタノールは、上記の含水率測定後、1時間以内に工程1に付した(具体的には第三級アミンと混合した)。含水率の測定から工程1に付すまでの間に2-メルカプトエタノールの含水率は変化しないか変化するとしても変化量は検出限界以下である。また、通常の作業環境または保管環境であれば、2-メルカプトエタノールの含水率は変化しないか変化するとしても変化量は検出限界以下である。
実施例、比較例において工程1に付すために用いる2-メルカプトエタノールの含水率を、温度20~25℃および絶対湿度2~5g/m3以下の環境下で、カールフィッシャー水分測定装置(京都電子工業株式会社製自動水分測定装置MKC-610型)および水分気化装置(京都電子工業株式会社製水分気化装置ADP-611型)を用いて測定した。実施例で用いた2-メルカプトエタノールは、市販の2-メルカプトエタノールを蒸留し、モレキュラーシーブを添加して含水率を低減させた2-メルカプトエタノールである。
2-メルカプトエタノールは、上記の含水率測定後、1時間以内に工程1に付した(具体的には第三級アミンと混合した)。含水率の測定から工程1に付すまでの間に2-メルカプトエタノールの含水率は変化しないか変化するとしても変化量は検出限界以下である。また、通常の作業環境または保管環境であれば、2-メルカプトエタノールの含水率は変化しないか変化するとしても変化量は検出限界以下である。
(2)ポリチオール化合物の着色評価(b*値)
実施例、比較例で得られたポリチオール化合物のb*値を、株式会社日立製作所製分光光度計U-3500を用いて光路長10mmで測定した。
実施例、比較例で得られたポリチオール化合物のb*値を、株式会社日立製作所製分光光度計U-3500を用いて光路長10mmで測定した。
(3)硬化物(ポリチオウレタン系樹脂)の着色評価(YI値)
実施例、比較例で得られた硬化物(0.00D、中心肉厚1.8mm)のYI値を、株式会社村上色彩技術研究所製分光透過率測定器DOT-3を用いて測定した。
実施例、比較例で得られた硬化物(0.00D、中心肉厚1.8mm)のYI値を、株式会社村上色彩技術研究所製分光透過率測定器DOT-3を用いて測定した。
以下の実施例、比較例において目的のポリチオール化合物が得られたことは、GPC(ゲル浸透クロマトグラフィー)、HPLC(高速液体クロマトグラフィー)およびMS(質量分析)により確認した。
[実施例1]
(工程1)
表1に示す含水率の2-メルカプトエタノール78.1g(1.0モル)とトリエチルアミン2.0gの混合液に、エピクロロヒドリン92.5g(1.0モル)を、内温を35~40℃に保ちながら1時間かけて滴下し、内温40℃で1時間熟成を行った。なお実施例、比較例に記載の熟成は、反応液を撹拌して行った。
(工程2)
上記工程1の後の反応液に、硫化ナトリウム9水和物125.0g(0.5モル)を純水100gに溶解して調製した水溶液を、内温を40~45℃に保ちながら1時間かけて滴下し、更に内温5℃で1時間熟成を行った。
(工程3、工程4)
上記工程2の後の反応液に36%塩酸303.8g(3.0モル)とチオ尿素190.3g(2.5モル)を加えて内温110℃で9時間加熱撹拌した(工程3)。反応液を室温まで冷却後、トルエン400mlを加え、30%水酸化ナトリウム水溶液600.4g(4.5モル)を徐々に加え内温60℃で4時間加水分解を行った(工程4)。
(工程5)
上記工程4の後の反応液を静置して水層と有機層に分離した後、有機層を取り出し、この有機層を36%塩酸100ml、水100mlで2回、順次洗浄した。洗浄後の有機層中のトルエンを、ロータリーエバポレーターにて留去し、目的とするポリチオール化合物(透明の液体)を収量170.5g(収率93.0%)で得た。
(工程1)
表1に示す含水率の2-メルカプトエタノール78.1g(1.0モル)とトリエチルアミン2.0gの混合液に、エピクロロヒドリン92.5g(1.0モル)を、内温を35~40℃に保ちながら1時間かけて滴下し、内温40℃で1時間熟成を行った。なお実施例、比較例に記載の熟成は、反応液を撹拌して行った。
(工程2)
上記工程1の後の反応液に、硫化ナトリウム9水和物125.0g(0.5モル)を純水100gに溶解して調製した水溶液を、内温を40~45℃に保ちながら1時間かけて滴下し、更に内温5℃で1時間熟成を行った。
(工程3、工程4)
上記工程2の後の反応液に36%塩酸303.8g(3.0モル)とチオ尿素190.3g(2.5モル)を加えて内温110℃で9時間加熱撹拌した(工程3)。反応液を室温まで冷却後、トルエン400mlを加え、30%水酸化ナトリウム水溶液600.4g(4.5モル)を徐々に加え内温60℃で4時間加水分解を行った(工程4)。
(工程5)
上記工程4の後の反応液を静置して水層と有機層に分離した後、有機層を取り出し、この有機層を36%塩酸100ml、水100mlで2回、順次洗浄した。洗浄後の有機層中のトルエンを、ロータリーエバポレーターにて留去し、目的とするポリチオール化合物(透明の液体)を収量170.5g(収率93.0%)で得た。
実施例1では、工程1~5における反応は、反応スキーム例1、2、4、6、8に示すように進行させることができる。なお反応スキーム例4には式(5)で表されるポリチオール化合物の骨格を有するイソチウロニウム塩を示し、反応スキーム例6では同骨格を有するポリチオールのアルカリ金属塩を示し、反応スキーム例8では式(5)で表されるポリチオール化合物を示しているが、工程3において、先に記載したように転位反応が起こることにより、式(5)で表されるポリチオール化合物の骨格を有するイソチウロニウム塩、式(6)で表されるポリチオール化合物の骨格を有するイソチウロニウム塩、および式(7)で表されるポリチオール化合物の骨格を有するイソチウロニウム塩の混合物を得ることができ、その結果、工程5において、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物の混合物を得ることができる。収率は、工程1で用いた2-メルカプトエタノール量(1.0モル)から得られる式(5)~(7)で表されるポリチオール化合物の理論モル収量(0.5モル)から求めた理論収量を用いて、収率=(上記収量/理論収量)×100として算出した。実施例2~6、比較例1、2の収率も同様の方法で算出した。
[実施例2]
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例1と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量171.1g(収率93.3%)で得た。
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例1と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量171.1g(収率93.3%)で得た。
[実施例3]
工程1で用いるアミンとして、トリエチルアミン2.0gに代えてトリブチルアミン2.0gを用いた点以外、実施例2と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量165.4g(収率90.2%)で得た。
工程1で用いるアミンとして、トリエチルアミン2.0gに代えてトリブチルアミン2.0gを用いた点以外、実施例2と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量165.4g(収率90.2%)で得た。
[実施例4]
工程4で用いる塩基として、30%水酸化ナトリウム水溶液600.4gに代えて30%水酸化カリウム水溶液841.7gを用いた点以外、実施例2と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量162.8g(収率88.8%)で得た。
工程4で用いる塩基として、30%水酸化ナトリウム水溶液600.4gに代えて30%水酸化カリウム水溶液841.7gを用いた点以外、実施例2と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量162.8g(収率88.8%)で得た。
[実施例5]
工程1で用いるエピハロヒドリンとして、エピクロロヒドリン92.5gに代えてエピブロモヒドリン137.0gを用いた点以外、実施例2と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量157.0g(収率85.6%)で得た。
工程1で用いるエピハロヒドリンとして、エピクロロヒドリン92.5gに代えてエピブロモヒドリン137.0gを用いた点以外、実施例2と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量157.0g(収率85.6%)で得た。
[実施例6]
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例1と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量160.6g(収率87.6%)で得た。
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例1と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量160.6g(収率87.6%)で得た。
[比較例1]
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例1と同様の方法により、目的とするポリチオール化合物(黄色みを呈した透明の液体)を収量138.6g(収率75.6%)で得た。
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例1と同様の方法により、目的とするポリチオール化合物(黄色みを呈した透明の液体)を収量138.6g(収率75.6%)で得た。
[比較例2]
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例1と同様の方法により、目的とするポリチオール化合物を収量127.6g(収率69.6%)で得た。
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例1と同様の方法により、目的とするポリチオール化合物を収量127.6g(収率69.6%)で得た。
[実施例7]
(工程1)
表1に示す含水率の2-メルカプトエタノール78.1g(1.0モル)とトリブチルアミン2.0gの混合液に、エピクロロヒドリン92.6g(1.0モル)を、内温を35~40℃に保ちながら1時間かけて滴下し、内温40℃で1時間熟成を行った。
(工程2)
上記工程1の後の反応液に、表1に示す含水率の2-メルカプトエタノール78.1g(1.0モル)と45%水酸化ナトリウム水溶液88.8g(1.0モル)を、内温を40~45℃に保ちながら1時間かけて滴下し、内温を80℃に昇温後、1時間熟成を行った。
(工程3、4)
上記工程2の後の反応液に36%塩酸303.8g(3.0モル)とチオ尿素228.4g(3.0モル)を加えて内温110℃で2時間加熱撹拌した(工程3)。反応液を室温まで冷却後、トルエン200mlを加え、45%水酸化ナトリウム水溶液266.7g(3.0モル)を徐々に加え反応液を60℃で4時間加水分解を行った(工程4)。
(工程5)
上記工程4の後の反応液を静置して水層と有機層に分離した後、有機層を取り出し、この有機層を36%塩酸100ml、水100mlで2回、順次洗浄した。洗浄後の有機層中のトルエンを、ロータリーエバポレーターにて留去し、目的とするポリチオール化合物(透明の液体)を収量222.4g(収率85.4%)得た。
(工程1)
表1に示す含水率の2-メルカプトエタノール78.1g(1.0モル)とトリブチルアミン2.0gの混合液に、エピクロロヒドリン92.6g(1.0モル)を、内温を35~40℃に保ちながら1時間かけて滴下し、内温40℃で1時間熟成を行った。
(工程2)
上記工程1の後の反応液に、表1に示す含水率の2-メルカプトエタノール78.1g(1.0モル)と45%水酸化ナトリウム水溶液88.8g(1.0モル)を、内温を40~45℃に保ちながら1時間かけて滴下し、内温を80℃に昇温後、1時間熟成を行った。
(工程3、4)
上記工程2の後の反応液に36%塩酸303.8g(3.0モル)とチオ尿素228.4g(3.0モル)を加えて内温110℃で2時間加熱撹拌した(工程3)。反応液を室温まで冷却後、トルエン200mlを加え、45%水酸化ナトリウム水溶液266.7g(3.0モル)を徐々に加え反応液を60℃で4時間加水分解を行った(工程4)。
(工程5)
上記工程4の後の反応液を静置して水層と有機層に分離した後、有機層を取り出し、この有機層を36%塩酸100ml、水100mlで2回、順次洗浄した。洗浄後の有機層中のトルエンを、ロータリーエバポレーターにて留去し、目的とするポリチオール化合物(透明の液体)を収量222.4g(収率85.4%)得た。
実施例7では、工程1~5における反応は、反応スキーム例1、3、5、7、9に示すように進行させることができる。収率は、工程1で用いた2-メルカプトエタノール量(1.0モル)から得られる式(4)で表されるポリチオール化合物の理論モル収量(1.0モル)から求めた理論収量を用いて、収率=(上記収量/理論収量)×100として算出した。実施例8、比較例3の収率も同様の方法で算出した。
[実施例8]
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例7と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量214.4g(収率82.3%)で得た。
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例7と同様の方法により、目的とするポリチオール化合物(透明の液体)を収量214.4g(収率82.3%)で得た。
[比較例3]
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例7と同様の方法により、目的とするポリチオール化合物(黄色みを呈した透明の液体)を収量186.0g(収率71.4%)で得た。
表1に示す含水率の2-メルカプトエタノールを用いた点以外、実施例7と同様の方法により、目的とするポリチオール化合物(黄色みを呈した透明の液体)を収量186.0g(収率71.4%)で得た。
上記実施例、比較例で得られたポリチオール化合物のb*値を、先に記載した方法により測定した。
以上の結果を、表1に示す。表1の実施例1~6と比較例1、2との対比、および実施例7、8と比較例3との対比から、工程1において含水率3000ppm以下の2-メルカプトエタノールを用いることにより、b*値の大幅な低減(即ち着色の大幅な低減)および10%を超える大幅な収率の向上が達成されたことが確認できる。
[実施例9]
キシリレンジイソシアナート50.6部、硬化触媒としてジメチル錫ジクロライド0.01部、離型剤として酸性リン酸エステル(城北化学工業株式会社製JP-506H)0.20部、紫外線吸収剤(シプロ化成株式会社製シーソーブ701)0.5部を混合、溶解させた。更に、実施例1で得られたポリチオール化合物49.4部を添加混合し、混合液とした。この混合液を200Paにて1時間脱泡を行った後、孔径5.0μmのPTFE(ポリテトラフルオロエチレン)フィルターにて濾過を行った。濾過後の混合液(硬化性組成物)を、直径75mm、-4.00Dまたは0.00Dのガラスモールドとテープからなるレンズ用成形型へ注入した。この成形型を電気炉へ投入し、15℃から120℃まで20時間かけて徐々に昇温し、2時間保持して重合(硬化反応)させた。重合終了後、電気炉から成形型を取り出し、離型して硬化物(プラスチックレンズ)を得た。得られたプラスチックレンズを更に炉内温度120℃のアニール炉において3時間アニールを行った。
キシリレンジイソシアナート50.6部、硬化触媒としてジメチル錫ジクロライド0.01部、離型剤として酸性リン酸エステル(城北化学工業株式会社製JP-506H)0.20部、紫外線吸収剤(シプロ化成株式会社製シーソーブ701)0.5部を混合、溶解させた。更に、実施例1で得られたポリチオール化合物49.4部を添加混合し、混合液とした。この混合液を200Paにて1時間脱泡を行った後、孔径5.0μmのPTFE(ポリテトラフルオロエチレン)フィルターにて濾過を行った。濾過後の混合液(硬化性組成物)を、直径75mm、-4.00Dまたは0.00Dのガラスモールドとテープからなるレンズ用成形型へ注入した。この成形型を電気炉へ投入し、15℃から120℃まで20時間かけて徐々に昇温し、2時間保持して重合(硬化反応)させた。重合終了後、電気炉から成形型を取り出し、離型して硬化物(プラスチックレンズ)を得た。得られたプラスチックレンズを更に炉内温度120℃のアニール炉において3時間アニールを行った。
[比較例4]
ポリチオール化合物を比較例1で得られたポリチオール化合物に変更した点以外、実施例9と同様にプラスチックレンズを作製した。
ポリチオール化合物を比較例1で得られたポリチオール化合物に変更した点以外、実施例9と同様にプラスチックレンズを作製した。
[実施例10]
キシリレンジイソシアナート52.0部、硬化触媒としてジメチル錫ジラウレート0.05部、離型剤として酸性リン酸エステル(城北化学工業株式会社製JP-506H)0.20部、紫外線吸収剤(シプロ化成株式会社製シーソーブ701)0.5部を混合、溶解させた。更に、実施例7で得られたポリチオール化合物48.0部を添加混合し、混合液とした。この混合液を200Paにて1時間脱泡を行った後、孔径5.0μmのPTFE(ポリテトラフルオロエチレン)フィルターにて濾過を行った。濾過後の混合液(硬化性組成物)を、直径75mm、-4.00Dまたは0.00Dのガラスモールドとテープからなるレンズ用成形型へ注入した。この成形型を電気炉へ投入し、30℃から120℃まで20時間かけて徐々に昇温し、2時間保持して重合(硬化反応)させた。重合終了後、電気炉から成形型を取り出し、離型して硬化物(プラスチックレンズ)を得た。得られたプラスチックレンズを更に炉内温度120℃のアニール炉において3時間アニールを行った。
キシリレンジイソシアナート52.0部、硬化触媒としてジメチル錫ジラウレート0.05部、離型剤として酸性リン酸エステル(城北化学工業株式会社製JP-506H)0.20部、紫外線吸収剤(シプロ化成株式会社製シーソーブ701)0.5部を混合、溶解させた。更に、実施例7で得られたポリチオール化合物48.0部を添加混合し、混合液とした。この混合液を200Paにて1時間脱泡を行った後、孔径5.0μmのPTFE(ポリテトラフルオロエチレン)フィルターにて濾過を行った。濾過後の混合液(硬化性組成物)を、直径75mm、-4.00Dまたは0.00Dのガラスモールドとテープからなるレンズ用成形型へ注入した。この成形型を電気炉へ投入し、30℃から120℃まで20時間かけて徐々に昇温し、2時間保持して重合(硬化反応)させた。重合終了後、電気炉から成形型を取り出し、離型して硬化物(プラスチックレンズ)を得た。得られたプラスチックレンズを更に炉内温度120℃のアニール炉において3時間アニールを行った。
[比較例5]
ポリチオール化合物を比較例3で得られたポリチオール化合物に変更した点以外、実施例10と同様にプラスチックレンズを作製した。
ポリチオール化合物を比較例3で得られたポリチオール化合物に変更した点以外、実施例10と同様にプラスチックレンズを作製した。
上記実施例、比較例で得られたプラスチックレンズのYI値を、先に記載した方法により測定した。
以上の結果を、表2に示す。実施例9と比較例4との対比、および実施例10と比較例5との対比から、含水率3000ppm以下の2-メルカプトエタノールを用いて得たポリチオール化合物を合成原料とすることにより、YI値の大幅な低減(即ち着色の大幅な低減)が達成されたことが確認できる。
最後に、前述の各態様を総括する。
一態様によれば、質量基準の含水率が3000ppm以下の2-メルカプトエタノールと、エピハロヒドリンと、を反応させて、式(1)で表されるハロゲン化物を得る工程1;式(1)で表されるハロゲン化物をアルカリ金属硫化物およびアルカリ金属水酸化物からなる群から選択されるアルカリ金属化合物と反応させて、式(2)で表されるポリオール化合物および式(3)で表されるポリオール化合物からなる群から選択されるポリオール化合物を得る工程2;上記ポリオール化合物を酸存在下でチオ尿素と反応させて、イソチウロニウム塩を得る工程3;上記イソチウロニウム塩を塩基存在下で加水分解することによって、ポリチオールの塩を得る工程4;ならびに、上記ポリチオールの塩を酸によりポリチオールに転換することによって、式(4)で表されるポリチオール化合物、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物からなる群から選択される一種以上のポリチオール化合物を得る工程5、を含む、ポリチオール化合物の製造方法を提供することができる。
上記のポリチオール化合物の製造方法によれば、着色が低減されたポリチオール化合物を、高収率で提供することができる。
一態様では、上記アルカリ金属化合物は、硫化ナトリウムおよび水酸化ナトリウムからなる群から選択されるアルカリ金属化合物である。
一態様では、上記ポリチオールの塩は、ポリチオールのアルカリ金属塩およびポリチオールのアンモニウム塩からなる群から選択される塩である。
他の一態様によれば、上記製造方法によってポリチオール化合物を製造する工程と、製造されたポリチオール化合物をポリイソ(チオ)シアネート化合物と混合して硬化性組成物を調製する工程と、を含む硬化性組成物の製造方法も提供される。
上記硬化性組成物の製造方法によれば、着色が低減された硬化物を提供することが可能な硬化性組成物を得ることができる。
他の一態様によれば、上記製造方法によって硬化性組成物を製造する工程と、製造された硬化性組成物を硬化して硬化物を得る工程と、を含む硬化物の製造方法も提供される。
上記硬化物の製造方法によれば、着色が低減された硬化物を提供することができる。
一態様では、上記硬化工程は、上記硬化性組成物を注型重合に付すことにより行われる。
一態様では、上記硬化物は眼鏡レンズ基材である。
今回開示された実施の形態はすべての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は上記した説明ではなくて特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内でのすべての変更が含まれることが意図される。
本発明の一態様は、眼鏡レンズ等の各種光学部材の製造分野において有用である。
Claims (7)
- 質量基準の含水率が3000ppm以下の2-メルカプトエタノールと、エピハロヒドリンと、を反応させて、式(1)で表されるハロゲン化物を得る工程1;
式(1)で表されるハロゲン化物をアルカリ金属硫化物およびアルカリ金属水酸化物からなる群から選択されるアルカリ金属化合物と反応させて、式(2)で表されるポリオール化合物および式(3)で表されるポリオール化合物からなる群から選択されるポリオール化合物を得る工程2;
前記イソチウロニウム塩を塩基存在下で加水分解することによって、ポリチオールの塩を得る工程4;ならびに、
前記ポリチオールの塩を酸によりポリチオールに転換することによって、式(4)で表されるポリチオール化合物、式(5)で表されるポリチオール化合物、式(6)で表されるポリチオール化合物および式(7)で表されるポリチオール化合物からなる群から選択される一種以上のポリチオール化合物を得る工程5;
を含む、ポリチオール化合物の製造方法。
- 前記アルカリ金属化合物は、硫化ナトリウムおよび水酸化ナトリウムからなる群から選択されるアルカリ金属化合物である請求項1に記載のポリチオール化合物の製造方法。
- 前記ポリチオールの塩は、ポリチオールのアルカリ金属塩およびポリチオールのアンモニウム塩からなる群から選択される塩である請求項1または2に記載のポリチオール化合物の製造方法。
- 請求項1~3のいずれか1項に記載の製造方法によってポリチオール化合物を製造する工程と、
製造されたポリチオール化合物をポリイソ(チオ)シアネート化合物と混合して硬化性組成物を調製する工程と、
を含む硬化性組成物の製造方法。 - 請求項4に記載の製造方法によって硬化性組成物を製造する工程と、
製造された硬化性組成物を硬化して硬化物を得る工程と、
を含む硬化物の製造方法。 - 前記硬化工程を、前記硬化性組成物を注型重合に付すことにより行う請求項5に記載の硬化物の製造方法。
- 前記硬化物は眼鏡レンズ基材である、請求項5または6に記載の硬化物の製造方法。
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2018524658A JP6588639B2 (ja) | 2016-06-30 | 2016-06-30 | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
| EP16907292.3A EP3480185B1 (en) | 2016-06-30 | 2016-06-30 | Method for preparing polythiol compound, method for preparing curable composition, and method for producing cured product |
| PCT/JP2016/069443 WO2018003059A1 (ja) | 2016-06-30 | 2016-06-30 | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
| CN201680083976.7A CN108884028B (zh) | 2016-06-30 | 2016-06-30 | 多硫醇化合物的制造方法、固化性组合物的制造方法、及固化物的制造方法 |
| US16/171,476 US10975026B2 (en) | 2016-06-30 | 2018-10-26 | Method for producing polythiol compound, method for producing curable composition, and method for producing cured product |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/JP2016/069443 WO2018003059A1 (ja) | 2016-06-30 | 2016-06-30 | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US16/171,476 Continuation US10975026B2 (en) | 2016-06-30 | 2018-10-26 | Method for producing polythiol compound, method for producing curable composition, and method for producing cured product |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2018003059A1 true WO2018003059A1 (ja) | 2018-01-04 |
Family
ID=60785165
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2016/069443 WO2018003059A1 (ja) | 2016-06-30 | 2016-06-30 | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US10975026B2 (ja) |
| EP (1) | EP3480185B1 (ja) |
| JP (1) | JP6588639B2 (ja) |
| CN (1) | CN108884028B (ja) |
| WO (1) | WO2018003059A1 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019065183A (ja) * | 2017-09-29 | 2019-04-25 | ホヤ レンズ タイランド リミテッドHOYA Lens Thailand Ltd | 光学部材用樹脂の製造方法、光学部材用樹脂、眼鏡レンズ及び眼鏡 |
| WO2019189761A1 (ja) * | 2018-03-29 | 2019-10-03 | ホヤ レンズ タイランド リミテッド | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
| WO2019189762A1 (ja) * | 2018-03-29 | 2019-10-03 | ホヤ レンズ タイランド リミテッド | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
| CN112004797A (zh) * | 2018-04-25 | 2020-11-27 | Skc株式会社 | 具有改善的储存稳定性的多元硫醇的制备方法 |
| JP2021096247A (ja) * | 2019-12-13 | 2021-06-24 | エスケイシー・カンパニー・リミテッドSkc Co., Ltd. | ポリチオール組成物の調製方法 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPWO2018003061A1 (ja) * | 2016-06-30 | 2019-01-17 | ホヤ レンズ タイランド リミテッドHOYA Lens Thailand Ltd | 硬化物の製造方法、硬化物および眼鏡レンズ基材 |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5319037B2 (ja) | 1973-03-28 | 1978-06-19 | ||
| JPH02270859A (ja) * | 1988-12-22 | 1990-11-05 | Mitsui Toatsu Chem Inc | メルカプト化合物及びその製造方法 |
| JPH07252207A (ja) * | 1994-01-26 | 1995-10-03 | Mitsui Toatsu Chem Inc | 新規なポリチオール及びそれを用いた含硫ウレタン系プラスチックレンズ |
| JP2006162926A (ja) * | 2004-12-07 | 2006-06-22 | Seiko Epson Corp | プラスチックレンズの製造方法及びプラスチックレンズ |
| WO2007129449A1 (ja) * | 2006-04-20 | 2007-11-15 | Mitsui Chemicals, Inc. | 光学材料用ポリチオール化合物の製造方法およびそれを含む重合性組成物 |
| WO2008047626A1 (en) * | 2006-10-16 | 2008-04-24 | Mitsui Chemicals, Inc. | Method for producing resin for optical material |
| JP2009262480A (ja) | 2008-04-28 | 2009-11-12 | Hoya Corp | 染色プラスチックレンズの製造方法 |
| KR20120058635A (ko) * | 2010-08-13 | 2012-06-08 | 주식회사 케이오씨솔루션 | 광학렌즈용 폴리티올 화합물의 제조법 및 이를 포함하는 수지 조성물 |
| WO2014027428A1 (ja) * | 2012-08-14 | 2014-02-20 | 三井化学株式会社 | ポリチオール化合物の製造方法、光学材料用重合性組成物およびその用途 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5191055A (en) | 1988-12-22 | 1993-03-02 | Mitsui Toatsu Chemicals, Inc. | Mercapto compound, a high refractive index resin and lens and a process for preparing them |
| US5087758A (en) | 1988-12-22 | 1992-02-11 | Mitsui Toatsu Chemicals, Inc. | Mercapto compound, a high refractive index resin and lens and a process for preparing them |
| IN2004DE02342A (ja) * | 2004-11-22 | 2006-08-25 | Shriram Inst Ind Res | |
| KR101464942B1 (ko) * | 2012-01-25 | 2014-11-25 | 주식회사 케이오씨솔루션 | 광학재료용 폴리티올화합물의 제조방법과 이를 포함하는 광학재료용 조성물 |
| JP5319037B1 (ja) | 2012-08-14 | 2013-10-16 | 三井化学株式会社 | ポリチオール化合物の製造方法 |
| JP5373226B1 (ja) * | 2012-08-14 | 2013-12-18 | 三井化学株式会社 | ポリチオール組成物、光学材料用重合性組成物およびその用途 |
| JP6633990B2 (ja) * | 2016-08-08 | 2020-01-22 | ホヤ レンズ タイランド リミテッドHOYA Lens Thailand Ltd | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
-
2016
- 2016-06-30 JP JP2018524658A patent/JP6588639B2/ja active Active
- 2016-06-30 WO PCT/JP2016/069443 patent/WO2018003059A1/ja active Application Filing
- 2016-06-30 CN CN201680083976.7A patent/CN108884028B/zh active Active
- 2016-06-30 EP EP16907292.3A patent/EP3480185B1/en active Active
-
2018
- 2018-10-26 US US16/171,476 patent/US10975026B2/en active Active
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5319037B2 (ja) | 1973-03-28 | 1978-06-19 | ||
| JPH02270859A (ja) * | 1988-12-22 | 1990-11-05 | Mitsui Toatsu Chem Inc | メルカプト化合物及びその製造方法 |
| JPH07252207A (ja) * | 1994-01-26 | 1995-10-03 | Mitsui Toatsu Chem Inc | 新規なポリチオール及びそれを用いた含硫ウレタン系プラスチックレンズ |
| JP2006162926A (ja) * | 2004-12-07 | 2006-06-22 | Seiko Epson Corp | プラスチックレンズの製造方法及びプラスチックレンズ |
| WO2007129449A1 (ja) * | 2006-04-20 | 2007-11-15 | Mitsui Chemicals, Inc. | 光学材料用ポリチオール化合物の製造方法およびそれを含む重合性組成物 |
| WO2008047626A1 (en) * | 2006-10-16 | 2008-04-24 | Mitsui Chemicals, Inc. | Method for producing resin for optical material |
| JP2009262480A (ja) | 2008-04-28 | 2009-11-12 | Hoya Corp | 染色プラスチックレンズの製造方法 |
| KR20120058635A (ko) * | 2010-08-13 | 2012-06-08 | 주식회사 케이오씨솔루션 | 광학렌즈용 폴리티올 화합물의 제조법 및 이를 포함하는 수지 조성물 |
| WO2014027428A1 (ja) * | 2012-08-14 | 2014-02-20 | 三井化学株式会社 | ポリチオール化合物の製造方法、光学材料用重合性組成物およびその用途 |
Cited By (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019065183A (ja) * | 2017-09-29 | 2019-04-25 | ホヤ レンズ タイランド リミテッドHOYA Lens Thailand Ltd | 光学部材用樹脂の製造方法、光学部材用樹脂、眼鏡レンズ及び眼鏡 |
| KR102366881B1 (ko) * | 2018-03-29 | 2022-02-23 | 호야 렌즈 타일랜드 리미티드 | 폴리티올 화합물의 제조 방법, 경화성 조성물의 제조 방법, 및 경화물의 제조 방법 |
| KR20200043464A (ko) * | 2018-03-29 | 2020-04-27 | 호야 렌즈 타일랜드 리미티드 | 폴리티올 화합물의 제조 방법, 경화성 조성물의 제조 방법, 및 경화물의 제조 방법 |
| EP3659999A4 (en) * | 2018-03-29 | 2021-04-28 | Hoya Lens Thailand Ltd. | PROCESS FOR PRODUCING A POLYTHIOL COMPOUND, PROCESS FOR PRODUCING A HARDENABLE COMPOSITION, AND PROCESS FOR PRODUCING A HARDENED MATERIAL |
| JP2019172630A (ja) * | 2018-03-29 | 2019-10-10 | ホヤ レンズ タイランド リミテッドHOYA Lens Thailand Ltd | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
| EP3660000A4 (en) * | 2018-03-29 | 2021-04-28 | Hoya Lens Thailand Ltd. | METHOD FOR MANUFACTURING A POLYTHIOL COMPOUND, METHOD FOR MANUFACTURING A HARDENABLE COMPOSITION, AND METHOD FOR MANUFACTURING A CURED PRODUCT |
| CN111278806A (zh) * | 2018-03-29 | 2020-06-12 | 豪雅镜片泰国有限公司 | 多硫醇化合物的制造方法、固化性组合物的制造方法、及固化物的制造方法 |
| CN111344278A (zh) * | 2018-03-29 | 2020-06-26 | 豪雅镜片泰国有限公司 | 多硫醇化合物的制造方法、固化性组合物的制造方法、及固化物的制造方法 |
| KR102645235B1 (ko) | 2018-03-29 | 2024-03-07 | 호야 렌즈 타일랜드 리미티드 | 폴리티올 화합물의 제조 방법, 경화성 조성물의 제조 방법, 및 경화물의 제조 방법 |
| JP2019172631A (ja) * | 2018-03-29 | 2019-10-10 | ホヤ レンズ タイランド リミテッドHOYA Lens Thailand Ltd | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
| WO2019189762A1 (ja) * | 2018-03-29 | 2019-10-03 | ホヤ レンズ タイランド リミテッド | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
| KR20220039858A (ko) * | 2018-03-29 | 2022-03-29 | 호야 렌즈 타일랜드 리미티드 | 폴리티올 화합물의 제조 방법, 경화성 조성물의 제조 방법, 및 경화물의 제조 방법 |
| WO2019189761A1 (ja) * | 2018-03-29 | 2019-10-03 | ホヤ レンズ タイランド リミテッド | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 |
| CN112004797A (zh) * | 2018-04-25 | 2020-11-27 | Skc株式会社 | 具有改善的储存稳定性的多元硫醇的制备方法 |
| US11453643B2 (en) | 2018-04-25 | 2022-09-27 | Skc Co., Ltd. | Preparation method for polythiol having improved storage stability |
| CN112004797B (zh) * | 2018-04-25 | 2023-03-10 | Skc株式会社 | 具有改善的储存稳定性的多元硫醇的制备方法 |
| JP7059343B2 (ja) | 2019-12-13 | 2022-04-25 | エスケイシー・カンパニー・リミテッド | ポリチオール組成物の調製方法 |
| JP2021096247A (ja) * | 2019-12-13 | 2021-06-24 | エスケイシー・カンパニー・リミテッドSkc Co., Ltd. | ポリチオール組成物の調製方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6588639B2 (ja) | 2019-10-09 |
| US10975026B2 (en) | 2021-04-13 |
| CN108884028A (zh) | 2018-11-23 |
| EP3480185A4 (en) | 2020-01-29 |
| CN108884028B (zh) | 2020-10-09 |
| EP3480185A1 (en) | 2019-05-08 |
| EP3480185B1 (en) | 2021-04-14 |
| JPWO2018003059A1 (ja) | 2019-01-17 |
| US20190062270A1 (en) | 2019-02-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6588639B2 (ja) | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 | |
| JP6633990B2 (ja) | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 | |
| JP6797855B2 (ja) | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 | |
| JP6632493B2 (ja) | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 | |
| EP3404052B1 (en) | Isocyanate composition for optical lenses and process for preparing the same | |
| JP6797856B2 (ja) | ポリチオール化合物の製造方法、硬化性組成物の製造方法、および硬化物の製造方法 | |
| JP6851762B2 (ja) | 光学材料用ポリチオール化合物の製造方法 | |
| KR20180130154A (ko) | 광학 렌즈에 사용되는 이소시아네이트 조성물 및 이의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 2018524658 Country of ref document: JP |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 16907292 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2016907292 Country of ref document: EP Effective date: 20190130 |