WO2013133377A1 - ラクチドの製造方法 - Google Patents
ラクチドの製造方法 Download PDFInfo
- Publication number
- WO2013133377A1 WO2013133377A1 PCT/JP2013/056291 JP2013056291W WO2013133377A1 WO 2013133377 A1 WO2013133377 A1 WO 2013133377A1 JP 2013056291 W JP2013056291 W JP 2013056291W WO 2013133377 A1 WO2013133377 A1 WO 2013133377A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- lactide
- lactic acid
- ester
- group
- carbon atoms
- Prior art date
Links
- LUGGQBCOTDQVME-UHFFFAOYSA-O C=CC=CC=C[NH3+] Chemical compound C=CC=CC=C[NH3+] LUGGQBCOTDQVME-UHFFFAOYSA-O 0.000 description 4
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/02—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides
- B01J31/0234—Nitrogen-, phosphorus-, arsenic- or antimony-containing compounds
- B01J31/0235—Nitrogen containing compounds
- B01J31/0244—Nitrogen containing compounds with nitrogen contained as ring member in aromatic compounds or moieties, e.g. pyridine
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/02—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides
- B01J31/0234—Nitrogen-, phosphorus-, arsenic- or antimony-containing compounds
- B01J31/0255—Phosphorus containing compounds
- B01J31/0267—Phosphines or phosphonium compounds, i.e. phosphorus bonded to at least one carbon atom, including e.g. sp2-hybridised phosphorus compounds such as phosphabenzene, the other atoms bonded to phosphorus being either carbon or hydrogen
- B01J31/0268—Phosphonium compounds, i.e. phosphine with an additional hydrogen or carbon atom bonded to phosphorous so as to result in a formal positive charge on phosphorous
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/61—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/10—1,4-Dioxanes; Hydrogenated 1,4-dioxanes
- C07D319/12—1,4-Dioxanes; Hydrogenated 1,4-dioxanes not condensed with other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/54—Quaternary phosphonium compounds
- C07F9/5442—Aromatic phosphonium compounds (P-C aromatic linkage)
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2231/00—Catalytic reactions performed with catalysts classified in B01J31/00
- B01J2231/40—Substitution reactions at carbon centres, e.g. C-C or C-X, i.e. carbon-hetero atom, cross-coupling, C-H activation or ring-opening reactions
- B01J2231/49—Esterification or transesterification
Definitions
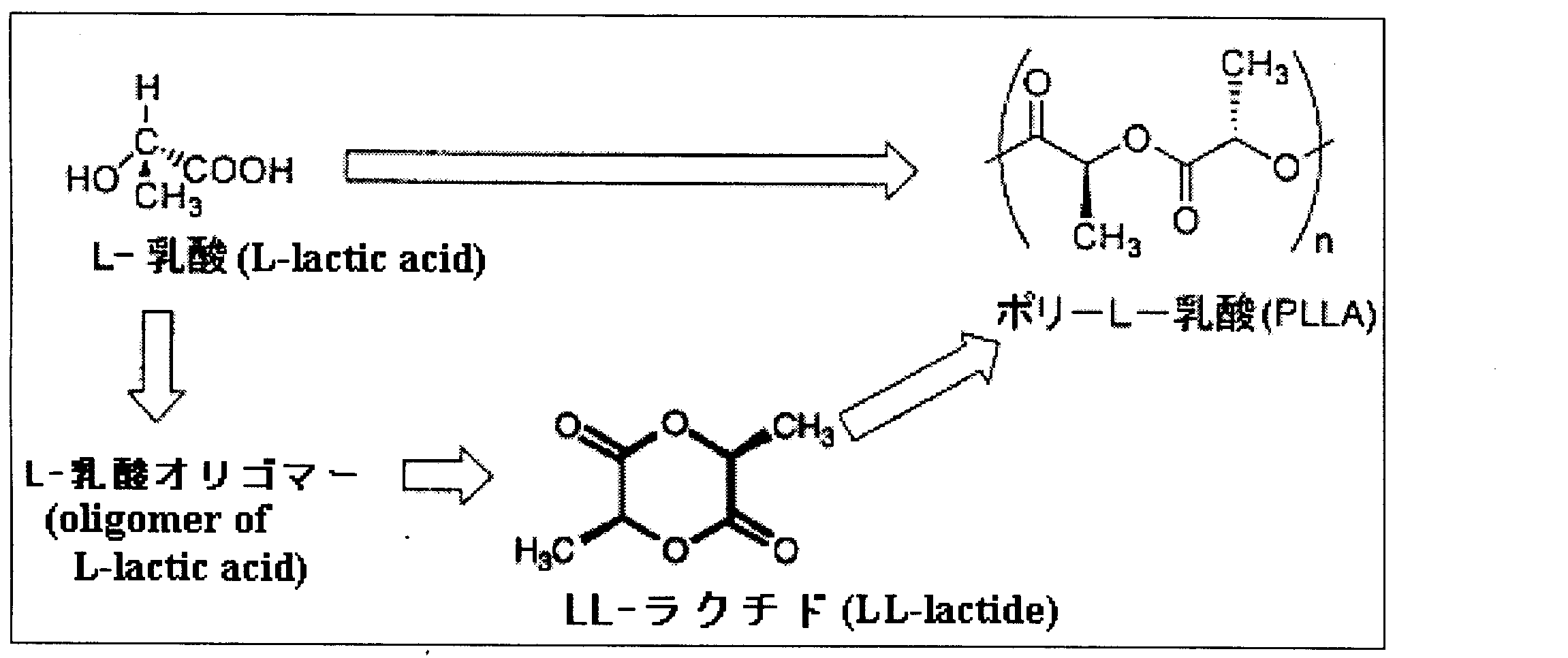
- Polyhydroxycarboxylic acid represented by poly-L-lactic acid is excellent in mechanical properties, physical properties, and chemical properties, and is decomposed in a natural environment, and finally converted into water and carbon dioxide by microorganisms. It has biodegradable properties, and it is expected that demand in various fields such as medical materials and replacement of general-purpose resins will greatly increase in the future.
- Examples of the method for producing poly-L-lactic acid include a direct dehydration polycondensation method of lactic acid (Patent Document 1) and a ring-opening polymerization method of LL-lactide, which is a cyclic diester monomer of lactic acid (lactide method).
- the lactide method is a method in which a lactic acid oligomer obtained by polycondensation of lactic acid is depolymerized and cyclized (hereinafter also referred to as thermal decomposition) to form lactide, which is then subjected to ring-opening polymerization to obtain polylactic acid.
- the process is common.
- the lactide method is disadvantageous in that the production process is long and the equipment cost and the production cost are high, but a technique for obtaining a high molecular weight poly-L-lactic acid was developed early. Therefore, it has become mainstream in the industrial production of polylactic acid.
- lactide is produced by a method in which a lactic acid oligomer is depolymerized and cyclized in the presence of a catalyst to produce lactide, which is distilled off (for example, Patent Documents 2 to 4).
- a catalyst to produce lactide which is distilled off
- the catalyst for the depolymerization / cyclization hereinafter also referred to as depolymerization catalyst
- various metals and metal compounds are known, and among these, tin compounds are preferred.
- lactide purity causes various problems. For example, reduction in optical purity causes deterioration in physical properties and quality of polylactic acid using lactide as a raw material.
- polylactic acid having a low optical purity has lower mechanical strength and moldability than pure L- or D-polylactic acid.
- the present invention aims to solve the above-mentioned problems and to provide a method for producing lactide capable of producing lactide satisfying high chemical purity, isomer purity and optical purity at a good yield. To do.
- the present inventors have intensively studied. As a result, the inventors have found that the object can be achieved by thermally decomposing a specific carboxylic acid ester of a lactic acid oligomer in the presence of a specific catalyst. It has been completed.
- the carboxyl group of the lactic acid oligomer is a primary alcohol having a total carbon number of 20 or more (provided that when an oxygen atom and / or a sulfur atom is present in the alcohol, the total carbon The number of the oxygen atom and / or sulfur atom is included in the number, and the esterified ester is also heated under reduced pressure to give a general formula (1) or (2
- a method for producing lactide is provided, which comprises using at least one compound selected from the group consisting of compounds represented by: *
- R 1 to R 5 each independently represents a hydrogen atom, a halogen atom, an aliphatic hydrocarbon group having 1 to 9 carbon atoms, an aryl group having 6 to 10 carbon atoms, or an aryl group having 3 to 9 carbon atoms.
- each other may form a ring .
- An acid ion, a fluorinated alkyl sulfonate ion having 1 to 8 carbon atoms, or a hydrogen sulfate ion, and Ph is a phenyl group.
- Ph in this specification represents a phenyl group.
- the primary alcohol having a total carbon number of 20 or more is docosanol, tetracosanol, 2-octyl-1-dodecanol, 2-decyl-1-tetradecanol, 1,10-decanediol monobehenate 1,10-decanediol monomyristic acid ester, 1,10-decanediol monolauric acid ester, 1,12-dodecanediol monobehenic acid ester, 1,12-dodecanediol monolauric acid ester, 1,12-dodecanediol monomyristic acid Acid ester, 1,12-dodecanediol monobenzyl ether, terephthalic acid bis (10-hydroxydecyl ester), terephthalic acid bis (12-hydroxydodecyl ester), 10-decylthiodecanol, oligo (1, 0 decanedio
- the average degree of polymerization of the esterified carboxyl group of the lactic acid oligomer is 3 or more and 50 or less.
- the heating is at a temperature of 140-200 ° C.
- lactide has a chemical purity of 99.0 w / w% or more, a meso form contamination rate of less than 1%, and an optical purity of 99.0% e.e. e. Satisfy above.
- the yield of high-purity lactide is excellent as compared with the case where the carboxyl group of the lactic acid oligomer is not esterified.
- lactide satisfying (i) high chemical purity, (ii) high isomer purity (low meso isomer mixing rate), and (iii) high optical purity can be produced in good yield.
- a primary alcohol having a carboxyl group of a lactic acid oligomer having a total carbon number of 20 or more (however, when an oxygen atom and / or a sulfur atom is present in the alcohol, the total carbon number is
- An esterified product (hereinafter referred to as the carboxylic acid ester of the lactic acid oligomer of the present invention) that is esterified with the number of oxygen atoms and / or sulfur atoms (including the oxygen atom of the hydroxyl group of the primary alcohol) is heated under reduced pressure.
- the catalyst is characterized by using at least one selected from the group consisting of compounds represented by the general formulas (1) and (2).
- the reduced pressure may be any pressure lower than atmospheric pressure, and is preferably 13 to 1300 Pa, more preferably 133 to 533 Pa.
- the heating is preferably 140 to 200 ° C, and more preferably 140 to 180 ° C. This is because when the heating temperature is lower than 140 ° C., depolymerization hardly proceeds, and when the heating temperature is higher than 200 ° C., side reactions are caused, which is not preferable.
- a primary alcohol having a total carbon number of 20 or more (when an oxygen atom and / or a sulfur atom is present in the alcohol, the total carbon number includes the oxygen atom). Including the number of atoms and / or sulfur atoms, and also including the oxygen atom of the hydroxyl group of the primary alcohol).
- the upper limit of the total carbon number of the primary alcohol may be any number that allows the production of lactide, and is usually 60 or less, preferably 50 or less, more preferably 40 or less.
- the primary alcohol of the present invention may be a polyol such as diol, triol or tetraol in addition to monool. These alcohols may be branched alkyl alcohols, aralkyl alcohols, and substituted alkyl alcohols in addition to long-chain alcohols.
- the substituent is not particularly limited, and examples thereof include an ether group, an ester group, a halogen group, an amide group, a sulfonyl group, an aryl group, a substituted aryl group, a heteroaryl group, and a substituted heteroaryl group.
- the substituent is introduced into the carbon chain or hydroxyl group of the primary alcohol. In this case, at least the hydroxyl group of the primary alcohol remains so that esterification with the carboxyl group of the lactic acid oligomer occurs.
- the term “including the oxygen atom of the hydroxyl group of the secondary alcohol” means that, for example, one oxygen atom in an ether bond has 1 carbon atom, two oxygen atoms in an ester bond have 2 carbon atoms, and one thioether bond. This means that the sulfur atom of 1 has 1 carbon, and the oxygen atom of the hydroxyl group of alcohol has 1 carbon.
- 1,10-decanediol monobehenate ester 1,10-decanediol monobehenate ester, terephthalic acid bis (10-hydroxydecyl ester), oligo (1,10-decanediol)
- n 3, 4, 5, etc.
- lactic acid oligomer carboxylic acid ester with cetyl alcohol having 16 or less carbon atoms glycerin, pentaerythritol and the like.
- the carboxylic acid ester of the lactic acid oligomer of the present invention preferably has an average degree of polymerization of 3 to 50, more preferably 6 to 20. This is because when the average degree of polymerization is less than 3, the productivity of lactide decreases, and when the average degree of polymerization is greater than 50, the depolymerization reaction rate decreases and the yield of lactide decreases.
- the average degree of polymerization refers to the number average degree of polymerization.
- the degree of polymerization can be measured by 1 H-NMR spectrum measurement.
- carboxylic acid ester of lactic acid oligomer of the present invention can be applied to the production method of the present invention even if it is produced by any known method.
- the carboxylic acid ester of the lactic acid oligomer is lactic acid, 1 A product obtained by direct dehydration condensation in the presence of a secondary alcohol. In this case, esterification of the lactic acid oligomer with a primary alcohol occurs while a lactic acid oligomer is generated by direct dehydration condensation.
- the carboxylic acid ester of the lactic acid oligomer may be obtained by esterifying the lactic acid oligomer as a raw material with a primary alcohol.
- lactic acid as a raw material, dehydrating polycondensation of lactic acid in the presence of the alcohol to produce a lactic acid oligomer carboxylic acid ester, followed by depolymerization without separating the lactic acid oligomer carboxylic acid ester
- dehydrating polycondensation of lactic acid in the presence of the alcohol to produce a lactic acid oligomer carboxylic acid ester
- depolymerization without separating the lactic acid oligomer carboxylic acid ester
- the carboxylic acid ester of the lactic acid oligomer of the present invention is produced using lactic acid and the above primary alcohol
- the molar ratio of lactic acid to primary alcohol used is preferably 3: 1 to 50: 1, and 6: 1 to 20 : 1 is more preferable.
- the primary alcohol of this invention has n hydroxyl groups
- the molar ratio of lactic acid shows the molar ratio per each hydroxyl group. .
- the process of producing the carboxylic acid ester of the lactic acid oligomer of the present invention may be performed with or without a solvent.
- solvent-free in the present invention means a reaction condition in which a solvent for azeotropic removal of water generated by a dehydration condensation reaction is not added.
- a solvent benzene, toluene, xylene and the like can be used.
- the amount used is about 1 to 3 times (volume) of lactic acid from the viewpoint of operability.
- the reaction conditions are selected so that the average degree of polymerization of the carboxylic acid ester of the lactic acid oligomer is 50 or less. There is a need.
- lactic acid oligomer is heated and dehydrated at a temperature of 120 to 160 ° C., preferably 130 to 150 ° C. under a pressure of 2500 to 9300 Pa, preferably 4000 to 6700 Pa in the presence of a calculated amount of alcohol.
- Carboxylic acid esters can be produced.
- the temperature is lower than 120 ° C., dehydration condensation does not proceed easily, and when the temperature is higher than 160 ° C., lactic acid or a low-polymerization degree oligomer comes to distill.
- the lower pressure is preferable because the reaction temperature can be lowered.
- the pressure is lower than 2500 Pa, a high vacuum apparatus is required, and problems such as clogging of the piping are likely to occur.
- a polycondensation catalyst When a lactic acid oligomer is obtained by direct dehydration polycondensation of lactic acid, a polycondensation catalyst may or may not be used.
- the polycondensation catalyst known compounds such as metal compounds can be used.
- the metal compound catalyst This is preferable because it can be used as a raw material for producing lactide without removing any of the above, and it is not necessary to re-add the lactide production catalyst before thermal decomposition.
- the amount of the polycondensation catalyst used in the direct dehydration polycondensation is preferably such that the concentration of the polycondensation catalyst relative to lactic acid (polycondensation catalyst / lactic acid) is 0.01 to 5 mol%, and more preferably 0.2 to 2 mol%. preferable.
- the lactic acid oligomer When a lactic acid oligomer is used as a raw material, the lactic acid oligomer may be regenerated by a known method such as heating by adding lactic acid and / or water to polylactic acid.
- a known method such as heating by adding lactic acid and / or water to polylactic acid.
- the polylactic acid in this case, known ones such as non-standard products and waste products can be used.
- dimers those having an average polymerization degree exceeding 100 are referred to as polylactic acid, those having 3 to 100 are referred to as lactic acid oligomers, and acyclic dimers are referred to as dimers.
- the reaction may be performed without catalyst, and a known metal compound catalyst or the like may be used as a catalyst. It is preferable to use the compound represented by the general formula (1) or (2) as a catalyst because it can be used as a raw material for producing lactide without removing the metal compound catalyst.
- the amount of the hydrolysis catalyst used to regenerate the lactic acid oligomer by adding lactic acid and / or water to polylactic acid and heating is preferably 0.01 to 5 mol% of the catalyst concentration based on polylactic acid. 0.2 to 2 mol% is more preferable.
- the optical purity can be represented by a value obtained by subtracting the smaller amount from the larger amount of D-lactic acid or L-lactic acid and dividing the result by the total amount.
- the optical purity of L-lactic acid is represented by the following formula (1).
- Optical purity (% ee) [(LD) / (L + D)] ⁇ 100 (1)
- the amount of D-lactic acid or L-lactic acid can be calculated from the peak area ratio of D / L lactic acid using high performance liquid chromatography (HPLC method).
- the catalyst used in the method for producing lactide of the present invention is a compound represented by the following general formula (1) or (2).
- R 1 to R 5 each independently represents a hydrogen atom, a halogen atom, an aliphatic hydrocarbon group having 1 to 9 carbon atoms, an aryl group having 6 to 10 carbon atoms, or an aryl group having 3 to 9 carbon atoms.
- each other may form a ring .
- An acid ion, a fluorinated alkyl sulfonate ion having 1 to 8 carbon atoms, or a hydrogen sulfate ion, and Ph is a phenyl group.
- Examples of the cation in the general formula (1) include the following structural formulas, more preferably at least one selected from these groups, and XH is a perfluoroalkylsulfonic acid having 1 to 6 carbon atoms, Of these, trifluoromethanesulfonic acid is more preferable.
- the position of the substituent represents an arbitrary position.
- the compound represented by the general formula (1) include salts of the above cation and trifluoromethanesulfonate ion, such as 3-chloropyridinium trifluoromethanesulfonate (hereinafter referred to as 3-Cl-PyH—). Abbreviated as T.).
- TPP-T triphenylphosphonium trifluoromethanesulfonate
- TPP-S triphenylphosphonium hydrogen sulfate
- the method for producing the catalyst of the general formulas (1) and (2) includes a nitrogen-containing compound of the cation component of the general formula (1) or a phosphorus-containing compound of the general formula (2) and an anion component such as X-.
- a method of reacting with sulfonic acids is simple.
- the production method of TPP-T is described in van der Aker, M. Jellinek, Recl. Trav. Chim. Pays-Bas, 1967, 86, 275-288.
- the catalyst mole relative to the lactic acid mole in the lactic acid oligomer is preferably 0.01 to 5 mol%, more preferably 0.2 to 2 mol%. . This is because if it is less than 0.01 mo 1%, the yield of lactide tends to be insufficient, and if it exceeds 2 mo 1%, the effect is hardly changed.
- LL-lactide and DD-lactide are optical isomers (isomers that are mirror images of each other), and LL-lactide and meso-lactide (DL-lactide) are isomers that are not mirror images of each other, both diastereomers and diastereomers. Said.
- lactide is a dimer of lactic acid, it is inevitable that lactide is produced from lactic acid oligomers produced from lactic acid with low optical purity, lactic acid oligomers produced with low optical purity, or polylactic acid with low optical purity.
- Mesolactide is produced in
- a lactide satisfying all of (i) high chemical purity, (ii) high isomer purity (low meso isomer mixing ratio), and (iii) high optical purity is obtained.
- the chemical purity (w / w%) is represented by the following formula (2).
- Chemical purity (w / w%) [(LL-lactide amount + DD-lactide amount + mesolactide amount) / (LL-lactide amount + DD-lactide amount + mesolactide amount + amount of compounds other than lactide)] ⁇ 100 (2)
- mesobody mixing rate (%) is calculated by the following equation (3).
- Meso-body contamination rate (%) [(mesolactide amount) / (LL-lactide amount + DD-lactide amount + mesolactide amount)] ⁇ 100 (3)
- optical purity is represented by the following formula
- Optical purity (% ee) [(LL-lactide amount ⁇ DD-lactide amount) / (LL-lactide amount + DD-lactide amount)] ⁇ 100 (4)
- the lactide yield is represented by the obtained lactide weight relative to the weight of the lactic acid oligomer of the raw material.
- the chemical purity can be determined using 1 H, 13 C NMR, GC, GC-MS, HPLC, HPLC-MS, or the like as appropriate.
- meso isomer contamination rate (%) and isomer purity are derived from LL-DD and DD-lactide peaks (a) and meso-lactide (DL-lactide) by 1 H- or 13 C-NMR analysis of lactide. It can be obtained by quantitatively comparing the peak (b).
- Mesobody mixing rate [%] [(b) / (a + b)] ⁇ 100
- Isomeric purity [%] [(a) / (a + b)] ⁇ 100
- optical purity can be determined from the peak derived from LL-lactide and DD-lactide and the peak derived from mesolactide (DL-lactide) using the following formula.
- the chemical purity of the lactide represented by the formula (2) is 99.0% or more, preferably 99.5% or more.
- the meso form mixing rate calculated by the above formula (3) that is, the mixing rate of meso lactide is less than 1%, preferably less than 0.5%.
- the optical purity represented by the formula (4) is 99.0% e.e. e. Or more, preferably 99.9% e.e. e. More preferably, it is 99.99% or more.
- a high-purity lactide that satisfies these values for chemical purity, meso form contamination rate, and optical purity can be obtained, so the purification step such as lactide recrystallization as described above is omitted or It can be simplified.
- polylactic acid production by the lactide method has a long production process, which causes high costs. Therefore, shortening the production process by the lactide production method of the present invention is extremely important.
- An excellent polylactic acid can be obtained using a known method and apparatus for ring-opening polymerization of the lactide obtained by the production method of the present invention to obtain a high molecular weight polylactic acid.
- a represents the abundance of LL-lactide and DD-lactide
- b represents the abundance of meso lactide.
- Mesobody mixing rate [%] [(b) / (a + b)] ⁇ 100 (5)
- Optical purity (% ee) [(4a 2 ⁇ b 2 ) / (4a 2 + b 2 )] ⁇ 100 (6)
- TMS tetramethylsilane
- Catalyst synthesis example 2 (synthesis of TPP-T catalyst)
- the thermal decomposition temperature of the TPP-T catalyst was 178 ° C.
- the resulting oligomer containing the catalyst was depolymerized by heating and decompression at 160 ° C. and 1 mmHg (133.3 Pa) for 3 hours to obtain 5.09 g (79%) of lactide.
- the purity of the crude lactide determined from 1 H-NMR was as follows: chemical purity> 99.5 w / w%, meso isomer contamination ⁇ 0.3%, and lactide optical purity> 99.99% ee.
- the 90 mass% L-lactic acid aqueous solution used in this example had an optical purity of L lactic acid of 99% e.e. e. That's all.
- the optical purity of lactic acid was measured by a known HPLC method.
- Example 2 Using terephthalic acid bis (10-hydroxydecyl ester), an oligomer having a polymerization degree of 9 and protecting the carboxylic acid terminal was obtained in the same manner as in Example 1 to obtain lactide in a yield of 68%. Obtained from 1 H-NMR. The purity of the crude lactide was chemical purity> 99.5 w / w%, meso form contamination rate ⁇ 0.3%, and lactide optical purity> 99.99% ee.
- Example 3 The reaction was carried out under the same conditions except that 2-decyl-1-tetradecanol was used in the same number of moles instead of docosanol of Example 1. As in the result of Example 1, chemical purity and meso form contamination were obtained. Good rates, optical purity, and yield were obtained.
- Example 4 The reaction was carried out under the same conditions except that the same number of moles of 1,10-decandiol monobehenate was used in place of the docosanol of Example 1. As in the result of Example 1, chemical purity and meso form contamination were obtained. Good rates, optical purity, and yield were obtained.
- Example 5 The reaction was carried out under the same conditions except that TPP-T was used instead of the catalyst 3-Cl—Py-T of Example 1. As in the result of Example 1, the chemical purity, the meso form contamination rate, The optical purity and the yield were all good.
- Comparative Example 1 Example of low yield, when carboxylic acid terminal is not protected
- the reaction was carried out under the same conditions as in Example 1 except that docosanol was not used, and the yield was 30%.
- Comparative Example 2 (example with poor chemical purity, when carboxylic acid terminal is protected with cetyl alcohol)
- an oligolactic acid cetyl ester having a polymerization degree of 9 was synthesized. That is, 90% hydrous lactic acid (147.43 g, 1.474 mol) and cetyl alcohol (39.72 g, 0.163 mol) were added to xylene (200 ml), and a Dean-Stark tube was attached and heated to reflux for 24 hours. Lactic acid oligomers were obtained by boiling dehydration polycondensation.
- 3-ClPy-T (0.22 g, 1 mol% of lactic acid) was added to the oligolactic acid cetyl ester having a polymerization degree of 9 (7.9 g) and heated at 27 Pa and 140 ° C. for 6 hours.
- the distilled crude lactide (4.7 g, 81%) had a chemical purity of 89.8 w / w%, an isomer purity of> 99.5%, and an optical purity of 99.99% ee.
- the impurity was an olefin derived from cetyl alcohol. As described above, the chemical purity is poor.
- Comparative Example 3 (example of high meso body mixing rate, in the case of a known tin-based catalyst)
- tin (II) octylate was used in place of the catalyst 3-Cl-Py-T, the meso form mixing rate was 3%.
- the production method of the present invention can efficiently produce high-purity optically active lactide at lower cost and is extremely effective in the field of high-purity lactide production and the field of polylactic acid production by the lactide method.
Abstract
乳酸オリゴマーのカルボキシル基が、特定の1級アルコールでエステル化されたものを減圧下で加熱し、ピリジニウム系触媒を用いるラクチドの製造方法が開示される。
Description
(関連分野の相互参照)
本願は、2012年3月8日に出願した特願2012-74985号明細書(その全体が参照により本明細書中に援用される)の優先権の利益を主張するものである。
(技術分野)
本発明は、高純度ラクチドの製造方法に関する。
本願は、2012年3月8日に出願した特願2012-74985号明細書(その全体が参照により本明細書中に援用される)の優先権の利益を主張するものである。
(技術分野)
本発明は、高純度ラクチドの製造方法に関する。
ポリ-L-乳酸に代表されるポリヒドロキシカルボン酸は、機械的特性、物理的性質、化学的性質に優れている上に自然環境下で分解され、最終的には微生物によって水と炭酸ガスになるという生分解性の性質も有しており、今後医療用材料や、汎用樹脂代替等、様々な分野での需要が大きく伸びることが期待されている。
ポリ-L-乳酸の製造方法としては、乳酸の直接脱水重縮合法(特許文献1)や、乳酸の環状ジエステルモノマーであるLL-ラクチドの開環重合法(ラクチド法)が挙げられる。
これらの製造方法のうち、ラクチド法は、乳酸を重縮合させた乳酸オリゴマーを解重合・環化(以下、熱分解ともいう)してラクチドとし、これを開環重合してポリ乳酸を得るというプロセスが一般的である。直接脱水重縮合法と比較すると、ラクチド法は製造工程が長く、設備コスト及び製造コストが大きくなるという点で不利ではあるが、高分子量のポリ-L-乳酸を得る技術が早期に開発されたことから、ポリ乳酸の工業生産において主流となっている。
ラクチド法において、ラクチドは、乳酸オリゴマーを触媒存在下で解重合・環化してラクチドを生成させ、これを溜去させる方法で製造されている(例えば、特許文献2~4)。その解重合・環化の際の触媒(以下、解重合触媒とも称する)としては、様々な金属や金属化合物が知られており、なかでもスズ化合物が好ましいとされている。
しかし、前述の特許文献2では、光学的に純粋なL(-)-ラクチドはイソプロパノールによる再結晶等の精製工程が必要とされている(明細書4頁右下欄下から3行目~5頁左上欄7行目及び5頁左上欄下から1行目~5頁右上欄4行目)。また特許文献3でも、解重合によって粗ラクチドを得、更にイソプロパノールで2回洗浄して純粋なラクチドを得ている(実施例2,3,4)。更に特許文献4では、高光学純度のラクチドを得ているが、当該方法で得られる光学活性ラクチドには2~5%程度のメソラクチドが混入している(実施例1~5)。以上のように、従来の高光学純度のラクチドを製造する方法では、ラクチドを溜去後、更に精製を行い、メソラクチド等を分離することが必要であった。
他方、特許文献5のラクチド製造方法においては、アルカリ金属のアルコキシド等の触媒と共に1-ヘキサデカノール等の高沸点アルコールを併用する事によって、ラクチドの収率を向上させ、また反応釜中の残渣を水溶性に変える事によって困難な残渣の処理を容易にさせている(段落番号0009参照)。また、特許文献6のラクチド製造方法においては、特定の金属化合物触媒存在下、グリセリン等の3個以上の水酸基を含む多価アルコールを併用して、ラクチドを高収率で得ている(請求項1及び発明が解決しようとする課題)。
従来のラクチド製造方法では反応時にラセミ化が起こり、例えば、ラクチドの原料としてL-乳酸オリゴマーを用いた場合でも、L-ラクチド以外に、メソラクチドやD-ラクチドが生成し、ラクチドの異性体純度、光学純度が低下するという問題があった。更に、乳酸の低分子オリゴマーなどの、ラクチド以外の化合物が混入する事もあり、またラクチド収率が悪いという問題がある。
ラクチド純度の低下は、各種の問題を生じ、例えば光学純度の低下は、ラクチドを原料とするポリ乳酸の物性低下や品質のばらつきの原因となる。また、光学純度の低いポリ乳酸は、純粋なL-又はD-ポリ乳酸に比べ、機械的強度や成型性が低い。
また、純粋なL-又はD-ラクチドが得られる方法であっても、再結晶や、溶媒による洗浄という付加工程を必要とし、そのために生産性や収率が低下するという問題もある。
そこで、本発明は、上記課題を解決し、高い化学純度、異性体純度、光学純度を同時に満足するラクチドを、好収率で製造することが可能なラクチドの製造方法を提供することを目的とする。
上記課題を解決するため、本発明者らは鋭意検討した結果、乳酸オリゴマーの特定のカルボン酸エステルを、特定の触媒の存在下で熱分解すると、上記目的を達成することを見出して本発明を完成させたものである。
すなわち、本発明の1態様によれば、乳酸オリゴマーのカルボキシル基が、総炭素数20以上の1級アルコール(ただし、酸素原子及び/又は硫黄原子が該アルコール中に存在する場合には、総炭素数には該酸素原子及び/又は硫黄原子の数も含み、1級アルコールの水酸基の酸素原子も含む)でエステル化されたものを減圧下で加熱し、触媒として一般式(1)又は(2)で表される化合物からなる群より選ばれる少なくとも1種の化合物を用いることを特徴とするラクチドの製造方法が提供される。
別段定めがない限り、本明細書においてPhはフェニル基を表す。
一つの実施形態において、総炭素数20以上の1級アルコールは、ドコサノール、テトラコサノール、2-オクチル-1-ドデカノール、2-デシル-1-テトラデカノール、1,10-デカンジオール モノベヘン酸エステル、1,10-デカンジオール モノミリスチン酸エステル、1,10-デカンジオール モノラウリン酸エステル、1,12-ドデカンジオール モノベヘン酸エステル、1,12-ドデカンジオール モノラウリン酸エステル、1,12-ドデカンジオール モノミリスチン酸エステル、1,12-ドデカンジオール モノベンジルエーテル、テレフタル酸 ビス(10-ヒドロキシデシルエステル)、テレフタル酸 ビス(12-ヒドロキシドデシルエステル)、10-デシルチオデカノール、オリゴ(1,10-デカンジオール) n=3、4、5(nは数平均重合度、オリゴジオールは各ジオールがエーテル結合したもの。以下同様)、およびこれらの混合物から選択される。
別の実施形態において、総炭素数20以上の1級アルコールは、ドコサノール、2-デシル-1-テトラデカノール、1,10-デカンジオール モノベヘン酸エステル、テレフタル酸 ビス(10-ヒドロキシデシルエステル)、又はオリゴ(1,10-デカンジオール) n=3、4、5である。
別の実施形態において、乳酸オリゴマーのカルボキシル基がエステル化されたものの平均重合度は、3以上50以下である。
また別の実施形態において、加熱は、140~200℃の温度である。
さらに別の実施形態において、ラクチドは、化学純度99.0w/w%以上、メソ体混入率が1%より少ない、かつ光学純度99.0%e.e.以上を満たす。
本発明のラクチドの製造方法によれば、乳酸オリゴマーのカルボキシル基がエステル化されていない場合に較べて高純度ラクチドの収率が優れている。特には、(i)高い化学純度、(ii)高い異性体純度(低いメソ体混入率)、かつ(iii)高い光学純度を満たすラクチドを、好収率で製造することができる。
以下、本発明の実施の形態について詳細に説明する。
本明細書において、単数形(a, an, the)は、本明細書で別途明示がある場合又は文脈上明らかに矛盾する場合を除き、単数と複数を含むものとする。
本発明のラクチドの製造方法は、乳酸オリゴマーのカルボキシル基が総炭素数20以上の1級アルコール(ただし、酸素原子及び/又は硫黄原子が該アルコール中に存在する場合には、総炭素数には該酸素原子及び/又は硫黄原子の数も含み、1級アルコールの水酸基の酸素原子も含む)でエステル化されたもの(以下、本発明の乳酸オリゴマーのカルボン酸エステルという)を減圧下で加熱し、触媒として一般式(1),(2)で表される化合物からなる群より選ばれる少なくとも1種を用いることを特徴とする。
〔ラクチド製造時の減圧、加熱条件〕
減圧下とは、大気圧より低い圧力であればよく、好ましくは13~1300Pa、より好ましくは133~533Paである。
減圧下とは、大気圧より低い圧力であればよく、好ましくは13~1300Pa、より好ましくは133~533Paである。
また、加熱とは、140~200℃が好ましく、140~180℃が更に好ましい。加熱温度が140℃よりも低いと解重合が進行しにくく、200℃よりも高いと副反応が惹起し好ましくないからである。
〔本発明の乳酸オリゴマーのカルボン酸エステル〕
本発明の乳酸オリゴマーのカルボン酸エステルを製造するには、総炭素数20以上の1級アルコール(酸素原子及び/又は硫黄原子が該アルコール中に存在する場合には、総炭素数には該酸素原子及び/又は硫黄原子の数も含み、1級アルコールの水酸基の酸素原子も含む)が用いられる。1級アルコールの総炭素数の上限は、ラクチドの製造が可能な数であればよく、通常60以下、好ましくは50以下、より好ましくは40以下である。
本発明の乳酸オリゴマーのカルボン酸エステルを製造するには、総炭素数20以上の1級アルコール(酸素原子及び/又は硫黄原子が該アルコール中に存在する場合には、総炭素数には該酸素原子及び/又は硫黄原子の数も含み、1級アルコールの水酸基の酸素原子も含む)が用いられる。1級アルコールの総炭素数の上限は、ラクチドの製造が可能な数であればよく、通常60以下、好ましくは50以下、より好ましくは40以下である。
本発明の1級アルコールとしては、モノオールのほか、ジオール、トリオール、テトラオールなどのポリオールでもよい。これらアルコールは、長鎖アルコールのほか、分岐アルキルアルコール、アラルキルアルコール、置換アルキルアルコールでもよい。その置換基としては特に制限はないが、エーテル基、エステル基、ハロゲン基、アミド基、スルホニル基、アリール基、置換アリール基、ヘテロアリール基、置換ヘテロアリール基などがあげられる。置換基は1級アルコールの炭素鎖又は水酸基に導入されるが、この場合にも乳酸オリゴマーのカルボキシル基とのエステル化が起こるよう1級アルコールの少なくとも水酸基は残されているものとする。
具体的に、モノオールとしては、ドコサノール、テトラコサノール、2-オクチル-1-ドデカノール、2-デシル-1-テトラデカノール、置換アルコールとしては、1,10-デカンジオール モノベヘン酸エステル、1,10-デカンジオール モノミリスチン酸エステル、1,10-デカンジオール モノラウリン酸エステル、1,12-ドデカンジオール モノベヘン酸エステル、1,12-ドデカンジオール モノラウリン酸エステル、1,12-ドデカンジオール モノミリスチン酸エステル、1,12-ドデカンジオール モノベンジルエーテル、ジオールとしては、テレフタル酸 ビス(10-ヒドロキシデシルエステル)、テレフタル酸 ビス(12-ヒドロキシドデシルエステル)、オリゴ(1,10-デカンジオール) n=3、4、5、その他10-デシルチオデカノール等が挙げられ、これらの混合物であってもかまわない。
前記、「総炭素数20以上の1級アルコール(酸素原子及び/又は硫黄原子が該アルコール中に存在する場合には、総炭素数には該酸素原子及び/又は硫黄原子の数も含み、1級アルコールの水酸基の酸素原子も含む)」との用語は、例えばエーテル結合の1個の酸素原子は炭素数1個、エステル結合の2個の酸素原子は炭素数2個、チオエーテル結合の1個の硫黄原子は炭素数1個、アルコールの水酸基の酸素原子は炭素数1個と数える意味である。
これらの中でもドコサノール、2-デシル-1-テトラデカノール、置換アルコールとしては、1,10-デカンジオール モノベヘン酸エステル、テレフタル酸 ビス(10-ヒドロキシデシルエステル)、オリゴ(1,10-デカンジオール) n=3、4、5、等が好ましく挙げられる。他方、炭素数16以下のセチルアルコール、グリセリン、ペンタエリトリトール等との乳酸オリゴマーカルボン酸エステルの場合は、有効ではない。
上記の知見は、特定の触媒を用いて乳酸オリゴマーを熱分解すると、高い異性体純度(低いメソ体混入率)、高い光学純度のラクチドを製造することができることを新たに見出したが、収率の点が十分満足とはいえなかった。そこで乳酸オリゴマーのカルボン酸エステルを各種検討したところ、中には収率を向上させるものを見出したが、得られたラクチドの純度が悪いものもあった。純度が悪い原因が、乳酸のカルボン酸エステルやアルコール自身の分解物(アルコールの脱離体であるアルケン等)であることを新たに認識し、ラクチド純度向上には、アルコールの脱離体であるアルケンの沸点が、ラクチド生成反応条件以上であれば良い等の発明者の認識に基づいて得られたものである。
本発明の乳酸オリゴマーのカルボン酸エステルは、好ましくは平均重合度が3~50、より好ましくは6~20である。平均重合度が3より小さいと、ラクチドの生産性が低下し、平均重合度が50より大きいと、解重合反応速度が低下し、ラクチドの収率が低下するからである。本明細書では、平均重合度は数平均重合度を指す。重合度は、1H-NMRスペクトル測定により測定することができる。
〔本発明の乳酸オリゴマーのカルボン酸エステルの製造〕
本発明の乳酸オリゴマーのカルボン酸エステルは、いずれの公知の方法によって製造されたものでも本発明の製造方法に適用できるが、一実施形態では、乳酸オリゴマーのカルボン酸エステルは、乳酸を、上記1級アルコール存在下、直接脱水縮合したものが挙げられる。この場合、直接脱水縮合により乳酸オリゴマーが生成しつつ、乳酸オリゴマーの1級アルコールによるエステル化が起こる。別の実施形態では、乳酸オリゴマーのカルボン酸エステルは、原料としての乳酸オリゴマーを、1級アルコールによりエステル化してもよい。
本発明の乳酸オリゴマーのカルボン酸エステルは、いずれの公知の方法によって製造されたものでも本発明の製造方法に適用できるが、一実施形態では、乳酸オリゴマーのカルボン酸エステルは、乳酸を、上記1級アルコール存在下、直接脱水縮合したものが挙げられる。この場合、直接脱水縮合により乳酸オリゴマーが生成しつつ、乳酸オリゴマーの1級アルコールによるエステル化が起こる。別の実施形態では、乳酸オリゴマーのカルボン酸エステルは、原料としての乳酸オリゴマーを、1級アルコールによりエステル化してもよい。
例えば、原料として乳酸を用い、乳酸を該アルコール存在下脱水重縮合して乳酸オリゴマーのカルボン酸エステルを製造し、乳酸オリゴマーのカルボン酸エステルを分離することなく、続いて解重合を行う方法を用いてもよく、あるいは乳酸オリゴマーのカルボン酸エステルを一旦取り出し、その取り出した乳酸オリゴマーのカルボン酸エステルをさらに解重合する方法を用いることもできる。
乳酸と上記1級アルコールを用いて本発明の乳酸オリゴマーのカルボン酸エステルを製造する場合、使用される乳酸と1級アルコールのモル比は3:1から50:1が好ましく、6:1から20:1が更に好ましい。尚、本発明の1級アルコールがn個の水酸基を有している場合には、乳酸のモル比は、各水酸基あたりのモル比を示す。
また、本発明の乳酸オリゴマーのカルボン酸エステルの生成過程は、溶媒を用いても又は無溶媒で行なってもよい。なお、特に断らない限り、本発明において「無溶媒」とは、脱水縮合反応により生じる水を共沸除去するための溶媒を添加しない反応条件を意味する。そのような溶媒としてはベンゼン、トルエン、キシレン等が使用できる。使用量は操作性の観点から、乳酸に対して1~3倍(容量)程度である。
前記のように乳酸オリゴマーのカルボン酸エステルの平均重合度が50を越えると、解重合速度が遅くなるので、乳酸オリゴマーのカルボン酸エステルの平均重合度が50以下となるように反応条件を選択する必要がある。
具体的には、乳酸を計算量のアルコール存在下、2500~9300Pa、好ましくは4000~6700Paの圧力下、120~160℃、好ましくは130~150℃の温度で加熱脱水することにより、乳酸オリゴマーのカルボン酸エステルを製造することができる。温度が120℃より低いと脱水縮合が進行しにくく、160℃より高いと乳酸又は、低重合度オリゴマーが留出するようになるので好ましくない。また、圧力が9300Paより高いと水が留出しにくくなるからである。また、より低圧とする方が反応温度を低くできるので好ましいが、2500Paよりも低くすると高真空装置が必要となり配管に詰まりが生じる等の問題が発生し易くなり好ましくない。
乳酸を直接脱水重縮合して乳酸オリゴマーを得る際には、重縮合触媒を用いても用いなくてもよい。重縮合触媒としては、金属化合物等公知のものを使用することができるが、後記一般式(1),(2)に示した化合物の少なくとも1種類(ラクチド製造触媒)を用いると、金属化合物触媒の除去をすることなくラクチド製造の原料とすることができ、またラクチド製造触媒を熱分解前に再添加する必要が無いので好ましい。
直接脱水重縮合における重縮合触媒の使用量としては、乳酸に対する重縮合触媒の濃度(重縮合触媒/乳酸)が0.01~5mol%であると好ましく、0.2~2mol%であると更に好ましい。
原料として乳酸オリゴマーを用いる場合、乳酸オリゴマーは、ポリ乳酸に乳酸及び/又は水を加えて、加熱する等公知の方法により、再生されたものであってもよい。この場合のポリ乳酸は、規格外品、廃棄品等、公知のものを利用できる。
なお、本発明においては、便宜上、平均重合度が100超過のものをポリ乳酸と称し、3以上100以下のものを乳酸オリゴマーと称し、非環状の2量体をダイマーと称する。
ポリ乳酸に乳酸及び/又は水を加えて、加熱することにより、乳酸オリゴマーを再生させる際、無触媒で反応を行っても良く、公知の金属化合物触媒等を触媒として使用しても良いが、前記一般式(1)又は(2)に示した化合物を触媒として用いると、金属化合物触媒の除去をすることなくラクチド製造の原料とすることができるので好ましい。
ポリ乳酸に乳酸及び/又は水を加えて、加熱することにより、乳酸オリゴマーを再生させる際の加水分解触媒の使用量としては、ポリ乳酸基準の触媒濃度が0.01~5mol%であると好ましく、0.2~2mol%であると更に好ましい。
本発明のラクチドを得るためには、本発明の乳酸オリゴマーのカルボン酸エステル又は乳酸オリゴマーの原料となるD-乳酸又はL-乳酸には光学純度の高いものを用いることが好ましく、光学純度が99.0%e.e.以上、好ましくは99.9%e.e.以上、更に好ましくは99.99%以上のものが挙げられる。ここで、光学純度とは、D-乳酸又はL-乳酸のいずれか多い方の量から少ない方の量を差し引き、全体の量で割った値で表すことができる。例えば、L-乳酸量を「L」、D-乳酸量を「D」とし、L-乳酸量が過剰な場合、例えばL-乳酸の光学純度は以下の式(1)で表される。
光学純度(%e.e.)=[(L-D)/(L+D)]×100 (1)
光学純度(%e.e.)=[(L-D)/(L+D)]×100 (1)
D-乳酸又はL-乳酸の量は、高速液体クロマトグラフ法(HPLC法)を用いて、乳酸のD/L体のピーク面積比から算出することができる。
[触媒]
本発明のラクチドの製造方法に用いられる触媒は、以下の一般式(1)又は(2)で表される化合物である。
(前記一般式において、R1~R5はそれぞれ独立に、水素原子、ハロゲン原子、炭素数1~9の脂肪族炭化水素基、炭素数6~10のアリール基、又は炭素数3~9の複素環基であり、相互に環を形成してもよい。X-は炭素数1~18のアルキルスルホン酸イオン、炭素数6~18のアリールスルホン酸イオン、炭素数4~18の複素環スルホン酸イオン、炭素数1~8のフッ化アルキルスルホン酸イオン、又は硫酸水素イオンであり、Phはフェニル基である。)
本発明のラクチドの製造方法に用いられる触媒は、以下の一般式(1)又は(2)で表される化合物である。
前記一般式(1)中のカチオンとしては、以下の構造式が挙げられ、これらの群から選ばれる少なくとも1種であるとより好ましく、かつXHが炭素数1~6のパーフルオロアルキルスルホン酸、中でもトリフルオロメタンスルホン酸であると一層好ましい。
一般式(2)の化合物としてはトリフェニルホスホニウムトルフルオロメタンスルホネート(以下、TPP-Tと略す)、トリフェニルホスホニウムハイドロジェンサルフェート(TPP-Sと略す)が好ましく挙げられる。
前記一般式(1)及び(2)の触媒の製造方法としては、一般式(1)のカチオン成分の含窒素化合物又は一般式(2)の含リン化合物と、X-等のアニオン成分であるスルホン酸類とを反応させる方法が簡便である。例えばTPP-Tの製造方法はvan der Akker, M. Jellinek, Recl. Trav. Chim. Pays-Bas, 1967, 86, 275-288に記載されている。
本発明のラクチド製造に用いる触媒の使用量については、乳酸オリゴマー中の乳酸モルに対する触媒モルとしては、好ましくは0.01~5mol%であると好ましく、0.2~2mol%であると更に好ましい。0.01mo1%より少ないとラクチド収率上、不十分となる傾向があり、また、2mo1%を越えてもその効果はほとんど変わらないからである。
〔ラクチド〕
本発明のラクチド製造方法では極めて高純度のラクチドを得ることができる。
本発明のラクチド製造方法では極めて高純度のラクチドを得ることができる。
例えば、100%e.e.のL-乳酸を用いて得たオリゴマーを原料として用いても、解重合・環化の条件が不適切であると、ラセミ化が起こり、L-乳酸の環状二量体であるLL-ラクチドのほかに、メソラクチド(DL-ラクチド)やDD-ラクチドが生成する。この場合原料がL-体であるから、まずメソラクチド(DL-ラクチド)が生成し、これがさらにラセミ化すれば、DD-ラクチドが生成する。
同様に、100%e.e.のD-乳酸を用いて得たオリゴマーを原料として用いても、解重合・環化の条件が不適切であると、D-乳酸の環状二量体であるDD-ラクチドのほかに、メソラクチド(DL-ラクチド)やLL-ラクチドも生成する。
尚、LL-ラクチドとDD-ラクチドは、光学異性体(互いに鏡像関係にある異性体)であり、LL-ラクチドとメソラクチド(DL-ラクチド)は、互いに鏡像関係にない異性体でジアステレオマーとも言われる。
ラクチドは乳酸の二量体であるため、光学純度が低い乳酸、光学純度が低い乳酸から製造された乳酸オリゴマー、又は光学純度が低いポリ乳酸から製造された乳酸オリゴマーからラクチドを生成すると、必然的にメソラクチドが生成する。
本発明のラクチドの製造方法によれば、(i)高い化学純度、(ii)高い異性体純度(低いメソ体混入率)、及び(iii)高い光学純度、の全てを満たすラクチドを、好収率で製造することができる。
本発明において化学純度(w/w%)とは、以下の式(2)で表される。
化学純度(w/w%)= [(LL-ラクチド量+DD-ラクチド量+メソラクチド量)/(LL-ラクチド量+DD-ラクチド量+メソラクチド量+ラクチド以外の化合物量)]×100 (2)
化学純度(w/w%)= [(LL-ラクチド量+DD-ラクチド量+メソラクチド量)/(LL-ラクチド量+DD-ラクチド量+メソラクチド量+ラクチド以外の化合物量)]×100 (2)
また、メソ体混入率(%)とは、以下の式(3)で算出される。
メソ体混入率(%)= [(メソラクチド量)/(LL-ラクチド量+DD-ラクチド量+メソラクチド量)]×100 (3)
メソ体混入率(%)= [(メソラクチド量)/(LL-ラクチド量+DD-ラクチド量+メソラクチド量)]×100 (3)
異性体純度は、以下の式で計算される。高い異性体純度とは、低いメソ体混入率であることを意味する。
異性体純度(%)=[(LL-ラクチド量+DD-ラクチド量)/(LL-ラクチド量+DD-ラクチド量+メソラクチド量)]×100
異性体純度(%)=[(LL-ラクチド量+DD-ラクチド量)/(LL-ラクチド量+DD-ラクチド量+メソラクチド量)]×100
また、光学純度は、以下の式(4)で表される。
光学純度(%e.e.)= [(LL-ラクチド量-DD-ラクチド量)/(LL-ラクチド量+DD-ラクチド量)]×100 (4)
光学純度(%e.e.)= [(LL-ラクチド量-DD-ラクチド量)/(LL-ラクチド量+DD-ラクチド量)]×100 (4)
尚、ラクチド収率は、原料の乳酸オリゴマー重量に対する、得られたラクチド重量で表わされる。
上記の化学純度は、1H、または13C NMR、GC、GC-MS、HPLC、HPLC-MS等を適宜用いて求めることができる。
上記のメソ体混入率(%)及び異性体純度は、ラクチドの1H-または13C-NMR分析により、LL‐ラクチド及びDD‐ラクチド由来のピーク(a)とメソラクチド(DL-ラクチド)由来のピーク(b)を定量比較することで求めることができる。
メソ体混入率[%]=[(b)/(a+b)]×100
異性体純度[%]=[(a)/(a+b)]×100
メソ体混入率[%]=[(b)/(a+b)]×100
異性体純度[%]=[(a)/(a+b)]×100
上記の光学純度は、LL‐ラクチド及びDD‐ラクチド由来のピークとメソラクチド(DL-ラクチド)由来のピークから、下記式を用いて求めることができる。
光学純度(%e.e.)= (LL-DD)/(LL+DD)=(4a2 - b2)/(4a2 + b2) x 100
光学純度(%e.e.)= (LL-DD)/(LL+DD)=(4a2 - b2)/(4a2 + b2) x 100
本発明の製造方法では、前記式(2)で表されるラクチドの化学純度が99.0%以上、好ましくは99.5%以上である。前記式(3)で算出されるメソ体混入率、即ちメソラクチドの混入率が1%より少なく、好ましくは0.5%より少ない。また、前記式(4)で表される光学純度が99.0%e.e.以上、好ましくは99.9%e.e.以上、更に好ましくは99.99%以上である。本発明の製造方法では、化学純度、メソ体混入率、及び光学純度がいずれもこれらの値を満たす高純度のラクチドが得られるため、前記のようなラクチドの再結晶等の精製工程を省略又は簡素化することが可能である。前記のとおり、ラクチド法によるポリ乳酸製造には製造プロセスが長く、これが高コストの原因となっているので、本発明のラクチド製造方法による製造プロセスの短縮は極めて重要な意義を持つものである。
本発明の製造方法によって得られたラクチドを、開環重合して高分子量のポリ乳酸を得るための公知の方法及び装置を使用して、優れたポリ乳酸を得ることができる。
以下、実施例を用いて本発明をさらに詳細に説明するが、本発明は以下の実施例に限定されるものではなく、本発明の範囲内において種々の改良及び変形が可能である。
本実施例にて行った分析及び物性測定の方法、使用した原料について以下のとおり示す。
1)ラクチドのメソ体混入率及び光学純度の測定
標準化合物としてテトラメチルシラン(TMS)を0.03vol%含むCDC13溶媒に試料を溶解し、ブルカーDRX500(500MHz)NMRスペクトロメーター(ブルカー社製)を使用して、1H-homodecoupling NMR測定を行い、1.68ppmの積分値(以下、aと略記する)と1.72ppmの積分値(以下、bと略記する)から以下の式(5)によりメソ体混入率を、式(6)により光学純度を求めた。尚、aはLL-ラクチド及びDD-ラクチドの存在量を示し、bはメソラクチドの存在量を示す。
メソ体混入率[%]=[(b)/(a+b)]×100 (5)
光学純度(%e.e.)=[ (4a2 - b2)/(4a2 + b2) ]×100 (6)
標準化合物としてテトラメチルシラン(TMS)を0.03vol%含むCDC13溶媒に試料を溶解し、ブルカーDRX500(500MHz)NMRスペクトロメーター(ブルカー社製)を使用して、1H-homodecoupling NMR測定を行い、1.68ppmの積分値(以下、aと略記する)と1.72ppmの積分値(以下、bと略記する)から以下の式(5)によりメソ体混入率を、式(6)により光学純度を求めた。尚、aはLL-ラクチド及びDD-ラクチドの存在量を示し、bはメソラクチドの存在量を示す。
メソ体混入率[%]=[(b)/(a+b)]×100 (5)
光学純度(%e.e.)=[ (4a2 - b2)/(4a2 + b2) ]×100 (6)
2)乳酸オリゴマー及びポリ乳酸の平均重合度
標準化合物としてテトラメチルシラン(TMS)を0.03vol%含むCDC13溶媒に試料を溶解し、ブルカーDRX500(500MHz)NMRスペクトロメーター(ブルカー社製)を使用して、1H-NMRスペクトル測定を行い、OH末端側のCH(δ4.3)と内部CH(δ5.2)の面積比から算出した。
標準化合物としてテトラメチルシラン(TMS)を0.03vol%含むCDC13溶媒に試料を溶解し、ブルカーDRX500(500MHz)NMRスペクトロメーター(ブルカー社製)を使用して、1H-NMRスペクトル測定を行い、OH末端側のCH(δ4.3)と内部CH(δ5.2)の面積比から算出した。
触媒の合成例1(3-Cl-PyH-Tの合成)
200mLナスフラスコ中で塩化メチレン25mLに3-クロロピリジン3.0mL(26.8mmol)を溶解し、氷冷、攪拌しながらトリフルオロメタンスルホン酸3.0mL(33.9mmol)を少しずつ滴下した。ジエチルエーテル(150mL)から析出した結晶を吸引ろ過して減圧乾燥し、7.3gの3-Cl-PyH-T触媒を得た(収率96.0%)。
1H NMR(CDCl3) δ8.11(dd,1H,J=5.8,2.7), 8.54(m,1H), 8.65(m,2H)
13C NMR (CDCl3) δ120.08(q,J=318.8),128.43(d.J=4.4), 135.60, 140.66(d,J=6.0),
141.11, 146.33(d,J=7.4)
19F NMR(CDCl3) δ-78.67
m.p. 103.0-105.2℃
200mLナスフラスコ中で塩化メチレン25mLに3-クロロピリジン3.0mL(26.8mmol)を溶解し、氷冷、攪拌しながらトリフルオロメタンスルホン酸3.0mL(33.9mmol)を少しずつ滴下した。ジエチルエーテル(150mL)から析出した結晶を吸引ろ過して減圧乾燥し、7.3gの3-Cl-PyH-T触媒を得た(収率96.0%)。
1H NMR(CDCl3) δ8.11(dd,1H,J=5.8,2.7), 8.54(m,1H), 8.65(m,2H)
13C NMR (CDCl3) δ120.08(q,J=318.8),128.43(d.J=4.4), 135.60, 140.66(d,J=6.0),
141.11, 146.33(d,J=7.4)
19F NMR(CDCl3) δ-78.67
m.p. 103.0-105.2℃
触媒の合成例2(TPP-T触媒の合成)
200mLナスフラスコ中で塩化メチレン25mLにトリフェニルホスフィン(和光純薬社製)2.3gを溶解し、氷冷、攪拌しながらトリフルオロメタンスルホン酸0.9mlを少しずつ滴下した。塩化メチレン/ジエチルエーテル/ヘキサン=2/2/1の溶媒から析出した結晶を吸引ろ過して減圧乾燥して、収率78.9%にて、以下に示すPP-T触媒を得た。TPP-T触媒の熱分解温度は178℃であった。
200mLナスフラスコ中で塩化メチレン25mLにトリフェニルホスフィン(和光純薬社製)2.3gを溶解し、氷冷、攪拌しながらトリフルオロメタンスルホン酸0.9mlを少しずつ滴下した。塩化メチレン/ジエチルエーテル/ヘキサン=2/2/1の溶媒から析出した結晶を吸引ろ過して減圧乾燥して、収率78.9%にて、以下に示すPP-T触媒を得た。TPP-T触媒の熱分解温度は178℃であった。
実施例1.
90%含水乳酸(9.02g, 90.2mmol)にドコサノール(3.27g, 10.0mol), 3-Cl-Py-T(0.254g, 0.90mmol)を50ml丸底フラスコに入れ、ビグリュー管を装着した蒸留装置にて、4kPa、140℃で、12時間加熱した。140℃, 25mmHg(3333Pa)で12時間、加熱・撹拌した。フラスコ残留物はすべて乳酸オリゴマーのカルボン酸エステルであり、その重量は9.51g(オリゴマー収率95%)であり、その重合度はNMRからXn=9であった。
5.17(m,for -O-CH(CH3)CO-), 4.35(q,J=6.9,for HO-CH(CH3)CO-), 4.12(m,for -COO -CH 2-CH2-)が9:1:2となっていることで、すべてのカルボン酸末端が保護されたと判断した。
90%含水乳酸(9.02g, 90.2mmol)にドコサノール(3.27g, 10.0mol), 3-Cl-Py-T(0.254g, 0.90mmol)を50ml丸底フラスコに入れ、ビグリュー管を装着した蒸留装置にて、4kPa、140℃で、12時間加熱した。140℃, 25mmHg(3333Pa)で12時間、加熱・撹拌した。フラスコ残留物はすべて乳酸オリゴマーのカルボン酸エステルであり、その重量は9.51g(オリゴマー収率95%)であり、その重合度はNMRからXn=9であった。
5.17(m,for -O-CH(CH3)CO-), 4.35(q,J=6.9,for HO-CH(CH3)CO-), 4.12(m,for -COO -CH 2-CH2-)が9:1:2となっていることで、すべてのカルボン酸末端が保護されたと判断した。
得られた触媒入りのオリゴマーを160℃, 1mmHg(133.3Pa)で3時間、加熱・減圧して解重合を行い、5.09g(79%)のラクチドを得た。1H-NMRから求めたこの粗ラクチドの純度は、化学純度>99.5w/w%、メソ体混入率<0.3%、ラクチド光学純度>99.99%eeであった。
本実施例において用いた90質量%のL-乳酸水溶液は、L乳酸の光学純度が99%e.e.以上のものである。乳酸の光学純度は、公知のHPLC法により測定した。
実施例2
テレフタル酸 ビス(10-ヒドロキシデシルエステル)を用いて実施例1と同様にして重合度9のカルボン酸末端が保護されたオリゴマーを得、収率 68%でラクチドを得た。1H-NMRから求めた。この粗ラクチドの純度は、化学純度>99.5w/w%、メソ体混入率<0.3%、ラクチド光学純度>99.99%eeであった。
テレフタル酸 ビス(10-ヒドロキシデシルエステル)を用いて実施例1と同様にして重合度9のカルボン酸末端が保護されたオリゴマーを得、収率 68%でラクチドを得た。1H-NMRから求めた。この粗ラクチドの純度は、化学純度>99.5w/w%、メソ体混入率<0.3%、ラクチド光学純度>99.99%eeであった。
実施例3
実施例1のドコサノールに代えて2-デシル-1-テトラデカノールを同モル数用いた以外は同様の条件で反応を行ったところ、実施例1の結果と同様に、化学純度、メソ体混入率、光学純度、収率の全てが良好な結果を得た。
実施例1のドコサノールに代えて2-デシル-1-テトラデカノールを同モル数用いた以外は同様の条件で反応を行ったところ、実施例1の結果と同様に、化学純度、メソ体混入率、光学純度、収率の全てが良好な結果を得た。
実施例4
実施例1のドコサノールに代えて1,10-デカンジオール モノベヘン酸エステルを同モル数用いた以外は同様の条件で反応を行ったところ、実施例1の結果と同様に、化学純度、メソ体混入率、光学純度、収率の全てが良好な結果を得た。
実施例1のドコサノールに代えて1,10-デカンジオール モノベヘン酸エステルを同モル数用いた以外は同様の条件で反応を行ったところ、実施例1の結果と同様に、化学純度、メソ体混入率、光学純度、収率の全てが良好な結果を得た。
実施例5
実施例1の触媒3-Cl-Py-Tに代えてTPP-Tを用いた以外は同様の条件で反応を行ったところ、実施例1の結果と同様に、化学純度、メソ体混入率、光学純度、収率の全てが良好な結果を得た。
実施例1の触媒3-Cl-Py-Tに代えてTPP-Tを用いた以外は同様の条件で反応を行ったところ、実施例1の結果と同様に、化学純度、メソ体混入率、光学純度、収率の全てが良好な結果を得た。
比較例1(収率が低い例、カルボン酸末端が保護されていない場合)
ドコサノールを用いない以外は、実施例1と同様の条件で反応を行ったところ、収率が30%であった。
ドコサノールを用いない以外は、実施例1と同様の条件で反応を行ったところ、収率が30%であった。
比較例2(化学純度が悪い例、カルボン酸末端がセチルアルコールで保護された場合)
まず、重合度9のオリゴ乳酸セチルエステルの合成を行った。即ち、90%含水乳酸(147.43g、1.474mol),セチルアルコール(39.72g,0.163mol)をキシレン(200ml)に加え、Dean-Stark管をつけて、24時間加熱還流し、共沸脱水重縮合により乳酸オリゴマーを得た。1H NMRでδ5.17(m、-O-CH(CH3)CO-)、4.35(q、J=6.9Hz,HO-CH(CH3)CO-)、4.12ppm(m、-COO-CH 2-CH2-)が9:1:2となっていることで、すべてのカルボン酸末端が保護された重合度9のオリゴ乳酸セチルエステルであると判断した。ここで得た重合度9のオリゴ乳酸セチルエステルは、後の実験にそのまま使用した。
まず、重合度9のオリゴ乳酸セチルエステルの合成を行った。即ち、90%含水乳酸(147.43g、1.474mol),セチルアルコール(39.72g,0.163mol)をキシレン(200ml)に加え、Dean-Stark管をつけて、24時間加熱還流し、共沸脱水重縮合により乳酸オリゴマーを得た。1H NMRでδ5.17(m、-O-CH(CH3)CO-)、4.35(q、J=6.9Hz,HO-CH(CH3)CO-)、4.12ppm(m、-COO-CH 2-CH2-)が9:1:2となっていることで、すべてのカルボン酸末端が保護された重合度9のオリゴ乳酸セチルエステルであると判断した。ここで得た重合度9のオリゴ乳酸セチルエステルは、後の実験にそのまま使用した。
前記重合度9のオリゴ乳酸セチルエステル(7.9g)に3-ClPy-T(0.22g、乳酸の1mol%)を加え、27Pa、140℃で6時間加熱した。留出した粗ラクチド(4.7g、81%)は、化学純度89.8w/w%、異性体純度>99.5%、光学純度99.99%eeであった。不純物は、セチルアルコール由来のオレフィンであった。以上のように化学純度が悪い。
比較例3(メソ体混入率が高い例、公知のスズ系触媒の場合)
触媒3-Cl-Py-Tに代えてオクチル酸スズ(II)を用いた以外は同様の条件で反応を行ったところ、メソ体混入率が3%であった。
触媒3-Cl-Py-Tに代えてオクチル酸スズ(II)を用いた以外は同様の条件で反応を行ったところ、メソ体混入率が3%であった。
本発明の製造方法は、高純度の光学活性ラクチドをより低コストで効率良く製造することができ、高純度ラクチド製造分野及びラクチド法によるポリ乳酸製造分野に極めて有効である。
Claims (6)
- 乳酸オリゴマーのカルボキシル基が、総炭素数20以上の1級アルコール(ただし、酸素原子及び/又は硫黄原子が該アルコール中に存在する場合には、総炭素数には該酸素原子及び/又は硫黄原子の数も含み、1級アルコールの水酸基の酸素原子も含む)でエステル化されたものを減圧下で加熱し、触媒として一般式(1)又は(2)で表される化合物からなる群より選ばれる少なくとも1種の化合物を用いることを特徴とするラクチドの製造方法。
- 前記総炭素数20以上の1級アルコールは、ドコサノール、テトラコサノール、2-オクチル-1-ドデカノール、2-デシル-1-テトラデカノール、1,10-デカンジオール モノベヘン酸エステル、1,10-デカンジオール モノミリスチン酸エステル、1,10-デカンジオール モノラウリン酸エステル、1,12-ドデカンジオール モノベヘン酸エステル、1,12-ドデカンジオール モノラウリン酸エステル、1,12-ドデカンジオール モノミリスチン酸エステル、1,12-ドデカンジオール モノベンジルエーテル、テレフタル酸 ビス(10-ヒドロキシデシルエステル)、テレフタル酸 ビス(12-ヒドロキシドデシルエステル)、10-デシルチオデカノール、オリゴ(1,10-デカンジオール) n=3、4、5、およびこれらの混合物から選択される請求項1に記載のラクチドの製造方法。
- 前記総炭素数20以上の1級アルコールは、ドコサノール、2-デシル-1-テトラデカノール、1,10-デカンジオール モノベヘン酸エステル、テレフタル酸 ビス(10-ヒドロキシデシルエステル)、又はオリゴ(1,10-デカンジオール) n=3、4、5である請求項1に記載のラクチドの製造方法。
- 乳酸オリゴマーのカルボキシル基がエステル化されたものの平均重合度が、3以上50以下である請求項1~3のいずれか一項記載のラクチドの製造方法。
- 加熱が、140~200℃の温度である請求項1~4のいずれか一項に記載のラクチドの製造方法。
- ラクチドが、化学純度99.0w/w%以上、メソ体混入率が1%より少ない、かつ光学純度99.0%e.e.以上を満たすものである請求項1~5のいずれか一つに記載のラクチドの製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014503543A JP6138111B2 (ja) | 2012-03-08 | 2013-03-07 | ラクチドの製造方法 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012074985 | 2012-03-08 | ||
| JP2012-074985 | 2012-03-08 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2013133377A1 true WO2013133377A1 (ja) | 2013-09-12 |
Family
ID=49116846
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2013/056291 WO2013133377A1 (ja) | 2012-03-08 | 2013-03-07 | ラクチドの製造方法 |
Country Status (2)
| Country | Link |
|---|---|
| JP (1) | JP6138111B2 (ja) |
| WO (1) | WO2013133377A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019026613A (ja) * | 2017-08-02 | 2019-02-21 | 日本曹達株式会社 | 環状エステル類の製造方法 |
| CN113416134A (zh) * | 2021-07-27 | 2021-09-21 | 重庆大学 | 一种乳酸低聚物及其制备方法与用途 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001181273A (ja) * | 1999-12-24 | 2001-07-03 | Mitsubishi Gas Chem Co Inc | グリコリド類の製造方法 |
| WO2007145195A1 (ja) * | 2006-06-15 | 2007-12-21 | National University Corporation Kyoto Institute Of Technology | ポリ乳酸合成のための有機酸系触媒 |
| JP2012140383A (ja) * | 2011-01-05 | 2012-07-26 | Kyoto Institute Of Technology | ラクチドの製造方法 |
-
2013
- 2013-03-07 WO PCT/JP2013/056291 patent/WO2013133377A1/ja active Application Filing
- 2013-03-07 JP JP2014503543A patent/JP6138111B2/ja not_active Expired - Fee Related
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001181273A (ja) * | 1999-12-24 | 2001-07-03 | Mitsubishi Gas Chem Co Inc | グリコリド類の製造方法 |
| WO2007145195A1 (ja) * | 2006-06-15 | 2007-12-21 | National University Corporation Kyoto Institute Of Technology | ポリ乳酸合成のための有機酸系触媒 |
| JP2012140383A (ja) * | 2011-01-05 | 2012-07-26 | Kyoto Institute Of Technology | ラクチドの製造方法 |
Non-Patent Citations (1)
| Title |
|---|
| YUKI ISHIJIMA ET AL.: "Onium En Shokubai ni yoru Lactide Gosei", CSJ: THE CHEMICAL SOCIETY OF JAPAN DAI 91 SHUNKI NENKAI (2011) KOEN YOKOSHU III, 11 March 2011 (2011-03-11) * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019026613A (ja) * | 2017-08-02 | 2019-02-21 | 日本曹達株式会社 | 環状エステル類の製造方法 |
| CN113416134A (zh) * | 2021-07-27 | 2021-09-21 | 重庆大学 | 一种乳酸低聚物及其制备方法与用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| JPWO2013133377A1 (ja) | 2015-07-30 |
| JP6138111B2 (ja) | 2017-05-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5179595B2 (ja) | ラクチドの製造方法 | |
| EP2582453B1 (en) | Transesterification process using mixed salt acetylacetonates catalysts | |
| EP2980084B1 (en) | Method for producing glycolide | |
| EP2264020A1 (en) | Catalyst for direct conversion of esters of lactic acid to lactide and the method for producing lactide using the same | |
| JP2014185150A (ja) | ジ(2−エチルヘキシル)テレフタレートの製造方法 | |
| JP2001261811A (ja) | 高分子量ポリカーボネートジオールの製造法 | |
| JP6138111B2 (ja) | ラクチドの製造方法 | |
| US9120833B2 (en) | Polyfluoroalkylphosphonic acid ester and process for producing the same | |
| JP5728781B2 (ja) | ラクチドの製造方法 | |
| JP5701524B2 (ja) | 1−アルキルグリセロールエーテルの調製方法 | |
| CN109311798A (zh) | 用于由回收原料制备对苯二甲酸二烷基酯的方法 | |
| JP3720040B2 (ja) | ナフタレンジカルボン酸のエステル化反応生成物混合液または混合物およびこれらの製造方法、ならびにポリエチレンナフタレートの製造方法 | |
| JP2015145345A (ja) | 環状α−ヒドロキシカルボン酸2量体エステルの製造方法 | |
| EP1679331A1 (en) | Acyloxy acetic acid polymer and method for producing same | |
| JP6378103B2 (ja) | ラクトン重合体の製造方法 | |
| US5504252A (en) | Synthesis of cyanoacrylate esters by oxidation of aromatic selenyl cyanopropionates | |
| JP4645032B2 (ja) | スピログリコールの製造方法 | |
| JP2019214545A (ja) | テレフタル酸ビス(2−ヒドロキシエチル)の製造方法 | |
| JP6828500B2 (ja) | 2−メチル−2−ヒドロキシ−1−プロピル(メタ)アクリレートおよび/または3−メチル−3−ヒドロキシ−1−ブチル(メタ)アクリレートの製造方法ならびに組成物 | |
| WO2013039038A1 (ja) | グリコリドの製造方法 | |
| JP4651178B2 (ja) | 2−グリシジルオキシエチル(メタ)アクリレートの製造方法 | |
| JPH11209370A (ja) | ラクチドの製造方法及びラクチド製造用触媒 | |
| EP3950663A1 (en) | New method for obtaining diester compounds useful for the manufacture of new quaternary ammonium compounds | |
| JP7039345B2 (ja) | グリコリドの製造方法 | |
| JP4010804B2 (ja) | 縮合リン酸エステル化合物の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 13758357 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2014503543 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 13758357 Country of ref document: EP Kind code of ref document: A1 |