RU2755503C2 - Анти-lag-3 антитела и их композиции - Google Patents
Анти-lag-3 антитела и их композиции Download PDFInfo
- Publication number
- RU2755503C2 RU2755503C2 RU2019113790A RU2019113790A RU2755503C2 RU 2755503 C2 RU2755503 C2 RU 2755503C2 RU 2019113790 A RU2019113790 A RU 2019113790A RU 2019113790 A RU2019113790 A RU 2019113790A RU 2755503 C2 RU2755503 C2 RU 2755503C2
- Authority
- RU
- Russia
- Prior art keywords
- lag
- antibody
- seq
- amino acid
- antigen
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
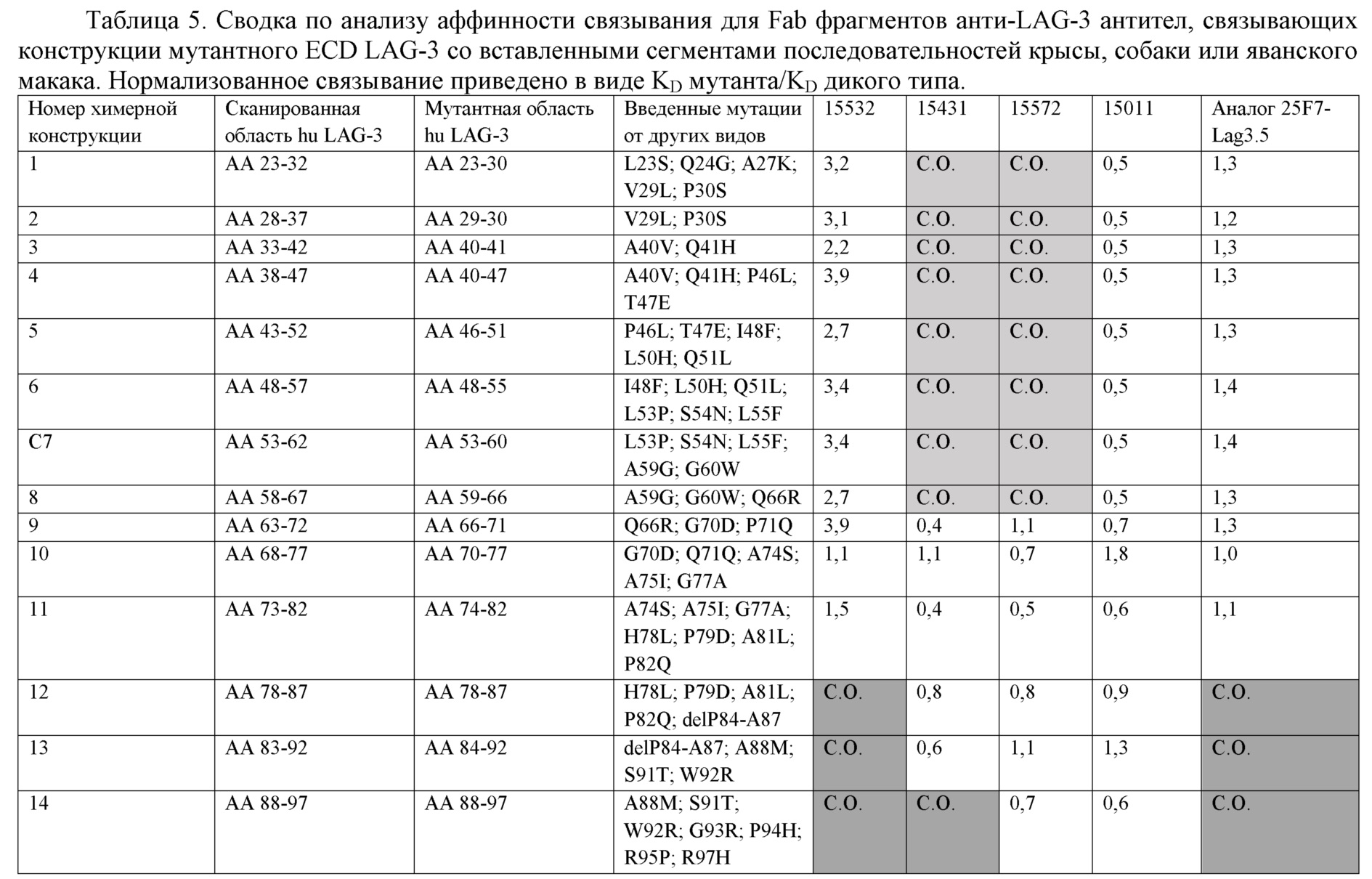
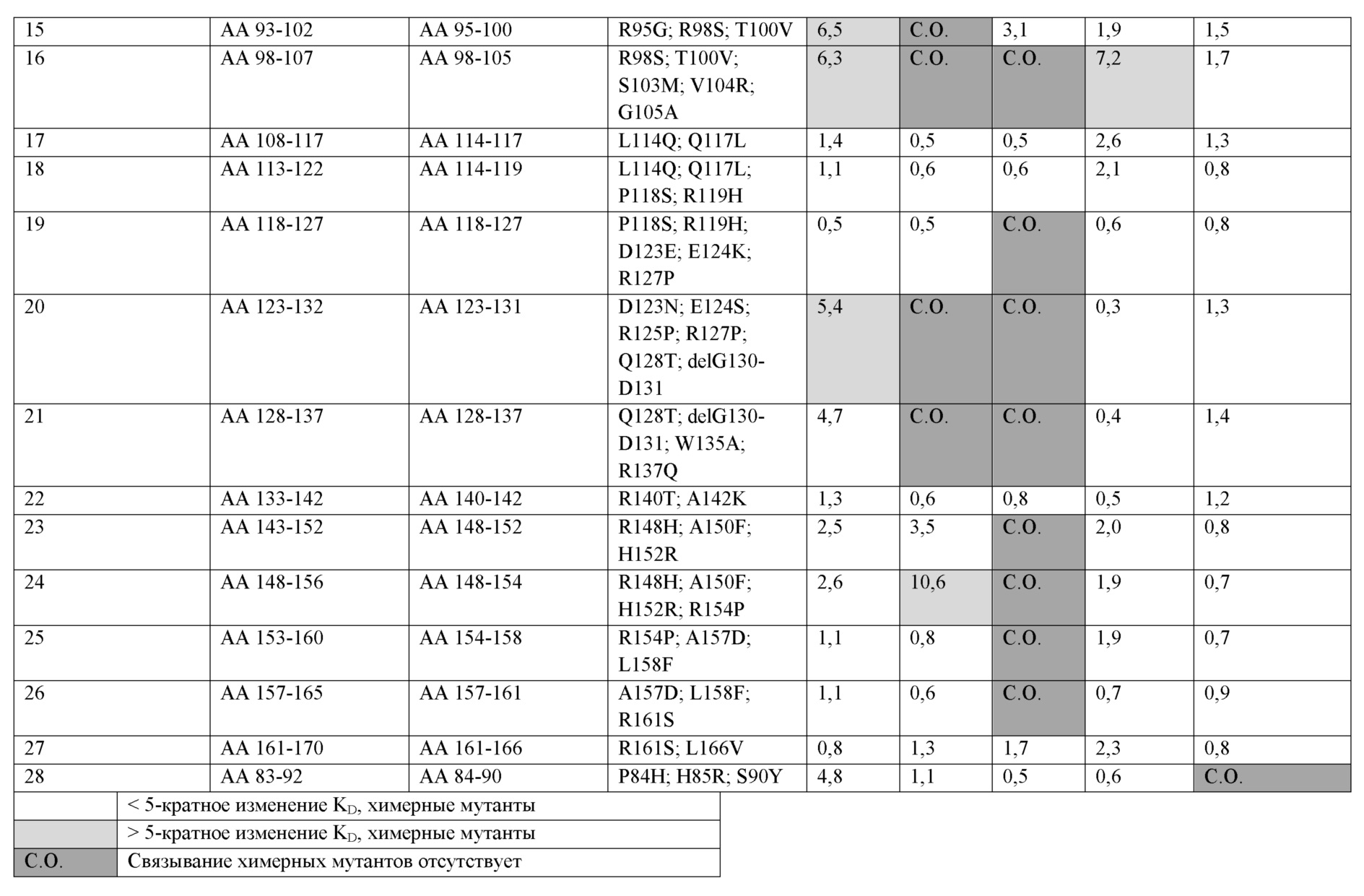
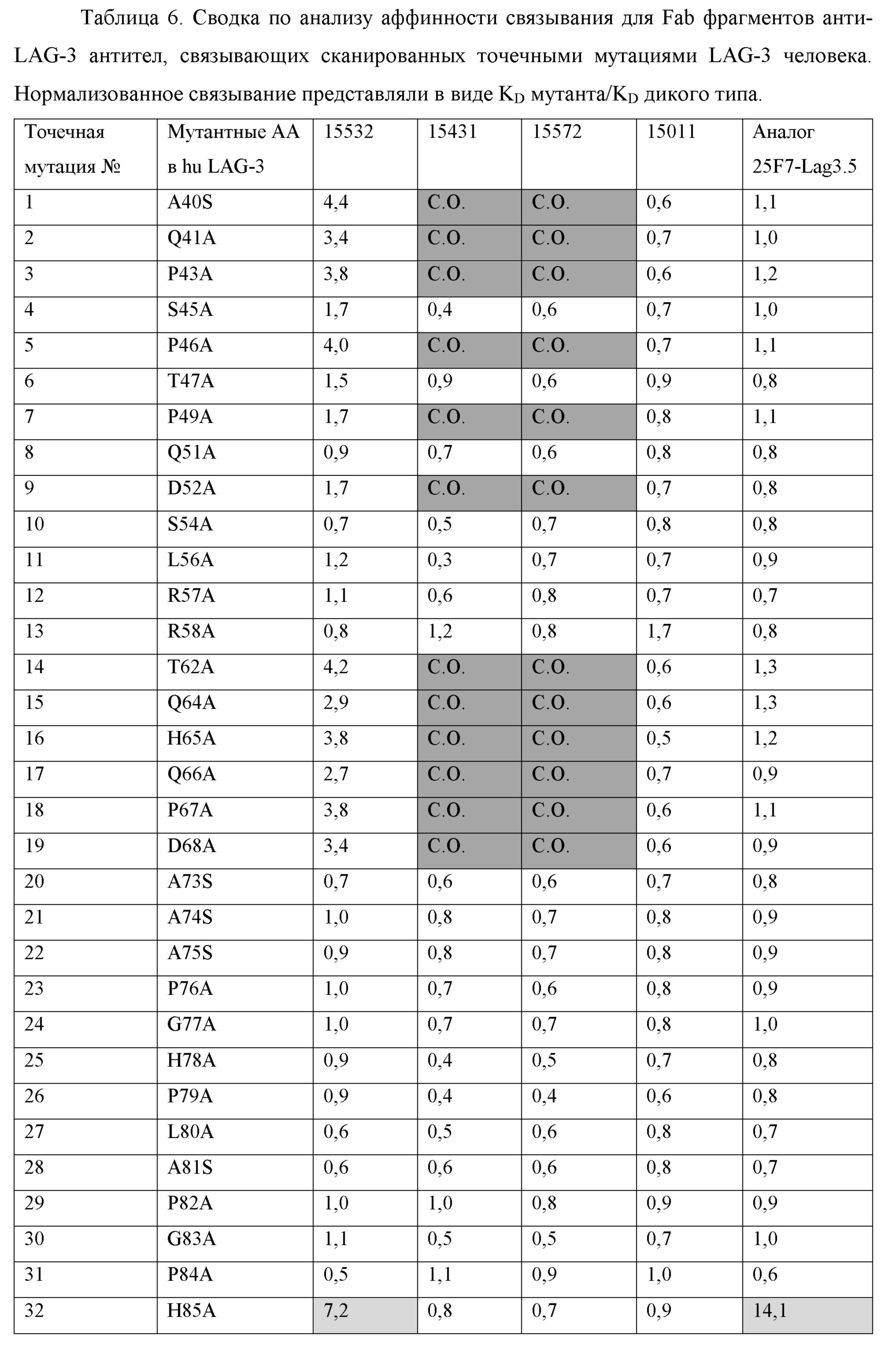
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/51—Complete heavy chain or Fd fragment, i.e. VH + CH1
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/515—Complete light chain, i.e. VL + CL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/71—Decreased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Epidemiology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Dermatology (AREA)
- Mycology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Изобретение относится к области биохимии, в частности к анти-LAG-3 антителу или его антигенсвязывающей части, которое специфически связывается с LAG-3, способу его получения, а также содержащей его композиции. Также раскрыта выделенная молекула нуклеиновой кислоты, кодирующая цепи вышеуказанного антитела, а также клетка, содержащая вышеуказанную нуклеиновую кислоту. Изобретение также относится к способу усиления иммунитета у пациента, предусматривающему использование вышеуказанного антитела или его части. Изобретение позволяет эффективно осуществлять лечение пациента со связанным с LAG-3 нарушением. 10 н. и 15 з.п. ф-лы, 9 ил., 10 табл., 14 пр.
Description
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0001] Настоящая заявка содержит список последовательностей, который подан в электронном виде в формате ASCII и включен, таким образом, посредством ссылки в полном объеме. Электронная копия списка последовательностей, созданная 5 октября 2017 года, названа 022675_WO057-SL.txt и имеет размер 64693 Б.
УРОВЕНЬ ТЕХНИКИ
[0002] LAG-3 (ген активации лимфоцитов 3), также известный как CD223, представляет собой белок суперсемейства иммуноглобулинов, который выполняет функцию рецептора контрольной точки иммунитета. Зрелый белок представляет собой трансмембранный белок I типа из 503 аминокислот, состоящий из четырех внеклеточных Ig-подобных доменов. Он экспрессируется клетками различных типов, в том числе активированными T-клетками, регуляторными T-клетками (Treg), естественные киллерами, B-клетками и плазмоцитоидными дендритными клетками. Информация о последовательности, организации экзонов/интронов и расположении LAG-3 на хромосоме указывает на его близкое родство с CD4. Как и CD4, LAG-3 связывается с молекулами MHC класса II, но с более высокой аффинностью и на другом сайте по сравнению с CD4.
[0003] LAG-3 представляет собой коингибирующий рецептор, который предположительно регулирует T-клеточную пролиферацию, активацию и гомеостаз сходным с CTLA-4 и PD-1 образом. При связывании с внеклеточным доменом лиганда, LAG-3 проявляет свой эффект посредством последующей передачу сигнала через цитоплазматический домен. Лучше всего охарактеризованным лигандом LAG-3 является MHC класса II (MHCII), но описаны другие лиганды LAG-3, в том числе LSECtin.
[0004] LAG-3 не имеет классических мотивов ITIM или ITSM, но имеет консервативный мотив KIEELE (SEQ ID NO:73), который предположительно обязателен для проявления его ингибирующего эффекта на T-клеточную активность. Точный механизм, по которому LAG-3 воздействует на T-клеточную активность, слабо изучен. LAG-3 ингибирует деление T-клеток посредством блокирования вхождения активированных T-клеток в фазу роста клеточного цикла, что ведет к накоплению клеток в S-фазе. LAG-3 также предположительно играет роль в усилении супрессорной активности регуляторных T-клеток и в модулировании функции дендритных клеток. Злокачественные клетки обладают способностью активировать экспрессию MHCII, который связывает LAG-3, на эффекторных T-клетках, таким образом ингибируя их активность и индуцируя ускользание опухоли от иммунного ответа.
[0005] Ввиду решающей роли LAG-3 в качестве иммунного модулятора, существует необходимость в новой и усовершенствованной иммунной терапии, которая нацеливается на LAG-3, для лечения злокачественных опухолей и определенных нарушений иммунной системы.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0006] Настоящее изобретение относится к новым рекомбинантным антителам, нацеленными на LAG-3, а также к фармацевтическим композициям, содержащим одно или несколько таких антител, и к применению антител и фармацевтических композиций для усиления иммунитета у пациента и для лечения злокачественных опухолей, происходящих из таких тканей, как кожа, легкое, кишечник, толстая кишка, яичник, головной мозг, предстательная железа, почка, мягкие ткани, гематопоэтическая система, голова и шея, печень, мочевой пузырь, молочная железа, желудок, матка и поджелудочная железа. По сравнению с существующими в настоящее время способами лечения таких злокачественных опухолей, включая терапию антителами, предполагается, что антитела по изобретению могут обеспечивать высокоэффективное лечение как при самостоятельном применении, так и в комбинации с другим противораковым терапевтическим средством, таким как антитело, нацеленное на другой белок контрольной точки иммунитета.
[0007] В одном из вариантов осуществления настоящее изобретение относится к анти-LAG-3 антителу или его антиген-связывающей части, где анти-LAG-3 антитело представляет собой любое антитело, указанное в настоящем описании как антитело 15646, 15532, 15723, 15595, 15431, 15572 или 15011, или его вариант, где вариант, например, может относиться к другому изотипу или изотипическому подклассу и/или содержать определенные минимальные аминокислотные замены относительно антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011, не утрачивая при этом антиген-связывающую специфичность родительского антитела.
[0008] В одном из вариантов осуществления анти-LAG-3 антитело конкурирует за связывание с LAG-3 человека с антителом, у которого CDR1-3 тяжелой цепи (H) и CDR1-3 легкой цепи (H) такие же как H-CDR1-3 и L-CDR1-3 антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011, или получены на основе этих антител.
[0009] В одном из вариантов осуществления анти-LAG-3 антитело связывается с тем же эпитопом LAG-3 человека, что и антитело, у которого CDR1-3 тяжелой цепи (H) и CDR1-3 легкой цепи (H) такие же как H-CDR1-3 и L-CDR1-3 антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011, или получены на основе этих антител.
[0010] В одном из вариантов осуществления анти-LAG-3 антитело содержит H-CDR3, содержащую аминокислотную последовательность H-CDR3 антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0011] В одном из вариантов осуществления анти-LAG-3 антитело содержит H-CDR1-3, содержащие последовательности H-CDR1-3, соответственно, антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0012] В одном из вариантов осуществления анти-LAG-3 антитело содержит L-CDR3, содержащую аминокислотную последовательность L-CDR3 антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0013] В одном из вариантов осуществления анти-LAG-3 антитело содержит L-CDR1-3, содержащие последовательности L-CDR1-3, соответственно, антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0014] В одном из вариантов осуществления анти-LAG-3 антитело содержит аминокислотные последовательности H-CDR3 и L-CDR3 антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0015] В одном из вариантов осуществления анти-LAG-3 антитело содержит аминокислотные последовательности H-CDR1-3 и L-CDR1-3 антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0016] В одном из вариантов осуществления анти-LAG-3 антитело конкурирует за связывание с LAG-3 человека с антителом 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0017] В одном из вариантов осуществления анти-LAG-3 антитело связывается с тем же эпитопом LAG-3 человека, что и антитело 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0018] В одном из вариантов осуществления анти-LAG-3 антитело содержит определяющую комплементарность область тяжелой цепи (H-CDR) 3, содержащую аминокислотную последовательность SEQ ID NO:37, 43, 46, 50, 55, 58 или 64.
[0019] В одном из вариантов осуществления анти-LAG-3 антитело содержит H-CDR1-3, содержащие аминокислотные последовательности, соответственно, из SEQ ID NO:35-37; 41-43; 35, 42, и 46; 48-50; 53-55; 56-58; или 62-64.
[0020] В одном из вариантов осуществления анти-LAG-3 антитело имеет вариабельный домен тяжелой цепи (VH), последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности VH c SEQ ID NO:3, 7, 11, 15, 19, 23 или 27.
[0021] В одном из вариантов осуществления анти-LAG-3 антитело имеет VH, который содержит SEQ ID NO:3, 7, 11, 15, 19, 23 или 27.
[0022] В одном из вариантов осуществления анти-LAG-3 антитело имеет тяжелую цепь (HC), которая содержит VH c аминокислотной последовательностью SEQ ID NO:3, 7, 11, 15, 19, 23 или 27 и константную области тяжелой цепи с аминокислотной последовательностью SEQ ID NO:30.
[0023] В одном из вариантов осуществления анти-LAG-3 антитело содержит определяющую комплементарность область легкой цепи (L-CDR) 3, содержащую аминокислотную последовательность SEQ ID NO:40, 52, 61 или 67.
[0024] В одном из вариантов осуществления анти-LAG-3 антитело содержит L-CDR1-3, содержащие аминокислотные последовательности SEQ ID NO:38-40; 44, 45 и 40; 44, 47 и 40; 51, 47 и 52; 59-61; или 65-67, соответственно.
[0025] В одном из вариантов осуществления анти-LAG-3 антитело имеет вариабельный домен легкой цепи (VL), последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности VL с SEQ ID NO:4, 8, 12, 16, 20, 24 или 28.
[0026] В одном из вариантов осуществления анти-LAG-3 антитело имеет VL, который содержит SEQ ID NO:4, 8, 12, 16, 20, 24 или 28.
[0027] В одном из вариантов осуществления анти-LAG-3 антитело имеет легкую цепь (LC), которая содержит VL с аминокислотной последовательностью SEQ ID NO:4, 8, 12, 16, 20, 24 или 28 и константную область легкой цепи с аминокислотной последовательностью SEQ ID NO:32 или 34.
[0028] В одном из вариантов осуществления анти-LAG-3 антитело содержит H-CDR3 и L-CDR3 с аминокислотными последовательностями SEQ ID NO:37 и 40; 43 и 40; 46 и 40; 50 и 52; 55 и 40; 58 и 61; или 64 и 67; соответственно.
[0029] В определенных вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению содержит H-CDR1-3 и L-CDR1-3 с аминокислотными последовательностями:
a) SEQ ID NO:35, 36, 37, 38, 39 и 40, соответственно;
b) SEQ ID NO:41, 42, 43, 44, 45 и 40, соответственно;
c) SEQ ID NO:35, 42, 46, 44, 47 и 40, соответственно;
d) SEQ ID NO:48, 49, 50, 51, 47 и 52, соответственно;
e) SEQ ID NO:53, 54, 55, 44, 45 и 40, соответственно;
f) SEQ ID NO:56, 57, 58, 59, 60 и 61, соответственно; или
g) SEQ ID NO:62, 63, 64, 65, 66 и 67, соответственно.
[0030] В определенных вариантах осуществления анти-LAG-3 антитело или его антиген-связывающая часть по изобретению:
a) имеет VH, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:3, и VL, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:4;
b) имеет VH, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:7, и VL, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:8;
c) имеет VH, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:11, и VL, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:12;
d) имеет VH, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:15, и VL, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:16;
e) имеет VH, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:19, и VL, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:20;
f) имеет VH, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:23, и VL, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:24; или
g) имеет VH, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:27, и VL, последовательность которого по меньшей мере на 90% (например, по меньшей мере на 92%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99%) идентична аминокислотной последовательности SEQ ID NO:28.
[0031] В определенных вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению:
a) имеет VH, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:3, и VL, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:4;
b) имеет VH, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:7, и VL, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:8;
c) имеет VH, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:11, и VL, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:12;
d) имеет VH, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:15, и VL, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:16;
e) имеет VH, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:19, и VL, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:20;
f) имеет VH, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:23, и VL, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:24; или
g) имеет VH, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:27, и VL, которая содержит или состоит из аминокислотной последовательности SEQ ID NO:28.
[0032] В определенных вариантах осуществления анти-LAG-3 антитело:
a) имеет LC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:4 и 34; и HC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:3 и 30;
b) имеет LC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:8 и 34; и HC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:7 и 30;
c) имеет LC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:12 и 34; и HC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:11 и 30;
d) имеет LC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:16 и 34; и HC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:15 и 30;
e) имеет LC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:20 и 34; и HC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:19 и 30;
f) имеет LC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:24 и 34; и HC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:23 и 30; или
g) имеет LC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:28 и 32; и HC, которая содержит или состоит аминокислотных последовательностей SEQ ID NO:27 и 30.
[0033] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению имеет по меньшей мере одно из следующих свойств:
a) при концентрации 20 мкг/мл более чем на 85% снижает связывание LAG-3 человека с MHC класса II человека на клетках A375 по сравнению с антителом отрицательного контроля, как определено конкурентным анализом на основе проточной цитометрии;
b) в концентрации 20 мкг/мл снижает связывание LAG-3 человека с MHC класса II человека на клетках A375 до 35-85% по сравнению с антителом отрицательного контроля, как определено конкурентным анализом на основе проточной цитометрии;
c) блокирует связывание LAG-3 человека, экспрессируемым на клетках Jurkat, и MHC класса II человека, экспрессируемым на клетках Raji;
d) связывается с LAG-3 человека при EC50 0,1 нМ или меньше, как измерено проточной цитометрией;
e) связывается с LAG-3 яванского макака при EC50 0,3 нМ или меньше, как измерено проточной цитометрией;
f) связывается с LAG-3 человека при KD 3,0×10-8 или меньше, как измерено поверхностным плазмонным резонансом;
g) связывается с LAG-3 яванского макака с KD 1,5×10-7 или меньше, как измерено поверхностным плазмонным резонансом;
h) связывается с LAG-3 мыши с KD 3,5×10-8 или меньше, как измерено поверхностным плазмонным резонансом;
i) стимулирует продукцию IL-2 мононуклеарными клетками периферической крови человека (PBMC), обработанными стафилококковым энтеротоксином B (SEB);
j) снижает клеточные уровни LAG-3 в T-клетках человека;
k) снижает растворимые уровни LAG-3 в культуре T-клеток человека;
l) индуцирует регрессию опухолевого роста in vivo;
m) задерживает опухолевый рост in vivo; и
n) не связывается с тем же эпитопом LAG-3 человека, что и антитело 25F7-Lag3.5.
[0034] Примеры такого антитела включают, без ограничения, антитело 15646 (по меньшей мере со свойствами b, c, d, e, i и n), антитело 15532 (по меньшей мере со свойствами a, c, d, e, f, g, i, j, k, m и n), антитело 15723 (по меньшей мере со свойствами b, c, d, e, i и n), антитело 15595 (по меньшей мере со свойствами a, c, d, e, i и n), антитело 15431 (по меньшей мере со свойствами a, c, d, e, f, g, i и n), антитело 15572 (по меньшей мере со свойствами b, c, d, e, f, g, i и n) и антитело 15011 (по меньшей мере со свойствами a, c, d, e, f, g, h, i, j, k, l, m и n). В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению имеет по меньшей мере 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 из указанных свойств. В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению имеет по меньшей мере свойства b, c, d, e, i и n; по меньшей мере свойства a, c, d, e, f, g, i, j, k, m и n; по меньшей мере свойства a, c, d, e, i и n; по меньшей мере свойства a, c, d, e, f, g, i и n; по меньшей мере свойства b, c, d, e, f, g, i и n; или по меньшей мере свойства a, c, d, e, f, g, h, i, j, k, l, m и n.
[0035] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению конкурирует за связывание с LAG-3 человека с антителом 15011, 15572 и/или 15431.
[0036] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению связывается с эпитопом LAG-3 человека, имеющим:
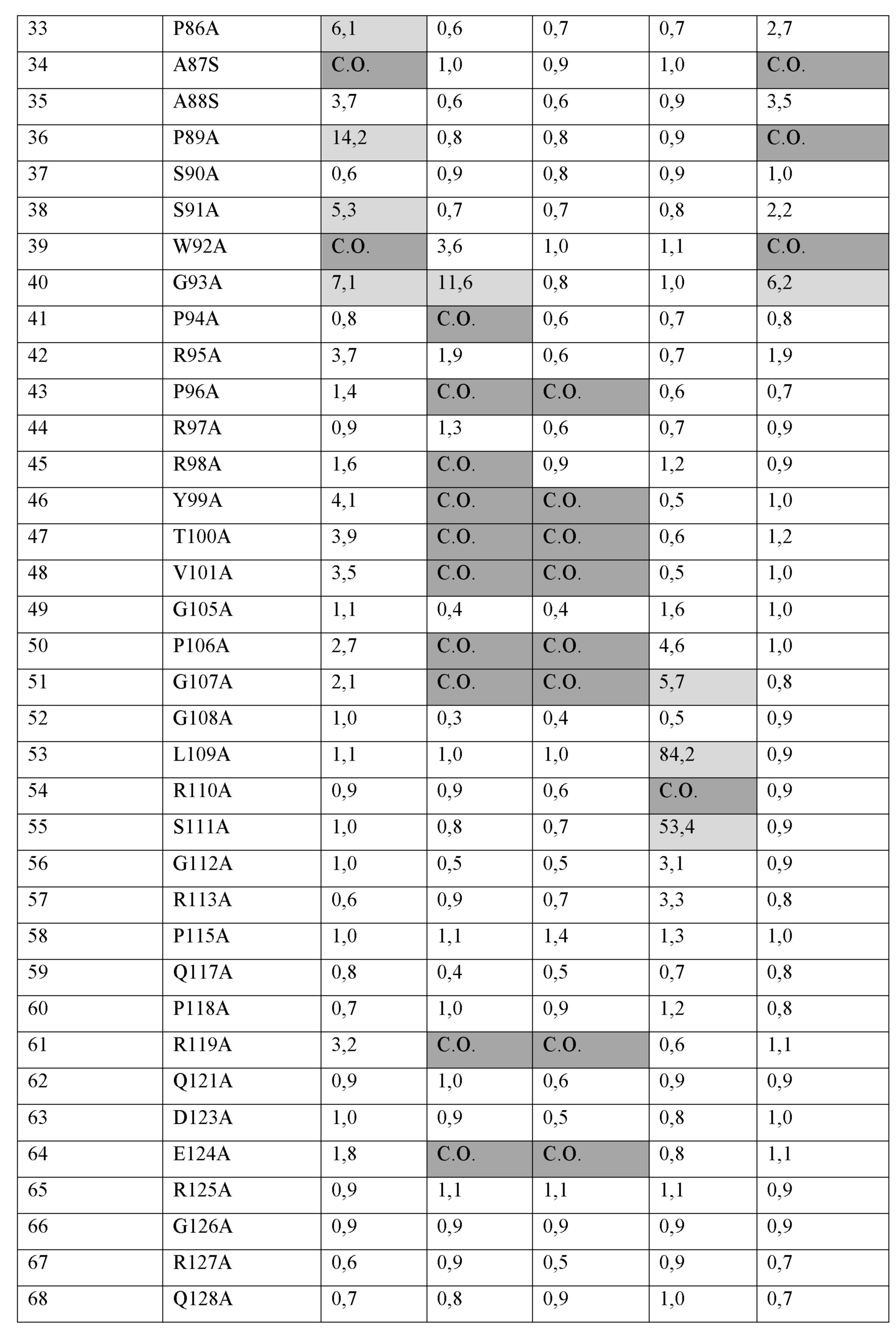
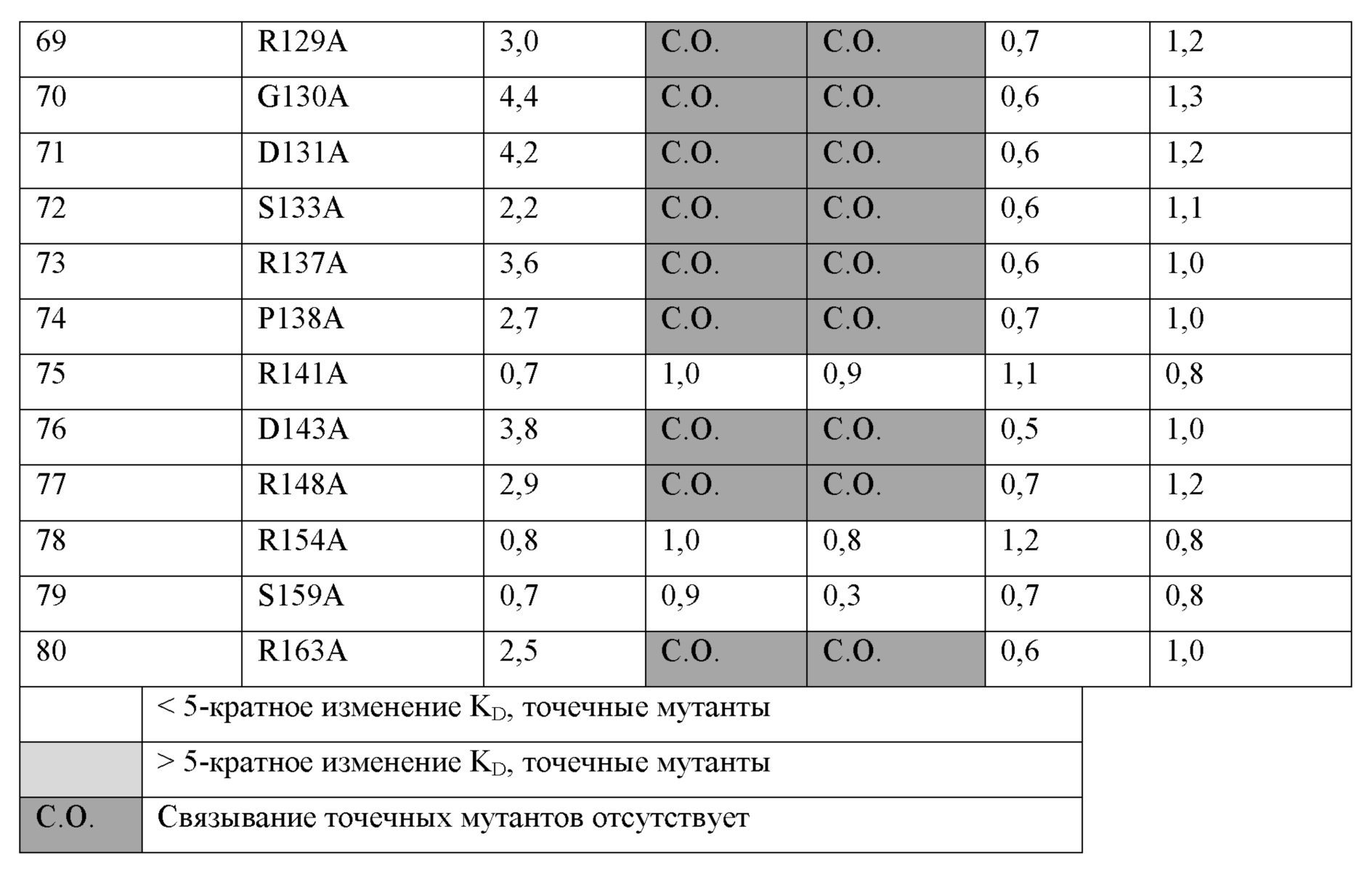
a) аминокислотные остатки H85, P86, A87, P89, S91, W92 и G93 из SEQ ID NO:68;
b) аминокислотные остатки A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67, D68, G93, P94, P96, R98, Y99, T100, V101, P106, G107, R119, E124, R129, G130, D131, S133, R137, P138, D143, R148 и R163 из SEQ ID NO:68;
c) аминокислотные остатки A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67, D68, P96, Y99, T100, V101, P106, G107, R119, E124, R129, G130, D131, S133, R137, P138, D143, R148 и R163 из SEQ ID NO:68; или
d) аминокислотные остатки G107, L109, R110 и S111 из SEQ ID NO:68.
[0037] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению связывается с эпитопом, имеющим аминокислотные остатки 98-105 SEQ ID NO:68. Примеры такого антитела включают, без ограничения, антитела 15532, 15431, 15572 и 15011.
[0038] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению связывается с эпитопом, имеющим:
a) аминокислотные остатки 78-105 и 123-131 SEQ ID NO:68;
b) аминокислотные остатки 23-30, 40-66, 88-105, 123-137 и 148-152 SEQ ID NO:68; или
c) аминокислотные остатки 23-30, 40-66, 98-105, 118-137 и 148-161 SEQ ID NO:68
[0039] В некоторых вариантах осуществления антитело по настоящему изобретению относится к изотипу IgG, например, подклассу IgG1 или IgG2 изотипа IgG. В определенных вариантах осуществления антитело содержит по меньшей мере одну мутацию в Fc-области. В конкретных вариантах осуществления антитело содержит мутацию в одном или нескольких аминокислотных положениях тяжелой цепи 228, 234 и 235, которые пронумерованы согласно схеме нумерации IMGT®. Например, один или оба аминокислотных остатка в положениях 234 и 235 могут быть мутированы из Leu в Ala и/или аминокислотный остаток в положении 228 может быть мутирован из Ser в Pro.
[0040] В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно (например, одно) анти-LAG-3 антитело или его антиген-связывающую часть, как раскрыто в настоящем описании, и фармацевтически приемлемый эксципиент, необязательно с дополнительным терапевтическим средством, таким как противораковое терапевтическое антитело.
[0041] Настоящее изобретение дополнительно относится к выделенным молекулам нуклеиновой кислоты, содержащим нуклеотидную последовательность, которая кодирует тяжелую цепь или ее антиген-связывающую часть, нуклеотидную последовательность, которая кодирует легкую цепь или ее антиген-связывающую часть, или обе цепи, анти-LAG-3 антитела, как раскрыто в настоящем описании. Изобретение также относится к векторам, содержащим такую выделенную молекулу нуклеиновой кислоты, где указанный вектор может дополнительно содержать последовательность, контролирующую экспрессию.
[0042] Настоящее изобретение также относится к клеткам-хозяевам, содержащим нуклеотидную последовательность, которая кодирует тяжелую цепь или ее антиген-связывающую часть, нуклеотидную последовательность, которая кодирует легкую цепь или ее антиген-связывающую часть, или обе цепи, анти-LAG-3 антитела, как раскрыто в настоящем описании.
[0043] Настоящее изобретение также относится к способу получения антитела или его антиген-связывающей части, как раскрыто в настоящем описании, который включает наличие клетки-хозяина, которая содержит нуклеотидную последовательность, которая кодирует тяжелую цепь или ее антиген-связывающую часть, и нуклеотидную последовательность, которая кодирует легкую цепь или ее антиген-связывающую часть, анти-LAG-3 антитела, как раскрыто в настоящем описании, культивирование указанной клетки-хозяина в условиях, подходящих для экспрессии антитела или его части, и выделение полученного антитела или его части.
[0044] Настоящее изобретение также относится к полиспецифической (например, биспецифической) связывающей молекуле, содержащей антиген-связывающую часть анти-LAG-3 антитела, описанного в настоящем описании, и антиген-связывающую часть другого отличающегося антитела, такого как другое анти-LAG-3 антитело (например, как раскрыто в настоящем описании) или антитело, которое нацелено на другой белок, такой как другой белок контрольной точки иммунтитета, раковый антиген или другую молекулу клеточной поверхности, активность которого опосредует патологическое состояние, такое как злокачественная опухоль.
[0045] Настоящее изобретение также относится к способу лечения пациента со связанным с LAG-3 нарушением, который включает введение указанному пациенту анти-LAG-3 антитела или его антиген-связывающей части, фармацевтической композиции или биспецифической связывающей молекулы, как раскрыто в настоящем описании. Если не указано иное, пациентом в настоящем описании является человек.
[0046] Настоящее изобретение также относится к способу усиления иммунитета у пациента, который включает введение указанному пациенту анти-LAG-3 антитела или его антиген-связывающей части, фармацевтической композиции или биспецифической связывающей молекулы, как раскрыто в настоящем описании.
[0047] Настоящее изобретение также относится к способу лечения злокачественной опухоли у пациента, который включает введение указанному пациенту анти-LAG-3 антитела или его антиген-связывающей части, фармацевтической композиции или биспецифической связывающей молекулы, как раскрыто в настоящем описании. В некоторых вариантах осуществления злокачественная опухоль происходит из ткани, выбранной из кожи, легкого, кишечника, толстой кишки, яичника, головного мозга, предстательной железы, почки, мягких тканей, гематопоэтической системы, головы и шеи, печени, мочевого пузыря, молочной железы, желудка, матки и поджелудочной железы. В определенных вариантах осуществления злокачественная опухоль представляет собой фибросаркому, немелкоклеточный рак легких, меланому, глиобластому, глиосаркому или рак толстой кишки.
[0048] Любой из вышеуказанных способов дополнительно может включать введение, например, химиотерапевтического средства, анти-неопластического средства, анти-ангиогенного средства, ингибитора тирозинкиназы, ингибитора пути LAG-3 или лучевой терапии. В некоторых вариантах осуществления способ дополнительно включает введение ретиноевой кислоты, фенилбутирата, полностью транс-ретиноевой кислоты и/или активной формы витамина D.
[0049] Настоящее изобретение дополнительно относится к применению композиции антител, содержащей анти-LAG-3 антитело или антиген-связывающую часть, как раскрыто в настоящем описании, для изготовления лекарственного средства для лечения пациента со связанным с LAG-3 нарушением, лечения злокачественной опухоли у пациента и/или усиления иммунитета у больного.
[0050] Настоящее изобретение дополнительно относится к анти-LAG-3 антителу или антиген-связывающей части, как раскрыто в настоящем описании, для лечения пациента со связанным с LAG-3 нарушением, лечения злокачественной опухоли у пациента и/или усиления иммунитета у больного.
[0051] Настоящее изобретение дополнительно относится к изделию, содержащему анти-LAG-3 антитело или антиген-связывающую часть, как раскрыто в настоящем описании, где указанное изделие подходит для лечения пациента со связанным с LAG-3 нарушением, лечения злокачественной опухоли у пациента и/или усиления иммунитета у больного.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0052] На фиг. 1A-1C представлены репрезентативные точечные диаграммы проточной цитометрии антител, полученных, как описано в примере 2. Фиг. 1A: клон антитела, специфически связывающийся с трансфицированными клетками LAG-3 человека. Фиг. 1B: клон антитела, связывающийся неспецифически с клетками CHO-S. Фиг. 1C: клон антитела, который не связывается ни с одной популяцией клеток, используемых при скрининге.
[0053] На фиг. 2 представлен уровень продукции IL-2 SEB-стимулированными PBMC после обработки моноклональными анти-LAG-3 антителами.
[0054] На фиг. 3 представлен уровень продукции IL-2 SEB-стимулированными PBMC после обработки моноклональными анти-LAG-3 антителами. Каждая точка представляет уровень секреции IL-2 у одного донора PBMC.
[0055] На фиг. 4 представлен уровень люминесценции в анализе блокирования LAG-3-MHC класса II после лечения моноклональными анти-LAG-3 антителами. Данные представлены в виде среднее ± SEM.
[0056] На фиг. 5 представлены уровни LAG-3 в лизатах и супернатантах трансфицированной LAG-3 T-клеточной линии после обработки моноклональными анти-LAG-3 антителами. Данные представлены в виде среднее ± SEM. Звездочки обозначают статистически значимое различие между 15532 и аналогами эталонного антитела (*: p<0,05, ***: p<0,001, ****: p<0,0001).
[0057] На фиг. 6 представлен эффект антитела 15011 in vivo в двух моделях сингенных опухолей на мышах.
[0058] На фиг. 7 представлен эффект антитела 15532 in vivo в модели полугуманизированной ксенотрансплантированной опухоли, где иммунную систему мышей NOG восстанавливали с использованием PBMC человека и мышам пересаживали клетки меланомы человека A375.
[0059] На фиг. 8 представлен обзор групп эпитопов (эпитопных групп), идентифицированных в анализе конкурентного связывания на панели из 13 анти-LAG-3 антител. Антитела, соединенные черными линиями, обозначают перекрестную блокирующую активность в обеих ориентациях (лиганд и аналит). Антитела, соединенные штриховыми линиями, обозначают однонаправленное блокирование, где антитело блокируют при тестировании только как аналит. Антитела группируют в соответствии с паттернами конкуренции с другими анти-LAG-3 антителами.
[0060] На фиг. 9 представлен кластерный анализ разнообразия эпитопов антител-лигандов. Антитела с точками ветвления при значениях по оси x выше 0 имеют эпитопы, которые отличаются по конкурентному связыванию с LAG-3 с другими антителами в панели.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0061] Настоящее изобретение относится к новым анти-LAG-3 антителам человека, которые можно использовать для усиления иммунной системы у человека, такого как больной злокачественной опухолью. Если не указано иное, как используют в настоящем описании, «LAG-3» относится к LAG-3 человека. Полипептидная последовательность LAG-3 человека доступна по номеру доступа UniProt P18627 (LAG3_HUMAN) (SEQ ID NO:68).
[0062] Термин «антитело» (Ab) или «иммуноглобулин» (Ig), как используют в настоящем описании, относится к тетрамеру, содержащему две тяжелые (H) цепи (приблизительно 50-70 кДа) и две легкие (L) цепи (приблизительно 25 кДа), соединенные друг с другом дисульфидными связями. Каждая тяжелая цепь состоит из вариабельного домена тяжелой цепи (VH) и константной области тяжелой цепи (CH). Каждая легкая цепь состоит из вариабельного домена легкой цепи (VL) и константной области легкой цепи (CL). Домены VH и VL можно дополнительно подразделить на гипервариабельные области, называемые «определяющими комплементарность областями» (CDR), которые чередуются с областями, которые более консервативны и называются «каркасными областями» (FR). Каждая VH и VL состоит из трех CDR (H-CDR в настоящем описании обозначает CDR тяжелой цепи; и L-CDR в настоящем описании обозначает CDR легкой цепи) и четыре FR, которые расположены от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Присвоение номеров аминокислотам в тяжелой или легкой цепи может происходить согласно определениями IMGT® (Lefranc et al., Dev Comp Immunol 27(1):55-77 (2003)); или определениями Kabat, Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, MD (1987 и 1991)); Chothia & Lesk, J. Mol. Biol. 196:901-917 (1987); или Chothia et al., Nature 342:878-883 (1989).
[0063] Термин «рекомбинантное антитело» относится к антителу, которое экспрессирует клетка или клеточная линия, содержащая нуклеотидную последовательность(и), которая кодирует антитело, где указанная нуклеотидная последовательность(и) не связана с клеткой в природе.
[0064] Термин «выделенный белок», «выделенный полипептид» или «выделенное антитело» относится к белку, полипептиду или антителу, которое по своему происхождению или источнику получения (1) не связано с природными компонентами, которые сопровождают его в его нативном состоянии, (2) свободно от других белков того же биологического вида, (3) экспрессируется клеткой другого биологического вида и/или (4) не является природным. Таким образом, полипептид, который синтезируют химически или синтезируют в клеточной системе, отличной от клетки, с которой он естественным образом связан, будет «выделенным» из его природных компонентов. Белок также может быть по существу свободным от природных компонентов посредством выделения, используя приемы очистки белков, хорошо известных в данной области.
[0065] Как используют в настоящем описании, термин «зародышевая линия» относится к нуклеотидным и аминокислотным последовательностям генов антител и сегментам генов, в том виде как они передаются от родителей потомству через половые клетки. Последовательности зародышевой линии отличаются от нуклеотидных последовательностей, кодирующих антитела в зрелых B-клетках, которые изменены посредством событий рекомбинации и гипермутации в ходе созревания B-клеток. Антитело, которое «использует» конкретную последовательность зародышевой линии, имеет нуклеотидную или аминокислотную последовательность, которую можно выровнять с нуклеотидной последовательностью или аминокислотной последовательностью указанной зародышевой линии более точно, чем с любой нуклеотидной или аминокислотной последовательностью другой зародышевой линии.
[0066] Термин «аффинность» относится к степени сродства антигена и антитела. Присущее сродство антитела к антигену обычно выражают в виде равновесной константы связывания (аффинности) (KD) для конкретного взаимодействия антитело-антиген. Говорят, что антитело специфически связывается с антигеном, если KD составляет ≤ 1 мМ, предпочтительно ≤ 100 нМ. Константу (аффинности) связывания KD можно измерять, например, посредством поверхностного плазмонного резонанса (BIAcore™) или Bio-Layer Interferometry, например, с использованием системы IBIS MX96 SPR bp IBIS Technologies или системы Octet™ из ForteBio.
[0067] Термин «koff» относится к константе скорости диссоциации конкретного взаимодействия антитела и антигена. Константу скорости диссоциации koff можно измерять, например, посредством SPR (поверхностный плазмонный резонанс), например, с использованием системы IBIS MX96.
[0068] Термин «эпитоп», как используют в настоящем описании, относится к части (детерминанте) антигена, которая специфически связывается с антителом или соответствующей молекулой, такой как биспецифическая связывающая молекула. Эпитопные детерминанты в целом состоят из химически активных поверхностных групп молекул, таких как аминокислоты или углеводные или сахарные боковые цепи, и в целом имеют конкретные характеристики трехмерной структуры, а также конкретные характеристики заряда. Эпитоп может быть «линейным» или «конформационным». В линейном эпитопе все точки взаимодействия между белком (например, антигеном) и взаимодействующей молекулой (например, антителом) расположении по линии первичной аминокислотной последовательности белка. В конформационном эпитопе точки взаимодействия находятся в аминокислотных остатках белка, которые разделены друг от друга в первичной аминокислотной последовательности. Если определен желаемый эпитоп на антигене, то можно создавать антитела к этому эпитопу, используя приемы, хорошо известные в данной области. Например, антитело к линейному эпитопу можно создавать, например, посредством иммунизации животного пептидом, имеющим аминокислотные остатки линейного эпитопа. Антитело к конформационному эпитопу можно создавать, например, посредством иммунизации животного с использованием минидомена, содержащего релевантные аминокислотные остатки конформационного эпитопа. Антитело к конкретному эпитопу также можно создавать, например, посредством иммунизации животного целевой молекулой, представляющей интерес, (например, LAG-3) или ее релевантной частью, с последующим скринингом на связывание с эпитопом.
[0069] Можно определить, связывается ли антитело с тем же эпитопом или конкурирует за связывание с анти-LAG-3 антителом по изобретению, используя известные в данной области способы, включая, без ограничения, конкурентный анализ, эпитопные группы и сканирование аланином. В одном из вариантов осуществления обеспечивают связывание анти-LAG-3 антитела по изобретению с LAG-3 при насыщающих условиях и затем измеряют способность тестируемого антитела связываться с LAG-3. Если тестируемое антитело способно связываться с LAG-3 одновременно с эталонным антителом против LAG-3, то тестируемое антитело связывается с другим эпитопом, нежели эталонное анти-LAG-3 антитело. Однако если тестируемое антитело не способно связываться с LAG-3 одновременно, то тестируемое антитело связывается с тем же эпитопом, перекрывающимся эпитопом или эпитопом, который находится в непосредственной близости от эпитопа, связываемого антителом против LAG-3 по изобретению. Этот эксперимент можно осуществлять с использованием, например, ELISA, RIA, BIAcore™, SPR, Bio-Layer Interferometry или проточной цитометрии. Для того чтобы тестировать, проявляет ли анти-LAG-3 антитело перекрестную конкуренцию с другим антителом против LAG-3, можно использовать конкурентный способ, описанный выше, в двух направлениях, то есть определять, обеспечивает ли известное антитело блокирование тестируемого антитела, и наоборот. Такие эксперименты перекрестной конкуренции можно осуществлять, например, с использованием прибора IBIS MX96 SPR или системы Octet™.
[0070] Антитело, которое связывается с тем же эпитопом или конкурирует за связывание с антителом по изобретению, предпочтительно обладает блокирующей MHCII активностью, например, как определяют конкурентным анализом на основе проточной цитометрии, описанным в примере 6. Антитело, которое связывается с тем же эпитопом или конкурирует за связывание с антителом по изобретению, может снижать связывание по меньшей мере, например, на 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, или 80% или предпочтительно по меньшей мере на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
[0071] Термин «химерное антитело» относится в широком смысле слова к антителу, которое содержит одну или несколько областей из одного антитела и одну или несколько областей из одного или нескольких других антител, обычно к антителу, которое частично происходит от человека и частично происходит от не относящегося к человеку вида, то есть получено частично от не относящегося к человеку животного, например, мыши, крысы или другого грызуна или птицы, такой как курица. Химерные антитела предпочтительнее не принадлежащих человеку антител для снижения риска ответа на антитело у человека, например, ответа на антитело мыши у человека в случае мышиного антитела. Примером типичного химерного антитела является то, в котором последовательности вариабельных доменов относятся к мыши, тогда как последовательности константных областей относятся к человеку. В случае химерного антитела, не относящиеся к человеку части можно подвергать дополнительному изменению для того, чтобы гуманизировать антитело. Химерные антитела, описанные в настоящем описании, могут иметь, например, последовательности вариабельных доменов курицы и последовательности константных областей человека.
[0072] Термин «гуманизировать» относится к тому факту, что когда антитело имеет происхождение полностью или частично не от человека (например, антитело мыши или курицы, полученное путем иммунизации мышей или кур, соответственно, с использованием антигена, представляющего интерес, или химерное антитело на основе такого антитела мыши или курицы), возможно осуществлять замену определенных аминокислот, в частности, в каркасных областях и константных областях тяжелых и легких цепей, во избежание или для минимизации иммунного ответа у человека. Несмотря на то, что для конкретного антитела невозможно точно предсказывать иммуногенность и, тем самым, ответ на антитело у человека, не принадлежащие человеку антитела склонны быть более иммуногенными у человека, чем антитела человека. Показано, что химерные антитела, в которых чужеродные константные области (например, грызуна или птицы) заменены на последовательности, происходящие от человека, в менее иммуногенны, чем антитела полностью чужеродного происхождения, и среди терапевтических антител тенденция направлена в сторону гуманизированных антител или полностью антител человека. Химерные антитела или другие антитела не относящегося к человеку происхождения, таким образом, можно гуманизировать для того, чтобы снижать риск ответа на антитело у человека.
[0073] Для химерных антител гуманизация обычно включает модификацию каркасных областей последовательностей вариабельных доменов. Аминокислотные остатки, которые являются частью определяющих комплементарность областей (CDR), наиболее часто не подвергают изменениям в связи с гуманизацией, хотя в определенных случаях может быть желательно изменять индивидуальные аминокислотные остатки CDR, например, чтобы удалять участок гликозилирования, участок дезамидирования, участок изомеризации аспартата или нежелательный остаток цистеина или метионина. N-связанное гликозилирование происходит посредством прикрепления олигосахаридной цепи к остатку аспарагина в трипептидной последовательности Asn-X-Ser или Asn-X-Thr, где X может представлять собой любую аминокислоту, за исключением Pro. Удаления участка N-гликозилирования можно добиваться посредством мутации остатка Asn или Ser/Thr в другой остаток, предпочтительно посредством консервативной замены. Дезамидирование остатков аспарагина и глутамина может происходить в зависимости от таких факторов, как pH и экспозиция на поверхности. Остатки аспарагина особенно восприимчивы к дезамидированию, в первую очередь когда присутствуют в последовательности Asn-Gly и в меньшей степени в других дипептидных последовательностях, таких как Asn-Ala. Когда такой участок дезамидирования, в частности Asn-Gly, присутствует в последовательности CDR, то может быть желательно удалять этот участок, обычно посредством консервативной замены для того, чтобы удалять один из вовлеченных остатков.
[0074] Многие способы гуманизации последовательности антитела известны в данной области; см., например, обзор Almagro & Fransson, Front Biosci. 13:1619-1633 (2008). Один широко используемый способ представляет собой пересадку CDR, которая, например, для химерного антитела мышиного происхождения, включает идентификацию аналогов в генах зародышевой линии человека для генов вариабельных доменов мыши и пересадку последовательностей CDR мыши в этот каркас. Специфичность взаимодействия антитела с целевым антигеном в первую очередь заключена в аминокислотных остатках, расположенных в шести CDR в тяжелой и легкой цепи. Следовательно, аминокислотные последовательности в CDR значительно более вариабельны между индивидуальными антителами, чем последовательности вне CDR. Поскольку последовательности CDR отвечают за большинство взаимодействий антитело-антиген, возможно экспрессировать рекомбинантные антитела, которые имитируют свойства конкретного встречаемого в природе антитела или, в более общем смысле, любого специфического антитела с данной аминокислотной последовательностью, например, посредством конструирования экспрессирующих векторов, которые экспрессируют последовательности CDR из специфического антитела, пересаженные в каркасные последовательности от другого антитела. Как результат, можно «гуманизировать» не принадлежащее человеку антитело и все еще по существу сохранять специфичность связывания и аффинность исходного антитела. Пересадка CDR может происходить на основе определений CDR по Kabat, хотя в более новой публикации (Magdelaine-Beuzelin et al., Crit Rev.Oncol Hematol. 64:210-225 (2007)) сделано предположение о том, что определение IMGT® (международная информационная система ImMunoGeneTics®, www.imgt.org) может усовершенствовать результат гуманизации (см. Lefranc et al., Dev. Comp Immunol. 27:55-77 (2003)).
[0075] В некоторых случаях пересадка CDR может снижать специфичность связывания и аффинность и, таким образом, биологическую активность антитела с пересадкой CDR по сравнению с родительским антителом, из которого получают CDR. Обратные мутации (иногда обозначаемые как «репарация каркаса») можно вводить в выбранные положения антитела с пересадкой CDR, обычно в каркасные области, чтобы восстанавливать специфичность связывания и аффинность родительского антитела. Положения для возможных обратных мутаций можно идентифицировать с использованием информации, доступной в литературе и в базах данных об антителах. Аминокислотными остатками, которые являются кандидатами для обратных мутаций, обычно являются те, которые расположены на поверхности молекулы антитела, тогда как погруженные остатки или те, которые имеют малую степень экспозиции на поверхности, обычно не подвергают изменениям. Альтернативным приемом гуманизации для пересадки CDR и обратной мутации является изменение поверхности, при котором сохраняют не экспонированные на поверхности остатки не относящегося к человеку происхождения, тогда как поверхностные остатки изменяют на остатки человека.
[0076] В определенных случаях также может быть желательно изменять один или несколько аминокислотных остатков CDR для того, чтобы усовершенствовать аффинность связывания с целевым эпитопом. Это известно как «созревание аффинности» и необязательно может быть выполнено в связи с гуманизацией, например, в ситуациях, когда гуманизация антитела ведет к снижению специфичности связывания или аффинности и невозможно в достаточной мере усовершенствовать специфичность или аффинность связывания с помощью только обратных мутаций. Различные способы созревания аффинности известны в данной области, например, способ сканирующего насыщающего мутагенеза in vitro, описанный в Burks et al., Proc Natl Acad Sci USA, 94:412-417 (1997), и способ постепенного созревания аффинности in vitro из Wu et al., Proc Natl Acad Sci USA 95:6037-6042 (1998).
[0077] Термин «антиген-связывающая часть» антитела (или просто «часть антитела»), как используют в настоящем описании, относится к одной или нескольким частям или фрагментам антитела, которые сохраняют способность к специфическому связыванию с антигеном (например, LAG-3 человека или его частью). Показано, что определенные фрагменты полноразмерного антитела могут выполнять антиген-связывающую функцию антитела. Примеры связывающих фрагментов, охваченных термином «антиген-связывающая часть», включают (i) фрагмент Fab: одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2: двухвалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH из одного плеча антитела, (v) фрагмент dAb, который состоит из домена VH; и (vi) выделенную определяющую комплементарность область (CDR), способную специфически связываться с антигеном. Кроме того, несмотря на то, что отдельные гены кодируют два домена фрагмента Fv, VL и VH, их можно объединять, используя рекомбинантные способы, посредством синтетического линкера, который позволяет создавать их в виде единой белковой цепи, в которой домены VL и VH образуют пару для того, чтобы формировать одновалентные молекулы (известные как одноцепочечный Fv (scFv)). Также в изобретение включены антиген-связывающие молекулы, содержащие VH и/или VL. В случае VH, молекулы также могут содержать одну или несколько из области CH1, шарнира, CH2 или CH3. Предусмотрено, что такие одноцепочечные антитела также включены в термин «антиген-связывающая часть» антитела. Другие формы одноцепочечных антител, такие как диатела, также включены. Диатела представляют собой двухвалентные биспецифические антитела, в которых домены VH и VL экспрессированы в одной полипептидной цепи, но с использованием линкера, который слишком короток, чтобы сделать возможным образование пар между двумя доменами в одной и той же цепи, тем самым принуждая домены образовывать пару с комплементарными доменами другой цепи и создавать два антиген-связывающих участка.
[0078] Часта антител, такие как фрагменты Fab и F(ab')2, можно получать из целых антител, используя общепринятые способы, такие как расщепление целых антител папаином или пепсином. Кроме того, антитела, части антител и молекулы иммуноадгезии можно получать с использованием стандартных способов рекомбинантной ДНК, например, как раскрыто в настоящем описании.
[0079] Класс (изотип) и подкласс анти-LAG-3 антител можно определять любым известным в данной области способом. В целом, класс и подкласс антитела можно определять с использованием антител, которые обладают специфичностью к конкретному классу и подклассу антител. Такие антитела доступны коммерчески. Класс и подкласс можно определять с помощью ELISA, вестерн-блоттинга, а также другими приемами. Альтернативно, класс и подкласс можно определять посредством полного или частичного секвенирования константных областей тяжелых и/или легких цепей антител, сравнения их аминокислотных последовательностей с известными аминокислотными последовательностями различных классов и подклассов иммуноглобулинов и определения класса и подкласса антител.
[0080] Если не указано иное, все номера аминокислотных остатков антител, упоминаемые в этом раскрытии, приведены в соответствии со схемой нумерации IMGT®.
Анти-LAG-3 антитела
[0081] Настоящее изобретение относится к антителам, нацеленным на LAG-3, и их антиген-связывающим частям. В конкретном варианте осуществления антитела, раскрытые в настоящем описании, представляют собой антитела человека, созданные у трансгенных крыс, которые способны создавать антитела с идиотипами человека. В другом варианте осуществления антитела представляют собой полученные у курицы химерные антитела, содержащие последовательности CDR курицы и каркасные области человека, где каркасные области подвергали гуманизации.
[0082] Одно преимущество новых анти-LAG-3 антител по изобретению состоит в том, что они способны усиливать активность T-клеток, как измеряют по увеличенному продуцированию IL-2; см., например, пример 7. Не желая ограничиваться какой-либо конкретной теорией, полагают, что анти-LAG-3 антитела по изобретению способны блокировать взаимодействие LAG-3 с его предполагаемыми лигандами, такими как MHCII и LSECtin. Антитела могут выполнять это непосредственно через блокирование области связывания лиганда, как продемонстрировано, например, в примере 6, или через индуцирование интернализации LAG-3, которая предусмотрена в качестве возможного механизма действия, лежащего в основе результатов, представленных в примере 9. Другое возможное преимущество анти-LAG-3 антител по изобретению состоит в низком уровне вторичных эффекторных функций у антител, имеющих мутации «LALA» (L234A/L235A), которые препятствуют значимому связыванию антитела с FcgR человека (рецепторы Fcγ), и, таким образом, истощении эффекторных T-клеток.
[0083] В одном из вариантов осуществления анти-LAG-3 антитело имеет CDR3 тяжелой цепи (H-CDR3), которая по меньшей мере на 90% идентична по последовательности с любой из SEQ ID NO:37, 43, 46, 50, 55, 58 и 64, например, по меньшей мере на 92% идентична, например, по меньшей мере на 95%, 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из SEQ ID NO:37, 43, 46, 50, 55, 58 и 64.
[0084] В одном из вариантов осуществления анти-LAG-3 антитело имеет вариабельный домен тяжелой цепи (VH), который по меньшей мере на 90% идентичен по последовательности с любой из SEQ ID NO:3, 7, 11, 15, 19, 23 или 27, например, по меньшей мере на 92% идентичен, например, по меньшей мере на 95%, 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен любой из SEQ ID NO:3, 7, 11, 15, 19, 23 или 27.
[0085] В другом варианте осуществления анти-LAG-3 антитело имеет вариабельный домен тяжелой цепи (VH), который по меньшей мере на 90% идентичен по последовательности любой из SEQ ID NO:3, 7, 11, 15, 19, 23 или 27, например, по меньшей мере на 92% идентичен, например, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен любой из SEQ ID NO:3, 7, 11, 15, 19, 23 или 27; и константную область тяжелой цепи, которая по меньшей мере на 90% идентична по последовательности с SEQ ID NO:30, например, по меньшей мере на 92% идентична, например, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична с SEQ ID NO:30.
[0086] В другом варианте осуществления анти-LAG-3 антитело имеет тяжелую цепь (HC), которая содержит аминокислотную последовательность VH из любой из SEQ ID NO:3, 7, 11, 15, 19, 23 или 27 и аминокислотную последовательность константной области тяжелой цепи из SEQ ID NO:30.
[0087] В одном из вариантов осуществления анти-LAG-3 антитело имеет CDR3 легкой цепи (L-CDR3), которая по меньшей мере на 90% идентична по последовательности любой из SEQ ID NO:40, 52, 61 и 67, например, по меньшей мере на 92% идентична, например, по меньшей мере на 95%, 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична любой из SEQ ID NO:40, 52, 61 и 67.
[0088] В другом варианте осуществления анти-LAG-3 антитело имеет вариабельный домен легкой цепи (VL), который по меньшей мере на 90% идентичен по последовательности с аминокислотной последовательностью VL из любой из SEQ ID NO:4, 8, 12, 16, 20, 24 или 28, например, по меньшей мере на 92% идентичен, например, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен любой из SEQ ID NO:4, 8, 12, 16, 20, 24 или 28.
[0089] В другом варианте осуществления анти-LAG-3 антитело имеет вариабельный домен легкой цепи (VL), который по меньшей мере на 90% идентичен по последовательности с аминокислотной последовательностью VL из любой из SEQ ID NO:4, 8, 12, 16, 20 или 24, например, по меньшей мере на 92% идентичен, например, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен любой из SEQ ID NO:4, 8, 12, 16, 20 или 24; и аминокислотную последовательность константной области легкой цепи, которая по меньшей мере на 90% идентична по последовательности с SEQ ID NO:34, например, по меньшей мере на 92% идентична, например, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична с SEQ ID NO:34.
[0090] В другом варианте осуществления анти-LAG-3 антитело имеет вариабельный домен легкой цепи (VL), который по меньшей мере на 90% идентичен по последовательности с аминокислотной последовательностью VL из SEQ ID NO:28, например, по меньшей мере на 92% идентичен, например, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичен с SEQ ID NO:28; и аминокислотную последовательность константной области легкой цепи, которая по меньшей мере на 90% идентична по последовательности с SEQ ID NO:32, например, по меньшей мере на 92% идентична, например, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична с SEQ ID NO:32.
[0091] В другом варианте осуществления анти-LAG-3 антитело имеет легкую цепь, которая содержит любую SEQ ID NO:4, 8, 12, 16, 20 или 24, и SEQ ID NO:34.
[0092] В другом варианте осуществления анти-LAG-3 антитело имеет легкую цепь, которая содержит SEQ ID NO:28 и SEQ ID NO:32.
[0093] В определенных вариантах осуществления анти-LAG-3 антитело содержит любую из описанных выше тяжелых цепей и любую из описанных выше легких цепей.
[0094] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению содержит аминокислотные последовательности H-CDR1-3 и L-CDR1-3 из:
a) SEQ ID NO:35, 36, 37, 38, 39 и 40, соответственно;
b) SEQ ID NO:41, 42, 43, 44, 45 и 40, соответственно;
c) SEQ ID NO:35, 42, 46, 44, 47 и 40, соответственно;
d) SEQ ID NO:48, 49, 50, 51, 47 и 52, соответственно;
e) SEQ ID NO:53, 54, 55, 44, 45 и 40, соответственно;
f) SEQ ID NO:56, 57, 58, 59, 60 и 61, соответственно; или
g) SEQ ID NO:62, 63, 64, 65, 66 и 67, соответственно.
[0095] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению содержит H-CDR3 и an L-CDR3, которые на 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичны аминокислотным последовательностям:
a) SEQ ID NO:37 и 40, соответственно;
b) SEQ ID NO:43 и 40, соответственно;
c) SEQ ID NO:46 и 40, соответственно;
d) SEQ ID NO:50 и 52, соответственно;
e) SEQ ID NO:55 и 40, соответственно;
f) SEQ ID NO:58 и 61, соответственно; или
g) SEQ ID NO:64 и 67, соответственно.
[0096] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению содержит VH и VL, которые на 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичны аминокислотным последовательностям:
a) SEQ ID NO:3 и 4, соответственно;
b) SEQ ID NO:7 и 8, соответственно;
c) SEQ ID NO:11 и 12, соответственно;
d) SEQ ID NO:15 и 16, соответственно;
e) SEQ ID NO:19 и 20, соответственно;
f) SEQ ID NO:23 и 24, соответственно; или
g) SEQ ID NO:27 и 28, соответственно.
[0097] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению содержит VH и VL, которые имеют аминокислотные последовательности:
a) SEQ ID NO:3 и 4, соответственно;
b) SEQ ID NO:7 и 8, соответственно;
c) SEQ ID NO:11 и 12, соответственно;
d) SEQ ID NO:15 и 16, соответственно;
e) SEQ ID NO:19 и 20, соответственно;
f) SEQ ID NO:23 и 24, соответственно; или
g) SEQ ID NO:27 и 28, соответственно.
[0098] В некоторых вариантах осуществления анти-LAG-3 антитело содержит:
a) HC с аминокислотными последовательностями SEQ ID NO:3 и 30 и LC с аминокислотными последовательностями SEQ ID NO:4 и 34;
b) HC с аминокислотными последовательностями SEQ ID NO:7 и 30 и LC с аминокислотными последовательностями SEQ ID NO:8 и 34;
c) HC с аминокислотными последовательностями SEQ ID NO:11 и 30 и LC с аминокислотными последовательностями SEQ ID NO:12 и 34;
d) HC с аминокислотными последовательностями SEQ ID NO:15 и 30 и LC с аминокислотными последовательностями SEQ ID NO:16 и 34;
e) HC с аминокислотными последовательностями SEQ ID NO:19 и 30 и LC с аминокислотными последовательностями SEQ ID NO:20 и 34;
f) HC с аминокислотными последовательностями SEQ ID NO:23 и 30 и LC с аминокислотными последовательностями SEQ ID NO:24 и 34; или
g) HC с аминокислотными последовательностями SEQ ID NO:27 и 30 и LC с аминокислотными последовательностями SEQ ID NO:28 и 32.
[0099] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению содержит аминокислотные последовательности H-CDR1-3 и L-CDR1-3 антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0100] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению содержит VH и VL, которые по меньшей мере на 90% идентичны по аминокислотной последовательности VH и VL, соответственно, антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0101] В некоторых вариантах осуществления анти-LAG-3 антитело или антиген-связывающая часть по изобретению содержит VH и VL, которые представляют собой VH и VL, соответственно, антитела 15646, 15532, 15723, 15595, 15431, 15572 или 15011.
[0102] В некоторых вариантах осуществления анти-LAG-3 антитело по изобретению представляет собой антитело 15646, 15532, 15723, 15595, 15431, 15572 или 15011 или антитело с теми же аминокислотными последовательностями, что и у указанного антитела.
[0103] Изобретение также относится к анти-LAG-3 антителу или его антиген-связывающей части, которое связывается с эпитопом LAG-3 человека, имеющим:
a) 1, 2, 3, 4, 5, 6 или все 7 аминокислотных остатков, выбранных из H85, P86, A87, P89, S91, W92 и G93 с SEQ ID NO:68 (например, антитело 15532);
b) 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 или все 32 аминокислотных остатка, выбранных из A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67, D68, G93, P94, P96, R98, Y99, T100, V101, P106, G107, R119, E124, R129, G130, D131, S133, R137, P138, D143, R148 и R163 с SEQ ID NO:68 (например, антитело 15431);
c) 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или все 29 аминокислотных остатков, выбранных из A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67, D68, P96, Y99, T100, V101, P106, G107, R119, E124, R129, G130, D131, S133, R137, P138, D143, R148 и R163 с SEQ ID NO:68 (например, антитело 15572); или
d) 1, 2, 3 или все 4 аминокислотных остатка, выбранных из G107, L109, R110 и S111 с SEQ ID NO:68 (например, антитело 15011).
[0104] Изобретение также относится к моноклональному антителу или его антиген-связывающей части, которые связываются с эпитопом LAG-3 человека, имеющим остатки 98-105. В некоторых вариантах осуществления антитело или антиген-связывающая часть связывается с эпитопом LAG-3 человека, имеющим:
a) 2 или 3 аминокислотных сегмента, выбранных из остатков 78-105 и 123-131 с SEQ ID NO:68 (например, антитело 15532);
b) 1, 2, 3, 4 или 5 аминокислотных сегментов, выбранных из остатков 23-30, 40-66, 88-105, 123-137 и 148-152 с SEQ ID NO:68 (например, антитело 15431);
c) 1, 2, 3, 4 или 5 аминокислотных сегментов, выбранных из остатков 23-30, 40-66, 98-105, 118-137 и 148-161 с SEQ ID NO:68 (например, антитело 15572); или
d) аминокислотные остатки 98-105 с SEQ ID NO:68 (например, антитело 15011).
[0105] Изобретение также относится к моноклональному антителу или его антиген-связывающей части, которые связываются с эпитопом LAG-3 человека, имеющим остатки 23-30 и 40-66 с SEQ ID NO:68. В некоторых вариантах осуществления эпитоп дополнительно имеет остатки 88-105, 123-137 и/или 148-152 с SEQ ID NO:68. В некоторых вариантах осуществления эпитоп дополнительно имеет остатки 98-105, 118-137 и 148-161 с SEQ ID NO:68.
[0106] Изобретение также относится к анти-LAG-3 антителу или его антиген-связывающей части, которое конкурируют или перекрестно конкурирует за связывание или связывается с тем же эпитопом, что и антитело, выбранное из группы, состоящей из 15532, 15646, 15723, 15595, 15431, 15572 и 15011.
[0107] В некоторых вариантах осуществления анти-LAG-3 антитело или его антиген-связывающая часть по изобретению не связываются с тем же эпитопом LAG-3 человека, что и антитело 25F7-Lag3.5.
[0108] В некоторых вариантах осуществления в анти-LAG-3 антителе или его антиген-связывающей части по изобретению используют ген тяжелой цепи зародышевой линии человека, выбранный из группы, состоящей из IGHV4-34, IGHV1-24, IGHV6-1, IGHV4-39 и IGHV3-23. В определенных вариантах осуществления ген тяжелой цепи зародышевой линии по меньшей мере на 75%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичен соответствующей последовательности тяжелой цепи в антителе против LAG3 или антиген-связывающей части. В определенных вариантах осуществления последовательности каркасных областей указанного гена тяжелой цепи зародышевой линии по меньшей мере на 75%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичны соответствующим последовательностям каркасных областей тяжелых цепей в антителе против LAG3 или антиген-связывающей части.
[0109] В некоторых вариантах осуществления в анти-LAG-3 антителе или его антиген-связывающей части по изобретению используют ген легкой цепи зародышевой линии человека, выбранный из группы, состоящей из IGKV3-11, IGKV1-12, IGKV1-5 и IGLV3-19. В определенных вариантах осуществления ген легкой цепи зародышевой линии по меньшей мере на 75%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичен соответствующей последовательности легкой цепи в антителе против LAG3 или антиген-связывающей части. В определенных вариантах осуществления последовательности каркасных областей указанного гена легкой цепи зародышевой линии по меньшей мере на 75%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичны соответствующим последовательностям легких цепей каркасных областей в антителе против LAG3 или антиген-связывающей части.
[0110] В конкретных вариантах осуществления в анти-LAG-3 антителе или его антиген-связывающей части по изобретению используют любую комбинацию вышеуказанных генов тяжелых цепей зародышевой линии человека и генов легких цепей зародышевой линии человека (например, IGHV4-34 и IGKV3-11, IGHV1-24 и IGKV1-12, IGHV6-1 и IGKV3-11, IGHV4-39 и IGKV1-5 или IGHV3-23 и IGLV3-19). В некоторых вариантах осуществления гены тяжелых и легких цепей зародышевой линии по меньшей мере на 75%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичны соответствующим последовательностям тяжелых и легких цепей, соответственно, в антителе против LAG3 или антиген-связывающей части. В определенных вариантах осуществления последовательности каркасных областей указанных генов тяжелых и легких цепей зародышевой линии по меньшей мере на 75%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичны соответствующим последовательностям тяжелых и легких цепей каркасных областей, соответственно, в антителе против LAG3 или антиген-связывающей части.
[0111] В некоторых вариантах осуществления любые анти-LAG-3 антитела или антиген-связывающие части, описанные в настоящем описании, могут связываться с LAG-3 человека с EC50, например, 0,2 нМ или меньше, 0,15 нМ или меньше, 0,1 нМ или меньше, 0,09 нМ или меньше, 0,08 нМ или меньше, 0,07 нМ или меньше, 0,06 нМ или меньше, 0,05 нМ или меньше или 0,04 нМ или меньше. В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут связываться с LAG-3 яванского макака, например, с EC50 0,4 нМ или меньше, 0,3 нМ или меньше, 0,2 нМ или меньше, 0,1 нМ или меньше, 0,09 нМ или меньше, 0,08 нМ или меньше, 0,07 нМ или меньше, 0,06 нМ или меньше, 0,05 нМ или меньше, 0,04 нМ или меньше или 0,03 нМ или меньше.
[0112] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут связываться с LAG-3 человека с EC50, например, 0,1 нМ или меньше. В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут связываться с LAG-3 яванского макака, например, с EC50 0,3 нМ или меньше. В конкретных вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут связываться с LAG-3 человека, например, с EC50 0,1 нМ или меньше и LAG-3 яванского макака, например, с EC50 0,3 нМ или меньше.
[0113] В некоторых вариантах осуществления любое анти-LAG-3 антитело или антиген-связывающая часть, описанная в настоящем описании, может ингибировать связывание лигандов, таких как MHC класса II (MHCII) или LSECtin, с LAG-3. Например, при 20 мкг/мл, анти-LAG-3 антитело или антиген-связывающая часть может снижать связывание LAG-3 с MHCII по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% по сравнению со связыванием в присутствии антитела отрицательного контроля. В одном из вариантов осуществления анти-LAG-3 антитело или антиген-связывающий белок может снижать связывание LAG-3 с MHCII больше чем на 85% по сравнению с отрицательным контролем. В одном из вариантов осуществления анти-LAG-3 антитело или антиген-связывающий белок может снижать связывание LAG-3 с MHCII приблизительно на 35-85% по сравнению с отрицательным контролем.
[0114] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут блокировать связывание между LAG-3 и MHC класса II, например, LAG-3 человека, экспрессируемым на клетках Jurkat, и MHC класса II человека, экспрессируемым на клетках Raji (например, в концентрации 0,1 мкг/мл, 0,5 мкг/мл, 1 мкг/мл, 5 мкг/мл, 10 мкг/мл, 20 мкг/мл, 30 мкг/мл, 40 мкг/мл или 50 мкг/мл).
[0115] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут связываться с LAG-3 человека с KD 5,0×10-8 или меньше, 4,0×10-8 или меньше, 3,0×10-8 или меньше, 2,0×10-8 или меньше, 1,0×10-8 или меньше, 9,0×10-9 или меньше, 8,0×10-9 или меньше, 7,0×10-9 или меньше, 6,0×10-9 или меньше, 5,0×10-9 или меньше, 4,0×10-9 или меньше, 3,0×10-9 или меньше, 2,0×10-9 или меньше или 1,0×10-9 или меньше, как измерено поверхностным плазмонным резонансом.
[0116] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут связываться с LAG-3 яванского макака с KD 1,5×10-7 или меньше, 1,0×10-7 или меньше, 9,0×10-8 или меньше, 8,0×10-8 или меньше, 7,0×10-8 или меньше, 6,0×10-8 или меньше, 5,0×10-8 или меньше, 4,0×10-8 или меньше, 3,0×10-8 или меньше, 2,0×10-8 или меньше или 1,0×10-8 или меньше, как измерено поверхностным плазмонным резонансом.
[0117] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут связываться с LAG-3 мыши с KD 5,0×10-8 или меньше, 4,5×10-8 или меньше, 4,0×10-8 или меньше, 3,5×10-8 или меньше или 3,0×10-8 или меньше, как измерено поверхностным плазмонным резонансом.
[0118] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут стимулировать продукцию IL-2, например, SEB-стимулированными PBMC.
[0119] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут снижать клеточные и/или растворимые уровни LAG-3, например, в линии T-клеток человека (такой как линия T-клеток человека со сверхэкспрессией LAG-3).
[0120] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут индуцировать регрессию опухолевого роста и/или задерживать опухолевый рост in vivo.
[0121] В некоторых вариантах осуществления любые из анти-LAG-3 антител или антиген-связывающих частей, описанных в настоящем описании, могут связываться с другим эпитопом LAG-3 человека, нежели антитело 25F7-Lag3.5.
[0122] В одном из вариантов осуществления введение анти-LAG-3 антитела по изобретению или его антиген-связывающей части может активировать T-клетки, вызывая усиленную противоопухолевую активность.
[0123] Класс анти-LAG-3 антитела, получаемого с помощью способов, описанных в настоящем описании, можно изменять или переключать на другой класс или подкласс. В одном аспектов изобретения, молекулу нуклеиновой кислоты, кодирующую VL или VH, выделяют с использованием способов, хорошо известных в данной области, так, что она не содержит последовательности нуклеиновой кислоты, кодирующие CL или CH, соответственно. Затем молекулы нуклеиновой кислоты, кодирующие VL или VH, функционально связывают с последовательностью нуклеиновой кислоты, кодирующей CL или CH, соответственно, из молекулы иммуноглобулина друого класса. Этого можно достигать с использованием вектора или молекулы нуклеиновой кислоты, которая содержит цепь CL или CH, как описано выше. Например, класс анти-LAG-3 антитела, которое исходно представляло собой IgM, можно переключать на IgG. Кроме того, переключение класса можно использовать для того, чтобы превращать IgG одного подкласса в другой, например, с IgG1 на IgG2. Константную область легкой цепи κ можно менять, например, на константную область легкой цепи λ. Предпочтительный способ получения антитела по изобретению желаемого изотипа Ig включает стадии выделения молекулы нуклеиновой кислоты, кодирующей тяжелую цепь анти-LAG-3 антитела, и молекулы нуклеиновой кислоты, кодирующей легкую цепь анти-LAG-3 антитела, получения вариабельного домена тяжелой цепи, лигирования вариабельного домена тяжелой цепи с константной областью тяжелой цепи желаемого изотипа, экспрессии легкой цепи и лигированной тяжелой цепи в клетке и сбора анти-LAG-3 антитела желаемого изотипа.
[0124] Анти-LAG-3 антитело по изобретению может представлять собой молекулу IgG, IgM, IgE, IgA или IgD, но обычно относится к изотипу IgG, например, IgG подкласса IgG1, IgG2a или IgG2b, IgG3 или IgG4. В одном из вариантов осуществления антитело представляет собой IgG1. В другом варианте осуществления антитело представляет собой IgG2. В определенных вариантах осуществления антитела IgG1 по настоящему изобретению, которые связываются с эпитопом LAG-3, описанным в настоящем описании, дают превосходящую активность при модулировании (например, ингибировании) функций LAG-3, чтобы добиваться лечения злокачественных опухолей или иммуностимулирующих эффектов.
[0125] В одном из вариантов осуществления анти-LAG-3 антитело может содержать по меньшей мере одну мутацию в Fc-области. Известно множество различных мутаций Fc, где эти мутации обеспечивают измененную эффекторную функцию. Например, во многих случаях будет желательно снижать или устранять эффекторную функцию, например, когда взаимодействия лиганд/рецептор нежелательны или в случае конъюгатов антитело-лекарственное средство.
[0126] В одном из вариантов осуществления анти-LAG-3 антитело содержит по меньшей мере одну мутацию в Fc-области, которая снижает эффекторную функцию. Положения аминокислот в Fc-области, которые могут быть полезны для мутаций, чтобы снижать эффекторную функцию, включают одно или несколько из положений 228, 233, 234 и 235, где положения аминокислот нумеруют в соответствии со схемой нумерации IMGT®.
[0127] В одном из вариантов осуществления один или оба из аминокислотных остатков в положениях 234 и 235 можно мутировать, например, из Leu в Ala (L234A/L235A). Эти мутации снижают эффекторную функцию Fc-области антител IgG1. Дополнительно или альтернативно, аминокислотный остаток в положении 228 можно мутировать, например, в Pro. В некоторых вариантах осуществления аминокислотный остаток в положении 233 можно мутировать, например, в Pro, аминокислотный остаток в положении 234 можно мутировать, например, в Val и/или аминокислотный остаток в положении 235 можно мутировать, например, в Ala. Положения аминокислот нумеруют в соответствии со схемой нумерации IMGT®.
[0128] В некоторых вариантах осуществления, где антитело относится к подклассу IgG4, оно может содержать мутацию S228P, то есть иметь пролин в положении 228, где положение аминокислоты нумеруют в соответствии со схемой нумерации IMGT®. Известно, что эта мутация снижает нежелательный обмен плечами Fab.
[0129] В определенных вариантах осуществления антитело или его антиген-связывающая часть по изобретению может быть частью более крупной молекулы иммуноадгезии, образованной посредством ковалентной или нековалентной связи антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры таких молекул иммуноадгезии включают использование области сердцевины стрептавидина для получения тетрамерной молекулы scFv (Kipriyanov et al., Human Antibodies and Hybridomas 6:93-101 (1995)) и использование остатка цистеина, маркерного пептида и C-концевой полигистидиновой метки для получения двухвалентных и биотинилированных молекул scFv (Kipriyanov et al., Mol. Immunol. 31:1047-1058 (1994)). Другие примеры включают, где одну или несколько CDR из антитела встраивают в молекулу, ковалентно или нековалентно, чтобы делать ее иммуноадгезином, который специфически связывается с антигеном, представляющим интерес. В таких вариантах осуществления CDR можно встраивать в качестве части более крупной полипептидной цепи, можно ковалентно связывать с другой полипептидной цепью или можно встраивать нековалентно.
[0130] В другом варианте осуществления можно создавать слитое антитело или иммуноадгезин, которые содержат полностью или часть анти-LAG-3 антитела по изобретению, которое связано с другим полипептидом. В определенных вариантах осуществления только вариабельные домены анти-LAG-3 антитела связывают с полипептидом. В определенных вариантах осуществления домен VH анти-LAG-3 антитела связывают с первым полипептидом, тогда как домен VL анти-LAG-3 антитела связывают со вторым полипептидом, который ассоциируется с первым полипептидом таким образом, что домены VH и VL могут взаимодействовать друг с другом для того, чтобы формировать антиген-связывающий участок. В другом предпочтительном варианте осуществления домен VH отделяют от домена VL посредством линкера так, что домены VH и VL могут взаимодействовать друг с другом (например, одноцепочечные антитела). Затем антитело VH-линкер-VL связывают с полипептидом, представляющим интерес. Кроме того, можно создавать слитые антитела, в которых два (или больше) одноцепочечных антитела связывают друг с другом. Это можно использовать при желании создавать двухвалентное или поливалентное антитело на одной полипептидной цепи или при желании создавать биспецифическое антитело.
[0131] Для того чтобы создавать одноцепочечное антитело (scFv), VH- и VL-кодирующие фрагменты ДНК функционально связывают с другим фрагментом, кодирующим гибкий линкер, например, кодирующим аминокислотную последовательность (Gly4 Ser)3 (SEQ ID NO:74), так, что последовательности VH и VL можно экспрессировать в виде непрерывного одноцепочечного белка, с доменами VL и VH, соединенными гибким линкером. См., например, Bird et al., Science 242:423 426 (1988); Huston et al., Proc. Natl. Acad. Sci. USA 85:5879 5883 (1988); и McCafferty et al., Nature 348:552 554 (1990). Одноцепочечное антитело может быть одновалентным, если только используют одну VH и VL; двухвалентным, если используют две VH и VL; или поливалентным, если используют больше чем две VH и VL. Например, можно создавать биспецифические или поливалентные антитела, которые специфически связываются с LAG-3 человека и другой молекулой.
[0132] В других вариантах осуществления можно получать другие модифицированные антитела с использованием молекул нуклеиновой кислоты, кодирующих анти-LAG-3 антитело. Например, «каппа-тела» (Ill et al., Protein Eng. 10:949-57 (1997)), «миниантитела» (Martin et al., EMBO J. 13:5303-9 (1994)), «диатела» (Holliger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993)) или «янусины» (Traunecker et al., EMBO J. 10:3655-3659 (1991) и Traunecker et al., Int. J. Cancer (Suppl.) 7:51-52 (1992)) можно получать с использованием стандартных молекулярно-биологических приемов, придерживаясь указаний из описания.
[0133] В анти-LAG-3 антитело или антиген-связывающую часть по изобретению можно ввести функциональные группы или связать с другой молекулой (например, другим пептидом или белком). В целом, в антитела или их части вводят такие функциональные группы, которые при получении производных или введении метки на связывание с LAG-3 не оказывают нежелательного влияния. Соответственно, предполагается, что антитела и части антител по изобретению включают как интактные, так и модифицированные формы анти-LAG-3 антител человека, описанных в настоящем описании. Например, антитело или часть антитела по изобретению можно функционально связывать (путем химического конъюгирования, генетического слияния, нековалентной ассоциации или иным образом) с одним или несколькими другими молекулярными объектами, такими как другое антитело (например, биспецифическое антитело или диатело), средство детекции, фармацевтическое средство и/или белок или пептид, который может опосредовать связывание антитела или части антитела с другой молекулой (такой как область сердцевины стрептавидина или полигистидиновая метка).
[0134] Один тип производных антитела получают посредством перекрестного связывания двух или нескольких антител (одного и того же типа или различных типов, например, для создания биспецифических антител). Подходящие агенты перекрестного связывания включают гетеробифункциональные агенты и агенты, имеющие две отдельные реакционноспособные группы, разделенные подходящим спейсером (например, сложный эфир м-малеимидобензоил-N-гидроксисукцинимида) или гомобифункциональным (например, дисукцинимидилсуберат). Такие линкеры доступны, например, в Pierce Chemical Company, Rockford, Il.
[0135] В анти-LAG-3 антитело также можно введсти функциональную химическую группу, такую как полиэтиленгликоль (PEG), метильная или этильная группа или углеводная группа. Эти группы можно использовать для улучшения биологических характеристик антитела, например, для повышения времени полужизни в сыворотке.
[0136] В антитело по настоящему изобретению также можно вводить метку. Как используют в настоящем описании, термины «введение метки» или «меченное» относятся ко встраиванию другой молекулы в антитело. В одном из вариантов осуществления метка представляет собой поддающийся обнаружению маркер, например, встраивание радиоактивно-меченной аминокислоты или присоединение к полипептиду биотинильных фрагментов, которые можно обнаруживать с помощью помеченного авидина (например, стрептавидина, содержащего флуоресцентный маркер или ферментативную активность, которые можно обнаруживать оптическими или колориметрическими способами). В другом варианте осуществления метка или маркер могут быть терапевтическими, например, конъюгат лекарственного средства или токсин. В настоящей области известны различные способы мечения полипептидов и гликопротеинов, которые можно использовать. Примеры меток для полипептидов включают, но не ограничиваясь ими, следующее: радиоизотопы или радионуклиды (например, 3H, 14C, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I), флуоресцентные метки (например, FITC, родамин, лантаноидные люминофоры), ферментативные метки (например, пероксидазу хрена, β-галактозидазу, люциферазу, щелочную фосфатазу), хемилюминесцентные маркеры, биотинильные группы, предварительно определяемые полипептидные эпитопы, распознаваемые вторичным репортером (например, пара последовательностей лейциновой молнии, сайты связывания для вторичных антител, металлсвязывающие домены, эпитопные метки), магнитные средства, такие как хелаты гадолиния, токсины, такие как токсин коклюша, таксол, цитохалазин B, грамицидин D, бромистый этидий, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи. В некоторых вариантах осуществления метки прикрепляют с помощью спейсерных плеч различной длины для того, чтобы снижать потенциальные стерические затруднения.
[0137] В определенных вариантах осуществления антитела по изобретению могут присутствовать в нейтральной форме (включая цвиттер-ионные формы) или в виде положительно или отрицательно заряженных частиц. В некоторых вариантах осуществления антитела могут образовывать комплексы с противоионом для того, чтобы формировать фармацевтически приемлемую соль.
[0138] Термин «фармацевтически приемлемая соль» относится к комплексу, содержащему одно или несколько антител и один или несколько противоионов, где противоионы происходят из фармацевтически приемлемых неорганических и органических кислот и оснований.
Биспецифические связывающие молекулы
[0139] В дополнительном аспекте, изобретение относится к биспецифической связывающей молекуле, обладающей специфичностью связывания (например, которая содержит антиген-связывающие части) анти-LAG-3 антитела, описанного в настоящем описании, и специфичностью связывания другого анти-LAG-3 антитела (например, другого анти-LAG-3 антитела, описанного в настоящем описании) или антитела, которое направлено на другой белок, такой как другой белок контрольной точки иммунтитета, антиген злокачественной опухоли или другая молекула клеточной поверхности, активность которой опосредует патологическое состояние, такое как злокачественная опухоль. Такие биспецифические связывающие молекулы известны в данной области, и примеры биспецифических связывающих молекул других типов приведены в другом месте в настоящем описании.
Молекулы нуклеиновой кислоты и векторы
[0140] Настоящее изобретение также относится к молекулам нуклеиновой кислоты и последовательностям, кодирующим анти-LAG-3 антитела или их антиген-связывающие части, описанные в настоящем описании. В некоторых вариантах осуществления различные молекулы нуклеиновой кислоты кодируют аминокислотные последовательности тяжелой цепи и легкой цепи анти-LAG-3 антитела или его антиген-связывающей части. В других вариантах осуществления одна и та же молекула нуклеиновой кислоты кодирует аминокислотные последовательности тяжелой цепи и легкой цепи анти-LAG-3 антитела или его антиген-связывающей части.
[0141] Указание нуклеотидной последовательности включает ее комплементарный варианте, если не указано иное. Таким образом, следует понимать, что указание на нуклеиновую кислоту с конкретной последовательностью, включает ее комплементарную цепь с комплементарной последовательностью. Термин «полинуклеотид», как обозначают в настоящем описании, обозначает полимерную форму нуклеотидов по меньшей мере в 10 оснований в длину, рибонуклеотидов или дезоксинуклеотидов, или модифицированную форму нуклеотида любого типа. Термин включает одно- и двухцепочечные формы.
[0142] Изобретение также относится к нуклеотидным последовательностям, которые по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичны одной или нескольким нуклеотидным последовательностям, перечисленным в настоящем описании, например, к нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO:1, 2, 5, 6, 9, 10, 13, 14, 17, 18, 21, 22, 25 и 26, или к нуклеотидной последовательности, кодирующей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:3, 4, 7, 8, 11, 12, 15, 16, 19, 20, 23, 24, 27 и 28. Термин «процент идентичности последовательностей» в контексте последовательностей нуклеиновой кислоты относится к остаткам в двух последовательностях, которые представляют собой одно и то же при выравнивании для максимального соответствия. Отрезок сравнения идентичности последовательностей может охватывать фрагмент по меньшей мере приблизительно в 9 нуклеотидов, обычно по меньшей мере приблизительно 18 нуклеотидов, более обычно по меньшей мере приблизительно 24 нуклеотида, обычно по меньшей мере приблизительно 28 нуклеотидов, более обычно по меньшей мере приблизительно 32 нуклеотида и предпочтительно по меньшей мере приблизительно 36, 48 или больше нуклеотидов. Существует множество различных алгоритмов, известных в данной области, которые можно использовать для того, чтобы измерять идентичность нуклеотидных последовательностей. Например, полинуклеотидные последовательности можно сравнивать с использованием FASTA, Gap или Bestfit, которые представляют собой программы в Wisconsin Package версии 10.0, Genetics Computer Group (GCG), Madison, Wisconsin. FASTA, которая включает, например, программы FASTA2 и FASTA3, предоставляет выравнивания и процент идентичности последовательностей для областей наилучшего перекрытия между запрашиваемой и поисковой последовательностями (см., например, Pearson, Methods Enzymol. 183:63-98 (1990); Pearson, Methods Mol. Biol. 132:185-219 (2000); Pearson, Methods Enzymol. 266:227-258 (1996); и Pearson, J. Mol. Biol. 276:71-84 (1998) включены в настоящее описание посредством ссылки). Если не указано иное, используют параметры по умолчанию для конкретной программы или алгоритма. Например, процент идентичности последовательностей между последовательностями нуклеиновой кислоты можно определять с использованием FASTA с ее параметрами по умолчанию (размер слова 6 и коэффициент NOPAM для весовой матрицы) или с использованием Gap с ее параметрами по умолчанию, как предоставлено в GCG версии 6.1, включенном в настоящее описание посредством ссылки.
[0143] В одном из аспектов, изобретение относится к молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1, 2, 5, 6, 9, 10, 13, 14, 17, 18, 21, 22, 25 и 26. В определенных вариантах осуществления молекула нуклеиновой кислоты содержит нуклеотидные последовательности из SEQ ID NO:1 и 2, SEQ ID NO:5 и 6, SEQ ID NO:9 и 10, SEQ ID NO:13 и 14, SEQ ID NO:17 и 18, SEQ ID NO:21 и 22 или SEQ ID NO:25 и 26.
[0144] В любом из приведенных выше вариантов осуществления, молекулы нуклеиновой кислоты могут быть выделенными.
[0145] В дополнительном аспекте, настоящее изобретение относится к вектор, подходящий для экспрессии одной из цепей антитела или его антиген-связывающей части, как раскрыто в настоящем описании. Термин «вектор», как используют в настоящем описании, обозначает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она связана. В некоторых вариантах осуществления вектор представляет собой плазмиду, то есть круглый двухцепочечный фрагмент ДНК, в который можно лигировать дополнительные сегменты ДНК. В некоторых вариантах осуществления вектор представляет собой вирусный вектор, где дополнительные сегменты ДНК можно лигировать в вирусный геном. В некоторых вариантах осуществления векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, имеющие бактериальный участок начала репликации, и эписомные векторы млекопитающих). В других вариантах осуществления векторы (например, не эписомные векторы млекопитающих) можно встраивать в геном клетки-хозяина после введения в клетку-хозяина и тем самым реплицировать наряду с геномом хозяина. Кроме того, определенные векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы обозначают в настоящем описании как «рекомбинантные экспрессирующие векторы» (или просто «экспрессирующие векторы»).
[0146] Изобретение относится к векторам, содержащим молекулы нуклеиновой кислоты, которые кодируют тяжелую цепь анти-LAG-3 антитела по изобретению или его антиген-связывающей части, легкую цепь анти-LAG-3 антитела по изобретению или его антиген-связывающей части или как тяжелую, так и легкую цепи анти-LAG-3 антитела по изобретению или его антиген-связывающей части. Изобретение дополнительно предусматривает векторы, содержащие молекулы нуклеиновой кислоты, кодирующие слитые белки, модифицированные антитела, фрагменты антител и их зонды.
[0147] Молекулу нуклеиновой кислоты, кодирующую тяжелую и/или легкую цепь анти-LAG-3 антитела или его антиген-связывающей части по изобретению, можно выделять из любого источника, который продуцирует такое антитело или часть. В различных вариантах осуществления молекулы нуклеиновой кислоты выделяют из B-клеток, экспрессирующих анти-LAG-3 антитело, которые выделены у животного, иммунизированного с использованием антигена LAG-3 человека, или из иммортализованной клетки, полученной из такой B-клетки. Способы выделения нуклеиновых кислот, кодирующих антитело, хорошо известны в данной области. мРНК можно выделять и использовать для получения кДНК для использования в полимеразной цепной реакции (ПЦР) или клонировании кДНК генов антитела. В определенных вариантах осуществления молекулу нуклеиновой кислоты по изобретению можно синтезировать, а не выделять.
[0148] В некоторых вариантах осуществления молекула нуклеиновой кислоты по изобретению может содержать нуклеотидную последовательность, кодирующую домен VH анти-LAG-3 антитела или антиген-связывающей части по изобретению, соединенный с сохранением рамки считывания с нуклеотидной последовательностью, кодирующей константную область тяжелой цепи, из любого источника. Аналогичным образом, молекула нуклеиновой кислоты по изобретению может содержать нуклеотидную последовательность, кодирующую домен VL анти-LAG-3 антитела или антиген-связывающей части по изобретению, соединенную с сохранением рамки считывания с нуклеотидной последовательностью, кодирующей константную область легкой цепи, из любого источника.
[0149] В дополнительном аспекте изобретения, молекулы нуклеиновой кислоты, кодирующие вариабельный домен тяжелых (VH) и/или легких (VL) цепей, можно «превращать» в полноразмерные гены антител. В одном из вариантов осуществления молекулы нуклеиновой кислоты, кодирующие домены VH или VL, превращают в полноразмерные гены антител посредством инсерции в экспрессирующий вектор, уже кодирующий константную область тяжелой цепи (CH) или константную область легкой цепи (CL), соответственно, так, что сегмент VH функционально связывают с сегментом(ами) CH в векторе и/или сегмент VL функционально связывают с сегментом CL в векторе. В другом варианте осуществления молекулы нуклеиновой кислоты, кодирующие домены VH и/или VL, превращают в полноразмерные гены антител посредством связывания, например, лигирования, молекулы нуклеиновой кислоты, кодирующей домены VH и/или VL, с молекулой нуклеиновой кислоты, кодирующей область CH и/или CL, используя стандартные приемы молекулярной биологии. Молекулы нуклеиновой кислоты, кодирующие полноразмерные тяжелые и/или легкие цепи, затем можно экспрессировать в клетке, в которую их ввели, и выделять анти-LAG-3 антитело.
[0150] Молекулы нуклеиновой кислоты можно использовать для рекомбинантной экспрессии больших количеств анти-LAG-3 антител. Молекулы нуклеиновой кислоты также можно использовать для получения химерных антител, биспецифических антител, одноцепочечных антител, иммуноадгезинов, диател, мутантных антител и производных антител, как раскрыто в настоящем описании.
[0151] В другом варианте осуществления молекулу нуклеиновой кислоты по изобретению используют в качестве зонда или ПЦР праймера для специфической последовательности антитела. Например, нуклеиновую кислоту можно использовать в качестве зонда в диагностических способах или в качестве ПЦР праймера для амплификации областей ДНК, что можно использовать, inter alia, для выделения дополнительных молекул нуклеиновой кислоты, кодирующих вариабельные домены анти-LAG-3 антител. В некоторых вариантах осуществления молекулы нуклеиновой кислоты представляют собой олигонуклеотиды. В некоторых вариантах осуществления олигонуклеотиды происходят из высоко вариабельных доменов тяжелых и легких цепей антитела, представляющего интерес. В некоторых вариантах осуществления олигонуклеотиды кодируют полностью или частично одну или несколько CDR анти-LAG-3 антител или их антиген-связывающих частей по изобретению, как раскрыто в настоящем описании.
[0152] В другом варианте осуществления молекулы нуклеиновой кислоты и векторы можно использовать для получения мутантных анти-LAG-3 антител. В вариабельные домены тяжелых и/или легких цепей антитела можно вводить мутации, например, чтобы изменять связывающее свойство антитела. Например, мутацию можно создавать в одной или нескольких из CDR для того, чтобы увеличивать или уменьшать KD анти-LAG-3 антитела, увеличивать или уменьшать koff или изменять специфичность связывания антитела. В другом варианте осуществления одну или несколько мутаций создают в аминокислотном остатке, который доподлинно подлежит изменению по сравнению с зародышевой линией в моноклональном антителе по изобретению. Мутации можно создавать в CDR или каркасной области вариабельного домена или в константной области. В предпочтительном варианте осуществления мутации выполняют в вариабельном домене. В некоторых вариантах осуществления одну или несколько мутаций выполняют в аминокислотном остатке, который доподлинно подлежит изменению по сравнению с зародышевой линией в CDR или каркасной области вариабельного домена антитела или его антиген-связывающей части по изобретению.
[0153] В другом варианте осуществления в каркасную область(и) вводят мутацию с тем, чтобы получаемая каркасная область(и) имела аминокислотную последовательность соответствующего гена зародышевой линии. Мутацию можно создавать в каркасной области или константной области для увеличения времени полужизни анти-LAG-3 антитела. См., например, публикацию PCT WO 00/09560. Мутацию в каркасной области или константной области также можно выполнять для того, чтобы изменять иммуногенность антитела и/или предоставлять участок для ковалентного или нековалентного связывания с другой молекулой. В соответствии с изобретением, одно антитело может иметь мутации в любой одной или нескольких CDR или каркасных областях вариабельного домена или в константной области.
[0154] В некоторых вариантах осуществления анти-LAG-3 антитела по изобретению или их антиген-связывающие части экспрессируют посредством встраивания ДНК, кодирующей частичные или полноразмерные легкие и тяжелые цепи, полученные как описано выше, в экспрессирующие векторы так, что гены функционально связывают с необходимыми управляющими экспрессией последовательностями, такими как транскрипционные и трансляционные управляющие последовательности. Экспрессирующие векторы включают плазмиды, ретровирусы, аденовирусы, аденоассоциированные вирусы (AAV), вирусы растений, такие как вирус мозаики цветной капусты, вирус табачной мозаики, космиды, YAC, эписомы, полученные из EBV, и т. п. Кодирующую последовательность антитела можно лигировать в вектор так, что транскрипционные и трансляционные управляющие последовательности в векторе выполняют свою предполагаемую функцию регуляции транскрипции и трансляции кодирующей последовательности антитела. Экспрессирующий вектор и управляющие экспрессией последовательности можно выбирать так, чтобы они были совместимыми с выбранной экспрессионной клеткой-хозяином. Кодирующую последовательность легкой цепи антитела и кодирующую последовательность тяжелой цепи антитела можно вставлять в отдельные векторы и можно функционально связывают в одними и теми же или различными управляющими экспрессией последовательностями (например, промоторами). В одном из вариантов осуществления обе кодирующие последовательности вставляют в один и тот же экспрессирующий вектор и можно функционально связывать с одними и теми же управляющими экспрессией последовательностями (например, обыкновенный промотор), с отдельными идентичными управляющими экспрессией последовательностями (например, промоторами) или с различными управляющими экспрессией последовательностями (например, промоторами). Кодирующие последовательности антитела можно вставлять в экспрессирующий вектор стандартными способами (например, лигированием комплементарных участков рестрикции на фрагменте гена антитела и векторе или лигированием тупых концов, если участки рестрикции отсутствуют).
[0155] Удобным вектором является тот, который кодирует функционально полную последовательность CH или CL иммуноглобулина человека с подходящими участками рестрикции, разработанными с тем, чтобы любую последовательность VH или VL можно было легко вставлять и экспрессировать, как описано выше. HC- и LC-кодирующие гены в таких векторах могут содержать последовательности интронов, которые будут вести к увеличенному общему выходу белков антител посредством стабилизации соответствующей мРНК. Последовательности интронов фланкируют посредством участками доноров сплайсинга и акцепторов сплайсинга, которые определяют, где будет происходить сплайсинг РНК. Местоположение последовательностей интронов может находиться в вариабельных или константных областях цепей антител или как в вариабельных, так и в константных областях, когда используют несколько интронов. Полиаденилирование и терминация транскрипции могут происходить в нативных хромосомных участках ниже по направлению считывания от кодирующих областей. Рекомбинантный экспрессирующий вектор также может кодировать сигнальный пептид, который облегчает секрецию цепи антитела клеткой-хозяином. Ген цепи антитела можно клонировать в вектор так, что сигнальный пептид связывают с сохранением рамки считывания с аминоконцом цепи иммуноглобулина. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (то есть сигнальный пептид из неиммуноглобулинового белка).
[0156] В дополнение к генам цепей антител, рекомбинантные экспрессирующие векторы по изобретению могут нести регуляторные последовательности, которые управляют экспрессией генов цепей антител в клетке-хозяине. Специалисты в данной области примут во внимание, что разработка экспрессирующего вектора, включая выбор регуляторных последовательностей, может зависеть от таких факторов как выбор клетки-хозяина, подлежащей трансформации, желаемый уровень экспрессии белка и т. д. Предпочтительные регуляторные последовательности для экспрессии в клетке-хозяине млекопитающего включают вирусные элементы, которые задают высокие уровни экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из ретровирусных LTR, цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьян 40 (SV40) (такие как промотор/энхансер SV40), аденовируса (например, главный поздний промотор аденовируса (AdMLP)), полиомы и сильные промоторы млекопитающих, такие как нативные промоторы иммуноглобулинов и актина. Дополнительное описание вирусных регуляторных элементов и их последовательностей см. например, в патентах США 5168062, 4510245 и 4968615. Способы экспрессии антител у растений, включая описание промоторов и векторов, а также трансформации растений известны в данной области. См., например, патент США 6517529. Способы экспрессии полипептидов в бактериальных клетках или грибковых клетках, например, дрожжевых клетках, также хорошо известны в данной области.
[0157] В дополнение к генам цепей антител и регуляторным последовательностям, рекомбинантные экспрессирующие векторы по изобретению могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, участки начала репликации), и гены селективных маркеров. Ген селективного маркера облегчает отбор клеток-хозяев, в которые введен вектор (см., например, патенты США 4399216, 4634665 и 5179017). Например, обычно ген селективного маркера придает устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую введен вектор. Например, гены селективных маркеров включают ген дигидрофолатредуктазы (DHFR) (для использования в dhfr- клетках-хозяевах с отбором/амплификацией на метотрексате), ген neo (для отбора на G418) и ген глутаматсинтетазы.
[0158] Термин «управляющая экспрессией последовательность», как используют в настоящем описании, обозначает полинуклеотидные последовательности, которые необходимы для того, чтобы вызывать экспрессию и процессинг кодирующих последовательностей, с которыми их лигируют. Управляющие экспрессией последовательности включают подходящие последовательности инициации транскрипции, терминации, промоторные и энхансерные последовательности; эффективные сигналы процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые увеличивают эффективность трансляции (то есть консенсусную последовательность Козак); последовательности, которые увеличивают стабильность белка; и, по желанию, последовательности, которые усиливают секрецию белка. Свойства таких управляющих последовательностей различаются в зависимости от организма-хозяина; у прокариот такие управляющие последовательности в целом включают промотор, участок связывания рибосомы и последовательность терминации транскрипции; у эукариот в целом такие управляющие последовательности включают промоторы и последовательность терминации транскрипции. Термин «управляющие последовательности» предназначен включать, как минимум, все компоненты, присутствие которых необходимо для экспрессии и процессинга, и также может включать дополнительные компоненты, присутствие которых благоприятно, например, лидерные последовательности и последовательности партнеров слияния.
Клетки-хозяева и способы получения антител и композиций антител
[0159] Дополнительный аспект изобретения относится к способам получения композиций антител и антител и их антиген-связывающих частей по изобретению. Один из вариантов осуществления этого аспекта изобретения относится к способу получения антитела, как определено в настоящем описании, который включает предоставление рекомбинантной клетки-хозяина, способной экспрессировать антитело, культивирование указанной клетки-хозяина в условиях, подходящих для экспрессии антитела, и выделение получаемого антитела. Антитела, получаемые посредством такой экспрессии в таких рекомбинантных клетках-хозяевах, обозначают в настоящем описании как «рекомбинантные антитела». Изобретение также относится к клеткам потомства таких клеток-хозяев и антителам, продуцируемым ими.
[0160] Термин «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин»), как используют в настоящем описании, обозначает клетку, в которую введен рекомбинантный экспрессирующий вектор. Изобретение относится к клеткам-хозяевам, которые могут содержать, например, вектор в соответствии с изобретением, описанный выше. Изобретение также относится к клеткам-хозяевам, которые содержат, например, нуклеотидную последовательность, кодирующую тяжелую цепь или ее антиген-связывающую часть, нуклеотидную последовательность, кодирующую легкую цепь или ее антиген-связывающую часть, или обе, анти-LAG-3 антитела или его антиген-связывающей части по изобретению. Следует понимать, что «рекомбинантная клетка-хозяин» и «клетка-хозяин» обозначают не только конкретную рассматриваемую клетку, но также потомство такой клетки. Поскольку определенные модификации могут происходить в последующих поколениях из-за мутационных или средовых влияний, такое потомство фактически может не быть идентичным родительской клетке, но все еще быть включенным в объем термина «клетка-хозяин» как используют в настоящем описании.
[0161] Молекулы нуклеиновой кислоты, кодирующие анти-LAG-3 антитела, и векторы, содержащие эти молекулы нуклеиновой кислоты, можно использовать для трансфекции подходящей клетки-хозяина млекопитающего, растения, бактерии или дрожжей. Трансформацию можно осуществлять любым известным способом введения полинуклеотидов в клетку-хозяина. Способы введения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны в данной области и включают опосредованную декстраном трансфекцию, преципитацию с фосфатом кальция, опосредованную полибреном трансфекцию, слияние протопластов, электропорацию, инкапсулирование полинуклеотида(ов) в липосомы и прямую микроинъекцию ДНК в ядра. Кроме того, молекулы нуклеиновой кислоты можно вводить в клетки млекопитающих посредством вирусных векторов. Способы трансформации клеток хорошо известны в данной области. См., например, патенты США 4399216, 4912040, 4740461 и 4959455. Способы трансформации клеток растения хорошо известны в данной области и включают, например, опосредованную Agrobacterium трансформацию, биолистическую трансформацию, прямую инъекцию, электропорацию и вирусную трансформацию. Способы трансформации бактериальных и дрожжевых клеток также хорошо известны в данной области.
[0162] Клеточные линии млекопитающих, доступные в качестве хозяев для экспрессии, хорошо известны в данной области и включают многие линии иммортализованных клеток, доступные в American Type Culture Collection (ATCC). Они включают, inter alia, клетки яичника китайского хомяка (CHO), клетки NS0, клетки SP2, клетки HEK-293T, клетки 293 Freestyle (Invitrogen), клетки NIH-3T3, клетки HeLa, клетки почки новорожденного хомяка (BHK), клетки почки африканской зеленой мартышки (COS), клетки гепатоцеллюлярной карциномы человек (например, Hep G2), клетки A549 и множество других клеточных линий. Клеточные линии, которым отдают конкретное предпочтение, выбирают посредством определения того, какие клеточные линии имеют высокие уровни экспрессии. Другие клеточные линии, которые можно использовать, представляют собой линии клеток насекомых, такие как клетки Sf9 или Sf21. Когда рекомбинантные экспрессирующие векторы, кодирующие гены антител, вводят в клетки-хозяева млекопитающих, антитела получают посредством культивирования клеток-хозяев в течение определенного периода времени, достаточного для того, чтобы сделать возможной экспрессию антитела в клетках-хозяевах или, более предпочтительно, секрецию антитела в среду для культивирования, в которой растят клетки-хозяева. Антитела можно извлекать из среды для культивирования с использованием стандартных способов очистки белка. Клетки-хозяева растений включают, например, Nicotiana, Arabidopsis, ряску, кукурузу, пшеницу, картофель и т. д. Бактериальные клетки-хозяева включают E. coli и виды Streptomyces. Клетки-хозяева дрожжей включают Schizosaccharomyces pombe, Saccharomyces cerevisiae и Pichia pastoris.
[0163] Кроме того, экспрессию антител по изобретению или их антиген-связывающих частей продуцирующими клеточными линиями можно усиливать с использованием множества известных приемов. Например, система экспрессии гена глутаминсинтетазы (система GS) представляет собой обычный подход для усиления экспрессии при определенных условиях. Система GS рассмотрена в целом или частично в связи с патентами EP 0 216 846, 0 256 055, 0 323 997 и 0 338 841.
[0164] Вероятно антитела, экспрессируемые различными клеточными линиями или трансгенными животными, будут иметь паттерны гликозилирования, отличные друг от друга. Однако, все антитела, кодируемые молекулами нуклеиновой кислоты, предусмотренными в настоящем описании, или содержащие аминокислотные последовательности, предусмотренные в настоящем описании, представляют собой часть настоящего изобретения, независимо от состояния гликозилирования антител и, в более общем смысле, независимо от присутствия или отсутствия посттрансляционной модификации(й).
Фармацевтические композиции
[0165] Другой аспект изобретения относится к фармацевтической композиции, содержащей в качестве активного ингредиента (или в качестве единственного активного ингредиента) анти-LAG-3 антитело или его антиген-связывающую часть, биспецифическую связывающую молекулу или композицию антител по изобретению. Фармацевтическая композиция может содержать любое анти-LAG-3 антитело или его антиген-связывающую часть, биспецифическую связывающую молекулу или композицию антител как раскрыто в настоящем описании. В некоторых вариантах осуществления фармацевтические композиции предназначены для улучшения, предотвращения и/или лечения связанного с LAG-3 нарушения и/или злокачественной опухоли. Как используют в настоящем описании, LAG-3-связанное или -опосредованное нарушение относится к нарушению, заболеванию или состоянию, которое улучшают или у которого замедляют прогрессирование посредством модуляции активности LAG-3. В некоторых вариантах осуществления композиции предназначены для активации иммунной системы. В определенных вариантах осуществления композиции предназначены для улучшения, предотвращения и/или лечения злокачественной опухоли, происходящей из таких тканей, как кожа, легкое, кишечник, ободочная кишка, яичник, головной мозг, предстательная железа, почка, мягкие ткани, гематопоэтическая система, голова и шея, печень, мочевой пузырь, молочная железа, желудок, матка и поджелудочная железа. В определенных вариантах осуществления злокачественная опухоль представляет собой фибросаркому, карциному легких или меланому. В определенных вариантах осуществления злокачественная опухоль представляет собой глиобластому, глиосаркому или рак толстой кишки. В определенных вариантах осуществления фармацевтические композиции по изобретению предназначены для лечения псориаза.
[0166] В целом, антитела, антиген-связывающие части и биспецифические связывающие молекулы по изобретению подходят для введения в виде состава в связи с одним или несколькими фармацевтически приемлемыми эксципиентами, например, как описано ниже.
[0167] Фармацевтические композиции по изобретению должны содержать одно или несколько анти-LAG-3 антител, связывающих частей или биспецифических связывающих молекул по изобретению, например, одно или два анти-LAG-3 антитела, связывающих части или биспецифических связывающих молекулы. В одном из вариантов осуществления композиция содержит одно анти-LAG-3 антитело по изобретению или его связывающую часть.
[0168] В другом варианте осуществления фармацевтическая композиция может содержать по меньшей мере одно анти-LAG-3 антитело или его антиген-связывающую часть, например, одно анти-LAG-3 антитело или часть, и одно или несколько дополнительных антител, которые направлены на один или несколько релевантных рецепторов клеточной поверхности, например, один или несколько релевантных рецепторов злокачественных опухолей.
[0169] Термин «эксципиент» используют в настоящем описании для того, чтобы описывать любой ингредиент, отличный от соединения(й) по изобретению. Выбор эксципиента(ов) в значительной степени зависит от таких факторов, как конкретный способ введения, эффект, оказываемый эксципиентом на растворимость и стабильность, и свойства дозированной формы. Как используют в настоящем описании, «фармацевтически приемлемый эксципиент» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и задерживающие абсорбцию средства и т. п., которые физиологически совместимы. Некоторые примеры фармацевтически приемлемых эксципиентов представляют собой воду, солевой раствор, фосфатно-солевой буфер, декстрозу, глицерин, этанол и т. п., а также их сочетания. Во многих случаях в композицию предпочтительно включать изотонические средства, например, сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия. Дополнительные примеры фармацевтически приемлемых веществ представляют собой смачивающие средства или незначительные количества вспомогательных веществ, таких как смачивающие или эмульгирующие средства, консерванты или буферы, которые увеличивают срок хранения или эффективность антитела.
[0170] Фармацевтические композиции по настоящему изобретению и способы их получения будут без труда видны специалистам в данной области. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19-е изд. (Mack Publishing Company, 1995). Фармацевтические композиции предпочтительно изготавливают по условиям GMP (Good Manufacturing Practice).
[0171] Фармацевтическую композицию по изобретению можно получать, упаковывать или продавать партиями, в виде единичной стандартной дозы или в виде множества единичных стандартных доз. Как используют в настоящем описании, «стандартная доза» представляет собой дискретное количество фармацевтической композиции, содержащей предварительно определяемое количество активного ингредиента. Количество активного ингредиента в целом равно дозе активного ингредиента, которую следует вводить субъекту, или удобной доле от такой дозы, например, такой как половина или треть такой дозы.
[0172] Любой способ введения пептидов, белков или антител, принятый в данной области, можно подходящим образом использовать для антител и антиген-связывающих частей по изобретению.
[0173] Фармацевтические композиции по изобретению обычно подходят для парентерального введения. Как используют в настоящем описании, «парентеральное введение» фармацевтической композиции включает любой путь введения, отличающийся физическим нарушением целостности ткани субъекта и введением фармацевтической композиции через брешь в ткани, что таким образом в целом ведет к непосредственному введению в кровоток, в мышцу или во внутренний орган. Парентеральное введение, таким образом, включает, но не ограничиваясь этим, введение фармацевтической композиции посредством инъекции композиции, посредством внесения композиции через хирургический разрез, посредством внесения композиции через проникающее не хирургическое ранение ткани и т. п. В частности, предусмотрено, что парентеральное введение включает, но не ограничиваясь этим, подкожную, внутрибрюшинную, внутримышечную, интрастернальную, внутривенную, внутриартериальную, интратекальную, внутрижелудочковую, внутриуретральную, внутричерепную, внутриопухолевую и интрасиновиальную инъекцию или инфузию; и приемы инфузии при почечном диализе. Также предусмотрены регионарные перфузии. Конкретные варианты осуществления включают внутривенные и подкожные пути.
[0174] Составы фармацевтической композиции, подходящие для парентерального введения, обычно содержат активный ингредиент в сочетании с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический солевой раствор. Такие составы можно получать, упаковывать или продавать в форме, подходящей для болюсного введения или для непрерывного введения. Инъецируемые составы можно получать, упаковывать или продавать в стандартной дозированной форме, например, в ампулах или в контейнерах нескольких доз, содержащих консервант. Составы для парентерального введения включают, но не ограничиваясь этим, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и т. п. Такие составы дополнительно могут содержать один или несколько дополнительных ингредиентов, включая в качестве неограничивающих примеров суспендирующее, стабилизирующее или диспергирующее средство. В одном из вариантов осуществления состава для парентерального введения активный ингредиент предоставляют в сухой (то есть порошковой или гранулированной) форме для восстановления с использованием подходящего носителя (например, стерильной апирогенной воды) перед парентеральным введением восстановленной композиции. Парентеральные составы также включают водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные средства (предпочтительно при pH от 3 до 9), но для некоторых применений их можно более подходящим образом формулировать в виде стерильного неводного раствора или в виде высушенной формы, подлежащей использованию в сочетании с подходящим носителем, таким как стерильная апирогенная вода. Образцовые формы для парентерального введения включают растворы или суспензии в стерильных водных растворах, например, водных растворах пропиленгликоля или декстрозы. При желании, такие дозированные формы можно подходящим образом забуферить. Другие парентерально вводимые составы, которые можно использовать, включают те, которые содержат активный ингредиент в микрокристаллической форме или в липосомном препарате. Составы для парентерального введения можно формулировать для незамедлительного и/или модифицированного высвобождения. Составы с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное и программируемое высвобождение.
[0175] Например, в одном из аспектов стерильные инъецируемые растворы можно получать посредством встраивания анти-LAG-3 антитела, его антиген-связывающей части, биспецифической связывающей молекулы или композиции антител в требуемом количестве в подходящий растворитель с одним или комбинацией ингредиентов, перечисленных выше, при необходимости, после чего следует стерилизация фильтрованием. В целом, дисперсии получают посредством встраивания активного соединения в стерильный носитель, который содержит основную дисперсионную среду и необходимые другие ингредиенты из тех, что перечислены выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, предпочтительные способы получения представляют собой вакуумную сушку и лиофилизацию, которая дает порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его раствора, предварительно стерилизованного фильтрованием. Надлежащую текучесть раствора можно поддерживать, например, с помощью покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии, и с помощью поверхностно-активных средств. Пролонгированную абсорбцию инъецируемых композиций можно обеспечивать посредством включения в композицию средства, которое задерживает абсорбцию, например, солей моностеаратов и желатина, и/или посредством использования покрытий с модифицированным высвобождением (например, покрытий с медленным высвобождением).
[0176] Антитела по изобретению также можно вводить интраназально или посредством ингаляции, обычно в форме сухого порошка (отдельно, в виде смеси или в виде смешанных частиц компонентов, например, смешанных с подходящим фармацевтически приемлемым эксципиентом) из ингалятора сухого порошка, в виде аэрозольного спрея из контейнера под давлением, насоса, спрея, атомизатора (предпочтительно атомизатора, использующего электрогидродинамику для получения мелкодисперсного тумана) или небулайзера, с использованием или без использования подходящего пропеллента, или в виде назальных капель.
[0177] Контейнер под давлением, насос, спрей, атомизатор или небулайзер в целом содержит раствор или суспензию антитела по изобретению, которые содержат, например, подходящее средство для диспергирования, солюбилизации или продления высвобождения активного средства, пропеллент(ы) в качестве растворителя.
[0178] Перед использованием в сухом порошковом или суспензионном составе, лекарственный продукт в целом микронизируют до размера, подходящего для доставки посредством ингаляции (обычно меньше 5 мкм). Этого можно достигать любым подходящим способом измельчения, таким как размол на спиральной струйной мельнице, размол на струйной мельнице с кипящим слоем, обработка сверхкритического текучего вещества для формирования наночастиц, гомогенизация высокого давления или распылительная сушка.
[0179] Для использования в ингаляторе или инсуффляторе можно формулировать капсулы, блистеры и картриджи, содержащие порошковую смесь соединения по изобретению, подходящей порошковой основы и модификатора эксплуатационных характеристик.
[0180] Подходящий состав раствора для использования в атомизаторе с использованием электрогидродинамики для получения мелкодисперсного тумана может содержать подходящую дозу антитела по изобретению на приведение в действие и объем приведения в действие, например, может варьировать от 1 мкл до 100 мкл.
[0181] Можно формулировать составы для ингаляционного/интраназального введения с незамедлительным и/или модифицированным высвобождением. Составы с модифицированным высвобождением включают отсроченное, замедленное, импульсное, контролируемое, направленное и программируемое высвобождение.
[0182] В случае ингаляторов сухого порошка и аэрозолей, единицу дозирования определяют с помощью клапана, который доставляет отмеренное количество. Единицы в соответствии с изобретением обычно устраивают так, чтобы вводить отмеренную дозу или «пшик» антитела по изобретению. Общую суточную дозу обычно вводят в однократной дозе или, более обычно, в виде разделенных доз на всем протяжении суток.
[0183] Антитела и части антител по изобретению также можно формулировать для введения через оральный путь. Оральное введение может включать проглатывание с тем, чтобы соединение попадало в желудочно-кишечный тракт, и/или буккальное, лингвальное или сублингвальное введение, посредством которого соединение попадает в кровоток непосредственно изо рта.
[0184] Составы, подходящие для орального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; пастилки (в том числе заполненные жидкостью); жвачки; гели; быстро диспергируемые дозированные формы; пленки; суппозитории; спреи; и буккальные/мукоадгезивные пластыри.
[0185] Жидкие составы включают суспензии, растворы, сиропы и крепкие настои. Такие составы можно использовать в качестве наполнителей в мягких или твердых капсулах (выполненных, например, из желатина или гидроксипропилметилцеллюлозы), и обычно они содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и одно или несколько эмульгирующих средств и/или суспендирующих средств. Жидкие составы также можно получать посредством восстановления твердого вещества, например, из саше.
Терапевтическое применение антител и композиций по изобретению
[0186] В одном из аспектов, анти-LAG-3 антитела и их антиген-связывающие части, композиции против LAG-3 и биспецифические связывающие молекулы по изобретению используют для усиления или активации иммунной системы у человека, нуждающегося в этом. В некоторых вариантах осуществления пациент имеет иммунную супрессию. Например, врач может повышать активность собственной иммунной системы пациента против злокачественной опухоли посредством введения анти-LAG-3 антитела по настоящему изобретению, отдельно или в комбинации с другими терапевтическими средствами (последовательно или параллельно). антитело к LAG-3 модулирует активность LAG-3 в клетках иммунной системы, что ведет к усилению иммунитета против злокачественной опухоли.
[0187] В определенных вариантах осуществления антитело или его антиген-связывающая часть, композиция или биспецифическая связывающая молекула предназначены для использования в лечении злокачественной опухоли, например, злокачественных опухолей, которые происходят из тканей, таких как кожа, легкое, кишечник, ободочная кишка, яичник, головной мозг, предстательная железа, почка, мягкие ткани, гематопоэтическая система, голова и шея, печень, мочевой пузырь, молочная железа, желудок, матка и поджелудочная железа и любые злокачественные опухоли или другие состояния, которые зависят от активности LAG-3 и/или при которых пациент экспрессирует или сверхэкспрессирует лиганд LAG-3 (например, MHCII, LSECtin или оба).
[0188] В некоторых вариантах осуществления злокачественные опухоли, которые лечат антителами против LAG-3, антиген-связывающими частями, биспецифическими связывающими молекулами и/или композициями антител по изобретению, могут включать, например, меланому (например, распространенную или метастатическую меланому), немелкоклеточный рак легких, плоскоклеточную злокачественную опухоль головы и шеи, почечноклеточную карциному, лимфому Ходжкина, неходжкинскую лимфому, глиобластому, глиому, плоскоклеточную злокачественную опухоль легких, мелкоклеточную злокачественную опухоль легких, гепатоцеллюлярную карциному, злокачественную опухоль мочевого пузыря, злокачественную опухоль верхних мочевых путей, злокачественную опухоль пищевода, злокачественную опухоль гастроэзофагеального перехода, злокачественную опухоль желудка, злокачественную опухоль печени, рак толстой кишки, карциному толстой кишки, множественную миелому, саркомы, острый миелолейкоз, хронический миелолейкоз, миелодиспластический синдром, назофарингеальную злокачественную опухоль, хронический лимфоцитарный лейкоз, острый лимфобластный лейкоз, мелкоклеточную лимфоцитарную лимфому, злокачественную опухоль яичников, злокачественную опухоль желудочно-кишечного тракта, первичную перитонеальную злокачественную опухоль, злокачественную опухоль фаллопиевой трубы, уротелиальную злокачественную опухоль, HTLV-ассоциированный T-клеточный лейкоз/лимфому, злокачественную опухоль предстательной железы, урогенитальную злокачественную опухоль, менингиому, адренокортикальную злокачественную опухоль, глиосаркому, фибросаркому, злокачественную опухоль почки, злокачественную опухоль молочной железы, злокачественную опухоль поджелудочной железы, злокачественную опухоль эндометрия, базальноклеточную злокачественную опухоль кожи, злокачественную опухоль аппендикса, злокачественную опухоль желчных путей, злокачественную опухоль слюнных желез, распространенную злокачественную опухоль из клеток Меркеля, диффузную крупноклеточную B-клеточную лимфому, фолликулярную лимфому, мезотелиому или солидные опухоли. Злокачественная опухоль может быть, например, на ранней, промежуточной, поздней или метастатической стадии.
[0189] В некоторых вариантах осуществления злокачественные опухоли, которые лечат антителами против LAG-3, антиген-связывающими частями, композициями и/или биспецифическими связывающими молекулами по изобретению, могут включать, например, гематологические злокачественные новообразования, глиобластому (например, рецидивирующую глиобластому), глиосаркому, немелкоклеточный рак легких (например, распространенную немелкоклеточный рак легких), рак толстой кишки и солидные опухоли.
[0190] В одном из аспектов анти-LAG-3 антитела и их антиген-связывающие части, композиции антител или биспецифические связывающие молекулы по изобретению можно использовать для лечения иммунно-опосредованного нарушения, такого как псориаз, системная красная волчанка, MLS (склероз), болезнь Крона, сахарный диабет и/или язвенный колит.
[0191] В некоторых вариантах осуществления анти-LAG-3 антитела и их антиген-связывающие части, композиции антител или биспецифические связывающие молекулы по изобретению можно использовать для лечения вирусных и/или паразитарных инфекций, например, при которых патогены подавляют иммунный ответ хозяина. Например, патогеном может быть HIV, гепатит (A, B или C), вирус папилломы человека (HPV), вирус лимфоцитарного хориоменингита (LCMV), аденовирус, флавивирус, эховирус, риновирус, вирус Коксаки, коронавирус, респираторный синцитиальный вирус, вирус паротита, ротавирус, вирус кори, вирус краснухи, парвовирус, вирус осповакцины, человек T-лимфотропный вирус человека (HTLV), вирус денге, вирус моллюска, полиовирус, вирус бешенства, вирус Джона Каннингема (JC), вирус арбовирусного энцефалита, вирус иммунодефицита обезьян (SIV), грипп, герпес, лямблия, малярия, лейшмания, Staphylococcus aureus или Pseudomonas aeruginosa.
[0192] В некоторых вариантах осуществления анти-LAG-3 антитела и их антиген-связывающие части, композиции антител или биспецифические связывающие молекулы по изобретению можно использовать для лечения пациента с ослабленным иммунитетом или у которого имеется риск ослабленного иммунитета (например, из-за химиотерапии или лучевой терапии).
[0193] В некоторых вариантах осуществления анти-LAG-3 антитела и их антиген-связывающие части, композиции антител или биспецифические связывающие молекулы по изобретению можно использовать для активации и деления антиген-специфических T-клеток ex vivo.
[0194] «Лечить», «лечащий» и «лечение» относятся к способу облегчения или устранения биологического нарушения и/или по меньшей мере одного из сопутствующих ему симптомов. Как используют в настоящем описании, «облегчать» заболевание, нарушение или состояние обозначает снижать тяжесть и/или частоту возникновения симптомов заболевания, нарушения или состояния. Кроме того, в настоящем описании отсылки к «лечению» включают отсылки к излечивающему, паллиативному и профилактическому лечению.
[0195] «Терапевтически эффективное количество» относится ко вводимому количеству терапевтического средства, которое будет облегчать в определенной степени один или несколько симптомов нарушения, подлежащего лечению. Терапевтически эффективное количество терапевтического средства против злокачественной опухоли, например, ведет к уменьшению размеров опухоли, увеличенной выживаемости, элиминации клеток злокачественной опухоли, сниженному прогрессированию заболевания, обращению метастазов или другим клиническим конечным точкам, которые желательны для работников здравоохранения.
[0196] Анти-LAG-3 антитела или их антиген-связывающие части, композиции антител или биспецифические связывающие молекулы по изобретению можно вводить отдельно или в комбинации с одним или несколькими другими лекарственными средствами или антителами (или в виде любого их сочетания). Фармацевтические композиции, способы и использования по изобретению, таким образом, также охватывают варианты осуществления комбинаций (совместное введение) с другими активными средствами, как подробно изложено далее.
[0197] Как используют в настоящем описании, термины «совместное введение», «совместно вводимый» и «в комбинации с», в отношении анти-LAG-3 антител и их антиген-связывающих частей, композиций антител и биспецифических связывающих молекул по изобретению с одним или несколькими другими терапевтическими средствами, предназначен для того, чтобы обозначать и ссылаться на и и включать следующее:
a) одновременное введение такой комбинации антитела/антиген-связывающей части/композиции антител/биспецифической связывающей молекулы по изобретению и терапевтического средства(в) больному, когда такие компоненты формулируют вместе в одной дозированной форме, которая высвобождает указанные компоненты указанному пациенту по существу одновременно,
b) по существу одновременное введение такой комбинации антитела/антиген-связывающей части/композиции антител/биспецифической связывающей молекулы по изобретению и терапевтического средства(в) больному, когда такие компоненты формулируют отдельно друг от друга в отдельных дозированных формах, которые указанный пациент принимает по существу одновременно, после чего происходит по существу одновременное высвобождение указанных компонентов указанному пациенту,
c) последовательное введение такой комбинации антитела/антиген-связывающей части/композиции антител/биспецифической связывающей молекулы по изобретению и терапевтического средства(в) больному, когда такие компоненты вводят в состав отдельно друг от друга в дозированные лекарственные формы, которые указанный пациент принимает последовательно во времени со значительным временным интервалом между каждым введением, в связи с чем происходит поступление указанных компонентов указанному пациенту по существу в разные моменты времени; и
d) последовательное введение такой комбинации антитела/антиген-связывающей части/композиции антител/биспецифической связывающей молекулы по изобретению и терапевтического средства(в) больному, когда такие компоненты вводят вместе в состав общей дозированной лекарственной формы, которая высвобождает указанные компоненты контролируемым образом, после чего происходит их параллельное, последовательное и/или перекрывающееся поступление указанному пациенту в один и те же и/или различные моменты времени, где каждую часть можно вводить одним и тем же или отличающимся путем.
[0198] Анти-LAG-3 антитела и их антиген-связывающие части, композиции антител или биспецифические связывающие молекулы по изобретению можно вводить без дополнительного терапевтического лечения, то есть в виде самостоятельно применяемой терапии (монотерапии). Альтернативно, лечение антителами против LAG-3 и их антиген-связывающими частями, композициями антител или биспецифическими связывающими молекулами по изобретению может включать по меньшей мере одно дополнительное терапевтическое лечение (комбинированная терапия), например, другое иммуностимулирующее средство, средство против злокачественной опухоли, противовирусное средство или вакцину (например, противоопухолевую вакцину).
[0199] В некоторых вариантах осуществления антитело или его антиген-связывающую часть, композицию антител или биспецифическую связывающую молекулу можно совместно вводить или формулировать с другим лекарством/лекарственным средством для лечения злокачественной опухоли. Дополнительное терапевтическое лечение может включать, например, химиотерапевтическое, антинеопластическое или антиангиогенное средство, другое антитело против злокачественной опухоли и/или лучевую терапию.
[0200] Посредством объединения антител или их антиген-связывающих частей, композиций антител или биспецифических связывающих молекул по изобретению со средствами, которые доподлинно индуцируют терминальную дифференцировку клеток злокачественной опухоли, эффект можно усовершенствовать дополнительно. Такие соединения, например, можно выбирать из группы, состоящей из ретиноевой кислоты, транс-ретиноевых кислот, цис-ретиноевых кислот, фенилбутирата, фактора роста нервов, диметилсульфоксида, активной формы витамина D3, активированного пролифератором пероксисом рецептора γ, 12-O-тетрадеканоилфорбол-13-ацетата, гексаметилен-бис-ацетамид, трансформирующего фактора роста β, масляной кислоты, циклического AMP и веснаринона. В некоторых вариантах осуществления соединение выбирают из группы, состоящей из ретиноевой кислоты, фенилбутирата, полностью транс-ретиноевой кислоты и активной формы витамина D.
[0201] Фармацевтические изделия, содержащие анти-LAG-3 антитело или его антиген-связывающую часть, композицию антител или биспецифическую связывающую молекулу по изобретению и по меньшей мере одно другое средство (например, химиотерапевтическое, антинеопластическое или антиангиогенное средство) можно использовать в качестве комбинированного лечения для одновременного, раздельного или последовательного введения при терапии злокачественной опухоли. Другое средство может представлять собой любое средство, подходящее для лечения конкретной рассматриваемой злокачественной опухоли, например, средство, выбранное из группы, состоящей из алкилирующих средств, например, производных платины, таких как цисплатин, карбоплатин и/или оксалиплатин; растительных алкалоидов, например, паклитаксела, доцетаксела и/или иринотекана; противоопухолевых антибиотиков, например, доксорубицина (адриамицина), даунорубицина, эпирубицина, идарубицина, митоксантрона, дактиномицина, блеомицина, актиномицина, лутеомицина и/или митомицина; ингибиторов топоизомеразы, таких как топотекан; и/или антиметаболитов, например, фторурацила и/или других фторпиримидинов. В некоторых вариантах осуществления другим средством является дакарбазин или гемцитабин.
[0202] Анти-LAG-3 антитело или его антиген-связывающую часть, композицию антител или биспецифическую связывающую молекулу по изобретению также можно использовать в комбинации с другой терапией против злокачественной опухоли, такой как вакцины, цитокины, ингибиторы ферментов, иммуностимулирующие соединения и T-клеточная терапия. В случае вакцины, например, она может представлять собой белковую, пептидную или ДНК вакцину, содержащую один или несколько антигенов, которые релевантны для злокачественной опухоли, подлежащей лечению, или вакцину, содержащую дендритные клетки наряду с антигеном. Подходящие цитокины включают, например, IL-2, IFN-γ и GM-CSF. Примером типа ингибитора фермента, который обладает активностью против злокачественной опухоли, является ингибитор индоламин-2,3-диоксигеназы (IDO), например, 1-метил-D-триптофан (1-D-MT). Адоптивная T-клеточная терапия относится к различным иммунотерапевтическим приемам, которые включают размножение или изменение собственных T-клеток пациентов для того, чтобы они распознавали и атаковали свои опухоли.
[0203] Также предусмотрено, что анти-LAG-3 антитело или его антиген-связывающую часть, композицию антител или биспецифическую связывающую молекулу по изобретению можно использовать в смежной терапии в связи с ингибиторами тирозинкиназы. Они представляют собой синтетические молекулы низкой молекулярной массы, преимущественно производные хиназолина, которые взаимодействуют с внутриклеточным доменом тирозинкиназы рецепторов и ингибируют индуцированное лигандом фосфорилирование рецептора посредством конкуренции за внутриклеточный сайт связывания Mg-ATP.
[0204] В некоторых вариантах осуществления антитело или его антиген-связывающую часть, композицию антител или биспецифическую связывающую молекулу можно использовать в комбинации с другим лекарством/лекарственным средством, которое опосредует активацию иммунной системы, включая в качестве неограничивающих примеров, средство, которое модулирует экспрессию или активность A2AR, BTLA, B7-H3, B7-H4, CTLA-4, CD27, CD28, CD40, CD47, CD55, CD73, CD122, CD137, CD160, CGEN-15049, CHK1, CHK2, CTLA-3, CEACAM (например, CEACAM-1 и/или CEACAM-5), GAL9, GITR, HVEM, LY108, LAIR1, ICOS, IDO, KIR, LAIR1, PD-1/PD-L1/PD-L2, OX40, TIGIT, TIM-3, TGFR-β, VISTA, LILRB2, CM™6 и/или 2B4. В определенных вариантах осуществления средством является антитело или его антиген-связывающий фрагмент, который связывается с одной из вышеуказанных молекул. Также предусмотрено, что анти-LAG-3 антитело или его антиген-связывающую часть, композицию антител или биспецифическую связывающую молекулу по изобретению можно использовать в комбинации с цитокином (например, IL-1, IL-2, IL-12, IL-15 или IL-21), ингибитором EGFR, ингибитором VEGF и т. д.
[0205] В определенных аспектах антитела и антиген-связывающие части, композиции антител или биспецифические связывающие молекулы по изобретению можно вводить в комбинации с другим ингибитором пути LAG-3, который может быть направлен на LAG-3 или один или несколько его лигандов. Примеры таких ингибиторов включают другие анти-LAG-3 антитела, антитела против MHCII, антитела против галектина-3 и антитела против LSECtin. В некоторых вариантах осуществления анти-LAG-3 антитело или его антиген-связывающую часть, биспецифическое антитело или композицию антител по изобретению можно вводить в комбинации с BMS-986016, GSK2831781, REGN3767, BAP050 или BAP050-chi или LAG525.
[0206] Понятно, что антитела и их антиген-связывающие части, композиции антител и биспецифические связывающие молекулы по изобретению можно использовать в способе лечения, как раскрыто в настоящем описании, могут быть для использования в лечении, как раскрыто в настоящем описании, и/или могут быть для использования в изготовлении лекарственного средства для лечения, как раскрыто в настоящем описании. Изобретение также относится к наборам и промышленным изделиям, содержащим антитела и их антиген-связывающие части, композиции антител и биспецифические связывающие молекулы, описанные в настоящем описании.
Доза и путь введения
[0207] Антитела или их антиген-связывающие части, композиции антител или биспецифические связывающие молекулы по изобретению следует вводить в эффективном количестве для лечения рассматриваемого состояния, то есть в дозах и в течение периодов времени, которые необходимы для достижения желаемого результата. Терапевтически эффективное количество может варьировать в соответствии с такими факторами, как конкретное состояние, подлежащее лечению, возраст, пол и масса пациента, и вводят ли антитела в качестве обособленного лечения или в комбинации с одним или несколькими дополнительными лечениями против злокачественных опухолей.
[0208] Схемы дозирования можно корректировать для того, чтобы обеспечивать оптимальный желаемый ответ. Например, можно вводить один болюс, можно вводить несколько разделенных доз с течением времени или дозу можно пропорционально уменьшать или увеличивать, как то указывают потребности терапевтической ситуации. В частности, благоприятно формулировать парентеральные композиции в форме единицы дозирования для облегчения введения и однородности дозы. Форма единицы дозирования, как используют в настоящем описании, относится к физически дискретным единицам, подходящим в качестве одинарных доз для пациентов/субъектов, подлежащих лечению; каждая единица содержит предварительно определяемое количество активного соединения, которое вычисляют для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Описание для форм единиц дозирования по изобретению в целом продиктовано и непосредственно зависит от (a) уникальных характеристик химиотерапевтического средства и конкретного терапевтического или профилактического эффекта, которого нужно достигнуть, и (b) ограничений, свойственных области компаундирования такого активного соединения для лечения чувствительности у индивидуумов.
[0209] Таким образом, специалист в данной области примет во внимание, на основе раскрытия, предоставленного в настоящем описании, что дозу и схему дозирования корректируют в соответствии со способами, общеизвестными области терапии. То есть, можно легко устанавливать максимальную переносимую дозу, а также можно определять эффективное количество, обеспечивающее поддающийся обнаружению терапевтический эффект у пациента, как позволяют временные требования для введения каждого средства, чтобы обеспечивать поддающийся обнаружению терапевтический эффект у пациента. Соответственно, хотя определенная доза и схемы введения приведены в качестве примера в настоящем описании, эти примеры ни коим образом не ограничивают дозу и схему введения, которые можно предоставлять пациенту при практическом осуществлении настоящего изобретения.
[0210] Следует отметить, что значения доз могут варьировать вместе с типом и тяжестью состояния, подлежащего облегчению, и могут включать однократные и многократные дозы. Кроме того, следует понимать, что у любого конкретного субъекта конкретные схемы дозирования следует корректировать с течением времени в соответствии с индивидуальными потребностями и профессиональным суждением человека, осуществляющего введение или наблюдение за введением композиций, и что диапазоны доз, приведенные в настоящем описании, являются лишь образцовыми и не предназначены для того, чтобы ограничивать объем или практику осуществленной композиции. Кроме того, схема дозирования композиций по данному изобретению может быть основана на различных факторах, включая тип заболевания, возраст, массу, пол, медицинское состояние пациента, тяжесть состояния, путь введения и конкретное используемое антитело. Таким образом, схема дозирования может варьировать широко, но ее можно определять обычным образом, используя стандартные способы. Например, дозы можно корректировать на основе фармакокинетических или фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты, и/или лабораторные значения. Таким образом, настоящее изобретение относится к индивидуальному увеличению дозы, как определяет специалист в данной области. Определение подходящих доз и схем общеизвестно в релевантной области, и специалисту в данной области будет понятно, что оно включено в предоставленные положения, раскрытые в настоящем описании.
[0211] Предусмотрено, что подходящая доза антитела, антиген-связывающей части, композиции антител или биспецифической связывающей молекулы по изобретению находится в диапазоне 0,1-100 мг/кг, таком как приблизительно 0,5-50 мг/кг, например, приблизительно 1-20 мг/кг. Антитело, антиген-связывающую часть, композицию антител или биспецифическую связывающую молекулу, например, можно вводить в дозе по меньшей мере 0,25 мг/кг, например, по меньшей мере 0,5 мг/кг, например, по меньшей мере 1 мг/кг, например, по меньшей мере 1,5 мг/кг, например, по меньшей мере 2 мг/кг, например, по меньшей мере 3 мг/кг, например, по меньшей мере 4 мг/кг, например, по меньшей мере 5 мг/кг; и, например, вплоть до самое большее 50 мг/кг, например, вплоть до самое большее 30 мг/кг, например, вплоть до самое большее 20 мг/кг, например, вплоть до самое большее 15 мг/кг. Введение обычно повторяют с подходящими интервалами, например, один раз в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели, и до тех пор, пока это сочтет подходящим ответственный врач, который может необязательно увеличивать или уменьшать дозу по мере необходимости.
[0212] Эффективное количество терапии опухоли можно измерять по ее способности стабилизировать прогрессирование заболевания и/или улучшать симптомы у пациента и предпочтительно обращать прогрессирование заболевания, например, посредством уменьшения размера опухоли. Способность антитела, антиген-связывающей части, композиции антител или биспецифической связывающей молекулы по изобретению ингибировать злокачественную опухоль можно оценивать посредством анализов in vitro, например, как описано в примерах, а также в подходящих моделях на животных, которые позволяют предсказывать эффект, оказываемый на опухоли человека. Подходящие схемы дозирования следует выбирать для того, чтобы обеспечивать оптимальный терапевтический ответ в каждой конкретной ситуации, например, введение в виде одного болюса или в виде непрерывной инфузии и с возможной корректировкой дозы, как то указывают потребности каждого случая.
Диагностическое применение и композиции
[0213] Антитела по настоящему изобретению также можно использовать в диагностических процессах (например, in vitro, ex vivo). Например, антитела можно использовать для того, чтобы обнаруживать и/или измерять уровень LAG-3 в образце от пациента (например, образце ткани или образце текучего вещества организма, такого как воспалительный экссудат, кровь, сыворотка, текучее вещество кишечника, слюна или моча). Подходящие способы обнаружения и измерения включают такие иммунологические способы, как проточная цитометрия, твердофазный иммуносорбентный анализ (ELISA), хемилюминесцентный анализ, радиоиммунологический анализ и иммуногистология. Изобретение дополнительно включает наборы (например, диагностические наборы), содержащие антитела, описанные в настоящем описании.
[0214] Если не определено иное в настоящем описании, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, в которых их обычно понимают средние специалисты в данной области. Образцовые способы и материалы описаны далее, хотя способы и материалы, подобные или эквивалентные тем, что описаны в настоящем описании, также можно использовать при практической реализации или тестировании настоящего изобретения. В случае противоречия, данное описание, включая определение, имеет решающее значение.
[0215] В целом, используемая номенклатура и приемы из культур клеток и тканей, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, синтетической органической химии, медицинской и фармацевтической химии, а также химии белков и нуклеиновых кислот и гибридизации, которые описаны в настоящем описании, являются общеизвестными и широко используемыми в данной области. Ферментативные реакции и приемы очистки осуществляют в соответствии с описаниями производителей, как обычно выполняют в данной области или как раскрыто в настоящем описании.
[0216] Кроме того, пока иного не требует контекст, формы единственного числа включают множественное число и формы множественного числа включают единственное число. На всем протяжении это описания и вариантов осуществления, слова «иметь» и «содержать» или вариации, такие как «имеет», «имеющий», «содержит» или «содержащий», следует понимать как подразумевающие включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
[0217] Все публикации и другие источники, упомянутые в настоящем описании, включены в данное описание посредством ссылки в полном объеме. Несмотря на то, что в настоящем описании процитировано множество документов, это цитирование не составляет допущение того, что любой из этих документов образует часть общих обычных познаний в данной области.
[0218] Для лучшего понимания этого изобретения приведены следующие примеры. Эти примеры служат лишь иллюстративной цели, и их не следует толковать в качестве ограничения объема изобретения каким-либо образом.
ПРИМЕРЫ
Пример 1: создание и скрининг репертуаров анти-LAG-3 антител
[0219] Два репертуара анти-LAG-3 антител создавали посредством иммунизации внеклеточным доменом LAG-3 (ECD) или слитым белком LAG-3 ECD Fc. Одну библиотеку антител получали из одноклеточных сортированных B-клеток от иммунизированных крыс OmniRat® с использованием технологии обнаружения антител Symplex™ (Osborn et al., J Immunol. 190(4): 1481-90 (2013); Meijer et al., J Mol Biol. 358(3): 764-72 (2006)). Экспрессионные конструкции из этого репертуара антител кодировали полностью иммуноглобулины человека в формате IgG1, несущие две мутации (L234A/L235A), которые заведомо снижают эффекторную функцию Fc-области антител IgG1 (Hezareh et al., J Virol. 75(24):12161-8 (2001)). Второй репертуар антител конструировали с использованием одноклеточных сортированных B-клеток, происходящих из лимфоидных органов иммунизированных кур дикого типа (Gallus gallus).
[0220] Клонированные антитела из обоих репертуаров против LAG-3 индивидуально трансфицировали и экспрессировали в клетках HEK293 с использованием трансфекционного реактива 293fectin™ (Invitrogen, № по каталогу 12347-019) в 384-луночном формате и собирали антителосодержащие супернатанты в сутки 6 после трансфекции.
[0221] Для клеточного скрининга антител клетки CHO-S трансфицировали в 384-луночном формате для того, чтобы экспрессировать GPI-заякоренный LAG-3 человека с использованием реактива FreeStyle™ MAX (Invitrogen, № по каталогу 16447-100), а клетки, трансфицированные нерелевантным GPI-заякоренным контрольным белком, использовали в качестве отрицательного контроля. Для того чтобы делать возможным проведение мультиплексного скрининга, контрольные клетки метили с использованием сложного эфира карбоксифлуоресцеинсукцинимидила (CFSE) и смешивали с немеченными LAG-3-трансфицированными клетками в соотношении 1 к 1 при плотности 1×106 клеток на мл. В 384-луночных планшетах 40 мкл это смеси клеток смешивали с 10 мкл антителосодержащего супернатанта, и антитело, связанное с клетками, обнаруживали посредством добавления вторичного антитела AF647 козы против IgG человека (H+L) (Molecular Probes, № по каталогу A21445). Параллельно осуществляли скрининг антител на связывание с LAG-3 яванского макака в схожей постановке. Образцы получали с использованием высокопропускной проточной цитометрии (iQue® Screener, Intellicyt) и анализировали данные с использованием программного обеспечения ForeCyt® посредством построения графика CFSE в зависимости от связывания IgG человека (AF647). LAG-3-специфические первичные попадания идентифицировали как клоны антител, связывающиеся клетками, трансфицированными LAG-3 как человека, так и яванского макака (CSFE-отрицательные), но не с контрольными клетками (CFSE-положительные), и собирали номера планшетов и координаты планшетов для извлечения попаданий и последующего анализа последовательностей.
[0222] Последовательности ДНК вариабельных областей тяжелых и легких цепей и белков шести функциональных полученных от OmniRat® анти-LAG-3 антител (15646, 15532, 15723, 15595, 15431 и 15572) и одного функционального полученного от курицы анти-LAG-3 антитела (15011; см. пример 2) предоставлены далее в разделе со списком последовательностей. Обзор SEQ ID NO:последовательностей ДНК вариабельных и константных областей и белков приведен в таблицах 8 и 9. SEQ ID NO:для CDR находятся в таблице 9. Последовательности CDR в настоящем описании определяли в соответствии с определениями IMGT® для CDR1 и CDR2. Для CDR3 тяжелых и легких цепей определения в настоящем описании включают один дополнительный аминокислотный остаток выше по направлению считывания от IMGT-CDR3 (Cys) и один дополнительный аминокислотный остаток ниже по направлению считывания (Trp для H-CDR3, Phe для L-CDR3). Использование генов зародышевой линии в шести полученных от OmniRat® антителах показано в таблице 10.
Пример 2: гуманизация полученных у курицы анти-LAG-3 антител
[0223] Гуманизацию каркасных областей полученных у курицы анти-LAG-3 антител осуществляли для того, чтобы получать молекулы антител, которые обладают минимальной иммуногенностью при введении человеку, при этом по существу сохраняя специфичность и аффинность родительских антител курицы.
[0224] Гуманизацию полученного у курицы антитела осуществляли с использованием подхода «пересадки CDR», способ исходно описан в посредством Jones et al., Nature 321(6069):522-5 (1986). Сначала вариабельные области тяжелых (VH) и легких (VL) цепей антител сравнивали программой BLAST с базами данных о IgG человека для того, чтобы находить ближайшие гены зародышевой линии человека. Так дентифицировали гены IGHV3-23*01 (M99660) и IGLV3-19*01 (X56178) человека в качестве ближайших к генам VH и VL курицы, соответственно. Аналогичным образом, выбранные аминокислотные последовательности человека для гуманизации области J-гена извлекали из IGHJ1*01 (J00256) и IGLJ6*01 (M18338) для VH и VL, соответственно. Затем гены VH и VL антител выравнивали с генами зародышевой линии иммуноглобулинов курицы для того, чтобы идентифицировать соматические мутации в каркасных областях, которые могут играть роль в функции и/или структуре антител. Наконец, определенные аминокислотные положения, так называемые «остатки Vernier» (Nishibori et al., Mol Immunol. 43(6):634-42 (2006)), которые доподлинно играют важную роль в структуре, стабильности и функции антител, учитывали при генерации альтернативных вариантов гуманизированных антител, содержащих остатки человека или курицы из соответствующих зародышевых линий.
[0225] Сборку CDR курицы и каркасных областей человека осуществляли in silico, а синтетические гены, кодирующие гуманизированные VH и VL, заказывали в Genscript Inc. Гены VH и VL клонировали в экспрессирующие векторы (плазмиды), несущие константные области легкой цепи и тяжелой цепи антитела человека. В частности, VL соединяли с константной λ IGLC1*01 человека (J00252). Для того чтобы повышать правильное отщепление сигнального пептида выше от цепи λ, вторую аминокислоту (Ser) в гене λ IGLV3.19 заменяли на другую аминокислоту (Tyr), которая присутствует в других зародышевых линиях человека, например, IGLV3.25.
[0226] Репрезентативные точечные диаграммы проточной цитометрии для клонов антител, созданных как описано в этом примере, представлены на фиг. 1A-C: (A) клон антитела, специфически связывающийся с трансфицированными LAG-3 человека клетками, (B) клон антитела, связывающийся неспецифически с клетками CHO-S, и (C) клон антитела, который не связывается с какими-либо из популяций клеток, используемых в скрининге.
Пример 3: клонирование аналогов эталонного анти-LAG-3 антитела
[0227] Аминокислотные последовательности, кодирующие вариабельные домены тяжелых и легких цепей аналогов антител 25F7-Lag3.5 и BAP050, получали из публикации патентной заявки США 2014/0093511 A1 (SEQ ID NO:12 и 14) и публикации патентной заявки PCT WO 2015/138920 Al (SEQ ID NO:6 и 16), соответственно. Последовательности белков подвергали обратной трансляции в последовательности ДНК с использованием кодонов человека. Соответствующие последовательности ДНК после этого синтезировали и клонировали в экспрессирующие векторы, содержащие кодирующую последовательность для константного домена тяжелой цепи или легкой κ цепи IgG4 человека, что вело к экспрессии полноразмерных антител. Для того чтобы предотвращать обмен плечами Fab, остаток серина в положении 228 заменяли на пролин (Angal et al., Mol. Immunol. 30:105-108 (1993)). Клетки CHO трансфицировали получаемыми экспрессирующими плазмидами с использованием стандартной экспрессирующей белок системы. Соответствующие антительные супернатанты очищали с использованием стандартной хроматографической очистки на колонке с белком A.
Пример 4: скрининг панели LAG-3-специфических mAb в SEB+PBMC анализе
[0228] Способность большой панели LAG-3-специфических mAb стимулировать секрецию IL-2 обработанными стафилококковым энтеротоксином B (SEB) мононуклеарными клетками периферической крови (PBMC) оценивали с использованием PBMC одного донора. SEB представляет собой суперантиген, который связывается с молекулами MHC класса II и специфическим областями Vβ T-клеточных рецепторов (TCR) и обеспечивает неспецифическую стимуляцию T-клеток. Это ведет к активации/пролиферации поликлональных T-клеток и высвобождению цитокинов, включая IL-2. PBMC человека, выделенные из лейкотромбоцитарных слоев от здоровых доноров, высевали в 384-луночные планшеты и оставляли без обработки или обрабатывали с использованием 10 нг/мл SEB и 10 мкг/мл антител. После 48 часов в увлажненном инкубаторе при 37°C, супернатанты удаляли и анализировали в них уровни IL-2 с использованием набора IL-2 ELISA (Life Technologies).
[0229] Увеличение секреции IL-2 после обработки репертуарами mAb против LAG-3 или аналогом 25F7-Lag3.5 представлено на фиг. 2. Очевидно, что уровни IL-2 после обработки различными mAb против LAG-3 значительно варьировали, что показывает, что некоторые антитела в репертуаре не имели функциональности в этом анализе, тогда как другие антитела индуцировали секрецию IL-2 до уровней, схожих с аналогом 25F7-Lag3.5.
Пример 5: связывание антител с LAG-3 человека или яванского макака, экспрессируемым клетками
[0230] Для того чтобы определять значения EC50 для связывания антител посредством проточной цитометрии, клетки CHO-временно трансфицировали для того, чтобы экспрессировать LAG-3 человека или яванского макака с использованием реактива FreeStyle™ MAX (Invitrogen, № по каталогу 16447-100). Антитела титровали в 3-кратных разведениях от 10 до 0,05 мкг/мл в окрашивающем буфере (PBS; 2% FBS; NaN3) и смешивали и инкубировали с клетками, трансфицированными LAG-3 человека или яванского макака. После двух промываний в окрашивающем буфере, связанной с клеткой антитело обнаруживали посредством добавления вторичного антитела козы AF647 против IgG человека (H+L) (Molecular Probes, № по каталогу A21445). Образцы получали с использованием высокопропускной проточной цитометрии (iQue® Screener, Intellicyt) и анализировали данные с использованием программного обеспечения ForeCyt® посредством построения графика концентрации антитела в зависимости от средней интенсивности флуоресценции (MFI) для AF647. Значения EC5 вычисляли с использованием функции «dose response graph» в ForeCyt®.
[0231] Сводка по связывающим свойствам антител, которые измеряли посредством титрования, находится далее в таблице 1, где huLAG-3 и cyLAG-3 представляют собой клетки, трансфицированные LAG-3 человека и яванского макака, соответственно. Как показано в таблице 1, антитела 15646, 15532, 15723, 15595, 15431 и 15572 связываются с LAG-3 как человека, так и яванского макака.
Таблица 1. Обзор свойств антител
| Антитело | Источник | EC50 по FACS - huLAG-3 (нМ) | EC50 по FACS - cyLAG-3 (нМ) |
| 15646 | OmniRat® | 0,10 | 0,11 |
| 15532 | OmniRat® | 0,07 | 0,05 |
| 15723 | OmniRat® | 0,09 | 0,26 |
| 15595 | OmniRat® | 0,05 | 0,03 |
| 15431 | OmniRat® | 0,04 | 0,04 |
| 15572 | OmniRat® | 0,07 | 0,06 |
| 15011 | Курица | NA | NA |
Пример 6: Проточный цитометрический анализ анти-LAG-3 антител на блокирующую MHCII активность
[0232] Этот пример иллюстрирует, как анти-LAG-3 антитела тестировали на блокирующую главный комплекс гистосовместимости II (MHCII) активность посредством выполнения конкурентным анализом на основе проточной цитометрии с использованием клеток A375 с положительной по MHCII поверхностью и меченного флуорохромом растворимого LAG-3.
[0233] Блокирующую MHCII активность изучали в клеточном анализе с использованием клеточной линии A375 меланомы человека (ATCC® CRL-1619™). R-PE-меченный химерный белок из LAG-3 человека и Fc может специфически связываться с MHCII, экспрессируемым на поверхности A375, что делает возможным количественное определение этого взаимодействия посредством проточной цитометрии. Коммерчески доступный рекомбинантный химерный белок из LAG-3 человека и Fc (R&D Systems, USA) конъюгировали с R-PE, используя Lightning-Link® R-Phycoerythrin Conjugation Kit (Innova Biosciences, UK). Клетки A375 собирали с использованием Cell Dissociation Buffer, не содержащего ферменты (Gibco™), промывали и ресуспендировали в холодном окрашивающем буфере (PBS, 2% FBS, NaN3). Анти-LAG-3 антитела, подлежащие тестированию, наносили на планшет в 96-луночном формате и корректировали до 20 мкг/мл в 50 мкл окрашивающего буфера. На лунку добавляли 1 мкл LAG-3-Fc-PE (соответствует приблизительно 0,17 мкг LAG-3-Fc), смешивали и инкубировали планшеты при 4°C в течение 30 мин для того, чтобы сделать возможным образование комплекса LAG-3-антитело. В ходе инкубации 1×105 клеток A375 (в 100 мкл окрашивающего буфера) высевали в 96-луночном формате, осаждали посредством центрифугирования и ресуспендировали клеточные осадки в предварительно инкубированных смесях LAG-3/антитело. Клетки инкубировали в течение дополнительных 20 мин при 4°C, промывали 1× в 200 мкл холодного окрашивающего буфера и ресуспендировали в 100 мкл окрашивающего буфера для регистрации.
[0234] Из семи тестированных анти-LAG-3 антител (при 20 мкг/мл), четыре, 15532, 15595, 15431 и 15011, индуцировали снижение связывания LAG-3 с MHCII (MFI) приблизительно на 90% по сравнению со связыванием в присутствии антитела отрицательного контроля, и, таким образом, считались эффективными блокаторами взаимодействия. Остальные три антитела, 15646, 15723 и 15572, оказывали только ограниченный эффект на связывание LAG-3-MHCII и могли считаться слабыми блокаторами. Аналог эталонного антитела 25F7-Lag3.5 демонстрировал промежуточную блокирующую активность. Результаты сведены в таблице 2.
Таблица 2. Блокирование связывания LAG-3 с MHCII на клетках A375 в присутствии анти-LAG-3 антител.
| Антитело | Блокирование LAG-3/MHCII (%)* |
| 15646 | 49 |
| 15532 | 89 |
| 15723 | 55 |
| 15595 | 94 |
| 15431 | 92 |
| 15572 | 37 |
| 15011 | 92 |
| Аналог 25F7-Lag3.5 | 77 |
*Медиана, нормализованная по связыванию LAG-3 в присутствии антитела отрицательного контроля.
Пример 7: Эффект моноклональных анти-LAG-3 антител в SEB+PBMC анализе
[0235] Оценивали способность семи mAb против LAG-3 стимулировать секрецию IL-2 обработанными стафилококковым энтеротоксином B (SEB) мононуклеарными клетками периферической крови (PBMC). В этом примере описан эффект семи mAb против LAG-3, оказываемый на PBMC нескольких доноров. Кроме того, описан эффект четырех mAb против LAG-3 из других кластеров последовательностей. Номера кластеров последовательностей приведены в скобках после номеров антител и дополнительно описаны в примере 13. Анти-LAG-3 антитела тестировали в концентрациях 10 или 12,5 мкг/мл в SEB+PBMC анализе, как описано в примере 4.
[0236] Увеличение секреции IL-2 после обработки с использованием mAb против LAG-3 15431, 15532, 15572, 15595, 15646, 15723 и 15011 или аналога 25F7-Lag3.5 показано на фиг. 3. Каждая точка представляет уровень секреции IL-2 в PBMC одного донора. Очевидно, что уровни IL-2 после обработки с использованием mAb против LAG-3 варьировали среди различных доноров PBMC, но все семь mAb против LAG-3 стимулировали продукцию IL-2 на схожих уровнях. Это отличается от mAb против LAG-3 15445, 15429 и 15491, которые не увеличивают продукцию IL-2.
Пример 8: эффект моноклональных анти-LAG-3 антител в клеточном анализе блокирования LAG-3-MHC класса II
[0237] Чтобы дополнительно охарактеризовать семь mAb против LAG-3, в клеточном анализе тестировали способность блокировать взаимодействие между LAG-3 и MHC класса II.
[0238] Клетки Jurkat, несущие ген люциферазы под управлением NFAT-RE и экспрессирующие модифицированный TCR и LAG-3 (Promega), инкубировали с клеточной линией Raji, экспрессирующей MHC класса II, 50 нг/мл стафилококкового энтеротоксина D (SED) и различными концентрациями моноклональных антител, как указано на фиг. 4. После 6 часов в увлажненном инкубаторе при 37°C, добавляли субстрат люциферазы (Promega) и измеряли люминесценцию. Люминесценция представляет собой меру экспрессии люциферазы, которую контролируют посредством передачи сигнала TCR и ингибируют посредством передачи сигнала LAG-3. Таким образом, меньшая передача сигнала LAG-3, например, посредством блокирования взаимодействия LAG-3 с MHCII, будет вести к повышенной люминесценции.
[0239] Увеличение люминесценции после обработки с использованием mAb против LAG-3 15431, 15532, 15572, 15595, 15646, 15723 и 15011 или аналога 25F7-Lag3.5 представлено на фиг. 4. Обнаруживали, что все тестируемые анти-LAG-3 антитела увеличивают люминесценцию до схожих уровней.
Пример 9: эффект моноклональных анти-LAG-3 антител, оказываемый на клеточные уровни LAG-3
[0240] Чтобы дополнительно охарактеризовать выбранные mAb против LAG-3, способность к понижающей регуляции уровней LAG-3 тестировали в линии T-клеток со сверхэкспрессией LAG-3.
[0241] Клетки Jurkat, экспрессирующие модифицированный TCR и LAG-3 (Promega), инкубировали с 25 мг/мл моноклональных антител, как указано на фиг. 5. После 24 часов в увлажненном инкубаторе при 37°C, собирали супернатанты и осуществляли лизис клеток. Уровни LAG-3 в клетках оценивали с использованием идентифицирующего анти-LAG-3 антитела (Novus Biologicals) и приема Simple Western (Sally Sue, Proteinsimple). Уровни LAG-3 в супернатанте оценивали с использованием ELISA против LAG-3 (R&D Systems). Исследования конкурентного связывания подтверждали, что тестируемые анти-LAG-3 антитела не конкурируют с идентифицирующим антителом ELISA за связывание с растворимым LAG-3. Статистический анализ осуществляли с использованием однофакторного дисперсионного анализа с коррекцией для множественных сравнений, после чего следовал апостериорный критерий Стьюдента с поправкой Бонферрони.
[0242] Уровни клеточного и растворимого LAG-3 после обработки с использованием mAb против LAG-3 15431, 15532, 15011, аналога 25F7-Lag3.5 или аналога BAP050 представлены на фиг. 5. 15532, 15011, аналог 25F7-Lag3.5 и аналог BAP050 снижали клеточные и растворимые уровни LAG-3. 15532 снижало клеточные уровни LAG-3 до более низкого уровня, чем аналог 25F7-Lag3.5, со статистической значимостью и снижало растворимые уровни LAG-3 до более низкого уровня, чем аналог 25F7-Lag3.5 и аналог BAP050, со статистической значимостью. 15431 не снижало ни клеточные ни растворимые уровни LAG-3.
Пример 10: эффект антитела 15011 in vivo, оказываемый в двух моделях сингенных опухолей на мышах
[0243] Этот пример демонстрирует эффект антитела 15011 in vivo, оказываемый в двух моделях сингенных опухолей на мышах.
Способы
[0244] 2×105 клеток Sa1N (фибросаркома) и 5×106 клеток ASB-XIV (карцинома легких) инокулировали подкожно в бок самок мышей A/J (Sa1N) или BALB/cAnNRj (ASB-XIV) в возрасте 6-8 недель. Опухоли измеряли три раза в неделю штангенциркулем по двум измерениям и объем опухоли в мм3 вычисляли в соответствии с формулой: (ширина)2 × длина × 0,5. В сутки 5-7 после инокуляции, при усредненном размере опухоли 30-50 мм3, мышей рандомизировали в две группы по 10 животных и начинали лечение. Мышей лечили три раза в неделю с использованием всего шести лечений посредством интраперитонеальной инъекции буфера-носителя или моноклонального антитела 15011, после чего следовал период наблюдения. Лечение антителами дозировали по 10 мг/кг. Двухфакторный дисперсионный анализ с использованием критерия множественного сравнения Бонферрони применяли для того, чтобы сравнивать объемы опухолей в каждый момент времени между группами лечения. Статистический анализ осуществляли с использованием GraphPad Prism версии 5.0 (GraphPad Sofrware, Inc.).
Результаты
[0245] Результаты показывали выраженный эффект ингибирования опухоли антителом 15011 в тестируемых моделях сингенных опухолей (*P<0,001) (фиг. 6). 15011 индуцировало регрессию опухолевого роста у 50% мышей с пересаженными опухолями Sa1N и вело к задержке опухолевого роста в модели сингенной опухоли ASB-XIV.
Пример 11: эффект антитела 15532 in vivo у мышей NOG, которых восстанавливали с использованием PBMC человека и которым пересаживали клетки меланомы человека A375
[0246] В этом примере продемонстрирован эффект антитела 15532 in vivo в модели полугуманизированной ксенотрансплантированной опухоли, где иммунную систему мышей NOG восстанавливали с использованием PBMC человека, и мышам пересаживали клетки меланомы человека A375.
Способы
[0247] В сутки исследования 0 мышам NOG подкожно инъецировали 2-4,5×106 клеток меланомы A375 и интраперитонеально вводили 9 или 12×106 PBMC в сутки исследования 2. В каждом эксперименте использовали PBMC от одного донора. Лечение инициировали в сутки инокуляции PBMC, и мышей лечили три раза в неделю с использованием всего шести или девяти лечений посредством интраперитонеальной инъекции буфера-носителя или моноклонального антитела 15532 (10 мг/кг), после чего следовал период наблюдения. Опухоли измеряли три раза в неделю штангенциркулем по двум измерениям и вычисляли объем опухоли мм3 в соответствии с формулой: (ширина)2 × длина × 0,5. Двухфакторный дисперсионный анализ с использованием критерия множественного сравнения Бонферрони применяли для того, чтобы сравнивать объемы опухолей в каждый момент времени между группами лечения. Статистический анализ осуществляли с использованием GraphPad Prism версии 5.0 (GraphPad Software, Inc.).
Результаты
[0248] На фиг. 7 представлены результаты из двух экспериментов с использованием PBMC двух различных доноров-людей, которые отвечали на лечение против LAG-3. Лечение с использованием 15532 вело к значительной задержке опухолевого роста по сравнению с группой лечения носителем [P<0,05 (донор 1) и P<0,001 (донор 2)].
Пример 12: измерение аффинностей моноклональных анти-LAG-3 антител в отношении LAG-3 человека, яванского макака и мыши
[0249] В этом примере продемонстрировано связывание анти-LAG-3 антител с внеклеточными доменами LAG-3 человека, яванского макака и мыши, как измерено поверхностным плазмонным резонансом (SPR). Последовательность белка LAG-3 человека доступна по № доступа UniProt P18627 (SEQ ID NO:68). Последовательность белка LAG-3 яванского макака доступна по № доступа NCBI XP_005570011.1 (SEQ ID NO:69). Последовательность белка LAG-3 мыши доступна по № доступа UniProt Q61790 (SEQ ID NO:72).
Материалы и способы
[0250] Кинетический анализ связывания осуществляли посредством поверхностного плазмонного резонанса (SPR), используя Continuous Flow Microspotter (CFM, Wasatch Microfluidics, Salt Lake City, US) в сочетании с прибором IBIS MX96 SPR (IBIS Technologies, The Netherlands).
[0251] Fab анти-LAG-3 антитела создавали посредством расщепления антител IgG1 с использованием фермента GingisKHAN, используя набор, предоставляемый в Genovis (Sweden).
[0252] Синтезировали кДНК LAG-3, кодирующую внеклеточные домены LAG-3 человека и яванского макака, и каждую клонировали в вектор, содержащий промотор CMV и последовательность Fc IgG1 человека (AA P101-K330), что вело к слиянию Fc IgG1 C-концом с клонированным ECD LAG-3. Слитые конструкции LAG-3 Fc создавали посредством стандартной ПЦР и приемов конструирования, и белок временно экспрессировали в 2 мл культуре с использованием экспрессирующей системы ExpiCHO™. После 9 суток собирали слитые конструкции LAG-3 человека Fc и супернатанты тестировали на аффинность связывания с Fab антителами к LAG-3 посредством SPR. Антигены очищали с использованием стандартных процедур и захватывали на G-a-hu-IgG Fc SensEye® (Ssens BV, The Netherlands) в течение 15 минут с использованием Continuous Flow Microspotter (CFM, Wasatch Microfluidics, Salt Lake City, US). После точечного нанесения, SensEye® помещали в биосенсор IBIS MX96 и оставшиеся захватывающие участки блокировали. Кинетический анализ осуществляли посредством применения так называемого ряда кинетического титрования (Karlsson R. 2006), где мономерные Fab фрагменты антител по изобретению впрыскивали в увеличивающихся концентрациях от 1 нМ до 1000 нМ без применения стадий регенерации поверхности после каждого впрыска Fab. Связывание Fab осуществляли в течение 15 минут и диссоциацию антигена осуществляли в течение 15 минут. Зарегистрированные сигналы связывания аппроксимировали к простой модели связывания Ленгмюра 1:1 с использованием программного обеспечения Scrubber 2 для вычисления констант скорости ассоциации (kon или ka), скорости диссоциации (koff или kd) и аффинности (KD).
Результаты
[0253] Результаты измерения аффинности показывают, что оцениваемые антитела 15532, 15431, 15572, 15011 и аналог эталонного антитела 25F7-Lag3.5 связывают LAG-3 человека и яванского макака с различными аффинностями. 15011 представляет собой единственное антитело с перекрестной реактивностью к LAG-3 мыши. Подробности о кинетике связывания приведены далее в таблице 3.
Таблица 3. Кинетика связывания Fab фрагментов против LAG-3 с LAG-3 человека, яванского макака и мыши ECD, как измеряют посредством SPR.
| Антитело | ECD LAG-3 | kon (M-1 с-1) | koff (с-1) | KD (M) |
| 15532 | Человек | 1,1E+05 | 6,5E-04 | 5,8E-09 |
| 15532 | Яванский макак | 7,1E+04 | 4,8E-03 | 6,8E-08 |
| 15532 | Мышь | С.О. | С.О. | С.О. |
| 15431 | Человек | 6,6E+04 | 2,0E-03 | 3,0E-08 |
| 15431 | Яванский макак | 5,9E+04 | 6,8E-03 | 1,2E-07 |
| 15431 | Мышь | С.О. | С.О. | С.О. |
| 15572 | Человек | 1,1E+05 | 3,0E-03 | 2,7E-08 |
| 15572 | Яванский макак | 4,0E+04 | 4,0E-03 | 1,0E-07 |
| 15572 | Мышь | С.О. | С.О. | С.О. |
| 15011 | Человек | 1,1E+05 | 4,8E-04 | 4,3E-09 |
| 15011 | Яванский макак | 7,0E+04 | 2,5E-03 | 3,5E-08 |
| 15011 | Мышь | 7,2E+04 | 2,3E-03 | 3,3E-08 |
| 25F7-Lag3.5 | Человек | 1,4E+05 | 1,2E-03 | 8,5E-09 |
| 25F7-Lag3.5 | Яванский макак | 4,2E+03 | 3,8E-03 | 9,1E-07 |
| 25F7-Lag3.5 | Мышь | С.О. | С.О. | С.О. |
*NB: связывание отсутствует
Пример 13: группировка эпитопов анти-LAG-3 антител
[0254] Этот пример иллюстрирует, как анти-LAG-3 антитела группировали по группам эпитопов на основе паттернов парной конкуренции в сэндвич-анализе. Антитела, относящиеся к различным группам эпитопов, распознают различные эпитопы на ECD LAG-3.
Материалы и способы
[0255] Исследование парной конкуренции антител осуществляли посредством анализа поверхностного плазмонного резонанса (SPR) с использованием Continuous Flow Microspotter (CFM) (Wasatch Microfluidics, US) в сочетании с прибором IBIS MX96 SPR (IBIS Technologies, The Netherlands). Анализ визуализации поверхностного плазмонного резонанса осуществляли на SPR датчике Goat-Anti-Human-IgG Fc SensEye® (Ssens BV, The Netherlands). Всего 13 анти-LAG-3 антител, включая эталонное антитело 25F7-Lag3.5, разводили до 7,5 мкг/мл в буфере PBS, содержащем 0,05% Tween 20 (PBS-T), pH 7,0. Антитела захватывали на поверхности датчика против Fc посредством точечного нанесения в течение 15 минут с использованием Continuous Flow Microspotter. После точечного нанесения, SensEye® помещали в биосенсор IBIS MX96 и оставшиеся участки против Fc блокировали посредством впрыска 30 мкг/мл неспецифического IgG1 человека. Захваченные антитела конъюгировали с поверхностью с использованием набора FixIt (Ssens BV, The Netherlands). После подготовки датчика иммобилизованные антитела (лиганды) использовали для захвата одновалентного антигена LAG-3 (50 нМ, Acro Biosystems, China) в растворе, когда впрыскивали на датчик. Затем панель антител к LAG-3, разведенных до 15 мкг/мл в буфере PBS-T, впрыскивали в качестве анализируемых веществ одно за одним на датчик и тестировали на связывание с захваченным LAG-3 в сэндвич-анализе, чтобы устанавливать паттерны конкуренции антител. После впрыска каждого антитела, поверхность датчика регенерировали с использованием 100 мМ H3PO4 буфера, pH 3,0.
Результаты
[0256] Паттерн конкуренции 13 анти-LAG-3 антител представлен на фиг. 8. Антитела названы в соответствии с их идентификационным номером, а кластерные группы перечислены в скобках. Ожидают, что mAb из идентичных кластерных групп связывают идентичные группы эпитопов, поскольку белковые последовательности элементов кластеров являются близкородственными и различаются только несколькими положениями.
[0257] Все антитела успешно проходили группировку по эпитопам; однако антитела 15595 (52), 15613 (33) и 15431 (38) не работают при использовании в качестве лигандов и могут тестироваться только в качестве анализируемых веществ. Антитела 15646 (15) и 15011 (94) тестировали только в качестве лигандов.
[0258] Анализ конкуренции показывал, что панель антител к LAG-3 охватывает 6 основных групп эпитопов (фиг. 8). Антитело 15011 (94) связывалось с уникальным эпитопом, который не подвергался перекрестному блокированию любыми другими антителами из панели, и, следовательно, это антитело присваивали группе эпитопов 1. Группа эпитопов 2 содержит 7 антител, которые перекрестно конкурировали с некоторыми другими mAb из группы, и эти антитела дополнительно делили на подгруппы. mAb 15584 (54) отличалось перекрестным блокированием 15532 (17) и 15595 (52) при тестировании в качестве лиганда или анализируемого вещества, но его не блокировало эталонное mAb 25F7-Lag3.5 при тестировании в качестве анализируемого вещества. mAb 15613 (33) тестировали только в качестве анализируемого вещества и показывали, что его блокируют 15723 (39), 15532 (17) и 15646 (15), но не 25F7-Lag3.5. Следовательно, несмотря на то, что 15532 (17) связывало эпитоп, перекрывающийся с 25F7-Lag3.5, эпитоп 15532 (17) отличается от такового для 25F7-Lag3.5 из-за различий в конкуренции с 15584 (84) и 15613 (33), и, следовательно, эти антитела присваивали различным подгруппам. Аналогичным образом, другие mAb в группе эпитопов 2 присваивали подгруппам на основе паттернов конкуренции с другими антителами в группе 2 (фиг. 8).
[0259] У mAb 15572 (91) обнаруживали только перекрестную конкуренцию с mAb 15584 (54), и его относили к отдельной группе 3. Аналогичным образом, mAb 15431 (83) относили к отдельной группе 4, поскольку это антитело перекрестно конкурирует только с mAb 15723 (39). Наконец, идентифицировали две отдельные группы эпитопов, содержащие антитела с нефункциональной активностью. Группа эпитопов 5 содержала перекрестно блокирующие антитела 15445 (70) и 15491 (84) и группа эпитопов 6 содержала mAb 15429 (72), которое не демонстрирует перекрестного блокирования любого из антител из панели. Антитела группы 5 также блокировали антитела 25F7-Lag3.5, 15532 (17) и 15723 (39) из группы 2, когда их тестировали в качестве анализируемых веществ (фиг. 8). Сводка по паттернам конкуренции для антител-лигандов приведена на фиг. 9, где родство эпитопов для mAb показано на основе кластеризации с использованием эвклидова расстояния. В кластерной диаграмме можно наблюдать, что антитела с точками ветвления при значениях по оси x выше нуля имеют другие эпитопы по сравнению с другими антителами в тестируемой панели LAG-3. В кластерный анализ не включали mAb 15595 (52), 15613 (33) и 15431 (38), поскольку они не работают в качестве лигандов.
Пример 14: картирование эпитопов антител к LAG-3 посредством мутагенеза LAG-3
[0260] Эпитопы антител в целом можно охарактеризовать как линейные эпитопы (также называемые непрерывными эпитопами) или конформационные эпитопы (также называемые прерывистыми эпитопами). Линейные эпитопы определяют на основе одной непрерывной аминокислотной последовательности, тогда как конформационные эпитопы могут состоять из нескольких более мелких не непрерывных линейных последовательностей или отдельных контактных остатков. Совокупность контактных остатков, которые образуют кластер в межмолекулярном белковом интерфейсе между антителом и антигеном, также называют горячей точкой (Moreira et al., Proteins 68(4):803-12 (2007)). Сейчас общепризнанным является то, что большинство эпитопов B-клеток являются не непрерывными по природе (Sivalingam and Shepherd, Mol Immunol. 51(3-4):304-92012 (2012), Kringelum et al., Mol Immunol. 53(1-2):24-34 (2013)), причем усредненный эпитоп охватывает 15-22 аминокислотных остатков, из которых 2-5 аминокислот вносят основной вклад в связывание (Sivalingam and Shepherd, выше).
[0261] Посредством ранжирования аффинности связывания с 108 различными мутантами LAG-3, этот пример иллюстрирует, как связывающие эпитопы анти-LAG-3 антител 15532, 15431, 15572 и 15011 можно делить на линейные эпитопы и горячие точки, которые отличаются от эпитопа, распознаваемого аналогом эталонного антитела 25F7-Lag3.5.
Способы
[0262] Рецептор LAG-3 человека (CD223) представляет собой трансмембранный белок из 525 аминокислот (AA), который содержит внеклеточный домен (ECD) из 427 аминокислот (остатки 23-450), после которого следует трансмембранный домен (остатки 451-471) и цитоплазматический домен (остатки 472-525). ECD LAG-3 содержит 4 иммуноглобулиновых домена (D1-D4), где первый домен, домен типа IgV, участвует в связывании лиганда (связывании MHCII), а остальные три домена представляют собой домены типа IgC2. Отдельно первых двух N-концевых доменов (D1-D2) достаточно для связывания лиганда и показано, что D2 необходим для корректного представления рецептора (Huard et al., Proc Natl Acad Sci USA 94:5744-5749 (1997), Andrews et al., Immunol Rev. 276(1):80-96 (2017)). Домен 1 содержит дополнительный уникальный фрагмент из 30 аминокислот (дополнительная петля), который не находят в других IgV-доменах и который, как показано, важен для связывания лиганда. Аминокислоты (AA) 99, 110, 125, 131 и 137 также идентифицированы в качестве важных для связывания лиганда (Y77, R88, R103, D109, R115 в зрелом белке) (Huard et al, выше; Andrews et al., выше). Структура LAG-3 не опубликована. Однако установлены последовательность и эволюционная гомология между LAG-3 и CD4, что, таким образом, делает возможным доступ к структурной информации о LAG-3 на основе моделирования по гомологии с CD4 (Huard et al., выше; Andrews et al., выше).
[0263] Белковые последовательности LAG-3 человека и ортологи загружали из UniProt или NCBI: человек (P18627; SEQ ID NO:68), яванский макак (Macaca fascicularis, XP_005570011.1; SEQ ID NO:69), крыса (Rattus norvegicus, Q5BK54; SEQ ID NO:70) и собака (Canis Lupus Familiaris, F1P7Z3; SEQ ID NO:71). Идентичности последовательностей для различных аминокислотных последовательностей внеклеточных доменов LAG-3 представлены далее в таблице 4.
Таблица 4. Список аминокислотных различий и идентичность последовательностей с LAG-3 человека во внеклеточном домене LAG-3 от трех различных биологических видов.
| Аминокислотные различия | % идентичности последовательностей | |
| ECD LAG-3 яванского макака | 34 | 92,1 |
| ECD LAG-3 крысы | 140 | 67,3 |
| ECD LAG-3 собаки | 197 | 54,1 |
[0264] Для картирования линейных эпитопов в контексте нативной структуры LAG-3 человека разрабатывали 35 химерных белков, где 10 аминокислоты в последовательности ECD LAG-3 человека последовательно заменяли на последовательность крысы в сегментах, которые перекрывались на 5 аминокислот, и с добавлением версий собаки и яванского макака в областях особого интереса (например, критичные AA вставочные последовательности и фрагментeы петель). Замены последовательностей осуществляли в домене 1 LAG-3 человека, охватывающем аминокислоты 23-170. По сконструированной гомологичной модели на основе кристаллических структур CD4 (1WIO, 1WIQ) и выравниваниям аминокислотных последовательностей идентифицировали аминокислоты, экспонированные на поверхности, и разрабатывали 80 индивидуальных замен в домене 1 LAG-3 человека. Введенные точечные мутации в первую очередь представляли собой аланиновые замены. Когда экспонированный на поверхности остаток представлял аланин, это положение меняли на серин.
[0265] кДНК LAG-3, кодирующую домены 1 и 2 внеклеточного домена LAG-3 человека (AA 1-266), синтезировали и клонировали в вектор, содержащий промотор CMV и последовательность Fc IgG1 человека (AA P101-K330), что вело к экспрессии слитого белка из доменов 1-2 LAG и Fc. Слитые конструкции мутантного LAG-3 человека и Fc создавали посредством стандартной ПЦР и приемов конструирования, и белок временно экспрессировали в 2 мл культуре с использованием экспрессирующей системы ExpiCHO™. Слитые конструкции из LAG-3 человека и Fc собирали, очищали и тестировали на аффинность связывания с mAb против LAG-3 посредством поверхностного плазмонного резонанса (SPR). Слитые белки LAG-3 иммобилизовали на G-a-hu-IgG Fc SensEye® (Ssens BV, The Netherlands) в течение 15 минут с использованием Continuous Flow Microspotter (CFM, Wasatch Microfluidics, Salt Lake City, US). После точечного нанесения, SensEye® помещали в биосенсор IBIS MX96 и оценивали аффинность связывания захваченных белков. Кинетический анализ осуществляли посредством применения так называемого радя кинетического титрования (Karlsson R. 2006), где мономерные Fab фрагменты антител по изобретению впрыскивали в увеличивающихся концентрациях от 0,4 нМ до 300 нМ без применения стадий регенерации поверхности после каждого впрыска Fab. Связывание Fab осуществляли в течение 15 минут и диссоциацию антигена осуществляли в течение 15 минут. Зарегистрированные сигналы связывания аппроксимировали к простой модели связывания Ленгмюра 1:1 с использованием программного обеспечения Scrubber 2 для вычисления констант скорости ассоциации (kon или ka), скорости диссоциации (koff или kd) и аффинности (KD).
Результаты
[0266] Аффинности связывания Fab фрагментов анти-LAG-3 антител 15532, 15431, 15572, 15011 и аналога эталонного антитела 25F7-Lag3.5 оценивали в отношении измененного связывания с конструкциями мутантного LAG-3. Аффинности связывания Fab фрагментов, связывающихся с конструкциями мутантного LAG-3, экспрессировали в виде соотношения KD мутанта/KD дикого типа (нормализованная аффинность связывания). Далее в таблицах 5 и 6 представлены нормализованные аффинности связывания со всеми тестированными химерными белками и для экспериментов сканирования аланином, соответственно. Порог по меньшей мере 5-кратного снижения аффинности использовали в качестве критерия для обнаружения значительно сниженной аффинности связывания с конструкциями мутантного LAG-3. В некоторых случаях нельзя обнаруживать связывание со специфическими антителами. Эти конструкции перечислены как «связывание отсутствует» (С.О.).
[0267] Анализ показывал, что связывающие эпитопы анти-LAG-3 антител 15532, 15431, 15572, 15011 отличаются от таковых для аналога эталонного антитела 25F7-Lag3.5. Связывающий эпитоп для 15532 был очевиден из химерных белков с AA, вставленными в положениях 78-87, 84-92, 88-97 - совокупный аминокислотный фрагмент в LAG-3, который находится в пределах дополнительной петли домена 1. Однако, в отличие от 25F7-Lag3.5, линейные эпитопы для 15532 выходят за пределы этого фрагмента, включая AA 95-100, AA 98-105 и AA123-131. Интересно, что ключевые аминокислоты для лигандных взаимодействий идентифицированы в сегменте 99-131 (Y99, R125 и D131; Huard et al, выше). Аналог 25F7-Lag3.5 не демонстрирует какую-либо чувствительность к мутациям в области, критичной для связывания лиганда. Контактные остатки 15532, как измеряют посредством аланиновых замен, идентифицировали как H85, P86, A87, P89, S91, W92 и G93, тогда как аналог 25F7-Lag3.5 не демонстрирует чувствительность к P86 и S91, что иллюстрирует дифференцированные контактные остатки в области AA 85-93. 15532 способен связывать химерную конструкцию №28 с обратными мутациями AA яванского макака (P84H; H85R; S90Y), тогда как аналог 25F7-Lag3.5 не способен, что снова отражает дифференцированный тонкий эпитоп в области AA 84-90.
[0268] Было обнаружено, что два антитела 15431 и 15572 связывают линейные эпитопы в сегментах AA 23-30 и 40-66. Кроме того, аланиновое сканирование иллюстрировало, что оба антитела имели идентичные контактные остатки в положениях A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67 и D68. Кроме того, 15431 чувствителен к химерным конструкциям 88-97, 95-100 и 98-105 (сегмент AA 88-105). Доказано, что AA область 98-105 является уникальным общим эпитопом для 15532, 15431, 15572 и 15011. Аналог 25F7-Lag3.5 не связывает этот эпитоп. Аланиновое сканирование показывало, что 15431 и 15572 делили контактные остатки P96, Y99, T100, V101, P106 и G107, тогда как 15431 имело уникальные контакты в положениях G93, P94 и R98. Антитело 15431 также имело линейный эпитоп в сегментах AA 123-131, 128-137 и 148-154. Интересно, что предварительно показано, что положения 125, 131 и 137 важны для связывания лиганда (Huard et al, выше). Эти сегменты (AA 123-131, 128-137 и 148-154) также важны для 15572, которое распознавало линейные эпитопы в сегментах AA 118-137 и 148-161. Кроме того, аланиновое сканирование показывало, что 15431 и 15572 делили контактные остатки в положениях R119, E124, R129, G130, D131, S133, R137, P138, D143, R148 и R163, тогда как аналог 25F7-Lag3.5 не демонстрирует чувствительность к любым из этих областей эпитопов или аминокислотных положений.
[0269] Антитело 15011 содержало линейный эпитоп, определяемый химерной конструкцией с мутациями в диапазоне AA 98-105, и аланиновое сканирование дополнительно расширяло уникальный эпитоп на контактные остатки в положениях G107, L109, R110 и S111. Интересно, что показано, что R110 важен для связывания лиганда (Huard et al, выше). Аминокислотная последовательность высоко консервативна в этой области (AA 98-113) между ортологами человека, яванского макака, мыши и крысы, что объясняет перекрестную реактивность этого антитела к LAG-3 мыши и яванского макака (пример 12). Сводка собранных находок при картировании эпитопов представлена далее в таблице 7.
[0270] Вкратце, авторы изобретения показали на разрешении в одну аминокислоту, посредством анализа связывания с панелью из 108 мутантов LAG-3, что четыре антитела 15532, 15431, 15572 и 15011 распознают уникальные, но частично перекрывающиеся эпитопы в домене 1 LAG-3. Эта находка соответствует анализу группировки эпитопов в примере 13, который показывает, что 15532 перекрестно конкурирует с аналогом 25F7-Lag3.5, но имеет дифференцированный паттерн конкуренции с другими антителами к LAG-3 и, таким образом, другой эпитоп (таблица 7). 15431, 15572 и 15011 не конкурируют за связывание с 15532 или 25F7-Lag3.5 и имеют уникальные паттерны конкуренции с отдельными антителами группы эпитопов 2. Присвоенные группы эпитопов (пример 13) хорошо совпадают с картированием эпитопом, которое обнаруживало, что каждое антитело демонстрировано уникальные дифференцированные эпитопы (таблица 7). Данные об эпитопах, включая химерную конструкцию №28, также хорошо подтверждаются анализом аффинности связывания (пример 12), в котором 15532 демонстрировало значимое связывание с LAG-3 яванского макака, а 25F7-Lag3.5 - нет, что отражает различные свойства антител из-за дифференцированных контактных остатков.
Таблица 7. Сводка по связывающим эпитопам, которые идентифицировали для тестируемых анти-LAG-3 антител
| Антитело | Группировка эпитопов | Линейные эпитопы | Контактные остатки |
| 15532 | 2D | 78-105, 123-131 | H85, P86, A87, P89, S91, W92, G93 |
| 15431 | 4 | 23-30, 40-66, 88-105, 123-137, 148-152 | A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67, D68, G93, P94, P96, R98, Y99, T100, V101, P106, G107, R119, E124, R129, G130, D131, S133, R137, P138,, D143, R148, R163 |
| 15572 | 3 | 23-30, 40-66, 98-105, 118-137, 148-161 | A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67, D68, P96, Y99, T100, V101, P106, G107, R119, E124, R129, G130, D131, S133, R137, P138,, D143, R148, R163 |
| 15011 | 1 | 98-105 | G107, L109, R110, S111 |
| 25F7-Lag3.5, аналог | 2E | 78-97 | H85, A87, P89, W92, G93 |
Таблица 8. SEQ ID NO последовательностей ДНК и белков VH, VL, HC и LC
| SEQ ID № | Последовательность |
| 1 | 15646 последовательность ДНК вариабельного домена тяжелой цепи (VH) |
| 2 | 15646 последовательность ДНК вариабельного домена легкой цепи (VL) |
| 3 | 15646 последовательность белка VH |
| 4 | 15646 последовательность белка VL |
| 5 | 15532 последовательность ДНК VH |
| 6 | 15532 последовательность ДНК VL |
| 7 | 15532 последовательность белка VH |
| 8 | 15532 последовательность белка VL |
| 9 | 15723 последовательность ДНК VH |
| 10 | 15723 последовательность ДНК VL |
| 11 | 15723 последовательность белка VH |
| 12 | 15723 последовательность белка VL |
| 13 | 15595 последовательность ДНК VH |
| 14 | 15595 последовательность ДНК VL |
| 15 | 15595 последовательность белка VH |
| 16 | 15595 последовательность белка VL |
| 17 | 15431 последовательность ДНК VH |
| 18 | 15431 последовательность ДНК VL |
| 19 | 15431 последовательность белка VH |
| 20 | 15431 последовательность белка VL |
| 21 | 15572 последовательность ДНК VH |
| 22 | 15572 последовательность ДНК VL |
| 23 | 15572 последовательность белка VH |
| 24 | 15572 последовательность белка VL |
| 25 | 15011 последовательность ДНК VH |
| 26 | 15011 последовательность ДНК VL |
| 27 | 15011 последовательность белка VH |
| 28 | 15011 последовательность белка VL |
| 29 | последовательность ДНК константной области тяжелой цепи (HC) IgG1-LALA |
| 30 | последовательность белка константной области тяжелой цепи (HC) IgG1-LALA |
| 31 | последовательность ДНК константной области легкой цепи λ (LC) Ig |
| 32 | последовательность белка константной области легкой цепи λ (LC) Ig |
| 33 | последовательность ДНК константной области легкой цепи κ (KC) Ig |
| 34 | последовательность белка константной области легкой цепи κ (KC) Ig |
Таблица 9. SEQ ID NO последовательностей ДНК и белка VH и VL и аминокислотных последовательностей H-CDR1-3 и L-CDR1-3 анти-LAG-3 антител
| Анти-тело | VH (ДНК) | VL (ДНК) | VH (белок) | VL (белок) | H-CDR1 | H-CDR2 | H-CDR3 | L-CDR1 | L-CDR2 | L-CDR3 |
| 15646 | 1 | 2 | 3 | 4 | 35 | 36 | 37 | 38 | 39 | 40 |
| 15532 | 5 | 6 | 7 | 8 | 41 | 42 | 43 | 44 | 45 | 40 |
| 15723 | 9 | 10 | 11 | 12 | 35 | 42 | 46 | 44 | 47 | 40 |
| 15595 | 13 | 14 | 15 | 16 | 48 | 49 | 50 | 51 | 47 | 52 |
| 15431 | 17 | 18 | 19 | 20 | 53 | 54 | 55 | 44 | 45 | 40 |
| 15572 | 21 | 22 | 23 | 24 | 56 | 57 | 58 | 59 | 60 | 61 |
| 15011 | 25 | 26 | 27 | 28 | 62 | 63 | 64 | 65 | 66 | 67 |
Таблица 10. Определяющие комплементарность области (CDR) анти-LAG-3 антител и происхождение генов зародышевой линии для антител, полученных у OMT крыс.
| № антитела | Ген IGHV | H-CDR1 | H-CDR2 | H-CDR3 | SEQ ID NO |
| 15646 | IGHV4-34 | GGSFSGYY | INHRGST | CTRGEEWESLFFDYW | 35-37 |
| 15532 | IGHV4-34 | GESFSGYY | INHSGST | CARGWDLLDWNDYWNEYW | 41-43 |
| 15723 | IGHV4-34 | GGSFSGYY | INHSGST | CARGEDWGESFFDYW | 35, 42, 46 |
| 15595 | IGHV1-24 | GYSLTEIS | FDPEDGET | CATGGWGPNWFDPW | 48-50 |
| 15431 | IGHV6-1 | GDSVSSNSA | TYYRSKW | CARDDDWNDFDYW | 53-55 |
| 15572 | IGHV4-39 | GDSISSSSYY | IFYSGNT | CAREDDFLTDYYGAFDIW | 56-58 |
| 15011 | IGHV3-23* | GFDFRSYA | INGEVGGSNT | CVKGAGACGICNDDIDAW | 62-64 |
| № антитела | IGKV ген | L-CDR1 | L-CDR2 | L-CDR3 | SEQ ID NO |
| 15646 | IGKV3-11 | QSISSY | GAS | CQQRSNWPLTF | 38-40 |
| 15532 | IGKV3-11 | QSVSSY | DAS | CQQRSNWPLTF | 44, 45, 40 |
| 15723 | IGKV3-11 | QSVSSY | AAS | CQQRSNWPLTF | 44, 47, 40 |
| 15595 | IGKV1-12 | QGISSW | AAS | CQQANSFPFTF | 51, 47, 52 |
| 15431 | IGKV3-11 | QSVSSY | DAS | CQQRSNWPLTF | 44, 45, 40 |
| 15572 | IGKV1-5 | QSISSW | KAS | CQQYNSYLTF | 59-61 |
| 15011 | IGLV3-19* | GSYAGSY | DND | CGSTNDNDDGGLF | 65-67 |
*Гены, используемые для гуманизации, см. пример 2.
Список последовательностей
Последовательности ДНК и белка VH и VL
SEQ ID NO:1 (15646 последовательность ДНК VH)
CAGGTGCAGCTGCAGCAGTGGGGTGCCGGTCTGCTGAAGCCTTCTGAAACTCTGTCTCTGACTTGTGCCGTCTATGGTGGATCATTCAGCGGCTACTATTGGTCCTGGATCAGGCAGCCCCCTGGCAAGGGCCTGGAGTGGATCGGCGAGATCAACCACCGGGGCTCTACCAACTACAATCCCTCTCTGAAGAGCAGGGTGACCATCTCCGTGGACACATCTAAGAATCAGTTCAGCCTGAAGCTGAGCTCCGTGACCGCCGCTGATACAGCCGTGTACTATTGCACAAGGGGGGAGGAATGGGAGTCACTGTTCTTTGATTACTGGGGGCAGGGGACACTGGTCACAGTCTCGAGT
SEQ ID NO:2 (15646 последовательность ДНК VL)
GAAATCGTCCTGACCCAGTCCCCCGCCACCCTGAGCCTGAGCCCCGGAGAAAGAGCCACCCTGTCCTGCCGAGCAAGCCAGTCCATCAGCTCCTATCTCGCCTGGTATCAGCAGAAACCAGGCCAGGCTCCCCGGCTGCTGATCTACGGCGCCTCCAACAGAGCTACAGGAATCCCAGCCCGCTTCAGCGGCTCCGGCTCTGGCACAGACTTTACCCTGACAATCTCTAGCCTGGAGCCTGAGGATTTCGCCGTGTACTATTGCCAGCAGAGATCTAATTGGCCACTGACATTCGGCGGCGGCACACGGGTGGAGATCAAG
SEQ ID NO:3 (15646 последовательность белка VH)
QVQLQQWGAGLLKPSETLSLTCAVYGGSFSGYYWSWIRQPPGKGLEWIGEINHRGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCTRGEEWESLFFDYWGQGTLVTVSS
SEQ ID NO:4 (15646 последовательность белка VL)
EIVLTQSPATLSLSPGERATLSCRASQSISSYLAWYQQKPGQAPRLLIYGASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPLTFGGGTRVEIK
SEQ ID NO:5 (15532 последовательность ДНК VH)
CAGGTTCAGCTGCAGCAGTGGGGCGCCGGCCTGCTGAGACCAAGCGAGACCCTGTCCCTGACATGCGCCGTGTATGGCGAGAGCTTCTCCGGCTATTACTGGAACTGGATCCGGCAGCCTCCCGGCAAGGGCCTGGAGTGGATCGGCGAGATCAATCACTCCGGCTCCACCAATTACAACCCATCCCTGAAGTCTCGGGTGACAATCAGCGTGGATACAAGCAAGACCCAGTTCAGCCTGAAGCTGAGCTCCGTGACAGCTGCCGATACCGCCGTGTATTACTGCGCCAGAGGCTGGGACCTGCTGGATTGGAATGACTACTGGAATGAGTACTGGGGCCAGGGGACCCTGGTGACCGTCTCGAGT
SEQ ID NO:6 (15532 последовательность ДНК VL)
GAGATCGTGCTGACCCAGTCCCCTGCCACCCTGTCTCTGTCCCCTGGCGAGCGGGCCACCCTGTCCTGTAGAGCTTCTCAGTCCGTGTCTTCCTACCTGGCTTGGTACCAGCAGAAGCCAGGACAGGCCCCAAGACTGCTGATCTATGACGCTTCCAATCGGGCTACCGGCATCCCAGCTCGCTTTAGCGGCTCCGGCTCCGGCACCGACTTCACCCTGACAATCAGCTCCCTGGAGCCAGAGGATTTTGCCGTGTATTACTGTCAGCAGAGGTCCAATTGGCCACTGACATTTGGCGGCGGCACAAAGGTTGAGATCAAG
SEQ ID NO:7 (15532 последовательность белка VH)
QVQLQQWGAGLLRPSETLSLTCAVYGESFSGYYWNWIRQPPGKGLEWIGEINHSGSTNYNPSLKSRVTISVDTSKTQFSLKLSSVTAADTAVYYCARGWDLLDWNDYWNEYWGQGTLVTVSS
SEQ ID NO:8 (15532 последовательность белка VL)
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPLTFGGGTKVEIK
SEQ ID NO:9 (15723 последовательность ДНК VH)
CAGGTTCAGCTGCAGCAGTGGGGCGCTGGCCTGCTGAAGCCCTCTGAGACCCTGTCTCTGACCTGTGCCGTGTATGGCGGCAGCTTCTCCGGCTATTACTGGAACTGGATCCGCCAGCCCCCCGGCAAGGGCCTGGAGTGGATCGGCGAGATCAACCACTCCGGCTCTACCAACTACAATCCTTCTCTGAAGTCCAGGGTGACAATCAGCGTGGACACCAGCAAGAACCAGTTTAGCCTGAAGCTGTCCAGCGTGACAGCTGCCGATACAGCCGTGTATTACTGCGCCAGAGGCGAGGATTGGGGCGAGAGCTTCTTTGATTACTGGGGCCAGGGGACCCTGGTGACCGTCTCGAGT
SEQ ID NO:10 (15723 последовательность ДНК VL)
GAGATCGTGCTGACCCAGTCCCCTGCCACCCTGTCTCTGTCCCCTGGCGAGCGGGCCACCCTGAGCTGTCGGGCCTCCCAGTCCGTGAGCTCCTACCTGGCTTGGTATCAGCAGAAGCCAGGACAGGCCCCAAGACTGCTGATCTACGCCGCTTCCAATCGGGCCACCGGCATCCCCGCCAGATTTTCCGGCTCTGGCTCCGGCACCGATTTCACCCTGACAATCAGCTCCCTGGAGCCAGAGGACTTCGCCGTGTACTACTGCCAGCAGAGGTCTAATTGGCCACTGACATTTGGCGGCGGCACCAAGGTTGAGATCAAG
SEQ ID NO:11 (15723 последовательность белка VH)
QVQLQQWGAGLLKPSETLSLTCAVYGGSFSGYYWNWIRQPPGKGLEWIGEINHSGSTNYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCARGEDWGESFFDYWGQGTLVTVSS
SEQ ID NO:12 (15723 последовательность белка VL)
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYAASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPLTFGGGTKVEIK
SEQ ID NO:13 (15595 последовательность ДНК VH)
CAGGTTCAGCTGGTGCAGTCCGGCGCTGAGGTGAAGAAGCCTGGAGCTTCTGTGAAGGTTTCCTGTAAGGTTTCCGGCTATAGCCTGACCGAGATCTCTATGCACTGGGTACGGCAAGCCCCCGGCAAGGGCCTGGAGTGGATGGGCGGCTTTGACCCAGAGGATGGCGAGACCATCTACGCTCAGAGGTTTCAGGGGCGCGTGATCATGACCGAGGATACCAGCACCGATACCGCCTACATGGAGCTGTCCAGCCTGAGATCCGAGGATACCGCCGTGTATTACTGCGCTACTGGTGGCTGGGGCCCCAATTGGTTCGATCCTTGGGGCCAGGGGACCCTGGTGACCGTCTCGAGT
SEQ ID NO:14 (15595 последовательность ДНК VL)
GACATCCAGATGACACAGTCTCCTTCCTCTGTGAGCGCCTCTGTGGGCGACCGCGTGACCATCACATGCCGCGCTTCCCAGGGGATCTCTTCCTGGCTGGCTTGGTACCAGCAGAAGCCCGGCAAGGCCCCCAAGCTGCTGATCTATGCTGCCAGCAGCCTGCAGTCCGGCGTGCCTTCCAGGTTTAGCGGCTCCGGCTCCGGCACCGACTTTACACTGACAATCAGCTCCCTGCAGCCCGAGGATTTTGCCACCTATTACTGTCAGCAGGCGAATTCCTTCCCTTTTACATTCGGCCCTGGCACCAAGGTTGATATCAAG
SEQ ID NO:15 (15595 последовательность белка VH)
QVQLVQSGAEVKKPGASVKVSCKVSGYSLTEISMHWVRQAPGKGLEWMGGFDPEDGETIYAQRFQGRVIMTEDTSTDTAYMELSSLRSEDTAVYYCATGGWGPNWFDPWGQGTLVTVSS
SEQ ID NO:16 (15595 последовательность белка VL)
DIQMTQSPSSVSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQANSFPFTFGPGTKVDIK
SEQ ID NO:17 (15431 последовательность ДНК VH)
CAGGTTCAGCTGCAGCAGTCCGGCCCCGGCCTGGTGAAGCCAAGCCAGACCCTGTCTCTGACATGCGCCATCTCCGGCGACAGCGTGTCCTCTAACTCCGCCGCTTGGAATTGGATCCGGCAGTCTCCATCCAGAGGCCTGGAGTGGCTGGGCAGAACCTATTACCGGTCCAAGTGGTACAACGATTATGCCGTGTCCGTGAAGAGCAGAATCACCATCAACCCTGATACCAGCAAGAACCAGTTCAGCCTGCAGCTGAATTCCGTGACCCCAGAGGATACAGCCGTGTATTACTGTGCTAGGGACGATGATTGGAATGACTTCGATTACTGGGGCCAGGGGACCCTGGTGACAGTCTCGAGT
SEQ ID NO:18 (15431 последовательность ДНК VL)
GAGATCGTGCTGACCCAGTCCCCAGCTACACTGTCCCTGTCTCCCGGCGAGCGGGCCACCCTGAGCTGTAGAGCTTCCCAGTCCGTGTCTTCCTATCTGGCTTGGTATCAGCAGAAGCCAGGACAGGCCCCAAGGCTGCTGATCTACGACGCCTCCAATAGAGCCACCGGCATCCCAGCTAGATTTTCTGGCTCCGGCTCCGGCACCGATTTCACACTGACCATCTCTAGCCTGGAGCCAGAGGATTTTGCTGTATATTACTGCCAGCAGCGCAGCAACTGGCCCCTGACATTTGGCGGCGGCACCAAGGTTGAGATCAAG
SEQ ID NO:19 (15431 последовательность белка VH)
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSNSAAWNWIRQSPSRGLEWLGRTYYRSKWYNDYAVSVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARDDDWNDFDYWGQGTLVTVSS
SEQ ID NO:20 (15431 последовательность белка VL)
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPLTFGGGTKVEIK
SEQ ID NO:21 (15572 последовательность ДНК VH)
CAGCTGCAGCTGCAGGAAAGCGGCCCCGGCCTGGTGAAGCCCTCTGAGACCCTGTCCCTGACATGCACCGTGAGCGGCGATTCCATCAGCTCTTCCAGCTATTACTGGGGCTGGATCCGGCAGCCCCCCGGCAAGGGCCTGGAGTGGATCGGCAGCATCTTCTACTCCGGCAATACATATTATAATCCTTCTCTGAAGAGCAGGGTGACAATCAGCGTGGATACCTCCAAGAATCAGTTTAGCCTGAAGCTGAGCTCCGTGACAGCTGCCGATACAGCCGTGTATTACTGCGCTAGGGAGGACGATTTTCTGACCGATTATTACGGCGCTTTCGACATCTGGGGCCAGGGGACAATGGTGACAGTCTCGAGT
SEQ ID NO:22 (15572 последовательность ДНК VL)
GATATCCAGATGACCCAGTCTCCAAGCACCCTGAGCGCCTCTGTGGGCGATCGGGTGACCATCACATGTCGGGCTTCTCAGTCCATCAGCAGCTGGCTGGCTTGGTATCAGCAGAAGCCCGGCAAGGCCCCAAAGCTGCTGATCTACAAGGCCTCTTCCAGCGAGAGCGGCGTGCCATCCAGGTTTAGCGGCTCCGGCTCCGGCACCGAGTTTACCCTGACCATCTCTTCCCTGCAGCCCGATGACTTTGCCACCTACTACTGTCAGCAGTACAATTCCTATCTGACATTCGGCGGCGGCACCAAGGTTGAGATCAAG
SEQ ID NO:23 (15572 последовательность белка VH)
QLQLQESGPGLVKPSETLSLTCTVSGDSISSSSYYWGWIRQPPGKGLEWIGSIFYSGNTYYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCAREDDFLTDYYGAFDIWGQG™VTVSS
SEQ ID NO:24 (15572 последовательность белка VL)
DIQMTQSPSTLSASVGDRVTITCRASQSISSWLAWYQQKPGKAPKLLIYKASSSESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYNSYLTFGGGTKVEIK
SEQ ID NO:25 (15011 последовательность ДНК VH)
GAGGTGCAGCTGCTGGAATCCGGAGGAGGACTGGTCCAGCCAGGTGGATCCCTGCGACTGAGCTGCGCCGCTTCTGGCTTCGACTTTAGAAGCTACGCAATGATGTGGGTCCGCCAGGCACCAGGAAAGGGACTGGAGTGGGTGGGAGGGATCAACGGTGAAGTCGGTGGCTCTAATACATACTATGCACCTGCCGTCAAGGGAAGGGCTACTATTAGTCGGGACAACTCAAAAAATACCCTGTATCTGCAAATGAACAGTCTGAGGGCCGAGGATACCGCCGTGTACTATTGCGTGAAAGGTGCTGGCGCATGCGGCATCTGTAATGACGATATTGATGCATGGGGACAGGGGACCCTGGTGACAGTCTCGAGT
SEQ ID NO:26 (15011 последовательность ДНК VL)
AGTTATGAGCTGACTCAGGACCCAGCAGTGTCAGTCGCCCTGGGCCAGACAGTGAGAATCACTTGCAGTGGGGCTGGTTCATATGCAGGCTCCTACTATTACGGATGGCACCAGCAGAAGCCCGGACAGGCACCTGTGACAGTCATCTACGACAACGATAAAAGGCCAAGCAATATTCCCGACCGGTTCTCTGGGTCCAGCTCTGGTAACACCGCCTCCCTGACCATTACTGGGGCCCAGGCTGAGGACGAAGCTGATTATTACTGTGGCTCTACAAACGATAATGACGATGGCGGACTGTTTGGCTCCGGAACTAAGGTCACCGTCCTA
SEQ ID NO:27 (15011 последовательность белка VH)
EVQLLESGGGLVQPGGSLRLSCAASGFDFRSYAMMWVRQAPGKGLEWVGGINGEVGGSNTYYAPAVKGRATISRDNSKNTLYLQMNSLRAEDTAVYYCVKGAGACGICNDDIDAWGQGTLVTVSS
SEQ ID NO:28 (15011 последовательность белка VL)
SYELTQDPAVSVALGQTVRITCSGAGSYAGSYYYGWHQQKPGQAPVTVIYDNDKRPSNIPDRFSGSSSGNTASLTITGAQAEDEADYYCGSTNDNDDGGLFGSGTKVTVL
Последовательности ДНК и белка константной области
SEQ ID NO:29 (последовательность ДНК константной области IgHC)
GCCTCCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCCGCCGGGGGACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCCCCGGGTAAA
SEQ ID NO:30 (последовательность белка константной области IgHC)
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:31 (последовательность ДНК константной области IgLC)
GGCCAGCCCAAGGCCAACCCCACTGTCACTCTGTTCCCGCCCTCCTCTGAGGAGCTCCAAGCCAACAAGGCCACACTAGTGTGTCTGATCAGTGACTTCTACCCGGGAGCTGTGACAGTGGCCTGGAAGGCAGATGGCAGCCCCGTCAAGGCGGGAGTGGAGACCACCAAACCCTCCAAACAGAGCAACAACAAGTACGCGGCCAGCAGCTACCTGAGCCTGACGCCCGAGCAGTGGAAGTCCCACAGAAGCTACAGCTGCCAGGTCACGCATGAAGGGAGCACCGTGGAGAAGACAGTGGCCCCTACAGAATGTTCA
SEQ ID NO:32 (последовательность белка константной области IgLC)
GQPKANPTVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADGSPVKAGVETTKPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS
SEQ ID NO:33 (последовательность ДНК константной области IgKC)
CGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT
SEQ ID NO:34 (последовательность белка константной области IgKC)
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO:35 (15646/15723 H-CDR1)
GGSFSGYY
SEQ ID NO:36 (15646 H-CDR2)
INHRGST
SEQ ID NO:37 (15646 H-CDR3)
CTRGEEWESLFFDYW
SEQ ID NO:38 (15646 L-CDR1)
QSISSY
SEQ ID NO:39 (15646 L-CDR2)
GAS
SEQ ID NO:40 (15646/15532/15723/15431 L-CDR3)
CQQRSNWPLTF
SEQ ID NO:41 (15532 H-CDR1)
GESFSGYY
SEQ ID NO:42 (15532/15723 H-CDR2)
INHSGST
SEQ ID NO:43 (15532 H-CDR3)
CARGWDLLDWNDYWNEYW
SEQ ID NO:44 (15532/15723/15431 L-CDR1)
QSVSSY
SEQ ID NO:45 (15532/15431 L-CDR2)
DAS
SEQ ID NO:46 (15723 H-CDR3)
CARGEDWGESFFDYW
SEQ ID NO:47 (15723/15595 L-CDR2)
AAS
SEQ ID NO:48 (15595 H-CDR1)
GYSLTEIS
SEQ ID NO:49 (15595 H-CDR2)
FDPEDGET
SEQ ID NO:50 (15595 H-CDR3)
CATGGWGPNWFDPW
SEQ ID NO:51 (15595 L-CDR1)
QGISSW
SEQ ID NO:52 (15595 L-CDR3)
CQQANSFPFTF
SEQ ID NO:53 (15431 H-CDR1)
GDSVSSNSA
SEQ ID NO:54 (15431 H-CDR2)
TYYRSKW
SEQ ID NO:55 (15431 H-CDR3)
CARDDDWNDFDYW
SEQ ID NO:56 (15572 H-CDR1)
GDSISSSSYY
SEQ ID NO:57 (15572 H-CDR2)
IFYSGNT
SEQ ID NO:58 (15572 H-CDR3)
CAREDDFLTDYYGAFDIW
SEQ ID NO:59 (15572 L-CDR1)
QSISSW
SEQ ID NO:60 (15572 L-CDR2)
KAS
SEQ ID NO:61 (15572 L-CDR3)
CQQYNSYLTF
SEQ ID NO:62 (15011 H-CDR1)
GFDFRSYA
SEQ ID NO:63 (15011 H-CDR2)
INGEVGGSNT
SEQ ID NO:64 (15011 H-CDR3)
CVKGAGACGICNDDIDAW
SEQ ID NO:65 (15011 L-CDR1)
GSYAGSY
SEQ ID NO:66 (15011 L-CDR2)
DND
SEQ ID NO:67 (15011 L-CDR3)
CGSTNDNDDGGLF
SEQ ID NO:68 (LAG-3 человека)
MWEAQFLGLLFLQPLWVAPVKPLQPGAEVPVVWAQEGAPAQLPCSPTIPLQDLSLLRRAGVTWQHQPDSGPPAAAPGHPLAPGPHPAAPSSWGPRPRRYTVLSVGPGGLRSGRLPLQPRVQLDERGRQRGDFSLWLRPARRADAGEYRAAVHLRDRALSCRLRLRLGQASMTASPPGSLRASDWVILNCSFSRPDRPASVHWFRNRGQGRVPVRESPHHHLAESFLFLPQVSPMDSGPWGCILTYRDGFNVSIMYNLTVLGLEPPTPLTVYAGAGSRVGLPCRLPAGVGTRSFLTAKWTPPGGGPDLLVTGDNGDFTLRLEDVSQAQAGTYTCHIHLQEQQLNATVTLAIITVTPKSFGSPGSLGKLLCEVTPVSGQERFVWSSLDTPSQRSFSGPWLEAQEAQLLSQPWQCQLYQGERLLGAAVYFTELSSPGAQRSGRAPGALPAGHLLLFLILGVLSLLLLVTGAFGFHLWRRQWRPRRFSALEQGIHPPQAQSKIEELEQEPEPEPEPEPEPEPEPEPEQL
SEQ ID NO:69 (LAG-3 яванского макака)
MWEAQFLGLLFLQPLWVAPVKPPQPGAEISVVWAQEGAPAQLPCSPTIPLQDLSLLRRAGVTWQHQPDSGPPAXAPGHPPVPGHRPAAPYSWGPRPRRYTVLSVGPGGLRSGRLPLQPRVQLDERGRQRGDFSLWLRPARRADAGEYRATVHLRDRALSCRLRLRVGQASMTASPPGSLRTSDWVILNCSFSRPDRPASVHWFRSRGQGRVPVQGSPHHHLAESFLFLPHVGPMDSGLWGCILTYRDGFNVSIMYNLTVLGLEPATPLTVYAGAGSRVELPCRLPPAVGTQSFLTAKWAPPGGGPDLLVAGDNGDFTLRLEDVSQAQAGTYICHIRLQGQQLNATVTLAIITVTPKSFGSPGSLGKLLCEVTPASGQEHFVWSPLNTPSQRSFSGPWLEAQEAQLLSQPWQCQLHQGERLLGAAVYFTELSSPGAQRSGRAPGALRAGHLPLFLILGVLFLLLLVTGAFGFHLWRRQWRPRRFSALEQGIHPPQAQSKIEELEQEPELEPEPELERELGPEPEPGPEPEPEQL
SEQ ID NO:70 (LAG-3 крысы)
MRQDLFLDLLLLQLLWEAPVVSSGPGKELSVVWAQEGAPVHLPCSLEFPHLDPNFLRRGWVTWQHRPDSDQPASIPALDLLQGMPSTRRHPPHRYTVLSVAPGGLRSGRQPLLSHVQLEKRGPQRGDFSLWLRPATRKDAGEYHAFVRLPDRDFSCSLRLRVGQASMIASPPGTLKPSDWVILNCSFSRPDRPVSVHWFQGQSRVPVHNSPRHYLAESFLLLPQVSPLDSGTWGCVLTYRDGFNVSITYNLKVQGLEPVAPLTVYAAEGSRVELPCHLPPVVGTPSLLIAKWTPPGGGPELPVTGKSGNFTLQLENVGRAQAGTYTCSIHLQGRQLSAAVTLAVITVTPKSFGLPGSPQKLLCEVVPASGEGRFVWRPLSDLSRSSLGPVLELQEAKLLAEQWQCQLYEGQKLLGATVYTAESSSGAWSAKRISGDLKGGHLFLSLILGALALFLLVTGAFGFHLWRRQLLRRRFSALEHGIRPPPVQSKIEELEREPETEMEPETEPDPEPQPEPELEPESRQL
SEQ ID NO:71 (LAG-3 собаки)
MWEVQFLVLLLLQLLWVAPVAAPGSGTEVQVVWAQEGAPVQLPCSPTIPLQDVSLLRNAGVTWYHLPESGPAAPALSLRPAAPSARGPGPRSYVVLMRAPGGLRSGLVPTVNALALNSPGPTRFSLALQTVISLPHSWLFPGPSSLPGQPLASCWPSPHVGVGCVCEHPPFIHLTLLPARQSPLLFLLPSLQPQCSASLYLSLSASTLASSFPGLEPSGPLTVYTGAGSRVGLPCRLPPGVGTQSFLTAKWTPPGGGPDLLVAGDDGNFTLQLEVVNQAQAGTYTCHIHLQGQQLSTTVTLAVITVTPKSSGLPGNLRKLLCEVTPASGQERFVWSPLDKQSWRGSPGPCLEMQETRLLSQPWQCHVYQAERLLGTAVYLIDPAGPGAQRSGRAQGVLKTGHLSLLLILGILFLLLLMTGAFGFQLWRRQWRPRRFSALELGTHPPQAQSKIGELEQEPELELEPEPELEPEPEPE
SEQ ID NO:72 (мыши LAG-3)
MREDLLLGFLLLGLLWEAPVVSSGPGKELPVVWAQEGAPVHLPCSLKSPNLDPNFLRRGGVIWQHQPDSGQPTPIPALDLHQGMPSPRQPAPGRYTVLSVAPGGLRSGRQPLHPHVQLEERGLQRGDFSLWLRPALRTDAGEYHATVRLPNRALSCSLRLRVGQASMIASPSGVLKLSDWVLLNCSFSRPDRPVSVHWFQGQNRVPVYNSPRHFLAETFLLLPQVSPLDSGTWGCVLTYRDGFNVSITYNLKVLGLEPVAPLTVYAAEGSRVELPCHLPPGVGTPSLLIAKWTPPGGGPELPVAGKSGNFTLHLEAVGLAQAGTYTCSIHLQGQQLNATVTLAVITVTPKSFGLPGSRGKLLCEVTPASGKERFVWRPLNNLSRSCPGPVLEIQEARLLAERWQCQLYEGQRLLGATVYAAESSSGAHSARRISGDLKGGHLVLVLILGALSLFLLVAGAFGFHWWRKQLLLRRFSALEHGIQPFPAQRKIEELERELETEMGQEPEPEPEPQLEPEPRQL
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> СИМФОГЕН А/С
<120> АНТИ-LAG-3 АНТИТЕЛА И ИХ КОМПОЗИЦИИ
<130> 022675.WO057
<140>
<141>
<150> 62/407,678
<151> 2016-10-13
<160> 74
<170> PatentIn версии 3.5
<210> 1
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 1
caggtgcagc tgcagcagtg gggtgccggt ctgctgaagc cttctgaaac tctgtctctg 60
acttgtgccg tctatggtgg atcattcagc ggctactatt ggtcctggat caggcagccc 120
cctggcaagg gcctggagtg gatcggcgag atcaaccacc ggggctctac caactacaat 180
ccctctctga agagcagggt gaccatctcc gtggacacat ctaagaatca gttcagcctg 240
aagctgagct ccgtgaccgc cgctgataca gccgtgtact attgcacaag gggggaggaa 300
tgggagtcac tgttctttga ttactggggg caggggacac tggtcacagt ctcgagt 357
<210> 2
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 2
gaaatcgtcc tgacccagtc ccccgccacc ctgagcctga gccccggaga aagagccacc 60
ctgtcctgcc gagcaagcca gtccatcagc tcctatctcg cctggtatca gcagaaacca 120
ggccaggctc cccggctgct gatctacggc gcctccaaca gagctacagg aatcccagcc 180
cgcttcagcg gctccggctc tggcacagac tttaccctga caatctctag cctggagcct 240
gaggatttcg ccgtgtacta ttgccagcag agatctaatt ggccactgac attcggcggc 300
ggcacacggg tggagatcaa g 321
<210> 3
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 3
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Arg Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Thr
85 90 95
Arg Gly Glu Glu Trp Glu Ser Leu Phe Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 4
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 4
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Val Glu Ile Lys
100 105
<210> 5
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 5
caggttcagc tgcagcagtg gggcgccggc ctgctgagac caagcgagac cctgtccctg 60
acatgcgccg tgtatggcga gagcttctcc ggctattact ggaactggat ccggcagcct 120
cccggcaagg gcctggagtg gatcggcgag atcaatcact ccggctccac caattacaac 180
ccatccctga agtctcgggt gacaatcagc gtggatacaa gcaagaccca gttcagcctg 240
aagctgagct ccgtgacagc tgccgatacc gccgtgtatt actgcgccag aggctgggac 300
ctgctggatt ggaatgacta ctggaatgag tactggggcc aggggaccct ggtgaccgtc 360
tcgagt 366
<210> 6
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 6
gagatcgtgc tgacccagtc ccctgccacc ctgtctctgt cccctggcga gcgggccacc 60
ctgtcctgta gagcttctca gtccgtgtct tcctacctgg cttggtacca gcagaagcca 120
ggacaggccc caagactgct gatctatgac gcttccaatc gggctaccgg catcccagct 180
cgctttagcg gctccggctc cggcaccgac ttcaccctga caatcagctc cctggagcca 240
gaggattttg ccgtgtatta ctgtcagcag aggtccaatt ggccactgac atttggcggc 300
ggcacaaagg ttgagatcaa g 321
<210> 7
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 7
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Arg Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Glu Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Thr Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Gly Trp Asp Leu Leu Asp Trp Asn Asp Tyr Trp Asn Glu Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 8
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 9
caggttcagc tgcagcagtg gggcgctggc ctgctgaagc cctctgagac cctgtctctg 60
acctgtgccg tgtatggcgg cagcttctcc ggctattact ggaactggat ccgccagccc 120
cccggcaagg gcctggagtg gatcggcgag atcaaccact ccggctctac caactacaat 180
ccttctctga agtccagggt gacaatcagc gtggacacca gcaagaacca gtttagcctg 240
aagctgtcca gcgtgacagc tgccgataca gccgtgtatt actgcgccag aggcgaggat 300
tggggcgaga gcttctttga ttactggggc caggggaccc tggtgaccgt ctcgagt 357
<210> 10
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 10
gagatcgtgc tgacccagtc ccctgccacc ctgtctctgt cccctggcga gcgggccacc 60
ctgagctgtc gggcctccca gtccgtgagc tcctacctgg cttggtatca gcagaagcca 120
ggacaggccc caagactgct gatctacgcc gcttccaatc gggccaccgg catccccgcc 180
agattttccg gctctggctc cggcaccgat ttcaccctga caatcagctc cctggagcca 240
gaggacttcg ccgtgtacta ctgccagcag aggtctaatt ggccactgac atttggcggc 300
ggcaccaagg ttgagatcaa g 321
<210> 11
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 11
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Gly Glu Asp Trp Gly Glu Ser Phe Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 12
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 12
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 13
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 13
caggttcagc tggtgcagtc cggcgctgag gtgaagaagc ctggagcttc tgtgaaggtt 60
tcctgtaagg tttccggcta tagcctgacc gagatctcta tgcactgggt acggcaagcc 120
cccggcaagg gcctggagtg gatgggcggc tttgacccag aggatggcga gaccatctac 180
gctcagaggt ttcaggggcg cgtgatcatg accgaggata ccagcaccga taccgcctac 240
atggagctgt ccagcctgag atccgaggat accgccgtgt attactgcgc tactggtggc 300
tggggcccca attggttcga tccttggggc caggggaccc tggtgaccgt ctcgagt 357
<210> 14
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 14
gacatccaga tgacacagtc tccttcctct gtgagcgcct ctgtgggcga ccgcgtgacc 60
atcacatgcc gcgcttccca ggggatctct tcctggctgg cttggtacca gcagaagccc 120
ggcaaggccc ccaagctgct gatctatgct gccagcagcc tgcagtccgg cgtgccttcc 180
aggtttagcg gctccggctc cggcaccgac tttacactga caatcagctc cctgcagccc 240
gaggattttg ccacctatta ctgtcagcag gcgaattcct tcccttttac attcggccct 300
ggcaccaagg ttgatatcaa g 321
<210> 15
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 15
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly Tyr Ser Leu Thr Glu Ile
20 25 30
Ser Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Gly Phe Asp Pro Glu Asp Gly Glu Thr Ile Tyr Ala Gln Arg Phe
50 55 60
Gln Gly Arg Val Ile Met Thr Glu Asp Thr Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Gly Gly Trp Gly Pro Asn Trp Phe Asp Pro Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 16
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 17
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 17
caggttcagc tgcagcagtc cggccccggc ctggtgaagc caagccagac cctgtctctg 60
acatgcgcca tctccggcga cagcgtgtcc tctaactccg ccgcttggaa ttggatccgg 120
cagtctccat ccagaggcct ggagtggctg ggcagaacct attaccggtc caagtggtac 180
aacgattatg ccgtgtccgt gaagagcaga atcaccatca accctgatac cagcaagaac 240
cagttcagcc tgcagctgaa ttccgtgacc ccagaggata cagccgtgta ttactgtgct 300
agggacgatg attggaatga cttcgattac tggggccagg ggaccctggt gacagtctcg 360
agt 363
<210> 18
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 18
gagatcgtgc tgacccagtc cccagctaca ctgtccctgt ctcccggcga gcgggccacc 60
ctgagctgta gagcttccca gtccgtgtct tcctatctgg cttggtatca gcagaagcca 120
ggacaggccc caaggctgct gatctacgac gcctccaata gagccaccgg catcccagct 180
agattttctg gctccggctc cggcaccgat ttcacactga ccatctctag cctggagcca 240
gaggattttg ctgtatatta ctgccagcag cgcagcaact ggcccctgac atttggcggc 300
ggcaccaagg ttgagatcaa g 321
<210> 19
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 19
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Asp Asp Trp Asn Asp Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 20
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 21
cagctgcagc tgcaggaaag cggccccggc ctggtgaagc cctctgagac cctgtccctg 60
acatgcaccg tgagcggcga ttccatcagc tcttccagct attactgggg ctggatccgg 120
cagccccccg gcaagggcct ggagtggatc ggcagcatct tctactccgg caatacatat 180
tataatcctt ctctgaagag cagggtgaca atcagcgtgg atacctccaa gaatcagttt 240
agcctgaagc tgagctccgt gacagctgcc gatacagccg tgtattactg cgctagggag 300
gacgattttc tgaccgatta ttacggcgct ttcgacatct ggggccaggg gacaatggtg 360
acagtctcga gt 372
<210> 22
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 22
gatatccaga tgacccagtc tccaagcacc ctgagcgcct ctgtgggcga tcgggtgacc 60
atcacatgtc gggcttctca gtccatcagc agctggctgg cttggtatca gcagaagccc 120
ggcaaggccc caaagctgct gatctacaag gcctcttcca gcgagagcgg cgtgccatcc 180
aggtttagcg gctccggctc cggcaccgag tttaccctga ccatctcttc cctgcagccc 240
gatgactttg ccacctacta ctgtcagcag tacaattcct atctgacatt cggcggcggc 300
accaaggttg agatcaag 318
<210> 23
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 23
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Asp Ser Ile Ser Ser Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Phe Tyr Ser Gly Asn Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Asp Asp Phe Leu Thr Asp Tyr Tyr Gly Ala Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 24
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Ser Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 25
<211> 375
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 25
gaggtgcagc tgctggaatc cggaggagga ctggtccagc caggtggatc cctgcgactg 60
agctgcgccg cttctggctt cgactttaga agctacgcaa tgatgtgggt ccgccaggca 120
ccaggaaagg gactggagtg ggtgggaggg atcaacggtg aagtcggtgg ctctaataca 180
tactatgcac ctgccgtcaa gggaagggct actattagtc gggacaactc aaaaaatacc 240
ctgtatctgc aaatgaacag tctgagggcc gaggataccg ccgtgtacta ttgcgtgaaa 300
ggtgctggcg catgcggcat ctgtaatgac gatattgatg catggggaca ggggaccctg 360
gtgacagtct cgagt 375
<210> 26
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 26
agttatgagc tgactcagga cccagcagtg tcagtcgccc tgggccagac agtgagaatc 60
acttgcagtg gggctggttc atatgcaggc tcctactatt acggatggca ccagcagaag 120
cccggacagg cacctgtgac agtcatctac gacaacgata aaaggccaag caatattccc 180
gaccggttct ctgggtccag ctctggtaac accgcctccc tgaccattac tggggcccag 240
gctgaggacg aagctgatta ttactgtggc tctacaaacg ataatgacga tggcggactg 300
tttggctccg gaactaaggt caccgtccta 330
<210> 27
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 27
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asp Phe Arg Ser Tyr
20 25 30
Ala Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Gly Ile Asn Gly Glu Val Gly Gly Ser Asn Thr Tyr Tyr Ala Pro
50 55 60
Ala Val Lys Gly Arg Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Lys Gly Ala Gly Ala Cys Gly Ile Cys Asn Asp Asp Ile
100 105 110
Asp Ala Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 28
<211> 110
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 28
Ser Tyr Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Ser Gly Ala Gly Ser Tyr Ala Gly Ser Tyr
20 25 30
Tyr Tyr Gly Trp His Gln Gln Lys Pro Gly Gln Ala Pro Val Thr Val
35 40 45
Ile Tyr Asp Asn Asp Lys Arg Pro Ser Asn Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gly Ser Thr Asn Asp Asn Asp
85 90 95
Asp Gly Gly Leu Phe Gly Ser Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 29
<211> 990
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 29
gcctccacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 60
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 240
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagag agttgagccc 300
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaagc cgccggggga 360
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 420
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 480
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 540
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 600
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 660
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggaggag 720
atgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 780
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 840
ctggactccg acggctcctt cttcctctat agcaagctca ccgtggacaa gagcaggtgg 900
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 960
cagaagagcc tctccctgtc cccgggtaaa 990
<210> 30
<211> 330
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 30
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 31
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 31
ggccagccca aggccaaccc cactgtcact ctgttcccgc cctcctctga ggagctccaa 60
gccaacaagg ccacactagt gtgtctgatc agtgacttct acccgggagc tgtgacagtg 120
gcctggaagg cagatggcag ccccgtcaag gcgggagtgg agaccaccaa accctccaaa 180
cagagcaaca acaagtacgc ggccagcagc tacctgagcc tgacgcccga gcagtggaag 240
tcccacagaa gctacagctg ccaggtcacg catgaaggga gcaccgtgga gaagacagtg 300
gcccctacag aatgttca 318
<210> 32
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 32
Gly Gln Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 33
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полинуклеотид»
<400> 33
cgtacggtgg ctgcaccatc tgtcttcatc ttcccgccat ctgatgagca gttgaaatct 60
ggaactgcct ctgttgtgtg cctgctgaat aacttctatc ccagagaggc caaagtacag 120
tggaaggtgg ataacgccct ccaatcgggt aactcccagg agagtgtcac agagcaggac 180
agcaaggaca gcacctacag cctcagcagc accctgacgc tgagcaaagc agactacgag 240
aaacacaaag tctacgcctg cgaagtcacc catcagggcc tgagctcgcc cgtcacaaag 300
agcttcaaca ggggagagtg t 321
<210> 34
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
полипептид»
<400> 34
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 35
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 35
Gly Gly Ser Phe Ser Gly Tyr Tyr
1 5
<210> 36
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 36
Ile Asn His Arg Gly Ser Thr
1 5
<210> 37
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 37
Cys Thr Arg Gly Glu Glu Trp Glu Ser Leu Phe Phe Asp Tyr Trp
1 5 10 15
<210> 38
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 38
Gln Ser Ile Ser Ser Tyr
1 5
<210> 39
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 39
Gly Ala Ser
1
<210> 40
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 40
Cys Gln Gln Arg Ser Asn Trp Pro Leu Thr Phe
1 5 10
<210> 41
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 41
Gly Glu Ser Phe Ser Gly Tyr Tyr
1 5
<210> 42
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 42
Ile Asn His Ser Gly Ser Thr
1 5
<210> 43
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 43
Cys Ala Arg Gly Trp Asp Leu Leu Asp Trp Asn Asp Tyr Trp Asn Glu
1 5 10 15
Tyr Trp
<210> 44
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 44
Gln Ser Val Ser Ser Tyr
1 5
<210> 45
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 45
Asp Ala Ser
1
<210> 46
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 46
Cys Ala Arg Gly Glu Asp Trp Gly Glu Ser Phe Phe Asp Tyr Trp
1 5 10 15
<210> 47
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 47
Ala Ala Ser
1
<210> 48
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 48
Gly Tyr Ser Leu Thr Glu Ile Ser
1 5
<210> 49
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 49
Phe Asp Pro Glu Asp Gly Glu Thr
1 5
<210> 50
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 50
Cys Ala Thr Gly Gly Trp Gly Pro Asn Trp Phe Asp Pro Trp
1 5 10
<210> 51
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 51
Gln Gly Ile Ser Ser Trp
1 5
<210> 52
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 52
Cys Gln Gln Ala Asn Ser Phe Pro Phe Thr Phe
1 5 10
<210> 53
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 53
Gly Asp Ser Val Ser Ser Asn Ser Ala
1 5
<210> 54
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 54
Thr Tyr Tyr Arg Ser Lys Trp
1 5
<210> 55
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 55
Cys Ala Arg Asp Asp Asp Trp Asn Asp Phe Asp Tyr Trp
1 5 10
<210> 56
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 56
Gly Asp Ser Ile Ser Ser Ser Ser Tyr Tyr
1 5 10
<210> 57
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 57
Ile Phe Tyr Ser Gly Asn Thr
1 5
<210> 58
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 58
Cys Ala Arg Glu Asp Asp Phe Leu Thr Asp Tyr Tyr Gly Ala Phe Asp
1 5 10 15
Ile Trp
<210> 59
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 59
Gln Ser Ile Ser Ser Trp
1 5
<210> 60
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 60
Lys Ala Ser
1
<210> 61
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 61
Cys Gln Gln Tyr Asn Ser Tyr Leu Thr Phe
1 5 10
<210> 62
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 62
Gly Phe Asp Phe Arg Ser Tyr Ala
1 5
<210> 63
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 63
Ile Asn Gly Glu Val Gly Gly Ser Asn Thr
1 5 10
<210> 64
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 64
Cys Val Lys Gly Ala Gly Ala Cys Gly Ile Cys Asn Asp Asp Ile Asp
1 5 10 15
Ala Trp
<210> 65
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 65
Gly Ser Tyr Ala Gly Ser Tyr
1 5
<210> 66
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 66
Asp Asn Asp
1
<210> 67
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 67
Cys Gly Ser Thr Asn Asp Asn Asp Asp Gly Gly Leu Phe
1 5 10
<210> 68
<211> 525
<212> Белок
<213> Homo sapiens
<400> 68
Met Trp Glu Ala Gln Phe Leu Gly Leu Leu Phe Leu Gln Pro Leu Trp
1 5 10 15
Val Ala Pro Val Lys Pro Leu Gln Pro Gly Ala Glu Val Pro Val Val
20 25 30
Trp Ala Gln Glu Gly Ala Pro Ala Gln Leu Pro Cys Ser Pro Thr Ile
35 40 45
Pro Leu Gln Asp Leu Ser Leu Leu Arg Arg Ala Gly Val Thr Trp Gln
50 55 60
His Gln Pro Asp Ser Gly Pro Pro Ala Ala Ala Pro Gly His Pro Leu
65 70 75 80
Ala Pro Gly Pro His Pro Ala Ala Pro Ser Ser Trp Gly Pro Arg Pro
85 90 95
Arg Arg Tyr Thr Val Leu Ser Val Gly Pro Gly Gly Leu Arg Ser Gly
100 105 110
Arg Leu Pro Leu Gln Pro Arg Val Gln Leu Asp Glu Arg Gly Arg Gln
115 120 125
Arg Gly Asp Phe Ser Leu Trp Leu Arg Pro Ala Arg Arg Ala Asp Ala
130 135 140
Gly Glu Tyr Arg Ala Ala Val His Leu Arg Asp Arg Ala Leu Ser Cys
145 150 155 160
Arg Leu Arg Leu Arg Leu Gly Gln Ala Ser Met Thr Ala Ser Pro Pro
165 170 175
Gly Ser Leu Arg Ala Ser Asp Trp Val Ile Leu Asn Cys Ser Phe Ser
180 185 190
Arg Pro Asp Arg Pro Ala Ser Val His Trp Phe Arg Asn Arg Gly Gln
195 200 205
Gly Arg Val Pro Val Arg Glu Ser Pro His His His Leu Ala Glu Ser
210 215 220
Phe Leu Phe Leu Pro Gln Val Ser Pro Met Asp Ser Gly Pro Trp Gly
225 230 235 240
Cys Ile Leu Thr Tyr Arg Asp Gly Phe Asn Val Ser Ile Met Tyr Asn
245 250 255
Leu Thr Val Leu Gly Leu Glu Pro Pro Thr Pro Leu Thr Val Tyr Ala
260 265 270
Gly Ala Gly Ser Arg Val Gly Leu Pro Cys Arg Leu Pro Ala Gly Val
275 280 285
Gly Thr Arg Ser Phe Leu Thr Ala Lys Trp Thr Pro Pro Gly Gly Gly
290 295 300
Pro Asp Leu Leu Val Thr Gly Asp Asn Gly Asp Phe Thr Leu Arg Leu
305 310 315 320
Glu Asp Val Ser Gln Ala Gln Ala Gly Thr Tyr Thr Cys His Ile His
325 330 335
Leu Gln Glu Gln Gln Leu Asn Ala Thr Val Thr Leu Ala Ile Ile Thr
340 345 350
Val Thr Pro Lys Ser Phe Gly Ser Pro Gly Ser Leu Gly Lys Leu Leu
355 360 365
Cys Glu Val Thr Pro Val Ser Gly Gln Glu Arg Phe Val Trp Ser Ser
370 375 380
Leu Asp Thr Pro Ser Gln Arg Ser Phe Ser Gly Pro Trp Leu Glu Ala
385 390 395 400
Gln Glu Ala Gln Leu Leu Ser Gln Pro Trp Gln Cys Gln Leu Tyr Gln
405 410 415
Gly Glu Arg Leu Leu Gly Ala Ala Val Tyr Phe Thr Glu Leu Ser Ser
420 425 430
Pro Gly Ala Gln Arg Ser Gly Arg Ala Pro Gly Ala Leu Pro Ala Gly
435 440 445
His Leu Leu Leu Phe Leu Ile Leu Gly Val Leu Ser Leu Leu Leu Leu
450 455 460
Val Thr Gly Ala Phe Gly Phe His Leu Trp Arg Arg Gln Trp Arg Pro
465 470 475 480
Arg Arg Phe Ser Ala Leu Glu Gln Gly Ile His Pro Pro Gln Ala Gln
485 490 495
Ser Lys Ile Glu Glu Leu Glu Gln Glu Pro Glu Pro Glu Pro Glu Pro
500 505 510
Glu Pro Glu Pro Glu Pro Glu Pro Glu Pro Glu Gln Leu
515 520 525
<210> 69
<211> 533
<212> Белок
<213> Macaca fascicularis
<220>
<221> модифицированный остаток
<222> (74)..(74)
<223> Любая аминокислота
<400> 69
Met Trp Glu Ala Gln Phe Leu Gly Leu Leu Phe Leu Gln Pro Leu Trp
1 5 10 15
Val Ala Pro Val Lys Pro Pro Gln Pro Gly Ala Glu Ile Ser Val Val
20 25 30
Trp Ala Gln Glu Gly Ala Pro Ala Gln Leu Pro Cys Ser Pro Thr Ile
35 40 45
Pro Leu Gln Asp Leu Ser Leu Leu Arg Arg Ala Gly Val Thr Trp Gln
50 55 60
His Gln Pro Asp Ser Gly Pro Pro Ala Xaa Ala Pro Gly His Pro Pro
65 70 75 80
Val Pro Gly His Arg Pro Ala Ala Pro Tyr Ser Trp Gly Pro Arg Pro
85 90 95
Arg Arg Tyr Thr Val Leu Ser Val Gly Pro Gly Gly Leu Arg Ser Gly
100 105 110
Arg Leu Pro Leu Gln Pro Arg Val Gln Leu Asp Glu Arg Gly Arg Gln
115 120 125
Arg Gly Asp Phe Ser Leu Trp Leu Arg Pro Ala Arg Arg Ala Asp Ala
130 135 140
Gly Glu Tyr Arg Ala Thr Val His Leu Arg Asp Arg Ala Leu Ser Cys
145 150 155 160
Arg Leu Arg Leu Arg Val Gly Gln Ala Ser Met Thr Ala Ser Pro Pro
165 170 175
Gly Ser Leu Arg Thr Ser Asp Trp Val Ile Leu Asn Cys Ser Phe Ser
180 185 190
Arg Pro Asp Arg Pro Ala Ser Val His Trp Phe Arg Ser Arg Gly Gln
195 200 205
Gly Arg Val Pro Val Gln Gly Ser Pro His His His Leu Ala Glu Ser
210 215 220
Phe Leu Phe Leu Pro His Val Gly Pro Met Asp Ser Gly Leu Trp Gly
225 230 235 240
Cys Ile Leu Thr Tyr Arg Asp Gly Phe Asn Val Ser Ile Met Tyr Asn
245 250 255
Leu Thr Val Leu Gly Leu Glu Pro Ala Thr Pro Leu Thr Val Tyr Ala
260 265 270
Gly Ala Gly Ser Arg Val Glu Leu Pro Cys Arg Leu Pro Pro Ala Val
275 280 285
Gly Thr Gln Ser Phe Leu Thr Ala Lys Trp Ala Pro Pro Gly Gly Gly
290 295 300
Pro Asp Leu Leu Val Ala Gly Asp Asn Gly Asp Phe Thr Leu Arg Leu
305 310 315 320
Glu Asp Val Ser Gln Ala Gln Ala Gly Thr Tyr Ile Cys His Ile Arg
325 330 335
Leu Gln Gly Gln Gln Leu Asn Ala Thr Val Thr Leu Ala Ile Ile Thr
340 345 350
Val Thr Pro Lys Ser Phe Gly Ser Pro Gly Ser Leu Gly Lys Leu Leu
355 360 365
Cys Glu Val Thr Pro Ala Ser Gly Gln Glu His Phe Val Trp Ser Pro
370 375 380
Leu Asn Thr Pro Ser Gln Arg Ser Phe Ser Gly Pro Trp Leu Glu Ala
385 390 395 400
Gln Glu Ala Gln Leu Leu Ser Gln Pro Trp Gln Cys Gln Leu His Gln
405 410 415
Gly Glu Arg Leu Leu Gly Ala Ala Val Tyr Phe Thr Glu Leu Ser Ser
420 425 430
Pro Gly Ala Gln Arg Ser Gly Arg Ala Pro Gly Ala Leu Arg Ala Gly
435 440 445
His Leu Pro Leu Phe Leu Ile Leu Gly Val Leu Phe Leu Leu Leu Leu
450 455 460
Val Thr Gly Ala Phe Gly Phe His Leu Trp Arg Arg Gln Trp Arg Pro
465 470 475 480
Arg Arg Phe Ser Ala Leu Glu Gln Gly Ile His Pro Pro Gln Ala Gln
485 490 495
Ser Lys Ile Glu Glu Leu Glu Gln Glu Pro Glu Leu Glu Pro Glu Pro
500 505 510
Glu Leu Glu Arg Glu Leu Gly Pro Glu Pro Glu Pro Gly Pro Glu Pro
515 520 525
Glu Pro Glu Gln Leu
530
<210> 70
<211> 525
<212> Белок
<213> Rattus norvegicus
<400> 70
Met Arg Gln Asp Leu Phe Leu Asp Leu Leu Leu Leu Gln Leu Leu Trp
1 5 10 15
Glu Ala Pro Val Val Ser Ser Gly Pro Gly Lys Glu Leu Ser Val Val
20 25 30
Trp Ala Gln Glu Gly Ala Pro Val His Leu Pro Cys Ser Leu Glu Phe
35 40 45
Pro His Leu Asp Pro Asn Phe Leu Arg Arg Gly Trp Val Thr Trp Gln
50 55 60
His Arg Pro Asp Ser Asp Gln Pro Ala Ser Ile Pro Ala Leu Asp Leu
65 70 75 80
Leu Gln Gly Met Pro Ser Thr Arg Arg His Pro Pro His Arg Tyr Thr
85 90 95
Val Leu Ser Val Ala Pro Gly Gly Leu Arg Ser Gly Arg Gln Pro Leu
100 105 110
Leu Ser His Val Gln Leu Glu Lys Arg Gly Pro Gln Arg Gly Asp Phe
115 120 125
Ser Leu Trp Leu Arg Pro Ala Thr Arg Lys Asp Ala Gly Glu Tyr His
130 135 140
Ala Phe Val Arg Leu Pro Asp Arg Asp Phe Ser Cys Ser Leu Arg Leu
145 150 155 160
Arg Val Gly Gln Ala Ser Met Ile Ala Ser Pro Pro Gly Thr Leu Lys
165 170 175
Pro Ser Asp Trp Val Ile Leu Asn Cys Ser Phe Ser Arg Pro Asp Arg
180 185 190
Pro Val Ser Val His Trp Phe Gln Gly Gln Ser Arg Val Pro Val His
195 200 205
Asn Ser Pro Arg His Tyr Leu Ala Glu Ser Phe Leu Leu Leu Pro Gln
210 215 220
Val Ser Pro Leu Asp Ser Gly Thr Trp Gly Cys Val Leu Thr Tyr Arg
225 230 235 240
Asp Gly Phe Asn Val Ser Ile Thr Tyr Asn Leu Lys Val Gln Gly Leu
245 250 255
Glu Pro Val Ala Pro Leu Thr Val Tyr Ala Ala Glu Gly Ser Arg Val
260 265 270
Glu Leu Pro Cys His Leu Pro Pro Val Val Gly Thr Pro Ser Leu Leu
275 280 285
Ile Ala Lys Trp Thr Pro Pro Gly Gly Gly Pro Glu Leu Pro Val Thr
290 295 300
Gly Lys Ser Gly Asn Phe Thr Leu Gln Leu Glu Asn Val Gly Arg Ala
305 310 315 320
Gln Ala Gly Thr Tyr Thr Cys Ser Ile His Leu Gln Gly Arg Gln Leu
325 330 335
Ser Ala Ala Val Thr Leu Ala Val Ile Thr Val Thr Pro Lys Ser Phe
340 345 350
Gly Leu Pro Gly Ser Pro Gln Lys Leu Leu Cys Glu Val Val Pro Ala
355 360 365
Ser Gly Glu Gly Arg Phe Val Trp Arg Pro Leu Ser Asp Leu Ser Arg
370 375 380
Ser Ser Leu Gly Pro Val Leu Glu Leu Gln Glu Ala Lys Leu Leu Ala
385 390 395 400
Glu Gln Trp Gln Cys Gln Leu Tyr Glu Gly Gln Lys Leu Leu Gly Ala
405 410 415
Thr Val Tyr Thr Ala Glu Ser Ser Ser Gly Ala Trp Ser Ala Lys Arg
420 425 430
Ile Ser Gly Asp Leu Lys Gly Gly His Leu Phe Leu Ser Leu Ile Leu
435 440 445
Gly Ala Leu Ala Leu Phe Leu Leu Val Thr Gly Ala Phe Gly Phe His
450 455 460
Leu Trp Arg Arg Gln Leu Leu Arg Arg Arg Phe Ser Ala Leu Glu His
465 470 475 480
Gly Ile Arg Pro Pro Pro Val Gln Ser Lys Ile Glu Glu Leu Glu Arg
485 490 495
Glu Pro Glu Thr Glu Met Glu Pro Glu Thr Glu Pro Asp Pro Glu Pro
500 505 510
Gln Pro Glu Pro Glu Leu Glu Pro Glu Ser Arg Gln Leu
515 520 525
<210> 71
<211> 476
<212> Белок
<213> Canis familiaris
<400> 71
Met Trp Glu Val Gln Phe Leu Val Leu Leu Leu Leu Gln Leu Leu Trp
1 5 10 15
Val Ala Pro Val Ala Ala Pro Gly Ser Gly Thr Glu Val Gln Val Val
20 25 30
Trp Ala Gln Glu Gly Ala Pro Val Gln Leu Pro Cys Ser Pro Thr Ile
35 40 45
Pro Leu Gln Asp Val Ser Leu Leu Arg Asn Ala Gly Val Thr Trp Tyr
50 55 60
His Leu Pro Glu Ser Gly Pro Ala Ala Pro Ala Leu Ser Leu Arg Pro
65 70 75 80
Ala Ala Pro Ser Ala Arg Gly Pro Gly Pro Arg Ser Tyr Val Val Leu
85 90 95
Met Arg Ala Pro Gly Gly Leu Arg Ser Gly Leu Val Pro Thr Val Asn
100 105 110
Ala Leu Ala Leu Asn Ser Pro Gly Pro Thr Arg Phe Ser Leu Ala Leu
115 120 125
Gln Thr Val Ile Ser Leu Pro His Ser Trp Leu Phe Pro Gly Pro Ser
130 135 140
Ser Leu Pro Gly Gln Pro Leu Ala Ser Cys Trp Pro Ser Pro His Val
145 150 155 160
Gly Val Gly Cys Val Cys Glu His Pro Pro Phe Ile His Leu Thr Leu
165 170 175
Leu Pro Ala Arg Gln Ser Pro Leu Leu Phe Leu Leu Pro Ser Leu Gln
180 185 190
Pro Gln Cys Ser Ala Ser Leu Tyr Leu Ser Leu Ser Ala Ser Thr Leu
195 200 205
Ala Ser Ser Phe Pro Gly Leu Glu Pro Ser Gly Pro Leu Thr Val Tyr
210 215 220
Thr Gly Ala Gly Ser Arg Val Gly Leu Pro Cys Arg Leu Pro Pro Gly
225 230 235 240
Val Gly Thr Gln Ser Phe Leu Thr Ala Lys Trp Thr Pro Pro Gly Gly
245 250 255
Gly Pro Asp Leu Leu Val Ala Gly Asp Asp Gly Asn Phe Thr Leu Gln
260 265 270
Leu Glu Val Val Asn Gln Ala Gln Ala Gly Thr Tyr Thr Cys His Ile
275 280 285
His Leu Gln Gly Gln Gln Leu Ser Thr Thr Val Thr Leu Ala Val Ile
290 295 300
Thr Val Thr Pro Lys Ser Ser Gly Leu Pro Gly Asn Leu Arg Lys Leu
305 310 315 320
Leu Cys Glu Val Thr Pro Ala Ser Gly Gln Glu Arg Phe Val Trp Ser
325 330 335
Pro Leu Asp Lys Gln Ser Trp Arg Gly Ser Pro Gly Pro Cys Leu Glu
340 345 350
Met Gln Glu Thr Arg Leu Leu Ser Gln Pro Trp Gln Cys His Val Tyr
355 360 365
Gln Ala Glu Arg Leu Leu Gly Thr Ala Val Tyr Leu Ile Asp Pro Ala
370 375 380
Gly Pro Gly Ala Gln Arg Ser Gly Arg Ala Gln Gly Val Leu Lys Thr
385 390 395 400
Gly His Leu Ser Leu Leu Leu Ile Leu Gly Ile Leu Phe Leu Leu Leu
405 410 415
Leu Met Thr Gly Ala Phe Gly Phe Gln Leu Trp Arg Arg Gln Trp Arg
420 425 430
Pro Arg Arg Phe Ser Ala Leu Glu Leu Gly Thr His Pro Pro Gln Ala
435 440 445
Gln Ser Lys Ile Gly Glu Leu Glu Gln Glu Pro Glu Leu Glu Leu Glu
450 455 460
Pro Glu Pro Glu Leu Glu Pro Glu Pro Glu Pro Glu
465 470 475
<210> 72
<211> 521
<212> Белок
<213> Mus musculus
<400> 72
Met Arg Glu Asp Leu Leu Leu Gly Phe Leu Leu Leu Gly Leu Leu Trp
1 5 10 15
Glu Ala Pro Val Val Ser Ser Gly Pro Gly Lys Glu Leu Pro Val Val
20 25 30
Trp Ala Gln Glu Gly Ala Pro Val His Leu Pro Cys Ser Leu Lys Ser
35 40 45
Pro Asn Leu Asp Pro Asn Phe Leu Arg Arg Gly Gly Val Ile Trp Gln
50 55 60
His Gln Pro Asp Ser Gly Gln Pro Thr Pro Ile Pro Ala Leu Asp Leu
65 70 75 80
His Gln Gly Met Pro Ser Pro Arg Gln Pro Ala Pro Gly Arg Tyr Thr
85 90 95
Val Leu Ser Val Ala Pro Gly Gly Leu Arg Ser Gly Arg Gln Pro Leu
100 105 110
His Pro His Val Gln Leu Glu Glu Arg Gly Leu Gln Arg Gly Asp Phe
115 120 125
Ser Leu Trp Leu Arg Pro Ala Leu Arg Thr Asp Ala Gly Glu Tyr His
130 135 140
Ala Thr Val Arg Leu Pro Asn Arg Ala Leu Ser Cys Ser Leu Arg Leu
145 150 155 160
Arg Val Gly Gln Ala Ser Met Ile Ala Ser Pro Ser Gly Val Leu Lys
165 170 175
Leu Ser Asp Trp Val Leu Leu Asn Cys Ser Phe Ser Arg Pro Asp Arg
180 185 190
Pro Val Ser Val His Trp Phe Gln Gly Gln Asn Arg Val Pro Val Tyr
195 200 205
Asn Ser Pro Arg His Phe Leu Ala Glu Thr Phe Leu Leu Leu Pro Gln
210 215 220
Val Ser Pro Leu Asp Ser Gly Thr Trp Gly Cys Val Leu Thr Tyr Arg
225 230 235 240
Asp Gly Phe Asn Val Ser Ile Thr Tyr Asn Leu Lys Val Leu Gly Leu
245 250 255
Glu Pro Val Ala Pro Leu Thr Val Tyr Ala Ala Glu Gly Ser Arg Val
260 265 270
Glu Leu Pro Cys His Leu Pro Pro Gly Val Gly Thr Pro Ser Leu Leu
275 280 285
Ile Ala Lys Trp Thr Pro Pro Gly Gly Gly Pro Glu Leu Pro Val Ala
290 295 300
Gly Lys Ser Gly Asn Phe Thr Leu His Leu Glu Ala Val Gly Leu Ala
305 310 315 320
Gln Ala Gly Thr Tyr Thr Cys Ser Ile His Leu Gln Gly Gln Gln Leu
325 330 335
Asn Ala Thr Val Thr Leu Ala Val Ile Thr Val Thr Pro Lys Ser Phe
340 345 350
Gly Leu Pro Gly Ser Arg Gly Lys Leu Leu Cys Glu Val Thr Pro Ala
355 360 365
Ser Gly Lys Glu Arg Phe Val Trp Arg Pro Leu Asn Asn Leu Ser Arg
370 375 380
Ser Cys Pro Gly Pro Val Leu Glu Ile Gln Glu Ala Arg Leu Leu Ala
385 390 395 400
Glu Arg Trp Gln Cys Gln Leu Tyr Glu Gly Gln Arg Leu Leu Gly Ala
405 410 415
Thr Val Tyr Ala Ala Glu Ser Ser Ser Gly Ala His Ser Ala Arg Arg
420 425 430
Ile Ser Gly Asp Leu Lys Gly Gly His Leu Val Leu Val Leu Ile Leu
435 440 445
Gly Ala Leu Ser Leu Phe Leu Leu Val Ala Gly Ala Phe Gly Phe His
450 455 460
Trp Trp Arg Lys Gln Leu Leu Leu Arg Arg Phe Ser Ala Leu Glu His
465 470 475 480
Gly Ile Gln Pro Phe Pro Ala Gln Arg Lys Ile Glu Glu Leu Glu Arg
485 490 495
Glu Leu Glu Thr Glu Met Gly Gln Glu Pro Glu Pro Glu Pro Glu Pro
500 505 510
Gln Leu Glu Pro Glu Pro Arg Gln Leu
515 520
<210> 73
<211> 6
<212> Белок
<213> Неизвестно
<220>
<221> источник
<223> /примечание=«описание неизвестного: мотив LAG-3»
<400> 73
Lys Ile Glu Glu Leu Glu
1 5
<210> 74
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«описание искусственной последовательности: синтетический
пептид»
<400> 74
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<---
Claims (62)
1. Анти-LAG-3 антитело или его антигенсвязывающая часть, которое специфически связывается с LAG-3,
где указанное антитело содержит аминокислотные последовательности H-CDR1-3 и L-CDR1-3:
a) SEQ ID NO:41, 42, 43, 44, 45 и 40 соответственно;
b) SEQ ID NO:35, 36, 37, 38, 39 и 40 соответственно;
c) SEQ ID NO:35, 42, 46, 44, 47 и 40 соответственно;
d) SEQ ID NO:48, 49, 50, 51, 47 и 52 соответственно;
e) SEQ ID NO:53, 54, 55, 44, 45 и 40 соответственно;
f) SEQ ID NO:56, 57, 58, 59, 60 и 61 соответственно; или
g) SEQ ID NO:62, 63, 64, 65, 66 и 67 соответственно.
2. Анти-LAG-3 антитело или его антигенсвязывающая часть по п.1, где указанное антитело содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи с аминокислотными последовательностями:
a) SEQ ID NO:7 и 8 соответственно;
b) SEQ ID NO:3 и 4 соответственно;
c) SEQ ID NO:11 и 12 соответственно;
d) SEQ ID NO:15 и 16 соответственно;
e) SEQ ID NO:19 и 20 соответственно;
f) SEQ ID NO:23 и 24 соответственно; или
g) SEQ ID NO:27 и 28 соответственно.
3. Анти-LAG-3 антитело или его антигенсвязывающая часть по п.1 или 2, где антитело или его антигенсвязывающая часть имеет по меньшей мере одно свойство, выбранное из:
a) снижает связывание с LAG-3 человека с MHC класса II человека на клетках A375 более чем на 85%, как определено конкурентным анализом на основе проточной цитометрии;
b) снижает связывание LAG-3 человека с MHC класса II человека на клетках A375 до 35-85%, как определено конкурентным анализом на основе проточной цитометрии;
c) блокирует связывание между LAG-3 человека, экспрессируемым на клетках Jurkat, и MHC класса II человека, экспрессируемым на клетках Raji;
d) связывается с LAG-3 человека с EC50, равной 0,1 нМ или меньше, как измерено проточной цитометрией;
e) связывается с LAG-3 яванского макака с EC50, равной 0,3 нМ или меньше, как измерено проточной цитометрией;
f) связывается с LAG-3 человека с KD, равной 3,0х10-8 М или меньше, как измерено поверхностным плазмонным резонансом;
g) связывается с LAG-3 яванского макака с KD, равной 1,5х10-7 М или меньше, как измерено поверхностным плазмонным резонансом;
h) связывается с LAG-3 мыши с KD, равной 3,5х10-8 М или меньше, как измерено поверхностным плазмонным резонансом;
i) стимулирует продукцию IL-2 в мононуклеарных клетках периферической крови человека (PBMC), обработанных стафилококковым энтеротоксином B (SEB);
j) снижает клеточные уровни LAG-3 в T-клетках человека;
k) снижает растворимые уровни LAG-3 в культуре T-клеток человека;
l) индуцирует регрессию опухолевого роста in vivo;
m) задерживает опухолевый рост in vivo; и
n) не связывается с тем же эпитопом LAG-3 человека, что и антитело 25F7-Lag3.5.
4. Анти-LAG-3 антитело или антигенсвязывающая часть по любому из пп.1-3, которое связывается с эпитопом LAG-3 человека, имеющим:
a) аминокислотные остатки H85, P86, A87, P89, S91, W92 и G93 SEQ ID NO:68;
b) аминокислотные остатки A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67, D68, G93, P94, P96, R98, Y99, T100, V101, P106, G107, R119, E124, R129, G130, D131, S133, R137, P138, D143, R148 и R163 SEQ ID NO: 68;
c) аминокислотные остатки A40, Q41, P43, P46, P49, D52, T62, Q64, H65, Q66, P67, D68, P96, Y99, T100, V101, P106, G107, R119, E124, R129, G130, D131, S133, R137, P138, D143, R148 и R163 SEQ ID NO: 68;
d) аминокислотные остатки G107, L109, R110 и S111 SEQ ID NO:68;
e) аминокислотные остатки 98-105 SEQ ID NO:68;
f) аминокислотные остатки 78-105 и 123-131 SEQ ID NO:68;
g) аминокислотные остатки 23-30, 40-66, 88-105, 123-137 и 148-152 SEQ ID NO:68; или
h) аминокислотные остатки 23-30, 40-66, 98-105, 118-137 и 148-161 SEQ ID NO:68.
5. Анти-LAG-3 антитело или его антигенсвязывающая часть по любому из пп.1-4, где:
а) антитело относится к подклассу IgG1 изотипа IgG и содержит мутацию в одном или обоих аминокислотных положениях тяжелой цепи 234 и 235, где один или оба аминокислотных остатка в положениях 234 и 235 мутированы из Leu в Ala, или
b) антитело относится к подклассу IgG4 изотипа IgG, где аминокислотный остаток в положении 228 мутирован из Ser в Pro;
где аминокислотные положения пронумерованы в соответствии со схемой нумерации IMGT®.
6. Антитело, которое специфически связывается с LAG-3, где указанное антитело содержит:
a) HC с аминокислотными последовательностями SEQ ID NO:7 и 30 и LC с аминокислотными последовательностями SEQ ID NO:8 и 34;
b) HC с аминокислотными последовательностями SEQ ID NO:3 и 30 и LC с аминокислотными последовательностями SEQ ID NO:4 и 34;
c) HC с аминокислотными последовательностями SEQ ID NO:11 и 30 и LC с аминокислотными последовательностями SEQ ID NO:12 и 34;
d) HC с аминокислотными последовательностями SEQ ID NO:15 и 30 и LC с аминокислотными последовательностями SEQ ID NO:16 и 34;
e) HC с аминокислотными последовательностями SEQ ID NO:19 и 30 и LC с аминокислотными последовательностями SEQ ID NO:20 и 34;
f) HC с аминокислотными последовательностями SEQ ID NO:23 и 30 и LC с аминокислотными последовательностями SEQ ID NO:24 и 34; или
g) HC с аминокислотными последовательностями SEQ ID NO:27 и 30 и LC с аминокислотными последовательностями SEQ ID NO:28 и 32.
7. Фармацевтическая композиция для лечения злокачественной опухоли, содержащая эффективное количество анти-LAG-3 антитела или его антигенсвязывающей части по любому из пп.1-6 и фармацевтически приемлемый эксципиент.
8. Выделенная молекула нуклеиновой кислоты для использования в получении анти-LAG-3 антитела или его антигенсвязывающей части, содержащая нуклеотидную последовательность, которая кодирует тяжелую цепь или ее антигенсвязывающую часть, или нуклеотидную последовательность, которая кодирует легкую цепь или ее антигенсвязывающую часть, или обе цепи, анти-LAG-3 антитела или его антигенсвязывающей части по любому из пп.1-6.
9. Вектор экспрессии, содержащий выделенную молекулу нуклеиновой кислоты по п.8, где указанный вектор дополнительно содержит последовательность, контролирующую экспрессию.
10. Клетка-хозяин для получения анти-LAG-3 антитела или его антигенсвязывающей части, содержащая нуклеотидную последовательность, которая кодирует тяжелую цепь или ее антигенсвязывающую часть, и нуклеотидную последовательность, которая кодирует легкую цепь или ее антигенсвязывающую часть, анти-LAG-3 антитела или его антигенсвязывающей части по любому из пп.1-6.
11. Способ получения анти-LAG-3 антитела или его антигенсвязывающей части, предусматривающий наличие клетки-хозяина по п.10, культивирование указанной клетки-хозяина в условиях, подходящих для экспрессии антитела или части, и выделение полученного антитела или части.
12. Способ лечения пациента со связанным с LAG-3 нарушением, включающий введение указанному больному анти-LAG-3 антитела или антигенсвязывающей части по любому из пп.1-6 или фармацевтической композиции по п.7.
13. Способ лечения злокачественной опухоли у пациента, включающий введение указанному больному анти-LAG-3 антитела или антигенсвязывающей части по любому из пп.1-6 или фармацевтической композиции по п.7.
14. Способ по п.13, где злокачественная опухоль представляет собой фибросаркому, немелкоклеточный рак легких, меланому, глиобластому, глиосаркому или рак толстой кишки.
15. Способ усиления иммунитета у пациента, включающий введение указанному пациенту анти-LAG-3 антитела или антигенсвязывающей части по любому из пп.1-6 или фармацевтической композиции по п.7.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662407678P | 2016-10-13 | 2016-10-13 | |
| US62/407,678 | 2016-10-13 | ||
| PCT/EP2017/076188 WO2018069500A2 (en) | 2016-10-13 | 2017-10-13 | Anti-lag-3 antibodies and compositions |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2019113790A RU2019113790A (ru) | 2020-11-13 |
| RU2019113790A3 RU2019113790A3 (ru) | 2021-02-01 |
| RU2755503C2 true RU2755503C2 (ru) | 2021-09-16 |
Family
ID=60201531
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2019113790A RU2755503C2 (ru) | 2016-10-13 | 2017-10-13 | Анти-lag-3 антитела и их композиции |
Country Status (25)
| Country | Link |
|---|---|
| US (3) | US11390676B2 (ru) |
| EP (1) | EP3526255A2 (ru) |
| JP (2) | JP7212821B2 (ru) |
| KR (2) | KR102583190B1 (ru) |
| CN (4) | CN117567621A (ru) |
| AU (1) | AU2017342071B2 (ru) |
| BR (1) | BR112019006876A2 (ru) |
| CA (1) | CA3039140A1 (ru) |
| CL (1) | CL2019000979A1 (ru) |
| CO (1) | CO2019004003A2 (ru) |
| EA (1) | EA201990912A1 (ru) |
| IL (1) | IL265844B2 (ru) |
| MA (1) | MA46525A (ru) |
| MX (1) | MX2019004241A (ru) |
| MY (1) | MY203971A (ru) |
| PE (1) | PE20190911A1 (ru) |
| PH (1) | PH12019500668B1 (ru) |
| RU (1) | RU2755503C2 (ru) |
| SA (1) | SA519401522B1 (ru) |
| SG (1) | SG10201912940WA (ru) |
| TN (1) | TN2019000099A1 (ru) |
| TW (1) | TWI784976B (ru) |
| UA (1) | UA127050C2 (ru) |
| WO (1) | WO2018069500A2 (ru) |
| ZA (1) | ZA201901924B (ru) |
Families Citing this family (80)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ792355A (en) | 2016-10-11 | 2025-12-19 | Agenus Inc | Anti-lag-3 antibodies and methods of use thereof |
| MA46525A (fr) * | 2016-10-13 | 2019-08-21 | Symphogen As | Anticorps anti-lag-3 et compositions |
| MY204068A (en) * | 2017-04-05 | 2024-08-06 | Servier Lab | Combination therapies targeting pd-1, tim-3, and lag-3 |
| CA3060989A1 (en) | 2017-05-30 | 2018-12-06 | Bristol-Myers Squibb Company | Compositions comprising a combination of an anti-lag-3 antibody, a pd-1 pathway inhibitor, and an immunotherapeutic agent |
| CA3060984A1 (en) | 2017-05-30 | 2018-12-06 | Bristol-Myers Squibb Company | Treatment of lag-3 positive tumors |
| JP7301002B2 (ja) | 2017-05-30 | 2023-06-30 | ブリストル-マイヤーズ スクイブ カンパニー | 抗lag-3抗体または抗lag-3抗体および抗pd-1もしくは抗pd-l1抗体を含む組成物 |
| US11795221B2 (en) * | 2018-02-28 | 2023-10-24 | WuXi Biologics Ireland Limited | Monoclonal antibody against human LAG-3, method for preparing the same, and use thereof |
| CN110204614B (zh) * | 2018-02-28 | 2022-07-12 | 广州誉衡生物科技有限公司 | 抗人lag-3单克隆抗体及其制备方法和用途 |
| AU2019263850A1 (en) | 2018-05-03 | 2020-11-19 | Shanghai Epimab Biotherapeutics Co., Ltd. | High affinity antibodies to PD-1 and LAG-3 and bispecific binding proteins made therefrom |
| CN110615840A (zh) * | 2018-06-19 | 2019-12-27 | 信达生物制药(苏州)有限公司 | 全人源的抗lag-3抗体及其应用 |
| US20210238287A1 (en) | 2018-07-26 | 2021-08-05 | Bristol-Myers Squibb Company | LAG-3 Combination Therapy for the Treatment of Cancer |
| EP4445958B1 (en) | 2018-10-19 | 2025-09-24 | Bristol-Myers Squibb Company | Combination therapy for melanoma |
| CN111620949A (zh) * | 2019-02-28 | 2020-09-04 | 三生国健药业(上海)股份有限公司 | 结合人lag-3的抗体、其制备方法和用途 |
| BR112021021713A2 (pt) | 2019-05-13 | 2022-04-19 | Regeneron Pharma | Método de tratamento de câncer ou inibição do crescimento de um tumor |
| US20220363760A1 (en) | 2019-05-30 | 2022-11-17 | Bristol-Myers Squibb Company | Multi-tumor gene signature for suitability to immuno-oncology therapy |
| JP2022534982A (ja) | 2019-05-30 | 2022-08-04 | ブリストル-マイヤーズ スクイブ カンパニー | 細胞局在化シグネチャーおよびその使用 |
| WO2020243570A1 (en) | 2019-05-30 | 2020-12-03 | Bristol-Myers Squibb Company | Cell localization signature and combination therapy |
| IT201900011676A1 (it) * | 2019-07-12 | 2021-01-12 | St Superiore Di Sanita | Anticorpo ricombinante umano contro il recettore di membrana LAG3, suoi usi medici e diagnostici. |
| WO2021024020A1 (en) | 2019-08-06 | 2021-02-11 | Astellas Pharma Inc. | Combination therapy involving antibodies against claudin 18.2 and immune checkpoint inhibitors for treatment of cancer |
| PH12022550509A1 (en) * | 2019-09-06 | 2023-03-20 | Servier Lab | Anti-cd73 antibodies |
| BR112022004316A2 (pt) | 2019-09-22 | 2022-06-21 | Bristol Myers Squibb Co | Caracterização espacial quantitativa para terapia de antagonista lag-3 |
| WO2021092220A1 (en) | 2019-11-06 | 2021-05-14 | Bristol-Myers Squibb Company | Methods of identifying a subject with a tumor suitable for a checkpoint inhibitor therapy |
| WO2021092221A1 (en) | 2019-11-06 | 2021-05-14 | Bristol-Myers Squibb Company | Methods of identifying a subject with a tumor suitable for a checkpoint inhibitor therapy |
| MX2022005474A (es) | 2019-11-08 | 2022-06-02 | Bristol Myers Squibb Co | Tratamiento de melanoma con antagonistas del gen 3 de activacion de linfocitos (lag-3). |
| EP4100426A1 (en) | 2020-02-06 | 2022-12-14 | Bristol-Myers Squibb Company | Il-10 and uses thereof |
| AU2021245931A1 (en) * | 2020-04-03 | 2022-11-03 | Yuhan Corporation | Engineered antibodies that bind LAG3 |
| CN114605544B (zh) * | 2020-06-05 | 2023-08-01 | 北京天广实生物技术股份有限公司 | Lag3抗体及其用途 |
| MX2023000197A (es) | 2020-07-07 | 2023-02-22 | BioNTech SE | Arn terapeutico para el cancer positivo para vph. |
| MX2023002332A (es) | 2020-08-28 | 2023-03-21 | Bristol Myers Squibb Co | Terapia con antagonistas del gen 3 de activacion de linfocitos (lag-3) para carcinoma hepatocelular. |
| WO2022047412A1 (en) | 2020-08-31 | 2022-03-03 | Bristol-Myers Squibb Company | Cell localization signature and immunotherapy |
| AU2021364837A1 (en) | 2020-10-23 | 2023-05-25 | Bristol-Myers Squibb Company | Lag-3 antagonist therapy for lung cancer |
| WO2022120179A1 (en) | 2020-12-03 | 2022-06-09 | Bristol-Myers Squibb Company | Multi-tumor gene signatures and uses thereof |
| WO2022135667A1 (en) | 2020-12-21 | 2022-06-30 | BioNTech SE | Therapeutic rna for treating cancer |
| TW202245808A (zh) | 2020-12-21 | 2022-12-01 | 德商拜恩迪克公司 | 用於治療癌症之治療性rna |
| WO2022135666A1 (en) | 2020-12-21 | 2022-06-30 | BioNTech SE | Treatment schedule for cytokine proteins |
| WO2022146947A1 (en) | 2020-12-28 | 2022-07-07 | Bristol-Myers Squibb Company | Antibody compositions and methods of use thereof |
| CA3196999A1 (en) | 2020-12-28 | 2022-07-07 | Masano HUANG | Methods of treating tumors |
| AU2022212123A1 (en) | 2021-01-29 | 2023-09-07 | Board Of Regents, The University Of Texas System | Methods of treating cancer with kinase inhibitors |
| AU2022246593A1 (en) | 2021-03-29 | 2023-10-12 | Juno Therapeutics, Inc. | Methods for dosing and treatment with a combination of a checkpoint inhibitor therapy and a car t cell therapy |
| EP4319755A4 (en) | 2021-04-08 | 2025-03-26 | Board of Regents, The University of Texas System | Compounds and methods for theranostic targeting of parp activity |
| US20240285740A1 (en) | 2021-05-12 | 2024-08-29 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for treating cancer |
| JP2024525758A (ja) | 2021-07-13 | 2024-07-12 | ビオンテック・ソシエタス・エウロパエア | がんのための併用療法におけるcd40およびcd137に対する多重特異性結合剤 |
| CA3226924A1 (en) | 2021-07-19 | 2023-01-26 | Regeneron Pharmaceuticals, Inc. | Il12 receptor agonists and methods of use thereof |
| KR20240046251A (ko) | 2021-08-16 | 2024-04-08 | 리제너론 파아마슈티컬스, 인크. | 신규 il27 수용체 효능제 및 그의 사용 방법 |
| TW202333802A (zh) | 2021-10-11 | 2023-09-01 | 德商拜恩迪克公司 | 用於肺癌之治療性rna(二) |
| CN118176214A (zh) | 2021-10-29 | 2024-06-11 | 百时美施贵宝公司 | 血液癌症的lag-3拮抗剂疗法 |
| JP2025503962A (ja) | 2022-01-26 | 2025-02-06 | ブリストル-マイヤーズ スクイブ カンパニー | 肝細胞がんのための併用療法 |
| JP2025507694A (ja) | 2022-02-25 | 2025-03-21 | ブリストル-マイヤーズ スクイブ カンパニー | 結腸直腸癌に対する組み合わせ療法 |
| WO2023168404A1 (en) | 2022-03-04 | 2023-09-07 | Bristol-Myers Squibb Company | Methods of treating a tumor |
| EP4490191A1 (en) | 2022-03-08 | 2025-01-15 | Alentis Therapeutics AG | Use of anti-claudin-1 antibodies to increase t cell availability |
| US20250206775A1 (en) | 2022-03-18 | 2025-06-26 | Bristol-Myers Squibb Company | Methods of isolating polypeptides |
| IL316892A (en) | 2022-05-11 | 2025-01-01 | Regeneron Pharma | Multispecific proprotein binding molecules and their uses |
| US20230382969A1 (en) | 2022-05-27 | 2023-11-30 | Regeneron Pharmaceuticals, Inc. | Interleukin-2 proproteins and uses thereof |
| IL317319A (en) | 2022-06-02 | 2025-01-01 | Bristol Myers Squibb Co | Antibody compounds and methods of using them |
| EP4536690A1 (en) | 2022-06-04 | 2025-04-16 | Regeneron Pharmaceuticals, Inc. | Interleukin-2 proproteins and uses thereof |
| WO2024040247A1 (en) | 2022-08-18 | 2024-02-22 | Regeneron Pharmaceuticals, Inc. | Interferon proproteins and uses thereof |
| US20240067691A1 (en) | 2022-08-18 | 2024-02-29 | Regeneron Pharmaceuticals, Inc. | Interferon receptor agonists and uses thereof |
| TW202440157A (zh) | 2022-12-01 | 2024-10-16 | 英商梅迪繆思有限公司 | 用於治療癌症的組合療法 |
| AU2023393653A1 (en) | 2022-12-14 | 2025-05-22 | Astellas Pharma Europe Bv | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and immune checkpoint inhibitors |
| CN120731228A (zh) | 2022-12-21 | 2025-09-30 | 百时美施贵宝公司 | 肺癌的组合疗法 |
| AU2024207005A1 (en) | 2023-01-13 | 2025-08-28 | Regeneron Pharmaceuticals, Inc. | Il12 receptor agonists and methods of use thereof |
| EP4658687A1 (en) | 2023-01-31 | 2025-12-10 | University of Rochester | Immune checkpoint blockade therapy for treating staphylococcus aureus infections |
| US20240287186A1 (en) | 2023-02-28 | 2024-08-29 | Regeneron Pharmaceuticals, Inc. | T cell activators and methods of use thereof |
| CN121127264A (zh) | 2023-03-13 | 2025-12-12 | 瑞泽恩制药公司 | 用于在治疗黑素瘤中增强疗效的pd-1抑制剂和lag-3抑制剂组合 |
| WO2024196952A1 (en) | 2023-03-20 | 2024-09-26 | Bristol-Myers Squibb Company | Tumor subtype assessment for cancer therapy |
| WO2025038763A1 (en) | 2023-08-15 | 2025-02-20 | Bristol-Myers Squibb Company | Ceramic hydroxyapatite chromatography flow through method |
| WO2025056011A1 (zh) * | 2023-09-13 | 2025-03-20 | 正大天晴药业集团股份有限公司 | 包含抗pd-1抗体和第二抗体的药物组合物 |
| CN119971023A (zh) * | 2023-11-02 | 2025-05-13 | 正大天晴(广州)医药有限公司 | 含抗lag-3抗体的药物组合物及其用途 |
| WO2025106469A1 (en) | 2023-11-14 | 2025-05-22 | Regeneron Pharmaceuticals, Inc. | Engineered heavy chain variable domains and uses thereof |
| WO2025106736A2 (en) | 2023-11-15 | 2025-05-22 | Regeneron Pharmaceuticals, Inc. | Combination of pd-1 inhibitors and lag-3 inhibitors for enhanced efficacy in treating lung cancer |
| WO2025122614A1 (en) | 2023-12-05 | 2025-06-12 | Regeneron Pharmaceuticals, Inc. | Il18 receptor agonists and methods of use thereof |
| WO2025121445A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and agents stabilizing or increasing expression of cldn18.2 |
| WO2025120866A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and agents stabilizing or increasing expression of cldn18.2 |
| WO2025120867A1 (en) | 2023-12-08 | 2025-06-12 | Astellas Pharma Inc. | Combination therapy involving bispecific binding agents binding to cldn18.2 and cd3 and anti-vegfr2 antibodies |
| US20250215087A1 (en) | 2023-12-29 | 2025-07-03 | Bristol-Myers Squibb Company | Combination therapy of kras inhibitor and treg depleting agent |
| US20250361320A1 (en) | 2024-02-27 | 2025-11-27 | Bristol-Myers Squibb Company | Anti-ceacam5 antibodies and uses thereof |
| EP4658320A1 (en) | 2024-02-27 | 2025-12-10 | Bristol-Myers Squibb Company | Anti-ceacam5 antibody drug conjugates |
| WO2025199243A1 (en) | 2024-03-20 | 2025-09-25 | Regeneron Pharmaceuticals, Inc. | Trivalent multispecific binding molecules and methods of use thereof |
| WO2025245489A1 (en) | 2024-05-24 | 2025-11-27 | Bristol-Myers Squibb Company | Treatment of tumors in subjects having fgl-1 positive samples |
| WO2025255480A1 (en) | 2024-06-07 | 2025-12-11 | Regeneron Pharmaceuticals, Inc. | Tetravalent multispecific binding molecules and methods of use thereof |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2178306C2 (ru) * | 1994-05-06 | 2002-01-20 | Энститю Гюстав Русси | Растворимые полипептидные фракции протеина lag-3, способ получения, терапевтическая композиция, антитело |
| WO2008132601A1 (en) * | 2007-04-30 | 2008-11-06 | Immutep | Cytotoxic anti-lag-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| WO2010019570A2 (en) * | 2008-08-11 | 2010-02-18 | Medarex, Inc. | Human antibodies that bind lymphocyte activation gene-3 (lag-3), and uses thereof |
| US20110070238A1 (en) * | 2007-04-30 | 2011-03-24 | Immutep Parc Club Orsay | Cytotoxic anti-lag-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| WO2014008218A1 (en) * | 2012-07-02 | 2014-01-09 | Bristol-Myers Squibb Company | Optimization of antibodies that bind lymphocyte activation gene-3 (lag-3), and uses thereof |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4634665A (en) | 1980-02-25 | 1987-01-06 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US5179017A (en) | 1980-02-25 | 1993-01-12 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4510245A (en) | 1982-11-18 | 1985-04-09 | Chiron Corporation | Adenovirus promoter system |
| US4740461A (en) | 1983-12-27 | 1988-04-26 | Genetics Institute, Inc. | Vectors and methods for transformation of eucaryotic cells |
| US5168062A (en) | 1985-01-30 | 1992-12-01 | University Of Iowa Research Foundation | Transfer vectors and microorganisms containing human cytomegalovirus immediate-early promoter-regulatory DNA sequence |
| AU584417B2 (en) | 1985-04-01 | 1989-05-25 | Lonza Group Ag | Transformed myeloma cell-line and a process for the expression of a gene coding for a eukaryotic polypeptide employing same |
| US4968615A (en) | 1985-12-18 | 1990-11-06 | Ciba-Geigy Corporation | Deoxyribonucleic acid segment from a virus |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| US4959455A (en) | 1986-07-14 | 1990-09-25 | Genetics Institute, Inc. | Primate hematopoietic growth factors IL-3 and pharmaceutical compositions |
| US4912040A (en) | 1986-11-14 | 1990-03-27 | Genetics Institute, Inc. | Eucaryotic expression system |
| GB8717430D0 (en) | 1987-07-23 | 1987-08-26 | Celltech Ltd | Recombinant dna product |
| GB8809129D0 (en) | 1988-04-18 | 1988-05-18 | Celltech Ltd | Recombinant dna methods vectors and host cells |
| AU770555B2 (en) | 1998-08-17 | 2004-02-26 | Abgenix, Inc. | Generation of modified molecules with increased serum half-lives |
| US6517529B1 (en) | 1999-11-24 | 2003-02-11 | Radius International Limited Partnership | Hemodialysis catheter |
| HUP0300369A2 (hu) | 2000-04-11 | 2003-06-28 | Genentech, Inc. | Többértékű antitestek és alkalmazásuk |
| US7612181B2 (en) | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| EP2566512A1 (en) * | 2010-05-04 | 2013-03-13 | Merrimack Pharmaceuticals, Inc. | Antibodies against epidermal growth factor receptor (egfr) and uses thereof |
| JO3532B1 (ar) * | 2013-03-13 | 2020-07-05 | Regeneron Pharma | الأجسام المضادة لمضاد انترلوكين-33 واستعمالاتها |
| WO2014140180A1 (en) | 2013-03-15 | 2014-09-18 | Glaxosmithkline Intellectual Property Development Limited | Anti-lag-3 binding proteins |
| EP3508502B1 (en) | 2013-09-20 | 2023-04-26 | Bristol-Myers Squibb Company | Combination of anti-lag-3 antibodies and anti-pd-1 antibodies to treat tumors |
| EP3049442A4 (en) | 2013-09-26 | 2017-06-28 | Costim Pharmaceuticals Inc. | Methods for treating hematologic cancers |
| US20150259420A1 (en) * | 2014-03-14 | 2015-09-17 | Novartis Ag | Antibody molecules to lag-3 and uses thereof |
| JO3663B1 (ar) | 2014-08-19 | 2020-08-27 | Merck Sharp & Dohme | الأجسام المضادة لمضاد lag3 وأجزاء ربط الأنتيجين |
| MA41463A (fr) | 2015-02-03 | 2017-12-12 | Anaptysbio Inc | Anticorps dirigés contre le gène d'activation 3 des lymphocytes (lag-3) |
| TWI773646B (zh) | 2015-06-08 | 2022-08-11 | 美商宏觀基因股份有限公司 | 結合lag-3的分子和其使用方法 |
| KR102419412B1 (ko) | 2016-05-18 | 2022-07-12 | 베링거 인겔하임 인터내셔날 게엠베하 | 암 치료용 항-pd1 및 항-lag3 항체 |
| MA46525A (fr) * | 2016-10-13 | 2019-08-21 | Symphogen As | Anticorps anti-lag-3 et compositions |
| MY204068A (en) | 2017-04-05 | 2024-08-06 | Servier Lab | Combination therapies targeting pd-1, tim-3, and lag-3 |
-
2017
- 2017-10-13 MA MA046525A patent/MA46525A/fr unknown
- 2017-10-13 TW TW106135145A patent/TWI784976B/zh active
- 2017-10-13 WO PCT/EP2017/076188 patent/WO2018069500A2/en not_active Ceased
- 2017-10-13 MY MYPI2019001727A patent/MY203971A/en unknown
- 2017-10-13 IL IL265844A patent/IL265844B2/en unknown
- 2017-10-13 PE PE2019000815A patent/PE20190911A1/es unknown
- 2017-10-13 CN CN202311388116.2A patent/CN117567621A/zh active Pending
- 2017-10-13 CN CN202311394766.8A patent/CN117567622A/zh active Pending
- 2017-10-13 PH PH1/2019/500668A patent/PH12019500668B1/en unknown
- 2017-10-13 EA EA201990912A patent/EA201990912A1/ru unknown
- 2017-10-13 EP EP17791987.5A patent/EP3526255A2/en active Pending
- 2017-10-13 TN TNP/2019/000099A patent/TN2019000099A1/en unknown
- 2017-10-13 JP JP2019520053A patent/JP7212821B2/ja active Active
- 2017-10-13 KR KR1020197012672A patent/KR102583190B1/ko active Active
- 2017-10-13 UA UAA201904924A patent/UA127050C2/uk unknown
- 2017-10-13 CN CN201780074499.2A patent/CN110062766B/zh active Active
- 2017-10-13 MX MX2019004241A patent/MX2019004241A/es unknown
- 2017-10-13 BR BR112019006876A patent/BR112019006876A2/pt unknown
- 2017-10-13 AU AU2017342071A patent/AU2017342071B2/en active Active
- 2017-10-13 KR KR1020237032304A patent/KR102846713B1/ko active Active
- 2017-10-13 CA CA3039140A patent/CA3039140A1/en active Pending
- 2017-10-13 RU RU2019113790A patent/RU2755503C2/ru active
- 2017-10-13 SG SG10201912940WA patent/SG10201912940WA/en unknown
- 2017-10-13 CN CN202311395764.0A patent/CN117567623A/zh active Pending
- 2017-10-13 US US16/340,855 patent/US11390676B2/en active Active
-
2019
- 2019-03-28 ZA ZA2019/01924A patent/ZA201901924B/en unknown
- 2019-04-10 SA SA519401522A patent/SA519401522B1/ar unknown
- 2019-04-11 CL CL2019000979A patent/CL2019000979A1/es unknown
- 2019-04-23 CO CONC2019/0004003A patent/CO2019004003A2/es unknown
-
2022
- 2022-06-07 US US17/834,497 patent/US11834503B2/en active Active
- 2022-12-07 JP JP2022195869A patent/JP7488323B2/ja active Active
-
2023
- 2023-10-19 US US18/490,500 patent/US20240052032A1/en active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2178306C2 (ru) * | 1994-05-06 | 2002-01-20 | Энститю Гюстав Русси | Растворимые полипептидные фракции протеина lag-3, способ получения, терапевтическая композиция, антитело |
| WO2008132601A1 (en) * | 2007-04-30 | 2008-11-06 | Immutep | Cytotoxic anti-lag-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| US20110070238A1 (en) * | 2007-04-30 | 2011-03-24 | Immutep Parc Club Orsay | Cytotoxic anti-lag-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| WO2010019570A2 (en) * | 2008-08-11 | 2010-02-18 | Medarex, Inc. | Human antibodies that bind lymphocyte activation gene-3 (lag-3), and uses thereof |
| WO2014008218A1 (en) * | 2012-07-02 | 2014-01-09 | Bristol-Myers Squibb Company | Optimization of antibodies that bind lymphocyte activation gene-3 (lag-3), and uses thereof |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2755503C2 (ru) | Анти-lag-3 антитела и их композиции | |
| AU2017361868B2 (en) | Anti-PD-1 antibodies and compositions | |
| KR102473028B1 (ko) | 항-tim-3 항체 및 조성물 | |
| AU2018247916B2 (en) | Combination therapies targeting PD-1, TIM-3, and LAG-3 | |
| JP6875385B2 (ja) | 抗pd−1抗体および組成物 | |
| KR101931591B1 (ko) | 항-il-23 항체 | |
| KR20210068065A (ko) | 안타고니스트 | |
| CN113135994A (zh) | 一种激活型抗ox40抗体、生产方法及应用 | |
| EA046220B1 (ru) | Анти-lag-3 антитела и их композиции |