RU2607595C2 - Составы разагилина с пролонгированным высвобождением и их применение - Google Patents
Составы разагилина с пролонгированным высвобождением и их применение Download PDFInfo
- Publication number
- RU2607595C2 RU2607595C2 RU2012136723A RU2012136723A RU2607595C2 RU 2607595 C2 RU2607595 C2 RU 2607595C2 RU 2012136723 A RU2012136723 A RU 2012136723A RU 2012136723 A RU2012136723 A RU 2012136723A RU 2607595 C2 RU2607595 C2 RU 2607595C2
- Authority
- RU
- Russia
- Prior art keywords
- salt
- coating
- active agent
- disease
- rasagiline
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5073—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings
- A61K9/5078—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings with drug-free core
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Psychiatry (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Группа изобретений относится к области фармацевтики. Описана пероральная фармацевтическая композиция в форме пролонгированного высвобождения для лечения нейродегенеративного заболевания или повреждения нервной системы. Указанная композиция включает R(+)-N-пропаpгил-1-аминоиндан (разагилин) в качестве активного вещества. Композиция содержит пеллеты с пролонгированным высвобождением и фармацевтически приемлемый носитель. Указанная пеллета содержит: i) инертное ядро пеллеты; ii) слой с активным веществом, поливинилпирролидоном и тальком; iii) необязательно, изолирующий слой с поливинилпирролидоном; iv) слой покрытия пролонгированного высвобождения с этилцеллюлозой и полиэтиленгликолем. Также описано применение и способ лечения указанной композицией нейродегенеративного заболевания или повреждения нервной системы. Изобретение обеспечивает усиленное действие на указанные заболевания. 3 н. и 13 з.п. ф-лы, 9 ил., 17 табл., 11 пр.
Description
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтическим композициям, приготовленным в форме для пролонгированного высвобождения активных соединений, подходящих для лечения нейродегенеративных заболеваний, в частности, болезни Паркинсона, и повреждений нервной системы.
УРОВЕНЬ ТЕХНИКИ
Было показано, что некоторые производные пропаргиламина селективно ингибируют активность моноаминоксидаз (МАО)-Б и/или МАО-А, которые инактивируют моноаминергические нейромедиаторы, такие как допамин, и, таким образом, подходят для лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона (БП) и болезнь Альцгеймера (БА), которые характеризуются низкими уровнями допамина. Также было показано, что данные соединения защищают от нейродегенерации путем предотвращения апоптоза.
Первым соединением, которое, как было обнаружено, селективно ингибирует МАО-Б, был R-(-)-N-метил-N-(проп-2-инил)-2-аминофенилпропан, также известный как L-(-)-депренил, R-(-)-депренил или селегилин (selegiline). Помимо БП,, селегилин, как было показано, может применяться также при лечении, других заболеваний и патологических состояний, которые включают синдром отмены лекарственного средства (WO 92/21333, включая синдром отмены психостимуляторов, опиатов, наркотических средств и барбитуратов); депрессию (US 4861800); БА; дегенерацию желтого пятна (US 5242950); возрастные дегенерации, включая дегенерацию функции почек и дегенерацию когнитивной функции, на основании данных о способности к пространственному обучению (US 5151449); болезнь Кушинга гипофизарного происхождения у людей и животных (US 5192808); дисфункцию иммунной системы как у людей (US 5387615), так и у животных (US 5276057); возрастную потерю массы тела у млекопитающих (US 5225446); шизофрению (US 5151419); и различные неопластические состояния, включая раковые опухоли, такие как рак молочной железы и гипофиза. В WO 92/17169 описано применение селегилина для лечения нейромышечных и нейродегенеративных заболеваний и для лечения повреждений ЦНС вследствие гипоксии, гипогликемии, ишемического инсульта или травмы. Кроме того, было широко изучено биохимическое действие селегилина в отношении нервных клеток (см., например, Tatton, 1993; и Tatton and Greenwood, 1991). В US 6562365 описано применение десметилселегилина для лечения чувствительных к селегилину заболеваний и патологических состояний.
Разагилин (rasagiline), R(+)-N-пропаргил-1-аминоиндан, высокоактивный селективный необратимый ингибитор МАО-Б, был разрешен для лечения БП в Европе, Израиле и в США под торговым названием АЗИЛЕКТ® (AZILECT®) или АГИЛЕКТ® (AGILECT®) (Teva Pharmaceutical Industries Ltd., Петах-Тиква, Израиль). При исследованиях на культурах клеток и in vivo было показано, что разагилин обладает нейропротекторной активностью и антиапоптотическим действием в отношении различных поражений (Youdim and Weinstock, 2002а). Механизм, лежащий в основе нейрозащиты разагилином, был изучен на допаминергических клетках SH-SY5Y и PC12 в культуре в отношении апоптоза, индуцированного N-метил(R)салсолинолом, донором пероксинитрита N-морфолино-сиднонимином (SIN-1), 6-гидроксидопамином, и удалением сыворотки и фактора роста нервов (Youdim et al, 2001b; Akao et al, 1999,2002; Maruyama et al, 2001a, 2001b, 2002).
Разагилин и его фармацевтически приемлемые соли были впервые описаны в патентах США №5387612, 5453446, 5457133, 5576353, 5668181, 5786390, 5891923 и 6630514 в качестве подходящих для лечения БП, нарушений памяти, деменции альцгеймеровского типа, депрессии и синдрома гиперактивности. Производные 4-фтор-, 5-фтор- и 6-фтор-N-пропаргил-1-аминоиндана были описаны в US 5486541 для тех же целей. В патентах США №5519061, 5532415, 5599991, 5744500, 6277886, 6316504, 5576353, 5668181, 5786390, 5891923 и 6630514 описан разагилин и его фармацевтически приемлемые соли в качестве подходящих для лечения при дополнительных терапевтических показаниях, в частности, для лечения аффективного расстройства, неврологической гипоксии или аноксии, нейродегенеративных заболеваний, нейротоксического поражения, инсульта, ишемии головного мозга, повреждения при травме головы, повреждения при травме позвоночника, шизофрении, синдрома дефицита внимания, рассеянного склероза и синдромов отмены.
В US 6251938 описаны соединения N-пропаргилфенилэтиламина, а в патентах США №6303650, 6462222 и 6538025 описаны соединения N-пропаргил-1-аминоиндана и N-пропаргил-1-аминотетралина в качестве подходящих для лечения депрессии, синдрома дефицита внимания, синдрома дефицита внимания и гиперактивности, синдрома Туретта, БА и другой деменции, такой как сенильная деменция, деменция паркиксоновского типа, сосудистая деменция и деменция с тельцами Леви.
В предыдущей работе было сделано предположение, что разагилин и родственные производные пропаргиламина подавляют каскад апоптотической гибели, начинающийся в митохондриях, за счет предотвращения предапоптотического снижения мембранного потенциала митохондрий (Δψm) вследствие изменения проницаемости и активации каспазы 3, ядерную транслокацию глицеральдегид-3-фосфатдегидрогеназы и апоптотические процессы нуклеосомной фрагментации ДНК (Youdim and Weinstock, 2002b). При контролируемой монотерапии и в качестве вспомогательного средства к L-допе (L-dopa) разагилин продемонстрировал активность в отношении болезни Паркинсона.
Были синтезированы два аналога разагилина, содержащие карбаматную группу, в попытке комбинации ингибирующих свойств в отношении МАО и нейропротекторных свойств разагилина с ингибирующей холинэстеразу (ChE) активностью ривастигмина (rivastigmine), лекарственного средства с доказанной эффективностью у пациентов с БА. Данные аналоги представляют собой (N-пропаргил-(3R)-аминоиндан-5-ил)-этилметилкарбамат (TV3326), обладающий ингибирующей активностью в отношении как ChE, так и МАО-А и Б, и его S-изомер, TV3279, являющийся ингибитором ChE, но не МАО (Weinstock, 1999; Grossberg and Desai, 2001). Подобно разагилину, TV3326 и TV3279 обладают нейропротекторными свойствами в отношении различных поражений, которые не зависят от ингибирующей активности в отношении ChE и МАО, а могут возникать вследствие некоторой фармакологической активности, свойственной пропаргиламинному фрагменту (Youdim and Weinstock, 2002а). Кроме того, данные соединения стимулируют высвобождение нейротрофического/нейропротекторного неамилоидогенного растворимого белка-предшественника амилоида (sAPPβ) путем активации протеинкиназы С и путей митоген-активируемой протеинкиназы (Yogev-Falach, 2002). Таким образом, данные лекарственные средства могут влиять на образование потенциально амилоидогенных производных и могут иметь клиническое значение для лечения БА.
В US 5169868, US 5840979 и US 6251950 описаны алифатические пропаргиламины в качестве селективных ингибиторов МАО-Б, нейропротекторных агентов и агентов «спасения» клеток. Было показано, что основное соединение, (R)-N-(2-гептил)метилпропаргиламин, является мощным ингибитором МАО-Б и антиапоптотическим агентом (Durden et al., 2000).
Много лет тому назад сообщалось, что пропаргиламин является суицидным ингибитором медьсодержащей аминоксидазы бычьей плазмы (BPАО), хотя его активность была невысокой. В US 6395780 пропаргиламин описан в качестве слабого ингибитора системы расщепления глицина.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению было обнаружено, что введение разагилина с обеспечением его замедленного высвобождения, вследствие чего воздействие лекарственного средства заметно продлевается по сравнению с воздействием после разового введения, может иметь решающее значение для достижения оптимального нейропротекторного действия при различных поражениях ЦНС. В частности, в то время как разовое введение возрастающих доз разагилина (0,1, 0,12 или 0,15 мг/кг) в модели болезни Паркинсона (БП) у мышей, индуцированной N-метил-4-фенил-1,2,3,6-тетрагидропиридином (МРТР), оказывало практически сходное действие на уровни допамина у мышей, приводя к повышению содержания допамина до примерно 60% по сравнению с мышами, не получавшими лекарственное средство, введение таких же трех доз лекарственного средства с замедленным высвобождением в течение 24 часов приводило к значительному ответу на дозу, при котором уровни допамина составляли 57%, 74% и 88%, соответственно, по сравнению с мышами, не получавшими лекарственное средство, что указывает на выраженный благоприятный эффект введения с замедленным высвобождением по сравнению с немедленным высвобождением в отношении уровней допамина в головном мозге мышей, подвергнутых воздействию МРТР. Интересным является тот факт, что схожие результаты получали после введения метаболита разагилина, 1-аминоиндана, с замедленным высвобождением, что приводило к значительному восстановлению уровней допамина по сравнению с мышами, которым вводили такую же дозу лекарственного средства один раз в сутки в течение такого же периода времени.
Также, как было обнаружено в модели индуцированной 6-гидроксидопамином (6-OHDA) БП у крыс, заметно улучшенный эффект при чистом вращении, индуцированном амфетамином, наблюдали у крыс, получавших лечение разагилином, вводимым способом с замедленным высвобождением, по сравнению с крысами, получавшими лечение тем же лекарственным средством путем ежедневных инъекций.
Таким образом, в соответствии с одним из аспектов настоящего изобретения предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, приготовленная в форме для пролонгированного высвобождения указанного активного агента. В предпочтительном варианте реализации активный агент, содержащийся в указанной фармацевтической композиции, представляет собой R(+)-N-пропаргил-1-аминоиндан (разагилин) или его фармацевтически приемлемую соль.
В соответствии с другим аспектом настоящего изобретения предложена пеллета с пролонгированным высвобождением, содержащая:
(i) инертное ядро пеллеты;
(ii) слой лекарственного средства, покрывающий указанное ядро пеллеты, при этом указанный слой лекарственного средства содержит активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически 20 приемлемую соль, возможно подходящим образом смешанные со связующим веществом и/или пленкообразующим полимером, и возможно дополнительно смешанные с веществом, способствующим скольжению;
(iii) возможно, изолирующий/защитный подслой покрытия, покрывающий указанный слой лекарственного средства; и
(iv) слой покрытия с замедленным высвобождением, покрывающий указанный подслой покрытия (при его наличии) или указанный слой лекарственного средства.
В соответствии с еще одним аспектом настоящего изобретения предложена фармацевтическая композиция для перорального введения, содержащая пеллеты с 30 пролонгированным высвобождением, как определено выше.
Различные фармацевтические композиции согласно настоящему изобретению подходят для лечения нейродегенеративных заболеваний, предпочтительно болезни Паркинсона, и повреждений нервной системы.
Таким образом, в соответствии с другим аспектом настоящее изобретение 35 относится к способу лечения нейродегенеративного заболевания или повреждения нервной системы у нуждающегося в этом индивидуума, включающему введение указанному индивидууму фармацевтической композиции, определенной выше.
В соответствии с еще одним аспектом настоящее изобретение относится к способу получения состава в форме для пролонгированного высвобождения, содержащего активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, включающему этапы:
(i) растворения указанного активного агента, возможно подходящим образом смешанного со связующим веществом и/или веществом, способствующим скольжению, в подходящей системе растворителей с получением однородной суспензии;
(ii) нанесения слоя указанной суспензии, полученной на этапе (i), на инертные пеллеты, такие как инертные гранулы нонпарель (nonpareil seeds);
(iii) возможно, нанесения на пеллетысодержащие активный агент, полученные на этапе (ii), изолирующего/защитного подслоя покрытия;
(iv) нанесения на пеллеты, полученные на этапе (ii) или (iii), слоя покрытия с пролонгированным высвобождением, который обеспечивает пролонгированное высвобождение указанного активного агента, с получением тем самым указанного состава с пролонгированным высвобождением; и
(v) возможно, смешивания покрытых пеллет, полученных на этапе (iv), с подходящим наполнителем.
КРАТКОЕ ОПИСАНИЕ ФИГУР
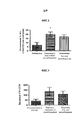
На Фиг.1 показано влияние комбинаций разагилин-прамипексол (pramipexole) (обозначенных Комб. 1, 2 и 3), в которых доза прамипексола является постоянной (0,5 мг/кг), а доза разагилина варьируется (0,1, 0,12 или 0,15 мг/кг, соответственно) на уровни допамина (DA) в головном мозге. В частности, как показано, введение МРТР без лекарственной терапии (физиологический раствор интраперитонеально и с замедленным высвобождением) вызывало снижение уровней допамина более чем на 80% по сравнению с уровнями у мышей, ранее не подвергнутых экспериментам (мыши, ранее не подвергнутые экспериментам, интраперитонеальное и введение способом с замедленным высвобождением). Лечение (интраперитонеальное введение) комбинациями разагилин-прамипексол вызывало восстановление уровней допамина до примерно 60% у мышей, ранее не подверженных экспериментам, - эффект, практически одинаковый для всех трех комбинаций; однако те же три комбинации при их введении способом с замедленным высвобождением (ЗВ) с использованием насоса Alzet, приводило к значительному дозозависимому повышению уровней допамина до 57%, 74% и 88% в соответствии с повышенными дозами разагилина.
На Фиг.2 показано влияние метаболита разагилина, аминоиндана, при введении ЗВ на уровни допамина (DA) в головном мозге. В частности, воздействие МРТР вызывало снижение уровней допамина более чем на 90% по сравнению с уровнями у мышей, ранее не подвергнутых экспериментам. Лечение аминоинданом, введенным способом с медленным высвобождением (ЗВ), вызывало значительное восстановление уровней допамина по сравнению с уровнями у мышей, получавших лечение разбавителем или аминоинданом, вводимым путем ежедневных интраперитонеальных инъекций (IP).
На Фиг.3 показано чистое вращение, индуцированное амфетамином, которое представляет собой вращение по часовой стрелке за вычетом вращения против часовой стрелки (CW-CCW), измеренное у крыс, получавших лечение разагилином, как описано в Примере 3. Значительно улучшенный эффект в чистом вращении показан у крыс, получавших лечение разагилином с пролонгированным высвобождением (ЗВ) с использованием насоса Alzet, по сравнению с крысами, получавшими лечение разагилином с быстрым высвобождением (БВ) путем ежедневных интраперитонеальных инъекций.
На Фиг.4 приведены данные растворения in vitro для пеллет мезилата разагилина (1,0 мг) со слоем покрытия с пролонгированным высвобождением (ПВ) из Примеров 4-6 (15% ПВ, 22% ПВ и 28% ПВ, соответственно) в буферном растворе кишечной жидкости (IFS).
На Фиг.5 приведены данные растворения in vitro для пеллет мезилата разагилина (1,0 мг) со слоем покрытия с пролонгированным высвобождением (ПВ), содержащие подслой покрытия, из Примеров 7-8 (15% ПВ и 16% ПВ, соответственно) в буфере IFS.
На Фиг.6 приведены данные растворения in vitro для пеллет мезилата разагилина (1,0 мг) со слоем покрытия с пролонгированным высвобождением (ПВ), содержащие подслой покрытия, из Примера 7 (15% ПВ) в (i) буфере IFS (рН 6,8), имитирующем условия в кишечнике; (ii) буферном растворе желудочного сока (GFS) (рН 1,2), имитирующем условия в пустом желудке; (iii) буфере GFS в течение 2 часов, а затем буфере IFS в течение еще 20 часов; (iv) ацетатном буфере (рН 4,5), имитирующем условия в полном желудке; и (v) дистиллированной воде (DI).
На Фиг.7 приведены данные исследования стабильности in vitro в буфере IFS для пеллет мезилата разагилина (1,0 мг) со слоем покрытия с пролонгированным высвобождением (ПВ), содержащих подслой покрытия, из Примера 7 (15% ПВ) в нулевой момент времени (сразу после получения), через 1 месяц при 40°С и 75% влажности (1М Аcc.) и через 2 и 3 месяца при 40°С и 75% влажности (2М Аcc. и 3М Аcc., соответственно).
На Фиг.8 приведены данные растворения in vitro для пеллет мезилата разагилина со слоем покрытия с пролонгированным высвобождением (ПВ), содержащих подслой покрытия, из Примера 7 (27% ПВ) в буфере IFS.
На Фиг.9 показан график зависимости концентрации разагилина в плазме крови (нг/мл) от времени, вводимого способом внутривенного болюсного введения, дуоденального болюсного введения или болюсного введения в толстую кишку.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Основной причиной ингибирования моноаминоксидазы Б (МАО-Б) при болезни Паркинсона является повышение активности стриарного допамина, приводящее к симптоматическим полезным эффектам в отношении двигательной функции. Поскольку МАО-Б ответственна, среди прочего, за гидролиз допамина, ингибирование МАО-Б вызывает увеличение уровня допамина. Согласно описанному механизму действия, активность разагилина отделена от его фармакокинетики вследствие того, что ингибирование МАО-Б разагилином является необратимым и, таким образом, эффект, обусловленный указанным ингибированием, сохраняется до образования новой МАО-Б, т.е. в течение примерно 2-3 недель. Следовательно, можно предположить, что не будет никакого полезного эффекта от введения разагилина способом с замедленным высвобождением. Тем не менее, недавно полученные данные показывают, что разагилин может индуцировать нейропротективное действие по альтернативному механизму - через ингибирование апоптоза или других путей. Также известно, что разагилин подвергается значительному метаболизму, и его основной метаболит, 1-аминоиндан, обладает нейропротекторной активностью, не связанной с ингибированием МАО-Б (Bar-Am et al., 2007; Weinreb et al., 2010).
Разагилин, селегилин и другие структурно родственные производные пропаргиламина увеличивают выживаемость нейронов независимо от ингибирования МАО-Б, отчасти за счет уменьшения апоптоза (Tatton et al., 2002). Данный эффект наиболее вероятно модулируется за счет изменения уровней или субклеточной локализации белков, влияющих на проницаемость мембраны митохондрий, удаляющих окислительные радикалы или участвующих в конкретных сигнальных путях апоптоза. Было подтверждено, что как разагилин, так и селегилин, а также другие производные пропаргиламина защищают нейроны от клеточной гибели, индуцируемой различными поражениями в моделях нейродегенеративных нарушений в клетках и у животных, таких как болезнь Паркинсона и болезнь Альцгеймера. Цепь пропаргиламина придает дозозависимые антиоксидантные и антиапоптотические эффекты, которые ассоциировали с нейропротекторным действием во многих экспериментальных моделях. Согласно недавним публикациям, нейропротекторное действие разагилина может быть связано с действием, обусловленным комбинацией разагилина и его метаболита 1-аминоиндана (Tazik et al., 2009; Bar-Am, 2010).
В соответствии с одним из аспектов настоящего изобретения предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, приготовленная в форме для пролонгированного высвобождения указанного активного агента.
Идея, лежащая в основе настоящего изобретения, основана на результатах, приведенных в разделе Примеры далее. В Примере 1 показано, что в то время как однократное введение возрастающих доз разагилина (0,1, 0,12 или 0,15 мг/кг) в модели БП, индуцированной МРТР, у мышей оказывало практически схожее действие на уровни допамина, приводя к повышению содержания допамина до примерно 60% по сравнению с мышами, не получавшими лекарственное средство (подвергнутые воздействию МРТР), введение таких же трех доз разагилина способом с замедленным высвобождением в течение 24 часов приводило к значительному эффекту дозы, при котором уровни допамина составляли 57%, 74% и 88%, соответственно, по сравнению с мышами, не получавшими лекарственное средство, что указывает на высоко благоприятный эффект введения способом с замедленным высвобождением по сравнению со способом с быстрым высвобождением в отношении уровней допамина в головном мозге мышей, подвергнутых воздействию МРТР. В Примере 2 описано исследование с использованием такой же модели БП у мышей, в котором мышей лечили метаболитом разагилина - 1-аминоинданом, и показано, что лечение 1-аминоинданом, вводимым способом с замедленным высвобождением, вызывает значительное восстановление уровней допамина по сравнению с уровнями у мышей, получавшими лечение разбавителем (физиологическим раствором) или тем же лекарственным средством, вводимым путем ежедневных инъекций. Эти выводы также подтверждены исследованием, описанным в Примере 3, показывающим, что в модели БП, индуцированной 6-OHDA, у крыс наблюдают значительно улучшенный эффект при чистом вращении (CW-CCW), индуцированном амфетамином, у крыс, получавших лечение разагилином, вводимым способом с замедленным высвобождением, по сравнению с крысами, получавшими лечение тем же лекарственным средством путем ежедневных инъекций.
Как в действительности показано в настоящем описании в первый раз, когда разагилин вводят способом с пролонгированным высвобождением, воздействие указанного лекарственного средства или его активного метаболита, 1-аминоиндана, значительно продлевается, обеспечивая, таким образом, гораздо более эффективное нейропротективное действие, которое может заметно улучшать состояние пациента. В соответствии с данной идей, как разагилин, так и селегилин, являющиеся ингибиторами МАО-Б, показанными для лечения болезни Паркинсона, а также другие производные пропаргиламина, можно считать «пролекарствами», непрерывно высвобождающими активный агент, или «доставляющими разбавителями» пропаргиламина/аминоиндана. Данные пролекарства или доставляющие разбавители независимо от их ингибирующей активности в отношении МАО, защищают нервные клетки на разных стадиях процесса апоптоза за счет постоянного замедленного воздействия активного агента, определенного выше, т.е. активного агента, содержащего пропаргиламинный фрагмент, аминоиндановый фрагмент, или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемой соли.
Согласно настоящему изобретению можно использовать любую фармацевтически приемлемую соль активного агента. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, мезилатную соль, эзилатную соль, тозилатную соль, сульфатную соль, сульфонатную соль, фосфатную соль, карбоксилатную соль, малеатную соль, фумаратную соль, тартратную соль, бензоатную соль, ацетатную соль, гидрохлоридную соль и гидробромидную соль.
В некоторых вариантах реализации активный агент, содержащийся в фармацевтической композиции согласно настоящему изобретению, представляет собой N-пропаргил-1-аминоиндан, его энантиомер, его метаболит, его аналог или фармацевтически приемлемую соль любого из вышеуказанных соединений.
В одном из конкретных вариантов реализации активный агент представляет собой N-пропаргил-1-аминоиндан в рацемической форме, как описано, например, в US 6630514, или его фармацевтически приемлемую соль.
В других конкретных вариантах реализации активный агент представляет собой R(+)-N-пропаргил-1-аминоиндан (разагилин), его S-энантиомер S-(-)-N-пропаргил-1-аминоиндан или его фармацевтически приемлемую соль. В более конкретных вариантах реализации активный агент представляет собой мезилатную соль, эзилатную соль, тозилатную соль, сульфатную соль, сульфонатную соль, фосфатную соль, карбоксилатную соль, малеатную соль, фумаратную соль, тартратную соль, бензоатную соль, ацетатную соль, гидрохлоридную соль или гидробромидную соль либо разагилина, либо S-(-)-N-пропаргил-1-аминоиндана. В предпочтительных вариантах реализации активный агент представляет собой мезилат разагилина, описанный, например, в US 5532415; эзилат разагилина или сульфат разагилина, описанные, например, в US 5599991; или гидрохлорид разагилина, описанный, например, в US 6630514, и, более предпочтительно, мезилат разагилина.
В другом конкретном варианте реализации активный агент представляет собой метаболит разагилина - 1-аминоиндан, или его фармацевтически приемлемую соль.
В еще других конкретных вариантах реализации активный агент представляет собой аналог N-пропаргил-1-аминоиндана, его энантиомера или его фармацевтически приемлемую соль. Примеры указанных аналогов включают соединения, описанные в US 5486541, такие как, без ограничения ими, 4-фтор-N-пропаргил-1-аминоиндан, 5-фтор-N-пропаргил-1-аминоиндан и 6-фтор-N-пропаргил-1-аминоиндан; соединения, описанные в US 6251938, такие как, без ограничения ими, 3-(N-метил-N-пропилкарбамилокси)-α-метил-N'-пропаргилфенэтиламин, 3-(N,N-диметилкарбамилокси)-α-метил-N'-метил-N'-пропаргилфенэтиламин; 3-(N-метил-N-гексилкарбшилокси)α-метил-N'-метил-N'-пропаргилфенэтиламин; 3-(N-метил-N-циклогексилкарбамилокси)-α-метил-N'-метил-N'-пропаргилфенэтиламин и 3-(N-метил-N-гексилкарбамилокси)-α-метил-N'-метил-N'-пропаргилфенэтиламин; соединения, описанные в US 6303650, такие как, без ограничения ими, 6-(N-метил-N-этилкарбамилокси)-N'-пропаргил-1-аминоиндан; 6-(N,N-диметилкарбамилокси)-N'-метил-N'-пропаргил-1-аминоиндан; 6-(N-метил-N-этилкарбамилокси-N'-пропаргил-1-аминотетралин; 6-(N,N-диметилтиокарбамилокси)-1-аминоиндан; 6-(N-пропилкарбамилокси)-N'-пропаргил-1-аминоиндан; 5-хлор-6-(N-метил-N-пропилкарбамилокси)-N'-пропаргил-1-аминоиндан и 6-(N-метил)-N-пропилкарбамилокси)-N'-пропаргил-1-аминоиндан; и соединения, описанные в US 6462222, такие как, без ограничения ими, 6-(N-метил-N-этилкарбамилокси)-N'-метил-N'-пропаргил-1-аминоиндан.
В некоторых других вариантах реализации активный агент, содержащийся в фармацевтической композиции согласно настоящему изобретению, представляет собой пропаргиламин, алифатический пропаргиламин или его фармацевтически приемлемую соль.
В одном из конкретных вариантов реализации активный агент представляет собой пропаргиламин или его фармацевтически приемлемую соль.
В других конкретных вариантах реализации активный агент представляет собой алифатический пропаргиламин, описанный в US 5169868, US 5840979 или US 6251950, такой как, не ограничиваясь ими, N-(1-гептил)пропаргиламин; N-(1-октил)пропаргиламин; N-(1-нонил)пропаргиламин; N-(1-децил)пропаргиламин; N-(1-ундецил)пропаргиламин; N-(1-додецил)пропаргиламин; N-(2-бутил)пропаргиламин; N-(2-пентил)пропаргиламин; N-(2-гексил)пропаргиламин; N-(2-гептил)пропаргиламин; N-(2-октил)пропаргиламин; N-(2-нонил)пропаргиламин; N-(2-децил)пропаргиламин; N-(2-ундецил)пропаргиламин; N-(2-додецил)пропаргиламин; N-(1-бутил)-N-метилпропаргиламин; N-(2-бутил)-N-метилпропаргиламин; N-(2-пентил)-N-метилпропаргиламин; (1-пентил)-N-метилпропаргиламин; N-(2-гексил)-N-метилпропаргиламин; (2-гептил)-N-метилпропаргиламин; N-(2-децил)-N-метилпропаргиламин; (2-додецил)-N-метилпропаргиламин; энантиомер указанных соединений; или фармацевтически приемлемую соль указанных соединений.
В некоторых других вариантах реализации активный агент, содержащийся в фармацевтической композиции согласно настоящему изобретению, представляет собой селегилин, десметилселегилин, паргилин или хлоргилин.
В другом варианте реализации активный агент, содержащийся в фармацевтической композиции согласно настоящему изобретению, представляет собой (N-метил-N-пропаргил)-10-аминометилдибензо[b,f]оксепин, также известный как: CGP 3466 и описанный в публикации Zimmermann et al. (1999).
Полное содержание всех патентов США и других публикаций, указанных выше, включено в настоящее описание посредством ссылки так, как если бы было полностью приведено в настоящем документе.
Термины «пролонгированное высвобождение» (ПВ), «контролируемое высвобождение» или «замедленное высвобождение» (ЗВ), являющиеся взаимозаменяемыми в настоящем описании, относятся к такому режиму высвобождения активного агента из его состава, при котором он всасывается в организме в течение определенного периода времени. Состав активного агента с пролонгированным высвобождением может быть получен, например, путем заключения указанного активного агента в каркас вещества, которое организм медленно растворяет, так, чтобы активный ингредиент медленно и постоянно «просачивался» из слоя покрытия, или за счет набухания активного агента с образованием геля с почти непроницаемой поверхностью, при этом лекарственное средство медленно выходит из полупроницаемого слоя.
Основные принципы получения продукта с контролируемым высвобождением заключаются в высвобождении вещества в определенном месте (прицельное воздействие); с постоянной скоростью; и в пределах необходимого терапевтического окна. Механизмы, основанные на принципе Системы контроля растворителями (Solvent Controlled System), такой как системы набухания и осмоса, поддерживающие постоянную концентрацию активного вещества в крови в течение длительных периодов времени, позволяют достигать более эффективных уровней лекарственного средства с меньшими побочными эффектами. Иными словами, терапевтическое окно представляет собой дозу лекарственного средства между количеством, оказывающим эффект (эффективная доза), и количеством, оказывающим больше побочных эффектов, чем желаемых эффектов. Поэтому, характеристики растворения каждого лекарственного средства должны быть соответствовать индивидуальной биодоступности, месту воздействия и всасываемости каждого соединения.
Фармацевтическая композиция согласно настоящему изобретению должна обеспечивать контролируемое высвобождение лекарственного средства, т.е. активного агента. В некоторых вариантах реализации лекарственное средство высвобождается из фармацевтической композиции способом с контролируемым высвобождением согласно кривой высвобождения нулевого, первого, второго или любого другого порядка (N порядка). Контролируемое высвобождение лекарственного средства предпочтительно должно быть медленными, и в некоторых вариантах реализации фармацевтическую композицию готовят в форме для непрерывного замедленного высвобождения лекарственного средства, пульсирующего высвобождения лекарственного средства, многоэтапного высвобождения лекарственного средства или их комбинацию.
Фармацевтические композиции согласно настоящему изобретению могут быть получены традиционными способами, например, описанными в Remington: The Science and Practice of Pharmacy, 19th Ed., 1995, могут находиться в любой традиционной форме и могут быть представлены в различных дозировках.
Композиции могут быть приготовлены в форме для любого подходящего способа введения, например, внутривенного, внутриартериального, внутримышечного, подкожного или интраперитонеального введения, но, предпочтительно, их готовят в форме для перорального введения.
Доза будет зависеть от состояния пациента и будет определяться по усмотрению лечащего врача. В конкретных вариантах реализации доза составляет 0,1-2,0, предпочтительно, 0,2-1,5, более предпочтительно, 0,5-1,0 мг в сутки для взрослого с массой тела 60 кг. Композиции согласно настоящему изобретению можно вводить, например, непрерывно, ежедневно, два раза в сутки, три раза в сутки или четыре раза в сутки, в течение периодов различной длительности, например, недель, месяцев, лет или десятилетий.
Фармацевтическая композиция согласно настоящему изобретению может, например, находиться в форме стерильной водной или масляной суспензии для инъекций, которая может быть приготовлена в соответствии с известными в данной области способами с применением подходящих диспергирующих, смачивающих или суспендирующих агентов. Стерильный лекарственный препарат для инъекций также может представлять собой стерильный раствор или суспензию для инъекций в приемлемом для парентерального введения нетоксичном разбавителе или растворителе. Приемлемые для использования разбавители и растворители включают, но не ограничиваются ими, воду, раствор Рингера и изотонический раствор хлорида натрия.
Фармацевтические композиции согласно настоящему изобретению, приготовленные для перорального введения, могут быть в форме таблеток, пастилок, леденцов, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов или эликсиров. Фармацевтические композиции, предназначенные для перорального применения, могут быть приготовлены в соответствии с любым способом, известным в данной области техники для приготовления фармацевтических композиций, и могут дополнительно содержать один или более агентов, выбранных из подсластителей, ароматизаторов, красителей и консервантов, с целью получения фармацевтически привлекательных и приятных на вкус препаратов. Таблетки содержат активный агент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, подходящими для изготовления таблеток. Данные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты и вещества, улучшающие распадаемость таблеток, такие как кукурузный крахмал или альгиновая кислота; связующие вещества; и смазывающие вещества. На таблетки предпочтительно наносят покрытие с использованием известных способов для задерживания распада и всасывания в желудочно-кишечном тракте и, тем самым, обеспечения пролонгированного высвобождения лекарственного средства в течение более длительного периода времени. Например, может быть использовано вещество с замедленным распадом, такое как глицерилмоностеарат или глицерилдистеарат. На них также может быть нанесено покрытие с использование способов, описанных в патентах США US 4256108, US 4166452 и US 4265874, с получением осмотических терапевтических таблеток для контроля высвобождения. Фармацевтическая композиция согласно настоящему изобретению также может быть в форме двухслойных таблеток, в которых два или более различных слоев гранулята спрессованы вместе и отдельными слоями лежат один поверх другого, при этом каждый отдельный слой получен для обеспечения разных режимов высвобождения лекарственного средства. Фармацевтическая композиция для перорального применения согласно настоящему изобретению также может быть в форме эмульсии «масло-в-воде».
Фармацевтические композиции согласно настоящему изобретению также могут быть изготовлены в виде матрицы с контролируемым высвобождением, например, в виде матричных таблеток с контролируемым высвобождением, в которых высвобождение растворимого активного агента контролируется за счет наличия активной диффузии через гель, образованный после набухания гидрофильного полимера, приведенного в контакт с растворяющей жидкостью (in vitro) или желудочно-кишечной жидкостью (in vivo). Было описано множество полимеров, способных образовывать такой гель, например, производные целлюлозы, в частности, простые эфиры целлюлозы, такие как гидроксипропилцеллюлоза, гидроксиметилцеллюлоза, метилцеллюлоза или гидроксипропилметилцеллюлоза, и среди разных коммерческих доступных таких эфиров есть соединения с довольно высокой вязкостью. В других вариантах реализации указанные композиции содержат активный агент, негодящийся в микроинкапсулированной лекарственной форме с контролируемым высвобождением, представляющей собой мелкие вкрапления активного агента, покрытые оболочкой или мембраной с образованием частиц размером от нескольких микрометров до нескольких миллиметров.
Другая предполагаемая лекарственная форма представляет собой депо-системы на основе биоразлагаемых полимеров, в которых по мере распада полимера медленно высвобождается активный агент. Наиболее распространенной группой биоразлагаемых полимеров являются гидролитически лабильные полиэфиры, полученные из молочной кислоты, гликолевой кислоты или их комбинаций.
Фармацевтическая композиция согласно настоящему изобретению может содержать один или более фармацевтически приемлемых наполнителей. Например, таблетка может содержать по меньшей мере один наполнитель, например, лактозу, этилцеллюлозу, микрокристаллическую целлюлозу, силицированную микрокристаллическую целлюлозу; по меньшей мере один разрыхлитель, например, поперечно-сшитый поливинилпирролидон; по меньшей мере одно связующее вещество, например, поливинилпиридон, гидроксипропилметилцеллюлозу; по меньшей мере одно поверхностно-активное вещество, например, лаурилсульфат натрия; по меньшей мере одно вещество, способствующее скольжению, например, коллоидный диоксид кремния; и по меньшей мере одно смазывающее вещество, например, стеарат магния.
В Примерах 4-6 далее описано получение трех типов пеллет мезилата разагилина со слоем покрытия с пролонгированным высвобождением (ПВ), содержащих слой лекарственного средства, покрывающий инертные пеллеты, и слой покрытия с пролонгированным высвобождением, т.е. функциональный слой, покрывающий указанный слой лекарственного средства (слой ПВ - 15%, 22% и 28%). Для получения слоя лекарственного средства повидон USP (PVP К29/32) растворяли в смеси дистиллированной воды и этанола; лекарственное средство растворяли в полученном растворе; затем диспергировали сверхтонкий тальк и добавляли его к указанному раствору с образованием однородной суспензии, которую наносили на сахарные сферические частицы размером 600-710 мкм (диаметр). Для получения покрывающих пленок ПВ различной толщины готовили один раствор, из которого во время процесса нанесения покрытия в различные моменты времени отбирали пробы, соответствующие различным количествам распыляемого раствора, в результате нанесения которых формируются слои различной толщины. Указанный раствор состоял из Ethocel 45 сПз (этилцеллюлоза; полимер, контролирующий высвобождение), растворенной в смеси ацетона и этанола; и полиэтиленгликоля (ПЭГ) 4000, растворенного в дистиллированной воде, которые затем смешивали с образованием гомогенного раствора. Функциональный раствор наносили на содержащие лекарственное средство пеллеты, описанные выше, с образованием пленок ПВ различной толщины. Характеристики растворения пеллет с разными покрытиями ПВ оценивали в Аппарате 1 (корзина) согласно Фармакопее США (USP) при скорости вращения шпинделя 100 об/мин и температуре 37°C с использованием раствора кишечной жидкости (IFS, рН 6,8), имитирующего условия в кишечнике, и, как показано, скорость высвобождения зависела от толщины пленки, и при большей толщине функционального слоя высвобождение происходило более медленно.
В Примерах 7-8 описано получение двух типов пеллет мезилата разагилина со слоем покрытия ПВ, содержащих слой лекарственного средства, покрывающий инертные пеллеты, подслой покрытия, покрывающий указанный слой лекарственного средства, и функциональный слой, покрывающий указанный подслой покрытия (слой ПВ - 15% и 18%). Для получения слоя лекарственного средства повидон (PVP К25) растворяли в смеси дистиллированной воды и этанола; лекарственное средство растворяли в полученном растворе; затем диспергировали сверхтонкий тальк и добавляли к полученному раствору с образованием однородной суспензии, которую затем наносили на сахарные сферические частицы размером 600-710 мкм. Раствор для подслоя покрытия готовили растворением PVP К25 в смеси дистиллированной воды и этанола, а затем наносили на загруженные лекарственным средством пеллеты. Для получения покрывающих пленок ПВ различной толщины готовили один раствор, из которого во время процесса нанесения покрытия в различные моменты времени отбирали пробы, соответствующие различным количествам распыляемого раствора, в результате нанесения которых формируются слои различной толщины. Указанный раствор состоял из Ethocel 45 сПз, растворенной в смеси ацетона и этанола; и ПЭГ 3000, растворенного в дистиллированной воде, которые затем смешивали с образованием гомогенного раствора. Сверхтонкий тальк диспергировали в дистиллированной воде и добавляли к раствору с образованием однородной суспензии, которую затем наносили на пеллеты с подслоем покрытия с образованием пленок ПВ различной толщины. Затем полученные пеллеты смешивали в сухом виде с Аэросилом 200 (Aerosil 200). Характеристики растворения полученных пеллет с двумя разными покрытиями ПВ оценивали в Аппарате 1 USP при 100 об/мин и температуре 37°C с использованием (i) IFS (рН 6,8), имитирующего условия в кишечнике; (ii) раствора желудочного сока (GFS, рН 1,2), имитирующего условия в пустом желудке, в течение 2 часов, а затем IFS в течение еще 20 часов; и (iii) ацетатного буфера (рН 4,5), имитирующего условия в полном желудке, и, как показано, скорость высвобождения оставалась постоянной (в пределах приемлемого диапазона ±10% для тестирования растворимости) в диапазоне рН 1,2-6,8 за счет присутствия в слое ПВ pH-зависимых полимеров, и оставалась стабильной в течение 3 месяцев несмотря на то, что пеллеты выдерживали в условиях ускоренного старения для оценки стабильности. Скорость высвобождения активного агента из пеллет с покрытием 15% ПВ была выше, чем из пеллет с покрытием 18% ПВ вследствие разной толщины функционального слоя.
В Примере 9 описано получение третьего типа пеллет мезилата разагилина со слоем покрытия ПВ, содержащих слой лекарственного средства, покрывающий инертные пеллеты, подслой покрытия и внешний функциональный слой с более высоким процентным содержанием (27%) слоя покрытия ПВ, которые смешивали в сухом виде с диоксидом кремния вместо Аэросила 200, используемого в Примерах 7-8. Характеристики растворения таких пеллет определяли в Аппарате 1, USP, при 100 об/мин и температуре 37°C с использованием IFS (рН 6,8), и, как показано, высвобождение в данном случае происходило медленнее, чем в случае пеллет из Примеров 7-8, вследствие разной толщины функционального слоя.
Дополнительные пеллеты мезилата разагилина ПВ с подслоем покрытия или без него, имеющие другие профили высвобождения лекарственного средства, описаны в Примере 10.
При создании продукта 24-часового пролонгированного высвобождения для перорального введения необходимо, чтобы лекарственное средство абсорбировалось в течение всего периода высвобождения, т.е. во всех отделах желудочно-кишечного тракта, включая двенадцатиперстную кишку и толстую кишку. В Примере 11 описано фармакокинетическое исследование, в котором однократную болюсную дозу разагилина вводили в виде водного раствора в толстую кишку, двенадцатиперстную кишку или яремную вену крыс, образцы крови забирали у животных за 5 минут до введения дозы и через 5, 15, 30, 50, 90, 150 и 200 минут после введения дозы, и измеряли содержание как разагилина, так и его метаболита в плазме крови. Как видно, исходный Т1/2 для групп введения в толстую и двенадцатиперстную кишку был больше по сравнению с Т1/2 для внутривенного введения. Кроме того, рассчитанные значения площади под кривой (ППК) для внутривенной дозы и дозы для двенадцатиперстной кишки оказались близкими, что позволяет предположить полную абсорбцию при пероральном введении, тогда как значение ППК после введения в толстую кишку составляло приблизительно 28% от значения ППК для внутривенной дозы, что подтверждает возможность абсорбции в толстой кишке.
С учетом характеристик растворения, приведенных для различных типов пеллет мезилата разагилина с покрытием ПВ, описанных выше, и исследования, описанного выше, демонстрирующего абсорбцию разагилина в различных отделах желудочно-кишечного тракта, в некоторых вариантах реализации фармацевтическую композицию согласно настоящему изобретению изготавливают в форме для перорального введения. В конкретных вариантах реализации фармацевтическая композиция может быть твердой в форме частиц, зерен, шариков или пеллет, которые смешивают и заключают в капсулы или саше или прессуют в таблетки любым традиционным способом, известным в данной области техники, как показано для некоторых пеллет мезилата разагилина ПВ, описанных в Примере 10. Например, предложена таблетка, в которой активный агент присутствует по меньшей мере в двух отдельных слоях, т.е. двухслойная или многослойная таблетка, при этом указанные слои возможно разделены промежуточным неактивным слоем, например, слоем, содержащим один или более разрыхлителей. Фармацевтическая композиция также может представлять собой полужидкую или жидкую систему.
В некоторых вариантах реализации фармацевтическая композиция согласно настоящему изобретению, изготовленная в форме для перорального введения, находится в форме монолитной матрицы, т.е. структуры, включающей пространственно стабильный матричный материал, имеющий дискретный размер и форму; таблетки, такой как двухслойная или многослойная таблетка, матричная таблетка, распадающаяся таблетка, растворяющаяся таблетка или жевательная таблетка; или капсулы или саше, например, заполненного гранулами, зернами, шариками или пеллетами. В некоторых других вариантах реализации фармацевтическая композиция согласно настоящему изобретению, изготовленная в форме для перорального введения, находится в форме депо-системы на основе биоразлагаемых полимеров, в которой по мере распада полимера медленно высвобождается активный агент. Наиболее распространенной группой биоразлагаемых полимеров являются гидролитически лабильные полиэфиры, полученные из молочной кислоты, гликолевой кислоты или их комбинаций. Примеры биоразлагаемых полимеров, полученных из данных конкретных мономеров, включают, но не ограничиваются ими, поли(D,L-лактид) (PLA), полигликолид (полигликолевую кислоту; PGA) и сополимер поли(D,L-лактид-ко-гликолид) (PLGA).
В некоторых конкретных вариантах реализации согласно настоящему изобретению предложена фармацевтическая композиция, определенная выше, т.е. фармацевтическая композиция, содержащая активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, при этом указанная композиция имеет следующие характеристики растворения в Аппарате 1 (корзина), USP, при 50-150, предпочтительно 100 об/мин при значении рН до 7,4, предпочтительно 1,12-6,8, при 37°С:
| Время (часы) | Средний % высвобождения активного агента |
| 2 | <30 |
| 6 | 30-70 |
| 12 | 50-85 |
| 24 | >70 |
Предпочтительно фармацевтические композиции представляют собой композиции, имеющие следующие характеристики растворения в Аппарате 1 (корзина), USP, при 50-150, предпочтительно 100 об/мин при значении рН до 7,4, предпочтительно 1,2-6,8, при 37°С:
| Время (часы) | Предпочтительный средний % высвобождения активного агента |
| 2 | <30 |
| 6 | 30-60 |
| 12 | 50-70 |
| 24 | >70 |
В более конкретных вариантах реализации активный агент, содержащийся в данной композиции, представляет собой N-пропаргил-1-аминоиндан; его энантиомер, т.е. разагилин или S-(-)-N-пропаргил-1-аминоиндан; его метаболит, в частности, 1-аминоиндан; его аналог или фармацевтически приемлемую соль любого из вышеуказанных соединений. В более конкретных вариантах реализации активный агент, содержащийся в данной композиции, представляет собой разагилин или его фармацевтически приемлемую соль.
В некоторых вариантах реализации фармацевтические композиции согласно настоящему изобретению при их введении обеспечивают более низкую Cmax и меньший индекс колебаний, и приводят к меньшим нежелательным побочным эффектам по сравнению с лекарственной формой с быстрым высвобождением. В настоящем описании термин «Cmax» относится к максимальной концентрации терапевтического лекарственного средства в плазме крови; и термин «индекс колебаний» в настоящем описании относится к изменениям концентрации терапевтического лекарственного средства в сыворотке в зависимости от времени после введения лекарственного средства. Нежелательные побочные эффекты от приема разагилина включают, но не ограничиваются ими, тяжелые аллергические реакции (сыпь; крапивницу; зуд; затруднение дыхания; сдавленность в груди; отек рта, лица, губ или языка); стул черного цвета или кровянистый стул; кровь в моче; затуманенное зрение; изменения половой функции или желания; боль в груди; спутанность сознания; депрессию; расширенные зрачки; частое или нерегулярное сердцебиение; лихорадку; галлюцинации; неспособность сидеть спокойно; онемение или покалывание рук или ног; одностороннюю слабость; припадки; чувствительность к свету; сильную головную боль; изменения кожи; боль или ригидность затылочных мышц; тремор; затруднение мышления: или ходьбы; необъяснимую тошноту или рвоту; несвойственную потливость; проблемы со зрением или речью; диарею; головокружение; сонливость; сухость во рту; гриппоподобные симптомы; головную боль; боль в суставах; дурноту; бессонницу; расстройство желудка; и заложенность носа.
В соответствии с другим аспектом настоящего изобретения предложена пеллета с пролонгированным высвобождением, содержащая:
(i) инертное ядро пеллеты;
(ii) слой лекарственного средства, покрывающий указанное ядро пеллеты, при этом указанный слой лекарственного средства содержит активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, возможно подходящим образом смешанные со связующим веществом и/или пленкообразующим полимером и возможно смешанные с веществом, способствующим скольжению;
(iii) возможно, изолирующий/защитный подслой покрытия, покрывающий указанный слой лекарственного средства; и
(iv) слой покрытия с замедленным высвобождением, покрывающий указанный подслой покрытия (при его наличии) или указанный слой лекарственного средства.
Пеллета ПВ согласно настоящему изобретению может возможно содержать изолирующий/защитный подслой покрытия, покрывающий указанный слой лекарственного средства. Роль данного подслоя покрытия заключается в изолировании слоя активного вещества от внешнего покрытия ПВ и защите от возможных взаимодействий с активным агентом, которые могут влиять на его стабильность и приводить к образованию продуктов распада активной фармацевтической субстанции (АФС). В некоторых вариантах реализации подслой покрытия содержит пленкообразующий полимер и, возможно, вещество, способствующее скольжению.
Пеллета ПВ согласно настоящему изобретению содержит внешний слой покрытия ПВ, также называемый в настоящем описании «функциональным слоем», покрывающий подслой покрытия (при его наличии) либо слой лекарственного средства.
В некоторых вариантах реализации слой покрытия ПВ содержит по меньшей мере один pH-независимый полимер, т.е. набухающий вводе/водонерастворимый/гидрофобный полимер и возможно порообразующий агент, при этом пеллета с пролонгированным высвобождением характеризуется pH-независимым высвобождением in vitro. В других вариантах реализации функциональный слой содержит pH-независимый полимер, гидрофильный полимер-модулятор высвобождения, выступающий в качестве порообразующего агента, и возможно гидрофобный или гидрофильный пластификатор и/или вещество, способствующее скольжению. В некоторых других вариантах реализации слой покрытия ПВ содержит смесь pH-зависимого полимера для энтеросолюбильного покрытия и pH-независимого полимера, при этом при значениях рН не более 7,4 пеллета с пролонгированным высвобождением имеет характеристику высвобождения in vitro, порядок которого близок к нулевому порядку.
Связующие вещества для применения в фармацевтике представляют собой гидрофильные вещества, такие как сахара и полимеры природного и синтетического происхождения, используемые в изготовлении твердых лекарственных форм вследствие их адгезионных и когезионных свойств. Роль связующих веществ заключается в способствовании увеличения размера частиц за счет придания порошкам когезионной способности, таким образом, обеспечивая гранулы и таблетки необходимой прочностью сцепления. Хотя связующие вещества улучшают внешний вид, твердость и прочность на истирание данных препаратов, они не влияют на скорость распада или растворения активных веществ. Связующие вещества природного происхождения, которые широко использовали раньше, включают гуммиарабик, желатин, крахмал и гидролизованный крахмал. Эти вещества заменили связующие вещества синтетического происхождения, наиболее важными из которых являются повидон и различные производные целлюлозы. Примеры связующих веществ, которые могут быть смешаны с активным агентом в слое лекарственного средства, покрывающем пеллету ПВ согласно настоящему изобретению, включают, но не ограничиваются ими, поливинилпирролидон (PVP), гидроксипропилметилцеллюлозу (ГПМЦ), гидроксипропилцеллюлозу (ГПЦ), микрокристаллическую целлюлозу и их комбинации. Связующее вещество может присутствовать в количестве от примерно 0,5% до примерно 20%, предпочтительно от примерно 0,5% до примерно 10% от массы всей пеллеты.
В настоящем описании термин «пленкообразующий полимер» относится к полимерам, способным затвердевать с образованием адгезивных пленок. Кроме того, физическим свойством данных полимеров, необходимым для нанесения в качестве покрытия, является способность образовывать пленки или некоторая адгезионная способность в отношении материала, на которое наносят покрытие. Примеры пленкообразующих полимеров включают, но не ограничиваются ими, PVP, ГПМЦ, ГПЦ, микрокристаллическую целлюлозу и их комбинации. Пленкообразующий полимер, содержащийся в слое лекарственного средства, может присутствовать в количестве до 90% от массы всего слоя лекарственного средства, предпочтительно от примерно 0,5% до примерно 20% от массы всей пеллеты. Количество пленкообразующего полимера в подслое покрытия может составлять до 100% от массы всего подслоя покрытия, предпочтительно от примерно 0,5% до примерно 10% от массы всей пеллеты.
Вещества, способствующие скольжению, как правило, добавляют в фармацевтические композиции для повышения текучести гранулятов и порошков за счет уменьшения трения и поверхностного заряда. Кроме того, их используют в качестве веществ, препятствующих слипанию, во время процесса нанесения покрытия. Определенные вещества, способствующие скольжению, такие как тальк и глицерилмоностеарат, обычно используют в составах для нанесения покрытий в качестве веществ, препятствующих слипанию, уменьшающих склонность к слипанию частиц при более низких температурах продукта. Другие вещества, способствующие скольжению, такие как коллоидный диоксид кремния, обеспечивают желаемые характеристики текучести, которые используют для улучшения сыпучести сухих порошков в ряде таких процессов, как таблетирование и капсулирование, из-за малого размера их частиц и большой удельной поверхности. Не ограничивающие примеры веществ, способствующих скольжению, включают тальк, в частности, сверхтонкий тальк, коллоидный диоксид кремния, глицерилмоностеарат и их комбинации.
Вещество, способствующее скольжению, когда оно содержится в слое лекарственного средства, может присутствовать в количестве до 30% от массы всего слоя лекарственного средства, предпочтительно от примерно 0,5% до примерно 5% от массы всей пеллеты. Количество вещества, способствующего скольжению при содержании его в подслое покрытия может составлять до примерно 10% от массы всего подслоя покрытия, предпочтительно от примерно 0,5% до примерно 5% от массы всей пеллеты.
Примеры pH-независимых полимеров, которые могут содержаться в пеллете ПВ согласно настоящему изобретению, включают, но не ограничиваются ими, этилцеллюлозу, Surelease®, сополимеры сложных эфиров акриловой и метакриловой кислот, такие как Эудрагит® RL (Eudragit® RL) (поли(этилакрилат, метилметакрилат, триметиламмониоэтилметакрилата хлорид), 1:2:0,2), Эудрагит® RS (поли(этилакрилат, метилметакрилат, триметиламмониоэтилметакрилата хлорид), 1:2:0,1)., Эудрагит® NE (поли(этилакрилат, метилметакрилат), 2:1) и их комбинации. pH-независимый полимер может присутствовать в количестве от примерно 10% до примерно 50%, предпочтительно от примерно 10% до примерно 30% от массы всей пеллеты.
Примеры pH-зависимых полимеров для энтеросолюбильного покрытия, которые могут содержаться в пеллете ПВ согласно настоящему изобретению, включают, но не ограничиваются ими, Эудрагит® S (поли(метакриловая кислота, метилметакрилат), 1:2), Эудрагит® L 55 (поли(метакриловая кислота, этилакрилат), 1:1), Колликоат® (Kollicoat®) (поли(метакриловая кислота, этилакрилат), 1:1), фталат гидроксипропилметилцеллюлозы (ФГПМЦ), альгинаты, карбоксиметилцеллюлозу и их комбинации. pH-зависимый полимер для энтеросолюбильного покрытия может присутствовать в количестве от примерно 10% до примерно 50%, предпочтительно от примерно 10% до примерно 30% от массы всей пеллеты.
В настоящем описании термин «порообразующий агент» относится к веществу, которое растворяется в среде организма, в результате чего в матрице образуются открытые поры, увеличивающие скорость диффузии активного агента через слой покрытия. Размер образуемых пор в некоторой степени можно регулировать с помощью размера используемого зернистого твердого материала. Для однородности размера пор зернистый материал может быть просеян через ряд сит с последовательным уменьшением размера ячеек с получением желаемого диапазона размеров частиц. Порообразующий агент, который может содержаться в пеллетах ПВ согласно настоящему изобретению, представляет собой неорганическое либо органическое вещество, включая, например, поливинилпирролидон (PVP), полиэтиленгликоль (ПЭГ), ГПМЦ, ГПЦ, метилцеллюлозу, 1,2-пропиленгликоль, лактозу, сахарозу, тальк, в частности, сверхтонкий тальк, и их комбинации. Порообразующий агент может присутствовать в количестве от примерно 0,1% до примерно 20%, предпочтительно от примерно 0,1% до примерно 10% от массы всей пеллеты.
В настоящем описании термин «гидрофильный полимер-модулятор высвобождения» относится к водорастворимому полимеру, контролирующему высвобождение активного агента. Тем не менее, в некоторых вариантах реализации гидрофильный полимер-модулятор высвобождения, содержащийся в слое покрытия ПВ пеллеты ПВ согласно настоящему изобретению, на самом деле выступает в качестве порообразующего агента. Примеры гидрофильных полимеров-модуляторов высвобождения включают, но не ограничиваются ими, PVP, ПЭГ, ГПМЦ, ГПЦ и их комбинации. Гидрофильный полимер-модулятор высвобождения может присутствовать в количестве от примерно 0,1% до примерно 20%, предпочтительно от примерно 0,1% до примерно 10% от массы всей пеллеты.
В настоящем описании термин «пластификатор» включает любое соединение или комбинацию соединений, способных пластифицировать или смягчать полимер, используемый в пеллете ПВ согласно настоящему изобретению. В ходе изготовления слоя покрытия ПВ пластификатор может понижать температуру плавления или температуру стеклования (температуру размягчения) используемого полимера или комбинации полимеров; может увеличивать среднюю молекулярную массу указанного полимера или комбинации полимеров, и дополнительно может уменьшать вязкость указанного полимера или комбинации полимеров для удобства обработки раствора для нанесения покрытия. Не ограничивающие примеры пластификаторов включают дибутилсебацинат; дибутилфталат; эфиры лимонной кислоты, такие как триэтилцитрат и триацетин; пропиленгликоль; поли(алкиленоксиды) небольшой молекулярной массы, такие как ПЭГ, поли(пропиленгликоли) и поли(этилен/пропиленгликоли); и их комбинации. Пластификаторы могут присутствовать в количестве от примерно 0,1% до примерно 20%, предпочтительно от примерно 0,1% до примерно 10% от массы всей пеллеты.
Слой покрытия лекарственного средства пеллеты ПВ согласно настоящему изобретению может содержать любой активный агент, как определено выше, т.е. любой активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль. В конкретных вариантах реализации указанный активный агент выбран из N-пропаргил-1-аминоиндана, его энантиомера, его метаболита, его аналога или его фармацевтически приемлемой соли. В более конкретных вариантах реализации активный агент представляет собой разагилин или его фармацевтически приемлемую соль.
Пеллета ПВ согласно настоящему изобретению может содержать дополнительные неактивные ингредиенты, такие как агент, регулирующий осмотическое давление/тоничность. Указанные агенты обычно используют для контролируемого по времени распада, когда необходима пульсирующая доставка лекарственного средства. Примеры подходящих наполнителей, регулирующих осмотическое давление/тоничность, которые могут быть использованы при получении пеллеты ПВ, включают, но не ограничиваются ими, хлорид натрия и маннит. Агент, регулирующий осмотическое давление/тоничность, содержащийся в пеллете ПВ, может присутствовать в количестве до 20%, предпочтительно от примерно 0,5% до примерно 10% от массы всей пеллеты.
В конкретном варианте реализации, приведенном в настоящем описании в качестве примера, пеллеты ПВ, приведенные в качестве примера в настоящем описании, содержат инертное ядро пеллеты; слой лекарственного средства, содержащий активный агент, смешанный с PVP в качестве пленкообразующего полимера/связующего вещества и со сверхтонким тальком в качестве вещества, способствующего скольжению; и слой покрытия ПВ, содержащий этилцеллюлозу в качестве pH-независимого полимера и ПЭГ в качестве порообразующего агента; при этом количество указанного пленкообразующего полимера/связующего вещества составляет до 90% от массы всего слоя лекарственного средства или от примерно 0,5% до примерно 20% от массы всей пеллеты; количество указанного вещества, способствующего скольжению, составляет до 30% от массы всего слоя лекарственного средства или от примерно 0,1% до примерно 10% от массы всей пеллеты; количество указанного pH-независимого полимера составляет от примерно 50% до примерно 90% от массы всего слоя покрытия ПВ или от примерно 10% до примерно 30% от массы всей пеллеты; и количество указанного порообразующего агента составляет от примерно 1% до примерно 20% от массы всего слоя покрытия ПВ или от примерно 0,1% до примерно 10% от массы всей пеллеты.
В других конкретных вариантах реализации, приведенных в качестве примера в настоящем описании, пеллета ПВ согласно настоящему изобретению содержит инертное ядро пеллеты; слой лекарственного средства, содержащий указанный активный агент, смешанный с PVP в качестве пленкообразующего полимера/связующего вещества и со сверхтонким тальком в качестве вещества, способствующего скольжению; изолирующий/защитный подслой покрытия, содержащий PVP в качестве пленкообразующего полимера; и слой покрытия ПВ, содержащий этилцеллюлозу в качестве рН-независимого полимера, ПЭГ в качестве порообразующего агента и сверхтонкий тальк в качестве вещества, способствующего скольжению; при этом количество указанного пленкообразующего полимера/связующего вещества в указанном слое лекарственного средства составляет до 90% от массы всего слоя лекарственного средства или от примерно 0,5% до примерно 20% от массы всей пеллеты; количество указанного вещества, способствующего скольжению, в указанном слое лекарственного средства составляет до 30% от массы всего слоя лекарственного средства или от примерно 0,1% до примерно 10% от массы всей пеллеты; количество указанного пленкообразующего полимера в указанном подслое покрытия составляет до 100% от массы всего подслоя покрытия или от примерно 0,5% до примерно 20% от массы всей пеллеты; количество указанного pH-независимого полимера составляет от примерно 50% до примерно 90% от массы всего слоя покрытия ПВ или от примерно 10% до примерно 30% от массы всей пеллеты; количество указанного порообразующего агента составляет от примерно 1% до примерно 20% от массы всего слоя покрытия ПВ или от примерно 0,1% до примерно 10% от массы всей пеллеты; и количество указанного вещества, способствующего скольжению, в указанном слое покрытия ПВ составляет от примерно 0,1% до примерно 20% от массы всего слоя покрытия ПВ или от примерно 0,1% до примерно 10% от массы всей пеллеты.
В соответствии с другим аспектом настоящего изобретения предложена фармацевтическая композиция для перорального введения, содержащая пеллеты ПВ, как определено выше. В некоторых вариантах реализации пеллеты ПВ, содержащиеся в данной композиции, смешивают с одним или несколькими подходящими наполнителями и заключают в капсулы либо прессуют в таблетки. Приготовление таких капсул или таблеток можно осуществлять с использованием любой подходящей технологии, известной в данной области техники.
Примеры подходящих наполнителей, которые могут быть использованы при приготовлении фармацевтической композиции для перорального введения, включают, но не ограничиваются ими, диоксиды кремния, а также другие вещества, способствующие скольжению, известные в данной области техники, как определено выше.
Наполнители таблеток заполняют объем таблетки или капсулы, что делает удобным процесс их получения и является удобным для использования потребителем. За счет увеличения суммарного объема наполнители обеспечивают конечному продукту объем, удобный для использования пациентом. Хороший наполнитель должен быть инертным, совместимым с другими компонентами лекарственной формы, негигроскопичным, относительно дешевым, способным к уплотнению и предпочтительно безвкусным или приятным на вкус. Растительная целлюлоза (чистый растительный наполнитель) представляет собой популярный наполнитель в таблетках или твердых желатиновых капсулах. Двухосновный фосфат кальция представляет собой другой широко используемый наполнитель для таблеток. В мягких желатиновых: капсулах можно использовать ряд растительных жиров и масел. Наполнители для таблеток включают, например, лактозу, маннит/Parteck®, сорбит, крахмал и их комбинации.
Разрыхлитель расширяется и растворяется при контакте с влагой, вызывая распад таблетки в пищеварительном тракте с высвобождением активных ингредиентов для их абсорбции. Типы разрыхлителей включают вещества, облегчающие поглощение воды, и активаторов разрушения таблетки. Они обеспечивают быстрый распад таблетки при контакте ее с водой на более мелкие фрагменты, облегчая ее растворение. Не ограничивающие примеры разрыхлителей включают поперечно-сшитый поливинилпирролидон (кросповидон), карбоксиметилцеллюлозу (КМЦ) натрия/кальция, кроскармеллозу натрия, гидроксипропилцеллюлозу с низкой степенью замещения, бикарбонат натрия, крахмал, натрия крахмала гликолят и их комбинации.
Смазывающие вещества добавляют в небольших количествах в лекарственные формы таблеток и капсул для улучшения некоторых технологических характеристик. В частности, данные агенты предотвращают слипание и прилипание ингредиентов к пуансонам для изготовления таблеток или машине для заполнения капсул. Смазывающие вещества также обеспечивают возможность формирования и выталкивания таблеток с малым трением между твердым веществом и стенкой матрицы. Примеры смазывающих веществ включают, но не ограничиваются ими, глицерил бегенат, стеариновую кислоту, тальк, стеарат цинка, стеарат кальция и их комбинации.
Как показано в разделе Примеры далее, в частности, в отношении разагилина и его метаболита 1-аминоиндана, фармацевтические композиции согласно настоящему изобретению подходят для лечения болезни Паркинсона и, кроме того, любого другого нейродегенеративного заболевания или состояния, а также повреждений нервной системы, для лечения которых активный агент, содержащийся в данной композиции, был описан как подходящий. Такие нейродегенеративные заболевания или состояния включают, не ограничиваясь ими, болезнь Альцгеймера; синдром отмены лекарственного средства, включая синдром отмены психостимуляторов, опиатов, наркотических средств и барбитуратов; депрессию; возрастные дегенерации, включая дегенерацию функции почек и дегенерацию когнитивной функции, о которой свидетельствует способность к пространственному обучению; болезнь Кушинга гипофизарного происхождения у людей и животных; дисфункцию иммунной системы как у людей, так и у животных; возрастную потерю массы тела у млекопитающих; шизофрению; различные неопластические состояния, включая раковые опухоли, такие как рак молочной железы и гипофиза; нейромышечное и нейродегенеративное заболевание; деменцию, такую как сенильная деменция, например, деменция паркинсоновского и альцгеймеровского типа, сосудистая деменция и деменция с тельцами Леви; синдром гиперактивности; аффективное расстройство; синдром дефицита внимания; синдром гиперактивности; рассеянный склероз; и синдром Туретта. Конкретные повреждения нервной системы, которые можно лечить фармацевтической композицией согласно настоящему изобретению, включают, не ограничиваясь ими, повреждение ЦНС вследствие повреждений при травме головы, гипоксию, аноксию, гипогликемию, нейротоксическое поражение, ишемический инсульт и травму, а также другие поражения нервов, при которых протекает апоптотический процесс.
Таким образом, в соответствии с другим аспектом настоящее изобретение относится к способу лечения нейродегенеративного заболевания или повреждения нервной системы у нуждающегося в этом индивидуума, включающему введение указанному индивидууму фармацевтической композиции, определенной выше.
В некоторых вариантах реализации фармацевтическую композицию, применяемую в способе согласно настоящему изобретению, изготавливают в форме для перорального введения. В конкретных вариантах реализации способ согласно настоящему изобретению включает введение фармацевтической композиции для перорального применения, изготовленной в форме для пролонгированного высвобождения активного агента, как определено выше, в частности, в которой активный агент выбран из N-пропаргил-1-аминоиндана, его энантиомера, его метаболита, его аналога или его фармацевтически приемлемой соли, предпочтительно, в которой активный агент представляет собой разагилин или его фармацевтически приемлемую соль.
Способ согласно настоящему изобретению можно применять для: лечения любого нейродегенеративного заболевания или повреждения нервной системы, как определено выше. В конкретных вариантах реализации указанное нейродегенератинное заболевание представляет собой болезнь Паркинсона или болезнь Альцгеймера, и указанное повреждение нервной системы представляет собой острое повреждение головного мозга, такое как инсульт или травматическое повреждение головного мозга.
В соответствии с другим аспектом настоящее изобретение относится к способу получения состава в форме для пролонгированного высвобождения, содержащего активный агент, определенный выше, т.е. активный агент, содержащий пропаргиламинный фрагмент, аминоиндановый фрагмент или пропаргиламинный и аминоиндановый фрагменты, или его фармацевтически приемлемую соль, при этом указанный способ включает этапы:
(i) растворения указанного активного агента, возможно подходящим образом смешанного со связующим веществом и/или веществом, способствующим скольжению, в подходящей системе растворителей с получением однородной суспензии;
(ii) нанесения слоя указанной суспензии, полученной на этапе (i), на инертные пеллеты, такие как инертные гранулы нонпарель (nonpareil seeds);
(iii) возможно, нанесения на пеллеты, содержащие активный агент, полученные на этапе (ii), изолирующего/защитного подслоя покрытия;
(iv) нанесения на пеллеты, полученные на этапе (ii) или (iii), слоя покрытия с пролонгированным высвобождением, т.е. полимерного слоя, обеспечивающего пролонгированное высвобождение указанного активного агента, с получением тем самым указанного состава с пролонгированным высвобождением; и
(v) возможно, смешивания покрытых пеллет, полученных на этапе (iv), с подходящим наполнителем.
Способ, описанный в настоящем тексте, получения состава с пролонгированным высвобождением, содержащего активный агент, определенный выше, может быть осуществлен с использованием любой подходящей технологии, известной в данной области техники, например, подробно описанной в разделе Примеры далее. В некоторых вариантах реализации один или несколько: этапов (ii) и (iv) этого способа, а также этапов (iii) и (v) при условии их проведения, осуществляют с использованием сушилки с псевдоожиженным слоем.
В некоторых вариантах реализации состав с пролонгированным высвобождением, полученный в соответствии с данным способом, затем заключают в капсулы или прессуют в таблетки.
Далее настоящее изобретение будет проиллюстрировано следующими не ограничивающими Примерами.
ПРИМЕРЫ
Экспериментальная часть
Модели болезни Паркинсона
Экспериментальные модели болезни Паркинсона (БП) нужны для понимания возможных патологических механизмов указанного заболевания, а также необходимы для разработки и тестирования новых терапевтических стратегий, будь то фармакологические или иные стратегии.
Модель МРТР у мыши
Значительный объем биохимических данных секционных патологоанатомических исследований головного мозга человека и животных указывает на постоянный процесс окислительного стресса в черной субстанции, который может инициировать допаминергическую нейродегенерацию. Хотя и не известно, является ли окислительный стресс первичным или вторичным явлением, окислительный стресс, индуцированный нейротоксином МРТР (N-метил-4-фенил-1,2,3,6-тетрагидропиридин), использовали в животных моделях для исследования процесса нейродегенерации с целью разработки антиоксидантных нейропротекторных лекарственных средств.
МРТР превращается в головном мозге в положительно заряженную молекулу МРР+(1-метил-4-фенилпиридиний) под действием фермента моноаминоксидазы МАО-Б, вызывая паркинсонизм у приматов вследствие уничтожения определенных допамин-продуцирующих нейронов в черной субстанции. МРР+ вмешивается в процесс окислительного фосфорилирования в митохондриях, что вызывает истощение АТФ и гибель клеток. Он также ингибирует синтез катехоламинов, снижает уровни допамина и сердечного норэпинефрина и инактивирует тирозингидроксилазу.
Модель 6-OHDA у крысы
При моделировании БП развитие заболевания в основном происходило с введением нейротоксина катехоламинов, 6-гидроксидопамина (6-OHDA). Данная молекула переносится в клеточные тела и волокна как допаминергических, так и норадренергических нейронов, и вызывает дегенерацию нервных окончаний, а также может влиять на клеточные тела, в частности, при введении в участки клеточного тела. Нейротоксичность 6-OHDA связана с его мощным ингибирующим действием по отношению к дыхательным ферментам митохондрий (комплексы цепи I и IV). Вследствие недостаточного метаболизма из-за блокады данных ферментов, нейроны больше не могут осуществлять нормальные физиологические функции и, следовательно, гибнут. Поскольку при БП именно допаминергический нигростриарный путь подвергается дегенерации, были разработаны животные модели, в которых поражения 6-OHDA допаминергической системы осуществляли путем односторонней инъекции указанного токсина напрямую в основную эфферентную проекцию нигростриарного волокна.
Подготовка образцов для ВЭЖХ анализа допамина и его метаболитов
Образцы ткани стриатума гомогенизировали на льду в 500 мкл буфера для гомогенизации (0,1 М хлорная кислота, 0,02% ЭДТА и 1% ЕТОН) с использованием набора для гомогенизации OMNI Tip от OMNI International (промежуточная скорость, 3×10 секунд с 5-секундными интервалами). Гомогенаты обрабатывали ультразвуком в течение 5 минут, а затем центрифугировали при 15000 об/мин при 4°С в течение 15 мин. Надосадочные жидкости переносили в чистые пробирки, и определяли содержание допамина методом ВЭЖХ.
Пример 1. Исследование комбинаций разагилин-прамипексол in vivo в модели БП, индуцированной МРТР, у мышей
Указанное исследование включало 10 групп по примерно 7-9 мышей каждая, которые получали лечение в соответствии с Таблицей 1. В частности, мышам интраперитонеально (IP) вводили МРТР для индуцирования модели болезни Паркинсона (БП), и лечили комбинациями лекарственных средств, содержащими постоянную дозу прамипексола, неэрголинового агониста допамина, показанного для лечения БП на ранней стадии, и различные дозы разагилина. МРТР вводили инъекционно каждый день в течение первых 5 дней (дни 0-4) и комбинации лекарственных средств вводили в дни 0-11 либо интраперитонеально, либо с использованием насоса ALZET (микроосмотический насос ALZET, модель 1002 со скоростью 0,25 мкл/ч, DURECT Corporation, Cupertino, США) для имитации замедленного высвобождения. Группам 5-7 вводили комбинацию лекарственных средств за 30 минут до введения МРТР каждый день в течение первых пяти дней (дни 0-4), а в последующие дни (5-11) лекарственные средства вводили приблизительно в одно и то же время каждый день введения доз. Насос ALZET имплантировали интраперитонеально за 15-17 часов перед первым введением МРТР (группы 8-10) и общее количество лекарственных средств, вводимых посредством указанного насоса в течение периода введения доз, было равным количеству, вводимому в группах интраперитонеальных инъекций. Контроли представляли собой не получавших лекарственное средство мышей, которым инъекционно вводили физиологический раствор, и подвергнутых воздействию МРТР мышей, которым инъекционно вводили физиологический раствор.
Массу тела измеряли до введения доз и ежедневно во время введения доз, и рассчитывали индивидуальные изменения массы тела. Клинические признаки фиксировали два раза в неделю на протяжении всего исследования. В 12 день, день окончания исследования, всех животных подвергали эвтаназии посредством асфиксии СО2. Головной мозг быстро извлекали, помещали на охлажденную пластину и рассекали на части. Извлекали левый и правый стриатум, определяли их массу, мгновенно замораживали в жидком азоте и хранили при -70°С до дальнейшей обработки. Образцы тканей стриатума подготавливали для ВЭЖХ, как описано в Экспериментальной части.
| Таблица 1. | ||
| Распределение по группам | ||
| Группа | Лечение (ежедневно) | Путь введения |
| 1 (n=8) | физиологический раствор+физиологический раствор | физиологический раствор-интраперитонеально |
| 2 (n=8) | физиологический раствор+физиологический раствор, насос ALZET | физиологический раствор-интраперитонеально; насос ALZET |
| 3 (n=7) | MPTP-HCL (40 мг/кг)+физиологический раствор | МРТР+физиологический раствор-интраперитонеально |
| 4 (n=6) | MPTP-HCL (40 мг/кг)+физиологический раствор, насос ALZET | МРТР-интраперитонеально; физиологический раствор-насос ALZET |
| 5 (n=5) | MPTP-HCL (40 мг/кг)+[разагилин (0,1 мг/кг)+прамипексол (0,5 мг/кг)] в физиологическом растворе, инъекции | МРТР+лекарственные средства-интраперитонеально |
| 6 (n=9) | MPTP-HCL (40 мг/кг)+[разагилин (0,12 мг/кг)+прамипексол (0,5 мг/кг)] в физиологическом растворе, инъекции | МРТР+лекарственные средства-интраперитонеально |
| 7 (n=9) | MPTP-HCL (40 мг/кг)+[разагилин (0,15 мг/кг)+прамипексол (0,5 мг/кг)] в физиологическом растворе, инъекции | МРТР+лекарственные средства-интраперитонеально |
| 8 (n=9) | MPTP-HCL (40 мг/кг)+[разагилин (0,1 мг/кг)+прамипексол (0,5 мг/кг)] в физиологическом растворе, насос ALZET | МРТР-интраперитонеально; лекарственные средства-насос ALZET |
| 9 (n=8) | MPTP-HCL (40 мг/кг)+[разагилин (0,12 мг/кг)+прамипексол (0,5 мг/кг)] в физиологическом растворе, насос ALZET | МРТР-интраперитонеально; лекарственные средства-насос ALZET |
| 10 (n=9) | MPTP-HCL (40 мг/кг)+[разагилин (0,15 мг/кг)+прамипексол (0,5 мг/кг)] в физиологическом растворе, насос ALZET | МРТР-интраперитонеально; лекарственные средства-насос ALZET |
| - Число в скобках показывает количество мышей на конец эксперимента | ||
Как показано на Фиг.1, при интраперитонеальном введении трех комбинаций разагилин+прамипексол их влияние на уровни допамина у мышей было практически одинаковым, они вызывали повышение содержания допамина до примерно 60% по сравнению с мышами, не получавшими лекарственное средство. Однако при введении указанных трех комбинаций способом с замедленным высвобождением (ЗВ) с использованием насоса ALZET в том же количестве в течение 24 часов наблюдали значительный эффект дозы, при котором уровни допамина повышались в соответствии с увеличением доз разагилина. Поскольку количество прамипексола было одинаковым во всех комбинациях, наблюдаемый эффект, должно быть, обусловлен возрастающими дозами разагилина, что указывает на крайне полезный эффект способа введения с замедленным высвобождением по сравнению со способом с быстрым высвобождением в отношении уровней допамина в головном мозге мышей, которым вводили МРТР.
Пример 2. Исследование метаболита разагилина, аминоиндана, in vivo в модели БП, индуцированной МРТР, у мышей
Самцов мышей С57В 1/6 массой 20+/-1 г использовали во всех экспериментах (по 10 мышей в группе). МРТР вводили путем интраперитонеальной инъекции в дозе 40 мг/кг в сутки в течение 5 дней. Контроли представляли собой не получавших лекарственное средство мышей, которым инъекционно вводили физиологический раствор, и подвергнутых воздействию МРТР мышей, которым инъекционно вводили физиологический раствор. Аминоиндан вводили в течение 12 дней либо путем ежедневной интраперитонеальной инъекции, либо способом с замедленным высвобождением с использованием насоса ALZET, имплантированного интраперитонеально. Эффект лечения оценивали путем измерения содержания допамина и его метаболитов (дигидроксифенилуксусной кислоты и гомованилиновой кислоты) в левом и правом стриатуме, извлеченном у мышей в конце эксперимента. Образцы тканей стриатума подготавливали для анализа методом ВЭЖХ, как описано в Экспериментальной части.
Как показано на Фиг.2, воздействие МРТР вызывало более чем 90% истощение уровней допамина по сравнению с уровнями контрольных мышей, ранее не подверженных экспериментам. Лечение метаболитом разагилина, аминоинданом, вводимым способом с замедленным высвобождением (ЗВ) с использованием насоса ALZET, вызывало значительное восстановление уровней допамина по сравнению с уровнями у мышей, получавших лечение разбавителем (физиологическим раствором) или тем же лекарственным средством, вводимым путем ежедневных интраперитонеальных инъекций
Пример 3. Исследование разагилина in vivo в модели БП, индуцированной 6-OHDA, у крыс
Одностороннее поражение медиального пучка переднего мозга (MFB) 6-OHDA вызывает одностороннее разрушение допаминергических нейронов нигростриарного пути, приводя к асимметрии моторного поведения у крыс. Когда пораженным крысам вводят лекарственные средства, действующие на систему допамина, они демонстрируют активное вращательное поведение. В частности, введение DA-высвобождающего агента, D-амфетамина, создает дисбаланс допамина в направлении непораженной нигростриарной проекции и, таким образом, приводит к вращениям по часовой стрелке. Эффект лечения заключается в том, что большее количество DA становится доступным и ожидается большее число вращений по часовой стрелке (CW). Индуцированные лекарственным средством вращения измеряют с использованием автоматизированного измерителя вращения (rotometer), состоящего из чаши для вращения и шарнира, прикрепленного к туловищу крысы.
В дополнение к результатам, представленным в Примерах 1-2, демонстрирующим явное преимущество способа лечения разагилином или его метаболитом, аминоинданом, с замедленным высвобождением (ЗВ) в отношении биохимического конечного содержания допамина в модели БП, индуцированной МРТР, у мышей, в данном исследовании терапевтический эффект введения разагилина способом ЗВ в отношении конечного поведения тестировали с использованием модели БП, индуцированной 6-OHDA, у крыс.
У взрослых самцов крыс линии Sprague-Dawley массой 250-300 г медиальный пучок переднего мозга (MFB) поражали 6-OHDA. Крыс анестезировали кетамином-ксилазином (85:15) 0,1 мл/100 г и закрепляли в стереотаксическом аппарате. 6-OHDA вводили путем инъекций в односторонний MFB в соответствии со следующими стереотаксическими координатами: АР-2,8 мм, ML-2 мм относительно брегмы и DV-9 относительно твердой мозговой оболочки. Скорость введения составляла 1 мкл/мин с использованием инъекционного насоса и микрошприца Hamilton. После инъекции микрошприц оставляли на 5 мин в месте инъекции, и отверстие закрывали костным воском.
Такую же дозу разагилина вводили либо путем ежедневных интраперитонеальных инъекций в течение 28 дней (начиная за 7 дней до введения 6-OHDA до 21 дня после), либо вводили с постоянной скоростью в течение 24 часов каждый день, всего 28 дней, с использованием насоса ALZET, трансплантированного за 7 дней до введения 6-OHDA, и продолжали в течение еще 21 дня. В обоих случаях за лечением следовало вымывание лекарственного средства в течение 10 дней перед умерщвлением крыс. В конце исследования, т.е. на 32 день после введения 6-OHDA, оценивали моторную асимметрию с использованием Rota Meter с помощью амфетамина в качестве индуктора. Амфетамин представляет собой допамин-высвобождающий агент и, следовательно, зависит от количества допаминергических (DAegic) нейронов, оставшихся жизнеспособными и функционирующими после введения 6-OHDA. Амфетамин вводили интраперитонеально путем инъекций в однократной дозе, составляющей 1,5 мг/кг, с последующей фиксацией вращения в течение 60 минут на Rota Meter.
Как показано на Фиг.3, значительно улучшенный эффект в чистом вращении, т.е. вращении по часовой стрелке за вычетом вращения против часовой стрелки (CW-CCW), наблюдали у крыс, получавших лечение разагилином с использованием насоса ALZET, демонстрирующего замедленное высвобождение, по сравнению с крысами, получавшими лечение разагилином путем ежедневных интраперитонеальных инъекций, демонстрирующих быстрое высвобождение.
Примеры 4-6. Пеллеты разагилина с покрытием с пролонгированным высвобождением без подслоя покрытия
Получали пеллеты мезилата разагилина с пролонгированным высвобождением (ПВ) без подслоя покрытия, имеющие состав, представленный в Таблице 2. В частности, для получения слоя лекарственного средства повидон USP (PVP К29/32) растворяли в смеси дистиллированной воды и 96% этанола, а затем в полученном растворе мезилат разагилина растворяли. Диспергировали сверхтонкий тальк и добавляли к полученному раствору с образованием однородной суспензии, которую затем наносили на сахарные сферические гранулы размером 600-710 мкм с использованием установки для нанесения покрытия с псевдоожиженным слоем. Суспензию для нанесения функционального покрытия готовили путем растворения Ethocel 45 сПз (этилцеллюлоза; полимер, контролирующий высвобождение) в смеси ацетона и 96% этанола, а затем полиэтиленгликоль (ПЭГ) 4000 растворяли в дистиллированной воде; и добавляли к полученному раствору. Полученную суспензию наносили на содержащие лекарственное средство пеллеты с использованием установки для нанесения покрытия с псевдоожиженным слоем.
| Таблица 2. | |||
| Гранулы мезилата разагина с покрытием ПВ | |||
| Ингредиенты | мг/капсула | ||
| Ядра - покрытые лекарственным слоем пеллеты | |||
| Этанол 96% | - | ||
| Дистиллированная вода | - | ||
| Мезилат разагилина | 1,0 | ||
| PVP К29/32 | 8,0 | ||
| Сверхтонкий тальк | 1,0 | ||
| Сахарные сферические гранулы 600-710 мкм | 90,0 | ||
| Общая масса ядра | 100,0 | ||
| Функциональное покрытие (покрытие ПВ) | |||
| Пример 4 15% ПВ |
Пример 5 22% ПВ |
Пример 6 28% ПВ |
|
| Ацетон | - | - | - |
| Этанол 96% | - | - | - |
| Дистиллированная вода | - | - | - |
| Ethocel 45 сПз | 13,9 | 20,3 | 25,8 |
| ПЭГ 4000 | 1,1 | 1,7 | 2,1 |
| Всего | 115,0 | 122,0 | 127,9 |
Характеристики растворения пеллет с разными покрытиями ПВ оценивали в следующих условиях: Аппарат 1, USP (Фармакопея США) использовали для 5 перемешивания среды для растворения (900 мл раствора кишечной жидкости, IFS, рН 6,8) со скоростью вращения шпинделя 100 об/мин и при температуре 37°С. Характеристики растворения представлены в Таблице 3 и на Фиг.4.
| Таблица 3. | |||
| Данные растворения in vitro для пеллет мезилата разагилина с покрытием ПВ из Примеров 4-6 в буфере IFS | |||
| Время (часы) | % Растворения | ||
| Пример 4 | Пример 5 | Пример 6 | |
| 0 | 0 | 0 | 0 |
| 1 | 5 | 1 | 1 |
| 2 | 28 | 9 | 9 |
| 4 | 53 | 36 | 25 |
| 6 | 65 | 53 | 40 |
| 8 | 74 | 53 | 51 |
| 12 | 84 | 74 | 62 |
| 24 | 97 | 89 | 81 |
Примеры 7-8. Пеллеты разагилина с покрытием с пролонгированным 20 высвобождением с подслоем покрытия
Получали пеллеты мезилата разагилина ПВ с подслоем покрытия, имеющие состав, представленный в Таблице 4. В частности, для получения слоя лекарственного средства повидон (PVP К25) растворяли в смеси дистиллированной воды и 96% этанола, а затем в полученном растворе растворяли мезилат разагилина. Диспергировали сверхтонкий тальк и добавляли его к полученному раствору с образованием однородной суспензии, которую затем наносили на сахарные сферические гранулы размером 600-710 мкм с использованием установки для нанесения покрытия с псевдоожиженным слоем. Раствор для нанесения подслоя покрытия готовили путем растворения PVP К25 в смеси дистиллированной воды и 96% этанола, а затем полученный раствор наносили на содержащие лекарственное средство пеллеты с использованием установки для нанесения покрытия с псевдоожиженным слоем. Суспензию для нанесения функционального покрытия готовили путем растворения Ethocel 45 сПз в смеси ацетона и 96% этанола, а затем ПЭГ 3000 растворяли в дистиллированной воде и добавляли к полученному раствору. Диспергировали сверхтонкий тальк и добавляли к полученному раствору с образованием однородной суспензии, которую затем наносили на пеллеты с подслоем покрытия с помощью установки для нанесения покрытия с псевдоожиженным слоем.
Сухую смесь пеллет разагилина ПВ и Аэросила 200 готовили с использованием смесителя Tumbler Bin Blender.
Характеристики растворения пеллет с разными покрытиями ПВ оценивали в условиях, описанных в Примерах 4-6, и полученные результаты представлены в Таблице 5 и на Фиг.5. Данные растворения in vitro для пеллет мезилата разагилина с покрытием ПВ из Примера 7 (15% ПВ) в (i) буфере IFS (рН 6,8), имитирующем условия в кишечнике; (ii) буфере GFS (раствор желудочного сока) (рН 1,2), имитирующем условия в пустом желудке; (iii) буфере GFS в течение 2 часов, а затем в буфере IFS в течение еще 20 часов; и (iv) ацетатном буфере (рН 4,5), имитирующем условия в полном желудке, представлены на Фиг.6. Данные изучения стабильности in vitro в буфере IFS для тех же пеллет с покрытием ПВ в нулевой момент времени (сразу после получения), через 1 месяц в условиях ускоренного старения (40°С, влажность 75%) и через 2 и 3 месяца в тех же условиях ускоренного старения представлены на Фиг.7.
| Таблица 4. | ||||
| Пеллеты мезилата разагилина с покрытием ПВ и подслоем покрытия | ||||
| Ингредиенты | мг/капсула | |||
| Ядра - покрытые лекарственным слоем пеллеты | ||||
| Этанол 96% | - | |||
| Дистиллированная вода | - | |||
| Мезилат разагилина | 1,0 | |||
| PVP К25 | 8,0 | |||
| Сверхтонкий тальк | 1,0 | |||
| Сахарные сферические гранулы 600-710 мкм | 90,0 | |||
| Общая масса ядра | 100.0 | |||
| Ядра - пеллеты с подслоем покрытия | ||||
| Дистиллированная вода | - | |||
| Этанол 96% | - | |||
| PVP К25 | 3,0 | |||
| Общая масса ядра с подслоем покрытия | 103,0 | |||
| Функциональное покрытие (покрытие ПВ) | ||||
| Пример 7 15% ПВ |
Пример 8 18% ПВ |
|||
| Ацетон | - | - | ||
| Этанол 96% | - | - | ||
| Дистиллированная вода | - | - | ||
| Ethocel 45 сПз | 13,90 | 16,68 | ||
| ПЭГ 3000 | 0,78 | 0,93 | ||
| Сверхтонкий тальк | 0,78 | 0,93 | ||
| Общая масса пеллет ПВ | 118,45 | 121,54 | ||
| Сухая смесь | ||||
| Аэросил 200 | 0,22 | 0,11 | ||
| Всего | 118,67 | 121,65 | ||
| Таблица 5. | ||
| Данные растворения in vitro для пеллет мезилата разагилина с покрытием ПВ из Примеров 7-8 в буфере IFS | ||
| Время (часы) | % Растворения | |
| Пример 7 | Пример 8 | |
| 0 | 0 | 0 |
| 1 | 5 | 3 |
| 2 | 25 | 14 |
| 4 | 45 | 37 |
| 6 | 59 | 52 |
| 8 | 67 | 61 |
| 10 | 74 | 66 |
| 12 | 78 | 71 |
| 16 | 79 | 76 |
| 20 | 86 | 81 |
| 24 | 87 | 85 |
Пример 9. Капсулы разагилина с пролонгированным высвобождением с подслоем покрытия
Пеллеты мезилата разагилина ПВ с подслоем покрытия, имеющие состав, представленный в Таблице 6, получали, как описано в Примерах 7-8; за исключением того, что для приготовления сухой смеси использовали коллоидный диоксид кремния вместо Аэросила 200. Характеристики растворения данных полученных пеллет с покрытием ПВ оценивали в условиях, приведенных в Примерах 4-8, и полученные данные представлены в Таблице 7 и на Фиг.8.
| Таблица 6. | |
| Пеллеты мезилата разагилина с покрытием ПВ и подслоем покрытия | |
| Ингредиенты | мг/капсула 27% ПВ |
| Ядра - покрытые лекарственным слоем пеллеты | |
| Этанол 96% | - |
| Дистиллированная вода | - |
| Мезилат разагилина | 1,59 |
| PVP К25 | 12,60 |
| Сверхтонкий тальк | 1,56 |
| Сахарные сферические гранулы 600-710 мкм | 141,73 |
| Общая масса ядра | 157,48 |
| Ядра - пеллеты с подслоем покрытия | |
| Дистиллированная вода | - |
| Этанол 96% | - |
| PVP К25 | 4,72 |
| Общая масса ядра с | 162,2 |
| подслоем покрытия | |
| Функциональное (покрытие ПВ) покрытие | |
| Ацетон | - |
| Этанол 96% | - |
| Дистиллированная вода | - |
| Ethocel 45 сПз | 39,42 |
| ПЭГ 3000 | 2,19 |
| Сверхтонкий тальк | 2,19 |
| Общая масса пеллет ПВ | 206,0 |
| Сухая смесь | |
| Коллоидный диоксид | 0,61 |
| кремния | |
| Всего | 206,61 |
| Таблица 7. | |
| Данные растворения in vitro для пеллет мезилата разагилина с покрытием ПВ из Примера 9 в буфере IFS | |
| Время (часы) | % Растворения |
| 0 | 0 |
| 2 | 9,6 |
| 6 | 45,1 |
| 12 | 65,1 |
| 24 | 77,7 |
Пример 10. Пеллеты разагилина с покрытием с пролонгированным высвобождением с/без подслоем(я) покрытия
Дополнительные пеллеты мезилата разагилина ПВ с подслоем покрытия или без него, имеющие состав, представленный в Таблицах 8-12, могут быть получены в соответствии с процедурой, описанной в Примерах 4-9. Сноски, указанные в каждой из Таблиц, включенных в данный Пример, представлены под Таблицей 16.
| Таблица 8. | ||
| Капсулы мезилата разагилина ПВ 0,2 мг (pH-независимый состав) | ||
| Ингредиент | Диапазон | Примечания |
| Активный ингредиент - слой лекарственного средства | ||
| Мезилат разагилина 0,2 мг | 0,1-5,0%1 | Активное вещество/АФС |
| Гидроксипропилцеллюлоза (ГПЦ) | 5-10% | Связующее вещество3 |
| Тальк | 2-5% | Вещество, способствующее скольжению4 |
| Сахарные сферические гранулы/Пеллеты микрокристаллической целлюлозы | 50-80% | Ядра |
| Очищенная вода | ||
| Этанол | ||
| Подслой покрытия (возможно) | ||
| Гидроксипропилметилцеллюлоза (ГПМЦ) | 2-5% | Пленкообразующий полимер5 |
| Очищенная вода | ||
| Этанол | ||
| Покрытие - Функциональное пленочное покрытие | ||
| Этилцеллюлоза (4-100 сПз) | 5-25% | pH-независимый полимер6 |
| ГПЦ | 1-12% | Порообразующий агент7 |
| ПЭГ 400 | 0,5-3% | Пластификатор8 |
| Тальк | 0,5-3% | Вещество, способствующее скольжению4 |
| Этанол | ||
| Оболочка капсулы | ||
| Гелевые капсулы/капсулы ГПМЦ | ||
| Таблица 9. | ||
| Капсулы мезилата разагилина ПВ 0,2 мг (pH-независимый состав для пульсирующей доставки лекарственного средства) | ||
| Ингредиент | Диапазон | Примечания |
| Активный ингредиент - слой лекарственного средства | ||
| Мезилат разагилина 0,2 мг | 0,1-5,0%1 | Активное вещество/АФС |
| PVP К-30 (Повидон) | 3-8% | Связующее вещество3 |
| Хлорид натрия | 5-20% | Агент, регулирующий осмотическое давление2 |
| Тальк | 2-5% | Вещество, способствующее скольжению4 |
| Сахарные сферические гранулы/ Пеллеты микрокристаллической целлюлозы | 50-80% | Ядра |
| Очищенная вода | ||
| Этанол | ||
| Покрытие - Функциональное пленочное покрытие | ||
| Этилцеллюлоза (4-100 сПз) | 5-25% | pH-независимый полимер6 |
| ПЭГ 400 | 0,5-3% | Пластификатор8 |
| Тальк | 0,5-3% | Вещество, способствующее скольжению4 |
| Этанол | ||
| Очищенная вода | ||
| Оболочка капсулы | ||
| Гелевые капсулы/капсулы ГПМЦ | ||
| Таблица 10. | ||
| Капсулы мезилата разагилина ПВ 5 мг (состав с комбинацией pH-зависимых и pH-независимых полимеров) | ||
| Ингредиент | Диапазон | Примечания |
| Активный ингредиент - слой лекарственного средства | ||
| Мезилат разагилина 0,2 мг | 0,1-5,0%1 | Активное вещество/АФС |
| ГПЦ | 5-10% | Связующее вещество3 |
| Тальк | 2-5% | Вещество, способствующее скольжению4 |
| Сахарные сферические гранулы/ Пеллеты микрокристаллической целлюлозы | 50-80% | Ядра |
| Очищенная вода | ||
| Этанол | ||
| Подслой покрытия (возможно) | ||
| ГПМЦ | 2-5% | Пленкообразующий полимер5 |
| Очищенная вода | ||
| Этанол | ||
| Покрытие - Функциональное пленочное покрытие | ||
| Этилцеллюлоза | 5-25% | pH-независимый полимер6 |
| Эудрагит® L 55 | 1-12% | pH-зависимый полимер для энтеросолюбильного покрытия9 |
| ПЭГ 3000 | 1-12% | Порообразующий агент7; Пластификатор8 |
| Дибутилсебацинат (DBS) | 0,5-3% | Пластификатор |
| Тальк | 0,5-3% | Вещество, способствующее скольжению4 |
| Этанол | ||
| Оболочка капсулы | ||
| Гелевые капсулы/капсулы ГПМЦ | ||
| Таблица 11. | |||
| Состав мезилата разагилина 5 мг с многоэтапным (БВ+ПВ) высвобождением* | |||
| Ингредиент | Диапазон | Примечания | |
| ядра БВ | ядра ПВ | ||
| 1 Фаза: Активный ингредиент - слой лекарственного средства | |||
| Мезилат разагилина 5 мг | 0,1-5,0%1 | 0,1-5,0% | Активное вещество/АФС |
| ГПЦ | 5-10% | 5-10% | Связующее вещество3 |
| Тальк | 2-5% | 2-5% | Вещество, способствующее скольжению4 |
| Сахарные сферические гранулы/ Пеллеты микрокристаллической целлюлозы | 60-90% | 50-80% | Ядра |
| Очищенная вода | |||
| Этанол | |||
| 2 Фаза: Подслой покрытия (возможно) | |||
| ПГМЦ | 4-10% | 2-5% | Пленкообразующий полимер5 |
| Очищенная вода | |||
| Этанол | |||
| 1 часть: быстрое высвобождение (БВ) - переход к сухой смеси (4 фаза) 2 часть: пеллеты с покрытием ПВ - переход к 3 фазе | |||
| 3 Фаза: покрытие ПВ - функциональное пленочное покрытие | 5-95% партии | ||
| Этилцеллюлоза (4-100 сПз) | нет данных | 5-25% | pH-независимый полимер6 |
| ГПЦ | нет данных | 1-12% | Порообразующий агент7 |
| ПЭГ 400 | нет данных | 0,5-3% | Пластификатор |
| DBS | нет данных | 0,5-3% | Пластификатор |
| Тальк | нет данных | 0,5-3% | Вещество, способствующее скольжению4 |
| 4 Фаза: Сухая смесь | |||
| пеллеты разагилина с верхним покрытием (экв. 0,25-4,75 мг) - 1 часть - БВ | |||
| Пеллеты разагилина с покрытием ПВ (экв. 0,25-4,75 мг) - 2 часть - ПВ | |||
| 5 Фаза: Оболочка капсулы | |||
| Гелевые капсулы/капсулы ГПМЦ | |||
| * Вместо состава с двумя типами зерен, частицы с многоэтапным высвобождением также могут быть получены в виде единого состава: слой лекарственного средства (0,25-4,75 мг) поверх сахарных сферических гранул или любых других инертных ядер (1 фаза) -> подслой покрытия (2 фаза) -> покрытие ПВ (3 фаза) -> дополнительный слой лекарственного средства (0,25-4,75 мг) -> верхнее покрытие (как во 2 фазе) -> оболочка капсулы. | |||
| Таблица 12. | |||
| Капсулы мезилата разагилина ПВ 0,2 мг (состав с pH-зависимыми полимерами; pH-независимыми полимерами или комбинацией pH-зависимых и рН-независимых полимеров) |
|||
| Ингредиент | Диапазон | Примечания | |
| Активное ядро (все ингредиенты смешивают с получением «влажной массы», которую затем экструдируют, придают сферическую форму, сушат (FBD) и просеивают перед переходом к фазе нанесения подслоя покрытия) | |||
| Мезилат разагилина 0,2 мг | 0,1-5,0%1 | Активное вещество/АФС | |
| ГПЦ | Связующее вещество3 | ||
| Крахмал | 20-40% | Наполнитель10 | |
| Микрокристаллическая целлюлоза | 20-40% | Наполнитель10 | |
| Очищенная вода | |||
| Этанол | |||
| Подслой покрытия (возможно) | |||
| ГПМЦ | 2-5% | Пленкообразующий полимер5 | |
| Очищенная вода | |||
| Этанол | |||
| Покрытие - Функциональное пленочное покрытие | |||
| Этилцеллюлоза | 5-25% | pH-независимый полимер6 | |
| ПЭГ | 1-15% | Порообразующий агент7; Пластификатор8 | |
| Тальк | 0,5-3% | Вещество, способствующее скольжению4 | |
| Этанол | |||
| Оболочка капсулы | |||
| Гелевые капсулы/капсулы ГПМЦ | |||
Составы мезилата разагилина, описанные в Таблицах 2, 4 и 6, а также составы, описанные в Таблицах 8-12 выше, можно прессовать в таблетки для изготовления также таблеток разагилина с покрытием ПВ. Для этой цели пеллеты разагилина с покрытием ПВ в сухом виде смешивают с дополнительными наполнителями с получением гомогенной смеси, которую затем прессуют в таблетки, на которые наносят верхний/косметический/нефункциональный слой покрытия (см., например, Таблицу 13).
| Таблица 13. | ||
| Таблетки мезилата разагилина 0,2 мг с покрытием ПВ | ||
| Ингредиент | Диапазон | Примечания |
| Таблетки разагилина 1 мг ПВ | ||
| Пеллеты мезилата разагилина 0,2 мг с покрытием ПВ | 20-70% | Из Таблиц 8-11 |
| Диоксид кремния | 1-10% | Вещество, способствующее скольжению4 |
| Микрокристаллическая целлюлоза (Авицел (Avicel)) | 20-70% | Наполнитель/разбавитель10; разрыхлитель11 |
| Стеарат магния | 0,1-1,5% | Смазывающее вещество12 |
| Таблетки разагилина 1 мг с покрытием ПВ Косметическое покрытие | ||
| Опадрай (Opadry) (вещество для покрытия на основе ГПМЦ) | 3-5% | Смесь наполнителей для косметического/верхнего/ влагоудерживающего покрытия |
| Очищенная вода | ||
| Этанол | ||
В Таблице 14 представлен состав таблеток разагилина 0,2 мг с покрытием ПВ, получаемый из влажного гранулята, который затем сушат, измельчают, смешивают в сухом виде, таблетируют и, наконец, на который наносят покрытие ПВ.
| Таблица 14. | ||
| Таблетки мезилата разагилина 0,2 мг с покрытием ПВ | ||
| Ингредиент | Диапазон | Примечания |
| Таблетки разагилина 1 мг | ||
| Мезилат разагилина 0,2 мг | 0,1-5,0%1 | Активное вещество |
| ГПМЦ | 5-10% | Связующее вещество3 |
| Прежелатинизированный крахмал | 30-50% | Наполнитель/разбавитель10; разрыхлитель11 |
| Диоксид кремния | 0,5-3% | Вещество, способствующее скольжению4 |
| Микрокристаллическая целлюлоза (Авицел) | 30-50% | Наполнитель/разбавитель10; разрыхлитель11 |
| Стеарат магния | 0,1-1,5% | Смазывающее вещество12 |
| Таблетки разагилина 1 мг с покрытием ПВ | ||
| Этилцеллюлоза | 5-15% | pH-независимый полимер6 |
| Опадрай | 1-5% | Порообразующий агент7 |
| Тальк | 0,5-3% | Вещество, способствующее скольжению4 |
| Очищенная вода | ||
| Этанол | ||
В Таблице 15 представлен состав таблеток разагилина 0,2 мг с покрытием ПВ, получаемый из влажного гранулята, содержащего полимеры, контролирующие высвобождение, который затем сушат, измельчают, смешивают в сухом виде, таблетируют и, наконец, на который наносят верхнее покрытие.
| Таблица 15. | ||
| Таблетки мезилата разагилина 0,2 мг с покрытием ПВ | ||
| Ингредиент | Диапазон | Примечания |
| Таблетки разагилина 1 мг | ||
| Мезилат разагилина 0,2 мг | 0,1-5,0%1 | Активное вещество |
| ГПМЦ | 30-70% | Связующее вещество3 |
| Крахмал | 10-40% | Наполнитель/разбавитель10; разрыхлитель11 |
| Этилцеллюлоза | 10-40% | pH-независимый полимер |
| Стеарат магния | 0,1-1,5% | Смазывающее вещество12 |
| Таблетки разагилина 1 мг с покрытием ПВ | ||
| Опадрай | 3-5% | Смесь наполнителей для косметического/верхнего/ влагоудерживающего покрытия |
| Очищенная вода | ||
| Этанол | ||
В Таблице 16 представлен состав таблеток разагилина 5 мг с покрытием ПВ, получаемый из влажного гранулята, который затем сушат, измельчают, смешивают в сухом виде, таблетируют с образованием двух слоев и, наконец, на который наносят верхнее покрытие.
| Таблица 16. | |||
| Таблетки мезилата разагилина 0,2 мг с покрытием ПВ | |||
| Ингредиент | Диапазон | Примечания | |
| Слой разагилина БВ 0,25-4,75 мг | |||
| Мезилат разагилина 5 мг | 0.1-5,0%1 | Активное вещество | |
| Крахмал | 50-90% | Наполнитель/разбавитель10; разрыхлитель11 | |
| Микрокристаллическая целлюлоза | 10-40% | Наполнитель/разбавитель10; разрыхлитель11 | |
| PVP | 1-5% | Связующее вещество3 | |
| Стеарат магния | 0,5-1,5% | Смазывающее вещество12 | |
| Слой разагилина ПВ 0,25-4,75 мг | |||
| Мезилат разагилина 5 мг | 0,1-5,0%' | Активное вещество | |
| Крахмал | 10-30% | Наполнитель/разбавитель10; разрыхлитель 1 | |
| Этилцеллюлоза | 10-30% | pH-независимый полимер6 | |
| ГПМЦ | 40-80% | Связующее вещество3 | |
| Стеарат магния | 0,5-1,5% | Смазывающее вещество12 | |
| Прессование в двухслойные таблетки с использованием таблетировочной машины для изготовления двухслойных таблеток | |||
| Таблетки разагилина 5 мг с покрытием ПВ | |||
| Опадрай | 3-5% | Смесь наполнителей для косметического покрытия/верхнего покрытия/гидроизолирующего покрытия | |
| Очищенная вода | |||
| Этанол | |||
1 Указанный состав может содержать 0,2-5 мг мезилата разагилина.
2 Могут быть включены дополнительные pH-зависимые полимеры вместо или в дополнение к агенту, регулирующему осмотическое давление, для получения состава с пульсирующим высвобождением лекарственного средства.
3 Альтернативные связующие вещества включают, например, гидроксипропилметилцеллюлозу (ГПМЦ), повидон (PVP), микрокристаллическую целлюлозу и комбинации указанных связующих веществ.
4 Альтернативные вещества, способствующие скольжению, включают, например, коллоидный диоксид кремния, глицерилмоностеарат, стеарат магния и комбинации указанных веществ, способствующих скольжению.
5 Альтернативные пленкообразующие полимеры включают, например, ГПМЦ, PVP, микрокристаллическую целлюлозу, полиэтиленгликоль (ПЭГ) и комбинации указанных пленкообразующих полимеров.
6 Альтернативные pH-независимые полимеры включают, например, Surelease®, Эудрагит® RL, Эудрагит® RS, Эудрагит® NE и комбинации указанных полимеров.
7 Альтернативные порообразующие агенты включают, например, ГПМЦ, PVP, ПЭГ и комбинации указанных порообразующих агентов.
8 Альтернативные пластификаторы включают, например, дибутилсебацинат/фталат, триацетин, триэтилцитрат и комбинации указанных пластификаторов.
9 Альтернативные pH-зависимые полимеры для энтеросолюбильного покрытия включают, например, Эудрагит® S, Колликоат®, фталат гидроксипропилметилцеллюлозы (ФГПМЦ) и комбинации указанных агентов.
10 Альтернативные наполнители для таблеток включают, например, лактозу, маннит/Parteck®, сорбит, крахмал и комбинации указанных наполнителей для таблеток.
11 Альтернативные разрыхлители включают, например, КМЦ натрия/кальция, кросповидон, кроскармеллозу натрия, гидроксипропилцеллюлозу с низкой степенью замещения, бикарбонат натрия, крахмал, натрия крахмала гликолят и комбинации указанных разрыхлителей.
12 Альтернативные смазывающие вещества включают, например, глицерилбегенат, стеариновую кислоту, тальк, стеарат цинка, стеарат кальция и комбинации указанных смазывающих веществ.
Пример 11. Абсорбция разагилина в различных отделах желудочно-кишечного тракта
Лекарственные средства по-разному абсорбируются из различных отделов желудочно-кишечного тракта. Для создания продукта для перорального введения 24-часового замедленного высвобождения необходимо, чтобы лекарственное средство абсорбировалось на протяжении всего времени, т.е. из всех отделов желудочно-кишечного тракта. Известно, что большинство лекарственных средств хорошо абсорбируются из двенадцатиперстной кишки; однако многие лекарственные средства не эффективно абсорбируются из толстой кишки. Поскольку лекарственное средство находится в течение значительного количества времени в толстой кишке, прежде чем оно будет выведено из организма, важно оценить его абсорбцию из толстой кишки для того, чтобы эффективно изобразить кривую высвобождения.
В данном исследовании разагилин (1,5 мг/кг) вводили в виде водного раствора 0,5 мг/мл посредством полиэтиленового катетера, имплантированного за один день до начала фармакокинетического эксперимента свободно перемещающимся самцам крыс линии Вистар. Указанные катетеры помещали в толстую кишку, либо двенадцатиперстную кишку, либо яремную вену для болюсного введения в толстую кишку, болюсного введения в двенадцатиперстную кишку или внутривенного болюсного введения, соответственно. Осуществляли введение однократной болюсной дозы в каждый участок. Кроме того, второй постоянный катетер помещали в правую вену каждого животного для систематического забора крови. Образцы крови (0,5 мл) забирали за 5 минут до введения дозы и через 5, 15, 30, 50, 90, 150 и 200 минут после введения дозы. Для предотвращения обезвоживания крысам вводили равные объемы физиологического раствора после каждого забора образца крови. Плазму отделяли путем центрифугирования с последующим аналитическим определением количества разагилина и его основного метаболита, 1-аминоиндана, с использованием тройной квадрупольной системы ЖХ-МС-МС. Фармакокинетический анализ без учета компартментов проводили с использованием программного обеспечения Excel. Площадь под кривой (ППК) рассчитывали на основе анализа без учета компартментов конечной измеряемой выборки с использованием линейно-логарифмического метода трапеций. Биодоступность разагилина при пероральном введении (F) рассчитывали в виде процентного соотношения:
ППК(двенадцатиперстная кишка)/ППК(внутривенное) или ППК(толстая кишка)/ППК(внутривенное).
В Таблице 17 и на Фиг.9 показаны различия максимальной (или пиковой) концентрации в плазме (Cmax) и ППК между группами введении в двенадцатиперстную и толстую кишку (данные представлены в виде среднего значения ± SE, n=4-5). В частности, исходный Т1/2 был больше для групп введения в толстую и двенадцатиперстную кишку по сравнению с Т1/2 после внутривенного введения. Рассчитанные значения ППК для внутривенной дозы и дозы для двенадцатиперстной кишки оказались схожими, что позволяет предположить полную абсорбцию при пероральном введении. ППК после введения в толстую кишку составляла приблизительно 28% от ППК внутривенной дозы, что подтверждает возможность абсорбции в толстой кишке. В соответствии с данными результатами, создание системы доставки разагилина с контролируемым высвобождением осуществимо и имеет практическое значение.
| Таблица 17. | |||
| Фармакокинетические параметры разагилина после внутривенного болюсного введения, болюсного введения в двенадцатиперстную кишку и в толстую кишку (1,5 мг/кг) | |||
| Параметр/группа* | внутривенное болюсное введение | болюсное введение в двенадцатиперстную кишку | болюсное введение в толстую кишку |
| Tmax (мин) | - | 7,5±2,5 | 31,3±7,2 |
| Cmax (нг/мл) | - | 505±104 | 72,5±21,3 |
| Т1/2 (мин) | 42,7±5,5 | 79,5±11,5 | 75£5,5 |
| CL (мл/мин/кг) | 54,3±7,1 | - | - |
| Vss (мл/кг) | 2,404±408 | - | - |
| ППК (ч*нг/мл) | 23,641±3,481 | 24,181±3,967 | 6,632±1,362 |
| F (% от внутривенной дозы) | -100 | -28 | |
* Cmax - максимальная концентрация в плазме; Tmax - время, при котором проявляется Cmax; Vss - объем распределения в равновесном состоянии; Сl - клиренс на кг; F - биодоступность разагилина при пероральном введении. Данные; представлены в виде среднего значения ± SE (n=4-5).
ссылки
Akao Y., Nakagawa Y., Maruyama W., Takahashi Т., Naoi M., Apoptosis induced by an endogenous neurotoxin, N-methyl(R)salsolinol, is mediated by activation of caspase-3, Newosci. Lett., 1999, 267, 153-156
Akao Y., Maruyama W., Shimizu S., Yi H., Nakagawa Y., Shamoto-Nagai M., Youdim M.B.H., Tsujimoto Y., Naoi M., Mitochondrial permeability transition mediates apoptosis induced by N-methyl(R)salsolinol, an endogenous neurotoxin, and is inhibited by Bcl-2 and Rasagiline, N-Propargyl-1(R)-aminoindan, J. Neurochem., 2002a, 82, 913-923
Akao Y., Maruyama W., Yi H., Shamoto-Nagai M., Youdim M.B.H., Naoi M., An anti-Parkinson's disease drug, N-propargyl-1(R)-aminoindan (rasagiline), enhances expression of anti-apoptotic Bcl-2 in human dopaminergic SH-SY5Y cells, Neurosci. Lett., 2002b, 326, 105-108
Bar-Am O., Amit Т., Youdim M.B., Aminoindan and hydroxyaminoindan, metabolites of rasagiline and ladostigil, respectively, exert neuroprotective properties in vitro, J. Neurochem., 2007,103(2), 500-508
Bar-Am O., Weinreb O., Amit Т., Youdim M.B., The neuroprotective: mechanism of 1-(R)-aminoindan, the major metabolite of the anti-parkinsonian drug rasagiline, J. Neurochem., 2010, 112,1 131-1137
Durden D.A., Dyck L.E., Davis B.A., Liu Y.D., Boulton A.A., Metabolism and pharmacokinetics, in the rat, of (R)-N-(2-heptyl)methyl-propargylamine (R-2HMP), a new potent monoamine oxidase inhibitor and antiapoptotic agent, Drug Metab Dispos., 2000, 28, 147-154
Grossberg G., Desai A., Review of rivastigmine and its clinical applications in Alzheimer's disease and related disorders, Expert Opin. Pharmacother., 2000, 2, 653-666
Maruyama W., Boulton A.A., Davis B.A., Dostert P., Naoi M.. Enantio-specific induction of apoptosis by an endogenous neurotoxin, N-methyl(R)salsolinol, in dopaminergic SH-SY5Y cells: suppression of apoptosis by N-(2-heptyl)-N-methylpropargylamine, J. Neural Transm., 2001a, 108, 11-24
Maruyama W., Akao Y., Youdim M.B.H., Boulton A.A., Davis B.A., Naoi M., Transfection-enforced Bcl-2 overexpression and an anti-Parkinson drug, rasagiline, prevent nuclear accumulation of glyceraldehyde-3 phosphate dehydrogenase induced by an endogenous dopaminergic neurotoxin, N-methyl(R)salsolinol, J. Neurochem., 2001b, 78, 727-735
Maruyama W., Takahashi Т., Youdim, M.B.H., Naoi M., The anti-Parkinson drug, rasagiline, prevents apoptotic DNA damage induced by peroxynitrite in human dopaminergic neuroblastoma SH-SY5Y cells, J. Neural Transm., 2002, 109, 467-481
Tazik S., Johnson S., Lu D., Johnson C, Youdim M.B., Stockmeier C.A., Ou X.M., Comparative neuroprotective effects of rasagiline and aminoindan with selegiline on dexamethasone-induced brain cell apoptosis, Neurotoxicity Research, 2009,15, 284-290
Tatton W.G., Chalmers-Redman R.M., Ju W.J., Mammen M., Carlile G.W., Pong A.W., Tatton N.A., Propargylamines induce antiapoptotic new protein synthesis in serum- and nerve growth factor (NGF)-withdrawn, NGF-differentiated PC-12 cells, J Pharmacol Exp Ther., 2002, 301, 753-764
Tatton W.G., Greenwood C.E., Rescue of dying neurons: a new action for deprenyl in MPTP parkinsonism, JNeurosci Res., 1991, 30, 666-672
Tatton W.G., Selegiline can mediate neuronal rescue rather than neuronal protection, Movement Disorders 8 (Supp.1), 1993, S20-S30
Weinreb O., Amit Т., Bar-Am O., Yousim M.B., Rasagiline: a novel anti-Parkinsonian monoamine oxidase-B inhibitor with neuroprotective activity, Prog Neurohiol, 2010, 92(3), 330-344
Weinstock M., Selectivity of cholinesterase inhibition: Clinical implications for the treatment of Alzheimer's disease, CNS Drugs, 1999, 12, 307-323
Yogev-Falach M., Amit Т., Bar-Am O., Sagi Y., Weinstock M., Youdim M.B.H., The involvement of mitogen-activated protein (MAP) kinase in the regulation of amyloid precursor protein processing by novel cholinesterase inhibitors derived from rasagiline, FASEB J., 2002, 16, 1674-1676
Youdim M.B.H., Weinstock M., ovel neuroprotective anti-Alzheimer drugs with antidepressant activity derived from the anti-Parkinson drug, rasagiline, Mechanisms of Ageing & Developments, 2002a, 123, 1081-1086
Youdim M.B.H., Gross A., Finberg J.P.M., Rasagiline [N-Propargyl-1R(+)-aminoindan], a selective and potent inhibitor of mitochondrial monoamine oxidase B, Br. J. Pharmacol., 2001a, 132, 500-506
Youdim M.B.H., Wadia A., Tatton N.A., Weinstock M., The anti-Parkinson drug rasagiline and its cholinesterase inhibitor derivatives exert neuroprotection unrelated to MAO inhibition in cell culture and in vivo, Ann N Y Acad Sci, 2001b, 939, 450-458
Zimmermann K, Waldmeier P.C., Tatton W.G., Dibenzoxepines as treatments for neurodegenerative diseases, Pure Appl Chem, 1999, 71, 2039-2046
Claims (23)
1. Пероральная фармацевтическая композиция для лечения нейродегенеративного заболевания или повреждения нервной системы, приготовленная в форме для пролонгированного высвобождения активного агента, выбранного из R(+)-N-пропаргил-1-аминоиндана (разагилина) или его фармацевтически приемлемой соли, и содержащая фармацевтически приемлемый носитель и пеллеты с пролонгированным высвобождением (ПВ), каждая из которых содержит:
(i) инертное ядро пеллеты;
(ii) слой лекарственного средства, покрывающий указанное инертное ядро пеллеты, содержащий указанный активный агент, смешанный с поливинилпирролидоном (PVP) в качестве пленкообразующего полимера/связующего вещества и со сверхтонким тальком в качестве вещества, способствующего скольжению;
(iii) необязательно, изолирующий/защитный подслой покрытия, покрывающий указанный слой лекарственного средства, где указанный подслой содержит PVP в качестве пленкообразующего полимера; и
(iv) слой покрытия ПВ, покрывающий указанный подслой покрытия, если он присутствует, или указанный слой лекарственного средства, где указанный слой покрытия ПВ содержит этилцеллюлозу в качестве рН-независимого полимера, полиэтиленгликоль (ПЭГ) в качестве порообразующего агента и, необязательно, сверхтонкий тальк в качестве вещества, способствующего скольжению,
при этом количество указанного пленкообразующего полимера/связующего вещества составляет до 90% от массы всего слоя лекарственного средства или от 0,5 до 20% от массы всей пеллеты; количество указанного вещества, способствующего скольжению, составляет до 30% от массы всего слоя лекарственного средства или от 0,1 до 10% от массы всей пеллеты; количество указанного пленкообразующего полимера в указанном подслое покрытия, если он присутствует, составляет до 100% от массы всего подслоя покрытия или от 0,5 до 20% от массы всей пеллеты; количество рН-независимого полимера в указанном слое покрытия ПВ составляет от 50 до 90% от массы всего слоя покрытия ПВ или от 10 до 30% от массы всей пеллеты; количество указанного порообразующего агента в указанном слое покрытия ПВ составляет от 1 до 20% от массы всего слоя покрытия ПВ или от примерно 0,1 до примерно 10% от массы всей пеллеты; и количество указанного вещества, способствующего скольжению, в указанном слое покрытия ПВ, если оно присутствует, составляет от 0,1 до 20% от массы всего слоя покрытия ПВ или от 0,1 до 10% от массы всей пеллеты,
и при этом доза активного агента составляет от 0,2 до 2,0 мг в сутки.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что указанная фармацевтически приемлемая соль выбрана из мезилатной соли, эзилатной соли, тозилатной соли, сульфатной соли, сульфонатной соли, фосфатной соли, карбоксилатной соли, малеатной соли, фумаратной соли, тартратной соли, бензоатной соли, ацетатной соли, гидрохлоридной соли или гидробромидной соли R(+)-N-пропаргил-1-аминоиндана, предпочтительно мезилатной соли R(+)-N-пропаргил-1-аминоиндана.
3. Фармацевтическая композиция по п. 1 в форме таблетки, или капсулы, или саше.
4. Фармацевтическая композиция по п. 1, отличающаяся тем, что указанная доза составляет от 0,2 до 1,5 мг в сутки.
5. Фармацевтическая композиция по любому из пп. 1-4, имеющая следующие характеристики растворения в Аппарате 1 (корзина) согласно Фармакопее США (USP) при 50-150 об/мин, при значении рН до 7,4, при 37°С:
6. Фармацевтическая композиция по п. 1, отличающаяся тем, что указанное нейродегенеративное заболевание представляет собой болезнь Паркинсона или болезнь Альцгеймера, и указанное повреждение нервной системы представляет собой острое повреждение головного мозга, такое как инсульт или травматическое повреждение головного мозга.
7. Фармацевтическая композиция по п. 6, отличающаяся тем, что указанное нейродегенеративное заболевание представляет собой болезнь Паркинсона.
8. Применение активного агента, выбранного из R(+)-N-пропаргил-1-аминоиндана (разагилина) или его фармацевтически приемлемой соли, для получения фармацевтической композиции по любому из пп. 1-7 для лечения нейродегенеративного заболевания или повреждения нервной системы, причем указанная фармацевтическая композиция приготовлена в форме для пролонгированного высвобождения указанного активного агента, и при этом доза активного агента составляет от 0,2 до 2,0 мг в сутки.
9. Применение по п. 8, отличающееся тем, что указанная фармацевтически приемлемая соль выбрана из мезилатной соли, эзилатной соли, тозилатной соли, сульфатной соли, сульфонатной соли, фосфатной соли, карбоксилатной соли, малеатной соли, фумаратной соли, тартратной соли, бензоатной соли, ацетатной соли, гидрохлоридной соли или гидробромидной соли R(+)-N-пропаргил-1-аминоиндана, предпочтительна мезилатная соль R(+)-N-пропаргил-1-аминоиндана.
10. Применение по п. 8, отличающееся тем, что указанное нейродегенеративное заболевание представляет собой болезнь Паркинсона или болезнь Альцгеймера, а указанное повреждение нервной системы представляет собой острое повреждение головного мозга, такое как инсульт или травматическое повреждение головного мозга.
11. Применение по п. 10, отличающееся тем, что указанное нейродегенеративное заболевание представляет собой болезнь Паркинсона.
12. Применение по п. 8, отличающееся тем, что указанная доза составляет от 0,2 до 1,5 мг в сутки.
13. Способ лечения нейродегенеративного заболевания или повреждения нервной системы у нуждающегося в этом индивидуума, включающий введение указанному индивидууму фармацевтической композиции по любому из пп. 1-7, где указанная фармацевтическая композиция приготовлена в форме для пролонгированного высвобождения указанного активного агента, и при этом доза активного агента составляет от 0,2 до 2,0 мг в сутки.
14. Способ по п. 13, отличающийся тем, что указанное нейродегенеративное заболевание представляет собой болезнь Паркинсона или болезнь Альцгеймера, и указанное повреждение нервной системы представляет собой острое повреждение головного мозга, такое как инсульт или травматическое повреждение головного мозга.
15. Способ по п. 14, отличающийся тем, что указанное нейродегенеративное заболевание представляет собой болезнь Паркинсона.
16. Способ по п. 13, отличающийся тем, что указанная доза составляет от 0,2 до 1,5 мг в сутки.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US30101910P | 2010-02-03 | 2010-02-03 | |
| US61/301,019 | 2010-02-03 | ||
| PCT/IL2011/000126 WO2011095973A1 (en) | 2010-02-03 | 2011-02-03 | Extended release formulations of rasagiline and uses thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016141314A Division RU2734632C2 (ru) | 2010-02-03 | 2011-02-03 | Составы разагилина с пролонгированным высвобождением и их применение |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012136723A RU2012136723A (ru) | 2014-03-10 |
| RU2607595C2 true RU2607595C2 (ru) | 2017-01-10 |
Family
ID=43896855
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016141314A RU2734632C2 (ru) | 2010-02-03 | 2011-02-03 | Составы разагилина с пролонгированным высвобождением и их применение |
| RU2012136723A RU2607595C2 (ru) | 2010-02-03 | 2011-02-03 | Составы разагилина с пролонгированным высвобождением и их применение |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016141314A RU2734632C2 (ru) | 2010-02-03 | 2011-02-03 | Составы разагилина с пролонгированным высвобождением и их применение |
Country Status (25)
| Country | Link |
|---|---|
| US (1) | US9943489B2 (ru) |
| EP (2) | EP2531181B1 (ru) |
| JP (3) | JP6045347B2 (ru) |
| KR (1) | KR101791715B1 (ru) |
| CN (1) | CN102791258B (ru) |
| AU (1) | AU2011212068B2 (ru) |
| BR (1) | BR112012019374B1 (ru) |
| CA (1) | CA2789006C (ru) |
| CL (1) | CL2012002175A1 (ru) |
| CY (1) | CY1121781T1 (ru) |
| DK (1) | DK2531181T3 (ru) |
| ES (1) | ES2733133T3 (ru) |
| HU (1) | HUE044221T2 (ru) |
| IL (1) | IL221274A (ru) |
| LT (1) | LT2531181T (ru) |
| MX (1) | MX354423B (ru) |
| NZ (1) | NZ602111A (ru) |
| PL (1) | PL2531181T3 (ru) |
| PT (1) | PT2531181T (ru) |
| RS (1) | RS58988B1 (ru) |
| RU (2) | RU2734632C2 (ru) |
| SG (1) | SG183150A1 (ru) |
| TR (1) | TR201909277T4 (ru) |
| WO (1) | WO2011095973A1 (ru) |
| ZA (1) | ZA201206462B (ru) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9943489B2 (en) * | 2010-02-03 | 2018-04-17 | Pharmatwob Ltd. | Extended release formulations of rasagiline and uses thereof |
| CA2758556A1 (en) * | 2011-11-17 | 2013-05-17 | Pharmascience Inc. | Pharmaceutical composition of amphetamine mixed salts |
| KR102276896B1 (ko) * | 2012-01-12 | 2021-07-14 | 파마 투 비 엘티디 | 파킨슨병의 고정용량 조합 치료법 |
| US9504657B2 (en) * | 2012-01-12 | 2016-11-29 | Pharmatwob Ltd. | Fixed dose combination therapy of Parkinson's disease |
| CN103316026B (zh) | 2012-03-23 | 2016-05-11 | 中国人民解放军军事医学科学院毒物药物研究所 | 含芬特明和托吡酯的联合产品及其制备方法 |
| EP2829270B1 (en) | 2012-03-23 | 2020-11-11 | Institute of Pharmacology and Toxicology Academy of Military Medical Sciences P.L.A. China | Joint product containing synephrine and topiramate |
| CN102579367B (zh) * | 2012-03-23 | 2014-03-12 | 中国人民解放军军事医学科学院毒物药物研究所 | 托吡酯缓释药物组合物、其制备方法及用途 |
| AR092168A1 (es) * | 2012-08-17 | 2015-03-25 | Teva Pharma | Formulaciones parenterales de rasagilina |
| IN2013MU01782A (ru) * | 2013-05-20 | 2015-06-26 | Cadila Healthcare Ltd | |
| US20150275167A1 (en) * | 2014-03-28 | 2015-10-01 | Corning Incorporated | Composition and method for cell culture sustained release |
| EP3922242A1 (en) * | 2014-09-15 | 2021-12-15 | Orphazyme A/S | Arimoclomol formulation |
| US20180333365A1 (en) * | 2017-05-19 | 2018-11-22 | Biscayne Neurotherapeutics, Inc. | Modified release pharmaceutical compositions of huperzine and methods of using the same |
| CN107049985B (zh) * | 2017-06-07 | 2020-06-19 | 广州帝奇医药技术有限公司 | 一种抗帕金森病药物的长效缓释制剂及其制备方法 |
| KR20210014289A (ko) | 2019-07-30 | 2021-02-09 | (주)비씨월드제약 | 라사길린을 함유하는 서방출성 미립구의 제조방법 |
| WO2022238401A1 (en) * | 2021-05-11 | 2022-11-17 | Advicenne | Prolonged-release pharmaceutical composition for oral administration of sultiame |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4415547A (en) * | 1982-06-14 | 1983-11-15 | Sterling Drug Inc. | Sustained-release pharmaceutical tablet and process for preparation thereof |
| RU2001614C1 (ru) * | 1990-01-03 | 1993-10-30 | Тева Фармасьютикал Индастриз Лтд. (Il) | R (+)-N-Пропаргил-1-аминоиндан и его фармацевтически пригодные кислотно-аддитивные соли и фармацевтическа композици , обладающа ингибирующей B-форму фермента моноаминооксидазы активностью |
| RU2176912C2 (ru) * | 1996-03-25 | 2001-12-20 | Американ Хоум Продактс Корпорейшн | Композиции длительного высвобождения венлафаксин гидрохлорида, композиция пленочного покрытия, способ обеспечения терапевтически активной концентрации венлафаксина и способ исключения нулевых и пиковых концентраций лекарственного средства |
| WO2004045515A2 (en) * | 2002-11-15 | 2004-06-03 | Teva Pharmaceutical Industries, Ltd. | Use of rasagiline with or without riluzole to treat amyotrophic lateral sclerosis |
| WO2006014973A2 (en) * | 2004-07-26 | 2006-02-09 | Teva Pharmaceutical Industries, Ltd. | Pharmaceutical dosage forms including rasagiline |
| WO2009151594A1 (en) * | 2008-06-10 | 2009-12-17 | Teva Pharmaceutical Industries, Ltd. | Rasagiline soft gelatin capsules |
Family Cites Families (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4166452A (en) | 1976-05-03 | 1979-09-04 | Generales Constantine D J Jr | Apparatus for testing human responses to stimuli |
| US4256108A (en) | 1977-04-07 | 1981-03-17 | Alza Corporation | Microporous-semipermeable laminated osmotic system |
| US4265874A (en) | 1980-04-25 | 1981-05-05 | Alza Corporation | Method of delivering drug with aid of effervescent activity generated in environment of use |
| US4861800A (en) | 1987-08-18 | 1989-08-29 | Buyske Donald A | Method for administering the drug deprenyl so as to minimize the danger of side effects |
| HU208484B (en) | 1988-08-17 | 1993-11-29 | Chinoin Gyogyszer Es Vegyeszet | Process for producing pharmaceutical composition containing acid additional salt of selegilin as active component for treating schisofrenia |
| US5744500A (en) | 1990-01-03 | 1998-04-28 | Teva Pharmaceutical Industries, Ltd. | Use of R-enantiomer of N-propargyl-1-aminoindan, salts, and compositions thereof |
| US5192808A (en) | 1990-08-31 | 1993-03-09 | Deprenyl Animal Health, Inc. | Therapeutic effect of L-deprenyl in the management of pituitary-dependent hyperadrenocorticism (cushing's disease) |
| US5151449A (en) | 1990-08-31 | 1992-09-29 | Deprenyl Animal Health, Inc. | Use of L-deprenyl for retention of specific physiological functions |
| CA2039194C (en) | 1990-08-31 | 1997-01-28 | Norton W. Milgram | Uses of l-deprenyl and compositions for same |
| US5225446A (en) | 1990-08-31 | 1993-07-06 | Deprenyl Animal Health, Inc. | Use of 1-deprenyl for retention of specific physiological functions |
| US5169868A (en) | 1991-03-01 | 1992-12-08 | University Of Saskatchewan | Aliphatic propargylamines as specific mao-b inhibitors |
| WO1992017169A1 (en) | 1991-04-04 | 1992-10-15 | The University Of Toronto Innovations Foundation | Use of deprenyl to maintain, prevent loss, or recover nerve cell function |
| WO1992021333A2 (en) | 1991-05-24 | 1992-12-10 | Pharmavene, Inc. | Treatment of drug withdrawal symptoms and drug craving with type b monoamine oxidase inhibitors |
| IL99759A (en) | 1991-10-16 | 1997-06-10 | Teva Pharma | Mono-fluorinated derivatives of n-propargyl-1-aminoindan, their preparation and pharmaceutical compositions containing them |
| US5242950A (en) | 1992-04-23 | 1993-09-07 | Somerset Pharmaceuticals, Inc. | Treatment of macular degeneration |
| JP2916978B2 (ja) * | 1993-08-25 | 1999-07-05 | エスエス製薬株式会社 | 放出開始制御型製剤 |
| IL111240A (en) * | 1993-10-18 | 2001-10-31 | Teva Pharma | Salts of r(+) - enantiomers of n- propargyl-1-aminoindan and pharmaceutical compositions comprising them |
| US6348208B1 (en) | 1995-01-13 | 2002-02-19 | Somerset Pharmaceuticals, Inc. | Methods and pharmaceutical compositions employing desmethylselegiline |
| IL118836A (en) | 1996-07-11 | 2001-01-11 | Teva Pharma | Pharmaceutical compositions comprising s-(-)-n-propargyl-1-aminoindan |
| IL130528A (en) | 1996-12-18 | 2004-12-15 | Teva Pharma | Aminoindan derivatives, pharmaceutical compositions comprising them and uses thereof |
| US6251938B1 (en) | 1996-12-18 | 2001-06-26 | Teva Pharmaceutical Industries, Ltd., | Phenylethylamine derivatives |
| US5840979A (en) | 1997-07-14 | 1998-11-24 | University Of Saskatchewan | Aliphatic propargylamines as cellular rescue agents |
| MXPA01010933A (es) | 1999-04-29 | 2002-06-21 | Merck Patent Gmbh | Inhibidores del sistema de clivaje de la glicina como potenciales antipsicoticos. |
| EP1411901B1 (en) * | 2001-07-04 | 2010-08-18 | Sun Pharma Advanced Research Company Ltd | Gastric retention controlled drug delivery system |
| US20040076668A1 (en) | 2002-07-03 | 2004-04-22 | Pfizer Inc. | Controlled-release pharmaceutical formulations |
| WO2005072705A1 (en) * | 2004-01-29 | 2005-08-11 | Neuromolecular, Inc. | Combination of a nmda receptor antagonist and a mao-inhibitor or a gadpf-inhibitor for the treatment of central nervous system-related conditions |
| MX2008000084A (es) * | 2005-06-29 | 2008-03-18 | Panacea Biotec Ltd | Composiciones farmaceuticas de liberacion sostenida y procedimientos de las mismas. |
| WO2007016350A2 (en) * | 2005-07-28 | 2007-02-08 | Supernus Pharmaceuticals, Inc. | Modified release tablet formulations with enhanced mechanical properties |
| JP5726401B2 (ja) * | 2005-07-28 | 2015-06-03 | シャイア エルエルシー | 単回投与形態の連日投与に適したグアンファシンの医薬品の剤形/組成物 |
| CN101032474B (zh) * | 2006-03-06 | 2011-02-16 | 重庆医药工业研究院有限责任公司 | 一种治疗或预防神经系统疾病的雷沙吉兰透皮贴片及其制备方法 |
| CN101486655A (zh) | 2008-01-17 | 2009-07-22 | 美德(江西)生物科技有限公司 | 甲磺酸雷沙吉兰晶形及其制备方法 |
| NZ590291A (en) | 2008-06-06 | 2013-11-29 | Pharma Two B Ltd | Pharmaceutical compositions for treatment of parkinson's disease |
| WO2010007181A2 (en) * | 2008-07-18 | 2010-01-21 | Medichem, S.A. | New salt forms of an aminoindan derivative |
| EP2218444A3 (en) | 2009-01-23 | 2010-08-25 | Teva Pharmaceutical Industries, Ltd. | Delayed release rasagiline formulation |
| US9943489B2 (en) * | 2010-02-03 | 2018-04-17 | Pharmatwob Ltd. | Extended release formulations of rasagiline and uses thereof |
-
2011
- 2011-02-03 US US13/577,099 patent/US9943489B2/en active Active
- 2011-02-03 LT LTEP11707489.8T patent/LT2531181T/lt unknown
- 2011-02-03 WO PCT/IL2011/000126 patent/WO2011095973A1/en active Application Filing
- 2011-02-03 SG SG2012057493A patent/SG183150A1/en unknown
- 2011-02-03 NZ NZ602111A patent/NZ602111A/en unknown
- 2011-02-03 MX MX2012009079A patent/MX354423B/es active IP Right Grant
- 2011-02-03 BR BR112012019374-0A patent/BR112012019374B1/pt active IP Right Grant
- 2011-02-03 ES ES11707489T patent/ES2733133T3/es active Active
- 2011-02-03 RU RU2016141314A patent/RU2734632C2/ru active
- 2011-02-03 CN CN201180012590.4A patent/CN102791258B/zh active Active
- 2011-02-03 EP EP11707489.8A patent/EP2531181B1/en active Active
- 2011-02-03 DK DK11707489.8T patent/DK2531181T3/da active
- 2011-02-03 RS RS20190810A patent/RS58988B1/sr unknown
- 2011-02-03 HU HUE11707489 patent/HUE044221T2/hu unknown
- 2011-02-03 PL PL11707489T patent/PL2531181T3/pl unknown
- 2011-02-03 CA CA2789006A patent/CA2789006C/en active Active
- 2011-02-03 JP JP2012551732A patent/JP6045347B2/ja active Active
- 2011-02-03 AU AU2011212068A patent/AU2011212068B2/en active Active
- 2011-02-03 KR KR1020127023006A patent/KR101791715B1/ko active IP Right Grant
- 2011-02-03 RU RU2012136723A patent/RU2607595C2/ru active
- 2011-02-03 PT PT11707489T patent/PT2531181T/pt unknown
- 2011-02-03 TR TR2019/09277T patent/TR201909277T4/tr unknown
- 2011-02-03 EP EP19159171.8A patent/EP3517103A1/en not_active Withdrawn
-
2012
- 2012-08-02 IL IL221274A patent/IL221274A/en active IP Right Grant
- 2012-08-03 CL CL2012002175A patent/CL2012002175A1/es unknown
- 2012-08-28 ZA ZA2012/06462A patent/ZA201206462B/en unknown
-
2016
- 2016-09-26 JP JP2016186945A patent/JP6440662B2/ja active Active
-
2018
- 2018-11-20 JP JP2018216973A patent/JP6770564B2/ja active Active
-
2019
- 2019-07-03 CY CY20191100699T patent/CY1121781T1/el unknown
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4415547A (en) * | 1982-06-14 | 1983-11-15 | Sterling Drug Inc. | Sustained-release pharmaceutical tablet and process for preparation thereof |
| RU2001614C1 (ru) * | 1990-01-03 | 1993-10-30 | Тева Фармасьютикал Индастриз Лтд. (Il) | R (+)-N-Пропаргил-1-аминоиндан и его фармацевтически пригодные кислотно-аддитивные соли и фармацевтическа композици , обладающа ингибирующей B-форму фермента моноаминооксидазы активностью |
| RU2176912C2 (ru) * | 1996-03-25 | 2001-12-20 | Американ Хоум Продактс Корпорейшн | Композиции длительного высвобождения венлафаксин гидрохлорида, композиция пленочного покрытия, способ обеспечения терапевтически активной концентрации венлафаксина и способ исключения нулевых и пиковых концентраций лекарственного средства |
| WO2004045515A2 (en) * | 2002-11-15 | 2004-06-03 | Teva Pharmaceutical Industries, Ltd. | Use of rasagiline with or without riluzole to treat amyotrophic lateral sclerosis |
| WO2006014973A2 (en) * | 2004-07-26 | 2006-02-09 | Teva Pharmaceutical Industries, Ltd. | Pharmaceutical dosage forms including rasagiline |
| WO2009151594A1 (en) * | 2008-06-10 | 2009-12-17 | Teva Pharmaceutical Industries, Ltd. | Rasagiline soft gelatin capsules |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2607595C2 (ru) | Составы разагилина с пролонгированным высвобождением и их применение | |
| JP4758064B2 (ja) | 有効物質を徐放する3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)フェノール含有医薬 | |
| AU2012230733B2 (en) | Methods and compositions for treatment of attention deficit disorder | |
| JP2018520112A (ja) | 制御持続放出プレガバリン | |
| EP2802319B1 (en) | Fixed dose combination therapy of parkinson's disease | |
| US9504657B2 (en) | Fixed dose combination therapy of Parkinson's disease | |
| RU2771522C9 (ru) | Терапия болезни паркинсона с применением комбинации с фиксированными дозами | |
| ES2263976T3 (es) | Medicamento de liberacion retardada del principio activo que contiene 1-dimetilamino-3-(3-metoxifenil)-2-metil-3-pentanol. | |
| CN101180039A (zh) | 至少一种形式的文拉法辛的缓释组合物 |