RU2523293C2 - Стабильная инсектицидная композиция и способ её получения (варианты) - Google Patents
Стабильная инсектицидная композиция и способ её получения (варианты) Download PDFInfo
- Publication number
- RU2523293C2 RU2523293C2 RU2011131067/13A RU2011131067A RU2523293C2 RU 2523293 C2 RU2523293 C2 RU 2523293C2 RU 2011131067/13 A RU2011131067/13 A RU 2011131067/13A RU 2011131067 A RU2011131067 A RU 2011131067A RU 2523293 C2 RU2523293 C2 RU 2523293C2
- Authority
- RU
- Russia
- Prior art keywords
- methyl
- composition
- ethyl
- mmol
- diastereomers
- Prior art date
Links
- 0 *c1ncc(C(CCC2)S2(=N*)=O)cc1 Chemical compound *c1ncc(C(CCC2)S2(=N*)=O)cc1 0.000 description 2
- PHXBEXGUYNSUFI-UHFFFAOYSA-N CC(c1ccc(C(Cl)(Cl)Cl)nc1)Br Chemical compound CC(c1ccc(C(Cl)(Cl)Cl)nc1)Br PHXBEXGUYNSUFI-UHFFFAOYSA-N 0.000 description 1
- XDXFXDNITMXZGJ-UHFFFAOYSA-N CC(c1ccc(C(Cl)(Cl)Cl)nc1)SC Chemical compound CC(c1ccc(C(Cl)(Cl)Cl)nc1)SC XDXFXDNITMXZGJ-UHFFFAOYSA-N 0.000 description 1
- PHBHUOZUNYIUKS-UHFFFAOYSA-N CC(c1ccc(C(F)(F)Cl)nc1)SC Chemical compound CC(c1ccc(C(F)(F)Cl)nc1)SC PHBHUOZUNYIUKS-UHFFFAOYSA-N 0.000 description 1
- QCBQMAKHLNEBHQ-UHFFFAOYSA-N CC(c1cnc(C(F)(F)Cl)cc1)Cl Chemical compound CC(c1cnc(C(F)(F)Cl)cc1)Cl QCBQMAKHLNEBHQ-UHFFFAOYSA-N 0.000 description 1
- ZQVLPMNLLKGGIU-UHFFFAOYSA-N O=Cc(nc1)ccc1Br Chemical compound O=Cc(nc1)ccc1Br ZQVLPMNLLKGGIU-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/34—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom
- A01N43/40—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom six-membered rings
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/40—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having a double or triple bond to nitrogen, e.g. cyanates, cyanamides
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/02—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one or more oxygen or sulfur atoms as the only ring hetero atoms
- A01N43/04—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one or more oxygen or sulfur atoms as the only ring hetero atoms with one hetero atom
- A01N43/22—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one or more oxygen or sulfur atoms as the only ring hetero atoms with one hetero atom rings with more than six members
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/28—Radicals substituted by singly-bound oxygen or sulphur atoms
- C07D213/32—Sulfur atoms
- C07D213/34—Sulfur atoms to which a second hetero atom is attached
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/44—Radicals substituted by doubly-bound oxygen, sulfur, or nitrogen atoms, or by two such atoms singly-bound to the same carbon atom
- C07D213/53—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/54—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/57—Nitriles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Environmental Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Plant Pathology (AREA)
- Pest Control & Pesticides (AREA)
- Agronomy & Crop Science (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Pyridine Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Изобретение относится к сельскому хозяйству. Осуществляютполучение инсектицидной композиции, имеющей первое соотношение стереоизомеров соединения, имеющего следующую структуру:
и нагревание композиции в течение 4-72 часов при температуре 23-70°С с получением второго, иного соотношения стереоизомеров. Изобретение позволяет повысить стабильность композиции. 3 н. и 9 з.п. ф-лы, 3 табл., 9 пр.
Description
Перекрестные ссылки на родственные заявки
Настоящая заявка испрашивает приоритет параллельно рассматриваемой предварительной заявки на патент США 61/203600, поданной 26 декабря 2008 года, содержание которой включено в настоящий документ в качестве ссылки во всей его полноте.
Область техники, к которой относится изобретение
Изобретение, описанное в настоящем документе, относится к области пестицидов и к их использованию в борьбе с насекомыми-вредителями.
Уровень техники
Насекомые-вредители вызывают миллионы смертей людей во всем мире ежегодно. Кроме того, имеется более десяти тысяч видов насекомых-вредителей, которые вызывают потери в земледелии. Эти сельскохозяйственные потери насчитывают миллиарды долларов США ежегодно. Термиты вызывают повреждения различных структур, таких как дома. Потери от этих повреждений термитами насчитывают миллиарды долларов США ежегодно. В качестве конечного замечания, огромное количество запасов продуктов питания съедаются и делаются непригодными для хранения из-за насекомых-вредителей. Эти потери запасов продуктов питания насчитывают миллиарды долларов США ежегодно, но, что более важно, они лишают людей необходимых продуктов питания.
Множество пестицидных композиций разработано со временем для уничтожения насекомых-вредителей и уменьшения вреда, который они наносят. В отношении по меньшей мере некоторых из этих композиций, физические и химические нестабильности могут приводить к уменьшению пестицидной активности композиции и/или вызывать осложнения при нанесении композиции на участок, где является необходимой или желательной борьба с насекомыми-вредителями. Например, физическая и химическая нестабильность может изменять одно или несколько свойств композиций, что делает сложным или невозможным приготовление соответствующих растворов композиции для использования. Более конкретно, многие пестицидные композиции поставляются в виде концентрированного препарата от производителя и разбавляются затем конечным пользователем перед их нанесением. В течение времени между получением и применением жидкие формы пестицидных композиций могут отверждаться вследствие химической и физической нестабильности композиции. Часто это отверждение делает невозможным или значительно затрудняет диспергирование композиции в растворе, пригодном для применения, что приводит к дополнительным проблемам для пользователя и к увеличению стоимости и/или к загрязнению пестицидных продуктов. Кроме того, когда физическая и химическая нестабильность приводит к уменьшению пестицидной активности композиции, часто требуется увеличение концентрации, при которой наносится пестицид, и/или более частые нанесения пестицидной композиции. В результате затраты пользователя и затраты потребителей могут возрастать. По этой причине существует потребность в новых пестицидных композициях, которые проявляют улучшенные свойства в отношении химической и физической стабильности композиции.
Публикация заявки на патент США 2007/0203191 Al описывает определенные N-замещенные (6-галогеналкилпиридин-3-ил)алкилсульфоксиминовые соединения и их использование в борьбе с насекомыми. В настоящее время обнаружено, как можно улучшить стабильность композиций, содержащих одно или несколько этих соединений, в течение более продолжительных периодов времени.
Сущность изобретения
Настоящее изобретения относится к новым композициям, содержащим N-замещенное (6-галогеналкилпиридин-3-ил)алкилсульфоксиминовое соединение и проявляющим повышенную стабильность, а также к их использованию в борьбе с насекомыми и определенными другими беспозвоночными, в частности афидами и другими сосущими насекомыми. Настоящее изобретение также включает новые процедуры синтеза для получения композиций и способов борьбы с насекомыми с использованием этих композиций.
Настоящее изобретение относится к композициям, пригодным для борьбы с насекомыми, в частности пригодным для борьбы с афидами и другими сосущими насекомыми, а также к способам их получения. Более конкретно, в одном из вариантов осуществления способ включает получение композиции, содержащей первое соотношение стереоизомеров соединения, имеющего формулу (I)
где
X представляет собой NO2, CN или COOR4;
L представляет собой одинарную связь или R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо;
R1 представляет собой (C1-C4)алкил;
R2 и R3 отличаются друг от друга и индивидуально представляют собой водород, метил, этил, фтор, хлор или бром;
n равно 1, когда L представляет собой одинарную связь, и равно 0, когда R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо;
Y представляет собой (C1-C4)галогеналкил, F, Cl, Br или I и
R4 представляет собой (C1-C3)алкил.
Способ также включает нагревание композиции способом, эффективным для получения второго, иного, соотношения стереоизомеров.
В одной из конкретных форм способа композиция содержит соединение формулы (I), где L представляет собой одинарную связь, т.е. оно имеет следующую структуру, где n равно 1
где
X представляет собой NO2, CN или COOR4;
R1 представляет собой (C1-C4) алкил;
R2 и R3 отличаются друг от друга и индивидуально представляют собой водород, метил, этил, фтор, хлор или бром;
Y представляет собой (C1-C4) галогеналкил, F, Cl, Br или I и
R4 представляет собой (C1-C3) алкил.
В другой конкретной форме способа композиция содержит соединение формулы (I), где R1, S и L, взятые вместе, образуют насыщенное 5-членное кольцо и n равно 0, т.е. оно имеет структуру
где
X представляет собой NO2, CN или COOR4;
Y представляет собой (C1-C4) галогеналкил, F, Cl, Br или I и
R4 представляет собой (C1-C3) алкил.
В других формах способа композиция содержит соединения формулы (I) в одном или нескольких из следующих классов:
(1) Соединения формулы (I), где X представляет собой NO2 или CN, наиболее предпочтительно CN.
(2) Соединения формулы (I), где Y представляет собой CF3.
(3) Соединения формулы (I), где R2 и R3 отличаются друг от друга и независимо представляют собой водород, метил или этил.
(4) Соединения формулы (I), где R1 представляет собой CH3.
Специалистам в данной области будет понятно, что одна или несколько композиций, описанных в настоящем документе, могут состоять из сочетаний описанных выше классов соединения формулы (I).
В одной из форм способа нагревание осуществляется при минимальной температуре примерно 20°C по меньшей мере примерно в течение четырех часов. В другой форме нагревание осуществляется при минимальной температуре примерно 50°C в течение от примерно четырех до примерно семидесяти двух часов.
В другом варианте осуществления способ включает получение композицию, которая содержит стереоизомерную смесь соединения, имеющего следующую структуру:
где
X представляет собой NO2, CN или COOR4;
R1 представляет собой (C1-C4) алкил;
R2 и R3 отличаются друг от друга и индивидуально представляют собой водород, метил, этил, фтор, хлор или бром;
Y представляет собой (C1-C4)галогеналкил, F, Cl, Br или I;
R4 представляет собой (C1-C3)алкил и
смесь определяется первой парой диастереомеров и второй парой диастереомеров.
Способ также включает нагревание композиции с превращением по меньшей мере части второй пары диастереомеров в первую пару диастереомеров.
В другом варианте осуществления композиция содержит стереоизомерную смесь {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида, определяемую первой парой диастереомеров и второй парой диастереомеров, где первая и вторая пары диастереомеров присутствуют при соотношении по меньшей мере примерно 3:1. В одной из форм первая и вторая пары диастереомеров присутствуют при соотношении от примерно 3:1 до 100:1. В другой форме первая и вторая пары диастереомеров присутствуют при соотношении от примерно 3:1 до 40:1.
Еще в одном варианте осуществления способ включает нанесение на участок, где является желательным уничтожение насекомых, некоторого количества пестицидной композиции.
Дополнительные варианты осуществления, формы, признаки, аспекты, выгоды, цели и преимущества настоящего изобретения станут понятны из подробного описания и приведенных примеров.
Заместители (неисчерпывающий список)
Примеры, приведенные для заместителей, являются (за исключением галогена) неисчерпывающими и не должны рассматриваться как ограничивающие настоящее изобретение, описанное в настоящем документе.
"Алкил" (включая производные термины, такие как алкокси) обозначает группы с прямой цепью, с разветвленной цепью и циклические группы, включая, например, метил, этил, 1-метилэтил, пропил, 1,1-диметилэтил и циклопропил.
"Алкокси" обозначает алкил, дополнительно содержащий одинарную связь углерод-кислород, например, метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и деокси.
"Арил" обозначает циклический ароматический заместитель, состоящий из водорода и углерода, например, фенил, нафтил и бифенилил.
"Галоген" обозначает фтор, хлор, бром и йод.
"Галогеналкил" обозначает алкильную группу, замещенную от одного до максимально возможного количества атомами галогена, включая все сочетания галогенов.
Подробное описание изобретения
В настоящем документе все температуры приводятся в °С и все % представляют собой % масс., если не утверждается иного.
Соединения формулы (Ia), где R1, R2, R3, R4, X, и Y являются такими, как определено ранее, L представляет собой одинарную связь и n равно 1, могут быть получены посредством способов, показанных на Схеме A:
На стадии a Схемы A сульфид формулы (A) окисляется с помощью мета-хлорпероксибензойной кислоты (mCPBA) в полярном растворителе при температуре ниже 0°C с получением сульфоксида формулы (B). В большинстве случаев дихлорметан представляет собой предпочтительный растворитель для окисления.
На стадии b Схемы A сульфоксид (B) иминируется с помощью азида натрия в присутствии концентрированной серной кислоты в апротонном растворителе при нагревании с получением сульфоксимина формулы (C). В большинстве случаев хлороформ представляет собой предпочтительный растворитель для этой реакции.
На стадии c Схемы A азот сульфоксимина (C) может либо цианироваться с помощью цианогена бромида в присутствии основания или нитрироваться с помощью азотной кислоты в присутствии уксусного ангидрида при умеренно повышенной температуре, либо карбоксилироваться с помощью алкил (R4) хлорформиата в присутствии основания, такого как 4-диметиламинопиридин (DMAP) с получением N-замещенного сульфоксимина (Ia). Основание необходимо для эффективного цианирования и карбоксилирования, и предпочтительное основание представляет собой DMAP, в то время как серная кислота используется в качестве катализатора для эффективной реакции нитрирования.
Соединения формулы (Ia), где X представляет собой CN и R1, R2, R3, R4 и Y являются такими, как определено ранее, и n равно 1, могут быть получены посредством мягкого и эффективного способа, иллюстрируемого на Схеме B.
На стадии a Схемы B сульфид окисляется йодбензолдиацетатом в присутствии цианамида при 0°C с получением сульфилимина (D). Реакция может осуществляться в полярном апротонном растворителе, подобном CH2Cl2.
На стадии b Схемы B сульфилимин (D) окисляется с помощью mCPBA. Основание, такое как карбонат калия, используется для нейтрализации кислотности mCPBA. Протонные полярные растворители, такие как этанол и вода, используются для повышения растворимости исходного материала сульфилимина и используемого основания. Сульфилимин (D) может также окисляться с помощью водного раствора натрия или калия периодината в присутствии катализатора рутения трихлорида гидрата или подобного катализатора. Органический растворитель для этого катализа может представлять собой полярный апротонный растворитель, такой как CH2Cl2, хлороформ или ацетонитрил.
α-Углерод N-замещенного сульфоксимина формулы (Ia), т.е. n=1, R3=H в группе (CR2R3), соседней с функциональной группой N-замещенного сульфоксимина, может дополнительно алкилироваться или галогенироваться (R5) в присутствии основания, такого как калийгексаметилдисиламид (KHMDS) с получением N-замещенных сульфоксиминов формулы (Ib), где R1, R2, R3, R4, X, L и Y являются такими, как определено ранее, и Z представляет собой соответствующую уходящую группу, как показано на Схеме C. Предпочтительные уходящие группы представляют собой йодид (R5 = алкил), бензолсульфонимид (R5 = F), тетрахлорпентен (R5 = Cl) и тетрафторпентен (R5 = Br).
Исходные сульфиды (A) на Схеме A могут быть получены различными способами, как показано на Схемах D, E, F, G и H.
На Схеме D сульфиды формулы (A1), где R1, R2 и Y являются такими, как определено ранее, n=1 и R3 = H могут быть получены из хлорида формулы (D) посредством нуклеофильного замещения натриевой солью алкилтиола.
На Схеме E сульфид формулы (A4), где R1, S и L, взятые вместе, представляют собой 4-, 5- или 6-членное кольцо (m=0, 1, или 2) и n равно 0, может быть получен из соответствующего замещенного хлорметилпиридина посредством обработки тиомочевиной, гидролиза и последующего алкилирования с помощью соответствующего бромхлоралкана (m=0, 1 или 2) в условиях водного раствора основания и циклизации в присутствии основания, подобного трет-бутоксиду калия, в полярном апротонном растворителе, таком как ТГФ (THF).
Сульфиды формулы (A1), где R1, R2 = CH3, Y являются такими, как определено ранее, и R3 = H, альтернативно могут быть получены с помощью способов, показанных на Схеме F. Соответственно, соответствующий енон связывается с диметиламиноакрилонитрилом и циклизируется с помощью ацетата аммония в ДМФ (DMF) с получением соответствующего 6-замещенного никотинонитрила. Обработка бромидом метилмагния, восстановление боргидридом натрия, хлорирование с помощью тионилхлорида и нуклеофильное замещение натриевой солью алкилтиола дают желаемые сульфиды (A1).
Сульфиды формулы (A1), где R1 = метил или этил, R2 и R3 отличаются друг от друга и независимо представляют собой водород, метил или этил, и Y является таким, как определено ранее, могут быть получены посредством варианта Схемы F, изображенного на Схеме G, где енамины, сформированные при добавлении амина, например пирролидина, с помощью аддукта Михаэля определенных сульфидов и соответствующим образом замещенных α,β-ненасыщенных альдегидов, связываются с замещенными енонами и циклизируются с помощью ацетата аммония в ацетонитриле с получением желаемых сульфидов (A1).
На Схеме H сульфиды формулы (A1), где Y представляет собой фторалкильную группу, R1, R2 и R3 являются такими, как определено ранее, и n=1, могут быть получены из 6-ацилпиридина или 6-формилпиридина посредством реакции с трифторидом диэтиламиносеры (DAST). Последующее галогенирование 3-метильной группы с помощью NBS с последующим нуклеофильным замещением натриевой солью алкилтиола дает желаемый сульфид.
Примеры неограничивающих соединений в соответствии с формулой (I):
Пример I. Получение [1-(6-трифторметилпиридин-3-ил)этил](метил)оксидо-λ
4
-сульфанилиденцианамида (2)
К раствору 3-хлорметил-6-(трифторметил)пиридина (5,1 г, 26 ммоль) в диметилсульфоксиде (ДМСО; 20 мл) добавляют одной порцией тиометоксид натрия (1,8 г, 26 ммоль). Наблюдают сильно экзотермическую реакцию, которая приводит к тому, что реакционная смесь темнеет. Реакционную смесь перемешивают в течение 1 часа, затем медленно добавляют дополнительный тиометоксид натрия (0,91 г, 13 ммоль). Реакционную смесь перемешивают в течение ночи, после чего ее выливают в H2O и добавляют несколько капель концентрированной HCl. Смесь экстрагируют Et2O (3×50 мл) и органические слои объединяют, промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Сырой продукт очищают с помощью хроматографии (Prep 500, 10% смесь ацетон/гексан) с получением сульфида (A) в виде бледно-желтого масла (3,6 г, 67%).
1H ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 3,7 (с, 2H), 2,0 (с, 3H).
ГХ-МС: вычисленная масса для C8H8F3NS [M]+ 207. Найдено 207.
К раствору сульфида (A) (3,5 г, 17 ммоль) и цианамида (1,4 мг, 34 ммоль) в CH2Cl2 (30 мл) при 0°C добавляют йодбензолдиацетат (11,0 г, 34 ммоль), все за один раз. Реакционную смесь перемешивают в течение 30 мин, затем позволяют ей нагреваться до комнатной температуры в течение ночи. Смесь разбавляют CH2Cl2 (50 мл) и промывают H2O. Водный слой экстрагируют этилацетатом (4×50 мл), и объединенные слои CH2Cl2 и этилацетата сушат над MgSO4 и концентрируют. Сырой продукт растирают с гексаном и очищают с помощью хроматографии (chromatotron, 60%-ная смесь ацетон/гексан) с получением сульфилимина (B) в виде желтой смолы (0,60 г, 14%).
ИК (пленка) 3008, 2924, 2143, 1693 см-1.
1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H), 4,5 (д, 1H), 4,3 (д, 1H), 2,9 (с, 3H).
ЖХ-МС (ESI): вычисленная масса для C9H9F3N3S [M+H]+ 248,04. Найдено 248.
К раствору м-хлорпербензойной кислоты (mCPBA; 80%, 1,0 г, 4,9 ммоль) в EtOH (10 мл) при 0°C добавляют раствор K2CO3 (1,4 г, 10 ммоль) в H2O (7 мл). Раствор перемешивают в течение 20 мин, затем добавляют раствор сульфилимина (B) (0,60 г, 2,4 ммоль) в EtOH (20 мл), все за один раз. Реакционную смесь перемешивают при 0°C в течение 30 мин, затем ей позволяют нагреваться до комнатной температуры в течение 1 часа. Затем реакционную смесь гасят водным раствором бисульфита натрия и смесь концентрируют с удалением этанола. Полученную смесь экстрагируют CH2Cl2, и объединенные органические слои сушат над MgSO4 и концентрируют. Сырой продукт очищают с помощью хроматографии (chromatotron, 50%-ная смесь ацетон/гексаны) с получением сульфоксимина (1) в виде беловатого твердого продукта (0,28 г, 44%). Т.пл. = 135-137°C.
1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,7 (м, 2H), 3,2 (с, 3H).
ЖХ-МС (ELSD): вычисленная масса для C9H9F3N3OS [M+H]+ 264,04. Найдено 263,92.
К раствору сульфоксимина (1) (50 мг, 0,19 ммоль) и гексаметилфосфорамида (HMPA; 17 мкл, 0,10 ммоль) в тетрагидрофуране (ТГФ; 2 мл) при -78°C добавляют по каплям калий гексаметилдисилазан (KHMDS; 0,5 M в толуоле, 420 мкл, 0,21 ммоль). Раствор перемешивают при -78°C в течение дополнительных 20 мин, после чего добавляют йодометан (13 мкл, 0,21 ммоль). Реакционной смеси позволяют нагреваться до комнатной температуры в течение 1 часа, после чего ее гасят насыщенным водным раствором NH4Cl и экстрагируют CH2Cl2. Органический слой сушат над Na2SO4, концентрируют и очищают сырой продукт с помощью хроматографии (chromatotron, 70%-ная смесь ацетон/CH2Cl2) с получением сульфоксимина (2) в виде смеси диастереомеров 2:1 (бесцветное масло; 31 мг, 59%). Сульфоксимин (2) обычно известен как сульфоксафлор, дополнительные детали относительно него доступны по адресу http://www.alanwood.net/pesticides/index_cn_frame.html. В соответствии с переработанной версией номенклатуры IUPAC сульфоксимин (2) также упоминается как [метил(оксидо){1-[6-(трифторметил)-3-пиридил]этил}-λ6-сульфанилиден]цианамид, и наименование CAS, присвоенное сульфоксимину (2), представляет собой N-[метилоксидо[1-[6-(трифторметил)-3-пиридинил]этил]-λ4-сульфанилиден]цианамид.
1H ЯМР (300 МГц, CDCl3) δ (главный диастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв., 1H), 3,0 (с, 3H), 2,0 (д, 3H); (дополнительный диастереомер) 8,8 (с, 1H), 8,1 (д, 1H), 7,8 (д, 1H), 4,6 (кв., 1H), 3,1 (с, 3H), 2,0 (д, 3H).
ЖХ-МС (ELSD): вычисленная масса для C10H10F3N3OS [M+H]+ 278,06. Найдено 278,05.
Пример II. Получение 2-(6-трифторметилпиридин-3-ил)-1-оксидотетрагидро-1H-1λ
4
-тиен-1-илиденцианамида (3)
К суспензии тиомочевины (1,2 г, 16 ммоль) в EtOH (25 мл) добавляют раствор 3-хлорметил-6-(трифторметил)пиридина в EtOH (10 мл). Суспензию перемешивают при комнатной температуре в течение 2 дней, в это время формируется белый осадок. Осадок фильтруют с получением желаемого амидин гидрохлорида в виде белого твердого вещества (2,4 г, 58%). Т.пл. = 186-188°C. Дополнительных попыток очистки продукта не делается.
1H ЯМР (300 МГц, CDCl3) δ 8,9 (ушир.с, 4H), 8,4 (с, 1H), 7,6 (д, 1H), 7,3 (д, 1H), 4,2 (с, 2H).
ЖХ-МС (ELSD): вычисленная масса для C8H8FN3S [M+H]+ 236,05. Найдено 236,01.
К раствору амидин гидрохлорида (A) (1,8 г, 6,8 ммоль) в H2O (12 мл) при 10°C добавляют 10 н. NaOH (0,68 мл, 6,8 ммоль), что приводит к образованию белого осадка. Суспензию нагревают при 100°C в течение 30 мин, затем охлаждают снова до 10°C. Затем добавляют дополнительный 10 н. NaOH (0,68 мл, 6,8 ммоль), а затем 1-бром-3-хлорпропан (0,67 мл, 6,8 ммоль), все за один раз. Реакционную смесь перемешивают при комнатной температуре в течение ночи, затем экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением сульфида (B) в виде бесцветного масла (1,7 г, 96%). Дополнительных попыток очистки продукта не проводят.
1H ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 3,8 (с, 2H), 3,6 (т, 2H), 2,6 (т, 2H), 2,0 (квинтет, 2H).
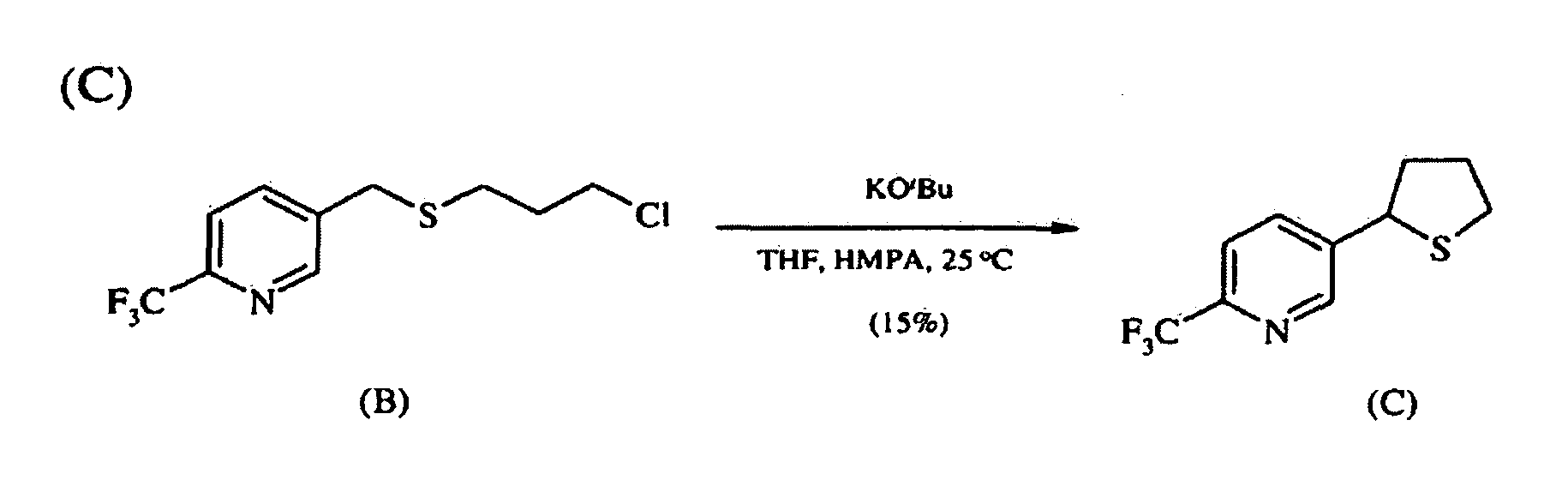
К суспензии трет-бутоксида калия (1,5 г, 13 ммоль) в ТГФ (12 мл) добавляют по каплям HMPA (1,7 мл, 10 ммоль), а затем раствор сульфида (B) (1,8 г, 6,7 ммоль) в ТГФ (3 мл). Реакционной смеси позволяют перемешиваться при комнатной температуре в течение ночи с последующим концентрированием и очисткой с помощью хроматографии (Biotage, 40%-ная смесь EtOAc/гексаны) с получением циклизованного продукта (C) в виде оранжевого масла (230 мг, 15%).
1H ЯМР (300 МГц, CDCl3) δ 8,7 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 4,6 (дд, 1H), 3,2 (м, 1H), 3,1 (м, 1H), 2,5 (м, 1H), 2,3 (м, 1H), 2,1-1,9 (м, 2H).
К раствору сульфида (C) (230 мг, 0,99 ммоль) и цианамида (83 мг, 2,0 ммоль) в CH2Cl2 (5 мл) при 0°C добавляют йодбензолдиацетат (350 мг, 1,1 ммоль), весь за один раз. Реакционную смесь перемешивают в течение 3 часов, затем концентрируют и сырой продукт очищают с помощью хроматографии (chromatotron, 50%-ная смесь ацетон/гексаны) с получением сульфилимина (D) в виде оранжевого масла (150 мг, смесь диастереомеров, 56%).
1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 7,9 (д, 1H), 7,8 (д, 1H), 4,8 (дд, 1H), 3,5 (м, 2H), 2,9-2,7 (м, 2H), 2,6 (м, 1H), 2,3 (м, 1H).
К раствору mCPBA (80%, 180 мг, 0,82 ммоль) в EtOH (3 мл) при 0°C добавляют раствор K2CO3 (230 мг, 1,7 ммоль) в H2O (1,5 мл). Раствор перемешивают в течение 20 мин, затем добавляют раствор сульфилимина (D) (150 мг, 0,55 ммоль) в EtOH (2 мл), весь за один раз. Реакционную смесь перемешивают при 0°C в течение 45 мин, после чего растворитель декантируют в отдельную колбу и концентрируют с получением белого твердого вещества. Твердое вещество суспендируют в CHCl3, фильтруют и концентрируют с получением чистого сульфоксимина (3) в виде бесцветного масла (72 мг, 44%).
1H ЯМР (300 МГц, CDCl3) δ (1,5:1 смесь диастереомеров) 8,8 (с, 2H), 8,0 (д, 2H), 7,8 (д, 2H), 4,7 (кв., 1H), 4,6 (кв., 1H), 4,0-3,4 (м, с, 4H), 3,0-2,4 (м, 8H).
ЖХ-МС (ELSD): вычисленная масса для C11H11F3N3OS [M+H]+ 290,06. Найдено 289,99.
Пример III. Получение (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)оксидо-λ
4
-сульфанилиденцианамиада (4)
(3E)-1-Хлор-4-этокси-1,1-дифторбут-3-ен-2-он (7,36 г, 40 ммоль) растворяют в сухом толуоле (40 мл) и обрабатывают 3-диметиламиноакрилонитрилом (4,61 г, 48 ммоль) при комнатной температуре. Раствор нагревают при 100°C в течение 3,5 часа. Затем растворитель удаляют при пониженном давлении и оставшуюся смесь повторно растворяют в ДМФ (20 мл), обрабатывают ацетатом аммония (4,62 г, 60 ммоль) и перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и полученную смесь дважды экстрагируют смесью простой эфир : CH2CH2 (1:2, об./об.). Объединенный органический слой промывают насыщенным раствором соли, сушат, фильтруют и концентрируют. Остаток очищают на силикагеле с получением 3,1 г 6-[хлор(дифтор)метил]никотинонитрила (A) в виде светлого масла с выходом 41%.
ГХ-МС: вычисленная масса для C7H3ClF2N2 [M]+ 188. Найдено 188.
6-[Хлор(дифтор)метил]никотинонитрил (A) (3,0 г 15,8 ммоль) растворяют в безводном простом эфире (25 мл) и охлаждают на ледяной бане. Раствор 3 M метилмагния бромида в гексане (6,4 мл, 19 ммоль) добавляют с помощью шприца. После завершения добавления смесь перемешивают при 0°C в течение 5 часов, а затем при комнатной температуре в течение 10 часов. Реакцию медленно гасят с помощью водного раствора 1 н. лимонной кислоты при 0°C и полученную смесь перемешивают при комнатной температуре в течение 1 часа. pH снова доводят до pH 7 с помощью насыщенного водного раствора NaHCO3. Две фазы разделяют и водную фазу дважды экстрагируют этилацетатом. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют. Оставшуюся смесь очищают на силикагеле с элюированием с помощью 15% ацетона в гексане с получением 0,88 г желаемого продукта 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанона (B) в виде коричневатого масла с выходом 30%.
ГХ-МС: вычисленная масса для C8H6ClF2NO [M]+ 205. Найдено 205.
К раствору 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанона (B) (0,85 г, 4,14 ммоль) в MeOH (10 мл) при 0°C добавляют NaBH4 (0,16 г, 4,14 ммоль). Смесь перемешивают в течение 30 мин и добавляют 2 M водный раствор HCl до тех пор, пока pH не достигнет 7. Растворитель удаляют при пониженном давлении и оставшуюся смесь экстрагируют CH2Cl2 (2×50 мл). Объединенный органический слой сушат над безводным Na2SO4, фильтруют, концентрируют и сушат в вакууме с получением 0,798 г аналитически чистого 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанола (C) с помощью ГХ-МС в виде светло-желтого масла с выходом 93%.
ГХ-МС: вычисленная масса для C8H6ClF2NO [M]+ 207. Найдено 207.
К раствору 1-{6-[хлор(дифтор)метил]пиридин-3-ил}этанола (0,78 г, 3,77 ммоль) в CH2Cl2 (40 мл) по каплям добавляют тионилхлорид (0,54 мл, 7,54 ммоль) при комнатной температуре. Через 1 час реакцию медленно гасят насыщенным водным раствором NaHCO3 и две фазы разделяют. Органический слой сушат над Na2SO4, фильтруют, концентрируют и сушат в вакууме с получением 0,83 г сырого 2-[хлор(дифтор)метил]-5-(1-хлорэтил)пиридина (D) в виде коричневого масла с выходом 98%, которое непосредственно используют для реакции на следующей стадии.
ГХ-МС: вычисленная масса для C8H7Cl2F2N [M]+ 225. Найдено 225.
К раствору 2-[хлор(дифтор)метил]-5-(1-хлорэтил)пиридина (D) (0,81 г, 3,6 ммоль) в этаноле (10 мл) добавляют тиометоксид натрия (0,52 г, 7,4 ммоль) при перемешивании одной порцией при 0°C. Через 10 мин смеси позволяют нагреваться до комнатной температуры и перемешивают в течение ночи. Этанол растворителя затем удаляют при пониженном давлении и остаток повторно извлекают в смесь простой эфир/CH2Cl2 и насыщенный раствор соли. Две фазы разделяют и органический слой экстрагируют CH2Cl2 еще раз. Объединенный органический слой сушат над безводным Na2SO4, фильтруют, концентрируют, очищают на силикагеле с использованием 5%-ного этилацетата в гексане с получением 0,348 г 2-[хлор(дифтор)метил]-5-[1-(метилтио)этил]пиридина (E) с выходом 40%.
ГХ-МС: вычисленная масса для C9H10ClF2NS [M]+ 237. Найдено 237.
К перемешиваемому раствору 2-[хлор(дифтор)метил]-5-[1-(метилтио)этил]пиридина (E) (0,32 г, 1,35 ммоль) и цианамида (0,058 г, 1,35 ммоль) в ТГФ (7 мл) добавляют йодбензолдиацетат (0,44 г, 1,35 ммоль) одной порцией при 0°C и полученную смесь перемешивают при этой температуре в течение 1 часа, а затем при комнатной температуре в течение 2 часов. Затем растворитель удаляют при пониженном давлении и полученную смесь растворяют в CH2Cl2, промывают полунасыщенным раствором соли, сушат над безводным Na2SO4, фильтруют, концентрируют и очищают на силикагеле с использованием 50%-ного раствора ацетона в гексане с получением 0,175 г (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)-λ4-сульфанилиденцианамида (F) в виде светло-желтого масла с выходом 48%.
1H ЯМР (300 МГц, CDCl3) δ 8,7 1 (д, J=1,8 Гц, 1H), 7,91 (дд, J=8,4, 1,8 Гц, 1H) 7,78 (д, J=8,4 Гц, 1H), 4,42 (кв., J=6,9 Гц, 1H), 2,64 (с, 3H), 1,92 (д, J=6,9 Гц, 3H).
ЖХ-МС: вычисленная масса для C10H10ClF2N3S [M+H]+ 278. Найдено 278.
К перемешиваемому раствору (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)-λ4-сульфанилиденцианамида (F) (0,16 г, 0,6 ммоль) в этаноле (10 мл) добавляют 20%-ный водный раствор карбоната калия (1,24 г, 1,8 ммоль) при 0°C при перемешивании. После 10 мин перемешивания добавляют к смеси 80% mCPBA (0,19 г, примерно 0,9 ммоль), перемешивают при 0°C в течение 2 часов, после чего реакционную смесь гасят с помощью шпателя твердого тиосульфата натрия. Большую часть этанола растворителя удаляют при пониженном давлении и добавляют водный насыщенный раствор NaHCO3 : насыщенный раствор соли (1:1, об./об.), и смесь три раза экстрагируют хлороформом. Объединенный органический слой сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на силикагеле с использованием 35-50%-ного раствора ацетона в гексане в качестве элюента с получением 0,092 г продукта (1-{6-[хлор(дифтор)метил]пиридин-3-ил}этил)(метил)оксидо-λ4-сульфанилиденцианамида (4) в виде бесцветного масла с выходом 57%.
1H ЯМР (300 МГц, CDCl3) δ 8,79 (с, 1H), 8,09 (д, J=8,1 Гц, 1H), 7,80 (д, J=8,1 Гц, 1H), 4,73 (кв., J=7,2 Гц, 1H), 3,16 и 3,11 (2 с, 3H, смесь двух диастереомерных групп α-CH3 между сульфоксимином и пиридиновым хвостом), 2,00 (д, J=7,2 Гц, 3H).
ЖХ-МС: вычисленная масса для C10H10ClF2N3OS [M-I]+ 292. Найдено 292.
Пример IV. Получение [1-(6-трихлорметилпиридин-3-ил)этил](метил)оксидо-1λ
4
-сульфанилиденцианамида (5)
Смесь 5-этилпиридин-2-карбоновой кислоты (1,98 г, 13 ммоль), фенилфосфонодихлорида (2,8 г, 14,3 ммоль), пентахлорида фосфора (7,7 г, 32 ммоль) перемешивают и медленно нагревают. После образования прозрачной желтой жидкости смесь нагревают с обратным холодильником в течение ночи. После охлаждения летучие продукты удаляют при пониженном давлении. Остаток осторожно выливают в насыщенный водный раствор карбоната натрия, охлажденный на ледяной бане. Затем водную фазу экстрагируют CH2Cl2 два раза. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют, концентрируют и частично очищают на силикагеле с помощью элюирования с помощью 10%-ной смеси EtOAc в гексане с получением 2,7 г сырого продукта, содержащего как 5-этил-2-(трихлорметил)пиридин, так и 5-(1-хлорэтил)-2-(трихлорметил)пиридин в соотношении приблизительно 3:1 (данные ГХ, массы вычисляют для C8H8Cl3N и C8H7Cl4N [M]+ 223 и 257 соответственно. Найдено 223 и 257 соответственно).
Смесь рассмотренного выше сырого продукта (2,6 г) в четыреххлористом углероде (100 мл) затем обрабатывают 80%-ным раствором N-бромсукцинимида (1,9 г, 11 ммоль) и бензоилпероксида (0,66 г, 0,275 ммоль), а затем нагревают с обратным холодильником в течение ночи. Твердый продукт отфильтровывают, фильтрат концентрируют и полученный остаток очищают на силикагеле с использованием 4%-ного раствора EtOAc в гексане с получением 1,0 г желаемого продукта 5-(1-бромэтил)-2-(трихлорметил)пиридина (A) в виде желтого твердого вещества. Объединенный выход для двух стадий составляет 25%.
ГХ-МС: вычисленная масса для C8H7BrCl3N [M-I-Cl]+ 266. Найдено 266.
Раствор 5-(1-бромэтил)-2-(трихлорметил)пиридина (A) (0,95 г, 3,14 ммоль) в этаноле (15 мл) обрабатывают тиометоксидом натрия (0,44 г, 6,29 ммоль) порциями при 0°C. Смесь перемешивают при комнатной температуре в течение ночи. Затем этанол растворителя удаляют при пониженном давлении и остаток повторно извлекают в CH2Cl2 и насыщенном растворе соли. Две фазы разделяют и органический слой сушат над безводным Na2SO4, фильтруют, концентрируют. Остаток очищают на силикагеле с использованием 5%-ного раствора EtOAc в гексане с получением 0,57 г частично очищенного 5-[1-(метилтио)этил]-2-(трихлорметил)пиридина (B) с выходом 67% сырого продукта.
ГХ-МС: вычисленная масса для C9H10Cl3NS [M]+ 269. Найдено 269.
К перемешиваемому раствору 5-[1-(метилтио)этил]-2-(трихлорметил)пиридина (B) (0,55 г, 2,3 ммоль) и цианамида (0,097 г, 2,3 ммоль) в ТГФ (7 мл), охлажденному до 0°C, добавляют йодбензолдиацетат (0,75 г, 2,3 ммоль) одной порцией. Полученную смесь перемешивают при 0°C в течение 1 часа, а затем при комнатной температуре в течение 2 часов. Растворитель удаляют в вакууме и полученную смесь очищают на силикагеле с использованием 50%-ного раствора ацетона в гексане с получением 0,254 г (1E)-метил{l-[6-(трихлорметил)пиридин-3-ил]этил}-λ4-сульфанилиденцианамида (C) в виде беловатого твердого продукта с выходом 40%.
1H ЯМР для диастереомерной смеси (300 МГц, d6-ацетон) δ 8,87 (с, 1H), 8,21-8,25 (м, 2H), 4,65-4,76 (м, 1H), 2,86-2,66 (м, 3H), 1,88-1,92 (м, 3H).
К перемешиваемому раствору (1E)-метил{1-[6-(трихлорметил)пиридин-3-ил]этил}-λ4-сульфанилиденцианамида (C) (0,20 г, 0,65 ммоль) в этаноле (15 мл) добавляют 20%-ный водный раствор карбоната калия (1,3 мл) при 0°C с последующим добавлением 80% mCPBA. Полученную смесь перемешивают в течение 2 часов при 0°C, а затем гасят с помощью твердого тиосульфата натрия. Большую часть растворителя выпаривают и добавляют водный насыщенный раствор NaHCO3 - насыщенный раствор соли 1:1 (об./об.) и смесь три раза экстрагируют хлороформом. Объединенный органический слой сушат над безводным Na2SO4, фильтруют и концентрируют. Остаток очищают на силикагеле с использованием 40%-ного раствора ацетона в гексане с получением 0,10 г [1-(6-трихлорметилпиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиденцианамида (5) в виде бесцветного масла с выходом 50%.
1H ЯМР (300 МГц, CDCl3) δ 8,83 (с, 1H), 8,12-8,23 (м, 1H), 5,15 (кв., 1H), 3,37 и 3,28 (2с, 3H, смесь двух диастереомерных групп α-CH3 между сульфоксимином и пиридиновым хвостом), 2,03 (д, 3H);
ЖХ-МС: вычисленная масса для C10H12Cl3N3OS [M+1]+ 328. Найдено 328.
Пример V. Получение [1-(6-дифторметилпиридин-3-ил)этил](метил)оксидо-λ
4
-сульфанилиденцианамида (6)
К раствору 2-йод-5-бромпиридина (18,4 г, 65 ммоль) в ТГФ (100 мл) при -15°C добавляют по каплям изопропилмагнийхлорид (2M, 35 мл, 70 ммоль) при такой скорости, чтобы температура реакции не превышала 0°C. Реакционную смесь перемешивают при -15°C в течение 1 часа, затем добавляют по каплям ДМФ (7,5 мл, 97 ммоль) при такой скорости, чтобы температура реакции не превышала 0°C. Реакционную смесь перемешивают в течение 30 мин, затем нагревают до комнатной температуры в течение дополнительного 1 часа. Реакционную смесь охлаждают снова до 0°C и добавляют по каплям 2 н. HCl (80 мл), поддерживая температуру ниже 20°C. После перемешивания в течение 30 мин добавляют 2 н. NaOH до тех пор, пока pH не достигнет 7. Затем органический слой отделяют и водный слой экстрагируют CH2Cl2 (3×). Объединенные органические слои сушат над MgSO4, концентрируют и очищают с помощью флэш-хроматографии (SiO2, 10% раствор EtOAc/гексаны) с получением 5-бромпиридин-2-карбальдегида (A) в виде белого твердого продукта (7,3 г, 60%).
1H ЯМР (300 МГц, CDCl3) δ 10,0 (с, 1H), 8,9 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H).
К охлажденному раствору 5-бромпиридин-2-карбальдегида (A) (7,0 г, 38 ммоль) в CH2Cl2 (300 мл) при -78°C добавляют трифторид диэтиламиносеры (DAST, 10,8 мл, 83 ммоль). Реакционной смеси позволяют нагреться до комнатной температуры в течение 6 часов, затем медленно гасят с помощью H2O, промывают насыщенным водным раствором NaHCO3 и сушат над Na2SO4. Концентрация и очистка с помощью слоя силикагеля (элюент CH2Cl2) дает 5-бром-2-дифторметилпиридин (B) в виде коричневых кристаллов (5,3 г, 67%).
1H ЯМР (300 МГц, CDCl3) δ 8,8 (с, 1H), 8,0 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H).
К раствору 5-бром-2-дифторметилпиридина (B) (1,8 г, 8,6 ммоль) в ТГФ (40 мл) при 25°C добавляют по каплям изопропилмагний хлорид (2M, 8,6 мл, 17 ммоль). Реакционной смеси позволяют перемешиваться в течение 2 часов, затем добавляют ДМФ (660 мкл, 8,6 ммоль), и реакционную смесь перемешивают в течение дополнительных 22 часов. Реакционную смесь гасят с помощью 2M HCl и подщелачивают с помощью 1M NaOH до тех пор, пока pH не достигнет 7. Органический слой отделяют и водный слой экстрагируют CH2Cl2. Объединенные органические слои сушат над Na2SO4, концентрируют и очищают с помощью флэш-хроматографии (10%-ный EtOAc/гексаны) с получением 6-дифторметилпиридин-3-карбальдегида (C) в виде оранжевого масла (320 мг, 24%).
К раствору 6-дифторметилпиридин-3-карбальдегида (C) (500 мг, 3,2 ммоль) в MeOH (10 мл) при 0°C добавляют NaBH4 (60 мг, 1,6 ммоль). Реакционной смеси позволяют перемешиваться в течение 30 мин, затем добавляют 2M HCl до тех пор, пока pH не достигнет 2. Полученный раствор экстрагируют с помощью CH2Cl2 (3×), и объединенные органические слои сушат над Na2SO4 и концентрируют с получением (6-дифторметилпиридин-3-ил)метанола (D) в виде оранжевого масла (420 мг, 82%), которое используют на следующей стадии без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,9 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H), 4,8 (с, 2H).
К раствору (6-дифторметилпиридин-3-ил)метанола (D) (450 мг, 2,8 ммоль) в CH2Cl2 (10 мл) при комнатной температуре добавляют SO2Cl (230 мкл, 3,1 ммоль). Реакционной смеси позволяют перемешиваться в течение 1 часа, затем реакционную смесь медленно гасят насыщенным водным раствором NaHCO3. Водную фазу экстрагируют CH2Cl2 (3×), и объединенные органические слои сушат над Na2SO4 и концентрируют. Полученный раствор экстрагируют CH2Cl2 (3×) и объединенные органические слои сушат над Na2SO4 и концентрируют с получением 5-хлорметил-2-дифторметилпиридина (E) в виде буровато-коричневого масла (490 мг, 98%), которое используют на следующей стадии без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3) δ 8,7 (с, 1H), 7,9 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H), 4,6 (с, 2H).
К раствору тиометоксида натрия (240 мг, 3,3 ммоль) в EtOH (10 мл) при комнатной температуре добавляют раствор 5-хлорметил-2-дифторметилпиридина (E) (490 мг, 2,8 ммоль) в EtOH (3 мл). Реакционной смеси позволяют перемешиваться в течение 9 часов, затем реакционную смесь концентрируют, извлекают в Et2O и промывают H2O. Органическую фазу сушат над Na2SO4 и концентрируют с получением 2-дифторметил-5-метилтиометилпиридина (F) в виде оранжевого масла (422 мг, 81%), которое используют на следующей стадии без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3) δ 8,6 (с, 1H), 7,8 (д, 1H), 7,6 (д, 1H), 6,6 (т, 1H), 3,7 (с, 2H), 2,0 (с, 3H).
[(6-Дифторметилпиридин-3-ил)метил](метил)оксидо-λ4-сульфанилиденцианамид (G) синтезируют из 2-дифторметил-5-метилтиометилпиридина (F) в две стадии, как описывается в Примерах I-B и I-C. Выделяют в виде белого твердого продукта (выход 51%).
1H ЯМР (300 МГц, CDCl3) δ 8,7 (с, 1H), 8,0 (д, 1H), 7,8 (д, 1H), 6,7 (т, 1H), 4,7 (дд, 2H), 3,2 (с, 3H);
ЖХ-МС (ELSD): вычисленная масса для C9H10F2N3OS [M+H]+, 246. Найдено 246.
[1-(6-дифторметилпиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиденцианамид (6) синтезируют из [(6-дифторметилпиридин-3-ил)метил](метил)оксидо-λ4-сульфанилиденцианамида (G) за одну стадию, как описывается в Примере I. Выделяют в виде бесцветного масла (выход 74%) и как смесь диастереомеров 1:1.
1H ЯМР (300 МГц, CDCl3) δ (смесь двух диастереомеров) 8,7 (с, 2H), 8,0 (д, 2H), 7,8 (д, 2H), 6,7 (т, 2H), 4,6 (кв., 2H), 3,1 (с, 3H), 3,0 (с, 3H), 2,0 (д, 6H).
ЖХ-МС (ELSD): вычисленная масса для C10H12F2N3OS [M+H]+, 260. Найдено 260.
Пример VI. Получение [1-(6-пентафторэтилпиридин-3-ил)этил](метил)оксидо-λ
4
-сульфанилиденцианамида (7)
(E)-1-этокси-4,4,5,5,5-пентафторпент-1-ен-3-он (1,09 г, 5 ммоль) в безводном простом этиловом эфире (5 мл) обрабатывают 1-((E)-3-метилтиобут-1-енил)пирролидином (0,85 г, 5 ммоль) в 2 мл сухого простого эфира при -15°C в течение периода времени 5 мин и реакцию продолжают в течение 20 мин. Затем температуре позволяют подняться до комнатной температуры, и реакция продолжается в течение 3 часов. Растворитель удаляют при пониженном давлении и остаток повторно растворяют в безводном ДМФ (5 мл). Добавляют ацетат аммония (0,58 г, 7,5 ммоль) и смесь перемешивают при комнатной температуре в течение выходных. Добавляют воду и смесь экстрагируют простым эфиром три раза. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют, концентрируют и очищают на силикагеле, элюируя 8% раствором EtOAc в гексане (об./об.) с получением 0,16 г желаемого 5-(1-метилтиоэтил)-2-пентафторэтилпиридина (A) в виде масла коричневатого цвета с выходом 12%.
ГХ-МС: вычисленная масса для C10H11F2N3S [M]+ 271. Найдено 271.
К перемешиваемому раствору 5-(1-метилтиоэтил)-2-пентафторэтилпиридина (A) (0,16 г, 0,6 ммоль) и цианамида (0,025 г, 0,6 ммоль) в ТГФ (3 мл), охлажденному до 0°C, добавляют йодбензолдиацетат (0,19 г, 0,6 ммоль) одной порцией и полученную смесь перемешивают при 0°C в течение 2 часов, а затем при комнатной температуре в течение ночи. Растворитель удаляют в вакууме и полученную смесь суспендируют в насыщенном растворе соли - насыщенном растворе NaHCO3 (9:1), который затем два раза экстрагируют CH2Cl2-EtOAc (1:1, об./об.). Объединенный органический слой сушат над Na2SO4, фильтруют, концентрируют и сушат с получением 0,16 г (1-{6-[пентафторэтил]пиридин-3-ил}этил)(метил)-λ4-сульфанилиденцианамида (B) в виде коричневатого масла с выходом 85%.
ЖХ-МС: вычисленная масса для C11H10F5N3S [M]+ 311,28. Найдено [M-I]+ 309,84.
К перемешиваемому раствору 80% 3-хлорпероксибензойной кислоты (0,17 г, примерно 0,8 ммоль) в этаноле (3 мл), охлажденному до 0°C, добавляют 20%-ный водный раствор карбоната калия (1,0 мл, 1,5 ммоль) и полученную смесь перемешивают при 0°C в течение 20 мин. Затем добавляют за один раз (1-{6[пентафторэтил]пиридин-3-ил}этил)(метил)-λ4-сульфанилиденцианамид (B) и смесь перемешивают при 0°C в течение 1 часа. Реакционную смесь гасят с помощью малого шпателя твердого тиосульфата натрия. Большую часть растворителя выпаривают и добавляют насыщенный раствор соли и смесь экстрагируют три раза CH2Cl2. Объединенный органический слой сушат над Na2SO4, фильтруют и концентрируют, и остаток очищают на силикагеле с использованием 10% ацетона в CH2Cl2 (об./об.) с получением 0,089 г [1-(6-пентафторэтилпиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиденцианамида (7) в виде белого твердого продукта с выходом 54%.
ЖХ-МС: вычисленная масса для C10H10F5N3OS [M]+ 327,28. Найдено [M-1]+ 325,83.
Пример VII. Получение 2-трифторметил-5-(1-{метил(оксидо)[оксидо(оксо)гидразоно]-λ
4
-сульфанил}этил)пиридина (8)
К раствору 5-(1-метилтиоэтил)-2-трифторметилпиридина (2,0 г, 9 ммоль) в CHCl3 (20 мл) при 0°C в течение 1,5 часа добавляют раствор mCPBA (2,1 г, 10 ммоль) в CHCl3 (25 мл). Раствор перемешивают в течение дополнительных 2 часов, затем его концентрируют и очищают с помощью флэш-хроматографии (10%-ный раствор MeOH/CH2Cl2) с получением 5-(1-метилсульфинилэтил)-2-трифторметилпиридина (A) в виде желтого масла (710 мг, 33%) и как смесь диастереомеров ~2:1.
1H ЯМР (300 МГц, CDCl3) δ (главный диастереомер) 8,7 (с, 1H), 7,8 (д, 1H), 7,7 (д, 1H), 4,0 (кв., 1H), 2,4 (с, 3H), 1,75 (д, 3H); (дополнительный диастереомер) 8,6 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 3,8 (кв., 1H), 2,3 (с, 3H), 1,8 (д, 3H).
ЖХ-МС (ELSD): вычисленная масса для C9H11F3NOS [M+H]+, 238. Найдено 238.
К раствору 5-(1-метилсульфинилэтил)-2-трифторметилпиридина (A) (600 мг, 2,5 ммоль) в CHCl3 (5 мл) при 0°C добавляют азид натрия (260 мг, 4,0 ммоль) и H2SO4 (1 мл). Реакционную смесь нагревают до 55°C до тех пор, пока не будет наблюдаться выделение газа, затем ее охлаждают снова до комнатной температуры в течение ночи. Жидкость декантируют в отдельную колбу, и оставшийся сироп растворяют в H2O, подщелачивают Na2CO3 и экстрагируют CH2Cl2. Объединенные органические слои сушат над Na2SO4, концентрируют и очищают с помощью флэш-хроматографии с получением 5-[1-(метилсульфонимидоил)этил]-2-трифторметилпиридина (B) в виде желтого масла (130 мг, 20%) и как смесь диастереомеров ~1:1.
1H ЯМР (300 МГц, CDCl3) δ (смесь диастереомеров) 8,8 (д, 2H), 8,0 (дд, 2H), 7,8 (д, 2H), 4,4 (м, 2H), 2,9 (с, 3H), 2,85 (с, 3H), 1,8 (м, 6H).
ЖХ-МС (ELSD): вычисленная масса для C9H11F3N2OS [M]+, 252. Найдено 252.
К раствору 5-[1-(метилсульфонимидоил)этил]-2-трифторметилпиридина (B) (100 мг, 0,4 ммоль) в CH2Cl2 (2 мл) при 0°C добавляют по каплям HNO3 (16 мкл, 0,4 ммоль). К полученной суспензии добавляют уксусный ангидрид (750 мкл) и концентрированную H2SO4 (5 мкл), и смесь нагревают до 40°C. Суспензия медленно становится гомогенной в течение 15 мин. Затем растворитель удаляют и сырой остаток растворяют в H2O. Твердый продукт Na2CO3 добавляют до тех пор, пока pH не достигнет 8, и водную фазу экстрагируют CH2Cl2. Объединенные органические слои сушат над Na2SO4, концентрируют и очищают с помощью флэш-хроматографии с получением 2-трифторметил-5-(1-{метил(оксидо)[оксидо(оксо)гидразоно]-λ4-сульфанил}этил)пиридина (8) в виде желтого масла (22 мг, 19%) и как смесь диастереомеров 1:1.
1H ЯМР (300 МГц, CDCb) δ (смесь диастереомеров) 8,8 (д, 2H), 8,1 (м, 2H), 7,8 (м, 2H), 5,1 (кв., 1H), 5,0 (кв., 1H), 3,3 (с, 3H), 3,25 (с, 3H), 2,0 (м, 6H).
ЖХ-МС (ELSD): вычисленная масса для C9H11F3N3O3S [M+H]+, 298. Найдено 298.
Пример VIII. Получение [6-(1,1-дифторэтил)пиридин-3-ил)этил](метил)оксидо-λ
4
-сульфанилиденцианамида (9)
К раствору 5-метил-2-ацетилпиридина (9,9 г, 73,3 ммоль) в CH2Cl2, осушенном на молекулярном сите (150 мл), добавляют при комнатной температуре диэтиламиносульфонилтрифторид (DAST) (25,8 г, 260 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Добавляют дополнительно DAST (12 г, 74 ммоль) и реакцию продолжают в течение еще двух дней, после чего добавляют дополнительный DAST (3,8 г, 23 ммоль) и реакцию продолжают в течение еще 3 дней. После того как реакционную смесь медленно гасят насыщенным NaHCO3 при 0°C, органическую фазу отделяют, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на силикагеле, элюируют 8% раствором EtOAc в гексане с получением 3,91 г 2-(1,1-дифторэтил)-5-метилпиридина (A) в виде светло-коричневатого масла с выходом 34%.
ГХ-МС: вычисленная масса для C8H9F2N [M]+ 157. Найдено 157.
Смесь 2-(1,1-дифторэтил)-5-метилпиридина (A) (2,0 г, 12,7 ммоль), N-бромсукцинимида (2,2 г, 12,7 ммоль) и бензоилпероксида (0,15 г, 0,63 ммоль) в четыреххлористом углероде (100 мл) нагревают с обратным холодильником в течение ночи. После удаления твердых продуктов посредством фильтрования фильтрат концентрируют. Остаток повторно растворяют в этаноле (40 мл) и добавляют тиометоксид натрия (1,33 г, 19 ммоль) при комнатной температуре и перемешивают в течение 3 часов. Растворитель удаляют при пониженном давлении и оставшуюся смесь растворяют в CH2Cl2 и воде. После отделения органический слой сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт 2-(1,1-дифторэтил)-5-метилтиометилпиридина (B) имеет чистоту 94% после ГХ/МС, которую используют непосредственно на следующей стадии реакции без дополнительной очистки.
ГХ-МС: вычисленная масса для C9H11F2NS [M]+ 203. Найдено 203.
К перемешиваемому раствору 2-(1,1-дифторэтил)-5-метилтиометилпиридина (B) (1,22 г, 6,0 ммоль) и цианамида (0,25 г, 6,0 ммоль) в ТГФ (7 мл), охлажденному до 0°C, добавляют йодбензолдиацетат (1,93 г, 6,0 ммоль) одной порцией и полученную смесь перемешивают при 0°C в течение 1 часа, а затем при комнатной температуре в течение 2 часов. Растворитель удаляют в вакууме и полученную смесь очищают на силикагеле с использованием 60%-ного раствора ацетона в гексане (об./об.) с получением 1,22 г [(6-(1,1-дифторэтилпиридин-3-ил)метил](метил)-λ4-сульфанилиденцианамида (C) (выход 84%) в виде коричневатого масла, которое превращается в коричневатый твердый продукт после стояния в холодильнике в течение ночи.
ЖХ-МС: вычисленная масса для C10H11F2N3S [M]+ 243,28. Найдено [M+l]+ 244,11.
В 100-миллилитровую круглодонную колбу, снабженную магнитной мешалкой, дополнительной воронкой и термометром, загружают периодат натрия (0,95 г, 4,44 ммоль) и воду (12 мл). После того как твердый продукт растворяется, добавляют 15 мл CH2Cl2, а затем рутений трихлорид гидрат (0,033 г, 0,15 ммоль). [(6-(1,1-дифторэтилпиридин-3-ил)метил](метил)-λ4-сульфанилиденцианамид (C) (0,72 г, 2,96 ммоль), растворенный в 5 мл CH2Cl2, добавляют по каплям в течение периода 30 мин. Смесь быстро перемешивают при комнатной температуре в течение 1,5 часа, а затем фильтруют через фильтровальную бумагу для удаления некоторых нерастворимых продуктов. Затем смесь разделяют в разделительной воронке после того, как добавляют этилацетат, для облегчения разделения. Водную фазу дважды экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором соли, сушат над сухим Na2SO4, фильтруют, концентрируют и быстро очищают на силикагеле с помощью 70%-ного раствора ацетона в гексане с получением 0,652 г желаемого продукта [(6-(1,1-дифторэтилпиридин-3-ил)метил](метил)оксидо-λ4-сульфанилиденцианамида (D) в виде белого твердого продукта с выходом 87%.
ЖХ-МС: вычисленная масса для C10H11F2N3OS [M]+ 259,28. Найдено [M+1]+ 260,02.
К раствору [(6-(1,1-дифторэтилпиридин-3-ил)метил](метил)оксидо λ4-сульфанилиденцианамида (D) (0,55 г, 2,0 ммоль) и HMPA (0,09 мл, 0,55 ммоль) в 20 мл безводного ТГФ добавляют по каплям 0,5 M калий бис(триметилсилил)амид в толуоле (4,4 мл, 2,2 ммоль) при -78°C. Через 45 мин добавляют с помощью шприца йодометан (0,14 мл, 2,2 ммоль) одной порцией. Через десять минут температуре позволяют подняться до 0°C и смесь продолжают перемешивать в течение 1,5 часов. Реакционную смесь гасят насыщенным водным раствором NH4Cl, разбавленным насыщенным раствором соли, экстрагируют по одному разу EtOAc и CH2Cl2. Объединенный органический слой сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают с помощью препаративной ВЭЖХ с получением 0,15 г желаемого [6-(1,1-дифторэтил)пиридин-3-ил)этил](метил)оксидо-λ4-сульфанилиденцианамида (9) с выходом 26%.
ЖХ-МС: вычисленная масса для C11H13F2N3OS [M]+ 273,31. Найдено [M+1]+ 274,21.
Дополнительные детали относительно Примеров I-VIII и других родственных соединений приводятся в публикации заявки на патент США 2007/0203191 A1, содержание которой включено в настоящий документ в качестве ссылки во всей ее полноте.
Должно быть понятно, что композиции по настоящему изобретению могут включать соединения, которые могут существовать как один или несколько стереоизомеров. Например, в определенных вариантах осуществления композиции содержат смесь стереоизомеров соединения в соответствии с формулой (I).
Различные стереоизомеры могут включать геометрические изомеры, диастереомеры и энантиомеры. Таким образом, композиции по настоящему изобретению могут содержать соединения как рацемические смеси, индивидуальные стереоизомеры и оптически активные смеси. Специалистам в данной области будет понятно, что один из стереоизомеров может быть более активным, чем другие. Индивидуальные стереоизомеры и оптически активные смеси могут быть получены посредством процедур селективного синтеза с помощью обычных процедур синтеза с использованием разрешенных исходных материалов или с помощью обычных процедур разрешения.
В качестве более конкретного примера относительно стереоизомеров, соединение {1-[6-(трифторметил)пиридин-3-ил]этил](метил}оксидо-λ4-сульфанилиденцианамида, описанное в Примере I, содержит четыре отдельных стереоизомера. Эти четыре стереоизомера определяют две пары диастереомеров, которые для целей настоящего документа помечены как диастереомерные группы (A) и (B). Диастереомерная группа (A) определяется как {(R)-1-[6-(трифторметил)пиридин-3-ил]этил}-(R)-(метил)оксидо-λ4-сульфанилиденцианамид (A1) и {(S)-1-[6-(трифторметил)пиридин-3-ил]этил}-(S)-(метил)оксидо-λ4-сульфанилиденцианамид (A2), как представлено ниже.
Диастереомерная группа A
{(R)-1-[6-(трифторметил)пиридин-3-ил]этил}-(R)-(метил)оксидо-λ4-сульфанилиденцианамид (A1)
{(S)-1-[6-(трифторметил)пиридин-3-ил]этил}-(S)-(метил)оксидо-λ4-сульфанилиденцианамид (A2)
Диастереомерная группа (B) определяется как {(R)-1-[6-(трифторметил)пиридин-3-ил]этил}-(S)-(метил)оксидо-λ4-сульфанилиденцианамид (В1) и {(S)-1-[6-(трифторметил)пиридин-3-ил]этил}-(R)-(метил)оксидо-λ4-сульфанилиденцианамид (В2), как представлено ниже.
Диастереомерная группа В
{(R)-1-[6-(трифторметил)пиридин-3-ил]этил}-(S)-(метил)оксидо-λ4-сульфанилиденцианамид (В1)
{(S)-1-[6-(трифторметил)пиридин-3-ил]этил}-(R)-(метил)оксидо-λ4-сульфанилиденцианамид (В2)
Для композиций, содержащих смесь стереоизомеров соединения в соответствии с формулой (I), предполагается взаимное превращение стереоизомеров со временем, оно приводит к соотношениям стереоизомеров, которые отличаются от начального соотношения стереоизомеров непосредственно после синтеза соединения. В качестве более конкретного примера, после начального синтеза соединения {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида диастереомерные группы (А) и (В) присутствуют в смеси приблизительно как 1:2.
Однако наблюдается, что возможно взаимное превращение диастереомерных групп (A) и (B) со временем, при этом возникают различные проблемы в отношении химической и физической стабильности к композиции, содержащей соединение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида.
Теперь были неожиданно обнаружены способы селективного контроля взаимного превращения стереоизомеров соединения в соответствии с формулой (I) в композиции, содержащей стереоизомерную смесь соединения. Например, в одной из форм взаимное превращение стереоизомеров, присутствующих в композиции при первом соотношении, ускоряется посредством нагревания композиции, способом, эффективным для получения второго соотношения стереоизомеров, которое отличается от первого соотношения. В одном из конкретных примеров этой формы нагревание осуществляется при минимальной температуре примерно 10°C в течение по меньшей мере примерно 4 часов. В другом примере нагревание осуществляется при минимальной температуре примерно 20°C в течение по меньшей мере примерно 4 часов. Еще в одном примере нагревание осуществляется при минимальной температуре примерно 30°C в течение по меньшей мере примерно 4 часов. Еще в другом примере нагревание осуществляется при минимальной температуре примерно 40°C в течение по меньшей мере примерно 4 часов. В другом примере нагревание осуществляется при минимальной температуре примерно 50°C в течение по меньшей мере примерно 4 часов. Еще в одном примере нагревание осуществляется при минимальной температуре примерно 60°C в течение по меньшей мере примерно 4 часов. В дополнительном примере нагревание осуществляется при минимальной температуре примерно 70°C в течение по меньшей мере примерно 4 часов. Еще в одном примере нагревание осуществляется при минимальной температуре примерно 80°C в течение по меньшей мере примерно 4 часов. Еще в одном примере нагревание осуществляется при минимальной температуре примерно 90°C в течение по меньшей мере примерно 4 часов. В другом примере нагревание осуществляется при минимальной температуре примерно 100°C в течение по меньшей мере примерно 4 часов.
Кроме того, рассматриваются и другие варианты температуры и времени, при которых осуществляется нагревание. Например, в одной или нескольких формах предполагается, что нагревание может осуществляться при одной из температур, указанных выше, но в течение альтернативного периода времени, например, от примерно 1 до примерно 100 часов. В более конкретной форме нагревание осуществляют при одной из указанных выше температур, от примерно 2 до примерно 90 часов. В другой форме нагревание осуществляют при одной из указанных выше температур от примерно 4 до примерно 72 часов. В другом варианте предполагается, что нагревание может осуществляться при температуре вплоть до температуры чуть ниже температуры разложения или плавления соединения в соответствии с формулой (I) в композиции, предотвращая тем самым разложение соединения во время нагревания. В качестве одного из неограничивающих примеров, когда композиция содержит соединение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида, нагревание должно осуществляться при температуре ниже, чем примерно 128°С, которая ниже обеих температур плавления для диастереомерных групп А и В.
В другом более конкретном примере нагревание осуществляется при температуре 23-70°С в течение периода 4-72 часа. В другом примере нагревание осуществляется при температуре 23°С в течение по меньшей мере примерно четырех часов. Еще в одном примере нагревание осуществляется при температуре примерно 54°С в течение периода 24-72 часа. Еще в одном примере нагревание осуществляется при температуре примерно 70°С в течение периода 4-72 часа. В другом варианте этого примера период выбирается из из 4, 8, 24 и 72 часов. Кроме того, рассматриваются другие изменения в температуре и времени, при которых осуществляется нагревание. Например, предполагается, что когда значение для одного из параметров температуры и периода времени, при которых осуществляется нагревание, изменяется, значение другого параметра из температуры и периода времени, при которых осуществляется нагревание, также может изменяться.
В одной или нескольких формах предполагается, что нагревание может осуществляться до того, как завершается приготовления композиции. Например, в одном из вариантов осуществления композиция, которая содержит стереоизомерную смесь соединения в соответствии с формулой (I) и по существу не содержит других материалов, нагревается для получения желаемого взаимного превращения стереоизомеров. Затем к композиции могут добавляться один или несколько дополнительных материалов, таких как фитологически приемлемый носитель, смачивающий агент, загущающий агент, инсектицид или антифриз, просто в порядке перечисления некоторых возможностей. В альтернативном варианте осуществления композиция, которая содержит стереоизомерную смесь соединения в соответствии с формулой (I) и по меньшей мере один другой инсектицид и по существу не содержит других материалов, нагревается для получения желаемого взаимного превращения стереоизомеров. Затем в композицию могут добавляться один или несколько дополнительных материалов, такие как фитологически приемлемый носитель, смачивающий агент, загущающий агент или антифриз просто для того, чтобы перечислить несколько примеров. Однако рассматриваются и другие варианты относительно того порядка, в котором могут приготавливаться композиции, описанные в настоящем документе. Например, в одной или нескольких формах приготовление композиции может завершаться до ее нагревания. В дополнение к указанному выше необходимо понять, что композиция может подвергаться дополнительной обработке после нагревания, включая, например, обработку в шаровой мельнице, для уменьшения размеров частиц композиции.
В одном из вариантов осуществления стереоизомеры соединения в соответствии с формулой (I) определяют две пары диастереомеров и нагревание преобразует по меньшей мере часть одной пары диастереомеров в другую пару диастереомеров, изменяя тем самым соотношение диастереомеров соединения, присутствующего в композиции. В более конкретной форме соотношение пар диастереоизомеров после нагревания составляет по меньшей мере примерно 3:1. В другой форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 10:1. Еще в одной форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 20:1. Еще в другой форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 30:1. В другой форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 40:1. В дополнительной форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 50:1. В другой форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 60:1. Еще в одной форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 70:1. Еще в одной форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 80:1. В другой форме соотношение пар диастереоизомеров после нагревания больше, чем примерно 90:1. Еще в одной форме соотношение пар диастереоизомеров после нагревания составляет по меньшей мере примерно 100:1. В другой форме предполагается, что после нагревания остается только одна пара диастереомеров.
В другой конкретной форме соотношение пар диастереомеров после нагревания составляет от примерно 3:1 до примерно 100:1. Еще в одной форме соотношение пар диастереомеров после нагревания составляет от примерно 3:1 до примерно 50:1. В другой форме соотношение пар диастереомеров после нагревания составляет от примерно 3:1 до примерно 40:1. Кроме того, в другой форме соотношение пар диастереомеров после нагревания составляет от примерно 3:1 до примерно 39:1. Еще в одной форме соотношение пар диастереомеров после нагревания составляет от примерно 19:1 до примерно 39:1. В другой форме соотношение пар диастереомеров после нагревания составляет от примерно 25:1 до примерно 39:1. Кроме того, в других формах соотношение пар диастереомеров после нагревания составляет примерно 39:1. Необходимо понять, однако, что рассматриваются и другие варианты соотношения пар диастереомеров.
В другом варианте осуществления композиция содержит соединение в соответствии с формулой (I) в виде стереоизомерной смеси, определяемой двумя парами диастереомеров. В одной из форм смесь содержит по отношению к общей массе стереоизомерной смеси в композиции первую пару диастереомеров от примерно 50 до примерно 98% масс. и вторую пару диастереомеров от примерно 2 до примерно 50% масс. В другой форме смесь содержит по отношению к общей массе стереоизомерной смеси в композиции первую пару диастереомеров от примерно 60 до примерно 98% масс. и вторую пару диастереомеров от примерно 2 до примерно 40% масс. В другой форме смесь содержит по отношению к общей массе стереоизомерной смеси в композиции первую пару диастереомеров от примерно 75 до примерно 98% масс. и вторую пару диастереомеров от примерно 2 до примерно 25% масс. В дополнительной форме смесь содержит по отношению к общей массе стереоизомерной смеси в композиции первую пару диастереомеров от примерно 85 до примерно 98% масс. и вторую пару диастереомеров от примерно 2 до примерно 15% масс. Кроме того, в другой форме смесь содержит по отношению к общей массе стереоизомерной смеси в композиции первую пару диастереомеров от примерно 90 до примерно 98% масс. и вторую пару диастереомеров от примерно 2 до примерно 10% масс. В другой форме смесь содержит по отношению к общей массе стереоизомерной смеси в композиции первую пару диастереомеров от примерно 95 до примерно 98% масс. и вторую пару диастереомеров от примерно 2 до примерно 5% масс. В другой форме смесь содержит по отношению к общей массе стереоизомерной смеси в композиции первую пару диастереомеров примерно 99% масс. и вторую пару диастереомеров примерно 1% масс. В дополнительной форме смесь содержит по отношению к общей массе стереоизомерной смеси в композиции примерно 100% масс. первой пары диастереомеров.
В одной из конкретных форм этого варианта осуществления соединение в соответствии с формулой (I) представляет собой {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамид и первая пара стереоизомеров определяется {(R)-1-[6-(трифторметил)пиридин-3-ил]этил}-(R)-(метил)оксидо-λ4-сульфанилиденцианамидом и {(S)-1-[6-(трифторметил)пиридин-3-ил]этил}-(S)-(метил)оксидо-λ4-сульфанилиденцианамидом, а вторая пара диастереомеров определяется {(R)-1-[6-(трифторметил)пиридин-3-ил]этил}-(S)-(метил)оксидо-λ4-сульфанилиденцианамидом и ((S)-1-[6-(трифторметил)пиридин-3-ил]этил}-(R)-(метил)оксидо-λ4-сульфанилиденцианамидом. В другом варианте этой формы стереоизомерная смесь, имеющая одно из указанных выше % масс. соотношений диастереомеров, приготавливается посредством нагревания композиции при температуре от примерно 20-70°C в течение периода от примерно 4-72 часов. В дополнение к этому или альтернативно предполагается, что в эту форму могут включаться один или несколько других инсектицидов. В качестве одного из примеров композиция может содержать спиносин, такой как спинеторам, спиносад или их смеси. Когда они присутствуют, композиция может содержать массовое соотношение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида и спиносина от примерно 1:10 до примерно 10:1. В другой форме композиция может содержать массовое соотношение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида и спиносина от примерно 1:5 до примерно 5:1. Еще в одной форме композиция может содержать массовое соотношение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида и спиносина от примерно 1:3 до примерно 3:1. Еще в одной форме композиция может содержать массовое соотношение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида и спиносина от примерно 2:1 до примерно 2,4:1.
Хотя выше описана смесь {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида и инсектицида, такого как спиносин, необходимо понять, что в определенных вариантах осуществления композиция может содержать любое соединение в соответствии с формулой (I) и один или несколько других инсектицидов. Например, эти композиции могут содержать соединение в соответствии с формулой (I) и спиносин, такой как спинеторам, спиносад, или их смеси. Когда они присутствуют, эти композиции могут содержать массовое соотношение соединения в соответствии с формулой (I) и инсектицида от примерно 1:10 до примерно 10:1. В другой форме эти композиции могут содержать массовое соотношение соединения в соответствии с формулой (I) и инсектицида от примерно 1:5 до примерно 5:1. Еще в одной форме эти композиции могут содержать массовое соединения в соответствии с формулой (I) и инсектицида от примерно 1:3 до примерно 3:1.
Композиции по настоящему изобретению могут также снабжаться фитологически приемлемым инертным носителем в форме спреев, материалов для местной обработки, гелей, покрытий для семян, препаратов микрокапсул, препаратов для системного приема, приманок, ушных бирок или пластырей, болюсов, фоггеров, аэрозолей фумигантов, дустов и многого другого. Как правило, препараты наносятся в виде водных суспензий или эмульсий. Такие суспензии или эмульсии получают из водорастворимых суспендируемых или эмульсифицируемых в воде препаратов, которые представляют собой (1) твердые продукты, обычно известные как смачиваемые порошки или диспергируемые в воде гранулы, или (2) жидкости, обычно известные как эмульсифицируемые концентраты, водные эмульсии, суспензионные концентраты и суспендированные в воде капсулы, содержащие композицию. Как можно легко понять, может использоваться любой материал, к которому может добавляться композиция, при условии, что он дает желаемые полезные свойства без значительного отрицательного воздействия на активность композиции как пестицида.
Смачиваемые порошки, которые могут компактироваться, экструдироваться или обрабатываться посредством диспергирования в воде с последующей сушкой распылением или агломерацией в псевдоожиженном слое с образованием диспергируемых в воде гранул, содержит мелкодисперсную смесь композиции, инертного носителя и поверхностно-активных веществ. Концентрация композиции в смачиваемом порошке обычно составляет от 10% до 90% масс. по отношению к общей массе смачиваемого порошка, более предпочтительно от 25% масс. до 75% масс. При приготовлении препаратов смачиваемых порошков композиция может компаундироваться с мелкодисперсным твердым материалом, таким как профиллит, тальк, мел, гипс, Фуллерова земля, бентонит, аттапульгит, крахмал, казеин, глютен, монтмориллонитовые глины, диатомовые земли, очищенные силикаты или что-либо подобное. При таких операциях мелкодисперсный носитель и поверхностно-активные вещества, как правило, смешиваются с композицией и измельчаются.
Эмульсифицируемые концентраты композиции содержат удобную концентрацию, например от 5% масс. до 75% масс., композиции в соответствующей жидкости по отношению к общей массе концентрата. Композицию растворяют в инертном носителе, который представляет собой либо воду, смешиваемый с водой растворитель, несмешиваемый с водой растворитель, либо их смесь и эмульсификаторы. Концентраты могут разбавляться водой и маслом с формированием распыляемых смесей в форме эмульсий типа масло-в-воде. Пригодные для использования органические растворители включают ароматические соединения, в частности высококипящие нафталиновые и олефиновые фракции нефти, такие как тяжелая ароматическая нафта. Могут также использоваться другие органические растворители, такие, например, как терпеновые растворители, включая производные канифоли, алифатические кетоны, такие как циклогексанон, и сложные спирты, такие как 2-этоксиэтанол.
Эмульсификаторы, которые могут использоваться в настоящем документе с преимуществами, могут легко определяться специалистами в данной области, и они включают различные неионные, анионные, катионные и амфотерные эмульсификаторы или смесь двух или более эмульсификаторов. Примеры неионных эмульсификаторов, пригодных при приготовлении эмульсифицируемых концентратов, включают простые эфиры полиалкиленгликолей и продукты конденсации алкил- и арилфенолов, алифатических спиртов, алифатических аминов или жирных кислот с этиленоксидом, пропиленоксидами, такие как этоксилированные алкилфенолы и сложные эфиры карбоновых кислот, солюбилизированные с помощью полиола или полиоксиалкилена. Катионные эмульсификаторы включают соединения четвертичного аммония и соли аминов жирных кислот. Анионные эмульсификаторы включают маслорастворимые соли (например, кальция) алкиларилсульфоновых кислот, маслорастворимые соли или простые эфиры сульфатированных полигликолей и соответствующие соли простых эфиров фосфатированных полигликолей.
Репрезентативные органические жидкости, которые могут использоваться при приготовлении эмульсифицируемых концентратов композиции, представляют собой ароматические жидкости, такие как фракции ксилола, пропилбензола; или смешанные нафталиновые фракции, минеральные масла, замещенные ароматические органические жидкости, такие как диоктилфталат; керосин; диалкиламиды различных жирных кислот, в частности, диметиламиды жирных гликолей и производных гликолей, такие как простой н-бутиловый эфир, простой этиловый эфир или простой метиловый эфир диэтиленгликоля и простой метиловый эфир триэтиленгликоля, и т.п. Смеси двух или более органических жидкостей могут также использоваться при приготовлении эмульсифицируемого концентрата. Предпочтительные органические жидкости включают фракции ксилола и пропилбензола, при этом фракции пропилбензола являются наиболее предпочтительными. Поверхностно-активные эмульсифицирующие агенты, как правило, используются в жидких препаратах и в количестве от 0,1 до 20% масс. по отношению к объединенной массе эмульсифицирующего агента и композиции. Препараты, содержащие композицию по настоящему изобретению, могут также содержать другие совместимые добавки, например акарициды, инсектициды, регуляторы роста растений, другие фунгициды, и другие биологически активные соединения, используемые в земледелии.
Водные суспензии содержат суспензии композиций, диспергированные в водном наполнителе, при концентрации в пределах от 5 до 50% масс. по отношению к общей массе водной суспензии. Водные суспензии приготавливают посредством энергичного перемешивания композиции по настоящему изобретению или ее раствора, в наполнителе, состоящем из воды и поверхностно-активных веществ, выбранных из тех типов, которые обсуждаются выше. Другие компоненты, такие как неорганические соли и синтетические или природные смолы, также могут добавляться для увеличения плотности и вязкости водного наполнителя. Примеры водных суспензий включают суспензии капель масла (EW), твердых продуктов (SC) и капсул (CS).
Композиция может также наноситься в виде гранулированных препаратов, которые являются особенно пригодными для нанесения на почву. Гранулированные препараты обычно содержат от 0,5 до 10% масс., по отношению к общей массе, гранулированного препарата композиции, диспергированного в инертном носителе, который состоит полностью или по большей части из грубо перемолотого инертного материала, такого как аттапульгит, бентонит, диатомит, глина или сходное недорогое вещество. Такие препараты обычно приготавливают посредством разбавления композиции в соответствующем растворителе и нанесения ее на гранулированный носитель, который предварительно формируется с соответствующим размером частиц, в пределах от 0,5 до 3 мм. Пригодный для использования растворитель представляет собой растворитель, в котором соединение является по существу или полностью растворимым. Такие препараты могут также быть получены посредством получения теста или пасты носителя и композиции и растворителя и измельчения и сушки с получением желаемых гранулированных частиц.
Композиция по настоящему изобретению может также наноситься в виде диспергируемых в воде гранул или сухого сыпучего препарата. Диспергируемые в воде гранулы, как правило, составляют от 10 до 70% композиции по отношению к общей массе препарата. Такие препараты, как правило, получают посредством смешивания и/или распыления смеси над носителем, с добавлением диспергирующего и/или смачивающего агента, и объединения с водой с получением смеси, пригодной для дальнейшей переработки с использованием хорошо известных технологий гранулирования, таких как гранулирование на поддоне, экструзия, сушка распылением, агломерация в псевдоожиженном слое и т.п.
Дусты, содержащие композицию, могут быть получены посредством тщательного перемешивания композиции вместе с соответствующим пылеобразным сельскохозяйственным носителем, таким, например, как каолиновая глина, измельченная вулканическая порода, и т.п. Дусты могут, соответственно, содержать от 1 до 10% масс. композиции по отношению к общей массе дуста. Дусты могут также быть получены посредством пропитки композицией носителя способом, сходным с тем, который описан выше для гранул.
Препараты по настоящему изобретению могут дополнительно содержать вспомогательные поверхностно-активные вещества для улучшения осаждения, смачивания и проникновения композиций в целевую сельскохозяйственную культуру и организм. Эти вспомогательные поверхностно-активные вещества могут необязательно использоваться в качестве компонента препарата или в качестве смеси, содержащейся в танке. Количество вспомогательного поверхностно-активного вещества будет, как правило, изменяться от 0,01 до 1,0% об., по отношению к распыляемому объему воды, предпочтительно, от 0,05 до 0,5% об. Соответствующие вспомогательные поверхностно-активные вещества включают, но не ограничиваясь этим, этоксилированные нонилфенолы, этоксилированные синтетические или природные спирты, соли сложных эфиров или сульфоянтарных кислот, этоксилированные органосиликоны, этоксилированные жирные амины и смеси поверхностно-активных веществ с минеральными или растительными маслами.
Пример IX. Получение композиции, содержащей стереоизомерную смесь (1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ
4
-сульфанилиденцианамида
1 литр общего объема (общая масса ~1100 г) продукта суспендированного концентрата, имеющего концентрацию 240 г/л {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида с приблизительным соотношением диастереомерных групп A и B 1:2, приготавливают посредством добавления сначала деионизованной воды в чистый химический стакан, снабженный механической мешалкой. Затем в химический стакан добавляют следующие ингредиенты, в любом порядке при непрерывном перемешивании: 3,5 г Agnique® DFM 112S, подавителя пенообразования на основе кремния, коммерчески доступного от Cognis Group, штаб-квартира в Monheim, Germany; 20 г Tersperse® 2500, полимерного поверхностно-активного вещества, коммерчески доступного от Huntsman Performance Products, 10003 Woodloch Forest Drive, The Woodlands, TX 77380; 30 г Morwet® D-360, поверхностно-активного вещества, коммерчески доступного от Akzo Nobel Surfactants, 525 W. Van Buren St., Chicago, IL 60607; 20 г Ethylan® NS 500 LQ, поверхностно-активного вещества, коммерчески доступного от Akzo Nobel Surfactants, 525 W. Van Buren St., Chicago, IL 60607; 40 г пропиленгликоля; 1 г Proxel® GXL, раствора микробиостатика, коммерчески доступного от Arch Chemicals, Inc., 1955 Lake Drive, Suite 100, Smyrna, GA 30080. Затем в химический стакан добавляют 240 г {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида с последующим добавлением 10 г Avicel® CL-611, стабилизатора, коммерчески доступного от FMC BioPOlymer, 1735 Market Street, Philadelphia, PA 19103, и 2 г Kelzan, ксантановой смолы, коммерчески доступной от CP Kelco, 1000 Parkwood Circle, Suite 1000, Atlanta, GA 30339. Ингредиенты перемешивают до тех пор, пока не получится гомогенная смесь. Затем смесь перемалывают с помощью шаровой мельницы до среднего размера частиц 3-5 мкм. Конечный препарат этого продукта суспендированного концентрата приведен в Таблице 1.
| Таблица 1 | |
| Ингредиенты | г/л |
| {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамид | 240 |
| Agnique® DFM 112S | 3,5 |
| Avicel® CL-611 | 10 |
| Tersperse® 2500 | 20 |
| Morwet® D-360 | 30 |
| Ethylan® NS 500 LQ | 20 |
| Пропиленгликоль | 40 |
| Proxel® GXL | 1 |
| Kelzan® | 2 |
| Вода | Остаток |
Композицию, имеющую общий объем 160 мл, приготавливают посредством объединения 80 мл продукта суспендированного концентрата, описанного выше, имеющего концентрацию 240 г/л {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида, и 80 мл Radiant® SC, препарата инсектицида, имеющего концентрацию 120 г/л спинеторама и коммерчески доступного от Dow AgroSciences, LLC, 9330 Zionsville Road, Indianapolis, IN 46268. Композицию тщательно перемешивают до получения гомогенной консистенции. Затем шестнадцать индивидуальных 10-миллилитровых образцов композиций (образцы (i)-(xvi)) нагревают в печи в соответствии с параметрами времени и температуры, приведенными в Таблице 2, ниже.
По истечении соответствующих периодов времени, приведенных в Таблице 2, образцы удаляют из печи, а затем анализируют с помощью хроматографии для измерения соотношения диастереомерных групп A и B {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида в каждом образце после нагревания. Результаты хроматографического анализа приводятся в Таблице 3, которая показывает также pH каждого образца и % масс. по отношению к общей массе соответствующего образца, {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида и спинеторама.
| Таблица 3 | |||||
| Отношения диастереомеров {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида в образцах (i)-(xvi) после нагревания | |||||
| Образец | pH | {1-[6-(трифторметил)пиридин-3-ил]этил} (метил)оксидо-λ4-сульфанилиденцианамид | Спинеторам | ||
| Диастереомер (A), % | Диастереомер (B), % | Общий анализ, % масс./масс. |
Общий анализ, % масс./масс. |
||
| (i) | 7,23 | 50,74 | 49,26 | 10,967 | 4,562 |
| (ii) | 7,20 | 53,33 | 46,67 | 10,981 | 4,574 |
| (iii) | 7,23 | 62,63 | 37,37 | 10,913 | 4,567 |
| (iv) | 7,28 | 94,98 | 5,02 | 10,722 | 4,557 |
| (v) | 7,23 | 50,95 | 49,05 | 10,953 | 4,564 |
| (vi) | 7,18 | 55,26 | 44,74 | 10,844 | 4,520 |
| (vii) | 7,21 | 74,02 | 25,98 | 10,786 | 4,548 |
| (viii) | 7,23 | 95,55 | 4,45 | 10,677 | 4,556 |
| (ix) | 7,20 | 51,52 | 48,48 | 10,975 | 4,569 |
| (x) | 7,16 | 63,31 | 36,69 | 10,887 | 4,576 |
| (xi) | 7,16 | 97,03 | 2,97 | 10,697 | 4,577 |
| (xii) | 7,21 | 95,18 | 4,82 | 10,710 | 4,541 |
| (xiii) | 7,16 | 53,38 | 46,62 | 11,035 | 4,595 |
| (xiv) | 7,15 | 86,06 | 13,94 | 10,832 | 4,598 |
| (xv) | 7,17 | 97,51 | 2,49 | 10,768 | 4,613 |
| (xvi) | 7,24 | 96,15 | 3,85 | 10,766 | 4,614 |
Необходимо понять, что указанные выше Примеры предназначены для целей иллюстрации и не должны рассматриваться как ограничивающие изобретение, описанное в настоящем документе, только вариантами осуществления, описанными в этих примерах. Например, предполагается, что соединение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида в иллюстративной композиции может заменяться одним из соединений в соответствии с формулой (I) или их смесью. Подобным же образом, предполагается, что иллюстративная композиция может быть получена с одним или несколькими дополнительными ингредиентами, в дополнение к спинетораму или вместо него, или альтернативно, может не содержать никаких дополнительных ингредиентов.
Инсектицидное применение
Композиции, описанные в настоящем документе, являются пригодными для борьбы с беспозвоночными, включая насекомых. По этой причине настоящее изобретение также направлено на способ ингибирования насекомых, который включает нанесение ингибирующего насекомых количества композиции на очаг насекомых, на площадь, которая должна быть защищена, или непосредственно на насекомых, которые должны контролироваться. Композиции по настоящему изобретению могут также использоваться для борьбы с другими беспозвоночными вредителями, такими как клещи и нематоды.
"Очаг" насекомых или других вредителей представляет собой термин, используемый в настоящем документе для упоминания окружающей среды, в которой живут насекомые или другие вредители или где присутствуют их яйца, включая воздух, окружающий их, корм, которые они едят, или объекты, с которыми они вступают в контакт. Например, насекомые, которые питаются, повреждают съедобные, продовольственные, декоративные, газонные или пастбищные растения или вступают с ними в контакт, могут контролироваться посредством нанесения композиций на семена растения перед посадкой, на рассаду или проростки, которые высаживаются, на листья, стебли, плоды, зерна и/или корни, или на почву или другую среду роста, до или после посадки сельскохозяйственного растения. Защита этих растений от болезней, вызываемых вирусами, грибками или бактериями, может также достигаться опосредованно с помощью борьбы с кровососущими насекомыми-вредителями, такими как белокрылка, дельфациды, тля и клещ паутинный. Такие растения включают такие, которые скрещивают с помощью обычных подходов, и те, которые генетически модифицируются с использованием современной биотехнологии для получения стойких к насекомым, стойких к гербицидам, имеющих улучшенное усвоение питательных веществ и/или имеющих любые другие благоприятные особенности растений.
Предполагается, что композиции были бы также полезными для защиты текстиля, бумаги, запасов зерна, семян и других продуктов питания, жилых домов и других зданий, в которых могут находиться люди, и/или домашних, содержащихся на фермах, в загонах, в зоопарках, или других животных посредством нанесения активной композиции на такие объекты или вблизи них. Одомашненные животные, здания или люди могут защищаться с помощью композиций посредством борьбы с беспозвоночными вредителями и/или вредителями-нематодами, которые являются паразитами или способны переносить инфекционные заболевания. Такими вредителями являются, например, клещи-тромбикулиды, иксодовые клещи, вши, москиты, мухи, блохи и сердечные гельминты. Неагрономические применения также включают контроль беспозвоночных вредителей в лесах, во дворах, по обочинам дорог и по откосам железных дорог.
Термин "ингибирование насекомых" относится к уменьшению количеств живых насекомых или к уменьшению количества жизнеспособных яиц насекомых. Степень уменьшения, достигаемая с помощью композиции, зависит, разумеется, от количества композиции, наносимой на единицу площади, от конкретной используемой композиции и от целевых видов насекомых. Должно использоваться по меньшей мере дезактивирующее количество. Термин "дезактивирующее насекомых количество" используется для описания количества, которое достаточно для того, чтобы вызвать измеримое уменьшение обрабатываемой популяции насекомых. Как правило, используется количество активного соединения в пределах от примерно 1 до примерно 1000 м.д. массовых. Например, насекомые или другие вредители, которые могут ингибироваться, включают, но не ограничиваясь этим, следующие:
Бабочки - Heliothis spp., Helicoverpa spp., Spodoptera spp., Mythimna unipuncta, Agrotis ipsilon, Earias spp., Euxoa auxiliaris, Trichoplusia ni, Anticarsia gemmatalis, Rachiplusia nu, Plutella xylostella, Chilo spp., Scirpophaga incertulas, Sesamia inferens, Cnaphalocrocis medinalis, Ostrinia nubilalis, Cydia pomonella, Carposina niponensis, Adoxophyes orana, Archips argyrospilus, Pandemis heparana, Epinotia aporema, Eupoecilia ambiguella, Lobesia botrana, Polychrosis viteana, Pectinophora gossypiella, Pieris rapae, Phyllonorycter spp., Leucoptera malifoliella, Phyllocnisitis citrella
Жесткокрылые - Diabrotica spp., Leptinotarsa decemlineata, Oulema orγzae, Anthonomus grandis, Lissorhoptrus oryzophilus, Agriotes spp., Melanotus communis, Popillia japonica, Cyclocephala spp., Tribolium spp.
Равнокрылые хоботные - Aphis spp., Myzus persicae, Rhopalosiphum spp., Dysaphis plantaginea, Toxoplera spp., Macrosiphum euphorbiae, Aulacorthum solani, Sitobion avenae, Metopolophium dirhodum, Schizaphis graminum, Brachycolus noxius, Nephotettix spp., Nilaparvata lugens, Sogatella furcifera, Laodelphax striatellus, Bemisia tabaci, Trialeurodes vaporariorum, Aleurodes proletella, Aleurothrixus floccosus, Quadraspidiotus perniciosus, Unaspis yanonensis, Ceroplastes rubens, Aonidiella aurantii
Клопы - Lygus spp., Eurγgaster maura, Nezara viridula, Piezodorus guildingi, Leptocorisa varicornis, Cimex lectularius, Cimex hemipterus
Thysanoptera - Frankliniella spp., Thrips spp., Scirtothrips dorsalis
Белые муравьи - Reticulitermes flavipes, Coptotermes formosanus, Reticulitermes virginicus, Heterotermes aureus, Reticulitermes hesperus, Coptotermes frenchii, Shedorhinotermes spp., Reticulitermes santonensis, Reticulitermes grassei, Reticulitermes banyulensis, Reticulitermes speratus, Reticulitermes hageni, Reticulitermes tibialis, Zootermopsis spp., Incisitermes spp., Marginitermes spp., Macrotermes spp., Microcerotermes spp., Microtermes spp.
Мухи - Liriomyza spp., Musca domestica, Aedes spp., Culex spp., Anopheles spp., Fannia spp., Stomoxys spp.
Перепончатокрылые насекомые - Iridomyrmex humilis, Solenopsis spp., Monomorium pharaonis, Atta spp., Pogonomyrmex spp., Camponotus spp., Monomorium spp., Tapinoma sessile, Tetramorium spp., Xylocapa spp., Vespula spp., Polistes spp.
Пухоеды (пухоед)
Вши (вошь) - Pthirus pubis, Pediculus spp.
Прыгающие прямокрылые (кузнечики, сверчки) - Melanoplus spp., Locusta migratoria, Schistocerca gregaria, Gryllotalpidae (медведки).
Таракановые (тараканы) - Blatta orientalis, Blattella germanica, Periplaneta americana, Supella longipalpa, Periplaneta australasiae, Periplaneta brunnea, Parcoblatta pennsylvanica, Periplaneta fuliginosa, Pycnoscelus surinamensis,
Блохи - Ctenophalides spp., Pulex irritans
Клещи - Tetranychus spp., Panonychus spp., Eotetranychus carpini, Phyllocoptruta oleivora, Aculus pelekassi, Brevipalpus phoencis, Boophilus spp., Dermacentor variabilis, Rhipicephalus sanguineus, Amblyomma americanum, Ixodes spp., Notoedres cati, Sarcoptes scabiei, Dermatophagoides spp.
Нематоды - Dirofilaria immitis, Meloidogyne spp., Heterodera spp., Hoplolaimus columbus, Belonolaimus spp., Pratylenchus spp., Rotylenchus reniformis, Criconemella ornata, Ditylenchus spp., Aphelenchoides besseyi, Hirschmanniella spp.
Реальное количество композиции, которое должно наноситься на очаги насекомых и клещей, не является критичным и может легко определяться специалистами в данной области с учетом примеров, приведенных выше. Как правило, ожидается, что концентрации соединения от 10 м.д. до 5000 м.д. массовых обеспечат хороший контроль. Для многих соединений будут достаточными концентрации от 100 до 1500 м.д.
Очаг, на который наносится композиция, может представлять собой любой очаг, в котором обитают насекомые или клещи, например, овощные сельскохозяйственные культуры, фруктовые и ореховые деревья, виноград, декоративные растения, домашние животные, внутренние или наружные поверхности зданий и почва вокруг зданий.
Из-за уникальной способности яиц насекомых противостоять действию токсикантов могут быть желательными многократные нанесения для борьбы с вновь появляющимися личинками, как это случается с другими известными инсектицидами и акарицидами.
Системное перемещение композиций по настоящему изобретению в растениях может использоваться для борьбы с насекомыми-вредителями в одной части растения посредством нанесения композиций на другую его часть. Например, борьба с насекомыми, питающимися листьями, может осуществляться с помощью капельного дождевания, или нанесения на борозды, или посредством обработки семян перед посевом. Обработка семян может применяться для любых типов семян, включая те, из которых будут прорастать растения, генетически трансформированные для экспрессирования специальных особенностей. Репрезентативные примеры включают растения, экспрессирующие белки, токсичные для беспозвоночных вредителей, таких как Bacillus thuringiensis, или другие инсектицидные белки, которые экспрессируют стойкость к гербицидам, такие как семена "Roundup Ready®" или семена с "пакетированными" посторонними генами, экспрессирующими инсектицидные белки, стойкость к гербицидам, улучшение усвоения питательных веществ и/или любые другие благоприятные особенности.
Композиция может также предусматриваться как препарат инсектицидной приманки, содержащий аттрактанты и/или кормовые стимулянты, которые могут использоваться для увеличения эффективности композиции против насекомых-вредителей в таких устройствах, как ловушка, устройство с приманкой, и т.п. Препарат приманки обычно представляет собой твердую, полутвердую (включая гель) или жидкую матрицу приманки, содержащую стимулянты и один или несколько немикроинкапсулированных или микроинкапсулированных инсектицидов в количестве, эффективном для действия в качестве агентов для уничтожения.
Композиции по настоящему изобретению часто применяются в сочетании с одним или несколькими другими инсектицидами, или фунгицидами, или гербицидами для получения контроля над более широким разнообразием заболеваний, вызываемых вредителями, и сорняков. Когда они используются в сочетании с другими инсектицидами, или фунгицидами, или гербицидами, заявляемые в настоящее время композиции могут приготавливаться вместе с другими инсектицидами, или фунгицидами, или гербицидами, смешиваться в танке с другими инсектицидами, или фунгицидами, или гербицидами или наноситься последовательно с другими инсектицидами, или фунгицидами, или гербицидами.
Некоторые инсектициды, которые могут использоваться с выгодой в сочетании с композициями по настоящему изобретению, включают инсектициды на основе антибиотиков, такие как аллосамидин и турингенсин; инсектициды на основе макроциклических лактонов, такие как спиносад, спинеторам, и другие спиносины, включая 21-бутенилспиносины и их производные; инсектициды на основе авермектина, такие как абамектин, дорамектин, эмамектин, эприномектин, ивермектин и селамектин; инсектициды на основе мильбемицина, такие как лепимектин, мильбемектин, мильбемицин оксим и моксидектин; инсектициды на основе мышьяка, такие как арсенат кальция, ацетоарсенит меди, арсенат меди, арсенат свинца, арсенит калия и арсенит натрия; биологические инсектициды, такие как Bacillus popilliae, B. sphaericius, B. thurinigiensis subsp. aizawai, B. thuringiensis subsp. kurstaki, B. thuriugiensis subsp. tenebrionis, Beauveria bassiana, вирус гранулеза Cydia pomonella, NPV волнянки псевдотсуговой, NPV непарного шелкопряда, Helicoverpa zea NPV, вирус гранулеза огневки амбарной, Metarhizium anisopliae, Nosema locustae, Paecilomyces fumosoroseus, P. lilacinus, Photorhabdus luminescens, Spodoptera exigua NPV, трипсин-модулирующий оостатический фактор, Xenorhabdus nematophilus и X. bovienii; защитные инсектициды, инкорпорированные в растения, такие как CrylAb, CrylAc, CrylF, CrylA.105, Cry2Ab2, Cry3A, mir Cry3A, Cry3Bbl, Cry34, Cry35 и VIP3A; ботанические инсектициды, такие как анабазин, азадирахтин, d-лимонен, никотин, пиретрины, цинерины, цинерин I, цинерин II, жасмолин I, жасмолин II, пиретрин I, пиретрин II, кассия, ротенон, риания и сабадилла; инсектициды на основе карбамата, такие как бендиокарб и карбарил; инсектициды на основе бензофуранилметилкарбамата, такие как бенфуракарб, карбофуран, карбосульфан, декарбофуран и фуратиокарб; инсектициды на основе диметилкарбамата, такие как димитан, диметилан, гиквинкарб и пиримикарб; инсектициды на основе оксима карбамата, такие как аланикарб, альдикарб, альдоксикарб, бутокарбоксим, бутоксикарбоксим, метомил, нитрилакарб, оксамил, тазимкарб, тиокарбоксим, тиодикарб и тиофанокс; инсектициды на основе фенилметилкарбамата, такие как алликсикарб, аминокарб, буфенкарб, бутакарб, карбанолат, клоэтокарб, дикрезил, диоксакарб, EMPC, этиофенкарб, фенетакарб, фенобукарб, изопрокарб, метиокарб, метолкарб, мексакарбат, промацил, промекарб, пропоксур, триметакарб, XMC и ксилилкарб; инсектициды на основе динитрофенола, такие как динекс, дипроп, диносам и DNOC; инсектициды на основе фтора, такие как барий гексафторсиликат, криолит, фторид натрия, гексафторсиликат и сульфлурамид натрия; инсектициды на основе формамидина, такие как амитраз, хлордимеформ, форметанат и формпаранат; инсектициды на основе фумигантов, такие как акрилонитрил, дисульфид углерода, четыреххлористый углерод, хлороформ, хлорпикрин, пара-дихлорбензол, 1,2-дихлорпропан, этилформиат, этилендибромид, этилендихлорид, этиленоксид, цианистый водород, йодометан, метилбромид, метилхлороформ, метиленхлорид, нафталин, фосфин, сульфурил фторид и тетрахлорэтан; неорганические инсектициды, такие как боракс, кальций полисульфид, олеат меди, хлористая ртуть, тиоцианат калия и тиоцианат натрия; ингибиторы синтеза хитина, такие как бистрифлурон, бупрофезин, хлорфлуазурон, циромазин, дифлубензурон, флуциклоксурон, флуфеноксурон, гексафлумурон, луфенурон, новалурон, новифлумурон, пенфлурон, тефлубензурон и трифлумурон; миметики ювенильных гормонов, такие как эпофенонан, веноксикарб, гидропрен, кинопрен, метопрен, пирипроксифен и трипрен; ювенильные гормоны, такие как ювенильный гормон I, ювенильный гормон II и ювенильный гормон III; агонисты гормонов линьки, такие как хромафенозид, галогенфенозид, метоксифенозид и тебуфенозид; гормоны линьки, такие как α-экдизон и экдистерон; ингибиторы линьки, такие как диофенолан; прекоцены, такие как прекоцен I, прекоцен II и прекоцен III; неклассифицированные регуляторы роста насекомых, такие как дицикланил; инсектициды на основе аналогов нереистоксина, такие как бенсультап, картап, тиоциклам и тиосультап; инсектициды на основе никотиноидов, такие как флоникамид; инсектициды на основе нитрогуанидина, такие как клотианидин, динотефуран, имидаклоприд и тиаметоксам; инсектициды на основе нитрометилена, такие как нитенпирам и нитиазин; инсектициды на основе пиридилметиламина, такие как ацетамиприд, имидаклоприд, нитенпирам и тиаклоприд; хлорорганичекие инсектициды, такие как бром-DDT, камфехлор, DDT, pp'-DDT, этил-DDD, HCH, гамма-HCH, линдан, метоксихлор, пентахлорфенол и TDE; инсектициды на основе циклодиенов, такие как алдрин, бромциклен, хлорбициклен, хлородан, хлородекон, диэлдрин, дилор, эдосульфан, эндрин, HEOD, гептахлор, HHDN, изобензан, изодрин, келеван и мирекс; фосфаторганические инсектициды, такие как бромфенвинфос, хлорфенвинфос, кротоксифос, дихлоровос, дикротофос, диметилвинфос, фоспират, гептенофос, метокротофос, мевинфос, монокротофос, налед, нафталофос, фосфаамидон, пропафос, TEPP и тетрахлорвинфос; тиофосфаторганические инсектициды, такие как диоксабензофос, фосметилан и фентоат; инсектициды на основе алифатических тиофосфаторганических соединений, такие как ацетион, амитон, кадусафос, хлорэтоксифос, хлормефос, демефион, демефион-O, демефион-S, деметон, деметон-O, деметон-S, деметон-метил, деметон-O-метил, деметон-S-метил, деметон-S-метилсульфон, дисульфотон, етион, этопрофос, PSP, изотиоат, малатион, метакрифос, оксидеметон-метил, оксидепрофос, оксидисульфотон, форат, сульфотеп, тербуфос и тиометон; инсектициды на основе алифатических амидтиофосфаторгантческих соединений, такие как амидитион, циантоат, диметоат, этоат-метил, формотион, мекарбам, ометоат, протоат, софамид и вамидотион; инсектициды на основе оксимтиофосфаторганических соединений, такие как хлорфоксим, фоксим и фоксим-метил; инсектициды на основе гетероциклических тиофосфаторганических соединений, такие как азаметифос, коумафос, кумитоат, диоксатион, эндотион, меназон, морфотион, фозалон, пираклофос, пиридафентион и хинотион; инсектициды на основе
бензотиопирантиофосфаторганических соединений, такие как дитикрофос и тикрофос; инсектициды на основе
бензотриазинтиофосфаторганических соединений, такие как азинфос-этил и азинфос-метил; инсектициды на основе изоиндолтиофосфаторганических соединений, такие как диалифос и фосмет; инсектициды на основе изоксазолтиофосфаторганических соединений, такие как изоксатион и золапрофос; инсектициды на основе пиразолопиримидинтиофосфаторганических соединений, такие как хлорпразофос и пиразофос; инсектициды на основе пиридинтиофосфаторганических соединений, такие как хлорпирифос и хлорпирифос-метил; инсектициды на основе пиримидинтиофосфаторганических соединений, такие как бутатиофос, диазинон, этримфос, лиримфос, пиримифос-этил, пиримифос-метил, примидофос, пиримитат и тебупиримфос; инсектициды на основе хиноксалинтиофосфаторганических соединений, такие как хиналфос и хиналфос-метил; инсектициды на основе тиадиазолтиофосфаторганических соединений, такие как атидатион, литидатион, метидатион и протидатион; инсектициды на основе триазолтиофосфаторганических соединений, такие как исазофос и триазофос; инсектициды на основе фенилтиофосфаторганических соединений, такие как азотоат, бромофос, бромофос-этил, карбофенотион, хлортиофос, цианофос, цитиоат, дикаптон, дихлофентион, этафос, фамфур, фенхлорофос, фенитротион фенсульфотион, фентион, фентион-этил, гетерофос, йодфенфос, месульфенфос, паратион, паратион-метил, фенкаптон, фоснихлор, профенофос, протиофос, сульпрофос, темнефос, трихлорметафос-3 и трифенофос; инсектициды на основе фосфолиата, такие как бутонат и трихлорфон; инсектициды на основе фосфонотиоата, такие как мекарфон; инсектициды на основе фенилэтилфосфонотиоата, такие как фонофос и трихлоронат; инсектициды на основе фенилфенилфосфонотиоата, такие как цианофенфос, EPN и лептофос; инсектициды на основе фосфорамидатов, такие как круфомат, фенамифос, фостиетан, мефосфолан, фосфолан и пириметафос; инсектициды на основе фосфорамидотиоатов, такие как ацефат, изокарбофос, изофенфос, метамидофос и пропетамфос; инсектициды на основе фосфородиамида, такие как димефокс, мазидокс, мипафокс и схрадан; инсектициды на основе оксадиазина, такие как индоксакарб; инсектициды на основе фталимида, такие как диалифос, фосмет и тетраметрин; инсектициды на основе пиразола, такие как ацетопрол, этипрол, фипронил, пирафлупрол, пирипрол, тебуфенпирад, толфенпирад и ванилипрол; инсектициды на основе сложных пиретроидных эфиров, такие как акринатрин, аллетрин, биоаллетрин, бартрин, бифентрин, биоэтанометрин, циклетрин, циклопротрин, цифлутрин, бета-цифлутрин, цигалотрин, гамма-цигалотрин, лямбда-цигалотрин, циперметрин, альфа-циперметрин, бета-циперметрин, тэта-циперметрин, зета-циперметрин, цифенотрин, дельтаметрин, димефлутрин, диметрин, эмпентрин, фенфлутрин, фенпиритрин, фенпропатрин, фенвалерат, эсфенвалерат, флуцитринат, флувалинат, тау-флувалинат, фуретрин, имипротрин, метофлутрин, перметрин, биоперметрин, трансперметрин, фенотрин, праллетрин, профлутрин, пиресметрин, ресметрин, биоресметрин, цисметрин, тефлутрин, тераллетрин, тетраметрин, тралометрин и трансфлутрин; инсектициды на основе простых пиретроидных эфиров, такие как этофенпрокс, флуфенпрокс, галфенпрокс, протрифенбут и силафлуофен; инсектициды на основе пиримидинаминов, такие как флуфенерим и пиримидифен; инсектициды на основе пиррола, такие как хлорфенапир; инсектициды на основе тетроновой кислоты, такие как спиродиклофен, спиромесифен и спиротетрамат; инсектициды на основе тиомочевины, такие как диафентиурон; инсектициды на основе мочевины, такие как флукофурон и сулькофурон; и неклассифицированные инсектициды, такие как AKD-3088, клосантель, кротамитон, цифлуметофен, E2Y45, EXD, феназафлор, феназахин, феноксакрим, фенпироксимат, FKI-1033, флубендиамид, HGW86, гидраметилнон, IKI-2002, изопротиолан, малонобен, метафлумизон, метоксадиазон, нифлуридин, NN1-9850, NNI-0101, пиметрозин, пиридабен, пиридалил, Qcide, рафоксанид, ринаксипир, SYJ-159, триаратен и триазамат и любые их сочетания.
Некоторые фунгициды, которые могут использоваться с выгодой в сочетании с композициями по настоящему изобретению, включают: 2-(тиоцианатометилтио)бензотиазол, 2-фенилфенол, 8-гидроксихинолин сульфат, Ampelomyces, хисквалис, азаконазол, азоксистробин, Bacillus subtilis, беналаксил, беномил, бентиаваликарб-изопропил, бензиламинобензол-сульфонат (BABS) соль, бикарбонаты, бифенил, бисмертиазол, битертанол, бластицидин-S, боракс, бордосскую смесь, боскалид, бромуконазол, бупиримат, кальций полисульфид, каптафол, каптан, карбендазим, карбоксин, карпропамид, карвон, хлорнеб, хлороталонил, хлозолинат, Coniothyrium minitans, гидроксид меди, октаноат меди, оксихлорид меди, сульфат меди, сульфат меди (триосновный), оксид одновалентной меди, циазофамид, цифлуфенамид, цимоксанил, ципроконазол, ципродинил, дазомет, дебакарб, диаммоний этиленбис-(дитиокарбамат), дихлофлуанид, дихлорофен, диклоцимет, дикломезин, дихлоран, диэтофенкарб, дифеноконазол, дифензокватный ион, дифлуметорим, диметоморф, димоксистробин, диниконазол, диниконазол-M, динобутон, динокап, дифениламин, дитианон, додеморф, додеморф ацетат, додин, свободное основание додина, эдифенфос, эпоксиконазол, этабоксам, этоксихин, этридиазол, фамоксадон, фенамидон, фенаримол, фенбуконазол, фенфурам, фенгексамид, феноксанил, фенпиклонил, фенпропидин, фенпропиморф, фентин, фентин ацетат, фентин гидроксид, фербам, феримзон, флуазинам, флудиоксонил, флуморф, флуопиколид, флуороимид, флуоксастробин, флухинконазол, флусилазол, флусульфамид, флутоланил, флутриафол, фолпет, формальдегид, фозетил, фозетил-алюминий, фуберидазол, фуралаксил, фураметпир, гуазатин, гуазатинацетаты, GY-81, гексахлорбензол, гексаконазол, гимексазол, имазалил, имазалил сульфат, имибенконазол, иминоктадин, иминоктадинтриацетат, иминоктадин трис(альбесилат), ипконазол, ипробенфос, ипродион, ипроваликарб, изопротиолан, касугамицин, касугамицин гидрохлорид гидрат, крезоксим-метил, манкоппер, манкозеб, манеб, мепанипирим, мепронил, хлорид ртути, оксид ртути, хлорид одновалентной ртути, металаксил, мефеноксам, металаксил-M, метам, метам-аммоний, метам-калий, метам-натрий, метконазол, метасульфокарб, метилйодид, метилизотиоцианат, метирам, метоминостробин, метрафенон, милдиомицин, миклобутанил, набам, нитротал-изопропил, нуаримол, октилинон, офурак, олеиновую кислоту (жирные кислоты), орисастробин, оксадиксил, оксин-медь, окспоконазол фумарат, оксикарбоксин, пефуразоат, пенконазол, пенцикурон, пентахлорфенол, пентахлорфенил лаурат, пентиопирад, ацетат фенилртути, фосфоновую кислоту, фталид, пикоксистробин, полиоксин B, полиоксины, полиоксорим, бикарбонат калия, калий гидроксихинолинсульфат, пробеназол, прохлораз, процимидон, пропамокарб, пропамокарб гидрохлорид, пропиконазол, пропинеб, прохиназид, протиоконазол, пираклостробин, пиразофос, пирибутикарб, пирифенокс, пириметанил, пирохилон, хинокламин, хиноксифен, хинтозен, экстракт Reynoutria sachalinensis, силтиофам, симеконазол, 2-фенилфеноксид натрия, бикарбонат натрия, пентахлорфеноксид натрия, спироксамин, серу, SYP-Z071, дегтярные масла, тебуконазол, текназен, тетраконазол, тиабендазол, тифлузамид, тиофанат-метил, тирам, тиадинил, толклофос-метил, толилфлуанид, триадимефон, триадименол, триазоксид, трициклазол, тридеморф, трифлоксистробин, трифлумизол, трифорин, тритиконазол, валидамицин, винклозолин, зинеб, зирам, зоксамид, Candida oleophila, Fusarium oxysporum, Gliocladium spp., Phlebiopsis gigantean, Streptomyces griseoviridis, Trichoderma spp., (RS)--N-(3,5-дихлорфенил)-2-(метоксиметил)сукцинимид, 1,2-дихлорпропан, 1,3-дихлор-1,1,3,3-тетрафторацетон гидрат, 1-хлор-2,4-динитронафталин, 1-хлор-2-нитропропан, 2-(2-гептадецил-2-имидазолин-1-ил)этанол, 2,3-дигидро-5-фенил-1,4-дитиин 1,1,4,4-тетраоксид, 2-метоксиэтилртуть ацетат, 2-метоксиэтилртуть хлорид, 2-метоксиэтилртуть силикат, 3-(4-хлорфенил)-5-метилроданин, 4-(2-нитропроп-1-энил)фенил тиоцианатем: ампропилфос, анилазин, азитирам, барий полисульфид, Bayer 32394, беноданил, бенхинокс, бенталурон, бензамакрил; бензамакрил-изобутил, бензаморф, бинапакрил, бис(метилртуть)сульфат, бис(трибутилолово)оксид, бутиобат, кадмий-кальций-медь-цинк хромат-сульфат, карбаморф, CECA, хлобентиазон, хлораниформетан, хлорфеназол, хлорхинокс, климбазол, бис(3-фенилсалицилат) меди, медь-цинк хромат, куфранеб, сульфат гидразиния меди, купробам, циклафурамид, ципендазол, ципрофурам, декафентин, дихлон, дихлозолин, дихлобутразол, диметиримол, диноктон, диносульфон, динотербон, дипиритион, диталимфос, додицин, дразоксолон, EBP, ESBP, этаконазол, этем, этирим, фенаминосульф, фенапанил, фенитропан, флуотримазол, фуркарбанил, фурконазол, фурконазол-цис, фурмециклокс, фурофанат, глиодин, грисеофулвин, галакринат, Hercules 3944, гексилтиофос, ICIA0858, изопамфос, изоваледион, мебенил, мекарбинзид, метазоксолон, метфуроксам, метилртуть дициандиамид, метсульфовакс, милнеб, хлормуциновый ангидрид, миклозолин, N-3,5-дихлорфенил-сукцинимид, N-3-нитрофенилитаконимид, натамицин, N-этилртуть-4-толуолсульфонанилид, никель бис(диметилдитиокарбамат), OCH, диметилдитиокарбамат фенилртути, нитрат фенилртути, фосдифен, протиокарб; протиокарб гидрохлорид, пиракарболид, пиридинитрил, пироксихлор, пироксифур, хинацетол; хинацетол сульфат, хиназамид, хинконазол, рабензазол, салициланилид, SSF-109, сультропен, текорам, тиадифлуор, тициофен, тиохлорфенфим, тиофанат, тиохинокс, тиоксимид, триамифос, триаримол, триазбутил, трихламид, урбацид, XRD-563 и зариламид, и любые их сочетания.
Некоторые из гербицидов, которые могут использоваться в сочетании с композициями по настоящему изобретению, включают: гербициды на основе амидов, такие как аллидохлор, бефлубутамид, бензадокс, бензипрам, бромбутид, кафенстрол, CDEA, хлортиамид, ципразол, диметенамид, диметенамид-P, дифенамид, эпроназ, этнипромид, фентразамид, флупоксам, фомезафен, галосафен, изокарбамид, изоксабен, напропамид, напталам, петоксамид, пропизамид, хинонамид и тебутам; гербициды на основе анилидов, такие как хлоранокрил, цисанилид, кломепроп, ципромид, дифлуфеникан, этобензанид, фенасулам, флуфенацет, флуфеникан, мефенацет, мефлуидид, метамифоп, моналид, напроанилид, пентанохлор, пиколинафен и пропанил; гербициды на основе арилаланинов, такие как бензоилпроп, флампроп и флампроп-M; гербициды на основе хлорацетанилидов, такие как ацетохлор, алахлор, бутахлор, бутенахлор, делахлор, диэтатил, диметахлор, метазахлор, метолахлор, S-метолахлор, претилахлор, пропахлор, пропизохлор, принахлор, тербухлор, тенилхлор и ксилахлор; гербициды на основе сульфонанилидов, такие как бензофлуор, перфлуидон, пиримисульфан и профлуазол; гербициды на основе сульфонамида, такие как азулам, карбазулам, фенасулам и оризалин; гербициды на основе антибиотиков, такие как биланафос; гербициды на основе бензойной кислоты, такие как хлорамбен, дикамба, 2,3,6-TBA и трикамба; гербициды на основе пиримидинилоксибензойной кислоты, такие как биспирибак и пириминобак; гербициды на основе пиримидинилтиобензойной кислоты, такие как пиритиобак; гербициды на основе фталевой кислоты, такие как хлортал; гербициды на основе пиколиновой кислоты, такие как аминопиралид, клопиралид и пиклорам; гербициды на основе хинолинкарбоновой кислоты, такие как хинклорак и хинмерак; гербициды на основе мышьяка, такие как какодиловая кислота, CMA, DSMA, гексафлурат, MAA, MAMA, MSMA, арсенит калия и арсенит натрия; гербициды на основе бензоилциклогександиона, такие как мезотрион, сулькотрион, тефурилтрион и темботрион; гербициды на основе бензофуранилалкилсульфоната, такие как бенфуресат и этофумесат; гербициды на основе карбамата, такие как азулам, карбоксазол хлорпрокарб, дихлормат, фенасулам, карбутилат и тербукарб; гербициды на основе карбанилата, такие как барбан, BCPC, карбазулам, карбетамид, CEPC, хлорбуфам, хлорпрофам, CPPC, десмедифам, фенизофам, фенмедифам, фенмедифам-этил, профам и свип; гербициды на основе циклогексеноксима, такие как аллоксидим, бутроксидим, клетодим, клопроксидим, циклоксидим, профоксидим, сетоксидим, тепралоксидим и тралкоксидим; гербициды на основе циклопропилизоксазола, такие как изоксахлортол и изоксафлутол; гербициды на основе дикарбоксимидов, такие как бензфендизон, цинидон-этил, флумезин, флумиклорак, флумиоксазин и флумипропин; гербициды на основе динитроанилина, такие как бенфлуралин, бутралин, динитрамин, этальфлуралин, флухлоралин, изопропалин, металпропалин, нитралин, оризалин, пендиметалин, продиамин, профлуралин и трифлуралин; гербициды на основе динитрофенола, такие как динофенат, динопроп, диносам, диносеб, динотерб, DNOC, этинофен и мединотерб; гербициды на основе простого дифенилового эфира, такие как этоксифен; гербициды на основе простого нитрофенилового эфира, такие как акифлуорфен, аклонифен, бифенокс, хлорметоксифен, хлорнитрофен, этнипромид, фтордифен, фторгликофен, фторнитрофен, фомезафен, фурилоксифен, галосафен, лактофен, нитрофен, нитрофлуорфен и оксифлуорфен; гербициды на основе дитиокарбамата, такие как дазомет и метам; гербициды на основе галогенированных алифатических соединений, такие как алорак, хлоропон, далапон, флупропанат, гексахлороацетон, йодометан, метил бромид, монохлоруксусная кислота, SMA и TCA; гербициды на основе имидазолинона, такие как имазаметабенз, имазамокс, имзапик, имазапир, имазахин и имазетапир; гербициды на основе неорганических соединений, такие как аммоний сульфамат, боракс, хлорат кальция, сульфат меди, сульфат железа(II), азид калия, цианат калия, азид натрия, хлорат натрия и серная кислота; гербициды на основе нитрилов, такие как бромбонил, бромксинил, хлорксинил, дихлобенил, йодобонил, иоксинил и пираклонил; гербициды на основе фосфорорганических соединений, такие как амипрофосметил, анилофос, бенсулид, биланафос, бутамифос, 2,4-DEP, DMPA, EBEP, фосамин, глуфозинат, глифосат и пиперофос; гербициды на основе феноксисоединений, такие как бромфеноксим, кломепроп, 2,4-DEB, 2,4-DEP, дифенопентен, дисул, эрбон, этнипромид, фентеракол и трифопсим; гербициды на основе феноксиуксусной кислоты, такие как 4-CPA, 2,4-D, 3,4-DA, MCPA, MCPA-тиоэтил и 2,4,5-T; гербициды на основе феноксимасляной кислоты, такие как 4-CPB, 2,4-DB, 3,4-DB, MCPB и 2,4,5-TB; гербициды на основе феноксипропионовой кислоты, такие как клопроп, 4-CPP, дихлорпроп, дихлорпроп-P, 3,4-DP, фенопроп, мекопроп и мекопроп-P; гербициды на основе арилоксифеноксипропионовых кислот, такие как хлоразифоп, клодинафоп, клофоп, цигалофоп, диклофоп, феноксапроп, феноксапроп-P, фентиапроп, флуазифоп, флуазифоп-P, галогенксифоп, галогенксифоп-P, изоксапирифоп, метамифоп, пропахизафоп, хизалофоп, хизалофоп-P и трифоп; гербициды на основе фенилендиаминов, такие как динитрамин и продиамин; гербициды на основе пиразолилов, такие как бензофенап, пиразолинат, пирасульфотол, пиразоксифен, пироксасульфон и топрамезон; гербициды на основе пиразолилфенила, такие как флуазолат и пирафлуфен; гербициды на основе пиридазина, такие как кредазин, пиридафол и пиридат; гербициды на основе пиридазинона, такие как бромпиразон, хлоридазон, димидазон, флуфенпир, метфлуразон, норфлуразон, оксапиразон и пиданон; гербициды на основе пиридина, такие как аминопиралид, клиодинат, клопиралид, дитиопир, флуроксипир, галоксидин, пиклорам, пиколинафен, пириклор, тиазопир и триклопир; гербициды на основе пиримидиндиамина, такие как ипримидам и тиоклорим; гербициды на основе четвертичного аммония, такие как циперкват, диэтамкват, дифензокват, дикват, морфамкват и паракват; гербициды на основе тиокарбамата, такие как бутилат, циклоат, диаллат, EPTC, эспрокарб, этиолат, изополинат, метиобенкарб, молинат, орбенкарб, пебулат, просульфокарб, пирибутикарб, сульфаллат, тиобенкарб, тиокарбазил, триаллат и вернолат; гербициды на основе тиокарбоната, такие как димексано, EXD и проксан; тиомочевина гербициды, такие как метиурон; гербициды на основе триазина, такие как дипропетрин, триазифлам и тригидрокситриазин; гербициды на основе хлортриазина, такие как атразин, хлоразин, цианазин, ципразин, эглиназин, ипазин, мезопразин, проциазин, проглиназин, пропазин, себутилазин, симазин, тербутилазин и триетазин; гербициды на основе метокситриазина, такие как атратон, метометон, прометон, секбуметон, симетон и тербуметон; гербициды на основе метилтиотриазина, такие как аметрин, азипротрин, цианатрин, десметрин, диметаметрин, метопротрин, прометрин, симетрин и тербутрин; гербициды на основе триазинона, такие как аметридион, амибузин, гексазинон, изометиозин, метамитрон и метрибузин; гербициды на основе триазола, такие как амитрол, кафенстрол, эпроназ и флупоксам; гербициды на основе триазолона, такие как амикарбазон, бенкарбазон, карфентразон, флукарбазон, пропоксикарбазон, сульфентразон и тиенкарбазонметил; гербициды на основе триазолопиримидина, такие как клорансулам, диклосулам, флорасулам, флуметсулам, метосулам, пенокссулам и пирокссулам; гербициды на основе урацила, такие как бутафенацил, бромацил, флупропацил, изоцил, ленацил и тербацил; 3-фенилурацилы; гербициды на основе мочевины, такие как бензтиазурон, кумилурон, циклурон, дихлоралмочевина, дифлуфензопир, изонорурон, изоурон, метабензтиазурон, монизоурон и норурон; гербициды на основе фенилмочевины, такие как анизурон, бутурон, хлорбромурон, хлоретурон, хлортолурон, хлороксурон, даимурон, дифеноксурон, димефурон, диурон, фенурон, флуометурон, флутиурон, изопротурон, линурон, метиурон, метилдимрон, метобензурон, метобромурон, метоксурон, монолинурон, монурон, небурон, парафлурон, фенобензурон, сидурон, тетрафлурон и тиадиазурон; гербициды на основе пиримидинилсульфонилмочевины, такие как амидосульфурон, азимсульфурон, бенсульфурон, хлоримурон, циклосульфамурон, этоксисульфурон, флазасульфурон, флуцетосульфурон, флупирсульфурон, форамсульфурон, галосульфурон, имазосульфурон, мезосульфурон, никосульфурон, ортосульфамурон, оксасульфурон, примисульфурон, пиразосульфурон, римсульфурон, сульфометурон, сульфосульфурон и трифлоксисульфурон; гербициды на основе триазинилсульфонилмочевины, такие как хлорсульфурон, циносульфурон, этаметсульфурон, йодсульфурон, метсульфурон, просульфурон, тифенсульфурон, триасульфурон, трибенурон, трифлусульфурон и тритосульфурон; гербициды на основе тиадиазолилмочевины, такие как бутиурон, этидимурон, тебутиурон, тиазафлурон и тидиазурон; и неклассифицированные гербициды, такие как акролеин, аллиловый спирт, азафенидин, беназолин, бентазон, бензобициклон, бутидазол, кальций цианамид, камбендихлор, хлорфенак, хлорфенпроп, хлорфлуразол, хлорфлуренол, цинметилин, кломазон, CPMF, крезол, орто-дихлорбензол, димепиперат, эндотал, фтормидин, флуридон, флурохлоридон, флуртамон, флутиацет, инданофан, метазол, метилизотиоцианат, нипираклофен, OCH, оксадиаргил, оксадиазон, оксазикломефон, пентахлорфенол, пентоксазон, ацетат фенилртути, пиноксаден, просульфалин, пирибензоксим, пирифталид, хинокламин, родетанил, сульгликапин, тиадиазимин, тридифан, триметурон, трипропиндан и тритак.
До того как инсектицид сможет использоваться или продаваться коммерчески, такая композиция подвергается продолжительным процессам оценки различными органами государственной власти (локальными, региональными, властями штата, национальными и международными). Объемные требования к данным указываются регулирующими органами, и они должны удовлетворяться посредством генерирования данных и их декларирования теми, кто регистрирует продукт, или кем-то другим по их поручению. Эти органы государственной власти затем проверяют такие данные, и если они делают вывод об определении безопасности, дают потенциальному пользователю и/или продавцу одобрение для регистрации продукта. После этого, в той области, где дается и поддерживается регистрация продукта, такой пользователь и/или продавец может использовать и/или продавать такое соединение.
Любая теория, механизм работы, проверка или данные, сформулированные в настоящем документе, как подразумевается, дополнительно улучшают понимание настоящего изобретения и не предназначаются для того, чтобы сделать настоящее изобретение каким-либо образом зависимым от такой теории, механизма работы, проверки или данных. Должно быть понятно, что хотя использование определения «предпочтительный», «предпочтительно» или «предпочитаемый» в описании выше показывает, что признак, описываемый таким образом, может быть более желательным, тем не менее, он может не быть необходимым, и варианты осуществления, в которых он отсутствует, могут рассматриваться в рамках настоящего изобретения, эти рамки определяются следующей далее формулой изобретения. При чтении формулы изобретения предполагается, что когда используются выражения такие как "по меньшей мере один", "по меньшей мере часть", нет намерения ограничивать пункт формулы изобретения только одним предметом, если только в этом пункте формулы изобретения не утверждается противоположного. Кроме того, когда используется выражение "по меньшей мере часть" и/или "некоторая часть", предмет может включать некоторую часть предмета и/или предмет полностью, если только конкретно не утверждается противоположного. Хотя настоящее изобретение показано и описывается подробно на чертежах и в предшествующем описании, они должны рассматриваться как иллюстративные и неограничивающие по характеру; понятно, что показаны и описаны только избранные варианты осуществления и что все изменения, модификации и эквиваленты, которые соответствуют духу изобретения, как определено в настоящем документе или с помощью любого пункта следующей далее формулы изобретения, желательно, должны быть защищены.
Claims (12)
2. Способ по п.1, в котором композиция дополнительно содержит спиносин, выбранный из группы, состоящей из спинеторама, спиносада и их смесей.
3. Способ по п.1, в котором нагревание осуществляют при минимальной температуре 50°С в течение от четырех до семидесяти двух часов.
4. Способ получения инсектицидной композиции, включающий
получение композиции, содержащей стереоизомерную смесь соединения, имеющего следующую структуру:
смесь определяется с помощью первой пары диастереомеров и второй пары диастереомеров; и
нагревание этой композиции в течение 4-72 часов при температуре 23-70°С для превращения по меньшей мере части второй пары диастереомеров в первую пару диастереомеров.
получение композиции, содержащей стереоизомерную смесь соединения, имеющего следующую структуру:
смесь определяется с помощью первой пары диастереомеров и второй пары диастереомеров; и
нагревание этой композиции в течение 4-72 часов при температуре 23-70°С для превращения по меньшей мере части второй пары диастереомеров в первую пару диастереомеров.
5. Способ по п.4, в котором нагревание осуществляют при минимальной температуре 50°С в течение от четырех до семидесяти двух часов.
6. Способ по п.4, в котором композиция содержит спиносин, выбранный из группы, состоящей из спинеторама, спиносада и их смеси.
7. Инсектицидная композиция, содержащая стереоизомерную смесь {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида, определяемую первой парой диастереомеров и второй парой диастереомеров, где первая и вторая пары диастереомеров присутствуют при соотношении по меньшей мере 3:1.
8. Композиция по п.7, в которой первая и вторая пары диастереомеров присутствуют при соотношении от 3:1 до 100:1.
9. Композиция по п.7, в которой первая и вторая пары диастереомеров присутствуют при соотношении от 3:1 до 40:1.
10. Композиция по п.7, в которой первая пара диастереомеров определяется {(R)-1-[6-(трифторметил)пиридин-3-ил]этил}-(R)-(метил)оксидо-λ4-сульфанилиденцианамидом и {(S)-1-[6-(трифторметил)пиридин-3-ил]этил}-(S)-(метил)оксидо-λ4-сульфанилиденцианамидом, а вторая пара диастереомеров определяется {(R)-1-[6-(трифторметил)пиридин-3-ил]этил}-(S)-(метил)оксидо-λ4-сульфанилиденцианамидом и ((S)-1-[6-(трифторметил)пиридин-3-ил]этил}-(R)-(метил)оксидо-λ4-сульфанилиденцианамидом.
11. Композиция по п.7, дополнительно содержащая спиносин, выбранный из группы, состоящей из спинеторама, спиносада и их смесей.
12. Композиция по п.11, в которой массовое соотношение {1-[6-(трифторметил)пиридин-3-ил]этил}(метил)оксидо-λ4-сульфанилиденцианамида и спиносина составляет от 3:1 до 1:3.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US20360008P | 2008-12-26 | 2008-12-26 | |
| US61/203,600 | 2008-12-26 | ||
| PCT/US2009/006670 WO2010074747A1 (en) | 2008-12-26 | 2009-12-22 | Stable insecticide compositions and methods for producing same |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011131067A RU2011131067A (ru) | 2013-02-10 |
| RU2523293C2 true RU2523293C2 (ru) | 2014-07-20 |
Family
ID=42046455
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011131067/13A RU2523293C2 (ru) | 2008-12-26 | 2009-12-22 | Стабильная инсектицидная композиция и способ её получения (варианты) |
Country Status (20)
| Country | Link |
|---|---|
| US (3) | US8507532B2 (ru) |
| EP (1) | EP2369935B1 (ru) |
| JP (1) | JP5718249B2 (ru) |
| KR (1) | KR101736078B1 (ru) |
| CN (1) | CN102271516B (ru) |
| AR (1) | AR075494A1 (ru) |
| AU (1) | AU2009330658B2 (ru) |
| BR (1) | BRPI0923702B8 (ru) |
| CA (1) | CA2748132C (ru) |
| CO (1) | CO6390084A2 (ru) |
| DK (1) | DK2369935T3 (ru) |
| ES (1) | ES2589006T3 (ru) |
| HK (1) | HK1160728A1 (ru) |
| IL (1) | IL213706A0 (ru) |
| MX (2) | MX2011006909A (ru) |
| NZ (1) | NZ593168A (ru) |
| PL (1) | PL2369935T3 (ru) |
| RU (1) | RU2523293C2 (ru) |
| UA (1) | UA112281C2 (ru) |
| WO (1) | WO2010074747A1 (ru) |
Families Citing this family (104)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW201309635A (zh) * | 2006-02-10 | 2013-03-01 | Dow Agrosciences Llc | 殺蟲性之n-取代(6-鹵烷基吡啶-3-基)烷基磺醯亞胺(二) |
| PL2369935T3 (pl) | 2008-12-26 | 2017-04-28 | Dow Agrosciences, Llc | Trwałe kompozycje owadobójcze oraz sposoby ich wytwarzania |
| KR101702337B1 (ko) * | 2008-12-26 | 2017-02-03 | 다우 아그로사이언시즈 엘엘씨 | 안정한 설폭시민-살충제 조성물 |
| WO2011138285A1 (de) | 2010-05-05 | 2011-11-10 | Bayer Cropscience Ag | Thiazolderivate als schädlingsbekämpfungsmittel |
| CA2802787C (en) | 2010-06-18 | 2020-02-25 | Bayer Intellectual Property Gmbh | Active substance combinations with insecticide and acaricide properties |
| MX2013000188A (es) | 2010-06-28 | 2013-01-28 | Bayer Ip Gmbh | Compuestos heterociclicos como pesticidas. |
| KR20130039331A (ko) | 2010-06-29 | 2013-04-19 | 바이엘 인텔렉쳐 프로퍼티 게엠베하 | 사이클릭 카보닐아미딘을 포함하는 개량된 살충성 조성물 |
| WO2012004293A2 (de) | 2010-07-08 | 2012-01-12 | Bayer Cropscience Ag | Insektizide und fungizide wirkstoffkombinationen |
| JP2012017289A (ja) | 2010-07-08 | 2012-01-26 | Bayer Cropscience Ag | 殺虫性ピロリン誘導体 |
| WO2012007500A2 (de) | 2010-07-15 | 2012-01-19 | Bayer Cropscience Ag | Neue heterocyclische verbindungen als schädlingsbekämpfungsmittel |
| JP2012062267A (ja) | 2010-09-15 | 2012-03-29 | Bayer Cropscience Ag | 殺虫性ピロリンn−オキサイド誘導体 |
| JP2012082186A (ja) | 2010-09-15 | 2012-04-26 | Bayer Cropscience Ag | 殺虫性アリールピロリジン類 |
| WO2012045680A2 (de) | 2010-10-04 | 2012-04-12 | Bayer Cropscience Ag | Insektizide und fungizide wirkstoffkombinationen |
| EP2630125B1 (en) | 2010-10-21 | 2016-08-24 | Bayer Intellectual Property GmbH | N-benzyl heterocyclic carboxamides |
| EP2630133A1 (de) | 2010-10-22 | 2013-08-28 | Bayer Intellectual Property GmbH | Neue heterocylische verbindungen als schädlingsbekämpfungsmittel |
| KR20130116074A (ko) | 2010-11-02 | 2013-10-22 | 바이엘 인텔렉쳐 프로퍼티 게엠베하 | N-헤타릴메틸 피라졸릴카르복사미드 |
| AR083875A1 (es) | 2010-11-15 | 2013-03-27 | Bayer Cropscience Ag | N-aril pirazol(tio)carboxamidas |
| CN103476749A (zh) | 2010-11-29 | 2013-12-25 | 拜耳知识产权有限责任公司 | α,β-不饱和亚胺 |
| JP6412311B2 (ja) | 2010-12-01 | 2018-10-24 | バイエル・インテレクチュアル・プロパティ・ゲゼルシャフト・ミット・ベシュレンクテル・ハフツングBayer Intellectual Property GmbH | 作物において線虫類を防除するための、及び、収量を増加させるための、フルオピラムの使用 |
| BR112013014277A2 (pt) | 2010-12-09 | 2016-07-19 | Bayer Ip Gmbh | misturas pesticidas com propriedades aperfeiçoadas |
| BR112013014270A2 (pt) | 2010-12-09 | 2017-10-24 | Bayer Ip Gmbh | misturas inseticidas com propriedades aperfeiçoadas |
| TWI667347B (zh) | 2010-12-15 | 2019-08-01 | 瑞士商先正達合夥公司 | 大豆品種syht0h2及偵測其之組合物及方法 |
| WO2012110464A1 (en) | 2011-02-17 | 2012-08-23 | Bayer Cropscience Ag | Use of sdhi fungicides on conventionally bred asr-tolerant, stem canker resistant and/or frog-eye leaf spot resistant soybean varieties |
| BR112013021019A2 (pt) | 2011-02-17 | 2019-02-26 | Bayer Ip Gmbh | uso de fungicidas sdhi em variedades de soja cultivadas de forma convencional com tolerância à ferrugem asiática da soja (asr), resistentes ao cancro da haste e/ou à mancha foliar olho-de-rã |
| US9000026B2 (en) | 2011-02-17 | 2015-04-07 | Bayer Intellectual Property Gmbh | Substituted 3-(biphenyl-3-yl)-8,8-difluoro-4-hydroxy-1-azaspiro[4.5]dec-3-en-2-ones for therapy |
| CA2828639C (en) | 2011-03-01 | 2019-02-12 | Bayer Intellectual Property Gmbh | 2-acyloxypyrrolin-4-ones |
| AR085509A1 (es) | 2011-03-09 | 2013-10-09 | Bayer Cropscience Ag | Indol- y bencimidazolcarboxamidas como insecticidas y acaricidas |
| WO2012120105A1 (en) | 2011-03-10 | 2012-09-13 | Bayer Cropscience Ag | Use of lipochito-oligosaccharide compounds for safeguarding seed safety of treated seeds |
| MX350121B (es) | 2011-03-18 | 2017-08-28 | Bayer Ip Gmbh | Derivados de n-(3-carbamoilfenil)-1h-pirazol-5-carboxamida y el uso de los mismos para el control de plagas de animales. |
| JP6104900B2 (ja) * | 2011-06-07 | 2017-03-29 | ダウ アグロサイエンシィズ エルエルシー | 昆虫の防除のためのスルホキシイミンの油分散体 |
| EP2535334A1 (de) | 2011-06-17 | 2012-12-19 | Bayer CropScience AG | Kristalline Modifikationen von Penflufen |
| EP2540163A1 (en) | 2011-06-30 | 2013-01-02 | Bayer CropScience AG | Nematocide N-cyclopropyl-sulfonylamide derivatives |
| BR112014001917A2 (pt) | 2011-07-26 | 2017-02-21 | Bayer Ip Gmbh | ésteres de lactato eterificados, processos para a sua produção e seu uso para melhorar o efeito de agentes para proteger plantas |
| UA115128C2 (uk) | 2011-07-27 | 2017-09-25 | Байєр Інтеллектуал Проперті Гмбх | Протравлювання насіння для боротьби з фітопатогенними грибами |
| JP2013082632A (ja) | 2011-10-05 | 2013-05-09 | Bayer Cropscience Ag | 農薬製剤及びその製造方法 |
| EP2604118A1 (en) | 2011-12-15 | 2013-06-19 | Bayer CropScience AG | Active ingredient combinations having insecticidal and acaricidal properties |
| WO2013092519A1 (en) | 2011-12-19 | 2013-06-27 | Bayer Cropscience Ag | Use of anthranilic acid diamide derivatives for pest control in transgenic crops |
| BR112014014972A2 (pt) | 2011-12-20 | 2017-06-13 | Bayer Ip Gmbh | novas amidas aromáticas inseticidas |
| EP2606726A1 (de) | 2011-12-21 | 2013-06-26 | Bayer CropScience AG | N-Arylamidine-substituierte trifluoroethylsulfid-Derivate als Akarizide und Insektizide |
| EP2804480A1 (en) | 2012-01-21 | 2014-11-26 | Bayer Intellectual Property GmbH | Use of host defense inducers for controlling bacterial harmful organisms in useful plants |
| BR112014021674A2 (pt) | 2012-03-14 | 2019-09-24 | Bayer Ip Gmbh | arilpirrolidinas pesticidas |
| KR102145261B1 (ko) | 2012-05-16 | 2020-08-18 | 바이엘 크롭사이언스 악티엔게젤샤프트 | 살곤충 유중수 (w/o) 제제 |
| CN104302173B (zh) | 2012-05-16 | 2019-10-15 | 拜尔农作物科学股份公司 | 水包油(o/w)杀虫制剂 |
| AR091104A1 (es) | 2012-05-22 | 2015-01-14 | Bayer Cropscience Ag | Combinaciones de compuestos activos que comprenden un derivado lipo-quitooligosacarido y un compuesto nematicida, insecticida o fungicida |
| EP3363289A3 (en) | 2012-05-30 | 2018-10-17 | Bayer CropScience Aktiengesellschaft | Compositions comprising a biological control agent and an insecticide |
| BR112014029758A2 (pt) | 2012-05-30 | 2017-06-27 | Clariant Finance Bvi Ltd | composição contendo n-metil-n-acilglucamina |
| ES2599504T3 (es) | 2012-05-30 | 2017-02-02 | Clariant International Ltd | Utilización de N-metil-N-acil-glucaminas como agentes solubilizantes |
| NZ701724A (en) | 2012-05-30 | 2016-11-25 | Bayer Cropscience Ag | Compositions comprising a biological control agent and an insecticide |
| MX2014014992A (es) | 2012-06-08 | 2015-03-05 | Bayer Cropscience Ag | Sistema de deteccion para la identificacion de resistencia a insecticidas. |
| RU2639870C2 (ru) * | 2012-06-30 | 2017-12-25 | ДАУ АГРОСАЙЕНСИЗ ЭлЭлСи | Инсектицидные n-замещенные сульфилимины и сульфоксимины n- оксидов пиридина |
| CA2876192C (en) * | 2012-06-30 | 2021-01-05 | Dow Agrosciences Llc | Production of n-substituted sulfoximine pyridine n-oxides |
| EP2866562B1 (en) * | 2012-06-30 | 2019-12-18 | Dow AgroSciences LLC | Pyridine n-oxides and processes for their preparation |
| EP2879493B1 (en) | 2012-07-31 | 2018-09-19 | Bayer CropScience AG | Pesticidal compositions comprising a terpene mixture and flupyradifurone |
| KR20150044895A (ko) | 2012-08-17 | 2015-04-27 | 바이엘 크롭사이언스 아게 | 살곤충제 및 살응애제로서의 아자인돌 카르복실산 아미드 및 아자인돌 티오카르복실산 아미드 |
| CN108477173B (zh) | 2012-10-02 | 2021-07-02 | 拜耳农作物科学股份公司 | 作为杀虫剂的杂环化合物 |
| WO2014060381A1 (de) | 2012-10-18 | 2014-04-24 | Bayer Cropscience Ag | Heterocyclische verbindungen als schädlingsbekämpfungsmittel |
| EP2914587A1 (de) | 2012-10-31 | 2015-09-09 | Bayer CropScience AG | Neue heterocylische verbindungen als schädlingsbekämpfungsmittel |
| DE102012021647A1 (de) | 2012-11-03 | 2014-05-08 | Clariant International Ltd. | Wässrige Adjuvant-Zusammensetzungen |
| UA117816C2 (uk) | 2012-11-06 | 2018-10-10 | Байєр Кропсайєнс Акцієнгезелльшафт | Гербіцидна комбінація для толерантних соєвих культур |
| JP6367214B2 (ja) | 2012-11-30 | 2018-08-01 | バイエル・クロップサイエンス・アクチェンゲゼルシャフト | 二成分殺菌剤混合物又は二成分殺害虫剤混合物 |
| EA201500580A1 (ru) | 2012-11-30 | 2016-01-29 | Байер Кропсайенс Акциенгезельшафт | Двойные фунгицидные смеси |
| CA2893027A1 (en) | 2012-12-03 | 2014-06-12 | Bayer Cropscience Ag | Composition comprising biological control agents |
| US20150289518A1 (en) | 2012-12-03 | 2015-10-15 | Bayer Cropscience Ag | Composition comprising a biological control agent and an insecticide |
| WO2014086758A2 (en) | 2012-12-03 | 2014-06-12 | Bayer Cropscience Ag | Composition comprising a biological control agent and an insecticide |
| WO2014086753A2 (en) | 2012-12-03 | 2014-06-12 | Bayer Cropscience Ag | Composition comprising biological control agents |
| BR112015012763B1 (pt) | 2012-12-03 | 2020-05-12 | Bayer Cropscience Ag | Composição, semente revestida com uma composição, uso da composição, kit de componentes e método para reduzir danos globais em plantas e controlar nematodes e insetos |
| WO2014090765A1 (en) | 2012-12-12 | 2014-06-19 | Bayer Cropscience Ag | Use of 1-[2-fluoro-4-methyl-5-(2,2,2-trifluoroethylsulfinyl)phenyl]-5-amino-3-trifluoromethyl)-1 h-1,2,4 tfia zole for controlling nematodes in nematode-resistant crops |
| AR093996A1 (es) | 2012-12-18 | 2015-07-01 | Bayer Cropscience Ag | Combinaciones bactericidas y fungicidas binarias |
| KR102191469B1 (ko) | 2013-02-06 | 2020-12-16 | 바이엘 애니멀 헬스 게엠베하 | 해충 방제제로서의 할로겐-치환된 피라졸 유도체 |
| CA2898725A1 (en) | 2013-02-11 | 2014-08-14 | Bayer Cropscience Lp | Compositions comprising a streptomyces-based biological control agent and an insecticide |
| JP2016511244A (ja) | 2013-02-11 | 2016-04-14 | バイエル クロップサイエンス エルピーBayer Cropscience Lp | ストレプトミセス(Streptomyces)属に基づく生物的防除剤及び別の生物的防除剤を含んでいる組成物 |
| BR112015021342A2 (pt) | 2013-03-12 | 2017-07-18 | Bayer Cropscience Ag | uso de ditiina-tetracarboximidas para controle de microrganismos bacterianos nocivos em plantas úteis |
| JP2016521268A (ja) | 2013-04-19 | 2016-07-21 | バイエル・クロップサイエンス・アクチェンゲゼルシャフト | 殺虫性を有する活性化合物の組合せ |
| WO2014170364A1 (en) | 2013-04-19 | 2014-10-23 | Bayer Cropscience Ag | Binary insecticidal or pesticidal mixture |
| CN103333101B (zh) * | 2013-06-08 | 2015-06-17 | 北京格林凯默科技有限公司 | 吡啶基亚磺酰亚胺化合物及其制备方法 |
| CN103333102B (zh) * | 2013-06-08 | 2015-06-17 | 北京格林凯默科技有限公司 | 吡啶基-n-氰基磺基肟化合物及其制备方法 |
| JP2016526538A (ja) | 2013-06-20 | 2016-09-05 | バイエル・クロップサイエンス・アクチェンゲゼルシャフト | 殺ダニ剤及び殺虫剤としてのアリールスルフィド誘導体及びアリールスルホキシド誘導体 |
| JP2016526539A (ja) | 2013-06-20 | 2016-09-05 | バイエル・クロップサイエンス・アクチェンゲゼルシャフト | 殺ダニ剤及び殺虫剤としてのアリールスルフィド誘導体及びアリールスルホキシド誘導体 |
| ES2728531T3 (es) | 2013-07-08 | 2019-10-25 | Bayer Cropscience Ag | Derivados de arilsulfuro y arilsulfóxido de seis miembros enlazados con C-N como agentes para combatir parásitos |
| DE202014008415U1 (de) | 2014-02-19 | 2014-11-25 | Clariant International Ltd. | Wässrige Adjuvant-Zusammensetzung zur Wirkungssteigerung von Elektrolyt-Wirkstoffen |
| DE202014008418U1 (de) | 2014-02-19 | 2014-11-14 | Clariant International Ltd. | Schaumarme agrochemische Zusammensetzungen |
| WO2015160618A1 (en) | 2014-04-16 | 2015-10-22 | Bayer Cropscience Lp | Compositions comprising ningnanmycin and a biological control agent |
| WO2015160620A1 (en) | 2014-04-16 | 2015-10-22 | Bayer Cropscience Lp | Compositions comprising ningnanmycin and an insecticide |
| DE102014005771A1 (de) | 2014-04-23 | 2015-10-29 | Clariant International Ltd. | Verwendung von wässrigen driftreduzierenden Zusammensetzungen |
| WO2016001129A1 (de) | 2014-07-01 | 2016-01-07 | Bayer Cropscience Aktiengesellschaft | Verbesserte insektizide zusammensetzungen |
| DE102014012022A1 (de) | 2014-08-13 | 2016-02-18 | Clariant International Ltd. | Organische Ammoniumsalze von anionischen Pestiziden |
| DE102014018274A1 (de) | 2014-12-12 | 2015-07-30 | Clariant International Ltd. | Zuckertenside und deren Verwendung in agrochemischen Zusammensetzungen |
| CA2971258A1 (en) | 2014-12-19 | 2016-06-23 | Clariant International Ltd | Aqueous electrolyte-containing adjuvant compositions, active ingredient-containing compositions and the use thereof |
| WO2016106063A1 (en) | 2014-12-22 | 2016-06-30 | Bayer Corpscience Lp | Method for using a bacillus subtilis or bacillus pumilus strain to treat or prevent pineapple disease |
| GB2536650A (en) | 2015-03-24 | 2016-09-28 | Augmedics Ltd | Method and system for combining video-based and optic-based augmented reality in a near eye display |
| TW201639453A (zh) * | 2015-03-31 | 2016-11-16 | 陶氏農業科學公司 | 殺蟲組成物及相關方法(一) |
| DE102015219651A1 (de) | 2015-10-09 | 2017-04-13 | Clariant International Ltd. | Zusammensetzungen enthaltend Zuckeramin und Fettsäure |
| DE202015008045U1 (de) | 2015-10-09 | 2015-12-09 | Clariant International Ltd. | Universelle Pigmentdispersionen auf Basis von N-Alkylglukaminen |
| CN105503672A (zh) * | 2015-12-06 | 2016-04-20 | 杨秀娟 | 一种药物中间体芳基砜类化合物的合成方法 |
| CN109068649A (zh) | 2016-04-24 | 2018-12-21 | 拜耳农作物科学股份公司 | 氟吡菌酰胺和/或枯草芽孢杆菌用于防治芭蕉科植物的枯萎病的用途 |
| DE102016207877A1 (de) | 2016-05-09 | 2017-11-09 | Clariant International Ltd | Stabilisatoren für Silikatfarben |
| AU2017290135B2 (en) * | 2016-07-01 | 2021-04-15 | Mclaughlin Gormley King Company | Mixtures of sabadilla alkaloids and Bacillus thuringiensis and uses thereof |
| EP3490379A1 (en) | 2016-07-29 | 2019-06-05 | Bayer CropScience Aktiengesellschaft | Active compound combinations and methods to protect the propagation material of plants |
| CN107254920B (zh) * | 2016-11-11 | 2019-11-01 | 新沂市金达木业有限公司 | 一种能够预防蛀虫的室内装饰用防火板的制备方法 |
| US10925286B2 (en) * | 2017-03-17 | 2021-02-23 | Telluris Biotech India Private Limited | Synergistic chalcone containing composition of a nematicide |
| WO2019211741A1 (en) | 2018-05-02 | 2019-11-07 | Augmedics Ltd. | Registration of a fiducial marker for an augmented reality system |
| US11766296B2 (en) | 2018-11-26 | 2023-09-26 | Augmedics Ltd. | Tracking system for image-guided surgery |
| US11382712B2 (en) | 2019-12-22 | 2022-07-12 | Augmedics Ltd. | Mirroring in image guided surgery |
| US11896445B2 (en) | 2021-07-07 | 2024-02-13 | Augmedics Ltd. | Iliac pin and adapter |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050038501A1 (en) * | 2003-08-12 | 2005-02-17 | Moore James E. | Dynamic stent |
| UY28506A1 (es) | 2003-09-12 | 2005-04-29 | Basf Ag | 6-halógeno-(1,2,4)triazolo(1,5-a)pirimidinas para combatir plagas animales. |
| ZA200607292B (en) * | 2004-04-08 | 2008-05-28 | Dow Agrosciences Llc | Insecticidal N-substituted sulfoximines |
| TW200626532A (en) | 2004-09-21 | 2006-08-01 | Syngenta Participations Ag | Novel insecticides |
| TW201309635A (zh) * | 2006-02-10 | 2013-03-01 | Dow Agrosciences Llc | 殺蟲性之n-取代(6-鹵烷基吡啶-3-基)烷基磺醯亞胺(二) |
| TWI381811B (zh) * | 2006-06-23 | 2013-01-11 | Dow Agrosciences Llc | 用以防治可抵抗一般殺蟲劑之昆蟲的方法 |
| TWI383973B (zh) * | 2006-08-07 | 2013-02-01 | Dow Agrosciences Llc | 用於製備2-取代-5-(1-烷硫基)烷基吡啶之方法 |
| TWI409256B (zh) * | 2006-09-01 | 2013-09-21 | Dow Agrosciences Llc | 殺蟲性之n-取代(雜芳基)環烷基磺醯亞胺 |
| TWI387585B (zh) * | 2006-09-01 | 2013-03-01 | Dow Agrosciences Llc | 殺蟲性之n-取代(雜芳基)烷基烴基硫亞胺 |
| TWI395736B (zh) * | 2006-11-08 | 2013-05-11 | Dow Agrosciences Llc | 作為殺蟲劑之雜芳基(取代的)烷基n-取代的磺醯亞胺(二) |
| TW200820902A (en) * | 2006-11-08 | 2008-05-16 | Dow Agrosciences Llc | Use of N-substituted sulfoximines for control of invertebrate pests |
| TWI383970B (zh) * | 2006-11-08 | 2013-02-01 | Dow Agrosciences Llc | 多取代的吡啶基磺醯亞胺及其作為殺蟲劑之用途 |
| KR101364353B1 (ko) * | 2006-11-30 | 2014-02-18 | 다우 아그로사이언시즈 엘엘씨 | 2-치환된-5-(1-알킬티오)알킬피리딘의 제조 방법 |
| US7511149B2 (en) * | 2007-02-09 | 2009-03-31 | Dow Agrosciences Llc | Process for the oxidation of certain substituted sulfilimines to insecticidal sulfoximines |
| US7709648B2 (en) * | 2007-02-09 | 2010-05-04 | Dow Agrosciences Llc | Process for the preparation of 2-substituted-5-(1-alkylthio)alkylpyridines |
| AU2008219748B2 (en) * | 2007-02-26 | 2012-05-03 | Corteva Agriscience Llc | Process for the preparation of certain substituted sulfilimines |
| JP5511393B2 (ja) | 2007-03-01 | 2014-06-04 | ビーエーエスエフ ソシエタス・ヨーロピア | アミノチアゾリン化合物を含む殺有害生物活性混合物 |
| WO2009134224A1 (en) * | 2008-05-01 | 2009-11-05 | Dow Agrosciences Llc | Synergistic pesticidal mixtures |
| AR066366A1 (es) * | 2007-05-01 | 2009-08-12 | Dow Agrosciences Llc | Mezclas sinergicas plaguicidas |
| US7844777B2 (en) * | 2007-06-26 | 2010-11-30 | Intel Corporation | Cache for a host controller to store command header information |
| US20090006676A1 (en) * | 2007-06-29 | 2009-01-01 | Intel Corporation | Method for Scheduling a Device Notification Time Slot for a Wireless USB System |
| BRPI0816422A2 (pt) | 2007-09-04 | 2017-05-16 | Segetis Inc | compostos de cetal a partir de polióis e oxocarboxilatos. |
| PL2219456T3 (pl) | 2007-11-16 | 2016-03-31 | Basf Se | Mieszaniny szkodnikobójcze zawierające związki cyjanosulfoksyiminowe |
| TWM332793U (en) * | 2007-11-28 | 2008-05-21 | Cooler Master Co Ltd | Heat radiating structure and the lighting apparatus |
| AU2009243775B2 (en) | 2008-05-07 | 2015-05-14 | Bayer Intellectual Property Gmbh | Synergistic active ingredient combinations |
| JP2012500824A (ja) * | 2008-08-28 | 2012-01-12 | ビーエーエスエフ ソシエタス・ヨーロピア | シアノスルホキシミン化合物とスピネトラムとを含む殺有害生物剤混合物 |
| PL2369935T3 (pl) * | 2008-12-26 | 2017-04-28 | Dow Agrosciences, Llc | Trwałe kompozycje owadobójcze oraz sposoby ich wytwarzania |
-
2009
- 2009-12-22 PL PL09795588T patent/PL2369935T3/pl unknown
- 2009-12-22 NZ NZ59316809A patent/NZ593168A/en unknown
- 2009-12-22 US US12/653,996 patent/US8507532B2/en active Active
- 2009-12-22 AU AU2009330658A patent/AU2009330658B2/en active Active
- 2009-12-22 JP JP2011543496A patent/JP5718249B2/ja active Active
- 2009-12-22 WO PCT/US2009/006670 patent/WO2010074747A1/en active Application Filing
- 2009-12-22 BR BRPI0923702A patent/BRPI0923702B8/pt active IP Right Grant
- 2009-12-22 CN CN200980152713.7A patent/CN102271516B/zh active Active
- 2009-12-22 DK DK09795588.4T patent/DK2369935T3/en active
- 2009-12-22 MX MX2011006909A patent/MX2011006909A/es active IP Right Grant
- 2009-12-22 KR KR1020117017454A patent/KR101736078B1/ko active IP Right Grant
- 2009-12-22 UA UAA201109330A patent/UA112281C2/uk unknown
- 2009-12-22 EP EP09795588.4A patent/EP2369935B1/en active Active
- 2009-12-22 CA CA2748132A patent/CA2748132C/en active Active
- 2009-12-22 AR ARP090105030 patent/AR075494A1/es not_active Application Discontinuation
- 2009-12-22 ES ES09795588.4T patent/ES2589006T3/es active Active
- 2009-12-22 RU RU2011131067/13A patent/RU2523293C2/ru active
- 2009-12-22 MX MX2013002749A patent/MX343270B/es unknown
-
2011
- 2011-06-21 IL IL213706A patent/IL213706A0/en active IP Right Grant
- 2011-06-22 CO CO11078100A patent/CO6390084A2/es active IP Right Grant
-
2012
- 2012-02-15 HK HK12101504A patent/HK1160728A1/xx unknown
-
2013
- 2013-03-15 US US13/833,069 patent/US8846717B2/en active Active
-
2014
- 2014-07-01 US US14/321,373 patent/US9125412B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2523293C2 (ru) | Стабильная инсектицидная композиция и способ её получения (варианты) | |
| JP6464109B2 (ja) | 安定なスルホキシイミン殺虫剤組成物 | |
| ES2415511T3 (es) | Composición insecticida que comprende sulfoximinas de (6-haloalquilpiridin-3-il)alquilo N-sustituidas | |
| ES2414983T3 (es) | Piridilsulfoximinas multisustituidas y su uso como insecticidas | |
| JP5266226B2 (ja) | 殺虫性n−置換(ヘテロアリール)アルキルスルフィルイミン類 | |
| ES2341302T3 (es) | (heteroaril)cicloalquilsulfoximinas sustituidas en n insecticidas. | |
| MX2008016527A (es) | Un metodo para controlar insectos resistentes a insecticidas comunes. | |
| JP2009526074A5 (ru) | ||
| JP2010509325A (ja) | 殺虫剤としてのヘテロアリール(置換)アルキルn−置換スルホキシイミン | |
| RU2639870C2 (ru) | Инсектицидные n-замещенные сульфилимины и сульфоксимины n- оксидов пиридина |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner |