RU2470665C2 - Способы профилактики и лечения ракового метастаза и разрежения кости, связанного с раковым метастазом - Google Patents
Способы профилактики и лечения ракового метастаза и разрежения кости, связанного с раковым метастазом Download PDFInfo
- Publication number
- RU2470665C2 RU2470665C2 RU2008132150/15A RU2008132150A RU2470665C2 RU 2470665 C2 RU2470665 C2 RU 2470665C2 RU 2008132150/15 A RU2008132150/15 A RU 2008132150/15A RU 2008132150 A RU2008132150 A RU 2008132150A RU 2470665 C2 RU2470665 C2 RU 2470665C2
- Authority
- RU
- Russia
- Prior art keywords
- ser
- thr
- leu
- gly
- val
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/662—Phosphorus acids or esters thereof having P—C bonds, e.g. foscarnet, trichlorfon
- A61K31/663—Compounds having two or more phosphorus acid groups or esters thereof, e.g. clodronic acid, pamidronic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Physical Education & Sports Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Endocrinology (AREA)
- Oncology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Группа изобретений предлагает способы профилактики и лечения остеолиза, ракового метастаза и разрежения кости, связанного с раковым метастазом, путем введения субъекту антагониста M-CSF в сочетании с бисфосфонатом. С помощью указанной группы изобретений достигается эффективное лечение остеолитического нарушения. 2 н. и 19 з.п. ф-лы, 32 ил., 3 табл., 4 пр.
Description
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к способам профилактики и лечения остеолитических заболеваний, включающих в себя раковый метастаз и разрежение кости, связанное с раковым метастазом, путем введения субъекту антагониста M-CSF в сочетании с другим терапевтическим средством.
УРОВЕНЬ ТЕХНИКИ
Остеокласты, опосредующие резорбцию кости, участвуют в нормальных и патологических процессах ремоделирования костей, включающих в себя остеолитические заболевания. Остеокласты представляют собой многоядерные клетки, дифференцирующиеся из гемопоэтических клеток. Принято считать, что остеокласты скорее образуются путем слияния одноядерных предшественников, образующихся из гемопоэтических стволовых клеток в костном мозге, чем в результате неполного деления клеток (Chambers, Bone and Mineral Research, 6: 1-25, 1989; Göthling et al., Clin Orthop Relat R. 120: 201-228, 1976; Kahn et al., Nature 258: 325-327, 1975, Suda et al., Endocr Rev 13: 66-80, 1992; Walker, Science 180: 875, 1973; Walker, Science 190: 785-787, 1975; Walker, Science 190: 784-785, 1975). Они происходят из тех же стволовых клеток, что и клеточные линии моноцитов-макрофагов (Ash et al., Nature 283: 669-670, 1980, Kerby et al., J. Bone Miner Res 7: 353-62, 1992). Дифференцировка предшественников остеокластов в зрелые многоядерные остеокласты требует присутствия разных факторов, включающих в себя гормональные и локальные стимулы (Athanasou et al.,Bone Miner 3: 317-333, 1988; Feldman et al., Endocrinology 107: 1137-1143, 1980; Walker, Science 190: 784-785, 1975; Zheng et al., Histochem J 23: 180-188, 1991), также показано, что в развитии остеокластов важную роль играют живые кости и костные клетки (Hagenaars et al., Bone Miner 6: 179-189, 1989). Кроме того, для дифференцировки остеокластов требуются остеобластные или стромальные клетки костного мозга. Одним из факторов, продуцирующихся данными клетками и поддерживающих образование остеокластов, является макрофагальный колониестимулирующий фактор, M-CSF (Wiktor-Jedrzejczak et al., Proc Natl Acad Sci USA 87: 4828-4832, 1990; Yoshida et al., Nature 345: 442-444, 1990). Лиганд В рецептора-активатора NF-κ (RANKL, также известного как TRANCE, ODF и OPGL) представляет собой другой сигнал (Suda et al., Endocr Rev 13: 66-80, 1992), участвующий в стимуляции образования остеокластов и резорбции под действием остеобластных/стромальных клеток, которое опосредуется рецептором RANK (TRANCER), расположенным на остеокластах и предшественниках остеокластов (Lacey et al., Cell 93: 165-176, 1998; Tsuda et al., Biochem Biophys Res Co 234: 137-142, 1997; Wong et al., J Exp Med 186: 2075-2080, 1997; Wong et al., J Biol. Chem 272: 25190-25194, 1997; Yasuda et al., Endocrinology 139: 1329-1337, 1998: Yasuda el al., Proc Natl Acad Sci US 95: 3597-3602, 1998). Остеобласты также секретируют белок остеопротегерин (OPG, также известный как OCIF), интенсивно ингибирующий образование остеокластов, который действует как рецептор-ловушка для RANKL, ингибируя положительный сигнал между остеокластами и остеобластами через RANK и RANKL.
Остеокласты отвечают за растворение как минерального, так и органического костного матрикса (Blair et al., J Cell Biol 102: 1164-1172, 1986). Остеокласты представляют собой дифференцированные клетки, обладающие уникальной поляризованной морфологией со специализированными участками мембраны и несколькими мембранными и цитоплазматическими маркерами, такими как тартрат-устойчивая кислая фофсатаза (TRAP) (Anderson et al. 1979), карбонангидраза II (Väänänen et al., Histochemistry 78: 481-485, 1983), рецептор кальцитонина (Warshafsky et al., Bone 6: 179-185, 1985) и рецептор витронектина (Davies et al., J Cell Biol 109: 1817-1826, 1989). Многоядерные остеокласты обычно содержат менее 10 ядер, однако они могут содержать до 100 ядер, составляя от 10 до 100 мкм в диаметре (Göthling et al., Clin Orthop Relat R 120: 201-228, 1976). Это позволяет относительно легко идентифицировать их с помощью световой микроскопии. В активном состоянии они являются высоко вакуолизированными и, кроме того, содержат много митохондрий, что указывает на высокую метаболическую активность (Mundy, in Primer on the metabolic bone diseases and disorders of mineral metabolism, pages 18-22, 1990). Поскольку остеокласты играют ключевую роль в остеолитических костных метастазах, в данной области существует потребность в новых средствах и способах предотвращения стимуляции и функционирования остеокластов.
Раковый метастаз представляет собой основную причину рецидива, встречающегося у раковых пациентов после операционного или терапевтического вмешательства. Несмотря на интенсивные усилия, направленные на разработку способов лечения, раковый метастаз по-прежнему практически не поддается лечению. Кость является одним из наиболее распространенных участков метастазирования различных раковых заболеваний человека (например, раковых заболеваний молочной железы, легкого, простаты и щитовидной железы). Появление остеолитических костных метастаз является серьезной проблемой, поскольку они сопровождаются трудноизлечимой болью, высокой вероятностью переломов, сдавливанием нерва и гиперкальцимией. Несмотря на указанные клинические проблемы существует несколько доступных способов лечения разрежения костей, связанного с раковыми метастазами.
В настоящее время используется или находится на стадии разработки несколько терапевтических стратегий, направленных на лечение остеолитических заболеваний, причем усилия в основном сфокусированы на разработке лекарственных средств, блокирующих резорбцию кости посредством ингибирования образования или активности остеокластов. Бисфосфонаты (BP), аналоги пирофосфата, которые концентрируются в кости, на сегодняшний день являются наиболее эффективными ингибиторами резорбции кости. BP поглощаются остеокластами, ингибируют их активность и стимулируют вступление клеток в апоптоз, подавляя в результате резорбцию кости. Алендронат является первым BP ингибитором резорбции кости, вызывающим значительное уменьшение переломов позвоночника/бедра, он представляет собой разрешенный препарат для лечения остеопороза. Последнее поколение BP, Zometa, представляет собой разрешенный препарат для лечения гиперкальцемии и заболевания кости при солидных опухолях и множественной миеломе, и находится в стадии исследования как потенциальное средство для лечения болезни Педжета и костного метастаза при солидных опухолях и множественной миеломе. Zometa действует в очень низких дозах, его вводят в виде 15-минутной в/в инфузии один раз в месяц, однако он также оказывает влияние на остеобласты и может вызывать побочные эффекты, такие как почечная токсичность и остеонекроз челюсти (Fromigue and Brody, J. Endocrinol. Invest. 25:39-46, 2002; Ibrahim, A. et al., Clin. Canс. Res. 9:2394-99, 2003; Body, J.J., The Breast. S2:S37-44, 2003; Yaccoby, S. et al., Brit. J. Hemat., 116:278-80, 2002; Corey, E. et al., Clin. Canс. Res. 9: 295-306, 2003; Coleman, R.E., Sem. Oncol., 29(6): 43-49, 2002; Coleman, R.E., Eur. Soc. Med. Oncol. 16:687-95, 2005; Bamias et al., J Clin Oncol 13: 8580-8587, 2005. Таким образом, в данной области остается потребность в разработке новых средств и способов профилактики или лечения остеолитических заболеваний и/или раковых метастаз, в том числе остеолитических костных метастаз.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Композиции и способы настоящего изобретения способствуют удовлетворению вышеупомянутых и других, связанных с ними, потребностей, существующих в данной области. В одном воплощении данное изобретение предлагает способ лечения субъекта, страдающего от остеолитического нарушения, или имеющего риск такого нарушения, включающий в себя введение субъекту монотерапевтически эффективного количества антагониста M-CSF и монотерапевтически эффективного количества второго противоостеокластного средства в течение переходного периода, составляющего приблизительно от 1 дня до года, в течение которого антагонист M-CSF уменьшает число активных остеокластов до терапевтически желательного уровня. Примеры антагонистов M-CSF включают в себя антитела против M-CSF, а примеры других противоостеокластных средств включают в себя бисфосфонаты и ингибиторы RANKL, в том числе антитела против RANKL. В способах и/или применениях настоящего изобретения, включающих в себя использование антитела против M-CSF и ингибитора остеокластов, необязательно исключается применение RX1-, 5H4-, MC1- и MC3-производных антител, раскрытых в международной публикации № WO 2005/068503. Длительность переходного периода может составлять, например, по меньшей мере, от одного дня до одного года, ее определяют, например, с помощью подходящих маркеров роста или по активности остеокластов. Альтернативно их можно вводить одновременно.
Например, маркеры формирования кости включают в себя, без ограничения, кальций, а также общую и специфичную для кости щелочную фосфатазу (BAP), остеокальцин (OC, костный gla-белок), проколлагена типа I C-пропептид (PICP) и проколлагена типа I N-пропептид (PINP), а маркеры резорбции кости включают в себя, без ограничения, NTX (N-концевой поперечно сшитый телопептид костного коллагена) и CTX (C-концевой поперечно сшитый телопептид костного коллагена), поперечно сшитый пиридиний (пиридинолин и дезоксипиридинолин [DPD]) и ассоциированные пептиды, продукты деградации костного коллагена типа I гидроксипролиновые и гидроксилизиновые гликозиды, устойчивую к тартрату кислую фосфатазу (TRACP) и костный сиалобелок (BSP). См. Fohr et al., J. Clin. Endocrinol. Metab., November 2003, 88(11):5059-5075.
В родственных воплощениях предлагаются упомянутые выше способы, в которых второе противоостеокластное средство прекращают давать после окончания переходного периода. В других родственных воплощениях предлагаются упомянутые выше способы, в которых количество второго противоостеокластного средства уменьшают после окончания переходного периода. В следующих родственных воплощениях предлагаются упомянутые выше способы, в которых количество антагониста M-CSF уменьшают после окончания переходного периода.
Предполагается, что способы настоящего изобретения оказывают терапевтическое действие путем ингибирования взаимодействия между M-CSF и его рецептором (M-CSFR). Также предполагается, что ингибирование взаимодействия M-CSF/M-CSFR подавляет пролиферацию и/или дифференциацию остеокластов. Во всех способах или композициях данного изобретения антагонист M-CSF может представлять собой полипептид, содержащий антитело против M-CSF; полипептид, содержащий антитело против M-CSFR; растворимый полипептид, содержащий мутеин M-CSF или его производное; или растворимый полипептид, содержащий мутеин M-CSFR или его производное; или молекулу нуклеиновой кислоты, ингибирующую экспрессию M-CSF или M-CSFR. Способы идентификации, продукции и модификации разных антагонистов M-CSF описаны в международной публикации № WO 2005/068503, включенной в данное описание в качестве ссылки во всей полноте.
Антитело против M-CSF может представлять собой поликлональное антитело; моноклональное антитело; гуманизированное антитело; человеческое антитело; человеческое рекомбинантное антитело; химерное антитело; фрагмент антитела Fab, F(ab')2 или Fv; или мутеин любого из вышеупомянутых антител.
Антитела против M-CSF настоящего изобретения, ингибирующие остеолиз, описаны в международной публикации № WO 2005/068503, которая включена в данное описание в качестве ссылки во всей полноте с целью приведения подробной информации по антителам против M-CSF.
В одном воплощении данное изобретение предлагает немышиное моноклональное антитело, содержащее функциональный фрагмент, который специфически связывается с таким же эпитопом M-CSF, как и одно из мышиных моноклональных антител RX1, MC1 или MC3, аминокислотные последовательности которых приведены на фигурах 1, 3 и 4, соответственно. В родственном воплощении предлагается вышеупомянутое антитело, где антитело выбрано из группы, включающей в себя поликлональное антитело; моноклональное антитело, в том числе Human EngineeredTM антитело; гуманизированное антитело; человеческое антитело; химерное антитело; фрагмент антитела Fab, F(ab')2; Fv; ScFv или SCA; диантитело; линейное антитело; или мутеин одного из указанных антител, причем сродство связывания упомянутого антитела предпочтительно сохраняется на уровне, составляющем, по меньшей мере, 10-7, 10-8, 10-9 или выше. Также предлагается немышиное моноклональное антитело, содержащее функциональный фрагмент, которое конкурирует с моноклональным антителом RX1, MC1 и/или MC3, имеющим аминокислотную последовательность, приведенную на фигуре 1, за связывание с M-CSF более чем на 75%.
В другом воплощении предлагается немышиное моноклональное антитело, содержащее функциональный фрагмент, где указанное немышиное моноклональное антитело, или его функциональный фрагмент, связывает эпитоп M-CSF, который содержит, по меньшей мере, 4, 5, 6, 7 или 8 смежных остатков аминокислот 98-105 последовательности, приведенной на фигуре 7.
В другом воплощении данное изобретение предлагает немышиное моноклональное антитело, содержащее функциональный фрагмент, где указанное немышиное моноклональное антитело или его функциональный фрагмент связывает эпитоп M-CSF, который содержит, по меньшей мере, 4, 5, 6, 7 или 8 смежных остатков аминокислот 65-73 или 138-144 последовательности, приведенной на фигуре 7 (соответствующий эпитопам M-CSF, распознаваемым 5H4 или MC3).
В следующем воплощении предлагается вышеуказанное антитело, или фрагмент, связывающий эпитоп M-CSF, который содержит аминокислоты 98-105 последовательности, приведенной на фигуре 7. В родственном воплощении предлагается вышеуказанное антитело, содержащее CDR3, последовательность которого приведена на фигуре 1A. В другом воплощении предлагается антитело, содержащее, по меньшей мере, 1, 2, 3, 4, 5 или 6 CDR мышиного антитела RX1, последовательность которого приведена на фигуре 1A. Антитело, которое содержит, по меньшей мере, 1, 2, 3, 4 или 5 CDR мышиного антитела RX1, также может содержать, по меньшей мере, любые 1, 2, 3, 4 или 5 CDR из 6 CDR антитела 5H4, последовательность которого приведена на фигуре 8A-B. Альтернативно антитело, которое содержит, по меньшей мере, 1, 2, 3, 4 или 5 CDR мышиного антитела RX1, может также содержать, по меньшей мере, любые 1, 2, 3, 4 или 5 CDR из 6 CDR антитела MC1, последовательность которого приведена на фигуре 8A-B. В следующем альтернативном воплощении вышеуказанное антитело может также содержать, по меньшей мере, любые 1, 2, 3, 4 или 5 CDR из 6 CDR антитела MC3, последовательность которого приведена на фигуре 8A-B. В родственном воплощении предлагается антитело, которое содержит, по меньшей мере, 1, 2, 3, 4 или 5 CDR мышиного антитела RX1, из которых, по меньшей мере, 1, 2, 3, 4 или 5 CDR могут иметь консенсусные последовательности, описанные на фигуре 8A-B. В следующем родственном воплощении в вышеуказанном антителе один или несколько остатков консенсусных CDR заменены на соответствующие остатки любого CDR мышиных антител RX1, 5H4, MC1 или MC3. Желательное сродство связывания антитела может сохраняться даже после мутации одной или нескольких аминокислот, например, в результате консервативных замен в CDR, и/или консервативных или неконсервативных изменений остатков низкого и среднего риска.
В другом воплощении данное изобретение предлагает варианты вышеуказанного антитела, содержащие вариабельную аминокислотную последовательность тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, приведенной на ах 1A, 2, 3 или 4. В родственном воплощении антитело содержит вариабельную аминокислотную последовательность легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, приведенной на фигурах 1A, 2, 3 или 4.
В следующем воплощении антитело содержит константный участок и один или несколько вариабельных каркасных участков тяжелой и легкой цепи последовательности человеческого антитела. В родственном воплощении антитело содержит модифицированный или не модифицированный константный участок человеческого IgG1, IgG2, IgG3 или IgG4. В предпочтительном воплощении константный участок представляет собой последовательность человеческого IgG1 или IgG4, которая может быть необязательно модифицирована с целью усиления или ослабления некоторых свойств. В случае IgG1 модификации константного участка, в особенности шарнирного участка или участка CH2, могут усиливать или ослаблять эффекторную функцию, в том числе, активность ADCC и/или CDC. В других воплощениях константный участок IgG2 модифицируют с целью увеличения образования агрегата антитело-антиген. В случае IgG4 модификации константного участка, в особенности шарнирного участка, могут уменьшить образование половинных антител.
В одном воплощении данное изобретение предлагает немышиное моноклональное антитело, которое специфически связывается с тем же эпитопом M-CSF, что и любое из мышиных антител RX1, 5H4, MC1 или MC3, описанных в международной публикации № WO 2005/068503, или конкурирует с любым из вышеуказанных мышиных антител за связывание с M-CSF более чем на 10%, предпочтительно, более чем на 25%, более предпочтительно, более чем на 50%, еще более предпочтительно, более чем на 75%, и наиболее предпочтительно, более чем на 90%. Антитела, полученные из последовательностей таких мышиных антител, в том числе химерные, человеческие, гуманизированные, человеческие рекомбинантные антитела, или их фрагменты, мутеины или версии, полученные путем химической дериватизации, описаны в WO 2005/068503.
Термин "RX1-производное антитело" включает в себя любое из нижеследующих антител:
1) аминокислотные варианты мышиного антитела RX1, имеющего аминокислотную последовательность, приведенную на фигуре 1, в том числе варианты, содержащие аминокислотную последовательность вариабельного участка тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, приведенной на фигуре 1, и/или содержащие аминокислотную последовательность вариабельного участка легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, приведенной на фигуре 1, с учетом аминокислот, считающихся подобными при определении гомологии;
2) M-CSF-связывающие полипептиды (за исключением мышиного антитела RX1), которые содержат один или несколько гипервариабельных участков (CDR) мышиного антитела RX1, имеющего аминокислотную последовательность, приведенную на фигуре 1, предпочтительно, включающие, по меньшей мере, CDR3 тяжелой цепи RX1, и, предпочтительно, включающие два или более, три или более, четыре или более, пять или более, или все шесть CDR;
3) Антитела Human EngineeredTM, содержащие аминокислотные последовательности тяжелой и легкой цепей, приведенные на фигурах 9B-12B, или их варианты, содержащие аминокислотные последовательности тяжелой или легкой цепей, по меньшей мере, на 60% идентичные аминокислотным последовательностям тяжелой или легкой цепей исходного Human EngineeredTM, приведенным на фигурах 9B-12B, более предпочтительно, идентичность аминокислотных последовательностей составляет, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 90%, и наиболее предпочтительно, по меньшей мере, 95%, в том числе, например, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и 100%;
4) M-CSF-связывающие полипептиды (за исключением мышиного антитела RX1), содержащие остатки высокого риска одного или нескольких CDR антитела Human EngineeredTM, последовательность которого приведена на фигурах 9B-12B, предпочтительно, они содержат остатки высокого риска двух или более, трех или более, четырех или более, пяти или более, или всех шести CDR;
5) Антитела или варианты Human EngineeredTM, сохраняющие аминокислотные остатки высокого риска, показанные на фигуре 1B, и содержащие одно или несколько изменений в остатках низкого или среднего риска, показанных на фигуре 1B;
например, содержащие одно или несколько изменений в остатках низкого риска и консервативные замены остатков среднего риска, показанных на фигуре 1B, или
например, сохраняющие аминокислотные остатки среднего и высокого риска, показанные на фигуре 1B, и содержащие одно или несколько изменений в остатках низкого риска,
где изменения включают в себя инсерции, делеции или замены, и могут представлять собой консервативные замены, или они могут увеличивать сходство последовательности рекомбинантного антитела с последовательностью человеческой легкой или тяжелой цепи, с последовательностью человеческой зародышевой легкой или тяжелой цепи, с консенсусной последовательностью человеческой легкой или тяжелой цепи, или с консенсусной последовательностью человеческой зародышевой легкой или тяжелой цепи;
которые сохраняют способность связывать M-CSF. Такие антитела предпочтительно связывают M-CSF со сродством, составляющим, по меньшей мере, 10-7, 10-8, 10-9 или выше, и предпочтительно нейтрализуют остеокластогенез, индуцирующий активность M-CSF.
Подобным образом, термин "MC3-производное антитело" включает в себя любое из нижеследующих антител:
1) аминокислотные варианты мышиного антитела MC3, имеющего аминокислотную последовательность, приведенную на фигуре 4, в том числе варианты, содержащие аминокислотную последовательность вариабельного участка тяжелой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, приведенной на фигуре 4, и/или содержащие аминокислотную последовательность вариабельного участка легкой цепи, которая, по меньшей мере, на 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% гомологична аминокислотной последовательности, приведенной на фигуре 4, с учетом аминокислот, считающихся подобными при определении гомологии;
2) M-CSF-связывающие полипептиды (необязательно включающие в себя или исключающие мышиное антитело MC3), которые содержат один или несколько гипервариабельных участков (CDR) мышиного антитела MC3, имеющего аминокислотную последовательность, приведенную на фигуре 4, предпочтительно, которые содержат, по меньшей мере, CDR3 тяжелой цепи RX1, и, предпочтительно, которые содержат два или более, три или более, четыре или более, пять или более, или все шесть CDR;
3) Антитела Human EngineeredTM, полученные путем изменения мышиной последовательности в соответствии со способами, описанными в Studnicka et al., патент США № 5766886, и в примере 4A данного описания, с использованием нумерации Kabat, приведенной на фигурах 13C-13E, с целью идентификации остатков низкого, среднего и высокого риска; такие антитела содержат, по меньшей мере, одну из нижеследующих тяжелых цепей и, по меньшей мере, одну из нижеследующих легких цепей: (a) тяжелую цепь, в которой все остатки низкого риска заменены, при необходимости, на остатки стандартной последовательности человеческого иммуноглобулина, или (b) тяжелую цепь, в которой все остатки низкого и среднего риска заменены, при необходимости, на остатки стандартной последовательности человеческого иммуноглобулина, (c) легкую цепь, в которой все остатки низкого риска заменены, при необходимости, на остатки стандартной последовательности человеческого иммуноглобулина, или (b) легкую цепь, в которой все остатки низкого и среднего риска заменены, при необходимости, на остатки стандартной последовательности человеческого иммуноглобулина;
4) варианты антитела, описанного в предыдущем параграфе (3), содержащие тяжелую или легкую цепи, аминокислотные последовательности которых, по меньшей мере, на 60% идентичны аминокислотным последовательностям тяжелой или легкой цепей исходного Human EngineeredTM, более предпочтительно, идентичность аминокислотных последовательностей составляет, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 85%, более предпочтительно, по меньшей мере, 90%, и, наиболее предпочтительно, по меньшей мере, 95%, в том числе, например, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и 100%;
5) M-CSF-связывающие полипептиды (необязательно включающие в себя или исключающие мышиное антитело MC3), содержащие остатки высокого риска одного или нескольких CDR мышиного антитела MC3, последовательность которого приведена на фигуре 4, и предпочтительно содержащие остатки высокого риска двух или более, трех или более, четырех или более, пяти или более или всех шести CDR;
6) Антитела или варианты Human EngineeredTM, сохраняющие аминокислотные остатки мышиного антитела MC3 высокого риска и содержащие одно или несколько изменений в остатках низкого или среднего риска;
например, содержащие одно или несколько изменений в остатках низкого риска и консервативные замены остатков среднего риска, или
например, сохраняющие аминокислотные остатки среднего и высокого риска, и содержащие одно или несколько изменений в остатках низкого риска,
где изменения включают в себя инсерции, делеции или замены, и могут представлять собой консервативные замены, или они могут увеличивать сходство последовательности рекомбинантного антитела с последовательностью человеческой легкой или тяжелой цепи, с последовательностью человеческой зародышевой легкой или тяжелой цепи, с консенсусной последовательностью человеческой легкой или тяжелой цепи, или с консенсусной последовательностью человеческой зародышевой легкой или тяжелой цепи;
которые сохраняют способность связывать M-CSF. Такие антитела предпочтительно связывают M-CSF со сродством, составляющим, по меньшей мере, 10-7, 10-8, 10-9 или выше, и предпочтительно нейтрализуют остеокластогенез, индуцирующий активность M-CSF.
Термины "5H4-производное антитело" или "MC1-производное антитело" имеют определения, аналогичные приведенным выше.
Как подробно описано в данном документе, RX1, 5H4, MC1 или MC3-производные антитела, в том числе антитела или варианты Human EngineeredTM, могут относиться к разным изотипам, таким как IgG, IgA, IgM или IgE. Антитела класса IgG могут содержать другой константный участок, например, антитело IgG2 можно модифицировать так, чтобы оно содержало константный участок IgG1 или IgG4. В предпочтительных воплощениях данное изобретение предлагает антитела или варианты Human EngineeredTM, содержащие модифицированный или немодифицированный константный участок IgG1 или IgG4. В случае IgG1 модификации константного участка, особенно, шарнирного участка или участка CH2, могут увеличивать или уменьшать эффекторную функцию, в том числе вктивность ADCC и/или CDC. В других воплощениях константный участок IgG2 модифицируют так, чтобы уменьшить образование агрегата антитело-антиген. В случае IgG4 модификации константного участка, в особенности шарнирного участка, могут уменьшить образование половинного антитела. В конкретных иллюстративных воплощениях предлагается изменение шарнирной последовательности IgG4 Cys-Pro-Ser-Cys на шарнирную последовательность IgG1 Cys-Pro-Pro-Cys.
В соответствии с настоящим изобретением можно вводить фармацевтическую композицию, содержащую один из вышеуказанных антагонистов M-CSF или антител против M-CSF и фармацевтически приемлемый носитель, наполнитель или разбавитель.
Смешивание двух или более антагонистов M-CSF, или совместное введение антагониста M-CSF и второго противоостеокластного средства дает дополнительное преимущество, обеспечивая повышенную эффективность средств данного изобретения против остеолитических заболеваний, включающих в себя раковый метастаз и/или разрежение костей, связанное с раковым метастазом.
В иллюстративных воплощениях данного изобретения предлагаются вышеуказанные способы, в которых второе противоостеокластное средство представляет собой бисфосфонат. В другом воплощении бисфосфонат представляет собой золедронат, памидронат, клондронат, этидронат, тилудронат, адендронат, ибандронат или ризедронат. Примеры других противоостеокластных средств включают в себя бисфосфонаты, PTHrP-нейтрализующие средства (такие как антитело, антисмысловая последовательность, siРНК), ингибиторы катепсина K, антагонисты MIP-1-α, RANK/RANKL-нейтрализующие средства (такие как антитело против RANK, антитело против RANKL, антисмысловая последовательность, растворимый рецептор RANKL или их мутеины), вакцину RANKL, остеопротегрин (OPG), тромбоцитарные факторы роста (PDGF), ингибиторы src-киназы, мальтолат галлия и ингибиторы матриксной металлопротеиназы (MMP).
Терапевтические способы настоящего изобретения также можно использовать в сочетании с третьим терапевтическим средством, таким как противораковое химиотерапевтическое средство, или в сочетании с лучевой терапией или хирургией. Противораковые химиотерапевтические средства включают в себя, без ограничения, алкилирующие средства, такие как карбоплатин и цисплатин; алкилирующие средства на основе азотистого иприта; алкилирующие средства на основе нитрозомочевины, такие как кармустин (BCNU); антиметаболиты, такие как метотрексат; антиметаболиты на основе аналогов пурина, такие как меркаптопурин; антиметаболиты на основе аналогов пиримидина, такие как фторурацил (5-FU) и гемцитабин; гормональные противоопухолевые средства, такие как госерелин, лейпролид и тамоксифен; натуральные противоопухолевые средства, такие как альдеслейкин, интерлейкин-2, доцетаксел, этопозид (VP-16), интерферон-альфа, паклитаксел и третиноин (ATRA); антибиотические натуральные противоопухолевые средства, такие как блеомицин, дактиномицин, даунорубицин, доксорубицин и митомицин; а также натуральные противоопухолевые средства на основе алкалоидов барвинка, такие как винбластин, винкристин, виндесин; гидроксимочевина; ацеглатон, адриамицин, ифосфамид, эноцитабин, эпитиостанол, акларубицин, анцитабин, нимустин, гидрохлорид прокарбазина, карбоквон, карбоплатин, кармофур, хромомицин A3, противоопухолевые полисахариды, противоопухолевые тромбоцитарные факторы, циклофосфамид, шизофиллан, цитарабин, дакарбазин, тиоинозин, тиотепа, тегафур, неокарзиностатин, OK-432, блеомицин, фуртулон, броксуридин, бусульфан, хонван, пепломицин, бестатин (убенимекс), интерферон-β, мепитиостан, митобронитол, мерфалан, ламининовые пептиды, лентинан, экстракт Coriolus versicolor, тегафур/урацил, эстрамустин (эстроген/мехлоретамин).
Другие средства, используемые в качестве дополнительной терапии для лечения раковых больных, включают в себя EPO, G-CSF, ганцикловир; антибиотики, лейпролид; меперидин; зидовудин (AZT); интерлейкины 1-18, в том числе их мутантные формы и аналоги; интерфероны или цитокины, такие как интерфероны α, β и γ; гормоны, такие как фактор, высвобождающий лютеинизирующий гормон (LHRH), и его аналоги, и гормон, высвобождающий гонадотропин (GnRH); факторы роста, такие как трансформирующий фактор роста-β (TGF-β), фактор роста фибробластов (FGF), фактор роста нервов (NGF), фактор, высвобождающий гормон роста (GHRF), эпидермальный фактор роста (EGF), фактор, гомологичный фактору роста фибробластов (FGFHF), фактор роста гепатоцитов (HGF) и инсулиновый фактор роста (IGF); факторы некроза опухоли-α и β (TNF-α и β); фактор, ингибирующий инвазию-2 (IIF-2); костные морфогенетические белки 1-7 (BMP 1-7); соматостатин; тимозин-α-1; γ-глобулин; супероксиддисмутаза (SOD); факторы комплемента; противоангиогенные факторы; антигенные вещества; пролекарства; ингибиторы киназы-рецептора фактора роста; антитело против Her2; и VEGF-нейтрализующее антитело.
По окончании переходного периода количество антагониста M-CSF или количество второго противоостеокластного средства, необходимое для достижения терапевтического эффекта, может уменьшиться. Так, после данного периода времени антагонист M-CSF может увеличивать эффективность второго противоостеокластного средства или уменьшать побочные эффекты, связанные с введением второго противоостеокластного средства, или повышать безопасность второго противоостеокластного средства. Антагонист M-CSF также может увеличивать эффективность, уменьшать побочные эффекты или повышать безопасность третьего терапевтического средства, такого как противораковое химиотерапевтическое средство, другое дополнительное терапевтическое средство, хирургия или лучевая терапия. В другом воплощении данного изобретения предлагается упаковка, флакон или контейнер, содержащий лекарственное средство, в состав которого входит антагонист M-CSF и инструкции, указывающие, что данное лекарственное средство следует принимать в сочетании со вторым и/или третьим терапевтическим средством и/или с хирургией или лучевой терапией.
С помощью способов настоящего изобретения можно лечить широкий ряд остеолитических нарушений. В данном описании термин "остеолитическое нарушение" относится к любому состоянию, возникающему в результате повышенной активности остеокластов. Риск остеолитического нарушения может иметь субъект, предрасположенный к развитию остеолитического нарушения или субъект, страдающий от заболевания, которе вызывает или вносит вклад в увеличение активности остеокластов. В иллюстративных воплощениях данного изобретения остеолитическое нарушение может представлять собой метаболическое заболевание кости, связанное с относительно высокой активностью остеокластов, которое включает в себя эндокринопатию (гиперкортизолизм, гипогонадизм, первичный или вторичный гиперпаратиреоз, гипертиреоз), гиперкальцемию, дефицитное состояние (рахит/остеомаляция, цинга, недостаточное питание), хроническое заболевание (синдромы мальабсорбции, хроническая почечная недостаточность (нефрогенная остеодистрофия), хроническое заболевание печени (гепатогенная остеодистрофия)), заболевание, связанное с введением лекарственных средств (таких как глюкокортикоиды (индуцированный глюкокортикоидом остеопороз), гепарин, спирт), или наследственное заболевание (несовершенный остеогенез, гомоцистинурия), рак, остеопороз, остеопетроз, воспаление кости, связанное с артритом и ревматоидным артритом, периодонтальная болезнь, фиброзная дисплазия и/или болезнь Педжета.
В других иллюстративных воплощениях остеолитическое нарушение может представлять собой раковый метастаз в кости, где метастатический рак представляет собой рак молочной железы, рак легкого, рак почек, множественную миелому, рак щитовидной железы, рак простаты, аденокарциному, злокачественное заболевание клеток крови, включающее в себя лейкоз и лимфому; рак головы и шеи; рак желудочно-кишечного тракта, включающий в себя рак пищевода, рак желудка, рак толстой кишки, рак тонкого кишечника, рак ободочной и прямой кишки, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчного протока или рак желчного пузыря; злокачественное заболевание женских половых органов, включающее в себя карциному яичника, рак эндометрия, рак влагалища или рак шейки матки; рак мочевого пузыря; рак мозга, в том числе, нейробластома, саркома, остеосаркома; или рак кожи, в том числе злокачественная меланома или рак сквамозных клеток.
В иллюстративных воплощениях данного изобретения с помощью любого из вышеуказанных способов можно предотвращать или уменьшать разрежение костей, или предотвращать или уменьшать метастазирование в кость или тяжесть разрежения костей, связанного с заболеванием.
Антитело против M-CSF в соответствии с настоящим изобретением вводят в дозе, составляющей приблизительно от 2 мкг/кг до 30 мг/кг, от 0,1 мг/кг до 30 мг/кг или от 0,1 мг/кг до 10 мг/кг массы тела.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1A показана аминокислотная последовательность M-CSF-специфичного мышиного антитела RX1 (SEQ ID NO: 2 и 4) (кодируемого вставкой кДНК в плазмиде, находящейся на хранении в американской коллекции типовых культур, Manassas, VA, USA, под номером депозита ATCC PTA-6113) и соответствующая нуклеотидная последовательность (SEQ ID NO: 1 и 3). Участки CDR пронумерованы и выделены жирным шрифтом.
На фигурах 1B и 1C показаны аминокислотные последовательности легкой (SEQ ID NO: 5) и тяжелой цепей (SEQ ID NO: 6) M-CSF-специфичного мышиного антитела RX1, соответственно, в которых остатки высокого риска (жирный шрифт), среднего риска (подчеркивание) и низкого риска идентифицированы по способу Studnicka et al., WO93/11794.
На фигурах 2, 3 и 4 показаны аминокислотные последовательности MCSF-специфичных мышиных антител 5H4 (SEQ ID NO: 10 и 11), MC1 (SEQ ID NO: 12 и 13) (полученных с использованием гибридомы, находящейся на хранении в ATCC под номером депозита PTA-6263) и MC3 (SEQ ID NO: 14 и 15) (полученных с использованием гибридомы, находящейся на хранении в ATCC под номером депозита PTA-45264), соответственно.
На фигуре 5 показана аминокислотная последовательность M-CSFα (SEQ ID NO: 7).
На фигуре 6 показана аминокислотная последовательность M-CSFβ (SEQ ID NO: 8).
На фигуре 7 показана аминокислотная последовательность M-CSFγ (SEQ ID NO: 9). Наличие полиморфизмов в молекуле ДНК может приводить к различиям в аминокислотном составе. Например, обычный полиморфизм обеспечивает присутствие в положении 104 Ala с большей вероятностью, чем Pro.
На фигурах 8A и B показан сравнительный анализ аминокислотных последовательностей участков CDR тяжелых и легких цепей человеческих M-CSF-специфичных мышиных антител RX1; 5H4; MC1 и MC3 (SEQ ID NO: 16-38).
На фигуре 9A показаны (a) линия риска для тяжелой цепи мышиного RX1 (H = высокий риск, M = средний риск, L = низкий риск), (b) аминокислотная последовательность тяжелой цепи RX1 {SEQ ID NO: 6), (c) аминокислотная последовательность человеческой консенсусной последовательности, консенсус Кабат Vh2, наиболее точно соответствующей RX1 (SEQ ID NO: 39), и (d) изменения, которые необходимо осуществить для получения двух типичных последовательностей Human EngineeredTM (SEQ ID NO: 41 и 43).
На фигуре 9B показаны аминокислотные последовательности двух типичных тяжелых цепей Human EngineeredTM (SEQ ID NO: 41 и 43), обозначенные "низкий риск" и "низкий+средний риск", а также соответствующие нуклеотидные последовательности (SEQ ID NO: 40 и 42).
На фигуре 10A показаны (a) линия риска для легкой цепи мышиного RX1 (H = высокий риск, M = средний риск, L = низкий риск), (b) аминокислотная последовательность легкой цепи RX1 {SEQ ID NO: 5), (c) аминокислотная последовательность человеческой консенсусной последовательности, консенсус Кабат Vk3, наиболее точно соответствующей RX1 (SEQ ID NO: 49), и (d) изменения, которые необходимо осуществить для получения двух типичных последовательностей Human EngineeredTM (SEQ ID NO: 45 и 47).
На фигуре 10B показаны аминокислотные последовательности двух типичных легких цепей Human EngineeredTM (SEQ ID NO: 45 и 47), обозначенные "низкий риск" и "низкий+средний риск", а также соответствующие нуклеотидные последовательности (SEQ ID NO: 44 и 46).
На фигуре 11A показаны (a) линия риска для легкой цепи мышиного RX1 (H = высокий риск, M = средний риск, L = низкий риск), (b) аминокислотная последовательность легкой цепи RX1 {SEQ ID NO: 5), (c) аминокислотная последовательность человеческой консенсусной последовательности, консенсус Кабат Vk3, наиболее точно соответствующей RX1 (SEQ ID NO: 49), и (d) альтернативная типичная аминокислотная последовательность, в которой положения 54-56 не изменены (т.е. остались остатки мышиной последовательности) (SEQ ID NO: 48).
На фигуре 11B показаны альтернативные аминокислотные последовательности двух типичных легких цепей Human EngineeredTM (SEQ ID NO: 48, 87), а также соответствующие нуклеотидные последовательности (SEQ ID NO: 88 и 86).
На фигуре 12A показаны (a) линия риска для легкой цепи мышиного RX1 (H = высокий риск, M = средний риск, L = низкий риск), (b) аминокислотная последовательность легкой цепи RX1 {SEQ ID NO: 5), (c) аминокислотная последовательность человеческой зародышевой консенсусной последовательности, Vk6, подгруппа 2-1-(1) А14, наиболее точно соответствующей RX1 (SEQ ID NO: 50), и (d) изменения, которые необходимо осуществить для получения двух типичных последовательностей Human EngineeredTM (SEQ ID NO: 51 и 53).
На фигуре 12B показаны аминокислотные последовательности двух типичных легких цепей Human EngineeredTM (SEQ ID NO: 51 и 53), обозначенные "низкий риск" и "низкий+средний риск", а также соответствующая нуклеотидная последовательность (SEQ ID NO: 52).
На фигурах 13A и 24B показан сравнительный анализ аминокислотной последовательности тяжелой цепи мышиного RX1 (SEQ ID NO: 54) и различных человеческих консенсусных и человеческих зародышевых консенсусных последовательностей с использованием системы нумерации Кабат (номера аминокислот указаны в строке, озаглавленной "POS") (SEQ ID NO: 55-83).
На фигурах 13C-13E показана нумерация аминокислотных остатков антител 5H4, MC1 и MC3 по системе Кабат (SEQ ID NO: 10 и 11 ; SEQ ID NO: 12 и 13; SEQ ID NO: 14 и 15, соответственно).
На фигуре 14 показано анти-резорбтивное действие Zometa на животной модели.
На фигуре 15 показан для каждой группы процент животных, у которых обнаружен остеолиз.
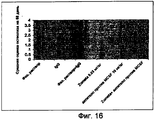
На фигуре 16 показаны средние оценки остеолиза на основе анализа рентгеновского снимка, полученного в последний день исследования.
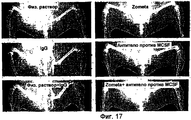
На фигуре 17 показаны типичные рентгеновские снимки Faxitron большеберцовой кости (участка инокуляции опухоли), полученные в последний день исследования. Участки остеолиза указаны стрелками.
На фигуре 18 показано влияние RX1 на активность остеокластов.
На фигуре 19 показано ингибирование активности остеокластов под действием Zometa.
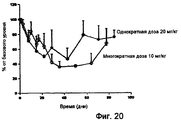
На фигуре 20 показаны результаты фармакокинетического исследования действия RX1 у приматов.
На фигуре 21 показаны результаты фармакокинетического исследования действия RX1 у приматов.
ПОДРОБНОЕ ОПИСАНИЕ
Обнаружено, что колониестимулирующий фактор (CSF-1), также известный как макрофагальный колониестимулирующий фактор (M-CSF), играет ключевую роль в формировании остеокластов. Кроме того, показано, что M-CSF модулирует остеокластные функции зрелых остеокластов, их миграцию и выживание в кооперации с другими растворимыми факторами и межклеточными взаимодействиями остеобластов и фибробластов (Fixe and Praloran, Cytokine 10: 3-7, 1998; Martin et al., Critical Rev. in Eukaryotic Gene Expression 8: 107-23 (1998)).
Полноразмерная человеческая мРНК M-CSF кодирует белок-предшественник, состоящий из 554 аминокислот. В результате альтернативного сплайсинга мРНК и разного посттрансляционного протеолитического процессинга M-CSF может либо секретироваться в кровоток в виде гликопротеина или хондроитинсульфат-содержащего протеогликана, либо экспрессироваться в виде мембраносвязанного гликопротеина на поверхности клеток, продуцирующих M-CSF. Трехмерная структура экспрессированных в бактериях 150 аминоконцевых аминокислот человеческого M-CSF, минимальной последовательности, необходимой для проявления полноценной биологической активности in vitro, указывает на то, что данный белок представляет собой соединенный дисульфидными связями димер, каждый мономер которого состоит из четырех альфа-спиральных доменов и анти-параллельной бета-складчатой структуры (Pandit et al., Science 258: 1358-62 (1992)). В результате альтернативного сплайсинга мРНК образуется три разных вида M-CSF. Три полипептидных предшественника включают в себя M-CSFα из 256 аминокислот, M-CSFβ из 554 аминокислот и M-CSFγ из 438 аминокислот. M-CSFβ представляет собой секретируемый белок, который не встречается в мембраносвязанной форме. M-CSFα экспрессируется в виде интегрального мембранного белка, который медленно высвобождается в результате протеолитического расщепления. M-CSFα расщепляется по аминокислотам 191-197 последовательности, приведенной на фигуре 5. Мембрано-связанная форма M-CSF может взаимодействовать с рецепторами на соседних клетках и таким образом опосредовать специфические межклеточные контакты. Термин "M-CSF" также может включать в себя аминокислоты 36-438 последовательности, приведенной на фигуре 7.
Разные формы M-CSF функционируют путем связывания с их рецептором M-CSFR на клетках-мишенях. M-CSFR представляет собой мембраносвязанную молекулу с пятью внеклеточными иммуноглобулин-подобными доменами, трансмембранным доменом и внутриклеточным прерывистым Src-родственным тирозинкиназным доменом. M-CSFR кодируется протоонкогеном c-fms. После связывания M-CSF с внеклеточным доменом M-CSFR происходит димеризация рецептора с последующей активацией цитоплазматического киназного домена, которая приводит к аутофосфорилированию и фосфорилированию других клеточных белков (Hamilton J. A., J Leukoc Biol., 62(2):145-55, 1997; Hamilton J, A., Immuno Today., 18(7): 313-7, 1997).
Фосфорилированные клеточные белки индуцируют каскад биохимических событий, составляющих клеточные ответы, такие как митоз, секреция цитокинов, активные перемещения в мембране клетки и регуляция транскрипции их собственного рецептора (Fixe and Praloran, Cytokine 10: 32-37, 1998).
Термин "опухоль" в данном описании относится к любым неопластическим клеточным росту и пролиферации, злокачественным или доброкачественным, и включает в себя все предраковые и раковые клетки и ткани.
Термины "рак" и "раковый" относятся к физиологическому состоянию или описывают физиологическое состояние млекопитающих, характеризующееся нерегулируемым клеточным ростом. Примеры рака включают в себя, без ограничения, карциному, лимфому, бластому, саркому и лейкоз. Более конкретно, примеры таких раковых заболеваний включают в себя рак молочной железы, рак простаты, рак ободочной кишки, плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак ободочной и прямой кишки, карциному эндометрия, карциному слюнных желез; рак почки, рак печени, рак наружных женских половых органов, рак щитовидной железы, карциному печени и разные типы рака головы и шеи.
"Лечение" представляет собой вмешательство, производимое с целью предотвратить развитие или изменить патологию нарушения. Соответственно, термин "лечение" относится как к терапевтическому лечению, так и к профилактическим или предупредительным мерам. Субъекты, нуждающиеся в лечении, включают в себя тех, кто уже имеет нарушение, а также тех, у кого развитие нарушения нужно предотвратить. При лечении опухоли (например, рака) терапевтическое средство может непосредственно уменьшить патологию опухолевых клеток или повысить чувствительность опухолевых клеток к лечению другими терапевтическими средствами, такими как облучение и/или химиотерапия. "Патология" рака включает в себя все процессы, угрожающие здоровью пациента. Данный термин включает в себя, без ограничения, аномальный или неконтролируемый клеточный рост, метастазирование, препятствование нормальному функционированию соседних клеток, высвобождение цитокинов или других секреторных продуктов на аномальном уровне, подавление или ухудшение воспалительного или иммунологического ответа, и др.
Термин "млекопитающее" в применении к лечению относится к любым животным, классифицируемым как млекопитающие, в том числе, к людям, домашним и сельскохозяйственным животным, а также к диким животным, спортивным животным или к домашним животным, таким как собаки, лошади, кошки, коровы и др. Предпочтительно, млекопитающее представляет собой человека.
В данном описании фраза "метастатический рак" относится к раковым заболеваниям, которые могут распространяться в другие участки организма, в частности в кости. Разные раковые заболеваниия могут метастазировать в кости, однако наиболее распространенными метастазирующими раковыми заболеваниями являются рак молочной железы, рак легкого, рак почки, множественная миелома, рак щитовидной железы и рак простаты. Примеры других раковых заболеваний, которые могут метастазировать в кость, включают в себя, без ограничения, аденокарциному, злокачественные заболевания клеток крови, в том числе лейкоз и лимфому; раковые заболевания головы и шеи; раковые заболевания желудочно-кишечного тракта, включающие в себя рак пищевода, рак желудка, рак толстой кишки, рак тонкого кишечника, рак ободочной и прямой кишки, рак прямой кишки, рак поджелудочной железы, рак печени, рак желчного протока или рак желчного пузыря; злокачественные заболевания женских половых органов, включающие в себя карциному яичника, рак эндометрия, рак влагалища и рак шейки матки; рак мочевого пузыря; рак мозга, в том числе нейробластома, саркома, остеосаркома; и рак кожи, в том числе злокачественная меланома и рак сквамозных клеток. В особенности настоящее изобретение предлагает профилактику и лечение индуцированных опухолью остеолитических повреждений кости.
В данном описании фраза "терапевтически эффективное количество" относится к количеству терапевтического или профилактического антагониста M-CSF, такого как антитело против M-CSF, подходящего для использования в воплощении настоящего изобретения, которое вызывает желательный терапевтический или профилактический эффект или ответ при введении в соответствии с желательным режимом лечения.
Человеческий "M-CSF" в данном описании представляет собой человеческий полипептид, имеющий практически такую же аминокислотную последовательность, как и у зрелых человеческих полипептидов M-CSFα, M-CSFβ или M-CSFγ, описанных в Kawasaki et al., Science 230:291 (1985), Cerretti et al., Molecular Immunology, 25:761 (1988), или Ladner et al., EMBO Journal 6:2693 (1987), где каждая из указанных публикаций включена в данное описание в качестве ссылки. Такая терминология отражает понимание, что три зрелых M-CSF имеют разные аминокислотные последовательности, как описано выше, и что активная форма M-CSF представляет собой димер, соединенный дисульфидными связями; таким образом, если термин "M-CSF" относится к биологически активной форме, подразумевается димерная форма. Термин "димер M-CSF" относится к двум полипептидным мономерам M-CSF, образующим димер, и включает в себя как гомодимеры (состоящие из двух мономеров M-CSF одного типа), так и гетеродимеры (состоящие из двух разных мономеров). Мономеры M-CSF можно превратить в димеры M-CSF in vitro, как описано в патенте США № 4929700, который включен в данное описание в качестве ссылки.
1. Антагонисты
В данном описании термин "антагонист", как правило, относится к способности молекулы, соединения или другого средства, например, препятствовать связыванию одной молекулы с другой молекулой, или стимуляции одной клетки другой клеткой либо посредством стерических затруднений, конформационных изменений или других биохимических механизмов. В одном случае термин антагонист относится к способности средства предотвращать связывание рецептора с его лигандом, например, связывание M-CSF с M-CSFR, и посредством этого ингибировать путь передачи сигнала, инициируемый M-CSF. Термин антагонист не ограничивается каким-либо конкретным механизмом действия, а скорее относится, в общем, к функциональному свойству, определенному в настоящем описании. Антагонисты настоящего изобретения включают в себя, без ограничения, антитела против M-CSF, их фрагменты, мутеины и модификации, растворимый M-CSF, его фрагменты, мутеины и модификации, антитела против M-CSFR, их фрагменты, мутеины и модификации, растворимый M-CSFR, его фрагменты, мутеины и модификации, а также пептиды и другие химические соединения и молекулы, которые связываются с M-CSF или M-CSFR, и молекулы нуклеиновых кислот, такие как соединения антисмысловых РНК или РНКи, которые ингибируют экспрессию M-CSF и M-CSFR. Все антагонисты настоящего изобретения можно вводить с помощью любого известного в данной области способа. Например, мутеины M-CSF, мутеины M-CSFR или фрагменты антител, которые связываются с M-CSF или M-CSFR, можно вводить посредством генной терапии.
Антагонисты M-CSF настоящего изобретения включают в себя, где применимо, функциональные эквиваленты. Например, молекулы могут различаться по длине, структуре, компонентам и др., однако они могут сохранять при этом одну или несколько из заданных функций. Более конкретно, функциональные эквиваленты антител, фрагментов антител или пептидов настоящего изобретения могут включать в себя миметические соединения, т.е. структуры, созданные для имитации конфигурации и/или ориентации, подходящей для связывания антигена.
Предпочтительные антагонисты M-CSF могут быть необязательно модифицированы путем добавления боковых групп, и др., например, путем аминоконцевого ацилирования, карбоксиконцевого амидирования или путем присоединения дополнительных групп к боковым цепям аминокислот. Антагонисты также могут содержать одну или несколько консервативных аминокислотных замен. Под "консервативными аминокислотными заменами" подразумевают изменения в аминокислотной последовательности, которые сохраняют общий заряд, гидрофобность/гидрофильность и/или пространственную конфигурацию замещенной аминокислоты. Например, консервативными являются замены среди следующих групп: Gly/Ala, Val/Ile/Leu, Asp/Glu, Lys/Arg, Asn/Gln, Ser/Cys/Thr и Phe/Trp/Tyr. Такие модификации практически не снижают эффективность антагонистов M-CSF и могут придавать желательные свойства, такие как, например, повышенный период полужизни in vivo или пониженная токсичность.
Также подразумевается, что данное изобретение включает в себя полипептиды, несущие модификации, отличные от инсерций, делеций или замен аминокислотных остатков. Например, модификации могут быть осуществлены путем образования ковалентных связей, таких как ковалентные связи с полимерами, липидами и другими органическими и неорганическими фрагментами. Такие производные получают для увеличения периода полужизни пептида в кровотоке, или для улучшения направленной доставки полипептида к целевым клеткам, тканям или органам. Подобным образом, данное изобретение также охватывает полипептиды M-CSF или M-CSFR, ковалентно модифицированные путем присоединения одного или нескольких водорастворимых полимеров, таких как полиэтиленгликоль, полиоксиэтиленгликоль или полипропиленгликоль.
A. Антитела против M-CSF
Термин "антитело" используется в самом широком смысле и включает в себя полностью собранные антитела, моноклональные антитела, поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела), фрагменты антител, которые могут связывать антиген (например, Fab', F'(ab)2, Fv, одноцепочечные антитела, диантитело), и рекомбинантные пептиды, содержащие вышеперечисленные соединения, при условии, что они обладают желательной биологической активностью.
Термин "моноклональное антитело" в данном описании относится к антителу, полученному из практически гомогенной популяции антител, т.е. из популяции, отдельные антитела которой являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Моноклональное антитела являются высокоспецифичными и направлены против одного антигенного участка. Кроме того, в отличие от препаратов традиционных (поликлональных) антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Помимо специфичности преимущество моноклональных антител заключается в том, что их синтезируют с применением гомогенной культуры, незагрязненной другими иммуноглобулинами с разными специфичностями и характеристиками.
Определение "моноклональный" указывает на то, что антитело получено из практически гомогенной популяции антител и не подразумевает получение антитела с помощью какого-либо конкретного способа. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены с помощью гибридомного метода, впервые описанного Kohler et al., Nature, 256:495 [1975], или с помощью технологии рекомбинантных ДНК (см., например, патент США № 4816567). "Моноклональное антитела" также можно выделить из фаговых библиотек антител с помощью методов, описанных, например, в Clackson et al., Nature, 352:624-628 [1991] и Marks et al., J. Mol. Biol., 222:581-597 (1991).
В зависимости от аминокислотных последовательностей константных доменов тяжелых цепей иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов, IgA, IgD, IgE, IgG и IgM, причем некоторые из них дополнительно подразделяют на подклассы или изотипы, например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, которые соответствуют разным классам иммуноглобулинов, называют альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры и трехмерные конфигурации субъединиц иммуноглобулинов разных классов хорошо известны. Разные изотипы имеют разные эффекторные функции; например, изотипы IgG1 и IgG3 обладают активностью ADCC.
"Фрагмент антитела" представляет собой фрагмент интактного полноразмерного антитела, предпочтительно, антигенсвязывающего или вариабельного участка интактного антитела. Примеры фрагментов антитела включают в себя фрагменты Fab, Fab', F(ab')2 и Fv; диантитело; линейные антитела (Zapata et al., Protein Eng., 8(10): 1057-1062 (1995)); молекулы одноцепочечных антител; и полиспецифичные антитела, полученные из фрагментов антител. Расщепление антител под действием папаина дает два идентичных антигенсвязывающих фрагмента, называемых фрагменты "Fab", каждый из которых содержит один антигенсвязывающий участок, и остаточный фрагмент "Fc", название которого отражает его способность легко кристаллизоваться 35. Обработка пепсином дает фрагмент F(ab')2, который содержит два "одноцепочечных Fv" или "sFv" фрагмента антитела, содержащих домены VH и VL, причем указанные домены находятся в одной полипептидной цепи. Предпочтительно, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, обеспечивающий структуру Fv, необходимую для связывания антигена. Обзор по sFv можно найти в Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
Термин "гипервариабельный" участок относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельный участок содержит аминокислотные остатки участка, определяющего комплементарность, или CDR [т.е. остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) легкой цепи вариабельного домена и остатки 31-35 (H1), 50-65 (H2) и 95-102 (H3) тяжелой цепи вариабельного домена, как описано Kabat et al., Sequences of Proteins of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)] и/или остатки гипервариабельной петли (т.е. остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) легкой цепи вариабельного домена и 26-32 (H1), 53-55 (H2) и 96-101 (H3) тяжелой цепи вариабельного домена, как описано [Chothia et al., J. Mol Biol. 196: 901-917 (1987)].
Остатки "каркасного участка" или FR представляют собой остатки вариабельного домена, отличные от остатков гипервариабельного участка.
Термин "диантитело" относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, в данных фрагментах вариабельный домен тяжелой цепи (VH) соединен с вариабельным доменом легкой цепи (VL) той же полипептидной цепи (VH VL). С помощью короткого линкера, не позволяющего спариваться двум доменам одной цепи, домены вынуждают спариваться с комплементарными доменами другой цепи, получая два антигенсвязывающих участка. Диантитела более подробно описаны, например, в EP 404097; WO 93/11161; и 30 Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
В некоторых воплощениях желательно использовать полиспецифические (например, биспецифические) моноклональные антитела, в том числе, моноклональные антитела, человеческие антитела, гуманизированные антитела, антитела Human EngineeredTM или варианты антител против M-CSF, способные специфично связываться, по меньшей мере, с двумя разными эпитопами. Например, биспецифические антитела могут связываться с двумя разными эпитопами M-CSF. Альтернативно, фрагмент, специфичный к M-CSF, можно объединить с фрагментом, который связывается с инициирующей молекулой на лейкоците, такой как молекула T-клеточного рецептора (например, CD2 или CD3) или Fc-рецепторы IgG (FcγR), такие как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), чтобы сфокусировать клеточные защитные механизмы на M-CSF-экспрессирующих клетках. Биспецифические антитела можно использовать для локализации цитотоксических средств в клетках, экспрессирующих M-CSF. Данные антитела содержат фрагмент, связывающий M-CSF, и фрагмент, связывающий цитотоксическое средство (например, сапорин, антиинтерферон-60, алкалоид барвинка, A-цепь рицина, метотрексат или гаптен, меченный радиоактивным изотопом). Биспецифические антитела можно получить в виде полноразмерных антител или фрагментов антитела (например, биспецифические антитела F(ab').sub.2).
В соответствии с другим способом получения биспецифических антител, участки контакта пары молекул антител можно сконструировать с помощью рекомбинантных методов так, чтобы максимизировать процент гетеродимеров, извлекаемых из рекомбинантной клеточной культуры. Предпочтительный участок контакта содержит, по меньшей мере, часть домена CH3 константного фрагмента антитела. В данном способе одну или несколько аминокислот с маленькими боковыми цепями из участка контакта первой молекулы антитела заменяют аминокислотами с более крупными боковыми цепями (такими как тирозин или триптофан). Компенсаторные "полости", размер которых идентичен или подобен размеру крупных боковых цепей, создают на поверхности контакта второй молекулы антитела путем замены аминокислот с большими боковыми цепями на аминокислоты с маленькими боковыми цепями (такими как аланин или треонин). Данный механизм позволяет получать гетеродимер с более высоким выходом, чем нежелательные конечные продукты, такие как гомодимеры. См. WO96/27011, опубликованный 6 сентября 1996.
Биспецифические антитела включают в себя поперечно-связанные или "гетероконъюгированные" антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое - с биотином. Гетероконъюгированные антитела можно получить с помощью традиционных способов поперечной сшивки. Подходящие средства, вызывающие образование поперечных связей, хорошо известны в данной области, они раскрыты в патенте США № 4676980, наряду с рядом способов поперечной сшивки.
Способы получения биспецифичных антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела можно получить путем образования химической связи. Brennan et al., Science 229:81 (1985) описывают способ, в котором интактные антитела подвергают протеолитическому расщеплению с получением фрагментов F(ab')2. Данные фрагменты восстанавливают в присутствии дитиол-комплексообразующего реагента арсенита натрия, чтобы стабилизировать соседние дитиолы и предотвратить образование межмолекулярных дисульфидных связей. Затем полученные фрагменты Fab' превращают в производные тионитробензоата (TNB). Затем одно из производных Fab'-TNB превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с получением биспецифического антитела. Полученные биспецифические антитела можно использовать в качестве средств для селективной иммобилизации ферментов. В следующем воплощении фрагменты Fab'-SH, непосредственно извлеченные из Е. coli, можно химически соединить in vitro с получением биспецифических антител (Shalaby et al., J. Exp. Med. 175:217-225 (1992)).
Shalaby et al., J. Exp. Med. 175:217-225 (1992) описывают продукцию молекулы полностью гуманизированного биспецифического антитела F(ab')2. Каждый фрагмент Fab', отдельно секретируемый E.coli, непосредственно подвергают реакции химического присоединения in vitro с получением биспецифического антитела. Полученное биспецифическое антитело способно связываться с клетками, в которых происходит сверхэкспрессия рецептора HER2, и с нормальными человеческими T-клетками, а также инициировать литическую активность человеческих цитотоксических лимфоцитов по отношению к мишеням - клеткам опухоли молочной железы человека.
Также описаны разные способы получения и выделения биспецифических фрагментов антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела получают с использованием лейциновых "молний" (Kostelny et al., J. Immunol. 148(5):1547-1553 (1992)). Пептиды лейциновых молний из белков Fos и Jun соединяют с фрагментами Fab' двух разных антител путем гибридизации генов. Гомодимерные антитела восстанавливают по шарнирному участку с получением мономеров и затем снова окисляют с получением гетеродимерных антител. Данный способ также можно использовать для получения гомодимерных антител. Технология "диантитела", описанная Hollinger et al., Proc. Natl. Acad. Sci. USA 90:6444-6448 (1993), представляет собой альтернативный механизм получения биспецифических фрагментов антител.
Фрагменты содержат вариабельный участок тяжелой цепи (VH), соединенный с вариабельным участком легкой цепи (VL) через линкер, длина которого слишком мала для того, чтобы обеспечить спаривание двух доменов одной цепи. Соответственно, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, образуя в результате два антигенсвязывающих участка. Также описана другая стратегия получения биспецифических фрагментов антител путем использования димеров одноцепочечных антител Fv (sFv). См. Gruber et al., J. Immunol. 152: 5368 (1994).
Альтернативно биспецифическое антитело может представлять собой "линейное антитело", полученное по способу, описанному Zapata et al. Protein Eng. 8(10):1057-1062 (1995). Коротко говоря, указанные антитела включают в себя пару последовательно расположенных сегментов Fd (VH-CH1-VH-CH1), которые образуют пару антигенсвязывающих участков. Линейные антитела могут быть биспецифическими или моноспецифическими.
В объем данного изобретения также входят антитела, валентность которых выше двух. Например, можно получить триспецифические антитела (Tutt et al., J. Immunol. 147:60 (1991)).
В некоторых воплощениях моноклональное антитело, человеческое антитело, гуманизированное антитело, антитело Human EngineeredTM или вариантное антитело против M-CSF представляет собой фрагмент антитела, такого как RX1, 5H4, MC1 или MC3. Для получения фрагментов антител разработано много способов. Обычно данные фрагменты получают путем протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science 229:81 (1'985)). Однако в настоящее время существуют способы, позволяющие непосредственно осуществлять продукцию данных фрагментов в рекомбинантных клетках-хозяевах. Better et al., Science 240: 1041-1043 (1988), описывают секрецию функциональных фрагментов антител из бактерий (см., например, Better et al., Skerra et al. Science 240: 1038-1041 (1988)). Например, фрагменты Fab'-SH можно непосредственно извлечь из E. coli и химически соединить с получением фрагментов F(ab')2 (Carter et al., Bio/Technology 10:163-167 (1992)). В другом воплощении с использованием лейциновой "молнии" GCN4 получают F(ab')2 с последующей активацией сборки молекулы F(ab')2. В соответствии с другим подходом фрагменты Fv, Fab или F(ab')2 можно выделить непосредственно из культуры рекомбинантных клеток-хозяев. Опытным специалистам известны и другие способы получения фрагментов антител.
"Выделенное" антитело представляет собой идентифицированное антитело, которое отделено от компонентов его природной среды. Нежелательными компонентами его природной среды являются вещества, которые могут препятствовать диагностическому или терапевтическому применению антитела, такие как ферменты, гормоны и другие белковые и небелковые вещества, присутствующие в растворе. В предпочтительных воплощениях антитело очищают (1) до степени, превышающей 95% по отношению к массе антитела по данным метода Лоури, наиболее предпочтительно превышающей 99% по массе, (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности путем применения секвенатора с вращающейся чашкой, или (3) до гомогенности по данным SDS-PAGE в восстанавливающих или невосстанавливающих условиях с окрашиванием Кумасси синим или, предпочтительно, серебром. Выделенное антитело включает в себя антитело in situ в рекомбинантных клетках, если, по меньшей мере, один компонент природного окружения антитела отсутствует. Однако обычно выделенное антитело получают с использованием, по меньшей мере, одной стадии очистки.
Более подробное описание структуры и способов получения антител можно найти в Roth, D.B., and Craig, N.L., Cell, 94:411-414 (1998) и патенте США № 6255458, включенных в данное описание в качестве ссылки во всей полноте. Коротко говоря, способ получения ДНК, кодирующей гены тяжелых и легких цепей иммуноглобулинов, как правило, осуществляют с использованием развивающихся B-клеток. Перед реаранжировкой и соединением разных сегментов гена иммуноглобулина генные сегменты V, D, J и константный (C) обычно находятся в относительной близости друг от друга на одной хромосоме. В процессе дифференцировки B-клеток все члены соответствующих семейств генных сегментов V, D, J (или только V и J в случае генов легкой цепи) подвергаются рекомбинации с образованием функционально реанжированных генов тяжелых и легких цепей иммуноглобулинов. Процесс реаранжировки генных сегментов является последовательным. Вначале происходит соединение D и J тяжелой цепи, затем присоединение V к DJ тяжелой цепи и соединение V и J легкой цепи.
Рекомбинация генных сегментов вариабельных участков с образованием функциональных вариабельных участков тяжелой и легкой цепи опосредуется рекомбинационными сигнальными последовательностями (RSS), которые фланкируют рекомбинационно-компетентные сегменты V, D и J. RSS, необходимые и достаточные для непосредственной рекомбинации, содержат попарно симметричный гептамер, AT-обогащенный нонамер и находящийся между ними спейсерный участок из 12 или 23 пар оснований. Данные сигналы являются консервативными для разных локусов и видов, которые несут рекомбинацию D-J (или V-J), и функционально взаимозаменяемыми. См. Oettinger, et al. (1990), Science, 248, 1517-1523, а также приведенные в указанном документе ссылки. Гептамер содержит последовательность CACAGTG или ее аналог, далее следует спейсер, имеющий неконсервативную последовательность, и затем нонамер, содержащий последовательность ACAAAAACC или ее аналог. Данные последовательности обнаружены на J или на нижних участках генных сегментов V и D. Зародышевым сегментам D и J опять же предшествуют две рекомбинационные сигнальные последовательности, первая представляет собой нонамер, затем следует гептамер, которые также разделены неконсервативной последовательностью. Гептамерные и нонамерные последовательности, которые следуют за сегментами VL, VH или D, комплементарны последовательностям, предшествующим сегментам JL, D или JH, с которыми они рекомбинируются. Длина спейсеров, находящихся между гептамерными и нонамерными последовательностями, составляет либо 12 пар оснований, либо от 22 до 24 пар оснований.
Помимо реаранжировки сегментов V, D и J дополнительное разнообразие первичного набора тяжелых и легких цепей иммуноглобулинов достигается путем вариабельной рекомбинации участков соединения сегментов V и J легкой цепи и сегментов D и J тяжелой цепи. В легкой цепи такая вариация обычно встречается в последнем кодоне генного сегмента V и в первом кодоне сегмента J. Подобное расхождение в соединении сегментов встречается в хромосоме тяжелой цепи между сегментами D и JH и может охватывать участок до 10 нуклеотидов. Кроме того, между генными сегментами D и JH, а также VH и D, можно вставить несколько нуклеотидов, которые не кодируются геномной ДНК. Добавление данных нуклеотидов известно как N-концевая вариабельность.
Суммарным результатом таких реаранжировок генных сегментов вариабельных участков и вариабельной рекомбинации, которая может происходить при соединении генных сегментов, является продукция первичного набора антител.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенраспознающий и антигенсвязывающий участок. Данный участок представляет собой димер, состоящий из одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, которые плотно прилегают друг к другу, удерживаясь с помощью нековалентных связей. В данной конфигурации три CDR каждого вариабельного домена взаимодействуют, формируя антигенсвязывающий участок на поверхности димера VH-VL. Шесть CDR совместно обеспечивают антигенсвязывающую специфичность антитела. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя и с меньшим сродством, чем полный участок связывания.
Фрагмент Fab также содержит константный домен легкой цепи и первый констаный домен (CH1) тяжелой цепи. Фрагменты Fab отличаются от фрагментов Fab' несколькими остатками, добавленными по карбоксильному концу домена CH1 тяжелой цепи, которые включают в себя один или несколько остатков цистеина шарнирного участка антитела. Fab'-SH в данном описании обозначает Fab', в котором остаток (остатки) цистеина константных доменов несут свободную тиольную группу. Фрагменты антитела F(ab')2 изначально продуцируются в виде пар фрагментов Fab', между которыми находятся остатки цистеина шарнирного участка.
Термин "нейтрализующее антитело" относится к молекуле антитела, способного устранять или значительно уменьшать эффекторную функцию антигена-мишени, с которым оно связывается. Соответственно, "нейтрализующее" антитело против мишени способно устранять или значительно уменьшать такие эффекторные функции, как ферментативная активность, связывание лиганда или внутриклеточная передача сигнала.
Композиции и способы, предлагающиеся в настоящем описании для лечения ракового метастаза и/или разрежения костей, связанного с раковым метастазом, могут включать в себя применение одного или нескольких антител отдельно или в сочетании с другими терапевтическими средствами с получением желательных эффектов. Антитела настоящего изобретения можно выделить из животного, продуцирующего антитело либо после непосредственного контакта с антигеном окружающей среды, либо после иммунизации антигеном. Альтернативно, антитела можно получить с помощью технологии рекомбинантных ДНК с использованием одной из систем экспрессии антител, хорошо известных в данной области (см., например, Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory (1988)). Такие антитела могут включать в себя рекомбинантные IgG, химерные гибридные белки, содержащие последовательности иммуноглобулинов, или антитела "Human EngineeredTM", которые можно использовать для лечения ракового метастаза и/или разрежения костей, связанного с раковым метастазом, в соответствии с настоящим изобретением. Помимо интактных полноразмерных молекул термин "антитело" также относится к их фрагментам (таким как, например, фрагменты scFv, Fv, Fd, Fab, Fab' и F(ab)'2) или мультимерам или агрегатам интактных молекул и/или фрагментам, которые связываются с M-CSF (или M-CSFR). Указанные фрагменты антител связывают антиген и могут быть дериватизированы с целью достижения структурных характеристик, которые облегчают выведение и поглощение, например, путем включения остатков галактозы.
В одном воплощении настоящего изобретения моноклональные антитела против M-CSF можно получить, по существу следуя способу, описанному в Halenbeck et al., патент США № 5491065 (1997), который включен в данное описание в качестве ссылки. Типичные моноклональные антитела против M-CSF включают в себя антитела, которые связываются с предполагаемым конформационным эпитопом, ассоциированным с рекомбинантным или нативным димерным M-CSF, с последующей нейтрализацией биологической активности. Указанные антитела практически не взаимодействуют с биологически неактивными формами M-CSF, включающими в себя мономерные и химически дериватизированные димерные M-CSF.
В других воплощениях настоящего изобретения получают моноклональное антитела против M-CSF Human EngineeredTM. Фраза "антитело Human EngineeredTM" относится к антителу, полученному из нечеловеческого антитела, обычно из мышиного моноклонального антитела. Альтернативно, антитело Human EngineeredTM может быть получено из химерного антитела, которое сохраняет, или по существу сохраняет, антигенсвязывающие свойства исходного нечеловеческого антитела, но которое обладает пониженной иммуногенностью по сравнению с исходным антителом при введении человеку. Фраза "химерное антитело" в данном описании относится к антителу, содержащему последовательности двух разных антител {см., например, патент США № 4816567), как правило, полученных от двух разных видов. Чаще всего химерные антитела содержат фрагменты человеческих и мышиных антител, обычно константные человеческие и вариабельные мышиные участки.
Фраза "участок, определяющий комплементарность", или термин "CDR", относятся к аминокислотным последовательностям, которые вместе определяют сродство связывания и специфичность природного участка Fv центра связывания нативного иммуноглобулина (см., например, Chothia et al., J. Mol. Biol. 196:901 917 (1987); Kabat et al., U.S. Dept. of Health and Human Services NIH Publication No. 91 3242 (1991)). Фраза "константный участок" относится к фрагменту молекулы антитела, который обеспечивает эффекторные функции. В настоящем изобретении мышиные константные участки предпочтительно заменяют на человеческие константные участки. Константные участки исследуемого антитела получают из человеческих иммуноглобулинов. Константный участок тяжелой цепи может относится к любому из пяти изотипов: альфа, дельта, эпсилон, гамма или мю.
Считается, что антитела настоящего изобретения являются иммуноспецифическими, или способными к специфическому связыванию, если они связывают антиген с Ka, превышающей или равной приблизительно 106M-1, предпочтительно, превышающей или равной приблизительно 107M-1, более предпочтительно, превышающей или равной приблизительно 108M-1, и, наиболее предпочтительно, превышающей или равной приблизительно 109M-1, 1010M-1, 1011M-1 или 1012M-1. Антитела против M-CSF могут связываться с разными формами M-CSF, в том числе, экспрессирующимися тканями хозяина/субъекта, а также экспрессирующимися опухолью. Раскрытые в данном описании моноклональные антитела, такие как RX1, 5H4, MC1 или MC3, имеют сродство к M-CSF и характеризуются равновесной константой диссоциации (Kd), которая составляет, по меньшей мере, 10-4 M, предпочтительно, по меньшей мере, приблизительно от 10-7 M до 10-8 M, более предпочтительно, по меньшей мере, приблизительно 10-8 M, 10-10 M, 10-11 M или 10-12 M. Характеристики сродства можно легко определить с помощью традиционных способов, таких как равновесный диализ с использованием прибора BIAcore 2000 и общих методов, предлагающихся производителем; радиоиммунологический анализ с использованием 125I-меченного M-CSF; или с помощью другого способа, известного специалистам в данной области. Характеристики сродства можно анализировать, например, с помощью способа, описанного Scatchard et al., Ann N.Y. Acad. Sci., 51:660 (1949). Таким образом, предпочтительные антитела против M-CSF обладают высокой специфичностью по отношению к M-CSF и связываются с другими молекулами с гораздо более низким сродством. Предпочтительные антитела связываются с M-CSF с таким же сродством, как и RX1, изображенный на фигуре 4, обладают низкой иммуногенностью и ингибируют метастазирование раковых клеток у животных моделей метастатических заболеваний. Другие типичные антитела связываются с M-CSF с таким же сродством, как и мышиные 5H4, MC1 или MC3, изображенные на фигурах 2, 3 или 4 соответственно.
Антиген, используемый для получения антител, может представлять собой, например, интактный M-CSF, или фрагмент M-CSF, который содержит требуемый эпитоп, необязательно сопряженный с другим полипептидом, который позволяет эпитопу сохранять нативную конформацию. Альтернативно, для получения антител можно использовать клетки, экспрессирующие M-CSF на поверхности. Такие клетки могут экспрессировать M-CSF в результате трансформации, или они могут представлять собой природные клетки, экспрессирующие M-CSF. Для получения антител специалисты в данной области могут использовать и другие формы M-CSF.
i. Поликлональные антитела
Генерирование поликлональных антител предпочтительно инициируют у животных путем многократного подкожного (п/к) или внутрибрюшинного (в/б) введения подходящего антигена и адъюванта. Увеличения образования антител можно достичь путем конъюгирования подходящего антигена с белком, который является иммуногенным для иммунизируемых видов, таким как гемоцианин лимфы улитки, сывороточный альбумин, бычий тиреоглобулин или соевый ингибитор трипсина, с использованием бифункционального или дериватизирующего реагента, такого как сложный эфир малеимидобензойной кислоты и сульфосукцинимида (конъюгирование осуществляют через остатки цистеина), N-гидроксисукцинимид (через остатки лизина), глутаральдегид, янтарный ангидрид или другие реагенты, известные в данной области.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных путем объединения, например, 100 мкг или 5 мкг белка или конъюгата (в случае кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и введения раствора внутрикожно в нескольких местах. Через месяц животных повторно иммунизируют, используя от 1/5 до 1/10 от исходного количества пептида или конъюгата в полном адъюванте Фрейнда путем подкожного введения в нескольких местах. Через 7-14 дней после повторной инъекции у животных берут кровь и определяют титр антител в сыворотке. Повторные иммунизации животных проводят до тех пор, пока титр антител не перестанет расти. Предпочтительно, повторную иммунизацию животного проводят конъюгатом того же антигена, полученным с использованием другого белка и/или другого сшивающего реагента. Конъюгаты также можно получить в культуре рекомбинантных клеток в виде гибридных белков. Кроме того, для усиления иммунного ответа можно использовать средства, вызывающие агрегацию, такие как алюминиевые квасцы.
ii. Моноклональные антитела
Моноклональные антитела можно получить с помощью гибридомного метода, впервые описанного Kohler et al., Nature, 256:495 (1975), или с помощью методов рекомбинантных ДНК.
В гибридомном методе мышь или другое подходящее животное-хозяин, такое как хомяк или обезьяна макака, иммунизируют, как описано в данном документе, и затем извлекают лимфоциты, которые продуцируют или способны продуцировать антитела, специфически связывающиеся с белком, используемым для иммунизации. Альтернативно, лимфоциты можно иммунизировать in vitro. Затем лимфоциты гибридизуют с клетками миеломы, используя подходящий гибридизующий реагент, такой как полиэтиленгликоль, и получают гибридомные клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные гибридомные клетки высевают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание негибридных исходных клеток миеломы. Например, если исходные миеломные клетки не содержат фермент гипоксантин-гуанин-фосфорибозил-трансферазу (HOPRT или HPRT), в состав питательной среды для гибридом обычно включают гипоксантин, аминоптерин и тимидин (среда HAT), которые препятствуют росту HGPRT-дефицитных клеток.
Предпочтительные миеломные клетки эффективно гибридизуются, поддерживают стабильную высокую продукцию антител выбранными антитело-продуцирующими клетками и являются чувствительными к среде. Также описано применение человеческих миеломных и мышино-человеческих гетеромиеломных клеточных линий для получения человеческих моноклональных антител (Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)). Примеры мышиных миеломных линий включают в себя линии мышиных опухолей MOP-21 и M.C.-11, которые можно получить из Salk Institute Cell Distribution Center, San Diego, Calif. USA, и клетки SP-2 или X63-Ag8-653, которые можно получить из Американской коллекции типовых культур, Rockville, Md. USA.
Культуральную среду, в которой выращивают гибридомные клетки, анализируют на присутствие моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют методом иммунопреципитации или путем анализа связывания in vitro, такого как радиоиммунологический анализ (RIA) или иммуноферментный твердофазный анализ (ELISA). Сродство связывания моноклонального антитела можно определить, например, с помощью анализа Скэтчарда (Munson et al., Anal. Biochem., 107:220 (1980)).
После идентификации гибридомных клеток, которые продуцируют антитела с желательными специфичностью, сродством и/или активностью, клоны можно субклонировать методом серийных разведений и выращивать стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Для выращивания можно использовать такую подходящую культуральную среду, как, например, D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo в организме животного в виде асцитных опухолей. Моноклональные антитела, секретируемые субклонами, можно выделить из культуральной среды, асцитной жидкости или сыворотки с помощью традиционных методов очистки иммуноглобулинов, таких как, например, хроматография на сефарозе, конъюгированной с белком А, или на гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография.
Считается, что антитела настоящего изобретения являются иммуноспецифическими или способными к специфическому связыванию, если они связывают антиген с Ka, превышающей или равной приблизительно 106M-1, предпочтительно, превышающей или равной приблизительно 107M-1, более предпочтительно, превышающей или равной приблизительно 108M-1, и, наиболее предпочтительно, превышающей или равной приблизительно 109M-1, 1010M-1, 1011M-1 или 1012M-1. Антитела против M-CSF могут связываться с разными природными формами M-CSF, в том числе, экспрессирующимися тканями хозяина/субъекта, а также экспрессирующимися опухолью. Раскрытые в данном описании моноклональные антитела, такие как RX1, 5H4, MC1 или MC3, имеют сродство к M-CSF и характеризуются равновесной константой диссоциации (Kd), которая составляет, по меньшей мере, 10-4 M, предпочтительно, по меньшей мере, приблизительно от 10-7 M до 10-8 M, более предпочтительно, по меньшей мере, приблизительно 10-8 M, 10-10 M, 10-11 M или 10-12 M. Характеристики сродства можно легко определить с помощью традиционных способов, таких как равновесный диализ с использованием прибора BIAcore 2000 и общих методов, предлагающихся производителем; радиоиммунологический анализ с использованием 125I-меченного M-CSF; или с помощью другого способа, известного специалистам в данной области. Характеристики сродства можно анализировать, например, с помощью способа, описанного Scatchard et al., Ann N.Y. Acad. Sci., 51:660 (1949). Таким образом, предпочтительные антитела против M-CSF обладают высокой специфичностью по отношению к M-CSF и связываются с другими молекулами с гораздо более низким сродством. Предпочтительные антитела связываются с M-CSF с таким же сродством, как и RX1, изображенный на фигуре 4, обладают низкой иммуногенностью и ингибируют метастазирование раковых клеток у животных моделей метастатических заболеваний. Другие типичные антитела связываются с M-CSF с таким же сродством, как и мышиные 5H4, MC1 или MC3, изображенные на фигурах 2, 3 или 4, соответственно.
Консервативные замены показаны в таблице 1 под заголовком "предпочтительные замены". Если такие замены приводят к изменению биологической активности, то могут быть осуществлены более существенные изменения, указанные в таблице 1 под заголовком "типичные замены", или, как описано ниже, со ссылкой на классы аминокислот, с последующим скринингом продуктов.
| Таблица 1 Примеры исходных предпочтительных замен остатков |
|
| Ala (A) val; leu; ile val | Arg (R) lys; gln; asn lys |
| Asn (N) gln; his; asp, lys; gln arg | Asp (D) glu; asn glu |
| Cys (C) ser; ala ser | Gln (Q) asn; glu asn |
| Glu (E) asp; gln asp | Gly (G) ala |
| His (H) asn; gln; lys; arg | Ile (I) leu; val; met; ala; leu phe; norleucine |
| Leu (L) norleucine; ile; val; ile met; ala; phe | |
| Lys (K) arg; gln; asn arg | Met (M) leu; phe; ile leu |
| Phe (F) leu; val; ile; ala; tyr | Pro (P) ala |
| Ser (S) thr | Thr (T) ser ser |
| Trp (W) tyr; phe tyr | Tyr (Y) trp; phe; thr; ser phe |
| Val (V) ile; leu; met; phe; leu ala; norleucine | |
Существенные изменения биологических свойств антитела достигаются путем выбора замен, которые значительно различаются по влиянию на поддержание (a) структуры полипептидного скелета в области замены, например, находящегося в складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в целевом участке, или (c) объема боковой цепи. В зависимости от общих свойств боковых цепей природные остатки подразделяют на следующие группы:
(1) гидрофобные: norleucine, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr;
(3) кислые: asp, glu;
(4) основные: asn, gln, his, lys, arg;
(5) остатки, которые влияют на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
К неконсервативным заменам относится замена члена одного класса членом другого класса.
Любой остаток цистеина, не участвующий в поддержании нужной конформации гуманизированного или вариантного антитела, также можно заменить, как правило, серином, для повышения устойчивости молекулы к окислению и предотвращения образования аберрантных поперечных связей. И наоборот, в молекулу антитела можно добавить цистеиновые связи для повышения стабильности антитела (особенно, если антитело представляет собой фрагмент антитела, такой как фрагмент Fv).
B. Мутеины M-CSF
Данное изобретение также предлагает мутеины M-CSF, которые можно использовать в качестве антагонистов MCSF в соответствии со способами данного изобретения.
Термин "фрагмент" в данном описании относится к части интактной нативной молекулы; например, фрагмент полипептида представляет собой фрагмент нативного полипептида, в котором одна или несколько аминокислот на N-конце или C-конце удалены.
Термин "мутеин", используемый в данном описании в применении к полипептидам, обозначает вариант интактной нативной молекулы или вариант фрагмента нативной молекулы, в котором одна или несколько аминокислот заменены, вставлены или удалены. Такие замены, инсерции или делеции можно осуществлять по N-концу, C-концу или во внутренней части молекулы. Таким образом, в объем термина "мутеины" входят фрагменты нативной молекулы. Инсерционные мутеины включают в себя гибриды по N- или C-концу, например гибриды с фрагментом Fc иммуноглобулина, получаемые с целью увеличения периода полужизни.
Последовательности предпочтительных мутеинов данного изобретения, по меньшей мере, приблизительно на 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, или более, идентичны (гомологичны) последовательности нативного полипептида, что определяют с помощью алгоритма установления гомологии Смита-Ватермана (Meth. Mol. Biol. 70:173-187 (1997)), выполняемого программой MSPRCH (Oxford Molecular) с использованием аффинного поиска гэпов, имеющего следующие параметры: пенальти для открытия гэпа 12, а пенальти для продолжения гэпа 1. Другие хорошо известные и широко используемые программы с алгоритмом сканирования гомологии/идентичности включают в себя программы, описанные в Pearson and Lipman, PNAS USA, 85:2444-2448 (1988); Lipman and Pearson, Science, 222:1435 (1985); Devereaux et al., Nuc. Acids Res., 12:387-395 (1984); или алгоритмы BLASTP, BLASTN или BLASTX, описанные в Altschul et al., Mol. Biol., 215:403-410 (1990). Компьютерные программы, использующие данные алгоритмы, также доступны и включают в себя, без ограничения: GAP, BESTFIT, BLAST, FASTA и TFASTA, которые поставляются в пакете программ Genetics Computing Group (GCG), версия 8, Madison Wis., USA; и CLUSTAL в программе PC/Gene от Intellegenetics, Mountain View Calif. Предпочтительно, процент идентичности последовательности определяют с помощью параметров, используемых программой по умолчанию.
Термин "модификация" в данном описании относится к любой модификации нативного полипептида, фрагмента или мутеина, такой как гликозилирование, фосфорилирование, конъюгирование с полимером (таким как полиэтиленгликоль) или другое добавление чужеродных фрагментов при условии, что она позволяет сохранять желательную активность (агонистическую или антагонистическую).
В патенте США № 6025146 и Koths, Mol. Reprod. Dev. 1997 Jan; 46(1):31-38, которые полностью включены в данное описание в качестве ссылки, описаны кристаллизация M-CSF и M-CSF в комплексе с MCSF-R, трехмерная структура M-CSF и остатки, участвующие в связывании рецептора. Патент США № 6025146 также описывает способы отбора подходящих аминокислотных замен в M-CSF, основывающиеся на информации о структуре. Общая топология данной формы M-CSF включает в себя антипараллельный пучок из четырех альфа-спиралей, в котором спирали направлены вверх-вверх-вниз-вниз, в отличие от наблюдаемого в большинстве четырехспиральных пучков соединения вверх-вниз-вверх-вниз. Длинное поперечное соединение связывает спираль A со спиралью B и подобное же соединение обнаружено между спиралями C и D. В димерной форме, соединяемой дисульфидными связями, пучки соединены конец к концу, образуя предельно плоскую, удлиненную структуру (размером приблизительно 85×35×25). В каждом мономере присутствуют три внутримолекулярные дисульфидные связи (Cys7-Cys90, Cys48-Cys139, Cys102-Cys146), которые находятся на удаленном конце молекулы. Одна межцепочечная дисульфидная связь (Cys31-Cys31) находится на поверхности контакта димера и через нее проходит некристаллографическая ось симметрии второго порядка, как показано на фиг. 2. Мутационные эксперименты показывают, что для проявления полноценной биологической активности данной формы M-CSF необходимы все остатки цистеина. Описанная в данном документе структура позволяет предположить, что ее роль скорее является структурной, чем связанной с распознаванием рецептора. Патент США № 6025146 предлагает трехмерную структуру усеченного рекомбинантного димера M-CSFα, идентифицированную по положению альфа-атомов углерода аминокислотных остатков в последовательности.
Особые остатки в спиралях A, C и D участвуют в обеспечении специфичности связывания с рецептором. Поскольку M-CSFβ содержит внутрицепочечные дисульфидные связи, в образовании которых участвуют остатки цистеина 157 и/или 159, C-концевой участок M-CSF, вероятно, простирается от "тыльной стороны" структуры, обеспечивая "границы" разной длины для мембранно-связанных форм M-CSF. Таким образом, "фронт" или рецептор-связывающий участок M-CSF располагается на противоположной стороне молекул и состоит из доступных для растворителя остатков, находящихся в спиралях A, C и D, или вблизи них, которые включают в себя остатки приблизительно от 6 до 26, от 71 до 90, и от 110 до 130, соответственно, нативного M-CSF. Изменяя в данных участках доступные для растворителя остатки путем направленного мутагенеза с увеличением или уменьшением взаимодействия боковых цепей с рецептором, можно получить агонисты или антагонисты M-CSF. Остатки, у которых площадь поверхности, доступной для растворителя, превышает приблизительно 0,25, предпочтительно превышает приблизительно 0,4, являются предпочтительными на основании нормализации по доступной площади поверхности аминокислоты, находящейся в трипептиде gly-x-gly (Kabsch W. et al., Biopolymers 22:2577 (1983)). Предпочтительно выбирают остатки, которые не взаимодействуют с другими частями белка, такими как поверхность контакта димера, чтобы сохранить относительную ориентацию мономеров и избежать нарушения процесса складывания белка. Дополнительное внимание может уделяться выбору остатков, которые не являются консервативными среди человеческих и мышиных M-CSF и не распознают человеческий рецептор M-CSF. Аминокислоты-кандидаты для замены на неконсервативные аминокислоты предпочтительно выбирают так, чтобы разрушить водородные связи и/или гидрофобные взаимодействия с остатками MCSF-R. Например, заменяя один или несколько остатков гистидина на аминокислоты подобного размера, которые не являются донорами водорода, можно получить M-CSF с измененной способностью к связыванию рецептора. Предпочтительные аминокислоты для замены включают в себя, без ограничения: H15; Q79; R86; E115; E41; K93; D99; L55; S18; Q20; I75; V78; L85; D69; N70; H9; N63 и T34. Полагают, что остатки M-CSF, играющие важную роль в сигнальном пути рецептора, составляют непрерывные участки M-CSF. Чтобы минимизировать вероятность образования антител против вводимых белковых лекарственных средств на основе M-CSF, желательно сохранить, где это возможно, доступные для растворителя остатки исходного M-CSF (чтобы получить молекулу, напоминающую нативную).
Путем мутагенеза аминокислот H15 и H9 в N-концевой области спирали A получают мутеины с гораздо более низкой биологической активностью и значительно пониженной способностью связывать MCSF-R. Полученные результаты указывают на то, что уменьшение биологической активности происходит вследствие снижения сродства связывания рецептора; таким образом, указанные остатки гистидина представляют собой точки контакта, играющие важную роль в обеспечении сродства связывания рецептора M-CSF, и должны быть оставлены, если нужно получить молекулу с полноценной способностью к связыванию рецептора. Соседние доступные для растворителя остатки, такие как Y6, S13 и другие, также могут участвовать в образовании контакта с рецептором M-CSF. Чтобы определить значение доступных для растворителя остатков центральной части спиралей А и С, получают двойной мутант M-CSF (Q20A, V78K). Этот двойной мутант обладает слегка пониженной (в 8-10 раз) биологической активностью и соответственно уменьшенной рецептор-связывающей активностью. Мутагенез остатков Q17, R21, E115 и E119 приводит к изменению свойств боковых цепей доступных для растворителя аминокислот в представляющей интерес области, но не влияет на специфическую биологическую активность, позволяя предположить, что для получения мутеинов, обладающих антагонистической активностью, указанные остатки можно не изменять.
В одном воплощении данное изобретение предлагает применение мутеинов M-CSF, в которых остатки спиралей A и/или C и/или D, участвующие в связывании рецептора (например, аминокислоты 6-26, 71-90 и/или 110-130) подвергаются неконсервативным мутациям. Такие мутеины предпочтительно сохраняют, по меньшей мере, 65%, 70%, 75%, 80%, 85% или 90% подобия (т.е. идентичных аминокислот или аминокислот, имеющих подобные свойства) по отношению к нативной последовательности, находящейся в спиралях A, C или D, однако имеют более высокую степень подобия по отношению к нативной последовательности остальной части полипептида, например, составляющую, по меньшей мере, 95%, 98% или 99%. Кроме того, неконсервативным мутациям могут подвергаться остатки, которые поддерживают трехмерную конформацию.
В другом воплощении мутеин M-CSF представляет собой мономерную форму M-CSF. Димерная форма M-CSF обладает биологической активностью, а мономерные формы M-CSF обычно являются неактивными. Дисульфидные связи в мономерах встречаются в виде межцепочечных мостиков Cys31-Cys31. Таким образом, предполагается, что мономерные формы M-CSF можно использовать в качестве антагонистов. Такие формы включают в себя мутеины, содержащие делеции остатков цистеина и/или замены остатков цистеина (например, замены цистеина на аланин) Cys31 и/или других остатков цистеина, или мутеины, в которых остаток (остатки) цистеина, в особенности Cys31, химически модифицируют, чтобы сделать его недоступным для образования дисульфидных связей.
В следующем воплощении мутеин M-CSF содержит одну или несколько спиралей A, C или D, или их фрагменты, участвующие в связывании рецептора, сами по себе, или гибридизованные с другими полипептидами, которые позволяют фрагментам иметь подходящую трехмерную конформацию.
Мутеины, содержащие любые желательные консервативные и/или неконсервативные мутации, можно легко получить с помощью известных в данной области способов, таких как рекомбинантные технологии или химический синтез.
Предполагается, что консервативные замены, в особенности, замены вне участков, участвующих в связывании лиганда с рецептором, практически не влияют на связывающие свойства мутеинов M-CSF (или мутеинов M-CSFR). Аминокислоты можно классифицировать по физическим свойствам и их вкладу в формирование вторичной и третичной структуры белка. Консервативную замену в данной области определяют как замену одной аминокислоты на другую аминокислоту, обладающую подобными свойствами. Примеры консервативных замен приведены в нижеследующей таблице 2 (из WO 97/09433, страница 10, опубликованного 13 марта 1997 (PCT/GB96/02197, поданный 9/6/96)).
| Таблица 2 Консервативные замены I |
|
| Характеристики боковых цепей | Аминокислоты |
| Алифатические | |
| неполярные | G A P I L V |
| полярные незаряженные | C S T M N Q |
| полярные заряженные | D E K R |
| Ароматические | H F W Y |
| Другие | N Q D E |
Альтернативно, консервативные аминокислоты можно классифицировать по Ленинджеру (Biochemistry, Second Edition; Worth Publishers, Inc. NY:NY (1975), pp.71-77), как показано в нижеследующей таблице 3.
| Таблица 3 Консервативные замены II |
|
| Характеристики боковых цепей | Аминокислоты |
| Неполярные (гидрофобные) | |
| А. Алифатические | A L I V P |
| В. Ароматические | F W |
| С. Серусодержащие | M |
| D. Промежуточные | G |
| Незаряженные полярные | |
| А. Гидроксилсодержащие | S T Y |
| В. Амиды | N Q |
| С. Сульфгидрил-содержащие | C |
| D. Промежуточные | G |
| Положительно-заряженные (основные) | K R H |
| Отрицательно-заряженные (кислые) | D E |
В нижеследующей таблице 4 приведены другие альтернативные примеры консервативных замен.
| Таблица 4 Консервативные замены III |
|
| Исходный остаток | Типичные замены |
| Ala (A) | Val, Leu, Ile |
| Arg (R) | Lys, Gln, Asn |
| Asn (N) | Gln, His, Lys, Arg |
| Asp (D) | Glu |
| Cys (C) | Ser |
| Gln (Q) | Asn |
| Glu (E) | Asp |
| His (H) | Asn, Gln, Lys, Arg |
| Ile (I) | Leu, Val, Met, Ala, Phe |
| Leu (L) | Ile, Val, Met, Ala, Phe |
| Lys (K) | Arg, Gln, Asn |
| Met (M) | Leu, Phe, Ile |
| Phe (F) | Leu, Val, Ile, Ala |
| Pro (P) | Gly |
| Ser (S) | Thr |
| Thr (T) | Ser |
| Trp (W) | Tyr |
| Tyr (Y) | Trp, Phe, Thr, Ser |
| Val (V) | Ile, Leu, Met, Phe, Ala |
Доступность последовательности ДНК, кодирующей M-CSF, позволяет получать целевые полипептиды с использованием разных систем экспрессии. Конструирование векторов экспрессии и проведение рекомбинантных способов получения осуществляют с помощью хорошо известных в данной области методов. Указанные способы, так же как и другие методы, обычно проводят в соответствии с руководствами, описанными в Sambrook et al., Molecular Cloning - A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. (1989), и Kriegler M., Gene Transfer and Expression, A Laboratory Manual, Stockton Press, New York (1990), которые включены в данное описание в качестве ссылки.
Некоторые модификации первичной последовательности M-CSF можно осуществить путем делеции, добавления или изменения аминокислот, кодируемых последовательностью ДНК, без нарушения желательной структуры (например, способности M-CSF связывать рецептор), в соответствии с хорошо известными методами рекомбинантных ДНК. Кроме того, опытному специалисту известно, что отдельные аминокислоты можно заменить или модифицировать путем окисления, восстановления или другого изменения, а полипептид можно расщепить с получением фрагментов, которые сохраняют активный связывающий центр и структурную информацию. В результате таких замен и изменений получают полипептиды, имеющие аминокислотные последовательности, удовлетворяющие определению "полипептида, содержащего практически такую же аминокислотную последовательность, как и природные полипептиды M-CSFα (SEQ ID ND: 7), M-CSFβ (SEQ ID NO: 8) и M-CSFγ (SEQ ID NO: 9)".
Полипептиды можно получить с помощью известных в данной области способов химического синтеза или рекомбинантных технологий.
Родство белков можно охарактеризовать по родству кодирующих их нуклеиновых кислот. Способы определения идентичности и/или подобия полинуклеотидных последовательностей описаны выше. Кроме того, подобие полинуклеотидных последовательностей можно определить путем тестирования их способности гибридизоваться в условиях средней или высокой жесткости с использованием нижеследующих способов. Типичные условия гибридизации средней жесткости включают в себя: проведение гибридизации при 42°C в растворе для гибридизации, содержащем 50% формамид, 1% SDS, 1 M NaCl, 10% сульфат декстрана, и промывание два раза в течение 30 минут при 60°C в растворе для промывания, содержащем 0,1×SSC и 1% SDS. Условия высокой жесткости включают в себя промывание при 68°C в растворе для промывания, содержащем 0,1×SSC и 1% SDS. Специалистам в данной области известно, что условия эквивалентной жесткости можно получить, варьируя температуру и состав буфера или концентрацию соли, как описано в данной области (Ausubel et al. (Eds.), Protocols in Molecular Biology, John Wiley & Sons (1994), pp. 6.0.3 to 6.4.10). Изменение условий гибридизации осуществляют опытным путем или на основе точных вычислений исходя из длины зонда и процентного содержания пар оснований гуанозин/цитозин (GC). Способы расчета условий гибридизации описаны в Sambrook et al., (Eds.), Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York (1989), pp. 9.47 to 9.51.
C. Растворимый M-CSFR
Типичные фрагменты M-CSFR в соответствии с данным изобретением могут содержать один или более, или два или более доменов, участвующих в связывании M-CSF/рецептора (предположительно это домены 1, 2 и 3). Предпочтительные фрагменты M-CSFR включают в себя все три домена 1, 2 и 3 M-CSFR. Дополнительные мутации и/или модификации таких фрагментов или всего внеклеточного домена M-CSFR входят в объем данного изобретения и могут быть получены с помощью способов, описанных выше в разделе "Мутеины M-CSF".
M-CSFR (SEQ ID NO: 84 и 85) представляет собой мембраносвязанную молекулу, содержащую пять внеклеточных иммуноглобулино-подобных доменов (из которых домены 1-3 предположительно участвуют в связывании лиганда с рецептором), трансмембранный домен и внутриклеточный прерывистый Src-связанный тирозин-киназный домен. В соответствии с последовательностью SEQ ID NO: 85, вышеуказанные домены располагаются следующим образом: Ig домен 1: аминокислоты 27-102; Ig домен 2: аминокислоты 112-196; Ig домен 3: аминокислоты 215-285; Ig домен 4: аминокислоты 308-399; Ig домен 5: аминокислоты 410-492; трансмембранный домен: аминокислоты 515-537; и киназный домен: аминокислоты 582-910. "Типичный" иммуноглобулино-подобный домен содержит петлеобразную структуру, обычно фиксирующуюся дисульфидной связью, образованной двумя остатками цистеина на конце каждой петли. В M-CSF-R остатки цистеина, образующие иммуноглобулино-подобные петли, находятся в следующих положениях: домен 1: 42, 84; домен 2: 127, 177; домен 3: 224, 278; домен 4: цистеины отсутствуют; домен 5: 419, 485.
Интактный внеклеточный домен M-CSFR или любой его фрагмент, который сохраняет антигенные свойства, например, одну или несколько Ig-подобных петель, можно использовать для получения антител, которые связываются с нативным рецептором. Поликлональные, моноклональное, химерные, CDR-привитые, гуманизированные, полностью человеческие антитела и их антигенсвязывающие фрагменты можно получить с помощью способов, описанных выше для получения антител против M-CSF. Полученные антитела можно подвергнуть скринингу на MCSF-антагонистическую активность и на возможность применения в способах лечения данного изобретения с помощью анализов, описанных в данном документе в разделе "Способы скрининга", или с помощью любых других подходящих анализов, известных в данной области.
Для ингибирования взаимодействия M-CSF с M-CSFR может быть достаточно одной или нескольких из вышеуказанных Ig-подобных петель внеклеточного домена рецептора. Так, фрагменты внеклеточного домена M-CSFR и его мутеины можно легко получить с помощью рекомбинантных технологий или способов химического синтеза, хорошо известных в данной области. Продукты можно подвергнуть скринингу на MCSF-антагонистическую активность и на возможность применения в способах лечения данного изобретения с помощью анализов, описанных в данном документе в разделе "Способы скрининга", или с помощью любых других подходящих анализов, известных в данной области.
D. Генная терапия
Доставку терапевтического белка к нужным клеткам можно осуществлять посредством генной терапии ex vivo, in situ или in vivo с помощью подходящих способов, известных в данной области, включающих в себя применение физических способов переноса ДНК (например, с помощью липосом или путем химической обработки) или применение вирусных векторов (например, на основе аденовируса, аденоассоциированного вируса или ретровируса). Настоящее изобретение также предлагает антисмысловые соединения и способы их применения. Уровень активности M-CSF или M-CSFR можно уменьшить с помощью хорошо известных способов применения антисмысловых последовательностей, "нокаута генов", рибозимов, тройных спиралей или РНКи, приводящих к уменьшению экспрессии генов. Методы получения и применения таких молекул хорошо известны специалистам в данной области.
В данном описании термин "пептидомиметик" относится к непептидному соединению, содержащему совокупность аминокислотных боковых цепей, или фармакофоров, или их подходящих производных, удерживаемых на скелете, который обеспечивает пространственную ориентацию, по существу имитирующую биоактивную конформацию природного пептида. Например, в пептидомиметике могут отсутствовать аминокислоты или пептидные связи, но он может сохранять конкретную трехмерную конфигурацию групп пептидной цепи исходного пептида, необходимую для проявления связывающей активности. Каркас может включать в себя бициклический, трициклический или высший полициклический углеродный или гетероатомный скелет, или в его основе могут лежать одна или несколько циклических структур (например, пиридин, индазол и др.) или амидных связей. К ядру данного каркаса через спейсеры с одного конца может быть присоединена кислая группа (например, карбоксильная функциональная группа), а с другого конца основная группа (например, N-содержащий фрагмент, такой как амидин или гуанидин). Примеры способов синтеза пептидомиметиков описаны в патентной заявке США № 20030199531, опубликованной 23 октября 2003, и в патентной заявке США № 20030139348, опубликованной 24 июля 2003.
Помимо антител и других белков данное изобретение охватывает альтернативные антагонисты M-CSF, включающие в себя, без ограничения, пептиды или маленькие органические молекулы, которые также эффективно ингибируют взаимодействие M-CSF с M-CSFR, или активацию M-CSFR.
II. Комбинированная (сочетанная) терапия
При совместном введении двух терапевтических средств настоящего изобретения, например, антагониста M-CSF и второго противоостеокластного средства, не требуется, чтобы средства вводили одновременно или с помощью одного и того же способа, при условии, что происходит перекрывание периодов времени, в течение которых средства оказывают терапевтическое действие. Можно осуществлять одновременное или последовательное введение, например, с интервалом в несколько дней или недель.
Значительное отставание во времени наблюдаемого терапевтического эффекта после начала лечения антителом против M-CSF (типичным антагонистом M-CSF) делает желательным введение в течение данного переходного периода второго противоостеокластного средства с более быстрым началом действия. В течение переходного периода оба средства нужно вводить в монотерапевтически эффективном количестве. По окончании переходного периода можно прекратить введение второго противоостеокластного средства или уменьшить его дозу. Если антагонист M-CSF и второе противоостеокластное средство оказывают синергическое действие, дозу одного из них или обоих можно уменьшить после окончания переходного периода.
Композиции данного изобретения вводят млекопитающему, страдающему от остеолитического нарушения, или предрасположенному к остеолитическому нарушению, включающему в себя раковые метастазы и/или разрежение костей, связанное с раковыми метастазами, или другие заболевания, связанные с разрежением костей, такие как остеопороз, в количестве, достаточном для предотвращения или, по меньшей мере, частичной приостановки развития такого заболевания. Если терапевтическое средство вводят одно (не в сочетании со вторым терапевтическим средством), то количество терапевтического средства, требуемое для достижения вышеуказанной цели, определяют как "монотерапевтически эффективная доза".
В сочетанной терапии согласно способам настоящего изобретения, антагонист M-CSF, такой как антитело против M-CSF, и второе противоостеокластное средство можно вводить одновременно или в разное время. Два средства можно вводить, например, с интервалом в 8 часов, 1 день, 14 дней, 30 дней, 3 месяца, 6 месяцев, 9 месяцев или 1 год.
Примерами второго противоостеокластного средства являются бисфосфонаты, включающие в себя, без ограничения, золедронат, памидронат, клондронат, этидронат, тилудронат, алендронат, ибандронат или ризедронат. Примеры других противоостеокластных средств включают в себя бисфосфонаты, PTHrP-нейтрализующие средства (такие как антитело, антисмысловая последовательность, siРНК), ингибиторы катепсина K, антагонисты MIP-1-α, RANK/RANKL-нейтрализующие средства (такие как антитело против RANK, например, AMG-162, или антисмысловая последовательность, растворимый рецептор RANKL или его мутеины), вакцину RANK-L, остеопротегрин (OPG), тромбоцитарные факторы роста (PDGF), ингибиторы src-киназы, мальтолат галия и ингибиторы матриксной металлопротеиназы (MMP).
Бисфосфонаты обычно вводят внутривенно в дозе 4 мг. Можно вводить более низкие дозы, например, 3,5 мг, 3,3 мг или 3,0 мг. Можно использовать и другие способы введения, такие как подкожное введение и способы, описанные в WO 02/087555. Эффективное количество антитела против M-CSF варьирует в зависимости от тяжести заболевания, массы тела и общего состояния пациента, подлежащего лечению, однако обычно оно находится в интервале приблизительно от 1,0 мг/кг до 100 мг/кг массы тела, или приблизительно от 10 мг/кг до 30 мг/кг, причем чаще используют дозы, составляющие приблизительно от 0,1 мг/кг до 10 мг/кг на прием, или приблизительно от 1 мг/кг до 10 мг/кг. Например, в качестве начальной дозы пациенту можно вводить приблизительно от 1 мг/кг до 5 мг/кг, или приблизительно от 30 мг/кг до 1 мг/кг антитела, например, в один или несколько приемов, или путем непрерывной инфузии. Введение осуществляют ежедневно, через день, еженедельно или реже, в зависимости от ответа пациента или от его способности переносить лечение. Для достижения желательного подавления симптомов заболевания может потребоваться введение поддерживающих доз в течение более продолжительного периода времени, такого как 4, 5, 6, 7, 8, 10, 12 недель или дольше, причем дозы можно регулировать по мере необходимости. Результаты лечения можно легко отслеживать с помощью традиционных методов и анализов.
Хотя способы настоящего изобретения можно использовать для лечения любой стадии рака, в особенности они подходят для лечения прогрессирующих или метастатических раковых заболеваний. Объединение терапевтического лечения с химиотерапевтическим или лучевым режимом предпочтительно используют для пациентов, не получающих химиотерапевтического лечения, тогда как лечение с помощью терапевтического способа настоящего изобретения можно назначать пациентам, получившим один или несколько курсов химиотерапии. Кроме того, терапевтические способы настоящего изобретения позволяют снизить дозы средств, использующихся при сопутствующей химиотерапии, особенно для пациентов, которые недостаточно хорошо переносят токсичность химиотерапевтических средств.
Способ данного изобретения включает в себя введение отдельных антител против M-CSF, а также сочетаний или "смесей" разных антител. Такие смеси антител могут иметь определенные преимущества, поскольку в их состав входят антитела, которые действуют посредством разных эффекторных механизмов, или они содержат непосредственно цитотоксические антитела вместе с антителами, обладающими иммунными эффекторными функциями. Такие антитела в сочетании могут проявлять синергическое терапевтическое действие.
Способы данного изобретения можно использовать в сочетании с другими терапевтическими средствами, такими как противораковые терапевтические средства. Типичные противораковые терапевтические средства и/или способы включают в себя, без ограничения, разные химиотерапевтические средства, блокаторы андрогенов и иммунные модуляторы (например, IL-2, GM-CSF, SLC), бисфосфонат(ы) (например, Aredia (т.е. памидронат, памидроновая кислота, памидронат динатрия, пентагидрат памидроната динатрия); Zometa (т.е. Aclasta, золедроновая кислота, золедронат); Clondronate (т.е. Bonefos, Loron, клондронат динатрия, клондронат натрия); Fosamax (т.е. алендронат, тригидрат натриевой соли алендроната, алендроновая кислота); Fosavance (т.е. Fosamax, содержащий витамин D); Bondronat, или Bonviva, или Boniva (т.е. ибандронат, ибандроновая кислота, ибандронат натрия; Actonel (т.е. ризедронат, ризедронат натрия, ризендроновая кислота); Didronel или Didrocal (т.е. этидронат, этидроновая кислота, этидронат динатрия); Nerixia (т.е. неридронат, неридроновая кислота); Skelid (т.е. тилудронат, тилудроновая кислота); диметил-APD (т.е. олпадронат, олпадроновая кислота); и медроновая кислота или медронат), хирургическое лечение, облучение, цитотоксическую химиотерапию, гормональную терапию (например, Tamoxifen; терапия с использованием антиандрогенов), лечение антителами (такими как нейтрализующие антитела против RANKL/RANK; нейтрализующие антитела против PTHrP, антитела против Her2, CD20, CD40, CD22, VEGF, IGFR-1, EphA2, HAAH, TMEFF2, CAIX), лечение терапевтическими белками (например, растворимым рецептором RANKL; ингибиторами OPG, а также PDGF и MMP), лечение низкомолекулярными лекарственными средствами (такими как ингибиторы Src-киназы), киназными ингибиторами рецепторов факторов роста, или ингибиторами RANKL, лечение олигонуклеотидами (такими как антисмысловые последовательности RANKL, или RANK, или PTHrP), генную терапию (например, с использованием ингибиторов RANKL или RANK, таких как антитела против RANKL), лечение пептидами (такими как мутеины RANKL), а также применение описанных в данном документе белков, пептидов, соединений и маленьких молекул.
Противораковые химиотерапевтические средства включают в себя, без ограничения, алкилирующие средства, такие как карбоплатин и цисплатин; алкилирующие средства на основе азотистого иприта; алкилирующие средства на основе нитрозомочевины, такие как кармустин (BCNU); антиметаболиты, такие как метотрексат; фолиновая кислота; антиметаболиты на основе аналогов пурина, такие как меркаптопурин; антиметаболиты на основе аналогов пиримидина, такие как фторурацил (5-FU) и гемцитабин (Gemzar®); гормональные противоопухолевые средства, такие как госерелин, лейпролид и тамоксифен; натуральные противоопухолевые средства, такие как альдеслейкин, интерлейкин-2, доцетаксел, этопозид (VP-16), интерферон-альфа, паклитаксел (Taxol®) и третиноин (ATRA); антибиотические натуральные противоопухолевые средства, такие как блеомицин, дактиномицин, даунорубицин, доксорубицин, дауномицин и митомицин, в том числе митомицин С; а также натуральные противоопухолевые средства на основе алкалоидов барвинка, такие как винбластин, винкристин, виндесин; гидроксимочевина; ацеглатон, адриамицин, ифосфамид, эноцитабин, эпитиостанол, акларубицин, анцитабин, нимустин, гидрохлорид прокарбазина, карбоквон, карбоплатин, кармофур, хромомицин A3, противоопухолевые полисахариды, противоопухолевые тромбоцитарные факторы, циклофосфамид (Cytoxin®), шизофиллан, цитарабин (цитозина арабинозид), дакарбазин, тиоинозин, тиотепа, тегафур, доластатины, аналоги доластатинов, такие как ауристатин, СРТ-11 (иринотекан), митозантрон, винорелбин, тенипозид, аминоптерин, карминомицин, эсперамицины (см., например, патент США № 4675187), неокарзиностатин, OK-432, блеомицин, фуртулон, броксуридин, бусульфан, хонван, пепломицин, бестатин (Ubenimex®), интерферон-β, мепитиостан, митобронитол, мелфалан, ламининовые пептиды, лентинан, экстракт Coriolus versicolor, тегафур/урацил, эстрамустин (эстроген/мехлоретамин).
Другие средства, используемые в качестве дополнительной терапии для лечения раковых больных, включают в себя EPO, G-CSF, ганцикловир; антибиотики, лейпролид; меперидин; зидовудин (AZT); интерлейкины 1-18, в том числе их мутантные формы и аналоги; интерфероны или цитокины, такие как интерфероны α, β и γ; гормоны, такие как фактор, высвобождающий лютеинизирующий гормон (LHRH), и его аналоги, и гормон, высвобождающий гонадотропин (GnRH); факторы роста, такие как трансформирующий фактор роста-β (TGF-β), фактор роста фибробластов (FGF), фактор роста нервов (NGF), фактор, высвобождающий гормон роста (GHRF), эпидермальный фактор роста (EGF), фактор, гомологичный фактору роста фибробластов (FGFHF), фактор роста гепатоцитов (HGF) и инсулиновый фактор роста (IGF); факторы некроза опухоли-α и -β (TNF-α и -β); фактор, ингибирующий инвазию-2 (IIF-2); костные морфогенетические белки 1-7 (BMP 1-7); соматостатин; тимозин-α-1; γ-глобулин; супероксиддисмутаза (SOD); факторы комплемента; противоангиогенные факторы; антигенные вещества; и пролекарства.
Пролекарство представляет собой предшественник или производное фармацевтически активного вещества, которое является менее токсичным для опухолевых клеток, чем исходное средство, или совсем нетоксичным, и способно активироваться под действием фермента, или превращаться в активную или более активную исходную форму. См., например, Wilman, " Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства включают в себя, без ограничения, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, D-аминокислотно-модифицированные пролекарства, гликозилированные пролекарства, β-лактам-содержащие пролекарства, необязательно замещенный феноксиацетамид-содержащие пролекарства или необязательно замещенный фенилацетамид-содержащие пролекарства, 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активные цитотоксические свободные лекарственные формы. Примеры цитотоксических средств, которые можно дериватизировать с получением пролекарственной формы для применения в соответствии с настоящим изобретением, включают в себя, без ограничения, описанные выше химиотерапевтические средства.
III. Способы введения и получения
Эффективное количество антагониста M-CSF варьирует в зависимости от тяжести заболевания, массы тела и общего состояния пациента, подвергающегося лечению, однако обычно оно находится в интервале приблизительно от 1,0 мкг/кг до 100 мг/кг массы тела, причем чаще используются дозы, составляющие приблизительно от 10 мкг/кг до 10 мг/кг на один прием. Эффективное количество композиции данного изобретения можно определить с помощью стандартных эмпирических методов, хорошо известных в данной области. Например, нейтрализующую активность in vivo сыворотки субъекта, получившего определенную дозу антагониста M-CSF, можно оценить с помощью анализа, позволяющего определить способность сыворотки блокировать M-CSF-индуцированную пролиферацию и выживание мышиных моноцитов (клетки CD11b+, подвид клеток CD11, который экспрессирует высокий уровень рецептора M-CSF) in vitro, как описано в Cenci et al., J Clin. Invest. 1055: 1279-87, 2000.
Введение осуществляют ежедневно, каждые два дня, каждые три дня, еженедельно или реже, в зависимости от ответа пациента или от его способности переносить лечение. В течение длительного периода можно вводить поддерживающие дозы, величину которых регулируют по необходимости.
Композиции можно вводить в один или несколько приемов, причем величину доз и способ введения выбирает лечащий врач.
На основе антагонистов M-CSF, в том числе антител против M-CSF, используемых при осуществлении способа данного изобретения, можно получить фармацевтические композиции, содержащие носитель, подходящий для желательного способа доставки. Подходящие носители включают в себя любое вещество, которое при объединении с антагонистом M-CSF сохраняет противоопухолевые свойства антагониста и не взаимодействует с иммунной системой субъекта. Примеры носителей включают в себя, без ограничения, любые стандартные фармацевтические носители, такие как стерильный физиологический раствор, забуференный фосфатом, бактериостатическая вода и т.п. Можно использовать ряд водных носителей, например, воду, забуференную воду, 0,4% солевой раствор, 0,3% раствор глицина и т.п., которые могут содержать другие белки, способствующие повышению стабильности, такие как альбумин, липопротеин, глобулин и др., подвергнутые умеренным химическим модификациям или т.п.
Терапевтические композиции антагониста для хранения получают путем смешивания антагониста, имеющего желательную степень чистоты, с выбранными физиологически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в виде лиофилизированных препаратов или водных растворов. Приемлемые носители, наполнители или стабилизаторы в использумых дозах и концентрациях являются нетоксичными по отношению к реципиентам и включают в себя буферы, например, содержащие фосфаты, цитраты и соли других органических кислот; антиоксиданты, такие как аскорбиновая кислота и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексметония; хлорид безалкония, хлорид бензэтония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (содержащие менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, такие как глюкоза, манноза или декстрины; хелатирующие средства, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как ионы натрия; комплексы металлов (например, комплексы Zn с белками); и/или неионные поверхностно-активные вещества, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (PEG).
Кроме того, если это необходимо для лечения конкретного состояния, композиции настоящего изобретения могут содержать несколько активных соединений, предпочтительно обладающих взаимодополняющими активностями и не оказывающих друг на друга неблаприятного воздействия. Например, иногда желательно включить в состав композиции иммуносупрессивное средство. Такие молекулы обычно присутствуют в сочетании в количестве, эффективном для достижения предполагаемой цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, полученные, например, путем коацервации или межфазной полимеризации, такие как гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (такие как липосомы, альбуминовые микросферы, микрроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Композиции, используемые для введения in vivo, должны быть стерильными. Стерилизацию можно легко осуществить путем фильтрации через стерильные фильтрационные мембраны.
Антагонист вводят подходящими способами, включающими в себя парентеральное, подкожное, внутрибрюшинное, внутрилегочное и внутриназальное введение, и, если это желательно при местном лечении, введение в участок повреждения. Парентеральные инфузии включают в себя внутривенное, внутриартериальное, внутрибрюшинное, внутримышечное, внутрикожное или подкожное введение. Кроме того, антагонист можно вводить путем импульсной инфузии, в частности, с понижением дозы антагониста. Предпочтительно лекарственное средство вводят путем инъекций, наиболее предпочтительно, путем внутривенных или подкожных инъекций, отчасти в зависимости от того, является ли введение кратким или продолжительным. Можно использовать и другие способы введения, включающие в себя местное, в частности, чрескожное введение, введение через слизистую оболочку, ректальное, пероральное или локальное введение, например, через катетер, расположенный вблизи нужного участка.
Композиции настоящего изобретения могут находиться в виде, например, гранул, порошков, таблеток, капсул, сиропов, свечей, растворов для инъекций, эмульсий, эликсиров, суспензий или растворов. Растворимые композиции могут быть получены для разных способов введения, таких как пероральное введение, назальное введение, ректальное введение, подкожные инъекции, внутривенные инъекции, внутримышечные инъекции или внутрибрюшинные инъекции.
Лекарственные формы для инъекций, как правило, включают в себя водные суспензии или масляные суспензии, которые могут быть получены с использованием подходящего диспергирующего или увлажняющего средства и суспендирующего средства. Формы для инъекций могут находиться в виде растворов или суспензий, которые получают с использованием растворителя или разбавителя. Приемлемые разбавители или среды включают в себя стерилизованную воду, раствор Рингера или изотонический водный солевой раствор. Альтернативно, в качестве растворителей или суспендирующих средств можно использовать стерильные масла. Предпочтительно, используемые масла или жирные кислоты являются нелетучими и включают в себя природные или синтетические масла, жирные кислоты, моно-, ди- или триглицериды.
Фармацевтическая композиция и/или лекарственное средство для инъекций может представлять собой порошок, который можно разбавить подходящим раствором, как описано выше. Примеры таких порошков включают в себя, без ограничения, порошки, полученные путем сушки из замороженного состояния, роторной сушки или сушки распылением, аморфные порошки, гранулы, выпавшую в осадок фазу или дисперсные частицы. Композиции для инъекций могут необязательно содержать стабилизаторы, средства, изменяющие pH, поверхностно-активные вещества, модификаторы биодоступности, а также их сочетания.
Можно получить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают в себя полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антагонист, данные матрицы могут находиться в виде формованных изделий, таких как пленки, или в виде микрокапсул. Примеры матриц, обеспечивающих замедленное высвобождение, включают в себя сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, не разрушаемые сополимеры этилена и винилацетата, разрушаемые сополимеры молочной кислоты и гликолевой кислоты, такие как Lupron DepotTM (подходящие для инъекций микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и лейпролида ацетата), и поли-D-(-)-3-гидроксимасляную кислоту. Такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы в течение периода, превышающего 100 дней, тогда как некоторые гидрогели высвобождают белки в течение более коротких периодов времени. Если заключенные в капсулы антагонисты находятся в организме в течение длительного периода времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°C, что приводит к утрате биологической активности и, возможно, к изменению иммуногенности. В зависимости от механизма протекания данных процессов можно разработать рациональные стратегии стабилизации. Например, если механизм агрегации включает в себя образование межмолекулярных связей S-S в результате тио-дисульфидного обмена, стабилизацию можно достичь путем модификации сульфгидрильных остатков, лиофилизации из кислых растворов с контролированием содержания влаги и использованием подходящих добавок, и получения конкретных композиций на основе полимерного матрикса.
В соответствии с настоящим изобретением можно получить композиции, обеспечивающие кратковременное действие, быстрое высвобождение, длительное действие или замедленное высвобождение. Таким образом, фармацевтические композиции можно получить в виде формы, обеспечивающей контролируемое или замедленное высвобождение.
Композиции настоящего изобретения также могут содержать, например, мицеллы или липосомы, или другие капсульные формы, или они могут находиться в виде формы с длительным высвобождением, обеспечивающей пролонгированное хранение и/или доставку. Следовательно, фармацевтические композиции и лекарственные средства можно прессовать в шарики или цилиндры и имплантировать внутримышечно или подкожно в виде инъекций-депо, или в виде таких имплантатов, как стенты. Такие имплантаты могут быть изготовлены из известных инертных материалов, таких как силиконы и биоразрушаемые полимеры.
Помимо описанных выше типичных лекарственных форм в объем настоящего изобретения входят фармацевтически приемлемые наполнители и носители, широко известные специалистам в данной области. Такие наполнители и носители описаны, например, в "Remingtons Pharmaceutical Sciences" Mack Pub. Co., New Jersey (1991), которая включена в данное описание в качестве ссылки.
Конкретные дозы можно установить в зависимости от состояния заболевания, возраста, массы тела, общего состояния здоровья, пола и диеты субъекта, диапазона дозировок, способов введения, скорости выведения и сочетания лекарственных средств. Все описанные выше лекарственные формы относятся к сфере рутинного экспериментирования и, следовательно, входят в объем настоящего изобретения.
Как правило, антагонисты M-CSF или антитела против M-CSF, используемые в качестве терапевтических средств в соответствии с настоящим изобретением, практически не содержат других природных иммуноглобулинов или других биологических молекул. Предпочтительные антагонисты M-CSF также обладают минимальной токсичностью при введении млекопитающему, страдающему от остеолитических нарушений, или предрасположенному к остеолитическим нарушениям, включающим в себя раковый метастаз и/или разрежение костей, связанное с раковым метастазом.
Композиции данного изобретения можно стерилизовать с помощью хорошо известных традиционных методов стерилизации. Полученные растворы можно упаковать для применения или отфильтровать в асептических условиях и лиофилизировать, перед введением лиофилизированный препарат объединяют со стерильным раствором. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, обеспечивающие соответствие физиологическим условиям, такие как средства, регулирующие pH, и забуферивающие средства, средства, регулирующие тоничность и т.п., например, ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция и стабилизаторы (например, 20% раствор мальтозы и др.).
Антагонисты M-CSF настоящего изобретения также можно вводить посредством липосом, которые представляют собой маленькие везикулы, состоящие из разных типов липидов и/или фосфолипидов и/или поверхностно-активных веществ, которые используются для доставки лекарственных средств (таких как раскрытые в данном описании антагонисты и, необязательно, химиотерапевтические средства). Липосомы могут находиться в виде эмульсий, пен, мицелл, нерастворимых монослоев, дисперсий фосфолипидов, ламеллярных слоев и т.п., и могут использоваться в качестве средств, направляющих антагонисты M-CSF к конкретной ткани, а также для увеличения периода полужизни композиции. Существует ряд способов получения липосом, как описано, например, в патентах США №№ 4837028 и 5019369, которые включены в данное описание в качестве ссылки.
Липосомы, содержащие антагонист, получают с помощью известных в данной области способов, таких как описанные в Epstein et al., Proc. Natl. Acad. Sci. USA 82: 3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA 77: 4030 (1980); и патентах США №№ 4485045 и 4544545. Липосомы с повышенным временем жизни в кровотоке раскрыты в патенте США № 5013556. Методом обращенно-фазового выпаривания можно получить особенно предпочтительные липосомы, липидный состав которых включает в себя фосфатидилхолин, холестерин и PEG-дериватизированный фосфатидилэтаноламин (PEG-PE). После экструдирования через фильтры с определенным размером пор получают липосомы желательного диаметра. Фрагменты Fab' антитела против M-CSF настоящего изобретения можно конъюгировать с липосомами по способу, описанному Martin et al., J. Biol. Chem. 257: 286-288 (1982), посредством реакции дисульфидного обмена. Химиотерапевтическое средство (такое как доксорубицин) необязательно находится внутри липосомы [см., например, Gabizon et al., J. National Cancer Inst. 81(19): 1484 (1989)].
Концентрация антагониста M-CSF в данных композициях может широко варьировать, например, от менее чем приблизительно 10%, обычно, по меньшей мере, приблизительно от 25% до 75% или 90% по массе, ее выбирают, в первую очередь, в зависимости от объема жидкости, вязкости и др., в соответствии с выбранным способом введения. Существующие способы получения композиций для перорального, местного и парентерального введения хорошо известны или очевидны для специалистов в данной области и подробно описаны, например, в Remington's Pharmaceutical Science, 19th ed., Mack Publishing Co., Easton, PA (1995), который включен в данное описание в качестве ссылки.
Определение эффективного количества композиции данного изобретения можно осуществлять с помощью стандартных эмпирических методов, хорошо известных в данной области. Например, нейтрализующую активность in vivo сыворотки субъекта, получившего определенную дозу антагониста M-CSF, можно оценить с помощью анализа, позволяющего определить способность сыворотки блокировать M-CSF-индуцированную пролиферацию и выживание мышиных моноцитов (клетки CD11b+, подвид клеток CD11, который экспрессирует высокий уровень рецептора M-CSF) in vitro, как описано в Cenci et al., J Clin. Invest. 1055: 1279-87, 2000.
Композиции данного изобретения вводят млекопитающему, страдающему от остеолитического нарушения или предрасположенного к остеолитическому нарушению, включающему в себя раковый метастаз и/или разрежение костей, связанное с раковым метастазом, в количестве, достаточном для предотвращения, или, по меньшей мере, частичной приостановки развития такого заболевания. Эффективное количество антагониста M-CSF варьирует и зависит от тяжести заболевания, а также от массы тела и общего состояния пациента, подлежащего лечению, однако обычно оно варьирует приблизительно от 1,0 мг/кг до 100 мг/кг массы тела, или приблизительно от 10 мг/кг до 90 мг/кг, причем для однократного приема используют дозы, составляющие приблизительно от 20 мг/кг до 80 мг/кг, или приблизительно от 30 мг/кг до 70 мг/кг, или приблизительно от 40 мг/кг до 60 мг/кг. Например, в качестве начальной дозы пациенту можно вводить приблизительно от 10 мг/кг до 50 мг/кг, или приблизительно от 20 мг/кг до 60 мг/кг антитела против MCSF, например, в один или несколько приемов, или путем непрерывной инфузии. Введение осуществляют ежедневно, через день, еженедельно или реже, в зависимости от ответа пациента или от его способности переносить лечение. Для достижения желательного подавления симптомов заболевания может потребоваться введение поддерживающих доз в течение более продолжительного периода времени, такого как 4, 5, 6, 7, 8, 10, 12 недель, или дольше, причем дозы можно регулировать по мере необходимости. Результаты лечения можно легко отслеживать с помощью традиционных методов и анализов.
Композиции можно вводить в один или несколько приемов, причем величину доз и способ введения выбирает лечащий врач. Доза антагониста M-CSF, включающего в себя антитело против M-CSF, подходящая для профилактики или лечения заболевания, зависит от типа заболевания, подлежащего лечению в соответствии с приведенным выше определением, тяжести и течения заболевания, от того, вводят ли антагонист с профилактической или терапевтической целью, предыдущей терапии, клинической истории пациента и ответа пациента на антагонист, а также от выбора лечащего врача. Антагонист можно применять путем однократного или многократного введения.
Антагонистическую композицию получают, разделяют на дозы и вводят в соответствии с успешной медицинской практикой. Факторы, учитывающиеся в данном контексте, включают в себя вид заболевания, подлежащего лечению, вид млекопитающего, подлежащего лечению, клиническое состояние отдельного пациента, причину заболевания, участок доставки средства, способ введения, режим введения, а также другие факторы, известные врачам. Терапевтически эффективное количество вводимого антагониста зависит от указанных факторов и представляет собой минимальное количество, необходимое для предотвращения, облегчения или лечения M-CSF-опосредованного заболевания, состояния или нарушения, предпочтительно для лечения раковых клеток, наиболее предпочтительно для лечения метастазирования опухолевых клеток. Предпочтительно данное количество ниже уровня, который является токсичным для хозяина, или значительно увеличивает чувствительность хозяина к инфекциям.
В другом воплощении данного изобретения предлагается промышленное изделие, содержащее вещества, используемые для лечения описанных выше заболеваний, нарушений или состояний. Промышленное изделие содержит контейнер и этикетку. Подходящие контейнеры включают в себя, например, бутылки, флаконы, шприцы и пробирки. Контейнеры могут быть изготовлены из ряда материалов, таких как стекло или пластик. Контейнер содержит композицию, эффективную для лечения состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой сумку для внутривенного раствора, или флакон с пробкой, которую можно проткнуть иглой для подкожных инъекций). Активное средство, входящее в состав композиции, представляет собой антагонист M-CSF или антитело данного изобретения. Этикетка на контейнере или прикрепленная к контейнеру, указывает, что композиция предназначена для лечения конкретного состояния. Промышленное изделие может дополнительно включать в себя второй контейнер, содержащий фармацевтически приемлемый буфер, такой как забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Оно также может содержать другие вещества, желательные с точки зрения производителя и пользователя, в том числе другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковку с инструкциями по применению.
Данное изобретение иллюстрируется нижеследующими примерами, которые не предназначены для какого-либо ограничения.
ПРИМЕРЫ
ПРИМЕР 1
В данном примере анализируют дозозависимые антирезорбтивные эффекты Zometa (золедронат) на животной модели (фигура 14). Введение ≥0,03 мг/кг Zometa приводит к ингибированию остелитического повреждения, вызванного ростом опухоли в участке кости. Кроме того, дозозависимый ответ наблюдается у мышей после обработки увеличивающимися концентрациями Zometa. Совместное применение mAb 5A1 и 5H4 против мышиного и против человеческого M-CSF также защищает мышей от повреждения кости. Антитело против M-CSF само по себе является более эффективным для лечения тяжелого остеолитического повреждения, чем Zometa в дозе 0,03 мг/кг. Остеолиз оценивают с помощью рентгеновских снимков, полученных в последний день исследования (фигура 14), следующим образом:
0 = нормальное состояние;
1 = сомнительное или нормальное повреждение с нормальной архитектурой внешнего слоя скелета;
2 = явное литическое повреждение с минимальными нарушениями архитектуры внешнего слоя скелета;
3 = обширное повреждение (повреждения) с нарушением архитектуры внешнего слоя скелета;
4 = обширные разрушения с отсутствием архитектуры.
Используя результаты, полученные в данном исходном эксперименте, проводят комбинированное исследование с применением субэффективной дозы Zometa 0,03 мг/кг. Через две недели после инокуляции 6×105 клеток MDA-MB-231Luc в большеберцовую кость, мышей Nu/Nu обрабатывают 5A1/5H4 (10 мг/кг один раз в неделю), Zometa (0,03 мг/кг два раза в неделю) или и антителом и бисфосфонатом. Повреждение кости отслеживают еженедельно с помощью анализа Faxitron (рентгеновский метод), в конце исследования всех животных подвергают последней рентгеноскопии, снимки собирают и группируют, чтобы оценить тяжесть повреждений. Анализ результатов показывает, что и mAb против MCSF, и Zometa являются эффективными средствами для лечения остеолиза, однако лечение сочетанием Zometa и mAb против M-CSF сильнее уменьшает случаи (фигура 15) и степень (фигура 16) лизиса костей, чем лечение каждым из них в отдельности.
На фигуре 16 показано, что обработка 0,03 мг/кг Zometa или 10 мг/кг антитела против MCSF (5A1+5H4) уменьшает остеолитическое повреждение, вызванное ростом опухоли в участке кости. Режим сочетания Zometa с антителом против MCSF дополнительно ингибирует лизис кости. Средние оценки остеолиза рассчитывают, используя 1) среднее значение оценок от 3 произвольных особей и 2) среднее значение в группе (исходно 10 животных/группу).
Остеолиз оценивают с помощью рентгеновских снимков, полученных в последний день исследования, следующим образом:
0 = нормальное состояние;
1 = сомнительное или нормальное повреждение с нормальной архитектурой внешнего слоя скелета;
2 = явное литическое повреждение с минимальными нарушениями архитектуры внешнего слоя скелета;
3 = обширное повреждение (повреждения) с нарушением архитектуры внешнего слоя скелета;
4 = обширные разрушения с отсутствием архитектуры.
Анализ типичных снимков faxitron дополнительно демонстрирует тяжесть повреждений, обнаруженных у нелеченых животных по сравнению с относительно минорными повреждениями у животных, получавшим Zometa и антитело против MCSF (фигура 17). Неблагоприятные взаимодействия, наблюдающиеся в группе, получающей комбинированное лечение, отсутствуют.
В заключение необходимо отметить, что и антитело против MCSF, и Zometa эффективно ингибируют остеолиз, а объединение двух способов лечения приводит к усилению антирезорбтивного эффекта по сравнению с обработкой одним средством. Полученные результаты позволяют предположить, что сочетание может быть безопасным и эффективным способом для тех пациентов с заболеванием кости, которые либо не переносят бисфосфонаты, либо уже подвергались лечению бисфосфонатами.
ПРИМЕР 2
Данный пример показывает, что ингибирование активности M-CSF не влияет на активность дифференцированных остеокластов (фигура 18). Влияние нейтрализующих антител против M-CSF и бисфосфонатов на активность дифференцированных остеокластов анализируют, используя гуманизированный Chir-RX1 и Zometa.
Индуцируют дифференцировку человеческих клеток костного мозга CD34+ (номер по каталогу Biowhittaker 2M-101A, 3×105 клеток/флакон) в остеокласты, используя описанные в данном документе экспериментальные условия. На 1 день оттаивают клетки CD34+, замороженные во флаконе в 10 мл среды (Alpha MEM, содержащая 10% FCS, 1 × Pen Strep и 1 × фунгизон). Клетки промывают один раз, ресуспендируют в 2 мл среды и помещают в планшет OsteoLyse (набор для анализа OsteoLyseTM (Human Collagen), Cambrex) в количестве 100 мкл на лунку. На 2 день, не удаляя исходную среду, в каждую лунку добавляют 50 мкл 4×CSF-1 до конечной концентрации 30 нг/мл и 50 мкл 4×RANKL (sRANKL, каталог Chemicon # GF091, 10 мкг/упаковку) до конечной концентрации 100 нг/мл. На 7 день в каждую лунку добавляют 50 мкл 5×RANKL до конечной концентрации 100 нг/мл.
На 15 день добавляют антитела (либо Chir-RX1, либо контрольное антитело) или Zometa в указанных концентрациях. На 17 день берут 10 мкл супернатанта клеточной культуры и смешивают с 200 мкл реагента, высвобождающего флуорофор, в каждой лунке черного 96-луночного аналитического планшета (входящего в состав набора для анализа OsteoLyse).
ПРИМЕР 3
Данный пример показывает, что Zometa ингибирует активность дифференцированных остеокластов в дозозависимой манере (фигура 19). Влияние нейтрализующих антител против M-CSF и бисфосфоната на активность дифференцированных остеокластов анализируют, используя гуманизированный Chir-RX1 и Zometa.
Индуцируют дифференцировку человеческих клеток костного мозга CD34+ (номер по каталогу Biowhittaker 2M-101A, 3×105 клеток/флакон) в остеокласты, используя описанные в данном документе экспериментальные условия. На 1 день оттаивают клетки CD34+, замороженные во флаконе в 10 мл среды (Alpha MEM, содержащая 10% FCS, 1 × Pen Strep и 1 × фунгизон). Клетки промывают один раз, ресуспендируют в 2 мл среды и помещают в планшет OsteoLyse (набор для анализа OsteoLyseTM (Human Collagen), Cambrex) в количестве 100 мкл на лунку. На 2 день, не удаляя исходную среду, в каждую лунку добавляют 50 мкл 4×CSF-1 до конечной концентрации 30 нг/мл и 50 мкл 4×RANKL (sRANKL, каталог Chemicon # GF091, 10 мкг/упаковку) до конечной концентрации 100 нг/мл. На 7 день в каждую лунку добавляют 50 мкл 5×RANKL до конечной концентрации 100 нг/мл.
На 15 день добавляют антитела (либо Chir-RX1, либо контрольное антитело) или Zometa в указанных концентрациях. На 17 день берут 10 мкл супернатанта клеточной культуры и смешивают с 200 мкл реагента, высвобождающего флуорофор, в каждой лунке черного 96-луночного аналитического планшета (входящего в состав набора для анализа OsteoLyse).
ПРИМЕР 4
Данный пример демонстрирует результаты фармакокинетического и фармакодинамического исследования RX1 у приматов (фигура 20 и фигура 21).
Целью данного исследования является исследование фармакодинамики и фармакокинетики heRX1-10.G1, гуманизированного антитела против человеческого MCSF, после введения человекообразным обезьянам либо в виде однократной медленной болюсной внутривенной инъекции (группы 2 и 3 на 1 день) с последующим 13-недельным периодом наблюдения, либо в виде нескольких инъекций (группа 1, дни 1, 43, 50 и 57) с последующим 10-недельным периодом наблюдения. Гуманизированное моноклональное антитело IgG1 против M-CSF вводят посредством медленной болюсной внутривенной (в/в) инъекции через плечевую вену или подкожную вену ноги.
Во всем мире контролирующие органы требуют применения животных для безопасного тестирования новых лекарственных средств. Антитело не вступает в перекрестные реакции у разных видов грызунов, однако показано, что оно является активным у человекообразных обезьян. Поэтому для проведения биологических исследований с применением внутривенного введения выбирают человекообразных обезьян, так как они относятся к разрешенным, отличным от грызунов видам.
Животных случайным образом распределяют по следующим группам.
| № группы, обозначение | Уровень дозы, (мг/кг) | Объем дозы (мл/кг) | Число животных | |
| Самцы | Самки | |||
| 1. heRX1-10.G1 | 0,2/10а | 4 | 2 | 2 |
| 2. heRX1-10.G1 | 2 | 4 | 2 | 2 |
| 3. heRX1-10.G1 | 20 | 4 | 2 | 2 |
| а На 1 день группа 1 получает дозу 0,2 мг/кг, а на 43, 50 и 57 дни эти же животные получают дозу 10 мг/кг | ||||
Группам 2 и 3 вводят композицию тестируемого средства (в дозах 2 и 20 мг/кг, соответственно) на 1 день путем внутривенной медленной болюсной инъекции в течение приблизительно 10 минут. Композиции вводят через подкожную вену ноги, используя катетер и канюлю. Объем дозы составляет 4 мл/кг и фактическую дозу рассчитывают по самому последнему значению реальной массы тела каждого животного. Группе 1 вводят дозу 0,2 мг/кг на 1 день и затем дозы 10 мг/кг на 43, 50 и 57 дни. Композицию вводят путем внутривенной медленной болюсной инъекции (в течение приблизительно 10 минут) через подкожную вену ноги, используя катетер и канюлю. Объем дозы составляет 4 мл/кг и фактическую дозу рассчитывают по самому последнему значению реальной массы тела каждого животного.
Кровь берут у всех животных для гематологического и/или клинического биохимического анализа следующим образом.
| Время взятия крови | Гематология | Биохимия | ||||
| Группа 1 | Группа 2 | Группа 3 | Группа 1 | Группа 2 | Группа 3 | |
| День 14* | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | 1 мл | 1 мл |
| День 7 | 0,5 мл | 0,5 мл | 0,5 мл | |||
| День 3а | 0,5 мл | 0,5 мл | 0,5 мл | |||
| День 8 | 0,5 мл | 0,5 мл | 0,5 мл | |||
| День 15 | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | 1 мл | 1 мл |
| День 22 | 0,5 мл | 0,5 мл | 0,5 мл | |||
| День 29 | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | 1 мл | 1 мл |
| День 43 | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | 1 мл | 1 мл |
| День 50 | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | ||
| День 57 | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | 1 мл | |
| День 64 | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | ||
| День 71 | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | 1 мл | |
| День 78 | 0,5 мл | 0,5 мл | 0,5 мл | 1 мл | ||
| День 85 | 0,5 мл | 0,5 мл | 1 мл | 1 мл | ||
| День 92 | 0,5 мл | 1 мл | ||||
| День 106 | 0,5 мл | 1 мл | ||||
| День 120 | 0,5 мл | 1 мл | ||||
| а Только количество белых кровяных клеток (общее и дифференциальное) требуется для проведения фенотипирования лимфоцитов | ||||||
Определяют следующие параметры.
Гематология: морфология клеток крови; индексы эритроцитов (MCV, MCH, MCHC и RDW); гематокрит; гемоглобин; средний объем тромбоцитов; количество тромбоцитов; количество красных кровяных клеток; ретикулоциты (абсолютное количество и процентное соотношение); и количество белых кровяных клеток (общее, абсолютное и дифференциальное процентное соотношение).
Клиническая биохимия: соотношение A/G (рассчитанное); аланинаминотрансфераза; альбумин; щелочная фосфатаза; аспартатаминотрансфераза; азот мочевины в крови; кальций; хлорид; холестерин; креатинин; глобулин (рассчитанное количество); глюкоза; неорганический фосфор; калий; натрий; общий, прямой и непрямой билирубин; общий белок; триглицериды; и C-реакционноспособный белок.
Биохимические маркеры метаболизма кости анализируют следующим образом (для определения костных биомаркеров у всех животных берут приблизительно 2 мл крови):
| Время взятия крови | Маркеры формирования кости (ВАР и кальций#) | Маркеры резорбции кости (NTX и CTX) | ||||
| Группа 1 | Группа 2 | Группа 3 | Группа 1 | Группа 2 | Группа 3 | |
| День 14 | 1 мл | 1 мл | 1 мл | 1 мл | 1 мл | 1 мл |
| День 7 | 1 мл | 1 мл | 1 мл | 1 мл | 1 мл | 1 мл |
| День 8 | 1 мл | 1 мл | 1 мл | |||
| День 15 | 1 мл | 1 мл | 1 мл | |||
| День 22 | 1 мл | 1 мл | 1 мл | |||
| День 29 | 1 мл | 1 мл | 1 мл | 1 мл | 1 мл | 1 мл |
| День 43 | 1 мл | 1 мл | 1 мл | |||
| День 45 | 1 мл | |||||
| День 50 | 1 мл | 1 мл | ||||
| День 52 | 1 мл | |||||
| День 57 | 1 мл | 1 мл | 1 мл | 1 мл | 1 мл | |
| День 59 | 1 мл | |||||
| День 64 | 1 мл | 1 мл | ||||
| День 71 | 1 мл | 1 мл | 1 мл | |||
| День 78 | 1 мл | |||||
| День 85 | 1 мл | 1 мл | 1 мл | 1 мл | ||
| День 92 | 1 мл | 1 мл | ||||
| День 106 | 1 мл | 1 мл | ||||
| День 120 | 1 мл | 1 мл | ||||
| (NTX: N-концевой поперечно-сшитый телопептид костного коллагена) (CTX: C-концевой поперечно-сшитый телопептид костного коллагена) |
||||||
Фармакокинетическое исследование и активность M-CSF в сыворотке:
В группах 2 и 3 кровь (1,5 мл от каждого животного) собирают путем венопункции в пробирки для SST до введения композиции, на 1 день (сразу после окончания вливания и через 4 часа после окончания вливания) и на 3, 8, 15, 22, 29, 43, 57, 71 и 85 дни. У животных группы 1 кровь (1,5 мл от каждого животного) собирают путем венопункции в пробирки для SST до введения композиции, на 1 день (сразу после окончания вливания и через 4 часа после окончания вливания) и на 3, 8, 15, 22, 29, 43 (до введения и через 4 часа после окончания вливания), 50 (до введения и через 4 часа после окончания вливания), 57 (до введения и через 4 часа после окончания вливания), 59, 64, 71, 78, 92, 106 и 120 дни. Образцы анализируют на фармакокинетические параметры, активность M-CSF в сыворотке и остаточную активность heRX1-10.G1.
Образцы крови оставляют при комнатной температуре приблизительно на 30 минут, чтобы произошло свертывание крови, и затем центрифугируют. Сыворотку получают путем центрифугирования при приблизительно 2700 об/мин в течение 10 минут при приблизительно 4°C и разделяют ее на 4 аликвоты.
Все патенты США, публикации патентных заявок США, патентные заявки США, иностранные патенты, иностранные патентные заявки и непатентные публикации, упоминающиеся в данном описании и/или перечисленные в инструкции по применению, включены в данное описание в качестве ссылки во всей полноте.
Принимая во внимание вышеизложенное, следует учитывать, что, хотя конкретные воплощения данного изобретения описаны в данном документе с целью иллюстрации, допускается осуществление различных изменений без отступления от сущности и объема данного изобретения.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Liu, et al.
<120> СПОСОБЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ РАКОВОГО МЕТАСТАЗА И РАЗРЕЖЕНИЯ КОСТИ, СВЯЗАННОГО С РАКОВЫМ МЕТАСТАЗОМ
<130> 028099.001
<140> Присвоить
<141>
<150>
<151>
<160> 88
<170> PatentIn version 3.3
<210> 1
<211> 1401
<212> ДНК
<213> Mus musculus
<400> 1
atgggttggt cctgtatcat cctattcctg gtggccactg ccacaggtgt gcactccgac 60
gtgcagcttc aggagtcagg acctggcctc gtgaaacctt ctcagagtct gtccctcacc 120
tgtactgtca ctgactactc catcaccagt gattacgcct ggaactggat acggcaattc 180
ccagggaata aacttgagtg gatggggtac ataagctaca gtggtagcac ttcctacaat 240
ccatctctca aaagtcggat ctccatcact cgagacacat ccaagaacca gttcttcctg 300
cagctgaact ctgtgactac tgaggacaca gccacatatt actgtgcatc cttcgactat 360
gcccacgcca tggattactg gggccaaggg acttcggtca ctgtctcttc cgccaaaaca 420
acagccccat cggtctatcc actggcccct gtgtgtggag atacaactgg ctcctcggtg 480
actctaggat gcctggtcaa gggttatttc cctgagccag tgaccttgac ctggaactct 540
ggatccctgt ccagtggtgt gcacaccttc ccagctgtcc tgcagtctga cctctacacc 600
ctcagcagct cagtgactgt aacctcgagc acctggccca gccagtccat cacctgcaat 660
gtggcccacc cggcaagcag caccaaggtg gacaagaaaa ttgagcccag agggcccaca 720
atcaagccct gtcctccatg caaatgccca gcacctaacc tcttgggtgg accatccgtc 780
ttcatcttcc ctccaaagat caaggatgta ctcatgatct ccctgagccc catagtcaca 840
tgtgtggtgg tggatgtgag cgaggatgac ccagatgtcc agatcagctg gtttgtgaac 900
aacgtggaag tacacacagc tcagacacaa acccatagag aggattacaa cagtactctc 960
cgggtggtca gtgccctccc catccagcac caggactgga tgagtggcaa ggagttcaaa 1020
tgcaaggtca acaacaaaga cctcccagcg cccatcgaga gaaccatctc aaaacccaaa 1080
gggtcagtaa gagctccaca ggtatatgtc ttgcctccac cagaagaaga gatgactaag 1140
aaacaggtca ctctgacctg catggtcaca gacttcatgc ctgaagacat ttacgtggag 1200
tggaccaaca acgggaaaac agagctaaac tacaagaaca ctgaaccagt cctggactct 1260
gatggttctt acttcatgta cagcaagctg agagtggaaa agaagaactg ggtggaaaga 1320
aatagctact cctgttcagt ggtccacgag ggtctgcaca atcaccacac gactaagagc 1380
ttctcccgga ctccgggtaa a 1401
<210> 2
<211> 447
<212> PRT
<213> Mus musculus
<400> 2
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Asp Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Phe Asp Tyr Ala His Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro
115 120 125
Leu Ala Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu Gly
130 135 140
Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp Asn
145 150 155 160
Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Ser Thr
180 185 190
Trp Pro Ser Gln Ser Ile Thr Cys Asn Val Ala His Pro Ala Ser Ser
195 200 205
Thr Lys Val Asp Lys Lys Ile Glu Pro Arg Gly Pro Thr Ile Lys Pro
210 215 220
Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser Leu
245 250 255
Ser Pro Ile Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp Pro
260 265 270
Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr Ala
275 280 285
Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Leu Arg Val Val
290 295 300
Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu Phe
305 310 315 320
Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ala Pro Ile Glu Arg Thr
325 330 335
Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro Gln Val Tyr Val Leu
340 345 350
Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln Val Thr Leu Thr Cys
355 360 365
Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn
370 375 380
Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val Glu Lys Lys
405 410 415
Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser Val Val His Glu Gly
420 425 430
Leu His Asn His His Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly
435 440 445
<210> 3
<211> 702
<212> ДНК
<213> Mus musculus
<400> 3
atggtatcca cacctcagtt ccttgtattt ttgcttttct ggattccagc ctccagaggt 60
gacatcttgc tgactcagtc tccagccatc ctgtctgtga gtccaggaga aagagtcagt 120
ttctcctgca gggccagtca gagcattggc acaagcatac actggtatca gcaaagaaca 180
aatggttctc caaggcttct cataaagtat gcttctgagt ctatctctgg gatcccttcc 240
aggtttagtg gcagtggatc agggacagat tttactctta gcatcaacag tgtggagtct 300
gaagatattg cagattatta ctgtcaacaa attaatagct ggccaaccac gttcggcggg 360
gggacaaagt tggaaataaa acgggctgat gctgcaccaa ctgtatccat cttcccacca 420
tccagtgagc agttaacatc tggaggtgcc tcagtcgtgt gcttcttgaa caacttctac 480
cccaaagaca tcaatgtcaa gtggaagatt gatggcagtg aacgacaaaa tggcgtcctg 540
aacagttgga ctgatcagga cagcaaagac agcacctaca gcatgagcag caccctcacg 600
ttgaccaagg acgagtatga acgacataac agctatacct gtgaggccac tcacaagaca 660
tcaacttcac ccattgtcaa gagcttcaac aggaatgagt gt 702
<210> 4
<211> 214
<212> PRT
<213> Mus musculus
<400> 4
Asp Ile Leu Leu Thr Gln Ser Pro Ala Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Ser
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Gln Gln Ile Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 5
<211> 109
<212> PRT
<213> Mus musculus
<400> 5
Asp Ile Leu Leu Thr Gln Ser Pro Ala Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Ser
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Gln Gln Ile Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala
100 105
<210> 6
<211> 118
<212> PRT
<213> Mus musculus
<400> 6
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Asp Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Phe Asp Tyr Ala His Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 7
<211> 256
<212> PRT
<213> ?
<400> 7
Met Thr Ala Pro Gly Ala Ala Gly Arg Cys Pro Pro Thr Thr Trp Leu
1 5 10 15
Gly Ser Leu Leu Leu Leu Val Cys Leu Leu Ala Ser Arg Ser Ile Thr
20 25 30
Glu Glu Val Ser Glu Tyr Cys Ser His Met Ile Gly Ser Gly His Leu
35 40 45
Gln Ser Leu Gln Arg Leu Ile Asp Ser Gln Met Glu Thr Ser Cys Gln
50 55 60
Ile Thr Phe Glu Phe Val Asp Gln Glu Gln Leu Lys Asp Pro Val Cys
65 70 75 80
Tyr Leu Lys Lys Ala Phe Leu Leu Val Gln Asp Ile Met Glu Asp Thr
85 90 95
Met Arg Phe Arg Asp Asn Thr Pro Asn Ala Ile Ala Ile Val Gln Leu
100 105 110
Gln Glu Leu Ser Leu Arg Leu Lys Ser Cys Phe Thr Lys Asp Tyr Glu
115 120 125
Glu His Asp Lys Ala Cys Val Arg Thr Phe Tyr Glu Thr Pro Leu Gln
130 135 140
Leu Leu Glu Lys Val Lys Asn Val Phe Asn Glu Thr Lys Asn Leu Leu
145 150 155 160
Asp Lys Asp Trp Asn Ile Phe Ser Lys Asn Cys Asn Asn Ser Phe Ala
165 170 175
Glu Cys Ser Ser Gln Gly His Glu Arg Gln Ser Glu Gly Ser Ser Ser
180 185 190
Pro Gln Leu Gln Glu Ser Val Phe His Leu Leu Val Pro Ser Val Ile
195 200 205
Leu Val Leu Leu Ala Val Gly Gly Leu Leu Phe Tyr Arg Trp Arg Arg
210 215 220
Arg Ser His Gln Glu Pro Gln Arg Ala Asp Ser Pro Leu Glu Gln Pro
225 230 235 240
Glu Gly Ser Pro Leu Thr Gln Asp Asp Arg Gln Val Glu Leu Pro Val
245 250 255
<210> 8
<211> 554
<212> PRT
<213> ?
<400> 8
Met Thr Ala Pro Gly Ala Ala Gly Arg Cys Pro Pro Thr Thr Trp Leu
1 5 10 15
Gly Ser Leu Leu Leu Leu Val Cys Leu Leu Ala Ser Arg Ser Ile Thr
20 25 30
Glu Glu Val Ser Glu Tyr Cys Ser His Met Ile Gly Ser Gly His Leu
35 40 45
Gln Ser Leu Gln Arg Leu Ile Asp Ser Gln Met Glu Thr Ser Cys Gln
50 55 60
Ile Thr Phe Glu Phe Val Asp Gln Glu Gln Leu Lys Asp Pro Val Cys
65 70 75 80
Tyr Leu Lys Lys Ala Phe Leu Leu Val Gln Asp Ile Met Glu Asp Thr
85 90 95
Met Arg Phe Arg Asp Asn Thr Pro Asn Ala Ile Ala Ile Val Gln Leu
100 105 110
Gln Glu Leu Ser Leu Arg Leu Lys Ser Cys Phe Thr Lys Asp Tyr Glu
115 120 125
Glu His Asp Lys Ala Cys Val Arg Thr Phe Tyr Glu Thr Pro Leu Gln
130 135 140
Leu Leu Glu Lys Val Lys Asn Val Phe Asn Glu Thr Lys Asn Leu Leu
145 150 155 160
Asp Lys Asp Trp Asn Ile Phe Ser Lys Asn Cys Asn Asn Ser Phe Ala
165 170 175
Glu Cys Ser Ser Gln Asp Val Val Thr Lys Pro Asp Cys Asn Cys Leu
180 185 190
Tyr Pro Lys Ala Ile Pro Ser Ser Asp Pro Ala Ser Val Ser Pro His
195 200 205
Gln Pro Leu Ala Pro Ser Met Ala Pro Val Ala Gly Leu Thr Trp Glu
210 215 220
Asp Ser Glu Gly Thr Glu Gly Ser Ser Leu Leu Pro Gly Glu Gln Pro
225 230 235 240
Leu His Thr Val Asp Pro Gly Ser Ala Lys Gln Arg Pro Pro Arg Ser
245 250 255
Thr Cys Gln Ser Phe Glu Pro Pro Glu Thr Pro Val Val Lys Asp Ser
260 265 270
Thr Ile Gly Gly Ser Pro Gln Pro Arg Pro Ser Val Gly Ala Phe Asn
275 280 285
Pro Gly Met Glu Asp Ile Leu Asp Ser Ala Met Gly Thr Asn Trp Val
290 295 300
Pro Glu Glu Ala Ser Gly Glu Ala Ser Glu Ile Pro Val Pro Gln Gly
305 310 315 320
Thr Glu Leu Ser Pro Ser Arg Pro Gly Gly Gly Ser Met Gln Thr Glu
325 330 335
Pro Ala Arg Pro Ser Asn Phe Leu Ser Ala Ser Ser Pro Leu Pro Ala
340 345 350
Ser Ala Lys Gly Gln Gln Pro Ala Asp Val Thr Gly Thr Ala Leu Pro
355 360 365
Arg Val Gly Pro Val Arg Pro Thr Gly Gln Asp Trp Asn His Thr Pro
370 375 380
Gln Lys Thr Asp His Pro Ser Ala Leu Leu Arg Asp Pro Pro Glu Pro
385 390 395 400
Gly Ser Pro Arg Ile Ser Ser Leu Arg Pro Gln Gly Leu Ser Asn Pro
405 410 415
Ser Thr Leu Ser Ala Gln Pro Gln Leu Ser Arg Ser His Ser Ser Gly
420 425 430
Ser Val Leu Pro Leu Gly Glu Leu Glu Gly Arg Arg Ser Thr Arg Asp
435 440 445
Arg Arg Ser Pro Ala Glu Pro Glu Gly Gly Pro Ala Ser Glu Gly Ala
450 455 460
Ala Arg Pro Leu Pro Arg Phe Asn Ser Val Pro Leu Thr Asp Thr Gly
465 470 475 480
His Glu Arg Gln Ser Glu Gly Ser Ser Ser Pro Gln Leu Gln Glu Ser
485 490 495
Val Phe His Leu Leu Val Pro Ser Val Ile Leu Val Leu Leu Ala Val
500 505 510
Gly Gly Leu Leu Phe Tyr Arg Trp Arg Arg Arg Ser His Gln Glu Pro
515 520 525
Gln Arg Ala Asp Ser Pro Leu Glu Gln Pro Glu Gly Ser Pro Leu Thr
530 535 540
Gln Asp Asp Arg Gln Val Glu Leu Pro Val
545 550
<210> 9
<211> 438
<212> PRT
<213> ?
<400> 9
Met Thr Ala Pro Gly Ala Ala Gly Arg Cys Pro Pro Thr Thr Trp Leu
1 5 10 15
Gly Ser Leu Leu Leu Leu Val Cys Leu Leu Ala Ser Arg Ser Ile Thr
20 25 30
Glu Glu Val Ser Glu Tyr Cys Ser His Met Ile Gly Ser Gly His Leu
35 40 45
Gln Ser Leu Gln Arg Leu Ile Asp Ser Gln Met Glu Thr Ser Cys Gln
50 55 60
Ile Thr Phe Glu Phe Val Asp Gln Glu Gln Leu Lys Asp Pro Val Cys
65 70 75 80
Tyr Leu Lys Lys Ala Phe Leu Leu Val Gln Asp Ile Met Glu Asp Thr
85 90 95
Met Arg Phe Arg Asp Asn Thr Pro Asn Ala Ile Ala Ile Val Gln Leu
100 105 110
Gln Glu Leu Ser Leu Arg Leu Lys Ser Cys Phe Thr Lys Asp Tyr Glu
115 120 125
Glu His Asp Lys Ala Cys Val Arg Thr Phe Tyr Glu Thr Pro Leu Gln
130 135 140
Leu Leu Glu Lys Val Lys Asn Val Phe Asn Glu Thr Lys Asn Leu Leu
145 150 155 160
Asp Lys Asp Trp Asn Ile Phe Ser Lys Asn Cys Asn Asn Ser Phe Ala
165 170 175
Glu Cys Ser Ser Gln Asp Val Val Thr Lys Pro Asp Cys Asn Cys Leu
180 185 190
Tyr Pro Lys Ala Ile Pro Ser Ser Asp Pro Ala Ser Val Ser Pro His
195 200 205
Gln Pro Leu Ala Pro Ser Met Ala Pro Val Ala Gly Leu Thr Trp Glu
210 215 220
Asp Ser Glu Gly Thr Glu Gly Ser Ser Leu Leu Pro Gly Glu Gln Pro
225 230 235 240
Leu His Thr Val Asp Pro Gly Ser Ala Lys Gln Arg Pro Pro Arg Ser
245 250 255
Thr Cys Gln Ser Phe Glu Pro Pro Glu Thr Pro Val Val Lys Asp Ser
260 265 270
Thr Ile Gly Gly Ser Pro Gln Pro Arg Pro Ser Val Gly Ala Phe Asn
275 280 285
Pro Gly Met Glu Asp Ile Leu Asp Ser Ala Met Gly Thr Asn Trp Val
290 295 300
Pro Glu Glu Ala Ser Gly Glu Ala Ser Glu Ile Pro Val Pro Gln Gly
305 310 315 320
Thr Glu Leu Ser Pro Ser Arg Pro Gly Gly Gly Ser Met Gln Thr Glu
325 330 335
Pro Ala Arg Pro Ser Asn Phe Leu Ser Ala Ser Ser Pro Leu Pro Ala
340 345 350
Ser Ala Lys Gly Gln Gln Pro Ala Asp Val Thr Gly His Glu Arg Gln
355 360 365
Ser Glu Gly Ser Ser Ser Pro Gln Leu Gln Glu Ser Val Phe His Leu
370 375 380
Leu Val Pro Ser Val Ile Leu Val Leu Leu Ala Val Gly Gly Leu Leu
385 390 395 400
Phe Tyr Arg Trp Arg Arg Arg Ser His Gln Glu Pro Gln Arg Ala Asp
405 410 415
Ser Pro Leu Glu Gln Pro Glu Gly Ser Pro Leu Thr Gln Asp Asp Arg
420 425 430
Gln Val Glu Leu Pro Val
435
<210> 10
<211> 441
<212> PRT
<213> Mus musculus
<400> 10
Glu Ile Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Thr Gly Thr
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Phe Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Ser Cys Tyr Asn Gly Asp Thr Asn Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Lys Ala Thr Phe Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Phe Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Gly Asn Tyr Pro Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu
115 120 125
Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys
130 135 140
Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser
145 150 155 160
Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp
180 185 190
Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr
195 200 205
Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys
210 215 220
Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val
245 250 255
Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe
260 265 270
Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu
275 280 285
Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His
290 295 300
Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala
305 310 315 320
Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg
325 330 335
Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met
340 345 350
Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro
355 360 365
Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn
370 375 380
Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val
385 390 395 400
Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr
405 410 415
Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu
420 425 430
Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 11
<211> 214
<212> PRT
<213> Mus musculus
<400> 11
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Thr Ser Thr Arg His Ala Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asp Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 12
<211> 449
<212> PRT
<213> Mus musculus
<400> 12
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Asn Gly Gly Gly Ser Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Arg Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gln Gly Ser Tyr Gly Tyr Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala Ala Lys Thr Thr Ala Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Leu Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Thr Ser Ser
180 185 190
Thr Trp Pro Ser Gln Ser Ile Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Glu Pro Arg Gly Pro Thr Ile Lys
210 215 220
Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met Ile Ser
245 250 255
Leu Ser Pro Ile Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp
260 265 270
Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr
275 280 285
Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Leu Arg Val
290 295 300
Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu
305 310 315 320
Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ala Pro Ile Glu Arg
325 330 335
Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro Gln Val Tyr Val
340 345 350
Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln Val Thr Leu Thr
355 360 365
Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr Val Glu Trp Thr
370 375 380
Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val Glu Lys
405 410 415
Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser Val Val His Glu
420 425 430
Gly Leu His Asn His His Thr Thr Lys Ser Phe Ser Arg Thr Pro Gly
435 440 445
Lys
<210> 13
<211> 214
<212> PRT
<213> Mus musculus
<400> 13
Ala Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Ser Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Lys Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 14
<211> 522
<212> PRT
<213> Mus musculus
<400> 14
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Leu Glu Thr Trp Leu Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu
115 120 125
Ala Pro Gly Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys
130 135 140
Leu Val Lys Gly Tyr Phe Pro Glu Ser Val Thr Val Thr Trp Asn Ser
145 150 155 160
Gly Ser Leu Ser Ser Ser Val His Thr Phe Pro Ala Leu Leu Gln Ser
165 170 175
Gly Leu Tyr Thr Met Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp
180 185 190
Pro Ser Gln Thr Val Thr Cys Ser Val Ala His Pro Ala Ser Ser Thr
195 200 205
Thr Val Asp Lys Lys Leu Glu Pro Ser Gly Pro Ile Ser Thr Ile Asn
210 215 220
Pro Cys Pro Pro Cys Lys Glu Cys His Lys Cys Pro Ala Pro Asn Leu
225 230 235 240
Glu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Asn Ile Lys Asp Val
245 250 255
Leu Met Ile Ser Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Val
260 265 270
Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val
275 280 285
Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser
290 295 300
Thr Ile Arg Val Val Ser Thr Leu Pro Ile Gln His Gln Asp Trp Met
305 310 315 320
Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ser
325 330 335
Pro Ile Glu Arg Thr Ile Ser Lys Ile Lys Gly Leu Val Arg Ala Pro
340 345 350
Gln Val Tyr Ile Leu Pro Pro Pro Ala Glu Gln Leu Ser Arg Lys Asp
355 360 365
Val Ser Leu Thr Cys Leu Val Val Gly Phe Asn Pro Gly Asp Ile Ser
370 375 380
Val Glu Trp Thr Ser Asn Gly His Thr Glu Glu Asn Tyr Lys Asp Thr
385 390 395 400
Ala Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Ile Tyr Ser Lys Leu
405 410 415
Asn Met Lys Thr Ser Lys Trp Glu Lys Thr Asp Ser Phe Ser Cys Asn
420 425 430
Val Arg His Glu Gly Leu Lys Asn Tyr Tyr Leu Lys Lys Thr Ile Ser
435 440 445
Arg Ser Pro Gly Leu Asp Leu Asp Asp Ile Cys Ala Glu Ala Lys Asp
450 455 460
Gly Glu Leu Asp Gly Leu Trp Thr Thr Ile Thr Ile Phe Ile Ser Leu
465 470 475 480
Phe Leu Leu Ser Val Cys Tyr Ser Ala Ser Val Thr Leu Phe Lys Val
485 490 495
Lys Trp Ile Phe Ser Ser Val Val Glu Leu Lys Gln Lys Ile Ser Pro
500 505 510
Asp Tyr Arg Asn Met Ile Gly Gln Gly Ala
515 520
<210> 15
<211> 214
<212> PRT
<213> Mus musculus
<400> 15
Asp Ile Leu Leu Thr Gln Ser Pro Ala Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Ser
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Gln Gln Ser Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Trp Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 16
<211> 5
<212> PRT
<213> Homo sapiens
<400> 16
Gly Tyr Phe Met His
1 5
<210> 17
<211> 5
<212> PRT
<213> Homo sapiens
<400> 17
Asp Tyr Tyr Met Tyr
1 5
<210> 18
<211> 6
<212> PRT
<213> Homo sapiens
<400> 18
Ser Asp Tyr Ala Trp Asn
1 5
<210> 19
<211> 17
<212> PRT
<213> Homo sapiens
<400> 19
Tyr Ile Ser Cys Tyr Asn Gly Asp Thr Asn Tyr Asn Gln Asn Phe Lys
1 5 10 15
Gly
<210> 20
<211> 17
<212> PRT
<213> Homo sapiens
<400> 20
Tyr Ile Ser Asn Gly Gly Gly Ser Thr Tyr Tyr Pro Asp Thr Val Lys
1 5 10 15
Gly
<210> 21
<211> 16
<212> PRT
<213> Homo sapiens
<400> 21
Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 22
<211> 8
<212> PRT
<213> Homo sapiens
<400> 22
Glu Gly Gly Asn Tyr Pro Ala Tyr
1 5
<210> 23
<211> 10
<212> PRT
<213> Homo sapiens
<400> 23
Gln Gly Ser Tyr Gly Tyr Pro Phe Ala Tyr
1 5 10
<210> 24
<211> 9
<212> PRT
<213> Homo sapiens
<400> 24
Phe Asp Tyr Ala His Ala Met Asp Tyr
1 5
<210> 25
<211> 8
<212> PRT
<213> Homo sapiens
<400> 25
Leu Glu Thr Trp Leu Phe Asp Tyr
1 5
<210> 26
<211> 7
<212> PRT
<213> Homo sapiens
<400> 26
Asp Tyr Gly Trp Phe Asp Tyr
1 5
<210> 27
<211> 11
<212> PRT
<213> Homo sapiens
<400> 27
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Thr
1 5 10
<210> 28
<211> 11
<212> PRT
<213> Homo sapiens
<400> 28
Ser Ala Ser Gln Gly Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 29
<211> 11
<212> PRT
<213> Homo sapiens
<400> 29
Arg Ala Ser Gln Ser Ile Gly Thr Ser Ile His
1 5 10
<210> 30
<211> 7
<212> PRT
<213> Homo sapiens
<400> 30
Trp Thr Ser Thr Arg His Ala
1 5
<210> 31
<211> 7
<212> PRT
<213> Homo sapiens
<400> 31
Tyr Thr Ser Ser Leu His Ser
1 5
<210> 32
<211> 7
<212> PRT
<213> Homo sapiens
<400> 32
Tyr Ala Ser Glu Ser Ile Ser
1 5
<210> 33
<211> 7
<212> PRT
<213> Homo sapiens
<400> 33
Tyr Thr Ser Glu Ser Ile Ser
1 5
<210> 34
<211> 9
<212> PRT
<213> Homo sapiens
<400> 34
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 35
<211> 9
<212> PRT
<213> Homo sapiens
<400> 35
Gln Gln Tyr Ser Lys Leu Pro Trp Thr
1 5
<210> 36
<211> 9
<212> PRT
<213> Homo sapiens
<400> 36
Gln Gln Ile Asn Ser Trp Pro Thr Thr
1 5
<210> 37
<211> 9
<212> PRT
<213> Homo sapiens
<400> 37
Gln Gln Ser Asn Ser Trp Pro Thr Thr
1 5
<210> 38
<211> 9
<212> PRT
<213> Homo sapiens
<400> 38
Gln Gln Tyr Ser Ser Trp Pro Thr Thr
1 5
<210> 39
<211> 130
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (23)..(23)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (27)..(27)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (29)..(29)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (31)..(36)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (51)..(51)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (56)..(57)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (59)..(59)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (61)..(61)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (84)..(84)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (86)..(86)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (101)..(116)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (119)..(119)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (125)..(125)
<223> Xaa может обозначать любую природную аминокислоту
<400> 39
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Xaa Val Ser Gly Xaa Ser Xaa Ser Xaa Xaa
20 25 30
Xaa Xaa Xaa Xaa Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Xaa Tyr Tyr Arg Ala Xaa Xaa Gly Xaa Thr Xaa Tyr Asn Pro
50 55 60
Ser Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln
65 70 75 80
Phe Ser Leu Xaa Leu Xaa Ser Val Thr Ala Ala Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
100 105 110
Xaa Xaa Xaa Xaa Phe Asp Xaa Trp Gly Gln Gly Thr Xaa Val Thr Val
115 120 125
Ser Ser
130
<210> 40
<211> 354
<212> ДНК
<213> Homo sapiens
<400> 40
gacgtacaac ttcaagaatc tggcccaggt ctcgtcaaac cttctcaaac tctctcactc 60
acctgcactg ttactgacta ctctattaca tccgactacg cttggaactg gatccgacaa 120
tttcctggta aaaaactcga atggatgggt tatatttctt actctggctc cacctcctac 180
aatccttctc tgaaatcacg catcacaatt tcccgcgata cctctaaaaa tcaattttca 240
ctccaactca attctgttac cgccgccgat actgccacct actactgtgc ctcttttgac 300
tacgctcacg ccatggatta ttggggacag ggtactaccg ttaccgtaag ctca 354
<210> 41
<211> 118
<212> PRT
<213> Homo sapiens
<400> 41
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Thr Asp Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Lys Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Ala Ala Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Phe Asp Tyr Ala His Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 42
<211> 354
<212> ДНК
<213> Homo sapiens
<400> 42
caagttcaac ttcaagaatc aggccccgga ctcgttaaac cctctcaaac tctctctctt 60
acttgcactg tatccgatta ctctattact tcagactacg cttggaactg gatcagacaa 120
tttcccggaa aaggactcga atggatggga tatatctctt actctggctc aacctcttac 180
aacccctctc tcaaatctcg aataacaatc tcacgcgata cttctaaaaa tcaattctca 240
cttcaactta actccgttac tgccgccgac actgccgttt actactgtgc ttccttcgat 300
tacgcccacg ctatggatta ttggggacaa ggaactaccg tcactgtcag ctca 354
<210> 43
<211> 118
<212> PRT
<213> Homo sapiens
<400> 43
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Asp Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Lys Gly Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Phe Asp Tyr Ala His Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 44
<211> 327
<212> ДНК
<213> Homo sapiens
<400> 44
gaaatagttc ttactcaatc ccccggtaca ctctcagttt ccccaggcga acgcgtcact 60
ttttcttgca gagcatcaca atcaatcggc acttcaattc attggtatca acaaaaaaca 120
ggacaggccc cacgacttct tattaaatat gcatcagaac gagccacagg catcccagac 180
agattttcag gttcaggatc aggcaccgat ttcacactta caatatccag agtcgaatca 240
gaagattttg cagattacta ttgtcaacaa ataaacagct ggcccactac attcggacaa 300
ggcacaaaac tcgaaattaa acgtacg 327
<210> 45
<211> 109
<212> PRT
<213> Homo sapiens
<400> 45
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Lys Thr Gly Gln Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Arg Ile Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Gln Gln Ile Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr
100 105
<210> 46
<211> 327
<212> ДНК
<213> Homo sapiens
<400> 46
gaaatagttc ttactcaatc ccccggtaca ctctcagttt ccccaggcga acgcgtcact 60
ttttcttgca gagcatcaca atcaatcggc acttcaattc attggtatca acaaaaaaca 120
ggacaggccc cacgacttct tattaaatat gcatcagaac gagccacagg catcccagac 180
agattttcag gttcaggatc aggcaccgat ttcacactta caatatccag agtcgaatca 240
gaagattttg cagattacta ttgtcaacaa ataaacagct ggcccactac attcggacaa 300
ggcacaaaac tcgaaattaa acgtacg 327
<210> 47
<211> 109
<212> PRT
<213> Homo sapiens
<400> 47
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Lys Thr Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Gln Gln Ile Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr
100 105
<210> 48
<211> 109
<212> PRT
<213> Homo sapiens
<400> 48
Asp Ile Leu Leu Thr Gln Ser Pro Ala Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Gln Gln Ile Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr
100 105
<210> 49
<211> 111
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (98)..(98)
<223> Xaa может обозначать любую природную аминокислоту
<400> 49
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Pro Xaa Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105 110
<210> 50
<211> 108
<212> PRT
<213> Homo sapiens
<400> 50
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Gln Ala Ser Glu Gly Ile Gly Asn Tyr
20 25 30
Leu Tyr Trp Tyr Gln Gln Lys Pro Asp Gln Ala Lys Leu Leu Ile Lys
35 40 45
Tyr Ala Ser Gln Ser Ile Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Lys His Pro Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105
<210> 51
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая цепь низкого риска в соответствии с подгруппой VK6 2-1-(1) А14:
<400> 51
Asp Ile Val Leu Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Phe Thr Cys Gln Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Lys Thr Asp Gln Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Glu Ala
65 70 75 80
Glu Asp Ala Ala Asp Tyr Tyr Cys Gln Gln Ile Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr
100 105
<210> 52
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Легкая цепь низкого + среднего риска в соответствии с подгруппой VK6 2-1-(1) А14: последовательность ДНК
<400> 52
gacatagttc tcacacaatc accagcattc ctctcagtta cacccggcga aaaagtaacc 60
tttacctgtc aggcttctca atctatcggc acttctattc actggtatca acaaaaaacc 120
gatcaagctc ctaaactcct cataaaatac gcatccgaat ccatctccgg tatcccctcc 180
agattttcag gctccggctc cggcacagat ttcaccctta ccattagctc agttgaagcc 240
gaagacgcag ctgattacta ctgtcaacaa ataaactcat ggcccactac tttcggcggc 300
ggcactaaac tcgaaataaa acgtacg 327
<210> 53
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая цепь низкого + среднего риска в соответствии с подгруппой VK6 2-1-(1) А14:
<400> 53
Asp Ile Val Leu Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Phe Thr Cys Gln Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Lys Thr Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Glu Ala
65 70 75 80
Glu Asp Ala Ala Asp Tyr Tyr Cys Gln Gln Ile Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr
100 105
<210> 54
<211> 100
<212> PRT
<213> Homo sapiens
<400> 54
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Asp Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg
100
<210> 55
<211> 98
<212> PRT
<213> Homo sapiens
<400> 55
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 56
<211> 98
<212> PRT
<213> Homo sapiens
<400> 56
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gly
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Asn Trp Trp Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Glu Ile Tyr His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Lys Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 57
<211> 98
<212> PRT
<213> Homo sapiens
<400> 57
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg
<210> 58
<211> 101
<212> PRT
<213> Homo sapiens
<400> 58
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg
100
<210> 59
<211> 98
<212> PRT
<213> Homo sapiens
<400> 59
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Asn Thr Gly Asn Pro Thr Tyr Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Cys Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 60
<211> 58
<212> PRT
<213> Mus musculus
<400> 60
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Asp Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr
50 55
<210> 61
<211> 59
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (1)..(1)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (16)..(16)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (30)..(30)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (33)..(33)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (35)..(35)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (50)..(50)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (52)..(52)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (55)..(56)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (58)..(58)
<223> Xaa может обозначать любую природную аминокислоту
<400> 61
Xaa Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Xaa
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Xaa Ser Tyr
20 25 30
Xaa Ile Xaa Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Xaa Ile Xaa Pro Tyr Xaa Xaa Gly Xaa Thr
50 55
<210> 62
<211> 62
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (23)..(23)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (27)..(27)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (29)..(29)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (32)..(37)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (52)..(52)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (58)..(59)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (61)..(61)
<223> Xaa может обозначать любую природную аминокислоту
<400> 62
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Xaa Val Ser Gly Xaa Ser Xaa Ser Ser Xaa
20 25 30
Xaa Xaa Xaa Xaa Xaa Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Xaa Ile Tyr Tyr Arg Ala Xaa Xaa Gly Xaa Thr
50 55 60
<210> 63
<211> 60
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (31)..(31)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (33)..(33)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (35)..(35)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (49)..(50)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (52)..(53)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (55)..(56)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (58)..(59)
<223> Xaa может обозначать любую природную аминокислоту
<400> 63
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Xaa Tyr
20 25 30
Xaa Met Xaa Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Xaa Xaa Ile Xaa Xaa Lys Xaa Xaa Gly Xaa Xaa Thr
50 55 60
<210> 64
<211> 58
<212> PRT
<213> Homo sapiens
<400> 64
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr
50 55
<210> 65
<211> 59
<212> PRT
<213> Homo sapiens
<400> 65
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Asp Asp Lys
50 55
<210> 66
<211> 58
<212> PRT
<213> Homo sapiens
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys
50 55
<210> 67
<211> 58
<212> PRT
<213> Homo sapiens
<400> 67
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gly
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Asn Trp Trp Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Glu Ile Tyr His Ser Gly Ser Thr
50 55
<210> 68
<211> 58
<212> PRT
<213> Homo sapiens
<400> 68
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr
50 55
<210> 69
<211> 61
<212> PRT
<213> Homo sapiens
<400> 69
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn
50 55 60
<210> 70
<211> 58
<212> PRT
<213> Homo sapiens
<400> 70
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Asn Thr Gly Asn Pro
50 55
<210> 71
<211> 60
<212> PRT
<213> Mus musculus
<400> 71
Ser Tyr Asn Pro Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr
1 5 10 15
Ser Lys Asn Gln Phe Phe Leu Gln Leu Asn Ser Val Thr Thr Glu Asp
20 25 30
Thr Ala Thr Tyr Tyr Cys Ala Ser Phe Asp Tyr Ala His Ala Met Asp
35 40 45
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
50 55 60
<210> 72
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (14)..(14)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (16)..(16)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (31)..(31)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (41)..(53)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (55)..(56)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (59)..(59)
<223> Xaa может обозначать любую природную аминокислоту
<400> 72
Asn Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Xaa Asp Xaa
1 5 10 15
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Xaa Asp
20 25 30
Thr Ala Val Tyr Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Asp Xaa Xaa Phe Asp Xaa Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 73
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (1)..(1)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (24)..(24)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (26)..(26)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (41)..(56)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (59)..(59)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (65)..(65)
<223> Xaa может обозначать любую природную аминокислоту
<400> 73
Xaa Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr
1 5 10 15
Ser Lys Asn Gln Phe Ser Leu Xaa Leu Xaa Ser Val Thr Ala Ala Asp
20 25 30
Thr Ala Val Tyr Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Phe Asp Xaa Trp Gly Gln Gly Thr
50 55 60
Xaa Val Thr Val Ser Ser
65 70
<210> 74
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (40)..(52)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (55)..(56)
<223> Xaa может обозначать любую природную аминокислоту
<220>
<221> вариабельный элемент
<222> (59)..(59)
<223> Xaa может обозначать любую природную аминокислоту
<400> 74
Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
1 5 10 15
Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys Ala Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Tyr Tyr Xaa Xaa Phe Asp Xaa Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 75
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (41)..(55)
<223> Xaa может обозначать любую природную аминокислоту
<400> 75
Asn Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr
1 5 10 15
Ser Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp
20 25 30
Thr Ala Val Tyr Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 76
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (42)..(55)
<223> Xaa может обозначать любую природную аминокислоту
<400> 76
Arg Tyr Ser Pro Ser Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr
1 5 10 15
Ser Lys Asn Gln Val Val Leu Thr Met Thr Asn Met Asp Pro Val Asp
20 25 30
Thr Ala Thr Tyr Tyr Cys Ala His Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 77
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (41)..(55)
<223> Xaa может обозначать любую природную аминокислоту
<400> 77
Tyr Tyr Val Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
1 5 10 15
Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 78
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (41)..(55)
<223> Xaa может обозначать любую природную аминокислоту
<400> 78
Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Ser Val Asp Lys
1 5 10 15
Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp
20 25 30
Thr Ala Val Tyr Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 79
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (41)..(55)
<223> Xaa может обозначать любую природную аминокислоту
<400> 79
Arg Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys
1 5 10 15
Ser Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp
20 25 30
Thr Ala Met Tyr Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 80
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (41)..(55)
<223> Xaa может обозначать любую природную аминокислоту
<400> 80
Asp Tyr Ala Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr
1 5 10 15
Ser Lys Asn Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 81
<211> 70
<212> PRT
<213> Homo sapiens
<220>
<221> вариабельный элемент
<222> (41)..(55)
<223> Xaa может обозначать любую природную аминокислоту
<400> 81
Thr Tyr Ala Gln Gly Phe Thr Gly Arg Phe Val Phe Ser Leu Asp Thr
1 5 10 15
Ser Val Ser Thr Ala Tyr Leu Gln Ile Cys Ser Leu Lys Ala Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys Ala Arg Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
50 55 60
Leu Val Thr Val Ser Ser
65 70
<210> 82
<211> 1404
<212> ДНК
<213> Homo sapiens
<400> 82
atgggatgga gttgcattat acttttcctc gttgccaccg ccactggagt tcactctgac 60
gtacaacttc aagaatctgg cccaggtctc gtcaaacctt ctcaaactct ctcactcacc 120
tgcactgtta ctgactactc tattacatcc gactacgctt ggaactggat ccgacaattt 180
cctggtaaaa aactcgaatg gatgggttat atttcttact ctggctccac ctcctacaat 240
ccttctctga aatcacgcat cacaatttcc cgcgatacct ctaaaaatca attttcactc 300
caactcaatt ctgttaccgc cgccgatact gccacctact actgtgcctc ttttgactac 360
gctcacgcca tggattattg gggacagggt actaccgtta ccgtaagctc agccagcaca 420
aagggcccat cggtcttccc cctggcaccc tcctccaaga gcacctctgg gggcacagcg 480
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 540
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 600
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc 660
aacgtgaatc acaagcccag caacaccaag gtggacaaga gagttgagcc caaatcttgt 720
gacaaaactc acacatgtcc accgtgccca gcacctgaac tcctgggggg accgtcagtc 780
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca 840
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac 900
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagtacaa cagcacgtac 960
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag 1020
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa 1080
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggagga gatgaccaag 1140
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 1200
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1260
gacggctcct tcttcctcta tagcaagctc accgtggaca agagcaggtg gcagcagggg 1320
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 1380
ctctccctgt ccccgggtaa atga 1404
<210> 83
<211> 467
<212> PRT
<213> Homo sapiens
<400> 83
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys
20 25 30
Pro Ser Gln Thr Leu Ser Leu Thr Cys Thr Val Thr Asp Tyr Ser Ile
35 40 45
Thr Ser Asp Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Lys Lys
50 55 60
Leu Glu Trp Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn
65 70 75 80
Pro Ser Leu Lys Ser Arg Ile Thr Ile Ser Arg Asp Thr Ser Lys Asn
85 90 95
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Ala Ala Asp Thr Ala Thr
100 105 110
Tyr Tyr Cys Ala Ser Phe Asp Tyr Ala His Ala Met Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 84
<211> 3985
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (293)..(3211)
<220>
<221> сигнальный пептид
<222> (293)..(349)
<220>
<221> зрелый пептид
<222> (350)..(3208)
<220>
<221> вариабельный элемент
<222> (374)..(598)
<223> Иммуноглобулин
<220>
<221> вариабельный элемент
<222> (917)..(1177)
<223> Иммуноглобулин
<220>
<221> вариабельный элемент
<222> (2516)..(3022)
<223> Тирозинкиназа, каталитический домен
<400> 84
gaagggcaga cagagtgtcc aaaagcgtga gagcacgaag tgaggagaag gtggagaaga 60
gagaagagga agaggaagag gaagagagga agcggaggga actgcggcca ggctaaaagg 120
ggaagaagag gatcagccca aggaggagga agaggaaaac aagacaaaca gccagtgcag 180
aggagaggaa cgtgtgtcca gtgtcccgat ccctgcggag ctagtagctg agagctctgt 240
gccctgggca ccttgcagcc ctgcacctgc ctgccacttc cccaccgagg cc atg ggc 298
Met Gly
1
cca gga gtt ctg ctg ctc ctg ctg gtg gcc aca gct tgg cat ggt cag 346
Pro Gly Val Leu Leu Leu Leu Leu Val Ala Thr Ala Trp His Gly Gln
5 10 15
gga atc cca gtg ata gag ccc agt gtc cct gag ctg gtc gtg aag cca 394
Gly Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val Lys Pro
20 25 30
gga gca acg gtg acc ttg cga tgt gtg ggc aat ggc agc gtg gaa tgg 442
Gly Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val Glu Trp
35 40 45 50
gat ggc ccc cca tca cct cac tgg acc ctg tac tct gat ggc tcc agc 490
Asp Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly Ser Ser
55 60 65
agc atc ctc agc acc aac aac gct acc ttc caa aac acg ggg acc tat 538
Ser Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly Thr Tyr
70 75 80
cgc tgc act gag cct gga gac ccc ctg gga ggc agc gcc gcc atc cac 586
Arg Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala Ile His
85 90 95
ctc tat gtc aaa gac cct gcc cgg ccc tgg aac gtg cta gca cag gag 634
Leu Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala Gln Glu
100 105 110
gtg gtc gtg ttc gag gac cag gac gca cta ctg ccc tgt ctg ctc aca 682
Val Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu Leu Thr
115 120 125 130
gac ccg gtg ctg gaa gca ggc gtc tcg ctg gtg cgt gtg cgt ggc cgg 730
Asp Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg Gly Arg
135 140 145
ccc ctc atg cgc cac acc aac tac tcc ttc tcg ccc tgg cat ggc ttc 778
Pro Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His Gly Phe
150 155 160
acc atc cac agg gcc aag ttc att cag agc cag gac tat caa tgc agt 826
Thr Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln Cys Ser
165 170 175
gcc ctg atg ggt ggc agg aag gtg atg tcc atc agc atc cgg ctg aaa 874
Ala Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg Leu Lys
180 185 190
gtg cag aaa gtc atc cca ggg ccc cca gcc ttg aca ctg gtg cct gca 922
Val Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val Pro Ala
195 200 205 210
gag ctg gtg cgg att cga ggg gag gct gcc cag atc gtg tgc tca gcc 970
Glu Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala
215 220 225
agc agc gtt gat gtt aac ttt gat gtc ttc ctc caa cac aac aac acc 1018
Ser Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn Asn Thr
230 235 240
aag ctc gca atc cct caa caa tct gac ttt cat aat aac cgt tac caa 1066
Lys Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg Tyr Gln
245 250 255
aaa gtc ctg acc ctc aac ctc gat caa gta gat ttc caa cat gcc ggc 1114
Lys Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His Ala Gly
260 265 270
aac tac tcc tgc gtg gcc agc aac gtg cag ggc aag cac tcc acc tcc 1162
Asn Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser Thr Ser
275 280 285 290
atg ttc ttc cgg gtg gta gag agt gcc tac ttg aac ttg agc tct gag 1210
Met Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser Ser Glu
295 300 305
cag aac ctc atc cag gag gtg acc gtg ggg gag ggg ctc aac ctc aaa 1258
Gln Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn Leu Lys
310 315 320
gtc atg gtg gag gcc tac cca ggc ctg caa ggt ttt aac tgg acc tac 1306
Val Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp Thr Tyr
325 330 335
ctg gga ccc ttt tct gac cac cag cct gag ccc aag ctt gct aat gct 1354
Leu Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala Asn Ala
340 345 350
acc acc aag gac aca tac agg cac acc ttc acc ctc tct ctg ccc cgc 1402
Thr Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu Pro Arg
355 360 365 370
ctg aag ccc tct gag gct ggc cgc tac tcc ttc ctg gcc aga aac cca 1450
Leu Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg Asn Pro
375 380 385
gga ggc tgg aga gct ctg acg ttt gag ctc acc ctt cga tac ccc cca 1498
Gly Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro
390 395 400
gag gta agc gtc ata tgg aca ttc atc aac ggc tct ggc acc ctt ttg 1546
Glu Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr Leu Leu
405 410 415
tgt gct gcc tct ggg tac ccc cag ccc aac gtg aca tgg ctg cag tgc 1594
Cys Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu Gln Cys
420 425 430
agt ggc cac act gat agg tgt gat gag gcc caa gtg ctg cag gtc tgg 1642
Ser Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln Val Trp
435 440 445 450
gat gac cca tac cct gag gtc ctg agc cag gag ccc ttc cac aag gtg 1690
Asp Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His Lys Val
455 460 465
acg gtg cag agc ctg ctg act gtt gag acc tta gag cac aac caa acc 1738
Thr Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn Gln Thr
470 475 480
tac gag tgc agg gcc cac aac agc gtg ggg agt ggc tcc tgg gcc ttc 1786
Tyr Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp Ala Phe
485 490 495
ata ccc atc tct gca gga gcc cac acg cat ccc ccg gat gag ttc ctc 1834
Ile Pro Ile Ser Ala Gly Ala His Thr His Pro Pro Asp Glu Phe Leu
500 505 510
ttc aca cca gtg gtg gtc gcc tgc atg tcc atc atg gcc ttg ctg ctg 1882
Phe Thr Pro Val Val Val Ala Cys Met Ser Ile Met Ala Leu Leu Leu
515 520 525 530
ctg ctg ctc ctg ctg cta ttg tac aag tat aag cag aag ccc aag tac 1930
Leu Leu Leu Leu Leu Leu Leu Tyr Lys Tyr Lys Gln Lys Pro Lys Tyr
535 540 545
cag gtc cgc tgg aag atc atc gag agc tat gag ggc aac agt tat act 1978
Gln Val Arg Trp Lys Ile Ile Glu Ser Tyr Glu Gly Asn Ser Tyr Thr
550 555 560
ttc atc gac ccc acg cag ctg cct tac aac gag aag tgg gag ttc ccc 2026
Phe Ile Asp Pro Thr Gln Leu Pro Tyr Asn Glu Lys Trp Glu Phe Pro
565 570 575
cgg aac aac ctg cag ttt ggt aag acc ctc gga gct gga gcc ttt ggg 2074
Arg Asn Asn Leu Gln Phe Gly Lys Thr Leu Gly Ala Gly Ala Phe Gly
580 585 590
aag gtg gtg gag gcc acg gcc ttt ggt ctg ggc aag gag gat gct gtc 2122
Lys Val Val Glu Ala Thr Ala Phe Gly Leu Gly Lys Glu Asp Ala Val
595 600 605 610
ctg aag gtg gct gtg aag atg ctg aag tcc acg gcc cat gct gat gag 2170
Leu Lys Val Ala Val Lys Met Leu Lys Ser Thr Ala His Ala Asp Glu
615 620 625
aag gag gcc ctc atg tcc gag ctg aag atc atg agc cac ctg ggc cag 2218
Lys Glu Ala Leu Met Ser Glu Leu Lys Ile Met Ser His Leu Gly Gln
630 635 640
cac gag aac atc gtc aac ctt ctg gga gcc tgt acc cat gga ggc cct 2266
His Glu Asn Ile Val Asn Leu Leu Gly Ala Cys Thr His Gly Gly Pro
645 650 655
gta ctg gtc atc acg gag tac tgt tgc tat ggc gac ctg ctc aac ttt 2314
Val Leu Val Ile Thr Glu Tyr Cys Cys Tyr Gly Asp Leu Leu Asn Phe
660 665 670
ctg cga agg aag gct gag gcc atg ctg gga ccc agc ctg agc ccc ggc 2362
Leu Arg Arg Lys Ala Glu Ala Met Leu Gly Pro Ser Leu Ser Pro Gly
675 680 685 690
cag gac ccc gag gga ggc gtc gac tat aag aac atc cac ctc gag aag 2410
Gln Asp Pro Glu Gly Gly Val Asp Tyr Lys Asn Ile His Leu Glu Lys
695 700 705
aaa tat gtc cgc agg gac agt ggc ttc tcc agc cag ggt gtg gac acc 2458
Lys Tyr Val Arg Arg Asp Ser Gly Phe Ser Ser Gln Gly Val Asp Thr
710 715 720
tat gtg gag atg agg cct gtc tcc act tct tca aat gac tcc ttc tct 2506
Tyr Val Glu Met Arg Pro Val Ser Thr Ser Ser Asn Asp Ser Phe Ser
725 730 735
gag caa gac ctg gac aag gag gat gga cgg ccc ctg gag ctc cgg gac 2554
Glu Gln Asp Leu Asp Lys Glu Asp Gly Arg Pro Leu Glu Leu Arg Asp
740 745 750
ctg ctt cac ttc tcc agc caa gta gcc cag ggc atg gcc ttc ctc gct 2602
Leu Leu His Phe Ser Ser Gln Val Ala Gln Gly Met Ala Phe Leu Ala
755 760 765 770
tcc aag aat tgc atc cac cgg gac gtg gca gcg cgt aac gtg ctg ttg 2650
Ser Lys Asn Cys Ile His Arg Asp Val Ala Ala Arg Asn Val Leu Leu
775 780 785
acc aat ggt cat gtg gcc aag att ggg gac ttc ggg ctg gct agg gac 2698
Thr Asn Gly His Val Ala Lys Ile Gly Asp Phe Gly Leu Ala Arg Asp
790 795 800
atc atg aat gac tcc aac tac att gtc aag ggc aat gcc cgc ctg cct 2746
Ile Met Asn Asp Ser Asn Tyr Ile Val Lys Gly Asn Ala Arg Leu Pro
805 810 815
gtg aag tgg atg gcc cca gag agc atc ttt gac tgt gtc tac acg gtt 2794
Val Lys Trp Met Ala Pro Glu Ser Ile Phe Asp Cys Val Tyr Thr Val
820 825 830
cag agc gac gtc tgg tcc tat ggc atc ctc ctc tgg gag atc ttc tca 2842
Gln Ser Asp Val Trp Ser Tyr Gly Ile Leu Leu Trp Glu Ile Phe Ser
835 840 845 850
ctt ggg ctg aat ccc tac cct ggc atc ctg gtg aac agc aag ttc tat 2890
Leu Gly Leu Asn Pro Tyr Pro Gly Ile Leu Val Asn Ser Lys Phe Tyr
855 860 865
aaa ctg gtg aag gat gga tac caa atg gcc cag cct gca ttt gcc cca 2938
Lys Leu Val Lys Asp Gly Tyr Gln Met Ala Gln Pro Ala Phe Ala Pro
870 875 880
aag aat ata tac agc atc atg cag gcc tgc tgg gcc ttg gag ccc acc 2986
Lys Asn Ile Tyr Ser Ile Met Gln Ala Cys Trp Ala Leu Glu Pro Thr
885 890 895
cac aga ccc acc ttc cag cag atc tgc tcc ttc ctt cag gag cag gcc 3034
His Arg Pro Thr Phe Gln Gln Ile Cys Ser Phe Leu Gln Glu Gln Ala
900 905 910
caa gag gac agg aga gag cgg gac tat acc aat ctg ccg agc agc agc 3082
Gln Glu Asp Arg Arg Glu Arg Asp Tyr Thr Asn Leu Pro Ser Ser Ser
915 920 925 930
aga agc ggt ggc agc ggc agc agc agc agt gag ctg gag gag gag agc 3130
Arg Ser Gly Gly Ser Gly Ser Ser Ser Ser Glu Leu Glu Glu Glu Ser
935 940 945
tct agt gag cac ctg acc tgc tgc gag caa ggg gat atc gcc cag ccc 3178
Ser Ser Glu His Leu Thr Cys Cys Glu Gln Gly Asp Ile Ala Gln Pro
950 955 960
ttg ctg cag ccc aac aac tat cag ttc tgc tga ggagttgacg acagggagta 3231
Leu Leu Gln Pro Asn Asn Tyr Gln Phe Cys
965 970
ccactctccc ctcctccaaa cttcaactcc tccatggatg gggcgacacg gggagaacat 3291
acaaactctg ccttcggtca tttcactcaa cagctcggcc cagctctgaa acttgggaag 3351
gtgagggatt caggggaggt cagaggatcc cacttcctga gcatgggcca tcactgccag 3411
tcaggggctg ggggctgagc cctcaccccc ccctccccta ctgttctcat ggtgttggcc 3471
tcgtgtttgc tatgccaact agtagaacct tctttcctaa tccccttatc ttcatggaaa 3531
tggactgact ttatgcctat gaagtcccca ggagctacac tgatactgag aaaaccaggc 3591
tctttggggc tagacagact ggcagagagt gagatctccc tctctgagag gagcagcaga 3651
tgctcacaga ccacactcag ctcaggcccc ttggagcagg atggctcctc taagaatctc 3711
acaggacctc ttagtctctg ccctatacgc cgccttcact ccacagcctc acccctccca 3771
cccccatact ggtactgctg taatgagcca agtggcagct aaaagttggg ggtgttctgc 3831
ccagtcccgt cattctgggc tagaaggcag gggaccttgg catgtggctg gccacaccaa 3891
gcaggaagca caaactcccc caagctgact catcctaact aacagtcacg ccgtgggatg 3951
tctctgtcca cattaaacta acagcattaa tgca 3985
<210> 85
<211> 972
<212> PRT
<213> Homo sapiens
<400> 85
Met Gly Pro Gly Val Leu Leu Leu Leu Leu Val Ala Thr Ala Trp His
1 5 10 15
Gly Gln Gly Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val
20 25 30
Lys Pro Gly Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val
35 40 45
Glu Trp Asp Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly
50 55 60
Ser Ser Ser Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly
65 70 75 80
Thr Tyr Arg Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala
85 90 95
Ile His Leu Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala
100 105 110
Gln Glu Val Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu
115 120 125
Leu Thr Asp Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg
130 135 140
Gly Arg Pro Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His
145 150 155 160
Gly Phe Thr Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln
165 170 175
Cys Ser Ala Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg
180 185 190
Leu Lys Val Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val
195 200 205
Pro Ala Glu Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys
210 215 220
Ser Ala Ser Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn
225 230 235 240
Asn Thr Lys Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg
245 250 255
Tyr Gln Lys Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His
260 265 270
Ala Gly Asn Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser
275 280 285
Thr Ser Met Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser
290 295 300
Ser Glu Gln Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn
305 310 315 320
Leu Lys Val Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp
325 330 335
Thr Tyr Leu Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala
340 345 350
Asn Ala Thr Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu
355 360 365
Pro Arg Leu Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg
370 375 380
Asn Pro Gly Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr
385 390 395 400
Pro Pro Glu Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr
405 410 415
Leu Leu Cys Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu
420 425 430
Gln Cys Ser Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln
435 440 445
Val Trp Asp Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His
450 455 460
Lys Val Thr Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn
465 470 475 480
Gln Thr Tyr Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp
485 490 495
Ala Phe Ile Pro Ile Ser Ala Gly Ala His Thr His Pro Pro Asp Glu
500 505 510
Phe Leu Phe Thr Pro Val Val Val Ala Cys Met Ser Ile Met Ala Leu
515 520 525
Leu Leu Leu Leu Leu Leu Leu Leu Leu Tyr Lys Tyr Lys Gln Lys Pro
530 535 540
Lys Tyr Gln Val Arg Trp Lys Ile Ile Glu Ser Tyr Glu Gly Asn Ser
545 550 555 560
Tyr Thr Phe Ile Asp Pro Thr Gln Leu Pro Tyr Asn Glu Lys Trp Glu
565 570 575
Phe Pro Arg Asn Asn Leu Gln Phe Gly Lys Thr Leu Gly Ala Gly Ala
580 585 590
Phe Gly Lys Val Val Glu Ala Thr Ala Phe Gly Leu Gly Lys Glu Asp
595 600 605
Ala Val Leu Lys Val Ala Val Lys Met Leu Lys Ser Thr Ala His Ala
610 615 620
Asp Glu Lys Glu Ala Leu Met Ser Glu Leu Lys Ile Met Ser His Leu
625 630 635 640
Gly Gln His Glu Asn Ile Val Asn Leu Leu Gly Ala Cys Thr His Gly
645 650 655
Gly Pro Val Leu Val Ile Thr Glu Tyr Cys Cys Tyr Gly Asp Leu Leu
660 665 670
Asn Phe Leu Arg Arg Lys Ala Glu Ala Met Leu Gly Pro Ser Leu Ser
675 680 685
Pro Gly Gln Asp Pro Glu Gly Gly Val Asp Tyr Lys Asn Ile His Leu
690 695 700
Glu Lys Lys Tyr Val Arg Arg Asp Ser Gly Phe Ser Ser Gln Gly Val
705 710 715 720
Asp Thr Tyr Val Glu Met Arg Pro Val Ser Thr Ser Ser Asn Asp Ser
725 730 735
Phe Ser Glu Gln Asp Leu Asp Lys Glu Asp Gly Arg Pro Leu Glu Leu
740 745 750
Arg Asp Leu Leu His Phe Ser Ser Gln Val Ala Gln Gly Met Ala Phe
755 760 765
Leu Ala Ser Lys Asn Cys Ile His Arg Asp Val Ala Ala Arg Asn Val
770 775 780
Leu Leu Thr Asn Gly His Val Ala Lys Ile Gly Asp Phe Gly Leu Ala
785 790 795 800
Arg Asp Ile Met Asn Asp Ser Asn Tyr Ile Val Lys Gly Asn Ala Arg
805 810 815
Leu Pro Val Lys Trp Met Ala Pro Glu Ser Ile Phe Asp Cys Val Tyr
820 825 830
Thr Val Gln Ser Asp Val Trp Ser Tyr Gly Ile Leu Leu Trp Glu Ile
835 840 845
Phe Ser Leu Gly Leu Asn Pro Tyr Pro Gly Ile Leu Val Asn Ser Lys
850 855 860
Phe Tyr Lys Leu Val Lys Asp Gly Tyr Gln Met Ala Gln Pro Ala Phe
865 870 875 880
Ala Pro Lys Asn Ile Tyr Ser Ile Met Gln Ala Cys Trp Ala Leu Glu
885 890 895
Pro Thr His Arg Pro Thr Phe Gln Gln Ile Cys Ser Phe Leu Gln Glu
900 905 910
Gln Ala Gln Glu Asp Arg Arg Glu Arg Asp Tyr Thr Asn Leu Pro Ser
915 920 925
Ser Ser Arg Ser Gly Gly Ser Gly Ser Ser Ser Ser Glu Leu Glu Glu
930 935 940
Glu Ser Ser Ser Glu His Leu Thr Cys Cys Glu Gln Gly Asp Ile Ala
945 950 955 960
Gln Pro Leu Leu Gln Pro Asn Asn Tyr Gln Phe Cys
<210> 86
<211> 327
<212> ДНК
<213> Homo sapiens
<400> 86
gaaatagtcc ttacccaatc tcccggaacc ctctcagtat ctcccggcga acgagtaacc 60
ttttcatgta gagcatccca atccatcggc acttcaattc actggtatca gcagaaaaca 120
ggtcaatccc cacggcttct tataaaatat gcatcagaat caatttctgg catcccagac 180
agattttcag gttcaggatc aggcaccgat ttcacactta caatatccag agtcgaatca 240
gaagattttg cagattacta ttgtcaacaa ataaacagct ggcccactac attcggacaa 300
ggcacaaaac tcgaaattaa acgtacg 327
<210> 87
<211> 109
<212> PRT
<213> Homo sapiens
<400> 87
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Ser
20 25 30
Ile His Trp Tyr Gln Gln Lys Thr Gly Gln Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Gln Gln Ile Asn Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr
100 105
<210> 88
<211> 327
<212> ДНК
<213> Homo sapiens
<400> 88
gaaatagttc ttactcaatc ccccggtaca ctctcagttt ccccaggcga acgcgtcact 60
ttttcttgca gagcatcaca atcaatcggc acttcaattc attggtatca acaaaaaaca 120
ggacaggccc cacgacttct tattaaatat gcatcagaat caatttctgg catcccagac 180
agattttcag gttcaggatc aggcaccgat ttcacactta caatatccag agtcgaatca 240
gaagattttg cagattacta ttgtcaacaa ataaacagct ggcccactac attcggacaa 300
ggcacaaaac tcgaaattaa acgtacg 327
Claims (21)
1. Способ лечения пациента, страдающего от остеолитического нарушения, включающий стадии введения указанному пациенту антитела против M-CSF в монотерапевтически эффективной дозе и бисфосфоната в монотерапевтически эффективной дозе в течение переходного периода, где антитело против M-CSF включает SEQ ID NO:53 и SEQ ID NO:43, и дополнительно включающий стадию прекращения лечения бисфосфонатом после окончания переходного периода.
2. Способ лечения пациента, страдающего от остеолитического нарушения, включающий стадии введения указанному пациенту антитела против M-CSF в монотерапевтически эффективной дозе и бисфосфоната в монотерапевтически эффективной дозе в течение переходного периода, где антитело против M-CSF включает SEQ ID NO:53 и SEQ ID NO:43, и дополнительно включающий стадию снижения дозы бисфосфоната после окончания переходного периода.
3. Способ по п.1 или 2, где остеолитическое нарушение представляет собой остеопороз, разрежение костей, связанное с раковым метастазом, болезнь Педжета или перипростетическое разрежение костей.
4. Способ по п.1 или 2, где бисфосфонат и антитело против MCSF вводят одновременно.
5. Способ по п.1 или 2, где бисфосфонат выбран из группы, состоящей из золедроната, памидроната, клодроната, этидроната, тилудроната, алендроната, ибандроната и ризедроната.
6. Способ по п.5, где бисфосфонат представляет собой золедронат.
7. Способ по п.1 или 2, где переходный период выбран из группы, составляющей приблизительно 1-7 дней, от 1 недели до 1 месяца, от 1 месяца до 3 месяцев, от 3 до 6 месяцев, от 6 до 12 месяцев.
8. Способ по п.7, где переходный период составляет приблизительно 1-7 дней.
9. Способ по п.7, где переходный период длится от 1 недели до 1 месяца.
10. Способ по п.7, где переходный период длится от 1 месяца до 3 месяцев.
11. Способ по п.7, где переходный период длится от 3 до 6 месяцев.
12. Способ по п.7, где переходный период длится от 6 до 12 месяцев.
13. Способ по пп.2 и 7, дополнительно включающий стадию прекращения лечения бисфосфонатом после окончания переходного периода.
14. Способ по пп.1 и 7, дополнительно включающий стадию уменьшения дозы бисфосфоната после окончания переходного периода.
15. Способ по п.7, где дозу бисфосфоната уменьшают сразу после окончания переходного периода.
16. Способ по п.2, где бисфосфонат вводят, по меньшей мере, один раз после окончания переходного периода.
17. Способ по п.6, где золедронат вводят в дозе, составляющей от 0,5 мг до 4 мг.
18. Способ по п.7, дополнительно включающий стадию уменьшения дозы антитела против MCSF после окончания переходного периода.
19. Способ по п.18, где дозу антитела против MCSF уменьшают сразу после окончания переходного периода.
20. Способ по п.1 или 2, где антитело против MCSF конкурирует за связывание с M-CSF с мышиным антителом RX1.
21. Способ по п.1 или 2, где антитело против MCSF связывается с тем же эпитопом, что и антитела RX1, МС1, МСЗ или 5Н4.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US75694406P | 2006-01-05 | 2006-01-05 | |
| US60/756,944 | 2006-01-05 | ||
| PCT/US2007/000405 WO2007081879A2 (en) | 2006-01-05 | 2007-01-04 | Methods for preventing and treating cancer metastasis and bone loss associated with cancer metastasis |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008132150A RU2008132150A (ru) | 2010-02-10 |
| RU2470665C2 true RU2470665C2 (ru) | 2012-12-27 |
Family
ID=38219019
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008132150/15A RU2470665C2 (ru) | 2006-01-05 | 2007-01-04 | Способы профилактики и лечения ракового метастаза и разрежения кости, связанного с раковым метастазом |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20090246208A1 (ru) |
| EP (2) | EP2705854A1 (ru) |
| JP (2) | JP5580535B2 (ru) |
| KR (1) | KR20080083187A (ru) |
| CN (1) | CN101534858A (ru) |
| AU (1) | AU2007205048B2 (ru) |
| BR (1) | BRPI0706314A2 (ru) |
| CA (1) | CA2636149A1 (ru) |
| IL (1) | IL192568A0 (ru) |
| RU (1) | RU2470665C2 (ru) |
| TW (1) | TW200738262A (ru) |
| WO (1) | WO2007081879A2 (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2609871C1 (ru) * | 2015-08-10 | 2017-02-06 | Федеральное бюджетное учреждение науки "Государственный научный центр вирусологии и биотехнологии "Вектор" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ВБ "Вектор" Роспотребнадзора) | Противоопухолевое средство |
| RU2631486C1 (ru) * | 2016-06-17 | 2017-09-22 | Федеральное бюджетное учреждение науки "Государственный научный центр вирусологии и биотехнологии "Вектор" (ФБУН ГНЦ ВБ "Вектор") | Способ получения противоопухолевого средства против метастазов костей в виде конъюгата белка-цитокина и аминобисфосфоната |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010062399A2 (en) | 2008-11-26 | 2010-06-03 | Five Prime Therapeutics, Inc. | Csf1r extracellular domain fusion molecules and treatments using same |
| US8183207B2 (en) | 2008-11-26 | 2012-05-22 | Five Prime Therapeutics, Inc. | Treatment of osteolytic disorders and cancer using CSF1R extracellular domain fusion molecules |
| MY159679A (en) | 2009-12-10 | 2017-01-13 | Hoffmann La Roche | Antibodies binding preferentially human csf1r extracellular domain 4 and their use |
| WO2011131407A1 (en) | 2010-03-05 | 2011-10-27 | F. Hoffmann-La Roche Ag | Antibodies against human csf-1r and uses thereof |
| CN102918060B (zh) | 2010-03-05 | 2016-04-06 | 霍夫曼-拉罗奇有限公司 | 抗人csf-1r抗体及其用途 |
| NZ626610A (en) | 2010-05-04 | 2015-11-27 | Five Prime Therapeutics Inc | Antibodies that bind csf1r |
| DK2734547T3 (en) | 2011-07-18 | 2017-04-03 | Univ Melbourne | USE OF C-FMS ANTIBODIES |
| WO2013033206A2 (en) * | 2011-08-29 | 2013-03-07 | University Of Rochester | Compositions and methods for inhibiting ccl3 |
| MX356337B (es) | 2011-12-15 | 2018-05-23 | Hoffmann La Roche | Anticuerpos contra csf-1r humano y sus usos. |
| US20130302322A1 (en) | 2012-05-11 | 2013-11-14 | Five Prime Therapeutics, Inc. | Methods of treating conditions with antibodies that bind colony stimulating factor 1 receptor (csf1r) |
| CN103044555B (zh) * | 2012-07-05 | 2016-08-31 | 雷克塞德(苏州)生物医药有限公司 | 包含cFms胞外片段的融合蛋白质及其制备方法和应用 |
| CN104684582A (zh) | 2012-08-31 | 2015-06-03 | 戊瑞治疗有限公司 | 用结合群落刺激因子1受体(csf1r)的抗体治疗病状的方法 |
| KR20150122731A (ko) * | 2013-03-15 | 2015-11-02 | 펀다시오 인스티튜트 드 르세르카 바이오메디카 (아이알비 바르셀로나) | 암 전이의 예후 및 치료 방법 |
| CN105121466A (zh) | 2013-04-12 | 2015-12-02 | 莫佛塞斯公司 | 靶向m-csf的抗体 |
| AR097584A1 (es) | 2013-09-12 | 2016-03-23 | Hoffmann La Roche | Terapia de combinación de anticuerpos contra el csf-1r humano y anticuerpos contra el pd-l1 humano |
| RU2551622C1 (ru) * | 2014-02-20 | 2015-05-27 | Федеральное государственное бюджетное учреждение "Ростовский научно-исследовательский онкологический институт" Министерства здравоохранения Российской Федерации | Способ лечения опухолей позвоночника |
| CN113350501A (zh) | 2014-06-23 | 2021-09-07 | 戊瑞治疗有限公司 | 用结合集落刺激因子1受体(csf1r)的抗体治疗病状的方法 |
| PL3212670T3 (pl) | 2014-10-29 | 2021-06-14 | Five Prime Therapeutics, Inc. | Leczenie skojarzone nowotworów |
| SG11201704792UA (en) | 2014-12-22 | 2017-07-28 | Five Prime Therapeutics Inc | Anti-csf1r antibodies for treating pvns |
| BR112017020952A2 (pt) | 2015-04-13 | 2018-07-10 | Five Prime Therapeutics Inc | método de tratamento de câncer, composição e uso da composição |
| WO2018036852A1 (en) | 2016-08-25 | 2018-03-01 | F. Hoffmann-La Roche Ag | Intermittent dosing of an anti-csf-1r antibody in combination with macrophage activating agent |
| WO2018115051A1 (en) | 2016-12-22 | 2018-06-28 | F. Hoffmann-La Roche Ag | Treatment of tumors with an anti-csf-1r antibody in combination with an anti-pd-l1 antibody after failure of anti-pd-l1/pd1 treatment |
| KR20200051024A (ko) | 2017-09-13 | 2020-05-12 | 파이브 프라임 테라퓨틱스, 인크. | 췌장암에 대한 조합 항-csf1r 및 항-pd-1 항체 조합 요법 |
| EP3833762A4 (en) | 2018-08-09 | 2022-09-28 | Verseau Therapeutics, Inc. | OLIGONUCLEOTIDE COMPOSITIONS FOR TARGETING CCR2 AND CSF1R AND THEIR USES |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2153358C1 (ru) * | 1999-11-10 | 2000-07-27 | Центральный научно-исследовательский рентгенорадиологический институт МЗ России | Способ лечения остеолитических метастазов |
| WO2005068503A2 (en) * | 2004-01-07 | 2005-07-28 | Chiron Corporation | M-csf-specific monoclonal antibody and uses thereof |
| US20070249680A1 (en) * | 2006-04-20 | 2007-10-25 | Illig Carl R | Inhibitors of c-fms kinase |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) * | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US4485045A (en) * | 1981-07-06 | 1984-11-27 | Research Corporation | Synthetic phosphatidyl cholines useful in forming liposomes |
| US4816567A (en) * | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4675187A (en) | 1983-05-16 | 1987-06-23 | Bristol-Myers Company | BBM-1675, a new antibiotic complex |
| US4544545A (en) | 1983-06-20 | 1985-10-01 | Trustees University Of Massachusetts | Liposomes containing modified cholesterol for organ targeting |
| US5019369A (en) | 1984-10-22 | 1991-05-28 | Vestar, Inc. | Method of targeting tumors in humans |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US4929700A (en) * | 1987-04-16 | 1990-05-29 | Cetus Corporation | Production of purified, biologically active, bacterially produced recombinant human CSF-1 |
| DE69028095T2 (de) * | 1989-02-10 | 1997-02-06 | Cetus Oncology Corp | M-csf-monoklonale antikörper, die ein neutralisierendes konformationales epitop erkennen |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| US5013556A (en) | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US6255458B1 (en) | 1990-08-29 | 2001-07-03 | Genpharm International | High affinity human antibodies and human antibodies against digoxin |
| ATE297465T1 (de) | 1991-11-25 | 2005-06-15 | Enzon Inc | Verfahren zur herstellung von multivalenten antigenbindenden proteinen |
| JP4157160B2 (ja) | 1991-12-13 | 2008-09-24 | ゾーマ テクノロジー リミテッド | 改変抗体可変領域の調製のための方法 |
| US20020111461A1 (en) * | 1999-05-21 | 2002-08-15 | Todd C. Somers | Low molecular weight peptidomimetic growth hormone secretagogues |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US6025146A (en) * | 1995-06-05 | 2000-02-15 | Chiron Corporation | Identification of M-CSF agonists and antagonists |
| GB9518220D0 (en) | 1995-09-06 | 1995-11-08 | Medical Res Council | Checkpoint gene |
| US20030199531A1 (en) | 2001-07-19 | 2003-10-23 | Todd Wipke | YIGSR peptidomimetics and methods for using the same |
| EP1458400A1 (en) * | 2001-12-13 | 2004-09-22 | Merck & Co., Inc. | Liquid bisphosphonate formulations for bone disorders |
| ES2457019T3 (es) * | 2002-09-27 | 2014-04-24 | Aeterna Zentaris Gmbh | Forma de administración para péptidos farmacéuticamente activos con liberación sostenida del principio activo y procedimiento para su preparación |
| WO2004045532A2 (en) * | 2002-11-15 | 2004-06-03 | Chiron Corporation | Methods for preventing and treating cancer metastasis and bone loss associated with cancer metastasis |
| JP5457671B2 (ja) * | 2005-07-28 | 2014-04-02 | ノバルティス アーゲー | M−csf特異的モノクローナル抗体およびその使用 |
-
2007
- 2007-01-04 CN CNA2007800067993A patent/CN101534858A/zh active Pending
- 2007-01-04 CA CA002636149A patent/CA2636149A1/en not_active Abandoned
- 2007-01-04 KR KR1020087018238A patent/KR20080083187A/ko active IP Right Grant
- 2007-01-04 EP EP13168106.6A patent/EP2705854A1/en not_active Withdrawn
- 2007-01-04 WO PCT/US2007/000405 patent/WO2007081879A2/en active Application Filing
- 2007-01-04 JP JP2008549592A patent/JP5580535B2/ja active Active
- 2007-01-04 BR BRPI0706314-8A patent/BRPI0706314A2/pt not_active IP Right Cessation
- 2007-01-04 AU AU2007205048A patent/AU2007205048B2/en active Active
- 2007-01-04 RU RU2008132150/15A patent/RU2470665C2/ru not_active IP Right Cessation
- 2007-01-04 US US12/159,665 patent/US20090246208A1/en not_active Abandoned
- 2007-01-04 EP EP07716432A patent/EP1984024A2/en not_active Withdrawn
- 2007-01-05 TW TW096100615A patent/TW200738262A/zh unknown
-
2008
- 2008-07-02 IL IL192568A patent/IL192568A0/en unknown
-
2012
- 2012-08-27 JP JP2012186613A patent/JP2012229271A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2153358C1 (ru) * | 1999-11-10 | 2000-07-27 | Центральный научно-исследовательский рентгенорадиологический институт МЗ России | Способ лечения остеолитических метастазов |
| WO2005068503A2 (en) * | 2004-01-07 | 2005-07-28 | Chiron Corporation | M-csf-specific monoclonal antibody and uses thereof |
| US20070249680A1 (en) * | 2006-04-20 | 2007-10-25 | Illig Carl R | Inhibitors of c-fms kinase |
Non-Patent Citations (4)
| Title |
|---|
| BERENSON JR. Recommendations for zoledronic acid treatment of patients with bone metastases // Oncologist. 2005 Jan; 10(1):52-62 онлайн [найдено в Интернет Ha(http://theoncologist.alphamedpress. org/cgi/content/full/146/52)]. * |
| MORONY S. ET AL. The inhibition of RANKL causes greater suppression of bone resorption and hypercalcemia compared with bisphosphonates in two models of humoral hypercalcemia of malignancy // Endocrinology. 2005 Aug; 146(8):3235-43. Epub 2005, Apr 21 онлайн [найдено в Интернет на (http://endo.endojournals.org/cgi/content/full/146/3235)]. * |
| ДАРЬЯЛОВА С.Л. и др. Диагностика и лечение злокачественных опухолей. - М.: Медицина, 1993, с.72-85. * |
| ДАРЬЯЛОВА С.Л. и др. Диагностика и лечение злокачественных опухолей. - М.: Медицина, 1993, с.72-85. MORONY S. ET AL. The inhibition of RANKL causes greater suppression of bone resorption and hypercalcemia compared with bisphosphonates in two models of humoral hypercalcemia of malignancy // Endocrinology. 2005 Aug; 146(8):3235-43. Epub 2005, Apr 21 онлайн [найдено в Интернет на (http://endo.endojournals.org/cgi/content/full/146/3235)]. BERENSON JR. Recommendations for zoledronic acid treatment of patients with bone metastases // Oncologist. 2005 Jan; 10(1):52-62 онлайн [найдено в Интернет Ha(http://theoncologist.alphamedpress. org/cgi/content/full/146/52)]. * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2609871C1 (ru) * | 2015-08-10 | 2017-02-06 | Федеральное бюджетное учреждение науки "Государственный научный центр вирусологии и биотехнологии "Вектор" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ВБ "Вектор" Роспотребнадзора) | Противоопухолевое средство |
| RU2631486C1 (ru) * | 2016-06-17 | 2017-09-22 | Федеральное бюджетное учреждение науки "Государственный научный центр вирусологии и биотехнологии "Вектор" (ФБУН ГНЦ ВБ "Вектор") | Способ получения противоопухолевого средства против метастазов костей в виде конъюгата белка-цитокина и аминобисфосфоната |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2705854A1 (en) | 2014-03-12 |
| IL192568A0 (en) | 2011-08-01 |
| CA2636149A1 (en) | 2007-07-19 |
| JP5580535B2 (ja) | 2014-08-27 |
| WO2007081879A3 (en) | 2007-09-07 |
| WO2007081879A2 (en) | 2007-07-19 |
| KR20080083187A (ko) | 2008-09-16 |
| US20090246208A1 (en) | 2009-10-01 |
| EP1984024A2 (en) | 2008-10-29 |
| CN101534858A (zh) | 2009-09-16 |
| TW200738262A (en) | 2007-10-16 |
| RU2008132150A (ru) | 2010-02-10 |
| BRPI0706314A2 (pt) | 2011-03-22 |
| JP2009522369A (ja) | 2009-06-11 |
| JP2012229271A (ja) | 2012-11-22 |
| AU2007205048A1 (en) | 2007-07-19 |
| AU2007205048B2 (en) | 2013-07-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2470665C2 (ru) | Способы профилактики и лечения ракового метастаза и разрежения кости, связанного с раковым метастазом | |
| KR101307868B1 (ko) | M-csf-특이적 단일클론 항체 및 그것의 사용 | |
| JP5457671B2 (ja) | M−csf特異的モノクローナル抗体およびその使用 | |
| DK2646470T3 (en) | ANTI-TRANSFERRIN RECEPTOR ANTIBODIES WITH LOW AFFINITY AND ITS USE FOR TRANSPORTING THERAPEUTIC SCFV OVER THE BLOOD-BRAIN BARRIER | |
| TWI774028B (zh) | 抗alk2抗體及其用途 | |
| BR112019021411A2 (pt) | métodos para tratar ou retardar a progressão do câncer e para melhorar a função, usos de um imunoconjugado, de um agonista, de um antagonista, composições, kit e invenção | |
| KR20160129698A (ko) | 항-b7-h5 항체 및 이의 용도 | |
| MX2013005477A (es) | Variantes de fc silenciosas de los anticuerpos anti-cd40. | |
| BR112014028838A2 (pt) | Usos de um anticorpo, método para fazer um anticorpo e anticorpos | |
| CN105101997A (zh) | 不减少血小板和不减少血红细胞的cd47抗体及其使用方法 | |
| MX2014004449A (es) | Tratamiento de enfermedad ocular. | |
| US20230265203A1 (en) | Use of anti-cd40 antibodies for treatment of lupus nephritis | |
| WO2023126445A1 (en) | Anti-cd2 antibodies | |
| KR20200143718A (ko) | 이식편 거부반응 예방에 사용하기 위한 항-cd40 항체 | |
| EP4340876A1 (en) | Anti-folate receptor conjugate combination therapy with bevacizumab | |
| US20240059781A1 (en) | Methods of inducing immune tolerance with modified anti-cd154 antibodies | |
| MX2008008570A (en) | Methods for preventing and treating cancer metastasis and bone loss associated with cancer metastasis | |
| KR20220007086A (ko) | T1dm 및 췌도염의 치료에 사용하기 위한 항-cd40 항체 | |
| EA039944B1 (ru) | Применение антител к cd40 для лечения волчаночного нефрита |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20160105 |