RU2382442C1 - Материал катода для применения в литий-ионных батареях - Google Patents
Материал катода для применения в литий-ионных батареях Download PDFInfo
- Publication number
- RU2382442C1 RU2382442C1 RU2008127740/09A RU2008127740A RU2382442C1 RU 2382442 C1 RU2382442 C1 RU 2382442C1 RU 2008127740/09 A RU2008127740/09 A RU 2008127740/09A RU 2008127740 A RU2008127740 A RU 2008127740A RU 2382442 C1 RU2382442 C1 RU 2382442C1
- Authority
- RU
- Russia
- Prior art keywords
- lithium
- materials
- air
- heating
- cathode
- Prior art date
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/52—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron
- H01M4/525—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron of mixed oxides or hydroxides containing iron, cobalt or nickel for inserting or intercalating light metals, e.g. LiNiO2, LiCoO2 or LiCoOxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/58—Selection of substances as active materials, active masses, active liquids of inorganic compounds other than oxides or hydroxides, e.g. sulfides, selenides, tellurides, halogenides or LiCoFy; of polyanionic structures, e.g. phosphates, silicates or borates
- H01M4/5825—Oxygenated metallic salts or polyanionic structures, e.g. borates, phosphates, silicates, olivines
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/04—Processes of manufacture in general
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/13—Electrodes for accumulators with non-aqueous electrolyte, e.g. for lithium-accumulators; Processes of manufacture thereof
- H01M4/139—Processes of manufacture
- H01M4/1397—Processes of manufacture of electrodes based on inorganic compounds other than oxides or hydroxides, e.g. sulfides, selenides, tellurides, halogenides or LiCoFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
- H01M10/0525—Rocking-chair batteries, i.e. batteries with lithium insertion or intercalation in both electrodes; Lithium-ion batteries
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M2004/021—Physical characteristics, e.g. porosity, surface area
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M2004/026—Electrodes composed of, or comprising, active material characterised by the polarity
- H01M2004/028—Positive electrodes
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/04—Processes of manufacture in general
- H01M4/0471—Processes of manufacture in general involving thermal treatment, e.g. firing, sintering, backing particulate active material, thermal decomposition, pyrolysis
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Manufacturing & Machinery (AREA)
- Materials Engineering (AREA)
- Crystallography & Structural Chemistry (AREA)
- Battery Electrode And Active Subsutance (AREA)
- Secondary Cells (AREA)
Abstract
Изобретение относится к семейству новейших материалов для катода и к уникальному способу их синтеза для Li-ионных батарей. Техническим результатом изобретения является создание семейства фосфата с дефектным переходным металлом лития, который можно легко синтезировать в атмосфере воздуха при низкой температуре, одновременно с наличием совместимости, производительности и цикличности. Согласно изобретению способ включает в себя: а) создание оксида кристаллического переходного металла лития (со структурой шпинели или со структурой слоев); b) создание промежуточного синтезированного материала, содержащего исходные химические элементы Li:Fe:P:C в молярном отношении 1:1:1:2; с) соединение и измельчение указанных материалов с образованием смеси материалов в виде частиц, и а) нагрев материала, полученного на этапе с) для образования материала катода из фосфата с дефектным кристаллическим переходным металлом лития. Нагрев производится в сосуде при наличии воздуха, и поверхности материала, обращенные к воздуху, покрыты слоем инертной оболочки, которая имеет поры для проникновения воздуха и выходящих газов, вызванных нагреванием. 6 н. и 15 з.п. ф-лы, 19 ил., 2 табл.
Description
Область изобретения
Настоящее изобретение обращено к семейству новейших материалов для катода и к уникальному способу для синтеза материалов для Li-ионных батарей.
Предпосылки изобретения
Стехиометрический материал для катода LiFePO4 обсуждался в качестве замены катодного материала типа LiCoO2 на применение ионов лития из-за потенциально малой стоимости (Fe замещает Со) и из-за более надежных рабочих характеристик материала (нет разложения материала во время зарядки). Однако существующие вопросы использования делают стехиометрический материал LiFePO4 затратным и трудным для производства. В настоящее время материалы из LiFePO4, пригодные для литий-ионных батарей, требуют синтеза с использованием высокотемпературной обработки (>600°С) в инертной среде. Также с целью повышения проводимости материала и улучшения электрохимических свойств синтезированного материала используется обычно электропроводящий углерод. Использование инертной среды является ключевым фактором, обеспечивающим хорошее качество материалов благодаря его важности в отношении остаточного углерода в материале. Нигде в уровне техники не показано, как синтезировать материал LiFePO4 в воздухе без защитной среды и как обеспечить хорошую проводимость материала и таким образом хорошие электрохимические свойства катода, полученного из этого материала.
Известно, что можно использовать структурированный оливином материал для создания активного материала для катода батареи, как в патенте США 5,910,382. Также в патентах США 6,723,470, 6,730,281, 6,815,122, 6,884,544 и 6,913,855 в основном раскрыты способы и предшественники, используемые для образования стехиометрического LiFePO4 или замещение катионов на Fe. Эти публикации только показывают, как синтезируются стехиометрические структурированные оливином материалы, имеющие разные замещения катионов. Нигде в уровне техники не показано, как синтезировать фосфатные материалы, имеющие дефектную кристаллическую структуру в воздухе, которые имеют подходящие хорошие электрохимические свойства для использования в качестве активного материала в катоде Li-ионной батареи.
В основном дефекты в кристаллической структуре материала могут радикально влиять на электрохимическое свойство синтезированного материала. Классическим примером является синтез стехиометрического LiNiO2. Недостаток лития приведет к неправильному расположению Ni на узлах Li, поэтому замедляется теплопроводность (диффузивность) Li и вызывает потерю емкости при некоторых показателях. Влияние электрохимических свойств, вызванное неправильным расположением узлов Ni и Li, было исследовано Чангом и др. (Solid State lonics, 112 (1998) 329-344). Кроме того, на концентрацию дефектов могут влиять разные обрабатывающие предшественники и протоколы обработки. Например, обработанное в растворе исходное вещество будет в основном обладать более высокой кинетикой реакции по сравнению с обычными процессами в твердом состоянии, и потому проявляют более низкую концентрацию дефектов. Причину можно отнести к тому, что LiNiO2 проходит реакцию разложения, которая вызывает потерю Li во время тепловой обработки. В результате необходимые исходные вещества, которые дают высокую кинетику образования, таким образом, уменьшат концентрацию дефектов синтезированного материала (Чанг и др.., "Journal of the Electrochemical Society, 149 (2002) A331-A338; 149 (2002) A1114-A1120). В данном примере, хотя дефекты могут физически задерживать диффузивность Li, электронная структура материала также может подвергаться влиянию присутствием дефектов и, таким образом, электропроводности получившегося материала. В результате показано, что такие факторы, как исходные вещества, условия обработки, протоколы обработки и кинетика реакции влияют на материалы для влияния на концентрацию дефектов и свойства получившегося материала. В данном изобретении семейство дефектного переходного материала из металла лития с фосфатом можно синтезировать при низкой температуре, причем создаются высокая производительность и циклическая способность. Образование дефектов вызвано включением разных оксидов литигированных переходных металлов с определенной стехиометрией.
Цели изобретения
Целью данного изобретения является создание нового семейства на основе фосфата с дефектным переходным металлом лития для основы материала катода без необходимости использования печи с инертной средой.
Целью данного изобретения является создание способа получения катодного материала на основе фосфата с дефектным переходным металлом лития без необходимости использования печи с инертной средой.
Еще одной целью этого изобретения является создание способа получения, который легко увеличивается до коммерческих применений.
И еще одной целью данного изобретения является способ получения материала катода, имеющего чрезвычайные характеристики циклизации и частоты зарядки/разрядки в батарее, изготовленной из материала катода.
Краткое изложение изобретения
Данное изобретение направлено на создание семейства фосфата с дефектным переходным металлом лития, который можно легко синтезировать в атмосфере воздуха при низкой температуре, одновременно с наличием совместимости, производительности и цикличности. Способ включает в себя: а) создание оксида кристаллического переходного металла лития (со структурой шпинели или со структурой слоев); b) создание промежуточного синтезированного материала, содержащего исходные химические элементы Li:Fe:P:С в молярном отношении 1:1:1:2; с) соединение и измельчение указанных материалов с образованием смеси материалов в виде частиц, и d) нагрев материала, полученного на этапе с) для образования материала катода из фосфата с дефектным кристаллическим переходным металлом лития. Нагрев производится в сосуде при наличии воздуха, и поверхности материала, обращенные к воздуху, покрыты слоем инертной оболочки, которая имеет поры для проникновения воздуха и выходящих газов, вызванных нагреванием.
Краткое описание чертежей
Изобретение станет более очевидным из следующего описания показанного ниже предпочтительного варианта осуществления изобретения только в виде примера на сопроводительных чертежах, на которых:
фиг.1 - вид в поперечном сечении сосуда с реакционной печью и инертной оболочкой для синтеза материала данного изобретения;
фиг.2 является видом рентгенографии для обычного материала катода LiFePO4 примера 1;
фиг.3(а) и 3(b) - графики, показывающие характеристики циклирования испытательной батареи, изготовленной из материала катода из примера 1;
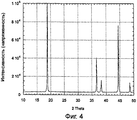
фиг.4 - вид рентгенографии для материала катода LiNi(0,92) Mg(0,08)O2 примера 2;
фиг.5 - вид рентгенографии для катодного материала из фосфата с дефектным кристаллическим переходным металлом лития из примера 3;
фиг.6(а) и 6(b) - графики, показывающие характеристики цикличности испытуемой батареи, изготовленной из материала катода по примеру 3;
фиг.7(а) и 7(b) - виды рентгенографии для фосфата с дефектным переходным металлом лития, имеющего 10% по массе и 20% массы, соответственно, LiNi(0,92)Mg(0,08)O2, как показано в примере 5;
фиг.8(а) и 8(b) - графики, показывающие характеристики цикличности испытуемой батареи, изготовленной из материала катода из примера 5, имеющего 10% по массе LiNi(0,92) Mg(0,08)O2;
фиг.8(с) и 8(d) - графики, показывающие характеристики цикличности испытуемой батареи, изготовленной из материала катода из примера 6, имеющего 20% по массе LiNi(0,92)Mg(0,08)O2;
фиг.9(а) и 9(b) являются наборами видов рентгенографии для показа пиковой интенсивности разных катодных материалов, обнаруженных в описанных примерах;
фиг.10 - вид рентгенографии для фосфата с дефектным кристаллическим металлом лития, созданного растворением 3% по весу от Li(1+x) Mn(2-x)O4, как описано в примере 8;
фиг.11(а) и 11(b) - графики, показывающие характеристики цикличности испытуемой батареи, изготовленной из материала катода из примера 8.
Подробное описание изобретения
На фиг.1 показаны конструкция печи и условия тепловой обработки для синтеза раскрытого здесь материала. Фиг.1 иллюстрирует реакционный сосуд 1, который открыт для воздуха в печи 2. Печь открыта для воздушной среды 3а и 3b, чтобы поддерживать в основном атмосферное давление в печи. Поток газов в печь и из нее зависит от циклов нагревания и охлаждения печи и химических реакций, происходящих с материалами в печи. Воздух может свободно поступать в печь, и воздух или/и продукты химической реакции материалов 4 в реакционном сосуде 1 могут свободно выйти из печи. Материалы 4 в сосуде 1 химически реагируют во время этапов нагревания с образованием катодных материалов согласно изобретению. Материалы 4 в сосуде 1, которые соприкасаются с воздухом, обнаруженным в печи, покрываются слоем высокотемпературной инертной оболочки 5 с порами для воздуха и выходящих газов, вызванных этапом нагревания. Нагревательные змеевики печи обозначены позицией 6.
В данном изобретении Fе2О3, Li2CO3 и Н3РO4 особенно выбираются в качестве исходных материалов для синтеза фосфата переходного металла лития. Причины выбора включают в себя относительно низкую стоимость исходного материала и химическую реакцию, в которой высвобождается СO2 и H2O, то есть Fe2O3+Li2CO3+2Н3РO4+1/2С→2LiFePO4+3/2CO2+3H2O. Побочные продукты, выделенные газы, во время реакции могут проходить через поры высокотемпературной инертной и пористой оболочки.
Стехиометрический LiFePO4 обычно известен как «активный материал» в катоде для использования в Li-ионной батарее. Однако было обнаружено, что электропроводность стехиометрического LiFePO4 не является хорошей, и рабочие характеристики батареи можно улучшить присутствием материала с хорошей электропроводностью вместе с LiFePO4. Известно, что углерод является хорошим материалом для улучшения электропроводности катода. Известно, что можно обеспечить некоторое количество С в исходном материале указанной реакции, что больше стехиометрического количества, чтобы обеспечить остаточное количество С с полученным стехиометрическим катодным материалом LiFePO4. Однако, для того, чтобы реакция имела место с производительностью, которая приемлема для коммерческого производства, требуется температура примерно 600°С или более. При такой температуре может произойти разложение углерода (например, угольной сажи), количество остаточного С нельзя контролировать. Известно, что можно производить синтез в контролируемой инертной атмосфере, однако коммерческое производство материала, таким образом, значительно удорожает производство. В данном изобретении найден способ для создания семейства новейших катодных материалов без использования описанных выше оборудования и процесса для контролируемой атмосферы.
В данном изобретении создан способ для получения фосфатов дефектного переходного металла лития, имеющих дефектную кристаллическую структуру, которая не требует высокотемпературной тепловой обработки, а также условий инертной атмосферы. Способ создания дефектной структуры заключается в растворении других материалов с оксидом лития в структуру LiFePO4. Химический процесс предлагается следующим:
xLiNiO2+(1-x)LiFePO4→LiNixFe(1-x)P(1-x)O2(2-x)
В этом случае Р и О являются недостаточными, и образуются некоторые вакансии, как показано в подстрочных символах для Р и О. Или
x/2LiMn2O4+(1-x)LiFePO4→Li(1-x/2) Mnx Fe(1-x) P(1-x)О2(2-x)
В этом случае Li, Р и О являются недостаточными, и некоторые вакансии будут образовываться образом, аналогичном показанному в предыдущей реакции. Предложенные реакции просто используются для объяснения появления материала с дефектной структурой. Однако в этом изобретении цель состоит не в том, чтобы синтезировать стехиометрический LiFePO4. В результате оксиды переходного металла лития со структурированным слоем или структурированным шпинелем реагируют с промежуточным вроде синтезированным материалом, который имеет молярное отношение Li:Fe:Р:С=1:1:1:2.
Для того чтобы облегчить образование упомянутых дефектных материалов в обычной воздушной среде, для синтеза используется низкотемпературная тепловая обработка. Значение низкой температуры предполагает достаточную температуру для образования требуемого материала. В данном изобретении температуру выбирают такой, чтобы она была от 550-650°С, желательно при 600°С. Слишком высокая температура не только увеличивает энергопотребление, но также увеличивает трудности в поддержании консистенции синтезированного материала.
К признакам данного изобретения относятся:
А. Неиспользование инертной атмосферы: Этот признак приводит к:
i. Простоте получения.
ii. Использованию гораздо менее дорогой печи, поскольку газонепроницаемая печь становится ненужной. Также можно сэкономить на стоимости инертного газа.
iii. Возможности снижения общей стоимости протокола синтеза.
iv. Легкому управлению качеством получаемых материалов.
В. Хорошим рабочим характеристикам синтезируемого материала: исключительные характеристики цикличности (продолжительность цикла) и производительность (производительность при >20°С) достигаются, как будет описано подробнее в примерах ниже.
С. Постоянство рабочих характеристик: Это наглядно важно для синтеза материала, поскольку постоянство рабочих характеристик чрезвычайно важно для батарей. Благодаря образованию материала с дефектной структурированной кристаллической структурой повышается не только проводимость как бы синтезированного материала, но также получается совместимость от партии к партии как бы синтезированных материалов, особенно при тепловой обработке в обстановке воздуха.
Выбор низкотемпературной тепловой обработки может свести к минимуму возможность разложения желательного дефектного материала. Кроме того, низкотемпературная тепловая обработка (ниже температуры разложения угольной сажи при 600°С) может также снизить изменения остаточного содержания углерода и его распределение во время тепловой обработки. Следует отметить, что хотя вариации в содержании углерода в конечном продукте в данном изобретении не так важны, как в материалах из уровня техники, благодаря высокой электропроводности дефектного материала низкотемпературная тепловая обработка все же рекомендуется для минимизации ненужных изменений.
В данном изобретении цель добавления материалов со структурированным слоем или структурированным шпинелем во время синтеза заключается в создании дефектной кристаллической структуры получившегося материала. Важность создания дефектной кристаллической структуры состоит в продвижении происхождения изменения структуры диапазона и таким образом электропроводимости полученного материала. Более ранняя публикация данного изобретателя с использованием способа расчета указывала, что на электрохимическое свойство материала могут значительно повлиять анионы (Чанг и др., Jornal of Electrochemical Society, 151 (2004) J91-J94). Из-за вышеописанного улучшения электропроводимости дефектного материала становится неважным или необязательным использование избыточного углерода и существование углерода в получившемся материале.
В данном изобретении создается новое семейство фосфатных материалов структуры кристаллического металлического лития с использованием условий тепловой обработки в воздухе. Получены исключительные электрохимические свойства. Высокая производительность показана в более чем 20°С.
Следуют примеры катодных материалов, как предыдущих материалов, так и катодных материалов этого изобретения.
Пример 1. Синтез обычного стехиометрического LiFePO4 с использованием избыточного углерода при инертной атмосфере
Fе2O3 и Li2СО3 и супер Р (угольная сажа), молярное отношение (1:1:2) смешивались вместе с добавлением требуемого количества воды с получением взвеси. После тщательного перемешивания нужное стехиометрическое количество фосфорной кислоты добавлялось в раствор и применялось длительное перемешивание. Наконец, взвесь высушивалась в воздухе при 150°С в течение 5 часов до получения больших кусков материалов. Так, приготовленный материал затем измельчался на шаровой мельнице в течение примерно 12 часов.
Тепловая обработка для синтеза производилась в герметичной металлической камере с потоком газа азота. Материалы подвергались тепловой обработке при 650°С в течение 10 часов с потоком газа азота.
Рентгенографические данные показаны на фиг.2. Было замечено, что материал с чистой фазой можно получить, используя обычный протокол тепловой обработки. Данные батареи (полученные с использованием испытательной батареи с конструкцией трех электродов и лития в качестве опорного электрода) показаны на фиг.3. Из фиг.3(а) можно видеть, что емкость высока во время первого цикла заряд/разряд (примерно С/5, 0,23 мА/см2). Циклы, следующие за первым циклом, испытывались при примерно 2С (2,3 мА/см2 при заряде и разряде при постоянном токе, причем постоянное напряжение заряда к току меньше 200 мкА во время этапа зарядки). Из фиг.3(b) можно видеть, что длительность цикла не была удовлетворительной. Емкость (производительность) уменьшается от примерно 80 м Ампер-час/г до примерно 65 м Ампер-час/г после 15 циклов. Снижение емкости является показанием недостаточной электропроводности материала, который не может поддерживать высокое токовое цитирование и таким образом снижает результаты емкости во время цитирования. Этот результат совместим с уровнем техники, раскрытым в патенте США 6,723,470.
Пример 2. Синтез LiNi0,92Mg0,08O2
Стехиометрические количества LiOH, H2O, Ni(OH)2 и Мg(ОН)2 смешивались в мешалке. Спустя 3 часа после перемешивания таким образом приготовленные материалы-предшественники подвергались тепловой обработке в воздухе при 600°С в течение 10 часов. После осторожного дробления и просеивания затем материалы снова подвергались тепловой обработке в кислороде при 700°С в течение 24 часов.
Вид рентгенографии таким образом синтезированных материалов показан на фиг.4. На фиг.4 можно видеть, что синтезированный материал является однородным по фазе. Это говорит о том, что все катионы Мg растворены в структуре LiNiO2. Согласно более ранними публикациям изобретателя, о которых говорилось выше, катионы Мg замещены в узлах переходного металла.
Пример 3. Синтез фосфата дефектного переходного материала лития, полученного включением 3% по массе LiNi0,92Mg0,08O2, и тепловая обработка в условиях воздуха
Fе2О3, Li2CO3 и супер Р, молярное отношение (1:1:2), смешивались вместе с добавлением пригодного количества воды для получения взвеси. После тщательного перемешивания стехиометрическое количество фосфорной кислоты добавлялось в смесь и использовалось длительное перемешивание. Наконец, взвесь высушивалась в воздухе при 150°С в течение 10 часов, за чем следовала дополнительная тепловая обработка при 400°С в течение 5 часов до получения крупных кусков материала. Таким образом синтезированный промежуточный материал затем подвергался дроблению и прохождению через шаровую мельницу с 3% по массе LiNi0,92Mg0,08O2, приготовленными, как описано в примере 2, в течение 12 часов.
Синтез материала производился тепловой обработкой при 600°С в течение 10 часов в печи по фиг.1 в атмосфере воздуха.
Рентгенографические данные показаны на фиг.5. Чистый по фазе характер синтезированного материала проверен путем сравнения этих рентгенографических данных с такими данными, показанными на фиг.2. Ясно, что возможно полное растворение LiNi0,92Mg0,08O2 со структурированным слоем в LiFePO4. Полное растворение объясняет образование фосфорных и кислородных вакансий во время обработки. Электрохимические данные показаны на фиг.6(а) и 6(b). Из фиг.6(а) можно видеть, что характеристики цикличности намного улучшаются по сравнению с данными, показанными для примера 1 на фиг.3(а) и 3(b). Не было замечено спада емкости (см. фиг.6(b)), поскольку наблюдалось перекрывание кривых цикличности. Результат говорил о том, что хорошая электропроводность материала поддерживается на всем протяжении цикличности, и, таким образом, материал не имеет характеристик спада. Кроме улучшения характеристик циклирования наблюдалось, что среднее напряжения разряда увеличивалось от 3,28 до 3,33 В со скоростью разряда 2С. Это увеличение говорит о том, что дефектный кристаллический материал имеет определенную структуру и характеристики свойств по сравнению с обычным стехиометрическим LiFePO4. Дополнительные свидетельства в поддержку представлены в примерах 6 и 7.
Пример 4. Производство батареи 1,5 Ампер-час с использованием материала изобретения, синтезированного в примере 3
Приготовление катода: 5% по весу Super P (500 г) и 5% по весу (500 г) поливинилиденфторида (PVDF) тщательно перемешивались с 90% по весу (9 кг) материала и использованием N-метилпирролидона (MNP) в качестве растворителя. После взбалтывания и смешивания в течение приблизительно 12 часов была получена гомогенная взвесь. Взвесь имела вязкость примерно 20,000 сантипуаз (ср) до начала покрытия. Взвесь покрывалась на алюминиевую фольгу с использованием comma (?) покрытия. Покрытая пленка высушивалась при 140°С приблизительно 10 минут в печи с конвекцией. Аналогичным образом, другая сторона алюминиевой фольги покрывалась тем же самым материалом. После просушивания покрытый материал прокатывали. Получившиеся сжатые пленки и фольга имели толщину 160+/-5 мкм.
Приготовление анода: 8% по весу PVDF и 95% по весу природного материала графита перемешивались с использованием NMP в качестве растворителя. После взбалтывания и перемешивания в течение приблизительно 12 часов была получена гомогенная взвесь. Взвесь имела вязкость примерно 15000 ср до покрытия. Взвесь покрывалась на медную фольгу с использованием comma (?) покрытия. Покрытая пленка высушивалась при 140°С приблизительно 10 минут в конвективной печи. Аналогичным образом, другая сторона медной фольги покрывалась тем же самым материалом. После сушки покрытая фольга покрывалась полимерным раствором, как раскрыто в более ранней патентной заявке заявителя США 6,727,017. Так, покрытый анод прокатывался до толщины 210+/-5 мкм.
Узел батареи: Батарея была выполнена с использованием 28 пар катодов (4 см × 5 см) и анодов (4 см × 5 см). Электроды помещались в чередующейся последовательности в виде АВАВАВ. После пропитывания электролитом (ЕС/диметилсульфатиметилсульфат (DMC)) в течение 12 часов батарея подвергалась циклированию.
Таблица 1 показывает характеристики циклирования приблизительно 1200 м Ампер-час при токе зарядки/разрядки 1,5 А. Среднее напряжение батареи во время зарядки/разрядки также показано в таблице 1.
| Таблица 1 Характеристики цикличности батареи по примеру 5 |
|||||||
| Номер цикла | Зарядная емкость (Ампер-час) | Разрядная емкость (А-ч) | Энергия зарядки (Вт) | Энергия разрядки (Вт) | Среднее напряжение зарядки | Среднее напряжение разрядки | |
| (напряжение, В) | |||||||
| 1 | 1,2719 | 1,1872 | 4,5453 | 3,6899 | 3,57Е+00 | 3,11Е+00 | |
| 2 | 1,1730 | 1,1676 | 4,1588 | 3,6294 | 3,55Е+00 | 3,11Е+00 | |
| 3 | 1,1535 | 1,1549 | 4,0825 | 3,5912 | 3,54Е+00 | 3,11Е+00 | |
| 4 | 1,1391 | 1,1505 | 4,0268 | 3,5791 | 3,54Е+00 | 3,11Е+00 | |
Батарея подвергалась тесту на высокую производительность
Тестовая установка и конфигурация: 7 ламп накаливания (12 В, 50 Вт на каждую лампу) подсоединялись последовательно с одним вольтметром и одним амперметром для отслеживания напряжения и тока. Четыре из батарей примера 4 также были подсоединены последовательно, и было получено общее напряжение 13,2 В (до размыкания сети). После размыкания сети наблюдались показания амперметра и показания напряжения 10,5 В (общее 315 В). Спустя 10 секунд показания амперметра упали до 28 А, и напряжение упало до 10,2 В (общее значение 286 Вт). После этого показания остались постоянными в течение следующих 20 секунд.
Из описанных выше высоких показателей разрядки можно заключить, что батареи обладали высокой способностью с емкостью разрядки более 20 С (скорость 1 C составляет 1,5 А, скорость 20 С составляет 30 А). Этот результат значителен для обнаружения того, что хороший катодный материал можно получить в атмосфере воздуха, и он будет обладать высокой производительностью. Потенциальное использование таких батарей - это электрические инструменты, транспортные средства и широкое семейство для использования батарей.
Пример 5. Дополнительный пример, показывающий синтез фосфата дефектного переходного материала лития, полученного включением 10% по весу и 20% по весу LiNi0,92Mg0,80O2 и тепловую обработку в условиях воздуха
Те же самые протоколы обработки, что и в примере 3, использовались для синтеза фосфата дефектного переходного материала лития с добавками 10% по массе и 20% по массе вместо 3% по массе в примере 3.
Рентгенографические данные показаны на фиг.7(а) и 7(b). Фазы с более сильной фазой без примесей наблюдались для 10% по массе и 20% по массе LiNi0,92Mg0,08O2 в добавленных образцах по сравнению с рентгенографическими данными, показанными для встроенного материала чистого LiFePO4 и 3% по массе LiNi0,92Mg0,08O2 (фиг.2 и 5, соответственно). Это говорит о том, что существование LiNi0,92Mg0,08O2 во время синтеза может привести к некоторым фазам с примесью, включая непрореагировавший LiNi0,92Mg0,08O2 и частично растворенный материал.
Электрохимические данные показаны на фиг.8(а)-8(d). Из фиг.8 можно видеть, что характеристики цикличности являются хорошими, как при включенном материале 3% по массе LiNi0,92Mg0,08O2, хотя производительность увеличилась с 75 мА-ч/г до 50-60 мА-час). Можно заключить, что при добавлении большего количества материала LiNi0,92Mg0,08O2, хотя и обеспечивается хорошая электропроводность материала благодаря присутствию дефектной кристаллической структуре со слишком большим добавлением LiNi0,92 Mg0,08O2, добавление недостаточного времени тепловой обработки приведет к существованию непрореагировавшего LiNi0,92Mg0,08O2, не имеющего никакой емкости. В результате для цели получения хорошего контроля характеристик материала типа дефектного лития железа фосфата, синтезированного в воздушной среде, нужно добавить нужное количество LiNi0,92Mg0,08O2 для получения наилучшей электропроводности и емкости материала. Количество добавки LiNi0,92Mg0,08O2 во время синтеза таким образом очень важно для получения наилучших электрохимических характеристик батареи.
Пример 6. Сравнительное исследование фосфата дефектного переходного металла лития (полученного из реакций с разными количествами LiNi0,92Mg0,08O2 и LiFePO4 просто механически смешанным с LiNi0,92Mg0,08O2 до разных массовых процентов
Фиг.9(а) показывает набор видов рентгенографии обычно синтезируемого LiFePO4 (приготовленного, как показано в примере 1), причем фосфат дефектного переходного металла лития имеет 3% по массе LiNi0,92Mg0,08O2 (приготовленного, как показано в примере 3), причем фосфат дефектного переходного материала лития имеет 10% по весу и 20% по весу LiNi0,92Mg0,08O2 (приготовленного по примеру 5).
Фиг.9(b) показывает набор видов рентгенографии 0% по массе, 3%, 10% и 20% LiNi0,92Mg0,08O2, просто механически добавленных и смешанных с обычным стехиометрическим LiFePO4. Из фиг.9(b) можно видеть, что при небольшом добавлении LiNi0,92Mg0,08O2 (3% по массе) можно наблюдать отличные пики LiNi0,92Mg0,08O2 (примерно 18,6 градуса для (003) и 44,4 градуса для (104)). Этот пример говорит о том, что характер чистой фазы прореагировавшего образца 3% по массе LiNi0,92Mg0,08O2 (пример 3) является результатом полного растворения LiNi0,92Mg0,08O2 в структуре LiFePO4, потому давая присутствие фосфорных и кислородных вакансий, как описано выше. Также с таким же количеством добавки LiNi0,92Mg0,08O2. В каждом из случаев (материал фиг.9(а) и материал фиг. 9(b)) LiNi0,92Mg0,08O2, добавленный (непрореагировавшая проба), всегда показывает более высокую пиковую интенсивность (003) и (104) (примерно 18,6 гр. И 44,4 гр.). Это говорит о том, что фосфат дефектного переходного металла лития является следствием реакций между как бы синтезированными материалами-предшественниками (как описано в примерах 3 и 4). Характеристики отличны от материала, просто механически смешанного с LiNi0,92Mg0,08O2 до разных процентов по массе.
Пример 7. Химический анализ обычного LiFePO4 (материал, выполненный в примере 1) и фосфата дефектного переходного металла лития, синтезированного путем включения 3% по массе LiNi0,92Mg0,08O2 (материал, выполненный в примере 3)
Результаты химического анализа для обычного LiFePO4 (материал, выполненный в примере 1) и фосфата дефектного переходного металла лития, включенного с 3% по массе LiNi0,92Mg0,08O2 (материал, выполненный в примере 3), показаны в таблице 2. Рассчитанные номера стехиометрии для двух образцов получены преобразованием % по массе в мол.% для каждого элемента, устанавливая стехиометрию Fe и (Fe+Ni+Mg) на единицу. В случае обычного LiFePO4 рассчитанное отношение стехиометрии Fe:P=1:0,9805. Аналогичным образом, материал, включенный 3% по массе, обладает отношением стехиометрии Li:(Fe+Ni+Mg):P=1:0,9534. Нехватка фосфора поддерживает предложенное образование вакансий во время реакции. Следует заметить, что содержание кислорода нельзя химически анализировать. Однако, если мы примем 100% по массе анализируемого образца, стехиометрические номера для 3% по массе включенного материала все же меньше, чем у обычного материала. Это все еще согласуется с предложенным образованием вакансий кислорода во время синтеза.
| Таблица 2 Химический анализ материалов, синтезированных в примере 1 и примере 3*+ |
|||||
| Элементы | Материал примера 1 | Мол. фракция | Элементы | Материал примера 3 | Мол. фракция |
| Li (% по м) | 4,3 | 0,61951 | Li (% по м) | 4,14 | 0,59646 |
| Fe (% по м) | 32 | 0,57299 | Fe (% по м) | 31,0 | 0,55509 |
| Р (% по м) | 17,4 | 0,56183 | Р (% по м) | 17,3 | 0,55861 |
| С (% по м) | 5,7 | 0,47460 | С (% по м) | 4,45 | 0,37052 |
| Ni (% по м) | 1,67 | 0,028455 | |||
| Мg (% по м) | 0,57 | 0,00234 | |||
| Молярное отношение | Fe:P | 1:0,9805 | Молярное отношение | (Fe+Mg+Ni):Р | 1:0,9534 |
| * Li, Fe,P, Ni, Mg были анализированы с использованием ICP-OES | |||||
С был анализирован с использованием ASTM D5373
Содержание кислорода нельзя определить непосредственно из-за относительно высокой концентрации металлов.
Пример 8. Синтез фосфата дефектного переходного металла лития, включенного со шпинельструктурированным Li0,07Mn1,93O4 (3% по массе) в условиях воздуха
Fe2O3, Li2CO3 и супер Р, молярное отношение (1:1:2) смешивались вместе с добавлением подходящего количества воды. После тщательного перемешивания стехиометрическое количество фосфорной кислоты добавлялось в раствор и применялось длительное перемешивание. Наконец, взвесь высушивалась в воздухе при 150°С в течение 10 часов, затем следовала дополнительная тепловая обработка при 400°С в течение 5 часов до получения больших кусков материала.
Li1,07Mn1,93O4 синтезировался с использованием Li2CO3 и Мn3O4 со стехиометрическим отношением Li:Mn 1,1:2 в предшественнике. Исходные материалы Li2СО3 и Мn3O4 сначала смешивались в шаровой мельнице в течение 8 часов, затем следовала тепловая обработка материала до 800°С в течение 24 часов в воздухе. Далее полученный материал подвергался размельчению и просеиванию.
Приготовленные выше материалы проходили через размельчение и шаровую мельницу в течение примерно 12 часов, причем количество Li1,07Mn1,93O4 составляло 3% по массе, затем проходили тепловую обработку при 600°С в течение 10 часов в печи, показанной на фиг.1, в атмосфере воздуха.
Рентгенографические данные показаны на фиг.10. Наблюдалось немного больше фаз с примесями по сравнению с данными рентгенографии, показанными для чистого LiFePO4 и 3% по массе LiNi0,92Mg0,08O2 включенного материала. Электрохимические данные показаны на фиг.11(а) и 11(b). Из фиг.11(а) можно видеть, что характеристики цикличности намного улучшились по сравнению с данными, показанными в примере 1. Не наблюдалось снижения емкости (см. фиг.11(b)) и перекрывания кривых цикличности. Этот результат говорит о том, что хорошая электропроводность материала поддерживается на протяжении всей цикличности, и таким образом материал не обладает характеристиками затухания.
Хотя изложены конкретные материалы, тепловые обработки и т.д. для целей описания вариантов осуществления изобретения, можно прибегнуть к различным модификациям в свете вышеизложенного, не отходя от нового вклада в технику заявителя; поэтому при определении объема данного изобретения нужно ссылаться на прилагаемую формулу изобретения.
Claims (21)
1. Семейство катодных материалов для литий-ионной батареи, содержащее в основном оксид дефектного кристаллического переходного металла лития в виде LiFe(1-x)MxP(1-x)O2(2-x), где 0,01<=x<=0,3, и М представляет собой один или несколько элементов, выбранных из группы переходных металлов, состоящей из никеля, титана, ванадия, хрома, марганца, железа, кобальта и алюминия.
2. Семейство катодных материалов по п.1, в котором М дополнительно включает в себя один или несколько элементов, выбранных из группы, включающей двухвалентные катионы, состоящей из магния, кальция, стронция, бария и цинка.
3. Семейство катодных материалов для литий-ионной батареи, содержащее в основном оксид дефектного кристаллического переходного металла лития в виде Li(1-x/2)MxFe(1-x)P(1-x)O2(2-x), где 0,01<=х<=0,3, и М представляет собой один или несколько элементов, выбранных из группы переходных металлов, состоящей из никеля, титана, ванадия, хрома, марганца, железа, кобальта и алюминия.
4. Семейство катодных материалов по п.3, в котором М дополнительно включает в себя один или несколько элементов, выбранных из группы, включающей двухвалентные катионы, состоящей из магния, кальция, стронция, бария и цинка.
5. Семейство катодных материалов по п.1, дополнительно содержащее неполностью прореагировавшую слоистую структуру или материал со структурой шпинели.
6. Семейство катодных материалов по п.2, дополнительно включающее в себя неполностью прореагировавшую слоистую структуру или материал со структурой шпинели.
7. Семейство катодных материалов по п.3, дополнительно включающее в себя неполностью прореагировавшую слоистую структуру или материал со структурой шпинели.
8. Семейство катодных материалов по п.4, дополнительно включающее в себя неполностью прореагировавшую слоистую структуру или материал со структурой шпинели.
9. Способ образования катодного материала для литий-ионной батареи, включающий в себя следующие этапы:
a) доставку оксида кристаллического переходного металла лития;
b) доставку исходных химических элементов Li:Fe:P:C в молярном отношении 1:1:1:2;
c) объединение и дробление материалов а) и b), чтобы образовать смесь материалов из а) и b) в виде частиц;
d) нагревание материала, полученного на этапе с) с образованием катодного материала, имеющего дефектную кристаллическую структуру кристаллических
LiFe(1-x)MxP(1-x)O2(2-x) или Li(1-x/2)MxFe(1-x)P(1-x)O2(2-x),
где 0,01<=x<=0,3, и М представляет собой один или несколько элементов, выбранных из группы металлов, состоящей из никеля, титана, ванадия, хрома, марганца, железа, кобальта и алюминия, и указанный нагрев проводится в сосуде в воздухе; и поверхности материала, обращенные к воздуху, покрыты слоем инертной пористой оболочки, которая позволяет проникать воздуху и выходить газам, вызванным этим нагреванием.
a) доставку оксида кристаллического переходного металла лития;
b) доставку исходных химических элементов Li:Fe:P:C в молярном отношении 1:1:1:2;
c) объединение и дробление материалов а) и b), чтобы образовать смесь материалов из а) и b) в виде частиц;
d) нагревание материала, полученного на этапе с) с образованием катодного материала, имеющего дефектную кристаллическую структуру кристаллических
LiFe(1-x)MxP(1-x)O2(2-x) или Li(1-x/2)MxFe(1-x)P(1-x)O2(2-x),
где 0,01<=x<=0,3, и М представляет собой один или несколько элементов, выбранных из группы металлов, состоящей из никеля, титана, ванадия, хрома, марганца, железа, кобальта и алюминия, и указанный нагрев проводится в сосуде в воздухе; и поверхности материала, обращенные к воздуху, покрыты слоем инертной пористой оболочки, которая позволяет проникать воздуху и выходить газам, вызванным этим нагреванием.
10. Способ по п.9, в котором исходные химические материалы этапа b) включают в себя Fe2O3, Li2CO3, H3PO4 и С,
Fe2O3+Li2CO3 и H3PO4 имеются в стехиометрических количествах, и С имеется в количестве, превосходящем стехиометрическое количество.
Fe2O3+Li2CO3 и H3PO4 имеются в стехиометрических количествах, и С имеется в количестве, превосходящем стехиометрическое количество.
11. Способ по п.9, в котором на этапе d) материалы нагреваются до температуры 550-650°С в течение 8-12 ч.
12. Способ по п.9, в котором этап b) дополнительно включает в себя образование и перемешивание взвеси исходных химических веществ, высушивание взвеси, нагревание высушенной взвеси для получения продукта, пригодного для дробления на этапе с).
13. Способ по п.12, в котором взвесь высушивается в воздухе при примерно 150°С в течение примерно 10 ч, и высушенная взвесь нагревается при примерно 400°С в течение примерно 5 ч.
14. Способ по п.9, в котором указанный оксид кристаллического переходного металла лития имеет общую химическую формулу LiNi(x)Mg(1-x)O2 или Li(1+x)Mn(2-x)O4, где 0<=x<=0,2.
15. Способ по п.9, в котором указанная оболочка является оболочкой из керамических волокон, имеющей толщину слоя примерно 1-3 дюйма.
16. Способ по п.9, в котором на этапе d) материалы нагреваются до температуры примерно 600°С в течение примерно 10 ч.
17. Способ по п.9, в котором смесь этапа с) содержит 1-5% по массе оксида кристаллического переходного металла лития.
18. Способ по п.14, в котором оксид кристаллического переходного металла лития представляет собой LiNi(0,92) Mg(0,08)O2 или Li(1,07)Mn(1,93)O4.
19. Способ образования катодного материала для литий-ионной батареи, включающий в себя следующие этапы:
а) обеспечение оксида кристаллического переходного металла лития LiNi(0,92)Mg(0,08)O2 или Li(1,07) Mn(1,93)O4;
b) обеспечение исходных химических веществ Fe2O3, Li2CO3, H3PO4 и С в стехиометрических количествах 1:1:2:2;
c) образование и перемешивание взвеси исходных химических веществ, высушивание взвеси в воздухе при, примерно 150°С, в течение примерно 10 ч, нагревание высушенной взвеси до примерно 400°С в течение 5 ч для получения продукта, пригодного для дробления;
d) соединение и дробление материалов по а) и с), чтобы образовать смесь материалов а) и с) в виде частиц, причем смесь содержит 3% по массе оксида кристаллического переходного металла лития;
e) нагревание материала из этапа d) с образованием катодного материала, имеющего дефектную кристаллическую структуру кристаллических LiFe(1-x)MxP(1-x)O2(2-x), или Li(1-x/2)MxFe(1-x)P(1-x)O2(2-x), причем нагревание проводится в сосуде на воздухе при температуре примерно 600°С в течение примерно 10 ч; и поверхности материала, обращенные к воздуху, покрыты слоем пористой инертной оболочки, которая позволяет воздуху проникать и выходит газам, вызванным этим нагревом.
а) обеспечение оксида кристаллического переходного металла лития LiNi(0,92)Mg(0,08)O2 или Li(1,07) Mn(1,93)O4;
b) обеспечение исходных химических веществ Fe2O3, Li2CO3, H3PO4 и С в стехиометрических количествах 1:1:2:2;
c) образование и перемешивание взвеси исходных химических веществ, высушивание взвеси в воздухе при, примерно 150°С, в течение примерно 10 ч, нагревание высушенной взвеси до примерно 400°С в течение 5 ч для получения продукта, пригодного для дробления;
d) соединение и дробление материалов по а) и с), чтобы образовать смесь материалов а) и с) в виде частиц, причем смесь содержит 3% по массе оксида кристаллического переходного металла лития;
e) нагревание материала из этапа d) с образованием катодного материала, имеющего дефектную кристаллическую структуру кристаллических LiFe(1-x)MxP(1-x)O2(2-x), или Li(1-x/2)MxFe(1-x)P(1-x)O2(2-x), причем нагревание проводится в сосуде на воздухе при температуре примерно 600°С в течение примерно 10 ч; и поверхности материала, обращенные к воздуху, покрыты слоем пористой инертной оболочки, которая позволяет воздуху проникать и выходит газам, вызванным этим нагревом.
20. Способ образования катода для литий-ионной батареи, включающий в себя следующие этапы:
a) обеспечение оксида кристаллического переходного материала лития;
b) обеспечение исходных химических веществ Li:Fe:P:C в молярном отношении 1:1:1:2;
c) соединение и дробление материалов по а) и b), чтобы образовать смесь материалов по а) и b) в виде частиц;
d) нагрев материала из этапа с) с образованием катодного материала, имеющего дефектную кристаллическую структуру кристаллических
LiFe(1-x)MxP(1-x)O2(2-x), или Li(1-x/2)MxFe(1-x)P(1-x)O2(2-x),
где
0,01<=x<=0,3, и М представляет собой один или несколько элементов, выбранных из группы металлов, состоящей из никеля, титана, ванадия, хрома, марганца, железа, кобальта и алюминия, и указанный нагрев осуществляют в сосуде в воздухе; и поверхности материала, обращенные к воздуху, покрыты слоем пористой инертной оболочки, которая позволяет воздуху проникать и выходить газам, вызванным этим нагревом;
e) приготовление взвеси, имеющей содержание 85-95% по массе материала из этапа d), 2-7% по массе углерода, 2-7% по массе растворимого связующего материала и растворитель для этого растворимого связующего материала;
f) покрытие, по меньшей мере, одной стороны фольги указанной взвесью;
g) высушивание этого покрытия из взвеси.
a) обеспечение оксида кристаллического переходного материала лития;
b) обеспечение исходных химических веществ Li:Fe:P:C в молярном отношении 1:1:1:2;
c) соединение и дробление материалов по а) и b), чтобы образовать смесь материалов по а) и b) в виде частиц;
d) нагрев материала из этапа с) с образованием катодного материала, имеющего дефектную кристаллическую структуру кристаллических
LiFe(1-x)MxP(1-x)O2(2-x), или Li(1-x/2)MxFe(1-x)P(1-x)O2(2-x),
где
0,01<=x<=0,3, и М представляет собой один или несколько элементов, выбранных из группы металлов, состоящей из никеля, титана, ванадия, хрома, марганца, железа, кобальта и алюминия, и указанный нагрев осуществляют в сосуде в воздухе; и поверхности материала, обращенные к воздуху, покрыты слоем пористой инертной оболочки, которая позволяет воздуху проникать и выходить газам, вызванным этим нагревом;
e) приготовление взвеси, имеющей содержание 85-95% по массе материала из этапа d), 2-7% по массе углерода, 2-7% по массе растворимого связующего материала и растворитель для этого растворимого связующего материала;
f) покрытие, по меньшей мере, одной стороны фольги указанной взвесью;
g) высушивание этого покрытия из взвеси.
21. Способ образования литий-ионной батареи, включающий в себя
a) образование ряда катодов по способу, указанному в п.20;
b) образование ряда анодов;
c) организацию ряда катодов и анодов в чередующейся последовательности;
d) наличие электролита между указанными чередующимися катодами и анодами.
a) образование ряда катодов по способу, указанному в п.20;
b) образование ряда анодов;
c) организацию ряда катодов и анодов в чередующейся последовательности;
d) наличие электролита между указанными чередующимися катодами и анодами.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/371,259 US7494744B2 (en) | 2006-03-08 | 2006-03-08 | Cathode material for Li-ion battery applications |
| US11/371,259 | 2006-03-08 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2382442C1 true RU2382442C1 (ru) | 2010-02-20 |
Family
ID=38475411
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008127740/09A RU2382442C1 (ru) | 2006-03-08 | 2007-03-02 | Материал катода для применения в литий-ионных батареях |
Country Status (11)
| Country | Link |
|---|---|
| US (4) | US7494744B2 (ru) |
| EP (1) | EP1992027B1 (ru) |
| JP (1) | JP5164858B2 (ru) |
| KR (1) | KR20080077412A (ru) |
| CN (1) | CN101401230B (ru) |
| CA (1) | CA2636380C (ru) |
| ES (1) | ES2688773T3 (ru) |
| HK (1) | HK1127165A1 (ru) |
| RU (1) | RU2382442C1 (ru) |
| TW (1) | TWI315297B (ru) |
| WO (1) | WO2007103179A2 (ru) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2453950C1 (ru) * | 2011-03-28 | 2012-06-20 | Открытое акционерное общество "Завод автономных источников тока" | Катодный активный материал на основе литированного фосфата железа с модифицирующей добавкой марганца |
| RU2457585C1 (ru) * | 2011-05-05 | 2012-07-27 | Государственное образовательное учреждение высшего профессионального образования Саратовский государственный технический университет (ГОУ ВПО СГТУ) | Катодный материал для литиевого источника тока |
| RU2556239C1 (ru) * | 2011-07-04 | 2015-07-10 | Ниссан Мотор Ко., Лтд. | Активный материал положительного электрода для электрического устройства, положительный электрод для электрического устройства и электрическое устройство |
| RU2747565C1 (ru) * | 2020-05-21 | 2021-05-07 | Федеральное государственное бюджетное учреждение науки Институт химии твердого тела и механохимии Сибирского отделения Российской академии наук | Способ получения композиционного катодного материала на основе Na3V2(PO4)2F3 для натрий-ионных аккумуляторов |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8158071B2 (en) * | 2006-04-29 | 2012-04-17 | Chun-Chieh Chang | Method and devices for producing air sensitive electrode materials for lithium ion battery applications |
| DE102006051735A1 (de) * | 2006-10-30 | 2008-05-08 | Merck Patent Gmbh | Druckfähiges Medium zur Ätzung von oxidischen, transparenten, leitfähigen Schichten |
| WO2008145034A1 (en) * | 2007-05-28 | 2008-12-04 | Byd Company Limited | Method for preparing lithium iron phosphate as a positive electrode active material for a lithium ion secondary battery |
| EP2142473B1 (en) * | 2007-07-31 | 2014-04-02 | Byd Company Limited | Method for preparing lithium iron phosphate as positive electrode active material for lithium ion secondary battery |
| CN101399343B (zh) * | 2007-09-25 | 2011-06-15 | 比亚迪股份有限公司 | 锂离子二次电池正极活性物质磷酸铁锂的制备方法 |
| CN101420048A (zh) * | 2007-10-26 | 2009-04-29 | 比亚迪股份有限公司 | 一种锂离子二次电池的制备方法 |
| RU2451755C2 (ru) * | 2007-11-14 | 2012-05-27 | Цун-Юй ЧАНГ | Способ и устройство для производства чувствительных к воздушной среде электродных материалов для применения в батареях литий-ионных аккумуляторов |
| WO2009064265A1 (en) * | 2007-11-14 | 2009-05-22 | Chun-Chieh Chang | Method and devices for producing air sensitive electrode materials for lithium ion battery applications |
| CN101453019B (zh) * | 2007-12-07 | 2011-01-26 | 比亚迪股份有限公司 | 含磷酸亚铁锂的正极活性物质及其制备方法和正极及电池 |
| CN101471432B (zh) * | 2007-12-27 | 2012-11-21 | 比亚迪股份有限公司 | 一种隔膜及其制备方法及锂离子电池 |
| CN101494305B (zh) * | 2008-01-25 | 2011-05-18 | 比亚迪股份有限公司 | 锂离子电池电解液和含有该电解液的电池及电池组 |
| US8088305B2 (en) * | 2008-02-22 | 2012-01-03 | Byd Company Limited | Lithium iron phosphate cathode material |
| US8062560B2 (en) * | 2008-02-29 | 2011-11-22 | Byd Company Limited | Composite compound with mixed crystalline structure |
| US8052897B2 (en) * | 2008-02-29 | 2011-11-08 | Byd Company Limited | Composite compound with mixed crystalline structure |
| US8062559B2 (en) * | 2008-02-29 | 2011-11-22 | Byd Company Limited | Composite compound with mixed crystalline structure |
| US20090220858A1 (en) * | 2008-02-29 | 2009-09-03 | Byd Company Limited | Composite Compound With Mixed Crystalline Structure |
| US8057711B2 (en) * | 2008-02-29 | 2011-11-15 | Byd Company Limited | Composite compound with mixed crystalline structure |
| US8148015B2 (en) * | 2008-03-21 | 2012-04-03 | Byd Company Limited | Cathode materials for lithium batteries |
| CN101597089A (zh) * | 2008-06-06 | 2009-12-09 | 比亚迪股份有限公司 | 一种过渡金属氢氧化物及其氧化物和正极材料的制备方法 |
| CN101640288B (zh) * | 2008-07-30 | 2012-03-07 | 比亚迪股份有限公司 | 一种锂离子电池电解液及含有该电解液的锂离子电池 |
| KR101108444B1 (ko) * | 2008-10-22 | 2012-01-31 | 주식회사 엘지화학 | 전극 효율 및 에너지 밀도 특성이 개선된 양극 합제 |
| RU2467434C1 (ru) * | 2008-10-22 | 2012-11-20 | ЭлДжи КЕМ, ЛТД. | Активный катодный материал, обеспечивающий улучшенную эффективность и плотность энергии электрода |
| CN104201379B (zh) * | 2008-10-22 | 2017-09-15 | 株式会社Lg化学 | 正极活性材料、正极混合物、正极和锂二次电池 |
| KR100939647B1 (ko) * | 2009-01-22 | 2010-02-03 | 한화석유화학 주식회사 | 전극 활물질인 음이온 부족형 비화학양론 리튬 전이금속 다중산 화합물, 그 제조 방법 및 그를 이용한 전기화학 소자 |
| US8388867B2 (en) * | 2009-08-14 | 2013-03-05 | The United States Of America, As Represented By The Secretary Of The Navy | Cation deficient materials for electrical energy storage |
| US8530095B2 (en) | 2009-09-09 | 2013-09-10 | Samsung Sdi Co., Ltd. | Negative active material for rechargeable lithium battery, method of preparing same, and rechargeable lithium battery including same |
| CA2801280C (en) | 2010-06-02 | 2015-02-10 | Sharp Kabushiki Kaisha | Method for producing lithium-containing composite oxide |
| JP5440460B2 (ja) * | 2010-09-10 | 2014-03-12 | 株式会社村田製作所 | 二次電池用電極活物質の製造方法、二次電池用電極活物質、二次電池、および、二次電池用電極活物質の前駆体 |
| JP5698951B2 (ja) | 2010-10-19 | 2015-04-08 | シャープ株式会社 | 正極活物質及びその製造方法、正極ならびに非水電解質二次電池 |
| JP5625880B2 (ja) * | 2010-12-20 | 2014-11-19 | 日産自動車株式会社 | 正極電極スラリーの製造方法、および正極電極スラリーの製造装置 |
| US9160001B2 (en) | 2010-12-23 | 2015-10-13 | Wildcat Discovery Technologies, Inc. | Lithium-ion battery materials with improved properties |
| JP5478549B2 (ja) * | 2011-04-18 | 2014-04-23 | シャープ株式会社 | 正極活物質の製造方法 |
| WO2012147837A1 (ja) * | 2011-04-28 | 2012-11-01 | 昭和電工株式会社 | リチウム二次電池用正極活物質の製造方法、リチウム二次電池用正極活物質及びリチウム二次電池 |
| US20130084384A1 (en) * | 2011-10-04 | 2013-04-04 | Semiconductor Energy Laboratory Co., Ltd. | Manufacturing method of secondary particles and manufacturing method of electrode of power storage device |
| US9090476B2 (en) | 2012-03-22 | 2015-07-28 | Chun-Chieh Chang | Direct deposition of graphene on substrate material |
| US9059466B2 (en) | 2012-03-22 | 2015-06-16 | Chun-Chieh Chang | Direct synthesis of lithium ion battery electrode materials using graphene treated raw materials as the reactant |
| CN103094568A (zh) * | 2013-01-29 | 2013-05-08 | 河北师范大学 | 一种磷酸铁锂材料的制备方法 |
| US8968669B2 (en) | 2013-05-06 | 2015-03-03 | Llang-Yuh Chen | Multi-stage system for producing a material of a battery cell |
| TWI631073B (zh) * | 2013-05-08 | 2018-08-01 | 長園科技實業股份有限公司 | 鋰鎳錳鈷磷之氧化物之合成及特徵 |
| KR102062705B1 (ko) | 2013-06-14 | 2020-01-06 | 삼성에스디아이 주식회사 | 리튬 금속인산화물의 제조방법 |
| CN106575742B (zh) | 2014-07-24 | 2020-08-18 | 长园科技实业股份有限公司 | 用于制造不含聚合物粘合剂的电极的方法和系统 |
| KR101979347B1 (ko) * | 2016-10-26 | 2019-05-16 | 주식회사 엘지화학 | 이차전지용 전극의 제조 방법 |
| US10727543B2 (en) | 2018-01-08 | 2020-07-28 | Changs Ascending Enterprise Co., Ltd. | Battery module system and method |
| US10641835B2 (en) | 2018-03-15 | 2020-05-05 | Ascending Energy Inc. | Health monitoring and safety protection for lithium ion battery modules and applications |
| JP7425751B2 (ja) * | 2018-05-30 | 2024-01-31 | ハイドロ-ケベック | セラミック、その生成のための方法、およびその使用 |
| CN109888205A (zh) * | 2019-01-18 | 2019-06-14 | 北方奥钛纳米技术有限公司 | 纳微球形碳包覆磷酸锰铁锂复合材料及制备方法、锂电池正极材料、锂电池 |
| US11673112B2 (en) | 2020-06-28 | 2023-06-13 | eJoule, Inc. | System and process with assisted gas flow inside a reaction chamber |
| US11376559B2 (en) | 2019-06-28 | 2022-07-05 | eJoule, Inc. | Processing system and method for producing a particulate material |
| US11121354B2 (en) | 2019-06-28 | 2021-09-14 | eJoule, Inc. | System with power jet modules and method thereof |
| US11546336B1 (en) | 2019-10-22 | 2023-01-03 | Amazon Technologies, Inc. | Independently configurable access device stages for processing interconnect access requests |
| US11392406B1 (en) | 2019-10-22 | 2022-07-19 | Amazon Technologies, Inc. | Alternative interrupt reporting channels for microcontroller access devices |
| DE102019135049A1 (de) * | 2019-12-19 | 2021-06-24 | Bayerische Motoren Werke Aktiengesellschaft | Lithiumionen-Batterie und Verfahren zur Herstellung einer Lithiumionen-Batterie |
| US11552948B1 (en) | 2020-03-26 | 2023-01-10 | Amazon Technologies, Inc. | Domain management intermediary service |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6514640B1 (en) | 1996-04-23 | 2003-02-04 | Board Of Regents, The University Of Texas System | Cathode materials for secondary (rechargeable) lithium batteries |
| US5910382A (en) * | 1996-04-23 | 1999-06-08 | Board Of Regents, University Of Texas Systems | Cathode materials for secondary (rechargeable) lithium batteries |
| US6017654A (en) | 1997-08-04 | 2000-01-25 | Carnegie Mellon University | Cathode materials for lithium-ion secondary cells |
| US6528033B1 (en) * | 2000-01-18 | 2003-03-04 | Valence Technology, Inc. | Method of making lithium-containing materials |
| TW525313B (en) * | 2000-04-25 | 2003-03-21 | Sony Corp | Positive electrode active material and non-aqueous electrolyte cell |
| JP4595205B2 (ja) * | 2001-01-22 | 2010-12-08 | 株式会社デンソー | 非水電解質二次電池 |
| US6727017B1 (en) | 2001-04-06 | 2004-04-27 | Changs Ascending Enterprise Co., Ltd. | Methods of fabricating binding layers for a Li-ion polymer battery |
| JP4153288B2 (ja) * | 2002-11-25 | 2008-09-24 | 日本電信電話株式会社 | 非水電解質二次電池 |
| CN100448071C (zh) * | 2003-03-18 | 2008-12-31 | 黄穗阳 | 锂电池正极材料及其制备方法 |
| JP4610925B2 (ja) * | 2004-05-11 | 2011-01-12 | 日本電信電話株式会社 | 非水電解質二次電池 |
| CN1585168A (zh) * | 2004-05-21 | 2005-02-23 | 河南金龙精密铜管股份有限公司 | 锂离子电池用改性磷酸亚铁理正极材料及其生产方法 |
| CN101361210B (zh) * | 2005-12-02 | 2014-11-26 | A123系统公司 | 非晶态或部分非晶态的纳米级离子贮存材料 |
-
2006
- 2006-03-08 US US11/371,259 patent/US7494744B2/en active Active
-
2007
- 2007-03-02 CA CA2636380A patent/CA2636380C/en active Active
- 2007-03-02 ES ES07752079.9T patent/ES2688773T3/es active Active
- 2007-03-02 RU RU2008127740/09A patent/RU2382442C1/ru active IP Right Revival
- 2007-03-02 WO PCT/US2007/005354 patent/WO2007103179A2/en active Application Filing
- 2007-03-02 JP JP2008550472A patent/JP5164858B2/ja active Active
- 2007-03-02 KR KR1020087017784A patent/KR20080077412A/ko active Search and Examination
- 2007-03-02 EP EP07752079.9A patent/EP1992027B1/en active Active
- 2007-03-02 CN CN2007800028467A patent/CN101401230B/zh active Active
- 2007-03-08 TW TW096107989A patent/TWI315297B/zh active
-
2009
- 2009-01-13 US US12/319,892 patent/US7585593B2/en active Active
- 2009-01-13 US US12/319,832 patent/US7629084B2/en active Active
- 2009-01-13 US US12/319,895 patent/US7718320B2/en active Active
- 2009-07-15 HK HK09106430.6A patent/HK1127165A1/xx unknown
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2453950C1 (ru) * | 2011-03-28 | 2012-06-20 | Открытое акционерное общество "Завод автономных источников тока" | Катодный активный материал на основе литированного фосфата железа с модифицирующей добавкой марганца |
| WO2012134356A2 (ru) * | 2011-03-28 | 2012-10-04 | Открытое акционерное общество "Завод автономных источников тока" | Катодный активный материал на основе литированного фосфата желез с модифицирующей добавкой марганца |
| WO2012134356A3 (ru) * | 2011-03-28 | 2012-12-27 | Открытое акционерное общество "Завод автономных источников тока" | Катодный активный материал на основе литированного фосфата желез с модифицирующей добавкой марганца |
| RU2457585C1 (ru) * | 2011-05-05 | 2012-07-27 | Государственное образовательное учреждение высшего профессионального образования Саратовский государственный технический университет (ГОУ ВПО СГТУ) | Катодный материал для литиевого источника тока |
| RU2556239C1 (ru) * | 2011-07-04 | 2015-07-10 | Ниссан Мотор Ко., Лтд. | Активный материал положительного электрода для электрического устройства, положительный электрод для электрического устройства и электрическое устройство |
| RU2747565C1 (ru) * | 2020-05-21 | 2021-05-07 | Федеральное государственное бюджетное учреждение науки Институт химии твердого тела и механохимии Сибирского отделения Российской академии наук | Способ получения композиционного катодного материала на основе Na3V2(PO4)2F3 для натрий-ионных аккумуляторов |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2636380C (en) | 2013-11-26 |
| JP2009523309A (ja) | 2009-06-18 |
| US7494744B2 (en) | 2009-02-24 |
| EP1992027B1 (en) | 2018-07-18 |
| HK1127165A1 (en) | 2009-09-18 |
| TWI315297B (en) | 2009-10-01 |
| EP1992027A4 (en) | 2013-01-23 |
| EP1992027A2 (en) | 2008-11-19 |
| ES2688773T3 (es) | 2018-11-06 |
| US20070212606A1 (en) | 2007-09-13 |
| WO2007103179A3 (en) | 2008-08-21 |
| TW200740690A (en) | 2007-11-01 |
| US20090146103A1 (en) | 2009-06-11 |
| US7718320B2 (en) | 2010-05-18 |
| WO2007103179A2 (en) | 2007-09-13 |
| US7629084B2 (en) | 2009-12-08 |
| CN101401230A (zh) | 2009-04-01 |
| US20090145536A1 (en) | 2009-06-11 |
| KR20080077412A (ko) | 2008-08-22 |
| US7585593B2 (en) | 2009-09-08 |
| CN101401230B (zh) | 2011-09-07 |
| JP5164858B2 (ja) | 2013-03-21 |
| CA2636380A1 (en) | 2007-09-13 |
| US20090146102A1 (en) | 2009-06-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2382442C1 (ru) | Материал катода для применения в литий-ионных батареях | |
| US7820137B2 (en) | Lithium titanate and method of forming the same | |
| US7524529B2 (en) | Method for making a lithium mixed metal compound having an olivine structure | |
| Irisarri et al. | Optimization of large scale produced hard carbon performance in Na-ion batteries: effect of precursor, temperature and processing conditions | |
| JP5880757B1 (ja) | リチウムイオン二次電池用正極材料、リチウムイオン二次電池用正極、リチウムイオン二次電池、リチウムイオン二次電池用正極材料の製造方法 | |
| Hu et al. | In situ catalytic formation of graphene-like graphitic layer decoration on Na 3 V 2− x Ga x (PO 4) 3 (0≤ x≤ 0.6) for ultrafast and high energy sodium storage | |
| JP5303081B2 (ja) | 非水電解質二次電池用正極材料 | |
| US20060257307A1 (en) | Method for making a lithium mixed metal compound | |
| KR20060045560A (ko) | 비수 전해질 2차 전지용 양극 활물질 및 그 제조 방법 및그것을 이용한 비수 전해질 2차 전지 | |
| KR20010081002A (ko) | 국부화된 입방형 스피넬 구조의 상을 가지지 않는 층상리튬 금속 산화물 및 그 제조방법 | |
| US20180277844A1 (en) | Production of a Spinel Material | |
| JP2021064598A (ja) | リチウムイオン二次電池用正極活物質およびその製造方法 | |
| Sun et al. | LiNi0. 5Mn1. 45Zn0. 05O4 with excellent electrochemical performance for lithium ion batteries | |
| Kozawa et al. | Insertion of lattice strains into ordered LiNi0. 5Mn1. 5O4 spinel by mechanical stress: A comparison of perfect versus imperfect structures as a cathode for Li-ion batteries | |
| Ding et al. | Modified solid-state reaction synthesized cathode lithium iron phosphate (LiFePO4) from different phosphate sources | |
| Wu et al. | Suppression of voltage-decay in Li 2 MnO 3 cathode via reconstruction of layered-spinel coexisting phases | |
| Qiao et al. | Synthesis and Electrochemical Properties of Na and Mg coDoped LiFe0. 65Mn0. 35PO4/C Cathode Materials for Lithium-Ion Batteries | |
| Jayamkondan et al. | Integrated Ni and Li‐Rich Layered Oxide Cathode Materials for High Voltage Cycling in Rechargeable Li‐Ion Batteries | |
| Ou et al. | Facilely synthesized LiFePO 4 nanocomposites with excellent electrochemical properties as cathodes for lithium ion batteries | |
| Chen et al. | A boron-nitride based dispersive composite coating on nickel-rich layered cathodes for enhanced cycle stability and safety | |
| EP1790617B1 (en) | Method for making a lithium mixed metal compound | |
| Lu et al. | Effect of V3+ Doping on the Structure and Electrochemical Properties of Na3MnTi (PO4) 3 Cathode Material | |
| Predoană et al. | Advanced techniques for LiCoO2 preparation and testing | |
| Arbizzani et al. | Power and temperature controlled microwave synthesis of SVO |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20110303 |
|
| NF4A | Reinstatement of patent |
Effective date: 20120127 |