KR970011449B1 - 이온전기 영동형 비침입 검체 채취 또는 이송 장치 및 방법 - Google Patents
이온전기 영동형 비침입 검체 채취 또는 이송 장치 및 방법 Download PDFInfo
- Publication number
- KR970011449B1 KR970011449B1 KR1019890701746A KR890701746A KR970011449B1 KR 970011449 B1 KR970011449 B1 KR 970011449B1 KR 1019890701746 A KR1019890701746 A KR 1019890701746A KR 890701746 A KR890701746 A KR 890701746A KR 970011449 B1 KR970011449 B1 KR 970011449B1
- Authority
- KR
- South Korea
- Prior art keywords
- membrane
- electrode
- skin
- contact
- positive
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/20—Applying electric currents by contact electrodes continuous direct currents
- A61N1/30—Apparatus for iontophoresis, i.e. transfer of media in ionic state by an electromotoric force into the body, or cataphoresis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/41—Detecting, measuring or recording for evaluating the immune or lymphatic systems
- A61B5/411—Detecting or monitoring allergy or intolerance reactions to an allergenic agent or substance
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14532—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring glucose, e.g. by tissue impedance measurement
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/20—Applying electric currents by contact electrodes continuous direct currents
- A61N1/30—Apparatus for iontophoresis, i.e. transfer of media in ionic state by an electromotoric force into the body, or cataphoresis
- A61N1/303—Constructional details
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
- A61M2037/0007—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin having means for enhancing the permeation of substances through the epidermis, e.g. using suction or depression, electric or magnetic fields, sound waves or chemical agents
Abstract
요약없음.
Description
제1도는 하전 또는 중성 물질의 이온전기 영동식 수거 또는 이송에 사용되는 생체의 확산셀의 사시도.
제2도는 제1도 2-2선 종단면도.
제3도는 제1도 확산셀의 분해 단면도.
제4도는 변형된 하부 반쪽셀과 수용체 용액의 순환 상태를 보인 단면도.
제5A도 내지 5H도는 상부 반쪽셀의 하부 5A-5A선에서 절단하여서 본 하부 반쪽셀의 상부 내부를 보인 여러가지 형태의 모형도.
제6도는 공지의 이온전기 영동셀의 사용상태도.
제7도는 본 발명에 의한 생체내 이송용 확산셀의 사용상태도.
제8도는 제7도 8-8선에서 본 확산셀의 사용상태를 보인 확대 단면도.
제9A 및 9B도는 제7도 및 제8도에 도시된 확산셀의 상면 사시도와 저면 사시도.
제10도는 전극이 분리된 이온전기 영동실험 상태를 보인 단면도.
제11도는 제1,2 또는 3도의 확산셀을 사용한 클로니딘의 생체외 이온전기 영동 채취 결과를 보인 도표.
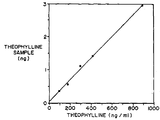
제12도는 제1,2 또는 3도의 확산셀을 사용한 테오필린의 생체외 이온전기 영동 채취 결과를 보인 도표.
제13도는 분리된 전극을 기니아픽에 부착하여 하전 또는 비하전 물질을 채취 또는 이송하는 상태를 보인 실시상태도.
제14도는 제1,2 또는 3도의 확산셀을 이용한 모르핀의 생체외 이온전기 영동 이송 결과를 보인 도표.
제15도는 제1,2 또는 3도의 확산셀을 이용한 피에스오에스(포타슘 슈크로스 옥타 셀페이트)의 생체외 이온전기 영동 이송 결과를 보인 도표.
* 도면의 주요부분에 대한 부호의 설명
10 : 이온전기 영동 확산셀11 : 확산셀의 상부 반쪽셀
12 : 확산셀의 하부 반쪽셀13 : 절채된 피부
14 : 외피 표면15A,15B,15E : 전기 절연성 측벽
16A,16B,16C : 챔버17 : 수용체 수용부
18 : 채널19 : 요홈
21C : 물자켓25A,25B : 전기 전도성 매체
26A,26B : 전극선.
본 발명은 포유동물의 절채된 피부와 같은 막을 통한 이온전기 영동식 검체 채취 및 이송 방법을 모델화하기 위한 생체의 방법과 장치에 관계되는 것이다. 본 발명은 살아있는 포유동물의 무상 피부를 통한 물질의 전기 영동식 이송 및 검체 채취 방법에도 관계된다. 특히 본 발명의 장치는 양극과 음극 및 전기한 두 전극을 전기적으로 분리하는 절연물질이 무상 피부의 동일면에 놓여지는 기구로 구성된다. 본 발명은 그 외에도 관계되는 생활성 물질의 레벨을 연속적으로 감시하고 유효한 레벨로 유지되도록 하는 피드백 메카니즘을 이용한 이온전기 영동 방법에도 관계된다.
베이슬 소재 카아거에 의하여 1987년도에 출판된 파마콜로지 스킨, 제1권, 201-208페이지에서 시. 시. 펙등은 수동 경피 채집 시스텝(TCS)를 이용하여 테오필린의 외향 경피이동을 생체 외적으로 측정하는 방법을 발표하였다.
이 문헌에는 전기를 이용한 이동의 촉진에 대하여는 언급되어 있지 않고 있다.
1986년에 출판된 더 저날 오브 파마큐티칼 사이엔스, 제75권 8호, 738-743페이지에서 알. 알. 버네트 등은 절채된 탈모 새앙쥐 피부를 가로지르는 티로트로핀 방출 호르몬(TRH)의 수동적 생체외 이동과 이온전기 영동적 이동을 표준 확산셀을 이용하여 비교하는데 대하여 발표하였다.
그 결과는 전기를 따거나 전기를 띠지 아니한 TRH가 이온전기 영동에 의하여 절채된 조직을 통하여 흐르는 것이 수동 확산셀에만 의하여 얻어진 것보다 크다는 것을 보여주고 있다.
생체의 이온전기 영동 연구용 표준 설비(제6도)에서는 확산셀의 두 반쪽 부분이 양측에 수평으로 놓여지고 두 반쪽 셀 사이에는 피부가 두 반쪽 셀이 각각 포피내측과 외측에 위치하도록 수직으로 놓여져 있다. 생활성제제와 활성 전극은 셀의 포피측 반쪽 부분에 넣고 셀의 다른쪽 반쪽 부분에는 전도성 유체중의 수동성 전극을 넣고 있다.
이와 같은 두 반쪽 셀을 서로 대향되게 수평으로 배치하는 것은 여러가지 결점과 제한을 갖고 있다. 수동성 전극이 피부의 안쪽에 놓여지도록 하는 구성은 생체내 응용의 경우 좋은 모델이라 할 수 없다. 이와 같은 비생리적 영향을 미치는 인자들은 임상적 경우에는 적당하지 않다. 또한 전술한 대향 배치하는 구성에 의하면 수평 수송의 가능성(예를들면 피부를 수직으로 관통하지 않고 층간 수송)에 대한 문제가 해결되지 않을 뿐 아니라 이온전기 영동적으로 주입된 약물이 수동적 전극에 의하여 피부밖으로 빠져나오게 되는 문제가 해결되지 아니한다.
이온전기 영동 약물 이송 시스템에 관계되는 "포레소"가 미국, 유타 84119, 살트 레이크 시티, 쉬트 에이, 사우드 2320, 웨스트 1290소재 모션 콘트롤, 인코포레이티드에 의하여 판매되고 있다.
생체외 이송
모델화 연구에서는 이온전기 영동이 절채된 피부 검체와 같은 막을 통한 하전된 물질의 화학적 수송을 시험하는데 유용하다. 예를들면 1986년에 출판된 디 인터내쇼날 저날 오브 파마큐틱스, 제30권 63-72페이지에서 엔. 에이 .취. 벨란톤은 공지의 대향 확산셀의 디자인과 전극 구성을 벤조익산의 이온전기 영동에 이용하는데 대하여 발표하였다(제6도 참조). 이 실험 결과는 대향셀의 디자인은 많은 제한이 있음을 지적하고 있다.
생체내 이송
이온전기 영동은 생활성 물질인 하전 물질의 수송을 향상시킨다. 그 공정은 공지의 경피 약물 이송 방법과 같다. 예를들면 S. C. 야콥센등의 미국특허 제4,141,359호에는 이온성 약물이나 약품을 기계적인 침투없이 표피조직을 통하여 국부 투여하는 개량된 이온전기 영동 장치가 기재되어 있다. 이 경우 양극과 음극은 분리된 위치에서 피부에 부착되고 이온 형태의 약물은 적당한 전극에 가하여진다음 전원으로부터의 직류 전류에 의하여 경피조직을 관통하여 조직내로 주입되도록 되었다. 이러한 약물 이송에는 전극이 분리되는데 따른 많은 문제점을 안고있다.
생체내 검체 채취
체내의 생활성 물질(특히, 혈액)을 채취하고 정량화하는 것은 대단히 중요하다. 예를들면 질병의 진단을 위하여 관건이되는 내인성 생화합물의 존재를 감시하는 것이 대단히 중요할 수도 있으며 그에 따라 약물 치료 기간중에 투여진 약물의 혈중농도를 최적의 상태로 유지하도록 하는 것도 필요할 수 있다. 일반적으로 요구하는 결정은 주사침을 통하여 채집관 속으로 뽑아낸 혈액 검체의 분석에 의하여 이루어지고 있다.
생체내 테오브로민의 수동적 경피 채집은 1987년에 출판된 슈프라에 시. 시. 펙에 의하여 발표되었다. 여기에서는 전류에 의한 이동 촉진에 대하여는 언급되어 있지 않았다.
체내 순환계의 생체물질 채취에 대한 비침입 공정이 기술된 문헌은 아직까지 알려지지 않았다. 체내 순환분자들을 피부나 점막 표면에 위치하는 재집기속으로 추출하여 내는데는 이온전기 영동을 이용할 수 있다. 본 발명에 의하면 피부가 손상되지 않을뿐 아니라 혈액 용기가 필요하지 않다.
생체내 생체 감지
입원 환자의 관계되는 생화학적 파라메터를 연속적으로 감시하는 것이 필요함은 물론이고 실시간 온라인 정량화를 얻는 의료 기구도 필요하다. 생체 감지기는 감지신호 도입 요소로서 생활성 분자를 이용하는 초미 전자 기구이다.
케이. 따블유. 훈터는 1987년 7월에 출판된 아취이브스 오브 패도로지 칼 래보라토리메디신, 제8권 633-636페이지에서 기구의 종류와 검사되는 물리적 성질을 발표하였다.
훈터는 또한 경피 도시메타에 대한 개량적인 도표도 제시하였다. 그러나 이 문헌에는 생감지 피드백 약물 수송 시스템을 만들기 위한 부가적인 특수 정보는 제공되어 있지 않다.
시. 시. 펙등은 더 저날 오브 파마코키네틱스 앤드 바이오파마큐틱스 제9권 제1호 41-58페이지에서 평가 약물 섭취와 약동력학에서의 연속적인 경표피 약물 채집(CTDC)의 용도에 대하여 언급하고 있다. 전기한 문헌에는 역수송이 극소화되는 경우에는 CTDC가 약물 노출의 양을 평가할 수 있는 유용한 기구일 수는 있으나 약물소인 운동학의 기타 분야 연구에서의 기타 체액의 개별 채취에는 그 이점이 적은 것으로 결론되었다.
관계되는 미국 특허로는 다음과 같은 것들이 있다 :
4,329,999 ; 4,585,652 ; 4,708,716 ; 제4,689,039 ; 4,702,732 ; 4,693,711 ; 4,717,378 ; 4,756,314 ; 4,699,146 ; 4,700,710 ; 4,706,680 ; 4,713,050 ; 4,721,111 ; 4,602,909 ; 4,595,011 ; 4,722,354 ; 4,722,726 ; 4,727,881; 4,731,049 ; 4,744,787 ; 4,749,819 ; 4,767,401
그외의 문헌으로는 다음과 같은 것들이 있다.
일반적 관심의 대상이 되는 경피 약물 이송 시스템에 관한 와이. 비. 배논의 유럽특허 공보 제252,732호(1988.1.13) ;
1987년 11월에 출판된 엠디 앤드 지아이, 52-57페지에 따블유. 샤람등이 발표한 "생체 감지기의 상업화" ;
1985년 영국 엘세비어 아플리이드 사이엔스 퍼블리셔에 의하여 출판된 "바이오센서", 제1권 85-115페지에 에이. 에프. 터너등에 의하여 발표된 "당뇨병 멜리투스" ;
와이. 이카르리야만등의 Proc. Electrochem. Soc., 1987, 87-9(proc. symp. chem. sens.) 378. CA107-(22) ; 207350n
피. 에이취. 에스. 초 등의 Anal. chem., 1987, 59(19), 2339, CA107(14) ; 1262448.
에이취. 월렌버거 등의 "K. Anal. Lett., 1987, 20(5), 857, CA107(9) ; 73551.
피. 제이. 콘웨이등의 D. A. Sens. Actuators, 1987, 11(4), 305, CA107(5) ; 36151.
엠. 마니시등의 Clin. Chem., (윈스턴-살렘, 엔시) 1987, 33(4), 591, CA107(5) ; 3581h.
아이. 한닝등의 Anal. Lett., 1988, 19(3-4), 461, CA105(6) ; 48993q
엠. 셔철등의 "당뇨병 치료", 1986, 9(3), 298, CA105(5) ; 38426t.
에스. 제이. 척 하우스등의 Anal. Proc.,(런던) 1986, 2395, 146, CA105(3) ; 21117v.
디. 에이. 고흐등의 Anal. Chem., 1985, 67(12), 2351, CA103(15) ; 11925a
시. 루등의 Chem. Eng. Sci., 1985, 40(5), 873, CA103(5) ; 34337a.
하전 또는 중성물질을 생체외적으로 막으로부터 채취하거나 막으로 이송하는 기구와 방법론을 제공하는 것도 중요하고 하전 또는 중성물질을 살아있는 포유동물의 무상 피부(예를들면 점막등)로부터 생체내적으로 채취하거나 무상 피부로 이송시키는 기구와 방법론을 제공하는 것도 중요하다.
본 발명은 이러한 목적을 달성하기 위한 것이다.
본 발명은 막으로부터의 검체 채취를 전기적으로 촉진하기 위하여 사용하거나 기계적인 침투 없이 물질을 막속으로 이송하거나 막을 관통하여 이송하는데 사용하는 장치에 있어서, 막 표면에 접촉하도록 된 최소한 2개의 전기 전도성 삼투성 전극과 전기한 전극들을 서로 전기적으로 분리하는 수단으로 구성되고 전기한 전극들은 실질적인 병열관계로서 나란히 위치하여 그 단부가 막의 동일 표면상에 있는 인접부분에 접촉하도록 된 확산셀에 관계된다.
본 발명은 또한 검체막으로부터 기계적인 침투없이 이온화 되거나 이온화 되지 아니한 물질들을 제거 또는 이송하는 생체외 장치로서, (a) 양극 ; (b) 음극 및 (c) 전기한 양극과 음극을 전기적으로 절연시키는 절연물질로 구성되고 전기한 양극, 음극 및 전기 절연 물질이 검체막의 동일 표면상에 놓이도록 된 장치에도 관계된다.
본 발명은 또한 기계적인 침투없이 무상 피부 또는 점막을 통하여 이온화된 물질을 분리시키거나 포유동물에 이송하는 장치에 있어서, (a) 양극, (b) 음극 및 (c) 양극과 음극사이를 전기적으로 격리하는 전기 절연성 물질로 구성되는 전기한 양극, 음극 및 전기 절연성 물질은 장치의 동일한 표면에서 포유동물의 피부나 점막의 동일 표면에 위치하도록 된 분리 또는 이송 장치에도 관계된다.
또한 본 발명은 살아있는 포유동물내의 하전 또는 하전되지 아니한 분자의 레벨을 측정하고 피드백 메카니즘을 이용하여 유용한 투여 경로에 의하여 적당한 량의 치료물질을 투여하는 이온전기 영동의 이용에도 관계된다.
그외에 본 발명은 가스 크로마토그래피(GC), 질량 분광측정(MS), 고압 액체 크로마토그래피(HPLC), 신틸레이션 카운팅에 의한 물질의 농도 측정에 뒤이어 살아있는 포유동물의 막이나 피부로부터의 하전되었거나 하전되지 아니한 종성 물질의 채집을 증가시는 이온전기 영동의 이용에도 관계된다.
본 발명에 사용된 용어들은 다음의 의미를 갖는다.
"확산셀"은 이온전기 영동을 위한 전기 시스템을 나타낸다. 이 시스템은 양극, 음극 및 양극과 음극사이에 놓이는 전지 절연체를 포함한다. 이 시스템은 그외에도 전기 배선과 절연체 및 접지구등을 포함할 수 있다.
"포유동물"은 토끼, 쥐, 기니아픽, 새앙쥐, 원숭이 등과 같은 실험에 사용되는 통상적인 실험용 동물을 나타낸다. 또한 포유동물의 범주내에는 개, 고양이, 양, 소, 말등이 포함될 수 있으며, 가장 대표적인 포유동물로는 사람이 있다.
"막 표면"은 절채된 피부, 합성막, 점막같은 얇은 막을 나타내며, 이 막 표면은 포유동물, 특히 인간의 무상 피부의 외표면과 내면에도 적용된다.
점체 채취 또는 이송용에 적당한 예에서는 삼투성 전극용 혼합물이 사용된다.
더 바람직한 전극의 예로는 막 표면과 접촉하는 겔과 결합되는 금속 도선을 포함한다.
이하 본 발명을 도면에 의하여 상세히 설명하면 다음과 같다.
이송 또는 채취된 생체 물질로는 분해 생성물, 금속이온, 펩타이드, 호르몬, 톡신 등과 같은 살아있는 포유동물의 조직 체계내에서 나타나는 어떠한 물질도 포함될 수 있는바, 이러한 물질들은 중성일 수도 있고 전하를 띠고 있거나 전하를 띠게 만든것일 수 있다.
검체 채취 및 이송 전극(개방됨)에서, 전기 전도성 겔은 일본국, 오사카 소재 니토 일렉트릭 인다스트리알캄파니 제품인 켄즈겔렐르크(KENZGELELC)이다. 전압은 0.1 내지 15볼트 사이가 보통이지만 1볼트 내지 10볼트 사이가 좋으며, 더 바람직한 것은 약 0.5볼트 정도의 것이 검체 채취와 이송에 모두 적합하다.
생체외 검체 채취
모델셀의 설명 제1도 내지 4도에 의함.
생체외 표준 검체 채취용 이온전기 영동 확산셀(10)은 상부의 반쪽셀(11)과 하부의 반쪽쎌(12)로 구성되었다. 절채 피부(13)는 제2도 및 제3도에 도시된 바와 같이 외피표면(14)이 상부 반쪽셀(11)쪽으로 향하도록 수평으로 배치된다. 상부 반쪽셀(11)은 2개의 수직 측벽(15A),(15B)에 의하여 3개의 챔버(16A)(16B)(16C)로 나누어진다. 2개의 외측 챔버(16A)(16C)는 그 사이에 형성된 중간 챔버(16B)에 의하여 격리되었다. 하부의 반쪽셀(12)에는 수용체 용액이 들어있다. 상부 반쪽셀(11)의 중간 챔버(16B)를 형성하는 측벽(15A)(15B)에 대응하는 하부 반쪽셀(12)의 상단부에는 전기한 측벽(15A)(15B)과 결합되어 연결되는 측벽(15C)(15D)가 형성되어 있는바, 이 측벽(15C)(15D)은 하부 반쪽셀(12)의 상단 내부를 가로지르는 요홈(19)를 갖는 채널(18)의 상단에 연결된다. 이 요홈(19)은 액체를 제거하기 위한 검체 채취구를 갖고 있을 수도 있다.
챔버(16A)(16C)는 각각 겔, 액체, 페이스트, 스폰지, 발포체, 에멀젼, 삼투성 금속, 삼투성 세라믹 또는 그들의 배합물중에서 선택되는 전기 전도성 매체(25A)(25B)를 수용한다. 제3도에서와 같이 전기 회로가 이루어지도록 하기 위하여 각개 챔버내의 전기 전도성 매체에는 전극선(26A)(26B)을 삽입한다.
상부 반쪽셀(11)과 하부 반쪽셀(12)사이에 피부(13)을 끼우고 두 반쪽셀(11)(12)를 결합시켜 상부겔(11)의 측벽(15A)(15B)가 각각 하부셀(12)의 측벽(15C)(15D)와 서로 결합되게 조립하면 두 셀의 측벽 단부사이에 협지된 피부 조각(13)은 전극이 삽입되는 챔버를 하부의 챔버로부터 차단시키게 된다. 또한 전극 챔버(16A)와 전극 챔버(16C)의 저면을 형성하는 피부의 부분들은 구조적으로 서로 격리되게 될뿐아니라 전기적으로도 격리되게 되어 전류와 생체 물질의 흐름은 피부 내부를 통하여서만 이루어지게 된다. 하부셀(12)의 측벽에는 유입구(20A)와 배출구(20B)가 형성되어 있어서, 이 유입구(20A)와 배출구(20B)로 유입, 배출되는 수용체 용액이 수용체 수용부(17)의 내부에 계속적으로 충만된 상태를 유지하게 되고 측벽(15C)(15D)에 의하여 형성된 요홈(19)에도 수용체 용액이 채워지게 되어서 피부(13)의 저면은 실험기간동안 항상 수용체 용액에 의하여 젖어있게 된다. 하부 반쪽셀(12)에는 격벽에 의하여 물순환 자켓(21C)이 형성되어 있고 이통수실(21C)에는 셀 내부의 온도가 일정하게 유지되도록 하기 위한 물이 유입구(21B)와 배출구(21A)를 통하여 순환된다.
상부 반쪽셀(11)과 하부 반쪽셀(12)은 결합면이 꼭맞게 되어 있어서 그 사이에 가검물 피부(13)를 삽입하고 스프링 클립(22A)(22B)같은 결착장치를 사용하여 결합시키면 상부겔(11)과 하부셀(12)이 완전 밀착되게 되었다.
제4도에서는 하부 반쪽셀(12)의 상단 내부에 차단체(18A)가 챔버(16A)와 챔버(16C)를 전기적으로 절연시키도록 가로질러 형성되었다. 제4도에서도 수용체 용액(17)이 저장조(29A)로부터 유입구(20A)를 거쳐 셀(12)의 내부로 순환되게 되었다. 저장조(29A)내의 용액(29B)은 펌프(29)에 의하여 압송 순환된다. 가검물의 검체 채취 및 이송에는 식염수, 혈액등과 같은 적당한 액체가 사용된다.
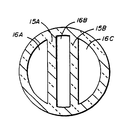
제5A도 내지 5H도에는 본 발명에 의한 여러가지 형태의 확산셀(10)을 제1도 5A-5A선에서 절단한 형태를 보여주고 있다. 제5A도는 제1도에 도시된 셀(10)의 단면도로서, 챔버(16A)(16B)(16C)와 전기 절연성 물질(예를들면 유리)로된 측벽(15A)(15B)이 나타나 있다. 제5B도는 단일 유리 측벽(15E)과 챔버(16A)(16C)를 보여준다. 제5C도는 상부 반쪽셀(11)이 4각형 챔버(16A)(16B)(16C)와 이들을 구획하는 전기 절연성 측벽(15A)(15B)을 갖고 있음을 보여주고 있다. 제5D도는 4각형 챔버(16A)(16C)와 이들을 구획하는 단일 유리 측벽(15F)을 보여주고 있다. 제5E도는 챔버들과 이들을 구획하는 측벽이 동심원상태로 배치되었음을 보여주는바, 양극이 삽입되는 챔버(16AA), 절연용 중감 챔버(16BB) 및 음극이 삽입되는 챔버(16CC)가 전기 절연성 측벽(15AA)(15BB)(15EE)에 의하여 구획되고 있음을 알 수 있다.
제5F도는 셀이 챔버(16AA)(16CC)와 전기 절연성 측벽(15CC)(15FF)를 갖고 있음을 보여주고 있다. 제5G도는 전극이 삽입되는 2개의 챔버(16A)(16C)가 전기 절연성 측벽(15G)내에서 전기 절연성 유리 측벽(15H)에 의하여 8자로 되게 형성되었음을 보여주고 있으며, 제5H도는 원형 챔버(16C)가 중앙에 형성되고 그 외주에 전기 절연성 측벽(15DD)에 의하여 분할된 챔버(16A)가 있음을 보여주고 있다. 이와 같은 형태는 상부 반쪽 챔버(11)의 하단 저면과 하부 반쪽셀(12)의 상단부에서 나타나게 되며 측벽과 챔버들은 제1도에서와 같이 두 셀을 결합시키면 그 연결부 표면에서 합쳐지게 되었다.
상부셀(11)의 상단에서 챔버(16A),(16C)는 개(방되게 되었다. 그러나 이러한 상부셀의 상단부는 밀폐시키거나 뚜껑으로 막을 수 있다. 이와 같이 상단부가 폐쇄되도록 하면 전극을 포함하는 챔버(16A)(16C)가 수직이나 수평등 어떠한 각도로 위치하여도 되므로 챔버(16A)(16C)에 있어서의 가검물의 막과 전기적인 접촉이 우수하게 유지된다.
견고한 전기적인 접촉을 유지하기 위하여는 미국, 미네소타, 생 파울소재 쓰리엠 캄파니에서 생산하는 하이포알레르직 화학 접착제와 같이 이온전기 영동에 영향을 미치지 아니하는 화학 접착제를 사용할 수도 있다.
이하 이온전기 영동을 이용하여 글루코스, 슈크로스등과 같은 비이온성 성분의 비침입 검체 채취 및 감시 방법 및 장치를 설명하면 다음과 같다.
글루코스 :
의학적인 진단과 환자치료는 체내에 있는 생활성 물질의 검체 채취와 분석에 의존한다. 통상적으로 검체 채취는 혈액과 침입성이고 불편하며 바이러스의 감염등에 의한 위험성이 있는 혈청의 분석을 포함하는바, 경우에 따라서는 혈액의 검체 채취에 한정시키고 있다. 검체 채취를 하여야하는 가장 중요한 경우로는 당뇨병 환자의 경우가 있는바, 당뇨병 환자는 하루에 3,4회의 검체 채취를 하여야하는 경우가 있다. 생체(예를들면 혈액)중의 글루코스 레벨에 관계되는 시간차 정보는 환자의 치료에 가장 중요한 정보로서 대부분의 경우 환자의 생사 문제와도 관계된다. 이하 본 발명에 의한 가장 간단한 이온전기 영동을 이용한 비침입 검체 채취 방법을 설명한다.
피부에서 글루코스를 생체외 채취하는 방법의 가능성을 보여주기 위하여 피부의 모델로서 털을 깍아낸 탈모 새앙쥐의 피부를 이용하고 제1도 내지 제13도의 이온전기 영동 확산셀을 사용하여 실험한다. 그 결과는 포유동물, 특히 인체로부터의 생체내 시료 채취에 적용할 수 있다. 두개의 자체 접착성 겔 전극(일본국, 니토 일렉트릭 인다스트리 캄파니 제품)을 털을 깍아낸 새앙쥐(Skh : hr-1, 8-13주 된것)의 피부(전두께 약 0.5mm)로된 시편의 동일 표면에 고정시킨다. 피부의 하방에는 PH 7.4의 인산염으로 완충시킨 염수(0.9% 염화나트륨)용액중의 공지 농도를 갖는 방사선 표식(14C-U)-글루코스 용액을 충만시킨다. 온도는 실온이다.
1차 실험에서는 셀을 조립하고 글루코스 용액을 충만시킨다음 2시간 동안 전류(0.5밀리암페아)를 인가한다. 전압은 1 내지 10볼트 사이에서 변화될 수 있으나 일반적으로는 약 0.5볼트이다. 실험중에 일정하게 유지하여야 할 가장 중요한 파라메타는 인가 전압이다. 전압은 검체측의 전기 저항에 의하여 변화될 수 있다. 그 다음 겔 전극을 떼어 내어서 통상적인 액체 신틸레이션 계측 방법으로 방사능 함량을 시험한다. 피부하방의 글루코스 농도가 1.07mg/ℓ로부터 0.153mg/ℓ까지(변수 0.143)변할때 2시간 동안 피부를 통하여 채취된 량은 4.9㎍으로부터 0.705㎍까지(변수 0.144)변한다(표 1참조). 이러한 결과는 일정한 전기적인 조건하에서 일정한 채취 시간 동안에는 피부중의 글루코스 농도와 채취된 글루코스의 양이 (+)전극에서 거의 선상 관계를 나타냄을 보여준다. 실험중의 전기적인 조건은 일정한 직류 전류(DC)를 사용하지만 이온전기 영동 이송은 펄스 전류하에서 이루어질 수도 있다. 펄스 아프로치는 시료 채취에 대하여 예시된 방법으로 실시할 수도 있다.
[표 1]
글루코스 검체
2차 실험에서는 1차 실험과 유사한 실험기구를 사용하며 인산염 완충식염수의 0.34mg/ml의 (14C-U)-글루코스 용액을 충만시키고 겔 전극을 매 30초마다 교체시킨다.
전극 겔에서 채취된 글루코스의 평가 결과는 표준 편차(S.D)±23%를 갖는 방사성 글루코스 0.8㎍/0.5시간의 양을 보여주었다(표 2참조). 각개 단일 실험용 피부는 다른 새앙쥐로부터 얻는 것이므로 일차 검체(실험 조건에 의하여 최초의 0.5시간은 다른 것보다 약간 높음)를 제외한 각개 단일 분산셀(의미 : 동일 조각의 피부를 통하여 수정된 검체들임)의 평가가 행하여졌다. 얻어진 실험치 0.79 내지 0.74㎍은 4개의 분리된 셀에서 나타난 글루코오스 양의 평균치이다.
[표 2]
글루코스 검체 채취
글루코오스의 농도는 0.34mg/ℓ이다.
글루코오스 용액의 유속은 15ml/시간이다.
n=4개의 셀에서의 각개 시료에 대하여 평균한 것이다.
각개 새양쥐를 의미하는 각개 분산셀에 대한 S.D는 4-9%였다(3번 셀에 대한 것은 제외함) 표 3참조.
[표 3]
글루코오스 검체
글루코오스의 농도는 0.34mg/ℓ이다.
글루코오스 용액의 유속은 15ml/시간이다.
n=4번의 시차(시간)의 각각에 대한 4개 셀의 평균치이다.
상기 표에 의하면 글루코오스는 본 발명에 의하여 이온전기 영동식에 의하여 정확하게 채취됨을 보여주고 있다. 피부 하방의 글루코오스 양과 채취된 글루코오스 양의 사이에는 분명한 상관 관계가 있다.
채취된 글루코오스의 양은 충분하였고 반복 실험할 수 있을 정도였으며 신뢰할 수 있는 정도였다. 이온전기 영동식 이동은 전류와 전류가 흐른 시간에 1차 종속되는 것으로 알려졌으므로 겔 전극에서 검출할 수 있는 양의 글루코오스를 얻기 위하여는 전술한 변수들을 안전하게 조작할 수 있게 된다. 이 방법은 경피 검체 채취에만 한정되는 것이 아니고 비이온화된 검체 이동이 대단히 낮은 표면(예를들면 비점막, 구강점막)을 통하여서도 실시할 수 있다.
본 발명의 방법은 특수 생체 감지기(예를들면 1988년에 출판된 저날 오브 바이오메디칼 엔지니어링, 제10권 210-219페이지, 제이. 시. 쿠퍼와 이. 에이. 에이취. 할) 또는 글루코오스 선택성 전극(예를들면 아날리티칼 케미스트리, 1988년판, 제60권 제12호 106R-113R, 알. 엘. 솔스키) 또는 통상적인 분석법(예를들면 비색계)등과 결합하여 사용하면 정확한 시간차 글루코오스 정보를 얻을 수 있다.
정확한 시간차 글루코오스 정보를 제공하는 전술한 계측방향을 이송장치(예를들면 인슐린 펌프, 이온전기 영동식 인슐린 이송장치)등과 결합시키면 유용한 클로오즈드-루우프, 피이드백 투약 시스템을 만들 수 있다.
본 발명에 의하면 신체내에 투여된 다음과 같은 약물의 체내 농도를 검사하고 측정할 수도 있는바, 이러한 약물에 한정되는 것은 아니다.
본 발명은 포유동물, 특히 인체내의 대사성 글루코스 레벨을 측정하는데 유용하다. 고혈당 및 저혈당 상태는 예를들면 약 -0.1mg/ml 내지 5.0mg/ml의 혈액 ml당 mg으로 표시되는 글루코오스 레벨을 기준으로 감시된다. 저혈당을 감시하는 바람직한 범위는 0.3과 0.7mg/ml사이이고 고혈당(당뇨)에 대한 바람직한 범위는 1.0과 5.0mg/ml사이이다. 통상적인 혈액 글루코오스 레벨은 혈액 ml당 글루코오스 0.8과 1.1mg사이이다.
관심있는 농도 레벨을 검출하기 위한 생체 감지기는 락케이트, 알콜, 수크로오스, 글락토오스, 뇨산-아밀라아제, 콜린 및 L-라이신의 분석에 유용하게 이용되는바 이들 모두는 산소 소비량 및 과산화수소 생성에 기초들을 간접 진류 적정법을 이용하여 측정한다. 그외에도 변칙적인 검출방법을 이용한 다수의 생체 감지기가 이용되고 있다.
현실적으로 이용하는데 가장 중요한 감지기로는 아이아드(NHIAL) 자동 화학 웨어 페어 약물 검출기가 있다.
글루코오스용 익사텍크 검출기(미국, 일리노이, 디어 피일드 소재 박스터 트라베놀사 제품)는 전류 적정법을 이용한 제2세대 생체 검출기이다. 산소는 전자를 생물학적 성분으로부터 전극으로 왕복 이동시키는 인공적인 전자 중간체에 의하여 대치된다.
이와 같은 혁신적인 중간체는 (1) 생물학적 성분 및 전극과 산화 환원 반응으로 참여하고, (2) 요구하는 검사 조건하에서 안정성을 나타내며, (3) 산소의 환원과 같은 전자의 이동중에 부반응에 참여하는 경향이 없으며, (4) 시료중에 존재할 수 있는 기타의 전기화학적 활성 성분의 전위와 다른 산화 환원 전위를 나타내며, (5) 생체내 이용할때 독성이 없으며 광범위한 PH 범위에 영향받지 않고 (6) 움직이지 않도록 고정하기 쉬운 이점이 있다.
엑사텍트 글루코오스 실험은 쉽게 실시될 수 있으며 실험결과는 펜 크기의 기구를 전체 혈액 검체를 처리하고 30초내에 얻어진다. 이러한 기구를 효과적으로 이용하는 최근의 방법에서는 기구에 놓여지는 처리할 스트립이(혈액을 뽑아내지 않고) 피부를 통하여 이온전기 영동에 의하여 채집된 글루코오스로 적셔진 물질로 대치된다. 검체 채치용 매트릭스는 처리할 스트립과 마찬가지로 염화비닐 수지로 만들 수 있으나 이온전기 영동식 검체 채취에 보다 좋은 특성을 갖는 다른 물질로 만들수도 있다. 지정된 매트릭스의 장착은 별도의 단계로 이루어질 수도 있고 글루코오스의 동시 또는 관련 검체 채취 및 검출과 동시에 검사의 일부로서 행하여질 수도 있다. 검출용 매트릭스는 혈액용 전류 검출시스템에서와 같이 검정할 스트립으로서 1회용일 수도 있고 여러번의 검체 채취에 이용할 수 있는 것일 수도 있다. 그리고 반복사용할 수 있는 매트릭스는 같은 장소에 유지할 수도 있고 검정의 회수에 따라 일정한 시간이 경과한 후에 이용할 수도 있다. 특히 매트릭스는 관계된 검정을 하기 위한 전극과 나란히 놓을 수도 있다. 그렇지만 매트릭스는 검체 채취 및 검출에 관계되는 기구(계측 시스템)에 맞는 형태를 만들어야 하며 이온전기 영동식으로 채칩된 글루코오스를 함유하는 젖은 매트릭스는 전극이 유리단부에 있는 가까운 전극부위에 처리된다. 글루코오스 산화효소는 중간체를 거쳐 처리된 전극으로 이동하는 전자로 글루코오스의 산화를 촉진한다. 발생된 전류의 양은 검체중의 혈액 글루코오스 농도에 비례하고 계측기 내에 설치된 액정 표시기에 mg/dL로 표시되어 나타난다. 전술한 검출기들이 통상적으로 사용되고 있으나 기타의 보다 민감한 글루코오스 검출기들이 전술한 혈액 검체 채취 시스템 대신에 사용될 수도 있다.
생체외 이송
본 발명에 의한 막으로서의 생체외 물질 이송은 제1,2,3,4 및 5도의 장치를 이용한다. 제6도는 종래의 생체외 이송 시스템(60)을 도시한 것이다. 제6도에 의하면 수평 전극(61A)(61B)은 수직막(63)에서 결합된다. 수용체 용액(63)은 액체(64)중에 있는 어떠한 물질도 포함하지 아니한다. 회로(65)가 전원(66)에 의하여 연결되면 액체(64)중의 물질은 막(62)을 통하여 이동하여 수용체 용액(63)에서 나타나게 된다.
본 발명의 장치와 그 이용 방법은 전술한 종래의 생체외 검체 채취 방법에 유사하고 금속(백금, 알미늄등), 전기 전도성 겔(예를들면 염화나트륨 용액을 갖는 겔등) 전기 전도성 용액(예를들면 염화나트륨 수용액 또는 이러한 물질들의 혼합물을 사용하는 것도 유사하다.
본 발명의 산투성 전극들은 그 크기가 1μ㎡ 내지 400㎠ , 특히 1m㎡ 내지 40㎠ 범위이고, 전류 밀도는 약 0.1μA/㎠ 내지 2mA/㎠ 특히 1μA/㎠ 내지 0.5mA/㎠ 이다. 전극들은 끈, 접착제 밴드 등에 의하여 부착된다.
생체외 검체 채취에서 기술한 바와 같은 동일한 막이 여기에서도 적용디는바, 예를들면 피부, 점막, 중합체 인조막 등이 있다.
생체내 검체 채취
생체내 검체 채취에는 제5,7,8,9A 및 9B도의 장치가 사용된다. 생체내외 검체 채취에 관하여 설명된 전술한 정보가 여기에도 적용될 수 있다.
제7도에는 본 발명에 의한 검체 채취의 일예를 보여주고 있다. 제7도에 도시된 상부셀(81)의 외형은 제1도 내지 제4도의 상부 반쪽셀(11)과 유사한 형태로 되었다. 전극들은 제1도 내지 제5도의 챔버에 동일 내지 유사한 챔버(16A)(16B)(16C)에 설치된다. 상부셀(81)은 살아있는 포유동물(인체)에 밴드(82)를 사용하여 부착한다. 전극 도선(26A)(26B)이 각각 라인(84)(84A)에 의하여 전원(83)에 연결되면 회로가 완성되고 검체 물질은 전기 전도성 겔(25A 또는 25B)에 수집된다. 제1도 내지 5도의 상부 반쪽셀(11)과 상부셀(81)의 주된 차이점은 유리 측벽(15A)(15B) 수평막 기질에 접촉면(85)에서 우수한 밀폐 특성을 나타내도록 연장되게 형성되었다는 것이다[전원(83)은 소형의 손목시계 크기의 휴대용이다.].
알콜, 아미노피린, 메틸유레아, 아세트아마이드, 셀파구아니딘, 설파다이아진, 데오르필린 및 기타 저분자량 비전해질과 같은 약물 또는 그들의 대사 산물은 땀, 타액으로 피부나 점막으로부터 분비된다는 것이 이미 알려졌다. 정상 상태인지 병적 상태인지를 나타낼 수 있는 기타의 화합물이나 그들의 대사 산물, 예를들면 페닐알라닌(페닐케톤 뇨증), 당(당뇨증), 에스트리올(임신) 칼슘(신생물) 및 동(백혈병)등은 기타 물질의 정상 또는 비정상 대사물등과 함께 전술한 액체중에 분비될 수 있다. 액체의 수집은 마그네슘과 같은 각종 물질의 생물학적 요구량을 측정하기 위하여 이용된다. 액체 검체를 얻어서 전술한 물질들은 분석하면 체내에 있는 전술한 물질들의 존재를 할 수 있다. 이와 같은 액체 수집은 실험, 진단, 치료 및 법의학적인 목적에 광범위하게 이용되고 있다. 전술한 액체들은 여러가지 방법으로 채집될 수 있는바, 본 발명은 전류를 이용한 채집 방법을 설명한다.
관심의 대상이 되는 각종 화합물들이 인체에서 채집 또는 이송될 수 있음이 "파마큐티칼 리서치" 제3권 제6호 318-326페지에 프라빈 타일에 의하여 발표된 "약물 이송용 이온전기 영동장치"에 알려져 있다. 전기한 문헌 320페지에 기재된 이온성 또는 비이온성 검체로서 채취 물질을 다음의 표 4에 기재한다.
[표 4]
이송 또는 채취 대상 물질
주 : a는 임상적 인상(적량)에 기초함.
b는 2중 블라인드 실험(잘 조절된 실험)에 기초함.
c는 생체외 실험에 기초함.
d는 조절된 비교실험(정량적이지만 2중 블라인드 실험은 아닌)에 기초함.
생체내 이송
생체내 검체 채취에 사용되는 제4,8,9A,9B 및 제10도에 도시된 바와 같이 종류의 기구들이 생체내 이송에 사용될 수 있다.
이온전기 영동을 이용한 생체 감지
이 경우에는 제5,7,8,9A 및 9B도의 장치가 중요하다. 생체내 검체 채취에 대한 전술한 설명은 분석 성분에도 관계된다.
분석 성분은 (이온)특정 전극, 선택성 전극, 특정 생물학적 변화를 전기적 신호로 연결하는 전기 생체 감지기, 비색 시약 등일 수 있다.
환자의 조직중에 있는 관심있는 물질의 존재 확인은 정성적일 수도 있고 정량적일 수도 있다. 측정된 값은 치료제의 투입 레벨을 제공하기 위한 약물 이송에 연결될 수 있다.
검체 성분의 채취는 단일 이온전기 영동 전극에 의하여 이루어질 수 있다.
미지의 물질(또는 생활성 물질)이 변화하는 것을 알면 그 분석 방법이 요구하는 치료제의 적당한 레벨을 자동적으로 조절 할 수도 있다. 측정은 치료제가 입, 피부, 항문, 정맥을 통하여 투입할 필요가 있는지를 관리자에게 주지시킬 수도 있따.
생체내 또는 생체의 이온전기 영동 검체 채취 또는 이송의 이점
1. 여기에서 설명하는 검체 채취 방법은 진단 및 감시의 목적으로 생활성 물질을 채취하기 위한 가장 간편하고 고통이 없는 기술이다.
2. 검체 채취는 통상적인 혈액 검체가 채집되지 않거나 또는 다수의 혈액 검체를 필요로 하지 아니하는 경우에 대단히 중요하다.
3. 검체 채취 기술은 바이오피드백 루프형 시스템으로 이어지는 특성을 제공한다. 환원하면 전술한 방법에 의하여 검체를 채취하는 이온전기 영동 기구는 어떠한 투여 경로(예를를면 검체 채취에 의하여 감지된 필요성에 따른)에 의하여 치료제를 투과하는데도 사용할 수 있다.
4. 검체 채취는 외래 환자를 안전하고 간단하게 감시할 수 있도록 하여 이온전기 영동을 광범위하고 일반적으로 용도에 이용할 수 있도록 한다.
5. 생활성 물질의 채취 및 이송은 채위된 생활성 물질이 피부를 충분하게 신속히 투과하지 아니하는 경우에도 이용될 수 있다 :
피부의 국부 차단 기능을 감소시키는 약물(예를들면 알콜, 지방산, 글리콜류, 아존등)은 추출 또는 이송을 향상시키기 위하여 전극 기구에 결합시켜 사용할 수 있다.
6. 이 기술은 두 전극을 이용한 검체 채취, 예를들면 하나 이상의 생활성 약품(예를들면 약물, 대산물 또는 배합약물)의 동시 측정에 적용될 수 있다.
7. 전술한 기술은 피부를 가로질러 감지되는 생체 물질에만 한정되지 않는다. 기타 점막표면은 아프로치용으로 적당하다. 점막표면으로는 비점막, 직장, 질 및 입안등이 있다. 이러한 표면들은 현재도 검체 채취 부위로 이용되고 있다. 이러한 점막표면들은 일반적으로 모세 혈관으로 가득차 있고 이러한 막들은 분자이동에 저항성이 적으므로 이러한 조딕들로부터의 검체 채취에는 보다 짧은 시간 동안 소량의 전류를 인가하여도 된다.
8. 이 기술은 전극사이에 인가된 전류와 전류가 흐르는 시간에 따라 효율이 달라진다. 이러한 변수들은 검체 채취를 재현할 수 있도록 정밀하게 조절할 수 있으며 그에 따라 비교용의 정확한 데이타를 재생할 수 있게 된다(예를들면 치료처치 중에나 또는 전후에 특정의 생활성 물질의 레벨의 레벨을 대비할 수 있게 된다). 이러한 기능은 재생성 정보를 얻기 곤란한 코의 특정 부위로부터 검체를 채취할때 특히 유익하다.
9. 하전 또는 회전되지 아니한 생활성 물질들이 이온전기 영동식 투여 또는 채취용 물질들이다.
이러한 물질로는 소량의 프로테인, 다- 내지 폴리-펩타이드, 친유 및 소유성 물질을 포함한다. 다른 경로로 쉽게 투여할 수 없는 하전된 물질들도 이용될 수 있다. 이러한 물질들은 미국특허 제3,731,683호 및 제3,797,494호에 기재되어 있다.
10. 본 발명의 장치는 전극들을 해당 표면의 동일측에 위치하도록 하여 물질(또는 생활성 물질)을 생체외 또는 생체내 채취 또는 투여할 수 있도록 한다. 검체는 일반적으로 수평으로 놓이도록 하고 전극 물질들은 서로 인접되게 수직으로 배치한다. 장치의 상단부가 밀폐된 경우에는 막 표면과의 전기적인 접촉을 방해하지 않는한 피부에 대하여 어떤 각도로도 위치하게 할 수 있다.
11. 본 발명의 장치와 그 응용 기술은 전신 또는 국부적인 검체 채취와 약물 이송에 이용할 수 있다. 예를들면 본 발명의 기술은 피부를 통하여 메토트랙 세이트를 투여하는 피부암의 처치에 이용할 수 있다.
다음의 실시예는 오직 실험적인 예를 설명하기 위한 것이고 권리를 제한하는 것은 아니다.
생체외 검체 채취
모델셀의 시험 : 전술한 유리 확산셀(제1,2,3 및 4도)은 피부 삼투 시스템(엘. 지. 에이., 미국 캘리포니아바 켈리)에 의하여 제조하였다. 셀(10)은 1987년도 발행의 "인터내쇼날 저날 오브 파마 콜로지"의 제40권 101페지에 굼머등에 의하여 발표된 표준 관류 확산셀(엘지에이 피부 침투셀 카다록 LG1084-MPG)를 개량한 것이다.
셀의 상반부는 두개의 측벽(15A)(15B)에 의하여 3개의 격리된 챔버(16A)(16B)(16C)로 나누어졌고 두 전극 챔버(1,2,3 또는 4도의 16A와 16C)사이는 물리적 및 전기적 연결이 감소되게 차단되어 있어서 피부의 연속성을 포함하는 문제들을 연구할 수 있도록 되었다. 셀(12)의 상단부에는 하방의 수용체 상으로부터 피부를 분리하는 채널(18)를 갖고 있다. 시험중에는 채널(18)의 요홈(19)에 수용체 용액이 채워져서 그위에 있는 피부를 적시게 된다. 셀(12)의 하단부에는 수용체 용액이 수용부(17)내부로 계속 유통되도록 하는 유입구(20A)와 배출구(20B) 및 물순환 자켓(21C)에 물을 순환시키는 유입구(21A)와 배출구(21B)를 갖고 있다.
분리측벽과 외부측벽간의 모세관 현상은 셀의 상단을 디클로로디메틸실란(미국 위스콘신 밀위키소재 알드리히 케미칼 캄파니 제품)으로 밀폐하므로서 방지할 수 있다. 셀에는 3단 마그네틱 교반기와 교반구(27)를 설치한다(바켈리, 엘지에이의 LG-1083-MS).
금속 전극선(26A)(26B)-백금선이다(피셔의 백금선 B-766-5A, 순도 99.95%).
전원(29)-자동 교차점을 갖는 전류 또는 전압 제어기이다(미국 뉴욕 플러싱 소재 케프코 인코포레이티드의 모델 APH 1000M). 이 전원은 그 전류-제어 출력에 대하여 2μA/8시간의 특정 편류를 갖고 있는바, 이는 약물의 흐름이 전류의 변화에 민감한 경우 대단히 중요한 의미를 갖는다.
수용체 용액-인산염 완충 식염수이다(PH=7.4, NaC1농도 W/V=0.9%).
염료-탈이온수중의 청색염료 #1FD & C.
약물-클로니딘 염산염(미국 미조리 세인트 루이스 소재 시그마 케미칼 캄파니 제품) ; 비방사능 90mCi/mg의 클로니딘 염산염(페닐-4-3H)(미국, 일리노이 아링톤 하이츠 소재 아머샴 제품). 모르핀 설페이트(시그마 케미칼 캄파니 제품) ; 비방사능 255mCi/mg의 모르핀(N-메틸-3H)(매사튜세츠 보스톤 소재 뉴잉글랜드 뉴클레아 제품). 비표식 약물은 거의 1μCi/mg의 방사능을 얻을 수 있는 충분한 표식 약물과 함께 1mg/ml의 용액을 형성하도록 탈이온수에 용해시킬 수 있다.
피부(13)-11 내지 15주된 탈모 암새앙쥐로부터 절취하여 낸 전체 두께의 피부(캘리포니아, 길로리 소재 시몬센 래보라토리의 SKH : HR-1)이다.
모델셀의 시험-분산셀(10)을 세가지 방법으로 시험하였다.
(1) 염료와 피부대신 실리콘 고무를 사용한 누출시험(전류 불사용) ;
(2) 염료와 피부를 사용한 누출시험(전류 불사용) ; 및 (3) 약물 용액과 피부를 사용한 이온전기 영동 시험(전류 사용 및 전류 불사용).
(1)과 (2)의 시험은 셀을 육안으로 관찰하여 평가하였다. (3)의 시험은 표식된 약물 용액 0.6ml를 챔버(16A)에 주입하고 완충 식염수 0.6ml를 챔버(16C)속에 한 방울씩 한 방울씩 적가한 다음 전압을 9V로 한정시킨 0.63mA/㎠의 정전류를 두 챔버 속에 있는 전극에 인가한다. 챔버(16A)(16C)내에 있는 용액의 활동도는 이온전기 영동 전후에 검사한다.
피부(13)의 활동도와 수용체 챔버로부터 채취한 검체의 활동도는 후-실험적으로 결정한다. 각개 실험은 매 시간 검체를 채취하면서 24시간±2시간만에 끝났다. 수용체 용액(17)은 교반구(27)로 자기 교반하면서 시간당 10ml씩 검체를 채취하였다. 각개 실험은 세번 반복하였다.
결과
실험(1)과 실험(2) : 실리콘 고무막과 새앙쥐 피부를 사용한 두 경우 모두 염료가 양측 챔버(16A)(16C)로부터 중간 챔버(16B)로 누출되지 않았으며 또한 어떠한 챔버로부터 외부로 염료가 누출되는 일도 나타나지 않았다.
실험(3) : 챔버(16A)내의 염료를 표식된 약물로 교체하고 전류를 인가하지 아니하였을때 클로니딘 염산염은 0.05㎍/㎠/시간의 평균 속도로, 그리고 모르핀 설페이드는 0.04㎍/㎠/시간의 평균속도로 수용체 용액(17)속으로 확산되었다. 전기한 두 경우 20시간 후에도 챔버(16C)내의 완충식염수에서는 약물이 나타나지 않았다.
표식된 약물을 갖는 챔버와 완충염수를 갖는 챔버사이에 전류를 통하게 한 경우에는 사실상 삼투현상이 증가되었다. 0.63mA/㎠의 전류를 인가한 피부를 통한 모르핀 설페이트의 투과속도는 0.04㎍/㎠/시간의 수동적 이동속도와는 달리 2.0㎍/㎠/시간이었다. 클로니딘 염산염의 경우 전류가 통하지 않을때 0.05㎍/㎠/시간이었으나 전류가 통하였을 때에는 15.0㎍/㎠/시간이었다. 약 20시간 사용하였을때 챔버(16C)의 완충 식염수에서 표식된 모르핀 설페이트 1㎍과 클로니딘 염산염 5㎍이 표식된 약물로서 검출되었다(제14도 참조).
표식된 약물은 수개의 경로를 통하여 챔버(16C)속으로 들어갈 수 있다. 가장 흔히 일어날 수 있는 것은 수동성 전극 밑에 있는 피부를 통한 흡인일 수 있다. 이러한 가능성을 시험하기 위하여 제10도에서와 같이 두개의 셀을 튜브(95)로 연통시켜 수용체 용액(92)(93)은 서로 일체로 되게하되 피부와 상부셀은 물리적으로 분리되게 한다. 표식된 약물과 전극은 셀(90A)의 챔버(91A)에 위치하게 하고 음극은 셀(90B)의 챔버(91B)내에 위치하게 하였다. 기타의 모든 챔버(91C)(91D)(92)(93)는 완충 식염수로 채운다. 기타의 실험공정, 전기적인 인자 등은 전술한 실험(3)과 동일하게 하였다. 표식된 약물은 셀(90A)의 챔버(91A)속으로 이송되었는바, 이는 실질적으로 이온전기 영동에 의한 검체 채취에서 역삼투 현상이 일어날 수 있음을 나타내는 것이다.
클로니딘에 관련하여 설명한 것과 동일한 방법으로 채취할 수 있는 그외의 물질로는 예를들면 모르핀, 히로인, 인슐린, 네오마이신, 니트로프라손 및 베타-메타손 등이 있다.
실시예 2
생체외 이온 영동 검체 채취
이온전기 영동 검체 채취는 전기에 의하여 피부를 통하여 체내로부터 화학 물질을 끌어내는 것으로 구성된다. 이 방법을 시험하기 위하여는 생체외 이온전기 영동 셀이 사용된다(제1,2,3 또는 4도) 전체 두께의 탈모 새앙쥐 피부(13)(8-13주된 것)를 상하부셀 사이에 넣는다.
인산염 완충 식염수중의 공지 농도의 방사성 표식 약물의 용액을 피부 하방에서 10ml/시간의 속도를 순환시킨다. 피부의 상부에는 정전류 모드(0.5mA)로 고정된 전원에 연결된 2개의 자체 점착성 겔 전극이 있다. 전류는 측정 기간(약 2시간)동안 약 0.63mA/㎠에 해당되게 전극에 인가된다. 실험후 겔 전극들은 전극들에 의하여 흡수된 약물의 양을 알려주는 섬광 계수기에서 처리한다. 동일기간 동안 동일한 전류를 사용하여 상이한 약몰 농도에 대한 측정을 한 결과 전극에 의하여 수집된 량과 약물 농도 사이에는 일차 상호관계가 기대된다.
각종 농도의 클로니딘과 테오필린을 사용한 전술한 방법의 결과는 제11도와 제12도의 도표에 표시하였다. 각개 데이타는 두번 실험한 실험 결과의 평균치이다. 데이타의 도표에 의하면 그 결과가 선상임을 보여주고 있다.
생체외 이송
(a) 모르핀-전술한 생체외 검체 채취에 관련하여 설명한 공정과 조건이 모르핀의 이송에 사용되었다 : 제1,2,3 또는 4도에 도시된 셀을 사용하였고 0.63mA/㎠의 전류를 20시간 동안 인가하였다. 모르핀은 챔버(16A)속에 넣었으며 이온전기 영동후 챔버(16C)내에서 모르핀이 발견되었다(제14도 참조).
모두 실험에 사용한 전기 전도성 겔은 일본국 오사카 소재 니토 일렉트릭 인다스트리알 캄파니의 켄즈-겔-이엘시 겔이었다.
(b) 피. 에스. 오. 에스(포타슘 슈크로스와 옥타 설페이트) ; 보릭 완충액중의 피. 에스. 오. 에스 1.5mg/ml용액 0.6ml를 제1,2 또는 3도에 도시된 셀의 챔버(16A)에 주입하였다. 0.5mA(0.65mA/㎠)의 직류를 사용한 결과 피. 에스. 오. 에스의 이동은 5㎍/시간까지 관찰하되었다. 오직 전류만을 사용한 동일 실험에서는 수 나노그램의 피. 에스. 오. 에스가 이동하였다(제15도 참조).
생체내 검체 채취
생체외 검체 채취에 이용된 공정과 조건을 이용하되 피부막 대신 29세된 남자의 팔표면에 대하여 실험하였다. 사용된 검체 채취용 셀은 제7,8,9A 및 9B도에 도시된 셀중의 하나를 이용하였다. 채취된 클로니딘의 양은 생체외의 경우에서 발견된 것에 비슷하였다.
생체내 이송
제13도는 서로 분리된 전극들을 사용하여 포유동물인 기니아픽(모르모트)으로부터 생활성 성분을 채취하는 것을 보여주는 개략도이다. 이온전기 영동 공정을 탈모한 기니아픽(133)에 대하여 실시하였다. 테오필린을 갖는 도선(131)의 겔 전극[132(+)](5.5㎍, 2.4×4.2㎝)은 등의 일측에 부착하고 도선(131A)의 다른 겔 전극[132A(-)]은 약 7㎝의 간격을 두고 등의 다른쪽 측면에 부착하였다. 전원(130)으로부터 1.0mA의 전류를 20분동안 흘려보낸 후 겔 전극들을 분리하여 조사하여 본 결과 (-)전극(음극)에서 1.93ng의 테오필린이 검출되었다. 기니아픽의 체내에 흡수된 양은 1.9㎍이었다.
이온전기 영동을 이용한 생체 감지
방사성 클로니딘의 생체외 검체 채취는 앞에서 설명하였다. 이러한 공정을 개의 생체내 검체 채취에 이용하면 방사성 클로니딘의 레벨이 이온전기 영동적으로 신속하고 정확하게 측정된다. 관찰자는 실험용 개의 요구하는 클로니딘 레벨을 유지하기 위하여 클로니딘을 주사할때 참고로 이용한다.
본 발명의 예들은 보다 이해하기 쉽도록 예를들어 설명한 것으므로 본 발명의 기술적 범주에서 벗어나지 아니하는 범위내에서 생활성 물질의 생체외 또는 생체내 채취 및 생활성 물질의 생체외 또는 생체내 이송용 이온전기 영동 확산셀의 구조와 그 생체 감지에의 용도를 개량 변화시킬 수 있음은 전문가들은 충분히 알 수 있을 것이다.
청구범위에 속하는 전술한 개량 또는 변경하는 것은 본 발명의 범위에 속하는 것이다.
Claims (40)
- 제1구성부 및 제2구성부로 이루어진 셀 장치로서, (1) 제1구성부가 (a) 막으로부터 대전되거나 대전되지 않은 물질을 수집하기 위하여 막의 윗 표면과 접촉하는 전극 표면을 가진 양의 전극, (b) 막으로부터 대전되거나 대전되지 않은 물질을 수집하기 위하여 막의 다른 위치의 윗 표면과 접촉하는 전극 표면을 가진 음의 전극 및 (c) 양의 전극과 음의 전극을 서로 절연시키기 위한 전기 절연 수단, (d) 양의 전극, 음의 전극 및 전기 절연 수단을 서로 물리적으로 분리시키기 위한 측벽을 제공하는 구조의 절연 재료로 구성되고, (2) 제2구성부는 제1구성부의 구조 측벽의 절연 재료의 단부와 상보적으로 분리가능한 관계에 있고, (a) 막의 아랫 표면과 접촉되는 양성 액체 저장조, (b) 막의 아랫 표면의 다른 표면과 접촉되는 음성 액체 저장조, (c) 양성 저장조 및 음성 저장조 사이에 직접 위치하고 막의 아랫 표면과 접촉하는 전기 절연 및 분리 수단 및 (d) 측벽과 전해질용 개방 챔버를 제공하기 위한 구조의 전기 절연 재료로 구성되며, 제1구성부에서 양의 전극, 음의 전극 및 전기 절연 수단이 막의 윗 표면과 접촉하는 동일 표면상에 위치하도록 배열되고, 제2구성부에서 양성 저장조, 음성 저장조, 전지 절연 수단 및 전기 절연 재료가 함께 막의 아래 표면에 대해 제1구성부와 상보적으로 조화되는 표면을 나타내며, 양성 저장조 및 음성 저장조가 액체 저장조로서 연속되어 전기 회로를 완성하는 액체 전해질을 함유함을 특징으로 하는, 기계적 침투없이 막의 윗 표면으로부터 대전되거나 대전되지 않은 물질을 생체외 제거하기 위한 이온전기 영동형 확산셀 장치.
- 제1항에 있어서, 상기 막의 윗 표면과 접촉되는 전극이 겔, 액체, 페이스트, 발포체, 스폰지, 다공성 금속, 금속, 다공성 세라믹 또는 이들의 조합중에서 선택된 것임을 특징으로 하는 확산셀 장치.
- 제2항에 있어서, 상기 전극들이 겔과 접촉되어 있는 금속 와이어의 조합인 것을 특징으로 하는 확산셀 장치.
- 제1항에 있어서, 상기 장치의 작동 온도 조절 수단을 추가로 포함함을 특징으로 하는 확산셀 장치.
- 제1구성부 및 제2구성부로 이루어진 셀 장치로서, (1) 제1구성부가 (a) 대전되거나 대전되지 않은 물질을 막으로 이송하기 위하여 막의 윗 표면과 접촉하는 전극 표면을 가진 양의 전극, (b) 대전되거나 대전되지 않은 물질을 막으로 이송하기 위하여 막의 다른 위치의 윗 표면과 접촉하는 전극 표면을 가진 음의 전극 및 (c) 양의 전극 및 음의 전극 사이에서 막의 연속성 또는 누출을 조사하기 위한 양의 전극과 음의 전극 사이의 전기 절연 수단으로 구성되고, (2) 제2구성부는 제1구성부와 상보적으로 분리가능한 관계에 있고, (a) 대전되거나 대전되지 않은 물질을 수집하기 위한 양성 액체 저장조, (b) 대전되거나 대전되지 않은 물질을 수집하기 위한 음성 액체 저장조, (c) 양성 저장조 및 음성 저장조 사이에 직접 위치하고 막의 아랫 표면과 접촉하는 전기 절연 및 분리 수단으로 구성되며, 제1구성부에서 양의 전극, 음의 전극 및 전기 절연 수단이 막의 윗 표면과 접촉하는 동일 표면상에 위치하도록 배열되고, 제2구성부에서 양성 저장조, 음성 저장조, 전기 절연 및 분리 수단이 함께 막의 아래 표면에 대해 제1구성부와 상보적으로 조화되는 표면을 나타내며, 양성 저장조 및 음성 저장조가 액체 저장조로서 연속되어 전기 회로를 완성하는 액체 전해질을 함유함을 특징으로 하는, 기계적 침투없이 대전되거나 대전되지 않은 물질을 막의 윗 표면에 생체외 이송하기 위한 이온전기 영동형 확산셀 장치.
- 제5항에 있어서, 상기 막 표면과 접촉되어 있는 전극 물질이 전기 전도성 겔, 액체, 페이스트, 종이, 발포체, 스폰지, 다공성 금속, 금속, 다공성 세라믹 또는 이들의 조합중에서 선택된 것임을 특징으로 하는 확산셀 장치.
- 제5항에 있어서, 기계적 지지체와 전기 부도성 영역이 막 표면과 접촉하는 습윤액을 함유하는 하부셀에 형성된 채널임을 특징으로 하는 확산셀 장치.
- 제5항에 있어서, 상기 전기 절연체는 공기이며, 상기 전극들은 겔과 조합된 금속 와이어임을 특징으로 하는 확산셀 장치.
- 제5항에 있어서, 상기 장치의 작동 온도 조절 수단을 추가로 포함함을 특징으로 하는 확산셀 장치.
- (a) 피부 표면과 접촉하는 전극 표면을 가진 양의 전극, (b) 피부의 다른 위치의 표면과 접촉하는 전극 표면을 가진 음의 전극, (c) 양의 전극과 음의 전극 사이에서 전류 누출을 모니터하고 전극들을 서로 절연시키기 위한, 양의 전극과 음의 전극 사이에 위치된 전기 절연 수단 및 (d) 양의 전극, 음의 전극 및 전기 절연 수단을 서로 물리적으로 분리시키기 위한 측벽 구조의 절연 재료로 구성되고, 양의 전극, 음의 전극 및 전기 절연 수단이 인간을 제외한 포유동물의 피부 또는 점막 표면과 동일면상에 접촉하는 장치의 공통면상에 존재하도록 배열되고, 양의 전극 또는 음의 전극이 대전되거나 대전되지 않은 제거된 물질을 수집하기 위한 수집 수단을 갖고 있음을 특징으로 하는, 전류의 영향하에서 이동할 수 있고 막 표면, 조직 및 혈압내에서 이동하는 하나 이상의 대전되거나 대전되지 않은 유기 물질을 인간을 제외한 포유동물로부터 피부 또는 점막을 통해 양의 전극 또는 음의 전극의 수집 수단내로 기계적 침투없이 제거하기 위한 생체내 이온전기 영동형 확산셀 장치.
- 제10항에 있어서, 상기 절연 재료가 유리, 세라믹, 공기 플라스틱 또는 고무중에서 선택된 것임을 특징으로 하는 확산셀 장치.
- 제11항에 있어서, 상기 구성 요소들이 양의 전극, 절연 재료, 음의 전극의 순서로 배치되며, 상기 전극들이 재료의 조합체임을 특징으로 하는 확산셀 장치.
- 제10항에 있어서, 상기 구성 요소들이 하나의 전극을 갖는 중심부, 전기 절연성 물질로 이루어진 중간부 및 다른 전극을 갖는 외곽부로 이루어진 동심원 튜브 형태인 것을 특징으로 하는 확산셀 장치.
- 제10항에 있어서, 상기 전극 물질이 전기 전도성 겔, 액체, 페이스트, 종이, 발포체, 스폰지, 다공성 금속, 금속, 다공성 세라믹 또는 이들의 조합중에서 선택된 것임을 특징으로 하는 확산셀 장치.
- (A) 제10항에 기재된 확산셀 장치를 제공하고, (B) 인간을 제외한 포유동물의 피부 또는 점막 표면을 상기 장치의 공통면과 접촉시켜 전기 회로를 발생시키고, (C) 전기 회로에 전류를 적용하여, 전극으로부터 피부 표면으로 또는 피부 표면으로부터 전극 챔버로, 대전되거나 대전되지 않은 유기 물질을 이송시키는 것으로 구성됨을 특징으로 하는, 대전되거나 대전되지 않은 유기 물질을 기계적 침투없이 인간을 제외한 포유동물의 피부 또는 점막 표면으로부터 시료 채취하거나, 인간을 제외한 포유동물의 피부 또는 점막 표면으로 이송시키기 위해, 제15항에 기재된 확산셀 장치를 사용하여 인간을 제외한 포유동물을 처리하는 방법.
- 제10항에 기재된 확산셀 장치의 전극들을 인간을 제외한 포유동물의 피부상에 위치시키고, 인간을 제외한 포유동물의 피부 표면으로부터 전류 영향하에 이동가능한 대전되거나 대전되지 않은 유기 물질을 추출하기에 충분한 전류를 가하여, 시간 경과후에 하나 또는 두개의 전극에서 상기 유기 물질을 수집하는 것을 특징으로 하는, 제10항에 기재된 장치를 사용하여 인간을 제외한 포유동물의 피부 또는 혈관으로부터 질병 상태의 진단 또는 처치에 유용한 물질을 시료 채취하는 방법.
- 제16항에 있어서, 수거된 유기 물질의 성분과 함량을 확인하기 위하여 분석함을 특징으로 하는 방법.
- 제10항에 있어서, 비이온성 지분을 모니터함을 특징으로 하는 장치.
- 제18항에 있어서, 상기 비이온성 지분이 천연 당임을 특징으로 하는 장치.
- 제19항에 있어서, 상기 천연 당이 글루코오스임을 특징으로 하는 장치.
- 제20항에 있어서, 상기 측정된 글루코오스 농도가 혈액 1ml당 0.1내지 5.0mg임을 특징으로 하는 장치.
- 제21항에 있어서, 상기 글루코오스 레벨이 혈액 1ml당 1.1 내지 5.0mg임을 특징으로 하는 장치.
- 제16항에 있어서, 혈관 또는 체내에 있는 비이온성 생활성 물질의 레벨을 측정하기 위하여 비이온성 생활성 물질을 표피 또는 혈관으로부터 비침입 채취하는 것을 특징으로 하는 방법.
- 제23항에 있어서, 상기 비이온성 생활성 물질이 인체내의 혈액 1ml당 0.1 내지 5.0mg의 양으로 존재하는 글루코오스임을 특징으로 하는 방법.
- 제1항에 있어서, 상기 비이온성 지분을 모니터함을 특징으로 하는 장치.
- 제16항에 있어서, 유기 화합물이 당류, 암 화학요법제, 술파 약제, 스테로이드, 스테로이드 유도체, 알카로이드, 항우울제, 남용약물, 호흡기 치료제, 아미노산, 국부 마취제, 바르비투레이트, 항생물질, 베타 차단제, 이들 화합물의 대사체 및 이들의 혼합물로부터 독립적으로 선택됨을 특징으로 하는 방법.
- 제16항에 있어서, 채취하는 유기 화합물이 알콜, 글루코스, 슈크로스, 락테이트, 갈락토스, 요산, 콜린, L-리신, 테오필린, 테로브롬, 클로니딘, 플루오로우라실, 메토트렉세이트, 프로스타글란딘, 아미트립틸린, 아미노피린, 메틸우레아, 아세트아미드, 술파니딘, 술파디아진, 페닐알라닌, 에스트리올, 메틸렌블루, 페니실린, 히스타민, 덱사메타손, 크실로카인, 필로카프린, 리도카인, 러그노카인, 아세틸베나메틸콜린 이독스리딘, 메틸프레드니솔론, 숙시네이트, 에피네프린, 살리실레이트, 아세트산, 에스테르화 글루코코르티코이드, 나트리움살리실리시움 부타졸레딘, 파파레린, 니코틴산, 6-히드록시도파민, 메트로프롤롤, 모르핀, 니트로푸라존, 베타메타손, 헤로인, 네오마이신, 이들 화합물의 대사체 또는 이들의 혼합물로 구성된 군으로부터 독립적으로 선택됨을 특징으로 하는 방법.
- (a) 피부 표면 및 하나의 전극과 전기적으로 통하는 전기 전도성 매질의 수집 저장조를 인간을 제외한 포유동물의 피부 표면과 접촉되로록 위치시키고, (b) 다른 하나의 전극을 피부 표면의 다른 부위와 접촉되도록 위치시켜 전기 회로를 형성하고, (c) 전류 영향하에서 이동가능한 피부 표면, 조직 및 혈액내의 유기 물질을 검출하기에 충분한 양의 전류를 발생시켜, 유기 물질을 피부 표면을 통해 이송시키고, (d) 수집 저장조내에 수집된 유기 물질의 수준을 분석하는 것으로 구성됨을 특징으로 하는, 인간을 제외한 포유동물의 피부 표면, 조직 또는 열액에 함유된 대전되거나 대전되지 않은 유기 물질의 수준을 비-침입형으로 결정하는 방법.
- 제28항에 있어서, (e) 수집 저장조에 함유된 유기 물질의 수준과 피부 표면, 조직 또는 순환계에 함유된 유기 물질의 수준을 결정한 표준치를 서로 관련시키는 것을 추가로 포함하는 방법.
- 제28항에 있어서, 유기 물질이 비이온성 화합물임을 특징으로 하는 방법.
- 제30항에 있어서, 비이온성 화합물이 글루코오스임을 특징으로 하는 방법.
- 제31항에 있어서, 피부 및 혈액내의 글루코오스 농도가 혈액 1ml당 0.1 내지 5.0mg임을 특징으로 하는 방법.
- 제32항에 있어서, 상기 글루코오스 레벨이 혈액 1ml당 1.0 내지 5.0mg임을 특징으로 하는 방법.
- 제32항에 있어서, 상기 글루코오스 레벨이 혈액 1ml당 0.3 내지 0.7mg임을 특징으로 하는 방법.
- 제32항에 있어서, 이온의 전류가 1 내지 10볼트의 전압에서 수득됨을 특징으로 하는 방법.
- 제35항에 있어서, 전류 밀도가 ㎠당 0.63mÅ임을 특징으로 하는 방법.
- 제36항에 있어서, 전류가 0.5m Å임을 특징으로 하는 방법.
- 막 표면으로부터 유기 물질을 수집하기 위하여, 막 표면과 직접 접촉하거나 전해질 매질 계면과 접촉하는 전극 표면을 갖는 하나 이상의 전기 전도성 양의 전극 ; 막 표면으로부터 유기 물질을 수집하기 위하여, 막 표면과 직접 접촉하거나 전해질 매질 계면과 접촉하는 전극 표면을 갖는 하나 이상의 전기 전도성 음의 전극 ; 및 전기 전도성 전극들을 서로 전기 절연 또는 분리시키고 막 표면 또는 피부 표면의 연속성을 검사하거나 양의 전극 및 음의 전극 사이의 전기 누출을 모니터하기 위한 것으로서, 막에 개방된 하부를 갖는 하나 이상의 챔버 및 막에 개방되거나 폐쇄된 상부를 갖는 하나 이상의 챔버로 구성되고 절연 가스 또는 절연 물질을 함유하는 전기 절연 수단으로 이루어지며, 양의 전극, 음의 전극 및 절연 수단이 전기절연성 재료에 의해 물리적으로 서로 분리되고, 양의 전극 및 음의 전극이 절연 수단에 의해 분리되는 실질적으로 병렬관계로 배열되며, 각각은 전기 절연 재료로 구성된 측벽을 갖고 이 측벽은 인간을 제외한 포유동물의 피부 또는 점막 표면과 동일 측면의 근접부와 접촉하는 실질적으로 공통면에서 연장 및 종단됨을 특징으로 하는, 인간을 제외한 포유동물의 막 또는 피부 또는 점막 표면에서 선택된 막 표면으로부터 전류 영향하에서 이동가능한 생활성 유기 물질을 기계적 침투없이 시료 채취하기 위한 확산셀 장치.
- 제1구성부 및 제2구성부로 이루어진 셀 장치로서, (1) 제1구성부가 (a) 시료의 막 표면으로부터 물질을 수집하기 위하여, 막의 표면과 접촉하는 전극 표면 및 전해질 매질 계면을 가진 양의 전극, (b) 시료의 막 표면으로부터 물질을 수집하기 위하여 막의 다른 위치의 동일 표면과 접촉하는 전극 표면 및 전해질 매질 계면을 가진 음의 전극 및 (c) 전기 전도성 전극들을 서로 전기 절연 또는 분리시키고 막 표면 또는 피부 표면의 연속성을 검사하거나 양의 전극 및 음의 전극 사이의 전기 누출을 모니터하기 위한 것으로서, 막에 개방된 하부를 갖는 하나 이상의 챔버 및 막에 개방되거나 폐쇄된 상부를 갖는 하나 이상의 챔버로 구성되고 절연 가스 또는 절연 물질을 함유하는 전기 절연 수단, (d) 양의 전극, 음의 전극 및 전기 절연 수단을 서로 물리적으로 분리시키기 위한 측벽을 제공하는 구조의 절연 재료로 구성되고, 제1구성부에서 양의 전극, 음의 전극 및 전기 절연 수단이 막의 윗 표면과 접촉하는 동일 표면상에 위치하도록 배열되며, (2) 제2구성부는 제1구성부의 구조 측벽의 절연 재료의 단부와 상보적으로 분리가능한 관계에 있고, (a) 전류의 영향하에 이동가능한 공유 결합 물질을 함유하기 위한 양성 액체 저장조, (b) 물질을 함유하기 위한 음성 액체 저장조, (c) 양성 저장조 및 음성 저장조 사이에 직접 위치하고 막의 아랫 표면과 접촉하며, 막에 개방되고 하부에서 폐쇄된 체널을 형성하고 액체 물질을 함유하는 하나 이상의 구획으로 이루어진 전기 절연 및 분리 수단 및 (d) 측벽과 전해질용 개방 챔버를 제공하기 위한 구조의 전기 절연 재료로 구성되며, 양성 저장조, 음성 저장조, 전기 절연 수단 및 전기 절연 재료가 함께 막의 아래 표면에 대해 제1구성부와 상보적으로 조화되는 표면을 나타내며, 양성 저장조 및 음성 저장조가 액체 저장조로서 연속되어 전기 회로를 완성하는 액체 전해질을 함유함을 특징으로 하는, 기계적 침투없이 막의 윗 표면으로부터 전류 영향하에 이송가능한 대전되거나 대전되지 않은 물질을 생체외 제거하기 위한 이온전기 영동형 확산셀 장치.
- (a) 인간을 제외한 포유동물의 표면으로부터 유기 물질을 수집하거나 피부 표면과 접촉하는 전류를 완성하기 위한 전극 표면 및 전해질 매질 계면을 가진 양의 전극, (b) 피부 표면으로부터 생활성 물질을 수집하거나 전기 회로를 완성하기 위한 전극 표면 및 전해질 매질 계면을 가진 음의 전극, (c) 양의 전극과 음의 전극 사이에서 전류 누출을 모니터하고 전극들을 서로 절연시키기 위한, 막에 개방된 하부를 갖는 하나 이상의 챔버 및 막에 개방되거나 폐쇄된 상부를 갖는 하나 이상의 챔버로 구성되고 절연 가스 또는 절연 물질을 함유하는 전기 절연 수단 및 (d) 양의 전극, 음의 전극 및 전기 절연 수단을 서로 물리적으로 분리시키기 위한 측벽 구조의 절연 재료로 구성되고, 양의 전극, 음의 전극 및 전기 절연 수단이 인간을 제외한 포유동물의 피부 또는 점막 표면과 동일면상에 접촉하는 장치의 공통면상에 존재하도록 배열되고, 양의 전극 또는 음의 전극이 대전되거나 대전되지 않은 제거된 생활성 물질을 수집하기 위한 수집 수단을 갖고 있음을 특징으로 하는, 인간을 제외한 포유동믈의 피부 또는 점막 표면을 통해 전류의 영향하에서 이동할 수 있는 막 표면, 조직 및 혈액내의 하나 이상의 대전되거나 대전되지 않은 유기 물질을 기계적 침투없이 제거하기 위한 생체내 이온전기 영동형 확산셀 장치.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US15015988A | 1988-01-29 | 1988-01-29 | |
| US150,159 | 1988-01-29 | ||
| US29939789A | 1989-01-24 | 1989-01-24 | |
| US299,397 | 1989-01-24 | ||
| PCT/US1989/000329 WO1989006989A1 (en) | 1988-01-29 | 1989-01-26 | Iontophoretic non-invasive sampling or delivery device |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR900700155A KR900700155A (ko) | 1990-08-11 |
| KR970011449B1 true KR970011449B1 (ko) | 1997-07-11 |
Family
ID=26847373
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1019890701746A KR970011449B1 (ko) | 1988-01-29 | 1989-01-26 | 이온전기 영동형 비침입 검체 채취 또는 이송 장치 및 방법 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US5279543A (ko) |
| EP (3) | EP1121896B1 (ko) |
| JP (1) | JP2907342B2 (ko) |
| KR (1) | KR970011449B1 (ko) |
| AT (3) | ATE230283T1 (ko) |
| DE (3) | DE68929447T2 (ko) |
| DK (1) | DK175443B1 (ko) |
| ES (3) | ES2188624T3 (ko) |
| IE (1) | IE63406B1 (ko) |
| PT (1) | PT89560B (ko) |
| WO (1) | WO1989006989A1 (ko) |
Families Citing this family (200)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6956032B1 (en) * | 1986-04-18 | 2005-10-18 | Carnegie Mellon University | Cyanine dyes as labeling reagents for detection of biological and other materials by luminescence methods |
| US5547467A (en) * | 1988-01-21 | 1996-08-20 | Massachusettes Institute Of Technology | Method for rapid temporal control of molecular transport across tissue |
| US5362307A (en) | 1989-01-24 | 1994-11-08 | The Regents Of The University Of California | Method for the iontophoretic non-invasive-determination of the in vivo concentration level of an inorganic or organic substance |
| US5115805A (en) * | 1990-02-23 | 1992-05-26 | Cygnus Therapeutic Systems | Ultrasound-enhanced delivery of materials into and through the skin |
| US5131403A (en) * | 1991-06-05 | 1992-07-21 | Becton Dickinson And Company | Method for obtaining blood using iontophoresis |
| JPH0670987A (ja) * | 1992-08-28 | 1994-03-15 | Katsuro Tachibana | 薬物投与・体液採取ユニット及び装置 |
| AU5121593A (en) * | 1992-12-14 | 1994-07-04 | Tovarischestvo S Orgranichennoi Otvetstvennostju "Bikap" | Device for electrotreating a liquid |
| US5771890A (en) | 1994-06-24 | 1998-06-30 | Cygnus, Inc. | Device and method for sampling of substances using alternating polarity |
| DE69519023T2 (de) * | 1994-06-24 | 2001-06-13 | Cygnus Therapeutic Systems | Einrichtung zur iontophoretischen probennahme |
| CA2205444A1 (en) * | 1994-12-09 | 1996-06-13 | Novartis Ag | Transdermal system |
| EP1131131A1 (en) * | 1995-04-23 | 2001-09-12 | Electromagnetic Bracing Systems, Inc. | Transdermal active drug delivery system and method |
| IL113459A (en) * | 1995-04-23 | 2000-07-16 | Electromagnetic Bracing System | Electrophoretic cuff apparatus |
| US5624415A (en) * | 1995-04-24 | 1997-04-29 | Alza Corporation | Reduction of skin irritation and resistance during electrotransport |
| WO1996037256A1 (en) * | 1995-05-22 | 1996-11-28 | Silicon Microdevices, Inc. | Micromechanical patch for enhancing the delivery of compounds through the skin |
| US5861431A (en) * | 1995-06-07 | 1999-01-19 | Iotek, Inc. | Incontinence treatment |
| AU706662B2 (en) * | 1995-07-12 | 1999-06-17 | Cygnus, Inc. | Hydrogel patch |
| US20040062759A1 (en) * | 1995-07-12 | 2004-04-01 | Cygnus, Inc. | Hydrogel formulations for use in electroosmotic extraction and detection of glucose |
| US5983131A (en) * | 1995-08-11 | 1999-11-09 | Massachusetts Institute Of Technology | Apparatus and method for electroporation of tissue |
| US5989409A (en) * | 1995-09-11 | 1999-11-23 | Cygnus, Inc. | Method for glucose sensing |
| US5735273A (en) | 1995-09-12 | 1998-04-07 | Cygnus, Inc. | Chemical signal-impermeable mask |
| JP2000500656A (ja) | 1995-11-22 | 2000-01-25 | ミニメッド インコーポレイティド | 化学的増幅及び光学センサーを用いる生物分子の検出 |
| US6002954A (en) * | 1995-11-22 | 1999-12-14 | The Regents Of The University Of California | Detection of biological molecules using boronate-based chemical amplification and optical sensors |
| US6766183B2 (en) | 1995-11-22 | 2004-07-20 | Medtronic Minimed, Inc. | Long wave fluorophore sensor compounds and other fluorescent sensor compounds in polymers |
| JP3316820B2 (ja) | 1995-12-28 | 2002-08-19 | シィグナス インコーポレィティド | 被験者の生理的分析物の継続モニタリング装置及び方法 |
| US5713353A (en) | 1996-04-19 | 1998-02-03 | Castano; Jaime A. | Optical method and device for determining blood glucose levels |
| US6385487B1 (en) | 1996-05-08 | 2002-05-07 | Biophoretic Therapeutic Systems, Llc | Methods for electrokinetic delivery of medicaments |
| US5676648A (en) * | 1996-05-08 | 1997-10-14 | The Aps Organization, Llp | Iontophoretic drug delivery apparatus and method for use |
| US5908401A (en) * | 1996-05-08 | 1999-06-01 | The Aps Organization, Llp | Method for iontophoretic delivery of antiviral agents |
| US5954685A (en) * | 1996-05-24 | 1999-09-21 | Cygnus, Inc. | Electrochemical sensor with dual purpose electrode |
| ATE234129T1 (de) * | 1996-06-18 | 2003-03-15 | Alza Corp | Vorrichtung zur verbesserung der transdermalen verabreichung von medikamenten oder der abnahme von körperflüssigkeiten |
| US5911223A (en) * | 1996-08-09 | 1999-06-15 | Massachusetts Institute Of Technology | Introduction of modifying agents into skin by electroporation |
| WO1998022820A1 (en) | 1996-11-21 | 1998-05-28 | Lawrence Livermore National Laboratory | Detection of biological molecules using boronate-based chemical amplification and optical sensors |
| US6246904B1 (en) | 1996-12-17 | 2001-06-12 | Alza Corporation | Electrotransport drug delivery reservoirs containing inert fillers |
| US6650934B2 (en) | 1996-12-17 | 2003-11-18 | Alza Corp | Polymeric foam reservoirs for an electrotransport delivery device |
| US6018679A (en) * | 1997-01-29 | 2000-01-25 | Novartis Finance Corp. | Iontophoretic transdermal delivery and control of adverse side-effects |
| US6139718A (en) * | 1997-03-25 | 2000-10-31 | Cygnus, Inc. | Electrode with improved signal to noise ratio |
| US6085115A (en) * | 1997-05-22 | 2000-07-04 | Massachusetts Institite Of Technology | Biopotential measurement including electroporation of tissue surface |
| JP4441000B2 (ja) * | 1997-06-23 | 2010-03-24 | 克郎 立花 | 生体組織処理装置 |
| WO1999029364A1 (en) * | 1997-12-11 | 1999-06-17 | Alza Corporation | Device for enhancing transdermal agent flux |
| DK1037687T3 (da) | 1997-12-11 | 2009-01-26 | Alza Corp | Anordning til at forbedre et middels transdermale strömning |
| EP1911488A3 (en) | 1997-12-11 | 2008-12-03 | Alza Corporation | Device for enhancing transdermal agent flux |
| CN1170603C (zh) * | 1997-12-11 | 2004-10-13 | 阿尔扎有限公司 | 增强透皮物剂流量的装置 |
| USRE37796E1 (en) | 1997-12-16 | 2002-07-23 | Biophoretic Therapeutic Systems, Llc | Methods for iontophoretic delivery of antiviral agents |
| US5968005A (en) * | 1998-01-07 | 1999-10-19 | Tu; Hosheng | Devices and means for treating canker sores |
| US7066884B2 (en) * | 1998-01-08 | 2006-06-27 | Sontra Medical, Inc. | System, method, and device for non-invasive body fluid sampling and analysis |
| US8287483B2 (en) * | 1998-01-08 | 2012-10-16 | Echo Therapeutics, Inc. | Method and apparatus for enhancement of transdermal transport |
| US20060015058A1 (en) * | 1998-01-08 | 2006-01-19 | Kellogg Scott C | Agents and methods for enhancement of transdermal transport |
| US6059736A (en) | 1998-02-24 | 2000-05-09 | Tapper; Robert | Sensor controlled analysis and therapeutic delivery system |
| US6022316A (en) * | 1998-03-06 | 2000-02-08 | Spectrx, Inc. | Apparatus and method for electroporation of microporated tissue for enhancing flux rates for monitoring and delivery applications |
| CA2265119C (en) | 1998-03-13 | 2002-12-03 | Cygnus, Inc. | Biosensor, iontophoretic sampling system, and methods of use thereof |
| US5916154A (en) * | 1998-04-22 | 1999-06-29 | Nellcor Puritan Bennett | Method of enhancing performance in pulse oximetry via electrical stimulation |
| US8480580B2 (en) | 1998-04-30 | 2013-07-09 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US8346337B2 (en) | 1998-04-30 | 2013-01-01 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US8465425B2 (en) | 1998-04-30 | 2013-06-18 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US6949816B2 (en) | 2003-04-21 | 2005-09-27 | Motorola, Inc. | Semiconductor component having first surface area for electrically coupling to a semiconductor chip and second surface area for electrically coupling to a substrate, and method of manufacturing same |
| US8688188B2 (en) | 1998-04-30 | 2014-04-01 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US9066695B2 (en) * | 1998-04-30 | 2015-06-30 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US6175752B1 (en) | 1998-04-30 | 2001-01-16 | Therasense, Inc. | Analyte monitoring device and methods of use |
| US8974386B2 (en) | 1998-04-30 | 2015-03-10 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US6272364B1 (en) | 1998-05-13 | 2001-08-07 | Cygnus, Inc. | Method and device for predicting physiological values |
| DE69914319T2 (de) * | 1998-05-13 | 2004-11-18 | Cygnus, Inc., Redwood City | Signalverarbeitung zur messung von physiologischen analyten |
| PT1053043E (pt) * | 1998-05-13 | 2002-11-29 | Cygnus Therapeutic Systems | Montagens de recolha para sistemas de amostragem transdermica |
| DE69910003T2 (de) | 1998-05-13 | 2004-04-22 | Cygnus, Inc., Redwood City | Überwachung physiologischer analyte |
| CA2338203A1 (en) * | 1998-07-21 | 2000-02-03 | Spectrx, Inc. | System and method for continuous analyte monitoring |
| DE69921489T2 (de) | 1998-08-31 | 2005-10-27 | Johnson & Johnson Consumer Companies, Inc. | Elektrotransportvorrichtung mit klingen |
| US6602678B2 (en) | 1998-09-04 | 2003-08-05 | Powderject Research Limited | Non- or minimally invasive monitoring methods |
| JP2002524120A (ja) | 1998-09-04 | 2002-08-06 | パウダージェクト リサーチ リミテッド | 粒子送達法を使用するモニタリング方法 |
| US6148231A (en) * | 1998-09-15 | 2000-11-14 | Biophoretic Therapeutic Systems, Llc | Iontophoretic drug delivery electrodes and method |
| ATE254877T1 (de) | 1998-09-17 | 2003-12-15 | Cygnus Therapeutic Systems | Gerät zum zusammendrücken einer gel/sensor- einheit |
| US6180416B1 (en) | 1998-09-30 | 2001-01-30 | Cygnus, Inc. | Method and device for predicting physiological values |
| US6326160B1 (en) * | 1998-09-30 | 2001-12-04 | Cygnus, Inc. | Microprocessors for use in a device for predicting physiological values |
| JP2002528190A (ja) | 1998-10-28 | 2002-09-03 | シグナス, インコーポレイテッド | イオン導入サンプリングシステムの品質管理試験のためのキットおよび方法 |
| US20040171980A1 (en) * | 1998-12-18 | 2004-09-02 | Sontra Medical, Inc. | Method and apparatus for enhancement of transdermal transport |
| CA2365609A1 (en) | 1999-02-12 | 2000-08-17 | Cygnus, Inc. | Devices and methods for frequent measurement of an analyte present in a biological system |
| EP1175241A1 (en) | 1999-03-08 | 2002-01-30 | PALTI, Yoram | Transdermal drug delivery system and method |
| US6792306B2 (en) | 2000-03-10 | 2004-09-14 | Biophoretic Therapeutic Systems, Llc | Finger-mounted electrokinetic delivery system for self-administration of medicaments and methods therefor |
| US6477410B1 (en) * | 2000-05-31 | 2002-11-05 | Biophoretic Therapeutic Systems, Llc | Electrokinetic delivery of medicaments |
| US7127285B2 (en) * | 1999-03-12 | 2006-10-24 | Transport Pharmaceuticals Inc. | Systems and methods for electrokinetic delivery of a substance |
| US6553253B1 (en) | 1999-03-12 | 2003-04-22 | Biophoretic Therapeutic Systems, Llc | Method and system for electrokinetic delivery of a substance |
| ATE290902T1 (de) | 1999-04-16 | 2005-04-15 | Johnson & Johnson Consumer | Vorrichtung zur iontophoretischen verabreichung von medikamenten mit internen sensoren |
| CA2369336A1 (en) | 1999-04-22 | 2000-11-02 | Cygnus, Inc. | Hydrogel in an iontophoretic device to measure glucose |
| US6669663B1 (en) * | 1999-04-30 | 2003-12-30 | Medtronic, Inc. | Closed loop medicament pump |
| US6890553B1 (en) | 1999-07-08 | 2005-05-10 | Johnson & Johnson Consumer Companies, Inc. | Exothermic topical delivery device |
| AU6076200A (en) | 1999-07-08 | 2001-01-30 | Johnson & Johnson Consumer Companies, Inc. | Exothermic bandage |
| US7113821B1 (en) | 1999-08-25 | 2006-09-26 | Johnson & Johnson Consumer Companies, Inc. | Tissue electroperforation for enhanced drug delivery |
| US7133717B2 (en) * | 1999-08-25 | 2006-11-07 | Johnson & Johnson Consumer Companies, Inc. | Tissue electroperforation for enhanced drug delivery and diagnostic sampling |
| US6673625B2 (en) | 1999-09-15 | 2004-01-06 | The Regents Of The University Of California | Saccharide sensing molecules having enhanced fluorescent properties |
| US6682938B1 (en) | 1999-09-15 | 2004-01-27 | The Regents Of The University Of California | Glucose sensing molecules having selected fluorescent properties |
| AU2001238226A1 (en) | 2000-02-18 | 2001-08-27 | University Of Utah Research Foundation | Methods for delivering agents using alternating current |
| CA2400074A1 (en) | 2000-02-18 | 2001-08-23 | William I. Higuchi | Methods for extracting substances using alternating current |
| EP1225831A2 (en) | 2000-03-17 | 2002-07-31 | Sontra Medical, Inc. | Non-invasive body fluid sampling and analysis |
| DZ3338A1 (fr) * | 2000-03-29 | 2001-10-04 | Univ Virginia | Méthode, systeme et programme d'ordinateur pour l'évaluation de régulation de glycemique du diabète à partir de données contrôllées automatiquement |
| US7404815B2 (en) * | 2000-05-01 | 2008-07-29 | Lifescan, Inc. | Tissue ablation by shear force for sampling biological fluids and delivering active agents |
| US6885883B2 (en) * | 2000-05-16 | 2005-04-26 | Cygnus, Inc. | Methods for improving performance and reliability of biosensors |
| WO2002017210A2 (en) * | 2000-08-18 | 2002-02-28 | Cygnus, Inc. | Formulation and manipulation of databases of analyte and associated values |
| ATE392178T1 (de) * | 2000-08-18 | 2008-05-15 | Animas Technologies Llc | Vorrichtung zum vorhersagen von hypoglyecemiefällen |
| US20020026111A1 (en) * | 2000-08-28 | 2002-02-28 | Neil Ackerman | Methods of monitoring glucose levels in a subject and uses thereof |
| IT1320262B1 (it) * | 2000-09-27 | 2003-11-26 | Servizi Medico Estetici Italia | Dispositivo erogatore per la somministrazione transdermica di unasostanza contenente un principio attivo e relativa testina erogatrice. |
| US6537243B1 (en) | 2000-10-12 | 2003-03-25 | Abbott Laboratories | Device and method for obtaining interstitial fluid from a patient for diagnostic tests |
| US6560471B1 (en) * | 2001-01-02 | 2003-05-06 | Therasense, Inc. | Analyte monitoring device and methods of use |
| US7137975B2 (en) * | 2001-02-13 | 2006-11-21 | Aciont, Inc. | Method for increasing the battery life of an alternating current iontophoresis device using a barrier-modifying agent |
| WO2002066986A2 (en) | 2001-02-15 | 2002-08-29 | Medtronic Minimed, Inc. | Polymers functionalized with fluorescent boronate motifs |
| KR20010067623A (ko) * | 2001-02-23 | 2001-07-13 | 홍영표 | 전기삼투압을 이용한 무채혈 글루코스 추출법 |
| EP1385571B1 (en) * | 2001-04-04 | 2008-07-30 | Alza Corporation | Transdermal electrotransport delivery device including an antimicrobial compatible reservoir composition |
| US6733485B1 (en) | 2001-05-25 | 2004-05-11 | Advanced Bionics Corporation | Microstimulator-based electrochemotherapy methods and systems |
| US7011630B2 (en) * | 2001-06-22 | 2006-03-14 | Animas Technologies, Llc | Methods for computing rolling analyte measurement values, microprocessors comprising programming to control performance of the methods, and analyte monitoring devices employing the methods |
| EP1270041A1 (en) | 2001-06-22 | 2003-01-02 | Universite De Geneve | Device for non-invasively determining the relative levels of two substances present in a biological system |
| US7045361B2 (en) | 2001-09-12 | 2006-05-16 | Medtronic Minimed, Inc. | Analyte sensing via acridine-based boronate biosensors |
| EP1647232B1 (en) | 2001-12-03 | 2011-08-17 | Ekos Corporation | Catheter with multiple ultrasound radiating members |
| US6952604B2 (en) | 2001-12-21 | 2005-10-04 | Becton, Dickinson And Company | Minimally-invasive system and method for monitoring analyte levels |
| BR0307589A (pt) | 2002-02-11 | 2005-02-01 | Antares Pharma Inc | Dispositivo de injeção intradérmica |
| DE60337038D1 (de) * | 2002-03-22 | 2011-06-16 | Animas Technologies Llc | Leistungsverbesserung einer Analytenüberwachungsvorrichtung |
| TR200200942A2 (tr) * | 2002-04-08 | 2004-02-23 | Tuncer De��M �. | Üre ölçer/üre saati:insan kanındaki ürenin ters iyontoforez ile, kan veya biyolojik örnek alınmadan tespiti. |
| AU2003236285A1 (en) * | 2002-04-09 | 2003-10-20 | Matsushita Electric Industrial Co., Ltd. | Health management system and health management method |
| US7099713B2 (en) | 2002-06-28 | 2006-08-29 | Battelle Memorial Institute | Skin conduction and transport systems |
| ES2456068T3 (es) | 2002-08-13 | 2014-04-21 | University Of Virginia Patent Foundation | Método, sistema y producto de programa informático para el procesamiento de datos de auto-supervisión de glucemia (SMBG) para mejorar la autogestión diabética |
| US7150975B2 (en) * | 2002-08-19 | 2006-12-19 | Animas Technologies, Llc | Hydrogel composition for measuring glucose flux |
| US7018345B2 (en) * | 2002-12-06 | 2006-03-28 | Hisamitsu Pharmaceutical Co., Inc. | Iontophoresis system |
| US20060129035A1 (en) * | 2002-12-27 | 2006-06-15 | Kaoru Asano | Devices, methods, and systems for measuring analytes extracted through skin |
| US20060254912A1 (en) * | 2003-03-04 | 2006-11-16 | Amos Nussinovitch | System and method for treating biological tissue usiing curret electrical field |
| JP4381705B2 (ja) * | 2003-03-26 | 2009-12-09 | シスメックス株式会社 | 経皮的分析物抽出システムと分析システムおよび経皮的分析物抽出方法と分析方法 |
| US7258673B2 (en) * | 2003-06-06 | 2007-08-21 | Lifescan, Inc | Devices, systems and methods for extracting bodily fluid and monitoring an analyte therein |
| JP2007533346A (ja) | 2003-08-15 | 2007-11-22 | アニマス・テクノロジーズ・リミテッド・ライアビリティ・カンパニー | 生理学的分析対象のモニタリングに使用するマイクロプロセッサ、デバイス、および方法 |
| US7189341B2 (en) * | 2003-08-15 | 2007-03-13 | Animas Technologies, Llc | Electrochemical sensor ink compositions, electrodes, and uses thereof |
| JP2005137416A (ja) * | 2003-11-04 | 2005-06-02 | Sysmex Corp | 経皮的分析物抽出システム及び経皮的分析物分析システム |
| CN1636505B (zh) * | 2004-01-09 | 2011-11-09 | 希森美康株式会社 | 提取器具、提取装置和血糖值测量装置 |
| ATE520340T1 (de) * | 2004-02-03 | 2011-09-15 | Sysmex Corp | Analysegerät, patrone, patronenkit |
| US20050220439A1 (en) * | 2004-03-19 | 2005-10-06 | Carton Owen A | Interactive multimedia system and method |
| US20050226921A1 (en) * | 2004-04-13 | 2005-10-13 | Kortzebom Robert N | Non-invasive analysis and controlled dosage transdermal active patch |
| US20060024757A1 (en) | 2004-07-30 | 2006-02-02 | Robert Hussa | Detection of oncofetal fibronectin for selection of concepti |
| WO2006050031A2 (en) | 2004-10-28 | 2006-05-11 | Sontra Medical Corporation | System and method for analyte sampling and analysis with error correction |
| US20060094945A1 (en) * | 2004-10-28 | 2006-05-04 | Sontra Medical Corporation | System and method for analyte sampling and analysis |
| JP2006167428A (ja) | 2004-11-16 | 2006-06-29 | Sysmex Corp | 分析物抽出装置、分析装置、分析物抽出方法および分析方法 |
| ES2716135T5 (es) | 2005-01-24 | 2023-06-15 | Antares Pharma Inc | Inyector de chorro asistido por aguja con jeringa precargada |
| US8809773B2 (en) * | 2005-03-22 | 2014-08-19 | Carnegie Mellon University | Membrane interface apparatus and method for mass spectrometry |
| US20060223786A1 (en) * | 2005-04-01 | 2006-10-05 | Smith David J | Transdermal pain control method and device |
| US7432069B2 (en) * | 2005-12-05 | 2008-10-07 | Sontra Medical Corporation | Biocompatible chemically crosslinked hydrogels for glucose sensing |
| KR100788186B1 (ko) * | 2005-12-09 | 2007-12-26 | 주식회사 테크라인 | 송풍형 이온발생장치의 일체형 챔버와 챔버의 탈부착방식구조 |
| WO2007081853A2 (en) | 2006-01-05 | 2007-07-19 | University Of Virginia Patent Foundation | Method, system and computer program product for evaluation of blood glucose variability in diabetes from self-monitoring data |
| US7658728B2 (en) * | 2006-01-10 | 2010-02-09 | Yuzhakov Vadim V | Microneedle array, patch, and applicator for transdermal drug delivery |
| US20070264130A1 (en) * | 2006-01-27 | 2007-11-15 | Phluid, Inc. | Infusion Pumps and Methods for Use |
| WO2007123142A1 (ja) * | 2006-04-20 | 2007-11-01 | Tti Ellebeau, Inc. | イオントフォレーシス装置 |
| US20070248657A1 (en) * | 2006-04-25 | 2007-10-25 | Smith David J | Multi-compartment transdermal pain control device |
| JP5025159B2 (ja) * | 2006-04-28 | 2012-09-12 | シスメックス株式会社 | 生体成分測定装置 |
| US9144648B2 (en) * | 2006-05-03 | 2015-09-29 | Antares Pharma, Inc. | Injector with adjustable dosing |
| WO2007131013A1 (en) | 2006-05-03 | 2007-11-15 | Antares Pharma, Inc. | Two-stage reconstituting injector |
| JP4706069B2 (ja) * | 2006-11-14 | 2011-06-22 | 国立大学法人 鹿児島大学 | 薬物注入装置 |
| US20080154513A1 (en) | 2006-12-21 | 2008-06-26 | University Of Virginia Patent Foundation | Systems, Methods and Computer Program Codes for Recognition of Patterns of Hyperglycemia and Hypoglycemia, Increased Glucose Variability, and Ineffective Self-Monitoring in Diabetes |
| US10182833B2 (en) | 2007-01-08 | 2019-01-22 | Ekos Corporation | Power parameters for ultrasonic catheter |
| KR101318087B1 (ko) * | 2007-03-07 | 2013-10-15 | 에코 테라퓨틱스, 인크. | 경피 피분석물 모니터링 시스템 및 피분석물 검출 방법 |
| WO2008118360A1 (en) * | 2007-03-23 | 2008-10-02 | Geno Llc | Conversion of nitrogen dioxide (no2) to nitric oxide (no) |
| MX2009011581A (es) | 2007-04-27 | 2010-02-17 | Echo Therapeutics Inc | Dispositivo de permeacion en la piel para deteccion de analito o suministro de farmaco transdermico. |
| ES2471118T3 (es) | 2007-06-22 | 2014-06-25 | Ekos Corporation | Método y aparato para el tratamiento de hemorragias intracraneales |
| US8986253B2 (en) * | 2008-01-25 | 2015-03-24 | Tandem Diabetes Care, Inc. | Two chamber pumps and related methods |
| WO2009114542A1 (en) | 2008-03-10 | 2009-09-17 | Antares Pharma, Inc. | Injector safety device |
| TWI394580B (zh) | 2008-04-28 | 2013-05-01 | Halozyme Inc | 超快起作用胰島素組成物 |
| US20090287180A1 (en) * | 2008-05-19 | 2009-11-19 | Diperna Paul M | Disposable pump reservoir and related methods |
| WO2010013808A1 (ja) * | 2008-07-31 | 2010-02-04 | シスメックス株式会社 | 生体内成分測定方法、生体内成分測定のためのデータ処理方法、生体内成分測定装置および収集部材 |
| CA2732812C (en) | 2008-08-05 | 2017-10-31 | Antares Pharma, Inc. | Multiple dosage injector |
| US8408421B2 (en) * | 2008-09-16 | 2013-04-02 | Tandem Diabetes Care, Inc. | Flow regulating stopcocks and related methods |
| US8650937B2 (en) * | 2008-09-19 | 2014-02-18 | Tandem Diabetes Care, Inc. | Solute concentration measurement device and related methods |
| US20100221313A1 (en) * | 2008-12-01 | 2010-09-02 | Innovative Pharmaceuticals, Llc | Transdermal reservoir patch |
| JP5470010B2 (ja) * | 2008-12-22 | 2014-04-16 | シスメックス株式会社 | 生体内成分測定方法および生体内成分測定装置 |
| EP3703066A1 (en) | 2009-02-25 | 2020-09-02 | The University of Virginia Patent Foundation | Method, system and computer program product for cgm-based prevention of hypoglycemia via hypoglycemia risk assessment and smooth reduction insulin delivery |
| US8579865B2 (en) | 2009-03-20 | 2013-11-12 | Antares Pharma, Inc. | Hazardous agent injection system |
| EP2724739B1 (en) | 2009-07-30 | 2015-07-01 | Tandem Diabetes Care, Inc. | Portable infusion pump system |
| JP5572016B2 (ja) | 2009-08-04 | 2014-08-13 | シスメックス株式会社 | 組織液抽出用デバイス、その製造方法、及び該デバイスを用いた組織液の分析方法 |
| US9327105B2 (en) | 2010-03-26 | 2016-05-03 | Itrace Biomedical Inc. | Active transdermal drug delivery system and the method thereof |
| US8882819B2 (en) | 2011-02-16 | 2014-11-11 | Richard Crowder | Handheld device for treating oral ulcers and sores |
| AU2012271361B2 (en) | 2011-06-17 | 2017-03-02 | Halozyme, Inc. | Continuous subcutaneous insulin infusion methods with a hyaluronan degrading enzyme |
| US9993529B2 (en) | 2011-06-17 | 2018-06-12 | Halozyme, Inc. | Stable formulations of a hyaluronan-degrading enzyme |
| US9220660B2 (en) | 2011-07-15 | 2015-12-29 | Antares Pharma, Inc. | Liquid-transfer adapter beveled spike |
| US8496619B2 (en) | 2011-07-15 | 2013-07-30 | Antares Pharma, Inc. | Injection device with cammed ram assembly |
| US9700245B2 (en) | 2011-09-23 | 2017-07-11 | Itrace Biomedical Inc. | Transdermal analyte extraction and detection system and the method thereof |
| PT2822618T (pt) | 2012-03-06 | 2024-03-04 | Antares Pharma Inc | Seringa pré-cheia com característica de força de rutura |
| EP2833944A4 (en) | 2012-04-06 | 2016-05-25 | Antares Pharma Inc | ADMINISTRATION OF TESTOSTERONE COMPOSITIONS BY NEEDLE-SUPPORTED NOZZLE INJECTION |
| US9364610B2 (en) | 2012-05-07 | 2016-06-14 | Antares Pharma, Inc. | Injection device with cammed ram assembly |
| US9180242B2 (en) | 2012-05-17 | 2015-11-10 | Tandem Diabetes Care, Inc. | Methods and devices for multiple fluid transfer |
| US9710607B2 (en) | 2013-01-15 | 2017-07-18 | Itrace Biomedical Inc. | Portable electronic therapy device and the method thereof |
| US10179239B2 (en) | 2013-01-15 | 2019-01-15 | Itrace Biomedical Inc. | Personalized pain management treatments |
| CA2900672C (en) | 2013-02-11 | 2018-03-27 | Antares Pharma, Inc. | Needle assisted jet injection device having reduced trigger force |
| ES2742046T3 (es) | 2013-03-11 | 2020-02-12 | Antares Pharma Inc | Inyector de dosis con sistema de piñón |
| WO2014165136A1 (en) | 2013-03-12 | 2014-10-09 | Antares Pharma, Inc. | Constant volume prefilled syringes and kits thereof |
| US9173998B2 (en) | 2013-03-14 | 2015-11-03 | Tandem Diabetes Care, Inc. | System and method for detecting occlusions in an infusion pump |
| JP2016532490A (ja) | 2013-07-29 | 2016-10-20 | クラル コーポレーション | 半電池を介した治療用電子及びイオン移動 |
| US9933387B1 (en) | 2014-09-07 | 2018-04-03 | Biolinq, Inc. | Miniaturized sub-nanoampere sensitivity low-noise potentiostat system |
| EP3307388B1 (en) | 2015-06-10 | 2022-06-22 | Ekos Corporation | Ultrasound catheter |
| US11278218B2 (en) | 2016-04-26 | 2022-03-22 | The University Of Bath | Multiplexed transdermal extraction and detection devices for non-invasive monitoring of substances and methods of use |
| US10092207B1 (en) | 2016-05-15 | 2018-10-09 | Biolinq, Inc. | Tissue-penetrating electrochemical sensor featuring a co-electrodeposited thin film comprised of polymer and bio-recognition element |
| US11045142B1 (en) | 2017-04-29 | 2021-06-29 | Biolinq, Inc. | Heterogeneous integration of silicon-fabricated solid microneedle sensors and CMOS circuitry |
| USD875254S1 (en) | 2018-06-08 | 2020-02-11 | Biolinq, Inc. | Intradermal biosensor |
| DE102018119137B4 (de) * | 2018-08-07 | 2021-08-19 | Pac Tech-Packaging Technologies Gmbh | Verfahren und Vorrichtung zur Reparatur einer Prüfkontaktanordnung |
| CN110470851B (zh) * | 2019-08-28 | 2022-06-03 | 重庆工业职业技术学院 | 一种通过汗液测定驾驶员是否饮酒的装置 |
| KR20220143663A (ko) | 2020-02-18 | 2022-10-25 | 에프. 호프만-라 로슈 아게 | 혈당 값의 비침습적 측정을 위해 피부로부터 휘발성 화합물을 수집하기 위한 장치 |
| CA3163460A1 (en) | 2020-07-29 | 2022-02-03 | Joshua Ray Windmiller | Continuous analyte monitoring system with microneedle array |
| USD988160S1 (en) | 2021-03-16 | 2023-06-06 | Biolinq Incorporated | Wearable dermal sensor |
| US11857344B2 (en) | 2021-05-08 | 2024-01-02 | Biolinq Incorporated | Fault detection for microneedle array based continuous analyte monitoring device |
| USD1013544S1 (en) | 2022-04-29 | 2024-02-06 | Biolinq Incorporated | Wearable sensor |
| USD996999S1 (en) | 2021-11-16 | 2023-08-29 | Biolinq Incorporated | Wearable sensor |
| USD1012744S1 (en) | 2022-05-16 | 2024-01-30 | Biolinq Incorporated | Wearable sensor with illuminated display |
Family Cites Families (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH530006A (de) * | 1970-10-01 | 1972-10-31 | Hoffmann La Roche | Elektrodenanordnung |
| US3794910A (en) * | 1971-07-26 | 1974-02-26 | Sherwood Medical Ind Inc | Iontophoresis and conductivity analysis circuit |
| US4767401A (en) * | 1975-04-22 | 1988-08-30 | Maurice Seiderman | Iontophoretic administration of ionizable or polar medicaments to a mammalian body |
| US4141359A (en) * | 1976-08-16 | 1979-02-27 | University Of Utah | Epidermal iontophoresis device |
| US4166457A (en) * | 1976-08-16 | 1979-09-04 | University Of Utah Research Institute | Fluid self-sealing bioelectrode |
| US4325367A (en) * | 1977-06-13 | 1982-04-20 | Robert Tapper | Iontophoretic treatment apparatus |
| US4195641A (en) * | 1977-12-15 | 1980-04-01 | Burton Larry W | Spectroscopic analysis of chemical substances |
| GB2033575B (en) * | 1978-05-24 | 1983-03-02 | Rolfe P | Investigating substances in a patient's bloodstream |
| US4239046A (en) * | 1978-09-21 | 1980-12-16 | Ong Lincoln T | Medical electrode |
| US4250878A (en) * | 1978-11-22 | 1981-02-17 | Motion Control, Inc. | Non-invasive chemical species delivery apparatus and method |
| US4365637A (en) * | 1979-07-05 | 1982-12-28 | Dia-Med, Inc. | Perspiration indicating alarm for diabetics |
| US4401122A (en) * | 1979-08-02 | 1983-08-30 | Children's Hospital Medical Center | Cutaneous methods of measuring body substances |
| US4633879A (en) * | 1979-11-16 | 1987-01-06 | Lec Tec Corporation | Electrode with disposable interface member |
| US4329999A (en) * | 1980-03-03 | 1982-05-18 | Michael Phillips | Patient attached patch and method of making |
| US4383529A (en) * | 1980-11-03 | 1983-05-17 | Wescor, Inc. | Iontophoretic electrode device, method and gel insert |
| GB2087567B (en) * | 1980-11-11 | 1984-09-19 | Searle & Co | Apparatus for monitoring partial pressure of gas in a flowing liquid |
| US4416274A (en) * | 1981-02-23 | 1983-11-22 | Motion Control, Inc. | Ion mobility limiting iontophoretic bioelectrode |
| US4406658A (en) * | 1981-03-06 | 1983-09-27 | Medtronic, Inc. | Iontophoretic device with reversible polarity |
| EP0060451B1 (en) * | 1981-03-06 | 1986-09-17 | Medtronic, Inc. | Iontophoretic electrode |
| US4820263A (en) * | 1981-03-06 | 1989-04-11 | Medtronic, Inc. | Apparatus and method for iontophoretic drug delivery |
| US4411648A (en) * | 1981-06-11 | 1983-10-25 | Board Of Regents, The University Of Texas System | Iontophoretic catheter device |
| JPS5810066A (ja) * | 1981-07-10 | 1983-01-20 | 株式会社アドバンス | イオントフオレ−ゼ用プラスタ−構造体 |
| US4419092A (en) * | 1981-11-06 | 1983-12-06 | Motion Control, Inc. | Iontophoretic electrode structure |
| US4477971A (en) * | 1981-11-06 | 1984-10-23 | Motion Control, Inc. | Iontophoretic electrode structure |
| US4693711A (en) * | 1981-12-22 | 1987-09-15 | Bremer Roger E | Long-life biomedical transcutaneous drug application device and method of transcutaneous application of drugs |
| HU185691B (en) * | 1982-02-09 | 1985-03-28 | Richter Gedeon Vegyeszet | Process for preparing a new analgetic pharmaceutical composition |
| US4456012A (en) * | 1982-02-22 | 1984-06-26 | Medtronic, Inc. | Iontophoretic and electrical tissue stimulation device |
| US4699146A (en) * | 1982-02-25 | 1987-10-13 | Valleylab, Inc. | Hydrophilic, elastomeric, pressure-sensitive adhesive |
| DE3309273A1 (de) * | 1982-03-15 | 1983-11-24 | Wescor Inc., 84321 Logan, Utah | Schweisssammelvorrichtung und verfahren zum sammeln von schweiss von der haut einer person fuer versuchszwecke |
| CA1247960A (en) * | 1983-03-24 | 1989-01-03 | Hideki Aoki | Transcutaneously implantable element |
| US4731926A (en) * | 1985-02-19 | 1988-03-22 | Drug Delivery Systems Inc. | Method of manufacturing disposable and/or replenishable transdermal drug applicators |
| US4622031A (en) * | 1983-08-18 | 1986-11-11 | Drug Delivery Systems Inc. | Indicator for electrophoretic transcutaneous drug delivery device |
| US4557723A (en) * | 1983-08-18 | 1985-12-10 | Drug Delivery Systems Inc. | Applicator for the non-invasive transcutaneous delivery of medicament |
| WO1986007269A1 (en) * | 1985-06-10 | 1986-12-18 | Drug Delivery Systems Inc. | Programmable control and mounting system for transdermal drug applicator |
| US4808152A (en) * | 1983-08-18 | 1989-02-28 | Drug Delivery Systems Inc. | System and method for controlling rate of electrokinetic delivery of a drug |
| US4708716A (en) * | 1983-08-18 | 1987-11-24 | Drug Delivery Systems Inc. | Transdermal drug applicator |
| US4640689A (en) * | 1983-08-18 | 1987-02-03 | Drug Delivery Systems Inc. | Transdermal drug applicator and electrodes therefor |
| CA1262564A (en) * | 1983-09-01 | 1989-10-31 | Minoru Sasaki | Iontophoresis device |
| US4727881A (en) * | 1983-11-14 | 1988-03-01 | Minnesota Mining And Manufacturing Company | Biomedical electrode |
| IL75048A0 (en) * | 1984-05-04 | 1985-08-30 | Dervieux Dominique | Bipolar electrodes and apparatus comprising them for the relief of pains |
| GB2159717B (en) * | 1984-06-08 | 1988-05-18 | Sciotronic Ltd | Medical electrode |
| DK8601218A (ko) * | 1984-07-18 | 1986-03-17 | ||
| US4744787A (en) * | 1984-10-29 | 1988-05-17 | Medtronic, Inc. | Iontophoresis apparatus and methods of producing same |
| US4747819A (en) * | 1984-10-29 | 1988-05-31 | Medtronic, Inc. | Iontophoretic drug delivery |
| US4585652A (en) * | 1984-11-19 | 1986-04-29 | Regents Of The University Of Minnesota | Electrochemical controlled release drug delivery system |
| US4702732A (en) * | 1984-12-24 | 1987-10-27 | Trustees Of Boston University | Electrodes, electrode assemblies, methods, and systems for tissue stimulation and transdermal delivery of pharmacologically active ligands |
| US4700710A (en) * | 1985-03-12 | 1987-10-20 | Murray Electronics Associates Limited Partnership | Apertured adhesively applied body electrode apparatus and method |
| US4679560A (en) * | 1985-04-02 | 1987-07-14 | Board Of Trustees Of The Leland Stanford Junior University | Wide band inductive transdermal power and data link |
| US4832036A (en) * | 1985-05-13 | 1989-05-23 | Baxter International Inc. | Medical electrode |
| US4722354A (en) * | 1985-06-14 | 1988-02-02 | Jens Axelgaard | Electrical stimulation electrode |
| JPS6222662A (ja) * | 1985-07-19 | 1987-01-30 | 林原 健 | イオン導入電子治療器 |
| US4756314A (en) * | 1985-10-28 | 1988-07-12 | Alza Corporation | Sweat collection patch |
| JPS62139672A (ja) * | 1985-12-14 | 1987-06-23 | 林原 健 | 正負イオントホレ−ゼ用治療器 |
| JPS62159661A (ja) * | 1985-12-31 | 1987-07-15 | 林原 健 | 正、負両イオン導入用低周波治療器 |
| US4722726A (en) * | 1986-02-12 | 1988-02-02 | Key Pharmaceuticals, Inc. | Method and apparatus for iontophoretic drug delivery |
| AU597890B2 (en) * | 1986-03-14 | 1990-06-14 | Drug Delivery Systems Inc. | Transdermal drug applicator and electrodes therefor |
| US4752285B1 (en) * | 1986-03-19 | 1995-08-22 | Univ Utah Res Found | Methods and apparatus for iontophoresis application of medicaments |
| US4717378A (en) * | 1986-03-31 | 1988-01-05 | Medtronic, Inc. | Methods for detecting dehydration of a biomedical hydrogel |
| JPH0794380B2 (ja) * | 1986-04-24 | 1995-10-11 | 久光製薬株式会社 | 経皮投薬用皮膚処理剤 |
| US4706680A (en) * | 1986-06-30 | 1987-11-17 | Nepera Inc. | Conductive adhesive medical electrode assemblies |
| IE60941B1 (en) * | 1986-07-10 | 1994-09-07 | Elan Transdermal Ltd | Transdermal drug delivery device |
| US5042975A (en) * | 1986-07-25 | 1991-08-27 | Rutgers, The State University Of New Jersey | Iontotherapeutic device and process and iontotherapeutic unit dose |
| US4725263A (en) * | 1986-07-31 | 1988-02-16 | Medtronic, Inc. | Programmable constant current source transdermal drug delivery system |
| AU7769187A (en) * | 1986-09-01 | 1988-03-03 | Paul Max Grinwald | Iontophoretic apparatus |
| US4848353A (en) * | 1986-09-05 | 1989-07-18 | Minnesota Mining And Manufacturing Company | Electrically-conductive, pressure-sensitive adhesive and biomedical electrodes |
| JPS63102768A (ja) * | 1986-10-20 | 1988-05-07 | 山之内製薬株式会社 | イオントフオレ−シス用の新規プラスタ−構造体 |
| US4786277A (en) * | 1986-11-21 | 1988-11-22 | Trustees Of Boston University | Electrodes, electrode assemblies, methods, and systems for tissue stimulation |
| US4731049A (en) * | 1987-01-30 | 1988-03-15 | Ionics, Incorporated | Cell for electrically controlled transdermal drug delivery |
| US4878892A (en) * | 1987-02-10 | 1989-11-07 | Drug Delivery Systems Inc. | Electrolytic transdermal delivery of polypeptides |
| AU609769B2 (en) * | 1987-02-10 | 1991-05-09 | Drug Delivery Systems Inc. | Electrolytic transdermal delivery of proteins |
| US4810699A (en) * | 1987-02-20 | 1989-03-07 | American Home Products Corporation | Substituted 1,3,4,9-tetrahydropyrano[3,4,-b]indole-1-acetic acids, pharmaceutical compositions containing them, and methods for treating inflammatory conditions and for analgesic purposes using them |
| CA1317522C (en) * | 1987-03-20 | 1993-05-11 | Dan Sibalis | Transdermal drug delivery system |
| US4865582A (en) * | 1987-06-05 | 1989-09-12 | Drug Delivery Systems Inc. | Disposable transdermal drug applicators |
| CA1333114C (en) * | 1987-11-25 | 1994-11-15 | Daniel C. Duan | Pressure-sensitive adhesives and bioelectrodes constructed with the adhesive |
-
1989
- 1989-01-26 JP JP1502486A patent/JP2907342B2/ja not_active Expired - Lifetime
- 1989-01-26 KR KR1019890701746A patent/KR970011449B1/ko not_active IP Right Cessation
- 1989-01-26 WO PCT/US1989/000329 patent/WO1989006989A1/en unknown
- 1989-01-27 DE DE68929447T patent/DE68929447T2/de not_active Expired - Lifetime
- 1989-01-27 IE IE28589A patent/IE63406B1/en not_active IP Right Cessation
- 1989-01-27 ES ES95105321T patent/ES2188624T3/es not_active Expired - Lifetime
- 1989-01-27 PT PT89560A patent/PT89560B/pt not_active IP Right Cessation
- 1989-01-27 AT AT95105321T patent/ATE230283T1/de not_active IP Right Cessation
- 1989-01-27 DE DE68924716T patent/DE68924716T2/de not_active Expired - Lifetime
- 1989-01-27 ES ES01110555T patent/ES2213077T3/es not_active Expired - Lifetime
- 1989-01-27 AT AT01110555T patent/ATE256420T1/de not_active IP Right Cessation
- 1989-01-27 EP EP01110555A patent/EP1121896B1/en not_active Expired - Lifetime
- 1989-01-27 EP EP95105321A patent/EP0673622B1/en not_active Expired - Lifetime
- 1989-01-27 ES ES89300782T patent/ES2085863T3/es not_active Expired - Lifetime
- 1989-01-27 EP EP89300782A patent/EP0326398B1/en not_active Expired - Lifetime
- 1989-01-27 DE DE68929508T patent/DE68929508T2/de not_active Expired - Lifetime
- 1989-01-27 AT AT89300782T patent/ATE129909T1/de not_active IP Right Cessation
-
1990
- 1990-07-27 DK DK199001793A patent/DK175443B1/da not_active IP Right Cessation
-
1992
- 1992-04-30 US US07/879,060 patent/US5279543A/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| DK179390D0 (da) | 1990-07-27 |
| EP0326398B1 (en) | 1995-11-08 |
| ATE230283T1 (de) | 2003-01-15 |
| AU3183889A (en) | 1989-08-25 |
| ATE256420T1 (de) | 2004-01-15 |
| ATE129909T1 (de) | 1995-11-15 |
| EP0673622A2 (en) | 1995-09-27 |
| DE68929447D1 (de) | 2003-02-06 |
| DK175443B1 (da) | 2004-10-25 |
| JP2907342B2 (ja) | 1999-06-21 |
| AU639888B2 (en) | 1993-08-12 |
| DE68929447T2 (de) | 2004-01-15 |
| JPH04502561A (ja) | 1992-05-14 |
| EP0326398A2 (en) | 1989-08-02 |
| DE68929508T2 (de) | 2004-09-30 |
| ES2085863T3 (es) | 1996-06-16 |
| US5279543A (en) | 1994-01-18 |
| EP0673622A3 (ko) | 1995-11-08 |
| DE68929508D1 (de) | 2004-01-29 |
| KR900700155A (ko) | 1990-08-11 |
| DE68924716T2 (de) | 1996-07-04 |
| IE890285L (en) | 1989-07-29 |
| EP0326398A3 (en) | 1991-03-20 |
| PT89560A (pt) | 1989-11-10 |
| WO1989006989A1 (en) | 1989-08-10 |
| IE63406B1 (en) | 1995-04-19 |
| EP0673622B1 (en) | 2003-01-02 |
| PT89560B (pt) | 1995-05-31 |
| DK179390A (da) | 1990-07-28 |
| ES2188624T3 (es) | 2003-07-01 |
| EP1121896A1 (en) | 2001-08-08 |
| DE68924716D1 (de) | 1995-12-14 |
| EP1121896B1 (en) | 2003-12-17 |
| ES2213077T3 (es) | 2004-08-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR970011449B1 (ko) | 이온전기 영동형 비침입 검체 채취 또는 이송 장치 및 방법 | |
| US5362307A (en) | Method for the iontophoretic non-invasive-determination of the in vivo concentration level of an inorganic or organic substance | |
| JP3155523B2 (ja) | バイオセンサー、イオン浸透サンプリングシステムおよびその使用方法 | |
| US5954685A (en) | Electrochemical sensor with dual purpose electrode | |
| US4020830A (en) | Selective chemical sensitive FET transducers | |
| US4883057A (en) | Cathodic electrochemical current arrangement with telemetric application | |
| JP3328290B2 (ja) | イオン導入サンプリング装置および方法 | |
| JP3366646B2 (ja) | 化学シグナル非透過性マスク | |
| US8046043B2 (en) | Extraction device, analyzer, extraction method, and analysis method | |
| US20030040682A1 (en) | Sensor controlled analysis and therapeutic delivery system | |
| TW200540413A (en) | Biosensors having improved sample application and uses thereof | |
| Tierney et al. | Electroanalysis of glucose in transcutaneously extracted samples | |
| US7857759B2 (en) | Extraction device, analyzer, extraction method, and analysis method | |
| KR20010052588A (ko) | 이온토퍼레시스 디바이스 구조체 및 생체내 성분의 검출방법 | |
| CN1404373A (zh) | 分析物的透皮取样法 | |
| AU639888C (en) | Iontophoretic non-invasive sampling or delivery device | |
| EP1270041A1 (en) | Device for non-invasively determining the relative levels of two substances present in a biological system | |
| JP2004016489A (ja) | 皮下含有物質の検査装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| G160 | Decision to publish patent application | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20101214 Year of fee payment: 14 |
|
| LAPS | Lapse due to unpaid annual fee |