KR20170063821A - 종양 치료에 사용하기 위한 코르텍솔론 17α-벤조에이트 - Google Patents
종양 치료에 사용하기 위한 코르텍솔론 17α-벤조에이트 Download PDFInfo
- Publication number
- KR20170063821A KR20170063821A KR1020177011239A KR20177011239A KR20170063821A KR 20170063821 A KR20170063821 A KR 20170063821A KR 1020177011239 A KR1020177011239 A KR 1020177011239A KR 20177011239 A KR20177011239 A KR 20177011239A KR 20170063821 A KR20170063821 A KR 20170063821A
- Authority
- KR
- South Korea
- Prior art keywords
- carcinoma
- tumor
- compound
- pancreatic
- pharmaceutical composition
- Prior art date
Links
- 0 C[C@](CC1)([C@@](CCC2)[C@](CC3)[C@@]1[C@@](C)(CC1)C3=CC1=O)[C@]2(*(CO)=O)OC(c1ccccc1)=O Chemical compound C[C@](CC1)([C@@](CCC2)[C@](CC3)[C@@]1[C@@](C)(CC1)C3=CC1=O)[C@]2(*(CO)=O)OC(c1ccccc1)=O 0.000 description 3
- GPNHMOZDMYNCPO-PDUMRIMRSA-N CCC(O[C@](CC1)([C@@](C)(CC2)[C@@H]1[C@H](CC1)[C@H]2[C@@](C)(CC2)C1=CC2=O)C(CO)=O)=O Chemical compound CCC(O[C@](CC1)([C@@](C)(CC2)[C@@H]1[C@H](CC1)[C@H]2[C@@](C)(CC2)C1=CC2=O)C(CO)=O)=O GPNHMOZDMYNCPO-PDUMRIMRSA-N 0.000 description 1
- NBHZSYVMYHBBPY-CYJLVYHFSA-N C[C@](CC1)([C@@H](CC2)[C@](C)(CC3)[C@H]1[C@@](C)(CC1)C3=CC1O)[C@]2(C(CO)=O)OC(c1ccccc1)=O Chemical compound C[C@](CC1)([C@@H](CC2)[C@](C)(CC3)[C@H]1[C@@](C)(CC1)C3=CC1O)[C@]2(C(CO)=O)OC(c1ccccc1)=O NBHZSYVMYHBBPY-CYJLVYHFSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07J—STEROIDS
- C07J5/00—Normal steroids containing carbon, hydrogen, halogen or oxygen, substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane and substituted in position 21 by only one singly bound oxygen atom, i.e. only one oxygen bound to position 21 by a single bond
- C07J5/0046—Normal steroids containing carbon, hydrogen, halogen or oxygen, substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane and substituted in position 21 by only one singly bound oxygen atom, i.e. only one oxygen bound to position 21 by a single bond substituted in position 17 alfa
- C07J5/0053—Normal steroids containing carbon, hydrogen, halogen or oxygen, substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane and substituted in position 21 by only one singly bound oxygen atom, i.e. only one oxygen bound to position 21 by a single bond substituted in position 17 alfa not substituted in position 16
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
- A61K31/573—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone substituted in position 21, e.g. cortisone, dexamethasone, prednisone or aldosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
- A61P5/46—Drugs for disorders of the endocrine system of the suprarenal hormones for decreasing, blocking or antagonising the activity of glucocorticosteroids
Abstract
Description
종양 또는 신생물은 이의 주변 구조와 독립적으로 지속하고 성장하는, 생리학적 용도가 없는, 새로운 조직 덩어리로 정의된다(Doreland's Medical Dictionary, 23 ED. 1960).
종양에 대해 몇 개의 분류가 이용 가능한데: 본 특허원의 이용에 대하여, 가장 중요한 것은 상피성 종양이다.
상피성 종양은 중공 내부 기관 및 신체 표면을 라이닝(lining)하는 세포의 유형인, 상피 세포로부터 유도된 신생물이며; 이 그룹은 가장 일반적인 암들 중의 다수를 포함하고, 유방, 전립선, 폐, 췌장 및 위장관에서 발달하는 암 대부분을 포함한다.
일부 경우, 상피성 종양은 또한 종양에 호르몬-민감성을 제공하는 종양 세포내 특이 호르몬-수용체의 존재를 특징으로 할 수도 있다.
상피 세포로부터 유도된 악성 종양인 암종은 100종의 암중 약 85종을 구성한다(85%).
상피성 암종의 한 예는 췌장 암종(췌장암이라고도 함)이다.
췌장암은 가장 치명적인 형태의 암종들 중의 하나이다. 췌장의 외분비 및 내분비 세포는 완전히 상이한 형태의 종양을 형성한다. 외분비 췌장 종양은 가장 일반적인 형태의 췌장암을 구성한다(95% 초과). 양성(비-암성) 낭종 및 양성 종양(선종)이 췌장에서 발달될 수 있지만, 대부분의 외분비 췌장 종양은 악성이다.
췌장의 암종, 특히 외분비 췌장 암종 및 도관 선암인, 훨씬 더 특히 가장 빈번한 췌장 암종은 남성의 다섯 번째의 가장 빈번한 사망 원인에 해당하고, 여성 사망의 네 번째 원인이다. 이는 예후가 최고로 불리한 종양들 중의 하나로, 진단 후 5년 생존률이 남성은 단지 5%, 여성은 6%이다. 최고 발병률은 60-70세 사이에 발생한다(AIOM. Linea Guida Carcinoma del Pancreas Esocrino, ed. 2013).
외분비 췌장 암종의 병인은 공지되어 있지 않다. 인정된 유전적 소인(가족력) 및 일부 위험 인자, 예를 들면, 흡연, 지방 식이, 2형 당뇨병, 만성 췌장염, 환경적 인자, 예를 들면, 용제 또는 살충제가 존재한다.
외분비 췌장의 암종은 초기 단계에서는, 무증상이고, 이는 진단 지연을 설명하며, 진단은 통상적으로는 다른 복부 질환에 대한 진단 과정 동안 우연히 검출되는 것을 제외하고, 질환이 진전된 단계일 때 수행된다.
췌장암을 진단받은 환자는 통상적으로 예후가 불량하다: 위에서 기재한 진단 지연을 고려하면, 약 15%의 사례만이 췌장으로 제한된 종양을 나타내는 반면, 나머지 사례에서는, 국소영역 림프절로의 확산이 환자의 약 25%에서 검출되고, 전이의 존재가 사례의 60%에서 검출된다.
암 진단으로부터의 중간 생존 기간은 약 3 내지 6개월인 반면, 5년 생존률은 5%보다 현저히 낮다.
췌장 암종의 치료는 가능한 경우, 또한 완화 목적으로 수술이다.
근치 췌십이지장절제술은 특히 최소 질환에 대하여 현재 유일한 치료 기회이다.
방사선 치료와도 연관된, 의학 요법은 절제 불가능한 경우, 또는 전이가 존재할 때, 또는 수술 후 보조 치료로서 제한된다. 젬시타빈(gemcitabine) 또는 플루오로우라실(fluorouracil), 또는 독소루비신(doxorubicin), 메토트렉세이트(methotrexate), 시스플라틴(cisplatin), 옥살리플라틴(oxaliplatin), 이리노테칸(irinotecan), 에를로티닙(erlotinib) 등과의 병용 요법에 반응하는 개인 환자의 부차적인 보고가 존재하지만, 화학요법의 결과는 일반적으로 불만족스럽고, 종종 전혀 치료하지 않은 것이나 다름없다(Martindale, 31 ed., page 530).
테브(Theve) 등은 1983년에 췌장 조직내 스테로이드 수용체 단백질, 사람 췌장내 에스트로겐 결합 단백질의 높은 용량 및 주 말초 에스트로겐, 에스트로겐 설페이트를 말단 생물학적 활성 에스트라디올-17β로 전환시키는 사람 췌장 조직의 능력에 대한 보고서를 기반으로 하여, 췌장에 대한 성 호르몬의 가능한 효과를 검토하였다.
이러한 배경하에, 이들은 췌장의 절제 불가능 선암 환자에 타목시펜(tamoxifen)(에스트로겐 수용체의 길항제)을 시도하여 1993년에 웡(Wong) 등에 의한 결과와 유사한 일부 예비 결과를 얻었다.
다음 해의 임상 실시는 예상된 결과를 나타내지 않았지만, 항-에스트로겐이 최적의 치료 형태를 구성하지 않더라도, 다른 종류의 호르몬 조작이 췌장암에서 시도되어야 한다고 결론지어졌다. 위를 고려하여, 종양 치료의 새로운 접근에 대한, 특히 암종의 치료, 보다 특히 상피성 종양의 치료, 특히 전립선 암종 또는 췌장 암종(바람직하게는 외분비성 췌장 암종)에 대한 강한 요구가 있다.
코르텍솔론의 17α-모노에스테르, 21-모노에스테르 및 17α,21-디에스테르라고 하는 다수의 화합물 및 이의 제조방법은 당해 기술분야에 공지되어 있다.
WO 제03/014141호에는 코르텍솔론(11-데옥시코르티손으로도 공지되어 있음)에 구조적으로 관련된 스테로이드 계통에 속하는 화합물이 주로 항안드로겐 활성을 갖는다고 기재되어 있다. 코르텍솔론 17α-프로피오네이트 등의 이러한 화합물들은 조직내 안드로겐 수용체(AR)에 대한 안드로겐 호르몬의 직접 작용을 방해하여 작용한다.
WO 제2007/031349호에는 항생식샘자극제로서 코르텍솔론에 구조적으로 관련된 유도체인 9,11-데하이드로코르텍솔론의 C3-C10 17α-에스테르가 기재되어 있으며, 이는 과량의 생식샘자극 생성에 밀접하게 관련된 장애 치료에 유용할 수 있다.
WO 제2009/019138호에는 코르텍솔론 및 9,11-데하이드로코르텍솔론의 17α-모노에스테르의 효소적 획득 방법이 기재되어 있고; 추가로 또한 코르텍솔론 17α-프로피오네이트의 몇 가지 결정 형태, 즉 결정 형태 I, 형태 II, 형태 III 및 수화물 형태 IV의 존재, 및 이를 수득하는 특정 방법이 기재되어 있다.
사이프로테론 아세테이트(Cyproterone Acetate; CPA로 단축함)는 합성 스테로이드로, 이는 안드로겐 민감성 종양, 특히 전립선암의 치료를 위한 표준 요법으로 고려되었다. 사이프로테론 아세테이트를 사용한 표준 요법은 안드로겐 수용체의 발현이 감소되거나 부재한 종양에 매우 무효한 결과를 낳았다(Br. J. Cancer (1989), 60, 789-792).
17α-에스테르화의 존재는 동물에 나타나는, 상이한 항안드로겐 활성을 코르텍솔론 17α-에스테르에 부여한다는 것이 당해 기술분야에 공지되어 있다(Celasco et al., Arzneim-Forsch 2005; 5: 581-7).
놀랍게도, 본 발명에 이르러, 코르텍솔론 17α(알파)-모노에스테르, 21-모노에스테르 및 17α(알파),21-디에스테르가 분리된 암세포 및 이종이식 전립선 및 췌장암종 둘 다에서 동물로의 예상 외의 항종양 효과를 가짐이 밝혀졌다.
본 발명의 항종양 효과는 전립선암 세포 PC3 또는 췌장암 세포 MiaPaca로서, 전립선 암세포 LNCaP 또는 췌장암 세포 Panc1의 경우와 같은, 안드로겐 수용체(AR+)를 하버링하는 암종 세포와, 매우 놀랍게도, 또한 안드로겐 수용체(AR-)의 발현이 부재하거나 감소된 세포 둘 다 에서 명백하였다. 본 발명의 항종양 효과는 또한 유방 암종(AR-) 및 위장관 암종(AR-)에서 또한 명백하였다.
본원은 2014년 10월 8일자로 출원된, "종양 치료에 사용하기 위한 코르텍솔론(cortexolone)의 17α-모노에스테르 및 17α,21-디에스테르"를 발명의 명칭으로 하는, 유럽 특허원 제14188063.3호에 대한 35 USC§119하의 우선권의 이권을 주장하며, 이의 전체 내용은 본원에서 전체적으로 참조로 인용된다.
일반적인 맥락에서, 본 발명은 화학식 I의 특정한 코르텍솔론 유도체, 및 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료 또는 보조, 또는 신보조 또는 완화 치료용 항종양 활성 성분으로서 사용하기 위한 동 화합물을 제공한다:
[화학식 I]
본 발명의 또 다른 측면은 활성 성분으로서 하나 이상의 화학식 I의 코르텍솔론 유도체를 하나 이상의 생리학적으로 허용되는 부형제와 포함하는 약제학적 조성물, 및 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료 또는 보조, 또는 신보조 또는 완화 치료용 항종양 의약품으로서 사용하기 위한 동 약제학적 조성물에 관한 것이다.
본 발명을 이제 다음의 비제한적인 도면 및 실시예에 의하여 설명한다.
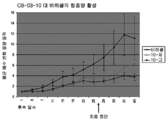
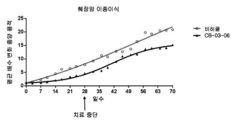
도 1: 저용량(230μM) 및 고용량(1150μM)에서의 코르텍솔론 17α-벤조에이트(도면에서는 "06" 및 "CB-03-06"으로 나타냄)를 사용한 누드 마우스들(nude mice)의 이종이식 동물 모델(MiaPaca 췌장 세포주)에서, 치료 개시에 대하여 측정된, 췌장 종양 용적의 평균 변화. "비히클"에 대한 언급은 생리식염수 중의 0.4%(v/v) 트윈(tween) 80 및 0.5%(w/v) 카복시메틸셀룰로스를 사용한 대조 치료 그룹이다. 마우스들을 28일 동안 연속해서 매일 화합물 및 비히클 SC로 치료하였다. 중단 치료 화살표는 치료가 종료되었을 때의 날짜를 말한다.
도 2: 저용량(230μM) 및 고용량(1150μM)에서의 코르텍솔론 17α-발레레이트-21-프로피오네이트(도면에서는 "10" 및 "CB-03-10"으로 나타냄)를 사용한 누드 마우스들의 이종이식 동물 모델(MiaPaca 췌장 세포주)에서, 치료 개시에 대하여 측정된, 췌장 종양 용적의 평균 변화. "비히클"에 대한 언급은 생리식염수(normal saline) 중의 0.4%(v/v) 트윈(tween) 80 및 0.5%(w/v) 카복시메틸셀룰로스를 사용한 대조 치료 그룹이다. 마우스들을 28일 동안 연속해서 매일 화합물 및 비히클 SC로 치료하였다. 중단 치료 화살표는 치료가 종료되었을 때의 날짜를 말한다.
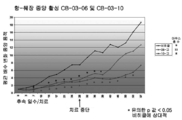
도 3: 사이프로테론 아세테이트(도면에서는 CPA로 나타냄), 코르텍솔론 17α-발레레이트-21-프로피오네이트(도면에서는 "10"으로 나타냄) 및 코르텍솔론 17α-벤조에이트(도면에서는 "06"으로 나타냄)(저 용량 및 고 용량의 각각의 화합물)로 치료된 누드 마우스들과, 비히클(즉, 생리식염수 중의 0.4%(v/v) 트윈 80 및 0.5%(w/v) 카복시메틸셀룰로스) 치료된 대조군의 동물 모델(MiaPaca 췌장 세포주)에서의 치료 개시에 대한 췌장 종양 용적의 평균 변화. 모든 마우스들은 28일 동안 연속해서(치료 일 수) 매일 화합물 및 비히클 SC로 치료하였다. 중단 치료 화살표는 치료가 종료되었을 때의 날짜를 말한다.
도 4: P 값 대 도 3으로부터의 최상의 용량의 비히클(즉, 생리식염수 중의 0.4%(v/v) 트윈 80 및 0.5%(w/v) 카복시메틸셀룰로스) 치료된 대조군을 나타내는 그래프. 모든 마우스들은 28일 동안 연속해서 매일 화합물 및 비히클 SC로 치료되었다. 중단 치료 화살표는 치료가 종료되었을 때의 날짜를 말한다.
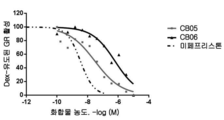
도 5: 사람 전립선(a) 및 췌장(b)암 세포주에서의 코르텍솔론 유도된 화합물의 세포독성의 용량 적정.
도 6: 암세포주에 대한 AR 발현 수준.
도 7: CB-03-06 글루코코르티코이드 길항제 활성(antagonist activity).
도 8: CB-03-06 글루코코르티코이드 효능제 활성(agonist activity).
도 9: MiaPaca2 세포내 세포자멸사의 CB-03-06 유도.
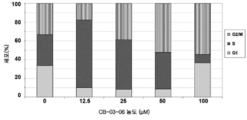
도 10: MiaPaca2 세포내 상이한 농도의 CB-03-06에 의한 세포 주기 정지의 유도.
도 11; MiaPaca2 세포내 카스파제(caspase) 활성화의 시간 경로(8-24-48 시간). 20μM(줄무늬 바) 또는 50μM(단색 바)는 화합물의 농도를 나타낸다.
도 12: LNCaP 전립선 암세포주에 대한 카스파제 활성화의 시간 경로.
도 13: (A) 사람 및 (B) 래트 혈장내 CB-03-06의 시험관내 대사.
도 14: 피하 및 경구 투여 후 마우스들의 혈장내 생체내 평가된 CB-03-06 약동학.
도 15: 피하 투여시 췌장암의 마우스 이종이식 모델에 대한 CB-03-06 생체내 항종양 활성.
도 16: 경구 섭식에 의하여 투여시 전립선암의 마우스 이종이식 모델에서의 CB-03-06 생체내 항종양 활성.
도 17: LNCaP 암세포주로부터의 시험관내 기준선 PSA 분비의 CB-03-06 억제.
도 18: 상이한 암세포주에서의 안드로겐 및 글루코코르티코이드 수용체 발현.
도 1: 저용량(230μM) 및 고용량(1150μM)에서의 코르텍솔론 17α-벤조에이트(도면에서는 "06" 및 "CB-03-06"으로 나타냄)를 사용한 누드 마우스들(nude mice)의 이종이식 동물 모델(MiaPaca 췌장 세포주)에서, 치료 개시에 대하여 측정된, 췌장 종양 용적의 평균 변화. "비히클"에 대한 언급은 생리식염수 중의 0.4%(v/v) 트윈(tween) 80 및 0.5%(w/v) 카복시메틸셀룰로스를 사용한 대조 치료 그룹이다. 마우스들을 28일 동안 연속해서 매일 화합물 및 비히클 SC로 치료하였다. 중단 치료 화살표는 치료가 종료되었을 때의 날짜를 말한다.
도 2: 저용량(230μM) 및 고용량(1150μM)에서의 코르텍솔론 17α-발레레이트-21-프로피오네이트(도면에서는 "10" 및 "CB-03-10"으로 나타냄)를 사용한 누드 마우스들의 이종이식 동물 모델(MiaPaca 췌장 세포주)에서, 치료 개시에 대하여 측정된, 췌장 종양 용적의 평균 변화. "비히클"에 대한 언급은 생리식염수(normal saline) 중의 0.4%(v/v) 트윈(tween) 80 및 0.5%(w/v) 카복시메틸셀룰로스를 사용한 대조 치료 그룹이다. 마우스들을 28일 동안 연속해서 매일 화합물 및 비히클 SC로 치료하였다. 중단 치료 화살표는 치료가 종료되었을 때의 날짜를 말한다.
도 3: 사이프로테론 아세테이트(도면에서는 CPA로 나타냄), 코르텍솔론 17α-발레레이트-21-프로피오네이트(도면에서는 "10"으로 나타냄) 및 코르텍솔론 17α-벤조에이트(도면에서는 "06"으로 나타냄)(저 용량 및 고 용량의 각각의 화합물)로 치료된 누드 마우스들과, 비히클(즉, 생리식염수 중의 0.4%(v/v) 트윈 80 및 0.5%(w/v) 카복시메틸셀룰로스) 치료된 대조군의 동물 모델(MiaPaca 췌장 세포주)에서의 치료 개시에 대한 췌장 종양 용적의 평균 변화. 모든 마우스들은 28일 동안 연속해서(치료 일 수) 매일 화합물 및 비히클 SC로 치료하였다. 중단 치료 화살표는 치료가 종료되었을 때의 날짜를 말한다.
도 4: P 값 대 도 3으로부터의 최상의 용량의 비히클(즉, 생리식염수 중의 0.4%(v/v) 트윈 80 및 0.5%(w/v) 카복시메틸셀룰로스) 치료된 대조군을 나타내는 그래프. 모든 마우스들은 28일 동안 연속해서 매일 화합물 및 비히클 SC로 치료되었다. 중단 치료 화살표는 치료가 종료되었을 때의 날짜를 말한다.
도 5: 사람 전립선(a) 및 췌장(b)암 세포주에서의 코르텍솔론 유도된 화합물의 세포독성의 용량 적정.
도 6: 암세포주에 대한 AR 발현 수준.
도 7: CB-03-06 글루코코르티코이드 길항제 활성(antagonist activity).
도 8: CB-03-06 글루코코르티코이드 효능제 활성(agonist activity).
도 9: MiaPaca2 세포내 세포자멸사의 CB-03-06 유도.
도 10: MiaPaca2 세포내 상이한 농도의 CB-03-06에 의한 세포 주기 정지의 유도.
도 11; MiaPaca2 세포내 카스파제(caspase) 활성화의 시간 경로(8-24-48 시간). 20μM(줄무늬 바) 또는 50μM(단색 바)는 화합물의 농도를 나타낸다.
도 12: LNCaP 전립선 암세포주에 대한 카스파제 활성화의 시간 경로.
도 13: (A) 사람 및 (B) 래트 혈장내 CB-03-06의 시험관내 대사.
도 14: 피하 및 경구 투여 후 마우스들의 혈장내 생체내 평가된 CB-03-06 약동학.
도 15: 피하 투여시 췌장암의 마우스 이종이식 모델에 대한 CB-03-06 생체내 항종양 활성.
도 16: 경구 섭식에 의하여 투여시 전립선암의 마우스 이종이식 모델에서의 CB-03-06 생체내 항종양 활성.
도 17: LNCaP 암세포주로부터의 시험관내 기준선 PSA 분비의 CB-03-06 억제.
도 18: 상이한 암세포주에서의 안드로겐 및 글루코코르티코이드 수용체 발현.
정의
달리 정의되지 않는 한, 본원에 사용된 기술, 표기법 및 기타 과학 전문 용어의 전 용어는 본 개시가 속하는 기술 분야의 숙련가에 의하여 일반적으로 이해되는 의미를 갖도록 의도된다. 일부 경우, 일반적으로 이해되는 의미를 갖는 용어는 명확성 및/또는 즉각적 참조를 위하여 본원에서 정의되고; 따라서 본원에 이러한 정의를 포함시키는 것은 당해 기술분야에서 일반적으로 이해되는 것과의 실질적 차이를 나타내는 것으로 해석하지 않아야 한다.
특히, 본원에서 용어 "생리학적으로 허용되는 부형제" 또는 "약제학적으로 허용되는 부형제"는 자체의 어떠한 약리학적 효과가 결여된 물질을 말하고, 이는 포유동물, 바람직하게는 사람에 투여시 역반응을 생성하지 않는다. 생리학적으로 허용되는 부형제는 당해 기술분야에 익히 공지되어 있고, 예를 들면, 본원에서 참조로 인용되는 문헌(Handbook of Pharmaceutical Excipients, sixth edition (2009))에 개시되어 있다.
본원에 사용된 바와 같은 용어 "알킬"은 포화 직쇄 또는 측쇄 탄화수소를 의미한다.
본원에서 용어 "아릴"은 방향족 모노- 및 폴리-카보사이클 환 시스템을 말하며, 여기서 폴리카보사이클릭 환 시스템내 개별적인 카보사이클릭 환은 단일 결합에 의하여 서로 결합되거나 융합될 수 있다. 적합한 "아릴" 기는 이들로 제한되지는 않지만, 페닐, 나프틸, 비페닐 등을 포함한다.
본원에서 용어 "헤테로아릴"은 환 시스템내 적어도 헤테로원자를 포함하는 방향족 모노- 및 폴리-카보사이클릭 환 시스템을 말하며, 여기서 헤테로원자는 이들로 제한되지는 않지만, 질소, 황, 산소 등을 포함하는 그룹에서 선택되고, 폴리-카보사이클릭 환 시스템내 개별적인 사이클릭 환은 단일 결합을 통하여 서로 결합되거나 융합될 수 있다. 적합한 "헤테로아릴" 기는, 이들로 제한되지는 않지만, 피리딜, 이미다졸릴, 피롤릴, 푸릴, 벤즈이미다졸릴, 티오푸라닐 등을 포함한다.
"아릴 기"는 환의 탄소원자 중의 하나 이상이 저급 알킬, 저급 알케닐, 저급 할로 알킬, 저급 할로알케닐, 저급 알콕시, 저급 알케닐옥시, 할로겐, 니트로, 시아노, 저급 알킬티오 등으로부터 선택된 기로 임의로 치환될 수 있다.
"헤테로아릴 기"는 환의 탄소원자들 중의 하나 이상 또는 헤테로원자들 중의 하나 이상이 저급 알킬, 저급 할로알킬, 저급 알콕시, 저급 알케닐, 저급 할로알케닐, 저급 알케닐옥시, 할로겐, 니트로, 시아노, 저급 알킬티오 등으로부터 선택된 기로 임의로 치환될 수 있다.
용어 "약(approximately)"은 측정시 발생할 수 있는, 실험적 오차 범위를 말한다.
용어 "포함하는(comprising)", "갖는(having)", "포함하는(including)" 및 "함유하는(containing)"은 제한 없는(open-ended) 용어로 해석되어야 하고(즉, "포함하지만, 제한되지 않는"을 의미), 또한 용어 "본질적으로 이루어지다", "본질적으로 이루어진", "이루어지다" 또는 "이루어진"에 대한 지지를 포함하고/하거나 제공하는 것으로 고려되어야 한다.
용어 "본질적으로 이루어지다" 및 "본질적으로 이루어진"은 본 발명의 기본 및 신규 특징에 실질적인 영향을 미치는 다른 성분이 포함되지 않음을 의미하여, 반-폐쇄 용어로 해석되어야 한다(임의 부형제가 따라서 포함될 수 있음).
용어 "이루어지다" 및 "이루어진"은 폐쇄 용어로 해석되어야 한다.
본원에서 사용된 바와 같이, 용어 "치료학적 유효량" 및 "유효량"은 목적하는 생물학적 반응을 이끌어내기에 충분한 양을 말한다. 본 발명에서 목적하는 생물학적 반응은 질환, 장애 또는 상태의 중증도, 기간, 진행 또는 개시를 억제, 감소 또는 개선시키거나, 질환, 장애 또는 상태, 또는 질환, 장애 또는 상태와 연관된 증상의 발달, 재발 또는 진행을 방지하는 것이다. 피검체에 투여되는 화합물의 정확한 양은 투여 방식, 질환, 장애 또는 상태의 유형 및 중증도, 및 피검체의 특성, 예를 들면, 일반 건강, 연령, 성별, 체중 및 약제에 대한 내성에 좌우된다. 숙련가는 이들 및 기타 인자에 따라 적합한 투여량을 결정할 수 있다. 적합한 투여량은 승인된 제제에 대해서는 공지되어 있고 피검체의 상태, 치료되는 상태(들)의 유형 및 사용되는 본원에 기재된 화합물의 양에 따라 숙련가에 의하여 조절될 수 있다. 양이 분명히 주지되지 않는 경우, 유효량은 추정되어야 한다. 예를 들면, 본원에 기재된 화합물 및 약제학적 조성물은 치료적 처치에 대하여 약 0.01 내지 100mg/㎏ 체중/일의 투여 범위로 피검체에 투여될 수 있다.
본원에서 사용된 바와 같이, 용어 "치료하다(treat)", "치료(treatment)" 및 "치료하는(treating)"은 하나 이상의 요법(예: 하나 이상의 치료제, 예를 들면, 본 발명의 화합물 또는 조성물)의 투여로부터 비롯되어, 치료적 처치가 질환, 장애 또는 상태의 진행, 중증도 및/또는 기간의 감소 또는 개선, 또는 질환, 장애 또는 상태의 하나 이상의 증상의 개선(특히 하나 이상의 인식 가능한 증상)의 개선을 포함함을 말한다. 특정 양태에서, 치료적 처치는 질환, 장애 또는 상태의 하나 이상의 측정 가능한 물리적 파라미터의 개선을 포함한다. 다른 양태에서, 치료적 처치는 예를 들면, 인식 가능한 증상의 안정화에 의하여 물리적으로, 예를 들면, 물리적 파라미터의 안정화에 의하여 생리학적으로, 또는 둘 다에서 상태의 진행의 억제를 포함한다. 다른 양태에서, 치료적 처치는 질환, 장애 또는 상태의 감소 또는 안정화를 포함한다.
본원에서 사용된 용어 "치유적 치료(curative treatment)"는 질환을 치유하거나 질환과 연관된 증상을 개선하는 목적의 처치를 말한다.
본원에서 사용된 용어 "완화 치료(palliative treatment)"는 질환을 치유하는 목적이 아니라 그보다는 경감을 제공하는 목적인 처치 또는 요법을 말한다.
본원에서 사용된 용어 "보조 치료(adjuvant treatment)"는 제1, 주 또는 초기 치료 이외에 제공되는 치료를 말한다.
본원에서 사용된 용어 "신보조 치료(neoadjuvant treatment)"는 종양의 크기 또는 범위를 감소시키려는 목적에서, 주 치료 이전에 제공되어, 종양이 크기 또는 범위에서 감소되지 않는 경우 필요할 보다 광범위한 치료 기술의 결과를 감소시키는 치료를 말한다.
본원에 기재된 바와 같이, 본 발명의 화합물은 일반적으로 아래에 예시된 바와 같거나, 본 발명의 특정한 종에 의하여 예시되는 바와 같은, 하나 이상의 치환체로 임의로 치환될 수 있다. "임의로 치환된"이라는 구문은 "치환되거나 치환되지 않는"이라는 구문과 상호 교환적으로 사용되는 것이 인정된다. 일반적으로, 용어 "치환된"은 용어 "임의로"가 선행되든 선행되지 않든, 명시된 치환체의 라디칼을 갖는 제공된 구조에서의 하나 이상의 수소 라디칼의 대체를 말한다. 달리 지시되지 않는 한, 임의로 치환된 기는 기의 각각 치환 가능한 위치에서의 치환체를 가질 수 있다. 제시된 구조내 하나 초과의 위치가 명시된 기로부터 선택된 하나 초과의 치환체로 치환될 수 있는 경우, 치환체는 각 위치에서 동일하거나 상이할 수 있다. 용어 "임의로 치환된"이 목록에 선행하는 경우, 상기 용어는 그 목록내 후속적 치환 가능한 기 전체를 말한다. 치환 라디칼 또는 구조가 "임의로 치환된"으로 확인되거나 정의되지 않는 경우, 치환 라디칼 또는 구조는 치환되지 않는다.
본 발명에 의하여 계획되는 치환체들 및 치환체들의 조합의 선택은 안정성 또는 화학적 실행 가능한 화합물의 형성을 발생시키는 것이다. 본원에서 사용된 용어 "안정성"은 본원에 개시된 목적 중의 하나 이상에 대하여 이의 생성, 검출 및 구체적으로, 이의 회복, 정제 및 사용을 감안하는 상태하에 두는 경우 실질적으로 변경되지 않는 화합물을 말한다. 일부 양태에서, 안정성 화합물 또는 화학적으로 실행 가능한 화합물은 수분 또는 기타 화학적 반응 조건의 부재하에, 1주 이상 동안 40℃ 이하의 온도에서 유지되는 경우 실질적으로 변경되지 않는 것이다. 안정성 구조를 발생시키는 치환체의 선택 및 조합만이 고려된다. 이러한 선택 및 조합은 당업자에게 명백하고 과도하게 실험하지 않고 결정될 수 있다.
본원에서 용어 "동시, 개별 또는 순차 투여"는 제1 및 제2 화합물을 동시에 투여하거나 두 화합물이 환자의 신체 내에서 동시에 작용하도록 하는 방식의 투여, 또는 치료적 효과를 제공하는 방식으로의 한 화합물 이후 다른 화합물의 투여를 말한다. 일부 양태에서, 화합물은 식사와 복용한다. 다른 양태에서, 화합물은 식후 30분 또는 60분과 같이, 식후 복용한다. 일부 양태에서는, 한 화합물을 얼마 동안 환자에게 투여한 후, 다른 화합물을 투여한다.
본원에서 사용된 바와 같이, 용어 "피검체(subject)" 및 환자(patient)"는 상호 교환적으로 사용된다. 용어 "피검체" 및 "환자"는 동물(예: 닭, 메추라기 또는 칠면조 등의 조류 또는 포유동물), 구체적으로 비영장류(예: 소, 돼지, 말, 양, 토끼, 기니 피그, 래트, 고양이, 개 및 마우스) 및 영장류(예: 원숭이, 침팬지 및 사람)를 포함하는 "포유동물", 보다 구체적으로 사람을 말한다. 일 양태에서, 피검체는 사람이다.
발명의 상세한 설명
본 발명에 이르러, 놀랍게도, 일부 코르텍솔론 유도체가 종양, 바람직하게는 상피성 및/또는 호르몬 의존성 종양에 대한 치료학적으로 흥미로운 항종양 특성을 가짐이 밝혀졌다.
일반적인 개념에 따라, 본 발명은 화학식 I의 화합물로 나타낸다:
화학식 I
위의 화학식 I에서,
R은 수소 또는 C(O)-R1(여기서, R1은 탄소수 2 내지 5의 직쇄 알킬이다)이고,
R'은 탄소수 3 내지 6의 직쇄 알킬 또는 임의로 치환된 아릴 기 또는 임의로 치환된 헤테로아릴 기이다.
화학식 I의 바람직한 화합물은 R이 수소 또는 C(O)-R1(여기서, R1은 CH2CH3이다)이고, R'이 -(CH2)3-CH3 또는 페닐인 것이다.
화학식 I의 가장 바람직한 화합물은 R이 수소이고, R'이 페닐인 화합물, 즉 코르텍솔론 17α-벤조에이트(본원에서는 "06" 또는 "CB-03-06"이라고도 함)이며, 이의 화학식을 아래에 보고한다.
코르텍솔론 17α-벤조에이트
약제학적으로 허용되는 염, 용매화물,
클라트레이트
,
프로드럭
및 기타 유도체
본원에 기재된 화합물은 유리 형태로 존재하거나, 필요한 경우, 염으로서 존재할 수 있다. 약제학적으로 허용되는 당해 염은 의학적 목적에 대하여 아래에 기재된 화합물을 투여하는 데 유용하므로, 특히 흥미롭다. 약제학적으로 허용되지 않는 염은 분리 및 정제 목적으로 제조 공정에서 유용하고, 일부 경우에는, 본 발명의 화합물 또는 이의 중간체의 입체이성체 형태를 분리하는 데 사용하기에 유용하다.
본원에서 사용되는 바와 같이, 용어 "약제학적으로 허용되는 염"은 안전한 의학적 판단 영역 내에, 과도한 부작용, 예를 들면, 독성, 자극, 알레르기성 반응 등이 없이 사람의 조직 및 하등 동물과 접촉하는 데 사용하기에 적합한 화합물의 염을 말하며, 합당한 이익/위험 비에 비례한다.
약제학적으로 허용되는 염은 당해 기술분야에 익히 공지되어 있다. 예를 들면, 본원에서 참조로 인용된 문헌(S. M. Berge et al., J. Pharmaceutical Sciences, 1977, 66, 1-19)에는 약제학적으로 허용되는 염이 상세히 기재되어 있다. 본원에 기재된 화합물의 약제학적으로 허용되는 염은 적합한 무기 및 유기산 및 염기로부터 유도된 것을 포함한다. 이들 염은 화합물의 최종 분리 및 정제 동안 반응계 내에서 제조될 수 있다.
본 발명이 상이한 약제학적으로 허용되는 염들의 혼합물/배합물, 및 또한 유리 형태의 화합물과 약제학적으로 허용되는 염의 혼합물/배합물을 포함함을 이해하여야 한다.
본원에 기재된 화합물 이외에, 이들 화합물의 약제학적으로 허용되는 용매화물(예: 수소화물) 및 클라트레이트는 본원에서 확인된 장애를 치료 또는 예방하는 조성물에 사용될 수도 있다.
본원에서 사용된 바와 같이, 용어 "약제학적으로 허용되는 용매화물"은 본원에 기재된 화합물들 중의 하나에 하나 이상의 약제학적으로 허용되는 용매 분자가 결합하여 형성된 용매화물이다. 용어 용매화물은 수화물(예: 반수화물, 일수화물, 이수화물, 삼수화물, 사수화물 등)을 포함한다.
본원에서 사용된 바와 같이, 용어 "수화물"은 비-공유 분자간 힘에 의하여 결합된 화학량론적 또는 비-화학량론적 양의 물을 추가로 포함하는 본원에 기재된 화합물 또는 이의 염을 의미한다.
본원에서 사용된 바와 같이, 용어 "클라트레이트"는 내부에 트랩핑된 게스트 분자(예: 용매 또는 물)를 갖는 공간(예: 채널)을 함유하는 결정 격자 형태의 본원에 기재된 화합물 또는 이의 염을 의미한다.
본원에 기재된 화합물 이외에, 이들 화합물의 약제학적으로 허용되는 유도체 또는 프로드럭은 또한 본원에서 확인된 장애를 치료 또는 예방하는 조성물에 사용될 수도 있다.
"약제학적으로 허용되는 유도체 또는 프로드럭"은 수용자에 투여시, 본원에 기재된 화합물 또는 이의 억제 활성 대사물 또는 잔사를 직접적으로 또는 간접적으로 제공할 수 있는, 본원에 기재된 화합물의 어떠한 약제학적으로 허용되는 에스테르, 에스테르의 염, 또는 기타 유도체 또는 이의 염을 포함한다. 특히 유리한 유도체 또는 프로드럭은 이러한 화합물이 환자에게 투여되는 경우(예를 들면, 경구 투여된 화합물을 혈액으로 보다 용이하게 흡수되도록 함으로써) 화합물의 생체이용률을 증가시키거나, 모 화합물을 모 화학종에 대하여 생물학적 구획(예: 뇌 또는 림프계)에 전달하는 것을 강화시키는 것이다.
본원에 기재된 화합물의 약제학적으로 허용되는 프로드럭은, 제한 없이, 에스테르, 아미노산 에스테르, 인산 에스테르, 금속염 및 설폰산 에스테르를 포함한다
의학 용도
일반적인 맥락에서, 본 발명은 의약으로서 사용하기 위한 화학식 I의 화합물로 나타낸다.
예를 들면, 본 발명은 글루코코르티코이드 수용체(GR) 조절자, 바람직하게는 글루코코르티코이드 길항제로서 사용하기 위한 상기 화학식 I의 화합물에 관한 것이다.
또 다른 측면에서, 본 발명은 글루코코르티코이드(glucocorticoid)에 의하여 매개된 질환 또는 장애를 치료하는 데 사용하기 위한 상기 화학식 I의 화합물에 관한 것이다.
또 다른 측면에서, 본 발명은 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료에 사용하기 위한 상기 화학식 I의 화합물에 관한 것이고; 또 다른 측면에 따라, 이러한 치료는 치유성, 보조성, 신보조성 또는 완화성일 수 있다.
이상적으로, 본 발명은 항종양제로서 사용하기 위한 상기 화학식 I의 화합물에 관한 것이다.
본 발명의 목적은 의약으로서 사용하기 위한 코르텍솔론 17α-벤조에이트(CB-03-06)에 의하여 나타낸다.
또 다른 측면에서, 본 발명은 글루코코르티코이드 수용체 조절자, 바람직하게는 글루코코르티코이드 길항제로서 사용하기 위한 코르텍솔론 17α-벤조에이트에 관한 것이다.
또 다른 측면에서, 본 발명은 글루코코르티코이드에 의하여 매개된 질환 또는 장애를 치료하는 데 사용하기 위한 코르텍솔론 17α-벤조에이트에 관한 것이다.
또 다른 측면에서, 본 발명은 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료에 사용하기 위한 코르텍솔론 17α-벤조에이트에 관한 것이고; 또 다른 측면에 따라, 이러한 치료는 치유성, 보조성, 신보조성 또는 완화성일 수 있다.
이상적으로, 코르텍솔론 17α-벤조에이트는 항종양제로서 사용하기 위한 것이다.
양태에서, 상기 종양 질환은 고형 종양, 바람직하게는 상피성 종양, 예를 들면, 전립선 암종, 유방 암종, 췌장 암종, 폐 암종, 위장관 암종(바람직하게는 결장 암종), 신장암, 갑상선 암종, 자궁 암종 및 부신 암종 등이다.
본원에서 개시된 발명의 바람직한 양태에서, 상기 상피성 종양은 전립선 암종, (바람직하게는 외분비 췌장 암종), 위장관 암종(바람직하게는 결장 암종) 및 유방 암종(바람직하게는 삼중 음성 유방암(TNBC))이다.
본원에서 개시된 발명의 바람직한 양태에서, 종양 질환은 전립선암이다. 본원에서 개시된 발명의 바람직한 양태에서, 전립선암은 선암이다. 본원에서 개시된 발명의 바람직한 양태에서, 종양 질환은 안드로겐 수용체의 발현이 부재하거나 감소된 전립선암이다. 본 발명의 또 다른 바람직한 양태에서, 종양 질환은 안드로겐 수용체가 돌연변이되거나 절단된(truncated) 전립선암이다.
이상적으로, 코르텍솔론 17α-벤조에이트(CB-03-06)은 항종양제로서 사용하기 위한 것이며, 여기서 종양 질환은 안드로겐 수용체가 돌연변이되거나 절단된 전립선암이다. 코르텍솔론 17α-벤조에이트(CB-03-06)의 한 가지 특히 유리한 용도는 엔잘루타마이드와 같은, 항-안드로겐 치료에 저항성이거나 저항성이 되는 전립선암의 치료에 사용하기 위한 것이다. 이는, AR이 돌연변이되거나 변화되었기 때문에, 치료 6개월 후, 암의 30%가 엔잘루타마이드에 저항성이 됨이 최근에 밝혀짐에 따라, 본 발명의 특히 유리한 양태이다. 흥미롭게도, 이러한 저항성 암세포는 GR을 상향 조절한다. 코르텍솔론 17α-벤조에이트(CB-03-06)는 활성이 GR을 통하여 매개됨에 따라, 이러한 암을 치료할 수 있다.
본원에서 개시된 발명의 또 다른 바람직한 양태에서, 외분비성 췌장 암종은 선암이다. 바람직한 양태에서, 외분비성 췌장암은 안드로겐 수용체의 발현이 부재하거나 감소된다.
본원에서 개시된 발명의 또 다른 바람직한 양태에서, 상기 상피성 종양은 위장관 암종(바람직하게는 결장 암종)이다.
본원에서 개시된 발명의 추가의 바람직한 양태에서, 상기 상피성 종양은 유방 암종(바람직하게는 삼중 음성 유방암)이다. 임의로, 치료되는 피검체 또는 환자는 통상적인 요법에 대하여 무반응자이거나 재발한다.
바람직한 양태에서, 본 발명은 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료에 사용하기 위한, R이 수소이고, R'이 페닐인, 화학식 I의 화합물, 즉 코르텍솔론 17α-벤조에이트(본원에서는 "06" 또는 "CB-03-06"이라고도 함)를 제공하고; 또 다른 측면에 따라, 이러한 치료는 치유성, 보조성, 신보조성 또는 완화성일 수 있다. 본 발명의 또 다른 목적은 다음으로 나타내는, 의약으로 사용하기 위한 코르텍솔론 17α-발레레이트(본원에서는 "05" 또는 "CB-03-05"라고도 함)이다:
CB-03-05(코르텍솔론 17α-발레레이트).
CB-03-05(코르텍솔론 17α-발레레이트)는 아래에서 논의할 것이며, 코르텍솔론 17α-벤조에이트(CB-03-06)에 관하여 위에서 기재된 바와 동일한 상태를 치료하는 의약으로서 사용될 수 있다.
본 발명의 또 다른 목적은 의약의 제조에 사용하기 위한, 화학식 I의 화합물, 바람직하게는 코르텍솔론 17α-벤조에이트 또는 코르텍솔론 17α-발레레이트, 또는 당해 화합물을 포함하는 약제학적 제형이다. 예를 들면, 화학식 I의 화합물, 바람직하게는 코르텍솔론 17α-벤조에이트 또는 코르텍솔론 17α-발레레이트, 또는 당해 화합물을 포함하는 약제학적 제형은 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료용 의약의 제조에 사용하기 위한 것일 수 있고; 또 다른 측면에 따라, 이러한 치료는 치유성, 보조성, 신보조성 또는 완화성일 수 있다. 이상적으로, 이들 화합물 또는 당해 화합물을 포함하는 약제학적 제형은 항종양제의 제조에 사용하기 위한 것이다.
양태에서, 상기 종양 질환은 고형 종양, 바람직하게는 상피성 종양, 예를 들면, 전립선 암종, 유방 암종(바람직하게는 삼중 음성 유방암), 췌장 암종(바람직하게는 외분비 췌장 암종), 폐 암종, 위장관 암종(바람직하게는 결장 암종), 신장암, 갑상선 암종, 자궁 암종 및 부신 암종 등이다.
또 다른 측면에서, 본 발명은 글루코코르티코이드에 의하여 매개된 질환 또는 장애를 치료하기 위한 의약의 제조에 사용하기 위한, 화학식 I의 화합물, 코르텍솔론 17α-벤조에이트 또는 코르텍솔론 17α-발레레이트, 또는 당해 화합물을 포함하는 약제학적 제형에 관한 것이다.
일 측면에서, 본원에 개시된 발명은 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환을 치료하는 방법을 제공하며, 상기 방법은 유효량의 화학식 I의 화합물을 이를 필요로 하는 피검체, 이를 필요로 하는 포유동물에 투여함을 포함한다:
화학식 I
위의 화학식 I에서,
R은 수소 또는 C(O)-R1(여기서, R1은 탄소수 2 내지 5의 직쇄 알킬이다)이고,
R'은 탄소수 3 내지 6의 직쇄 알킬 또는 임의로 치환된 아릴 기 또는 임의로 치환된 헤테로아릴 기이다.
바람직하게는, 상기 포유동물은 사람이다.
바람직하게는, 본원에 개시된 발명은 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환을 치료하는 방법을 제공하며, 상기 방법은 유효량의 코르텍솔론 17α-벤조에이트 또는 코르텍솔론 17α-발레레이트를 이를 필요로 하는 포유동물에 투여함을 포함한다. 바람직하게는, 상기 포유동물은 사람이다.
바람직한 양태에서, 본원에 개시된 발명은 종양의 치료방법을 제공하며, 상기 방법은 유효량의 코르텍솔론 17α-벤조에이트 또는 코르텍솔론 17α-발레레이트를 이를 필요로 하는 포유동물에 투여함을 포함한다. 이들 양태에서, 상기 종양 질환은 고형 종양, 특히 상피성 종양, 예를 들면, 전립선 암종, 유방 암종(바람직하게는 삼중 음성 유방암), 자궁 암종, 췌장 암종(바람직하게는 외분비 췌장 암종), 폐 암종, 위장관 암종(바람직하게는 결장 암종), 신장암, 갑상선 암종 및 부신 암종 등이다.
본원에서 개시된 발명의 바람직한 양태에서, 상기 상피성 종양은 전립선 암종 또는 췌장 암종, 보다 바람직하게는 외분비성 췌장 암종 또는 유방 암종, 예를 들면, 삼중 음성 유방암이다. 임의로, 치료되는 피검체 또는 환자는 통상적인 요법에 대하여 무반응자이거나 재발한다.
가장 바람직한 양태에서, 상기 방법은 유효량의, R이 수소이고, R'이 페닐인 화학식 I의 화합물, 즉 코르텍솔론 17α-벤조에이트의 투여를 포함한다.
본 발명의 화합물은 상이한 치료적 적용, 특히 종양 적용에 사용될 수 있다.
본원에 개시된 발명에 따르는 화합물은 췌장 암종, 바람직하게는 외분비성 췌장 암종, 및 전립선 암종의 치료 또는 보조, 또는 신보조 또는 완화 치료에 특히 유효한 것으로 밝혀졌다.
본 발명의 화합물의 약리학적 특성의 설명은 실험 부분에서 이후에 발견된다.
화학식 I의 화합물은 예를 들면, WO 제03/014141호 및 WO 제2009/019138호에 개시된 공정에 의하여 어떠한 통상적인 방법에 따라 제조할 수 있으며, 이의 내용은 본원에서 전체적으로 참조로 인용된다. 발명의 양태에 따라, 이들 화합물은 실시예 10 및 11에 개시된 방법에 따라 각각 제조될 수 있다.
약제학적 조성물
본원에 기재된 화합물은 약제학적으로 허용되는 담체, 희석제, 보조제 또는 비히클을 추가로 포함하는 약제학적 조성물로 제형화될 수 있다. 일 양태에서, 본 발명은 본원에 기재된 발명의 화합물과 약제학적으로 허용되는 담체, 희석제, 보조제 또는 비히클을 포함하는 약제학적 조성물에 관한 것이다. 일 양태에서, 본 발명은 유효량의 본 발명의 화합물 또는 약제학적으로 허용되는 이의 염과 약제학적으로 허용되는 담체, 희석제, 보조제 또는 비히클을 포함하는 약제학적 조성물이다. 약제학적으로 허용되는 담체는 예를 들면, 의도된 투여 형태에 대하여 적합하게 선택되고, 통상적인 약제학적 실시와 일치하는 약제학적 희석제, 부형제 또는 담체를 포함한다.
가장 바람직한 양태에 따라, 상기 약제학적 조성물은 활성 성분으로서, 코르텍솔론 17α-벤조에이트(CB-03-06)를 하나 이상의 생리학적으로 허용되는 부형제와 함께 포함한다.
또 다른 바람직한 양태에 따라, 상기 약제학적 조성물은 활성 성분으로서, 코르텍솔론 17α-발레레이트(CB-03-05)를 하나 이상의 생리학적으로 허용되는 부형제와 함께 포함한다.
추가의 목적에서, 상기 약제학적 조성물은 의약으로서 사용하기 위한 것이다. 추가의 목적에서, 상기 약제학적 조성물은 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료에 사용하기 위한 것이고; 또 다른 측면에 따라, 이러한 치료는 치유성, 보조성, 신보조성 또는 완화성일 수 있다.
추가의 목적에서, 상기 약제학적 조성물은 항종양제로서 사용하기 위한 것이다.
바람직하게는, 상기 종양 질환은 고형 종양이다. 보다 바람직하게는, 상기 고형 종양은 상피성 종양, 예를 들면, 전립선 암종, 유방 암종, 췌장 암종, 폐 암종, 위장관 암종(바람직하게는 결장 암종), 신장암, 갑상선 암종, 자궁 암종 및 부신 암종 등이다.
본원에서 개시된 발명의 바람직한 양태에서, 상기 상피성 종양은 전립선 암종 및 췌장 암종, 보다 바람직하게는 외분비성 췌장 암종, 위장관 암종(바람직하게는 결장 암종) 및 유방 암종(바람직하게는 삼중 음성 유방암)이다.
본원에서 개시된 발명의 바람직한 양태에서, 종양 질환은 전립선암이다. 본원에서 개시된 발명의 바람직한 양태에서, 전립선암은 선암이다. 본원에서 개시된 발명의 바람직한 양태에서, 종양 질환은 AR의 발현이 돌연변이되거나 부재하거나 감소된 전립선암이다. 이러한 방식으로, 본 발명에 따라 치료될 수 있는 전립선암은 엔잘루타마이드 등의, 항-안드로겐 표적 요법에 저항성이거나 저항성이 될 수 있다.
본원에서 개시된 발명의 바람직한 양태에서, 외분비성 췌장 암종은 선암이다. 바람직한 양태에서, 외분비성 췌장암은 AR의 발현이 부재하거나 감소된다.
바람직한 양태에서, 유방 암종은 삼종 음성 유방암(TNBC)이다. 임의로, 치료되는 피검체 또는 환자는 통상적인 요법에 대하여 무반응자이거나 재발한다.
본 발명의 또 다른 목적에서, 상기 약제학적 조성물은 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료용 의약의 제조에 사용하기 위한 코르텍솔론 17α-벤조에이트를 포함하고; 또 다른 측면에 따라, 이러한 치료는 치유성, 보조성, 신보조성 또는 완화성일 수 있다
추가의 목적에서, 상기 약제학적 조성물은 글루코코르티코이드 수용체(GR) 조절자, 바람직하게는 글루코코르티코이드 길항제로서 사용하기 위한 것이다.
또 다른 측면에서, 본 발명은 글루코코르티코이드에 의하여 매개된 질환 또는 장애의 치료용 의약의 제조에 사용하기 위한 상기 약제학적 조성물에 관한 것이다.
가장 바람직한 목적에서, 상기 약제학적 조성물은 코르텍솔론 17α-벤조에이트를 포함한다.
또 다른 양태에 따라, 상기 약제학적 조성물은 동시, 개별 또는 순차 투여를 위하여, 임의로 배합물(combination)로서, 적어도 또 다른 활성 성분, 바람직하게는 화학요법 활성 성분을 함유할 수 있다.
본 발명의 약제학적 조성물은 고체 형태, 예를 들면, 산제, 냉동 건조 산제, 입제, 펠릿, 정제 또는 캡슐일 수 있다. 필요한 경우, 특정 감미료, 향료 또는 착색제가 또한 첨가될 수 있다. 본 발명의 화합물은 또한 하나 이상의 부형제와 마이크로캡슐화된 형태일 수도 있다. 정제, 캡슐, 환제 및 입제 형태의 고체 투여 형태는 약제학적 제형화 기술 분야에 익히 공지된 장용성 제피 및 기타 피막 등의 피막 및 쉘로 제조될 수 있다. 고체 약제학적 조성물에 적합한 부형제는, 제한 없이, 흡착제, 충전제, 계면활성제, 압축 보조제, 결합제, 윤활제, 붕해제, 희석제, 분해제, 유동 촉진제, 냉동 건조제, 활주제, 동결건조 보조제, 막 형성제, 염료, 산화방지제 등의 당업자에게 공지된 카테고리 중에서 선택될 수 있다. 예로써, 고체 약제학적 조성물에 적합한 부형제는 비제한적 방법에서, 인산칼슘, 스테아르산마그네슘, 활석, 당, 락토스, 덱스트린, 전분, 젤라틴, 셀룰로스 및 이의 유도체, 폴리비닐피롤리돈, 코팅제, 염료 및 왁스로부터 선택될 수 있다. 이들 부형제의 어떠한 혼합물이라도 본 발명에 따라 적당하게 사용될 수 있다.
본 발명에 따라, 정제, 입제, 펠릿, 캡슐 등의 고체 약제학적 조성물은 속방출 형태, 지연 방출 형태, 조절 방출 형태, 확장 방출 형태 또는 연장 방출 형태로서 제형화될 수 있고, 경구, 설하 투여 경로에 의하여 또는 이식물로서 투여하기에 적합하다.
조절, 확장 및/또는 연장 조성물은 예를 들면, 본원에서 전체적으로 참조로 인용되는 WO 제OO/76478호에 따라 어떠한 통상적인 방법 또는 시스템에 따라 제조될 수 있다.
본 발명의 약제학적 조성물은 또한 액체 형태, 예를 들면, 용제, 에멀젼, 현탁제 또는 시럽일 수도 있다.
경구 투여용 액체 투여 형태는 이들로 제한되지는 않지만, 약제학적으로 허용되는 에멀젼, 마이크로에멀젼, 용제, 현탁제, 시럽 및 엘릭서를 포함한다. 활성 화합물 이외에, 액체 투여 형태는 당해 기술분야에 일반적으로 사용되는 불활성 희석제를 함유할 수 있다. 불활성 희석제 이외에, 경구 조성물은 또한 습윤제, 유화제 및 현탁제, 감미료, 향료 및 방향제 등의 보조제를 포함할 수도 있다.
액체 약제학적 조성물에 적합한 부형제는 제한 없이, 용매, 공용매, 유지성 비히클, 완충제, 계면활성제, 유화제, 용해도 강화제, 현탁제, 가용화제, 킬레이트화제, 산성화제, 알칼리화제, 산화방지제, 보존제, 삼투제, 강장제, 점도 조절제 등의, 당업자에게 익히 공지된 카테고리 중에서 선택될 수 있다. 예로써, 액상 제제에 적합한 약제학적 부형제는 주사제, 유기 용매 또는 공용매, 예를 들면, 에탄올, 글리콜 및 글리세롤 및 이들의 혼합물, 천연 오일, 예를 들면, 대두유, 중쇄 트리글리세라이드, 폴리옥실 15-하이드록시스테아레이트, 폴리소르베이트 80, 폴리옥실 35-피마자유, 염화나트륨, 인산나트륨, 인산칼륨 등으로부터 선택될 수 있다. 본 발명에 따라, 상기 액체 약제학적 조성물은 멸균성 또는 비-멸균성일 수 있다. 일 양태에서, 액체 약제학적 조성물은 건조 열 살균, 습윤성 열 살균, 감마 방사선, e-빔 살균 등의, 당업자에게 익히 공지된 기술에 의하여 최종적으로 살균된다. 또 다른 양태에서, 액체 약제학적 조성물은 멸균 여과에 의하여 살균되고 최종 1차 포장 용기에 무균적으로 충전시킨다. 본원에 개시된 발명에 따르는 액체 약제학적 조성물은 정맥내, 근육내, 복강내, 피하 또는 종양내 투여 등의, 주사, 주입 또는 살포를 위하여 사용될 수 있다.
투여 방법
본원에 기재된 화합물 및 약제학적 조성물은 경구, 비경구, 흡입 분무, 국소, 직장, 코, 구강, 질로 또는 이식 저장소를 통하여 투여될 수 있다. 본원에서 사용되는 용어 "비경구"는, 이들로 제한되지는 않지만, 피하, 정맥내, 근육내, 동맥내, 활액내, 흉골내, 수막강내, 간내, 병변내 및 두개내 주사 또는 주입 기술을 포함한다.
주사용 제제, 예를 들면, 멸균 주사용 수성 또는 유지성 현탁제는 적합한 분산제 또는 습윤제 및 현탁제를 사용하여 공지된 기술에 따라 제형화될 수 있다. 멸균 주사용 제제는 또한 비독성 비경구 허용 가능한 희석제 또는 용제 중의 멸균 주사용 용제, 현탁제 또는 에멀젼일 수도 있다. 주사용 제형은 예를 들면, 박테리아 보유 필터를 통하여 여과시키거나, 사용전 멸균수 또는 기타 멸균 주사용 매질에 용해시키거나 분산시킬 수 있는 멸균 고체 조성물 형태의 살균제를 혼입시켜 살균될 수 있다.
본원에 기재된 화합물 및 조성물의 멸균 주사용 형태는 수성이거나 유지성 현탁제일 수 있다. 이들 현탁제는 적합한 분산제 또는 습윤제 및 현탁제를 사용하여 당해 기술분야에 공지된 기술에 따라 제형화될 수 있다. 멸균 주사용 제제는 또한 비독성 비경구 허용 가능한 희석제 또는 용제 중의 멸균 주사용 용제 또는 현탁제일 수도 있다.
본 발명의 방법에 사용하기 위한 화합물은 단위 투여 형태로 제형화될 수 있다. 용어 "단위 투여 형태"는 치료를 받는 피검체에 대한 단일 투여량으로서 적합한 물리적으로 별개의 단위를 말하며, 각 단위는 목적하는 치료 효과를 생성하도록 계산된 소정량의 활성 물질을 임의로 적합한 약제학적 담체와 함께 함유한다. 단위 투여 형태는 단일 일일 용량 또는 다중 일일 용량(예: 일일 약 1 내지 4회 또는 그 이상) 중의 하나에 대한 것일 수 있다. 다중 일일 용량이 사용되는 경우, 단위 투여 형태는 각각의 용량에 대하여 동일하거나 상이할 수 있다.
본 발명에 따라, 화학식 I의 화합물 또는 당해 화합물을 포함하는 약제학적 조성물은 바람직하게는 정맥내 주사, 보다 바람직하게는 주입 백 또는 주사기 또는 펌프 카테터를 통하여, 또는 근육내 주사에 의하여, 또는 피하 주사에 의하여, 또는 정제 또는 캡슐 형태로 경구로(입으로) 투여된다.
양태에 따라, 상기 약제학적 조성물은 액체 형태이고 주사에 적합하고, 0.1 내지 50.0% 중량 대 용적(w/v), 바람직하게는 0.25 내지 25% w/v, 보다 바람직하게는 0.5 내지 10% w/v, 보다 더 바람직하게는 1 내지 5% w/v 범위의 양으로, 화학식 I의 코르텍솔론 유도된 화합물을 포함한다.
또 다른 양태에 따라, 상기 약제학적 조성물은 고체 형태이고 0.1 내지 50% 중량 대 중량(w/w), 바람직하게는 0.5 내지 40% w/w, 보다 바람직하게는 1 내지 30% w/w의 범위의 양으로 화학식 I의 코르텍솔론 유도된 화합물을 포함한다.
상기 약제학적 조성물 중의 하나 이상의 화학식 I의 화합물의 양은 유효 투여 수준이 악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환을 앓는 포유동물에 투여시 수득될 수 있도록 한다.
악성 신생물 및 전이를 포함한, 전암 병변, 이형성증, 화생 및 종양 질환의 치료 또는 보조, 또는 신보조 또는 완화 치료에 사용하기 위한 항종양 활성 성분으로서의, 화학식 I의 화합물 및 동 화합물을 포함하는 약제학적 조성물은 바람직하게는 포유동물에 투여되며, 상기 포유동물은 사람 또는 동물, 바람직하게는 사람이다.
병용 요법
또 다른 양태에 따라, 코르텍솔론 17α-벤조에이트(CB-03-06), 코르텍솔론 17α-발레레이트(CB-03-05) 화합물 및 당해 화합물을 포함하는 약제학적 조성물은 동시, 개별 또는 순차적 투여용 조합으로서, 적어도 또 다른 활성 성분, 바람직하게는 화학요법 활성 성분을 함유할 수 있다.
특정 양태에서, 화학식 I의 화합물 및 하나 이상의 화학식 I의 화합물과 하나 이상의 본 발명에 따르는 생리학적으로 허용되는 부형제를 포함하는 약제학적 조성물은 하나 이상의 기타 약제, 특히 화학요법 약제와의 병용 요법에서 사용될 수 있다. 특정 양태에서, 본 발명의 화합물은 또 다른 약제, 특히 화학요법 약제의 투여와 동시에 투여될 수 있다. 특정 양태에서, 본 발명의 화합물은 또 다른 약제, 특히 화학요법 약제의 투여 이전에 또는 투여에 이어서 투여될 수 있다. 상기 하나 이상의 기타 약제, 특히 화학요법 약제는 동일하거나 상이한 질환, 장애 또는 상태를 치료하는 데 유효할 수 있다. 본 발명의 방법은 병용된 투여가 본 발명의 하나 이상의 화합물의 치료 효능을 억제하지 않고/않거나 비-허용되는 부정적인 병용 효과를 생성하지 않는다면, 본 발명의 하나 이상의 화학식 I의 화합물 또는 하나 이상의 화학식 I의 화합물을 포함하는 약제학적 조성물과, 적어도 또 다른 약제, 바람직하게는 화학요법 약제의 투여를 포함한다.
코르텍솔론
17α
-
발레레이트
(본원에서 "05" 또는 "CB-03-05"라고도 함)
위에서 기재한 바와 같이, 본 발명의 또 다른 목적은 의약으로 사용하기 위한, 다음으로 나타내는 코르텍솔론 17α-발레레이트(본원에서 "05" 또는 "CB-03-05"라고도 함)이다:
CB-03-05 (코르텍솔론 17α-발레레이트)
이상적으로, 코르텍솔론 17α-발레레이트는 악성 신생물 및 전이를 임의로 포함하는, 전암 병변, 이형성증, 화생 및 종양 질환의 치료에 사용하기 위한 것이다. 바람직하게는, 코르텍솔론 17α-발레레이트는 항종양제로서 사용하기 위한 것이다. 바람직하게는, 종양 질환은 고형 종양, 바람직하게는 상피성 종양이다. 상피성 종양은 전립선 암종; 유방 암종; 췌장 암종(바람직하게는 외분비성 췌장암); 폐 암종; 위장관 암종, 예를 들면, 결장 암종; 신장암; 갑상선 암종; 자궁 암종; 및 부신 암종으로부터 선택될 수 있다.
일 양태에 따라, 상피성 종양은 전립선 암종이다. 발명의 또 다른 바람직한 양태에서, 종양 질환은 안드로겐 수용체가 돌연변이되거나 절단된 전립선암이다. 이러한 방식으로, 본 발명에 따라 치료될 수 있는 전립선암은 엔잘루타마이드와 같은, 항-안드로겐 표적 요법에 저항성이거나 저항성이 될 수 있다.
또 다른 양태에 따라, 상피성 종양은 췌장 암종, 바람직하게는 외분비성 췌장 암종이다.
일 양태에 따라, 상피성 종양은 유방 암종, 바람직하게는 삼중 음성 유방암(TNBC)이다. 일 양태에서 유방 암종은 삼중 음성 유방암이고, 피검체는 통상적인 요법에 대해 재발되거나 무응답자이다.
또 다른 양태에 따라, 상피성 종양은 위장관 암종, 예를 들면, 결장 암종이다.
또 다른 양태에 따라, 코르텍솔론 17α-발레레이트는 글루코코르티코이드 수용체(GR) 조절자, 바람직하게는 글루코코르티코이드 길항제로서 사용하기 위한 것이다.
또 다른 측면에 따라, 바람직하게는 악성 신생물 및 전이를 임의로 포함하는, 전암 병변, 이형성증, 화생 및 종양 질환의 치료에서의 의약으로서 사용하기 위한, 다음 구조식의 화합물과 하나 이상의 생리학적으로 허용되는 부형제를 포함하는 약제학적 조성물이 제공된다:
바람직하게는 상기 종양 질환은 고형 종양, 바람직하게는 상피성 종양, 예를 들면, 전립선 암종; 유방 암종; 췌장 암종; 폐 암종; 위장관 암종, 예를 들면, 결장 암종; 신장암; 갑상선 암종; 자궁 암종; 부신 암종이다.
또 다른 양태에 따라, 상기 상피성 종양은 전립선 암종이다. 발명의 또 다른 바람직한 양태에서, 종양 질환은 안드로겐 수용체가 돌연변이되거나 절단된 전립선암이다. 이러한 방식으로, 본 발명에 따라 치료될 수 있는 전립선암은 엔잘루타마이드 등의 항-안드로겐 표적 요법에 저항성이거나 저항성이 될 수 있다.
또 다른 양태에 따라, 상피성 종양은 췌장 암종, 바람직하게는 외분비성 췌장 암종이다.
또 다른 양태에 따라, 상피성 종양은 유방 암종, 바람직하게는 삼중 음성 유방암(TNBC)이다. 일 양태에서, 유방 암종은 삼중 음성 유방암이고, 피검체는 통상적인 요법에 대해 재발되거나 무-반응자이다.
또 다른 양태에 따라, 상피성 종양은 위장관 암종, 예를 들면, 결장 암종이다.
약제학적 조성물은 또한 동시, 개별 또는 순차적 투여를 위하여 하나 이상의 기타 활성 성분, 바람직하게는 화학요법 활성 성분을 포함할 수도 있다.
또 다른 측면에 따라, 글루코코르티코이드 수용체(GR) 조절자, 바람직하게는 글루코코르티코이드 길항제로서 사용하기 위한, 다음 구조식의 화합물과 하나 이상의 생리학적으로 허용되는 부형제를 포함하는 약제학적 조성물이 제공된다:
또 다른 측면에서, 치료학적 유효량의 다음 구조식의 화합물 또는 당해 화합물을 포함하는 약제학적 조성물을 이를 필요로 하는 피검체에 투여함을 포함하는, 당해 피검체의 전암 병변, 이형성증, 화생 및 종양 질환의 치료 방법이 제공된다:
일 양태에 따라, 종양 질환은 악성 신생물 또는 전이이다.
바람직하게는, 피검체는 포유동물이다. 이상적으로, 피검체는 사람이다.
일 양태에 따라, 종양 질환은 고형 종양이다. 임의로, 고형 종양은 상피성 종양이다. 상피성 종양은 전립선 암종, 유방 암종, 자궁 암종, 췌장 암종, 폐 암종, 위장관 암종(바람직하게는 결장 암종), 신장암, 갑상선 암종 및 부신 암종 등으로부터 선택될 수 있다.
또 다른 양태에 따라, 상피성 종양은 전립선 암종, 췌장 암종, 외분비성 췌장 암종 또는 유방 암종이다.
또 다른 양태에 따라, 상기 상피성 종양은 전립선 암종이다. 또 다른 바람직한 양태에서, 종양 질환은 안드로겐 수용체가 돌연변이되거나 절단된 전립선암이다. 이러한 방식으로, 본 발명에 따라 치료될 수 있는 전립선암은 엔잘루타마이드와 같은, 항-안드로겐 표적 요법에 저항성이거나 저항성이 될 수 있다.
또 다른 양태에 따라, 상피성 종양은 췌장 암종, 바람직하게는 외분비성 췌장 암종이다.
또 다른 양태에 따라, 유방 암종은 삼중 음성 유방암이다. 일 양태에서, 유방 암종은 삼중 음성 유방암이고, 피검체는 통상적인 요법에 대하여 재발되거나 무-응답자이다.
또 다른 양태에 따라, 상피성 종양은 위장관 암종, 예를 들면, 결장 암종이다.
발명의 또 다른 측면에 따라, 치료학적 유효량의 코르텍솔론 17α-발레레이트 또는 코르텍솔론 17α-발레레이트를 포함하는 약제학적 조성물을 투여함을 포함하는, 이를 필요로 하는 피검체의 글루코코르티코이드에 의하여 매개된 질환 또는 장애의 치료 방법이 제공된다.
실시예
실시예
1: 전립선암 세포주 상의
코르텍솔론
17α
-
벤조에이트(CB-03-06)의
시험관내 항종양 활성
실험을 수행하여 각각 안드로겐 수용체 양성 또는 음성 발현을 갖는 대표적인 전립선암 세포주인, LNCaP(AR+) 및 PC3(AR-) 상의 코르텍솔론 17α-벤조에이트의 시험관내 항종양 활성을 시험하고 정의하였다. 실험 방법은 다음으로 이루어졌다:
1. 3000개의 암세포를 2% 목탄 스트립핑된 소 혈청을 함유하는 완전한 배지 중의 96-웰 평저 플레이트에서 씨딩하였다.
2. 24시간 후, 항-안드로겐 화합물의 존재 또는 부재하에 10nM DHT(디하이드로테스토스테론) 또는 DMSO 비히클(음성 대조군)을 배양물에 가하였다.
3. 3일 후, 생세포 수를 ATP-의존성 증식 검정을 사용하여 정량화하였다.
시험의 목적은 생체내 동물 시험에서 화합물의 잠재적 적용을 고려하여 각각의 화합물이 암세포의 50%를 죽이는 농도(IC50)를 측정하는 것이었다.
로부터의 데이터를 S자형 용량 반응 곡선을 통하여 피팅시키고, 프리즘(Prizm) 통계 분석 소프트웨어를 사용하여 분석하였다. 실험 2로부터의 데이터를 프리즘 통계 분석 소프트웨어에서 비선형 회귀 최소 제곱 곡선 피트를 사용하여 분석하였다. 각각의 세포주에 대하여 밝혀진 IC50 값을 현재 전립선암을 치료하는 데 사용되는, 익히 공지된 비교기인, 가장 강력한 항-안드로겐성 스테로이드, 사이프로테론 아세테이트(CPA) 및 전이성 거세-저항성 전립선암을 앓는 남성들의 생존율을 연장시킬 수 있는 경구 안드로겐-수용체 억제제인, 엔잘루타마이드와 비교하여, 다음 표에 보고한다. 실험 두 세트로부터의 결과는 다음과 같다.
실험 1
결과를 프리즘 통계 분석 소프트웨어에서 S자형 용량 반응 곡선을 통하여 피팅하였다.
실험 2
아래 결과는 실험 1의 결과에 대한 추가의 실험을 포함한다. 결과를 프리즘 통계 분석 소프트웨어에서 비선형 회귀 최소 제곱 곡선 피트를 사용하여 분석하였다.
IC50 값은 코르텍솔론 17α-벤조에이트의 항종양 활성이 약한 상관 관계의 경향성에도 불구하고, 비교기와는 상이하게, 안드로겐 수용체 발현에 엄격하게 좌우되는 것으로 생각되지 않을 수 있을 것임을 나타낸다.
실시예
2: 전립선암 세포주에 대한
코르텍솔론
17α
-
발레레이트
-21-
프로피오
네이트(CB-03-10)의 시험관내 항종양 활성
실험을 수행하여 각각 안드로겐 수용체 양성 또는 음성 발현을 갖는 대표적인 전립선암 세포주인, LNCaP(AR+) 및 PC3(AR-)에 대한 코르텍솔론 17α-발레레이트-21-프로피오네이트의 시험관내 항종양 활성을 시험하고 정의하였다. 실험 방법은 다음으로 이루어졌다:
1. 3000개의 암세포를 2% 목탄 스트립핑된 소 혈청을 함유하는 완전한 배지 중의 96-웰 평저 플레이트에서 씨딩하였다.
2. 24시간 후, 항-안드로겐 화합물의 존재 또는 부재하에 10nM DHT(디하이드로테스토스테론) 또는 DMSO 비히클(음성 대조군)을 배양물에 가하였다.
3. 3일 후, 생세포 수를 ATP-의존성 증식 검정을 사용하여 정량화하였다.
시험의 목적은 생체내 동물 시험에서 화합물의 잠재적 적용을 고려하여 각각의 화합물이 암세포의 50%를 죽이는 농도(IC50)를 측정하는 것이었다.
실험 1로부터의 데이터를 S자형 용량 반응 곡선을 통하여 피팅시키고, 프리즘 통계 분석 소프트웨어를 사용하여 분석하였다. 실험 2로부터의 데이터를 프리즘 통계 분석 소프트웨어에서 비선형 회귀 최소 제곱 곡선 피트를 사용하여 분석하였다. 각각의 세포주에 대하여 밝혀진 IC50 값을, 현재 전립선암의 치료에 사용되는, 익히 공지된 비교기인, 가장 강력한 항-안드로겐성 스테로이드, 사이프로테론 아세테이트(CPA) 및 전이성 거세-저항성 전립선암을 앓는 남성들의 생존율을 연장시킬 수 있는 경구 안드로겐-수용체 길항제인, 엔잘루타마이드와 비교하여, 다음 표에 보고한다. 실험 두 세트로부터의 결과는 다음과 같다.
실험 1
결과를 프리즘 통계 분석 소프트웨어에서 S자형 용량 반응 곡선을 통하여 피팅시켰다.
실험 2
아래 결과는 실험 1의 결과에 대한 추가의 실험을 포함한다. 결과를 프리즘 통계 분석 소프트웨어에서 비선형 회귀 최소 제곱 곡선 피트를 사용하여 분석하였다.
IC50 값은 코르텍솔론 17α-발레레이트-21-프로피오네이트(CB-03-10)의 항종양 활성이 세포주에서 안드로겐 수용체 발현과 상호 연관될 수 있음을 나타낸다.
실시예
3: 췌장암 세포주에 대한
코르텍솔론
17α
-
벤조에이트(CB-03-06)의
시험관내 항종양 활성
실험을 수행하여 대표적인 췌장암 세포주인, 2개의 췌장 종양 세포주, Panc1(AR+) 및 MiaPaca2(AR 저)에 대한 코르텍솔론 17α-벤조에이트의 시험관내 항종양 활성을 시험하고 정의하였다.
세포주는 또한 안드로겐 수용체의 존재 및 발현에 대하여 양성(AR+) 또는 저(AR+/-)/음성(AR-)으로 분류되었다.
실험 방법은 다음으로 이루어졌다:
1. 3000개의 암세포를 2% 목탄 스트립핑된 소 혈청을 함유하는 완전한 배지 중의 96-웰 평저 플레이트에서 씨딩하였다.
2. 24시간 후, 항-안드로겐 화합물의 존재 또는 부재하에 10nM DHT(디하이드로테스토스테론) 또는 DMSO 비히클(음성 대조군)을 배양물에 가하였다.
3. 3일 후, 생세포 수를 ATP-의존성 증식 검정을 사용하여 정량화하였다.
시험의 목적은 생체내 동물 시험에서 화합물의 잠재적 적용을 고려하여 각각의 화합물이 암세포의 50%를 죽이는 농도(IC50)를 측정하는 것이었다.
실험 1로부터의 데이터를 S자형 용량 반응 곡선을 통하여 피팅시키고, 프리즘 통계 분석 소프트웨어를 사용하여 분석하였다. 실험 2로부터의 데이터를 프리즘 통계 분석 소프트웨어에서 비선형 회귀 최소 제곱 곡선 피트를 사용하여 분석하였다. 각각의 세포주에 대하여 밝혀진 IC50 값을, 현재 전립선암을 치료하는 데 사용되는, 익히 공지된 비교기인, 가장 강력한 항-안드로겐성 스테로이드, 사이프로테론 아세테이트(CPA) 및 전이성 거세-저항성 전립선암을 앓는 남성들의 생존율을 연장시킬 수 있는 경구 안드로겐-수용체 길항제인, 엔잘루타마이드와 비교하여, 다음 표에 보고한다. 실험 두 세트로부터의 결과는 다음과 같다.
실험 1
결과를 프리즘 통계 분석 소프트웨어에서 S자형 용량 반응 곡선을 통하여 피팅시켰다.
실험 2
아래 결과는 실험 1의 결과에 대한 추가의 실험을 포함한다. 결과를 프리즘 통계 분석 소프트웨어에서 비선형 회귀 최소 제곱 곡선 피트를 사용하여 분석하였다.
IC50 값은 코르텍솔론 17α-벤조에이트(CB-03-06)의 항종양 활성이 비교기(CPA 및 엔잘루타마이드)의 활성의 2배 이상이고, 세포주내 안드로겐 수용체 발현과 상관 관계가 존재하지 않음을 나타낸다. MiaPaca2는 저/무 AR 발현을 특징으로 하므로, 화합물의 항암 활성은 암 세포주에서의 안드로겐 수용체 발현과 직접 상호 연관되지 않는다.
실시예
4: 췌장암 세포주에 대한
코르텍솔론
17α
-
발레레이트
-21-
프로피오네
이트(CB-03-10)의 시험관내 항종양 활성
실험을 수행하여 대표적인 췌장 종양 세포주, 즉 대표적인 췌장암 세포인 Panc1(AR+) 및 MiaPaca2(R 저)에 대한 코르텍솔론 17α-발레레이트-21-프로피오네이트의 시험관내 항종양 활성을 시험하고 정의하였다.
세포주는 또한 안드로겐 수용체의 존재 및 발현에 대하여 양성(AR+) 또는 저(AR+/-)/음성(AR-)로 분류되었다.
실험 방법은 다음으로 이루어졌다:
1. 3000개의 암세포를 2% 목탄 스트립핑된 소 혈청을 함유하는 완전한 배지 중의 96-웰 평저 플레이트에서 씨딩하였다.
2. 24시간 후, 항-안드로겐 화합물의 존재 또는 부재하에 10nM DHT(디하이드로테스토스테론) 또는 DMSO 비히클(음성 대조군)을 배양물에 가하였다.
3. 3일 후, 생세포 수를 ATP-의존성 증식 검정을 사용하여 정량화하였다.
시험의 목적은 생체내 동물 시험에서 화합물의 잠재적 적용을 고려하여 각각의 화합물이 암세포의 50%를 죽이는 농도(IC50)를 측정하는 것이었다.
실험 1로부터의 데이터를 S자형 용량 반응 곡선을 통하여 피팅시키고, 프리즘 통계 분석 소프트웨어를 사용하여 분석하였다. 실험 2로부터의 데이터를 프리즘 통계 분석 소프트웨어에서 비선형 회귀 최소 제곱 곡선 피트를 사용하여 분석하였다.
각각의 세포주에 대하여 밝혀진 IC50 값을, 익히 공지된 비교기인, 가장 강력한 항-안드로겐성 스테로이드, 사이프로테론 아세테이트(CPA) 및 암을 앓는 남성의 생존율을 연장시킬 수 있는 경구 안드로겐-수용체 길항제인, 엔잘루타마이드와 비교하여, 다음 표에 보고한다. 실험 두 세트로부터의 결과는 다음과 같다.
실험 1
결과를 프리즘 통계 분석 소프트웨어에서 S자형 용량 반응 곡선을 통하여 피팅시켰다.
실험 2
아래 결과는 실험 1의 결과에 대한 추가의 실험을 포함한다. 결과를 프리즘 통계 분석 소프트웨어에서 비선형 회귀 최소 제곱 곡선 피트를 사용하여 분석하였다.
IC50 값은 코르텍솔론 17α-발레레이트-21-프로피오네이트의 항종양 활성이 세포주에 대한 안드로겐 수용체 발현에 상호 연관되지 않음을 나타낸다.
실시예
5:
마우스들내
생체내
사람 췌장 종양 이종이식
누드 마우스들내 췌장 이종이식 종양 성장에 대한 코르텍솔론 17α-벤조에이트(CB-03-06)의 활성을 가장 강력한 항-안드로겐성 스테로이드 사이프로테론 아세테이트(CPA)와 비교하여 평가하였다.
코르텍솔론 17α-벤조에이트 및 사이프로테론 아세테이트를 DMSO/2-하이드록시프로필 β-사이클로덱스트린(비히클)에 개별적으로 희석하였다.
2개의 상이한 투여량(약 230μM에 상응하는 8.0mg/㎏, 및 1150μM에 상응하는 40mg/㎏)의 코르텍솔론 17α-벤조에이트 대 비히클(즉, 생리식염수 중의 0.4% (v/v) tween 80 및 0.5% (w/v) 카복시메틸셀룰로스) 대 2개의 상이한 투여량(7.4㎎/㎏ 및 37㎎/㎏)의 사이프로테론 아세테이트 비교기의 항종양 활성을 비교하여 시험을 수행하였다.
마트리겔(matrigel)에 현탁된 1×106 MiaPaca-2 세포를 6주된 무흉선 누드 마우스들로 피하 주사하였다.
시험된 화합물, 비히클 및 비교용 화합물을 사용한 치료는 종양 용적이 이식 후 50㎣에 이른 후 개시하였다. 모든 화합물을 코르텍솔론 17α-벤조에이트, 비히클 및 사이프로테론 아세테이트 각각의 저 용량 용액 100㎕/마우스(약 230μM) 또는 고 용량 용액 100㎕/마우스(약 1150μM)를 주사하였다. 화합물 및 대조군을 28일 동안 매일 피하 투여하였다.
종양을 디지털 캘리퍼(digital caliper)로 4일마다 측정하였다.
결과를 치료 개시에 대한 종양 용적의 평균 변화로서 도 1에 플로팅한다. 종양 용적을 식 0.5236(r1)2(r2)(여기서, r1<r2이다)에 따라 계산하였다.
오차 바는 치료 그룹당 7 내지 10마리의 마우스에 대한 SEM이다. P 값은 스튜던트(Student)의 t 시험에 따라 계산하였다.
고 용량의 코르텍솔론 17α-벤조에이트는 치료가 개시되었을 때의 종양 크기의 5배 미만으로 췌장 종양 크기 증가를 유지하였다. 대조적으로, 비히클 및 사이프로테론 아세테이트 치료 그룹에서의 평균 종양은 크기가 12배 증가하였다. 이 데이터로부터 본 발명의 화합물, 코르텍솔론 17α-벤조에이트의 항종양 활성이 명백하다.
실시예
6 - 마우스들의
생체내
사람 췌장 종양 이종이식
누드 마우스들의 췌장 종양 이종이식 모델에 대한 코르텍솔론 17α-발레레이트-21-프로피오네이트(CB-03-10) 의 활성을 항-안드로겐성 스테로이드 사이프로테론 아세테이트(CPA)와 비교하여 평가하였다.
코르텍솔론 17α-발레레이트-21-프로피오네이트 및 사이프로테론 아세테이트를 DMSO/2-하이드록시프로필 β-사이클로덱스트린(비히클)에 개별적으로 희석하였다.
2개의 상이한 투여량(약 8.6mg/㎏ 대 43mg/㎏)의 코르텍솔론 17α-발레레이트-21-프로피오네이트 대 비히클(즉, 생리식염수 중의 0.4%(v/v) 트윈 80 및 0.5%(w/v) 카복시메틸셀룰로스) 대 2개의 상이한 투여량(7.4mg/㎏ 및 37mg/㎏)의 사이프로테론 아세테이트 비교기의 항종양 활성을 비교하여 시험을 수행하였다.
마트리겔에 현탁된 1×106 MiaPaca-2 세포를 6주된 무흉선 누드 마우스들로 피하 주사하였다
시험된 화합물, 비히클 및 비교용 화합물을 사용한 치료는 종양이 이식 후 50㎣의 용적 이른 후 개시하여, 코르텍솔론 17α-발레레이트-21-프로피오네이트, 비히클 및 사이프로테론 아세테이트 각각의 저 용량 용액 100㎕/마우스(약 230μM) 또는 고 용량 용액 100㎕/마우스(약 1150μM)를 피하 주사하였다. 화합물 및 대조군을 28일 동안 매일 피하 투여하였다. 종양을 디지털 캘리퍼로 4일마다 측정하였다.
결과를 치료 개시에 대한 종양 용적의 평균 변화로서 도 2에 플로팅한다. 종양 용적을 식 0.5236(r1)2(r2)(여기서, r1<r2이다)에 따라 계산하였다.
오차 바는 치료 그룹당 7 내지 10마리의 마우스에 대한 SEM이다. P 값은 스튜던트의 t 시험에 따라 계산하였다.
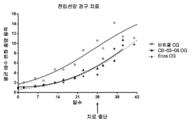
코르텍솔론 17-발레레이트-21-프로피오네이트는 치료 시기의 초기 종양 크기의 5배 미만의 췌장 종양 크기 증가를 유지하였다. 더욱이, 치료가 중단되었을 때, 종양 크기는 다시 증가하는 경향이 있었지만, 더 낮은 비율 및 범위로 증가하였다. 대조적으로, 비히클 및 사이프로테론 아세테이트 치료 그룹에서의 평균 종양은 크기가 12배 이상 증가하여, 윤리적인 이유로 이들 그룹의 동물중 일부는 억제시킬 필요가 있었다. 이들 데이터로부터 본 발명의 화합물, 코르텍솔론 17α-발레레이트-21-프로피오네이트의 항종양 활성이 명백하다.
실시예 5 및 6의 데이터로부터, 분명한 생체내 췌장 종양에 대한 코르텍솔론 17α-벤조에이트 및 코르텍솔론 17α-발레레이트-21-프로피오네이트의 생체내 항종양 활성이 확인되었고, 두 화합물 모두 동일한 동물 모델에서의 사이프로테론 아세테이트보다 항종양 활성이 더 높은 결과를 낳았다(도 3 및 4 참조).
실시예
7: 췌장암 세포주에 대한
시험관내
치료 지수
세포주 생존력 실험에서 시험되는 화합물의 안전성을 평가하기 위하여, 세포 생존 및 생존력에 영향을 미치는 모든 인자를 고려하여야 한다. 이러한 의미에서, 화합물 및 비교기의 고유한 독성의 평가는 정말 중요하다. 말초 혈액 단구 세포(PBMC)에 대한 화합물의 IC50 및 암세포주에 대한 IC50으로부터의 비는 치료 지수를 구성하고, 무엇이 더 안전한 시험 화합물인지를 나타낸다.
PBMC 중의 IC50을 2개의 상이한 활성 상태에서 시험하였다:
자극됨(stimulated) - 활발하게 분할하는 세포
휴지(resting) - 조용한, 비분할 세포
결과는 각각 자극된 PBMC 및 휴지 PBMC에 관련된, 아래 표에 보고되어 있다:
자극된 PBMC에 대한 IC50(μM)
실험 1
실험 2
휴지 PBMC에 대하여 동시에 동일한 실험을 반복하여 아래의 결과를 수득하였다.
휴지 PBMC에 대한 IC50(μM)
실험 1
실험 2
자극된 PBMC에 대하여 계산된 수득한 치료 지수(TI)를 아래 표에 보고한다:
자극된 PBMC에 대한 TI
실험 1
실험 2
휴지 PBMC에 대하여 계산된 수득한 치료 지수를 아래 표에 보고한다:
휴지 PBMC에 대한 TI
실험 1
실험 2
표에서, 0 값은 암 세포주 중에서보다 PBMC 중에서 더 높은 독성을 나타낸다.
실시예
8: 상피성 장암 세포주에 대한
코르텍솔론
17α
-
벤조에이트
및
코르
텍솔론 17α-발레레이트, 21-프로피오네이트(CB-03-10)의
시험관내
항종양 활성
실험을 수행하여 상피성 장 종양, 즉 HT29로 대표되는 세포주에 대한 코르텍솔론 17α-벤조에이트 및 코르텍솔론 17α-발레레이트, 21-프로피오네이트의 시험관내 항암 활성을 시험하고 정의하였다. 실험 방법은 다음으로 이루어졌다:
1. 단층 HT-29 세포를 내부에 플레이팅하였다: 2×104 세포/㎖의 밀도에서 96-웰 플레이트. 플레이팅된 세포를 5% CO2 중에서 37℃에서 유지시키고, 24시간 동안 부착 상태로 방치하였다.
2. 그 후, 세포를 0.16, 0.8, 4, 20, 100 및 500mM의 농도 각각에서 시험 화합물로 72시간 동안 배양하였다.
3. 72시간의 처리 후, MTT 비색 검정을 수행하였다.
시험의 목적은 각각의 화합물이 생체내 동물 시험에서 화합물의 잠재적 적용을 고려하여 암세포의 50%를 죽이는 농도(IC50)를 측정하는 것이었다.
데이터를 s자형 용량 반응 곡선을 통하여 피팅시키고, 프리즘 통계 분석 소프트웨어를 사용하여 분석하였다.
각각의 세포주에서 밝혀진 IC50 값을 다음 표에 보고한다.
HT29에 대한 2개의 생성물에 대한 상이한 마이크로몰 농도에서의 억제율(%)
2개의 생성물에 대하여 계산된 IC50 값(본원에서 아래에 보고됨)은 두 화합물 모두 HT29에 대한 명백한 항암 활성을 나타냄을 보여준다.
계산된 IC50(μM 농도)
실시예
9: 상피성 장암 세포주에 대한
시험관내
치료 지수
세포주 생존력 실험에서 시험되는 화합물의 안전성을 평가하기 위하여, 세포 생존 및 생존력에 영향을 미치는 모든 인자를 고려하여야 한다. 이러한 의미에서, 화합물 및 비교기의 고유한 독성의 평가는 정말 중요하다. PBMC에 대한 화합물의 IC50과 암세포주에 대한 IC50 사이의 비는 안전한 상태에서의 생성물 효능을 정의하는 데 중요한 파라미터인, 치료 지수를 구성한다.
PBMC 중의 IC50을 2개의 상이한 활성 상태에서 시험하였다:
자극됨 - 활발하게 분할하는 세포
휴지 - 조용한, 비분할 세포
자극된 PBMC 및 휴지 PBMC에 대하여 계산된 수득한 치료 지수(TI)를 본원에서 아래 표에 보고한다:
실험 1
실험 2
이들 데이터로부터 본 발명의 화합물, 코르텍솔론 17α-발레레이트, 21-프로피오네이트의 항종양 활성 및 안전성이 상피성 장암 세포에 대하여 확인되었다.
실시예
10 -
코르텍솔론
17α
-
벤조에이트의
합성
다음 단계를 포함하는 합성 도식에 따라 코르텍솔론 17α-벤조에이트를 제조하였다:
단계 1에서는 코르텍솔론을 적합한 용매(예: 에틸 아세테이트)에 용해시켰다. 피리디늄 토실레이트 또는 p-톨루엔 설폰산을 촉매량(1-10%mol)으로 가한 후, 트리-알킬 오르토벤조에이트(R = 메틸 또는 R = 에틸)를 수득하였다. 반응 혼합물을 80℃에서 3 내지 6시간 동안 가열하였다.
용매를 제거하고 알콜성 용매 중에서 결정화시킨 후, 코르텍솔론 오르토벤조에이트 1 을 고체로서 수득하였다.
단계 2에서는, 코르텍솔론 오르토벤조에이트 1 (R= 메틸 또는 R= 에틸)을 알콜성 용매(예: 메탄올)에 용해시키고, 환류하에 0.1N 아세트산 완충제로 처리하였다. 용매를 제거한 후, 잔사를 탈광수로 처리하여 정제하고, 코르텍솔론-17α-벤조에이트를 고체로서 회수하였다.
실시예
11 -
코르텍솔론
17α
-
발레레이트
-21-
프로피오네이트의
합성
코르텍솔론 17α-발레레이트-21-프로피오네이트를 다음 합성 도식에 따라 제조하였다:
단계 1에서는, 코르텍솔론을 적합한 용매(예: 에틸 아세테이트)에 용해시켰다. 피리디늄 토실레이트 또는 p-톨루엔 설폰산을 촉매량(1-10%mol)으로 가한 후, 트리-알킬 오르토발레레이트(R = 메틸 또는 R = 에틸)를 수득하였다. 반응 혼합물을 80℃에서 3 내지 5시간 동안 가열하고, 용매를 제거하고 알콜성 용매 중에서의 결정화 후, 코르텍솔론 오르토발레레이트 1 을 수득하였다.
단계 2에서는, 코르텍솔론 오르토발레레이트 1 (R= 메틸 또는 R= 에틸)을 알콜성 용매(예: 메탄올)에 용해시키고, 환류하에 0.1N 아세트산 완충제(pH 3 내지 3.9)로 처리하였다. 용매를 제거하고 정제수로 처리한 후, 코르텍솔론- 17α-발레레이트 2 를 고체로서 회수하였다.
단계 3에서는, 코르텍솔론- 17α-발레레이트 2 를 피리딘에 용해시키고, 1당량의 프로피오닐 클로라이드와 가하였다. 전환이 완료되면, 혼합물을 물로 희석하고, 생성물 3 을 고체로서 회수하고, 알콜로 재결정화시켜 정제하였다.
실시예
12 -
코르텍솔론
유도된 화합물, 특히 CB-03-06의
시험관내
항암 활성의 분석
일련의 코르텍솔론 유도된 화합물, 특히 CB-03-06의 시험관내 달성된 암 세포주의 성장을 억제하는 능력을 시험하였다.
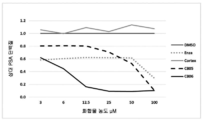
암 세포주를 2% 목탄 스트립핑된 소 혈청을 함유하는 완전한 배지 중에서 96-웰 평저 플레이트에서 3000 세포로 씨딩하였다. 24시간 후, 시험 화합물 또는 DMSO/비히클(음성 대조군으로서 0.1% 최종 농도)을 가하였다. 2종의 강력한 인식된 항-안드로겐인, 사이프로테론 아세테이트(CPA) 및 엔잘루타마이드를 세포 독성에 대한 양성 대조군으로서 사용하였다. 3일 후, 생세포 수를 ATP-의존성 세포 생존력 검정(Promega Cell Titer Glo)을 사용하여 정량화하였다. 도 5는 사람 전립선 및 췌장 세포주에 대한 코르텍솔론 유도된 화합물의 세포독성 활성의 용량 적정을 나타낸다. 각각의 화합물이 암세포의 50%를 죽이는 농도(IC50)의 측정을 수행하여 CB-03-06 및 기타 화합물의 암세포 성장을 억제하는 능력을 발현하였다. 각각의 화합물을 3 내지 200uM으로 적정하였다. 3일 후, 생세포 수를 ATP-의존성 증식 검정을 사용하여 정량화하였다. 표 1에 나타낸 데이터를 s자형 용량 반응 곡선을 통하여 피팅시키고, 프리즘 통계를 사용하여 분석하였다.
[표 1]
전립선암 및 췌장암 세포주에서 시험관내 시험된 코르텍솔론 유도된 화합물의 IC50
도 5 및 표 1에 나타낸 데이터로부터 코르텍솔론 유도된 화합물이 다양한 농도 및 IC50에서 암세포를 죽임이 명백하다. CB-03-06은 전립선암 세포(패널 a)를 강력한 항-안드로겐 CPA보다 잘 죽인다. 보다 중요하게는, 이는 안드로겐 의존성 전립선암에 대한 제1의 선택으로서 현재 병원에서 사용되는 신규하고 강력한 항-안드로겐 약제인, 엔잘루타마이드(패널 b)보다 우수하게 전립선암 세포의 시험관내 성장을 억제한다.
흥미롭게도, CB-03-06은 안드로겐 수용체를 매우 낮은 수준으로 발현하는 것으로 공지된 췌장 세포주(패널 b)의 성장을 억제한다. 이들 데이터는 세포독성에 이어서 항-안드로겐 활성에 관련된 작용의 독립적 메카니즘을 제시한다.
실시예
13 -
시험된
암 세포주에 대한 안드로겐 수용체(AR) 발현의 분석
표 1에서 시험된 전립선 및 췌장 세포주에 대하여 FACS 검정을 수행하여 암 세포주에 대한 AR 발현과 코르텍솔론 유도된 화합물 CB-03-06의 암세포 성장을 억제하는 능력 사이의 관계를 더 잘 이해하였다.
도 6은 시험된 암세포에 대한 AR 발현의 수준을 나타낸다. 예상과 같이, 전립선 및 췌장 세포주에서의 FACS 분석 AR 발현은 공개된 발현 수준과 일치한다: LNCaP > Pancl > PC3 = MiaPaca2.
AR과 IC50 사이의 상관 관계를 보다 명확하게 하기 위하여, 표 1에 시험된 암 세포주의 AR 발현 수준을 추가하였다(표 2).
[표 2]
예상한 바와 같이, 강력한 항-안드로겐 CPA 및 엔잘루타마이드에 의하여 나타난 성장 억제율은 전립선암 세포주 내 AR 발현과 상호 연관된다. CB-03-06의 억제 활성 또한 전립선암 세포내 AR 발현과 상호 연관된다(덜 엄격함). 그러나, 췌장암 세포내 AR 발현과 억제 활성 사이에는 역 상관 관계가 존재한다. 모든 시험된 화합물은 Panc1 세포(AR+)와 비교하여 MiaPaca2(AR+/-)를 발현하는 더 낮은 AR에서 더 활성이었다. 이러한 결과는 췌장암에서의 작용의 가능한 Ar-의존성 메카니즘에 대해 암시를 준다. CB-03-06은 시리즈중 가장 강력한 화합물들 중의 하나이다. 특히, CB-03-06은 시험된 모든 4개의 암 세포주에 걸쳐 CPA보다 우수하다. CB-03-06은 또한 전립선암 세포주에서 엔잘루타마이드보다 강력하다.
실시예
14 - 고형 종양으로부터 유도된 암 세포주의 더 큰 샘플에 대한,
코
르텍솔론 유도된 화합물, 특히 CB-03-06의
시험관내
항암 활성의 분석
CB-03-06의 세포독성 활성은 AR 발현과는 독립적인 것으로 보였으므로, 고형 종양의 더 큰 샘플을 시험하였다. 유방암 세포주인 MCF7(AR+/-), 더 큰 AR 발현을 갖는 추가의 췌장 세포주(BxPC3) 및 장암 세포주(HT29)를 이전의 패널에 가하였다. 결과를 표 3에 나타낸다.
[표3] AR 발현을 특징으로 하는 암 세포주에 대한 코르텍솔론 유도된 화합물의 IC50
CB-03-06은 상이한 상피성 기원으로부터의 다중 암 세포주의 세포 생존력을 강하게 억제한다. 화합물의 세포독성 활성은 안드로겐 수용체의 발현과 상호 연관되지 않는다. 이는 야생형(WT)의 발현과 상호 연관되지도 않는다. 추가로, CB-03-06은 시험되는 모든 암 세포주에서 엔잘루타마이드보다 더 강력하다.
실시예
15 - 상이한 암 세포주에 대한
코르텍솔론
유도된 화합물의 치료 지수
치료 지수(TI)(치료 창, 안전 창 또는 때로는 치료 비라고도 함)는 치료 효과를 유발하는 치료제의 양을 독성을 유발하는 양과 비교하는 것이다. 화합물의 IC50을 사람 혈액으로부터 분리된 새로운 세포(PBMC)에서 측정하였다. 화합물 독성은 다음과 같이 측정하였다:
치료 지수 = 안전성/효능 = IC50 자극된 PBMC_/IC50 암세포
결과를 표 4에 나타낸다.
[표 4] 암 세포주의 패널에 대한 코르텍솔론 유도된 화합물의 치료 지수
모든 코르텍솔론 유도된 화합물은 강한 안전성 프로파일을 나타낸다. CB-03-06은 가장 높은 치료 지수를 나타낸다. 이로부터 CB-03-06이 CPA 및 엔잘루타마이드와 비교하여 더 안전한 프로파일을 가짐이 드러난다.
실시예
16 - 안드로겐 수용체에 대한 CB-03-06 결합 친화도
이전의 실험은 상이한 기원의 종양으로부터 유도된 암 세포주에 대한 CB-03-06의 강한 세포독성 활성을 나타내었다. 이러한 세포독성 활성은 시험된 암세포에 대한 항-안드로겐 수용체 발현과 완전히 상호 연관되지 않았다.
이러한 증거를 기반으로 하여, 안드로겐 수용체(AR)에 대한 화합물의 친화도를 시험하는 검정을 계획하였다. 야생형 AR에 대한 CB-03-06의 상대 결합 친화도를 측정하기 위하여 편광 스크린 키트(Polar Screen kit)(제조원: life Technologies)를 사용한 경쟁 검정을 사용하였다. 간략하게, AR을 형광 안드로겐 리간드(Fluormone™ AL Green)에 가하여 AR-LBD 착체를 형성한다. 경쟁물은 AR-LBD로부터 형광 플루오르몬™ AL 그린(Fluormone™ AL Green) 리간드를 대체하여 형광 리간드가 이의 형광 수명 동안 신속하게 텀블링(tumbling)하도록 하여, 낮은 편광 값을 발생시킨다. 비-경쟁물은 착체로부터의 형광 리간드를 대체하지 않아서, 편광 값이 높은 상태로 남는다. 시험 화합물의 존재하의 편광 값 이동을 사용하여 AR-LBD에 대한 시험 화합물의 상대 친화도를 측정한다.
AR 수용체에 대한 CB03-06 친화도는 2.6E - 06(IC50 몰)이었다. 동일한 검정 내에서 디하이드로테스토스테론의 친화도(강력한 AR 수용체 결합제)는 1.1E-08이었다.
DHT와 비교시 AR 수용체에 대한 CB-03-06 결합 친화도는 낮고 AR 잠재적 결합제로서의 CB-03-06을 특징으로 한다.
실시예
17 - 글루코코르티코이드 수용체에 대한 CB-03-06 전사 활성
안드로겐 및 글루코코르티코이드 호르몬은 세포, 조직 및 동물에서 상이하고 종종 반대인 효과를 이끌어낸다. 광범위한 생리학적 및 분자생물학적 증거는 이들 효과를 매개하는 수용체, 안드로겐 및 글루코코르티코이드 수용체(각각 AR 및 GR)가 서로의 전사 활성에 영향을 미침을 제시한다. CB-03-06 GR 길항제 및 효능제 활성을 시험관내 검정에서 시험하였다. 간략하게, 사람 신장 상피 세포를 발광성계 리포터 분자에 연결된 GR 결합 부위를 함유하는 DNA 구성물로 트랜스펙팅시켰다. 24시간 후, 세포를 길항제 또는 효능제 방식하에 처리하였다. 추가로 24시간 후, GR 효능제 전사 활성에 비례하는 발광을 정량화시켰다.
길항제 검정은 덱사메타손(Dex)에 의하여 유도된 발광의 억제를 기반으로 하였다.
CB-03-06의 길항제 활성을 도 7에 나타낸 바와 같은 공지된 GR 길항제, 미페프리스톤(RU486이라고도 함)과 비교하였다.
효능제 검정은 CB-03-06에 의한 발광의 유도를 기반으로 하였다.
CB-03-06의 효능제 활성을 도 8에 나타낸 바와 같이 효능제 활성을 갖지 않는 것으로 공지된 RU486과 비교하였다.
도 7에 나타낸 바와 같이, CB-03-06은 매우 강력한 길항제가 아니다(RU486의 100배 미만). 대조적으로, CB-03-06은 GR을 Dex 4.6E-09M과 동일한 범위로 활성화시키는 1.4E-0.8M의 농도에서 강력한 GR 효능제이다. CB-03-06은 Dex 최대 45%에서 이의 활성이 안정 상태이므로, Dex만큼 강력하지 않다. 결과적으로, CB-03-06은 약한 GR 길항제이자 우수한 GR 효능제이다.
실시예
18 -
세포자멸사
및 세포 주기 정지의 CB-03-06 유도
현재의 사용에서 대부분의 세포독성 항암 약제는 감수성 세포내 세포자멸사를 유도하는 것으로 나타났다. 상이한 표적과 상호 작용하는 이질적인 제제가 일부 일반적 특징을 갖는 세포사를 유도한다는 사실은 세포독성이 세포의 이러한 이른바 "프로그래밍된" 세포사를 끌어들이는 능력에 의하여 결정됨을 제시한다. CB-03-06은 평가되어 암 세포주에 대한 세포독성의 메카니즘이 세포자멸사 및 세포 주기 정지에 의하여 매개되는지를 결정한다. 암 세포주는 6-웰 평저 플레이트에서 씨딩하였다. 24시간 후 시험 화합물 또는 DMSO 비히클(음성 대조군)을 가하였다. 추가의 24시간 후, 세포를 스크랩핑하고, 플루오레세인 공액 아넥신(Annexin) V 및 요오드화프로듐으로 착색시키고, 유동 세포측정에 의하여 분석하였다.
도 9는 어떻게 CB-03-06이 췌장암 세포주 MiaPaca2 에서 세포자멸사를 유도할 수 있는지를 명백하게 나타낸다. CB-03-06은 대조군에 의한 단지 12%의 세포자멸사에 대하여 전체 56% 세포에서 세포자멸사를 유도한다(초기 및 후기 세포자멸사).
세포자멸사는 세포 주기의 Gl/S 또는 G2/M 전이에서 발생할 수 있다. 세포를 CB-03-10으로 24시간 동안 처리한 다음, 파라포름알데히드로 고정시키고, 요오드화프로피듐으로 착색시켰다. 도 10의 데이터는 CB-03-06이 보다 저 농도에서 S기 블록을 유도한 다음, 보다 고 농도에서 G2/M 블록을 유도함을 나타낸다. G1 블록의 결핍은 p53에 대한 영향이 없음을 나타낸다. S 및 G2/M 블록은 세포 주기 확인점 분자에 대한 활성을 나타낼 수 있다. S기에 대하여, 가능한 표적은 사이클린 의존성 키나제 2(CDK2)이다. 겜자(Gemzar) 및 시스플라틴은 S기에 작용하는 약제의 예이다. G2에 대하여, 가능한 표적은 CDK1이다.
실시예
19 - CB-03-06에 의한
카스파제
유도의 분석
이전의 연구로부터, MiaPaca2 세포에서 착색하는 아넥신 V를 사용하여 CB-03-06이 세포자멸사를 유도함이 결정되었다. 당해 현상을 더 잘 분석하기 위하여, 카스파제 8(외인성 경로에 대한 개시제 카스파제) 및 카스파제 9(내인성 경로에 대한 개시제 카스파제)의 효소 활성 및 카스파제 3 및 7(작동기 카스파제)의 효소 활성을 측정하였다.
이를 위하여, MiaPaca2 세포를 96 웰 평저 배양 플레이트에서 씨딩하였다. 24시간 후, 시험 화합물을 세포에 가하고, 젬시타빈(공지된 췌장암 화학요법제) 및 DMSO를 각각 양성 및 음성 대조군으로서 사용하였다. 3개의 배양 시점이 있었다: 8, 24 및 48시간. 각 시점 이후, 세포를 카스파제 8 또는 카스파제 9 시약과 배합된 카스파제 3/7 기질을 함유하는 다중 완충제에 용해시키며, 이는 독점 완충제 중에 안정성 루시퍼라제를 함유한다. 용해물을 백색 불투명 96-웰 플레이트로 옮긴 다음, 테칸 사파이어(Tecan Safire) 기구상에서 발광을 측정하였다. 동일하게 처리된 평행 플레이트를 사용하여 세포 생존율을 측정하였다. 모든 카스파제 활성을 생세포의 수에 대하여 교정하였다. 결과를 도 11에 나타낸다.
카스파제 8 및 9(패널 A 및 B)의 활성은 CB-03-06에 의하여 유도되었다. 이러한 유도는 신속하고, 용량 관련되고, 8시간 후 이미 명백하며, 대조군과 비교하여 7배 증가로 높다.
젬시타빈(췌장암 치료에 사용되는 공지된 화학요법제) 또한 카스파제 8 및 9 활성을 유도하였지만 CB-03-06과 비교하여 지연되고 덜 강력한 반응을 가졌다. 카스파제 8 및 9 활성의 2, 3배 증가는 48시간 표시까지 보이지 않는다.
카스파제 3/7(패널 C)은 48시간 배양 후 높은 수준에서 CB-03-06에 의하여 유도되었다. 흥미롭게도 CB-03-05는 카스파제 활성에 대한 우수한 프로파일을 나타내지 않는다.
LNCaP 전립선암 세포주를 사용하여 동일한 검정을 반복하였다. 이 검정에 대하여, 양성 대조군은 전립선암 환자를 치료하는 병원에서 현재 사용되는 강력하고 신규한 항안드로겐인, 엔잘루타마이드이다. 결과는 카스파제 활성이 정점일 때 24시간 배양 후 도 12에 나타낸다.
도 12는 CB-03-06이 엔잘루타마이드(양성 대조군)보다 더 우수하게 개시제(8 및 9) 및 작동기(3/7) 카스파제 활성을 유도하였음을 명백하게 나타낸다.
이러한 결과는 전립선암 세포주에 대한 카스파제 활성의 CB-03-06 강 유도를 나타내어, 내인성 및 외인성 경로 둘 다에 영향을 미쳐, MiaPaca2 세포주에서 관찰되는 억제를 확인하였다.
실시예
20 -
래트
및 사람 혈장 중의 CB-03-06
시험관내
대사
사람 및 래트 혈장 중의 CB-03-06의 대사에 대한 일부 병식을 수득하기 위하여, 특정 검정을 고안하였다. 간략하게, 화합물을 37℃에서 사람 및 래트 혈장 중에서 상이한 시점에 배양하였다. 배양 후, 샘플을 액체 크로마토그래피에 의하여 무손상 화합물의 존재에 대하여 시험하였다. 시간 경로 및 농도를 도 13에 나타낸다.
결과는 CB-03-06이 혈장 중에서 8시간에 걸쳐 초기 농도의 90% 넘게 유지하고, 사람 혈장과 비교하여 래트에서 보다 신속하게 분해됨을 나타낸다.
실시예
21 - 동물 모델(마우스)에서의 CB-03-06
생체내
약동학의 분석
CB-03-06의 약동학을 정맥내(IV), 피하(SC) 및 경구 투여(PO) 후 마우스들의 혈장 중에서 평가하였다.
마우스들(그룹당 3마리)에 다음 용량을 투여하고, 지시된 시간에 채혈하였다. 혈장 샘플을 HPLC-MS/MS에 의하여 분석하였다.
CB-03-06에 대한 실제 신체 노출(AUC에 의하여 반영된 바와 같음)은 피하 투여 후 최고이고(1620hr*ng/㎖), 정맥내 투여시 50%로 내려가고(896), 경구 투여시 17%로 내려간다(276).
실시예
22 - 사람 췌장암의 마우스 이종이식 모델의 CB-03-06의
생체내
시험(MiaPaca2 세포주)
이전의 연구로부터 CB-03-06은 MiaPaca2 췌장 세포주(AR+/-)의 시험관내 성장을 강하게 억제하는 것으로 관찰되었다. 이러한 결과가 생체내 이종이식 췌장암 모델로 해석될 수 있는지에 대한 연구가 수행되었다. 익히 알려진 항-안드로겐인 사이프로테론 아세테이트(CPA)를 대조군으로서 사용하였다. 간략하게 마트리겔에 현탁된 1×106개의 MiaPaca2 세포를 6주된 수컷 무흉선 누드 마우스들로 피하(SC) 주사하였다. 종양들을 디지털 캘리퍼로 4주마다 측정하였다. 종양 용적을 식: 0.5236(rl)2(r2)[여기서, r1<r2이다]에 따라 계산하였다. 종양이 50㎣에 이른 후, CB-03-10 및 대조군 화합물로의 치료를 개시하였다. DMSO/2-하이드록시프로필 b-사이클로덱스트린(비히클)에 희석된 화합물을 28일 동안 연속해서 일일 40㎎/㎏의 농도로 매일 피하(SC) 주사하였다(100㎕/마우스). 도 15는 비히클과 비교시 CB-03-06의 SC 주사 후 생체내 이종이식 모델내 평균 종양 증가를 나타낸다.
도 15에서, CB-03-06은 대조군과 비교시 현저한 생체내 항-췌장 종양 활성을 나타낸다. 이는 비히클 단독 또는 CPA(나타내지 않음)와 비교시 현저한 항-종양 활성(p < 0.5)도 나타낸다.
치료 기간 동안 CB-03-06은 초기 크기에 대하여 5배 미만으로의 췌장 종양 크기를 유지하였다. 대조적으로, 비히클 또는 CPA 치료 그룹에서의 평균 종양은 12배로 크기가 증가하였다. CB-03-06은 종양 성장 억제를 나타낼뿐만 아니라, 마우스들 생존 이점을 또한 나타낸다. 중간 생존 일수는 비히클 치료된 마우스들에 대한 60일 또는 CPA로 치료된 마우스들에 대한 40일과 비교하여 CB-03-06으로 치료된 마우스들에 대하여 70일이었다. 이러한 차이는 비히클 치료 그룹에서 2 내지 4배 더 높은 사망 위험으로 현저하다.
실시예
23 - 마우스 이종이식 사람 전립선암 모델(
LNCaP
세포)에서의 경구 투여된 CB-03-06의 생체내 시험
이전의 연구로부터 CB-03-06은 LNCaP 전립선암 세포주의 시험관내 성장을 억제하는 데 또한 유효한 것으로 관찰되었다. 이러한 결과가 생체내 이종이식 전립선암 모델로 해석될 수 있는지에 대한 연구를 수행하였다. 마트리겔에 현탁된 3×106개의 LNCaP 세포를 6주된 수컷 무흉선 누드 마우스들로 피하 주사하였다(우측 옆구리에). 종양들을 위에서 기재한 바와 같이 측정하였다. 종양이 50㎣에 이른 후 CB-03-06 및 대조군 화합물로의 치료를 개시하였다. 투여용 제형을 20mM 시트레이트 완충제(pH 4) 중의 15% 비타민 E-TPGS 및 65%의 0.5% w/v CMC 용액 중에서 제조하였다. 경구 투여를 28일 동안 연속해서 매일 수행하였다(200㎕/마우스 중의 100㎎/㎏). 결과를 치료 개시에 대한 종양 용적의 평균 변화로서 플로팅하였다. 도 16은 CB-03-06의 경구 투여 후 생체내 이종이식 전립선암 모델로부터 수득한 결과를 나타낸다. 엔잘루타마이드는 신규하고 강력한 항-안드로겐이고, 양성 대조군으로서 작용한다.
경구 투여된 CB-03-06에 대한 경향은 전립선암에 대하여 강한 항종양 활성을 나타낸다. 억제 활성은 엔잘루타마이드와 거의 동일하며, 이는 사람의 안드로겐-의존성 전립선암의 치료에 사용되는 현재의 의약이다.
실시예
24 -
LNCaP
전립선암 세포로부터의
시험관내
전립선-특이 항원(PSA) 분비의 CB-03-06 억제
전립선-특이 항원 또는 PSA는 전립선의 세포에 의하여 생성된 단백질이다. PSA 시험은 사람의 혈액 중의 PSA 수준을 측정한다. PSA의 혈중 수준은 전립선암을 앓는 사람에 있어서 종종 상승되고, 이는 대리 표지자(surrogate marker)로서 사용되어 사람 개체군의 전립선암 진행을 시험한다. CB-03-06이 전립선암의 생체내 성장을 억제할 수 있었음을 관찰 한 후, 화합물이 암세포로부터의 시험관내 PSA 분비를 억제하는 능력을 측정하였다. LNCaP 세포를 10nM DHT의 존재 또는 부재하에 목탄 스트립핑된 혈청을 함유하는 배지 중의 96 웰 평저 배양 플레이트에서 씨딩하였다. 24시간 후, 비히클 음성 대조군으로서 DMSO를 사용하고 양성 대조군으로서 엔잘루타마이드를 사용하여, 시험 화합물을 세포에 가한다. 시험 화합물로 배양한 지 48시간 후, 상청액을 채취하고 PSA에 대한 엘리사(Elisa) 검정으로 시험하고, 동일한 세포를 세포 생존율 평가를 위하여 용해시켰다.
예상한 바와 같이, 순수한 항-안드로겐, 엔잘루타마이드는 IC50<3μM으로 PSA 분비를 억제하는 데 강력하고; CB-03-06은 또한 강력한 PSA 억제제이다(IC50 4μM). 그러나, 엔잘루타마이드 활성은 CB-03-06과 마찬가지로 적정되지 않았다. 특히, 모든 본 발명의 화합물의 최종 모 대사물인, 코르텍솔론은 PSA 분비에 본질적으로 불활성이다(612μM의 IC50). 이들 세포의 세포 생존율을 시험하는 경우, 엔잘루타마이드는 61μM의 IC50을 나타내었고, CB-03-06은 12μM의 IC50을 나타내었다. 이는 화합물 둘 다의 강한 성장 억제 활성을 확인한다. 중요하게도, 코르텍솔론은 매우 높은 농도에서만 LNCaP 생존력을 억제하고(153μM의 IC50), 암 세포주에 대한 세포독성 화합물로서 불활성한 것으로 정의될 수 있다.
실시예
25 - 유방암 세포주에 대한 CB-03-06의
시험관내
항암 활성의 분석
삼중 음성 유방암(TNBC)은 새로이 진단된 침습 유방암의 약 20%를 차지한다. 이러한 암은 호르몬 에스트로겐 및 프로게스테론에 의하여 지지되지도 않고 지나치게 많은 HER2 수용체의 존재에 의해서도 지지되지 않고, 이러한 이유로 환자들은 통상적인 요법(예: 타목시펜 또는 허셉틴)에 반응하지 않는다. 결과적으로, TNBC는 화학요법에 대해 저항성인 것을 특징으로 하고, 저 생존율을 갖는다.
이러한 암 저항성과 높은 GR 발현 사이에 상관 관계가 존재한다(Cancer therapy 2013). TNBC의 치료에 대한 화학요법과 병용하는 GR 길항제를 시험하는 임상 시험(미페프리스톤/RU486)이 존재한다. 그러나, 미페프리스톤 임상 용도는 프로게스테론 수용체(PR) 길항 작용에 연관된 다약리학(poly pharmacology)으로 인하여 절충된다. CB-03-06이 유방암, 특히 TNBC에 대한 잠재적 치료로서 사용될 수 있는지 평가하기 위하여, 다양한 호르몬 수용체 발현을 특징으로 하는 유방암 세포주를 사용하여 세포독성 검정을 수행하였다.
이러한 검정에 대하여 선택된 유방암 세포주는 다음과 같다:
MCF7 유방암 세포(ER+PR+Her2+, GR+/-)
MDA-MB-231 TBNC 세포(ER-PR-Her2-, GR++)
세포 성장 억제를 시험하기 전에, 유방암 세포는 위에서 기재한 바와 같이, FACS에 의한 AR 및 GR 수용체 발현에 대하여 특징지워졌다. 도 18의 데이터는 문헌에 지시된 바와 같은 수용체 발현을 확인한다.
세포독성 검정에 대하여: 세포를 목탄 스트립핑된 혈청을 함유하는 배지 중의 96 웰 평저 배양 플레이트에 씨딩하였다. 24시간 후, 시험 화합물을 세포에 가하였다. DMSO를 비히클 음성 대조군으로 사용하고 RU486을 양성 대조군으로 사용하였다. 72시간 배양 후, 세포를 채취하고, 용해시켜 세포 역가 백열 검정(Cell Titer Glow assay)을 사용하여 세포 생존력을 측정하였다.
표 5는 위에서 언급된 유방암 세포주에 대한 CB-03-06의 IC50을 나타낸다.
[표 5]
CB-03-06은 유방암 세포주 둘 다에 대하여 활성이지만, MDA-MB-231보다 MCF7 세포에서 더 활성인 것으로 보여, 아마도 GR이 이러한 화합물의 유일한 표적이 아님을 암시한다. RU486, 미페프리스톤(GR/PR 길항제)은 예상되는 바와 같이, GR+/- MCF7 세포의 생존력에 영향을 미치지 않는 한편, 매우 낮은 범위에서, 100μM에서 최대 25%까지의 TNBC GR+ MDA-MB-231 세포의 생존력을 억제한다.
흥미롭게도, CB-03-05는 MDA-MB-231에서가 아니라, MCF7에서만 활성이다. 이들 세포는 4개 이상의 수용체에 대하여 상이하기 때문에, 어느 수용체가 이러한 차별적 효과의 원인이 되는지 명확하지는 않다. GR이 아니라면, MCF7에서 발현되지만 MDA-MB-231에서는 발현되지 않는 HER2, ER(에스트로겐 수용체)(ER) 또는 PR(프로게스테론 수용체)일 수 있다.
일반 결론
이들 실시예는 특히 코르텍솔론 17-벤조에이트(CB-03-06)가 기타 공지된 코르텍솔론 유도된 화합물보다 우수한 활성을 가짐을 입증한다. 본 발명자들은 예를 들면, 다음 측면에서 시험관내 및 생체내 둘 다의 개선된 결과를 관찰하였다:
I) 일반적인 시험관내 항-종양 활성;
II) AR 발현과 직접 상호 연관되지 않는 시험관내 항-종양 활성;
III) II) GR 발현과 직접적으로 상호 연관되지 않는 시험관내 항-종양 활성;
IV) 치료 지수(TI); 및
V) 췌장 및 전립선 종양에 대한 생체내 항-종양 활성.
I) 코르텍솔론 유도된 화합물이 다양한 농도 및 IC50에서 암세포를 죽인다는 것이 아래 표 6에서 나타낸 데이터로부터 명백하다. 그러나, CB-03-06 및 CB-03-10은 상이한 기원의 암세포주에 걸쳐 코르텍솔론 유도된 계열내 기타 화합물과 비교시 최상의 IC50을 나타낸다. CB-03-10의 대사물 CB-03-05라도, LNCaP 전립선암 세포(IC50 32μM)에서 우수한 IC50 값을 나타낸다. 더 낮은 IC50이 더 강한 시험관내 항-종양 활성에 대해 나타난다.
[표 6]
II) 안드로겐 수용체(AR) 발현을 암 세포주에 대하여 시험하였다. 표 7 참조.
예상된 바와 같이, 강력한 항-안드로겐 CPA 및 엔잘루타마이드에 의하여 나타난 성장 억제는 전립선암 세포에서의 AR 발현과 상호 연관된다. 특히, CB-03-06 및 CB-03-10의 활성은 안드로겐 수용체와 독립적이다. CB-03-04는 LNCaP(안드로겐 수용체를 발현하는 전립선암 세포주)에서 시험시 46의 IC50을 나타내지만, 저 또는 무 AR을 발현하는 PC3에 대해 시험시 IC50은 훨씬 더 높다(135). CB-03-06 및 CB-03-10은 AR 발현과 거의 상관 없는 매우 우수한 IC50을 나타내었다. 동일한 거동이 췌장 세포주에서 관찰되었다.
[표 7]
III) 치료 지수(TI)(치료 창, 안전 창 또는 치료 비라고도 함)는 독성을 유발하는 양에 대한 치료 효과를 유발하는 치료제의 양의 비교이다. 화합물의 IC50은 사람 혈액으로부터 분리된 새로운 세포(PBMC)에 대하여 측정하였다. 화합물 독성은 다음과 같이 측정하였다:
치료 지수 = 안전성/효능 = IC 50 자극된 PBMC/ IC50 암세포
결과를 표 8에 나타낸다. 모든 코르텍솔론 유도된 화합물은 강한 안전 독성 프로파일을 나타낸다. 그러나, CB-03-06은 시험관내 시험된 모든 7개의 암 세포주에 걸쳐 시험시 최고 치료 지수를 나타내었다.
[표 8]
IV) 실시예 24에 나타낸 바와 같은 삼중 음성 유방암(TNBC). CB-03-06에 의하여 나타낸 세포독성 활성은, 통상적으로 기존 치료제가 삼중 음성 유방암(TNBC) 세포주에 작용하지 않기 때문에, 특히 인상적이다. TNBC는 ERBB2 증폭뿐만 아니라 에스트로겐 및 프로게스테론 수용체 발현의 부재로 정의된다. 이는 엔도크린 또는 항- ERBB2 요법에 대한 반응이 없다. 최근의 연구로 TNBC에 대한 일부 잠재적 치료 표적이 밝혀졌다. 그러나, 이는 여전히 불량한 결과를 갖는다. CB-03-06의 세포독성 활성 및 탁월한 안전성 프로파일을 고려하면; CB-03-06은 이러한 암의 임상 치료에 대한 신규하고 개선된 후보이다.
본 발명을 이제 다음의 번호를 매긴 양태로 설명한다:
1. 일 양태에서, 본 발명은 화학식 I의 화합물이다:
화학식 I
위의 화학식 I에서,
R은 수소 또는 C(O)-R1(여기서, R1은 탄소수 2 내지 5의 직쇄 알킬이다)이고,
R'은 탄소수 3 내지 6의 직쇄 알킬 또는 임의로 치환된 아릴 기 또는 임의로 치환된 헤테로아릴 기이다.
2. 또 다른 양태에서, 본 발명은 임의로 치환된 아릴 기가 페닐인 1항에 따르는 화학식 I의 화합물이다.
3. 또 다른 양태에서, 본 발명은 R1이 수소 또는 CH2CH3이고, R'이 -(CH2)3-CH3 또는 페닐인 1항에 따르는 화학식 I의 화합물이다.
4. 또 다른 양태에서, 본 발명은 화학식
의 1항에 따르는 화합물이다.
5. 또 다른 양태에서, 본 발명은 화학식
의 1항에 따르는 화합물이다.
6. 또 다른 양태에서, 본 발명은 의약으로서 사용하기 위한 1항 내지 5항 중의 어느 한 항에 따르는 화합물이다.
7. 또 다른 양태에서, 본 발명은 전암 병변, 이형성증, 화생 및 종양 질환의 치료에 사용하기 위한 1항 내지 5항 중의 어느 한 항에 따르는 화합물이다.
8. 또 다른 양태에서, 본 발명은 상기 종양 질환이 악성 신생물 및 전이를 포함함을 특징으로 하는, 7항에 따르는 용도를 위한 화합물이다.
9. 또 다른 양태에서, 본 발명은 상기 종양 질환이 고형 종양, 바람직하게는 상피성 종양, 예를 들면, 전립선 암종; 유방 암종; 췌장 암종; 폐 암종; 위장관 암종, 예를 들면, 결장 암종; 신장암; 갑상선 암종; 자궁 암종; 부신 암종임을 특징으로 하는, 8항에 따르는 용도를 위한 화합물이다.
10. 또 다른 양태에서, 본 발명은 상기 상피성 종양이 전립선 암종 또는 췌장 암종, 바람직하게는 외분비성 췌장 암종임을 특징으로 하는, 9항에 따르는 용도를 위한 화합물이다.
11. 또 다른 양태에서, 본 발명은 1항 내지 5항 중의 어느 한 항에 따르는 하나 이상의 화학식 I의 화합물을, 하나 이상의 생리학적으로 허용되는 부형제와 함께 포함하는 약제학적 조성물이다.
12. 또 다른 양태에서, 본 발명은 고체 또는 액체 형태임을 특징으로 하는, 11항에 따르는 약제학적 조성물이다.
13. 또 다른 양태에서, 본 발명은 산제, 냉동 건조 산제, 입제, 펠릿, 정제 또는 캡슐임을 특징으로 하는, 12항에 따르는 고체 형태의 약제학적 조성물이다.
14. 또 다른 양태에서, 본 발명은 용제, 에멀젼, 현탁제 또는 시럽임을 특징으로 하는, 12항에 따르는 액체 형태의 약제학적 조성물이다.
15. 또 다른 양태에서, 본 발명은 적어도 또 다른 활성 성분, 바람직하게는 화학요법 활성 성분을 동시, 개별 또는 순차 투여용 배합물로서 함유함을 특징으로 하는, 11항 내지 14항 중의 어느 한 항에 따르는 약제학적 조성물이다.
16. 또 다른 양태에서, 본 발명은 전암 병변, 이형성증, 화생 및 종양 질환의 치료에 사용하기 위한 11항 내지 15항에 따르는 약제학적 조성물이다.
17. 또 다른 양태에서, 본 발명은 상기 종양 질환이 악성 신생물 및 전이를 포함함을 특징으로 하는, 16항에 따르는 용도를 위한 약제학적 조성물이다.
18. 또 다른 양태에서, 본 발명은 상기 종양 질환이 고형 종양, 바람직하게는 상피성 종양, 예를 들면, 전립선 암종; 유방 암종; 췌장 암종; 폐 암종; 위장관 암종, 예를 들면, 결장 암종; 신장암; 갑상선 암종; 자궁 암종; 부신 암종임을 특징으로 하는, 17항에 따르는 용도를 위한 약제학적 조성물이다.
19. 또 다른 양태에서, 본 발명은 상기 상피성 종양이 전립선 암종 또는 췌장 암종, 바람직하게는 외분비성 췌장 암종임을 특징으로 하는, 18항에 따르는 용도를 위한 약제학적 조성물이다.
Claims (42)
- 제2항에 있어서,
상기 종양 질환이 악성 신생물 및 전이를 포함하는 화합물. - 제1항 내지 제3항 중의 어느 한 항에 있어서,
항종양제로서 사용하기 위한 화합물. - 제3항 또는 제4항에 있어서,
상기 종양 질환은,
고형 종양인 화합물. - 제5항에 있어서,
상기 고형 종양은,
상피성 종양인 화합물. - 제6항에 있어서,
상기 상피성 종양은,
전립선 암종; 유방 암종; 췌장 암종; 폐 암종; 위장관 암종, 예를 들면, 결장 암종; 신장암; 갑상선 암종; 자궁 암종; 및 부신 암종인 화합물. - 제6항 또는 제7항에 있어서,
상기 상피성 종양은,
전립선 암종이고, 바람직하게는 상기 전립선 암종이 엔잘루타마이드 등의 항-안드로겐 표적 요법에 저항성이거나 저항성이 되는 화합물. - 제6항 또는 제7항에 있어서,
상기 상피성 종양은,
췌장 암종, 바람직하게는 외분비성 췌장 암종인 화합물. - 제6항 또는 제7항에 있어서,
상기 상피성 종양은,
유방 암종인 화합물. - 제10항에 있어서,
상기 유방 암종은,
삼중 음성 유방암(triple negative breast cancer)인 화합물. - 제11항에 있어서,
피검체가 통상적인 요법에 재발되거나 무-반응자인 화합물. - 제6항 또는 제7항에 있어서,
상기 상피성 종양이 위장관 암종, 예를 들면, 결장 암종인 화합물. - 제15항 또는 제16항에 있어서,
동시, 개별 또는 순차 투여를 위한; 하나 이상의 기타 활성 성분, 바람직하게는 화학요법 활성 성분을; 임의로 배합물로서 포함하는 약제학적 조성물. - 제16항 또는 제17항에 있어서,
상기 종양 질환이 악성 신생물 및 전이를 포함하는 약제학적 조성물. - 제15항 내지 제18항 중의 어느 한 항에 있어서,
항종양제로서 사용하기 위한 약제학적 조성물. - 제16항 내지 제19항 중의 어느 한 항에 있어서,
상기 종양 질환은,
고형 종양, 바람직하게는 상피성 종양, 예를 들면, 전립선 암종; 유방 암종; 췌장 암종; 폐 암종; 위장관 암종, 예를 들면, 결장 암종; 신장암; 갑상선 암종; 자궁 암종; 또는 부신 암종인 약제학적 조성물. - 제20항에 있어서,
상기 상피성 종양은,
전립선 암종이고, 바람직하게는 상기 전립선 암종이 엔잘루타마이드 등의 항-안드로겐 표적 요법에 저항성이거나 저항성이 되는 약제학적 조성물. - 제20항에 있어서,
상기 상피성 종양은,
췌장 암종, 바람직하게는 외분비성 췌장 암종인 약제학적 조성물. - 제20항에 있어서,
상기 상피성 종양은,
유방 암종인 약제학적 조성물. - 제23항에 있어서,
상기 유방 암종은,
삼중 음성 유방암인 약제학적 조성물. - 제24항에 있어서,
피검체가 통상적인 요법에 재발되거나 무-반응자인 약제학적 조성물. - 제20항에 있어서,
상기 상피성 종양은,
위장관 암종, 예를 들면, 결장 암종인 약제학적 조성물. - 제27항에 있어서,
동시, 개별 또는 순차 투여를 위한; 하나 이상의 기타 활성 성분, 바람직하게는 화학요법 활성 성분을; 임의로 배합물로서 포함하는 약제학적 조성물. - 제29항에 있어서,
상기 종양 질환은,
악성 신생물 또는 전이인 방법. - 제29항에 있어서,
상기 피검체가 포유동물인 방법. - 제31항에 있어서,
상기 포유동물이 사람인 방법. - 제29항에 있어서,
상기 종양 질환이 고형 종양인 방법. - 제33항에 있어서,
상기 고형 종양이 상피성 종양인 방법. - 제34항에 있어서,
상기 상피성 종양은,
전립선 암종, 유방 암종, 자궁 암종, 췌장 암종, 폐 암종, 위장관 암종(바람직하게는 결장 암종), 신장암, 갑상선 암종 및 부신 암종 등인 방법. - 제35항에 있어서,
상기 상피성 종양은,
전립선 암종, 췌장 암종, 외분비성 췌장 암종, 위장관 암종(바람직하게는 결장 암종) 또는 유방 암종인 방법. - 제36항에 있어서,
상기 전립선 암종은,
엔잘루타마이드와 같은 항-안드로겐 표적 요법에 대하여 저항성이거나 저항성이 되는 방법. - 제36항에 있어서,
상기 췌장 암종이 외분비성 췌장 암종인 방법. - 제36항에 있어서,
상기 유방 암종이 삼중 음성 유방암인 방법. - 제39항에 있어서,
피검체가 통상적인 요법에 재발되거나 무-반응자인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP14188063.3 | 2014-10-08 | ||
| EP14188063.3A EP3006453A1 (en) | 2014-10-08 | 2014-10-08 | 17alpha-monoesters and 17alpha,21-diesters of cortexolone for use in the treatment of tumors |
| PCT/EP2015/073176 WO2016055537A1 (en) | 2014-10-08 | 2015-10-07 | Cortexolone 17alpha-benzoate for use in the treatment of tumours |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170063821A true KR20170063821A (ko) | 2017-06-08 |
Family
ID=51687868
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237011743A KR20230052990A (ko) | 2014-10-08 | 2015-10-07 | 종양 치료에 사용하기 위한 코르텍솔론의 17a,21-디에스테르 |
| KR1020177011114A KR102248983B1 (ko) | 2014-10-08 | 2015-10-07 | 종양 치료에 사용하기 위한 코르텍솔론의 17a,21-디에스테르 |
| KR1020217002286A KR102520411B1 (ko) | 2014-10-08 | 2015-10-07 | 종양 치료에 사용하기 위한 코르텍솔론의 17a,21-디에스테르 |
| KR1020177011239A KR20170063821A (ko) | 2014-10-08 | 2015-10-07 | 종양 치료에 사용하기 위한 코르텍솔론 17α-벤조에이트 |
Family Applications Before (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237011743A KR20230052990A (ko) | 2014-10-08 | 2015-10-07 | 종양 치료에 사용하기 위한 코르텍솔론의 17a,21-디에스테르 |
| KR1020177011114A KR102248983B1 (ko) | 2014-10-08 | 2015-10-07 | 종양 치료에 사용하기 위한 코르텍솔론의 17a,21-디에스테르 |
| KR1020217002286A KR102520411B1 (ko) | 2014-10-08 | 2015-10-07 | 종양 치료에 사용하기 위한 코르텍솔론의 17a,21-디에스테르 |
Country Status (23)
| Country | Link |
|---|---|
| US (7) | US10183030B2 (ko) |
| EP (4) | EP3006453A1 (ko) |
| JP (5) | JP6735739B2 (ko) |
| KR (4) | KR20230052990A (ko) |
| CN (5) | CN107001406B (ko) |
| AU (3) | AU2015329999B2 (ko) |
| BR (2) | BR112017007076B1 (ko) |
| CA (3) | CA2962746A1 (ko) |
| DK (2) | DK3204400T3 (ko) |
| ES (3) | ES2806094T3 (ko) |
| HR (2) | HRP20190194T1 (ko) |
| HU (2) | HUE041503T2 (ko) |
| IL (3) | IL272095B2 (ko) |
| LT (2) | LT3456330T (ko) |
| MX (3) | MX366294B (ko) |
| PL (2) | PL3456330T3 (ko) |
| PT (2) | PT3204400T (ko) |
| RS (2) | RS58607B1 (ko) |
| RU (3) | RU2712752C2 (ko) |
| SI (2) | SI3204400T1 (ko) |
| TR (1) | TR201901422T4 (ko) |
| WO (2) | WO2016055533A1 (ko) |
| ZA (2) | ZA201702209B (ko) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8859774B2 (en) | 2012-05-25 | 2014-10-14 | Corcept Therapeutics, Inc. | Heteroaryl-ketone fused azadecalin glucocorticoid receptor modulators |
| EP3006453A1 (en) | 2014-10-08 | 2016-04-13 | Cosmo Technologies Ltd. | 17alpha-monoesters and 17alpha,21-diesters of cortexolone for use in the treatment of tumors |
| US9943505B2 (en) | 2016-09-09 | 2018-04-17 | Corcept Therapeutics, Inc. | Glucocorticoid receptor modulators to treat pancreatic cancer |
| UA127409C2 (uk) | 2017-03-31 | 2023-08-16 | Корцепт Терап'Ютікс, Інк. | Модулятори глюкокортикоїдного рецептора для лікування раку шийки матки |
| CN113194931B (zh) | 2018-12-19 | 2023-11-10 | 科塞普特治疗公司 | 含有瑞拉可兰、杂芳基-酮稠合的氮杂十氢化萘化合物的药物制剂 |
| US11234971B2 (en) | 2018-12-19 | 2022-02-01 | Corcept Therapeutics Incorporated | Methods of treating cancer comprising administration of a glucocorticoid receptor modulator and a cancer chemotherapy agent |
| US11389432B2 (en) | 2018-12-19 | 2022-07-19 | Corcept Therapeutics Incorporated | Methods of treating cancer comprising administration of a glucocorticoid receptor modulator and a cancer chemotherapy agent |
| CN110698527B (zh) * | 2019-11-19 | 2022-08-26 | 湖南新合新生物医药有限公司 | 一种高纯度氢化可的松-17-戊酸酯的制备方法 |
| CN112028956A (zh) * | 2020-09-10 | 2020-12-04 | 那路新 | 合成21-羟基-17-(1-氧代丙氧基)孕甾-4-烯-3,20-二酮的方法 |
| CN114113603B (zh) * | 2021-06-30 | 2023-11-17 | 四川大学华西医院 | Cytl1作为胃癌预后标志物的应用 |
| WO2023088308A1 (zh) * | 2021-11-16 | 2023-05-25 | 石家庄迪斯凯威医药科技有限公司 | 一种具有抗耐药性的抗菌化合物 |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BE619180A (fr) * | 1961-06-24 | 1962-12-20 | Vismara Francesco Spa | 17-monoesters de 17 alpha, 21-dihydroxy stéroïdes et leur procédé de préparation |
| CH429716A (de) | 1961-06-24 | 1967-02-15 | Vismara Francesco Spa | Verfahren zur Herstellung von 17a-Acyloxy-21-hydroxy-Steroiden |
| NL6605514A (ko) * | 1966-04-25 | 1967-10-26 | ||
| EP0001737B1 (de) | 1977-10-26 | 1981-01-07 | Schering Aktiengesellschaft | 17-Alpha-(3-Jodbenzoyloxy)-9-Alpha-chlor-4-pregnen-3.20-dione, deren D-Homo-analoga und Verfahren zu ihrer Herstellung |
| DE2748442C3 (de) | 1977-10-26 | 1981-08-27 | Schering Ag Berlin Und Bergkamen, 1000 Berlin | 17α-(3-Jodbenzoyloxy)-9α -chlor4-pregnen-3.20-dione, Zwischenprodukte und Verfahren zu ihrer Herstellung, 9α -chlor-17α, 21-dihydroxy-1,4-pregnadien-3,20-dion und dieses enthaltende Arzneimittel |
| ATE12237T1 (de) * | 1980-12-23 | 1985-04-15 | Schering Ag | Neue 6-alpha-methylhydrocortison-derivate, ihre herstellung und verwendung. |
| DE3260474D1 (en) | 1981-02-02 | 1984-09-06 | Schering Corp | Aromatic heterocyclic esters of steroids, their preparation and pharmaceutical compositions containing them |
| US4920216A (en) * | 1987-05-28 | 1990-04-24 | The Trustees Of Columbia In The City Of New York | Selective chlorination of steroids and other substrates directed by covalently linked pyridine derivatives acting as templates |
| US5990099A (en) | 1988-10-31 | 1999-11-23 | Alcon Laboratories, Inc. | Angiostatic agents and methods and compositions for controlling ocular hypertension |
| ATE113959T1 (de) | 1989-02-07 | 1994-11-15 | Upjohn Co | Enthalogenierung organischer verbindungen unter verwendung von zinn oder blei. |
| DE4121484A1 (de) | 1991-06-26 | 1993-01-07 | Schering Ag | Verfahren zur herstellung von 6-methylensteroiden |
| US6172054B1 (en) | 1995-06-15 | 2001-01-09 | Alcon Laboratories, Inc. | Combination therapy for lowering and controlling intraocular pressure |
| AU3703900A (en) | 1999-02-24 | 2000-09-14 | Nitromed, Inc. | Nitrosated and nitrosylated steroids for the treatment of cardiovascular diseases and disorders |
| WO2000076478A1 (en) | 1999-06-14 | 2000-12-21 | Cosmo S.P.A. | Controlled release and taste masking oral pharmaceutical compositions |
| IT1314184B1 (it) | 1999-08-12 | 2002-12-06 | Nicox Sa | Composizioni farmaceutiche per la terapia di condizioni di stressossidativo |
| WO2002040030A1 (en) | 2000-11-16 | 2002-05-23 | Alcon Manufacturing, Ltd. | Combination therapy for lowering and controlling intraocular pressure |
| ITMI20011762A1 (it) * | 2001-08-10 | 2003-02-10 | Cosmo Spa | Esteri di 17alfa,21-diidrossipregnene, loro uso come agenti anti-androgenetici e procedimenti per la loro preparazione |
| ITMI20051695A1 (it) * | 2005-09-14 | 2007-03-15 | Cosmo Spa | Uso di 17a-esteri c3-c10 del 9,11-deidrocortexolone cme agenti anti-gonadotropinici |
| DE102006059063A1 (de) | 2005-12-24 | 2007-06-28 | Bayer Healthcare Ag | Verwendung von BAY 59-3074 zur Herstellung von Medikamenten zur Therapie von Hirntumoren sowie Kombinationen von BAY 59-3074 |
| US7687484B2 (en) | 2006-05-25 | 2010-03-30 | Bodor Nicholas S | Transporter enhanced corticosteroid activity |
| ITMI20071616A1 (it) | 2007-08-03 | 2009-02-04 | Cosmo Spa | Processo enzimatico per l'ottenimento di 17-alfa monoesteri del cortexolone e/o suoi 9,11-deidroderivati. |
| CN101397317A (zh) | 2007-09-27 | 2009-04-01 | 天津药业研究院有限公司 | 一种新型硝酸酯类甾体化合物 |
| CA2708149A1 (en) * | 2007-12-13 | 2009-06-18 | Novartis Ag | Combinations of therapeutic agents for treating cancer |
| US20090240049A1 (en) | 2008-03-18 | 2009-09-24 | Marco Villa | Purification of air sensitive steroids |
| EP3355057A3 (en) * | 2010-06-01 | 2018-12-12 | Metanomics Health GmbH | Means and methods for diagnosing pancreatic cancer in a subject |
| US20120245552A1 (en) * | 2011-03-23 | 2012-09-27 | Pop Test Cortisol Llc | Combination Therapy |
| RU2506974C1 (ru) | 2012-11-06 | 2014-02-20 | Федеральное государственное бюджетное учреждение "Ростовский научно-исследовательский онкологический институт" Министерства здравоохранения Российской Федерации | Способ лечения первично нерезектабельного рака легкого |
| JOP20200097A1 (ar) | 2013-01-15 | 2017-06-16 | Aragon Pharmaceuticals Inc | معدل مستقبل أندروجين واستخداماته |
| EP3006453A1 (en) * | 2014-10-08 | 2016-04-13 | Cosmo Technologies Ltd. | 17alpha-monoesters and 17alpha,21-diesters of cortexolone for use in the treatment of tumors |
-
2014
- 2014-10-08 EP EP14188063.3A patent/EP3006453A1/en not_active Withdrawn
-
2015
- 2015-10-07 CN CN201580060690.2A patent/CN107001406B/zh active Active
- 2015-10-07 BR BR112017007076-6A patent/BR112017007076B1/pt active IP Right Grant
- 2015-10-07 CA CA2962746A patent/CA2962746A1/en not_active Abandoned
- 2015-10-07 CN CN202211571443.7A patent/CN116102604A/zh active Pending
- 2015-10-07 EP EP15775455.7A patent/EP3204012B1/en active Active
- 2015-10-07 DK DK15778634.4T patent/DK3204400T3/en active
- 2015-10-07 RU RU2017115773A patent/RU2712752C2/ru active
- 2015-10-07 KR KR1020237011743A patent/KR20230052990A/ko not_active Application Discontinuation
- 2015-10-07 LT LTEP18198653.0T patent/LT3456330T/lt unknown
- 2015-10-07 CN CN202010134553.1A patent/CN111285913B/zh active Active
- 2015-10-07 US US15/517,653 patent/US10183030B2/en active Active
- 2015-10-07 HU HUE15778634A patent/HUE041503T2/hu unknown
- 2015-10-07 CA CA2960928A patent/CA2960928C/en active Active
- 2015-10-07 RS RS20190207A patent/RS58607B1/sr unknown
- 2015-10-07 US US15/517,659 patent/US10231980B2/en active Active
- 2015-10-07 PL PL18198653T patent/PL3456330T3/pl unknown
- 2015-10-07 CA CA3160391A patent/CA3160391A1/en active Pending
- 2015-10-07 JP JP2017518978A patent/JP6735739B2/ja active Active
- 2015-10-07 KR KR1020177011114A patent/KR102248983B1/ko active IP Right Grant
- 2015-10-07 PT PT15778634T patent/PT3204400T/pt unknown
- 2015-10-07 CN CN202211425819.3A patent/CN115671114A/zh active Pending
- 2015-10-07 BR BR112017007078A patent/BR112017007078A2/pt not_active Application Discontinuation
- 2015-10-07 RU RU2020102939A patent/RU2020102939A/ru unknown
- 2015-10-07 RU RU2017115771A patent/RU2712950C2/ru active
- 2015-10-07 PL PL15778634T patent/PL3204400T3/pl unknown
- 2015-10-07 SI SI201530614T patent/SI3204400T1/sl unknown
- 2015-10-07 HU HUE18198653A patent/HUE055143T2/hu unknown
- 2015-10-07 WO PCT/EP2015/073172 patent/WO2016055533A1/en active Application Filing
- 2015-10-07 EP EP15778634.4A patent/EP3204400B1/en active Active
- 2015-10-07 MX MX2017004660A patent/MX366294B/es active IP Right Grant
- 2015-10-07 RS RS20210928A patent/RS62147B1/sr unknown
- 2015-10-07 MX MX2017004661A patent/MX2017004661A/es unknown
- 2015-10-07 EP EP18198653.0A patent/EP3456330B1/en active Active
- 2015-10-07 AU AU2015329999A patent/AU2015329999B2/en active Active
- 2015-10-07 TR TR2019/01422T patent/TR201901422T4/tr unknown
- 2015-10-07 KR KR1020217002286A patent/KR102520411B1/ko active IP Right Grant
- 2015-10-07 CN CN201580060711.0A patent/CN107074905B/zh not_active Expired - Fee Related
- 2015-10-07 SI SI201531666T patent/SI3456330T1/sl unknown
- 2015-10-07 AU AU2015330003A patent/AU2015330003A1/en not_active Abandoned
- 2015-10-07 DK DK18198653.0T patent/DK3456330T3/da active
- 2015-10-07 PT PT181986530T patent/PT3456330T/pt unknown
- 2015-10-07 JP JP2017518340A patent/JP6503057B2/ja active Active
- 2015-10-07 WO PCT/EP2015/073176 patent/WO2016055537A1/en active Application Filing
- 2015-10-07 KR KR1020177011239A patent/KR20170063821A/ko unknown
- 2015-10-07 ES ES15775455T patent/ES2806094T3/es active Active
- 2015-10-07 LT LTEP15778634.4T patent/LT3204400T/lt unknown
- 2015-10-07 IL IL272095A patent/IL272095B2/en unknown
- 2015-10-07 ES ES15778634T patent/ES2713699T3/es active Active
- 2015-10-07 ES ES18198653T patent/ES2882223T3/es active Active
-
2017
- 2017-03-08 IL IL251028A patent/IL251028B/en active IP Right Grant
- 2017-03-23 IL IL251371A patent/IL251371A0/en unknown
- 2017-03-29 ZA ZA2017/02209A patent/ZA201702209B/en unknown
- 2017-04-07 MX MX2019008063A patent/MX2019008063A/es unknown
-
2018
- 2018-11-23 US US16/199,015 patent/US10646497B2/en active Active
-
2019
- 2019-01-17 JP JP2019006199A patent/JP7028809B2/ja active Active
- 2019-01-29 HR HRP20190194TT patent/HRP20190194T1/hr unknown
- 2019-02-12 US US16/273,575 patent/US20190175618A1/en not_active Abandoned
- 2019-04-12 ZA ZA2019/02320A patent/ZA201902320B/en unknown
-
2020
- 2020-02-27 AU AU2020201446A patent/AU2020201446B2/en active Active
- 2020-03-16 US US16/820,407 patent/US10993949B2/en active Active
- 2020-05-27 JP JP2020092411A patent/JP2020143140A/ja active Pending
- 2020-12-01 JP JP2020199555A patent/JP2021046418A/ja active Pending
-
2021
- 2021-04-06 US US17/223,776 patent/US11712443B2/en active Active
- 2021-07-22 HR HRP20211177TT patent/HRP20211177T1/hr unknown
-
2022
- 2022-12-19 US US18/068,346 patent/US20230128438A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102248983B1 (ko) | 종양 치료에 사용하기 위한 코르텍솔론의 17a,21-디에스테르 |