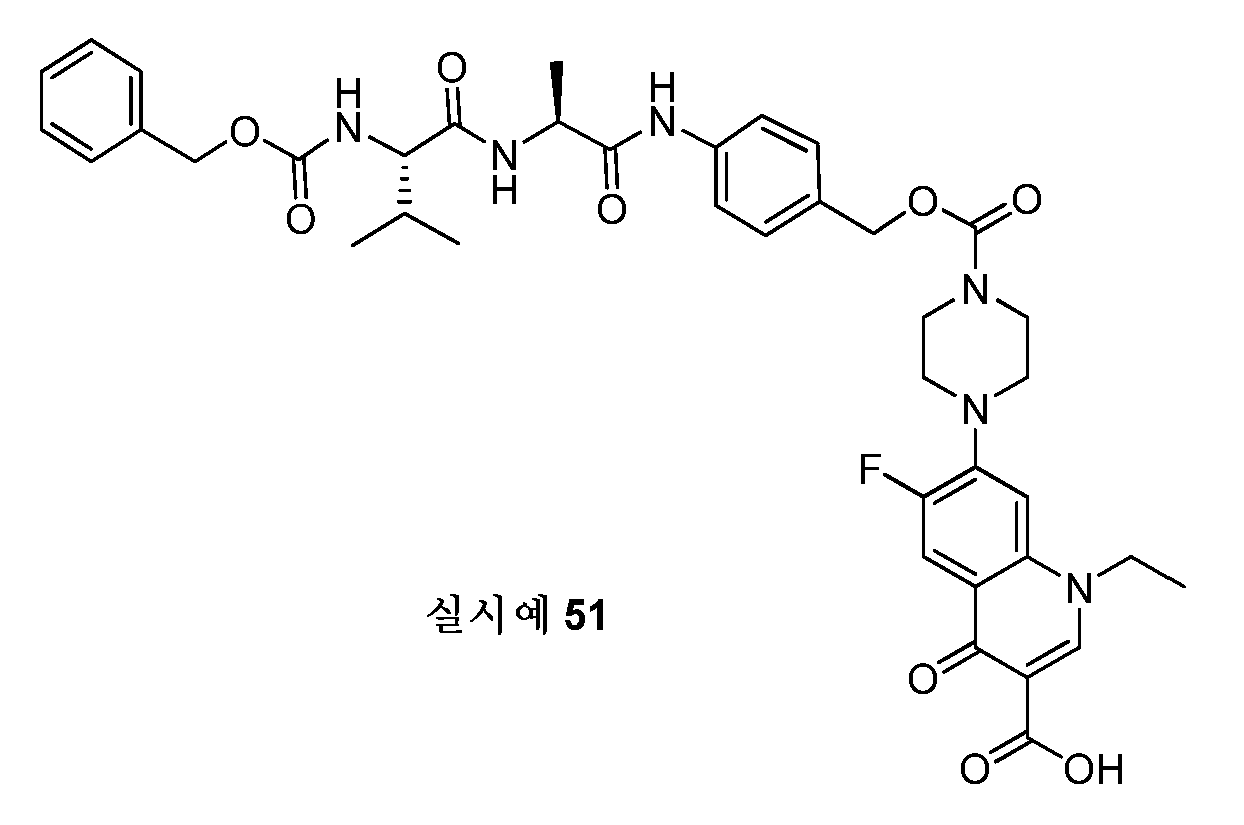
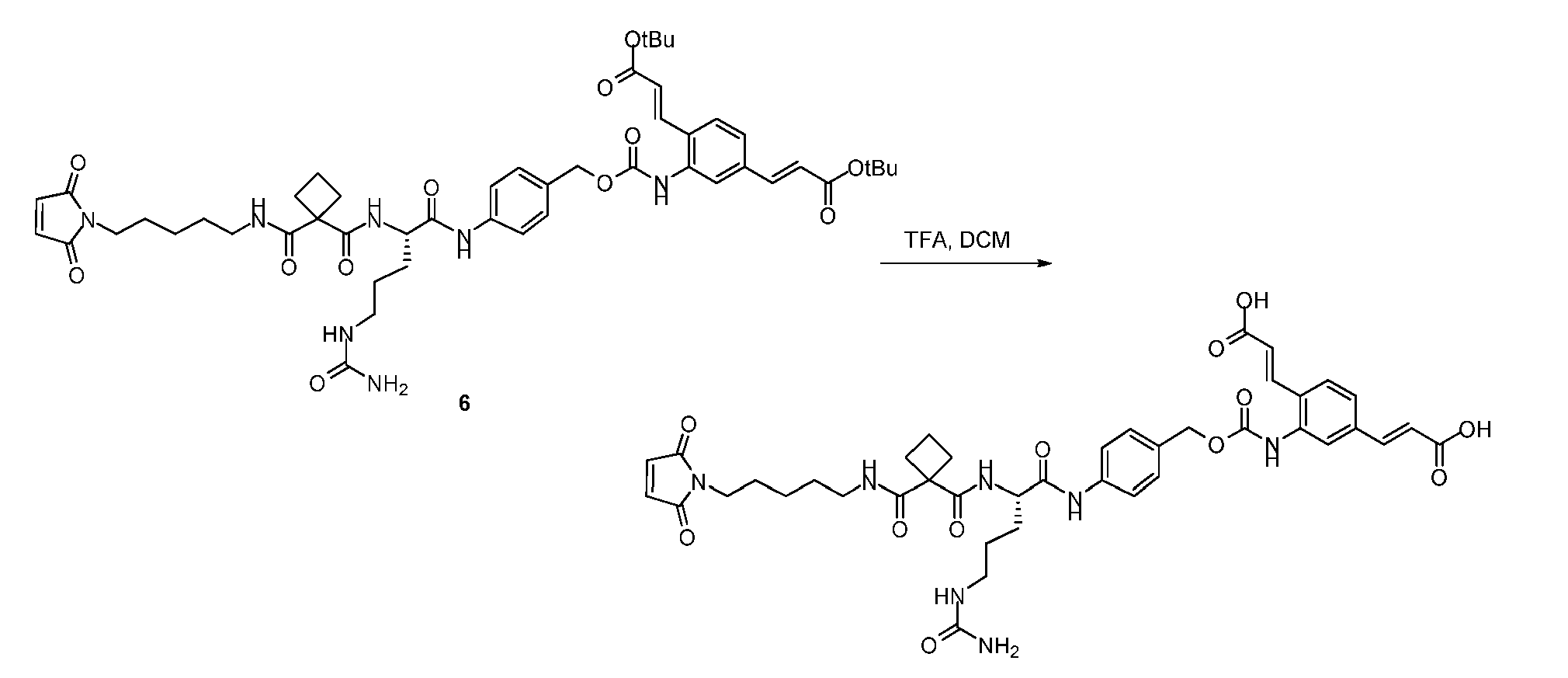
KR20170042495A - 펩티드모방체 화합물 및 그의 항체-약물 접합체 - Google Patents
펩티드모방체 화합물 및 그의 항체-약물 접합체 Download PDFInfo
- Publication number
- KR20170042495A KR20170042495A KR1020167019163A KR20167019163A KR20170042495A KR 20170042495 A KR20170042495 A KR 20170042495A KR 1020167019163 A KR1020167019163 A KR 1020167019163A KR 20167019163 A KR20167019163 A KR 20167019163A KR 20170042495 A KR20170042495 A KR 20170042495A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- alkyl
- alkylene
- formula
- mmol
- Prior art date
Links
- 0 C*N(C(CC1C)=O)C1=O Chemical compound C*N(C(CC1C)=O)C1=O 0.000 description 24
- QAWBREUIKKVFBW-FJUVWJEFSA-N CC(C)COC(/C=C/c1ccc(/C=C/C(OCC(C)C)=O)c(NC(CCNC([C@H](CCCNC(N)=O)NC(C2(CCC2)C(NCCCCCN(C(C=C2)=O)C2=O)=O)=O)=O)=O)c1)=O Chemical compound CC(C)COC(/C=C/c1ccc(/C=C/C(OCC(C)C)=O)c(NC(CCNC([C@H](CCCNC(N)=O)NC(C2(CCC2)C(NCCCCCN(C(C=C2)=O)C2=O)=O)=O)=O)=O)c1)=O QAWBREUIKKVFBW-FJUVWJEFSA-N 0.000 description 2
- HELAAOFYNISAPQ-HKVCBSCNSA-N CC(C)COC(/C=C/c1ccc(/C=C/C(OCC(C)C)=O)c(NC(CCNC([C@H](CCCNC(N)=O)NC(C2(CCC2)C(O)=O)=O)=O)=O)c1)=O Chemical compound CC(C)COC(/C=C/c1ccc(/C=C/C(OCC(C)C)=O)c(NC(CCNC([C@H](CCCNC(N)=O)NC(C2(CCC2)C(O)=O)=O)=O)=O)c1)=O HELAAOFYNISAPQ-HKVCBSCNSA-N 0.000 description 1
- HHRJREIQMLSZRP-HOCLYGCPSA-N CC(C)[C@@H](C(N=N1)=C[NH+]1[S-]=O)N(C)C[C@H](Cc1ccccc1)N=S=O Chemical compound CC(C)[C@@H](C(N=N1)=C[NH+]1[S-]=O)N(C)C[C@H](Cc1ccccc1)N=S=O HHRJREIQMLSZRP-HOCLYGCPSA-N 0.000 description 1
- VGNOVRFCCSUTEB-OALUTQOASA-N CC(C)[C@@H](c1c[n]([C@@H](CCCNC(N)=O)C(Nc2ccc(CO)cc2)=O)nn1)NC(C)=O Chemical compound CC(C)[C@@H](c1c[n]([C@@H](CCCNC(N)=O)C(Nc2ccc(CO)cc2)=O)nn1)NC(C)=O VGNOVRFCCSUTEB-OALUTQOASA-N 0.000 description 1
- PVRRZENZLXVUHV-RYUDHWBXSA-N CC(C)[C@@H](c1c[n]([C@@H](CCCNC(N)=O)C(O)=O)nn1)NC(C)=O Chemical compound CC(C)[C@@H](c1c[n]([C@@H](CCCNC(N)=O)C(O)=O)nn1)NC(C)=O PVRRZENZLXVUHV-RYUDHWBXSA-N 0.000 description 1
- BNMSQFKGKLNMQJ-QMMMGPOBSA-N CC(C)[C@H](C#C)NC(C)=O Chemical compound CC(C)[C@H](C#C)NC(C)=O BNMSQFKGKLNMQJ-QMMMGPOBSA-N 0.000 description 1
- PPMHNYXRYAGMKY-OTOKDRCRSA-N CC(C)[C@H](c1nnc(C(C)C(Nc2ccc(CO)cc2)=O)[o]1)NC(OCc1ccccc1)=O Chemical compound CC(C)[C@H](c1nnc(C(C)C(Nc2ccc(CO)cc2)=O)[o]1)NC(OCc1ccccc1)=O PPMHNYXRYAGMKY-OTOKDRCRSA-N 0.000 description 1
- XEYORFKUJZEQCH-UHFFFAOYSA-N CC(Nc1ccc(CO)cc1)=O Chemical compound CC(Nc1ccc(CO)cc1)=O XEYORFKUJZEQCH-UHFFFAOYSA-N 0.000 description 1
- BLUXDACWCTXYPG-ZJOZMMEXSA-N CCN(C=C(C(O)=O)C(c1c2)=O)c1cc(N(CC1)CCN1C(OCc(cc1)ccc1NC([C@H](CCCCN)[n]1nnc(C(Cc3ccc[s]3)NC(OCc3ccccc3)=O)c1)=O)=O)c2F Chemical compound CCN(C=C(C(O)=O)C(c1c2)=O)c1cc(N(CC1)CCN1C(OCc(cc1)ccc1NC([C@H](CCCCN)[n]1nnc(C(Cc3ccc[s]3)NC(OCc3ccccc3)=O)c1)=O)=O)c2F BLUXDACWCTXYPG-ZJOZMMEXSA-N 0.000 description 1
- RHOOOCDLECRSIZ-YJNPBZNESA-N CCN(C=C(C(O)=O)C(c1c2)=O)c1cc(N(CC1)CCN1C(OCc(cc1)ccc1NC([C@H](CCCNC(N)=O)NC(C1(CCC1)C(N[C@H](C)c1ccccc1)=O)=O)=O)=O)c2F Chemical compound CCN(C=C(C(O)=O)C(c1c2)=O)c1cc(N(CC1)CCN1C(OCc(cc1)ccc1NC([C@H](CCCNC(N)=O)NC(C1(CCC1)C(N[C@H](C)c1ccccc1)=O)=O)=O)=O)c2F RHOOOCDLECRSIZ-YJNPBZNESA-N 0.000 description 1
- GTJAAYAUJIMTMX-DITALETJSA-N CCN(C=C(C(O)=O)C(c1c2)=O)c1cc(N(CC1)CCN1C(OCc(cc1)ccc1NC([C@H](CCCNC(N)=O)[n]1nnc([C@H](C(C)C)NC(C)=O)c1)=O)=O)c2F Chemical compound CCN(C=C(C(O)=O)C(c1c2)=O)c1cc(N(CC1)CCN1C(OCc(cc1)ccc1NC([C@H](CCCNC(N)=O)[n]1nnc([C@H](C(C)C)NC(C)=O)c1)=O)=O)c2F GTJAAYAUJIMTMX-DITALETJSA-N 0.000 description 1
- HYYDTBIZQAXAMB-MPXPTZKZSA-N CCN(C=C1C(O)=O)C(CC(C)(C(F)=C2)N(CC3)CCN3C(OCc(cc3)ccc3NC([S-](CCCCNC(N)=O)[NH+]3N=NC([C@@H](Cc4c(C[C@H](C(NC[SiH3])=O)NC(CCCCCN(C(CC5)=O)C5=O)=O)cccc4)C(C)C)=C3)=O)=O)=C2C1=O Chemical compound CCN(C=C1C(O)=O)C(CC(C)(C(F)=C2)N(CC3)CCN3C(OCc(cc3)ccc3NC([S-](CCCCNC(N)=O)[NH+]3N=NC([C@@H](Cc4c(C[C@H](C(NC[SiH3])=O)NC(CCCCCN(C(CC5)=O)C5=O)=O)cccc4)C(C)C)=C3)=O)=O)=C2C1=O HYYDTBIZQAXAMB-MPXPTZKZSA-N 0.000 description 1
- JOWDVIBQVOQIQX-NCJJPXCVSA-N CCN(C=C1C(O)=O)c(cc(c(F)c2)N(CC3)CCN3C(OCc(cc3)ccc3NC(C(C)c3nnc([C@H](C(C)C)NC(OCc4ccccc4)=O)[nH]3)=O)=O)c2C1=O Chemical compound CCN(C=C1C(O)=O)c(cc(c(F)c2)N(CC3)CCN3C(OCc(cc3)ccc3NC(C(C)c3nnc([C@H](C(C)C)NC(OCc4ccccc4)=O)[nH]3)=O)=O)c2C1=O JOWDVIBQVOQIQX-NCJJPXCVSA-N 0.000 description 1
- MEPNGIUXUWKKDZ-HXOSKORISA-N CCN(C=C1C(O)=O)c(cc(c(F)c2)N(CC3)CCN3C(OCc(cc3)ccc3NC([C@H](CCCNC(N)=O)[n]3nnc([C@H](C(C)C)NC(CCCCCN(C(C=C4)=O)C4=O)=O)c3)=O)=O)c2C1=O Chemical compound CCN(C=C1C(O)=O)c(cc(c(F)c2)N(CC3)CCN3C(OCc(cc3)ccc3NC([C@H](CCCNC(N)=O)[n]3nnc([C@H](C(C)C)NC(CCCCCN(C(C=C4)=O)C4=O)=O)c3)=O)=O)c2C1=O MEPNGIUXUWKKDZ-HXOSKORISA-N 0.000 description 1
- QMIQUXGVWLIOTM-VIFPVBQESA-N CCOC(C1(CCC1)C(N[C@@H](CCCNC(N)=O)C(O)=O)=O)=O Chemical compound CCOC(C1(CCC1)C(N[C@@H](CCCNC(N)=O)C(O)=O)=O)=O QMIQUXGVWLIOTM-VIFPVBQESA-N 0.000 description 1
- FBPVILDJPZUMSU-UHFFFAOYSA-N CN(C(CC1)=O)/C1=[O]/I Chemical compound CN(C(CC1)=O)/C1=[O]/I FBPVILDJPZUMSU-UHFFFAOYSA-N 0.000 description 1
- KYEACNNYFNZCST-UHFFFAOYSA-N CN(C(CC1)=O)C1=O Chemical compound CN(C(CC1)=O)C1=O KYEACNNYFNZCST-UHFFFAOYSA-N 0.000 description 1
- MNTKEEYFTXZSSU-LURJTMIESA-N CNC([C@H](CCCNC(N)=O)N(C)N)=O Chemical compound CNC([C@H](CCCNC(N)=O)N(C)N)=O MNTKEEYFTXZSSU-LURJTMIESA-N 0.000 description 1
- MPKDWEOIUWKIJP-UHFFFAOYSA-N COc(cc(c(N=CC1N2CCC1)c1)C2=O)c1OC Chemical compound COc(cc(c(N=CC1N2CCC1)c1)C2=O)c1OC MPKDWEOIUWKIJP-UHFFFAOYSA-N 0.000 description 1
- RFNZRMBSXGFPNK-XBNZZVMDSA-N NC(NCCC[C@@H](C(NCCC(Nc1cc(/C=C/C(O)=O)ccc1/C=C/C(O)=O)=O)=O)NC(C1(CCC1)C(NCCCCCN(C(C=C1)=O)C1=O)=O)=O)=O Chemical compound NC(NCCC[C@@H](C(NCCC(Nc1cc(/C=C/C(O)=O)ccc1/C=C/C(O)=O)=O)=O)NC(C1(CCC1)C(NCCCCCN(C(C=C1)=O)C1=O)=O)=O)=O RFNZRMBSXGFPNK-XBNZZVMDSA-N 0.000 description 1
- AHLAQJXELUHIEW-UHFFFAOYSA-N NCCCCCN(C(C=C1)=O)C1=O Chemical compound NCCCCCN(C(C=C1)=O)C1=O AHLAQJXELUHIEW-UHFFFAOYSA-N 0.000 description 1
- RHGKLRLOHDJJDR-BYPYZUCNSA-N N[C@@H](CCCNC(N)=O)C(O)=O Chemical compound N[C@@H](CCCNC(N)=O)C(O)=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-MRVPVSSYSA-N N[C@H](Cc1ccccc1)C(O)=O Chemical compound N[C@H](Cc1ccccc1)C(O)=O COLNVLDHVKWLRT-MRVPVSSYSA-N 0.000 description 1
- AXKGIPZJYUNAIW-UHFFFAOYSA-N Nc1ccc(CO)cc1 Chemical compound Nc1ccc(CO)cc1 AXKGIPZJYUNAIW-UHFFFAOYSA-N 0.000 description 1
- DLRBIDBYCGAORF-UHFFFAOYSA-N O=C(CCCCCN(C(CC1)=O)C1=O)ON(C(CC1)=O)C1=O Chemical compound O=C(CCCCCN(C(CC1)=O)C1=O)ON(C(CC1)=O)C1=O DLRBIDBYCGAORF-UHFFFAOYSA-N 0.000 description 1
- SMTZQLLWTRHIMG-QGZVFWFLSA-N OC([C@H](CCC(CCCCCN(C(CC1)=O)C1=O)=O)Cc1ccccc1)=O Chemical compound OC([C@H](CCC(CCCCCN(C(CC1)=O)C1=O)=O)Cc1ccccc1)=O SMTZQLLWTRHIMG-QGZVFWFLSA-N 0.000 description 1
- LOVPHSMOAVXQIH-UHFFFAOYSA-N [O-][N+](c(cc1)ccc1OC(O)=O)=O Chemical compound [O-][N+](c(cc1)ccc1OC(O)=O)=O LOVPHSMOAVXQIH-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6889—Conjugates wherein the antibody being the modifying agent and wherein the linker, binder or spacer confers particular properties to the conjugates, e.g. peptidic enzyme-labile linkers or acid-labile linkers, providing for an acid-labile immuno conjugate wherein the drug may be released from its antibody conjugated part in an acidic, e.g. tumoural or environment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A61K47/48715—
-
- A61K47/48384—
-
- A61K47/48569—
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2851—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the lectin superfamily, e.g. CD23, CD72
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Abstract
본 발명은 펩티드모방체 링커 및 그의 항체-약물 접합체, 그를 함유하는 제약 조성물, 및 암의 예방 또는 치료를 위한 요법에서의 그의 용도에 관한 것이다.
Description
관련 출원에 대한 상호 참조
37 CFR §1.53(b) 하에 출원된 본 비-가출원은 2013년 12월 16일에 출원된 미국 가출원 일련 번호 61/916,661 및 2013년 12월 16일에 출원된 미국 가출원 일련 번호 61/916,691의 35 USC §119(e) 하의 이익을 청구하며, 이들 모두는 그 전문이 본원에 참조로 포함된다.
서열 목록
본 출원은 ASCII 포맷으로 전자 제출되고 그 전문이 본원에 참조로 포함되는 서열 목록을 함유한다. 2014년 12월 12일에 작성된 상기 ASCII 사본은 P5760PCT_SL.txt로 명명되고, 35,047 바이트 크기이다.
발명의 분야
본 발명은 항체-약물 접합체 (ADC)의 링커로서 유용한 신규 펩티드모방체 화합물에 관한 것이다. 본 발명은 또한 펩티드모방체 링커를 포함하는 ADC에 관한 것이다. 본 발명은 또한 인간에서 질환을 치료하는 방법에 관한 것이다.
항암 약물을 종양 세포로 직접적으로 전달하기 위한 모노클로날 항체 (mAB)의 사용은 최근 수년간 상당한 관심을 끌어 왔다. 2종의 신규 항체-약물 접합체가 암의 치료에 대해 FDA에 의해 승인받았다. 아드세트리스(Adcetris)® (브렌툭시맙 베도틴)는 재발성 또는 불응성 호지킨 림프종 및 전신 역형성 대세포 림프종 (ALCL)의 치료에 지시되는 CD30-지시된 항체-약물 접합체 (ADC)이다. 카드실라(Kadcyla)® (아도-트라스투주맙 엠탄신)는 HER2-양성, 말기 (전이성) 유방암을 갖는 환자에 대해 승인된 신규 요법이다. 강력한 치료 항종양 활성 및 ADC에서 허용되는 치료 지수 둘 다를 얻기 위해, 설계의 여러 측면이 최적화될 수 있다. 특히, 링커의 화학 구조가 ADC의 효능 및 안전성 둘 다에 유의한 영향을 미칠 수 있는 것으로 널리 공지되어 있다 (Ducry & Stump, Bioconjugate Chem, 2010, 21, 5-13). 올바른 링커를 선택하는 것은 암 세포의 의도된 세포 구획으로의 적절한 약물 전달에 영향을 미친다. 링커는 일반적으로 2개의 카테고리로 분류될 수 있다: 절단가능 (예컨대 펩티드, 히드라존 또는 디술피드) 또는 비-절단가능 (예컨대 티오에테르). 리소솜 효소 (예컨대 카텝신 B)에 의해 가수분해될 수 있는 펩티드 링커, 예컨대 발린-시트룰린 (Val-Cit)이 약물과 항체를 연결하는데 사용된 바 있다 (US6214345). 이들은, 부분적으로 그의 체순환에서의 상대 안정성 및 종양에서 약물을 효율적으로 방출하는 능력으로 인해 특히 유용하다. Val-Cit 링커를 함유하는 ADC는 생체내에서 상대적으로 안정한 것으로 제시된 바 있다 (약물 방출에 대한 t1/2 ~7일) (Doronina et al. (2008), Bioconjugate Chem., 19, 1960-1963). 그러나, 천연 펩티드에 의해 나타나는 화학적 공간은 제한되고; 따라서, 펩티드와 유사하게 작용하며 리소솜 프로테아제에 의해 효과적으로 절단될 수 있는 다양한 비-펩티드 링커를 갖는 것이 바람직하다. 비-펩티드 구조의 보다 큰 다양성은 펩티드 링커에 의해 제공되지 되지 않는 유익한 신규 특성을 제공할 수 있다. 리소솜 효소에 의해 절단될 수 있는 ADC에 대한 상이한 유형의 비-펩티드 링커가 본원에 제공된다.
본 발명은 화학식 (I)에 의해 나타내어지는 항체-약물 접합체에 관한 것이다.
<화학식 (I)>
Ab는 항체이고;
L은 하기 화학식에 의해 나타내어지는 펩티드모방체 링커이고,
여기서
Str은 Ab에 공유 부착된 스트레쳐 단위이고;
Sp는 결합 또는 약물 모이어티에 공유 부착된 스페이서 단위이고;
PM은
로 이루어진 군으로부터 선택된 비-펩티드 화학적 모이어티이고;
W는 -NH-헤테로시클로알킬- 또는 헤테로시클로알킬이고;
Y는 헤테로아릴, 아릴, -C(O)C1-C6알킬렌, C1-C6알킬렌-NH2, C1-C6알킬렌-NH-CH3, C1-C6알킬렌-N-(CH3)2, C1-C6알케닐 또는 C1-C6알킬레닐이고;
각각의 R1은 독립적으로 C1-C10알킬, C1-C10알케닐, (C1-C10알킬)NHC(NH)NH2 또는 (C1-C10알킬)NHC(O)NH2이고;
R3 및 R2는 각각 독립적으로 H이고, C1-C10알킬, C1-C10알케닐, 아릴알킬 또는 헤테로아릴알킬이거나, 또는 R3과 R2는 함께 C3-C7시클로알킬을 형성할 수 있고;
R4 및 R5는 각각 독립적으로 C1-C10알킬, C1-C10알케닐, 아릴알킬, 헤테로아릴알킬, (C1-C10알킬)OCH2-이거나, 또는 R4와 R5는 C3-C7시클로알킬 고리를 형성할 수 있고;
p는 1 내지 8의 정수이고;
D는 약물 모이어티이다.
본 발명은 또한 화학식 (I)의 항체-약물 접합체의 제약 조성물에 관한 것이다.
본 발명은 또한 암을 치료하는 방법, 요법에서의 화학식 (I)의 항체-약물 접합체의 용도, 및 암을 치료하기 위한 의약의 제조에서의 화학식 (I)의 화합물의 용도에 관한 것이다.
본 발명은 또한 화학식 (I)의 항체-약물 접합체를 제조하는 방법에 관한 것이다.
도 1은 HL-60 인간 급성 골수성 백혈병 종양을 갖는 SCID 마우스에서의 CD33 ADC (CD33 CBI-PBD ADC3-2 및 ADC2-2)의 효능 비교를 제시한다.
도 2는 OVCAR3X2.1 인간 난소 종양을 갖는 SCID-베이지색 마우스에서의 NaPi2b ADC (NaPi2b CBI-PBD ADC2-1 및 ADC3-1)의 효능 비교를 제시한다.
도 2는 OVCAR3X2.1 인간 난소 종양을 갖는 SCID-베이지색 마우스에서의 NaPi2b ADC (NaPi2b CBI-PBD ADC2-1 및 ADC3-1)의 효능 비교를 제시한다.
리소솜 효소에 의해 절단가능한 ADC를 위한 상이한 유형의 비-펩티드 링커가 본원에 제공된다. 예를 들어, 디펩티드 (예를 들어, Val-Cit)의 중간에서의 아미드 결합은 아미드 모방체로 대체되고/거나; 전체 아미노산 (예를 들어, Val-Cit 디펩티드 내 발린 아미노산)은 비-아미노산 모이어티 (예를 들어, 시클로알킬 디카르보닐 구조 (예를 들어, 고리 크기 = 4 또는 5))로 대체되었다.
본 발명은 화학식 (I)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 Y가 헤테로아릴이고; R4와 R5가 함께 시클로부틸 고리를 형성하는 것인 화학식 (I)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 Y가
로 이루어진 군으로부터 선택된 모이어티인 화학식 (I)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한
Str이 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
여기서 R6은 C1-C10알킬렌, C1-C10알케닐, C3-C8시클로알킬, (C1-C8알킬렌)O- 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬, 아릴, 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고, 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고; Sp가 -Ar-Rb-이고, 여기서 Ar은 아릴 또는 헤테로아릴이고, Rb는 (C1-C10알킬렌)O-인
화학식 (I)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 Str이 하기 화학식을 갖고,
여기서 R7은 C1-C10알킬렌, C1-C10알케닐, (C1-C10알킬렌)O-, N(Rc)-(C2-C6 알킬렌)-N(Rc) 및 N(Rc)-(C2-C6알킬렌)으로부터 선택되고; 여기서 각각의 Rc는 독립적으로 H 또는 C1-C6 알킬이고; Sp가 -Ar-Rb-이고, 여기서 Ar은 아릴 또는 헤테로아릴이고, Rb는 (C1-C10알킬렌)O- 또는 Sp -C1-C6알킬렌-C(O)NH-인
화학식 (I)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한
Ab가 항체이고; L이 하기 화학식에 의해 나타내어지는 비-펩티드 화학적 모이어티이고,
R1은 C1-C6알킬, C1-C6알케닐, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
R3 및 R2는 각각 독립적으로 H 또는 C1-C10알킬인
화학식 (I)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한
Ab가 항체이고;
L이 하기 화학식에 의해 나타내어지는 비-펩티드 화학적 모이어티이고,
R1은 C1-C6알킬, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
R4와 R5는 함께 C3-C7시클로알킬 고리를 형성하는 것인
화학식 (I)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한
Ab가 항체이고;
L이 하기 화학식에 의해 나타내어지는 비-펩티드 화학적 모이어티이고,
R1은 C1-C6알킬, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2인
화학식 (I)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(A1)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(A1)>
여기서
Str은 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
여기서 R6은 C1-C10알킬렌 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌으로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬, 아릴, 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고, 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고;
p는 1, 2, 3 또는 4이다.
본 발명은 또한 하기 화학식 (I)(B1)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(B1)>
여기서
Str은 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
여기서 R6은 C1-C10알킬렌 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌으로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬, 아릴, 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고, 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고;
p는 1, 2, 3 또는 4이다.
본 발명은 또한 하기 화학식 (I)(C1)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(C1)>
여기서
Str은 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
여기서 R6은 C1-C10알킬렌 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌으로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬, 아릴, 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고, 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고;
p는 1, 2, 3 또는 4이다.
본 발명은 또한 Y가 헤테로아릴, 아릴 또는 알케닐이고; R6이 C1-C10알킬렌인 상기 항체 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 Y가
상기 항체 접합체 (I) 및 (I)(A1) 중 어느 하나에 관한 것이다.
본 발명은 또한 Y가
상기 항체 접합체 (I) 및 (I)(A1) 중 어느 하나에 관한 것이다.
본 발명은 또한 Y가
상기 항체 접합체 (I) 및 (I)(A1) 중 어느 하나에 관한 것이다.
본 발명은 또한
Str이 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
R6은 아릴 및 헤테로아릴로부터 선택된 1-3개의 기로 치환될 수 있는 C1-C6알킬렌이고;
Sp가 -C1-C6알킬렌-C(O)NH- 또는 -Ar-Rb-이고, 여기서 Ar은 아릴이고, Rb는 (C1-C3알킬렌)O-인
상기 항체 접합체 (I)(A1), (I)(B1) 및 (I)(C1) 중 어느 하나에 관한 것이다.
본 발명은 또한
Str이 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
R6은 아릴 및 헤테로아릴로부터 선택된 1-3개의 기로 치환될 수 있는 C1-C6알킬렌이고;
Sp가 -C1-C6알킬렌-C(O)NH-인
상기 항체 접합체 (I)(A1), (I)(B1) 및 (I)(C1) 중 어느 하나에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(A2)에 의해 나타내어지는 상기 항체 접합체 (I) 및 (I)(A1) 중 어느 하나에 관한 것이다.
<화학식 (I)(A2)>
여기서
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
p는 1, 2, 3 또는 4이다.
본 발명은 또한 하기 화학식 (I)(B2)에 의해 나타내어지는 상기 항체 접합체 (I) 및 (I)(B1) 중 어느 하나에 관한 것이다.
<화학식 (I)(B2)>
여기서
p는 1, 2, 3 또는 4이고;
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
R4 및 R5는 각각 독립적으로 C1-C6알킬이고, 여기서 상기 알킬은 비치환되거나, 또는 R4와 R5는 C3-C7시클로알킬 고리를 형성할 수 있다.
본 발명은 또한 하기 화학식 (I)(C2)에 의해 나타내어지는 상기 항체 접합체 (I) 및 (I)(C1) 중 어느 하나에 관한 것이다.
<화학식 (I)(C2)>
여기서
p는 1, 2, 3 또는 4이고;
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이다.
본 발명은 또한 하기 화학식 (I)(B3)에 의해 나타내어지는 (I)의 항체 접합체에 관한 것이다.
<화학식 (I)(B3)>
여기서
p는 1, 2, 3 또는 4이고;
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이다.
본 발명은 또한
Str이 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
R6은 아릴 및 헤테로아릴로부터 선택된 1-3개의 기로 치환될 수 있는 C1-C6알킬렌인
(I)(B3)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 R1이 (CH2)3NHC(O)NH2인 (I)(B3)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 R1이 (CH2)4NH2인 (I)(B3)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 R1이 (C1-C6알킬)NHC(NH)NH2인 (I), (I)(B1), (I)(B2) 및 (I)(B3)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 D가 하기 화학식을 갖는 이량체 약물 모이어티이고,
여기서
R11은 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
R22는 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
Raa 및 Rbb는 독립적으로 H, 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나,
또는 Raa와 Rbb는 5 또는 6원 헤테로시클로알킬 기를 형성하고;
T는 C3-C12알킬렌, Y1, (C1-C6알킬렌)-Y1-(C1-C6 알킬렌), (C1-C6알킬렌)-Y1-(C1-C6알킬렌)-Y1-(C1-C6알킬렌), (C2-C6알케닐렌)-Y1-(C2-C6알케닐렌) 및 (C2-C6알키닐렌)-Y1-(C2-C6알키닐렌)으로부터 선택된 테더 기이고;
여기서 Y1는 독립적으로 O, S, NR11, 아릴 및 헤테로아릴로부터 선택되고;
여기서 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 F, OH, O(C1-C6알킬), NH2, NHCH3, N(CH3)2, NHC(O)(C1-C6알킬렌)m, OP(O)3H2, 및 C1-C6알킬로 독립적으로 및 임의로 치환되고, 여기서 알킬은 1개 이상의 F로 임의로 치환되고, m은 0 또는 1이고;
또는 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 L에 대한 결합으로 독립적으로 및 임의로 치환되고, 여기서 L에 대한 결합은 임의적인 치환기 중 1개를 통해 연결될 수 있고;
D'는
로부터 선택된 약물 모이어티이고,
여기서 파상선은 T에 대한 부착 부위를 나타내고;
X1 및 X2는 독립적으로 O 및 NR33으로부터 선택되고, 여기서 R33은 H, C(O), 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나, 또는 X1 및 X2는 각각 독립적으로 부재하고;
R44는 H, CO2R, C(O), 또는 L에 대한 결합이고, 여기서 R은 C1-C6알킬 또는 벤질이고;
R55는 H 또는 C1-C6알킬인
상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(B4)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(B4)>
여기서,
Ab는 Her2, CLL1, CD33, CD22 및 NaPi2b로부터 선택된 표적에 결합하는 항체이고;
p는 1-4이고;
D는
X1은 부재하거나 또는 O이고;
R11은 C(O)N-피페라진(CH3) 또는 P(O)3H2이다.
본 발명은 또한 하기 화학식 (I)(B5)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(B5)>
여기서,
Ab는 Her2, CLL1, CD33, CD22 및 NaPi2b로부터 선택된 표적에 결합하는 항체이고;
p는 1-4이고;
D는
X1은 부재하거나 또는 O이고;
R11은 C(O)N-피페라진(CH3) 또는 P(O)3H2이다.
본 발명은 또한 하기 화학식 (I)(B6)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(B6)>
여기서,
Ab는 Her2, CLL1, CD33, CD22 및 NaPi2b로부터 선택된 표적에 결합하는 항체이고;
p는 1-4이고;
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
R20은 H 또는 Me이다.
본 발명은 또한
R20이 H이고, R1이 (CH2)4NH2인
화학식 (I)(B6)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한
R20이 Me이고, R1이 (CH2)4NH2인
화학식 (I)(B6)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(B7)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(B7)>
여기서,
Ab는 Her2, CLL1, CD33, CD22 및 NaPi2b로부터 선택된 표적에 결합하는 항체이고;
p는 1-4이고;
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
R20은 H 또는 Me이다.
본 발명은 또한
R20이 H이고, R1이 (CH2)4NH2인
화학식 (I)(B7)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한
R20이 Me이고, R1이 (CH2)4NH2인
화학식 (I)(B7)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(B8)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(B8)>
여기서,
Ab는 Her2, CLL1, CD33, CD22 및 NaPi2b로부터 선택된 표적에 결합하는 항체이고;
P는 1-4이고;
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이다.
본 발명은 또한
R1이 (CH2)4NH2인
화학식 (I)(B8)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(B9)에 의해 나타내어지는 화학식 (I)의 항체-약물 접합체에 관한 것이다.
<화학식 (I)(B9)>
여기서,
Ab는 Her2, CLL1, CD33, CD22 및 NaPi2b로부터 선택된 표적에 결합하는 항체이고;
P는 1-4이고;
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
X1 및 X2는 각각 독립적으로 부재하거나 또는 O이고;
각각의 R11은 독립적으로 C(O)N-피페라진(CH3) 또는 P(O)3H2이다.
본 발명은 또한
X1이 부재하고, R11이 P(O)3H2이고, R1이 (CH2)4NH2인
화학식 (I)(B9)의 항체-약물 접합체에 관한 것이다.
본 발명은 또한 Ab가 Her2에 결합하는 항체인 화학식 (I)(B6), (I)(B7), (I)(B8) 및 (I)(B9)의 상기 항체-약물 접합체 중 어느 것에 관한 것이다.
본 발명은 또한 Ab가 CLL1에 결합하는 항체인 화학식 (I)(B6), (I)(B7), (I)(B8) 및 (I)(B9)의 상기 항체-약물 접합체 중 어느 것에 관한 것이다.
본 발명은 또한 Ab가 CD33에 결합하는 항체인 화학식 (I)(B6), (I)(B7), (I)(B8) 및 (I)(B9)의 상기 항체-약물 접합체 중 어느 것에 관한 것이다.
본 발명은 또한 Ab가 CD22에 결합하는 항체이 화학식 (I)(B6), (I)(B7), (I)(B8) 및 (I)(B9)의 상기 항체-약물 접합체 중 어느 것에 관한 것이다.
본 발명은 또한 Ab가 NaPi2b에 결합하는 항체인 화학식 (I)(B6), (I)(B7), (I)(B8) 및 (I)(B9)의 상기 항체-약물 접합체 중 어느 것에 관한 것이다.
본 발명은 또한
Y1이 F, OH, O(C1-C6알킬), NH2, NHCH3, N(CH3)2, NHC(O)(C1-C6알킬렌)m, OP(O)3H2 및 C1-C6알킬로 임의로 치환된 페닐이고, 여기서 알킬은 1개 이상의 F로 임의로 치환되고, m은 0 또는 1인
상기 항체-약물 접합체 중 어느 것에 관한 것이다.
본 발명은 또한 화학식 (I)(B)(LD1)의 비-펩티드 화합물에 관한 것이다.
<화학식 (I)(B)(LD1)>
여기서
Str은 항체에 공유 부착될 수 있는 스트레쳐 단위이고;
Sp는 결합 또는 약물 모이어티에 공유 부착된 스페이서 단위이고;
R1은 C1-C10알킬, (C1-C10알킬)NHC(NH)NH2 또는 (C1-C10알킬)NHC(O)NH2이고;
R4 및 R5는 각각 독립적으로 C1-C10알킬, 아릴알킬, 헤테로아릴알킬, (C1-C10알킬)OCH2-이거나, 또는 R4와 R5는 C3-C7시클로알킬 고리를 형성할 수 있고;
D는 약물 모이어티이다.
본 발명은 또한 하기 화학식 (I)(B)(LD2)에 의해 나타내어지는 비-펩티드 화합물에 관한 것이다.
<화학식 (I)(B)(LD2)>
여기서 R6은 C1-C10알킬렌이고; R4와 R5는 함께 C3-C7시클로알킬 고리를 형성한다.
본 발명은 또한 하기 화학식 (I)(B)(LD3)에 의해 나타내어지는 비-펩티드 화합물에 관한 것이다.
<화학식 (I)(B)(LD3)>
본 발명은 또한 화학식 (I)(A)(LD1)의 비-펩티드 화합물에 관한 것이다.
<화학식 (I)(A)(LD1)>
여기서
Str은 항체에 공유 부착될 수 있는 스트레쳐 단위이고;
Sp는 약물 모이어티에 공유 부착된 임의적인 스페이서 단위이고;
Y는 헤테로아릴, 아릴, -C(O)C1-C6알킬렌, C1-C6알킬렌-NH2, C1-C6알킬렌-NH-CH3, C1-C6알킬렌-N-(CH3)2, C1-C6알케닐 또는 C1-C6알킬레닐이고;
R1은 C1-C10알킬, (C1-C10알킬)NHC(NH)NH2 또는 (C1-C10알킬)NHC(O)NH2이고;
R3 및 R2는 각각 독립적으로 H, C1-C10알킬, 아릴알킬 또는 헤테로아릴알킬이거나 또는 R3과 R2는 함께 C3-C7시클로알킬을 형성할 수 있고;
D는 약물 모이어티이다.
본 발명은 또한 하기 화학식 (I)(A)(LD2)에 의해 나타내어지는 비-펩티드 화합물에 관한 것이다.
<화학식 (I)(A)(LD2)>
여기서
R6은 C1-C10알킬렌이다.
본 발명은 또한 하기 화학식 (I)(A)(LD3)에 의해 나타내어지는 비-펩티드 화합물에 관한 것이다.
<화학식 (I)(A)(LD3)>
본 발명은 또한 Str이 하기 화학식을 갖고,
여기서 R6은 C1-C10알킬렌, C3-C8시클로알킬, O-(C1-C8알킬렌) 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌으로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬 아릴, 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고; 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고; Sp가 -Ar-Rb-이고, 여기서 Ar은 아릴 또는 헤테로아릴이고, Rb는 (C1-C10알킬렌)O-인
상기 비-펩티드 화합물 중 어느 것에 관한 것이다.
본 발명은 또한
R6이 C1-C10알킬렌이고, Sp가 -Ar-Rb-이고, 여기서 Ar은 아릴이고, Rb는 (C1-C6알킬렌)O-인
비-펩티드 화합물에 관한 것이다.
본 발명은 또한 R6이 -(CH2)q이고, 1-10인 비-펩티드 화합물에 관한 것이다.
본 발명은 또한 Str이 하기 화학식을 갖고,
여기서 R7은 C1-C10알킬렌, C1-C10알킬렌-O, N(Rc)-(C2-C6 알킬렌)-N(Rc) 및 N(Rc)-(C2-C6알킬렌)으로부터 선택되고; 여기서 각각의 Rc는 독립적으로 H 또는 C1-C6 알킬이고;
Sp가 -Ar-Rb-이고, 여기서 Ar은 아릴 또는 헤테로아릴이고, Rb는 (C1-C10 알킬렌)O-인
비-펩티드 화합물에 관한 것이다.
본 발명은 또한 R6이 C1-C10 알킬렌이고, Sp가 -Ar-Rb-이고, 여기서 Ar은 아릴이고, Rb는 (C1-C6 알킬렌)O-인 비-펩티드 화합물에 관한 것이다.
본 발명은 또한 D가 하기 화학식을 갖는 이량체 약물 모이어티이고,
여기서
R11은 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
R22는 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
Raa 및 Rbb는 독립적으로 H, 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나,
또는 Raa와 Rbb는 5 또는 6원 헤테로시클로알킬 기를 형성하고;
T는 C3-C12알킬렌, Y1, (C1-C6알킬렌)-Y1-(C1-C6 알킬렌), (C1-C6알킬렌)-Y1-(C1-C6알킬렌)-Y1-(C1-C6알킬렌), (C2-C6알케닐렌)-Y1-(C2-C6알케닐렌) 및 (C2-C6알키닐렌)-Y1-(C2-C6알키닐렌)으로부터 선택된 테더 기이고;
여기서 Y1은 독립적으로 O, S, NR11, 아릴 및 헤테로아릴로부터 선택되고;
여기서 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 F, OH, O(C1-C6알킬), NH2, NHCH3, N(CH3)2, NHC(O)(C1-C6알킬렌)m, OP(O)3H2 및 C1-C6알킬로 독립적으로 및 임의로 치환되고, 여기서 알킬은 1개 이상의 F로 임의로 치환되고, m은 0 또는 1이거나;
또는 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 L에 대한 결합으로 독립적으로 및 임의로 치환되고, 여기서 L에 대한 결합은 임의적인 치환기 중 1개를 통해 연결될 수 있고;
D'는
로부터 선택된 약물 모이어티이고,
여기서 파상선은 T에 대한 부착 부위를 나타내고;
X1 및 X2는 독립적으로 O 및 NR33으로부터 선택되고, 여기서 R33은 H, C(O), 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나, 또는 X1 및 X2는 각각 독립적으로 부재하고;
R44는 H, CO2R, C(O), 또는 L에 대한 결합이고, 여기서 R은 C1-C6알킬 또는 벤질이고;
R55는 H 또는 C1-C6알킬인
화학식 (IV), (IV)(A), (IV)(B), (V), (V)(A) 및 (V)(B)의 상기 비-펩티드 화합물 중 어느 하나에 관한 것이다.
본 발명은 또한
Y1이 F, OH, O(C1-C6알킬), NH2, NHCH3, N(CH3)2, NHC(O)(C1-C6알킬렌)m, OP(O)3H2 및 C1-C6알킬로 임의로 치환된 페닐이고, 여기서 알킬은 1개 이상의 F로 임의로 치환되고, m은 0 또는 1인
상기 링커 약물 화합물 중 어느 것에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(B)(LD4)의 화합물에 관한 것이다.
<(I)(B)(LD4)>
여기서,
D는 하기 화학식의 약물 모이어티이다.
본 발명은 또한 하기 화학식 (I)(B)(LD5)의 화합물에 관한 것이다.
<화학식 (I)(B)(LD5)>
여기서,
D는 하기 화학식의 약물 모이어티이고,
X1은 부재하거나 또는 O이고;
R11은 C(O)N-피페라진(CH3) 또는 P(O)3H2이다.
본 발명은 또한 하기 화학식 (I)(B)(LD6)의 화합물에 관한 것이다.
<화학식 (I)(B)(LD6)>
여기서,
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
R20은 H 또는 Me이다.
본 발명은 또한
R20이 H이고, R1이 (CH2)4NH2인
화학식 (I)(B)(LD6)의 화합물에 관한 것이다.
본 발명은 또한
R20이 Me이고, R1이 (CH2)4NH2인
화학식 (I)(B)(LD6)의 화합물에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(B)(LD7)의 화합물에 관한 것이다.
<화학식 (I)(B)(LD7)>
여기서,
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
R20은 H 또는 Me이다.
본 발명은 또한
R20이 H이고, R1이 (CH2)4NH2인
화학식 (I)(B)(LD7)의 화합물에 관한 것이다.
본 발명은 또한
R20이 Me이고, R1이 (CH2)4NH2인
화학식 (I)(B)(LD7)의 화합물에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(B)(LD8)의 화합물에 관한 것이다.
<화학식 (I)(B)(LD8)>
여기서,
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이다.
본 발명은 또한
R1이 (CH2)4NH2인
화학식 (I)(B)(LD8)의 화합물에 관한 것이다.
본 발명은 또한 하기 화학식 (I)(B)(LD9)의 화합물에 관한 것이다.
<화학식 (I)(B)(LD9)>
여기서,
R1은 C1-C6알킬-NH2, (C1-C6알킬)NHC(NH)NH2 또는 (C1-C6알킬)NHC(O)NH2이고;
X1 및 X2는 각각 독립적으로 부재하거나 또는 O이고;
각각의 R11은 독립적으로 C(O)N-피페라진(CH3) 또는 P(O)3H2이다.
본 발명은 또한 D가 클린다마이신, 노보비오신, 레타파물린, 답토마이신, GSK-2140944, CG-400549, 시타플록사신, 테이코플라닌, 트리클로산, 나프티리돈, 라데졸리드, 독소루비신, 암피실린, 반코마이신, 이미페넴, 도리페넴, 겜시타빈, 달바반신 및 아지트로마이신으로 이루어진 군으로부터 선택된 항생제 모이어티인 상기 접합체 중 어느 하나에 관한 것이다. 이러한 항생제의 살박테리아 및 정박테리아 작용 메카니즘은 (i) 세포벽, 펩티도글리칸 신장의 억제 (반코마이신, 테이코플라닌, 달바반신); (ii) 세포벽, 페니실린-결합 단백질 가교의 억제 (이미페넴, 도리페넴, 암피실린); (iii) 세포 막 탈분극 (답토마이신); (iv) DNA 복제의 파괴 (겜시타빈); (v) DNA 결합 (독소루비신); (vi) 에노일 ACP-리덕타제 FABI (CG-400549, 트리클로산, 나프티리돈); (vii) 리보솜 단백질 합성, 리보솜 30S의 억제 (클린다마이신, 레타파물린, 라데졸리드); 및 (viii) 토포이소머라제 (topoIIA) 억제제 (노보비오신, 시타플록사신, GSK-2140944)를 포함하나, 이에 제한되지는 않는다. 구조적으로, 대부분의 항생제는 (i) 아미노글리코시드; (ii) 베타-락탐; (iii) 마크롤리드/시클릭 펩티드; (iv) 테트라시클린; (v) 플루오로퀴놀린/플루오로퀴놀론; 및 (vi) 옥사졸리디논으로 그룹화될 수 있다. 참조: 문헌 [Shaw, K. and Barbachyn, M. (2011) Ann. N.Y. Acad. Sci. 1241:48-70; Sutcliffe, J. (2011) Ann. N.Y. Acad. Sci. 1241:122-152].
본 발명은 또한 p가 1인 본원에 기재된 상기 항체-약물 접합체 또는 항체-항생제 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 p가 2인 본원에 기재된 상기 항체-약물 접합체 또는 항체-항생제 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 p가 3인 본원에 기재된 상기 항체-약물 접합체 또는 항체-항생제 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 p가 4인 본원에 기재된 상기 항체-약물 접합체 또는 항체-항생제 접합체 중 어느 하나에 관한 것이다.
본 발명은 통상적인 항생제 요법을 피하는 박테리아 집단을 표적화함으로써 항생제 회피를 방지하는 것을 목표로 하는 신규 항박테리아 요법을 제공한다. 신규 항박테리아 요법은 (MRSA 포함) 에스. 아우레우스(S. aureus)에서 발견되는 세포벽 성분에 대해 특이적인 항체가 강력한 항생제에 화학적으로 연결된 항체-항생제 접합체 (AAC)로 달성된다. 항생제는 대부분의 포유동물 세포 유형에서 발견되는 리소솜 프로테아제인 카텝신 B에 의해 절단되도록 설계된 프로테아제 절단가능한 펩티드 링커를 통해 항체에 연결된다 (Dubowchik et al (2002) Bioconj. Chem. 13:855-869). AAC는 링커가 절단될 때까지 항생제가 (항체의 큰 크기로 인해) 불활성이라는 점에서 전구약물로서 작용한다. 천연 감염에서 발견되는 유의한 비율의 에스. 아우레우스는 숙주에서의 감염 과정 동안 일부 지점에서 숙주 세포, 주로 호중구 및 대식세포에 의해 흡수되기 때문에, 숙주 세포 내부에서 소비된 이러한 시간은 박테리아가 항생제 활성을 피할 유의한 기회를 제공한다. 본 발명의 AAC는 에스. 아우레우스에 결합하고, 박테리아가 숙주 세포에 의해 흡수된 후 포식리소솜 내부에서 항생제를 방출하도록 설계된다. 이러한 메카니즘에 의해, AAC는 에스. 아우레우스가 통상적인 항생제에 의해 불량하게 치료된 위치에서 활성 항생제를 특이적으로 농축시킬 수 있다. 본 발명은 특정한 작용 메카니즘에 의해 제한 또는 정의되지는 않지만, AAC는 하기 3가지 잠재적 메카니즘을 통해 항생제 활성을 개선시킨다: (1) AAC는 박테리아를 흡수하는 포유동물 세포 내부에서 항생제를 전달하여, 박테리아가 격리된 포식리소솜 내로 불량하게 확산하는 항생제의 효력을 증가시킨다. (2) AAC는 박테리아를 옵소닌화시키고 - 그에 의해 식세포에 의한 유리 박테리아의 흡수를 증가시킴 -, 항생제를 국부 방출시켜 박테리아를 이들이 포식리소솜에 격리되어 있는 동안에 사멸시킨다. (3) AAC는 항생제를 항체에 연결시킴으로써 항생제의 생체내 반감기를 개선시킨다 (개선된 약동학). AAC의 개선된 약동학은 전신 투여될 필요가 있는 항생제의 전체 용량을 제한하면서, 에스. 아우레우스가 농축되어 있는 영역에서의 충분한 항생제의 전달을 가능하게 한다. 이러한 특성은 AAC로의 장기 요법이 지속성 감염을 최소 항생제 부작용으로 표적화하도록 허용해야 한다.
본 발명은 또한 항체가 박테리아에 결합하고, D가 항생제 모이어티인 항체-항생제 접합체인 항체-약물 접합체에 관한 것이다.
본 발명은 또한 D가 클린다마이신, 노보비오신, 레타파물린, 답토마이신, GSK-2140944, CG-400549, 시타플록사신, 테이코플라닌, 트리클로산, 나프티리돈, 라데졸리드, 독소루비신, 암피실린, 반코마이신, 이미페넴, 도리페넴, 겜시타빈, 달바반신 및 아지트로마이신을 포함하는 군으로부터 선택된 약물인 상기 항체-항생제 접합체 중 어느 하나에 관한 것이다.
본 발명의 또 다른 측면은 본 발명의 항체-항생제 접합체 화합물을 포함하는 제약 조성물이다.
본 발명의 또 다른 측면은 환자에게 치료 유효량의 본 발명의 항체-항생제 접합체 화합물을 투여함으로써 박테리아 감염을 치료하는 방법이다. 한 실시양태에서, 환자는 인간이다. 한 실시양태에서, 박테리아 감염은 스타필로코쿠스 아우레우스(Staphylococcus aureus) 감염이다. 일부 실시양태에서, 환자는 스타필로코쿠스 아우레우스 감염으로 진단받은 바 있다. 일부 실시양태에서, 박테리아 감염을 치료하는 것은 박테리아 부하를 감소시키는 것을 포함한다.
또 다른 실시양태에서, 치료 방법은 제2 치료제를 투여하는 것을 추가로 포함한다. 추가 실시양태에서, 제2 치료제는 항생제이다.
한 실시양태에서, 본 발명의 항체-항생제 접합체 화합물과 조합되어 투여되는 제2 항생제는 하기 구조적 부류로부터 선택된다: (i) 아미노글리코시드; (ii) 베타-락탐; (iii) 마크롤리드/시클릭 펩티드; (iv) 테트라시클린; (v) 플루오로퀴놀린/플루오로퀴놀론; 및 (vi) 옥사졸리디논.
한 실시양태에서, 본 발명의 항체-항생제 접합체 화합물과 조합되어 투여되는 제2 항생제는 리파마이신, 클린다마이신, 노보비오신, 레타파물린, 답토마이신, GSK-2140944, CG-400549, 시타플록사신, 테이코플라닌, 트리클로산, 나프티리돈, 라데졸리드, 독소루비신, 암피실린, 반코마이신, 이미페넴, 도리페넴, 겜시타빈, 달바반신 및 아지트로마이신으로부터 선택된다.
본 발명의 또 다른 측면은 본 발명의 항체 또는 항체-항생제 접합체 화합물을 제조하는 방법이다.
본 발명의 또 다른 측면은 본 발명의 제약 조성물 및 사용 지침서를 포함하는, 박테리아 감염을 치료하기 위한 키트이다.
본 발명은 또한 항체가 하기로 이루어진 군으로부터 선택된 1종 이상의 폴리펩티드에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다:
CLL1;
BMPR1B;
E16;
STEAP1;
0772P;
MPF;
NaPi2b;
Sema 5b;
PSCA hlg;
ETBR;
MSG783;
STEAP2;
TrpM4;
CRIPTO;
CD21;
CD79b;
FcRH2;
HER2;
NCA;
MDP;
IL20Rα;
브레비칸;
EphB2R;
ASLG659;
PSCA;
GEDA;
BAFF-R;
CD22;
CD79a;
CXCR5;
HLA-DOB;
P2X5;
CD72;
LY64;
FcRH1;
IRTA2;
TENB2;
PMEL17;
TMEFF1;
GDNF-Ra1;
Ly6E;
TMEM46;
Ly6G6D;
LGR5;
RET;
LY6K;
GPR19;
GPR54;
ASPHD1;
티로시나제;
TMEM118;
GPR172A;
MUC16 및
CD33.
본 발명은 또한 질환의 치료를 필요로 하는 인간에게 유효량의 청구범위 제1항의 항체-약물 접합체를 투여하는 것을 포함하는, 상기 인간에서 질환을 치료하는 방법에 관한 것이다.
본 발명은 또한 청구범위 제1항의 화합물 및 그의 제약상 허용되는 담체를 포함하는 제약 조성물에 관한 것이다.
본 발명은 또한 항체가 하기로 이루어진 군으로부터 선택된 1종 이상의 폴리펩티드에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다:
CLL1;
STEAP1;
NaPi2b;
STEAP2;
TrpM4;
CRIPTO;
CD21;
CD79b;
FcRH2;
HER2;
CD22;
CD79a;
CD72;
LY64;
Ly6E;
MUC16; 및
CD33.
본 발명은 또한 항체가 CD33에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 CD22에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 NaPi2b에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 CLL1에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 Her2에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 CD33에 결합하며 항-CD33 항체가 서열식별번호(SEQ ID NO): 11의 아미노산 서열을 포함하는 HVR-L1, 서열식별번호: 12의 아미노산 서열을 포함하는 HVR-L2, 서열식별번호: 13의 아미노산 서열을 포함하는 HVR-L3, 서열식별번호: 14의 아미노산 서열을 포함하는 HVR-H1, 서열식별번호: 15의 아미노산 서열을 포함하는 HVR-H2, 및 서열식별번호: 16의 아미노산 서열을 포함하는 HVR-H3을 포함하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 CD33에 결합하며 항-CD33 항체가 서열식별번호: 17의 아미노산 서열을 포함하는 VL 도메인 및 서열식별번호: 18의 아미노산 서열을 포함하는 VH 도메인을 포함하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
일부 실시양태에서, 항체-약물 접합체의 항체는 CD33에 결합한다. 일부 실시양태에서, 항체-약물 접합체의 항체는 (a) 서열식별번호: 22의 아미노산 서열을 포함하는 HVR-H1; (b) 서열식별번호: 23의 아미노산 서열을 포함하는 HVR-H2; (c) 서열식별번호: 24의 아미노산 서열을 포함하는 HVR-H3; (d) 서열식별번호: 19의 아미노산 서열을 포함하는 HVR-L1; (e) 서열식별번호: 20의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열식별번호: 21로부터 선택된 아미노산 서열을 포함하는 HVR-L3을 포함한다.
일부 실시양태에서, 항체는 상기 제공된 실시양태 중 어느 것에서와 같은 VH 및 상기 제공된 실시양태 중 어느 것에서와 같은 VL을 포함한다. 한 실시양태에서, 항체는 각각 서열식별번호: 25 및 서열식별번호: 26의 VH 및 VL 서열을 포함한다 (이들 서열의 번역후 변형 포함).
본 발명은 또한 항체가 NaPi2b에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 NaPi2b에 결합하며 NaPi2b 항체가 서열식별번호: 1의 아미노산 서열을 포함하는 HVR-L1, 서열식별번호: 2의 아미노산 서열을 포함하는 HVR-L2, 서열식별번호: 3의 아미노산 서열을 포함하는 HVR-L3, 서열식별번호: 4의 아미노산 서열을 포함하는 HVR-H1, 서열식별번호: 5의 아미노산 서열을 포함하는 HVR-H2, 및 서열식별번호: 6의 아미노산 서열을 포함하는 HVR-H3을 포함하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 NaPi2b에 결합하며 NaPi2b 항체가 서열식별번호: 7의 아미노산 서열을 포함하는 VL 도메인 및 서열식별번호: 8의 아미노산 서열을 포함하는 VH 도메인을 포함하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 NaPi2b에 결합하며 NaPi2b 항체가 서열식별번호: 9의 아미노산 서열 및 서열식별번호: 10의 아미노산 서열을 포함하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 CD22에 결합하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 CD22에 결합하며 CD22 항체가 서열식별번호: 41의 아미노산 서열을 포함하는 HVR-L1, 서열식별번호: 42의 아미노산 서열을 포함하는 HVR-L2, 서열식별번호: 43의 아미노산 서열을 포함하는 HVR-L3, 서열식별번호: 44의 아미노산 서열을 포함하는 HVR-H1, 서열식별번호: 45의 아미노산 서열을 포함하는 HVR-H2, 및 서열식별번호: 46의 아미노산 서열을 포함하는 HVR-H3을 포함하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 CD22에 결합하며 CD22 항체가 서열식별번호: 47의 아미노산 서열을 포함하는 VL 도메인 및 서열식별번호: 48의 아미노산 서열을 포함하는 VH 도메인을 포함하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
본 발명은 또한 항체가 CD22에 결합하며 CD22 항체가 서열식별번호: 49의 아미노산 서열 및 서열식별번호: 50의 아미노산 서열을 포함하는 것인 상기 항체-약물 접합체 중 어느 하나에 관한 것이다.
정의
달리 언급되지 않는 한, 본원에 사용된 하기 용어 및 어구는 하기 의미를 갖는 것으로 의도된다: 본원에서 상표명이 사용되는 경우에, 본 출원인은 상표명 제품 제제, 제네릭 약물 및 상표명 제품의 활성 제약 성분(들)이 독립적으로 포함되는 것으로 의도한다.
본원에 사용된 용어 "펩티드모방체" 또는 PM은 비-펩티드 화학적 모이어티를 의미한다. 펩티드는 1개의 아미노산의 카르복실 기가 또 다른 것의 아미노 기와 반응할 때 형성되는 공유 화학 결합인 펩티드 (아미드) 결합에 의해 연결된 아미노산 단량체의 단쇄이다. 가장 짧은 펩티드는 단일 펩티드 결합에 의해 연결된 2개의 아미노산으로 이루어진 디펩티드, 이어서 트리펩티드, 테트라펩티드 등이다. 펩티드모방체 화학적 모이어티는 비-아미노산 화학적 모이어티를 포함한다. 펩티드모방체 화학적 모이어티는 또한 1개 이상의 비-아미노산 화학적 단위에 의해 분리되는 1개 이상의 아미노산을 포함할 수 있다. 펩티드모방체 화학적 모이어티는 그의 화학 구조의 임의의 부분에 펩티드 결합에 의해 연결되는 2개 이상의 인접 아미노산을 함유하지 않는다.
본원에 사용된 용어 "아미노산"은 글리신, 알라닌, 발린, 류신, 이소류신, 페닐알라닌, 프롤린, 세린, 트레오닌, 티로신, 시스테인, 메티오닌, 리신, 아르기닌, 히스티딘, 트립토판, 아스파르트산, 글루탐산, 아스파라긴, 글루타민 또는 시트룰린을 의미한다.
용어 "항생제" (abx 또는 Abx)는 성장을 특이적으로 억제하거나 또는 미생물, 예컨대 박테리아를 사멸시키지만, 투여되는 농도 및 투여 간격에서 숙주에 대해 비-치사성인 임의의 분자를 포함한다. 구체적 측면에서, 항생제는 투여되는 농도 및 투여 간격에서 숙주에 대해 비-독성이다. 박테리아에 대해 효과적인 항생제는 살박테리아 (즉, 직접 사멸시킴) 또는 정박테리아 (즉, 분열을 막음)로서 광범위하게 분류될 수 있다. 항-살박테리아 항생제는 협역 또는 광역으로서 추가로 하위분류될 수 있다. 광역 항생제는 더 작은 범위 또는 특정한 패밀리의 박테리아에 대해 효과적인 협역 항생제와 달리, 그람-양성 및 그람-음성 박테리아 둘 다를 포함한 넓은 범위의 박테리아에 대해 효과적인 것이다. 항생제의 예는 하기를 포함한다: (i) 아미노글리코시드, 예를 들어 아미카신, 겐타미신, 카나마이신, 네오마이신, 네틸미신, 스트렙토마이신, 토브라마이신, 파로마이신, (ii) 안사마이신, 예를 들어 겔다나마이신, 헤르비마이신, (iii) 카르바세펨, 예를 들어 로라카르베프, (iv) 카르바페넴, 예를 들어 에르타페넴, 도리페넴, 이미페넴/실라스타틴, 메로페넴, (v) 세팔로스포린 (제1 세대), 예를 들어 세파드록실, 세파졸린, 세팔로틴, 세팔렉신, (vi) 세팔로스포린 (제2 세대), 예를 들어 세파클로르, 세파만돌, 세폭시틴, 세프프로질, 세푸록심, (vi) 세팔로스포린 (제3 세대), 예를 들어 세픽심, 세프디니르, 세프디토렌, 세포페라존, 세포탁심, 세프포독심, 세프타지딤, 세프티부텐, 세프티족심, 세프트리악손, (vii) 세팔로스포린 (제4 세대), 예를 들어 세페핌, (viii), 세팔로스포린 (제5 세대), 예를 들어 세프토비프롤, (ix) 당펩티드, 예를 들어 테이코플라닌, 반코마이신, (x) 마크롤리드, 예를 들어 악시트로마이신, 클라리트로마이신, 디리트로마이신, 에리트로마이신, 록시트로마이신, 트롤레안도마이신, 텔리트로마이신, 스펙티노마이신, (xi) 모노박탐, 예를 들어 악스트레오남, (xii) 페니실린, 예를 들어 아목시실린, 암피실린, 악슬로실린, 카르베니실린, 클록사실린, 디클록사실린, 플루클록사실린, 메즐로실린, 메티실린, 나프실린, 옥사실린, 페니실린, 피페라실린, 티카르실린, (xiii) 항생제 폴리펩티드, 예를 들어 바시트라신, 콜리스틴, 폴리믹신 B, (xiv) 퀴놀론, 예를 들어 시프로플록사신, 에녹사신, 가티플록사신, 레보플록사신, 레메플록사신, 목시플록사신, 노르플록사신, 오르플록사신, 트로바플록사신, (xv) 술폰아미드, 예를 들어 마페니드, 프론토실, 술프아세트아미드, 술파메티졸, 술파닐아미드, 술파살라진, 술프이속사졸, 트리메토프림, 트리메토프림-술파메톡사졸 (TMP-SMX), (xvi) 테트라시클린, 예를 들어 데메클로시클린, 독시시클린, 미노시클린, 옥시테트라시클린, 테트라시클린 및 (xvii) 다른 것, 예컨대 아르스페나민, 클로람페니콜, 클린다마이신, 린코마이신, 에탐부톨, 포스포마이신, 푸시드산, 푸라졸리돈, 이소니아지드, 리네졸리드, 메트로니다졸, 뮤피로신, 니트로푸란토인, 플라텐시마이신, 피라진아미드, 퀴누프리스틴/달포프리스틴, 리팜핀/리팜피신 또는 티니다졸.
다중약물 내성 스타필로코쿠스 아우레우스 또는 옥사실린-내성 스타필로코쿠스 아우레우스 (ORSA)로서 대안적으로 공지된 용어 "메티실린-내성 스타필로코쿠스 아우레우스" (MRSA)는, 페니실린 (예를 들어, 메티실린, 디클록사실린, 나프실린, 옥사실린 등) 및 세팔로스포린을 포함한 베타-락탐 항생제에 대해 내성인 스타필로코쿠스 아우레우스의 임의의 균주를 지칭한다. "메티실린-감수성 스타필로코쿠스 아우레우스" (MSSA)는 베타-락탐 항생제에 대해 감수성인 스타필로코쿠스 아우레우스의 임의의 균주를 지칭한다.
본원에서 용어 "항체"는 가장 넓은 의미로 사용되고, 구체적으로 모노클로날 항체, 폴리클로날 항체, 이량체, 다량체, 다중특이적 항체 (예를 들어 이중특이적 항체), 및 바람직한 생물학적 활성을 나타내는 항체 단편을 포함한다 (Miller et al. (2003) Jour. of Immunology 170:4854-4861). 항체는 뮤린, 인간, 인간화, 키메라이거나, 또는 다른 종으로부터 유래될 수 있다. 항체는 특정 항원을 인식하고 그에 결합할 수 있는, 면역계에 의해 생성되는 단백질이다. (Janeway, C., Travers, P., Walport, M., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). 표적 항원은 일반적으로 다수의 항체 상의 CDR에 의해 인식되는, 에피토프로도 불리는 많은 결합 부위를 갖는다. 상이한 에피토프에 특이적으로 결합하는 각각의 항체는 상이한 구조를 갖는다. 따라서, 1개의 항원은 1개 초과의 상응하는 항체를 가질 수 있다. 항체는 전장 이뮤노글로불린 분자 또는 전장 이뮤노글로불린 분자의 면역학적 활성 부분, 즉 관심 표적 항원 (이러한 표적은 암 세포, 또는 자가면역 질환과 연관된 자가면역 항체를 생성하는 세포를 포함하나, 이에 제한되지는 않음) 또는 그의 일부와 면역특이적으로 결합하는 항원 결합 부위를 함유하는 분자를 포함한다. 본원에 개시된 이뮤노글로불린은 이뮤노글로불린 분자의 임의의 유형 (예를 들어, IgG, IgE, IgM, IgD 및 IgA), 부류 (예를 들어, IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2) 또는 하위부류일 수 있다. 이뮤노글로불린은 임의의 종으로부터 유래될 수 있다. 그러나, 한 측면에서, 이뮤노글로불린은 인간, 뮤린 또는 토끼 기원의 것이다.
본원에 사용된 용어 "항체 단편(들)"은 전장 항체의 일부, 일반적으로 그의 항원 결합 또는 가변 영역을 포함한다. 항체 단편의 예는 Fab, Fab', F(ab')2, 및 Fv 단편; 디아바디; 선형 항체; 미니바디 (Olafsen et al. (2004) Protein Eng. Design & Sel. 17(4):315-323), Fab 발현 라이브러리에 의해 생성된 단편, 항-이디오타입 (항-Id) 항체, CDR (상보성 결정 영역), 및 암 세포 항원, 바이러스 항원 또는 미생물 항원에 면역특이적으로 결합하는 상기 중 어느 것의 에피토프-결합 단편, 단일-쇄 항체 분자; 및 항체 단편으로부터 형성된 다중특이적 항체를 포함한다.
본원에 사용된 용어 "모노클로날 항체"는 실질적으로 동종인 항체의 집단으로부터 수득된 항체를 지칭하며, 즉 이러한 집단을 포함하는 개별 항체는 소량으로 존재할 수 있는 가능한 자연 발생 돌연변이를 제외하고는 동일하다. 모노클로날 항체는 단일 항원 부위에 대해 지시되어 고도로 특이적이다. 게다가, 상이한 결정기 (에피토프)에 대해 지시된 상이한 항체를 포함하는 폴리클로날 항체 제제와는 반대로, 각각의 모노클로날 항체는 항원 상의 단일 결정기에 대해 지시된다. 그의 특이성 이외에도, 모노클로날 항체는 다른 항체에 의해 오염되지 않은 상태로 합성될 수 있다는 점에서 유리하다. 수식어 "모노클로날"은 항체의 특징이 실질적으로 동종인 항체 집단으로부터 수득된 것임을 나타내며, 임의의 특정한 방법에 의한 항체 생산을 요구한다는 것으로 해석되어서는 안된다. 예를 들어, 본 발명에 따라 사용될 모노클로날 항체는 문헌 [Kohler et al. (1975) Nature, 256:495]에 최초로 기재된 하이브리도마 방법에 의해 제조되거나, 또는 재조합 DNA 방법 (예를 들어, US 4816567; US 5807715 참조)에 의해 제조될 수 있다. 모노클로날 항체는 또한, 예를 들어 문헌 [Clackson et al. (1991) Nature, 352:624-628; Marks et al. (1991) J. Mol. Biol., 222:581-597]에 기재된 기술을 사용하여 파지 항체 라이브러리로부터 단리될 수 있다.
본원에서 모노클로날 항체는 구체적으로, 목적하는 생물학적 활성을 나타내는 한, 중쇄 및/또는 경쇄의 일부가 특정한 종으로부터 유래되거나 특정한 항체 부류 또는 하위부류에 속하는 항체의 상응하는 서열과 동일하거나 또는 그에 상동성인 한편 쇄(들)의 나머지 부분은 다른 종으로부터 유래되거나 또 다른 항체 부류 또는 하위부류에 속하는 항체의 상응하는 서열과 동일하거나 그에 상동성인 "키메라" 항체, 뿐만 아니라 상기 항체의 단편을 포함한다 (US 4816567; 및 Morrison et al. (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). 본원에서 관심 키메라 항체는 비-인간 영장류 (예를 들어, 구세계 원숭이, 유인원 등)로부터 유래된 가변 도메인 항원-결합 서열 및 인간 불변 영역 서열을 포함하는 "영장류화" 항체를 포함한다.
본원에 사용된 용어 "무손상 항체"는 VL 및 VH 도메인 뿐만 아니라 경쇄 불변 도메인 (CL) 및 중쇄 불변 도메인, CH1, CH2 및 CH3을 포함하는 것이다. 불변 도메인은 천연 서열 불변 도메인 (예를 들어, 인간 천연 서열 불변 도메인) 또는 그의 아미노산 서열 변이체일 수 있다. 무손상 항체는, 항체의 Fc 불변 영역 (천연 서열 Fc 영역 또는 아미노산 서열 변이체 Fc 영역)에 기인할 수 있는 생물학적 활성을 지칭하는 1종 이상의 "이펙터 기능"을 가질 수 있다. 항체 이펙터 기능의 예는 C1q 결합; 보체 의존성 세포독성; Fc 수용체 결합; 항체-의존성 세포-매개 세포독성 (ADCC); 식세포작용; 및 세포 표면 수용체, 예컨대 B 세포 수용체 및 BCR의 하향 조절을 포함한다.
본원에 사용된 용어 "Fc 영역"은 불변 영역의 적어도 일부를 함유하는 이뮤노글로불린 중쇄의 C-말단 영역을 의미한다. 상기 용어는 천연 서열 Fc 영역 및 변이체 Fc 영역을 포함한다. 한 실시양태에서, 인간 IgG 중쇄 Fc 영역은 Cys226 또는 Pro230으로부터 중쇄의 카르복실-말단까지 연장된다. 그러나, Fc 영역의 C-말단 리신 (Lys447)은 존재하거나 또는 존재하지 않을 수 있다. 본원에 달리 명시되지 않는 한, Fc 영역 또는 불변 영역에서 아미노산 잔기의 넘버링은 문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991]에 기재된 바와 같은, EU 인덱스로도 불리는 EU 넘버링 시스템에 따른다.
본원에 사용된 용어 "프레임워크" 또는 "FR"은 초가변 영역 (HVR) 잔기 이외의 가변 도메인 잔기를 지칭한다. 가변 도메인의 FR은 일반적으로 4개의 FR 도메인: FR1, FR2, FR3 및 FR4로 이루어진다. 따라서, HVR 및 FR 서열은 일반적으로 VH (또는 VL)에서 하기 서열로 나타난다: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
중쇄 불변 도메인의 아미노산 서열에 따라, 무손상 항체는 상이한 "부류"로 지정될 수 있다. 5가지 주요 부류의 무손상 이뮤노글로불린 항체: IgA, IgD, IgE, IgG 및 IgM이 존재하고, 이들 중 몇몇은 "하위부류" (이소형), 예를 들어 IgG1, IgG2, IgG3, IgG4, IgA 및 IgA2로 추가로 분류될 수 있다. 상이한 부류의 항체에 상응하는 중쇄 불변 도메인은 각각 α, δ, ε, γ, 및 μ로 불린다. 상이한 부류의 이뮤노글로불린의 서브유닛 구조 및 3차원 형상은 널리 공지되어 있다. Ig 형태는 힌지-변형 또는 무힌지 형태를 포함한다 (Roux et al. (1998) J. Immunol. 161:4083-4090; Lund et al. (2000) Eur. J. Biochem. 267:7246-7256; US 2005/0048572; US 2004/0229310).
본원에 사용된 용어 "인간 항체"는 인간 또는 인간 세포에 의해 생산되거나, 또는 인간 항체 레퍼토리 또는 다른 인간 항체-코딩 서열을 사용하는 비-인간 공급원으로부터 유래된 항체의 아미노산 서열에 상응하는 아미노산 서열을 보유하는 항체를 지칭한다. 인간 항체의 이러한 정의는 비-인간 항원-결합 잔기를 포함하는 인간화 항체를 분명히 배제한다.
본원에 사용된 용어 "인간 컨센서스 프레임워크"는 인간 이뮤노글로불린 VL 또는 VH 프레임워크 서열의 선택 시 가장 흔히 발생하는 아미노산 잔기를 나타내는 프레임워크를 지칭한다. 일반적으로, 인간 이뮤노글로불린 VL 또는 VH 서열의 선택은 가변 도메인 서열의 하위군으로부터 행한다. 일반적으로, 서열의 하위군은 문헌 [Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3]에서와 같은 하위군이다. 한 실시양태에서, VL의 경우에 하위군은 상기 문헌 [Kabat et al.]에서와 같은 하위군 카파 I이다. 한 실시양태에서, VH의 경우에 하위군은 상기 문헌 [Kabat et al.]에서와 같은 하위군 III이다.
본원에 사용된 용어 "인간화 항체"는 비-인간 HVR로부터의 아미노산 잔기 및 인간 FR로부터의 아미노산 잔기를 포함하는 키메라 항체를 지칭한다. 특정 실시양태에서, 인간화 항체는 적어도 1개, 전형적으로 2개의 가변 도메인을 실질적으로 모두 포함할 것이며, 여기서 모든 또는 실질적으로 모든 HVR (예를 들어, CDR)은 비-인간 항체의 것에 상응하고, 모든 또는 실질적으로 모든 FR은 인간 항체의 것에 상응한다. 인간화 항체는 임의로 인간 항체로부터 유래된 항체 불변 영역의 적어도 일부를 포함할 수 있다. 항체, 예를 들어 비-인간 항체의 "인간화 형태"는 인간화를 거친 항체를 지칭한다.
본원에 사용된 용어 "초가변 영역" 또는 "HVR"은 서열이 초가변성이고/거나 구조적으로 한정된 루프 ("초가변 루프")를 형성하는 항체 가변 도메인의 각각의 영역을 지칭한다. 일반적으로, 천연 4-쇄 항체는 6개의 HVR; VH 내의 3개 (H1, H2, H3) 및 VL 내의 3개 (L1, L2, L3)를 포함한다. HVR은 일반적으로 초가변 루프로부터의 및/또는 "상보성 결정 영역" (CDR)으로부터의 아미노산 잔기를 포함하며, 후자는 서열 가변성이 가장 높고/거나 항원 인식과 관련된다. 예시적인 초가변 루프는 아미노산 잔기 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2) 및 96-101 (H3)에서 발생한다. (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987).) 예시적인 CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 및 CDR-H3)은 L1의 아미노산 잔기 24-34, L2의 50-56, L3의 89-97, H1의 31-35B, H2의 50-65 및 H3의 95-102에서 발생한다. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991).) VH 내의 CDR1을 제외하고, CDR은 일반적으로 초가변 루프를 형성하는 아미노산 잔기를 포함한다. CDR은 또한 항원에 접촉하는 잔기인 "특이성 결정 잔기" 또는 "SDR"을 포함한다. SDR은 단축-CDR, 또는 a-CDR로 불리는 CDR의 영역 내에 함유된다. 예시적인 a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 및 a-CDR-H3)은 L1의 아미노산 잔기 31-34, L2의 50-55, L3의 89-96, H1의 31-35B, H2의 50-58 및 H3의 95-102에서 발생한다. (문헌 [Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)] 참조.) 달리 나타내지 않는 한, HVR 잔기 및 가변 도메인 내의 다른 잔기 (예를 들어, FR 잔기)는 상기 문헌 [Kabat et al.]에 따라 넘버링된다.
본원에 사용된 용어 "가변 영역" 또는 "가변 도메인"은 항원에 대한 항체의 결합에 관여하는 항체 중쇄 또는 경쇄의 도메인을 지칭한다. 천연 항체의 중쇄 및 경쇄의 가변 도메인 (각각 VH 및 VL)은 일반적으로 유사한 구조를 갖고, 각각의 도메인은 4개의 보존된 프레임워크 영역 (FR) 및 3개의 초가변 영역 (HVR)을 포함한다. (예를 들어, 문헌 [Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)] 참조.) 단일 VH 또는 VL 도메인은 항원-결합 특이성을 부여하기에 충분할 수 있다. 게다가, 특정한 항원에 결합하는 항체는 각각 상보적 VL 또는 VH 도메인의 라이브러리를 스크리닝하기 위해 항원에 결합하는 항체로부터의 VH 또는 VL 도메인을 사용하여 단리될 수 있다. 예를 들어, 문헌 [Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991)]을 참조한다.
본원에 사용된 용어 "벡터"는 연결되어 있는 또 다른 핵산을 전파시킬 수 있는 핵산 분자를 지칭한다. 이 용어는 자기-복제 핵산 구조로서의 벡터 뿐만 아니라, 벡터가 도입된 숙주 세포의 게놈 내로 통합된 벡터를 포함한다. 특정 벡터는 작동가능하게 연결된 핵산의 발현을 지시할 수 있다. 이러한 벡터는 본원에서 "발현 벡터"로 지칭된다.
본원에 사용된 용어 "유리 시스테인 아미노산"은 모 항체 내로 조작되고 티올 관능기 (-SH)를 가지며 분자내 또는 분자간 디술피드 가교로서 쌍형성되지 않는 시스테인 아미노산 잔기를 지칭한다.
본원에 사용된 용어 "링커", "링커 단위" 또는 "링크"는 약물 모이어티를 항체에 공유 부착시키는 원자의 쇄를 포함하는 화학적 모이어티를 의미한다. 다양한 실시양태에서, 링커는 L로 명시되는 2가 라디칼이다.
본원에 사용된 용어 "약물 모이어티"는 세포 기능을 억제 또는 방지하고/거나 세포 사멸 또는 파괴를 유발하는 물질을 의미한다. 세포독성제는 방사성 동위원소 (예를 들어, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 및 Lu의 방사성 동위원소); 화학요법제 또는 약물 (예를 들어, 메토트렉세이트, 아드리아미신, 빈카 알칼로이드 (빈크리스틴, 빈블라스틴, 에토포시드), 독소루비신, 멜팔란, 미토마이신 C, 클로람부실, 다우노루비신 또는 다른 삽입제); 성장 억제제; 효소 및 그의 단편 예컨대 핵산분해 효소; 및 하기 개시된 다양한 항종양제 또는 항암제를 포함하나, 이에 제한되지는 않는다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "아실"은 기 -C(O)R'를 지칭하며, 여기서 R'는 각각 본원에 정의된 바와 같은 알킬, C3-C6시클로알킬 또는 헤테로시클릴이다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "알콕시"는 기 -OR'를 지칭하며, 여기서 R'는 상기 정의된 바와 같은 C1-C4알킬 또는 C3-C6시클로알킬이다. "알콕시"의 예는 메톡시, 에톡시, 이소프로폭시, 프로폭시, 부톡시, t-부톡시, 이소부톡시, 시클로프로폭시, 및 시클로부톡시, 및 그의 할로겐화 형태, 예를 들어 플루오로메톡시 및 디플루오로메톡시를 포함한다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "알킬"은 비치환되거나 또는 다중 치환도 (예를 들어 1, 2, 3, 4, 5 또는 6개가 본 발명에 포함됨)로 치환될 수 있는 1 내지 12개의 (C1-C12) 탄소 원자를 갖는 직쇄형 또는 분지형, 1가 또는 2가 탄화수소 쇄 라디칼을 지칭한다. 치환기의 예는 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산 및 알킬티오로 이루어진 군으로부터 선택된다. 본원에 사용된 "알킬"의 예는 메틸 (Me, -CH3), 에틸 (Et, -CH2CH3), 1-프로필 (n-Pr, n-프로필, -CH2CH2CH3), 2-프로필 (i-Pr, i-프로필, -CH(CH3)2), 1-부틸 (n-Bu, n-부틸, -CH2CH2CH2CH3), 2-메틸-1-프로필 (i-Bu, i-부틸, -CH2CH(CH3)2), 2-부틸 (s-Bu, s-부틸, -CH(CH3)CH2CH3), 2-메틸-2-프로필 (t-Bu, t-부틸, -C(CH3)3), 1-펜틸 (n-펜틸, -CH2CH2CH2CH2CH3), 2-펜틸 (-CH(CH3)CH2CH2CH3), 3-펜틸 (-CH(CH2CH3)2), 2-메틸-2-부틸 (-C(CH3)2CH2CH3), 3-메틸-2-부틸 (-CH(CH3)CH(CH3)2), 3-메틸-1-부틸 (-CH2CH2CH(CH3)2), 2-메틸-1-부틸 (-CH2CH(CH3)CH2CH3), 1-헥실 (-CH2CH2CH2CH2CH2CH3), 2-헥실 (-CH(CH3)CH2CH2CH2CH3), 3-헥실 (-CH(CH2CH3)(CH2CH2CH3)), 2-메틸-2-펜틸 (-C(CH3)2CH2CH2CH3), 3-메틸-2-펜틸 (-CH(CH3)CH(CH3)CH2CH3), 4-메틸-2-펜틸 (-CH(CH3)CH2CH(CH3)2), 3-메틸-3-펜틸 (-C(CH3)(CH2CH3)2), 2-메틸-3-펜틸 (-CH(CH2CH3)CH(CH3)2), 2,3-디메틸-2-부틸 (-C(CH3)2CH(CH3)2), 3,3-디메틸-2-부틸 (-CH(CH3)C(CH3)3, 뿐만 아니라 2가 ("알킬렌") 및 그의 치환된 버전을 포함하나, 이에 제한되지는 ?莩쨈?. 치환된 알킬의 예는 히드록시메틸, 디플루오로메틸 및 트리플루오로메틸을 포함하나, 이에 제한되지는 않는다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "알케닐"은 적어도 1개의 불포화 부위, 즉 탄소-탄소, sp2 이중 결합을 갖는 2 내지 8개의 탄소 원자 (C2-C10)의 임의의 길이의 선형 또는 분지형, 1가 탄화수소 쇄 라디칼을 의미하며, 여기서 알케닐 라디칼은 독립적으로 "알킬"의 정의에 상기 기재된 1개 이상의 치환기로 임의로 치환될 수 있고, "시스" 및 "트랜스" 배향 또는 대안적으로, "E" 및 "Z" 배향을 갖는 라디칼을 포함한다. 알케닐의 예는 에테닐 또는 비닐 (-CH=CH2), 프로프-1-에닐 (-CH=CHCH3), 프로프-2-에닐 (-CH2CH=CH2), 2-메틸프로프-1-에닐, 부트-1-에닐, 부트-2-에닐, 부트-3-에닐, 부타-1,3-디에닐, 2-메틸부타-1,3-디엔, 헥스-1-에닐, 헥스-2-에닐, 헥스-3-에닐, 헥스-4-에닐, 헥사-1,3-디에닐 뿐만 아니라 2가 ("알케닐렌") 및 그의 치환된 버전을 포함하나, 이에 제한되지는 않는다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "알키닐"은 적어도 1개의 불포화 부위, 즉 탄소-탄소, sp 삼중 결합을 갖는 2 내지 8개의 탄소 원자 (C2-C10)의 임의의 길이의 선형 또는 분지형, 1가 또는 2가 탄화수소 라디칼을 지칭하며, 여기서 알키닐 라디칼은 독립적으로 알킬의 정의에 상기 기재된 1개 이상의 치환기로 임의로 치환될 수 있고, 알키닐의 예는 에티닐 (-C≡CH), 프로프-1-이닐 (-C≡CCH3), 프로프-2-이닐 (프로파르길, -CH2C≡CH), 부트-1-이닐, 부트-2-이닐 및 부트-3-이닐, 뿐만 아니라 2가 ("알키닐렌") 및 그의 치환된 버전을 포함하나, 이에 제한되지는 않는다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "알킬아미노"는 기 -NR'R"를 지칭하며, 여기서 R'는 H, C1-C6알킬 또는 C3-C6시클로알킬이고, R"는 C1-C6알킬 또는 C3-C6시클로알킬이고, 알킬아미노의 예는 메틸아미노, 디메틸아미노, 에틸아미노, 디에틸아미노, 프로필아미노 및 시클로프로필아미노를 포함하나, 이에 제한되지는 않는다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "아미드"는 기 -C(O)NR'R"를 지칭하며, 여기서 R' 및 R"는 각각 독립적으로 H, C1-C6알킬 또는 C3-C6시클로알킬이고; 아미드의 예는 -C(O)NH2, -C(O)NHCH3, 및 -C(O)N(CH3)2를 포함하나, 이에 제한되지는 않는다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "아릴"은 방향족, 탄화수소, 고리계를 지칭한다. 고리계는 치환 또는 비치환된 모노시클릭 또는 융합된 폴리시클릭 (예를 들어, 비시클릭, 트리시클릭 등)일 수 있다. 다양한 실시양태에서, 모노시클릭 아릴 C5-C10, 또는 C5-C7, 또는 C5-C6이며, 여기서 이들 탄소수는 고리계를 형성하는 탄소 원자의 수를 지칭한다. C6 고리계, 즉 페닐 고리는 아릴 기이다. 다양한 실시양태에서, 폴리시클릭 고리는 비시클릭 아릴 기이며, 여기서 비시클릭 아릴 기의 예는 C8-C12, 또는 C9-C10을 포함한다. 10개의 탄소 원자를 갖는 나프틸 고리는 폴리시클릭 아릴 기이다. 아릴에 대한 치환기의 예는 하기 "임의로 치환된"의 정의에 기재되어 있다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "시아노"는 기 -CN을 지칭한다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 "시클로알킬"은 비-방향족, 치환 또는 비치환된, 포화 또는 부분 불포화 탄화수소 고리 기를 지칭한다. 치환기의 예는 "임의로 치환된"의 정의에 기재되어 있다. 한 예에서, 시클로알킬 기는 3 내지 12개의 탄소 원자 (C3-C12)이다. 다른 예에서, 시클로알킬은 C3-C8, C3-C10 또는 C5-C10이다. 다른 예에서, 모노사이클로서의 시클로알킬 기는 C3-C8, C3-C6 또는 C5-C6이다. 또 다른 예에서, 비사이클로서의 시클로알킬 기는 C7-C12이다. 또 다른 예에서, 스피로계로서의 시클로알킬 기는 C5-C12이다. 모노시클릭 시클로알킬의 예는 시클로프로필, 시클로부틸, 시클로펜틸, 1-시클로펜트-1-에닐, 1-시클로펜트-2-에닐, 1-시클로펜트-3-에닐, 시클로헥실, 퍼듀테리오시클로헥실, 1-시클로헥스-1-에닐, 1-시클로헥스-2-에닐, 1-시클로헥스-3-에닐, 시클로헥사디에닐, 시클로헵틸, 시클로옥틸, 시클로노닐, 시클로데실, 시클로운데실 및 시클로도데실을 포함한다. 7 내지 12개의 고리 원자를 갖는 비시클릭 시클로알킬의 예시적인 배열은 [4,4], [4,5], [5,5], [5,6] 또는 [6,6] 고리계를 포함하나, 이에 제한되지는 않는다. 예시적인 가교된 비시클릭 시클로알킬은 비시클로[2.2.1]헵탄, 비시클로[2.2.2]옥탄 및 비시클로[3.2.2]노난을 포함하나, 이에 제한되지는 않는다. 스피로 시클로알킬의 예는 스피로[2.2]펜탄, 스피로[2.3]헥산, 스피로[2.4]헵탄, 스피로[2.5]옥탄 및 스피로[4.5]데칸을 포함한다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "에스테르"는 기 -C(O)OR'를 지칭하며, 여기서 R'는 C1-C6알킬, 또는 C3-C6시클로알킬이다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "헤테로사이클", "헤테로시클로알킬" 또는 "헤테로시클릴"은 2 내지 12개의 고리 탄소 원자 및 1 내지 3개의 고리 헤테로 원자를 함유하는 비치환 및 치환된 모노- 또는 폴리시클릭 비-방향족 고리계를 지칭한다. 폴리시클릭 고리계는 융합된 비- 또는 트리-시클릭, 스피로 또는 가교일 수 있다. 헤테로원자의 예는 N-옥시드, 황 옥시드 및 디옥시드를 포함한 N, O 및 S를 포함한다. 한 실시양태에서, 고리는 3 내지 8-원이고, 완전 포화되거나 또는 1 이상의 불포화도를 갖는다. 다중 치환도는 본 정의 내에 포함된다. 치환기의 예는 하기에 정의된다. "헤테로시클릭" 기의 예는 테트라히드로푸라닐, 피라닐, 1,4-디옥사닐, 1,3-디옥사닐, 옥솔라닐, 옥세타닐, 2-옥사-6-아자스피로[3.3]헵탄-6-일, 피페리디닐, 피롤리디닐, 모르폴리닐, 아제티디닐, 피페라지닐, 피롤리디노닐, 피페라지노닐, 피라졸리디닐, 및 그의 다양한 호변이성질체를 포함하나, 이에 제한되지는 않는다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "헤테로아릴"은, 청구범위에 달리 정의되지 않는 한, 1 내지 9개의 탄소(들) 및 적어도 1개의 헤테로원자를 함유하는 방향족 고리계를 지칭한다. 헤테로원자의 예는 N, O, 및 S를 포함한다. 헤테로아릴은 치환 또는 비치환된, 모노시클릭 또는 폴리시클릭일 수 있다. 모노시클릭 헤테로아릴 기는 고리 내에 2 내지 6개의 고리 탄소 원자 및 1 내지 3개의 고리 헤테로 원자를 가질 수 있으며, 폴리시클릭 헤테로아릴은 3 내지 9개의 고리 탄소 원자 및 1 내지 5개의 고리 헤테로 원자를 함유할 수 있다. 폴리시클릭 헤테로아릴 고리는 융합된, 스피로 또는 가교된 고리 접합을 함유할 수 있으며, 예를 들어 비시클릭 헤테로아릴은 폴리시클릭 헤테로아릴이다. 비시클릭 헤테로아릴 고리는 8 내지 12개의 구성원 원자를 함유할 수 있다. 모노시클릭 헤테로아릴 고리는 5 내지 8개의 구성원 원자 (탄소 및 헤테로원자)를 함유할 수 있다. 예시적인 헤테로아릴 기는 벤조푸라닐, 벤조티오페닐, 푸라닐, 이미다졸릴, 인돌릴, 아자인돌릴, 아자벤즈이미다졸릴, 벤족사졸릴, 벤즈티아졸릴, 벤조티아디아졸릴, 벤조트리아졸릴, 벤조이미다졸릴, 테트라지닐, 테트라졸릴, 이소티아졸릴, 옥사졸릴, 이속사졸릴, 피라지닐, 피라졸릴, 피리다지닐, 피리디닐, 피리미디닐, 피롤릴, 퀴놀리닐, 퀴나졸리닐, 퀴녹살리닐, 트리아지닐, 트리아졸릴, 티아졸릴 및 티오페닐을 포함하나, 이에 제한되지는 않는다. 헤테로아릴에 대한 치환기의 예는 하기 "임의로 치환된"의 정의에 기재되어 있다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "헤테로아릴알킬"은 기 (헤테로아릴)C1-C3알킬을 의미한다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "아릴알킬"은 기 (아릴)C1-C3알킬을 의미한다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "우레아"는 기 -NR'C(O)NR"를 지칭하며, 여기서 R' 및 R"는 각각 독립적으로 H, C1-C6알킬, 또는 C3-C6시클로알킬이다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "임의로"는 후속적으로 기재된 사건(들)이 발생하거나 발생하지 않을 수 있다는 것을 의미하며, 발생하는 사건(들) 및 발생하지 않는 사건(들) 둘 다를 포함한다.
달리 정의되지 않는 한, 본원에 사용된 어구 "임의로 치환된", "치환된" 또는 그의 변형은 1개 이상의 치환기, 예를 들어 1, 2 또는 3개로의 임의적인 치환 (다중 치환도 포함)을 나타낸다. 상기 어구는 본원에 기재 및 도시된 치환과 중복되게 해석되어서는 안된다. 예시적인 임의적인 치환기는 아실, C1-C6알킬, 술포닐, 아미노, 술폰아미드, 술폭시드, 알콕시, 시아노, 할로, 우레아, 에스테르, 카르복실산, 아미드, 히드록시, 옥소, 및 니트로를 포함한다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "치료"는 명시된 상태를 완화시키는 것, 상태의 1종 이상의 증상을 제거하거나 감소시키는 것, 상태의 진행을 늦추거나 제거하는 것을 지칭한다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "유효량"은, 예를 들어 연구원 또는 임상의가 추구하는 조직, 계, 동물 또는 인간의 생물학적 또는 의학적 반응을 이끌어낼 약물 또는 제약 작용제의 양을 의미한다.
청구범위에 달리 정의되지 않는 한, 본원에 사용된 용어 "치료 유효량"은 이러한 양을 제공받지 못한 상응하는 대상체와 비교하여 질환, 장애 또는 부작용의 치료, 또는 질환 또는 장애의 진행 속도의 감소를 일으키는 임의의 양을 의미한다. 상기 용어는 또한 정상적인 생리학적 기능을 증진시키는데 유효한 양을 그의 범주 내에 포함한다. 요법에 사용하기 위해, 치료 유효량의 화학식 I의 화합물, 뿐만 아니라 그의 염은 미가공 화학물질로서 투여될 수 있다. 추가로, 활성 성분은 제약 조성물로서 제공될 수 있다.
본 발명은 또한 실험 섹션에서의 실시예 중 어느 하나에 관한 것이다.
본원에 사용된 어구 "제약상 허용되는 염"은 항체-약물 접합체 (ADC) 또는 링커-약물 모이어티의 제약상 허용되는 유기 또는 무기 염을 지칭한다. 예시적인 염은 술페이트, 시트레이트, 아세테이트, 옥살레이트, 클로라이드, 브로마이드, 아이오다이드, 니트레이트, 비술페이트, 포스페이트, 산 포스페이트, 이소니코티네이트, 락테이트, 살리실레이트, 산 시트레이트, 타르트레이트, 올레에이트, 탄네이트, 판토테네이트, 비타르트레이트, 아스코르베이트, 숙시네이트, 말레에이트, 겐티시네이트, 푸마레이트, 글루코네이트, 글루쿠로네이트, 사카레이트, 포르메이트, 벤조에이트, 글루타메이트, 메탄술포네이트, 에탄술포네이트, 벤젠술포네이트, p-톨루엔술포네이트, 및 파모에이트 (즉, 1,1'-메틸렌-비스 -(2-히드록시-3- 나프토에이트)) 염을 포함하나, 이에 제한되지는 않는다. 제약상 허용되는 염은 또 다른 분자, 예컨대 아세테이트 이온, 숙시네이트 이온 또는 다른 반대이온의 내포를 포함할 수 있다. 반대이온은 모 화합물 상의 전하를 안정화시키는 임의의 유기 또는 무기 모이어티일 수 있다. 게다가, 제약상 허용되는 염은 그의 구조 내에 1개 초과의 하전된 원자를 가질 수 있다. 다수의 하전된 원자가 제약상 허용되는 염의 일부인 경우에는 다수의 반대이온을 가질 수 있다. 따라서, 제약상 허용되는 염은 1개 이상의 하전된 원자 및/또는 1개 이상의 반대이온을 가질 수 있다.
제약상 허용되지 않는 다른 염이 본 발명의 화합물을 제조하는데 유용할 수 있고, 이들은 본 발명의 추가 측면을 형성하는 것으로 간주되어야 한다. 이들 염, 예컨대 옥살산 또는 트리플루오로아세테이트는 그 자체로는 제약상 허용되지 않지만, 본 발명의 화합물 및 그의 제약상 허용되는 염을 수득하는데 있어서 중간체로서 유용한 염을 제조하는데 유용할 수 있다.
본 발명의 화합물은 고체 또는 액체 형태로 존재할 수 있다. 고체 상태에서는, 결정질 또는 비결정질 형태, 또는 그의 혼합물로서 존재할 수 있다. 통상의 기술자는 제약상 허용되는 용매화물이 결정질 또는 비-결정질 화합물에 대해 형성될 수 있다는 것을 인지할 것이다. 결정질 용매화물에서, 용매 분자는 결정화 동안 결정질 격자 내에 혼입된다. 용매화물은 결정질 격자 내로 혼입되는 용매로서, 비-수성 용매, 예컨대 비제한적으로 에탄올, 이소프로판올, DMSO, 아세트산, 에탄올아민, 또는 에틸 아세테이트를 포함할 수 있거나, 또는 이들은 물을 포함할 수 있다. 물이 결정질 격자에 혼입된 용매인 용매화물은 전형적으로 "수화물"로서 지칭된다. 수화물은 화학량론적 수화물 뿐만 아니라 가변량의 물을 함유하는 조성물을 포함한다. 본 발명은 모든 이러한 용매화물을 포함한다.
통상의 기술자는 추가로 결정질 형태로 존재하는 본 발명의 특정 화합물, 예컨대 그의 다양한 용매화물이 다형성 (즉, 다양한 결정질 구조로 발생하는 능력)을 나타낼 수 있음을 인지할 것이다. 이들 다양한 결정질 형태는 전형적으로 "다형체"로 공지되어 있다. 본 발명은 모든 이러한 다형체를 포함한다. 다형체는 동일한 화학적 조성을 갖지만, 패킹, 기하학적 배열, 및 결정질 고체 상태의 다른 서술적 특성이 상이하다. 따라서, 다형체는 다양한 물리적 특성, 예컨대 형상, 밀도, 경도, 변형성, 안정성 및 용해 특성을 가질 수 있다. 전형적으로, 다형체는 확인에 사용할 수 있는 다양한 융점, IR 스펙트럼 및 X선 분말 회절 패턴을 나타낸다. 통상의 기술자는, 예를 들어 화합물의 제조에 사용되는 반응 조건 또는 시약을 변화시키거나 또는 조정함으로써 다양한 다형체가 제조될 수 있음을 인지할 것이다. 예를 들어, 온도, 압력 또는 용매에서의 변화로 다형체를 생성할 수 있다. 추가로, 1종의 다형체는 특정 조건 하에 또 다른 다형체로 자발적으로 전환될 수 있다.
본 발명의 화합물 또는 그의 염은 입체이성질체 형태로 존재할 수 있다 (예를 들어, 1개 이상의 비대칭 탄소 원자를 함유함). 개별 입체이성질체 (거울상이성질체 및 부분입체이성질체) 및 이들의 혼합물은 본 발명의 범위 내에 포함된다. 마찬가지로, 화학식 (I)의 화합물 또는 염은 화학식으로 제시되는 것 이외의 호변이성질체 형태로 존재할 수 있고, 이들은 또한 본 발명의 범위 내에 포함되는 것으로 이해된다. 본 발명은 본원에 상기 정의된 특정한 기의 모든 조합 및 하위세트를 포함하는 것으로 이해되어야 한다. 본 발명의 범위는 입체이성질체의 혼합물 뿐만 아니라 정제된 거울상이성질체 또는 거울상이성질체적으로/부분입체이성질체적으로 풍부한 혼합물을 포함한다. 본 발명은 본원에 상기 정의된 특정한 기의 모든 조합 및 하위세트를 포함하는 것으로 이해되어야 한다.
본 발명은 또한, 1개 이상의 원자가 자연에서 통상적으로 발견되는 원자 질량 또는 질량수와 상이한 원자 질량 또는 질량수를 갖는 원자에 의해 대체된 점이 상이한, 본 발명의 화합물의 동위원소-표지된 형태를 포함한다. 본 발명의 화합물 또는 그의 제약상 허용되는 염 내로 혼입될 수 있는 동위원소의 예는 수소, 탄소, 질소, 산소, 인, 황, 플루오린, 아이오딘 및 염소의 동위원소, 예컨대 2H, 3H, 11C, 13C, 14C, 15N, 17O, 18O, 31P, 32P, 35S, 18F, 36Cl, 123I 및 125I를 포함한다.
상기 언급된 동위원소 및/또는 다른 원자의 다른 동위원소를 함유하는 본 발명의 화합물 및 상기 화합물의 제약상 허용되는 염은 본 발명의 범위 내에 있다. 본 발명의 동위원소-표지된 화합물, 예를 들어 방사성 동위원소, 예컨대 3H, 14C가 혼입된 것은 약물 및/또는 기질 조직 분포 검정에 유용하다. 삼중수소화, 즉 3H, 및 탄소-14, 즉 14C, 동위원소는 통상적으로 그의 제조의 용이성 및 검출감도를 위해 사용된다. 11C 및 18F 동위원소는 PET (양전자 방출 단층촬영)에 유용하고, 125I 동위원소는 SPECT (단일 광자 방출 컴퓨터 단층촬영)에 유용하며, 이들 모두는 뇌 영상화에 유용하다. 또한, 보다 무거운 동위원소, 예컨대 중수소 즉 2H로의 치환은 더 큰 대사 안정성, 예를 들어 증가된 생체내 반감기 또는 감소된 투여량 요건으로 인한 특정 치료 이점을 제공할 수 있고, 따라서 일부 상황에서 바람직할 수 있다. 동위원소 표지된 본 발명의 화학식 (I)의 화합물 및 하기는 용이하게 입수가능한 동위원소 표지된 시약으로 비-동위원소 표지된 시약을 치환하여 하기 반응식 및/또는 실시예에 개시된 절차를 수행함으로써 일반적으로 제조될 수 있다.
ADC의 제약 조성물
본 발명의 치료 항체-약물 접합체 (ADC)의 제약 제제는 전형적으로 제약상 허용되는 비경구 비히클과 함께 단위 투여 주사가능한 형태로, 비경구 투여, 즉 볼루스, 정맥내, 종양내 주사를 위해 제조된다. 원하는 정도의 순도를 갖는 항체-약물 접합체 (ADC)는 제약상 허용되는 희석제, 담체, 부형제 또는 안정화제 (Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.)와 함께 동결건조된 제제 또는 수용액의 형태로 임의로 혼합된다.
시스테인 조작된 항체
본 발명의 화합물은 야생형 또는 모 항체의 1개 이상의 아미노산이 시스테인 아미노산으로 치환된 시스테인 조작된 항체를 포함하는 항체-약물 접합체를 포함한다. 임의의 형태의 항체가 그와 같이 조작, 즉 돌연변이될 수 있다. 예를 들어, 모 Fab 항체 단편은 본원에서 "티오Fab"로 지칭되는 시스테인 조작된 Fab를 형성하도록 조작될 수 있다. 유사하게, 모 모노클로날 항체는 "티오Mab"를 형성하도록 조작될 수 있다. 단일 부위 돌연변이는 티오Fab에 단일 조작된 시스테인 잔기를 생성하지만, IgG 항체의 이량체 특성 때문에 단일 부위 돌연변이는 티오Mab에 2개의 조작된 시스테인 잔기를 생성함을 유념해야 한다. 치환된 ("조작된") 시스테인 (Cys) 잔기를 갖는 돌연변이체는 새로 도입되고 조작된 시스테인 티올 기의 반응성에 대해 평가된다. 티올 반응성 값은 0 내지 1.0 범위의 상대적인 수치 항이고, 임의의 시스테인 조작된 항체에 대해 측정될 수 있다. 본 발명의 시스테인 조작된 항체의 티올 반응성 값은 0.6 내지 1.0; 0.7 내지 1.0; 또는 0.8 내지 1.0의 범위 내이다.
돌연변이유발에 의해 시스테인 조작된 항체를 제조하기 위해, 출발 폴리펩티드의 아미노산 서열 변이체를 코딩하는 DNA가 관련 기술분야에 공지된 다양한 방법에 의해 제조된다. 이들 방법은 폴리펩티드를 코딩하는 앞서 제조된 DNA의 부위-지정 (또는 올리고뉴클레오티드-매개) 돌연변이유발, PCR 돌연변이유발, 및 카세트 돌연변이유발에 의한 제조를 포함하나, 이에 제한되지는 않는다. 재조합 항체의 변이체는 또한 제한 단편 조작에 의해 또는 합성 올리고뉴클레오티드를 사용한 중복 연장 PCR에 의해 제조될 수 있다. 돌연변이유발 프라이머는 시스테인 코돈 치환(들)을 코딩한다. 표준 돌연변이유발 기술이 이러한 돌연변이체 시스테인 조작된 항체를 코딩하는 DNA를 생성하기 위해 이용될 수 있다. 일반적인 안내는 문헌 [Sambrook et al. Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; 및 Ausubel et al. Current Protocols in Molecular Biology, Greene Publishing and Wiley-Interscience, New York, N.Y., 1993]에서 찾아볼 수 있다.
시스테인 아미노산은 항체 내의 반응성 부위에서 조작될 수 있고, 쇄내 또는 분자간 디술피드 연결을 형성하지 않는다 (Junutula, et al., 2008b Nature Biotech., 26(8):925-932; Dornan et al. (2009) Blood 114(13):2721-2729; US 7521541; US 7723485; WO2009/052249, Shen et al. (2012) Nature Biotech., 30(2):184-191; Junutula et al. (2008) Jour of Immun. Methods 332:41-52). 조작된 시스테인 티올은 티올-반응성, 친전자성 기, 예컨대 말레이미드 또는 알파-할로 아미드를 갖는 본 발명의 링커 시약 또는 링커-약물 중간체와 반응하여 시스테인 조작된 항체 (티오Mab) 및 약물 (D) 모이어티를 갖는 ADC를 형성할 수 있다. 따라서, 약물 모이어티의 위치는 설계, 제어 및 공지될 수 있다. 약물 로딩은, 조작된 시스테인 티올 기가 전형적으로 티올-반응성 링커 시약 또는 링커-약물 중간체와 고수율로 반응하기 때문에 제어될 수 있다. 항체를 조작하여 중쇄 또는 경쇄 상의 단일 부위에서의 치환에 의해 시스테인 아미노산을 도입하는 것은, 대칭 항체 상에 2개의 새로운 시스테인을 제공한다. 거의 2의 약물 로딩 및 거의 동질성의 접합 생성물 ADC가 달성될 수 있다.
본 발명의 시스테인 조작된 항체는 바람직하게는 그의 야생형 모 항체 대응물의 항원 결합 능력을 보유한다. 따라서, 시스테인 조작된 항체는 항원에, 바람직하게는 특이적으로 결합할 수 있다. 이러한 항원은 예를 들어 종양-연관 항원 (TAA), 세포 표면 수용체 단백질 및 다른 세포 표면 분자, 막횡단 단백질, 신호전달 단백질, 세포 생존 조절 인자, 세포 증식 조절 인자, 조직 발생 또는 분화와 연관된 (예를 들어, 조직 발생 또는 분화에 기능적으로 기여하는 것으로 공지되거나 또는 의심되는) 분자, 림포카인, 시토카인, 세포 주기 조절에 관여하는 분자, 혈관형성에 관여하는 분자 및 혈관신생과 연관된 (예를 들어, 혈관신생에 기능적으로 기여하는 것으로 공지되거나 또는 의심되는) 분자를 포함한다. 종양-연관 항원은 클러스터 분화 인자 (즉, CD 단백질)일 수 있다. 시스테인 조작된 항체가 결합할 수 있는 항원은 상기 언급된 카테고리 중 하나의 하위세트의 구성원일 수 있고, 여기서 상기 카테고리의 다른 하위세트(들)는 (관심 항원에 관한) 특징적인 특성을 갖는 다른 분자/항원을 포함한다.
시스테인 조작된 항체는 쇄내 디술피드 기의 환원 및 재산화에 의해 링커-약물 중간체와의 접합을 위해 제조된다.
종양-연관 항원:
암의 치료에 있어서 본 발명의 항체-약물 접합체에 유용할 수 있는 시스테인 조작된 항체를 포함하나 이에 제한되지는 않는 항체는 세포 표면 수용체 및 종양-연관 항원 (TAA)에 대한 항체를 포함하나, 이에 제한되지는 않는다. 특정 종양-연관 항원은 관련 기술분야에 공지되어 있고, 관련 기술분야에 널리 공지된 방법 및 정보를 사용하여 항체를 생성하는데 사용하기 위해 제조될 수 있다. 암 진단 및 요법에 효과적인 세포 표적을 발견하기 위한 시도에서, 연구자들은 1종 이상의 정상적인 비-암성 세포(들)와 비교하여 1종 이상의 특정한 유형(들)의 암 세포의 표면에서 특이적으로 발현되는 막횡단 또는 달리 종양-연관된 폴리펩티드를 확인하기 위한 모색을 해왔다. 종종, 이러한 종양-연관 폴리펩티드는 비-암성 세포의 표면에서와 비교하여 암 세포의 표면에서 보다 풍부하게 발현된다. 이러한 종양-연관 세포 표면 항원 폴리펩티드의 확인은, 항체-기반 요법을 통해 파괴할 암 세포를 보다 특이적으로 표적화하는 능력을 생성한다.
종양-연관 항원 TAA의 예는 하기 열거된 것을 포함하나, 이에 제한되지는 않는다. 편의상, 이들 항원에 관한 정보 (이들 모두는 관련 기술분야에 공지되어 있음)가 하기 열거되어 있고, 미국 국립 생물 공학 정보 센터 (NCBI)의 핵산 및 단백질 서열 확인 규정에 따른 명칭, 대체 명칭, 진뱅크(Genbank) 수탁 번호 및 주요 참고문헌(들)을 포함한다. 하기 열거된 TAA에 상응하는 핵산 및 단백질 서열은 공개 데이터베이스, 예컨대 진뱅크에서 입수가능하다. 항체에 의해 표적화되는 종양-연관 항원은 언급된 참고문헌에서 확인되는 서열과 비교하여 적어도 약 70%, 80%, 85%, 90% 또는 95% 서열 동일성을 보유하고/거나 언급된 참고문헌에서 확인되는 서열을 갖는 TAA와 실질적으로 동일한 생물학적 특성 또는 특징을 나타내는 모든 아미노산 서열 변이체 및 이소형을 포함한다. 예를 들어, 일반적으로, 변이체 서열을 갖는 TAA는 열거된 상응하는 서열을 갖는 TAA에 특이적으로 결합하는 항체에 특이적으로 결합할 수 있다. 본원에서 구체적으로 인용된 참고문헌의 서열 및 개시내용은 명백하게 참조로 포함된다.
(1) BMPR1B (골 형태발생 단백질 수용체-유형 IB, 진뱅크 수탁 번호 NM_001203)
문헌 [ten Dijke,P., et al. Science 264 (5155):101-104 (1994), Oncogene 14 (11):1377-1382 (1997)]; WO2004063362 (청구항 2); WO2003042661 (청구항 12); US2003134790-A1 (페이지 38-39); WO2002102235 (청구항 13; 페이지 296); WO2003055443 (페이지 91-92); WO200299122 (실시예 2; 페이지 528-530); WO2003029421 (청구항 6); WO2003024392 (청구항 2; 도 112); WO200298358 (청구항 1; 페이지 183); WO200254940 (페이지 100-101); WO200259377 (페이지 349-350); WO200230268 (청구항 27; 페이지 376); WO200148204 (실시예; 도 4)
NP_001194 골 형태발생 단백질 수용체, 유형 IB /pid=NP_001194.1 -
상호-참조: MIM:603248; NP_001194.1; AY065994
(2) E16 (LAT1, SLC7A5, 진뱅크 수탁 번호 NM_003486)
문헌 [Biochem. Biophys. Res. Commun. 255 (2), 283-288 (1999), Nature 395 (6699):288-291 (1998), Gaugitsch, H.W., et al. (1992) J. Biol. Chem. 267 (16):11267-11273]; WO2004048938 (실시예 2); WO2004032842 (실시예 IV); WO2003042661 (청구항 12); WO2003016475 (청구항 1); WO200278524 (실시예 2); WO200299074 (청구항 19; 페이지 127-129); WO200286443 (청구항 27; 페이지 222, 393); WO2003003906 (청구항 10; 페이지 293); WO200264798 (청구항 33; 페이지 93-95); WO200014228 (청구항 5; 페이지 133-136); US2003224454 (도 3); WO2003025138 (청구항 12; 페이지 150);
NP_003477 용질 운반체 패밀리 7 (양이온성 아미노산 수송체, y+ 시스템), 구성원 5 /pid=NP_003477.3 - 호모 사피엔스(Homo sapiens)
상호-참조: MIM:600182; NP_003477.3; NM_015923; NM_003486_1
(3) STEAP1 (전립선의 6회 막횡단 상피 항원, 진뱅크 수탁 번호 NM_012449)
문헌 [Cancer Res. 61 (15), 5857-5860 (2001), Hubert, R.S., et al. (1999) Proc. Natl. Acad. Sci. U.S.A. 96 (25):14523-14528]; WO2004065577 (청구항 6); WO2004027049 (도 1L); EP1394274 (실시예 11); WO2004016225 (청구항 2); WO2003042661 (청구항 12); US2003157089 (실시예 5); US2003185830 (실시예 5); US2003064397 (도 2); WO200289747 (실시예 5; 페이지 618-619); WO2003022995 (실시예 9; 도 13A, 실시예 53; 페이지 173, 실시예 2; 도 2A);
NP_036581 전립선의 6회 막횡단 상피 항원
상호-참조: MIM:604415; NP_036581.1; NM_012449_1
(4) 0772P (CA125, MUC16, 진뱅크 수탁 번호 AF361486)
문헌 [J. Biol. Chem. 276 (29):27371-27375 (2001)]; WO2004045553 (청구항 14); WO200292836 (청구항 6; 도 12); WO200283866 (청구항 15; 페이지 116-121); US2003124140 (실시예 16); 상호-참조: GI:34501467; AAK74120.3; AF361486_1
(5) MPF (MPF, MSLN, SMR, 거핵구 강화 인자, 메소텔린, 진뱅크 수탁 번호 NM_005823) 문헌 [Yamaguchi, N., et al. Biol. Chem. 269 (2), 805-808 (1994), Proc. Natl. Acad. Sci. U.S.A. 96 (20):11531-11536 (1999), Proc. Natl. Acad. Sci. U.S.A. 93 (1):136-140 (1996), J. Biol. Chem. 270 (37):21984-21990 (1995)]; WO2003101283 (청구항 14); (WO2002102235 (청구항 13; 페이지 287-288); WO2002101075 (청구항 4; 페이지 308-309); WO200271928 (페이지 320-321); WO9410312 (페이지 52-57); 상호-참조: MIM:601051; NP_005814.2; NM_005823_1
(6) Napi3b/NaPi2b (NAPI-3B, NPTIIb, SLC34A2, 용질 운반체 패밀리 34 (인산나트륨), 구성원 2, 유형 II 나트륨-의존성 포스페이트 수송체 3b, 진뱅크 수탁 번호 NM_006424)
문헌 [J. Biol. Chem. 277 (22):19665-19672 (2002), Genomics 62 (2):281-284 (1999), Feild, J.A., et al. (1999) Biochem. Biophys. Res. Commun. 258 (3):578-582]; WO2004022778 (청구항 2); EP1394274 (실시예 11); WO2002102235 (청구항 13; 페이지 326); EP875569 (청구항 1; 페이지 17-19); WO200157188 (청구항 20; 페이지 329); WO2004032842 (실시예 IV); WO200175177 (청구항 24; 페이지 139-140);
상호-참조: MIM:604217; NP_006415.1; NM_006424_1
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, 세마포린 5b Hlog, sema 도메인, 7개 트롬보스폰딘 반복부 (유형 1 및 유형 1-유사), 막횡단 도메인 (TM) 및 짧은 세포질 도메인, (세마포린) 5B, 진뱅크 수탁 번호 AB040878)
문헌 [Nagase T., et al. (2000) DNA Res. 7 (2):143-150]; WO2004000997 (청구항 1); WO2003003984 (청구항 1); WO200206339 (청구항 1; 페이지 50); WO200188133 (청구항 1; 페이지 41-43, 48-58); WO2003054152 (청구항 20); WO2003101400 (청구항 11);
수탁: Q9P283; EMBL; AB040878; BAA95969.1. Genew; HGNC:10737;
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, RIKEN cDNA 2700050C12, RIKEN cDNA 2700050C12 유전자, 진뱅크 수탁 번호 AY358628); 문헌 [Ross et al. (2002) Cancer Res. 62:2546-2553]; US2003129192 (청구항 2); US2004044180 (청구항 12); US2004044179 (청구항 11); US2003096961 (청구항 11); US2003232056 (실시예 5); WO2003105758 (청구항 12); US2003206918 (실시예 5); EP1347046 (청구항 1); WO2003025148 (청구항 20);
상호-참조: GI:37182378; AAQ88991.1; AY358628_1
(9) ETBR (엔도텔린 유형 B 수용체, 진뱅크 수탁 번호 AY275463);
문헌 [Nakamuta M., et al. Biochem. Biophys. Res. Commun. 177, 34-39, 1991; Ogawa Y., et al. Biochem. Biophys. Res. Commun. 178, 248-255, 1991; Arai H., et al. Jpn. Circ. J. 56, 1303-1307, 1992; Arai H., et al. J. Biol. Chem. 268, 3463-3470, 1993; Sakamoto A., Yanagisawa M., et al. Biochem. Biophys. Res. Commun. 178, 656-663, 1991; Elshourbagy N.A., et al. J. Biol. Chem. 268, 3873-3879, 1993; Haendler B., et al. J. Cardiovasc. Pharmacol. 20, s1-S4, 1992; Tsutsumi M., et al. Gene 228, 43-49, 1999; Strausberg R.L., et al. Proc. Natl. Acad. Sci. U.S.A. 99, 16899-16903, 2002; Bourgeois C., et al. J. Clin. Endocrinol. Metab. 82, 3116-3123, 1997; Okamoto Y., et al. Biol. Chem. 272, 21589-21596, 1997; Verheij J.B., et al. Am. J. Med. Genet. 108, 223-225, 2002; Hofstra R.M.W., et al. Eur. J. Hum. Genet. 5, 180-185, 1997; Puffenberger E.G., et al. Cell 79, 1257-1266, 1994; Attie T., et al., Hum. Mol. Genet. 4, 2407-2409, 1995; Auricchio A., et al. Hum. Mol. Genet. 5:351-354, 1996; Amiel J., et al. Hum. Mol. Genet. 5, 355-357, 1996; Hofstra R.M.W., et al. Nat. Genet. 12, 445-447, 1996; Svensson P.J., et al. Hum. Genet. 103, 145-148, 1998; Fuchs S., et al. Mol. Med. 7, 115-124, 2001; Pingault V., et al. (2002) Hum. Genet. 111, 198-206]; WO2004045516 (청구항 1); WO2004048938 (실시예 2); WO2004040000 (청구항 151); WO2003087768 (청구항 1); WO2003016475 (청구항 1); WO2003016475 (청구항 1); WO200261087 (도 1); WO2003016494 (도 6); WO2003025138 (청구항 12; 페이지 144); WO200198351 (청구항 1; 페이지 124-125); EP522868 (청구항 8; 도 2); WO200177172 (청구항 1; 페이지 297-299); US2003109676; US6518404 (도 3); US5773223 (청구항 1a; Col 31-34); WO2004001004;
(10) MSG783 (RNF124, 가설 단백질 FLJ20315, 진뱅크 수탁 번호 NM_017763);
WO2003104275 (청구항 1); WO2004046342 (실시예 2); WO2003042661 (청구항 12); WO2003083074 (청구항 14; 페이지 61); WO2003018621 (청구항 1); WO2003024392 (청구항 2; 도 93); WO200166689 (실시예 6);
상호-참조: LocusID:54894; NP_060233.2; NM_017763_1
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, 전립선암 연관 유전자 1, 전립선암 연관 단백질 1, 전립선의 6회 막횡단 상피 항원 2, 6회 막횡단 전립선 단백질, 진뱅크 수탁 번호 AF455138)
문헌 [Lab. Invest. 82 (11):1573-1582 (2002)]; WO2003087306; US2003064397 (청구항 1; 도 1); WO200272596 (청구항 13; 페이지 54-55); WO200172962 (청구항 1; 도 4B); WO2003104270 (청구항 11); WO2003104270 (청구항 16); US2004005598 (청구항 22); WO2003042661 (청구항 12); US2003060612 (청구항 12; 도 10); WO200226822 (청구항 23; 도 2); WO200216429 (청구항 12; 도 10);
상호-참조: GI:22655488; AAN04080.1; AF455138_1
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, 일시적 수용체 전위 양이온 채널, 서브패밀리 M, 구성원 4, 진뱅크 수탁 번호 NM_017636)
문헌 [Xu, X.Z., et al. Proc. Natl. Acad. Sci. U.S.A. 98 (19):10692-10697 (2001), Cell 109 (3):397-407 (2002), J. Biol. Chem. 278 (33):30813-30820 (2003)]; US2003143557 (청구항 4); WO200040614 (청구항 14; 페이지 100-103); WO200210382 (청구항 1; 도 9A); WO2003042661 (청구항 12); WO200230268 (청구항 27; 페이지 391); US2003219806 (청구항 4); WO200162794 (청구항 14; 도 1A-D);
상호-참조: MIM:606936; NP_060106.2; NM_017636_1
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, 기형암종-유래 성장 인자, 진뱅크 수탁 번호 NP_003203 또는 NM_003212)
문헌 [Ciccodicola, A., et al. EMBO J. 8 (7):1987-1991 (1989), Am. J. Hum. Genet. 49 (3):555-565 (1991)]; US2003224411 (청구항 1); WO2003083041 (실시예 1); WO2003034984 (청구항 12); WO200288170 (청구항 2; 페이지 52-53); WO2003024392 (청구항 2; 도 58); WO200216413 (청구항 1; 페이지 94-95, 105); WO200222808 (청구항 2; 도 1); US5854399 (실시예 2; Col 17-18); US5792616 (도 2);
상호-참조: MIM:187395; NP_003203.1; NM_003212_1
(14) CD21 (CR2 (보체 수용체 2) 또는 C3DR (C3d/엡스타인 바르 바이러스 수용체) 또는 Hs.73792 진뱅크 수탁 번호 M26004)
문헌 [Fujisaku et al. (1989) J. Biol. Chem. 264 (4):2118-2125; Weis J.J., et al. J. Exp. Med. 167, 1047-1066, 1988; Moore M., et al. Proc. Natl. Acad. Sci. U.S.A. 84, 9194-9198, 1987; Barel M., et al. Mol. Immunol. 35, 1025-1031, 1998; Weis J.J., et al. Proc. Natl. Acad. Sci. U.S.A. 83, 5639-5643, 1986; Sinha S.K., et al. (1993) J. Immunol. 150, 5311-5320]; WO2004045520 (실시예 4); US2004005538 (실시예 1); WO2003062401 (청구항 9); WO2004045520 (실시예 4); WO9102536 (도 9.1-9.9); WO2004020595 (청구항 1);
수탁: P20023; Q13866; Q14212; EMBL; M26004; AAA35786.1.
(15) CD79b (CD79B, CD79β, IGb (이뮤노글로불린-연관 베타), B29, 진뱅크 수탁 번호 NM_000626 또는 11038674)
문헌 [Proc. Natl. Acad. Sci. U.S.A. (2003) 100 (7):4126-4131, Blood (2002) 100 (9):3068-3076, Muller et al. (1992) Eur. J. Immunol. 22 (6):1621-1625]; WO2004016225 (청구항 2, 도 140); WO2003087768, US2004101874 (청구항 1, 페이지 102); WO2003062401 (청구항 9); WO200278524 (실시예 2); US2002150573 (청구항 5, 페이지 15); US5644033; WO2003048202 (청구항 1, 페이지 306 및 309); WO 99/558658, US6534482 (청구항 13, 도 17A/B); WO200055351 (청구항 11, 페이지 1145-1146);
상호-참조: MIM:147245; NP_000617.1; NM_000626_1
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (포스파타제 앵커 단백질 1a를 함유하는 SH2 도메인), SPAP1B, SPAP1C, 진뱅크 수탁 번호 NM_030764, AY358130)
문헌 [Genome Res. 13 (10):2265-2270 (2003), Immunogenetics 54 (2):87-95 (2002), Blood 99 (8):2662-2669 (2002), Proc. Natl. Acad. Sci. U.S.A. 98 (17):9772-9777 (2001), Xu, M.J., et al. (2001) Biochem. Biophys. Res. Commun. 280 (3):768-775]; WO2004016225 (청구항 2); WO2003077836; WO200138490 (청구항 5; 도 18D-1-18D-2); WO2003097803 (청구항 12); WO2003089624 (청구항 25);
상호-참조: MIM:606509; NP_110391.2; NM_030764_1
(17) HER2 (ErbB2, 진뱅크 수탁 번호 M11730)
문헌 [Coussens L., et al. Science (1985) 230(4730):1132-1139; Yamamoto T., et al. Nature 319, 230-234, 1986; Semba K., et al. Proc. Natl. Acad. Sci. U.S.A. 82, 6497-6501, 1985; Swiercz J.M., et al. J. Cell Biol. 165, 869-880, 2004; Kuhns J.J., et al. J. Biol. Chem. 274, 36422-36427, 1999; Cho H.-S., et al. Nature 421, 756-760, 2003; Ehsani A., et al. (1993) Genomics 15, 426-429]; WO2004048938 (실시예 2); WO2004027049 (도 1I); WO2004009622; WO2003081210; WO2003089904 (청구항 9); WO2003016475 (청구항 1); US2003118592; WO2003008537 (청구항 1); WO2003055439 (청구항 29; 도 1A-B); WO2003025228 (청구항 37; 도 5C); WO200222636 (실시예 13; 페이지 95-107); WO200212341 (청구항 68; 도 7); WO200213847 (페이지 71-74); WO200214503 (페이지 114-117); WO200153463 (청구항 2; 페이지 41-46); WO200141787 (페이지 15); WO200044899 (청구항 52; 도 7); WO200020579 (청구항 3; 도 2); US5869445 (청구항 3; Col 31-38); WO9630514 (청구항 2; 페이지 56-61); EP1439393 (청구항 7); WO2004043361 (청구항 7); WO2004022709; WO200100244 (실시예 3; 도 4);
수탁: P04626; EMBL; M11767; AAA35808.1. EMBL; M11761; AAA35808.1.
(18) NCA (CEACAM6, 진뱅크 수탁 번호 M18728);
문헌 [Barnett T., et al. Genomics 3, 59-66, 1988; Tawaragi Y., et al. Biochem. Biophys. Res. Commun. 150, 89-96, 1988; Strausberg R.L., et al. Proc. Natl. Acad. Sci. U.S.A. 99:16899-16903, 2002]; WO2004063709; EP1439393 (청구항 7); WO2004044178 (실시예 4); WO2004031238; WO2003042661 (청구항 12); WO200278524 (실시예 2); WO200286443 (청구항 27; 페이지 427); WO200260317 (청구항 2);
수탁: P40199; Q14920; EMBL; M29541; AAA59915.1. EMBL; M18728;
(19) MDP (DPEP1, 진뱅크 수탁 번호 BC017023)
문헌 [Proc. Natl. Acad. Sci. U.S.A. 99 (26):16899-16903 (2002)]; WO2003016475 (청구항 1); WO200264798 (청구항 33; 페이지 85-87); JP05003790 (도 6-8); WO9946284 (도 9);
상호-참조: MIM:179780; AAH17023.1; BC017023_1
(20) IL20Rα (IL20Ra, ZCYTOR7, 진뱅크 수탁 번호 AF184971);
문헌 [Clark H.F., et al. Genome Res. 13, 2265-2270, 2003; Mungall A.J., et al. Nature 425, 805-811, 2003; Blumberg H., et al. Cell 104, 9-19, 2001; Dumoutier L., et al. J. Immunol. 167, 3545-3549, 2001; Parrish-Novak J., et al. J. Biol. Chem. 277, 47517-47523, 2002; Pletnev S., et al. (2003) Biochemistry 42:12617-12624; Sheikh F., et al. (2004) J. Immunol. 172, 2006-2010]; EP1394274 (실시예 11); US2004005320 (실시예 5); WO2003029262 (페이지 74-75); WO2003002717 (청구항 2; 페이지 63); WO200222153 (페이지 45-47); US2002042366 (페이지 20-21); WO200146261 (페이지 57-59); WO200146232 (페이지 63-65); WO9837193 (청구항 1; 페이지 55-59);
수탁: Q9UHF4; Q6UWA9; Q96SH8; EMBL; AF184971; AAF01320.1.
(21) 브레비칸 (BCAN, BEHAB, 진뱅크 수탁 번호 AF229053)
문헌 [Gary S.C., et al. Gene 256, 139-147, 2000; Clark H.F., et al. Genome Res. 13, 2265-2270, 2003; Strausberg R.L., et al. Proc. Natl. Acad. Sci. U.S.A. 99, 16899-16903, 2002]; US2003186372 (청구항 11); US2003186373 (청구항 11); US2003119131 (청구항 1; 도 52); US2003119122 (청구항 1; 도 52); US2003119126 (청구항 1); US2003119121 (청구항 1; 도 52); US2003119129 (청구항 1); US2003119130 (청구항 1); US2003119128 (청구항 1; 도 52); US2003119125 (청구항 1); WO2003016475 (청구항 1); WO200202634 (청구항 1);
(22) EphB2R (DRT, ERK, Hek5, EPHT3, Tyro5, 진뱅크 수탁 번호 NM_004442)
문헌 [Chan,J. and Watt, V.M., Oncogene 6 (6), 1057-1061 (1991) Oncogene 10 (5):897-905 (1995), Annu. Rev. Neurosci. 21:309-345 (1998), Int. Rev. Cytol. 196:177-244 (2000)]; WO2003042661 (청구항 12); WO200053216 (청구항 1; 페이지 41); WO2004065576 (청구항 1); WO2004020583 (청구항 9); WO2003004529 (페이지 128-132); WO200053216 (청구항 1; 페이지 42);
상호-참조: MIM:600997; NP_004433.2; NM_004442_1
(23) ASLG659 (B7h, 진뱅크 수탁 번호 AX092328)
US20040101899 (청구항 2); WO2003104399 (청구항 11); WO2004000221 (도 3); US2003165504 (청구항 1); US2003124140 (실시예 2); US2003065143 (도 60); WO2002102235 (청구항 13; 페이지 299); US2003091580 (실시예 2); WO200210187 (청구항 6; 도 10); WO200194641 (청구항 12; 도 7b); WO200202624 (청구항 13; 도 1A-1B); US2002034749 (청구항 54; 페이지 45-46); WO200206317 (실시예 2; 페이지 320-321, 청구항 34; 페이지 321-322); WO200271928 (페이지 468-469); WO200202587 (실시예 1; 도 1); WO200140269 (실시예 3; 페이지 190-192); WO200036107 (실시예 2; 페이지 205-207); WO2004053079 (청구항 12); WO2003004989 (청구항 1); WO200271928 (페이지 233-234, 452-453); WO 0116318;
(24) PSCA (전립선 줄기 세포 항원 전구체, 진뱅크 수탁 번호 AJ297436)
문헌 [Reiter R.E., et al. Proc. Natl. Acad. Sci. U.S.A. 95, 1735-1740, 1998; Gu Z., et al. Oncogene 19, 1288-1296, 2000; Biochem. Biophys. Res. Commun. (2000) 275(3):783-788]; WO2004022709; EP1394274 (실시예 11); US2004018553 (청구항 17); WO2003008537 (청구항 1); WO200281646 (청구항 1; 페이지 164); WO2003003906 (청구항 10; 페이지 288); WO200140309 (실시예 1; 도 17); US2001055751 (실시예 1; 도 1b); WO200032752 (청구항 18; 도 1); WO9851805 (청구항 17; 페이지 97); WO9851824 (청구항 10; 페이지 94); WO9840403 (청구항 2; 도 1B);
수탁: O43653; EMBL; AF043498; AAC39607.1.
(25) GEDA (진뱅크 수탁 번호 AY260763);
AAP14954 지방종 HMGIC 융합-파트너-유사 단백질 /pid=AAP14954.1 - 호모 사피엔스
종: 호모 사피엔스 (인간)
WO2003054152 (청구항 20); WO2003000842 (청구항 1); WO2003023013 (실시예 3, 청구항 20); US2003194704 (청구항 45);
상호-참조: GI:30102449; AAP14954.1; AY260763_1
(26) BAFF-R (B 세포-활성화 인자 수용체, BLyS 수용체 3, BR3, 진뱅크 수탁 번호 AF116456); BAFF 수용체 /pid=NP_443177.1 - 호모 사피엔스
문헌 [Thompson, J.S., et al. Science 293 (5537), 2108-2111 (2001)]; WO2004058309; WO2004011611; WO2003045422 (실시예; 페이지 32-33); WO2003014294 (청구항 35; 도 6B); WO2003035846 (청구항 70; 페이지 615-616); WO200294852 (Col 136-137); WO200238766 (청구항 3; 페이지 133); WO200224909 (실시예 3; 도 3);
상호-참조: MIM:606269; NP_443177.1; NM_052945_1; AF132600
(27) CD22 (B-세포 수용체 CD22-B 이소형, BL-CAM, Lyb-8, Lyb8, SIGLEC-2, FLJ22814, 진뱅크 수탁 번호 AK026467);
문헌 [Wilson et al. (1991) J. Exp. Med. 173:137-146]; WO2003072036 (청구항 1; 도 1);
상호-참조: MIM:107266; NP_001762.1; NM_001771_1
(28) CD79a (CD79A, CD79α, 이뮤노글로불린-연관 알파, Ig 베타 (CD79B)와 공유적으로 상호작용하고 표면 상에서 Ig M 분자와 복합체를 형성하며 B-세포 분화에 관련된 신호를 변환시키는 B 세포-특이적 단백질), pI: 4.84, MW: 25028 TM: 2 [P] 유전자 염색체: 19q13.2, 진뱅크 수탁 번호 NP_001774.10)
WO2003088808, US20030228319; WO2003062401 (청구항 9); US2002150573 (청구항 4, 페이지 13-14); WO9958658 (청구항 13, 도 16); WO9207574 (도 1); US5644033; 문헌 [Ha et al. (1992) J. Immunol. 148(5):1526-1531; Mueller et al. (1992) Eur. J. Biochem. 22:1621-1625; Hashimoto et al. (1994) Immunogenetics 40(4):287-295; Preud'homme et al. (1992) Clin. Exp. Immunol. 90(1):141-146; Yu et al. (1992) J. Immunol. 148(2) 633-637; Sakaguchi et al. (1988) EMBO J. 7(11):3457-3464];
(29) CXCR5 (버킷 림프종 수용체 1, CXCL13 케모카인에 의해 활성화되고 림프구 이동 및 체액 방어에서 기능하며 HIV-2 감염 및 아마도 AIDS, 림프종, 골수종 및 백혈병의 발생에서 역할을 하는 G 단백질-커플링된 수용체); 372 aa, pI: 8.54 MW: 41959 TM: 7 [P] 유전자 염색체: 11q23.3, 진뱅크 수탁 번호 NP_001707.1)
WO2004040000; WO2004015426; US2003105292 (실시예 2); US6555339 (실시예 2); WO200261087 (도 1); WO200157188 (청구항 20, 페이지 269); WO200172830 (페이지 12-13); WO200022129 (실시예 1, 페이지 152-153, 실시예 2, 페이지 254-256); WO9928468 (청구항 1, 페이지 38); US5440021 (실시예 2, col 49-52); WO9428931 (페이지 56-58); WO9217497 (청구항 7, 도 5); 문헌 [Dobner et al. (1992) Eur. J. Immunol. 22:2795-2799; Barella et al. (1995) Biochem. J. 309:773-779];
(30) HLA-DOB (펩티드에 결합하고 이를 CD4+ T 림프구에 제시하는 MHC 부류 II 분자의 베타 서브유닛 (Ia 항원)); 273 aa, pI: 6.56 MW: 30820 TM: 1 [P] 유전자 염색체: 6p21.3, 진뱅크 수탁 번호 NP_002111.1)
문헌 [Tonnelle et al. (1985) EMBO J. 4(11):2839-2847; Jonsson et al. (1989) Immunogenetics 29(6):411-413; Beck et al. (1992) J. Mol. Biol. 228:433-441; Strausberg et al. (2002) Proc. Natl. Acad. Sci USA 99:16899-16903; Servenius et al. (1987) J. Biol. Chem. 262:8759-8766; Beck et al. (1996) J. Mol. Biol. 255:1-13; Naruse et al. (2002) Tissue Antigens 59:512-519]; WO9958658 (청구항 13, 도 15); US6153408 (Col 35-38); US5976551 (col 168-170); US6011146 (col 145-146); 문헌 [Kasahara et al. (1989) Immunogenetics 30(1):66-68; Larhammar et al. (1985) J. Biol. Chem. 260(26):14111-14119];
(31) P2X5 (퓨린성 수용체 P2X 리간드-게이팅 이온 채널 5, 세포외 ATP에 의해 게이팅된 이온 채널 (시냅스 전달 및 신경발생에 관련될 수 있고, 결핍은 특발성 배뇨근 불안정의 병리생리상태에 기여할 수 있음); 422 aa), pI: 7.63, MW: 47206 TM: 1 [P] 유전자 염색체: 17p13.3, 진뱅크 수탁 번호 NP_002552.2)
문헌 [Le et al. (1997) FEBS Lett. 418(1-2):195-199]; WO2004047749; WO2003072035 (청구항 10); 문헌 [Touchman et al. (2000) Genome Res. 10:165-173]; WO200222660 (청구항 20); WO2003093444 (청구항 1); WO2003087768 (청구항 1); WO2003029277 (페이지 82);
(32) CD72 (B-세포 분화 항원 CD72, Lyb-2) 단백질 서열 전체 maeaity...tafrfpd (1..359; 359 aa), pI: 8.66, MW: 40225 TM: 1 [P] 유전자 염색체: 9p13.3, 진뱅크 수탁 번호 NP_001773.1)
WO2004042346 (청구항 65); WO2003026493 (페이지 51-52, 57-58); WO200075655 (페이지 105-106); 문헌 [Von Hoegen et al. (1990) J. Immunol. 144(12):4870-4877; Strausberg et al. (2002) Proc. Natl. Acad. Sci USA 99:16899-16903];
(33) LY64 (림프구 항원 64 (RP105), 류신 풍부 반복부 (LRR) 패밀리의 유형 I 막 단백질 (B-세포 활성화 및 아폽토시스를 조절하고, 기능 상실은 전신 홍반성 루푸스를 갖는 환자에서 증가된 질환 활성과 연관됨); 661 aa, pI: 6.20, MW: 74147 TM: 1 [P] 유전자 염색체: 5q12, 진뱅크 수탁 번호 NP_005573.1)
US2002193567; WO9707198 (청구항 11, 페이지 39-42); 문헌 [Miura et al. (1996) Genomics 38(3):299-304; Miura et al. (1998) Blood 92:2815-2822]; WO2003083047; WO9744452 (청구항 8, 페이지 57-61); WO200012130 (페이지 24-26);
(34) FcRH1 (Fc 수용체-유사 단백질 1, C2 유형 Ig-유사 및 ITAM 도메인을 함유하는 이뮤노글로불린 Fc 도메인에 대한 추정 수용체 (B-림프구 분화에서 역할을 할 수 있음); 429 aa, pI: 5.28, MW: 46925 TM: 1 [P] 유전자 염색체: 1q21-1q22, 진뱅크 수탁 번호 NP_443170.1)
WO2003077836; WO200138490 (청구항 6, 도 18E-1-18-E-2); 문헌 [Davis et al. (2001) Proc. Natl. Acad. Sci USA 98(17):9772-9777]; WO2003089624 (청구항 8); EP1347046 (청구항 1); WO2003089624 (청구항 7);
(35) IRTA2 (이뮤노글로불린 슈퍼패밀리 수용체 전위 연관 2, B 세포 발생 및 림프종발생에서 가능한 역할을 갖는 추정 면역수용체; 전위에 의한 유전자의 탈조절이 일부 B 세포 악성종양에서 일어남); 977 aa, pI: 6.88 MW: 106468 TM: 1 [P] 유전자 염색체: 1q21, 진뱅크 수탁 번호 인간:AF343662, AF343663, AF343664, AF343665, AF369794, AF397453, AK090423, AK090475, AL834187, AY358085; 마우스:AK089756, AY158090, AY506558; NP_112571.1
WO2003024392 (청구항 2, 도 97); 문헌 [Nakayama et al. (2000) Biochem. Biophys. Res. Commun. 277(1):124-127]; WO2003077836; WO200138490 (청구항 3, 도 18B-1-18B-2);
(36) TENB2 (TMEFF2, 토모레귤린, TPEF, HPP1, TR, 추정 막횡단 프로테오글리칸 (성장 인자의 EGF/헤레귤린 패밀리 및 폴리스타틴과 관련됨)); 374 aa, NCBI 수탁: AAD55776, AAF91397, AAG49451, NCBI RefSeq: NP_057276; NCBI 유전자: 23671; OMIM: 605734; 스위스프로트 Q9UIK5; 진뱅크 수탁 번호 AF179274; AY358907, CAF85723, CQ782436
WO2004074320 (서열식별번호: 810); JP2004113151 (서열식별번호: 2, 4, 8); WO2003042661 (서열식별번호: 580); WO2003009814 (서열식별번호: 411); EP1295944 (페이지 69-70); WO200230268 (페이지 329); WO200190304 (서열식별번호: 2706); US2004249130; US2004022727; WO2004063355; US2004197325; US2003232350; US2004005563; US2003124579; 문헌 [Horie et al. (2000) Genomics 67:146-152; Uchida et al. (1999) Biochem. Biophys. Res. Commun. 266:593-602; Liang et al. (2000) Cancer Res. 60:4907-12; Glynne-Jones et al. (2001) Int J Cancer. Oct 15;94(2):178-84];
(37) PMEL17 (은 상동체; SILV; D12S53E; PMEL17; (SI); (SIL); ME20; gp100) BC001414; BT007202; M32295; M77348; NM_006928; 문헌 [McGlinchey, R.P. et al. (2009) Proc. Natl. Acad. Sci. U.S.A. 106 (33), 13731-13736; Kummer, M.P. et al. (2009) J. Biol. Chem. 284 (4), 2296-2306];
(38) TMEFF1 (EGF-유사 및 2개의 폴리스타틴-유사 도메인을 갖는 막횡단 단백질 1; 토모레귤린-1; H7365; C9orf2; C9ORF2; U19878; X83961) NM_080655; NM_003692; 문헌 [Harms, P.W. (2003) Genes Dev. 17 (21), 2624-2629; Gery, S. et al. (2003) Oncogene 22 (18):2723-2727];
(39) GDNF-Ra1 (GDNF 패밀리 수용체 알파 1; GFRA1; GDNFR; GDNFRA; RETL1; TRNR1; RET1L; GDNFR-알파1; GFR-알파-1; U95847; BC014962; NM_145793) NM_005264; 문헌 [Kim, M.H. et al. (2009) Mol. Cell. Biol. 29 (8), 2264-2277; Treanor, J.J. et al. (1996) Nature 382 (6586):80-83];
(40) Ly6E (림프구 항원 6 복합체, 유전자좌 E; Ly67,RIG-E,SCA-2,TSA-1) NP_002337.1; NM_002346.2; 문헌 [de Nooij-van Dalen, A.G. et al. (2003) Int. J. Cancer 103 (6), 768-774; Zammit, D.J. et al. (2002) Mol. Cell. Biol. 22 (3):946-952];
(41) TMEM46 (shisa 상동체 2 (크세노푸스 라에비스(Xenopus laevis)); SHISA2) NP_001007539.1; NM_001007538.1; 문헌 [Furushima, K. et al. (2007) Dev. Biol. 306 (2), 480-492; Clark, H.F. et al. (2003) Genome Res. 13 (10):2265-2270];
(42) Ly6G6D (림프구 항원 6 복합체, 유전자좌 G6D; Ly6-D, MEGT1) NP_067079.2; NM_021246.2; 문헌 [Mallya, M. et al. (2002) Genomics 80 (1):113-123; Ribas, G. et al. (1999) J. Immunol. 163 (1):278-287];
(43) LGR5 (류신-풍부 반복부-함유 G 단백질-커플링된 수용체 5; GPR49, GPR67) NP_003658.1; NM_003667.2; 문헌 [Salanti, G. et al. (2009) Am. J. Epidemiol. 170 (5):537-545; Yamamoto, Y. et al. (2003) Hepatology 37 (3):528-533];
(44) RET (ret 원종양유전자; MEN2A; HSCR1; MEN2B; MTC1; (PTC); CDHF12; Hs.168114; RET51; RET-ELE1) NP_066124.1; NM_020975.4; 문헌 [Tsukamoto, H. et al. (2009) Cancer Sci. 100 (10):1895-1901; Narita, N. et al. (2009) Oncogene 28 (34):3058-3068];
(45) LY6K (림프구 항원 6 복합체, 유전자좌 K; LY6K; HSJ001348; FLJ35226) NP_059997.3; NM_017527.3; 문헌 [Ishikawa, N. et al. (2007) Cancer Res. 67 (24):11601-11611; de Nooij-van Dalen, A.G. et al. (2003) Int. J. Cancer 103 (6):768-774];
(46) GPR19 (G 단백질-커플링된 수용체 19; Mm.4787) NP_006134.1; NM_006143.2; 문헌 [Montpetit, A. and Sinnett, D. (1999) Hum. Genet. 105 (1-2):162-164; O'Dowd, B.F. et al. (1996) FEBS Lett. 394 (3):325-329];
(47) GPR54 (KISS1 수용체; KISS1R; GPR54; HOT7T175; AXOR12) NP_115940.2; NM_032551.4; 문헌 [Navenot, J.M. et al. (2009) Mol. Pharmacol. 75 (6):1300-1306; Hata, K. et al. (2009) Anticancer Res. 29 (2):617-623];
(48) ASPHD1 (아스파르테이트 베타-히드록실라제 도메인 함유 1; LOC253982) NP_859069.2; NM_181718.3; 문헌 [Gerhard, D.S. et al. (2004) Genome Res. 14 (10B):2121-2127];
(49) 티로시나제 (TYR; OCAIA; OCA1A; 티로시나제; SHEP3) NP_000363.1; NM_000372.4; 문헌 [Bishop, D.T. et al. (2009) Nat. Genet. 41 (8):920-925; Nan, H. et al. (2009) Int. J. Cancer 125 (4):909-917];
(50) TMEM118 (ring 핑거 단백질, 막횡단 2; RNFT2; FLJ14627) NP_001103373.1; NM_001109903.1; 문헌 [Clark, H.F. et al. (2003) Genome Res. 13 (10):2265-2270; Scherer, S.E. et al. (2006) Nature 440 (7082):346-351]
(51) GPR172A (G 단백질-커플링된 수용체 172A; GPCR41; FLJ11856; D15Ertd747e) NP_078807.1; NM_024531.3; 문헌 [Ericsson, T.A. et al. (2003) Proc. Natl. Acad. Sci. U.S.A. 100 (11):6759-6764; Takeda, S. et al. (2002) FEBS Lett. 520 (1-3):97-101].
한 실시양태에서, 항체는 하기 폴리펩티드 중 1개 이상에 결합한다: BMPR1B; E16; STEAP1; 0772P; MPF; NaPi2b; Sema 5b; PSCA hlg; ETBR; MSG783; STEAP2; TrpM4; CRIPTO; CD21; CD79b; FcRH2; HER2; NCA; MDP; IL20Rα; 브레비칸; EphB2R; ASLG659; PSCA; GEDA; BAFF-R; CD22; CD79a; CXCR5; HLA-DOB; P2X5; CD72; LY64; FcRH1; IRTA2; TENB2; PMEL17; TMEFF1; GDNF-Ra1; Ly6E; TMEM46; Ly6G6D; LGR5; RET; LY6K; GPR19; GPR54; ASPHD1; 티로시나제; TMEM118; GPR172A; 및 CD33.
한 실시양태에서, 항체는 BMPR1B에 결합하고;
한 실시양태에서, 항체는 E16에 결합하고;
한 실시양태에서, 항체는 STEAP1에 결합하고;
한 실시양태에서, 항체는 0772P에 결합하고;
한 실시양태에서, 항체는 MPF에 결합하고;
한 실시양태에서, 항체는 NaPi2b에 결합하고;
한 실시양태에서, 항체는 Sema 5b에 결합하고;
한 실시양태에서, 항체는 PSCA hlg에 결합하고;
한 실시양태에서, 항체는 ETBR에 결합하고;
한 실시양태에서, 항체는 MSG783에 결합하고;
한 실시양태에서, 항체는 STEAP2에 결합하고;
한 실시양태에서, 항체는 TrpM4에 결합하고;
한 실시양태에서, 항체는 CRIPTO에 결합하고;
한 실시양태에서, 항체는 CD21에 결합하고;
한 실시양태에서, 항체는 CD79b에 결합하고;
한 실시양태에서, 항체는 FcRH2에 결합하고;
한 실시양태에서, 항체는 HER2에 결합하고;
한 실시양태에서, 항체는 NCA에 결합하고;
한 실시양태에서, 항체는 MDP에 결합하고;
한 실시양태에서, 항체는 IL20Rα에 결합하고;
한 실시양태에서, 항체는 브레비칸에 결합하고;
한 실시양태에서, 항체는 EphB2R에 결합하고;
한 실시양태에서, 항체는 ASLG659에 결합하고;
한 실시양태에서, 항체는 PSCA에 결합하고;
한 실시양태에서, 항체는 GEDA에 결합하고;
한 실시양태에서, 항체는 BAFF-R에 결합하고;
한 실시양태에서, 항체는 CD22에 결합하고;
한 실시양태에서, 항체는 CD79a에 결합하고;
한 실시양태에서, 항체는 CXCR5에 결합하고;
한 실시양태에서, 항체는 HLA-DOB에 결합하고;
한 실시양태에서, 항체는 P2X5에 결합하고;
한 실시양태에서, 항체는 CD72에 결합하고;
한 실시양태에서, 항체는 LY64에 결합하고;
한 실시양태에서, 항체는 FcRH1에 결합하고;
한 실시양태에서, 항체는 IRTA2에 결합하고;
한 실시양태에서, 항체는 TENB2에 결합하고;
한 실시양태에서, 항체는 PMEL17에 결합하고;
한 실시양태에서, 항체는 TMEFF1에 결합하고;
한 실시양태에서, 항체는 GDNF-Ra1에 결합하고;
한 실시양태에서, 항체는 Ly6E에 결합하고;
한 실시양태에서, 항체는 TMEM46에 결합하고;
한 실시양태에서, 항체는 Ly6G6D에 결합하고;
한 실시양태에서, 항체는 LGR5에 결합하고;
한 실시양태에서, 항체는 RET에 결합하고;
한 실시양태에서, 항체는 LY6K에 결합하고;
한 실시양태에서, 항체는 GPR19에 결합하고;
한 실시양태에서, 항체는 GPR54에 결합하고;
한 실시양태에서, 항체는 ASPHD1에 결합하고;
한 실시양태에서, 항체는 티로시나제에 결합하고;
한 실시양태에서, 항체는 TMEM118에 결합하고;
한 실시양태에서, 항체는 GPR172A에 결합하고;
한 실시양태에서, 항체는 CD33에 결합한다.
모 항체는 또한 알부민-결합 펩티드 (ABP) 서열을 포함하는 융합 단백질일 수 있다 (Dennis et al. (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" J Biol Chem. 277:35035-35043; WO 01/45746). 본 발명의 항체는 (i) 문헌 [Dennis et al. (2002) J Biol Chem. 277:35035-35043]의 표 III 및 IV, 페이지 35038; (ii) US 20040001827의 [0076]; 및 (iii) WO 01/45746의 페이지 12-13 (이들 모두는 본원에 참조로 포함됨)에 교시된 ABP 서열을 갖는 융합 단백질을 포함한다.
항체는, 예를 들어 US 4816567에서 기술된 바와 같이 및 관련 기술분야에 공지된 바와 같이 재조합 방법 및 조성물을 사용하여 생산될 수 있다. 일부 실시양태에서, 항체는 진핵 숙주 세포 (예를 들어, 포유동물 숙주 세포)에서 생산된다. 일부 실시양태에서, 항체는 원핵 숙주 세포 (예를 들어, 이. 콜라이(E. coli))에서 생산된다.
특정 실시양태에서, 1개 이상의 아미노산 변형이 본원에 제공된 항체의 Fc 영역에 도입되어 Fc 영역 변이체가 생성될 수 있다. Fc 영역 변이체는 1개 이상의 아미노산 위치에서 아미노산 변형 (예를 들어, 치환)을 포함하는 인간 Fc 영역 서열 (예를 들어, 인간 IgG1, IgG2, IgG3 또는 IgG4 Fc 영역)을 포함할 수 있다.
특정 실시양태에서, 본 발명은, 모든 이펙터 기능은 아니지만 일부 이펙터 기능을 보유하며, 생체내 항체 반감기가 중요하긴 하지만 특정 이펙터 기능 (예컨대 보체 및 ADCC)이 불필요하거나 유해한 적용에 대한 바람직한 후보가 되는 항체 변이체를 고려한다. CDC 및/또는 ADCC 활성의 감소/고갈을 확인하기 위해 시험관내 및/또는 생체내 세포독성 검정이 수행될 수 있다. 예를 들어, 항체에 FcγR 결합이 결여되어 있지만 (따라서 ADCC 활성 결여 가능성이 있음) FcRn 결합 능력은 보유하는 것을 보장하기 위해 Fc 수용체 (FcR) 결합 검정이 수행될 수 있다.
ADC의 약물 로딩
약물 로딩은 항체당 약물 모이어티의 평균 수이다. 약물 로딩은 항체 (Ab) 1개당 1개 내지 8개의 약물 (D) 범위일 수 있으며, 즉 1, 2, 3, 4, 5, 6, 7 및 8개의 약물 모이어티가 항체에 공유 부착된다. ADC의 조성물은 1 내지 8개 범위의 약물과 접합된 항체의 집합체를 포함한다. 접합 반응에 의한 ADC의 제제에서의 항체당 약물의 평균 수는 통상적인 수단, 예를 들어 질량 분광분석, ELISA 검정, 전기영동 및 HPLC에 의해 특성화될 수 있다. 또한, ADC의 정략적 분포가 p의 측면에서 결정될 수 있다. ELISA에 의해, ADC의 특정한 제제에서의 p의 평균 값을 결정할 수 있다 (Hamblett et al. (2004) Clin. Cancer Res. 10:7063-7070; Sanderson et al. (2005) Clin. Cancer Res. 11:843-852). 그러나, p (약물) 값의 분포는 항체-항원 결합 및 ELISA의 검출 한계로 인해 식별불가능하다. 또한, 항체-약물 접합체를 검출하기 위한 ELISA 검정은 약물 모이어티가 항체, 예컨대 중쇄 또는 경쇄 단편, 또는 특정한 아미노산 잔기에 부착되는 위치를 결정하지 못한다. 일부 경우에, p가 다른 약물 로딩을 갖는 ADC로부터의 특정 값인 균질 ADC의 분리, 정제 및 특성화는 역상 HPLC 또는 전기영동과 같은 수단에 의해 달성될 수 있다.
일부 항체-약물 접합체의 경우에, p는 항체 상의 부착 부위의 수에 의해 제한될 수 있다. 예를 들어, 항체는 시스테인 티올 기를 단지 1개 또는 수개 가질 수도 있거나, 또는 링커가 부착될 수 있는 충분히 반응성인 티올 기를 단지 1개 또는 수개 가질 수 있다. 약물 로딩이 높을수록 (예를 들어 p >5), 특정 항체-약물 접합체의 응집, 불용성, 독성, 또는 세포 투과성 상실이 유발될 수 있다.
전형적으로, 이론적 최대치 미만의 약물 모이어티가 접합 반응 동안 항체에 접합된다. 항체는 예를 들어 링커-약물 중간체 (X-L-D) 또는 링커 시약과 반응하지 않는 다수의 리신 잔기를 함유할 수 있다. 오직 가장 반응성인 리신 기만이 아민-반응성 링커 시약과 반응할 수 있다. 또한, 오직 가장 반응성인 시스테인 티올 기만이 티올-반응성 링커 시약 또는 링커-약물 중간체와 반응할 수 있다. 일반적으로, 항체는 약물 모이어티에 연결될 수 있는 유리 및 반응성 시스테인 티올 기를 함유하더라도 다수 함유하지는 않는다. 화합물의 항체 내의 대부분의 시스테인 티올 잔기는 디술피드 가교로 존재하고, 부분적 또는 완전한 환원 조건 하에 환원제, 예컨대 디티오트레이톨 (DTT) 또는 TCEP를 사용하여 환원시켜야 한다. ADC의 로딩 (약물/항체 비, "DAR")은 (i) 항체에 대한 몰 과량의 약물-링커 중간체 또는 링커 시약의 제한, (ii) 접합 반응 시간 또는 온도의 제한, 및 (iii) 시스테인 티올 변형에 대한 부분적 또는 제한적 환원 조건을 포함한 여러 상이한 방식으로 제어될 수 있다.
항체의 1개 초과의 친핵성 또는 친전자성 기가 약물-링커 중간체 또는 링커 시약에 이어서 이량체 약물 모이어티 시약과 반응하는 경우에, 생성된 생성물은 항체에 부착된 약물 모이어티의 분포가 예를 들어 1, 2, 3 등인 항체-약물 접합체의 혼합물이다. 액체 크로마토그래피 방법, 예컨대 중합체 역상 (PLRP) 및 소수성 상호작용 (HIC)은 혼합물 중의 화합물을 약물 로딩 값에 따라 분리할 수 있다. 단일 약물 로딩 값 (p)을 갖는 ADC의 제제가 단리될 수 있지만, 이들 단일 로딩 값 ADC는, 약물 모이어티가 항체 상의 여러 부위에서 링커를 통해 부착될 수 있기 때문에 여전히 불균질 혼합물일 수 있다. 따라서, 본 발명의 항체-약물 접합체 조성물은 항체가 1개 이상의 약물 모이어티를 가지며 약물 모이어티가 다양한 아미노산 잔기에서 항체에 부착될 수 있는 항체-약물 접합체 화합물의 혼합물을 포함한다.
예시적인 약물 모이어티
메이탄신 및 메이탄시노이드
일부 실시양태에서, 면역접합체는 1개 이상의 메이탄시노이드 분자에 접합된 항체를 포함한다. 메이탄시노이드는 메이탄신의 유도체이고, 튜불린 중합을 억제함으로써 작용하는 유사분열 억제제이다. 메이탄신은 동아프리카 관목 메이테누스 세라타(Maytenus serrata)로부터 처음 단리되었다 (미국 특허 번호 3896111). 후속적으로, 특정 미생물이 또한 메이탄시노이드, 예컨대 메이탄시놀 및 C-3 메이탄시놀 에스테르를 생산하는 것으로 발견되었다 (미국 특허 번호 4,151,042). 합성 메이탄시노이드는, 예를 들어 미국 특허 번호 4,137,230; 4,248,870; 4,256,746; 4,260,608; 4,265,814; 4,294,757; 4,307,016; 4,308,268; 4,308,269; 4,309,428; 4,313,946; 4,315,929; 4,317,821; 4,322,348; 4,331,598; 4,361,650; 4,364,866; 4,424,219; 4,450,254; 4,362,663; 및 4,371,533에 개시되어 있다.
메이탄시노이드 약물 모이어티는 이들이 (i) 발효 또는 발효 생성물의 화학적 변형 또는 유도체화에 의해 제조하는 것에 비교적 이용가능하고, (ii) 비-디술피드 링커를 통해 항체에 접합시키기에 적합한 관능기로의 유도체화가 가능하고, (iii) 혈장 중에서 안정하고, (iv) 다양한 종양 세포주에 대해 효과적이기 때문에, 항체-약물 접합체에서 매력적인 약물 모이어티이다.
메이탄시노이드 약물 모이어티로서 사용하기에 적합한 특정 메이탄시노이드는 관련 기술분야에 공지되어 있으며, 공지된 방법에 따라 천연 공급원으로부터 단리되거나 또는 유전 공학 기술을 사용하여 생산될 수 있다 (예를 들어, 문헌 [Yu et al (2002) PNAS 99:7968-7973] 참조). 메이탄시노이드는 또한 공지된 방법에 따라 합성적으로 제조될 수 있다.
예시적인 메이탄시노이드 약물 모이어티는 변형된 방향족 고리를 갖는 것, 예컨대 C-19-데클로로 (미국 특허 번호 4256746) (예를 들어, 안사미토신 P2의 수소화알루미늄리튬 환원에 의해 제조됨); C-20-히드록시 (또는 C-20-데메틸) +/-C-19-데클로로 (미국 특허 번호 4361650 및 4307016) (예를 들어, 스트렙토미세스(Streptomyces) 또는 악티노미세스(Actinomyces)를 사용한 탈메틸화 또는 LAH를 사용한 탈염소화에 의해 제조됨); 및 C-20-데메톡시, C-20-아실옥시 (-OCOR), +/-데클로로 (미국 특허 번호 4,294,757) (예를 들어, 아실 클로라이드를 사용한 아실화에 의해 제조됨) 및 방향족 고리의 다른 위치에 변형을 갖는 것을 포함하나, 이에 제한되지는 않는다.
예시적인 메이탄시노이드 약물 모이어티는 또한 변형을 갖는 것, 예컨대 C-9-SH (미국 특허 번호 4424219) (예를 들어, 메이탄시놀과 H2S 또는 P2S5와의 반응에 의해 제조됨); C-14-알콕시메틸(데메톡시/CH2 OR) (US 4331598); C-14-히드록시메틸 또는 아실옥시메틸 (CH2OH 또는 CH2OAc) (미국 특허 번호 4450254) (예를 들어, 노카르디아(Nocardia)로부터 제조됨); C-15-히드록시/아실옥시 (US 4364866) (예를 들어, 스트렙토미세스에 의한 메이탄시놀의 전환에 의해 제조됨); C-15-메톡시 (미국 특허 번호 4313946 및 4315929) (예를 들어, 트레위아 누디플로라(Trewia nudiflora)로부터 단리됨); C-18-N-데메틸 (미국 특허 번호 4362663 및 4322348) (예를 들어, 스트렙토미세스에 의한 메이탄시놀의 탈메틸화에 의해 제조됨); 및 4,5-데옥시 (US 4371533) (예를 들어, 메이탄시놀의 삼염화티타늄/LAH 환원에 의해 제조됨)를 포함한다.
메이탄시노이드 화합물 상의 많은 위치는 연결 위치로서 유용하다. 예를 들어, 에스테르 연결은 통상적인 커플링 기술을 사용한 히드록실 기와의 반응에 의해 형성될 수 있다. 일부 실시양태에서, 반응은 히드록실 기를 갖는 C-3 위치, 히드록시메틸로 변형된 C-14 위치, 히드록실 기로 변형된 C-15 위치 및 히드록실 기를 갖는 C-20 위치에서 발생할 수 있다. 일부 실시양태에서, 연결은 메이탄시놀 또는 메이탄시놀 유사체의 C-3 위치에서 형성된다.
메이탄시노이드 약물 모이어티는 하기 구조를 갖는 것을 포함한다.
여기서 파상선은 ADC의 링커에 대한 메이탄시노이드 약물 모이어티의 황 원자의 공유 부착을 나타낸다. 각각의 R은 독립적으로 H 또는 C1-C6 알킬일 수 있다. 황 원자에 아미드 기를 부착시키는 알킬렌 쇄는 메타닐, 에타닐 또는 프로필일 수 있으며, 즉 m은 1, 2 또는 3이다 (US 633410; US 5208020; 문헌 [Chari et al. (1992) Cancer Res. 52:127-131; Liu et al. (1996) Proc. Natl. Acad. Sci USA 93:8618-8623]).
본 발명의 ADC에 대해 메이탄시노이드 약물 모이어티의 모든 입체이성질체, 즉 키랄 탄소에서의 R 및 S 배위의 임의의 조합이 고려된다 (그 전문이 본원에 참조로 포함되는 US 7276497; US 6913748; US 6441163; US 633410 (RE39151); US 5208020; 문헌 [Widdison et al. (2006) J. Med. Chem. 49:4392-4408]). 일부 실시양태에서, 메이탄시노이드 약물 모이어티는 하기 입체화학을 갖는다.
메이탄시노이드 약물 모이어티의 예시적 실시양태는 하기 구조를 갖는 DM1; DM3; 및 DM4를 포함하나, 이에 제한되지는 않는다.
여기서 파상선은 항체-약물 접합체의 링커 (L)에 대한 약물의 황 원자의 공유 부착을 나타낸다.
다른 예시적인 메이탄시노이드 항체-약물 접합체는 하기 구조 및 약어를 갖는다 (여기서, Ab는 항체이고, p는 1 내지 약 20임. 일부 실시양태에서, p는 1 내지 10이거나, p는 1 내지 7이거나, p는 1 내지 5이거나, 또는 p는 1 내지 4임).
DM1이 BMPEO 링커를 통해 항체의 티올 기에 연결된 예시적인 항체-약물 접합체는 하기 구조 및 약어를 갖는다.
여기서 Ab는 항체이고; n은 0, 1 또는 2이고; p는 1 내지 약 20이다. 일부 실시양태에서, p는 1 내지 10이거나, p는 1 내지 7이거나, p는 1 내지 5이거나, 또는 p는 1 내지 4이다.
메이탄시노이드를 함유하는 면역접합체, 그의 제조 방법 및 그의 치료 용도는, 예를 들어 그 개시내용이 명백하게 본원에 참조로 포함되는 미국 특허 번호 5,208,020 및 5,416,064; US 2005/0276812 A1; 및 유럽 특허 EP 0 425 235 B1에 개시되어 있다. 예를 들어, 문헌 [Liu et al. Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996); 및 Chari et al. Cancer Research 52:127-131 (1992)]을 참조한다.
일부 실시양태에서, 항체-메이탄시노이드 접합체는 항체 또는 메이탄시노이드 분자의 생물학적 활성을 유의하게 감소시키지 않으면서 항체를 메이탄시노이드 분자에 화학적으로 연결시킴으로써 제조될 수 있다. 예를 들어, 미국 특허 번호 5,208,020 (그 개시내용이 명백하게 본원에 참조로 포함됨)을 참조한다. 일부 실시양태에서, 항체 분자당 평균 3-4개의 메이탄시노이드 분자가 접합된 ADC는 항체의 기능 또는 용해도에 부정적인 영향을 미치지 않으면서 표적 세포의 세포독성을 증진시키는데 있어서 효능을 가졌다. 일부 경우에, 심지어 독소/항체의 1개의 분자도 네이키드 항체의 사용에 비해 세포독성을 증진시킬 것으로 예상된다.
항체-메이탄시노이드 접합체를 제조하기 위한 예시적인 연결기는, 예를 들어 본원에 기재된 것, 및 그 개시내용이 명백하게 본원에 참조로 포함되는 미국 특허 번호 5208020; 유럽 특허 0 425 235 B1; 문헌 [Chari et al. Cancer Research 52:127-131 (1992)]; US 2005/0276812 A1; 및 US 2005/016993 A1에 개시된 것을 포함한다.
칼리케아미신
일부 실시양태에서, 면역접합체는 1개 이상의 칼리케아미신 분자에 접합된 항체를 포함한다. 칼리케아미신 패밀리의 항생제 및 그의 유사체는 피코몰 미만의 농도에서 이중-가닥 DNA 절단을 생성시킬 수 있다 (Hinman et al., (1993) Cancer Research 53:3336-3342; Lode et al., (1998) Cancer Research 58:2925-2928). 칼리케아미신은 세포내 작용 부위를 갖지만, 특정 경우에는 형질 막을 용이하게 통과하지 못한다. 따라서, 항체-매개 내재화를 통한 이들 작용제의 세포 흡수는 일부 실시양태에서 그의 세포독성 효과를 크게 증진시킬 수 있다. 칼리케아미신 약물 모이어티를 갖는 항체-약물 접합체를 제조하는 비제한적 예시적인 방법은, 예를 들어 US 5712374; US 5714586; US 5739116; 및 US 5767285에 기재되어 있다.
CBI 이량체
일부 실시양태에서, 약물 모이어티는 하기 화학식을 갖는 CBI 이량체이다.
여기서
R11은 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
R22는 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
Raa 및 Rbb는 독립적으로 H, 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나,
또는 Raa와 Rbb는 5 또는 6원 헤테로시클로알킬 기를 형성하고;
T는 C3-C12알킬렌, Y1, (C1-C6알킬렌)-Y1-(C1-C6 알킬렌), (C1-C6알킬렌)-Y1-(C1-C6알킬렌)-Y1-(C1-C6알킬렌), (C2-C6알케닐렌)-Y1-(C2-C6알케닐렌) 및 (C2-C6알키닐렌)-Y1-(C2-C6알키닐렌)으로부터 선택된 테더 기이고;
여기서 Y1는 독립적으로 O, S, NR11, 아릴 및 헤테로아릴로부터 선택되고;
여기서 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 F, OH, O(C1-C6알킬), NH2, NHCH3, N(CH3)2, OP(O)3H2 및 C1-C6알킬로 독립적으로 및 임의로 치환되고, 여기서 알킬은 1개 이상의 F로 임의로 치환되거나;
또는 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 L에 대한 결합으로 독립적으로 및 임의로 치환되고;
D'는
로부터 선택된 약물 모이어티이고,
여기서 파상선은 T에 대한 부착 부위를 나타내고;
X1 및 X2는 독립적으로 O 및 NR33으로부터 선택되고, 여기서 R33은 H, 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나, 또는 X1 및 X2는 각각 독립적으로 부재하고;
R44는 H, CO2R, C(O), 또는 L에 대한 결합이고, 여기서 R은 C1-C6알킬 또는 벤질이고;
R55는 H 또는 C1-C6알킬이다.
다른 약물 모이어티
약물 모이어티는 또한 겔다나마이신 (Mandler et al. (2000) J. Nat. Cancer Inst. 92(19):1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2002) Bioconjugate Chem. 13:786-791); 및 디프테리아 A 쇄, 디프테리아 독소의 비결합 활성 단편, 외독소 A 쇄 (슈도모나스 아에루기노사(Pseudomonas aeruginosa)로부터), 리신 A 쇄, 아브린 A 쇄, 모데신 A 쇄, 알파-사르신, 알레우리테스 포르디이(Aleurites fordii) 단백질, 디안틴 단백질, 피토라카 아메리카나(Phytolaca americana) 단백질 (PAPI, PAPII 및 PAP-S), 모모르디카 카란티아(momordica charantia) 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스(sapaonaria officinalis) 억제제, 겔로닌, 미토겔린, 레스트릭토신, 페노마이신, 에노마이신 및 트리코테센을 포함하나, 이에 제한되지는 않는 그의 효소적 활성 독소 및 단편을 포함한다. 예를 들어, WO 93/21232를 참조한다. 약물 모이어티는 또한 핵산분해 활성을 갖는 화합물 (예를 들어, 리보뉴클레아제 또는 DNA 엔도뉴클레아제)을 포함한다.
항생제
항체에 접합될 수 있는 항생제는 클린다마이신, 노보비오신, 레타파물린, 답토마이신, GSK-2140944, CG-400549, 시타플록사신, 테이코플라닌, 트리클로산, 나프티리돈, 라데졸리드, 독소루비신, 암피실린, 반코마이신, 이미페넴, 도리페넴, 겜시타빈, 달바반신 및 아지트로마이신을 포함한다. 이러한 항생제의 살박테리아 및 정박테리아 작용 메카니즘은 (i) 세포벽, 펩티도글리칸 신장의 억제 (반코마이신, 테이코플라닌, 달바반신); (ii) 세포벽, 페니실린-결합 단백질 가교의 억제 (이미페넴, 도리페넴, 암피실린); (iii) 세포 막 탈분극 (답토마이신); (iv) DNA 복제의 파괴 (겜시타빈); (v) DNA 결합 (독소루비신); (vi) 에노일 ACP-리덕타제 FABI (CG-400549, 트리클로산, 나프티리돈); (vii) 리보솜 단백질 합성, 리보솜 30S의 억제 (클린다마이신, 레타파물린, 라데졸리드); 및 (viii) 토포이소머라제 (topoIIA) 억제제 (노보비오신, 시타플록사신, GSK-2140944)를 포함하나, 이에 제한되지는 않는다. 구조적으로, 대부분의 항생제는 (i) 아미노글리코시드; (ii) 베타-락탐; (iii) 마크롤리드/시클릭 펩티드; (iv) 테트라시클린; (v) 플루오로퀴놀린/플루오로퀴놀론; 및 (vi) 옥사졸리디논으로 그룹화될 수 있다. 참조: 문헌 [Shaw, K. and Barbachyn, M. (2011) Ann. N.Y. Acad. Sci. 1241:48-70; Sutcliffe, J. (2011) Ann. N.Y. Acad. Sci. 1241:122-152].
특정 실시양태에서, 면역접합체는 고도의 방사성 원자를 포함할 수 있다. 다양한 방사성 동위원소가 방사성접합된 항체의 제조에 이용가능하다. 예는 At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 및 Lu의 방사성 동위원소를 포함한다. 일부 실시양태에서, 면역접합체가 검출에 사용되는 경우에, 이는 신티그래피 연구를 위한 방사성 원자, 예를 들어 Tc99 또는 I123, 또는 핵 자기 공명 (NMR) 영상화 (자기 공명 영상화, MRI로도 공지됨)를 위한 스핀 표지, 예컨대 지르코늄-89, 아이오딘-123, 아이오딘-131, 인듐-111, 플루오린-19, 탄소-13, 질소-15, 산소-17, 가돌리늄, 망가니즈 또는 철을 포함할 수 있다. 지르코늄-89는, 예를 들어 PET 영상화를 위해, 다양한 금속 킬레이트화제에 복합체화되고, 항체에 접합될 수 있다 (WO 2011/056983). 방사성- 또는 다른 표지는 공지된 방식으로 면역접합체에 혼입될 수 있다. 예를 들어, 펩티드는 생합성되거나, 또는 예를 들어 1개 이상의 수소 대신에 1개 이상의 플루오린-19 원자를 포함하는 적합한 아미노산 전구체를 사용하여 화학적으로 합성될 수 있다. 일부 실시양태에서, 표지, 예컨대 Tc99, I123, Re186, Re188 및 In111은 항체에서 시스테인 잔기를 통해 부착될 수 있다. 일부 실시양태에서, 이트륨-90은 항체의 리신 잔기를 통해 부착될 수 있다. 일부 실시양태에서, 아이오도겐(IODOGEN) 방법 (Fraker et al. (1978) Biochem. Biophys. Res. Commun. 80: 49-57)을 사용하여 아이오딘-123을 혼입시킬 수 있다. 문헌 ["Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989)]은 특정 다른 방법을 기재하고 있다.
특정 실시양태에서, 면역접합체는 전구약물-활성화 효소에 접합된 항체를 포함할 수 있다. 일부 이러한 실시양태에서, 전구약물-활성화 효소는 전구약물 (예를 들어, 펩티딜 화학요법제, WO 81/01145 참조)을 활성 약물, 예컨대 항암 약물로 전환시킨다. 이러한 면역접합체는 일부 실시양태에서 항체-의존성 효소-매개 전구약물 요법 ("ADEPT")에 유용하다. 항체에 접합될 수 있는 효소는 포스페이트-함유 전구약물을 유리 약물로 전환시키는데 유용한 알칼리성 포스파타제; 술페이트-함유 전구약물을 유리 약물로 전환시키는데 유용한 아릴술파타제; 비-독성 5-플루오로시토신을 항암 약물인 5-플루오로우라실로 전환시키는데 유용한 시토신 데아미나제; 펩티드-함유 전구약물을 유리 약물로 전환시키는데 유용한 프로테아제, 예컨대 세라티아 프로테아제, 써모리신, 서브틸리신, 카르복시펩티다제 및 카텝신 (예컨대, 카텝신 B 및 L); D-아미노산 치환기를 함유하는 전구약물을 전환시키는데 유용한 D-알라닐카르복시펩티다제; 글리코실화 전구약물을 유리 약물로 전환시키는데 유용한 탄수화물-절단 효소, 예컨대 β-갈락토시다제 및 뉴라미니다제; β-락탐으로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 β-락타마제; 및 그의 아민 질소에서 각각 페녹시아세틸 또는 페닐아세틸 기로 유도체화된 약물을 유리 약물로 전환시키는데 유용한 페니실린 아미다제, 예컨대 페니실린 V 아미다제 또는 페니실린 G 아미다제를 포함하나, 이에 제한되지는 않는다. 일부 실시양태에서, 효소는 관련 기술분야에 널리 공지된 재조합 DNA 기술에 의해 항체에 공유 결합될 수 있다. 예를 들어, 문헌 [Neuberger et al., Nature 312:604-608 (1984)]을 참조한다.
적응증 및 치료 방법
본 발명의 항체-약물 접합체 (ADC)를 사용하여 예를 들어 종양 항원의 과다발현을 특징으로 하는 다양한 질환 또는 장애를 치료할 수 있는 것으로 고려된다. 예시적인 상태 또는 과다증식성 장애는 양성 또는 악성 고형 종양 및 혈액 장애 예컨대 백혈병 및 림프성 악성종양을 포함한다. 다른 것은 뉴런, 신경교, 성상세포, 시상하부, 선상, 대식세포, 상피, 기질, 포배강, 염증성, 혈관신생 및 면역 (자가면역 포함) 장애를 포함한다.
특정 실시양태에서, 항-NaPi2b 항체, 예컨대 상기 기재된 것을 포함하는 본 발명의 ADC는 고형 종양, 예를 들어 난소를 치료하는 방법에 사용된다.
또 다른 실시양태에서, 항-CD33 항체, 예컨대 본원에 기재된 것을 포함하는 본 발명의 ADC는 혈액 악성종양 예컨대 비-호지킨 림프종 (NHL), 미만성 대 조혈 림프종, 여포성 림프종, 외투 세포 림프종, 만성 림프구성 백혈병, 다발성 골수종, 급성 골수성 백혈병 (AML) 및 골수 세포 백혈병 (MCL), 예를 들어 B-세포 관련 암 및 증식성 장애를 치료하는 방법에 사용된다. US 8226945; 문헌 [Li et al. (2013) Mol. Cancer. Ther. 12(7):1255-1265; Polson et al. (2010) Leukemia 24:1566-1573; Polson et al. (2011) Expert Opin. Investig. Drugs 20(1):75-85]을 참조하며, 이들 내용은 참조로 포함된다.
또 다른 실시양태에서, 항-MUC16 항체, 예컨대 본원에 기재된 것을 포함하는 본 발명의 ADC는 난소암, 유방암 및 췌장암을 치료하는 방법에 사용된다. 암은 MUC16/CA125/O772P 폴리펩티드의 발현 또는 활성과 관련될 수 있다. WO 2007/001851; US 7989595; US 8449883; US 7723485; 문헌 [Chen et al. (2007) Cancer Res. 67(10): 4924-4932; Junutula, et al., (2008) Nature Biotech., 26(8):925-932]를 참조하며, 이들 내용은 참조로 포함된다.
특정 실시양태에서, 항-HER2 항체, 예컨대 상기 기재된 것을 포함하는 본 발명의 ADC는 이러한 ADC를 암, 예를 들어 유방암 또는 위암, 보다 구체적으로 HER2+ 유방암 또는 위암의 치료를 필요로 하는 환자에게 투여하는 것을 포함하는, 암, 예를 들어 유방암 또는 위암, 보다 구체적으로 HER2+ 유방암 또는 위암을 치료하는 방법에 사용된다. 하나의 이러한 실시양태에서, ADC는 항-HER2 항체 트라스투주맙 또는 페르투주맙을 포함한다.
일반적으로, 치료할 질환 또는 장애는 과다증식성 질환 예컨대 암이다. 본원에서 치료할 암의 예는 암종, 림프종, 모세포종, 육종 및 백혈병 또는 림프성 악성종양을 포함하나, 이에 제한되지는 않는다. 이러한 암의 보다 특정한 예는 편평 세포암 (예를 들어 상피 편평 세포암), 폐암, 예를 들어 소세포 폐암, 비소세포 폐암, 폐의 선암종 및 폐의 편평세포 암종, 복막암, 간세포성암, 위의 암 또는 위암, 예를 들어 위장암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 방광암, 간세포암, 유방암, 결장암, 직장암, 결장직장암, 자궁내막 또는 자궁 암종, 타액선 암종, 신장암 또는 신암, 전립선암, 외음부암, 갑상선암, 간 암종, 항문 암종, 음경 암종 뿐만 아니라 두경부암을 포함한다.
항체-약물 접합체를 치료에 사용할 수 있는 자가면역 질환은 류마티스 장애 (예컨대, 예를 들어, 류마티스 관절염, 쇼그렌 증후군, 경피증, 루푸스 예컨대 전신 홍반성 루푸스 (SLE) 및 루푸스 신염, 다발근염/피부근염, 한랭글로불린혈증, 항-인지질 항체 증후군, 및 건선성 관절염), 골관절염, 자가면역 위장 및 간 장애 (예컨대, 예를 들어, 염증성 장 질환 (예를 들어, 궤양성 결장염 및 크론병), 자가면역 위염 및 악성 빈혈, 자가면역 간염, 원발성 담즙성 간경변증, 원발성 경화성 담관염, 및 복강 질환), 혈관염 (예컨대, 예를 들어, ANCA-연관 혈관염, 예를 들어 처그-스트라우스 혈관염, 베게너 육아종증, 및 다발동맥염), 자가면역 신경계 장애 (예컨대, 예를 들어, 다발성 경화증, 안진전 근간대성경련 증후군, 중증 근무력증, 시신경척수염, 파킨슨병, 알츠하이머병 및 자가면역 다발신경병증), 신장애 (예컨대, 예를 들어, 사구체신염, 굿패스쳐 증후군 및 베르게르병), 자가면역 피부과 장애 (예컨대, 예를 들어, 건선, 두드러기, 심마진, 심상성 천포창, 수포성 유천포창, 및 피부 홍반성 루푸스), 혈액 장애 (예컨대, 예를 들어, 혈소판감소성 자반증, 혈전성 혈소판감소성 자반증, 수혈후 자반증 및 자가면역 용혈성 빈혈), 아테롬성동맥경화증, 포도막염, 자가면역 청각 질환 (예컨대, 예를 들어, 내이 질환 및 청각 상실), 베체트병, 레이노 증후군, 기관 이식, 및 자가면역 내분비 장애 (예컨대, 예를 들어, 당뇨병-관련 자가면역 질환 예컨대 인슐린-의존성 당뇨병 (IDDM), 애디슨병 및 자가면역 갑상선 질환 (예를 들어, 그레이브스병 및 갑상선염))을 포함한다. 보다 바람직한 이러한 질환은 예를 들어 류마티스 관절염, 궤양성 결장염, ANCA-연관 혈관염, 루푸스, 다발성 경화증, 쇼그렌 증후군, 그레이브스병, IDDM, 악성 빈혈, 갑상선염 및 사구체신염을 포함한다.
질환을 예방 또는 치료하는데 적절한 ADC 투여량은 상기 정의된 바와 같은 치료할 질환의 유형, 질환의 중증도 및 경과, 분자가 예방 목적으로 투여되는지 치료 목적으로 투여되는지의 여부, 선행 요법, 환자의 임상 병력 및 항체에 대한 반응, 및 담당의의 판단에 따라 달라질 것이다. 분자는 환자에게 1회 또는 일련의 치료에 걸쳐 적합하게 투여된다. 질환의 유형 및 중증도에 따라, 예를 들어 1회 이상의 개별 투여에 의해서든 또는 연속 주입에 의해서든 관계없이, 약 1 μg/kg 내지 15 mg/kg (예를 들어 0.1-20 mg/kg)의 분자가 환자에게 투여할 초기 후보 투여량이다. 전형적인 1일 투여량은 상기 언급된 인자에 따라 약 1 μg/kg 내지 100 mg/kg 또는 그 초과의 범위일 수 있다. 환자에게 투여될 ADC의 예시적인 투여량은 약 0.1 내지 약 10 mg/kg 환자 체중의 범위이다.
실험부
펩티드모방체 링커 약물 모이어티를 제조하는 방법; PCT/US2014/042560은 본원에 참조로 포함됨.
실시예 1. 7-(4-((4-((2R,5S,Z)-5-(벤질옥시카르보닐아미노)-4-플루오로-6-메틸-2-(3-우레이도프로필)헵트-3-엔아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. 1-1 (10.0 g, 85.36 mmol), 1-2 (13.3 g, 89.79 mmol)의 혼합물을 150℃에서 1시간 동안 교반하였다. 혼합물을 25℃로 냉각시키고, 고체를 온수 중에 용해시켰다. 혼합물을 빙조에서 냉각시키고, 침전물을 여과에 의해 수집하고, 물로 세척하였다. 필터 케이크를 건조시켜 1-3을 백색 고체 (19.0 g, 90.0%)로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 11.96 (br, 1H), 7.78 - 7.77 (m, 4H), 3.52 (t, J = 6.8 Hz, 2H), 2.18 (t, J = 7.2 Hz, 2H), 1.59 - 1.51 (m, 2H), 1.47 - 1.41 (m, 2H).
단계 2. 무수 DCM (100 mL) 중 1-3 (9.0 g, 36.40 mmol)의 혼합물에 (COCl)2 (15.0 mL, 157.76 mmol), DMF (1 mL)를 실온에서 적가하였다. 반응 혼합물을 실온에서 0.5시간 동안 교반한 후, 이를 감압 하에 농축시켰다. 잔류물을 무수 THF (60 mL)와 공증발시켜 아실 염소를 황색 고체로서 수득하였다.
무수 THF (60 mL) 중 1-4 (6.6 g, 37.25 mmol)의 혼합물에 N2 하에 -78℃에서 n-BuLi (15.0 mL, 2.5 M, 37.5 mmol)를 적가하였다. THF 중 아실 클로라이드 (40 mL)를 천천히 -78℃에서 혼합물에 첨가하였다. 반응 혼합물을 -78℃에서 15분 동안 교반하고, 수성 NH4Cl 용액 (30 mL)으로 켄칭하였다. 혼합물을 EtOAc와 물 사이에 분배하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켰다. 잔류물을 실리카 겔 (PE/EtOAc 3:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 조 화합물 1-5를 백색 고체 (13.0 g, 87.9%)로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.89 - 7.83 (m, 4H), 7.32 - 7.28 (m, 2H), 7.25 - 7.22 (m, 1H), 7.19 - 7.17 (m, 2H), 4.66 - 4.60 (m, 1H), 4.30 (t, J = 8.4 Hz, 1H), 4.17 (dd, J = 9.2, 2.8 Hz, 1H), 3.61 (t, J = 6.4 Hz, 2H), 3.00 - 2.78 (m, 4H), 1.70 - 1.60 (m, 4H).
단계 3. DCM (100 mL) 중 1-6 (3.0 g, 25.39 mmol)의 용액에 PCC (10.9 g, 50.78 mmol)를 첨가하였다. 혼합물을 N2 하에 25℃에서 16시간 동안 교반한 후에, 이를 실리카 플러그를 통해 여과하였다. 여과물을 감압 하에 25℃의 조 온도에서 농축시켜 화합물 1-7을 오일 (1.8 g, 61.0%)로서 수득하였다.
1H NMR (400 MHz, CDCl3) δ 9.18 (d, J = 18.4Hz, 1 H), 5.79 (dd, J =32.8, 9.2 Hz, 1 H), 3.02 - 2.93 (m, 1 H), 1.13 (d, J = 6.8 Hz, 6 H).
단계 4. DCM (20 mL) 중 1-5 (6.0 g, 14.7 mmol)의 용액을 빙조를 사용하여 0℃로 냉각시켰다. DCM 중 Bu2BOTf (1M, 15 mL, 15 mmol)에 이어서 Et3N (3.03 g, 30 mmol)을 내부 온도가 3℃ 미만으로 유지되는 속도로 적가하였다. 빙조를 드라이 아이스-아세톤 조로 대체하였다. 내부 온도가 -65℃ 미만으로 떨어지면, DCM (10 mL) 중 화합물 1-7 (1.5 g, 12.9 mmol)을 적가하였다. 용액을 드라이 아이스-아세톤 조에서 20분 동안 교반한 다음, 빙조 온도에서 1시간 동안 교반하였다. 반응 혼합물을 수성 인산염 완충액 (pH = 7.0, 20 mL) 및 MeOH (10 mL)로 켄칭하였다. 이 탁한 용액에 내부 온도가 10℃ 미만으로 유지되는 속도로 MeOH/30% H2O2의 혼합물 (2:1, 20 mL)을 첨가하였다. 용액을 추가로 1시간 동안 교반한 후, 휘발성 물질을 25-30℃의 조 온도에서 회전 증발기 상에서 제거하였다. 슬러리를 EtOAc (50 mL x 3)로 추출하였다. 합한 유기 층을 포화 Na2SO3 용액 (15 mL), 5% NaHCO3 용액 (30 mL) 및 염수 (25 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켰다. 잔류물을 실리카 겔 (PE/EtOAc 3:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 조 1-8을 오일 (4.0 g, 59.7%)로서 수득하였다.
LCMS (ESI): m/z 505.0 [M-17].
단계 5. DCM (20 mL) 중 1-8 (4.0 g, 7.65 mmol) 및 Cl3CCN (1.67 g, 11.48 mmol)의 용액에 N2 하에 0℃에서 DBU (234 mg, 1.53 mmol)를 첨가하였다. 혼합물을 0℃에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 실리카 겔 (EtOAc 중 5%-20% 석유) 상에서 칼럼 크로마토그래피에 의해 정제하여 1-9 (3.0 g, 58.8%)를 수득하였다.
LCMS (ESI): m/z 505.1 [M-160].
1H NMR (400 MHz, CDCl3) δ 8.47 (s, 1H), 7.83 - 7.80 (m, 2H), 7.72 - 7.69 (m, 2H), 7.36 - 7.28 (m, 2H), 7.28 - 7.22 (m, 3H), 5.69 - 5.63 (q, 1H), 4.89 (dd, J = 37.6, 9.6 Hz, 1H), 4.63 - 4.58 (m, 2H), 4.20 - 4.11 (m, 2H), 3.74 - 3.69 (m, 2H), 3.35 (dd, J = 13.2, 3.2 Hz, 1H), 2.78 - 2.69 (m, 2H), 1.99 - 1.85 (m, 2H), 1.80 - 1.76 (m, 2H), 0.96 - 0.92 (q, 6H).
단계 6. 크실렌 (5 mL) 중 1-9 (3.0 g, 4.50 mmol)의 용액을 마이크로웨이브에서 135℃에서 2시간 동안 가열하였다. 혼합물을 25℃로 냉각시키고, 실리카 겔 (EtOAc 중 5%-10%-50% PE) 상에서 칼럼 크로마토그래피에 의해 정제하여 1-10 (1.4 g, 46.7%)을 수득하였다.
LCMS (ESI): m/z 685.0 [M+H2O].
1H NMR (400 MHz, CDCl3) δ 7.83 - 7.81 (m, 2H), 7.71 - 7.69 (m, 2H), 7.36 - 7.32 (m, 2H), 7.29 - 7.25 (m, 1H), 7.21 - 7.19 (m, 2H), 6.90 (d, J = 8.8 Hz, 1H), 5.11 (dd, J = 36.4, 9.6 Hz, 1H), 4.81 - 4.76 (m, 1H), 4.68 - 4.64 (m, 1H), 4.30 - 4.16 (m, 3H), 3.75 - 3.68 (m, 2H), 3.27 (dd, J = 13.2, 3.2 Hz, 1H), 2.80 - 2.74 (q, 1H), 2.08-2.05 (m, 1H), 1.93 - 1.90 (m, 1H), 1.76 - 1.70 (m, 2H), 1.65 - 1.62 (m, 1H), 1.00 (dd, J = 6.8, 3.2 Hz, 6H).
단계 7. THF/H2O (v/v 4:1, 10 mL) 중 화합물 1-10 (1.4 g, 2.1 mmol)의 용액에 H2O2 (1.43 g, 물 중 30%, 12.6 mmol)에 이어서 LiOH.H2O (264.6 mg, 6.3 mmol)를 첨가하였다. 용액을 25℃에서 1.5시간 동안 교반한 후, 포화 Na2SO3 용액 (8 mL)을 첨가하였다. 용매를 제거하고, 잔류물을 DCM (20 mL x 2)으로 추출하였다. 수용액을 1M HCl을 사용하여 pH = 1로 산성화시키고, EtOAc/MeOH (10/1, 25 mL x 3)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 화합물 1-11 (1.0 g, 93.4%)을 수득하였다.
LCMS (ESI): m/z 527.0 [M+Na+].
단계 8. DCM/MeOH (v/v 2:1, 7.5 mL) 중 화합물 1-11 (1.0 g, 1.97 mmol) 및 (4-아미노페닐) 메탄올 (364 mg, 2.96 mmol)의 용액에 N2 하에 0℃에서 EEDQ (732 mg, 2.96 mmol)를 첨가하였다. 혼합물을 25℃에서 16시간 동안 교반하였다. 용매를 제거하고, 잔류물을 실리카 겔 (EtOAc 중 30% 석유) 상에서 칼럼 크로마토그래피에 의해 정제하여 조 화합물 1-13 (1.0 g, 82.8%)을 수득하였다.
LCMS (ESI): m/z 614.0 [M+H+].
단계 9. EtOH (15 mL) 중 화합물 1-13 (1.0 g, 1.63 mmol)의 용액에 0℃에서 NaBH4 (364.8 mg, 9.60 mmol)를 첨가하였다. 혼합물을 25℃에서 2시간 동안 교반하고, 물 (10 mL)을 첨가하여 반응물을 켄칭하였다. 이어서, Cbz-Cl (410.4 mg, 2.40 mmol)을 0℃에서 적가하였다. 혼합물을 0℃에서 1시간 동안 교반하였다. 혼합물을 물로 희석하고, DCM (25 mL x 3)으로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 감압 하에 농축시켰다. 잔류물을 실리카 겔 (DCM/MeOH = 20:1~5:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 조 화합물 1-14 (300 mg, 31.2%)를 수득하였다.
LCMS (ESI): m/z 602.0 [M+H].
단계 10. EtOH (10 mL) 중 화합물 1-14 (300 mg, 0.498 mmol)의 용액에 NH2NH2.xH2O (48 mg, 50%, 0.748 mmol)를 적가하였다. 혼합물을 환류 하에 1시간 동안 가열하였다. 반응 혼합물을 농축시키고, 잔류물 (1-15)을 후속 반응에 추가 정제 없이 직접 사용하였다.
단계 11. DMF (5 mL) 중 화합물 1-15 (281.0 mg, 0.496 mmol)의 교반 용액에 TEA (100 mg, 0.992 mmol) 및 CDI (162.7 mg, 0.992 mmol)를 첨가하였다. 혼합물을 29℃에서 1시간 동안 교반한 후, NH3H2O (5 mL)를 첨가하고, 혼합물을 29℃에서 16시간 동안 교반하였다. 반응 혼합물을 여과하고, 여과물을 정제용 HPLC에 의해 정제하여 화합물 1-16 (50 mg, 19.6%)을 백색 고체로서 수득하였다.
LCMS (ESI): m/z 515.1 [M+1].
1H NMR (400 MHz, DMSO-d6) δ 9.94 (s, 1H), 7.66 (d, J = 9.2 Hz, 1H), 7.53 (d, J = 8.4 Hz, 2H), 7.35 - 7.29 (m, 5H), 7.22 (d, J = 8.4 Hz, 2H), 5.94 (t, J = 6.0 Hz, 1H), 5.36 (s, 2H), 5.10 (t, J = 6.0 Hz, 1H), 5.05 - 4.94 (m, 3H), 4.42 (d, J = 4.2 Hz, 2H), 3.92 - 3.83 (m, 1H), 3.46 - 3.44 (m, 1H), 3.01 - 2.90 (m, 2H), 1.92 - 1.85 (m, 1H), 1.65 - 1.63 (m, 1H), 1.44 - 1.28 (m, 3H), 0.88 (t, J = 6.4 Hz, 6H).
단계 12. 무수 DMF (3 mL) 중 화합물 1-16 (50 mg, 0.097 mmol)의 혼합물에 DIPEA (63 mg, 0.485 mmol)를 첨가하였다. PNP 카르보네이트 (87 mg, 0.291 mmol)를 25℃에서 첨가하였다. 반응 혼합물을 25℃에서 8시간 동안 교반하고, 노르플록사신 (93 mg, 0.291 mmol)을 첨가하였다. 혼합물을 25℃에서 추가로 3시간 동안 교반한 후, 이를 여과하고, 여과물을 정제용 HPLC에 의해 정제하여 실시예 1 (35 mg, 42.0%)을 수득하였다.
LCMS (ESI): RT = 0.885분, M/2+H+ = 430.7. 방법 = 5-95 /2분.
1H NMR (400 MHz, DMSO-d6) δ 15.32 (s, 1H), 10.04 (s, 1H), 8.95 (s, 1H), 7.94 (d, J = 12.8 Hz, 1H), 7.66 (d, J = 8.8 Hz, 1H), 7.60 (d, J = 8.8 Hz, 2H), 7.34 - 7.28 (m, 7H), 7.21 (d, J = 7.2 Hz, 1H), 5.94 (t, J = 5.2 Hz, 1H), 5.36 (s, 2H), 5.06 - 4.94 (m, 5H), 4.59 - 4.57 (q, 2H), 3.92 - 3.84 (m, 1H), 3.61 (s, 4H), 3.49 - 3.43 (q, 1H), 3.33 - 3.31 (m, 4H), 3.01 - 2.90 (m, 2H), 1.90 - 1.83 (m, 1H), 1.68 - 1.65 (m, 1H), 1.41 (d, J = 6.8 Hz, 5H), 1.33 - 1.23 (m, 1H), 0.86 (t, J = 6.8 Hz, 6H).
실시예 2. 7-(4-((4-((2R,5S,Z)-5-(벤질옥시카르보닐아미노)-4-플루오로-2,6-디메틸헵트-3-엔아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF (200 mL) 중 NaH (1.82 g, 45.5 mmol)의 혼합물에 THF (20 mL) 중 2-1 (10.0 g, 41.3 mmol)을 0℃에서 적가하였다. 혼합물을 0℃에서 1시간 동안 교반한 다음, -78℃로 냉각시켰다. THF (5 mL) 중 화합물 2-2 (2.98 g, 41.3 mmol)를 적가하고, 혼합물을 25℃로 천천히 가온하고, 25℃에서 16시간 동안 교반하였다. 포화 NH4Cl 용액을 천천히 0℃에서 첨가한 다음, 이어서 물 (50 mL)을 첨가하고, 혼합물을 EtOAc (80 mLx2)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시키고, 실리카 겔 (PE/EtOAc = 50:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 2-3 (2.2 g, 33%)을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 5.73 (dd, J = 10.4, 22.0 Hz, 1 H), 4.30 (q, J = 7.2 Hz, 2 H), 3.37-3.31 (m, 1 H), 1.35 (t, J = 7.2 Hz, 3 H), 1.08-1.04 (m, 6 H).
단계 2. THF (80 mL) 중 2-3 (12.0 g, 74.91 mmol)의 용액에 0℃에서 LiAlH4 (5.69 g, 149.82 mmol)를 첨가하였다. 혼합물을 0℃에서 2시간 동안 교반한 후, 이를 포화 NH4Cl 용액 (1 mL)으로 켄칭하였다. 유기 용매를 감압 하에 제거하고, 혼합물을 물 (50 mL)로 희석하고, EtOAc (100 mL x 2)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 조 생성물 2-4 (8.0 g)를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 5.06 (dd, J = 10.4, 21.2 Hz, 1 H), 4.24 (d, J = 21.2 Hz, 2 H), 2.42-2.37 (m, 1 H), 1.03-0.99 (m, 6 H).
단계 3. DCM (100 mL) 중 2-4 (8.0 g, 33.86 mmol)의 용액에 25℃에서 PCC (29.2 g, 67.72 mmol)를 첨가하였다. 혼합물을 환류 하에 N2 하에 3시간 동안 가열한 후, 이를 25℃로 냉각시키고, 실리카 겔의 플러그를 통해 여과하였다. 여과물을 농축시켜 조 2-5 (5.1 g)를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 9.19 (d, J = 18.0Hz, 1 H), 5.79 (dd, J = 9.6, 32.8 Hz, 1 H), 3.01-2.95 (m, 1 H), 1.15-1.13 (m, 6 H).
단계 4. DCM 중 Bu2BOTf (1M, 66 mL, 66 mmol)를 DCM (200 mL) 중 2-6 (15.37 g, 65.88 mmol)의 용액에 이어서 Et3N (8.89 g, 87.84 mmol)을 내부 온도를 3℃ 미만으로 유지하는 속도로 적가하였다. 이를 -65℃로 냉각시키고, DCM (10 mL) 중 2-5 (5.1 g, 43.92 mmol)를 적가하였다. 용액을 드라이 아이스-아세톤 조에서 20분 동안, 이어서 빙조에서 1시간 동안 교반하였다. 반응 혼합물을 pH 7 수성 인산염 완충액 (50 mL) 및 MeOH (150 mL)로 켄칭하였다. 이 탁한 용액에 내부 온도를 10℃ 미만으로 유지하도록 하는 속도로 MeOH/30% H2O2의 혼합물 (2:1, 90 mL)을 첨가하였다. 용액을 추가로 1시간 동안 교반한 후, 휘발성 물질을 25-30℃의 조 온도에서 회전 증발기 상에서 제거하였다. 생성된 슬러리를 EtOAc (150 mLx3)로 추출하였다. 합한 유기 층을 포화 Na2SO3 용액 (150 mL), 5% NaHCO3 용액 (150 mL) 및 염수 (150 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켰다. 잔류물을 실리카 겔 (PE/EtOAc 3:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 2-7 (8.8 g, 57%)을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.36-7.27 (m, 3 H), 7.21-7.19 (m, 2 H), 4.85 (dd, J = 9.2, 38.4 Hz, 1 H), 4.73-4.67 (m, 1 H), 4.53-4.50 (m, 1 H), 4.27-4.19 (m, 2 H), 3.99-3.95 (m, 1 H), 3.24 (dd, J = 3.2, 13.6 Hz, 1 H), 3.17-3.16 (m, 1 H), 2.83-2.74 (m, 2 H), 1.29 (d, J = 6.8Hz, 3 H), 1.02-0.99 (m, 6 H).
단계 5. DCM (15 mL) 중 2-7 (2.0 g, 5.72 mmol) 및 Cl3CCN (1.24 g, 8.58 mmol)의 용액에 N2 하에 0℃에서 DBU (174 mg, 1.14 mmol)를 첨가하였다. 혼합물을 0℃에서 1시간 동안 교반한 후, 용매를 제거하고, 잔류물을 실리카 겔 (EtOAc 중 5%-20% 석유) 상에서 칼럼 크로마토그래피에 의해 정제하여 2-8 (1.55 g, 55%)을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 8.47 (s, 1 H), 7.35-7.27 (m, 3 H), 7.25-7.19 (m, 2 H), 5.81-5.75 (m, 1 H), 4.98-4.85 (m, 1 H), 4.64-4.59 (m, 1 H), 4.40-4.36 (m, 1 H), 4.22-4.17 (m, 2 H), 3.27-3.24 (m, 1 H), 2.83-2.71 (m, 2 H), 1.40-1.38 (m, 3 H), 0.99-0.95 (m, 6 H).
단계 6. 크실렌 (10 mL) 중 2-8 (1.55 g, 3.14 mmol)의 용액을 135℃에서 30시간 동안 가열하였다. 이를 실온으로 냉각시키고, 용매를 감압 하에 제거하였다. 잔류물을 실리카 겔 (EtOAc 중 석유 5%-10%-50%) 상에서 칼럼 크로마토그래피에 의해 정제하여 2-9 (450 mg, 29%)를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.35-7.28 (m, 3 H), 7.21-7.20 (m, 2 H), 6.75 (d, J = 8.4 Hz, 1 H), 5.20 (dd, J = 9.2, 37.6 Hz, 1 H), 4.76-4.65 (m, 2 H), 4.28-4.17 (m, 3 H), 3.27-3.23 (m, 1 H), 2.79 (dd, J = 9.6, 13.2 Hz, 1 H), 2.07-2.00 (m, 1 H), 1.33 (d, J = 7.2Hz, 3 H), 1.00-0.94 (m, 6 H).
단계 7. THF 및 H2O (v/v 4:1, 10 mL) 중 2-9 (950 mg, 1.92 mmol)의 용액에 H2O2 (1.38 mg, 11.52 mmol)에 이어서 물 (2 mL) 중 LiOH.H2O (242 mg, 5.76 mmol)를 첨가하였다. 용액을 10℃에서 1시간 동안 교반한 후, 포화 Na2SO3 용액 (8 mL)을 첨가하였다. 용매를 제거하고, 잔류물을 DCM (20 mL x 2)으로 세척하였다. 수용액을 1M HCl을 사용하여 pH 1로 산성화시키고, EtOAc (25 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 2-10 (420 mg, 65%)을 수득하였다.
LCMS (ESI): m/z 334.0 [M+H+].
단계 8. DCM (10 mL) 중 2-10 (420 mg, 1.26 mmol) 및 (4-아미노페닐)메탄올 (233 mg, 1.89 mmol)의 용액에 N2 하에 0℃에서 EEDQ (623 mg, 2.52 mmol)를 첨가하였다. 혼합물을 10℃에서 3시간 동안 교반한 후, 용매를 제거하고, 잔류물을 실리카 겔 (에틸 아세테이트 중 석유 30%) 상에서 칼럼 크로마토그래피에 의해 정제하여 2-11 (300 mg, 54%)을 수득하였다.
LCMS (ESI): m/z 439.0 [M+H+].
단계 9. EtOH (6 mL) 중 2-11 (300 mg, 0.682 mmol)의 용액에 0℃에서 NaBH4 (300 mg, 7.94 mmol)를 첨가하였다. 혼합물을 10℃에서 3시간 동안 교반하였다. 물 (0.5 mL)을 첨가하고, EtOH를 감압 하에 제거하였다. 조 물질을 THF (4 mL) 및 포화 NaHCO3 용액 (4 mL)의 혼합물 중에 용해시키고, CbzCl (140 mg, 8.18 mmol)을 10℃에서 첨가하였다. 혼합물을 10℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 DCM (8 mLx2)으로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시키고, 실리카 겔 (PE/EtOAc = 2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 2-12 (125 mg, 43%)를 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.53-7.46 (m, 2 H), 7.36-7.25 (m, 7 H), 5.11-5.00 (m, 3 H), 4.56 (s, 2 H), 3.94-3.87 (m, 1 H), 3.63-3.59 (m, 1 H), 1.98-1.92 (m, 1 H), 1.27 (d, J = 6.8 Hz, 3 H), 0.96-0.93 (m, 6 H).
LCMS (ESI): m/z 429.2 [M+H+].
단계 10. DCM (2 mL) 중 2-12 (20 mg, 0.0467 mmol)의 용액에 10℃에서 PNP 카르보네이트 (43 mg, 0.140 mmol) 및 DIEA (24 mg, 0.187 mmol)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열한 후, 용매를 제거하고, 잔류물을 DMF (2 mL) 중에 용해시켰다. 이 용액에 10℃에서 DIEA (24 mg, 0.187 mmol) 및 노르플록사신 (22 mg, 0.070 mmol)을 첨가하고, 생성된 용액을 10℃에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 2 (14.1 mg, 39%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.35 (br, 1 H), 10.02 (s, 1 H), 8.95 (s, 1 H), 7.95-7.91 (m, 1 H), 7.69-7.58 (m, 3 H), 7.34-7.19 (m, 8 H), 5.12-5.00 (m, 5 H), 4.59-4.57 (m, 2 H), 3.87-3.81 (m, 1 H), 3.60-3.51 (m, 5 H), 3.30 (s, 4 H), 1.89-1.83 (m, 1 H), 1.40 (t, J = 7.2 Hz, 3 H), 1.20-1.81 (m, 3 H), 0.87 (m, 6 H).
LCMS (ESI): m/z 774.8 [M+H+]
실시예 3. 1-에틸-6-플루오로-4-옥소-7-(4-((4-((S)-2-(1-((S)-1-(티오펜-3-일)에틸카르바모일) 시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. MeOH (20 mL) 중 화합물 3-1 (2 g, 15.9 mmol)의 용액에 20℃에서 NH4OAc (12.2 g, 0.159 mol) 및 NaBH3CN (3.5 g, 55.5 mmol)을 첨가하였다. 혼합물을 20℃에서 16시간 동안 교반한 후, 이를 농축시켰다. 잔류물을 EtOAc (50 mL)와 NaOH 용액 (5 M, 5 mL) (pH>13으로 조정) 사이에 분배하였다. 유기 층을 염수 (20 mLx2)로 세척하고, 농축시키고, 칼럼 (DCM 중 20%-30% MeOH)에 의해 정제하여 조 화합물 3-2 (800 mg, 40% 수율)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.63 - 7.61 (d, J = 8.0 Hz, 1 H), 7.58 - 5.57 (m, 1 H), 7.25 - 7.23 (d, J = 8.0 Hz, 2 H), 4.53 - 4.48 (m, 1 H), 1.51 - 1.49 (d, J = 8.0 Hz, 3 H).
단계 2. DMF (3 mL) 중 화합물 3-3 (500 mg, 1.23 mmol)의 용액에 20℃에서 화합물 3-2 (600 mg, 4.7 mmol), DIPEA (0.5 mL, 3 mmol) 및 HATU (740 mg, 2 mmol)를 첨가하였다. 혼합물을 20℃에서 2시간 동안 교반한 후, 이를 정제용 HPLC에 의해 정제하여 3-4 (360 mg, 57% 수율)를 수득하였다. 화합물 3-4 (300 mg)를 SFC 분리로 분리하여 2종의 이성질체 3-4A 및 3-4B를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.03 (s, 1 H), 8.12 - 8.10 (m, 1H), 7.9 -7.75 (m, 1 H), 7.55 - 7.52 (m, 2 H), 7.45 - 7.35 (m, 2 H), 7.3 - 7.2 (m, 3 H), 7.04 (m, 1 H), 6.0 (m, 1 H), 5.5 - 5.2 (m, 2 H), 5.1 - 5.0 (m, 1 H), 4.45 - 4.35 (m, 3 H), 3.1 - 2.9 (m, 4 H), 2.43 - 2.39 (m, 4 H), 1.8 - 1.7 (m, 3 H), 1.7 - 1.5 (m, 1 H), 1.5-1.33 (m, 5 H).
단계 3. 건조 DMF (3 mL) 중 화합물 3-4B (110 mg, 0.21 mmol)의 용액에 20℃에서 PNP (130 mg, 0.43 mmol) 및 DIPEA (0.5 ml, 3 mmol)를 첨가하였다. 혼합물을 N2 하에 20℃에서 1.5시간 동안 교반한 후, 노르플록사신 (100 mg, 0.31 mmol)을 첨가하였다. 혼합물을 20℃에서 추가로 1시간 동안 교반하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 3 (102.1 mg, 57%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.15 (s, 1H), 8.93 (s, 1 H), 8.10 - 8.08 (d, 1H), 8.04 (s, 1 H), 7.93 - 7.90 (m, 2 H), 7.60 - 7.58 (d, J = 8.0 Hz, 2 H), 7.41 - 7.39 (d,, 2 H), 7.32 - 7.30 (d, J = 8.0 Hz, 2 H), 7.25 (d, 1H), 7.20 (d, 1H), 7.04 - 7.02(d, 1H), 6.0 (m, 1 H), 5.40 (s, 2 H), 5.1-5.0 (m, 3 H), 4.6 - 4.5 (m, 2 H), 4.5 - 4.35 (m, 1 H), 3.59 (s, 1 H), 3.2 (s, 4 H), 3.1 - 2.9 (m, 2 H), 2.42 - 2.40 (m, 4 H), 1.8 - 1.7 (m, 3 H), 1.7 - 1.6 (m, 1 H), 1.5 - 1.3 (m, 8 H).
실시예 4. (S)-1-에틸-7-(4-((4-(2-(1-(에틸카르바모일)시클로부탄카르복스아미도)-5-구아니디노펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DCM / MeOH (20 mL / 20 mL) 중 화합물 4-1 (1.3 g, 2 mmol)의 용액에 4-아미노-페닐)-메탄올 (370 mg, 3 mmol) 및 EEDQ (989 mg, 4 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 잔류물을 칼럼 (PE/EtOAc=1/3)에 의해 정제하여 4-3 (1.94 g, 수율: 90%)을 수득하였다.
DCM (50 mL) 중 4-3 (1.44 g, 2 mmol)의 용액에 실온에서 4-4 (1.2 ml, 9.56 mmol)를 시린지를 통해 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 잔류물을 농축시키고, 메틸 tert-부틸 에테르로 세척한 다음, 여과하고, 여과물 케이크를 합하여 4-5 (700 mg, 수율: 70%)를 수득하였다.
단계 2. DME (10 ml) 중 4-5 (700 mg, 1.32 mmol)의 용액에 물 (10 ml) 중 4-6 (424 mg, 1.58 mmol) 및 NaHCO3 (222 mg, 2.64 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 EtOAc로 세척하고, 10% HCl을 사용하여 pH = 3으로 조정하였다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시키고, 칼럼 (PE/EtOAc=1/3)에 의해 정제하여 4-7 (400 mg, 수율: 37%)을 수득하였다.
단계 3. DMF (4 mL) 중 4-7 (250 mg, 0.365 mmol), PNP 카르보네이트 (223 mg, 0.731 mmol)의 용액에 0℃에서 DIPEA (142 mg, 1.095 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물 (4-8)을 추가 정제 없이 후속 단계에 사용하였다.
단계 4. 최종 단계로부터의 혼합물에 실온에서 노르플록사신 (234 mg, 0.73 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반한 후, 이를 정제용 HPLC 및 SFC에 의해 정제하여 4-9 (수율: 30%)를 수득하였다.
단계 5. 화합물 4-9 (100 mg, 0.1 mmol)에 0℃에서 DCM (1:5) 중 TFA의 용액을 첨가하였다. 혼합물을 실온에서 3시간 동안 교반하였다. 혼합물을 NH3.H2O에 의해 pH = 9로 염기성화시켰다. 잔류물을 정제용 HPLC에 이어서 SFC에 의해 정제하여 실시예 4 (16.0 mg, 수율: 15%)를 수득하였다.
1H NMR (400 MHz, 메탄올-d4) δ 8.83 (s, 1 H), 8.55 (s, 1 H), 7.97 (d, J = 13.2 Hz, 1 H), 7.62 (d, J = 7.6 Hz, 2 H), 7.35 (d, J = 7.6 Hz, 2 H), 7.17 (s, 1 H), 5.13 (s, 2 H), 4.55 - 4.52 (m, 3 H), 3.72 (s, 4 H), 3.34 (s, 4 H), 3.31 - 3.24 (m, 4 H), 2.58 - 2.54 (m, 4 H), 2.00 - 1.69 (m, 6 H), 1.52 (s, 3 H), 1.15 - 0.11 (m, 3 H).
실시예 5. 1-에틸-6-플루오로-4-옥소-7-(4-((4-((S)-2-(1-((S)-1-페닐에틸카르바모일) 시클로부탄카르복스아미도)-5 우레이도펜탄아미도)벤질옥시)카르보닐) 피페라진-1-일)-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DMF (10 mL) 중 화합물 5-1 (50 mg, 0.1 mmol) 및 5-2 (15 mg, 0.12 mmol)의 혼합물을 실온에서 3시간 동안 교반하였다. 혼합물을 농축시키고, 정제용 TLC (MeOH/ DCM=1/10)에 의해 정제하여 5-3 (50 mg, 99%)을 수득하였다.
단계 2. DMF (4 mL) 중 화합물 5-3 (40 mg, 0.078 mmol), PNP 카르보네이트 (48 mg, 0.157 mmol)의 용액에 0℃에서 DIPEA (30 mg, 0.236 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물 (5-4)을 추가 정제 없이 후속 단계에 사용하였다.
단계 3. 최종 단계로부터의 혼합물에 노르플록사신 (51 mg, 0.157 mmol)을 실온에서 첨가하고, 1시간 동안 교반하였다. 잔류물을 정제용 HPLC에 의해 정제하여 실시예 5를 수득하였다. (7 mg, 수율: 8%)
1H NMR (400 MHz, MeOH-d4) δ 8.86 (s, 1 H), 8.46 (s, 1 H), 8.00 (d, J = 12.8 Hz, 1 H), 7.61 (d, J = 8 Hz, 2 H), 7.35 - 7.33 (m, 2 H), 7.30 (d, J = 7.2 Hz, 2 H), 7.24 (d, J = 7.2 Hz, 2 H), 7.20 (d, J = 14 Hz, 2 H), 7.16 (s, 2 H), 5.12 (s, 2 H), 5.04 (d, J = 7.2 Hz, 1 H), 4.50 - 4.47 (m, 4 H), 3.71 (s, 4 H), 3.34 (s, 4 H), 3.22 - 3.03 (m, 2 H), 2.60 - 2.51 (m, 4 H), 1.94 - 1.86 (m, 3 H), 1.74 - 1.71 (m, 1 H), 1.60 - 1.45 (m, 7 H).
실시예 6. 1-에틸-6-플루오로-4-옥소-7-(4-((4-((S)-2-(1-((S)-1-(티오펜-2-일)에틸카르바모일) 시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1,4-디히드로퀴놀린-3-카르복실산
실시예 6을 실시예 3과 같은 절차를 사용하여 제조하였다. 이는 중간체를 실시예 10과 공유하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.3 (s, 1H), 10.13 (s, 1H), 8.93 (s, 1 H), 8.25 (d, 1H), 7.94 - 7.91 (d, J = 12.0 Hz, 1H), 7.8 (d, 1 H), 7.60 - 7.58 (d, J = 8.0 Hz, 2 H), 7.33 - 7.30 (d, J = 8.0 Hz, 3H), 7.20 (d, 1 H), 6.92 - 6.91 (m, 2 H), 5.95 (m, 1 H), 5.40 (s, 1H), 5.25 - 5.15 (m, 1H), 5.04 (s, 2 H), 4.65 - 4.4 (m, 2 H), 4.5 - 4.4 (m, 1 H), 3.7 - 3.5 (s, 4 H), 3.3 (s, 4 H), 3.1 - 2.85 (m, 2 H), 2.44 - 2.42 (m, 4 H), 1.8 - 1.7 (m, 3 H), 1.7 - 1.55 (m, 1 H), 1.46 - 1.45 (d, J = 4.0 Hz, 1 H), 1.45 - 1.3 (m, 5 H).
실시예 7. 7-(4-((4-((S)-2-(1-((R)-3-(알릴옥시)-3-옥소-1-(티오펜-3-일)프로필카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. EtOH (100 mL) 중 화합물 7-1 (10.0 g, 89.17 mmol) 및 CH2(COOH)2 (9.3 g, 89.17 mmol)의 용액에 NH4OAc (13.7 g, 178.33 mmol)를 첨가하였다. 혼합물을 80℃에서 6시간 동안 교반하였다. 이를 실온으로 냉각시키고, 여과하고, EtOH (100 mL)로 세척하였다. 필터 케이크를 수집하고, 감압 하에 농축시켜 화합물 7-2 (8.0 g, 52.6%)를 백색 고체로서 수득하였다.
1H NMR D2O 400 MHz, δ 7.44 (s, 2H), 7.13 (d, J = 3.2 Hz, 1H), 4.69 (t, J = 7.2 Hz, 1H), 2.84 - 2.73 (m, 2H).
단계 2. 화합물 7-3 (60.0 g) 중 화합물 7-2 (6.0 g, 35.04 mmol)의 혼합물에 TMSCl (13.4 mL, ρ = 0.85, 105.13 mmol)을 적가하였다. 반응 혼합물을 N2 하에 실온에서 밤새 교반하였다. 혼합물을 감압 하에 농축시키고, 잔류물을 H2O (50 mL)로 희석하고, HCl 용액에 의해 pH 1로 조정하고, EtOAc (50 mL x 3)로 세척하였다. 수상을 NH3H2O에 의해 pH 12로 조정하고, EtOAc (50 mL x 3)로 추출하였다. 합한 EtOAc 층을 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 화합물 7-4를 오일 (4.0 g, 54.1%)로서 수득하였다.
1H NMR DMSO-d6 400 MHz, δ 7.45 - 7.43 (q, 1H), 7.31 (s, 1H), 7.15 (d, J =4.8 Hz, 1H), 5.91 - 5.85 (m, 1H), 5.27 (dd, J = 17.2, 1.6 Hz, 1H), 5.20 - 5.17 (m, 1H), 4.53 (d, J = 5.2 Hz, 2H), 4.31 - 4.27 (m, 1H), 2.73 - 2.61 (m, 2H).
단계 3. DMF (20 mL) 중 화합물 7-5 (1.0 g, 2.46 mmol)의 혼합물에 DIPEA (636 mg, 4.92 mmol)에 이어서 HATU (1.4 g, 3.69 mmol)를 첨가하였다. 혼합물을 실온에서 15분 동안 교반하고, 화합물 7-4 (624 mg, 2.95 mmol)를 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반하고, 정제용 HPLC에 의해 정제하여 화합물 7-6을 백색 고체 (800 mg, 54.1%)로서 수득하였다.
화합물 7-6을 1.5 g으로 스케일 업하고, SFC에 의해 정제하여 7-6a (580 mg) 및 7-6b (560 mg)를 수득하였다.
7-6a
LCMS: (5-95, AB, 1.5분, ESI), 0.773분, MS = 600.1 [M+1]
1H NMR DMSO-d6 400 MHz, δ 10.05 (s, 1H), 8.25 (d, J = 8.4 Hz, 1H), 7.74 (d, J = 7.9 Hz, 1H), 7.56 (d, J = 8.4 Hz, 2H), 7.45 - 7.43 (q, 1H), 7.31 (d, J = 2.6 Hz, 1H), 7.24 (d, J = 8.4 Hz, 2H), 7.08 (d, J = 4.0 Hz, 1H), 5.97 (t, J = 5.6 Hz, 1H), 5.90 - 5.80 (m, 1H), 5.43 - 5.37 (m, 3H), 5.27 (dd, J = 17.4, 1.5 Hz, 1H), 5.17 (dd, J = 10.4 Hz, 1.3 Hz, 1H), 5.17 (t, J = 5.7 Hz, 1H), 4.51 (d, J = 5.3 Hz, 2H), 4.44 - 4.39 (m, 3H), 3.06 - 2.98 (m, 1H), 2.97 - 2.88 (m, 3H), 2.48 - 2.39 (m, 4H), 1.78 - 1.70 (m, 3H), 1.64 - 1.55 (m, 1H), 1.42 - 1.28 (m, 2H).
7-6b
LCMS: (5-95, AB, 1.5분, ESI), 0.762분, MS = 600.1 [M+1]
1H NMR DMSO-d6 400 MHz, δ 10.04 (s, 1H), 8.26 (d, J = 8.4 Hz, 1H), 7.79 (d, J = 7.7 Hz, 1H), 7.57 (d, J = 8.4 Hz, 2H), 7.39 - 7.37 (q, 1H), 7.31 (s, 1H), 7.24 (d, J = 8.4 Hz, 2H), 7.07 (d, J = 4.9 Hz, 1H), 5.97 (t, J = 5.5 Hz, 1H), 5.91 - 5.81 (m, 1H), 5.43 - 5.36 (m, 3H), 5.26 (dd, J = 17.3, 1.4 Hz, 1H), 5.18 (d, J = 10.4 Hz, 1H), 5.11 (t, J = 5.7 Hz, 1H), 4.53 - 4.52 (m, 2H), 4.44 - 4.40 (m, 3H), 3.05 - 2.98 (m, 1H), 2.97 - 2.85 (m, 3H), 2.46 - 2.33 (m, 4H), 1.77 - 1.72 (m, 3H), 1.64 - 1.56 (m, 1H), 1.42 - 1.30 (m, 2H).
단계 4. 무수 DMF (5 mL) 중 7-6a (50 mg, 0.083 mmol)의 용액에 DIPEA (107 mg, 0.83 mmol)에 이어서 PNP 카르보네이트 (60 mg, 0.20 mmol)를 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 이어서, 노르플록사신 (64 mg, 0.20 mmol)을 첨가하였다. 반응 혼합물을 실온에서 추가로 2시간 동안 교반하였다. 혼합물을 여과하고, 여과물을 정제용 HPLC에 의해 정제하여 실시예 7을 백색 고체 (41.7 g, 53.5%)로서 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.858분, MS = 473.3 [1/2M+1]
1H NMR DMSO-d6 400 MHz, δ 15.32 (br, 1H), 10.15 (s, 1H), 8.95 (s, 1H), 8.23 (d, J = 8.0 Hz, 1H), 7.91 (d, J = 13.0 Hz, 1H), 7.77 (d, J = 7.5 Hz, 1H), 7.62 (d, J = 8.0 Hz, 2H), 7.44 - 7.42 (q, 1H), 7.35 - 7.31 (m, 3H), 7.19 (br, 1H), 7.08 (d, J = 4.5 Hz, 1H), 5.98 (br, 1H), 5.89 - 5.80 (m, 1H), 5.44 - 5.37 (m, 3H), 5.23 (d, J = 17.6 Hz, 1H), 5.16 (d, J = 10.5 Hz, 1H), 5.07 (s, 2H), 4.57 (br, 2H), 4.51 (d, J = 5.5 Hz, 2H), 4.45 - 4.40 (m, 1H), 3.61 (br, 4H), 3.31 (br, 4H), 3.06 - 3.01 (m, 1H), 2.95 - 2.90 (m, 3H), 2.47 - 2.40 (m, 4H), 1.76 - 1.72 (m, 3H), 1.62 - 1.59 (m, 1H), 1.40 - 1.35 (m, 5H).
실시예 8. 1-에틸-6-플루오로-4-옥소-7-(4-((4-((S)-2-(1-((R)-1-(티오펜-3-일)에틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1,4-디히드로퀴놀린-3-카르복실산
실시예 8을 실시예 3의 합성으로부터의 중간체로 실시예 3과 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.14 (s, 1H), 8.92 (s, 1 H), 8.05 - 8.03 (d, 1H), 7.93 - 7.90 (d, J = 12.0 Hz, 1 H), 7.85 - 7.83 (d, 1 H), 7.61 - 7.59 (d, J = 8.0 Hz, 1H), 7.36 - 7.35 (m, 1 H), 7.33 - 7.31 (d, J = 8.0 Hz, 2 H), 7.24 (s, 1 H), 7.20 (m, 1 H), 5.5 (m, 1 H), 7.04 - 7.03 (m, 1H), 6.0 (m, 1H), 5.40 (s, 2 H), 5.1 - 5.0 (m, 3 H), 4.6 - 4.5 (m, 2 H), 4.5 - 4.35 (m, 1 H), 3.59 (s, 1 H), 3.2 (s, 4 H), 3.05 - 2.9 (m, 2 H), 2.44 - 2.41 (m, 4 H), 1.8 - 1.7 (m, 3 H), 1.7 - 1.6 (m, 1 H), 1.5 - 1.35 (m, 8 H).
실시예 9. 1-에틸-6-플루오로-7-(4-((4-((2S)-2-(1-(4-메틸펜탄-2-일카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
실시예 9를 실시예 5와 같은 절차를 사용하여 제조하였다.
LCMS: (5-95 AB, 1.5분), T = 0.858분, M = 8.352 (M+1);
1H NMR (400 MHz, DMSO-d6) δ 10.22 (s, 1H), 8.85 (s, 1H), 7.89 - 7.71 (m, 2H), 7.65 - 7.64 (d, J = 8.8 Hz, 2H), 7.53 - 7.50 (m, 1H), 7.34 - 7.31 (d, J = 8.8 Hz, 2H), 7.18 - 7.13 (m, 1H), 6.06 (s, 1H), 5.45 (d, J = 3.2 Hz, 2H), 5.05 (s, 2H), 4.60 - 4.42 (m, 2H), 3.91 - 3.88 (t, J = 6.4 Hz, 1H), 3.59 (s, 4H), 3.26 (s, 4H), 3.03 - 2.99 (m, 1H), 2.97 - 2.91 (m, 1H), 2.41 - 2.39 (m, 5H), 1.74 - 1.71 (m, 3H), 1.7 - 1.5 (m, 2H), 1.5 - 1.3 (m, 6H), 1.2 - 1.1 (m, 1H), 1.03 -1.00 (m, 3H), 0.81 (m, 6H).
실시예 10. 1-에틸-6-플루오로-4-옥소-7-(4-((4-((S)-2-(1-((R)-1-(티오펜-2-일)에틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1,4-디히드로퀴놀린-3-카르복실산
실시예 10을 실시예 3과 같은 절차를 사용하여 제조하였다. 이는 중간체를 실시예 6과 공유하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.3 (s, 1H), 10.13 (s, 1H), 8.94 (s, 1 H), 8.25 (d, 1H), 7.94 - 7.91 (d, J = 12.0 Hz, 1H), 7.8 (d, 1 H), 7.62 - 7.60 (d, J = 8.0 Hz, 2 H), 7.34 - 7.31 (d, J = 8.0 Hz, 2H), 7.28 - 7.27 (d, J = 4.0 Hz, 1 H), 7.20 (d, 1 H), 6.93 (s, 1 H), 6.90 - 6.88 (m, 1 H), 5.95 (m, 1 H), 5.40 (s, 1H), 5.25 - 5.15 (m, 1H), 5.05 (s, 2 H), 4.65 - 4.4 (m, 2 H), 4.5 - 4.4 (m, 1 H), 3.7 - 3.5 (s, 4 H), 3.3 (s, 4 H), 3.1 - 2.85 (m, 2 H), 2.44 - 2.42 (m, 4 H), 1.85 - 1.7 (m, 3 H), 1.7 - 1.55 (m, 1 H), 1.47 - 1.46 (d, J = 4.0 Hz, 1 H), 1.46 - 1.3 (m, 5 H).
실시예 11. 1-에틸-6-플루오로-4-옥소-7-(4-((4-((2S)-2-(1-(펜탄-2-일카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1,4-디히드로퀴놀린-3-카르복실산
실시예 11을 실시예 5와 같은 절차를 사용하여 제조하였다.
LCMS: (5-95 AB, 1.5분), T = 0.848분, M = 821.2 (M+1);
1H NMR (400 MHz, DMSO-d6) δ 10.15 - 10.13 (m, 1H), 8.96 (s, 1H), 7.97 - 7.93 (d, J = 13.2 Hz, 1H), 7.81 - 7.74 (m, 1H), 7.63 (d, J = 8.8 Hz, 2H), 7.50 - 7.46 (m, 1H), 7.34 (d, J = 8.4 Hz, 2H), 7.21 (d, J = 7.2 Hz, 1H), 5.98 - 5.95 (t, J = 5.6 Hz, 1H), 5.42 (s, 2H), 5.06 (s, 2H), 4.60 - 4.57 (q, J = 6.8 Hz, 2H), 4.44 - 4.42 (m, 1H), 3.81(m, 1H), 3.60 (s, 4H), 3.49 - 3.36 (s, 4H), 3.33 - 3.29 (m, 2H), 3.1 - 2.9(m, 2H), 2.42 - 2.39 (m, 4H), 1.73 (m, 4H), 1.63 - 1.58 (m, 1H), 1.41 (m, 5H), 1.35 - 1.30 (m, 2H), 1.04 - 1.02 (m, 3H), 0.84 - 0.78 (m, 3H).
실시예 12. (S)-1-에틸-6-플루오로-7-(4-((4-(2-(1-(이소프로필카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DMF (10 mL) 중 화합물 12-1 (120 mg, 0.3 mmol), HATU (171 mg, 0.45 mmol), DIPEA (195 mg, 1.5 mmol)의 혼합물을 실온에서 30분 동안 교반하였다. 이어서, 화합물 12-2 (9 mg, 0.3 mmol)를 첨가하였다. 반응 혼합물을 실온에서 3시간 동안 교반하였다. 혼합물을 농축시키고, 정제용 TLC (MeOH/ DCM=1/10)에 의해 정제하여 12-3 (180 mg, 136%)을 수득하였다.
단계 2. DMF (4 mL) 중 화합물 12-3 (180 mg, 0.4 mmol), PNP 카르보네이트 (245 mg, 0.81 mmol)의 용액에 0℃에서 DIPEA (156 mg, 1.21 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물 (12-4)을 추가 정제 없이 후속 단계에 사용하였다.
단계 3. 최종 단계의 혼합물에 실온에서 노르플록사신 (259 mg, 0.81 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 잔류물을 정제용 HPLC에 의해 정제하여 실시예 12 (18.5 mg, 수율: 6%, 2 단계에 걸쳐)를 수득하였다.
1H NMR (400 MHz, MeOH-d4) δ 8.88 (s, 1 H), 8.02 - 7.99 (d, J = 13.2 Hz, 1 H), 7.65 - 7.62 (d, J = 8.8 Hz, 3 H), 7.37 - 7.35 (d, J = 8.4 Hz, 2 H), 7.19 (d, J = 6.4 Hz, 1 H), 5.13 (s, 2 H), 4.54 - 4.50 (m, 4 H), 4.06 - 4.01 (m, 1 H), 3.73(s, 4 H), 3.35 (s, 4 H), 3.26 - 3.19 (m, 2 H), 2.57 - 2.52 (m, 4 H), 1.94 - 1.90 (m, 2 H), 1.81 - 1.74 (m, 2 H), 1.59 - 1.53 (m, 3 H), 1.21 - 1.13 (m, 6 H).
실시예 13. (S)-1-에틸-7-(4-((4-(2-(1-(에틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 화합물 13-1 (1 g, 2.63 mmol) 및 디옥산 중 HCl (4 M, 10 mL)의 혼합물을 실온에서 2시간 동안 교반하였다. 용액을 농축시켜 13-2를 수득하였다.
단계 2. DME-H2O (10 mL / 2 mL) 중 화합물 13-2 (651 mg, 2.326 mmol)의 용액에 화합물 13-3 (623 mg, 2.326 mmol) 및 포화 NaHCO3 (10 mL)의 혼합물을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 용액을 농축시키고, 잔류물을 정제용 HPLC에 의해 정제하여 13-4를 수득하였다.
1H NMR (400 MHz, 메탄올-d4) δ 7.62 (d, J = 8.4 Hz, 2 H), 7.33 (d, J = 8.8 Hz, 2 H), 4.57-4.52 (m, 3 H), 3.29-3.10 (m, 4 H), 2.60-2.53 (m, 4 H), 2.05-1.50 (m, 6 H), 1.16 (t, J = 7.6 Hz, 3 H).
LCMS (ESI): m/z 434.1 [M+H+].
단계 3. DCM (10 mL) 중 13-4 (60 mg, 0.139 mmol)의 용액에 DIPEA (90 mg, 0.695 mmol) 및 PNP 카르보네이트 (84 mg, 0.277 mmol)을 첨가하였다. 혼합물을 25℃에서 2일 동안 교반하였다. 혼합물을 농축시키고, DMF (5 mL) 중에 용해시키고, 노르플록사신 (88 mg, 0.278 mmol)을 첨가하였다. 혼합물을 25℃에서 1.5시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 13을 수득하였다.
1H NMR (400 MHz, 메탄올-d4) δ 8.86 (s, 1 H), 8.00 (d, J = 13.2 Hz, 1 H), 7.63 (d, J = 8.4 Hz, 2 H), 7.35 (d, J = 8.8 Hz, 2 H), 7.18 (d, J = 6.8 Hz, 1 H), 5.11 (s, 2 H), 4.57-4.48 (m, 3 H), 3.71 (s, 4 H), 3.33-3.32 (m, 4 H), 3.26-3.08 (m, 4 H), 2.60-2.47 (m, 4 H), 1.93-1.50 (m, 10 H), 1.14 (t, J = 7.2 Hz, 3 H).
LCMS (ESI): m/z 779.4.[M+H+].
실시예 14. 1-에틸-6-플루오로-7-(4-((4-((S)-2-(1-((R)-3-메틸부탄-2-일카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
실시예 14를 실시예 5와 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.16 (s, 1 H), 8.96 (s, 1 H), 7.97 - 7.93 (d, J = 13.2 Hz, 1 H), 7.85 - 7.83 (d, J = 7.6 Hz, 1 H), 7.63 - 7.61 (d, J = 8.8 Hz, 2 H), 7.43 - 7.41 (d, J = 8.8 Hz, 1 H), 7.35 - 7.33 (d, J = 8.8 Hz, 2 H), 7.22 - 7.21 (d, J = 6.8 Hz, 1 H), 6.00 - 5.97 (m, 1 H), 5.43 (s, 2 H), 5.07 (s, 2 H), 4.61 - 4.56 (m, 2 H), 4.46 - 4.41 (m, 1 H), 3.62 (m, 6 H), 3.41 (s, 2 H), 3.30 (s, 4 H), 3.12 - 2.89 (m, 2 H), 2.45 - 2.39 (m, 4 H), 1.76 - 1.62 (m, 4 H), 1.44 - 1.39 (m, 3 H), 1.00 (d, J = 6.8 Hz, 3 H), 0.82 (d, J = 5.6 Hz, 6 H).
실시예 15. 7-(4-((4-((S)-2-(3,3-디메틸-1-((R)-1-페닐에틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. MeCN (250 mL) 중 Ph3P (91.8 g, 350 mmol)의 교반 용액에 MeCN (40 mL) 중 브로민 (56 g, 350 mmol)의 용액을 0℃에서 적가하였다. 이어서, 화합물 15-1 (18.2 g, 175 mmol)을 혼합물에 첨가하였다. 반응물을 환류 하에 16시간 동안 가열하였다. 용매를 제거하고, 잔류물을 증류시켜 15-2를 담황색 오일 (14 g, 35%)로서 수득하였다.
1H NMR CDCl3 400 MHz, δ 3.40 (s, 4 H), 1.17 (s, 6 H).
단계 2. DMF (40 mL) 중 NaH (3.4 g, 60%, 84.9 mmol)의 현탁액에, 화합물 15-3 (11.14 g, 69.6 mmol)을 0℃에서 적가하였다. 혼합물을 N2 하에 70℃에서 1시간 동안 가열하였다. 이어서, 화합물 15-2 (8.0 g, 34.8 mmol)를 첨가하고, N2 하에 60시간 동안 교반하였다. 혼합물을 NH4Cl (300 mL 중 20 g)의 수용액에 붓고, PE (50 mL x 5)로 추출하였다. 유기 상을 농축시키고, 크로마토그래피 (PE)에 의해 정제하여 화합물 15-4 (3.0 g, 수율: 37.9%)를 수득하였다.
1H NMR CDCl3 400 MHz δ 4.21- 4.16 (m, 4 H), 2.36 (s, 4 H), 1.26 - 1.22 (m, 6H), 1.11 (s, 6 H).
단계 3. EtOH (10 mL) 중 화합물 15-4 (3.0 g, 13.9 mmol)의 교반 용액에 실온에서 수성 KOH (85%, 779 mg, 13.9 mmol)를 첨가하였다. 반응 혼합물을 76℃에서 3시간 동안 교반하였다. 혼합물을 농축시키고, EtOAc (75 mL)와 H2O (125 mL) 사이에 분배하였다. 수성 상을 pH = 3일 때까지 1N HCl을 사용하여 산성화시키고, EtOAc (75 mL x 2)로 추출하였다. 유기 층을 농축시켜 화합물 15-5 (1.9 g, 68.3%)를 오일로서 수득하였다.
1H NMR CDCl3 400 MHz, δ 11.62 (s, 1 H), 4.26 - 4.21 (m, 2 H), 2.42 (s, 4 H), 1.29 - 1.26 (m, 3H), 1.15 - 1.13 (d, J = 7.2 Hz, 6 H).
단계 4. DCM (8 mL) 중 화합물 15-5 (500 mg, 0.5 mmol)의 교반 용액에 실온에서 HATU (285.0 mg, 0.75 mmol) 및 DIPEA (193.5 mg, 1.5 mmol)를 첨가하였다. 반응 혼합물을 실온에서 30분 동안 교반한 후, 15-6 (90.9 mg, 0.75 mmol)을 첨가하고, 실온에서 16시간 동안 교반하였다. 혼합물을 농축시키고, 크로마토그래피 (DCM: MeOH = 90: 10)에 의해 정제하여 화합물 15-7을 백색 고체 (70 mg, 46.2%)로서 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.807분, MS = 303.9[M+1]
1H NMR CDCl3 400 MHz, δ 7.34 - 7.22 (m, 5 H), 6.19 (d, J = 7.2 Hz, 1 H), 5.14 - 5.06 (m, 1 H), 4.22 - 4.16 (m, 2 H), 2.46 - 2.31 (m, 4 H), 1.46 (d, J = 6.8 Hz, 3 H), 1.25 - 1.21 (m, 3 H), 1.09 (s, 6 H).
단계 5. MeOH / THF /H2O (1 mL / 2 mL/2 mL) 중 화합물 15-7 (70 mg, 0.23 mmol)의 교반 용액에 실온에서 LiOH·H2O (19.4 mg, 0.462 mmol)를 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반하였다. 유기 용매를 제거하고, EtOAc (30 mL)와 H2O (25 mL) 사이에 분배하였다. 수성 상을 1N HCl을 사용하여 pH = 3으로 산성화시키고, EtOAc (30 mL)로 추출하였다. 유기 상을 농축시켜 화합물 15-8을 백색 고체 (50 mg, 78.7%)로서 수득하였다.
1H NMR CDCl3 400 MHz, δ 7.34 - 7.23 (m, 5 H), 6.30 (d, J = 7.2 Hz, 1 H), 5.14 - 5.07 (m, 1 H), 2.50 - 2.31 (m, 4 H), 1.48 (d, J = 6.8 Hz, 3 H), 1.11 (d, J = 16 Hz, 6 H).
단계 6. DCM (10 ml) 중 화합물 15-8 (50 mg, 0.18 mmol)의 교반 용액에 HATU (102.6 mg, 0.27 mmol) 및 DIPEA (46.44 mg, 0.36 mmol)를 실온에서 첨가하고, 30분 동안 교반하였다. 화합물 15-9 (53 mg, 0.19 mmol)를 반응 혼합물에 첨가하고, 실온에서 16시간 동안 교반하였다. 혼합물을 농축시키고, 크로마토그래피 (DCM: MeOH = 85: 15)에 의해 정제하여 화합물 15-10 (60 mg, 61.8%)을 백색 고체로서 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.803분, MS = 538.2[M+1]
1H NMR 메탄올-d4 400 MHz, δ 8.19 (d, J = 8 Hz, 1 H), 7.58 (d, J = 8.4 Hz, 2 H), 7.31 - 7.17 (m, 7 H), 5.07 - 5.00 (m, 1 H), 4.56 (s, 2 H), 4.51 - 4.47 (m, 1 H), 3.21 - 3.17 (m, 1 H), 2.45 - 2.35 (m, 4 H), 1.89 - 1.85 (m, 1 H), 1.75 - 1.72 (m, 1 H),1.55 - 1.47 (m, 5H), 1.08(d, J = 2 Hz, 6 H).
단계 7. 건조 DMF (3 mL) 중 화합물 15-10 (60 mg, 0.11 mmol)의 교반 용액에 PNP 카르보네이트 (15-11) (66.9 mg, 0.22 mmol) 및 DIPEA (70.9 mg, 0.55 mmol)를 실온에서 첨가하고, 실온에서 3시간 동안 교반하였다. 혼합물 (15-12)을 추가 정제 없이 후속 단계에 사용하였다.
단계 8. 최종 단계의 반응 혼합물에, 노르플록사신 (70.2 mg, 0.22 mmol)을 실온에서 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하고, 정제용 HPLC에 의해 정제하여 실시예 15 (14.4 mg, 수율: 14.8%)를 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.887분, MS = 883.4.4[M+1], 442.4 [1/2M+1]
1H NMR DMSO - d6 400 MHz, δ 10.24 (s, 1 H), 8.94 (s, 1 H), 8.39 (s, 1 H), 8.13 (d, J = 2 Hz, 1 H), 7.965 - 7.963 (m, 2 H), 7.63 (d, J = 8.4 Hz, 2 H), 7.47 (d, J = 8.8 Hz, 2 H), 7.30 - 7.26 (m, 4 H), 7.19 - 7.18 (m, 2 H), 6.05 (s, 1 H), 5.46 (s, 2 H), 5.07 (s, 2 H), 4.97 - 4.91 (m, 1 H), 4.57 (s, 2 H), 4.45 (s, 1 H), 3.62 (s, 4 H), 3.35 (s, 4 H), 3.05 - 3.02 (m, 1 H), 2.96 - 2.92 (m, 1 H), 2.32 - 2.26 (m, 4 H), 1.73 - 1.71 (m, 1 H), 1.63 - 1.61 (m, 1 H), 1.42 - 1.37 (m, 8 H), 0.99 (s, 6 H).
실시예 16. (S)-1-에틸-7-(4-((4-(2-(1-(에틸카르바모일)시클로펜탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DMF (50 mL) 중 화합물 16-1 (10 g, 62.4 mmol)의 용액에 1,4-디브로모부탄 (14.8 g, 68.6 mmol), K2CO3 (21.5 g, 155.8 mmol) 및 화합물 16-2 (1.4 g, 6.2 mmol)를 실온에서 첨가하고, 실온에서 16시간 동안 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 EtOAc (200 mL)와 H2O (80 mL) 사이에 분배하고, 합한 유기 상을 건조시키고, 농축시켜 화합물 16-3을 오일 (10.0 g, 수율: 75%)로서 수득하였다.
1H NMR (400 MHz, CDCl3) δ 4.15 - 4.10 (m, 4 H), 2.14 - 2.10 (m, 4 H), 1.64 - 1.61 (m, 4 H), 1.20 - 1.17 (m, 6 H).
단계 2. EtOH (20 mL) 중 화합물 16-3 (6.0 g, 28.0 mmol)의 용액에 85% 수성 KOH 용액 (1.85 g, 28.0 mmol)을 실온에서 첨가하고, 76℃에서 3시간 동안 교반하였다. 용매를 제거하고, 잔류물을 EtOAc (20 mL)와 H2O (30 mL) 사이에 분배하였다. 수성 상을 1N HCl을 사용하여 pH = 3으로 산성화시키고, EtOAc (20 mLx2)로 추출하였다. 유기 층을 건조시키고, 농축시켜 화합물 16-4를 오일 (2.5 g, 수율: 48.0%)로서 수득하였다.
1H NMR (400 MHz, CDCl3) δ 10.61 - 10.60 (m, 1 H), 4.21 - 4.15 (m, 2 H), 2.21 - 2.18 (m, 4 H), 1.72 - 1.65 (m, 4 H), 1.26 - 1.22 (m, 3 H).
단계 3. 건조 THF (20 mL) 중 화합물 16-4 (2.5 g, 13.4 mmol) 및 화합물 16-5 (1.62 g, 14.1 mmol)의 용액에 0℃에서 DCC (3.04 g, 14.74 mmol)를 첨가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반하였다. 혼합물을 여과하고, 여과물을 농축시켜 조 화합물 16-6을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
1H NMR (400 MHz, MeOH-d4) δ 4.23 - 4.18 (m, 2 H), 2.79 (s, 4 H), 2.36 - 2.23 (m, 4 H), 1.76 - 1.72 (m, 4 H), 1.30 - 1.28 (t, J = 7.2 Hz, 3 H).
단계 4. DMF (15 mL) 중 화합물 16-6 (1.0 g, 3.53 mmol)의 용액에 실온에서 화합물 16-7 (658.7 mg, 2.35 mmol)을 첨가하였다. 반응 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 농축시키고, 실리카 겔 칼럼 크로마토그래피 (DCM: MeOH = 10:1)에 의해 정제하여 화합물 16-8을 백색 고체 (150 mg, 수율: 14.2%)로서 수득하였다.
LCMS (ESI): m/z 449.0 [M+1].
단계 5. THF/ MeOH /H2O(3 mL / 3 mL/1.5 mL) 중 화합물 16-8 (150 mg, 0.33 mmol)의 용액에 실온에서 LiOH·H2O (28.14 mg, 0.67 mmol)를 첨가하였다. 반응 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 농축시키고, EtOAc (15 mL)와 H2O (20 mL) 사이에 분배하였다. 수성 상을 1N HCl을 사용하여 pH = 3으로 산성화시키고, EtOAc (15 mL x 3)로 추출하고, 농축시켜 조 화합물 16-9를 백색 고체로서 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
LCMS (ESI): m/z 420.9 [M+1].
단계 6. DMF (15 mL) 중 화합물 16-9 (250 mg, 0.595 mmol)의 용액에 HATU (339.2 mg, 0.89 mmol) 및 DIPEA (268.6 mg, 2.08 mmol)를 실온에서 첨가하고, 30분 동안 교반하였다. 에틸아민 히드로클로라이드 (96.98 mg, 1.19 mmol)를 반응 혼합물에 첨가하고, 실온에서 16시간 동안 교반하였다. 혼합물을 여과하고, 정제용 HPLC 및 SFC에 의해 정제하여 화합물 16-10을 백색 고체 (30 mg, 수율: 11.3%)로서 수득하였다.
LCMS (ESI): m/z 447.9 [M+1].
1H NMR (400 MHz, DMSO - d6) δ 9.99 (s, 1 H), 7.75 - 7.73 (m, 2 H), 7.57 - 7.55 (m, 2 H), 7.23 - 7.21 (m, 2 H), 5.97 - 5.94 (m, 1 H), 5.39 (s, 2 H), 5.11 - 5.08 (m, 1 H),4.41 - 4.36 (m, 2 H), 4.35 - 4.32 (s, 1 H),3.13 - 3.06 (m, 2 H), 2.97 - 2.90 (m, 2 H), 2.16 - 2.14 (m,2 H), 2.11 - 2.05 (m, 1 H), 1.95 - 1.93 (m, 1 H), 1.92 - 1.91 (m, 1 H), 1.51 - 1.49 (m, 4 H), 1.39 - 1.37 (m, 1 H), 1.20 - 1.19 (m, 2 H), 1.02 - 0.98 (t, J = 7.2 Hz, 3 H).
단계 7. 건조 DMF (3 mL) 중 화합물 16-10 (30 mg, 0.067 mmol)의 용액에 0℃에서 화합물 16-11 (40.7 mg, 0.134 mmol) 및 DIPEA (43.22 mg, 0.335 mmol)를 첨가하였다. 혼합물을 실온에서 5시간 동안 교반한 후, 이를 추가 정제 없이 후속 단계에 직접 사용하였다.
단계 8. 최종 단계 (16-12)로부터의 혼합물에 실온에서 화합물 16-13 (42.8 mg, 0.134 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반한 다음, 정제용 HPLC에 의해 정제하여 목적 생성물 실시예 16을 수득하였다. (35.0 mg 수율: 66.0%)
1H NMR (400 MHz, DMSO-d6) δ 15.32 (s, 1 H), 10.09 (s, 1 H), 8.95 (s, 1 H), 7.93 (d, J = 13.2 Hz, 1 H), 7.80 - 7.71 (m, 2 H), 7.62 (d, J = 8.4 Hz, 2 H), 7.32 (d, J = 8.4 Hz, 2 H), 7.18 (d, J = 8.0 Hz, 1 H), 5.98 - 5.91 (m, 1 H), 5.39 (s, 2 H), 5.04 (s, 2 H), 4.60 - 4.52 (m, 2 H), 4.38 - 4.32 (m, 1 H), 3.59 (s, 4 H), 3.30 (s, 4 H), 3.12 - 3.08 (m, 2 H), 2.96 - 2.85 (m, 2 H), 2.14 - 2.11 (m, 2 H), 2.10 - 2.00 (m, 1 H), 1.94 - 1.89 (m, 1 H), 1.63 - 1.40 (m, 5 H), 1.38 - 1.30 (m, 5 H), 1.02 - 0.98 (t, J = 7.2 Hz, 3 H).
실시예 17. 7-(4-((4-((S)-2-(1-((S)-3-(알릴옥시)-3-옥소-1-(티오펜-3-일)프로필카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
실시예 17을 실시예 7의 합성으로부터의 중간체로 실시예 7과 같은 절차를 사용하여 제조하였다.
실시예 18. (S)-1-에틸-7-(4-((4-(2-(1-(에틸카르바모일)시클로헥산카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. EtOH (20 mL) 중 화합물 18-1 (4.0 g, 17.5 mmol)의 용액에 실온에서 85% 수성 KOH 용액 (1.15 g, 17.5 mmol)을 첨가하였다. 반응 혼합물을 76℃에서 3시간 동안 교반한 후, 이를 농축시키고, EtOAc (15 mL)와 H2O (25 mL) 사이에 분배하였다. 수성 상을 1N HCl을 사용하여 pH = 3으로 산성화시키고, EtOAc (15 mL x 2)로 추출하였다. 유기 층을 농축시켜 화합물 18-2를 오일 (2.5 g, 수율: 71.4%)로서 수득하였다.
1H NMR (400 MHz, CDCl3) δ 4.20 - 4.15 (m, 2 H), 2.03 - 1.90 (m, 4 H), 1.56 - 1.47 (m, 6 H), 1.45 - 1.43 (t, 4.0 Hz, 3 H).
단계 2. 건조 THF (20 mL) 중 화합물 18-2 (2.5 g, 12.5 mmol) 및 18-3 (1.51 g, 13.13 mmol)의 용액에 0℃에서 DCC (2.83 g, 13.35 mmol)를 첨가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반하였다. 혼합물을 여과하고, 여과물을 농축시켜 조 화합물 18-4를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다 (2.0 g, 수율: 53.8%).
단계 3. DMF (15 mL) 중 화합물 18-4 (2.0 g, 6.7 mmol)의 교반 용액에 실온에서 화합물 18-5 (1.26 g, 4.5 mmol)를 첨가하였다. 반응 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 농축시키고, 칼럼 크로마토그래피 (DCM: MeOH = 10:1)에 의해 정제하여 화합물 18-6을 백색 고체 (700 mg, 수율: 22.4%)로서 수득하였다.
LCMS (ESI): m/z 463.0 [M+1].
단계 4. THF/ MeOH /H2O(4 mL / 4 mL/2 mL) 중 화합물 18-6 (700 mg, 1.50 mmol)의 용액에 실온에서 LiOH·H2O (126.0 mg, 3.0 mmol)를 첨가하였다. 반응 혼합물을 실온에서 16시간 동안 교반한 후, 이를 농축시키고, EtOAc (25 mL)와 H2O (30 mL) 사이에 분배하고, 수성 상을 1N HCl을 사용하여 pH = 3으로 산성화시키고, EtOAc (25 mL x 2)로 추출하고, 농축시켜 조 화합물 18-7을 백색 고체로서 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
LCMS (ESI): m/z 435.0 [M+1].
단계 5. DMF (15 mL) 중 화합물 18-7 (300 mg, 0.69 mmol)의 용액에 HATU (395.2 mg, 1.04 mmol) 및 DIPEA (267.03 mg, 2.07 mmol)를 실온에서 첨가하고, 실온에서 30분 동안 교반하였다. 에틸아민 (112.47 mg, 1.38 mmol)을 반응 혼합물에 첨가하고, 실온에서 16시간 동안 교반하였다. 혼합물을 여과하고, 정제용 HPLC 및 SFC에 의해 정제하여 화합물 18-8 (60 mg, 수율: 18.8%)을 백색 고체로서 수득하였다.
LCMS (ESI): m/z 462.0 [M+1].
1H NMR (400 MHz, MeOH - d4) δ 7.62 (d, J =8.4 Hz, 2 H), 7.28 (d, J =8.8 Hz, 2 H), 4.58 (s, 1 H), 4.54 - 4.50 (m, 3 H),3.62 - 3.57 (m, 1 H), 3.26 - 3.18 (s, 2 H),3.10 - 3.07 (m, 2 H), 2.16 - 2.02 (m, 2 H), 1.85 -1.81 (m, 3 H), 1.73 - 1.71 (m, 1 H), 1.59 - 1.50 (m, 5 H), 1.18 - 1.14 (m, 1 H), 1.12 - 1.09 (m, 3 H).
단계 6. 건조 DMF (3 ml) 중 화합물 18-8 (100 mg, 0.216 mmol)의 교반 용액에 0℃에서 화합물 18-9 (131.3 mg, 0.432 mmol) 및 DIPEA (139.3 mg, 1.08 mmol)를 첨가하였다. 혼합물 (18-10)을 실온에서 3시간 동안 교반하고, 추가 정제 없이 후속 단계에 사용하였다.
단계 7. 최종 단계로부터의 혼합물 (18-10)에 노르플록사신 (18-11) (137.9 mg, 0.432 mmol)을 실온에서 첨가하고, 실온에서 1시간 동안 교반하였다. 혼합물을 정제용 HPLC에 의해 정제하여 실시예 18 (98.0 mg 수율: 56.2%)을 수득하였다.
1H NMR (400 MHz, DMSO - d6) δ 15.30 (s, 1 H), 10.09 (s, 1 H), 8.93 (s, 1 H), 7.92 (d, J = 13.2 Hz, 1 H), 7.78 - 7.72 (m, 1 H), 7.67 (d, J = 7.6 Hz, 1 H), 7.63 (d, J = 8.8 Hz, 2 H), 7.32 (d, J = 8.8 Hz, 2 H), 7.18 (d, J = 8.0 Hz, 1 H), 5.98 - 5.92 (m, 1 H), 5.38 (s, 2 H), 5.04 (s, 2 H), 4.57 - 4.55 (m, 2 H), 4.39 - 4.31 (m, 1 H), 3.59 (s, 4 H), 3.31 (s, 4 H), 3.31 - 3.08 (m, 2 H), 3.00 - 2.86 (m, 2 H), 2.12 - 2.03 (m, 1 H), 2.01 - 1.91 (m, 1 H), 1.90 - 1.83 (m, 3 H), 1.58 - 1.67 (m, 1 H), 1.40 - 1.25 (m, 11 H), 1.01 - 0.97 (t, J = 7.2 Hz, 3 H).
실시예 19. 7-(4-((4-((S)-2-(2,2-디메틸-3-옥소-3-((R)-1-페닐에틸아미노)프로판아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 무수 THF (70 mL) 중 화합물 19-1 (5.0 g, 31.22 mmol)의 용액에 NaH (3.75 g, 93.65 mmol, c = 60%)를 0℃에서 천천히 첨가하였다. 혼합물을 0℃에서 10분 동안 교반한 후, MeI (6.15 mL, 124.88 mmol)를 0℃에서 적가하고, 반응 혼합물을 0℃에서 2시간 동안 교반하였다. 혼합물을 EtOAc (50 mL)로 희석하고, 여과하고, 여과물을 감압 하에 농축시켰다. 잔류물을 EtOAc (50 mL)로 희석하고, 여과하고, 여과물을 농축시켜 화합물 19-2 (3.5 g, 59.6%)를 오일로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 4.13 - 4.08 (q, 4H), 1.33 (s, 6H), 1.16 (t, J = 6.8 Hz, 6H).
단계 2. EtOH (20 mL) 중 화합물 19-2 (3.0 g, 15.94 mmol)의 용액에 수성 KOH 용액 (85%, 894 mg, 15.94 mmol)을 첨가하였다. 반응 혼합물을 환류 하에 1시간 동안 가열하였다. 유기 용매를 감압 하에 제거한 후, 이를 H2O (20 mL)로 희석하고, PE (10 mL x 2)로 세척하였다. 수성 상을 진한 HCl 용액을 사용하여 pH 2로 조정하고, EtOAc (20 mL x 3)로 추출하였다. 합한 EtOAc 층을 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 화합물 19-3 (1.5 g, 58.8%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 3.98 - 3.93 (q, 4H), 1.17 (s, 6H), 1.12 (t, J = 7.2 Hz, 3H).
단계 3. 무수 DCM (20 mL) 중 화합물 19-3 (1.0 g, 6.24 mmol)의 혼합물에 DIPEA (1.61 g, 12.48 mmol)에 이어서 HATU (2.85 g, 7.49 mmol)를 첨가하였다. 혼합물을 실온에서 15분 동안 교반한 후, 화합물 19-4 (908 mg, 7.49 mmol)를 첨가하였다. 반응 혼합물을 실온에서 3시간 동안 교반하고, 시트르산 용액 (10 mL x 3), 염수 (10 mL x 1)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켰다. 잔류물을 칼럼 크로마토그래피 (PE/EtOAc = 5:1)에 의해 정제하여 화합물 19-5를 백색 고체 (1.30 g, 79.3%)로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 8.00 (d, J = 8.0 Hz, 1H), 7.31 - 7.28 (m, 4H), 7.22 - 7.18 (m, 1H), 4.97 - 4.90 (m, 1H), 4.12 - 4.01 (m, 2H), 1.36 (d, J = 6.8 Hz, 3H), 1.33 (d, J = 2.4 Hz, 6H), 1.14 (d, J = 6.8 Hz, 3H).
단계 4. MeOH/H2O (15 mL/ 5 mL)의 혼합물 중 화합물 19-5 (1.5 g, 5.70 mmol)의 용액에 LiOH·H2O (478 mg, 11.40 mmol)를 첨가하였다. 반응 혼합물을 환류 하에 2시간 동안 가열하였다. 유기 용매를 감압 하에 제거하고, 물 슬러리를 DCM (5 mL x 3)으로 세척하였다. 이를 진한 HCl 용액을 사용하여 pH 1로 조정하고, EtOAc (10 mL x 3)로 추출하였다. 합한 EtOAc 층을 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 화합물 19-6을 백색 고체 (800 mg, 59.7%)로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 12.45 (br, 1H), 7.95 (d, J = 8.0 Hz, 1H), 7.32 - 7.27 (m, 4H), 7.23 - 7.17 (m, 1H), 4.97 - 4.90 (m, 1H), 1.36 (d, J = 6.8 Hz, 3H), 1.31 (d, J = 3.6 Hz, 6H).
단계 5. DMF (5 mL) 중 화합물 19-6 (167 mg, 0.71 mmol)의 용액에 DIPEA (183 mg, 1.42 mmol)에 이어서 HATU (323 mg, 0.85 mmol)를 첨가하였다. 혼합물을 실온에서 10분 동안 교반하고, 화합물 19-7 (200 mg, 0.71mmol)을 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반한 후, 이를 정제용 HPLC에 의해 정제하여 화합물 19-8을 백색 고체 (80 mg, 22.7%)로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.05 (s, 1H), 8.11 (d, J = 8.0 Hz, 1H), 7.88 (d, J = 7.6 Hz, 1H), 7.57 - 7.54 (m, 2H), 7.32 - 7.25 (m, 4H), 7.22 - 7.15 (m, 3H), 5.95 (t, J = 5.6 Hz, 1H), 5.39 (s, 2H), 5.08 (br, 1H), 4.98 - 4.94 (m, 1H), 4.41 (s, 2H), 4.36 - 4.31 (m, 1H), 3.00 - 2.89 (m, 2H), 1.78 - 1.75 (m, 1H), 1.63 - 1.59 (m, 1H), 1.40 - 1.33 (m, 8H), 1.30 (s, 3H).
단계 6. 무수 DMF (4 mL) 중 화합물 19-8 (80 mg, 0.16 mmol)의 용액에 DIPEA (103 mg, 0.80 mmol)에 이어서 PNP 카르보네이트 (97 mg, 0.32 mmol)를 첨가하였다. 이를 N2 하에 실온에서 2시간 동안 교반한 후, 노르플록사신 (102 mg, 0.32 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하고, 여과하고, 여과물을 정제용 HPLC에 의해 정제하여 실시예 19를 백색 고체 (81 mg, 60.0%)로서 수득하였다.
LCMS (ESI): RT = 0.854분, M/2+H+ = 422.2. 방법 = 5-95 /1.5분.
1H NMR (400 MHz, DMSO-d6) δ 15.30 (br, 1H), 10.16 (s, 1H), 8.95 (s, 1H), 8.11 (d, J = 8.0 Hz, 1H), 7.95 - 7.91 (m, 2H), 7.64 (d, J = 8.8 Hz, 2H), 7.35 - 7.27 (m, 6H), 7.21 - 7.17 (m, 2H), 5.97 (t, J = 5.6 Hz, 1H), 5.42 (s, 2H), 5.07 (s, 2H), 5.00 - 4.97 (m, 1H), 4.58 - 4.55 (m, 2H), 4.39 - 4.33 (m, 1H), 3.61 (s, 4H), 3.31 (s, 4H), 3.02 - 2.92 (m, 2H), 1.80 - 1.78 (m, 1H), 1.64 - 1.62 (m, 1H), 1.42 - 1.33 (m, 14H).
실시예 20. (S)-7-(4-((4-(6-아미노-2-(1-(에틸카르바모일)시클로부탄카르복스아미도)헥산아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DCM 중 화합물 20-1 (5 g, 10.7 mmol)의 교반 용액에 실온에서 화합물 20-2 (5.5 ml, 53 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 반응 혼합물을 H2O로 추출하고, 합한 수성 층을 농축시켜 20-3을 수득하였다. (수율: 95%)
단계 2. DME (50 ml) 중 화합물 20-4 (1.5 g, 5.6 mmol)의 용액에 물 (50 mL) 중 화합물 20-3 (2.75 g, 11.2 mmol) 및 NaHCO3 (940 mg, 11.2 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 EtOAc로 세척하고, 10% HCl을 사용하여 pH 3으로 산성화시켰다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시켜 화합물 20-5를 수득하였다. (수율: 80%)
LCMS (ESI): m/z 400.0 [M+H+].
단계 3. DCM 및 MeOH (20 mL, 10 mL)의 혼합물 중 화합물 20-5 (1 g, 2.5 mmol)의 용액에 4-아미노-페닐)메탄올 (20-6) (462 mg, 3.75 mmol) 및 EEDQ (1.236 g, 5 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 잔류물을 칼럼 (PE/EtOAc= 1/3)에 의해 정제하여 20-7 (수율: 60%)을 수득하였다.
LCMS (ESI): m/z 505.1 [M+H+].
단계 4. DMF (6 mL) 중 화합물 20-7 (180 mg, 0.36 mmol)의 용액에 0℃에서 화합물 20-8 (219 mg, 0.72 mmol) 및 DIPEA (140 mg, 1.08 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물 (20-9)을 추가 정제 없이 후속 단계에 사용하였다. (수율: 100%)
LCMS (ESI): m/z 670.6 [M+H+].
단계 5. 조 20-9의 혼합물에 노르플록사신 (230 mg, 0.72 mmol)을 실온에서 첨가하고, 실온에서 1시간 동안 교반하였다. 잔류물을 정제용 HPLC에 의해 정제하여 화합물 20-11을 수득하였다. (수율: 60%)
LCMS (ESI): m/z 850.5 [M+H+].
단계 6. 화합물 20-11에 0℃에서 TFA 및 DCM (1:1)의 용액을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 혼합물을 NH3.H2O를 사용하여 pH = 9로 염기성화시켰다. 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 실시예 20 (수율: 30%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.26 (s, 1 H), 9.43 (HCOOH), 8.97 (d, J = 7.6 Hz, 1 H), 7.99 - 7.89 (m, 6 H), 7.67 - 7.65 (m, 2 H), 7.39 - 7.33 (m, 2 H), 7.23 - 7.21 (m, 1 H), 5.06 (s, 2 H), 4.72 - 4.60 (m, 2 H), 4.40 (s, 1 H), 3.80 - 3.55 (m, 6 H), 3.31 (s, 4 H), 3.15 - 3.12 (m, 2 H), 2.76 - 2.73 (m, 2 H), 2.48 - 2.41 (m, 2 H), 1.81 - 1.69 (m, 4 H), 1.59 - 1.55 (m, 2 H), 1.43 - 1.34 (m, 5 H), 1.07 - 0.98 (m, 3 H).
실시예 21. (S)-7-(4-((4-(5-아미노-2-(1-(에틸카르바모일)시클로부탄카르복스아미도) 펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. H2O (300 mL) 중 21-1 (10.0 g, 0.06 mol)의 용액에 Cu2(OH)2CO3 (24.0 g, 0.12 mol)을 첨가하였다. 혼합물을 100℃에서 1시간 동안 교반한 후, 이를 신속하게 여과하였다. Na2CO3 (20.0 g, 0.18 mol)을 여과물에 첨가하였다. 이를 실온에서 20분 동안 교반한 후, AllocCl (12.0 g, 0.10 mol)을 실온에서 적가하고, 실온에서 3시간 동안 교반하였다. 혼합물을 여과하고, H2O로 세척한 다음, 에탄티오아미드 (7.5 g, 0.10 mol)를 첨가하였다. 이를 50℃에서 3시간 동안 교반한 후, HCl (수성)을 첨가하여 pH = 3-4로 조정하였다. 혼합물을 환류 하에 1시간 동안 가열하였다. 뜨거운 혼합물을 여과한 후, 여과물을 백색 고체가 침전될 때까지 농축시켰다. 이를 실온으로 냉각시키고, 여과하여 21-2를 백색 고체 (4.5 g, 35%)로서 수득하였다.
단계 2. THF (30 mL) 중 21-2 (1.0 g, 4.6 mmol)의 용액에 DIPEA (1.9 g, 15.0 mmol) 및 화합물 21-3 (1.2 g, 4.6 mmol)을 첨가하였다. 이를 100℃에서 4시간 동안 교반한 후, 혼합물을 실온으로 냉각시켰다. 물 (100 mL)을 첨가한 다음, HCl (수성)을 첨가하여 pH = 2-3으로 조정하였다. 혼합물을 EtOAc (50 mLx2)로 추출하였다. 유기 층을 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 농축시켜 조 21-4를 갈색 고체 (1.3 g, 조 물질)로서 수득하였다.
단계 3. DCM (50 mL) 중 21-4 (1.2 g, 3.2 mmol)의 용액에 EEDQ (1.1 g, 4.5 mmol) 및 (4-아미노페닐)메탄올 (750 mg, 6.0 mmol)을 첨가하였다. 혼합물을 실온에서 4시간 동안 교반한 후, 물 (50 mL)을 첨가하였다. 혼합물을 DCM (60 mLx2)으로 추출하고, Na2SO4 상에서 건조시키고, 농축시키고, 칼럼 (PE: EtOAc = 1:20)에 의해 정제하여 21-5를 황색 오일 (500 mg, 30%)로서 수득하였다.
단계 4. DCM (30 mL) 중 21-5 (500 mg, 1.05 mmol)의 용액에 DIPEA (650 mg, 5.0 mmol) 및 PNP 카르보네이트 (320 mg, 1.5 mmol)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거하고, 잔류물을 DMF (20 mL) 중에 용해시켰다. DIPEA (400 mg, 3.0 mol) 및 노르플록사신 (380 mg, 1.2 mmol)을 첨가하였다. 혼합물을 100℃에서 5시간 동안 교반한 다음, 실온으로 냉각시켰다. 포화 NaCl (100 mL)을 첨가하고, 여과하여 조 생성물을 황색 고체 (300 mg, MS = 820.2, M +1)로서 수득하였다.
THF (30 mL) 중 상기 조 생성물 (300 mg)의 용액에 Pd(PPh3)4 (80 mg, 0.07 mmol) 및 1,3-디메틸피리미딘-2,4,6(1H,3H,5H)-트리온 (1.0 g, 6.4 mmol)을 첨가하였다. 혼합물을 N2 하에 50℃에서 16시간 동안 교반하고, 실온으로 냉각시켰다. 혼합물을 여과하고, 농축시키고, 정제용 HPLC에 의해 정제하여 실시예 21 (24 mg, 8%)을 수득하였다.
1H NMR (400MHz, DMSO-d6) δ 10,37 (s, 1 H), 8.94 (s, 1 H), 7.94 - 7.89 (m, 6 H), 7.65 - 7.63 (d, J = 8.4 Hz, 2 H), 7.37 - 7.31 (m, 2 H), 7.19 (d, J = 7.6 Hz, 1 H), 5.04 (s, 2 H), 4.63 - 4.54 (m, 2 H), 4.47 - 4.41 (m, 1 H), 3.68 - 3.53 (m, 6 H), 3.29 (s, 4 H), 3.14 - 3.08 (m, 2 H), 2.80 - 2.77 (m, 2 H), 2.48 - 2.42 (m, 2 H), 1.88 - 1.63 (m, 6 H), 1.48 (t, J = 6.8 Hz, 3 H), 1.05 - 0.95 (t, J = 7.2 Hz, 3 H).
실시예 22. 7-(4-((4-(2-(3-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)이속사졸-5-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 0℃에서 THF 및 H2O (300 mL/300 mL) 중 화합물 22-1 (50.0 g, 0.43 mol) 및 Na2CO3 (90.0 g, 0.85 mol)의 현탁액에 CbzCl (84.0 g, 0.49 mol)을 천천히 첨가하였다. 반응 혼합물을 실온으로 가온되도록 하고, 실온에서 16시간 동안 교반하였다. 유기 용매를 제거하고, 수용액을 EtOAc (200 mL)로 추출하였다. 수용액을 1M HCl을 사용하여 pH = 2로 산성화시킨 다음, EtOAc (200 mL x 2)로 추출하였다. 합한 유기 층을 염수 (150 mL)로 세척하고, 무수 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 조 22-2를 백색 고체로서 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 2. 건조 DCM (200 mL) 중 화합물 22-2 (20 g, 79.6 mmol)의 용액에 HATU (35 g, 92.1 mmol) 및 DIPEA (28 g, 217 mmol)를 첨가하였다. 이를 실온에서 15분 동안 교반한 후, N-메톡시메탄아민 히드로클로라이드 (11 g, 112.8 mmol)를 첨가하였다. 용액을 3시간 동안 교반한 후, 이를 1M HCl, 포화 NaHCO3, 및 염수로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시키고, 실리카 겔 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 22-3 (12 g, 51.2%)을 수득하였다.
단계 3. DIBAL-H (30 mL, 톨루엔 중 1M)를 건조 DCM (150 mL) 중 화합물 22-3 (4 g, 13.6 mmol)의 용액에 N2 하에 -78℃에서 적가하였다. 용액을 -78℃에서 6시간 동안 교반한 후, 이를 MeOH (100 mL) 및 물 (10 mL)로 켄칭하였다. 현탁액을 여과해내고, 여과물을 Na2SO4 상에서 건조시켰다. 용매를 제거하고, 잔류물을 실리카 겔 칼럼에 의해 정제하여 화합물 22-4를 무색 오일 (1.1 g, 34.4%)로서 수득하였다.
1H NMR (400 MHz, CDCl3) δ 9.65 (s, 1 H), 7.37-7.32 (m, 5 H), 5.35-5.33 (m, 1 H), 5.12 (s, 2 H), 4.38-4.32 (m, 1 H), 2.36-2.28 (m, 1 H), 1.05 - 1.03 (d, J = 7.2 Hz, 3 H), 0.95 (d, J = 6.8 Hz, 3 H).
단계 4. EtOH (10 mL) 중 화합물 22-4 (110 mg, 0.47 mmol)의 용액에 아세트산나트륨 (57.5 mg, 0.7 mmol) 및 히드록실아민 히드로클로라이드 (49 mg, 0.7 mmol)를 첨가하였다. 반응물을 80℃에서 16시간 동안 교반한 후, 용매를 제거하고, 잔류물을 물 중에 용해시키고, EtOAc (30 mLx2)로 추출하였다. 합한 유기 층을 염수 (30 mL)로 세척하고, 무수 황산나트륨 상에서 건조시키고, 여과하고, 농축시켜 화합물 22-5를 백색 고체로서 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.97 (s, 0.6 H), 10.73 (s, 0.3 H), 7.49-7.45 (m, 1 H), 7.39-7.29 (m, 5 H), 7.18 (d, J = 7.2 Hz, 0.3 H), 6.54 (d, J = 6.8 Hz, 0.6 H), 5.02 (s, 2 H), 4.63-4.58 (m, 0.6 H), 3.88-3.82 (m, 0.3 H), 1.89-1.78 (m, 1 H), 0.84 (q, J = 6.8 Hz, 6 H).
LCMS (ESI): m/z 251.0 [M+H+].
단계 5. DMF (5 mL) 중 화합물 22-5 (800 mg, 3.2 mmol)의 용액에 NCS (470 mg, 3.5 mmol)를 첨가하였다. 혼합물을 40℃에서 1시간 동안 교반한 후, 이를 EtOAc (50 mL) 및 물 (20 mL)로 희석하였다. 유기 층을 분리하고, 염수 (30 mL x 5)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 화합물 22-6을 수득하였으며, 이를 직접 후속 단계에 사용하였다.
단계 6. DCM (10 mL) 중 화합물 22-7 (168 mg, 2.4 mmol)의 교반 용액에 0℃에서 TEA (240 mg, 2.4 mmol)를 첨가하였다. 이를 30분 동안 교반한 후, DCM (10 mL) 중 화합물 22-6 (1.2 mmol)의 용액을 천천히 첨가하였다. 반응 혼합물을 실온으로 가온하고, 실온에서 16시간 동안 교반하였다. 물을 반응 혼합물에 첨가하고, 층을 분리하고, 수성 층을 DCM (20 mL x 3)으로 추출하였다. 합한 유기 층을 염수 (20 mL)로 세척하고, 무수 황산나트륨 상에서 건조시키고, 여과하고, 농축시켰다. 잔류물을 실리카 겔 칼럼에 의해 정제하여 화합물 22-8을 연황색 고체 (150 mg, 39.3%)로서 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.34-7.31 (m, 5 H), 6.09 (s, 1 H), 5.41 (d, J = 8.0 Hz, 1 H), 5.14-5.06 (m, 2 H), 4.96 (d, J = 6.4 Hz, 1 H), 4.78 - 4.74 (q, J = 9.2 Hz, 1 H), 2.17-2.08 (m, 1 H), 1.55 (d, J = 6.8 Hz, 3 H), 1.03 (d, J = 6.8 Hz, 3 H), 0.96-0.91 (t, J = 9.6 Hz, 6 H).
단계 7. 건조 DCM (50 mL) 중 화합물 22-8 (1 g, 3.14 mmol)의 용액에 0℃에서 MsCl (5 g, 43.9 mmol)을 첨가하였다. 반응 혼합물을 실온으로 가온되도록 하고, 실온에서 3시간 동안 교반하였다. 물을 반응 혼합물에 첨가하고, 층을 분리하고, 수성 층을 DCM (50 mLx3)으로 추출하였다. 합한 유기 층을 염수 (50 mL)로 세척하고, 무수 황산나트륨 상에서 건조시키고, 여과하고, 농축시켰다. 조 생성물을 실리카 겔 칼럼에 의해 정제하여 화합물 22-9를 무색 오일 (1.2 g, 96.4%)로서 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.36 - 7.33 (m, 5 H), 6.26 (s, 1 H), 5.82 - 5.77 (q, J = 13.6 Hz, 1 H), 5.32 - 5.31 (d, J = 8.8 Hz, 1 H), 5.14 - 5.08 (m, 2 H), 4.80 - 4.77 (m, 1 H), 3.00 (s, 3 H), 2.20 - 2.12 (m, 1 H), 1.79 - 1.77 (d, J = 6.8 Hz, 3 H), 0.97 - 0.93 (q, J = 10 Hz, 6 H).
단계 8. CsF (690 mg, 4.54 mmol)가 들은 플라스크를 N2로 퍼징하고, TMSCN (750 mg, 7.57 mmol) 및 건조 DMF (2.5 mL)를 첨가하였다. 혼합물을 실온에서 15분 동안 교반하였으며, 연황색 현탁액이 형성되었다. 건조 DMF (2 mL) 중 화합물 22-9 (600 mg, 1.51 mmol)의 용액을 첨가하였다. 혼합물을 N2 하에 50℃에서 16시간 동안 교반하고, 물 (50 mL) 및 EtOAc (50 mL)를 첨가하고, 층을 분리하였다. 수성 층을 EtAc (50 mL x 2)로 추출하였다. 합한 유기 층을 수성 NaHCO3, 염수로 세척하고, Na2SO4 상에서 건조시켰다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 화합물 22-10 (60 mg, 12.1%)을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.37 - 7.33 (m, 5 H), 6.22 (s, 1 H), 5.28 - 5.26 (m, 1 H), 5.15 - 5.08 (m, 2 H), 4.80 - 4.76 (m, 1 H), 4.12 - 4.06 (m, J = 14.8 Hz ,1 H), 2.19 - 2.14 (m, 1 H), 1.74 - 1.70 (d, J = 7.2 Hz, 3 H), 0.98 - 0.93 (m, 6 H).
LCMS (ESI): m/z 327.9 [M+H+].
단계 9. EtOH (10 mL) 중 화합물 22-10 (500 mg, 1.5 mmol)의 교반 용액에 NaOH 수용액 (4 M, 5 mL)을 첨가하였다. 반응 혼합물을 50℃에서 2시간 동안 교반한 후, 유기 용매를 제거하고, 수성 층을 H2O (20 mL) 및 EtOAc (30 mL)로 희석하였다. 층을 분리하고, 수성 층을 1 M HCl을 사용하여 pH = 2로 산성화시켰다. 이를 EtOAc (30 mL x 2)로 추출하였다. 합한 유기 층을 염수로 세척하고, 건조시키고, 농축시켜 조 화합물 22-11을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 10. EEDQ (300 mg, 1.22 mmol)를 건조 DCM (10 mL) 중 화합물 22-11 (220 mg, 0.61 mmol) 및 (4-아미노페닐)메탄올 (155 mg, 1.22 mmol)의 용액에 N2 하에 0℃에서 첨가하였다. 반응 혼합물을 실온으로 가온하고, N2 하에 실온에서 1시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC 및 SFC 분리에 의해 정제하여 22-12 및 22-13을 수득하였다.
1H NMR (400 MHz, MeOD-d4) δ 7.49 - 7.47 (d, J = 8.4 Hz, 2 H), 7.27 - 7.23 (m, 7 H), 6.23 (s, 1H), 5.05 - 4.97 (m, 2 H), 4.48 (s, 3 H), 4.00 - 3.94 (q, J = 14.0 Hz, 1 H), 2.04 - 1.95 (m, 1 H), 1.52 1.51 (d, J = 7.2 Hz, 3 H), 0.91 - 0.90 (d, J = 6.8 Hz, 3 H), 0.82 - 0.80 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 473.9 [M+Na+], 497.0 [M+2Na+].
1H NMR (400 MHz, MeOD) δ 7.54 - 7.52 (d, J = 8.4 Hz, 2 H), 7.31 - 7.29 (m, 7 H), 6.29 (s, 1 H), 5.05 (s, 2 H), 4.55 (s, 3 H), 4.05 - 4.00 (m, 1 H), 2.10 - 2.00 (m, 1 H), 1.58 - 1.56 (d, J = 7.2 Hz, 3 H), 0.97 - 0.96 (d, J = 6.8 Hz, 3 H), 0.87 - 0.85 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 473.8 [M+Na+], 496.9 [M+2Na+].
단계 11. 건조 DCM (5 mL) 중 22-12 또는 22-13 (30 mg, 0.066 mmol)의 용액에 PNP 카르보네이트 (40.4 mg, 0.13 mmol) 및 DIPEA (0.5 mL)를 첨가하였다. 혼합물을 환류 하에 20시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (3 mL) 중에 용해시켰다. DIPEA (0.5 mL) 및 노르플록사신 (63.5 mg, 0.2 mmol)을 첨가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 22를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.32 (s, 1 H), 10.37 (s, 1 H), 8.97 (s, 1 H), 7.97 - 7.94 (d, J = 13.2 Hz, 1 H), 7.83 - 7.81 (d, J = 10.8 Hz, 1 H), 7.62 - 7.60 (d, J = 8.4 Hz, 2 H), 7.37 - 7.21 (m, 8 H), 6.34 (s, 1 H), 5.07 - 5.01 (m, 4 H), 4.60 - 4.56 (m, 2 H), 4.47 - 4.43 (m, 1 H), 4.08 - 4.03 (m, 1 H), 3.61 (s, 4 H), 3.33 (s, 4 H), 1.97 - 1.92 (m, 1 H), 1.49 - 1.47 (d, J = 7.2 Hz, 3 H), 1.43 - 1.39 (t, J = 7.2 Hz, 3 H), 0.91 - 0.90 (d, J = 4.8 Hz, 3 H), 0.77 - 0.76 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 797.0 [M+H+].
실시예 23. 7-(4-((4-((S)-2-((R)-3-(벤질옥시카르보닐아미노)-3-메틸-2-옥소피롤리딘-1-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 물 (100 mL) 중 L-알라닌 23-1 (18 g, 0.2 mol)의 용액에 탄산나트륨 (32 g, 0.30 mol)을 첨가하였다. 용액은 투명해졌으며, 이를 0℃로 냉각시켰다. 온도를 5℃ 미만으로 유지하면서, THF (200 mL) 중 CbzCl (40 g, 235 mmol)을 1시간 내에 첨가하였다. 이를 실온에서 추가로 3시간 동안 교반한 후, 용액을 EtOAc로 세척하였다. 이어서, 수성 용액을 산성화시키고, EtOAc (300 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 화합물 23-2를 수득하였다.
단계 2. 티오닐 클로라이드 (3.27 mL, 44.8 mmol)를 0℃에서 건조 THF 중 CBz-L-알라닌 23-2 (10.0 g, 44.8 mmol) 및 벤즈알데히드 디메틸 아세탈 (6.73 mml, 44.8 mmol)의 교반 혼합물에 첨가하였다. 이를 30분 동안 교반한 후, 무수 ZnCl2 (6.11 g, 44.8 mmol)를 첨가하였다. 혼합물을 0℃에서 3시간 동안 교반하고, ZnCl2/SOCl2의 추가 0.2 당량을 이어서 첨가하였다. 이어서, 혼합물을 물 (10℃ 미만)로 켄칭하고, MTBE (150 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 실리카 겔 상 칼럼에 의해 정제하여 화합물 23-4를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.41-7.39 (m, 10 H), 6.65 (s, 1 H), 5.18-5.16 (m, 2 H), 4.47-4.52 (m, 1 H), 1.63-1.57 (m, 3 H).
단계 3. -78℃에서 건조 THF (80 mL) 중 화합물 23-4 (15.0 g, 48.2 mmol)의 용액에 LiHMDS (1M, 63 mL)를 1시간 내에 첨가하고, 용액을 -78℃에서 20분 동안 교반하였다. 이어서, 알릴 아이오다이드 (6.3 mL, 68.9 mmol)를 천천히 첨가하고, 반응물을 -78℃에서 3시간 동안 교반하였다. 혼합물을 실온으로 가온하고, 추가로 12시간 동안 교반하였다. 혼합물을 에테르로 희석하고, 수성 NH4Cl (100 mL)로 켄칭하였다. 혼합물을 에테르 (150 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 실리카 겔 상 칼럼에 의해 정제하여 화합물 23-5 (15 g, 88%)를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.34-7.14 (m, 9 H), 6.82-6.81 (m, 1 H), 6.28-6.21 (m, 2 H), 5.62-5.56 (m, 1 H), 5.23-5.08 (m, 2 H), 5.01-4.84 (m, 2 H), 3.36-3.19 (m, 1 H), 2.50-2.45 (m, 1 H), 1.65 (s, 2 H), 1.62-1.60 (m, 1 H).
단계 4. 오존을 용액이 청색으로 변할 때까지 -78℃에서 DCM 중 화합물 23-5 (7.8 g, 22.2 mmol)의 용액에 버블링하였다. N2를 용액이 무색으로 변할 때까지 이에 버블링한 다음, Me2S (33 mL)를 첨가하고, -78℃에서 1시간 동안 교반하였다. 이를 실온으로 가온하고, 용매를 증발시켜 화합물 23-6을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 9.66 (s, 1 H), 7.42-7.16 (m, 9 H), 6.80-6.78 (m, 2 H), 6.57 (s, 1 H), 4.99-4.96 (m, 1 H), 4.86-4.83 (m, 1 H), 4.13-4.02 (m, 1 H), 3.10-3.05 (m, 1 H), 1.76 (s, 3 H).
단계 5. MeOH (20 mL) 중 화합물 23-6 (1.0 g, 2.83 mmol)의 용액에 화합물 23-7 (438 mg, 4.24 mmol), NaCNBH3 (263 mg, 4.24 mmol) 및 NaOAc (100 mg)를 첨가하였다. 아세트산을 첨가하여 pH를 6.0으로 조정하였다. 반응물을 N2 하에 실온에서 24시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 DCM (50 mL x 2)으로 추출하고, 10% HCl 및 물 (30 mL)로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시키고, 칼럼에 의해 정제하여 화합물 23-8을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.37-7.29 (m, 5 H), 5.35 (s, 1 H), 5.11-5.03 (m, 2 H), 4.89-4.88 (m, 1 H), 3.71 (s, 3 H), 3.41-3.35 (m, 2 H), 2.45-2.43 (m, 1 H), 2.32-2.31 (m, 1 H), 1.47-1.39 (m, 6 H).
단계 6. THF (1 mL) 중 화합물 23-8 (334 mg, 1 mmol)의 용액에 수성 LiOH (4 당량)를 첨가하였다. 혼합물을 실온에서 3시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 물 중에 용해시키고, 수성 HCl을 사용하여 pH 3.0으로 산성화시켰다. 이를 에테르 (20 mL x 3)로 추출하였다. 유기 층을 합하고, 건조시키고, 농축시켜 화합물 23-9를 수득하였으며, 이를 직접 후속 단계에 사용하였다.
단계 7. DCM (20 mL) 중 화합물 23-9 (320 mg, 1.0 mmol)의 용액에 EEDQ (247 mg, 1.0 mmol) 및 화합물 23-10 (123 mg, 1.0 mmol)을 첨가하였다. 반응물을 실온에서 1시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 23-11을 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.55-7.52 (m, 2 H), 7.34-7.27 (m, 7 H), 5.05 (s, 2 H), 4.65-4.58 (m, 1 H), 4.54 (s, 2 H), 3.61-3.59 (m, 2 H), 2.60-2.45 (m, 1 H), 2.10-2.00 (m, 1 H), 1.56-1.54 (m, 3 H), 1.33 (s, 3 H).
LCMS (ESI): m/z 448.1 [M+Na+].
단계 8. DCM (20 mL) 중 23-11 (42 mg, 0.1 mmol)의 용액에 PNP 카르보네이트 (2 당량) 및 DIPEA (0.2 mL)를 첨가하였다. 용액을 환류 하에 16시간 동안 가열하였다. 용매를 증발시키고, 잔류물을 건조 DMF (5 mL) 중에 용해시켰다. DIPEA (0.2 mL) 및 노르플록사신 (4 당량)을 첨가하였다. 혼합물을 실온에서 30분 동안 교반하고, 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 23을 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.77 (s, 1 H), 7.91-7.88 (m, 1 H), 7.50-7.48 (m, 2 H), 7.25-7.23 (m, 7 H), 7.10-7.00 (m, 1 H), 5.02 (s, 2 H), 4.96 (s, 2 H), 4.61-4.42 (m, 6 H), 4.15-4.08 (m, 1 H), 3.62 (s, 4 H), 3.52-3.50 (m, 2 H), 2.50-2.40 (m, 1 H), 2.00-1.92 (m, 1 H), 1.47-1.41 (m, 6 H), 1.27 (s, 3 H).
LCMS (ESI): m/z 771.1 [M+H+].
실시예 24. 7-(4-((4-((S)-2-((2S,3S)-3-(벤질옥시카르보닐아미노)-1,1,1-트리플루오로-4-메틸펜탄-2-일아미노)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF (100 mL) 중 화합물 24-1 (9.93 g, 35.28 mmol) 및 2-메틸프로판-2-술핀아미드 (4.28 g, 35.28 mmol)의 용액에 Ti(OEt)4 (32.19 g, 141.12 mmol)를 0℃에서 적가하였다. 혼합물을 25℃에서 16시간 동안 교반한 후, 물 (25 mL)을 0℃에서 적가하였다. 혼합물을 여과하고, 여과물을 EtOAc (50 mL x 3)로 추출하였다. 용매를 제거하여 조 생성물 24-2 (11 g, 81.1%)를 수득하였다.
LCMS (ESI): m/z 385.3 [M+H+].
단계 2. TMSCF3 (3.55 g, 24.96 mmol)을 THF (30 mL) 중 24-2 (6.4 g, 16.64 mmol) 및 TMAF (1.86 g, 19.97 mmol)의 용액에 -78℃에서 적가하였다. 용액을 -78℃에서 2시간 동안 교반한 후, 이를 물 (2 mL)로 천천히 켄칭한 다음, 물 (50 mL)로 희석하였다. 혼합물을 EtOAc (60 mL x 2)로 추출하였다. 유기 층을 농축시키고, 잔류물을 실리카 겔 상에서 칼럼 크로마토그래피에 의해 정제하여 24-3 (3.3 g, 44%)을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.37-7.20 (m, 10 H), 4.21-4.11 (m, 1 H), 3.98-3.93 (m, 3 H), 3.65-3.61 (m, 2 H), 2.88-2.85 (m, 1 H), 2.29-2.20 (m, 1 H), 1.22 (s, 9 H), 1.13-1.11 (m, 3 H), 0.95-0.91 (m, 3 H).
단계 3. MeOH (25 mL) 중 24-3 (3.3 g, 7.26 mmol) 및 4M HCl의 혼합물을 25℃에서 6시간 동안 교반하였다. 용매를 제거하여 24-4의 조 생성물 (2.8 g)을 수득하였다.
LCMS (ESI): m/z 351.2 [M+H+].
단계 4. DCE (12 mL) 중 24-4 (900 mg, 2.57 mmol), 2-옥소프로판산 (905 mg, 10.28 mmol) 및 HOAc (617 mg, 10.28 mmol)의 용액에 25℃에서 NaBH(AcO)3 (2.18 g, 10.28 mmol)을 첨가하였다. 혼합물을 25℃에서 16시간 동안 교반한 후, 용매를 제거하고, 잔류물을 칼럼 크로마토그래피에 의해 정제하여 24-5 (700 mg, 64.5%)를 수득하였다.
LCMS (ESI): m/z 423.3 [M+H+].
단계 5. MeOH (5 mL) 중 24-5 (700 mg, 1.66 mmol)의 용액에 SOCl2 (395 mg, 3.32 mmol)를 0℃에서 적가하였다. 용액을 50℃에서 16시간 동안 교반한 후, 이를 25℃로 냉각시키고, 용매를 감압 하에 제거하여 24-6의 조 생성물 (620 mg, 조 물질)을 수득하였다.
LCMS (ESI): m/z 437.3 [M+H+].
단계 6. MeOH (8 mL) 중 24-6 (520 mg, 1.19 mmol) 및 Boc2O (260 mg, 1.19 mmol)의 용액에 Pd/C (100 mg)를 첨가하였다. 혼합물을 25℃에서 16시간 동안 H2 하에 교반한 후, 이를 여과하고, 용매를 제거하고, 잔류물을 실리카 겔 (PE/EtOAc 5:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 24-7 (390 mg, 92%)을 수득하였다.
LCMS (ESI): m/z 357.2 [M+H+].
단계 7. MeOH (5 mL) 중 24-7 (395 mg, 1.08 mmol)의 용액에 MeOH 중 4M HCl (5 mL, 20 mmol)을 첨가하였다. 용액을 25℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 DCM (8 mL) 중에 용해시켰다. CbzCl (276 mg, 1.62 mmol) 및 Et3N (219 mg, 2.16 mmol)을 0℃에서 첨가하고, 혼합물을 25℃에서 6시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 TLC에 의해 정제하여 화합물 8 (110 mg, 26%)을 수득하였다.
LCMS (ESI): 391.1 [M+H+].
단계 8. THF/MeOH/H2O (0.5 mL: 0.5 mL: 0.5 mL) 중 화합물 8 (110 mg, 0.282 mmol)의 용액에 25℃에서 LiOH.H2O (42 mg, 1 mmol)를 첨가하였다. 용액을 25℃에서 2시간 동안 교반하였다. 용매를 제거하고, 잔류물을 물 (3 mL)로 녹였다. 수용액을 1M HCl을 사용하여 pH 2로 산성화시키고, EtOAc (15 mLx3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 화합물 9 (100 mg, 94%)를 수득하였다.
LCMS (ESI): 377.1 m/z [M+H+].
단계 9. DCM (3 mL) 중 24-9 (120 mg, 0.319 mmol) 및 (4-아미노페닐) 메탄올 (79 mg, 0.638 mmol)의 용액에 N2 하에 0℃에서 EEDQ (158 mg, 0.638 mmol)를 첨가하였다. 혼합물을 실온에서 6시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 TLC에 이어서 SFC 분리에 의해 정제하여 주요 이성질체 (72 mg) 24-10 및 부차 이성질체 (26 mg)를 수득하였다. 각각의 이성질체의 절대 배위는 결정되지 않았다.
1H NMR (400 MHz, MeOD) δ 7.65-7.63 (m, 2 H), 7.37-7.27 (m, 7 H), 5.14-5.07 (m, 2 H), 4.56 (s, 2 H), 3.81-3.79 (m, 1 H), 3.59-3.57 (m, 1 H), 3.37-3.35 (m, 1 H), 2.11-2.10 (m, 1 H), 1.33 (d, J = 6.8 Hz, 3 H), 0.93 (d, J = 6.8 Hz, 3 H), 0.87 (d, J = 6.4 Hz, 3 H).
LCMS (ESI): 482.2 m/z [M+H+].
단계 10. THF (1.5 mL) 중 24-10 (20 mg, 0.042 mmol)의 용액에 25℃에서 PNP 카르보네이트 (38 mg, 0.125 mmol) 및 DIPEA (21 mg, 0.166 mmol)를 첨가하였다. 혼합물을 50℃에서 18시간 동안 가열하였다. 용매를 제거하고, 잔류물을 DMF (1.5 mL) 중에 용해시켰다. 노르플록사신 (20 mg, 0.062 mmol)을 첨가하고, 혼합물을 25℃에서 2시간 동안 교반하였다. 혼합물을 정제용 HPLC에 의해 정제하여 실시예 24 (11.2 mg, 33%)를 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.86 (s, 1 H), 8.41 (s, 1 H), 8.1-7.94 (m, 1 H), 7.70-7.68 (m, 2 H), 7.37-7.09 (m, 9 H), 5.13-5.09 (m, 4 H), 4.89-4.86 (m, 2 H), 3.80-3.57 (m, 6H), 3.38-3.28 (m, 3 H), 2.20-2.07 (m, 1 H), 1.52 (s, 3 H), 1.33 (t, J = 6.8 Hz, 3 H), 0.937 (d, J = 6.8 Hz, 3 H), 0.87(d, J = 6.8 Hz, 3 H).
LCMS (ESI): 827.3 m/z [M+H+].
실시예 25. 7-(4-((4-((2S,5R)-5-(벤질옥시카르보닐아미노)-2,6-디메틸-4-옥소헵탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. EtOH (50 mL) 중 화합물 25-1 (2 g, 17.07 mmol) 및 K2CO3 (7.066 g, 51.2mmol)의 용액에 벤질 브로마이드 (8.7 g, 51.2 mmol)를 첨가하였다. 혼합물을 환류 하에 5시간 동안 가열한 후, 고체를 여과해내고, 여과물을 감압 하에 농축시키고, 실리카 겔 (EtOAc: 헥산 = 1:10) 상에서 플래쉬 크로마토그래피에 의해 정제하여 25-2 (3.52 g, 58.1%)를 수득하였다.
단계 2. 건조 THF (60 mL) 중 디메틸 메틸포스포네이트 (6.78 g, 54.7 mmol)의 용액에 LDA (2 mol/L, 27 mL)를 -78℃에서 1시간에 걸쳐 적가하였다. 이를 -78℃에서 1시간 동안 교반한 후, 건조 THF (10 mL) 중 25-2 (3.52 g, 9.12 mmol)의 용액을 -78℃에서 적가하였다. 혼합물을 1시간 동안 교반하고, 이를 EtOAc (100 mL x 3)로 추출하였다. 유기 층을 염수 (60 mL)로 세척하고, 농축시켜 25-3의 조 생성물을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다 (3.12 g, 84.9%).
LCMS (ESI): m/z 403.9 [M+H+], 425.9 [M+Na+]
단계 3. 건조 THF (60 mL) 중 25-3 (3.12 g, 7.75 mmol)의 용액에 0℃에서 수소화나트륨 (372 mg, 9.3 mmol, 60%)을 첨가하였다. 이를 0℃에서 30분 동안 교반한 후, 건조 THF (5 mL) 중 2-옥소-프로피온산 에틸 에스테르 (1.349 g, 11.6 mmol)의 용액을 적가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 25-4 (2.85 g, 93.6%)를 수득하였다.
LCMS (ESI): m/z 394.2 [M+H+].
단계 4. EtOH (60 mL) 중 25-4 (2.85 g, 7.3 mmol) 및 황산 (750 mg, 7.3 mmol)의 용액에 활성탄 상 10% 팔라듐 (1 g)을 첨가하였다. 이를 수소 하에 6시간 동안 교반한 후, 반응 혼합물을 셀라이트의 패드를 통해 여과하고, 농축시켜 목적 생성물 25-5 (3.65 g, 100%)를 수득하였다.
단계 5. CH2Cl2 (150 mL) 중 25-5 (3.65 g, 7.3 mmol) 및 트리에틸아민 (2.21 g, 21.9 mmol)의 용액에 빙조에서 CbzCl (1.36 g, 8.03 mmol)의 용액을 적가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 이를 EtOAc (50 mL x 3)로 추출하였다. 유기 층을 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 조 생성물 25-6을 수득하였다.
LCMS (ESI): m/z 350.2 [M+H+], 372.2 [M+Na+].
단계 6. H2O 및 THF의 혼합물 (40 mL, 1:3) 중 25-6 (1.6 g, 4.58 mmol)의 용액에 수산화리튬 수화물 (1.93 g, 45.8 mmol)을 첨가하였다. 반응 혼합물을 실온에서 16시간 동안 교반한 후, 이를 EtOAc (50 mL x 3)로 추출하였다. 유기 층을 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 조 생성물 25-7 (1.43 g, 97.3%)을 수득하였다.
LCMS (ESI): m/z 344.1 [M+Na+].
단계 7. 건조 DCM (20 mL) 중 화합물 25-7 (1.0 g, 3.11 mmol)의 용액에 EEDQ (1.52 g, 6.22 mmol) 및 25-8 (765 mg, 6.22 mmol)을 첨가하였다. 혼합물을 N2 하에 0℃에서 16시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 25-9, 25-10, 25-11, 및 25-12를 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.49 (d, J = 8.8 Hz, 2 H), 7.35-7.25 (m, 7 H), 5.06 (s, 2 H), 4.53 (s, 2 H), 4.12 (d, J = 5.6 Hz, 1 H), 3.07-3.92 (m, 2 H), 2.62-2.57 (m, 1 H), 2.26-2.21 (m, 1 H), 1.18 (d, J = 6.8 Hz, 3 H), 0.95 (d, J = 6.8 Hz, 3 H), 0.81 (d, J = 6.8 Hz, 3 H). LCMS (ESI): m/z 427.2 [M+H+], 449.1 [M+Na+], 409.2 [M-OH].
1H NMR (400 MHz, MeOD) δ 7.49 (d, J = 8.8 Hz, 2 H), 7.33-7.20 (m, 7 H), 5.07 (s, 2 H), 4.53 (s, 2 H), 4.12 (d, J = 5.6 Hz, 1 H), 3.28-2.92 (m, 2 H), 2.63-2.57 (m, 1 H), 2.27-2.19 (m, 1 H), 1.18 (d, J = 6.8 Hz, 3 H), 0.95 (d, J = 6.8 Hz, 3 H), 0.81 (d, J = 6.8 Hz, 3 H). LCMS (ESI): m/z 427.2 [M+H+], 449.1 [M+Na+], 409.2 [M-OH].
1H NMR (400 MHz, MeOD) δ 7.41 (d, J = 6.8 Hz, 2 H), 7.39-7.16 (m, 7 H), 5.03-4.96 (m, 2 H), 4.47 (s, 2 H), 3.89 (d, J = 6.4 Hz, 1 H), 2.93-2.82 (m, 2 H), 2.49-2.43 (m, 1 H), 2.10-2.05 (m, 1 H), 1.07 (d, J = 6.8 Hz, 3 H), 0.82 (d, J = 6.8 Hz, 3 H), 0.77 (d, J = 6.8 Hz, 3 H). LCMS (ESI): m/z 427.2 [M+H+], 449.1 [M+Na+], 409.2 [M-OH].
1H NMR (400 MHz, MeOD) δ 8.02 (d, J = 18.8 Hz, 2 H), 7.79-7.29 (m, 7 H), 5.16-5.08 (m, 2 H), 4.56 (s, 2 H), 4.01 (d, J = 6.0 Hz, 1 H), 3.32-2.94 (m, 2 H), 2.60-2.55 (m, 1 H), 2.24-2.12 (m, 1 H), 1.19 (d, J = 6.8 Hz, 3 H), 0.95-0.88 (m, 6 H). LCMS (ESI): m/z 409.0 [M-OH].
단계 8. 건조 DCM (2 mL) 중 25-9 (100 mg, 0.235 mmol)의 용액에 PNP 카르보네이트 (147 mg, 0.47 mmol) 및 DIPEA (61 mg)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (3 mL) 중에 용해시켰다. DIPEA (61 mg, 0.47 mmol) 및 노르플록사신 (150 mg, 0.47 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 25를 백색 고체로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.33 (s, 1 H), 10.01 (s, 1 H), 8.96 (s, 1 H), 7.94 (d, J = 12.8 Hz, 1 H), 7.72 (d, J = 8.0 Hz, 1 H), 7.58 (d, J = 8.4 Hz, 2 H), 7.37-7.30 (m, 7 H), 7.21 (d, J = 7.2 Hz, 1 H), 5.05-5.04 (m, 4 H), 4.59-4.58 (m, 2 H), 3.84-3.80 (m, 1 H), 3.61 (s, 4 H), 2.94-2.89 (m, 2 H), 2.12-2.05 (m, 1 H), 1.42-1.39 (m, 3 H), 1.07 (d, J = 6.0 Hz, 3 H), 0.82 (d, J = 6.4 Hz, 6 H). LCMS (ESI): m/z 772.6 [M+H+], 386.7 [M/2+H+].
실시예 26. 7-(4-((4-(2-(5-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)-1,3,4-옥사디아졸-2-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. MeOH (180 mL) 및 H2O (180 mL) 중 26-1 (10.0 g, 78.7 mmol)의 용액에 LiOH·H2O (16.9 g, 393.3 mmol)를 첨가하였다. 혼합물을 실온에서 24시간 동안 교반한 후, 이를 진한 HCl을 사용하여 pH = 6으로 산성화시켰다. 이어서, 조 물질을 (200 mLx3)로 추출하고, 농축시켜 26-2를 수득하였다.
단계 2. DCM (400 mL) 중 26-2(2 g, 20.2 mmol) 및 DMAP (247 mg, 2.02 mmol)의 교반 용액에 26-3 (5.89 g, 22.2 mmol) 및 EDCI (4.26 g, 22.2 mmol)를 첨가하였다. 용액을 실온에서 2시간 동안 교반한 후, 이를 물 (200 mLx3), 염수 (100 mL)로 연속적으로 세척하고, Na2SO4 상에서 건조시키고, 농축시켜 26-4를 수득하였다.
단계 3. THF (50 mL) 중 26-4 (3 g, 8.7 mmol) 및 버지스 시약 (3.1 g, 13.1 mmol)의 혼합물을 실온에서 24시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 EtOAc (100 mLx3)로 추출하였다. 유기 층을 염수 (100 mL)로 세척하고, 농축시키고, 실리카 겔 (PE: EtOAc = 2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 26-5를 수득하였다.
단계 4. EtOH (66 mL) 및 H2O (66 mL) 중 26-5(1.67 g, 5.09 mmol) 및 NaOH의 용액 (66 mmol)의 혼합물을 80℃에서 12시간 동안 가열하였다. 이를 실온으로 냉각시킨 후, 혼합물을 EtOAc (50 mL)로 세척하고, 수성 층을 pH 5-6으로 조정하고, EtOAc (60 mLx3)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 26-6을 수득하였다.
단계 5. DCM (50 mL) 중 26-6 (1.47 g, 4.23 mmol), 26-7 (1.56 g, 12.7 mmol) 및 EEDQ (3.14 g, 12.7 mmol)의 혼합물을 실온에서 2시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 26-8 및 26-9를 수득하였다.
단계 6. DCM (3 mL) 중 26-8 (40 mg, 0.088 mmol), PNP (57 mg, 0.18 mmol) 및 DIPEA (34 mg, 0.26 mmol)의 혼합물을 50℃에서 12시간 동안 교반하였다. 이를 농축시키고, DMF (5 mL) 중 노르플록사신 (82 mg, 0.26 mmol) 및 DIPEA (34 mg, 0.26 mmol)와 혼합하였다. 이를 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 26 (30.5 mg, 43.6%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.33 (s, 1 H), 10.44 (s, 1 H), 8.97 (s, 1 H), 8.12-8.08 (m, 1 H), 7.95 (d, J = 13.2 Hz, 1 H), 7.58 (d, J = 8.4 Hz, 2 H), 7.37-7.34 (m, 7 H), 7.21 (d, J =7.2 Hz, 1 H), 5.05 (d, J = 14.8 Hz, 4 H), 4.59-4.58 (m, 3 H), 4.19-4.17 (m, 1 H), 3.61 (s, 4 H), 3.38 (s, 4 H), 2.10-2.07 (m, 1 H), 1.58 (dd, J =2.0, 7.2 Hz, 3 H), 1.40 (t, J = 6.8 Hz, 3 H), 0.93 (d, J = 6.8 Hz, 3 H), 0.82 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 798.3 [M+H+], 820.2 [M+Na+].
실시예 27. 7-(4-((4-((S)-2-(2-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)티아졸-5-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. -78℃에서 건조 THF (100 mL) 중 27-1 (8 g, 31.8 mmol) 및 Et3N (6.43 g, 63.6 mmol)의 용액에 THF (10 mL) 중 에틸 클로로포르메이트 (3.45 g, 31.8 mmol)의 용액을 적가하였다. 반응물을 -78℃에서 1시간 동안 교반한 후, NH3.H2O (5 mL)를 첨가하였다. 반응물을 실온으로 2시간에 걸쳐 가온하였다. 백색 고체를 여과에 의해 수집하고, 건조시켜 27-2 (5.1 g, 63.8%)를 수득하였다.
단계 2. 건조 THF (60 mL) 중 27-2 (3 g, 12 mmol) 및 라웨슨 시약 (9.7 g, 24 mmol)의 용액을 70℃에서 16시간 동안 교반하였다. 용매를 제거하고, 잔류물을 칼럼 (EtOAc: 헥산= 1:3)에 의해 정제하여 27-3 (2.9 g, 90.6%)을 수득하였다.
LCMS (ESI): m/z 267.1 [M+H+], 289.1 [M+Na+].
단계 3. 건조 DME (40 mL) 중 27-3 (3 g, 11.26 mmol), KHCO3 (3.38 g, 33.8 mmol)의 용액에 DME (10 mL) 중 27-3a (11.31 g, 22.52 mmol)의 용액을 적가하였다. 반응물을 -40℃에서 16시간 동안 교반한 후, 물 (50 mL) 및 EtOAc (100 mL)를 첨가하고, 유기 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. THF (20 mL) 중 조 중간체 및 2,6-디메틸피리딘 (3.3 g, 30.4 mmol)의 혼합물에 2,2,2-트리플루오로아세트산 무수물 (3.2 g, 15.2 mmol)의 용액을 -40℃에서 천천히 적가하였다. 반응물을 -10℃에서 2시간 동안 교반한 후, 물 (100 mL) 및 EtOAc (100 mL)를 첨가하였다. 유기 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 조 생성물을 정제용 HPLC에 의해 정제하여 27-4 (2 g, 67.7%)를 수득하였다.
LCMS (ESI): m/z 391.2 [M+H+].
단계 4. CH3OH 및 H2O (60 mL/20 mL)의 혼합물 중 27-4 (2 g, 5.13 mmol)의 용액에 수산화리튬 (2.15g, 51.3 mmol)을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, pH를 묽은 HCl (5%)을 사용하여 5로 조정하고, 혼합물을 EtOAc (60 mL x 2)로 추출하였다. 유기 층을 염수 (60 mL)로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 27-5를 수득하였다.
LCMS (ESI): m/z 363.2 [M+H+].
단계 5. CH2Cl2 (20 mL) 중 27-5 (1 g, 2.76 mmol) 및 EEDQ (750 mg, 5.52 mmol)의 용액에 0℃에서 (4-아미노페닐)메탄올 (680 mg, 5.52 mmol)을 첨가하였다. 반응 혼합물을 0℃에서 2시간 동안 교반한 다음, 실온에서 16시간 동안 교반하였다. 반응 혼합물을 CH2Cl2 (50 mL)로 희석하고, 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시키고, 정제용 HPLC 및 SFC에 의해 정제하여 27-6 및 27-7 (370 mg 각각, 28.7%)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.55 (d, J = 8.4 Hz, 2 H), 7.36-7.29 (m, 8 H), 5.11 (s, 2 H), 4.80 (d, J = 6.8 Hz, 1 H), 4.56 (s, 2 H), 4.07-4.01 (m, 1 H), 2.33-2.25 (m, 1 H), 1.60 (d, J = 6.8 Hz, 3 H), 0.96-0.91 (m, 6 H). LCMS (ESI): m/z 468.0 [M+H+], 490.2 [M+Na+].
1H NMR (400 MHz, CDCl3) δ 8.90 (s, 1 H), 7.49-7.23 (m, 9 H), 7.05 (s, 1 H), 5.48-5.45 (m, 1 H), 5.14-5.10 (m, 2 H), 5.03-4.99 (m, 1 H), 4.61 (s, 2 H), 3.94-3.88 (m, 1 H), 2.42-2.34 (m, 1 H), 1.63 (d, J = 7.2 Hz, 3 H), 1.02-1.94 (m, 6H). LCMS (ESI): m/z 489.9 [M+Na+].
단계 6. 건조 DCM (2 mL) 중 27-6 (50 mg, 0.11 mmol)의 용액에 PNP 카르보네이트 (67 mg, 0.22 mmol) 및 DIPEA (28 mg)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 건조 DMF (5 mL) 중에 용해시켰다. DIPEA (60 mg, 047 mmol) 및 노르플록사신 (60 mg, 0.188 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 27을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.34 (s, 1 H), 10.17 (s, 1 H), 8.97 (s, 1 H), 8.10 (d, J = 8.4 Hz, 1 H), 7.95 (d, J = 8.4 Hz, 1 H), 7.60 (d, J = 8.4 Hz, 2 H), 7.36-7.31 (m, 7 H), 7.21 (d, J = 7.2 Hz, 1 H), 5.05 (s, 4 H), 4.66-4.56 (m, 3 H), 4.03-3.97 (m, 1 H), 3.61 (s, 4 H), 3.35 (s, 4 H), 2.20-2.14 (m, 1 H), 1.47-1.39 (m, 6 H), 0.87-0.80 (m, 6 H). LCMS (ESI): m/z 813.1, [M+H+], 407.1 [M/2+H+].
실시예 28. 7-(4-((4-((R)-2-((S)-6-(벤질옥시카르보닐)-7-이소프로필-5-옥소-6,7-디히드로-5H-이미다조[5,1-c][1,2,4]트리아졸-3-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. MeOH (200 mL) 중 28-1 (12 g, 0.1 mol)의 용액에 0℃에서 SOCl2 (10 mL)를 10분 내에 첨가하였다. 혼합물을 실온에서 12시간 동안 교반한 후, 용매를 제거하여 목적 생성물 28-2를 수득하였다.
단계 2. DCM (50 mL) 중 28-2 (2.6 g, 5 mmol)의 용액에 TEA (2 mL)를 첨가하고, 용액이 투명해질 때까지 0℃에서 교반하였다. 이어서, CbzCl (10.2 g, 6 mmol)을 1시간 내에 적가하고, 온도를 5℃ 미만으로 유지하였다. 이어서, 혼합물을 실온에서 추가로 10시간 동안 교반하였다. 용액을 DCM (100 mL)으로 녹이고, 수성 HCl, 수성 NaHCO3 및 물로 세척하고, 유기 층을 무수 Na2SO4 상에서 건조시킨 다음, 용매를 증발시켜 28-3을 수득하였다.
LCMS (ESI): m/z 265.9 [M+H+].
단계 3. MeOH (25 mL) 중 28-3 (2.65 g, 10 mmol)의 용액에 NH2NH2.H2O (5 mL, 80%)를 첨가하였다. 혼합물을 실온에서 6시간 동안 교반한 후, 고체를 여과에 의해 수집하여 28-4를 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.36-7.30 (m, 5 H), 5.07 (s, 2 H), 4.59 (s, 1 H), 3.84-3.82 (m, 1 H), 0.94-0.91 (m, 6 H).
단계 4. 화합물 28-4 (2.65g, 10 mmol), 28-5 (4.2 g, 20.2 mmol) 및 건조 MeOH (50 mL)를 밀봉된 용기 중에서 150℃에서 24시간 동안 가열하였다. 용매를 제거하여 목적 생성물 28-6을 수득하였다.
단계 5. EtOH (20 mL) 및 물 (10 mL) 중 28-6 (740 mg, 2 mmol)의 용액에 NaOH (400 mg, 10mmol)를 첨가하였다. 혼합물을 50℃에서 1시간 동안 교반한 후, 용매를 제거하고, 잔류물을 칼럼에 의해 정제하여 28-7을 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.32-7.26 (m, 5 H), 5.10-5.05 (m, 2 H), 4.61-4.59 (m, 1 H), 3.94-3.92 (m, 1 H), 2.16-2.14 (m, 1 H), 1.55-1.53 (m, 3 H), 0.99-0.82 (m, 6 H).
단계 6. 건조 DCM (5 mL) 중 28-7 (100 mg, 0.28 mmol)의 용액에 (4-아미노페닐)메탄올 (250 mg, 2 mmol) 및 EEDQ (247 mg, 1 mmol)를 첨가하였다. 혼합물을 0℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 28-8 및 28-9를 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.57 (d, J = 8.4 Hz, 2 H), 7.35-7.30 (m, 7 H), 5.13-5.05 (m, 2 H), 4.63 (d, J = 7.6 Hz, 1 H), 4.57 (s, 2 H), 4.07-4.02 (m, 1 H), 2.23-2.17 (m, 1 H), 1.66 (d, J = 7.2 Hz, 3 H), 0.98 (d, J = 6.8 Hz, 3 H), 0.87 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 452.0 [M+H+].
1H NMR (400 MHz, MeOD) δ 7.57 (d, J = 8.4 Hz, 2 H), 7.35-7.30 (m, 7 H), 5.13-5.05 (m, 2 H), 4.63 (d, J = 7.6 Hz, 1 H), 4.57 (s, 2 H), 4.00-3.99 (m, 1 H), 2.19-2.17 (m, 1 H), 1.66 (s, 3 H), 0.98 (d, J = 5.6 Hz, 3 H), 0.87 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 473.9 [M+Na+].
단계 7. 건조 DCM (30 mL) 중 28-8 (45 mg, 0.1 mmol)의 용액에 PNP 카르보네이트 (62 mg, 0.2 mmol) 및 DIPEA (1 mL)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하고, 용매를 제거하고, 잔류물을 DMF (5 mL) 중에 용해시켰다. DIPEA (1.0 mL) 및 노르플록사신 (65 mg, 0.2 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 28을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 8.97 (s, 1 H), 7.97-7.94 (m, 2 H), 7.48-7.23 (m, 10 H), 5.17 (s, 2 H), 5.04 (s, 2 H), 4.61-4.58 (m, 2 H), 4.50-4.40 (m, 1 H), 3.69-3.63 (m, 4 H), 3.40-3.35 (m, 1 H), 3.29-3.26 (m, 4 H), 2.09-2.08 (m, 1 H), 1.91-1.88 (m, 2 H), 1.41 (t, J = 7.2 Hz, 3 H), 0.96-0.89 (m, 6 H).
LCMS (ESI): 823.3 m/z [M+H+].
실시예 29. 7-(4-((4-((R)-2-(2-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)티아졸-5-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
실시예 29를 실시예 27과 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.33 (brs, 1 H), 10.17 (s, 1 H), 8.96 (s, 1 H), 8.10 (d, J = 8.4 Hz, 1 H), 7.95 (d, J = 8.4 Hz, 1 H), 7.60 (d, J = 8.4 Hz, 2 H), 7.36-7.31 (m, 7 H), 7.21 (d, J = 7.2 Hz, 1 H), 5.05 (s, 4 H), 4.66-4.56 (m, 3 H), 4.03-3.97 (m, 1 H), 3.61 (s, 4 H), 3.35 (s, 4 H), 2.20-2.14 (m, 1 H), 1.47-1.39 (m, 6 H), 0.87-0.80 (m, 6 H). LCMS (ESI): m/z 813.1, [M+H+], 407.3 [M/2+H+].
실시예 30. 7-(4-((4-((S)-2-((S)-6-(벤질옥시카르보닐)-7-이소프로필-5-옥소-6,7-디히드로-5H-이미다조[5,1-c][1,2,4]트리아졸-3-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
실시예 30을 실시예 28과 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 8.99 (s, 1 H), 8.14-7.93 (m, 2 H), 7.57-7.19 (m, 10 H), 5.19 (s, 2 H), 5.11-5.03 (m, 2 H), 4.62-4.56 (m, 2 H), 4.51-4.47 (m, 1 H), 3.67-3.57 (m, 4 H), 3.52-3.50 (m, 1 H), 3.40-3.35 (m, 4 H), 2.25-2.15 (m, 1 H), 1.90 (s, 2 H), 1.41 (t, J = 7.2 Hz, 3 H), 0.98-0.84 (m, 6 H).
실시예 31. 7-(4-((4-((2S,5S)-5-(벤질옥시카르보닐아미노)-2,6-디메틸-4-옥소헵탄아미도)벤질옥시) 카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. 실시예 31을 실시예 25와 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.29 (s, 1 H), 9.98 (s, 1 H), 8.92 (s, 1 H), 7.90 (d, J = 13.2 Hz, 1 H), 7.57-7.54 (m, 3 H), 7.32-7.24 (m, 7 H), 7.17 (d, J = 7.6 Hz, 1 H), 5.05-4.97 (m, 4 H), 4.56-4.54 (m, 2 H), 3.95-3.92 (m, 1 H), 3.58 (s, 4 H), 3.26 (s, 4 H), 2.93-2.83 (m, 2 H), 2.57-2.52 (m, 1 H), 2.16-2.08 (m, 1 H), 1.45-1.35 (m, 3 H), 1.07 (d, J = 6.4 Hz, 3 H), 0.85 (d, J = 8.2 Hz, 3 H), 0.75 (d, J = 8.0 Hz, 3 H). LCMS (ESI): m/z 772.1 [M+H+].
실시예 32. 7-(4-((4-((2R,5R)-5-(벤질옥시카르보닐아미노)-2,6-디메틸-4-옥소헵탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. 실시예 32를 실시예 25의 합성으로부터의 중간체로 실시예 25와 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.30 (s, 1 H), 10.03 (s, 1 H), 8.97 (s, 1 H), 7.95 (d, J = 12.8 Hz, 1 H), 7.74 (d, J = 8.4 Hz, 1 H), 7.58 (d, J = 8.4 Hz, 2 H) 7.37-7.31 (m, 7 H), 7.21 (d, J = 7.2 Hz, 1 H) 5.09-5.02 (m, 4 H), 4.60-4.56 (m, 2 H), 3.84-3.80 (m, 1 H), 3.61 (s, 4 H), 3.34 (s, 4 H), 2.92-2.85 (m, 2 H), 2.12-2.08 (m, 1 H), 2.05 (s, 1 H), 1.42-1.39 (m, 3 H), 1.07 (d, J = 6.8 Hz, 3 H), 0.82 (d, J = 6.8 Hz, 6 H). LCMS (ESI): m/z 772.4 [M+H+].
실시예 33. 7-(4-((4-((2R,5S)-5-(벤질옥시카르보닐아미노)-2,6-디메틸-4-옥소헵탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 실시예 33을 실시예 25의 합성으로부터의 중간체로 실시예 25와 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.34 (s, 1 H), 10.02 (s, 1 H), 8.97 (s, 1 H), 7.95 (d, J = 12.8 Hz, 1 H), 7.58 (d, J = 8.4 Hz, 3 H), 7.36-7.29 (m, 7 H), 7.21 (d, J = 7.2 Hz, 1 H), 5.08-5.00 (m, 4 H), 4.61-4.56 (m, 2 H), 3.99-3.95 (m, 1 H), 3.61 (s, 4 H), 3.31 (s, 4 H), 2.96-2.85 (m, 2 H), 2.50-2.47 (m, 1 H), 2.19-2.13 (m, 1 H), 1.42-1.39 (m, 3 H), 1.08 (d, J = 6.0 Hz, 3 H), 0.90 (d, J = 6.0 Hz, 3 H), 0.82 (d, J = 6.4 Hz, 3 H). LCMS (ESI): m/z 772.0 [M+H+].
실시예 34. 7-(4-((4-(2-(5-((R)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)-1,3,4-옥사디아졸-2-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
실시예 34를 실시예 26의 합성으로부터의 중간체로 실시예 26과 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.32 (s, 1 H), 10.46 (s, 1 H), 8.95 (s, 1 H), 8.09 (s, 1 H), 7.94 (d, J = 13.2 Hz, 1 H), 7.58 (d, J = 8.0 Hz, 2 H), 7.36-7.33 (m, 7 H), 7.20 (d, J = 6.4 Hz, 1 H), 5.04 (d, J =15.2 Hz, 4 H), 4.62-4.57 (m, 3 H), 4.22-4.21 (m, 1 H), 3.61 (s, 4 H), 3.35 (s, 4 H), 2.13-2.11 (m, 1 H), 1.58 (d, J = 5.6 Hz, 3 H), 1.40 (t, J = 6.8 Hz, 3 H), 0.93 (d, J = 6.0 Hz, 3 H), 0.81 (d, J =6.4 Hz, 3H).
LCMS (ESI): m/z 798.1 [M+H+].
실시예 35. 7-(4-((4-((2S,5S)-5-(벤질옥시카르보닐아미노)-4-히드록시-2,6-디메틸헵탄아미도) 벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. 건조 CH3OH (20 mL) 중 실시예 25 (120 mg, 0.156 mmol)에 NaBH4 (6 mg, 0.158 mmol)의 용액을 빙조에서 첨가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 35를 고체 (40 mg)로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.33 (s, 1 H), 9.88 (s, 1 H), 8.96 (s, 1 H), 7.94 (d, J = 12.8 Hz, 1 H), 7.62 (d, J = 8.4 Hz, 2 H), 7.37-7.20 (m, 8 H), 6.95 (d, J = 10.0 Hz, 1 H), 5.05-4.99 (m, 4 H), 4.59-4.57 (m, 3 H), 3.61 (s, 4 H), 3.47-3.42 (m, 1 H), 3.30 (s, 4 H), 2.72-2.66 (m, 1 H) 2.07-2.04 (m, 1 H), 1.59-1.51 (m, 2 H), 1.45-1.35 (m, 3 H), 1.05 (d, J = 8.0 Hz, 3 H), 0.85-0.75 (m, 6 H). LCMS (ESI): m/z 387.7 [M/2+H+].
실시예 36. 7-(4-((4-(2-(5-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)-4H-1,2,4-트리아졸-3-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. DCM (3 mL) 중 28-8 (80 mg, 0.177 mmol)의 용액에 15℃에서 Boc2O (232 mg, 1.062 mmol) 및 Et3N (107 mg, 1.062mmol)을 첨가하였다. 용액을 15℃에서 16시간 동안 교반한 후, DCM을 감압 하에 제거하고, 잔류물을 석유 에테르 (5 mL x 3)로 세척하였다. 생성된 고체를 DCM (3 mL) 중에 용해시키고, PNP 카르보네이트 (108 mg, 0.354 mmol) 및 DIPEA (92 mg, 0.708 mmol)를 첨가하였다. 용액을 15℃에서 2시간 동안 교반한 후, 용매를 감압 하에 제거하고, 잔류물을 DMF (3 mL) 중에 용해시키고, 노르플록사신 (170 mg, 0.531 mmol) 및 DIPEA (92 mg, 0.708 mmol)를 첨가하였다. 이를 15℃에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 36의 혼합물 (37 mg, 26%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 8.96 (s, 1 H), 7.95 (d, J = 13.2 Hz, 1 H), 7.60 (d, J = 8.4 Hz, 2 H), 7.34-7.20 (m, 8 H), 5.06-5.00 (m, 4 H), 4.59-4.41 (m, 3 H), 4.08-3.82 (m, 1 H), 3.61 (s, 4 H), 3.29 (s, 4 H), 2.15-2.07 (m, 1 H), 1.50-1.49 (m, 3 H), 1.40 (t, J = 7.2 Hz, 3 H), 0.88-0.87 (m, 3 H), 0.75-0.73 (m, 3 H).
실시예 37. 7-(4-((4-(2-(5-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)이속사졸-3-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. 피리딘 (50 mL) 중 37-1 (5 g, 43.1 mmol) 및 히드록실아민 히드로클로라이드 (3.02 g, 43.1 mmol)의 혼합물을 70℃에서 16시간 동안 교반하였다. 용매를 제거하고, 잔류물을 DMF (30 mL) 중에 용해시키고, NCS (5.73 g, 43.1 mmol)를 0℃에서 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 용매를 제거한 후, 잔류물 (37-2)을 직접 후속 단계에 정제 없이 사용하였다.
단계 2. t-BuOH 및 H2O (20 mL/20 mL)의 혼합물 중 37-2 (5 g, 30.2 mmol), CuSO4 .5H2O (250 mg, 1 mmol), 아스코르브산나트륨 (198 mg, 1 mmol), Na2CO3 (1.1 g, 10.4 mmol)의 혼합물에 0℃에서 (1-이소프로필-프로프-2-이닐)-카르밤산 벤질 에스테르 (1.2 g, 5.2 mmol)를 첨가하였다. 혼합물을 60℃에서 16시간 동안 교반한 후, 이를 EtOAc (80 mL x 3)로 추출하였다. 유기 층을 염수 (60 mL)로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시키고, 정제용 HPLC에 의해 정제하여 37-3을 수득하였다.
LCMS (ESI): m/z 361.1 [M+H+]
단계 3. THF 및 H2O (8 mL/4 mL)의 혼합물 중 37-3 (150 mg, 0.417 mmol)의 용액에 수산화리튬 수화물 (145 mg, 4.17 mmol)을 첨가하고, 혼합물을 실온에서 16시간 동안 교반하였다. 용매를 제거하고, 혼합물을 EtOAc로 세척하였다. 이를 산성화시킨 후, 이를 EtOAc (30 mLx3)로 추출하였다. 유기 층을 염수 (30 mL)로 세척하고, Na2SO4상에서 건조시키고, 농축시켜 조 생성물 37-4를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다 (123 mg, 84.8%).
LCMS (ESI): m/z 347.2 [M+H+].
단계 4. CH2Cl2 (5 mL) 중 37-4 (123 mg, 0.35 mmol) 및 (4-아미노페닐)메탄올 (87 mg, 0.71 mmol)의 혼합물에 0℃에서 EEDQ (174 mg, 0.71 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하고, EtOAc (30 mL x 3)로 추출하였다. 유기 층을 염수 (30 mL)로 세척하고, Na2SO4 상에서 건조시키고, 농축시키고, 정제용 HPLC에 의해 정제하여 37-5 (63 mg, 39.4%)를 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.44-7.42 (m, 2 H), 7.23-7.19 (m, 7 H), 6.23 (d, J = 2.8 Hz, 1 H), 4.99-4.98 (m, 2 H), 4.58-4.54 (m, 1 H), 4.46 (s, 2 H), 3.90-3.85 (m, 1 H), 2.10-2.01 (m, 1 H), 1.45-1.43 (m, 3 H), 089-0.79 (m, 6 H). LCMS (ESI): m/z 434.1 [M-OH].
단계 5. 건조 DCM (2 mL) 중 37-5 (40 mg, 0.089 mmol)의 용액에 PNP 카르보네이트 (57 mg, 0.177 mmol) 및 DIPEA (23 mg)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (2 mL) 중에 용해시키고, DIPEA (23 mg) 및 노르플록사신 (54 mg, 0.178 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 37을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.30 (s, 1 H), 10.28 (s, 1 H), 8.93 (s, 1 H), 7.95-7.89 (m, 2 H), 7.57 (d, J = 8.8 Hz, 2 H), 7.35-7.12 (m, 8 H), 6.32 (d, J = 4.4 Hz, 1 H), 5.02 (d, J = 11.6 Hz, 4 H), 4.56-4.52 (m, 3 H), 3.97-3.91 (m, 1 H), 3.57 (s, 4 H), 3.29 (s, 4 H), 2.03-1.96 (m, 1 H), 1.41-1.35 (m, 6 H), 0.85-0.75 (m, 6 H). LCMS (ESI): m/z 797.3 [M+H+], 399.3 [M/2+H+].
실시예 38. 7-(4-((4-(2-(5-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)티아졸-2-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. N2 하에 0℃에서 MeOH (200 mL) 중 38-1 (40 g, 0.34 mol)의 용액에 SOCl2 (28 mL, 0.38 mol)를 첨가하였다. 혼합물을 실온에서 12시간 동안 교반한 후, 용매를 제거하여 조 생성물 38-2를 수득하였다.
단계 2. CbzCl (53 mL, 0.37 mol)을 물 (300 mL) 중 38-2 (57 g, 0.34 mol) 및 Na2CO3 (72 g, 0.68 mol)의 혼합물에 20분에 걸쳐 적가하였다. 혼합물을 실온에서 12시간 동안 교반한 후, 이를 EtOAc (500 mL x 3)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 조 생성물을 수득하였으며, 이를 실리카 겔 (PE: EtOAc = 5:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 38-3을 수득하였다.
단계 3. THF (20 mL) 중 화합물 38-3 (10 g, 37.7 mmol)의 용액에 ClCH2I (26.6 g, 151 mmol)를 첨가하였다. 이를 -78℃로 냉각시킨 후, LDA를 2시간 내에 천천히 첨가하였다. 이를 N2 하에 -78℃에서 30분 동안 교반한 후, THF 중 HOAc (21 mL, 377 mmol)를 -70℃ 하에 첨가하였다. 이를 실온으로 가온하고, EtOAc (30 mL)를 첨가하고, 혼합물을 염수에 부었다. 이를 EtOAc (80 mL x 3)로 추출하고, Na2SO4 상에서 건조시키고, 농축시키고, 실리카 겔 (PE: EtOAc= 5:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 38-4를 수득하였다.
단계 4. 화합물 38-4 (5 g, 17.6 mmol) 및 NaN3 (1.8 g, 26.4 mmol)의 혼합물을 실온에서 1시간 동안 교반한 후, 이를 물에 붓고, EtOAc (150 mL x 3)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 압력 하에 농축 감소시켜 화합물 38-5의 조 생성물을 수득하였다.
단계 5. MeOH (50 mL) 중 화합물 38-5 (4.84 g, 16.7 mmol)의 용액에 SnCl·2H2O (7.5 g, 33.3 mmol)를 첨가하고, 혼합물을 실온에서 2시간 동안 교반하였다. 용매를 제거한 후; 잔류물 (38-6)을 직접 후속 단계에 사용하였다.
단계 6. H2O (15 mL) 및 디옥산 (15 mL) 중 화합물 38-6 (3.75 g, 14.2 mmol), NaHCO3 (11.93 g, 142 mmol), Boc2O (3.41 g, 15.6 mmol)의 혼합물을 실온에서 1시간 동안 교반하였다. 혼합물을 EtOAc (150 mL x 3)로 추출하고, Na2SO4 상에서 건조시키고, 농축시키고, 실리카 겔 (PE: EtOAc = 5:1에서 2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 38-7을 수득하였다. MeOH (20 mL) 중 화합물 38-7 (1.6 g, 4.43 mmol) 및 4 M HCl의 혼합물을 실온에서 1시간 동안 교반한 후, 이를 증발시켜 화합물 38-6을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 7. DCM (20 mL) 중 화합물 38-6 (1.17 g, 4.43 mmol) 및 화합물 38-8 (643 mg, 4.87 mmol)의 용액에 EEDQ (1.31 g, 5.31 mmol)를 첨가하였다. 혼합물을 실온에서 1시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 화합물 38-9를 수득하였다.
단계 8. N2 하에 THF (20 mL) 중 화합물 38-9 (1 g, 2.64 mmol)의 용액에 라웨슨 시약 (1.18 g, 2.91 mmol)을 첨가하였다. 혼합물을 60℃에서 1시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 화합물 38-10을 수득하였다.
단계 9. MeOH (5 mL) 및 H2O (1 mL) 중 화합물 38-10 (630 mg, 1.67 mmol)의 용액에 LiOH·H2O (105 mg, 2.51 mmol)를 첨가하였다. 현탁액을 실온에서 1시간 동안 교반한 후, 이를 진한 HCl을 사용하여 pH = 6으로 산성화시켰다. 혼합물을 (50 mL x 3)로 추출하고, 감압 하에 농축시켜 화합물 38-11을 수득하였다.
단계 10. DCM (10 mL) 중 화합물 38-11 (438 mg, 1.21 mmol), 화합물 38-12 (446 mg, 3.62 mmol), HATU (690 mg, 1.82 mmol), DIPEA (468 mg, 3.62 mmol) 및 EEDQ (895 mg, 3.62 mmol)의 혼합물을 실온에서 2시간 동안 교반하였다. 용매를 제거한 후, 이를 정제용 HPLC에 의해 정제하여 38-13 (200 mg, 35.4%)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.54 (d, J = 8.4 Hz, 3 H), 7.31-7.25 (m, 7 H), 5.06-5.04 (m, 2 H), 4.64 (d, J = 8.0 Hz, 1 H), 4.55 (s, 2 H), 4.21 (m, 1 H), 2.14-2.04 (m, 1 H), 1.63 (d, J = 6.8 Hz, 3 H), 0.99 (d, J = 6.8 Hz, 3 H), 0.89-0.86 (m, 3 H).
LCMS (ESI): m/z 467.9 [M+H+].
단계 11. DCM (5 mL) 중 38-13 (50 mg, 0.107 mmol), PNP (65 mg, 0.214 mmol) 및 DIPEA (41 mg, 0.321 mmol)의 혼합물을 50℃에서 12시간 동안 교반하였다. 이를 농축시키고, DMF (5 mL) 중 노르플록사신 (102 mg, 0.321 mmol) 및 DIPEA (41 mg, 0.321 mmol)의 혼합물에 첨가하였다. 이를 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 38 (24 mg, 27.6%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.32 (s, 1 H), 10.40 (s, 1 H), 8.96 (s, 1 H), 7.96-7.88 (m, 2 H), 7.61 (d, J = 8.4 Hz, 2 H), 7.51 (s, 1 H), 7.36-7.20 (m, 8 H), 5.07 (s, 2 H), 5.02-5.00 (m, 2 H), 4.59-4.55 (m, 3 H), 4.24-4.22 (m, 1 H), 3.61 (s, 4 H), 3.32 (s, 4 H), 1.97-1.92 (m, 1 H), 1.52 (d, J = 6.8 Hz, 3 H), 1.40 (t, J = 6.8 Hz, 3 H), 0.92 (d, J = 6.0 Hz, 3 H), 0.79-0.77 (m, 3 H).
LCMS (ESI): m/z 813.2 [M+H+].
실시예 39. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-3-메틸부탄아미도)-5-구아니디노펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF (20 mL) 중 화합물 39-1 (1 g, 4 mmol), 화합물 39-2 (459 mg, 4 mmol)의 교반 용액에 0℃에서 DCC (908 mg, 4.4 mmol)를 첨가하였다. 반응 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 여과하고, 여과물을 농축시켜 화합물 39-3 (수율: 90%)을 수득하였다.
단계 2. DCM / MeOH (20 mL / 20 mL) 중 화합물 39-4 (2 g, 3.1 mmol)의 용액에 4-아미노-페닐-메탄올 (39-60) (570 mg, 4.6 mmol) 및 EEDQ (1.532 mg, 6.2 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하고, 칼럼 크로마토그래피 (PE/EtOAc = 1/3)에 의해 정제하여 화합물 39-6 (2 g, 수율: 86%)을 수득하였다.
단계 3. DCM (50 mL) 중 화합물 39-6 (2 g, 2.65 mmol)의 용액에 실온에서 화합물 39-7 (1.3 mL, 13.3 mmol)을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 농축시키고, MTBE로 세척하고, 여과하여 화합물 39-8 (수율: 80%)을 수득하였다.
단계 4. DME (10 mL) 중 화합물 39-8 (640 mg, 1.2 mmol)의 용액에 물 (10 mL) 중 화합물 39-3 (640 mg, 1.8 mmol) 및 NaHCO3 (304 mg, 3.6 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 EtOAc로 세척하고, 10% HCl을 사용하여 pH 3으로 산성화시켰다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시키고, 칼럼 크로마토그래피 (PE/EtOAc=1/2)에 의해 정제하여 39-9 (510 mg, 수율: 55%)를 수득하였다.
단계 5. DMF (4 mL) 중 화합물 39-9 (200 mg, 0.26 mmol), PNP 카르보네이트 (158 mg, 0.52 mmol)의 용액에 0℃에서 DIPEA (101 mg, 0.78 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물에 실온에서 노르플록사신 (170 mg, 0.52 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하고, 정제용 HPLC 및 SFC에 의해 정제하여 화합물 39-10 (수율: 30%, 2 단계에 걸쳐)을 수득하였다.
단계 6. 화합물 39-10 (100 mg, 0.1 mmol)에 0℃에서 TFA 및 DCM (TFA/DCM=1/5)의 혼합물을 첨가하였다. 혼합물을 실온에서 3시간 동안 교반한 후, 이를 NH3.H2O에 의해 pH = 9로 염기성화시켰다. 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 실시예 39 (13.8 mg, 15%)를 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.826분, MS = 858.2[M+1]
1H NMR 메탄올-d4 400 MHz, δ 8.80 (s, 1 H), 8.55 (s, 1 H), 7.98 (d, J = 13.2 Hz, 1 H), 7.58 (s, 2 H), 7.36 - 7.27 (m, 9 H),7.15 (m, 1H), 5.11 (d, J = 16.4 Hz, 4 H), 4.57 - 4.50 (m, 4 H), 3.94 (d, J = 7.2 Hz, 1 H), 3.71 (m, 4 H), 3.22 (s, 2 H), 2.07 (d, J = 6.8 Hz, 1 H), 1.95 (s, 1 H), 1.83 - 1.79 (m, 1 H), 1.70 (d, J = 1.6 Hz, 2 H), 1.51 (s, 3 H), 0.97 - 0.96 (m, 6 H).
실시예 40. 7-(4-((4-((S)-6-아미노-2-((S)-2-(벤질옥시카르보닐아미노)-3-(티오펜-2-일)프로판아미도)헥산아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. H2O (6 mL) 및 디옥산 (9 mL) 중 화합물 40-1 (1 g, 5.85 mmol)의 혼합물에 0℃에서 K2CO3 (2.02 g, 14.63 mmol), 및 Cbz-Cl (1.2 g, 7.01 mmol)을 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반하였다. 혼합물을 EtOAc (20 mL)로 세척하였다. 수성 상을 1N HCl을 사용하여 pH = 3으로 산성화시키고, EtOAc (25 ml x 2)로 추출하고, 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 조 화합물 40-2를 오일 (1.5 g, 수율: 84.3%)로서 수득하였다.
LCMS: (10-80, AB, 2분, ESI), 0.954분, MS = 305.8[M+1], 327.8[M+Na+]
1H NMR DMSO-d6 400 MHz δ 7.65 - 7.63 (d, J = 8.0 Hz, 1H), 7.37 - 7.29 (m, 6 H), 6.94 - 6.90 (m, 2H), 5.01 (s, 2 H), 4.2 - 4.1 (m, 1 H), 3.31 - 3.27 (m, 1H), 3.12 - 3.06 (m, 1 H).
단계 2. 건조 THF (25 mL) 중 화합물 40-2 (2.0 g, 6.55 mmol), 화합물 40-3 (829.15 mg, 7.2 mmol)의 용액에, DCC (1.49 g, 7.21 mmol)를 0℃에서 첨가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반하였다. 혼합물을 여과하고, 여과물을 농축시켜 조 화합물 40-4를 수득하였으며, 이를 추가 정제 없이 후속 단계에 직접 사용하였다 (2.2 g, 수율: 84.6%).
LCMS: (10-80, AB, 2분, ESI), 1.040분, MS = 424.8[M+Na+]
단계 3. DCM (80 mL) 중 화합물 40-5 (5 g, 10.7 mmol)의 교반 용액에 피페리딘 (4.5 g, 52.8 mmol)을 실온에서 시린지를 통해 적가하였다. 혼합물을 실온에서 30분 동안 교반한 후, 이를 감압 하에 농축시키고, 잔류물을 EtOAc (30 mL)와 H2O (50 ml) 사이에 분배하였다. 수성 상을 농축시켜 조 화합물 40-6 (2.0 g, 76%)을 백색 고체로서 수득하였으며, 이를 후속 단계에 직접 사용하였다.
단계 4. DME (10 mL) 중 화합물 40-4 (980 mg, 2.44 mmol)의 용액에 물 (10 mL) 중 화합물 40-6 (500 mg, 2.03 mmol) 및 NaHCO3 (374 mg, 4.46 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 EtOAc (20 mL)로 세척하고, 수성 상을 15% 시트르산 용액을 사용하여 pH=3으로 산성화시켰다. 생성된 현탁액을 EtOAc (30 mL x 2)로 추출하였다. 유기 층을 정제용 HPLC에 의해 정제하여 화합물 40-7을 백색 고체 (200 mg, 18.4%)로서 수득하였다.
LCMS: (10-80, AB, 2분, ESI), 1.123분, MS = 434.1[M+1-Boc+], 556.1[M+Na+]
단계 5. DCM / MeOH (20 mL / 10 mL) 중 화합물 40-7 (300 mg, 0.563 mmol)의 용액에 4-아미노-페닐-메탄올 (40-8) (103.9 mg, 0.845 mmol) 및 EEDQ (208.82 mg, 0.845 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 농축시켰다. 잔류물을 칼럼 크로마토그래피 (PE : EtOAc = 2:3)에 의해 정제하여 화합물 40-9를 백색 고체 (260 mg, 수율: 72.3%)로서 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.880분, MS = 539.0[M+1-Boc+], 661.0[M+Na+]
1H NMR CDCl3 400 MHz, δ 8.51 (s, 1 H), 7.44 (d, J = 8 Hz, 2 H), 7.24 - 7.19 (m, 6 H), 7.05 - 7.03 (m, 1 H), 6.78 - 6.73 (m, 3 H), 5.52 (d, J = 3.2 Hz, 1 H), 5.03 (s, 2 H),4.56 (s, 2 H),4.46 - 4.39 (m, 2 H), 3.25 (d, J = 5.6 Hz, 2 H), 2.98 (s, 2 H), 1.87 - 1.83 (m, 1 H), 1.39 (d, J = 7.6 Hz, 2 H), 1.35 (s, 9 H), 1.25 - 1.17 (m, 2 H).
단계 6. 건조 DMF (5 mL) 중 화합물 40-9 (250 mg, 0.39 mmol)의 용액에 0℃에서 PNP 카르보네이트 (237.14 mg, 0.78 mmol) 및 DIPEA (251.6 mg, 1.95 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물 (40-11)을 추가 정제 없이 후속 단계에 직접 사용하였다.
단계 7. 40-11의 혼합물에 실온에서 노르플록사신 (249.1 mg, 0.78 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반한 후, 이를 정제용 HPLC에 의해 정제하여 조 화합물 40-13 (220 mg 수율: 57.3%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.964분, MS = 442.6 [1/2M+1], 984.4[M+1]
단계 8. 화합물 40-13 (120 mg, 0.12 mmol)에 실온에서 DCM:TFA의 혼합물 (5:1, 3 mL)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반한 후, 이를 암모니아를 사용하여 pH=7로 조정한 다음, 농축시키고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 40 (29 mg, 수율: 16.9%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.826분, MS = 884.3[M+1], 442.8[1/2M+1]
1H NMR DMSO-d6 400 MHz, δ 10.23 (s, 1 H), 8.93 (s, 1 H), 8.44 (s, 1 H), 8.42 (s, 0.5 H, HCOOH), 7.92 (d, J = 13.2 Hz, 1 H), 7.93 - 7.61 (m, 3 H), 7.33 - 7.25 (m, 8 H), 7.20 - 7.16 (m, 1 H), 6.88 - 6.86 (m, 2 H), 5.63 (s, 2 H), 4.97 (s, 2 H), 4.58 - 4.53 (m, 2 H), 4.40 - 4.31 (m, 1 H), 4.30 - 4.19 (m, 1 H), 3.58 (s, 4 H), 3.28 - 3.19 (m, 4 H), 3.19 - 3.03 (m, 2 H), 3.04 - 2.96 (m, 2 H), 2.69 - 2.64 (m, 2 H), 1.73 - 1.67 (m, 2 H), 1.57 - 1.49 (m, 2 H), 1.47 - 1.34 (m, 3 H), 1.32 - 1.28 (m, 2 H).
실시예 41. 7-(4-((4-((S)-2-((S)-2-아세트아미도-3-메틸부탄아미도)-5-우레이도펜탄아미도)벤질옥시) 카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 물 (10 mL) 중 화합물 41-1 (470.6 mg, 4 mmol)을 6분 동안 초음파처리한 후, Ac2O를 4분에 걸쳐 첨가하였다. 혼합물을 농축시키고, 잔류물을 MeOH 중에 용해시키고, 여과하고, 농축시켜 조 41-2를 백색 고체 (350 mg, 55%)로서 수득하였다.
1H NMR DMSO-d6 400 MHz, δ 7.94 - 7.92 (d, J = 8.0 1 H), 4.10 - 4.08 (m, 1H), 2.01 - 1.99 (m, 1 H), 1.84 (s, 1 H), 0.83 - 0.80 (m, 6 H)
단계 2. THF (10 mL) 중 화합물 41-2 (160 mg, 1 mmol) 및 HO-Su (122 mg, 1.05 mmol)의 용액에 실온에서 DCC (218 mg, 1.05 mmol)를 첨가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반하였다. 혼합물을 여과하고, 여과물을 농축시켜 41-3 (242 mg, 수율: 95%)을 수득하였다.
단계 3. 화합물 41-3 (242 mg, 0.94 mmol), 41-4 (265 mg, 0.94 mmol)를 DMF (15 mL) 중에 용해시켰다. 반응 혼합물을 실온에서 3시간 동안 교반한 후, 이를 여과하고, 정제용 HPLC에 의해 정제하여 41-5 (70 mg, 수율: 17.7%)를 수득하였다.
단계 4. 건조 DMF (3 mL) 중 화합물 41-5 (60 mg, 0.142 mmol)의 용액에 실온에서 PNP 카르보네이트 (87 mg, 0.285 mmol) 및 DIPEA (56 mg, 0.427 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 노르플록사신 (91 mg, 0.285 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 혼합물을 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 41 (40 mg, 수율: 37%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.784분, MS = 767.1[M+1]
1H NMR DMSO-d6 400 MHz, δ 9.96 (s, 1 H), 8.93 (s, 1 H), 8.10 (d, J = 7.6 Hz, 1 H), 7.92 (d, J = 12.4 Hz, 1 H), 7.86 (d, J = 8.8 Hz, 1 H), 7.58 (d, J = 8.4 Hz, 2 H), 7.31 (d, J = 8.8 Hz, 2 H), 7.18 (d, J = 7.2 Hz, 1 H), 5.96 - 5.94 (m, 1 H), 5.38 (s, 2 H), 5.03 (s, 2 H), 4.58 - 4.53 (m, 2 H), 4.38 - 4.32 (m, 1 H), 4.17 - 4.14 (m, 1 H), 3.58 (s, 4 H), 3.26 (s, 4 H), 3.00 - 2.91 (m, 2 H), 1.96 - 1.92 (m, 1 H), 1.86 (s, 3 H), 1.68 - 1.55 (m, 2 H), 1.38 (m, 5 H), 0.85 - 0.80 (m, 6 H).
실시예 42. 7-(4-{4-[(S)-6-아미노-2-((S)-2-벤질옥시카르보닐아미노-3-페닐-프로피오닐아미노)-헥사노일아미노]-벤질옥시카르보닐}-피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로-퀴놀린-3-카르복실산
단계 1. 42-1 (200 mg, 0.25 mmol)의 5ml THF 용액에 DIEA (0.18 ml, 0.99 mmol)를 첨가한 다음, (4-니트로페닐) 카르보노클로리데이트 (150 mg, 0.75 mmol)에 이어서 피리딘 (0.03 ml, 0.32 mmol)을 첨가하였다. 반응 혼합물을 28℃에서 밤새 교반하였다. 혼합물을 농축 건조시키고, EtOAc 중에 용해시키고, 포화 NH4Cl, 염수에 의해 세척하였다. 유기 층을 MgSO4 상에서 건조시키고, 농축시켰다. 조 물질을 에테르로 연화처리하고, 여과하여 담황색 고체 42-2 (190 mg, 79%)를 수득하였다.
LCMS (ESI): m/z 970.7 [M+H+].
단계 2. 2ml DMF 중 1-에틸-6-플루오로-4-옥소-7-(피페라진-1-일)-1,4-디히드로퀴놀린-3-카르복실산 (59 mg, 0.18 mmol)의 현탁액에 DIEA (0.11 mL, 0.62 mmol)를 첨가한 다음, 42-2 (120 mg, 0.12 mmol)를 1 부분으로 첨가하였으며, 반응이 완결될 때까지 천천히 황색 용액으로 되었다. 반응 혼합물을 빙수에 붓고, DCM으로 추출하였다. 유기 층을 포화 NH4Cl, 염수로 세척하고, MgSO4 상에서 건조시키고, 농축시켜 42-3 (140 mg, 99%)을 수득하였다.
LCMS (ESI): m/z 1150.9 [M+H+].
단계 3. 42-3 (145 mg, 0.13 mmol)의 10 ml DCM 용액에 아니솔 (0.05 ml, 0.50 mmol)을 첨가하고, 빙조로 냉각시킨 다음, TFA (0.1 ml, 1.00 mmol)를 적가하였다. 10분 후, 반응을 완결하고, 빙조를 제거하였다. 반응 혼합물을 농축 건조시키고, DCM 중에 용해시키고, 포화 NaHCO3/물, 염수에 의해 세척하였다. 유기 층을 MgSO4 상에서 건조시키고, 농축시켰다. 조 물질을 DCM으로 연화처리하고, 여과하여 담황색 고체 42 (38 mg, 34%)를 수득하였다.
LCMS (ESI): m/z 878.7 [M+H+].
1H NMR (400 MHz, DMSO-d6) δ 10.13 (s, 1H), 8.86 (s, 1H), 8.26 (s, 1H), 7.91 (d, J = 12.7 Hz, 1H), 7.62 (d, J = 8.2 Hz, 2H), 7.48 (d, J = 9.2 Hz, 1H), 7.38 - 7.10 (m, 13H), 5.07 (s, 2H), 4.95 (s, 2H), 4.51 (s, 2H), 4.40 (s, 1H), 4.33 (s, 1H), 3.61 (s, 4H), 3.03 (d, J = 12.2 Hz, 2H), 1.69 (d, J = 15.5 Hz, 3H), 1.39 (t, J = 6.8 Hz, 8H).
실시예 43. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-3-(티오펜-2-일)프로판아미도) -5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF (3 mL) 중 화합물 43-1 (178 mg, 0.665 mmol) 및 화합물 43-2 (79 mg, 0.688 mmol)의 용액에 10℃에서 THF (0.5 mL) 중 DCC (149 mg, 0.721 mmol)를 첨가하였다. 용액을 10℃에서 6시간 동안 교반하였다. 고체를 여과하고, 용매를 제거하였다. 잔류물을 DCM (5 mL) 중에 용해시켰다. 혼합물을 1시간 동안 정치되도록 하고, 여과하여 추가의 DCU를 제거하였다. 여과물을 증발시켜 조 화합물 43-3 (245 mg)을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.21 (d, J = 5.2Hz, 1 H), 7.02-6.96 (m, 2 H), 5.30-4.93 (m, 1 H), 3.54-3.40 (m, 2 H), 2.82 (s, 4 H), 1.44 (s, 9 H).
단계 2. DME (2 mL) 중 화합물 43-3 (245 mg, 0.665 mmol)의 용액에 물 (2 mL) 중 화합물 43-4 (175 mg, 0.998 mmol)의 용액을 첨가하였다. 용액을 10℃에서 16시간 동안 교반하였다. 포화 NaHCO3 용액 (3 mL)을 첨가하고, 혼합물을 DCM (15 mL x 2)으로 세척하였다. 수성 층을 1M HCl 용액을 사용하여 pH 3으로 산성화시키고, EtOAc (15 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 조 생성물 43-5 (270 mg)를 수득하였다.
LCMS (ESI): m/z429.2 [M+H+].
단계 3. MeOH의 HCl (4 M, 5 mL) 중 화합물 43-5 (270 mg, 0.63 mmol)의 용액을 10℃에서 2시간 동안 교반하였다. 용매를 감압 하에 제거하고, 잔류물을 H2O/THF (v/v 1:1, 3 mL) 중에 용해시킨 다음, Na2CO3 (134 mg, 1.26 mmol) 및 CbzCl (167 mg, 0.979 mmol)을 첨가하였다. 혼합물을 10℃에서 2시간 동안 교반한 다음, LiOH.H2O (79 mg, 1.89 mmol)를 첨가하고, 생성된 용액을 10℃에서 1시간 동안 교반하였다. 유기 용매를 제거하고, 수용액을 DCM (15 mL x 2)으로 세척하였다. 수성 층을 1M HCl 용액을 사용하여 pH 2로 산성화시키고, EtOAc (15 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 조 생성물 (182 mg)을 수득하였다.
LCMS (ESI): m/z 463.2 [M+H+].
단계 4. DMF (4 mL) 중 화합물 43-6 (180 mg, 0.389 mmol) 및 (4-아미노페닐) 메탄올 (144 mg, 1.17 mmol)의 용액에 N2 하에 EEDQ (289 mg, 1.17 mmol)를 첨가하였다. 혼합물을 30℃에서 16시간 동안 교반하였다. 혼합물을 정제용 HPLC에 의해 정제하여 43-6 (80 mg, 36%)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.55-7.53 (m, 2 H), 7.32-7.27 (m, 7 H), 7.17-7.15 (m, 1 H), 6.88-6.84 (m, 2 H), 5.11-5.03 (m, 2 H), 4.55 (s, 2 H), 4.50-4.39 (m, 2 H), 3.38-3.36 (m, 1 H), 3.19-3.05 (m, 3 H), 1.89-1.50 (m, 4 H).
LCMS (ESI): m/z 568.1 [M+H+].
단계 5. DMF (2 mL) 중 43-7 (20 mg, 0.035 mmol)의 용액에 10℃에서 PNP 카르보네이트 (21 mg, 0.070 mmol) 및 DIPEA (18 mg, 0.141 mmol)를 첨가하였다. 혼합물을 10℃에서 24시간 동안 교반한 후, 노르플록사신 (17 mg, 0.053 mmol) 및 DIPEA (9 mg, 0.0695 mmol)를 첨가하였다. 생성된 용액을 10℃에서 1시간 동안 교반하고, 정제용 HPLC에 의해 정제하여 실시예 43 (7 mg, 22%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.16 (s, 1 H), 8.95 (s, 1 H), 8.33-8.32 (m, 1 H), 7.94 (d, J = 12.0Hz, 1 H), 7.63-7.57 (m, 3 H), 7.35-7.19 (m, 10 H), 6.91-6.90 (m, 2 H), 6.04 (m, 1 H), 5.44 (s, 2 H), 5.06 (s, 2 H), 5.00 (s, 2 H), 4.59-4.29 (m, 4 H), 3.61 (s, 4 H), 3.21 (s, 4 H), 3.04-2.94 (m, 4 H), 1.71-1.61 (m, 2 H), 1.45-1.38 (m, 5 H).
LCMS (ESI): m/z 913.3 [M+H+].
실시예 44. 7-(4-((4-((S)-2-((S)-2-(2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)아세트아미도)-3-메틸부탄아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 화합물 44-1 (600 mg, 2.14 mmol) 및 화합물 44-2 (936 mg, 2.14 mmol)를 DMF (5 mL) 중에 용해시키고, 실온에서 3시간 동안 교반하여 44-3을 혼합물로서 수득하였다.
단계 2. DMF (10 mL) 중 화합물 44-3 (2.14 mmol)의 용액에 화합물 44-4 (0.6 mL, 4.5 mmol)를 첨가하고, 실온에서 1시간 동안 교반하였다. 혼합물을 농축시키고, MTBE (30 mL x 3)로 세척하고, 여과하고, 여과물을 농축시켜 44-5 (597 mg, 수율: 70%)를 수득하였다.
단계 3. DME (10 mL) 중 화합물 44-7 (75 mg, 1 mmol)의 용액에 물 (10 mL) 중 화합물 44-6 (340 mg, 1.1 mmol) 및 NaHCO3 (252 mg, 3 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 EtOAc로 세척하고, 10% HCl을 사용하여 pH = 3으로 산성화시켰다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시켜 조 화합물 44-8 (350 mg)을 수득하였다.
단계 4. THF (15 mL) 중 44-8 (350 mg, 1.3 mmol) 및 44-9 (157 mg, 1.36 mmol)의 용액에 DCC (281 mg, 1.36 mmol)를 첨가하였다. 이를 16시간 동안 질소 하에 교반한 후, 이를 농축시켜 44-10 (480 mg, 수율: 100%)을 수득하였다.
단계 5. 화합물 44-10 (404 mg, 1.1 mmol), 화합물 44-5 (835 mg, 2.2 mmol)를 DMF (6 mL) 중에 용해시켰다. 반응 혼합물을 실온에서 3시간 동안 교반한 후, 이를 여과하고, 정제용 HPLC에 의해 정제하여 화합물 44-11 (110 mg, 수율: 16%)을 수득하였다.
단계 6. 건조 DMF (5 mL) 중 화합물 44-11 (85 mg, 0.135 mmol)의 용액에 실온에서 PNP 카르보네이트 (82 mg, 0.27 mmol) 및 DIPEA (52 mg, 0.40 mmol)를 첨가하였다. 이를 실온에서 16시간 동안 교반하였다. 노르플록사신 (85 mg, 0.27 mmol)을 첨가하고, 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 혼합물을 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 44 (70 mg, 수율: 51%)를 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.794분, MS = 977.3[M+1],489.3 [1/2M+1]
1H NMR DMSO-d6 400 MHz, δ 15.32 (s, 1 H), 9.90 (s, 1 H), 8.96 (s, 1 H), 8.17 (s, 2 H), 8.11 (s, 1 H), 7.95 (d, J = 13.6 Hz, 1 H), 7.82 (d, J = 8.4 Hz, 1 H), 7.62 (d, J = 8.8 Hz, 2 H), 7.33 (d, J = 8.4 Hz, 2 H), 7.21 (d, J = 9.6 Hz, 1 H), 5.98 (s, 1 H), 5.41 (s, 2 H), 5.06 (s, 2 H), 4.59 (d, J = 7.2 Hz, 2 H), 4.35 (s, 1 H), 4.22 (d, J = 14.8 Hz, 1 H), 3.76 - 3.73 (m, 2 H), 3.61 (s, 4 H), 3.28 (s, 4 H), 3.12 - 2.86 (m, 2 H), 2.60 (s, 4 H), 2.07 (d, J = 6.8 Hz, 2 H), 1.98 (s, 1 H), 1.80 - 1.56 (m, 2 H), 1.47 - 1.39 (m, 9 H), 1.18 (s, 2 H), 0.87 - 0.82 (m, 6 H).
실시예 45. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-3-(3-플루오로페닐)프로판아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF (3 mL) 중 화합물 45-1 (178 mg, 0.63 mmol) 및 화합물 45-2 (76 mg, 0.662 mmol)의 용액에 10℃에서 THF (0.5 mL) 중 DCC (143 mg, 0.693 mmol)를 첨가하였다. 용액을 10℃에서 3시간 동안 교반한 후, 고체를 여과하고, 용매를 제거하였다. 잔류물을 DCM (5 mL) 중에 용해시켰다. 혼합물을 1시간 동안 정치되도록 한 다음, 여과하여 추가의 DCU를 제거하였다. 여과물을 증발시켜 조 화합물 45-3 (250 mg)을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.69-7.27 (m, 1 H), 7.23-6.95 (m, 3 H), 4.98-4.85 (m, 1 H), 3.33-3.14 (m, 2 H), 2.82 (s, 4 H), 1.37 (s, 9 H).
단계 2. DME (2 mL) 중 화합물 45-3 (250 mg, 0.63 mmol)의 용액에 물 (2 mL) 중 화합물 45-4 (173 mg, 0.986 mmol)의 용액을 첨가하였다. 용액을 10℃에서 16시간 동안 교반하였다. 포화 NaHCO3 용액 (3 mL)을 첨가하고, 혼합물을 DCM (5 mL x 2)으로 세척하였다. 수성 층을 1M HCl 용액을 사용하여 pH 3으로 산성화시키고, EtOAc (10 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 조 생성물 45-5 (280 mg)를 수득하였다.
LCMS (ESI): m/z 441.2 [M+H+].
단계 3. MeOH 중 4M HCl (5 mL) 중 화합물 45-5 (240 mg, 0.545 mmol)의 용액을 10℃에서 2시간 동안 교반하고, 용매를 감압 하에 제거하고, 잔류물을 H2O/THF (v/v 1:1, 3 mL) 중에 용해시켰다. Na2CO3 (116 mg, 1.09 mmol) 및 CbzCl (139 mg, 0.817 mmol)을 첨가하였다. 혼합물을 10℃에서 2시간 동안 교반한 다음, LiOH.H2O (67 mg, 1.63 mmol)를 첨가하고, 생성된 용액을 10℃에서 1시간 동안 교반하였다. 용매를 제거하고, 수용액을 DCM (5 mL x 2)으로 세척하고, 1M HCl 용액을 사용하여 pH 2로 산성화시켰다. 이를 EtOAc (10 mL x 3)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 조 생성물 45-6 (198 mg)을 수득하였다.
LCMS (ESI): m/z 475.2 [M+H+].
단계 4. DMF (4 mL) 중 화합물 45-6 (192 mg, 0.405 mmol) 및 (4-아미노페닐) 메탄올 (150 mg, 1.21 mmol)의 용액에 N2 하에 EEDQ (300 mg, 1.21 mmol)를 첨가하였다. 혼합물을 30℃에서 16시간 동안 교반한 후, 이를 정제용 HPLC에 의해 정제하여 45-7 (70 mg, 30%)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.55-7.53 (m, 2 H), 7.31-7.17 (m, 8 H), 7.05-7.00 (m, 2 H), 6.91-6.86 (m, 1 H), 5.07-4.99 (m, 2 H), 4.56 (s, 2 H), 4.49-4.41 (m, 2 H), 3.17-3.06 (m, 3 H), 2.91-2.85 (m, 1 H), 1.87-1.50 (m, 4 H).
LCMS (ESI): m/z 580.2 [M+H+].
단계 5. DMF (2 mL) 중 45-7 (20 mg, 0.0345 mmol)의 용액에 10℃에서 PNP 카르보네이트 (21 mg, 0.069 mmol) 및 DIPEA (18 mg, 0.139 mmol)를 첨가하였다. 혼합물을 10℃에서 24시간 동안 교반한 후, 노르플록사신 (17 mg, 0.053 mmol) 및 DIPEA (9 mg, 0.0695 mmol)를 첨가하였다. 반응 혼합물을 10℃에서 1시간 동안 교반하고, 정제용 HPLC에 의해 정제하여 실시예 45 (17 mg, 53%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.32 (br, 1 H), 10.12 (s, 1 H), 8.96 (s, 1 H), 8.30-8.28 (m, 1 H), 7.94 (d, J = 13.2 Hz, 1 H), 7.62 (d, J = 8.4 Hz, 2 H), 7.52 (d, J = 8.8 Hz, 1 H),7.35-7.13 (m, 11 H), 7.04-7.00 (m, 1 H), 5.99 (m, 1 H), 5.43 (s, 2 H), 5.06 (s, 2 H), 4.95 (s, 2 H), 4.61-4.33 (m, 4 H), 3.61 (s, 4 H), 3.32 (s, 4 H), 3.06-2.66 (m, 4 H), 1.75-1.60 (m, 2 H), 1.45-1.35 (m, 5 H).
LCMS (ESI): m/z 925.5 [M+H+].
실시예 46. 7-(4-((4-((S)-2-((R)-2-(벤질옥시카르보닐아미노)-4,4,4-트리플루오로부탄아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-2-카르복실산
단계 1. THF (10 mL) 중 화합물 46-1 (200 mg, 1.27 mmol)의 용액에 빙조에서 벤질 카르보노클로리데이트 (226 mg, 1.33 mmol)를 첨가하였다. 물 (10 mL) 중 Na2CO3 (270 mg, 2.54 mmol)의 용액을 격렬한 교반 하에 7℃ 이하에서 적가하였다. 혼합물을 16시간 동안 교반한 후, 유기 층을 분리하고, 묽은 HCl (0.1 M, 60 mL) 및 포화 NaHCO3 용액 (60 mL)으로 세척하고, 무수 Na2SO4 상에서 건조시키고, 농축시켜 화합물 46-2를 백색 고체 (250 mg, 67.6%)로서 수득하였다.
단계 2. 건조 THF (10 mL) 중 화합물 46-2 (250 mg, 0.887 mmol), 1-히드록시피롤리딘-2,5-디온 (102 mg, 0.887 mmol)의 혼합물에 0℃에서 DCC (183 mg, 0.887 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하고, 여과하였다. 여과물을 진공 하에 농축시켜 화합물 46-3의 조 생성물을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 3. DME 및 H2O (10 mL/10 mL)의 혼합물 중 화합물 46-3 (710 mg, 1.87 mmol)의 용액에 0℃에서 화합물 46-4 (327 mg, 1.87 mmol) 및 NaHCO3 (236 mg, 2.8 mmol)을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 EtOAc (50 mL x 3)로 추출하였다. 유기 층을 염수 (50 mL)로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켰다. 조 생성물을 정제용 HPLC에 의해 정제하여 화합물 46-5의 목적 생성물을 백색 고체 (421 mg, 50.2%)로서 수득하였다.
LCMS (ESI): m/z 449.2 [M+H+].
단계 4. DCM (10 mL) 중 화합물 46-5 (410 mg, 0.915 mmol)의 용액에 EEDQ (448 mg, 1.83 mmol) 및 4-아미노페닐-메탄올 (225 g, 1.83 mmol)을 첨가하였다. 혼합물을 0℃에서 1시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC 및 SFC 분리에 의해 정제하여 46-6A 및 46-6B를 수득하였다.
46-6A
1H NMR (400 MHz, MeOD-d4) δ 7.54 (d, J = 8.4 Hz, 2 H), 7.35-7.29 (m, 7 H), 5.12 (s, 2 H), 4.55-4.49 (m, 4 H), 3.30-3.03 (m, 2 H), 2.83-2.53 (m, 2 H), 1.93-1.75 (m, 4 H). LCMS: m/z 553.9 [M+H+].
46-6B
1H NMR (400 MHz, DMSO-d6) δ 10.94 (s, 1 H), 9.31(d, J = 9.2 Hz, 1 H), 8.53 (d, J = 9.6 Hz, 1 H), 8.26(d, J = 9.6 Hz, 2H), 8.00-7.96 (m, 5 H), 7.90 (d, J = 9.6 Hz, 2 H), 6.45-6.44 (m, 1 H), 5.81 (s, 1 H), 5.48-5.36 (m, 3 H), 4.77-4.69 (m, 4 H), 3.09-2.95 (m, 2 H), 2.79-2.64 (m, 2 H), 1.64-1.20 (m, 4 H). LCMS (ESI): m/z 553.9 [M+H+].
단계 5. 건조 DCM (2 mL) 중 46-6A (20 mg, 0.036 mmol)의 용액에 PNP 카르보네이트 (22 mg, 0.072 mmol) 및 DIPEA (14 mg)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (5 mL) 중에 용해시켰다. DIPEA (9 mg, 0.072 mmol) 및 노르플록사신 (23 mg, 0.072 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 46을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.33 (s, 1 H), 10.11 (s, 1 H), 8.97 (s, 1 H), 8.34 (d, J = 7.6 Hz, 1 H), 7.95 (d, J = 12.8 Hz, 1 H), 7.78 (d, J = 8.4 Hz, 1 H), 7.60 (d, J = 8.4 Hz, 2 H), 7.37-7.21 (m, 8 H), 6.00-5.98 (m, 1 H), 5.97 (s, 2 H), 5.43-5.03 (m, 4 H), 4.61-4.37 (m, 4 H), 3.61 (s, 4 H), 3.31 (s, 4 H), 3.04-2.49 (m, 4 H), 1.70-1.20 (m, 7 H). LCMS (ESI): m/z 450.3 [M/2+H+].
실시예 47. 7-(4-((4-((R)-3-(2-아미노-2-옥소에틸티오)-2-((S)-2-(벤질옥시카르보닐아미노)-3-메틸부탄아미도)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. 4 M HCl / 1,4-디옥산 (5 mL) 중 화합물 47-1 (120 mg, 0.411 mmol)의 혼합물을 실온에서 2시간 동안 교반하였다. 혼합물을 농축시켜 47-2를 수득하였다.
LCMS (ESI): m/z 193.0 [M+H+].
단계 2. DCM (20 mL) 중 화합물 47-2 (1.3 g, 6.85 mmol)의 용액에 화합물 47-3 (2.065 g, 8.22 mmol), DIPEA (4.418 g, 34.25 mmol), HOBt (1.018 g, 7.535 mmol) 및 EDCI (1.7 g, 8.905 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 용액을 여과하고, 고체를 추가 정제 없이 후속 단계에 사용하였다 (47-4).
LCMS (ESI): m/z 425.9 [M+H+].
단계 3. THF / MeOH / H2O (6 mL /2 mL / 2 mL) 중 화합물 47-4 (500 mg, 1.176 mmol)의 용액에 LiOH (85 mg, 7.05 mmol)를 첨가하였다. 혼합물을 실온에서 1.5시간 동안 교반하였다. 혼합물을 농축시키고, 잔류물을 정제용 HPLC에 의해 정제하여 화합물 47-5를 수득하였다.
LCMS (ESI): m/z 412.0 [M+H+].
단계 4. DCM / DMF (10 mL / 2 mL) 중 화합물 47-5 (600 mg, 1.46 mmol)의 용액에 4-아미노-페닐-메탄올 (216 mg, 1.75 mmol) 및 EEDQ (541 mg, 2.19mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 H2O로 켄칭하였다. 잔류물을 정제용 HPLC에 의해 정제한 다음, SFC에 의해 정제하여 47-6A 및 47-6B를 수득하였다.
47-6A
1H NMR (400 MHz, MeOD-d4) δ 7.57 (d, J = 8.4 Hz, 2 H), 7.35-7.26 (m, 7 H), 5.06 (s, 2 H), 4.71-4.68 (m, 1 H), 4.54 (s, 2 H), 3.97 (d, J = 6.4 Hz, 2 H), 3.25 (m, 2 H), 3.13-3.08 (m, 1 H), 3.0-2.93 (m, 1 H), 2.13-2.01 (m, 1 H), 0.98-0.95 (m, 6 H).
LCMS (ESI): m/z 517.2 [M+H+].
47-6B
1H NMR (400 MHz, DMSO-d6) δ 9.93 (m, 1 H), 8.597-8.56 (m, 1 H), 7.61-7.1 (m, 11 H), 5.13-5.00 (m, 3 H), 4.63-4.59 (m, 1 H), 4.44-4.41 (m, 2 H), 3.92-3.90 (m, 2 H), 3.17-2.84 (m, 4 H), 2.00-1.96 (m, 1 H), 0.90-0.89 (m, 6 H).
LCMS (ESI): m/z 517.1 [M+H+].
단계 5. DCM (3 mL) 중 47-6A (40 mg, 0.0775 mmol)의 용액에 탄산 비스-(4-니트로-페닐) 에스테르 (20 mg, 0.093 mmol) 및 DIPEA (15 mg, 0.116 mmol)를 첨가하였다. 혼합물을 45℃에서 16시간 동안 교반하였다. 용액을 농축시키고, DMF (3 mL) 중에 용해시키고, 노르플록사신 (50 mg, 0.155 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 47 (5.5 mg)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.25 (s, 1 H), 8.93-8.89 (m, 1 H), 8.40-8.34 (m, 2 H), 7.63-7.61 (m, 4 H), 7.36-7.35 (m, 8 H), 7.13 (m, 2 H), 5.06-5.03 (4 H), 4.62-4.52 (m, 3 H), 3.94-3.91 (m, 1 H), 3.36 (m, 4 H), 3.19 (m, 4 H), 3.00-2.86 (m, 3 H), 2.03-1.95 (m, 1 H), 1.38 (m, 3 H), 0.88-0.83 (m, 6 H).
LCMS (ESI): m/z 862.4 [M+H+].
실시예 48. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-3-(푸란-2-일)프로판아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF 및 NaHCO3 용액 중 화합물 48-1 (1.0 g, 6.45 mmol)의 혼합물에 0℃에서 CbzCl을 시린지를 통해 첨가하였다. 반응 혼합물을 실온에서 2시간 동안 교반하고, 정제용 HPLC에 의해 정제하여 48-2 (수율: 32%)를 수득하였다.
단계 2. THF (25 mL) 중 화합물 48-2 (380 mg, 1.31 mmol), 화합물 48-3 (151 mg, 1.31 mmol)의 용액에 0℃에서 DCC (271 mg, 1.31 mmol)를 첨가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반하였다. 용액을 여과하고, 여과물을 농축시켜 48-4를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다 (수율: 90%).
단계 3. DME (15 ml) 중 화합물 48-4 (540 mg, 1.38 mmol)의 용액에 물 (15 mL) 중 화합물 48-5 (364 mg, 2.07 mmol) 및 NaHCO3 (174 mg, 2.07 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 EtOAc로 세척하고, 10% HCl을 사용하여 pH 3.0으로 산성화시켰다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시켜 화합물 48-6 (수율: 90%)을 수득하였다.
LCMS: (10-80, AB, 2분, ESI), 0.826분, MS = 447.1 [M+1]
단계 4. DCM / MeOH (20 mL / 10 mL) 중 화합물 48-6 (420 mg, 0.94 mmol)의 용액에 4-아미노-페닐-메탄올 (174 mg, 1.4 mmol) 및 EEDQ (495 mg, 1.88 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 H2O로 켄칭하였다. 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 48-8 (수율: 50%)을 수득하였다.
1H NMR DMSO-d6 400 MHz, δ 9.98 (s, 1 H), 8.20 (d, J = 8 Hz, 1 H), 7.56 - 7.49 (m, 3 H), 7.37 (s, 1 H), 7.35 - 7.30 (m, 5 H), 7.24 (d, J = 8.8 Hz, 3 H), 6.33 - 6.32 (m, 1 H), 6.13 (d, J = 3.2 Hz, 1 H), 5.98 - 5.95 (t, J = 6.0 Hz, 1 H), 5.41 (s, 2 H), 5.11 - 5.08 (t, J = 5.6 Hz, 1 H), 4.99 (d, J = 13.2 Hz, 2 H), 4.44 - 4.35 (m, 3 H), 3.33 - 2.83 (m, 4 H), 1.71 - 1.58 (m, 2 H), 1.44 - 1.34 (m, 2 H).
단계 5. DMF (5 mL) 중 화합물 48-9 (30 mg, 0.06 mmol)의 용액에 0℃에서 PNP 카르보네이트 (37 mg, 0.12 mmol) 및 DIPEA (24 mg, 0.18 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물 (48-10)을 추가 정제 없이 후속 단계에 사용하였다 (수율: 95%).
LCMS: (10-80, AB, 2분, ESI), 1.092분, MS = 717.1[M+1]
단계 6. 최종 단계로부터의 48-10 및 노르플록사신의 혼합물을 실온에서 1시간 동안 교반하였다. 잔류물을 정제용 HPLC에 의해 정제한 다음, SFC에 의해 정제하여 실시예 48을 수득하였다. (수율: 30%)
1H NMR DMSO-d6 400 MHz δ 10.08 (s, 1 H), 8.96 (s, 1 H), 8.22 (d, J = 7.2 Hz, 1 H), 7.95 (d, J = 13.2 Hz, 1 H), 7.62 (s, 1 H), 7.60 (s, 1 H), 7.53 (d, J = 8.4 Hz, 1 H), 7.50 (s, 1 H), 7.36 - 7.33 (m, 5 H), 7.30 (d, J = 7.6 Hz, 4 H), 7.21 (d, J = 7.2 Hz, 1 H), 6.33 - 6.32 (m, 1 H), 6.13 (d, J = 2.4 Hz, 1 H), 5.99 - 5.96 (m, 1 H), 5.42 (s, 2 H), 5.07 (s, 2 H), 5.01 (d, J = 1.6 Hz, 2 H), 4.61 - 4.56 (m, 2 H), 4.45 - 4.35 (m, 2 H), 3.62 (d, J = 10.4 Hz, 5 H), 3.06 - 3.01 (m, 2 H), 2.89 - 2.83 (m, 2 H), 2.55 - 2.45 (m, 2 H), 1.71 - 1.58 (m, 2 H), 1.42 (s, 5 H).
실시예 49. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-3-메틸부탄아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 화합물 49-1 (100 mg, 0.26 mmol) 및 화합물 49-2 (138 mg, 0.38 mmol)를 실온에서 DMF (5 mL) 중에 용해시켰다. 반응 혼합물을 실온에서 3시간 동안 교반하고, 여과하고, 정제용 HPLC에 의해 정제하여 49-3 (100 mg, 수율: 54%)을 수득하였다.
단계 2. 건조 DMF (3 mL) 중 화합물 49-3 (60 mg, 0.142 mmol)의 용액에 실온에서 PNP 카르보네이트 (87 mg, 0.285 mmol) 및 DIPEA (56 mg, 0.427 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 노르플록사신 (91 mg, 0.285 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 혼합물을 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 49 (40 mg, 수율: 37%)를 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.866분, MS = 859.2[M+1]
1H NMR DMSO-d6 400 MHz, δ 15.32 - 15.28 (m, 1 H), 10.08 (s, 1 H), 8.96 (s, 1 H), 8.11 (d, J = 7.2 Hz, 1 H), 7.94 (d, J = 13.2 Hz, 1 H), 7.61 (d, J = 8.4 Hz, 2 H), 7.37 - 7.30 (m, 8 H), 7.21 (d, J = 7.2 Hz, 1 H), 5.78 (d, J = 4.8 Hz, 1 H), 5.41 (s, 2 H), 5.05 (d, J = 9.6 Hz, 4 H), 4.58 (d, J = 7.2 Hz, 2 H), 4.41 (d, J = 5.6 Hz, 1 H), 3.93 (s, 1 H), 3.33 (s, 4 H), 3.04 - 2.93 (m, 2 H), 2.00 - 1.95 (m, 1 H), 1.68 (s, 2 H), 1.60 - 1.58 (m, 5 H), 1.42 (d, J = 7.2 Hz, 6 H).
실시예 50. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-3-메틸부탄아미도)-3-(피페리딘-4-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. DCM/TFA (5:1,v:v)의 혼합물 (1 mL)을 0℃에서 실시예 56 (50 mg, 52 mmol)에 첨가하였다. 혼합물을 0℃에서 1시간 동안 교반되도록 하였다. LCMS는 80% 목적 생성물 및 20% STM을 나타내었다. 혼합물을 정제용 HPLC (FA)에 의해 정제하여 실시예 50 (31.2 mg, 70%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.811분, MS = 856.2[M+1], 428.8[1/2M+1]
1H NMR 메탄올-d4 400MHz, δ 8.81 (s, 1H), 8.54(s, 1H), 7.98 - 7.95(m, 1H), 7.59 - 7.57 (m, 2H), 7.36 - 7.32 (m, 7H), 7.2 - 7.1(m, 1H), 5.12 - 5.09 (m, 4H), 4.7 - 4.4 (m, 3H), 3.88 - 3.86 (m, 1H), 3.70 (m, 4H), 3.3(m, 4H), 3.0 - 2.8 (m, 2H), 2.1 - 1.7 (m, 6H), 1.6 - 1.3 (m, 5H), 0.98 - 0.96 (m, 6H).
실시예 51. 7-(4-{4-[(S)-2-((S)-2-벤질옥시카르보닐아미노-3-메틸-부티릴아미노)-프로피오닐아미노]-벤질옥시카르보닐}-피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로-퀴놀린-3-카르복실산
실시예 51을 실시예 42와 같은 절차를 사용하여 제조하였다.
단계 1. 2ml DMF 중 1-에틸-6-플루오로-4-옥소-7-(피페라진-1-일)-1,4-디히드로퀴놀린-3-카르복실산 (129 mg, 0.40 mmol)의 현탁액에 DIEA (0.30 ml, 1.69 mmol)를 첨가한 다음, 51-1 (120 mg, 0.34 mmol)을 1 부분으로 첨가하였으며, 반응이 완결될 때까지 천천히 황색 용액으로 되었다. 반응 혼합물을 빙수에 붓고, DCM으로 추출하였다. 유기 층을 포화 NH4Cl, 염수에 의해 세척하고, MgSO4 상에서 건조시키고, 농축시키고, 정제용 HPLC에 의해 정제하여 51 (125 mg, 48%)을 수득하였다.
LCMS (ESI): m/z 773.3 [M+H+].
1H NMR (400 MHz, DMSO-d6) δ 15.29 (s, 1H), 9.98 (s, 1H), 8.95 (s, 1H), 8.14 (d, J = 6.8 Hz, 1H), 7.95 (d, J = 13.1 Hz, 1H), 7.59 (d, J = 8.3 Hz, 2H), 7.47 - 7.12 (m, 8H), 5.05 (d, J = 9.9 Hz, 4H), 4.70 - 4.48 (m, 2H), 4.42 (t, J = 7.0 Hz, 1H), 3.91 (t, J = 7.8 Hz, 1H), 3.61 (s, 4H), 1.98 (d, J = 6.8 Hz, 1H), 1.53 - 1.14 (m, 6H), 0.86 (dd, J = 17.7, 6.7 Hz, 6H).
실시예 52. 7-(4-((4-((S)-2-((R)-2-(벤질옥시카르보닐아미노)-3-(트리메틸실릴)프로판아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 10℃에서 DCM (10 mL) 중 52-1 (3.31 g, 10.0 mmol)의 교반 용액에 DBU (1.67 g, 11.0 mmol)를 첨가하고, 실온에서 1시간 동안 교반하였다. -78℃에서 DCM (30 mL) 중 (COCl)2 (1.83 g, 14.4 mmol)의 교반 용액에 DMSO (1.28 g, 16.32 mmol)를 첨가하였다. 15분 후, 화합물 52-1 (1.0 g, 9.60 mmol)과 DBU의 혼합물을 5분에 걸쳐 첨가하였다. 30분 후, Et3N (3.59 g, 35.52 mmol)을 첨가하고, 30분 후, 일리드 52-2를 -78℃에서 첨가하였다. 이를 30분 동안 교반한 후, 반응 혼합물을 실온으로 가온하고, 실온에서 6시간 동안 교반하였다. 혼합물을 1M HCl 용액으로 켄칭하였다. 용매를 제거한 후, 잔류물을 EtOAc (60 mL x 3)로 추출하였다. 유기 층을 염수 (60 mL)로 세척하고, Na2SO4로 건조시키고, 농축시켰다. 잔류물을 정제용 HPLC에 의해 정제하여 화합물 52-3 (940 mg, 32%)을 수득하였다.
1H NMR: 400 MHz, CDCl3, δ 7.37 - 7.30 (m, 5 H), 6.58 (s, 1 H), 5.15 (s, 2 H), 3.76 (s, 3 H), 0.16 - 0.13 (s, 9 H). LCMS (ESI): m/z 308.1 [M+H+].
단계 2. 습윤 Pd/C (0.1 g)를 실온에서 MeOH (50 mL) 중 화합물 52-3 (0.5 g, 1.6 mmol)의 용액에 첨가하였다. 반응 혼합물을 실온에서 H2 (50 psi) 하에 4시간 동안 교반하였다. 반응 혼합물을 여과하고, 여과물을 농축시켜 화합물 52-4를 수득하였으며, 이를 직접 추가 정제 없이 후속 단계에 사용하였다.
1H NMR: CDCl3, 400 MHz, δ 7.36 - 7.30 (m, 5 H), 5.10 (s, 2 H), 4.42 - 4.36 (m, 1 H), 3.72 (s, 3 H), 1.17 - 1.11 (dd, J = 6.4, 14.8 Hz, 1 H), 0.99 - 0.93 (dd, J = 9.2, 14.8 Hz, 1 H), 0.04 (s, 9 H). LCMS (ESI): m/z 310.1 [M+H+].
단계 3. THF/H2O (5 mL/5 mL) 중 화합물 52-4 (220 mg, 0.7 mmol)의 용액에 0℃에서 LiOH (44 mg, 1 mmol)를 첨가하였다. 반응 혼합물을 실온으로 가온하고, 20시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 EtOAc (20 mL)로 추출하고, 수성 층을 1 M HCl을 사용하여 pH = 2로 산성화시키고, EtOAc (30 mL x 2)로 추출하였다. 유기 층을 염수 (20 mL x 2)로 세척하고, 황산나트륨 상에서 건조시키고, 농축시켰다. 잔류물을 정제용 HPLC에 의해 정제하여 화합물 52-5를 수득하였다.
LCMS (ESI): m/z 280.1 [M+H+].
단계 4. 건조 THF (20 mL) 중 화합물 52-5 (145 mg, 0.49 mmol) 및 52-6 (57 mg, 0.495 mmol)의 용액에 건조 THF (10 mL) 중 DCC (102.3 mg, 0.495 mmol)의 용액을 0℃에서 적가하였다. 반응 혼합물을 0-5℃에서 3시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 DCM (20 mL) 중에 용해시켰다. 침전물을 여과하고, 여과물을 농축시켜 조 생성물 52-7을 백색 고체로서 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 5. DME (15 mL) 및 H2O (15 mL) 중 화합물 52-7 (상기 수득됨, 0.49 mmol)의 용액에 화합물 52-8 (129.5 mg, 0.74 mmol) 및 NaHCO3 (61.8 mg, 0.74 mmol)을 첨가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반하였다. 용매를 제거한 후, 잔류물 (52-9)을 추가 정제 없이 후속 단계에 사용하였다.
1H NMR: DMSO-d6, 400 MHz, δ 7.97 (dd, J = 7.6, 29.2 Hz, 1 H), 7.35 - 7.29 (m, 5 H), 5.93 - 5.92 (m, 1 H), 5.36 (s, 2 H), 5.07 - 4.98 (m, 2 H), 4.15 - 4.07 (m, 2 H), 2.95 - 2.90 (m, 2 H), 1.75 - 1.64 (m, 1 H), 1.58 - 1.49 (m, 1 H), 0.98 - 0.87 (m, 2 H), -0.01 (s, 9 H).
단계 6. 건조 DCM (10 mL) 중 화합물 52-9 (160 mg, 0.35 mmol) 및 (4-아미노페닐)메탄올 (65.2 mg, 0.53 mmol)의 용액에 N2 하에 0℃에서 EEDQ (175 mg, 0.71 mmol)를 첨가하였다. 반응 혼합물을 실온으로 가온하고, N2 하에 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 52-10 및 52-11을 수득하였다.
LCMS: (10-80, AB, 2분, ESI), 1.151분, MS = 558.1[M+1]
1H NMR 메탄올-d4, 400MHz, δ 9.99 (s, 1 H), 7.92 (d, J = 8.0 Hz, 1 H), 7.55 (d, J = 8.8 Hz, 1 H), 7.45 - 7.24 (m, 8 H), 6.01 - 5.98 (m, 1 H), 5.41 (s, 2 H), 5.11 (t, J = 5.2 Hz, 1 H), 5.05 (d, J = 4.8 Hz, 2 H), 4.44 (d, J = 5.6 Hz, 3 H), 4.15 - 4.08 (m, 1 H), 3.08 - 2.87 (m, 2 H), 1.72 - 1.41 (m, 4 H), 1.02 - 0.90 (m, 2 H), 0 (s, 9 H).
LCMS: (10-80, AB, 2분, ESI), 1.130분, MS = 558.1[M+1]
1H NMR 메탄올-d4, 400MHz, δ 9.89 (s, 1 H), 8.16 (d, J = 8.0 Hz, 1 H), 7.59 - 7.57 (d, J = 8.8 Hz, 2 H), 7.45 - 7.24 (m, 8 H), 6.01 - 5.95 (m, 1 H), 5.41 (s, 2 H), 5.11 (t, J = 5.6 Hz, 1 H), 5.03 (d, J = 11.2 Hz, 2 H), 4.43 (d, J = 5.6 Hz, 2 H), 4.42 - 4.38 (m, 1 H), 4.20 - 4.12 (m, 1 H), 3.05 - 2.87 (m, 2 H), 1.72 - 1.41 (m, 4 H), 0.95 (d, J = 8.0 Hz, 2 H), 0 (s, 9 H).
단계 7. 건조 DCM (5 mL) 중 52-11 (30 mg, 0.066 mmol)의 용액에 PNP 카르보네이트 (40.4 mg, 0.13 mmol) 및 DIPEA (0.5 mL)를 첨가하였다. 혼합물을 환류 하에 20시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (3 mL) 중에 용해시켰다. DIPEA (0.5 mL) 및 노르플록사신 (63.5 mg, 0.2 mmol)을 첨가하였다. 혼합물을 실온에서 2시간 동안 교반하였다. 반응 혼합물을 정제용 HPLC에 의해 정제하여 실시예 52를 수득하였다.
LCMS: (10-80, AB, 2분, ESI), 1.269분, MS = 903.0[M+1]
1H NMR DMSO-d6, 400 MHz, δ 10.00 (s, 1 H), 8.97 (s, 1 H), 8.18 (d, J = 10.4 Hz, 1 H), 7.94 (d, J = 13.2 Hz, 1 H), 7.63 (d, J = 8.4 Hz, 2 H), 7.40 (d, J = 8.4 Hz, 1 H), 7.35 - 7.30 (m, 7 H), 7.21 (d, J = 7.6 Hz, 1 H), 5.96 (t, J = 6.4 Hz, 1 H), 5.41 (s, 2 H), 5.06 (s, 2 H), 5.02 (d, J = 9.6 Hz, 2 H), 4.61 - 4.55 (m, 2 H), 4.41 - 4.36 (m, 1 H), 4.21 - 4.12 (m, 1 H), 3.61 (s, 4 H), 3.33 (s, 4 H), 3.03 - 2.90 (m, 2 H), 1.71 - 1.68 (m, 1 H), 1.58 - 1.53 (m, 1 H), 1.41 (t, J = 7.2 Hz, 4 H), 1.42 - 1.31 (m, 1 H), 0.93 (d, J = 6.8 Hz, 2 H), -0.01 (s, 9 H).
실시예 53. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-4,4,4-트리플루오로부탄아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-2-카르복실산
실시예 53을 실시예 46의 합성으로부터의 중간체로 실시예 46과 같은 절차를 사용하여 제조하였다.
단계 1. 건조 DCM (2 mL) 중 46-6B (23 mg, 0.041 mmol)의 용액에 PNP 카르보네이트 (25 mg, 0.082 mmol) 및 DIPEA (16 mg)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (5 mL) 중에 용해시켰다. DIPEA (16 mg, 0.123 mmol) 및 노르플록사신 (26 mg, 0.082 mmol)을 첨가하고, 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 53을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.33 (s, 1 H), 10.03 (s, 1 H), 8.97 (s, 1 H), 8.51 (d, J = 8.0 Hz, 1 H), 7.45 (d, J = 13.2 Hz, 1 H), 7.79(d, J = 8.4 Hz, 1 H), 7.63 (d, J = 8.4 Hz, 2 H), 7.36-7.21(m, 8 H), 5.98-5.96 (m, 1 H), 5.41 (s, 2 H), 5.07-5.01 (m, 4 H), 4.59-4.42 (m, 4 H), 3.61(s, 4 H), 3.31(s, 4 H), 3.17-2.50 (m, 4 H), 1.71-1.60 (m, 7 H). LCMS (ESI): m/z 898.8 [M+H+], 450.3 [M/2+H+].
실시예 54. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-3-(트리메틸실릴)프로판아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
실시예 54를 실시예 52의 합성으로부터의 중간체로 실시예 52과 같은 절차를 사용하여 제조하였다.
LCMS: (10-80, AB, 2분, ESI), 1.274분, MS = 903.0[M+1]
1H NMR (400 MHz, DMSO-d6) δ 10.10 (s, 1 H), 8.97 (s, 1 H), 7.95 (d, J = 13.2 Hz, 2 H), 7.61 (d, J = 8.4 Hz, 2 H), 7.40 (d, J = 8.4 Hz, 1 H), 7.37 - 7.29 (m, 7 H), 7.21 (d, J = 10.8 Hz, 1 H), 5.98 (t, J = 6.4 Hz, 1 H), 5.05 (d, J = 8.8 Hz, 2 H), 5.01 (d, J = 13.2 Hz, 2 H), 4.62 - 4.56 (m, 2 H), 4.43 - 4.40 (m, 1 H), 4.14 - 4.08 (m, 1 H), 3.61 (s, 4 H), 3.33 (s, 4 H), 3.05 - 2.91 (m, 2 H), 1.76 - 1.52 (m, 2 H), 1.48 - 1.39 (m, 5 H), 1.01 - 0.89 (m, 2 H), -0.01 (s, 9 H).
실시예 55. 7-(4-((4-((R)-3-(2-아미노에틸티오)-2-((S)-2-(벤질옥시카르보닐아미노)-3-메틸부탄아미도) 프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DMF (20 mL) 중 화합물 55-1 (1.55 g, 10 mmol), 55-1a (2.51 g, 10 mmol) 및 Et3N (3.03 g, 30 mmol)의 혼합물에 HATU (3.8 g, 10 mmol)를 첨가하였다. 혼합물을 실온에서 3시간 동안 교반한 후, 이를 EtOAc (60 mL x 3)로 추출하였다. 유기 층을 염수 (60 mL x 3)로 세척하고, NaSO4 상에서 건조시키고, 진공 하에 농축시키고, 칼럼 (헥산 중 20% EtOAc)에 의해 정제하여 화합물 55-2 (3.21 g, 91.2%)를 수득하였다.
LCMS (ESI): m/z 353.1 [M+H+].
단계 2. 건조 DCM (60 mL) 중 트리페닐포스핀 (2.87 g, 10.94 mmol)을 0℃에서 건조 DCM 중 화합물 55-2 (3.21 g, 9.12 mmol) 및 테트라브로모메탄 (4.54 g, 13.68 mmol)의 잘 교반된 용액에 10-15분에 걸쳐 적가하였다. 혼합물을 실온에서 9-10시간 동안 교반한 후, 이를 펜탄 (200 mL)으로 처리하고, 생성된 침전물을 여과에 의해 제거하고, 펜탄으로 수회 세척하였다. 합한 펜탄 용액을 5% NaHCO3, 물, 염수로 세척하고, Na2SO4 상에서 건조시켰다. 용매를 증발시키고, 오일을 실리카 겔 (헥산: EtOAc = 4:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 55-3 (3.43 g, 90.7%)을 수득하였다.
LCMS (ESI): m/z 414.9 [M+H+].
단계 3. DMF (5 mL) 중 화합물 55-3 (3.43 g, 8.3 mmol)의 용액에 화합물 55-4 (1.12 g, 4.0 mmol) 및 K2CO3 (1.15 g, 8.3 mmol)을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 EtOAc (100 mL x 2)로 추출하였다. 유기 층을 염수 (60 mL)로 세척하고, Na2SO4 상에서 건조시키고, 농축시켜 화합물 55-5의 조 생성물 (3.67 g, 86.4%)을 수득하였다.
LCMS (ESI): m/z 412.0 [M-BOC+H+], 534.1 [M+Na+].
단계 4. THF/H2O (30 mL/10 mL) 중 화합물 55-5 (3.67 g, 6.22 mmol)의 용액에 LiOH.H2O (2.6 g, 62.2 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 용매를 제거하고, 물 (30 mL)을 첨가하였다. 이를 EtOAc (80 mL x 3)로 추출하였다. 유기 층을 염수 (60 mL)로 세척하고, Na2SO4 상에서 건조시키고, 진공 하에 농축시켜 화합물 55-6을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다 (3 g, 96.9%).
LCMS (ESI): m/z 398.2 [M-BOC+H+].
단계 5. DCM (10 mL) 중 화합물 55-6 (500 mg, 1.0 mmol), (4-아미노-페닐)-메탄올 (246 mg, 2 mmol) 및 DIPEA (258 mg, 2 mmol)의 용액에 0℃에서 HATU (380 mg, 1.0 mmol)를 첨가하였다. 혼합물을 0℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC 및 SFC 분리에 의해 정제하여 55-7a 및 55-7b를 수득하였다.
55-7a
1H NMR (400 MHz, MeOD) δ 7.60 (d, J = 8.8 Hz, 2 H), 7.31-7.24 (m, 7 H), 5.06 (s, 2 H), 4.67-4.64 (m, 1 H), 4.53 (s, 2 H), 3.88 (d, J = 7.6 Hz, 1 H), 3.28-3.11 (m, 3 H), 2.89-2.84 (m, 1 H), 2.67-2.57 (m, 2 H), 2.08-1.99 (m, 1 H), 1.41 (s, 9 H), 1.01-1.99 (m, 6 H). LCMS (ESI): m/z 503.0 [M+H+-BOC].
55-7b
1H NMR (400 MHz, MeOD) δ 7.56 (d, J = 8.8 Hz, 2 H), 7.34-7.25 (m, 7 H), 5.08 (s, 2 H), 4.66-4.63 (m, 1 H), 4.54 (s, 2 H), 3.96 (d, J = 7.6 Hz, 1 H), 3.22-3.04 (m, 3 H), 2.90-2.80 (m, 1 H), 2.69-2.57 (m, 2 H), 2.13-2.03 (m, 1 H), 1.40 (s, 9 H), 0.98-0.94 (m, 6 H). LCMS (ESI): m/z 502.9 [M+H+-BOC], 624.5 [M+Na+].
단계 6. 건조 DCM (2 mL) 중 55-7a (28 mg, 0.047 mmol)의 용액에 PNP 카르보네이트 (30 mg, 0.094 mmol) 및 DIPEA (0.2 mL)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (2 mL) 중에 용해시켰다. DIPEA (0.2 mL) 및 노르플록사신 (29 mg, 0.094 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 화합물 55-8 (38 mg, 84.4%)을 수득하였다.
LCMS (ESI): m/z 948.4 [M+H+].
단계 7. 건조 DCM (10 mL) 중 화합물 55-8 (38 mg, 0.04 mmol)의 용액에 HCl/CH3OH (4 mol/L)를 0℃에서 10분에 걸쳐 첨가하였다. 혼합물을 실온에서 1시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 55를 백색 고체로서 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.86 (s, 1 H), 7.97 (d, J = 13.2 Hz, 1 H), 7.66 (d, J = 8.4 Hz, 2 H), 7.34 (d, J = 8.8 Hz, 2 H), 7.27-7.22 (m, 5 H), 7.14 (d, J = 7.2 Hz, 1 H), 5.08 (d, J = 21.6 Hz, 4 H), 4.73-4.51 (m, 1 H), 4.50-4.48 (m, 2 H), 3.81 (d, J = 8.0 Hz, 1 H), 3.69 (s, 4 H), 3.34 (s, 4 H), 3.25-2.91 (m, 3 H), 2.90-2.79 (m, 3 H), 2.09-2.00 (m, 1 H), 1.55-1.45 (m, 3 H), 1.09-1.00 (m, 6 H). LCMS (ESI): m/z 848.1 [M+H+].
실시예 56. 7-(4-((4-((S)-2-((S)-2-(벤질옥시카르보닐아미노)-3-메틸부탄아미도)-3-(1-(tert-부톡시카르보닐)피페리딘-4-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF / H2O (10 mL / 2 mL) 중 화합물 56-2 (150 mg, 0.551 mmol)의 용액에 NaHCO3 (138 mg, 1.653 mmol) 및 화합물 56-1 (287 mg, 0.827 mmol)을 첨가하였다. 혼합물을 25℃에서 밤새 교반하고, 이를 HCl (1 N)을 사용하여 pH = 6으로 산성화시키고, EtOAc (50 mL x 3)로 추출하였다. 유기 층을 건조시키고, 농축시켜 56-3을 수득하였으며, 이를 실리카 겔 (PE / EtOAc =10 / 1에서 1 / 10) 상에서 칼럼 크로마토그래피에 의해 정제하였다.
LCMS: (0-60, AB, 2분, ESI), 1.309분, MS = 406.3 [M+1-Boc+]
단계 2. DCM (20 mL) 중 화합물 56-3 (1.2 g, 2.376 mmol)의 용액에 화합물 56-4 (439 mg, 3.56 mmol), 및 HATU (1.7 g, 5.064 mmol)를 첨가하였다. 혼합물을 25℃에서 밤새 교반하였다. 용액을 H2O로 켄칭하고, DCM (50 mL x 3)으로 추출하였다. 유기 층을 건조시키고, 농축시키고, 실리카 겔 (PE / EtOAc = 10 / 1에서 1 / 10) 상에서 칼럼 크로마토그래피에 의해 정제하여 56-5를 수득하였다.
LCMS: (0-60, AB, 2분, ESI), 1.413분, MS = 511.2 [M+1-Boc+]
단계 3. 0℃에서 건조 DMF (2 mL) 중 화합물 56-5 (100 mg, 0.16 mmol)에 N2 하에 DIPEA (0.5 mL, 3 mmol) 및 PNP 카르보네이트 (200 mg, 0.66 mmol, 4.1 당량)를 첨가하였다. 혼합물을 실온에서 밤새 교반하였다. 혼합물에 노르플록사신 (102 mg, 0.32 mmol, 2당량)을 첨가하고, 1시간 동안 교반하였다. 혼합물을 정제용 HPLC (FA)에 의해 정제하여 실시예 56 (60 mg, 40%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 1.064분, MS = 956.3[M+1]
1H NMR: MeOH-d4 400MHz, δ 8.84 (s, 1H), 7.97 - 7.93 (dd, J = 16, 1H), 7.59 - 7.57 (m, 2H), 7.35 - 7.27 (m, 7H), 7.20 - 7.10 (m, 1H), 5.11 - 5.07 (m, 4H), 4.6 - 4.5 (m, 1H), 4.55 - 4.45 (m, 2H), 4.10 - 3.90 (m, 3H), 3.75 - 3.65 (m, 4H), 3.3 (m, 4H), 2.80 - 2.50 (m, 2H), 2.1 - 2.0 (m, 1H), 1.8 - 1.6 (m, 5H), 1.6 - 1.5 (m, 3H), 1.43 (s, 9H), 1.2 - 1.0 (m, 2H), 0.96 - 0.94 (d, J = 6.8 Hz, 6H).
단계 1. 빙초산 (30 mL) 중 화합물 57-2 (10 g, 100 mmol)의 용액을 빙초산 (150 mL) 중 화합물 57- 1 (13.1 g, 100 mmol)의 용액에 N2 하에 15분의 기간에 걸쳐 첨가하였다. 이를 실온에서 1시간 동안 교반한 후, 백색 불균질 반응 혼합물을 환류 하에 5시간 동안 가열하였다. 대부분의 아세트산을 진공 하에 제거하였다. 잔류물을 물과 DCM 사이에 분배하였다. DCM을 제거하고, 갈색 오일을 소량의 EtOAc 중에 용해시키고, PE에 부었다. 백색 침전물을 여과에 의해 수집하여 57-3 (12 g, 수율: 56%)을 수득하였다.
1H NMR DMSO-d6 400 MHz, δ 11.98 (s, 1 H), 3.34 - 3.31 (m, 2 H), 2.61 (m, 4 H), 2.19 - 2.16 (m, 2 H), 1.50 - 1.43 (m, 4 H), 1.23 (d, J = 7.2 Hz, 2 H).
단계 2. DCM (100 mL) 중 화합물 57-3 (12 g, 56.3 mmol) 및 과량의 트리에틸아민 (25 mL, 168.9 mmol)의 용액에 과량의 화합물 57-4 (36 g, 140.8 mmol)를 15분에 걸쳐 첨가하였다. 혼합물을 N2 하에 실온에서 6시간 동안 교반하였다. 혼합물은 균질해졌으며, 이를 40℃에서 3시간 동안 교반하였다. 이를 농축시키고, 물 및 염수로 세척하고, 무수 MgSO4 상에서 건조시켰다. 이를 농축시키고, 칼럼 크로마토그래피 (EtOAc)에 의해 정제하여 57-5 (4 g, 수율: 23%)를 수득하였다.
1H NMR MeOD-d4 400 MHz, δ 3.54 - 3.50 (m, 2 H), 2.86 (d, J = 3.2 Hz, 4 H), 2.71 (d, J = 2.8 Hz, 4 H), 2.66 - 2.63 (m, 2 H), 1.79 - 1.75 (m, 2 H), 1.65 - 1.59 (m, 2 H), 1.45 - 1.41 (m, 2 H).
단계 3. DME (10 mL) 중 화합물 57-6 (375 mg, 2.86 mmol)의 용액에 물 (10 mL) 중 화합물 57-5 (800 mg, 2.6 mmol) 및 NaHCO3 (656 mg, 7.8 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 EtOAc로 세척하고, 10% HCl을 사용하여 pH = 3으로 산성화시켰다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시켜 조 화합물 57-7 (1.2 g, 불순물 함유)을 수득하였다.
단계 4. THF (50 mL) 중 화합물 57-8 (2.0 g, 4.10 mmol)의 혼합물에 화합물 57-9 (3.8 g, 24.34 mol) 및 Pd(PPh3)4 (946 mg, 0.82 mmol)를 첨가하였다. 반응 혼합물을 60℃에서 3시간 동안 교반하였다. 혼합물을 실온으로 냉각시키고, 여과하고, 여과물 케이크를 정제용 HPLC에 의해 정제하여 57-10 (1.0 g, 60.4%)을 수득하였다.
단계 5. 화합물 57-7 (100 mg, 0.31mmol), HATU (175 mg, 0.46 mmol), DIPEA (119 mg, 0.92 mmol)를 DMF (10 ml) 중에 용해시켰다. 반응 혼합물을 실온에서 30분 동안 교반하였다. 이어서, 화합물 57-10 (124 mg, 119 mmol)을 첨가하였다. 반응 혼합물을 실온에서 3시간 동안 교반하였다. 이어서, 혼합물을 농축시키고, 정제용 HPLC에 의해 정제하여 57-11a 및 57-11b (30 mg 각각, 5%)를 수득하였다.
단계 6. DMF (2 mL) 중 화합물 57-11a (30 mg, 0.042 mmol) 및 PNP 카르보네이트 (26 mg, 0.084 mmol)의 용액에 0℃에서 DIPEA (17 mg, 0.127 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하고, 노르플록사신 (27 mg, 0.084 mmol)을 실온에서 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 잔류물을 정제용 HPLC에 의해 정제하여 실시예 57 (14 mg, 수율: 15%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.832분, MS = 529.4[1/2M+1]
1H NMR 메탄올-d4 400 MHz, δ 8.89 (s, 1 H), 8.33 (d, J = 4.6 Hz, 1 H), 8.06 - 8.01 (m, 2 H), 7.63 (d, J = 8.4 Hz, 2 H), 7.50 - 7.40 (m, 1 H), 7.39 (d, J = 8.4 Hz, 2 H), 7.21 (s, 1 H), 5.55 - 5.51 (m, 1 H), 5.15 (s, 2 H), 4.92 (s, 1 H), 4.58 (s, 6 H), 3.74 (s, 4 H), 3.49 - 3.46 (m, 2 H), 3.35 - 3.33 (m, 4 H), 2.69 (s, 4 H), 2.26 - 2.22 (m, 4 H), 1.65 - 1.57 (m, 9 H), 1.56 - 1.29 (m, 5 H), 1.01 (d, J = 6.8 Hz, 3 H), 0.93 (d, J = 6.4 Hz, 3 H), 0.92 - 0.81 (m, 6 H)
실시예 58. 7-(4-((4-((S)-6-아미노-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)헥산아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. CbzCl (26.7 mL, 0.19 mol)을 물 (100 mL) 중 58-1 (20 g, 0.17 mol) 및 Na2CO3 (36 g, 0.34 mol)의 혼합물에 20분에 걸쳐 적가하였다. 이를 실온에서 12시간 동안 교반한 후, 이를 EtOAc (200 mL x 2)로 세척하였다. 수성 층을 pH = 2로 조정하고, EtOAc (200 mL x 4)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 58-2를 수득하였다.
단계 2. DCM (200 mL) 중 58-2 (20 g, 79.3 mmol), N,O-디메틸히드록실아민 (8.4 g, 87.2 mmol) 및 HATU (45.2 g, 118.9 mmol)의 용액에 Et3N (45.8 mL, 317.1 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 EtOAc (200 mL x 3)로 추출하였다. 유기 층을 진한 HCl, 수성 NaHCO3, 포화 NaCl로 세척하고, 농축시켰다. 조 물질을 실리카 겔 (PE: EtOAc=2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 58-3을 수득하였다.
단계 3. DCM (100 mL) 중 화합물 58-3 (6.0 g, 20.4 mmol)을 드라이 아이스/아세톤 조에서 -78℃로 냉각시켰다. DIBAL-H (30.6 mL, 30.6 mmol)를 적가하고, 혼합물을 -78℃에서 4시간 동안 교반하였다. 과량의 히드라이드를 MeOH (5 mL)로 켄칭하고, 용액을 실온으로 가온하였다. 용매를 제거한 후, 58-4를 추가 정제 없이 후속 단계에 사용하였다.
단계 4. MeOH (60 mL) 중 58-4 (4.80 g, 20.4 mmol), 화합물 5 (4.70 g, 24.5 mmol) 및 K2CO3 (5.64 g, 40.8 mmol)의 혼합물을 실온에서 12시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 EtOAc (100 mL x 3)로 추출하였다. 유기 층을 염수 (60 mL)로 세척하고, Na2SO4 상에서 건조시켰다. 용매를 제거하고, 조 물질을 실리카 겔 (PE: EtOAc = 10:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 58-6을 수득하였다.
단계 5. H2O (100 mL) 중 58-7 (10 g, 68.4 mmol) 및 Cu(OH)2CO3 (15.12 g, 68.4 mmol)의 용액을 환류 하에 30분 동안 가열하였다. 환류 동안 형성된 고체를 뜨겁게 하면서 여과에 의해 제거하였다. 여과물을 0℃로 냉각시키고, 고체 Na2CO3 (1.0 g)을 첨가하여 pH 9로 조정하였다. 용액을 0℃에서 교반하면서, AllocCl (10.8 mL, 102.6 mmol)을 적가하였다. 첨가 동안, 반응 혼합물을 고체 Na2CO3 (20 g)의 첨가에 의해 pH 9에서 유지하였다. 반응 혼합물을 실온으로 가온되도록 하고, 12시간 동안 교반하였다. 반응 동안 형성된 청색 고체 생성물을 여과에 의해 정량적 수율로 수집하였다. 상기 수집된 Orn(Alloc)의 고체 구리 염을 H2O (200 mL) 중에 현탁시키고, 2 당량의 티오아세트아미드 (6.511 g, 86.66 mmol)를 첨가하였다. 알칼리 현탁액을 50℃에서 3시간 동안 교반하였고, 그 시간 동안 고체는 천천히 용해되었다. 이어서, 용액을 2M HCl을 사용하여 pH 2로 산성화시키고, 5분 동안 추가로 끓였다. 침전된 CuS를 여과에 의해 제거하였다. 여과물을 진공 하에 약 100 mL로 농축시키고, 그 시점에 Orn(Alloc) 58-8의 생성물 히드로클로라이드 염은 백색 고체로서 정량적 수율로 침전되었다.
단계 6. 증류된 H2O (45 mL) 및 CH2Cl2 (75 mL) 중 NaN3 (8.5 g, 129.7 mmol)의 용액을 빙조에서 냉각시켰다. Tf2O (4.4 mL, 25.94 mmol)를 5분에 걸쳐 천천히 첨가하고, 2시간 동안 계속 교반하였다. 혼합물을 분리기 깔때기에 넣고, CH2Cl2 상을 제거하였다. 수성부를 CH2Cl2 (35 mL x 2)로 추출하였다. 트리플릴 아지드를 함유하는 유기 분획을 합하고, 포화 Na2CO3으로 1회 세척하고, 추가 정제 없이 사용하였다. 화합물 58-8 (2.99 g, 12.97 mmol)을 증류된 H2O (90 mL) 및 MeOH (180 mL) 중 K2CO3 (2.69 g, 19.46 mmol) 및 CuSO4·5H2O (486 mg, 1.94 mmol)와 합하였다. CH2Cl2 중 트리플릴 아지드 (150 mL)를 첨가하고, 혼합물을 실온에서 12시간 동안 교반하였다. 후속적으로, 유기 용매를 압력 하에 제거하고, 수성 슬러리를 0.2 M pH 6.2 인산염 완충액 (100 mL)으로 희석하고, EtOAc (200 mL x 2)로 추출하여 술폰아미드 부산물을 제거하였다. 이어서, 수성 상을 진한 HCl을 사용하여 pH 2로 산성화시켰다. 생성물을 EtOAc 추출 (400 mL x 3)의 또 다른 라운드로부터 수득하였다. EtOAc 추출물을 합하고, Na2SO4 상에서 건조시키고, 증발시켜 58-9를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 7. DMF (10 mL) 중 58-9 (3.32 g, 12.97 mmol), 58-6 (1.50 g, 6.48 mmol) 및 Cu(CH3CN)4PF6 (362 mg, 0.97 mmol)의 혼합물을 50℃에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 58-10 (2.3 g, 36.4%)을 수득하였다.
단계 8. DCM (50 mL) 중 58-10 (2.33 g, 4.78 mmol), 58-11 (1.76 mg, 14.3 mmol) 및 EEDQ (3.55 g, 14.3 mmol)의 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC 및 SFC 분리에 의해 정제하여 58-12 (326 mg) 및 58-13 (30 mg)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.04 (s, 1 H), 7.55-7.53 (m, 2 H), 7.33-7.30 (m, 7 H), 5.91-5.87 (m, 1 H), 5.45-5.41 (m, 1 H), 5.27-5.23 (m, 1 H), 5.15-5.11 (m, 1 H), 5.07 (d, J = 2.8 Hz, 2 H), 4.70-4.68 (m, 1 H), 4.55 (s, 2 H), 4.48-4.46 (m, 2 H), 3.34-3.32 (m, 1 H), 3.09-3.07 (m, 2 H), 2.28-2.22 (m, 3 H), 1.54-1.50 (m, 2 H), 1.44-1.35 (m, 2 H), 0.93 (d, J = 6.8 Hz, 3 H), 0.87 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 593.0 [M+H+].
1H NMR (400 MHz, MeOD) δ 8.04 (s, 1 H), 7.55-7.52 (m, 2 H), 7.32-7.27 (m, 7 H), 5.91-5.87 (m, 1 H), 5.43-5.42 (m, 1 H), 5.27-5.22 (m, 1 H), 5.15-5.12 (m, 1 H), 5.07 (d, J =3.6 Hz, 2 H), 4.70-4.68 (m, 1 H), 4.55 (s, 2 H), 4.47 (d, J = 5.2 Hz, 2 H), 3.07-3.05 (m, 2 H), 2.22-2.14 (m, 3 H), 1.54-1.50 (m, 2 H), 1.44-1.20 (m, 2 H), 0.92 (d, J = 6.8 Hz, 3 H), 0.87 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 593.0 [M+H+].
단계 9. DCM (5 mL) 중 58-12 (100 mg, 0.169 mmol), PNP (103 mg, 0.338 mmol) 및 DIPEA (66 mg, 0.507 mmol)의 혼합물을 50℃에서 12시간 동안 교반하고, 용매를 제거하였다. DMF (5 mL) 중 상기 조 생성물 (128 mg, 0.169 mmol), 노르플록사신 (160 mg, 0.507 mmol) 및 DIPEA (66 mg, 0.507 mmol)의 혼합물을 실온에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 중간체 100 mg을 수득하였다. THF (5 mL) 중 중간체 (50 mg, 0.053 mmol) 및 1,3-디메틸바르비투르산 (67 mg, 0.426 mmol)에 Pd(PPh3)4 (12 mg, 0.0106 mmol)를 첨가하였다. 혼합물을 50℃에서 12시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 58 (20.6 mg)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 8.96 (s, 1 H), 8.47-8.43 (m, 1 H), 8.09 (s, 1 H), 7.96-7.93 (m, 1 H), 7.74-7.72 (m, 1 H), 7.62-7.60 (m, 2 H), 7.38-7.29 (m, 7 H), 7.22-7.20 (m, 1 H), 5.52-5.49 (m, 1 H), 5.07 (s, 2 H), 5.02 (d, J = 4.8 Hz, 2 H), 4.62-4.58 (m, 3 H), 3.62 (s, 4 H), 3.15 (s, 4 H), 2,67-2.66 (m, 2 H), 2.15-2.09 (m, 3 H), 1.54-1.52 (m, 2 H), 1.40 (t, J = 7.2 Hz, 3 H), 1.23-1.18 (m, 2 H), 0.84 (d, J = 6.4 Hz, 3 H), 0.78 (d, J = 6.4 Hz, 3 H).
LCMS (ESI): m/z 854.1 [M+H+].
실시예 59. 7-(4-((4-((S)-2-(4-((S)-1-((R)-2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)-3-페닐프로판아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시) 카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DME (5 mL) 중 화합물 59-2 (118 mg, 0.71 mmol)의 용액에 물 (5 mL) 중 화합물 59-1 (200 mg, 0.71 mmol) 및 NaHCO3 (122 mg, 1.42 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 EtOAc로 세척하고, 10% HCl을 사용하여 pH = 3으로 산성화시켰다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시켜 조 화합물 59-3 (240 mg)을 수득하였다.
단계 2. 화합물 59-3 (240 mg, 0.67mmol), HATU (506 mg, 1.34 mmol), DIPEA (258 mg, 2.01 mmol)를 DMF (5 mL) 중에 용해시키고, 실온에서 30분 동안 교반하였다. 이어서, 화합물 59-4 (269 mg, 0.67 mmol)를 첨가하였다. 반응 혼합물을 실온에서 3시간 동안 교반하였다. 혼합물을 농축시키고, 정제용 HPLC에 의해 정제하여 59-5a 및 59-5b (40 mg 각각, 8%)를 수득하였다.
단계 3. 건조 DMF (3 mL) 중 화합물 59-5a (40 mg, 0.054 mmol)의 용액에 PNP 카르보네이트 (34 mg, 0.11 mmol) 및 DIPEA (21 mg, 0.162 mmol)를 실온에서 첨가하고, 실온에서 1.5시간 동안 교반하였다. 노르플록사신 (35 mg, 0.11 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하고, 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하였다 (14 mg, 수율: 20%).
LCMS: (5-95, AB, 1.5분, ESI), 0.838분, MS = 546.5[1/2M+1]
1H NMR DMSO-d6 400 MHz, δ 10.64 (s, 1 H), 8.96 (s, 1H), 8.22 (d, J = 9.2 Hz, 1 H), 8.04 (d, J = 8.4 Hz, 1 H), 8.04 - 7.92 (m, 2 H), 7.61 (d, J = 8.4 Hz, 2 H), 7.36 (d, J = 8.4 Hz, 2 H), 7.22 - 7.20 (m, 5 H), 7.14 (s, 1 H), 6.06 (d, J = 6 Hz, 1 H), 5.50 - 5.47 (m, 1 H), 5.44 (s, 2 H), 5.07 (s, 2 H), 4.90 - 4.86 (m, 1 H), 4.61 - 4.58 (m, 3 H), 3.61 (s, 4 H), 3.34 - 3.25 (m, 4 H), 3.04 - 2.91 (m, 4 H), 2.75 - 2.71 (m, 2 H), 2.60 (s, 4 H), 2.14 - 2.11 (m, 2 H), 2.09 - 2.00 (m, 2H), 1.42 - 1.29 (m, 10H), 1.40 (d, J = 7.2 Hz, 2 H), 0.85 - 0.79 (m, 6H).
실시예 60. 7-(4-((4-((S)-2-(4-((S)-1-((R)-2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)-3-메틸부탄아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시) 카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DME (5 mL) 중 화합물 60-2 (83 mg, 0.71 mmol)의 용액에 물 (5 mL) 중 화합물 60-1 (200 mg, 0.71 mmol) 및 NaHCO3 (122 mg, 1.42 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 EtOAc로 세척하고, 10% HCl을 사용하여 pH 3으로 산성화시켰다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시켜 화합물 60-3 (160 mg, 불순물 함유, 수율: 80%)을 수득하였다.
단계 2. 화합물 60-3 (160 mg, 0.51mmol), HATU (390 mg, 1.02 mmol), DIPEA (200 mg, 0.68 mmol)를 DMF (5 mL) 중에 용해시키고, 실온에서 30분 동안 교반하였다. 이어서, 화합물 60-4 (207 mg, 0.51 mmol)를 첨가하였다. 반응 혼합물을 실온에서 3시간 동안 교반하였다. 이어서, 혼합물을 농축시키고, 정제용 HPLC에 의해 정제하여 60-5a 및 60-5b (각각 60 mg 및 60 mg, 8% 및 8%)를 수득하였다.
단계 3. 건조 DMF (3 mL) 중 화합물 60-5a (60 mg, 0.086 mmol)의 용액에 실온에서 PNP 카르보네이트 (60 mg, 0.2 mmol) 및 DIPEA (0.5 mL, 3 mmol)를 첨가하고, 혼합물을 실온에서 1.5시간 동안 교반하였다. 노르플록사신 (60 mg, 0.19 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 혼합물을 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 60 (47.9 mg, 수율: 54%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.824분, MS = 522.4[1/2M+1]
1H NMR DMSO-d6 400 MHz, δ 10.1 (s, 1H), 8.93 (s, 1 H), 8.15 - 8.13 (d, 1H), 7.99 (s, 1 H), 7.93 - 7.90 (d, 1 H), 7.81 - 7.79 (d, 1H), 7.57 - 7.55 (d, J = 8.0 Hz, 2 H), 7.35 - 7.33 (d, J = 8.0 Hz, 2 H), 7.20 - 7.18 (m, 1 H), 6.0 (m, 1 H), 5.5 (m, 1 H), 5.40 (s, 2 H), 5.04 (s, 2 H), 4.8 (m, 1 H), 4.6 - 4.5 (m, 2 H), 4.2 - 4.1(m, 1 H), 3.6 (s, 4 H), 3.2 (m, 6 H), 3.05 - 2.9 (m, 2 H), 2.57 (s, 4 H), 2.15 - 2.0 (m, 5 H), 1.9 - 1.8 (m, 1 H), 1.5 - 1.35 (m, 7 H), 1.3 - 1.1 (m, 4 H), 0.82 - 0.80 (m, J = 8.0 Hz, 3H), 0.76 - 0.70 (m, 9H).
실시예 61. 7-(4-((4-((S)-2-(4-((S)-1-((R)-2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)프로판아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DME (5 mL) 중 화합물 61-2 (64 mg, 0.71 mmol)의 용액에 물 (5 mL) 중 화합물 61-1 (200 mg, 0.71 mmol) 및 NaHCO3 (122 mg, 1.42 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 EtOAc로 세척하고, 10% HCl을 사용하여 pH = 3으로 산성화시켰다. 생성된 현탁액을 EA로 추출하였다. 합한 유기 층을 농축시켜 화합물 61-3을 수득하였다. (100 mg, 불순물 함유, 수율: 60%)
단계 2. 화합물 61-3 (100 mg, 0.35mmol), HATU (267 mg, 0.7 mmol), DIPEA (136 mg, 1.05 mmol)를 DMF (5 mL) 중에 용해시키고, 실온에서 30분 동안 교반하였다. 화합물 61-4 (142 mg, 0.35 mmol)를 첨가하고, 반응 혼합물을 실온에서 3시간 동안 교반하였다. 혼합물을 농축시키고, 정제용 HPLC에 의해 정제하여 61-5a 및 61-5b (각각 43 mg, 22 mg, 6%, 3%)를 수득하였다.
단계 3. 건조 DMF (2 mL) 중 화합물 61-5b (22 mg, 0.033 mmol)의 용액에 실온에서 PNP 카르보네이트 (20 mg, 0.066 mmol) 및 DIPEA (0.2 mL, 1.2 mmol)를 첨가하고, 혼합물을 실온에서 1.5시간 동안 교반하였다. 노르플록사신 (20 mg, 0.066 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 혼합물을 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 61 (14.6 mg 수율: 43%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.805분, MS = 508.3[1/2M+1]
1H NMR 메탄올-d4 + CDCl3 400 MHz, δ 8.83 (s, 1 H), 8.02 - 7.99 (m, 2 H), 7.77 (용매:CDCl3), 7.59 - 7.57 (d, J = 8.0 Hz, 2 H), 7.36 - 7.34 (d, J = 8.0 Hz, 2 H), 7.15 - 7.13 (m, 1 H), 5.5 (m, 1 H), 5.11 (s, 2 H), 4.95 - 4.9 (m, 1 H), 4.55 - 4.45 (m, 2 H), 4.4 - 4.35 (m, 1 H), 3.7 (s, 4 H), 3.45 (m, 2 H), 3.4 (s, 4 H), 3.25 - 3.05 (m, 2 H), 2.66 (s, 4 H), 2.3 - 2.1 (m, 5 H), 1.6 - 1.5 (m, 7 H), 1.5 - 1.3 (m, 2 H), 1.3 - 1.2 (m, 5 H), 0.96 - 0.94 (d, J = 8.0 Hz, 3 H), 0.87 - 0.85 (d, J = 8.0 Hz, 3 H).
실시예 62. 7-(4-((4-((S)-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2,2-디메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. CbzCl (24 mL, 0.17 mol)을 물 (100 mL) 중 62-1 (20 g, 0.15 mol) 및 Na2CO3 (32 g, 0.30 mol)의 혼합물에 20분에 걸쳐 적가하였다. 반응 혼합물을 12시간 동안 교반한 후, 이를 EtOAc (200 mL x 2)로 세척하였다. 수성 층을 pH = 2로 조정하고, EtOAc (200 mL x 4)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 62-2를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 2. DCM (100 mL) 중 62-2 (10 g, 37.7 mmol), N,O-디메틸히드록실아민 (4.0 g, 41.5 mmol) 및 HATU (21.3 g, 56.0 mmol)의 혼합물에 Et3N (21.8 mL, 150.8 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반한 후, 용매를 제거하고, 조 물질을 물 (200 mL)로 녹였다. 수성 층을 EtOAc (200 mL x 3)로 추출하였다. 추출물을 진한 HCl, 수성 NaHCO3, 포화 NaCl로 세척하였다. 이를 농축시키고, 실리카 겔 (PE: EtOAc = 2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 62-3을 수득하였다.
단계 3. DIBAL-H (19.5 mL, 19.46 mmol)를 DCM (60 mL) 중 화합물 3 (4 g, 12.97 mmol)의 용액에 -78℃에서 적가하였다. 혼합물을 -78℃에서 4시간 동안 교반한 후, 과량의 히드라이드를 MeOH (5 mL)로 켄칭하고, 생성된 용액을 실온으로 가온하였다. 용액을 농축시켜 화합물 4를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 4. MeOH (40 mL) 중 62-4 (3.23 g, 12.97 mmol), 62-5 (2.99 g, 15.56 mmol) 및 K2CO3 (3.58 g, 25.94 mmol)의 혼합물을 실온에서 12시간 동안 교반한 후, 용매를 제거하고, 잔류물을 EtOAc (60 mL x 3)로 추출하였다. 유기 층을 염수로 세척하고, Na2SO4 상에서 건조시키고, 농축시키고, 칼럼 (PE: EtOAc= 10:1)에 의해 정제하여 62-6을 수득하였다.
단계 5. Tf2O (4.4 mL, 25.94 mmol)를 0℃에서 H2O (45 mL) 및 DCM (75 mL)의 혼합물 중 NaN3 (8.3 g, 129.7 mmol)의 용액에 5분에 걸쳐 천천히 첨가하였다. 이를 2시간 동안 교반한 후, DCM 층을 분리하고, 수성부를 DCM (35 mLx2)으로 추출하였다. 트리플릴 아지드를 함유하는 유기 분획을 합하고, 포화 Na2CO3으로 1회 세척하고, H2O (90 mL) 및 MeOH (180 mL) 중 62-7 (2.27 g, 12.97 mmol), K2CO3 (2.69 g, 19.46 mmol) 및 CuSO4·5H2O (323 mg, 1.30 mmol)의 혼합물에 첨가하였다. 혼합물을 12시간 동안 교반한 후, 유기 용매를 압력 하에 제거하고, 수성 슬러리를 인산염 완충액 (0.2M, pH 6.2, 100 mL)으로 희석하고, EtOAc (200 mL x 2)로 추출하였다. 이어서, 수성 상을 진한 HCl을 사용하여 pH = 2로 산성화시키고, (400 mL x 3)로 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켜 62-8을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 6. DMF (5 mL) 중 62-8 (2.61 g, 12.97 mmol), 62-6 (1.59 g, 6.48 mmol) 및 Cu(CH3CN)4PF6 (362 mg, 0.97 mmol)의 혼합물을 50℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 62-9를 수득하였다.
단계 7. DCM (50 mL) 중 62-9 (968 mg, 2.17 mmol), 62-10 (801 mg, 6.50 mmol) 및 EEDQ (1.61 g, 6.50 mmol)의 혼합물을 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 62-11 (395.9 mg, 33.1%)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.11 (s, 1 H), 7.59-7.56 (m, 2 H), 7.37-7.27 (m, 7 H), 5.55-5.51 (m, 1 H), 5.13-5.05 (m, 2 H), 4.79 (s, 1 H), 4.58 (s, 2 H), 3.34-3.32 (m, 1 H), 3.25-3.11 (m, 1 H), 2.28-2.22 (m, 2 H), 1.48-1.41 (m, 2 H), 0.96 (s, 9 H).
LCMS (ESI): m/z 551.9 [M+H+].
단계 8. DCM (5 mL) 중 62-11 (190 mg, 0.34 mmol), PNP 카르보네이트 (126 mg, 0.41 mmol) 및 DIPEA (132 mg, 1.02 mmol)의 혼합물을 50℃에서 12시간 동안 교반한 후, 용매를 제거하고, DMF (5 mL) 중 노르플록사신 (323 mg, 1.02 mmol) 및 DIPEA (132 mg, 1.02 mmol)의 혼합물에 첨가하였다. 이를 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 62 (6.2 mg)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.31 (s, 1 H), 10.66 (s, 1 H), 8.96 (s, 1 H), 8.15 (s, 1 H), 7.94 (d, J =13.2 Hz, 1 H), 7.72-7.70 (m, 1 H), 7.60 (d, J = 8.0 Hz, 2 H), 7.38-7.28 (m, 8 H), 6.04-6.03 (m, 1 H), 5.52-5.51 (m, 1 H), 5.42 (s, 2 H), 5.07 (s, 2 H), 5.03-5.01 (m, 2 H), 4.66 (d, J = 9.6 Hz, 1 H), 4.58-4.56 (m, 2 H), 3.61 (s, 4 H), 3.41 (s, 4 H), 3.02-2.98 (m, 2 H), 2.12-2.02 (m, 2 H), 1.42-1.39 (m, 3 H), 1.26-1.23 (m, 2 H), 0.84 (s, 9 H).
LCMS (ESI): m/z 897.1 [M+H+].
실시예 63. 7-(4-((4-((S)-2-(4-((S)-1-((S)-2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)프로판아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
실시예 63을 실시예 61의 합성으로부터의 중간체로 실시예 61과 같은 절차를 사용하여 제조하였다.
단계 1. 건조 DMF (3 mL) 중 화합물 61-5a (43 mg, 0.064 mmol)의 용액에 실온에서 PNP 카르보네이트 (40 mg, 0.128 mmol) 및 DIPEA (0.4 ml, 2.4 mmol)를 첨가하고, 혼합물을 실온에서 1.5시간 동안 교반되도록 하였다. 노르플록사신 (40 mg, 0.128 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 혼합물을 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 63 (33.8 mg, 수율: 52%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.803분, MS = 508.4[1/2M+1]
1H NMR 메탄올-d4 400 MHz, δ 8.86 (s, 1 H), 8.15 - 8.12 (d, 1H), 8.10 - 8.05 (m, 1 H), 8.05 - 7.98 (d, 1 H), 7.62 - 7.60 (d, J = 8.0 Hz, 2 H), 7.37 - 7.35 (d, J = 8.0 Hz, 2 H), 7.20 - 7.18 (m, 1 H), 5.5 (m, 1 H), 5.12 (s, 2 H), 4.95 - 4.9 (m, 1 H), 4.6 - 4.5 (m, 2 H), 4.42 - 4.38(m, 1 H), 3.7 (s, 4 H), 3.41 (m, 2 H), 3.3 (s, 4 H), 3.25 - 3.1 (m, 2 H), 2.63 (s, 4 H), 2.35 - 2.2 (m, 5 H), 1.6 - 1.5 (m, 7 H), 1.5 - 1.3 (m, 2 H), 1.35 - 1.33 (d, J = 8.0 Hz, 3 H), 1.3 - 1.2 (m, 2H), 0.95 - 0.93 (d, J = 8.0 Hz, 3 H), 0.91 - 0.88 (d, J = 8.0 Hz, 3 H).
실시예 64. 7-(4-((4-((S)-2-(4-((S)-1-아세트아미도-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF 중 64-1 (1.1 g, 11.4 mmol)의 교반 용액에 0℃에서 64-2 (4.5 mL, 57 mmol), TEA (9 mL, 62.7 mmol)를 첨가하였다. 혼합물을 N2 하에 실온에서 3시간 동안 교반하였다. 반응 혼합물을 물 (30 mL)에 붓고, DCM으로 추출하고, 합한 유기 층을 수성 NaCl로 세척하고, 농축시켜 64-3 (수율: 95%)을 수득하였다.
단계 2. 화합물 64-3 (139 mg, 1 mmol), 64-4 (302 mg, 1.5 mmol), Cu(CH3CN)4PF6 (75 mg, 0.2 mmol)을 실온에서 DMF (8 mL) 중에 용해시켰다. 혼합물을 60℃에서 2시간 동안 교반하였다. 혼합물 64-5를 추가 정제 없이 후속 단계에 사용하였다.
단계 3. 64-5의 조 혼합물에 실온에서 64-6 (1.123 g, 9.12 mmol) 및 EEDQ (3 g, 12.2 mmol)를 첨가하였다. 혼합물을 N2 분위기 하에 실온에서 16시간 동안 교반하였다. 잔류물을 정제용 HPLC에 의해 정제한 다음, SFC에 의해 정제하여 64-7을 수득하였다. (수율: 80%)
LCMS (ESI): m/z 446.0 [M+H+].
단계 4. DMF (2 mL) 중 64-7 (30 mg, 0.068 mmol)의 용액에 0℃에서 PNP 카르보네이트 (42 mg, 0.136 mmol) 및 DIPEA (27 mg, 0.21 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물 64-8을 추가 정제 없이 후속 단계에 사용하였다. (수율: 95%)
LCMS (ESI): m/z 611.2 [M+H+].
단계 5. 혼합물 64-8에 실온에서 노르플록사신 (44 mg, 0.136 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 잔류물을 정제용 HPLC에 의해 정제한 다음, SFC에 의해 정제하여 실시예 64 (수율: 30%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.62 (s, 1 H), 8.96 (s, 1 H), 8.17 (d, J = 9.2 Hz, 1 H), 8.06 (d, J = 6.8 Hz, 1 H), 7.94 (d, J = 13.2 Hz, 1 H), 7.60 (d, J = 8.4 Hz, 2 H), 7.36 (d, J = 8.0 Hz, 2 H), 7.21 (d, J = 6.0 Hz, 1 H), 6.02 (d, J = 4.4 Hz, 1 H), 5.51 - 5.42 (m, 3 H), 5.07 (s, 2 H), 4.90 - 4.86 (m, 1 H), 4.59 - 4.57 (m, 2 H), 3.65 - 3.61 (m, 4 H), 3.06 - 2.96 (m, 2 H), 2.12 - 1.87 (m, 3 H), 1.86 (s, 3 H), 1.48 - 1.35 (m, 3 H), 1.28 (s, 2 H), 0.89 - 0.72 (m, 6 H).
실시예 65. 7-(4-((4-((S)-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. Tf2O (8.8 mL, 51.9 mmol)를 증류된 H2O (30 mL) 및 CH2Cl2 (45 mL)의 혼합물 중 NaN3 (16.9 g, 259.4 mmol)의 용액에 0℃에서 5분에 걸쳐 천천히 첨가하였다. 이를 2시간 동안 교반한 후, 유기 상을 분리하고, 수성부를 CH2Cl2 (40 mLx2)로 추출하였다. 트리플릴 아지드를 함유하는 유기 분획을 합하고, 포화 Na2CO3으로 1회 세척하고, H2O (90 mL) 및 MeOH (180 mL) 중 65-1 (2.3 g, 12.97 mmol), K2CO3 (2.69 g, 19.46 mmol) 및 CuSO4.5H2O (65 mg, 0.26 mmol)의 혼합물에 첨가하였다. 혼합물을 26℃에서 12시간 동안 교반한 후, 유기 용매를 감압 하에 제거하고, 수성 슬러리를 H2O (50 mL)로 희석하였다. 혼합물을 진한 HCl을 사용하여 pH = 6으로 산성화시킨 다음, 인산염 완충액 (0.2 M, pH 6.2, 50 mL)으로 희석하였다. 혼합물을 EtOAc (100 mL x 2)로 세척한 다음, 수성 상을 진한 HCl을 사용하여 pH = 2로 산성화시켰다. 혼합물을 EtOAc (200 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 65-2를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 2. DMF (10 mL) 중 65-2 (2.6 g, 12.97 mmol), 65-3 (1.5 g, 6.48 mmol) 및 Cu(MeCN)4PF6 (304 mg, 0.97mmol)의 혼합물을 50℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 65-4 (516 mg, 18%)를 수득하였다.
단계 3. DCM (30 mL) 중 65-4 (285 mg, 0.66 mmol), 65-5 (244 mg, 1.98 mmol) 및 EEDQ (490 mg, 1.98 mmol)의 혼합물을 24℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 65-6 (250 mg, 70.4%)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.10 (s, 1 H), 7.58 (s, 2 H), 7.45-7.20 (m, 7 H), 5.55-5.52 (m, 1 H), 5.10-5.05 (m, 2 H), 4.77-4.58 (m, 3 H), 3.22-3.21 (m, 2 H), 2.33-2.15 (m, 3 H), 1.49-1.47 (m, 2 H), 0.97 (s, 3 H), 0.90 (s, 3 H).
LCMS (ESI): m/z 538.3 [M+H+].
단계 4. DCM (10 mL) 중 65-6 (127 mg, 0.24 mmol), PNP (143 mg, 0.47 mmol) 및 DIPEA (92 mg, 0.71 mmol)의 혼합물을 50℃에서 12시간 동안 교반한 후, 용매를 제거하고, 잔류물을 DMF (10 mL) 중 DIPEA (93 mg, 0.72 mmol) 및 노르플록사신 (230 mg, 0.72 mmol)과 혼합하였다. 이를 24℃에서 4시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 65 (30 mg, 14.1%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.32 (s, 1 H), 10.63 (s, 1 H), 8.96 (s, 1 H), 8.08 (s, 1 H), 7.94 (d, J = 13.2 Hz, 1 H), 7.71 (d, J = 9.2 Hz, 1 H), 7.60 (d, J = 8.4 Hz, 2 H), 7.38-7.29 (m, 8 H), 7.21 (d, J = 7.6 Hz, 1 H), 6.02 (s, 1 H), 5.48-5.47 (m, 1 H), 5.42 (s, 2 H), 5.06 (s, 2 H), 5.02 (s, 2 H), 4.62-4.60 (m, 3 H), 3.61 (s, 4 H), 3.44 (s, 4 H), 3.02-2.99 (m, 2 H), 2.12-2.02 (m, 3 H), 1.40 (t, J = 6.8 Hz, 3 H), 1.27-1.24 (m, 2 H), 0.84 (d, J = 6.8 Hz, 3 H), 0.78 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 883.7 [M+H+].
실시예 66. 7-(4-((4-((S)-2-(4-((S)-(벤질옥시카르보닐아미노)(시클로프로필)메틸)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. H2O (50 mL) 중 66-1 (5.0 g, 43.43 mmol) 및 Na2CO3 (6.9 g, 65.15 mmol)의 혼합물에 CbzCl (8.89 g, 52.12 mmol)을 0℃에서 적가하였다. 반응 혼합물을 25℃에서 16시간 동안 교반한 후, 이를 EtOAc (30 mL x 2)로 세척하였다. 수성 상을 진한 HCl을 사용하여 pH 2로 산성화시키고, EtOAc (50 mL x 2)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 66-2 (11 g, 조 물질)를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.38-7.29 (m, 5 H), 5.13-5.08 (m, 2 H), 4.72-4.68 (m, 1 H), 1.12-1.09 (m, 1 H), 0.61-0.43 (m, 4 H).
단계 2. DCM (10 mL) 중 66-2 (500 mg, 2.006 mmol), N,O-디메틸히드록실아민 히드로클로라이드 (235 mg, 2.407 mmol) 및 Et3N (609 mg, 6.018 mmol)의 혼합물에 25℃에서 HATU (1.14 g, 3.009 mmol)를 첨가하였다. 이를 25℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 물 (10 mL)로 녹였다. 수성 층을 EtOAc (8 mL x 2)로 추출하였다. 유기 층을 포화 Na2CO3 용액 (10 mL), 1N HCl 용액 (10 mL)에 이어서 물 (10 mL)로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켰다. 조 물질을 실리카 겔 (PE/EtOAc = 2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 66-3 (400 mg, 68%)을 수득하였다.
LCMS (ESI): m/z 293.1 [M+H+].
단계 3. 톨루엔 중 DIBAL-H (1M, 18 mL, 18 mmol)를 -78℃에서 DCM (30 mL) 중 66-3 (3.5 g, 11.97 mmol)의 혼합물에 첨가하였다. 혼합물을 -78℃에서 3시간 동안 교반한 후, MeOH (5 mL)를 적가하였다. 혼합물을 25℃로 가온하였다. 용매를 제거하고, 이를 MeOH (25 mL) 중에 용해시키고, K2CO3 (3.31 g, 23.94 mmol) 및 66-4 (2.76 g, 14.36 mmol)를 0℃에서 첨가하였다. 혼합물을 25℃에서 16시간 동안 교반하였다. 용매를 제거한 후, 조 물질을 1N HCl 용액 (30 mL)으로 녹이고, EtOAc (20 mL x 3)으로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시키고, 실리카 겔 (PE/EtOAc = 5:1-2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 66-5 (1.5 g, 55%)를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.41-7.30 (m, 5 H), 5.12-5.05 (m, 3 H), 4.47 (m, 1 H), 2.24 (s, 1 H), 1.18-1.11 (m, 1 H), 0.56-0.47 (m, 4 H).
단계 4. Cu(CH3CN)4PF6 (366 mg, 0.981 mmol)을 DMF (10 mL) 중 66-6 (2.63 g, 13.08 mmol) 및 66-5 (1.5 g, 6.54 mmol)의 용액에 25℃에서 첨가하였다. 반응 혼합물을 N2 하에 50℃에서 2시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 66-7 (3.0 g, 53%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 8.01 (s, 1 H), 7.83-7.81 (m, 1 H), 7.37-7.14 (m, 5 H), 5.97 (br, 1 H), 5.40-5.38 (m, 1 H), 5.03-4.99 (m, 2 H), 4.32-4.28 (m, 1 H), 2.94 (s, 2 H), 2.17-2.07 (m, 2 H), 1.30-1.10 (m, 3 H), 0.50-0.26 (m, 4 H).
단계 5. DCM (15 mL) 중 66-7 (1.0 g, 2.32 mmol), 66-8 (571 mg, 4.64 mmol) 및 EEDQ (1.15 g, 4.64 mmol)의 용액을 25℃에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 66-9 (500 mg) 및 66-10 (112 mg)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.60 (s, 1 H), 8.10 (s, 1 H), 7.82 (d, J = 9.2 Hz, 1 H), 7.56-7.54 (m, 2 H), 7.36-7.25 (m, 7 H), 6.08-6.05 (m, 1 H), 5.51-5.43 (m, 3 H), 5.14 (t, J = 5.6 Hz, 1 H), 5.03 (s, 2 H), 4.44 (d, J = 5.6 Hz, 2 H), 4.31 (t, J = 8.4 Hz, 1 H), 3.04-2.97 (m, 2 H), 2.15-2.08 (m, 2 H), 1.30-1.23 (m, 3 H), 0.49-0.30 (m, 4 H).
LCMS (ESI): m/z 536.3 [M+H+].
1H NMR (400 MHz, DMSO-d6) δ 10.54 (s, 1 H), 8.09 (s, 1 H), 7.82-7.80 (m, 1 H), 7.56-7.54 (m, 2 H), 7.36-7.26 (m, 7 H), 6.03-6.01 (m, 1 H), 5.49-5.42 (m, 3 H), 5.13 (t, J = 5.6 Hz, 1 H), 5.03 (s, 2 H), 4.44 (d, J = 5.6 Hz, 2 H), 4.29 (t, J = 8.4 Hz, 1 H), 3.04-2.97 (m, 2 H), 2.14-2.05 (m, 2 H), 1.30-1.25 (m, 3 H), 0.49-0.30 (m, 4 H).
LCMS (ESI): m/z 536.4 [M+H+].
단계 6. DCM (2 mL) 중 66-9 (80 mg, 0.149 mmol)의 용액에 25℃에서 PNP 카르보네이트 (136 mg, 0.447 mmol) 및 DIPEA (77 mg, 0.596 mmol)를 첨가하였다. 혼합물을 환류 하에 20시간 동안 가열하였다. 용매를 제거하고, 잔류물을 DMF (2 mL) 중에 용해시키고, 노르플록사신 (72 mg, 0.224 mmol) 및 DIEA (96 mg, 0.745 mmol)를 25℃에서 첨가하고, 혼합물을 25℃에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 TLC (DCM/MeOH =10:1)에 의해 정제하여 실시예 66 (23 mg, 18%)을 수득하였다.
1H NMR (400 MHz, MDSO-d6) δ 15.33 (s, 1 H), 10.65 (s, 1 H), 8.96 (s, 1 H), 8.14 (s, 1 H), 8.09 (s, 1 H), 7.96-7.81 (m, 2 H), 7.62-7.60 (m, 2 H), 7.38-7.20 (m, 8 H), 6.04-6.00 (m, 1 H), 5.48-5.43 (m, 1 H), 5.07 (s, 2 H), 5.02 (s, 2 H), 4.59-4.57 (m, 2 H), 4.40-4.31 (m, 1 H), 3.61 (s, 4 H), 3.32 (s, 4 H), 3.03-2.99 (m, 2 H), 2.20-2.11 (m, 2 H), 1.40 (t, J = 7.2 Hz, 3 H), 1.30-1.23 (m, 3 H), 0.48-0.23 (m, 4 H).
LCMS (ESI): m/z 881.4 [M+H+].
실시예 67. 7-(4-((4-((S)-2-(4-((S)-1-(2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)아세트아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. DME (10 mL) 중 화합물 67-2 (75 mg, 1 mmol)의 용액에 물 (10 mL) 중 화합물 67-1 (310 mg, 1 mmol) 및 NaHCO3 (252 mg, 3 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반하였다. 혼합물을 EtOAc로 세척하고, 10% HCl을 사용하여 pH = 3으로 산성화시켰다. 생성된 현탁액을 EtOAc로 추출하였다. 합한 유기 층을 농축시켜 화합물 67-3 (270 mg, 불순물 함유)을 수득하였다.
단계 2. THF (10 mL) 중 화합물 67-3 (200 mg, 0.74 mmol) 및 화합물 67-4 (90 mg, 0.777 mmol)의 용액에 실온에서 DCC (161 mg, 0.777 mmol)를 첨가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반하였다. 이를 농축시키고, 여과물을 농축시켜 67-5 (200 mg, 수율: 74%)를 수득하였다.
단계 3. 화합물 67-5 (200 mg, 0.53 mmol), 화합물 67-6 (107 mg, 0.265 mmol)을 DMF (6 mL) 중에 용해시키고, 반응 혼합물을 실온에서 3시간 동안 교반하였다. 혼합물을 여과하고, 정제용 HPLC에 의해 정제하여 67-7 (25 mg, 수율: 6.3%)을 수득하였다.
단계 4. 건조 DMF (3 mL) 중 화합물 67-7 (25 mg, 0.038 mmol)의 용액에 실온에서 PNP 카르보네이트 (25 mg, 0.076 mmol) 및 DIPEA (15 mg, 0.114 mmol)를 첨가하였다. 혼합물을 실온에서 1.5시간 동안 교반하였다. 노르플록사신 (30 mg, 0.076 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 혼합물을 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 67 (20 mg, 수율: 48%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.802분, MS = 501.3[1/2M+1]
1H NMR 메탄올-d4 +CDCl3 400 MHz, δ 8.83 (s, 1 H), 7.99 (d, J = 13.2 Hz, 2 H), 7.59 (d, J = 6.8 Hz, 2 H), 7.35 (d, J = 8.0 Hz, 2 H), 7.11 (s, 1 H), 5.51 (s, 1 H), 5.12 (s, 2 H), 4.95 (s, 1 H), 4.47 (s, 2 H), 3.86 (s, 2 H), 3.71 (s, 4 H), 3.48 - 3.44 (m, 2 H), 3.31 (s, 4 H), 3.25 (s, 1 H), 3.15 (s, 1 H), 2.67 (s, 4 H), 2.26 - 2.20 (m, 5 H), 1.65 - 1.61 (m, 6 H), 1.58 - 1.52 (m, 1 H), 1.33 - 1.29 (m, 4 H), 0.95 (d, J = 6.8 Hz, 3 H), 0.88 (d, J = 6.4 Hz, 3 H).
실시예 68. 7-(4-((4-((S)-2-(4-((S)-1-(6-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)헥산아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 1,4-디옥산/H2O (10 mL/5 mL) 중 조 화합물 68-1 (500 mg, 1.24 mmol)의 용액에 디옥산 (10mL) 중 K2CO3 (428 mg, 3 mmol) 및 Fmoc-Cl (416 mg, 1.6 mmol)을 적가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 농축시키고, 칼럼 크로마토그래피 (DCM 중 15%-20% MeOH)에 의해 정제하여 화합물 68-2 (286 mg, 37%)를 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.709분, MS = 626.1[M+1]
1H NMR 메탄올-d4 400 MHz, δ 8.06 (s, 1H), 7.80 - 7.78 (d, J = 7.2 Hz, 2 H), 7.67 - 7.63 (t, J = 6.8 Hz, 2 H), 7.58 - 7.56 (d, J = 8.4 Hz, 2 H), 7.39 - 7.27 (m, 6 H), 5.6 - 5.5 (m, 1 H), 4.69 - 4.67 (d, J = 7.2 Hz, 1 H), 4.57 (s, 2 H), 4.40 - 4.36 (m, 2 H), 4.25 - 4.15 (m, 1 H), 3.3 - 3.2 (m, 1 H), 3.2 - 3.1 (m, 1 H), 2.35 - 2.15 (m, 3 H), 1.55 - 1.35 (m, 2 H), 0.98 - 0.97(d, J = 6.8 Hz, 3 H), 0.90 - 0.88(d, J = 6.8 Hz, 3 H).
단계 2. 건조 DMF (5 mL) 중 화합물 68-2 (200 mg, 0.31 mmol)의 용액에 실온에서 PNP 카르보네이트 (185 mg, 0.62 mmol) 및 DIPEA (0.5 mL, 3.0 mmol)를 첨가하고, 혼합물을 질소 하에 실온에서 1.5시간 동안 교반하였다. 노르플록사신 (197 mg, 0.62 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 이어서, 피페리딘 (0.1 mL, 1 mmol)을 첨가하였다. 30분 후, 혼합물을 정제용 HPLC에 의해 정제하여 화합물 68-4 (250 mg, 4-니트로페놀 함유)를 수득하였다. 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 3. 건조 DMF (2 mL) 중 화합물 68-4 (100 mg, 0.134 mmol)의 용액에 화합물 5 (50 mg, 0.162 mmol)를 첨가하였다. 혼합물을 23℃에서 2시간 동안 교반하였다. 혼합물을 정제용 HPLC에 의해 정제하여 실시예 68 (20 mg, 수율 16%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.803분, MS = 942.4 [M+1],471.8[1/2M+1]
1H NMR DMSO-d6 400 MHz, δ 15.3 (s, 1H), 10.60 (s, 1H), 8.94 (s, 1H), 8.1(d, 1H) 8.01 (s, 1H),7.94 - 7.90 (dd, J = 12.8 Hz, 1 H), 7.58 - 7.56 (d, J = 8.8 Hz, 2 H), 7.34 - 7.32 (d, J = 8.8 Hz, 2 H), 7.2 (d, 1 H), 6.97 (s, 2 H), 6.0 (m, 1H), 5.5 - 5.4 (m, 1H), 5.40 (s, 2H), 5.04 (s, 2H), 4.9 - 4.85 (m, 1H), 4.6 - 4.5 (m, 2H), 3.58 (s, 4H), 3.4 - 3.3(m, 6H), 3.1 - 2.9 (m, 2H), 2.2 - 2.0 (m, 5H), 1.6 - 1.4 (m, 7H), 1.3 - 1.2 (m, 4H), 0.80 - 0.78 (d, J = 6.8 Hz, 3 H), 0.76 - 0.74 (d, J = 6.8 Hz, 3 H).
실시예 69. 7-(4-((4-((S)-2-(4-((S)-1-(벤질옥시카르보닐아미노)펜틸)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 수성 Na2CO3 (16 g, 152.5 mmol) 및 69-1 (5 g, 38.1 mmol)의 혼합물에 THF (40 mL) 중 Cbz-OSu (11.4 g, 45.7 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 pH > 10으로 조정하고, EtOAc (100 mL x 2)로 세척하였다. 수성 층을 진한 HCl을 사용하여 pH < 1로 산성화시켰다. 용액을 EtOAc (200 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 69-2 (9.7 g, 95.9%)를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 2. DCM (100 mL) 중 69-2 (9.7 g, 36.6 mmol), N,O-디메틸히드록실아민 히드로클로라이드 (3.9 g, 40.2 mmol) 및 HATU (20.8 g, 54.8 mmol)의 혼합물에 Et3N (21 mL, 146.2 mmol)을 첨가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 조 물질을 물 (150 mL)로 녹이고, EtOAc (150 mL x 3)로 추출하였다. 유기 층을 포화 NaHCO3, 진한 HCl, 포화 NaCl로 세척하고, 농축시켰다. 잔류물을 실리카 겔 (PE: EtOAc = 2: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 69-3 (10.1 g, 89.6%)을 수득하였다.
단계 3. DIBAL-H (19.5 mL, Tol 중 1M)를 무수 CH2Cl2 (50 mL) 중 69-3 (4.0 g, 13.0 mmol)의 용액에 -78℃에서 적가하였다. 반응 혼합물을 -78℃에서 2시간 동안 교반한 후, 과량의 DIBAL을 무수 MeOH (15 mL)에 의해 켄칭하고, 혼합물을 실온으로 가온하였다. 이를 농축시켜 69-4 (3.2 g, 조 물질)를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 4. MeOH (60 mL) 중 69-4 (3.2 g, 13.0 mmol), 69-5 (3.0 g, 15.6 mmol) 및 K2CO3 (3.6 g, 26.0 mmol)의 혼합물을 실온에서 16시간 동안 교반한 후, 용매를 제거하고, 잔류물을 EtOAc (80 mL x 3)로 추출하였다. 유기 층을 염수 (60 mL)로 세척하고, 무수 Na2SO4 상에서 건조시키고, 농축시키고, 실리카 겔 (PE: EtOAc = 10: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 69-6 (1.9 g, 60.3%)을 수득하였다.
단계 5. Tf2O (3.3 mL, 19.6 mmol)를 0℃에서 H2O (30 mL) 및 CH2Cl2 (48 mL) 중 NaN3 (6.3 g, 97.8 mmol)의 용액에 천천히 첨가하였다. 이를 2시간 동안 교반한 후, 유기 상을 분리하고, 수성 상을 CH2Cl2 (24 mLx2)로 추출하였다. 트리플릴 아지드를 함유하는 유기 분획을 합하고, 포화 Na2CO3으로 1회 세척하고, 추가 정제 없이 사용하였다. CH2Cl2 중 트리플릴 아지드 용액을 H2O (54 mL) 및 MeOH (108 mL) 중 69-7 (1.71 g, 13.9 mmol), K2CO3 (2.03 g, 14.67 mmol) 및 CuSO4.5H2O (245 mg, 0.98 mmol)의 혼합물에 첨가하였다. 혼합물을 26℃에서 12시간 동안 교반한 후, 유기 용매를 감압 하에 제거하고, 수성 슬러리를 H2O (200 mL)로 희석하였다. 혼합물을 진한 HCl을 사용하여 pH 6으로 산성화시키고, 인산염 완충액 (0.2M, pH 6.2, 200 mL)으로 희석하고, EtOAc (300 mL x 2)로 세척하였다. 이어서, 수성 상을 진한 HCl을 사용하여 pH = 2로 산성화시켰다. 이를 (300 mL x 3)로 추출하고, 추출물을 Na2SO4 상에서 건조시키고, 농축시켜 69-8을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 6. DMF (5 mL) 중 69-8 (2.0 g, 9.78 mmol), 69-6 (1.2 g, 4.89 mmol) 및 Cu(CH3CN)4PF6 (273 mg, 0.73 mmol)의 혼합물을 50℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 69-9 (600 mg, 27.5%)를 수득하였다.
단계 7. DCM (15 mL) 중 69-9 (600 mg, 1.34 mmol), 69-10 (496 mg, 4.03 mmol) 및 EEDQ (996 mg, 4.03 mmol)의 혼합물을 23℃에서 4시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 69-11 (350 mg, 47.4%) 및 69-12 (23.1 mg)를 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.02 (s, 1 H), 7.54 (d, J = 6.8 Hz, 2 H), 7.34-7.25 (m, 7 H), 5.49-5.46 (m, 1 H), 5.08 (s, 2 H), 4.55 (s, 2 H), 3.37-3.33 (m, 1 H), 3.24-3.16 (m, 1 H), 2.24-1.80 (m, 3 H), 1.45-1.43 (m, 7 H), 1.41 (s, 3 H).
LCMS (ESI): m/z 552.1 [M+H+].
1H NMR (400 MHz, MeOD) δ 10.53 (s, 1 H), 8.03 (s, 1 H), 7.55 (d, J = 9.2 Hz, 1 H), 7.35 (d, J = 4.0 Hz, 2 H), 7.31-7.26 (m, 7 H), 6.04 (s, 1 H), 5.50-5.43 (m, 3 H), 5.12 -5.03 (m, 3 H), 4.77-4.73 (m, 1 H), 4.44 (d, J = 3.2 Hz, 2 H), 3.08-2.91 (m, 2 H), 2.24-2.16 (m, 2 H), 1.90-1.71 (m, 2 H), 1.35-1.20 (m, 6 H), 0.86-0.83 (m, 3 H).
LCMS (ESI): m/z 552.2 [M+H+].
단계 8. DCM (5 mL) 중 69-11 (100 mg, 0.18 mmol), PNP 카르보네이트 (109 mg, 0.36 mmol) 및 DIPEA (70 mg, 0.54 mmol)의 혼합물을 50℃에서 12시간 동안 교반하였다. 이를 농축시키고, DMF (5 mL) 중 DIPEA (70 mg, 0.54 mmol) 및 노르플록사신 (172 mg, 0.54 mmol)의 혼합물에 첨가하였다. 이를 23℃에서 4시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 69 (69.3 mg, 43%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.32 (s, 1 H), 10.63 (s, 1H), 8.96 (s, 1 H), 8.02 (s, 1 H), 7.94 (d, J =12.8 Hz, 1 H), 7.70 (d, J = 8.0 Hz, 1 H), 7.60 (d, J = 8.8 Hz, 2 H), 7.38-7.20 (m, 8 H), 6.03 (s, 1 H), 5.49-5.42 (m, 3 H), 5.07 (s, 2 H), 5.04 (d, J = 4.0 Hz, 2 H), 4.72-4.71 (m, 1 H), 4.58-4.57 (m, 2 H), 3.67 (s, 4 H), 3.61 (s, 4 H), 3.06-3.01 (m, 2 H), 2.12-2.07 (m, 2 H), 1.80-1.68 (m, 2 H), 1.42-1.38 (m, 3 H), 1.34 (s, 6 H), 0.84 (s, 3 H).
LCMS (ESI): m/z 897.4 [M+H+].
실시예 70. 7-(4-((4-((S)-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)-1H-1,2,3 트리아졸-1-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4,4a,8a-테트라히드로퀴놀린-3-카르복실산
단계 1. 물 (20 mL) 중 화합물 70-1 (3.0 g, 25.61 mmol)의 혼합물에 Na2CO3 (2.71 g, 25.61 mmol)을 첨가하였다. CbzCl (4.81 g, 28.17 mmol)을 첨가하고, 반응 혼합물을 28℃에서 16시간 동안 교반하였다. 혼합물을 여과하고, EtOAc (15 mL x 2)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 화합물 70-2 (5.9 g, 92%)를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 8.21-7.30 (m, 5 H), 5.86 (br, 1 H), 5.15 (s, 2 H), 4.37-4.34 (m, 1 H), 2.28-2.21 (m, 1 H), 1.01-0.84 (m, 6 H).
단계 2. DCM (60 mL) 중 화합물 70-2 (5.9 g, 23.48 mmol), N-메톡시메탄아민 히드로클로라이드 (2.52 g, 25.83 mmol) 및 Et3N (7.13 g, 70.44 mmol)의 용액에 28℃에서 HATU (13.4 g, 35.22 mmol)를 첨가하였다. 혼합물을 28℃에서 3시간 동안 교반한 후, 용매를 제거하고, 잔류물을 물 (30 mL) 중에 용해시켰다. 수성 층을 EtOAc (80 mL x 3)로 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켰다. 조 물질을 실리카 겔 (PE/EtOAc = 2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 70-3 (4.5 g, 65%)을 수득하였다.
LCMS (ESI): m/z 295.1 [M+H+].
단계 3. -78℃에서 DCM (8 mL) 중 화합물 70-3 (588 mg, 2.0 mmol)의 혼합물에 톨루엔 중 DIBAL-H (1M, 2.4 mL, 2.4 mmol)를 적가하였다. 혼합물을 -78℃에서 2시간 동안 교반한 후, MeOH (1 mL)를 적가하였다. 혼합물을 실온으로 가온되도록 하였다. 용매를 제거하고, 조 물질을 직접 후속 단계에 사용하였다.
MeOH (5 mL) 중 상기 조 물질의 용액에 K2CO3 (553 mg, 4.0 mmol) 및 화합물 70-4 (461 mg, 2.4 mmol)를 첨가하였다. 반응 혼합물을 26℃에서 8시간 동안 교반하였다. 용매를 제거하고, 잔류물을 실리카 겔 (PE/EtOAc = 20:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 70-5 (300 mg, 65.2%)를 수득하였다.
LCMS (ESI): m/z 232.1 [M+H+].
단계 4. 증류된 H2O (4.5 mL) 및 DCM (7.5 mL) 중 NaN3 (2.0 g, 30.76 mmol)의 혼합물에 Tf2O (1.57 g, 5.55 mmol)를 0℃에서 적가하였다. 혼합물을 0℃에서 3시간 동안 교반하였다. 수성 층을 DCM (4 mL x 2)으로 추출하고, 포화 Na2CO3 용액 (8 mL)으로 세척하였다. H2O (9 mL) 및 MeOH (18 mL) 중 화합물 70-6 (249 mg, 2.79 mmol), K2CO3 (578 mg, 4.19 mmol) 및 CuSO4 5H2O (7 mg, 27.9 umol)의 혼합물에 DCM 중 트리플릴 아지드 (15.5 mL)를 적가하였다. 혼합물을 26℃에서 밤새 교반한 후, 유기 용매를 감압 하에 제거하고, 수성 슬러리를 H2O (50 mL)로 희석하였다. 이를 진한 HCl을 사용하여 pH 6으로 산성화시키고, 인산염 완충액 (0.2 M, pH 6.2, 50 mL)으로 희석하고, EtOAc (50 mL x 2)로 추출하였다. 이어서, 수성 상을 진한 HCl을 사용하여 pH 2로 산성화시키고, EtOAc (80 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 증발시켜 70-7을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 5. DMF (3 mL) 중 화합물 70-7 (321 mg, 2.79 mmol) 및 화합물 70-5 (278 mg, 1.2 mmol)의 용액에 Cu(CH3CN)4PF6 (67 mg, 0.18 mmol)을 첨가하였다. 반응 혼합물을 50℃에서 N2 하에 2시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 실리카 겔 (DCM 중 2.5-5% MeOH) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 70-8 (90 mg, 22%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.65 (s, 1 H), 7.37-7.32 (m, 5 H), 5.05 (s, 2 H), 4.64 (s, 1 H), 3.35 (s, 4 H), 2.02 (s, 1 H), 0.85-0.67 (m, 6 H).
단계 6. DCM (15 mL) 중 화합물 70-8 (1.4 g, 4.04 mmol) 및 화합물 70-9 (1.49 g, 12.12 mmol)의 용액에 25℃에서 EEDQ (3.0 g, 12.12 mmol)를 첨가하였다. 반응 혼합물을 25℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 혼합물 (1.1 g)을 수득하였다. 2종의 이성질체를 SFC 분리에 의해 정제하여 70-10a (250 mg) 및 다른 거울상이성질체 70-10b (116 mg)를 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.03 (s, 1 H), 7.57-7.54 (m, 2 H), 7.35-7.28 (m, 7 H), 5.57 (q, J = 7.2 Hz, 1 H), 5.13-5.06 (m, 2 H), 4.72-4.65 (m, 1 H), 4.58 (s, 2 H), 2.21-2.17 (m, 1 H), 1.87 (d, J = 7.2 Hz, 3 H), 0.97 (d, J = 6.8 Hz, 3 H), 0.90 (d, J = 6.8 Hz, 3 H). LCMS (ESI): m/z 452.2 [M+H+].
단계 7. THF (3 mL) 중 70-10a (100 mg, 0.221 mmol)의 용액에 25℃에서 PNP 카르보네이트 (202 mg, 0.663 mmol) 및 DIPEA (114 mg, 0.884 mmol)를 첨가하였다. 혼합물을 환류 하에 24시간 동안 가열한 후, 용매를 제거하고, 잔류물을 실리카 겔 (DCM/MeOH = 20:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 중간체 (90 mg)를 수득하였다. DMF (2 mL) 중 노르플록사신 용액 (70 mg, 0.219 mmol)에 DIPEA (94 mg, 0.73 mmol)를 첨가하였다. 용액을 25℃에서 15분 동안 교반한 후, 상기 중간체 (90 mg, 0.219 mmol)를 첨가하였다. 혼합물을 25℃에서 2시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 TLC (DCM/MeOH = 10:1)에 의해 정제하여 실시예 70 (26.5 mg, 23%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.32 (s, 1 H), 10.61 (s, 1 H), 8.98 (s, 1 H), 8.07 (s, 1 H), 7.95-7.92 (m, 1 H), 7.71-7.58 (m, 3 H), 7.38-7.16 (m, 8 H), 5.52 (m, 1 H), 5.10-5.00 (m, 4 H), 4.63-4.52 (m, 3 H), 3.60 (s, 4 H), 3.30 (s, 4 H), 2.10-2.00 (m, 1 H), 1.75 (d, J = 7.6 Hz, 3 H), 1.42 (t, J = 7.6 Hz, 3 H), 0.88-0.75 (m, 6H). LCMS (ESI): m/z 797.6 [M+H+].
실시예 71. 7-(4-((4-((2S)-6-아미노-2-(4-(1-(벤질옥시카르보닐아미노)-2-(티오펜-2-일)에틸)-1H-1,2,3-트리아졸-1-일)헥산아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 무수 DCM (20 mL) 중 화합물 71-1 (500 mg, 1.84 mmol)의 혼합물에 Et3N (559 mg, 5.52 mmol) 및 HATU (1.049 g, 2.76 mmol)를 첨가하였다. 혼합물을 실온에서 15분 동안 교반한 다음, NHMe(OMe)HCl (269 mg, 2.76 mmol)을 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 혼합물을 EtOAc (30 mLx 3) 및 물 (30 mL)로 추출하고, 합한 유기 층을 건조시키고, 농축시키고, 실리카 겔 (PE: EtOAc = 2: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 71-2 (500 mg, 86.4%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.34 (d, J = 4.8 Hz, 1H), 7.22 (d, J = 9.2 Hz, 1H), 6.94 - 6.89 (m, 2H), 4.56 (s, 1H), 3.70 (s, 3H), 3.11 (s, 3H), 3.09 - 2.95 (m, 2H), 1.35 (s, 9H).
단계 2. 화합물 71-2 (500 mg, 1.59 mmol)를 무수 CH2Cl2 (5 mL) 중에 용해시키고, 드라이아이스/아세톤 조에서 -78℃로 냉각시켰다. DIBAL-H (4.8 mL, 4.77 mmol, 톨루엔 중 1.0 M)를 적가하고, 생성된 용액을 -78℃에서 3시간 동안 교반하였다. 과량의 히드라이드를 MeOH (5 mL)로 켄칭하고, 생성된 용액을 실온으로 가온하였다. 용액을 증발시켜 추가 정제 없이 화합물 71-3을 수득하였다.
단계 3. MeOH (20 mL) 중 조 화합물 71-3 (406 mg, 1.59 mmol), 화합물 71-4 (611 mg, 3.18 mmol)의 용액에 K2CO3 (659 mg, 4.77 mmol)을 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 혼합물을 진공 하에 농축시키고, 실리카 겔 (PE: EtOAc = 5: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 71-5 (250 mg, 62.3%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.45 (d, J = 8.4 Hz, 1H), 7.35 (dd, J = 4.8, 1.2 Hz, 1H), 6.96 - 6.92 (m, 2H), 4.35 - 4.31 (m, 1H), 3.19 (d, J = 1.2 Hz, 1H), 3.10 - 3.08 (m, 2H), 1.36 (s, 9H).
단계 4. DCM (5 mL) 중 화합물 71-5 (250 mg, 0.99 mmol)의 용액에 HCl-EtOAc (5 mL, 4.0 M, 20.00 mmol)를 0℃에서 적가하였다. 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 혼합물을 진공 하에 25℃에서 농축시켜 71-6을 HCl 염 (180 mg, 96.9%)으로서 수득하였다.
단계 5. THF (2 mL) 중 Cbz-Cl (287 mg, 1.68 mmol)을 포화 수성 NaHCO3 용액 (2 mL) 중 화합물 71-6 (170 mg, 0.91 mmol)의 용액에 적가하였다. 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 혼합물을 EtOAc (10 mL x 3) 및 H2O (10 mL)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켰다. 잔류물을 실리카 겔 (PE: EtOAc = 5:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 71-7 (250 mg, 96.3%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.93 (d, J = 8.4 Hz, 1H), 7.38 - 7.31 (m, 6H), 6.96 - 6.93 (m, 2H), 5.02 (s, 2H), 4.45 - 4.39 (m, 1H), 3.26 (d, J = 2.0 Hz, 1H), 3.13 (dd, J = 6.8, 2.0 Hz, 2H).
단계 6. DMF (5 mL) 중 화합물 71-7 (280 mg, 0.98 mmol) 및 화합물 71-8 (400 mg, 1.47 mmol)의 용액에 Cu(CH3CN)4PF6 (37 mg, 0.1 mmol)을 첨가하였다. 반응 혼합물을 50℃에서 2시간 동안 교반하여 71-9을 수득하였으며, 이를 직접 후속 단계에 사용하였다.
단계 7. DMF (5 mL) 중 조 화합물 71- 9 (547 mg, 0.98 mmol)의 혼합물에 EEDQ (484 mg, 1.96 mmol) 및 화합물 71-10 (181 mg, 1.47 mmol)을 첨가하였다. 반응 혼합물을 N2 하에 실온에서 밤새 교반하였다. 혼합물을 정제용 HPLC에 의해 정제하여 71-11 (100 mg, 15.4%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.54 (s, 1H), 8.11 - 8.06 (m, 1H), 7.90 (t, J = 8.4 Hz, 1H), 7.53 (d, J = 8.8 Hz, 2H), 7.36 - 7.26 (m, 8H), 6.92 - 6.89 (m, 1H), 6.85 (d, J = 3.2 Hz, 1H), 6.79 (t, J = 4.8 Hz, 1H), 5.44 - 5.40 (m, 1H), 5.14 (t, J = 6.0 Hz, 1H), 5.06 - 4.93 (m, 3H), 4.44 (d, J = 5.6 Hz, 2H), 3.43 - 3.38 (m, 1H), 3.01 - 3.24 (m, 1H), 2.90 - 2.85 (m, 2H), 2.12 - 2.07 (m, 2H), 1.43 - 1.39 (m, 2H), 1.37 (s, 9H), 1.18 - 1.10 (m, 2H).
단계 8. 무수 DMF (2 mL) 중 화합물 71-11 (100 mg, 0.15 mmol)의 용액에 DIPEA (116 mg, 0.90 mmol), PNP 카르보네이트 (91 mg, 0.30 mmol)를 0℃에서 첨가하였다. 반응 혼합물을 0℃에서 2시간 동안 교반한 후, 노르플록사신을 첨가하였다. 혼합물을 ℃에서 추가로 1시간 동안 교반하고, 이를 정제용 HPLC에 의해 정제하여 화합물 71-12 (120 mg, 79.4%)를 수득하였다.
단계 9. 무수 DCM (2.5 mL) 중 화합물 71-12 (100 mg, 0.10 mmol)의 혼합물에 TFA (0.5 mL)를 첨가하였다. 반응 혼합물을 0℃에서 1시간 동안 교반하였다. 이어서, 혼합물을 DMF로 희석하고, NH3H2O 적가를 사용하여 pH 8로 조정하였다. 생성된 혼합물을 정제용 HPLC에 의해 정제하여 실시예 71 (63 mg, 69.4%)을 수득하였다.
LCMS (ESI): RT = 0.830분, M/2+H+ = 454.8. 방법 = 5-95 /2분.
1H NMR (400 MHz, DMSO-d6) δ 10.84 (bs, 1H), 8.96 (s, 1H), 8.46 (s, 1H), 8.13 - 8.09 (m, 1H), 7.96 - 7.89 (m, 2H), 7.61 (d, J = 8.8 Hz, 2H), 7.38 - 7.30 (m, 8H), 7.21 (d, J = 7.2 Hz, 1H), 6.92 - 6.90 (m, 1H), 6.86 (d, J = 2.0 Hz, 1H), 5.49 - 5.45 (m, 1H), 5.08 - 4.92 (m, 5H), 4.60 - 4.55 (m, 2H), 3.61 (s, 4H), 3.34 - 3.26 (m, 6H), 2.70 - 2.66 (m, 2H), 2.19 - 2.08 (m, 2H), 1.57 - 1.49 (m, 2H), 1.42 - 1.37 (m, 3H), 1.23 - 1.16 (m, 2H).
실시예 72. 7-(4-((4-((S)-6-아미노-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2-페닐에틸)-1H-1,2,3-트리아졸-1-일)헥산아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. 물 (300 mL) 중 화합물 72-1 (14.7 g, 0.1 mol)의 용액에 Cu2(OH)2CO3 (38 g, 0.1 mol)을 첨가하였다. 이를 환류 하에 1시간 동안 가열하였다. 고체를 여과해내고, 여과물의 pH를 Na2CO3의 첨가에 의해 9.0으로 조정하였다. pH를 Na2CO3의 첨가에 의해 9.0으로 유지하면서, Alloc-Cl (14.4 g, 0.12 mmol)을 0℃에서 적가하였다. 혼합물을 실온에서 12시간 동안 교반하였다. 청색 고체를 여과에 의해 수집하고, 물 (300 mL) 중에 재용해시켰다. 티오아세트아미드 (20 mmol)를 첨가하고, 용액을 50℃에서 3시간 동안 교반하였다. 용액을 HCl을 사용하여 pH 2.0으로 산성화시키고, 10분 동안 끓였다. CuS를 여과해내고, 용액을 100 mL로 농축시키고, 72-2를 여과에 의해 수집하였다.
1H NMR (400 MHz, MeOD) δ 5.94-5.88 (m, 1 H), 5.30-5.26 (m, 1 H), 5.18-5.15 (m, 1 H), 4.55-4.93 (m, 1 H), 3.50 (brs, 1 H), 3.13-3.09 (m, 2 H), 2.00-1.70 (m, 2 H), 1.54-1.41 (m, 4 H).
단계 2. H2O (5 mL) 및 DCM (7.5 mL)의 혼합물 중 NaN3 (1.78 g, 27.45 mmol)의 용액에 Tf2O (0.93 mL, 5.55 mmol)를 첨가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 이를 DCM (50 mLx3)으로 추출하였다. 유기 층을 수성 Na2CO3으로 세척하고, 10 mL로 농축시켰다. 화합물 72-2 (640 mg, 2.8 mmol)를 첨가하고, 이어서 K2CO3 (577 mg, 4.19 mmol), CuSO4 (7 mg, 0.028 mmol), H2O (9 mL) 및 MeOH (18 mL)를 첨가하였다. 혼합물을 실온에서 12시간 동안 교반하였다. 유기 용매를 증발시키고, 용액을 물로 희석하고, pH를 HCl을 사용하여 6.0으로 조정하고, 인산염 완충액 (0.25 M, pH 6.2, 50 mL)으로 희석하였다. 혼합물을 EtOAc (50 mL x 3)로 추출하였다. 유기 층을 건조시켜 화합물 72-3을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 3. DMF (5 mL) 중 72-3 (560 mg, 2 mmol)의 용액에 72-4 (1.12 g, 4.0 mmol) 및 촉매량 Cu(CH3CN)4PF6을 첨가하였다. 혼합물을 N2 하에 50℃에서 3시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 72-5를 수득하였다.
LCMS (ESI): m/z 536.2 [M+H+]
단계 4. DCM (10 mL) 중 72-5 (480 mg, 1.0 mmol)의 용액에 EEDQ (247 mg, 1.0 mmol) 및 72-6 (123 g, 1.0 mmol)을 첨가하고, 혼합물을 N2 하에 0℃에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC 및 SFC 분리에 의해 정제하여 72-7 및 72-8을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.91 (s, 1 H), 7.55-7.52 (m, 2 H), 7.33-7.15 (m, 12 H), 5.89-5.87 (m, 1 H), 5.42-5.38 (m, 1 H), 5.28-5.23 (m, 1 H), 5.15-5.02 (m, 3 H), 4.58 (s, 2 H), 4.51-4.47 (m, 2 H), 3.31-3.05 (m, 4 H), 2.20-2.15 (m, 2 H), 1.53-1.50 (m, 2 H), 1.31-1.21 (m, 2 H). LCMS (ESI): m/z 641.1 [M+H+].
1H NMR (400 MHz, CDCl3) δ 7.95 (s, 1 H), 7.56 (d, J = 8.4 Hz, 2 H), 7.35-7.17 (m, 12 H), 5.95-5.88 (m, 1 H), 5.45-5.41 (m, 1 H), 5.30-5.26 (m, 1 H), 5.18-5.03 (m, 3 H), 4.58 (s, 2 H), 4.51-4.50 (m, 2 H), 3.31-3.23 (m, 1 H), 3.15-3.01 (m, 3 H), 2.23-2.15 (m, 2 H), 1.56-1.53 (m, 2 H), 1.32-1.22 (m, 2 H). LCMS: m/z 641.1 [M+H+].
단계 5. 건조 DCM (30 mL) 중 72-7 (59 mg, 0.1 mmol)의 용액에 PNP 카르보네이트 (62 mg, 0.2 mmol) 및 DIPEA (1 mL)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (5 mL) 중에 용해시켰다. DIPEA (0.2 mL) 및 노르플록사신 (65 mg, 0.2 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 칼럼에 의해 정제하였다. 건조 THF (10 mL) 중 중간체에 Pd(PPh3)4 (116 mg, 0.1 mmol)를 첨가하였다. 혼합물을 N2 하에 실온에서 12시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 실리카 겔 상에서 칼럼에 의해 정제하여 실시예 72를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 8.86 (s, 1 H), 8.47 (s, 1 H), 8.01-7.93 (m, 2 H), 7.59-7.57 (m, 2 H), 7.39-7.37 (m, 2 H), 7.27-7.14 (m, 11 H), 5.41 (s, 1 H), 5.14 (s, 2 H), 5.09-4.92 (m, 3 H), 4.59-4.50 (m, 2 H), 3.72-3.71 (m, 4 H), 3.30 (s, 4 H), 3.21-3.19 (m, 2 H), 2.89-2.85 (m, 2 H), 2.25-2.23 (m, 2 H), 1.69-1.67 (m, 2 H), 1.52-1.49 (m, 3 H), 1.40-1.20 (m, 2 H). LCMS (ESI): m/z 902.5 [M+H+].
실시예 73. 7-(4-((4-((S)-2-(4-((S)-2-(벤질옥시카르보닐아미노)-3-메틸부탄-2-일)-1H-1,2,3-트리아졸-1-일)프로판아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4,4a,8a-테트라히드로퀴놀린-3-카르복실산
단계 1. 수성 Na2CO3 (82 g, 0.78 mol) 및 화합물 73-1 (20 g, 0.19 mol)의 혼합물에 THF (150 mL) 중 Cbz-OSu (57 g, 0.23 mol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 pH > 10으로 조정하고, 용액을 EtOAc (400 mL x 2)로 추출하였다. 수성 층을 진한 HCl을 사용하여 pH < 1로 산성화시키고, 용액을 EtOAc (500 mL x 2)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 화합물 73-2 (45 g, 0.19 mol)를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 2. DCM (200 mL) 중 화합물 73-2 (20 g, 84.3 mmol), N,O-디메틸히드록실아민 히드로클로라이드 (8.9 g, 92.7 mmol) 및 HATU (48.1 g, 126.4 mmol)의 혼합물에 Et3N (48.7 mL, 337.2 mmol)을 첨가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 물 (300 mL)로 녹였다. 수성 층을 EtOAc (300 mL x 3)로 추출하였다. 유기 층을 포화 NaHCO3 (100 mL), 진한 HCl (100 mL), 포화 NaCl (100 mL)로 세척하였다. 용매를 제거하고, 잔류물을 실리카 겔 (PE: EtOAc = 2: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 73-4 (12.9 g, 46.0 mmol)를 수득하였다.
단계 3. DIBAL (17.8 mL, Tol 중 1M)을 무수 CH2Cl2 (100 mL) 중 화합물 73-4 (4.15 g, 14.8 mmol)의 용액에 -78℃에서 적가하였다. 생성된 용액을 -78℃에서 2시간 동안 교반하고, 과량의 DIBAL을 무수 MeOH (5 mL)로 켄칭하고, 생성된 용액을 실온으로 가온하였다. 용액을 농축시켜 화합물 73-5 (3.27 g, 14.8mmol)를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 4. MeOH (60 mL) 중 화합물 75-5 (3.27 g, 14.8 mmol), 73-6 (2.96 g, 17.8 mmol) 및 K2CO3 (4.1 g, 29.7 mmol)의 혼합물을 실온에서 16시간 동안 교반한 후, 용매를 감압 하에 제거하고, 조 잔류물을 EtOAc (200 mL)와 물 (100 mL) 사이에 분배하였다. 유기 층을 염수로 세척하고, 무수 Na2SO4 상에서 건조시켰다. 용매를 제거한 후, 잔류물을 실리카 겔 (PE: EtOAc = 10: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 73-7 (606 mg, 2.79 mmol)을 수득하였다.
단계 5. 증류된 H2O (10 mL) 및 CH2Cl2 (16 mL) 중 NaN3 (3.2 g, 49.3mmol)의 혼합물에 Tf2O (1.7 mL, 9.9 mmol)를 0℃에서 5분에 걸쳐 천천히 첨가하였다. 이를 2시간 동안 교반한 후, 유기 상을 분리하고, 수성 상을 CH2Cl2 (8 mL x 2)로 추출하였다. 트리플릴 아지드를 함유하는 유기 분획을 포화 Na2CO3으로 1회 세척하고, 증류된 H2O (18 mL) 및 MeOH (36 mL) 중 화합물 73-8 (0.86 g, 4.93 mmol), K2CO3 (1.02 g, 7.40 mmol) 및 CuSO4.5H2O (25 mg, 0.099 mmol)의 혼합물에 첨가하였다. 혼합물을 26℃에서 12시간 동안 교반한 후, 유기 용매를 감압 하에 제거하고, 수성 슬러리를 H2O (50 mL)로 희석하고, 진한 HCl을 사용하여 pH 6으로 산성화시키고, 0.2M pH 6.2 인산염 완충액 (50 mL)으로 희석하였다. 이를 EtOAc (100 mL x 2)로 세척한 다음, 수성 상을 진한 HCl을 사용하여 pH 2로 산성화시켰다. 이를 EtOAc (200 mL x 3)로 추출하고, 합한 층을 Na2SO4 상에서 건조시키고, 농축시키고, 추가 정제 없이 후속 단계에 사용하였다.
단계 6. DMF (5 mL) 중 화합물 73-9 (0.99 g, 4.93 mmol), 화합물 73-7 (0.54 g, 2.46 mmol) 및 Cu(CH3CN)2PF6 (115 mg, 0.37 mmol)의 혼합물을 50℃에서 2시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 화합물 73-10 (250 mg, 23%)을 수득하였다.
단계 7. DCM (10 mL) 중 화합물 73-10 (199 mg, 0.55 mmol), 화합물 73-11 (176 mg, 1.43 mmol) 및 EEDQ (353 mg, 1.43 mmol)의 혼합물을 24℃에서 2시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 73-12 (100 mg, 39.1%)를 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.98 (s, 1 H), 7.54 (d, J = 8.4 Hz, 2 H), 7.33-7.31 (m, 6 H), 7.10 (s, 1 H), 5.55-5.49 (m, 1 H), 4.98 (s, 2 H),4.55 (s, 3 H), 2.35 (s, 1 H), 1.84 (d, J = 6.4 Hz, 3 H), 1.69 (s, 3 H) ,0.94 (d, J = 6.8 Hz, 3 H), 0.79 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 465.9 [M+H+].
단계 8. DCM (5 mL) 중 73-12 (150 mg, 0.29 mmol), PNP (173 mg, 0.57 mmol) 및 DIPEA (111 mg, 0.86 mmol)의 혼합물을 50℃에서 12시간 동안 교반하였다. 용매를 제거하고, 잔류물을 추가 정제 없이 후속 단계에 사용하였다. DMF (5 mL) 중 혼합물 (200 mg, 0.29 mmol), DIPEA (112 mg, 0.87 mmol) 및 노르플록사신 (316 mg, 0.87 mmol)을 25℃에서 4시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 73 (38.9 mg, 14.8%)을 수득하였다.
1H NMR (400 MHz, CDCl3) δ 8.69 (s, 1 H), 8.11 (d, J = 12.8 Hz, 1 H), 7.94 (s, 1 H), 7.59 (s, 1 H), 7.50 (d, J = 8.0 Hz, 2 H), 7.32-7.27 (m, 6 H), 6.82 (d, J = 6.4 Hz, 1 H), 5.45 (s, 1 H), 5.38-5.37 (m, 1 H), 5.10 (s, 2 H) ,4.97 (s, 2 H), 4.34-4.29 (m, 2 H), 3.71 (d, J = 2.4 Hz, 4 H), 3.25 (s, 4 H), 2.52-2.46 (m, 1 H), 1.94-1.91 (m, 3 H), 1.74 (s, 3 H) ,1.58-1.56 (m, 3 H), 0.93 (d, J = 7.2 Hz, 3 H), 0.82 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 811.2 [M+H+].
실시예 74. 7-(4-((4-((S)-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2-(4-플루오로페닐)에틸)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4,4a,8a-테트라히드로퀴놀린-3-카르복실산.
단계 1. Tf2O (3.15 mL, 18.4mmol)를 빙조에서 H2O (18 mL) 및 DCM (30 mL) 중 NaN3 (5.93 g, 91.3 mmol)의 용액에 교반과 함께 5분에 걸쳐 천천히 첨가하였다. 이를 0℃에서 2시간 동안 교반한 후, 유기 상을 분리하였다. 수성부를 DCM (30 mL x 2)으로 추출하였다. 트리플릴 아지드를 함유하는 유기 분획을 합하고, 포화 Na2CO3으로 1회 세척하고, 추가 정제 없이 사용하였다. 화합물 74-1 (1.6 g, 9.14 mmol), K2CO3 (1.90 g, 13.7 mmol) 및 CuSO4 .5H2O (46 mg, 0.183 mmol)를 H2O (33 mL) 및 MeOH (66 mL) 중에서 혼합하였다. DCM 중 트리플릴 아지드를 첨가하고, 혼합물을 20℃에서 12시간 동안 교반하였다. 유기 용매를 감압 하에 제거하고, 수성 슬러리를 H2O (60 mL)로 희석하고, 진한 HCl을 사용하여 pH 6으로 산성화시키고, 0.2 M pH 6.2 인산염 완충액 (60 mL)으로 희석하였다. 이를 EtOAc (150 mLx2)로 추출하여 술폰아미드 부산물을 제거하였다. 이어서, 수성 상을 진한 HCl을 사용하여 pH 2로 산성화시켰다. 이를 EtOAc (200 mL x 3)로 추출하고, 유기 층을 합하고, Na2SO4 상에서 건조시키고, 증발시켜 74-2를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 2. DMF (10 mL) 중 74-2 (1.84 g, 9.14 mmol), 74-3 (1.36 g, 4.57 mmol) 및 Cu(CN)4PF6 (213 mg, 0.687 mmol)의 혼합물을 50℃에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 74-4 (470 mg, 20.6%)를 수득하였다.
LCMS (ESI): m/z 499.2 [M+H+].
단계 3. DCM (10 mL) 중 74-4 (300 mg, 0.602 mmol), 74-5 (148 mg, 1.20 mmol) 및 EEDQ (294 mg, 1.20 mmol)의 혼합물을 20℃에서 10시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC 및 SFC에 의해 정제하여 74-6 (160 mg, 44.1%) 및 74-7 (95 mg, 26.2%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.5 (s, 1 H), 8.07 (s, 1 H), 7.80 (d, J = 9.2 Hz, 1 H), 7.53 (d, J = 6.8 Hz, 2 H), 7.51-7.18 (m, 8 H), 7.05-7.00 (m, 2 H), 6.03-6.00 (m, 1 H), 5.47-5.41 (m, 3 H), 5.12-5.09 (m, 1 H), 4.99-4.88 (m, 3 H) 4.42 (d, J = 5.6 Hz, 2 H), 3.17-2.92 (m, 4 H) ,2.14-2.05 (m, 2 H), 1.28-1.22 (m, 2 H).
LCMS (ESI): m/z 604.1 [M+H+].
1H NMR (400 MHz, DMSO-d6) δ 10.56 (s, 1 H), 8.03 (s, 1 H), 7.81 (d, J = 9.2 Hz, 1 H), 7.51 (d, J = 6.8 Hz, 2 H), 7.28-7.18 (m, 8 H), 7.04-7.00 (m, 2 H), 6.06-6.03 (m, 1 H), 5.49-5.41 (m, 3 H), 5.13-5.10 (m, 1 H), 4.99-4.87 (m, 3 H) 4.42 (d, J = 5.6 Hz, 2 H), 3.18-2.92 (m, 4 H) ,2.13-2.02 (m, 2 H), 1.24-1.23 (m, 2 H).
LCMS (ESI): m/z 604.1 [M+H+].
단계 4. DCM (5 mL) 중 74-6 (50 mg, 0.082 mmol), PNP (53 mg, 0.166 mmol) 및 DIPEA (32 mg, 0.246 mmol)의 혼합물을 50℃에서 12시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 추가 정제 없이 사용하였다. DMF (5 mL) 중 상기 조 생성물 (110 mg, 조 물질, 0.082 mmol), DIPEA (32 mg, 0.246 mmol) 및 노르플록사신 (51 mg, 0.166 mmol)의 혼합물을 20℃에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 74 (25 mg, 32.1%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.64-15.33 (m, 1 H), 10.67 (s, 1 H), 8.96 (s, 1 H), 8.21-7.03 (m, 17 H), 6.08 (s, 1 H), 5.47 (s, 3 H), 5.08 (s, 2 H), 5.01-4.91 (m, 3 H), 4.58 (s, 2 H), 3.61 (s, 4 H), 3.31 (s, 4 H), 3.20-2.96 (m, 4 H), 2.12 (s, 2 H), 1.41-1.24 (m, 5 H).
LCMS (ESI): m/z 949.1 [M+H+], 475.3 [M/2+H+].
실시예 75. 7-(4-((4-((S)-2-(4-((S)-1-아미노-3-메틸부틸)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. THF (60 mL) 중 Cbz-HOSu (22.8 g, 91.4 mmol)를 물 (60 mL) 및 THF (30 mL)의 혼합물 중 75-1 (10.0 g, 76.2 mmol)의 혼합물에 15분에 걸쳐 적가하였다. 혼합물을 Na2CO3 (24.2 g, 228.6 mmol)으로 처리하였다. 반응 혼합물을 25℃에서 16시간 동안 교반한 후, 용매를 제거하고, 잔류물을 EtOAc (150 mL x 3)로 추출하였다. 수성 상을 진한 HCl을 사용하여 pH = 2로 산성화시키고, EtOAc (60 mLx3)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 감압 하에 농축시켜 75-2 (21.0 g 조 물질)를 수득하였다.
LCMS (ESI): m/z 288.1 [M+Na+].
단계 2. DCM (150 mL) 중 75-2 (5.0 g, 18.85 mmol), N,O-디메틸히드록실아민 히드로클로라이드 (2.2 g, 22.62 mmol) 및 Et3N (5.7 g, 56.55 mmol)의 용액에 25℃에서 HATU (10.8 g, 28.28 mmol)를 첨가하였다. 혼합물을 25℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 물 (80 mL)로 녹였다. 수성 층을 EtOAc (80 mL x 2)로 추출하였다. 유기 층을 2N HCl 용액 (80 mL)으로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 농축시켰다. 조 물질을 실리카 겔 (PE/EtOAc = 2:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 75-3 (4.1 g, 71%)을 수득하였다.
LCMS (ESI): m/z 309.2 [M+H+].
단계 3. 톨루엔 중 DIBAL-H (1M, 16 mL, 16 mmol)를 DCM (25 mL) 중 75-3 (4.1 g, 13.3 mmol)의 혼합물에 -78℃에서 적가하였다. 혼합물을 -78℃에서 2시간 동안 교반한 후, MeOH (1 mL)를 적가하였다. 혼합물을 25℃로 가온하고, 용매를 제거하고, MeOH (40 mL) 중에 용해시켰다. 이 용액에 K2CO3 (3.68 g, 26.6 mmol) 및 75-4 (3.07 g, 16.0 mmol)를 0℃에서 첨가하였다. 용액을 25℃에서 16시간 동안 교반한 후, 용매를 제거하고, 조 물질을 1N HCl 용액 (30 mL)으로 녹이고, EtOAc (360 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 진공 하에 농축시켰다. 조 물질을 실리카 겔 (PE/EtOAc = 20:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 75-5 (1.9 g, 58%)를 수득하였다.
LCMS (ESI): m/z 246.1 [M+H+].
단계 4. Cu(CH3CN)4PF6 (432 mg, 1.16 mmol)을 25℃에서 DMF (15 mL) 중 75-6 (3.11 g, 15.48 mmol) 및 화합물 5 (1.9 g, 7.74 mmol)의 용액에 첨가하였다. 반응 혼합물을 N2 하에 50℃에서 2시간 동안 가열한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 75-7 (2.1 g, 61%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.95 (s, 1 H), 7.69 (d, J = 8.8 Hz, 1 H), 7.36-7.29 (m, 5 H), 5.96 (br, 1 H), 5.38-5.35 (m, 1 H), 5.07-4.99 (m, 2 H), 4.82-4.77 (m, 1 H), 2.94 (s, 2 H), 2.16-2.06 (m, 2 H), 1.68-1.56 (m, 3 H), 1.28-1.05 (m, 2 H), 0.92-0.80 (m, 6 H).
단계 5. DCM (10 mL) 중 75-7 (500 mg, 1.12 mmol), 75-8 (414 mg, 3.36 mmol) 및 EEDQ (831 mg, 3.36 mmol)의 혼합물을 25℃에서 2시간 동안 교반하였다. 용매를 제거하고, 잔류물을 실리카 겔 (DCM/MeOH = 5:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 75-9 (350 mg, 57%)를 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.02 (s, 1 H), 7.56-7.54 (m, 2 H), 7.33-7.27 (m, 7 H), 5.50-5.46 (m, 1 H), 5.07 (s, 2 H), 4.95-4.91 (m, 1 H), 4.55 (s, 2 H), 3.25-3.07 (m, 2 H), 2.25-2.21 (m, 2 H), 1.77-1.64 (m, 3 H), 1.44-1.40 (m, 2 H), 0.96-0.95 (m, 6 H).
LCMS (ESI): m/z 552.2 [M+H+].
단계 6. THF (3 mL) 중 75-9 (120 mg, 0.218 mmol)의 용액에 25℃에서 PNP 카르보네이트 (199 mg, 0.654 mmol) 및 DIPEA (113 mg, 0.872 mmol)를 첨가하였다. 혼합물을 50℃에서 18시간 동안 가열한 후, 용매를 제거하고, 잔류물을 DMF (3 mL) 중에 용해시켰다. 노르플록사신 (104 mg, 0.327 mmol) 및 DIPEA (141 mg, 1.09 mmol)를 첨가하고, 혼합물을 25℃에서 6시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 75 (90 mg, 46%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.34 (s, 1 H), 10.64 (s, 1 H), 8.97 (s, 1 H), 8.13 (s, 1 H), 8.04 (s, 1 H), 7.97-7.93 (m, 1 H), 7.73-7.70 (m, 1 H), 7.61-7.59 (m, 2 H), 7.38-7.20 (m, 8 H), 6.03 (m, 1 H), 5.47-5.43 (m, 1 H), 5.07-5.03 (m, 4 H), 4.82-4.74 (m, 1 H), 4.59-4.57 (m, 2 H), 3.61 (s, 4 H), 3.34 (s, 4 H), 2.90-3.01 (m, 2 H), 2.10-2.07 (m, 2 H), 1.62-1.56 (m, 3 H), 1.42-1.38 (m, 3 H), 1.27 (m, 2 H), 0.90-0.89 (m, 6 H).
LCMS (ESI): m/z 897.4 [M+H+].
실시예 76. 7-(4-((4-((S)-2-(4-((S)-1-((S)-2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)-4-메틸펜탄아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
실시예 76을 실시예 57의 합성으로부터의 중간체로 실시예 57과 같은 절차를 사용하여 제조하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.828분, MS = 529.4[1/2M+1]
1H NMR 메탄올-d4 400 MHz, δ 8.89 (s, 1 H), 8.09 (s, 1 H), 8.00 (d, J = 13.2 Hz, 1 H), 7.62 (d, J = 8 Hz, 2 H), 7.38 (d, J = 8 Hz, 2 H), 7.20 (s, 1 H), 5.51 (d, J = 5.2 Hz, 1 H), 5.15 (s, 2 H), 4.96 (d, J = 6.8 Hz, 1 H), 4.88 (s, 2 H), 4.60 (s, 4 H), 3.73 (s, 4 H), 3.46 - 3.42 (m, 2 H), 3.35 (s, 4 H), 2.65 (s, 4 H), 2.30 - 2.22 (m, 4 H), 1.65 - 1.56 (m, 9 H), 1.54 - 1.28 (m, 5 H), 1.00 - 0.97 (m, 12 H).
실시예 77. 7-(4-((4-((S)-2-(4-((S)-1-((S)-2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)-3-페닐프로판아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시) 카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
실시예 77을 실시예 59의 합성으로부터의 중간체로 실시예 59와 같은 절차를 사용하여 제조하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.841분, MS = 546.5[1/2M+1]
1H NMR DMSO-d6 400 MHz, δ 10.66 (s, 1 H), 8.96 (s, 1H), 8.34 (d, J = 9.2 Hz, 1 H), 8.09 (s, 1 H), 8.04 (d, J = 8.8 Hz, 1 H), 7.95 (d, J = 12.8 Hz, 1 H), 7.61 (d, J = 8.4 Hz, 2 H), 7.36 (d, J = 8.8 Hz, 2 H), 7.28 - 7.17 (m, 6 H), 6.05 (s, 1 H), 5.55 - 5.48 (m, 1 H), 5.43 (s, 2 H), 5.07 (s, 2 H), 4.90 - 4.86 (m, 1 H), 4.59 - 4.58 (m, 3 H), 3.61 (s, 4 H), 3.34 - 3.23 (m, 4 H), 3.04 - 2.95 (m, 4 H), 2.78 (s, 1 H), 2.59 (s, 4 H), 2.05 - 1.98 (m, 4 H), 1.43 - 1.22 (m, 10H), 1.04 (d, J = 7.2 Hz, 2 H), 0.77 (d, J = 6.8 Hz, 3 H), 1.42 (d, J = 6.8 Hz, 3 H).
실시예 78. 7-(4-((4-((S)-2-(4-((S)-1-((S)-2-(6-(2,5-디옥소피롤리딘-1-일)헥산아미도)-3-메틸부탄아미도)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도) 벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
실시예 78을 실시예 60의 합성으로부터의 중간체로 실시예 60과 같은 절차를 사용하여 제조하였다.
단계 1. 건조 DMF (3 mL) 중 화합물 60-5b (50 mg, 0.072 mmol)의 용액에 실온에서 PNP 카르보네이트 (50 mg, 0.16 mmol) 및 DIPEA (0.5 mL, 3 mmol)를 첨가하고, 혼합물을 실온에서 1.5시간 동안 교반하였다. 노르플록사신 (50 mg, 0.16 mmol)을 첨가하였다. 혼합물을 실온에서 추가로 1시간 동안 교반하였다. 혼합물을 농축시키고, 여과하고, 정제용 HPLC (FA)에 의해 정제하여 실시예 78 (38.8 mg, 수율: 52%)을 수득하였다.
LCMS: (5-95, AB, 1.5분, ESI), 0.833분, MS = 522.4[1/2M+1]
1H NMR DMSO-d6 400 MHz, δ 10.1 (s, 1H), 8.93 (s, 1 H), 8.25 - 8.22 (d, 1H), 8.04 (s, 1 H), 7.93 - 7.90 (d, 1 H), 7.81 - 7.79 (d, 1H), 7.58 - 7.56 (d, J = 8.0 Hz, 2 H), 7.35 - 7.33 (d, J = 8.0 Hz, 2 H), 7.20 - 7.18 (m, 1 H), 6.0 (m, 1 H), 5.5 (m, 1 H), 5.40 (s, 2 H), 5.04 (s, 2 H), 4.9 - 4.87 (m, 1 H), 4.6 - 4.5 (m, 2 H), 4.2 - 4.1(m, 1 H), 3.6 (s, 4 H), 3.2 (m, 6 H), 3.05 - 2.9 (m, 2 H), 2.55 (s, 4 H), 2.18 - 2.0 (m, 5 H), 1.9 - 1.8 (m, 1 H), 1.5 - 1.35 (m, 7 H), 1.3 - 1.05 (m, 4 H), 0.84 - 0.77 (m, 12H).
실시예 79. 7-(4-((4-((S)-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)-5-구아니디노펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. THF (4 mL) 중 화합물 79-1 (2 g, 19.4 mmol)의 용액에 0℃에서 포화 수성 K2CO3 (30 mL)에 이어서 Cbz-Cl (3.958 g, 23.2 mmol)을 첨가하였다. 반응 혼합물을 28℃에서 1시간 동안 교반한 후, 이를 EtOAc (20 mL x 3) 및 H2O (20 mL)로 추출하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 화합물 79-2 (5 g, 100%)를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.36 - 7.31 (m, 5H), 6.92 (d, J = 8.8 Hz, 1H), 5.01 (s, 2H), 3.39 - 3.32 (m, 3H), 1.80 - 1.76 (m, 1H), 0.85 - 0.80 (m, 6H).
단계 2. N2 하에 0℃에서 DCM (100 mL) 중 화합물 79-2 (6.8 g, 28.7 mmol)의 용액에 DMP (14.59 mg, 343.4 mmol)를 첨가하였다. 5분 후, 반응 혼합물을 실온으로 가온하고, 실온에서 1시간 동안 교반하였다. 반응 혼합물을 0℃로 냉각시키고, NaHCO3/Na2SO3 (1:1)의 포화 용액으로 세척하였다. 분리한 후, 유기 층을 1회 더 세척하였다. 합한 수성 층을 DCM (30 mL x 2)으로 추출하였다. 이를 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜 화합물 79-3 (5.3 g, 79%)을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
1H NMR (400 MHz, DMSO-d6) δ 9.51 (d, J = 0.8 Hz, 1H), 7.72 - 7.61 (m, 1H), 7.43 - 7.30 (m, 5H), 5.04 (s, 2H), 3.91 - 3.88 (m, 1H), 2.18 - 2.13 (m, 6H), 0.94 - 0.82 (m, 6H).
단계 3. MeOH (50 mL) 중 화합물 79-3 (조 물질, 4.9 g, 12.76 mmol), 화합물 79-4 (4.9 g, 25.5 mmol)의 용액에 K2CO3 (5.28 g, 38.28 mmol)을 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 혼합물을 농축시키고, 실리카 겔 (PE: EtOAc = 10: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 목적 생성물 79-5 (1.30 g, 44%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 7.74 (d, J = 8.8 Hz, 1H), 7.37 - 7.29 (m, 5H), 5.01 (s, 2H), 4.09 - 4.05 (m, 1H), 3.16 (d, J = 2.4 Hz, 1H), 1.76 (d, J = 6.8 Hz, 1H), 0.91 (d, J = 6.8 Hz, 3H), 0.87 (d, J = 6.8 Hz, 3H).
단계 4. DCM (30 mL) 중 화합물 79-6 (2 g, 3.09 mmol)의 용액에 화합물 79-7 (1.6 mL, 15.4 mmol)을 첨가하였다. 반응 혼합물을 실온에서 16시간 동안 교반한 후, 이를 진공 하에 농축시키고, MTBE로 세척하고, 여과하여 목적 생성물 79-8 (1.315 g, 100%)을 수득하였다.
단계 5. 증류된 H2O (5 mL) 및 CH2Cl2 (10 mL) 중 NaN3 (1.6 g, 15.45 mmol)의 혼합물을 빙조에서 냉각시켰다. Tf2O (1.1 mL, 6.18 mmol)를 5분에 걸쳐 천천히 첨가하고, 2시간 동안 교반하였다. CH2Cl2 상을 제거하고, 수성 상을 CH2Cl2 (5 mL x 2)로 추출하였다. 트리플릴 아지드를 함유하는 유기 분획을 합하고, 포화 Na2CO3 (40 mL)으로 1회 세척하고, 추가 정제 없이 사용하였다. 화합물 79-8 (1.315 g, 3.09 mmol), K2CO3 (641 mg, 4.635 mmol) 및 CuSO4·5H2O (155 mg, 0.618 mmol)를 증류된 H2O (10 mL) 및 MeOH (20 mL)에 첨가하였다. CH2Cl2 중 트리플릴 아지드 용액 (50 mL)을 첨가하고, 혼합물을 실온에서 밤새 교반하였다. 유기 용매를 감압 하에 제거하고, 수성 슬러리를 H2O (50 mL)로 희석하고, 진한 HCl을 사용하여 pH 6으로 산성화시킨 다음, 0.2 M pH 6.2 인산염 완충액 (50 mL)으로 희석하고, EtOAc (3 x 100 mL)로 추출하여 술폰아미드 부산물을 제거하였다. 이어서, 수성 상을 진한 HCl을 사용하여 pH 2로 산성화시켰다. 생성물을 EtOAc/MeOH (20: 1) 추출 (4 x 100 mL)의 또 다른 라운드로부터 수득하였다. 이들 EtOAc/MeOH 추출물을 합하고, Na2SO4 상에서 건조시키고, 증발시켜 추가 정제 없이 화합물 79-9 (600 mg, 43%)를 수득하였다.
단계 6. DMF (5 mL) 중 화합물 79-9 (500 mg, 1.1 mmol) 및 79-5 (307 g, 1.33 mmol)의 용액에 Cu(CH3CN)4PF6 (165 mg, 0.44 mmol)을 첨가하였다. 반응 혼합물을 50℃에서 2시간 동안 교반하고, 혼합물 (79-10)을 직접 후속 단계에 사용하였다.
단계 7. DMF (5 mL) 중 화합물 79-10 (조 물질, 752 mg, 1.1 mmol)의 혼합물에 EEDQ (544 mg, 2.2 mmol) 및 화합물 79-11 (203 g, 1.65 mmol)을 첨가하였다. 반응 혼합물을 0℃에서 교반하고, N2 하에 실온에서 밤새 교반하였다. 혼합물을 정제용 HPLC 및 SFC 분리에 의해 정제하여 화합물 79-12 (250 mg, 30%)를 수득하였다.
단계 8. DMF (3 mL) 중 화합물 79-12 (90 mg, 0.114 mmol) 및 PNP 카르보네이트 (69 mg, 0.228 mmol)의 용액에 DIPEA (45 mg, 0.342 mmol)를 첨가하였다. 반응 혼합물을 N2 하에 21℃에서 3시간 동안 교반하였다. 혼합물 (79-13)을 직접 후속 단계에 정제 없이 사용하였다.
단계 9. 이전 단계로부터의 용액에 노르플록사신 (75 mg, 0.228 mmol)을 첨가하였다. 반응 혼합물을 21℃에서 1시간 동안 교반하였다. 혼합물을 정제용 HPLC에 의해 정제하여 화합물 79-14 (80 mg, 62%)를 수득하였다.
단계 10. DCM (5 mL) 중 화합물 79-14 (60 mg, 0.053 mmol)의 용액에 0℃에서 TFA (1 mL)를 첨가하였다. 반응 혼합물을 16℃에서 5시간 동안 교반하였다. 혼합물을 정제용 HPLC 및 SFC에 의해 정제하여 실시예 79 (30 mg, 64%)를 수득하였다.
LCMS (ESI): RT = 0.837분, M+H+ = 882.2. 방법 = 5-95 /1.5분.
1H NMR (400 MHz, DMSO-d6) δ 8.94 (s, 1H), 8.48 (s, 1H), 8.12 (s, 1H), 7.92 (d, J = 12.4 Hz, 1H), 7.76 (d, J = 8.8 Hz, 1H), 7.61 (s, 1H), 7.34 (m, 10H), 5.07 - 4.99 (m, 5H), 4.59 (d, J = 7.2 Hz, 1H), 3.61 (s, 4H), 3.17 (m, 6H), 3.12 (s, 2H), 2.18 - 2.03 (m, 4H), 1.39 (s, 5H), 0.84 (d, J = 6.4 Hz, 3H), 0.78 (d, J = 6.0 Hz, 3H).
실시예 80. (S)-7-(4-((4-(2-(4-(2-(벤질옥시카르보닐아미노)프로판-2-일)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
단계 1. THF (150 mL) 중 Cbz-OSu (57 g, 0.23 mol)를 수성 Na2CO3 (82 g, 0.78 mol) 및 80-1 (20 g, 0.19 mol)의 혼합물에 첨가하였다. 이를 실온에서 16시간 동안 교반한 후, 이를 pH > 10으로 조정하고, EtOAc (400 mL x 2)로 세척하였다. 수성 층을 합하고, 진한 HCl을 사용하여 pH < 1로 산성화시켰다. 이를 EtOAc (500 mL x 2)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 증발시켜 80-2 (45 g, 97.8%)를 수득하였다.
단계 2. DCM (200 mL) 중 80-2 (20 g, 84.3 mmol), N,O-디메틸히드록실아민 히드로클로라이드 (8.9 g, 92.7 mmol) 및 HATU (48.1 g, 126.4 mmol)의 혼합물에 Et3N (48.7 mL, 337.2 mmol)을 첨가하였다. 혼합물을 실온에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 물 (300 mL)로 녹였다. 수성 층을 EtOAc (300 mL x 3)로 추출하고, 유기 층을 포화 NaHCO3 (150 mL), 진한 HCl (100 mL) 및 포화 NaCl (100 mL)로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시키고, 실리카 겔 (PE: EtOAc = 2: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 80-3 (12.9 g, 54.6%)을 수득하였다.
단계 3. DIBAL-H (17.8 mL, 톨루엔 중 1M)를 무수 CH2Cl2 (100 mL) 중 80-3 (4.15 g, 14.8 mmol)의 용액에 -78℃에서 적가하고, 생성된 용액을 -78℃에서 2시간 동안 교반하였다. 과량의 DIBAL을 무수 MeOH (5 mL)에 의해 켄칭하고, 용액을 실온으로 가온하였다. 용액을 농축시켜 80-4 (3.27 g)를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 4. MeOH (60 mL) 중 80-4 (3.27 g, 14.8 mmol), 80-5 (2.96 g, 17.8 mmol) 및 K2CO3 (4.1 g, 29.7 mmol)의 혼합물을 실온에서 16시간 동안 교반하였다. 용매를 감압 하에 제거하고, 조 잔류물을 EtOAc (200 mL)와 물 (100 mL)로 분배하였다. 유기 층을 염수 (50 mL)로 세척하고, 무수 Na2SO4 상에서 건조시켰다. 용매를 감압 하에 제거하고, 실리카 겔 (PE: EtOAc= 10: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 80-6 (606 mg, 18.9%)을 수득하였다.
단계 5. Tf2O (1.7 mL, 9.9 mmol)를 증류된 H2O (10 mL) 및 CH2Cl2 (16 mL) 중 NaN3 (3.2 g, 49.3 mmol)의 용액에 0℃에서 5분에 걸쳐 천천히 첨가하였다. 이를 2시간 동안 교반한 후, 유기 상을 분리하고, 수층을 CH2Cl2 (20 mL x 2)로 추출하였다. 트리플릴 아지드를 함유하는 합한 유기 분획을 합하고, 포화 Na2CO3으로 1회 세척하고, 추가 정제 없이 사용하였다.
H2O (18 mL) 및 MeOH (36 mL) 중 80-7 (0.86 g, 4.93 mmol) 및 K2CO3 (1.02 g, 7.40 mmol), CuSO4.5H2O (25 mg, 0.099 mmol)의 혼합물에 CH2Cl2 중 트리플릴 아지드 (32 mL)를 첨가하고, 혼합물을 26℃에서 12시간 동안 교반하였다. 유기 용매를 감압 하에 제거하고, 수성 슬러리를 H2O (50 mL)로 희석하였다. 이를 진한 HCl을 사용하여 pH 6으로 산성화시키고, 인산염 완충액 (0.2M, pH 6.2, 50 mL)으로 희석하고, EtOAc (100 mL x 2)로 세척하였다. 이어서, 수성 상을 진한 HCl을 사용하여 pH 2로 산성화시키고, EtOAc (100 mL x 2)로 추출하고, Na2SO4 상에서 건조시키고, 농축시켜 80-8을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 6. DMF (5 mL) 중 80-8 (0.99 g, 4.93 mmol), 80-6 (0.54 g, 2.46 mmol) 및 Cu(CH3CN)4PF6 (115 mg, 0.37 mmol)의 혼합물을 50℃에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 80-9 (250 mg, 23%)를 수득하였다.
단계 7. DCM (10 mL) 중 80-9 (199 mg, 0.48 mmol), 80-10 (176 mg, 1.43 mmol) 및 EEDQ (353 mg, 1.43 mmol)의 혼합물을 24℃에서 2시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 80-11 (211 mg, 84%)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.00 (s, 1 H), 7.56 (dd, J =1.6, 8.4 Hz, 2 H), 7.33-7.31 (m, 7 H), 5.48-5.44 (m, 2 H), 4.99 (s, 2 H), 4.56 (s, 2 H), 3.23-3.16 (m, 1 H), 3.09-3.03 (m, 1 H), 2.26-2.20 (m, 2 H), 1.68 (s, 6 H), 1.51-1.45 (m, 1 H), 1.39-1.29 (m, 1 H).
LCMS (ESI): m/z 524.3 [M+H+].
단계 8. DCM (5 mL) 중 80-11 (150 mg, 0.29 mmol), PNP 카르보네이트 (173 mg, 0.57 mmol) 및 DIPEA (111 mg, 0.86 mmol)의 혼합물을 50℃에서 12시간 동안 교반한 후, 용매를 제거하고, DMF (5 mL) 중 DIPEA (112 mg, 0.87 mmol) 및 노르플록사신 (316 mg, 0.87 mmol)의 용액에 첨가하고, 25℃에서 4시간 동안 교반하였다. 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 80 (113 mg, 45%)을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.65 (s, 1 H), 8.96 (s, 1 H), 7.98-7.93 (m, 2 H), 7.63-7.60 (m, 3 H), 7.38-7.20 (m, 9 H), 6.05 (s, 1 H), 5.44 (s, 3 H), 5.07 (s, 2 H), 4.93 (s, 2 H), 4.59-4.57 (m, 2 H), 3.61 (s, 4 H), 3.02-2.98 (m, 2 H), 2.12-2.02 (m, 2 H), 1.57 (d, J = 4.0 Hz, 6 H), 1.42-1.38 (m, 3 H), 1.28-1.23 (m, 2 H).
LCMS (ESI): m/z 869.3 [M+H+].
실시예 81. 7-(4-((4-((S)-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2-페닐에틸)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4,4a,8a-테트라히드로퀴놀린-3-카르복실산.
단계 1. DCM (100 mL) 중 Cbz-L-페닐알라닌 (3.0 g, 10 mmol)의 용액에 HATU (4.57 g, 12.0 mmol) 및 DIPEA (3.87 g, 30.0 mmol)를 첨가하였다. 이를 실온에서 15분 동안 교반한 후, N-메톡시메탄아민 히드로클로라이드 (1.2 g, 12 mmol)를 첨가하였다. 용액을 추가로 1시간 동안 교반한 후, 이를 DCM (60 mL x 3)으로 추출하고, 10% 수성 HCl (60 mL) 및 물 (60 mL)로 세척하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시키고, 실리카 겔 상에서 칼럼 크로마토그래피에 의해 정제하여 81-2 (3.2 g, 94%)를 수득하였다.
1H NMR (400 MHz, CDCl3) δ 7.36-7.14 (m, 10 H), 5.42-5.40 (m, 1 H), 5.13-5.02 (m, 3 H), 3.69 (s, 3 H), 3.18 (s, 3 H), 3.11-3.06 (m, 1 H), 2.94-2.89 (m, 1 H).
단계 2. DIBAL-H (20 mL, 톨루엔 중 1M)를 건조 DCM (150 mL) 중 81-2 (3.4 g, 10 mmol)의 용액에 N2 하에 -78℃에서 첨가하였다. 용액을 -78℃에서 6시간 동안 교반한 후, 혼합물을 MeOH (50 mL) 및 물 (50 mL)로 켄칭하였다. 이를 여과하고, 여과물을 Na2SO4 상에서 건조시키고, 농축시키고, 81-3을 직접 추가 정제 없이 후속 단계에 사용하였다.
LCMS (ESI): m/z 284.1 [M+H+].
단계 3. MeOH (100 mL) 중 81-3 (10 mmol)의 용액에 0℃에서 K2CO3 (2.76 g, 20 mmol) 및 81-4 (2.31 g, 12 mmol)를 첨가하였다. 반응물을 0℃에서 12시간 동안 교반한 후, 용매를 제거하고, 잔류물을 실리카 겔 상에서 칼럼 크로마토그래피에 의해 정제하여 81-5를 수득하였다.
LCMS (ESI): m/z 280.1 [M+H+].
단계 4. H2O (5 mL) 및 DCM (7.5 mL)의 혼합물 중 NaN3 (1.78 g, 27.45 mmol)의 용액에 Tf2O (0.93 mL, 5.55 mmol)를 첨가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 이를 DCM (60 mL x 3)으로 추출하였다. 유기 층을 수성 Na2CO3으로 세척하고, 10 mL로 농축시켰다. 이어서, 81-6 (500 mg, 2.8 mmol)을 첨가한 다음, K2CO3 (577 mg, 4.19 mmol), CuSO4 (7 mg, 0.028 mmol), H2O (9 mL) 및 MeOH (18 mL)를 첨가하였다. 혼합물을 실온에서 12시간 동안 교반하였다. 유기 용매를 증발시킨 후, 이를 물 (20 mL)로 희석하고, pH를 HCl을 사용하여 6.0으로 조정한 다음, 인산염 완충액 (0.25 M, pH 6.2, 50 mL)으로 희석하였다. 혼합물을 EtOAc (50 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시켜 81-7을 수득하였으며, 이를 직접 후속 단계에 사용하였다.
단계 5. DMF (5 mL) 중 81-5 (560 mg, 2 mmol)의 용액에 81-7 (804 mg, 4.0 mmol) 및 촉매량 Cu(CH3CN)4PF6을 첨가하였다. 혼합물을 N2 하에 50℃에서 3시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 81-8을 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.00 (s, 1 H), 7.57 (d, J = 8.4 Hz, 2 H), 7.35-7.18 (m, 12 H), 5.50-5.45 (m, 1 H), 5.14-5.11 (m, 1 H), 5.05-5.03 (m, 2 H), 4.58 (s, 2 H), 3.26-3.24 (m, 2 H), 3.13-3.12 (m, 2 H), 2.35-2.15 (m, 2 H), 1.55-1.35 (m, 2 H).
단계 6. DCM (10 mL) 중 81-8 (480 mg, 1.0 mmol)의 용액에 EEDQ (247 mg, 1.0 mmol) 및 81-9 (123 g, 1.0 mmol)를 N2 하에 첨가하고, 혼합물을 0℃에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC 및 SFC 분리에 의해 정제하여 81-10 및 81-11을 수득하였다.
1H NMR (400 MHz, MeOD) δ 8.00-7.95 (m, 1 H), 7.58-7.56 (m, 2 H), 7.35-7.18 (m, 12 H), 5.51-5.47 (m, 1 H), 5.15-5.09 (m, 1 H), 5.55-5.00 (m, 2 H), 4.58 (s, 2 H), 3.33-3.20 (m, 2 H), 3.16-3.09 (m, 2 H), 2.25-2.18 (m, 2 H), 1.43-1.38 (m, 2 H). LCMS (ESI): m/z 586.0 [M+H+].
1H NMR (400 MHz, MeOD) δ 7.96 (s, 1 H), 7.57 (d, J = 8.8 Hz, 2 H), 7.35-7.18 (m, 12 H), 5.52-5.48 (m, 1 H), 5.13-4.87 (m, 3 H), 4.58 (s, 2 H), 3.33-3.15 (m, 2 H), 3.14-3.07 (m, 2 H), 2.27-2.14 (m, 2 H), 1.46-1.31 (m, 2 H). LCMS (ESI): m/z 586.1 [M+H+].
단계 7. 건조 DCM (30 mL) 중 81-10 (59 mg, 0.1 mmol)의 용액에 PNP 카르보네이트 (62 mg, 0.2 mmol) 및 DIPEA (1 mL)를 첨가하였다. 혼합물을 환류 하에 16시간 동안 가열하였다. 용매를 제거한 후, 잔류물을 DMF (5 mL) 및 DIPEA (0.3 mL) 중에 용해시키고, 노르플록사신 (65 mg, 0.2 mmol)을 첨가하였다. 혼합물을 실온에서 1시간 동안 교반하였다. 용매를 제거한 후, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 81을 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 15.35 (br s, 1 H), 10.66 (s, 1 H), 8.97 (s, 1 H), 8.10 (s, 1 H), 7.95 (d, J = 12.8 Hz, 1 H), 7.85-7.83 (m, 1 H), 7.62 (d, J = 8.4 Hz, 2 H), 7.39-7.19 (m, 13 H), 6.07-6.02 (m, 1 H), 5.51-5.45 (m, 3 H), 5.07 (s, 2 H), 5.01-4.92 (m, 3 H), 4.59 (d, J = 7.6 Hz, 2 H), 3.61 (s, 4 H), 3.44-3.38 (m, 4 H), 3.21-3.16 (m, 1 H), 3.06-2.98 (m, 3 H), 2.12-2.00 (m, 2 H), 1.45-1.15 (m, 5 H). LCMS (ESI): m/z 931.2 [M+H+].
실시예 82. (S)-7-(4-((4-(2-(4-(1-(벤질옥시카르보닐아미노)시클로프로필)-1H-1,2,3-트리아졸-1-일)-5-우레이도펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산
단계 1. 수성 용액 Na2CO3 (41.9 g, 395.6 mmol) 중 82-1 (10 g, 98.9 mmol)의 혼합물에 THF (150 mL) 중 Cbz-OSu (29.6 g, 118.7 mmol)를 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 pH > 10으로 조정하고, 용액을 EtOAc (200 mL x 2)로 세척하였다. 수성 층을 진한 HCl을 사용하여 pH < 1로 산성화시키고, 용액을 EtOAc (250 mL x 2)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 82-2 (23 g, 조 물질)를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 2. DCM (100 mL) 중 82-2 (10 g, 42.5 mmol), N,O-디메틸히드록실아민 히드로클로라이드 (4.5 g, 46.8 mmol) 및 HATU (24.2 g, 63.8 mmol)의 용액에 Et3N (24.6 mL, 170.0 mmol)을 첨가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 용매를 제거하고, 조 물질을 물 (300 mL)로 녹였다. 수성 층을 EtOAc (300 mL x 3)로 추출하였다. 유기 층을 포화 NaHCO3, 묽은 HCl, 포화 NaCl로 세척하고, 농축시키고, 실리카 겔 (PE: EtOAc = 2: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 82-3 (10.8 g, 91.3%)을 수득하였다.
단계 3. DIBAL-H (22.5 mL, 톨루엔 중 1M)를 무수 CH2Cl2 (50 mL) 중 82-3 (4.2 g, 15.0 mmol)의 용액에 -78℃에서 적가하였다. 혼합물을 -78℃에서 2시간 동안 교반한 후, 과량의 DIBAL을 무수 MeOH (15 mL)에 의해 켄칭하고, 생성된 용액을 실온으로 가온하였다. 용액을 농축시켜 82-4 (3.3 g, 조 물질)를 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 4. MeOH (60 mL) 중 82-4 (3.3 g, 15.0 mmol), 82-5 (3.0 g, 18.1 mmol) 및 K2CO3 (4.1 g, 30 mmol)의 혼합물을 실온에서 16시간 동안 교반한 후, 용매를 감압 하에 제거하고, 조 잔류물을 EtOAc (200 mL)와 물 (100 mL) 사이에 분배하였다. 유기 층을 염수로 세척하고, 무수 Na2SO4 상에서 건조시켰다. 용매를 제거한 후, 잔류물을 실리카 겔 (PE: EtOAc = 10: 1) 상에서 칼럼 크로마토그래피에 의해 정제하여 82-6 (1.8 g, 55.6%)을 수득하였다.
단계 5. Tf2O (4.7 mL, 27.9 mmol)를 증류된 H2O (30 mL) 및 DCM (48 mL) 중 NaN3 (9.2 g, 139.3 mmol)의 혼합물에 0℃에서 천천히 첨가하였다. 이를 2시간 동안 교반한 후, DCM 층을 분리하고, 수성부를 CH2Cl2 (24 mL x 2)로 추출하였다. 트리플릴 아지드를 함유하는 유기 분획을 합하고, 포화 Na2CO3으로 1회 세척하고, 추가 정제 없이 사용하였다.
CH2Cl2 중 트리플릴 아지드 (96 mL)를 H2O (54 mL) 및 MeOH (108 mL) 중 82-7 (2.44 g, 13.9 mmol), K2CO3 (2.89 g, 20.9 mmol) 및 CuSO4.5H2O (347 mg, 1.39 mmol)의 혼합물에 첨가하였다. 혼합물을 26℃에서 12시간 동안 교반한 후, 유기 용매를 감압 하에 제거하고, 수성 슬러리를 H2O (200 mL)로 희석하였다. 혼합물을 진한 HCl을 사용하여 pH = 6으로 산성화시키고, 인산염 완충액 (0.2 M, pH 6.2, 200 mL)으로 희석하고, EtOAc (300 mLx2)로 세척하였다. 이어서, 수성 상을 진한 HCl을 사용하여 pH = 2로 산성화시켰다. 이를 EtOAc (300 mLx3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 82-8을 수득하였으며, 이를 추가 정제 없이 후속 단계에 사용하였다.
단계 6. DMF (20 mL) 중 82-8 (2.8 g, 14.0 mmol), 82-6 (1.5 g, 7.0 mmol) 및 Cu(CN)4PF6 (779 mg, 2.1 mmol)의 혼합물을 50℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 82-9 (200 mg, 6.9%)를 수득하였다.
단계 7. DCM (10 mL) 중 82-9 (410 mg, 0.98 mmol), 82-10 (364 mg, 2.95 mmol) 및 EEDQ (730 mg, 2.95 mmol)의 혼합물을 24℃에서 2시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 82-11 (350 mg, 68%)을 수득하였다.
1H NMR (400 MHz, MeOD) δ 7.96 (s, 1 H), 7.60 (d, J = 8.4 Hz, 2 H), 7.42-7.35 (m, 7 H), 5.50-5.46 (m, 1 H), 5.14 (s, 2 H), 4.61 (s, 2 H), 3.24-3.22 (m, 1 H), 3.15-3.13 (m, 1 H), 2.30-2.15 (m, 2 H), 1.46-1.40 (m, 4 H), 1.29 (s, 2 H).
LCMS (ESI): m/z 522.0 [M+H+].
단계 8. DCM (10 mL) 중 82-11 (200 mg, 0.38 mmol), PNP (234 mg, 0.77 mmol) 및 DIPEA (149 mg, 1.15 mmol)의 혼합물을 50℃에서 12시간 동안 교반한 후, 이를 농축시키고, DMF (8 mL) 중 DIPEA (149 mg, 1.15 mmol) 및 노르플록사신 (367 mg, 1.15 mmol)의 용액에 첨가하였다. 이를 23℃에서 4시간 동안 교반한 후, 용매를 제거하고, 잔류물을 정제용 HPLC에 의해 정제하여 실시예 82 (50 mg, 15.2%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 10.62 (s, 1 H), 8.96 (s, 1 H), 8.18 (s, 1 H), 7.96-7.89 (m, 2 H), 7.62-7.60 (m, 2 H), 7.38-7.36 (m, 7 H), 7.22-7.20 (m, 1 H), 6.04 (s, 1 H), 5.43 (s, 3 H), 5.07 (s, 2 H), 5.03 (s, 2 H), 4.59-4.57 (m, 2 H), 3.67 (s, 6 H), 3.30--2.98 (m, 4 H), 2.20-2.09 (m, 2 H), 1.42-1.38 (m, 3 H), 1.25-1.22 (s, 4 H), 1.13 (s, 2 H).
MS (ESI): m/z 867.05 [M+H+], 889.16 [M+Na+].
실시예 83. 7-(4-((4-((S)-5-아미노-2-(4-((S)-1-(벤질옥시카르보닐아미노)-2-메틸프로필)-1H-1,2,3-트리아졸-1-일)펜탄아미도)벤질옥시)카르보닐)피페라진-1-일)-1-에틸-6-플루오로-4-옥소-1,4-디히드로퀴놀린-3-카르복실산.
실시예 83을 실시예 58과 같은 절차를 사용하여 제조하였다.
1H NMR (400 MHz, DMSO-d6) δ 8.96 (s, 1 H), 8.47-8.39 (m, 1 H), 8.08 (s, 1 H), 7.94 (d, J = 13.2 Hz, 1 H), 7.74 (d, J = 9.2 Hz, 1 H), 7.61 (d, J = 8.4 Hz, 2 H), 7.38-7.29 (m, 8 H), 7.22-7.20 (m, 1 H), 5.49-5.47 (m, 1 H), 5.07 (s, 2 H), 5.02 (d, J = 6.0 Hz, 2 H), 4.62-4.55 (m, 3 H), 3.60 (s, 4 H), 3.16 (s, 4 H), 2.77-2.70 (m, 2 H), 2.20-2.15 (m, 2 H), 2.09-2.00 (m, 1 H), 1.40 (t, J = 6.8 Hz, 5 H), 1.23 (s, 1 H), 0.85 (d, J = 6.8 Hz, 3 H), 0.78 (d, J = 6.8 Hz, 3 H).
LCMS (ESI): m/z 840.2 [M+H+].
링커-약물 화합물을 제조하는 방법
CBI-PBD LD1의 제조
(11aS)-4-((S)-6-아미노-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)헥산아미도)벤질 8-(6-((S)-1-(클로로메틸)-5-(포스포노옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실옥시)-11-히드록시-7-메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트
합성 반응식
실시예 1. 2,2,2-트리플루오로아세트산 화합물과 (11aS)-4-((S)-6-아미노-2-(1-((5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)카르바모일) 시클로부탄카르복스아미도)헥산아미도)벤질 8-((6-((S)-1-(클로로메틸)-5-(포스포노옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실)옥시)-11-히드록시-7-메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트 (1:1) (CBI-PBD LD1).
질소 분위기 하에 20℃에서 건조 DCM (25 mL) 중 페놀 1 (3.34 g, 10.0 mmol)의 교반된 균질 용액에 디옥산 중 4M HCl (12.5 mL, 50.0 mmol)을 첨가하였다. 첨가한 후, 반응 혼합물을 질소 하에 20℃에서 추가로 20시간 동안 교반하였다. 혼합물을 석유 에테르 (250 mL)로 희석하고, 질소 하에 20℃에서 20분 동안 교반하였다. 용매를 가만히 따르고, 절차를 석유 에테르 (250 mL)를 사용하여 1회 더 반복하였다. 생성된 고체를 25℃에서 1시간 동안 진공 하에 건조시켜 화합물 2 (2.7 g, 100%)를 수득하였다; 1H NMR [(CD3)2SO] δ 10.80 (s, 1 H), 8.15 (d, J = 8.3 Hz, 1 H), 7.87 (d, J = 8.2 Hz, 1 H), 7.58 (br t, J = 7.5 Hz, 1 H), 7.43 (br t, J = 7.4 Hz, 1 H), 6.81 (s, 1 H), 4.27-4.17 (m, 1 H), 4.01 (dd, J = 11.0, 3.2 Hz, 1 H), 3.93-3.74 (m, 3 H), 2개의 양성자는 관찰되지 않음. 조 생성물을 추가 정제 없이 후속 단계에 사용하였다.
질소 분위기 하에 0℃에서 건조 DCM (10 mL) 및 디옥산 (30 mL) 중 아민 2 (2.7 g, 10.0 mmol)의 교반된 불균질 혼합물에 트리플루오로아세트산 무수물 (TFAA) (3.4 mL, 24.0 mmol)에 이어서 디이소프로필에틸아민 (DIPEA) (8.71 mL, 50.0 mmol)을 첨가하였다. 첨가한 후, 반응 혼합물을 질소 하에 0℃에서 추가로 50분 동안 교반하였다. 에틸 아세테이트 (400 mL)를 첨가하고, 1N HCl (200 mL)을 0℃에서 첨가하고, 혼합물을 질소 하에 20분 동안 교반하였다. 에틸 아세테이트 층을 분리하고, 1N HCl (200 mL) 및 물 (2x200 mL)로 연속적으로 세척한 다음, 건조 (MgSO4)시키고, 감압 하에 25℃의 조 온도에서 증발시켜 3 (3.3 g, 100%)을 녹색-회색 고체로서 수득하였다. 이 물질을 추가 정제 없이 후속 단계에 사용하였다.
질소 분위기 하에 20℃에서 건조 THF (40 mL) 중 페놀 3 (3.3 g, 10.0 mmol)의 교반된 균질 용액에 디-tert-부틸-N,N-디이소프로필포스포르아미다이트 (4.31 mL, 13.0 mmol)를 첨가하였다. 첨가한 후, 반응 혼합물을 질소 하에 20℃에서 5-10분 동안 교반한 다음, 테트라졸 (CH3CN 중 3% 용액, 38.0 mL, 13.0 mmol)을 17분에 걸쳐 적가하였다. 최종 반응 혼합물을 추가로 20℃에서 질소 하에 19시간 동안 교반하였다. 혼합물을 빙조에서 냉각시키고, 30% H2O2 (11.3 mL, 100.0 mmol)를 첨가하였다. 첨가한 후, 반응 혼합물을 20℃에서 추가로 1시간 30분 동안 교반하였다. 혼합물을 에틸 아세테이트 (300 mL) 및 10% 수성 Na2S2O3 (500 mL)으로 희석하고, 0℃에서 20분 동안 교반하였다. 에틸 아세테이트 층을 분리하고, 물 (200 mL), 포화 NaHCO3 (200 mL), 및 물 (200 mL)로 연속적으로 세척한 다음, 건조 (MgSO4)시키고, 감압 하에 25℃의 조 온도에서 증발시켜 호박색 오일을 수득하였다. 실리카 겔 상에서 크로마토그래피 (에틸 아세테이트:석유 에테르 1:3으로 용리)에 의해 정제하여 화합물 4 (4.7 g, 90%)를 무색 발포성 고체로서 수득하였다; mp 39-42℃; [α]D -61.8° (c 1.02, CHCl3). 분석 (C23H28ClF3NO5P) 계산치: C, 52.93; H, 5.41; N, 2.68. 실측치: C, 53.05; H, 5.43; N, 2.80.
건조 DCM (25 mL) 중 알콜 5 (4.14 g, 6.95 mmol) (J. Med. Chem. 2003, 46, 2132-2151)의 교반 용액에 아세트산 무수물 (3.30 mL, 34.8 mmol) 및 트리에틸아민 (5.81 mL, 41.7 mmol)을 첨가하였다. 혼합물을 20℃에서 3시간 30분 동안 교반하였다. 건조 MeOH (4.0 mL)를 첨가하고, 혼합물을 30분 동안 교반하였다. 혼합물을 EtOAc (400 mL)와 물 (400 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 물 (2x200mL)로 세척한 다음, 건조 (MgSO4)시키고, 증발시켜 아세테이트 6 (4.28 g, 96%)을 오일로서 수득하였다; [α]D -57.4° (c 0.21, CHCl3); 1H NMR [(CD3)2SO] δ 9.10 (s, 1 H), 7.17 (s, 1 H), 6.87 (s, 1 H), 6.01-5.87 (m, 1 H), 5.32 (dd, J = 17.2, 1.5 Hz, 1 H), 5.21 (dd, J = 10.4, 1.4 Hz, 1 H), 4.89 (s, 2 H), 4.54 (d, J = 5.4 Hz, 2 H), 4.39-4.20 (m, 3 H), 3.93 (t, J = 6.4 Hz, 2 H), 3.75 (s, 3 H), 3.46-3.27 (m, 2 H), 2.13-1.90 (m, 4 H), 1.89-1.60 (m, 7 H), 1.54-1.40 (m, 2 H), 2개의 양성자는 DMSO 피크에 의해 가려짐. HRMS (ESI) m/z 계산치 C27H36 Cl3N2O9: 637.1481, 실측치: 637.1475 [MH+]; 계산치 C27H35Cl3N2NaO9: 659.1300, 실측치: 659.1303 [MNa+]; 계산치 C27H35Cl3KN2O9: 675.1040, 실측치: 675.1035 [MK+].
아세톤 (75 mL), 물 (50 mL), 및 THF (30 mL) 중 아세테이트 6 (4.27 g, 6.69 mmol)의 교반 용액에 아연 분말 (17.5 g, 268 mmol) 및 NH4Cl (28.6 g, 535 mmol)을 첨가하였다. 혼합물을 질소 분위기 하에 20℃에서 42시간 동안 교반하였다. 아세톤 (100 mL)을 첨가하고, 혼합물을 10분 동안 교반하고, 상청액을 가만히 따랐다. 절차를 2회 반복하고, 합한 상청액을 감압 하에 증발시켜 아세톤 및 THF을 제거하였다. 잔류물을 물 (50 mL)로 희석하고, 수성 1N HCl을 사용하여 pH 대략 1로 산성화시켰다. 산성 혼합물을 석유 에테르 (2x200 mL)로 세척하고, EtOAc (400 mL)로 추출하였다. EtOAc 추출물을 물 (200 mL)로 세척하고, 건조 (MgSO4)시키고, 용매를 증발시켜 산 7 (2.72 g, 80%)을 오일로서 수득하였다; [α]D -73.5° (c 1.12, CHCl3); 1H NMR [(CD3)2SO] δ 11.99 (s, D2O로 교환가능, 1 H), 9.10 (s, D2O로 교환가능, 1 H), 7.17 (s, 1 H), 6.87 (s, 1 H), 6.00-5.86 (m, 1 H), 5.32 (dd, J = 17.2, 1.5 Hz, 1 H), 5.20 (dd, J = 10.4, 1.5 Hz, 1 H), 4.57-4.52 (m, 2 H), 4.37-4.03 (m, 3 H), 3.93 (t, J = 6.5 Hz, 2 H), 3.75 (s, 3 H), 3.40-3.10 (m, 2 H), 2.23 (t, J = 7.3 Hz, 2 H), 2.07-1.93 (m, 4 H), 1.89-1.66 (m, 5 H), 1.62-1.49 (m, 2 H), 1.47-1.34 (m, 2 H). HRMS (ESI) m/z 계산치 C25H35N2O9: 507.2337, 실측치: 507.2340 [MH+]; 계산치 C25H34KN2O9: 545.1896, 실측치: 545.1906 [MK+]; 계산치 C25H34N2NaO9: 529.2157, 실측치: 529.2169 [MNa+].
질소 분위기 하에 0℃에서 MeOH (10 mL) 중 트리플루오로아세트아미드 4 (1.38 g, 2.64 mmol)의 교반 용액에 Cs2CO3 (1.03 g, 3.17 mmol)을 첨가하였다. 혼합물을 0℃에서 2시간 30분 동안 교반한 다음, EtOAc (200 mL)와 물 (150 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 물 (100 mL)로 다시 세척한 다음, 건조 (MgSO4)시키고, 감압 하에 25℃의 조 온도에서 증발시켜 불안정한 아민 8 (1.17 g)을 연황색 발포성 고체로서 수득하였다.
이 조 물질을 건조 DMA (14 mL) 중 산 7 (1.24 g, 2.45 mmol), EDCI.HCl (1.41 g, 7.35 mmol) 및 p-톨루엔술폰산 (84 mg, 0.49 mmol)으로 0-20℃에서 22시간 동안 처리하였다. 혼합물을 EtOAc (400 mL)와 물 (300 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 물 (100 mL)로 다시 세척한 다음, 건조 (MgSO4)시키고, 증발시켰다. 실리카 겔 상에서 크로마토그래피 (EtOAc:석유 에테르 2:1로 용리)에 의해 정제하여 아미드 9 (1.49 g, 66%)를 연황색 발포성 고체로서 수득하였다; mp 55-59℃; [α]D -68.0° (c 1.00, CHCl3); 1H NMR [(CD3)2SO] δ 9.10 (s, D2O로 교환가능, 1 H), 8.56 (s, 1 H), 8.03 (d, J = 8.1 Hz, 1 H), 7.92 (d, J = 8.4 Hz, 1 H), 7.57 (t, J = 8.1 Hz, 1 H), 7.47 (t, J = 7.6 Hz, 1 H), 7.19 (s, 1 H), 6.86 (s, 1 H), 5.99-5.86 (m, 1 H), 5.32 (dd, J = 17.2, 1.6 Hz, 1 H), 5.20 (dd, J = 10.4, 1.5 Hz, 1 H), 4.53 (d, J = 5.4 Hz, 2 H), 4.45-3.84 (m, 10 H), 3.74 (s, 3 H), 3.44-3.26 (m, 2 H), 2.68-2.47 (m, 2 H), 2.02 (br s, 3 H), 1.93-1.43 (m, 10 H), 1.474 및 1.469 (2 s, 18 H). HRMS (ESI) m/z 계산치 C46H62ClN3O12P: 914.3754, 실측치: 914.3749 [MH+]; 계산치: C46H61ClKN3O12P: 952.3313, 실측치: 952.3381 [MK+]; 계산치 C46H61ClN3NaO12P: 936.3574, 실측치: 936.3589 [MNa+].
질소 분위기 하에 20℃에서 DCM (8 mL) 중 카르바메이트 9 (548 mg, 0.60 mmol)의 교반 용액에 Pd(Ph3P)4 (17.1 mg; 9.8% Pd) 및 피롤리딘 (0.49 mL, 6.00 mmol)을 첨가하였다. 혼합물을 20℃에서 30분 동안 교반한 다음, EtOAc (200 mL)와 물 (150 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 물 (50 mL)로 다시 세척한 다음, 건조 (MgSO4)시키고, 감압 하에 25℃의 조 온도에서 증발시켰다. 조 생성물을 실리카 겔 상에서 크로마토그래피 (EtOAc:MeOH 50:1로 용리)에 의해 정제하여 아닐린 10 (323 mg, 65%)을 연황색 발포성 고체로서 수득하였다; mp 46-49℃; [α]D -85.2° (c 0.36, CHCl3); 1H NMR [(CD3)2SO] δ 8.56 (s, 1 H),8.04 (d, J = 8.3 Hz, 1 H), 7.93 (d, J = 8.4 Hz, 1 H),7.58 (t, J = 8.2 Hz, 1 H), 7.47 (t, J = 8.1 Hz, 1 H), 6.67 (s, 1 H), 6.37 (s, 1 H), 5.09 (s, D2O로 교환가능, 2 H), 4.46-3.85 (m, 10 H), 3.63 (s, 3 H), 3.52-3.34 (m, 2 H), 2.69-2.50 (m, 2 H), 2.08-1.94 (m, 1 H), 2.01 (s, 3 H), 1.91-1.61 (m, 7 H), 1.58-1.44 (m, 2 H), 1.476 및 1.470 (2 s, 18 H). HRMS (ESI) m/z 계산치 C42H58ClN3O10P: 830.3522, 실측치: 830.3543 [MH+].
질소 분위기 하에 20℃에서 건조 DCM (7 mL) 중 아닐린 10 (293 mg, 0.35 mmol) 및 DMAP (202 mg, 1.65 mmol)의 교반 용액에 건조 DCM 중 디포스겐의 용액 (0.05 M, 6.7 mL, 0.33 mmol)을 첨가하였다. 혼합물을 25분 동안 교반한 다음, 건조 DCM (20 mL) 중 알콜 11 (1.54 g, 3.54 mmol)의 용액을 첨가하였다. 혼합물을 질소 분위기 하에 20℃에서 68시간 동안 교반한 다음, EtOAc (300 mL)와 물 (200 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 물 (100 mL)로 다시 세척한 다음, 건조 (MgSO4)시키고, 30℃의 조 온도에서 증발시켰다. 생성된 오렌지색 오일을 실리카 겔 상에서 크로마토그래피 (EtOAc:MeOH:석유 에테르 30:0.5:10으로 용리)에 의해 정제하여 카르바메이트 12 (385 mg, 84%)를 발포성 고체로서 수득하였다; mp 72-75℃; [α]D -55.2° (c 0.53, CHCl3); 1H NMR [(CD3)2SO] δ10.04 (s, D2O로 교환가능, 1 H), 9.12 (br s, D2O로 교환가능, 1 H), 8.56 (s, 1 H), 8.03 (d, J = 8.3 Hz, 1 H), 7.92 (d, J = 8.4 Hz, 1 H), 7.65-7.52 (m, 3 H, D2O 후 2 H로 감소됨), 7.46 (t, J = 7.8 Hz, 2 H), 7.31 (d, J = 8.5 Hz, 2 H), 7.20 (br s, 1 H), 6.86 (s, 1 H), 6.75 (불량하게 분해된 t, D2O로 교환가능, 1 H), 5.97-5.83 (m, 1 H), 5.30 (br d, J = 17.3 Hz, 1 H), 5.17 (br d, J = 10.6 Hz, 1 H), 5.18-4.97 (m, 2 H), 4.51-3.85 (m, 13 H), 3.74 (s, 3 H), 3.43-3.23 (m, 2 H, 물 피크에 의해 부분적으로 가려짐), 2.94-2.83 (m, 2 H), 2.65-2.50 (m, 2 H, DMSO 피크에 의해 부분적으로 가려짐), 2.07-1.91 (m, 1 H), 2.01 (br s, 3 H), 1.88-1.43 (m, 11 H), 1.473-1.468 (2 s, 18 H), 1.43-1.20 (m, 4 H), 1.35 (s, 9 H). HRMS (ESI) m/z 계산치 C65H89ClN6O17P: 1291.5665, 실측치: 1291.5705 [MH+]; 계산치 C65H88ClKN6O17P: 1329.5262, 실측치: 1329.5264 [MK+]; 계산치 C65H88ClN6NaO17P: 1313.5554, 실측치: 1313.5524 [MNa+].
DCM (9 mL) 및 MeOH (9 mL) 중 아세테이트 12 (366 mg, 0.28 mmol) 및 K2CO3 (1.14 g, 8.24 mmol)의 혼합물을 0℃에서 3시간 30분 동안 교반하였다. 혼합물을 차가운 EtOAc (200 mL) 및 빙수 (150 mL)와 함께 10분 동안 교반하였다. EtOAc 층을 분리하고, 물 (100 mL)로 다시 세척한 다음, 건조 (MgSO4)시키고, 25℃의 조 온도에서 증발시켜 알콜 13 (343 mg, 97%)을 무색 발포성 고체로서 수득하였다; mp 71-75℃; [α]D -58.2° (c 0.57, CHCl3); 1H NMR [(CD3)2SO] δ10.04 (s, D2O로 교환가능, 1 H), 9.11 (br s, D2O로 교환가능, 1 H), 8.56 (s, 1 H), 8.03 (d, J = 8.3 Hz, 1 H), 7.92 (d, J = 8.4 Hz, 1 H), 7.65-7.53 (m, 3 H, D2O 후 2 H로 감소됨), 7.46 (t, J = 7.6 Hz, 2 H), 7.32 (d, J = 8.6 Hz, 2 H), 7.27 (br s, 1 H), 6.93 (s, 1 H), 6.75 (불량하게 분해된 t, D2O로 교환가능, 1 H), 5.97-5.82 (m, 1 H), 5.29 (br d, J = 17.2 Hz, 1 H), 5.17 (br d, J = 10.5 Hz, 1 H), 5.03 (br s, 2 H), 4.73 (t, J = 5.8 Hz, D2O로 교환가능, 1 H), 4.50-3.82 (m, 11 H), 3.74 (s, 3 H), 3.62-3.44 (m, 2 H), 3.40-3.21 (m, 2 H, 물 피크에 의해 부분적으로 가려짐), 2.95-2.80 (m, 2 H), 2.65-2.50 (m, 2 H, DMSO 피크에 의해 부분적으로 가려짐), 1.93-1.21 (m, 16 H), 1.473-1.468 (2 s, 18 H), 1.35 (s, 9 H). HRMS (ESI) m/z 계산치 C63H86ClKN6O16P: 1287.5158, 실측치: 1287.5113 [MK+]; 계산치 C63H86ClN6NaO16P: 1271.5419, 실측치: 1271.5381 [MNa+].
0℃에서 건조 DCM (14 mL) 중 알콜 13 (322 mg, 0.26 mmol)의 교반 용액에 데스-마르틴 퍼아이오디난 (DMP) (131 mg, 0.31 mmol)을 3분에 걸쳐 조금씩 첨가하였다. 반응 혼합물을 0℃에서 추가로 2시간 동안 교반한 다음, 20℃에서 50시간 동안 교반하였다. 혼합물을 DCM (40 mL) 및 10% Na2S2O3 (40 mL)로 희석하고, 20℃에서 10분 동안 교반한 다음, DCM (200 mL)과 포화 NaHCO3 용액 (150 mL) 사이에 분배하였다. DCM 층을 분리하고, 수성 층을 추가로 DCM (2x50 mL)으로 추출하였다. 합한 DCM 추출물을 포화 NaHCO3 용액 (2x100 mL) 및 물 (2x100 mL)로 세척한 다음, 건조 (MgSO4)시키고, 25℃의 조 온도에서 증발시켰다. 생성된 오렌지색 오일을 실리카 겔 상에서 크로마토그래피 (CHCl3:MeOH 40:1로 용리)에 의해 정제하여 14 (228 mg, 71%)를 연갈색 발포성 고체로서 수득하였다; mp 98℃ (분해); [α]D +74.5° (c 0.26, CHCl3); 1H NMR [(CD3)2SO] δ 10.02 (s, D2O로 교환가능, 1 H), 8.56 (s, 1 H), 8.04 (d, J = 8.3 Hz, 1 H), 7.92 (d, J = 8.4 Hz, 1 H), 7.65-7.47 (m, 5 H, D2O 후 4 H로 감소됨), 7.25-7.12 (m, 2 H, br s 및 D2O 교환 시 1 H), 7.03 (s, 1 H), 6.83-6.64 (m, 2 H), 6.48 (br s, D2O로 교환가능, 1 H), 5.96-5.80 (m, 1 H), 5.52-5.39 (m, D2O 교환 시 d, J = 9.6 Hz, 1 H), 5.27 (br d, J = 16.8 Hz, 1 H), 5.21-5.10 (m, 2 H), 4.81 (br d, J = 12.3 Hz, 1 H), 4.54-3.85 (m, 8 H), 3.83-3.70 (m, 5 H), 3.53-3.21 (m, 3 H, 물 피크에 의해 부분적으로 가려짐), 2.93-2.82 (m, 2 H), 2.64-2.47 (m, 2 H, DMSO 피크에 의해 부분적으로 가려짐), 2.10-1.20 (m, 16 H), 1.470 및 1.464 (2 s, 18 H), 1.34 (s, 9 H). HRMS (ESI) m/z 계산치 C63H84ClKN6O16P: 1285.5002, 실측치: 1285.4938 [MK+]; 계산치 C63H84ClN6NaO16P: 1269.5262, 실측치: 1269.5220 [MNa+].
질소 분위기 하에 20℃에서 DCM (2 mL) 중 14 (125 mg, 0.10 mmol)의 교반 용액에 Pd(Ph3P)4 (2.9 mg; 9.8% Pd) 및 피롤리딘 (0.08 mL, 1.00 mmol)을 첨가하였다. 혼합물을 20℃에서 교반하고, TLC (EtOAc:MeOH 20:1)에 의해 모니터링하였다. 40분 후, 추가의 Pd(Ph3P)4 (5.8 mg; 9.8% Pd) 및 피롤리딘 (0.16 mL, 2.00 mmol)을 첨가하고, 혼합물을 추가로 3시간 동안 교반하였다. 혼합물을 EtOAc (100 mL)와 물 (100 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 물 (50 mL)로 다시 세척한 다음, 건조 (MgSO4)시키고, 25℃의 조 온도에서 증발시켰다. 조 생성물 15 (94 mg, 81%)를 추가 정제 없이 후속 단계에 사용하였다. HRMS (ESI) m/z 계산치 C59H81ClN6O14P: 1163.5231, 실측치: 1163.5188 [MH+].
건조 DMA (1.0 mL) 중 15 (91 mg, 0.078 mmol)의 용액을 질소 분위기 하에 20℃에서 건조 DMA (0.5 mL) 중 산 16 (36 mg, 0.12 mmol), EDCI.HCl (34 mg, 0.18 mmol), 및 TsOH (4.0 mg, 0.023 mmol)의 미리 형성된 (20℃에서 10분 동안) 혼합물로 처리하였다. 10분 후, DIPEA (0.016 mL, 0.078 mmol)를 첨가하고, 반응 혼합물을 23시간 동안 교반하였다. 혼합물을 EtOAc (100 mL)와 물 (100 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 포화 NaHCO3 (50 mL), 물 (50 mL)로 추가로 세척한 다음, 건조 (MgSO4)시켰다. 25℃의 조 온도에서 용매를 증발시켜 조 생성물을 수득하였으며, 이를 실리카 겔 상에서 크로마토그래피 (CHCl3:EtOAc:MeOH 30:10:2로 용리)에 의해 정제하여 17 (63 mg, 56%)을 연갈색 발포성 고체로서 수득하였다; mp 67-70℃; [α]D +23.9° (c 2.09, CHCl3); 1H NMR [(CD3)2SO] δ 10.05 (s, D2O로 교환가능, 1 H), 8.56 (s, 1 H), 8.03 (d, J = 8.3 Hz, 1 H), 7.92 (d, J = 8.4 Hz, 1 H), 7.84-7.71 (m, 2 H, D2O로 교환가능), 7.62-7.52 (m, 3 H), 7.46 (t, J = 7.7 Hz, 1 H), 7.22-7.13 (m, 2 H), 7.03 (br s, 1 H), 6.96 (s, 2 H), 6.71 (br s, 2 H, D2O 후 1 H로 감소됨), 6.49 (br s, D2O로 교환가능, 1 H), 5.51-5.41 (m, 그러나 D2O 교환 시 d, J = 9.5 Hz, 1 H), 5.15 (d, J = 12.2 Hz, 1 H), 4.82 (br d, J = 12.4 Hz, 1 H), 4.47-3.85 (m, 8 H), 3.77 (br s, 3 H), 3.52-3.20 (m, 3 H, 물 피크에 의해 부분적으로 가려짐), 3.12-3.20 (m, 그러나 D2O 교환 시 t, J = 6.7 Hz, 2 H), 2.92-2.80 (m, 2 H), 2.65-2.50 (m, 2 H, DMSO 피크에 의해 부분적으로 가려짐), 2.39 (t, J = 7.9 Hz, 2 H), 2.07-1.24 (m, 28 H), 1.469 및 1.463 (2 s, 18 H), 1.33 (s, 9 H). HRMS (ESI) m/z 계산치 C74H98ClN8NaO18P: 1475.6317, 실측치: 1475.6267 [MNa+].
질소 하에 20℃에서 DCM (1.0 mL) 중 17 (45 mg, 0.031 mmol)의 교반 용액에 TFA (1.0 mL)를 첨가하고, 혼합물을 15분 동안 교반하였다. 석유 에테르 (20 mL)를 첨가하고, 혼합물을 30분 동안 교반하였다. 상청액을 가만히 따르고, 절차를 EtOAc:석유 에테르 (1:5) (2x20 mL)를 사용하여 반복하였다. 생성된 고체를 수집하고, 정제용 HPLC [시너지 폴라RP(Synergi PolarRP) 칼럼; CH3CN 중 수성 TFA (pH = 2.56; 90%에서 2%)/10% 물 (10%에서 98%); 유량 12 mL/분으로 23분에 걸친 구배 용리]에 의해 정제하여 순수한 CBI-PBD LD1 (17.5 mg, 38%)을 베이지색 고체로서 수득하였다; 순도 (HPLC): 99.1%; [α]D +54.9° (c 0.18, MeOH); 1H NMR [(CD3)2SO] δ 10.20 (s, D2O로 교환가능, 1 H), 8.50 (s, 1 H), 8.20-7.78 (m, 7 H, D2O 후 1H로 감소됨), 8.12 (d, J = 9.1 Hz, 1 H), 7.72-7.47 (m, 4 H, D2O 후 3H로 감소됨), 7.40 (t, J = 7.5 Hz, 1 H), 7.17 (br d, J = 7.3 Hz, 2 H), 7.03 (br s, 1 H), 6.97 (s, 2 H), 6.66 (br s, D2O로 교환가능, 1 H), 5.51 (br s, 1 H), 5.48 (br d, J = 9.7 Hz, 1 H), 5.32-5.18 (m, 그러나 D2O 후 d, J = 12.6 Hz, 1 H), 4.75 (br d, J = 12.4 Hz, 1 H), 4.44-3.81 (m, 8 H), 3.77 (s, 3 H), 3.52-3.21 (m, 5 H, 물 피크에 의해 부분적으로 가려짐), 3.04 (q, 그러나 D2O 후 t, J = 6.8 Hz, 2 H), 2.80-2.68 (m, 2 H), 2.39 (t, J = 7.7 Hz, 2 H), 2.12-1.08 (m, 28 H). HRMS (ESI) m/z 계산치 C61H75ClN8O16P: 1241.4722, 실측치: 1241.4700 [MH+]; 계산치 C61H74ClN8NaO16P: 1263.4541, 실측치: 1263.4531 [MNa+].
CBI-CBI LD4의 합성
4-((S)-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질 (S)-1-(클로로메틸)-3-(5-((S)-1-(클로로메틸)-5-(포스포노옥시)-1H-벤조[e]인돌-3(2H)-일)-5-옥소펜타노일)-2,3-디히드로-1H-벤조[e]인돌-5-일카르바메이트
합성 반응식
실시예 2. 4-((S)-2-(1-((5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질 ((S)-1-(클로로메틸)-3-(5-((S)-1-(클로로메틸)-5-(포스포노옥시)-1H-벤조[e]인돌-3(2H)-일)-5-옥소펜타노일)-2,3-디히드로-1H-벤조[e]인돌-5-일)카르바메이트 (CBI-CBI LD4).
질소 하에 20℃에서 건조 DCM (10 mL) 및 MeOH (10 mL) 중 이민 18 (497 mg, 1.00 mmol)의 교반 용액에 디옥산 중 4M HCl (0.63 mL, 2.5 mmol)을 첨가하였다. 첨가한 후, 반응 혼합물을 20℃에서 1시간 동안 교반하였다. 휘발성 물질을 감압 하에 20℃에서 증발시켜 황색 고체를 수득하였으며, 이를 EtOAc 및 석유 에테르 (1:10)의 혼합물 (200 mL)과 함께 20℃에서 30분 동안 교반하였다. 상청액을 가만히 따르고, 절차를 반복하였다. 생성된 고체를 수성 Na2CO3 (2N, 200 mL) 및 DCM (200 mL)의 혼합물과 함께 0℃에서 15분 동안 교반하였다. DCM 층을 분리하고, 물 (100 mL)로 세척한 다음, 건조 (MgSO4)시키고, 25℃에서 증발시켜 아닐린 19 (322 mg, 97%)를 불안정한 고체로서 수득하였다; 1H NMR [(CD3)2SO] δ 8.01 (d, J = 8.4 Hz, 1 H), 7.94-7.78 (m, 2 H), 7.52 (t, J = 7.3 Hz, 1 H), 7.39 (t, J = 7.5 Hz, 1 H), 4.20-3.72 (m, 5 H), 1.54 (s, 9 H), 2개의 양성자는 관찰되지 않음. HRMS (ESI) m/z 계산치 C18H22 ClN2O2: 333.1364, 실측치: 333.1355 [MH+]; 계산치 C18H21ClKN2O2: 371.0923, 실측치: 371.0920 [MK+]; 계산치 C18H21ClN2NaO2: 355.1184, 실측치: 355.1179 [MNa+]. 이 물질을 추가 정제 없이 후속 단계에 사용하였다.
질소 하에 20℃에서 건조 DCM (30 mL) 중 아닐린 19 (322 mg, 0.97 mmol) 및 DMAP (730 mg, 6.00 mmol)의 교반된 균질 혼합물에 건조 DCM 중 디포스겐의 용액 (0.10 M, 11 mL, 1.10 mmol)을 첨가하였다. 혼합물을 20분 동안 교반한 다음, 고체 p-니트로벤질 알콜 (1.53 g, 10.0 mmol)을 첨가하였다. 최종 반응 혼합물을 질소 하에 20℃에서 18시간 동안 교반한 다음, EtOAc (300 mL)와 물 (300 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 염수 (200 mL)로 세척하고, 건조 (MgSO4)시켰다. 30℃에서 용매를 증발시켜 연질 황색 고체를 수득하였으며, 이를 실리카 겔 상에서 크로마토그래피 (DCM:EtOAc:석유 에테르 20:1:10으로 용리)에 의해 정제하여 카르바메이트 20 (411 mg, 83%)을 연황색 고체로서 수득하였다; mp 141-142℃; [α]D -15.0° (c 0.20, CHCl3); 1H NMR [(CD3)2SO] δ9.85 (s, 1 H), 8.36-8.15 (m, 3 H), 8.05 (d, J = 8.4 Hz, 1 H), 7.88 (d, J = 8.3 Hz, 1 H), 7.72 (d, J = 8.6 Hz, 2 H), 7.57-7.49 (m, 1 H), 7.45-7.36 (m, 1 H), 5.35 (s, 2 H), 4.27-4.12 (m, 2 H), 4.10-3.96 (m, 2 H), 3.94-3.81 (m, 1 H), 1.52 (s, 9 H). 분석 (C26H26ClN3O6) 계산치: C, 61.00; H, 5.12; N, 8.21. 실측치: C, 61.27; H, 5.05; N, 8.25.
질소 하에 0℃에서 DCM (6 mL) 중 20 (282 mg, 0.55 mmol)의 교반 용액에 트리플루오로아세트산 (TFA) (3 mL)을 첨가하였다. 첨가한 후, 반응 혼합물을 0℃에서 1시간 15분 동안 교반한 다음, DCM (300 mL)과 차가운 수성 Na2CO3 (2N, 300 ml) 사이에 분배하였다. DCM 층을 분리하고, 차가운 수성 Na2CO3 (2N, 100 mL) 및 물 (100 mL)로 세척한 다음, 건조 (MgSO4)시키고, 25℃에서 증발시켜 오렌지색 고체를 수득하였다. 이 고체를 건조 DMA (4 mL) 중에 용해시키고, 산 21 (297 mg, 0.55 mmol), EDCI.HCl (317 mg, 1.65 mmol) 및 TsOH (19 mg, 0.11 mmol)로 처리하였다. 혼합물을 질소 하에 20℃에서 22시간 동안 교반한 다음, EtOAc (300 mL)와 물 (300 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 물 (200 mL)로 세척하고, 건조 (MgSO4)시켰다. 25℃에서 용매를 증발시켜 오일을 수득하였으며, 이를 실리카 겔 상에서 크로마토그래피 (DCM:EtOAc 2:1로 용리)에 의해 정제하여 아미드 22 (181 mg, 35%)를 점착성 고체로서 수득하였다; [α]D -26.8° (c 0.37, CHCl3); 1H NMR [(CD3)2SO] δ9.84 (s, 1 H), 8.62 (s, 1 H), 8.59 (s, 1 H), 8.28 (d, J = 8.5 Hz, 2 H), 8.04 (d, J = 8.5 Hz, 2 H), 7.92 (d, J = 8.2 Hz, 2 H), 7.72 (d, J = 8.3 Hz, 2 H), 7.63-7.57 (m, 2 H), 7.51-7.39 (m, 2 H), 5.34 (s, 2 H), 4.48-4.17 (m, 6 H), 4.10-3.97 (m, 2 H), 3.97-3.84 (m, 2 H), 2.82-2.54 (m, 4 H), 2.04-1.91 (m, 2 H), 1.49 (s, 18 H). HRMS (ESI) m/z 계산치 C47H51Cl2KN4O10P: 971.2351, 실측치: 971.2344 [MK+]; 계산치 C47H51Cl2N4NaO10P: 955.2612, 실측치: 955.2621 [MNa+].
질소 하에 0℃에서 아세톤:물:THF (10:5:1) (6 mL) 중 니트로 화합물 22 (47 mg, 0.05 mmol)의 교반 용액에 Zn 분말 (65.4 mg, 1.00 mmol) 및 NH4Cl (107 mg, 2.00 mmol)을 첨가하였다. 첨가한 후, 반응 혼합물을 0℃에서 40분 동안 교반하였다. 반응 혼합물을 셀라이트를 통해 여과하고, 차가운 DCM으로 수회 세척하였다. 합한 여과물을 냉수 (50 mL)로 세척한 다음, 건조 (MgSO4)시키고, 25℃에서 증발시켜 황색 발포성 고체를 수득하였다. 이 고체를 건조 DMA (1 mL) 중에 용해시키고, DMA (0.3 mL) 중 Fmoc-L-시트룰린 (29.8 mg, 0.075 mmol) 및 EEDQ (18.5 mg, 0.075 mmol)의 미리 형성된 (20℃에서 10분) 혼합물에 첨가하였다. 반응 혼합물을 질소 하에 20℃에서 48시간 동안 교반한 다음, EtOAc (100 mL)와 물 (100 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 물 (50 mL)로 세척하고, 건조 (MgSO4)시켰다. 25℃에서 용매를 증발시켜 오일을 수득하였으며, 이를 실리카 겔 상에서 크로마토그래피 (EtOAc:MeOH 10:1)에 의해 정제하여 23 (24 mg, 38%)을 점착성 고체로서 수득하였다; [α]D -31.9° (c 0.28, CHCl3); 1H NMR [(CD3)2SO] δ 10.09 (s, 1 H), 9.66 (s, 1 H), 8.62 (s, 1 H), 8.59 (s, 1 H), 8.10-7.25 (m, 21 H), 6.04-5.94 (m, 1 H), 5.53-5.29 (m, 2 H), 5.13 (s, 2 H), 4.51-4.08 (m, 10 H), 4.08-3.82 (m, 4 H), 3.11-2.90 (m, 2 H), 2.80-2.54 (m, 4 H), 2.04-1.92 (m, 2 H), 1.80-1.30 (m, 4 H), 1.49 (s, 18 H). HRMS (ESI) m/z 계산치 C68H75Cl2N7O12P: 1282.4583, 실측치: 1282.4536 [MH+]; 계산치 C68H74Cl2KN7O12P: 1320.4142, 실측치: 1320.4119 [MK+]; 계산치 C68H74Cl2N7NaO12P: 1304.4402, 실측치: 1304.4388 [MNa+].
질소 하에 0℃에서 건조 DMA (3 mL) 중 23 (86 mg, 0.067 mmol)의 교반 용액에 DMA 중 피페리딘의 용액 (1.00 M, 0.58 mL, 0.58 mmol)을 첨가하고, 혼합물을 0℃에서 1시간 30분 동안 교반하였다. EtOAc 및 석유 에테르의 혼합물 (1:10, 60 mL)을 첨가하고, 혼합물을 0℃에서 40분 동안 교반하였다. 상청액을 가만히 따르고, 절차를 추가의 EtOAc-석유 에테르 (1:3, 50 mL에 이어서 30 mL)를 사용하여 반복하였다. 잔류 오일을 진공 하에 20℃에서 1시간 동안 건조시켜 중간체 아민 24 (67 mg, 94%)를 점착성 고체로서 수득하였다. 이 고체를 추가 정제 없이 후속 단계에 사용하였다.
건조 DMA (0.7 mL) 중 산 8 (30.4 mg, 0.098 mmol), EDCI.HCl (25.3 mg, 0.13 mmol) 및 TsOH (2.2 mg, 0.013 mmol)의 혼합물을 질소 하에 20℃에서 10분 동안 교반하였다. 이 혼합물에 상기 아민 24 (67 mg, 0.060 mmol)의 용액에 이어서 DIPEA (0.011 mL, 0.065 mmol)를 첨가하였다. 반응 혼합물을 질소 하에 20℃에서 20시간 동안 교반하였다. 빙수 (30 mL)를 첨가하고, 혼합물을 0℃에서 30분 동안 교반하였다. 분리된 고체를 여과해내고, 건조시키고, 실리카 겔 상에서 크로마토그래피 (DCM:EtOAc;MeOH 10:10:1로 용리)에 의해 정제하여 25 (44 mg, 54%)를 점착성 고체로서 수득하였다; [α]D -51.6° (c 0.16, CHCl3); 1H NMR [(CD3)2SO] δ 10.15 (s, D2O로 교환가능, 1 H), 9.66 (s, D2O로 교환가능, 1 H), 8.62 (s, 1 H), 8.59 (s, 1 H), 8.08-7.76 (m, 6 H, D2O 교환 후 4 H로 감소됨), 7.69-7.34 (m, 8 H), 6.97 (s, 2 H), 5.96 (t, J = 5.7 Hz, D2O로 교환가능, 1 H), 5.40 (s, D2O로 교환가능, 2 H), 5.11 (s, 2 H), 4.50-4.15 (m, 7 H), 4.02-3.82 (m, 4 H), 3.25 (t, 물 피크에 의해 부분적으로 가려짐, J = 6.8 Hz, 2 H), 3.13-2.86 (m, 4 H), 2.81-2.56 (m, 4 H), 2.45-2.33 (m, 4 H), 2.05-1.91 (m, 2 H), 1.83-1.09 (m, 12 H), 1.49 (s, 18 H). HRMS (ESI) m/z 계산치 C68H83Cl2N9O14P: 1350.5169, 실측치: 1350.5170 [MH+]; 계산치 C68H82Cl2KN9O14P: 1388.4727, 실측치: 1388.4771 [MK+]; 계산치 C68H82Cl2N9NaO14P: 1372.4988, 실측치: 1372.4992 [MNa+].
질소 하에 20℃에서 DCM (1.0 mL) 중 25 (30.3 mg, 0.022 mmol)의 교반 용액에 TFA (1.0 mL)를 첨가하였다. 첨가한 후, 혼합물을 이 온도에서 1분 동안 교반하였다. 차가운 석유 에테르 (20 mL)를 첨가하고, 혼합물을 0℃에서 15분 동안 교반하였다. 상청액을 가만히 따르고, 절차를 EtOAc-석유 에테르 (1:3, 2x20 mL)를 사용하여 반복하였다. 생성된 고체를 수집하고, 20℃에서 진공 하에 건조시켜 CBI-CBI LD4 (25.3 mg, 93%)를 베이지색 고체로서 수득하였다; [α]D -186° (c 0.059, MeOH); 1H NMR [(CD3)2SO] δ 10.13 (s, D2O로 교환가능, 1 H), 9.66 (s, D2O로 교환가능, 1 H), 8.62 (s, 1 H), 8.51 (s, 1 H), 8.10 (d, J = 8.4 Hz, 1 H), 8.00 (d, J = 8.5 Hz, 1 H), 7.94-7.73 (m, 4 H, D2O 교환 후 2 H로 감소됨), 7.65 (d, J = 8.4 Hz, 2 H), 7.60-7.32 (m, 6 H), 6.97 (s, 2 H), 6.00 (t, J = 5.5 Hz, D2O로 교환가능, 1 H), 5.45 (br s, D2O로 교환가능, 2 H), 5.13 (s, 2 H), 4.52-4.15 (m, 7 H), 4.10-3.82 (m, 4 H), 3.28 (t, 물 피크에 의해 부분적으로 가려짐, J = 6.9 Hz, 2 H), 3.13-2.84 (m, 4 H), 2.81-2.56 (m, 4 H), 2.47-2.34 (m, 4 H), 2.08-1.89 (m, 2 H), 1.84-1.53 (m, 4 H), 1.53-1.09 (m, 8 H), 2개의 H는 관찰되지 않음. HRMS (ESI) m/z 계산치 C60H65Cl2N9O14P: 1236.3771, 실측치: 1236.3772 [M-H]-.
(11aS)-4-((S)-6-아미노-2-(1-((5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)카르바모일)시클로부탄카르복스아미도)헥산아미도)벤질 8-((6-((S)-1-(클로로메틸)-5-((4-메틸피페라진-1-카르보닐)옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실)옥시)-11-히드록시-7-메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트 비스(2,2,2-트리플루오로아세테이트) (CBI-PBD LD2) 및 (11aS)-4-((S)-6-아미노-2-(1-((5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)카르바모일)시클로부탄카르복스아미도)헥산아미도)벤질 8-((6-((S)-1-(클로로메틸)-5-((4-메틸피페라진-1-카르보닐)옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실)옥시)-7,11-디메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트 비스(2,2,2-트리플루오로아세테이트) (CBI-PBD LD3)의 제조
단계 A:
화합물 15 (PCT/US2014/042560에서의 65j)의 합성:
(S)-4-((S)-2-(알릴옥시카르보닐아미노)-6-(tert-부톡시카르보닐아미노)헥산아미도)벤질 8-(6-((S)-1-(클로로메틸)-5-(4-메틸피페라진-1-카르보닐옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실옥시)-11-히드록시-7-메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트
반응식
단계 1. (S)-2,2,2-트리클로로에틸 6-(5-(tert-부톡시카르보닐아미노)-4-(2-(히드록시메틸)피롤리딘-1-카르보닐)-2-메톡시페녹시)헥사노에이트 54c
무수 THF (140 mL) 중 문헌 [Tercel et al. (2003) J. Med. Chem 46:2132-2151]의 절차에 의해 제조된 (S)-(2-아미노-4-히드록시-5-메톡시페닐)(2-(히드록시메틸)피롤리딘-1-일)메타논 54a (7.6 g, 28.6 mmol), 및 디-t-부틸 디카르보네이트 (12.48 g, 57.2 mmol)의 혼합물을 질소 분위기 중 환류 하에 18시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 2N NaOH (57.2 mL, 114 mmol) 및 MeOH (70 mL)를 첨가하였다. 혼합물을 실온에서 6시간 동안 교반하였다. 휘발성 물질을 감압 하에 35-40℃ (조 온도)에서 증발시켰다. 빙수 (250 mL)를 첨가하고, pH를 8-9로 0℃에서 조정하였다. 혼합물을 석유 에테르-에틸 아세테이트 (20:1) (2x400 mL)와 함께 실온에서 15분 동안 교반하였다. 유기 층을 분리하고, 버렸다. 수성 층을 DCM (4x300 mL)으로 추출하고, 합한 추출물을 건조 (MgSO4)시키고, 감압 하에 증발시켜 (S)-tert-부틸 5-히드록시-2-(2-(히드록시메틸)피롤리딘-1-카르보닐)-4-메톡시페닐카르바메이트 54b를 분홍색-백색 고체 (9.36 g, 89%)로서 수득하였다; mp 154-156℃; 1H NMR [(CD3)2SO] δ 9.51 (s, 1 H), 8.90 (s, 1 H), 7.27 (s, 1 H), 6.91 (s, 1 H), 4.73 (t, J = 5.8 Hz, 1 H), 4.16-4.02 (m, 1 H), 3.73 (s, 3 H), 3.64-3.34 (m, 4 H), 1.99-1.60 (m, 4 H), 1.43 (s, 9 H). 분석 (C18H26N2O6) 계산치: C, 59.00; H, 7.15; N, 7.65. 실측치: C, 58.94; H, 7.31; N, 7.39.
건조 DMA (7 mL) 중 문헌 [Tercel et al. (2003) J. Med. Chem 46:2132-2151]에서의 절차에 의해 제조된 54b (2.88 g, 7.87 mmol) 및 2,2,2-트리클로로에틸 6-브로모헥사노에이트 (3.86 g, 11.8 mmol)의 용액에 무수 K2CO3 (2.61 g, 18.9 mmol)을 첨가하였다. 생성된 혼합물을 실온에서 68시간 동안 교반하였다. 이를 빙수 (600 mL)에 붓고, 생성물을 에틸 아세테이트 (600 mL)로 추출하였다. 추출물을 차가운 (0℃) 수성 2N Na2CO3 용액 (2x400 mL) 및 물 (400 mL)로 연속적으로 세척한 다음, 건조 (MgSO4)시켰다. 용매를 증발시켜 갈색 오일을 수득하였으며, 이를 SiO2 칼럼 크로마토그래피 (DCM-에틸 아세테이트 = 2:1)에 의해 정제하여 순수한 (S)-2,2,2-트리클로로에틸 6-(5-(tert-부톡시카르보닐아미노)-4-(2-(히드록시메틸)피롤리딘-1-카르보닐)-2-메톡시페녹시)헥사노에이트 54c (3.62 g, 76%)를 연황색 발포체로서 수득하였다; mp 36-39℃; 1H NMR [(CD3)2SO] δ 9.90 (s, 1 H), 7.33 (s, 1 H), 6.93 (s, 1 H), 4.89 (s, 2 H), 4.74 (t, J = 5.8 Hz, 1 H), 4.17-4.02 (m, 1 H), 3.94 (t, J = 6.4 Hz, 2 H), 3.73 (s, 3 H), 3.63-3.26 (m, 4 H), 2.55-2.46 (m, 2 H, DMSO 피크에 의해 부분적으로 가려짐), 2.00-1.55 (m, 8 H), 1.53-1.36 (m, 11 H). 분석 (C26H37N2O8) 계산치: C, 51.03; H, 6.09; N, 4.58. 실측치: C, 51.33; H, 6.21; N, 4.35.
단계 2: (S)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 58b
CH2Cl2 (80 mL) 중 (S)-tert-부틸 1-(클로로메틸)-5-히드록시-1H-벤조[e]인돌-3(2H)-카르복실레이트 51a (3.338 g, 10 mmol), 4-메틸피페라진-1-카르보닐 클로라이드 히드로클로라이드 (5.98 g, 30 mmol), Et3N (3.5 g, 35 mmol) 및 DMAP (1.34 g, 11 mmol)의 혼합물을 실온에서 2일 동안 교반하였다. 도 12를 참조한다. 혼합물을 물로 세척하고, 용매를 건조시키고, 진공 하에 제거하여 (S)-tert-부틸 1-(클로로메틸)-5-(4-메틸피페라진-1-카르보닐옥시)-1H-벤조[e]인돌-3(2H)-카르복실레이트 58a (Boger D.L. et al., Synthesis, (1999), 1505-1509)를 정량적 수율로 수득하였다: mp 98℃; 1H NMR (CDCl3) δ 8.11 (br, 1H), 7.84 (d, J = 8.4 Hz, 1H), 7.70 (d, J = 8.4 Hz, 1H), 7.50 (ddd, J = 8.2, 6.9, 1.1 Hz, 1H), 7.37 (ddd, J = 8.1, 6.9, 1.0 Hz, 1H), 4.34-4.20 (m, 1H), 4.17-4.10 (m, 1H), 4.01-3.98 (m, 1H), 3.94 (dd, J = 9.6, 2.4 Hz, 1H), 3.87-3.80 (br, 2H), 3.68-3.60 (br, 2H), 3.47 (t, J = 10.8 Hz, 1H), 2.57-2.48 (m, 4H), 2.83 (s, 3H), 1.58 (s, 9H); MS (APCI+) m/z 461.2 MH+. 분석 계산치 C24H30ClN3O4: C, 62.7; H, 6.6; N, 9.1. 실측치: C, 62.5; H, 6.8; N, 9.2%.
CH2Cl2 (50 mL) 중 58a (2.30 g, 5 mmol)의 용액을 과량의 트리플루오로아세트산 (TFA)으로 0℃에서 4시간 동안 처리하고, 혼합물을 차가운 수성 NH3으로 중화시켰다. 헥산으로 희석하여 고체를 침전시켰으며, 이를 여과에 의해 수집하고, 물 및 헥산으로 세척하고, 건조시켜 (S)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 58b (1.60 g, 89%)를 수득하였다: mp 144-147℃; 1H NMR (CDCl3) δ 7.69 (d, J = 8.4 Hz, 1H), 7.63 (d, J = 8.4 Hz, 1H), 7.45 (ddd, J = 8.3, 6.9, 1.2 Hz, 1H), 7.25 (ddd, J = 8.4, 6.8, 1.2 Hz, 1H), 6.82 (s, 1H), 5.30 (s, 1H), 4.17-4.05 (m, 2H), 4.03-3.96 (m, 2H), 3.89-3.77 (m, 4H), 3.54 (t, J = 10.9 Hz, 1H), 3.20-2.90 (m, 4H), 2.76 (s, 3H). 분석 계산치 C19H22ClN3O2: C, 63.4; H, 6.2; N, 11.7. 실측치: C, 63.2; H, 6.2; N, 11.5%.
단계 3: (S)-3-(6-(4-((S)-2-(아세톡시메틸)피롤리딘-1-카르보닐)-5-아미노-2-메톡시페녹시)헥사노일)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 65d
실온에서 건조 DCM (10 mL) 중 (S)-2,2,2-트리클로로에틸 6-(5-(tert-부톡시카르보닐아미노)-4-(2-(히드록시메틸)피롤리딘-1-카르보닐)-2-메톡시페녹시)헥사노에이트 54c (1.66 g, 2.71 mmol)의 교반 용액에 아세트산 무수물 (1.29 mL, 13.6 mmol) 및 트리에틸아민 (2.27 mL, 16.3 mmol)을 첨가하였다. 도 17을 참조한다. 반응 혼합물을 추가로 4시간 동안 교반하였다. 건조 MeOH (1.5 mL)를 첨가하고, 혼합물을 30분 동안 교반하였다. 에틸 아세테이트 (200 mL)를 첨가하고, 에틸 아세테이트 층을 분리한 다음, 물로 수회 세척하였다. 에틸 아세테이트 용액을 건조 (MgSO4)시키고, 증발시켜 (S)-2,2,2-트리클로로에틸 6-(4-(2-(아세톡시메틸)피롤리딘-1-카르보닐)-5-(tert-부톡시카르보닐아미노)-2-메톡시페녹시)헥사노에이트 65a (1.8 g, 100%)를 연황색 점착물로서 수득하였다; 1H NMR [(CD3)2SO] δ 8.82 (br s, 1 H), 7.27 (s, 1 H), 6.86 (s, 1 H), 4.89 (s, 2 H), 4.39-4.20 (m, 3 H), 3.93 (t, J = 6.4 Hz, 2 H), 3.74 (s, 3 H), 3.50-3.33 (m, 2 H), 2.10-1.94 (m, 4 H), 1.92-1.61 (m, 7 H), 1.53-1.42 (m, 2 H), 1.43 (s, 9 H), 2개의 H는 DMSO에 의해 가려짐. HRMS (ESI) m/z 계산치 C28H39Cl3N2NaO9: 675.1613, 실측치: 675.1603 [MNa+]. 계산치 C28H40Cl3N2O9: 653.1794, 실측치: 653.1778 [MH+].
질소 하에 아세톤 (30 mL), 물 (20 mL), 및 THF (12 mL)의 혼합물 중 65a (1.76 g, 2.69 mmol)의 교반 용액에 Zn (7.06 g, 108 mmol) 및 NH4Cl (11.6 g, 216 mmol)을 첨가하였다. 혼합물을 실온에서 23시간 동안 교반하였다. 에틸 아세테이트 (100 mL)를 첨가하고, 혼합물을 15분 동안 교반하였다. 유기 층을 가만히 따랐다. 추출을 추가의 에틸 아세테이트 (2x100 mL)를 사용하여 반복하였다. 합한 유기 용액을 물 (2x100 mL)로 세척하고, 건조 (MgSO4)시키고, 셀라이트를 통해 여과하고, 증발시켜 (S)-6-(4-(2-(아세톡시메틸)피롤리딘-1-카르보닐)-5-(tert-부톡시카르보닐아미노)-2-메톡시페녹시)헥산산 65b (1.36 g, 96%)를 점착성 무색 발포체로서 수득하였다; 1H NMR [(CD3)2SO] δ 11.49 (매우 br s, 1 H), 8.83 (s, 1 H), 7.27 (s, 1 H), 6.86 (br s, 1 H), 4.39-4.02 (m, 3 H), 3.93 (t, J = 6.4 Hz, 2 H), 3.74 (s, 3 H), 3.51-3.33 (m, 2 H, 물 피크에 의해 부분적으로 가려짐), 2.21 (t, J = 7.1 Hz, 2 H), 2.11-1.93 (m, 4 H), 1.90-1.66 (m, 5 H), 1.62-1.50 (m, 2 H), 1.50-1.35 (m, 2 H), 1.43 (s, 9 H). 분석 (C26H38N2O9.) 계산치: C, 59.76; H, 7.33; N, 5.36. 실측치: C, 59.66; H, 7.49; N, 5.29.
질소 분위기 하에 0℃에서 건조 DMA (5 mL) 중 65b (0.87 g, 2.41 mmol) 및 (S)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 58b (1.26 g, 2.41 mmol)의 교반 용액에 p-디옥산 중 4M HCl (1.21 mL, 4.82 mmol)에 이어서 EDCI.HCl (1.39 g, 7.23 mmol), 및 무수 TsOH (83 mg, 0.48 mmol)를 첨가하였다. 반응 혼합물을 질소 하에 0℃에서 21시간 동안 교반한 다음, 에틸 아세테이트 (500 mL)와 물 (500 mL) 사이에 분배하였다. 에틸 아세테이트 층을 분리하고, 수성 층을 추가로 추가의 에틸 아세테이트 (200 mL)로 추출하였다. 합한 에틸 아세테이트 추출물을 물 (200 mL), 포화 NaHCO3 용액 (2x200 mL) 및 물 (200 mL)로 연속적으로 세척하였다. 에틸 아세테이트 층을 건조시키고, 증발시켜 (S)-3-(6-(4-((S)-2-(아세톡시메틸)피롤리딘-1-카르보닐)-5-(tert-부톡시카르보닐아미노)-2-메톡시페녹시)헥사노일)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 65c (1.66 g, 80%)를 베이지색 고체-발포체로서 수득하였다; mp 84-87℃; 1H NMR [(CD3)2SO] δ 8.84 (br s, 1 H), 8.21 (s, 1 H), 7.95 (d, J = 8.3 Hz, 1 H), 7.81 (d, J = 8.3 Hz, 1 H), 7.58 (br t, J = 7.7, 1 H), 7.46 (br t, J = 8.1 Hz, 1 H), 7.29 (s, 1 H), 6.86 (s, 1 H), 4.40 (t, J = 10.0 Hz, 1 H), 4.36-3.86 (m, 10 H), 3.83-3.74 (m, 1 H), 3.73 (s, 3 H), 3.54-3.36 (m, 4 H), 2.67-2.34 (m, 6 H, DMSO 피크에 의해 부분적으로 가려짐), 2.26 (s, 3 H), 2.02 (br s, 3 H), 1.93-1.62 (m, 8 H), 1.60-1.47 (m, 2 H), 1.42 (s, 9 H). 분석 (C45H58ClN5O10 ·1½H2O) 계산치: C, 60.63; H, 6.90; N, 7.86. 실측치: C, 60.39; H, 6.66; N, 8.08.
질소 분위기 하에 0℃에서 DCM (20 mL) 중 65c (2.17 g, 2.51 mmol)의 교반 용액에 TFA (20 mL)를 첨가하였다. 첨가한 후, 혼합물을 추가로 이 온도에서 2.5시간 동안 교반하였다. 혼합물을 NaHCO3 (50 g), 물 (700 mL), 및 DCM (500 mL)의 차가운 (0℃) 혼합물에 붓고, 15분 동안 교반하였다 (pH 대략 8). DCM 층을 분리하고, 추가의 수성 NaHCO3 (200 mL) 및 물 (200 mL)로 세척한 다음, 건조 (MgSO4)시켰다. 용매를 증발시켜 (S)-3-(6-(4-((S)-2-(아세톡시메틸)피롤리딘-1-카르보닐)-5-아미노-2-메톡시페녹시)헥사노일)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 65d를 연갈색 고체-발포체 (1.76 g, 92%)로서 수득하였다; mp 62℃; 1H NMR [(CD3)2SO] δ 8.21 (s, 1 H), 7.95 (d, J = 8.3 Hz, 1 H), 7.81 (d, J = 8.3 Hz, 1 H), 7.57 (br t, J = 7.6 Hz, 1 H), 7.46 (br t, J = 7.2 Hz, 1 H), 6.67 (s, 1 H), 6.37 (s, 1 H), 5.09 (s, 2 H), 4.41 (t, J = 9.7 Hz, 1 H), 4.36-4.20 (m, 3 H), 4.17-4.00 (m, 3 H), 3.97-3.86 (m, 3 H), 3.81-3.70 (m, 2 H), 3.63 (s, 3 H), 3.54-3.32 (m, 5 H), 2.66-2.34 (m, 6 H, DMSO 피크에 의해 부분적으로 가려짐), 2.26 (s, 3 H), 2.08-1.96 (m, 1 H), 2.10 (s, 3 H), 1.93-1.63 (m, 7 H), 1.57-1.45 (m, 2 H). 분석 (C40H50ClN5O8·½H2O) 계산치: C, 62.13; H, 6.65; N, 9.06. 실측치: C, 62.12; H, 6.76; N, 8.77.
단계 4: 65g
건조 DMA (10 mL) 중 (S)-2-(알릴옥시카르보닐아미노)-6-(tert-부톡시카르보닐아미노)헥산산 65e (3.30 g, 10.0 mmol) 및 EEDQ (3.71 g, 15.0 mmol)의 혼합물을 질소 하에 실온에서 15분 동안 교반하였다. 도 18을 참조한다. 이 미리 형성된 혼합물에 건조 DMA (3 mL) 중 4-((tert-부틸디메틸실릴옥시)메틸)아닐린 (DMF 중 상응하는 p-니트로벤질 알콜 및 TBDMSCl로부터 제조되고; 이어서 Zn/NH4Cl을 사용하여 환원됨) (2.37 g, 10.0 mmol)의 용액을 첨가하였다. 최종 반응 혼합물을 추가로 질소 분위기 하에 실온에서 23시간 동안 교반하였다. 혼합물을 에틸 아세테이트 (500 mL)와 물 (500 mL) 사이에 분배하였다. 에틸 아세테이트 층을 분리하고, 포화 NaHCO3 (2x300 mL) 및 물 (300 mL)로 연속적으로 세척한 다음, 건조 (MgSO4)시켰다. 용매를 증발시켜 오렌지색 오일을 수득하였으며, 이를 실리카 칼럼 크로마토그래피 (석유 에테르-에틸 아세테이트 구배, 10-35%)에 의해 정제하여 TBDMS-보호된 리신 65f (4.87 g, 89%)를 점착성 베이지색 고체-발포체로서 수득하였다; 1H NMR [(CD3)2SO] δ 9.97 (s, 1 H), 7.55 (d, J = 8.50 Hz, 2 H), 7.44 (d, J = 7.8 Hz, 1 H), 7.21 (d, J = 8.5 Hz, 2 H), 6.75 (t, J = 5.3 Hz, 1 H), 5.99-5.82 (m, 1 H), 5.28 (br d, J = 17.2 Hz, 1 H), 5.17 (br d, J = 10.5 Hz, 1 H), 4.64 (s, 2 H), 4.46 (d, J = 5.2 Hz, 2 H), 4.12-4.02 (m, 1 H), 2.93-2.83 (m, 2 H), 1.70-1.52 (m, 2 H), 1.46-1.20 (m, 4 H), 1.35 (s, 9 H), 0.89 (s, 9 H), 0.06 (s, 6 H). HRMS (ESI) m/z 계산치 C28H47N3NaO6Si: 572.3126, 실측치: 572.3136 [MNa+].
실온에서 THF (30 mL) 중 65f (4.81 g, 8.75 mmol)의 교반 용액에 THF 중 테트라부틸암모늄 플루오라이드의 1M 용액 (17.5 mL, 17.5 mmol)을 첨가하였다. 첨가한 후, 혼합물을 이 온도에서 추가로 2.5시간 동안 교반하였다. 수성 NH4Cl (300 mL)을 첨가하고, 생성물을 에틸 아세테이트 (500 mL)로 추출하였다. 에틸 아세테이트를 물 (2x100 mL)로 세척하고, 건조 (MgSO4)시켰다. 용매를 증발시켜 벤질 알콜 리신 65g (3.81 g, 100%)를 베이지색 고체로서 수득하였다; mp 101-103℃; 1H NMR [(CD3)2SO] δ 9.94 (s, 1 H), 7.52 (d, J = 8.4 Hz, 2 H), 7.44 (d, J = 7.8 Hz, 1 H), 7.23 (d, J = 8.4 Hz, 2 H), 6.76 (t, J = 5.4 Hz, 1 H), 5.97-5.84 (m, 1 H), 5.29 (br d, J = 17.2 Hz, 1 H), 5.17 (br d, J = 10.4 Hz, 1 H), 5.08 (t, J = 5.7 Hz, 1 H), 4.47 (d, J = 5.3 Hz, 2 H), 4.43 (d, J = 5.7 Hz, 2 H), 4.13-4.03 (m, 1 H), 2.96-2.82 (m, 2 H), 1.72-1.52 (m, 2 H), 1.46-1.20 (m, 4 H), 1.36 (s, 9 H). HRMS (ESI) m/z 계산치 C22H33N3NaO6: 458.2262, 실측치: 458.2272 [MNa+]; 계산치 C22H33N3KO6: 474.2001, 실측치: 474.1998 [MK+].
단계 5: (S)-3-(6-(4-((S)-2-(아세톡시메틸)피롤리딘-1-카르보닐)-5-((4-((S)-2-(알릴옥시카르보닐아미노)-6-(tert-부톡시카르보닐아미노)헥산아미도)벤질옥시)카르보닐아미노)-2-메톡시페녹시)헥사노일)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 65h
질소 하에 실온에서 건조 DCM (15 mL) 중 65d (764 mg, 1.00 mmol) 및 DMAP (367 mg, 3.00 mmol)의 교반 용액에 건조 DCM 중 디포스겐의 용액 (0.05 mmol / mL, 12 mL, 0.60 mmol)을 첨가하고, 혼합물을 추가로 20분 동안 교반하였다. 도 19를 참조한다. 이 혼합물에 건조 DCM (80 mL) 중 65g (3.97 g, 9.13 mmol)의 용액을 첨가하였다. 최종 반응 혼합물을 추가로 질소 분위기 하에 실온에서 48시간 동안 교반하였다. 혼합물을 에틸 아세테이트 (500 mL)와 물 (300 mL) 사이에 분배하였다. 에틸 아세테이트 층을 분리하고, 수성 층을 추가로 에틸 아세테이트 (2x200 mL)로 추출하였다. 합한 에틸 아세테이트 용액을 추가의 물 (2x200 mL)로 세척하고, 건조 (MgSO4)시켰다. 용매를 30℃ (조 온도)에서 증발시켜 오렌지색 오일을 수득하였으며, 이를 실리카 칼럼 크로마토그래피 (에틸 아세테이트-MeOH = 10:1)에 의해 정제하여 (S)-3-(6-(4-((S)-2-(아세톡시메틸)피롤리딘-1-카르보닐)-5-((4-((S)-2-(알릴옥시카르보닐아미노)-6-(tert-부톡시카르보닐아미노)헥산아미도)벤질옥시)카르보닐아미노)-2-메톡시페녹시)헥사노일)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 65h (1.04 g, 85%)를 연오렌지색 고체로서 수득하였다; mp 90-93℃; 1H NMR [(CD3)2SO] δ 10.04 (s, 1 H), 9.10 (br s, 1 H), 8.21 (s, 1 H), 7.95 (d, J = 8.3 Hz, 1 H), 7.81 (d, J = 8.3 Hz, 1 H), 7.63-7.53 (m, 3 H), 7.51-7.42 (m, 2 H), 7.32 (d, J = 8.5 Hz, 2 H), 7.21 (br s, 1 H), 6.85 (br s, 1 H), 6.79-6.72 (m, 1 H), 5.97-5.83 (m, 1 H), 5.29 (br d, J = 17.2 Hz, 1 H), 5.17 (br d, J = 10.4 Hz, 1 H), 5.08-4.96 (m, 2 H), 4.52-4.37 (m, 3 H), 4.37-3.85 (m, 10 H), 3.83-3.66 (m, 2 H), 3.74 (s, 3 H), 3.54-3.41 (m, 2 H), 3.41-3.23 (m, 2 H, 물 피크에 의해 부분적으로 가려짐), 2.95-2.83 (m, 2 H), 2.66-2.34 (m, 6 H, DMSO 피크에 의해 부분적으로 가려짐), 2.25 (s, 3 H), 2.07-1.92 (m, 4 H), 1.87-1.45 (m, 11 H), 1.45-1.20 (m, 4 H), 1.35 (s, 9 H). HRMS (ESI) m/z 계산치 C63H82ClN8O15: 1225.5583, 실측치: 1225.5557 [MH+]; 계산치 C63H81ClN8NaO15: 1247.5402, 실측치: 1247.5401 [MNa+]; 계산치 C63H81ClKN8O15: 1263.5142, 실측치: 1263.5141 [MK+].
DCM (20 mL) 및 MeOH (10 mL) 중 65h (1.01 g, 0.824 mmol) 및 K2CO3 (1.14 g, 8.24 mmol)의 혼합물을 실온에서 1시간 40분 동안 교반하였다. 혼합물을 DCM (200 mL)으로 희석하고, 빙수 (200 mL)와 함께 10분 동안 교반하였다. DCM 층을 분리하고, 수성 층을 추가로 DCM (2x100 mL)으로 추출하였다. 합한 DCM 용액을 추가의 물 (200 mL)로 세척하고, 건조 (MgSO4)시켰다. 용매를 25℃ (조 온도)에서 증발시켜 (S)-3-(6-(5-((4-((S)-2-(알릴옥시카르보닐아미노)-6-(tert-부톡시카르보닐아미노)헥산아미도)벤질옥시)카르보닐아미노)-4-((S)-2-(히드록시메틸)피롤리딘-1-카르보닐)-2-메톡시페녹시)헥사노일)-1-(클로로메틸)-2,3-디히드로-1H-벤조[e]인돌-5-일 4-메틸피페라진-1-카르복실레이트 65i (0.94 g, 96%)를 베이지색 고체로서 수득하였다; mp 104-107℃; 1H NMR [(CD3)2SO] δ 10.04 (s, 1 H), 9.17 (br s, 1 H), 8.21 (s, 1 H), 7.95 (d, J = 8.4 Hz, 1 H), 7.80 (d, J = 8.3 Hz, 1 H), 7.63-7.53 (m, 3 H), 7.51-7.42 (m, 2 H), 7.38-7.21 (m, 3 H), 6.93 (s, 1 H), 5.32 (t, J = 5.4 Hz, 1 H), 5.98-5.83 (m, 1 H), 5.30 (br d, J = 17.2 Hz, 1 H), 5.17 (br d, J = 11.7 Hz, 1 H), 5.03 (s, 2 H), 4.73 (t, J = 5.7 Hz, 1 H), 4.52-4.36 (m, 3 H), 4.36-4.17 (m, 2 H), 4.17-3.85 (m, 6 H), 3.83-3.66 (m, 2 H), 3.73 (s, 3 H), 3.61-3.40 (m, 4 H), 3.40-3.20 (m, 2 H, 물 피크에 의해 부분적으로 가려짐), 2.94-2.83 (m, 2 H), 2.67-2.34 (m, 6 H, DMSO 피크에 의해 부분적으로 가려짐), 2.25 (s, 3 H), 1.96-1.45 (m, 12 H), 1.45-1.20 (m, 4 H), 1.35 (s, 9 H). HRMS (ESI) m/z 계산치 C61H80ClN8O14: 1183.5477, 실측치: 1183.5445 [MH+]; 계산치 C61H79ClN8NaO14: 1205.5296, 실측치: 1205.5256 [MNa+]; 계산치 C61H79ClKN8O14: 1221.5036, 실측치: 1221.5026 [MK+].
0℃에서 건조 DCM (20 mL) 중 65i (0.92 g, 0.78 mmol)의 교반 용액에 데스-마르틴 퍼아이오디난 (DMP, 1,1,1-트리아세톡시-1,1-디히드로-1,2-벤즈아이오독솔-3(1H)-온, CAS 등록 번호 87413-09-0, 492 mg, 1.16 mmol)을 (8분에 걸쳐) 조금씩 첨가하였다. 첨가가 완결된 후, 반응 혼합물을 추가로 0℃에서 2시간 동안, 이어서 실온에서 45시간 동안 교반하였다. 혼합물을 DCM (100 mL)으로 희석하고, 10% Na2S2O3 (100 mL)과 함께 실온에서 10분 동안 교반하였다. 생성된 혼합물을 DCM (400 mL)과 포화 NaHCO3 용액 (400 mL) 사이에 분배하였다. DCM 층을 분리하고, 수성 층을 추가로 DCM (2x100 mL)으로 추출하였다. 합한 DCM 용액을 추가로 포화 NaHCO3 용액 (200 mL) 및 물 (200 mL)로 세척한 다음, 건조 (MgSO4)시켰다. 용매를 25℃ (조 온도)에서 증발시켜 연갈색 고체를 수득하였으며, 이를 SiO2 칼럼 크로마토그래피 (DCM-에틸 아세테이트-MeOH = 15:15:1에서 15:15:3, 구배)에 의해 정제하여 (S)-4-((S)-2-(알릴옥시카르보닐아미노)-6-(tert-부톡시카르보닐아미노)헥산아미도)벤질 8-(6-((S)-1-(클로로메틸)-5-(4-메틸피페라진-1-카르보닐옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실옥시)-11-히드록시-7-메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트 65j (0.64g, 70%)를 연황색 고체로서 수득하였다; mp 137℃ (분해); 1H NMR [(CD3)2SO] δ 10.02 (s, 1 H), 8.21 (s, 1 H), 7.95 (d, J = 8.4 Hz, 1 H), 7.80 (d, J = 8.3 Hz, 1 H), 7.65-7.38 (m, 5 H), 7.18 (d, J = 7.0 Hz, 2 H), 7.03 (s, 1 H), 6.82-6.63 (m, 2 H), 6.49 (불량하게 분해된 d, J = 4.7 Hz, D2O로 교환가능, 1 H), 5.96-5.82 (m, 1 H), 5.46 (불량하게 분해된 dd, J = 9.8, 4.7 Hz, D2O 후 d가 됨, J = 10.1 Hz, 1 H), 5.27 (br d, J = 17.1 Hz, 1 H), 5.21-5.10 (m, 2 H), 4.81 (br d, J = 12.3 Hz, 1 H), 4.51-4.17 (m, 5 H), 4.13-3.84 (m, 4 H), 3.84-3.67 (m, 2 H), 3.77 (s, 3 H), 3.55-3.20 (m, 6 H, 물 피크에 의해 부분적으로 가려짐), 2.66-2.30 (m, 6 H, DMSO 피크에 의해 부분적으로 가려짐), 2.26 (s, 3 H), 2.10-1.20 (m, 16 H), 1.35 (s, 9 H였음). HRMS (ESI) m/z 계산치 C61H78ClN8O14:1181.5321, 실측치: 1181.5286 [MH+]; 계산치 C61H77ClN8NaO14: 1203.5140, 실측치: 1203.5130 [MNa+]; 계산치 C61H77ClKN8O14: 1219.4879, 실측치: 1219.4861 [MK+].
단계 B:
(11aS)-4-((S)-6-아미노-2-(1-((5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)카르바모일)시클로부탄카르복스아미도)헥산아미도)벤질 8-((6-((S)-1-(클로로메틸)-5-((4-메틸피페라진-1-카르보닐)옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실)옥시)-11-히드록시-7-메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트 비스(2,2,2-트리플루오로아세테이트) (CBI-PBD LD2) 및 (11aS)-4-((S)-6-아미노-2-(1-((5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)카르바모일)시클로부탄카르복스아미도)헥산아미도)벤질 8-((6-((S)-1-(클로로메틸)-5-((4-메틸피페라진-1-카르보닐)옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실)옥시)-7,11-디메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트 비스(2,2,2-트리플루오로아세테이트) (CBI-PBD LD3)
CBI-PBD LD2 및 CBI-PBD LD3의 합성
합성 반응식
CBI-PBD LD2 및 CBI-PBD LD3의 합성
합성 반응식 (계속)
1-(tert-부톡시카르보닐)시클로부탄카르복실산 (16) (200 mg, 1.00 mmol) (PCT Int. Appl. 2002, WO 2002076968 A1), 1-(5-아미노펜틸)-1H-피롤-2,5-디온 히드로클로라이드 (17) (218 mg, 1.00 mmol) (J. Med. Chem. 2013, 56, 7890-7901), EDCI.HCl (576 mg, 3.00 mmol) 및 TsOH (35 mg, 0.20 mmol)의 혼합물에 DMA (2 mL)를 첨가하였다. 혼합물을 20℃에서 15분 동안 교반하고, DIPEA (0.17 mL, 1.00 mmol)를 첨가하였다. 반응 혼합물을 추가로 20시간 동안 교반하고, EtOAc (200 mL)와 물 (100 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 차가운 1N HCl (100 mL), 포화 NaHCO3 (100 mL), 및 물 (100 mL)로 연속적으로 세척한 다음, 건조 (MgSO4)시켰다. 용매를 증발시켜 tert-부틸 1-((5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)카르바모일)시클로부탄카르복실레이트 (18) (290 mg, 80%)를 연황색 고체로서 수득하였다; mp 63-65℃; 1H NMR [(CD3)2SO] δ 7.58 (t, J = 5.6 Hz, 1 H), 7.00 (s, 2 H), 3.37 (t, J = 7.0 Hz, 2 H), 3.03 (q, J = 6.0 Hz, 2 H), 2.40-2.23 (m, 4 H), 1.85-1.64 (m, 2 H), 1.55-1.32 (m, 4 H), 1.38 (s, 9 H), 1.26-1.01 (m, 2 H). HRMS (ESI) m/z 계산치 C19H29N2O5: 365.2071, 실측치: 365.2071 [MH+]; 계산치 C19H28N2NaO5: 387.1890, 실측치: 387.1898 [MNa+]; 계산치 C19H28KN2O5: 403.1630, 실측치: 403.1629 [MK+].
DCM (50 mL) 중 18 (794 mg, 2.18 mmol)의 교반 용액에 메탄술폰산 (2.83 mL, 43.6 mmol)을 첨가하였다. 탁한 혼합물을 20℃에서 2시간 30분 동안 교반하였다. 혼합물을 DCM (200 mL)으로 희석하고, 물 (2x50 mL)로 세척하였다. DCM 용액을 건조 (MgSO4)시키고, 25℃ (조 온도)에서 증발시켜 1-((5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)카르바모일)시클로부탄카르복실산 (19) (636 mg, 95%)을 연황색 고체로서 수득하였다; mp 100-102℃; 1H NMR [(CD3)2SO] δ 12.46 (br s, 1 H), 7.63 (t, J = 5.4 Hz, 1 H), 7.00 (s, 2 H), 3.37 (t, J = 7.0 Hz, 2 H), 3.02 (q, J = 5.9 Hz, 2 H), 2.42-2.28 (m, 4 H), 1.89-1.63 (m, 2 H), 1.55-1.32 (m, 4 H), 1.29-1.11 (m, 2 H). 분석 (C15H20N2O5) 계산치: C, 58.43; H, 6.54; N, 9.09. 실측치: C, 58.54; H, 6.39; 8.84.
질소 분위기 하에 20℃에서 건조 DCM (2 mL) 중 (11aS)-4-((S)-2-(((알릴옥시)카르보닐)아미노)-6-((tert-부톡시카르보닐)아미노)헥산아미도)벤질 8-((6-((S)-1-(클로로메틸)-5-((4-메틸피페라진-1-카르보닐)옥시)-1H-벤조[e]인돌-3(2H)-일)-6-옥소헥실)옥시)-11-히드록시-7-메톡시-5-옥소-2,3,11,11a-테트라히드로-1H-벤조[e]피롤로[1,2-a][1,4]디아제핀-10(5H)-카르복실레이트 (15) (177 mg, 0.15 mmol) (출원된 특허: GENENLAW-#446508 참조)의 교반된 균질 용액에 피롤리딘 (0.122 mL, 1.50 mmol)에 이어서 Pd(Ph3P)4 (4.28 mg, 9.8% Pd)를 첨가하였다. 첨가한 후, 반응 혼합물을 추가로 20℃ (N2)에서 25분 동안 교반하였다. 혼합물을 석유 에테르 (50 mL)로 희석하고, 20℃ (N2)에서 10분 동안 교반하였다. 용매를 가만히 따르고, 절차를 DCM-석유 에테르 (1:10) (2x30 mL)를 사용하여 반복하였다. 남겨진 고체를 DCM (100 mL) 중에 용해시키고, 물 (50 mL), 염수 (50 mL)로 세척한 다음, 건조 (MgSO4)시켰다. 용매를 25℃ (조 온도)에서 증발시켜 유리 아민을 베이지색 고체 (140 mg, 85%)로서 수득하였다. 일부의 이 물질 (110 mg, 0.10 mmol)을 건조 DMA (1 mL) 중 19 (34 mg, 0.11 mmol), EDCI.HCl (58 mg, 0.30 mmol), 및 TsOH (3.4 mg, 0.02 mmol)의 미리 형성된 (20℃에서 10분 동안) 혼합물로 (질소 분위기 하에) 20℃에서 처리하였다. 10분 후, DIPEA (0.02 mL, 0.10 mmol)를 첨가하고, 반응 혼합물을 추가로 22시간 동안 교반하였다. 혼합물을 EtOAc (200 mL)와 물 (100 mL) 사이에 분배하였다. EtOAc 층을 분리하고, 추가로 포화 NaHCO3 (100 mL), 물 (100 mL)로 세척한 다음, 건조 (MgSO4)시켰다. 용매를 25℃ (조 온도)에서 증발시켜 조 생성물을 수득하였으며, 이를 SiO2 칼럼 크로마토그래피 (DCM-EtOAc-MeOH = 20:10:3)에 의해 정제하여 20 (92 mg, 66%)을 연황색 고체로서 수득하였다; mp 106-109℃; [α]D +43.1° (c 0.418, CHCl3); 1H NMR [(CD3)2SO] δ 10.06 (s, D2O로 교환가능, 1 H), 8.21 (s, 1 H), 7.95 (d, J = 8.4 Hz, 1 H), 7.85-7.77 (m, 2 H, D2O 후 1 H로 감소됨), 7.75 (d, J = 8.0 Hz, D2O로 교환가능, 1 H), 7.65-7.51 (m, 3 H), 7.46 (t, J = 7.6 Hz, 1 H), 7.24-7.11 (m, 2 H), 7.03 (s, 1 H), 6.96 (s, 2 H), 6.79-6.66 (m, 2 H, D2O 후 1 H로 감소됨), 6.54-6.43 (m, D2O로 교환가능, 1 H), 5.52-5.41 (m, 그러나 D2O 후 d, J = 9.5 Hz, 1 H), 5.15 (d, J = 12.0 Hz, 1 H), 4.81 (d, J = 12.0 Hz, 1 H), 4.47-4.18 (m, 5 H), 4.08-3.98 (m, 1 H), 3.97-3.86 (m, 2 H), 3.84-3.67 (m, 5 H), 3.56-3.21 (m, 8 H, 물 피크에 의해 부분적으로 가려짐), 3.12-3.02 (m, 그러나 D2O 후 t, J = 6.2 Hz, 2 H), 2.92-2.80 (m, 2 H), 2.65-2.33 (m, 10 H, DMSO 피크에 의해 부분적으로 가려짐), 2.25 (s, 3 H), 2.15-1.12 (m, 23 H), 1.33 (s, 9 H). HRMS (ESI) m/z 계산치 C72H92ClN10O16: 1387.6376, 실측치: 1387.6319 [MH+]; 계산치 C72H91ClN10NaO16: 1409.6195, 실측치: 1409.6146 [MNa+]; 계산치 C72H91ClKN10O16: 1425.5935, 실측치: 1425.5875 [MK+].
질소 하에 20℃에서 DCM (5 mL) 중 20 (79 mg, 0.057 mmol)의 교반 용액에 TFA (5 mL)를 첨가하였다. 첨가한 후, 혼합물을 추가로 이 온도에서 20분 동안 교반하였다. 석유 에테르 (100 mL)를 첨가하고, 혼합물을 20℃에서 30분 동안 교반하였다. 용매를 제거하고, 남겨진 오일을 추가의 EtOAc-석유 에테르 (1:10) (3x50 mL)와 함께 교반하였다. 잔류 오일을 MeOH 중에 용해시키고, 용액을 증발시켜 유리질 고체 (76 mg)를 수득하였으며, 이를 CH3CN 중 정제용 HPLC [시너지맥스RP(SynergiMaxRP) 칼럼, 4μ, 21x250 mm; 물-TFA (pH = 2.56; 95%에서 55%)/10% H2O (5%에서 45%); 구배 시간 30분; 유량: 12 mL/분]에 의해 정제하여 (i) CBI-PBD LD2 (26.2 mg, 30%)를 연호박색 고체로서 수득하였다; HPLC 순도: 98.5%; [α]D +30.0° (c 0.233, MeOH); 1H NMR [(CD3)2SO] δ 10.08 (s, D2O로 교환가능, 1 H), 9.82 (br s, D2O로 교환가능, 1 H), 8.27 (s, 1 H), 7.97 (d, J = 8.4 Hz, 1 H), 7.92-7.79 (m, 3 H, D2O 후 1 H로 감소됨), 7.67-7.52 (m, 5 H, D2O 후 3 H로 감소됨), 7.46 (t, J = 8.0 Hz, 1 H), 7.21-7.11 (m, 2 H), 7.04 (s, 1 H), 6.97 (s, 2 H), 6.75 (s, 1 H), 6.50 (br s, 1 H, D2O로 교환가능), 5.45 (br d, 그러나 D2O 후 d, J = 9.0 Hz, 1 H), 5.10 (br d, J = 13 Hz, 1 H), 4.87 (br d, J = 12 Hz, 1 H), 4.55-4.10 (m, 5 H), 4.50 (dd, J = 11.4, 3.4 Hz, 1 H), 4.01-3.88 (m, 2 H), 3.76 (s, 3 H), 3.39-3.22 (m, 4 H), 3.14-3.03 (m, 2 H), 2.89 (s, 3 H), 2.81-2.69 (m, 2 H), 2.65-2.55 (m, 1 H), 2.47-2.34 (m, 4 H), 2.07-1.13 (m, 23 H), 나머지 12개의 H는 물 및 DMSO 피크에 의해 가려짐. HRMS (ESI) m/z 계산치 C67H84ClN10O14:1287.5852, 실측치: 1287.5845 [MH+]; 계산치 C67H83ClN10NaO14: 1309.5671, 실측치: 1309.5654 [MNa+].
또한 (ii) CBI-PBD LD3 (11.2 mg, 15%)을 베이지색 고체로서 정제하였다; HPLC 순도: 92.6%; 1H NMR [(CD3)2SO] δ 10.07 (s, D2O로 교환가능, 1 H), 9.90 (br s, D2O로 교환가능, 1 H), 8.27 (s, 1 H), 7.96 (d, J = 8.5 Hz, 1 H), 7.93-7.76 (m, 3 H, D2O 후 1 H로 감소됨), 7.73-7.51 (m, 5 H, D2O 후 3 H로 감소됨), 7.46 (t, J = 8.2 Hz, 1 H), 7.16-7.08 (m, 2 H), 7.04 (s, 1 H), 6.97 (s, 2 H), 6.85 (s, 1 H), 5.33 (br d, J = 7.8 Hz, 1 H), 5.07 (br d, J = 12 Hz, 1 H), 4.93 (br d, J = 13 Hz, 1 H), 4.56-4.10 (m, 5 H), 3.77 (s, 3 H), 3.62-3.23 (m, 6 H), 3.44 (s, 3 H), 3.15-3.01 (m, 2 H), 2.89 (s, 3 H), 2.82-2.69 (m, 2 H), 2.66-2.55 (m, 1 H), 2.46-2.34 (m, 4 H), 2.11-1.12 (m, 23 H), 나머지 13개의 H는 물 및 DMSO 피크에 의해 가려짐. HRMS (ESI) m/z 계산치 C68H86ClN10O14: 1301.6008, 실측치: 1301.5952 [MH+]; 계산치 C68H85ClN10NaO14: 1323.5827, 실측치: 1323.5778 [MNa+].
(2E,2'E)-3,3'-(2-(3-((S)-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)프로판아미도)-1,4-페닐렌)디아크릴산의 제조
반응식
INT 12의 합성:
건조 DMF (20 mL) 중 2 (1.35 g, 4.34 mmol)의 교반 용액에 HATU (2.20 g, 5.79 mmol), DIEA (1.12 g, 8.68 mmol)를 첨가하였다. 혼합물을 25℃에서 10분 동안 교반한 후, 화합물 1 (1.0 g, 2.89 mmol)을 첨가하였다. 반응 혼합물을 N2 하에 25℃에서 15시간 동안 교반하였다. 물 (20 mL)을 첨가하고, 이를 EtOAc (30 mLx3)로 추출하였다. 합한 유기 상을 염수로 세척하고, Na2SO4 상에서 건조시키고, 농축시켰다. 이를 플래쉬 칼럼 (PE: EtOAc = 1:1)에 의해 정제하여 조 생성물 3 (2.25 g)을 황색 고체로서 수득하였다. LCMS: (5-95 AB, 1.5분), 1.075분, [M-114]+= 527.0.
건조 DCM (30 mL) 중 화합물 3 (1.95 g, 3.05 mmol)의 교반 용액에 피페리딘 (2.60 g, 30.5 mmol)을 첨가하였다. 혼합물을 N2 하에 25℃에서 2.5시간 동안 교반하였다. 이를 H2O (20 mLx3), 염수 (15 mL)로 세척하고, Na2SO4 상에서 건조시켰다. 이를 농축시키고, PE (20 mLx3)로 세척하고, 건조시켜 조 생성물 4 (2.4 g)를 황색 고체로서 수득하였다.
DME/H2O (40 mL / 20 mL) 중 화합물 9 (3.0 g, 17.1 mmol)의 용액에 NaHCO3 (2.88 g, 34.3 mmol)을 첨가하였다. 혼합물을 25℃에서 15분 동안 교반한 후, 화합물 10 (5.54 g, 20.6 mmol)을 첨가하였다. 혼합물을 N2 하에 25℃에서 16시간 동안 교반하였다. 용매를 제거하고, H2O (5 mL)를 첨가하였다. 이를 EtOAc (30 mLx3)로 추출하였다. 수상의 pH를 HCl 용액을 사용하여 3으로 조정하고, 이를 EtOAc (120 mLx3)로 추출하였다. 합한 유기 상을 Na2SO4 상에서 건조시키고, 농축시켜 조 생성물 11을 무색 오일로서 수득하였다.
건조 THF (120 mL) 중 화합물 11 (5.64 g, 17.1 mmol)의 용액에 HOSu (2.07 g, 17.98 mmol) 및 DCC (3.70 g, 17.98 mmol)를 첨가하였다. 혼합물을 N2 하에 25℃에서 15시간 동안 교반하였다. 이를 여과하고, 농축시켰다. 잔류물을 PE (30 mLx3)로 세척하고, 건조시키고, 농축시켜 조 생성물 12 (8.30 g)를 백색 고체로서 수득하였다.
건조 DMF (20 mL) 중 화합물 4 (1.65 g, 3.96 mmol)의 용액에 화합물 12 (2.03 g, 4.75 mmol)를 첨가하였다. 혼합물을 N2 하에 25℃에서 15시간 동안 교반하였다. 물 (30 mL)을 첨가하고, 이를 EtOAc (30 mLx3)로 추출하였다. 합한 유기 상을 염수 (30 mL)로 세척하고, Na2SO4 상에서 건조시켰다. 이를 농축시켜 조 생성물을 수득하였으며, 이를 PE (30 mLx4) 및 MTBE/PE (15 mL/45 mL x2)로 세척하고, 건조시켜 생성물 5 (0.96 g, 수율: 33%)를 담황색 고체로서 수득하였다.
MeOH (4 mL), THF (8 mL) 및 H2O (8 mL) 중 화합물 5 (0.96 g, 1.32 mmol)의 용액에 LiOH-H2O (111 mg, 2.64 mmol)를 첨가하였다. 혼합물을 N2 하에 25℃에서 30분 동안 교반하였다. 유기 용매를 감압 하에 제거하고, H2O (10 mL)를 첨가하였다. HCl 용액을 첨가하여 pH를 3-4로 조정하였다. 이를 EtOAc (50 mLx4)로 추출하고, Na2SO4 상에서 건조시키고, 농축시켜 조 생성물을 수득하였다. 조 생성물을 PE (30 mL) 및 MTBE (10 mL x 3)로 세척하고, 건조시켜 생성물 6 (620 mg, 수율: 67%)을 백색 고체로서 수득하였다.
건조 DMF (10 mL) 중 화합물 6 (620 mg, 0.89 mmol)의 용액에 0℃에서 DIEA (573 mg, 4.43 mmol) 및 Bop-Cl (248 mg, 0.97 mmol)을 첨가하였다. 화합물 7 (177.59 mg, 0.97 mmol)을 첨가하였다. 혼합물을 0℃에서 30분 동안 N2 하에 교반한 후, H2O (20 mL)를 첨가하고, 이를 EtOAc (30 mLx3)로 추출하였다. 합한 유기 상을 염수 (30 mL)로 세척하고, Na2SO4 상에서 건조시키고, 농축시켜 조 생성물을 수득하였다. 이를 MTBE (10 mL x2) 및 PE (50 mLx3)로 세척하고, 건조시켜 생성물 8 (690 mg, 수율: 90%)을 백색 고체로서 수득하였다. LCMS: (5-95 AB, 1.5분), 0.875분, MS=864.2 [M+1];
건조 DCM (4.0 mL) 중 화합물 8 (300 mg, 0.347 mmol)의 교반 용액에 TFA (2.0 mL)를 적가하였다. 혼합물을 N2 하에 25℃에서 30분 동안, 용매를 제거하였다. 잔류물을 DMF 중에 용해시키고, 정제용 HPLC (HCOOH)에 의해 정제하여 생성물 (2E,2'E)-3,3'-(2-(3-((S)-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)프로판아미도)-1,4-페닐렌)디아크릴산 (81.4 mg, 수율: 31%)을 담황색 분말로서 수득하였다.
1H NMR (400 MHz, DMSO-d6) δ 9.93 (s, 2H), 6.13 (s, 1H), 7.82 - 7.46 (m, 8H), 6.98 (s, 2H), 6.55 - 6.51 (d, J = 16.0 Hz, 2H), 5.98 (s, 1H), 5.41 (s, 2H), 4.22 (s, 1H), 3.03 - 2.90 (m, 6H ), 2.67 - 2.50 (m, 4H), 2.36 (s, 4H), 1.69 (s, 3H), 1.46 - 1.33 (m, 7H), 1.23 - 1.16 (d, J = 28 Hz, 2H).
CBI-CBI LD5의 제조
4-((S)-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질 2,5-비스((E)-3-((S)-1-(클로로메틸)-5-(포스포노옥시)-1H-벤조[e]인돌-3(2H)-일)-3-옥소프로프-1-에닐)페닐카르바메이트
2
빙조에서 냉각시킨 MeOH (2 mL) 중 1 (230 mg, 0.44 mmol)의 용액에 Cs2CO3 (287 mg, 0.88 mmol) 및 몇 방울의 물을 첨가하였다. 혼합물을 빙조에서 1시간 동안 교반한 다음, 에틸 아세테이트와 물 사이에 재분포시켰다. 수성 상을 에틸 아세테이트로 3회 추출하였다. 합한 유기 추출물을 물 및 염수로 세척하고, 무수 Na2SO4 상에서 건조시키고, 셀라이트를 통해 여과하고, 용매를 제거하였다. 생성된 잔류물을 에틸 아세테이트 중에 용해시키고, 플로리실(Florisil)의 패드를 통해 여과하여 조 2를 회백색 검 (188 mg, 100%)으로서 수득하였으며, 이를 직접 추가 정제 없이 사용하였다.
4
2 (상기 언급된 절차에 의해 새로이 제조됨) 180 mg (0.42 mmol)에 (2E,2'E)-3,3'-(2-(3-((S)-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)프로판아미도)-1,4-페닐렌)디아크릴산 3 (100 mg, 0.12 mmol), EDCI.HCl (185 mg, 0.96 mmol), 톨루엔술폰산 (2.1 mg, 0.012 mmol) 및 DMA (0.5 mL)를 첨가하였다. 혼합물을 밤새 교반한 후, 대부분의 DMA를 진공 하에 제거하고, 잔류물을 에틸 아세테이트와 수성 NaHCO3 사이에 재분포시켰다. 수성 상을 에틸 아세테이트로 3회 추출하였다. 합한 유기 추출물을 물에 이어서 염수로 세척하고, 무수 Na2SO4 상에서 건조시키고, 셀라이트의 패드를 통해 여과하였다. 용매를 제거하고, 생성된 잔류물을 최소 DCM 중에 용해시키고, 헵탄을 첨가함으로써 침전시켜 조 생성물 (207 mg)을 수득하였으며, 이를 추가로 정제용 HPLC [칼럼: 시너지-맥스 RP 4μ, 250 x 21.20 mm; 이동상: A/B = 20%에서 1% (A: 포름산암모늄 pH 3.45, B: 물 중 90% 아세토니트릴); 유량 12 mL/분]에 의해 정제하여 4 (65 mg, 33%)를 황색 고체로서 수득하였다.
1H NMR (CDCl3) δ 9.67 (br s, 1H), 8.67 (br s, 2H), 8.18-7.98 (m, 4H), 7.90-7.72 (m, 3H), 7.66-7.58 (m, 6H), 7.50-7.28 (m, 8H), 6.84-6.62 (m, 4H), 6.66 (s, 2H, 말레이미드), 6.00 (br s, 1H), 5.23-5.13 (m, 2H), 4.80-4.70 (m, 1H), 4.40-3.85 (m, 6H), 3.50-3.40 (m, 6H), 3.20-3.14 (m, 2H), 2.90-2.75 (m, 2H), 2.60-2.45 (m, 4H), 1.92-1.80 (m, 2H), 1.62, 1.60, 1.57, 1.56 (4s, 36H), 1.55-1.40 (m, 6H), 1.30-1.20 (m, 3H). 31P NMR (CDCl3) δ -15.44 (s), 15.82 (s). HRMS (ESI) 실측치 m/z 1666.6051 (M + Na). C83H101Cl2N9NaO18P2 요구치 1666.6009.
5
빙조에서 냉각시킨 DCM (0.6 mL) 중 4 (25 mg, 0.015 mmol)의 용액에 TFA (0.2 mL, 2.61mmol)를 첨가하였다. 혼합물을 빙조에서 0.5시간 동안 교반하였다. 모든 휘발성 성분을 0℃에서 펌핑하고, 생성된 잔류물을 에틸 아세테이트로 연화처리한 다음, THF 및 석유 에테르로 세척하여 5 (CBI-CBI LD5)를 황색 고체 (19 mg, 88%)로서 수득하였다.
1H NMR (DMSO) δ 10.33 (br s, 1H), 9.63 (s, 1H), 8.70 (s, 1H), 8.95 (s, 1H), 8.14-8.11 (m, 4H), 7.96-7.90 (m, 4H), 7.81-7.69 (m, 6H), 7.64-7.54 (m, 2H), 7.50-7.39 (m, 4H), 7.33-7.26 (m, 2H), 6.97 (s, 2H, 말레이미드), 6.13 (br s, 2H), 5.14 (s, 2H), 4.58 (s, 4H), 4.40-4.30 (m, 4H), 4.08-3.95 (m, 4H), 3.29 (t, J = 6.9 Hz, 2H), 2.99-2.94 (m, 4H), 2.39-2.33 (m, 2H), 1.71-1.67 (m, 4H), 1.40-1.35 (m, 6H), 1.12-1.10 (m, 3H). 31P NMR (DMSO) δ -5.91 (s). HRMS (ESI) 실측치 m/z 1442.3438 (M + Na). C67H69Cl2N9NaO18P2 요구치 1442.3505.
CBI-CBI LD6
4-((S)-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질 2,5-비스((E)-3-((S)-1-(클로로메틸)-5-(포스포노옥시)-1H-벤조[e]인돌-3(2H)-일)-3-옥소프로프-1-에닐)페닐카르바메이트
단계 A: (S)-N-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸)-N-(1-(4-(히드록시메틸)페닐아미노)-1-옥소-5-우레이도펜탄-2-일)시클로부탄-1,1-디카르복스아미드
반응식
절차
화합물 1 (150 g, 1.53 mol)을 HOAc (1000 mL) 중 화합물 2 (201 g, 1.53 mol)의 교반 용액에 첨가하였다. 혼합물을 실온에서 2시간 동안 교반한 후, 이를 환류 하에 8시간 동안 가열하였다. 유기 용매를 감압 하에 제거하고, 잔류물을 EtOAc (500 mL x 3)로 추출하고, H2O로 세척하였다. 합한 유기 층을 Na2SO4 상에서 건조시키고, 농축시켜 조 생성물을 수득하였다. 이를 석유 에테르로 세척하여 화합물 3을 백색 고체 (250 g, 77.4%)로서 수득하였다.
DPPA (130 g, 473 mmol) 및 TEA (47.9 g, 473 mmol)를 t-BuOH (200 mL) 중 화합물 3 (100 g, 473 mmol)의 용액에 첨가하였다. 혼합물을 환류 하에 N2 하에 8시간 동안 가열하였다. 혼합물을 농축시키고, 잔류물을 실리카 겔 (PE:EtOAc= 3:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 4 (13 g, 10%)를 수득하였다.
무수 EtOAc (30 mL) 중 화합물 4 (28 g, 992 mmol)의 용액에 HCl/EtOAc (50 mL)를 적가하였다. 혼합물을 실온에서 5시간 동안 교반한 후, 이를 여과하고, 고체를 건조시켜 화합물 5 (16 g, 73.7%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6): δ 8.02 (s, 2H), 6.99 (s, 2H), 3.37-3.34 (m, 2H), 2.71-2.64 (m, 2H), 1.56-1.43 (m, 4H), 1.23-1.20 (m, 2H).
디옥산 및 H2O (50 mL / 75 mL)의 혼합물 중 화합물 6 (17.50 g, 0.10 mol)의 혼합물에 K2CO3 (34.55 g, 0.25 mol)을 첨가하였다. Fmoc-Cl (30.96 g, 0.12 mol)을 0℃에서 천천히 첨가하였다. 반응 혼합물을 실온으로 2시간에 걸쳐 가온하였다. 유기 용매를 감압 하에 제거하고, 물 슬러리를 6 M HCl 용액을 사용하여 pH = 3으로 조정하고, EtOAc (100 mL x 3)로 추출하였다. 유기 층을 Na2SO4 상에서 건조시키고, 여과하고, 감압 하에 농축시켜 목적 생성물 7 (38.0 g, 95.6%)을 수득하였다. (이후 화합물 7은 상업적으로 입수가능하였음)
DCM 및 MeOH (100 mL / 50 mL)의 혼합물 중 화합물 7 (4 g, 10 mmol)의 용액에 4-아미노-페닐-메탄올 (8) (1.6 g, 13 mmol, 1.3 당량) 및 EEDQ (3.2 g, 13 mmol, 1.3 당량)를 첨가하였다. 혼합물을 N2 하에 실온에서 16시간 동안 교반한 후, 이를 농축시켜 갈색 고체를 수득하였다. MTBE (200 mL)를 첨가하고, 이를 15℃에서 2시간 동안 교반하였다. 고체를 여과에 의해 수집하고, MTBE (50 mL x 2)로 세척하여 조 생성물 9를 오렌지색 고체 (4.2 g, 84%)로서 수득하였다.
LCMS (ESI): m/z 503.0 [M+1].
건조 DMF (20 ml) 중 화합물 9(4.2 g, 8.3 mmol)의 교반 용액에 피페리딘 (1.65 mL, 17 mmol, 2 당량)을 실온에서 적가하였다. 혼합물을 실온에서 30분 동안 교반하였으며, 고체 침전물이 형성되었다. 건조 DCM (50 mL)을 첨가하였으며, 혼합물은 즉시 투명하게 되었다. 혼합물을 실온에서 추가로 30분 동안 교반하였으며, LCMS는 화합물 9 가 소모되었음을 나타내었다. 이를 감압 하에 농축 건조시키고 (피페리딘이 남겨지지 않도록 확실하게 함), 잔류물을 EtOAc와 H2O (50 mL / 20 mL) 사이에 분배하였다. 수성 상을 EtOAc (50 mL x 2)로 세척하고, 농축시켜 10을 유성 잔류물 (2.2 g, 94%) (소량의 DMF 함유)로서 수득하였다.
DME (50 mL) 중 화합물 11 (8 g, 29.7 mmol)의 용액에 물 (30 mL) 중 화합물 10 (6.0 g, 21.4 mmol) 및 NaHCO3 (7.48 g, 89.0 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 16시간 동안 교반한 후, 이를 감압 하에 농축 건조시키고, 잔류물을 칼럼 크로마토그래피 (DCM:MeOH = 10:1)에 의해 정제하여 조 화합물 12를 백색 고체 (6.4 g, 68.7% )로서 수득하였다.
LCMS (ESI): m/z 435.0 [M+1].
THF 및 MeOH (20 mL / 10 mL)의 혼합물 중 화합물 12 (6.4 g, 14.7 mmol)의 교반 용액에 실온에서 H2O (20 mL) 중 LiOH·H2O ( 1.2 g, 28.6 mmol)의 용액을 첨가하였다. 반응 혼합물을 실온에서 16시간 동안 교반한 후, 용매를 감압 하에 제거하고, 수득된 잔류물을 정제용 HPLC에 의해 정제하여 화합물 13 (3.5 g, 수율: 58.5%)을 수득하였다.
LCMS (ESI): m/z 406.9 [M+1].
1H NMR (400 MHz, 메탄올-d4) δ 8.86 (d, J = 8.4 Hz, 2 H), 8.51 (d, J = 8.4 Hz, 2 H), 5.88 - 5.85 (m, 1 H), 5.78 (s, 2 H), 4.54 - 4.49 (m, 3 H), 4.38 - 4.32 (m, 1 H), 3.86 - 3.75 (m, 1 H), 3.84 - 3.80 (m, 2 H), 3.28 - 3.21 (m, 1 H), 3.30 - 3.24 (m, 1 H), 3.00 - 2.80 (m, 1 H), 2.37 - 2.28 (m, 2 H).
DIPEA (1.59 g, 12.3 mmol) 및 BOP-Cl (692 mg, 2.71 mmol)을 0℃에서 DMF (10 mL) 중 화합물 13 (1.0 g, 2.46 mmol)의 용액에 첨가하고, 이어서 화합물 5 (592 mg, 2.71 mmol)를 첨가하였다. 혼합물을 0℃에서 0.5시간 동안 교반하였다. 반응 혼합물을 시트르산 용액 (10 mL)으로 켄칭하고, DCM/MeOH (10:1)로 추출하였다. 유기 층을 건조시키고, 농축시키고, 잔류물을 실리카 겔 (DCM:MeOH = 10:1) 상에서 칼럼 크로마토그래피에 의해 정제하여 화합물 14 (1.0 g, 71%)를 수득하였다.
1H NMR (400 MHz, DMSO-d6): δ 10.00 (s, 1H), 7.82-7.77 (m, 2H), 7.53 (d, J = 8.4 Hz, 2 H), 7.19 (d, J = 8.4 Hz, 2 H), 6.96 (s, 2H), 5.95 (t, J = 6.4 Hz, 1H), 5.39 (s, 2H), 5.08 (t, J = 5.6 Hz, 1H), 4.40-4.35 (m, 3H), 4.09 (d, J = 4.8 Hz, 1 H), 3.01 (d, J = 3.2 Hz, 2 H), 3.05-2.72 (m, 4H), 2.68-2.58 (m, 3H), 2.40-2.36 (m, 4H), 1.72-1.70 (m, 3H), 1.44-1.42 (m, 1H), 1.40-1.23 (m, 6H), 1.21-1.16 (m, 4H).
단계 B: (2E,2'E)-3,3'-(2-((4-((S)-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐아미노)-1,4-페닐렌)디아크릴산의 합성
반응식
절차
디옥산 (4.0 mL) 중 화합물 1 (1.5 g, 21.4 mmol)의 용액에 화합물 2 (2.74 g, 85.6 mmol), DIPEA (3.45 g, 107 mmol) 및 Pd(t-Bu3P)2(0.55 g, 4.30 mmol)를 첨가하였다. 반응물을 마이크로웨이브 조사 하에 120℃에서 2.0시간 동안 교반하였다. 반응물을 4회 반복하였다 (총 6.0 g의 1을 사용하였음). 합한 반응 혼합물을 농축시키고, 물 (20 mL)로 희석하고, EtOAc (100.0 mL x 3)로 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시켰다. 이를 농축시키고, 칼럼 (PE: EtOAc=10:1)에 의해 정제하여 목적 생성물 (3.8 g, 47%)을 수득하였다.
EtOH/H2O (120.0 mL) 중 화합물 3 (3.8 g, 10.1 mmol)의 용액에 Fe (2.83 g, 50.7 mmol), 및 NH4Cl (5.4 g, 101 mmol)을 첨가하고, 반응 혼합물을 100℃에서 2.0시간 동안 교반하였다. 반응 혼합물을 여과하고, 여과물을 농축시키고, EtOAc (60.0 mL x 3)로 추출하였다. 유기 층을 합하고, Na2SO4 상에서 건조시키고, 농축시켜 생성물 (2.5 g, 72%)을 수득하였다.
빙조에서 트리포스겐 (224 mg, 0.76 mmol)의 용액에 DCM (5.0 mL) 중 화합물 4 (725 mg, 2.1 mmol) 및 Et3N (530.3 mg, 5.25 mmol)의 용액을 적가하였다. 반응 혼합물을 21℃에서 1.0시간 동안 출발 물질이 남지않을 때까지 교반하였다. 반응 혼합물을 물 (5.0 mL x 2)로 세척하고, Na2SO4 상에서 건조시켰다. 이를 농축시키고, DCM (5.0 mL) 중에 용해시켰다. 화합물 5 (1.0 g, 1.75 mmol)의 용액을 첨가하고, 반응 혼합물을 21℃에서 3.0시간 동안 교반하였다. 반응물을 MeOH (2.0 mL)로 켄칭하고, 칼럼 (DCM: MeOH=10:1)에 의해 정제하여 목적 생성물 (380 mg, 23%)을 수득하였다.
DCM (10.0 mL) 중 화합물 6 (300.0 mg, 0.32 mmol)의 용액에 TFA (2.0 mL)를 첨가하고, 혼합물을 21℃에서 30.0분 동안 교반하였다. 혼합물을 NH3·H2O를 사용하여 pH 6으로 조정하였다. 침전물을 여과에 의해 수집하여 생성물 (2E,2'E)-3,3'-(2-((4-((S)-2-(1-(5-(2,5-디옥소-2,5-디히드로-1H-피롤-1-일)펜틸카르바모일)시클로부탄카르복스아미도)-5-우레이도펜탄아미도)벤질옥시)카르보닐아미노)-1,4-페닐렌)디아크릴산 (112.0 mg, 수율 42%)을 수득하였다.
LCMS (10-80, AB, 2.0분) RT = 0.962분, [M+1]+ = 830.0;
1H NMR (400MHz, DMSO-d6) δ 12.45 (br, 2H), 10.10 (s, 1H),9.55 (s, 1H), 7.50-7.81 (m, 8H), 7.34 (m, 2H), 6.95 (s, 2H), 6.47-6.57 (m, 2H), 5.96 (s, 1H), 5.40 (s, 2H), 5.05 (s, 2H), 4.36-4.39 (m, 1H), 2.98-3.06 (m, 6H), 2.35-2.39 (m, 4H), 1.15-1.73 (m, 13H).
단계 C:
8
2 (상기 언급된 절차에 의해 새로이 제조됨) 184 mg (0.43 mmol)에 3 (80 mg, 0.11 mmol), EDCI.HCl (165 mg, 0.86 mmol), 톨루엔술폰산 (2.0 mg, 0.011 mmol) 및 DMA (0.5 mL)를 첨가하였다. 혼합물을 밤새 교반한 후, 대부분의 DMA를 진공 하에 제거하고, 잔류물을 에틸 아세테이트와 수성 NaHCO3 사이에 재분포시켰다. 수성 상을 에틸 아세테이트로 3회 추출하였다. 합한 유기 추출물을 물에 이어서 염수로 세척하고, 무수 Na2SO4 상에서 건조시키고, 셀라이트의 패드를 통해 여과하였다. 용매를 제거하고, 생성된 잔류물을 최소 DCM 중에 용해시키고, 헵탄의 첨가에 의해 침전시켜 조 생성물 (195 mg)을 수득하였으며, 이를 추가로 정제용 HPLC [칼럼: 시너지-맥스 RP 4μ, 250 x 21.20 mm; 이동상: A/B = 90%에서 2% (A: 포름산암모늄 pH 3.45, B: 물 중 90% 아세토니트릴); 유량 12 mL/분]에 의해 정제하여 4 (56 mg, 34%)를 황색 고체로서 수득하였다.
1H NMR (DMSO) δ 10.02 (s, 1H), 8.67 (s, 2H), 8.14-8.06 (m, 4H), 7.97 (d, J = 8.4 Hz, 2H), 7.86-7.76 (m, 4H), 7.70 (d, J = 15.2 Hz, 1H), 7.63-7.59 (m, 2H), 7.53-7.49 (m, 2H), 7.29-7.23 (m, 2H), 6.96 (s, 2H, 말레이미드), 5.91 (br s, 1H), 5.36 (br s, 2H), 4.65-4.50 (m, 4H), 4.44-4.37 (m, 2H), 4.28-4.22 (m, 2H), 4.05-3.95 (m, 4H), 3.60 (t, J = 6.6 Hz, 1H), 3.07-3.00 (m, 2H), 2.95-2.88 (m, 2H), 2.68-2.58 (m, 2H), 2.42-2.32 (m, 3H), 1.78-1.62 (m, 4H), 1.51, 1.50, 1.49, 1.48 (4s, 36H), 1.49-1.28 (m, 11H). 31P NMR (CDCl3) δ -15.44 (s), 15.46 (s). HRMS (ESI) 실측치 m/z 1588.5827 (M + Na). C78H99Cl2N9NaO17P2 요구치 1588.5903.
5
빙조에서 냉각시킨 DCM (0.6 mL) 중 4 (25 mg, 0.015 mmol)의 용액에 TFA (0.2 mL, 2.61 mmol)를 첨가하였다. 혼합물을 빙조에서 0.5시간 동안 교반하였다. 에테르를 첨가하고, 생성된 침전물을 여과에 의해 수집하고, 에틸 아세테이트, THF 및 석유 에테르로 세척하여 5 (CBI-CBI LD6)를 갈색 고체 (18 mg, 86%)로서 수득하였다.
1H NMR (DMSO) δ 10.01 (br s, 1H), 8.60 (br s, 2H), 8.16-8.09 (m, 4H), 7.96-7.93 (m, 2H), 7.88-7.58 (m, 8H), 7.46 (t, J = 7.7 Hz, 2H), 7.30-7.25 (m, 2H), 6.97 (s, 2H, 말레이미드), 6.10 (br s, 1H), 5.35 (br s, 2H), 4.60-4.18 (m, 6H), 4.05-3.95 (m, 4H), 3.45-3.29 (m, 5H), 3.04-2.87 (m, 4H), 2.68-2.60 (m, 2H), 2.40-2.30 (m, 4H), 1.72-1.57 (m, 4H), 1.43-1.28 (m, 5H), 1.20-1.07 (m, 3H). 31P NMR (DMSO) δ -5.82 (s). HRMS (ESI) 실측치 m/z 1342.3562 (M + H). C62H68Cl2N9O17P2 요구치 1342.3580.
ADC를 제조하는 방법
환원 및 재산화에 의한 접합을 위한 시스테인 조작된 항체의 제조
특정 조건 하에, 시스테인 조작된 항체는 환원제 예컨대 DTT (클리랜드(Cleland) 시약, 디티오트레이톨) 또는 TCEP (트리스(2-카르복시에틸)포스핀 히드로클로라이드; 문헌 [Getz et al. (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA])로의 처리에 의해 본 발명의 링커-약물 중간체와의 접합에 반응성이도록 제조될 수 있다. CHO 세포에서 발현된 전장, 시스테인 조작된 모노클로날 항체 (티오Mab) (Gomez et al. (2010) Biotechnology and Bioeng. 105(4):748-760; Gomez et al. (2010) Biotechnol. Prog. 26:1438-1445)를 예를 들어 약 50배 과량의 DTT를 사용하여 실온에서 밤새 환원시켜 새로 도입된 시스테인 잔기와 배양 배지에 존재하는 시스테인 사이에 형성될 수 있는 디술피드 결합을 환원시켰다.
경쇄 아미노산은 카바트 (Kabat et al., Sequences of proteins of immunological interest, (1991) 5th Ed., US Dept of Health and Human Service, National Institutes of Health, Bethesda, MD)에 따라 넘버링하였다. 중쇄 아미노산은 카바트 시스템으로 나타낸 경우를 제외하고는 EU 넘버링 시스템에 따라 넘버링하였다 (Edelman et al. (1969) Proc. Natl. Acad. of Sci. 63(1):78-85). 단일 문자의 아미노산 약어를 사용하였다.
CHO 세포에서 발현된 전장, 시스테인 조작된 모노클로날 항체 (티오Mab)는 시스테인 부가물 (시스틴)을 보유하거나, 또는 세포 배양 조건으로 인해 조작된 시스테인 상에서 글루타티오닐화된다. 조작된 시스테인의 반응성 티올 기를 유리시키기 위해, 티오Mab를 약 pH 8.0에서 500 mM 붕산나트륨 및 500 mM 염화나트륨 중에 용해시키고, 약 50-100배 과량의 1 mM TCEP (트리스(2-카르복시에틸)포스핀 히드로클로라이드 (Getz et al. (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA)로 37℃에서 약 1-2시간 동안 환원시켰다. 대안적으로, DTT를 환원제로서 사용할 수 있다. 쇄간 디술피드 결합의 형성을 비-환원 SDS-PAGE 또는 변성 역상 HPLC PLRP 칼럼 크로마토그래피에 의해 모니터링하였다. 환원된 티오Mab를 희석하고, 10 mM 아세트산나트륨, pH 5 중에서 하이트랩(HiTrap) SP FF 칼럼 상에 로딩하고, 0.3 M 염화나트륨을 함유하는 PBS, 또는 150 mM 염화나트륨을 함유하는 50 mM 트리스-Cl, pH 7.5로 용리하였다.
재산화를 수행함으로써 모 Mab에 존재하는 시스테인 잔기 사이에 디술피드 결합을 재확립시켰다. 용리된 환원된 티오Mab를 15X 또는 2 mM 데히드로아스코르브산 (dhAA)으로 pH 7에서 3시간 동안, 또는 50 mM 트리스-Cl, pH 7.5 중에서 3시간 동안, 또는 2 mM 수성 황산구리 (CuSO4)로 실온에서 밤새 처리하였다. 관련 기술분야에 공지된 다른 산화제, 즉 산화 작용제, 및 산화 조건이 사용될 수 있다. 주위의 공기 산화가 또한 효과적일 수 있다. 이 온화한 부분적 재산화 단계는 효율적으로 쇄내 디술피드를 고충실도로 형성시킨다. 완충제를 세파덱스(Sephadex) G25 수지 상에서의 용리에 의해 교환하고, 1 mM DTPA를 함유하는 PBS로 용리시켰다. 상기 용액의 280 nm에서의 흡광도로부터 환원된 항체 농도를 결정하고, DTNB (알드리치(Aldrich), 위스콘신주 밀워키)와 반응시켜 412 nm에서의 흡광도를 측정하여 티올 농도를 결정함으로써 티올/Ab 값을 확인하였다.
액체 크로마토그래피/질량 분광측정 분석을 확장된 질량 범위를 갖는 TSQ 퀀텀 트리플(Quantum Triple) 사중극자™ 질량 분광계 (써모 일렉트론(Thermo Electron), 캘리포니아주 산 호세) 상에서 수행하였다. 샘플을 75℃로 가열한 PRLP-S®, 1000 A, 소구경 칼럼 (50mm × 2.1mm, 폴리머 래보러토리즈(Polymer Laboratories), 영국 슈롭셔) 상에서 크로마토그래피하였다. 30-40% B (용매 A: 물 중 0.05% TFA, 용매 B: 아세토니트릴 중 0.04% TFA)의 선형 구배를 사용하였고, 용리액은 전기분무 공급원을 사용하여 직접 이온화하였다. 데이터는 엑스칼리버(Xcalibur)® 데이터 시스템에 의해 수집하였고, 디컨볼루션은 프로매스(ProMass)® (노바티아, 엘엘씨(Novatia, LLC), 뉴저지주)를 사용하여 수행하였다. LC/MS 분석 전에, 항체 또는 약물 접합체 (50 마이크로그램)를 PNGase F (2 단위/mL, 프로자임(PROzyme), 캘리포니아주 산 레안드로)로 37℃에서 2시간 동안 처리하여 N-연결된 탄수화물을 제거하였다.
소수성 상호작용 크로마토그래피 (HIC) 샘플을 부틸 HIC NPR 칼럼 (2.5 마이크로미터 입자 크기, 4.6 mm × 3.5 cm) (도소 바이오사이언스(Tosoh Bioscience))에 주입하고, 0에서 70% B, 0.8 ml/분의 선형 구배 (A: 50 mM 인산칼륨, pH 7 중 1.5 M 황산암모늄, B: 50 mM 인산칼륨 pH 7, 20% 이소프로판올)로 용리하였다. 다중 파장 검출기 및 켐스테이션(Chemstation) 소프트웨어가 장착된 애질런트(Agilent) 1100 시리즈 HPLC 시스템을 사용하여 항체당 다양한 비의 약물을 갖는 항체 종을 분석하고 정량화하였다. 시스테인 조작된 본 발명의 항체는 상기 기재된 일반적 방법에 따라 제조될 수 있다.
항체에 대한 링커-약물 중간체의 접합 (절차 1)
조작된 항체 시스테인을 CHO 세포에서 발현된 글루타티온 및/또는 시스테인과의 혼합 디술피드로서 차단하였다. 이들 시스테인은 접합 전에 "탈차단"되어야 한다.
20 mM 숙시네이트, 150 mM NaCl, 2 mM EDTA 중 탈차단된 항체 (5-12 mg/mL)를 75-100 mM 트리스, pH 7.5-8로 만들었다 (1M 트리스 사용). 공용매 (DMSO, DMF 또는 DMA)를 항체 용액에 첨가하고, 이어서 링커-약물 (DMSO 또는 DMF 중)을 첨가하여 10-13%의 최종 %-유기 용매 및 항체 농도에 대해 링커-약물 2.5-10X의 최종 농도를 수득하였다. 반응을 1-12시간 동안 (최대 접합이 달성될 때까지) 실온에서 진행되도록 하였다. 접합 반응물을 양이온 교환 크로마토그래피 및/또는 겔 여과를 통해 일회용 칼럼 (각각 S 맥시(S maxi) 또는 제바(Zeba))을 사용하여 정제하였다. 분석용 SEC에 따라 조 접합체가 유의하게 응집되면 (예를 들어, >10%) 정제용 겔 여과 (S200 칼럼)에 의한 추가의 정제를 수행하였다. 후속적으로, 접합체를 겔 여과 또는 투석을 사용하여 제제 완충제 (20 mM His-아세테이트, pH 5.5, 240 mM 수크로스)으로 교환하였다. 후속적으로, 트윈-20을 정제된 접합체에 첨가하여 0.02%의 최종 농도에 도달하였다. 최종 접합체 농도는 2.4 내지 7.5 mg/ml 범위였다 (%수율: 탈차단된 항체로부터 34-81%). 접합체를 LCMS에 의해 분석하여 약물-항체 비 (DAR)를 측정하였으며, 이는 1.3 내지 2.1 범위였다 (평균: 1.8). 접합체를 또한 분석용 SEC (제닉스(Zenix) 또는 쇼덱스(Shodex) 칼럼)를 사용하여 고분자량 응집체의 존재에 대해 분석하였으며; 최종 정제된 접합체는 0-10% 범위의 응집을 나타내었다. 접합체를 또한 내독소 오염에 대해 평가하였으며, 모든 경우에 1.3 EU/mg을 초과하지 않았다. 유리, 비접합 약물은 최종 접합체의 1%를 초과하지 않았다.
항체에 대한 링커-약물 중간체의 접합 (절차 2, 대안적 절차)
상기 실시예의 환원 및 재산화 절차 후에, 항체를 PBS (포스페이트 완충 염수) 완충제 중에 용해시키고, 얼음 상에서 냉각시켰다. 과량의, 약 1.5 몰 내지 20 당량의 링커-약물 중간체와 티올-반응성 관능기 예컨대 말레이미도 또는 브로모-아세트아미드를 DMSO 중에 용해시키고, 아세토니트릴 및 물 중에 희석하고, PBS 중 냉각 환원된, 재산화된 항체에 첨가하였다. 약 1시간 후, 과량의 말레이미드를 첨가하여 반응물을 켄칭하고, 임의의 미반응 항체 티올 기를 캡핑하였다. 접합체 혼합물을 로딩하고, 하이트랩 SP FF 칼럼을 통해 용리하여 잉여 약물-링커 중간체 및 다른 불순물을 제거할 수 있다. 반응 혼합물을 원심 한외여과에 의해 농축시키고, 시스테인 조작된 항체-약물 접합체를 PBS 중 G25 수지를 통한 용리에 의해 정제 및 탈염하고, 멸균 조건 하에 0.2 μm 필터를 통해 여과하고 냉동시켜 저장하였다.
본 발명의 ADC는 상기 섹션에 기재된 절차에 따라 제조될 수 있다.
검정
이어서, 선택 링커를 시험하였으며, 시험관내 및 생체내 검정에서 활성인 것으로 확인되었다. 절단 데이터가 하기 표에 제시된다
카텝신 B 절단 검정
펩티드 링커와 같이, ADC에 대한 비-펩티드 링커는 적절한 약물 방출을 위해 리소솜에서 절단가능할 것으로 예상된다. 세포의 소화 소기관으로서, 리소솜을 산성 pH에서 최적 가수분해 활성을 나타내는 일부 프로테아제로 풍부화하였다. 카텝신 B는 대표적인 리소솜 프로테아제이며, ADC 펩티드 링커 (ref)의 활성화에 기여하는 것으로 밝혀진 바 있다. 초기 스크린으로서, 항체와의 접합에 적합한 절단가능한 링커-약물 구축물을 확인하기 위해 정제된 카텝신 B를 사용한 검정을 개발하였다. 노르플록사신을 링커-약물의 약물 성분을 나타내도록 사용하였다. 주어진 시점에서의 대조군 펩티드 (예컨대 Val-Cit)에 대한 절단의 백분율, 뿐만 아니라 절단 반응의 동역학적 파라미터 (Km 및 Vmax)를 측정하였다. 검정의 상세한 설명이 하기 제시된다. 본 검정으로부터, 다양한 단백질분해적으로 활성이며 구조적으로 다양한 링커를 확인하고, 이후 ADC의 제조에 사용하였다.
실험 링커-약물을 기질로서 사용한 카텝신 B 절단 활성을 LC/MS를 사용하여 노르플록사신의 방출을 모니터링함으로써 측정하였다. 다양한 농도의 링커-약물 (3배 연속 희석물)을 20 nM 카텝신 B (EMD 밀리포어(EMD Millipore) 카탈로그 #219364, 인간 간), 10 mM MES pH 6.0, 1 mM DTT, 0.03% CHAPS 및 25 nM 노르플록사신-d5 내부 표준 (산타 크루즈 바이오테크놀로지(Santa Cruz Biotechnology), 카탈로그 #sc-301482)을 함유하는 20 uL 반응물 중에서 인큐베이션하였다. 반응물을 37℃에서 1시간 동안 인큐베이션하고, 이어서 2% 포름산 60 uL를 첨가하여 반응물을 켄칭하였다. 워터스 액퀴티(Waters Acquity) UPLC BEH 페닐 칼럼 (2.1 mm x 50 mm, 워터스 카탈로그 #186002884) 상에 정지된 반응물 2 uL를 주입함으로써 샘플을 분석하였다. 워터스 액퀴티 UPLC 상에서 아세토니트릴, 0.1% 포름산의 선형 2분 구배 (0%에서 80%)를 사용하여 샘플을 정제하였다. 노르플록사신 및 노르플록사신-d5 내부 표준을 양성 MRM 모드로 작동하는 AB 사이엑스 Q트랩 5500(AB Sciex QTrap 5500) 삼중 사중극자 질량 분광계를 사용하여 검출하였다 (노르플록사신 320→233 m/z, 노르플록사신-d5 325→233 m/z). 정량화된 노르플록사신 (내부 표준으로 정규화됨)을 링커-약물 농도에 대해 플롯팅하였으며, 생성된 플롯은 동역학적 상수 Km 및 Vmax에 대해 그래프패드 프리즘(GraphPad Prism) 소프트웨어를 사용하여 미카엘리스-멘텐(Michaelis-Menten) 피트로 피팅된 곡선이었다.
시험관내 세포 증식 검정
ADC의 효능을 하기 프로토콜을 이용하여 세포 증식 검정에 의해 측정하였다 (셀타이터 글로(CELLTITER GLO)™ 발광 세포 생존율 검정, 프로메가 코포레이션(Promega Corp.) 기술 회보 TB288; Mendoza et al. (2002) Cancer Res. 62:5485-5488):
1. 배지 중에 약 104개의 세포 (SKBR-3, BT474, MCF7 또는 MDA-MB-468)를 함유하는 세포 배양물 100 μl의 분취물을 96-웰, 불투명-벽 플레이트의 각 웰에 침착시켰다.
2. 배지를 함유하며 세포는 함유하지 않는 대조군 웰을 제조하였다.
3. ADC를 실험 웰에 첨가하고, 3-5일 동안 인큐베이션하였다.
4. 플레이트를 대략 30분 동안 실온으로 평형화시켰다.
5. 각 웰에 존재하는 세포 배양 배지의 부피와 동등한 부피의 셀타이터-글로™ 시약을 첨가하였다.
6. 내용물을 오비탈 진탕기 상에서 2분 동안 혼합하여 세포 용해를 유도하였다.
7. 플레이트를 실온에서 10분 동안 인큐베이션하여 발광 신호를 안정화시켰다.
8. 발광을 기록하고, RLU = 상대적 발광 단위로서 그래프로 보고하였다.
데이터를 표준 편차 오차 막대와 함께 각 세트의 반복에 대한 발광의 평균으로서 플롯팅하였다. 프로토콜은 셀타이터 글로™ 발광 세포의 변형이었다.
배지: SK-BR-3을 50/50/10%FBS/글루타민 중에서 성장시키고/250 μg/mL G-418 OVCAR-3을 RPMI/20%FBS/글루타민에서 성장시켰다.
생체내 검정
1. 항-CD33 항체-약물 접합체 (ADC)의 효능을 HL-60 또는 EOL-1 (인간 급성 골수성 백혈병)의 마우스 이종이식편 모델에서 조사하였다. HL-60 세포주는 ATCC (아메리칸 타입 컬쳐 콜렉션(American Type Culture Collection); 버지니아주 마나사스)로부터 입수하였고, EOL-1 세포주는 DSMZ (저먼 콜렉션 오브 마이크로오가니즘스 앤드 셀 컬쳐스(German Collection of Microorganisms and Cell Cultures); 독일 브라운슈바이크)로부터 유래되었다.
암컷 C.B-17 SCID 마우스 (찰스 리버 래보러토리즈; 캘리포니아주 홀리스터) 각각의 측복부 영역에 HL-60 또는 EOL-1의 5백만개의 세포를 피하로 접종하였다. 이종이식 종양이 100-300 mm3의 평균 종양 부피에 도달하면 (제0일로 지칭됨), 동물을 각각 7-10마리 마우스의 군으로 무작위 배정하고, ADC의 단일 정맥내 주사를 제공하였다. ADC 투여 대략 4시간 전에, 동물에게 과량 (30mg/kg)의 항-gD 대조 항체를 복강내로 투여하여 종양 세포 상의 가능한 비특이적 항체 결합 부위를 차단하였다. 마우스의 종양 및 체중을 연구 전반에 걸쳐 주 1-2회 측정하였다. 체중 감소가 그의 출발 체중의 >20%인 경우에 마우스를 즉시 안락사시켰다. 종양이 3000 mm3에 도달하기 전에 또는 절박 궤양화의 징후를 나타내기 전에 모든 동물을 안락사시켰다.
2. 항-Napi2B 항체-약물 접합체 (ADC)의 효능을 OVCAR3-X2.1 (인간 난소암)의 마우스 이종이식편 모델에서 조사하였다. OVCAR3 세포주는 ATCC (아메리칸 타입 컬쳐 콜렉션; 버지니아주 마나사스)로부터 입수하였고, 마우스에서의 최적 성장을 위해 하위-세포주 OVCAR3-X2.1을 제넨테크(Genentech)에서 생성하였다.
암컷 C.B-17 SCID-베이지 마우스 (찰스 리버 래보러토리즈(Charles River Laboratories); 캘리포니아주 샌디에고) 각각의 흉부 유방 지방 패드 영역에 10백만개의 OVCAR3-X2.1 세포를 접종하였다. 이종이식 종양이 100-300 mm3의 평균 종양 부피에 도달하면 (제0일로 지칭함), 동물을 각각 7-10마리 마우스의 군으로 무작위 배정하고, ADC의 단일 정맥내 주사를 제공하였다. 마우스의 종양 및 체중을 연구 전반에 걸쳐 주 1-2회 측정하였다. 체중 감소가 그의 출발 체중의 >20%인 경우에 마우스를 즉시 안락사시켰다. 종양이 3000 mm3에 도달하기 전에 또는 절박 궤양화의 징후를 나타내기 전에 모든 동물을 안락사시켰다.
3. 항-CD22 항체-약물 접합체 (ADC)의 효능을 BJAB-luc (인간 버킷 림프종) 또는 WSU-DLCL2 (인간 미만성 대 B-세포 림프종)의 마우스 이종이식편 모델에서 조사하였다. BJAB 세포주는 DSMZ (저먼 콜렉션 오브 마이크로오가니즘스 앤드 셀 컬쳐스; 독일 브라운슈바이크)로부터 입수하였고, 루시페라제 유전자를 안정하게 발현하도록 하위-세포주 BJAB-luc를 제넨테크에서 생성하였다. WSU-DLCL2 세포주가 또한 DSMZ로부터 기원하였다.
암컷 C.B-17 SCID 마우스 (찰스 리버 래보러토리즈; 캘리포니아주 홀리스터) 각각의 측복부 영역에 BJAB-luc 또는 WSU-DLCL2의 20백만개의 세포를 피하로 접종하였다. 이종이식 종양이 100-300 mm3의 평균 종양 부피에 도달하면 (제0일로 지칭됨), 동물을 각각 7-10마리 마우스의 군으로 무작위 배정하고, ADC의 단일 정맥내 주사를 제공하였다. 마우스의 종양 및 체중을 연구 전반에 걸쳐 주 1-2회 측정하였다. 체중 감소가 그의 출발 체중의 >20%인 경우에 마우스를 즉시 안락사시켰다. 종양이 3000 mm3에 도달하기 전에 또는 절박 궤양화의 징후를 나타내기 전에 모든 동물을 안락사시켰다.
4. 항-Her2 항체-약물 접합체 (ADC)의 효능을 MMTV-HER2 창시자 #5 (뮤린 유방 종양)의 마우스 동종이식편 모델에서 조사하였다. MMTV-HER2 창시자 #5 (Fo5) 모델 (제넨테크에 개발됨)은 뮤린 유방 종양 바이러스 프로모터 (MMTV-HER2)의 전사 조절 하에 인간 HER2 유전자가 유방 상피에서 과다발현되는 트랜스제닉 마우스 모델이다. 과다발현은 인간 HER2 수용체를 과다발현하는 유방 종양의 자발적 발생을 초래한다. 창시자 동물 (창시자 #5, Fo5) 중 하나로부터의 유방 종양을 종양 단편의 연속 이식에 의해 FVB 마우스 (찰스 리버 래보러토리즈)에 전파시켰다.
효능 연구를 위해, Fo5 트랜스제닉 유방 종양을 대략 2mm x 2mm 크기의 종양 단편으로서 암컷 nu/nu 마우스 (찰스 리버 래보러토리즈; 캘리포니아주 홀리스터)의 흉부 유방 지방 패드 내로 외과적으로 이식하였다. 이종이식 종양이 100-300 mm3의 평균 종양 부피에 도달하면 (제0일로 지칭됨), 동물을 각각 7-10마리 마우스의 군으로 무작위 배정하고, ADC의 단일 정맥내 주사를 제공하였다. 마우스의 종양 및 체중을 연구 전반에 걸쳐 주 1-2회 측정하였다. 체중 감소가 그의 출발 체중의 >20%인 경우에 마우스를 즉시 안락사시켰다. 종양이 3000 mm3에 도달하기 전에 또는 절박 궤양화의 징후를 나타내기 전에 모든 동물을 안락사시켰다.
생물학적 데이터
링커-약물 화합물 구조 및 카텝신 B 절단 데이터
하기 링커-약물 화합물은 하기 화학식으로서 일반화될 수 있다.
여기서 Cap는 카텝신 B 검정에서 아미노 기를 보호하는 캡핑 기 (예를 들어, CBZ 및 에틸)이고; PM은 펩티드모방체 모이어티이고; Sp는 스페이서이고, T는 약물 모이어티를 위한 치환기이다.
하기 표에서의 CAT B 절단 데이터는 본 발명의 비-펩티드 링커의 절단 비율이 펩티드 링커와 비슷한 것 (40-56)을 나타낸다. 펩티드 링커는 활성 약물 모이어티를 방출시키기 위해 항체-약물 접합체에 광범위하게 사용되어 왔으며; 따라서, 본 발명의 비-펩티드 링커를 포함하는 접합체는 시험관내 및 생체내에서 유사한 결과를 달성할 수 있을 것으로 예상된다.
ADC 링커-약물 구조
서열
NaPi2b 인간화 항체:
한 실시양태에서, 본 발명의 ADC의 NaPi2b 항체는 3개의 경쇄 초가변 영역 및 3개의 중쇄 초가변 영역 (서열식별번호: 1-6)을 포함하며, 이들 서열이 하기 제시된다.
한 실시양태에서, 본 발명의 ADC의 NaPi2b 항체는 서열식별번호: 7의 가변 경쇄 서열 및 서열식별번호: 8의 가변 중쇄 서열을 포함한다.
한 실시양태에서, 본 발명의 ADC의 NaPi2b 항체는 서열식별번호: 9의 경쇄 서열 및 서열식별번호: 10의 중쇄 서열을 포함한다.
항-CD33 인간화 항체:
한 실시양태에서, 본 발명의 ADC의 항-CD33 항체는 3개의 경쇄 초가변 영역 및 3개의 중쇄 초가변 영역을 포함하며, 이들 서열 (서열식별번호: 11-16)이 하기 제시된다.
한 실시양태에서, 본 발명의 ADC의 항-CD33 항체는 서열식별번호: 17의 가변 경쇄 서열 및 서열식별번호: 18의 가변 중쇄 서열을 포함한다.
한 실시양태에서, 본 발명의 ADC의 항-CD33 항체는 서열식별번호: 19의 경쇄 서열 및 서열식별번호: 20의 중쇄 서열을 포함한다.
한 실시양태에서, 본 발명의 ADC의 항-CD33 항체는 3개의 경쇄 초가변 영역 및 3개의 중쇄 초가변 영역을 포함하며, 이들 서열 (서열식별번호: 19-24)이 하기 제시된다.
한 실시양태에서, 본 발명의 ADC의 항-CD33 항체는 서열식별번호: 25의 가변 경쇄 서열 및 서열식별번호: 26의 가변 중쇄 서열을 포함한다.
한 실시양태에서, 본 발명의 ADC의 항-CD33 항체는 서열식별번호: 27의 가변 경쇄 서열 및 서열식별번호: 28의 가변 중쇄 서열을 포함한다.
한 실시양태에서, 본 발명의 ADC의 항-CD33 항체는 서열식별번호: 29의 가변 경쇄 서열 및 서열식별번호: 30의 가변 중쇄 서열을 포함한다.
한 실시양태에서, 본 발명의 ADC의 항-CD33 항체는 서열식별번호: 31의 가변 경쇄 서열 및 서열식별번호: 32의 가변 중쇄 서열을 포함한다.
항-CD22 인간화 항체:
한 실시양태에서, 본 발명의 ADC의 항-CD22 항체는 3개의 경쇄 초가변 영역 및 3개의 중쇄 초가변 영역 (서열식별번호: 41-46)을 포함하며, 이들 서열이 하기 제시된다.
한 실시양태에서, 본 발명의 ADC의 항-CD22 항체는 서열식별번호: 47의 가변 경쇄 서열 및 서열식별번호: 48의 가변 중쇄 서열을 포함한다.
한 실시양태에서, 본 발명의 ADC의 항-CD22 항체는 서열식별번호: 49의 경쇄 서열 및 서열식별번호: 50의 중쇄 서열을 포함한다.
ADC 시험관내 데이터
하기 ADC를 상기 기재된 시험관내 검정에서 시험하였고, 활성인 것으로 확인되었다. 상기 ADC의 활성은 하기 표에 예시되어 있다. NaPi2b ADC를 비-표적화 대조군으로서 사용하였다.
ADC 생체내 데이터
도 1은 HL-60 인간 급성 골수성 백혈병 종양을 갖는 SCID 마우스에서의 CD33 ADC의 효능 비교를 제시한다. CD33 CBI-PBD ADC3-2는 비히클 군에 비해 종양 성장의 용량-의존성 억제를 나타내었다. 비-표적화 대조군 NaPi2b CBI-PBD ADC3-1은 종양 성장에 대해 최소 효과를 가졌다.
도 2는 OVCAR3X2.1 인간 난소 종양을 갖는 SCID-베이지색 마우스에서의 NaPi2b ADC의 효능 비교를 제시한다. NaPi2b CBI-PBD ADC2-1 및 ADC3-1은 비히클 군에 비해 종양 성장의 적당한 억제를 나타내었다. NaPi2b CBI-PBD ADC2-1 및 ADC3-1의 항종양 활성은 비슷하여, 3 mg/kg의 항체 용량 (= 73 ug/m2의 약물 용량)에서 종양 성장 지연을 유발하였다.
SEQUENCE LISTING
<110> GENENTECH, INC. ET AL.
<120> PEPTIDOMIMETIC COMPOUNDS AND ANTIBODY-DRUG CONJUGATES THEREOF
<130> P5760-PCT
<140>
<141>
<150> 61/916,661
<151> 2013-12-16
<150> 61/916,691
<151> 2013-12-16
<160> 50
<170> PatentIn version 3.5
<210> 1
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 1
Arg Ser Ser Glu Thr Leu Val His Ser Ser Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 2
Arg Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 3
Phe Gln Gly Ser Phe Asn Pro Leu Thr
1 5
<210> 4
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 4
Gly Phe Ser Phe Ser Asp Phe Ala Met Ser
1 5 10
<210> 5
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 5
Ala Thr Ile Gly Arg Val Ala Phe His Thr Tyr Tyr Pro Asp Ser Met
1 5 10 15
Lys Gly
<210> 6
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 6
Ala Arg His Arg Gly Phe Asp Val Gly His Phe Asp Phe
1 5 10
<210> 7
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 7
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser Phe Asn Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 8
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asp Phe
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Gly Arg Val Ala Phe His Thr Tyr Tyr Pro Asp Ser Met
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Arg Gly Phe Asp Val Gly His Phe Asp Phe Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 9
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser Phe Asn Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 10
<211> 450
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asp Phe
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Gly Arg Val Ala Phe His Thr Tyr Tyr Pro Asp Ser Met
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Arg Gly Phe Asp Val Gly His Phe Asp Phe Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Cys Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 11
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 11
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 12
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 12
Leu Gly Val Asn Ser Val Ser
1 5
<210> 13
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 13
Met Gln Ala Leu Gln Thr Pro Trp Thr
1 5
<210> 14
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 14
Asn His Ala Ile Ser
1 5
<210> 15
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 15
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 16
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 16
Glu Trp Ala Asp Val Phe Asp Ile
1 5
<210> 17
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 17
Glu Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Val Asn Ser Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 18
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 18
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Ile Phe Ser Asn His
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Phe
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Trp Ala Asp Val Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 19
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 19
Arg Ala Ser Gln Gly Ile Arg Asn Asp Leu Gly
1 5 10
<210> 20
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 20
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 21
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 21
Leu Gln His Asn Ser Tyr Pro Trp Thr
1 5
<210> 22
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 22
Gly Asn Tyr Met Ser
1 5
<210> 23
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 23
Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 24
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 24
Asp Gly Tyr Tyr Val Ser Asp Met Val Val
1 5 10
<210> 25
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 26
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 26
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Ile Ser Gly Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Asn Ile Ser Arg Asp Ile Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Gly Tyr Tyr Val Ser Asp Met Val Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 27
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 27
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 28
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 28
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Ile Ser Gly Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Ile Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Gly Tyr Tyr Val Ser Asp Met Val Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 29
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 29
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 30
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 30
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Ile Ser Gly Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Ser Ile Ser Arg Asp Ile Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Gly Tyr Tyr Val Ser Asp Met Val Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 31
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 31
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 32
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 32
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Ile Ser Gly Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Ala Ile Ser Arg Asp Ile Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Gly Tyr Tyr Val Ser Asp Met Val Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 33
<400> 33
000
<210> 34
<400> 34
000
<210> 35
<400> 35
000
<210> 36
<400> 36
000
<210> 37
<400> 37
000
<210> 38
<400> 38
000
<210> 39
<400> 39
000
<210> 40
<400> 40
000
<210> 41
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 41
Arg Ser Ser Gln Ser Ile Val His Ser Val Gly Asn Thr Phe Leu Glu
1 5 10 15
<210> 42
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 42
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 43
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 43
Phe Gln Gly Ser Gln Phe Pro Tyr Thr
1 5
<210> 44
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 44
Gly Tyr Glu Phe Ser Arg Ser Trp Met Asn
1 5 10
<210> 45
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 45
Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Ser Gly Lys Phe Lys
1 5 10 15
Gly
<210> 46
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 46
Asp Gly Ser Ser Trp Asp Trp Tyr Phe Asp Val
1 5 10
<210> 47
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Val Gly Asn Thr Phe Leu Glu Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser Gln Phe Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 48
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 48
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Glu Phe Ser Arg Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Ser Gly Lys Phe
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Asp Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 49
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Val Gly Asn Thr Phe Leu Glu Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser Gln Phe Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Cys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 50
<211> 450
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 50
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Glu Phe Ser Arg Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Ser Gly Lys Phe
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Ser Ser Trp Asp Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
Claims (54)
- 화학식 (I)에 의해 나타내어지는 항체-약물 접합체.
<화학식 (I)>
Ab는 항체이고;
L은 하기 화학식에 의해 나타내어지는 펩티드모방체 링커이고,
여기서
Str은 Ab에 공유 부착된 스트레쳐 단위이고;
Sp는 결합 또는 약물 모이어티에 공유 부착된 스페이서 단위이고;
PM은
로 이루어진 군으로부터 선택된 비-펩티드 화학적 모이어티이고;
W는 -NH-헤테로시클로알킬- 또는 헤테로시클로알킬이고;
Y는 헤테로아릴, 아릴, -C(O)C1-C6알킬렌, C1-C6알킬렌-NH2, C1-C6알킬렌-NH-CH3, C1-C6알킬렌-N-(CH3)2, C1-C6알케닐 또는 C1-C6알킬레닐이고;
각각의 R1은 독립적으로 C1-C10알킬, C1-C10알케닐, (C1-C10알킬)NHC(NH)NH2 또는 (C1-C10알킬)NHC(O)NH2이고;
R3 및 R2는 각각 독립적으로 H, C1-C10알킬, C1-C10알케닐, 아릴알킬 또는 헤테로아릴알킬이거나, 또는 R3과 R2는 함께 C3-C7시클로알킬을 형성할 수 있고;
R4 및 R5는 각각 독립적으로 C1-C10알킬, C1-C10알케닐, 아릴알킬, 헤테로아릴알킬, (C1-C10알킬)OCH2-이거나, 또는 R4와 R5는 함께 C3-C7시클로알킬 고리를 형성할 수 있고;
p는 1 내지 8의 정수이고;
D는 약물 모이어티이다. - 제1항에 있어서, Y가 헤테로아릴이고; R4와 R5가 함께 시클로부틸 고리를 형성하는 것인 항체-약물 접합체.
- 제1항 또는 제2항에 있어서,
Str이 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
여기서 R6은 C1-C10알킬렌, C1-C10알케닐, C3-C8시클로알킬, (C1-C8알킬렌)O- 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌으로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬, 헤테로아릴알킬, 아릴 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고, 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고;
Sp가 -C1-C6알킬렌-C(O)NH- 또는 -Ar-Rb-이고, 여기서 Ar은 아릴 또는 헤테로아릴이고, Rb는 (C1-C10알킬렌)O-인
항체-약물 접합체. - 제1항에 있어서, 하기 화학식 (I)(A1)에 의해 나타내어지며,
<화학식 (I)(A1)>
여기서
Str은 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
R6은 C1-C10알킬렌 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌으로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬, 헤테로아릴알킬, 아릴, 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고, 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고;
p는 1, 2, 3 또는 4인
항체-약물 접합체 화합물. - 제1항에 있어서, 하기 화학식 (I)(B1)에 의해 나타내어지며,
<화학식 (I)(B1)>
여기서
Str은 하기 화학식에 의해 나타내어지는 화학적 모이어티이고,
R6은 C1-C10알킬렌 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌으로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬, 아릴, 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고, 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고;
p는 1, 2, 3 또는 4인
항체-약물 접합체. - 제4항 내지 제6항 및 제9항 중 어느 한 항에 있어서, Y가 헤테로아릴, 아릴 또는 알케닐이고; R6이 C1-C10알킬렌인 항체-약물 접합체.
- 제1항 내지 제17항 중 어느 한 항에 있어서,
D가 하기 화학식을 갖는 이량체 약물 모이어티이고,
여기서
R11은 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
R22는 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
Raa 및 Rbb는 독립적으로 H, 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나,
또는 Raa와 Rbb는 5 또는 6원 헤테로시클로알킬 기를 형성하고;
T는 C3-C12알킬렌, Y1, (C1-C6알킬렌)-Y1-(C1-C6 알킬렌), (C1-C6알킬렌)-Y1-(C1-C6알킬렌)-Y1-(C1-C6알킬렌), (C2-C6알케닐렌)-Y1-(C2-C6알케닐렌) 및 (C2-C6알키닐렌)-Y1-(C2-C6알키닐렌)으로부터 선택된 테더 기이고;
여기서 Y1은 독립적으로 O, S, NR11, 아릴 및 헤테로아릴로부터 선택되고;
여기서 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 F, OH, O(C1-C6알킬), NH2, NHCH3, N(CH3)2, NHC(O)(C1-C6알킬렌)m, OP(O)3H2 및 C1-C6알킬로 독립적으로 및 임의로 치환되고, 여기서 알킬은 1개 이상의 F로 임의로 치환되고, m은 0 또는 1이거나;
또는 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 L에 대한 결합으로 독립적으로 및 임의로 치환되고, 여기서 L에 대한 결합은 임의적인 치환기 중 1개를 통해 연결될 수 있고;
D'는
로부터 선택된 약물 모이어티이고,
여기서 파상선은 T에 대한 부착 부위를 나타내고;
X1 및 X2는 독립적으로 O 및 NR33으로부터 선택되고, 여기서 R33은 H, C(O), 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나, 또는 X1 및 X2는 각각 독립적으로 부재하고;
R44는 H, CO2R, C(O), 또는 L에 대한 결합이고, 여기서 R은 C1-C6알킬 또는 벤질이고;
R55는 H 또는 C1-C6알킬인
항체-약물 접합체. - 화학식 (I)(A)(LD1)의 화합물.
<화학식 (I)(A)(LD1)>
여기서
Str은 항체에 공유 부착될 수 있는 스트레쳐 단위이고;
Sp는 약물 모이어티에 공유 부착된 임의적인 스페이서 단위이고;
Y는 헤테로아릴, 아릴, -C(O)C1-C6알케닐, C1-C6알케닐 또는 -C1-C6알케닐-NH-이고;
R1은 C1-C10알킬, (C1-C10알킬)NHC(NH)NH2 또는 (C1-C10알킬)NHC(O)NH2이고;
R3 및 R2는 각각 독립적으로 H, C1-C10알킬, 아릴알킬 또는 헤테로아릴알킬이거나, 또는 R3과 R2는 함께 C3-C7시클로알킬을 형성할 수 있고;
D는 약물 모이어티이다. - 제23항 또는 제26항에 있어서, Str이 하기 화학식을 갖고,
여기서 R6은 C1-C10알킬렌, C3-C8시클로알킬, O-(C1-C8알킬렌) 및 C1-C10알킬렌-C(O)N(Ra)-C2-C6알킬렌으로 이루어진 군으로부터 선택되고, 여기서 각각의 알킬렌은 할로, 트리플루오로메틸, 디플루오로메틸, 아미노, 알킬아미노, 시아노, 술포닐, 술폰아미드, 술폭시드, 히드록시, 알콕시, 에스테르, 카르복실산, 알킬티오, C3-C8시클로알킬, C4-C7헤테로시클로알킬 아릴, 아릴알킬, 헤테로아릴알킬 및 헤테로아릴로 이루어진 군으로부터 선택된 1 내지 5개의 치환기에 의해 치환될 수 있고, 각각의 Ra는 독립적으로 H 또는 C1-C6알킬이고;
Sp가 -C1-C6알킬렌-C(O)NH- 또는 -Ar-Rb-이고, 여기서 Ar은 아릴 또는 헤테로아릴이고, Rb는 (C1-C10알킬렌)O-인
화합물. - 제26항에 있어서, R6이 C1-C10알킬렌이고, Sp가 -Ar-Rb-이고, 여기서 Ar은 아릴이고, Rb는 (C1-C6알킬렌)O-인 화합물.
- 제23항 또는 제26항에 있어서, R6이 -(CH2)q이고, 1-10인 화합물.
- 제26항에 있어서, R6이 C1-C10 알킬렌이고, Sp가 -Ar-Rb-이고, 여기서 Ar은 아릴이고, Rb는 (C1-C6 알킬렌)O-인 화합물.
- 제1항 내지 제22항 중 어느 한 항에 있어서, p가 2인 항체-약물 접합체.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 항체가
CLL1;
BMPR1B;
E16;
STEAP1;
0772P;
MPF;
NaPi2b;
Sema 5b;
PSCA hlg;
ETBR;
MSG783;
STEAP2;
TrpM4;
CRIPTO;
CD21;
CD79b;
FcRH2;
HER2;
NCA;
MDP;
IL20Rα;
브레비칸;
EphB2R;
ASLG659;
PSCA;
GEDA;
BAFF-R;
CD22;
CD79a;
CXCR5;
HLA-DOB;
P2X5;
CD72;
LY64;
FcRH1;
IRTA2;
TENB2;
PMEL17;
TMEFF1;
GDNF-Ra1;
Ly6E;
TMEM46;
Ly6G6D;
LGR5;
RET;
LY6K;
GPR19;
GPR54;
ASPHD1;
시나제;
TMEM118;
GPR172A;
MUC16 및
CD33
으로 이루어진 군으로부터 선택된 폴리펩티드 중 1종 이상에 결합하는 것인 항체 접합체. - 제1항 내지 제35항 중 어느 한 항에 있어서, D가 항종양제 또는 항생제 모이어티인 화합물.
- 제1항 내지 제36항 중 어느 한 항에 있어서, D가
메토트렉세이트, 아드리아미신, 빈크리스틴, 빈블라스틴, 에토포시드, 독소루비신, 멜팔란, 미토마이신 C, 클로람부실 및 다우노루비신
으로 이루어진 군으로부터 선택된 것인 화합물. - 제23항 내지 제33항 중 어느 한 항에 있어서,
D가 하기 화학식을 갖는 이량체 약물 모이어티이고,
여기서
R11은 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
R22는 H, P(O)3H2, C(O)NRaaRbb, 또는 L에 대한 결합으로부터 선택되고;
Raa 및 Rbb는 독립적으로 H, 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나,
또는 Raa와 Rbb는 5 또는 6원 헤테로시클로알킬 기를 형성하고;
T는 C3-C12알킬렌, Y1, (C1-C6알킬렌)-Y1-(C1-C6 알킬렌), (C1-C6알킬렌)-Y1-(C1-C6알킬렌)-Y1-(C1-C6알킬렌), (C2-C6알케닐렌)-Y1-(C2-C6알케닐렌) 및 (C2-C6알키닐렌)-Y1-(C2-C6알키닐렌)으로부터 선택된 테더 기이고;
여기서 Y1은 독립적으로 O, S, NR11, 아릴 및 헤테로아릴로부터 선택되고;
여기서 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 F, OH, O(C1-C6알킬), NH2, NHCH3, N(CH3)2, NHC(O)(C1-C6알킬렌)m, OP(O)3H2 및 C1-C6알킬로 독립적으로 및 임의로 치환되고, 여기서 알킬은 1개 이상의 F로 임의로 치환되고, m은 0 또는 1이거나;
또는 알킬렌, 알케닐렌, 아릴 및 헤테로아릴은 L에 대한 결합으로 독립적으로 및 임의로 치환되고, 여기서 L에 대한 결합은 임의적인 치환기 중 1개를 통해 연결될 수 있고;
D'는
으로부터 선택된 약물 모이어티이고,
여기서 파상선은 T에 대한 부착 부위를 나타내고;
X1 및 X2는 독립적으로 O 및 NR33으로부터 선택되고, 여기서 R33은 H, C(O), 및 1개 이상의 F로 임의로 치환된 C1-C6알킬로부터 선택되거나, 또는 X1 및 X2는 각각 독립적으로 부재하고;
R44는 H, CO2R, C(O), 또는 L에 대한 결합이고, 여기서 R은 C1-C6알킬 또는 벤질이고;
R55는 H 또는 C1-C6알킬인
화합물. - 항체를 제23항 내지 제33항 중 어느 한 항의 1 내지 8종의 화합물과 공유 부착시킴으로써 제조되는 항체 접합체 화합물.
- 질환의 치료를 필요로 하는 인간에게 유효량의 제1항의 항체-약물 접합체를 투여하는 것을 포함하는, 상기 인간에서 질환을 치료하는 방법.
- 제1항의 화합물 및 그의 제약상 허용되는 담체를 포함하는 제약 조성물.
- 제30항에 있어서, 항체가
CLL1;
STEAP1;
NaPi2b;
STEAP2;
TrpM4;
CRIPTO;
CD21;
CD79b;
FcRH2;
HER2;
CD22;
CD79a;
CD72;
LY64;
Ly6E;
MUC16; 및
CD33
으로 이루어진 군으로부터 선택된 폴리펩티드 중 1종 이상에 결합하는 것인 화합물. - 제1항 내지 제22항 중 어느 한 항에 있어서, 항체가 CD33에 결합하는 것인 항체-약물 접합체.
- 제34항에 있어서, 항-CD33 항체가 서열식별번호: 11의 아미노산 서열을 포함하는 HVR-L1, 서열식별번호: 12의 아미노산 서열을 포함하는 HVR-L2, 서열식별번호: 13의 아미노산 서열을 포함하는 HVR-L3, 서열식별번호: 14의 아미노산 서열을 포함하는 HVR-H1, 서열식별번호: 15의 아미노산 서열을 포함하는 HVR-H2, 및 서열식별번호: 16의 아미노산 서열을 포함하는 HVR-H3을 포함하는 것인 항체-약물 접합체.
- 제34항에 있어서, 상기 항-CD33 항체가 서열식별번호: 17의 아미노산 서열을 포함하는 VL 도메인 및 서열식별번호: 18의 아미노산 서열을 포함하는 VH 도메인을 포함하는 것인 항체-약물 접합체.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 항체가 NaPi2b에 결합하는 것인 항체-약물 접합체.
- 제46항에 있어서, NaPi2b 항체가 서열식별번호: 1의 아미노산 서열을 포함하는 HVR-L1, 서열식별번호: 2의 아미노산 서열을 포함하는 HVR-L2, 서열식별번호: 3의 아미노산 서열을 포함하는 HVR-L3, 서열식별번호: 4의 아미노산 서열을 포함하는 HVR-H1, 서열식별번호: 5의 아미노산 서열을 포함하는 HVR-H2, 및 서열식별번호: 6의 아미노산 서열을 포함하는 HVR-H3을 포함하는 것인 항체-약물 접합체.
- 제46항에 있어서, 상기 NaPi2b 항체가 서열식별번호: 7의 아미노산 서열을 포함하는 VL 도메인 및 서열식별번호: 8의 아미노산 서열을 포함하는 VH 도메인을 포함하는 것인 항체-약물 접합체.
- 제46항에 있어서, 상기 NaPi2b 항체가 서열식별번호: 9의 아미노산 서열 및 서열식별번호: 10의 아미노산 서열을 포함하는 것인 항체-약물 접합체.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 항체가 CD-22에 결합하는 것인 항체-약물 접합체.
- 제50항에 있어서, CD-22 항체가 서열식별번호: 41의 아미노산 서열을 포함하는 HVR-L1, 서열식별번호: 42의 아미노산 서열을 포함하는 HVR-L2, 서열식별번호: 43의 아미노산 서열을 포함하는 HVR-L3, 서열식별번호: 44의 아미노산 서열을 포함하는 HVR-H1, 서열식별번호: 45의 아미노산 서열을 포함하는 HVR-H2, 및 서열식별번호: 46의 아미노산 서열을 포함하는 HVR-H3을 포함하는 것인 항체-약물 접합체.
- 제50항에 있어서, 상기 CD-22 항체가 서열식별번호: 47의 아미노산 서열을 포함하는 VL 도메인 및 서열식별번호: 48의 아미노산 서열을 포함하는 VH 도메인을 포함하는 것인 항체-약물 접합체.
- 제50항에 있어서, 상기 CD-22 항체가 서열식별번호: 49의 아미노산 서열 및 서열식별번호: 50의 아미노산 서열을 포함하는 것인 항체-약물 접합체.
- 제50항에 있어서, 상기 CD-22 항체가 서열식별번호: 49의 아미노산 서열과 적어도 95% 서열 동일성을 갖는 아미노산 서열, 및 서열식별번호: 50의 아미노산 서열과 적어도 95% 서열 동일성을 갖는 아미노산 서열을 포함하는 것인 항체-약물 접합체.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361916691P | 2013-12-16 | 2013-12-16 | |
| US201361916661P | 2013-12-16 | 2013-12-16 | |
| US61/916,661 | 2013-12-16 | ||
| US61/916,691 | 2013-12-16 | ||
| PCT/US2014/070660 WO2015095227A2 (en) | 2013-12-16 | 2014-12-16 | Peptidomimetic compounds and antibody-drug conjugates thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170042495A true KR20170042495A (ko) | 2017-04-19 |
Family
ID=52293250
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167019163A KR20170042495A (ko) | 2013-12-16 | 2014-12-16 | 펩티드모방체 화합물 및 그의 항체-약물 접합체 |
Country Status (18)
| Country | Link |
|---|---|
| US (2) | US10124069B2 (ko) |
| EP (1) | EP3082875B1 (ko) |
| JP (1) | JP6895254B2 (ko) |
| KR (1) | KR20170042495A (ko) |
| CN (1) | CN107106700B (ko) |
| AU (1) | AU2014364927A1 (ko) |
| BR (1) | BR112016013861A2 (ko) |
| CA (1) | CA2933557A1 (ko) |
| CL (1) | CL2016001514A1 (ko) |
| CR (1) | CR20160271A (ko) |
| EA (1) | EA201691023A1 (ko) |
| IL (1) | IL246277A0 (ko) |
| MX (1) | MX2016007826A (ko) |
| PE (1) | PE20161394A1 (ko) |
| PH (1) | PH12016501171A1 (ko) |
| SG (1) | SG11201604905WA (ko) |
| UA (1) | UA118113C2 (ko) |
| WO (1) | WO2015095227A2 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020180158A1 (ko) * | 2019-03-07 | 2020-09-10 | 에이비엘바이오 주식회사 | 항체-약물 접합체 및 이의 용도 |
Families Citing this family (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2789684B1 (en) | 2008-05-23 | 2016-12-21 | Siwa Corporation | Methods and compositions for facilitating regeneration |
| MX2016001862A (es) | 2013-08-12 | 2016-08-03 | Genentech Inc | Compuestos de conjugado anticuerpo-farmaco dimerico de 1-(clorometil)-2,3-dihidro-1h-benzo[e]indol, y metodos de uso y tratamiento. |
| JP6980384B2 (ja) | 2013-12-16 | 2021-12-15 | ジェネンテック, インコーポレイテッド | 1−(クロロメチル)−2,3−ジヒドロ−1h−ベンゾ[e]インドール二量体抗体−薬物コンジュゲート化合物、並びに使用及び処置の方法 |
| RU2689388C1 (ru) | 2013-12-16 | 2019-05-28 | Дженентек, Инк. | Пептидомиметические соединения и их конъюгаты антител с лекарственными средствами |
| CA2931798C (en) | 2013-12-16 | 2023-06-27 | Genentech, Inc. | Peptidomimetic compounds and antibody-drug conjugates thereof |
| EP3082875B1 (en) | 2013-12-16 | 2020-11-25 | Genentech, Inc. | Peptidomimetic compounds and antibody-drug conjugates thereof |
| WO2016008112A1 (en) * | 2014-07-16 | 2016-01-21 | Medshine Discovery Inc. | Linkers and application towards adc thereof |
| CA2957354A1 (en) | 2014-09-12 | 2016-03-17 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| EA201790545A1 (ru) | 2014-09-12 | 2017-07-31 | Дженентек, Инк. | Антитела и иммуноконъюгаты против her2 |
| US9751946B2 (en) | 2014-09-12 | 2017-09-05 | Genentech, Inc. | Anti-CLL-1 antibodies and immunoconjugates |
| JP6751393B2 (ja) * | 2014-12-03 | 2020-09-02 | ジェネンテック, インコーポレイテッド | 抗staphylococcus aureus抗体リファマイシン抱合体及びその使用 |
| EP3226909A1 (en) * | 2014-12-03 | 2017-10-11 | Genentech, Inc. | Quaternary amine compounds and antibody-drug conjugates thereof |
| US10358502B2 (en) | 2014-12-18 | 2019-07-23 | Siwa Corporation | Product and method for treating sarcopenia |
| US9993535B2 (en) | 2014-12-18 | 2018-06-12 | Siwa Corporation | Method and composition for treating sarcopenia |
| JP2018524295A (ja) * | 2015-06-15 | 2018-08-30 | ジェネンテック, インコーポレイテッド | 抗体及び免疫複合体 |
| MA43354A (fr) | 2015-10-16 | 2018-08-22 | Genentech Inc | Conjugués médicamenteux à pont disulfure encombré |
| CN105348112A (zh) * | 2015-11-06 | 2016-02-24 | 上海皓元化学科技有限公司 | 一种1-氨基环丙基乙炔的工艺合成方法 |
| JP6722293B2 (ja) | 2016-02-19 | 2020-07-15 | シワ コーポレーション | 終末糖化産物(age)に対する抗体を使用して、がんを治療、転移性がん細胞を殺傷、及びがん転移を予防するための方法及び組成物 |
| CA3057829A1 (en) | 2016-04-15 | 2017-10-19 | Siwa Corporation | Anti-age antibodies for treating neurodegenerative disorders |
| TW201808936A (zh) | 2016-05-18 | 2018-03-16 | 美商梅爾莎納醫療公司 | 吡咯并苯并二氮呯類及其共軛物 |
| WO2017201449A1 (en) | 2016-05-20 | 2017-11-23 | Genentech, Inc. | Protac antibody conjugates and methods of use |
| JP7022080B2 (ja) | 2016-05-27 | 2022-02-17 | ジェネンテック, インコーポレイテッド | 部位特異的抗体-薬物複合体の特徴付けのための生化学分析的方法 |
| US11013816B2 (en) * | 2016-05-31 | 2021-05-25 | Sorrento Therapeutics, Inc. | Antibody drug conjugates having derivatives of amatoxin as the drug |
| EP3464280B1 (en) | 2016-06-06 | 2021-10-06 | F. Hoffmann-La Roche AG | Silvestrol antibody-drug conjugates and methods of use |
| CN109641910A (zh) | 2016-06-24 | 2019-04-16 | 梅尔莎纳医疗公司 | 吡咯并苯二氮*及其缀合物 |
| WO2018031662A1 (en) | 2016-08-11 | 2018-02-15 | Genentech, Inc. | Pyrrolobenzodiazepine prodrugs and antibody conjugates thereof |
| CN110139674B (zh) | 2016-10-05 | 2023-05-16 | 豪夫迈·罗氏有限公司 | 制备抗体药物缀合物的方法 |
| US11135307B2 (en) | 2016-11-23 | 2021-10-05 | Mersana Therapeutics, Inc. | Peptide-containing linkers for antibody-drug conjugates |
| EP3360865A1 (en) | 2017-02-13 | 2018-08-15 | F.I.S.- Fabbrica Italiana Sintetici S.p.A. | Process for the preparation of cyclopropyldiketopiperazines, and of a key intermediate of ds-5272 |
| JP2020516648A (ja) * | 2017-04-13 | 2020-06-11 | シワ コーポレーション | ヒト化モノクローナル終末糖化産物抗体 |
| CN107216277B (zh) * | 2017-06-22 | 2020-04-24 | 东南大学 | 一种lcz696药物杂质的制备方法 |
| CN109180681B (zh) * | 2017-08-18 | 2021-08-20 | 四川百利药业有限责任公司 | 一种dna毒性二聚体化合物 |
| US11638760B2 (en) | 2017-11-27 | 2023-05-02 | Mersana Therapeutics, Inc. | Pyrrolobenzodiazepine antibody conjugates |
| CN111757757A (zh) | 2017-12-21 | 2020-10-09 | 梅尔莎纳医疗公司 | 吡咯并苯并二氮呯抗体共轭物 |
| US11518801B1 (en) | 2017-12-22 | 2022-12-06 | Siwa Corporation | Methods and compositions for treating diabetes and diabetic complications |
| CN108949987B (zh) * | 2018-08-02 | 2021-03-16 | 青岛泱深生物医药有限公司 | Gpr19作为诊治宫颈癌的靶标 |
| JP2022505450A (ja) * | 2018-10-24 | 2022-01-14 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | コンジュゲート化された化学的分解誘導物質および使用方法 |
| CN113227119A (zh) | 2018-12-10 | 2021-08-06 | 基因泰克公司 | 用于与含Fc的蛋白质进行位点特异性缀合的光交联肽 |
| CN109824621A (zh) * | 2019-03-28 | 2019-05-31 | 中国药科大学 | 噁二唑类和噻二唑类化合物及其制备方法和用途 |
| US20220387618A1 (en) | 2019-11-15 | 2022-12-08 | Seagen Inc. | Methods of treating her2 positive breast cancer with tucatinib in combination with an anti-her2 antibody-drug conjugate |
| BR112023001143A2 (pt) | 2020-07-21 | 2023-02-14 | Genentech Inc | Conjugado, composto, composição farmacêutica, métodos para tratar uma doença e reduzir o nível de uma proteína brm alvo em um indivíduo |
| CN115192732A (zh) * | 2021-04-01 | 2022-10-18 | 成都百利多特生物药业有限责任公司 | 一种dna毒性二聚体化合物及其偶联物 |
| WO2023178641A1 (zh) * | 2022-03-25 | 2023-09-28 | 成都百利多特生物药业有限责任公司 | 一种dna毒性二聚体化合物及其偶联物 |
| WO2023056069A1 (en) | 2021-09-30 | 2023-04-06 | Angiex, Inc. | Degrader-antibody conjugates and methods of using same |
| WO2023147329A1 (en) | 2022-01-26 | 2023-08-03 | Genentech, Inc. | Antibody-conjugated chemical inducers of degradation and methods thereof |
| WO2023147328A1 (en) | 2022-01-26 | 2023-08-03 | Genentech, Inc. | Antibody-conjugated chemical inducers of degradation with hydolysable maleimide linkers and methods thereof |
| WO2023215737A1 (en) | 2022-05-03 | 2023-11-09 | Genentech, Inc. | Anti-ly6e antibodies, immunoconjugates, and uses thereof |
Family Cites Families (301)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US633410A (en) | 1898-09-22 | 1899-09-19 | George A Ames | Ice-cutter. |
| US3896111A (en) | 1973-02-20 | 1975-07-22 | Research Corp | Ansa macrolides |
| US4151042A (en) | 1977-03-31 | 1979-04-24 | Takeda Chemical Industries, Ltd. | Method for producing maytansinol and its derivatives |
| US4137230A (en) | 1977-11-14 | 1979-01-30 | Takeda Chemical Industries, Ltd. | Method for the production of maytansinoids |
| US4265814A (en) | 1978-03-24 | 1981-05-05 | Takeda Chemical Industries | Matansinol 3-n-hexadecanoate |
| US4307016A (en) | 1978-03-24 | 1981-12-22 | Takeda Chemical Industries, Ltd. | Demethyl maytansinoids |
| JPS5562090A (en) | 1978-10-27 | 1980-05-10 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| US4256746A (en) | 1978-11-14 | 1981-03-17 | Takeda Chemical Industries | Dechloromaytansinoids, their pharmaceutical compositions and method of use |
| JPS5566585A (en) | 1978-11-14 | 1980-05-20 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55164687A (en) | 1979-06-11 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55102583A (en) | 1979-01-31 | 1980-08-05 | Takeda Chem Ind Ltd | 20-acyloxy-20-demethylmaytansinoid compound |
| JPS55162791A (en) | 1979-06-05 | 1980-12-18 | Takeda Chem Ind Ltd | Antibiotic c-15003pnd and its preparation |
| JPS55164685A (en) | 1979-06-08 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55164686A (en) | 1979-06-11 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| US4309428A (en) | 1979-07-30 | 1982-01-05 | Takeda Chemical Industries, Ltd. | Maytansinoids |
| JPS5645483A (en) | 1979-09-19 | 1981-04-25 | Takeda Chem Ind Ltd | C-15003phm and its preparation |
| EP0028683A1 (en) | 1979-09-21 | 1981-05-20 | Takeda Chemical Industries, Ltd. | Antibiotic C-15003 PHO and production thereof |
| JPS5645485A (en) | 1979-09-21 | 1981-04-25 | Takeda Chem Ind Ltd | Production of c-15003pnd |
| WO1981001145A1 (en) | 1979-10-18 | 1981-04-30 | Univ Illinois | Hydrolytic enzyme-activatible pro-drugs |
| WO1982001188A1 (en) | 1980-10-08 | 1982-04-15 | Takeda Chemical Industries Ltd | 4,5-deoxymaytansinoide compounds and process for preparing same |
| US4450254A (en) | 1980-11-03 | 1984-05-22 | Standard Oil Company | Impact improvement of high nitrile resins |
| US4315929A (en) | 1981-01-27 | 1982-02-16 | The United States Of America As Represented By The Secretary Of Agriculture | Method of controlling the European corn borer with trewiasine |
| US4313946A (en) | 1981-01-27 | 1982-02-02 | The United States Of America As Represented By The Secretary Of Agriculture | Chemotherapeutically active maytansinoids from Trewia nudiflora |
| JPS57192389A (en) | 1981-05-20 | 1982-11-26 | Takeda Chem Ind Ltd | Novel maytansinoid |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| JPS6098584A (ja) | 1983-11-02 | 1985-06-01 | Canon Inc | カメラ―体形vtr |
| US5807715A (en) | 1984-08-27 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and transformed mammalian lymphocyte cells for producing functional antigen-binding protein including chimeric immunoglobulin |
| AU6355090A (en) | 1989-08-23 | 1991-04-03 | Scripps Clinic And Research Foundation | Compositions and methods for detection and treatment of epstein-barr virus infection and immune disorders |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| CA2026147C (en) | 1989-10-25 | 2006-02-07 | Ravi J. Chari | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5256643A (en) | 1990-05-29 | 1993-10-26 | The Government Of The United States | Human cripto protein |
| AU9016591A (en) | 1990-10-25 | 1992-05-26 | Tanox Biosystems, Inc. | Glycoproteins associated with membrane-bound immunoglobulins as antibody targets on B cells |
| US5440021A (en) | 1991-03-29 | 1995-08-08 | Chuntharapai; Anan | Antibodies to human IL-8 type B receptor |
| US5543503A (en) | 1991-03-29 | 1996-08-06 | Genentech Inc. | Antibodies to human IL-8 type A receptor |
| CA2407304A1 (en) | 1991-03-29 | 1992-10-15 | Genentech, Inc. | Human pf4a receptors and their use |
| JP3050424B2 (ja) | 1991-07-12 | 2000-06-12 | 塩野義製薬株式会社 | ヒトエンドセリンリセプター |
| US5264557A (en) | 1991-08-23 | 1993-11-23 | The United States Of America As Represented By The Department Of Health And Human Services | Polypeptide of a human cripto-related gene, CR-3 |
| US6011146A (en) | 1991-11-15 | 2000-01-04 | Institut Pasteur | Altered major histocompatibility complex (MHC) determinant and methods of using the determinant |
| US6153408A (en) | 1991-11-15 | 2000-11-28 | Institut Pasteur And Institut National De La Sante Et De La Recherche Medicale | Altered major histocompatibility complex (MHC) determinant and methods of using the determinant |
| ZA932522B (en) | 1992-04-10 | 1993-12-20 | Res Dev Foundation | Immunotoxins directed against c-erbB-2(HER/neu) related surface antigens |
| IL107366A (en) | 1992-10-23 | 2003-03-12 | Chugai Pharmaceutical Co Ltd | Genes coding for megakaryocyte potentiator |
| US5644033A (en) | 1992-12-22 | 1997-07-01 | Health Research, Inc. | Monoclonal antibodies that define a unique antigen of human B cell antigen receptor complex and methods of using same for diagnosis and treatment |
| US5801005A (en) | 1993-03-17 | 1998-09-01 | University Of Washington | Immune reactivity to HER-2/neu protein for diagnosis of malignancies in which the HER-2/neu oncogene is associated |
| US5869445A (en) | 1993-03-17 | 1999-02-09 | University Of Washington | Methods for eliciting or enhancing reactivity to HER-2/neu protein |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| US5773223A (en) | 1993-09-02 | 1998-06-30 | Chiron Corporation | Endothelin B1, (ETB1) receptor polypeptide and its encoding nucleic acid methods, and uses thereof |
| US5773001A (en) | 1994-06-03 | 1998-06-30 | American Cyanamid Company | Conjugates of methyltrithio antitumor agents and intermediates for their synthesis |
| WO2001016318A2 (en) | 1999-09-01 | 2001-03-08 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US5750370A (en) | 1995-06-06 | 1998-05-12 | Human Genome Sciences, Inc. | Nucleic acid encoding human endothlein-bombesin receptor and method of producing the receptor |
| US5712374A (en) | 1995-06-07 | 1998-01-27 | American Cyanamid Company | Method for the preparation of substantiallly monomeric calicheamicin derivative/carrier conjugates |
| US5714586A (en) | 1995-06-07 | 1998-02-03 | American Cyanamid Company | Methods for the preparation of monomeric calicheamicin derivative/carrier conjugates |
| US5707829A (en) | 1995-08-11 | 1998-01-13 | Genetics Institute, Inc. | DNA sequences and secreted proteins encoded thereby |
| US20020193567A1 (en) | 1995-08-11 | 2002-12-19 | Genetics Institute, Inc. | Secreted proteins and polynucleotides encoding them |
| JP3646191B2 (ja) | 1996-03-19 | 2005-05-11 | 大塚製薬株式会社 | ヒト遺伝子 |
| EP0910636A1 (en) | 1996-05-17 | 1999-04-28 | Schering Corporation | Human b-cell antigens, related reagents |
| EP0941120A4 (en) * | 1996-11-05 | 2004-08-18 | Bristol Myers Squibb Co | BRANCHED PEPTIDLINKERS |
| US5945511A (en) | 1997-02-20 | 1999-08-31 | Zymogenetics, Inc. | Class II cytokine receptor |
| US20030185830A1 (en) | 1997-02-25 | 2003-10-02 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of prostate cancer |
| US7033827B2 (en) | 1997-02-25 | 2006-04-25 | Corixa Corporation | Prostate-specific polynucleotide compositions |
| NZ337413A (en) | 1997-03-10 | 2003-02-28 | Univ California | Antibodies that bind to Prostate Stem Cell Antigen (PSCA) to treat prostate cancer. |
| US6261791B1 (en) | 1997-03-10 | 2001-07-17 | The Regents Of The University Of California | Method for diagnosing cancer using specific PSCA antibodies |
| US6541212B2 (en) | 1997-03-10 | 2003-04-01 | The Regents Of The University Of California | Methods for detecting prostate stem cell antigen protein |
| US6555339B1 (en) | 1997-04-14 | 2003-04-29 | Arena Pharmaceuticals, Inc. | Non-endogenous, constitutively activated human protein-coupled receptors |
| US6319688B1 (en) | 1997-04-28 | 2001-11-20 | Smithkline Beecham Corporation | Polynucleotide encoding human sodium dependent phosphate transporter (IPT-1) |
| WO1998051824A1 (en) | 1997-05-15 | 1998-11-19 | Abbott Laboratories | Reagents and methods useful for detecting disease of the urinary tract |
| US6890749B2 (en) | 1997-05-15 | 2005-05-10 | Abbott Laboratories | Reagents and methods useful for detecting diseases of the prostate |
| US20030060612A1 (en) | 1997-10-28 | 2003-03-27 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| US20020034749A1 (en) | 1997-11-18 | 2002-03-21 | Billing-Medel Patricia A. | Reagents and methods useful for detecting diseases of the breast |
| US6110695A (en) | 1997-12-02 | 2000-08-29 | The Regents Of The University Of California | Modulating the interaction of the chemokine, B Lymphocyte Hemoattractant, and its Receptor, BLR1 |
| WO1999046284A2 (en) | 1998-03-13 | 1999-09-16 | The Burnham Institute | Molecules that home to various selected organs or tissues |
| AU4078599A (en) | 1998-05-13 | 1999-11-29 | Epimmune, Inc. | Expression vectors for stimulating an immune response and methods of using the same |
| US20030064397A1 (en) | 1998-05-22 | 2003-04-03 | Incyte Genomics, Inc. | Transmembrane protein differentially expressed in prostate and lung tumors |
| US20020187472A1 (en) | 2001-03-09 | 2002-12-12 | Preeti Lal | Steap-related protein |
| WO2002016429A2 (en) | 2000-08-24 | 2002-02-28 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| WO2000012130A1 (en) | 1998-08-27 | 2000-03-09 | Smithkline Beecham Corporation | Rp105 agonists and antagonists |
| JP4689781B2 (ja) | 1998-09-03 | 2011-05-25 | 独立行政法人科学技術振興機構 | アミノ酸輸送蛋白及びその遺伝子 |
| WO2000020579A1 (en) | 1998-10-02 | 2000-04-13 | Mcmaster University | Spliced form of erbb-2/neu oncogene |
| WO2001057188A2 (en) | 2000-02-03 | 2001-08-09 | Hyseq, Inc. | Novel nucleic acids and polypeptides |
| US6962980B2 (en) | 1999-09-24 | 2005-11-08 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US6468546B1 (en) | 1998-12-17 | 2002-10-22 | Corixa Corporation | Compositions and methods for therapy and diagnosis of ovarian cancer |
| US6858710B2 (en) | 1998-12-17 | 2005-02-22 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US20020119158A1 (en) | 1998-12-17 | 2002-08-29 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US20030091580A1 (en) | 2001-06-18 | 2003-05-15 | Mitcham Jennifer L. | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| JP2002536966A (ja) | 1998-12-30 | 2002-11-05 | ベス・イスラエル・ディーコニス・メディカル・センター・インコーポレーテッド | カルシウムチャネルファミリーの特徴付け |
| US20030190669A1 (en) | 1998-12-30 | 2003-10-09 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| CA2361009C (en) | 1999-01-29 | 2012-10-23 | Corixa Corporation | Her-2/neu fusion proteins |
| GB9905124D0 (en) | 1999-03-05 | 1999-04-28 | Smithkline Beecham Biolog | Novel compounds |
| AU3395900A (en) | 1999-03-12 | 2000-10-04 | Human Genome Sciences, Inc. | Human lung cancer associated gene sequences and polypeptides |
| US7304126B2 (en) | 1999-05-11 | 2007-12-04 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| AU4952600A (en) | 1999-06-03 | 2000-12-28 | Takeda Chemical Industries Ltd. | Screening method with the use of cd100 |
| DK2283866T3 (en) | 1999-06-25 | 2015-05-18 | Genentech Inc | METHODS OF TREATMENT USING ANTI-ERBB ANTIBODY-MAYTANSINOID CONJUGATES |
| US20030119113A1 (en) | 1999-07-20 | 2003-06-26 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US7297770B2 (en) | 1999-08-10 | 2007-11-20 | Genentech, Inc. | PRO6496 polypeptides |
| US7294696B2 (en) | 1999-08-17 | 2007-11-13 | Genentech Inc. | PRO7168 polypeptides |
| US20030129192A1 (en) | 1999-09-10 | 2003-07-10 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US20030206918A1 (en) | 1999-09-10 | 2003-11-06 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US20030232056A1 (en) | 1999-09-10 | 2003-12-18 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| IL149116A0 (en) | 1999-10-29 | 2002-11-10 | Genentech Inc | Anti-prostate stem cell antigen (psca) antibody compositions and methods of use |
| EP2418212B1 (en) | 1999-11-29 | 2016-06-15 | The Trustees of Columbia University in the City of New York | Isolation of five novel genes coding for new fc receptors-type melanoma involved in the pathogenesis of lymphoma/melanoma |
| CA2392510A1 (en) | 1999-11-30 | 2001-06-07 | Corixa Corporation | Compositions and methods for therapy and diagnosis of breast cancer |
| EP1568373A3 (en) | 1999-12-10 | 2005-12-21 | Epimmune Inc. | Inducing cellular immune responses to HER2/neu using peptide and nucleic acid compositions |
| NZ502058A (en) | 1999-12-23 | 2003-11-28 | Ovita Ltd | Isolated mutated nucleic acid molecule for regulation of ovulation rate |
| US6610286B2 (en) | 1999-12-23 | 2003-08-26 | Zymogenetics, Inc. | Method for treating inflammation using soluble receptors to interleukin-20 |
| JP2003535037A (ja) | 1999-12-23 | 2003-11-25 | ザイモジェネティクス,インコーポレイティド | 炎症を治療する方法 |
| RU2279441C2 (ru) | 1999-12-23 | 2006-07-10 | Займодженетикс, Инк. | Выделенный растворимый il-20 рецептор (варианты) |
| US20040001827A1 (en) | 2002-06-28 | 2004-01-01 | Dennis Mark S. | Serum albumin binding peptides for tumor targeting |
| ATE337403T1 (de) | 1999-12-24 | 2006-09-15 | Genentech Inc | Verfahren und verbindungen zur verlängerung der halbwertzeiten bei der ausscheidung von biowirksamen verbindungen |
| US7294695B2 (en) | 2000-01-20 | 2007-11-13 | Genentech, Inc. | PRO10268 polypeptides |
| EP1252294A2 (en) | 2000-01-21 | 2002-10-30 | Corixa Corporation | Compounds and methods for prevention and treatment of her-2/neu associated malignancies |
| US20030224379A1 (en) | 2000-01-21 | 2003-12-04 | Tang Y. Tom | Novel nucleic acids and polypeptides |
| US20030186372A1 (en) | 2000-02-11 | 2003-10-02 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| AU2001238596A1 (en) | 2000-02-22 | 2001-09-03 | Millennium Pharmaceuticals, Inc. | 18607, a novel human calcium channel |
| US20030219806A1 (en) | 2000-02-22 | 2003-11-27 | Millennium Pharmaceuticals, Inc. | Novel 18607, 15603, 69318, 12303, 48000, 52920, 5433, 38554, 57301, 58324, 55063, 52991, 59914, 59921 and 33751 molecules and uses therefor |
| US20040005561A1 (en) | 2000-03-01 | 2004-01-08 | Corixa Corporation | Compositions and methods for the detection, diagnosis and therapy of hematological malignancies |
| US20040002068A1 (en) | 2000-03-01 | 2004-01-01 | Corixa Corporation | Compositions and methods for the detection, diagnosis and therapy of hematological malignancies |
| WO2001066689A2 (en) | 2000-03-07 | 2001-09-13 | Hyseq, Inc. | Novel nucleic acids and polypeptides |
| AU4941101A (en) | 2000-03-24 | 2001-10-08 | Fahri Saatcioglu | Novel prostate-specific or testis-specific nucleic acid molecules, polypeptides,and diagnostic and therapeutic methods |
| EP1268554A2 (de) | 2000-03-31 | 2003-01-02 | IPF Pharmaceuticals GmbH | Diagnostik- und arzneimittel zur untersuchung des zelloberflächenproteoms von tumor- und entzündungszellen sowie zur behandlung von tumorerkrankungen und entzündlichen erkrankungen vorzugsweise mit hilfe einer spezifischen chemokinrezeptor-analyse und der chemokinrezeptor-ligand-interaktion |
| AU2001253140A1 (en) | 2000-04-03 | 2001-10-15 | The Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services | Tumor markers in ovarian cancer |
| MXPA02009902A (es) | 2000-04-07 | 2003-06-17 | Arena Pharm Inc | Receptores acoplados a proteina g, conocidos, activados constitutivamente, no endogenos. |
| WO2001088133A2 (en) | 2000-05-18 | 2001-11-22 | Lexicon Genetics Incorporated | Human semaphorin homologs and polynucleotides encoding the same |
| AU2001274888A1 (en) | 2000-05-19 | 2001-12-03 | Human Genome Sciences, Inc. | Nucleic acids, proteins, and antibodies |
| WO2001094641A2 (en) | 2000-06-09 | 2001-12-13 | Idec Pharmaceuticals Corporation | Gene targets and ligands that bind thereto for treatment and diagnosis of ovarian carcinomas |
| AU2001268471A1 (en) | 2000-06-16 | 2002-01-02 | Incyte Genomics, Inc. | G-protein coupled receptors |
| US20020165347A1 (en) | 2000-06-30 | 2002-11-07 | Amgen, Inc. | B7-like molecules and uses thereof |
| CA2413186A1 (en) | 2000-06-30 | 2002-01-10 | Incyte Genomics, Inc. | Extracellular matrix and cell adhesion molecules |
| WO2002002587A1 (en) | 2000-06-30 | 2002-01-10 | Human Genome Sciences, Inc. | B7-like polynucleotides, polypeptides, and antibodies |
| WO2002006339A2 (en) | 2000-07-03 | 2002-01-24 | Curagen Corporation | Proteins and nucleic acids encoding same |
| US20040044179A1 (en) | 2000-07-25 | 2004-03-04 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| WO2002010187A1 (en) | 2000-07-27 | 2002-02-07 | Mayo Foundation For Medical Education And Research | B7-h3 and b7-h4, novel immunoregulatory molecules |
| US7205108B2 (en) | 2000-07-28 | 2007-04-17 | Ulrich Wissenbach | Trp8, Trp9 and Trp10, novel markers for cancer |
| US7229623B1 (en) | 2000-08-03 | 2007-06-12 | Corixa Corporation | Her-2/neu fusion proteins |
| WO2002013847A2 (en) | 2000-08-14 | 2002-02-21 | Corixa Corporation | Methods for diagnosis and therapy of hematological and virus-associated malignancies |
| WO2002014503A2 (en) | 2000-08-14 | 2002-02-21 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of her-2/neu-associated malignancies |
| US6333410B1 (en) | 2000-08-18 | 2001-12-25 | Immunogen, Inc. | Process for the preparation and purification of thiol-containing maytansinoids |
| GB0020953D0 (en) | 2000-08-24 | 2000-10-11 | Smithkline Beecham Biolog | Vaccine |
| AU2001290548A1 (en) | 2000-09-11 | 2002-03-26 | Hyseq, Inc. | Novel nucleic acids and polypeptides |
| US7582293B2 (en) | 2000-09-15 | 2009-09-01 | Genentech, Inc. | Anti-PRO6308 antibodies |
| US6613567B1 (en) | 2000-09-15 | 2003-09-02 | Isis Pharmaceuticals, Inc. | Antisense inhibition of Her-2 expression |
| AU2001290837A1 (en) | 2000-09-15 | 2002-03-26 | Zymogenetics Inc. | Use of a polypeptide comprising the extracellular domains of il-20rb for the treatment of inflammation |
| AU2001292724B2 (en) | 2000-09-18 | 2005-05-26 | Biogen Idec Ma Inc. | CRIPTO mutant and uses thereof |
| UA83458C2 (uk) | 2000-09-18 | 2008-07-25 | Байоджен Айдек Ма Інк. | Виділений поліпептид baff-r (рецептор фактора активації в-клітин сімейства tnf) |
| MXPA03003151A (es) | 2000-10-13 | 2003-08-19 | Eos Biotechnology Inc | Metodos de diagnostico de cancer de prostata, composiciones y metodos para seleccionar moduladores de cancer de prostata. |
| US20030092164A1 (en) | 2000-11-07 | 2003-05-15 | Gross Jane A. | Human tumor necrosis factor receptor |
| US20020150573A1 (en) | 2000-11-10 | 2002-10-17 | The Rockefeller University | Anti-Igalpha-Igbeta antibody for lymphoma therapy |
| WO2002061087A2 (en) | 2000-12-19 | 2002-08-08 | Lifespan Biosciences, Inc. | Antigenic peptides, such as for g protein-coupled receptors (gpcrs), antibodies thereto, and systems for identifying such antigenic peptides |
| AU2002243495A1 (en) | 2001-01-12 | 2002-07-24 | University Of Medicine And Dentistry Of New Jersey | Bone morphogenetic protein-2 in the treatment and diagnosis of cancer |
| US20030119119A1 (en) | 2001-01-16 | 2003-06-26 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US20030119126A1 (en) | 2001-01-16 | 2003-06-26 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US7754208B2 (en) | 2001-01-17 | 2010-07-13 | Trubion Pharmaceuticals, Inc. | Binding domain-immunoglobulin fusion proteins |
| MXPA03006617A (es) | 2001-01-24 | 2004-12-02 | Protein Design Labs Inc | Metodos de diagnostico de cancer de pecho, composiciones y metodos de rastreo de moduladores de cancer de pecho. |
| US20030073144A1 (en) | 2001-01-30 | 2003-04-17 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of pancreatic cancer |
| WO2002064798A1 (en) | 2001-02-12 | 2002-08-22 | Bionomics Limited | Dna sequences differentially expressed in tumour cell lines |
| US20030087250A1 (en) | 2001-03-14 | 2003-05-08 | Millennium Pharmaceuticals, Inc. | Nucleic acid molecules and proteins for the identification, assessment, prevention, and therapy of ovarian cancer |
| GB0107365D0 (en) | 2001-03-23 | 2001-05-16 | Novartis Ag | Organic compounds |
| AU2002311787A1 (en) | 2001-03-28 | 2002-10-15 | Zycos Inc. | Translational profiling |
| WO2003008537A2 (en) | 2001-04-06 | 2003-01-30 | Mannkind Corporation | Epitope sequences |
| US6820011B2 (en) | 2001-04-11 | 2004-11-16 | The Regents Of The University Of Colorado | Three-dimensional structure of complement receptor type 2 and uses thereof |
| AU2002254615A1 (en) | 2001-04-17 | 2002-10-28 | The Board Of Trustees Of The University Of Arkansas | Repeat sequences of the ca125 gene and their use for diagnostic and therapeutic interventions |
| AU2002309583A1 (en) | 2001-04-18 | 2002-11-05 | Protein Desing Labs, Inc. | Methods of diagnosis of lung cancer, compositions and methods of screening for modulators of lung cancer |
| WO2003083041A2 (en) | 2002-03-22 | 2003-10-09 | Biogen, Inc. | Cripto-specific antibodies |
| PT1390389E (pt) | 2001-04-26 | 2009-04-03 | Biogen Idec Inc | Anticorpos que bloqueiam o cripto e as utilizações dos mesmos |
| WO2002089747A2 (en) | 2001-05-09 | 2002-11-14 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of prostate cancer |
| WO2002092836A2 (en) | 2001-05-11 | 2002-11-21 | Sloan-Kettering Institute For Cancer Research | Nucleic acid sequence encoding ovarian antigen, ca125, and uses thereof |
| SI1436003T1 (sl) | 2001-05-24 | 2010-02-26 | Zymogenetics Inc | TACI-imunoglobulinski fuzijski proteini |
| US6441163B1 (en) | 2001-05-31 | 2002-08-27 | Immunogen, Inc. | Methods for preparation of cytotoxic conjugates of maytansinoids and cell binding agents |
| AU2002314901A1 (en) | 2001-06-04 | 2002-12-16 | Eos Biotechnology, Inc. | Methods of diagnosis and treatment of androgen-dependent prostate cancer, prostate cancer undergoing androgen-withdrawal, and androgen-independent prostate cancer |
| WO2003000842A2 (en) | 2001-06-04 | 2003-01-03 | Curagen Corporation | Novel proteins and nucleic acids encoding same |
| WO2002098356A2 (en) | 2001-06-05 | 2002-12-12 | Exelixis Inc. | Ppp2cs as modifiers of the p53 pathway and methods of use |
| ATE483976T1 (de) | 2001-06-05 | 2010-10-15 | Exelixis Inc | Gfats als modifikatoren des p53-wegs und verwendungsverfahren |
| US7235358B2 (en) | 2001-06-08 | 2007-06-26 | Expression Diagnostics, Inc. | Methods and compositions for diagnosing and monitoring transplant rejection |
| WO2002101075A2 (en) | 2001-06-13 | 2002-12-19 | Millennium Pharmaceuticals, Inc. | Novel genes, compositions, kits, and methods for identification, assessment, prevention, and therapy of cervical cancer |
| CA2451465A1 (en) | 2001-06-18 | 2002-12-27 | Eos Biotechnology Inc. | Methods of diagnosis of ovarian cancer, compositions and methods of screening for modulators of ovarian cancer |
| US7189507B2 (en) | 2001-06-18 | 2007-03-13 | Pdl Biopharma, Inc. | Methods of diagnosis of ovarian cancer, compositions and methods of screening for modulators of ovarian cancer |
| AU2002322280A1 (en) | 2001-06-21 | 2003-01-21 | Millennium Pharmaceuticals, Inc. | Compositions, kits, and methods for identification, assessment, prevention, and therapy of breast cancer |
| WO2003002717A2 (en) | 2001-06-28 | 2003-01-09 | Schering Corporation | Biological activity of ak155 |
| US20030120040A1 (en) | 2001-06-29 | 2003-06-26 | Genentech, Inc. | Secreted and Transmembrane polypeptides and nucleic acids encoding the same |
| AU2002314433A1 (en) | 2001-07-02 | 2003-01-21 | Licentia Ltd. | Ephrin-tie receptor materials and methods |
| US20040076955A1 (en) | 2001-07-03 | 2004-04-22 | Eos Biotechnology, Inc. | Methods of diagnosis of bladder cancer, compositions and methods of screening for modulators of bladder cancer |
| WO2003003984A2 (en) | 2001-07-05 | 2003-01-16 | Curagen Corporation | Novel proteins and nucleic acids encoding same |
| US7446185B2 (en) | 2001-07-18 | 2008-11-04 | The Regents Of The University Of California | Her2/neu target antigen and use of same to stimulate an immune response |
| US20030108963A1 (en) | 2001-07-25 | 2003-06-12 | Millennium Pharmaceuticals, Inc. | Novel genes, compositions, kit, and methods for identification, assessment, prevention and therapy of prostate cancer |
| WO2003014294A2 (en) | 2001-08-03 | 2003-02-20 | Genentech, Inc. | Tacis and br3 polypeptides and uses thereof |
| AU2002324700A1 (en) | 2001-08-14 | 2003-03-03 | Bayer Ag | Nucleic acid and amino acid sequences involved in pain |
| US20030092013A1 (en) | 2001-08-16 | 2003-05-15 | Vitivity, Inc. | Diagnosis and treatment of vascular disease |
| WO2003018621A2 (en) | 2001-08-23 | 2003-03-06 | Oxford Biomedica (Uk) Limited | Genes |
| AU2002357643A1 (en) | 2001-08-29 | 2003-04-14 | Vanderbilt University | The human mob-5 (il-24) receptors and uses thereof |
| US20030124579A1 (en) | 2001-09-05 | 2003-07-03 | Eos Biotechnology, Inc. | Methods of diagnosis of ovarian cancer, compositions and methods of screening for modulators of ovarian cancer |
| AU2002336446B2 (en) | 2001-09-06 | 2008-03-06 | Agensys, Inc. | Nucleic acid and corresponding protein entitled STEAP-1 useful in treatment and detection of cancer |
| AU2002330039A1 (en) | 2001-09-17 | 2003-04-01 | Eos Biotechnology, Inc. | Methods of diagnosis of cancer compositions and methods of screening for modulators of cancer |
| IL160933A0 (en) | 2001-09-18 | 2004-08-31 | Proteologics Inc | Methods and compositions for treating ?cap associated diseases |
| WO2003024392A2 (en) | 2001-09-18 | 2003-03-27 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| WO2003025148A2 (en) | 2001-09-19 | 2003-03-27 | Nuvelo, Inc. | Novel nucleic acids and polypeptides |
| AU2002327792A1 (en) | 2001-09-28 | 2003-04-07 | Bing Yang | Diagnosis and treatment of diseases caused by mutations in cd72 |
| WO2003029277A2 (en) | 2001-10-03 | 2003-04-10 | Rigel Pharmaceuticals, Inc. | Modulators of lymphocyte activation and migration |
| US20040249144A1 (en) | 2001-10-03 | 2004-12-09 | Zairen Sun | Regulated breast cancer genes |
| US20050123925A1 (en) | 2002-11-15 | 2005-06-09 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| JP2005522986A (ja) | 2001-10-19 | 2005-08-04 | ジェネンテック・インコーポレーテッド | 炎症性腸疾患の診断と治療のための組成物と方法 |
| WO2003088808A2 (en) | 2002-04-16 | 2003-10-30 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| AU2002356858A1 (en) | 2001-10-24 | 2003-05-06 | National Jewish Medical And Research Center | Structure of tall-1 and its cognate receptor |
| KR20100013352A (ko) | 2001-10-31 | 2010-02-09 | 알콘, 인코퍼레이티드 | 뼈 형태발생 단백질(bmp), bmp 수용체 및 bmp 결합 단백질 및 녹내장 진단 및 치료에서 그의 용도 |
| WO2003042661A2 (en) | 2001-11-13 | 2003-05-22 | Protein Design Labs, Inc. | Methods of diagnosis of cancer, compositions and methods of screening for modulators of cancer |
| US20030232350A1 (en) | 2001-11-13 | 2003-12-18 | Eos Biotechnology, Inc. | Methods of diagnosis of cancer, compositions and methods of screening for modulators of cancer |
| AU2002339691A1 (en) | 2001-11-29 | 2003-06-10 | Genset | Agonists and antagonists of prolixin for the treatment of metabolic disorders |
| WO2003048202A2 (en) | 2001-12-03 | 2003-06-12 | Asahi Kasei Pharma Corporation | Nf-kappab activating genes |
| AU2002366951A1 (en) | 2001-12-10 | 2003-07-09 | Nuvelo,Inc. | Novel nucleic acids and polypeptides |
| US20030134790A1 (en) | 2002-01-11 | 2003-07-17 | University Of Medicine And Dentistry Of New Jersey | Bone Morphogenetic Protein-2 And Bone Morphogenetic Protein-4 In The Treatment And Diagnosis Of Cancer |
| US7452675B2 (en) | 2002-01-25 | 2008-11-18 | The Queen's Medical Center | Methods of screening for TRPM4b modulators |
| JP2005526501A (ja) | 2002-02-21 | 2005-09-08 | デューク・ユニヴァーシティ | 自己免疫疾患用の試薬および治療方法 |
| CA2476518A1 (en) | 2002-02-22 | 2003-09-04 | Genentech, Inc. | Compositions and methods for the treatment of immune related diseases |
| US20030165966A1 (en) | 2002-03-01 | 2003-09-04 | Marcia Belvin | MSRAs as modifiers of the p53 pathway and methods of use |
| WO2003104399A2 (en) | 2002-06-07 | 2003-12-18 | Avalon Pharmaceuticals, Inc | Cancer-linked gene as target for chemotherapy |
| EP2258712A3 (en) | 2002-03-15 | 2011-05-04 | Multicell Immunotherapeutics, Inc. | Compositions and Methods to Initiate or Enhance Antibody and Major-histocompatibility Class I or Class II-restricted T Cell Responses by Using Immunomodulatory, Non-coding RNA Motifs |
| CA2486490A1 (en) | 2002-03-19 | 2003-12-31 | Curagen Corporation | Therapeutic polypeptides, nucleic acids encoding same, and methods of use |
| WO2003081210A2 (en) | 2002-03-21 | 2003-10-02 | Sunesis Pharmaceuticals, Inc. | Identification of kinase inhibitors |
| US7193069B2 (en) | 2002-03-22 | 2007-03-20 | Research Association For Biotechnology | Full-length cDNA |
| EP1490085A2 (en) | 2002-03-25 | 2004-12-29 | Uab Research Foundation | Fc receptor homolog, reagents, and uses thereof |
| WO2003083074A2 (en) | 2002-03-28 | 2003-10-09 | Idec Pharmaceuticals Corporation | Novel gene targets and ligands that bind thereto for treatment and diagnosis of colon carcinomas |
| US20030194704A1 (en) | 2002-04-03 | 2003-10-16 | Penn Sharron Gaynor | Human genome-derived single exon nucleic acid probes useful for gene expression analysis two |
| WO2003087306A2 (en) | 2002-04-05 | 2003-10-23 | Agensys, Inc. | Nucleic acid and corresponding protein entitled 98p4b6 useful in treatment and detection of cancer |
| AU2003223520A1 (en) | 2002-04-12 | 2003-10-27 | Mitokor | Targets for therapeutic intervention identified in the mitochondrial proteome |
| US20030224467A1 (en) | 2002-04-17 | 2003-12-04 | Osborne C. Kent | AIB1 as a prognostic marker and predictor of resistance to endocrine therapy |
| AU2003228869A1 (en) | 2002-05-03 | 2003-11-17 | Incyte Corporation | Transporters and ion channels |
| AU2003229294A1 (en) | 2002-05-15 | 2003-12-02 | Avalon Pharmaceuticals | Cancer-linked gene as target for chemotherapy |
| WO2003101388A2 (en) | 2002-05-30 | 2003-12-11 | Bristol-Myers Squibb Company | Human solute carrier family 7 member 11 (hslc7a11) |
| EP1575492A4 (en) | 2002-06-04 | 2007-05-09 | Avalon Pharmaceuticals | GENERAL ASSOCIATED WITH CANCER AS TARGET FOR CHEMOTHERAPY |
| AU2003240495A1 (en) | 2002-06-04 | 2003-12-19 | Incyte Corporation | Diagnostics markers for lung cancer |
| BRPI0311822B8 (pt) | 2002-06-06 | 2021-05-25 | Oncotherapy Science Inc | composição farmacêutica para o tratamento de câncer |
| AU2003242633A1 (en) | 2002-06-06 | 2003-12-22 | Molecular Engines Laboratories | Dudulin genes, non-human animal model: uses in human hematological disease |
| AU2003245441A1 (en) | 2002-06-12 | 2003-12-31 | Avalon Pharmaceuticals, Inc. | Cancer-linked gene as target for chemotherapy |
| US20040249130A1 (en) | 2002-06-18 | 2004-12-09 | Martin Stanton | Aptamer-toxin molecules and methods for using same |
| US20040022727A1 (en) | 2002-06-18 | 2004-02-05 | Martin Stanton | Aptamer-toxin molecules and methods for using same |
| AU2003245615A1 (en) | 2002-06-20 | 2004-01-06 | The Regents Of The University Of California | Compositions and methods for modulating lymphocyte activity |
| JP2005530856A (ja) | 2002-06-21 | 2005-10-13 | ジョンズ ホプキンス ユニバーシティー スクール オブ メディシン | 膜関連腫瘍内皮マーカー |
| WO2004009622A2 (en) | 2002-07-19 | 2004-01-29 | Cellzome Ag | Protein complexes of cellular networks underlying the development of cancer and other diseases |
| CA2492447A1 (en) | 2002-07-25 | 2004-02-05 | Genentech, Inc. | Taci antibodies and uses thereof |
| AU2003251471A1 (en) | 2002-08-06 | 2004-02-25 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with human cxc chemokine receptor 5(cxcr5) |
| JP2004121218A (ja) | 2002-08-06 | 2004-04-22 | Jenokkusu Soyaku Kenkyusho:Kk | 気管支喘息または慢性閉塞性肺疾患の検査方法 |
| EP1542723B1 (en) | 2002-08-16 | 2011-02-23 | ImmunoGen, Inc. | Cross-linkers with high reactivity and solubility and their use in the preparation of conjugates for targeted delivery of small molecule drugs |
| AU2003259913A1 (en) | 2002-08-19 | 2004-03-03 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| JP2006515742A (ja) | 2002-08-27 | 2006-06-08 | ブリストル−マイヤーズ スクイブ カンパニー | 乳癌細胞でのプロテインチロシンキナーゼおよび/またはプロテインチロシンキナーゼ経路と相互作用および/またはモデュレートする化合物の活性を予測するためのポリヌクレオチドの同定 |
| WO2004020595A2 (en) | 2002-08-29 | 2004-03-11 | Five Prime Therapeutics, Inc. | Novel human polypeptides encoded by polynucleotides |
| AU2002951346A0 (en) | 2002-09-05 | 2002-09-26 | Garvan Institute Of Medical Research | Diagnosis of ovarian cancer |
| CN1691964A (zh) | 2002-09-06 | 2005-11-02 | 曼康公司 | 表位序列 |
| JP2006513702A (ja) | 2002-09-09 | 2006-04-27 | ヌラ インコーポレーティッド | Gタンパク質共役受容体およびその使用 |
| JP2004113151A (ja) | 2002-09-27 | 2004-04-15 | Sankyo Co Ltd | 癌遺伝子及びその用途 |
| AU2003278002A1 (en) | 2002-10-03 | 2004-04-23 | Mcgill Univeristy | Antibodies and cyclic peptides which bind cea (carcinoembryonic antigen) and their use as cancer therapeutics |
| CA2501131A1 (en) | 2002-10-04 | 2004-04-22 | Van Andel Research Institute | Molecular sub-classification of kidney tumors and the discovery of new diagnostic markers |
| US7608429B2 (en) | 2002-10-31 | 2009-10-27 | Genentech, Inc. | Methods and compositions for increasing antibody production |
| CA2503748A1 (en) | 2002-11-08 | 2004-05-27 | Genentech, Inc. | Compositions and methods for the treatment of natural killer cell related diseases |
| WO2004044178A2 (en) | 2002-11-13 | 2004-05-27 | Genentech, Inc. | Methods and compositions for diagnosing dysplasia |
| EP2292259A3 (en) | 2002-11-15 | 2011-03-23 | MUSC Foundation For Research Development | Complement receptor 2 targeted complement modulators |
| AU2003294355A1 (en) | 2002-11-15 | 2004-06-15 | The Board Of Trustees Of The University Of Arkansas | Ca125 gene and its use for diagnostic and therapeutic interventions |
| US20080213166A1 (en) | 2002-11-20 | 2008-09-04 | Biogen Idec Inc. | Novel Gene Targets and Ligands that Bind Thereto for Treatment and Diagnosis of Colon Carcinomas |
| AU2003294462C1 (en) | 2002-11-21 | 2011-06-30 | University Of Utah Research Foundation | Purinergic modulation of smell |
| AU2003298786A1 (en) | 2002-11-26 | 2004-06-18 | Protein Design Labs, Inc. | Methods of detecting soft tissue sarcoma, compositions and methods of screening for soft tissue sarcoma modulators |
| EP1581641A4 (en) | 2002-12-06 | 2006-11-15 | Diadexus Inc | COMPOSITIONS, SPREADING VARIATIONS AND METHODS RELATED TO OVARAL SPECIFIC GENES AND PROTEINS |
| US20040157278A1 (en) | 2002-12-13 | 2004-08-12 | Bayer Corporation | Detection methods using TIMP 1 |
| WO2004058171A2 (en) | 2002-12-20 | 2004-07-15 | Protein Design Labs, Inc. | Antibodies against gpr64 and uses thereof |
| WO2004058309A1 (en) | 2002-12-23 | 2004-07-15 | Human Genome Sciences, Inc. | Neutrokine-alpha conjugate, neutrokine-alpha complex, and uses thereof |
| WO2004063709A2 (en) | 2003-01-08 | 2004-07-29 | Bristol-Myers Squibb Company | Biomarkers and methods for determining sensitivity to epidermal growth factor receptor modulators |
| US20050181375A1 (en) | 2003-01-10 | 2005-08-18 | Natasha Aziz | Novel methods of diagnosis of metastatic cancer, compositions and methods of screening for modulators of metastatic cancer |
| US20050227301A1 (en) | 2003-01-10 | 2005-10-13 | Polgen | Cell cycle progression proteins |
| US20040171823A1 (en) | 2003-01-14 | 2004-09-02 | Nadler Steven G. | Polynucleotides and polypeptides associated with the NF-kappaB pathway |
| JP2007520996A (ja) | 2003-01-15 | 2007-08-02 | ミレニアム・ファーマシューティカルズ・インコーポレイテッド | 44390、54181、211、5687、884、1405、636、4421、5410、30905、2045、16405、18560、2047、33751、52872、14063、20739、32544、43239、44373、51164、53010、16852、1587、2207、22245、2387、52908、69112、14990、18547、115、579、15985、15625、760、18603、2395、2554、8675、32720、4809、14303、16816、17827、32620、577、619、1423、2158、8263、15402、16209、16386、21165、30911、41897、1643、2543、9626、13231、32409、84260、2882、8203、32678または55053を用いて泌尿器科障害を処置するための方法および組成物 |
| CA2513113A1 (en) | 2003-01-23 | 2004-08-05 | Genentech, Inc. | Methods for producing humanized antibodies and improving yield of antibodies or antigen binding fragments in cell culture |
| EP1594893A2 (en) | 2003-02-14 | 2005-11-16 | Sagres Discovery, Inc. | Therapeutic targets in cancer |
| US20030224411A1 (en) | 2003-03-13 | 2003-12-04 | Stanton Lawrence W. | Genes that are up- or down-regulated during differentiation of human embryonic stem cells |
| US7755007B2 (en) | 2003-04-17 | 2010-07-13 | K&H Manufacturing, Inc | Heated pet mat |
| US7276497B2 (en) | 2003-05-20 | 2007-10-02 | Immunogen Inc. | Cytotoxic agents comprising new maytansinoids |
| NZ551180A (en) | 2004-06-01 | 2009-10-30 | Genentech Inc | Antibody drug conjugates and methods |
| EP1791565B1 (en) | 2004-09-23 | 2016-04-20 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| US20100111856A1 (en) | 2004-09-23 | 2010-05-06 | Herman Gill | Zirconium-radiolabeled, cysteine engineered antibody conjugates |
| WO2006130669A2 (en) * | 2005-05-31 | 2006-12-07 | Ensemble Discovery Corporation | Anchor-assisted fragment selection and directed assembly |
| NZ563370A (en) | 2005-06-20 | 2010-10-29 | Genentech Inc | Compositions and methods for the diagnosis and treatment of tumor |
| AR060978A1 (es) | 2006-05-30 | 2008-07-23 | Genentech Inc | Anticuerpos e inmunoconjugados y sus usos |
| CA2683568A1 (en) | 2007-05-08 | 2008-11-20 | Genentech, Inc. | Cysteine engineered anti-muc16 antibodies and antibody drug conjugates |
| AU2008312457B2 (en) | 2007-10-19 | 2014-04-17 | Genentech, Inc. | Cysteine engineered anti-TENB2 antibodies and antibody drug conjugates |
| TW201004647A (en) * | 2008-05-20 | 2010-02-01 | Sigma Tau Ind Farmaceuti | Novel dual targeting antitumoural conjugates |
| CA2726050A1 (en) * | 2008-05-30 | 2009-12-10 | Siemens Medical Solutions Usa, Inc. | Achievement of high therapeutic index through molecular imaging guided targeted drug treatment |
| DE102009051799B4 (de) * | 2009-11-03 | 2021-07-01 | Georg-August-Universität Göttingen Stiftung Öffentlichen Rechts | Bifunktionale Prodrugs und Drugs |
| CA3220104A1 (en) | 2010-06-08 | 2011-12-15 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| AU2012311505B2 (en) * | 2011-09-20 | 2016-09-29 | Medimmune Limited | Pyrrolobenzodiazepines as unsymmetrical dimeric PBD compounds for inclusion in targeted conjugates |
| WO2013065009A1 (en) * | 2011-11-01 | 2013-05-10 | National Institute Of Immunology | A sortase-click reaction suite for synthesis of multivalent dendrimeric protein assembly |
| EP2804566B1 (en) | 2012-01-18 | 2018-08-01 | Smith & Nephew, Inc. | Compliant anti-resorption implant |
| CA2872327A1 (en) * | 2012-05-21 | 2013-11-28 | Genentech, Inc. | Anti-ly6e antibodies and immunoconjugates and methods of use |
| CN104755632B (zh) | 2012-09-06 | 2017-10-03 | 生命技术公司 | 多重y‑str分析 |
| MX369022B (es) | 2013-05-31 | 2019-10-25 | Genentech Inc | Anticuerpos anti-ácido teicoico de la pared celular y conjugados. |
| RU2687044C2 (ru) | 2013-05-31 | 2019-05-06 | Дженентек, Инк. | Антитела против стеночной тейхоевой кислоты и их конъюгаты |
| AR096388A1 (es) | 2013-05-31 | 2015-12-30 | Genentech Inc | Anticuerpos anti-ácido teicoico de pared y sus conjugados |
| MX2016001862A (es) | 2013-08-12 | 2016-08-03 | Genentech Inc | Compuestos de conjugado anticuerpo-farmaco dimerico de 1-(clorometil)-2,3-dihidro-1h-benzo[e]indol, y metodos de uso y tratamiento. |
| WO2015061209A1 (en) | 2013-10-21 | 2015-04-30 | Genentech, Inc. | ANTI-Ly6E ANTIBODIES AND METHODS OF USE |
| RU2689388C1 (ru) | 2013-12-16 | 2019-05-28 | Дженентек, Инк. | Пептидомиметические соединения и их конъюгаты антител с лекарственными средствами |
| JP6980384B2 (ja) | 2013-12-16 | 2021-12-15 | ジェネンテック, インコーポレイテッド | 1−(クロロメチル)−2,3−ジヒドロ−1h−ベンゾ[e]インドール二量体抗体−薬物コンジュゲート化合物、並びに使用及び処置の方法 |
| EP3082875B1 (en) | 2013-12-16 | 2020-11-25 | Genentech, Inc. | Peptidomimetic compounds and antibody-drug conjugates thereof |
| CA2931798C (en) | 2013-12-16 | 2023-06-27 | Genentech, Inc. | Peptidomimetic compounds and antibody-drug conjugates thereof |
| CA2957354A1 (en) | 2014-09-12 | 2016-03-17 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| KR20170086536A (ko) | 2014-12-03 | 2017-07-26 | 제넨테크, 인크. | 항-스타필로코커스 아우레우스 항체 리파마이신 접합체 및 이의 용도 |
| JP6751393B2 (ja) | 2014-12-03 | 2020-09-02 | ジェネンテック, インコーポレイテッド | 抗staphylococcus aureus抗体リファマイシン抱合体及びその使用 |
| EP3226909A1 (en) | 2014-12-03 | 2017-10-11 | Genentech, Inc. | Quaternary amine compounds and antibody-drug conjugates thereof |
| JP2018524295A (ja) | 2015-06-15 | 2018-08-30 | ジェネンテック, インコーポレイテッド | 抗体及び免疫複合体 |
-
2014
- 2014-12-16 EP EP14824688.7A patent/EP3082875B1/en active Active
- 2014-12-16 CA CA2933557A patent/CA2933557A1/en not_active Abandoned
- 2014-12-16 KR KR1020167019163A patent/KR20170042495A/ko not_active Application Discontinuation
- 2014-12-16 BR BR112016013861A patent/BR112016013861A2/pt not_active IP Right Cessation
- 2014-12-16 CN CN201480075618.2A patent/CN107106700B/zh active Active
- 2014-12-16 UA UAA201606612A patent/UA118113C2/uk unknown
- 2014-12-16 MX MX2016007826A patent/MX2016007826A/es unknown
- 2014-12-16 AU AU2014364927A patent/AU2014364927A1/en not_active Abandoned
- 2014-12-16 EA EA201691023A patent/EA201691023A1/ru unknown
- 2014-12-16 WO PCT/US2014/070660 patent/WO2015095227A2/en active Application Filing
- 2014-12-16 JP JP2016541497A patent/JP6895254B2/ja active Active
- 2014-12-16 SG SG11201604905WA patent/SG11201604905WA/en unknown
- 2014-12-16 CR CR20160271A patent/CR20160271A/es unknown
- 2014-12-16 PE PE2016000829A patent/PE20161394A1/es unknown
-
2016
- 2016-06-13 IL IL246277A patent/IL246277A0/en unknown
- 2016-06-14 US US15/182,429 patent/US10124069B2/en active Active
- 2016-06-15 CL CL2016001514A patent/CL2016001514A1/es unknown
- 2016-06-16 PH PH12016501171A patent/PH12016501171A1/en unknown
-
2018
- 2018-10-03 US US16/150,623 patent/US10632210B2/en active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020180158A1 (ko) * | 2019-03-07 | 2020-09-10 | 에이비엘바이오 주식회사 | 항체-약물 접합체 및 이의 용도 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20190083643A1 (en) | 2019-03-21 |
| JP6895254B2 (ja) | 2021-06-30 |
| BR112016013861A2 (pt) | 2017-10-10 |
| PH12016501171A1 (en) | 2016-08-15 |
| AU2014364927A1 (en) | 2016-07-07 |
| CR20160271A (es) | 2016-12-02 |
| MX2016007826A (es) | 2017-03-31 |
| US10632210B2 (en) | 2020-04-28 |
| CN107106700A (zh) | 2017-08-29 |
| CN107106700B (zh) | 2020-10-30 |
| WO2015095227A2 (en) | 2015-06-25 |
| EP3082875B1 (en) | 2020-11-25 |
| IL246277A0 (en) | 2016-07-31 |
| EA201691023A1 (ru) | 2016-10-31 |
| CL2016001514A1 (es) | 2017-05-05 |
| PE20161394A1 (es) | 2017-01-06 |
| US20160279261A1 (en) | 2016-09-29 |
| SG11201604905WA (en) | 2016-07-28 |
| CA2933557A1 (en) | 2015-06-25 |
| WO2015095227A3 (en) | 2015-12-10 |
| JP2017504606A (ja) | 2017-02-09 |
| EP3082875A2 (en) | 2016-10-26 |
| US10124069B2 (en) | 2018-11-13 |
| UA118113C2 (uk) | 2018-11-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10632210B2 (en) | Peptidomimetic compounds and antibody-drug conjugates thereof | |
| CN105873614B (zh) | 肽模拟化合物及其抗体-药物缀合物 | |
| KR102337414B1 (ko) | 펩타이드 모방체 화합물 및 이의 항체-약물 컨쥬게이트 | |
| JP2020040954A (ja) | 1−(クロロメチル)−2,3−ジヒドロ−1h−ベンゾ[e]インドール二量体抗体 − 薬物コンジュゲート化合物、並びに使用及び処置の方法 | |
| CN107206101B (zh) | 季铵化合物及其抗体-药物缀合物 | |
| US10544215B2 (en) | 1-(Chloromethyl)-2,3-dihydro-1H-benzo[e]indole dimer antibody-drug conjugate compounds, and methods of use and treatment |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |