KR20140114859A - 부분적 mhc 구축물 및 이의 사용 방법 - Google Patents
부분적 mhc 구축물 및 이의 사용 방법 Download PDFInfo
- Publication number
- KR20140114859A KR20140114859A KR1020147021913A KR20147021913A KR20140114859A KR 20140114859 A KR20140114859 A KR 20140114859A KR 1020147021913 A KR1020147021913 A KR 1020147021913A KR 20147021913 A KR20147021913 A KR 20147021913A KR 20140114859 A KR20140114859 A KR 20140114859A
- Authority
- KR
- South Korea
- Prior art keywords
- leu
- val
- glu
- gly
- ser
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70539—MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0008—Antigens related to auto-immune diseases; Preparations to induce self-tolerance
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/14—Decongestants or antiallergics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6881—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for tissue or cell typing, e.g. human leukocyte antigen [HLA] probes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56966—Animal cells
- G01N33/56977—HLA or MHC typing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
- A61K2039/605—MHC molecules or ligands thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
- C07K2319/74—Fusion polypeptide containing domain for protein-protein interaction containing a fusion for binding to a cell surface receptor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70596—Molecules with a "CD"-designation not provided for elsewhere in G01N2333/705
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/04—Screening involving studying the effect of compounds C directly on molecule A (e.g. C are potential ligands for a receptor A, or potential substrates for an enzyme A)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/10—Screening for compounds of potential therapeutic value involving cells
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Zoology (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Rheumatology (AREA)
- Diabetes (AREA)
- Analytical Chemistry (AREA)
- Hematology (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Physics & Mathematics (AREA)
- Urology & Nephrology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Ophthalmology & Optometry (AREA)
- Pain & Pain Management (AREA)
- Mycology (AREA)
Abstract
본원은 단리된 주조직접합성 복합체(MHC) 클래스 II α1 도메인 폴리펩티드 및 이의 사용 방법을 개시한다. 일부 실시양태에서, 상기 단리된 폴리펩티드는 MHC 클래스 II α1 도메인 폴리펩티드(또는 이의 부분)를 포함하거나 이러한 폴리펩티드로 구성되고 MHC 클래스 II α2, β1 또는 β2 도메인을 포함하지 않는다. 개시된 MHC 클래스 II α1 도메인 폴리펩티드는 대상체에서 장애, 예컨대, 염증성 및/또는 자가면역 장애를 치료하거나 억제하는 데에 유용하다. MHC 클래스 II α1 도메인 폴리펩티드(또는 이의 부분)를 포함하는 폴리펩티드, 또는 MHC 클래스 II α1 도메인 및 β1 도메인을 포함하는 폴리펩티드(예컨대, β1α1 RTL)를 사용한 대상체의 치료의 효능을 평가하거나 이러한 치료를 최적화하는 방법도 개시한다.
Description
관련 출원의 상호 참조
본원은 2012년 1월 6일자로 제출된 미국 가출원 제61/584,045호를 우선권으로 주장하며, 그 전체가 본원에 참고로 인용되어 있다.
분야
본 개시내용은 부분적 주조직적합성 복합체 폴리펩티드, 및 특히 염증 또는 자가면역 장애의 치료 또는 억제에 있어서 이를 사용하는 방법에 관한 것이다.
정부 지원의 승인
본 발명은 국립보건원에 의해 수여된 허가번호 NS47661, AI43960 및 DK0688861, 및 원호부에 의해 수여된 탁월성 심사 및 연구 향상 수여 프로그램 허가 하에 정부 지원으로 만들어졌다. 정부는 본 발명에 있어서 일정한 권리를 갖는다.
포유동물에서 특정 항원에 대한 면역 반응의 개시는 그 항원이 T 세포에 제시됨으로써 일어난다. 항원은 주조직적합성 복합체(MHC)와 회합된 상태로 T 세포에 제시된다. MHC는 항원 제시 세포(APC)의 표면 상에 위치하고, MHC의 삼차원 구조는 제시된 항원이 피팅되는 홈 또는 틈을 포함한다. T 세포 상의 적절한 수용체가 필요한 보조자극 신호의 존재 하에서 APC 상의 MHC/항원 복합체와 상호작용할 때, T 세포가 자극되어, 세포독성 T 세포 기능의 유도, B 세포 기능의 유도 및 사이토카인 생성의 자극을 포함하는, 다양한 양태의 잘 특징규명된 일련의 면역 시스템 활성화 사건들을 유발한다.
다발성 경화증의 병리는 중추신경계에 대해 유도된 비정상적인 면역 반응을 특징으로 한다. 특히, 수초 항원에 대해 반응하는 T 림프구는 중추신경계 내에서 염증 반응을 개시하는 것으로 생각된다. 발생된 염증 반응은 동원된 T 림프구, 활성화된 대식세포, B 림프구 및 혈장 세포를 포함한다. 이들 염증 세포들에 의해 방출된 가용성 매개자는 탈수초화 및 보다 적게는 축삭 변성을 초래한다. 유사하게, 많은 자가면역 장애들에서 염증 반응은 종종 진행성 성질의 조직 손상을 초래한다. 최근 진보에도 불구하고, 자가면역 장애 및 염증성 장애의 효과적인 치료가 여전히 필요하다.
본원은 단리된 주조직적합성 복합체(MHC) 클래스 II α1 도메인 폴리펩티드 및 이의 사용 방법을 개시한다. 일부 실시양태에서, 상기 단리된 폴리펩티드는 MHC 클래스 II α1 도메인 폴리펩티드(또는 이의 부분)를 포함하거나 이러한 폴리펩티드(또는 이의 부분)로 구성되고 MHC 클래스 II α2, β1 또는 β2 도메인을 포함하지 않는다. 일부 예에서, MHC 클래스 II α1 도메인은 예를 들면, 펩티드 링커, 화학 연결제 또는 직접적인 공유결합에 의해 항원 결정기에 공유 결합된다.
개시된 MHC 클래스 II α1 도메인 폴리펩티드는 대상체에서 염증성 장애 및/또는 자가면역 장애를 포함하는 장애를 치료하거나 억제하는 데에 유용하다. 일부 실시양태에서, MHC 클래스 II α1 도메인 폴리펩티드(예컨대, α1 폴리펩티드 또는 항원성 펩티드를 갖는 α1 폴리펩티드) 또는 이의 부분은 염증성 및/또는 자가면역 질환 또는 장애를 치료하거나 억제하는 데에 효과적인 양으로 상기 질환 또는 장애를 갖는 대상체에게 투여된다. 일부 예에서, MHC 클래스 II α1 도메인 폴리펩티드는 CD74의 발현 및/또는 활성을 감소시킨다.
MHC 클래스 II α1 도메인을 포함하는 폴리펩티드 또는 MHC 클래스 II α1 도메인(또는 이의 부분) 및 β1 도메인을 포함하는 폴리펩티드(예컨대, β1α1 폴리펩티드)를 사용한 대상체의 치료의 효능을 측정하거나 평가하거나 이러한 치료를 최적화하는 방법도 개시된다. 일부 실시양태에서, 상기 방법은 상기 대상체로부터의 샘플에서 CD74 발현 또는 활성을 측정하는 단계, CD74 발현 또는 활성을 대조군과 비교하는 단계, 및 CD74 발현 및/또는 활성 수준을 기초로 치료의 효능을 측정하거나 상기 폴리펩티드의 용량이 조절되어야 하는 지를 결정하는 단계를 포함한다.
본 개시내용의 상기 특징들 및 다른 특징들은 첨부된 도면과 관련하여 기재된 하기 상세한 설명으로부터 보다 더 명확해질 것이다.
도면 및 명세서 전체에서, 하기 용어들이 상호교환적으로 사용된다: pDR2/mMOG-35-55는 RTL342M과 상호교환적으로 사용되고; pDR2/펩티드 부재는 RTL302-5D와 상호교환적으로 사용되고; pDR2/MBP-85-99는 RTL340과 상호교환적으로 사용되고; pDR2/hMOG35-55는 RTL1000과 상호교환적으로 사용된다.
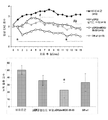
도 1a는 mMOG-35-55 펩티드/완전 프로인트 항원보강제(CFA)/Ptx로 면역화된 DR*1501-Tg 마우스의 평균 임상 EAE 매일 점수(좌측) 또는 누적 질환 지수(CDI; 우측)를 보여주는 한 쌍의 그래프이다. 질환 발병 시(2 이상의 임상 EAE 점수), 마우스를 표시된 바와 같이 비히클, pDR2/mMOG-35-55, pDR2/펩티드 부재 또는 pDR2/MBP-85-99로 치료하였다. 화살표는 마우스가 치료받은 날을 표시한다. pDR2/mMOG-35-55 대 비히클, pDR2/MBP-85-99 및 pDR2/펩티드 부재에 대해 *p<0.003.
도 1b는 hMOG-35-55 펩티드/CFA/Ptx로 면역화된 DR*1502-Tg 마우스의 평균 임상 EAE 매일 점수(좌측) 또는 CDI(우측)를 보여주는 한 쌍의 그래프이다. 질환 발병 시(2 이상의 임상 EAE 점수), 마우스를 표시된 바와 같이 비히클, pDR2/mMOG-35-55, pDR2/펩티드 부재 또는 pDR2/MBP-85-99로 치료하였다. 화살표는 마우스가 치료받은 날을 표시한다. pDR2/hMOG-35-55 대 비히클, pDR2/MBP-85-99 및 pDR2/펩티드 부재에 대해 *p<0.0023.
도 2a는 단핵세포를 확인하는 데에 사용된 단핵세포 게이트(gate)의 셋팅을 보여주는 한 쌍의 유세포측정 도면이다. 단핵세포는 좌측 패널에 나타낸 전면 산점도/측면 산점도에서 원에 의해 표시된 영역 내에 존재하는 것으로서 확인되었고, 요오드화프로피듐(PI)-양성 사멸 세포는 우측 패널에 나타낸 바와 같이 배제되었다.
도 2b는 500 ㎍의 표지된 pDR2의 주사 전 및 15분 후 항원미접촉(naive) DR*1501-Tg 마우스로부터 채취되고 단핵세포 게이트에 대해 분류되고 CD11b(제1열), CD19(제2열), CD11c(제3열) 및 CD3(제4열)의 발현에 대해 파이코에리쓰린(PE)으로 염색되고 표지된 pDR2 유도체의 결합(x-축)에 대해 FITC로 염색된 혈액의 유세포측정 도면을 보여준다. 좌측 패널은 RTL 부재 대조군의 결합을 보여주고, 중심 패널은 RTL342M(pDR2/mMOG-35-55)의 결합을 보여주고, 우측 패널은 RTL1000(단량체 pDR2/hMOG-35-55)의 결합을 보여준다.
도 2c는 항원미접촉 DR*1501-Tg 마우스로부터 채취되고 500 ㎍의 표지된 pDR2와 함께 시험관내에서 항온처리되고 단핵세포 게이트에 대해 분류되고 CD11b(제1열), CD19(제2열), CD11c(제3열) 및 CD3(제4열)의 발현에 대해 파이코에리쓰린(PE)으로 염색되고 표지된 pDR2 유도체의 결합(x-축)에 대해 FITC로 염색된 혈액의 유세포측정 도면을 보여준다. 좌측 패널은 RTL 부재 대조군의 결합을 보여주고, 중심 패널은 RTL342M의 결합을 보여주고, 우측 패널은 RTL1000의 결합을 보여준다.
도 2d는 40분 동안 알렉사-546으로 표지되고 형광 현미경 관찰로 평가된, 10 ㎍/㎖ RTL342M으로 치료받은 DR*1501/GFP 형질전환 마우스의 GFP+ CD11b+ 세포의 디지털 영상이다.
도 3a는 전면 산점도 및 측면 산점도에 의해 분석된 림프구 게이트의 셋팅을 보여주는 한 쌍의 도면이다. 림프구는 좌측 패널에 나타낸 전면 산점도/측면 산점도에서 원에 의해 표시된 영역 내에 존재하는 것으로서 확인되었고, 요오드화프로피듐(PI) 양성 사멸 세포는 우측 패널에 나타낸 바와 같이 배제되었다.
도 3b는 500 ㎍의 표지된 RTL의 주사 전 및 15분 후 항원미접촉 DR*1501-Tg 마우스로부터 채취되고 림프구 게이트에 대해 분류되고 CD11b(제1열), CD19(제2열), CD11c(제3열) 및 CD3(제4열)의 발현에 대해 파이코에리쓰린(PE)으로 염색되고 표지된 pDR2 유도체의 결합(x-축)에 대해 FITC로 염색된 혈액의 유세포측정 도면을 보여준다. 좌측 패널은 RTL 부재 대조군의 결합을 보여주고, 중심 패널은 RTL342M의 결합을 보여주고, 우측 패널은 RTL1000의 결합을 보여준다.
도 3c는 항원미접촉 DR*1501-Tg 마우스로부터 채취되고 500 ㎍의 표지된 RTL과 함께 시험관내에서 항온처리되고 림프구 게이트에 대해 분류되고 CD11b(제1열), CD19(제2열), CD11c(제3열) 및 CD3(제4열)의 발현에 대해 파이코에리쓰린(PE)으로 염색되고 표지된 RTL 유도체의 결합(x-축)에 대해 FITC로 염색된 혈액의 유세포측정 도면을 보여준다. 좌측 패널은 RTL 부재 대조군의 결합을 보여주고, 중심 패널은 RTL342M의 결합을 보여주고, 우측 패널은 RTL1000의 결합을 보여준다.
도 4a는 항원미접촉 DR*1501-Tg 마우스로부터 채취되고 도 2a의 단핵세포 게이트에 따라 게이팅되고 비히클 단독(좌측 패널), pDR2 특이적 Fab1b11(중심 패널) 또는 대조군 FabD2(우측 패널)와 함께 90분 항온처리 후 CD11b의 발현 및 FITC-DR2 구축물의 결합에 대해 염색된 말초 혈액 단핵세포(PBMC)의 유세포측정 도면 세트(좌측), 및 Fab의 부재 하에서 pDR2/mMOG-35-55의 % 결합으로 표준화된 pDR2/mMOG-35-55의 결합을 나타내는 막대 그래프(우측)를 포함한다. *** p<0.0001.
도 4b는 질환 발병 시 표시된 바와 같이 비히클, RTL342M, RTL342M + Fab1b11, RTL342M + FabD2 또는 Fab1b11 단독으로 3일 동안 매일 치료받은(화살표는 치료일을 표시함), EAE를 갖는 DR*1501-Tg 마우스의 1일 평균 임상 EAE 점수(상부) 및 CDI(하부)를 보여주는 한 쌍의 그래프이다. Fab 단편은 치료 전 pMHC와 함께 항온처리되었다. * p<0.05; *** p<0.0001; # p<0.0005.
도 4c의 상부 패널은 RTL342M을 Fab1B11 또는 대조군 FabD2와 함께, 또는 RTL 부재 또는 Fab1B11 단독과 함께 예비항온처리한 후 CD74의 평균 형광 강도(MFI)의 히스토그램이다. 하부 패널은 상부 패널로부터의 데이터를 요약하는 막대 그래프이다. * p<0.05; ** p<0.005, *** p<0.0005.
도 4d의 좌측 패널은 임상 징후의 발생 시 5일 동안 정맥내로 매일 주사된 100 ㎍의 RTL342M(pDR2/mMOG-35-55), 등몰(10 ㎍) 자유 mMOG-35-55 펩티드 또는 비히클로 치료받은, mMOG-35-55/CFA/Ptx-유도된 EAE를 갖는 DR*1501-Tg 마우스의 임상 EAE 점수의 선 그래프이다. 우측 패널은 누적 질환 지수를 보여주는 동일한 동물의 막대 그래프이다. * p<0.05(매일 점수) ** p<0.01(CDI 점수) 대 비히클 치료군 또는 자유 mMOG35-55 치료군.
도 5a는 RTL1000과 비장세포의 결합의 선 그래프이다. 항원미접촉 비장세포를 표시된 농도의 알렉사 플루오르 488®-표지된 RTL1000과 함께 항온처리하였다. 세포를 6 M 우레아에서 용해시키고 단백질을 SDS-PAGE로 분리하고 형광 밀도측정으로 정량하였다. 데이터는 2개 결합 부위 모델에 가장 잘 피팅된다(R2=0.998). 2개 결합 부위의 KD 값은 고친화성 부위의 경우 2.65 nM이었고 저친화성 부위의 경우 131.0 nM이었다.
도 5b는 증가하는 양의 표시된 비표지된 경쟁자의 존재 하에서 표지된 RTL1000과 DR*1501-Tg 마우스로부터 단리된 전체 세포의 결합을 보여주는 선 그래프이다.
도 5c는 증가하는 양의 표시된 비표지된 경쟁자의 존재 하에서 표지된 RTL1000과 MHC 클래스 II 넉아웃 마우스로부터 단리된 전체 세포의 결합을 보여주는 선 그래프이다.
도 6은 pDR2에 결합된 단백질의 면역침전물의 블롯의 한 쌍의 디지털 영상이다. DR*1501-Tg 마우스로부터의 비장세포를 표면 바이오티닐화하고 CHAPS를 함유하는 완충제로 용해시켰다. 용해물을 RTL1000과 함께 항온처리한 후, DR2 특이적 단일클론 항체 TU39를 상기 용해물에 첨가하였다. 면역 복합체를 세척하여 비결합된 물질을 제거하고 환원 전기영동 샘플 완충제에서 8분 내지 10분 동안 끓여 상기 면역 복합체로부터 결합된 단백질을 분리하였다. 면역침전으로부터 회수된 단백질을 SDS-PAGE로 분리하고 필터 상에 블롯팅한 후 스트렙타비딘 PE(좌측) 또는 콴텀-레드(Quantum-Red)-표지된 항-DR2 HK14 항체(우측)로 프로빙하였다.
도 7은 표면 플라스몬 공명에 의해 측정된 RTL1000과 히스톤 복합체의 결합을 보여주는 도면이다. 히스톤 복합체를 아민 커플링으로 CM5 센서 칩에 결합시키고 표시된 농도의 RTL1000을 상기 복합체에 결합시켰다. 결합 곡선을, 변동 기준(Ka=5.74 x 103 M-1s-1; Kd=3.3 x 10-3 s-1; RMax=223 RU; Chi2=9.89)을 갖는 1:1 랭뮤어 결합 모델에 피팅하여 575 nM의 겉보기 친화성 상수 KD를 수득하였다.
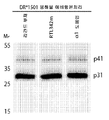
도 8a는 CD74에 결합된 단백질의 면역침전물의 웨스턴 블롯의 디지털 영상이다. DR*1501-Tg 마우스로부터의 비장세포를 표면 바이오티닐화하고 용해시켰다. 용해물을 항-CD74 항체와 접합된 단백질 L 비드와 혼합하였다. 이들을 4℃에서 밤새 항온처리하였다. 단백질을 면역 복합체로부터 회수하고 블롯팅하고 스트렙타비딘-PE를 사용하여 가시화하였다. M은 분자량 마커를 표시하고; T는 총 용해물을 표시하고; CD74 IP는 면역침전된 CD74를 표시한다.
도 8b는 25 nmole의 표시된 FITC-표지된 RTL 분자와 함께 항온처리된 표면 바이오티닐화된 DR*1501-Tg 비장세포로부터 면역침전된 CD74 단백질 복합체의 SDS-PAGE 겔의 한 쌍의 디지털 영상이다. 겔을 FITC의 존재에 대해 스캐닝하였다.
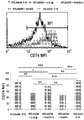
도 9a는 비표지된 DR-α1 및 DR2-β1의 존재 하에서 FITC-표지된 RTL1000과 함께 항온처리된 표면 바이오티닐화된 DR*1501-Tg 비장세포로부터 면역침전된 CD74 단백질 복합체의 SDS-PAGE 겔의 디지탈 영상이다.
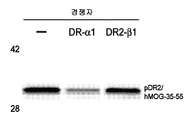
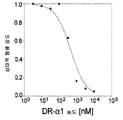
도 9b는 RTL1000의 결합이 용량 의존적 방식으로 DR-α1에 의해 억제되는 것을 보여주는 그래프이다. 바이오-라드(Bio-Rad) 이미저(Imager) FX® 스캐너를 이용하여 폴리아크릴아미드 겔 상의 FITC-표지된 RTL1000 밴드를 검출한 후, 콴티 원(Quantity One)® 소프트웨어를 이용한 밀도측정으로 정량하였다. 데이터를 표준화하고 DR-α1의 농도에 대하여 작도하였고, 그래프패드 프리즘(GraphPad Prism)® 소프트웨어를 이용하여 곡선을 1개 부위 또는 2개 부위 경쟁 모델에 피팅하였다. 가장 잘 피팅되는 것은 447 nM의 EC50 및 0.956의 R2를 갖는 1개 부위 경쟁 방정식이었다.
도 10a는 면역흡착된 CD74와 함께 항온처리되었을 때 증가하는 양의 FITC-표지된 RTL1000, RTL342M, RTL340(pDR2/MBP-85-99), RTL302-5D(단량체 pDR2/펩티드 부재) 및 DR-α1의 결합을 보여주는 도면이다. 그래프패드 프리즘® 소프트웨어를 이용하여 모든 결합된 리간드들에 대한 0.95 초과의 R2를 갖는 1개 부위 또는 2개 부위 결합에 대해 데이터를 분석하였다.
도 10b는 L243 단일클론 항체에 접합된 단백질-L 비드에 의해 CD74-고갈된 용해물로부터 면역흡착된 풍부한 MHC 클래스 II와 함께 항온처리되었을 때 증가하는 양의 FITC-표지된 RTL1000, RTL342M, RTL340, RTL302-5D 및 DR-α1의 결합을 보여주는 도면이다.
도 11a는 항원미접촉 마우스에 비해 상대적으로 EAE 마우스에서 단핵세포 상에서의 CD74의 발현을 보여주는 히스토그램이다. 삽입도는 항원미접촉 마우스(n=4) 및 EAE를 갖는 mMOG-35-55 면역화된 마우스(n=4)로부터의 단핵세포에서 CD74 발현의 평균 형광 강도를 보여준다. ** p<0.01.
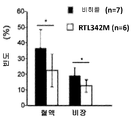
도 11b는 비히클 또는 RTL342M(100 ㎍)으로 치료받은, EAE를 갖는 마우스의 혈액 및 비장에서 CD74 발현을 보여주는 막대 그래프이다. * p<0.05.
도 11c는 비히클(좌측) 또는 RTL342M(100 ㎍; 우측)으로 치료받은 마우스의 척수 내의 단핵세포에서 CD74 발현을 보여주는 한 쌍의 도면이다.
도 12a는 표시된 농도의 RTL1000으로 처리된 CD11b+ 단핵세포에서 RTL1000 FITC 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 12b는 CD74 발현의 백분율 및 표시된 RTL의 결합의 백분율을 보여주는 선 그래프 세트이다. 하부 우측 패널은 RTL 결합과 CD74 발현 사이의 역의 상관관계를 보여주는 모든 구축물들의 선형 회귀 분석이다.
도 13a는 비히클로 처리된(pMHC 처리 부재) CD11b+ 인간 단핵세포 상에서의 RTL 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13b는 CD11b+ 인간 단핵세포 상에서의 1 ㎍ RTL342M 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13c는 CD11b+ 인간 단핵세포 상에서의 1 ㎍ RTL1000 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13d는 CD11b+ 인간 단핵세포 상에서의 5 ㎍ RTL1000 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13e는 CD11b+ 인간 단핵세포 상에서의 5 ㎍ RTL340 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13f는 분석 전에 배양물에서 다양한 농도의 RTL1000으로 처리된 인간 단핵세포에서의 RTL1000 결합 대 CD74 발현의 선형 회귀를 보여주는 선 그래프이다. 원데이터는 도 13a 내지 13e에 제시되어 있다.
도 14a는 EAE가 MBP-85-99를 사용한 면역화에 의해 유도된 마우스에 대한 평균 임상 EAE 매일 점수를 보여주는 선 그래프(좌측) 및 CDI를 보여주는 막대 그래프(우측)이다. 질환 발병(그래프 상에서 화살표로 표시됨) 후 5일 동안 MBP-TCR/DR2-Tg 마우스를 비히클, RTL342M, RTL1000, RTL340 또는 RTL302-5D로 치료하였다. EAE 매일 평균 점수 및 피크 질환의 경우 RTL342M 대 비히클에 대한 *p<0.02, 및 RTL340 및 RTL1000 대 비히클에 대한 *** p<0.002(좌측 패널). CDI의 경우 RTL342M 대 비히클에 대한 **p<0.0014, 및 RTL340 및 RTL1000 대 비히클에 대한 ***p<0.001(우측 패널).
도 14b는 EAE가 mMOG-35-55를 사용한 면역화에 의해 유도된 마우스에 대한 평균 임상 EAE 매일 점수를 보여주는 선 그래프(좌측) 및 CDI를 보여주는 막대 그래프(우측)이다. EAE를 갖는 DR*1501 마우스를 발병 시 RTL340(100 ㎍), RTL342M(100 ㎍), RTL302-5D(100 ㎍, 5회 매일 치료), RTL302-5D(1 mg) 또는 RTL342M(100 ㎍, 2회 매일 치료)으로 치료하였다. 비히클 및 비치료군은 서로 유의하게 상이하지 않았고 조합되었다. EAE 매일 평균 점수 및 피크 질환(좌측 패널)의 경우 *p<0.04, RTL302-5D(1 mg X2), ***p<0.0001, RTL342M(100 ㎍ X5), #p<0.01, RTL342M(100 ㎍ X2) 대 비히클/비치료군; CDI(우측 패널)의 경우 ***p<0.0001, RTL342M(100 ㎍ X2 및 5회 매일 치료), p<0.013, RTL302-5D(1 mg X2 매일 치료) 대 비히클/비치료군.
도 14c는 도 14b에 나타낸 마우스 군들에 대한 CD11b+ 세포 상에서의 CD74 수준과 평균 CDI 사이의 관계를 보여주는 그래프이다.
도 15는 공유결합된 mMOG-35-55를 갖는 pDR2(100 ㎍), 펩티드를 갖지 않는 pDR2(1000 ㎍), DR-α1(750 ㎍) 또는 비히클 단독으로 치료받은 마우스의 임상 EAE 점수를 보여주는 선 그래프(상부) 및 CDI를 보여주는 막대 그래프(하부)이다. 각각의 치료군은 3마리의 마우스들로 구성되었다. * p<0.05 pDR2 mMOG-35-55 대 비치료군; # p<0.05 pDR2/펩티드 부재 대 비치료군; Φ p<0.05 DR-α1 대 비치료군.
도 16은 비히클(비치료군), 펩티드를 갖지 않는 변경된 pDR2(RTL302-5D), 공유결합된 mMOG-35-55를 갖는 변경된 pDR2(RTL342M), 또는 DR-α1로 치료받은 마우스의 임상 EAE 점수를 보여주는 선 그래프(상부) 및 CDI를 보여주는 막대 그래프(하부)이다. 각각의 치료군은 3마리의 마우스들로 구성되었다.
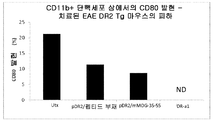
도 17은 표시된 바와 같이 치료받은 EAE DR2-Tg 마우스의 척수로부터 수득된 CD11b+ 단핵세포 상에서의 CD74(도 17a), ICAM(도 17b) 및 CD80(도 17c)의 발현을 보여주는 일련의 막대 그래프이다.
도 18a는 1시간 동안 10 ㎍/㎖ RTL342M 또는 완충제로 치료받은 후 1시간 동안 100 ng/㎖의 MIF와 함께 또는 MIF 없이 10 ng/㎖의 LPS로 자극받은 3마리의 항원미접촉 DR*1501-Tg 마우스로부터 단리된 비장세포에서 실시간 PCR에 의해 측정된 ICAM-1의 상대적 발현을 보여주는 그래프이다. * p<0.05.
도 18b는 2시간 동안 50 ㎍/㎖ RTL342M으로 치료받은 DR*1501/GFP-Tg 마우스로부터 단리된 GFP+CD11b+ 세포의 평균 트랙(track) 속도의 막대 그래프이다. 10개의 저속 촬영 필드(5개의 비치료 필드 및 5개의 치료 필드)를 생형광 현미경 관찰로 영상화하였다. *** p<0.0005.
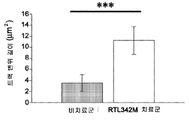
도 18c는 도 18b에 기재된 바와 같이 단리되고 처리된 세포의 평균 트랙 변위 길이의 막대 그래프이다. *** p<0.0005.
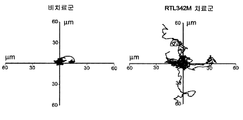
도 18d는 4개의 대표적인 필드들로부터 개별 세포들(각각의 필드에서 9개 내지 11개의 세포들)의 트랙을 보여주는 한 쌍의 그래프이다. 세포를 도 18b에 기재된 바와 같이 단리하고 처리하였다.
도 19는 DRA α1 아미노산 35 내지 58 영역(상자로 표시됨)을 보여주는 MHC 클래스 II α 쇄 아미노산 서열들의 부분의 예시적 정렬이다. 상기 서열들은 다음과 같다: DR2(서열번호 110), DR4(서열번호 111), DP2(서열번호 112), DQ2(서열번호 113), IAs(서열번호 114), IAg7(서열번호 115) 및 RT1.B(서열번호 116).
도 20은 RTL 구축물이 항-CD74 항체와 CD74의 결합을 방해하지 않는다는 것을 확인시켜주는 웨스턴 블롯의 영상이다. DR*1501 용해물을 4℃에서 리간드 없이, 또는 15 ㎍의 RTL342M 또는 DR-α1과 함께 예비항온처리하였다. 용해물을 단백질/비드에 흡착된 ln-1 Ab에 첨가하였다. 면역 복합체를 1% CHAPS/TEN 완충제로 4회 세척한 후 TEN 완충제로 4회 세척하였다. 물질을 2% SDS를 갖는 샘플 완충제에서 7분 내지 9분 동안 끓임으로써 비드로부터 용출하였다. 그 다음, 샘플을 10% 내지 20% 폴리아크릴아미드 겔에서 분석하고 PVDF로 옮기고 항-CD74 mAb ln-1-FITC로 프로빙하여 CD74를 검출하였다.
도 21은 X 축 상에서 CD74 발현을 보여주고 Y 축 상에서 CD11b 발현을 보여주는 3개 플롯도의 세트이다. mMOG35-55/CFA/Ptx-유도된 EAE를 갖는 DR*1501-Tg 마우스를 임상 징후의 발병 시 3일 동안 100 ㎍ RTL342M, 500 ㎍ DR2-β1 또는 비히클로 치료하였다. * p<0.05.
도 22의 좌측 패널은 도 21에 기재된 바와 같이 치료된 마우스의 임상 EAE 점수를 보여주는 선 그래프이다. 우측 패널은 동일한 마우스에 대한 누적 질환 지수의 막대 그래프이다. ** p<0.01, *** p<0.001
도 23의 좌측 패널은 임상 징후의 발병 시 비히클, DR2-β1(500 ㎍), DR-α1(100 ㎍), DR-α1(300 ㎍), DR-α1(500 ㎍), DR-α1(1000 ㎍) 또는 RTL342M(100 ㎍)으로 치료받은, mMOG-35-55/CFA/Ptx-유도된 EAE를 갖는 DR*1501-Tg 마우스의 임상 EAE 점수를 보여주는 선 그래프이다. * p<0.05 DRα1 대 비히클; δ p<0.04 RTL342M, DR-α1(300 ㎍), DR-α1(500 ㎍), DR-α1(1000 ㎍) 대 DR2-β1; # p<0.0003 RTL342M, DR-α1(300 ㎍), DR-α1(500 ㎍), DR-α1(1000 ㎍) 대 비히클; ψ p<0.05 DR-α1(100 ㎍) 대 DR2-β1. 우측 패널은 동일한 동물에 대한 누적 질환 지수를 보여주는 막대 그래프이다. * p<0.05; ** p<0.005 DR-α1(100 ㎍) 대 비히클; *** p<0.0005 대 비히클.
서열목록
본 명세서에 또는 첨부된 서열목록에 나열된 임의의 핵산 및 아미노산 서열은 37 C.F.R. § 1.822에 정의된 바와 같이 뉴클레오티드 염기의 경우 표준 문자 약어, 및 아미노산의 경우 3 문자 코드를 이용함으로써 표시된다. 적어도 일부 경우, 각각의 핵산 서열의 한 가닥만이 표시되어 있지만, 상보적인 가닥은 표시된 가닥의 임의의 언급에 의해 포함되는 것으로서 이해된다.
서열번호 1 내지 49는 예시적 MHC 클래스 II α 쇄 폴리펩티드의 아미노산 서열이다.
서열번호 50 내지 85는 예시적 항원 결정기 펩티드의 아미노산 서열이다.
서열번호 86 내지 108은 pDR2/hMOG35-55에 결합하는 단백질로부터의 펩티드의 아미노산 서열이다.
서열번호 109는 MHC DRA 잔기 38 내지 58 단편의 아미노산 서열이다.
서열번호 110 내지 116은 MHC 클래스 II α 쇄 아미노산 서열의 부분적 아미노산 서열이다.
도 1a는 mMOG-35-55 펩티드/완전 프로인트 항원보강제(CFA)/Ptx로 면역화된 DR*1501-Tg 마우스의 평균 임상 EAE 매일 점수(좌측) 또는 누적 질환 지수(CDI; 우측)를 보여주는 한 쌍의 그래프이다. 질환 발병 시(2 이상의 임상 EAE 점수), 마우스를 표시된 바와 같이 비히클, pDR2/mMOG-35-55, pDR2/펩티드 부재 또는 pDR2/MBP-85-99로 치료하였다. 화살표는 마우스가 치료받은 날을 표시한다. pDR2/mMOG-35-55 대 비히클, pDR2/MBP-85-99 및 pDR2/펩티드 부재에 대해 *p<0.003.
도 1b는 hMOG-35-55 펩티드/CFA/Ptx로 면역화된 DR*1502-Tg 마우스의 평균 임상 EAE 매일 점수(좌측) 또는 CDI(우측)를 보여주는 한 쌍의 그래프이다. 질환 발병 시(2 이상의 임상 EAE 점수), 마우스를 표시된 바와 같이 비히클, pDR2/mMOG-35-55, pDR2/펩티드 부재 또는 pDR2/MBP-85-99로 치료하였다. 화살표는 마우스가 치료받은 날을 표시한다. pDR2/hMOG-35-55 대 비히클, pDR2/MBP-85-99 및 pDR2/펩티드 부재에 대해 *p<0.0023.
도 2a는 단핵세포를 확인하는 데에 사용된 단핵세포 게이트(gate)의 셋팅을 보여주는 한 쌍의 유세포측정 도면이다. 단핵세포는 좌측 패널에 나타낸 전면 산점도/측면 산점도에서 원에 의해 표시된 영역 내에 존재하는 것으로서 확인되었고, 요오드화프로피듐(PI)-양성 사멸 세포는 우측 패널에 나타낸 바와 같이 배제되었다.
도 2b는 500 ㎍의 표지된 pDR2의 주사 전 및 15분 후 항원미접촉(naive) DR*1501-Tg 마우스로부터 채취되고 단핵세포 게이트에 대해 분류되고 CD11b(제1열), CD19(제2열), CD11c(제3열) 및 CD3(제4열)의 발현에 대해 파이코에리쓰린(PE)으로 염색되고 표지된 pDR2 유도체의 결합(x-축)에 대해 FITC로 염색된 혈액의 유세포측정 도면을 보여준다. 좌측 패널은 RTL 부재 대조군의 결합을 보여주고, 중심 패널은 RTL342M(pDR2/mMOG-35-55)의 결합을 보여주고, 우측 패널은 RTL1000(단량체 pDR2/hMOG-35-55)의 결합을 보여준다.
도 2c는 항원미접촉 DR*1501-Tg 마우스로부터 채취되고 500 ㎍의 표지된 pDR2와 함께 시험관내에서 항온처리되고 단핵세포 게이트에 대해 분류되고 CD11b(제1열), CD19(제2열), CD11c(제3열) 및 CD3(제4열)의 발현에 대해 파이코에리쓰린(PE)으로 염색되고 표지된 pDR2 유도체의 결합(x-축)에 대해 FITC로 염색된 혈액의 유세포측정 도면을 보여준다. 좌측 패널은 RTL 부재 대조군의 결합을 보여주고, 중심 패널은 RTL342M의 결합을 보여주고, 우측 패널은 RTL1000의 결합을 보여준다.
도 2d는 40분 동안 알렉사-546으로 표지되고 형광 현미경 관찰로 평가된, 10 ㎍/㎖ RTL342M으로 치료받은 DR*1501/GFP 형질전환 마우스의 GFP+ CD11b+ 세포의 디지털 영상이다.
도 3a는 전면 산점도 및 측면 산점도에 의해 분석된 림프구 게이트의 셋팅을 보여주는 한 쌍의 도면이다. 림프구는 좌측 패널에 나타낸 전면 산점도/측면 산점도에서 원에 의해 표시된 영역 내에 존재하는 것으로서 확인되었고, 요오드화프로피듐(PI) 양성 사멸 세포는 우측 패널에 나타낸 바와 같이 배제되었다.
도 3b는 500 ㎍의 표지된 RTL의 주사 전 및 15분 후 항원미접촉 DR*1501-Tg 마우스로부터 채취되고 림프구 게이트에 대해 분류되고 CD11b(제1열), CD19(제2열), CD11c(제3열) 및 CD3(제4열)의 발현에 대해 파이코에리쓰린(PE)으로 염색되고 표지된 pDR2 유도체의 결합(x-축)에 대해 FITC로 염색된 혈액의 유세포측정 도면을 보여준다. 좌측 패널은 RTL 부재 대조군의 결합을 보여주고, 중심 패널은 RTL342M의 결합을 보여주고, 우측 패널은 RTL1000의 결합을 보여준다.
도 3c는 항원미접촉 DR*1501-Tg 마우스로부터 채취되고 500 ㎍의 표지된 RTL과 함께 시험관내에서 항온처리되고 림프구 게이트에 대해 분류되고 CD11b(제1열), CD19(제2열), CD11c(제3열) 및 CD3(제4열)의 발현에 대해 파이코에리쓰린(PE)으로 염색되고 표지된 RTL 유도체의 결합(x-축)에 대해 FITC로 염색된 혈액의 유세포측정 도면을 보여준다. 좌측 패널은 RTL 부재 대조군의 결합을 보여주고, 중심 패널은 RTL342M의 결합을 보여주고, 우측 패널은 RTL1000의 결합을 보여준다.
도 4a는 항원미접촉 DR*1501-Tg 마우스로부터 채취되고 도 2a의 단핵세포 게이트에 따라 게이팅되고 비히클 단독(좌측 패널), pDR2 특이적 Fab1b11(중심 패널) 또는 대조군 FabD2(우측 패널)와 함께 90분 항온처리 후 CD11b의 발현 및 FITC-DR2 구축물의 결합에 대해 염색된 말초 혈액 단핵세포(PBMC)의 유세포측정 도면 세트(좌측), 및 Fab의 부재 하에서 pDR2/mMOG-35-55의 % 결합으로 표준화된 pDR2/mMOG-35-55의 결합을 나타내는 막대 그래프(우측)를 포함한다. *** p<0.0001.
도 4b는 질환 발병 시 표시된 바와 같이 비히클, RTL342M, RTL342M + Fab1b11, RTL342M + FabD2 또는 Fab1b11 단독으로 3일 동안 매일 치료받은(화살표는 치료일을 표시함), EAE를 갖는 DR*1501-Tg 마우스의 1일 평균 임상 EAE 점수(상부) 및 CDI(하부)를 보여주는 한 쌍의 그래프이다. Fab 단편은 치료 전 pMHC와 함께 항온처리되었다. * p<0.05; *** p<0.0001; # p<0.0005.
도 4c의 상부 패널은 RTL342M을 Fab1B11 또는 대조군 FabD2와 함께, 또는 RTL 부재 또는 Fab1B11 단독과 함께 예비항온처리한 후 CD74의 평균 형광 강도(MFI)의 히스토그램이다. 하부 패널은 상부 패널로부터의 데이터를 요약하는 막대 그래프이다. * p<0.05; ** p<0.005, *** p<0.0005.
도 4d의 좌측 패널은 임상 징후의 발생 시 5일 동안 정맥내로 매일 주사된 100 ㎍의 RTL342M(pDR2/mMOG-35-55), 등몰(10 ㎍) 자유 mMOG-35-55 펩티드 또는 비히클로 치료받은, mMOG-35-55/CFA/Ptx-유도된 EAE를 갖는 DR*1501-Tg 마우스의 임상 EAE 점수의 선 그래프이다. 우측 패널은 누적 질환 지수를 보여주는 동일한 동물의 막대 그래프이다. * p<0.05(매일 점수) ** p<0.01(CDI 점수) 대 비히클 치료군 또는 자유 mMOG35-55 치료군.
도 5a는 RTL1000과 비장세포의 결합의 선 그래프이다. 항원미접촉 비장세포를 표시된 농도의 알렉사 플루오르 488®-표지된 RTL1000과 함께 항온처리하였다. 세포를 6 M 우레아에서 용해시키고 단백질을 SDS-PAGE로 분리하고 형광 밀도측정으로 정량하였다. 데이터는 2개 결합 부위 모델에 가장 잘 피팅된다(R2=0.998). 2개 결합 부위의 KD 값은 고친화성 부위의 경우 2.65 nM이었고 저친화성 부위의 경우 131.0 nM이었다.
도 5b는 증가하는 양의 표시된 비표지된 경쟁자의 존재 하에서 표지된 RTL1000과 DR*1501-Tg 마우스로부터 단리된 전체 세포의 결합을 보여주는 선 그래프이다.
도 5c는 증가하는 양의 표시된 비표지된 경쟁자의 존재 하에서 표지된 RTL1000과 MHC 클래스 II 넉아웃 마우스로부터 단리된 전체 세포의 결합을 보여주는 선 그래프이다.
도 6은 pDR2에 결합된 단백질의 면역침전물의 블롯의 한 쌍의 디지털 영상이다. DR*1501-Tg 마우스로부터의 비장세포를 표면 바이오티닐화하고 CHAPS를 함유하는 완충제로 용해시켰다. 용해물을 RTL1000과 함께 항온처리한 후, DR2 특이적 단일클론 항체 TU39를 상기 용해물에 첨가하였다. 면역 복합체를 세척하여 비결합된 물질을 제거하고 환원 전기영동 샘플 완충제에서 8분 내지 10분 동안 끓여 상기 면역 복합체로부터 결합된 단백질을 분리하였다. 면역침전으로부터 회수된 단백질을 SDS-PAGE로 분리하고 필터 상에 블롯팅한 후 스트렙타비딘 PE(좌측) 또는 콴텀-레드(Quantum-Red)-표지된 항-DR2 HK14 항체(우측)로 프로빙하였다.
도 7은 표면 플라스몬 공명에 의해 측정된 RTL1000과 히스톤 복합체의 결합을 보여주는 도면이다. 히스톤 복합체를 아민 커플링으로 CM5 센서 칩에 결합시키고 표시된 농도의 RTL1000을 상기 복합체에 결합시켰다. 결합 곡선을, 변동 기준(Ka=5.74 x 103 M-1s-1; Kd=3.3 x 10-3 s-1; RMax=223 RU; Chi2=9.89)을 갖는 1:1 랭뮤어 결합 모델에 피팅하여 575 nM의 겉보기 친화성 상수 KD를 수득하였다.
도 8a는 CD74에 결합된 단백질의 면역침전물의 웨스턴 블롯의 디지털 영상이다. DR*1501-Tg 마우스로부터의 비장세포를 표면 바이오티닐화하고 용해시켰다. 용해물을 항-CD74 항체와 접합된 단백질 L 비드와 혼합하였다. 이들을 4℃에서 밤새 항온처리하였다. 단백질을 면역 복합체로부터 회수하고 블롯팅하고 스트렙타비딘-PE를 사용하여 가시화하였다. M은 분자량 마커를 표시하고; T는 총 용해물을 표시하고; CD74 IP는 면역침전된 CD74를 표시한다.
도 8b는 25 nmole의 표시된 FITC-표지된 RTL 분자와 함께 항온처리된 표면 바이오티닐화된 DR*1501-Tg 비장세포로부터 면역침전된 CD74 단백질 복합체의 SDS-PAGE 겔의 한 쌍의 디지털 영상이다. 겔을 FITC의 존재에 대해 스캐닝하였다.
도 9a는 비표지된 DR-α1 및 DR2-β1의 존재 하에서 FITC-표지된 RTL1000과 함께 항온처리된 표면 바이오티닐화된 DR*1501-Tg 비장세포로부터 면역침전된 CD74 단백질 복합체의 SDS-PAGE 겔의 디지탈 영상이다.
도 9b는 RTL1000의 결합이 용량 의존적 방식으로 DR-α1에 의해 억제되는 것을 보여주는 그래프이다. 바이오-라드(Bio-Rad) 이미저(Imager) FX® 스캐너를 이용하여 폴리아크릴아미드 겔 상의 FITC-표지된 RTL1000 밴드를 검출한 후, 콴티 원(Quantity One)® 소프트웨어를 이용한 밀도측정으로 정량하였다. 데이터를 표준화하고 DR-α1의 농도에 대하여 작도하였고, 그래프패드 프리즘(GraphPad Prism)® 소프트웨어를 이용하여 곡선을 1개 부위 또는 2개 부위 경쟁 모델에 피팅하였다. 가장 잘 피팅되는 것은 447 nM의 EC50 및 0.956의 R2를 갖는 1개 부위 경쟁 방정식이었다.
도 10a는 면역흡착된 CD74와 함께 항온처리되었을 때 증가하는 양의 FITC-표지된 RTL1000, RTL342M, RTL340(pDR2/MBP-85-99), RTL302-5D(단량체 pDR2/펩티드 부재) 및 DR-α1의 결합을 보여주는 도면이다. 그래프패드 프리즘® 소프트웨어를 이용하여 모든 결합된 리간드들에 대한 0.95 초과의 R2를 갖는 1개 부위 또는 2개 부위 결합에 대해 데이터를 분석하였다.
도 10b는 L243 단일클론 항체에 접합된 단백질-L 비드에 의해 CD74-고갈된 용해물로부터 면역흡착된 풍부한 MHC 클래스 II와 함께 항온처리되었을 때 증가하는 양의 FITC-표지된 RTL1000, RTL342M, RTL340, RTL302-5D 및 DR-α1의 결합을 보여주는 도면이다.
도 11a는 항원미접촉 마우스에 비해 상대적으로 EAE 마우스에서 단핵세포 상에서의 CD74의 발현을 보여주는 히스토그램이다. 삽입도는 항원미접촉 마우스(n=4) 및 EAE를 갖는 mMOG-35-55 면역화된 마우스(n=4)로부터의 단핵세포에서 CD74 발현의 평균 형광 강도를 보여준다. ** p<0.01.
도 11b는 비히클 또는 RTL342M(100 ㎍)으로 치료받은, EAE를 갖는 마우스의 혈액 및 비장에서 CD74 발현을 보여주는 막대 그래프이다. * p<0.05.
도 11c는 비히클(좌측) 또는 RTL342M(100 ㎍; 우측)으로 치료받은 마우스의 척수 내의 단핵세포에서 CD74 발현을 보여주는 한 쌍의 도면이다.
도 12a는 표시된 농도의 RTL1000으로 처리된 CD11b+ 단핵세포에서 RTL1000 FITC 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 12b는 CD74 발현의 백분율 및 표시된 RTL의 결합의 백분율을 보여주는 선 그래프 세트이다. 하부 우측 패널은 RTL 결합과 CD74 발현 사이의 역의 상관관계를 보여주는 모든 구축물들의 선형 회귀 분석이다.
도 13a는 비히클로 처리된(pMHC 처리 부재) CD11b+ 인간 단핵세포 상에서의 RTL 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13b는 CD11b+ 인간 단핵세포 상에서의 1 ㎍ RTL342M 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13c는 CD11b+ 인간 단핵세포 상에서의 1 ㎍ RTL1000 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13d는 CD11b+ 인간 단핵세포 상에서의 5 ㎍ RTL1000 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13e는 CD11b+ 인간 단핵세포 상에서의 5 ㎍ RTL340 결합(상부) 및 CD74 발현(하부)을 보여주는 도면 세트이다.
도 13f는 분석 전에 배양물에서 다양한 농도의 RTL1000으로 처리된 인간 단핵세포에서의 RTL1000 결합 대 CD74 발현의 선형 회귀를 보여주는 선 그래프이다. 원데이터는 도 13a 내지 13e에 제시되어 있다.
도 14a는 EAE가 MBP-85-99를 사용한 면역화에 의해 유도된 마우스에 대한 평균 임상 EAE 매일 점수를 보여주는 선 그래프(좌측) 및 CDI를 보여주는 막대 그래프(우측)이다. 질환 발병(그래프 상에서 화살표로 표시됨) 후 5일 동안 MBP-TCR/DR2-Tg 마우스를 비히클, RTL342M, RTL1000, RTL340 또는 RTL302-5D로 치료하였다. EAE 매일 평균 점수 및 피크 질환의 경우 RTL342M 대 비히클에 대한 *p<0.02, 및 RTL340 및 RTL1000 대 비히클에 대한 *** p<0.002(좌측 패널). CDI의 경우 RTL342M 대 비히클에 대한 **p<0.0014, 및 RTL340 및 RTL1000 대 비히클에 대한 ***p<0.001(우측 패널).
도 14b는 EAE가 mMOG-35-55를 사용한 면역화에 의해 유도된 마우스에 대한 평균 임상 EAE 매일 점수를 보여주는 선 그래프(좌측) 및 CDI를 보여주는 막대 그래프(우측)이다. EAE를 갖는 DR*1501 마우스를 발병 시 RTL340(100 ㎍), RTL342M(100 ㎍), RTL302-5D(100 ㎍, 5회 매일 치료), RTL302-5D(1 mg) 또는 RTL342M(100 ㎍, 2회 매일 치료)으로 치료하였다. 비히클 및 비치료군은 서로 유의하게 상이하지 않았고 조합되었다. EAE 매일 평균 점수 및 피크 질환(좌측 패널)의 경우 *p<0.04, RTL302-5D(1 mg X2), ***p<0.0001, RTL342M(100 ㎍ X5), #p<0.01, RTL342M(100 ㎍ X2) 대 비히클/비치료군; CDI(우측 패널)의 경우 ***p<0.0001, RTL342M(100 ㎍ X2 및 5회 매일 치료), p<0.013, RTL302-5D(1 mg X2 매일 치료) 대 비히클/비치료군.
도 14c는 도 14b에 나타낸 마우스 군들에 대한 CD11b+ 세포 상에서의 CD74 수준과 평균 CDI 사이의 관계를 보여주는 그래프이다.
도 15는 공유결합된 mMOG-35-55를 갖는 pDR2(100 ㎍), 펩티드를 갖지 않는 pDR2(1000 ㎍), DR-α1(750 ㎍) 또는 비히클 단독으로 치료받은 마우스의 임상 EAE 점수를 보여주는 선 그래프(상부) 및 CDI를 보여주는 막대 그래프(하부)이다. 각각의 치료군은 3마리의 마우스들로 구성되었다. * p<0.05 pDR2 mMOG-35-55 대 비치료군; # p<0.05 pDR2/펩티드 부재 대 비치료군; Φ p<0.05 DR-α1 대 비치료군.
도 16은 비히클(비치료군), 펩티드를 갖지 않는 변경된 pDR2(RTL302-5D), 공유결합된 mMOG-35-55를 갖는 변경된 pDR2(RTL342M), 또는 DR-α1로 치료받은 마우스의 임상 EAE 점수를 보여주는 선 그래프(상부) 및 CDI를 보여주는 막대 그래프(하부)이다. 각각의 치료군은 3마리의 마우스들로 구성되었다.
도 17은 표시된 바와 같이 치료받은 EAE DR2-Tg 마우스의 척수로부터 수득된 CD11b+ 단핵세포 상에서의 CD74(도 17a), ICAM(도 17b) 및 CD80(도 17c)의 발현을 보여주는 일련의 막대 그래프이다.
도 18a는 1시간 동안 10 ㎍/㎖ RTL342M 또는 완충제로 치료받은 후 1시간 동안 100 ng/㎖의 MIF와 함께 또는 MIF 없이 10 ng/㎖의 LPS로 자극받은 3마리의 항원미접촉 DR*1501-Tg 마우스로부터 단리된 비장세포에서 실시간 PCR에 의해 측정된 ICAM-1의 상대적 발현을 보여주는 그래프이다. * p<0.05.
도 18b는 2시간 동안 50 ㎍/㎖ RTL342M으로 치료받은 DR*1501/GFP-Tg 마우스로부터 단리된 GFP+CD11b+ 세포의 평균 트랙(track) 속도의 막대 그래프이다. 10개의 저속 촬영 필드(5개의 비치료 필드 및 5개의 치료 필드)를 생형광 현미경 관찰로 영상화하였다. *** p<0.0005.
도 18c는 도 18b에 기재된 바와 같이 단리되고 처리된 세포의 평균 트랙 변위 길이의 막대 그래프이다. *** p<0.0005.
도 18d는 4개의 대표적인 필드들로부터 개별 세포들(각각의 필드에서 9개 내지 11개의 세포들)의 트랙을 보여주는 한 쌍의 그래프이다. 세포를 도 18b에 기재된 바와 같이 단리하고 처리하였다.
도 19는 DRA α1 아미노산 35 내지 58 영역(상자로 표시됨)을 보여주는 MHC 클래스 II α 쇄 아미노산 서열들의 부분의 예시적 정렬이다. 상기 서열들은 다음과 같다: DR2(서열번호 110), DR4(서열번호 111), DP2(서열번호 112), DQ2(서열번호 113), IAs(서열번호 114), IAg7(서열번호 115) 및 RT1.B(서열번호 116).
도 20은 RTL 구축물이 항-CD74 항체와 CD74의 결합을 방해하지 않는다는 것을 확인시켜주는 웨스턴 블롯의 영상이다. DR*1501 용해물을 4℃에서 리간드 없이, 또는 15 ㎍의 RTL342M 또는 DR-α1과 함께 예비항온처리하였다. 용해물을 단백질/비드에 흡착된 ln-1 Ab에 첨가하였다. 면역 복합체를 1% CHAPS/TEN 완충제로 4회 세척한 후 TEN 완충제로 4회 세척하였다. 물질을 2% SDS를 갖는 샘플 완충제에서 7분 내지 9분 동안 끓임으로써 비드로부터 용출하였다. 그 다음, 샘플을 10% 내지 20% 폴리아크릴아미드 겔에서 분석하고 PVDF로 옮기고 항-CD74 mAb ln-1-FITC로 프로빙하여 CD74를 검출하였다.
도 21은 X 축 상에서 CD74 발현을 보여주고 Y 축 상에서 CD11b 발현을 보여주는 3개 플롯도의 세트이다. mMOG35-55/CFA/Ptx-유도된 EAE를 갖는 DR*1501-Tg 마우스를 임상 징후의 발병 시 3일 동안 100 ㎍ RTL342M, 500 ㎍ DR2-β1 또는 비히클로 치료하였다. * p<0.05.
도 22의 좌측 패널은 도 21에 기재된 바와 같이 치료된 마우스의 임상 EAE 점수를 보여주는 선 그래프이다. 우측 패널은 동일한 마우스에 대한 누적 질환 지수의 막대 그래프이다. ** p<0.01, *** p<0.001
도 23의 좌측 패널은 임상 징후의 발병 시 비히클, DR2-β1(500 ㎍), DR-α1(100 ㎍), DR-α1(300 ㎍), DR-α1(500 ㎍), DR-α1(1000 ㎍) 또는 RTL342M(100 ㎍)으로 치료받은, mMOG-35-55/CFA/Ptx-유도된 EAE를 갖는 DR*1501-Tg 마우스의 임상 EAE 점수를 보여주는 선 그래프이다. * p<0.05 DRα1 대 비히클; δ p<0.04 RTL342M, DR-α1(300 ㎍), DR-α1(500 ㎍), DR-α1(1000 ㎍) 대 DR2-β1; # p<0.0003 RTL342M, DR-α1(300 ㎍), DR-α1(500 ㎍), DR-α1(1000 ㎍) 대 비히클; ψ p<0.05 DR-α1(100 ㎍) 대 DR2-β1. 우측 패널은 동일한 동물에 대한 누적 질환 지수를 보여주는 막대 그래프이다. * p<0.05; ** p<0.005 DR-α1(100 ㎍) 대 비히클; *** p<0.0005 대 비히클.
서열목록
본 명세서에 또는 첨부된 서열목록에 나열된 임의의 핵산 및 아미노산 서열은 37 C.F.R. § 1.822에 정의된 바와 같이 뉴클레오티드 염기의 경우 표준 문자 약어, 및 아미노산의 경우 3 문자 코드를 이용함으로써 표시된다. 적어도 일부 경우, 각각의 핵산 서열의 한 가닥만이 표시되어 있지만, 상보적인 가닥은 표시된 가닥의 임의의 언급에 의해 포함되는 것으로서 이해된다.
서열번호 1 내지 49는 예시적 MHC 클래스 II α 쇄 폴리펩티드의 아미노산 서열이다.
서열번호 50 내지 85는 예시적 항원 결정기 펩티드의 아미노산 서열이다.
서열번호 86 내지 108은 pDR2/hMOG35-55에 결합하는 단백질로부터의 펩티드의 아미노산 서열이다.
서열번호 109는 MHC DRA 잔기 38 내지 58 단편의 아미노산 서열이다.
서열번호 110 내지 116은 MHC 클래스 II α 쇄 아미노산 서열의 부분적 아미노산 서열이다.
종래, 공유 결합된 MHC 클래스 II β1 및 α1 도메인(재조합 T 세포 수용체 리간드(RTL)로서도 공지된 β1α1 폴리펩티드)을 포함하는 2개의 도메인 MHC 구축물은 보조자극 분자의 부재 하에서 동족 T 세포 수용체와 직접적으로 상호작용하여(McMahan et al., J. Biol. Chem. 278:30961-30970, 2003), 부분적 T 세포 수용체 작용제로서 작용하고 준최적 다운스트림 신호전달 및 사이토카인 변동을 유발한다는 것이 밝혀졌다(Burrows et al., J. Immunol. 167:4386-4395, 2001; Wang et al., J. Immunol. 171:1934-1940, 2003). 예를 들면, 본원에 참고로 인용되는 미국 특허 제6,270,772호, 및 미국 특허출원 공보 제2005/0142142호 및 제2009/0280135호를 참조한다. 부착된 수초 펩티드를 포함하는 RTL은 실험적 자가면역 뇌척수염을 갖는 마우스의 치료(Burrows, Curr. Drug Targets Inflamm. Allergy 4:185-193, 2005) 및 다발성 경화증 환자의 I 기 시험(Yadav et al., Neurol. 74:A293-294, 2010; Offner et al., J. Neuroimmunol. 231:7-14, 2011)에서 이미 성공적으로 사용되었다.
본원에 개시된 바와 같이, 놀랍게도 2개의 도메인 RTL이 MHC 클래스 II 불변 쇄(CD74), 세포 표면 히스톤 및 MHC 클래스 II 그 자체를 포함하는 복합체에 결합한다는 것을 발견하였다. 구체적으로, CD74와의 결합은 단핵세포 상에서 CD74의 신속한 용량 의존적 하향조절을 초래하는, MHC 클래스 II α1 도메인과 CD74 사이의 상호작용을 수반한다. 이 하향조절은 2개의 도메인 RTL 및 α1 도메인 단독에 의해 야기된다. 추가로, 예기치 않게 MHC 클래스 II α1 도메인만을 사용한 치료가 마우스에서 EAE의 중증도를 감소시킨다는 것을 발견하였는데, 이것은 α1 도메인이 예를 들면, 염증성 장애 및/또는 자가면역 장애를 위한 치료 조성물로서 사용될 수 있다는 것을 표시한다.
MHC 클래스 II α1 도메인을 포함하되 다른 MHC 클래스 II 도메인을 포함하지 않는 치료제의 한 이점은 치료 전에 환자의 HLA 하위유형분류(subtyping)에 대한 필요성이 감소된다는 것이다. 이것은 모든 DR β 쇄 폴리펩티드들과 상호작용하는 단일 α 쇄 폴리펩티드를 갖는 HLA-DR의 경우 특히 사실이다. 따라서, DR α1 도메인 폴리펩티드는 DR β1 도메인 함유 폴리펩티드로의 치료를 위해 현재 요구되는 HLA 유형분류를 필요로 하지 않으면서 모든 개체들에게 투여될 수 있다고 생각된다. 다른 HLA 하위유형의 경우, α 및 β 대립형질 둘다의 하위유형분류보다는 오히려 α 도메인 대립형질만의 하위유형분류가 요구될 것이다. 또한, 개시된 MHC 클래스 II α1 도메인 폴리펩티드는 β1 도메인 함유 폴리펩티드(예컨대, β1α1 폴리펩티드)보다 더 작은 크기를 갖기 때문에 다량으로 보다 신속히 저렴하게 제조될 수 있고, α1 도메인의 단편은 합성 펩티드로서 생성될 수 있으므로, 제조의 용이성 및 속도가 훨씬 더 증가된다.
마우스에서 실험적 자가면역 뇌척수염(EAE)을 치료하는 데에 있어서 MHC 클래스 II β1α1 폴리펩티드 및 α1 도메인 폴리펩티드의 효능은 하기 실시예에 나타낸 바와 같이 CD74를 하향조절하는 그들의 예기치 않은 능력과 밀접한 상관관계를 갖는다는 것을 발견하였다. 따라서, CD74 수준(예컨대, CD74 발현 또는 활성)은 MHC 클래스 II β1α 폴리펩티드 또는 MHC 클래스 II α1 도메인 폴리펩티드로 치료받은 대상체에서 치료 효능의 마커로서 사용될 수 있다. 유사하게, CD74 수준은 MHC 클래스 II β1α1 폴리펩티드 또는 MHC 클래스 II α1 도메인 폴리펩티드로 대상체의 치료를 최적화하는 데에(예컨대, 용량을 최적화하거나 조절하는 데에) 사용될 수 있다.
I. 약어
APC 항원 제시 세포
CDI 누적 질환 지수
EAE 실험적 자가면역 뇌척수염
HLA 인간 백혈구 항원
MBP 수초 염기성 단백질
MIF 대식세포 이동 억제 인자
MHC 주조직적합성 복합체
MOG 수초 희소돌기아교세포 당단백질
PBMC 말초 혈액 단핵세포
pMHC 부분적 MHC(β1α1) 폴리펩티드
PLP 단백지질 단백질
RTL 재조합 T 세포 수용체 리간드
II. 용어
달리 언급되어 있지 않은 한, 기술 용어들은 보편적인 용법에 따라 사용된다. 분자생물학의 통상의 용어들의 정의는 문헌(Benjamin Lewin, Genes V, published by Oxford University Press, 1994 (ISBN 0-19-854287-9)); 문헌(Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9)); 및 문헌(Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8))에서 발견될 수 있다.
달리 설명되어 있지 않은 한, 본원에서 사용된 모든 기술 용어들 및 과학 용어들은 본 개시내용이 속하는 분야에서 통상의 기술을 가진 자에 의해 통상적으로 이해되는 의미와 동일한 의미를 갖는다. 단수형 용어는, 내용이 달리 명시하고 있지 않은 한, 복수형 지시대상을 포함한다. 유사하게, 용어 "또는"은, 문맥이 달리 명시하고 있지 않은 한, "및"을 포함하기 위한 것이다. 따라서, "A 또는 B를 포함하는"은 A 또는 B, 또는 A 및 B를 포함한다는 것을 의미한다. 핵산 또는 폴리펩티드에 대해 주어진 모든 염기 크기 또는 아미노산 크기, 및 모든 분자 중량 또는 분자 질량 값은 근사치이고 설명을 위해 제공된다는 것도 이해해야 한다. 본원에 기재된 방법 및 재료와 유사하거나 동등한 방법 및 재료가 본 개시내용의 실시 또는 시험에서 사용될 수 있지만, 적합한 방법 및 재료가 이하에 기재된다.
본원에서 언급된 모든 공개문헌들, 특허출원들, 특허들 및 다른 참고문헌들은 전체적으로 참고로 인용된다. 본원에서 언급된 모든 진뱅크 등록번호들은 2012년 1월 6일자로 진뱅크에서 제공된 바와 같이 전체적으로 참고로 인용된다. 모순이 있는 경우, 용어의 설명을 포함하는 본 명세서가 좌우할 것이다. 또한, 재료, 방법 및 예는 단지 예증적인 것이고 한정하기 위한 것이 아니다.
본 개시내용의 다양한 실시양태들의 검토를 용이하게 하기 위해, 과학 용어들의 하기 설명이 제공된다:
항원: 동물 내로 주사되거나 흡수되는 조성물을 비롯한, 동물에서 항체의 생성 또는 T 세포 반응을 자극할 수 있는 화합물, 조성물 또는 물질. 항원은 이종 면역원에 의해 유도되는 면역을 비롯한 특이적 체액성 또는 세포성 면역의 생성물과 반응한다. 용어 "항원"은 모든 관련된 항원성 에피토프들을 포함한다. "에피토프" 또는 "항원 결정기"는 B 및/또는 T 세포가 반응하는 항원 상의 부위를 지칭한다. 한 실시양태에서, T 세포는 에피토프가 MHC 분자와 함께 제시될 때 에피토프에 반응한다. 에피토프는 단백질의 삼차 폴딩에 의해 병치되는 인접 아미노산(contiguous amino acid)들 또는 비인접 아미노산들 둘다로부터 형성될 수 있다. 인접 아미노산들로부터 형성된 에피토프는 전형적으로 변성 용매에의 노출 시 보유되는 반면, 삼차 폴딩에 의해 형성된 에피토프는 전형적으로 변성 용매를 사용한 처리 시 상실된다. 에피토프는 전형적으로 독특한 공간적 입체구조로 적어도 3개, 보다 통상적으로 적어도 8개의 아미노산(예컨대, 약 8개 내지 50개 또는 8개 내지 23개의 아미노산)을 포함한다. 에피토프의 공간적 입체구조를 확인하는 방법은 예를 들면, x-선 결정학 및 2차원 핵 자기 공명을 포함한다.
항원은 조직 특이적 항원 또는 질환 특이적 항원일 수 있다. 조직 특이적 항원이 질환 특이적 항원일 수도 있기 때문에 이들 용어들은 배타적이지 않다. 조직 특이적 항원은 제한된 수의 조직, 예컨대, 단일 조직에서 발현된다. 조직 특이적 항원은 하나 초과의 조직에 의해 발현될 수 있다(예컨대, 중추신경계 또는 말초신경계에서 발현되는 항원을 포함하나 이것으로 한정되지 않음).
CD74: CD74 분자, 주조직적합성 복합체, 클래스 II 불변 쇄 또는 Ii로서도 공지되어 있다. CD74는 면역 반응을 위한 항원 제시를 조절하는 샤페론이다. 이것은 대식세포 이동 억제 인자(MIF)에 대한 세포 표면 수용체이기도 하다.
CD74에 대한 핵산 서열 및 단백질 서열은 공개적으로 입수가능하다. 예를 들면, 진뱅크 등록번호 NM_001025158, NM_004355 및 NM_001025159는 예시적 인간 CD74 핵산 서열을 개시하고, 진뱅크 등록번호 NP_001020329, NP_004346 및 NP_001020330은 예시적 인간 CD74 아미노산 서열을 개시한다. 유사하게, 진뱅크 등록번호 NM_001042605 및 NM_010545는 예시적 마우스 CD74 핵산 서열을 개시하고, 진뱅크 등록번호 NP_001036070 및 NP_034675는 예시적 마우스 CD74 아미노산 서열을 개시한다. 이들 서열들 각각은 2012년 1월 6일자로 진뱅크에서 제공된 바와 같이 본원에 참고로 인용된다.
보존적 변이체: 아미노산 잔기를 유사한 생화학적 성질을 갖는 또 다른 아미노산 잔기로 치환시키는 것. "보존적" 아미노산 치환은 MHC 클래스 II 폴리펩티드, 예컨대, MHC 클래스 II α1 폴리펩티드의 활성에 실질적으로 영향을 미치지 않거나 이러한 활성을 실질적으로 감소시키지 않는 치환이다. 폴리펩티드는 1개 이상의 아미노산 치환, 예를 들면, 1개 내지 10개의 보존적 치환, 2개 내지 5개의 보존적 치환, 4개 내지 9개의 보존적 치환, 예컨대, 1개, 2개, 5개 또는 10개의 보존적 치환을 포함할 수 있다. 보존적 치환의 특정 비한정적 예로는 하기 예들이 있다:
대조군: "대조군"은 실험 샘플과의 비교를 위해 사용된 샘플 또는 표준물을 지칭한다. 일부 실시양태에서, 대조군은 건강한 대상체 또는 건강한 대상체 집단으로부터 수득된 샘플이다. 다른 실시양태에서, 대조군은 과거(historical) 대조군, 또는 표준 기준 값 또는 값의 범위(예컨대, 과거에 시험된 대조군 샘플, 예컨대, 기준 또는 정상 값, 예컨대, 건강한 대상체에서의 CD74 발현 또는 활성의 수준을 나타내는 샘플의 군)이다. 추가 예에서, 대조군은 치료 전에 대상체로부터 수득된다(예컨대, MHC 클래스 II β1α1 폴리펩티드 또는 MHC 클래스 II α1 도메인 폴리펩티드로의 치료 전 CD74 발현 또는 활성 수준).
도메인: 특정 기능으로 동일시될 수 있는 폴리펩티드 또는 단백질의 아미노산 서열의 별개의 부분. 예를 들면, MHC 클래스 II 분자를 구성하는 α 폴리펩티드 및 β 폴리펩티드는 각각 2개의 도메인, 즉 α1 및 α2, 및 β1 및 β2를 갖는 것으로서 각각 인식된다. 다양한 도메인들은 전형적으로 아미노산 서열들을 연결함으로써 연결된다. 한 실시양태에서, 전체 도메인 서열은 연결제 또는 인접 도메인의 전부 또는 일부를 포함하도록 서열을 연장함으로써 재조합 분자에 포함된다. 예를 들면, MHC 클래스 II 분자의 α1 도메인을 선택할 때, 선택된 서열은 전체 α1 도메인을 통해 α 쇄의 아미노산 잔기 번호 1부터 연장될 수 있고 약 아미노산 잔기 76 내지 90(α1 도메인의 카복실 말단, 또는 α1 도메인과 α2 도메인 사이)에 위치한 연결제 서열의 전부 또는 일부를 포함할 수 있다. 다양한 MHC 분자 도메인들에서 아미노산의 정확한 수는 포유동물의 종에 따라 상이할 뿐만 아니라 종 내의 유전자 부류들 사이에도 상이하다. 재조합 분자에서 사용될 서열의 선택에 중요한 양태는 아미노산의 수에 기초한 정확한 구조적 정의보다는 오히려 도메인 기능의 유지이다. 당분야에서 통상의 기술을 가진 자는 선택된 도메인의 전체 아미노산 서열보다 다소 적은 아미노산 서열이 이용되는 경우조차도 도메인 기능이 유지될 수 있다는 것을 인식할 것이다. 예를 들면, α1 도메인의 아미노 또는 카르복시 말단에서 다수의 아미노산들이 도메인 기능에 영향을 미치지 않으면서 결실될 수 있다.
특정 선택된 도메인의 기능적 활성은 본 개시내용에 의해 제공된 MHC 클래스 II 폴리펩티드(예를 들면, α1 또는 β1α1 폴리펩티드)와 관련하여 평가될 수 있다(예를 들면, T 세포 증식 및/또는 CD74 결합 분석).
유효량: 질환 또는 병태의 진행을 억제하거나 질환 또는 병태의 퇴행을 야기하거나, 질환 또는 병태에 의해 야기된 증상을 경감시킬 수 있기에 충분한 특정 화합물의 용량 또는 양. 예를 들면, 이것은 장애, 예컨대, 염증성 장애 및/또는 자가면역 장애를 치료하거나 억제하기 위해 요구되는 개시된 MHC 분자의 양 또는 용량일 수 있다. 한 실시양태에서, 유효량은 단독으로 또는 하나 이상의 추가 치료제와 함께 대상체에서 원하는 반응, 예컨대, 염증성 또는 자가면역 장애, 또는 다른 질환 또는 장애의 치료 또는 억제를 유도하는 양이다.
염증: 염증 물질을 격리시키는 데에 기여하는, 조직 손상에 의해 유발된 국한된 보호 반응. 염증은 유해한 자극, 예컨대, 병원체, 손상된 세포 또는 자극제에 대한 혈관 조직의 복합 생물학적 반응에 의해 조정된다. 염증은 손상성 자극을 제거하고 조직을 위한 치유 과정을 시작하기 위한 유기체에 의한 보호 시도이다. 염증 반응은 전신적으로 또는 염증 부위에서 국소적으로 백혈구 세포의 축적을 특징으로 한다. 염증 반응은 당분야에서 잘 공지된 많은 방법들, 예컨대, 백혈구 세포의 수, 다형핵 호중구(PMN)의 수, PMN 활성화 정도의 측정, 예컨대, 내강 향상된-화학발광, 또는 존재하는 사이토카인의 양의 측정에 의해 측정될 수 있다. 일차 염증 장애는 염증 그 자체에 의해 야기되는 장애이다. 이차 염증 장애는 또 다른 장애의 결과인 염증이다. 염증은 류마티스성 관절염, 골관절염, 염증성 폐 질환(만성 폐쇄성 폐 질환을 포함함), 염증성 장 질환(궤양성 결장염 및 크론병을 포함함), 치주 질환, 류마티스성 다발근육통, 죽상동맥경화증, 전신 홍반 루푸스, 전신 경화증, 쇼그렌 증후군, 천식, 알레르기성 비염 및 피부 장애(피부근육염 및 건선을 포함함) 등을 포함하나 이들로 한정되지 않는 다수의 염증성 질환을 유발할 수 있다. 염증성 성분을 포함하는 자가면역 장애(다발성 경화증을 포함하나 이것으로 한정되지 않음)도 염증성 장애인 것으로 간주된다.
질환의 억제 또는 치료: 질환을 "억제하는"은 예를 들면, 질환, 예컨대, 염증성 또는 자가면역 장애에 대한 소인을 갖는 것으로 공지된 사람에서 질환의 완전한 발생을 억제하는 것을 지칭한다. 질환의 억제는 예를 들면, 질환 또는 장애를 갖거나 질환 또는 장애를 발생시킬 위험에 있는 대상체에서 질환의 부분적 억제부터 실질적으로 완전한 억제(예방)에 이르는 범위를 포괄할 수 있다. 일부 예에서, 용어 "억제하는"은 질환의 발병 또는 진행을 감소시키거나 지연시키는 것을 지칭한다. 질환 또는 장애를 억제하거나 치료하기 위해 유효량의 약학 조성물을 투여받을 대상체는 예를 들면, 가족력, 또는 상기 질환 또는 장애를 발생시킬 위험 인자를 기초로 이러한 장애에 대한 표준 진단 기법에 의해 확인될 수 있다. 대조적으로, "치료"는 질환 또는 병리학적 상태의 징후 또는 증상이 발생되기 시작한 후 이러한 징후 또는 증상을 완화시키는 치료적 중재를 지칭한다.
단리된: "단리된" 생물학적 성분(예컨대, 핵산, 펩티드 또는 단백질)은 이 성분이 존재하는 유기체의 세포 내의 다른 생물학적 성분, 예를 들면, 다른 염색체 및 염색체외 DNA 및 RNA, 및 단백질로부터 실질적으로 분리되어 있거나, 별도로 생성되어 있거나 정제되어 있다. 따라서, "단리된" 핵산, 펩티드 및 단백질은 표준 정제 방법에 의해 정제된 핵산 및 단백질을 포함한다. 상기 용어는 숙주 세포에서 재조합 발현에 의해 제조된 핵산, 펩티드 및 단백질뿐만 아니라 화학적으로 합성된 핵산도 포괄한다.
연결제: 2개의 분자들(예컨대, 2개의 폴리펩티드들)을 공유 결합하는 분자. 연결제(예컨대, 펩티드 링커 또는 화학적 연결제)는 예를 들면, α1 도메인과 항원성 펩티드 사이에서 본 개시내용의 재조합 MHC 폴리펩티드에 포함될 수 있다. 일반적으로 2개 내지 25개 아미노산의 길이를 갖는 펩티드 링커 서열이 당분야에서 잘 공지되어 있고, 문헌(Chaudhary et al., Nature 339:394-397, 1989)에 기재된 글리신(4)-세린 스페이서를 포함하나 이것으로 한정되지 않는다. 유사하게, 화학적 연결제(예컨대, 티올 결합 또는 가교연결제)는 당분야에서 잘 공지되어 있다.
MHC 클래스 II: MHC 클래스 II 분자는 2개의 비공유 결합된 단백질인 α 쇄 및 β 쇄로부터 형성된다. α 쇄는 α1 도메인 및 α2 도메인을 포함하고, β 쇄는 β1 도메인 및 β2 도메인을 포함한다. 항원이 피팅되는 틈은 α1 도메인과 β1 도메인의 상호작용에 의해 형성된다. α2 도메인 및 β2 도메인은 α 쇄 및 β 쇄를 APC의 세포막 내에 고착시키는 경막 Ig-폴드 유사 도메인이다. MHC 클래스 II 복합체는 항원과 회합할 때(그리고 적절한 보조자극 신호의 존재 하에서) CD4 T 세포를 자극한다. CD4 T 세포의 일차 기능은 염증 반응을 시작하는 것, 면역 시스템에서 다른 세포를 조절하는 것, 및 항체 합성을 위해 B 세포에 도움을 제공하는 것이다.
약학적으로 허용가능한 담체: 본 개시내용에서 유용한 약학적으로 허용가능한 담체는 통상적인 담체이다. 문헌(Remington: The Science and Practice of Pharmacy, The University of the Sciences in Philadelphia, Editor, Lippincott, Williams, & Wilkins, Philadelphia, PA, 21st Edition (2005))은 본원에 개시된 단백질의 약학적 전달에 적합한 조성물 및 제제를 기술한다.
폴리펩티드: 단량체가 아미드 결합을 통해 서로 연결되어 있는 아미노산 잔기인 중합체. 아미노산이 알파-아미노산일 때, L-광학 이성질체 또는 D-광학 이성질체가 사용될 수 있고, L-이성질체가 바람직하다. 본원에서 사용된 용어 "폴리펩티드", "단백질" 또는 "펩티드"는 임의의 아미노산 서열을 포괄하기 위한 것이고 변경된 서열, 예컨대, 당단백질을 포함한다. 용어 "폴리펩티드", "단백질" 또는 "펩티드"는 구체적으로 천연 발생 단백질뿐만 아니라 재조합적으로 또는 화학적으로 제조된 단백질도 포함하기 위한 것이다. 용어 "폴리펩티드" 또는 "단백질"은 단백질의 천연 발생 변경된 형태, 예컨대, 글리코실화된, 인산화된 또는 유비퀴틴화된 형태를 포함한다.
정제된: 용어 "정제된"은 절대적인 순도를 요구하지 않고, 오히려 상대적인 용어로서 의도된다. 따라서, 예를 들면, 정제된 펩티드 제제는 펩티드 또는 단백질이 그의 환경, 예를 들면, 세포 또는 제제 내에서 존재하는 양보다 더 풍부한 양으로 상기 펩티드 또는 단백질을 함유하는 제제이다. 바람직하게는, 제제는 단백질 또는 펩티드가 제제의 총 펩티드 또는 단백질 함량의 적어도 50%를 차지하도록 정제된다. 일부 실시양태에서, 정제된 제제는 적어도 60%, 적어도 70%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95% 또는 그 이상의 단백질 또는 펩티드를 함유한다.
재조합: 재조합 핵산 또는 폴리펩티드는 천연적으로 발생하지 않는 서열을 갖거나 2개 이상의 다른 방식으로 분리된 서열 절편들의 인공 조합에 의해 제조된 서열을 갖는 핵산 또는 폴리펩티드이다. 이 인공 조합은 종종 화학적 합성, 또는 보다 통상적으로 단리된 핵산 절편의 인공 조작, 예를 들면, 유전공학 기법에 의해 달성된다.
샘플: 대상체로부터 수득된 핵산(예를 들면, DNA 또는 RNA(mRNA를 포함함)), 단백질 또는 이들의 조합을 함유하는 생물학적 표본. 예로는 말초 혈액, 미세 바늘 흡입물, 소변, 타액, 조직 생검, 수술 표본 및 부검 물질이 있으나 이들로 한정되지 않는다. 일례에서, 샘플은 혈액 샘플(예컨대, 혈액; 혈액의 유도체 및 분획, 예컨대, 혈청), 또는 단리된 또는 정제된 세포 집단(예를 들면, 부분적으로 단리된 또는 부분적으로 정제된 세포 집단을 포함하는 T 세포, B 세포, PBMC, 림프구 등)을 포함한다.
서열 동일성: 2개의 핵산 서열들 또는 2개의 아미노산 서열들 사이의 유사성은 서열 동일성으로도 지칭되는, 서열들 사이의 유사성의 관점에서 표현된다. 서열 동일성은 종종 백분율 동일성(또는 유사성 또는 상동성)의 관점에서 측정되고; 백분율이 높을수록 2개의 서열들이 보다 더 유사하다.
비교를 위한 서열들의 정렬 방법은 당분야에서 잘 공지되어 있다. 다양한 프로그램들 및 정렬 알고리즘들이 문헌(Smith & Waterman, Adv. Appl. Math. 2: 482, 1981); 문헌(Needleman & Wunsch, J. Mol. Biol. 48: 443, 1970); 문헌(Pearson & Lipman, Proc. Natl. Acad. Sci. USA 85: 2444, 1988); 문헌(Higgins & Sharp, Gene, 73: 237-244, 1988); 문헌(Higgins & Sharp, Comput. Appl. Biosci. 5: 151-153, 1989); 문헌(Corpet et al., Nucl. Acids Res. 16, 10881-90, 1988); 문헌(Huang et al., Comput. Appl. Biosci. 8, 155-65, 1992); 및 문헌(Pearson, Methods Mol. Biol. 24:307-331, 1994)에 기재되어 있다. 문헌(Altschul et al., J. Mol. Biol. 215:403-410, 1990)은 서열 정렬 방법 및 상동성 계산의 상세한 고려사항을 제시한다. 서열 분석 프로그램 blastp, blastn, blastx, tblastn 및 tblastx와 관련하여 사용될 NCBI 기본 국소 정렬 검색 수단(BLAST)(Altschul et al., J. Mol. Biol. 215:403-410, 1990)은 국립 생명공학 정보 센터(NCBI, 미국 매릴랜드주 베쎄스다 소재) 및 인터넷을 비롯한 여러 공급원들로부터 입수될 수 있다.
고도의 서열 동일성을 보이지 않는 핵산 서열들이 그럼에도 불구하고 유전 코드의 축퇴성으로 인해 유사한 아미노산 서열들을 코딩할 수 있다. 이 축퇴성을 이용하여 핵산 서열을 변화시켜 실질적으로 동일한 단백질을 모두 코딩하는 다수의 핵산 분자들을 생성할 수 있다는 것이 이해된다.
대상체: 인간 및 비인간 포유동물 둘다를 포함하는 카테고리인 살아있는 다세포 척추동물 유기체.
III. MHC 클래스 II α1 폴리펩티드
본원은 MHC 클래스 II α1 도메인 또는 이의 단편을 포함하고 MHC 클래스 II α2, β1 또는 β2 도메인을 포함하지 않는 단리된 폴리펩티드를 개시한다. 포유동물 MHC 클래스 II α 및 β 쇄 단백질들의 아미노산 서열뿐만 아니라 이들 단백질들을 코딩하는 핵산도 당분야에서 잘 공지되어 있고 진뱅크를 비롯한 다수의 공급원으로부터 입수될 수 있다. 예시적 서열은 문헌(Auffray et al., Nature 308:327-333, 1984)(인간 HLA DQ α); 문헌(Larhammar et al., Proc. Natl. Acad. Sci. USA 80:7313-7317, 1983)(인간 HLA DQ β); 문헌(Das et al., Proc. Natl. Acad. Sci. USA 80:3543-3547, 1983)(인간 HLA DR α); 문헌(Tonnelle et al., EMBO J. 4:2839-2847, 1985)(인간 HLA DR β); 문헌(Lawrance et al., Nucl. Acids Res. 13:7515-7528, 1985)(인간 HLA DP α); 문헌(Kelly and Trowsdale, Nucl. Acids Res. 13:1607-1621, 1985)(인간 HLA DP β); 문헌(Syha et al., Nucl. Acids Res. 17:3985, 1989)(래트 RT1.B α); 문헌(Syha-Jedelhauser et al., Biochim. Biophys. Acta 1089:414-416, 1991)(래트 RT1.B β); 문헌(Benoist et al., Proc. Natl. Acad. Sci. USA 80:534-538, 1983)(마우스 I-A α); 및 문헌(Estess et al., Proc. Natl. Acad. Sci. USA 83:3594-3598, 1986)(마우스 I-A β)(이들 모두 본원에 참고로 인용됨)에서 제공되어 있다. 추가 MHC 클래스 II α 및 β 쇄 폴리펩티드들은 예를 들면, 공개 데이터베이스, 예컨대, (전세계 웹 사이트(ebi.ac.uk/imgt/hla/) 상에서 입수가능한) IMGT/HLA 데이터베이스로부터 당분야에서 통상의 기술을 가진 자에 의해 확인될 수 있다.
일부 실시양태에서, 개시된 폴리펩티드는 MHC 클래스 II α1 도메인, 예컨대, DR-α1, DP-α1, DQ-α1, DM-α1 또는 DO-α1 도메인, 또는 이의 부분을 포함한다. 특정 실시양태에서, MHC 클래스 II α1 도메인은 인간 HLA-DRA 폴리펩티드이다. α1 도메인은 포유동물 MHC 클래스 II α 쇄 단백질에서 잘 정의되어 있다. 일부 예에서, MHC 클래스 II α 쇄는 폴리펩티드를 수송하는 데에 관여하고 단백질용해에 의해 제거되어 성숙 α 폴리펩티드를 생성하는 리더 서열을 포함한다. α1 도메인은 일반적으로 성숙(단백질용해에 의해 프로세싱된) α 쇄의 약 잔기 1 내지 90을 포함하는 것으로서 간주된다. MHC 클래스 II 단백질의 α1 도메인과 α2 도메인 사이의 천연 펩티드 링커 영역은 고려되는 특정 α 쇄에 따라 성숙 α 쇄의 약 아미노산 76부터 약 아미노산 93까지 걸쳐 있다. 예시적 MHC 클래스 II α 폴리펩티드는 본원에서 제공되어 있다(예를 들면, 서열번호 1 내지 49). 따라서, α1 도메인은 성숙 α 쇄의 약 아미노산 잔기 1 내지 90을 포함할 수 있으나, 당분야에서 통상의 기술을 가진 자는 이 도메인의 C 말단 컷-오프가 반드시 정확히 정의되지 않고 예를 들면, 성숙 α 쇄의 아미노산 잔기 70 내지 100 사이의 임의의 점에서 발생할 것이라는 것을 인식할 것이다. 일부 예에서, α1 도메인은 성숙 MHC 클래스 II α 도메인의 아미노산 1 내지 70, 1 내지 71, 1 내지 72, 1 내지 73, 1 내지 74, 1 내지 75, 1 내지 76, 1 내지 77, 1 내지 78, 1 내지 79, 1 내지 80, 1 내지 81, 1 내지 82, 1 내지 83, 1 내지 84, 1 내지 85, 1 내지 86, 1 내지 87, 1 내지 88, 1 내지 89, 1 내지 90, 1 내지 91, 1 내지 92, 1 내지 93, 1 내지 94, 1 내지 95, 1 내지 96, 1 내지 97, 1 내지 98, 1 내지 99 또는 1 내지 100을 포함한다. 다른 예에서, α1 도메인은 전장 MHC 클래스 II α 폴리펩티드(예컨대, 본원에 개시된 서열번호 1 내지 49)의 약 잔기 20 내지 120(예컨대, 약 잔기 20 내지 110, 24 내지 110, 24 내지 109, 25 내지 100, 25 내지 109, 26 내지 110, 26 내지 109, 30 내지 120, 32 내지 120, 32 내지 115, 26 내지 90, 26 내지 85, 26 내지 84, 또는 다른 중첩 영역)을 포함한다. 일부 예에서, MHC 클래스 II α1 도메인은 N 말단 메티오닌을 포함하지 않지만, N 말단 메티오닌은 예를 들면, 세균, 효모 또는 포유동물 시스템에서 발현의 결과로서 존재할 수 있다.
추가 예에서, α1 도메인은 5' 말단 및/또는 3' 말단에서 몇몇 아미노산의 결실 또는 추가, 예컨대, 5' 말단 또는 3' 말단으로부터 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개 또는 10개의 아미노산의 추가 또는 결실, 또는 이들의 조합(예컨대, 한 말단으로부터의 결실, 및 다른 말단에의 추가)을 포함할 수 있다. 이들 파라미터들 이외에 α1 도메인의 조성도 포유동물 종 및 해당 구체적인 α 쇄에 따라 상이할 수 있다. 당분야에서 통상의 기술을 가진 자는 아미노산 서열의 정확한 수치적 파라미터들이 도메인 기능(예를 들면, CD74 결합 또는 하향조절)의 유지보다 덜 중요하다는 것을 인식할 것이다.
다른 예에서, α1 도메인 폴리펩티드는 α1 도메인의 부분, 예컨대, CD74에 결합할 수 있고/있거나 CD74의 발현 또는 활성을 감소시킬 수 있는 α1 도메인의 부분을 포함하거나 이러한 부분으로 구성된다. 예를 들면, MHC 클래스 II α1 폴리펩티드는 성숙 HLA-DRA 폴리펩티드의 아미노산 38 내지 58(예를 들면, KKETVWRLEEFGRFASFEAQG; 서열번호 109) 또는 이의 부분(예컨대, 이의 5개 이상의 인접 아미노산, 예를 들면, 5개 내지 16개, 8개 내지 15개, 8개 내지 10개 또는 12개 내지 15개의 인접 아미노산), 또는 HLA-DP, HLA-DQ, HLA-DM 또는 HLA-DO 폴리펩티드의 상동 영역을 포함할 수 있거나 이러한 영역으로 구성될 수 있다. 예시적 정렬은 도 19에 제시되어 있다. 당분야에서 통상의 기술을 가진 자는 예를 들면, 다수의 서열 정렬 수단을 이용하여 다른 MHC 클래스 II α 도메인 폴리펩티드의 상동 영역을 확인할 수 있다.
여러 실시양태에서, MHC 클래스 II α 폴리펩티드는 서열번호 1 내지 49로서 기재된 아미노산 서열을 포함하거나 이러한 서열로 구성된다. 추가 실시양태에서, MHC 클래스 II α 폴리펩티드는 서열번호 1 내지 49 중 하나에 기재된 아미노산 서열 또는 이의 단편과 적어도 75%, 85%, 90%, 95%, 96%, 97%, 98% 또는 99% 동일한 서열을 갖는다. 예를 들면, 폴리펩티드는 서열번호 1 내지 49에 기재된 아미노산 서열들 중 하나 또는 이의 단편과 적어도 85%, 90%, 95%, 96%, 97%, 98% 또는 99% 동일한 아미노산 서열을 가질 수 있다. 예시적 서열은 인터넷 상에서 용이하게 입수될 수 있는 컴퓨터 프로그램 및 본원에 기재된 아미노산 서열을 사용함으로써 수득될 수 있다. 일부 예에서, 상기 폴리펩티드는 MHC 클래스 II α1 폴리펩티드의 기능, 예컨대, CD74와의 결합을 보유한다. 예시적 MHC 클래스 II α1 도메인 폴리펩티드는 표 1에 제시된 폴리펩티드들을 포함한다.
MHC 클래스 II α1 폴리펩티드 일차 아미노산 서열의 소수 변경은 본원에 기재된 비변경된 대응 폴리펩티드와 비교될 때 실질적으로 동등한 활성을 갖는 펩티드를 발생시킬 수 있다. 이러한 변경은 부위-지정된 돌연변이유발에 의한 의도적 변경일 수 있거나 자발적 변경일 수 있다. 이들 변경에 의해 생성된 모든 폴리펩티드들이 본원에 포함된다. 따라서, MHC 클래스 II α1 폴리펩티드의 비한정적 예는 α1 폴리펩티드의 보존적 변이체(예컨대, 보존적 아미노산 치환, 예를 들면, 1개 이상의 보존적 아미노산 치환, 예를 들면, 1개 내지 10개의 보존적 치환, 2개 내지 5개의 보존적 치환, 4개 내지 9개의 보존적 치환, 예컨대, 1개, 2개, 5개 또는 10개의 보존적 치환)이다. 예시적 보존적 치환의 목록은 상기 제공되어 있다. 아미노산 서열, 예컨대, 서열번호 1 내지 49에 제시된 서열들 또는 이들의 단편들의 치환은 이 목록을 기초로 만들어질 수 있다.
α1 도메인을 코딩하는 핵산 분자는 표준 수단, 예컨대, 중합효소 연쇄 반응(PCR)에 의한 증폭에 의해 생성될 수 있다. α1 도메인을 코딩하는 개방 판독 프레임을 증폭하기 위한 프라이머를 디자인하기 위해 표준 방법이 이용될 수 있다. α1 도메인의 증폭에 적합한 라이브러리는 예를 들면, 해당 포유동물 종으로부터 제조된 cDNA 라이브러리를 포함하고, 이러한 라이브러리는 상업적으로 입수될 수 있거나 표준 방법에 의해 제조될 수 있다. 따라서, 예를 들면, α1 도메인 폴리펩티드를 코딩하는 구축물은 α1 도메인 코딩 영역의 5' 말단 및 3' 말단에 상응하는 프라이머를 사용하는 PCR에 의해 생성될 수 있다. PCR 증폭 후, 증폭된 핵산 분자는 표준 클로닝 벡터 내로 클로닝될 수 있다. 일부 실시양태에서, 예를 들면, (하기 논의된) 항원 결정기의 편리한 클로닝 또는 연결을 용이하게 하기 위해, α1 도메인의 증폭에 사용된 프라이머들 중 하나 또는 둘다는 α1 도메인 코딩 단편이 증폭 및 선택된 제한효소를 사용한 절단 후 또 다른 핵산과 용이하게 라이게이션될 수 있도록 적합한 제한효소 부위를 포함할 수 있다.
일부 실시양태에서, MHC 클래스 II α1 도메인 폴리펩티드는 원핵세포 또는 진핵세포에서 핵산 구축물로부터 발현된다. MHC 클래스 II α1 도메인 폴리펩티드를 발현하는 핵산 구축물은 조절 요소, 예컨대, 프로모터, 인핸서 및 3' 조절 영역도 포함할 수 있고, 이의 선택은 단백질이 발현되어야 하는 세포의 유형을 기초로 결정될 것이다. 상기 구축물은 선택된 유형의 세포에서 MHC 클래스 II α1 도메인 폴리펩티드를 발현하기에 적합한 벡터 내로 도입된다.
폴리펩티드의 발현 및 정제를 위한 다수의 원핵 시스템 및 진핵 시스템이 공지되어 있다. 예를 들면, 이종 폴리펩티드는 강한 조절된 프로모터 및 효율적인 리보좀 결합 부위를 폴리펩티드 코딩 구축물의 업스트림에 배치함으로써 원핵세포에서 생성될 수 있다. 적합한 프로모터 서열은 베타 락타마제 프로모터, 트립토판(trp) 프로모터, 파지 T7 프로모터 및 람다 PL 프로모터를 포함한다. 세균 또는 포유동물 세포에서 이종 단백질을 생성하는 방법 및 플라스미드 벡터는 문헌(Sambrook et al., Molecular Cloning: A Laboratory Manual, 2d ed., Cold Spring Harbor Laboratory Press, 1989); 문헌(Sambrook et al., Molecular Cloning: A Laboratory Manual, 3d ed., Cold Spring Harbor Press, 2001); 문헌(Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates, 1992 (and Supplements to 2000)); 및 문헌(Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, 4th ed., Wiley & Sons, 1999)에 기재되어 있다.
다량의 단백질의 발현에 적합한 원핵세포는 에스케리키아 콜라이(Escherichia coli) 및 바실러스 서브틸리스(Bacillus subtilis)를 포함한다. 종종, 고수준으로 발현된 단백질은 불용성 봉입체(inclusion bodies)로 발견되고, 이들 응집체로부터 단백질을 추출하는 방법은 예를 들면, 문헌(Sambrook et al., 2001, 제15장 참조)에 기재되어 있다. 원핵세포에서 MHC 클래스 II α1 도메인 폴리펩티드의 재조합 발현은 대안적으로 융합 단백질의 최적 발현 및 정제를 위해 디자인된 상업적 시스템을 이용함으로써 편리하게 수득될 수 있다. 이러한 융합 단백질은 전형적으로 정제를 용이하게 하는 태그를 포함한다. 이러한 시스템의 예로는 pMAL 단백질 융합 및 정제 시스템(뉴 잉글랜드 바이오랩스 인코포레이티드(New England Biolabs, Inc.), 미국 매사추세츠주 베벌리 소재); GST 유전자 융합 시스템(아머샴 파마샤 바이오텍 인코포레이티드(Amersham Pharmacia Biotech, Inc.), 미국 뉴저지주 피스카타웨이 소재); 및 pTrcHis 발현 벡터 시스템(인비트로겐(Invitrogen), 미국 캘리포니아주 칼스바드 소재)이 있다. 추가 시스템은 His6-태그(예를 들면, 로슈 어플라이드 사이언스(Roche Applied Science), 독일 만하임 소재) 또는 스트렙타비딘 결합 펩티드(예를 들면, 시그마-알드리치(Sigma-Aldrich), 미국 미조리주 세인트 루이스 소재)를 포함한다. 예를 들면, pMAL 발현 시스템은 말토스 결합 단백질을 발현된 단백질에 추가하는 벡터를 이용한다. 융합 단백질은 이. 콜라이에서 발현되고, 융합 단백질은 아밀로스 컬럼의 사용을 통해 미정제 세포 추출물로부터 정제된다. 필요한 경우, 말토스 결합 단백질 도메인은 적합한 단백질분해효소, 예컨대, 인자 Xa를 사용한 처리에 의해 융합 단백질로부터 절단될 수 있다. 그 다음, 말토스 결합 단편은 제2 아밀로스 컬럼 상에서의 통과에 의해 제제로부터 제거될 수 있다.
MHC 클래스 II α1 도메인 폴리펩티드는 인비트로겐(미국 캘리포니아주 칼스바드 소재)에 의해 제조된 피키아 파스토리스(Pichia pastoris), 초파리(Drosophila), 바큘로바이러스(Baculovirus) 및 신드비스(Sindbis) 발현 시스템을 비롯한 진핵 발현 시스템에서 발현될 수도 있다. 진핵세포, 예컨대, 중국 햄스터 난소(CHO), 원숭이 신장(COS), HeLa, 스포도프테라 프루기페르다(Spodoptera frugiperda) 및 사카로마이세스 세레비지애(Saccharomyces cerevisiae)도 MHC 클래스 II α1 도메인 폴리펩티드의 발현을 위해 사용될 수 있다. 이들 세포들에서 사용되기에 적합한 조절 영역은 포유동물 세포의 경우 바이러스 프로모터, 예컨대, CMV, 아데노바이러스 또는 SV40의 프로모터, 및 효모 세포의 경우 3-포스포글리세레이트 인산화효소(kinase) 또는 알코올 탈수소효소(dehydrogenase)에 대한 프로모터를 포함한다.
진핵세포 내로의 DNA의 전달은 관용적이다. 벡터는 예를 들면, 인산칼슘 또는 인산스트론튬을 사용한 침전, 전기천공, 지질감염, DEAE 덱스트란, 미세주입, 원형질체 융합 또는 미세발사체 총에 의해 순수한 DNA로서 수용자 세포 내로 도입된다(형질감염). 대안적으로, 핵산 분자는 바이러스 벡터를 사용한 감염에 의해 도입될 수 있다. 예를 들면, 레트로바이러스, 아데노바이러스 또는 헤르페스 바이러스를 사용하는 시스템이 개발되어 있다.
포유동물 세포에서 생성된 MHC 클래스 II α1 도메인 폴리펩티드는 상청액 내로의 단백질의 방출 후 추출될 수 있고, 항-MHC 항체를 사용하여 제조한 면역친화성 컬럼을 사용함으로써 정제될 수 있다. 대안적으로, MHC 폴리펩티드는 예를 들면, β-글로빈과의 키메라 단백질로서 발현될 수 있다. 그 후, β-글로빈에 대한 항체를 사용하여 상기 키메라 단백질을 정제한다. 그 다음, β-글로빈 유전자와 MHC 클래스 II α1 도메인 폴리펩티드를 코딩하는 핵산 서열 사이의 조작된 상응하는 단백질분해효소 절단 부위를 이용하여 번역 후 2개의 폴리펩티드 단편들을 서로 분리한다. β-글로빈 키메라 단백질을 발생시키는 데에 유용한 한 발현 벡터는 pSG5(스트라타진(Stratagene), 미국 캘리포니아주 라 졸라 소재)이다.
원핵세포에서의 MHC 폴리펩티드의 발현은 글리코실화되지 않은 폴리펩티드를 발생시킬 것이다. 천연 발생 글리코실화 표적 부위에서의 상기 폴리펩티드의 글리코실화는 적합한 진핵 발현 시스템, 예컨대, 포유동물 세포에서의 상기 폴리펩티드의 발현에 의해 달성될 수 있다. 다른 예에서, MHC 클래스 II α1 도메인은 원하는 번역 후 변경 부위, 예컨대, N-연결된 글리코실화, 인산화 또는 다른 변경을 위한 하나 이상의 부위를 포함하도록 (예를 들면, 부위-지정된 돌연변이유발의 이용을 통해) 변경될 수 있다.
발현된 단백질의 정제는 일반적으로 6 M 우레아를 함유하는 염기성 용액(전형적으로 약 pH 10)에서 수행된다. 그 다음, 정제된 단백질의 폴딩은 중성 pH의 완충된 용액(전형적으로 약 pH 7.4의 인산염 완충 식염수)에 대한 투석에 의해 달성된다.
IV. 항원 결정기
일부 실시양태에서, 개시된 방법은 공유 결합된 항원 결정기를 포함하는 MHC 클래스 II 분자(예컨대, MHC 클래스 II α1 도메인)를 사용한다. 당분야에서 잘 공지되어 있는 바와 같이(예를 들면, 미국 특허 제5,468,481호 참조), APC의 표면 상에서의 MHC 복합체 중의 항원의 제시는 일반적으로 전체 항원성 펩티드를 수반하지 않는다. 오히려, β1 도메인과 α1 도메인(MHC II의 경우) 또는 α1 도메인과 α2 도메인(MHC I의 경우) 사이의 홈에 위치한 펩티드는 전형적으로 전체 항원성 펩티드의 작은 단편이다. 문헌(Janeway & Travers, Immunobiology: The Immune System in Health and Disease, 1997)에서 논의된 바와 같이, MHC 클래스 I 분자의 펩티드 홈에 위치한 펩티드는 결합 주머니의 크기에 의해 제한되고, 전형적으로 8개 내지 15개 아미노산의 길이(예컨대, 8개, 9개, 10개, 11개, 12개, 13개, 14개 또는 15개 아미노산), 보다 전형적으로 8개 내지 10개 아미노산의 길이를 갖는다(그러나, 가능한 예외에 대해서는 문헌(Collins et al., Nature 371:626-629, 1994) 참조). 대조적으로, MHC 클래스 II 분자의 펩티드 홈에 위치한 펩티드는 이 방식으로 제한되지 않고 종종 더 큰 길이, 전형적으로 적어도 3개 내지 50개 아미노산의 길이(예컨대, 8개 내지 30개, 10개 내지 25개 또는 15개 내지 23개 아미노산의 길이)를 갖는다. 일부 예에서, MHC 클래스 II 분자의 펩티드 홈에 위치한 펩티드는 약 15개 내지 23개 아미노산의 길이를 갖는다. 일부 예에서, 개시된 조성물은 항원성 펩티드, 예를 들면, MHC 클래스 II α1 도메인에 공유 결합된 항원성 펩티드를 포함한다. 펩티드 단편은 표준 수단, 예컨대, 합성 펩티드 합성 기계의 이용에 의해 제조될 수 있다.
일부 예에서, 항원 결정기는 신경 또는 중추신경계 단백질, 예컨대, 수초 단백질(예를 들면, 수초 희소돌기아교세포 당단백질(MOG), 수초 염기성 단백질(MBP) 또는 단백지질 단백질(PLP))로부터의 펩티드를 포함한다. 다른 예에서, 항원 결정기는 망막 단백질, 예컨대, 광수용체간 레티노이드 결합 단백질(IRBP), 어레스틴(arrestin), 포스덕신(phosducin) 또는 레코버린(recoverin)으로부터의 펩티드이다. 추가 항원 결정기는 II형 콜라겐(콜라겐 II), 피브리노겐-α, 비멘틴(vimentin), α-에놀라제(enolase), 인간 연골 당단백질-39, α2 글리아딘(gliadin) 또는 인슐린으로부터의 펩티드를 포함한다. 일부 예에서, 항원 결정기는 번역 후 변경, 예컨대, 인산화, 글리코실화 또는 시트룰린화를 포함한다. 예시적 항원성 펩티드는 표 2에서 제공되어 있다. 당분야에서 통상의 기술을 가진 자는 특정 질환 또는 장애와 관련된 추가 항원 결정기를 확인할 수 있다.
일부 예에서, 항원성 펩티드는 발현된 펩티드에서 항원성 펩티드가 α1 도메인의 아미노 말단에 연결되도록 선택된 항원을 코딩하는 핵산 서열을 MHC 클래스 II α1 폴리펩티드를 코딩하는 구축물의 5' 말단에 작동가능하게 연결함으로써 MHC 클래스 II α1 폴리펩티드에 공유 결합된다. 다른 예에서, 항원성 펩티드는 발현된 펩티드에서 항원성 펩티드가 α1 도메인의 카르복시 말단에 연결되도록 선택된 항원을 코딩하는 핵산 서열을 MHC 클래스 II α1 폴리펩티드를 코딩하는 구축물의 3' 말단에 작동가능하게 연결함으로써 MHC 클래스 II α1 폴리펩티드에 공유 결합된다. 이러한 결과를 수득하는 한 편리한 방식은 항원을 코딩하는 서열을, MHC 클래스 II α1 도메인 코딩 영역을 증폭하는 데에 사용된 PCR 프라이머 내로 도입하는 것이다. 일부 예에서, 연결제 펩티드 서열을 코딩하는 서열은 항원성 펩티드와 MHC 클래스 II α1 폴리펩티드 사이에 포함된다. 그러나, 항원성 펩티드가 MHC 클래스 II α1 도메인 코딩 영역의 5' 말단(또는 3' 말단)에 정확히 라이게이션될 필요는 없다. 예를 들면, 항원성 코딩 영역은 MHC 클래스 II α1 도메인 코딩 서열의 5' 또는 3' 말단의 처음 수개 이내(전형적으로 처음 10개 이내)의 코돈 내에 삽입될 수 있다.
일부 실시양태에서, 항원성 펩티드를 MHC 클래스 II α1 도메인에 연결하기 위한 이 유전 시스템은 상이한 항원성 펩티드를 갖는 다수의 MHC 클래스 II α1 도메인들이 생성되어야 하는 경우 특히 유용하다. 기재된 시스템은 독특한 제한 부위가 (예를 들면, α1 도메인의 5' 또는 3' 말단에서) MHC 클래스 II α1 도메인 내에 포함되어 있는 발현 벡터의 구축을 허용한다. 이러한 구축물과 함께, 선택된 제한효소에 대한 부위에 의해 플랭킹된 각각의 항원 코딩 영역을 갖는 항원성 펩티드 코딩 서열들의 라이브러리를 제조한다. 그 다음, 단순히 (a) 항원 코딩 영역을 선택된 제한효소로 방출하고 (b) MHC 클래스 II α1 도메인 구축물을 동일한 제한효소로 절단하고 (c) 항원 코딩 영역을 MHC 클래스 II α1 도메인 구축물 내로 라이게이션시킴으로써 MHC 클래스 II α1 도메인 내로의 특정 항원의 도입을 수행한다. 이 방식으로, 다수의 MHC 클래스 II α1 도메인-펩티드 항원 구축물들을 짧은 시간 동안 제조하고 발현시킬 수 있다.
일부 예에서, 항원을 이황화 결합으로 MHC 클래스 II α1 도메인 폴리펩티드에 공유 결합한다. 일부 예에서, MHC 클래스 II α1 도메인 폴리펩티드 내의 천연 발생 시스테인 잔기(예컨대, MHC 클래스 II α1 도메인 내의 시스테인 잔기)를 이용하여 이황화 연결을 형성한다. 당분야에서 통상의 기술을 가진 자는 MHC 클래스 II α1 도메인 폴리펩티드에서 적합한 시스테인 잔기를 확인할 수 있다. 다른 예에서, MHC 클래스 II α1 도메인 폴리펩티드 내의 비천연 발생 시스테인 잔기, 예컨대, 돌연변이유발에 의해 MHC 클래스 II α1 도메인 폴리펩티드 내로 도입된 시스테인 잔기를 이용하여 이황화 연결을 형성한다. 추가 예에서, 펩티드 항원 내의 천연 발생 시스테인 잔기를 이용하여 이황화 연결을 형성한다. 추가 예에서, 펩티드 항원 내의 비천연 발생 시스테인 잔기, 예컨대, 돌연변이유발에 의해 펩티드 항원 내로 도입된 시스테인 잔기를 이용하여 이황화 연결을 형성한다.
V. 장애를 치료하거나 억제하는 방법
본원은 대상체에서 염증성 장애 및/또는 자가면역 장애를 포함하나 이들로 한정되지 않는 장애를 치료하거나 억제하는 방법을 개시한다. 개시된 방법은 MHC 클래스 II α1 도메인 폴리펩티드(예컨대, α1 도메인 폴리펩티드 또는 항원에 공유 결합된 α1 도메인 폴리펩티드)를 대상체에게 투여하는 단계를 포함한다.
일부 실시양태에서, 상기 방법은 치료될 장애를 갖는 대상체를 선택하는 단계, 및 유효량의 MHC 클래스 II α1 도메인 폴리펩티드 또는 MHC 클래스 II α1 도메인 폴리펩티드를 코딩하는 핵산을 상기 대상체에게 투여하는 단계를 포함한다. 일부 예에서, MHC 클래스 II α1 도메인은 항원 결정기 또는 펩티드(예컨대, 상기 논의된 항원 결정기 또는 펩티드)에 공유 결합된다.
일부 실시양태에서, 대상체는 전신 홍반 루푸스, 쇼그렌 증후군, 류마티스성 관절염, I형 진성 당뇨병, 베게너 육아종증, 염증성 장 질환, 다발근육염, 피부근육염, 다발성 내분비 기능상실, 슈미츠 증후군, 자가면역 포도막염, 셀리악병, 애디슨병, 부신염, 그레이브스병, 갑상선염, 하시모토 갑상선염, 자가면역 갑상선 질환, 악성 빈혈, 위 위축증, 만성 간염, 루포이드 간염, 죽상동맥경화증, 초로성 치매, 탈수초 질환, 다발성 경화증, 아급성 피부홍반루푸스, 부갑상선저하증, 드레슬러 증후군, 중증근육무력증, 자가면역 혈소판감소증, 특발성 혈소판감소성 자색반병, 용혈성 빈혈, 보통천포창, 천포창, 포진피부염, 원형탈모증, 유사천포창, 공피증, 진행성 전신 경화증, CREST 증후군(석회증, 레이노 현상, 식도 운동저하, 가락피부경화증 및 모세혈관확장증), 성인 발병 진성당뇨병(II형 당뇨병), 남성 및 여성 자가면역 불임, 강직 척추염, 궤양성 결장염, 크론병, 혼합된 결합 조직 질환, 결절다발동맥염, 전신 괴사 혈관염, 소아 발병 류마티스성 관절염, 사구체신염, 아토피성 피부염, 아토피성 비염, 굿파스처 증후군, 샤가스병, 사르코이드증, 류마티스성 발열, 천식, 재발성 유산, 항-인지질 증후군, 농부폐병, 다형홍반, 심장절개 후 증후군, 쿠싱 증후군, 자가면역 만성 활성 간염, 조류사육자폐병, 알레르기성 질환, 알레르기성 뇌척수염, 독성 표피 괴사용해, 탈모증, 알포트 증후군, 폐포염, 알레르기성 폐포염, 섬유화 폐포염, 간질 폐 질환, 결절홍반, 괴저화농피부증, 수혈 반응, 나병, 말라리아, 리슈만편모충증, 파동편모충증, 타카야수 동맥염, 류마티스성 다발근육통, 측두동맥염, 주혈흡충증, 거대세포 동맥염, 회충증, 아스페르길루스증, 샘터 증후군, 습진, 림프종모양육아종증, 베체트병, 카플란 증후군, 가와사키병, 뎅기, 뇌척수염, 심내막염, 심내막심근섬유증, 안구내염, 지속융기홍반, 건선, 태아적모구증, 호산구성 근막염, 설만 증후군, 펠티 증후군, 사상충증, 섬모체염, 만성 섬모체염, 이종만성 섬모체염, 푹스 섬모체염, IgA 신장병증, 헤노흐-쇤라인 자색반병, 사구체신염, 이식편 대 숙주 질환, 이식 거부, 인간 면역결핍 바이러스 감염, 에코바이러스 감염, 심근병증, 알쯔하이머병, 파보바이러스 감염, 풍진 바이러스 감염, 백신접종 후 증후군, 선천성 풍진 감염, 호지킨 및 비호지킨 림프종, 신장세포암종, 다발성 골수종, 이튼-램버트 증후군, 재발 다발연골염, 악성 흑색종, 한랭글로불린혈증, 발덴스트롬 마크로글로불린혈증, 엡스테인-바 바이러스 감염, 루불라바이러스 및 이반 증후군을 포함하나 이들로 한정되지 않는 염증성 및/또는 자가면역 질환 또는 장애를 갖는다. 추가 염증성 질환은 골관절염, 염증성 폐 질환(만성 폐쇄성 폐 질환), 치주 질환, 류마티스성 다발근육통, 죽상동맥경화증, 전신 경화증, 알레르기성 비염 및 피부 장애(피부근육염 및 건선을 포함함) 등을 포함한다.
다른 실시양태에서, 대상체는 망막 장애, 예컨대, 망막 변성, 예컨대, 색소성망막염, 추체간체이영양증, 레버 선천성 흑암시 또는 황반병증(예를 들면, 연령 관련 황반 변성, 스타가르트 유사 황반 변성, 난황상 황반 이영양증(베스트병), 말라티아 레벤티네스(Malattia Leventinese)(도인 벌집 망막 이영양증), 당뇨병성 황반병증, 잠재성 황반 이영양증 및 셀로판 황반병증)을 갖는다. 다른 예에서, 망막 장애는 망막병증, 예컨대, 자가면역 망막병증, 당뇨병성 망막병증 또는 혈관 망막병증을 포함한다. 추가 예에서, 망막 장애는 망막 탈착 또는 녹내장을 포함한다. 망막 장애는 진행성(예를 들면, 망막 변성 또는 녹내장) 또는 급성(예를 들면, 망막 탈착)일 수 있다. 추가 예에서, 대상체는 포도막염 또는 시신경염을 갖는 대상체이다. 다른 실시양태에서, 대상체는 뇌졸중(예컨대, 허혈성 뇌졸중 또는 출혈성 뇌졸중)을 갖는다. 추가 예에서, 대상체는 물질 중독을 갖는 대상체, 예를 들면, 물질 중독에 의해 유도된 인지 또는 신경정신 손상을 갖는 대상체이다.
일부 실시양태에서, 대상체는 MHC 클래스 II α1 도메인 또는 이의 부분(예컨대, CD74에 결합할 수 있거나 CD74의 발현 및/또는 활성을 감소시킬 수 있는 α1 도메인의 부분)을 포함하는 조성물을 유효량으로 투여받는다. 본원에 개시된 하나 이상의 MHC 클래스 II α1 도메인(예컨대, 2개, 3개, 4개, 5개 또는 그 이상의 MHC 클래스 II α1 도메인)을 포함하는 약학 조성물은 선택된 구체적인 투여 경로에 따라 적절한 고체 또는 액체 담체로 제제화될 수 있다. 이 개시내용에서 유용한 약학적으로 허용가능한 담체 및 부형제는 통상적인 담체 및 부형제이다. 예를 들면, 문헌(Remington: The Science and Practice of Pharmacy, The University of the Sciences in Philadelphia, Editor, Lippincott, Williams, & Wilkins, Philadelphia, PA, 21st Edition (2005))을 참조한다. 예를 들면, 비경구 제제는 통상적으로 약학적으로 및 생리학적으로 허용가능한 유체 비히클, 예컨대, 물, 생리식염수, 다른 균형 잡힌 염 용액, 수성 덱스트로스, 글리세롤 등인 주사가능한 유체를 포함한다. 고체 조성물(예를 들면, 산제, 환제, 정제 또는 캡슐제)의 경우, 통상적인 무독성 고체 담체는 예를 들면, 약학적 등급의 만니톨, 락토스, 전분 또는 스테아르산마그네슘을 포함할 수 있다. 생물학적 중성 담체 이외에, 투여될 약학 조성물은 소량의 무독성 보조 물질, 예컨대, 습윤화제, 유화제, 보존제, pH 완충제 등, 예를 들면, 아세트산나트륨 또는 소르비탄 모노라우레이트를 함유할 수 있다. 포함될 수 있는 부형제는 예를 들면, 다른 단백질, 예컨대, 인간 혈청 알부민 또는 혈장 제제이다.
약학 조성물의 투약 제형은 선택된 투여 방식에 의해 결정될 것이다. 예를 들면, 주사가능한 유체 이외에 국소, 흡입, 경구 및 좌약 제제가 사용될 수 있다. 국소 제제는 점안제, 연고, 분무제, 패치 등을 포함할 수 있다. 흡입 제제는 액체(예를 들면, 용액 또는 현탁액)일 수 있고 연무제, 분무제 등을 포함할 수 있다. 경구 제제는 액체(예를 들면, 시럽, 용액 또는 현탁액) 또는 고체(예를 들면, 산제, 환제, 정제 또는 캡슐제)일 수 있다. 좌약 제제도 고체, 겔 또는 현탁액 형태일 수 있다. 고체 조성물의 경우, 통상적인 무독성 고체 담체는 약학적 등급의 만니톨, 락토스, 전분 또는 스테아르산마그네슘을 포함할 수 있다. 이러한 투약 제형을 제조하는 실제 방법은 당업자에게 공지되어 있거나 자명할 것이다.
일부 예에서, 약학 조성물은 그의 의도된 목적을 달성하는 임의의 수단에 의해 투여될 수 있다. 선택된 MHC 클래스 II α1 도메인 폴리펩티드 또는 이의 부분(예컨대, 이러한 폴리펩티드를 코딩하는 핵산)의 투여를 위한 양 및 투약법은 주치의에 의해 결정될 것이다. 치료 적용을 위한 유효 용량은 치료될 병태의 성질 및 중증도, 선택된 구체적인 MHC 클래스 II α1 도메인 또는 이의 부분, 환자의 연령 및 상태, 및 다른 임상 인자에 따라 상이할 것이다. 전형적으로, 용량 범위는 약 0.1 ㎍/kg(체중) 내지 약 100 mg/kg(체중)일 것이다. 다른 적합한 범위는 약 100 ㎍/kg(체중) 내지 약 50 mg/kg(체중), 약 500 ㎍/kg(체중) 내지 약 10 mg/kg(체중), 또는 약 1 mg/kg(체중) 내지 약 5 mg/kg(체중)을 포함한다. 투약 일정은 다수의 임상 인자, 예컨대, 단백질에 대한 대상체의 민감성에 따라 매주 1회부터 매일까지 상이할 수 있다. 투약 일정의 예는 매월 1회, 2주마다 1회, 매주 1회, 매주 2회, 매주 3회 또는 매일 투여되는 약 1 mg/kg; 매주 1회, 매주 2회, 매주 3회 또는 매일 약 2.5 mg/kg의 용량; 매주 1회, 매주 2회, 매주 3회 또는 매일 약 5 mg/kg의 용량; 매주 1회, 매주 2회, 매주 3회 또는 매일 약 10 mg/kg의 용량; 또는 매주 1회, 매주 2회, 매주 3회 또는 매일 약 30 mg/kg의 용량이다.
하나 이상의 개시된 MHC 클래스 II α1 도메인 분자를 포함하는 약학 조성물은 정확한 용량의 개별 투여에 적합한 유닛 용량 제형으로 제제화될 수 있다. 한 특정 비한정적 예에서, 유닛 용량은 약 1 ng 내지 약 5 g의 MHC 클래스 II α1 도메인(예컨대, 약 10 ㎍ 내지 1 g 또는 약 10 mg 내지 100 mg)을 함유할 수 있다. 투여되는 활성 화합물(들)의 양은 치료되는 대상체, 고통의 중증도 및 투여 방식에 의존할 것이고 처방 임상의의 판단에 맡기는 것이 최선이다. 이들 한계 내에서, 투여되는 제제는 치료되는 대상체에서 원하는 효과를 달성하기에 효과적인 양으로 활성 성분(들)을 함유할 것이다.
본 개시내용의 화합물은 이들이 다양한 방식으로, 예컨대, 국소, 경구, 정맥내, 근육내, 복강내, 비내, 피내, 경막내, 피하, 안내, 흡입 또는 좌약을 통해 효과를 나타내는 조직을 갖는 인간 또는 다른 동물에게 투여될 수 있다. 일례에서, 상기 화합물은 피하로 대상체에게 투여된다. 또 다른 예에서, 상기 화합물은 정맥내로 대상체에게 투여된다. 구체적인 투여 방식 및 투약법은 해당 사례의 세부사항(예를 들면, 대상체, 질환, 관련된 질환 상태, 및 치료가 예방적 치료인지 여부)을 고려하여 주치 임상의에 의해 선택될 것이다. 치료는 수일 내지 수개월, 또는 심지어 수년의 기간에 걸쳐 화합물(들)의 매월 투약, 2개월마다 투약, 매주 투약, 매일 투약 또는 매일 다회 투약을 포함할 수 있다.
일부 실시양태에서, 개시된 MHC 클래스 II α1 도메인 분자는 국소 적용을 위한 불활성 매트릭스에 포함될 수 있다. 일부 예에서, 예를 들면, 유리체내 주사를 위해 제제를 눈 내로 주사할 수 있다. 불활성 매트릭스의 일례로서, 디팔미토일 포스파티딜콜린(DPPC), 예컨대, 난(egg) 포스파티딜콜린(PC)으로부터 리포좀을 제조할 수 있다. 당업자에게 공지된 표준 절차를 이용하여 양이온성 리포좀 및 음이온성 리포좀을 포함하는 리포좀을 제조할 수 있다. 하나 이상의 MHC 클래스 II α1 도메인을 포함하는 리포좀을 점적제의 형태 또는 수성 기제의 크림으로서 국소 적용할 수 있거나 안내로 주사할 수 있다. 국소 적용용 제제에서, 리포좀 캡슐이 눈 표면으로부터의 마모 및 인열로 인해 분해되기 때문에 MHC 클래스 II α1 도메인은 시간의 경과에 따라 서서히 방출된다. 안내 주사용 제제에서, 리포좀 캡슐은 세포내 소화로 인해 분해된다. 이들 제제들 둘다는 대상체가 시간의 경과에 따라 실질적으로 일정한 농도의 MHC 클래스 II α1 도메인에 노출되게 하는 서방출 약물 전달 시스템의 이점을 제공한다. 일례에서, MHC 클래스 II α1 도메인은 종래 기재된 바와 같이 유기 용매, 예컨대, DMSO 또는 알코올에 용해될 수 있고 폴리무수물, 폴리(글리콜)산, 폴리(젖)산 또는 폴리카프로락톤 중합체를 함유한다. MHC 클래스 II α1 도메인은 이식물의 크기, 형태 및 제제, 및 이식 절차의 유형에 따라 눈 내의 다양한 위치에서 이식될 수 있는 전달 시스템에 포함될 수 있다. 적합한 부위는 전안방, 전안부, 후안방, 후안부, 유리체강, 맥락막위공간, 결막하, 공막외, 각막내, 각막외 및 공막을 포함하나 이들로 한정되지 않는다.
일부 예에서, 개시된 MHC 클래스 II α1 도메인 폴리펩티드의 유효량(예를 들면, 치료 유효량)은 대상체에서 장애(예컨대, 염증성 및/또는 자가면역 장애)를 치료하거나 억제하는 데에 필요한 MHC 클래스 II α1 도메인 폴리펩티드 또는 항원(예컨대, 수초 단백질 항원, 망막 항원 또는 다른 항원, 예컨대, 상기 논의된 항원)을 포함하는 MHC 클래스 II α1 도메인 폴리펩티드의 양일 수 있다. 다른 예에서, 개시된 MHC 클래스 II α1 도메인 폴리펩티드의 치료 유효량은 망막 장애, 뇌졸중, 또는 물질 중독과 관련된 장애(예컨대, 물질 중독으로부터 발생된 인지 또는 신경정신 손상)를 치료하거나 억제하는 데에 필요한 MHC 클래스 II α1 도메인 폴리펩티드 또는 항원을 포함하는 MHC 클래스 II α1 도메인 폴리펩티드의 양일 수 있다.
본 개시내용은 하나 이상의 개시된 MHC 클래스 II α1 도메인과 장애의 치료에 유용한 하나 이상의 다른 물질의 조합도 포함한다. 일부 예에서, 본 개시내용의 화합물은 비스테로이드성 소염 약물, 코르티코스테로이드, 메토트렉세이트, 항-TNF 화합물, 마이코페놀레이트, 아미노살리실레이트, 항생제, 인터페론, 글라티라머(glatiramer) 아세테이트, 항체 요법(예컨대, 리툭시맙 또는 밀라투주맙), 또는 면역억제제 또는 면역조절제 화합물을 포함하나 이들로 한정되지 않는, 염증성 또는 자가면역 장애에 대한 유효량의 하나 이상의 요법과 함께 투여될 수 있다. 또 다른 예에서, 본 개시내용의 화합물은 유전자 요법, 비타민 또는 무기질 보충제(예컨대, 비타민 A, C 및/또는 E, 또는 아연 및/또는 구리), 항혈관신생 요법(예컨대, 라니비주맙 또는 베바시주맙), 광응고, 광역학 치료, 루테인(lutein) 또는 제아잔틴(zeaxanthin), 코르티코스테로이드 또는 면역억제제를 포함하나 이들로 한정되지 않는, 망막 장애에 대한 유효량의 하나 이상의 요법과 함께 투여될 수 있다. 특정 질환에 대한 적절한 병용요법은 당분야에서 통상의 기술을 가진 자에 의해 선택될 수 있다. 용어 "병용 투여" 또는 "공투여"는 활성제의 동시적 투여 및 순차적 투여 둘다를 지칭한다.
VI. 치료를 평가하거나 최적화하는 방법
본원은 대상체에서 질환 또는 장애(염증성 또는 자가면역 장애를 포함하나 이들로 한정되지 않음)의 치료 효능을 평가하거나 최적화하는 방법을 개시한다. 상기 방법은 CD74 발현 또는 활성 수준을 측정하는 단계, 및 CD74 발현 또는 활성 수준을 기초로 MHC 클래스 II α1 도메인(또는 이의 부분), MHC 클래스 II β1 도메인 또는 이들의 조합을 포함하는 폴리펩티드로의 치료의 효능을 측정하거나 이러한 치료를 조절하는(예를 들면, 용량을 증가시키거나 감소시키는) 단계를 포함한다. 일부 예에서, CD74 발현은 (예를 들면, 염증성 또는 자가면역 장애를 갖지 않는 대상체에 비해) 염증성 또는 자가면역 장애를 갖는 대상체에서 증가된다.
일부 실시양태에서, 상기 방법은 MHC 클래스 II α1 도메인(또는 이의 부분), MHC 클래스 II β1 도메인, 또는 이들의 조합물(예컨대, β1α1 폴리펩티드)을 포함하는 폴리펩티드로 치료받은 대상체에서 장애(예컨대, 상기 단락 V에서 논의된 장애)의 치료 효능을 측정하는 단계를 포함한다. 상기 방법은 대상체로부터 수득된 샘플에서 CD74 발현 또는 활성 수준을 측정하는 단계를 포함한다. CD74 발현 또는 활성 수준을 대조군과 비교하고 치료 효능을 측정한다. 일부 예에서, CD74 발현 또는 활성 수준이 대조군보다 더 적거나 대조군과 동등한 경우 치료는 효과적인 것으로 간주된다. 다른 예에서, CD74 발현 또는 활성 수준이 대조군보다 더 큰 경우 치료는 준최적으로 효과적이거나 효과적이지 않은 것으로 간주된다.
다른 실시양태에서, 상기 방법은 대상체에서 장애(예컨대, 상기 단락 V에서 논의된 장애)의 치료 효능을 최적화하는 단계를 포함한다. 상기 방법은 MHC 클래스 II α1 도메인(또는 이의 부분), MHC 클래스 II β1 도메인, 또는 이들의 조합물(예컨대, β1α1 폴리펩티드)을 포함하는 폴리펩티드를 장애를 갖는 대상체에게 투여하는 단계, 및 상기 대상체로부터 수득된 샘플에서 CD74 발현 또는 활성 수준을 측정하는 단계를 포함한다. CD74 발현 또는 활성 수준을 대조군과 비교하고 대상체에게 후속적으로 투여되어야 하는 폴리펩티드의 용량을 결정한다. 일부 예에서, CD74 발현 또는 활성 수준이 대조군보다 더 큰 경우 상기 폴리펩티드의 용량은 증가될 수 있다. 다른 예에서, CD74 발현 또는 활성 수준이 대조군보다 더 적거나 대조군과 동등한 경우 상기 폴리펩티드의 용량은 유지될 수 있거나 감소될 수 있다.
추가 실시양태에서, 상기 방법은 MHC 클래스 II α1 도메인(또는 이의 부분), MHC 클래스 II β1 도메인, 또는 이들의 조합물(예컨대, β1α1 폴리펩티드)을 포함하는 폴리펩티드를 장애를 갖는 대상체에게 투여하고 대상체로부터 수득된 샘플에서 CD74 발현 또는 활성 수준이 대조군보다 더 큰 경우 상기 폴리펩티드의 용량을 증가시키거나 상기 대상체로부터 수득된 샘플에서 CD74 발현 또는 활성 수준이 대조군보다 더 적거나 대조군과 동등한 경우 상기 폴리펩티드의 용량을 유지하거나 감소시킴으로써 대상체에서 장애를 치료하거나 억제하는 단계를 포함한다.
일부 예에서, 대조군보다 더 큰(예컨대, 대조군보다 통계적으로 유의하게 더 큰) CD74 발현 또는 활성의 수준은 대상체에게 후속적으로 투여되는 MHC 클래스 II 폴리펩티드(예컨대, MHC 클래스 II α1 도메인 폴리펩티드 또는 이의 부분, 또는 MHC 클래스 II β1α1 폴리펩티드)의 양 또는 용량을 증가시킬 필요성을 표시한다. 다른 예에서, 대조군보다 더 적은(예컨대, 대조군보다 통계적으로 유의하게 더 적은) CD74 발현 또는 활성의 수준은 대상체에게 후속적으로 투여되는 MHC 클래스 II 폴리펩티드(예컨대, MHC 클래스 II α1 도메인 폴리펩티드 또는 이의 부분, 또는 MHC 클래스 II β1α1 폴리펩티드)의 양 또는 용량을 유지하거나 감소시킬 필요성을 표시한다. 일부 예에서, 대조군과 거의 동등한 CD74 발현 또는 활성 수준을 생성하도록 MHC 클래스 II 폴리펩티드(예컨대, MHC 클래스 II α1 도메인 폴리펩티드 또는 MHC 클래스 II β1α1 폴리펩티드)의 용량을 조절한다. 당분야에서 통상의 기술을 가진 자는 측정된 CD74 발현 또는 활성, 질환 또는 장애, 대상체의 상태 및 다른 인자를 기초로 용량을 조절할 수 있다(예를 들면, 용량을 증가시킬 수 있거나 감소시킬 수 있다). 일부 예에서, 용량을 조절하고, 조절된 용량의 투여 후(예를 들면, 조절된 용량의 투여 후 약 1일, 2일, 3일, 4일, 5일, 6일, 7일, 10일, 14일 또는 그 이상의 날)에 CD74 발현 또는 활성 수준을 측정한다. CD74 발현 또는 활성의 수준을 기초로 용량을 유지할 수 있거나 다시 조절할 수 있다. 원하는 수준의 CD74 발현 또는 활성뿐만 아니라 질환 또는 장애의 원하는 억제(예를 들면, 질환 또는 장애의 증상의 완화)를 달성하기 위해 필요한 만큼 많은 횟수로 이것을 반복할 수 있다.
대조군은 CD74 발현 또는 활성 수준에 대한 임의의 적합한 대조군이다. 일부 실시양태에서, 대조군은 건강한 대상체 또는 건강한 대상체 집단으로부터 수득된 샘플이다. 다른 실시양태에서, 대조군은 과거 대조군, 또는 표준 기준 값 또는 값의 범위(예컨대, 과거에 시험된 대조군 샘플, 예컨대, 기준 또는 정상 값, 예컨대, 건강한 대상체에서의 CD74 발현 또는 활성의 수준을 나타내는 샘플의 군)이다. 일부 예에서, 대조군은 건강한 대상체로부터 수득된 샘플에서의 CD74 발현 수준, 예컨대, CD74 RNA(예를 들면, CD74 mRNA) 또는 CD74 단백질 수준 또는 양, 또는 건강한 대상체 집단에서의 CD74 RNA 또는 단백질 수준 또는 양에 대한 기준 값(예컨대, 건강한 대상체 집단에서의 평균 CD74 수준)이다. 다른 예에서, 대조군은 건강한 대상체로부터 수득된 샘플에서의 CD74 활성 수준, 예컨대, CD74 활성, 또는 건강한 대상체 집단에서의 CD74 활성에 대한 기준 값(예컨대, 건강한 대상체 집단에서의 평균 CD74 활성 수준)이다. 추가 예에서, 대조군은 비치료된 대상체, 또는 MHC 클래스 II β1α1 폴리펩티드 또는 MHC 클래스 II α1 도메인 폴리펩티드로의 치료를 시작하기 전 대상체(예컨대, 동일한 대상체, 또는 동일한 장애를 갖는 상이한 대상체)로부터 수득된 샘플에서의 CD74 발현 또는 활성 수준이다. 다른 예에서, 대조군은 건강한 대상체 집단(예를 들면, 연령, 성별, 장애 및 다른 임상 인자들 중 하나 이상에 대해 일치된 대상체 집단)에서의 CD74 발현 또는 활성 수준이다.
일부 실시양태에서, 샘플은 MHC α1 도메인, MHC 클래스 II β1 도메인 또는 이들의 조합을 포함하는 MHC 클래스 II 폴리펩티드를 투여받았거나 이러한 MHC 클래스 II 폴리펩티드가 투여되는 대상체로부터 수득된다. 일부 예에서, 상기 폴리펩티드는 MHC 클래스 II α1 도메인을 포함하고 MHC 클래스 II α2, β1 또는 β2 도메인(예를 들면, 본원에 개시된 MHC 클래스 II α1 도메인 폴리펩티드)을 포함하지 않는다. 다른 예에서, 상기 폴리펩티드는 MHC 클래스 II β1 도메인 및 MHC 클래스 II α1 도메인을 포함하고, 이때α1 도메인의 아미노 말단은 β1 도메인의 카르복시 말단에 (예를 들면, 직접적으로 또는 펩티드 링커에 의해) 공유 결합되어 있다(β1α1 폴리펩티드). MHC 클래스 II β1α1 폴리펩티드는 이미 기재되어 있다. 예를 들면, 미국 특허 제6,270,772호; 및 미국 특허출원 공보 제2005/0142142호, 제2009/0280135호, 제2011/0262479호, 제2011/0008382호 및 제2011/0217308호(이들 각각은 전체적으로 본원에 참고로 인용됨)를 참조한다. 일부 예에서, MHC 클래스 II α1 도메인 폴리펩티드 또는 MHC 클래스 II β1α1 폴리펩티드는 예를 들면, MHC 클래스 II 폴리펩티드에 공유 결합되어 있거나 비공유 결합되어 있는 항원 결정기도 포함한다.
CD74 발현 또는 활성 수준의 측정
CD74 발현 또는 활성 수준을 측정하는 방법은 당분야에서 통상의 기술을 가진 자에게 공지되어 있다. 일부 예에서, CD74 발현의 측정은 CD74 핵산 또는 단백질의 발현(예컨대, 존재, 부재 또는 양)의 측정을 포함한다. 일부 예에서, 상기 방법은 CD74의 1개, 2개, 3개 또는 그 이상의 동형체(isoforms)(예컨대, 대안적으로 스플라이싱된 동형체)의 존재 또는 양을 측정하는 단계를 포함한다. 다른 예에서, CD74 활성의 측정은 CD74 단백질 활성, 예를 들면, CD74 활성에 의해 매개되거나 변경된 세포내 또는 분자 사건의 측정을 포함한다.
CD74 발현 또는 활성 수준을 측정하기에 적합한 샘플은 대상체로부터 수득된, 핵산(예를 들면, DNA 또는 RNA(mRNA를 포함함), 단백질 또는 이들의 조합을 함유하는 생물학적 표본을 포함한다. 예로는 말초 혈액, 미세 바늘 흡입물, 소변, 타액, 조직 생검, 수술 표본 및 부검 물질이 있으나 이들로 한정되지 않는다. 일례에서, 샘플은 혈액 샘플(예컨대, 혈액; 혈액의 유도체 및 분획, 예컨대, 혈청), 또는 단리된 또는 정제된 세포 집단(예를 들면, 부분적으로 단리된 또는 부분적으로 정제된 세포 집단을 포함하는 T 세포, B 세포, PBMC, 림프구 등)을 포함한다. 일부 예에서, 샘플은 단핵세포, B 세포, CD11b+ 세포, CD34+ 세포, CD4+ 세포, CD19+ 세포, CD74+ 세포, 또는 이들 중 둘 이상의 조합을 포함하거나, 이러한 세포 또는 조합로 본질적으로 구성되거나, 이러한 세포 또는 조합으로 구성된다.
CD74 발현
CD74를 코딩하는 RNA(예컨대, mRNA)를 검출함으로써 유전자 발현을 평가할 수 있다. 상업적으로 입수될 수 있는 키트를 포함하는, 당업자에게 잘 공지된 방법을 이용하여 대상체로부터 수득된 샘플(예컨대, 혈액 샘플)로부터 RNA를 단리할 수 있다. 일반적인 RNA 추출 방법은 당분야에서 잘 공지되어 있고, 문헌(Ausubel et al., Current Protocols of Molecular Biology, John Wiley and Sons (1997))을 포함하는 표준 분자생물학 교재에 개시되어 있다. 파라핀 포매된 조직으로부터 RNA를 추출하는 방법은 예를 들면, 문헌(Rupp and Locker, Biotechniques 6:56-60 (1988)) 및 문헌(De Andres et al., Biotechniques 18:42-44 (1995))에 개시되어 있다.
유전자 발현을 측정하는 방법은 폴리뉴클레오티드의 혼성화 분석에 기초한 방법, 폴리뉴클레오티드의 서열분석에 기초한 방법, 및 단백질체학에 기초한 방법을 포함한다. 당분야에서 통상의 기술을 가진 자는 CD74 유전자 발현을 측정하는 방법에서 사용되기에 적합한 프라이머 및/또는 프로브를 수득할 수 있다. 일부 예에서, 노던 블롯팅 또는 제자리 혼성화(Parker & Barnes, Methods in Molecular Biology 106:247-283, 1999); RNAse 보호 분석(Hod, Biotechniques 13:852-4, 1992); 및 PCR에 기초한 방법, 예컨대, 역전사 중합효소 연쇄 반응(RT-PCR)(Weis et al., Trends in Genetics 8:263-4, 1992), 정량 RT-PCR 또는 TaqMan RT-PCR을 이용하여 샘플에서 mRNA 발현을 정량한다. 대안적으로, DNA 이중체, RNA 이중체 및 DNA-RNA 하이브리드 이중체 또는 DNA-단백질 이중체를 포함하는 특정 이중체를 인식할 수 있는 항체를 사용할 수 있다. 서열분석에 기초한 대표적인 유전자 발현 분석 방법은 일련의 유전자 발현 분석(SAGE), 및 초병렬 시그너처 서열분석(MPSS)에 의한 유전자 발현 분석을 포함한다. 일례에서, RT-PCR을 이용하여 상이한 샘플들, 예를 들면, 대상체 및 대조군으로부터 수득된 샘플들에서 mRNA 수준을 비교함으로써 CD74 발현을 측정할 수 있다.
샘플-대-샘플 변이의 오류 및 효과를 최소화하기 위해, 내부 표준물을 사용하여 RT-PCR을 수행할 수 있다. 이상적인 내부 표준물은 상이한 조직들 중에서 일정한 수준으로 발현되고, 실험적 처리에 의해 영향을 받지 않는다. 유전자 발현의 패턴을 표준화하는 데에 통상적으로 사용되는 RNA는 하우스킵핑(housekeeping) 유전자 GAPDH, β-액틴 및 18S 리보좀 RNA에 대한 mRNA이다.
제자리 혼성화(ISH)는 관심있는 유전자들의 발현을 검출하고 비교하는 또 다른 방법이다. ISH는 핵산 혼성화의 기술을 단일 세포 수준에 적용하고 외삽하고, 세포화학, 면역세포화학 및 면역조직화학의 분야와 함께 세포 마커의 형태 유지 및 확인을 가능하게 하고 서열을 집단, 예컨대, 조직 및 혈액 샘플 내의 특정 세포에 국한시킬 수 있다. ISH는 상보적인 핵산을 사용하여 하나 이상의 특정 핵산 서열을 조직의 부분 또는 절편(제자리), 또는 조직이 충분히 작은 경우 전체 조직(전체 마운트 ISH)에 국한시키는 혼성화의 한 유형이다. RNA ISH를 이용하여 조직에서 발현 패턴, 예컨대, 암 생존 인자 관련 유전자의 발현을 분석할 수 있다.
검출 방법의 일부 실시양태에서, 하나 이상의 "하우스킵핑" 유전자 또는 "내부 대조군"의 발현도 평가할 수 있다. 이들 용어들은 그의 존재가 CD74 유전자(또는 단백질) 수준의 평가를 가능하게 하는 임의의 항시적으로 또는 전체적으로 발현되는 유전자(또는 하기 논의된 바와 같은 단백질)를 포함한다. 이러한 평가는 유전자 전사의 전체 항시적 수준의 측정 및 RNA(또는 단백질) 회수에서의 변이에 대한 조절을 포함한다.
일부 예에서, CD74 단백질의 발현을 분석한다. CD74에 대한 특이적 항체는 당분야에서 잘 공지된 다수의 면역분석 방법들, 예컨대, 문헌(Harlow and Lane, Antibodies, A Laboratory Manual, CSHL, New York, 1988)에서 제시된 방법들 중 하나에 의한 단백질 발현의 검출 및 정량을 위해 사용될 수 있다. 이러한 항체를 구축하는 방법은 당분야에서 공지되어 있다. 추가로, 이러한 항체는 상업적으로 입수될 수 있다. 상업적으로 입수될 수 있는 예시적 항체는 산타 크루즈 바이오테크놀로지(Santa Cruz Biotechnology)(미국 캘리포니아주 산타 크루즈 소재)로부터 입수될 수 있는 카탈로그 번호 sc-70781, sc-166047, sc-81626 및 sc-65272; 애브캄(Abcam)(미국 매사추세츠주 캠브리지 소재)으로부터 입수될 수 있는 카탈로그 번호 b9514, ab22603, ab64772 및 ab108402; 및 알앤드디 시스템스(R&D Systems)(미국 미네소타주 미네아폴리스 소재)로부터 입수될 수 있는 카탈로그 번호 MAB35901 및 AF3590을 포함한다.
임의의 표준 면역분석 포맷(예컨대, ELISA, 웨스턴 블롯, 유세포측정 또는 RIA 분석)을 이용하여 단백질 수준을 측정할 수 있다. 따라서, 일례에서, 샘플에서 CD74 단백질의 폴리펩티드 수준을 이들 방법을 이용하여 용이하게 평가할 수 있다. CD74 검출 및 정량을 위해 면역조직화학적 기법도 이용할 수 있다. 이러한 기법에 대한 일반적인 지침은 문헌(Bancroft and Stevens, Theory and Practice of Histological Techniques, Churchill Livingstone, 1982) 및 문헌(Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, 1998)에서 발견될 수 있다.
CD74 활성
CD74(불변 쇄, Ii)는 2개의 고도로 비조직화된 영역에 의해 플랭킹된 삼량체화 도메인을 함유하는 II형 경막 당단백질이다(Jasanoff et al., Immunity 10:761-768, 1999). CD74의 한 역할은 새로 합성된 MHC 클래스 II를 세포내이입 경로를 통해 APC의 세포 표면까지 동반하는 것이다(Cresswell, Cell 84:505-507, 1996). CD44, CXCR2 및 CXCR4와 함께 CD74는 대식세포 이동 억제 인자(MIF)에 대한 수용체이기도 하다(Leng et al., J. Exp. Med. 197:1467-1479, 2003; Naujokas et al., Cell 74:257-268, 1993). CD74를 통한 MIF 신호 전달도입은 세포외 신호-조절된 인산화효소(ERK) 1/2의 활성화, NF-κB 활성화, Bcl-2 발현 및 IL-8 분비를 포함한다(예를 들면, 문헌(Leng et al., J. Exp. Med. 197:1467-1476, 2003); 문헌(Starlets et al., Blood 107:4807-4816, 2006); 문헌(Binsky et al., Proc. Natl. Acad. Sci. USA 104:13408-13413, 2007); 문헌(Gore et al., J. Biol. Chem. 283:2784-2792, 2008)). MIF-활성화된 CD74를 통한 신호전달의 활성화의 한 결과는 세포 증식 또는 생존의 증가, 또는 아폽토시스의 감소이다.
당분야에서 통상의 기술을 가진 자는 CD74 활성의 수준을 확인하고 측정할 수 있다. 일부 예에서, 예를 들면, CD74의 하나 이상의 다운스트림 이펙터의 활성 또는 CD74에 의해 조절된 하나 이상의 세포 표현형(예컨대, 세포 증식, 생존 또는 이동)을 측정함으로써 CD74 활성을 간접적으로 측정한다. 다른 예에서, CD74 활성을 예를 들면, 하기 실시예 3에 기재된 바와 같이 MIF 결합, 또는 MHC 클래스 II 폴리펩티드, 예컨대, MHC 클래스 II β1α1 폴리펩티드 또는 MHC 클래스 II α1 폴리펩티드 결합으로 측정한다.
일부 실시양태에서, 대상체(예컨대, 염증성 및/또는 자가면역 질환을 갖는 대상체 또는 대조군)로부터 수득된 샘플, 예를 들면, 단핵세포, B 세포, CD11b+ 세포, CD34+ 세포, CD4+ 세포, CD19+ 세포, CD74+ 세포, 또는 이들 중 둘 이상의 조합을 포함하는 샘플에서 CD74 활성을 측정한다. 일부 예에서, 샘플을 MIF와 접촉시키고 CD74의 다운스트림 이펙터의 활성, 예컨대, ERK1/2 활성(예를 들면, 인산화), NF-κB 활성화(예를 들면, pp65/RelA에 의해 매개된 전사), Bcl-2 발현, ICAM-1 발현 및/또는 IL-8 분비를 측정함으로써 CD74 활성을 측정한다. 일부 예에서, 샘플과 MIF의 접촉은 CD74의 하나 이상의 다운스트림 이펙터의 활성을 증가시킨다. 이 CD74 활성 수준을 MIF와 접촉된 대조군, 예컨대, 건강한 대상체 또는 장애를 갖는 비치료된 대상체로부터 수득된 샘플과 비교할 수 있다. 이들 활성을 측정하는 방법(예를 들면, 웨스턴 블롯팅, 유세포측정, ELISA, 레포터 분석 또는 PCR에 기초한 방법의 이용)은 당분야에서 통상의 기술을 가진 자에게 잘 공지되어 있다. 예시적 분석은 문헌(Leng et al., J. Exp. Med. 197:1467-1476, 2003); 문헌(Starlets et al., Blood 107:4807-4816, 2006); 문헌(Binsky et al., Proc. Natl. Acad. Sci. USA 104:13408-13413, 2007); 및 문헌(Gore et al., J. Biol. Chem. 283:2784-2792, 2008)(이들 각각은 전체적으로 본원에 참고로 인용됨)에 제시되어 있다.
다른 예에서, 샘플을 MIF와 접촉시키고 표현형을 관찰하기에 충분한 시간 후 세포 표현형, 예컨대, 세포 증식, 세포 이동 및/또는 아폽토시스를 측정함으로써 CD74 활성을 측정한다. 세포 증식을 측정하는 방법, 예를 들면, DNA 표지(예를 들면, 5-브로모-2-데옥시유리딘(BrdU), [3H]티미딘 또는 형광 표지)의 도입, MTT 또는 XTT 분석, 또는 세포 카운팅은 당분야에서 잘 공지되어 있다. 아폽토시스를 측정하는 방법은 당분야에서 잘 공지되어 있다. 예를 들면, 아폽토시스성 세포 사멸은 세포 수축, 막 수포형성, 및 세포 단편화에서 절정에 달하는 염색질 응축을 특징으로 할 수 있다. 아폽토시스를 겪는 세포는 뉴클레오좀간 DNA 절단의 특징적인 패턴도 나타낸다. 세포 이동을 측정하는 방법, 예컨대, 보이덴(Boyden) 챔버 분석은 당분야에서 통상의 기술을 가진 자에게 잘 공지되어 있다. CD74 활성 수준을 MIF와 접촉된 대조군, 예컨대, 건강한 대상체 또는 장애를 갖는 비치료된 대상체로부터 수득된 샘플과 비교할 수 있다. 예시적 분석은 문헌(Leng et al., J. Exp. Med. 197:1467-1476, 2003); 문헌(Starlets et al., Blood 107:4807-4816, 2006); 문헌(Binsky et al., Proc. Natl. Acad. Sci. USA 104:13408-13413, 2007); 및 문헌(Gore et al., J. Biol. Chem. 283:2784-2792, 2008)(이들 각각은 전체적으로 본원에 참고로 인용됨)에 제시되어 있다.
하기 실시예는 일부 특정 특징 및/또는 실시양태를 예증하기 위해 제공된다. 이들 실시예는 본 개시내용을 기재된 특정 특징 또는 실시양태로 한정하기 위한 것으로 해석되어서는 안 된다.
실시예
실시예 1
재료 및 방법
마우스: DR*1501-Tg, DR*1502-Tg 및 MBP-TCR/DR2-Tg 마우스를 포틀랜드 재향군인 의료 센터의 수의학과에서 사내 사육하여 8주령 내지 12주령에서 사용하였다. 모든 절차를 제도적 지침에 따라 승인받고 수행하였다.
DR2-Tg 및 MBP-TCR/DR2-Tg 마우스에서 EAE의 유도: HLA-DR2 마우스를 HLA 형질전이유전자의 발현에 대해 FACS로 스크리닝하였다(McMahan et al., J Biol Chem 278:30861-30970, 2003). 200 ㎍의 면역원성 펩티드, 및 400 ㎍ 열-사멸된 마이코박테리움 튜버큘로시스(Mycobacterium tuberculosis) H37RA(딥코(Difco), 미국 미시간주 디트로이트 소재)를 함유하는 완전 프로인트 항원보강제로 구성된 0.2 ㎖의 유화액을 사용하여 8주령 내지 12주령의 HLA-DR2 양성 수컷 및 암컷 마우스를 옆구리 상의 4개 부위에서 피하 면역화시켰다(Vandenbark et al, J Immunol 171:127-133, 2003; Buenafe et al, Immunology 130:114-124, 2010). 추가로, 면역화 후 0일째 날 및 2일째 날에 리스트 바이올로지칼 레이보레이토리스(List Biological Laboratories)(미국 캘리포니아주 캠벨 소재)로부터 입수된 백일해 독소(Ptx)(마우스 당 각각 75 ng 및 200 ng)를 마우스에게 제공하였다. 면역화된 마우스를 합산된 뒷다리 및 앞다리 마비 점수의 6점 크기로 EAE의 임상 징후에 대해 매일 평가하였다. 뒷다리의 경우 점수: 0 = 정상; 0.5 = 처진 꼬리 또는 경미한 뒷다리 약화(예를 들면, 마우스가 꼬리의 기저부의 90o 회전 후 역위에 저항할 수 없음); 1 = 처진 꼬리 및 경미한 뒷다리 약화; 2 = 처진 꼬리 및 중간 정도의 뒷다리 약화(예를 들면, 마우스가 역위 후 신속히 그 자신을 바로 세울 능력이 없음); 3 = 처진 꼬리 및 약간 심각한 뒷다리 약화(예를 들면, 마우스가 역위 후 그 자신을 바로 세울 능력이 없고 걷는 동안 뒤쪽 4분의 1이 어느 한쪽으로 명확히 기울어짐); 4 = 처진 꼬리 및 심각한 뒷다리 약화(뒷발을 움직일 수 있으나 전방을 향하기보다는 더 빈번히 끌고 감); 5 = 처진 꼬리 및 대마비(뒷다리의 움직임이 없음). 앞다리 마비 점수는 정상적인 움직임에서의 명확한 제한이 있는 경우 0.5 또는 완전한 앞다리 마비의 경우 1이다. 합산된 점수는 뒷다리 점수와 앞다리 점수의 합계이다.
드물게는, 심각한 EAE를 갖는 HLA-DR2 마우스의 사망이 있고, 이 경우 실험의 나머지 기간 동안 마우스에게 6의 점수를 부여하였다. RTL 또는 비히클 치료의 시작에 따라 분류된 마우스에 대한 평균 EAE 점수 및 표준 편차를 매일 계산하여 전체 실험 동안 합산하였다(누적 질환 지수, 즉 CDI는 총 질환 부하를 나타냄). 매일 평균 점수를 비히클 치료군과 pDR2 치료군 사이의 비모수 비교에 대한 양측 만 휘트니(Mann Whitney) U 검정으로 분석하였다. 평균 CDI를 터키 사후 검정과 함께 일방 ANOVA, 및 던(Dunn) 다중 비교 사후 검정과 함께 비모수 일방 크루스칼-왈리스(Kruskal-Wallis) ANOVA로 분석하여 모든 군들 사이의 유의성을 확인하였다.
DR2-Tg 마우스에서 EAE의 pMHC 치료: HLA-DR2-Tg 및 MBP-TCR/DR2-Tg 마우스에서 유도된 EAE를 치료하기 위해 pDR2 구축물(표 3)을 표시된 용량으로 5일 동안 매일 피하 주사하였고, 임상 징후를 전술된 바와 같이 점수화하였다. 중화 실험을 위해, DR*1501-Tg 마우스를 비히클(5 중량/부피%의 D-글루코스를 함유하는 20 mM 트리스-HCl, pH 8.0), 20 ㎍ RTL342M(pDR2/mMOG-35-55), 또는 1:1(40 ㎍) 또는 1:2(80 ㎍) 몰비에서 Fab1B11(2-도메인 DR2 구축물에 대해 특이적임) 또는 FabD2(pDR4/GAD-555-567 구축물에 대해 특이적임)와 함께 예비항온처리된 20 ㎍ RTL342M으로 피하 치료하였다. 비히클 중의 Fab1B11 단독은 음성 대조군으로서 사용되었다. 방법은 문헌(Dahan et al., Eur. J. Immunol. 41:1465-1479, 2011)에 이미 기재되어 있다.
유세포측정: 4색(플루오레세인 이소티오시아네이트(FITC), 파이코에리쓰린(PE), 요오드화프로피듐, 알로파이코시아닌) 유세포측정을 이용하여 항원미접촉 DR2 PBMC 하위유형의 분석을 수행하였다. 1X PBS/EDTA 내로의 심장 실혈을 통해 항원미접촉 DR2 마우스로부터 혈액을 채취하였다. 혈액을 1X PBS로 세척한 후, 적혈구 세포를 1X RBC 용해 완충제(이바이오사이언스 인코포레이티드(eBioscience, Inc.), 미국 캘리포니아주 샌 디에고 소재)로 용해시킨 후, RPMI로 2회 세척하였다. 백만 개의 세포를 37℃에서 1시간 동안 1 ㎍의 비표지된 pDR2, 1 ㎍의 pDR2 FITC 또는 l ㎍의 Fab 중화된 pDR2 FITC와 함께 RPMI에서 항온처리하였다. pDR2 결합의 Fab 중화를 평가하는 샘플의 경우, pDR2를 세포와 함께 항온처리하기 전에 실온에서 2시간 동안 1:1 몰비의 Fab1B11 또는 FabD2와 함께 항온처리하였다. pDR2 항온처리 직후, 4℃에서 CD3 PE(이바이오사이언스 인코포레이티드, 미국 캘리포니아주 샌 디에고 소재), CD74 PE(산타 크루즈 바이오테크놀로지 인코포레이티드(미국 캘리포니아주 산타 크루즈 소재), 또는 CD11b PE, CD11b 알로파이코시아닌, CD11c 알로파이코시아닌, CD19 알로파이코시아닌(비디 파밍겐(BD Pharmingen), 미국 캘리포니아주 샌 디에고 소재)과 함께 30분 동안 항온처리하였다. 1X PBS/0.5% BSA 염색 배지에서 2회 추가 세척하여 항체 및 pDR2를 철저히 제거하였다. 세포를 요오드화프로피듐을 함유하는 염색 배지에 재현탁하고 FCS EXPRESS™ 소프트웨어를 이용하여 FACSCALIBUR™(비디 바이오사이언시스(BD Biosciences), 미국 캘리포니아주 산 호세 소재)로 즉시 분석하였다. 데이터는 100,000개의 게이팅된 생존 단핵세포 및 림프구(생체내 분석), 또는 10,000개의 게이팅된 생존 단핵세포(시험관내 분석)를 나타낸다.
pDR2 결합의 현미경 관찰 및 영상화: CD11b+ 세포를 마우스 단핵세포 농축 키트(스템 셀 테크놀로지스(Stem Cell Technologies), 캐나다 밴쿠버 소재)로 DR*1501/GFP-Tg 마우스로부터 음성적으로 단리하고 40분 동안 RPMI에서 알렉사 플루오르® 546으로 태깅된 10 mg/㎖ RTL342M으로 처리하였다. 조절된 환경 챔버 내에 봉입된 전매특허 XYZ 단을 갖는 올림푸스 IX71 도립 현미경을 이용하여 고해상 광시야 코어 DV 현미경 관찰 시스템(어플라이드 프리시전(Applied Precision), 미국 워싱톤주 이사쿠아 소재) 상에서 영상을 획득하였다: 시차 간섭 명암대비(DIC) 투과된 광 및 형광을 위한 고체 상태 모듈. 쿨스냅(Coolsnap) ES2 HQ 카메라를 2색 FITC 및 TRITC에서 60배(개구수, 1.42) 플랜 아포(Plan Apo) N 대물렌즈와 함께 사용하여 광학 축으로서 영상을 획득하였다. 화소 크기는 0.10704 ㎛이었다. 10회 반복의 반복적 알고리즘을 이용하여 영상을 적절한 OTF(광학 전달 함수)로 데콘볼루션(deconvolution)시켰다. 히스토그램을 가장 강한 양성 영상에 대해 최적화하고 24 비트 병합 TIFF로서 영상을 저장하기 전에 일관성을 위해 모든 다른 영상들에 적용하였다. 데이터를 가시화하고 이마리스(Imaris)®(비트플레인(Bitplane)) 및 MATLAB®(매쓰워크스(Mathworks), 미국 매사추세츠주 나틱 소재)를 이용하여 분석하였다.
단백질 정제 및 표지부착: 에스케리키아 콜라이에서 생성된 봉입체로부터의 pDR2 단백질의 클로닝, 발현 및 정제는 문헌(Chang et al., J. Biol. Chem. 276:24170-24176, 2001)에 기재된 바와 같이 수행하였다.
세포 표면 단백질의 바이오티닐화 및 세포 용해: DR*1501-Tg 또는 MHC 클래스 II-넉아웃 마우스로부터 비장세포를 RPMI에 수집하고 실험에서 사용하기 전에 얼음 상에서 보관하였다. 세포를 pH 8.0의 냉각된 PBS로 광범위하게 세척하고 얼음 상에서 15분 동안 EZ-링크(Link)® 설포-NHS-LC-바이오틴(피어스 바이오테크놀로지(Pierce Biotechnology), 카탈로그 번호 21335)으로 바이오티닐화하여 과다표지부착을 방해하였다. 바이오티닐화된 세포 현탁액을 pH 7.4의 TEN(50 mM 트리스, 2 mM EDTA, 150 mM NaCl) 완충제로 5배 희석하여 반응을 켄칭하였다. TEN 완충제를 사용하여 후속 세척을 수행함으로써 바이오티닐화 시약을 제거하였고, 펠렛을 용해시킬 때까지 동결된 상태로 보관하였다. 세포 펠렛을 얼음 상에서 해동시켰고 1 μM PMSF(시그마-알드리치(Sigma-Aldrich), 미국 미조리주 세인트 루이스 소재) 이외에 단백질분해효소 억제제(중단 단백질분해효소 억제제 칵테일, 피어스 바이오테크놀로지)의 존재 하에서 30분 내지 60분 동안 1%의 트리톤 X-100(TEN-TX100) 또는 1%의 CHAPS(TEN-CHAPS)를 함유하는 TEN 완충제에서 용해를 수행하였다. 용해 후, 세포를 4℃에서 15분 동안 14,000 RPM에서 침강시켰고, 추가 분석을 위해 상청액을 수집하였다.
직접적 및 경쟁적 결합 분석: (식균작용 기작을 통한 내재화를 최소화하기 위해) DR*1501-Tg 마우스로부터 수득된 2백만 개의 비장세포를 얼음에서 1시간 동안 RPMI에서 증가하는 농도의 알렉사 플루오르® 488-표지된 pDR2/hMOG-35-55(RTL1000)와 함께 항온처리하였다. 그 다음, 상기 세포를 100 ㎕의 6 M 우레아에서 용해시켜 후속 분석을 위해 결합된 표지된 리간드를 해리하고 가용화시켰다. 용해물을 원심분리하여 불용성 물질(핵, 세포소기관)을 제거한 후 상청액을 10% 내지 20% 폴리아크릴아미드 겔에서 SDS-PAGE 전기영동으로 분리하였다. 그 다음, 상기 겔을 표지된 pDR2에 대해 스캐닝하였다. 콴티 원® 소프트웨어(바이오라드)를 이용하여 밀도측정으로 밴드 형광 강도를 정량하고 표지된 RTL1000 농도에 대하여 작도하였다. 그래프패드 프리즘® 소프트웨어를 이용하여 데이터를 분석하고 1 또는 2 결합 부위 수학적 모델에 피팅하였다.
증가하는 농도의 비표지된 pDR2 구축물(0 내지 8 μM)의 존재 하에서 2백만 개의 비장세포 및 일정한 농도의 표지된 RTL1000(280 nM)을 사용하여 경쟁적 결합을 수행하였다. 그 후, 세포를 전체 세포에서의 포화 분석에 대해 전술한 바와 같이 세척하고 용해시키고 분석하였다. 결과는 특이적 결합의 절반에 대해 경쟁하는 데에 요구되는 경쟁자의 농도인 EC50으로서 제시된다.
CD74 및 MHC 클래스 II 분자에 대한 면역침전, 및 직접적 및 경쟁적 결합 분석: 면역침전 실험을 위해, 항체 TU39(비디 파밍겐)를 빙냉 TEN-TX100 또는 TEN-CHAPS에서 2시간 동안 비드-접합된 단백질 A에 미리 결합시킨 후, RTL을 이들 복합체에 결합시켰다. 용해물(비드-접합된 단백질 A로 미리 예비정화시킴)을 튜브에 첨가하고 약하게 궤도 진탕하면서 4℃에서 밤새 결합을 수행하였다. 샘플을 TEN 완충제 및 적절한 세제로 광범위하게 세척하였다. CD74 면역침전을 위해, ln-1 mAb를 전술한 바와 같이 비드-접합된 단백질 L에 흡착시키고 예비정화된 용해물을 이 혼합물에 첨가하였다. 필요한 경우, 전기영동 샘플 완충제에서 면역 복합체를 끓임으로써 결합된 물질을 용출하고 SDS-PAGE 및 웨스턴 블롯으로 분석하였다.
RTL 구축물의 직접적 결합을 위해, 단백질-L/ln-1/CD74 복합체를 전술한 바와 같이 제조하였다. 표지된 리간드 구축물을 4℃에서 TEN 완충제 중의 1% CHAPS에서 4시간 동안 항온처리하였고, 광범위한 세척으로 자유 리간드를 제거하였다. 결합된 단백질의 용출을 전술한 바와 같이 수행하였고 용출물을 SDS-PAGE로 분석하였다. TEN-CHAPS 완충제에서 3시간 내지 4시간 동안 4℃에서 500 ㎕ 반응 부피로 2:1 몰비의 표지된 RTL1000을 사용하여 경쟁 실험을 수행함으로써 경쟁자를 "냉각"시켰다. 0.5 ㎖의 총 반응 부피로 0.160 nmol(4 ㎍)의 표지된 RTL1000 및 증가하는 농도(0, 0.032, 0.096, 0.320 및 0.960 nmol)의 DR-α1 도메인을 사용하여 CD74와의 결합에 대한 RTL1000과 DR-α1 도메인 사이의 경쟁을 수행하였다. 이들 조건들 하에서 RTL1000의 최종 농도는 320 nM이었다. 형광 표지부착을 수반하는 모든 분석들에서, 몰레큘라 이미저(Molecular Imager)® FX 스캐너(바이오-라드)를 이용하여 적절한 파장에서 스캐닝함으로써 발색단을 검출하였고, 상기 이미저와 연결된 콴티 원® 소프트웨어(바이오-라드)를 이용하여 형광 강도를 측정하였다.
리간드와 RTL 수용체의 분리된 성분들의 결합을 시험하기 위해, DR*1501-Tg 비장세포를 전술한 바와 같이 바이오티닐화하고 용해시켰고, CD74를 4℃에서 항-CD74 단일클론 항체 ln-1로 밤새 면역침전시켰다. 증가하는 농도의 상이한 구축물(0 내지 10 nM)로 직접적 결합 포화를 수행함으로써 FITC-표지된 pDR2 RTL 구축물에 결합하는 면역 복합체(단백질 L-비드/ln-1/CD74)의 능력을 분석하였다. TEN 완충제 중의 1% CHAPS의 존재 하에서 약하게 진탕하면서 4℃에서 4시간 동안 결합을 수행하였다. 그 후, 상기 복합체를 1% CHAPS/TEN으로 철저히 세척하고 TEN 완충제로만 1회 세척하여 여분의 세제를 제거하였다. 결합된 단백질을 90℃에서 6분 내지 8분 동안 2% SDS 전기영동 샘플 완충제에서 용출하고 비드를 침강시켰다. 상청액을 수집하고 10% 내지 20% SDS-PAGE를 이용하여 단백질을 분리한 후, 겔을 FITC 발색단에 대해 스캐닝하고 밀도측정으로 정량하였다. 리간드 농도를 밴드의 형광 강도에 대하여 작도하였고, 발생된 곡선을 그래프패드 프리즘® 소프트웨어로 1 또는 2 결합 부위에 피팅하였다. 마찬가지로, CD74-고갈된 용해물을 사용하여 단백질-L 비드에 접합된 L243 단일클론 항체로 DR*1501-Tg 마우스로부터 MHC 클래스 II를 정제하였다. 이들 조건들 하에서 DR*1501-Tg 마우스로부터 MHC 클래스 II의 균질한 제제를 단리하였다. 포화 농도의 pDR2 구축물과의 직접적 결합을 전술한 바와 같이 수행하고 분석하였다.
전기영동, 웨스턴 블롯팅 및 LC-MS/MS: 단백질을 면역침전물로부터 용출한 후 10% 내지 20% SDS-PAGE를 이용하여 분리하고 쿠마시 블루 염색으로 가시화하였거나, PVDF로 블롯팅하고 스트렙타비딘-접합된 PE로 검출하였다. PE 염색에 의해 검출된 관련 단백질을 쿠마시 블루로 염색된 복제 겔에 국한시키고 겔 밴드를 절단하고 트립신으로 분해하고 LC-MS/MS로 특징규명하였다.
표면 공명 영상: 히스톤 복합체(시그마)를 10 mM NaOAc(pH 6.0)에서 표준 아민 커플링으로 CM5 바이오센서 칩에 커플링시켰는데, 이때 발생된 최종 공명은 6597 공명 유닛(RU)이었다. 에탄올아민을 음성 대조군으로서 별도의 유동 셀에 커플링시켰다. 질량 전달 효과의 증거 없이 20 ㎕/분의 유속으로 HBS-EP 완충제(10 mM HEPES, pH 7.4, 150 mM NaCl, 3 mM EDTA, 0.005% P20)에서 비아코어(Biacore) 3000 상에서 반응속도 측정을 수행하였다. pDR2/hMOG-35-55를 일련의 농도로 주입하고 각각의 주입 전에 표면을 50 mM NaOH로 재생시켰다. 비아에발루션(Biaevaluation) 3.0 소프트웨어(지이 헬쓰케어, 미국 뉴저지주 피스카타웨이 소재)를 이용하여, 기준이 변동되는 1:1 결합 모델에의 반응속도 데이터의 피팅을 수행하였다.
ICAM-1의 MIF-향상된 발현의 RTL342M(pDR2/mMOG-35-55) 억제: 비장세포를 DR*1501-Tg 마우스로부터 단리하고 5% CO2 하에서 1시간 동안 37℃에서 2% 열 불활성화된 FCS를 함유하는 완전 RPMI 배지 1640에서 10 ㎍/㎖ RTL342M의 존재 또는 부재 하에서 배양하였다. 세포를 수거하기 전에 1시간 동안 10 ng/㎖의 LPS(이. 콜라이, 혈청형 055:B5, 시그마-알드리치) 및 100 ng/㎖의 재조합 MIF(알앤드디 시스템스, 미국 미네소타주 미네아폴리스 소재)로 자극하였다. DNase 단계를 포함하는, RNeasy® 배양된 세포 키트(퀴아젠, 미국 캘리포니아주 발렌시아 소재)를 제조자의 설명서에 따라 사용하여 비장세포로부터 총 RNA를 단리하였다. ICAM-1(분석 ID: Mm00516023_m1)에 대한 주문형 유전자(gene-on-demand) 분석 제품(어플라이드 바이오시스템스(Applied Biosystems))과 함께 ABI 7000 서열 검출 시스템을 이용하여 정량 실시간 PCR을 수행하였다. GADPH 하우스킵핑 유전자를 내생성 대조군으로서 증폭하였다. 프라이머를 제조자의 설명서에 따라 사용하였다.
실시예 2
DR2-Tg 마우스에서 pMHC 구축물을 사용한 EAE의 치료
본 실시예는 DR2 형질전환 마우스에서 EAE에 대한 pMHC 구축물 및 펩티드의 효과를 기술한다.
DR*1501-Tg 마우스(마우스 (m)MOG-35-55 펩티드의 주사 후에만 EAE를 발생시키는 DRA:DRβ1*1501 품종(Link et al., Clin. Immunol. 123:95-104, 2007)) 및 DR*1502-Tg 마우스(인간 (h)MOG-35-55 펩티드의 주사 후 EAE를 발생시키는 I-Eb:DRβ1*1502 품종(Chou et al., J. Neurosci. Res. 77:670-680, 200))를 포함하는 2종의 상이한 DR2-Tg 마우스 품종에서 EAE의 pDR2 치료의 특이성을 평가하였다. 질환 발병 후 DR*1501-Tg 마우스는 pDR2에 부착된 동족 mMOG-35-55 펩티드(서열번호 50)로 효과적으로 치료되었다(도 1a; 표 4). DR*1502-Tg 마우스는 동일한 pDR2 플랫폼에 부착된 동족 hMOG-35-55 펩티드(서열번호 51)로 효과적으로 치료되었으나(도 1b; 표 5), (질환 유도를 위해 사용된 펩티드와 상이한) 비동족 뇌염유발성 펩티드를 함유하는 pDR2/MBP-85-99(서열번호 56) 또는 부착된 펩티드를 갖지 않는 pDR2(pDR2/펩티드 부재, 도 1a 및 1b; 표 4 및 5)로는 효과적으로 치료되지 않았다.
실시예 3
pDR2 결합 부위
본 실시예는 PBMC 상의 pDR2 결합 부위의 확인을 기술한다.
RTL342M-FITC 또는 RTL1000-FITC에 부착된 pDR2를 항원미접촉 DR*1501-Tg 마우스에게 정맥내 주사하였다. 생존가능한 PBMC 하위유형을 유세포측정기를 이용하여 단핵세포 게이트에서 pMHC 결합에 대해 평가하였다. 전면 산점도 및 측면 산점도를 이용하여 단핵세포 집단을 확인하였고, 전면 산점도와 요오드화프로피듐 염색의 조합을 이용하여 생존 단핵세포를 확인하였다(도 2a).
생체외에서 검출된 주요 RTL 결합 세포 집단은 CD11b+ 단핵세포이었고(도 2b, 가장 윗줄; 상부 우측 사분면에서 PE 및 FITC 염색 둘다에 대해 양성을 나타내는 세포의 축적을 주목함), 이때 CD19+ B 세포, CD3+ T 세포 및 CD11c+ DC에 의한 단지 약간의 결합이 존재하였다. 결합은 mMOG 및 hMOG 펩티드 둘다에 대해 실질적으로 유사하였다(도 2c). 이들 각각의 PBMC 하위집단의 최소 RTL 결합만이 림프구 게이트에서 검출되었다(도 3a 내지 3c).
RTL342M 및 RTL1000 둘다에 의한 이 세포 결합 패턴을 DR*1501-Tg 마우스로부터의 PBMC와 함께 1시간 동안 항온처리한 후 시험관내에서 검증하였다. 도 2b에 나타낸 결과와 유사하게, 시험관내에서 pMHC 복합체에 가장 잘 결합된 집단은 CD11b+ 단핵세포이었고, 이때 CD19+ B 세포, CD3+ T 세포 및 CD11c+ DC와의 결합은 최소한이었다(도 2c). 표지된 RTL342M과 GFP-표지된 CD11b+ 단핵세포의 직접적 결합을 색채 향상된 형광 현미경 관찰로 가시화하였고(도 2d), RTL의 세포 표면 복합체뿐만 아니라 내재화된 복합체도 입증하였다.
1B11 항체의 Fab 단편은 2-도메인 pMHC 분자에 결합한다. EAE 모델에서 세포 결합을 억제하고 RTL 치료 효과를 중화시키는 Fab1B11의 능력을 시험하였다. pDR/GAD555-567(Dahan et al., Eur. J. Immunol. 41:1465-1479, 2011)에 결합하는 D2 항체의 대조군 Fab 단편도 사용하였다. pDR2/mMOG-35-55와 CD11b+ 단핵세포의 결합은 Fab1B11의 존재 하에서 약 60%까지 억제되었다(p<0.0001)(도 4a). pDR2/mMOG-35-55와 CD11b+ 단핵세포의 결합은 FabD2의 존재 하에서 약 20%까지 증가되었지만, 이 결과는 통계적으로 유의하지 않았다. 유사하게, EAE를 갖는 DR*1501-Tg 마우스 내로 주사하기 전에 pDR2/mMOG-35-55와 Fab1B11의 항온처리는 pDR2/mMOG-35-55의 보호 활성을 약 60% 중화시켰지만, pDR2/mMOG-35-55와 FabD2의 항온처리는 그러하지 못하였다(p<0.0001, 도 4b).
CD74의 RTL-유도된 하향조절을 차단하는 Fab1B11 항체의 능력도 시험하였다. 1:1 또는 1:2 몰비에서 2시간 동안 RTL342M과 Fab1B11의 항온처리는 시험관내에서 CD11b+ 단핵세포 상에서의 CD74 발현의 RTL342M-유도된 하향조절을 60% 차단하였지만, RTL342M과 FabD2의 항온처리는 그러하지 못하였다(p<0.01)(도 4c).
관련 연구에서, RTL342M과 등몰 농도에서 자유 mMOG-35-55 펩티드의 5회 매일 주사(각각 10 ㎍ 대 100 ㎍)는 RTL342M에 비해 EAE를 유의하게 억제하지 못하였으므로(도 4d 및 표 6), 억제 활성이 MOG 펩티드에 의해 매개되지 않았고 mMOG-35-55보다는 오히려 DR2-β1α1 모이어티에 대한 Fab1B11의 중화 효과가 유도되었다는 것을 확인시켜준다. Fab1B11 대 FabD2의 이들 조합된 선택적 효과는 CD74의 RTL 및 DRα1 결합 및 하향조절이 그의 치료 활성을 위해 필요하다는 것을 입증한다.
(식균작용 및 저친화성 비특이적 결합을 억제하기 위해) 얼음 상에서 증가하는 농도의 알렉사-488-표지된 RTL1000과 함께 1시간 동안 항온처리된 후 광범위하게 세척된 2백만 개의 비장세포를 사용하여 포화 결합 곡선을 확립하였다. 포획된 RTL1000을 갖는 세포를 원심분리하고, 세포 펠렛을 6 M 우레아에서 가용화시키고, 단백질 성분을 SDS-PAGE로 분리하고, 추출된 알렉사-488-표지된 RTL1000의 형광 강도를 겔 전기영동 후 정량하였다. 도 5a에 나타낸 바와 같이, 포화 데이터는 쌍곡선 2개 부위 결합 곡선(R2=0.998)에 가장 잘 피팅되었는데, 이때 한 결합 부위는 2.65 nM의 K D로 RTL1000에 대한 고친화성 결합 및 신속한 포화를 보이고, 또 다른 결합 부위는 131 nM의 K D로 RTL1000에 대한 보다 낮은 친화성 결합을 보인다.
그 다음, 알렉사-488-표지된 RTL1000과 증가하는 농도의 비표지된 RTL1000의 혼합물을 고정된 수의 비장세포와 함께 항온처리하는 경쟁 실험을 수행하였다. 이들 경쟁 실험도 pDR2/hMOG35-55와 DR*1501-Tg 비장세포의 2개 부위 결합 패턴을 입증하였다(도 5b). 저친화성 부위는 11 nM의 EC50을 가졌는데, 이는 상대적으로 낮은 농도의 비표지된 RTL1000이 표지된 RTL1000을 치환시키는 데에 필요하였다는 것을 표시한다. 대조적으로, 고친화성 부위는 4,000 nM의 EC50을 가졌는데, 이것은 350배 초과의 보다 높은 농도의 비표지된 RTL1000이 표지된 RTL1000을 치환시키는 데에 필요하였다는 것을 표시한다.
증가하는 농도의 다른 pDR2 구축물과 혼합된 A488-표지된 RTL1000을 사용하여 추가 경쟁 연구를 수행함으로써 MHC 클래스 II β1α1 및 pDR2/펩티드의 펩티드 모이어티 둘다의 결합을 평가하였다. 비록 RTL1000, RTL342M 및 RTL340(pDR2/MBP-85-99) 모두가 저친화성 결합 부위 및 고친화성 결합 부위 둘다에 대해 경쟁할 수 있었지만(도 5b 및 표 7), "빈" pDR2/펩티드 부재는 저친화성 부위에 대해서만 pDR2/hMOG-35-55와 경쟁할 수 있었다. 이들 데이터는 RTL에 대한 저친화성 결합 부위가 공유부착된 펩티드의 부재 하에서조차도 β1α1 모이어티와 상호작용하는 반면, 고친화성 결합 부위는 공유부착된 항원성 펩티드 모이어티를 비롯한 항원성 펩티드 모이어티를 포함하였을 때 RTL에 결합할 가능성이 훨씬 더 높았다는 것을 명확히 표시한다.
MHC 클래스 II 결핍 마우스로부터 수득된 비장세포를 사용하여 전술된 경쟁 연구도 수행하였다. 도 5c 및 표 7에 나타낸 바와 같이, 저친화성 결합 부위만이 MHC 클래스 II-KO 비장세포 상에 존재하였다. 이들 결과는 세포 표면에 발현된 MHC 클래스 II 그 자체가 RTL에 대한 고친화성 결합 부위라는 것을 시사하였다.
TU39 단일클론 항체 단독 또는 단백질 A에 접합된 TU39-결합된 RTL1000을 1% CHAPS 완충제에서 바이오티닐화된 전체 비장세포와 함께 밤새 항온처리하였다. 결합된 막 단백질을 용출하고 전기영동 및 웨스턴 블롯팅으로 분석하였다. 바이오티닐화된 단백질을 스트렙타비딘-PE로 가시화하였다. RTL1000을 항-DR mAb HK14로 가시화하였다. 이 분석은 RTL1000 이외에, RTL1000 없이 항온처리된 샘플에 비해 존재하지 않거나(31 kD 및 72 kDa) 또는 풍부한(15 kD 및 18 kD) 적어도 4개의 상이한 밴드들을 보여주었다(도 6). 평행한 밴드들을 비염색된 샘플로부터 용출하여 LC-MS/MS로 서열분석하였다(표 8).
주요 pDR2 결합 단백질들을 H4 히스톤(14 kD), H2A, H2B 및 H3 히스톤(18 kD), CD74(31 kD), 및 MHC 클래스 II(72 kD)로서 확인하였다. p72 kD 클래스 II 서열을 발현된 DR2-형질전이유전자(Madsen et al., Nature Genetics 23:343-347, 1999)로부터 유래되었으나 pDR2 구축물로부터 유래되지 않은 H-2Eα2 도메인으로서 확인하였다. 플라스몬 표면 공명 측정을 이용한 추가 평가는 RTL1000과 히스톤 복합체 사이의 저친화성 결합 상호작용을 확인시켜주었다(도 7).
CD74가 pMHC 수용체의 주성분으로서 관여한다는 것을 확인하기 위해, 단백질-L-접합된 항-CD74 단일클론 항체(ln-1)를 사용하여 바이오티닐화된 DR*1501-Tg 비장세포 막 제제로부터 CD74를 면역침전시켰고 스트렙타비딘-PE로 가시화하였다(도 8a). 면역침전된 CD74는 p72 및 p130 단백질과 복합체를 형성한 상태로 발견되었다. 전장 MHC 클래스 II 분자는 전혀 확인되지 않았다. 더욱이, FITC-표지된 RTL을 비드-면역정제된 CD74와 함께 항온처리한 후, RTL1000 및 RTL342M 둘다가 CD74와 함께 용이하게 동시면역침전되었다. RTL340 및 RTL302-5D "빈" pDR2도 훨씬 더 낮은 수준으로 CD74와 함께 동시면역침전되었다(도 8b).
(DR2-β1 도메인 또는 펩티드 없이) DR-α1 도메인만을 포함하는 구축물은 CD74와 함께 동시면역침전되었다(도 8b). 이 결과는 DR-α1 도메인 단독이 CD74와의 결합에 대해 pDR2/hMOG-35-55와 경쟁하였다는 것을 보여주는 경쟁적 결합 실험에 의해 뒷받침되었다(도 9a). (DR-α1 도메인 또는 펩티드를 갖지 않는) DR2-β1 도메인은 CD74와 동시면역침전되지 않았거나 CD74와의 결합에 대해 pDR2/hMOG-35-55와 경쟁하지 않았다(도 8b, 도 9a). 이들 실험들은 DR2-β1 도메인 또는 펩티드를 갖지 않는 DR-α1 도메인에 대한 단일 결합 부위가 CD74 상에 존재한다는 것을 확립하였다(도 9b).
증가하는 농도의 FITC-표지된 RTL 구축물과 면역정제된 CD74의 직접적 결합(도 10a)은 RTL1000, RTL-342M 및 DR-α1이 CD74와 결합하고(그러나, 다른 RTL 구축물들은 그러하지 않음), 이 결합이 용량 의존적이고 포화가능하고 약 2.9 내지 4.5 nM의 단일 결합 부위를 수반한다는 것을 표시하였다(표 9). (CD74 고갈 후) 동일한 막 제제에서 FITC-표지된 pDR2 구축물과 4-도메인 MHC 클래스 II 분자의 결합은 RTL1000 및 RTL342M의 결합을 확립하였으나, DR-α1 또는 다른 pDR2 구축물은 그러하지 않았다(도 10b). 검출된 결합은 용량 의존적이고 포화가능하고 약 1.1 내지 2.0 nM의 단일 결합 부위도 수반하였다(표 9).
이들 데이터는 pDR2 분자의 DR-α1 모이어티 내의 결정인자에 대한 단일 결합 부위가 CD74 상에 존재하고, 공유부착된 펩티드 그 자체를 포함할 수 있는 DR-α1 도메인 상에 존재하지 않는 별도의 다소 더 높은 친화성 결합 부위가 4-도메인 클래스 II 상에 존재하거나, 대안적으로 항원성 펩티드, 예컨대, 공유부착된 항원성 펩티드가 존재할 때 형성되는 구조적으로 민감한 결합 부위가 pDR2 상에 존재한다는 것을 표시한다.
이들 데이터는 DR2-β1 도메인 또는 펩티드를 갖지 않는 단리되고 정제된 DR-α1이 CD74에 결합할 수 있다는 것도 표시한다.
실시예 4
CD74 발현 수준
본 실시예는 CD74 발현에 대한 pMHC 결합의 효과를 기술한다.
생체외 연구는 CD11b+ 단핵세포 상에서의 CD74의 발현이 항원미접촉 대조군에 비해 상대적으로 EAE를 갖는 마우스에서 증가되었다는 것을 입증하였다(도 11a). 임상 징후의 발병 시 RTL342M을 사용한 EAE 마우스의 치료는 48시간 이내에 CD74 발현을 유의하게 하향조절하였다. 이 결과는 혈액, 비장 및 척수로부터 단리된 CD11b+ 세포 상에서 관찰되었다(도 11b 및 11c). pDR2/mMOG-35-55를 사용한 치료는 MHC 클래스 II 세포 표면 발현을 변경시키지 않았다. 이것은 MHC 클래스 II가 일반적으로 단핵세포의 세포 표면 상에서 CD74와 회합되지 않는다는 것을 암시하는 문헌(Roche et al., Proc. Natl. Acad. Sci. USA 90:8581-8595, 1993; Eynon et al., J. Biol. Chem. 274:26266-26271, 1999)과 대조적이다. 단백질 L-접합된 항-CD74 ln-1 mAb를 사용하여 RTL342M 또는 DR-α1과 함께 예비항온처리된 바이오티닐화된 DR*1501-Tg 비장세포 막 제제로부터 CD74를 면역침전시킬 수 있었기 때문에 CD74 발현의 하향조절은 RTL에 의해 차단되는 항-CD74 결합 부위의 차단에 기인하지 않았다(도 20).
RTL1000에 대해 나타낸 바와 같이, 항원미접촉 CD11b+ 단핵세포를 37℃에서 1시간 동안 증가하는 농도의 RTL 구축물과 함께 항온처리한 후, RTL의 결합 및 CD74의 세포 표면 발현에 대해 FACS로 평가하였다(도 12a). 5개의 상이한 구축물들로부터 수득된 결과(도 12b)는 CD74의 감소된 발현을 증가하는 RTL 결합의 함수로서 나타내었다. 이 관계는 모든 구축물들에 대한 데이터 점들이 조합되었을 때 통계적으로 유의하였다(p<0.001, 도 12b 하부 우측 패널). DR-α1 단독의 경우 pMHC 농도와 CD74 발현 사이의 역의 관계를 주목한다.
RTL1000과 인간 단핵세포의 결합도 평가하였다. 인간 CD11b+ 단핵세포를 DR2+ 인간 공여자로부터 단리하고 1 ㎍ RTL342M, 1 ㎍ RTL1000, 5 ㎍ RTL1000, 5 ㎍ RTL340 및 비히클 단독으로 처리하였다(도 13a 내지 13e). 처리 후 CD74를 발현하는 세포의 백분율 및 FITC-RTL1000에 결합하는 세포의 백분율에 대한 모든 처리 조건들로부터의 결과의 회귀 분석은 도 13f에 제시되어 있다. CD74를 발현하는 세포의 백분율은 표지된 RTL1000에 결합하는 세포의 백분율과 역의 상관관계를 가졌다.
실시예 5
EAE에 대한 RTL 구축물의 효과
본 실시예는 DR-α1 단독의 효과를 비롯한, EAE에 대한 pMHC 구축물들의 효과를 기술한다.
RTL1000 또는 RTL342M을 비동족 펩티드에 의해 유도된 EAE를 치료하는 그들의 능력에 대해 RTL340, pDR2/펩티드 부재 또는 비히클과 비교하였다. MBP-85-99 펩티드/CFA/Ptx를 사용하여 MBP-TCR/DR2-Tg 마우스에서 EAE를 유도하였다. 도 14a 및 표 10에 나타낸 바와 같이, RTL1000 및 RTL342M 둘다가 (동족 펩티드를 보유하지만 CD74의 보다 덜 강력한 조절을 갖는) pDR2/MBP-85-99의 EAE에 대한 효과에 필적할만한 EAE에 대한 효과를 보였다. 대조적으로, "빈(empty)" pDR2/펩티드 부재는 EAE의 치료에 있어서 비효과적이었고 CD74 발현에 대한 약한 효과를 가졌다.
EAE에 대한 pDR2 구축물의 가능한 펩티드 비의존적 억제 효과를 더 조사하기 위해, CD74의 유의한 결합 및 조절을 보인 10배 더 높은 용량의 pDR2/펩티드 부재(5일 동안 1 mg 2회)의 치료 활성을, mMOG-35-55-유도된 EAE를 갖는 DR2-Tg 마우스에서 표준 용량 및 치료법(100 ㎍ 5회)의 pDR2/펩티드 부재, pDR2/mMOG-35-55 및 비히클과 비교하여 시험하였다. 도 14b 및 표 11에 나타낸 바와 같이, 1 mg 용량의 pDR2/펩티드 부재를 사용한 EAE의 치료는 비히클을 사용한 치료에 비해 매일 EAE 점수 및 누적 EAE 점수를 실제로 유의하게 감소시켰다. 2일 또는 5일 동안 매일 표준 용량의 RTL342M을 사용한 치료가 EAE를 훨씬 더 강력하게 억제하였다.
EAE의 유도로부터 15일 후 RTL342M, 100 ㎍ pMHC(매일 2회), "빈" RTL302-5D(1 mg 2회) 또는 비히클(치료 효과를 갖지 않는 최대 질환-유도된 수준의 CD74)로 치료받은 항원미접촉 DR2-Tg 마우스(임상적 EAE를 갖지 않는 배경 수준의 CD74) 및 mMOG-35-55-면역화된 DR2-Tg 마우스(DR*1501 Tg)로부터 수득된 CNS 유래의 CD11b+ 세포 상에서 CD74 수준을 평가하였다. 도 14c에 나타낸 바와 같이, 상이한 마우스 군들에 대한 CD11b+ 세포 상에서의 CD74 수준과 평균 CDI 사이에 유의한 관계(p=0.035)가 있었다.
mMOG-35-55를 사용한 면역화로 마우스에서 EAE를 유도하였다. 질환 발병 시, 마우스를 하기 구축물들 중 하나로 치료하였다: (i) mMOG-35-55와 공유결합된 pDR2(100 ㎍), (ii) 펩티드를 갖지 않는 pDR2(1000 ㎍), (iii) DR-α1(750 ㎍), 또는 (iv) 비히클 단독. 상기 구축물들을 연속 2일 동안 피하 투여하였다. 면역화 후 15일째 날, 마우스를 희생시키고 척수를 채취하고 각각의 군에 대해 풀링하였다. 단리된 세포를 CD74, CD11b, CD80, ICAM 및 HLA-DR 발현에 대해 염색하고 FACS로 분석하였다. 펩티드를 갖지 않는 pDR2로 치료받은 마우스 및 DR-α1로 치료받은 마우스에 대한 임상 점수는 비히클 단독으로 치료받은 마우스들의 임상 점수보다 더 낮았다(도 15). 비히클, RTL302-5D(용액에서의 응집을 감소시키는 5개의 아미노산 치환을 갖는 pDR2), RTL342M(mMOG35-55를 갖는 RTL302-5D) 또는 DR-α1로 치료받은 마우스들에서 유사한 결과를 수득하였다(도 16). 결과가 유의 수준에 이르지 못하였지만, 이들 결과는 보다 큰 샘플 크기를 이용하거나 투약 및/또는 투여 파라미터를 변경하여 EAE를 치료하기 위한 pDR2(펩티드 부재) 또는 DR-α1을 사용한 최적 치료법을 달성함으로써 통계적으로 유의한 결과를 수득할 수 있다는 것을 암시한다.
CD74 발현은 pDR2/mMOG-35-55로 치료받은 마우스의 척수로부터 수득된 CD11b+ 단핵세포에서 감소되었다(도 17a). CD80 발현은 pDR2/펩티드 부재 및 pDR2/mMOG-35-55로 치료받은 마우스에서 감소되었다(도 17b). ICAM 발현은 비치료된 대조군에 비해 임의의 치료군에서 통계적으로 변화되지 않았다(도 17c).
pMHC 결합이 MIF-유도된 신호전달을 직접적으로 억제하는지를 확립하기 위해, 항원미접촉 비장세포를 MIF 및 LPS로 자극하기 전에 1시간 동안 pDR2/mMOG-35-55와 함께 항온처리한 후 ICAM-1의 발현에 대해 평가하였다. 도 18a에 나타낸 바와 같이, pDR2/mMOG-35-55는 ICAM-1 메시지의 MIF-향상된 유도를 LPS 배경 수준까지 유의하게 감소시켰는데, 이것은 MIF 의존적 효과의 완전한 억제가 있으나 LPS 의존적 활성화에 대한 추가 효과는 없다는 것을 입증한다.
MIF와 CD74의 결합은 대식세포의 무작위적 이동을 억제하는 것으로 공지되어 있다. pDR2/mMOG-35-55 결합에 의해 매개된 감소된 CD74 세포 표면 발현이 단핵세포의 이동 패턴을 변경시켰는지를 확인하기 위해, 생존 영상화 현미경 관찰을 이용하여 항원미접촉 DR*1501/GFP-Tg 마우스로부터 단리된 GFP+CD11b+ 세포의 이동을 첨가된 pDR2/mMOG-35-55의 존재 또는 부재 하에서 시험관내에서 2시간 동안 추적하였다. 도 18b 내지 18d에 나타낸 바와 같이, pDR2/mMOG-35-55의 존재 하에서 유의한 증가가 측정된 속도(p<0.0005, 도 18b), 평균 평방 변위(p<0.0005, 도 18c) 및 무작위적 이동 경로(도 18d)에서 관찰되었다. 이들 데이터는 pDR2/mMOG-35-55에 의해 유도된 CD74의 감소된 세포 표면 발현이 ICAM-1의 감소된 발현 및 CD11b+ 단핵세포의 증가된 무작위적 이동과 관련되어 있다는 것을 암시하는데, 이것은 MIF 효과의 차단과 일치한다.
실시예 7
EAE에서 DRα1의 용량-반응
mMOG-35-55를 사용한 면역화로 마우스에서 EAE를 유도하였다. 질환 발병 시, 마우스를 하기 구축물들 중 하나로 치료하였다: (i) 비히클 단독, (ii) 500 ㎍의 DR2-β1, (iii) 100 ㎍의 DR-α1, (iv) 300 ㎍의 DR-α1, (v) 500 ㎍의 DR-α1, (vi) 1000 ㎍의 DR-α1 및 100 ㎍의 RTL342M(DR2/mMOG35-55). 모든 용량은 매일 2회 투여하였다. 결과는 도 23 및 표 12에 제시되어 있다.
추가로, DR2-β1만으로 치료받은 마우스는 CD74를 하향조절하지 못하였거나 EAE를 치료하지 못하였다. mMOG35-55/CFA/Ptx-유도된 EAE를 갖는 DR*1501-TG 마우스는 임상 징후의 발병 시 3일 동안 매일 100 ㎍ RTL342M, 500 ㎍ DR2-β1 또는 비히클로 치료받았다. 데이터는 도 21 및 22, 및 표 13에 요약되어 있다.
실시예 8
대상체에서 다발성 경화증을 치료하거나 억제하는 방법
본 실시예는 대상체에서 다발성 경화증을 치료하거나 억제하는 예시적 방법을 기술한다. 그러나, 당분야에서 통상의 기술을 가진 자는 이들 특정 방법들을 벗어나는 방법도 대상체에서 다발성 경화증을 치료하거나 억제하는 데에 이용될 수 있다는 것을 인식할 것이다. 당분야에서 통상의 기술을 가진 자는 상이한 장애, 예컨대, 상이한 자가면역 장애를 갖는 대상체를 치료하기 위해 이들 방법들을 변경시킬 수도 있다.
다발성 경화증을 갖는 대상체를 선택한다. MHC 클래스 II α1 도메인 폴리펩티드(또는 이의 부분), 또는 수초 항원(예컨대, MOG 35-55, MBP 85-99 또는 PLP 139-151)에 공유 결합된 MHC 클래스 II α1 폴리펩티드(또는 이의 부분)를 0.1 mg/kg 내지 50 mg/kg의 용량으로 사용하여 대상체를 (예를 들면, 피하 주사로) 매주 치료한다. 치료의 시작 전에, 치료 기간 동안 주기적으로, 및//또는 치료 과정의 말기에 MRI 척도(예컨대, T2 병변 부하, T1 저신호강도의 부피, NAA 수준, 및 전체 뇌 위축증); 임상 척도(예컨대, EDSS의 변화, SRS(Scripps Neurological Rating Scale)의 변화, 재발률 및 9-홀 페그(peg) 검사), 및 면역학적 척도(예컨대, Th1 및 Th2 T 세포 계통의 마커, 다양한 T 세포 마커의 FACS 분석, 시험관내에서 T 세포에 의한 사이토카인 생성, 및 T 세포의 증식) 중 하나 이상을 포함하는 다발성 경화증의 척도에 대해 대상체를 평가한다.
대상체에서 다발성 경화증(또는 또 다른 자가면역 장애)를 치료하거나 억제하는 데에 있어서 MHC 클래스 II α1 도메인 폴리펩티드로의 치료의 효능은 예를 들면, 대조군, 예컨대, 비치료된 대상체, 치료 전 상기 장애를 갖는 대상체(예를 들면, 치료 전 동일한 대상체), 또는 플라세보로(예를 들면, 비히클만으로) 치료받은 장애를 갖는 대상체에 비해 상기 장애의 하나 이상의 증상의 진행에 있어서 개선 또는 감소에 의해 입증될 수 있다.
실시예 9
대상체에서 치료 효능을 측정하는 방법
본 실시예는 대상체에서 MHC 클래스 II 폴리펩티드로의 치료의 효능을 측정하는 예시적 방법을 기술한다. 그러나, 당분야에서 통상의 기술을 가진 자는 이들 특정 방법들을 벗어나는 방법도 대상체에서 치료 효능을 측정하는 데에 이용될 수 있다는 것을 인식할 것이다.
적어도 1회 용량의 MHC 클래스 II β1α1 폴리펩티드 또는 MHC 클래스 II α1 도메인 폴리펩티드(또는 이들의 부분)로 치료받은 대상체를 선택한다. 샘플, 예컨대, 혈액 샘플을 상기 대상체로부터 수득한다. 일부 예에서, 예를 들면, 상기 샘플로부터 핵산을 추출하고 RT-PCR로 CD74 발현을 측정하거나 ELISA 또는 유세포측정으로 CD74 단백질 발현을 측정함으로써 CD74의 발현을 샘플에서 측정한다. 다른 예에서, 예를 들면, 상기 샘플을 MIF와 접촉시키고 ERK1/2 활성, NF-κB 활성화, Bcl-2 발현, IL-8 분비, 세포 증식 및 아폽토시스 중 하나 이상을 측정함으로써 CD74 활성을 측정한다. CD74 발현 및/또는 활성의 수준을 대조군(예를 들면, 기준 값, 또는 MHC 클래스 II 폴리펩티드로의 치료 전에 대상체로부터의 샘플에서 측정된 CD74 발현 또는 활성 수준)과 비교한다.
CD74 발현 및/또는 활성 수준이 대조군보다 적거나 대조군과 동등한 경우 치료는 효과적인 것으로 확인된다. CD74 발현 및/또는 활성 수준이 대조군보다 더 큰 경우 치료는 준최적으로 효과적인 것으로 확인된다. 치료가 효과적인 것으로 확인된 경우 MHC 클래스 II 폴리펩티드의 용량을 유지할 수 있다(또는 감소시킬 수 있다). 치료가 준최적으로 효과적인 것으로 확인된 경우, MHC 클래스 II 폴리펩티드의 용량을 증가시킬 수 있다. 당분야에서 통상의 기술을 가진 자는 CD74 발현 또는 활성 수준, 치료되는 장애, 대상체의 상태 및 다른 인자를 기초로 적절한 용량(예컨대, 용량에서의 점진적인 증가 또는 감소)을 선택할 수 있다.
실시예 10
대상체에서 치료 효능을 최적화하는 방법
본 실시예는 대상체에서 MHC 클래스 II 폴리펩티드로의 치료의 효능을 최적화하는 예시적 방법을 기술한다. 그러나, 당분야에서 통상의 기술을 가진 자는 이들 특정 방법들을 벗어나는 방법도 대상체에서 치료 효능을 최적화하는 데에 이용될 수 있다는 것을 인식할 것이다.
자가면역 또는 염증성 장애(예컨대, 다발성 경화증)를 갖는 대상체를 선택한다. MHC 클래스 II β1α1 폴리펩티드 또는 MHC 클래스 II α1 도메인 폴리펩티드(또는 이들의 부분)의 일정 용량을 상기 대상체에게 투여한다. 샘플, 예컨대, 혈액 샘플을 상기 대상체로부터 수득한다. 일부 예에서, 예를 들면, 상기 샘플로부터 핵산을 추출하고 RT-PCR로 CD74 발현을 측정하거나 ELISA 또는 유세포측정으로 CD74 단백질 발현을 측정함으로써 CD74의 발현을 샘플에서 측정한다. 다른 예에서, 예를 들면, 상기 샘플을 MIF와 접촉시키고 ERK1/2 활성, NF-κB 활성화, Bcl-2 발현, IL-8 분비, 세포 증식 및 아폽토시스 중 하나 이상을 측정함으로써 CD74 활성을 측정한다. CD74 발현 및/또는 활성의 수준을 대조군(예를 들면, 기준 값, 또는 MHC 클래스 II 폴리펩티드로의 치료 전에 대상체로부터의 샘플에서 측정된 CD74 발현 또는 활성 수준)과 비교한다. 그 다음, 대상체에게 후속적으로 투여될 상기 폴리펩티드의 용량을 결정한다. CD74 발현 또는 활성 수준이 대조군보다 더 큰 경우, MHC 클래스 II 폴리펩티드의 용량을 증가시켜 치료 효능을 개선할 수 있다.
CD74 발현 또는 활성 수준이 대조군보다 적거나 대조군과 동등한 경우, MHC 클래스 II 폴리펩티드의 용량을 유지할 수 있거나 감소시킬 수 있다. 당분야에서 통상의 기술을 가진 자는 CD74 발현 또는 활성 수준, 치료되는 장애, 대상체의 상태 및 다른 인자를 기초로 적절한 용량(예컨대, 용량에서의 점진적인 증가 또는 감소)을 선택할 수 있다.
본 개시내용의 원리가 적용될 수 있는 많은 가능한 실시양태들에 비추어 볼 때, 예증된 실시양태들은 단지 예이고 본 발명의 범위를 한정하는 것으로서 간주되어서는 안 된다는 것을 인식해야 한다. 오히려, 본 발명의 범위는 하기 청구항들 의해 정의된다. 따라서, 본 발명자들은 이들 청구항들의 범위 및 개념 내에 있는 모든 발명들을 본 발명으로서 청구한다.
SEQUENCE LISTING
<110> Oregon Health & Science University
The United States Government as Represented by the
Department of Veterans Affairs
Vandenbark, Arthur A
Burrows, Gregory G
Meza-Romero, Roberto
Benedek, Gil
Andrew, Shayne
Mooney, Jeffery
<120> PARTIAL MHC CONSTRUCTS AND METHODS OF USE
<130> 899-88290-02
<150> US 61/584,045
<151> 2012-01-06
<160> 116
<170> PatentIn version 3.5
<210> 1
<211> 254
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Ile Ser Gly Val Pro Val Leu Gly Phe Phe Ile Ile Ala Val
1 5 10 15
Leu Met Ser Ala Gln Glu Ser Trp Ala Ile Lys Glu Glu His Val Ile
20 25 30
Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp Gln Ser Gly Glu Phe Met
35 40 45
Phe Asp Phe Asp Gly Asp Glu Ile Phe His Val Asp Met Ala Lys Lys
50 55 60
Glu Thr Val Trp Arg Leu Glu Glu Phe Gly Arg Phe Ala Ser Phe Glu
65 70 75 80
Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala Asn Leu Glu
85 90 95
Ile Met Thr Lys Arg Ser Asn Tyr Thr Pro Ile Thr Asn Val Pro Pro
100 105 110
Glu Val Thr Val Leu Thr Asn Ser Pro Val Glu Leu Arg Glu Pro Asn
115 120 125
Val Leu Ile Cys Phe Ile Asp Lys Phe Thr Pro Pro Val Val Asn Val
130 135 140
Thr Trp Leu Arg Asn Gly Lys Pro Val Thr Thr Gly Val Ser Glu Thr
145 150 155 160
Val Phe Leu Pro Arg Glu Asp His Leu Phe Arg Lys Phe His Tyr Leu
165 170 175
Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr Asp Cys Arg Val Glu His
180 185 190
Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Phe Asp Ala Pro
195 200 205
Ser Pro Leu Pro Glu Thr Thr Glu Asn Val Val Cys Ala Leu Gly Leu
210 215 220
Thr Val Gly Leu Val Gly Ile Ile Ile Gly Thr Ile Phe Ile Ile Lys
225 230 235 240
Gly Val Arg Lys Ser Asn Ala Ala Glu Arg Arg Gly Pro Leu
245 250
<210> 2
<211> 254
<212> PRT
<213> Homo sapiens
<400> 2
Met Ala Ile Ser Gly Val Pro Val Leu Gly Phe Phe Ile Ile Ala Val
1 5 10 15
Leu Met Ser Ala Gln Glu Ser Trp Ala Ile Lys Glu Glu His Val Ile
20 25 30
Ile Gln Ala Glu Phe Tyr Leu Asn Pro Asp Gln Ser Gly Glu Phe Met
35 40 45
Phe Asp Phe Asp Gly Asp Glu Ile Phe His Val Asp Met Ala Lys Lys
50 55 60
Glu Thr Val Trp Arg Leu Glu Glu Phe Gly Arg Phe Ala Ser Phe Glu
65 70 75 80
Ala Gln Gly Ala Leu Ala Asn Ile Ala Val Asp Lys Ala Asn Leu Glu
85 90 95
Ile Met Thr Lys Arg Ser Asn Tyr Thr Pro Ile Thr Asn Val Pro Pro
100 105 110
Glu Val Thr Val Leu Thr Asn Ser Pro Val Glu Leu Arg Glu Pro Asn
115 120 125
Val Leu Ile Cys Phe Ile Asp Lys Phe Thr Pro Pro Val Val Asn Val
130 135 140
Thr Trp Leu Arg Asn Gly Lys Pro Val Thr Thr Gly Val Ser Glu Thr
145 150 155 160
Val Phe Leu Pro Arg Glu Asp His Leu Phe Arg Lys Phe His Tyr Leu
165 170 175
Pro Phe Leu Pro Ser Thr Glu Asp Val Tyr Asp Cys Arg Val Glu His
180 185 190
Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Phe Asp Ala Pro
195 200 205
Ser Pro Leu Pro Glu Thr Thr Glu Asn Val Val Cys Ala Leu Gly Leu
210 215 220
Thr Val Gly Leu Val Gly Ile Ile Ile Gly Thr Ile Phe Ile Ile Lys
225 230 235 240
Gly Leu Arg Lys Ser Asn Ala Ala Glu Arg Arg Gly Pro Leu
245 250
<210> 3
<211> 255
<212> PRT
<213> Homo sapiens
<400> 3
Met Ile Leu Asn Lys Ala Leu Leu Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Cys Gly Val Asn Leu Tyr Gln Phe Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Ala Trp Arg Trp Pro Glu Phe Ser Lys Phe Gly Gly Phe
65 70 75 80
Asp Pro Gln Gly Ala Leu Arg Asn Met Ala Val Ala Lys His Asn Leu
85 90 95
Asn Ile Met Ile Lys Arg Tyr Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly Gln Ser Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Gln Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly
210 215 220
Leu Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile
225 230 235 240
Gln Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 4
<211> 255
<212> PRT
<213> Homo sapiens
<400> 4
Met Ile Leu Asn Lys Ala Leu Leu Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Cys Gly Val Asn Leu Tyr Gln Phe Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Ala Trp Arg Trp Pro Glu Phe Ser Lys Phe Gly Gly Phe
65 70 75 80
Asp Pro Gln Gly Ala Leu Arg Asn Met Ala Val Ala Lys His Asn Leu
85 90 95
Asn Ile Met Ile Lys Arg Tyr Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly Gln Ser Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Gln Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly
210 215 220
Leu Ser Val Gly Leu Met Gly Ile Val Val Gly Thr Val Phe Ile Ile
225 230 235 240
Gln Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 5
<211> 255
<212> PRT
<213> Homo sapiens
<400> 5
Met Ile Leu Asn Lys Ala Leu Leu Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Cys Gly Val Asn Leu Tyr Gln Phe Tyr Gly Pro Ser Gly Gln Phe
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Glu Lys
50 55 60
Lys Glu Thr Ala Trp Arg Trp Pro Glu Phe Ser Lys Phe Gly Gly Phe
65 70 75 80
Asp Pro Gln Gly Ala Leu Arg Asn Met Ala Val Ala Lys His Asn Leu
85 90 95
Asn Ile Met Ile Lys Arg Tyr Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly His Ala Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Gln Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly
210 215 220
Leu Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile
225 230 235 240
Gln Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 6
<211> 255
<212> PRT
<213> Homo sapiens
<400> 6
Met Ile Leu Asn Lys Ala Leu Leu Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Met Met Ser Pro Cys Gly Gly Glu Gly Ile Val Ala Asp His Val Ala
20 25 30
Ser Cys Gly Val Asn Leu Tyr Gln Phe Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Ala Trp Arg Trp Pro Glu Phe Ser Lys Phe Gly Gly Phe
65 70 75 80
Asp Pro Gln Gly Ala Leu Arg Asn Met Ala Val Ala Lys His Asn Leu
85 90 95
Asn Ile Met Ile Lys Arg Tyr Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly Gln Ser Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Gln Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Thr Leu Gly
210 215 220
Leu Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile
225 230 235 240
Gln Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 7
<211> 255
<212> PRT
<213> Homo sapiens
<400> 7
Met Ile Leu Asn Lys Ala Leu Leu Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Met Met Ser Pro Cys Gly Gly Glu Gly Ile Val Ala Asp His Val Ala
20 25 30
Ser Cys Gly Val Asn Leu Tyr Gln Phe Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Ala Trp Arg Trp Pro Glu Phe Ser Lys Phe Gly Gly Phe
65 70 75 80
Asp Pro Gln Gly Ala Leu Arg Asn Met Ala Val Ala Lys His Asn Leu
85 90 95
Asn Ile Met Ile Lys Arg Tyr Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly Gln Ser Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Gln Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly
210 215 220
Leu Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile
225 230 235 240
Gln Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 8
<211> 82
<212> PRT
<213> Homo sapiens
<400> 8
Asp His Val Ala Ser Cys Gly Val Asn Leu Tyr Gln Phe Tyr Gly Pro
1 5 10 15
Ser Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val
20 25 30
Asp Leu Glu Arg Lys Glu Ala Ala Trp Arg Trp Pro Glu Phe Ser Lys
35 40 45
Phe Gly Gly Phe Asp Pro Gln Gly Ala Leu Arg Asn Met Ala Val Ala
50 55 60
Lys His Asn Leu Asn Ile Met Ile Lys Arg Tyr Asn Ser Thr Ala Ala
65 70 75 80
Thr Asn
<210> 9
<211> 255
<212> PRT
<213> Homo sapiens
<400> 9
Met Ile Leu Asn Lys Ala Leu Leu Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Met Met Ser Pro Cys Gly Gly Glu Gly Ile Val Ala Asp His Val Ala
20 25 30
Ser Cys Gly Val Asn Leu Tyr Gln Phe Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Ala Trp Arg Trp Pro Glu Phe Ser Lys Phe Gly Gly Phe
65 70 75 80
Asp Pro Gln Gly Ala Leu Arg Asn Met Ala Val Ala Lys His Asn Leu
85 90 95
Asn Ile Met Ile Lys Cys Tyr Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly Gln Ser Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Gln Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Thr Leu Gly
210 215 220
Leu Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile
225 230 235 240
Gln Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 10
<211> 254
<212> PRT
<213> Homo sapiens
<400> 10
Met Ile Leu Asn Lys Ala Leu Met Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Phe
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Val Trp Lys Leu Pro Leu Phe His Arg Leu Arg Phe Asp
65 70 75 80
Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Leu Lys His Asn Leu Asn
85 90 95
Ile Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val Pro
100 105 110
Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro Asn
115 120 125
Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn Ile
130 135 140
Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu Thr
145 150 155 160
Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr Leu
165 170 175
Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu His
180 185 190
Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Pro Glu Ile Pro
195 200 205
Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly Leu
210 215 220
Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Leu Ile Ile Arg
225 230 235 240
Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250
<210> 11
<211> 255
<212> PRT
<213> Homo sapiens
<400> 11
Met Ile Leu Asn Lys Ala Leu Met Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Ser His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Val Trp Gln Leu Pro Leu Phe Arg Arg Phe Arg Arg Phe
65 70 75 80
Asp Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Leu Lys His Asn Leu
85 90 95
Asn Ile Val Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Thr Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly
210 215 220
Leu Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Leu Ile Ile
225 230 235 240
Arg Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 12
<211> 255
<212> PRT
<213> Homo sapiens
<400> 12
Met Ile Leu Asn Lys Ala Leu Met Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Thr Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Ser His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Val Trp Gln Leu Pro Leu Phe Arg Arg Phe Arg Arg Phe
65 70 75 80
Asp Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Leu Lys His Asn Leu
85 90 95
Asn Ile Val Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Asp Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Thr Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly
210 215 220
Leu Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Leu Ile Ile
225 230 235 240
Arg Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 13
<211> 255
<212> PRT
<213> Homo sapiens
<400> 13
Met Ile Leu Asn Lys Ala Leu Met Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Ser His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val Asp Leu Glu Arg
50 55 60
Lys Glu Thr Val Trp Gln Leu Pro Leu Phe Arg Arg Phe Arg Arg Phe
65 70 75 80
Asp Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Leu Lys His Asn Leu
85 90 95
Asn Ile Val Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val
100 105 110
Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro
115 120 125
Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn
130 135 140
Ile Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu
145 150 155 160
Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr
165 170 175
Leu Thr Phe Leu Pro Ser Asp Asp Glu Ile Tyr Asp Cys Lys Val Glu
180 185 190
His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Pro Glu Ile
195 200 205
Pro Thr Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly
210 215 220
Leu Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Leu Ile Ile
225 230 235 240
Arg Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250 255
<210> 14
<211> 254
<212> PRT
<213> Homo sapiens
<400> 14
Met Ile Leu Asn Lys Ala Leu Leu Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Gly Arg
50 55 60
Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln Phe Arg Phe Asp
65 70 75 80
Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Thr Lys His Asn Leu Asn
85 90 95
Ile Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val Pro
100 105 110
Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro Asn
115 120 125
Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn Ile
130 135 140
Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu Thr
145 150 155 160
Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr Leu
165 170 175
Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu His
180 185 190
Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Pro Glu Ile Pro
195 200 205
Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly Leu
210 215 220
Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile Arg
225 230 235 240
Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250
<210> 15
<211> 175
<212> PRT
<213> Homo sapiens
<400> 15
Asp His Val Ala Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro
1 5 10 15
Ser Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val
20 25 30
Asp Leu Gly Arg Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln
35 40 45
Phe Arg Phe Asp Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Thr Lys
50 55 60
His Asn Leu Asn Ile Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr
65 70 75 80
Asn Glu Val Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu
85 90 95
Gly Gln Pro Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro
100 105 110
Val Val Asn Ile Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly
115 120 125
Val Ser Glu Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys
130 135 140
Ile Ser Tyr Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys
145 150 155 160
Lys Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp
165 170 175
<210> 16
<211> 175
<212> PRT
<213> Homo sapiens
<400> 16
Asp His Val Ala Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro
1 5 10 15
Ser Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val
20 25 30
Asp Leu Gly Arg Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln
35 40 45
Phe Arg Phe Asp Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Thr Lys
50 55 60
His Asn Leu Asn Ile Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr
65 70 75 80
Asn Glu Val Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu
85 90 95
Gly Gln Pro Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro
100 105 110
Val Val Asn Ile Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly
115 120 125
Val Ser Glu Ile Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys
130 135 140
Ile Ser Tyr Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys
145 150 155 160
Lys Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp
165 170 175
<210> 17
<211> 175
<212> PRT
<213> Homo sapiens
<400> 17
Asp His Val Ala Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro
1 5 10 15
Ser Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val
20 25 30
Asp Leu Gly Arg Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln
35 40 45
Phe Arg Phe Asp Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Thr Lys
50 55 60
His Asn Leu Asn Ile Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr
65 70 75 80
Asn Glu Val Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu
85 90 95
Gly Gln Pro Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro
100 105 110
Val Val Asn Ile Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly
115 120 125
Val Ser Glu Thr Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys
130 135 140
Ile Ser His Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys
145 150 155 160
Lys Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp
165 170 175
<210> 18
<211> 254
<212> PRT
<213> Homo sapiens
<400> 18
Met Ile Leu Asn Lys Ala Leu Met Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Gly Arg
50 55 60
Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln Phe Arg Phe Asp
65 70 75 80
Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Leu Lys His Asn Leu Asn
85 90 95
Ser Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val Pro
100 105 110
Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro Asn
115 120 125
Ile Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn Ile
130 135 140
Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu Thr
145 150 155 160
Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr Leu
165 170 175
Thr Leu Leu Pro Ser Ala Glu Glu Ser Tyr Asp Cys Lys Val Glu His
180 185 190
Trp Gly Leu Asp Lys Pro Leu Leu Lys His Trp Glu Pro Glu Ile Pro
195 200 205
Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly Leu
210 215 220
Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile Arg
225 230 235 240
Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250
<210> 19
<211> 86
<212> PRT
<213> Homo sapiens
<400> 19
Glu Asp Ile Val Ala Asp His Val Ala Ser Tyr Gly Val Asn Leu Tyr
1 5 10 15
Gln Ser Tyr Gly Pro Ser Gly Gln Tyr Thr His Glu Phe Asp Gly Asp
20 25 30
Glu Gln Phe Tyr Val Asp Leu Gly Arg Lys Glu Thr Val Trp Cys Leu
35 40 45
Pro Val Leu Arg Gln Phe Arg Phe Asp Pro Gln Phe Ala Leu Thr Asn
50 55 60
Ile Ala Val Leu Lys His Asn Leu Asn Ser Leu Ile Lys Arg Ser Asn
65 70 75 80
Ser Thr Ala Ala Thr Asn
85
<210> 20
<211> 74
<212> PRT
<213> Homo sapiens
<400> 20
Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Tyr Thr His
1 5 10 15
Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Gly Arg Lys Glu
20 25 30
Thr Val Trp Cys Leu Pro Val Leu Arg Gln Phe Arg Phe Asp Arg Gln
35 40 45
Phe Ala Leu Thr Asn Ile Ala Val Leu Lys His Asn Leu Asn Ser Leu
50 55 60
Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr
65 70
<210> 21
<211> 254
<212> PRT
<213> Homo sapiens
<400> 21
Met Ile Leu Asn Lys Ala Leu Met Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Gly Arg
50 55 60
Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln Phe Arg Phe Asp
65 70 75 80
Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Leu Lys His Asn Leu Asn
85 90 95
Ser Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val Pro
100 105 110
Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro Asn
115 120 125
Ile Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn Ile
130 135 140
Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu Thr
145 150 155 160
Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr Leu
165 170 175
Thr Leu Leu Pro Ser Ser Glu Glu Ser Tyr Asp Cys Lys Val Glu His
180 185 190
Trp Gly Leu Asp Lys Pro Leu Leu Lys His Trp Glu Pro Glu Ile Pro
195 200 205
Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly Leu
210 215 220
Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile Arg
225 230 235 240
Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250
<210> 22
<211> 81
<212> PRT
<213> Homo sapiens
<400> 22
Asp His Val Ala Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Leu
1 5 10 15
Ser Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val
20 25 30
Asp Leu Gly Arg Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln
35 40 45
Phe Arg Phe Asp Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Leu Lys
50 55 60
His Asn Leu Asn Ser Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr
65 70 75 80
Asn
<210> 23
<211> 254
<212> PRT
<213> Homo sapiens
<400> 23
Met Ile Leu Asn Lys Ala Leu Met Leu Gly Thr Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Tyr
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Gly Arg
50 55 60
Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln Phe Arg Phe Asp
65 70 75 80
Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Leu Lys His Asn Leu Asn
85 90 95
Ser Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val Pro
100 105 110
Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro Asn
115 120 125
Ile Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn Ile
130 135 140
Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu Thr
145 150 155 160
Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr Leu
165 170 175
Thr Leu Leu Pro Ser Ala Glu Glu Ser Tyr Asp Cys Lys Val Glu His
180 185 190
Trp Gly Leu Asp Lys Pro Leu Leu Lys His Trp Glu Pro Glu Ile Pro
195 200 205
Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly Leu
210 215 220
Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile Arg
225 230 235 240
Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250
<210> 24
<211> 254
<212> PRT
<213> Homo sapiens
<400> 24
Met Ile Leu Asn Lys Ala Leu Leu Leu Gly Ala Leu Ala Leu Thr Thr
1 5 10 15
Val Met Ser Pro Cys Gly Gly Glu Asp Ile Val Ala Asp His Val Ala
20 25 30
Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Phe
35 40 45
Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Gly Arg
50 55 60
Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln Phe Arg Phe Asp
65 70 75 80
Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Thr Lys His Asn Leu Asn
85 90 95
Ile Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn Glu Val Pro
100 105 110
Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu Gly Gln Pro Asn
115 120 125
Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro Val Val Asn Ile
130 135 140
Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly Val Ser Glu Thr
145 150 155 160
Ser Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys Ile Ser Tyr Leu
165 170 175
Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys Lys Val Glu His
180 185 190
Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp Glu Pro Glu Ile Pro
195 200 205
Ala Pro Met Ser Glu Leu Thr Glu Thr Val Val Cys Ala Leu Gly Leu
210 215 220
Ser Val Gly Leu Val Gly Ile Val Val Gly Thr Val Phe Ile Ile Arg
225 230 235 240
Gly Leu Arg Ser Val Gly Ala Ser Arg His Gln Gly Pro Leu
245 250
<210> 25
<211> 75
<212> PRT
<213> Homo sapiens
<400> 25
Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro Ser Gly Gln Phe Thr His
1 5 10 15
Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val Asp Leu Gly Arg Lys Glu
20 25 30
Thr Val Trp Cys Leu Pro Val Leu Arg Gln Phe Arg Phe Asp Pro Gln
35 40 45
Phe Ala Leu Thr Asn Ile Ala Val Thr Lys His Asn Leu Asn Ile Leu
50 55 60
Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr Asn
65 70 75
<210> 26
<211> 175
<212> PRT
<213> Homo sapiens
<400> 26
Asp His Val Ala Ser Tyr Gly Val Asn Leu Tyr Gln Ser Tyr Gly Pro
1 5 10 15
Ser Gly Gln Phe Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val
20 25 30
Asp Leu Gly Arg Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln
35 40 45
Phe Arg Phe Asp Pro Gln Phe Ala Leu Thr Asn Ile Ala Val Thr Lys
50 55 60
His Asn Leu Asn Ile Leu Ile Lys Arg Ser Asn Ser Thr Ala Ala Thr
65 70 75 80
Asn Glu Val Pro Glu Val Thr Val Phe Ser Lys Ser Pro Val Thr Leu
85 90 95
Gly Gln Pro Asn Thr Leu Ile Cys Leu Val Asp Asn Ile Phe Pro Pro
100 105 110
Val Val Asn Ile Thr Trp Leu Ser Asn Gly His Ser Val Thr Glu Gly
115 120 125
Val Ser Glu Thr Arg Phe Leu Ser Lys Ser Asp His Ser Phe Phe Lys
130 135 140
Ile Ser Tyr Leu Thr Phe Leu Pro Ser Ala Asp Glu Ile Tyr Asp Cys
145 150 155 160
Lys Val Glu His Trp Gly Leu Asp Glu Pro Leu Leu Lys His Trp
165 170 175
<210> 27
<211> 260
<212> PRT
<213> Homo sapiens
<400> 27
Met Arg Pro Glu Asp Arg Met Phe His Ile Arg Ala Val Ile Leu Arg
1 5 10 15
Ala Leu Ser Leu Ala Phe Leu Leu Ser Leu Arg Gly Ala Gly Ala Ile
20 25 30
Lys Ala Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His Arg
35 40 45
Pro Thr Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Met Phe Tyr
50 55 60
Val Asp Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly
65 70 75 80
Gln Ala Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile
85 90 95
Leu Asn Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln
100 105 110
Ala Thr Asn Asp Pro Pro Glu Val Thr Val Phe Pro Lys Glu Pro Val
115 120 125
Glu Leu Gly Gln Pro Asn Thr Leu Ile Cys His Ile Asp Lys Phe Phe
130 135 140
Pro Pro Val Leu Asn Val Thr Trp Leu Cys Asn Gly Glu Leu Val Thr
145 150 155 160
Glu Gly Val Ala Glu Ser Leu Phe Leu Pro Arg Thr Asp Tyr Ser Phe
165 170 175
His Lys Phe His Tyr Leu Thr Phe Val Pro Ser Ala Glu Asp Phe Tyr
180 185 190
Asp Cys Arg Val Glu His Trp Gly Leu Asp Gln Pro Leu Leu Lys His
195 200 205
Trp Glu Ala Gln Glu Pro Ile Gln Met Pro Glu Thr Thr Glu Thr Val
210 215 220
Leu Cys Ala Leu Gly Leu Val Leu Gly Leu Val Gly Ile Ile Val Gly
225 230 235 240
Thr Val Leu Ile Ile Lys Ser Leu Arg Ser Gly His Asp Pro Arg Ala
245 250 255
Gln Gly Thr Leu
260
<210> 28
<211> 74
<212> PRT
<213> Homo sapiens
<400> 28
Ala Phe Val Gln Thr His Arg Pro Thr Gly Glu Phe Met Phe Glu Phe
1 5 10 15
Asp Glu Asp Glu Met Phe Tyr Val Asp Leu Asp Lys Lys Glu Thr Val
20 25 30
Trp His Leu Glu Glu Phe Gly Gln Ala Phe Ser Phe Glu Ala Gln Gly
35 40 45
Gly Leu Ala Asn Ile Ala Ile Leu Asn Asn Asn Leu Asn Thr Leu Ile
50 55 60
Gln Arg Ser Asn His Thr Gln Ala Thr Asn
65 70
<210> 29
<211> 81
<212> PRT
<213> Homo sapiens
<400> 29
Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Met Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Gln Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Thr
65 70 75 80
Asn
<210> 30
<211> 220
<212> PRT
<213> Homo sapiens
<400> 30
Ala Ala Phe Val Gln Thr His Arg Pro Thr Gly Glu Phe Met Phe Glu
1 5 10 15
Phe Asp Asp Asp Glu Met Phe Tyr Val Asp Leu Asp Lys Lys Glu Thr
20 25 30
Val Trp His Leu Glu Glu Phe Gly Gln Ala Phe Ser Phe Glu Ala Gln
35 40 45
Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn Asn Asn Leu Asn Thr Leu
50 55 60
Ile Gln Arg Ser Asn His Thr Gln Ala Thr Asn Asp Pro Pro Glu Val
65 70 75 80
Thr Val Phe Pro Lys Glu Pro Val Glu Leu Gly Gln Pro Asn Thr Leu
85 90 95
Ile Cys His Ile Asp Lys Phe Phe Pro Pro Val Leu Asn Val Thr Trp
100 105 110
Leu Cys Asn Gly Glu Leu Val Thr Glu Gly Val Ala Glu Ser Leu Phe
115 120 125
Leu Pro Arg Thr Asp Tyr Ser Phe His Lys Phe His Tyr Leu Thr Phe
130 135 140
Val Pro Ser Ala Glu Asp Phe Tyr Asp Cys Arg Val Glu His Trp Gly
145 150 155 160
Leu Asp Gln Pro Leu Leu Lys His Trp Glu Ala Gln Glu Pro Ile Gln
165 170 175
Met Pro Glu Thr Thr Glu Thr Val Leu Cys Ala Leu Gly Leu Val Leu
180 185 190
Gly Leu Val Gly Ile Ile Val Gly Thr Val Leu Ile Ile Lys Ser Leu
195 200 205
Arg Ser Gly His Asp Pro Arg Ala Gln Gly Thr Leu
210 215 220
<210> 31
<211> 75
<212> PRT
<213> Homo sapiens
<400> 31
Ala Ala Phe Val Gln Thr His Arg Pro Thr Gly Glu Phe Met Phe Glu
1 5 10 15
Phe Asp Glu Asp Glu Met Phe Tyr Val Asp Leu Asp Lys Lys Glu Thr
20 25 30
Val Trp His Leu Glu Glu Phe Gly Gln Ala Phe Ser Phe Glu Ala Gln
35 40 45
Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn Asn Asn Leu Asn Thr Leu
50 55 60
Ile Gln Arg Ser Asn His Thr Gln Ala Ala Asn
65 70 75
<210> 32
<211> 81
<212> PRT
<213> Homo sapiens
<400> 32
Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Gln Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Gln Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Thr
65 70 75 80
Asn
<210> 33
<211> 80
<212> PRT
<213> Homo sapiens
<400> 33
His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His Arg Pro Thr Gly
1 5 10 15
Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Met Phe Tyr Val Asp Leu
20 25 30
Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Gln Thr Phe
35 40 45
Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn Asn
50 55 60
Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Thr Asn
65 70 75 80
<210> 34
<211> 81
<212> PRT
<213> Homo sapiens
<400> 34
Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Met Phe Glu Phe Asp Asp Asp Glu Met Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Arg Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Thr
65 70 75 80
Asn
<210> 35
<211> 81
<212> PRT
<213> Homo sapiens
<400> 35
Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Thr Phe Glu Phe Asp Glu Asp Glu Met Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Gln Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Thr
65 70 75 80
Asn
<210> 36
<211> 229
<212> PRT
<213> Homo sapiens
<400> 36
Ile Lys Ala Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His
1 5 10 15
Arg Pro Thr Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Gln Phe
20 25 30
Tyr Val Asp Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe
35 40 45
Gly Arg Ala Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala
50 55 60
Ile Leu Asn Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr
65 70 75 80
Gln Ala Ala Asn Asp Pro Pro Glu Val Thr Val Phe Pro Lys Glu Pro
85 90 95
Val Glu Leu Gly Gln Pro Asn Thr Leu Ile Cys His Ile Asp Arg Phe
100 105 110
Phe Pro Pro Val Leu Asn Val Thr Trp Leu Cys Asn Gly Glu Pro Val
115 120 125
Thr Glu Gly Val Ala Glu Ser Leu Phe Leu Pro Arg Thr Asp Tyr Ser
130 135 140
Phe His Lys Phe His Tyr Leu Thr Phe Val Pro Ser Ala Glu Asp Val
145 150 155 160
Tyr Asp Cys Arg Val Glu His Trp Gly Leu Asp Gln Pro Leu Leu Lys
165 170 175
His Trp Glu Ala Gln Glu Pro Ile Gln Met Pro Glu Thr Thr Glu Thr
180 185 190
Val Leu Cys Ala Leu Gly Leu Val Leu Gly Leu Val Gly Ile Ile Val
195 200 205
Gly Thr Val Leu Ile Ile Lys Ser Leu Arg Ser Gly His Asp Pro Arg
210 215 220
Ala Gln Gly Pro Leu
225
<210> 37
<211> 81
<212> PRT
<213> Homo sapiens
<400> 37
Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Gln Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Arg Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Ala
65 70 75 80
Asn
<210> 38
<211> 74
<212> PRT
<213> Homo sapiens
<400> 38
Ala Phe Val Gln Thr His Arg Pro Thr Gly Glu Phe Met Phe Glu Phe
1 5 10 15
Asp Glu Asp Glu Gln Phe Tyr Val Asp Leu Asp Lys Lys Glu Thr Val
20 25 30
Trp His Leu Glu Glu Phe Gly Arg Ala Phe Ser Phe Glu Ala Gln Gly
35 40 45
Gly Leu Ala Asn Ile Ala Ile Leu Asn Asn Asn Leu Asn Thr Leu Ile
50 55 60
Gln Arg Ser Asn His Thr Gln Ala Ala Asn
65 70
<210> 39
<211> 86
<212> PRT
<213> Homo sapiens
<400> 39
Ile Lys Ala Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His
1 5 10 15
Arg Pro Thr Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Gln Phe
20 25 30
Tyr Val Asp Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe
35 40 45
Gly Arg Ala Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala
50 55 60
Ile Leu Asn Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr
65 70 75 80
Gln Ala Ala Asn Asp Pro
85
<210> 40
<211> 222
<212> PRT
<213> Homo sapiens
<400> 40
Thr Tyr Ala Met Phe Val Gln Thr His Arg Pro Thr Gly Glu Phe Met
1 5 10 15
Phe Glu Phe Asp Glu Asp Glu Gln Phe Tyr Val Asp Leu Asp Lys Lys
20 25 30
Glu Thr Val Trp His Leu Glu Glu Phe Gly Arg Ala Phe Ser Phe Glu
35 40 45
Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn Asn Asn Leu Asn
50 55 60
Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Ala Asn Asp Pro Pro
65 70 75 80
Glu Val Thr Val Phe Pro Lys Glu Pro Val Glu Leu Gly Gln Pro Asn
85 90 95
Thr Leu Ile Cys His Ile Asp Arg Phe Phe Pro Pro Val Leu Asn Val
100 105 110
Thr Trp Leu Cys Asn Gly Glu Pro Val Thr Glu Gly Val Ala Glu Ser
115 120 125
Leu Phe Leu Pro Arg Thr Asp Tyr Ser Phe His Lys Phe His Tyr Leu
130 135 140
Thr Phe Val Pro Ser Ala Glu Asp Val Tyr Asp Cys Arg Val Glu His
145 150 155 160
Trp Gly Leu Asp Gln Pro Leu Leu Lys His Trp Glu Ala Gln Glu Pro
165 170 175
Ile Gln Met Pro Glu Thr Thr Glu Thr Val Leu Cys Ala Leu Gly Leu
180 185 190
Val Leu Gly Leu Val Gly Ile Ile Val Gly Thr Val Leu Ile Ile Lys
195 200 205
Ser Leu Arg Ser Gly His Asp Pro Arg Ala Gln Gly Pro Leu
210 215 220
<210> 41
<211> 226
<212> PRT
<213> Homo sapiens
<400> 41
Asp His Val Ser Thr Tyr Ala Met Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Gln Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Arg Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Ala
65 70 75 80
Asn Asp Pro Pro Glu Val Thr Val Phe Pro Lys Glu Pro Val Glu Leu
85 90 95
Gly Gln Pro Asn Thr Leu Ile Cys His Ile Asp Arg Phe Phe Pro Pro
100 105 110
Val Leu Asn Val Thr Trp Leu Cys Asn Gly Glu Pro Val Thr Glu Gly
115 120 125
Val Ala Glu Ser Leu Phe Leu Pro Arg Thr Asp Tyr Ser Phe His Lys
130 135 140
Phe His Tyr Leu Thr Phe Val Pro Ser Ala Glu Asp Val Tyr Asp Cys
145 150 155 160
Arg Val Glu His Trp Gly Leu Asp Gln Pro Leu Leu Lys His Trp Glu
165 170 175
Ala Gln Glu Pro Ile Gln Met Pro Glu Thr Thr Glu Thr Val Leu Cys
180 185 190
Ala Leu Gly Leu Val Leu Gly Leu Val Gly Ile Ile Val Gly Thr Val
195 200 205
Leu Ile Ile Lys Ser Leu Arg Ser Gly His Asp Pro Arg Ala Gln Gly
210 215 220
Pro Leu
225
<210> 42
<211> 79
<212> PRT
<213> Homo sapiens
<400> 42
Val Ser Thr Tyr Ala Met Phe Val Gln Thr His Arg Pro Thr Gly Glu
1 5 10 15
Phe Met Phe Glu Phe Asp Glu Asp Glu Gln Phe Tyr Val Asp Leu Asp
20 25 30
Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Arg Ala Phe Ser
35 40 45
Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn Asn Asn
50 55 60
Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Ala Asn
65 70 75
<210> 43
<211> 81
<212> PRT
<213> Homo sapiens
<400> 43
Asp His Val Ser Thr Tyr Ala Ala Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Met Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Arg Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Ala
65 70 75 80
Asn
<210> 44
<211> 220
<212> PRT
<213> Homo sapiens
<400> 44
Ala Met Phe Val Gln Thr His Arg Pro Thr Gly Glu Phe Met Phe Glu
1 5 10 15
Phe Asp Glu Asp Glu Met Phe Tyr Val Asp Leu Asp Lys Lys Glu Thr
20 25 30
Val Trp His Leu Glu Glu Phe Gly Gln Ala Phe Ser Phe Glu Ala Gln
35 40 45
Gly Gly Leu Ala Asn Ile Ala Ile Ser Asn Asn Asn Leu Asn Thr Leu
50 55 60
Ile Gln Arg Ser Asn His Thr Gln Ala Thr Asn Asp Pro Pro Glu Val
65 70 75 80
Thr Val Phe Pro Lys Glu Pro Val Glu Leu Gly Gln Pro Asn Thr Leu
85 90 95
Ile Cys His Ile Asp Lys Phe Phe Pro Pro Val Leu Asn Val Thr Trp
100 105 110
Leu Cys Asn Gly Glu Leu Val Thr Glu Gly Val Ala Glu Ser Leu Phe
115 120 125
Leu Pro Arg Thr Asp Tyr Ser Phe His Lys Phe His Tyr Leu Thr Phe
130 135 140
Val Pro Ser Ala Glu Asp Phe Tyr Asp Cys Arg Val Glu His Trp Gly
145 150 155 160
Leu Asp Gln Pro Leu Leu Lys His Trp Glu Ala Gln Glu Pro Ile Gln
165 170 175
Met Pro Glu Thr Thr Glu Thr Val Leu Cys Ala Leu Gly Leu Val Leu
180 185 190
Gly Leu Val Gly Ile Ile Val Gly Thr Val Leu Ile Ile Lys Ser Leu
195 200 205
Arg Ser Gly His Asp Pro Arg Ala Gln Gly Thr Leu
210 215 220
<210> 45
<211> 81
<212> PRT
<213> Homo sapiens
<400> 45
Asp His Val Ser Thr Tyr Ala Met Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Met Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Gln Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Thr
65 70 75 80
Asn
<210> 46
<211> 81
<212> PRT
<213> Homo sapiens
<400> 46
Asp His Val Ser Thr Tyr Ala Met Phe Val Gln Thr His Arg Pro Thr
1 5 10 15
Gly Glu Phe Met Phe Glu Phe Asp Asp Asp Glu Met Phe Tyr Val Asp
20 25 30
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Gln Ala
35 40 45
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn Ile Ala Ile Ser Asn
50 55 60
Asn Asn Leu Asn Thr Leu Ile Gln Arg Ser Asn His Thr Gln Ala Thr
65 70 75 80
Asn
<210> 47
<211> 220
<212> PRT
<213> Homo sapiens
<400> 47
Ala Ala Phe Val Gln Thr His Arg Thr Thr Gly Glu Phe Met Phe Glu
1 5 10 15
Phe Asp Asp Asp Glu Met Phe Tyr Val Asp Leu Asp Lys Lys Glu Thr
20 25 30
Val Trp His Leu Glu Glu Phe Gly Arg Ala Phe Ser Phe Glu Ala Gln
35 40 45
Gly Gly Leu Ala Asn Ile Ala Ile Leu Asn Asn Asn Leu Asn Ile Ala
50 55 60
Ile Gln Arg Ser Asn His Thr Gln Ala Ala Asn Asp Pro Pro Glu Val
65 70 75 80
Thr Val Phe Pro Lys Glu Ala Val Glu Leu Gly Gln Pro Asn Thr Leu
85 90 95
Ile Cys His Ile Asp Lys Phe Phe Pro Pro Val Leu Asn Val Thr Trp
100 105 110
Leu Cys Asn Gly Glu Pro Val Thr Glu Gly Val Ala Glu Ser Leu Phe
115 120 125
Leu Pro Arg Thr Asp Tyr Ser Phe His Lys Phe His Tyr Leu Thr Phe
130 135 140
Val Pro Ser Ala Glu Asp Val Tyr Asp Cys Arg Val Glu His Trp Gly
145 150 155 160
Leu Asp Gln Pro Leu Leu Lys His Trp Glu Ala Gln Glu Pro Ile Gln
165 170 175
Met Pro Glu Thr Ala Glu Thr Val Leu Cys Ala Leu Gly Leu Val Leu
180 185 190
Gly Leu Val Gly Ile Ile Val Gly Thr Val Leu Ile Ile Lys Ser Leu
195 200 205
Arg Ser Gly His Asp Pro Arg Ala Gln Gly Pro Leu
210 215 220
<210> 48
<211> 261
<212> PRT
<213> Homo sapiens
<400> 48
Met Gly His Glu Gln Asn Gln Gly Ala Ala Leu Leu Gln Met Leu Pro
1 5 10 15
Leu Leu Trp Leu Leu Pro His Ser Trp Ala Val Pro Glu Ala Pro Thr
20 25 30
Pro Met Trp Pro Asp Asp Leu Gln Asn His Thr Phe Leu His Thr Val
35 40 45
Tyr Cys Gln Asp Gly Ser Pro Ser Val Gly Leu Ser Glu Ala Tyr Asp
50 55 60
Glu Asp Gln Leu Phe Phe Phe Asp Phe Ser Gln Asn Thr Arg Val Pro
65 70 75 80
Arg Leu Pro Glu Phe Ala Asp Trp Ala Gln Glu Gln Gly Asp Ala Pro
85 90 95
Ala Ile Leu Phe Asp Lys Glu Phe Cys Glu Trp Met Ile Gln Gln Ile
100 105 110
Gly Pro Lys Leu Asp Gly Lys Ile Pro Val Ser Arg Gly Phe Pro Ile
115 120 125
Ala Glu Val Phe Thr Leu Lys Pro Leu Glu Phe Gly Lys Pro Asn Thr
130 135 140
Leu Val Cys Phe Val Ser Asn Leu Phe Pro Pro Met Leu Thr Val Asn
145 150 155 160
Trp Gln His His Ser Val Pro Val Glu Gly Phe Gly Pro Thr Phe Val
165 170 175
Ser Ala Val Asp Gly Leu Ser Phe Gln Ala Phe Ser Tyr Leu Asn Phe
180 185 190
Thr Pro Glu Pro Ser Asp Ile Phe Ser Cys Ile Val Thr His Glu Ile
195 200 205
Asp Arg Tyr Thr Ala Ile Ala Tyr Trp Val Pro Arg Asn Ala Leu Pro
210 215 220
Ser Asp Leu Leu Glu Asn Val Leu Cys Gly Val Ala Phe Gly Leu Gly
225 230 235 240
Val Leu Gly Ile Ile Val Gly Ile Val Leu Ile Ile Tyr Phe Arg Lys
245 250 255
Pro Cys Ser Gly Asp
260
<210> 49
<211> 250
<212> PRT
<213> Homo sapiens
<400> 49
Met Ala Leu Arg Ala Gly Leu Val Leu Gly Phe His Thr Leu Met Thr
1 5 10 15
Leu Leu Ser Pro Gln Glu Ala Gly Ala Thr Lys Ala Asp His Met Gly
20 25 30
Ser Tyr Gly Pro Ala Phe Tyr Gln Ser Tyr Gly Ala Ser Gly Gln Phe
35 40 45
Thr His Glu Phe Asp Glu Glu Gln Leu Phe Ser Val Asp Leu Lys Lys
50 55 60
Ser Glu Ala Val Trp Arg Leu Pro Glu Phe Gly Asp Phe Ala Arg Phe
65 70 75 80
Asp Pro Gln Gly Gly Leu Ala Gly Ile Ala Ala Ile Lys Ala His Leu
85 90 95
Asp Ile Leu Val Glu Arg Ser Asn Arg Ser Arg Ala Ile Asn Val Pro
100 105 110
Pro Arg Val Thr Val Leu Pro Lys Ser Arg Val Glu Leu Gly Gln Pro
115 120 125
Asn Ile Leu Ile Cys Ile Val Asp Asn Ile Phe Pro Pro Val Ile Asn
130 135 140
Ile Thr Trp Leu Arg Asn Gly Gln Thr Val Thr Glu Gly Val Ala Gln
145 150 155 160
Thr Ser Phe Tyr Ser Gln Pro Asp His Leu Phe Arg Lys Phe His Tyr
165 170 175
Leu Pro Phe Val Pro Ser Ala Glu Asp Val Tyr Asp Cys Gln Val Glu
180 185 190
His Trp Gly Leu Asp Ala Pro Leu Leu Arg His Trp Glu Leu Gln Val
195 200 205
Pro Ile Pro Pro Pro Asp Ala Met Glu Thr Leu Val Cys Ala Leu Gly
210 215 220
Leu Ala Ile Gly Leu Val Gly Phe Leu Val Gly Thr Val Leu Ile Ile
225 230 235 240
Met Gly Thr Tyr Val Ser Ser Val Pro Arg
245 250
<210> 50
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - mouse MOG 35-55
<400> 50
Met Glu Val Gly Trp Tyr Arg Ser Pro Phe Ser Arg Val Val His Leu
1 5 10 15
Tyr Arg Asn Gly Lys
20
<210> 51
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - human MOG 35-55
<400> 51
Met Glu Val Gly Trp Tyr Arg Pro Pro Phe Ser Arg Val Val His Leu
1 5 10 15
Tyr Arg Asn Gly Lys
20
<210> 52
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - human MOG 1-25
<400> 52
Gly Gln Phe Arg Val Ile Gly Pro Arg His Pro Ile Arg Ala Leu Val
1 5 10 15
Gly Asp Glu Val
20
<210> 53
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - human MOG 94-116
<400> 53
Gly Gly Phe Thr Cys Phe Phe Arg Asp His Ser Tyr Gln Glu Glu Ala
1 5 10 15
Ala Met Glu Leu Lys Val Glu
20
<210> 54
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - human MOG 145-160
<400> 54
Val Phe Leu Cys Leu Gln Tyr Arg Leu Arg Gly Lys Leu Arg Ala Glu
1 5 10 15
<210> 55
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - human MOG 194-208
<400> 55
Leu Val Ala Leu Ile Ile Cys Tyr Asn Trp Leu His Arg Arg Leu
1 5 10 15
<210> 56
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - MBP 85-99
<400> 56
Glu Asn Pro Val Val His Phe Phe Lys Asn Ile Val Thr Pro Arg
1 5 10 15
<210> 57
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - MBP 145-164
<400> 57
Val Asp Ala Gln Gly Thr Leu Ser Lys Ile Phe Lys Leu Gly Gly Arg
1 5 10 15
Asp Ser Arg Ser
20
<210> 58
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - MBP 149-171
<400> 58
Gly Thr Leu Ser Lys Ile Phe Lys Leu Gly Gly Arg Asp Ser Arg Ser
1 5 10 15
Gly Ser Gly Pro Met Ala Arg Arg
20
<210> 59
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - PLP 139-151
<400> 59
Cys His Cys Leu Gly Lys Trp Leu Gly His Pro Asp Lys Phe Val Gly
1 5 10 15
<210> 60
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - PLP 95-116
<400> 60
Gly Ala Val Arg Gln Ile Phe Gly Asp Tyr Lys Thr Thr Ile Cys Gly
1 5 10 15
Lys Gly Leu Ser Ala Thr
20
<210> 61
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - IRBP 1177-1191
<400> 61
Ala Asp Gly Ser Ser Trp Glu Gly Val Gly Val Val Pro Asp Val
1 5 10 15
<210> 62
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - arrestin 291-310
<400> 62
Asn Arg Glu Arg Arg Gly Ile Ala Leu Asp Gly Lys Ile Lys His Glu
1 5 10 15
Asp Thr Asn Leu
20
<210> 63
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - phosducin 65-96
<400> 63
Lys Glu Arg Met Ser Arg Lys Met Ser Ile Gln Glu Tyr Glu Leu Ile
1 5 10 15
His Gln Asp Lys Glu Asp Glu Gly Cys Leu Arg Lys Tyr Arg Arg Gln
20 25 30
<210> 64
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - recoverin 48-52
<400> 64
Gln Phe Gln Ser Ile
1 5
<210> 65
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - recoverin 64-70
<400> 65
Lys Ala Tyr Ala Gln His Val
1 5
<210> 66
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - recoverin 62-81
<400> 66
Pro Lys Ala Tyr Ala Gln His Val Phe Arg Ser Phe Asp Ala Asn Ser
1 5 10 15
Asp Gly Thr Leu
20
<210> 67
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - 149-162
<400> 67
Glu Lys Arg Ala Glu Lys Ile Trp Ala Ser Phe Gly Lys Lys
1 5 10
<210> 68
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - collagen II 261-274
<400> 68
Ala Gly Phe Lys Gly Glu Gln Gly Pro Lys Gly Glu Pro Gly
1 5 10
<210> 69
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - collagen II 259-273
<400> 69
Gly Ile Ala Gly Phe Lys Gly Glu Gln Gly Pro Lys Gly Glu Pro
1 5 10 15
<210> 70
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - collagen II 257-270
<400> 70
Glu Pro Gly Ile Ala Gly Phe Lys Gly Glu Gln Gly Pro Lys
1 5 10
<210> 71
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - modified collagen II 257-270
<400> 71
Ala Pro Gly Ile Ala Gly Phe Lys Ala Glu Gln Ala Ala Lys
1 5 10
<210> 72
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - fibrinogen-alpha 40-59
<400> 72
Val Glu Arg His Gln Ser Ala Cys Lys Asp Ser Asp Trp Pro Phe Cys
1 5 10 15
Ser Asp Glu Asp
20
<210> 73
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - fibrinogen-alpha 616-625
<400> 73
Thr His Ser Thr Lys Arg Gly His Ala Lys Ser Arg Pro Val Arg Gly
1 5 10 15
Ile His Thr Ser
20
<210> 74
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - fibrinogen-alpha 79-91
<400> 74
Gln Asp Phe Thr Asn Arg Ile Asn Lys Leu Lys Asn Ser
1 5 10
<210> 75
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - fibrinogen-alpha 121-140
<400> 75
Asn Asn Arg Asp Asn Thr Tyr Asn Arg Val Ser Glu Asp Leu Arg Ser
1 5 10 15
Arg Ile Glu Val
20
<210> 76
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - vimentin 59-79
<400> 76
Gly Val Tyr Ala Thr Arg Ser Ser Ala Val Arg Leu Arg Ser Ser Val
1 5 10 15
Pro Gly Val Arg Leu
20
<210> 77
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - vimentin 26-44
<400> 77
Ser Ser Arg Ser Tyr Val Thr Thr Ser Thr Arg Thr Tyr Ser Leu Gly
1 5 10 15
Ser Ala Leu
<210> 78
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - vimentin 256-275
<400> 78
Ile Asp Val Asp Val Ser Lys Pro Asp Leu Thr Ala Ala Leu Arg Asp
1 5 10 15
Val Arg Gln Gln
20
<210> 79
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - vimentin 415-433
<400> 79
Leu Pro Asn Phe Ser Ser Leu Asn Leu Arg Glu Thr Asn Leu Asp Ser
1 5 10 15
Leu Pro Leu
<210> 80
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - alpha-enolase 5-21
<400> 80
Lys Ile His Ala Arg Glu Ile Phe Asp Ser Arg Gly Asn Pro Thr Val
1 5 10 15
Glu
<210> 81
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - cartilage glycoprotein-39 259-271
<400> 81
Pro Thr Phe Gly Arg Ser Phe Thr Leu Ala Ser Ser Glu
1 5 10
<210> 82
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - alpha 2-gliadin 61-
<400> 82
Pro Gln Pro Glu Leu Pro Tyr Pro Gln Pro
1 5 10
<210> 83
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - alpha 2-gliadin 58-77
<400> 83
Leu Gln Pro Phe Pro Gln Pro Gln Leu Pro Tyr Pro Gln Pro Gln Leu
1 5 10 15
Pro Tyr Pro Gln
20
<210> 84
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - insulin B 9-23
<400> 84
Ser His Leu Val Glu Ala Leu Tyr Leu Val Cys Gly Glu Arg Gly
1 5 10 15
<210> 85
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - insulin B 16-23
<400> 85
Tyr Leu Val Cys Gly Glu Arg Gly
1 5
<210> 86
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 86
Phe Ala Ser Phe Glu Ala Gln Gly Ala Lys Ala Asn Ile Ala Val Asp
1 5 10 15
Lys Ala
<210> 87
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 87
Arg Leu Glu Glu Phe Ala Ser Phe Glu Ala Gln Gly Ala Lys Ala Asn
1 5 10 15
Ile Ala Val Asp Lys Ala
20
<210> 88
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 88
Asn Gly Arg Pro Val Thr Glu Gly Val Ser Glu Thr Val Phe Leu Pro
1 5 10 15
Arg Asp
<210> 89
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 89
Leu Asp Lys Leu Thr Ile Thr Ser Gln Asn Leu Gln Leu Glu Ser Leu
1 5 10 15
Arg Met
<210> 90
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 90
Asn Ser Leu Glu Glu Lys Lys Pro Thr Glu Ala Pro Pro Lys Val
1 5 10 15
<210> 91
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 91
Glu Pro Leu Asp Met Glu Asp Leu Ser Ser Gly Leu Gly Val Thr Arg
1 5 10 15
Gln
<210> 92
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 92
Ala Gly Leu Gln Phe Pro Val Gly Arg Val
1 5 10
<210> 93
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 93
His Leu Gln Leu Ala Ile Arg Asn
1 5
<210> 94
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 94
His Leu Gln Leu Ala Ile Arg Asn Asp Glu Glu Leu Asn Lys Leu
1 5 10 15
<210> 95
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 95
Val Thr Ile Gln Gly Gly Val Leu Pro Asn Ile Gln Ala Val Leu Leu
1 5 10 15
Pro Lys Lys
<210> 96
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 96
Val Thr Ile Gln Gly Gly Val Leu Pro Asn Ile Gln Ala Val Leu Leu
1 5 10 15
Pro Lys Lys Thr
20
<210> 97
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 97
Ser Arg Lys Glu Ser Tyr Ser Val Tyr Val Tyr Lys Val Leu Lys Gln
1 5 10 15
<210> 98
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 98
Ala Met Gly Ile Met Asn Ser Phe Val Asn Asp Ile Phe Glu Arg Ile
1 5 10 15
<210> 99
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 99
Glu Ile Gln Thr Ala Val Arg Leu Leu Leu Pro Gly Glu Leu Ala Lys
1 5 10 15
His
<210> 100
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 100
Leu Leu Leu Pro Gly Glu Leu Ala Lys His Ala Val Ser Glu Gly Thr
1 5 10 15
Lys Ala
<210> 101
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 101
His Ala Val Ser Glu Gly Thr Lys Ala Val Thr Lys Tyr Thr Ser Ser
1 5 10 15
Lys
<210> 102
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 102
Glu Ile Ala Lys Asp Phe Lys Thr Asp Leu Arg Phe
1 5 10
<210> 103
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 103
Leu Val Gly Leu Phe Glu Asp Thr Asn Leu Cys Ala Ile His Ala Lys
1 5 10 15
Arg
<210> 104
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 104
Asp Ile Lys Leu Ala Arg Arg
1 5
<210> 105
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 105
Asp Asn Ile Gln Gly Ile Thr Lys Pro Ala Ile Arg Arg
1 5 10
<210> 106
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 106
Arg Ile Ser Gly Leu Ile Tyr Glu Glu Thr Arg Gly Val Leu Lys Val
1 5 10 15
<210> 107
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 107
Lys Thr Val Thr Ala Met Asp Val Val Tyr Ala Leu Lys Arg Gln
1 5 10 15
<210> 108
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide binding to pDR2/hMOG35-55
<400> 108
Thr Leu Tyr Gly Phe Gly Gly
1 5
<210> 109
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide - HLA-DRA 38-58
<400> 109
Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly Arg Phe Ala Ser
1 5 10 15
Phe Glu Ala Gln Gly
20
<210> 110
<211> 43
<212> PRT
<213> Artificial Sequence
<220>
<223> Partial DR alpha1 sequence
<400> 110
Gly Glu Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His Val Asp
1 5 10 15
Met Ala Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly Arg Phe
20 25 30
Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn
35 40
<210> 111
<211> 43
<212> PRT
<213> Artificial Sequence
<220>
<223> Partial DR4 alpha1 sequence
<400> 111
Gly Glu Phe Met Phe Asp Phe Asp Gly Asp Glu Ile Phe His Val Asp
1 5 10 15
Met Ala Lys Lys Glu Thr Val Trp Arg Leu Glu Glu Phe Gly Arg Phe
20 25 30
Ala Ser Phe Glu Ala Gln Gly Ala Leu Ala Asn
35 40
<210> 112
<211> 43
<212> PRT
<213> Artificial Sequence
<220>
<223> Partial DP2 alpha1 sequence
<400> 112
Gly Glu Phe Met Phe Glu Phe Asp Glu Asp Glu Met Phe Tyr Val Asp
1 5 10 15
Leu Asp Lys Lys Glu Thr Val Trp His Leu Glu Glu Phe Gly Gln Ala
20 25 30
Phe Ser Phe Glu Ala Gln Gly Gly Leu Ala Asn
35 40
<210> 113
<211> 44
<212> PRT
<213> Artificial Sequence
<220>
<223> Partial DQ2 alpha1 sequence
<400> 113
Ser Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu Gln Phe Tyr Val
1 5 10 15
Asp Leu Gly Arg Lys Glu Thr Val Trp Cys Leu Pro Val Leu Arg Gln
20 25 30
Phe Arg Gly Phe Asp Pro Gln Phe Ala Leu Thr Asn
35 40
<210> 114
<211> 44
<212> PRT
<213> Artificial Sequence
<220>
<223> Partial IAs alpha1 sequence
<400> 114
Ile Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu Trp Phe Tyr Val
1 5 10 15
Asp Leu Asp Lys Lys Glu Thr Ile Trp Met Leu Pro Glu Phe Gly Gln
20 25 30
Leu Thr Ser Phe Asp Pro Gln Gly Gly Leu Gln Asn
35 40
<210> 115
<211> 44
<212> PRT
<213> Artificial Sequence
<220>
<223> Partial IAg7 alpha1 sequence
<400> 115
Ile Gly Gln Tyr Thr His Glu Phe Asp Gly Asp Glu Leu Phe Tyr Val
1 5 10 15
Asp Leu Asp Lys Lys Lys Thr Val Trp Arg Leu Pro Glu Phe Gly Gln
20 25 30
Leu Ile Leu Phe Glu Pro Gln Gly Gly Leu Gln Asn
35 40
<210> 116
<211> 44
<212> PRT
<213> Artificial Sequence
<220>
<223> Partial RT1.B alpha1 sequence
<400> 116
Arg Gly Gln Phe Thr His Glu Phe Asp Gly Asp Glu Glu Phe Tyr Val
1 5 10 15
Asp Leu Asp Lys Lys Glu Thr Ile Trp Arg Ile Pro Glu Phe Gly Gln
20 25 30
Leu Thr Ser Phe Asp Pro Gln Gly Gly Leu Gln Asn
35 40
Claims (57)
- 단리된 폴리펩티드로서,
주조직적합성 복합체(MHC) 클래스 II α1 도메인을 포함하고, 이때 MHC 클래스 II α2, β1 또는 β2 도메인을 포함하지 않으며; 또는
CD74에 결합할 수 있거나 CD74의 발현 또는 활성을 감소시킬 수 있는 MHC 클래스 II α1 도메인의 부분을 포함하는 것인 단리된 폴리펩티드. - 제1항에 있어서, α1 도메인이 인간 MHC 클래스 II α1 도메인을 포함하는 것인 단리된 폴리펩티드.
- 제2항에 있어서, α1 도메인이 DR-α1, DQ-α1, DP-α1, DM-α1 또는 DO-α1 도메인을 포함하는 것인 단리된 폴리펩티드.
- 제1항 내지 제3항 중 어느 한 항에 있어서, MHC 클래스 II α1 도메인이 성숙 MHC 클래스 II α 쇄의 아미노산 잔기 1 내지 75, 또는 이의 5개 이상의 인접 아미노산(contiguous amino acid)을 포함하는 것인 단리된 폴리펩티드.
- 제1항 내지 제5항 중 어느 한 항에 있어서, α1 도메인이 서열번호 1 내지 49 중 어느 하나에 기재된 아미노산 서열을 포함하는 α 쇄로부터의 α1 도메인을 포함하는 것인 단리된 폴리펩티드.
- 제1항에 있어서, MHC 클래스 II α1 도메인의 부분이 성숙 DR-α 쇄의 아미노산 잔기 38 내지 58 또는 이의 부분, 또는 DPα 또는 DQα의 상동 영역을 포함하는 것인 단리된 폴리펩티드.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 항원 결정기를 추가로 포함하는 것인 단리된 폴리펩티드.
- 제7항에 있어서, 항원 결정기가 α1 도메인에 공유 결합되어 있는 것인 단리된 폴리펩티드.
- 제6항에 있어서, 공유 결합이 펩티드 링커 또는 화학적 가교제를 포함하는 것인 단리된 폴리펩티드.
- 제7항 내지 제9항 중 어느 한 항에 있어서, 항원 결정기가 수초 단백질 펩티드 항원, 셀리악병 관련 펩티드 항원, 류마티스성 관절염 관련 펩티드 항원, 포도막염 관련 펩티드 항원 또는 I형 당뇨병 관련 펩티드 항원을 포함하는 것인 단리된 폴리펩티드.
- 제10항에 있어서, 항원 결정기가 수초 희소돌기아교세포 당단백질(MOG) 펩티드, 수초 염기성 단백질(MBP) 펩티드 또는 단백지질 단백질(PLP) 펩티드를 포함하는 수초 단백질 펩티드 항원인 단리된 폴리펩티드.
- 제11항에 있어서, 수초 단백질 펩티드 항원이 MOG35-55, MBP85-99, MBP149-171 또는 PLP139-151을 포함하는 것인 단리된 폴리펩티드.
- 제10항에 있어서, 항원 결정기가 인슐린 B:16-23을 포함하는 I형 당뇨병 관련 펩티드 항원인 단리된 폴리펩티드.
- 제1항 내지 제13항 중 어느 한 항의 폴리펩티드를 코딩하는 단리된 핵산 분자.
- 프로모터에 작동가능하게 연결된 제14항의 단리된 핵산 분자를 포함하는 벡터.
- 제1항 내지 제13항 중 어느 한 항의 단리된 폴리펩티드 또는 제14항 또는 제15항의 단리된 핵산 분자, 및 약학적으로 허용가능한 담체를 포함하는 약학 조성물.
- 대상체에서 장애를 치료하거나 억제하는 방법으로서, 유효량의 제1항 내지 제13항 중 어느 한 항의 단리된 폴리펩티드, 제14항 또는 제15항의 단리된 핵산 분자, 또는 제16항의 약학 조성물을 상기 대상체에게 투여하여 상기 장애를 치료하거나 억제하는 단계를 포함하는 것인 방법.
- 제17항에 있어서, 장애가 염증성 및/또는 자가면역 장애를 포함하는 것인 방법.
- 제18항에 있어서, 염증성 및/또는 자가면역 장애가 다발성 경화증, 셀리악병, 류마티스성 관절염, I형 진성 당뇨병, 염증성 장 질환, 강직 척추염, 굿파스처 증후군, 하시모토 갑상선염, 전신 홍반 루푸스, 건선, 포도막염, 시신경염을 포함하는 것인 방법.
- 제17항에 있어서, 장애가 망막 장애, 뇌졸중 또는 물질 중독을 포함하는 것인 방법.
- 제20항에 있어서, 물질 중독이 암페타민 남용을 포함하는 것인 방법.
- 제17항 내지 제21항 중 어느 한 항에 있어서, 폴리펩티드, 핵산 또는 약학 조성물이 비경구 또는 경구 투여되는 것인 방법.
- 제17항 내지 제22항 중 어느 한 항에 있어서, 대상체가 약 10 ㎍ 내지 약 1 g의 폴리펩티드, 핵산 또는 약학 조성물을 투여받는 것인 방법.
- 제17항 내지 제22항 중 어느 한 항에 있어서, 장애의 치료 또는 억제가 대조군에 비해 CD74의 발현 또는 활성의 감소를 포함하는 것인 방법.
- 제17항 내지 제24항 중 어느 한 항에 있어서, 대상체로부터의 샘플에서 CD74 발현 또는 활성 수준을 측정하는 단계를 추가로 포함하는 것인 방법.
- 제24항 또는 제25항에 있어서, CD74 발현 수준이 CD74 RNA 및/또는 단백질 발현 수준을 포함하는 것인 방법.
- 제24항 또는 제25항에 있어서, CD74 활성 수준이 NFκB 활성, 세포 증식, 아폽토시스, 또는 이들 중 둘 이상의 조합을 포함하는 것인 방법.
- 제25항 내지 제27항 중 어느 한 항에 있어서, 대상체로부터의 샘플이 단핵세포, B 세포, CD11b+ 세포, CD34+ 세포, CD4+ 세포, CD19+ 세포, CD74+ 세포, 또는 이들 중 둘 이상의 조합을 포함하는 것인 방법.
- 제25항 내지 제28항 중 어느 한 항에 있어서, CD74 발현 또는 활성 수준을 대조군과 비교하는 단계, 및 CD74 발현 또는 활성 수준이 대조군보다 더 큰 경우 단리된 폴리펩티드, 단리된 핵산 또는 약학 조성물의 용량 또는 빈도를 증가시키는 단계를 추가로 포함하는 것인 방법.
- MHC 클래스 II α1 도메인, MHC 클래스 II β1 도메인 또는 이들의 조합을 포함하되 α2 도메인 또는 β2 도메인을 포함하지 않는 폴리펩티드로 대상체에서의 장애의 치료 효능을 측정하는 방법으로서,
상기 대상체로부터의 샘플에서 CD74 발현 또는 활성 수준을 측정하는 단계;
상기 CD74 발현 또는 활성 수준을 대조군과 비교하는 단계; 및
치료 효능을 측정하는 단계로서, 이때 상기 CD74 발현 또는 활성 수준이 대조군보다 적거나 대조군과 동등한 경우 치료가 효과적인 것으로 간주하는 것인 단계
를 포함하는 것인 방법. - 대상체에서 장애의 치료 효능을 최적화하는 방법으로서,
MHC 클래스 II α1 도메인, MHC 클래스 II β1 도메인 또는 이들의 조합을 포함하되 α2 도메인 또는 β2 도메인을 포함하지 않는 폴리펩티드를 상기 장애를 갖는 대상체에게 투여하는 단계;
상기 대상체로부터의 샘플에서 CD74 발현 또는 활성 수준을 측정하는 단계;
상기 CD74 발현 또는 활성 수준을 대조군과 비교하는 단계; 및
상기 대상체에게 후속적으로 투여될 폴리펩티드의 용량을 결정함으로써 상기 대상체에서 상기 장애의 치료 효능을 최적화하는 단계로서, 이때 대조군보다 더 큰 CD74 발현 또는 활성 수준이 상기 폴리펩티드의 용량을 증가시켜야 한다는 것을 표시하고, 대조군보다 적거나 대조군과 동등한 CD74 발현 또는 활성 수준이 상기 폴리펩티드의 용량을 감소시켜야 한다는 것을 표시하는 것인 단계
를 포함하는 것인 방법. - 대상체에서 장애를 치료하거나 억제하는 방법으로서,
MHC 클래스 II α1 도메인, MHC 클래스 II β1 도메인 또는 이들의 조합을 포함하되 α2 도메인 또는 β2 도메인을 포함하지 않는 폴리펩티드의 일정 용량을 상기 장애를 갖는 대상체에게 투여하는 단계로서, 상기 대상체로부터의 샘플에서 CD74 발현 또는 활성 수준이 대조군보다 더 큰 경우 상기 폴리펩티드의 용량을 증가시키거나, 또는 상기 대상체로부터의 샘플에서 CD74 발현 또는 활성 수준이 대조군보다 더 적거나 대조군과 동등한 경우 상기 폴리펩티드의 용량을 감소시키는 것인 단계를 포함하는 것인 방법. - 제30항 내지 제32항 중 어느 한 항에 있어서, CD74 발현 수준이 CD74 RNA 및/또는 단백질 발현 수준을 포함하는 것인 방법.
- 제30항 내지 제32항 중 어느 한 항에 있어서, CD74 활성 수준이 NFκB 활성, 세포 증식, 아폽토시스 또는 이들의 조합을 포함하는 것인 방법.
- 제30항 내지 제34항 중 어느 한 항에 있어서, 폴리펩티드가
주조직적합성 복합체(MHC) 클래스 II α1 도메인을 포함하고, 이때 MHC 클래스 II α2, β1 또는 β2 도메인을 포함하지 않으며; 또는
CD74에 결합할 수 있거나 CD74의 발현 또는 활성을 감소시킬 수 있는 MHC 클래스 II α1 도메인의 부분을 포함하는 것인 방법. - 제30항 내지 제34항 중 어느 한 항에 있어서, 폴리펩티드가 MHC 클래스 II β1 및 MHC 클래스 II α1 도메인을 포함하고, 이때 α1 도메인의 아미노 말단이 β1 도메인의 카르복시 말단에 공유 결합되어 있고, 상기 폴리펩티드가 α2 또는 β2 도메인을 포함하지 않는 것인 방법.
- 제35항 또는 제36항에 있어서, α1 도메인이 인간 MHC 클래스 II α1 도메인을 포함하는 것인 방법.
- 제37항에 있어서, α1 도메인이 DR-α, DQ-α1, DP-α1, DM-α1 또는 DO-α1 도메인을 포함하는 것인 방법.
- 제35항 내지 제38항 중 어느 한 항에 있어서, MHC 클래스 II α1 도메인이 MHC 클래스 II α 쇄의 아미노산 잔기 1 내지 75, 또는 이의 5개 이상의 인접 아미노산을 포함하는 것인 방법.
- 제37항 내지 제39항 중 어느 한 항에 있어서, α1 도메인이 서열번호 1 내지 49 중 어느 하나에 기재된 아미노산 서열을 포함하는 α 쇄로부터의 α1 도메인을 포함하는 것인 방법.
- 제37항에 있어서, MHC 클래스 II α1 도메인의 부분이 DR-α 쇄의 아미노산 잔기 38 내지 58, 또는 DP-α 또는 DQα의 상동 영역을 포함하는 것인 방법.
- 제41항에 있어서, β1 도메인이 DR, DQ 또는 DP β1 도메인을 포함하는 것인 방법.
- 제30항 내지 제42항 중 어느 한 항에 있어서, 폴리펩티드가 항원 결정기를 추가로 포함하는 것인 방법.
- 제43항에 있어서, 항원 결정기가 α1 도메인에 공유 결합되어 있는 것인 방법.
- 제44항에 있어서, 공유 결합이 펩티드 링커 또는 화학적 가교제를 포함하는 것인 방법.
- 제43항 내지 제45항 중 어느 한 항에 있어서, 항원 결정기가 수초 단백질 펩티드 항원, 셀리악병 관련 펩티드 항원, 류마티스성 관절염 관련 펩티드 항원, 포도막염 관련 펩티드 항원 또는 I형 당뇨병 관련 펩티드 항원을 포함하는 것인 방법.
- 제46항에 있어서, 항원 결정기가 수초 희소돌기아교세포 당단백질(MOG) 펩티드, 수초 염기성 단백질(MBP) 펩티드 또는 단백지질 단백질(PLP) 펩티드를 포함하는 수초 단백질 펩티드 항원인 방법.
- 제47항에 있어서, 수초 단백질 펩티드 항원이 MOG35-55, MBP85-99, MBP149-171 또는 PLP139-151을 포함하는 것인 방법.
- 제47항에 있어서, 항원 결정기가 인슐린 B:16-23을 포함하는 I형 당뇨병 관련 펩티드 항원인 방법.
- 제30항 내지 제49항 중 어느 한 항에 있어서, 대상체로부터의 샘플이 단핵세포, B 세포, CD11B+ 세포, CD34+ 세포, CD4+ 세포, CD19+ 세포, CD74+ 세포, 또는 이들의 조합을 포함하는 것인 방법.
- 제30항 내지 제50항 중 어느 한 항에 있어서, 장애가 염증성 및/또는 자가면역 장애를 포함하는 것인 방법.
- 제51항에 있어서, 염증성 및/또는 자가면역 장애가 다발성 경화증, 셀리악병, 류마티스성 관절염, I형 진성 당뇨병, 염증성 장 질환, 강직 척추염, 굿파스처 증후군, 하시모토 갑상선염, 전신 홍반 루푸스, 건선, 포도막염, 시신경염을 포함하는 것인 방법.
- 제30항 내지 제50항 중 어느 한 항에 있어서, 장애가 망막 장애, 뇌졸중 또는 물질 중독을 포함하는 것인 방법.
- 제30항 내지 제53항 중 어느 한 항에 있어서, 후속 용량의 폴리펩티드를 대상체에게 투여하는 단계를 추가로 포함하고, 이때 상기 용량이 CD74 발현 또는 활성 수준을 기초로 하여 조절되는 것인 방법.
- 세포에서 CD74 발현 또는 활성 수준을 감소시키는 방법으로서,
폴리펩티드를 상기 세포와 접촉시키는 단계를 포함하며, 상기 폴리펩티드는
주조직적합성 복합체(MHC) 클래스 II α1 도메인을 포함하고, 이때 MHC 클래스 II α2, β1 또는 β2 도메인을 포함하지 않으며; 또는
CD74에 결합할 수 있거나 CD74의 발현 또는 활성을 감소시킬 수 있는 MHC 클래스 II α1 도메인의 부분을 포함하는 것인 방법. - 대상체에서 장애를 치료하거나 억제하는 데에 사용되기 위한 제1항 내지 제13항 중 어느 한 항의 단리된 폴리펩티드, 제14항 또는 제15항의 단리된 핵산 분자, 또는 약학 조성물.
- 제56항에 있어서, 장애가 염증성 및/또는 자가면역 장애, 망막 장애, 뇌졸중 또는 물질 중독을 포함하는 것인 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261584045P | 2012-01-06 | 2012-01-06 | |
| US61/584,045 | 2012-01-06 | ||
| PCT/US2013/020287 WO2013103816A1 (en) | 2012-01-06 | 2013-01-04 | Partial mhc constructs and methods of use |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140114859A true KR20140114859A (ko) | 2014-09-29 |
Family
ID=47561855
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147021913A KR20140114859A (ko) | 2012-01-06 | 2013-01-04 | 부분적 mhc 구축물 및 이의 사용 방법 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20150044245A1 (ko) |
| EP (1) | EP2800582A1 (ko) |
| JP (1) | JP6364352B2 (ko) |
| KR (1) | KR20140114859A (ko) |
| CN (1) | CN104105503A (ko) |
| AU (1) | AU2013207489A1 (ko) |
| BR (1) | BR112014016652A2 (ko) |
| CA (1) | CA2860678A1 (ko) |
| MX (1) | MX2014008146A (ko) |
| RU (1) | RU2014132426A (ko) |
| WO (1) | WO2013103816A1 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8685404B2 (en) * | 2011-01-31 | 2014-04-01 | Oregon Health & Science University | Recombinant T-cell receptor ligand for the treatment of cognitive and neuropsychiatric impairment induced by substance addiction |
| WO2015051328A1 (en) * | 2013-10-03 | 2015-04-09 | Oregon Health & Science University | TREATMENT OF ISCHEMIC STROKE WITH DRα1-MOG-35-55 |
| EP3052526A4 (en) * | 2013-10-03 | 2017-04-19 | Oregon Health & Science University | Recombinant polypeptides comprising mhc class ii 1 domains |
| WO2017070569A1 (en) | 2015-10-23 | 2017-04-27 | Oregon Health & Science University | Compounds that bind macrophage migration inhibitory factor |
| WO2017120483A1 (en) | 2016-01-08 | 2017-07-13 | Oregon Health & Science University | Recombinant t cell receptor ligand compositions and methods for treatment of prostate cancer |
| US20190248867A1 (en) * | 2016-07-01 | 2019-08-15 | Loma Linda University | Myelin oligodendrocyte glycoprotein-specific peptide for the treatment or prevention of multiple sclerosis |
| AU2019321536A1 (en) * | 2018-08-14 | 2021-02-25 | Board Of Regents, The University Of Texas System | Single molecule sequencing peptides bound to the major histocompatibility complex |
| JP2022504217A (ja) | 2018-10-05 | 2022-01-13 | オレゴン ヘルス アンド サイエンス ユニバーシティー | 改変されたMHCクラスII DRα1ドメインを含む組換えポリペプチドおよび使用方法 |
| EP4069722A1 (en) * | 2019-12-02 | 2022-10-12 | Regeneron Pharmaceuticals, Inc. | Peptide-mhc ii protein constructs and uses thereof |
| DE102020109447A1 (de) * | 2020-04-03 | 2021-10-07 | Jacobs University Bremen Ggmbh | Synthetisches mhc-klasse-ii-protein |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5468481A (en) | 1988-06-23 | 1995-11-21 | Amergen, Inc. | MHC class II-peptide conjugates useful in ameliorating autoimmunity |
| JP3603374B2 (ja) * | 1995-04-14 | 2004-12-22 | 東レ株式会社 | 融合蛋白質およびその融合蛋白質を固定化した材料 |
| DK0935607T3 (da) * | 1996-08-16 | 2004-12-06 | Harvard College | Oplöselige monovalente og multivalente MHC klasse II-fusionsproteiner samt anvendelser deraf |
| US20030007978A1 (en) | 1997-09-16 | 2003-01-09 | Burrows Gregory G. | Recombinant MHC molecules useful for manipulation of antigen-specific T-cells |
| DE69840600D1 (de) | 1997-09-16 | 2009-04-09 | Univ Oregon Health & Science | Rekombinante mhc-moleküle welche nützlich sind für die manipulation von antigen-spezifischen t-zellen |
| US6232445B1 (en) * | 1997-10-29 | 2001-05-15 | Sunol Molecular Corporation | Soluble MHC complexes and methods of use thereof |
| JP2002504342A (ja) * | 1998-02-19 | 2002-02-12 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 一価mhc結合ドメイン融合タンパク質および接合体、多価mhc結合ドメイン融合タンパク質および接合体、ならびに多量体mhc結合ドメイン融合タンパク質および接合体、そしてそれらのための使用 |
| CA2537759C (en) * | 2003-09-05 | 2015-03-24 | Oregon Health & Science University | Monomeric recombinant mhc molecules useful for manipulation of antigen-specific t cells |
| US7576183B2 (en) * | 2003-12-24 | 2009-08-18 | Los Alamos National Security, Llc | Structure-based receptor MIMICS targeted against bacterial superantigen toxins |
| JP2008537736A (ja) | 2005-03-18 | 2008-09-25 | オレゴン ヘルス アンド サイエンス ユニバーシティ | 抗原特異的t細胞の操作に有用な組換えmhc分子 |
| US8491913B2 (en) | 2009-03-07 | 2013-07-23 | Oregon Health & Science University | Compositions and methods using recombinant MHC molecules for the treatment of stroke |
| US20110008382A1 (en) | 2009-03-07 | 2011-01-13 | Burrows Gregory G | Compositions and methods using recombinant MHC molecules for the treatment of uveitis |
-
2013
- 2013-01-04 EP EP13700425.5A patent/EP2800582A1/en not_active Withdrawn
- 2013-01-04 BR BR112014016652A patent/BR112014016652A2/pt not_active IP Right Cessation
- 2013-01-04 US US14/370,454 patent/US20150044245A1/en not_active Abandoned
- 2013-01-04 RU RU2014132426A patent/RU2014132426A/ru not_active Application Discontinuation
- 2013-01-04 CA CA2860678A patent/CA2860678A1/en not_active Abandoned
- 2013-01-04 JP JP2014551338A patent/JP6364352B2/ja not_active Expired - Fee Related
- 2013-01-04 KR KR1020147021913A patent/KR20140114859A/ko active Search and Examination
- 2013-01-04 AU AU2013207489A patent/AU2013207489A1/en not_active Abandoned
- 2013-01-04 CN CN201380004958.1A patent/CN104105503A/zh active Pending
- 2013-01-04 MX MX2014008146A patent/MX2014008146A/es unknown
- 2013-01-04 WO PCT/US2013/020287 patent/WO2013103816A1/en active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| BR112014016652A2 (pt) | 2019-09-24 |
| WO2013103816A8 (en) | 2014-06-26 |
| MX2014008146A (es) | 2016-02-03 |
| CA2860678A1 (en) | 2013-07-11 |
| CN104105503A (zh) | 2014-10-15 |
| RU2014132426A (ru) | 2016-02-27 |
| AU2013207489A1 (en) | 2014-08-28 |
| WO2013103816A1 (en) | 2013-07-11 |
| US20150044245A1 (en) | 2015-02-12 |
| JP6364352B2 (ja) | 2018-07-25 |
| AU2013207489A8 (en) | 2014-09-18 |
| EP2800582A1 (en) | 2014-11-12 |
| JP2015505315A (ja) | 2015-02-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20140114859A (ko) | 부분적 mhc 구축물 및 이의 사용 방법 | |
| EP1372696B1 (en) | Methods for treating rheumatic diseases using a soluble ctla4 molecule | |
| CN106659775B (zh) | 基于il-15的分子及其方法和用途 | |
| KR101235484B1 (ko) | 가용성 ctla4 돌연변이체 분자를 이용하여 이식편이식과 연관된 면역 장애를 치료하는 방법 | |
| EP2313432B1 (en) | Use of cd31 peptides in the treatment of thrombotic and autoimmune disorders | |
| KR20200034958A (ko) | 암 요법에서 면역 관련된 유해 사례를 치료하기 위한 가용성 cd24의 사용 방법 | |
| AU2009249540B9 (en) | Novel soluble CD83 polypeptides, formulations and methods of use | |
| EP2692733B1 (en) | Nucleic acids encoding soluble forms of CD83 | |
| KR102169902B1 (ko) | 펩타이드 | |
| EP3268382B1 (en) | Myelin oligodendrocyte glycoprotein, myelin basic protein, and proteolipid protein compositions and methods of use | |
| Cloake et al. | Thiopalmitoylation of altered peptide ligands enhances their protective effects in an animal model of multiple sclerosis | |
| US20210038685A1 (en) | Myelin oligodendrocyte glycoprotein, myelin basic protein, and proteolipid protein compositions and methods of use | |
| CN113164573B (zh) | 包含修饰的MHC II类DRα1结构域的重组多肽及其应用方法 | |
| KR20210071019A (ko) | 변형된 MHC 클래스 II DRα1 도메인을 포함하는 재조합 폴리펩타이드 및 이의 사용 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination |