KR20100126515A - 건선의 치료방법 - Google Patents
건선의 치료방법 Download PDFInfo
- Publication number
- KR20100126515A KR20100126515A KR1020107023101A KR20107023101A KR20100126515A KR 20100126515 A KR20100126515 A KR 20100126515A KR 1020107023101 A KR1020107023101 A KR 1020107023101A KR 20107023101 A KR20107023101 A KR 20107023101A KR 20100126515 A KR20100126515 A KR 20100126515A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- antigen
- binding portion
- subject
- amino acid
- Prior art date
Links
- GDOPTJXRTPNYNR-UHFFFAOYSA-N CC1CCCC1 Chemical compound CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Dermatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
Abstract
본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛에 결합할 수 있는 항체를 피검체에게 투여하여 피검체의 건선을 치료하는 방법을 제공한다.
Description
관련 출원
본 출원은 미국 임시출원번호 61/069,840 (2008.3.18); 61/095,275 (2008.9.8); 및 61/207,904 (2009.2.18)에 대한 우선권을 주장하는 출원이며, 이 출원들은 각각 전문이 본원에 참고인용된다.
컴팩트
디스크 제출
본 출원은 785KB의 데이터를 포함하고 2009.3.10일에 제작되고 컴퓨터-판독가능 형태(CRF)로 제출된 SequenceListing.txt라는 명칭으로 확인되는 ASCII 텍스트 파일을 참고 인용한다.
건선은 세계적인 유병률이 매우 다양하지만 성인의 약 2% 내지 3%가 걸려있는 가장 일반적인 자가면역질환 중 하나인 것으로 생각되고 있는 T-세포 매개 염증 질환이다(Stern R.S., et al., J Investig Dermatol Symp Proc 2004, 9: 136-39; Davidson A and Diamond B. N Engl J Med 2001, 345: 340-50; Langley R.G.B., et al., Ann Rheum Dis 2005, 64(Suppl II): ii18-23). 건선은 삶의 질에 주요한 영향을 미치고(de Korte J, et al., J Investig Dermatol Symp Proc 2004, 9: 140-7; Krueger G, et al., Arch Dermatol 2001, 137: 280-4; Finlay AY and Coles EC, Br J Dermatol 1995, 132: 236-44), 많은 정신적 및 정신사회적 문제와 관련이 있다 (Kimball AB, et al., Am J Clin Dermatol 2005, 6: 383-92; Russo PA, et al., Australas J Dermatol 2004, 45: 155-9). 많은 전통적 건선 치료법은 독성의 부작용이 있고, 따라서 장기 사용이 제한된다(Lebwohl M. and Ali S., J Am Acad Dermatol 2001, 45: 487-98; Lebwohl M. and Ali S., J Am Acad Dermatol 2001, 45: 649-61). 또한, 많은 건선 환자들은 전통적 치료에 불만을 느끼며(Stern RS, et al., J Investig Dermatol Symp Proc 2004, 9: 136-39; Finlay AY and Ortonne JP, J Cutan Med Surg 2004, 8: 310-20); 이에 따라, 사용하기 쉽고 안전하며 장기간 처방이 가능한 치료법을 분명하게 필요로 한다.
인터루킨-12(IL-12) 및 관련 사이토카인 IL-23은 공통된 p40 서브유닛을 공유하는 사이토카인의 IL-12 슈퍼패밀리의 구성원이다(Anderson EJR, et al., Springer Semin Immunopathol 2006, 27: 425-42). 이 두 사이토카인은 건선에서 1T형 헬퍼 세포(Th1) 면역 반응의 발달에 기여하지만, 각각 독특한 역할이 있다(Rosmarin D and Strober BE, J Drugs Dermatol 2005, 4: 318-25; Hong K, et al., J Immunol 1999, 162: 7480-91; Yawalkar N, et al., J Invest Dermatol 1998, 111: 1053-57). IL-12는 1차적으로 Th1 세포의 분화 및 후속되는 인터페론-감마의 분비를 자극하는 반면, IL-23은 우선적으로 염증촉진성 매개인자인 IL-17을 분비하는 작동 T 헬퍼 세포(Th17)로의 순수 T 세포의 분화를 자극한다(Rosmarin D and Strober BE, J Drugs Dermatol 2005, 4: 318-25; Harrington Le, et al., Nature Immunol 2005, 6: 1123-32; Park H, et al. Nature Immunol 2005, 6: 1132-41). 건선 피부 병변에서 IL-12 p40 및 IL-23 p40 전령 RNA의 과발현은 IL-12/23 p40 서브유닛 단백질에 대한 중화 항체로 IL-12 및 IL-23의 억제가 건선 치료에 효과적인 치료적 접근법을 제공할 수 있음을 시사한다(Yawalkar N, et al., J Invest Dermatol 1998, 111: 1053-57; Lee E, et al., J Exp Med 2004, 199: 125-30; Shaker OG, et al., Clin Biochem 2006, 39: 119-25; Piskin G, et al., J Immunol 2006, 176: 1908-15). 이러한 건선 치료의 치료적 접근법은 당업계에서 분명하게 필요한 것이다.
본 발명은 사람 IL-12 및/또는 사람 IL-23에 결합하는 항체 또는 이의 항원결합부(antigen-binding portion)를 사용하여 건선, 예컨대 만성 건선을 치료하는 방법 및 조성물을 제공한다.
한 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하는 것을 포함하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 제1 연장 기간 동안 적어도 PASI 75 반응을 유지하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 제2 연장 기간 동안 적어도 PASI 75 반응을 유지하여 피검체의 건선을 치료하는, 상기 피검체의 건선 치료방법을 제공한다.
하나의 구체예에서, 제1 연장 기간은 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주이고, 바람직하게는 12주이다.
하나의 구체예에서, 항체의 투여는 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주, 바람직하게는 12주 동안 중단된다.
하나의 구체예에서, 제2 연장 기간은 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주, 바람직하게는 12주이다.
하나의 구체예에서, 항체 또는 이의 항원결합부는 격주로 투여된다. 하나의 구체예에서, 항체 또는 이의 항원결합부는 매주 투여된다. 하나의 구체예에서, 항체 또는 이의 항원결합부는 단일 용량으로 투여된다.
하나의 구체예에서, 항체 또는 이의 항원결합부는 약 100mg, 110mg, 120mg, 130mg, 140mg, 150mg, 160mg, 170mg, 180mg, 190mg, 200mg, 210mg 또는 220mg의 용량으로 투여된다.
하나의 구체예에서, 건선은 만성 건선이다. 하나의 구체예에서, 건선은 판상 건선, 예컨대 만성 판상 건선이다. 다른 구체예에서, 건선은 만성 건선, 예컨대 만성 판상 건선이다. 또 다른 구체예에서, 건선은 중등도 내지 중증 건선, 예컨대 중등도 내지 중증 판상 건선, 중등도 내지 중증 만성 건선 또는 중등도 내지 중증 만성 판상 건선이다. 하나의 구체예에서, 피검체는 적어도 6개월 동안 건선의 임상 진단을 받은 피검체이다. 다른 구체예에서, 피검체는 적어도 2개월 동안 안정한 판상 건선을 보유한 피검체이다.
다른 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 투여한 후 적어도 약 3일의 반감기, 약 4일 이하의 Tmax 및 적어도 약 40%의 생체이용률로 이루어진 그룹 중에서 선택되는 적어도 하나의 약동학적 특징이 달성되는, 상기 항체 또는 이의 항원결합부의 단일 용량을 피검체에게 투여하는 것을 포함하여, 피검체의 건선을 치료하는 방법을 제공한다.
다양한 구체예에서, 적어도 약 2일, 3일, 4일, 5일, 6일, 7일, 8일, 9일 또는 10일의 반감기가 달성된다.
다양한 구체예에서, 약 1일, 2일, 3일, 4일, 5일, 6일 또는 그 이상과 같거나 그 미만인 Tmax가 달성된다.
다양한 구체예에서, 적어도 약 0.1%, 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 그 이상의 생체이용률이 달성된다.
한 구체예에서, 항체는 정맥내 주사를 통해 투여된다.
한 구체예에서, 항체는 피하 주사를 통해 투여된다.
한 구체예에서, 단일 용량은 약 0.1 내지 약 5.0 mg/kg(예: 약 0.1 내지 약 1.0 mg/kg, 약 0.1 내지 약 2.0 mg/kg, 약 0.1 내지 약 3.0 mg/kg, 약 0.1 내지 약 4.0 mg/kg, 약 1.0 내지 약 2.0 mg/kg, 약 1.0 내지 약 3.0 mg/kg, 약 1.0 내지 약 4.0 mg/kg, 또는 약 1.0 내지 약 5.0 mg/kg)의 항체 또는 이의 항원결합부이다.
다른 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하는 것을 포함하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 제1 연장 기간 동안 적어도 PASI 75 반응을 유지하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 제2 연장 기간 동안 적어도 PASI 50 반응을 유지하여 피검체의 건선을 치료하는, 상기 피검체의 건선 치료방법을 제공한다.
하나의 구체예에서, 제1 연장 기간은 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주이고, 바람직하게는 12주이다.
하나의 구체예에서, 항체의 투여는 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주, 바람직하게는 12주 동안 중단된다.
하나의 구체예에서, 제2 연장 기간은 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주, 바람직하게는 12주이다.
하나의 구체예에서, 항체 또는 이의 항원결합부는 격주로 투여된다. 하나의 구체예에서, 항체 또는 이의 항원결합부는 매주 투여된다.
하나의 구체예에서, 항체 또는 이의 항원결합부는 단일 용량으로 투여된다. 하나의 구체예에서, 항체 또는 이의 항원결합부는 약 100mg, 110mg, 120mg, 130mg, 140mg, 150mg, 160mg, 170mg, 180mg, 190mg 또는 200mg의 용량으로 투여된다.
하나의 구체예에서, 건선은 만성 건선이다.
다른 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하는 것을 포함하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 제1 연장 기간 동안 적어도 PASI 75 반응을 유지하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 제2 연장 기간 동안 클리어(clear) PGA 점수 또는 최소의 PGA 점수를 유지하여 피검체의 건선을 치료하는, 상기 피검체의 건선 치료방법을 제공한다.
하나의 구체예에서, 제1 연장 기간은 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주이고, 바람직하게는 12주이다.
하나의 구체예에서, 항체의 투여는 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주, 바람직하게는 12주 동안 중단된다.
하나의 구체예에서, 제2 연장 기간은 적어도 약 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 또는 14주, 바람직하게는 12주이다.
하나의 구체예에서, 항체 또는 이의 항원결합부는 격주로 투여된다. 하나의 구체예에서, 항체 또는 이의 항원결합부는 매주 투여된다.
하나의 구체예에서, 항체 또는 이의 항원결합부는 단일 용량으로 투여된다. 하나의 구체예에서, 항체 또는 이의 항원결합부는 약 100mg, 110mg, 120mg, 130mg, 140mg, 150mg, 160mg, 170mg, 180mg, 190mg 또는 200mg의 용량으로 투여된다.
하나의 구체예에서, 건선은 만성 건선이다.
또 다른 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부의 단일 용량을 피검체에게 투여하는 것을 포함하고, 상기 항체 또는 이의 항원결합부의 1차 투여 후 약 0.15 내지 약 150 ㎍/ml 사이(예: 약 0.2 내지 약 140 ㎍/ml 사이, 약 0.5 내지 약 125 ㎍/ml 사이, 약 1.0 내지 약 100 ㎍/ml 사이, 약 10 내지 약 90 ㎍/ml 사이, 약 25 내지 약 75 ㎍/ml 사이, 약 35 내지 약 60 ㎍/ml 사이 및 약 40 내지 약 50 ㎍/ml 사이)의 최대 혈청 농도(Cmax) 및 약 80 내지 약 13,000 ㎍ × hr/ml 사이(예: 약 100 내지 약 12,000 ㎍ × hr/ml 사이, 약 150 내지 약 10,000 ㎍ × hr/ml 사이, 약 200 내지 약 8,000 ㎍ × hr/ml 사이, 약 400 내지 약 6,000 ㎍ × hr/ml 사이, 약 800 내지 약 4,000 ㎍ × hr/ml 사이, 약 1000 내지 약 2,000 ㎍ × hr/ml 사이, 약 145 내지 약 13,000 ㎍ × hr/ml 사이 및 약 80 내지 약 5,000 ㎍ × hr/ml 사이)의 혈청농도-시간 곡선 이하 면적(AUC)으로 이루어진 그룹 중에서 선택되는 적어도 하나의 약동학적 특징이 달성되는, 상기 피검체의 건선을 치료하는 방법을 제공한다.
하나의 구체예에서, 항체는 정맥내 주사를 통해 투여된다.
바람직한 구체예에서, Cmax는 약 1 내지 약 150 ㎍/ml 사이(예컨대, 약 2 내지 약 125 ㎍ × hr/ml 사이, 약 5 내지 약 100 ㎍ × hr/ml 사이, 약 10 내지 약 80 ㎍ × hr/ml 사이, 약 20 내지 약 60 ㎍ × hr/ml 사이, 약 30 내지 약 50 ㎍ × hr/ml 사이, 약 1 내지 약 20 ㎍ × hr/ml 사이, 약 20 내지 약 300 ㎍ × hr/ml 사이, 및 약 140 내지 약 150 ㎍ × hr/ml 사이)이다.
바람직한 구체예에서, AUC는 약 145 내지 약 13,000 ㎍ × hr/ml 사이(예: 약 200 내지 약 11,000 ㎍ × hr/ml 사이, 약 500 내지 약 10,000 ㎍ × hr/ml 사이, 약 1000 내지 약 5,000 ㎍ × hr/ml 사이, 약 2000 내지 약 4,000 ㎍ × hr/ml 사이, 약 145 내지 약 165 ㎍ × hr/ml 사이, 약 500 내지 약 600 ㎍ × hr/ml 사이, 약 2000 내지 약 3,000 ㎍ × hr/ml 사이 및 약 12,000 내지 약 13,000 ㎍ × hr/ml 사이)이다.
하나의 구체예에서, 항체는 피하 주사를 통해 투여된다.
바람직한 구체예에서, Cmax는 약 0.15 내지 약 20 ㎍/ml 사이(예: 약 0.25 내지 약 15 ㎍/ml 사이, 약 0.5 내지 약 13 ㎍/ml 사이, 약 1 내지 약 10 ㎍/ml 사이, 약 2 내지 약 8 ㎍/ml 사이, 약 0.15 내지 약 0.3 ㎍/ml 사이, 약 0.5 내지 약 2 ㎍/ml 사이, 약 2 내지 약 4 ㎍/ml 사이 및 약 10 내지 약 15 ㎍/ml 사이)이다.
바람직한 구체예에서, AUC는 약 80 내지 약 5,000 ㎍ × hr/ml 사이(예: 약 200 내지 약 3,000 ㎍ × hr/ml 사이, 약 400 내지 약 2,000 ㎍ × hr/ml 사이, 약 500 내지 약 1,500 ㎍ × hr/ml 사이, 약 4000 내지 약 5,000 ㎍ × hr/ml 사이, 약 80 내지 약 90 ㎍ × hr/ml 사이 및 약 200 내지 약 300 ㎍ × hr/ml 사이)이다.
한 구체예에서, 단일 용량은 약 0.1 내지 약 5.0 mg/kg 사이(예: 약 0.1 내지 약 1.0 mg/kg, 약 0.1 내지 약 2.0 mg/kg, 약 0.1 내지 약 3.0 mg/kg, 약 0.1 내지 약 4.0 mg/kg, 약 1.0 내지 약 2.0 mg/kg, 약 1.0 내지 약 3.0 mg/kg, 약 1.0 내지 약 4.0 mg/kg 또는 약 1.0 내지 약 5.0 mg/kg 사이)의 항체 또는 이의 항원결합부이다.
다른 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부의 단일 용량을 피검체에게 투여하는 것을 포함하고, 상기 항체 또는 이의 항원결합부의 정맥내 투여 후 약 30 내지 약 600 ml/hr 사이(예: 약 50 내지 약 500 ml/hr 사이, 약 75 내지 약 400 ml/hr 사이, 약 100 내지 약 300 ml/hr 사이, 약 150 내지 약 250 ml/hr 사이, 약 30 내지 약 40 ml/hr 사이, 약 40 내지 약 60 ml/hr 사이 및 약 500 내지 약 600 ml/hr 사이)의 제거율(CL) 및 약 8 내지 약 11L 사이(예: 약 8 내지 약 10L 사이, 약 8 내지 약 9L 사이, 약 9 내지 약 10L 사이, 약 10 내지 약 11L 사이 및 약 8.5 내지 9.5L 사이)의 분포용적(Vz)으로 이루어진 그룹 중에서 선택되는 적어도 하나의 약동학적 특징이 달성되는, 피검체의 건선을 치료하는 방법을 제공한다.
관련된 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부의 단일 용량을 피검체에게 투여하는 것을 포함하고, 상기 항체 또는 이의 항원결합부의 피하 투여 후 약 90 내지 약 250 ml/hr 사이(예: 약 100 내지 약 225 ml/hr 사이, 약 125 내지 약 200 ml/hr 사이, 약 140 내지 약 180 ml/hr 사이, 약 90 내지 약 100 ml/hr 사이, 약 150 내지 약 200 ml/hr 사이, 약 200 내지 약 250 ml/hr 사이)의 겉보기 제거율(CL/F) 및 약 23 내지 약 67L 사이(예: 약 25 내지 약 60L 사이, 약 30 내지 약 55L 사이, 약 35 내지 약 50L 사이, 약 40 내지 약 45L 사이, 약 23 내지 약 35L 사이 및 약 60 내지 70L 사이)의 겉보기 분포용적(V/F)으로 이루어진 그룹 중에서 선택되는 적어도 하나의 약동학적 특징이 달성되는, 피검체의 건선을 치료하는 방법을 제공한다.
한 구체예에서, 단일 용량은 약 0.1 내지 약 5.0 mg/kg 사이(예: 약 0.1 내지 약 1.0 mg/kg, 약 0.1 내지 약 2.0 mg/kg, 약 0.1 내지 약 3.0 mg/kg, 약 0.1 내지 약 4.0 mg/kg, 약 1.0 내지 약 2.0 mg/kg, 약 1.0 내지 약 3.0 mg/kg, 약 1.0 내지 약 4.0 mg/kg 또는 약 1.0 내지 약 5.0 mg/kg 사이)의 항체 또는 이의 항원결합부이다.
다른 관점에서, 본 발명은 사람 IL-12 및/또는 사람 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하는 것을 포함하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 PASI 75 반응을 나타내고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 약 25일까지 적어도 PASI 75 반응을 나타내어 피검체의 건선을 치료하는, 상기 피검체의 건선을 치료하는 방법을 제공한다.
한 구체예에서, 피검체는 항체 또는 이의 항원결합부를 재투여한 후 약 50일까지 적어도 PASI 75 반응을 나타낸다. 한 구체예에서, 피검체는 항체 또는 이의 항원결합부를 재투여한 후 약 60일까지 적어도 PASI 75 반응을 나타낸다. 한 구체예에서, 피검체는 항체 또는 이의 항원결합부를 재투여한 후 약 30일, 35일, 40일, 45일, 50일, 60일, 65일, 70일, 75일, 80일, 85일, 90일 이상까지 적어도 PASI 75 반응을 나타낸다.
한 구체예에서, 항체의 1차 투여는 적어도 약 12주 동안이다.
한 구체예에서, 항체의 투여는 적어도 약 4, 5, 6, 7, 8, 9, 10, 11 또는 12주 동안 중단된다.
한 구체예에서, 항체 또는 이의 항원결합부는 격주로 투여된다. 한 구체예에서, 항체 또는 이의 항원결합부는 매주 투여된다. 한 구체예에서, 항체 또는 이의 항원결합부는 단일 용량으로 투여된다.
한 구체예에서, 항체 또는 이의 항원결합부는 약 100mg, 110mg, 120mg, 130mg, 140mg, 150mg, 160mg, 170mg, 180mg, 190mg 또는 200mg의 용량으로 투여된다.
한 구체예에서, 건선은 만성 건선이다.
또 다른 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하는 것을 포함하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 PASI 75 반응을 나타내고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 약 60일까지 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 PASI 75 반응을 달성하여 피검체의 건선을 치료하는, 상기 피검체의 건선을 치료하는 방법을 제공한다.
한 구체예에서, 피검체는 항체 또는 이의 항원결합부의 투여를 중단한 후 약 120일까지 반응 상실을 나타낸다. 한 구체예에서, 피검체는 항체 또는 이의 항원결합부의 투여를 중단한 후 약 180일까지 반응 상실을 나타낸다. 한 구체예에서, 피검체는 항체 또는 이의 항원결합부의 투여를 중단한 후 약 50일, 55일, 60일, 65일, 70일, 75일, 80일, 85일, 90일, 95일, 100일, 110일, 120일, 130일, 140일, 150일, 160일, 170일, 180일, 190일, 200일 이상까지 반응 상실을 나타낸다.
한 구체예에서, 항체의 1차 투여는 적어도 약 12주 동안이다.
한 구체예에서, 항체 또는 이의 항원결합부는 격주로 투여된다. 한 구체예에서, 항체 또는 이의 항원결합부는 매주 투여된다. 한 구체예에서, 항체 또는 이의 항원결합부는 단일 용량으로 투여된다.
한 구체예에서, 항체 또는 이의 항원결합부는 약 100mg, 110mg, 120mg, 130mg, 140mg, 150mg, 160mg, 170mg, 180mg, 190mg 또는 200mg의 용량으로 투여된다.
한 구체예에서, 건선은 만성 건선이다.
다른 관점에서, 본 발명은 사람 IL-12 및 사람 IL-23에 대해 지시된 항체 또는 이의 항원결합부를 격주, 매주 또는 단일 용량으로 피검체에게 투여하는 것을 포함하여, 피검체의 건선을 치료하는 방법을 제공한다. 관련된 관점으로, 본 발명은 (i) 만성 건선을 앓고 있는 피검체를 선택하는 단계; 및 (ii) 이 피검체에게 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 투여하는 단계를 포함하여 피검체의 만성 건선을 치료하는, 피검체의 건선을 치료하는 방법을 제공한다.
다른 관련된 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하는 것을 포함하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 연장 기간 동안 적어도 PASI 50 반응, 적어도 PASI 75 반응 또는 적어도 PASI 90 반응을 유지하여, 피검체의 건선을 치료하는, 피검체의 건선을 치료하는 방법을 제공한다.
또 다른 관점에서, 본 발명은 IL-12 및/또는 IL-23의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하는 것을 포함하고, 이 피검체가 항체 또는 이의 항원결합부의 1차 투여 후 연장 기간 동안 클리어 PGA 등급 또는 최소의 PGA 등급을 유지하여 피검체의 건선을 치료하는, 피검체의 건선을 치료하는 방법을 제공한다.
또 다른 관점에서, 본 발명은 IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하는 것을 포함하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 약 8주까지 개선된 PASI 점수를 나타내어 피검체의 건선을 치료하는, 피검체의 건선을 치료하는 방법을 제공한다. 한 구체예에서, 피검체는 상기 항체 또는 이의 항원결합부를 1차 투여한 후 약 7주, 약 6주, 약 5주, 약 4주, 약 3주, 약 2주 또는 약 1주까지 개선된 PASI 점수를 나타낸다.
한 구체예에서, 항체 투여를 중단한 후 연장 기간은 적어도 약 12주이다. 한 구체예에서, 연장 기간은 적어도 약 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 또는 24주이다. 한 구체예에서, 항체는 적어도 약 12주 동안 투여된다.
한 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 IL-12의 p40 서브유닛의 에피토프에 결합할 수 있다.
다른 구체예에서, 항체 또는 이의 항원결합부는 p40 서브유닛이 IL-12의 p35 서브유닛에 결합할 때 p40 서브유닛의 에피토프에 결합할 수 있다. 또 다른 구체예에서, 항체 또는 이의 항원결합부는 p40 서브유닛이 p19 서브유닛에 결합할 때 p40 서브유닛의 에피토프에 결합할 수 있다. 한 구체예에서, 항체 또는 이의 항원결합부는 p40 서브유닛이 IL-12의 p35 서브유닛에 결합할 때, 그리고 p40 서브유닛이 p19 서브유닛에 결합할 때 p40 서브유닛의 에피토프에 결합할 수 있다.
한 구체예에서, 항체 또는 이의 항원결합부는 Y61 및 J695로 이루어진 그룹 중에서 선택되는 항체가 결합하는, IL-12의 p40 서브유닛의 에피토프에 결합한다.
다른 구체예에서, 항체는 또한 제1 이종이량체에 결합할 수 있고, 또한 제2 이종이량체에 결합할 수 있으며, 상기 제1 이종이량체는 IL-12의 p40 서브유닛 및 IL-12의 p35 서브유닛을 포함하고, 제2 이종이량체는 IL-12의 p40 서브유닛 및 p19 서브유닛을 포함한다.
또 다른 구체예에서, 항체는 제1 이종이량체의 활성을 중화한다. 다른 구체예에서, 항체는 제2 이종이량체의 활성을 중화한다. 또 다른 구체예에서, 항체는 제1 이종이량체 및 제2 이종이량체의 활성을 중화한다.
또 다른 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 1 x 10-9M 이하의 IC50으로 피토헤마글루티닌 모세포 증식을 저해하거나, 또는 1 x 10-10 M 이하의 IC50으로 사람 IFNγ 생산을 저해한다.
한 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 표면 플라즈몬 공명법으로 측정 시, IL-12의 p40 서브유닛으로부터 1 x 10-10M 이하의 Kd 또는 1 x 10-3 s-1 이하의 koff 속도 상수로 해리한다.
한 구체예에서, 본 발명의 방법에 사용된, 분리된 항체 또는 이의 항원결합부는 키메라 항체, 사람화된 항체 또는 사람 항체이다.
다른 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 서열번호 25의 아미노산 서열을 함유하는 중쇄 CDR3 및 서열번호 26의 아미노산 서열을 함유하는 경쇄 CDR3을 보유한다.
추가의 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 서열번호 27의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 28의 아미노산 서열을 함유하는 경쇄 CDR2를 보유한다.
한 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 서열번호 29의 아미노산 서열을 함유하는 중쇄 CDR1 및 서열번호 30의 아미노산 서열을 함유하는 경쇄 CDR1을 보유한다.
다른 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 p40 서브유닛을 함유하는 인터루킨에 결합할 수 있다. 한 구체예에서, 인터루킨은 p40 서브유닛 및 p35 서브유닛을 포함하고, 예컨대 인터루킨은 IL-12이다. 다른 구체예에서, 인터루킨은 p40 서브유닛 및 p19 서브유닛을 포함한다. 또 다른 구체예에서, 항체 또는 이의 항원결합부는 인터루킨의 활성을 중화한다.
한 구체예에서, 항체 또는 이의 항원결합부는 p40 서브유닛의 에피토프에 결합한다.
한 구체예에서, 항체 또는 이의 항원결합부는 항체 또는 이의 항원결합부 및 약제학적으로 허용되는 담체를 함유하는 약제학적 조성물로 피검체에게 투여한다. 약제학적 조성물은 또한 추가 제제, 예컨대 치료제, 예를 들면 부데노사이드, 상피성장인자, 코르티코스테로이드, 사이클로스포린, 설파살라진, 아미노살리실레이트, 6-머캅토퓨린, 아자티오프린, 메트로니다졸, 리폭시게나제 억제제, 메살라민, 올살라진, 발살라자이드, 항산화제, 트롬복산 억제제, IL-1 수용체 길항물질, 항-IL-1β 모노클로날 항체, 항-IL-6 모노클로날 항체, 성장인자, 엘라스타제 억제제, 피리디닐-이미다졸 화합물, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF 및 PDGF의 항체 또는 작용제(agonist), CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90의 항체 또는 이들의 리간드, 메토트렉세이트, 사이클로스포린, FK506, 라파마이신, 미코페놀레이트 모페틸, 레플루노마이드, NSAID, 이부프로펜, 코르티코스테로이드, 프레드니솔론, 포스포디에스터라제 억제제, 아데노신 작용제, 항혈전제, 보체 억제제, 아드레날린제, IRAK, NIK, IKK, p38, MAP 키나제 억제제, IL-1β 전환효소 억제제, TNFα 전환효소 억제제, T-세포 시그널링 억제제, 메탈로프로테이나제 억제제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환효소 억제제, 가용성 사이토카인 수용체, 가용성 p55 TNF 수용체, 가용성 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R, 항염증성 사이토카인, IL-4, IL-10, IL-11, IL-13 및 TGFβ를 포함할 수 있다.
다른 구체예에서, 피검체에게 투여되는 약제학적 조성물 중의 치료제는 항-TNF 항체 및 이의 항체 단편, TNFR-Ig 작제물, TACE 억제제, PDE4 억제제, 코르티코스테로이드, 부데노사이드, 덱사메타손, 설파살라진, 5-아미노살리실산, 올살라진, IL-1β 전환효소 억제제, IL-1ra, 티로신 키나제 억제제, 6-머캅토퓨린 및 IL-11로 이루어진 그룹 중에서 선택될 수 있다.
다른 구체예에서, 치료제는 코르티코스테로이드, 프레드니솔론, 메틸프레드니솔론, 아자티오프린, 사이클로포스파미드, 사이클로스포린, 메토트렉세이트, 4-아미노피리딘, 티자니딘, 인터페론-β1a, 인터페론-β1b, 공중합체 1, 고압산소, 정맥내 면역글로불린, 클라브리빈, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF 및 PDGF의 항체 또는 작용제(agonist), CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90에 대한 항체 또는 이들의 리간드, 메토트렉세이트, 사이클로스포린, FK506, 라파마이신, 미코페놀레이트 모페틸, 레플루노마이드, NSAID, 이부프로펜, 코르티코스테로이드, 프레드니솔론, 포스포디에스터라제 억제제, 아데노신 작용제, 항혈전제, 보체 억제제, 아드레날린제, IRAK, NIK, IKK, p38 또는 MAP 키나제 억제제, IL-1β 전환효소 억제제, TACE 억제제, T-세포 시그널링 억제제, 키나제 억제제, 메탈로프로테이나제 억제제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환효소 억제제, 가용성 사이토카인 수용체, 가용성 p55 TNF 수용체, 가용성 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R, sIL-13R, 항-P7, p-셀렉틴 당단백질 리간드(PSGL), 항염증성 사이토카인, IL-4, IL-10, IL-13 및 TGFβ로 이루어진 그룹 중에서 선택될 수 있다.
한 구체예에서, 본 발명의 방법에 사용되는 항체 또는 이의 항원결합부는 사람 IL-12 및/또는 사람 IL-23에 결합하고, 표면 플라즈몬 공명법으로 측정했을 때, Kd 1 x 10-10 M 이하 및 koff 속도 상수 1 x 10-3 s-1 이하로 각각 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다. 한 구체예에서, 항체 또는 이의 항원결합부는 koff 속도 상수 1 x 10-4s-1 이하로 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다. 다른 구체예에서, 항체 또는 이의 항원결합부는 koff 속도 상수 1 x 10-5s-1 이하로 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다.
다른 구체예에서, 항체 또는 이의 항원결합부는 사람 IL-12 및/또는 사람 IL-23에 결합하고, 표면 플라즈몬 공명법으로 측정했을 때, koff 속도 상수 1 x 10-2s-1 이하로 각각 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다. 또 다른 구체예에서, 항체 또는 이의 항원결합부는 koff 속도 상수 1 x 10-3s-1 이하로 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다. 또 다른 구체예에서, 항체 또는 이의 항원결합부는 koff 속도 상수 1 x 10-4 s-1 이하로 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다. 다른 구체예에서, 항체 또는 이의 항원결합부는 koff 속도 상수 1 x 10-5 s-1 이하로 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다.
또 다른 구체예에서, 항체 또는 이의 항원결합부는 사람 IL-12 및/또는 사람 IL-23에 결합하고 Kd 1.34 x 10-10 M 이하로 각각 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다. 또 다른 구체예에서, 항체 또는 이의 항원결합부는 사람 IL-12 및/또는 사람 IL-23에 결합하고 kd 9.74 x 10-11 M 이하로 각각 사람 IL-12 및/또는 사람 IL-23으로부터 해리한다. 한 구체예에서, 항체 또는 이의 항원결합부는 재조합 항체 또는 이의 항원결합부이다.
한 구체예에서, 본 발명의 방법에 사용되는 항체 또는 이의 항원결합부는 중화 항체로서, 예컨대 사람 IL-12 및/또는 사람 IL-23의 활성을 중화시킨다. 한 양태에서, 중화 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-9M 이하의 IC50으로 저해한다. 다른 구체예에서, 중화 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-10 M 이하의 IC50으로 저해한다. 또 다른 구체예에서, 중화 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-11M 이하의 IC50으로 저해한다. 또 다른 구체예에서, 중화 항체 또는 이의 항원결합부는 시험관내 피토헤마글루티닌 모세포 증식 분석(PHA 분석)에서 1 x 10-7M 이하의 IC50으로 피토헤마글루타닌 모세포 증식을 저해한다. 또 다른 구체예에서, 중화 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-8M 이하의 IC50으로 저해한다. 한 구체예에서, 중화 항체 또는 이의 항원결합부는 1 x 10-10M 이하의 IC50으로 사람 IFNγ 생산을 저해한다. 또 다른 구체예에서, 중화 항체 또는 이의 항원결합부는 1 x 10-11M 이하의 IC50으로 사람 IFNγ 생산을 저해한다. 또 다른 구체예에서, 중화 항체 또는 이의 항원결합부는 5 x 10-12M 이하의 IC50으로 사람 IFNγ 생산을 저해한다.
한 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는
a) 시험관내 PHA 분석에서 1 x 10-9M 이하의 IC50으로 피토헤마글루티닌 모세포 증식을 저해하고;
b) 서열번호 25의 아미노산 서열을 포함하는 중쇄 CDR3을 보유하며;
c) 서열번호 26의 아미노산 서열을 포함하는 경쇄 CDR3을 보유한다.
한 구체예에서, 항체는 추가로 서열번호 27의 아미노산 서열을 포함하는 중쇄 CDR2; 및 서열번호 28의 아미노산 서열을 포함하는 경쇄 CDR2를 보유한다. 또 다른 구체예에서, 항체 또는 이의 항원결합부는 추가로 서열번호 29의 아미노산 서열을 포함하는 중쇄 CDR1; 및 서열번호 30의 아미노산 서열을 포함하는 경쇄 CDR1을 보유한다. 또 다른 구체예에서, 항체 또는 이의 항원결합부는 또한 시험관내 PHA 분석에서 1x10-10 M 이하의 IC50으로 피토헤마글루티닌 모세포 증식을 저해한다. 또 다른 구체예에서, 항체 또는 이의 항원결합부는 또한 시험관내 PHA 분석에서 1x10-11 M 이하의 IC50으로 피토헤마글루티닌 모세포 증식을 저해한다.
한 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 서열번호 31의 아미노산 서열을 포함하는 중쇄 가변 영역 및 서열번호 32의 아미노산 서열을 포함하는 경쇄 가변 영역을 보유한다.
한 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는 IgG1, IgG2, IgG3, IgG4, IgM, IgA 및 IgE 불변 영역으로 이루어진 그룹 중에서 선택되는 중쇄 불변 영역을 포함한다. 한 구체예에서, 항체 중쇄 불변 영역은 IgG1이다. 다른 구체예에서, 항체는 Fab 단편, F(ab')2 단편, 또는 단일쇄 Fv 단편이다.
한 구체예에서, 본 발명의 방법에 사용되는 항체 또는 이의 항원결합부는 1x10-10M 이하의 Kd로 사람 IL-12 및/또는 사람 IL-23으로부터 해리하고 사람 IL-12 및/또는 사람 IL-23의 p40 서브유닛에 있는 에피토프에 결합한다.
한 구체예에서, 본 발명의 방법에 사용된 항체 또는 이의 항원결합부는
a) 표면 플라즈몬 공명법으로 측정했을 때 koff 속도 상수 1 x 10-3 s-1 이하로 사람 IL-12로부터 해리하고;
b) 서열번호 25의 아미노산 서열을 포함하는 중쇄 CDR3을 보유하고;
c) 서열번호 26의 아미노산 서열을 포함하는 경쇄 CDR3을 보유하는 사람 항체 또는 이의 항원결합부이다.
다른 구체예에서, 본 발명의 방법들에 사용되는 항체 또는 이의 항원결합부는 koff 속도 상수 1 x 10-4 s-1 이하로 사람 IL-12로부터 해리한다. 또 다른 구체예에서, 사람 항체 또는 이의 항원결합부는 koff 속도 상수 1 x 10-5 s-1 이하로 사람 IL-12로부터 해리한다.
한 구체예에서, 본 발명의 방법들에 사용되는 항체 또는 이의 항원결합부는 사람 IL-12에 결합하고, 서열번호 26의 아미노산 서열을 포함하는 경쇄 CDR3 도메인; 및 서열번호 25의 아미노산 서열을 포함하는 중쇄 CDR3 도메인을 포함하는 사람 항체 또는 이의 항원결합부이다.
한 구체예에서, 항체 또는 이의 항원결합부는 서열번호 26의 아미노산 서열을 포함하는 CDR3 도메인을 보유하는 경쇄 가변영역(LCVR), 및 서열번호 25의 아미노산 서열을 포함하는 CDR3을 보유하는 중쇄 가변영역(HCVR)을 보유한다. 다른 구체예에서, 항체 또는 이의 항원결합부는 추가로 서열번호 28의 아미노산 서열을 함유하는 CDR2 도메인을 보유하는 LCVR 및 추가로 서열번호 27의 아미노산 서열을 함유하는 CDR2 도메인을 함유하는 HCVR을 포함한다. 또 다른 구체예에서, LCVR은 추가로 서열번호 30의 아미노산 서열을 함유하는 CDR1 도메인을 보유하고, HCVR은 서열번호 29의 아미노산 서열을 함유하는 CDR1 도메인을 보유한다.
한 구체예에서, 항체 또는 이의 항원결합부는 사람 IL-12 및/또는 사람 IL-23에 결합하고, 항체 J695(또한, ABT-874라고도 불림) 또는 이의 항원결합부이다.
한 구체예에서, 항체 또는 이의 항원결합부는 사람 IL-12 및/또는 사람 IL-23에 결합하고, 1.34 x 10-10 M 이하의 Kd로 사람 IL-12로부터 해리하고, 사람 IL-12 및/또는 사람 IL-23을 중화시킨다. 한 구체예에서, 항체 또는 이의 항원결합부는 사람 IL-12 및/또는 사람 IL-23으로부터 9.74 x 10-11 M 이하의 Kd로 해리한다. 한 구체예에서, 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-7 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-8 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-9 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-10 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-11 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 사람 IFNγ 생산을 1 x 10-10 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 사람 IFNγ 생산을 1 x 10-11 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 사람 IFNγ 생산을 5 x 10-12 M 이하의 IC50으로 억제한다.
한 구체예에서, 본 발명의 방법들에 사용되는 항체 또는 이의 항원결합부는 IL-12 또는 IL-23 수용체 결합 분석(RBA)에서 IL-12 및/또는 IL-23의 이의 수용체에 대한 결합을 각각 1 x 10-9 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 IL-12 또는 IL-23 수용체 결합 분석(RBA)에서 IL-12 및/또는 IL-23의 이의 수용체에 대한 결합을 각각 1 x 10-10 M 이하의 IC50으로 억제한다. 한 구체예에서, 항체 또는 이의 항원결합부는 IL-12 또는 IL-23 수용체 결합 분석(RBA)에서 IL-12 및/또는 IL-23의 이의 수용체에 대한 결합을 각각 1 x 10-11 M 이하의 IC50으로 억제한다.
도 1은 실험 중인 환자 처치를 나타낸 것이다("격주"란 용어는 격주 투여를 의미한다).
도 2는 실험 12주 동안 건선 면적 및 중증 지수(PASI 75)의 개선율이 적어도 75%인 환자의 백분율을 도시한다. 8주까지는 200mg x 1 그룹을 제외하고, PASI 75 반응을 나타내는 환자의 백분율은 치료 의도(intention-to-treat) 집단에서 관찰되는 데이터의 분산분석을 기초로 하여 각각 위약과 비교했을 때 각 ABT-874 처리 그룹에서 통계학상 유의적으로 높았다(p<0.001)("격주"란 용어는 격주 투여를 의미한다).
도 3은 건선 면적과 중증 지수(PASI) 점수의 기준값 대비 평균 개선율을 도시한 것이다. 이 데이터는 치료 의도 집단에서 관찰된 데이터의 분산분석을 기초로 하여 모든 시점(1주에 100mg 격주 제외, p=0.023)에서 위약 대비 각 ABT-874 처리 군의 *p<0.001을 나타낸다.("격주"는 격주 투여를 의미한다).
도 4A 내지 도 4C는 항체의 투여 중단 후 12주째인 실험 24주째, PASI 50, PASI 75 및 PASI 90 반응을 각각 유지하는 환자의 백분율을 도시한 것이다.
도 4D는 실험 24주 동안 경시적으로 PASI 75 반응을 유지하는 환자의 백분율을 도시한 것이다.
도 5A는 4주 내지 12주 동안 PASI 점수의 기준값 대비 평균 개선율(%)을 도시한 것이다.
도 5B는 재치료 후 4주 내지 12주 동안 PASI 점수의 기준값 대비 평균 개선율(%)을 도시한 것이다.
도 6A는 ABT-874의 IV 용량투여 동안 혈청 농도-시간 곡선을 도시한 것이다.
도 6B는 ABT-874의 SC 용량투여 동안 혈청 농도-시간 곡선을 도시한 것이다.
도 7A는 재치료 후 PASI 75 반응을 재달성한 환자의 백분율을 도시한 것이다.
도 7B는 재치료 후 모든 ABT-874 투약 그룹별 PASI 75 반응을 달성하는 시간의 중간값을 도시한 것이다.
도 7C는 치료의 초기 12주 후 PASI 75 반응을 상실하는 시간의 중간값을 도시한 것이다.
도 7D는 재치료 후 0 또는 1의 PGA 점수를 달성하는 환자의 백분율을 도시한 것이다.
도 8A-8B는 사람 IL-12에 결합하는 일련의 사람 항체를 생식계열 서열 Cos-3/JH3 및 Dp118 Lv1042와 비교한 중쇄 가변 영역 아미노산 서열 정렬을 도시한 것이다. 아미노산 위치의 식별에는 카벳 넘버링을 이용한다. Joe 9 야생형은 전체 서열을 도시했다. 다른 항체들은 Joe 9 야생형과 다른 아미노산 위치만을 도시했다.
도 8C-8D는 사람 IL-12에 결합하는 일련의 사람 항체의 경쇄 가변 영역 아미노산 서열을 정렬한 것이다. 아미노산 위치의 식별에는 카벳 넘버링을 이용한다. Joe 9 야생형은 전체 서열을 도시했다. 다른 항체들은 Joe 9 야생형과 다른 아미노산 위치만을 도시했다.
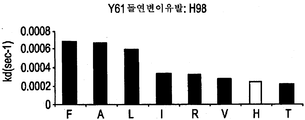
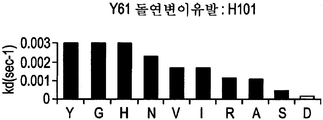
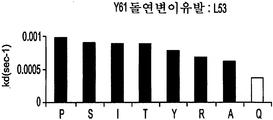
도 9A-9E는 부위-지시된 돌연변이유발 및 각 위치에서 각 아미노산의 치환을 통해 돌연변이된 Y61 항체의 중쇄에 존재하는 CDR 위치를 나타낸다. 도면 우측의 그래프는 돌연변이되지 않은 Y61(흰색 막대) 대비 치환된 항체(흑색 막대)의 해리(off) 속도를 나타낸다.
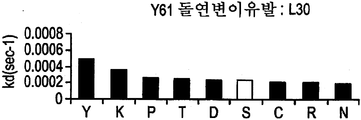
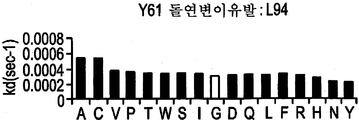
도 9F-9H는 부위-지시된 돌연변이유발 및 각 위치에서 각 아미노산의 치환을 통해 돌연변이된 Y61 항체의 경쇄에 존재하는 CDR 위치를 나타낸다. 도면 우측의 그래프는 돌연변이되지 않은 Y61(흰색 막대) 대비 치환된 항체(흑색 막대)의 해리(off) 속도를 나타낸다.
도 2는 실험 12주 동안 건선 면적 및 중증 지수(PASI 75)의 개선율이 적어도 75%인 환자의 백분율을 도시한다. 8주까지는 200mg x 1 그룹을 제외하고, PASI 75 반응을 나타내는 환자의 백분율은 치료 의도(intention-to-treat) 집단에서 관찰되는 데이터의 분산분석을 기초로 하여 각각 위약과 비교했을 때 각 ABT-874 처리 그룹에서 통계학상 유의적으로 높았다(p<0.001)("격주"란 용어는 격주 투여를 의미한다).
도 3은 건선 면적과 중증 지수(PASI) 점수의 기준값 대비 평균 개선율을 도시한 것이다. 이 데이터는 치료 의도 집단에서 관찰된 데이터의 분산분석을 기초로 하여 모든 시점(1주에 100mg 격주 제외, p=0.023)에서 위약 대비 각 ABT-874 처리 군의 *p<0.001을 나타낸다.("격주"는 격주 투여를 의미한다).
도 4A 내지 도 4C는 항체의 투여 중단 후 12주째인 실험 24주째, PASI 50, PASI 75 및 PASI 90 반응을 각각 유지하는 환자의 백분율을 도시한 것이다.
도 4D는 실험 24주 동안 경시적으로 PASI 75 반응을 유지하는 환자의 백분율을 도시한 것이다.
도 5A는 4주 내지 12주 동안 PASI 점수의 기준값 대비 평균 개선율(%)을 도시한 것이다.
도 5B는 재치료 후 4주 내지 12주 동안 PASI 점수의 기준값 대비 평균 개선율(%)을 도시한 것이다.
도 6A는 ABT-874의 IV 용량투여 동안 혈청 농도-시간 곡선을 도시한 것이다.
도 6B는 ABT-874의 SC 용량투여 동안 혈청 농도-시간 곡선을 도시한 것이다.
도 7A는 재치료 후 PASI 75 반응을 재달성한 환자의 백분율을 도시한 것이다.
도 7B는 재치료 후 모든 ABT-874 투약 그룹별 PASI 75 반응을 달성하는 시간의 중간값을 도시한 것이다.
도 7C는 치료의 초기 12주 후 PASI 75 반응을 상실하는 시간의 중간값을 도시한 것이다.
도 7D는 재치료 후 0 또는 1의 PGA 점수를 달성하는 환자의 백분율을 도시한 것이다.
도 8A-8B는 사람 IL-12에 결합하는 일련의 사람 항체를 생식계열 서열 Cos-3/JH3 및 Dp118 Lv1042와 비교한 중쇄 가변 영역 아미노산 서열 정렬을 도시한 것이다. 아미노산 위치의 식별에는 카벳 넘버링을 이용한다. Joe 9 야생형은 전체 서열을 도시했다. 다른 항체들은 Joe 9 야생형과 다른 아미노산 위치만을 도시했다.
도 8C-8D는 사람 IL-12에 결합하는 일련의 사람 항체의 경쇄 가변 영역 아미노산 서열을 정렬한 것이다. 아미노산 위치의 식별에는 카벳 넘버링을 이용한다. Joe 9 야생형은 전체 서열을 도시했다. 다른 항체들은 Joe 9 야생형과 다른 아미노산 위치만을 도시했다.
도 9A-9E는 부위-지시된 돌연변이유발 및 각 위치에서 각 아미노산의 치환을 통해 돌연변이된 Y61 항체의 중쇄에 존재하는 CDR 위치를 나타낸다. 도면 우측의 그래프는 돌연변이되지 않은 Y61(흰색 막대) 대비 치환된 항체(흑색 막대)의 해리(off) 속도를 나타낸다.
도 9F-9H는 부위-지시된 돌연변이유발 및 각 위치에서 각 아미노산의 치환을 통해 돌연변이된 Y61 항체의 경쇄에 존재하는 CDR 위치를 나타낸다. 도면 우측의 그래프는 돌연변이되지 않은 Y61(흰색 막대) 대비 치환된 항체(흑색 막대)의 해리(off) 속도를 나타낸다.
본 발명이 더욱 쉽게 이해될 수 있도록 하기 위해, 먼저 특정 용어에 대해 정의한다.
"활성 증강성 아미노산 잔기"란 용어는 항체의 활성을 향상시키는 아미노산 잔기를 포함한다. 물론, 활성 증강성 아미노산 잔기는 접촉, 초돌연변이(hypermutation) 또는 바람직한 선택적 돌연변이유발 위치에 있는 아미노산 잔기를 교체할 수 있고, 1 보다 많은 활성 증강성 아미노산 잔기는 하나 이상의 CDR 내에 존재할 수 있다. 활성 증강성 아미노산 잔기는 항체, 예컨대 사람 IL-12에 결합하는 항사람 IL-12 항체의 결합 특이성/친화성을 향상시키는 아미노산 잔기를 포함한다. 또한, 활성 증강성 아미노산 잔기는 항체, 예컨대 사람 IL-12를 억제하는 사람 IL-12 항체의 중화능을 향상시키는 아미노산 잔기를 포함하는 것을 의미한다.
"항체"란 용어는 이황화 결합에 의해 상호연결된 2개의 중쇄(H)와 2개의 경쇄(L)인 4개의 폴리펩타이드 사슬로 구성된 면역글로불린 분자를 포함한다. 각 중쇄는 중쇄 가변 영역(여기서 HCVR 또는 VH로 약칭하기도 함)과 중쇄 불변 영역으로 구성된다. 중쇄 불변 영역은 3개의 도메인, CH1, CH2 및 CH3으로 구성된다. 각 경쇄는 경쇄 가변 영역(여기서 LCVR 또는 VL로 약칭하기도 함)과 경쇄 불변 영역으로 구성된다. 경쇄 불변 영역은 하나의 도메인 CL로 구성된다. VH 및 VL 영역은 다시 프레임워크 영역(FR)이라는 더욱 보존적인 영역이 산재해 있는 상보성 결정 영역(CDR)으로 불리는 초가변 영역으로 세분될 수 있다. 각 VH 및 VL은 3개의 CDR과 4개의 FR로 구성되며, 아미노 말단부터 카르복시 말단까지 다음과 같은 순서로 배열된다: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. 한 구체예에서, 본 발명의 조성물과 방법에서 사용되는 항체는 본 발명에 참고인용되는 미국 특허 6,914,128에 기술된 항체이다. 다른 구체예에서, 본 발명의 조성물과 방법에서 사용되는 항체는 항체 ABT-874(J695라고도 불림; Abbott Laboratories).
항체의 "항원 결합부"(또는 "항체부")란 용어는 항원(예: hIL-12)에 대한 특이적 결합능을 보유하는 항체의 단편을 포함한다. 항체의 항원 결합 기능은 완전한 항체의 단편에 의해 수행될 수 있는 것으로 밝혀져 있다. 항체의 "항원 결합부"라는 용어에 포함되는 결합 단편의 예에는 (i) VL, VH, CL 및 CH1 도메인으로 이루어진 일가 단편인 Fab 단편; (ii) 2개의 Fab 단편이 힌지(hinge) 영역에서 이황화 가교에 의해 결합되어 있는 이가 단편인 F(ab')2 단편; (iii) VH 및 CH1 도메인으로 이루어진 Fd 단편; (iv) 항체 한쪽 아암(arm)의 VL 및 VH 도메인으로 이루어진 Fv 단편; (v) VH 도메인으로 이루어진 dAb 단편(Ward et al.,(1989) Nature 341: 544-546); 및 (vi) 분리된 상보성 결정 영역(CDR)이 포함된다. 또한, Fv 단편의 두 도메인, VL 및 VH는 다른 유전자에 의해 암호화되지만, VL 및 VH 영역이 쌍을 이루어 일가 분자(단일쇄 Fv(scFv)로 알려진 것; 예컨대 Bird et al.(1998) Science 242: 423-426; 및 Huston et al.(1988) Proc.Natl.Acad.Sci. USA 85:5879-5883)를 형성하고 있는 단일 단백질 쇄로서 제조될 수 있게 하는 합성 링커를 이용하여 VL 및 VH 영역은 재조합법으로 결합될 수 있다. 이러한 단일쇄 항체는 항체의 "항원 결합부"라는 용어에도 포함되는 것으로도 간주된다. 단일쇄 항체의 다른 형태, 예컨대 디아바디(diabody)도 포함된다. 디아바디는 단일쇄 폴리펩타이드에서 VH 및 VL 도메인이 발현되지만, 동일 쇄 상의 두 도메인 사이에 쌍 형성을 허용하기에는 너무 짧은 링커를 사용하여 상기 도메인들이 다른 쇄의 상보성 도메인과 쌍을 이루어 2개의 항원 결합 부위를 생성하는 2가의 이특이적 항체이다(예컨대, Holliger, P., et al.(1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R.J., et al.(1994) Structure 2: 1121-1123). 또한, 항체 또는 이의 항원결합부는 이 항체 또는 항체 일부와 하나 이상의 다른 단백질 또는 펩타이드와의 공유 결합 또는 비공유 결합에 의해 형성된 큰 면역부착 분자의 일부분일 수 있다. 이러한 면역부착 분자의 예는 사량체 scFv 분자를 제조하기 위한 스트렙타비딘 코어 영역의 사용(Kipriyanov, S.M., et al.(1995) Human Antibodies and Hybridomas 6: 93-101) 및 2가 및 비오틴화된 scFv 분자를 제조하기 위한 시스테인 잔기, 마커 펩타이드 및 C-말단 폴리히스티딘 태그의 사용(Kipriyanov, S.M., et al.(1994) Mol. Immunol. 31: 1047-1058)을 포함한다. 항체 일부, 예컨대 Fab 및 F(ab')2 단편은 전 항체로부터 통상의 기술, 예컨대 전 항체의 파파인 또는 펩신 분해 등을 이용하여 제조할 수 있다. 더욱이, 항체, 항체 일부 및 면역부착 분자는 본 명세서에 기술된 표준 재조합 DNA 기술을 사용하여 수득할 수 있다. 바람직한 항원결합부는 전체 도메인 또는 전체 도메인의 쌍이다.
"역돌연변이"란 용어는 사람 항체의 체세포 변이된 아미노산 중 일부 또는 전부가 동종 생식계열(germline) 항체 서열 유래의 대응하는 생식계열 잔기로 교체되는 방법을 의미한다. 본 발명의 사람 항체의 중쇄 및 경쇄 서열은 최고의 상동성인 서열을 확인하기 위해 VBASE 데이터베이스의 생식계열 서열들과 각각 정렬된다. 본 발명의 사람 항체 중의 차이는 이러한 다른 아미노산을 암호화하는 일정한 뉴클레오타이드 위치를 돌연변이시킴으로써 생식계열 서열로 복원된다. 역돌연변이의 후보로서 이와 같이 확인된 각 아미노산의 역할은 항원 결합에서 직접적 또는 간접적인 역할에 대해 조사되어야 하고, 돌연변이 이후 사람 항체에 필요한 임의의 특징에 영향을 미치는 것으로 발견된 모든 아미노산은 최종 사람 항체에 포함되지 않을 것이며; 일 예로서 선택적 돌연변이 접근법에 의해 확인된 활성 증강성 아미노산은 역돌연변이로 처리되지 않을 것이다. 역돌연변이로 처리되는 아미노산의 수를 최소화하기 위해, 가장 유사한 생식계열 서열과 상이하지만 제2 생식계열 서열의 대응 아미노산과는 동일한 것으로 발견된 아미노산 위치는, 제2 생식계열 서열이 당해 아미노산의 양방향으로 적어도 10개, 바람직하게는 12개 아미노산에서 본 발명의 사람 항체 서열과 동일하고 대응직선성이라면 남을 수 있다. 역돌연변이는 항체 최적화를 위해 모든 단계에서 일어날 수 있지만, 선택적 돌연변이유발 시도 직전이나 직후에 일어나는 것이 바람직하다. 역돌연변이는 선택적 돌연변이유발 시도 직전에 일어나는 것이 보다 바람직하다.
본 명세서에 사용된 "사람 인터루킨 12"(여기서, hIL-12 또는 IL-12라고 약칭함)란 어구는 1차적으로 대식세포 및 수지상 세포에 의해 분비되는 사람 사이토카인을 포함한다. 이 용어는 이황화 가교에 의해 함께 결합된 35kD 서브유닛(p35)과 40kD 서브유닛(p40)을 함유하는 이종이량체성 단백질을 포함한다. 이종이량체성 단백질은 "p70 서브유닛"으로 불린다. 사람 IL-12의 구조는 예컨대 문헌[Kobayashi, et al . (1989) J. Exp Med . 170:827-845; Seder, et al . (1993) Proc. Natl . Acad . Sci . 90:10188-10192; Ling, et al . (1995) J. Exp Med . 154:116-127; Podlaski, et al . (1992) Arch . Biochem . Biophys . 294:230-237]에 더 상세하게 설명되어 있다. 사람 IL-12란 용어는 표준 재조합 발현 방법으로 제조할 수 있는 재조합 사람 IL-12(rh IL-12)를 포함하는 것으로 간주한다.
"Kabat 넘버링", "Kabat 정의" 및 "Kabat 라벨링"이란 용어는 본 명세서에서 호환 사용된다. 당업계에서 인식되고 있는 이 용어들은 항체 또는 이의 항원결합부의 중쇄 및 경쇄 가변 영역에 존재하는 다른 아미노산 잔기들보다 더욱 가변성(즉, 초가변성)인 아미노산 잔기를 넘버링하는 시스템을 의미한다 (Kabat et al. (1971) Ann. NY Acad , Sci . 190:382-391 및 Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest , Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). 중쇄 가변 영역에서, 초가변성 영역은 CDR1의 아미노산 위치 31에서 35까지, CDR2의 아미노산 위치 50에서 65까지, CDR3의 아미노산 위치 95에서 102까지의 범위이다. 경쇄 가변 영역에서, 초가변성 영역은 CDR1의 아미노산 위치 24에서 34, CDR2의 아미노산 위치 50에서 56, CDR3의 아미노산 위치 89에서 97까지의 범위이다.
Kabat 넘버링은 본 발명의 항체에 형성된 아미노산 변형의 위치를 나타내는데 사용된다. 예를 들어, Y61 항-IL-12 항체는 중쇄 CDR1의 위치 31에서 세린(S)이 글루탐산(E)으로 돌연변이되거나(H31S→E), 경쇄 CDR3의 위치 94에서 글리신(G)이 타이로신(Y)으로 돌연변이될 수 있다(L94G→Y).
"사람 항체"란 용어는 카벳 등(Kabat, et al . (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242)에 의해 기술된 바와 같이 사람 생식계열 면역글로불린 서열에 대응하는 가변 및 불변 영역을 보유하는 항체를 포함한다. 본 발명의 사람 항체는 사람 생식계열 면역글로불린 서열에 의해 암호화되지 않는 아미노산 잔기(예: 시험관내 무작위 또는 부위 특이적 돌연변이유발 또는 생체내 체세포 돌연변이에 의해 도입된 돌연변이)를 예컨대 CDR 내에, 특히 CDR3 내에 포함할 수 있다. 돌연변이는 본 명세서에 기술된 "선택적 돌연변이유발 접근법"을 사용하여 도입하는 것이 바람직하다. 사람 항체는 사람 생식계열 면역글로불린 서열에 의해 암호화되지 않는 활성 증강성 아미노산 잔기와 같은 아미노산 잔기로 교체된 위치를 하나 이상 보유할 수 있다. 사람 항체는 사람 생식계열 면역글로불린 서열의 일부가 아닌 아미노산 잔기로 교체된 위치를 20개까지 보유할 수 있다. 다른 구체예에 따르면, 10개 이하, 5개 이하, 3개 이하 또는 2개 이하의 위치가 교체된다. 바람직한 구체예에 따르면, 이러한 교체는 이하에 상세히 기술되듯이 CDR 영역 내에서 이루어진다. 하지만, 본 명세서에 사용된 "사람 항체"란 용어는 마우스와 같은 다른 포유동물 종의 생식계열에서 유래된 CDR 서열이 사람 프레임워크 서열에 이식된 항체를 포함하는 것으로 간주되지는 않아야 한다.
"재조합 사람 항체"란 어구는 재조합 수단에 의해 제조, 발현, 생성 또는 분리된 사람 항체로서, 예컨대 숙주 세포를 형질감염시킨 재조합 발현 벡터에 의해 발현된 항체(이하, 섹션 II에 자세히 설명됨), 재조합성 조합 사람 항체 라이브러리로부터 분리된 항체(이하 섹션 III에서 자세하게 설명됨), 사람 면역글로불린 유전자에 대해 돌연변이성인 동물(예: 마우스)로부터 분리된 항체(예: Taylor, L.D., et al . (1992) Nucl . Acids Res. 20:6287-6295) 또는 사람 면역글로불린 유전자 서열을 다른 DNA 서열에 연결시키는 것을 포함하는 임의의 다른 수단에 의해 제조, 발현, 생성 또는 분리된 항체를 포함한다. 이러한 재조합 사람 항체는 사람 생식계열 면역글로불린 서열 유래의 가변 및 불변 영역을 보유한다(Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest , Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242 참조). 하지만, 특정 구체예에서 이러한 재조합 사람 항체는 시험관내 돌연변이유발(또는 사람 Ig 서열에 대해 돌연변이성인 동물이 사용될 때에는 생체내 체세포 돌연변이유발)로 처리되고, 이에 따라 재조합 항체의 VH 및 VL 영역의 아미노산 서열은 사람 생식계열 VH 및 VL 서열에서 유래되고 이 서열과 관련이 있지만, 생체내 사람 항체 생식계열 목록 내에는 당연히 존재할 수 없는 서열이다. 하지만, 특정 구체예에서, 이러한 재조합 항체는 선택적 돌연변이유발 접근법 또는 역돌연변이 또는 이 둘 모두의 결과이다.
"분리된 항체"는 다른 항원 특이성을 가진 다른 항체가 실질적으로 없는 항체(예컨대, hIL-12 이외의 다른 항원에 특이적으로 결합하는 항체가 실질적으로 없는, hIL-12에 특이적으로 결합하는 분리된 항체)를 포함한다. hIL-12에 특이적으로 결합하는 분리된 항체는 다른 종 유래의 IL-12 분자에 결합할 수 있다(이하에 더 자세하게 논의된다). 더욱이, 분리된 항체는 다른 세포 물질 및/또는 화학물질이 실질적으로 없는 것일 수 있다.
"중화 항체"(또는 "hIL-12 활성을 중화시키는 항체")는 hIL-12에 결합하여 hIL-12의 생물학적 활성을 억제시키는 항체를 포함한다. hIL-12의 생물학적 활성의 억제는 hIL-12 생물학적 활성의 하나 이상의 지표인자, 예컨대 피토헤마글루티닌 모세포 증식 분석(PHA)에서 사람 피토헤마글루티닌 모세포 증식의 억제, 또는 사람 IL-12 수용체 결합 분석에서 수용체 결합의 억제(미국 특허 6,914,128의 실시예 3-인터페론-감마 유도 분석 참조)를 측정하여 평가할 수 있다. 이러한 hIL-12 생물학적 활성의 지표인자들은 당업계에 공지된 몇몇 표준 시험관내 또는 생체 분석 중 하나 이상으로 평가할 수 있다(미국 특허 6,914,128의 실시예 3 참조).
"활성"이란 용어는 항원에 대한 항체, 예컨대 IL-12 항원에 결합하는 항-hIL-12 항체의 결합 특이성/친화성, 및/또는 항체, 예컨대 hIL-12에 결합하여 hIL-12의 생물학적 활성을 억제하는 항-hIL-12 항체의 중화 효능과 같은 활성, 예컨대 사람 IL-12 수용체 결합 분석에서 수용체 결합의 억제 또는 PHA 모세포 증식의 억제를 포함한다(미국 특허 6,914,128의 실시예 3 참조).
"표면 플라즈몬 공명"이란 어구는 BIAcore 시스템(Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, NJ) 등을 이용하여 바이오센서 매트릭스 내의 단백질 농도의 변경을 검출하여 생체특이적 상호작용을 실시간 분석할 수 있는 광학 현상을 포함한다. 이에 대한 상세한 설명은 미국 특허 6,914,128의 실시예 5 및 문헌[Jonsson, U., et al. (1993) Ann. Biol. Clin. 51: 19-26; Jonsson, U., et al. (1991) Biotechniques 11: 620-627; Johnsson, B., et al.(1995) J. Mol. Recognit. 8: 125-131; 및 Johnnson, B., et al. (1991) Anal. Biochem. 198: 268-277]을 참조한다.
본 명세서에 사용된 "Koff"란 용어는 항체/항원 복합체로부터 항체의 해리를 나타내는 해리 속도 상수(off rate constant)를 의미하는 것으로 간주한다.
본 명세서에 사용된 "Kd"란 용어는 특정 항체-항원 상호작용의 해리 상수(dissociation constant)를 의미하는 것으로 간주한다.
"핵산 분자"란 어구는 DNA 분자 및 RNA 분자를 포함한다. 핵산 분자는 일본쇄 또는 이본쇄일 수 있으나, 이본쇄 DNA인 것이 바람직하다.
"분리된 항체"를 비롯하여 hIL-12에 결합하는 항체 또는 항체 일부(예: VH, VL, CDR3)를 암호화하는 핵산과 관련하여 본 명세서에 사용된 "분리된 핵산 분자"란 어구는 항체 또는 항체 일부를 암호화하는 뉴클레오타이드 서열에, 사람 게놈 DNA에서 상기 핵산과 자연스럽게 인접해 있을 수 있는, hIL-12 외에 다른 항원에 결합하는 항체 또는 항체 일부를 암호화하는 다른 뉴클레오타이드 서열이 없는 핵산 분자를 포함한다. 따라서, 예를 들어 항-IL-12 항체의 VH 영역을 암호화하는 본 발명의 분리된 핵산은 IL-12 외에 다른 항원에 결합하는 다른 VH 영역을 암호화하는 다른 서열은 전혀 함유하지 않는다. 또한, "분리된 핵산 분자"란 어구는 이가의 이특이적 항체, 예컨대 VH 및 VL 영역이 디아바디의 서열 외에 다른 서열을 전혀 함유하지 않는 디아바디를 암호화하는 서열을 포함하는 것으로 간주한다.
"벡터"란 용어는 결합된 다른 핵산을 수송할 수 있는 핵산 분자를 포함한다. 벡터의 한가지 형태는 추가 DNA 분절이 연결될 수 있는 원형의 이본쇄 DNA 루프를 의미하는 "플라스미드"이다. 다른 형태의 벡터는 추가 DNA 분절이 바이러스 게놈에 연결될 수 있는 바이러스 벡터이다. 특정 벡터는 도입된 숙주 세포에서 자가 복제할 수 있다(예컨대, 세균 복제 오리진을 보유한 세균 벡터 및 에피좀성 포유동물 벡터). 다른 벡터(예컨대, 비에피좀성 포유동물 벡터)는 숙주 세포에 도입 시 숙주 세포의 게놈으로 통합될 수 있고, 이로써 숙주 게놈을 따라 복제된다. 더욱이, 특정 벡터는 작동가능하게 결합된 유전자의 발현을 유도할 수 있다. 이러한 벡터는 본 명세서에서 "재조합 발현 벡터"(또는 간단히 "발현 벡터")라 한다. 일반적으로 재조합 DNA법에 유용한 발현 벡터는 흔히 플라스미드 형태이다. 따라서, 본 명세서에 사용된 "플라스미드" 및 "벡터"는 플라스미드가 벡터의 가장 일반적으로 사용되는 형태이기 때문에 호환 사용될 수 있다. 하지만, 본 발명은 등가 기능을 하는 바이러스 벡터와 같은 다른 형태의 발현 벡터(예: 복제 결손성 레트로바이러스, 아데노바이러스 및 아데노 관련 바이러스)도 포함하는 것으로 간주한다.
"재조합 숙주 세포"(또는 간단히 "숙주 세포")란 어구는 재조합 발현 벡터가 도입된 세포를 포함한다. 물론 이러한 용어는 특정 피검체 세포뿐만 아니라 이러한 세포의 자손도 의미하는 것으로 간주해야 한다. 후속 세대에서는 돌연변이 또는 환경적 영향으로 인해 특정 변형이 일어날 수 있기 때문에, 이러한 자손이 사실상 모세포와 동일하지 않을 수 있지만, 본 명세서에 사용된 "숙주 세포"란 용어의 범위에는 포함된다.
본 명세서에 사용된 "변형"이란 용어는, 항체 또는 이의 항원결합부에 존재하는 하나 이상의 아미노산의 변화를 의미하는 것으로 간주한다. 이러한 변화는 하나 이상의 위치에서 아미노산의 부가, 치환 또는 결실에 의해 생길 수 있다. 이러한 변화는 PCR 돌연변이유발법과 같은 공지의 기술을 사용하여 제조할 수 있다.
"접촉 위치"란 어구는 공지된 26개의 항체-항원 구조 중 하나로 항원과 접촉하는 아미노산이 차지하고 있는 항체의 중쇄 가변 영역 또는 경쇄 가변 영역의 CDR1, CDR2 또는 CDR3의 아미노산 위치를 포함한다. 26개의 공지된 항체-항원 복합체의 해명된 구조 중 어느 하나로 CDR 아미노산이 항원과 접촉하면, 그 아미노산은 접촉 위치를 차지하고 있는 것으로 간주할 수 있다. 접촉 위치는 비접촉 위치보다 항원과 접촉하는 아미노산이 차지할 확률이 훨씬 높다. 접촉 위치는 26개 구조 중 3개보다 많은 구조로 항원과 접촉하는 아미노산을 함유하는 CDR 위치인 것이 바람직하다(>11.5%). 가장 바람직하게는, 접촉 위치는 25개 구조 중 8개보다 많은 구조로 항원과 접촉하는 아미노산을 함유하는 CDR 위치이다(>32%).
"초돌연변이 위치"란 용어는 항체의 생체내 친화성 성숙 동안 체세포 초돌연변이의 높은 빈도나 확률을 보유하는 것으로 생각되는 항체의 중쇄 가변 영역 또는 경쇄 가변 영역의 CDR1, CDR2 또는 CDR3 영역에 위치를 차지하는 아미노산 잔기를 포함한다. "체세포 초돌연변이의 높은 빈도나 확률"은 잔기가 항체의 생체내 친화성 성숙 동안 체세포 초돌연변이를 일으킬 기회가 5 내지 약 40%인 빈도 또는 확률을 포함한다. 물론, 언급한 범위에 속하는 모든 범위, 예컨대 5 내지 약 30%, 5 내지 약 15%, 15 내지 약 30%도 역시 본 발명의 일부인 것으로 간주한다.
"바람직한 선택적 돌연변이유발 위치"란 용어는 접촉 위치 및 초돌연변이 위치일 것으로 생각될 수 있는 중쇄 가변 영역 또는 경쇄 가변 영역의 CDR1, CDR2 또는 CDR3 영역에 위치를 차지하는 아미노산 잔기를 포함한다.
"선택적 돌연변이유발 접근법"이란 어구는 적어도 하나의 바람직한 선택적 돌연변이유발 위치, 초돌연변이 위치 및/또는 접촉 위치에서 CDR 아미노산을 선택하여 개별적으로 돌연변이시킴으로써 항체의 활성을 향상시키는 방법을 포함한다. "선택적으로 돌연변이된" 사람 항체는 선택적 돌연변이유발 접근법을 사용하여 선택한 위치에 돌연변이를 함유하는 항체이다. 다른 구체예에 따르면, 선택적 돌연변이유발 접근법은 항체의 중쇄 가변 영역의 CDR1, CDR2 또는 CDR3(이하, 각각 H1, H2 및 H3이라 함) 또는 경쇄 가변 영역의 CDR1, CDR2 또는 CDR3(이하, 각각 L1, L2 및 L3이라 함)에 있는 선택된 개별 아미노산 잔기를 우선적으로 돌연변이시키는 방법을 제공하고자 한다. 아미노산 잔기는 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치 중에서 선택될 수 있다. 개별 아미노산은 경쇄 또는 중쇄 가변 영역에서의 위치를 기초로 하여 선택한다. 물론, 초돌연변이 위치도 접촉 위치일 수 있다. 한 구체예에 따르면, 선택적 돌연변이유발 접근법은 "표적화된 접근법"이다. "표적화된 접근법"이란 말은 항체의 중쇄 가변 영역의 CDR1, CDR2 또는 CDR3이나 경쇄 가변 영역의 CDR1, CDR2 또는 CDR3에 있는 선택된 개별 아미노산 잔기를 표적화된 방식으로, 예컨대 "그룹별 표적화된 접근법" 또는 "CDR별 표적화된 접근법"으로 우선적으로 돌연변이시키는 방법을 포함하는 것으로 간주한다. "그룹별 표적화된 접근법"에서는 특정 그룹의 개별 아미노산 잔기가, 예컨대 그룹 I(L3 및 H3 포함), II(H2 및 L1 포함) 및 III(L2 및 H1 포함)(이 순서는 표적화에 바람직한 그룹 순서이다)이 선택적 돌연변이의 표적이 된다. "CDR별 표적화된 접근법"에서는 특정 CDR의 개별 아미노산 잔기가, 다음과 같은 표적화의 바람직한 순서로 선택적 돌연변이의 표적이 된다: H3, L3, H2, L1, H1 및 L2. 선택된 아미노산 잔기는 예컨대 적어도 2개의 다른 아미노산 잔기로 돌연변이되고, 이 돌연변이가 항체의 활성에 미치는 효과를 측정한다. 활성은 항체의 결합 특이성/친화성의 변화 및/또는 항체의 중화 효능의 변화로서 측정한다. 물론, 선택적 돌연변이유발 접근법은 파지 디스플레이, 사람 IgG 생식계열 유전자를 보유한 돌연변이 동물, 사람 B-세포에서 분리된 사람 항체를 비롯한 임의의 급원에서 유래되는 임의의 항체의 최적화를 위해 사용될 수 있다. 선택적인 돌연변이유발 접근법은 파지 디스플레이 기술을 사용하여 추가로 최적화될 수 없는 항체에 사용하는 것이 바람직하다. 물론, 파지 디스플레이, 사람 IgG 생식계열 유전자를 보유하는 돌연변이 동물, 사람 B-세포로부터 분리된 사람 항체를 비롯한 임의의 급원 유래의 항체는 선택적인 돌연변이유발 접근법전이나 후에 역돌연변이될 수 있다.
"활성 증강성 아미노산 잔기"란 용어는 항체의 활성을 향상시키는 아미노산 잔기를 포함한다. 물론, 활성 증강성 아미노산 잔기는 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 있는 아미노산 잔기를 대체할 수 있고, 하나보다 많은 활성 증강성 아미노산 잔기는 하나 이상의 CDR 내에 존재할 수 있다. 활성 증강성 아미노산 잔기는 사람 IL-12에 대한 항사람 IL-12 항체 결합과 같은 항체의 결합 특이성/친화성을 향상시키는 아미노산 잔기를 포함한다. 또한, 활성 증강성 아미노산 잔기는 사람 IL-12를 억제하는 사람 IL-12 항체와 같은 항체의 중화 효능을 향상시키는 아미노산 잔기를 포함하는 것으로 간주한다.
"Cmax"란 용어는 투여 후 피검체에서 관찰되는 제제의 최대 또는 최고 혈청 또는 혈장 농도를 의미한다.
"Tmax"란 용어는 Cmax가 나타나는 시간을 의미한다.
"생체이용율" 또는 "F%"는 주어진 투약 형태를 투여한 후 흡수되어 전신 혈행으로 유입된 용량의 분율 또는 퍼센트를 의미한다. 제제의 용량은 임의의 경로를 통해, 바람직하게는 정맥내 또는 피하 주사를 통해 투여할 수 있다.
본 명세서에 사용된 "용량투여"란 용어는 치료적 목적(예: 류마티스성 관절염의 치료)을 달성하기 위한 물질(예: 항-IL-12 및 항-IL-23 항체)의 투여를 의미한다.
본 명세서에 사용된 "격주 용량투여 요법", "격주 용량투여" 및 "격주 투여"란 용어는 치료 목적을 달성하기 위해 피검체에게 물질(예: 항-lL-12, 항-IL-23 항체)을 투여하는, 격주(eow)인 시간 진행을 의미한다. 격주 투여 요법은 매주 투여 요법을 포함하는 것을 의미하지 않는다. 약물은 9 내지 19일마다, 더욱 바람직하게는 11 내지 17일마다, 더욱 더 바람직하게는 13 내지 15일마다, 가장 바람직하게는 14일마다 투여하는 것이 바람직하다.
"제2 약제와 병용된 제1 약제"란 어구에서 "병용"이란 용어는 예컨대 동일한 약제학적으로 허용되는 담체 중에 용해되거나 상호혼합될 수 있는 제1 약제와 제2 약제의 공동투여, 또는 제1 약제 이후 제2 약제의 투여 또는 제2 약제에 이어 제1 약제의 투여를 포함한다. 따라서, 본 발명은 병용 치료요법적 치료 방법 및 병용 약제학적 조성물을 포함한다.
"동반 치료요법적 치료"란 어구에서 "동반"이란 용어는 제2 약제의 존재 하에 하나의 약제를 투여하는 것을 포함한다. 동반 치료요법적 치료 방법은 제1, 제2, 제3 또는 추가 약제가 공동투여되는 방법을 포함한다. 또한, 동반 치료요법적 치료 방법은 예컨대 이전에 투여되었을 수 있는 제2 약제 또는 추가 약제의 존재 하에 제1 또는 추가 약제가 투여되는 방법을 포함한다. 동반 치료요법적 치료 방법은 다른 행위자에 의해 단계적으로 실시될 수 있다. 예를 들어, 한 행위자는 제1 약제를 피검체에게 투여할 수 있고, 제2 행위자는 제2 약제를 피검체에게 투여할 수 있으며, 투여 단계는 동시에 실행되거나, 또는 거의 동시에, 또는 시간을 두고 실행할 수 있지만, 제1 약제(및 추가 약제)는 제2 약제(및 추가 약제)의 존재 하에 후투여이기만 하면 된다. 행위자 및 피검체는 동일한 존재(예: 사람)일 수 있다.
본 명세서에 사용된 "병용 치료법"이란 용어는 2 이상의 치료 약물, 예컨대 항-IL-12, 항-IL-23 항체 및 다른 약물의 투여를 의미한다. 다른 약물(들)은 항-IL-12 및 항-IL-23 항체의 투여와 동반하여, 투여 전 또는 투여 후에 투여될 수 있다.
본 명세서에 사용된 "키트"란 용어는 IL-12 관련 장애를 치료하기 위해 본 발명의 항-IL-12, 항-IL-23 항체를 투여하는데 함께 이용되는 구성성분을 포함하는 포장된 제품을 의미한다. 키트는 키트의 구성성분을 담고 있는 박스 또는 용기를 포함하는 것이 바람직하다. 이러한 박스 또는 용기에는 식약청의 승인을 받은 프로토콜 또는 라벨이 부착되어 있다. 이 박스 또는 용기는 바람직하게는 플라스틱, 폴리에틸렌, 폴리프로필렌, 에틸렌 또는 프로필렌 용기 내에 함유된 본 발명의 구성성분을 담고 있다. 용기는 캡이 있는 튜브 또는 병일 수 있다. 또한, 키트는 항-IL-12, 항-IL-23 항체를 투여하는 지침서를 추가로 포함할 수 있다.
본 발명의 다양한 관점은 다음 세부항목에서 더 자세하게 설명된다.
I. 사람
IL
-12에 결합하는 사람 항체
본 발명은 건선의 치료를 위해 사람 IL-12에 결합하는 사람 항체 또는 이의 항원결합부를 사용하는 방법 및 조성물을 제공한다. 또한, 본 발명은 IL-12 및 IL-23에 모두 결합하는 항체를 이용하는 방법과 조성물도 포함한다. 본 발명에 사용되는 사람 항체는 재조합 중화성 사람 항-hIL-12 항체인 것이 바람직하다.
한 구체예에서, 본 발명에 사용되는 항체는 항체 ABT-874(미국 특허 6,914,128 참조)이다. ABT-874는 인터루킨 12(IL-12) 및 IL-23에 대항하는 완전 사람 항체이다. ABT-874는 건선(Ps)의 치료에 확인된 표적인 IL-12 및 IL-23 모두에 공통적인 p40 서브유닛에 대해 높은 친화성으로 결합한다.
사람 IL-12에 결합하는 항체는 미국 특허 6,914,128의 실시예 1에 기술된 바와 같은 파지 디스플레이 기술 등으로, 하나 이상의 사람 VL 및 VH cDNA 라이브러리를 hIL-12로 선별함으로써 선택할 수 있다. 사람 VL 및 VH cDNA 라이브러리의 선별은 처음으로 일련의 항-IL-12 항체를 확인했고, 이 항체 중 하나의 항체(본 명세서에서 "Joe 9" 또는 "Joe 9 야생형"으로 언급함)는 추가 개발을 위해 선택했다. Joe 9는 비교적 낮은 친화도의 사람 IL-12 항체(예: 약 0.1sec-1의 Koff)이지만, hIL-12를 특이적으로 결합 및 검출하는데 유용하다. Joe 9 항체의 친화성은 중쇄 및 경쇄 CDR의 돌연변이유발을 수행하고, "혼합 및 매칭"되고 추가 돌연변이된 경쇄 및 중쇄 가변 영역의 패널을 생산하여 hIL-12에 대한 친화성이 증가된 다수의 추가 항-hIL-12 항체를 수득함으로써 향상되었다(미국 특허 6,914,128의 실시예 1, 표 2(여기에 첨부된 부록 A의 표 2 참조) 및 미국 특허 6,914,128의 도 1A 내지 D의 서열 정렬을 참조한다(본 명세서의 도 8A-D 참조)).
이러한 항체 중에서, Y61로 언급되는 사람 항-hIL-12 항체는 결합 친화성의 유의적인 개선을 입증했다(예컨대 약 2 x 10-4 sec-1의 Koff). Y61 항-hIL-12 항체는 중쇄 및 경쇄 CDR 내에 특정 아미노산 잔기를 개별적으로 돌연변이시켜 추가 친화성 성숙을 위해 선택했다. Y61의 아미노산 잔기는 바람직한 선택적 돌연변이유발 위치, 접촉 및/또는 초돌연변이 위치를 차지하고 있는 아미노산 잔기를 기초로 하여 부위 특이적 돌연변이(선택적 돌연변이유발 접근법)를 위해 선택했다. 중쇄 및 경쇄 CDR 중 선택된 위치에서의 치환은 미국 특허 6,914,128의 도 2A 내지 2H(본 명세서의 도 9A-H)에 정리되어 있다. 본 명세서에서 J695라고 지칭(ABT-874(Abbott Laboratories)라고도 지칭되고 있다)되는 바람직한 본 발명의 재조합 중화 항체는 Y61의 경쇄 CDR2 중 위치 50에서 Gly이 Tyr으로 치환되고 Y61의 경쇄 CDR3 중 위치 94에서 Gly이 Tyr으로 치환된 것이다.
Joe 9 야생형부터 J695의 계통에 존재하는, 본 발명에 사용된 항-IL-12 항체의 패널 중 중쇄 및 경쇄 가변 영역의 아미노산 서열 정렬은 미국 특허 6,914,128의 도 1A 내지 1D(본 명세서의 도 8A-D)에 제시했다. 이 서열 정렬은 Joe 9부터 J695의 계통에 존재하는, hIL-12에 결합하는 본 발명의 항체의 바람직한 중쇄 및 경쇄 가변 영역에서의 컨센서스 서열뿐만 아니라 CDR3, CDR2 및 CDR1의 컨센서스 서열의 확인도 가능하게 했다. 또한, US 6,914,128의 도 2A 내지 2H(본 명세서의 도 9A-H)에 정리된 Y61 돌연변이유발 분석은 Y61로부터 변형이 있지만 양호한 hIL-12 결합 특징을 보유하는 서열을 포함하는, Y61부터 J695의 계통에 존재하는, hIL-12에 결합하는 CDR3, CDR2 및 CDR1의 컨센서스 서열뿐만 아니라 hIL-12에 결합하는 중쇄 및 경쇄 가변 영역의 컨센서스 서열의 확인도 가능하게 했다. 첨부된 서열목록의 서열번호로 식별되는 본 발명의 바람직한 CDR, VH 및 VL 서열(컨센서스 서열 포함)은 이하에 정리했다.
Joe 9 야생형의 친화성 성숙으로부터 생성된 항체는 Kd 및 Koff 속도를 측정하기 위해 표면 플라즈몬 분석으로 기능상의 특성을 규명했다. Koff 속도가 약 0.1s-1 내지 약 1 x 105s-1 범위, 더욱 바람직하게는 Koff가 약 1 x 10-4 s-1 내지 1 x 10-5 s-1 이하인 일련의 항체가 생산되었다. 또한, 항체는 미국 특허 6,914,128의 실시예 3에 기술된 바와 같은 피토헤마글루티닌(PHA) 모세포 증식을 억제하는 능력에 대해 시험관내에서 특성 규명했다. IC50 값이 약 1 x 10-6 M 내지 약 1 x 10-11 M, 더욱 바람직하게는 약 1 x 10-10 M 내지 약 1 x 10-11 M 이하 범위인 일련의 항체가 생산되었다.
따라서, 한 관점으로 본 발명은 사람 IL-12에 결합하고, 표면 플라즈몬 공명으로 측정할 때, Koff 속도 상수 0.1s-1 이하로 사람 IL-12로부터 해리하거나, 또는 시험관내 피토헤마글루티닌 모세포 증식 분석(PHA 분석)에서 IC50 1x10-6 M 이하로 피토헤마글루티닌 모세포 증식을 억제하는 분리된 사람 항체 또는 이의 항원결합부를 사용하는 방법 및 조성물을 제공한다. 바람직한 구체예에 따르면, 분리된 사람 IL-12 항체 또는 이의 항원결합부는 1x10-2 s-1 이하의 Koff 속도 상수로 사람 IL-12로부터 해리하거나, 또는 1x10-7 M 이하의 IC50으로 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 억제한다. 더욱 바람직한 구체예에 따르면, 분리된 사람 IL-12 항체 또는 이의 항원결합부는 1x10-3 s-1 이하의 Koff 속도 상수로 사람 IL-12로부터 해리하거나, 또는 1x10-8 M 이하의 IC50으로 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 억제한다. 더욱 바람직한 구체예에 따르면, 분리된 사람 IL-12 항체 또는 이의 항원결합부는 1x10-4 s-1 이하의 Koff 속도 상수로 사람 IL-12로부터 해리하거나, 또는 1x10-9 M 이하의 IC50으로 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 억제한다. 더욱 바람직한 구체예에 따르면, 분리된 사람 IL-12 항체 또는 이의 항원결합부는 1x10-5 s-1 이하의 Koff 속도 상수로 사람 IL-12로부터 해리하거나, 또는 1x10-10 M 이하의 IC50으로 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 억제한다. 더욱 바람직한 구체예에 따르면, 분리된 사람 IL-12 항체 또는 이의 항원결합부는 1x10-5 s-1 이하의 Koff 속도 상수로 사람 IL-12로부터 해리하거나, 또는 1x10-11 M 이하의 IC50으로 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 억제한다.
IL-12 항체의 해리 속도 상수(Koff)는 표면 플라즈몬 공명(미국 특허 6,914,128의 실시예 5 참조)으로 측정할 수 있다. 일반적으로, 표면 플라즈몬 공명 분석은 BIAcore 시스템(Pharmacia Biosensor, Piscataway, NJ)을 사용하여 표면 플라즈몬 공명(SPR)으로 리간드(바이오센서 매트릭스에 고정된 재조합 사람 IL-12)와 피분석물(용액 중의 항체) 사이에 실시간 결합 상호작용을 측정한다. 또한, 표면 플라즈몬 분석은 피분석물(바이오센서 매트릭스에 항체)을 고정시키고 리간드(용액 중의 재조합 IL-12)를 제공하여 수행할 수도 있다. IL-12 항체 또는 이의 항원결합부의 중화 활성은 여러 적당한 시험관내 분석 중 하나 이상을 사용하여 평가할 수 있다(미국 특허 6,914,128의 실시예 3 참조).
항체 중쇄 및 경쇄 CDR은 항원에 대한 항체의 결합 특이성/친화성에 중요한 역할을 한다는 것이 당업계에 잘 알려져 있다. 따라서, 본 발명은 Joe 9의 경쇄 및 중쇄 CDR을 보유하는 사람 항체뿐만 아니라 항체의 결합 특이성/친화성을 향상시키기 위해 변형된 CDR을 보유하는 다른 항체를 포함한다. 미국 특허 6,914,128의 실시예 1에 입증된 바와 같이, 경쇄 및 중쇄 CDR에 대한 일련의 변형은 사람 항-hIL-12 항체를 친화성 성숙시킨다. 사람 IL-12에 결합하는 Joe 9 야생형부터 J695에 이르는 일련의 사람 항체의 중쇄 및 경쇄 가변 영역 아미노산 서열 정렬은 미국 특허 6,914,128의 도 1A 내지 1D에 제시했다(본 명세서의 도 8A-D). 이러한 서열 정렬로부터 항체의 CDR에 대한 컨센서스 서열 모티프를 측정할 수 있다. 예를 들어, Joe 9부터 J695 계통의 VH CDR3에 존재하는 컨센서스 모티프는 서열번호 7에 제시된 컨센서스 HCVR의 위치 95 내지 102의 아미노산을 포함하는, 아미노산 서열 (H/S)-G-S-(H/Y)-D-(N/T/Y)(서열번호 1)를 함유한다. VL CDR3의 컨센서스 모티프는 서열번호 8에 제시된 컨센서스 LCVR의 위치 89 내지 97의 아미노산을 포함하는 아미노산 서열: Q-(S/T)-Y-(D/E)-(S/R/K)-(S/G/Y)-(L/F/T/S)-(R/S/T/W/H)-(G/P)-(S/T/A/L)-(R/S/M/T/L-V/I/T/M/L) (서열번호 2)을 함유한다.
따라서, 다른 관점으로서, 본 발명은 다음과 같은 특징이 있는 분리된 사람 항체 또는 이의 항원결합부를 함유하는 방법 및 조성물을 제공한다:
a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1x 10-6 M 이하의 IC50으로 억제하고;
b) 서열번호 1의 아미노산 서열을 포함하는 중쇄 CDR3을 보유하며;
c) 서열번호 2의 아미노산 서열을 포함하는 경쇄 CDR3을 보유한다.
바람직한 구체예에서, 항체는 추가로 아미노산 서열 F-I-R-Y-D-G-S-N-K-Y-Y-A-D-S-V-K-G (서열번호 3)(서열번호 7의 아미노산 서열을 함유하는 컨센서스 HCVR의 위치 50 내지 65의 아미노산을 포함한다)을 함유하는 VH CDR2를 포함하고, 또한 아미노산 서열 (G/Y)-N-(D/S)-(Q/N)-R-P-S(서열번호 4)(서열번호 8의 아미노산 서열을 함유하는 컨센서스 LCVR의 위치 50 내지 56의 아미노산을 포함한다)을 함유하는 VL CDR2를 포함한다.
다른 바람직한 구체예에 따르면, 항체는 추가로 아미노산 서열 F-T-F-S-(S/E)-Y-G-M-H (서열번호 5) (서열번호 7의 아미노산 서열을 함유하는 컨센서스 HCVR의 위치 27 내지 35의 아미노산을 포함한다)을 함유하는 VH CDR1을 포함하고, 또한 아미노산 서열 (S/T)-G-(G/S)-(R/S)-S-N-I-(G/V)-(S/A)-(N/G/Y)-(T/D)-V-(K/H) (서열번호 6)(서열번호 8의 아미노산 서열을 함유하는 컨센서스 LCVR의 위치 24 내지 34의 아미노산을 포함한다)을 함유하는 VL CDR1을 포함한다.
또 다른 바람직한 구체예에서, 본 발명에 사용되는 항체는 서열번호 7의 아미노산 서열을 함유하는 HCVR 및 서열번호 8의 아미노산 서열을 함유하는 LCVR을 포함한다.
다른 컨센서스 모티프는 J695 항체로 이어지는 Y61에 수행된 돌연변이 분석을 기초로 하여 측정할 수 있다(미국 특허 6,914,128의 도 2A 내지 도 2H에 정리됨; 본 명세서의 도 9A-H). 미국 특허 6,914,128의 도 2A 내지 2H에 제시된 그래프에 의해 입증되듯이, Y61의 중쇄 및 경쇄 CDR의 특정 잔기는 항체의 hIL-12 결합 성질을 유의적으로 손상시킴이 없이 쉽게 치환할 수 있었다. 예를 들어, CDR H1의 위치 30에서 12개의 다른 아미노산 잔기로의 각 치환은 항체의 Koff 속도를 유의적으로 감소시켰고, 이것은 이 위치가 다양한 여러 아미노산 잔기로 쉽게 치환될 수 있다는 것을 시사한다. 따라서, 돌연변이 분석을 기초로 하여(즉, 다른 아미노산 잔기로 쉽게 치환할 수 있는 Y61 내의 위치), 컨센서스 모티프가 측정되었다. 중쇄 및 경쇄 CDR3의 컨센서스 모티프는 각각 서열번호 9 및 10에 제시했고, 중쇄 및 경쇄 CDR2의 컨센서스 모티프는 각각 서열번호 11 및 12에 제시했으며, 중쇄 및 경쇄 CDR1의 컨센서스 모티프는 각각 서열번호 13 및 14에 제시했다. VH 및 VL 영역의 컨센서스 모티프는 각각 서열번호 15 및 16에 제시했다.
따라서, 한 관점에서, 본 발명은 다음과 같은 특징이 있는 분리된 사람 항체 또는 이의 항원결합부를 포함한다:
a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-9 M 이하의 IC50으로 억제하고;
b) 서열번호 9의 아미노산 서열을 포함하는 중쇄 CDR3을 보유하며;
c) 서열번호 10의 아미노산 서열을 포함하는 경쇄 CDR3을 보유한다.
바람직한 구체예에서, 항체는 추가로 서열번호 11의 아미노산 서열을 함유하는 VH CDR2 및 서열번호 12의 아미노산 서열을 함유하는 VL CDR2를 포함한다.
다른 바람직한 구체예에서, 항체는 추가로 서열번호 13의 아미노산 서열을 함유하는 VH CDR1 및 서열번호 14의 아미노산 서열을 함유하는 VL CDR1을 포함한다.
또 다른 바람직한 구체예에서, 본 발명에 사용되는 항체는 서열번호 15의 아미노산 서열을 함유하는 HCVR 및 서열번호 16의 아미노산 서열을 함유하는 LCVR을 포함한다.
본 발명에 사용된 바람직한 항체, 사람 항-hIL-12 항체 Y61은 CDR3의 PCR 돌연변이유발에 의한 Joe 9 야생형의 친화성 성숙에 의해서 생산될 수 있다(미국 특허 6,914,128의 실시예 1 참조). Y61은 표면 플라즈몬 공명 및 시험관내 중화 분석으로 측정되는 향상된 특이성/결합 친화성을 나타냈다. Y61의 중쇄 및 경쇄 CDR3은 각각 서열번호 17 및 18에 제시하고, Y61의 중쇄 및 경쇄 CDR2는 각각 서열번호 19 및 20에 제시하며, Y61의 중쇄 및 경쇄 CDR1은 각각 서열번호 21과 22에 제시한다. Y61의 VH는 서열번호 23의 아미노산 서열을 보유하고, Y61의 VL은 서열번호 24의 아미노산 서열을 보유한다(이 서열들은 또한 미국 특허 6,914,128의 도 1A 내지 1D(본 명세서의 도 8A-D)에 Joe9와 정렬하여 제시되어 있다).
따라서, 다른 관점에서 본 발명은
a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1 x 10-9 M 이하의 IC50으로 억제하고;
b) 서열번호 17의 아미노산 서열을 포함하는 중쇄 CDR3을 보유하며;
c) 서열번호 18의 아미노산 서열을 포함하는 경쇄 CDR3을 보유하는, 분리된 사람 항체 또는 이의 항원결합부의 사용을 특징으로 한다.
바람직한 양태에 따르면, 본 발명의 방법과 조성물에 사용되는 분리된 사람 항체 또는 이의 항원결합부는 서열번호 19의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 20의 아미노산 서열을 함유하는 경쇄 CDR2를 보유한다.
다른 바람직한 구체예에서, 본 발명의 방법과 조성물에 사용되는 분리된 사람 항체 또는 이의 항원결합부는 서열번호 21의 아미노산 서열을 함유하는 중쇄 CDR1 및 서열번호 22의 아미노산 서열을 함유하는 경쇄 CDR1을 보유한다.
또 다른 바람직한 구체예에서, 본 발명의 방법과 조성물에 사용되는 분리된 사람 항체 또는 이의 항원결합부는 서열번호 23의 아미노산 서열을 함유하는 중쇄 가변 영역 및 서열번호 24의 아미노산 서열을 함유하는 경쇄 가변 영역을 포함한다.
특정 구체예에서, 전장(full length)의 항체는 중쇄 불변 영역, 예컨대 IgG1, IgG2, IgG3, IgG4, IgM, IgA 및 IgE 불변 영역 및 문헌[Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest , Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]에 기술된 바와 같은 모든 알로타입(allotype) 변형체를 포함한다. 항체 중쇄 불변 영역은 IgG1 중쇄 불변 영역인 것이 바람직하다. 대안적으로, 항체 부는 Fab 단편, F(ab'2) 단편 또는 단일쇄 Fv 단편일 수 있다.
Y61의 각 잔기의 변형은 미국 특허 6,914,128의 도 2A 내지 2H(본 명세서에서 도 9A-H)에 제시된 항체 패널의 생산으로 이어졌다. 각 항체의 특이성/결합 친화성은 표면 플라즈몬 공명 및/또는 시험관내 중화 분석으로 측정했다.
따라서, 다른 관점으로서 본 발명은
a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1x 10-9 M 이하의 IC50으로 억제하고;
b) 서열번호 404 내지 서열번호 469로 이루어진 그룹 중에서 선택되는 아미노산 서열을 함유하는 중쇄 CDR3을 보유하며;
c) 서열번호 534 내지 서열번호 579로 이루어진 그룹 중에서 선택되는 아미노산 서열을 함유하는 경쇄 CDR3을 보유하는, 분리된 사람 항체 또는 이의 항원결합부를 특징으로 한다.
바람직한 구체예에서, 본 발명의 방법과 조성물에 사용되는 분리된 사람 항체 또는 이의 항원결합부는 서열번호 335 내지 서열번호 403으로 이루어진 그룹 중에서 선택되는 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 506 내지 서열번호 533으로 이루어진 그룹 중에서 선택되는 아미노산 서열을 함유하는 경쇄 CDR2를 보유한다.
다른 바람직한 구체예에서, 분리된 사람 항체 또는 이의 항원결합부는 서열번호 288 내지 서열번호 334로 이루어진 그룹 중에서 선택되는 아미노산 서열을 함유하는 중쇄 CDR1; 및 서열번호 470 내지 서열번호 505로 이루어진 그룹 중에서 선택되는 아미노산 서열을 함유하는 경쇄 CDR1을 보유한다.
또 다른 바람직한 구체예에서, 분리된 사람 항체 또는 이의 항원결합부는 서열번호 23의 아미노산 서열을 함유하는 중쇄 가변 영역 및 서열번호 24의 아미노산 서열을 함유하는 경쇄 가변 영역을 포함한다.
특정 구체예에서, 전장(full length)의 항체는 중쇄 불변 영역, 예컨대 IgG1, IgG2, IgG3, IgG4, IgM, IgA 및 IgE 불변 영역 및 문헌[Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest , Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]에 기술된 바와 같은 모든 알로타입(allotype) 변형체를 포함한다. 항체 중쇄 불변 영역은 IgG1 중쇄 불변 영역인 것이 바람직하다. 대안적으로, 항체 부는 Fab 단편, F(ab'2) 단편 또는 단일쇄 Fv 단편일 수 있다.
본 발명에 사용될 수 있는 특히 바람직한 재조합 중화 항체 J695는 항체 Y61의 접촉 및 초돌연변이 아미노산 잔기의 부위 지시된 돌연변이유발에 의해 제조했다(미국 특허 6,914,128의 실시예 2 및 이하 섹션 III 참조). J695는 경쇄 CDR2의 위치 50에서 Y61의 Gly이 Tyr으로 치환되고, 경쇄 CDR3의 위치 94에서 Gly이 Tyr으로 치환되어 Y61과 상이하다. J695의 중쇄 및 경쇄 CDR3은 각각 서열번호 25 및 26에 제시되어 있고, J695의 중쇄 및 경쇄 CDR2는 각각 서열번호 27과 28에 제시되어 있고, J695의 중쇄 및 경쇄 CDR1은 각각 서열번호 29 및 30에 제시되어 있다. J695의 VH는 서열번호 31의 아미노산 서열을 보유하고, J695의 VL은 서열번호 32의 아미노산 서열을 보유한다(이 서열들은 미국 특허 6,914,128의 도 1A 내지 1D(본 명세서의 도 8A-D)에도 Joe9와 정렬시켜 제시되고 있다).
따라서, 다른 관점에서 본 발명은 a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1x 10-9 M 이하의 IC50으로 억제하고; b) 서열번호 25의 아미노산 서열을 함유하는 중쇄 CDR3을 보유하며; c) 서열번호 26의 아미노산 서열을 함유하는 경쇄 CDR3을 보유하는, 분리된 사람 항체 또는 이의 항원결합부를 특징으로 한다.
바람직한 구체예에서, 본 발명에 사용되는 분리된 사람 항체 또는 이의 항원결합부는 서열번호 27의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 28의 아미노산 서열을 함유하는 경쇄 CDR2를 보유한다.
다른 바람직한 구체예에서, 본 발명에 사용되는 분리된 사람 항체 또는 이의 항원결합부는 서열번호 29의 아미노산 서열을 함유하는 중쇄 CDR1 및 서열번호 30의 아미노산 서열을 함유하는 경쇄 CDR1을 보유한다.
또 다른 바람직한 구체예에서, 본 발명에 사용되는 분리된 사람 항체 또는 이의 항원결합부는 서열번호 31의 아미노산 서열을 함유하는 중쇄 가변 영역 및 서열번호 32의 아미노산 서열을 함유하는 경쇄 가변 영역을 보유한다.
특정 구체예에서, 전장의 항체는 중쇄 불변 영역, 예컨대 IgG1, IgG2, IgG3, IgG4, IgM, IgA 및 IgE 불변 영역, 및 문헌[Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest , Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]에 기술된 바와 같은 모든 알로타입(allotype) 변형체를 포함한다. 항체 중쇄 불변 영역은 IgG1 중쇄 불변 영역인 것이 바람직하다. 대안적으로, 항체 부는 Fab 단편, F(ab'2) 단편 또는 단일쇄 Fv 단편일 수 있다.
Joe 9 내지 J695 계통, 또는 Y61 내지 J695 계통에 있는 항체의 CDR3, CDR2 및 CDR1의 바람직한 컨센서스 서열에서 추가 돌연변이는 본 발명의 또 다른 항-IL-12 항체를 제공하기 위해 이루어질 수 있다. 이러한 변형 방법은 PCR 돌연변이유발, 경쇄 및/또는 중쇄 CDR 중에 각각의 접촉 또는 초돌연변이 아미노산 잔기의 표적화 후, 본 명세서에 기술된 바와 같은 변형 항체의 속도론적 분석 및 기능적 분석(예컨대, 미국 특허 6,914,128의 실시예 3에 기술된 중화 분석 및 미국 특허 6,914,128의 실시예 5에 기술된 BIAcore 분석) 등과 같은 표준 분자생물학 기술을 이용하여 수행할 수 있다.
따라서, 다른 관점에서 본 발명은
a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1x 10-6 M 이하의 IC50으로 억제하고;
b) 서열번호 1의 아미노산 서열을 함유하는 중쇄 CDR3, 서열번호 3의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 5의 아미노산 서열을 함유하는 중쇄 CDR1을 포함하거나, 또는 이러한 서열번호 1의 아미노산 서열을 함유하는 중쇄 CDR3, 서열번호 3의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 5의 아미노산 서열을 함유하는 중쇄 CDR1을 포함하는 항체보다 koff 속도가 10배 이하로 높은, 바람직한 선택 돌연변이유발 위치 또는 초돌연변이 위치에 하나 이상의 아미노산 치환을 보유하는 돌연변이체를 포함하고;
c) 서열번호 2의 아미노산 서열을 함유하는 경쇄 CDR3, 서열번호 4의 아미노산 서열을 함유하는 경쇄 CDR2 및 서열번호 6의 아미노산 서열을 함유하는 경쇄 CDR1을 포함하거나, 또는 이러한 서열번호 2의 아미노산 서열을 함유하는 경쇄 CDR3, 서열번호 4의 아미노산 서열을 함유하는 경쇄 CDR2 및 서열번호 6의 아미노산 서열을 함유하는 경쇄 CDR1을 포함하는 항체보다 koff 속도가 10배 이하로 높은, 바람직한 선택 돌연변이유발 위치 또는 초돌연변이 위치에 하나 이상의 아미노산 치환을 보유하는 돌연변이체를 포함하는 분리된 사람 항체 또는 이의 항원결합부의 사용을 특징으로 한다.
다른 관점에서, 본 발명은
a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1x 10-9 M 이하의 IC50으로 억제하고;
b) 서열번호 9의 아미노산 서열을 함유하는 중쇄 CDR3, 서열번호 11의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 13의 아미노산 서열을 함유하는 중쇄 CDR1을 포함하거나, 또는 이러한 서열번호 9의 아미노산 서열을 함유하는 중쇄 CDR3, 서열번호 11의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 13의 아미노산 서열을 함유하는 중쇄 CDR1을 포함하는 항체보다 koff 속도가 10배 이하로 높은, 바람직한 선택 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 하나 이상의 아미노산 치환을 보유하는 돌연변이체를 포함하고;
c) 서열번호 10의 아미노산 서열을 함유하는 경쇄 CDR3, 서열번호 12의 아미노산 서열을 함유하는 경쇄 CDR2 및 서열번호 14의 아미노산 서열을 함유하는 경쇄 CDR1을 포함하거나, 또는 이러한 서열번호 10의 아미노산 서열을 함유하는 경쇄 CDR3, 서열번호 12의 아미노산 서열을 함유하는 경쇄 CDR2 및 서열번호 14의 아미노산 서열을 함유하는 경쇄 CDR1을 포함하는 항체보다 koff 속도가 10배 이하로 높은, 바람직한 선택 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 하나 이상의 아미노산 치환을 보유하는 돌연변이체를 포함하는 분리된 사람 항체 또는 이의 항원결합부의 사용을 특징으로 한다.
또한, 당업자는 본 발명의 추가 항-IL-12 항체를 제공하기 위해, Y61 또는 J695에서처럼 항체의 CDR 영역에 추가 돌연변이를 만들 수 있다는 것을 이해할 것이다. 이러한 변형 방법은 전술한 바와 같은 표준 분자생물학 기술을 이용하여 수행할 수 있다. 변형된 항체의 기능적 및 속도론적 분석은 각각 미국 특허 6,914,128의 실시예 3 및 미국 특허 6,914,128의 실시예 5에 기술된 바와 같이 수행할 수 있다. J695의 확인으로 이어지는 Y61의 개별 잔기들의 변형은 미국 특허 6,914,128의 도 2A 내지 2H(본 명세서의 도 9A 내지 H)에 제시되어 있고 미국 특허 6,914,128의 실시예 2에 기술되어 있다.
따라서, 다른 관점에서 본 발명은
a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1x 10-9 M 이하의 IC50으로 억제하고;
b) 서열번호 17의 아미노산 서열을 함유하는 중쇄 CDR3, 서열번호 19의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 21의 아미노산 서열을 함유하는 중쇄 CDR1을 포함하거나, 또는 이러한 서열번호 17의 아미노산 서열을 함유하는 중쇄 CDR3, 서열번호 19의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 21의 아미노산 서열을 함유하는 중쇄 CDR1을 포함하는 항체보다 koff 속도가 10배 이하로 높은, 바람직한 선택 돌연변이유발 위치 또는 초돌연변이 위치에 하나 이상의 아미노산 치환을 보유하는 돌연변이체를 포함하고;
c) 서열번호 18의 아미노산 서열을 함유하는 경쇄 CDR3, 서열번호 20의 아미노산 서열을 함유하는 경쇄 CDR2 및 서열번호 22의 아미노산 서열을 함유하는 경쇄 CDR1을 포함하거나, 또는 이러한 서열번호 18의 아미노산 서열을 함유하는 경쇄 CDR3, 서열번호 20의 아미노산 서열을 함유하는 경쇄 CDR2 및 서열번호 22의 아미노산 서열을 함유하는 경쇄 CDR1을 포함하는 항체보다 koff 속도가 10배 이하로 높은, 바람직한 선택 돌연변이유발 위치 또는 초돌연변이 위치에 하나 이상의 아미노산 치환을 보유하는 돌연변이체를 포함하는, 분리된 사람 항체 또는 이의 항원결합부의 사용을 특징으로 한다.
다른 관점에서, 본 발명은
a) 시험관내 PHA 분석에서 피토헤마글루티닌 모세포 증식을 1x 10-9 M 이하의 IC50으로 억제하고;
b) 서열번호 25의 아미노산 서열을 함유하는 중쇄 CDR3, 서열번호 27의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 29의 아미노산 서열을 함유하는 중쇄 CDR1을 포함하거나, 또는 이러한 서열번호 25의 아미노산 서열을 함유하는 중쇄 CDR3, 서열번호 27의 아미노산 서열을 함유하는 중쇄 CDR2 및 서열번호 29의 아미노산 서열을 함유하는 중쇄 CDR1을 포함하는 항체보다 koff 속도가 10배 이하로 높은, 바람직한 선택 돌연변이유발 위치 또는 초돌연변이 위치에 하나 이상의 아미노산 치환을 보유하는 돌연변이체를 포함하고;
c) 서열번호 26의 아미노산 서열을 함유하는 경쇄 CDR3, 서열번호 28의 아미노산 서열을 함유하는 경쇄 CDR2 및 서열번호 30의 아미노산 서열을 함유하는 경쇄 CDR1을 포함하거나, 또는 이러한 서열번호 26의 아미노산 서열을 함유하는 경쇄 CDR3, 서열번호 28의 아미노산 서열을 함유하는 경쇄 CDR2 및 서열번호 30의 아미노산 서열을 함유하는 경쇄 CDR1을 포함하는 항체보다 koff 속도가 10배 이하로 높은, 바람직한 선택 돌연변이유발 위치 또는 초돌연변이 위치에 하나 이상의 아미노산 치환을 보유하는 돌연변이체를 포함하는, 분리된 사람 항체 또는 이의 항원결합부의 사용을 특징으로 한다.
또 다른 구체예에서, 본 발명은 사람 IL-12, 및 비비 IL-12, 마모셋 IL-12, 침팬지 IL-12, 사이노몰거스 IL-12 및 리서스 IL-12로 이루어진 그룹 중에서 선택되는 적어도 하나의 추가 영장류 IL-12의 활성을 중화시키지만, 마우스 IL-12의 활성을 중화시키지는 않는 분리된 사람 항체 또는 이의 항원결합부의 사용을 제공한다.
II
. 재조합 사람 항체의 선택
본 발명에 사용될 수 있는 재조합 사람 항체는 사람 림프구 유래의 mRNA로부터 제조된 사람 VL 및 VH cDNA를 사용하여 제조한 재조합성 조합 항체 라이브러리, 바람직하게는 scFv 파지 디스플레이 라이브러리를 선별하여 분리할 수 있다. 본 발명의 방법 및 조성물에 사용할 수 있는 항체를 확인하는 방법은 본원에 참고 인용된 미국 특허 6,914,128에 기술되어 있다. 이러한 라이브러리를 제조 및 선별하는 방법론은 당업계에 공지되어 있다. 파지 디스플레이 라이브러리를 생성하기 위한 시판 키트 외에도(예컨대, Pharmacia Recombinant Phage Antibody System, catalog no. 27-9400-01; 및 Stratagene SurfZAP TM 파지 디스플레이 키트, 카탈로그 번호 240612), 항체 디스플레이 라이브러리를 발생 및 선별하는데 특히 쉽게 이용할 수 방법 및 시약의 예는 문헌[예컨대, Kang et al . PCT 공개번호 WO 92/18619; Winter et al . PCT 공개번호 WO 92/20791; Breitling et al . PCT 공개번호 WO 93/01288; McCafferty et al . PCT 공개번호 WO 92/01047; Garrard et al . PCT 공개번호 WO 92/09690; Fuchs et al . (1991) Bio / Technology 9:1370-1372; Hay et al . (1992) Hum Antibod Hybridomas 3:81-85; Huse et al . (1989) Science 246:1275-1281; McCafferty et al ., Nature (1990) 348:552-554; Griffiths et al . (1993) EMBO J 12:725-734; Hawkins et al . (1992) J Mol Biol 226:889-896; Clackson et al . (1991) Nature 352:624-628; Gram et al . (1992) PNAS 89:3576-3580; Garrad et al. (1991) Bio / Technology 9:1373-1377; Hoogenboom et al . (1991) Nuc Acid Res 19:4133-4137; 및 Barbas et al . (1991) PNAS 88:7978-7982]에서 찾아볼 수 있다.
이러한 방법에 사용되는 항체 라이브러리는 사람 VL 및 VH cDNA로부터 제조된 scFv 라이브러리가 바람직하다. 이러한 scFv 항체 라이브러리는 IL-12에 대해 결합 활성이 있는 사람 중쇄 및 경쇄 서열을 선택하는 항원으로서, 재조합 사람 IL-12를 사용하여 선별하는 것이 바람직하다. IL-12의 p35 서브유닛 또는 p70 이종이량체에 특이적인 항체를 선택하기 위해, 선별 분석은 과량의 유리 p40 서브유닛의 존재 하에서 수행했다. 서브유닛의 바람직함은 미국 특허 6,914,128의 실시예 1에 기술된 바와 같이 마이크로-프리구엣(micro-Friguet) 적정으로 결정할 수 있다.
일단 1차 사람 VL 및 VH 분절이 선택되면, IL-12 결합에 대해 여러 쌍의 선택된 VL 및 VH 분절이 선별되는 "혼합 및 매칭" 실험을 수행하여 바람직한 VL/VH 쌍 조합을 선택한다(미국 특허 6,914,128의 실시예 1 참조). 또한, hIl-12 결합에 대한 해리 속도(off rate) 상수를 저하시키고/시키거나 친화성을 더욱 향상시키기 위해, 바람직한 VL/VH 쌍(들)의 VL 및 VH 분절을, 바람직하게는 VH 및/또는 VL의 CDR3 영역 내에서, 자연 면역 반응 동안 항체의 친화성 성숙에 책임이 있는 생체내 체세포 돌연변이 방법과 유사한 방법으로 무작위로 돌연변이시킬 수 있다. 이러한 시험관내 친화성 성숙은 각각 VH CDR3 또는 VL CDR3에 상보적인 PCR 프라이머를 사용하여 VH 및 VL 영역을 증폭시켜 달성할 수 있으며, 상기 프라이머는 최종 PCR 산물이 무작위 돌연변이가 VH 및/또는 VL CDR3 영역에 도입되어 있는 VH 및 VL 분절을 암호화하도록 4개의 뉴클레오타이드 염기의 무작위 혼합물이 특정 위치에 "스파이크화(spiked)" 되었다. 이러한 무작위 돌연변이된 VH 및 VL 분절은 hIL-12에 대한 결합에 대해 재선택 및 재선별할 수 있고, IL-12 결합에 대해 높은 친화성과 낮은 해리 속도를 나타내는 서열을 선택할 수 있다. 미국 특허 6,914,128의 부록 A의 표 2(여기에 첨부된 부록 A의 표 2 참조)는 시험관내 친화성 성숙의 결과로서 생산된, 변경된 결합 특이성/친화성을 나타내는 항체를 제시한 것이다.
재조합 면역글로불린 디스플레이 라이브러리로부터 본 발명의 항-hIL-12 항체를 선택, 분리 및 선별한 후, 선택된 항체를 암호화하는 핵산은 파지 입자(들)(예컨대, 파지 게놈)로부터 회수할 수 있고, 표준 재조합 DNA 기술로 다른 발현 벡터 내로 서브클로닝할 수 있다. 원한다면, 핵산은 추가 조작하여 본 발명의 다른 항체 형태로 생성될 수 있다(예컨대, 추가 불변 영역과 같은 추가 면역글로불린 도메인을 암호화하는 핵산에 결합시킨다). 조합 라이브러리의 선별에 의해 분리된 재조합 사람 항체를 발현시키기 위해, 이 항체를 암호화하는 DNA는 이하 섹션 IV에서 더 상세하게 설명되듯이, 재조합 발현 벡터에 클로닝하고 포유동물 숙주 세포에 도입시킨다.
파지 디스플레이 기술에 의한 사람 IL-12 결합 항체를 선택하는 방법 및 선택한 항체를 CDR 영역의 무작위 또는 부위 지시된 돌연변이유발로 친화성 성숙시키는 방법은 미국 특허 6,914,128의 실시예 1에 더 상세하게 설명되어 있다.
미국 특허 6,914,128의 실시예 1에 설명된 바와 같이, 사람 VL 및 VH cDNA 라이브러리의 선별은 일련의 항-IL-12 항체를 확인했고, 이 중 Joe 9 항체를 추가 개발을 위해 선택했다. Joe 9의 중쇄 가변 영역과 VBASE 데이터베이스에서 선택한 중쇄 생식계열 서열을 비교한 결과, Joe 9는 COS-3 생식계열 서열과 유사한 것으로 나타났다. COS-3은 생식계열 서열의 VH3 패밀리에 속한다.
VH3 패밀리는 뉴클레오타이드 서열 상동성에 기초할 때 7개의 패밀리, VH1-VH7로 그룹화되는 사람 VH 생식계열 목록의 일부이다(Tomlinson et al . (1992) J. Mol. Biol ., 227, 776-798 및 Cook et al . (1995) Immunology Today, 16, 237-242). VH3 패밀리는 가장 많은 수의 구성원을 함유하며 생식계열 목록에 가장 크게 기여한다. 제시된 모든 사람 VH3 생식계열 항체 서열에서, 전체 VH3 패밀리 내의 아미노산 서열 동일성은 높다(예컨대, Tomlinson et al . (1992) J. Mol . Biol ., 227, 776-798 및 Cook et al . (1995) Immunology Today, 16, 237-242 참조). VH3 패밀리의 임의의 2가지 생식계열 VH 서열 간의 아미노산 서열 동일성의 범위는 약 100개 VH 잔기 중 69 내지 98개 잔기이다(즉, 임의의 2가지 생식계열 VH 서열 간에 69 내지 98% 아미노산 서열 상동성). 생식계열 서열들의 대부분의 쌍에서는 적어도 80개 이상의 동일한 아미노산 잔기가 존재한다(즉, 적어도 80% 아미노산 서열 상동성). VH3 패밀리 구성원들 간에 고도의 아미노산 서열 상동성은 VH 사슬의 CDR 및 프레임워크 영역 중의 주요 부위에 존재하는 특정 아미노산 잔기를 제공한다. 이러한 아미노산 잔기는 CDR에 구조적 특징을 부여한다.
항체 구조의 연구는 CDR 입체형태가 CDR 및 프레임워크 영역의 특정 위치를 차지하는 주요 아미노산 잔기를 기초로 하여 정준 CDR 구조의 패밀리로 그룹화될 수 있음을 입증했다. 결론적으로, 주요 아미노산 잔기가 동일한 정준 구조를 보유하는 여러 항체에는 유사한 국소 CDR 입체형태가 존재한다(Chothia et al . (1987) J. Mol . Biol ., 196, 901-917 및 Chothia et al . (1989) Nature, 342, 877-883). VH3 패밀리 내에는 CDR1 및 CDR2 정준 구조의 주요 부위에서 아미노산 잔기 동일성의 보존이 존재한다(Chothia et al . (1992) J. Mol . Biol ., 227, 799-817).
COS-3 생식계열 VH 유전자는 VH3 패밀리의 구성원이고 3-30(DP-49) 생식계열 VH 대립유전자의 변형체이다. COS-3은 Joe9 VH 아미노산 서열과 5개의 위치만이 상이하다. Joe9 VH와 COS-3 사이, 그리고 Joe9 VH와 다른 VH3 패밀리 구성원들간에 고도의 아미노산 서열 상동성도 역시 고도의 CDR 구조 상동성을 부여한다(Chothia et al. (1992) J. Mol . Biol ., 227, 799-817; Chothia et al . (1987) J. Mol . Biol ., 196, 901-917 및 Chothia et al . (1989) Nature, 342, 877-883).
당업자라면, Joe 9와 높은 아미노산 서열 및 정준 구조 유사성을 기초로 하여 다른 VH3 패밀리 구성원을 사용해서 사람 IL-12에 결합하는 항체를 생성할 수 있다는 것도 이해할 것이다. 이것은 예를 들어 사슬-셔플링(shuffling) 기술(Winter et al . (1994) Annual Rev . Immunol ., 12, 433-55)에 의해, 또는 VH3 패밀리 프레임워크 위에 본 발명의 항체 유래의 CDR을 비롯한 설치류 또는 다른 사람 항체 유래의 CDR의 이식에 의해 적당한 VL을 선택함으로써 수행할 수 있다.
사람 V 람다 생식계열 목록은 뉴클레오타이드 서열 상동성을 기초로 해서 10개의 패밀리로 그룹화된다(Williams et al . (1996) J. Mol . Biol ., 264, 220-232). VBASE 데이터베이스 중에서 선택된 경쇄 생식계열 서열과 Joe9의 경쇄 가변 영역의 비교는 Joe9가 DPL8 람다 생식계열과 유사하다는 것을 나타냈다. Joe9 VL은 4개의 프레임워크 위치에서만 DPL8 서열과 다르고, 다른 Vλ1 패밀리 구성원들의 프레임워크 서열들과 높은 상동성이다. Joe9와의 높은 아미노산 서열 상동성 및 정준 구조 유사성을 기초로 하면, 다른 Vλ1 패밀리 구성원들도 사람 IL-12에 결합하는 항체를 생성하는데 사용할 수 있다. 이것은 예를 들어 사슬 셔플링 기술(Winter et al., 상기 언급된 문헌 참조)로 적당한 VH를 선택하거나, 또는 Vλ1 패밀리 프레임워크에 본 발명의 항체 유래의 CDR을 비롯한 다른 사람 항체 또는 설치류 항체 유래의 CDR을 이식하여 수행할 수 있다.
본 발명의 방법은 VH3 패밀리의 생식계열 서열의 구성원 유래의 중쇄 가변 영역과 Vλ1 패밀리의 생식계열 서열의 구성원 유래의 경쇄 가변 영역을 포함하는, hIL-12에 결합하는 재조합 항체를 포함하고자 한다. 더욱이, 당업자는 VH3 패밀리 중쇄 서열의 모든 구성원이 Vλ1 패밀리 경쇄 서열의 모든 구성원과 배합될 수 있다는 것을 이해할 것이다.
또한, 당업자는 생식계열의 아미노산 서열에 변화로 이어지는 DNA 서열 다형태가 한 집단(예컨대, 사람 집단) 내에 존재할 수 있다는 것을 이해할 것이다. 이러한 생식계열 서열 중의 유전자 다형태는 자연 대립유전자 변형으로 인하여 한 집단 내의 개체들 중에서 존재할 수 있다. 이러한 자연 대립유전자 변형은 보통 한 유전자의 뉴클레오타이드 서열 중 1 내지 5% 분산성을 초래할 수 있다. 자연 대립유전자 변형의 결과인, 생식계열 서열 중의 임의의 모든 이러한 뉴클레오타이드 변형 및 그 결과 수득되는 아미노산 다형태는 본 발명의 영역에 포함시키고자 한다.
따라서, 한 관점에 따르면, 본 발명은 다음과 같은 특징,
a) 사람 IL-12에 결합하고, 표면 플라즈몬 공명으로 측정했을 때 koff 속도 상수 0.1 s-1 이하로 사람 IL-12로부터 해리하거나, 시험관내 피토헤마글루티닌 세포 증식 분석(PHA 분석)에서 1x10-6M 이하의 IC50으로 피토헤마글루티닌 모세포 증식을 억제하는 특징;
b) VH3 생식계열 패밀리 구성원 중에서 선택되는 아미노산 서열을 함유하되, 접촉 또는 초돌연변이 위치에 활성 증강성 아미노산 잔기를 보유하는 돌연변이가 있는 중쇄 가변 영역을 보유하는 특징;
c) Vλ1 생식계열 패밀리의 구성원 중에서 선택되는 아미노산 서열을 함유하되, 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에서 활성 증강성 아미노산 잔기를 보유하는 돌연변이가 있는 경쇄 가변 영역을 보유하는 특징을 갖고 있는 분리된 사람 항체 또는 이의 항원결합부를 특징으로 한다.
바람직한 구체예에서, 분리된 사람 항체 또는 이의 항원결합부는 중쇄 CDR3에 돌연변이를 보유한다. 다른 바람직한 구체예에서, 분리된 사람 항체 또는 이의 항원결합부는 경쇄 CDR3에 돌연변이를 보유한다. 다른 바람직한 구체예에서, 분리된 사람 항체 또는 이의 항원결합부는 중쇄 CDR2에 돌연변이를 보유한다. 또 다른 바람직한 구체예에서, 분리된 사람 항체 또는 이의 항원결합부는 경쇄 CDR2에 돌연변이를 보유한다. 또 다른 바람직한 구체예에서, 분리된 사람 항체 또는 이의 항원결합부는 중쇄 CDR1에 돌연변이를 보유한다. 다른 바람직한 구체예에서, 분리된 사람 항체 또는 이의 항원결합부는 경쇄 CDR1에 돌연변이를 보유한다.
당업자는 VH3 생식계열 패밀리의 구성원들 간에 또는 경쇄 Vλ1 생식계열 패밀리의 구성원들 간에 높은 아미노산 서열 유사성을 기초로 할 때, 그러한 생식계열 서열들에 대한 돌연변이가 사람 IL-12에 결합하는 추가 항체를 제공할 수 있다는 것을 이해할 것이다. 미국 특허 6,914,128의 표 1(또한, 여기에 첨부된 부록 A의 표 1 참조)은 VH3 패밀리 구성원들의 생식계열 서열을 제시하고, 패밀리 구성원들 내에서 유의적인 서열 상동성을 입증하고 있다. 또한, 미국 특허 6,914,128의 표 1(여기에 첨부된 부록 A의 표 1 참조)에는 Vλ1 패밀리 구성원들의 생식계열 서열들도 제시되어 있다. 또한, 비교용으로서, Joe9의 중쇄 및 경쇄 서열도 제공되어 있다. VH3 또는 Vλ1 패밀리 구성원들의 생식계열 서열들에 대한 돌연변이는 예컨대 본 발명의 항체에 제조된 것과 동일한 아미노산 위치에서 제조될 수 있다(예컨대, Joe9의 돌연변이). 이러한 변형은 PCR 돌연변이유발, 생식계열 서열 중에 각각의 아미노산 잔기의 표적화 후, 본 명세서에 기술된 바와 같은 변형 항체의 속도론적 분석 및 기능적 분석(예컨대, 미국 특허 6,914,128의 실시예 3에 기술된 중화 분석 및 미국 특허 6,914,128의 실시예 5에 기술된 BIAcore 분석) 등과 같은 표준 분자생물학 기술을 이용하여 수행할 수 있다.
따라서, 한 관점에서, 본 발명은 다음과 같은 특징,
a) 서열번호 595 내지 667로 이루어진 그룹 중에서 선택되는 아미노산 서열을 함유하되, 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 활성 증강성 아미노산 잔기를 보유하는 돌연변이가 있는 중쇄 가변 영역을 보유하고;
b) 서열번호 669 내지 675로 이루어진 그룹 중에서 선택되는 아미노산 서열을 함유하되, 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 활성 증강성 아미노산 잔기를 보유하는 돌연변이가 있는 경쇄 가변 영역을 보유하는 특징을 갖고 있는 분리된 사람 항체 또는 이의 항원결합부의 사용을 특징으로 한다.
당업자라면, Joe 9와 COS-3 중쇄 생식계열 서열 사이 및 Joe9와 DPL8 람다 생식계열 서열 사이의 높은 아미노산 서열 유사성을 기초로 할 때, 이러한 생식계열 서열들의 CDR 영역들에 대한 다른 돌연변이가 사람 IL-12에 결합하는 추가 항체를 제공할 수 있다는 것을 이해할 것이다. 이러한 변형 방법은 전술한 바와 같은 표준 분자생물학 기술을 사용하여 수행할 수 있다.
따라서, 한 관점에서, 본 발명은 다음과 같은 특징,
a) 사람 IL-12에 결합하고, 표면 플라즈몬 공명으로 측정했을 때 koff 속도 상수 0.1 s-1 이하로 사람 IL-12로부터 해리하거나, 시험관내 피토헤마글루티닌 모세포 증식 분석(PHA 분석)에서 1x10-6M 이하의 IC50으로 피토헤마글루티닌 모세포 증식을 억제하는 특징;
b) COS-3 생식계열 아미노산 서열을 함유하되, 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 활성 증강성 아미노산 잔기를 보유하는 돌연변이가 있는 중쇄 가변 영역을 보유하는 특징;
c) DPL8 생식계열 아미노산 서열을 함유하되, 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 활성 증강성 아미노산 잔기를 보유하는 돌연변이가 있는 경쇄 가변 영역을 보유하는 특징을 갖고 있는, 분리된 사람 항체 또는 이의 항원결합부의 사용을 특징으로 한다.
경쇄 및 중쇄 가변 영역의 CDR 및 프레임워크 영역에서 주요 부위를 차지하고 있는 특정 아미노산 잔기들로 인하여, 이들 영역에는 구조적 특징이 부여되어 있다. 구체적으로, CDR2 및 CDR1 영역은 정준 구조 분류를 받는다. 패밀리 구성원들 간에는 고도의 아미노산 서열 상동성이 있기 때문에, 이러한 정준 특징이 존재한다. 당업자는 이러한 정준 구조를 부여하는 아미노산 잔기의 변형이 IL-12에 결합하는 추가 항체를 생산할 것이라는 것을 이해할 것이다. 이러한 변형은 전술한 표준 분자생물학 기술을 이용하여 수행할 수 있다.
따라서, 다른 관점에서 본 발명은 다음과 같은 특징,
a) 사람 IL-12에 결합하고, 표면 플라즈몬 공명으로 측정했을 때 koff 속도 상수 0.1 s-1 이하로 사람 IL-12로부터 해리하거나, 시험관내 피토헤마글루티닌 모세포 증식 분석(PHA 분석)에서 1x10-6M 이하의 IC50으로 피토헤마글루티닌 모세포 증식을 억제하는 특징;
b) VH3 생식계열 패밀리 구성원 중에서 선택되는 아미노산 서열을 함유하되, 다른 VH3 생식계열 패밀리 구성원 유래의 CDR2와 구조적으로 유사한 CDR2, 및 다른 VH3 생식계열 패밀리 구성원 유래의 CDR1과 구조적으로 유사한 CDR1을 함유하고, 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 활성 증강성 아미노산 잔기를 보유하는 돌연변이가 있는 중쇄 가변 영역을 보유하는 특징;
c) Vλ1 생식계열 패밀리의 구성원 중에서 선택되는 아미노산 서열을 함유하되, 다른 Vλ1 생식계열 패밀리 구성원 유래의 CDR2와 구조적으로 유사한 CDR2, 및 다른 Vλ1 생식계열 패밀리 구성원 유래의 CDR1과 구조적으로 유사한 CDR1을 함유하고, 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에 활성 증강성 아미노산 잔기를 보유하는 돌연변이가 있는 경쇄 가변 영역을 보유하는 특징을 갖고 있는, 분리된 사람 항체 또는 이의 항원결합부의 사용을 특징으로 한다.
본 발명에 사용되는 재조합 사람 항체는 VBASE 데이터베이스 중에서 선택되는 사람 생식계열 면역글로불린 서열과 상동성인 가변 및 불변 영역을 보유한다. 재조합 사람 항체에 대한 돌연변이(예컨대, 무작위 돌연변이유발 또는 PCR 돌연변이유발에 의한)는 사람 생식계열 면역글로불린 서열에 의해 암호화되지 않는 아미노산을 생성한다. 또한, 사람 공여체에서 유래된 재조합 항체의 라이브러리는 B-세포 발생 동안 일어나는 정상 체세포 돌연변이 과정으로 인한 대응하는 생식계열 서열과 다른 항체 서열을 함유할 것이다. PCR 증폭에 의해 수득된 "생식계열" 서열이 진정한 생식계열 입체형태 유래의 프레임워크 영역에 있는 아미노산 차이(즉, 진정한 생식계열 서열과 비교했을 때 증폭된 서열의 차이)를 암호화한다면, 이러한 아미노산 차이는 다시 진정한 생식계열 서열로 변화하는 것이 바람직할 수 있다(즉, 프레임워크 잔기의 생식계열 입체형태로의 "역돌연변이"). 즉, 본 발명은 경우에 따라 역돌연변이 단계를 포함할 수 있다. 이를 수행하기 위해, 먼저 생식계열에 의해 암호화된 중쇄 및 경쇄의 아미노산 서열(예컨대, VBASE 데이터베이스에서 발견되는 것)을 돌연변이된 면역글로불린 중쇄 및 경쇄 프레임워크 아미노산 서열과 비교하여, 돌연변이된 면역글로불린 프레임워크 서열에서 가장 유사한 생식계열 서열과 다른 아미노산 잔기를 확인한다. 그 후, 돌연변이된 면역글로불린 서열의 적당한 뉴클레오타이드를 유전자 코드를 이용하여 생식계열 서열에 대응하도록 역돌연변이시켜 어느 뉴클레오타이드 변화가 이루어져야 하는지를 결정한다. 돌연변이된 면역글로불린 프레임워크 서열의 돌연변이유발은 표준 방법, 예컨대 PCR 매개의 돌연변이유발(돌연변이된 뉴클레오타이드가 PCR 프라이머에 혼입되어 PCR 산물이 돌연변이를 함유한다) 또는 부위 지시된 돌연변이유발 등으로 수행한다. 역돌연변이의 후보로서 확인된 각 아미노산의 역할은 항원 결합에서의 직접 또는 간접적인 역할에 대해 조사되어야 하고, 돌연변이 이후 사람 항체의 임의의 바람직한 특징에 영향을 미치는 것으로 발견된 모든 아미노산은 최종 사람 항체에 포함되지 않아야 한다; 한 예로서, 선택적 돌연변이유발 시도에 의해 확인된 활성 증강성 아미노산은 역돌연변이되지 않아야 할 것이다. 돌연변이유발에 의해 생성된 항체의 특징을 측정하는 분석법으로는 ELISA, 경쟁 ELISA, 시험관내 및 생체내 중화 분석 및/또는 (예컨대, 미국 특허 6,914,128의 실시예 3 참조) 다양한 근원(사람, 영장류 및/또는 다른 종 포함) 유래의 조직 절편을 이용한 면역조직화학을 포함할 수 있다.
역돌연변이되는 아미노산 수를 최소화하기 위해, 가장 유사한 생식계열 서열과 다르지만 제2의 생식계열 서열의 대응하는 아미노산과 동일한 것으로 확인된 아미노산 위치는, 당해 아미노산의 양측에 있는 적어도 10개, 바람직하게는 12개 아미노산이 본 발명의 사람 항체의 서열과 동일하고 동일선상이라면, 유지될 수 있다. 이것은 본 발명의 사람 항체로 처리된 피검체에서 전문 항원제시세포에 의해 면역계에 제공된 임의의 펩타이드 에피토프가 자기항원과 이종성이 아니라 동일성인, 즉 제2 생식계열 서열에 의해 암호화된 면역글로불린이도록 보장해준다. 역돌연변이는 항체 최적화의 임의의 단계에서 일어날 수 있으며, 특히 선택적 돌연변이유발 시도 전 또는 후에 곧이어 역돌연변이가 일어나는 것이 바람직하다. 역돌연변이는 선택적 돌연변이유발 시도 직전에 일어나는 것이 더욱 바람직하다.
III
. 바람직한 선택적 돌연변이유발 위치, 접촉 위치 및/또는
초돌연변이
위치에 대한 변형
일반적으로, 친화성이 향상된 항체의 선택은 상기 섹션 II 및 본 발명에 참고인용된 미국 특허 6,914,128에 기술된 바와 같은 파지 디스플레이법을 이용하여 수행할 수 있다. 이것은 조합 CDR 잔기를 무작위로 돌연변이시키고, 다른 서열의 항체를 함유하는 대형 라이브러리를 발생시켜 수행할 수 있다. 하지만, 이러한 선택 방법을 수행하기 위해서는 항체-항원 반응이 평형을 이루는 경향이 있어서, 시간이 지남에 따라 항원에 대해 친화성이 더 높은 항체가 우선적으로 결합하게 해야 한다. 평형이 수립될 수 있게 하는 선택 조건은, 달성된 친화성의 특정 수준(즉, 항체 Y61의 친화성)에 도달하자마자, 선택된 항-IL-12 항체의 친화성을 향상시키기 위해 파지 디스플레이법을 사용했을 때에는 결정할 수 없었다(이것은 아마도 항원과 파지 입자 간에 또 다른 비특이적 상호작용이 있기 때문일 것이다). 따라서, 친화성이 훨씬 높은 항체는 파지 디스플레이법에 의해서는 선택될 수 없다. 즉, 적어도 특정 항체 또는 항원의 경우에는 매우 향상된 결합 특이성/친화성을 보유한 항체를 선택하는 파지 디스플레이법의 능력이 제한적이다. 따라서, 이러한 제한을 극복하기 위해서 항체의 파지 디스플레이 친화성 성숙을 필요로 하지 않는 선택적 돌연변이유발 시도라 불리는 방법이 수립되었고, 본 발명에 의해 제공된다. 이러한 선택적 돌연변이유발 시도는 파지 디스플레이 시스템의 이용 시의 한계를 극복하기 위해 개발되었지만, 이 방법은 파지 디스플레이 시스템과 함께 사용될 수도 있다는 것을 주목해야 한다. 더욱이, 선택적 돌연변이유발 시도는 임의의 항체의 활성을 향상시키기 위해 사용될 수 있다.
항체의 활성(예컨대, 친화성 또는 중화 활성)을 향상시키기 위해, 이론적으로는 중쇄 및 경쇄 내의 모든 CDR 위치를 모든 다른 가능한 아미노산 잔기로 돌연변이시키는 것이 바람직할 것이다. 하지만, 항체 내에는 평균 70개의 CDR 위치가 있어서, 이러한 시도는 매우 시간 소모적이며 일이 많은 작업일 것이다. 따라서, 본 발명의 방법은 중쇄 및/또는 경쇄 CDR 내의 선택된 특정 잔기만을 돌연변이시켜 항체의 활성이 향상되도록 한다. 더욱이, 본 발명의 방법은 항체의 다른 바람직한 성질에 영향을 미침이 없이 항체의 활성을 향상시킨다.
항원과 접촉하고 있는 항체 가변 영역의 아미노산 잔기의 결정은 1차 서열이나 가변 영역 내의 위치를 기초로 해서 정확하게 예측할 수는 없다. 그럼에도 불구하고, 카벳 등은 특이성이 다른 항체들의 서열을 정렬시켜 항체들 간에 유의적으로 다른 가변 영역내의 국소 영역으로서 CDR을 확인했다(Kabat et al. (1971) Ann . NY Acad, Sci . 190:382-393, Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest , Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). 구조 연구는 항원결합표면이 CDR에 존재하는 아미노산 잔기에 의해 형성된다는 것을 입증했다. 또한, CDR 외측의 다른 아미노산 잔기들도 항원 결합에 직접 관여하거나 또는 구조적 역할을 하는 것으로 알려져 있다. 따라서, 각 항원-항체 쌍마다, CDR 내측 및 외측에 존재하는 아미노산 잔기가 중요할 수 있다.
톰리슨 등에 의한 서열 정렬 연구는 중쇄 및 경쇄 CDR1 및 CDR2와 빈번한 체세포 돌연변이 부위인 카파쇄 CDR3의 일부에서 많은 위치를 확인했다(Tomlison et al (1996) J. Mol . Biol . 256: 813-817). 특히, 위치 H31, H31B, H33, H33B, H52B, H56, H58, L30, L31, L31A, L50, L53, L91, L92, L93 및 L94는 체세포 돌연변이의 빈번한 부위로서 확인되었다. 하지만, 이 분석은 중요한 중쇄 CDR3 영역, 및 항체 결합 부위의 중심에 위치하고 잠재적으로 항원과 중요한 상호작용을 제공하는 것으로 알려져 있는 경쇄 CDR3의 구역을 배제한다. 더욱이, 톰리슨 등은 체세포 다양성만이 항원 결합에서 특정 아미노산의 역할을 반드시 예측할 수 있는 것은 아니라고 제안하고, 항원과 접촉하는 보존적인 아미노산 잔기 및 항원과 접촉하지 않는 다양성 아미노산 잔기를 제시한다. 이러한 결론은 항체 친화성에 대한 체세포 돌연변이의 역할에 미치는 돌연변이 연구에 의해 더욱 지지되고 있다(Sharon , (1990), PNAS, 87:4814-7). 고친화성 항-p-아조페닐아르소네이트(Ars) 항체의 19개 체세포 돌연변이는 동시에 이들의 대응하는 생식계열 잔기로 교체되어 활성이 200배 감소된 생식계열형 항-Ars 항체를 생성했다. 항-Ars 항체의 완전한 친화성은 19개의 체세포 돌연변이 중 3개만을 복원시킴으로써 회복할 수 있었고, 이것은 항원 결합 활성에 기여하지 않는 많은 체세포 돌연변이가 허용될 수 있다는 것을 증명하는 것이다.
이러한 결과는 항체 다양성 자체의 성질로 부분적으로 설명될 수 있다. 미성숙 B 세포는 처음에는 다수의 자기 또는 비자기 항원을 인식하는 저친화성 항체를 생산할 수 있다. 게다가, 항체는 친화성 성숙 과정에서 자기반응성을 유발할 수 있는 서열 변동을 일으킬 수 있다. 이러한 저 친화성 항체의 초돌연변이는 자기반응성을 없애고("음성 선택"), 이종 항원에 대한 친화성을 증가시키는 작용을 할 수 있다. 따라서, 다수의 항체의 1차 및 구조 데이터의 분석은 (1) 친화성 성숙 과정 대 불필요한 항원에 대한 친화성 저하 과정에서 체세포 초돌연변이 부위의 역할 또는 (2) 주어진 아미노산이 특정 항원-항체 쌍의 성질에 기여하는 방식 중 어느 하나를 예측하는 방법도 제공하지 못한다.
항원 인식에서 특정 아미노산 잔기의 역할을 밝혀내기 위한 다른 시도는 항원-항체 복합체의 다수의 결정 구조를 분석함으로써 이루어졌다(MacCallum et al . (1996) J. Mol . Biol . 262: 732-745). CDR 내부 및 외부에 위치한 위치들의 잠재적인 역할이 예시되었다. 26개의 분석된 구조 중 10개 이상의 구조에서 항원 결합에 관여하는 CDR의 위치는 중쇄의 H31, H33, H50, H52, H53, H54, H56, H58, H95, H96, H97, H98 및 H100과 경쇄의 L30A, L32, L91, L92, L93, L94 및 L96을 포함했다. 하지만, 상기 저자들은 이러한 구조 데이터와 다른 구조 데이터를 이용한 항원 접촉부의 예측이 접촉 위치를 과대 및 과소 예측할 수 있고, 이로써 다른 항원들에 다른 전략이 적용되어야만 할 것이라는 고찰을 하게 될 수 있다는 것을 지적했다.
피니 등은 대형 파지 디스플레이 라이브러리에 있는 항체 CDR 서열들의 다수의 잔기를 무작위로 선별하여 항체 친화성을 급증시키는 방법을 설명하고 있다(Pini et al . (1998) J. Biol Chem . 273: 21769-21776). 하지만, 피니 등에 의해 논의된 고친화성 항체는 총 8개 위치에서 돌연변이를 갖고 있었고, 항체의 친화성을 향상시키기 위해 절대적으로 필요한 변화의 축소 분석(reductionary analysis)은 필요한 아미노산의 최소 수에 대하여 검사해야 하는 다수의 가능한 조합으로 인해 비현실적이다.
더욱이, 다수의 잔기들의 무작위 선별은 항체의 다른 바람직한 성질을 반드시 보존시킬 수는 없다. 항체의 바람직한 성질 또는 특징은 업계에 잘 알려져 있고, 그 예로는 다른 단백질 또는 사람 조직 등과의 비-교차반응성의 보존, 및 중화 효능의 향상을 위한 사람 생식계열 면역글로불린 서열과 유사한 항체 서열의 보존을 포함한다. 다른 바람직한 성질 또는 특징으로는 종 교차반응성을 보존하는 능력, 에피토프 특이성을 보존하는 능력 및 포유동물 세포에서 단백질의 높은 발현 수준을 보존하는 능력을 포함한다. 이러한 바람직한 성질 또는 특징은 당업계에서 인정된 기술, 예컨대 ELISA, 경쟁적 ELISA, 시험관내 및 생체내 중화 분석(미국 특허 6,914,128의 실시예 3 참조), 사람, 영장류 또는 필요할 수 있는 다른 근원을 비롯하여 여러 근원 유래의 조직 절편과의 면역조직화학, 및 일시적 발현 또는 안정한 발현을 이용한 포유동물 세포에서의 발현에 대한 연구 등, 이에 국한되지 않는 기술로 관찰하거나 측정할 수 있다.
또한, 피니 등의 방법은 친화성을 향상시키는데 실제 필요한 최소 수보다 더 많은 변화를 도입시킬 수 있고, 그 결과 사람 피검체에서 항-사람 항체(HAMA) 형성을 자극하는 항체를 초래할 수 있다. 또한, 다른 곳에서 논의된 것처럼, 여기서 입증된 바와 같은 파지 디스플레이, 또는 다른 관련 방법, 예컨대 리보좀 디스플레이는 항체와 항원 간에 일정한 친화성에 도달하자마자 적당한 작업을 할 수 없고, 다른 파지 또는 리보좀 성분과 항원과의 상호작용을 비롯한 다른 상호작용으로 인해 적당한 시간 틀이 지난 후에도 평형에 도달하는데 필요한 조건이 수립되지 못할 수 있다.
당업자는 앞에서 논한 참고문헌들의 교시로부터 항체 다양성의 기원에 대한 흥미로운 과학적 정보를 조금씩 수집할 수 있다. 하지만, 본 발명은 항체의 바람직한 특징이나 다른 관련 특성을 보존하면서 특정 항원-항체 쌍의 항체 친화성을 증가시키는 방법을 제공한다. 이것은 항원 결합을 비롯하여 다수의 여러 특징을 특정 항체에 부여하는 바람직함을 생각할 때, 특히 중요하다.
출발 항체가 보유되어야 하는 바람직한 성질 또는 특징을 갖고 있다면, 항체의 활성을 향상시키면서 상기 바람직한 성질을 보존시킬 수 있는 최상의 전략은 선택적 돌연변이유발 시도일 수 있다. 예를 들어, Y61의 돌연변이유발에서, 목표는 hIL-12에 대한 친화성을 증가시키고, 바람직한 성질을 보존시키면서 항체의 중화 효능을 향상시키는 것이었다. Y61의 바람직한 성질은 (1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, (2) 정밀 에피토프 특이성의 보존, 즉 p70(p40/p35) 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및 (3) 각각의 생식계열 면역글로불린 서열과 가능한 한 유사한 중쇄 및 경쇄 아미노산 서열을 보유한 항체의 생성을 포함했다.
한 구체예에서, 본 발명의 방법은 친화성 및/또는 중화 효능을 향상시키면서 항체의 바람직한 성질 또는 특징을 보존시키는 전략으로써 선택적 돌연변이유발 시도를 제공한다. "선택적 돌연변이유발 시도"란 용어는 앞에서 정의한 바와 같고 선택한 아미노산 잔기를 개별적으로 돌연변이시키는 방법을 포함한다. 돌연변이될 아미노산 잔기는 먼저 바람직한 선택적 돌연변이유발 위치 중에서 선택하고, 그 다음 접촉 위치 중에서 선택한 다음 초돌연변이 위치 중에서 선택할 수 있다. 개별적인 선택 위치는 적어도 2개의 다른 아미노산 잔기로 돌연변이시킬 수 있고, 이 돌연변이가 항체의 바람직한 성질과 항체 활성의 향상 모두에 미치는 효과를 측정한다.
선택적 돌연변이유발 시도는
1) 바람직한 선택적 돌연변이유발 위치; 2) 접촉 위치; 3) 초돌연변이 위치의 순서로 후보 위치들을 선택하고 이 위치들의 순위를 항체의 중쇄 및 경쇄 가변 영역 내의 존재 위치를 기초로 하여(CDR3이 CDR2보다 바람직하고 CDR2가 CDR1보다 바람직하다) 정하는 단계;
순위의 순서대로 후보인 바람직한 선택적 돌연변이유발 위치, 초돌연변이 위치 및/또는 접촉 위치를 가능한 모든 다른 아미노산 잔기로 개별적으로 돌연변이시키고 각 돌연변이들이 항체의 활성에 미치는 효과를 분석하여 활성 증강성 아미노산 잔기를 측정하는 단계;
필요하다면, 각 활성 증강성 아미노산 잔기의 단계별 조합을 만들어, 이러한 다양한 조합이 항체의 활성에 미치는 효과를 분석하고; 활성 증강성 아미노산 잔기를 보유하는 돌연변이 항체들을 선택하여, 이 항체들의 면역원성 잠재력과 관련된 아미노산 치환의 위치 및 정체(identity)를 기초로 해서 돌연변이 항체의 순위를 정하는 단계를 포함한다. 최고 순위는 생식계열 데이터베이스에 기술된 가변 영역 서열과 거의 동일한 아미노산 서열을 포함하거나, 또는 다른 사람 항체와 비슷한 아미노산 서열을 보유하는 돌연변이 항체에 주어진다. 하급 순위는 생식계열 서열이나 다른 사람 항체 서열에서 드물게 나타나는 아미노산 치환을 함유하는 돌연변이 항체에 주어진다. 최저 순위는 생식계열 서열 또는 다른 사람 항체의 서열에서 나타난 적이 없는 아미노산 치환을 보유하는 돌연변이 항체에 주어진다. 전술한 바와 같이, CDR3에 위치한 적어도 하나의 활성 증강성 아미노산 잔기를 함유하는 돌연변이 항체는 CDR2보다 바람직하고, 이 CDR2는 CDR1보다 바람직하다. 중쇄 가변 영역의 CDR은 경쇄 가변 영역의 CDR보다 바람직하다.
또한, 돌연변이 항체는 예컨대 이의 대응하는 모 항체와 비교했을 때, 활성의 향상에 대해 조사할 수 있다. 돌연변이 항체의 활성 향상은 예컨대 중화 분석을 통해 또는 표면 플라즈몬 공명 분석에 의한 결합 특이성/친화성을 통해(미국 특허 6,914,128의 실시예 3 참조) 측정할 수 있다. 활성의 향상은 모 항체보다 적어도 2 내지 20배 이상인 것이 바람직하다. 활성 향상은 모 항체보다 적어도 "x1" 내지 "x2"배 더 높을 수 있고, 여기서 "x1" 및 "x2"는 2와 20을 포함하는 2 내지 20의 정수, 예컨대 이 범위 내의 범위, 예를 들어 2-15, 예컨대 5-10이다.
또한, 활성 증강성 아미노산 잔기를 보유하는 돌연변이 항체는 돌연변이 후에 적어도 하나의 다른 바람직한 성질이 보유되고 있는지를 측정하는 조사를 수행할 수 있다. 예를 들어, 항-hIL-12 항체는 (1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, (2) 에피토프 인식의 보존, 즉 p70(p40/p35) 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및 (3) 각각의 생식계열 면역글로불린 서열과 가능한 한 유사한 중쇄 및 경쇄 아미노산 서열을 보유한 항체의 생성에 대해 검사하고, 생식계열 서열과 차이의 수를 기초로 해서 사람 면역 반응을 가장 적게 유발할 가능성이 있는지를 측정한다. 이와 동일한 관찰은 발생한 바람직한 성질 또는 특징의 보유 여부를 측정하기 위하여, 하나보다 많은 활성 증강성 아미노산 잔기, 예컨대 적어도 2개 또는 적어도 3개의 활성 증강성 아미노산 잔기를 보유하는 항체에 실시할 수 있다.
Y61의 돌연변이유발에서 "선택적 돌연변이유발 시도"를 이용한 한 예는 이하에 기술한다. 개별 돌연변이 H31S→E, L50→Y 또는 L94G→Y는 각각 항체의 중화 활성을 향상시켰다. 하지만, 조합 클론을 검사해보면, 조합 클론 H31S→E + L50→Y + L94G→Y의 활성은 L50→Y + L94G→Y(J695)보다 우수하지 않았다. 따라서, CDR1의 위치 31에서의 생식계열 아미노산 잔기 Ser의 Glu으로의 변화는 Y61보다 향상된 J695의 활성에는 불필요했다. 따라서, 이러한 선택적 돌연변이유발 시도는 최종 활성에 기여하는 변화의 최소 수를 확인했고, 이로써 최종 항체의 면역원성 잠재력을 감소시키면서 항체의 다른 바람직한 성질을 보존시킬 수 있다.
선택적 돌연변이유발 시도에 의해 생산된 VH 및 VL을 암호화하는 분리된 DNA는 섹션 IV에 기술된 바와 같이 전장의 항체 사슬 유전자, scFV 유전자에 대해 Fab 단편 유전자로 전환될 수 있다. 선택적 돌연변이유발 시도에 의해 생성된 VH 및 VL 영역을 발현시키고자 하는 경우에는, 중쇄 및 경쇄를 암호화하는 발현 벡터를 이용하여 섹션 IV에 상세하게 기술된 다양한 숙주 세포를 형질전환시킬 수 있다. 바람직한 숙주 세포에는 원핵생물 숙주 세포, 예컨대 이.콜라이 또는 진핵생물 숙주 세포, 예컨대 효모 세포, 구체적으로 에스.세레비지에(S. cerevisiae)를 포함한다. 가장 바람직한 진핵생물 숙주 세포는 섹션 IV에 상세하게 기술된 포유동물 숙주 세포이다.
선택적 돌연변이유발 시도는 다른 수단을 통한 항체의 사전 친화성 성숙 없이 활성이 향상된 항체를 생산하는 방법을 제공한다. 선택적 돌연변이유발 시도는 역돌연변이 처리된 친화성이 향상된 항체를 생산하는 방법을 제공한다. 또한, 선택적 돌연변이유발 시도는 친화성 성숙된 항체의 활성을 향상시키는 방법도 제공한다.
당업자는 선택적 돌연변이유발 시도가 당업계에 공지된 표준 항체 조작 기술에 사용될 수 있다는 것을 이해할 것이다. 그 예로는 CDR 이식 항체, 키메라 항체, scFv 단편, 전장 항체의 Fab 단편 및 다른 근원, 예컨대 돌연변이 마우스 유래의 사람 항체를 포함하지만, 이에 국한되는 것은 아니다.
항체의 고속 대량 돌연변이 분석은 리보좀 디스플레이 기술을 이용한 시험관내 전사 및 해독을 포함한다(예컨대, Hanes et al ., (1997) Proc . Natl . Acad . Sci. 94: 4937-4942; Dall Acqua et al .,(1998) Curr . Opin . Struc . Biol . 8: 443-450; He et al ., (1997) Nucleic Acid Res . 25: 5132-5134, 및 미국 특허 5,643,768 및 5,658,754(특허권자 가와사키(Kawasaki)) 참조). 또한, 선택적 돌연변이 시도는 리보좀 디스플레이 기술을 이용하여 선택할 수 있는, 활성이 향상된 항체를 생산하는 방법도 제공한다.
본 발명의 방법들에서, 항체 또는 이의 항원결합부는 HCVR 및/또는 LCVR의 CDR 내의 개별 위치들을 변경함으로써 추가로 변형시킨다. 이러한 변형들이 파지 디스플레이된 항체에 이루어질 수 있지만, 이 방법은 세균, 효모 또는 포유동물 세포 발현계와 같은 다른 종류의 숙주계에서 발현되는 항체로 수행될 수 있다는 점에서 유리하다. 변형을 위해 선택한 CDR 내의 개별 위치는 접촉 및/또는 초돌연변이 위치인 위치들을 기준으로 한다.
본 명세서에 정의된 바와 같은 바람직한 접촉 위치 및 초돌연변이 위치는 미국 특허 6,914,128의 표 3(미국 특허 6,914,128의 부록 A 및 여기에 첨부된 부록 A의 표 3)에 제시되어 있고, 본 발명의 방법에 따른 상기 위치들의 변형은 미국 특허 6,914,128의 실시예 2에 상세하게 기술되어 있다. 바람직한 접촉 위치는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택된다. 바람직한 초돌연변이 위치는 H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 및 L93으로 이루어진 그룹 중에서 선택된다. 더욱 바람직한 아미노산 잔기("바람직한 선택적 돌연변이유발 위치"라고도 언급됨)는 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94로 이루어진 그룹 중에서 선택되는 접촉 및 초돌연변이 위치이다. 특히 바람직한 접촉 위치는 L50 및 L94로 이루어진 그룹 중에서 선택된다. 바람직한 활성 증강성 아미노산 잔기는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택되는 위치에 존재하는 아미노산 잔기를 교체한다. 더욱 바람직한 활성 증강성 아미노산 잔기는 위치 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94에 존재하는 아미노산 잔기를 교체한다. 특히, 바람직한 활성 증강성 아미노산 잔기는 L50 및 L94로 이루어진 그룹 중에서 선택되는 위치에 존재하는 아미노산 잔기를 교체한다.
일반적으로, 본 발명의 방법은 당해의 모 항체 또는 이의 항원결합부의 중쇄 또는 경쇄의 CDR 내에서 특히 바람직한 선택적 돌연변이유발 위치, 접촉 및/또는 초돌연변이 위치를 선택하는 단계, 그 개별 위치를 무작위로 돌연변이유발시키거나(예컨대, 변형 항체의 "미니라이브러리"를 생산하는 돌연변이유발성 올리고뉴클레오타이드를 이용한 유전자 수단을 통해), 또는 한 위치를 바람직한 특정 아미노산으로 돌연변이시켜 발현하는 활성 증강성 아미노산 잔기를 확인하는 단계, 및 변형된 항체를 정제하는 단계(예컨대, 비파지 디스플레이 숙주계에서), 항원에 대한 변형 항체의 활성을 측정하는 단계(예컨대, BIAcore 분석으로 koff 속도를 측정하여), 이 단계들을 필요하다면 다른 CDR 위치들에서 반복하는 단계 및 활성이 향상된 것으로 나타난 개별 돌연변이들을 조합하고, 이 조합(들)이 모 항체 또는 이의 항원결합부보다 훨씬 큰 활성(예: 친화성 또는 중화 효능)의 항체를 생성하는지를 검사하는 단계를 포함한다.
따라서, 한 구체예로서 본 발명은
a) 모 항체 또는 이의 항원결합부를 제공하는 단계;
b) 돌연변이를 위한, 상보성 결정 영역(CDR) 내의 1) 바람직한 선택적 돌연변이 위치, 2) 접촉 위치 또는 3) 초돌연변이 위치를 순서대로 선택하여, 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 확인하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체 또는 이의 항원결합부의 패널을 생성하는 단계;
d) 돌연변이된 항체 또는 이의 항원결합부의 패널의 활성을 상기 모 항체 또는 이의 항원결합부와 비교하여 평가하는 단계;
e) 선택적으로, 적어도 하나의 다른 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 위해 상기 단계 a) 내지 d)를 반복하는 단계;
f) 활성을 향상시키는 것으로 확인된 개별 돌연변이를 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
g) 조합 항체 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교하여 평가하는 단계를 포함하고, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지, 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다. 선택된 항체 또는 항체들은 전술한 모 항체의 적어도 하나의 바람직한 특징 또는 성질을 상실함이 없이 또는 보유하여 향상된 활성을 나타내는 것이 바람직하다. 바람직한 특징 또는 성질은 당업계에서 인정된 기술을 이용하여 당업자에 의해 측정되거나 관찰될 수 있다.
바람직한 접촉 위치는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택된다. 바람직한 초돌연변이 위치는 H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 및 L93으로 이루어진 그룹 중에서 선택된다. 더욱 바람직한 선택적 돌연변이유발 위치는 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93 및 L94로 이루어진 그룹 중에서 선택된다. 특히 바람직한 접촉 위치는 L50 및 L94로 이루어진 그룹 중에서 선택된다.
다른 구체예로서, 본 발명은
a) 모 항체 또는 이의 항원결합부를 제공하는 단계;
b) 돌연변이를 위한, 상보성 결정 영역(CDR) 내의 바람직한 선택적 돌연변이 위치, 접촉 위치 또는 초돌연변이 위치를 선택하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체 또는 이의 항원결합부의 패널을 생성하는 단계;
d) 돌연변이된 항체 또는 이의 항원결합부의 패널의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 선택적으로, 적어도 하나의 다른 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 위해 상기 단계 a) 내지 d)를 반복하는 단계;
f) 활성을 향상시키는 것으로 확인된 2개의 개별 활성 증강성 아미노산 잔기를 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
g) 2개의 활성 증강성 아미노산 잔기를 보유하는 상기 조합 항체 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교하여 평가하는 단계를 포함하고, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직한 접촉 위치는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택된다. 바람직한 초돌연변이 위치는 H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 및 L93으로 이루어진 그룹 중에서 선택된다. 더욱 바람직한 선택적 돌연변이 위치는 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93 및 L94로 이루어진 그룹 중에서 선택된다. 특히 바람직한 접촉 위치는 L50 및 L94로 이루어진 그룹 중에서 선택된다.
다른 구체예로서, 본 발명은
a) 모 항체 또는 이의 항원결합부를 제공하는 단계;
b) 돌연변이를 위한, 상보성 결정 영역(CDR) 내의 바람직한 선택적 돌연변이 위치, 접촉 위치 또는 초돌연변이 위치를 선택하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체 또는 이의 항원결합부의 패널을 생성하는 단계;
d) 돌연변이된 항체 또는 이의 항원결합부의 패널의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 선택적으로, 적어도 하나의 다른 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 위해 상기 단계 a) 내지 d)를 반복하는 단계;
f) 활성을 향상시키는 것으로 확인된 3개의 개별 활성 증강성 아미노산 잔기를 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
g) 2개의 활성 증강성 아미노산 잔기를 보유하는 상기 조합 항체 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교하여 평가하는 단계를 포함하고, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직하게는, 활성 증강성 아미노산 잔기는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택되는 위치에 존재하는 아미노산 잔기를 교체한다.
개별 선택된 위치의 돌연변이유발 이후, 돌연변이된 클론은 서열분석하여 각 클론의 선택된 위치에 도입된 아미노산 잔기를 확인할 수 있다. 통계적으로 10 내지 15개의 고유 항체를 산출할 소수의 클론(예: 약 24개)을 선택하여 서열분석할 수 있고, 이에 반해 선택된 위치마다 가능한 모든 치환이 이루어진 항체를 확인하기 위해서는 다수의 클론(예: 60개 이상)을 서열분석할 수 있다.
한 구체예에 따르면, 먼저 중쇄 및/또는 경쇄의 CDR3 영역 내의 접촉 위치 및/또는 초돌연변이 위치가 돌연변이유발을 위해 선택된다. 하지만, 파지 디스플레이 선택을 통해 CDR3 영역의 무작위 돌연변이유발에 의해 이미 시험관내에서 친화성 성숙된 항체인 경우에는, 먼저 중쇄 및/또는 경쇄의 CDR1 또는 CDR2 내의 접촉 및/또는 초돌연변이 위치를 선택하는 것이 바람직할 수 있다.
더욱 바람직한 구체예에 따르면, 먼저 중쇄 및/또는 경쇄의 CDR3 영역 내의 바람직한 선택적 돌연변이유발 위치가 돌연변이유발을 위해 선택된다. 하지만, 파지 디스플레이 선택을 통해 CDR3 영역의 무작위 돌연변이유발에 의해 이미 시험관내에서 친화성 성숙된 항체인 경우에는, 먼저 중쇄 및/또는 경쇄의 CDR1 또는 CDR2 내의 바람직한 선택적 돌연변이유발 위치를 선택하는 것이 바람직할 수 있다.
다른 바람직한 구체예에 따르면, 선택된 항체의 선택적 돌연변이유발 시도에 의한 최적화는 연속해서 다음과 같이 수행한다: H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94로 이루어진 그룹 중에서 선택되는 바람직한 선택적 돌연변이유발 위치를 먼저 적어도 2개의 다른 아미노산으로 각각(바람직하게는 5 내지 14개의 다른 아미노산)으로 돌연변이시키고, 수득되는 항체를 친화성, 중화 효능의 증가(및 가능하게는 다른 곳에서 논의되는 적어도 하나의 다른 보유 특징 또는 성질)에 대해 특성규명한다. 하나의 바람직한 선택적 돌연변이유발 위치의 돌연변이가 친화성 또는 중화 효능을 전혀 또는 충분히 증가시키지 못하고, 심지어 바람직한 선택적 돌연변이유발 위치의 아미노산을 교체하는 다수의 활성 증강성 아미노산의 조합이 목표 활성(예컨대, 친화성 및/또는 중화 효능)에 부합하는 조합 항체를 생성하지 못한다면, 선택적 돌연변이유발을 위해 H35, H50, H53, H54, H95, H96, H97, H98, L30A 및 L96으로 이루어진 그룹 중에서 선택되는 추가 아미노산 잔기를 적어도 2개의 다른 아미노산으로 각각(바람직하게는 5 내지 14개의 다른 아미노산) 돌연변이시키고, 수득되는 항체를 친화성, 중화 효능의 증가(및 가능하게는 다른 곳에서 논의되는 적어도 하나의 다른 보유 특징 또는 성질)에 대해 특성규명한다.
H35, H50, H53, H54, H95, H96, H97, H98, L30A 및 L96으로 이루어진 그룹 중에서 선택된 단일 아미노산 잔기의 돌연변이가 활성(예컨대, 친화성 및/또는 중화 효능)을 전혀 또는 충분히 증가시키지 않는다면, 심지어 상기 위치들의 아미노산을 교체하는 복수의 활성 증강성 아미노산의 조합이 목표 활성(예컨대, 친화성 및/또는 목표 중화 효능)에 부합하는 조합 항체를 생성하지 않는다면, 선택적 돌연변이유발을 위해 H33B, H52B 및 L31A로 이루어진 그룹 중에서 선택되는 추가 아미노산 잔기를 적어도 2개의 다른 아미노산으로 각각(바람직하게는 5 내지 14개의 다른 아미노산) 돌연변이시키고, 수득되는 항체를 친화성, 중화 효능의 증가(및 가능하게는 다른 곳에서 논의되는 적어도 하나의 다른 보유 특징 또는 성질)에 대해 특성규명한다.
물론, 연속적인 선택적 돌연변이유발 시도는 바람직한 활성(예컨대, 친화성 및 중화 효능)을 가진 항체가 확인되자마자 상기 개략한 임의의 단계에서 종결할 수 있다. 사전 선택된 위치들의 돌연변이유발이 활성 증강성 아미노산 잔기를 확인했지만, 조합 항체가 여전히 목표 활성 세트(예컨대, 친화성 및 중화 효능)에 부합하지 않는다면 및/또는 확인된 활성 증강성 아미노산이 다른 바람직한 특징들에도 영향을 미쳐 허용될 수 없다면, 나머지 CDR 잔기를 돌연변이유발로 처리할 수 있다(섹션 IV 참조).
본 발명의 방법은 소정의 목표 활성(예: 소정의 친화성 및/또는 중화 효능, 및/또는 바람직한 성질 또는 특징)을 달성하도록 항체 또는 이의 항원결합부의 활성을 향상시키는데 사용될 수 있다.
따라서, 본 발명은
a) 모 항체 또는 이의 항원결합부를 제공하는 단계;
b) H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94로 이루어진 그룹 중에서 선택되는 바람직한 선택적 돌연변이유발 위치를 선택하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 제1 패널 또는 이의 항원결합부를 생성하는 단계;
d) 돌연변이된 항체의 제1 패널 또는 이의 항원결합부의 활성을 평가하여, 단일 선택적 돌연변이유발 위치의 돌연변이가 소정의 목표 활성 또는 부분 목표 활성을 가진 항체 또는 이의 항원결합부를 생산하는지를 결정하는 단계;
e) 활성을 향상시키는 것으로 확인된 개별 돌연변이를 단계별 방식으로 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계;
f) 상기 조합 항체 또는 이의 항원결합부의 활성을 평가하여 그 조합 항체 또는 이의 항원결합부가 소정의 목표 활성 또는 부분 목표 활성을 보유하는지를 측정하는 단계;
g) 단계 d) 또는 f)가 소정의 목표 활성을 보유하는 항체 또는 이의 항원결합부를 생성하지 못한다면, 또는 부분 활성만을 보유하는 항체를 생성한다면, H35, H50, H53, H54, H95, H96, H97, H98, L30A 및 L96으로 이루어진 그룹 중에서 선택되는 추가 아미노산 잔기를 적어도 2개의 다른 아미노산 잔기로 돌연변이시켜, 돌연변이된 항체의 제2 패널 또는 이의 항원결합부를 생성하는 단계;
h) 제2 패널의 돌연변이된 항체 또는 이의 항원결합부의 활성을 평가하여, H35, H50, H53, H54, H95, H96, H97, H98, L30A 및 L96으로 이루어진 그룹 중에서 선택되는 단일 아미노산 잔기의 돌연변이가 소정의 목표 활성 또는 부분 활성을 보유하는 항체 또는 이의 항원결합부를 생성하는지를 측정하는 단계;
i) 활성을 향상시키는 것으로 확인된 단계 g)의 개별 돌연변이를 단계별 방식으로 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계;
j) 상기 조합 항체 또는 이의 항원결합부의 활성을 평가하여 그 조합 항체 또는 이의 항원결합부가 소정의 목표 활성 또는 부분 목표 활성을 보유하는지를 측정하는 단계;
k) 단계 h) 또는 j)가 소정의 목표 활성을 보유하는 항체 또는 이의 항원결합부를 생성하지 못한다면, 또는 부분 활성만을 보유하는 항체를 생성한다면, H33B, H52B 및 L31A로 이루어진 그룹 중에서 선택되는 추가 아미노산 잔기를 적어도 2개의 다른 아미노산 잔기로 돌연변이시켜, 돌연변이된 항체의 제3 패널 또는 이의 항원결합부를 생성하는 단계;
l) 제3 패널의 돌연변이된 항체 또는 이의 항원결합부의 활성을 평가하여, H33B, H52B 및 L31A로 이루어진 그룹 중에서 선택되는 단일 아미노산 잔기의 돌연변이가 소정의 목표 활성 또는 부분 활성을 보유하는 항체 또는 이의 항원결합부를 생성하는지를 측정하는 단계;
m) 활성을 향상시키는 것으로 확인된 단계 k)의 개별 돌연변이를 단계별 방식으로 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계;
n) 상기 조합 항체 또는 이의 항원결합부의 활성을 평가하여 그 조합 항체 또는 이의 항원결합부가 소정의 목표 활성을 보유하는지를 측정하여 소정의 목표 활성을 보유하는 항체 또는 이의 항원결합부를 생산하는 단계를 포함하여, 소정의 목표 활성을 달성하기 위해 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
돌연변이유발 방법은 PCR 어셈블리, 쿤켈(Kunkel)(dut-ung-) 및 티오포스페이트(Amersham Sculptor 키트) 올리고뉴클레오타이드 지시된 돌연변이유발을 비롯한 다수의 방법을 사용할 수 있다.
돌연변이된 항체의 발현에는 다양한 숙주 발현계, 예컨대 세균, 효모, 배큘로바이러스 및 포유동물 발현계(뿐만 아니라 파지 디스플레이 발현계)를 사용할 수 있다. 적합한 세균 발현 벡터의 한 예는 pUC119(Sfi)이다. 다른 항체 발현계는 당업계에 공지되어 있고/있거나 이하 섹션 IV에 기술된다.
본 발명의 방법에 의해 생산된 변형 항체 또는 이의 항원결합부는 선별을 위한 파지 디스플레이 방법에 의존함이 없이 확인될 수 있다. 따라서, 본 발명의 방법은 파지 디스플레이계에서 선별하여 수득했지만 그 활성이 파지 디스플레이계에서의 돌연변이유발에 의해 추가로 향상될 수 없는 재조합 모 항체 또는 이의 항원결합부의 활성을 향상시키는데 특히 유리하다.
따라서, 다른 구체예에 따르면, 본 발명은
a) 파지 디스플레이계에서 선별에 의해 수득되었지만 이 파지 디스플레이계에서의 돌연변이유발에 의해 활성이 추가로 향상될 수 없는 재조합 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) 돌연변이를 위한, 상보성 결정 영역(CDR) 내의 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 선택하여, 선택된 접촉 또는 초돌연변이 위치를 확인하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 비-파지 디스플레이계에서 발현시키는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계;
e) 선택적으로, 적어도 하나의 다른 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 위해 상기 단계 b) 내지 d)를 반복하는 단계;
f) 활성을 향상시키는 것으로 확인된 개별 돌연변이를 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
g) 상기 조합 항체 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교하여 평가하는 단계를 포함하고, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직한 접촉 위치는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택된다. 바람직한 초돌연변이 위치는 H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 및 L93으로 이루어진 그룹 중에서 선택된다. 더욱 바람직한 선택적 돌연변이유발 위치는 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93 및 L94로 이루어진 그룹 중에서 선택된다. 특히 바람직한 접촉 위치는 L50 및 L94로 이루어진 그룹 중에서 선택된다.
이용할 수 있는 방법으로는, 앞에서 논한 항체의 다른 성질 또는 특징을 유지하면서 증가된 결합 친화성 및 중화 효능을 가진 항체를 유도하는 것이 불가능하거나 극히 어렵다. 하지만, 본 발명의 방법은 이러한 항체를 쉽게 확인할 수 있다. 본 발명의 방법으로 처리된 항체는 어떠한 근원에서도 얻을 수 있다.
따라서, 다른 구체예로서, 본 발명은
a) 재조합 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) 돌연변이를 위한, 상보성 결정 영역(CDR) 내의 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 선택하여, 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 확인하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 적당한 발현계에서 발현시키는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 항체에 보유되어야 하는 적어도 하나의 다른 성질 또는 특징에 대하여 상기 돌연변이된 항체의 패널 또는 이의 항원결합부를 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하고, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 적어도 하나의 보유 성질 또는 특징을 가진 항체 또는 이의 항원결합부가 수득될 때까지 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직한 구체예로서, 접촉 위치는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
다른 바람직한 구체예로서, 초돌연변이 위치는 H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 및 L93으로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
더욱 바람직한 구체예에서, 선택적 돌연변이유발을 위한 잔기는 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94로 이루어진 그룹의 바람직한 선택적 돌연변이유발 위치 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
더욱 바람직한 구체예로서, 접촉 위치는 L50 및 L94로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
따라서, 특정 항원에 대한 항체의 친화성이 향상되어야 하지만, 파지 디스플레이(또는 리보좀 디스플레이를 비롯한 관련 계) 방법이 더 이상 적용할 수 없는 경우, 그리고 다른 바람직한 성질 또는 특징이 보유되어야만 한다면, 본 발명의 방법이 사용될 수 있다. 따라서, 다른 구체예로서, 본 발명은
a) 파지 디스플레이계에서 선별에 의해 수득되었지만 이 파지 디스플레이계에서의 돌연변이유발에 의해 활성이 추가로 향상될 수 없는 재조합 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) 돌연변이를 위한, 상보성 결정 영역(CDR) 내의 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 선택하여, 선택된 바람직한 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 확인하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 비-파지 디스플레이계에서 발현시키는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 항체에 보유되어야 하는 적어도 하나의 다른 성질 또는 특징에 대하여 상기 돌연변이된 항체의 패널 또는 이의 항원결합부를 상기 모 항체 또는 이의 항원결합부와, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 적어도 하나의 보유 성질 또는 특징을 가진 항체 또는 이의 항원결합부가 수득될 때까지 비교 평가하는 단계;
f) 선택적으로, 적어도 하나의 다른 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 위해 상기 단계 a) 내지 e)를 반복하는 단계; 및
g) 활성을 향상시키는 것으로 확인된 적어도 2개의 개별 활성 증강성 아미노산 잔기를 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
h) 상기 조합 항체 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교하여 평가하는 단계를 포함하고, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 적어도 하나의 보유된 다른 성질 또는 특징을 보유하는 항체 또는 이의 항원결합부가 수득될 때까지 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직한 구체예로서, 접촉 위치는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
다른 바람직한 구체예로서, 초돌연변이 위치는 H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 및 L93으로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
더욱 바람직한 구체예에서, 선택적 돌연변이유발을 위한 잔기는 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94로 이루어진 그룹의 바람직한 선택적 돌연변이유발 위치 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
더욱 바람직한 구체예로서, 접촉 위치는 L50 및 L94로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
또 다른 구체예로서, 본 발명은
a) 파지 디스플레이계에서 선별에 의해 수득되었지만 이 파지 디스플레이계에서의 돌연변이유발에 의해 활성이 추가로 향상될 수 없는 재조합 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) 돌연변이를 위한, 상보성 결정 영역(CDR) 내의 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 선택하여, 선택된 접촉 또는 초돌연변이 위치를 확인하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 비-파지 디스플레이계에서 발현시키는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 항체에 보유되어야 하는 적어도 하나의 다른 성질 또는 특징에 대하여 상기 돌연변이된 항체의 패널 또는 이의 항원결합부를 상기 모 항체 또는 이의 항원결합부와, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 적어도 하나의 보유 성질 또는 특징을 가진 항체 또는 이의 항원결합부가 수득될 때까지 비교 평가하는 단계를 포함하여 항체 또는 이의 항원 결합부의 활성을 향상시키는 방법을 제공한다.
바람직한 구체예로서, 접촉 위치는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
다른 바람직한 구체예로서, 초돌연변이 위치는 H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 및 L93으로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
더욱 바람직한 구체예에서, 선택적 돌연변이유발을 위한 잔기는 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94로 이루어진 그룹의 바람직한 선택적 돌연변이유발 위치 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
더욱 바람직한 구체예로서, 접촉 위치는 L50 및 L94로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
다른 구체예로서, 본 발명은
a) 파지 디스플레이계에서 선별에 의해 수득되었지만 이 파지 디스플레이계에서의 돌연변이유발에 의해 활성이 추가로 향상될 수 없는 재조합 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) 돌연변이를 위한, 상보성 결정 영역(CDR) 내의 바람직한 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치를 선택하여, 선택된 접촉 또는 초돌연변이 위치를 확인하는 단계;
c) 상기 선택된 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 비-파지 디스플레이계에서 발현시키는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 항체에 보유되어야 하는 적어도 하나의 다른 성질 또는 특징에 대하여 상기 돌연변이된 항체의 패널 또는 이의 항원결합부를 상기 모 항체 또는 이의 항원결합부와, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 적어도 하나의 보유 특징을 가진 항체 또는 이의 항원결합부가 수득될 때까지 비교 평가하는 단계;
f) 선택적으로, 적어도 하나의 다른 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치를 위해 상기 단계 a) 내지 e)를 반복하는 단계; 및
g) 활성을 향상시키고 적어도 하나의 보유된 다른 특징을 가진 것으로 확인된 적어도 2개의 개별 활성 증강성 아미노산 잔기를 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
h) 상기 조합 항체 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교하여 평가하는 단계를 포함하고, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 적어도 하나의 보유된 성질 또는 특징을 가진 항체 또는 이의 항원결합부가 수득될 때까지 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직한 구체예로서, 접촉 위치는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96으로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
다른 바람직한 구체예로서, 초돌연변이 위치는 H30, H31, H31B, H32, H52, H56, H58, L30, L31, L32, L53 및 L93으로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
더욱 바람직한 구체예에서, 선택적 돌연변이유발을 위한 잔기는 H30, H31, H31B, H32, H33, H52, H56, H58, L30, L31, L32, L50, L91, L92, L93, L94로 이루어진 그룹의 바람직한 선택적 돌연변이유발 위치 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
더욱 바람직한 구체예로서, 접촉 위치는 L50 및 L94로 이루어진 그룹 중에서 선택되고, 다른 특징은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
IV
. 다른
CDR
잔기의
변형
최종적으로, 주어진 항체-항원 쌍 중의 모든 CDR 잔기는 어떠한 방식에 의해서든지 활성 증강성 아미노산 잔기로서 필요로 되고/되거나 항원에 결합하고/하거나 항체의 다른 바람직한 성질 또는 특징을 보유하기 위해 직접 또는 간접적으로 필요로 되는 것으로 확인되었다. 이러한 CDR 잔기들은 "바람직한 선택적 돌연변이유발 위치"라고도 불린다. 물론, 특정 상황에서는 바람직한 선택적 돌연변이유발 잔기가 항체와 항원의 공결정화 및 분자 모델링을 비롯한 다른 방식에 의해 확인될 수도 있다.
전술한 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치에 초점을 맞춘 활성 증강성 아미노산을 확인하기 위한 바람직한 시도가 고갈된다면, 또는 추가 개선안이 필요하다면, 나머지 CDR 잔기를 이하에 기술되는 바와 같이 변형시킬 수 있다. 물론, 항체가 앞에서 논한 구체예에 따라 어느 하나 이상의 접촉 또는 초돌연변이 위치에서 이미 변형이 이루어져 있을 수 있지만, 추가 개선을 필요로 할 수도 있다. 따라서, 다른 구체예로서, 본 발명은
a) 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L50, L52, L54, L55, L91, L92, L93, L94 및 L96 외에 다른 돌연변이를 위하여 상보성 결정 영역(CDR) 내의 아미노산 잔기를 선택하는 단계;
c) 상기 선택된 위치를 예컨대 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체 또는 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하는 단계;
d) 돌연변이된 항체, 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여, 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 적어도 하나의 다른 성질 또는 특징의 변화에 대하여, 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지, 상기 돌연변이된 항체 또는 돌연변이된 항체의 패널, 또는 이의 항원결합부를 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하여, 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직하게는, 다른 특징 또는 성질은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
단일 잔기의 돌연변이유발이 충분하지 않다면, 다른 잔기들이 관련될 수 있고; 이에 따라 또 다른 구체예에 따르면, 본 발명은
a) 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 외에 다른 돌연변이를 위하여 상보성 결정 영역(CDR) 내의 아미노산 잔기를 선택하는 단계;
c) 상기 선택된 위치를 예컨대 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여, 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 상기 b)에서 선택된 위치 또는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 위치도 아닌 적어도 하나의 다른 CDR 위치를 위해 상기 단계 b) 내지 d)를 반복하는 단계;
f) 활성을 향상시키는 것으로 확인된 적어도 2개의 개별 활성 증강성 아미노산 잔기를 상기 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
g) 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지 2개의 활성 증강성 아미노산 잔기를 보유하는 상기 조합 항체 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하여, 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
전술한 접촉 또는 초돌연변이 위치에 초점을 맞춘 활성 증강성 아미노산을 확인하기 위한 바람직한 시도가 고갈되었다면, 또는 추가 개선안이 필요하다면, 그리고 당해의 항체가 돌연변이유발 및 파지 디스플레이(또는 관련 리보좀 디스플레이)에 의해 더 이상 최적화될 수 없다면, 나머지 CDR 잔기를 이하에 기술되는 바와 같이 변형시킬 수 있다. 물론, 항체가 앞에서 논한 구체예에 따라 어느 하나 이상의 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치에서 이미 변형이 이루어져 있을 수 있지만, 추가 개선을 필요로 할 수도 있다.
따라서, 다른 구체예로서, 본 발명은
a) 파지 디스플레이계에서 선별에 의해 수득되었지만 이 파지 디스플레이계에서의 돌연변이유발에 의해 활성이 추가로 향상될 수 없는 재조합 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 외에 다른 돌연변이를 위한 상보성 결정 영역(CDR) 내의 아미노산 잔기를 선택하는 단계;
c) 상기 선택된 접촉 또는 초돌연변이 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 비파지 디스플레이계에서 발현시키는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부를 적어도 하나의 다른 성질 또는 특징에 대하여, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지, 상기 모항체 또는 이의 항원결합부와 비교 평가하는 단계;
e) 적어도 하나의 다른 성질 또는 특징의 변화에 대하여, 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지, 상기 돌연변이된 항체의 패널, 또는 이의 항원결합부를 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하여, 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직하게는, 다른 특징 또는 성질은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
단일 돌연변이유발이 항체의 친화성 증가에 충분하지 않다면, 다른 잔기들이 돌연변이유발에 포함될 수 있다. 따라서, 또 다른 구체예에 따르면, 본 발명은
a) 파지 디스플레이계에서 선별에 의해 수득되었지만 이 파지 디스플레이계에서의 돌연변이유발에 의해 활성이 추가로 향상될 수 없는 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 외에 다른 돌연변이를 위한 상보성 결정 영역(CDR) 내의 아미노산 잔기를 선택하는 단계;
c) 상기 선택된 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 비파지 디스플레이계에서 발현시키는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 상기 b)에서 선택된 위치 또는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 위치도 아닌 적어도 하나의 다른 위치를 위해 상기 단계 b) 내지 d)를 반복하는 단계;
g) 활성을 향상시키는 것으로 확인된 적어도 2개의 개별 활성 증강성 아미노산 잔기를 상기 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
h) 2개의 활성 증강성 아미노산 잔기를 보유하는 상기 조합 항체 또는 이의 항원결합부의 활성 및 다른 성질을 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하고, 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직하게는, 다른 특징 또는 성질은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
전술한 바람직한 선택적 돌연변이유발 위치, 접촉 또는 초돌연변이 위치에 초점을 맞춘 활성 증강성 아미노산을 확인하기 위한 바람직한 시도는 고갈될 수 있고, 또는 추가 개선안이 필요할 수 있어, 항체의 다른 성질 또는 특징을 보유하는 것이 중요하다.
따라서, 다른 구체예로서, 본 발명은
a) 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 외에 다른 돌연변이를 위하여 상보성 결정 영역(CDR) 내의 아미노산 잔기를 선택하는 단계;
c) 상기 선택된 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여, 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 적어도 하나의 다른 성질 또는 특징의 변화에 대하여, 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 다른 성질 또는 특징이 보유된 항체 또는 이의 항원결합부가 수득될 때까지, 상기 돌연변이된 항체의 패널, 또는 이의 항원결합부를 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하고, 다른 특징에 영향을 미침이 없이 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직하게는, 다른 특징 또는 성질은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
단일 잔기의 돌연변이유발이 충분하지 않다면, 다른 잔기들이 관련될 수 있고; 이에 따라 또 다른 구체예에 따르면, 본 발명은
a) 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 외에 다른 돌연변이를 위하여 상보성 결정 영역(CDR) 내의 아미노산 잔기를 선택하는 단계;
c) 상기 선택된 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여, 활성 증강성 아미노산 잔기를 확인하는 단계;
e.) 하나 이상의 다른 특징 또는 성질의 변화에 대해, 돌연변이된 항체 또는 이의 항원결합부의 패널을 상기 모 항체 또는 이의 항원결합부와 비교하여 평가하는 단계;
e) 상기 b)에서 선택된 위치 또는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 위치도 아닌 적어도 하나의 다른 CDR 위치를 위해 상기 단계 b) 내지 e)를 반복하는 단계;
f) 활성을 향상시키는 것으로 확인된 적어도 2개의 개별 활성 증강성 아미노산 잔기를 상기 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
g) 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 적어도 하나의 보유된 다른 성질 또는 특징을 가진 항체 또는 이의 항원결합부가 수득될 때까지 2개의 활성 증강성 아미노산 잔기를 보유하는 상기 조합 항체 또는 이의 항원결합부의 활성 및 적어도 하나의 다른 성질 또는 특징의 보유를 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하여, 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
바람직한 선택적 돌연변이유발 위치, 접촉 및 초돌연변이 잔기의 돌연변이유발은 항체의 친화성을 충분하게 증가시키지 못할 수 있고, 돌연변이유발 및 파지 디스플레이법(또는 관련 리보좀 디스플레이법)은 더 이상 유용하게 사용될 수 없을 수 있고 항체의 적어도 하나의 다른 특징 또는 성질이 보유되어야만 할 수 있다.
따라서, 다른 구체예로서, 본 발명은
a) 파지 디스플레이계에서 선별에 의해 수득되었지만 이 파지 디스플레이계에서의 돌연변이유발에 의해 활성이 추가로 향상될 수 없는 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 외에 다른 돌연변이를 위한 상보성 결정 영역(CDR) 내의 아미노산 잔기를 선택하는 단계;
c) 상기 선택된 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 비파지 디스플레이계에서 발현시키는 단계;
d) 상기 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성을 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 적어도 하나의 다른 성질 또는 특징의 변화에 대하여, 모 항체 또는 이의 항원결합부에 비해 활성이 향상된 항체 또는 이의 항원결합부가 수득될 때까지, 상기 돌연변이된 항체의 패널, 또는 이의 항원결합부를 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하여, 항체 또는 이의 항원결합부의 친화성을 향상시키는 방법을 제공한다.
바람직하게는, 다른 특징 또는 성질은 1) 다른 단백질 또는 사람 조직과 비-교차반응성의 보존, 2) 에피토프 인식의 보존, 즉 p70 p40/p35 이종이량체 환경 중의 p40 에피토프를 우선적으로 인식하여, 유리 가용성 p40에 의한 결합 방해의 방지; 및/또는 3) 생식계열 면역글로불린 서열과 유사한 서열을 보유하는 항체의 생성 중에서 선택된다.
단일 잔기의 돌연변이유발이 충분하지 않다면, 다른 잔기들이 포함될 수 있고, 이에 따라 다른 구체예로서 본 발명은
a) 파지 디스플레이계에서 선별에 의해 수득되었지만 이 파지 디스플레이계에서의 돌연변이유발에 의해 활성이 추가로 향상될 수 없는 모 항체 또는 이의 항원결합부를 준비하는 단계;
b) H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 외에 다른 돌연변이를 위한 상보성 결정 영역(CDR) 내의 아미노산 잔기를 선택하는 단계;
c) 상기 선택된 위치를 적어도 2개의 다른 아미노산 잔기로 개별적으로 돌연변이시켜 돌연변이된 항체의 패널 또는 이의 항원결합부를 생성하고, 이 패널을 비파지 디스플레이계에서 발현시키는 단계;
d) 돌연변이된 항체의 패널 또는 이의 항원결합부의 활성 및 적어도 하나의 다른 성질 또는 특징의 보유를 상기 모 항체 또는 이의 항원결합부와 비교 평가하여 활성 증강성 아미노산 잔기를 확인하는 단계;
e) 상기 b)에서 선택된 위치 또는 H30, H31, H31B, H32, H33, H35, H50, H52, H52A, H53, H54, H56, H58, H95, H96, H97, H98, H101, L30, L31, L32, L34, L50, L52, L53, L55, L91, L92, L93, L94 및 L96 위치도 아닌 적어도 하나의 다른 CDR 위치를 위해 상기 단계 b) 내지 d)를 반복하는 단계;
f) 활성을 향상시키는 것으로 확인된 적어도 2개의 개별 활성 증강성 아미노산 잔기를 상기 모 항체 또는 이의 항원결합부 내에 조합시켜 조합 항체 또는 이의 항원결합부를 형성시키는 단계; 및
g) 상기 모 항체 또는 이의 항원결합부에 비해 활성이 향상되고 적어도 하나의 다른 보유한 특징 또는 성질을 가진 항체 또는 이의 항원결합부가 수득될 때까지, 2개의 활성 증강성 아미노산 잔기를 보유하는 상기 조합 항체 또는 이의 항원결합부의 활성 및 적어도 하나의 성질 또는 특징의 보유를, 상기 모 항체 또는 이의 항원결합부와 비교 평가하는 단계를 포함하여, 항체 또는 이의 항원결합부의 활성을 향상시키는 방법을 제공한다.
V. 항체의 발현
본 발명의 항체 또는 항체부는 숙주 세포에서 면역글로불린 경쇄 및 중쇄 유전자의 재조합 발현에 의해 제조할 수 있다. 항체를 재조합 발현하기 위해서, 숙주 세포는 항체의 면역글로불린 경쇄 및 중쇄를 암호화하는 DNA 단편을 운반하는 하나 이상의 재조합 발현 벡터로 형질감염시켜, 숙주 세포에서 경쇄와 중쇄가 발현되어, 바람직하게는 숙주 세포가 배양된 배지로 분비되도록 하고, 이 배지로부터 항체를 회수할 수 있다. 표준 재조합 DNA 방법론은 항체 중쇄와 경쇄 유전자를 수득하고, 이 유전자들을 재조합 발현 벡터에 혼입시킨 후, 이 벡터를 숙주 세포 내로 도입시키는데 사용되며, 이에 대해서는 예컨대 문헌[Sambrook, Fritsch and Maniatis (eds), Molecular Cloning ; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), Ausubel, F.M. et al . (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) 및 미국 특허 4,816,397, Boss et al .]에 기술되어 있다.
Joe 9 wt 항체 또는 Joe 9 wt 관련 항체의 중쇄 가변 영역을 암호화하는 DNA 단편을 수득하기 위해, 사람 IL-12에 특이적인 항체를 섹션 II에 기술된 바와 같이 사람 라이브러리로부터 선별하고 돌연변이시켰다. 일단 Joe 9 wt 항체 또는 Joe 9 wt 관련 VH 및 VL 분절을 암호화하는 DNA 단편이 수득되면, 이 서열들의 돌연변이유발을 표준 방법, 예컨대 PCR 부위 지시된 돌연변이유발(돌연변이된 뉴클레오타이드가 PCR 프라이머 내에 혼입되어 PCR 산물이 돌연변이를 함유하게 되는 PCR 매개의 돌연변이유발) 또는 다른 부위 지시된 돌연변이유발 방법으로 수행한다. J695와 같이 바람직한 활성 및 결합 특이성/친화성의 수준을 나타내는 사람 IL-12 항체는 표준 재조합 DNA 기술로 추가 조작하여, 가변 영역 유전자를 전장의 항체 사슬 유전자, Fab 단편 유전자 또는 scFv 유전자로 전환시켰다. 이러한 조작에서, VL- 또는 VH-암호화 DNA 단편은 항체 불변 영역 또는 가요성 링커와 같은 다른 단백질을 암호화하는 다른 DNA 단편에 작동가능하게 결합된다. 이러한 상황에서 사용된 "작동가능하게 결합된"이란 용어는 2개의 DNA 단편에 의해 암호화된 아미노산 서열이 이 프레임내(in-frame)로 유지하도록 결합된다는 것을 의미하고자 한다.
VH 영역을 암호화하는 분리된 DNA는 VH-암호화 DNA를 중쇄 불변 영역을 암호화하는 다른 DNA 분자(CH1, CH2 및 CH3)에 작동가능하게 결합시킴으로써 전장의 중쇄 유전자로 전환될 수 있다. 사람 중쇄 불변 영역 유전자의 서열은 당업계에 공지되어 있고(Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), 이러한 영역을 포함하는 DNA 단편은 표준 PCR 증폭으로 수득할 수 있다. 중쇄 불변 영역은 IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM 또는 IgD 불변 영역 및 카베트 문헌(Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest , Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242)에 기술된 바와 같은 모든 알로타입 변형체일 수 있지만, IgG1 또는 IgG4 불변 영역이 가장 바람직하다. Fab 단편 중쇄 유전자인 경우에, VH 암호화 DNA는 중쇄 CH1 불변 영역만을 암호화하는 다른 DNA 분자에 작동가능하게 결합될 수 있다.
VL 영역을 암호화하는 분리된 DNA는 VL 암호화 DNA를 경쇄 불변영역 CL을 암호화하는 다른 DNA 분자에 작동가능하게 결합함으로써 전장의 경쇄 유전자(및 Fab 경쇄 유전자)로 전환될 수 있다. 사람 경쇄 불변 영역 유전자 서열은 당업계에 공지되어 있고(예컨대, Kabat, E.A., et al . (1991) Sequences of Proteins of Immunological Interest , Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), 이 영역을 함유하는 DNA 단편은 표준 PCR 증폭을 통해 수득할 수 있다. 경쇄 불변 영역은 카파 또는 람다 불변 영역일 수 있으나, 람다 불변 영역인 것이 가장 바람직하다.
scFv 유전자를 제조하기 위해, VH- 및 VL-암호화 DNA 단편을 가요성 링커, 예컨대 아미노산 서열 (Gly4-Ser)3을 암호화하는 다른 단편에 작동가능하게 결합시켜, VL 및 VH 영역이 가요성 링커에 의해 결합되어 있는 인접 단일쇄 단백질로서 VH 및 VL 서열이 발현될 수 있게 한다(예컨대, Bird et al . (1988) Science 242:423-426; Huston et al . (1988) Proc . Natl . Acad . Sci . USA 85:5879-5883; McCafferty et al ., Nature (1990) 348:552-554).
본 발명의 항체 또는 항체부를 발현하기 위해, 전술한 바와 같이 수득한 부분 또는 전장의 경쇄 및 중쇄를 암호화하는 DNA를 이 유전자가 전사 및 해독 조절 서열에 작동가능하게 결합되도록 발현 벡터에 삽입한다. 이러한 상황에서, "작동가능하게 결합된"이란 용어는 벡터 내의 전사 및 해독 조절 서열이 항체 유전자의 전사 및 해독을 조절하는 의도된 기능을 수행하도록 항체 유전자가 벡터에 결합되어 있다는 것을 의미하고자 한 것이다. 발현 벡터 및 발현 조절 서열은 사용되는 발현 숙주 세포와 화합성인 것으로 선택한다. 항체 경쇄 유전자 및 항체 중쇄 유전자는 별개 벡터에 삽입할 수도 있고, 또는 더 일반적으로는 두 유전자를 동일한 발현 벡터에 삽입한다. 항체 유전자는 표준 방법(예: 항체 유전자 단편과 벡터에 상보성 제한효소 부위의 연결 또는 제한 효소부위가 존재하지 않는다면 평활말단 연결)으로 발현 벡터에 삽입한다. J695 또는 J695 관련 경쇄 또는 중쇄 서열을 삽입하기 전에 발현 벡터는 이미 항체 불변 영역 서열을 운반할 수 있다. 예를 들어, J695 또는 J695 관련 VH 및 VL 서열을 전장의 항체 유전자로 전환시키는 1가지 시도는 이미 중쇄 불변 및 경쇄 불변 영역을 각각 암호화하고 있는 발현 벡터 내의 CH 분절(들)에 VH 분절이 작동가능하게 결합하고 상기 벡터 내의 CL 분절에 VL 분절이 작동가능하게 결합하도록 상기 발현 벡터에 상기 VH 및 VL 서열을 각각 삽입하는 것이다. 추가로 또는 대안적으로, 재조합 발현 벡터는 숙주 세포로부터 항체 사슬의 분비를 촉진하는 시그널 펩타이드를 암호화할 수 있다. 항체 사슬 유전자는 이 항체 사슬 유전자의 아미노 말단에 시그널 펩타이드가 프레임내 결합하도록 벡터에 클로닝할 수 있다. 이 시그널 펩타이드는 면역글로불린 시그널 펩타이드 또는 이종 시그널 펩타이드(즉, 비면역글로불린 단백질 유래의 시그널 펩타이드)일 수 있다.
항체 사슬 유전자 외에도, 본 발명의 재조합 발현 벡터는 숙주 세포 내에서 항체 사슬 유전자의 발현을 조절하는 조절 서열을 운반한다. "조절 서열"이란 용어는 프로모터, 인핸서 및 항체 사슬 유전자의 전사 또는 해독을 조절하는 다른 발현 조절 인자(예: 폴리아데닐화 시그널)를 포함하고자 한다. 이러한 조절 서열은 예컨대 문헌[Goeddel; Gene Expression Technology : Methods in Enzymology 185, Academic Press, San Diego, CA (1990)]에 기술되어 있다. 당업자라면, 조절 서열의 선택을 비롯한 발현 벡터의 설계가 형질전환되는 숙주 세포의 선택, 원하는 단백질의 발현 수준 등과 같은 요인에 따라서 달라질 수 있다는 것을 알고 있을 것이다. 포유동물 숙주 세포 발현에 바람직한 조절 서열은 포유동물 세포에서 높은 단백질 발현 수준을 유도하는 바이러스 인자, 예컨대 사이토메갈로바이러스(CMV)(예: CMV 프로모터/인핸서), 시미안 바이러스 40(SV40)(예컨대, SV40 프로모터/인핸서), 아데노바이러스(예: 아데노바이러스 주요 후기 프로모터(AdMLP)) 및 폴리오마 유래의 프로모터 및/또는 인핸서를 포함한다. 바이러스 조절 인자 및 이의 서열에 대한 추가 설명에 대해서는 예컨대 미국 특허 5,168,062(Stinski), 미국 특허 4,510,245(Bell et al.), 미국 특허 4,968,615(Schaffner et al.), 미국 특허 5,464,758(Bujard et al.) 및 미국 특허 5,654,168(Bujard et al.)을 참조한다.
항체 사슬 유전자 및 조절 서열 외에도, 본 발명의 재조합 발현 벡터는 추가 서열, 예컨대 숙주 세포에서 벡터의 복제를 조절하는 서열(예: 복제 오리진) 및 선택성 마커 유전자를 운반할 수 있다. 선택성 마커 유전자는 벡터가 도입된 숙주 세포의 선택을 용이하게 한다(예컨대, 미국 특허 4,399,216, 4,634,665 및 5,179,017, 모두 Axel et al. 참조). 예컨대, 일반적으로 선택성 마커 유전자는 G418, 하이그로마이신 또는 메토트렉세이트와 같은 약물에 대한 내성을 벡터가 도입되어 있는 숙주 세포에 부여한다. 바람직한 선택성 마커 유전자는 디하이드로폴레이트 리덕타제(DHFR) 유전자(메토트렉세이트 선택/증폭에서 dhfr- 숙주 세포에 사용됨) 및 neo 유전자(G418 선택을 위해)를 포함한다.
경쇄 및 중쇄의 발현을 위해, 중쇄 및 경쇄를 암호화하는 발현 벡터(들)는 표준 기술에 의해 숙주 세포를 형질감염시킨다. "형질감염"이란 용어의 다양한 형태는 원핵생물 또는 진핵생물 숙주 세포에 외인성 DNA를 도입시키는데 통용되는 다양한 기술, 예컨대 전기천공, 인산칼슘 침전, DEAE-덱스트란 형질감염 등을 포함하고자 한다. 원핵생물 또는 진핵생물 숙주 세포에서 본 발명의 항체를 발현시키는 것은 이론적으로 가능하지만, 진핵생물 세포, 특히 포유동물 세포가 원핵생물 세포보다 적당히 폴딩된 면역학적 활성의 항체를 조립하고 분비할 가능성이 더 크기 때문에 진핵생물 세포, 가장 바람직하게는 포유동물 숙주 세포에서 항체의 발현이 가장 바람직하다. 본 발명의 재조합 항체를 발현시키기에 바람직한 포유동물 숙주 세포로는 중국 햄스터 난소(CHO 세포)[예컨대, R.J. Kaufman and P.A. Sharp (1982) Mol. Biol . 159:601-621에 기술된 바와 같은 DHFR 선택성 마커가 사용된, Urlaub and Chasin, (1980) Proc . Natl . Acad . Sci . USA 77:4216-4220에 기술된 dhfr- CHO 세포], NS0 골수종 세포, COS 세포 및 SP2 세포를 포함한다. 항체 유전자를 암호화하는 재조합 발현 벡터가 포유동물 숙주 세포에 도입되면, 숙주 세포는 이 세포에서 항체가 발현하기에 충분한 시간 동안, 또는 바람직하게는 숙주 세포가 성장되는 배양 배지로 항체를 분비하기에 충분한 시간 동안 숙주 세포를 배양하여 항체를 생산한다. 항체는 표준 단백질 정제 방법을 이용해서 배양 배지로부터 회수할 수 있다.
또한, 숙주 세포는 Fab 단편 또는 scFv 분자와 같이, 완전 항체의 일부를 생산하는 데에도 사용할 수 있다. 상기 절차의 변형도 본 발명의 범주 내에 속한다는 것은 이해될 것이다. 예를 들어, 본 발명의 항체의 경쇄 또는 중쇄 중 어느 하나(둘다는 아니다)를 암호화하는 DNA로 숙주 세포를 형질감염시키는 것이 바람직할 수 있다. 또한, hIL-12에 결합하는데 필요하지 않은 경쇄 및 중쇄 중 어느 하나 또는 둘 모두를 암호화하는 DNA의 일부 또는 전부를 제거하는 데에도 재조합 DNA 기술을 사용할 수 있다. 이러한 절두형 DNA 분자로부터 발현된 분자도 역시 본 발명의 항체에 포함된다. 또한, 하나의 중쇄 및 하나의 경쇄는 본 발명의 항체이고 다른 중쇄 및 경쇄는 hIL-12 외에 다른 항원에 특이적인 이작용성(bifunctional) 항체도 본 발명의 항체를 표준 화학적 가교 방법에 의해 제2 항체에 가교시킴으로써 생산할 수 있다.
본 발명의 항체 또는 이의 항원결합부를 재조합 발현시키기에 바람직한 계에 따르면, 항체 중쇄 및 항체 경쇄를 모두 암호화하는 재조합 발현 벡터는 인산칼슘 매개의 형질감염을 통해 dhfr- CHO 세포 내로 도입된다. 재조합 발현 벡터 내에서, 항체 중쇄 및 경쇄 유전자는 이 유전자의 높은 전사율을 유도하기 위해 인핸서/프로모터 조절 인자(예: SV40, CMV, 아데노바이러스 등에서 유래, 예컨대 CMV 인핸서/AdMLP 프로모터 조절 인자 또는 SV40 인핸서/AdMLP 프로모터 조절 인자)에 각각 작동가능하게 결합된다. 또한, 재조합 발현 벡터는 이 벡터로 형질감염된 CHO 세포를 메토트렉세이트/증폭을 통해 선택할 수 있게 하는 DHFR 유전자도 운반한다. 선택된 형질전환 숙주 세포는 항체 중쇄 및 경쇄가 발현되도록 배양하고 이 배양 배지로부터 완전 항체가 회수된다. 재조합 발현 벡터의 제조, 숙주 세포의 형질감염, 형질전환체의 선택, 숙주 세포의 배양 및 배양 배지로부터 항체의 회수에는 표준 분자생물학 기술이 사용된다. 본 발명의 항체 또는 이의 항원결합부는 사람 면역글로불린 유전자에 대해 돌연변이성인 동물(예: 마우스)에서 발현될 수 있다(예컨대, Taylor, L.D. et al. (1992) Nucl. Acids Res. 20: 6287-6295). 또한, 식물 세포를 변형시켜 본 발명의 항체 또는 이의 항원결합부를 발현하는 돌연변이 식물을 제조할 수도 있다.
이러한 설명에 비추어 볼 때, 본 발명의 다른 관점은 본 발명의 항체 및 항체부를 재조합 발현시키는데 사용할 수 있는 핵산, 벡터 및 숙주 세포 조성물에 관한 것이다. 바람직하게는, 본 발명은 J695의 CDR, 또는 J695의 전체 중쇄 및/또는 경쇄 가변 영역을 암호화하는 분리된 핵산을 특징으로 한다. 따라서, 한 구체예로서, 본 발명은 서열번호 25의 아미노산 서열을 함유하는 J695 중쇄 CDR3을 암호화하는, 항체 중쇄 가변 영역을 암호화하는 분리된 핵산을 특징으로 한다. 항체 중쇄 가변 영역을 암호화하는 핵산은 추가로 서열번호 27의 아미노산 서열을 함유하는 J695 중쇄 CDR2를 암호화하는 것이 바람직하다. 더욱 바람직하게는, 항체 중쇄 가변 영역을 암호화하는 핵산은 서열번호 29의 아미노산 서열을 함유하는 J695 중쇄 CDR1을 추가로 암호화하는 것이다. 더욱 더 바람직하게는, 분리된 핵산은 서열번호 31의 아미노산 서열을 함유하는 항체 중쇄 가변 영역(J695의 VH 전영역)을 암호화하는 것이다.
다른 구체예에 따르면, 본 발명은 서열번호 26의 아미노산 서열을 함유하는 J695 경쇄 CDR3을 암호화하는, 항체 경쇄 가변 영역을 암호화하는 분리된 핵산을 특징으로 한다. 항체 경쇄 가변 영역을 암호화하는 핵산은 추가로 서열번호 28의 아미노산 서열을 함유하는 J695 경쇄 CDR2를 암호화하는 것이 바람직하다. 더욱 바람직하게는, 항체 경쇄 가변 영역을 암호화하는 핵산은 서열번호 30의 아미노산 서열을 함유하는 J695 경쇄 CDR1을 추가로 암호화하는 것이다. 더욱 더 바람직하게는, 분리된 핵산은 서열번호 32의 아미노산 서열을 함유하는 항체 경쇄 가변 영역(J695의 VL 전영역)을 암호화하는 것이다.
또한, 본 발명은 항체 중쇄 및 항체 경쇄를 모두 암호화하는 재조합 발현 벡터를 제공한다. 예를 들어, 한 구체예로서, 본 발명은
a) 서열번호 31의 아미노산 서열을 함유하는 가변 영역을 보유하는 항체 중쇄; 및
b) 서열번호 32의 아미노산 서열을 함유하는 가변 영역을 보유하는 항체 경쇄를 암호화하는 재조합 발현 벡터를 제공한다.
또한, 본 발명은 본 발명의 하나 이상의 재조합 발현 벡터가 도입된 숙주 세포를 제공한다. 숙주 세포는 바람직하게는 포유동물 숙주 세포이고, 더욱 바람직하게는 CHO 세포, NS0 세포 또는 COS 세포이다. 또한, 본 발명은 본 발명의 재조합 사람 항체가 합성될 때까지 적당한 배양 배지에서 본 발명의 숙주 세포를 배양하여 본 발명의 재조합 사람 항체를 합성하는 방법을 제공한다. 이 방법은 또한 배양 배지로부터 재조합 사람 항체를 분리하는 단계를 포함할 수 있다.
VI
. 약제학적 조성물 및 약제학적 투여
본 발명의 항체 및 항체부는 피검체에게 투여하기에 적합한 약제학적 조성물에 혼입될 수 있다. 일반적으로, 약제학적 조성물은 본 발명의 항체 또는 항체부와 약제학적으로 허용되는 담체를 포함한다. 여기서 사용된, "약제학적으로 허용되는 담체"는 생리적 화합성인 임의의 용매 및 모든 용매, 분산 매질, 코팅제, 항세균제 및 항진균제, 등장제 및 흡수지연제 등을 포함한다. 약제학적으로 허용되는 담체의 예로는 물, 식염수, 인산염 완충 식염수, 덱스트로스, 글리세롤, 에탄올 등 중 하나 이상뿐만 아니라 이의 배합물을 포함한다. 많은 경우에, 등장제, 예컨대 당, 다알콜, 예컨대 만니톨, 소르비톨 또는 염화나트륨을 조성물에 포함하는 것이 바람직할 것이다. 약제학적으로 허용되는 담체는 추가로 보조 물질, 예컨대 항체 또는 항체부의 보관수명 또는 효과를 향상시키는 함습제 또는 유화제, 보존제 또는 완충제를 소량 함유할 수 있다.
본 발명의 항체 및 항체부는 비경구 투여에 적합한 약제학적 조성물에 혼입될 수 있다. 항체 또는 항체부는 0.1 내지 250mg/ml 항체를 함유하는 주사 용액으로 제조하는 것이 바람직하다. 주사 용액은 플린트 또는 호박색 바이알, 앰플 또는 예비충전된 주사기에 담긴 액체 또는 동결건조 투여량 형태로 구성될 수 있다. 완충액은 L-히스티딘(1-50mM), 최적으로는 5 내지 10mM, pH 5.0 내지 7.0(최적으로 pH 6.0)일 수 있다. 다른 적당한 완충액으로는, 석신산나트륨, 시트르산나트륨, 인산나트륨 또는 인산칼륨을 포함하지만, 이에 국한되는 것은 아니다. 염화나트륨은 0 내지 300mM(액체 투여량 형태인 경우, 최적으로는 150mM)의 농도로 용액의 독성을 변화시키는데 사용될 수 있다. 동결건조 투여량 형태에는 동결보호제, 주로 0 내지 10% 슈크로스(최적으로는 0.5 내지 1.0%)가 포함될 수 있다. 다른 적당한 동결보호제로는 트레할로스 및 락토스를 포함한다. 동결건조 투여량 형태에는 충전제, 주로 1 내지 10% 만니톨(최적으로는 2 내지 4%)이 포함될 수 있다. 안정제는 액체 및 동결건조 투여량 형태 모두에 사용될 수 있고, 주로 1 내지 50mM L-메티오닌(최적으로는 5 내지 10mM)이 사용된다. 다른 적당한 충전제로는 글리신, 아르기닌을 포함하고, 0 내지 0.05% 폴리소르베이트-80(최적으로는 0.005 내지 0.01%)이 포함될 수 있다. 다른 계면활성제로는 폴리소르베이트 20 및 BRIJ 계면활성제가 포함되지만, 이에 국한되는 것은 아니다.
바람직한 구체예로서, 약제학적 조성물은 항체를 약 100mg 내지 200mg 용량의 투여량으로 포함한다.
본 발명의 조성물은 다양한 형태일 수 있다. 그 예로는 액체, 반고체 및 고체 투여량 형태, 예컨대 액체 용액(예: 주사 용액 및 주입 용액), 분산액 또는 현탁액, 정제, 환제, 산제, 리포좀 및 좌약을 포함한다. 바람직한 형태는 의도한 투여 방식 및 치료 용도에 따라 달라진다. 일반적으로 바람직한 조성물은 주사 용액 또는 주입 용액 형태이고, 그 예로는 다른 항체와 함께 사람의 수동 면역에 사용되는 조성물과 유사한 조성물이 있다. 바람직한 투여 방식은 비경구 투여(예: 정맥내, 피하, 복강내, 근육내 투여)이다. 바람직한 구체예에 따르면, 항체는 피하 주사로 투여된다.
치료 조성물은 일반적으로 멸균되어야 하고 제조 및 보관 조건 하에서 안정해야 한다. 이 조성물은 용액, 마이크로에멀젼, 분산액, 리포좀, 또는 높은 약물 농도에 적합한 다른 주문 구조로 조제될 수 있다. 멸균 주사 용액은 필요한 양의 활성 화합물(즉, 항체 또는 항체부)을, 필요하다면 앞에서 열거한 하나의 성분 또는 성분의 배합물과 함께 적당한 용매에서 혼합한 뒤, 여과 멸균하여 제조할 수 있다. 일반적으로, 분산액은 기본 분산 매질과 앞에서 열거한 것 중에서 필요한 다른 성분을 함유하는 멸균 매개제에 활성 화합물을 첨가하여 제조한다. 멸균 주사 용액을 제조하기 위한 멸균 동결건조 분말의 경우에, 바람직한 제조방법은 앞서 멸균 여과된 용액으로부터 활성 성분과 추가 필요한 성분의 분말을 생산하는 진공건조 및 분무건조이다. 용액의 적당한 유동성은 예컨대 레시틴과 같은 코팅 사용, 분산액의 경우에는 필요한 입자 크기의 유지 및 계면활성제의 사용 등을 통해서 유지시킬 수 있다. 주사 조성물의 지속적인 흡수는 흡수를 지연시키는 제제, 예컨대 모노스테아레이트 염 및 젤라틴을 조성물에 첨가하여 야기할 수 있다.
본 발명의 항체 및 항체부는 많은 치료 용도들에서 바람직한 투여 경로/방식이 피하 주사, 정맥내 주사 또는 주입이더라도, 당업계에 공지된 다양한 방법을 통해 투여할 수 있다. 당업자라면 잘 알고 있듯이, 투여 경로 및/또는 방식은 원하는 결과에 따라 달라질 것이다. 특정 구체예로서, 활성 화합물은 화합물이 급속 방출되지 않게 하는 담체와 함께 조제될 수 있고, 그 예로는 조절 방출 제형, 예컨대 임플란트, 경피 패치 및 마이크로캡슐화된 전달 시스템이 있다. 생분해성, 생체화합성 중합체가 사용될 수 있으며, 그 예로는 에틸렌 비닐 아세테이트, 폴리안하이드라이드, 폴리글리콜산, 콜라겐, 폴리오르토에스테르 및 폴리락트산이 있다. 이러한 제형을 제조하는 다수의 방법은 특허되어 있거나 당업자에게 일반적으로 알려져 있다[예컨대, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978 참조].
특정 구체예에서, 본 발명의 항체 또는 항체부는 불활성 희석제 또는 동화성 식용 담체 등과 함께 경구 투여될 수 있다. 화합물(및 필요하다면 다른 성분)은 또한 경질 또는 연질 외피 젤라틴 캡슐에 봉인하거나, 정제로 압축하거나 또는 피검체의 식이에 직접 혼입할 수도 있다. 경구 치료적 투여 시에, 화합물은 부형제와 혼합되고, 복용가능한 정제, 협측 정제, 트로키, 캡슐, 엘릭시르, 현탁액, 시럽, 웨이퍼 등의 형태로 사용될 수 있다. 비경구 투여 외에 다른 투여로 본 발명의 화합물을 투여하기 위해서는 화합물의 불활성화를 방지하기 위한 물질로 화합물을 코팅하거나 또는 그런 물질과 화합물을 함께 투여하는 것이 필요할 수 있다.
또한, 보충 활성 화합물은 조성물에 혼입될 수 있다. 특정 양태에 따르면, 본 발명의 항체 또는 항체부는 IL-12 활성이 유해한 장애를 치료하는데 유용한 하나 이상의 추가 치료제와 함께 공동조제 및/또는 공동투여된다. 예를 들어, 본 발명의 항-hIL-12 항체 또는 항체부는 다른 표적들에 결합하는 하나 이상의 추가 항체(예: 다른 사이토카인에 결합하거나 세포 표면 분자에 결합하는 항체)와 공동조제 및/또는 공동투여될 수 있다. 더욱이, 본 발명의 하나 이상의 항체는 전술한 치료제 2종 이상과 함께 사용될 수도 있다. 이러한 병용 요법은 투여되는 치료제의 투여량을 낮추기 위해 유리하게 사용될 수 있고, 이로써 각종 단독요법과 관련이 있는 가능한 독성 또는 합병증을 피할 수 있다. 숙련된 의료인이라면, 본 발명의 항체가 병용 요법의 일부로서 사용될 때 항체가 단독으로 피검체에게 투여될 때보다 낮은 투여량이 필요로 될 수 있음을 잘 알고 있을 것이다(예를 들어, 상승작용적 치료 효과는 병용 요법의 사용을 통해 달성될 수 있고, 결과적으로 원하는 치료 효과를 달성하기 위한 항체 용량을 낮출 수 있다).
인터루킨 12는 면역 및 염증 인자를 수반하는 다양한 질환들과 관련이 있는 병리상태에 중요한 역할을 한다. 이러한 질환으로는 류마티스성 관절염, 골관절염, 소아만성관절염, 라임 관절염, 건선 관절염, 반응 관절염, 척추관절염, 전신홍반루푸스, 크론병, 궤양성 결장염, 염증장병, 인슐린 의존 당뇨병, 갑상선염, 천식, 알레르기병, 건선, 피부염 피부경화증, 아토피 피부염, 이식편대숙주병, 기관 이식거부, 기관 이식과 관련된 급성 또는 만성 면역병, 사르코이드증, 죽상경화증, 파종 혈관내 응고, 가와사키병, 그레이브스병, 신장증후군, 만성 피로증후군, 베게너 육아종증, 헨녹-쇈라인 자반증(Henoch-Schoenlein purpurea), 신장의 현미경적 혈관염, 만성 활성 간염, 포도막염, 패혈 쇼크, 독소 쇼크 증후군, 패혈증 증후군, 악액질, 감염성 질병, 기생충병, 후천성 면역결핍 증후군, 급성 횡단 척수염, 헌팅톤씨 무도병, 파킨슨씨병, 알츠하이머병, 졸중, 1차담관성간경화증, 용혈빈혈, 악성암, 심장부전, 심근경색, 애디슨씨병, 산발성, 다선성 I형 결핍증 및 다선성 결핍 II형, 슈미트씨 증후군, 성인(급성) 호흡곤란증후군, 탈모증, 원형탈모증, 혈청음성 관절증, 관절증, 라이터씨병, 건선관절증, 궤양성결장염관절증, 창자병 윤활막염, 클라미디아, 예르시니아 및 살모넬라 관련 관절증, 척추관절증, 죽상병/동맥경화증, 아토피성 알레르기, 자가면역수포병, 보통천포창, 낙엽천포창, 유사천포창, 선형 IgA 병, 자가면역 용혈빈혈, 쿰스 양성 용혈빈혈, 후천성 악성빈혈, 소아악성빈혈, 근육통성 뇌염/로얄 프리병(Royal Free Disease), 만성 점막피부칸디다증, 거대세포 동맥염, 1차 경화증 간염, 잠복성 자가면역 간염, 후천성 면역결핍 증후군, 후천성 면역결핍 관련병, C형 간염, 공통가변성면역결핍(공통가변성 저감마글로불린혈증), 확장성 심근증, 여성 불임, 난소부전, 조기 난소부전, 섬유소성 폐병, 잠복성 섬유화 폐포염, 염증후 간질성 폐병, 간질성 폐렴, 결합조직병 관련 간질성 폐병, 복합 결합조직병 관련 폐병, 전신 경화증 관련 간질성 폐병, 류마티스성 관절염 관련 간질성 폐병, 전신홍반루푸스 관련 폐병, 피부근육염/다발근육염 관련 폐병, 쇼그렌병 관련 폐병, 강직척추염 관련 폐병, 혈관염성 광범위 폐병, 혈철소증 관련 폐병, 약물 유도 간질성 폐병, 섬유증, 방사선 섬유증, 폐쇄세기관지염, 만성 호산구성 폐렴, 림프구성 침윤 폐병, 감염후 간질성 폐병, 통풍 관절염, 자가면역 간염, 1형 자가면역 간염(고전적 자가면역 또는 루푸스 간염), 2형 자가면역 간염(항-LKM 항체 간염), 자가면역 매개 저혈당증, 흑색가시세포증 관련 B형 인슐린 내성, 부갑상선항진증, 기관 이식 관련 급성 면역 질환, 기관 이식 관련 만성 면역 질환, 골관절염, 1차경화담관염, 건선 1형, 건선 2형, 특발 백혈구감소증, 자가면역 호중구 감소증, 신장병 NOS, 사구체신염, 신장의 현미경적 혈관염, 라임병, 원반형 홍반루푸스, 특발성 또는 NOS 남성 불임, 정자 자가면역성, 다발성 경화증(모든 서브타입), 인슐린 의존성 진성당뇨병, 교감 눈염증, 결합조직 질환에 부차적인 폐 고혈압, 굿파스쳐 증후군, 결절다발동맥염의 폐동맥 징후, 급성 류마티스열, 류마티스성 척추염, 스틸스병, 전신 경화증, 쇼그렌 증후군, 다카야스씨병/동맥염, 자가면역 저혈소판증, 특발 저혈소판증, 자가면역 갑상선 질환, 갑상선항진증, 갑상선종 자가면역 갑상선항진증(하시모토씨병), 위축 자가면역 갑상선항진증, 1차 점액부종, 수정체성 포도막염, 1차 혈관염 및 백반증을 포함하지만, 이에 국한되는 것은 아니다. 본 발명의 사람 항체 및 항체부는 자가면역 질환, 특히 염증과 관련된 자가면역 질환, 구체적으로 류마티스성 척추염, 알레르기, 자가면역 당뇨병, 자가면역 포도막염 등을 치료하는데 사용될 수 있다.
바람직하게는, 본 발명의 항체 또는 이의 항원결합부는 섹션 VII에서 더 상세하게 설명되는 류마티스성 관절염, 크론병, 다발성경화증, 인슐린 의존성 진성당뇨병 및 건선을 치료하는데 사용된다.
본 발명의 사람 항체 또는 항체부는 자가면역 및 염증 질환의 치료에 유용한 하나 이상의 추가 치료제와 함께 투여될 수 있다.
본 발명의 항체 또는 이의 항원결합부는 상기 질환을 치료하는데 단독으로 또는 병용해서 사용될 수 있다. 물론, 본 발명의 IL-12 항체 또는 이의 항원결합부는 추가 제제, 예컨대 치료제와 함께 사용되거나 단독으로 사용될 수 있고, 이러한 추가 제제는 의도된 목적에 따라 당업자가 선택할 수 있다. 예를 들어, 추가 제제는 본 발명의 항체에 의해 치료되는 질환 또는 병태를 치료하는데 유용한 것으로 당업계에서 인식되어 있는 치료제일 수 있다. 또한, 추가 제제는 치료 조성물에 유익한 특성을 부여하는 제제, 예컨대 조성물의 점도에 효과가 있는 제제일 수 있다.
또한, 본 발명에 포함되어야 하는 배합물은 의도된 목적에 유용한 배합물이라는 것은 당연하다. 이하에 제시되는 제제는 예시하기 위한 것이며 제한하려는 것이 아니다. 본 발명의 일부인 배합물은 본 발명의 항체 및 이하 목록 중에서 선택되는 적어도 하나의 추가 제제일 수 있다. 배합물은 또한 형성된 조성물이 의도된 기능을 수행할 수 있도록 하는 배합이라면 하나보다 많은 추가 제제, 예컨대 2종 또는 3종의 추가 제제를 포함할 수 있다. 더욱이, IL-12 항체와 배합물로 사용되는 본 명세서에 기술된 추가 제제는 치료용으로 여겨지는 장애에만 제한되지 않는다.
바람직한 배합물은 이부프로펜과 같은 약물을 포함하는 NSAID로 언급되기도 하는 비스테로이드성 항염증 약물(들)이다. 다른 바람직한 배합물은 프레드니솔론을 비롯한 코르티코스테로이드이고, 스테로이드 사용 시의 공지된 부작용은 본 발명의 항-IL-12 항체와 함께 환자를 치료할 때 필요한 스테로이드 용량을 점감시킴으로써 감소되거나 심지어 없어질 수도 있다. 본 발명의 항체 또는 항체부와 함께 배합될 수 있는 류마티스성 관절염용 치료제의 비제한적인 예로는 다음을 포함한다: 사이토카인 억제성 항염증 약물(들)(CSAIDs); 다른 사람 사이토카인 또는 성장인자에 대한 항체 또는 길항물질, 예컨대 TNF(아달리무마브/HUMIRA 포함), LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF 및 PDGF를 포함한다. 본 발명의 항체 또는 이의 항원결합부는 CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, 또는 이들의 리간드(예컨대, CD154(gp39 또는 CD40L))와 같은 세포 표면 분자에 대한 항체와 배합될 수 있다.
치료제의 바람직한 배합물은 자가면역 및 후속 염증성 캐스캐이드 중의 다른 지점에서 간섭할 수 있고; 바람직한 예로는 TNF 길항물질, 예컨대 키메릭 사람화된 또는 사람 TNF 항체, D2E7(미국 특허출원 일련번호 08/599,226, 1996. 2. 9), cA2(RemicadeTM), CDP 571, 항-TNF 항체 단편(예: CDP870) 및 가용성 p55 또는 p75 TNF 수용체, 이의 유도체(p75TNFRIgG (EnbrelTM) 또는 p55TNFRIgG (Lenercept)), 가용성 IL-13 수용체(sIL-13) 및 TNFα 전환효소(TACE) 억제제를 포함하고; 이와 유사하게 IL-1 억제제(예: 인터루킨-1-전환효소 억제제, 예컨대 Vx740 또는 IL-1RA 등)도 같은 이유로 효과적일 수 있다. 다른 바람직한 배합물은 인터루킨 11, 항-P7 및 p-셀렉틴 당단백질 리간드(PSGL)를 포함한다. 또 다른 바람직한 배합물은 IL-12 기능과 나란히 또는 의존적으로 또는 협동하여 작용할 수 있는 자가면역 반응의 다른 주요 역할자이다; 특히 IL-18 길항물질, 예컨대 IL-18 항체 또는 가용성 IL-18 수용체, 또는 IL-18 결합 단백질이 바람직하다. IL-12 및 IL-18은 중복성이지만 상이한 기능을 갖고 있고 이 둘에 대한 길항물질의 배합물이 가장 효과적일 수 있는 것으로 밝혀져 있다. 또 다른 바람직한 배합물은 비소모성 항-CD4 억제제이다. 또 다른 바람직한 배합물은 공동자극성 경로의 길항물질, CD80 (B7.1) 또는 CD86 (B7.2), 예컨대 항체, 가용성 수용체 또는 길항성 리간드를 포함한다.
또한, 항-IL12 항체 또는 이의 항원결합부는 메토트렉세이트, 6-MP, 아자티오프린 설파살라진, 메살라진, 올살라진 클로로퀴닌/하이드록시클로로퀸, 펜실라민, 오로 티오말레이트(근육내 및 경구), 아자티오프린, 콜히친, 코르티코스테로이드(경구, 흡입 및 국소 주사), 베타-2 아드레날린수용체 효능제(살부타몰, 터부탈린, 살메테랄), 크산틴(테오필린, 아미노필린), 크로모글리케이트, 네도크로밀, 케토티펜, 이프라트로퓸 및 옥시트로퓸, 사이클로스포린, FK506, 라파마이신, 미코페놀레이트 모페틸, 레플루노미드, NSAID, 예컨대 이부프로펜, 코르티코스테로이드, 예컨대 프레드니솔론, 포스포디에스터라제 억제제, 아데노신 효능제, 항혈전제, 보체 억제제, 아드레날린작용제, 염증촉진성 사이토카인, 예컨대 TNFα 또는 IL-1에 의한 시그널 전달을 방해하는 제제(예: IRAK, NIK, IKK, p38 또는 MAP 키나제 억제제), IL-1β 전환효소 억제제(예: Vx740), 항-P7, p-셀렉틴 당단백질 리간드(PSGL), TNFα 전환효소(TACE) 억제제, T-세포 시그널링 억제제, 예컨대 키나제 억제제, 메탈로프로테이나제 억제제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환 효소 억제제, 가용성 사이토카인 수용체 및 이의 유도체(예: 가용성 p55 또는 p75 TNF 수용체 및 유도체 p75TNFRIgG(Enbrel™) 및 p55TNFRIgG(Lenercept)), sIL-1RI, sIL-1RII, sIL-6R, 가용성 IL-13 수용체(sIL-13)) 및 항염증성 사이토카인(예: IL-4, IL-10, IL-11, IL-13 및 TGFβ)과 같은 제제와 배합될 수도 있다. 바람직한 배합물은 메토트렉세이트 또는 레플루노마이드와 중등성 또는 중증 류마티스성 관절염 증례인 경우에는 사이클로스포린을 포함한다.
항-IL-12 항체 또는 항체 일부가 배합될 수 있는 염증장병에 유용한 치료제의 비제한적 예에는 다음과 같은 것이 있다: 부데노사이드; 상피 성장 인자; 코르티코스테로이드; 사이클로스포린, 설파살라진; 아미노살리실레이트; 6-머캅토퓨린; 아자티오프린; 메트로니다졸; 리폭시게나제 억제제; 메살라민; 올살라진; 발살라지드; 항산화제; 트롬복산 억제제; IL-1 수용체 길항제; 항-IL-1β 모노클로날 항체; 항-IL-6 모노클로날 항체; 성장인자; 엘라스타제 억제제; 피리디닐-이미다졸 화합물; 다른 사람 사이토카인 또는 성장 인자, 예컨대 TNF(아달리무마브/HUMIRA 포함), LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF 및 PDGF 등에 대한 항체 또는 길항제. 본 발명의 항체 또는 이의 항원 결합부는 세포 표면 분자, 예컨대 CD2, CD3, CD4, CD8, CD25, CD30, CD40, CD45, CD69, CD90 또는 이들의 리간드에 대한 항체와 배합될 수도 있다. 본 발명의 항체 또는 이의 항원결합부는 또한 제제, 예컨대 메토트렉세이트, 사이클로스포린, FK506, 라파마이신, 마이코페놀레이트 모페틸, 레플루노마이드, NSAID, 예컨대 이부프로펜, 코르티코스테로이드, 예컨대 프레드니솔론, 포스포디에스터라제 억제제, 아데노신 효능제, 항혈전제, 보체 억제제, 아드레날린작용제, TNFα 또는 IL-1과 같은 염증촉진성 사이토카인에 의한 시그널 전달을 방해하는 제제(예: IRAK, NIK, IKK, p38 또는 MAP 키나제 억제제), IL-1β 전환효소 억제제(예: Vx740), 항-P7, p-셀렉틴 당단백질 리간드(PSGL), TNFα전환효소 억제제, T-세포 시그널 전달 억제제, 예컨대 키나제 억제제, 메탈로프로테이나제 억제제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환 효소 억제제, 가용성 사이토카인 수용체 및 이의 유도체(예: 가용성 p55 또는 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R, 가용성 IL-13 수용체(sIL-13)) 및 항염증성 사이토카인(예: IL-4, IL-10, IL-11, IL-13 및 TGFβ)과 배합될 수 있다.
항체 또는 항원결합부가 배합될 수 있는 크론병 치료제의 바람직한 예에는 다음과 같은 것이 있다: TNF 길항제, 예컨대 항-TNF 항체, D2E7(아달리무마브/HUMIRA), cA2(REMICADE™), CDP 571, 항-TNF 항체 단편(예: CDP870), TNFR-Ig 작제물(p75TNFRIgG(Enbrel™) 및 p55TNFRIgG(Lenercept)), 항-P7, p-셀렉틴 당단백질 리간드(PSGL), 가용성 IL-13 수용체(sIL-13) 및 PDE4 억제제. 본 발명의 항체 또는 이의 항원결합부는 코르티코스테로이드, 예컨대 부데노사이드 및 덱사메타손과 배합될 수 있다. 또한, 항체는 설파살라진, 5-아미노살리실산 및 올살라진과 같은 제제, 및 염증촉진성 사이토카인, 예컨대 IL-1 등의 합성 또는 작용을 방해하는 제제, 예를 들어 IL-1β 전환효소 억제제(예: Vx740) 및 IL-1ra와 배합될 수 있다. 항체 또는 이의 항원결합부는 또한 T 세포 시그널 전달 억제제, 예컨대 타이로신 키나제 억제제 6-머캅토퓨린과 함께 사용될 수 있다. 항체 또는 이의 항원결합부는 IL-11과 배합될 수 있다.
항체 또는 항체 일부와 배합될 수 있는 다발성 경화증 치료제의 비제한적 예에는 다음과 같은 것이 있다: 코르티코스테로이드; 프레드니솔론; 메틸프레드니솔론; 아자티오프린; 사이클로포스파미드; 사이클로스포린; 메토트렉세이트; 4-아미노피리딘; 티자니딘; 인터페론-β1a(AVONEX; Biogen); 인터페론-β1b(Betaseron; Chiron/Berlex); 공중합체 1(Cop-1; Copaxone; Teva Pharmaceutical Industries, Inc.); 고압 산소; 정맥내 면역글로불린; 클라브리빈; 다른 사람 사이토카인 또는 성장인자, 예컨대 TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF 및 PDGF에 대한 항체 또는 길항제. 본 발명의 항체 또는 이의 항원결합부는 CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90과 같은 세포 표면 분자 또는 이의 리간드에 대한 항체와 배합될 수 있다. 본 발명의 항체 또는 이의 항원결합부는 또한 제제, 예컨대 메토트렉세이트, 사이클로스포린, FK506, 라파마이신, 마이코페놀레이트 모페틸, 레플루노마이드, NSAID, 예컨대 이부프로펜, 코르티코스테로이드, 예컨대 프레드니솔론, 포스포디에스터라제 억제제, 아데노신 효능제, 항혈전제, 보체 억제제, 아드레날린작용제, TNFα 또는 IL-1과 같은 염증촉진성 사이토카인에 의한 시그널 전달을 방해하는 제제(예: IRAK, NIK, IKK, p38 또는 MAP 키나제 억제제), IL-1β 전환효소 억제제(예: Vx740), 항-P7, p-셀렉틴 당단백질 리간드(PSGL), TACE 억제제, T-세포 시그널 전달 억제제, 예컨대 키나제 억제제, 메탈로프로테이나제 억제제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환 효소 억제제, 가용성 사이토카인 수용체 및 이의 유도체(예: 가용성 p55 또는 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R, 가용성 IL-13 수용체(sIL-13)) 및 항염증성 사이토카인(예: IL-4, IL-10, IL-13 및 TGFβ)과 배합될 수 있다.
항체 또는 이의 항원결합부와 배합될 수 있는 다발성 경화증 치료제의 바람직한 예에는 인터페론 β, 예컨대 IFNβ1a 및 IFNβ1b; 코팍손, 코르티코스테로이드, IL-1 억제제, TNF 억제제 및 CD40 리간드 및 CD80에 대한 항체가 포함된다.
항체 또는 이의 항원결합부는 피부 병태를 치료하기 위한 다른 제제와 함께 사용될 수 있다. 예를 들어, 본 발명의 항체, 항체부 또는 다른 IL-12 억제제는 PUVA 요법과 병용된다. PUVA는 많은 여러 피부 병태를 치료하는데 사용되는 솔라렌(P)과 장파 자외선(UVA)의 배합물이다. 본 발명의 항체, 항체부 또는 다른 IL-12 억제제는 피메클로리무스와 함께 배합될 수도 있다. 다른 구체예에서, 본 발명의 항체는 건선 치료에 사용되며, 여기서 항체는 태크롤리무스와 함께 투여된다. 또 다른 구체예에서, 태크롤리무스 및 IL-12 억제제는 메토트렉세이트 및/또는 사이클로스포린과 함께 투여된다. 또 다른 구체예에서, 본 발명의 IL-12 억제제는 건선 치료를 위한 엑시머레이저 치료와 함께 투여된다.
본 발명의 약제학적 조성물은 본 발명의 항체 또는 항체부의 "치료학적 유효량" 또는 "예방학적 유효량"을 포함할 수 있다. "치료학적 유효량"이란 용어는 원하는 치료 결과를 수득하기 위한 투여량과 필요 기간 동안의 유효한 양을 의미한다. 상기 항체 또는 항체부의 치료학적 유효량은 질병상태, 연령, 성별 및 개체의 체중과 개체 내에서 원하는 반응을 유도해내는 항체 또는 항체 일부의 능력과 같은 요인에 따라 달라질 수 있다. 또한, 치료학적 유효량은 치료학적 유익 효과가 항체 또는 항체부의 임의의 독성 또는 유해 효과를 능가하는 양이다. "예방학적 유효량"은 원하는 예방학적 결과를 수득하기 위한 투여량 및 필요 기간 동안의 유효한 양을 의미한다. 일반적으로, 예방학적 용량은 질병의 초기 단계전이나 초기 단계에 피검체에 사용되기 때문에 예방학적 유효량은 치료학적 유효량보다 적은 양일 것이다.
투여 계획은 원하는 최적 반응(예컨대, 치료학적 또는 예방학적 반응)을 제공하도록 조정될 수 있다. 예를 들어, 단일 일시투여로 투여할 수도 있고, 여러 분할 용량을 경시적으로 투여할 수도 있으며 또는 치료 상황의 위급성에 따라 비례하여 감소 또는 증가된 용량을 투여할 수도 있다. 특히, 투여 용이성과 투여량의 균일성을 위해 비경구 조성물을 투여 단위 형태로 조제하는 것이 유리하다. 본 명세서에 사용된 투여 단위 형태는 치료하는 포유동물 피검체에 대하여 단일 투여량으로서 적당한 물리적으로 분리된 단위를 의미한다; 각 단위는 필요한 약제학적 담체와 관련하여 원하는 치료 효과를 제공하도록 계산된 소정 양의 활성 화합물을 포함한다. 본 발명의 투여 단위 형태에 대한 세부사항은 (a) 활성 화합물의 독특한 특징 및 수득하고자 하는 특정 치료 또는 예방학적 효과, 및 (b) 개체의 민감도 치료에 있어서 상기 활성 화합물을 배합하는 기술 고유의 제한에 따라 결정되고 직접 좌우된다.
한 양태에서, IL-12 항체 또는 이의 항원결합부는 격주 투여 요법, 예컨대 약 50 내지 300mg 범위의 격주 투여량, 약 100mg 내지 약 200mg 범위의 투여량 및 약 125 내지 약 175mg의 투여량으로 투여한다. 대안적으로, IL-12 항체는 단일 용량, 예컨대 약 200mg 용량, 약 100mg 용량으로 투여될 수 있다, 다른 구체예에서, IL-12 항체는 매주 투여 요법, 예컨대 약 50 내지 300mg 범위의 용량, 약 100mg 내지 약 200mg 범위의 투여량, 및 약 125 내지 약 175mg 범위의 투여량으로 투여한다. 물론, 언급한 범위 내의 용량들, 예컨대 85mg, 97mg 등도 본 발명에 포함된다.
다른 구체예에서, 사람 IL-12 항체 또는 이의 항원결합부는 단일 용량으로서 IL-12 활성이 유해한 장애, 예컨대 건선이 있는 피검체에게 투여되어 치료한다. IL-12 항체 또는 이의 항원결합부에 대한 반응은 피검체에서 연속 기간 동안 유지될 수 있다. 반응의 유지는 치료되는 장애에 따라 모니터될 수 있다. 예를 들어, 건선 치료 시에 IL-12 항체 또는 이의 항원결합부와의 반응 유지는 피검체의 PASI 75 반응을 경시적으로 측정하여 결정할 수 있다. 또한, 건선 치료 시에 반응의 유지는 피검체의 PASI 50 반응 또는 PASI 90 반응으로 경시적으로 측정할 수 있다. 대안적으로, 건선 치료 시에 반응의 유지는 "클리어" 또는 "최소의" PGA 점수, 예컨대 0 또는 1의 PGA 점수를 경시적으로 달성하는 피검체에 의해 측정될 수 있다.
물론, 투여량 값은 경감되어야 하는 병태의 종류 및 중증도에 따라 달라질 수 있다. 또한, 임의의 특정 피검체에서는 특정 투여량 요법이 개체의 필요 및 조성물 투여를 관리하거나 감독하는 자의 전문가적 판단에 따라 경시적으로 조정되어야 하며, 본 명세서에 제시된 투여량 범위는 예시적일 뿐이며 청구된 조성물의 범위 또는 실시를 제한하고자 하는 것이 아님을 명심해야 한다.
VII
. 발명의 용도
본 발명은 IL-12 활성이 유해한 장애를 앓고 있는 피검체의 IL-12 활성을 억제하는 방법을 제공한다. 한 구체예로서, 본 발명은 IL-12 항체 또는 이의 항원결합부의 단일 용량을 투여하는 단계를 포함하는 건선 치료방법을 제공한다.
IL-12는 다양한 장애의 병태생리에 관련되어 있다(Windhagen et al ., (1995) J. Exp. Med. 182: 1985-1996; Morita et al . (1998) Arthritis and Rheumatism. 41: 306-314; Bucht et al ., (1996) Clin . Exp . Immunol . 103: 347-367; Fais et al. (1994) J. Interferon Res . 14:235-238; Parronchi et al ., (1997) Am . J. Path. 150:823-832; Monteleone et al ., (1997) Gastroenterology . 112:1169-1178, and Berrebi et al ., (1998) Am . J. Path 152:667-672; Parronchi et al (1997) Am. J. Path . 150:823-832). 본 발명은 이러한 이러한 장애를 앓고 있는 피검체의 IL-12 활성을 억제하는 방법으로서, 피검체의 IL-12 활성이 억제되도록 피검체에게 본 발명의 항체 또는 항체부를 투여하는 단계를 포함하는 방법을 제공한다. IL-12는 사람 IL-12이고 피검체는 사람 피검체인 것이 바람직하다. 또는, 피검체는 본 발명의 항체와 교차반응하는 IL-12를 발현하는 포유동물일 수 있다. 또한, 피검체는 hIL-12가 도입된(예컨대, hIL-12의 투여에 의해 또는 hIL-12 도입유전자의 발현에 의해) 포유동물일 수 있다. 본 발명의 항체는 치료 목적으로 사람 피검체에게 투여될 수 있다(이하에 더 상세하게 논의됨). 더욱이, 본 발명의 항체는 수의학 목적으로 또는 사람 질환의 동물 모델로서, 항체와 교차반응하는 IL-12를 발현하는 사람을 제외한 포유동물에게 투여할 수 있다. 후자와 관련하여, 이러한 동물 모델은 본 발명에 따른 항체의 치료적 효능을 평가하는데 유용할 수 있다(예컨대, 투여량 및 투여 시간 과정의 검사).
본 명세서에 사용된 "IL-12 활성이 유해한 장애"란 어구는 장애를 앓고 있는 피검체에 IL-12의 존재가 장애의 병태생리에 책임이 있거나 또는 장애의 악화에 기여하는 요인인 것으로 확인되었거나 의심되는 질환 및 여타 장애를 포함하고자 한다. 따라서, IL-12 활성이 유해한 장애는 IL-12 활성의 억제가 장애의 증상 및/또는 진행을 경감시킬 것으로 예상되는 장애이다. 이러한 장애는 전술한 항-IL-12 항체를 사용하는 등에 의해 검출할 수 있는, 상기 장애를 앓고 있는 피검체의 체액 내의 IL-12 농도의 증가(예컨대, 피검체의 혈청, 혈장, 윤활액 등에서의 IL-12의 농도의 증가) 등으로 인해 입증될 수 있다. IL-12 활성이 유해한 장애의 예에는 많은 종류가 있다. 한 구체예로서, 항체 또는 이의 항원결합부는 본 명세서에 기술된 질환 또는 장애를 치료하는 치료법에 사용될 수 있다. 다른 구체예에 따르면, 항체 또는 이의 항원결합부는 본 명세서에 기술된 질환 또는 장애를 치료하는 의약의 제조에 사용될 수 있다. 몇몇 비제한적 특정 장애를 치료하는데 있어서 본 발명의 항체 및 항체부의 용도는 이하에 더 상세하게 논의된다:
A.
류마티스성
관절염
인터루킨-12는 류마티스성 관절염과 같은 염증성 질환에서 한 역할을 하는 데 관련되어 있다. 유도성 IL-12p40 메시지(message)는 류마티스성 관절염 환자의 윤활막에서 검출되었고, IL-12는 류마티스성 관절염 환자의 윤활액에도 존재하는 것으로 밝혀진 바 있다(예컨대, Morita et al ., (1998) Arthritis and Rheumatism 41: 306-314). IL-12 양성 세포는 류마티스성 관절염 윤활막의 부분내층에 존재하는 것으로 발견되었다. 본 발명의 사람 항체 및 항체부는 예컨대, 류마티스성 관절염, 소아류마티스성 관절염, 라임 관절염, 류마티스성 척추염, 골관절염 및 통풍 관절염을 치료하는데 사용될 수 있다. 특정 장애에 대해서는 항체 또는 항체부의 국소 투여가 유익할 수 있을지라도 항체 또는 항체부는 전신 투여되는 것이 일반적이다. 또한, 본 발명의 항체 또는 항체부는 자가면역 질환의 치료에 유용한 하나 이상의 추가 치료제와 함께 투여될 수 있다.
류마티스성 관절염의 콜라겐 유도 관절염(CIA) 쥐 모델에서, 관절염 전에 항-IL-12 mAb(래트 항-마우스 IL-12 모노클로날 항체, C17.15)로 마우스를 치료하면 질환의 개시가 완전히 억제되고, 질환의 발생빈도 및 중증도를 감소시켰다. 관절염 개시 후 초기에 항-IL-12 mAb로의 치료는 중증도를 감소시켰지만, 질환의 개시 후에 항-IL-12 mAb로의 마우스의 후속 치료는 질병 중증도에 미미한 효과를 나타냈다.
B. 크론병
또한, 인터루킨-12는 염증성 장 질환인 크론병에서도 한 역할을 한다. 크론병이 있는 환자의 장 점막에서는 IFN-γ 및 IL-12의 발현 증가가 일어난다(예컨대, Fais et al.,(1994) J. Interferon Res . 14: 235-238; Parronchi et al., (1997) Amer. J. Pathol . 150: 823-832; Monteleone et al ., (1997) Gastroenterology 112: 1169-1178; Berrebi et al ., (1998) Amer . J. Pathol . 152: 667-672 참조). 항-IL-12 항체는 결장염의 마우스 모델, 예컨대 TNBS 유도 결장염 IL-2 녹아웃 마우스, 및 최근에는 IL-10 녹아웃 마우스에서 질환을 억제하는 것으로 밝혀져 있다. 따라서, 본 발명의 항체 및 항체부는 염증성 장 질환을 치료하는데 사용될 수 있다.
C. 다발성 경화증
인터루킨-12는 다발성 경화증의 주요 매개인자로서 관련되어 있다. 유도성 IL-12 p40 메시지 또는 IL-12 자체의 발현은 다발성 경화증 환자의 병변에서 입증될 수 있다(Windhagen et al ., (1995) J. Exp . Med . 182: 1985-1996, Drulovic et al., (1997) J. Neurol . Sci . 147: 145-150). 다발성 경화증이 있는 만성 진행성 환자는 IL-12의 혈행 수준이 상승되어 있다. 다발성 경화증 환자 유래의 T 세포 및 항원제시세포(APC)를 이용한 연구는 Th1형 면역반응으로 이어지는 진행성 다발성 경화증의 기초로서 자기지속성인 일련의 면역 상호작용을 밝혀냈다. T 세포로부터 IFN-γ의 분비 증가는 APC에 의한 IL-12 생산을 증가시켰고, 이것은 그 사이클을 지속시켜 Th1형 면역 활성화 및 질환의 만성 상태를 야기한다(Balashov et al., (1997) Proc.Natl.Acad. Sci. 94: 599-603). 다발성 경화증에서 IL-12의 역할은 다발성 경화증의 마우스 및 래트 실험적 알레르기 뇌척수염(EAE) 모델에서 조사되었다. 마우스의 다발성 경화증의 재발성-완화성 EAE 모델에서, 항-IL-12 mAb 예비치료는 마비를 지연시켰고 임상 점수를 저하시켰다. 최고 마비 시에 또는 후속 완화기 중에 항-IL-12 mAb로의 치료는 임상 점수를 저하시켰다. 따라서, 본 발명의 항체 또는 항원결합부는 사람의 다발성 경화증과 관련된 증상을 경감시키는 작용을 할 수 있다.
D. 인슐린-의존성 진성당뇨병
인터루킨-12는 인슐린 의존성 진성당뇨병(IDDM)의 중요한 매개인자로서 관련되어 있다. IDDM은 IL-12의 투여에 의해 NOD 마우스에서 유도되었고, IDDM의 입양 전달 모델에서 항-IL-12 항체는 예방적이었다. 조기발병 IDDM 환자는 일부 잔여 도세포 기능이 유지되는, 소위 "허니문 기간"을 종종 경험한다. 이러한 잔여 도세포는 인슐린을 생산하고 투여된 인슐린보다 더욱 양호하게 혈당 수준을 조절한다. 이러한 조기발병 환자의 항-IL-12 항체를 이용한 치료는 도세포(islet cell)의 추가 파괴를 예방할 수 있어, 인슐린의 내인성 근원을 유지한다.
E.
건선
인터루킨-12(IL-12)와 관련 사이토카인 IL-23은 건선의 주요 매개인자로서 관련되어 있다. 건선은 TH1형 사이토카인 발현 프로필과 관련이 있는 급성 및 만성 피부 병변을 수반한다(Hamid et al.(1996) J.Allergy Clin. Immunol. 1: 225-231; Turka et al.(1995) Mol.Med. 1: 690-699). IL-12 및 IL-23은 모두 건선의 타입 1T 헬퍼 세포(Th1) 면역반응의 발생에 기여한다. 더욱이, IL-12 p40 및 IL-23 p40 메신저 RNA는 건선 피부 병변에서 과발현된다. 따라서, 본 발명의 항체 또는 이의 항원결합부는 건선과 같은 만성 피부 장애를 경감시키는 작용을 할 수 있다.
한 구체예에서, 본 발명은 건선을 치료하는 방법을 제공한다. 건선의 치료는 종종 국소 코르티코스테로이드, 비타민 D 유사체 및 국소 또는 경구 레티노이드 또는 이의 배합물을 포함한다. 한 구체예에서, IL-12 및/또는 IL-23 항체는 이러한 일반 치료들 중 하나와 함께 또는 이러한 일반 치료들 중 하나의 존재 하에 투여된다. 건선을 치료하기 위해 IL-12 및/또는 IL-23 항체와 배합될 수 있는 추가 치료제는 이하에 더욱 상세하게 설명된다.
건선의 진단은 일반적으로 피부의 외관을 기초로 한다. 또한, 피부 생검, 또는 피부 패치의 찰과표본 및 배양이 다른 피부 장애를 배제시키기 위해 필요할 수도 있다. 관절 통증이 있고 지속성이라면 건선 관절염을 검사하기 위해 x선을 사용할 수도 있다.
피검체의 건선의 개선은 피검체의 건선 면적 및 중증도 점수(PASI)로 모니터할 수 있다. PASI를 측정하는 방법은 문헌[Fredriksson and Pettersson(1978) Dermatologica 157:238 및 Marks et al.(1989) Arch Dermatol 125:235]에 기술되어 있다. 간단히 설명하면, 지수는 두부, 상지, 몸통 및 하지를 포함하는 4개의 해부학적 부위를 5점 규모를 사용하여 홍반, 경화 및 표피탈락에 대한 평가를 기초로 한다(0= 증상 없음; 1=약간; 2=중간; 3=현저; 4= 매우 현저). 제공된 해부학적 부위내 병변의 정도를 기초로 하여, 영향받은 부위를 수치로 지정한다(0=0; 1 = < 10%; 2 = 10-29%; 3 = 30-49%; 4 = 50-69%; 5 = 70-89%; 6 = 90-100%). PASI 점수를 이후에 계산하는데, 여기서, PASI 점수의 가능한 범위는 0.0 내지 72.0 범위이고, 최고 점수는 가장 심각한 정도의 완전한 홍색피부증을 나타낸다.
본 발명의 일 양태에서, IL-12 및/또는 IL-23 항체는 만성 판상 건선, 방울 건선, 역위 건선, 농포성 건선, 심상성 천포창, 홍피 건선, 염증성 장 질환(IBD)과 관련된 건선, 및 류마티스성 관절염(RA)과 관련된 건선을 포함하는, 건선의 치료에 사용된다. 다른 양태에서, J695/ABT-874와 같은 IL-12 및/또는 IL-23 항체는 PsA와 함께 건선이 있는 피검체를 치료하는데 사용된다. 본 발명의 치료 방법에 포함된 특정 유형의 건선은 하기에 상세히 기술한다:
a. 만성
판상
건선
만성 판상 건선(심상성 건선으로도 불림)은 건선의 가장 일반적인 형태이다. 만성 판상 건선은 동전 크기에서부터 훨씬 더 큰 범위의 피부의 융기된 발적 반을 특징으로 한다. 만성 판상 건선에서, 플라크는 하나이거나 또는 다수일 수 있으며, 이들은 몇 밀리미터 내지 수 센티미터의 크기로 변할 수 있다. 플라크는 일반적으로 비늘 표면을 지닌 적색이고, 부드럽게 긁을 경우 빛을 반사하여 "은빛" 효과를 낸다. 만성 판상 건선 유래의 병변(이는 종종 대칭이다)은 신체상의 모두 곳에서 발생하지만 무릎, 팔꿈치, 요천골 영역, 두피 및 손발톱을 포함하는 강한 표면을 편애한다. 때때로 만성 판상 건선은 음경, 외음 및 굽이에서 발생할 수 있으나, 비늘형성은 일반적으로 존재하지 않는다. 만성 판상 건선 환자의 진단은 일반적으로 하기 기술된 임상 특징을 기초로 하다. 특히, 만성 판상 건선에서 병변의 분포, 색상 및 대표적인 은빛 비늘형성은 만성 판상 건선의 특징이다.
b. 방울
건선
방울 건선은 물방울형 비늘 플라크를 특징으로 하는 건선의 형태를 말한다. 방울 건선의 발적은 일반적으로 감염, 대부분 현저하게는 스트렙토코커스 인후 감염을 수반한다. 방울 건선의 진단은 일반적으로 피부의 외관과, 종종 최근 인후통 병력이 있다는 사실을 기준으로 한다.
c. 역위
건선
역위 건선은, 환자가 적색의 염증이 있는 피부의 부드럽고, 일반적으로 축축한 부위를 갖는 건선의 형태이며, 이는 판상 건선과 관련된 비늘형성과는 다르다. 역위 건선은 또한 간찰부 건선 또는 자리바꿈 건선(flexural psoriasis)으로 언급된다. 역위 건선은 대부분 겨드랑이, 샅고랑 부위, 유방밑 및 생식기와 엉덩이 주변의 기타 피부 겹침부 위에서 대부분 발생하며, 부위의 위치로 인하여, 문지름 및 발한이 영향받은 부위를 자극할 수 있다.
d. 농포성
건선
또한, 손발바닥 건선이라고도 언급되는 농포성 건선은 크기 및 위치가 다양한 고름이-찬 물집을 유발하는 건선의 형태이나, 흔히 손 및 발에 발생한다. 물집은 신체의 많은 부위에 위치하거나 이들 부위에 분산될 수 있다. 농포성 건선은 압통 및 통증 둘다를 유발할 수 있으며, 열을 유발시킬 수 있다.
e. 기타
건선
질환
IL-12 및/또는 IL-23 항체로 치료할 수 있는 건선 장애의 다른 예에는 홍피 건선, 사마귀, IBD와 관련된 건선, 및 류마티스성 관절염을 포함하는 관절염과 관련된 건선을 포함한다.
본 발명은 이하 실시예를 통해 더 상세히 예시되며, 이 실시예는 어떠한 방식으로든지 제한하는 것으로 간주되어서는 아니된다. 본 출원을 통해 인용된 모든 인용 참고문헌, 예컨대 논문 참고문헌, 허여된 특허 및 공개된 특허출원 등의 내용은 본 발명에 참고인용된 것이라는 것은 자명하다. 또한, 여기에 첨부된 모든 표의 내용(여기에 첨부된 부록 A 및 미국 특허 6,914,128의 부록 A 참조) 및 미국 특허 6,914,128의 전문은 참고인용된 것으로 이해되어야 한다.
[표 1]
[표 2]
[표 3]
[표 4]
실시예
실시예
1: 중등도 내지 중증
판상
건선의
치료에서
완전 사람
IL
-12/
IL
-23 모노클로날 항체,
ABT
-874의 효능
ABT-874는 인터루킨-12(IL-12) 및 IL-23에 대한 완전 사람 항체이다. ABT-874는 건선(Ps)의 치료에 확인된 표적인 IL-12 및 IL-23에 공통적인 p40 서브유닛에 대하여 상당한 친화성으로 결합한다.
이하 연구의 목적은 중등도 내지 중증 판상 Ps 환자의 치료에 있어서 ABT-874의 피하 주사의 효능을 평가하는 것이다.
기준선에서 건선이 체표면적(BSA)의 10% 이상에 영향을 미치고 PASI(건선 면적과 중증 지수) 점수가 12 이상인 성인 환자는 12주 이중맹 위약 대조 연구에 적격이었다. 환자는 6개 그룹 중 하나로 무작위로 선별했다: 1) 12주 동안 100mg ABT-874 격주(eow); 2) 0주째 200mg ABT-874 단일 용량; 3) 4주 동안 매주 200mg ABT-874; 4) 12주 동안 200mg ABT-874 격주; 5) 12주 동안 매주 200mg ABT-874; 또는 6) 위약. 1차 종점은 12주째 ≥PASI75 반응이었다. 다른 효능 평가로, PASI50 및 주치의의 총괄 평가(PGA)를 포함했다. 1차 종점을 충족시키는 환자는 36주 맹검/재치료 단계를 시작하여 반응 상실 시까지의 시간을 모니터했다.
각 그룹마다 30명씩 총 180명의 환자를 당해 연구에 등록시켰다. 기준선에서의 특징은 그룹마다 유사하고, 중등도 내지 중증 Ps를 나타냈다(남성%를 제외하고는 모두 평균 값이다): 연령, 46세, 74% 남성; Ps 기간 21년; PASI 19; 및 25% BSA 영향받음. 12주째, ≥PASI75에 도달한 환자의 백분율은 위약 군에 비해 5개의 ABT-874 그룹 각각의 환자들이 통계적으로 훨씬 컸다(각각 93%, 63%, 90%, 93%, 90% 대 3%, p<0.001, ITT). 또한, ≥PASI50에 도달한 환자의 백분율은 위약 군에 비해 5개의 ABT-874 그룹 각각의 환자들이 통계적으로 훨씬 컸다(각각 100%, 77%, 97%, 97% 및 100%, 대 17%, p<0.001). 12주째 PASI의 평균 감소(개선) 백분율은 ABT-874 그룹에서 각각 90%, 70%, 92%, 92% 및 90%였고, 위약군에서는 26%였다. 이와 마찬가지로, PGA가 클리어/최소인 환자의 백분율은 ABT-874 그룹에서 각각 83%, 50%, 73%, 87% 및 87%이고 위약에서 3%였다.
결론적으로, ABT-874는 중등도 내지 중증 판상 건선의 치료에서 위약보다 훨씬 더 효능적이었다.
실시예
2: 중등도 내지 중증
판상
건선의
치료에서
완전 사람
IL
-12/
IL
-23 모노클로날 항체,
ABT
-874의 안전성 및 효능
ABT-874는 인터루킨-12(IL-12) 및 IL-23에 대한 완전 사람 항체이다. ABT-874는 건선(Ps)의 치료에 확인된 표적인 IL-12 및 IL-23에 공통적인 p40 서브유닛에 대하여 상당한 친화성으로 결합한다. 이 단계 II 연구의 목적은 중등도 내지 중증 판상 Ps의 치료에 있어서 ABT-874의 피하 주사의 효능 및 안전성을 평가하는 것이다.
건선이 체표면적(BSA)의 10% 이상에 영향을 미치고 PASI 점수가 12 이상인 성인은 12주 이중맹 위약 대조 연구에 적격이었다. 환자는 6개 그룹 중 하나로 무작위로 선별했다: 1) 12주 동안 100mg ABT-874 격주(eow); 2) 0주째 200mg ABT-874 단일 용량; 3) 4주 동안 매주 200mg ABT-874; 4) 12주 동안 200mg ABT-874 격주; 5) 12주 동안 매주 200mg ABT-874; 또는 6) 위약. 1차 종점은 12주째 ≥PASI75 반응이었다. 1차 종점을 충족시키는 환자는 36주 맹검/재치료 단계를 시작하여 반응 상실 시까지의 시간을 모니터했다. 모든 환자는 54주 동안 안전성 평가를 받았다.
각 그룹마다 30명씩 총 180명의 환자를 등록시켰다. 기준선에서의 특징은 그룹마다 유사했다(남성%를 제외하고는 평균 값이다): 연령, 46세, 74% 남성; Ps 기간 21년; PASI=19; 및 25% BSA 영향받음. 12주째, ≥PASI75인 환자의 백분율은 위약 군에 비해 5개의 ABT-874 그룹 각각에서 통계적으로 훨씬 컸다(각각 93%, 63%, 90%, 93%, 90% 대 3%, p<0.001, ITT). 12주 DB 단계동안, ABT-874 그룹의 감염성 AE는 23 내지 43% 범위, 위약군은 23%였고, 비인두염이 가장 일반적이었다(ABT-874에서는 7 내지 17%, 위약군에서는 3%). 그룹 간에 통계적으로 유의적인 차이는 없었다. 심각한 감염성 AE는 보고되지 않았고 사망자도 없었다.
결론적으로, ABT-874는 중등도 내지 중증 판상 Ps의 치료에서 위약보다 훨씬 더 효능적이고 안전성 프로필이 바람직한 것으로 나타났다.
실시예
3: 중등도 내지 중증
판상
건선의
치료에서
완전 사람
IL
-12/
IL
-23 모노클로날 항체,
ABT
-874의 반응 유지
ABT-874의 효능 및 안전성은 12주, II기, 무작위 선발 대조 실험 및 후속 36주 단계로 평가했다. 본 실시예의 목적은 중등도 내지 중증 판상 Ps의 치료에 있어서 ABT-874를 피하 주사한 상기 II기 연구의 다음 12주 동안 치료를 중단한 후 반응의 유지를 분석하는 것이었다.
건선이 체표면적(BSA)의 10% 이상에 영향을 미치고 PASI 점수가 12 이상인 성인은 12주 이중맹 위약 대조 연구에 적격이었다. 환자는 6개 그룹 중 하나로 무작위로 선별했다:
1) 12주 동안 100mg ABT-874 격주(eow);
2) 0주째 200mg ABT-874 단일 용량;
3) 4주 동안 매주 200mg ABT-874;
4) 12주 동안 200mg ABT-874 격주;
5) 12주 동안 매주 200mg ABT-874; 또는
6) 위약.
1차 종점은 12주째 ≥PASI75 반응이었다. 1차 종점을 충족시키는 환자는 36주 맹검/재치료 단계를 시작했다. 연구 약물 치료를 중단하고, 환자의 반응 상실까지의 시간을 모니터했다(PASI 점수의 감소, 36주 후속 기간 중에 <PASI 50까지의 임의의 시간). PASI 반응의 유지는 24주 동안 평가했다.
각 그룹마다 30명씩 총 180명의 환자를 등록시켰다. 기준선에서의 특징은 그룹마다 유사했다(남성%를 제외하고는 평균 값이다): 연령, 46세, 74% 남성; Ps 기간 21년; PASI=19; 및 25% BSA 영향받음.
12주째, ≥PASI75인 환자의 백분율은 위약 군에 비해 5개의 ABT-874 그룹 각각의 환자들이 통계학상 유의적으로 더 컸다(표 1). 24주째 활성 치료 그룹에서 PASI 75 반응자의 상당한 백분율은 적어도 PASI 50 반응을 유지했다.
[표 1]
결론적으로, ABT-874는 중등도 내지 중증 판상 건선의 치료에서 위약보다 훨씬 더 효능적이었다. PASI 75 반응자들의 상당한 백분율은 활성 치료의 중단 후 24주째에 상기 반응을 유지했다.
실시예
4: 중등도 내지 중증 만성
판상
건선의
치료에서
완전 사람
IL
-12/IL-23
모노클로날
항체,
ABT
-874의 안전성 및 효능
본 실시예의 목적은 임상적으로 안정한 중등도 내지 중증 만성 판상 건성 환자의 치료에서 위약 대비, 일정 용량 범위의 사람 IL-12/23 모노클로날 항체(ABT-874)의 효능 및 안전성을 입증하는 것이다.
I. 재료 및 방법
A. 연구 설계: 미국(16개소)과 캐나다(8개소)의 24개 센터에서 수행한 12주 다중 센터, 무작위 선발한 이중맹 II기 위약 대조 실험이었다. ABT-874(Abbott Laboratories, Abbott Park, IL)는 IL-12/23 p40 서브유닛 단백질에 대해 높은 친화성이 있는 유전자조작된 상보성 결정 영역을 보유한 사람 모노클로날 항체이다. 환자는 다음과 같은 6가지 치료 중 한가지로 치료되도록 1:1:1:1:1:1 비로 무작위로 분류했다: ABT-874 200mg, 0주째 단일 용량(200mg x 1); 12주 동안 ABT-874 격주(eow) 100mg(100mg 격주); 처음 4주 동안 매주 ABT-874 200mg(200mg x 4); 12주 동안 200mg ABT-874 격주 (200mg 격주); 12주 동안 매주 ABT-874 200mg(200mg 매주); 또는 위약. 12주 후, 건선 면적과 중증 지수의 적어도 75% 감소(PASI 75)에 도달한 모든 환자는 36주 맹검 관찰/재치료 단계를 시작했다.
B. 환자: 환자는 연령이 18세 이상이었고 적어도 6개월 동안 건선에 대한 임상 진단(환자 인터뷰와 조사자에 의한 신체 검사를 통한 진단 확인으로 결정), 피검체의 인터뷰에서 결정된, 선별 전인 기준선 방문 시에 적어도 2개월 동안 안정한 판상 건선의 임상 진단, 기준선 방문 시에 체표면적(BSA) 10% 이상의 수반, 기준선 방문 시에 PASI 점수 ≥12 및 기준선 방문 시에 의사의 총괄 평가(PGA)가 적어도 중등도 질환으로 정의되는 중등도 내지 중증 판상 건선의 임상 진단을 받은 환자이다.
환자는 전신 또는 생물학적 항-IL-12 요법; 비판상 건선; 기준선 방문 전에 다음과 같은 요법, 즉 적어도 2주 전에 국소 건선 요법, 적어도 2주 전에 자외선 B선 광요법, 적어도 4주 전에 솔라렌-자외선 광요법, 적어도 4주 전에 전신 요법, 및 적어도 12주 전에 생물학적 요법의 중단 불능; 연구 동안 경구 또는 주사성 코르티코스테로이드의 투여 필요성(안정한 의학 상태를 위한 흡입성 코르티코스테로이드는 허용됨); 선별되기 10년 전에 입원을 요한 천식 악화; 중증 감염의 감염 인자 또는 위험 인자; 성공적으로 치료된 기저세포 암종(편평세포 암종의 이력이 있는 환자는 제외함) 또는 상피내 경부 암종 외에 다른 악성종양의 이력; 또는 면역글로불린 G 함유 제제(예: 정맥내 감마 글로불린, 융합 단백질 또는 모노클로날 항체)에 대한 주요 면역반응(예: 혈청병 또는 유사아나필락시스 반응)의 이력을 가졌던 자라면 부적격자였다.
환자는 연구 중에 손바닥, 발바닥, 얼굴, 염증 부위 및 서혜부 부위에 대해서는 코르티코이드, 시판(베타- 또는 알파-하이드록시 산이 없는) 연화제 또는 클래스 VI 또는 VII 저독성 국소 코르티코스테로이드를 함유하지 않는 약물첨가된 샴푸를 이용한 치료는 계속 허용했다. 이러한 국소 건선 요법은 연구 방문 24 시간 내에는 시행하지 않았다. 생바이러스제를 이용한 백신접종은 ABT-874의 용량 투여 전 1개월 이내, 연구 중에 또는 연구 약물의 최종 투여 후 1개월 동안에는 실시하지 않았다.
다음과 같은 임상적으로 유의적인 비정상적 실험 결과가 발생하면 어느 것이든지 그 환자를 연구에서 즉시 제외시켰다: 정상 범위의 상한선보다 5배가 넘는 아스파르테이트 트랜스아미나제 또는 알라닌 트랜스아미나제; 정상 범위의 상한선보다 3배가 넘는 혈청 총 빌리루빈; 정상 범위의 상한선보다 3배가 넘는 혈청 크레아티닌; 정상 범위의 상한선보다 5배가 넘는 크레아틴 포스포키나제; 헤모글로빈 <8g/dL; 백혈구 수 <2 x 109/L; 또는 혈소판 수 <75 x 109/L.
C. 효능 평가: 1차 효능 평가는 기준선 점수에 비해 PASI 점수가 적어도 75% 감소된 것으로 정의되는 12주째 PASI 75 반응을 달성한 환자의 백분율이었다. PASI는 건선 병변(홍반, 경화 및 표피탈락의 의함)의 중증도 및 BSA 수반의 척도이다. PASI 점수는 0(건선 없음) 내지 72(중증 질환) 범위이다(Fredriksson T, Pettersson U. dermatologica 1978; 157: 238-44). 다른 효능 척도는 1주, 2주, 4주 및 8주에 적어도 PASI 75에 도달한 환자의 백분율; 1주, 2주, 4주, 8주 및 12주에 적어도 PASI 50 또는 PASI 90에 도달한 환자의 백분율; 12주 및 1주, 2주, 4주 및 8주에 클리어 또는 최소의 PGA에 도달한 환자의 백분율을 포함했다. PGA는 0(무 질환 또는 클리어) 내지 5(매우 중증) 범위인 6단계 척도로 질환의 중증도를 측정한다(Ko H-S. Clinical trial design in psoriasis. Presented at: 49th Meeting of the Dermatologic and Ophthalmologic Advisory Committee; March 20, 1998; Bethesda, MD).
D. 안전성 평가: 연구 동안 부작용, 실험 데이터 및 활력징후를 평가했다. 환자는 감염, 악성종양 및 면역학적 반응의 징후에 대하여 정밀하게 모니터했다. 치료-발생한 AE는 0주와 마지막 비누락(nonmissing) 연구 약물 용량 후 45일 또는 최초 재치료 용량의 투여 1일 전 중 빠른 날 사이에 발생한 사건으로서 정의했다(연속해서 36주 실험을 시작하는 환자용).
E. 통계 분석: 샘플 크기는 nQuery Advisor® 4.0(Statistical Solutions, Saugus, MA)을 사용하여 계산했다. 위약 그룹의 환자 중 15%가 12주째 PASI 75 반응에 도달할 것이라는 가정 하에, 본 연구 설계자는 각 투여량 그룹의 샘플 크기가 26인 것이 0.05 2면 유의성 수준에서 90% 파워의 피셔 직접확률검정법을 사용해서 처리 그룹으로부터 적어도 45% 차이를 검출하기에 적당할 것이라고 결정했다. 본 연구는 각 그룹에 30명씩, 약 180명의 환자가 등록하도록 설계했다.
ITT(intention-to-treat) 집단은 0주째 무작위로 선발하고 연구 약물을 1회 이상 주사 맞은 적이 있는 모든 환자를 포함했고; 이 집단을 효능 분석에 사용했다. 모든 검사는 α=0.05에서 수행했다. 모든 효능 분석에는 무응답자 귀속(nonresponder imputation)을 사용했다. 방문 시마다 누락 PASI 또는 PGA 점수가 있는 모든 환자는 그 방문 시점에서의 무응답자로 간주했다. 누락 데이터의 영향을 평가하기 위해 12주 데이터의 민감도 분석은 LOCF(last-observation-carried-forward) 방법으로 완료했다. 12주째 PASI 75 반응의 1차 분석은 다중도에 대해 조정하기 위해 다음과 같은 후속 순서대로 수행했다: 200mg 매주 대 위약, 200mg 격주 대 위약, 100mg 격주 대 위약, 200mg x 4 대 위약 및 200mg x 1 대 위약. 각 ABT-874 치료 그룹과 위약 그룹 간에, PASI 점수의 평균 백분율 변화에 대한 치료 차이는 인자로서 기준선 PASI 점수와 치료 그룹과 함께 분산 분석을 이용하여 평가했다. 안전성 분석은 연구 약물을 1회 이상 주사맞은 환자를 모두 포함하는 안전성 집단을 사용해서 수행했다.
II
. 결과
A. 환자: 총 180명의 환자를 등록시켜서 6개의 처리 그룹 중 하나로 무작위로 선별했다(도 1). 환자의 대부분(위약 처리 환자 76.7% 및 모든 ABT-874 처리 그룹 환자 98%)은 연구의 12주분을 완료했다.
환자들은 인구 특성과 질환 활성 면에서 처리 그룹 간에 고른 분포를 나타냈다(표 1). 환자는 주로 남성(74.4%)과 백인(92.2%)이었다. 평균 BSA 수반은 25%였고, 평균 PASI 점수는 18.8이었다.
B. 효능: 12주째 PASI 75 반응의 1차 종점에 도달한 환자의 백분율은 위약(3.3%, 30명 중 1명)에 비해 모든 ABT-874 처리 그룹(200mg x 1; 63.3%, 30명 중 19명; 100mg 격주: 93.3%, 30명 중 28명; 200mg x 4: 90.0%, 30명 중 27명; 200mg 격주: 93.3%, 30명 중 28명; 200mg 매주: 90.0%, 30명 중 27명)에서 통계학상 유의적으로 더 컸다(p<0.001). 본 실험의 비교적 짧은 기간 동안 모든 ABT-874 처리 그룹의 PASI 75 반응은 200mg x 1 처리 그룹 외에는 유사했다(도 2).
인구통계학(성별, 연령, 인종 및 체중), 기준선 질환 특징(건선성 관절염의 이력, BSA 및 PASI 점수) 및 연구 치료(전신 생물학적 및 비생물학적, 국소 및 광요법)를 받은 12개월 동안 건선에 대한 기준선 요법에 의한 아형 분석은 각종 아형 중의 ABT-874 처리된 환자들이 12주째 고도의 PASI 75 반응을 일정하게 달성한다는 것을 증명했다.
높은 ABT-874 투여량 그룹의 거의 100%는 12주까지 적어도 PASI50 반응에 도달했다(200mg x 1; 76.7%, 30명 중 23명; 100mg 격주: 100.0%, 30명 중 30명; 200mg x 4: 96.7%, 30명 중 29명; 200mg 격주: 96.7%, 30명 중 29명; 200mg 매주: 100.0%, 30명 중 30명; 위약: 16.7%, 30명 중 5명; 위약과 각각의 비교마다 p<0.001). 12주째 적어도 PASI 90 반응을 달성한 환자의 백분율은 위약과 비교했을 때 하나의 ABT-874 처리 그룹(200mg x 1)을 제외한, 다음과 같은 모든 처리 그룹에서 통계적으로 유의적으로 더 컸다(p<0.001): 200mg x 1: 16.7%, 30명 중 5명; 100mg 격주: 53.3%, 30명 중 16명; 200mg x 4: 63.3%, 30명 중 19명; 200mg 격주: 76.6%, 30명 중 23명; 200mg 매주: 53.3%, 30명 중 16명; 및 위약: 0%, 30명 중 0명. 또한, 12주까지 모든 ABT-874 처리 그룹 중의 유의적으로 많은 (p<0.001) 환자들이 위약 그룹의 환자들에 비해 다음과 같이 클리어 또는 최소 PGA 등급에 도달했다: 200mg x 1; 50.0%, 30명 중 15명; 100mg 격주: 83.3%, 30명 중 25명; 200mg x 4: 73.3%, 30명 중 22명; 200mg 격주: 86.7%, 30명 중 26명; 200mg 매주: 86.7%, 30명 중 26명; 대 위약: 3.3%, 30명 중 1명.
12주째 PASI 100 반응의 1차 종점에 도달한 환자의 백분율은 위약(0%, 30명 중 0명)에 비해 다음 ABT-874 처리 그룹(200mg 격주: 46.7%, 30명 중 14명; 200mg 매주: 36.7%, 30명 중 11명)에서 통계적으로 훨씬 더 컸다(p<0.001).
ABT-874에 대한 반응은 빨랐다. 기준선으로부터 PASI 점수의 평균 백분율 향상은 모든 ABT-874 처리 그룹에서 경시적으로 증가했고(도 3), 각 시점마다 위약에 비해 각 ABT-874 처리 그룹에서 통계적으로 훨씬 더 컸다(p<0.001, 1주째 100mg 격주 그룹(p=0.023)을 제외하고).
C. 안전성: ABT-874 요법은 일반적으로 양호하게 허용되는 요법이었다(표 2). ABT-874로 처리된 1명(0.7%)의 환자는 국소적인 피부 탈색으로 인해 연구를 중단했고; 위약으로 처리된 2명(6.7%)의 환자는 1명은 건선성 관절병증, 1명은 난소암으로 인해 연구를 중단했다. 2명(1.1%)의 환자는 심각한 부작용(AE)를 겪었고; 1명의 위약 처리된 환자는 37일째 난소암 진단을 받았으며, 1명의 ABT-874 처리된 환자(200mg x 1)는 10일째 늑연골염 진단을 받았다. 심근경색이나 뇌경색을 겪은 환자는 없었고, 사망자도 없었다.
ABT-874를 어떠한 용량으로든지 투여받은 환자는 위약을 투여받은 환자보다 연구 약물과 적어도 가능한 관련성이 있는 AE를 겪을 가능성이 훨씬(p=0.033) 더 많았다(ABT-874:36.0%, 150명 중 54명; 위약: 10.0%, 30명 중 3명; 표 2); 이러한 AE의 대부분은 주사 부위와 관련이 있었다 (주사 부위 반응, 홍반, 가려움 또는 자극).
대부분의 AE는 경미했다(경미한 AE는 ABT-874 처리 환자의 46.0%(150명 중 69명)에서, 위약 처리 환자 중 30.0%(30명 중 9명)에서 일어났다). 가장 일반적인 AE는 ABT-874의 임의의 용량으로 처리된 환자의 16.7%(150명 25명)에서 일어나는 주사 부위 반응이었다(위약 처리된 환자에서는 주사 부위 반응이 보고되지 않았다; p=0.028; 표 3). 위약 처리된 환자와 비교했을 때 ABT-874 처리된 환자에서의 다른 AE의 발생빈도는 통계적으로 유의적인 차이가 없었다. 다음으로 가장 빈번하게 보고된 AE는 비인두염 및 상기도 감염이었다.
감염성 AE는 모든 환자 중 32.8%(180명 중 59명)까지 보고되었다(위약: 23.3%, 30명 중 7명; 모든 ABT-874 처리된 환자: 34.7%, 150명 중 52명). 모든 ABT-874 처리 그룹에서 보고된 가장 일반적인 감염성 AE는 비인두염(12.0%, 150명 18명), 상기도 감염(10.7%, 150명 16명), 및 기관지염 및 바이러스 감염(둘 모두 2.7%, 150명 4명)이었다. 심각한 감염성 AE는 보고되지 않았다.
2명의 환자는 연구 중에 악성종양을 보고했다. 위약 처리된 환자 1명은 129일 현재 진행중인 난소암 진단을 받았다. ABT-874 처리된 환자(200mg x 4) 1명은 133일째 제거된 비흑색종 피부암(편평세포 암종) 진단을 받았다. 이 환자의 의학적 이력 중에는 2005년 3월에 양성 피부 성장 제거를 받은 바 있었다.
위약과 비교했을 때, 임상적으로 유의적인 혈액학, 화학(예컨대, 혈당 농도) 또는 활력징후의 변화는 없었다.
III
. 결론
본 실시예에 기술된 II기, 다중센터, 무작위 선별된, 이중맹, 위약 대조 실험은 중등도 내지 중증 만성 판상 건선의 치료에 있어서 ABT-874의 통계적 및 임상적으로 유의적인 효능을 입증했다. ABT-874 200mg x 1 처리 그룹을 제외한, 모든 ABT-874 처리 그룹의 90% 이상의 환자는 위약 처리 환자의 3.3%에 비해 12주째 PASI 75 이상에 도달했다. 심지어 연구 약물을 단일 용량을 투여 받은 그룹(200mg x 1)에서도, 환자의 대부분(63.3%)이 12주까지 적어도 PASI 75에 도달했다. 또한, ABT-874 처리 환자 중 거의 100%는 PASI 50 이상에 도달했고, 이는 12주까지 임상적으로 유의적인 개선인 것으로 간주된다(Carlin CS, Feldman SR, Krueger JG, Menter A, Krueger GG. J Am Acad Dermatol 2004; 50: 859-66). 다른 2차 종점, 예컨대 PASI 90 및 클리어 또는 최소의 PGA에 대한 결과는 1차 효능 분석과 일치했고, 그 분석을 지지했다.
ABT-874에 대한 반응은 빨랐다. 위약 처리 환자 및 ABT-874 처리 환자 간에 통계적으로 유의적인 분리는 PASI 점수의 평균 개선 백분율에서 빠르게는 1주 정도에 나타났다. 개선은 심지어 ABT-874 200mg x 1 투여 그룹 및 200mg x 4 투여 그룹의 환자들에서도 실험 12주 동안 지속되었다.
ABT-874는 충분히 견딜 수 있는 약물로서 대부분의 AE는 경미했다. ABT-874 처리된 환자가 적어도 연구 약물과 관련이 있을 수 있는 AE를 겪을 가능성이 훨씬 크지만, 이러한 AE의 대부분은 주사 부위 관련 AE(주사 부위 반응, 홍반, 가려움 또는 자극)였다. ABT-874의 증가 용량과 AE의 증가 빈도 간에 분명한 연관성은 없었다. 특히, 심근경색이나 뇌경색은 없었다.
항-IL-12/23 항체를 투여 받은 환자들에서 특히 주목해야 할 것은 면역학적 관련 사건이다. 가장 빈번하게 보고된 감염성 AE는 비인두염, 상기도 감염, 기관지염 및 바이러스 감염이다. 이 실험의 기간 동안 심각한 감염성 AE는 전혀 보고되지 않았다. 연구 중에 악성종양의 진단을 받은 2명 중, 1명은 위약 처리 환자에서 난소암 진단을 받았고, 다른 1명은 ABT-874 처리된 환자이지만 양성 피부 성장의 이력이 있었던 환자로서 비흑색종 피부암 진단을 받았다.
이를 정리하면, ABT-874는 중등도 내지 중증 만성 판상 건선 환자의 치료에 있어서 통계적 및 임상적으로 유의적인 유익이 있으며 충분히 견딜 수 있는 약물로 입증되었다.
실시예
5: 중등도 내지 중증
판상
건선의
치료에서 완전 사람
IL
-12/23
모노
클로날 항체,
ABT
-874에 의한 반응의 유지
ABT-874의 효능과 안전성은 12주, II기, 무작위 선별된 대조 실험 및 36주 후속 단계로 평가했다. 본 실시예의 목적은 중등도 내지 중증 판상 Ps의 치료에서 ABT-874의 피하 주사를 통한 상기 II기 연구에서 제2 12주 동안 치료 중단 후의 반응의 유지를 분석하는 것이었다.
10% 이상의 체표면적(BSA)이 Ps 영향을 받고 PASI 점수가 12 이상인 성인은 상기 12주 이중맹 위약 대조 연구에 적격이었다. 환자는 6 그룹 중 하나로 무작위로 선별했다:
1) 12주 동안 100mg ABT-874 격주(eow);
2) 0주째 200mg ABT-874 단일 용량;
3) 4주 동안 매주 200mg ABT-874;
4) 12주 동안 200mg ABT-874 격주;
5) 12주 동안 매주 200mg ABT-874; 또는
6) 위약.
1차 종점은 12주째 ≥PASI75 반응이었다. 1차 종점을 충족시키는 환자는 36주 맹검/재치료 단계를 시작했다. 연구 약물 치료를 중단하고, 36주의 후속 기간 동안 다양한 시점에서 환자의 PASI 점수를 모니터했다(PASI 50, PASI 75 및 PASI 90 반응). PASI 반응의 유지는 24주 동안 평가했다.
각 그룹마다 30명씩 총 180명의 환자를 등록시켰다. 기준선에서의 특징은 그룹마다 유사했다(남성%를 제외하고는 평균 값이다): 연령, 46세, 74% 남성; Ps 기간 21년; PASI=19; 및 25% BSA 영향받음.
12주째, ≥PASI 75인 환자의 백분율은 위약 그룹에 비해 5개의 ABT-874 그룹 각각의 환자들이 통계적으로 훨씬 더 컸다(표 4). 활성 치료 그룹에서 PASI 75 반응자의 상당한 백분율은 24주째 적어도 PASI 50 이상의 PASI 점수를 유지했다. 또한, 활성 치료 그룹의 PASI 75 반응자 중 상당한 백분율은 적어도 ≥PASI 75의 PASI 점수뿐만 아니라 ≥PASI 90의 PASI 점수를 유지했다(표 4 및 도 4A-C 참조). 24주 기간 동안 경시적으로 PASI 75 반응을 유지하는 환자의 백분율은 도 4D에 도시했다.
결론적으로, ABT-874는 중등도 내지 중증 판상 건선의 치료에서 위약보다 훨씬 더 효능적이었다. PASI 75 반응자들의 상당한 백분율은 활성 치료의 중단 후 24주째에 ≥PASI 50, ≥PASI 75 및 ≥PASI 90 반응을 유지했다.
실시예
6: 중등도 내지 중증
판상
건선의
치료에서
완전 사람
IL
-12/23
모노클로날
항체,
ABT
-874에 의한 재치료 반응의 유지
ABT-874의 효능과 안전성은 12주의 초기 치료 단계와 초기 치료에 반응하는 환자의 36주 재치료 단계를 포함하는, 48주, II기, 무작위 선별된 대조 실험으로 평가했다. 초기 12주 효능 결과 및 반응 결과의 유지는 상기 실시예들에 기술되어 있다. 본 실시예의 목적은 중등도 내지 중증 판상 Ps의 치료에서 ABT-874의 피하 주사를 통한 상기 II기 연구의 초기 반응을 상실한 환자의 36주 재치료/후속 단계 동안의 재치료 반응을 조사하는 것이다. 본 실시예의 추가 목적은 중등도 내지 중증 판상 Ps의 48주 치료 시에 피하 주사되는 ABT-874의 안전성을 조사하는 것이다.
기준선에서, 인구통계 및 임상 특징은 치료 그룹마다 유사했다(이하 표 5에 정리).
체표면적 10% 이상에 건선을 보유하고 건선 면적 및 중증도 지수(PASI) 점수가 12 이상인 성인을 1 내지 6 그룹으로 무작위로 선별했다: 1) 0주에 ABT-874 200mg 단일 용량; 2) 12주 동안 격주로 ABT-874 100mg; 3) 4주 동안 매주 200mg ABT-874; 4) 12주 동안 200mg ABT-874 격주; 5) 12주 동안 매주 200mg ABT-874; 또는 6) 위약. 1차 종점은 12주째 ≥PASI75 반응이었다. 1차 종점을 충족시키는 환자는 36주 재치료 단계를 시작했다. 연구 약물 치료를 중단하고, 12-36주 동안 반응을 상실한 환자(≤PASI 50)는 초기 12주 기간 동안 지정받은 동일한 용량투여 요법으로 재치료를 받았다. 재치료는 12주 동안 지속했다. 소인에 상관없이, 모든 환자는 전 연구 기간 동안 또는 중단 시까지 모니터했다.
초기 등록한 180명의 환자 중에서 130명(1명은 위약군)은 재치료 단계에 등록했고, 58명(모두 ABT-874)은 재치료를 받았다. 12주째 PASI 75 이상을 달성하고 다시 재치료 후 12주째 PASI 75 이상을 달성한 환자의 백분율은 각 그룹마다 다음과 같았다: 200mg 단일 용량, 63% 대 55%; 100mg 격주, 93% 대 94%; 200mg 매주 4주, 90% 대 69%; 200mg 격주, 93% 대 75%; 및 200mg 매주, 90% 대 83%. 재치료를 받은 환자 총 58명 중 76%는 재치료 후 12주째 PASI 75 이상을 달성했다.
재치료를 받은 환자들의 경시적인 PASI 점수의 개선은 도 5A-B에 도시했다. 구체적으로, 도 5A는 PASI 반응자들이 4주 내지 12주 동안 나타낸 PASI 점수들의 기준선으로부터의 평균 개선율을 나타낸 것이고, 도 5B는 PASI 75 반응자들이 재치료 후 4주 내지 12주 동안 나타낸 PASI 점수들의 기준선으로부터의 평균 개선율을 나타낸 것이다.
재치료 후 12주째 ≥PASI 50을 달성한 환자의 백분율은 각 그룹마다 다음과 같았다: 200mg 단일 용량, 82%; 100mg 격주, 100%; 200mg 매주 4주, 77%; 200mg 격주, 83%; 및 200mg 매주, 100%. 재치료를 받은 환자 총 58명 중 88%는 재치료 후 12주째 ≥PASI 50을 달성했다.
재치료 후 12주째 "클리어" 또는 "최소"의 PGA를 달성한 환자의 백분율은 각 그룹마다 다음과 같았다: 200mg 단일 용량, 36%; 100mg 격주, 75%; 200mg 매주 4주, 62%; 200mg 격주, 67%; 및 200mg 매주, 83%. 재치료를 받은 환자 총 58명 중 64%는 재치료 후 12주째 "클리어" 또는 "최소"의 PGA를 달성했다.
48주 동안 적어도 하나의 치료 그룹에서 ≥5% 일어나는 부작용(AE)은 하향 순서로 다음과 같았다: 비인두염, 주사 부위 반응, 상기도 감염, 두통, 고혈압 및 관절통. 48주 동안 개략적인 치료-발생 부작용은 이하 표 6에 나타냈다. 임의의 치료 그룹에서 발생빈도가 ≥5%인 개략적인 치료-발생 부작용은 이하 표 7에 제시했다.
상기 데이터는 ABT-874가 중등도 내지 중증 건선을 치료하는데 매우 효과적이라는 것을 증명한다. 반응 상실 및 재치료 후, 대부분의 환자들은 PASI 75 반응을 다시 달성할 수 있었다. 더욱이, ABT-874는 장기간 동안 안전성 프로필이 바람직한 것으로 나타난다.
실시예
7: 건강한 정상인
지원자에서
완전 사람
IL
-12/23
모노클로날
항체, ABT-874의 약동학
광범위한 용량의 ABT-874가 나타내는 내성, 안전성 및 약동학(PK)은 무작위 선별한 이중맹, 위약-대조군이 있는 다양한 용량의 연구에서 평가했다. 본 실시예의 목적은 건강한 지원자들에서 ABT-874의 정맥내(IV) 및 피하(SC) 주사 후의 약동학을 조사하는 것이었다.
주요 지원자 포함 기준은 다음과 같다: (i) 나이가 18세 내지 45세인 건강한 남성 지원자; (ii) 선별 검사(신체검사, 활력 징후, 심전도, 생화학, 혈액학, 소변검사, 혈청학)의 모든 조사에서 임상적 관련 이상이 전혀 없음; 및 (iii) 연구 시작전 12개월 이내에 흉부 x선 검사에서 정상. 주요 배제 기준은 다음과 같다: (i) 매일 담배를 10개 이상 피우는 흡연자; (ii) 매일 알콜 30g 이상을 마시는 음주자; (iii) 소변 약물 선별에서 양성인 자; (iv) 임상 감염, 특히 결핵균과 같은 세포내 세균 병원균에 의한 감염이 있는 자; 및 (v) 종전 2년 이내에 입원이나 IV 항생제를 필요로 하는 주요 감염이 있던 자.
젊고(18 내지 45세), 건강한 남성 지원자는 2회 동등 용량(1회 IV 및 1회의 SC를 8주 간격으로 투여받음)의 0.1, 0.3, 1.0 또는 5.0 mg/kg ABT-874을 2-기간 교차(2 x 2 라틴 스퀘어) 설계로 투여받았다. ABT-874 농도를 측정하기 위한 혈액 시료는 1차 용량투여 전(0) 및 용량투여 후 0.5시간, 1, 1.5, 2, 4, 8, 12, 24, 48, 72, 120, 168, 336, 504 및 672 시간째에 수집했다. ABT-874의 혈청 농도는 효소-결합된 면역흡착 분석법으로 측정했다.
ABT-874 혈청 농도는 각각 표로 작성하고, 통계 특징(예컨대, 기하 평균 및 기하 표준편차)으로 나타냈으며, 개별적으로 뿐만 아니라 IV 및 SC 치료 및 각 치료 그룹의 평균, 중간값 및 기하 평균 농도 대 시간 곡선으로 나타냈다. 다음 PK 매개변수는 비구획 방법으로 추산했다:
· Cmax 최대 혈청 농도(㎍/ml)
· Tmax Cmax에 도달하는 시간(hr)
· AUC 혈청 농도-시간 곡선 이하 면적(㎍×hr/ml)
· t½ 반감기(hr)
· CL 제거율(ml/hr)(IV 투여 시)
· Vz 분포 용적(ml)(IV 투여 시)
· CL/F 겉보기 CL(ml/hr)(SC 투여 시)
· V/F 겉보기 Vz(ml)(SC 투여 시)
총 64명의 환자는 다음과 같이 무작위로 선별했다: 각 용량 그룹 당 12명에게는 ABT-874를 투여하고 4명에게는 위약을 투여했다. ABT-874는 IV 투여 후 이중-지수 동역학을 따르고 투여 후 약 7일째에 말기에 들어갔다. 0.1, 0.3, 1.0 및 3.0 mg IV 용량의 평균±SD 말기 반감기는 각각 81.2±55.6, 147±73.2, 208±79.2 및 196±55.4시간이었다. 0.1, 0.3, 1.0 및 3.0 mg SC 용량의 평균±SD 말기 반감기는 각각 221±103, 161±92.6, 210±90.9 및 208±79.2시간이었다. IV 투여의 평균 말기 반감기는 81.2±55.6시간 내지 208±79.2시간 범위였다. SC 투여 시의 평균 말기 반감기는 161±92.6시간 내지 221±103시간 범위였다. 총 평균 말기 반감기는 8 내지 9일이었다.
ABT-874의 약동학(약물의 최대 농도[Cmax] 또는 곡선 이하 면적[AUC])은 IV 및 SC 투여 후 모두 용량에 비례해서 증가했다. IV 및 SC 용량투여 시의 혈청 농도-시간 곡선은 각각 도 6A 및 도 6B에 도시했다. 분포 용적은 IV 투여 후 약 8 내지 10L, SC 투여 후 24 내지 67L 범위였다. SC 투여 후, Cmax에 도달하는 시간은 약 3 내지 4일이었다. SC 투여 후 생체이용률은 평가된 용량들에서 42% 내지 62%였다. IV 또는 SC 투여 후 각 용량에서 약동학 매개변수, 예컨대 Cmax(최대 혈청 농도, ㎍/ml), AUC(혈청 농도-시간 곡선 이하 면적, ㎍×hr/ml), tmax(Cmax에 도달하는 시간, hr), t1 /2(반감기, hr), CL(제거율, ml/hr), 및 Vz(분포 용적(ml))는 이하 표 8에 제시했다.
상기 데이터는 단일 용량으로 IV 및 SC 투여된 0.1 내지 5.0mg/kg의 ABT-874는 젊은 건강한 남성이 잘 견뎌낼 수 있는 것임을 증명했다. 반감기가 8 내지 9일인 ABT-874의 약동학 성질은 IgG1 항체에서 예상된 것과 같았다.
실시예
8: 중등도 내지 중증
판상
건선의
치료에서
완전 사람
IL
-12/23
모노클로날
항체,
ABT
-874에 의한 재치료 반응의 유지
ABT-874의 효능과 안전성은 12주의 초기 치료 단계와 초기 치료에 반응하는 환자의 36주 재치료 단계를 포함하는, 48주, II기, 무작위 선별된 대조 실험으로 평가했다. 초기 12주 효능 결과 및 반응 결과의 유지는 상기 실시예 1 내지 5에 기술되어 있다. 본 실시예의 목적은 중등도 내지 중증 판상 Ps의 치료에서 ABT-874의 피하 주사를 통한 상기 II기 연구의 초기 반응을 상실한 환자의 36주 재치료/후속 단계 동안의 재치료 반응을 조사하는 것이다. 본 실시예의 추가 목적은 중등도 내지 중증 판상 Ps의 48주 치료 시에 피하 주사되는 ABT-874의 안전성을 조사하는 것이다.
본 실험의 주요 지원자 포함 기준은 다음과 같다: (i) 선별 전에 적어도 6개월 동안 건선의 임상 진단을 받고 적어도 2개월 동안 안정한 판상 건성을 보유한 성인; 및 (ii) 기준선 방문 시에 중등도 내지 중증 판상 건선을 보유한 자(연관 체표면적 ≥10%, 건선 면적 및 중증도 지수[PASI] 점수 ≥12 및 의사의 총괄 평가[PGA] 중등도 이상의 질환).
본 실험의 1차 배제 기준은 전신 또는 생물학적 항-IL-12 요법에 대한 노출 경험이었다. 2차 배제 기준은 기준선 방문 전에 다음과 같은 치료의 중단 불능이었다: ≥2주 전에 국소 건선 치료; ≥2주 전에 자외선(UV)-B선 광선요법; ≥4주 전에 솔라렌-UV선 광선요법; ≥4주 전에 전신 요법; 및 ≥12주 전에 생물학적 요법.
기준선에서, 인구통계 및 임상 특징은 처리 그룹마다 유사했다(상기 실시예 6의 표 5에 정리).
체표면적 10% 이상에 건선을 보유하고 건선 면적 및 중증도 지수(PASI) 점수가 12 이상인 성인을 6개의 그룹 중 하나로 무작위로 선별했다: 1) 0주에 ABT-874 200mg 단일 용량; 2) 12주 동안 격주(eow)로 ABT-874 100mg; 3) 4주 동안 매주 200mg ABT-874; 4) 12주 동안 200mg ABT-874 격주; 5) 12주 동안 매주 200mg ABT-874; 또는 6) 위약. 1차 종점은 12주째 ≥PASI75 반응이었다. 1차 종점을 충족시키는 환자는 36주 재치료 단계를 시작했다. 연구 약물 치료를 중단하고, 12-36주 동안 반응을 상실한 환자(≤PASI 50)는 초기 12주 기간 동안 지정받은 동일한 용량투여 요법으로 재치료를 받았다. 재치료는 12주 동안 지속했다. 소인에 상관없이, 모든 환자는 전 연구 기간 동안 또는 중단 시까지 모니터했다.
결과 측정값은 다음을 포함했다: (i) PASI 75를 달성한 환자의 백분율; (ii) 재치료 후 PASI 75를 달성하는 평균 시간; (iii) PASI 75 반응을 상실하는 평균 시간; (iv) 재치료 후 PGA 점수가 "클리어" 또는 "최소"인 환자의 백분율.
통계 분석은 다음과 같이 수행했다. ITT 분석은 무작위 선별된 치료 그룹에서 수행되었다. ABT-874로 재치료 후에 수득되는 PASI 평가 시, 이 평가는 재치료 1차 용량 후 경과일에 따른 방문 연구로 지정했다. PASI 반응(예/아니오)을 달성한 환자의 비율은 유도된 연구 방문일에 따라 제시했다. 모든 통계 검사는 유의 값이 0.05인 양측 검정이었다.
초기 등록한 180명의 환자(치료 그룹 당 환자 30명) 중에서 130명(1명은 위약군)은 재치료 단계에 등록했고, 58명(모두 ABT-874)은 재치료되었다. 12주째 PASI 75 이상을 달성하고 다시 재치료 후 12주째 PASI 75 이상을 달성한 환자의 백분율은 각 그룹마다 다음과 같았다: 200mg 단일 용량, 63% 대 55%; 100mg 격주, 93% 대 94%; 200mg 매주 4주, 90% 대 69%; 200mg 격주, 93% 대 75%; 및 200mg 매주, 90% 대 83%. 재치료를 받은 환자 총 58명 중 76%는 재치료 후 12주째 PASI 75 이상을 달성했다. 환자의 대부분은 PASI 75 반응을 재달성할 수 있었다(도 7A).
모든 ABT-874 투약량 그룹별 재치료 단계 동안 PASI 75를 달성하는 평균 시간(일)은 도 7B에 도시했다. 재치료 동안 ≥PASI 75를 달성하는 평균 시간은 각 그룹마다 각각 다음과 같았다: 200mg 단일 용량, 60 내지 65일; 100mg 격주, 55 내지 60일; 200mg 매주 4주, 55 내지 60일; 200mg 격주, 25 내지 35일; 및 200mg 매주, 55 내지 60일.
치료의 초기 12주 후 PASI 75를 상실하는 평균 시간(일)은 도 7C에 도시했다. 치료의 초기 12주 후 PASI 75를 상실하는 평균 시간은 각 그룹마다 각각 다음과 같았다: 200mg 단일 용량, 55 내지 60일; 100mg 격주, 110 내지 120일; 200mg 매주 4주, 110 내지 120일; 200mg 격주, 160 내지 180일; 및 200mg 매주, 180 내지 190일.
재치료 후 12주째 "클리어" 또는 "최소의" PGA(예: PGA 0 또는 1)를 달성한 환자의 백분율은 도 7D에 도시했다. 재치료 동안 PGA 0 또는 1을 달성한 환자의 백분율은 각각 각 그룹마다 다음과 같았다: 200mg 단일 용량, 35 내지 40%; 100mg 격주, 70 내지 80%; 200mg 매주 4주, 60 내지 65%; 200mg 격주, 60 내지 70%; 및 200mg 매주, 80 내지 90%. 재치료를 받은 총 환자 중 60 내지 65%는 재치료 후 0 또는 1의 PGA를 달성했다.
48주 동안 적어도 하나의 치료 그룹에서 ≥5% 일어나는 부작용(AE)은 하향 순서로 다음과 같았다: 비인두염, 주사 부위 반응, 상기도 감염, 두통, 고혈압 및 관절통. 48주 동안 개략적인 치료-발생 부작용은 상기 실시예 6의 표 6에 나타냈다. 임의의 치료 그룹에서 발생빈도가 ≥5%인 개략적인 치료-발생 부작용은 상기 실시예 6의 표 7에 제시했다.
상기 데이터는 ABT-874가 중등도 내지 중증 건선을 치료하는데 매우 효과적이라는 것을 증명한다. 반응 상실 및 재치료 시, 대부분의 환자들은 PASI 75 반응을 다시 달성할 수 있었다. 더욱이, ABT-874는 장기간 동안 안전성 프로필이 바람직한 것으로 나타난다.
동등물
당업자라면, 통상의 실험만으로 본 명세서에 기술된 본 발명의 특정 구체예들의 많은 동등물을 인식하거나 확인할 수 있을 것이다. 이러한 동등물은 다음 특허청구범위에 포함되는 것으로 간주한다.
<110> Abbott Laboratories
<120> Methods for treating psoriasis
<130> BBI-329PC
<150> US 61/069,840
<151> 2008-03-18
<150> US 61/095,275
<151> 2008-09-08
<150> US 61/207,904
<151> 2009-02-18
<160> 675
<170> KopatentIn 1.71
<210> 1
<211> 6
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 1 could be either His or Ser
<220>
<223> Xaa at position 4 could be either Tyr or His
<220>
<223> Xaa at position 6 could be either Tyr, Asn or Thr
<400> 1
Xaa Gly Ser Xaa Asp Xaa
1 5
<210> 2
<211> 12
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 2 could be either Ser or Thr
<220>
<223> Xaa at position 4 could be either Asp or Glu
<220>
<223> Xaa at position 5 could be either Ser, Arg or Lys
<220>
<223> Xaa at position 6 could be either Ser, Gly or Tyr
<220>
<223> Xaa at position 7 could be either Leu, Phe, Thr or
Ser
<220>
<223> Xaa at position 8 could be either Arg, Ser, Thr,
Trp or His
<220>
<223> Xaa at position 9 could be either Gly or Pro
<220>
<223> Xaa at position 10 could be either Ser, Thr, Ala
or Leu
<220>
<223> Xaa at position 11 could be either Arg, Ser, Met,
Thr or Leu
<220>
<223> Xaa at position 12 could be either Val, Ile, Thr,
Met or Leu
<400> 2
Gln Xaa Tyr Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 3
<211> 17
<212> PRT
<213> Homo sapiens
<400> 3
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 4
<211> 7
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 1 could be either Gly or Tyr
<220>
<223> Xaa at position 3 could be either Asp or Ser
<220>
<223> Xaa at position 4 could be either Gln or Asn
<400> 4
Xaa Asn Xaa Xaa Arg Pro Ser
1 5
<210> 5
<211> 9
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa represents either Ser or Glu
<400> 5
Phe Thr Phe Ser Xaa Tyr Gly Met His
1 5
<210> 6
<211> 13
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 1 could be either Ser or Thr
<220>
<223> Xaa at position 3 could be either Ser or Gly
<220>
<223> Xaa at position 4 could be either Arg or Ser
<220>
<223> Xaa at position 8 could be either Gly or Val
<220>
<223> Xaa at position 9 could be either Ser or Ala
<220>
<223> Xaa at position 10 could be either Asn, Gly or Tyr
<220>
<223> Xaa at position 11 could be either Thr or Asp
<220>
<223> Xaa at position 13 could be either Lys or His
<400> 6
Xaa Gly Xaa Xaa Ser Asn Ile Xaa Xaa Xaa Xaa Val Xaa
1 5 10
<210> 7
<211> 115
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 6 could be either Gln or Glu
<220>
<223> Xaa at position 16 could be either Arg or Gly
<220>
<223> Xaa at position 31 could be either Ser or Glu
<220>
<223> Xaa at position 84 could be either Lys or Asn
<220>
<223> Xaa at position 97 could be either Thr, Ala or Lys
<220>
<223> Xaa at position 98 could be either Thr or Lys
<220>
<223> Xaa at position 99 could be either Ser or His
<220>
<223> Xaa at position 102 could be either Tyr or His
<220>
<223> Xaa at position 104 could be either Tyr, Asn or
Thr
<400> 7
Gln Val Gln Leu Val Xaa Ser Gly Gly Gly Val Val Gln Pro Gly Xaa
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Xaa Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Asx
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Xaa Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Xaa Xaa Xaa Gly Ser Xaa Asp Xaa Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 8
<211> 112
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 1 could be either Ser or Gln
<220>
<223> Xaa at position 2 could be either Tyr or Ser
<220>
<223> Xaa at position 13 could be either Thr or Ala
<220>
<223> Xaa at position 23 and 91 could be either Ser or
Thr
<220>
<223> Xaa at position 25 could be either Gly or Ser
<220>
<223> Xaa at position 26 could be either Arg or Ser
<220>
<223> Xaa at position 30 could be either Gly or Val
<220>
<223> Xaa at position 31 could be either Ser or Ala
<220>
<223> Xaa at position 35 could be either Lys or His
<220>
<223> Xaa at position 51 could be either Gly or Lys
<220>
<223> Xaa at position 54 could be either Gln or Asn
<220>
<223> Xaa at position 79 could be either Val or Leu
<220>
<223> Xaa at position 93 could be either Asp or Glu
<220>
<223> Xaa at position 94 could be either Ser, Arg or Lys
<220>
<223> Xaa at position 95 could be either Ser, Gly or Tyr
<220>
<223> Xaa at position 96 could be either Leu, Phe, Thr
or Ser
<220>
<223> Xaa at position 97 could be either Arg, Ser, Thr,
Trp or His
<220>
<223> Xaa at position 98 could be either Gly or Pro
<220>
<223> Xaa at position 99 could be either Ser, Thr, Ala
or Leu
<220>
<223> Xaa at position 100 could be either Arg, Ser, Met,
Thr or Leu
<220>
<223> Xaa at position 101 could be either Val, Ile, Thr,
Met or Leu
<220>
<223> Xaa at position 32 could be either Asn, Gly or Tyr
<220>
<223> Xaa at position 33 could be either Thr or Asp
<220>
<223> Xaa at position 53 could be either Asp or Ser
<400> 8
Xaa Xaa Val Leu Thr Gln Pro Pro Ser Val Ser Gly Xaa Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Xaa Gly Xaa Xaa Ser Asn Ile Xaa Xaa Xaa
20 25 30
Xaa Val Xaa Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Xaa Asn Xaa Xaa Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Xaa Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Xaa Tyr Xaa Xaa Xaa Xaa
85 90 95
Xaa Xaa Xaa Xaa Xaa Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 9
<211> 6
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 2 could be either Gly, Val, Cys or
His
<220>
<223> Xaa at position 3 could be either Ser or Thr
<220>
<223> Xaa at position 4 could be either His, Thr, Val, Arg, or Ile
<220>
<223> Xaa at position 5 could be either Asp or Ser
<220>
<223> Xaa at position 6 could be either Asn, Lys, Ala,
Thr, Ser, Phe, Trp, or His
<400> 9
His Xaa Xaa Xaa Xaa Xaa
1 5
<210> 10
<211> 12
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 4 could be either Asp or Ser
<220>
<223> Xaa at position 5 represents any amino acid
<220>
<223> Xaa at position 6 could be either Gly, Asp, Gln,
Leu, Phe, Arg, His, Asn or Tyr
<400> 10
Gln Ser Tyr Xaa Xaa Xaa Thr His Pro Ala Leu Leu
1 5 10
<210> 11
<211> 17
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 1 could be either Phe, Thr or Tyr
<220>
<223> Xaa at position 3 could be either Arg or Ala
<220>
<223> Xaa at position 5 could be either Asp, Ser, Glu or
Ala
<220>
<223> Xaa at position 6 could be either Gly or Arg
<220>
<223> Xaa at position 8 represents any amino acid
<220>
<223> Xaa at position 10 could be either Tyr or Glu
<400> 11
Xaa Ile Xaa Tyr Xaa Xaa Ser Xaa Lys Xaa Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 12
<211> 7
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 1 could be either Gly, Tyr, Ser,
Thr, Asn or Gln
<400> 12
Xaa Asn Asp Gln Arg Pro Ser
1 5
<210> 13
<211> 9
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 4 and 5 represents any amino acid
<220>
<223> Xaa at position 6 could be either Tyr or His
<220>
<223> Xaa at position 7 could be either Gly, Met, Ala,
Asn or Ser
<400> 13
Phe Thr Phe Xaa Xaa Xaa Xaa Met His
1 5
<210> 14
<211> 13
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 9 could be either Ser, Cys, Arg,
Asn, Asp or Thr
<220>
<223> Xaa at position 10 could be either Asn, Met or Ile
<220>
<223> Xaa at position 11 could be either Thr, Tyr, Asp,
His, Lys or Pro
<400> 14
Ser Gly Gly Arg Ser Asn Ile Gly Xaa Xaa Xaa Val Lys
1 5 10
<210> 15
<211> 114
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 30 could be Ser or Glu
<220>
<223> Xaa at position 83 could be Lys or Asn
<220>
<223> Xaa at position 5 could be either Gln or Glu
<400> 15
Gln Val Gln Val Xaa Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Xaa Tyr Gly
20 25 30
Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
35 40 45
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Xaa Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Lys
85 90 95
Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr Val
100 105 110
Ser Ser
<210> 16
<211> 112
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 1 could be either Ser or Gln
<220>
<223> Xaa at position 2 could be Tyr or Ser
<220>
<223> Xaa at position 13 could be either Thr or Ala
<220>
<223> Xaa at position 25 could be either Gly or Ser
<220>
<223> Xaa at position 51 and 95 could be either Gly or
Tyr
<220>
<223> Xaa at position 79 could be either Val or Leu
<400> 16
Xaa Xaa Val Leu Thr Gln Pro Pro Ser Val Ser Gly Xaa Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Xaa Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Xaa Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Xaa Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Xaa Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 17
<211> 6
<212> PRT
<213> Homo sapiens
<400> 17
His Gly Ser His Asp Asn
1 5
<210> 18
<211> 12
<212> PRT
<213> Homo sapiens
<400> 18
Gln Ser Tyr Asp Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 19
<211> 17
<212> PRT
<213> Homo sapiens
<400> 19
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 20
<211> 7
<212> PRT
<213> Homo sapiens
<400> 20
Gly Asn Asp Gln Arg Pro Ser
1 5
<210> 21
<211> 9
<212> PRT
<213> Homo sapiens
<400> 21
Phe Thr Phe Ser Ser Tyr Gly Met His
1 5
<210> 22
<211> 13
<212> PRT
<213> Homo sapiens
<400> 22
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Thr Val Lys
1 5 10
<210> 23
<211> 115
<212> PRT
<213> Homo sapiens
<400> 23
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 24
<211> 112
<212> PRT
<213> Homo sapiens
<400> 24
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Trp Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 25
<211> 6
<212> PRT
<213> Homo sapiens
<400> 25
His Gly Ser His Asp Asn
1 5
<210> 26
<211> 12
<212> PRT
<213> Homo sapiens
<400> 26
Gln Ser Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu
1 5 10
<210> 27
<211> 17
<212> PRT
<213> Homo sapiens
<400> 27
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 28
<211> 7
<212> PRT
<213> Homo sapiens
<400> 28
Tyr Asn Asp Gln Arg Pro Ser
1 5
<210> 29
<211> 9
<212> PRT
<213> Homo sapiens
<400> 29
Phe Thr Phe Ser Ser Tyr Gly Met His
1 5
<210> 30
<211> 13
<212> PRT
<213> Homo sapiens
<400> 30
Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn Thr Val Lys
1 5 10
<210> 31
<211> 115
<212> PRT
<213> Homo sapiens
<400> 31
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 32
<211> 112
<212> PRT
<213> Homo sapiens
<400> 32
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Tyr Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 33
<211> 115
<212> PRT
<213> Homo sapiens
<400> 33
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Ser Gly Ser Tyr Asp Tyr Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 34
<211> 112
<212> PRT
<213> Homo sapiens
<400> 34
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser Leu
85 90 95
Arg Gly Ser Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 35
<211> 115
<212> PRT
<213> Homo sapiens
<400> 35
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ser Gly Ser Tyr Asp Tyr Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 36
<211> 112
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa at position 32 represents either Gly or Tyr
<400> 36
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Xaa
20 25 30
Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser Leu
85 90 95
Ser Gly Ser Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 37
<211> 115
<212> PRT
<213> Homo sapiens
<400> 37
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 38
<211> 112
<212> PRT
<213> Homo sapiens
<400> 38
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser Leu
85 90 95
Arg Gly Ser Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 39
<211> 115
<212> PRT
<213> Homo sapiens
<400> 39
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Ser Gly Ser Tyr Asp Tyr Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 40
<211> 112
<212> PRT
<213> Homo sapiens
<400> 40
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Phe
85 90 95
Thr Gly Ser Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 41
<211> 115
<212> PRT
<213> Homo sapiens
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Ser Gly Ser Tyr Asp Tyr Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 42
<211> 112
<212> PRT
<213> Homo sapiens
<400> 42
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser Leu
85 90 95
Trp Gly Ser Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 43
<211> 115
<212> PRT
<213> Homo sapiens
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 44
<211> 112
<212> PRT
<213> Homo sapiens
<400> 44
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Phe
85 90 95
Thr Gly Ser Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 45
<211> 115
<212> PRT
<213> Homo sapiens
<400> 45
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 46
<211> 112
<212> PRT
<213> Homo sapiens
<400> 46
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser Leu
85 90 95
Trp Gly Ser Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 47
<211> 115
<212> PRT
<213> Homo sapiens
<400> 47
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 48
<211> 112
<212> PRT
<213> Homo sapiens
<400> 48
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Thr Tyr Asp Lys Gly Phe
85 90 95
Thr Gly Ser Ser Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 49
<211> 115
<212> PRT
<213> Homo sapiens
<400> 49
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 50
<211> 112
<212> PRT
<213> Homo sapiens
<400> 50
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Thr Tyr Asp Lys Gly Phe
85 90 95
Thr Gly Ser Ser Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 51
<211> 115
<212> PRT
<213> Homo sapiens
<400> 51
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr His Gly Ser His Asp Thr Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 52
<211> 112
<212> PRT
<213> Homo sapiens
<400> 52
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser Leu
85 90 95
Trp Gly Thr Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 53
<211> 115
<212> PRT
<213> Homo sapiens
<400> 53
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 54
<211> 112
<212> PRT
<213> Homo sapiens
<400> 54
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Val Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Phe
85 90 95
Thr Gly Ser Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 55
<211> 115
<212> PRT
<213> Homo sapiens
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 56
<211> 112
<212> PRT
<213> Homo sapiens
<400> 56
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Val Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Phe
85 90 95
Thr Gly Ala Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 57
<211> 115
<212> PRT
<213> Homo sapiens
<400> 57
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 58
<211> 112
<212> PRT
<213> Homo sapiens
<400> 58
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Thr Tyr Asp Lys Gly Phe
85 90 95
Thr Gly Ser Ser Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 59
<211> 115
<212> PRT
<213> Homo sapiens
<400> 59
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 60
<211> 112
<212> PRT
<213> Homo sapiens
<400> 60
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Glu Arg Gly Phe
85 90 95
Thr Gly Ser Met Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 61
<211> 115
<212> PRT
<213> Homo sapiens
<400> 61
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 62
<211> 112
<212> PRT
<213> Homo sapiens
<400> 62
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Thr
85 90 95
His Pro Leu Thr Ile Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 63
<211> 115
<212> PRT
<213> Homo sapiens
<400> 63
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 64
<211> 112
<212> PRT
<213> Homo sapiens
<400> 64
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Ser
85 90 95
His Pro Ala Leu Thr Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 65
<211> 115
<212> PRT
<213> Homo sapiens
<400> 65
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 66
<211> 112
<212> PRT
<213> Homo sapiens
<400> 66
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Thr
85 90 95
His Pro Leu Thr Met Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 67
<211> 115
<212> PRT
<213> Homo sapiens
<400> 67
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 68
<211> 112
<212> PRT
<213> Homo sapiens
<400> 68
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Thr
85 90 95
His Pro Leu Thr Met Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 69
<211> 115
<212> PRT
<213> Homo sapiens
<400> 69
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 70
<211> 112
<212> PRT
<213> Homo sapiens
<400> 70
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 71
<211> 115
<212> PRT
<213> Homo sapiens
<400> 71
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Glu Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 72
<211> 112
<212> PRT
<213> Homo sapiens
<400> 72
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 73
<211> 115
<212> PRT
<213> Homo sapiens
<400> 73
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 74
<211> 112
<212> PRT
<213> Homo sapiens
<400> 74
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Gly Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 75
<211> 115
<212> PRT
<213> Homo sapiens
<400> 75
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 76
<211> 112
<212> PRT
<213> Homo sapiens
<400> 76
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Tyr Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
<210> 77
<211> 6
<212> PRT
<213> Homo sapiens
<400> 77
Ser Gly Ser Tyr Asp Tyr
1 5
<210> 78
<211> 6
<212> PRT
<213> Homo sapiens
<400> 78
His Gly Ser His Asp Asn
1 5
<210> 79
<211> 6
<212> PRT
<213> Homo sapiens
<400> 79
His Gly Ser Tyr Asp Tyr
1 5
<210> 80
<211> 6
<212> PRT
<213> Homo sapiens
<400> 80
Arg Arg Arg Ser Asn Tyr
1 5
<210> 81
<211> 6
<212> PRT
<213> Homo sapiens
<400> 81
Ser Gly Ser Ile Asp Tyr
1 5
<210> 82
<211> 6
<212> PRT
<213> Homo sapiens
<400> 82
His Gly Ser His Asp Asp
1 5
<210> 83
<211> 6
<212> PRT
<213> Homo sapiens
<400> 83
His Gly Ser His Asp Asn
1 5
<210> 84
<211> 12
<212> PRT
<213> Homo sapiens
<400> 84
Thr Thr His Gly Ser His Asp Asn Trp Gly Gln Gly
1 5 10
<210> 85
<211> 12
<212> PRT
<213> Homo sapiens
<400> 85
Ala Lys His Gly Ser His Asp Asn Trp Gly Gln Gly
1 5 10
<210> 86
<211> 12
<212> PRT
<213> Homo sapiens
<400> 86
Thr Thr His Gly Ser His Asp Asn Trp Ser Gln Gly
1 5 10
<210> 87
<211> 12
<212> PRT
<213> Homo sapiens
<400> 87
Thr Thr His Gly Ser His Asp Thr Trp Gly Gln Gly
1 5 10
<210> 88
<211> 12
<212> PRT
<213> Homo sapiens
<400> 88
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly
1 5 10
<210> 89
<211> 12
<212> PRT
<213> Homo sapiens
<400> 89
Lys Thr His Gly Ser His Asp Asn Trp Gly His Gly
1 5 10
<210> 90
<211> 12
<212> PRT
<213> Homo sapiens
<400> 90
Thr Thr His Gly Ser His Asp Asn Trp Ser Gln Gly
1 5 10
<210> 91
<211> 12
<212> PRT
<213> Homo sapiens
<400> 91
Thr Thr His Arg Ser His Asn Asn Trp Gly Gln Gly
1 5 10
<210> 92
<211> 8
<212> PRT
<213> Homo sapiens
<400> 92
Thr Thr His Gly Ser His Asp Asn
1 5
<210> 93
<211> 8
<212> PRT
<213> Homo sapiens
<400> 93
Thr Thr His Gly Ser His Asp Thr
1 5
<210> 94
<211> 8
<212> PRT
<213> Homo sapiens
<400> 94
Thr Lys His Gly Ser His Asp Asn
1 5
<210> 95
<211> 8
<212> PRT
<213> Homo sapiens
<400> 95
Thr Thr Gln Gly Arg His Asp Asn
1 5
<210> 96
<211> 8
<212> PRT
<213> Homo sapiens
<400> 96
Lys Thr Arg Gly Arg His Asp Asn
1 5
<210> 97
<211> 8
<212> PRT
<213> Homo sapiens
<400> 97
Thr Thr His Gly Ser His Asp Lys
1 5
<210> 98
<211> 8
<212> PRT
<213> Homo sapiens
<400> 98
Thr Thr His Gly Ser His Asp Asp
1 5
<210> 99
<211> 8
<212> PRT
<213> Homo sapiens
<400> 99
Lys Thr His Gly Ser His Asp Asn
1 5
<210> 100
<211> 8
<212> PRT
<213> Homo sapiens
<400> 100
Lys Thr His Gly Ser His Asp Asn
1 5
<210> 101
<211> 8
<212> PRT
<213> Homo sapiens
<400> 101
Thr Thr His Gly Ser His Asp Asn
1 5
<210> 102
<211> 8
<212> PRT
<213> Homo sapiens
<400> 102
Thr Thr Ser Gly Ser Tyr Asp Tyr
1 5
<210> 103
<211> 8
<212> PRT
<213> Homo sapiens
<400> 103
Thr Thr His Gly Ser His Asp Asn
1 5
<210> 104
<211> 8
<212> PRT
<213> Homo sapiens
<400> 104
Thr Thr His Gly Ser Gln Asp Asn
1 5
<210> 105
<211> 8
<212> PRT
<213> Homo sapiens
<400> 105
Ala Thr His Gly Ser Gln Asp Asn
1 5
<210> 106
<211> 6
<212> PRT
<213> Homo sapiens
<400> 106
His Gly Ser Gln Asp Thr
1 5
<210> 107
<211> 6
<212> PRT
<213> Homo sapiens
<400> 107
Ser Gly Ser Tyr Asp Tyr
1 5
<210> 108
<211> 6
<212> PRT
<213> Homo sapiens
<400> 108
His Gly Ser Gln Asp Asn
1 5
<210> 109
<211> 9
<212> PRT
<213> Homo sapiens
<400> 109
Cys Lys Thr His Gly Ser His Asp Asn
1 5
<210> 110
<211> 12
<212> PRT
<213> Homo sapiens
<400> 110
Gln Ser Tyr Asp Ser Ser Leu Arg Gly Ser Arg Val
1 5 10
<210> 111
<211> 12
<212> PRT
<213> Homo sapiens
<400> 111
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Arg Val
1 5 10
<210> 112
<211> 12
<212> PRT
<213> Homo sapiens
<400> 112
Gln Ser Tyr Asp Ser Ser Leu Arg Gly Ser Arg Val
1 5 10
<210> 113
<211> 12
<212> PRT
<213> Homo sapiens
<400> 113
Gln Ser Tyr Asp Ser Ser Leu Thr Gly Ser Arg Val
1 5 10
<210> 114
<211> 12
<212> PRT
<213> Homo sapiens
<400> 114
Gln Ser Tyr Asp Ser Ser Leu Trp Gly Ser Arg Val
1 5 10
<210> 115
<211> 12
<212> PRT
<213> Homo sapiens
<400> 115
Gln Thr Tyr Asp Ile Ser Glu Ser Gly Ser Arg Val
1 5 10
<210> 116
<211> 12
<212> PRT
<213> Homo sapiens
<400> 116
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Arg Val
1 5 10
<210> 117
<211> 12
<212> PRT
<213> Homo sapiens
<400> 117
Gln Thr Tyr Asp Arg Gly Phe Thr Gly Ser Arg Val
1 5 10
<210> 118
<211> 12
<212> PRT
<213> Homo sapiens
<400> 118
Gln Thr Tyr Asp Lys Gly Phe Thr Gly Ser Ser Val
1 5 10
<210> 119
<211> 12
<212> PRT
<213> Homo sapiens
<400> 119
Gln Ser Tyr Asp Arg Arg Phe Thr Gly Ser Arg Val
1 5 10
<210> 120
<211> 12
<212> PRT
<213> Homo sapiens
<400> 120
Gln Ser Tyr Asp Trp Asn Phe Thr Gly Ser Arg Val
1 5 10
<210> 121
<211> 12
<212> PRT
<213> Homo sapiens
<400> 121
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Arg Val
1 5 10
<210> 122
<211> 12
<212> PRT
<213> Homo sapiens
<400> 122
Gln Ser Tyr Asp Asn Gly Phe Thr Gly Ser Arg Val
1 5 10
<210> 123
<211> 12
<212> PRT
<213> Homo sapiens
<400> 123
Gln Ser Tyr Asp Asn Ala Val Thr Ala Ser Lys Val
1 5 10
<210> 124
<211> 12
<212> PRT
<213> Homo sapiens
<400> 124
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Arg Val
1 5 10
<210> 125
<211> 12
<212> PRT
<213> Homo sapiens
<400> 125
Gln Ser Tyr Asp Ser Ser Leu Trp Gly Thr Arg Val
1 5 10
<210> 126
<211> 12
<212> PRT
<213> Homo sapiens
<400> 126
Gln Ser Tyr Asp Arg Asp Phe Thr Gly Ser Arg Val
1 5 10
<210> 127
<211> 12
<212> PRT
<213> Homo sapiens
<400> 127
Gln Ser Tyr Glu Arg Gly Phe Thr Gly Ser Met Val
1 5 10
<210> 128
<211> 12
<212> PRT
<213> Homo sapiens
<400> 128
Gln Ser Tyr Asp Asn Gly Phe Thr Gly Ala Arg Val
1 5 10
<210> 129
<211> 12
<212> PRT
<213> Homo sapiens
<400> 129
Gln Ser Tyr Asp Arg Arg Phe Thr Gly Ser Arg Val
1 5 10
<210> 130
<211> 12
<212> PRT
<213> Homo sapiens
<400> 130
Gln Thr Tyr Asp Lys Gly Phe Thr Gly Ser Ser Val
1 5 10
<210> 131
<211> 12
<212> PRT
<213> Homo sapiens
<400> 131
Gln Ser Tyr Asp Arg Asp Phe Thr Gly Thr Arg Val
1 5 10
<210> 132
<211> 12
<212> PRT
<213> Homo sapiens
<400> 132
Gln Ser Tyr Asp Arg Gly Phe Tyr Gly Ser Met Val
1 5 10
<210> 133
<211> 12
<212> PRT
<213> Homo sapiens
<400> 133
Gln Thr Tyr Asp Lys Gly Phe Thr Gly Ser Ser Val
1 5 10
<210> 134
<211> 12
<212> PRT
<213> Homo sapiens
<400> 134
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ala Arg Val
1 5 10
<210> 135
<211> 12
<212> PRT
<213> Homo sapiens
<400> 135
Gln Ser Tyr Glu Arg Gly Phe Thr Gly Ala Arg Val
1 5 10
<210> 136
<211> 13
<212> PRT
<213> Homo sapiens
<400> 136
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 137
<211> 13
<212> PRT
<213> Homo sapiens
<400> 137
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Phe Lys Val Phe
1 5 10
<210> 138
<211> 13
<212> PRT
<213> Homo sapiens
<400> 138
Gln Ser Tyr Asp Arg Gly Phe Val Ser Ala Tyr Val Phe
1 5 10
<210> 139
<211> 13
<212> PRT
<213> Homo sapiens
<400> 139
Gln Ser Tyr Asp Arg Gly Leu Thr Val Thr Lys Val Phe
1 5 10
<210> 140
<211> 13
<212> PRT
<213> Homo sapiens
<400> 140
Gln Ser Tyr Asp Arg Gly Tyr Thr Ala Ser Arg Val Phe
1 5 10
<210> 141
<211> 13
<212> PRT
<213> Homo sapiens
<400> 141
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Lys Val Phe
1 5 10
<210> 142
<211> 13
<212> PRT
<213> Homo sapiens
<400> 142
Gln Ser Tyr Asp Arg Gly Leu Thr Gly Phe Arg Val Phe
1 5 10
<210> 143
<211> 13
<212> PRT
<213> Homo sapiens
<400> 143
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Tyr Lys Val Phe
1 5 10
<210> 144
<211> 13
<212> PRT
<213> Homo sapiens
<400> 144
Gln Ser Tyr Asp Arg Gly Leu Thr Gly Tyr Arg Leu Phe
1 5 10
<210> 145
<211> 13
<212> PRT
<213> Homo sapiens
<400> 145
Gln Ser Tyr Asp Arg Gly Phe Thr Asp Tyr Lys Val Phe
1 5 10
<210> 146
<211> 13
<212> PRT
<213> Homo sapiens
<400> 146
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Pro Arg Leu Phe
1 5 10
<210> 147
<211> 13
<212> PRT
<213> Homo sapiens
<400> 147
Gln Ser Tyr Asp Arg Gly Leu Thr Gly Ser Arg Val Phe
1 5 10
<210> 148
<211> 13
<212> PRT
<213> Homo sapiens
<400> 148
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ala Arg Val Trp
1 5 10
<210> 149
<211> 13
<212> PRT
<213> Homo sapiens
<400> 149
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Tyr Arg Val Phe
1 5 10
<210> 150
<211> 13
<212> PRT
<213> Homo sapiens
<400> 150
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Pro Arg Val Phe
1 5 10
<210> 151
<211> 13
<212> PRT
<213> Homo sapiens
<400> 151
Gln Ser Tyr Asp Arg Gly Met Thr Ser Ser Arg Val Phe
1 5 10
<210> 152
<211> 13
<212> PRT
<213> Homo sapiens
<400> 152
Gln Ser Tyr Asp Arg Asp Ser Thr Gly Ser Arg Val Phe
1 5 10
<210> 153
<211> 13
<212> PRT
<213> Homo sapiens
<400> 153
Gln Ser Tyr Asp Ser Ser Leu Arg Gly Ser Arg Val Phe
1 5 10
<210> 154
<211> 13
<212> PRT
<213> Homo sapiens
<400> 154
His Ser Tyr Asp Ser Asp Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 155
<211> 13
<212> PRT
<213> Homo sapiens
<400> 155
His Ser Ser Glu Ser Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 156
<211> 13
<212> PRT
<213> Homo sapiens
<400> 156
His Ser Tyr Asp Asn Arg Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 157
<211> 13
<212> PRT
<213> Homo sapiens
<400> 157
His Ser Tyr Asp Ser Arg Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 158
<211> 13
<212> PRT
<213> Homo sapiens
<400> 158
Gln Ser Tyr Asp Ser Glu Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 159
<211> 13
<212> PRT
<213> Homo sapiens
<400> 159
Gln Ser Tyr Asp Thr Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 160
<211> 13
<212> PRT
<213> Homo sapiens
<400> 160
His Ser Tyr Asp Ser Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 161
<211> 13
<212> PRT
<213> Homo sapiens
<400> 161
Gln Ser Tyr Asp Thr Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 162
<211> 13
<212> PRT
<213> Homo sapiens
<400> 162
His Ser Tyr Asp Thr Lys Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 163
<211> 13
<212> PRT
<213> Homo sapiens
<400> 163
His Ser Ser Asp Ser Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 164
<211> 13
<212> PRT
<213> Homo sapiens
<400> 164
Gln Ser Tyr Asp Ser Asp Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 165
<211> 13
<212> PRT
<213> Homo sapiens
<400> 165
His Ser Tyr Glu Ser Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 166
<211> 13
<212> PRT
<213> Homo sapiens
<400> 166
Gln Ser Tyr Asp Ala Pro Trp Ser Gly Ser Arg Val Phe
1 5 10
<210> 167
<211> 13
<212> PRT
<213> Homo sapiens
<400> 167
Gln Ser Tyr Asp Ser Asp Phe Thr Gly Ser Lys Val Phe
1 5 10
<210> 168
<211> 13
<212> PRT
<213> Homo sapiens
<400> 168
His Thr Asn Asp Ser Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 169
<211> 13
<212> PRT
<213> Homo sapiens
<400> 169
His Ser Tyr Asp Thr Arg Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 170
<211> 13
<212> PRT
<213> Homo sapiens
<400> 170
Gln Ser Tyr Asp Met Arg Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 171
<211> 13
<212> PRT
<213> Homo sapiens
<400> 171
His Ser Ser Asp Ser Asp Ser Thr Gly Ser Arg Val Phe
1 5 10
<210> 172
<211> 13
<212> PRT
<213> Homo sapiens
<400> 172
Gln Ser Tyr Asn Thr Asp Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 173
<211> 13
<212> PRT
<213> Homo sapiens
<400> 173
Gln Ser Tyr Asp Ser Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 174
<211> 13
<212> PRT
<213> Homo sapiens
<400> 174
His Ser Tyr Asp Met Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 175
<211> 13
<212> PRT
<213> Homo sapiens
<400> 175
His Ser Tyr Asp Asn Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 176
<211> 13
<212> PRT
<213> Homo sapiens
<400> 176
His Ser His Asp Arg Asp Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 177
<211> 12
<212> PRT
<213> Homo sapiens
<400> 177
Gln Ser Tyr Asp Ser Ser Leu Arg Gly Ser Arg Val
1 5 10
<210> 178
<211> 13
<212> PRT
<213> Homo sapiens
<400> 178
Gln Ser Tyr Asp Arg Gly Ile His Gly Ser Arg Val Phe
1 5 10
<210> 179
<211> 13
<212> PRT
<213> Homo sapiens
<400> 179
Gln Ser Tyr Asp Ser Gly Phe Pro Gly Ser Arg Val Phe
1 5 10
<210> 180
<211> 13
<212> PRT
<213> Homo sapiens
<400> 180
Gln Ser Tyr Asp Ile Gly Ser Thr Gly Ser Arg Val Phe
1 5 10
<210> 181
<211> 13
<212> PRT
<213> Homo sapiens
<400> 181
Gln Ser Tyr Asp Ser Gly Leu Thr Gly Ser Arg Val Phe
1 5 10
<210> 182
<211> 13
<212> PRT
<213> Homo sapiens
<400> 182
Gln Ser Tyr Asp Ile Gly Met Thr Gly Ser Arg Val Phe
1 5 10
<210> 183
<211> 13
<212> PRT
<213> Homo sapiens
<400> 183
Gln Ser Tyr Asp Ile Gly Leu Thr Gly Ser Arg Val Phe
1 5 10
<210> 184
<211> 13
<212> PRT
<213> Homo sapiens
<400> 184
Gln Ser Tyr Asp Ser Gly Val Thr Gly Ser Arg Val Phe
1 5 10
<210> 185
<211> 13
<212> PRT
<213> Homo sapiens
<400> 185
Gln Ser Tyr Asp Arg Gly Leu Thr Ala Ser Arg Val Phe
1 5 10
<210> 186
<211> 13
<212> PRT
<213> Homo sapiens
<400> 186
Gln Ser Tyr Asp Thr Gly Leu Thr Gly Ser Arg Val Phe
1 5 10
<210> 187
<211> 13
<212> PRT
<213> Homo sapiens
<400> 187
Gln Ser Tyr Asp Thr Ala Leu Thr Gly Ser Arg Val Phe
1 5 10
<210> 188
<211> 13
<212> PRT
<213> Homo sapiens
<400> 188
Gln Ser Tyr Asp Ile Arg Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 189
<211> 13
<212> PRT
<213> Homo sapiens
<400> 189
Gln Ser Tyr Asp Ile Arg Ser Thr Gly Ser Arg Val Phe
1 5 10
<210> 190
<211> 13
<212> PRT
<213> Homo sapiens
<400> 190
Gln Ser Tyr Asp Asn Arg Leu Thr Gly Ser Arg Val Phe
1 5 10
<210> 191
<211> 13
<212> PRT
<213> Homo sapiens
<400> 191
Gln Ser Tyr Glu Thr Ser Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 192
<211> 13
<212> PRT
<213> Homo sapiens
<400> 192
Gln Ser Tyr Asp Ser Ser Ser Thr Gly Ser Arg Val Phe
1 5 10
<210> 193
<211> 13
<212> PRT
<213> Homo sapiens
<400> 193
Gln Ser Tyr Asp Ser Gly Phe Thr Ala Ser Arg Val Phe
1 5 10
<210> 194
<211> 13
<212> PRT
<213> Homo sapiens
<400> 194
Gln Thr Tyr Asp Lys Gly Phe Thr Gly Ser Ser Val Phe
1 5 10
<210> 195
<211> 13
<212> PRT
<213> Homo sapiens
<400> 195
Gln Ser Tyr Asp Asn Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 196
<211> 13
<212> PRT
<213> Homo sapiens
<400> 196
Gln Ser Tyr Asp Thr Gly Phe Thr Lys Ser Arg Val Phe
1 5 10
<210> 197
<211> 13
<212> PRT
<213> Homo sapiens
<400> 197
Gln Ser Tyr Asp Ser Asp Val Thr Gly Ser Arg Val Phe
1 5 10
<210> 198
<211> 13
<212> PRT
<213> Homo sapiens
<400> 198
Gln Ser Tyr Asp Ala Gly Phe Thr Gly Ser Arg Val Phe
1 5 10
<210> 199
<211> 12
<212> PRT
<213> Homo sapiens
<400> 199
Gln Ser Tyr Asp Arg Gly Thr His Pro Ser Met Leu
1 5 10
<210> 200
<211> 12
<212> PRT
<213> Homo sapiens
<400> 200
Gln Ser Tyr Asp Arg Gly Thr Thr Pro Arg Pro Met
1 5 10
<210> 201
<211> 12
<212> PRT
<213> Homo sapiens
<400> 201
Gln Ser Tyr Asp Arg Gly Arg Asn Pro Ala Leu Thr
1 5 10
<210> 202
<211> 12
<212> PRT
<213> Homo sapiens
<400> 202
Gln Ser Tyr Asp Arg Gly Thr His Pro Trp Leu His
1 5 10
<210> 203
<211> 12
<212> PRT
<213> Homo sapiens
<400> 203
Gln Ser Tyr Asp Arg Gly Asn Ser Pro Ala Thr Val
1 5 10
<210> 204
<211> 12
<212> PRT
<213> Homo sapiens
<400> 204
Gln Ser Tyr Asp Arg Gly Thr Phe Pro Ser Pro Gln
1 5 10
<210> 205
<211> 12
<212> PRT
<213> Homo sapiens
<400> 205
Gln Ser Tyr Asp Arg Gly Leu Asn Pro Ser Ala Thr
1 5 10
<210> 206
<211> 12
<212> PRT
<213> Homo sapiens
<400> 206
Gln Ser Tyr Asp Arg Gly Lys Ser Asn Lys Met Leu
1 5 10
<210> 207
<211> 12
<212> PRT
<213> Homo sapiens
<400> 207
Gln Ser Tyr Asp Arg Gly His Thr Ala His Leu Tyr
1 5 10
<210> 208
<211> 12
<212> PRT
<213> Homo sapiens
<400> 208
Gln Ser Tyr Asp Arg Gly Gln Thr Pro Ser Ile Thr
1 5 10
<210> 209
<211> 12
<212> PRT
<213> Homo sapiens
<400> 209
Gln Ser Tyr Asp Arg Gly Tyr Pro Arg Asn Ile Leu
1 5 10
<210> 210
<211> 12
<212> PRT
<213> Homo sapiens
<400> 210
Gln Ser Tyr Asp Arg Gly Ile Thr Pro Gly Leu Ala
1 5 10
<210> 211
<211> 12
<212> PRT
<213> Homo sapiens
<400> 211
Gln Ser Tyr Asp Arg Gly Gln Pro His Ala Val Leu
1 5 10
<210> 212
<211> 12
<212> PRT
<213> Homo sapiens
<400> 212
Gln Ser Tyr Asp Arg Gly Asn Ser Pro Ile Pro Thr
1 5 10
<210> 213
<211> 12
<212> PRT
<213> Homo sapiens
<400> 213
Gln Ser Tyr Asp Arg Gly Thr Pro Asn Asn Ser Phe
1 5 10
<210> 214
<211> 12
<212> PRT
<213> Homo sapiens
<400> 214
Gln Ser Tyr Asp Ser Gly Val Asp Pro Gly Pro Tyr
1 5 10
<210> 215
<211> 12
<212> PRT
<213> Homo sapiens
<400> 215
Gln Ser Tyr Asp Arg Gly Arg Pro Arg His Ala Leu
1 5 10
<210> 216
<211> 12
<212> PRT
<213> Homo sapiens
<400> 216
Gln Ser Tyr Asp Arg Gly Pro Tyr His Pro Ile Arg
1 5 10
<210> 217
<211> 12
<212> PRT
<213> Homo sapiens
<400> 217
Gln Ser Tyr Asp Arg Gly Pro His Thr Gln Pro Thr
1 5 10
<210> 218
<211> 12
<212> PRT
<213> Homo sapiens
<400> 218
Gln Ser Tyr Asp Arg Gly His Asn Asn Phe Ser Pro
1 5 10
<210> 219
<211> 12
<212> PRT
<213> Homo sapiens
<400> 219
Gln Ser Tyr Asp Arg Gly Pro Thr His Leu Pro His
1 5 10
<210> 220
<211> 12
<212> PRT
<213> Homo sapiens
<400> 220
Gln Ser Tyr Asp Arg Gly Thr Pro Ser Tyr Pro Thr
1 5 10
<210> 221
<211> 12
<212> PRT
<213> Homo sapiens
<400> 221
Gln Ser Tyr Asp Ser Gly Thr Ser Asn Leu Leu Pro
1 5 10
<210> 222
<211> 12
<212> PRT
<213> Homo sapiens
<400> 222
Gln Ser Tyr Asp Arg Gly Asp Ser Asn His Asp Leu
1 5 10
<210> 223
<211> 12
<212> PRT
<213> Homo sapiens
<400> 223
Gln Ser Tyr Asp Arg Gly Leu Pro Arg Leu Thr His
1 5 10
<210> 224
<211> 12
<212> PRT
<213> Homo sapiens
<400> 224
Gln Ser Tyr Asp Arg Gly Ile Pro Thr Ser Tyr Leu
1 5 10
<210> 225
<211> 12
<212> PRT
<213> Homo sapiens
<400> 225
Gln Ser Tyr Asp Arg Gly Leu Arg Val Gln Ala Pro
1 5 10
<210> 226
<211> 12
<212> PRT
<213> Homo sapiens
<400> 226
Gln Ser Tyr Asp Arg Gly Leu Ser Asp Ser Pro Leu
1 5 10
<210> 227
<211> 12
<212> PRT
<213> Homo sapiens
<400> 227
Gln Ser Tyr Asp Ser Gly Ser Leu Arg Arg Ile Leu
1 5 10
<210> 228
<211> 12
<212> PRT
<213> Homo sapiens
<400> 228
Gln Ser Tyr Asp Arg Gly Pro Ala Arg Thr Ser Pro
1 5 10
<210> 229
<211> 12
<212> PRT
<213> Homo sapiens
<400> 229
Gln Ser Tyr Asp Arg Gly Arg Ala Ala His Pro Gln
1 5 10
<210> 230
<211> 12
<212> PRT
<213> Homo sapiens
<400> 230
Gln Ser Tyr Asp Arg Gly Thr Gln Pro Ala Asx Ile
1 5 10
<210> 231
<211> 12
<212> PRT
<213> Homo sapiens
<400> 231
Gln Ser Tyr Asp Arg Gly Thr His Pro Thr Met Ile
1 5 10
<210> 232
<211> 12
<212> PRT
<213> Homo sapiens
<400> 232
Gln Ser Tyr Asp Arg Gly Arg Ile Pro Ala Asx Thr
1 5 10
<210> 233
<211> 12
<212> PRT
<213> Homo sapiens
<400> 233
Gln Ser Tyr Asp Arg Gly Thr His Pro Val Pro Ala
1 5 10
<210> 234
<211> 12
<212> PRT
<213> Homo sapiens
<400> 234
Gln Ser Tyr Asp Arg Gly Ser Asx Pro Ile Pro Ala
1 5 10
<210> 235
<211> 12
<212> PRT
<213> Homo sapiens
<400> 235
Gln Ser Tyr Asp Arg Gly Thr His Pro Val Pro Ala
1 5 10
<210> 236
<211> 12
<212> PRT
<213> Homo sapiens
<400> 236
Gln Ser Tyr Asp Arg Gly Thr His Pro Thr Met Tyr
1 5 10
<210> 237
<211> 12
<212> PRT
<213> Homo sapiens
<400> 237
Gln Ser Tyr Asp Arg Gly His His Tyr Thr Thr Phe
1 5 10
<210> 238
<211> 12
<212> PRT
<213> Homo sapiens
<400> 238
Gln Ser Tyr Asp Arg Gly Ser His Pro Ala Ala Glu
1 5 10
<210> 239
<211> 12
<212> PRT
<213> Homo sapiens
<400> 239
Gln Ser Tyr Asp Arg Gly Thr Ile Pro Ser Ile Glu
1 5 10
<210> 240
<211> 12
<212> PRT
<213> Homo sapiens
<400> 240
Gln Ser Tyr Asp Arg Gly Ser Ser Pro Ala Ile Met
1 5 10
<210> 241
<211> 12
<212> PRT
<213> Homo sapiens
<400> 241
Gln Ser Tyr Asp Arg Gly Ile Trp Pro Asn Leu Asn
1 5 10
<210> 242
<211> 12
<212> PRT
<213> Homo sapiens
<400> 242
Gln Ser Tyr Asp Arg Gly Thr His Pro Asn Leu Asn
1 5 10
<210> 243
<211> 12
<212> PRT
<213> Homo sapiens
<400> 243
Gln Ser Tyr Asp Arg Gly Thr His Pro Ser Ile Ser
1 5 10
<210> 244
<211> 12
<212> PRT
<213> Homo sapiens
<400> 244
Gln Ser Tyr Asp Arg Gly Ser Ala Pro Met Ile Asn
1 5 10
<210> 245
<211> 12
<212> PRT
<213> Homo sapiens
<400> 245
Gln Ser Tyr Asp Arg Gly His His Pro Ala Met Ser
1 5 10
<210> 246
<211> 12
<212> PRT
<213> Homo sapiens
<400> 246
Gln Ser Tyr Asp Arg Gly Thr His Pro Ser Ile Thr
1 5 10
<210> 247
<211> 12
<212> PRT
<213> Homo sapiens
<400> 247
Gln Ser Tyr Asp Arg Gly Thr Asp Pro Ala Ile Val
1 5 10
<210> 248
<211> 12
<212> PRT
<213> Homo sapiens
<400> 248
Gln Ser Tyr Asp Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 249
<211> 12
<212> PRT
<213> Homo sapiens
<400> 249
Gln Ser Tyr Asp Arg Gly Ser His Pro Ala Leu Thr
1 5 10
<210> 250
<211> 12
<212> PRT
<213> Homo sapiens
<400> 250
Gln Ser Tyr Asp Arg Gly Thr Thr Pro Ala Pro Glu
1 5 10
<210> 251
<211> 12
<212> PRT
<213> Homo sapiens
<400> 251
Gln Ser Tyr Asp Arg Gly Ser His Pro Thr Leu Ile
1 5 10
<210> 252
<211> 12
<212> PRT
<213> Homo sapiens
<400> 252
Gln Ser Tyr Asp Arg Gly Thr His Pro Ser Met Leu
1 5 10
<210> 253
<211> 12
<212> PRT
<213> Homo sapiens
<400> 253
Gln Ser Tyr Asp Arg Gly Thr Thr Pro Arg Pro Met
1 5 10
<210> 254
<211> 12
<212> PRT
<213> Homo sapiens
<400> 254
Gln Ser Tyr Asp Arg Gly Arg Leu Pro Ala Gln Thr
1 5 10
<210> 255
<211> 12
<212> PRT
<213> Homo sapiens
<400> 255
Gln Ser Tyr Asp Arg Gly Thr His Pro Leu Thr Ile
1 5 10
<210> 256
<211> 12
<212> PRT
<213> Homo sapiens
<400> 256
Gln Ser Tyr Asp Arg Gly Gln Thr Pro Ser Ile Thr
1 5 10
<210> 257
<211> 12
<212> PRT
<213> Homo sapiens
<400> 257
Gln Ser Tyr Asp Arg Gly Thr His Phe Gln Met Tyr
1 5 10
<210> 258
<211> 12
<212> PRT
<213> Homo sapiens
<400> 258
Gln Ser Tyr Asp Arg Gly Arg Asn Pro Ala Leu Thr
1 5 10
<210> 259
<211> 12
<212> PRT
<213> Homo sapiens
<400> 259
Gln Ser Tyr Asp Arg Gly Thr His Pro Leu Thr Met
1 5 10
<210> 260
<211> 12
<212> PRT
<213> Homo sapiens
<400> 260
Gln Ser Tyr Asp Arg Gly Thr His Pro Leu Thr Met
1 5 10
<210> 261
<211> 12
<212> PRT
<213> Homo sapiens
<400> 261
Gln Ser Tyr Asp Ser Gly Tyr Thr Gly Ser Arg Val
1 5 10
<210> 262
<211> 12
<212> PRT
<213> Homo sapiens
<400> 262
Gln Ser Tyr Asp Ser Gly Phe Thr Gly Ser Arg Val
1 5 10
<210> 263
<211> 12
<212> PRT
<213> Homo sapiens
<400> 263
Gln Ser Tyr Asp Ser Arg Phe Thr Gly Ser Arg Val
1 5 10
<210> 264
<211> 12
<212> PRT
<213> Homo sapiens
<400> 264
Gln Ser Tyr Pro Asp Gly Thr Pro Ala Ser Arg Val
1 5 10
<210> 265
<211> 12
<212> PRT
<213> Homo sapiens
<400> 265
Gln Ser Tyr Ser Thr His Met Pro Ile Ser Arg Val
1 5 10
<210> 266
<211> 12
<212> PRT
<213> Homo sapiens
<400> 266
Gln Ser Tyr Asp Ser Gly Ser Thr Gly Ser Arg Val
1 5 10
<210> 267
<211> 12
<212> PRT
<213> Homo sapiens
<400> 267
Gln Ser Tyr Pro Asn Ser Tyr Pro Ile Ser Arg Val
1 5 10
<210> 268
<211> 10
<212> PRT
<213> Homo sapiens
<400> 268
Gln Ser Tyr Ile Arg Ala Pro Gln Gln Val
1 5 10
<210> 269
<211> 12
<212> PRT
<213> Homo sapiens
<400> 269
Gln Ser Tyr Leu Lys Ser Arg Ala Phe Ser Arg Val
1 5 10
<210> 270
<211> 12
<212> PRT
<213> Homo sapiens
<400> 270
Gln Ser Tyr Asp Ser Arg Phe Thr Gly Ser Arg Val
1 5 10
<210> 271
<211> 12
<212> PRT
<213> Homo sapiens
<400> 271
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Met Val
1 5 10
<210> 272
<211> 12
<212> PRT
<213> Homo sapiens
<400> 272
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Met Val
1 5 10
<210> 273
<211> 12
<212> PRT
<213> Homo sapiens
<400> 273
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Phe Asp Gly
1 5 10
<210> 274
<211> 12
<212> PRT
<213> Homo sapiens
<400> 274
Gln Ser Tyr Asp Arg Gly Thr Ala Pro Ala Leu Ser
1 5 10
<210> 275
<211> 12
<212> PRT
<213> Homo sapiens
<400> 275
Gln Ser Tyr Asp Arg Gly Ser Tyr Pro Ala Leu Arg
1 5 10
<210> 276
<211> 12
<212> PRT
<213> Homo sapiens
<400> 276
Gln Ser Tyr Asp Arg Gly Asn Trp Pro Asn Ser Asn
1 5 10
<210> 277
<211> 12
<212> PRT
<213> Homo sapiens
<400> 277
Gln Ser Tyr Asp Arg Gly Thr Ala Pro Ser Leu Leu
1 5 10
<210> 278
<211> 12
<212> PRT
<213> Homo sapiens
<400> 278
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Met Val
1 5 10
<210> 279
<211> 12
<212> PRT
<213> Homo sapiens
<400> 279
Gln Ser Tyr Asp Arg Gly Thr Thr Pro Arg Ile Arg
1 5 10
<210> 280
<211> 12
<212> PRT
<213> Homo sapiens
<400> 280
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Met Val
1 5 10
<210> 281
<211> 12
<212> PRT
<213> Homo sapiens
<400> 281
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Met Val
1 5 10
<210> 282
<211> 12
<212> PRT
<213> Homo sapiens
<400> 282
Gln Ser Tyr Asp Arg Gly Met Ile Pro Ala Leu Thr
1 5 10
<210> 283
<211> 12
<212> PRT
<213> Homo sapiens
<400> 283
Gln Ser Tyr Asp Arg Asn Thr His Pro Ala Leu Leu
1 5 10
<210> 284
<211> 12
<212> PRT
<213> Homo sapiens
<400> 284
Gln Ser Tyr Asp Arg Phe Thr His Pro Ala Leu Leu
1 5 10
<210> 285
<211> 12
<212> PRT
<213> Homo sapiens
<400> 285
Gln Ser Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu
1 5 10
<210> 286
<211> 12
<212> PRT
<213> Homo sapiens
<400> 286
Gln Ser Tyr Asp Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 287
<211> 12
<212> PRT
<213> Homo sapiens
<400> 287
Gln Ser Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu
1 5 10
<210> 288
<211> 9
<212> PRT
<213> Homo sapiens
<400> 288
Phe Thr Phe Glu Ser Tyr Gly Met His
1 5
<210> 289
<211> 9
<212> PRT
<213> Homo sapiens
<400> 289
Phe Thr Phe Ser Ser Tyr Gly Met His
1 5
<210> 290
<211> 9
<212> PRT
<213> Homo sapiens
<400> 290
Phe Thr Phe Tyr Ser Tyr Gly Met His
1 5
<210> 291
<211> 9
<212> PRT
<213> Homo sapiens
<400> 291
Phe Thr Phe His Ser Tyr Gly Met His
1 5
<210> 292
<211> 9
<212> PRT
<213> Homo sapiens
<400> 292
Phe Thr Phe Lys Ser Tyr Gly Met His
1 5
<210> 293
<211> 9
<212> PRT
<213> Homo sapiens
<400> 293
Phe Thr Phe Arg Ser Tyr Gly Met His
1 5
<210> 294
<211> 9
<212> PRT
<213> Homo sapiens
<400> 294
Phe Thr Phe Asn Ser Tyr Gly Met His
1 5
<210> 295
<211> 9
<212> PRT
<213> Homo sapiens
<400> 295
Phe Thr Phe Thr Ser Tyr Gly Met His
1 5
<210> 296
<211> 9
<212> PRT
<213> Homo sapiens
<400> 296
Phe Thr Phe Gly Ser Tyr Gly Met His
1 5
<210> 297
<211> 9
<212> PRT
<213> Homo sapiens
<400> 297
Phe Thr Phe Val Ser Tyr Gly Met His
1 5
<210> 298
<211> 9
<212> PRT
<213> Homo sapiens
<400> 298
Phe Thr Phe Ile Ser Tyr Gly Met His
1 5
<210> 299
<211> 9
<212> PRT
<213> Homo sapiens
<400> 299
Phe Thr Phe Trp Ser Tyr Gly Met His
1 5
<210> 300
<211> 9
<212> PRT
<213> Homo sapiens
<400> 300
Phe Thr Phe Ser Glu Tyr Gly Met His
1 5
<210> 301
<211> 9
<212> PRT
<213> Homo sapiens
<400> 301
Phe Thr Phe Ser Cys Tyr Gly Met His
1 5
<210> 302
<211> 9
<212> PRT
<213> Homo sapiens
<400> 302
Phe Thr Phe Ser Ser Tyr Gly Met His
1 5
<210> 303
<211> 9
<212> PRT
<213> Homo sapiens
<400> 303
Phe Thr Phe Ser Tyr Tyr Gly Met His
1 5
<210> 304
<211> 9
<212> PRT
<213> Homo sapiens
<400> 304
Phe Thr Phe Ser His Tyr Gly Met His
1 5
<210> 305
<211> 9
<212> PRT
<213> Homo sapiens
<400> 305
Phe Thr Phe Ser Arg Tyr Gly Met His
1 5
<210> 306
<211> 9
<212> PRT
<213> Homo sapiens
<400> 306
Phe Thr Phe Ser Asn Tyr Gly Met His
1 5
<210> 307
<211> 9
<212> PRT
<213> Homo sapiens
<400> 307
Phe Thr Phe Ser Gln Tyr Gly Met His
1 5
<210> 308
<211> 9
<212> PRT
<213> Homo sapiens
<400> 308
Phe Thr Phe Ser Thr Tyr Gly Met His
1 5
<210> 309
<211> 9
<212> PRT
<213> Homo sapiens
<400> 309
Phe Thr Phe Ser Ala Tyr Gly Met His
1 5
<210> 310
<211> 9
<212> PRT
<213> Homo sapiens
<400> 310
Phe Thr Phe Ser Ile Tyr Gly Met His
1 5
<210> 311
<211> 9
<212> PRT
<213> Homo sapiens
<400> 311
Phe Thr Phe Ser Ser Glu Gly Met His
1 5
<210> 312
<211> 9
<212> PRT
<213> Homo sapiens
<400> 312
Phe Thr Phe Ser Ser Cys Gly Met His
1 5
<210> 313
<211> 9
<212> PRT
<213> Homo sapiens
<400> 313
Phe Thr Phe Ser Ser Ser Gly Met His
1 5
<210> 314
<211> 9
<212> PRT
<213> Homo sapiens
<400> 314
Phe Thr Phe Ser Ser Tyr Gly Met His
1 5
<210> 315
<211> 9
<212> PRT
<213> Homo sapiens
<400> 315
Phe Thr Phe Ser Ser His Gly Met His
1 5
<210> 316
<211> 9
<212> PRT
<213> Homo sapiens
<400> 316
Phe Thr Phe Ser Ser Arg Gly Met His
1 5
<210> 317
<211> 9
<212> PRT
<213> Homo sapiens
<400> 317
Phe Thr Phe Ser Ser Asn Gly Met His
1 5
<210> 318
<211> 9
<212> PRT
<213> Homo sapiens
<400> 318
Phe Thr Phe Ser Ser Thr Gly Met His
1 5
<210> 319
<211> 9
<212> PRT
<213> Homo sapiens
<400> 319
Phe Thr Phe Ser Ser Ala Gly Met His
1 5
<210> 320
<211> 9
<212> PRT
<213> Homo sapiens
<400> 320
Phe Thr Phe Ser Ser Val Gly Met His
1 5
<210> 321
<211> 9
<212> PRT
<213> Homo sapiens
<400> 321
Phe Thr Phe Ser Ser Leu Gly Met His
1 5
<210> 322
<211> 9
<212> PRT
<213> Homo sapiens
<400> 322
Phe Thr Phe Ser Ser Ile Gly Met His
1 5
<210> 323
<211> 9
<212> PRT
<213> Homo sapiens
<400> 323
Phe Thr Phe Ser Ser Tyr Asp Met His
1 5
<210> 324
<211> 9
<212> PRT
<213> Homo sapiens
<400> 324
Phe Thr Phe Ser Ser Tyr Glu Met His
1 5
<210> 325
<211> 9
<212> PRT
<213> Homo sapiens
<400> 325
Phe Thr Phe Ser Ser Tyr Cys Met His
1 5
<210> 326
<211> 9
<212> PRT
<213> Homo sapiens
<400> 326
Phe Thr Phe Ser Ser Tyr Ser Met His
1 5
<210> 327
<211> 9
<212> PRT
<213> Homo sapiens
<400> 327
Phe Thr Phe Ser Ser Tyr Tyr Met His
1 5
<210> 328
<211> 9
<212> PRT
<213> Homo sapiens
<400> 328
Phe Thr Phe Ser Ser Tyr Asn Met His
1 5
<210> 329
<211> 9
<212> PRT
<213> Homo sapiens
<400> 329
Phe Thr Phe Ser Ser Tyr Gly Met His
1 5
<210> 330
<211> 9
<212> PRT
<213> Homo sapiens
<400> 330
Phe Thr Phe Ser Ser Tyr Ala Met His
1 5
<210> 331
<211> 9
<212> PRT
<213> Homo sapiens
<400> 331
Phe Thr Phe Ser Ser Tyr Val Met His
1 5
<210> 332
<211> 9
<212> PRT
<213> Homo sapiens
<400> 332
Phe Thr Phe Ser Ser Tyr Met Met His
1 5
<210> 333
<211> 9
<212> PRT
<213> Homo sapiens
<400> 333
Phe Thr Phe Ser Ser Tyr Ile Met His
1 5
<210> 334
<211> 9
<212> PRT
<213> Homo sapiens
<400> 334
Phe Thr Phe Ser Ser Tyr Pro Met His
1 5
<210> 335
<211> 17
<212> PRT
<213> Homo sapiens
<400> 335
Glu Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 336
<211> 17
<212> PRT
<213> Homo sapiens
<400> 336
Cys Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 337
<211> 17
<212> PRT
<213> Homo sapiens
<400> 337
Tyr Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 338
<211> 17
<212> PRT
<213> Homo sapiens
<400> 338
His Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 339
<211> 17
<212> PRT
<213> Homo sapiens
<400> 339
Lys Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 340
<211> 17
<212> PRT
<213> Homo sapiens
<400> 340
Asn Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 341
<211> 17
<212> PRT
<213> Homo sapiens
<400> 341
Gln Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 342
<211> 17
<212> PRT
<213> Homo sapiens
<400> 342
Thr Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 343
<211> 17
<212> PRT
<213> Homo sapiens
<400> 343
Leu Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 344
<211> 17
<212> PRT
<213> Homo sapiens
<400> 344
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 345
<211> 17
<212> PRT
<213> Homo sapiens
<400> 345
Phe Ile Glu Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 346
<211> 17
<212> PRT
<213> Homo sapiens
<400> 346
Phe Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 347
<211> 17
<212> PRT
<213> Homo sapiens
<400> 347
Phe Ile Tyr Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 348
<211> 17
<212> PRT
<213> Homo sapiens
<400> 348
Phe Ile His Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 349
<211> 17
<212> PRT
<213> Homo sapiens
<400> 349
Phe Ile Lys Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 350
<211> 17
<212> PRT
<213> Homo sapiens
<400> 350
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 351
<211> 17
<212> PRT
<213> Homo sapiens
<400> 351
Phe Ile Gln Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 352
<211> 17
<212> PRT
<213> Homo sapiens
<400> 352
Phe Ile Thr Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 353
<211> 17
<212> PRT
<213> Homo sapiens
<400> 353
Phe Ile Gly Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 354
<211> 17
<212> PRT
<213> Homo sapiens
<400> 354
Phe Ile Ala Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 355
<211> 17
<212> PRT
<213> Homo sapiens
<400> 355
Phe Ile Val Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 356
<211> 17
<212> PRT
<213> Homo sapiens
<400> 356
Phe Ile Leu Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 357
<211> 17
<212> PRT
<213> Homo sapiens
<400> 357
Phe Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 358
<211> 17
<212> PRT
<213> Homo sapiens
<400> 358
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 359
<211> 17
<212> PRT
<213> Homo sapiens
<400> 359
Phe Ile Arg Tyr Glu Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 360
<211> 17
<212> PRT
<213> Homo sapiens
<400> 360
Phe Ile Arg Tyr Ser Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 361
<211> 17
<212> PRT
<213> Homo sapiens
<400> 361
Phe Ile Arg Tyr Tyr Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 362
<211> 17
<212> PRT
<213> Homo sapiens
<400> 362
Phe Ile Arg Tyr Lys Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 363
<211> 17
<212> PRT
<213> Homo sapiens
<400> 363
Phe Ile Arg Tyr Arg Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 364
<211> 17
<212> PRT
<213> Homo sapiens
<400> 364
Phe Ile Arg Tyr Asn Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 365
<211> 17
<212> PRT
<213> Homo sapiens
<400> 365
Phe Ile Arg Tyr Gln Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 366
<211> 17
<212> PRT
<213> Homo sapiens
<400> 366
Phe Ile Arg Tyr Thr Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 367
<211> 17
<212> PRT
<213> Homo sapiens
<400> 367
Phe Ile Arg Tyr Ala Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 368
<211> 17
<212> PRT
<213> Homo sapiens
<400> 368
Phe Ile Arg Tyr Val Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 369
<211> 17
<212> PRT
<213> Homo sapiens
<400> 369
Phe Ile Arg Tyr Leu Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 370
<211> 17
<212> PRT
<213> Homo sapiens
<400> 370
Phe Ile Arg Tyr Ile Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 371
<211> 17
<212> PRT
<213> Homo sapiens
<400> 371
Phe Ile Arg Tyr Phe Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 372
<211> 17
<212> PRT
<213> Homo sapiens
<400> 372
Phe Ile Arg Tyr Asp Asp Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 373
<211> 17
<212> PRT
<213> Homo sapiens
<400> 373
Phe Ile Arg Tyr Asp Glu Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 374
<211> 17
<212> PRT
<213> Homo sapiens
<400> 374
Phe Ile Arg Tyr Asp Ser Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 375
<211> 17
<212> PRT
<213> Homo sapiens
<400> 375
Phe Ile Arg Tyr Asp Tyr Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 376
<211> 17
<212> PRT
<213> Homo sapiens
<400> 376
Phe Ile Arg Tyr Asp Lys Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 377
<211> 17
<212> PRT
<213> Homo sapiens
<400> 377
Phe Ile Arg Tyr Asp Arg Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 378
<211> 17
<212> PRT
<213> Homo sapiens
<400> 378
Phe Ile Arg Tyr Asp Asn Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 379
<211> 17
<212> PRT
<213> Homo sapiens
<400> 379
Phe Ile Arg Tyr Asp Gln Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 380
<211> 17
<212> PRT
<213> Homo sapiens
<400> 380
Phe Ile Arg Tyr Asp Thr Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 381
<211> 17
<212> PRT
<213> Homo sapiens
<400> 381
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 382
<211> 17
<212> PRT
<213> Homo sapiens
<400> 382
Phe Ile Arg Tyr Asp Val Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 383
<211> 17
<212> PRT
<213> Homo sapiens
<400> 383
Phe Ile Arg Tyr Asp Phe Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 384
<211> 17
<212> PRT
<213> Homo sapiens
<400> 384
Phe Ile Arg Tyr Asp Gly Ser Ser Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 385
<211> 17
<212> PRT
<213> Homo sapiens
<400> 385
Phe Ile Arg Tyr Asp Gly Ser Tyr Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 386
<211> 17
<212> PRT
<213> Homo sapiens
<400> 386
Phe Ile Arg Tyr Asp Gly Ser His Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 387
<211> 17
<212> PRT
<213> Homo sapiens
<400> 387
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 388
<211> 17
<212> PRT
<213> Homo sapiens
<400> 388
Phe Ile Arg Tyr Asp Gly Ser Thr Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 389
<211> 17
<212> PRT
<213> Homo sapiens
<400> 389
Phe Ile Arg Tyr Asp Gly Ser Gly Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 390
<211> 17
<212> PRT
<213> Homo sapiens
<400> 390
Phe Ile Arg Tyr Asp Gly Ser Met Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 391
<211> 17
<212> PRT
<213> Homo sapiens
<400> 391
Phe Ile Arg Tyr Asp Gly Ser Leu Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 392
<211> 17
<212> PRT
<213> Homo sapiens
<400> 392
Phe Ile Arg Tyr Asp Gly Ser Ile Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 393
<211> 17
<212> PRT
<213> Homo sapiens
<400> 393
Phe Ile Arg Tyr Asp Gly Ser Pro Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 394
<211> 17
<212> PRT
<213> Homo sapiens
<400> 394
Phe Ile Arg Tyr Asp Gly Ser Phe Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 395
<211> 17
<212> PRT
<213> Homo sapiens
<400> 395
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Glu Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 396
<211> 17
<212> PRT
<213> Homo sapiens
<400> 396
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Ser Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 397
<211> 17
<212> PRT
<213> Homo sapiens
<400> 397
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 398
<211> 17
<212> PRT
<213> Homo sapiens
<400> 398
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 399
<211> 17
<212> PRT
<213> Homo sapiens
<400> 399
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Val Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 400
<211> 17
<212> PRT
<213> Homo sapiens
<400> 400
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Leu Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 401
<211> 17
<212> PRT
<213> Homo sapiens
<400> 401
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Ile Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 402
<211> 17
<212> PRT
<213> Homo sapiens
<400> 402
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Pro Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 403
<211> 17
<212> PRT
<213> Homo sapiens
<400> 403
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Phe Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 404
<211> 6
<212> PRT
<213> Homo sapiens
<400> 404
Glu Gly Ser His Asp Asn
1 5
<210> 405
<211> 6
<212> PRT
<213> Homo sapiens
<400> 405
Ser Gly Ser His Asp Asn
1 5
<210> 406
<211> 6
<212> PRT
<213> Homo sapiens
<400> 406
His Gly Ser His Asp Asn
1 5
<210> 407
<211> 6
<212> PRT
<213> Homo sapiens
<400> 407
Lys Gly Ser His Asp Asn
1 5
<210> 408
<211> 6
<212> PRT
<213> Homo sapiens
<400> 408
Gln Gly Ser His Asp Asn
1 5
<210> 409
<211> 6
<212> PRT
<213> Homo sapiens
<400> 409
Thr Gly Ser His Asp Asn
1 5
<210> 410
<211> 6
<212> PRT
<213> Homo sapiens
<400> 410
Ala Gly Ser His Asp Asn
1 5
<210> 411
<211> 6
<212> PRT
<213> Homo sapiens
<400> 411
Leu Gly Ser His Asp Asn
1 5
<210> 412
<211> 6
<212> PRT
<213> Homo sapiens
<400> 412
Pro Gly Ser His Asp Asn
1 5
<210> 413
<211> 6
<212> PRT
<213> Homo sapiens
<400> 413
Phe Gly Ser His Asp Asn
1 5
<210> 414
<211> 6
<212> PRT
<213> Homo sapiens
<400> 414
His Asp Ser His Asp Asn
1 5
<210> 415
<211> 6
<212> PRT
<213> Homo sapiens
<400> 415
His Cys Ser His Asp Asn
1 5
<210> 416
<211> 6
<212> PRT
<213> Homo sapiens
<400> 416
His His Ser His Asp Asn
1 5
<210> 417
<211> 6
<212> PRT
<213> Homo sapiens
<400> 417
His Arg Ser His Asp Asn
1 5
<210> 418
<211> 6
<212> PRT
<213> Homo sapiens
<400> 418
His Thr Ser His Asp Asn
1 5
<210> 419
<211> 6
<212> PRT
<213> Homo sapiens
<400> 419
His Gly Ser His Asp Asn
1 5
<210> 420
<211> 6
<212> PRT
<213> Homo sapiens
<400> 420
His Val Ser His Asp Asn
1 5
<210> 421
<211> 6
<212> PRT
<213> Homo sapiens
<400> 421
His Met Ser His Asp Asn
1 5
<210> 422
<211> 6
<212> PRT
<213> Homo sapiens
<400> 422
His Leu Ser His Asp Asn
1 5
<210> 423
<211> 6
<212> PRT
<213> Homo sapiens
<400> 423
His Ile Ser His Asp Asn
1 5
<210> 424
<211> 6
<212> PRT
<213> Homo sapiens
<400> 424
His Pro Ser His Asp Asn
1 5
<210> 425
<211> 6
<212> PRT
<213> Homo sapiens
<400> 425
His Trp Ser His Asp Asn
1 5
<210> 426
<211> 6
<212> PRT
<213> Homo sapiens
<400> 426
His Gly Asp His Asp Asn
1 5
<210> 427
<211> 6
<212> PRT
<213> Homo sapiens
<400> 427
His Gly Ser His Asp Asn
1 5
<210> 428
<211> 6
<212> PRT
<213> Homo sapiens
<400> 428
His Gly Tyr His Asp Asn
1 5
<210> 429
<211> 6
<212> PRT
<213> Homo sapiens
<400> 429
His Gly His His Asp Asn
1 5
<210> 430
<211> 6
<212> PRT
<213> Homo sapiens
<400> 430
His Gly Arg His Asp Asn
1 5
<210> 431
<211> 6
<212> PRT
<213> Homo sapiens
<400> 431
His Gly Asn His Asp Asn
1 5
<210> 432
<211> 6
<212> PRT
<213> Homo sapiens
<400> 432
His Gly Thr His Asp Asn
1 5
<210> 433
<211> 6
<212> PRT
<213> Homo sapiens
<400> 433
His Gly Gly His Asp Asn
1 5
<210> 434
<211> 6
<212> PRT
<213> Homo sapiens
<400> 434
His Gly Ala His Asp Asn
1 5
<210> 435
<211> 6
<212> PRT
<213> Homo sapiens
<400> 435
His Gly Ile His Asp Asn
1 5
<210> 436
<211> 6
<212> PRT
<213> Homo sapiens
<400> 436
His Gly Pro His Asp Asn
1 5
<210> 437
<211> 6
<212> PRT
<213> Homo sapiens
<400> 437
His Gly Trp His Asp Asn
1 5
<210> 438
<211> 6
<212> PRT
<213> Homo sapiens
<400> 438
His Gly Phe His Asp Asn
1 5
<210> 439
<211> 6
<212> PRT
<213> Homo sapiens
<400> 439
His Gly Ser His Asp Asn
1 5
<210> 440
<211> 6
<212> PRT
<213> Homo sapiens
<400> 440
His Gly Ser Arg Asp Asn
1 5
<210> 441
<211> 6
<212> PRT
<213> Homo sapiens
<400> 441
His Gly Ser Thr Asp Asn
1 5
<210> 442
<211> 6
<212> PRT
<213> Homo sapiens
<400> 442
His Gly Ser Ala Asp Asn
1 5
<210> 443
<211> 6
<212> PRT
<213> Homo sapiens
<400> 443
His Gly Ser Val Asp Asn
1 5
<210> 444
<211> 6
<212> PRT
<213> Homo sapiens
<400> 444
His Gly Ser Leu Asp Asn
1 5
<210> 445
<211> 6
<212> PRT
<213> Homo sapiens
<400> 445
His Gly Ser Ile Asp Asn
1 5
<210> 446
<211> 6
<212> PRT
<213> Homo sapiens
<400> 446
His Gly Ser Phe Asp Asn
1 5
<210> 447
<211> 6
<212> PRT
<213> Homo sapiens
<400> 447
His Gly Ser His Asp Asn
1 5
<210> 448
<211> 6
<212> PRT
<213> Homo sapiens
<400> 448
His Gly Ser His Ser Asn
1 5
<210> 449
<211> 6
<212> PRT
<213> Homo sapiens
<400> 449
His Gly Ser His Tyr Asn
1 5
<210> 450
<211> 6
<212> PRT
<213> Homo sapiens
<400> 450
His Gly Ser His His Asn
1 5
<210> 451
<211> 6
<212> PRT
<213> Homo sapiens
<400> 451
His Gly Ser His Arg Asn
1 5
<210> 452
<211> 6
<212> PRT
<213> Homo sapiens
<400> 452
His Gly Ser His Asn Asn
1 5
<210> 453
<211> 6
<212> PRT
<213> Homo sapiens
<400> 453
His Gly Ser His Gly Asn
1 5
<210> 454
<211> 6
<212> PRT
<213> Homo sapiens
<400> 454
His Gly Ser His Ala Asn
1 5
<210> 455
<211> 6
<212> PRT
<213> Homo sapiens
<400> 455
His Gly Ser His Val Asn
1 5
<210> 456
<211> 6
<212> PRT
<213> Homo sapiens
<400> 456
His Gly Ser His Ile Asn
1 5
<210> 457
<211> 6
<212> PRT
<213> Homo sapiens
<400> 457
His Gly Ser His Asp Ser
1 5
<210> 458
<211> 6
<212> PRT
<213> Homo sapiens
<400> 458
His Gly Ser His Asp His
1 5
<210> 459
<211> 6
<212> PRT
<213> Homo sapiens
<400> 459
His Gly Ser His Asp Lys
1 5
<210> 460
<211> 6
<212> PRT
<213> Homo sapiens
<400> 460
His Gly Ser His Asp Arg
1 5
<210> 461
<211> 6
<212> PRT
<213> Homo sapiens
<400> 461
His Gly Ser His Asp Asn
1 5
<210> 462
<211> 6
<212> PRT
<213> Homo sapiens
<400> 462
His Gly Ser His Asp Thr
1 5
<210> 463
<211> 6
<212> PRT
<213> Homo sapiens
<400> 463
His Gly Ser His Asp Gly
1 5
<210> 464
<211> 6
<212> PRT
<213> Homo sapiens
<400> 464
His Gly Ser His Asp Ala
1 5
<210> 465
<211> 6
<212> PRT
<213> Homo sapiens
<400> 465
His Gly Ser His Asp Leu
1 5
<210> 466
<211> 6
<212> PRT
<213> Homo sapiens
<400> 466
His Gly Ser His Asp Ile
1 5
<210> 467
<211> 6
<212> PRT
<213> Homo sapiens
<400> 467
His Gly Ser His Asp Pro
1 5
<210> 468
<211> 6
<212> PRT
<213> Homo sapiens
<400> 468
His Gly Ser His Asp Trp
1 5
<210> 469
<211> 6
<212> PRT
<213> Homo sapiens
<400> 469
His Gly Ser His Asp Phe
1 5
<210> 470
<211> 13
<212> PRT
<213> Homo sapiens
<400> 470
Ser Gly Gly Arg Ser Asn Ile Gly Asp Asn Thr Val Lys
1 5 10
<210> 471
<211> 13
<212> PRT
<213> Homo sapiens
<400> 471
Ser Gly Gly Arg Ser Asn Ile Gly Cys Asn Thr Val Lys
1 5 10
<210> 472
<211> 13
<212> PRT
<213> Homo sapiens
<400> 472
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Thr Val Lys
1 5 10
<210> 473
<211> 13
<212> PRT
<213> Homo sapiens
<400> 473
Ser Gly Gly Arg Ser Asn Ile Gly Tyr Asn Thr Val Lys
1 5 10
<210> 474
<211> 13
<212> PRT
<213> Homo sapiens
<400> 474
Ser Gly Gly Arg Ser Asn Ile Gly Lys Asn Thr Val Lys
1 5 10
<210> 475
<211> 13
<212> PRT
<213> Homo sapiens
<400> 475
Ser Gly Gly Arg Ser Asn Ile Gly Arg Asn Thr Val Lys
1 5 10
<210> 476
<211> 13
<212> PRT
<213> Homo sapiens
<400> 476
Ser Gly Gly Arg Ser Asn Ile Gly Asn Asn Thr Val Lys
1 5 10
<210> 477
<211> 13
<212> PRT
<213> Homo sapiens
<400> 477
Ser Gly Gly Arg Ser Asn Ile Gly Thr Asn Thr Val Lys
1 5 10
<210> 478
<211> 13
<212> PRT
<213> Homo sapiens
<400> 478
Ser Gly Gly Arg Ser Asn Ile Gly Pro Asn Thr Val Lys
1 5 10
<210> 479
<211> 13
<212> PRT
<213> Homo sapiens
<400> 479
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asp Thr Val Lys
1 5 10
<210> 480
<211> 13
<212> PRT
<213> Homo sapiens
<400> 480
Ser Gly Gly Arg Ser Asn Ile Gly Ser Glu Thr Val Lys
1 5 10
<210> 481
<211> 13
<212> PRT
<213> Homo sapiens
<400> 481
Ser Gly Gly Arg Ser Asn Ile Gly Ser Ser Thr Val Lys
1 5 10
<210> 482
<211> 13
<212> PRT
<213> Homo sapiens
<400> 482
Ser Gly Gly Arg Ser Asn Ile Gly Ser Tyr Thr Val Lys
1 5 10
<210> 483
<211> 13
<212> PRT
<213> Homo sapiens
<400> 483
Ser Gly Gly Arg Ser Asn Ile Gly Ser His Thr Val Lys
1 5 10
<210> 484
<211> 13
<212> PRT
<213> Homo sapiens
<400> 484
Ser Gly Gly Arg Ser Asn Ile Gly Ser Lys Thr Val Lys
1 5 10
<210> 485
<211> 13
<212> PRT
<213> Homo sapiens
<400> 485
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Thr Val Lys
1 5 10
<210> 486
<211> 13
<212> PRT
<213> Homo sapiens
<400> 486
Ser Gly Gly Arg Ser Asn Ile Gly Ser Gln Thr Val Lys
1 5 10
<210> 487
<211> 13
<212> PRT
<213> Homo sapiens
<400> 487
Ser Gly Gly Arg Ser Asn Ile Gly Ser Thr Thr Val Lys
1 5 10
<210> 488
<211> 13
<212> PRT
<213> Homo sapiens
<400> 488
Ser Gly Gly Arg Ser Asn Ile Gly Ser Gly Thr Val Lys
1 5 10
<210> 489
<211> 13
<212> PRT
<213> Homo sapiens
<400> 489
Ser Gly Gly Arg Ser Asn Ile Gly Ser Met Thr Val Lys
1 5 10
<210> 490
<211> 13
<212> PRT
<213> Homo sapiens
<400> 490
Ser Gly Gly Arg Ser Asn Ile Gly Ser Ile Thr Val Lys
1 5 10
<210> 491
<211> 13
<212> PRT
<213> Homo sapiens
<400> 491
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Asp Val Lys
1 5 10
<210> 492
<211> 13
<212> PRT
<213> Homo sapiens
<400> 492
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Cys Val Lys
1 5 10
<210> 493
<211> 13
<212> PRT
<213> Homo sapiens
<400> 493
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Ser Val Lys
1 5 10
<210> 494
<211> 13
<212> PRT
<213> Homo sapiens
<400> 494
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Tyr Val Lys
1 5 10
<210> 495
<211> 13
<212> PRT
<213> Homo sapiens
<400> 495
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn His Val Lys
1 5 10
<210> 496
<211> 13
<212> PRT
<213> Homo sapiens
<400> 496
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Lys Val Lys
1 5 10
<210> 497
<211> 13
<212> PRT
<213> Homo sapiens
<400> 497
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Arg Val Lys
1 5 10
<210> 498
<211> 13
<212> PRT
<213> Homo sapiens
<400> 498
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Asn Val Lys
1 5 10
<210> 499
<211> 13
<212> PRT
<213> Homo sapiens
<400> 499
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Gln Val Lys
1 5 10
<210> 500
<211> 13
<212> PRT
<213> Homo sapiens
<400> 500
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Thr Val Lys
1 5 10
<210> 501
<211> 13
<212> PRT
<213> Homo sapiens
<400> 501
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Ala Val Lys
1 5 10
<210> 502
<211> 13
<212> PRT
<213> Homo sapiens
<400> 502
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Val Val Lys
1 5 10
<210> 503
<211> 13
<212> PRT
<213> Homo sapiens
<400> 503
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Leu Val Lys
1 5 10
<210> 504
<211> 13
<212> PRT
<213> Homo sapiens
<400> 504
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Ile Val Lys
1 5 10
<210> 505
<211> 13
<212> PRT
<213> Homo sapiens
<400> 505
Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn Pro Val Lys
1 5 10
<210> 506
<211> 7
<212> PRT
<213> Homo sapiens
<400> 506
Asp Asn Asp Gln Arg Pro Ser
1 5
<210> 507
<211> 7
<212> PRT
<213> Homo sapiens
<400> 507
Glu Asn Asp Gln Arg Pro Ser
1 5
<210> 508
<211> 7
<212> PRT
<213> Homo sapiens
<400> 508
Cys Asn Asp Gln Arg Pro Ser
1 5
<210> 509
<211> 7
<212> PRT
<213> Homo sapiens
<400> 509
Ser Asn Asp Gln Arg Pro Ser
1 5
<210> 510
<211> 7
<212> PRT
<213> Homo sapiens
<400> 510
Tyr Asn Asp Gln Arg Pro Ser
1 5
<210> 511
<211> 7
<212> PRT
<213> Homo sapiens
<400> 511
His Asn Asp Gln Arg Pro Ser
1 5
<210> 512
<211> 7
<212> PRT
<213> Homo sapiens
<400> 512
Lys Asn Asp Gln Arg Pro Ser
1 5
<210> 513
<211> 7
<212> PRT
<213> Homo sapiens
<400> 513
Arg Asn Asp Gln Arg Pro Ser
1 5
<210> 514
<211> 7
<212> PRT
<213> Homo sapiens
<400> 514
Asn Asn Asp Gln Arg Pro Ser
1 5
<210> 515
<211> 7
<212> PRT
<213> Homo sapiens
<400> 515
Gln Asn Asp Gln Arg Pro Ser
1 5
<210> 516
<211> 7
<212> PRT
<213> Homo sapiens
<400> 516
Thr Asn Asp Gln Arg Pro Ser
1 5
<210> 517
<211> 7
<212> PRT
<213> Homo sapiens
<400> 517
Gly Asn Asp Gln Arg Pro Ser
1 5
<210> 518
<211> 7
<212> PRT
<213> Homo sapiens
<400> 518
Ala Asn Asp Gln Arg Pro Ser
1 5
<210> 519
<211> 7
<212> PRT
<213> Homo sapiens
<400> 519
Val Asn Asp Gln Arg Pro Ser
1 5
<210> 520
<211> 7
<212> PRT
<213> Homo sapiens
<400> 520
Met Asn Asp Gln Arg Pro Ser
1 5
<210> 521
<211> 7
<212> PRT
<213> Homo sapiens
<400> 521
Leu Asn Asp Gln Arg Pro Ser
1 5
<210> 522
<211> 7
<212> PRT
<213> Homo sapiens
<400> 522
Ile Asn Asp Gln Arg Pro Ser
1 5
<210> 523
<211> 7
<212> PRT
<213> Homo sapiens
<400> 523
Pro Asn Asp Gln Arg Pro Ser
1 5
<210> 524
<211> 7
<212> PRT
<213> Homo sapiens
<400> 524
Trp Asn Asp Gln Arg Pro Ser
1 5
<210> 525
<211> 7
<212> PRT
<213> Homo sapiens
<400> 525
Phe Asn Asp Gln Arg Pro Ser
1 5
<210> 526
<211> 7
<212> PRT
<213> Homo sapiens
<400> 526
Gly Asn Asp Ser Arg Pro Ser
1 5
<210> 527
<211> 7
<212> PRT
<213> Homo sapiens
<400> 527
Gly Asn Asp Tyr Arg Pro Ser
1 5
<210> 528
<211> 7
<212> PRT
<213> Homo sapiens
<400> 528
Gly Asn Asp Arg Arg Pro Ser
1 5
<210> 529
<211> 7
<212> PRT
<213> Homo sapiens
<400> 529
Gly Asn Asp Gln Arg Pro Ser
1 5
<210> 530
<211> 7
<212> PRT
<213> Homo sapiens
<400> 530
Gly Asn Asp Thr Arg Pro Ser
1 5
<210> 531
<211> 7
<212> PRT
<213> Homo sapiens
<400> 531
Gly Asn Asp Ala Arg Pro Ser
1 5
<210> 532
<211> 7
<212> PRT
<213> Homo sapiens
<400> 532
Gly Asn Asp Ile Arg Pro Ser
1 5
<210> 533
<211> 7
<212> PRT
<213> Homo sapiens
<400> 533
Gly Asn Asp Pro Arg Pro Ser
1 5
<210> 534
<211> 12
<212> PRT
<213> Homo sapiens
<400> 534
Gln Ser Tyr Asp Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 535
<211> 12
<212> PRT
<213> Homo sapiens
<400> 535
Gln Ser Tyr Cys Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 536
<211> 12
<212> PRT
<213> Homo sapiens
<400> 536
Gln Ser Tyr Ser Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 537
<211> 12
<212> PRT
<213> Homo sapiens
<400> 537
Gln Ser Tyr Tyr Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 538
<211> 12
<212> PRT
<213> Homo sapiens
<400> 538
Gln Ser Tyr Asn Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 539
<211> 12
<212> PRT
<213> Homo sapiens
<400> 539
Gln Ser Tyr Gln Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 540
<211> 12
<212> PRT
<213> Homo sapiens
<400> 540
Gln Ser Tyr Thr Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 541
<211> 12
<212> PRT
<213> Homo sapiens
<400> 541
Gln Ser Tyr Gly Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 542
<211> 12
<212> PRT
<213> Homo sapiens
<400> 542
Gln Ser Tyr Ala Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 543
<211> 12
<212> PRT
<213> Homo sapiens
<400> 543
Gln Ser Tyr Leu Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 544
<211> 12
<212> PRT
<213> Homo sapiens
<400> 544
Gln Ser Tyr Ile Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 545
<211> 12
<212> PRT
<213> Homo sapiens
<400> 545
Gln Ser Tyr Trp Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 546
<211> 12
<212> PRT
<213> Homo sapiens
<400> 546
Gln Ser Tyr Phe Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 547
<211> 12
<212> PRT
<213> Homo sapiens
<400> 547
Gln Ser Tyr Asp Asp Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 548
<211> 12
<212> PRT
<213> Homo sapiens
<400> 548
Gln Ser Tyr Asp Cys Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 549
<211> 12
<212> PRT
<213> Homo sapiens
<400> 549
Gln Ser Tyr Asp Ser Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 550
<211> 12
<212> PRT
<213> Homo sapiens
<400> 550
Gln Ser Tyr Asp Tyr Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 551
<211> 12
<212> PRT
<213> Homo sapiens
<400> 551
Gln Ser Tyr Asp Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 552
<211> 12
<212> PRT
<213> Homo sapiens
<400> 552
Gln Ser Tyr Asp Asn Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 553
<211> 12
<212> PRT
<213> Homo sapiens
<400> 553
Gln Ser Tyr Asp Gln Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 554
<211> 12
<212> PRT
<213> Homo sapiens
<400> 554
Gln Ser Tyr Asp Thr Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 555
<211> 12
<212> PRT
<213> Homo sapiens
<400> 555
Gln Ser Tyr Asp Gly Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 556
<211> 12
<212> PRT
<213> Homo sapiens
<400> 556
Gln Ser Tyr Asp Ala Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 557
<211> 12
<212> PRT
<213> Homo sapiens
<400> 557
Gln Ser Tyr Asp Val Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 558
<211> 12
<212> PRT
<213> Homo sapiens
<400> 558
Gln Ser Tyr Asp Met Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 559
<211> 12
<212> PRT
<213> Homo sapiens
<400> 559
Gln Ser Tyr Asp Leu Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 560
<211> 12
<212> PRT
<213> Homo sapiens
<400> 560
Gln Ser Tyr Asp Ile Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 561
<211> 12
<212> PRT
<213> Homo sapiens
<400> 561
Gln Ser Tyr Asp Pro Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 562
<211> 12
<212> PRT
<213> Homo sapiens
<400> 562
Gln Ser Tyr Asp Trp Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 563
<211> 12
<212> PRT
<213> Homo sapiens
<400> 563
Gln Ser Tyr Asp Arg Asp Thr His Pro Ala Leu Leu
1 5 10
<210> 564
<211> 12
<212> PRT
<213> Homo sapiens
<400> 564
Gln Ser Tyr Asp Arg Cys Thr His Pro Ala Leu Leu
1 5 10
<210> 565
<211> 12
<212> PRT
<213> Homo sapiens
<400> 565
Gln Ser Tyr Asp Arg Ser Thr His Pro Ala Leu Leu
1 5 10
<210> 566
<211> 12
<212> PRT
<213> Homo sapiens
<400> 566
Gln Ser Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu
1 5 10
<210> 567
<211> 12
<212> PRT
<213> Homo sapiens
<400> 567
Gln Ser Tyr Asp Arg His Thr His Pro Ala Leu Leu
1 5 10
<210> 568
<211> 12
<212> PRT
<213> Homo sapiens
<400> 568
Gln Ser Tyr Asp Arg Arg Thr His Pro Ala Leu Leu
1 5 10
<210> 569
<211> 12
<212> PRT
<213> Homo sapiens
<400> 569
Gln Ser Tyr Asp Arg Asn Thr His Pro Ala Leu Leu
1 5 10
<210> 570
<211> 12
<212> PRT
<213> Homo sapiens
<400> 570
Gln Ser Tyr Asp Arg Gln Thr His Pro Ala Leu Leu
1 5 10
<210> 571
<211> 12
<212> PRT
<213> Homo sapiens
<400> 571
Gln Ser Tyr Asp Arg Thr Thr His Pro Ala Leu Leu
1 5 10
<210> 572
<211> 12
<212> PRT
<213> Homo sapiens
<400> 572
Gln Ser Tyr Asp Arg Gly Thr His Pro Ala Leu Leu
1 5 10
<210> 573
<211> 12
<212> PRT
<213> Homo sapiens
<400> 573
Gln Ser Tyr Asp Arg Ala Thr His Pro Ala Leu Leu
1 5 10
<210> 574
<211> 12
<212> PRT
<213> Homo sapiens
<400> 574
Gln Ser Tyr Asp Arg Val Thr His Pro Ala Leu Leu
1 5 10
<210> 575
<211> 12
<212> PRT
<213> Homo sapiens
<400> 575
Gln Ser Tyr Asp Arg Leu Thr His Pro Ala Leu Leu
1 5 10
<210> 576
<211> 12
<212> PRT
<213> Homo sapiens
<400> 576
Gln Ser Tyr Asp Arg Ile Thr His Pro Ala Leu Leu
1 5 10
<210> 577
<211> 12
<212> PRT
<213> Homo sapiens
<400> 577
Gln Ser Tyr Asp Arg Pro Thr His Pro Ala Leu Leu
1 5 10
<210> 578
<211> 12
<212> PRT
<213> Homo sapiens
<400> 578
Gln Ser Tyr Asp Arg Trp Thr His Pro Ala Leu Leu
1 5 10
<210> 579
<211> 12
<212> PRT
<213> Homo sapiens
<400> 579
Gln Ser Tyr Asp Arg Phe Thr His Pro Ala Leu Leu
1 5 10
<210> 580
<211> 48
<212> DNA
<213> synthetic construct
<223> nucleotides at positions 16 to 34 can be
substituted with any nucleotide such that the
randomized nucleotides represent 12% of the
sequence
<400> 580
tgtcccttgg ccccagtagt catagctccc actggtcgta cagtaata 48
<210> 581
<211> 35
<212> DNA
<213> synthetic construct
<400> 581
gacacctcga tcagcggata acaatttcac acagg 35
<210> 582
<211> 15
<212> DNA
<213> synthetic construct
<400> 582
tggggccaag ggaca 15
<210> 583
<211> 45
<212> DNA
<213> synthetic construct
<400> 583
attcgtccta taccgttcta ctttgtcgtc tttccagacg ttagt 45
<210> 584
<211> 18
<212> DNA
<213> synthetic construct
<400> 584
attcgtccta taccgttc 18
<210> 585
<211> 66
<212> DNA
<213> synthetic construct
<223> nucleotides from position 28 to 42 can be
substituted with any nucleotide such that the
randomized nucleotides represent 12% of the
sequence
<400> 585
ggtcccagtt ccgaagaccc tcgaacccct caggctgctg tcatatgact ggcagtaata 60
gtcagc 66
<210> 586
<211> 15
<212> DNA
<213> synthetic construct
<400> 586
tggggccaag ggaca 15
<210> 587
<211> 24
<212> DNA
<213> synthetic construct
<400> 587
tgaagagacg gtgaccattg tccc 24
<210> 588
<211> 16
<212> DNA
<213> synthetic construct
<400> 588
gacacctcga tcagcg 16
<210> 589
<211> 48
<212> DNA
<213> synthetic construct
<400> 589
gagtcattct cgacttgcgg ccgcacctag gacggtcagc ttggtccc 48
<210> 590
<211> 12
<212> PRT
<213> Homo sapiens
<400> 590
Gln Ser Tyr Asp Arg Gly Phe Thr Gly Ser Met Val
1 5 10
<210> 591
<211> 12
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa is encoded by a randomized codon of sequence
NNS with N being any nucleotide and S being either
deoxycytosine or deoxyguanidine
<400> 591
Xaa Xaa Xaa Xaa Xaa Xaa Phe Thr Gly Ser Met Val
1 5 10
<210> 592
<211> 12
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa is encoded by a randomized codon of sequence
NNS with N being any nucleotide and S being either
deoxycytosine or deoxyguanidine
<400> 592
Gln Ser Tyr Xaa Xaa Xaa Xaa Xaa Xaa Ser Met Val
1 5 10
<210> 593
<211> 12
<212> PRT
<213> Homo sapiens
<220>
<223> Xaa is encoded by a randomized codon of sequence
NNS with N being any nucleotide and S being either
deoxycytosine or deoxyguanidine
<400> 593
Gln Ser Tyr Asp Arg Gly Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 594
<211> 100
<212> PRT
<213> Homo sapiens
<400> 594
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Thr Arg Asn Lys Ala Asn Ser Tyr Thr Thr Glu Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg
100
<210> 595
<211> 100
<212> PRT
<213> Homo sapiens
<400> 595
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Gln Gly Lys Gly Leu Glu Leu Val
35 40 45
Gly Leu Ile Arg Asn Lys Ala Asn Ser Tyr Thr Thr Glu Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Leu Thr Ile Ser Arg Glu Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Ser Ser Leu Lys Thr Glu Asp Leu Ala Val Tyr
85 90 95
Tyr Cys Ala Arg
100
<210> 596
<211> 100
<212> PRT
<213> Homo sapiens
<400> 596
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Gln Gly Lys Gly Leu Glu Leu Val
35 40 45
Gly Leu Ile Arg Asn Lys Ala Asn Ser Tyr Thr Thr Glu Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Leu Thr Ile Ser Arg Glu Asp Ser Lys Asn Thr
65 70 75 80
Met Tyr Leu Gln Met Ser Asn Leu Lys Thr Glu Asp Leu Ala Val Tyr
85 90 95
Tyr Cys Ala Arg
100
<210> 597
<211> 100
<212> PRT
<213> Homo sapiens
<400> 597
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Gln Gly Lys Gly Leu Glu Leu Val
35 40 45
Gly Leu Ile Arg Asn Lys Ala Asn Ser Tyr Thr Thr Glu Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Leu Thr Ile Ser Arg Glu Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Ser Ser Leu Lys Thr Glu Asp Leu Ala Val Tyr
85 90 95
Tyr Cys Ala Arg
100
<210> 598
<211> 98
<212> PRT
<213> Homo sapiens
<400> 598
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys
<210> 599
<211> 98
<212> PRT
<213> Homo sapiens
<400> 599
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Arg Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Asn Trp Asn Gly Gly Ser Thr Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr His Cys
85 90 95
Ala Arg
<210> 600
<211> 98
<212> PRT
<213> Homo sapiens
<400> 600
Glu Val Gln Leu Val Glu Ser Gly Gly Val Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Ser Trp Asp Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Thr Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys
<210> 601
<211> 98
<212> PRT
<213> Homo sapiens
<400> 601
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 602
<211> 98
<212> PRT
<213> Homo sapiens
<400> 602
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Ser Ser Tyr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 603
<211> 100
<212> PRT
<213> Homo sapiens
<400> 603
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Gly Ser
20 25 30
Ala Met His Trp Val Arg Gln Ala Ser Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Ala Asn Ser Tyr Ala Thr Ala Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg
100
<210> 604
<211> 100
<212> PRT
<213> Homo sapiens
<400> 604
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr
100
<210> 605
<211> 100
<212> PRT
<213> Homo sapiens
<400> 605
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Glu Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr
100
<210> 606
<211> 100
<212> PRT
<213> Homo sapiens
<400> 606
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr
100
<210> 607
<211> 100
<212> PRT
<213> Homo sapiens
<400> 607
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asn Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr
100
<210> 608
<211> 100
<212> PRT
<213> Homo sapiens
<400> 608
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr
100
<210> 609
<211> 100
<212> PRT
<213> Homo sapiens
<400> 609
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ala
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Lys Ser Lys Thr Asp Gly Gly Thr Thr Asp Tyr Ala Ala
50 55 60
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Thr
100
<210> 610
<211> 98
<212> PRT
<213> Homo sapiens
<400> 610
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Pro Ala Ser Gly Phe Thr Phe Ser Asn His
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Gly Asp Ser Gly Tyr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Asn Asn Ser Pro Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys
<210> 611
<211> 98
<212> PRT
<213> Homo sapiens
<400> 611
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn His
20 25 30
Tyr Thr Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ser Ser Gly Asn Ser Gly Tyr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys
<210> 612
<211> 98
<212> PRT
<213> Homo sapiens
<400> 612
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ser
20 25 30
Asp Met Asn Trp Val His Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Val Ser Trp Asn Gly Ser Arg Thr His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Thr Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg
<210> 613
<211> 98
<212> PRT
<213> Homo sapiens
<400> 613
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ser
20 25 30
Asp Met Asn Trp Ala Arg Lys Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Val Ser Trp Asn Gly Ser Arg Thr His Tyr Val Asp Ser Val
50 55 60
Lys Arg Arg Phe Ile Ile Ser Arg Asp Asn Ser Arg Asn Ser Leu Tyr
65 70 75 80
Leu Gln Lys Asn Arg Arg Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Val Arg
<210> 614
<211> 98
<212> PRT
<213> Homo sapiens
<400> 614
Thr Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Glu Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Ser
20 25 30
Asp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Val Ser Trp Asn Gly Ser Arg Thr His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Asn Ser Arg Asn Phe Leu Tyr
65 70 75 80
Gln Gln Met Asn Ser Leu Arg Pro Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Val Arg
<210> 615
<211> 97
<212> PRT
<213> Homo sapiens
<400> 615
Glu Val His Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Asn Gly Thr Ala Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg
<210> 616
<211> 97
<212> PRT
<213> Homo sapiens
<400> 616
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val Ser Ser Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Tyr Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg
<210> 617
<211> 97
<212> PRT
<213> Homo sapiens
<400> 617
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val His Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Thr Gly Gly Gly Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys Ala
85 90 95
Arg
<210> 618
<211> 97
<212> PRT
<213> Homo sapiens
<400> 618
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Thr Gly Gly Gly Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys Ala
85 90 95
Arg
<210> 619
<211> 98
<212> PRT
<213> Homo sapiens
<400> 619
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys
<210> 620
<211> 98
<212> PRT
<213> Homo sapiens
<400> 620
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ser Ala Ile Ser Ser Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Val Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys
<210> 621
<211> 98
<212> PRT
<213> Homo sapiens
<400> 621
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ser Ala Ile Ser Ser Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Val Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys
<210> 622
<211> 98
<212> PRT
<213> Homo sapiens
<400> 622
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ser Ala Ile Ser Ser Asn Gly Gly Ser Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Gly Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 623
<211> 98
<212> PRT
<213> Homo sapiens
<400> 623
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Gly Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys
<210> 624
<211> 98
<212> PRT
<213> Homo sapiens
<400> 624
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 625
<211> 98
<212> PRT
<213> Homo sapiens
<400> 625
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 626
<211> 98
<212> PRT
<213> Homo sapiens
<400> 626
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 627
<211> 98
<212> PRT
<213> Homo sapiens
<400> 627
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 628
<211> 98
<212> PRT
<213> Homo sapiens
<400> 628
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 629
<211> 98
<212> PRT
<213> Homo sapiens
<400> 629
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 630
<211> 98
<212> PRT
<213> Homo sapiens
<400> 630
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 631
<211> 98
<212> PRT
<213> Homo sapiens
<400> 631
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 632
<211> 98
<212> PRT
<213> Homo sapiens
<400> 632
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 633
<211> 98
<212> PRT
<213> Homo sapiens
<400> 633
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ser Ala Ile Ser Ser Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Val Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys
<210> 634
<211> 98
<212> PRT
<213> Homo sapiens
<400> 634
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ser Ala Ile Ser Ser Asn Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 635
<211> 98
<212> PRT
<213> Homo sapiens
<400> 635
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 636
<211> 98
<212> PRT
<213> Homo sapiens
<400> 636
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 637
<211> 98
<212> PRT
<213> Homo sapiens
<400> 637
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys
<210> 638
<211> 97
<212> PRT
<213> Homo sapiens
<400> 638
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Thr Ala Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg
<210> 639
<211> 98
<212> PRT
<213> Homo sapiens
<400> 639
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Glu Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 640
<211> 98
<212> PRT
<213> Homo sapiens
<400> 640
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Leu Arg Ala Arg Leu Cys Ile Thr Val
85 90 95
Arg Glu
<210> 641
<211> 98
<212> PRT
<213> Homo sapiens
<400> 641
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 642
<211> 98
<212> PRT
<213> Homo sapiens
<400> 642
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 643
<211> 98
<212> PRT
<213> Homo sapiens
<400> 643
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 644
<211> 98
<212> PRT
<213> Homo sapiens
<400> 644
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 645
<211> 98
<212> PRT
<213> Homo sapiens
<400> 645
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Arg Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 646
<211> 98
<212> PRT
<213> Homo sapiens
<400> 646
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 647
<211> 98
<212> PRT
<213> Homo sapiens
<400> 647
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 648
<211> 98
<212> PRT
<213> Homo sapiens
<400> 648
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Gly Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 649
<211> 98
<212> PRT
<213> Homo sapiens
<400> 649
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys
<210> 650
<211> 98
<212> PRT
<213> Homo sapiens
<400> 650
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys
<210> 651
<211> 98
<212> PRT
<213> Homo sapiens
<400> 651
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 652
<211> 98
<212> PRT
<213> Homo sapiens
<400> 652
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys
<210> 653
<211> 95
<212> PRT
<213> Homo sapiens
<400> 653
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Arg Lys
85 90 95
<210> 654
<211> 98
<212> PRT
<213> Homo sapiens
<400> 654
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 655
<211> 98
<212> PRT
<213> Homo sapiens
<400> 655
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Thr Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 656
<211> 98
<212> PRT
<213> Homo sapiens
<400> 656
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Ser Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 657
<211> 98
<212> PRT
<213> Homo sapiens
<400> 657
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 658
<211> 97
<212> PRT
<213> Homo sapiens
<400> 658
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg
<210> 659
<211> 98
<212> PRT
<213> Homo sapiens
<400> 659
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 660
<211> 98
<212> PRT
<213> Homo sapiens
<400> 660
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Ser Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 661
<211> 97
<212> PRT
<213> Homo sapiens
<400> 661
Glu Asp Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Pro Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Ser Tyr
20 25 30
Val Leu His Trp Val Arg Arg Ala Pro Gly Lys Gly Pro Glu Trp Val
35 40 45
Ser Ala Ile Gly Thr Gly Gly Asp Thr Tyr Tyr Ala Asp Ser Val Met
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Ile Ala Glu Asp Met Ala Val Tyr Tyr Cys Ala
85 90 95
Arg
<210> 662
<211> 98
<212> PRT
<213> Homo sapiens
<400> 662
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asn Ser Asp Gly Ser Ser Thr Ser Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 663
<211> 98
<212> PRT
<213> Homo sapiens
<400> 663
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asn Ser Asp Gly Ser Ser Thr Ser Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 664
<211> 98
<212> PRT
<213> Homo sapiens
<400> 664
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 665
<211> 98
<212> PRT
<213> Homo sapiens
<400> 665
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asn Ser Asp Gly Ser Ser Thr Ser Tyr Ala Asp Ser Met
50 55 60
Lys Gly Gln Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Thr Arg
<210> 666
<211> 98
<212> PRT
<213> Homo sapiens
<400> 666
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 667
<211> 98
<212> PRT
<213> Homo sapiens
<400> 667
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Lys Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr
<210> 668
<211> 98
<212> PRT
<213> Homo sapiens
<400> 668
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Gln
65 70 75 80
Thr Gly Asp Glu Ala Asp Tyr Tyr Cys Gly Thr Trp Asp Ser Ser Leu
85 90 95
Ser Ala
<210> 669
<211> 98
<212> PRT
<213> Homo sapiens
<400> 669
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asp Met Gly Asn Tyr
20 25 30
Ala Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Glu Asn Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Trp
65 70 75 80
Pro Glu Asp Glu Ala Asp Tyr Tyr Cys Leu Ala Trp Asp Thr Ser Pro
85 90 95
Arg Ala
<210> 670
<211> 98
<212> PRT
<213> Homo sapiens
<400> 670
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly
<210> 671
<211> 98
<212> PRT
<213> Homo sapiens
<400> 671
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Tyr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Ser Gly
<210> 672
<211> 98
<212> PRT
<213> Homo sapiens
<400> 672
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Leu Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Pro Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly
<210> 673
<211> 99
<212> PRT
<213> Homo sapiens
<400> 673
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Val Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Gln Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu
65 70 75 80
Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Lys Ala Trp Asp Asn Ser
85 90 95
Leu Asn Ala
<210> 674
<211> 99
<212> PRT
<213> Homo sapiens
<400> 674
Gln Ser Val Val Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser
85 90 95
Leu Ser Gly
<210> 675
<211> 98
<212> PRT
<213> Homo sapiens
<400> 675
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Gly Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Val Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser Leu
85 90 95
Arg Gly
Claims (69)
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하여 상기 피검체의 건선을 치료함을 포함하는 피검체의 건선 치료방법으로서, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 제1 연장 기간 동안 적어도 PASI 75 반응을 유지하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 제2 연장 기간 동안 적어도 PASI 75 반응을 유지하는, 피검체의 건선 치료방법.
- 제1항에 있어서, 상기 제1 연장 기간이 적어도 약 12주인 방법.
- 제1항에 있어서, 상기 항체의 투여가 적어도 약 12주 동안 중단되는 방법.
- 제1항에 있어서, 상기 제2 연장 기간이 적어도 약 12주인 방법.
- 제1항에 있어서, 상기 항체 또는 이의 항원결합부가 격주로 투여되는 방법.
- 제1항에 있어서, 상기 항체 또는 이의 항원결합부가 매주 투여되는 방법.
- 제1항에 있어서, 상기 항체 또는 이의 항원결합부가 단일 용량으로 투여되는 방법.
- 제1항에 있어서, 상기 항체 또는 이의 항원결합부가 약 200mg의 용량으로 투여되는 방법.
- 제1항에 있어서, 상기 항체 또는 이의 항원결합부가 약 100mg의 용량으로 투여되는 방법.
- 제1항에 있어서, 상기 건선이 만성 건선인 방법.
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부의 단일 용량을 피검체에게 투여함을 포함하는 피검체의 건선 치료방법으로서, 상기 항체 또는 이의 항원결합부를 투여한 후 적어도 약 3일의 반감기, 약 4일 이하의 Tmax 및 적어도 약 40%의 생체이용률로 이루어진 그룹 중에서 선택되는 적어도 하나의 약동학적 특징이 달성되는, 피검체의 건선 치료방법.
- 제11항에 있어서, 적어도 약 8일의 반감기가 달성되는 방법.
- 제11항에 있어서, 약 3일 이하의 Tmax가 달성되는 방법.
- 제11항에 있어서, 적어도 약 60%의 생체이용률이 달성되는 방법.
- 제11항에 있어서, 상기 항체가 정맥내 주사를 통해 투여되는 방법.
- 제11항에 있어서, 상기 항체가 피하 주사를 통해 투여되는 방법.
- 제11항에 있어서, 상기 단일 용량이 약 0.1 내지 약 5.0mg/kg의 항체 또는 이의 항원결합부인 방법.
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하여 상기 피검체의 건선을 치료함을 포함하는 피검체의 건선 치료방법으로서, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 제1 연장 기간 동안 적어도 PASI 75 반응을 유지하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 제2 연장 기간 동안 적어도 PASI 50 반응을 유지하는, 피검체의 건선 치료방법.
- 제18항에 있어서, 상기 제1 연장 기간이 적어도 약 12주인 방법.
- 제18항에 있어서, 상기 항체의 투여가 적어도 약 12주 동안 중단되는 방법.
- 제18항에 있어서, 상기 제2 연장 기간이 적어도 약 12주인 방법.
- 제18항에 있어서, 상기 항체 또는 이의 항원결합부가 격주로 투여되는 방법.
- 제18항에 있어서, 상기 항체 또는 이의 항원결합부가 매주 투여되는 방법.
- 제18항에 있어서, 상기 항체 또는 이의 항원결합부가 단일 용량으로 투여되는 방법.
- 제18항에 있어서, 상기 항체 또는 이의 항원결합부가 약 200mg의 용량으로 투여되는 방법.
- 제18항에 있어서, 상기 항체 또는 이의 항원결합부가 약 100mg의 용량으로 투여되는 방법.
- 제18항에 있어서, 상기 건선이 만성 건선인 방법.
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하여 상기 피검체의 건선을 치료함을 포함하는 피검체의 건선 치료방법으로서, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 제1 연장 기간 동안 적어도 PASI 75 반응을 유지하고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 제2 연장 기간 동안 클리어(clear) PGA 점수 또는 최소의 PGA 점수를 유지하는, 피검체의 건선 치료방법.
- 제28항에 있어서, 상기 제1 연장 기간이 적어도 약 12주인 방법.
- 제28항에 있어서, 상기 항체의 투여가 적어도 약 12주 동안 중단되는 방법.
- 제28항에 있어서, 상기 제2 연장 기간이 적어도 약 12주인 방법.
- 제28항에 있어서, 상기 항체 또는 이의 항원결합부가 격주로 투여되는 방법.
- 제28항에 있어서, 상기 항체 또는 이의 항원결합부가 매주 투여되는 방법.
- 제28항에 있어서, 상기 항체 또는 이의 항원결합부가 단일 용량으로 투여되는 방법.
- 제28항에 있어서, 상기 항체 또는 이의 항원결합부가 약 200mg의 용량으로 투여되는 방법.
- 제28항에 있어서, 상기 항체 또는 이의 항원결합부가 약 100mg의 용량으로 투여되는 방법.
- 제28항에 있어서, 상기 건선이 만성 건선인 방법.
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부의 단일 용량을 피검체에게 투여함을 포함하는 피검체의 건선 치료방법으로서, 상기 항체 또는 이의 항원결합부의 투여 후 약 0.15 내지 약 150 ㎍/ml의 최대 혈청 농도(Cmax) 및 약 80 내지 약 13,000 ㎍ × hr/ml의 혈청농도-시간 곡선 이하 면적(AUC)으로 이루어진 그룹 중에서 선택되는 적어도 하나의 약동학적 특징이 달성되는, 피검체의 건선 치료방법.
- 제38항에 있어서, 상기 항체가 정맥내 주사를 통해 투여되는 방법.
- 제39항에 있어서, 상기 Cmax가 약 1 내지 약 150 ㎍/ml인 방법.
- 제39항에 있어서, 상기 AUC가 약 145 내지 약 13,000 ㎍ × hr/ml인 방법.
- 제38항에 있어서, 상기 항체가 피하 주사를 통해 투여되는 방법.
- 제42항에 있어서, 상기 Cmax가 약 0.15 내지 약 20 ㎍/ml인 방법.
- 제42항에 있어서, 상기 AUC가 약 80 내지 약 5,000 ㎍ × hr/ml인 방법.
- 제38항에 있어서, 상기 단일 용량이 약 0.1 내지 약 5.0 mg/kg의 항체 또는 이의 항원결합부인 방법.
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부의 단일 용량을 피검체에게 투여함을 포함하는 피검체의 건선 치료방법으로서, 상기 항체 또는 이의 항원결합부의 정맥내 투여 후 약 30 내지 약 600 ml/hr의 제거율(CL) 및 약 8 내지 약 11L의 분포용적(Vz)으로 이루어진 그룹 중에서 선택되는 적어도 하나의 약동학적 특징이 달성되는, 피검체의 건선 치료방법.
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부의 단일 용량을 피검체에게 투여함을 포함하는 피검체의 건선 치료방법으로서, 상기 항체 또는 이의 항원결합부의 피하 투여 후 약 90 내지 약 250 ml/hr의 겉보기 제거율(CL/F) 및 약 23 내지 약 67L의 겉보기 분포용적(V/F)으로 이루어진 그룹 중에서 선택되는 적어도 하나의 약동학적 특징이 달성되는, 피검체의 건선 치료방법.
- 제46항 또는 제47항에 있어서, 상기 단일 용량이 약 0.1 내지 약 5.0 mg/kg의 항체 또는 이의 항원결합부인 방법.
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하여 상기 피검체의 건선을 치료함을 포함하는 피검체의 건선 치료방법으로서, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 PASI 75 반응을 나타내고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 약 25일까지 적어도 PASI 75 반응을 나타내는, 피검체의 건선 치료방법.
- 제49항에 있어서, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 약 50일까지 적어도 PASI 75 반응을 나타내는 방법.
- 제49항에 있어서, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 약 60일까지 적어도 PASI 75 반응을 나타내는 방법.
- 제49항에 있어서, 상기 항체의 1차 투여가 적어도 약 12주 동안인 방법.
- 제49항에 있어서, 상기 항체의 투여가 적어도 약 8주 동안 중단되는 방법.
- 제49항에 있어서, 상기 항체 또는 이의 항원결합부가 격주로 투여되는 방법.
- 제49항에 있어서, 상기 항체 또는 이의 항원결합부가 매주 투여되는 방법.
- 제49항에 있어서, 상기 항체 또는 이의 항원결합부가 단일 용량으로 투여되는 방법.
- 제49항에 있어서, 상기 항체 또는 이의 항원결합부가 약 200mg의 용량으로 투여되는 방법.
- 제49항에 있어서, 상기 항체 또는 이의 항원결합부가 약 100mg의 용량으로 투여되는 방법.
- 제49항에 있어서, 상기 건선이 만성 건선인 방법.
- IL-12 및/또는 IL-23의 p40 서브유닛의 에피토프에 결합할 수 있는 항체 또는 이의 항원결합부를 피검체에게 투여하여 상기 피검체의 건선을 치료함을 포함하는 피검체의 건선 치료방법으로서, 상기 피검체가 상기 항체 또는 이의 항원결합부의 1차 투여 후 PASI 75 반응을 나타내고, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 약 60일까지 반응 상실을 나타내며, 상기 피검체가 상기 항체 또는 이의 항원결합부를 재투여한 후 PASI 75 반응을 달성하는, 피검체의 건선 치료방법.
- 제60항에 있어서, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 약 120일까지 반응 상실을 나타내는 방법.
- 제60항에 있어서, 상기 피검체가 상기 항체 또는 이의 항원결합부의 투여를 중단한 후 약 180일까지 반응 상실을 나타내는 방법.
- 제60항에 있어서, 상기 항체의 1차 투여가 적어도 약 12주 동안인 방법.
- 제60항에 있어서, 상기 항체 또는 이의 항원결합부가 격주로 투여되는 방법.
- 제60항에 있어서, 상기 항체 또는 이의 항원결합부가 매주 투여되는 방법.
- 제60항에 있어서, 상기 항체 또는 이의 항원결합부가 단일 용량으로 투여되는 방법.
- 제60항에 있어서, 상기 항체 또는 이의 항원결합부가 약 200mg의 용량으로 투여되는 방법.
- 제60항에 있어서, 상기 항체 또는 이의 항원결합부가 약 100mg의 용량으로 투여되는 방법.
- 제60항에 있어서, 상기 건선이 만성 건선인 방법.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US6984008P | 2008-03-18 | 2008-03-18 | |
| US61/069,840 | 2008-03-18 | ||
| US9527508P | 2008-09-08 | 2008-09-08 | |
| US61/095,275 | 2008-09-08 | ||
| US20790409P | 2009-02-18 | 2009-02-18 | |
| US61/207,904 | 2009-02-18 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100126515A true KR20100126515A (ko) | 2010-12-01 |
Family
ID=41091468
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107023101A KR20100126515A (ko) | 2008-03-18 | 2009-03-11 | 건선의 치료방법 |
Country Status (16)
| Country | Link |
|---|---|
| US (2) | US8178092B2 (ko) |
| EP (2) | EP2274333A4 (ko) |
| JP (1) | JP2011515404A (ko) |
| KR (1) | KR20100126515A (ko) |
| CN (1) | CN102037011A (ko) |
| AU (1) | AU2009225797A1 (ko) |
| BR (1) | BRPI0908715A2 (ko) |
| CA (1) | CA2717569A1 (ko) |
| HK (1) | HK1203516A1 (ko) |
| IL (1) | IL208069A0 (ko) |
| MX (1) | MX2010010265A (ko) |
| NZ (2) | NZ587765A (ko) |
| RU (2) | RU2497545C2 (ko) |
| SG (1) | SG188909A1 (ko) |
| TW (2) | TW201513883A (ko) |
| WO (1) | WO2009117289A2 (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6914128B1 (en) | 1999-03-25 | 2005-07-05 | Abbott Gmbh & Co. Kg | Human antibodies that bind human IL-12 and methods for producing |
| NZ578065A (en) * | 2007-01-16 | 2012-09-28 | Abbott Lab | Methods for treating psoriasis with an antibody which binds to an epitope |
| NZ598881A (en) * | 2007-03-29 | 2013-11-29 | Abbvie Inc | Crystalline anti-human il-12 antibodies |
| NZ587765A (en) | 2008-03-18 | 2013-02-22 | Abbott Lab | Methods for treating psoriasis |
| US20090269398A1 (en) * | 2008-04-26 | 2009-10-29 | Vilambi Nrk Reddy | Compositions for the encapsulation of natural product extracts in oil medium in hard gelatin capsules and a method of encapsulation |
| WO2010062896A1 (en) * | 2008-11-28 | 2010-06-03 | Abbott Laboratories | Stable antibody compositions and methods for stabilizing same |
| KR20140048229A (ko) * | 2009-09-14 | 2014-04-23 | 애브비 인코포레이티드 | 건선을 치료하는 방법 |
| JO3244B1 (ar) | 2009-10-26 | 2018-03-08 | Amgen Inc | بروتينات ربط مستضادات il – 23 البشرية |
| WO2011146727A1 (en) * | 2010-05-19 | 2011-11-24 | Philip Bosch | Methods of treating interstitial cystitis |
| JP2013542209A (ja) * | 2010-10-06 | 2013-11-21 | アッヴィ・インコーポレイテッド | 乾癬を治療するための方法 |
| EP3869201A1 (en) * | 2013-03-12 | 2021-08-25 | Abbott Laboratories | Reagents, systems and methods for analyzing white blood cells |
| EP3689369A1 (en) * | 2013-03-15 | 2020-08-05 | Amgen, Inc | Methods for treating psoriasis using an anti-il-23 antibody |
| EA201591579A1 (ru) * | 2013-03-15 | 2016-01-29 | Амген Инк. | Способы лечения болезни крона при помощи анти-il-23 антитела |
| US10858422B2 (en) | 2016-05-31 | 2020-12-08 | Abcentra, Llc | Methods for treating systemic lupus erythematosus with an anti-apolipoprotein B antibody |
| KR20210044742A (ko) * | 2018-05-29 | 2021-04-23 | 앱센트라 엘엘시 | 건선 치료용 조성물 및 방법 |
Family Cites Families (111)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US128A (en) | 1837-02-16 | Holdback for sleds | ||
| US6914A (en) | 1849-11-27 | Propeller | ||
| US5179017A (en) | 1980-02-25 | 1993-01-12 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4634665A (en) | 1980-02-25 | 1987-01-06 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4510245A (en) | 1982-11-18 | 1985-04-09 | Chiron Corporation | Adenovirus promoter system |
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| US5168062A (en) | 1985-01-30 | 1992-12-01 | University Of Iowa Research Foundation | Transfer vectors and microorganisms containing human cytomegalovirus immediate-early promoter-regulatory DNA sequence |
| US4968615A (en) | 1985-12-18 | 1990-11-06 | Ciba-Geigy Corporation | Deoxyribonucleic acid segment from a virus |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5811523A (en) | 1988-11-10 | 1998-09-22 | Trinchieri; Giorgio | Antibodies to natural killer stimulatory factor |
| KR0184860B1 (ko) | 1988-11-11 | 1999-04-01 | 메디칼 리써어치 카운실 | 단일영역 리간드와 이를 포함하는 수용체 및 이들의 제조방법과 이용(법) |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| ES2118066T3 (es) | 1989-10-05 | 1998-09-16 | Optein Inc | Sintesis y aislamiento, exentos de celulas, de nuevos genes y polipeptidos. |
| US6683046B1 (en) | 1989-12-22 | 2004-01-27 | Hoffmann-La Roche Inc. | Purification and characterization of cytotoxic lymphocyte maturation factor and monoclonal antibodies thereto |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6713610B1 (en) | 1990-01-12 | 2004-03-30 | Raju Kucherlapati | Human antibodies derived from immunized xenomice |
| US6673986B1 (en) | 1990-01-12 | 2004-01-06 | Abgenix, Inc. | Generation of xenogeneic antibodies |
| DK0585287T3 (da) | 1990-07-10 | 2000-04-17 | Cambridge Antibody Tech | Fremgangsmåde til fremstilling af specifikke bindingsparelementer |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US6300129B1 (en) | 1990-08-29 | 2001-10-09 | Genpharm International | Transgenic non-human animals for producing heterologous antibodies |
| US5789650A (en) | 1990-08-29 | 1998-08-04 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US7084260B1 (en) | 1996-10-10 | 2006-08-01 | Genpharm International, Inc. | High affinity human antibodies and human antibodies against human antigens |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US6255458B1 (en) | 1990-08-29 | 2001-07-03 | Genpharm International | High affinity human antibodies and human antibodies against digoxin |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| ES2246502T3 (es) | 1990-08-29 | 2006-02-16 | Genpharm International, Inc. | Animales no humanos transgenicos capaces de producir anticuerpos heterologos. |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| ES2113940T3 (es) | 1990-12-03 | 1998-05-16 | Genentech Inc | Metodo de enriquecimiento para variantes de proteinas con propiedades de union alteradas. |
| US6284471B1 (en) | 1991-03-18 | 2001-09-04 | New York University Medical Center | Anti-TNFa antibodies and assays employing anti-TNFa antibodies |
| US5919452A (en) | 1991-03-18 | 1999-07-06 | New York University | Methods of treating TNFα-mediated disease using chimeric anti-TNF antibodies |
| US6277969B1 (en) | 1991-03-18 | 2001-08-21 | New York University | Anti-TNF antibodies and peptides of human tumor necrosis factor |
| US5698195A (en) | 1991-03-18 | 1997-12-16 | New York University Medical Center | Methods of treating rheumatoid arthritis using chimeric anti-TNF antibodies |
| US5656272A (en) | 1991-03-18 | 1997-08-12 | New York University Medical Center | Methods of treating TNF-α-mediated Crohn's disease using chimeric anti-TNF antibodies |
| DE69233750D1 (de) | 1991-04-10 | 2009-01-02 | Scripps Research Inst | Bibliotheken heterodimerer Rezeptoren mittels Phagemiden |
| WO1994004679A1 (en) | 1991-06-14 | 1994-03-03 | Genentech, Inc. | Method for making humanized antibodies |
| DE4122599C2 (de) | 1991-07-08 | 1993-11-11 | Deutsches Krebsforsch | Phagemid zum Screenen von Antikörpern |
| DK0605522T3 (da) | 1991-09-23 | 2000-01-17 | Medical Res Council | Fremgangsmåde til fremstilling af humaniserede antistoffer |
| GB9122820D0 (en) | 1991-10-28 | 1991-12-11 | Wellcome Found | Stabilised antibodies |
| DK1024191T3 (da) | 1991-12-02 | 2008-12-08 | Medical Res Council | Fremstilling af autoantistoffer fremvist på fag-overflader ud fra antistofsegmentbiblioteker |
| ATE381614T1 (de) | 1992-07-24 | 2008-01-15 | Amgen Fremont Inc | Bildung von xenogenen antikörpern |
| US5652138A (en) | 1992-09-30 | 1997-07-29 | The Scripps Research Institute | Human neutralizing monoclonal antibodies to human immunodeficiency virus |
| DK0614984T4 (da) | 1993-03-05 | 2010-12-20 | Bayer Healthcare Llc | Humane monoklonale anti-TNF-alfa-antistoffer |
| CA2161351C (en) | 1993-04-26 | 2010-12-21 | Nils Lonberg | Transgenic non-human animals capable of producing heterologous antibodies |
| US5654168A (en) | 1994-07-01 | 1997-08-05 | Basf Aktiengesellschaft | Tetracycline-inducible transcriptional activator and tetracycline-regulated transcription units |
| US5464758A (en) | 1993-06-14 | 1995-11-07 | Gossen; Manfred | Tight control of gene expression in eucaryotic cells by tetracycline-responsive promoters |
| CA2125763C (en) | 1993-07-02 | 2007-08-28 | Maurice Kent Gately | P40 homodimer of interleukin-12 |
| EP0638644A1 (en) | 1993-07-19 | 1995-02-15 | F. Hoffmann-La Roche Ag | Receptors of interleukin-12 and antibodies |
| EP0659766A1 (en) | 1993-11-23 | 1995-06-28 | Schering-Plough | Human monoclonal antibodies against human cytokines and methods of making and using such antibodies |
| ZA95960B (en) | 1994-03-14 | 1995-10-10 | Genetics Inst | Use of interleukin-12 antagonists in the treatment of autoimmune diseases |
| US5910486A (en) | 1994-09-06 | 1999-06-08 | Uab Research Foundation | Methods for modulating protein function in cells using, intracellular antibody homologues |
| US5562138A (en) * | 1994-10-13 | 1996-10-08 | The Longaberger Company | Bowing press |
| ES2304786T3 (es) | 1995-04-27 | 2008-10-16 | Amgen Fremont Inc. | Anticuerpos anti-il-8 humanos, derivados a partir de xenoratones inmunizados. |
| EP0823941A4 (en) | 1995-04-28 | 2001-09-19 | Abgenix Inc | HUMAN ANTIBODIES DERIVED FROM IMMUNIZED XENO MOUSES |
| US6685940B2 (en) | 1995-07-27 | 2004-02-03 | Genentech, Inc. | Protein formulation |
| US5853697A (en) | 1995-10-25 | 1998-12-29 | The United States Of America, As Represented By The Department Of Health & Human Services | Methods of treating established colitis using antibodies against IL-12 |
| US6297395B1 (en) | 1995-11-10 | 2001-10-02 | The Secretary Of State For Defence In Her Brittanic Majesty's Government Of The United Kingdom Of Great Britain And Northern Ireland | Calixarenes and their use for sequestration of metals |
| US6090382A (en) | 1996-02-09 | 2000-07-18 | Basf Aktiengesellschaft | Human antibodies that bind human TNFα |
| RU2270030C2 (ru) | 1996-02-09 | 2006-02-20 | Абботт Байотекнолоджи эЛтиди. | СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ ЧЕЛОВЕЧЕСКОГО TNFα (ВАРИАНТЫ), ПРИМЕНЕНИЕ ВЫДЕЛЕННОГО АНТИТЕЛА ЧЕЛОВЕКА ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩЕГО ФРАГМЕНТА В КАЧЕСТВЕ КОМПОНЕНТА ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННОГО СРЕДСТВА (ВАРИАНТЫ) И ВЫДЕЛЕННОЕ ЧЕЛОВЕЧЕСКОЕ АНТИТЕЛО ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ |
| AU7257696A (en) | 1996-10-11 | 1998-05-11 | Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services, The | Methods for enhancing oral tolerance and treating autoimmune disease using inhibitors of interleukin-12 |
| ATE256476T1 (de) | 1996-11-15 | 2004-01-15 | Kennedy Inst Of Rheumatology | Unterdrückung von tnfalpha und il-12 in der therapie |
| DK1500329T3 (da) | 1996-12-03 | 2012-07-09 | Amgen Fremont Inc | Humane antistoffer, der specifikt binder TNF-alfa |
| US6054487A (en) | 1997-03-18 | 2000-04-25 | Basf Aktiengesellschaft | Methods and compositions for modulating responsiveness to corticosteroids |
| PL336464A1 (en) | 1997-03-18 | 2000-06-19 | Basf Ag | Method of and compositions for modulating reactivity in respect to corticosteroids i |
| US6183744B1 (en) | 1997-03-24 | 2001-02-06 | Immunomedics, Inc. | Immunotherapy of B-cell malignancies using anti-CD22 antibodies |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| EP1015480A2 (en) | 1997-08-18 | 2000-07-05 | Innogenetics N.V. | Interferon-gamma-binding molecules for treating septic shock, cachexia, immune diseases and skin disorders |
| ATE274920T1 (de) | 1997-10-31 | 2004-09-15 | Wyeth Corp | Verwendung von anti-il-12 antikörpern bei transplantationsabstossungen |
| TR200002145T2 (tr) | 1998-01-23 | 2000-11-21 | F.Hoffmann-La Roche Ag | İnsan IL-12'ye karşı antikorlar |
| US20020161199A1 (en) | 1998-04-08 | 2002-10-31 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| EP0953639A1 (en) | 1998-04-30 | 1999-11-03 | Boehringer Ingelheim International GmbH | FAPalpha-specific antibody with improved producibility |
| DE69927520T2 (de) | 1998-12-09 | 2006-06-22 | Protein Design Labs, Inc., Fremont | Verwendung von il-12 antikörpern zur behandlung von psoriasis |
| KR101222450B1 (ko) * | 1999-03-25 | 2013-01-16 | 애보트 게엠베하 운트 콤파니 카게 | 사람 il-12에 결합하는 사람 항체 및 이의 제조방법 |
| US7883704B2 (en) | 1999-03-25 | 2011-02-08 | Abbott Gmbh & Co. Kg | Methods for inhibiting the activity of the P40 subunit of human IL-12 |
| US6914128B1 (en) | 1999-03-25 | 2005-07-05 | Abbott Gmbh & Co. Kg | Human antibodies that bind human IL-12 and methods for producing |
| BR0013231A (pt) * | 1999-08-09 | 2002-07-23 | Lexigen Pharm Corp | Complexos citocina-anticorpo múltiplos |
| US6902734B2 (en) | 2000-08-07 | 2005-06-07 | Centocor, Inc. | Anti-IL-12 antibodies and compositions thereof |
| KR20030074693A (ko) | 2000-12-28 | 2003-09-19 | 알투스 바이올로직스 인코포레이티드 | 전항체 및 이의 단편의 결정과 이의 제조 및 사용 방법 |
| WO2002097048A2 (en) | 2001-05-30 | 2002-12-05 | Centocor, Inc. | ANTI-p40 IMMUNOGLOBULIN DERIVED PROTEINS, COMPOSITIONS, METHODS AND USES |
| US20040156835A1 (en) | 2001-05-30 | 2004-08-12 | Taiji Imoto | Protein preparation |
| JP2005529152A (ja) * | 2002-05-17 | 2005-09-29 | プロテイン デザイン ラブス インコーポレイティド | 抗インターフェロンγ抗体を用いたクローン病又は乾癬の治療 |
| US20050276823A1 (en) | 2002-07-12 | 2005-12-15 | Cini John K | Methods and compositions for preventing oxidative degradation of proteins |
| US20090280065A1 (en) | 2006-04-10 | 2009-11-12 | Willian Mary K | Uses and Compositions for Treatment of Psoriasis |
| US7608260B2 (en) | 2003-01-06 | 2009-10-27 | Medimmune, Llc | Stabilized immunoglobulins |
| KR101224235B1 (ko) | 2003-04-11 | 2013-01-25 | 메디뮨 엘엘씨 | 재조합 il9 항체 및 그의 용도 |
| JP2007515939A (ja) | 2003-05-09 | 2007-06-21 | セントカー・インコーポレーテツド | IL−23p40特異的免疫グロブリン由来タンパク質、組成物、方法および用途 |
| AU2004270881A1 (en) * | 2003-09-04 | 2005-03-17 | Laboratoires Serono Sa | Novel UBP8rp polypeptides and their use in the treatment of psoriasis |
| JP4219932B2 (ja) | 2003-10-01 | 2009-02-04 | 協和発酵キリン株式会社 | 抗体の安定化方法及び安定化された溶液状抗体製剤 |
| EP1694317A4 (en) | 2003-12-19 | 2010-05-12 | Protemix Corp Ltd | COPPER ANTAGONIST COMPOUNDS |
| JP4943161B2 (ja) | 2003-12-23 | 2012-05-30 | ジェネンテック, インコーポレイテッド | 新規抗il13モノクローナル抗体での癌の処置 |
| RU2390353C2 (ru) | 2004-02-12 | 2010-05-27 | Мерк Патент Гмбх | Высококонцентрированные жидкие композиции анти-egfr антител |
| RU2292215C2 (ru) * | 2004-05-21 | 2007-01-27 | Дмитрий Васильевич Николенко | Комплекс для лечения псориаза и способ лечения |
| AR049390A1 (es) | 2004-06-09 | 2006-07-26 | Wyeth Corp | Anticuerpos contra la interleuquina-13 humana y usos de los mismos |
| JP4994232B2 (ja) | 2004-07-23 | 2012-08-08 | ジェネンテック, インコーポレイテッド | 抗体又はその断片の結晶化 |
| KR20070094927A (ko) | 2004-12-21 | 2007-09-27 | 센토코 인코포레이티드 | 항-il-12 항체, 에피토프, 조성물, 방법 및 용도 |
| NZ591701A (en) * | 2005-05-16 | 2012-11-30 | Abbott Biotech Ltd | Use of tnf inhibitor for treatment of erosive polyarthritis |
| JP2009501006A (ja) | 2005-06-30 | 2009-01-15 | セントカー・インコーポレーテツド | 抗il−23抗体、組成物、方法および用途 |
| AU2007212147A1 (en) | 2006-02-03 | 2007-08-16 | Medimmune, Llc | Protein formulations |
| EP2064345B1 (en) | 2006-09-11 | 2013-03-13 | Celera Corporation | Genetic polymorphisms associated with psoriasis, methods of detection and uses thereof |
| SG175622A1 (en) | 2006-10-13 | 2011-11-28 | Centocor Ortho Biotech Inc | Enhancement of hybridoma fusion efficiencies through cell synchronization |
| NZ578065A (en) * | 2007-01-16 | 2012-09-28 | Abbott Lab | Methods for treating psoriasis with an antibody which binds to an epitope |
| NZ598881A (en) | 2007-03-29 | 2013-11-29 | Abbvie Inc | Crystalline anti-human il-12 antibodies |
| NZ587765A (en) | 2008-03-18 | 2013-02-22 | Abbott Lab | Methods for treating psoriasis |
| WO2010062896A1 (en) | 2008-11-28 | 2010-06-03 | Abbott Laboratories | Stable antibody compositions and methods for stabilizing same |
| KR20140048229A (ko) | 2009-09-14 | 2014-04-23 | 애브비 인코포레이티드 | 건선을 치료하는 방법 |
| JP2013542209A (ja) | 2010-10-06 | 2013-11-21 | アッヴィ・インコーポレイテッド | 乾癬を治療するための方法 |
| AU2012204237A1 (en) | 2011-01-07 | 2013-07-04 | Abbvie Inc. | Anti-IL-12/IL-23 antibodies and uses thereof |
| WO2012097288A1 (en) | 2011-01-14 | 2012-07-19 | Abbott Laboratories | Human antibodies that bind the p40 subunit of human il-12/il-23 and uses therefor |
-
2009
- 2009-03-11 NZ NZ587765A patent/NZ587765A/xx not_active IP Right Cessation
- 2009-03-11 CN CN2009801179497A patent/CN102037011A/zh active Pending
- 2009-03-11 MX MX2010010265A patent/MX2010010265A/es active IP Right Grant
- 2009-03-11 US US12/402,342 patent/US8178092B2/en not_active Expired - Fee Related
- 2009-03-11 TW TW103129438A patent/TW201513883A/zh unknown
- 2009-03-11 KR KR1020107023101A patent/KR20100126515A/ko not_active Application Discontinuation
- 2009-03-11 JP JP2011500870A patent/JP2011515404A/ja not_active Ceased
- 2009-03-11 EP EP09723430A patent/EP2274333A4/en not_active Withdrawn
- 2009-03-11 NZ NZ602511A patent/NZ602511A/en not_active IP Right Cessation
- 2009-03-11 RU RU2010142309/10A patent/RU2497545C2/ru not_active IP Right Cessation
- 2009-03-11 EP EP14176768.1A patent/EP2810954A3/en not_active Withdrawn
- 2009-03-11 SG SG2013019617A patent/SG188909A1/en unknown
- 2009-03-11 AU AU2009225797A patent/AU2009225797A1/en not_active Abandoned
- 2009-03-11 CA CA2717569A patent/CA2717569A1/en not_active Abandoned
- 2009-03-11 WO PCT/US2009/036765 patent/WO2009117289A2/en active Application Filing
- 2009-03-11 BR BRPI0908715A patent/BRPI0908715A2/pt not_active IP Right Cessation
- 2009-03-11 TW TW098107971A patent/TWI461210B/zh not_active IP Right Cessation
-
2010
- 2010-09-07 IL IL208069A patent/IL208069A0/en unknown
-
2011
- 2011-06-29 HK HK15103080.8A patent/HK1203516A1/xx unknown
-
2012
- 2012-03-08 US US13/415,337 patent/US8945545B2/en not_active Expired - Fee Related
-
2013
- 2013-07-16 RU RU2013132928/10A patent/RU2013132928A/ru not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| RU2497545C2 (ru) | 2013-11-10 |
| US8178092B2 (en) | 2012-05-15 |
| JP2011515404A (ja) | 2011-05-19 |
| TW200948379A (en) | 2009-12-01 |
| US8945545B2 (en) | 2015-02-03 |
| EP2274333A4 (en) | 2011-06-15 |
| WO2009117289A3 (en) | 2010-04-22 |
| CN102037011A (zh) | 2011-04-27 |
| US20120219562A1 (en) | 2012-08-30 |
| CA2717569A1 (en) | 2009-09-24 |
| AU2009225797A1 (en) | 2009-09-24 |
| NZ602511A (en) | 2014-03-28 |
| WO2009117289A2 (en) | 2009-09-24 |
| MX2010010265A (es) | 2010-09-30 |
| EP2810954A3 (en) | 2015-03-18 |
| RU2013132928A (ru) | 2015-01-27 |
| TW201513883A (zh) | 2015-04-16 |
| SG188909A1 (en) | 2013-04-30 |
| TWI461210B (zh) | 2014-11-21 |
| BRPI0908715A2 (pt) | 2016-05-03 |
| HK1203516A1 (en) | 2015-10-30 |
| EP2274333A2 (en) | 2011-01-19 |
| RU2010142309A (ru) | 2012-04-27 |
| EP2810954A2 (en) | 2014-12-10 |
| US20100028363A1 (en) | 2010-02-04 |
| IL208069A0 (en) | 2010-12-30 |
| NZ587765A (en) | 2013-02-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2497545C2 (ru) | Способ лечения псориаза (варианты) | |
| TWI410433B (zh) | 結合人類間白素-12之人類抗體及其製法 | |
| RU2475265C2 (ru) | Способы лечения псориаза | |
| KR20090114368A (ko) | 사람 il-12에 결합하는 사람 항체 및 이의 제조방법 | |
| KR20120112384A (ko) | 건선을 치료하는 방법 | |
| KR20130130713A (ko) | 건선의 치료 방법 | |
| AU2013202849A1 (en) | Methods for treating psoriasis | |
| CN101636080A (zh) | 用于治疗银屑病的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| A201 | Request for examination | ||
| WITB | Written withdrawal of application |