KR101781706B1 - 방향족 이미드 화합물 및 그 제조 방법 - Google Patents
방향족 이미드 화합물 및 그 제조 방법 Download PDFInfo
- Publication number
- KR101781706B1 KR101781706B1 KR1020157014483A KR20157014483A KR101781706B1 KR 101781706 B1 KR101781706 B1 KR 101781706B1 KR 1020157014483 A KR1020157014483 A KR 1020157014483A KR 20157014483 A KR20157014483 A KR 20157014483A KR 101781706 B1 KR101781706 B1 KR 101781706B1
- Authority
- KR
- South Korea
- Prior art keywords
- group
- haloalkyl
- fluorine atom
- compound
- carbon atoms
- Prior art date
Links
- 0 *ON(C(c1cccc2cccc3c12)=O)C3=O Chemical compound *ON(C(c1cccc2cccc3c12)=O)C3=O 0.000 description 1
- KHGLEOCABXBLDW-UHFFFAOYSA-N O=C(c(c1c2cc3)cccc1c3C#Cc1ccccc1)OC2=O Chemical compound O=C(c(c1c2cc3)cccc1c3C#Cc1ccccc1)OC2=O KHGLEOCABXBLDW-UHFFFAOYSA-N 0.000 description 1
- GTMJKAUGQDKDBR-UHFFFAOYSA-N O=C(c(cccc12)c1c1ccc2C#CC2C=CC=CC2)OC1=O Chemical compound O=C(c(cccc12)c1c1ccc2C#CC2C=CC=CC2)OC1=O GTMJKAUGQDKDBR-UHFFFAOYSA-N 0.000 description 1
- WMWVBESKFXRJHE-UHFFFAOYSA-N OC(c(cc1)c2c3cccc2c1Br)OC3=O Chemical compound OC(c(cc1)c2c3cccc2c1Br)OC3=O WMWVBESKFXRJHE-UHFFFAOYSA-N 0.000 description 1
- CJQDLPQUVFDCKC-UHFFFAOYSA-N ON(C(c(c1c2cc3)cccc1c3C#Cc1ccccc1)=O)C2=O Chemical compound ON(C(c(c1c2cc3)cccc1c3C#Cc1ccccc1)=O)C2=O CJQDLPQUVFDCKC-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D221/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00
- C07D221/02—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00 condensed with carbocyclic rings or ring systems
- C07D221/04—Ortho- or peri-condensed ring systems
- C07D221/06—Ring systems of three rings
- C07D221/14—Aza-phenalenes, e.g. 1,8-naphthalimide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/04—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/06—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/0045—Photosensitive materials with organic non-macromolecular light-sensitive compounds not otherwise provided for, e.g. dissolution inhibitors
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/0046—Photosensitive materials with perfluoro compounds, e.g. for dry lithography
Abstract
g 선 및 h 선 등 가시광에 대한 감도가 향상되고, 또한 용해성도 개선된 방향족 이미드 화합물은 식 (1)
[화학식 1]
(식 중, R1 은 탄소수 1 ∼ 7 의 할로알킬기 또는 할로아릴기를 나타내고, R2 는 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 지방족기 또는 방향족기 함유기를 나타내고, R3 은 할로겐 원자 또는 탄화수소기를 나타내고, m 은 0 또는 1 이상의 정수이고, n 은 0 또는 1 이상의 정수이고, m 과 n 의 합계는 1 이상 6 이하이다) 로 나타낸다. 이 화합물은, 예를 들어, 할로겐화나프틸산 무수물과 에티닐벤젠 등의 방향족기 함유 탄화수소의 반응에 의해, 방향족기 함유기로 치환된 무수 나프틸산을 제조하고, 이것을 염산하이드록실아민과 반응시켜, N-하이드록시이미드화시키고, 이어서 트리플루오로술포닐클로라이드 등의 술포닐할라이드와 반응시킴으로써 얻어진다.
[화학식 1]
(식 중, R1 은 탄소수 1 ∼ 7 의 할로알킬기 또는 할로아릴기를 나타내고, R2 는 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 지방족기 또는 방향족기 함유기를 나타내고, R3 은 할로겐 원자 또는 탄화수소기를 나타내고, m 은 0 또는 1 이상의 정수이고, n 은 0 또는 1 이상의 정수이고, m 과 n 의 합계는 1 이상 6 이하이다) 로 나타낸다. 이 화합물은, 예를 들어, 할로겐화나프틸산 무수물과 에티닐벤젠 등의 방향족기 함유 탄화수소의 반응에 의해, 방향족기 함유기로 치환된 무수 나프틸산을 제조하고, 이것을 염산하이드록실아민과 반응시켜, N-하이드록시이미드화시키고, 이어서 트리플루오로술포닐클로라이드 등의 술포닐할라이드와 반응시킴으로써 얻어진다.
Description
본 발명은 방향족 이미드 화합물 및 그 제조 방법에 관한 것이다.
포토 레지스트 재료용 산 발생제는 자외선이나 그 이하의 에너지의 광을 흡수할 수 있는 분자 구조와, 광 흡수에 의한 여기 후에 산을 발생시킬 수 있는 결합을 겸비하는 것이 기대된다. 그러한 산 발생제로서 오늄염 화합물, 옥심 화합물, 아미드 화합물, 이미드 화합물 등이 알려져 있다. 예를 들어, 이미드 화합물로는 방향족 부위가 무치환인 술폰산에스테르가 알려져 있다 (예를 들어, 특허문헌 1 참조).
그러나, 특허문헌 1 등에 기재된 종래의 산 발생제에서는, 장파장의 광을 효율적으로 흡수할 수 없다는 문제가 여전히 있다.
그래서 본 발명은 상기 문제를 해결하기 위하여 이루어진 것으로서, 장파장측의 광을 흡수하여 산을 발생시키는 방향족 이미드 화합물을 제공하는 것을 목적으로 한다. 또, 본 발명은 간편하고 고수율의 방향족 이미드 화합물의 제조 방법을 제공하는 것을 목적으로 한다.
즉, 본 발명은 하기 [1] 또는 [2] 에 기재된 방향족 이미드 화합물 및 하기 [3] 및 [4] 에 기재된 방향족 이미드 화합물의 제조 방법에 관한 것이다.
[1] 하기 식 (1) 로 나타내는 방향족 이미드 화합물.
[화학식 1]
(식 중, R1 은 탄소수 1 ∼ 7 의 할로알킬기 또는 할로아릴기를 나타내고, R2 는 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 지방족기 또는 방향족기 함유기를 나타내고, R3 은 할로겐 원자 또는 탄화수소기를 나타내고, 또 R2 는 인접하는 기가 서로 결합하여 이미드기를 형성해도 되고, m 은 0 또는 1 이상의 정수이고, n 은 0 또는 1 이상의 정수이고, m 과 n 의 합계는 1 이상 6 이하이다)
[2] g 선 (436 ㎚) 및/또는 h 선 (405 ㎚) 의 광을 흡수할 수 있는 상기 [1] 에 기재된 방향족 이미드 화합물.
[3] 식 (1) :
[화학식 2]
(식 중, R1 은 탄소수 1 ∼ 7 의 할로알킬기 또는 할로아릴기를 나타내고, R2 는 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 지방족기 또는 방향족기 함유기를 나타내고, R3 은 할로겐 원자 또는 탄화수소기를 나타내고, 또 R2 는 인접하는 기가 서로 결합하여 이미드기를 형성해도 되고, m 은 0 또는 1 이상의 정수이고, n 은 0 또는 1 이상의 정수이고, m 과 n 의 합계는 1 이상 6 이하이다) 로 나타내는 방향족 이미드 화합물을 제조하는 방법으로서,
(A) 하기 식 (3-1) 및/또는 (3-2) 로 나타내는 화합물을 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 지방족기 또는 방향족기 함유 탄화수소와 반응시켜, 하기 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 제조하는 제 1 공정과,
[화학식 3]
[화학식 4]
(식 중, Z1 및 Z2 는 각각 독립적으로 하이드록실기 또는 알콕시기를 나타내고, X 는 할로겐 원자를 나타내고, m, n, R3 은 상기와 동일한 의미를 나타낸다)
[화학식 5]
[화학식 6]
(식 중, R2, R3, Z1, Z2, m, n 은 상기와 동일한 의미를 나타낸다)
(B) 상기 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 하이드록실암모늄 화합물과 반응시킴으로써, 하기 식 (5) 로 나타내는 화합물을 제조하는 제 2 공정과,
[화학식 7]
(식 중, R2, R3, m, n 은 상기와 동일한 의미를 나타낸다)
(C) 상기 식 (5) 로 나타내는 화합물을 하기 식 (6) 으로 나타내는 화합물과 반응시켜, 상기 식 (1) 로 나타내는 방향족 이미드 화합물을 제조하는 제 3 공정을 포함하는 방향족 이미드 화합물의 제조 방법.
[화학식 8]
(식 중, R1 은 상기와 동일한 의미를 나타내고, Y 는 할로겐 원자 또는 토실기를 나타낸다)
[4] 상기 [3] 에 기재된 방향족 이미드 화합물의 제조 방법에 있어서, 식 (1) 로 나타내는 방향족 이미드 화합물이 g 선 (436 ㎚) 및/또는 h 선 (405 ㎚) 의 광을 흡수할 수 있는 화합물인 것을 특징으로 하는 방향족 이미드 화합물의 제조 방법.
본 발명의 방향족 이미드 화합물은 장파장측의 광을 흡수하여 산을 발생시킬 수 있다. 또, 본 발명의 방향족 이미드 화합물의 제조 방법은 간편하고 고수율이다.
도 1 은 실시예 1 에서 얻어진 N-트리플루오로메탄술포닐옥시-4-페닐에티닐-1,8-나프탈이미드의 열분석에 의한 내열성의 평가 결과를 나타내는 도면이다.
도 2 는 실시예 1 ∼ 5 에서 얻어진 화합물의 흡수 스펙트럼도이다.
도 3 은 실시예 1 ∼ 5 에서 얻어진 각 화합물의 g 선, h 선, i 선의 흡광도를 나타내는 도면이다.
도 4 는 실시예 1 에서 얻어진 화합물을 광 조사하였을 때의 흡수 스펙트럼의 시간 경과적 변화를 나타내는 도면이다.
도 2 는 실시예 1 ∼ 5 에서 얻어진 화합물의 흡수 스펙트럼도이다.
도 3 은 실시예 1 ∼ 5 에서 얻어진 각 화합물의 g 선, h 선, i 선의 흡광도를 나타내는 도면이다.
도 4 는 실시예 1 에서 얻어진 화합물을 광 조사하였을 때의 흡수 스펙트럼의 시간 경과적 변화를 나타내는 도면이다.
이하, 본 발명을 더욱 상세하게 설명한다.
본 발명의 방향족 이미드 화합물은 하기 식 (1) 로 나타낸다. 본 발명의 방향족 이미드 화합물은 장파장측의 광을 흡수하여 산을 발생시킬 수 있다. 또한, 광산 발생제에 있어서의 열안정성이나 합성의 간편성과 같은 특성을 유지한 채로, g 선 및 h 선 등 가시광에 대한 감도가 향상되고, 또한 용해성의 면에서도 종래의 것에 비해 향상되어, 광산 발생제로서 바람직하게 사용할 수 있다.
[화학식 9]
(식 중, R1, R2, R3, m, n 은 상기와 동일한 의미를 나타낸다)
또한, 본 발명의 방향족 이미드 화합물로는, 장파장측의 광으로서, 통상적으로 380 ∼ 830 ㎚ 의 광을 흡수할 수 있고, 그 중에서도 g 선 (436 ㎚), h 선 (405 ㎚), 또는 g 선 및 h 선을 효율적으로 흡수하는 것이 바람직하다. 광을 흡수하는지의 여부는 자외 가시 흡수 스펙트럼에 의해 확인할 수 있다. 또, 산을 발생시킬 수 있는지의 여부는 실시예에 기재된 방법 (산 발생능 평가 시험) 으로 확인할 수 있다.
또, 본 발명의 방향족 이미드 화합물은 단파장측의 광으로서, 380 ㎚ 보다 단파장의 광을 흡수할 수도 있지만, 그 중에서는 i 선 (365 ㎚) 의 광을 효율적으로 흡수할 수 있는 것이 바람직하다.
상기 식 (1) 에 있어서의 R1 은 탄소수 1 ∼ 7 의 할로알킬기 또는 할로아릴기이고, 탄소수 1 ∼ 7 의 알킬기 또는 아릴기의 수소 원자의 일부 또는 전부를 할로겐 원자로 치환시킨 기이다. 그러한 할로겐 원자로는, 불소 원자, 염소 원자, 브롬 원자 또는 요오드 원자를 들 수 있다. 또 상기 탄소수 1 ∼ 7 의 알킬기로는, 직사슬, 분기, 고리형 알킬기가 예시되며, 구체적으로는 메틸기, 에틸기, 프로필기, 부틸기, 펜틸기, 헥실기, 또는 헵틸기 등을 들 수 있다. 또한, 아릴기로는, 구체적으로는 페닐기 또는 톨릴기를 들 수 있다.
상기 식 (1) 에 있어서의 R2 는 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 지방족기 또는 방향족기를 함유하는 기이다. 방향족기로는, 특별히 제한되지 않지만, 구체적으로는 비페닐기, 트리틸기, 스티릴기, 디페닐비닐기, 페닐에티닐기, 나프틸기, 플루오레닐기, 안트라세닐기, 페난트릴기 등을 들 수 있다. 또, 헤테로 원자를 함유하는 방향족기로는, 특별히 제한되지 않지만, 구체적으로는 이하의 화합물을 관능기화시킨 것을 들 수 있다.
[화학식 10]
또, 상기 R2 는 R4-R5- 기로 나타내도 된다. 여기서, R4 는 상기의 치환 혹은 무치환의 지방족기 또는 방향족기, 또는 헤테로 원자를 함유하는 지방족기 또는 방향족기를 나타낸다. 또, R5 는 직접 결합 또는 2 가의 기이며, 특별히 제한되지 않지만, 구체적으로는, 예를 들어, 치환 혹은 무치환의 알킬렌기, 알케닐렌기, 알키닐렌기, 에테르기, 에스테르기, 티오에스테르기, 술폰산에스테르기, 보론산에스테르기, 술파이드기, 디술파이드기, 아미노기, 아미드기, 티오아미드기, 디이미드기, 아조기, 디아조기, 트리아졸기 등을 나타낸다.
상기 알킬렌기로는, 특별히 제한되지 않지만, 구체적으로는, 메틸렌기, 메틸렌옥시메틸렌기, 플루오로메틸렌기, 에틸렌기, 프로필렌기, 테트라메틸렌기 등을 들 수 있다.
알케닐렌기로는, 특별히 제한되지 않지만, 구체적으로는, 비닐렌기, 1-메틸비닐렌기, 프로페닐렌기, 1-부테닐렌기, 2-부테닐렌기, 1-펜테닐렌기, 2-펜테닐렌기 등을 들 수 있다.
알키닐렌기로는, 특별히 제한되지 않지만, 구체적으로는, 에티닐렌기, 프로피닐렌기, 부타닐렌기 등을 들 수 있다.
또, 상기 R4 또는 R5 가 치환되는 경우의 치환기로는, 할로겐 원자, 탄소수 1 ∼ 10 의, 알킬기 및 할로알킬기, 알콕시기 및 할로알콕시기, 치환 혹은 무치환의 아릴기, 아릴옥시기 등을 들 수 있다.
상기 치환기로서의 할로겐 원자로는, 특별히 제한되지 않지만, 예를 들어, 불소 원자, 염소 원자, 브롬 원자 또는 요오드 원자를 들 수 있다. 또, 탄소수 1 ∼ 10 의 알킬기 및 할로알킬기의 구체예로는, 예를 들어, 메틸기, 에틸기, n-프로필기, i-프로필기, n-부틸기, i-부틸기, s-부틸기, t-부틸기, n-아밀기, i-아밀기, s-아밀기, n-헥실기, n-헵틸기, n-옥틸기, n-노닐기, n-데실기, 트리플루오로메틸기, 펜타플루오로에틸기 등을 들 수 있다. 탄소수 1 ∼ 10 의 알콕시기 및 할로알콕시기의 구체예로는, 예를 들어, 메톡시기, 에톡시기, n-프로폭시기, i-프로폭시기, n-부톡시기, n-아밀옥시기, n-옥틸옥시기, n-데실옥시기, 트리플루오로메톡시기, 펜타플루오로에톡시기 등을 들 수 있다. 치환 혹은 무치환의 아릴기 및 아릴옥시기의 구체예로는, 페닐기, 나프틸기, 페녹시기 등을 들 수 있다.
상기 R2 또는 R4 의 치환 혹은 무치환의 방향족기의 구체적인 예로서의 치환 혹은 무치환의 페닐기로는, 특별히 제한되지 않지만, 예를 들어, 페닐기, o-톨릴기, m-톨릴기, p-톨릴기, o-에틸페닐기, m-에틸페닐기, p-에틸페닐기, p-(n-프로필)페닐기, p-(i-프로필)페닐기, p-(n-부틸)페닐기, p-(i-부틸)페닐기, p-(s-부틸)페닐기, p-(t-부틸)페닐기, p-(n-아밀)페닐기, p-(i-아밀)페닐기, p-(t-아밀)페닐기, o-메톡시페닐기, m-메톡시페닐기, p-메톡시페닐기, o-에톡시페닐기, m-에톡시페닐기, p-에톡시페닐기, p-(n-프로폭시)페닐기, p-(i-프로폭시)페닐기, p-(n-부톡시)페닐기, p-(i-부톡시)페닐기, p-(s-부톡시)페닐기, p-(t-부톡시)페닐기, p-(n-아밀옥시)페닐기, p-(i-아밀옥시)페닐기, p-(t-아밀옥시)페닐기, p-클로르페닐기, p-브로모페닐기, p-플루오로페닐기, 2,4-디클로르페닐기, 2,4-디브로모페닐기, 2,4-디플루오로페닐기, 2,4,6-디클로르페닐기, 2,4,6-트리브로모페닐기, 2,4,6-트리플루오로페닐기, 펜타클로로페닐기, 펜타브로모페닐기, 펜타플루오로페닐기, p-비페닐릴기 등을 들 수 있다.
상기 치환 혹은 무치환의 나프틸기로는, 특별히 제한되지 않지만, 구체적으로는, 나프틸기, 2-메틸-1-나프틸기, 3-메틸-1-나프틸기, 4-메틸-1-나프틸기, 5-메틸-1-나프틸기, 6-메틸-1-나프틸기, 7-메틸-1-나프틸기, 8-메틸-1-나프틸기, 1-메틸-2-나프틸기, 3-메틸-2-나프틸기, 4-메틸-2-나프틸기, 5-메틸-2-나프틸기, 6-메틸-2-나프틸기, 7-메틸-2-나프틸기, 8-메틸-2-나프틸기 등을 들 수 있다. 이들 치환 혹은 무치환의 페닐기나 나프틸기는 R2 또는 R4 의 방향족기의 치환기로서의 치환 또는 무치환의 방향족기의 예에도 해당한다.
상기 식 (1) 에 있어서의 R3 의 할로겐 원자로는, 예를 들어, 불소 원자, 염소 원자, 브롬 원자 또는 요오드 원자를 들 수 있다. 또 R3 의 탄화수소기로는, 상기 치환기로서 기재한 알킬기, 할로알킬기, 치환 또는 무치환의 헤테로 원자를 함유해도 되는 방향족 탄화수소기 등을 들 수 있다.
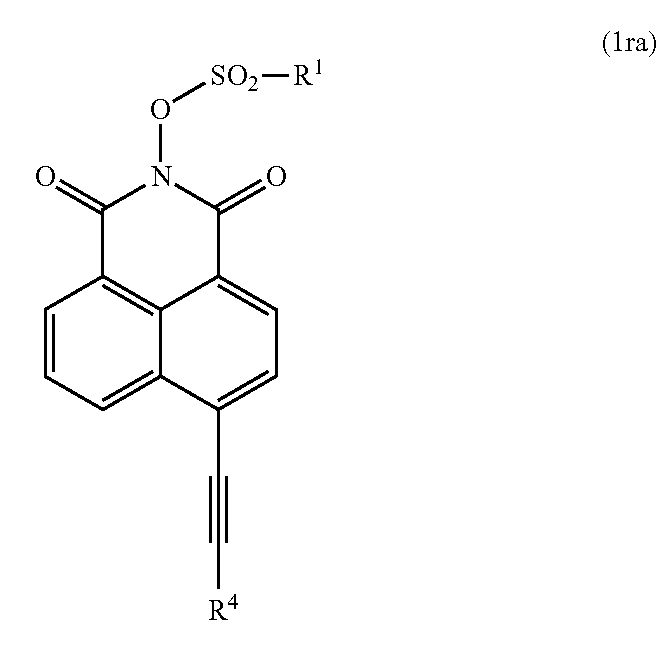
상기 식 (1) 로 나타내는 방향족 이미드 화합물의 구체예로는, 노광에 사용하는 활성광, 그 중에서도 특히 g 선 (436 ㎚) 및 h 선 (405 ㎚) 에 대하여 고감도이고 또한 고효율의 산 발생제로서 기능하고, 범용 유기 용매에 대한 용해성도 양호한 화합물로서, 하기 식 (2) 로 나타내는 방향족 이미드 화합물을 들 수 있다.
[화학식 11]
(식 중, R1, R4 는 상기와 동일한 의미를 나타낸다)
상기 식 (2) 의 R4 로 나타내는 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 방향족기로는, 특별히 제한되지 않지만, 페닐기, 나프틸기, 안트라세닐기, 플루오로페닐기, 메틸페닐기, 메톡시페닐기, 페녹시페닐기, 피리딜기, 티에닐기 등이 합성의 면에서는 바람직한 것이다.
상기 식 (1) 로 나타내는 방향족 이미드 화합물의 구체예로는, 예를 들어, 하기 화학식으로 나타내는 화합물을 들 수 있다.
[화학식 12]
[화학식 13]
[방향족 이미드 화합물의 제조 방법]
본 발명의 방향족 이미드 화합물의 제조 방법은 비교적 적은 공정수로 이루어지고, 각 공정의 반응 및 정제가 비교적 간편하게 실시 가능한 점에서, 간편하고 고수율의 제조 방법이 된다. 즉, 본 발명의 방향족 이미드 화합물의 제조 방법은 상기 식 (1) 로 나타내는 방향족 이미드 화합물을 제조하는 방법으로서, (A) 하기 식 (3-1) 및/또는 (3-2) 로 나타내는 화합물을 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 방향족기 함유 탄화수소와 반응시켜, 하기 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 제조하는 제 1 공정,
[화학식 14]
[화학식 15]
(식 중, m, n, X, R3, Z1 및 Z2 는 상기와 동일한 의미를 나타낸다)
[화학식 16]
[화학식 17]
(식 중, m, n, R2, R3, Z1 및 Z2 는 상기와 동일한 의미를 나타낸다)
(B) 상기 식 (4-1) 및/또는 (4-2) 로 나타낸 화합물을 하이드록실암모늄 화합물과 반응시킴으로써, 하기 식 (5) 로 나타내는 화합물을 제조하는 제 2 공정,
[화학식 18]
(식 중, m, n, R2 및 R3 은 상기와 동일한 의미를 나타낸다)
(C) 상기 식 (5) 로 나타내는 화합물을 하기 식 (6) 으로 나타내는 화합물과 반응시켜, 상기 식 (1) 로 나타내는 방향족 이미드 화합물을 제조하는 제 3 공정을 포함한다.
[화학식 19]
(식 중, R1 및 Y 는 상기와 동일한 의미를 나타낸다)
상기 식 (3-1) 로 나타내는 화합물은, Z1 및 Z2 가 모두 하이드록실기인 경우에는 디카르복실산 화합물을 나타내고, Z1 및 Z2 가 모두 치환기를 갖고 있어도 되는 알콕시기인 경우에는 디에스테르 화합물을 나타내고, Z1 및 Z2 중 어느 일방이 하이드록실기이고, 타방이 치환기를 갖고 있어도 되는 알콕시기인 경우에는 모노카르복실산모노에스테르 화합물을 나타낸다.
상기 식 (3-2) 로 나타내는 화합물은 고리형의 산 무수물의 구조를 갖는데, 제 1 공정의 개시 후에 반응계 중에 있어서 어느 조건하에서 분자 내 개환을 일으키는 경우가 있다. 그 때에는, 반응계 중에 있어서, 식 (3-1) 로 나타내는 화합물의 염을 형성할 수 있기 때문에, 제 1 공정의 반응은 반응 기질이 식 (3-1) 로 나타내는 화합물인 경우와 동일하게 진행된다.
상기 식 (4-1) 로 나타내는 화합물에 있어서도, Z1 및 Z2 가 모두 하이드록실기인 경우에는 디카르복실산 화합물을 나타내고, Z1 및 Z2 가 모두 치환기를 갖고 있어도 되는 알콕시기인 경우에는 디에스테르 화합물을 나타내고, Z1 및 Z2 중 어느 일방이 하이드록실기이고, 타방이 치환기를 갖고 있어도 되는 알콕시기인 경우에는 모노카르복실산모노에스테르 화합물을 나타낸다.
상기 식 (4-2) 로 나타내는 화합물은 고리형의 산 무수물의 구조를 갖는데, 제 2 공정의 개시 후에 반응계 중에 있어서 분자 내 개환을 일으킨다. 그 때에는, 반응계 중에 있어서, 식 (4-1) 로 나타내는 화합물의 염을 형성할 수 있기 때문에, 제 2 공정의 반응은 반응 기질이 식 (4-1) 로 나타내는 화합물인 경우와 동일하게 진행된다.
상기 Z1 및 Z2 에 있어서, 치환기를 갖고 있어도 되는 알콕시기는 특별히 제한되지 않지만, 메톡시기, 에톡시기, 프로폭시기, 이소프로폭시기, 또는 tert-부톡시기 등이 합성의 면에서는 바람직하다.
상기 식 (3-1) 및 식 (3-2) 에 있어서, X 의 할로겐 원자로는, 예를 들어, 불소 원자, 염소 원자, 브롬 원자 또는 요오드 원자를 들 수 있다. 또 X 와의 반응에 사용되는 헤테로 원자로 탄소 원자가 치환되어도 되는 탄화수소로는, 하이드록실기, 메르캅토기, 아미노기, 카르보닐기, 카르복실기, 아실기, 아미드기, 이미노기, 아조기, 니트로기, 시아노기, 술포기, 포스파이드기 등을 갖고 있어도 되는 탄화수소를 들 수 있다.
상기 식 (6) 중, Y 의 할로겐 원자로는, 예를 들어, 불소 원자, 염소 원자, 브롬 원자 또는 요오드 원자를 들 수 있다.
[제 1 공정]
제 1 공정은 식 (3-1) 및/또는 (3-2) 로 나타내는 화합물을 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 지방족기 또는 방향족기 함유 탄화수소와 반응시켜, 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 제조하는 공정이다.
제 1 공정에서는, 특별히 한정되지 않지만, 커플링 반응, 부가 반응, 티오에테르화 반응, 또는 축합 반응 등을 합목적적으로 실시할 수 있다.
제 1 공정에 있어서, 커플링 반응 또는 부가 반응을 실시하는 경우에는, 식 (3-1) 및/또는 (3-2) 로 나타내는 화합물을 지방족기 또는 방향족기 함유 탄화수소의 관능기와 반응시켜 탄소-탄소 결합을 구축하여, 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 제조한다. 단, 디아조 커플링 반응을 실시하는 경우에는 디아조 결합을, 고리화 부가 반응을 실시하는 경우에는 복소 고리 구조를 구축하여, 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 제조한다. 또, 티오에테르화 반응을 실시하는 경우에는, 식 (3-1) 및/또는 (3-2) 로 나타내는 화합물을 방향족기 함유 탄화수소의 관능기와 반응시켜, 술파이드 결합 또는 디술파이드 결합 등을 구축하여, 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 제조한다. 또, 축합 반응을 실시하는 경우에는, 식 (3-1) 및/또는 (3-2) 로 나타내는 화합물을 지방족기 또는 방향족기 함유 탄화수소의 관능기와 반응시켜, 에스테르 결합, 티오에스테르 결합, 황산에스테르 결합, 질산에스테르 결합, 인산에스테르 결합, 아미드 결합, 또는 이미드 결합 등을 구축하여, 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 제조한다.
상기 반응의 종류에 따라, 제 1 공정의 반응 온도는 25 ∼ 60 ℃ 가 바람직하다. 또, 반응 시간은 1 ∼ 5 시간이 바람직하다. 또한, 반응은 무용매 혹은 용매 중에서 실시할 수 있다. 그러한 용매로는 특별히 제한되지 않지만, 구체적으로는, 벤젠, 톨루엔, 자일렌, 에틸벤젠, 메시틸렌과 같은 방향족 탄화수소계 용매 ; 디에틸에테르, n-부틸에테르, 아니솔, 디페닐에테르, 테트라하이드로푸란, 디옥산, 비스(2-메톡시에틸)에테르, 1,2-비스(2-메톡시에톡시)에탄과 같은 에테르계 용매 ; 디클로로메탄, 클로로포름과 같은 함할로겐 용매 ; N-메틸피롤리돈, 디메틸포름아미드, 디메틸아세트아미드와 같은 유기 극성 용매 ; 및 이들의 혼합 용매를 사용할 수 있다. 또, 상기 반응의 종류에 따라, 적절히 반응 촉매, 무기 혹은 유기 염기, 또는 무기산 혹은 유기산을 사용해도 된다. 반응 압력은 감압, 상압, 가압 중 어느 것이어도 상관없지만, 반응 온도가 용매의 비점보다 높은 경우에는 내압의 반응 용기를 사용하여 가압 반응을 실시하는 것이 바람직하다.
식 (3-1) 및/또는 (3-2) 로 나타내는 화합물과 방향족기 함유 탄화수소의 반응 개시시의 몰비 ([식 (3-1) 및/또는 (3-2) 로 나타내는 화합물의 몰수]/[지방족기 또는 방향족기 함유 탄화수소의 몰수]) 로는, 10/90 ∼ 90/10 이 바람직하고, 25/75 ∼ 75/25 가 보다 바람직하고, 40/60 ∼ 60/40 이 더욱 바람직하다.
식 (4-1) 및/또는 (4-2) 로 나타내는 화합물의 정제 분리 방법으로는, 특별히 제한되지 않지만, 단일 또는 2 종의 상이한 용매를 사용하는 재침전으로 실시할 수 있다.
제 1 공정에 있어서, 식 (3-1) 및/또는 (3-2) 중의 X 부위와 반응하는 치환 혹은 무치환의 헤테로 원자를 함유해도 되는 지방족기 및/또는 방향족기 함유 탄화수소로는, 반응 후에 상기 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물의 R2 기를 형성하는 화합물이면 특별히 제한되지 않지만, 예를 들어, 이하의 화학식으로 나타내는 화합물을 들 수 있다.
[화학식 20]
제 1 공정은 반응 후에 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 제조하는 공정이면 특별히 제한되지 않으며, 반응 기질이 식 (3-1) 로 나타내는 화합물인지, 식 (3-2) 로 나타내는 화합물인지의 차이나, 혹은 반응 기질이 식 (3-1) 로 나타내는 화합물인 경우에 그것이 디카르복실산 화합물인지, 디에스테르 화합물인지, 모노카르복실산모노에스테르 화합물인지의 차이에 의해, 반응에 대한 적성이 현저하게 변화하지는 않는다.
또한, 제 1 공정에서는, 반응 기질로서 식 (3-2) 로 나타내는 화합물을 적용한 경우에도, 반응 후에 식 (4-1) 로 나타내는 화합물을 생성하는 경우도 있지만, 이와 같이 하여 얻어진 생성물도 제 2 공정의 반응 기질로서 적용할 수 있다.
[제 2 공정]
제 2 공정은 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물을 하이드록실암모늄 화합물과 반응시켜, 식 (5) 로 나타내는 화합물을 제조하는 공정이다. 제 2 공정의 반응에서는, 식 (4-1) 및/또는 (4-2) 로 나타내는 화합물의 카르복실 부위를 하이드록실암모늄 화합물과 반응시켜, 식 (5) 로 나타내는 화합물을 제조한다.
제 2 공정의 반응 온도는 70 ∼ 90 ℃ 가 바람직하다. 또, 반응 시간은 6 ∼ 12 시간이 바람직하다. 또한, 반응은 무용매 혹은 용매 중에서 실시할 수 있다. 그러한 용매로는 특별히 제한되지 않지만, 구체적으로는, 제 1 공정에서 예시한 것을 사용할 수 있다. 또 적절히 무기 또는 유기 염기를 사용해도 된다. 반응 압력은 감압, 상압, 가압 중 어느 것이어도 상관없지만, 반응 온도가 용매의 비점보다 높은 경우에는 내압의 반응 용기를 사용하여 가압 반응을 실시하는 것이 바람직하다.
식 (4-1) 및/또는 (4-2) 로 나타내는 화합물과 하이드록실암모늄 화합물의 반응 개시시의 몰비 ([식 (4-1) 및/또는 (4-2) 로 나타내는 화합물의 몰수]/[하이드록실암모늄 화합물의 몰수]) 로는, 10/90 ∼ 90/10 이 바람직하고, 25/75 ∼ 75/25 가 보다 바람직하고, 40/60 ∼ 60/40 이 더욱 바람직하다.
식 (5) 로 나타내는 화합물의 정제 분리 방법으로는, 특별히 제한되지 않지만, 단일 또는 2 종의 상이한 용매를 사용하는 재침전으로 실시할 수 있다.
하이드록실암모늄 화합물로는, 특별히 제한되지 않지만, 구체적으로는, 하이드록실암모늄클로라이드, 하이드록실암모늄술페이트, 하이드록실암모늄포스페이트, 하이드록실암모늄아세테이트, 하이드록실암모늄옥살레이트 등을 들 수 있다. 또, 하이드록실암모늄 화합물을 사용하는 대신에, 무기산과 하이드록실아민 등의 복수의 시약을 사용함으로써 반응계 중에서 암모늄염을 발생시켜도 된다.
또한, 제 2 공정은 반응 후에 식 (5) 로 나타내는 화합물을 제조하는 공정이면 특별히 제한되지 않으며, 반응 기질이 식 (4-1) 로 나타내는 화합물인지, 식 (4-2) 로 나타내는 화합물인지의 차이나, 혹은 반응 기질이 식 (4-1) 로 나타내는 화합물인 경우에 그것이 디카르복실산 화합물인지, 디에스테르 화합물인지, 모노카르복실산모노에스테르 화합물인지의 차이에 의해, 반응에 대한 적성이 현저하게 변화하지는 않는다.
[제 3 공정]
제 3 공정은 식 (5) 로 나타내는 화합물을 식 (6) 으로 나타내는 화합물과 반응시켜, 식 (1) 로 나타내는 방향족 이미드 화합물을 제조하는 공정이다. 제 3 공정의 반응은 축합 반응이며, 식 (5) 로 나타내는 화합물의 하이드록실기를 술포닐할라이드와 반응시켜, 식 (1) 로 나타내는 방향족 이미드 화합물을 제조한다.
제 3 공정의 반응 온도는 0 ∼ 40 ℃ 가 바람직하다. 또, 반응 시간은 2 ∼ 4 시간이 바람직하다. 반응 압력은 감압, 상압, 가압 중 어느 것이어도 상관없지만, 반응 온도가 용매의 비점보다 높은 경우에는, 내압의 반응 용기를 사용하여 가압 반응을 실시하는 것이 바람직하다.
또한, 반응은 무용매 혹은 용매 중에서 실시할 수 있다. 그러한 용매로는 특별히 제한되지 않지만, 구체적으로는, 제 1 공정에서 예시한 것을 사용할 수 있다. 또 적절히 반응 촉매를 사용해도 된다.
식 (6) 으로 나타내는 플루오로알킬 혹은 플루오로아릴술폰산 할로겐화물로는, 특별히 제한되지 않지만, 구체적으로는, 트리플루오로메틸술포닐클로라이드, 펜타플루오로에틸술포닐클로라이드, 헵타플루오로 n-프로필술포닐클로라이드, 헵타플루오로이소프로필술포닐클로라이드, 노나플루오로 n-부틸술포닐클로라이드, 노나플루오로이소부틸술포닐클로라이드, 퍼플루오로 n-펜틸술포닐클로라이드, 퍼플루오로이소펜틸술포닐클로라이드, 퍼플루오로 n-헥실술포닐클로라이드, 퍼플루오로이소 헥실술포닐클로라이드, 퍼플루오로 n-헵틸술포닐클로라이드, 퍼플루오로이소헵틸술포닐클로라이드, 펜타플루오로페닐술포닐클로라이드 등을 들 수 있다. 또, 식 (6) 으로 나타내는 화합물 대신에, 술폰산 무수물을 사용하거나, 술폰산과 염화티오닐 등의 복수의 시약을 사용함으로써, 반응계 중에서 술포닐클로라이드 화합물을 발생시켜도 된다.
식 (5) 로 나타내는 화합물과 식 (6) 으로 나타내는 화합물의 반응 개시시의 몰비 ([식 (5) 로 나타내는 화합물]/[식 (6) 으로 나타내는 화합물]) 로는, 10/90 ∼ 90/10 이 바람직하고, 25/75 ∼ 75/25 가 보다 바람직하고, 40/60 ∼ 60/40 이 더욱 바람직하다.
식 (6) 으로 나타내는 화합물의 정제 분리 방법으로는, 특별히 제한되지 않지만, 단일 또는 2 종의 상이한 용매를 사용하는 재침전으로 실시할 수 있다.
식 (1) 로 나타내는 방향족 이미드 화합물은 산 발생제, 특히 g 선 및 h 선, 또는 이들을 포함하는 브로드밴드 노광용 활성광에 대하여 고감도이고 또한 고효율의 산 발생제로서 유용하다.
실시예
이하에 실시예를 들어 본 발명을 더욱 구체적으로 설명하는데, 본 발명은 이들 실시예에 의해 조금도 한정되는 것은 아니다.
실시예에 있어서의 각 물성의 측정 장치 및 측정 조건은 이하와 같다.
[1] 질량 분석
장치 : LCQ Advantage MAX (Thermo Fisher Scientific 사 제조)
검출법 : ESI 법
측정 용매 : 아세트산암모늄 수용액·아세토니트릴
[2] 1H NMR
장치 : JNM-EX400 (JEOL 사 제조)
측정 용매 : CDCl3, Acetone-d6, 또는 DMSO-d6
[3] 자외 가시 흡광 스펙트럼
기종 : Varian Cary4000 (Agilent Technologies 사 제조)
측정 용매 : 디클로로메탄
[4] 열분석
장치 : EXSTAR6000 TG/DTA6200 (Seiko Instruments Inc. 사 제조)
실시예 1
[제 1 공정 : 4-페닐에티닐-1,8-나프탈릭안하이드라이드의 합성]
[화학식 21]
교반기, 질소 가스 도입관 및 온도계를 구비한 1 ℓ 3 구 플라스크에 반응 기질로서 4-브로모-1,8-나프탈릭안하이드라이드 (화합물 7) 5.0 g (18 m㏖), 반응시약으로서 에티닐벤젠 2.3 g (23 m㏖), 트리페닐포스핀 0.24 g (0.9 m㏖), 비스(트리페닐포스핀)팔라듐 (Ⅱ) 디클로라이드 0.63 g (0.9 m㏖), 요오드화구리 (Ⅰ) 0.17 g (0.9 m㏖), 및 트리에틸아민 18 ㎖, 반응 용매로서 탈수 디메틸포름아미드 180 ㎖ 를 넣고, 질소 가스를 유입시키면서 실온에서 30 분간 교반한 후, 온도를 55 ℃ 로 높여 2 시간 반응시켰다. 반응 종료 후, 트리에틸아민 및 디메틸포름아미드를 감압 증류 제거하고, 재침전, 감압 건조에 의해 4-페닐에티닐-1,8-나프탈릭안하이드라이드 (화합물 8) 의 담황색 분말 5.1 g (수율 95 %) 이 얻어졌다.
상기 생성물이 화합물 8 인 것을 이하 1H-NMR 의 해석에 의해 동정하였다. 또한, 대응하는 수소 원자에 대해 이탤릭체로 나타냈다.
[수학식 1]
[제 2 공정 : N-하이드록시-4-페닐에티닐-1,8-나프탈이미드의 합성]
[화학식 22]
교반기, 환류 냉각관 및 온도계를 구비한 500 ㎖ 1 구 플라스크에 반응 기질로서 화합물 8 3.6 g (12 m㏖), 반응 시약으로서 염산하이드록실아민 1.7 g (24 m㏖) 및 탄산수소나트륨 3.1 g, 반응 용매로서 에탄올 300 ㎖ 를 넣고, 85 ℃ 에서 환류시키면서 12 시간 반응시켰다. 반응 종료 후, 1 N 염산 중에 생성물을 재침전시켜 여과 채취하고, 수세한 후 감압 건조에 의해 N-하이드록시-4-페닐에티닐-1,8-나프탈이미드 (화합물 9) 의 담황색 고체 3.5 g (수율 98 %) 이 얻어졌다.
상기 생성물이 화합물 9 인 것을 이하 1H-NMR 의 해석에 의해 동정하였다. 또한, 대응하는 수소 원자에 대해 이탤릭체로 나타냈다.
[수학식 2]
[제 3 공정 : N-트리플루오로메탄술포닐옥시-4-페닐에티닐-1,8-나프탈이미드의 합성]
[화학식 23]
빙욕, 교반기, 질소 가스 도입관 및 온도계를 구비한 300 ㎖ 3 구 플라스크에 반응 기질로서 화합물 9 6.8 g (22 m㏖), 반응 용매로서 탈수 피리딘 120 ㎖ 를 넣고, 질소 가스를 유입시키면서 실온에서 충분히 용해시켰다. 그 후, 빙욕에서 0 ℃ 를 유지하면서, 반응 시약으로서 트리플루오로메탄술포닐클로라이드 7.3 g (43 m㏖) 을 적하하여 30 분간 교반한 후 실온으로 되돌려 2 시간 반응시켰다. 반응 종료 후, 순수 중에 생성물을 재침전시켜 여과 채취 건조시키고, 디클로로메탄 및 헥산 또는 에탄올로 재침전시키고, 감압 건조에 의해 N-트리플루오로메탄술포닐옥시-4-페닐에티닐-1,8-나프탈이미드 (화합물 1H) 의 담황색 고체 6.6 g (수율 69 %) 이 얻어졌다.
상기 생성물이 화합물 1H 인 것을 이하 1H-NMR 의 해석 및 질량 분석에 의해 동정하였다. 또한, 대응하는 수소 원자에 대해 이탤릭체로 나타냈다.
[수학식 3]
상기 실시예에 의해 얻어진 화합물 1H 에 대해, 열분석에 의해 내열성의 평가를 실시하였다. 결과를 도 1 에 나타낸다. 또한, 비교예로는, N-트리플루오로메탄술포닐옥시-1,8-나프탈이미드 (토요 합성 공업 주식회사 제조) 를 사용하였다.
실시예 2 ∼ 5
실시예 1 의 제 1 공정 ∼ 제 3 공정의 기질, 반응 시약, 그들의 사용량은 이하 표 1 의 실시예 2 ∼ 5 에 기재된 바와 같이 하고, 그 밖에는 실시예 1 의 제 1 공정 ∼ 제 3 공정과 동일하게 하여 반응을 실시함으로써, 각 공정에서의 각 생성물을 표 1 에 기재된 양과 수율로 얻었다. 표 중의 화합물 8F, 8MeO, 8PhO, 8Th, 9F, 9MeO, 9PhO, 9Th, 1F, 1MeO, 1PhO, 1Th 는, 이하에 나타내는 바와 같이, 화합물 8r, 9r, 1r 에 있어서, 각각 R 이 페닐기, 3-플루오로페닐기, 4-메톡시페닐기, 4-페녹시페닐기, 3-티에닐기인 화합물을 나타낸다.
[화학식 24]
상기 화합물 1F 가 얻어진 것을 이하 1H-NMR 의 해석 및 질량 분석에 의해 확인하였다. 또한, 대응하는 수소 원자에 대해 이탤릭체로 나타냈다.
[수학식 4]
상기 화합물 1MeO 가 얻어진 것을 이하 1H-NMR 의 해석 및 질량 분석에 의해 확인하였다. 또한, 대응하는 수소 원자에 대해 이탤릭체로 나타냈다.
[수학식 5]
상기 화합물 1PhO 가 얻어진 것을 이하 1H-NMR 의 해석 및 질량 분석에 의해 확인하였다. 또한, 대응하는 수소 원자에 대해 이탤릭체로 나타냈다.
[수학식 6]
상기 화합물 1Th 가 얻어진 것을 이하 1H-NMR 의 해석 및 질량 분석에 의해 확인하였다. 또한, 대응하는 수소 원자에 대해 이탤릭체로 나타냈다.
[수학식 7]
상기 실시예 1 ∼ 5 에 의해 얻어진 화합물에 대해, 각각 흡수 스펙트럼을 측정하였다. 결과를 도 2 에 나타낸다. 또, 각 화합물의 g 선, h 선, i 선의 흡광도는 하기 표 3 및 도 3 에 나타내는 바와 같았다. 또한, 비교예로는, N-트리플루오로메탄술포닐옥시-1,8-나프탈이미드를 사용하였다.
상기 실시예에 의해 얻어진 화합물이 광 조사하에서 산 발생제로서 기능하는지의 여부를 하기 장치를 사용하여 하기 수법 (산 발생능 평가 시험) 에 의해 평가하였다. 실제의 평가에는, 화합물 1H 를 사용하였다. 평가시에 사용된 장치는 이하와 같은 것이다.
[1] 자외 가시 흡광 스펙트럼
기종 : Varian Cary4000 (Agilent Technologies 사 제조)
측정 용매 : 디클로로메탄
[2] 핸디 UV 램프
기종 : SLUV-4 (애즈원 주식회사)
사용 파장 : 365 ㎚
[평가 수법]
(1) 상기 화합물 1H 의 20 ㎕ 디클로로메탄 용액을 조제하고, pH 프로브로서 브로모크레졸 그린 (BCG) 50 % 에탄올 용액을 수 방울 첨가하였다.
(2) 흡수 스펙트럼을 측정하고, 300 ∼ 400 ㎚ 에 화합물 1H, 630 ㎚ 부근에 BCG 의 흡수 극대가 각각 있는 것을 확인하였다 (진한청색 용액).
(3) 상기 (2) 의 용액에 UV 램프로 광 조사하면서, 2 분마다 흡수 스펙트럼을 측정하였다. 이 때, 산 발생에 의한 계의 pH 저하에 수반하여, BCG 의 스펙트럼의 흡수 극대가 감쇠되는 경과와, 용액이 나타내는 진한청색이 퇴색되는 모습을 육안으로 관찰하였다.
상기 실시예에 있어서 적용한 광 조사의 조건은 가용성의 면에 있어서 광원을 UV 램프로 하고, 최대 한계 파장으로서 상기 파장을 사용한 것이다. 결과를 도 4 에 나타낸다.
또한, 상기 화합물 1H 를 사용하여, 포토 레지스트 조성물 I 를 제조하였다. 포토 레지스트 조성물은 하이드록시스티렌, 스티렌 및 tert-부틸아크릴레이트가 중합된 단위를 갖는 터폴리머 수지, 테트라부틸암모늄하이드록사이드 (상기 수지의 0.3 중량%), m,p-크레졸 노볼락 레진 (상기 수지의 33 중량%), 폴리프로필렌글리콜모노부틸에테르 (상기 수지의 8.0 중량%), 폴리비닐에테르 (상기 수지의 8.0 중량%), 계면 활성제 (전체 고형분의 0.12 중량%), 화합물 1H (상기 수지의 1.5 중량%), 용매 (프로필렌글리콜-1-모노메틸에테르-2-아세테이트) 로 이루어진다.
또한, 상기 포토 레지스트 조성물의 비교예로서, 화합물 1H 대신에 N-트리플루오로메탄술포닐옥시-1,8-나프탈이미드 (토요 합성 공업 주식회사 제조) 를 사용한 것 이외에는, 상기와 동일하게 하여 제조한 포토 레지스트 조성물을 사용하였다.
상기 화합물 1H 를 사용한 포토 레지스트 조성물과 비교예의 포토 레지스트 화합물을 사용한 리소그래피 시험을 각각 실시하고, g 선, h 선을 포함하는 브로드밴드 노광시의 레지스트 패터닝 성능을 평가하였다. 실시예에 사용한 장치 및 실시 조건은 이하와 같다.
[1] 코터
장치 : DSW-636BPV (다이닛폰 스크린 제조사 제조)
[2] 노광기 (콘택트 얼라이너)
장치 : MA-200/ML (SUSS MicroTec 사 제조)
광원 : 브로드밴드 광원
[3] 주사 전자 현미경 (SEM)
기종 : S-4700 (히타치 제작소사 제조)
[평가 수법]
HMDS 처리한 실리콘 웨이퍼 상에 상기 포토 레지스트 조성물을 도포하고, 135 ℃ 에서 360 초간 베이크하여, 50 미크론의 막두께의 레지스트 필름을 얻었다. 이 웨이퍼를 콘택트 홀 패턴 마스크를 사용하여 1200 및 1500 mJ/㎠ 의 선량으로 노광하였다. 이 웨이퍼를 105 ℃ 에서 100 초간 베이크한 후, AZ 300MIF 디벨로퍼 (2.38 % TMAH) 를 사용하여 딥 방식으로 210 초간 현상하였다. 그 후, 웨이퍼 상에 형성된 패턴을 주사 전자 현미경으로 관찰하여, 필름 표면에 있어서의 홀 사이즈를 계측하였다. 이하 표 3 에 30 ㎛ 1 : 1 콘택트 홀 패턴의 홀 사이즈 계측 결과에 대해 기재한다 (홀 사이즈 단위 : ㎛).
상기 리소그래피 시험의 결과로부터, 상기 포토 레지스트 조성물 I 는, 각 노광 선량에 있어서, 비교예를 상회하는 홀 사이즈의 패턴 형성을 기록하였다. 이 결과는, 포토 레지스트 조성물 I 에 함유되는 상기 화합물 1H 가 노광의 광원에 장파장측의 광이 포함되는 경우에 보다 우수한 산 발생제로서 기능함을 나타내고 있다.
지금까지 서술해 온 실시형태는 단순한 예시에 불과하며, 본 발명의 특허청구범위에 기재된 기술적 사상과 실질적으로 동일한 구성을 갖고, 동일한 작용 효과를 발휘하는 것은 어떠한 것이라도 본 발명의 기술적 범위에 포함된다.
Claims (15)
- 제 1 항에 있어서, 메틸렌 클로라이드 중 용액 중의 상기 방향족 이미드 화합물의 용액의 자외선 흡수 분광학을 사용하여 측정되는 바와 같이 g 선 (436 ㎚), h 선 (405 ㎚), 또는 g 선 (436 ㎚) 및 h 선 (405 ㎚) 의 광을 흡수할 수 있고, 브로모크레졸 그린의 첨가가 상기 용액에 진한청색을 부여하고, 추가로 상기 광으로의 조사시, 용액이 pH 저하를 나타내는 진한청색의 퇴색, 및 g 선 (436 ㎚), h 선 (405 ㎚), 또는 g 선 (436 ㎚) 및 h 선 (405 ㎚) 에서 자외선 분광학에 의해 측정되는 흡수 극대의 감쇠 모두를 보여주는 산 발생제.
- 제 1 항에 있어서, R1 이 탄소수 1 ∼ 7 의 할로알킬기를 나타내는 산 발생제.
- 제 3 항에 있어서, R5 가 알키닐렌기인 산 발생제.
- 제 5 항에 있어서, R1 이 탄소수 1 ∼ 7 의 할로알킬기를 나타내는 산 발생제.
- 삭제
- 제 5 항에 있어서, 탄소수 1 ∼ 7 의 할로알킬기 또는 할로아릴에 있어서, 할로 잔기가 불소 원자이고, 추가로 할로알킬의 알킬기 또는 할로아릴기의 아릴 중의 수소 원자의 일부 또는 전부 각각이 불소 원자로 치환되고, 추가로 할로알킬의 알킬기가 직사슬 알킬, 분기 알킬 및 고리형 알킬기로 이루어지는 군으로부터 선택되는 산 발생제.
- 제 5 항에 있어서, 탄소수 1 ∼ 7 의 할로알킬기 또는 할로아릴에 있어서, 할로 잔기가 불소 원자이고, 추가로 할로알킬의 알킬기 또는 할로아릴기의 아릴 중의 수소 원자의 일부 또는 전부 각각이 불소 원자로 치환되고, 추가로 할로알킬의 알킬기가 메틸기, 에틸기, 프로필기, 부틸기, 펜틸기, 헥실기, 및 헵틸기로 이루어지는 군으로부터 선택되고, 추가로 할로아릴의 아릴기가 페닐 또는 톨릴로부터 선택되는 산 발생제.
- 제 5 항에 있어서, R1 이 탄소수 1 ∼ 7 의 할로알킬기이고, 상기 할로알킬에 있어서 할로 잔기가 불소 원자이고 추가로 할로알킬의 알킬기 중의 수소 원자의 일부 또는 전부가 불소 원자로 치환되고, 추가로 할로알킬의 알킬기가 메틸기, 에틸기, 프로필기, 부틸기, 펜틸기, 헥실기, 및 헵틸기로 이루어지는 군으로부터 선택되는 산 발생제.
- 제 11 항에 있어서, 탄소수 1 ∼ 7 의 할로알킬기에 있어서, 할로 잔기가 불소 원자이고, 추가로 할로알킬의 알킬기 또는 할로아릴기의 아릴 중의 수소 원자의 일부 또는 전부 각각이 불소 원자로 치환되고, 추가로 할로알킬 중의 알킬기가 직사슬 알킬, 분기 알킬 및 고리형 알킬기로 이루어지는 군으로부터 선택되는 산 발생제.
- 제 11 항에 있어서, 탄소수 1 ∼ 7 의 할로알킬기에 있어서, 할로 잔기가 불소 원자이고, 추가로 할로알킬의 알킬기, 또는 할로아릴기의 아릴 중의 수소 원자의 일부 또는 전부 각각이 불소 원자로 치환되고, 추가로 할로알킬의 알킬기가 메틸기, 에틸기, 프로필기, 부틸기, 펜틸기, 헥실기, 및 헵틸기로 이루어지는 군으로부터 선택되고, 추가로 할로아릴의 아릴기가 페닐 또는 톨릴로부터 선택되는 산 발생제.
- 제 11 항에 있어서, R1 이 탄소수 1 ∼ 7 의 할로알킬기이고, 할로 잔기가 불소 원자이고, 추가로 할로알킬의 알킬기 중의 수소 원자의 일부 또는 전부 각각이 불소 원자로 치환되고, 추가로 할로알킬의 알킬기가 메틸기, 에틸기, 프로필기, 부틸기, 펜틸기, 헥실기, 및 헵틸기로 이루어지는 군으로부터 선택되는 산 발생제.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012248648A JP5990447B2 (ja) | 2012-11-12 | 2012-11-12 | 芳香族イミド化合物及びその製造方法 |
| JPJP-P-2012-248648 | 2012-11-12 | ||
| PCT/JP2013/079140 WO2014073409A1 (ja) | 2012-11-12 | 2013-10-28 | 芳香族イミド化合物及びその製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20150087846A KR20150087846A (ko) | 2015-07-30 |
| KR101781706B1 true KR101781706B1 (ko) | 2017-09-25 |
Family
ID=50684518
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157014483A KR101781706B1 (ko) | 2012-11-12 | 2013-10-28 | 방향족 이미드 화합물 및 그 제조 방법 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US9505721B2 (ko) |
| JP (1) | JP5990447B2 (ko) |
| KR (1) | KR101781706B1 (ko) |
| CN (1) | CN104797560B (ko) |
| DE (1) | DE112013005388T5 (ko) |
| MY (1) | MY170486A (ko) |
| SG (1) | SG11201503108WA (ko) |
| TW (1) | TWI610921B (ko) |
| WO (1) | WO2014073409A1 (ko) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6137862B2 (ja) * | 2013-02-20 | 2017-05-31 | アーゼッド・エレクトロニック・マテリアルズ(ルクセンブルグ)ソシエテ・ア・レスポンサビリテ・リミテ | ネガ型感光性シロキサン組成物 |
| US9383644B2 (en) * | 2014-09-18 | 2016-07-05 | Heraeus Precious Metals North America Daychem LLC | Sulfonic acid derivative compounds as photoacid generators in resist applications |
| US9477150B2 (en) * | 2015-03-13 | 2016-10-25 | Heraeus Precious Metals North America Daychem LLC | Sulfonic acid derivative compounds as photoacid generators in resist applications |
| KR102021456B1 (ko) * | 2015-08-21 | 2019-09-16 | 헤레우스 프레셔스 메탈즈 노스 아메리카 데이켐 엘엘씨 | 레지스트 적용에서 광산 발생제로서 술폰산 유도체 화합물 |
| EP3182203A1 (en) | 2015-12-18 | 2017-06-21 | Heraeus Precious Metals North America Daychem LLC | A combination of nit derivatives with sensitizers |
| KR102130135B1 (ko) * | 2017-09-04 | 2020-07-03 | 주식회사 엘지화학 | 다기능성 광산발생제 및 이를 포함하는 후막용 포토레지스트 조성물 |
| KR102129049B1 (ko) | 2017-09-11 | 2020-07-01 | 주식회사 엘지화학 | 광산 발생제 및 이를 포함하는 후막용 화학 증폭형 포지티브 타입 포토레지스트 조성물 |
| KR102146095B1 (ko) | 2017-09-15 | 2020-08-19 | 주식회사 엘지화학 | 화학증폭형 포토레지스트 조성물, 포토레지스트 패턴, 및 포토레지스트 패턴 제조방법 |
| CN110041317B (zh) * | 2019-05-16 | 2022-01-04 | 福州大学 | 一种萘酰亚胺荧光探针及其制备与应用 |
| CN112558409B (zh) * | 2019-09-25 | 2022-05-20 | 常州强力先端电子材料有限公司 | 能够在i线高产酸的磺酰亚胺类光产酸剂 |
| WO2021057813A1 (zh) * | 2019-09-25 | 2021-04-01 | 常州强力先端电子材料有限公司 | 磺酰亚胺类光产酸剂、感光性树脂组合物、图形化方法及感光性树脂组合物的应用 |
| CN112552280A (zh) * | 2019-09-25 | 2021-03-26 | 常州强力先端电子材料有限公司 | 一种高产酸的磺酰亚胺类光产酸剂 |
| CN112094232B (zh) * | 2020-09-18 | 2022-04-08 | 河北凯力昂生物科技有限公司 | 一种n-羟基萘酰亚胺甲磺酸酯的合成方法 |
| CN112094231B (zh) * | 2020-09-18 | 2022-04-08 | 河北凯力昂生物科技有限公司 | 一种n-羟基萘酰亚胺三氟甲磺酸酯的合成方法 |
| CN114516863A (zh) * | 2020-11-19 | 2022-05-20 | 常州强力电子新材料股份有限公司 | 一种高产酸的酰亚胺磺酸酯类光产酸剂、组合物及应用 |
| CN117658997A (zh) * | 2022-08-26 | 2024-03-08 | 常州强力先端电子材料有限公司 | 磺酸酯类光产酸剂及其制备方法、图形化方法、抗蚀剂组合物及其应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004217748A (ja) | 2003-01-14 | 2004-08-05 | Konica Minolta Holdings Inc | 活性光線硬化型インク組成物、それを用いた画像形成方法及びインクジェット記録装置 |
| CN101602856A (zh) * | 2009-07-23 | 2009-12-16 | 中国科学院化学研究所 | 一种苯乙炔萘酐基团封端的聚酰亚胺树脂及其制备方法与用途 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4371605A (en) | 1980-12-09 | 1983-02-01 | E. I. Du Pont De Nemours And Company | Photopolymerizable compositions containing N-hydroxyamide and N-hydroxyimide sulfonates |
| US6582879B2 (en) * | 2001-03-27 | 2003-06-24 | Korea Research Institute Of Chemical Technology | Reactive photo acid-generating agent and heat-resistant photoresist composition with polyamide precursor |
| BRPI0810553A8 (pt) * | 2007-04-27 | 2018-10-30 | Valspar Sourcing Inc | substrato revestido, método para produzir uma bobina revestida, e, sistema de revestimento em bobina |
| FR2935977B1 (fr) * | 2008-09-15 | 2010-12-17 | Centre Nat Rech Scient | Procede d'hydrolyse-polycondensation photochimique de chromophores reticulables a encombrement sterique, catalyse par un acide photogenere et ses applications. |
| US8455176B2 (en) * | 2008-11-12 | 2013-06-04 | Az Electronic Materials Usa Corp. | Coating composition |
| WO2011087011A1 (ja) * | 2010-01-13 | 2011-07-21 | 株式会社Adeka | 新規スルホン酸誘導体化合物及び新規ナフタル酸誘導体化合物 |
-
2012
- 2012-11-12 JP JP2012248648A patent/JP5990447B2/ja active Active
-
2013
- 2013-10-28 CN CN201380058490.4A patent/CN104797560B/zh active Active
- 2013-10-28 US US14/439,477 patent/US9505721B2/en active Active
- 2013-10-28 MY MYPI2015701470A patent/MY170486A/en unknown
- 2013-10-28 SG SG11201503108WA patent/SG11201503108WA/en unknown
- 2013-10-28 DE DE112013005388.8T patent/DE112013005388T5/de not_active Withdrawn
- 2013-10-28 WO PCT/JP2013/079140 patent/WO2014073409A1/ja active Application Filing
- 2013-10-28 KR KR1020157014483A patent/KR101781706B1/ko active IP Right Grant
- 2013-11-12 TW TW102141050A patent/TWI610921B/zh active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004217748A (ja) | 2003-01-14 | 2004-08-05 | Konica Minolta Holdings Inc | 活性光線硬化型インク組成物、それを用いた画像形成方法及びインクジェット記録装置 |
| CN101602856A (zh) * | 2009-07-23 | 2009-12-16 | 中国科学院化学研究所 | 一种苯乙炔萘酐基团封端的聚酰亚胺树脂及其制备方法与用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP5990447B2 (ja) | 2016-09-14 |
| JP2014094926A (ja) | 2014-05-22 |
| DE112013005388T5 (de) | 2015-08-13 |
| TW201425299A (zh) | 2014-07-01 |
| MY170486A (en) | 2019-08-07 |
| WO2014073409A1 (ja) | 2014-05-15 |
| SG11201503108WA (en) | 2015-06-29 |
| US9505721B2 (en) | 2016-11-29 |
| US20150299132A1 (en) | 2015-10-22 |
| KR20150087846A (ko) | 2015-07-30 |
| TWI610921B (zh) | 2018-01-11 |
| CN104797560A (zh) | 2015-07-22 |
| CN104797560B (zh) | 2016-10-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101781706B1 (ko) | 방향족 이미드 화합물 및 그 제조 방법 | |
| US20170062740A1 (en) | Organic semiconductor compositions | |
| JP2014517820A (ja) | ナフタレンジイミドのスタンニル誘導体及び関連組成物並びに方法 | |
| US8853441B2 (en) | Sulfonium compound, photoacid generator, and resist composition | |
| KR20090074248A (ko) | 신규한 축합다환방향족 화합물 및 그의 제조 방법과 그의 용도 | |
| TW201002706A (en) | Rylene-based semiconductor materials and methods of preparation and use thereof | |
| KR101156528B1 (ko) | 신규한 질소계 반도체 화합물 및 이를 이용한 소자 | |
| TW201420581A (zh) | 芳香族化合物之製造方法 | |
| Gudeika et al. | Hydrazones containing electron-accepting and electron-donating moieties | |
| KR20080110801A (ko) | 축합환 화합물의 제조 방법 | |
| JP2009019022A (ja) | 感放射線性化合物及びフォトレジスト組成物 | |
| KR101490104B1 (ko) | 나프탈렌 다이이미드 유도체 화합물 및 제조방법과 이를 포함하는 유기전자소자 | |
| WO2012133874A1 (ja) | 芳香族ポリマーの製造方法 | |
| Song et al. | Effects of the acceptor pattern and substitution position on the properties of N-phenyl-carbazolyl based donor–acceptor–donor molecules | |
| KR101424978B1 (ko) | 길만시약 화합물을 이용한 헤테로 융합고리 화합물의 신규한 제조방법 | |
| JP2020508576A (ja) | 有機トランジスタ | |
| CN112442169B (zh) | 不对称异靛蓝受体及聚合物及其制备方法与应用 | |
| Kim et al. | Tuning the charge transport properties of dicyanodistyrylbenzene derivatives by the number of fluorine substituents | |
| TW201821430A (zh) | 芳香族化合物,及使用該芳香族化合物之有機半導體材料、薄膜形成用組成物、有機薄膜,及有機半導體裝置 | |
| JP2005200336A (ja) | テトラシアノブタジエン誘導体 | |
| WO2014006887A1 (ja) | フルオレン系重合体、及びそれを用いた有機エレクトロルミネッセンス素子 | |
| CN114583051A (zh) | 一种光致变色的有机场效应晶体管 | |
| JP2021138828A (ja) | ビスマス−ジチオカルボキシレート錯体構造を有するポリマーおよびフッ化物イオン検出用剤 | |
| CN111808270A (zh) | 半导体组合物及其应用 | |
| CN116057058A (zh) | 有机半导体材料 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| A302 | Request for accelerated examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |