KR100269079B1 - 할로치환된방향족산의제조방법 - Google Patents
할로치환된방향족산의제조방법 Download PDFInfo
- Publication number
- KR100269079B1 KR100269079B1 KR1019970700404A KR19970700404A KR100269079B1 KR 100269079 B1 KR100269079 B1 KR 100269079B1 KR 1019970700404 A KR1019970700404 A KR 1019970700404A KR 19970700404 A KR19970700404 A KR 19970700404A KR 100269079 B1 KR100269079 B1 KR 100269079B1
- Authority
- KR
- South Korea
- Prior art keywords
- benzenedicarboxylic acid
- amino
- acid
- hcl
- solution
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims description 19
- 238000002360 preparation method Methods 0.000 title description 7
- 159000000032 aromatic acids Chemical class 0.000 title description 2
- 239000000243 solution Substances 0.000 claims abstract description 14
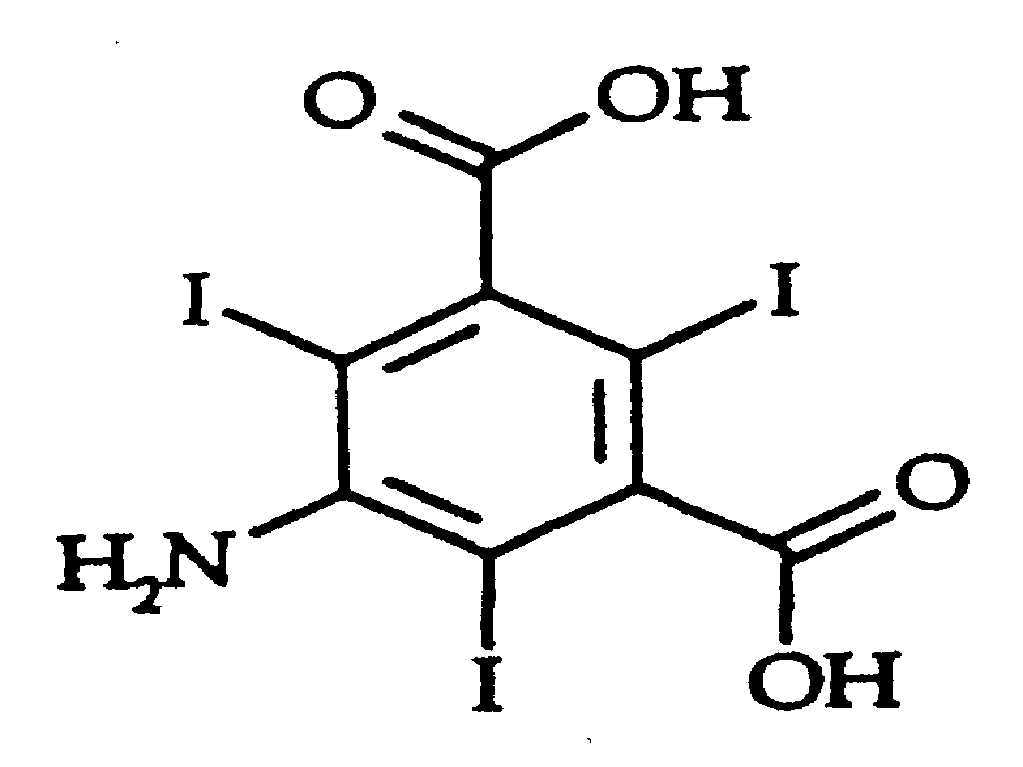
- JEZJSNULLBSYHV-UHFFFAOYSA-N 5-amino-2,4,6-triiodobenzene-1,3-dicarboxylic acid Chemical compound NC1=C(I)C(C(O)=O)=C(I)C(C(O)=O)=C1I JEZJSNULLBSYHV-UHFFFAOYSA-N 0.000 claims abstract description 12
- NBDAHKQJXVLAID-UHFFFAOYSA-N 5-nitroisophthalic acid Chemical compound OC(=O)C1=CC(C(O)=O)=CC([N+]([O-])=O)=C1 NBDAHKQJXVLAID-UHFFFAOYSA-N 0.000 claims abstract description 10
- IUEVXLACZFKZSP-UHFFFAOYSA-L disodium;5-aminobenzene-1,3-dicarboxylate Chemical compound [Na+].[Na+].NC1=CC(C([O-])=O)=CC(C([O-])=O)=C1 IUEVXLACZFKZSP-UHFFFAOYSA-L 0.000 claims abstract description 8
- 238000000746 purification Methods 0.000 claims abstract description 7
- 239000007864 aqueous solution Substances 0.000 claims abstract description 4
- 230000007935 neutral effect Effects 0.000 claims abstract description 4
- 239000012266 salt solution Substances 0.000 claims abstract description 4
- 238000009903 catalytic hydrogenation reaction Methods 0.000 claims abstract description 3
- 238000004519 manufacturing process Methods 0.000 claims abstract description 3
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 claims description 12
- 239000002253 acid Substances 0.000 claims description 5
- CAHWDGJDQYAFHM-UHFFFAOYSA-N 2-nitroisophthalic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=C1[N+]([O-])=O CAHWDGJDQYAFHM-UHFFFAOYSA-N 0.000 claims 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 claims 1
- KBZFDRWPMZESDI-UHFFFAOYSA-N 5-aminobenzene-1,3-dicarboxylic acid Chemical compound NC1=CC(C(O)=O)=CC(C(O)=O)=C1 KBZFDRWPMZESDI-UHFFFAOYSA-N 0.000 abstract description 9
- 230000026045 iodination Effects 0.000 abstract 1
- 238000006192 iodination reaction Methods 0.000 abstract 1
- 159000000000 sodium salts Chemical class 0.000 abstract 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 21
- 238000006243 chemical reaction Methods 0.000 description 17
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 12
- 239000000047 product Substances 0.000 description 12
- QZRGKCOWNLSUDK-UHFFFAOYSA-N Iodochlorine Chemical compound ICl QZRGKCOWNLSUDK-UHFFFAOYSA-N 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- 150000001875 compounds Chemical class 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 230000000052 comparative effect Effects 0.000 description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 239000003610 charcoal Substances 0.000 description 3
- 239000012467 final product Substances 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 239000012535 impurity Substances 0.000 description 3
- 239000000543 intermediate Substances 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000002872 contrast media Substances 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 239000002002 slurry Substances 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- IPHVGAPABXWWLO-UHFFFAOYSA-N 2,4,6-triiodobenzene-1,3-dicarboxylic acid Chemical compound OC(=O)C1=C(I)C=C(I)C(C(O)=O)=C1I IPHVGAPABXWWLO-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 208000034809 Product contamination Diseases 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 239000003377 acid catalyst Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 150000008064 anhydrides Chemical group 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000020477 pH reduction Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000001226 reprecipitation Methods 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C227/00—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C227/04—Formation of amino groups in compounds containing carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C227/00—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C227/14—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton from compounds containing already amino and carboxyl groups or derivatives thereof
- C07C227/16—Preparation of compounds containing amino and carboxyl groups bound to the same carbon skeleton from compounds containing already amino and carboxyl groups or derivatives thereof by reactions not involving the amino or carboxyl groups
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Macromolecular Compounds Obtained By Forming Nitrogen-Containing Linkages In General (AREA)
Abstract
본 발명은
a) 5-니트로-1,3-벤젠디카르복실산을 중성 또는 염기성 환경 중에서 촉매적 수소첨가 반응시켜 5-아미노-1,3-벤젠디카르복실산 나트륨염의 수용액을 얻는 단계;
b) 단계 a)에서 얻은 5-아미노-1,3-벤젠디카르복실산 나트륨염 용액을 더 정제하지 않고서 이 용액에 미리 HCl 및 H2SO4를 첨가한 후 HCl 중의 ICl 용액으로 직접 요오드화시키는 단계
로 이루어지는 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 제조 방법에 관한 것이다.
Description
할로치환된 방향족 산의 제조 방법
[발명의 상세한 설명]
본 발명은 화학식 I로 표시되는 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 신규한 합성 방법에 관한 것이다.
[화학식 I]
화학식 I의 화합물은 요오드화 X-선 조영제, 특히 비이온성 요오드화 X-선 조영제의 제조를 위한 중간체로서 유용하다.
상기 화합물은 문헌[참조 : Beilstein 및 Chemical Abstracts]에 인용되어 있고, 실온에서 염산 중에 과량의 일염화요오드를 사용하여 이 화합물을 제조하는 방법이 미국 특허 제2820814호[참조 : 쉐링사(Schering Corp.), 1955; CA 52 : 16305; GB-A-785670]에 최초로 개시되어 있다. 5-아미노-이소프탈산(또는 5-아미노-1,3-벤젠디카르복실산)은 일-또는 이할로겐화 중간체 물질을 단리하고 이어서 더 요오드화함으로써 단계적으로 요오드화시킬 수 있지만, 직접 삼요오드화시킬 수 있다. 얻어진 60%의 반응 수율이라는 것은 공업적으로 사용하기에는 만족스럽지 못한 것인데, 상기 특허의 실시예에서 나타난 바와 같이, 목탄으로 처리하고 진한 염산을 첨가하여 추가로 재침전시키는 정제 단계를 필요로 하기 때문에 최종 수율은 더 낮아지게 된다.
랑가나탄(Ranganathan) 등의 더 최근의 문헌(참조 : J. Org. Chem, 59, 1344, 1994)에는 문헌[참조 : Larsen등, J. Am. Chem. Soc., 78, 3210, 1956]에 이미 공지된 방법에 따라 KIO3를 염산 존재하에 KI와 반응시켜서 반응계내에서 생성한 KICl2를 사용하여 5-아미노-1,3-벤젠디카르복실산을 요오드화시키는 반응이 개시되어 있다. 이 반응은 중성 pH 및 55∼60℃의 온도에서 수행하고, 항상 목탄으로 정제한 후 산성화에 의해 재침전시키고 메탄올로 결정화시킨 후에야 74%의 수율이 얻어진다.
인용된 양 문헌에서는 최종 생성물 중에 미량의 일- 또는 이요오드화된 생성물 뿐만 아니라 착색된 부산물이 존재하기 때문에 정제 단계를 필요로 한다. 인용된 양 방법은 매우 낮은 출발 물질 농도에서 수행된다.
보다 최근에는 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 제조 및 정제 방법과 모액으로부터의 요오드 회수 방법에 대한 몇몇 일본 특허 출원이 공개되었다(Mitsui Toatsu Chemical Ltd., JP-A-3197451, JP-A-1224203, JP-A-1224202, JP-A-1201002, JP-A-1201003, JP-A-1047746, JP-A-1047745, JP-A-1047744).
최초의 특허 출원 JP-A-1047744호에는 쉐링 특허에 따른 요오드화 반응 조건하에 반응을 더 높은 온도(80∼100℃)에서 수행하여 97.7%의 공표된 수율을 얻은, 반응 수율이 개선된 방법이 개시되어 있다. 그러나, 후속 특허 출원 JP-A-3197451호에 인용되어 있는 종래 기술로부터 추론한 바와 같이, 상기 방법의 생성물의 순도는 충분하지 않고, 이 출원에서는 이러한 문제를 해결하기 위하여 촉매로서 H2SO4또는 H3PO4존재하에 5-아미노이소프탈산을 IC1로 처리하여 상기 화합물을 제조하는 방법을 기재하고 있다.
산 촉매는 산에 대하여 0.1∼20몰%, 바람직하게는 1∼10몰%의 양으로 첨가한다. 산의 농도는 1.0∼15중량%, 바람직하게는 2.0∼10중량%이다. 일염화요오드는 전구체에 대해 3.0∼4.5몰당량, 바람직하게는 3.0∼3.9몰당량으로 사용한다. 반응은 바람직하게는 50∼100℃에서 1∼5시간 동안 행한다. 최종 생성물은 높은 순도(99.5%) 및 높은 수율(98.1%)로 얻어진다.
상기 출원이 극복하고자 한 것은 일-또는 이요오드화 반응의 중간체에 의해 생성물이 오염되는 문제이다. 상기 목표는 황산 또는 인산을 사용한 촉매화에 의해, IC1에 대한 용매로서 염산을 사용하지 않고서도 달성할 수 있다. 이 특허 출원은 착색된 불순물-이전의 문헌에서도 언급된 바 있으며, 본 발명자들이 상기 출원에 기재된 조건하에서 수득한 생성물에도 역시 존재-의 형성을 방지하는 방법에 대해서는 아무것도 제안하지 않고 있다.
양 출원의 실험에 대한 부분을 보면, 기질의 농도는 이전의 종래 기술 문헌에 비해서는 증가되었으나, 공업적 생산성을 고려한다면 여전히 낮은 것이다.
이들 문헌 모두에 있어서, 출발 물질은 해리되지 않은 형태의 단리된 5-아미노-1,3-벤젠디카르복실산이다.
본 발명의 방법은 5-니트로-1,3-벤젠디카르복실산을 중성 또는 염기성 환경중에서 촉매적 수소첨가 반응시켜서 얻은 5-아미노-1,3-벤젠디카르복실산 나트륨염을, HCl 및 H2SO4를 미리 첨가한 후, HCl중의 IC1용액으로 직접 요오드화 반응시키는 것을 특징으로 한다.
본 발명의 방법을 수행하기 위한 특히 바람직한 요오드화 조건은 다음과 같다.
-HCl 및 H2SO4로부터 유래된 산의 총 당량 대 5-니트로-1,3-벤젠디카르복실산의 몰비는 2.5 : 1 내지 3.5 : 1이고;
-HCl 당량 대 5-니트로-1,3-벤젠디카르복실산 몰비는 0 : 1 내지 2 : 1, 바람직하게는 0.5 : 1 내지 1.5 : 1이며;
-H2SO4당량 대 5-니트로-1,3-벤젠디카르복실산 몰수의 비율은 0.5 : 1 내지 3.5 : 1범위, 바람직하게는 2.0 : 1이고;
-ICl 및 5-니트로-1,3-벤젠디카르복실산의 몰비는 3.0 : 1 내지 3.5 : 1이며;
-HCl 중의 ICl 용액에서 HCl 대 ICl의 몰비는 0.4 : 1 내지 1.2 : 1이고;
-요오드화 반응의 온도는 75 내지 110℃, 바람직하게는 70 내지 95℃이다.
최초로, 상술한 양으로 존재하는 산으로 인해, 목적 생성물을 추가의 정제 공정없이도 우수한 수율과 높은 순도로 짙은 색의 화합물을 함유하지 않는 백색(수화물 형태) 또는 황색(무수물 형태) 결정으로서 수득할 수 있게 되었다.
상술한 양의 황산이 존재함으로 인한 또다른 현저한 잇점은, 공업적 생산성에 있어서는 매우 중요한 것으로, 황산을 사용하지 않는 통상의 표준보다 더 높은 기질 농도의 조건 하에 동일한 수율로 요오드화 반응을 수행할 수 있다는 것이다.
실험에 관한 설명 부분에는, 황산을 첨가하지 않고 염산 3당량을 첨가한 실시예와, 황산만을 첨가한 실시예를 기재하였다. 전자의 경우에는 뚜렷하게 낮은 수율이 달성되는 반면, 후자의 경우에는 수율은 만족스럽지만 최종 생성물이 짙은 갈색이어서 후속의 정제 단계를 필요로 한다.
본 발명의 실시를 위한 하기 실시예들은 예시를 위한 것이고 어떠한 방식으로도 본 발명의 범위를 한정하지 않는다.
[실시예]
[실시예 1]
5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산
A) 5-아미노-1,3-벤젠디카르복실산
5-니트로-1,3-벤젠디카르복실산(시판 제품) 325g을 물 2.8ℓ와 함께 반응기에 넣었다. 이것을 60∼70℃까지 가열하고, 30% NaOH 410g을 첨가하여 출발 물질을 용해시켰다. 이어서, 목탄 10g을 첨가하고, 슬러리를 여과하고 여과기를 물 200ml로 세척하였다.
이후, 5% Pd/C(시판 제품) 8g을 넣고, 대략 0.01m3의 질소로 조절하였다. 수소 0.1m3를 30kPa의 압력하에 첨가하였다. 온도는 자발적으로 50℃에 도달하였고 냉각에 의해 유지되도록 하였다. 수소의 소모가 멈췄을 때, 용액을 가압하에 1시간 동안 유지시킨 후, 질소 0.02m3로 세척하여 잔류 수소를 제거하였다. 현탁액을 여과하고 여과기를 물 100ml로 세척하여, 5-아미노-1,3-벤젠디카르복실산 나트륨염을 함유하는 용액을 대략 3.85kg 수득하였다.
B) 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산
물 2.75ℓ를 넣은 반응기에 HCl(34%w/w) 0.08kg, 상기 반응에서 얻은 5-아미노-1,3-벤젠디카르복실산 나트륨염의 용액 3.85kg 및 H2SO4(1 : 1수용액)375g을 순차적으로 첨가하였다. 내용물을 70℃까지 가열하고, 3시간 동안 HCl 중의 ICl 용액(요오드 44.5%, ICl : HCl의 몰비=1 : 1)(시판 제품) 1.35kg을 첨가하였다. 첨가를 마쳤을 때 용액을 90℃까지 가열하고 온도를 6시간 동안 유지시켰다. 내용물을 60℃로 냉각시키고, 다른 반응기로 옮겨서 30℃까지 냉각시켰다. 중아황나트륨 45g을 교반하에 첨가하여 슬러리를 탈색시킨 후, 원심분리하고, 생성물을 물 0.3kg으로 세척하여 목적하는 습윤 생성물 935g을 수득하였다. 건조시킨 후, 목적 생성물 830g을 수득하였다.
2 단계의 총 수율(무수 생성물에 대하여) : 95.0%
함수율 : 2%
전위차 분석 : 99.3%
1H-NMR,13C-NMR, IR 및 MS 스펙트럼은 이 구조에 일치한다.
[실시예 2]
비교예 : HCl 3 당량 존재하에서의 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 제조
실시예 1에 기재된 방법에 따라, 5-아미노-1,3-벤젠디카르복실산 나트륨염의 용액 3.85kg을 HCl(34% w/w) 0.48kg 존재하에 ICl과 반응시켰다.
2 단계의 무수 생성물의 총 수율 : 82.0%
화학적-물리적 특성은 상술한 것과 일치하였다.
[실시예 3]
비교예 : H2SO43 당량 존재하에서의 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 제조
실시예 1에 기재된 방법에 따라, 5-아미노-1,3-벤젠디카르복실산 나트륨염의 용액 3.85kg을 H2SO4(1 : 1수용액) 450g 존재하에 ICl과 반응시켰다.
2 단계의 무수 생성물의 총 수율 : 91.0%
화학적-물리적 특성은 상술한 것과 일치하였으나 생성물은 짙은 갈색이었다.
[실시예 4]
비교예 : JP-A-3197451호의 실시예 1에 기재된 방법에 따른 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 제조(3배의 규모)
교반기가 장착된 재킷 반응기에 5-아미노-1,3-벤젠디카르복실산 57.2g(함수율 5%, 역가 95%, 0.3몰과 동일함), 물 1440g 및 황산 1.47g을 넣었다. 이것을 70℃까지 가열하고, 35% HCl 중의 50중량% ICl 용액 306.9g(0.945mol)을 1시간 동안 적가하였다. 70℃에서 교반하에 4시간 동안 유지시켜 반응을 완결시켰다. 이것을 10℃까지 냉각시키고, 침전물을 여과하고, 감압하에 농축시켰다. 물 0.8%(w/w) 및 불완전한 요오드화 반응에 의해 생긴 불순물 1%를 함유하는 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산으로 이루어진 갈색 결정질 고체 144g(86%)을 수득하였다.
[실시예 5]
비교예 : JP-A-3197451호의 실시예 1에 기재된 방법에 따르되, 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 단리를 행하지 않은 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 제조
단리된 5-아미노-1,3-벤젠디카르복실산 대신에, 수소첨가 반응의 말기에 얻은 5-아미노-1,3-벤젠디카르복실산 나트륨염을 함유하는 용액을 동량(580g)으로 넣은 것을 제외하고는 실시예 4의 방법을 반복하였다. 반응이 완결되었을 때 흑색 현탁액을 얻었고, 이것을 여과하여, 아마도 산화 반응으로 인한 불순물에 의하여 심하게 오염된 5-아미노-트리요오도-1,3-벤젠디카르복실산으로 이루어진 적당량(70g)의 흑색 고체를 수득하였다.
Claims (5)
- a) 5-니트로-1,3-벤젠디카르복실산을 중성 또는 염기성 환경 중에서 촉매적 수소첨가 반응시켜 5-아미노-1,3-벤젠디카르복실산 나트륨염의 수용액을 얻는 단계;b) 이 염 수용액에 HCl 및 H2SO4를 첨가하는 단계;c) 단계 b)에서 얻은 용액을 더 정제하지 않고서 HCl 중의 ICl 용액으로 직접 요오드화시키는 단계[여기서, HCl 및 H2SO4에 의해 제공되는 산의 총 당량 대 5-니트로-1,3-벤젠디카르복실산의 몰비가 2.5 : 1 내지 3.5 : 1이고, H2SO4의 당량 대 5-니트로-1,3-벤젠디카르복실산의 몰비가 0.5 : 1 내지 3.5 : 1이며, ICl 대 5-니트로-1,3-벤젠디카르복실산의 몰비가 3.0 : 1 내지 3.5 : 1임)를 포함하는 이루어지는 5-아미노-2,4,6-트리요오도-1,3-벤젠디카르복실산의 제조방법.
- 제1항에 있어서, H2SO4의 당량 대 5-니트로-1,3-벤젠디카르복실산의 몰비가 2.0 : 1인 방법.
- 제1항에 있어서, HCl 중의 ICl 용액에서 HCl 대 IC1의 몰비가 0.4 : 1 내지 1.2 : 1인 방법.
- 제1항에 있어서, 단계 c)의 온도가 75 내지 110℃인 방법.
- 제4항에 있어서, 단계 c)의 온도가 70 내지 95℃의 범위인 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| ITMI951045A IT1274547B (it) | 1995-05-23 | 1995-05-23 | Processo per la preparazione dell'acido 5-ammino-2,4,6- triiodoisoftalico |
| ITMI95A001045 | 1995-05-23 | ||
| ITRM950549 IT1277899B1 (it) | 1995-08-04 | 1995-08-04 | Processo per la preparazione dell'acido 5-ammino-2,4,6 -triiodo- isoftalico" |
| ITRM95A000549 | 1995-08-04 | ||
| PCT/EP1996/002105 WO1996037458A1 (en) | 1995-05-23 | 1996-05-17 | Process for the preparation of a halosubstituted aromatic acid |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR100269079B1 true KR100269079B1 (ko) | 2000-10-16 |
Family
ID=26331278
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1019970700404A KR100269079B1 (ko) | 1995-05-23 | 1996-05-17 | 할로치환된방향족산의제조방법 |
Country Status (23)
| Country | Link |
|---|---|
| US (1) | US5763650A (ko) |
| EP (1) | EP0773923B1 (ko) |
| JP (1) | JP4012568B2 (ko) |
| KR (1) | KR100269079B1 (ko) |
| CN (1) | CN1109670C (ko) |
| AT (1) | ATE192138T1 (ko) |
| AU (1) | AU707177B2 (ko) |
| BR (1) | BR9606487A (ko) |
| CA (1) | CA2195635C (ko) |
| CZ (1) | CZ289771B6 (ko) |
| DE (2) | DE773923T1 (ko) |
| DK (1) | DK0773923T3 (ko) |
| ES (1) | ES2103254T3 (ko) |
| GR (2) | GR970300029T1 (ko) |
| HU (1) | HU217686B (ko) |
| IL (1) | IL118360A (ko) |
| MX (1) | MX9700549A (ko) |
| NO (1) | NO314257B1 (ko) |
| PL (1) | PL318285A1 (ko) |
| PT (1) | PT773923E (ko) |
| SI (1) | SI9620011A (ko) |
| SK (1) | SK8997A3 (ko) |
| WO (1) | WO1996037458A1 (ko) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7968745B2 (en) | 2005-12-19 | 2011-06-28 | Ge Healthcare As | Purification process of iodixanol |
| WO2009091758A1 (en) * | 2008-01-14 | 2009-07-23 | Mallinckrodt Inc. | Process for the preparation of iosimenol |
| EP2093206A1 (en) * | 2008-02-20 | 2009-08-26 | BRACCO IMAGING S.p.A. | Process for the iodination of aromatic compounds |
| EP2230227A1 (en) | 2009-03-20 | 2010-09-22 | Bracco Imaging S.p.A | Process for the preparation of triiodinated carboxylic aromatic derivatives |
| EP2243767A1 (en) | 2009-04-21 | 2010-10-27 | Bracco Imaging S.p.A | Process for the iodination of aromatic compounds |
| PL2451994T3 (pl) * | 2009-07-07 | 2014-04-30 | Bracco Imaging Spa | Proces wytwarzania środka jodującego |
| US7999135B2 (en) | 2009-07-21 | 2011-08-16 | Ge Healthcare As | Crystallization of iodixanol using ultrasound |
| US7999134B2 (en) | 2009-07-21 | 2011-08-16 | Ge Healthcare As | Crystallization of iodixanol using milling |
| KR101699226B1 (ko) | 2009-11-26 | 2017-01-24 | 호비온 차이나 홀딩 리미티드 | 이오딕사놀의 제조 및 정제 |
| EP2394984A1 (en) | 2010-06-10 | 2011-12-14 | Bracco Imaging S.p.A | Process for the iodination of phenolic derivatives |
| JP6694713B2 (ja) | 2012-12-11 | 2020-05-20 | ブラッコ・イメージング・ソシエタ・ペル・アチオニBracco Imaging S.P.A. | (s)−2−アセチルオキシプロピオン酸クロリドの連続製造方法 |
| EP3066071B1 (en) | 2013-11-05 | 2018-04-18 | Bracco Imaging S.p.A | Process for the preparation of iopamidol |
| US9963416B2 (en) | 2014-06-10 | 2018-05-08 | Bracco Imaging S.P.A. | Method for the preparation of (S)-2-acetyloxypropionic acid and derivatives thereof |
| KR102562581B1 (ko) * | 2017-06-07 | 2023-08-02 | 브라코 이미징 에스.피.에이. | 수성 용액으로부터 요오드의 회수 방법 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU502875A1 (ru) * | 1973-03-26 | 1976-02-15 | Войсковая Часть 41598 | Способ получени метилового эфира 4-диметиламиносалициловой кислоты |
| JPH03197451A (ja) * | 1989-12-27 | 1991-08-28 | Mitsui Toatsu Chem Inc | 5―アミノ―2,4,6―トリヨードイソフタル酸の製造方法 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2820814A (en) * | 1955-03-21 | 1958-01-21 | Schering Corp | Polyiodinated 5-aminoisophthalic acids, salts, and esters |
| SU502874A1 (ru) * | 1973-12-07 | 1976-02-15 | Институт Органического Катализа И Электрохимии | Способ получени м-аминоизофталевой кислоты |
| US4102917A (en) * | 1977-06-01 | 1978-07-25 | American Cyanamid Company | Substituted phenyl naphthalenesulfonic acids |
-
1996
- 1996-05-13 US US08/645,448 patent/US5763650A/en not_active Expired - Lifetime
- 1996-05-17 AT AT96919779T patent/ATE192138T1/de active
- 1996-05-17 CZ CZ1997185A patent/CZ289771B6/cs not_active IP Right Cessation
- 1996-05-17 DE DE0773923T patent/DE773923T1/de active Pending
- 1996-05-17 HU HU9700189A patent/HU217686B/hu unknown
- 1996-05-17 MX MX9700549A patent/MX9700549A/es unknown
- 1996-05-17 PT PT96919779T patent/PT773923E/pt unknown
- 1996-05-17 SK SK89-97A patent/SK8997A3/sk unknown
- 1996-05-17 AU AU58189/96A patent/AU707177B2/en not_active Ceased
- 1996-05-17 DK DK96919779T patent/DK0773923T3/da active
- 1996-05-17 EP EP96919779A patent/EP0773923B1/en not_active Expired - Lifetime
- 1996-05-17 BR BR9606487A patent/BR9606487A/pt not_active Application Discontinuation
- 1996-05-17 WO PCT/EP1996/002105 patent/WO1996037458A1/en active IP Right Grant
- 1996-05-17 CN CN96190526A patent/CN1109670C/zh not_active Expired - Lifetime
- 1996-05-17 JP JP53534796A patent/JP4012568B2/ja not_active Expired - Lifetime
- 1996-05-17 PL PL96318285A patent/PL318285A1/xx unknown
- 1996-05-17 SI SI9620011A patent/SI9620011A/sl unknown
- 1996-05-17 ES ES96919779T patent/ES2103254T3/es not_active Expired - Lifetime
- 1996-05-17 CA CA002195635A patent/CA2195635C/en not_active Expired - Lifetime
- 1996-05-17 KR KR1019970700404A patent/KR100269079B1/ko not_active IP Right Cessation
- 1996-05-17 DE DE69607921T patent/DE69607921T2/de not_active Expired - Lifetime
- 1996-05-22 IL IL11836096A patent/IL118360A/xx not_active IP Right Cessation
-
1997
- 1997-01-21 NO NO19970263A patent/NO314257B1/no not_active IP Right Cessation
- 1997-09-30 GR GR970300029T patent/GR970300029T1/el unknown
-
2000
- 2000-07-14 GR GR20000401642T patent/GR3033957T3/el unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU502875A1 (ru) * | 1973-03-26 | 1976-02-15 | Войсковая Часть 41598 | Способ получени метилового эфира 4-диметиламиносалициловой кислоты |
| JPH03197451A (ja) * | 1989-12-27 | 1991-08-28 | Mitsui Toatsu Chem Inc | 5―アミノ―2,4,6―トリヨードイソフタル酸の製造方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100269079B1 (ko) | 할로치환된방향족산의제조방법 | |
| JPH0240661B2 (ko) | ||
| JPH05500500A (ja) | 2,4,6―トリヨード―5―アミノ―n―アルキルイソフタルアミド酸及び2,4,6―トリヨード―5―アミノイソフタルアミド化合物の調製方法 | |
| KR910008936B1 (ko) | 2,4-디클로로-5-플루오로-벤조산의 제조방법 | |
| US5723676A (en) | Process for producing benzophenone compounds | |
| EP0055630B1 (en) | Method for the preparation of fluorophthalamic compounds | |
| US6307091B1 (en) | Trifluoro-substituted benzoic acid, esters thereof and processes for preparing the same | |
| JP3011493B2 (ja) | 4−アルキル−3−チオセミカルバジドの製造方法 | |
| US4374266A (en) | Ammonium salts of fluorophthalamic acids and method of preparation | |
| US5523472A (en) | Process for the preparation of 5-fluoroanthranilic acid | |
| JP2927880B2 (ja) | 4,4’‐ジヒドロキシ‐3,3’,5,5’‐テトラメチルジフェニルメタンの製造方法 | |
| US5093510A (en) | Process for producing copper formate | |
| JPH10316639A (ja) | 5−アミノ−2,4,6−トリヨードイソフタル酸の製造法 | |
| JP3199618B2 (ja) | 1,4−ジヒドロキシ−2−ナフトエ酸の製造方法 | |
| JP4383604B2 (ja) | 芳香族シアノ安息香酸化合物の製造方法 | |
| JP3927835B2 (ja) | ヨウ化芳香族化合物ジアセテートの製造方法 | |
| JP3908794B2 (ja) | N−置換不飽和アミドの製造方法 | |
| JP2560431B2 (ja) | 2,4−ジヒドロキシアセトフェノンの製造法 | |
| EP0621260B1 (en) | Process for producing N,N-disubstituted p-phenylenediamine derivative sulphate | |
| JP3547497B2 (ja) | ベンゾチアゾロン化合物の製造方法 | |
| JPH03167153A (ja) | 3,5―ジヨードサリチル酸の製造方法 | |
| JPH02282345A (ja) | 2,4,5―トリフルオロ安息香酸の製造方法 | |
| JP2000264887A (ja) | グリコールウリルの製造方法 | |
| JPS6230190B2 (ko) | ||
| JPH0366659A (ja) | イセチオン酸の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20130705 Year of fee payment: 14 |
|
| FPAY | Annual fee payment |
Payment date: 20140708 Year of fee payment: 15 |
|
| FPAY | Annual fee payment |
Payment date: 20150706 Year of fee payment: 16 |
|
| EXPY | Expiration of term |