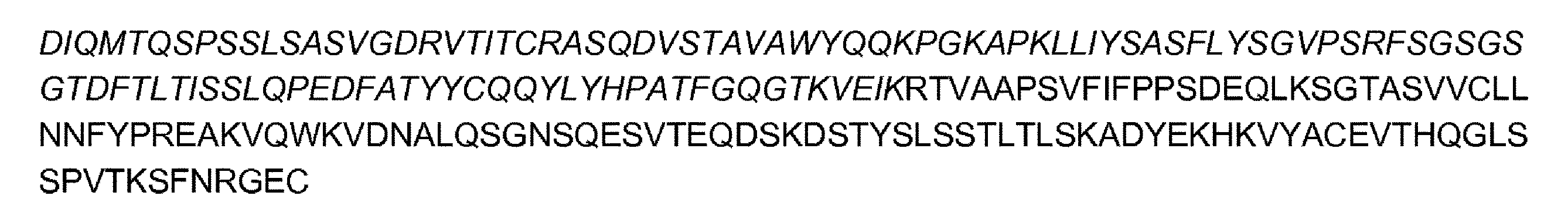JP7587656B2 - Pd-l1及びcd137に結合する抗体分子 - Google Patents
Pd-l1及びcd137に結合する抗体分子 Download PDFInfo
- Publication number
- JP7587656B2 JP7587656B2 JP2023169756A JP2023169756A JP7587656B2 JP 7587656 B2 JP7587656 B2 JP 7587656B2 JP 2023169756 A JP2023169756 A JP 2023169756A JP 2023169756 A JP2023169756 A JP 2023169756A JP 7587656 B2 JP7587656 B2 JP 7587656B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- antibody molecule
- domain
- nos
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 title claims description 428
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 title claims description 386
- 108010074708 B7-H1 Antigen Proteins 0.000 title claims description 373
- 102000008096 B7-H1 Antigen Human genes 0.000 title claims 5
- 210000004027 cell Anatomy 0.000 claims description 321
- 230000027455 binding Effects 0.000 claims description 283
- 206010028980 Neoplasm Diseases 0.000 claims description 150
- 239000000427 antigen Substances 0.000 claims description 142
- 102000036639 antigens Human genes 0.000 claims description 141
- 108091007433 antigens Proteins 0.000 claims description 141
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 66
- 201000011510 cancer Diseases 0.000 claims description 60
- 238000011282 treatment Methods 0.000 claims description 58
- 102000011769 Member 9 Tumor Necrosis Factor Receptor Superfamily Human genes 0.000 claims description 56
- 108010037274 Member 9 Tumor Necrosis Factor Receptor Superfamily Proteins 0.000 claims description 56
- 230000002998 immunogenetic effect Effects 0.000 claims description 55
- 150000007523 nucleic acids Chemical class 0.000 claims description 47
- 108010073807 IgG Receptors Proteins 0.000 claims description 40
- 102000009490 IgG Receptors Human genes 0.000 claims description 38
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 claims description 31
- 239000013598 vector Substances 0.000 claims description 28
- 210000002865 immune cell Anatomy 0.000 claims description 27
- 102000039446 nucleic acids Human genes 0.000 claims description 26
- 108020004707 nucleic acids Proteins 0.000 claims description 26
- 125000000539 amino acid group Chemical group 0.000 claims description 19
- 238000004519 manufacturing process Methods 0.000 claims description 14
- 210000004881 tumor cell Anatomy 0.000 claims description 11
- 239000008194 pharmaceutical composition Substances 0.000 claims description 9
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 5
- 238000012258 culturing Methods 0.000 claims description 3
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 claims description 3
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 399
- 210000001744 T-lymphocyte Anatomy 0.000 description 181
- 241000282414 Homo sapiens Species 0.000 description 158
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 124
- 238000003556 assay Methods 0.000 description 118
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 description 89
- 230000000694 effects Effects 0.000 description 80
- 230000006044 T cell activation Effects 0.000 description 78
- 239000013641 positive control Substances 0.000 description 75
- 102000048776 human CD274 Human genes 0.000 description 59
- 230000014509 gene expression Effects 0.000 description 54
- 230000004913 activation Effects 0.000 description 52
- 238000004132 cross linking Methods 0.000 description 52
- 238000000034 method Methods 0.000 description 52
- 239000000872 buffer Substances 0.000 description 51
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 50
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 45
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 45
- 108090000623 proteins and genes Proteins 0.000 description 44
- 241000699666 Mus <mouse, genus> Species 0.000 description 41
- 235000018102 proteins Nutrition 0.000 description 41
- 102000004169 proteins and genes Human genes 0.000 description 41
- 102000050327 human TNFRSF9 Human genes 0.000 description 39
- 230000004075 alteration Effects 0.000 description 38
- 241000699670 Mus sp. Species 0.000 description 35
- 230000035772 mutation Effects 0.000 description 34
- 238000005516 engineering process Methods 0.000 description 32
- 230000004044 response Effects 0.000 description 30
- 108010002350 Interleukin-2 Proteins 0.000 description 29
- 102000000588 Interleukin-2 Human genes 0.000 description 29
- 150000001413 amino acids Chemical class 0.000 description 29
- 235000001014 amino acid Nutrition 0.000 description 28
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 27
- 229940024606 amino acid Drugs 0.000 description 27
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 27
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 25
- 239000000203 mixture Substances 0.000 description 25
- 230000000903 blocking effect Effects 0.000 description 24
- 238000012512 characterization method Methods 0.000 description 24
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 24
- 239000002609 medium Substances 0.000 description 23
- 239000013642 negative control Substances 0.000 description 23
- 238000012360 testing method Methods 0.000 description 23
- 108091028043 Nucleic acid sequence Proteins 0.000 description 22
- 102000004127 Cytokines Human genes 0.000 description 21
- 108090000695 Cytokines Proteins 0.000 description 21
- 238000010790 dilution Methods 0.000 description 21
- 239000012895 dilution Substances 0.000 description 21
- 238000000684 flow cytometry Methods 0.000 description 20
- 230000001965 increasing effect Effects 0.000 description 20
- 101001117316 Mus musculus Programmed cell death 1 ligand 1 Proteins 0.000 description 19
- 238000004458 analytical method Methods 0.000 description 19
- 238000003780 insertion Methods 0.000 description 18
- 230000037431 insertion Effects 0.000 description 18
- 238000007799 mixed lymphocyte reaction assay Methods 0.000 description 18
- 102000005962 receptors Human genes 0.000 description 18
- 108020003175 receptors Proteins 0.000 description 18
- 231100000491 EC50 Toxicity 0.000 description 17
- 108010074328 Interferon-gamma Proteins 0.000 description 17
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 16
- 101100112922 Candida albicans CDR3 gene Proteins 0.000 description 16
- 238000002965 ELISA Methods 0.000 description 16
- 238000002835 absorbance Methods 0.000 description 16
- 230000008484 agonism Effects 0.000 description 16
- 239000000556 agonist Substances 0.000 description 16
- 239000012091 fetal bovine serum Substances 0.000 description 16
- 238000006467 substitution reaction Methods 0.000 description 16
- 241000282567 Macaca fascicularis Species 0.000 description 15
- 101001043827 Mus musculus Interleukin-2 Proteins 0.000 description 15
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 15
- 230000003389 potentiating effect Effects 0.000 description 15
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 14
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 14
- 239000006143 cell culture medium Substances 0.000 description 14
- 238000010494 dissociation reaction Methods 0.000 description 14
- 230000005593 dissociations Effects 0.000 description 14
- 108010026228 mRNA guanylyltransferase Proteins 0.000 description 14
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 14
- 108010057466 NF-kappa B Proteins 0.000 description 13
- 102000003945 NF-kappa B Human genes 0.000 description 13
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 13
- 230000003993 interaction Effects 0.000 description 13
- 230000036515 potency Effects 0.000 description 13
- 230000002829 reductive effect Effects 0.000 description 13
- 238000012216 screening Methods 0.000 description 13
- 230000001225 therapeutic effect Effects 0.000 description 13
- 229950005972 urelumab Drugs 0.000 description 13
- 102100037850 Interferon gamma Human genes 0.000 description 12
- 108090000765 processed proteins & peptides Proteins 0.000 description 12
- 239000006228 supernatant Substances 0.000 description 12
- 230000004614 tumor growth Effects 0.000 description 12
- 201000010099 disease Diseases 0.000 description 11
- 239000003814 drug Substances 0.000 description 11
- 230000005764 inhibitory process Effects 0.000 description 11
- 230000004083 survival effect Effects 0.000 description 11
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical group N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 10
- 230000001270 agonistic effect Effects 0.000 description 10
- 230000009260 cross reactivity Effects 0.000 description 10
- 230000005714 functional activity Effects 0.000 description 10
- 239000000178 monomer Substances 0.000 description 10
- 238000002823 phage display Methods 0.000 description 10
- 238000000746 purification Methods 0.000 description 10
- 206010006187 Breast cancer Diseases 0.000 description 9
- 229940116741 CD137 agonist Drugs 0.000 description 9
- 239000004971 Cross linker Substances 0.000 description 9
- 108010021468 Fc gamma receptor IIA Proteins 0.000 description 9
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 9
- 108060003951 Immunoglobulin Proteins 0.000 description 9
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 9
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 9
- 125000003275 alpha amino acid group Chemical group 0.000 description 9
- 210000003719 b-lymphocyte Anatomy 0.000 description 9
- 230000028993 immune response Effects 0.000 description 9
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 9
- 102000018358 immunoglobulin Human genes 0.000 description 9
- 230000004048 modification Effects 0.000 description 9
- 238000012986 modification Methods 0.000 description 9
- 230000019491 signal transduction Effects 0.000 description 9
- 238000001542 size-exclusion chromatography Methods 0.000 description 9
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 description 9
- 239000004471 Glycine Substances 0.000 description 8
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 8
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 8
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 8
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 8
- 102100032101 Tumor necrosis factor ligand superfamily member 9 Human genes 0.000 description 8
- 230000000259 anti-tumor effect Effects 0.000 description 8
- 239000011324 bead Substances 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 230000006240 deamidation Effects 0.000 description 8
- 238000012217 deletion Methods 0.000 description 8
- 230000037430 deletion Effects 0.000 description 8
- 210000004443 dendritic cell Anatomy 0.000 description 8
- 230000001419 dependent effect Effects 0.000 description 8
- 230000001976 improved effect Effects 0.000 description 8
- 238000011534 incubation Methods 0.000 description 8
- 239000003446 ligand Substances 0.000 description 8
- 108010068617 neonatal Fc receptor Proteins 0.000 description 8
- 238000004806 packaging method and process Methods 0.000 description 8
- 230000035755 proliferation Effects 0.000 description 8
- 238000001959 radiotherapy Methods 0.000 description 8
- 230000000717 retained effect Effects 0.000 description 8
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 8
- 206010005003 Bladder cancer Diseases 0.000 description 7
- 101000638251 Homo sapiens Tumor necrosis factor ligand superfamily member 9 Proteins 0.000 description 7
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 7
- 239000012515 MabSelect SuRe Substances 0.000 description 7
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 7
- 230000009824 affinity maturation Effects 0.000 description 7
- 235000004279 alanine Nutrition 0.000 description 7
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 7
- 235000020958 biotin Nutrition 0.000 description 7
- 238000004422 calculation algorithm Methods 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 239000002299 complementary DNA Substances 0.000 description 7
- 230000006870 function Effects 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 230000002401 inhibitory effect Effects 0.000 description 7
- 210000001616 monocyte Anatomy 0.000 description 7
- 208000008443 pancreatic carcinoma Diseases 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 230000009870 specific binding Effects 0.000 description 7
- 229940124597 therapeutic agent Drugs 0.000 description 7
- 210000001519 tissue Anatomy 0.000 description 7
- 238000004448 titration Methods 0.000 description 7
- 201000005112 urinary bladder cancer Diseases 0.000 description 7
- OZFAFGSSMRRTDW-UHFFFAOYSA-N (2,4-dichlorophenyl) benzenesulfonate Chemical compound ClC1=CC(Cl)=CC=C1OS(=O)(=O)C1=CC=CC=C1 OZFAFGSSMRRTDW-UHFFFAOYSA-N 0.000 description 6
- 208000026310 Breast neoplasm Diseases 0.000 description 6
- 238000011740 C57BL/6 mouse Methods 0.000 description 6
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 6
- 239000012591 Dulbecco’s Phosphate Buffered Saline Substances 0.000 description 6
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 6
- 108060001084 Luciferase Proteins 0.000 description 6
- 239000005089 Luciferase Substances 0.000 description 6
- 206010033128 Ovarian cancer Diseases 0.000 description 6
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 6
- 229930182555 Penicillin Natural products 0.000 description 6
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 6
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 6
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 6
- 238000007792 addition Methods 0.000 description 6
- 238000012575 bio-layer interferometry Methods 0.000 description 6
- 239000011616 biotin Substances 0.000 description 6
- 229960002685 biotin Drugs 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 230000000875 corresponding effect Effects 0.000 description 6
- 230000007423 decrease Effects 0.000 description 6
- 238000011161 development Methods 0.000 description 6
- 230000018109 developmental process Effects 0.000 description 6
- 230000036541 health Effects 0.000 description 6
- 231100000304 hepatotoxicity Toxicity 0.000 description 6
- 210000000987 immune system Anatomy 0.000 description 6
- 238000000338 in vitro Methods 0.000 description 6
- 230000001939 inductive effect Effects 0.000 description 6
- 210000000265 leukocyte Anatomy 0.000 description 6
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 6
- 201000002528 pancreatic cancer Diseases 0.000 description 6
- 229940049954 penicillin Drugs 0.000 description 6
- 102000004196 processed proteins & peptides Human genes 0.000 description 6
- 230000011664 signaling Effects 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 6
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 6
- 101150013553 CD40 gene Proteins 0.000 description 5
- 241000283707 Capra Species 0.000 description 5
- 229920001917 Ficoll Polymers 0.000 description 5
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 5
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 5
- 101000599940 Homo sapiens Interferon gamma Proteins 0.000 description 5
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 5
- 102000008070 Interferon-gamma Human genes 0.000 description 5
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 5
- 206010061535 Ovarian neoplasm Diseases 0.000 description 5
- 206010060862 Prostate cancer Diseases 0.000 description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 5
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 5
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 230000005907 cancer growth Effects 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 239000012228 culture supernatant Substances 0.000 description 5
- 231100000371 dose-limiting toxicity Toxicity 0.000 description 5
- 231100000673 dose–response relationship Toxicity 0.000 description 5
- 239000012636 effector Substances 0.000 description 5
- 230000002708 enhancing effect Effects 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 230000012010 growth Effects 0.000 description 5
- 229960003130 interferon gamma Drugs 0.000 description 5
- 238000002955 isolation Methods 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 230000009871 nonspecific binding Effects 0.000 description 5
- 239000012071 phase Substances 0.000 description 5
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 5
- 238000011002 quantification Methods 0.000 description 5
- 230000008929 regeneration Effects 0.000 description 5
- 238000011069 regeneration method Methods 0.000 description 5
- 229950003520 utomilumab Drugs 0.000 description 5
- 208000003174 Brain Neoplasms Diseases 0.000 description 4
- 101710185679 CD276 antigen Proteins 0.000 description 4
- 102100038078 CD276 antigen Human genes 0.000 description 4
- 206010008342 Cervix carcinoma Diseases 0.000 description 4
- 206010009944 Colon cancer Diseases 0.000 description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 4
- 238000008157 ELISA kit Methods 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 108010021472 Fc gamma receptor IIB Proteins 0.000 description 4
- 206010019851 Hepatotoxicity Diseases 0.000 description 4
- 102000037982 Immune checkpoint proteins Human genes 0.000 description 4
- 108091008036 Immune checkpoint proteins Proteins 0.000 description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 description 4
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 4
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 4
- 102100029205 Low affinity immunoglobulin gamma Fc region receptor II-b Human genes 0.000 description 4
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 4
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 4
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 4
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 4
- 206010038389 Renal cancer Diseases 0.000 description 4
- 206010041067 Small cell lung cancer Diseases 0.000 description 4
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 description 4
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 4
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 4
- 230000003213 activating effect Effects 0.000 description 4
- 239000007825 activation reagent Substances 0.000 description 4
- 239000012190 activator Substances 0.000 description 4
- 238000001042 affinity chromatography Methods 0.000 description 4
- 239000002246 antineoplastic agent Substances 0.000 description 4
- 229950002916 avelumab Drugs 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 239000011230 binding agent Substances 0.000 description 4
- 230000000975 bioactive effect Effects 0.000 description 4
- 210000000481 breast Anatomy 0.000 description 4
- 201000010881 cervical cancer Diseases 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 238000002512 chemotherapy Methods 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 4
- 230000004069 differentiation Effects 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 230000007783 downstream signaling Effects 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 210000003743 erythrocyte Anatomy 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 206010017758 gastric cancer Diseases 0.000 description 4
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 4
- 230000007686 hepatotoxicity Effects 0.000 description 4
- 239000002955 immunomodulating agent Substances 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 201000010982 kidney cancer Diseases 0.000 description 4
- 238000004020 luminiscence type Methods 0.000 description 4
- 201000005202 lung cancer Diseases 0.000 description 4
- 208000020816 lung neoplasm Diseases 0.000 description 4
- 201000001441 melanoma Diseases 0.000 description 4
- 210000000822 natural killer cell Anatomy 0.000 description 4
- 229920001184 polypeptide Polymers 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 238000000159 protein binding assay Methods 0.000 description 4
- 238000002818 protein evolution Methods 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 4
- 208000000587 small cell lung carcinoma Diseases 0.000 description 4
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 4
- 229940054269 sodium pyruvate Drugs 0.000 description 4
- 201000011549 stomach cancer Diseases 0.000 description 4
- 229960005322 streptomycin Drugs 0.000 description 4
- 230000008685 targeting Effects 0.000 description 4
- 238000010361 transduction Methods 0.000 description 4
- 230000026683 transduction Effects 0.000 description 4
- 230000010474 transient expression Effects 0.000 description 4
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 4
- PNDPGZBMCMUPRI-HVTJNCQCSA-N 10043-66-0 Chemical compound [131I][131I] PNDPGZBMCMUPRI-HVTJNCQCSA-N 0.000 description 3
- 239000012114 Alexa Fluor 647 Substances 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 3
- 241000588724 Escherichia coli Species 0.000 description 3
- 108700024394 Exon Proteins 0.000 description 3
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101000979342 Homo sapiens Nuclear factor NF-kappa-B p105 subunit Proteins 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 208000002030 Merkel cell carcinoma Diseases 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 206010029266 Neuroendocrine carcinoma of the skin Diseases 0.000 description 3
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 3
- 239000012979 RPMI medium Substances 0.000 description 3
- 238000012300 Sequence Analysis Methods 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- QTENRWWVYAAPBI-YZTFXSNBSA-N Streptomycin sulfate Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.OS(O)(=O)=O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@H]1[C@H](N=C(N)N)[C@@H](O)[C@H](N=C(N)N)[C@@H](O)[C@@H]1O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@H]1[C@H](N=C(N)N)[C@@H](O)[C@H](N=C(N)N)[C@@H](O)[C@@H]1O QTENRWWVYAAPBI-YZTFXSNBSA-N 0.000 description 3
- 230000024932 T cell mediated immunity Effects 0.000 description 3
- 230000006052 T cell proliferation Effects 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- VWQVUPCCIRVNHF-OUBTZVSYSA-N Yttrium-90 Chemical compound [90Y] VWQVUPCCIRVNHF-OUBTZVSYSA-N 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 230000002776 aggregation Effects 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 230000000735 allogeneic effect Effects 0.000 description 3
- 238000011394 anticancer treatment Methods 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- 229930189065 blasticidin Natural products 0.000 description 3
- 201000008274 breast adenocarcinoma Diseases 0.000 description 3
- 229940022399 cancer vaccine Drugs 0.000 description 3
- 238000013368 capillary electrophoresis sodium dodecyl sulfate analysis Methods 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 230000000973 chemotherapeutic effect Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000011198 co-culture assay Methods 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 description 3
- 230000016396 cytokine production Effects 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 230000001472 cytotoxic effect Effects 0.000 description 3
- 238000007405 data analysis Methods 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 238000000113 differential scanning calorimetry Methods 0.000 description 3
- -1 e.g. Proteins 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 210000004602 germ cell Anatomy 0.000 description 3
- 208000005017 glioblastoma Diseases 0.000 description 3
- 235000013922 glutamic acid Nutrition 0.000 description 3
- 239000004220 glutamic acid Substances 0.000 description 3
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 3
- 201000010536 head and neck cancer Diseases 0.000 description 3
- 208000014829 head and neck neoplasm Diseases 0.000 description 3
- 208000006454 hepatitis Diseases 0.000 description 3
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 3
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 3
- 102000047410 human NFKB1 Human genes 0.000 description 3
- 210000004408 hybridoma Anatomy 0.000 description 3
- 230000008629 immune suppression Effects 0.000 description 3
- 229960001438 immunostimulant agent Drugs 0.000 description 3
- XMBWDFGMSWQBCA-YPZZEJLDSA-N iodane Chemical compound [125IH] XMBWDFGMSWQBCA-YPZZEJLDSA-N 0.000 description 3
- 229940044173 iodine-125 Drugs 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 201000007270 liver cancer Diseases 0.000 description 3
- 208000018191 liver inflammation Diseases 0.000 description 3
- 208000014018 liver neoplasm Diseases 0.000 description 3
- 230000003211 malignant effect Effects 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 238000002703 mutagenesis Methods 0.000 description 3
- 231100000350 mutagenesis Toxicity 0.000 description 3
- 238000001422 normality test Methods 0.000 description 3
- 238000005457 optimization Methods 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000003439 radiotherapeutic effect Effects 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 238000009097 single-agent therapy Methods 0.000 description 3
- 238000002741 site-directed mutagenesis Methods 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 239000013638 trimer Substances 0.000 description 3
- 229960005486 vaccine Drugs 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- KKVYYGGCHJGEFJ-UHFFFAOYSA-N 1-n-(4-chlorophenyl)-6-methyl-5-n-[3-(7h-purin-6-yl)pyridin-2-yl]isoquinoline-1,5-diamine Chemical compound N=1C=CC2=C(NC=3C(=CC=CN=3)C=3C=4N=CNC=4N=CN=3)C(C)=CC=C2C=1NC1=CC=C(Cl)C=C1 KKVYYGGCHJGEFJ-UHFFFAOYSA-N 0.000 description 2
- WUAPFZMCVAUBPE-NJFSPNSNSA-N 188Re Chemical compound [188Re] WUAPFZMCVAUBPE-NJFSPNSNSA-N 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- IVLXQGJVBGMLRR-UHFFFAOYSA-N 2-aminoacetic acid;hydron;chloride Chemical compound Cl.NCC(O)=O IVLXQGJVBGMLRR-UHFFFAOYSA-N 0.000 description 2
- 108010082808 4-1BB Ligand Proteins 0.000 description 2
- 239000012103 Alexa Fluor 488 Substances 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 208000003950 B-cell lymphoma Diseases 0.000 description 2
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 2
- 108700031361 Brachyury Proteins 0.000 description 2
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 2
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 2
- 206010052360 Colorectal adenocarcinoma Diseases 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 101000609767 Dromaius novaehollandiae Ovalbumin Proteins 0.000 description 2
- 206010014733 Endometrial cancer Diseases 0.000 description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 2
- 229910052693 Europium Inorganic materials 0.000 description 2
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 2
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 2
- 101100099884 Homo sapiens CD40 gene Proteins 0.000 description 2
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 2
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 description 2
- 101000679921 Homo sapiens Tumor necrosis factor receptor superfamily member 21 Proteins 0.000 description 2
- 101000679851 Homo sapiens Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 2
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 2
- GRRNUXAQVGOGFE-UHFFFAOYSA-N Hygromycin-B Natural products OC1C(NC)CC(N)C(O)C1OC1C2OC3(C(C(O)C(O)C(C(N)CO)O3)O)OC2C(O)C(CO)O1 GRRNUXAQVGOGFE-UHFFFAOYSA-N 0.000 description 2
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 2
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 2
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 2
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 2
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 2
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 2
- 102000003814 Interleukin-10 Human genes 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 102000013462 Interleukin-12 Human genes 0.000 description 2
- 108010065805 Interleukin-12 Proteins 0.000 description 2
- 102000003812 Interleukin-15 Human genes 0.000 description 2
- 108090000172 Interleukin-15 Proteins 0.000 description 2
- 108010002586 Interleukin-7 Proteins 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 239000012097 Lipofectamine 2000 Substances 0.000 description 2
- 101710099301 Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 241001529936 Murinae Species 0.000 description 2
- 101100381978 Mus musculus Braf gene Proteins 0.000 description 2
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 2
- 239000012661 PARP inhibitor Substances 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Natural products OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 208000006265 Renal cell carcinoma Diseases 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- 208000034254 Squamous cell carcinoma of the cervix uteri Diseases 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 229940123237 Taxane Drugs 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 description 2
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 2
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 102100022205 Tumor necrosis factor receptor superfamily member 21 Human genes 0.000 description 2
- 229940125666 actinium-225 Drugs 0.000 description 2
- QQINRWTZWGJFDB-YPZZEJLDSA-N actinium-225 Chemical compound [225Ac] QQINRWTZWGJFDB-YPZZEJLDSA-N 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 230000003432 anti-folate effect Effects 0.000 description 2
- 238000011319 anticancer therapy Methods 0.000 description 2
- 229940127074 antifolate Drugs 0.000 description 2
- 230000030741 antigen processing and presentation Effects 0.000 description 2
- 239000003972 antineoplastic antibiotic Substances 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 235000009697 arginine Nutrition 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 229940009098 aspartate Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 239000012911 assay medium Substances 0.000 description 2
- RYXHOMYVWAEKHL-OUBTZVSYSA-N astatine-211 Chemical compound [211At] RYXHOMYVWAEKHL-OUBTZVSYSA-N 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 238000004166 bioassay Methods 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 150000001615 biotins Chemical class 0.000 description 2
- JCXGWMGPZLAOME-RNFDNDRNSA-N bismuth-213 Chemical compound [213Bi] JCXGWMGPZLAOME-RNFDNDRNSA-N 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- YCIMNLLNPGFGHC-UHFFFAOYSA-N catechol Chemical compound OC1=CC=CC=C1O YCIMNLLNPGFGHC-UHFFFAOYSA-N 0.000 description 2
- 238000000423 cell based assay Methods 0.000 description 2
- 239000008004 cell lysis buffer Substances 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 201000006612 cervical squamous cell carcinoma Diseases 0.000 description 2
- 239000012829 chemotherapy agent Substances 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical class N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 230000004186 co-expression Effects 0.000 description 2
- 208000037966 cold tumor Diseases 0.000 description 2
- 238000002591 computed tomography Methods 0.000 description 2
- 239000013068 control sample Substances 0.000 description 2
- RYGMFSIKBFXOCR-AKLPVKDBSA-N copper-67 Chemical compound [67Cu] RYGMFSIKBFXOCR-AKLPVKDBSA-N 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 229960003722 doxycycline Drugs 0.000 description 2
- XQTWDDCIUJNLTR-CVHRZJFOSA-N doxycycline monohydrate Chemical compound O.O=C1C2=C(O)C=CC=C2[C@H](C)[C@@H]2C1=C(O)[C@]1(O)C(=O)C(C(N)=O)=C(O)[C@@H](N(C)C)[C@@H]1[C@H]2O XQTWDDCIUJNLTR-CVHRZJFOSA-N 0.000 description 2
- 229950009791 durvalumab Drugs 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 229940096118 ella Drugs 0.000 description 2
- 239000002532 enzyme inhibitor Substances 0.000 description 2
- 201000004101 esophageal cancer Diseases 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 239000004052 folic acid antagonist Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000012737 fresh medium Substances 0.000 description 2
- 201000006585 gastric adenocarcinoma Diseases 0.000 description 2
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 2
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 2
- 239000012561 harvest cell culture fluid Substances 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 102000048362 human PDCD1 Human genes 0.000 description 2
- 150000007857 hydrazones Chemical class 0.000 description 2
- GRRNUXAQVGOGFE-NZSRVPFOSA-N hygromycin B Chemical compound O[C@@H]1[C@@H](NC)C[C@@H](N)[C@H](O)[C@H]1O[C@H]1[C@H]2O[C@@]3([C@@H]([C@@H](O)[C@@H](O)[C@@H](C(N)CO)O3)O)O[C@H]2[C@@H](O)[C@@H](CO)O1 GRRNUXAQVGOGFE-NZSRVPFOSA-N 0.000 description 2
- 229940097277 hygromycin b Drugs 0.000 description 2
- 230000002519 immonomodulatory effect Effects 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 229940027941 immunoglobulin g Drugs 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 210000005007 innate immune system Anatomy 0.000 description 2
- 230000010354 integration Effects 0.000 description 2
- 230000004073 interleukin-2 production Effects 0.000 description 2
- 108010074108 interleukin-21 Proteins 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 230000002147 killing effect Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 2
- OHSVLFRHMCKCQY-NJFSPNSNSA-N lutetium-177 Chemical compound [177Lu] OHSVLFRHMCKCQY-NJFSPNSNSA-N 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 2
- 239000012516 mab select resin Substances 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 231100000682 maximum tolerated dose Toxicity 0.000 description 2
- 230000015654 memory Effects 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 229960001156 mitoxantrone Drugs 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 210000000066 myeloid cell Anatomy 0.000 description 2
- 229960003301 nivolumab Drugs 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- 150000003833 nucleoside derivatives Chemical class 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 230000002611 ovarian Effects 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 229960001756 oxaliplatin Drugs 0.000 description 2
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical class O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 210000002741 palatine tonsil Anatomy 0.000 description 2
- 238000004091 panning Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 229960002621 pembrolizumab Drugs 0.000 description 2
- 238000009520 phase I clinical trial Methods 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 150000003057 platinum Chemical class 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 210000004986 primary T-cell Anatomy 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000011363 radioimmunotherapy Methods 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- GHMLBKRAJCXXBS-UHFFFAOYSA-N resorcinol Chemical compound OC1=CC=CC(O)=C1 GHMLBKRAJCXXBS-UHFFFAOYSA-N 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000011519 second-line treatment Methods 0.000 description 2
- 208000011571 secondary malignant neoplasm Diseases 0.000 description 2
- 231100000847 severe hepatotoxicity Toxicity 0.000 description 2
- 239000001488 sodium phosphate Substances 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- GZCRRIHWUXGPOV-NJFSPNSNSA-N terbium-161 Chemical compound [161Tb] GZCRRIHWUXGPOV-NJFSPNSNSA-N 0.000 description 2
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 2
- 238000011287 therapeutic dose Methods 0.000 description 2
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 201000002510 thyroid cancer Diseases 0.000 description 2
- 230000001131 transforming effect Effects 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- 206010044412 transitional cell carcinoma Diseases 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 2
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 2
- OOLLAFOLCSJHRE-ZHAKMVSLSA-N ulipristal acetate Chemical compound C1=CC(N(C)C)=CC=C1[C@@H]1C2=C3CCC(=O)C=C3CC[C@H]2[C@H](CC[C@]2(OC(C)=O)C(C)=O)[C@]2(C)C1 OOLLAFOLCSJHRE-ZHAKMVSLSA-N 0.000 description 2
- 241000712461 unidentified influenza virus Species 0.000 description 2
- 230000003827 upregulation Effects 0.000 description 2
- 208000023747 urothelial carcinoma Diseases 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- 230000003442 weekly effect Effects 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- ITFICYZHWXDVMU-IPTZIORSSA-N (2S)-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-4-amino-2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-6-amino-2-[[(2S,3S)-2-[[(2S)-2-[[(2R)-2-[[(2S)-1-[(2S)-2-[[(2S,3R)-2-[[(2S,3S)-2-[[(2S,3R)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-amino-4-carboxybutanoyl]amino]acetyl]amino]-3-hydroxypropanoyl]amino]-3-carboxypropanoyl]amino]-3-hydroxybutanoyl]amino]-3-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]-4-methylpentanoyl]pyrrolidine-2-carbonyl]amino]-3-sulfanylpropanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-3-methylpentanoyl]amino]hexanoyl]amino]-5-oxopentanoyl]amino]-3-phenylpropanoyl]amino]-3-methylpentanoyl]amino]-4-oxobutanoyl]amino]-4-methylsulfanylbutanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-5-oxopentanoyl]amino]pentanedioic acid Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC2=CNC3=CC=CC=C32)C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CS)NC(=O)[C@@H]4CCCN4C(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(=O)O)N ITFICYZHWXDVMU-IPTZIORSSA-N 0.000 description 1
- QGKMIGUHVLGJBR-UHFFFAOYSA-M (4z)-1-(3-methylbutyl)-4-[[1-(3-methylbutyl)quinolin-1-ium-4-yl]methylidene]quinoline;iodide Chemical compound [I-].C12=CC=CC=C2N(CCC(C)C)C=CC1=CC1=CC=[N+](CCC(C)C)C2=CC=CC=C12 QGKMIGUHVLGJBR-UHFFFAOYSA-M 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- 108010058566 130-nm albumin-bound paclitaxel Proteins 0.000 description 1
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical class O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 1
- QRBLKGHRWFGINE-UGWAGOLRSA-N 2-[2-[2-[[2-[[4-[[2-[[6-amino-2-[3-amino-1-[(2,3-diamino-3-oxopropyl)amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2s,3r,4r,5s)-4-carbamoyl-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-4,5-dihydroxy-6-(hydroxymethyl)- Chemical compound N=1C(C=2SC=C(N=2)C(N)=O)CSC=1CCNC(=O)C(C(C)=O)NC(=O)C(C)C(O)C(C)NC(=O)C(C(O[C@H]1[C@@]([C@@H](O)[C@H](O)[C@H](CO)O1)(C)O[C@H]1[C@@H]([C@](O)([C@@H](O)C(CO)O1)C(N)=O)O)C=1NC=NC=1)NC(=O)C1=NC(C(CC(N)=O)NCC(N)C(N)=O)=NC(N)=C1C QRBLKGHRWFGINE-UGWAGOLRSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- 102100022464 5'-nucleotidase Human genes 0.000 description 1
- LLIANSAISVOLHR-GBCQHVBFSA-N 5-[(3as,4s,6ar)-2-oxidanylidene-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoic acid Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21.N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 LLIANSAISVOLHR-GBCQHVBFSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 description 1
- 206010001197 Adenocarcinoma of the cervix Diseases 0.000 description 1
- 208000034246 Adenocarcinoma of the cervix uteri Diseases 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 102100037435 Antiviral innate immune response receptor RIG-I Human genes 0.000 description 1
- 101710127675 Antiviral innate immune response receptor RIG-I Proteins 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- 229940125565 BMS-986016 Drugs 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 101100495352 Candida albicans CDR4 gene Proteins 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- 102100025597 Caspase-4 Human genes 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 201000005171 Cystadenoma Diseases 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 235000016936 Dendrocalamus strictus Nutrition 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 1
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 1
- 101000933112 Homo sapiens Caspase-4 Proteins 0.000 description 1
- 101000737793 Homo sapiens Cerebellar degeneration-related antigen 1 Proteins 0.000 description 1
- 101000737796 Homo sapiens Cerebellar degeneration-related protein 2 Proteins 0.000 description 1
- 101000868279 Homo sapiens Leukocyte surface antigen CD47 Proteins 0.000 description 1
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 description 1
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 1
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 1
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 1
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical class C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000002227 Interferon Type I Human genes 0.000 description 1
- 108010014726 Interferon Type I Proteins 0.000 description 1
- 102100027353 Interferon-induced helicase C domain-containing protein 1 Human genes 0.000 description 1
- 101710085994 Interferon-induced helicase C domain-containing protein 1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 108090000171 Interleukin-18 Proteins 0.000 description 1
- 102100030703 Interleukin-22 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 102000002698 KIR Receptors Human genes 0.000 description 1
- 108010043610 KIR Receptors Proteins 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 1
- 229930064664 L-arginine Natural products 0.000 description 1
- 235000014852 L-arginine Nutrition 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 102000017578 LAG3 Human genes 0.000 description 1
- 101150030213 Lag3 gene Proteins 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 102100032913 Leukocyte surface antigen CD47 Human genes 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 108091054437 MHC class I family Proteins 0.000 description 1
- 102000043129 MHC class I family Human genes 0.000 description 1
- 108091054438 MHC class II family Proteins 0.000 description 1
- 102000043131 MHC class II family Human genes 0.000 description 1
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100028123 Macrophage colony-stimulating factor 1 Human genes 0.000 description 1
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 1
- 101710150918 Macrophage colony-stimulating factor 1 receptor Proteins 0.000 description 1
- 206010073059 Malignant neoplasm of unknown primary site Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 101001044384 Mus musculus Interferon gamma Proteins 0.000 description 1
- 101001034843 Mus musculus Interferon-induced transmembrane protein 1 Proteins 0.000 description 1
- 101100519207 Mus musculus Pdcd1 gene Proteins 0.000 description 1
- 101100207073 Mus musculus Tnfsf9 gene Proteins 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 108010004729 Phycoerythrin Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 101710094000 Programmed cell death 1 ligand 1 Proteins 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 241000588769 Proteus <enterobacteria> Species 0.000 description 1
- 108091005685 RIG-I-like receptors Proteins 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 239000008156 Ringer's lactate solution Substances 0.000 description 1
- 102000000395 SH3 domains Human genes 0.000 description 1
- 108050008861 SH3 domains Proteins 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 102100038803 Somatotropin Human genes 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 230000010782 T cell mediated cytotoxicity Effects 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 description 1
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 1
- GKLVYJBZJHMRIY-OUBTZVSYSA-N Technetium-99 Chemical compound [99Tc] GKLVYJBZJHMRIY-OUBTZVSYSA-N 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- 208000000728 Thymus Neoplasms Diseases 0.000 description 1
- 108010060818 Toll-Like Receptor 9 Proteins 0.000 description 1
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 1
- 102100039390 Toll-like receptor 7 Human genes 0.000 description 1
- 102100033117 Toll-like receptor 9 Human genes 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 description 1
- 206010053613 Type IV hypersensitivity reaction Diseases 0.000 description 1
- 229940127174 UCHT1 Drugs 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 108010084455 Zeocin Proteins 0.000 description 1
- SXEHKFHPFVVDIR-UHFFFAOYSA-N [4-(4-hydrazinylphenyl)phenyl]hydrazine Chemical compound C1=CC(NN)=CC=C1C1=CC=C(NN)C=C1 SXEHKFHPFVVDIR-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000006786 activation induced cell death Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 201000005188 adrenal gland cancer Diseases 0.000 description 1
- 208000024447 adrenal gland neoplasm Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- 230000001512 anti-cytomegaloviral effect Effects 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 230000006023 anti-tumor response Effects 0.000 description 1
- 238000009175 antibody therapy Methods 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000001174 ascending effect Effects 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960003852 atezolizumab Drugs 0.000 description 1
- 229960003005 axitinib Drugs 0.000 description 1
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical compound CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 201000009036 biliary tract cancer Diseases 0.000 description 1
- 208000020790 biliary tract neoplasm Diseases 0.000 description 1
- 238000013378 biophysical characterization Methods 0.000 description 1
- 108091006004 biotinylated proteins Proteins 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- HUTDDBSSHVOYJR-UHFFFAOYSA-H bis[(2-oxo-1,3,2$l^{5},4$l^{2}-dioxaphosphaplumbetan-2-yl)oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O HUTDDBSSHVOYJR-UHFFFAOYSA-H 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 238000002725 brachytherapy Methods 0.000 description 1
- LRHPLDYGYMQRHN-UHFFFAOYSA-N butyl alcohol Substances CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- BMLSTPRTEKLIPM-UHFFFAOYSA-I calcium;potassium;disodium;hydrogen carbonate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].OC([O-])=O BMLSTPRTEKLIPM-UHFFFAOYSA-I 0.000 description 1
- ZEWYCNBZMPELPF-UHFFFAOYSA-J calcium;potassium;sodium;2-hydroxypropanoic acid;sodium;tetrachloride Chemical compound [Na].[Na+].[Cl-].[Cl-].[Cl-].[Cl-].[K+].[Ca+2].CC(O)C(O)=O ZEWYCNBZMPELPF-UHFFFAOYSA-J 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000004611 cancer cell death Effects 0.000 description 1
- 230000005880 cancer cell killing Effects 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 238000005251 capillar electrophoresis Methods 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 190000008236 carboplatin Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 201000006662 cervical adenocarcinoma Diseases 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 208000006990 cholangiocarcinoma Diseases 0.000 description 1
- 238000003501 co-culture Methods 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 108091036078 conserved sequence Proteins 0.000 description 1
- 230000037011 constitutive activity Effects 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 210000000172 cytosol Anatomy 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 229960002465 dabrafenib Drugs 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000009615 deamination Effects 0.000 description 1
- 238000006481 deamination reaction Methods 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 229950008937 defactinib Drugs 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 201000003683 endocervical adenocarcinoma Diseases 0.000 description 1
- INVTYAOGFAGBOE-UHFFFAOYSA-N entinostat Chemical compound NC1=CC=CC=C1NC(=O)C(C=C1)=CC=C1CNC(=O)OCC1=CC=CN=C1 INVTYAOGFAGBOE-UHFFFAOYSA-N 0.000 description 1
- 229950005837 entinostat Drugs 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- UFNVPOGXISZXJD-XJPMSQCNSA-N eribulin Chemical compound C([C@H]1CC[C@@H]2O[C@@H]3[C@H]4O[C@H]5C[C@](O[C@H]4[C@H]2O1)(O[C@@H]53)CC[C@@H]1O[C@H](C(C1)=C)CC1)C(=O)C[C@@H]2[C@@H](OC)[C@@H](C[C@H](O)CN)O[C@H]2C[C@@H]2C(=C)[C@H](C)C[C@H]1O2 UFNVPOGXISZXJD-XJPMSQCNSA-N 0.000 description 1
- 229960003649 eribulin Drugs 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 description 1
- 238000002710 external beam radiation therapy Methods 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 201000003911 head and neck carcinoma Diseases 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 239000013628 high molecular weight specie Substances 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 230000005745 host immune response Effects 0.000 description 1
- 208000037967 hot tumor Diseases 0.000 description 1
- 102000050320 human TNFRSF4 Human genes 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- 230000005931 immune cell recruitment Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 229940127121 immunoconjugate Drugs 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 230000006054 immunological memory Effects 0.000 description 1
- 239000003022 immunostimulating agent Substances 0.000 description 1
- 238000011078 in-house production Methods 0.000 description 1
- 229940055742 indium-111 Drugs 0.000 description 1
- APFVFJFRJDLVQX-AHCXROLUSA-N indium-111 Chemical compound [111In] APFVFJFRJDLVQX-AHCXROLUSA-N 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 108091008042 inhibitory receptors Proteins 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 238000012933 kinetic analysis Methods 0.000 description 1
- 239000000990 laser dye Substances 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 238000007169 ligase reaction Methods 0.000 description 1
- 230000007056 liver toxicity Effects 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 239000013627 low molecular weight specie Substances 0.000 description 1
- 201000005249 lung adenocarcinoma Diseases 0.000 description 1
- 201000005243 lung squamous cell carcinoma Diseases 0.000 description 1
- 238000002794 lymphocyte assay Methods 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Chemical class 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- 238000002625 monoclonal antibody therapy Methods 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 238000000569 multi-angle light scattering Methods 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- FWLMVFUGMHIOAA-UHFFFAOYSA-N n-methyl-4-[[4-[[3-[methyl(methylsulfonyl)amino]pyrazin-2-yl]methylamino]-5-(trifluoromethyl)pyrimidin-2-yl]amino]benzamide Chemical compound C1=CC(C(=O)NC)=CC=C1NC1=NC=C(C(F)(F)F)C(NCC=2C(=NC=CN=2)N(C)S(C)(=O)=O)=N1 FWLMVFUGMHIOAA-UHFFFAOYSA-N 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 230000009437 off-target effect Effects 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 244000309459 oncolytic virus Species 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 208000012988 ovarian serous adenocarcinoma Diseases 0.000 description 1
- 201000003709 ovarian serous carcinoma Diseases 0.000 description 1
- LXCFILQKKLGQFO-UHFFFAOYSA-N p-hydroxybenzoic acid methyl ester Natural products COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229960005079 pemetrexed Drugs 0.000 description 1
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- JGWRKYUXBBNENE-UHFFFAOYSA-N pexidartinib Chemical compound C1=NC(C(F)(F)F)=CC=C1CNC(N=C1)=CC=C1CC1=CNC2=NC=C(Cl)C=C12 JGWRKYUXBBNENE-UHFFFAOYSA-N 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- CWCMIVBLVUHDHK-ZSNHEYEWSA-N phleomycin D1 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC[C@@H](N=1)C=1SC=C(N=1)C(=O)NCCCCNC(N)=N)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C CWCMIVBLVUHDHK-ZSNHEYEWSA-N 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 230000034190 positive regulation of NF-kappaB transcription factor activity Effects 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 230000006577 protective pathway Effects 0.000 description 1
- 238000012514 protein characterization Methods 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 239000012217 radiopharmaceutical Substances 0.000 description 1
- 229940121896 radiopharmaceutical Drugs 0.000 description 1
- 230000002799 radiopharmaceutical effect Effects 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 210000003289 regulatory T cell Anatomy 0.000 description 1
- 230000008844 regulatory mechanism Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- 239000012146 running buffer Substances 0.000 description 1
- 239000012723 sample buffer Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000002805 secondary assay Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000008354 sodium chloride injection Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- SFVFIFLLYFPGHH-UHFFFAOYSA-M stearalkonium chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCCCC[N+](C)(C)CC1=CC=CC=C1 SFVFIFLLYFPGHH-UHFFFAOYSA-M 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 231100000057 systemic toxicity Toxicity 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 229960000814 tetanus toxoid Drugs 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 231100001274 therapeutic index Toxicity 0.000 description 1
- 231100000041 toxicology testing Toxicity 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 238000005829 trimerization reaction Methods 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 230000005951 type IV hypersensitivity Effects 0.000 description 1
- 208000027930 type IV hypersensitivity disease Diseases 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 229960000653 valrubicin Drugs 0.000 description 1
- ZOCKGBMQLCSHFP-KQRAQHLDSA-N valrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)CCCC)[C@H]1C[C@H](NC(=O)C(F)(F)F)[C@H](O)[C@H](C)O1 ZOCKGBMQLCSHFP-KQRAQHLDSA-N 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 229960003862 vemurafenib Drugs 0.000 description 1
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 230000003313 weakening effect Effects 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
本発明は、PD-L1及びCD137の両方に結合し、CD137のアゴニスト作用を誘導することができる抗体分子に関する。抗体分子は、PD-L1のCDRベースの結合部位と、抗体分子の定常ドメインに位置するCD137抗原結合部位とを含む。本発明の抗体分子は、例えば、癌などの疾患の処置に、用途が見出される。
プログラム細胞死1(PD-1)及びそのリガンドPD-L1(CD274、B7-H1)及びPD-L2(B7-DC)は、T細胞の活性化、耐性、及び免疫病理学のバランスを調節する阻害シグナルを伝達する。PD-L1は、全ての免疫細胞及び一部の腫瘍細胞で一過性に発現する。PD-L1は、B7タンパク質ファミリーのメンバーであり、B7.1及びB7.2とおよそ20%のアミノ酸配列同一性を共有している。ヒトPD-L1は、PD-L1のマウス及びカニクイザルのオルソログとそれぞれ70%及び93%のアミノ酸同一性を共有している。
関連発現は、免疫抵抗性を付与し、T細胞媒介性アポトーシスから腫瘍細胞を保護する可能性があることが示されている。
び二次処置に承認されている(Iwai et al., 2017)。アベルマブ(MSB0010718C、Bavencio(商標))はPD-L1に結合する完全ヒトIgG1抗体であり、メルケル細胞癌の処置及び膀胱癌の二次処置に承認されている一方で、完全ヒトIgG1抗体デュルバルマブ(MEDI4736、Imfinzi(商標))は二次膀胱癌の処置に承認されている。これらの抗体及
びその他の抗PD-L1治療薬を用いた追加の試験は、結腸直腸癌、胃癌、乳癌、頭頸部癌、膵臓癌、卵巣癌、及び腎細胞癌を含む、処置可能な固形癌の範囲を拡大することに焦点を当てて進行中である。
害性の増強におけるCD137の主要な機能的役割は、最初に1997年に説明され(Shuford et al., 1997)、その後すぐ、抗CD137mAbが抗癌治療薬として提案された。
et al., 2002)。CD8+T細胞の場合、インターフェロンガンマ及びインターロイキ
ン2の産生を介した増殖、生存及び細胞傷害性エフェクター機能は、CD137架橋に起因するとされている。CD137架橋は、メモリーCD8+T細胞の分化及び維持にも寄与する(Chacon et al., 2013)。CD4+T細胞の一部のサブセットでは、CD137
架橋が同様に増殖及び活性化を引き起こし、インターロイキン2などのサイトカインの放出をもたらす(Makkouk et al., 2016)。CD137は、腫瘍浸潤リンパ球(TIL)の腫瘍応答性サブセットで発現することも実証されている。CD137単剤療法は、MC38、CT26及びB細胞リンパ腫などのいくつかの前臨床免疫原性腫瘍モデルで有効であることが示されている。
最初の抗CD137抗体であったが、これらは、顕著なオンターゲットの用量依存的な肝毒性が観察された後に中止された(Chester et al., 2018;Segal et al., 2017;及びSegal et al., 2018)。より最近では、固形癌の処置におけるウレルマブの臨床試験が再開され、ウレルマブ処置は、放射線療法(NCT03431948)、又はリツキシマブ(NCT01775631)、セツキシマブ(NCT02110082)、抗PD-1抗体ニボルマブ(NCT02253992、NCT02534506、NCT02845323)、及びニボルマブと抗LAG-3抗体BMS986016(NCT02658981)の組み合わせなどの、他の治療用抗体と組み合わされた。しかし、ウレルマブ処置に関連する
肝毒性を低減するために、これらの試験でのウレルマブの投与は制限されなければならず、有効性の結果は期待外れであった(Chester et al., 2018)。
組み合わせで、安全性、忍容性、用量制限毒性(DLT)、最大耐量(MTD)、及び異なる処置の組み合わせの有効性を評価するために試験された。これらの試験は進行中であり、初期の結果では、5mg/kgまでの用量でDLTを示さず、ウトミルマブとペンブロリズマブの組み合わせで26%の患者応答率を示している。(Tolcher et al., 2016)(Perez-Ruiz et al, 2017)。
マブとアベルマブ及び他の療法との3つの組み合わせも試験されている(NCT02554812、NCT03217747、NCT03440567、NCT03414658)。
(Hinner et al., 2015及び国際公開第2016/177802 A1号)、又はEph
A2(Liu et al., 2017)を標的とするものである。例えばFAP-アルファを介して腫瘍を標的とするCD137L融合タンパク質(Claus et al., 2017)も開発されている。最も臨床的に進歩したCD137二重特異性は、CD137/HER2二重特異性分子であるPRS-343であり、最近、その安全性、忍容性及び有効性を評価するための一連の固形腫瘍の処置に関する第I相臨床試験に入っている(NCT03330561)。
上記の背景セクションで説明したように、CD137アゴニスト分子の臨床開発は、用量を制限する高グレードの肝臓の炎症(ウレルマブ)又は低い臨床効果(ウトミルマブ)のいずれかに関連する処置のため、制限されてきた。
同じ優先的結合を示すことは予想されない。
いてはT細胞の活性化を誘導するために一方又は両方の標的のより高い発現を要することが予想される。これは、分子のCH3ドメインの1つにおいて、PD-L1に対する二価のFab結合部位及びCD137に対する一価の結合部位を含む、mAb2分子が、両方の標的に二価的に結合するmAb2より低レベルの、IFNγ放出によって測定されるT細胞活性化を誘導することを示す、本発明者らによって実施された実験によって裏付けられる。
(a)PD-L1の相補性決定領域(CDR)ベースの抗原結合部位;及び
(b)抗体分子のCH3ドメインに位置するCD137抗原結合部位
を含み、CDRベースの抗原結合部位が、
(i)それぞれ配列番号1、2、3、4、5及び6[E12v2];
(ii)それぞれ配列番号1、2、3、18、19及び20[E05v2];又は
(iii)それぞれ配列番号1、2、3、18、19及び29[G12v2]
に記載のCDR1~6を含み、CD137抗原結合部位が、それぞれ、CH3ドメインのAB、CD及びEF構造ループに位置する第1の配列及び第2の配列を含み、第1及び第2の配列が、それぞれ配列番号113及び114[FS22-172-003]、又は79及び80[FS22-53-008]に記載の配列を有する、プログラム死リガンド1(PD-L1)及びCD
137に結合する抗体分子。
(a)PD-L1の相補性決定領域(CDR)ベースの抗原結合部位;及び
(b)抗体分子のCH3ドメインに位置するCD137抗原結合部位
を含み、CDRベースの抗原結合部位が、
(i)それぞれ配列番号7、8、9、10、11及び6[E12v2];
(ii)それぞれ配列番号21、8、9、22、11及び20[E05v2];又は
(iii)それぞれ配列番号21、8、9、22、11及び29[G12v2]
に記載のIMGTに従うCDR1~6を含み、CD137抗原結合部位が、それぞれ、CH3ドメインのAB、CD及びEF構造ループに位置する第1の配列及び第2の配列を含
み、第1及び第2の配列が、それぞれ配列番号113及び114[FS22-172-003]、又は79及び80[FS22-53-008]に記載の配列を有する、プログラム死リガンド1(PD-
L1)及びCD137に結合する抗体分子。
(i)それぞれ配列番号12及び14[E12v2];
(ii)それぞれ配列番号23及び25[E05v2];又は
(iii)それぞれ配列番号23及び30[G12v2]
に記載のものである、[5]から[6]のいずれか一項に記載の抗体分子。
いずれか一項に記載の抗体分子。
(i)配列番号115[FS22-172-003];又は
(ii)配列番号81[FS22-53-008]
に記載のCH3ドメイン配列を含む、[1]から[15]のいずれか一項に記載の抗体分子。
(i)それぞれ配列番号134及び17に記載のFS22-172-003-AA/E12v2;
(ii)それぞれ配列番号137及び28に記載のFS22-172-003-AA/E05v2;
(iii)それぞれ配列番号140及び33に記載のFS22-172-003-AA/G12v2;
(iv)それぞれ配列番号143及び17に記載のFS22-053-008-AA/E12v2;
(v)それぞれ配列番号146及び28に記載のFS22-053-008-AA/E05v2;又は
(vi)それぞれ配列番号149及び33に記載のFS22-053-008-AA/G12v2
の重鎖及び軽鎖を含む、[1]から[19]のいずれか一項に記載の抗体分子。
]のいずれか一項に記載の抗体分子。
(i)それぞれ配列番号32及び39、又は135及び136に記載のFS22-172-003-AA/E12v2、好ましくは、それぞれ配列番号32及び39;
(ii)それぞれ配列番号138及び139に記載のFS22-172-003-AA/E05v2;
(iii)それぞれ配列番号141及び142に記載のFS22-172-003-AA/G12v2;
(iv)それぞれ配列番号144及び145に記載のFS22-053-008-AA/E12v2;
(v)それぞれ配列番号147及び148に記載のFS22-053-008-AA/E05v2;又は
(vi)それぞれ配列番号150及び151に記載のFS22-053-008-AA/G12v2
の重鎖核酸配列及び/又は軽鎖核酸配列を含む、[1]から[2]、[5]から[7]、[10]から[16]、[19]から[20]及び[23]から[33]のいずれか一項に記載の抗体分子をコードする、1つ又は複数の核酸分子。
ここで、本発明の態様及び実施形態を、添付の図面を参照して論ずる。さらなる態様及び実施形態は、当業者には明らかであろう。この文章で言及される全ての文書は、参照により本明細書に組み込まれる。
、E12v2の、3つのVH CDR又は3つのVL CDR、好ましくは3つのVH CD
R及び3つのVL CDRを含み得る。
(i)抗体E12v2のVH及びVLドメイン配列は、それぞれ配列番号12及び14に示さ
れ;
(ii)抗体E05v2のVH及びVLドメイン配列は、それぞれ配列番号23及び25に示
され;
(iii)抗体G12v2のVH及びVLドメイン配列は、それぞれ配列番号23及び30に
示され;
(iv)抗体lam-G02v3のVH及びVLドメイン配列は、それぞれ配列番号23及び41
に示される。
)に従って決定され得る。
、それぞれVHドメインの31~35、50~65、及び95~102位に位置する配列であり得る。
、それぞれVLドメインの24~34、50~56、及び89~97位に位置する配列であり得る。
リンを含む。
ここで、X1は、P又はTであり、好ましくは、X1は、Pであり;
ここで、CDR配列は、IMGT番号付けスキームに従って定義される。
(i)それぞれ配列番号7、8及び9[E12v2];又は
(ii)それぞれ配列番号21、8及び9[E05v2、G12v2又はlam-G02v3]、
のVHドメインCDR1、CDR2及びCDR3の配列を含み得、
ここで、CDR配列は、IMGT番号付けスキームに従って定義される。
それぞれ配列番号55、56、57及び54のHFW1、HFW2、HFW3及びHFW4配列を含み得、ここで、FW及びCDR配列は、IMGT番号付けスキームに従って定義される。
スキームに従って定義される。VLドメインは、ラムダVLドメインに由来し得る。例えば、各VLドメインCDRは、ラムダVLドメイン由来のフレームワーク(FW)配列(LFW1、LFW2、LFW3、及びLFW4)に隣接し得る。具体的には、VLドメインは、それぞれ配列番号65、66、67及び68のLFW1、LFW2、LFW3及びLFW4配列を含み得、ここで、FW配列は、Kabat番号付けスキームに従って定義され
る。
ここで、X2は、S又はGであり、X3は、N又はGであり;X4は、T又はNであり;X5は、S又はLであり;X6は、T又はSであり;X7は、T又はWであり;X8は、不存在又はRであり;X9は、Y、R、又はVであり;
ここで、CDR配列及び位置の番号付けは、Kabat番号付けスキームに従って定義される
。
CDR3(配列番号6)の配列を含み、ここで、CDR配列は、Kabat番号付けスキー
ムに従って定義される。VLドメインは、カッパVLドメインに由来し得る。例えば、各VLドメインCDRは、カッパVLドメイン由来のフレームワーク(FW)配列(LFW1、LFW2、LFW3、及びLFW4)に隣接し得る。具体的には、VLドメインは、それぞれ配列番号58、59、60及び61のLFW1、LFW2、LFW3及びLFW4配列を含み得、ここで、FW配列は、Kabat番号付けスキームに従って定義される。
(i)それぞれ配列番号4、5及び6[E12v2];
(ii)それぞれ配列番号18、19及び20[E05v2];
(iii)それぞれ配列番号18、19及び29[G12v2];又は
(iv)それぞれ配列番号34、35及び36[lam-G02v3]、
のVLドメインCDR1、CDR2及びCDR3の配列を含み得、
ここで、CDR配列は、Kabat番号付けスキームに従って定義される。
2、LFW3、及びLFW4)に隣接し得る。具体的には、VLドメインは、それぞれ配列番号69、70、71及び68のLFW1、LFW2、LFW3及びLFW4配列を含み得、ここで、FW配列は、IMGT番号付けスキームに従って定義される。
ここで、X10は、G又はSであり;X11は、N又はGであり;X12は、不在又はTであり;X13は、T、W又はPであり;X14は、P又はRであり;X15は、Y又はRであり、
ここで、CDR配列及び位置の番号付けは、IMGT番号付けスキームに従って定義される。
(i)それぞれ配列番号10、11及び6[E12v2];
(ii)それぞれ配列番号22、11及び20[E05v2];
(iii)それぞれ配列番号22、11及び29[G12v2];又は
(iv)それぞれ配列番号37、38及び36[lam-G02v3]、
のVLドメインCDR1、CDR2及びCDR3の配列を含み得、
ここで、CDR配列は、IMGT番号付けスキームに従って定義される。
、E12v2の、VH又はVLドメイン、好ましくはVH及びVLドメインを含み得る。
620号及び国際公開第2009/132876号に記載される。
、好ましくはCH3ドメインの、AB及びEF構造ループ中に位置する配列を含み得る。
-017、FS22-053-014、FS22-053-010、FS22-053-012、FS22-053-013、FS22-053-015、FS22-053-016、FS22-053、FS22-172-003、FS22-172-002、FS22-172-004、FS22-172-001、FS22-172-005、FS22-172-006、又はFS22-172、好ましくは、FS22-053-008、FS22-053-009、FS22-053-011、FS22-053-017、FS22-053-014、FS22-172-003、FS22-172-002、FS22-172-004、FS22-172-001、FS22-172-005、又はFS22-172-006、より好ましくは、FS22-053-008、FS22-053-009、FS22-053-011、FS22-053-017、FS22-172-003、FS22-172-002、又はFS22-172-004、さらに好ましくは、FS22-053-008又はFS22-172-003、さらにより好ましくは、FS22-172-003のCH3ドメインの第1及び第2の配列であり得る。代替的に好ましい実施形態において、第1の配列及び第2の配列は、FS22-053-017のCH3ドメインの第1及び第2の配列であり得る。
の能力の範囲内であり、Hasenhindl et al. (2013)に記載されている。好ましい実施形態において、IMGT番号付けシステムによるAB、CD及びEF構造ループは、それぞれ、CH3ドメインの10位と19位、42位と79位、及び91位と102位の間に位置する。したがって、好ましい実施形態において、第1、第2及び第3の配列は、それぞれ、FS22-053-008、FS22-053-009、FS22-053-011、FS22-053-017、FS22-053-014、FS22-053
-010、FS22-053-012、FS22-053-013、FS22-053-015、FS22-053-016、FS22-053、FS22-172-003、FS22-172-002、FS22-172-004、FS22-172-001、FS22-172-005、FS22-172-006、又はFS22-172のCH3ドメインの10位と19位、42位と79位、及び91位と102位の間の配列である。
ループ配列を含む。さらに好ましい実施形態において、CD137抗原結合部位の第1及び第2の配列は、それぞれ配列番号171及び172[FS22-172-003]に記載のAB及びEF構造ループを含む。
(i)それぞれ配列番号79及び80[FS22-053-008];
(ii)それぞれ配列番号79及び83[FS22-053-009];
(iii)それぞれ配列番号79及び86[FS22-053-011];
(iv)それぞれ配列番号79及び89[FS22-053-017];
(v)それぞれ配列番号79及び92[FS22-053-014];
(vi)それぞれ配列番号79及び95[FS22-053-010];
(vii)それぞれ配列番号79及び98[FS22-053-012];
(viii)それぞれ配列番号79及び101[FS22-053-013];
(ix)それぞれ配列番号79及び104[FS22-053-015];
(x)それぞれ配列番号79及び107[FS22-053-016];
(xi)それぞれ配列番号79及び110[FS22-053];
(xii)それぞれ配列番号113及び114[FS22-172-003];
(xiii)それぞれ配列番号117及び114[FS22-172-002];
(xiv)それぞれ配列番号120及び114[FS22-172-004];
(xv)それぞれ配列番号123及び114[FS22-172-001];
(xvi)それぞれ配列番号126及び114[FS22-172-005];
(xvii)それぞれ配列番号129及び114[FS22-172-006];又は
(xviii)それぞれ配列番号129及び114[FS22-172];
に記載の第1及び/又は第2の、好ましくは第1及び第2の配列を含み、ここで、第1及び第2の配列は、好ましくは、それぞれ、抗体分子のCH3ドメインの14位と17位、及び91位と99位の間に位置する。
(i)それぞれ配列番号79及び80[FS22-053-008];
(ii)それぞれ配列番号79及び83[FS22-053-009];
(iii)それぞれ配列番号79及び86[FS22-053-011];
(iv)それぞれ配列番号79及び89[FS22-053-017];
(v)それぞれ配列番号113及び114[FS22-172-003];
(vi)それぞれ配列番号117及び114[FS22-172-002];又は
(vii)それぞれ配列番号120及び114[FS22-172-004];
に記載の第1及び/又は第2の、好ましくは第1及び第2の配列を含む。
れ配列番号113及び114[FS22-172-003]に記載の第1及び第2の配列、又はそれぞれ配列番号79及び80[FS22-53-008]に記載の第1及び第2の配列を含む。さらによ
り好ましい実施形態において、抗体分子のCD137抗原結合部位は、それぞれ配列番号113及び114[FS22-172-003]に記載の第1及び第2の配列を含む。例えば、CD137抗原結合部位は、それぞれ配列番号171及び172[FS22-172-003]に記載のAB及びEF構造ループ配列を含み得る。
ンの残基位置のIMGT番号付け、IMGTエクソン番号付け、EU番号付け、及びKabat番号付けの間の一致を図1に示す。したがって、例えば、本出願が、クローンのCH3
ドメインのそれぞれ14位と17位の間に位置する第1の配列に言及し、残基の位置は、IMGT番号付けスキームに従って番号付けされる場合、第1の配列は、CH3ドメインの18位と21位の間に位置し、ここで、残基の位置は、図1に示すように、IMGTエクソン番号付けスキームに従って番号付けされる。或いは、本明細書に記載されるような、CH3ドメイン中のアミノ酸配列、置換、欠失及び挿入の位置を含む、CH3ドメインにおけるアミノ酸残基の位置は、配列番号75に記載の野生型CH3ドメイン配列におけるそれらの位置を参照することにより定義され得る。IMGT番号付け及び野生型CH3ドメイン配列の一致も図1に示される。
変異には、Bruhns et al., 2009及びHezareh et al., 2001に記載される「LALA変異
」が含まれ、これは、CH2ドメインの1.3位及び1.2位のロイシン残基をアラニン(L1.3A及びL1.2A)で置換することを含む。或いは、CH2ドメインの84.4位のアスパラギン(N)をアラニン、グリシン、又はグルタミン(N84.4A、N84.4G、又はN84.4Q)に変異させることによる、保存されたN結合型グリコシル化部位の変異を通じたα-グリコシル抗体の生成は、IgG1エフェクター機能を低下させることも知られている(Wang et al., 2018)。さらなる代替として、補体活性化(C
1q結合)及びADCCは、CH2ドメインの114位のプロリンをアラニン又はグリシン(P114A又はP114G)に変異させることによって低減することが知られている(Idusogie et al., 2000;Klein et al., 2016)。これらの変異は、ADCC又はCD
C活性がさらに低下した、又は全くない抗体分子を生成するために組み合わせることもできる。
(i)1.3位及び1.2位のアラニン残基;及び/又は
(ii)114位のアラニン又はグリシン;及び/又は
(iii)84.4位のアラニン、グルタミン又はグリシン;
を含み、ここで、アミノ酸残基の番号付けは、IMGT番号付けスキームに従う。
(i)1.3位のアラニン残基;及び
(ii)1.2位のアラニン残基;
を含み、ここで、アミノ酸残基の番号付けは、IMGT番号付けスキームに従う。
(i)1.3位のアラニン残基;
(ii)1.2位のアラニン残基;及び
(iii)114位のアラニン;
を含み、ここで、アミノ酸残基の番号付けは、IMGT番号付けスキームに従う。
(a)PD-L1のCDRベースの抗原結合部位;及び
(b)抗体分子のCH3ドメインに位置するCD137抗原結合部位
を含み、CDRベースの抗原結合部位は、抗体E12v2、E05v2、又はG12v2、好ましくはE12v2の3つのVH CDR及び3つのVL CDR(CDR1~6)を含み;
CD137抗原結合部位は、それぞれ、CH3ドメインのAB、CD及びEF構造ループに位置する第1の配列及び第2の配列を含み、第1及び第2の配列は、それぞれ配列番号113及び114[FS22-172-003]、又は79及び80[FS22-53-008]に記載の配列を
有し、好ましくは、第1及び第2の配列は、配列番号113及び114[FS22-172-003]に記載の配列を有する。
(a)PD-L1のCDRベースの抗原結合部位;及び
(b)抗体分子のCH3ドメインに位置するCD137抗原結合部位
を含み、CDRベースの抗原結合部位は、抗体E12v2、E05v2、又はG12v2、好ましくはE12v2の3つのVH CDR及び3つのVL CDR(CDR1~6)を含み;
CD137抗原結合部位は、それぞれ、CH3ドメインのAB、CD及びEF構造ループに位置する第1の配列及び第2の配列を含み、第1及び第2の配列は、それぞれ配列番号79及び89[FS22-053-017]に記載の配列を有する。
(a)PD-L1のCDRベースの抗原結合部位;及び
(b)抗体分子のCH3ドメインに位置するCD137抗原結合部位
を含み、CDRベースの抗原結合部位は、抗体E12v2、E05v2、又はG12v2、好ましくはE12v2の3つのVH CDR及び3つのVL CDR(CDR1~6)を含み;
CD137抗原結合部位は、それぞれ、CH3ドメインのAB、CD及びEF構造ループに位置する第1の配列及び第2の配列を含み、第1及び第2の配列は、それぞれ配列番号113及び114[FS22-172-003]、又は79及び80[FS22-53-008]に記載の配列を
有し、好ましくは、第1及び第2の配列が、配列番号113及び114[FS22-172-003]に記載の配列を有し、ただし、抗体分子は、配列番号79及び80[FS22-053-008]に記載の第1及び第2の配列を有するCD137抗原結合部位と対形成される抗体G12v2のC
DR1~6を含まない。
(b)配列番号115[FS22-172-003]、又は81[FS22-53-008]、好ましくは配列番
号115[FS22-172-003]、に記載の配列を含むか、それを有するか、又はそれからなる、CH3ドメイン;
を含み、CDRベースの抗原結合部位は、抗体E12v2、E05v2、又はG12v2、好ましくはE12v2の3つのVH CDR及び3つのVL CDR(CDR1~6)を含む。
(a)PD-L1のCDRベースの抗原結合部位;及び
(b)配列番号90[FS22-053-017]に記載の配列を含むか、それを有するか、又はそれからなる、CH3ドメイン;
を含み、CDRベースの抗原結合部位は、抗体E12v2、E05v2、又はG12v2、好ましくはE12v2の3つのVH CDR及び3つのVL CDR(CDR1~6)を含む。
(a)PD-L1のCDRベースの抗原結合部位を含むVHドメイン及びVLドメイン;及び
(b)配列番号115[FS22-172-003]、又は81[FS22-53-008]、好ましくは配列番
号115[FS22-172-003]、に記載の配列を含むか、それを有するか、又はそれからなる、CH3ドメイン;
を含み、VH及びVLドメインは、抗体E12v2、E05v2、又はG12v2、好ましくはE12v2のVH及びVLを含むか、それを有するか、又はそれからなる。
(a)PD-L1のCDRベースの抗原結合部位を含むVHドメイン及びVLドメイン;及び
(b)配列番号90[FS22-053-017]に記載の配列を含むか、それを有するか、又はそれからなる、CH3ドメイン;
を含み、VH及びVLドメインは、抗体E12v2、E05v2、又はG12v2、好ましくはE12v2のVH及びVLを含むか、それを有するか、又はそれからなる。
(a)PD-L1のCDRベースの抗原結合部位を含むVHドメイン及びVLドメイン;(b)配列番号115[FS22-172-003]、又は81[FS22-53-008]、好ましくは配列番
号115[FS22-172-003]、に記載の配列を含むか、それを有するか、又はそれからなる、CH3ドメイン;
(c)CH2ドメインが、
(i)1.3位のアラニン残基;
(ii)1.2位のアラニン残基;
を含む、配列番号76に記載の配列を含むか、それを有するか、又はそれからなる、CH2ドメイン;
を含み、ここで、アミノ酸残基の番号付けは、IMGT番号付けスキームに従い;
VH及びVLドメインは、抗体E12v2、E05v2、又はG12v2、好ましくはE12v2のVH及びVLを含むか、それを有するか、又はそれからなる。
(a)CDRベースの抗原結合部位がCDR1~6を含む、PD-L1のCDRベースの抗原結合部位を含むVH及びVLドメイン;及び
(b)抗体分子のCH3ドメインに位置し、CD137抗原結合部位であって、CH3ドメインのAB及びEF構造ループに位置する第1の配列及び第2の配列を含む、CD137抗原結合部位;
を含み、ここで、CDR1~6、第1の配列及び第2の配列は、
(i)それぞれ配列番号1、2、3、4、5、6、113及び114[FS22-172-003-AA/E12v2];
(ii)それぞれ配列番号1、2、3、18、19、20、113及び114[FS22-172-003-AA/E05v2];
(iii)それぞれ配列番号1、2、3、18、19、29、113及び114[FS22-172-003-AA/G12v2];
(iv)それぞれ配列番号1、2、3、4、5、6、79及び80[FS22-053-008-AA/E12v2];又は
(v)それぞれ配列番号1、2、3、18、19、20、79及び80[FS22-053-008-AA/E05v2]、
に記載の配列を有するか、
VHドメイン、VLドメイン、第1の配列及び第2の配列は、
(i)それぞれ配列番号12、14、113及び114[FS22-172-003-AA/E12v2];
(ii)それぞれ配列番号23、25、113及び114[FS22-172-003-AA/E05v2];
(iii)それぞれ配列番号23、30、113及び114[FS22-172-003-AA/G12v2]
;
(iv)それぞれ配列番号12、14、79及び80[FS22-053-008-AA/E12v2];又は
(v)それぞれ配列番号23、25、79及び80[FS22-053-008-AA/E05v2];
に記載の配列を有するか、
VHドメイン、VLドメイン、及びCH3ドメインは、
(i)それぞれ配列番号12、14、及び115[FS22-172-003-AA/E12v2];
(ii)それぞれ配列番号23、25、及び115[FS22-172-003-AA/E05v2];
(iii)それぞれ配列番号23、30、及び115[FS22-172-003-AA/G12v2];
(iv)それぞれ配列番号12、14、及び81[FS22-053-008-AA/E12v2];又は
(v)それぞれ配列番号23、25、及び81[FS22-053-008-AA/E05v2]
に記載の配列を有する。
(i)それぞれ配列番号134及び17に記載のFS22-172-003-AA/E12v2;
(ii)それぞれ配列番号137及び28に記載のFS22-172-003-AA/E05v2;
(iii)それぞれ配列番号140及び33に記載のFS22-172-003-AA/G12v2;
(iv)それぞれ配列番号143及び17に記載のFS22-053-008-AA/E12v2;
(v)それぞれ配列番号146及び28に記載のFS22-053-008-AA/E05v2;又は
(vi)それぞれ配列番号149及び33に記載のFS22-053-008-AA/G12v2
の重鎖及び軽鎖を含むか、それらを有するか、又はそれらからなる、重鎖を含む。
(i)それぞれ配列番号134及び17に記載のFS22-172-003-AA/E12v2;
(ii)それぞれ配列番号137及び28に記載のFS22-172-003-AA/E05v2;
(iii)それぞれ配列番号140及び33に記載のFS22-172-003-AA/G12v2;
(iv)それぞれ配列番号143及び17に記載のFS22-053-008-AA/E12v2;又は
(v)それぞれ配列番号146及び28に記載のFS22-053-008-AA/E05v2;
の重鎖及び軽鎖を含むか、それらを有するか、又はそれらからなる、重鎖を含む。
(i)それぞれ配列番号134及び17に記載のFS22-172-003-AA/E12v2;又は
(iv)それぞれ配列番号143及び17に記載のFS22-053-008-AA/E12v2
の重鎖及び軽鎖を含むか、それらを有するか、又はそれらからなる、重鎖を含む。
鎖を含むか、それらを有するか、又はそれらからなる、重鎖を含む。
(i)それぞれ配列番号152及び17に記載のFS22-053-017-AA/E12v2;
(ii)それぞれ配列番号153及び28に記載のFS22-053-017-AA/E05v2;又は
(iii)それぞれ配列番号154及び33に記載のFS22-053-017-AA/G12v2
の重鎖及び軽鎖を含むか、それらを有するか、又はそれらからなる、重鎖を含む。
、少なくとも99.7%、少なくとも99.8%、又は少なくとも99.9%の配列同一性を有するCH2ドメイン配列を有するか、又はそれを含む。
Inc、米国サンディエゴ(San Diego USA))を参照して定義される。GAPは、NeedlemanとWunschのアルゴリズムを使用して、2つの完全配列を整列させ、一致の数を最大化し、ギャップの数を最小化する。一般的に、ギャップ生成ペナルティが12に等しく、ギャップ拡張ペナルティが4に等しいデフォルトのパラメーターが使用される。GAPの使用が好ましい場合もあるが、他のアルゴリズム、例えば、BLAST(Altschul et al., 1990の方法を使用)、FASTA(Pearson and Lipman, 1988の方法を使用)、又はSmith-Watermanアルゴリズム(Smith and Waterman, 1981)、又は上掲Altschul et al.(1990)のTBLASTNプログラムも、一般的にデフォルトパラメーターを使用して用いられ得る。特に、psi-Blastアルゴリズム(Altschul et al., 1997)が使用され得る。
は、例えば、別の非極性アミノ酸で置換されている。いくつかの実施形態において、右端の列の同じ行のアミノ酸が互いに置換されている。
ができるだけでなく、ヒトPD-L1及びヒトCD137が単一の細胞、例えば免疫細胞上で共発現される場合、ヒトPD-L1及びヒトCD137に結合することができる可能性がある。
is)を備えた組換えヒトPD-L1であってもよい(カタログ番号:PD1-H82E5)。組
換えヒトPD-L1は、ビオチン化されていてもよい。
が、ヒトにおける抗体分子及び有効性と毒性を予測することを保証するために有益であると考えられている。
ラズモン共鳴(SPR)によって決定することができる。適切な方法のさらなる詳細は、実施例に記載される。
などのSPRによって決定することができる。適切な方法のさらなる詳細は、実施例に記載される。
され得る。PD-L1のPD-1への結合を遮断する抗体分子の能力は、ELISAを使用して決定され得る。これらのアッセイのさらなる詳細は、実施例に記載される。
抗体G1/280_02_G02の重鎖及び軽鎖を含むか、又はそれらからなる、抗体分子を参照する
ことによって決定され得る。
鎖配列及び軽鎖配列、又はそれぞれ配列番号177及び178に記載の抗体G1/280_02_G02の重鎖及び軽鎖を含むか、又はそれらからなる、抗体分子のPD-1/PD-L1遮断
活性の少なくとも70%、80%、又は90%であるPD-1/PD-L1遮断活性を有し得る。
鎖配列及び軽鎖配列、又はそれぞれ配列番号177及び178に記載の抗体G1/280_02_G02の重鎖及び軽鎖を含むか、又はそれらからなる、抗体分子のPD-1/PD-L1遮断
活性の70%から130%、80%から120%、又は90%から110%の間であるPD-1/PD-L1遮断活性を有し得る。
倍、5倍、4倍、3倍、又は2倍以内であるEC50を有し、ここで、FS22-172-003-AA/E12v2は、配列番号134の重鎖及び配列番号17の軽鎖からなる。
内であり、ここで、FS22-172-003-AA/E12v2は、配列番号134の重鎖及び配列番号17
の軽鎖からなる。
コードする。好ましくは、1つ又は複数の核酸分子は、配列番号116又は82に記載の配列を含み、これはそれぞれFS22-172-003又はFS22-053-008のCH3ドメインをコードする。より好ましくは、1つ又は複数の核酸分子は、配列番号116に記載の配列を含み、これはFS22-172-003のCH3ドメインをコードする。
(i)配列番号13に記載の抗体E12v2のVHドメイン核酸配列、及び/又は配列番号1
5に記載の抗体E12v2のVLドメイン核酸配列;又は
(ii)配列番号24に記載の抗体E05v2のVHドメイン核酸配列、及び/又は配列番号
26に記載の抗体E05v2のVLドメイン核酸配列;
(iii)配列番号24に記載の抗体G12v2のVHドメイン核酸配列、及び/又は配列番
号31に記載の抗体G12v2のVLドメイン核酸配列;又は
(v)配列番号24に記載の抗体lam-G02v3のVHドメイン核酸配列、及び/又は配列番
号42に記載の抗体lam-G02v3のVLドメイン核酸配列
を含み得る。
しくは、抗体FS22-172-003-AA/E12v2の、重鎖及び/又は軽鎖、好ましくは、重鎖及び軽
鎖をコードし得る。これらの抗体の重鎖及び軽鎖配列は本明細書に記載されている。
(i)配列番号32又は135に記載の抗体FS22-172-003-AA/E12v2の重鎖核酸配列、及
び/又は配列番号39又は136に記載の抗体FS22-172-003-AA/E12v2の軽鎖核酸配列;
又は
(ii)配列番号138に記載の抗体FS22-172-003-AA/E05v2の重鎖核酸配列、及び/又
は配列番号139に記載の抗体FS22-172-003-AA/E05v2の軽鎖核酸配列;
(iii)配列番号141に記載の抗体FS22-172-003-AA/G12v2の重鎖核酸配列、及び/
又は配列番号142に記載の抗体FS22-172-003-AA/G12v2の軽鎖核酸配列;
(iv)配列番号144に記載の抗体FS22-053-008-AA/E12v2の重鎖核酸配列、及び/又
は配列番号145に記載の抗体FS22-053-008-AA/E12v2の軽鎖核酸配列;
(v)配列番号147に記載の抗体FS22-053-008-AA/E05v2の重鎖核酸配列、及び/又は
配列番号148に記載の抗体FS22-053-008-AA/E05v2の軽鎖核酸配列;又は
(vi)配列番号150に記載の抗体FS22-053-008-AA/G12v2の重鎖核酸配列、及び/又
は配列番号151に記載の抗体FS22-053-008-AA/G12v2の軽鎖核酸配列;
を含み得る。
上記のような核酸を含むベクターを提供する。プロモーター配列、転写終結フラグメント、ポリアデニル化配列、エンハンサー配列、マーカー遺伝子及び必要に応じて他の配列を含む、適切な調節配列を含有する適切なベクターを選択又は構築することができる。好ましくは、ベクターは、宿主細胞における核酸の発現を駆動するための適切な調節配列を含む。ベクターは、必要に応じて、プラスミド、ウイルス性、例えば、ファージ、又はファージミドであり得る。
(i)医薬としての使用のための本明細書に記載の抗体分子、
(ii)疾患又は障害の処置方法における使用のための本明細書に記載の抗体分子、
(iii)疾患又は障害の処置における使用のための医薬品の製造における本明細書に記載の抗体分子の使用;及び
(iv)個体の疾患又は障害の処置方法であって、本明細書に記載の治療有効量の抗体分子を個体に投与することを含む方法
を提供する。
調製することが十分に可能である。リン酸、クエン酸及びその他の有機酸などの緩衝剤;アスコルビン酸及びメチオニンなどの酸化防止剤;保存剤(塩化オクタデシルジメチルベンジルアンモニウム;塩化ヘキサメトニウム;塩化ベンザルコニウム;塩化ベンゼトニウム;フェノール、ブチル、又はベンジルアルコール;メチル又はプロピルパラベンなどのアルキルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3’-ペンタノール;及びm-クレゾール);低分子量ポリペプチド;血清アルブミン、ゼラチン、又は免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン、又はリジンなどのアミノ酸;単糖、二糖、及びグルコース、マンノース、デキストリを含む他の炭水化物;EDTAなどのキレート剤;ショ糖、マンニトール、トレハロース又はソルビトールなどの糖;ナトリウムなどの塩形成対イオン;金属錯体(例えば、Zn-タンパク質複合体);及び/又はTWEEN(商標)、PLURONICS(商標)又はポリエチレングリコール(PEG)などの非イオン性界面活性剤を含む、保存剤、安定剤、緩衝剤、酸化防止剤及び/又は他の添加剤を必要に応じて使用してもよい。
(2003)に示されている特定の投与量が使用され得る。抗体分子の治療有効量又は適切な
用量は、動物モデルにおけるインビトロ活性及びインビボ活性を比較することによって決定することができる。マウス及び他の試験動物における有効投与量をヒトに外挿するための方法は公知である。正確な用量は、処置される領域のサイズ及び位置、並びに抗体分子の正確な性質を含む、多数の要因に依存する。
癌であり得る。すなわち、処置される個体は、問題の癌の化学療法剤又は放射線治療剤で処置を受けていない癌患者であり得る。
剤は、タキサン、細胞傷害性抗生物質、チロシンキナーゼ阻害剤、PARP阻害剤、B-Raf酵素阻害剤、MEK阻害剤、c-MET阻害剤、VEGFR阻害剤、PDGFR阻害剤、アルキル化剤、プラチナ類似体、ヌクレオシド類似体、葉酸代謝拮抗剤、サリドマイド誘導体、抗悪性腫瘍化学療法剤などからなる群から選択され得る。タキサンは、ドセタキセル、パクリタキセル及びnab-パクリタキセルを含み;細胞傷害性抗生物質は、アクチノマイシン、ブレオマイシン、並びにドキソルビシン、ミトキサントロン及びバルルビシンなどのアントラサイクリンを含み;チロシンキナーゼ阻害剤は、エルロチニブ、ゲフィチニブ、アキシチニブ、PLX3397、イマチニブ、コベミチニブ及びトラメチニブを含み;PARP阻害剤は、ピラパリブを含み;B-Raf酵素阻害剤は、ベムラフェニブ及びダブラフェニブを含み;アルキル化剤は、ダカルバジン、シクロホスファミド及びテモゾロミドを含み;プラチナ類似体は、カルボプラチン、シスプラチン及びオキサリプラチンを含み;ヌクレオシド類似体は、アザシチジン、カペシタビン、フルダラビン、フルオロウラシル及びゲムシタビンを含み;葉酸代謝拮抗剤は、メトトレキサート及びペメトレキセドを含む。本発明における使用に適した他の化学療法剤には、デファクチニブ、エンチノスタット、エリブリン、イリノテカン、及びビンブラスチンが含まれる。
に、顆粒球マクロファージコロニー刺激因子(GM-CSF)を伴う場合と伴わない場合の両方で、ワクチン接種方法としてこれらの細胞を使用することにより、自己又は同種異
系の癌細胞によって発現される様々な細胞マーカーに応答するように免疫系を刺激する戦略を含む。GM-CSFは、抗原提示において強い反応を引き起こし、前記戦略で使用される場合、特によく機能する。
載された整数若しくはステップ又は整数若しくはステップの群を含むが、他のいかなる整数若しくはステップ又は整数若しくはステップの群を除外するものではないことを意味するものと理解される。
及び「the」は、文脈が明確に別のものを示さない限り、複数の指示対象を含むことに留
意されたい。本明細書において、範囲は、「約」ある特定の値から、及び/又は「約」別の特定の値まで、として表され得る。そのような範囲が表される場合、別の実施形態は、ある特定の値から、及び/又は他の特定の値まで、を含む。同様に、値が近似値として表される場合、先行詞「約」を使用することにより、特定の値が別の実施形態を形成することが理解されるであろう。数値に関連する「約」という用語は、任意選択によるものであり、例えば、+/-10%を意味する。
実施例1:抗原選択及び特性評価
PD-L1及びCD137の両方に結合し、CD137にアゴナイジングすることが可能なmAb2を識別するために使用される選択及びスクリーニング方法は、様々なPD-L1及びCD137抗原の使用を必要とする。これらの抗原の産生については、以下でより詳細に記載される。
CD137などの腫瘍壊死因子受容体スーパーファミリー(TNFRSF)メンバーは、同族リガンドに結合する場合、クラスターを形成する多量体を形成する傾向があることで知られている(Croft,M.2003)。それらの機能のために凝集するこの傾向は、ファージ及び酵母ディスプレイなどのインビトロ選択で使用するため、及び選択されたタンパク質
の特性評価のために、溶液中で凝集しない可溶性組換えタンパク質を産生することを困難にする。
、カタログ番号71171)のみ(以下「hCD137-hFc-Avi-BPS」と表記)は、十分に凝集が低
く適切であり、選択に使用されたが、限定的な成功であった(実施例2を参照)。
クトし、発現したCD137をHisTrap(商標)excelニッケルカラム(GE LifeSciences
、29048586)及びサイズ排除クロマトグラフィー(SEC)を使用して精製し、抗原が単一種であり、凝集体を含まないことを確実にした。
種であり、凝集体を含まないことを確実にした。
にDPBS(Life Technologies 14190-169)に緩衝液交換をした。
びフローサイトメトリーによるヒト及びマウスCD137リガンド発現DO11.10細胞に結合することが確認された。細胞をCD137抗原と共に1時間インキュベートした後、蛍光標識した抗マウスFcフラグメント抗体を使用して細胞結合を検出した。組換えcyno抗原は、上記のフローサイトメトリーによりcynoCD137リガンドを発現するDO11.10細胞(National Jewish Health)に結合することが確認された。選択プロトコルで使用される材料について可能な限り高い純度を確実にするために、抗原の徹底的なタンパク質特性評価は、タンパク質凝集体の存在は、割合が2%を超えないことを確実にするために実行された。
DO11.10細胞(National Jewish Health)発現完全長マウスCD137(配列番号187)又はヒトCD137(配列番号185)、それぞれ「DO11.10.mCD137」及び「DO11.10.hCD137」と指定され、表2に列挙されたように選択されたFcabの選択及びさらなる特性評価のために、その天然形態に最も類似した膜結合立体配座で抗原を提示するために産生された。
A1号)の結合によって確認された。
融合タンパク質を含むヒト及びマウスのPD-L1抗原は、抗体の選択及びスクリーニングに使用するために生成された。抗原は、C末端Hisタグ及び単量体ラットCD4+、ドメイン3及び4(rCD4)タグ(Brown and Barclay, 1994)、二量体ヒトIgG
1 Fcドメイン又は、ヒトPD-L1のみにつき、Aviタグ、(hPD-L1-rCD4-Hisをもたらす(配列番号195)、hPD-L1-Fc-His(配列番号196)、mPD-L1-rCD4-His(配列番号197)、mPD-L1-Fc-His(配列番号198)及びhPD-L1-His-Avi(配列番号199)のいずれかと共に発現させた。異なる形式での抗原の産生により、抗体ファージディスプレイのパニングの連続ラウンド中に、タグバインダーの除去が可能となった。抗原をコードする発現プラスミドは、Chapple et al.,2006に記載されるように、HEK293細胞にトラン
スフェクトされた。トランスフェクションの5日後に上清を回収し、分泌された抗原をNi-NTAセファロースアフィニティークロマトグラフィーで精製した(Schofield et al.,2007)。rCD4及びFc含有PD-L1抗原は、EZ-link Sulfo-NHS-ビオチン試薬(Thermo Fisher Scientific、製品コード21326)を使用して、製造元の推奨に従ってビオチン化された。ビオチン化反応生成物をゲル濾過し、単量体画分を回収した。単量体画分は、全ての液相ファージディスプレイの選択のために使用された。蛍光ビオチン定量キット(Thermo Fisher Scientific、製品コード46610)を使用して決定した分子あたりの平均ビオ
チン数は、PD-L1単量体あたり1から3ビオチンであった。
2.1 抗ヒトCD137 Fcabのナイーブ選択
ヒトCD137に結合するFcabを選択するために、酵母及びファージディスプレイ選択キャンペーンを採用して、同定されたFcabの多様性を最大化した。細胞表面は、両方ともヒトCD137及び組換え二量体ヒトCD137を表示し、二量体又は多量体CD137タンパク質に対して結合力駆動型選択圧を発揮するために、様々な抗原形式を提供するために使用された。単量体CD137への高親和性ではなく、CD137複合体へ強く結合するFcabを取得することは、そのようなFcabがT細胞刺激の後に、CD137のアップレギュレーションが生じる活性化及びプライミングされたT細胞を優先的に標的化するであろうために有益であると考えられた。理論に拘束されることを望むものではないが、CD137膜発現のレベルが非常に低い又は無視できるT細胞は、タンパク質の大部分が二量体、三量体、又はそれ以上の多量体状態である高度にアップレギュレートされたCD137を有する活性化T細胞とは異なり、単量体状態のCD137を持つ可能性が高いと仮定された。結合力駆動型選択の結果、Fcabは活性化T細胞に優先的に結合し、単量体CD137だけに表示するナイーブT細胞には良好に結合しない。結合力の高いCD137 Fcabを選択することにより、潜在的な標的外T細胞の活性化が減少し、それに伴う毒性が減少する。
ージディスプレイによる選択に使用した。6つのライブラリーは全て、ランダム化されたABループ(IMGT番号付けによる位置14~18の残基を含む)及びランダム化されたEFループ(IMGT番号付けによる位置92~101の残基を含む)で構成された。ライブラリーの1つは、EFループの101位に2つ又は4つのアミノ酸(2つ又は4つのNNKコドンによってコードされる)のいずれかが挿入されたクローンで構成された(挿入された残基はIMGT番号付けによる101.4~101.1の位置にある)。
例3.2を参照)。
ファージから単離された76個の抗ヒトCD137 Fcabクローン及び酵母選択から単離された9個のクローンを含むIgG1分子からなる「モック」mAb2抗体は、mAb2形式でFcabの特性評価を可能にするために産生した。モックmAb2は、抗鶏卵リゾチーム抗体HelD1.3のCH3ドメインの対応する領域に対して、AB、CD及びEFループを含むCH3ドメインFcabの一部を置換することにより調製した。HelD1.3抗体の生成は、Tello et al.1993に記載されている。抗体HelD1.3の重鎖及び軽鎖配列は、それぞれ配列番号191及び159に示されている。モックmAb2分子がHEK293-6E細胞中での一過性発現によって産生された。産生されたタンパク質の量を評価するために、PALL(18-5021)のプロテインA定量バイオセンサーを備
えたOctet QKeプラットフォームを使用して、バイオレイヤー干渉法によってIgGタン
パク質含有量を定量した。タンパク質を、mAb SelectSureカラムを使用したプロテインA親和性クロマトグラフィーによって精製した。53個のファージ由来CD137mAb2タンパク質は、検出閾値を下回る測定値を示し、そのため、さらなる分析には不適であると判断された。32mAb2を、mAb Select SuReプロテインAカラム(GE Healthcare、
11003494)を使用して精製した。
ヤー干渉法(BLI)を使用して、ヒト組換え抗原(ビオチン化hCD137-mFc-A
vi)への結合について試験した。12個のmAb2は、結合せず、19個はCD137コーティングセンサーに結合した(FS22-007、FS22-033、FS22-042、FS22-049、FS22-050、FS22-052、FS22-053、FS22-054、FS22-169、FS22-172、FS22-173、FS22-174、FS22-179、FS22-180、FS22-181、FS22-183、FS22-187、FS22-194、FS22-195)。
TNFRシグナル伝達には多量体化及びクラスター化が必要である(Bitra et al.,2017)。CD137は、NF-κB同族のリガンドであるCD137Lと相互作用する場合
、NF-κBシグナル伝達経路をクラスター化し活性化する。アゴニスト分子は、CD137のクラスター化及び活性化を促進するリガンドを模倣し、それによってNF-κBシグナル伝達経路を活性化する。一部のアゴニスト性抗体は、例えば、ウレルマブのように、結合時にCD137クラスター化を本質的に引き起こすことができ、一方で、他の抗体は、例えば、ウトミルマブのように、CD137クラスター化を誘導するために抗体自体の追加の架橋を必要とするものも知られている(Fisher et al,2012)。エフェクター細
胞上のFcガンマ受容体は、インビボでそのような架橋を誘導することが知られているが、これは非効率的であり、治療上の関心のある部位から離れて発生する可能性がある。用量制限毒性はウレルマブに関連しているがウトリムマブには関連していないため、本質的にアゴナイズする能力を持たない抗CD137結合Fcabを選択するが、CD137クラスター化を誘導するために追加の架橋を必要とするもののみを選択することにした。そこで、架橋抗体により細胞表面に発現させたCD137のクラスター化することにより、細胞内のNF-κBシグナル伝達経路の活性化を検出できるが、抗体が架橋されていない場合には、ほとんど活性を示さないアッセイを開発した。次に、このアッセイは、FcabがBLIによって組換え抗原に結合することが見出されたかどうかにかかわらず、モックmAb2形式における27個の抗CD137 Fcabクローン、及び抗CD20mAb2形式における6個の抗CD137 Fcabクローンのアゴニスト性機能活性を試験するために使用された。
ーニングした。RetroPack PT67細胞株(Clontech、Cat.631510)を、製造元のプロトコルに従ってレトロウイルス粒子を産生するために使用した。その後、このレトロウイルスを用いて、ルシフェラーゼの発現を制御するNF-κB感受性プロモーターを含有するQiagen Cignal Lenti NFkB リポーター(luc)(Qiagen、カタログ番号336851)レンチウ
イルスを用いて、Flp-In T-REx 293 HEK細胞株(Life Technologies、R780-07)を形質導入することによって以前に産生されたHEK.FRT.luc細胞を形質導入した。これらのHEK.FRT.luc.hCD137細胞を使用して、選択において同定されたCD137結合体を含有するモックmAb2をスクリーニングした。
し、レポーター細胞培地(DMEM(Gibco、Cat.61965-026);10%FCS(Gibco、Cat.10270-106);PennStrep1個(Gibco、Cat.15140-122);ブラスチシジン15μg/
ml(Melford Laboratories Ltd、Cat.B1105);ピューロマイシン5μg/ml(Life technologies、Cat.A11113803);ゼオシン100μg/ml(InvivoGen、Cat.11006-33-0);ジェネチシン500μg/ml(Life Technologies、Cat.10131-027)中で1:3にさらに希釈した。タンパク質L(Life Technologies、21189)を、人工架橋剤として使用し、mAb2分子と1:4のモル比で混合した。24時間のインキュベーション後、細胞を100μlのPromega Bio-Glo(商標)ルシフェラーゼアッセイ試薬(Promegaカタログ番号G7941)で製造元の指示に従って処置し、Gen5 Software、BioTekを備えたプレートリーダーで0.5秒の積分時間で発光を測定した。発光値は、架橋Fcabによって誘導されるCD137のクラスター化によるNF-κBシグナル伝達経路の活性化に応答して産生されるルシフェラーゼの尺度である。発光値をFcabの対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
活性化T細胞上のアゴニスト分子を介したCD137クラスター化は、T細胞の活性化及び下流のシグナル伝達を誘発し、その結果IL-2産生をもたらすが、これに限定されるものではない。FS22-053及びFS22-172はNF-κBレポーターアッセイにおいて、活性があることが確認されたため、CD137を活性化するそれらの能力をT細胞活性化アッセイで試験した。ヒトCD137を過剰発現するように操作されたDO11.10T細胞を使用してDO11.10T細胞活性化アッセイが開発され、IL-2放出を測定することにより、T細胞活性化が評価された。
7細胞に添加した。18時間のインキュベーション後、上清を回収し、製造元の指示に従
ってマウスIL-2 ELISAキット(eBioscience、88-7024-86)でアッセイした。Gens Software、BioTekを備えたプレートリーダーを使用して、プレートを450nmで読み取った。450nm(補正)の吸光度値から570nmの吸光度値を差し引いた。サイトカイン濃度を計算するための標準曲線は、4つのパラメーターのロジスティック曲線適合(Gens Software、BioTek)に基づいていた。mIL-2の濃度をmAb2又はベンチ
マークmAbの対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
前述のように、NF-κBレポーターアッセイ、DO11.10T細胞活性化アッセイにおける機能特性に基づいて、親和性成熟のために2つのクローン(FS22-053及びFS22-172)を選択した。
FS22-053及びFS22-172Fcabクローンから4つの酵母ディスプレイライブラリを構築した。各クローンのCH3ドメインのABループでELLAプライマーを使用して7つの残基(IMGTによる位置15~16.1)をランダム化し、ライブラリーFS22-053AB及びFS22-172ABを作成した。CH3ドメインのEFループでELLAプライマーを使用して5つの残基(IMGTによる位置92~94及び97~98)をランダム化し、ライブラリーFS22-053EF及びFS22-172EFを得た。
親FS22-053クローン(FS22-053-001からFS22-053-016)に由来する16の親和性成熟クローン、及び親FS22-172クローン(FS22-172-001からFS22-172-006)に由来する6つの親和性成熟クローンを「モック」及び「モデル」mAb2形式で調製した。クローンFS22-053-001からFS22-053-007は、さらなる試験及び特性評価のための下流精製を可能にするレベルでmAb2形式において発現しなかったため、さらに追跡されなかった。
また産生された。これらは、AB、CD、及びEFループ含有抗PD-L1結合抗体のCH3の一部をFcabの対応する領域で置換することにより、実施例2.2に記載の方法
と類似の方法で調製した。これらのPD-L1モデルmAb2は、CH2ドメイン(AA)にLALA変異を含んでいた。ヒトIgG1のCH2ドメインにLALA変異の導入は、すると、Fcγ受容体結合の低下が知られている(Bruhns,P.,et al. (2009)及びHezareh M.,et al. (2001))。
E細胞中で一過性発現によって産生し、mAb Select SuReプロテインAカラムを使用して
精製した。
列挙されたモックmAb2(HelD1.3)形式の親和性成熟抗ヒトCD137 F
cabの機能的活性を、実施例2.3に記載された同様のNF-κBルシフェラーゼアッセイで試験した。Gen5 Software、BioTekを備えたプレートリーダーで0.5秒の積分時
間で発光を測定した。予想通り、Fcabはタンパク質L架橋(-XL)なしでは活性を示さなかった。全ての親和性成熟CD137 Fcabは、親CD137 Fcabよりも大きな改善を示し、このアッセイにおいては陽性であるが、EC50値の計算は不可能であった(実施例2.3参照)FS22-053-008及びFS22-172-003は、たんぱく質L(+XL)で架橋した場合、最も低いEC50(それぞれ26.34nM及び32.64nM)で各ファミリーから最高の活性を示した。
モデルmAb2(PD-L1 LALA)形式の親和性成熟ヒトFcabの機能的活性
を、実施例2.4で記載したアッセイと類似のDO11.10T細胞活性化アッセイで試験した。
イジン(Melford Laboratories Ltd、B1105)を含有するDMEMで、安定的に形質転換
された細胞のコロニーが形成されるまで3~4週間増殖させた。これらのコロニーを1μg/mlのドキシサイクリン(Sigma Aldrich、D9891)の存在下で増幅し、PEコンジュゲート抗マウスPD-L1(MIH5)抗体(BD Biosciences、558091)を使用してPD-L1の発現について試験した。
ーター(BD Biosciences)で測定し、FlowJoXを使用してデータを分析した。マウスPD
-L1の発現が再度確認された。
2x104細胞/ウェル)を0.1μg/ml抗CD3抗体(クローン17A2、BioLegend、100208)で一晩コーティングした96ウェル平底プレートに添加した。18時間の
インキュベーション後、上清を回収し、製造元の指示に従ってマウスIL-2 ELISAキット(eBioscience、88-7024-86)でアッセイした。Gens Software、BioTekを備えたプレートリーダーを使用して、プレートを450nmで読み取った。450nm(補正)の吸光度値から570nmの吸光度値を差し引いた。サイトカイン濃度を計算するための標準曲線は、4つのパラメーターのロジスティック曲線適合(Gens Software、BioTek)
に基づいていた。mIL-2の濃度をmAb2又はベンチマークmAbの対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。T細胞活性化は、mIL-2の放出を測定することによって検出された。
CD137を過剰発現するT細胞上でCD137を活性化するFcabの能力を実施例3.3に示した。CD137を過剰発現するように操作されていない細胞に対するFcabの活性を試験するには、初代ヒトT細胞アッセイが必要であった。活性化細胞傷害性CD8+T細胞は、癌細胞を直接殺傷するのに関与し、それらの細胞表面にCD137を発現する(Ye et al,2014)。CD137のクラスター化は、下流のシグナル伝達及びさら
なるCD8+T細胞の活性化の誘導に不可欠であることが知られている。したがって、CD8+T細胞活性化アッセイを使用して、Fcab(以下に詳述するmAb2形式)がCD137のクラスター化及び下流シグナル伝達を駆動する能力を評価した。CD8+T細胞活性化は、hIL-2の放出を測定することによって検出された。
キットII(Miltenyi Biotec Ltd、130-096-495)を製造業者の指示に従って使用して、溶出液中に存在するPBMCから単離した。
した。HEK.hPD-L1細胞を2×105細胞/ウェルで、抗CD3抗体(8μg/ml)でコーティングした96ウェル平底プレート上に100μlのT細胞培養培地(10%FBS(Life Technologies)、1Xペニシリンストレプトマイシン(Life Technologies、15140122)、1mMピルビン酸ナトリウム(Gibco、11360-070)、10mMヘペス(Sigma-Aldrich、H0887)、2mML-グルタミン(Sigma-Aldrich、G7513)及び50μM 2-メルカプトエタノール(Gibco、M6250)を含むRPMI培地(Life Technologies、61870-044))でプレーティングした。hPD-L1を発現するように形質導入されなかったHEK.hPD-L1細胞又はHEK細胞が4時間のインキュベーション後に付着した時点で、全てのT細胞培養培地を除去し、T細胞を含有する100μlのT細胞培養培地で5.0×105細胞/mlの濃度で置き換え、5.0×104細胞/ウェルを得た。
使用して、プレートを450nmで読み取った。450nm(補正)の吸光度値から630nmの吸光度値を差し引いた。サイトカイン濃度を計算するための標準曲線は、4つのパラメーターのロジスティック曲線適合(Gen5 Software、BioTek)に基づいていた。ヒ
トIL-2(hIL-2)の濃度を抗体の対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
)で架橋する場合、0.5nMのEC50でhIL-2放出の増加を示す。全てのクローンは、アッセイにおいて活性を有し、大部分はナノモル濃度以下のEC50で良好な効力を示した。Fcab含有mAb2は、FS22-053-007、FS22-053-008、FS22-053-010、FS22-053-011、FS22-053-012、FS22-172-003、FS 22-172-004、FS22-172-005が0.19~0.49nMの範囲で、最も低いEC50で最大のT細胞応答を誘導した。mAb2のサブセット(Fcab含有FS22-053-008、FS22-053-011、FS22-053-014、FS22-173-003及びFS22-172-004)も、HEK細胞上で発現されたPD-L1による架橋なしで試験され、予想されたように、このアッセイにおいて活性を示さなかった。これにより、NF-kBアッセイ及びDO11.10T細胞活性化アッセイで見られる活性が確認される。
他の関連するTNFSFRファミリーメンバーと比較したヒトCD137に対する抗ヒトCD137 Fcabの特異性を試験した。Fcabのうち8つを、モックmAb2(HelD1.3)形式で試験し、他のヒトTNFRSF受容体:CD40、OX40及びGITRへの結合を試験することにより、Biacore T200(GE Healthcare)でSPRによ
って測定された。アミンカップリング(アミンカップリングキット、GE Healthcare、BR-1000-50)を使用して、Biacore CM5チップ(GE Healthcare、カタログ番号291496
03)でヒトCD40、GITR、及びOX40を約1000RUにコーティングした。1μMから開始のモックmAb2形式での抗ヒトCD137 Fcabの希釈液(FS22-053-008/HelD1.3、FS22-053-009/HelD1.3、FS22-053-010/HelD1.3、FS22-053-011/HelD1.3、FS22-053-012/HelD1.3、FS22-053-014/HelD1.3、FS22-172-003/HelD1.3、FS22-172-004/HelD1.3)を、HBS-EP+緩衝液(BR100669)で調製し、30μl/分で3分間注入した後、緩衝液中で4分間解離した。チップを、10mMグリシンpH2.5を30μl/分で12秒間注入することにより再生した。異なるTNFRSFメンバーに特異的な抗体を、Biacoreチップコーティングを検証するための陽性対照として使用した。データを
、二重参照減算し、BIAevaluation3.2ソフトウェアを使用して分析した。Fcabは
、試験したTNFRSF受容体のいずれにも結合せず、CD137に対する特異性を示した。結果として、Fcab、又はこれらのFcabから抗原結合部位を含むmAb2は、CD137以外のいかなるものへ非標的結合を誘発することは期待されていない。
ヒト、カニクイザル(cyno)及びマウスCD137に対するモックmAb2形式(実施例3.2参照)における抗ヒトCD137 Fcab(FS22-053-008、FS22-053-011、FS22-053-014、FS22-172-004、FS22-172-004)の親和性をSPRで測定し、Fcabが動物試験での試験に有用であり得るかどうかを決定した。抗ヒトFab捕捉抗体を、製造業者の推奨(GE Healthcare、ヒトFabキャプチャーキット、#28958325)に従って、平均表面密度6000RUになるように、CM5シリーズSチップ(GE Healthcare#BR-1005-30)の4つのフローセル全てに固定化した。25℃及び10μl/分の流速での固定化は、6000RUの平均最終応答を達成した。各mAb2は、HBS-EP+緩衝液(GE Healthcare#BR1006-69)で希釈したmAb2の3μg/ml溶液を30μl/分で60秒間注入することによ
り、約150RUまで捕捉した。次に、HBS-EP+緩衝液中の異なる濃度のヒト、Cyno又はマウスCD137抗原(非ビオチン化ヒト、cyno又はマウスCD137-mFc-Avi又はヒトCD137-Avi-His)を、60μl/分で3分間チップ上に流し、次いで10分間解離させた。各抗原濃度の後、10mMグリシンpH2.1を30μl/分の流速で30秒間感染させることにより、チップを再生した。緩衝液HBS-EP+を、参照減算のために、最高濃度の抗原の前及び最低濃度の抗原の後に注入し、ランダムな濃度の1つを2回繰り返した。結合速度論を、1:1ラングミュアモデルに適合させて、各サンプルにつき平衡結合(KD)を生成した。データ分析は、BiaEvaluationソフトウェアバージョン3.2を使用して実行された。結果を表3に示す。
グルタミン酸(E)に変異し、クローンFS22-053-017が得られた。
017の平衡解離定数(KD)をクローンFS22-053-014のそれと比較した。その結果は、両方のFcabクローンについて、ヒト抗原と非常に類似した速度論的プロファイルを示し、それにより、位置98のアスパラギン酸をグルタミン酸に変異させてもヒト抗原への結合に対して負の影響がなかったことを証明した。この結果は、FS22-053-017がマウスCD137抗原に対する結合強度の2倍の減少を示したことを示した。
、タンパク質L架橋なしで試験した又は、タンパク質Lと1:4の比率で架橋した。
要約すると、親和性成熟抗CD137 Fcabを生成し、mAb2形式に調製され、その後特性評価された。CH3ドメインにこれらのCD137抗原結合ドメイン含有mAb2は、ヒトNF-κBリポーター細胞アッセイにおいて高いレベルの活性を示し、この活性は架橋依存性であることが示された。FS22-053-008及びFS22-172-003Fcabからの抗原結合ドメイン含有mAb2は、このアッセイにおいて最も優れた活性を示した。
4.1 選択
「IONTAS 1」ヒト抗体ファージディスプレイライブラリー(IONTAS Ltd.)を使用して
、抗PD-L1クローンを選択した。IONTAS 1ライブラリーの構築のために使用された抗体遺伝子は、ヒトリンパ球(42のバフィーコートの提供)及び1つの扁桃腺組織サンプルに由来した。バフィーコート及び扁桃腺組織の両方が、地域研究倫理委員会(Local Research Ethical Committee)の承認の下で入手された。
ィングされた抗原を使用して、IONTAS1抗体ファージディスプレイライブラリーで3ラウ
ンドの固相選択を実行した。第1、第2,及び第3の選択ラウンドは、それぞれヒトPD-L1-Fc-His、マウスPD-L1-rCD4-His及びヒトPD-L1-Fc-Hisが使用された(抗原の詳細については実施例1.3参照)。
4.2.1 モノクローナルscFvELISA
実施例4.1からの選択280scFv集団をELISAによってスクリーニングして、ヒトPD-L1に最もよく結合するクローンを同定した。scFv集団を可溶性scFvベクターpSANG10にサブクローニングし、(Martin et al., 2006; Studier, 2005)に記載されているように、可溶性scFvを含有する大腸菌(E.coli)培養物を調製した。次に、可溶性scFvを、Schofield et al., 2007により記載されたように、固定化されたヒトPD-L1-rCd4-Hisを用いたモノクローナルELISAで使用した。Nunc Maxisorpプレート(Thermo Fisher Scientific、437111)をヒトPD-L1-
rCd4-His(5μg/ml、PBS)で一晩コーティングし、2%MPBSで1時間ブロックし、大腸菌(E.coli)培養上清(2x2%MPBSで1:2に希釈)を添加し、scFvを室温で1時間結合させた。結合したscFvは、ユーロピウムで標識された抗FLAG M2抗体(Sigma、F1804)で検出された。合計470のクローンがスクリーニング
され、これにより、抗原を含有しない「空の」ブロックされたウェルと比較して、バックグラウンドより少なくとも10倍高いPD-L1の結合シグナルを持つ346の抗PD-L1クローンが同定された。一次ELISAシグナルによって評価された192の最良の抗ヒトPD-L1クローンが、さらなる分析のために選択された。
PD-L1及びPD-1の間の相互作用を遮断したクローンを特定するために、ELISAを実行してブロッキングscFvのためのスクリーニングを実行した。簡単に説明すると、Nunc Maxisorpプレート(437111、Thermo Fisher Scientific)を抗rCd4(ド
メイン3及び4)抗体(MCA1022、OX-68、Bio-Rad)で一晩コーティングし、3%MPB
Sでブロックし、室温で1時間、ヒトPD-1-rCd4-His(3%MPBS中5μg/ml)でインキュベートした。ヒトPD-L1-Fc-His(50μl、0.2nM)を、scFvを含有する大腸菌(E.coli)培養上清と事前に混合した。Nunc96ウェルプレートを、PBS、0.1%Tween(商標)-20(PBS-T)で3回、PBSで3回洗浄した後、ヒトPD-L1-Fc-His/scFv混合を添加し、室温で1時間インキュベートした。プレートを洗浄し、結合したヒトPD-L1-Fc-Hisをヤギ抗Fc-ビオチン(Jackson ImmunoResearch、109-065-098、Laboratories、0.1μg/m
l、3%MPBS)及びストレプトアビジン・ユーロピウム(Streptavidin-Europium)
(Perkin Elmer、1244-360)、その後にDELFIAエンハンスメントソリューション(Perkin
Elmer、4001-0010)を使用して検出した。スクリーニングされた192個のクローンの
うち、培地対照と比較して、183個は少なくとも90%のブロッキング活性を示した。同定された183個の抗PD-L1scFvクローンを、上記の実施例4.2.1に記載されているように、一次ELISAでマウスPD-L1交差反応性についてさらにスクリーニングしたが、ヒトPD-L1の代わりに固定化マウスPD-L1-rCD4-Hisを使用した。これにより、50のマウス交差反応性抗PD-L1クローンが特定され、これは、IgG1形式への変換の候補であった。
PD-L1及びPD-1の間の相互作用を遮断した抗PD-L1scFvクローンは、VL及びVH遺伝子をIgG1発現プラスミドpINT3-IgG1にサブクローニングすることにより、IgG1形式に変換され、Chapple et al., 2006に記載されるように、HEK293で、4mlスケールで発現した。抗体は、製造元の指示に従って、プロテインAセファロースビーズ(PC-A100)及びProteus「1ステップバッチ」ミディス
ピンカラム(Generon、GEN-1SB08)を使用して、バッチアフィニティー精製された。精製された抗体の透析は、8kDaカットオフのGeBAflexマキシチューブ(Generon、D045)
を使用して実行された。必要に応じて、抗体を限外濾過により2μMに濃縮した。
次に、精製された抗PD-L1mAbの機能的活性を、共培養レポーターアッセイスクリーニングで評価した。このスクリーニングは、GloResponse NFAT-luc2/PD-1安定ジャ
ーカット細胞株(Promega、CS187102)及び、解凍及び使用PD-L1細胞(Promega、CS178103)を使用して製造元の指示に従って実行された。PD-L1細胞を、10%FBSを含有するHAM’S-F12培地に播種した。翌日、培地を除去し並行して、PD-1ジャーカットレポーター細胞(Promega、CS187102)をアッセイ培地(90% RPMI
1640、1% FBS)中に再懸濁した。付着したPD-L1細胞を含有するプレートに、2倍濃度(200nM)で異なる抗体を含む40μlのアッセイ培地、その後に40μlのPD-1細胞混合物を添加した。プレートは、5%CO2、37℃で6時間インキュベートした。BioGlo試薬(Promega、G7940、80μl)を各ウェルに添加し、BMG pherastarプレートリーダーを使用してルシフェラーゼアウトプットを読み取った。これによ
り、抗体を含有しない対照と比較してルシフェラーゼ活性が増加するために共培養アッセイでPD-1とPD-L1の相互作用を遮断することができる抗体G1/280_02_G02が特定
された。この活性は、用量反応共培養アッセイ(濃度範囲を2倍にする:200から1.56nM)で確認され、計算された半数効果濃度(EC50)は4.2nMになった。
G1/280_02_G02抗体の配列の予備分析により、VH-CDR2の潜在的な脱アミド化部
位、具体的にはKabat位54から55のNGモチーフが同定された。この部位での脱アミ
ド化は、潜在的に結合に影響を与える可能性があるため、NGモチーフがNA、NS、S
G、又はGGのいずれかに変更された変異体クローンが作成された。これらの修飾は、組換えPD-L1に対する親和性又はPD-L1ブロッキング活性の効力の顕著な低下をもたらさず、軽鎖シャッフルで使用するために、G1/280_02_G02_NSと指定されたNS修飾を含有する変異体クローンを選択した。
ファージ選択戦略により、強力なインビトロPD-1/PD-L1ブロッキング活性とマウスPD-L1交差反応性を備えた50を超える抗ヒトPD-L1結合クローンが同定された。特に、G1/280_02_G02は、細胞ベースのPD-L1レポーターアッセイで強力な
活性化を示し、そのためにさらなる最適化のために選択された。
G1/280_02_G02_NS抗体はラムダ軽鎖を有する。臨床状況で使用されてきたほとんどのモノクローナル抗体はカッパ軽鎖を持っているため(Jain et al., 2017)、チェーンシャ
ッフリングキャンペーンを使用して、G1/280_02_G02_NS抗体の重鎖を含むが、ヒトPD-L1及びマウスの交差反応性に対する親和性を保持したカッパ軽鎖と対となる、クローンを生成することが求められた。ファージディスプレイプラスミドpIONTAS-1(カッパライ
ブラリー)のIONTAS(商標)カッパ軽鎖ライブラリーを使用して、軽鎖変異体と結合したG1/280_02_G02_NS抗体の重鎖を含むscFvクローンの軽鎖シャッフルライブラリーを調製した。
ビオチン化ヒトPD-L1-rCD4-His及びマウスPD-L1-rCD4-His抗原(抗原の詳細は実施例1.3を参照)を使用して、3ラウンドで多数のファージディスプレイ溶液の選択を行った。選択は、全てのラウンドで抗原濃度を減少させることによって実行され(100から0.02nMまで変化)、選択の各ラウンドにおいて「非抗原」対照が使用された。
で発現させ、培養上清をIgG1形式でさらにスクリーニングするためにトランスフェクション後5日目に回収した。
48の抗体は全て、SPR(Biacore T200機器)を使用して親和性によってランク付けされた。ランク付けのために、希釈した上清(1XPBS及び0.002%Tween(商標
)-20で作製されたランニングバッファー中1:10)をプロテインAチップ(GE healthcare、製品コード:29127556)上に固定化し、ヒトPD-L1-rCD4-Hisを50nMの濃度で調製した表面上に流した。この1回の注入を使用して生成された結合(ka)及び解離(kd)速度定数を使用して、解離定数(KD)を決定した。クローンのKD値は、Ig1形式(G1/280_02_G02_NS)にクローンG1/280_02_G02_NSのそれと比較した。クローンG1/280_02_G02_NSよりもヒトPD-L1に対して高い親和性を示し、そのためクローンG1/280_02_G02_NSとともに完全な速度論的分析が行われたユニークな配列の10個のクローンが同定された。
養上清からの抗体を、FC2上のプロテインAチップ(GE Healthcare、29127556)に1
0μl/分の流速で、60秒の接触時間で捕捉した。典型的には、これにより500~800RUの抗体が捕捉される。PD-L1-rCd4-Hisの2倍希釈液を、FC1及びFC2上で50nMから30μl/分の流速で注入した(濃度範囲:50nM~0.05nM)。結合は180秒にわたって測定され、解離は300秒にわたって測定された。全ての測定は、PBS、pH7.4、0.05%Tween(商標)-20で、25℃で実施した。速度論的パラメーターは、参照細胞の減算及びBIAevaluationソフトウェア(GE、BR-1005-97)を使用した1:1の相互作用を想定したセンソグラム実験データのフィッティン
グによって決定された。得られたデータは、BIAevaluationソフトウェアを使用してフィ
ッティングされ、対応するka、kd、及びKD値を算出した。試験された10個のクローンのうち、「G1/887_04_E12」、「894_08_A05」、「G1/894_08_E05」及び「G1/887_04_G12」と指定された4つの抗体は、ナノモル濃度以下のKD値を示し、これは、G1/280_02_G02_NSにつきKDよりも低かった。記載のスクリーニング条件下で得られた親和性デー
タは、実施例5.1に記載のカッパ軽鎖シャッフルにより、G1/280_02_G02_NS抗体の重鎖がラムダ軽鎖だけでなくカッパ軽鎖とも対になって、組換えヒトPD-L1に対する良好な、そして実際に改善された、親和性を有する抗体を産生することを示した。
5.3.1 細胞ベースのPD-1/PD-L1ブロッキングアッセイ
カッパ軽鎖、G1/887_04_E12、G1/894_08_E05及びG1/887_04_G12を含有する抗PD-L
1クローンが、PD-1及びPD-L1の間の相互作用を遮断する能力を、PD-1/PD-L1 Blockade Bioassay製品(Promega、J1250/J1255)を製造元の推奨に従って使用した生体発光細胞ベースのアッセイで評価した。ブロッキング活性をG1/280_02_G02_NSクローンと比較した。
は、ラムダ軽鎖を含有するクローンG1/280_02_G02_NSよりもさらに優れたIC50値を示した。
抗PD-L1 mAb G1/887_04_E12、G1/887_04_G12及びG1/894_08_E05の組換えヒ
ト(ビオチン化hPD-L1-Avi-His, Acro Biosystems、PD1-H82E5)、カニクイザル(cPD-L1-His, Acro Biosystems、PD1-C52H4)及びマウス(mPD-L1-His, Acro Biosystems、PD1-M5220)との結合を、Biacore T200処理ユニット(GE Healthcare)を使用してSPRで測
定した。親和性をIgG1形式の280_02_G02_NSクローンと比較した(G1-AA/280_02_G02_NS;このクローン名の「AA」は、このクローンがCH2ドメインに「LALA」変異も含んでいたことを示す)。
した抗PD-L1 mAbを、30μl/分で、プロテインAチップ(GE Healthcare、29127556)のフローセル2、3、及び4に個別に注入し、約110RUの最終応答を達成
した。HBS-EP緩衝液で希釈した組換えヒト、カニクイザル及びマウスPD-L1-His抗原を、必要に応じてフローセル1、2、3、又は4に、81nMから0.037nMの濃度範囲で3倍希釈して、75μl/分で4分間注入し、その後緩衝液中で10分間解離させた。再生は、10mMグリシン-HCL pH1.5(GE Healthcare、Human Antibody Capture Kit、BR00356)を30μl/分の速度で30秒間注入することによ
って達成された。差し引かれたデータ(フローセル2-フローセル1、フローセル3-フローセル1、又はフローセル4-フローセル1)は、BIAevaluation 3.2ソフトウェア(GE Healthcare)を使用して分析して、屈折率(RI)定数0で、質量移動を伴うモデル1:1結合を使用して結合を同定した。マウスPD-L1結合曲線の親和性を決定するために、対応するヒト結合プロファイルのRmaxを使用した。
抗ヒトPD-L1mAb、G1/894_08_E05、G1/887_04_E12及びG1/887_04_G12を、次に
、フローサイトメトリーを使用して、ヒトPD-L1(HEK.hPD-L1細胞)を発現するHEK293細胞への結合を試験した。非特異的結合は、ヒトPD-L1を欠くHEK293親細胞(Flp-In T-Rex 293細胞株、Life Technologies、R780-07)への結合を試験することによっても評価された。
ログ番号V601020)にサブクローンし、その後、Lipofectamine 2000(Life Technologies、11668-019)を使用してベクターをFlp-In T-REx 293細胞株(Life Technologies、R780-07)に形質転換した。細胞を、10%FBS、100μg/mlハイグロマイシンB(Melford Laboratories Ltd、Z2475)及び15μg/mlブラストサイジン(Melford Laboratories Ltd、B1105)を含有するDMEMで、安定的に形質転換された細胞のコロニー
が形成されるまで3~4週間増殖させた。これらのコロニーを1μg/mlのドキシサイクリン(Sigma Aldrich、D9891)の存在下で増幅し、PEコンジュゲート抗ヒトPD-L1(MIH1)抗体(BD Biosciences、557924)を使用してPD-L1の発現について試験した。細胞解離緩衝液を使用して細胞を剥離し、PBSで1回洗浄し、96ウェルプレートのウェルに2×105細胞でプレーティングし、PBSで1:20に希釈した抗体と4℃で1時間インキュベートした後、PBSで再度洗浄し、Accur iC6サイトメーター(BD Biosciences)を使用して測定した。FlowJoXソフトウェアを使用してデータを分析した。ヒトPD-L1の発現が細胞株で検出された。
~0.29nMの範囲で細胞表面ヒトPD-L1に結合することが見出された。親HEK293細胞への結合は観察されず、結合の特異性を示した。したがって、試験した全てのmAbクローンは、非特異的な結合は観察されず、PD-L1に特異的に結合した。
抗PD-L1 mAbの活性は、混合リンパ球反応(MLR)アッセイで試験された。MLRアッセイは、2つの同種異系リンパ球集団(同じ種であるが、遺伝的に異なる)間で発生する細胞性免疫応答を測定する。このアッセイでは、あるドナーからのCD4+T細胞及び別のドナーからの単球由来樹状細胞(iDC)を使用する。免疫細胞には生理学的レベルの免疫チェックポイント調節因子が含まれているため、MLRアッセイを使用して、T細胞活性化がヒトシステムのmAbによって増強されることを確認することができる。
PBMCは、フィコール勾配分離によって白血球錐体から分離された。CD4+T細胞は、Human CD4+T Cell Isolation Kit(Miltenyi Biotec Ltd、130-096-533)を使用して、製造元の指示に従って分離した。ヒトT-アクチベーターCD3/CD28 Dynabeads(Life Technologies、11131D)をボルテックスで再懸濁した。ビーズを滅菌15mlチ
ューブに移し、10%FBS(Life Technologies、10270106)を含む10ml RPM
I(Life Technologies、61870044)及び1×ペニシリンストレプトマイシン(Life Technologies、15140122)を加えてダイナビーズを洗浄した。上澄みを廃棄した。10%FBS及び1×ペニシリンストレプトマイシン溶液を添加したRPMI中の1.0×106細胞/mlのCD4+T細胞、及び3:1のビーズ対細胞比を有する50IU/mlの組換えヒトIL-2(Peprotech、200-02-50μg)をT75フラスコ(Greiner Bio-one、690195)に移し、37℃+5%CO2でインキュベートした。3日後、細胞を穏やかに再懸濁し、計数した。細胞密度は、必要に応じて新鮮な培地(RPMI-10%FBS+ペニシリンストレプトマイシン溶液1X+50IU/mlのrhuIL-2)を添加することにより、0.8~1×106細胞/mlの範囲に維持した。7日目又は8日目に、CD3/28ビーズを除去し、CD4+T細胞を、減量した10IU/mlのrhuIL-2を有する新鮮培地RPMI-10%FBS+ペニシリンストレプトマイシン溶液1Xの1×106細胞/mlで一晩静置した。細胞は必要になるまで凍結保存した。
未処理の単球は、Human Pan Monocyte Isolation Kit(Miltenyi Biotec Ltd、130-096-537)を使用して、製造元の指示に従ってヒトPBMCから分離した。単球は、ヒトMo-DC分化培地(Miltenyi Biotec Ltd、130-094-812)を使用して、製造元の指示に従ってi
DCに分化させた。
丸底プレート(VWR、734-1797)中、50μlのAIM V培地で、最終濃度の4倍で3
回希釈した。LALA変異を含有する4420と指定される抗FITC抗体(Bedzyk et al., 1989及びBedzyk et al., 1990)が陰性対照として含まれていた。30nMから0.002nMまでの3倍希釈系列を試験した。50μlのAIM V培地に懸濁した1×104iDC細胞、及び100μlのAIM V培地に懸濁した1×105拡大培養したCD4+T細胞の両方を、抗体希釈液に添加し、37℃+5%CO2で5日間インキュベートした。以下の対照が含まれていた:CD4+T細胞単独、iDC単独、CD4+T細胞
+iDC、及びAIMV培地単独。上清を回収し、サンプルを希釈し(1:25)、ヒトIFNガンマELISA Ready-SET-Go!キット(Life Technologies、88-7316-77)を使用して、インターフェロンガンマ(IFN-γ)濃度を測定した。Gen5 Software、BioTekを備えたプレートリーダーを使用して、プレートを450nmで読み取った。450n
m(補正)の吸光度値から630nmの吸光度値を差し引いた。サイトカイン濃度を計算するための標準曲線は、4パラメーターロジスティック曲線適合(Gen5 Software、BioTek)に基づいていた。ヒトIFN-γの濃度を抗体の対数濃度に対してプロットし、得ら
れた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
抗ヒトPD-L1 mAb G1/887_04_E12、G1/887_4_G12及びG1/894_08_E05はマウスPD-L1に対して弱い交差反応性を示すことが示されたため(実施例5.3.2を参照)、マウスPD-L1に対するそれらの機能的活性を、DO11.10 OVA T-リンパ球及びLK35.2B-リンパ球ハイブリドーマ細胞株に基づく、インターロイキン2(IL-2)放出アッセイで調査した。IL-2放出はT細胞活性化のマーカーである。内因性マウスPD-1を発現するT細胞に空のベクター(pLVX)をトランスフェクトした。B-細胞にマウスPD-L1構築物をトランスフェクトした。
レンチウイルス形質導入法を使用したLenti-X HTXパッケージングシステム(Clontech
、631249)を使用して、空のレンチウイルスベクターpLVXを含有するDO11.10細胞(National Jewish Health)を生成した。Lenti-X発現ベクター(pLVX)(カタログ
番号631253)をLenti-X HTXパッケージングミックスと共にLenti-X293T細胞株(カタログ番号632180)に同時トランスフェクトして、ウイルスを生成した。DO11.10細胞株は、Lenti-XHTXパッケージングシステムで産生されたレンチウイルス粒子を使用して形質導入された。
レンチウイルス形質導入法を使用したLenti-X HTXパッケージングシステム(カタログ
番号631249)を使用してマウスPD-L1を過剰発現するLK35.2 B細胞リンパ腫細胞(ATCC、HB-98)を生成した。cDNAをコードするマウスPD-L1(配列番号187)を含有するLenti-X発現ベクター(pLVX)(カタログ番号631253)は、Lenti-XHTXパッケージングミックスと共にLenti-X293T細胞株(カタログ番号632180)に同時トランスフェクトして、ウイルスを生成した。LK35.2細胞株は、Lenti-X HTXパッ
ケージングシステムで生成したレンチウイルスベクターを使用して形質導入された。
抗PD-L1 mAb G1/887_04_E12、G1/887_4_G12及びG1/894_08_E05又は抗FITC陰性対照mAb(G1-AA/4420)の希釈液は、実験培地(DMEM(Gibco、61965-026)、10% FBS(Gibco、10270-106)、1mMピルビン酸ナトリウム(Gibco、11360-070))で調製された。2.46μM OVAペプチド(H-ISQAVHAAHAEINEAGR-OH(配列番号192)(Pepscan))(100μL LK35.2mPD-
L1細胞(マウスPD-L1を過剰発現させるためにmPD-L1を含むレンチウイルスベクターで形質導入されたB細胞ハイブリドーマ)/mAb混合物が96丸底プレートの1ウェルあたり)の存在下、mAbは、4×105/ml LK35.2mPD-L1細胞と1:1で、実験培地中で混合し、37℃、5% CO2で1時間インキュベートした。100μl容量の実験培地中の2×105/ DO11.10 pLVX細胞(空のレンチウイルスベクターで形質導入されたDO11.10 T細胞ハイブリドーマ)を、100μlのLK35.2mPD-L1/(mAbs)混合物に添加した。次いで、細胞を混合し、37℃、5%CO2で、24時間インキュベートした。上清を収集し、製造元の指示に従ってマウスIL-2 ELISAキット(eBioscience、88-7024-88又はR&Dシ
ステム、SM2000)でアッセイした。Gen5 Software、BioTekを備えたプレートリーダーを
使用して、プレートを450nmで読み取った。450nm(補正)の吸光度値から570nmの吸光度値を差し引いた。サイトカイン濃度を計算するための標準曲線は、4パラメーターロジスティック曲線適合(Gen5 Software、BioTek)に基づいていた。マウスI
L-2の濃度をmAbの対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
った。効力の差は、測定された親和性よりも低く、これは、このアッセイにおけるLK35.2細胞でのマウスPD-L1の過剰発現によるためである可能性が高い。
選択されたカッパ軽鎖を含む抗PD-L1 mAb G1/894_08_E05、G1/887_04_E12、及びG1/887_04_G12は、カニクイザル及びマウスPD-L1の交差反応性を示し、細胞表
面に発現したPD-L1への特異的結合を示し、ラムダ軽鎖を含むクローンG1/280_02_G02よりも、組換えヒト及びカニクイザルPD-L1に対してさらに高い親和性を示した。
抗PD-L1 mAb G1/894_08_E05、G1/887_04_E12、及びG1/887_04_G12は、インビ
トロでヒトT細胞の強力な活性化因子であり、且つ機能的なマウス交差反応性を有することを示した。
6.1 潜在的なタンパク質脱アミド化部位の特定及び除去
G1/280_02_G02_NSクローン配列の解析により、H-CDR2ループ(Kabat位54~5
7)内の配列NSNTが、脱アミド化された場合、結合に影響を与える可能性がある潜在的な脱アミド化部位として同定された。このクローンの重鎖は、実施例5に記載のチェーンシャッフリングキャンペーンによって得られた全てのカッパ軽鎖含有クローンに保持されていたため、この潜在的な脱アミド化部位は、クローンG1/887_04_E12、G1/894_08_A05、G1/894_08_E05、及びG1/887_4_G12にも存在した。生殖細胞系列配列に最も近い特定の
プライマーを使用して、4つのカッパ軽鎖含有クローンにおいて、NSNT配列は、部位特異的変異導入法により、GGST、SGGT又はSGNAのいずれかに変化して、特定される変異体クローンを産生した。この潜在的な脱アミド化部位を除去すると同時に、カッパ軽鎖シャッフル中にこの抗体の配列に意図せず導入された、G1/887_04_E12クローン
のVH領域内のKabat位28のプロリン残基の役割は、G1/280_02_G02_NSクローンに含ま
れるスレオニン残基に戻すことによっても調査された。親及び得られた変異体クローン(全てIgG1形式)を0.8mlスケールでトランスフェクトし、トランスフェクションの5日後に回収した培養上清を使用して、SPRによるヒト及びカニクイザルPD-L1-rCD4-Hisに対するクローンの親和性を決定した。Cyno PD-L1-rCD4-Hisを実施例1.3で記載されているように生成した。G1/887_04_E12クローン
に由来する変異体クローンを除いて、全ての変異体クローンは、それぞれの親クローンと比較して、ヒト及びカニクイザルPD-L1に対するナノモル濃度以下の親和性を保持していた。
ンは全て、それぞれの親クローンと同等のヒト及びカニクイザルPD-L1に対するナノモル濃度以下の親和性を示し、GGST、SGGT、及びSGNA置換が良好に許容されていることを示唆した。親(G1/887_04_E12)と比較してG1/929_01_A01、G1/929_01_A02
、及びG1/929_01_A03クローンの親和性が大幅に低下したのは、H-CDR2におけるG
GST、SGGT及びSGNAの置換の存在よりも、Kabat位28におけるVH領域のプ
ロリンが除去に起因する可能性が高いと考えられた。G1/887_04_E12クローン内のこのプ
ロリン残基がPD-L1に対する親和性について重要であるように見えたことは驚くべきことであった。H-CDR2(54~57位)におけるSGGT置換を含む3つの親クローンG1/887_04_E12、G1/894_08_E05及びG1/887_04_G12に由来する変異体、すなわちクロ
ーンG1/929_01_A02、G1/929_01_A08及びG1/929_01_A11は、このSGGT置換が生殖細胞
系列配列に最も近いことに基づいて、さらなる特性評価のために選択された。
。さらに、このクローンのラムダ軽鎖のCDR1におけるKabat位31から32で特定さ
れる、さらなる潜在的な脱アミド化部位(NSモチーフ)は、IGLV2-8-01、IGLV2-8-02、IGLV2-8-03、IGLV2-11-01、IGLV2-11-02、IGLV2-11-03及びIGLV2-14-01、IGLV2-14-02、IGLV2-14-03、IGLV2-14-04などのいくつかの生殖細胞系列配列におけるこの位置にチロシンが見られるように、セリン32(Kabat番号付け)をチロ
シンに変異させることによってNYへと修飾された。これらの修飾の組み合わせにより、ラムダ軽鎖含有クローンG1/lam-G02v3が得られ、これもさらなる特性評価のために選択された。
7.1 mAb形式におけるクローンのクローニング化及び産生
実施例6で同定されたG1/929_01_A02「SGGT」変異体クローンのVH領域のKabat位28のスレオニン残基を、ヒト及びカニクイザルPD-L1に対する親和性を改善する目的で、親クローンG1/887_04_E12の同じ位置に存在するようにプロリンに変異させた。H
EK293-6E細胞における一過性発現及びmAb Select SuReプロテインAカラムを使
用した精製を使用して、この修飾された変異体クローン、及び実施例6においてIgG1形式及びLALA変異で同定された他の3つの「SGGT」変異体クローン(G1/929_01_A08、G1/929_01_A11、及びG1/lam-G02v3)を産生し、エフェクター機能が非存在下の場合の機能的活性の試験を可能にした。得られたmAbは、G1-AA/E12v2、G1-AA/E05v2、G1-AA/G12v2及びG1-AA/lamG02v3(G1-AA/lamG02v3又はG1-AA/lambdav3と呼ばれる)と指定さ
れた。重鎖及び軽鎖配列は、それぞれG1-AA/E12v2につき配列番号16及び配列番号17
、G1-AA/E05v2につき配列番号27及び配列番号28、G1-AA/G12v2につき配列番号27及び配列番号33、及びG1-AA/lam-G02v3につき配列番号27及び配列番号44に示されて
いる。
G1-AA/lam-G02v3(すなわち、VH-CDR2におけるNSNTからSGGT、VL-
CDR1におけるNSからNY、及びLALA変異)及びカッパ軽鎖含有mAbのG1-AA/E12v2、G1-AA/E05v2及びG1-AA/G12v2(すなわち、LALA変異、及びG1-AA/E12v2単独、VH領域におけるKabat位28のスレオニンからプロリン)に存在するさらなる配列修飾
が結合動力学に影響を及ぼしたかどうかを決定するために、実施例5.3.2に記載のように、ヒト及びカニクイザルPD-L1についてのこれらの抗PD-L1mAbの親和性が決定された。mAbのG1-AA/lam-G02v3、G1-AA/E05v2、G1-AA/E12v2、及びG1-AA/G12v2は、mAbのG1-AA/280_02_G02_NS、G1/894_08_E05、G1/887_04_E12及びG1/887_04_G12について実施例5.3で観察されたそれらと類似のヒト及びカニクイザルPD-L1についての親和性を示し、試験されたmAb及びmAb2の結合親和性は、潜在的な脱アミノ化部位の修飾又はLALA変異の導入により影響を受けなかったことが実証された。G1-AA/E12v2mAbは、試験した4つのmAb全ての中で最低のKD値を示した(ヒトPD-L
1では0.21nM、カニクイザルPD-L1では0.37nM)。結果を表4に示す。
における28位(Kabat命名法)のプロリン残基が、ヒト及びカニクイザルPD-L1に
対する親和性に重要であることを示す。
抗PD-L1mAbのG1-AA/E05v2、G1-AA/E12v2、及びG1-AA/G05v2は、実施例5.3
.4に記載されているように混合リンパ球反応(MLR)アッセイで試験された。G1-AA/4420を陰性対照として使用した。結果を表5に示す。mAbのG1-AA/E05v2、G1-AA/E12v2及びG1-AA/G12v2は、0.054nM未満のEC50及び600pg/mlを超えるIF
N-γの最大レベル(Emax)のMLRアッセイにおいて強力な活性を示した(表5)。EC50、特にEmax値は、実施例5.3.4で記載した値とは顕著に異なっていた。応答は、あるドナーからのT細胞及び別のドナーからの単球由来樹状細胞との間の同種反応に依存するため、この違いはドナーのばらつきによるものと考えられている。抗ヒトPD-L1mAbの効力は、クローンの効力の順序にランク付けしたのと同様に、実施例5.3.4に記載されたデータと一致していた。予想通り、陰性対照G1-AA/4420 mAbの活性は観察されなかった。
mAbのG1-AA/E05v2、G1-AA/E12v2、及びG1-AA/G12v2はラボスケールで産生され、S
EC及び示差走査熱量測定(DSC)の標準的な分析方法によって特徴付けられた。
mAbのG1-AA/E05v2、G1-AA/E12v2、及びG1-AA/G12v2をコードするDNA配列を、PEIpro(Polyplus、フランス)を使用してHEK293 6E(カナダ国立研究評議会(National Research Council Canada))細胞にトランスフェクトした。5日後、細胞培養液
を回収し、AKTAxpress機器を使用してMabSelectプロテイン-Aプレパックカラム(両方GE Healthcare、ウプサラ(Uppsala)、スウェーデン)で精製した。カラムの平衡化は、
50mM Tris、pH7.0の250mM NaCl、で行い、その後、回収した細胞培養液をロードした。樹脂を50mM Tris、pH7.0の250mM NaClを使用して洗浄し、続いてpH3.5未満の緩衝液を使用してmAbを溶出した。
精製後のSE-UPLCは、Acquity H-Class Bio UPLC(Waters Corp、UK)を使用し
て、単量体の割合を測定するために精製から24時間以内に実施した(材料は4℃で保存した)。Acquity UPLC BEH200 SEC 1.7mmカラム(4.6×150mm)を使用し
、移動相は、250mMリン酸ナトリウム、100mM L-アルギニン、pH6.8で構成されていた。単量体、低分子量及び高分子量種の定量化は、Empowerソフトウェア(Waters Corp、UK)を使用して実行された。
G1-AA/E05v2、G1-AA/E12v2、及びG1-AA/G12v2の融解温度(Tm)は、Microcal VPキャピラリー示差走査熱量計(DSC)を使用して測定した。G1-AA/lam-G02v3は、カッパ軽
鎖含有mAb及びラムダ軽鎖含有mAbの違いを評価するために含まれていた。サンプルは、サンプル緩衝液中、0.2mg/mlの濃度で測定された。スキャン速度は60℃/時間に設定され、データは35℃から100℃の間で収集された。データ分析は、Origin7.0ソフトウェアを使用して実行された。Fab及びCH3のDSCピークが重複してい
たため、1つの値が報告された。
%を超え、Fab遷移の熱安定性(Tm)は、IgG1について典型的に報告される遷移の上端で確認され、G1-AA/E12v2が最も熱的に安定しているように見えた(Fab/CH
3 TM=81.484.1℃)。ラムダ軽鎖mAbのG1-AA/lamG02v3は、3つのカッパ軽鎖含有mAbよりもTmが低かった。
8.1 抗ヒトCD137/PD-L1mAb2の産生
3つの抗ヒトCD137 FcabクローンFS22-053-008、FS22-053-017及びFS22-172-003(実施例3参照)を含むIgG1分子からなるCD137/PD-L1mAb2抗体を産生し、mAb2形式でのFcabの特性評価を可能にした。CD137/PD-L1mAb2は、3つの抗PD-L1結合抗体(G1-AA/E05v2、G1-AA/E12v2、G1-AA/G12v2、実施例7.1参照)のうちの1つのCH3ドメイ
ンの対応する領域について、AB、CD及びEFループを含むCH3ドメインFcabの一部を置換することによって調製された。全ての結果のmAb2は、LALA変異を含んでいた。CD137/PD-L1mAb2は、PEIpro(Polyplus、France)を使用してHEK293 6E(NRCC、Canada)細胞で一過性に発現した。5日後、細胞培養液を回収し、AKTAxpress機器を使用してMabSelectプロテイン-Aプレパックカラム(両方GE Healthcare、ウプサラ、スウェーデン)で精製した。カラムの平衡化は、50mM Tris-HCl、pH7.0の250mM NaClで行い、続いて、回収した細胞培養液をロードした。次に、樹脂を50mM Tris-HCl、pH7.0の250mM NaClを使用して洗浄し、その後pH<3.5の緩衝液を使用してmAb2を溶出した。
イオセンサーを備えたOctet QKe(ForteBio)を使用して、バイオレイヤー干渉法によっ
てIgGタンパク質含有量を定量した。タンパク質を、mAbSelectSureカラムを使用した
プロテインA親和性クロマトグラフィーによって精製した。9つのmAb2を、mAb Select SuReプロテインAカラム(GE Healthcare、11003494)を使用して精製した。結果を表7に示す。
精製された。
8.2.1 SE-HPLCによる分析
移動相として、20mMリン酸ナトリウム、200mM塩化ナトリウム、pH6.8を使用し、TSK-GEL SUPERSW 3000 4.6mmIDx30.0cmカラム(Tosoh Bioscience)を装備したAgilent1100シリーズHPLC(Agilent、UK)で精製後SE-HPL
Cを行った。単量体の割合の定量化を、Chemstationソフトウェア(Agilent、UK)を使用して実行した。
CE-SDS分析を、製造元の指示に従い、2100 Bioanalyzerキャピラリー電気泳動システム(Agilent、UK)で実行した。還元条件ために、DTTを添加し、サンプルを70
℃で5分間変性させた。
A精製後に凝集を示し、その結果、それ以上進行しなかった。
9.1 SPRによるヒト及びカニクイザルPD-L1について抗ヒトCD137/PD-L1mAb2結合親和性
次に、抗ヒトCD137/PD-L1mAb2、FS22-172-003-AA/lam-G02v3、FS22-172-003-AA/E05v2、FS22-053-008-AA/E05v2、FS22-172-003-AA/E12v2、FS22-053-008-AA/E12v2及びFS22-172-003-AA/G12v2の組換えヒト及びカニクイザルPD-L1抗原への結合を、Biacore T200processing unit(GE Healthcare)を使用してSPRにより測定した。
に希釈した抗ヒトCD137/PD-L1mAb2を、30μl/分で、プロテインAチップ(GE Healthcare、29127556)のフローセル2、3、及び4に個別に注入し、約11
0RUの最終応答を達成した。2つの異なる組換えヒトPD-L1抗原、すなわちhPD-L1-His-Avi(抗原の詳細については実施例1.3を参照)及びビオチン化hPD-L1-Avi-His(Acrobiosystems、PD-1-H82E5)を使用した。HBS-EP緩衝液で希釈したヒト及びカニクイザルPD-L1-His(Acrobiosystems、PD-1-C52H4)抗原を、81nMから0.037nMの濃度範囲で、75μl/分で4分間、3倍希釈して、フローセル1、2、3又は4上に適当に注入し、その後、緩衝液中で10分間解離させた。再生は、10mMグリシン-HCL pH1.5(GE Healthcare、Human Antibody Capture Kit、BR00356)を30μl/分の速度で30秒間注入することによって達成された。減算したデータ(フローセル2-フローセル1、フローセル3-フローセル1、又はフローセル4-フローセル1)を、BIAevaluation3.2ソフトウェア(GE Healthcare)を使用して分析し、屈折率(RI)定数0で、質量移動を伴うモデル1:1結合を使用して結合を同定した。
抗ヒトCD137/PD-L1mAb2の組換え二量体ヒト及びカニクイザルCD137抗原への結合も、Biacore T200processing unit(GE Healthcare)を使用してSPRによって測定された。
)のフローセル1、2、3及び4上にコーティングし、約5000RUの最終応答を達成した。HBS-EP緩衝液(GE Healthcare、BR100188)で2~5μg/mlに希釈した
mAb2クローンを、30μl/分で、フローセル2、3、及び4に個別に注入し、約70RU(FS22-172-003-AA/E12v2については200RU)の応答を達成した。HBS-E
P緩衝液で希釈した組換え二量体抗原、ヒトCD137-mFc-Avi又はカニクイザルCD137-mFc-Avi(抗原の詳細については実施例1.1参照)を、フローセル1、2、3又は4に、81nMから0.037nMの濃度範囲で3倍希釈して、70μl/分で4分間適当に注入し、その後、緩衝液中で10分間解離させた。再生は、10mMグリシンpH2.1(GE Healthcare、Human Fab Capture kit 28958325)を30μl
/分の速度で60秒間注入することによって達成された。データ分析は、実施例9.1で記載したように実行した。
Aviに対しても親和性を試験した。81nMまでのFS22-172-003-AA/E12v2の単量体C
D137への結合は検出されず、抗ヒトCD137/PD-L1 mAb2のFcab結合領域は、単量体CD137に対して低い親和性を有することが示された。これらの結果は、FS22-053-008 CD137 Fcabについても観察されたものと類似であり、FcabのmAb2形式への変換は、CD137への結合においてほとんど変化をもたらさなかったことを示している。
9.3.1 ヒトPD-L1の特異性
抗ヒトCD137/PD-L1 mAb2の特異性を分析するために、6つのmAb2(FS22-172-003-AA/lam-G02v3、FS22-172-003-AA/E05v2、FS22-053-008-AA/E05v2、FS22-172-003-AA/E12v2、FS22-053-008-AA/E12v2及びFS22-172-003-AA/G12v2)の他のT細胞標的への結合を、SPRを用いて試験した。この目的は、mAb2が、1μMの濃度でPD-L2、CD80、PD-1、及びB7-H3の抗原に対するmAb2の結合を示さないことにより特異性を実証することであった。
いで4分間解離させた。10mMグリシンpH1.5の30秒注入を再生に使用した。陽性対照抗体を、各抗原のコーティングを実証するために50~100nMで注入した。結合レベルは、会合フェーズの終わりに決定され、比較された。
満であった。これらの結果は、PD-L1に対する抗ヒトCD137/PD-L1mAb2の高いレベルの特異性を実証したが、列挙された他のT細胞標的には結合しなかった。
CD137/HelD1.3mAb2と比較した場合、CD137/PD-L1 mAb2において、CD137 Fcab結合部位の特異性が保持されていることが予想され
る(実施例3.6参照)。TNFRファミリーメンバーであるOX40、GITR、CD40及びDR6(R&D Biosystems)に対するFS22-172-003-AA/E12v2の特異性を、実施例
9.3.1で記載したように類似してSPRによって分析した。1μMの濃度では、FS22-172-003-AA/E12v2は、ヒトCD137-mFcに対して278RUであったのに対し、
ヒトOX40、GITR、CD40及びDR6に対して7RU未満で結合した。この結果は、CD137に対するFS22-172-003-AA/E12v2mAb2の高いレベルの特異性を実証し
た。
ヒトCD137及びヒトPD-L1-His Avi(抗原の詳細については実施例1.3参照)に同時結合するFS22-172-003-AA/E12v2mAb2の能力を、Biacore T200のS
PRにより試験した。G1/S70を対照として使用した。酢酸ナトリウム緩衝液pH5.0(GE Healthcare、18-1069)で10μg/mlに希釈したヒトPD-L1Hisを、CM5センサーSチップ(GE Healthcare、BR100530)に約1100RUの表面密度で固定化し
た。バックグラウンド除去のために固定化したタンパク質なしで、1つのフローセルを活性化及び不活性化した。HBS-EP緩衝液中で5μg/mlに希釈した抗体を、約200~300RUの密度になるように30μl/分の流速で捕捉した。ヒトCD137-mFc-Aviの結合は、0及び100nMで30μl/分で5分間試験し、次いで2.5分間の解離ステップを行った。20mM NaOHを流速30μl/分で60秒間の各サイクル後、センサーチップを再生した。FS22-172-003-AA/E12v2は、ヒトPD-L1及び
ヒトCD137の両方に同時に結合できたが、対照G1/S70はヒトPD-L1にのみ結合した。
抗ヒトCD137/PD-L1mAb2の細胞表面ヒト及びカニクイザルPD-L1への結合を評価するために、ヒトPD-L1を過剰発現させたHEK293細胞を生成した。ヒトPD-L1を過剰発現するHEK293細胞(HEK.hPD-L1)を、実施例5.3.3に記載のように産生した。カニクイザルPD-L1をコードするcDNA(配列番号189)を、ヒトPD-L1配列の代わりにpcDNA(商標)5/FRTベクターに
サブクローニングした以外は、カニクイザルPD-L1(HEK.cPD-L1)を過剰発現するHEK293細胞もまた、実施例5.3.3.に記載したように作製した。
サイトメトリーを使用してヒト又はカニクイザルPD-L1を発現するHEK293細胞への結合について試験した。非特異的結合は、ヒトPD-L1を欠くHEK293親細胞(Flp-In T-Rex 293細胞株、Life Technologies、R780-07)への結合を試験することによっても評価された。結合親和性を、陽性対照抗体G1-AA/E12v2(それぞれ重鎖及び軽鎖に
つき配列番号16及び17)と比較し、クローン化したその可変ドメインをCH2ドメインのLALA変異を含むヒトIgG1形式(G1-AA形式)で発現させた。
、1x105細胞/ウェルで100μlの丸底96ウェルプレート(VWR、734-1797)中
に播種した。細胞をFACS緩衝液中で1回洗浄した。mAb2FS22-172-003-AA/E12v2
、モックmAb2FS22-172-003-AA/HelD1.3、mAbG1-AA/E12v2及び陰性対照mAbG1-AA/4420を、100μlのFACS緩衝液中で希釈した(400nM~0.005nM、5倍希釈)。洗浄した細胞を希釈した抗体混合物に再懸濁し、4℃で30分間インキュベートした後、FACS緩衝液で1回洗浄した。次に、100μl/ウェルの二次抗体(ヤギ抗ヒトIgGAlexa Fluor 647標識抗体、Invitrogen、A21445)をFACS緩衝液中で1
:1000に希釈して添加し、4℃で20分間インキュベートし、細胞をFACS緩衝液で再び洗浄し、そして7AAD(1:1000、Biotium、40043)を含有する100μlのPBSに再懸濁し、その後、Canto IIフローサイトメーター(BD Bioscience)を用い
て分析した。死細胞を除外し、APCチャネル(638nm660/20)の蛍光を測定した。幾何平均蛍光強度(GMFI)値を抗体の対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
D-L1に特異的に結合した。これらの結果は、PD-L1mAb(実施例5.3.3参照)について観察されたヒト及びcynoPD-L1に対する特異性が保持されていることを示す。
完全長ヒト(配列番号:185)又はカニクイザルCD137(配列番号:189)を発現するDO11.10細胞(National Jewish Health)は、それぞれ「DO11.10.hCD137」及び「DO11.10.cCD137」と指定され、選択された抗ヒトCD137/PD-L1mAb2のさらなる特性評価のために、その天然形態に最も類似した膜結合立体配座で抗原を提示するために産生された。DO11.10.hCD137及びDO11.10.cCD137細胞の産生及び発現の確認の詳細は、実施例1.2に記載されている。
リーを使用して、ヒト又はカニクイザルCD137(DO11.10.hCD137又はDO11.10.cCD137)を発現する細胞への結合について試験した。非特異的結合は、CD137発現を欠くDO11.10細胞への結合を試験することによっても評価された。MOR7480.1(米国特許出願公開第2012/0237498号)の可変ドメインをクローン化し、CH2ドメインにLALA変異を含むヒトIgG1形式(G1-AA形式)で発現させ、これを陽性対照として使用した。
体、Invitrogen、A21445)を添加し、細胞/抗体混合物を4℃で20分間インキュベートし、その後、細胞をFACS緩衝液で再度洗浄し、7AAD(1:1000、Biotium、40043)を含有する100μlのPBSに再懸濁した後、Canto IIフローサイトメーター(BD Bioscience)を使用して分析した。死細胞を除去し、APCチャネル(638nm
660/20)の蛍光を測定した。幾何平均蛍光強度(GMFI)値を抗体の対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
活性化された初代ヒトT細胞の内因性発現CD137及びPD-L1に対する抗ヒトCD137/PD-L1mAb2の親和性を、フローサイトメトリーを使用して決定した。T細胞を単離するために、血小板提供の副産物である白血球枯渇コーンから末梢血単核細胞(PBMC)を単離した。簡単に説明すると、白血球コーンの内容物をPBSで洗い流し、フィコール(Sigma-Aldrich、1440-02)勾配に重ねた。PBMCを遠心分離により分離し、フィコール勾配を通過しなかった細胞を回収した。PBMCをさらにPBSで洗浄し、残りの赤血球を、製造元の指示に従って10ml 1Xの赤血球溶解緩衝液(eBioscience、00-4300-54)の添加により溶解した。汎T細胞を、汎T細胞単離キットII(Miltenyi Biotec Ltd、130-095-130)を製造業者の指示に従って使用して、溶出液中に存在
するPBMCから単離した。CD137は、活性化されたCD8+T細胞上で高レベルに急速に発現し、活性化されたCD4+T細胞上でも低レベルに発現する(Xue-Zhong Yu et al,2013)ので、製造業者の指示に従って、Dynabeads(商標)Human T-Activator CD3/CD28(Thermo、11132D)を使用して、汎T細胞を24時間刺激した。Human T-Activator beads は、FS22-172-003-AA/E12v2mAb2、FS22-172-003-AA/HelD1.3モックmAb2、
G1-AA/E12v2陽性対照抗ヒトPD-L1抗体、G1-AA/MOR7480.1陽性対照抗ヒトCD137抗体、G1-AA/4420陰性対照抗体の結合について試験をするために細胞結合アッセイを使用する前に、製造業者の指示に従って、DynaMag(商標)-15マグネット(Thermo、12301D)を使用してT細胞から洗浄した。
回洗浄し、mAb2FS22-172-003-AA/E12v2、モックmAb2FS22-172-003-AA/HelD1.3、陽性対照抗体G1-AA/E12v2、陽性対照抗体G1-AA/20H4.9、及び陰性対照抗体G1-AA/4420を
、100μlのFACS緩衝液中で希釈した(80nM~0.005nM、5倍希釈)。洗浄した細胞を、抗ヒトCD4+FITC標識抗体(BD Biosciences、550628)及び抗ヒトCD8+eFluor450標識抗体(Invitrogen、48-0087-42)を含有する希釈した抗体混合
物中に再懸濁し、CD4+及びCD8+T細胞を分化させ、4℃で30分間インキュベートした後、FACS緩衝液中で1回洗浄した。次に、FACS緩衝液で1:1000に希釈した100μl/ウェルの二次抗体(ヤギ抗ヒトIgGAlexa Fluor 647標識抗体、Invitrogen、A21445)を添加し、細胞/抗体混合物を4℃で20分間インキュベートし、そ
の後、細胞をFACS緩衝液で再度洗浄し、7AAD(1:1000、Biotium、40043)を含有する100μlのPBSに再懸濁した後、Canto IIフローサイトメーター(BD Bioscience)を使用して分析した。死細胞を除去し、APCチャネル(638nm 660
/20)の蛍光を測定し、試験抗体結合を示した。幾何平均蛍光強度(GMFI)値を抗体の対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
たヒト初代CD4+T細胞及びCD8+T細胞に結合することが見出された。PD-L1陽性対照抗体G1-AA/E12v2は、mAb2と類似のMFI値でCD4+及びCD8+T細胞
の両方に結合し、PD-L1が細胞上で発現していることを確認した。
が、MFIはFS22-172-003-AA/E12v2又はG1-AA/E12v2のいずれかで観察されたものよりはるかに低かった。これは、PD-L1発現と比較して、細胞上のCD137発現が低いことに起因すると考えられる。さらに、G1-AA/MOR7480.1の結合についてCD4+T細胞よ
りもCD8+T細胞の方が、MFI値が高かった。前述したように、CD8+T細胞よりも刺激されたCD4+T細胞の方が低いCD137発現を観察することが予想され(Xue-Zhong Yu et al,2013)、これはCD8+T細胞とは対照的に、CD4+T細胞上のCD
137陽性対照抗体MOR7480.1の低い結合レベルを説明する。初代T細胞、特にCD4+T細胞で見られるこの低いCD137発現は、モックmAb2形式(FS22-172-003-AA/HelD1.3)におけるFcabの結合が無い又はほとんど見られないことも説明して
いる可能性がある。
胎児性Fc受容体(FcRn)の結合は、抗体のリサイクルに重要である(Martins et
al.,2016)。FS22-172-003-AA/lam-G02v3、FS22-172-003-AA/E12v2、及びFS22-053-008-AA/E12v2mAb2のヒト及びマウスFcRnへの結合は、BIAcore T200(GE Healthcare
)を使用してSPRにより測定された。G1-AA/HelD1.3は、CH3ドメインに変異がない
アイソタイプ対照IgG対照として含まれた。
)のフローセル2、3、及び4に個別にコーティングして、約1000RUの応答を達し
た。フローセル1を活性化/不活性化したが、参照としてブランクのままにした。ヒトFcRn(Acro Biosystems、FCM-H5286)又はマウスFcRn(R&D systems、9114-Fc)を透析し、MHBS-EP+B pH6.0又はpH7.4緩衝液(10mM MES、ForteBio、18-5026;1x HBS-EP、GE Healthcare、BR100669;0.1mg/ml BSA、Sigma、A7906)で希釈し、フローセル1,2,3及び4に2000~3000nMで2倍希釈液を1分間80μl/分で注入し、次いで緩衝液中で3分間解離させた。再生は必要なかった。減算したデータ(フローセル2-フローセル1、フローセル3-フローセル1、又はフローセル4-フローセル1)をBiacore T200評価ソフトウェア2.0を使用して分析し、モデルの定常状態親和性を使用して結合を特定した。結合データを表13に示し、FS22-172-003-AA/lam-G02v3、FS22-172-003-AA/E12v2及びFS22-053-008-AA/E12v2mAb2が、pH6.0でヒト又はマウスFcRnに、対照抗体G1-AA/HelD1.3と類似の親和性で結合することを示した。pH7.4のヒト又はマウスのFcRnでは結合は観察されなかった。このデータは、FcRn結合は、mAb2によって保持されたことを示した。
TNFRSFメンバーを標的とするアゴニスト抗体は、Fcγ受容体を介した架橋を必要とし、標的のクラスター化及び活性化を促進してインビボ活性を達成する(Li et al, 2013)。しかし、Fcγ受容体結合による架橋のため、体系的なCD137活性化などの潜在的な標的外作用を回避し、両標的を発現する免疫細胞、例えばT細胞のADCC誘導の可能性を低下させるため、CH2ドメインにLALA変異(LALA形式の詳細については、実施例3.2参照)を導入することにより、抗ヒトCD137/PD-L1mAb2のFcγ受容体結合能を低下させることを決定した。FcγRIIA(ECACCカタログ番号15042905)、FcγRIIA(ECACCカタログ番号15042903)、FcγRIIA (ECACCカタログ番号15042902)、FcγRIIIA (ECACCカタログ番号15042901)又はFcγRIIB(ECACCカタログ番号15042907)のみを過剰発現しているCHO細胞へのフローサイトメトリーによる細胞結合を使用して、抗ヒトCD137/PD-L1mAb2のCH2ドメインにおけるLALA変異の存在が先述のFcγ受容体に対する結合親和性を低下させることを確認した。
緩衝液中で1回洗浄し、mAb2FS22-172-003-AA/E12v2、Fcγ受容体結合抗体G1/4420に対する陽性対照及びFcγ受容体抗体G1-AA/4420に対する陰性対照を、100μlのF
ACS緩衝液中で希釈した(500nM~0.03nM、4倍希釈)。洗浄した細胞を希釈した抗体混合物に再懸濁し、4℃で30分間インキュベートした後、FACS緩衝液で1回洗浄した。次に、FACS緩衝液で1:1000に希釈した100μl/ウェルの二次抗体(ヤギ抗ヒトIgGAlexa Fluor 488標識抗体、Stratech Scientific Ltd、109-545-098-JIR)を添加し、細胞/抗体混合物を4℃で20分間インキュベートし、その後、
細胞をFACS緩衝液で再度洗浄し、7AAD(1:1000、Biotium、40043)を含有する100μlのPBSに再懸濁した後、CytoFLEXフローサイトメーター(Beckman Coulter)を使用して分析した。死細胞を除外し、FITCチャネル(488nm/525/
40)の蛍光を測定した。幾何平均蛍光強度(GMFI)値を抗体の対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
合(又は陰性対照抗体G1-AA/4420のレベル以下に結合)を示さなかった(図3(A)FcgRIIA131H、(B)FcgRIIA131E、(C)FcgRIIB、(D)FcgRIIIA158F、(E)FcgRIIIA158V)。これは、LALA変異がFcγRIIA、FcγRIIIA又はFγgRIIBへの結合を減少させ、インビボでこれらの受容体を介したmAb2架橋も減少させるはずであることを示す。
10.1 ヒト初代CD8+T細胞アッセイにおける抗ヒトCD137/PD-L1 mAb2の活性
実施例3.5に記載のヒト初代T細胞アッセイは、mAb2の活性を試験するために使用した。
1(表14)を発現するSKBR3細胞と共に使用した。
s、61870-044))でプレーティングした。対照として使用されたhPD-L1を発現するように形質導入されなかったHEK.hPD-L1細胞又はHEK細胞が4時間のインキュベーション後に付着した時点で、全てのT細胞培養培地を除去し、T細胞を含有する100μlのT細胞培養培地で5.0×105細胞/mlの濃度で置き換え、5.0×104細胞/ウェルを得た。
:5滴定を実行した。100μlの希釈した陽性対照抗体/架橋剤混合物を、合計200μlのアッセイ体積及び1倍の抗体濃度のために細胞に添加した。
使用して、プレートを450nmで読み取った。450nm(補正)の吸光度値から630nmの吸光度値を差し引いた。サイトカイン濃度を計算するための標準曲線は、4つのパラメーターのロジスティック曲線適合(Gen5 Software、BioTek)に基づいていた。ヒ
トIL-2(hIL-2)の濃度を抗体の対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
EK.hPD-L1ベースのアッセイでは0.19~0.31nMの範囲、MDA-MB-231ベースのアッセイでは0.01~0.02nMの範囲のEC50を有する最大のT細胞応答を誘発した。mAb2のサブセット(Fcab含有FS22-053-008、FS22-053-011、FS22-053-014、FS22-173-003及びFS22-172-004)も、HEK細胞上で発現されたPD-L1による架橋なしで試験され、予想されたように、このアッセイにおいて活性を示さなかった。図4及び図5は、表15に列挙されたmAb2のT細胞活性化アッセイについてIL-2放出の代表的なプロットを示す。
腺癌細胞株SK-BR-3(ATCC HTB-30)を使用して試験した。予想通り、PD-L1の発現が低いと、前の2つのアッセイと一致してCD8+T細胞の活性化が低下した(データは示さず)。
異なる細胞株によるPD-L1の発現レベルがCD137の活性化に影響することが観察されたため、試験したmAb2の機能的活性に対するPD-L1発現の影響をさらに調査することを決定した。集団ベースのアプローチにおいて、ヒトPD-L1発現のレベルを調節するために、HEK.hPD-L1対HEK.WT細胞の比率を変化させた、実施例10.1に記載されたものと同様のアッセイを実施した。
ストレプトマイシン(Life Technologies、15140122)、1mMピルビン酸ナトリウム(Gibco、11360-070)、及び50μM 2-メルカプトエタノール(Gibco、M6250)を含む
RPMI培地(Life Technologies、61870-044))でプレーティングした。4時間のインキュベーション後に全てのHEK細胞を接着した後、全てのT細胞培養培地を除去し、T細胞を5.0×105細胞/mlの濃度で含有する100μlのT細胞培養培地で置換し、5.0×104細胞/ウェルを得た。
して実行したが、それ以外は実施例10.1に記載のプロトコルに従った。抗CD137陽性対照抗体G1-AA/20H4.9は、抗CH2抗体を介した追加の架橋と共に含まれていた。抗体G1-AA/4420を陰性対照として使用した。
PD-L1細胞の集団が増加するにつれて、mAb2の活性も増加したことを示す。存在するHEK細胞集団の100%がHEK.hPD-L1であった場合、最大の架橋が達成され、最高の最大hIL-2濃度が観察された。陽性対照抗体G1-AA/20H4.9も、抗CH2抗体
によって最大限に人工的に架橋された場合、同様の最大hIL-2濃度に達した。
抗ヒトCD137/PD-L1 mAb2の活性は、混合リンパ球反応(MLR)アッセイで試験された(実施例5.3.4を参照)。MLRアッセイでは、あるドナーからのCD4+T細胞及び別のドナーからの単球由来樹状細胞(iDC)を使用した。免疫細胞には生理学的レベルの免疫チェックポイント調節因子が含まれているため、MLRアッセイを使用して、T細胞活性化がヒト系のmAb2によって増強されることを確認することができる。
終濃度の4倍に希釈した。LALA変異を含むMSL109(国際公開第1994/016730 A1号に記載)と呼ばれる抗サイトメガロウイルス(CMV)gH糖タンパク質抗体を陰性対照として含めた。30nMから0.002nMまでの3倍希釈系列を試験した。50μlのAIM V培地に懸濁した1x104iDC細胞、及び100μlのAIM V培地に懸濁した1x105拡大培養したCD4+T細胞の両方を、抗体希釈液に添加し、37℃+5%CO2で5日間インキュベートした。以下の陰性対照が含まれていた:CD4+T細胞単独、iDC単独、CD4+T細胞+iDC、及びAIM V培地単独。上清を回収し、サンプルを希釈し(1:25)、ヒトIFNガンマELISA Ready-SET-Go!キット(Life Technologies、88-7316-77)を使用して、インターフェロンガンマ(I
FN-γ)濃度を測定した。Gen5 Software、BioTekを備えたプレートリーダーを使用し
て、プレートを450nmで読み取った。450nm(補正)の吸光度値から630nmの吸光度値を差し引いた。サイトカイン濃度を計算するための標準曲線は、4つのパラメーターのロジスティック曲線適合(Gen5 Software、BioTek)に基づいていた。ヒトIF
N-γの濃度を抗体の対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
発しなかった。これは、CD137の発現が低い可能性があり、PD-L1の遮断が非常に強いため、このアッセイではPD-L1の遮断がCD137のシグナル伝達を圧倒することを示している。驚くべきことに、このアッセイにおいて試験された全ての抗ヒトCD137/PD-L1 mAb2は、2626から3327pg/mlの範囲で0.04未満の非常に強力なEC50値及び高いEmax値を示した。これは、mAb2が、PD-L1及びCD137モノクローナル抗体のいずれよりもこのアッセイで効力が増加していることを示す。
ベルのIFN-γ(Emax)が12421pg/mlであるMLRアッセイにおいて強力な活性を示した(表17;代表図7C)。予想通り、陰性対照G1-AA/4420抗体では活性
は観察されず、モックmAb2形式の抗ヒトFcab FS22-173-003では活性は観察されなか
った。陽性の抗ヒトCD137抗体対照G1-AA/20H4.9は、抗hCH2抗体と架橋した場合、活性を
誘発しなかった。これは、CD137の発現が低い可能性があり、上記で見られたようにPD-L1の遮断が非常に強いため、このアッセイではPD-L1の遮断がCD137のシグナル伝達を圧倒することを示している。予想通り、抗ヒトCD137/PD-L1 FS22-172-003-AA/E12v2 mAb2は、0.07nMの非常に強力なEC50値及び17874pg/mlの高いEmax値を示した。これは、mAb2が、抗PD-L1及び抗CD137モノクローナル抗体のいずれか単独又は両方の組み合わせよりも、このアッセイで効力が増加していることを示す。データは、mAb2が、それぞれ、mAb2のFcab及びFab結合部位を含む2つの抗体の組み合わせよりも大きな効力を有していたことも示す。
生理学的に関連する抗原を含有する2つの異なるペプチドプールに対する免疫応答を測定することによって、抗原リコールT細胞活性化アッセイにおける抗ヒトCD137/PD-L1 mAb2の活性を試験した。1つのプールは、CD8+T細胞の活性化を試験するサイトメガロウイルス、エプスタイン・バーウイルス、及びインフルエンザウイルス(CEF)からのMHCクラスI制限ペプチドを含み、第2のプールは、CD4+T細胞の活性化を試験したサイトメガロウイルス、エプスタイン・バーウイルス、インフルエンザウイルス、及び破傷風毒素(CEFT)からのMHCクラスII制限ペプチドを含む。単一のドナーからのヒトPBMCが使用され、免疫細胞は生理学的レベルの免疫チェックポイント調節因子を含み、抗CD3抗体によるT細胞受容体の架橋ではなく抗原提示によって刺激されたため、アッセイの結果は、抗原駆動T細胞活性化は、ヒトの系におけるmAb2により増強されること確認する。
Fペプチドプール(Thinkpeptides、カタログ番号PX-CEF-G)又は1μg/mlのCEF
Tペプチドプール(Thinkpeptides、カタログ番号PX-CEF-G)のいずれかを含有する、2
00μlのRoswell Park Memorial Institute(RPMI)培地中、ウェルあたり1.9
x105細胞を96ウェル平底プレートに播種した。細胞を、3日間、5%CO2と共に37℃でインキュベートした。3日後、10%FBSを含有し、1ng/mlのIL-2及び1ng/mlのIL-7を維持する、22.5μlの新鮮RPMIを添加して培地を補充した。細胞を、さらに4日間、5%CO2と共に37℃でインキュベートした。
元の指示に従ってアッセイした。プレートは、1:5のサンプル希釈を使用して、MESO QuickPlex SQ 120電気化学発光プレートリーダー機器で読み取った。サイトカイン濃度を
計算するための標準曲線は、MSD Discovery Workbench 4.0ソフトウェアを使用して計算
され、上清中のサイトカイン濃度は、GraphPad Prismの対数(アゴニスト)対応答式を使用して適合された。
06nm及び0.04nMのEC50値(それぞれ65840pg/ml及び86613pg/mlのEmax)で、CD4+及びCD8+の両方のT細胞の活性化につき活性を示した。EC50は、アゴニスト性応答の半分が達成されるmAbの濃度を示し、他方で、Emaxは、アッセイで達成されるIFN-γの最大濃度を示す絶対値である。陽性の抗ヒトCD137抗体対照G1-AA/20H4.9は、抗hCH2抗体と架橋した場合、0.33nMのEC50値及び116204pg/mlのEmax値で、CD8+T細胞活性化につき活性を示したが、CD4+T細胞活性化につき活性は誘発されず、これは、CD137発現が、CD4+T細胞と比較してCD8+T細胞でより高い可能性があることを示している。予想通り、陰性対照G1-AA/4420抗体では活性は観察されなかった。驚くべきことに、mAb2は、それぞれ0.08nM及び0.03nMのEC50値で、CD4+T細胞活性化及びCD8+T細胞活性化の両方のアッセイにおいて活性を示した。mAb2は、PBMC発現PD-L1に結合でき、両方の細胞タイプで同等のPD-L1活性を示した。さらに、PBMC発現PD-L1への結合は、mAb2の架橋をもたらし、IFN-γ放出によって測定されるように、両方のT細胞サブタイプにおいて、CD137を結合し、クラスター化し、活性化することができた。mAb2で処置されたT細胞によって放出されたIFN-γの最大濃度は、CD4+T細胞の活性化及びCD8+T細胞の活性化につき、それぞれ、86680pg/ml及び188242pg/mlのEmax値で、どの陽性対照抗体よりも高かった。これは、mAb2が、PD-L1及びCD137モノクローナル抗体のいずれよりもこのアッセイで活性が増加していることを示す。
FS22-172-003-AA/E12v2の活性は、PD-L1チェックポイント遮断活性を調査するた
めに、マウスDO11.10 T細胞活性化アッセイで試験した。ヒトPD-L1に対する機能的活性は、実施例5.4に記載されているように、DO11.10 OVA T細胞及びLK35.2 B細胞ハイブリドーマ細胞を使用するIL-2放出アッセイで調べた。
できることを確認する。その活性は、陽性対照抗ヒトPD-L1抗体G1-AA/E12v2及びG1-AA/S70の活性と類似しており、これは、G1-AA/E12v2がFS22-172-003-AA/E12v2 mAb2分子
に組み込まれた場合、抗ヒトPD-L1活性の喪失が発生しなかったことを示す。
11.1 カニクイザルDO11.10T細胞活性化アッセイにおける抗ヒトCD137/PD-L1 mAb2の活性
活性化T細胞上のアゴニスト分子を介したCD137クラスター化は、T細胞の活性化及び下流のシグナル伝達を誘発し、その結果IL-2産生をもたらすが、これに限定されるものではない。カニクイザルCD137を発現するDO11.10細胞を活性化する抗ヒトCD137/PD-L1 mAb2の能力は、T細胞活性化アッセイで試験した。カニクイザルCD137を過剰発現するように操作されたDO11.10T細胞を使用してDO11.10T細胞活性化アッセイが開発され、IL-2放出を測定することにより、T細胞活性化が評価された。
丸底プレートに入れられたDO11.10.cCD137細胞に添加し、2×105HEK.cyPD-L1細胞を
播種して、カニクイザルPD-L1を過剰発現する細胞ベースの架橋細胞として使用した。実施例9.5に記載のカニクイザルPD-L1を使用して、実施例5.3.3に記載のようにカニクイザルPD-L1を過剰発現する細胞を作製した。18時間のインキュベーション後、上清を回収し、製造元の指示に従ってマウスIL-2 ELISAキット(eBioscience、88-7024-86)でアッセイした。Gens Software、BioTekを備えたプレートリーダーを使用して、プレートを450nmで読み取った。450nm(補正)の吸光度値から570nmの吸光度値を差し引いた。サイトカイン濃度を計算するための標準曲線は、4つのパラメーターのロジスティック曲線適合(Gens Software、BioTek)に基づいてい
た。mIL-2の濃度をmAb2又はベンチマークmAbの対数濃度に対してプロットし、得られた曲線をGraphPad Prismの対数(アゴニスト)対応答式を使用して適合させた。
生による読み出しとしてDO11.10 T細胞活性化を誘発するカニクイザルCD137に結合し、クラスター化することを示す(表21及び図8を参照)。全ての抗ヒトCD137/PD-L1 mAb2は、細胞発現カニクイザルPD-L1を介して架橋された場合にのみ、0.06から0.11nMの範囲のEC50値及び8060から12300pg/ml IL-2の範囲のEmaxで、類似の活性を示した。カニクイザルPD-L1の不存在下において、カニクイザルPD-L1を発現しないHEK細胞を使用してアッセイを行った場合、架橋がない結果として活性を有しなかった。カニクイザルの交差反応性が示されている陽性対照CD137抗体G1-AA/MOR7480.1(Fisher et al, 2012)は、
抗CH2と架橋した場合、このアッセイで活性を示すが、全ての抗ヒトCD137/PD-L1 mAb2は、カニクイザルCD137発現系において、交差反応性及びより良好な活性を示す、より低いEC50値及びより高いEmax値の両方の意味でより良好である。
抗ヒトCD137/PD-L1 mAb2の活性は、カニクイザル混合リンパ球反応(MLR)アッセイで試験された。実施例10.3に記載のヒトMLRアッセイと同様に、このアッセイは、2つの同種異系リンパ球集団(同じ種であるが、遺伝的に異なる)間で発生する細胞性免疫アッセイ応答を測定する。このアッセイでは、一個体のカニクイザルのCD4+T細胞と、別の個体のCD14+単球を使用する。免疫細胞には生理学的レベルの免疫チェックポイント調節因子が含まれているため、MLRアッセイを使用して、T細胞活性化がカニクイザル系のmAb2によって増強されることを確認することができる。
PBMCは、フィコール勾配分離によってカニクイザル血液サンプルから分離された。CD4+T細胞は、非ヒト霊長類CD4+単離キット(Miltenyi Biotec Ltd、130-091-102)を使用して、製造元の指示に従って単離した。細胞は、MLRアッセイで新鮮に使用された。
未処理の単球は、非ヒト霊長類CD14単離キット(Miltenyi Biotec Ltd、130-091-097)を使用して、製造元の指示に従ってカニクイザルPBMCから単離した。単球は、MLRアッセイで新鮮に使用された。
抗ヒトCD137/PD-L1 mAb2 FS22-172-003-AA/E12v2及び抗ヒトPD-L1抗体G1-AA/E12v2及びアイソタイプ対照抗体G1-AA/4420を、96ウェル丸底プレート(VWR、734-1797)中、50μl AIM V培地で最終濃度の4倍に希釈した。LALA変異を含有するHelD1.3と呼ばれる抗鶏卵リゾチーム(HEL)抗体(実施例2.2に記載)を陰性対照として含めた。300nMから0.02nMまでの4倍希釈系列を試験した。50μlのAIM V培地に懸濁した7.5x104単球細胞、及び100μlのAIM V培地に懸濁した7.5x105CD4+T細胞の両方を、抗体希釈液に添加し、37℃+5%CO2で6日間インキュベートした。以下の陰性対照が含まれていた:CD4+T細胞単独、CD14+T単球単独、CD4+T細胞+iDC、及びAIM V培地単独。上清を2日目に収集し、インターロイキン2(IL-2)濃度をMILLIPLEX MAP非ヒト霊長類サイトカイン磁気ビーズパネル(Merck Millipore、カタログ番号PRCYTOMAG-40K-01)を使用して測定し、上清をまた6日目に収集し、インターフェロンガンマ(IFN-γ)濃度を同じキットを使用して測定した。サンプルは、Bio-RadのBio Plex 200
装置で分析した。
抗ヒトCD137/PD-L1 mAb2の活性がカニクイザル初代PMBCアッセイで試験された。このアッセイは、抗CD3 mAbで刺激されたPBMCの混合集団で発生する細胞性免疫アッセイ応答を測定する。アッセイは、一個体のカニクイザルからの全PBMCを使用し、免疫細胞には生理学的レベルの免疫チェックポイント調節因子が含まれているため、PBMCアッセイを使用して、T細胞活性化がカニクイザル系のmAb2によって増強されることを確認することができる。
体(mG1/MK1A6))を含有する40nMで開始する2倍の最終濃度で、細胞を播種したも
のと同じ培地中に希釈し、1:4滴定を実行した。mAb2(FS22-172-003-AA/E12v2)
及び陰性対照抗体(G1-AA/HelD1.3)は、架橋剤なしで同じ方法で希釈した。100μl
の希釈した抗体/架橋剤混合物を、合計200μlのアッセイ体積及び1倍の抗体濃度のために細胞に添加した。このアッセイを、3日間、5%CO2と共に37℃でインキュベートした。
使用して計算され、上清中のサイトカイン濃度は、GraphPad Prismの対数(アゴニスト)対応答式を使用して適合された。
BMCアッセイで活性を示した。予想通り、陰性対照G1-AA/HelD1.3抗体では活性は観察
されなかった。驚くべきことに、mAb2は、それぞれ0.08nM及び0.03nMのEC50値で、両方のPBMCアッセイにおいて類似の活性を示した。EC50は、アゴニスト性応答の半分が達成されるmAbの濃度を示す。したがって、mAb2は、PBMC発現PD-L1へ結合でき、mAb2の架橋をもたらし、IFN-γ放出によって測定されるように、両方の種のT細胞において、CD137を結合し、クラスター化し、活性化することができた。mAb2で処置されたT細胞によって放出されたIFN-γの最大濃度は、どの陽性対照抗体よりも高く、これは、mAb2が、抗CD137モノクローナル抗体よりもこのアッセイで活性が増加していることを示す。
マウス及びヒトのCD137配列間の配列相同性が低いことから、マウスのヒト交差反応性Fcabを取得できないリスクがあるため、インビボのマウスモデルにおけるCD137抗原結合領域を含有するmAb2の活性を試験するために、マウスCD137に特異的に結合するFcabを生成され、特性評価した。マウスCD137結合Fcabが生成された後、驚くべきことに、FS22-053-14はマウス及びヒトの交差反応性を有することが
できることがその後見出された。
ヒトCD137に結合するFcabを選択するために、ヒトCD137に結合するFcabの選択について前述したものと同様に、酵母及びファージディスプレイ選択キャンペーンを採用した(実施例2.1を参照)。組換えマウス二量体CD137又は抗原として使用される完全長マウスCD137を発現する細胞(実施例1を参照)。
マウスCD137に対する抗マウスCD137 Fcabの特異性は、HelD1.3「モック」mAb2形式で試験し、Fcabの他のマウスTNFRSF受容体(CD40、OX40、GITR)への結合を試験することにより、Octet QKeシステムのBLIに
よって測定した。10ng/μlのマウスCD40、GITR、OX40受容体をコーティングするためのストレプトアビジンバイオセンサー(PALL ForteBio 18-5021)(全てR&D Systemsから入手し、Thermoscientific #21328のEZ-Link Sulfo-NHS-SS-Biotinキットを使用してビオチン化した)。モックmAb2形式の抗マウスCD137 Fcabは、少なくとも1μMの最終濃度まで、動的バッファー(PALL 18-1092)で1:1に希釈した。抗原でコーティングされたセンサーをmAb2溶液に180秒間浸した後、1×動的バッファーに180秒間浸した。各TNFRSF受容体の抗体を陽性対照として使用した。FcabクローンFS22m-055、FS22m-063、FS22m-066、FS22m-075、FS22m-135、FS22m-055、FS22m-063、FS22m-066は、試験したTNFRSF受容体のいずれにも結合せず、したがって、そのマウスCD137に対する特異性を示した。
3で前述したものと同じ方法に従って産生された。前に選択された抗マウスCD137 Fcabを含有するmAb2は、実施例2.3に記載された方法に従って、この細胞株、HEK.FRT.luc.mCD137を使用してスクリーニングした。56のmAb2が試験され、そのうち29がNF-κB活性につき陽性であった。LALA変異を有するヒトIgG1 Fc(G1-AA/Lob12.3)を含有するLob12.3を、陽性対照抗マウスCD137 mAb
として使用し、発光の増加を示し、アッセイの有効性を確認した。LALA変異を有するヒトIgG1 Fcも含有するHelD1.3を、陰性対照ヒトIgGアイソタイプとして使用して、このアッセイにおけるヒトIgGモックFabからの干渉を除外した。可能な場合、EC50を計算し、活性においてプラトーに達しなかったmAb2は、古典的なS字状の活性動態を示したmAb2の有利になるよう無視された。mAb2は、プロテインL架橋時の活性のEC50及び倍率変化の順にランク付けした。FS22m-063は、架橋時
に最高のEC50(1.44nM)を有し、架橋時に活性の倍率変化が最も大きい(27倍)ことに基づいて選択された。
FS22-053-017クローン(HelD1.3モックmAb2形式)も、実施例2.4に記載されているようなマウスCD137DO11.10T細胞活性化アッセイにおいて、親のFS22-053-014
クローン(HelD1.3モックmAb2形式)と同様に、マウスCD137結合FcabクローンFS22m-063(HelD1.3モックmAb2形式)と比較された。mAb2分
子は、4:1のモル比(mAb2:タンパク質L)で、プロテインLと架橋された。結果を表22に示す。
のEC50で、アッセイ中最高の活性を有していた。FS22-053-14とFS22-053-017の両方
がアッセイで活性を示し、変異誘発によって機能が失われなかったことを示している。ただし、FS22-053-017は、プロテインLで架橋された場合にFS22-053-14よりおよそ8倍低
いEC50で、活性のわずかな損失を有していた。図10は、DO11.10T細胞活性化アッセイにおいて、親和性成熟ヒト及びマウス交差反応性CD137 Fcab FS22-053-014及びFS22-053-017、並びに抗マウスCD137 Fcab FS22m-063が、He
lD1.3モックmAb2形式で、プロテインLと架橋するとCD137を活性化し、mIL-2を放出することを示す。
インビボのマウスモデルにおけるCD137抗原結合領域を含有するmAb2の活性を試験するために、実施例12.3に記載されているように、T細胞活性化アッセイにおいて最良の活性を示したFcabとしてFS22m-063を選択した。
抗マウスCD137 Fcab FS22m-063と、PD-L1結合Fab領域(米国特許
第8,217,149 B2号からのクローンYW243.55.S70)も含む、抗マ
ウスCD137/PD-L1 mAb2が産生された。これらは、AB、CD、及びEFループ含有抗PD-L1結合抗体のCH3の一部をFcabの対応する領域で置換することにより、実施例3.2に記載の方法と同様に調製した。これらのPD-L1モデルmAb2は、CH2ドメイン(AA)にLALA変異を含んでいた。ヒトIgG1のCH2ドメインにLALA変異の導入は、すると、Fcγ受容体結合の低下が知られている(Bruhns,P.,et al.(2009)及びHezareh M.,et al.(2001))。
CD137を過剰発現するように操作されていない細胞に対する抗マウスCD137/PD-L1 mAb2の活性を試験するには、マウス初代T細胞アッセイが必要であった。活性化細胞傷害性CD8+T細胞は、癌細胞を直接殺傷するのに関与し、それらの細胞表面にCD137を発現する(Ye et al,2014)。CD137のクラスター化は、下流の
シグナル伝達及びさらなるCD8+T細胞の活性化の誘導に不可欠であることが知られている。したがって、CD8+T細胞活性化アッセイを使用して、mAb2がCD137のクラスター化及び下流シグナル伝達を駆動する能力を評価した。ヒトCD8+T細胞活性化アッセイを同じように反映する試みがなされたが、ナイーブC57BL/6又はBalb/c脾臓から単離されたマウスCD8+T細胞は、そのようなアッセイに必要な活性化の可能性を示さなかった。したがって、代替の抗原特異的CD8+T細胞活性化アッセイが開発された。CD8+T細胞の活性化は、オバルブミンペプチド257-264に特異的なT細胞受容体を有するC57BL/6 OT-1マウス(Jackson Laboratory、カタログ番号003831)から単離された遺伝子改変OT-1T細胞の抗原刺激によって達成され、IL-2の放出によって決定された。
した後、6ウェル組織培養プレートのウェルに移し、2本の針で機械的に破砕した。破砕した脾臓を70μmの細胞ストレーナーに通し、ストレーナーをPBSですすいだ。次に、細胞懸濁液を遠心分離によってペレット化し、上清を除去し、赤血球を製造元の指示に従って10mlの1×赤血球溶解緩衝液(eBioscience、00-4300-54)の添加により溶解
した。脾細胞を、10nMのSIINFEKLペプチド(配列番号194)(InvivoGen、カタロ
グ番号vac-sin)を含有するT細胞活性化培地(IMDM、5%FCS、50μM 2-
メルカプトエタノール、1×Penstrep)用にウェルあたり10×106細胞で6ウェルプレートにプレーティングした。プレートは、5%CO2と共に37℃で48時間インキュベートした。48時間後、CD8+T細胞を、製造元の指示に従って、CD8+T cell Isolation Kit(Miltenyi Biotec、130-104-075)を用いて単離した。単離及び活性化されたCD8+T細胞を、30U/ml IL-2(Peprotech、AF-200-02)を補充した培地(IMDM、5%FCS、50μM 2-メルカプトエタノール、1×Penstrep)にプレーティングし、さらに3日間、毎日各分割でmlあたり1×106未満に維持した。3日間の拡大培養後、細胞を次のアッセイで使用した。
性化を促進するための最初のシグナルとして使用され、その後、抗マウスCD137/PD-L1 mAb2FS22m-063-AA/S70の有効性を評価するために使用された。
次いで、これらの細胞を平底96ウェルプレートに100μlの培地中ウェルあたり1.5×104細胞で播種する前に、37℃で1時間500nMのSIINFEKLペプチドとインキュベートした。50μlの培地中、ウェルあたり2×104のOT-1細胞をB16.F10細胞に添加した。試験抗体(FS22m-063-AA/S70、G1-AA/S70、G1-AA/Lob12.3、FS22m-063-AA/HelD1.3)は、160nM(最終濃度の4倍)から開始する1:4滴定で調製し、50μlの抗体ミックスを各ウェルに添加し、それに応じて最終アッセイ量を200μlにした。このアッセイを、3日間、5%CO2と共に37℃でインキュベートした。3日後、上清を回収し、mIFN-γ(eBioscience、カタログ番号88-7314-88)につき製造
元の指示に従ってELISAを実施した。
14.1 CT26同系マウス腫瘍モデルにおける抗マウスCD137/PD-L1 mAb2の活性
FS22m-063 FcabがインビトロでCD137のクラスター化及び活性化を駆動できることを示したため、インビボでCD137を活性化する能力を試験することが望まれた。
実施例3.2で産生したモデルmAb2と同様の方法を用いて、抗マウスCD137 Fcab、FS22m-063、及びPD-L1に特異的なFab領域を含むmAb2を、CT26同系マウス腫瘍モデルにおけるインビボ抗腫瘍活性について調製及び試験した。
部分的に応答し(Kim et al, 2009)、PD-L1を発現する(Kleinovink, 2017)こと
が知られているため、この実験ではCT26同系腫瘍モデルを使用した。
試験開始前の1週間休息させた。全ての動物は、マイクロチップ化され、固有の識別子が与えられた。各コホートには12匹のマウスがいた。CT26結腸癌細胞株(S.Rosenberg, NIH)を最初に拡大培養し、保存し、その後IMPACT Iプロトコルを用いて病原体に対するIDEXX Bioresearchにより予備スクリーニングし、病原体フリーであることを
示した。各動物は、左脇腹に100μlのDMEM中の0.1×106細胞の皮下注射を受けた。腫瘍細胞接種後の7日目に、この時点で腫瘍を有しないマウスは試験から除外された。
+1mMアルギニン+0.05 Tween 80中、マウスあたり20μg(最終濃度約1mg/kg)で、マウスに腹腔内注射した。各マウスは、腫瘍接種後7日目、9日目及び11日目に200μlの腹腔内(IP)注射により、mAb2分子又は対照抗体若しくは2つの対照抗体の組み合わせを投与された。腫瘍の正確な測定が行われ、問題の日に予定されている薬物投与が行われ、残りの研究の間、マウスは綿密な観察下に置かれた。腫瘍の最
長軸及び最短軸を決定するために、カリパスを使用して腫瘍体積の測定を行った。次の計算式を使用して、腫瘍体積を計算した。
LX(S2)/2
(ここで、L=最長軸、S=最短軸)
比較して、有意な腫瘍増殖阻害を示した。統計的有意性は、全ての群を比較した混合モデル分析を使用した研究の全時間にわたる増殖速度につき対で示された。明白な毒性の兆候を示したマウスはなく、全ての処置は十分に許容され、これは、CD137及びPD-L1を標的とする二重特異性が重大な毒性を誘発しないことを示している。
ALA変異を伴う抗CD137陽性対照)で処置された動物の7%、及びFS22m-063-AA/S70(モデルPD-L1 mAb2形式の抗マウスCD137 Fcab FS22m-063)で
処置されたマウスの0%は、腫瘍がないと見なされた。FS22m-063-AA/S70は、IgG対照で処置したマウスと比較して、CT26同系腫瘍モデルで有意な腫瘍増殖阻害を誘導する。G1-AA/4420(IgG対照)又はG1/S70(PD-L1陽性対照)で処置された動物で、研究の終了まで腫瘍がなかった動物はいなかった。図17のグラフは、経時的な各動物の腫瘍増殖の測定値(mm3)を示す。
L1 mAb2形式の抗マウスCD137 Fcab FS22m-063)で処置されたBal
b/cマウスの皮下に成長したCT26同系腫瘍モデルの各群の生存日数中央値の概要及び対統計分析(対数順位)を示す。FS22m-063-AA/S70は、IgG対照で処置されたマウスと比較して有意な生存率の増加をもたらした。FS22m-063-AA/S70は、G1/S70+G1-AA/Lob12.3の組み合わせに対して有意な延命効果を示さなかった。
皮下に成長したCT26同系腫瘍モデルの各群の生存日数中央値の概要及び対統計分析(対数順位)を示す。FS22m-063-AA/S70は、IgG対照で処置したマウス及びCD137陽性対照で処置したマウスと比較して、CT26同系腫瘍モデルで有意な生存を誘導した。
用量応答抗腫瘍活性
抗マウスCD137/PD-L1 mAb2 FS22m-063-AA/S70は、2日ごとに3回投
与されたマウスあたり20μg(約1mg//kg)の用量で、CT26同系腫瘍モデルにおいて抗腫瘍活性を示した(q2dx3)。インビボでのFS22m-063-AA/S70 mAb2の最
適用量を調べるために、一連の用量(2、6、20、及び200μg/マウス、約0.1、0.3、1、及び10mg/kgに相当)が腫瘍細胞接種の7日後に開始する上記のq2dx3投与スケジュールでCT26モデルにおいて試験された。陰性対照抗体G1-AA/4420は、同じスケジュールで、マウス1匹あたり200μg(約10mg/kg)の用量で含まれていた。陽性対照抗体G1/Lob12.3は、同じスケジュールで、マウス1匹あたり20μg(約1mg/kg)の最適以下の用量で含まれていた。
させた。全ての動物は、マイクロチップ化され、固有の識別子が与えられた。各コホートには12匹のマウスがいた。CT26結腸癌細胞株(ATCC CRL-2638)を最初に拡大培養し、保存し、その後IMPACT Iプロトコルを用いて病原体に対するIDEXX Bioresearchにより予備スクリーニングし、病原体フリーであることを示した。各動
物は、左脇腹に100μlのDMEM中の0.1×105細胞の皮下注射を受けた。腫瘍細胞接種後の7日目に、この時点で腫瘍を有しないマウスは試験から除外された。
に腹腔内注射した。対照抗体(G1/Lob12.3(CD137陽性対照抗体)、G1-AA/4420(アイソタイプ対照))を、DPBS+1mMアルギニン+0.05 Tween 80中、マウスあたり20μg(約1mg/kg)及びマウスあたり200μg(約10mg/kg)の最終濃度で、マウスに腹腔内注射した。各マウスは、腫瘍接種後7日目、9日目及び11日目に200μlの腹腔内(IP)注射により、mAb2分子又は対照抗体を投与された(q2dx3)。腫瘍の正確な測定が行われ、問題の日に予定されている薬物投与が行われ、残りの研究の間、マウスは綿密な観察下に置かれた。実施例14.1で説明されるように、腫瘍の最長軸及び最短軸を決定するために、カリパスを使用して腫瘍体積の測定を行った。
g/kgで投与した場合、アイソタイプ対照(G1-AA/4420)で処置したマウスと比較して、有意な腫瘍増殖阻害を示した。統計的有意性は、全ての群を比較した混合モデル分析を使用して示された。生存分析(図13B及び表27)は、FS22m-63-AA/S70 mAb2が、0.3mg/kgを超えるレベルで投与された場合、CT26同種モデルのアイソタイプ対照と比較して統計的に有意な延命効果を誘導したことを示す。対数順位(Mantel Cox)検定を使用して統計的有意性が行われた。*P≦0.05;**P≦0.01;***P≦0.001;****P≦0.0001。明白な毒性の兆候を示したマウスはなく、全ての処置は十分に許容された。
抗マウスCD137/PD-L1 mAb2の作用機序は、実施例14.2に記載されているものと同じCT26担癌マウスモデルで評価された。FS22m-063-AA/S70を4つの異なる用量(2、6、20、及び200μg/マウス、およそ0.1、0.3、1、10mg/kgに相当)で処置したCT26担癌の血液、脾臓、及び腫瘍組織、並びに陰性対照抗体G1-AA/4420は、CD137アゴニスト作用の下流効果であることが知られているT細胞活性化及び増殖マーカーについて試験した(Fisher et al., 2012)。
Excel及びGraphPadPrismを使用してデータを分析した。プロットされたデータは、CD4+及びCD8+T細胞亜集団について経時的に観察されたT細胞の存在量及び増殖を表す。データは、Y軸に記載の集団に従う親集団のパーセンテージとして表示される。
同系マウスモデルは、治療標的を阻害する抗腫瘍効果を試験するための適切なマウス系として受け入れられており、ヒト治療薬の開発を検証するために広く使用されてきた。MC38腫瘍は、免疫原性が高く、抗CD137抗体単剤療法に応答し(Kocak et al, 200
6)、PD-L1を発現する(Juneja et al, 2017)ことが知られているため、この実験
ではMC38同系腫瘍モデルを使用した。
LX(S2)/2
(ここで、L=最長軸、S=最短軸)
比較して、有意な腫瘍増殖阻害を示した。統計的有意性は、全ての群を比較した混合モデル分析を使用した研究の全時間にわたる増殖速度につき対で示された。表29に示すように、予想外にも、抗PD-L1抗体と抗CD137抗体(G1-AA/S70 + G1-AA/Lob12.3)
の組み合わせ、又はPD-L1若しくはCD137抗体単独で処置された12匹のマウスのうち4匹のみと比較して、FS22m-063-AA/S70 mAb2で処置された全てのマウスは、研究
の終了時に腫瘍がなかった。図21のグラフは、経時的な各動物の腫瘍増殖の測定値(mm3)を示す。
ラスG1-AA/Lob12.3の組み合わせ、及びFS22m-063-AA/S70(モデルPD-L1 mAb2
形式の抗マウスCD137 Fcab FS22m-063)で処置された各処置群の生存日数中
央値の概要を示す。表30はまた、対統計分析(対数順位)を示す。FS22m-063-AA/S70は、IgG対照で処置したマウスと比較して、MC38同系腫瘍モデルで完全な生存を誘導し、研究の終了時に動物の100%生存率を有する(「未決定」と表示)。
B16.F10同系マウス腫瘍モデルを、抗マウスCD137/PD-L1 mAb2(FS22m-063-AA/S70)の抗腫瘍活性をインビボで試験するために使用した。このモデルは、治療用抗体で処置するのがより難しいと考えられている(Baird, J. R., et al, 2013
)。この試験では、抗体G1-AA/4420をアイソタイプ対照として使用した。B16.F10同系腫瘍モデルは、CD137アゴニスト抗体に感受性があることはこれまで示されていない。しかし、B16.F10腫瘍から単離された腫瘍浸潤リンパ球(TIL)は、CD137を発現する(Curran.M., et al, 2013)。
、試験開始前の1週間順応させた。全ての動物は、マイクロチップ化され、固有の識別子
が与えられた。各コホートは10匹のマウスがいた。B16.F10黒色腫細胞株(ATCC、カタログ番号CRL-6475)を最初に拡大培養し、保存し、その後IMPACT Iプロトコルを用いて病原体に対するIDEXXX Bioresearchにより予備スクリーニングし、病原体フリーであることを示した。B16.F10細胞を-150℃の保存から解凍し、T175組織培養フラスコ内の10%FCS(Gibco,10270-106)を含む20ml
DMEM(Gibco, 61965-026)に添加した。各動物は、左脇腹に皮下注射された1×106細胞を受けた。
。増殖速度の統計分析は、混合モデル分析を使用して、研究の全時間にわたって対で実行された。
示す。FS22m-063-AA/S70は、IgG対照で処置したマウスと比較して、B16.F10同系腫瘍モデルで生存率の増加を誘導した。
てのCD137アゴニスト作用が、おそらく腫瘍内のCD8+T細胞の細胞傷害活性の増加を通じて腫瘍増殖の低下をもたらすことを示した。
臨床試験中のウレルマブを伴う固形腫瘍患者の抗CD137 mAb処置は、投与されたウレルマブの用量に関連することが示されている重度の処置関連免疫事象をもたらした。これらの免疫事象の影響は、重度の肝毒性として肝臓に現れた(Segal, N. H., et al,
2017)。
明白な兆候を示さなかった。これらの動物において、約1mg/kgのFS22m-063-AA/S70
mAb2(抗腫瘍免疫活性と相関)による処置の結果として観察された免疫活性化が肝毒性
と相関するかどうかを決定するために、肝臓サンプルが剖検時に組織学的評価のために採取された。FS22m-063-AA/S70 mAb2及び対照マウスを最後の投与から4、7及び14日後
に剖検し(各時点で群あたり3匹のマウス)、肝臓サンプルをホルマリン固定し、パラフィン包埋した。次に、肝臓の切片を切り取り、ヘマトキシリン及びエオシン染色による組織病理学的評価、及び認定された病理医による肝臓の炎症及び損傷のパラメーターのスコアリングに供した。組織調製並びにヘマトキシリン及びエオシンによる組織病理学的染色の方法は、高度に標準化されており、当技術分野で周知である。
:
・ 柔組織における混合リンパ球浸潤を有する最小からわずかな肝細胞壊死
・ 門脈周囲管における最小からわずかな混合炎症細胞
・ 最小の変性肝細胞
・ 最小から著しい有糸分裂の増加
架橋を介してCD137をアゴナイズするmAb2が、治療的用量で処置されたヒト患者に肝毒性を誘発するリスクが低いことを示す。
実施例14.3において、抗マウスCD137-PD-L1 mAb2 FS22m-063-AA/S70は、複数回投
与後に腫瘍内のCD8+T細胞を増加させる能力を示した。T細胞への標的結合、PD-L1遮断、及びFS22m-063-AA/S70がT細胞増殖に及ぼす影響の程度を調べるために、実
施例14.1に記載されるものと同じCT26同系腫瘍モデルで単回投与の薬力学的研究を実施した。
させた。全ての動物は、マイクロチップ化され、固有の識別子が与えられた。本研究は、8時点(2時間、6時間、24時間、48時間、72時間、96時間、120時間、192時間)にわたる2つの用量のうち1つで、対照抗体又はmAb2のいずれかを投与される3つの投与群を含んでいた。各投与コホートには64匹のマウスがいた(時点ごとに8匹のマウス)。CT26結腸癌細胞株(S.Rosenberg, NIH)を最初に拡大培養し、保存し、その後IMPACT Iプロトコルを用いて病原体に対するIDEXX Bioresearchにより
予備スクリーニングし、病原体フリーであることを示した。各動物は、左脇腹に100μlのDMEM中の1×105細胞の皮下注射を受けた。腫瘍細胞接種後の7日目に、この時点で腫瘍を有しないマウスは試験から除外された。
20μg又は200μg(それぞれ約1mg/kg及び約10mg/kgの最終濃度)のいずれかでマウスに静脈内注射し、対照抗体G1-AA/4420(アイソタイプ対照)を投与される群では、DPBS+1mMアルギニン+0.05 Tween 80中、マウスあたり200μg(最終濃度約10mg/kg)でマウスに静脈内注射した。
)で2回溶解した。
cブロック(eBioscience カタログ番号14-0161-86、1:50)の存在下で、抗体染色パネル(Ki67及びFoxP3抗体を除く全て)(以下の表33)を使用して、4℃で30分間、フローサイトメトリー用に細胞表面マーカーで細胞を染色した。次に、製造元の指示に従って、細胞を固定し、eBioscience Foxp3染色キット(eBioscienceカタログ番号00-5523-00)で透過処理した。次に、細胞を、Fcブロックの存在下で、Ki67及びFoxp3抗体を有する100μlの透過処理緩衝液に再懸濁し、室温の暗所で30分間インキュベートした。次に、細胞を透過処理緩衝液で1回洗浄し、200μlのPBS+0.5%BSAに再懸濁した。次に、細胞をBD Fortessaフローサイトメーターで分析した
。FlowJoX、Excel及びGraphPadPrismを使用してデータを分析した。
は、PD-L1受容体の係合は、血液及び腫瘍に存在するT細胞でおよそ72時間後に減少し、血液に存在するT細胞におけるPD-L1受容体の係合は、腫瘍に存在するT細胞よりもはるかに速く減少した。このデータは、PD-1/PD-L1軸を阻害し、血液におけるよりも長く、腫瘍における抗mCD137/PD-L1 mAb2を保持する利点の両方を有するPD-L1の腫瘍特異的遮断を示し、これは、薬剤の完全な効果が腫瘍内で持続することを可能にすると同時に、末梢での標的効果を制限することが期待される。
マウスにおける抗CD137/PD-L1 mAb2の薬物動態を決定するために、M
C38腫瘍を含まないC57BL/6雌マウス(実施例14.4を参照)、すなわち腫瘍のないマウスに、100μlの抗CD137/PD-L1 mAb2を4用量(25mg/kg、10mg/kg、3mg/kg、1mg/kg)で投与し、384時間にわたって監視した。
、Gyrolab Bioaffy 1000 CD(製品番号P0004253)を使用してサンドイッチアッセイを実
施した。8000~0.07ng/mlの範囲で作成された標準曲線を使用してサンプル濃度を決定し、必要に応じてサンプルをRexxip ANバッファーで希釈した(Gyros 製品番
号P0004994)。製造元の推奨に従い、他のバッファーを使用した。時点ごとの個々のマウス(時点ごとに3匹のマウス)からの平均サンプル濃度をプロットした(図27)。
カニクイザルにおける抗ヒトCD137/PD-L2 mAb2に対する薬物動態/薬力学的(PK/PD)応答及びその忍容性を評価するために、予備的な用量範囲発見研究が実施された。簡単に説明すると、FS22-172-003-AA/E12v2 mAb2は、単回投与又は反復投与として静脈内(IV)注入を介してカニクイザルに投与した。体重、食餌量、臨床所見、血液学及び血液化学などの標準的な毒物学パラメーターについて、試験期間中の忍容性評価を評価した。
E12v2 mAbのCDRアミノ酸配列(Kabat)
VH CDR1-SYGIS(配列番号1)
VH CDR2-WISAYSGGTNYAQKLQG(配列番号2)
VH CDR3-DLFPTIFGVSYYYY(配列番号3)
VL CDR1-RASQSIGNRLA(配列番号4)
VL CDR2-EASTSET(配列番号5)
VL CDR3-QQSYSTPYT(配列番号6)
VH CDR1-GYPFTSYG(配列番号7)
VH CDR2-ISAYSGGT(配列番号8)
VH CDR3-ARDLFPTIFGVSYYYY(配列番号9)
VL CDR1-QSIGNR(配列番号10)
VL CDR2-EAS(配列番号11)
VL CDR3-QQSYSTPYT(配列番号6)
IMGT CDR(太字斜体);Kabat CDR(斜体及び下線)。
E12v2 mAbのVHドメイン核酸配列(配列番号13)
E12v2 mAbのVLドメインアミノ酸配列(配列番号14)
IMGT CDR(太字斜体);Kabat CDR(斜体及び下線)。
E12v2 mAbのVLドメイン核酸配列(配列番号15)
G1-AA/E12v2 mAbの重鎖アミノ酸配列(LALAあり)(配列番号16)
VHドメイン(斜体);IMGT CDR(太字及び斜体);Kabat CDR(斜体及び
下線);LALA変異(太字及び下線)
G1-AA/E12v2 mAbの軽鎖アミノ酸配列(配列番号17)
VHドメイン(斜体);IMGT CDR(太字及び斜体);Kabat CDR(斜体及び
下線)
VH CDR1-SYGIS(配列番号1)
VH CDR2-WISAYSGGTNYAQKLQG(配列番号2)
VH CDR3-DLFPTIFGVSYYYY(配列番号3)
VL CDR1-RASQSISGRLA(配列番号18)
VL CDR2-EASNLES(配列番号19)
VL CDR3-QQSYSTPRVT(配列番号20)
VH CDR1-GYTFTSYG(配列番号21)
VH CDR2-ISAYSGGT(配列番号8)
VH CDR3-ARDLFPTIFGVSYYYY(配列番号9)
VL CDR1-QSISGR(配列番号22)
VL CDR2-EAS(配列番号11)
VL CDR3-QQSYSTPRVT(配列番号20)
IMGT CDR(太字及び斜体);Kabat CDR(斜体及び下線)
E05v2 mAbのVHドメイン核酸配列(配列番号24)
E05v2 mAbのVLドメインアミノ酸配列(配列番号25)
IMGT CDR(太字及び斜体);Kabat CDR(斜体及び下線)
E05v2 mAbのVLドメイン核酸配列(配列番号26)
G1-AA/E05v2 mAbの重鎖アミノ酸配列(LALAあり)(配列番号27)
VHドメイン(斜体);IMGT CDR(太字及び斜体);Kabat CDR(斜体及び
下線);LALA変異(太字及び下線)
G1-AA/E05v2 mAb並びにFS22-172-003-AA/E05v2及びFS22-053-008-AA/E05v2 mAb2の軽鎖アミノ酸配列(配列番号28)
VHドメイン(斜体);IMGT CDR(太字及び斜体);Kabat CDR(斜体及び
下線)
VH CDR1-SYGIS(配列番号1)
VH CDR2-WISAYSGGTNYAQKLQG(配列番号2)
VH CDR3-DLFPTIFGVSYYYY(配列番号3)
VL CDR1-RASQSISGRLA(配列番号18)
VL CDR2-EASNLES(配列番号19)
VL CDR3-QQSYSWPRT(配列番号29)
VH CDR1-GYTFTSYG(配列番号21)
VH CDR2-ISAYSGGT(配列番号8)
VH CDR3-ARDLFPTIFGVSYYYY(配列番号9)
VL CDR1-QSISGR(配列番号22)
VL CDR2-EAS(配列番号11)
VL CDR3-QQSYSWPRT(配列番号29)
IMGT CDR(太字及び斜体);Kabat CDR(斜体及び下線)
G12v2 mAbのVHドメイン核酸配列(配列番号24)
G12v2 mAbのVLドメインアミノ酸配列(配列番号30)
IMGT CDR(太字及び斜体);Kabat CDR(斜体及び下線)
G12v2 mAbのVLドメイン核酸配列(配列番号31)
G1-AA/G12v2 mAbの重鎖アミノ酸配列(LALAあり)(配列番号27)
VHドメイン(斜体);IMGT CDR(太字及び斜体);Kabat CDR(斜体及び
下線);LALA変異(太字及び下線)
G1-AA/G12v2 mAb並びにFS22-172-003-AA/G12v2及びFS22-053-008-AA/G12v2 mAb2の軽鎖アミノ酸配列(配列番号33)
VHドメイン(斜体);IMGT CDR(太字及び斜体);Kabat CDR(斜体及び
下線)
VH CDR1-SYGIS(配列番号1)
VH CDR2-WISAYSGGTNYAQKLQG(配列番号2)
VH CDR3-DLFPTIFGVSYYYY(配列番号3)
VL CDR1-TGTSSDVGGYNYVS(配列番号34)
VL CDR2-EVTNRPS(配列番号35)
VL CDR3-SSFKRGSTLVV(配列番号36)
VH CDR1-GYTFTSYG(配列番号21)
VH CDR2-ISAYSGGT(配列番号8)
VH CDR3-ARDLFPTIFGVSYYYY(配列番号9)
VL CDR1-SSDVGGYNY(配列番号37)
VL CDR2-EVT(配列番号38)
VL CDR3-SSFKRGSTLVV(配列番号36)
IMGT CDR(太字及び斜体);Kabat CDR(斜体及び下線)
lambdav3/lam-G02v3 mAbのVHドメイン核酸配列(配列番号24)
lambdav3/lam-G02v3 mAbのVLドメインアミノ酸配列(配列番号41)
IMGT CDR(太字及び斜体);Kabat CDR(斜体及び下線)
lambdav3/lam-G02v3 mAbのVLドメイン核酸配列(配列番号42)
G1-AA/lambdav3/lam-G02v3 mAbの重鎖アミノ酸配列(LALAあり)(配列番号27)
VHドメイン(斜体);IMGT CDR(太字及び斜体);Kabat CDR(斜体及び
下線);LALA変異(太字及び下線)
G1-AA/lambdav3/lam-G02v3 mAbの軽鎖アミノ酸配列(LALAあり)(配列番号44)
VLドメイン(斜体);IMGT CDR(太字及び斜体);Kabat CDR(斜体及び
下線)
GYX1FTSYG
ここで、X1は、P又はTである
RASQSIX2X3RLA
ここで、X2は、S又はGであり、X3は、N又はGである
EASX4X5EX6
ここで、X4は、T又はNであり;X5は、S又はLであり;X6は、T又はSである
QQSYSX7PX8X9T
ここで、X7は、T又はWであり;X8は、不在又はRであり;X9は、Y、R又はVである
QSIX10X11R
式中、X10は、G又はSであり;X11は、N又はGである
QQSYSX12X13X14X15T
式中、X12は、不在又はTであり;X13は、T、W又はPであり;X14は、P又はRであり;X15は、Y又はRである
HFW1-EVQLVQSGAEVKRPGASVKVSCKASGYX16FT(配列番号51)
ここで、X16は、P又はTである
HFW2-WVRQAPGQGLEWMG(配列番号52)
HFW3-RVTMTTDTSTSTAYMELRSLRSDDTAVYYCAR(配列番号53)
HFW4-WGQGTLVTVSS(配列番号54)
HFW1-EVQLVQSGAEVKRPGASVKVSCKAS(配列番号55)
HFW2-ISWVRQAPGQGLEWMGW(配列番号56)
HFW3-NYAQKLQGRVTMTTDTSTSTAYMELRSLRSDDTAVYYC(配列番号57)
HFW4-WGQGTLVTVSS(配列番号54)
LFW1-DIQMTQSPSTLSASVRDRVIITC(配列番号58)
LFW2-WYQHKPGKAPKLLIY(配列番号59)
LFW3-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC(配列番号60)
LFW4-FGQGTKLEIK(配列番号61)
LFW1-DIQMTQSPSTLSASVRDRVIITCRAS(配列番号62)
LFW2-LAWYQHKPGKAPKLLIY(配列番号63)
LFW3-TSETGVPSRFSGSGSGTDFTLTISSLQPEDFATYY
C(配列番号64)
LFW4-FGQGTKLEIK(配列番号61)
LFW1-QSALTQPASVSGSPGQSITISC(配列番号65)
LFW2-WYQQFPGKAPKLMIF(配列番号66)
LFW3-GVSDRFSGSKSDNTASLTISGLQAEDEAEYYC(配列番号67)
LFW4-FGGGTKLTVL(配列番号68)
LFW1-QSALTQPASVSGSPGQSITISCTGT(配列番号69)
LFW2-VSWYQQFPGKAPKLMIF(配列番号70)
LFW3-NRPSGVSDRFSGSKSDNTASLTISGLQAEDEAEYYC(配列番号71)
LFW4-FGGGTKLTVL(配列番号68)
WT ABループ-RDELTKNQ(配列番号72)
WT CDループ-SNGQPENNY(配列番号73)
WT EFループ-DKSRWQQGNV(配列番号74)
AB、CD、EFループは下線が付されている
CH2ドメインのアミノ酸配列(配列番号76)
LALA変異を有するCH2ドメインのアミノ酸配列(配列番号77)
LALA変異は下線が付されている
LALA変異及びP114A変異を有するCH2ドメインのアミノ酸配列(配列番号176)
LALA変異は下線が付され、P114A変異は太字で下線が付されている
PPY
FS22-053-008 第1の配列-NPPYLFS(配列番号79)
FS22-053-008 第2の配列-DYWRWLE(配列番号80)
FS22-053-009 第1の配列-NPPYLFS(配列番号79)
FS22-053-009 第2の配列-EHTRWLD(配列番号83)
FS22-053-011 第1の配列-NPPYLFS(配列番号79)
FS22-053-011 第2の配列-DYWRWTD(配列番号86)
第1及び第2の配列に下線が付されている。
Fcab FS22-053-011 CH3ドメインの核酸配列(配列番号88)
FS22-053-017 第1の配列-NPPYLFS(配列番号79)
FS22-053-017 第2の配列-YHWRWLE(配列番号89)
第1及び第2の配列に下線が付されている。
Fcab FS22-053-017 CH3ドメインの核酸配列(配列番号91)
FS22-053-014 第1の配列-NPPYLFS(配列番号79)
FS22-053-014 第2の配列-YHWRWLD(配列番号92)
第1及び第2の配列に下線が付されている。
Fcab FS22-053-014 CH3ドメインの核酸配列(配列番号94)
FS22-053-010 第1の配列-NPPYLFS(配列番号79)
FS22-053-010 第2の配列-DYMRWLD(配列番号95)
第1及び第2の配列に下線が付されている。
Fcab FS22-053-010 CH3ドメインの核酸配列(配列番号97)
FS22-053-012 第1の配列-NPPYLFS(配列番号79)
FS22-053-012 第2の配列-DHMRWLE(配列番号98)
第1及び第2の配列に下線が付されている。
Fcab FS22-053-012 CH3ドメインの核酸配列(配列番号100)
FS22-053-013 第1の配列-NPPYLFS(配列番号79)
FS22-053-013 第2の配列-GYERWLE(配列番号101)
第1及び第2の配列に下線が付されている。
Fcab FS22-053-013 CH3ドメインの核酸配列(配列番号103)
FS22-053-015 第1の配列-NPPYLFS(配列番号79)
FS22-053-015 第2の配列-DHWRWLQ(配列番号104)
第1及び第2の配列に下線が付されている。
Fcab FS22-053-015 CH3ドメインの核酸配列(配列番号106)
FS22-053-016 第1の配列-NPPYLFS(配列番号79)
FS22-053-016 第2の配列-DYIRWLN(配列番号107)
第1及び第2の配列に下線が付されている。
Fcab FS22-053-016 CH3ドメインの核酸配列(配列番号109)
FS22-053-008 第1の配列-NPPYLFS(配列番号79)
FS22-053-008 第2の配列-YYNRWQD(配列番号110)
FS22-172-003 第1の配列-PYIIPPY(配列番号113)
FS22-172-003 第2の配列-GADRWLE(配列番号114)
第1及び第2の配列に下線が付されている。
Fcab FS22-172-003 CH3ドメインの核酸配列(配列番号116)
FS22-172-002 第1の配列-PFQMPPY(配列番号117)
FS22-172-002 第2の配列-GADRWLE(配列番号114)
第1及び第2の配列に下線が付されている。
Fcab FS22-172-002 CH3ドメインの核酸配列(配列番号119)
FS22-172-004 第1の配列-NYIYPPY(配列番号120)
FS22-172-004 第2の配列-GADRWLE(配列番号114)
第1及び第2の配列に下線が付されている。
Fcab FS22-172-004 CH3ドメインの核酸配列(配列番号122)
FS22-172-001 第1の配列-PFVMPPY(配列番号123)
FS22-172-001 第2の配列-GADRWLE(配列番号114)
第1及び第2の配列に下線が付されている。
Fcab FS22-172-001 CH3ドメインの核酸配列(配列番号125)
FS22-172-005 第1の配列-QQVYPPY(配列番号126)
FS22-172-005 第2の配列-GADRWLE(配列番号114)
第1及び第2の配列に下線が付されている。
Fcab FS22-172-005 CH3ドメインの核酸配列(配列番号128)
FS22-172-006 第1の配列-RKYYPPY(配列番号129)
FS22-172-006 第2の配列-GADRWLE(配列番号114)
第1及び第2の配列に下線が付されている。
Fcab FS22-172-006 CH3ドメインの核酸配列(配列番号131)
FS22-172 第1の配列-RKYYPPY(配列番号129)
FS22-172 第2の配列-GADRWLE(配列番号114)
第1及び第2の配列に下線が付されている。
Fcab FS22-172 CH3ドメインの核酸配列(配列番号133)
LALA変異を有するFS22-172-003-AA/E12v2 mAb2の重鎖のアミノ酸配列(配列番号134)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-172-003-AA/E12v2 mAb2の重鎖の核酸配列(配列番号135)
FS22-172-003-AA/E12v2及びFS22-053-008-AA/E12v2 mAb2の軽鎖のアミノ酸配列(配列番
号17)
FS22-172-003-AA/E12v2 mAb2の軽鎖の核酸配列(配列番号136)
LALA変異を有するFS22-172-003-AA/E05v2 mAb2の重鎖のアミノ酸配列(配列番号137)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-172-003-AA/E05v2 mAb2の重鎖の核酸配列(配列番号138)
FS22-172-003-AA/E05v2 mAb2の軽鎖の核酸配列(配列番号139)
LALA変異を有するFS22-172-003-AA/G12v2 mAb2の重鎖のアミノ酸(AA)配列(配列番号140)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-172-003-AA/G12v2 mAb2の重鎖の核酸配列(配列番号141)
FS22-172-003-AA/G12v2 mAb2の軽鎖の核酸配列(配列番号142)
LALA変異を有するFS22-053-008-AA/E12v2 mAb2の重鎖のAA配列(配列番号143)VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-053-008-AA/E12v2 mAb2の重鎖の核酸配列(配列番号144)
FS22-053-008-AA/E12v2 mAb2の軽鎖の核酸配列(配列番号145)
LALA変異を有するFS22-053-008-AA/E05v2の重鎖のAA配列(配列番号146)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-053-008-AA/E05v2 mAb2の重鎖の核酸配列(配列番号147)
FS22-053-008-AA/E05v2 mAb2の軽鎖の核酸配列(配列番号148)
LALA変異を有するFS22-053-008-AA/G12v2の重鎖のAA配列(配列番号149)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-053-008-AA/G12v2 mAb2の重鎖の核酸配列(配列番号150)
FS22-053-008-AA/G12v2 mAb2の軽鎖の核酸配列(配列番号151)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-053-017AA/E05v2の重鎖のAA配列(配列番号153)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-053-017AA/G12v2の重鎖のAA配列(配列番号154)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-172-003AA/lam-G02v3の重鎖のAA配列(配列番号155)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22-172-003AA/S70の重鎖のAA配列(配列番号156)
VHドメイン(斜体);LALA変異(太字下線)
S70の軽鎖のAA配列(配列番号157)
VLドメイン(斜体);
LALA変異を有するFS22-172-003AA/HelD1.3の重鎖のAA配列(配列番号158)
VHドメイン(斜体);LALA変異(太字下線)
HelD1.3の軽鎖のAA配列(配列番号159)
VLドメイン(斜体)
LALA変異を有するFS22m-063AA/S70の重鎖のAA配列(配列番号160)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するFS22m-063AA/HelD1.3の重鎖のAA配列(配列番号161)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するG1-AA/E12v2の重鎖のAA配列(配列番号162)
VHドメイン(斜体);LALA変異(太字下線)
G1/S70の重鎖のAA配列(配列番号163)
VHドメイン(斜体)
LALA変異を有するG1-AA/S70の重鎖のAA配列(配列番号164)
VHドメイン(斜体);LALA変異(太字下線)
G1/4420の重鎖のAA配列(配列番号165)
VHドメイン(斜体)
4420の軽鎖のAA配列(配列番号166)
VLドメイン(斜体)
LALA変異を有するG1-AA/4420の重鎖のAA配列(配列番号167)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するG1-AA/HelD1.3の重鎖のAA配列(配列番号168)
VHドメイン(斜体);LALA変異(太字下線)
LALA変異を有するG1-AA/MLS109の重鎖のAA配列(配列番号169)
VHドメイン(斜体);LALA変異(太字下線)
MLS109の軽鎖のアミノ酸配列(配列番号170)
VLドメイン(斜体)
FS22-172-003 CH3ドメインAB及びEFループのアミノ酸配列
ABループ-RDELPYIIPPYNQ(配列番号171)
EFループ-GADRWLEGNV(配列番号172)
ABループ-RDELNPPYLFSNQ(配列番号173)
EFループ-DYWRWLEGNV(配列番号174)
ABループ-RDELNPPYLFSNQ(配列番号173)
EFループ-YHWRWLEGNV(配列番号175)
VHドメイン(斜体)
G1/280_02_G02の軽鎖のアミノ酸配列(配列番号178)
VLドメイン(斜体)
ヒトPD-L1のアミノ酸配列(配列番号179)
細胞外ドメイン(斜体);膜貫通及び細胞内ドメイン(太字)
ヒトPD-L1細胞外ドメインのアミノ酸配列(配列番号180)
マウスPD-L1のアミノ酸配列(配列番号181)
細胞外ドメイン(斜体);膜貫通及び細胞内ドメイン(太字)
マウスPD-L1細胞外ドメインのアミノ酸配列(配列番号182)
カニクイザルPD-L1のアミノ酸配列(配列番号183)
細胞外ドメイン(斜体);膜貫通及び細胞内ドメイン(太字)
カニクイザルPD-L1細胞外ドメインのアミノ酸配列(配列番号184)
細胞外ドメイン(斜体);膜貫通及び細胞内ドメイン(太字)
ヒトCD137細胞外ドメインのアミノ酸配列(配列番号186)
マウスCD137のアミノ酸配列(配列番号187)
細胞外ドメイン(斜体);膜貫通及び細胞内ドメイン(太字)
マウスCD137細胞外ドメインのアミノ酸配列(配列番号188)
カニクイザルCD137のアミノ酸配列(配列番号189)
細胞外ドメイン(斜体);膜貫通及び細胞内ドメイン(太字)
カニクイザルCD137細胞外ドメインのアミノ酸配列(配列番号190)
G1/HelD1.3の重鎖のアミノ酸配列(配列番号191)
VHドメイン(斜体)
OVAペプチド(配列番号192)
ISQAVHAAHAEINEAGR
ヒトB7-H3細胞外ドメインのアミノ酸配列(配列番号193)
SIINFEKLペプチド(配列番号194)
SIINFEKL
ヒトPD-L1-rCD4-Hisのアミノ酸配列(配列番号195)
シグナルペプチド(下線);PD-L1の細胞外ドメイン(通常フォント);C末端ラットCD4+(ドメイン3及び4)(斜体);NotI制限部位をコードする、抗原とC末端融合の間の接合部(太字及び下線);C末端ヘキサヒスチジンタグ(太字)
ヒトPD-L1-Fc-Hisのアミノ酸配列(配列番号196)
シグナルペプチド(下線) PD-L1の細胞外ドメイン(通常フォント) ヒトIgG1 Fc(斜体) NotI制限部位をコードする、抗原とC末端融合の間の接合部(太字及び下線) C末端ヘキサヒスチジンタグ(太字)
シグナルペプチド(下線);PD-L1の細胞外ドメイン(通常フォント);C末端ラットCD4+(ドメイン3及び4)(斜体);NotI制限部位をコードする、抗原とC末端融合の間の接合部(太字及び下線);C末端ヘキサヒスチジンタグ(太字)
マウスPD-L1-Fc-Hisのアミノ酸配列(配列番号198)
シグナルペプチド(下線) PD-L1の細胞外ドメイン(通常フォント) ヒトIgG1 Fc(斜体) NotI制限部位をコードする、抗原とC末端融合の間の接合部(太字及び下線) C末端ヘキサヒスチジンタグ(太字)
ヒトPD-L1-His-Aviのアミノ酸配列(配列番号199)
PD-L1の細胞外ドメイン(通常フォント) C末端ヘキサヒスチジンタグ(斜体) Aviタグ(太字)
FS22-172-003-AA/E12v2重鎖をコードするコドン最適化核酸配列(配列番号32)
FS22-172-003-AA/E12v2軽鎖をコードするコドン最適化核酸配列(配列番号39)
本明細書で言及されている全ての文書は、参照によりその全体が本明細書に組み込まれる。
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ. Basic local alignment search
tool. J. Mol. Biol. 215(3), 403-10 (1990).
Altschul SF, Madden TL, Schaeffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Res. 25(17), 3389-402 (1997).
Bagshawe KD, Sharma SK, Springer CJ, Antoniw P, Rogers GT, Burke PJ, Melton R. Antibody-enzyme conjugates can generate cytotoxic drugs from inactive precursors at tumor sites. Antibody, Immunoconjugates and Radiopharmaceuticals 4, 915-922 (
1991).
Baird JR et al. Immune-mediated regression of established B16F10 melanoma by intratumoral injection of attenuated Toxoplasma gondii protects against rechallenge. J Immunol. 190(1): 469-478 (2013).
Bartkowiak T, Curran MA. 4-1BB Agonists: Multi-Potent Potentiators of Tumor Immunity. Front Oncol. Jun 8;5, 117 (2015).
Bartkowiak T et al. Activation of 4-1BB on Liver Myeloid Cells Triggers Hepatitis via an Interleukin-27-Dependent Pathway. Clin Cancer Res. 24(5), 1138-51 (2018).
Bergman I, Burckart GJ, Pohl CR, Venkataramanan R, Barmada MA, Griffin JA And Cheung NV. Pharmacokinetics of IgG and IgM Anti-Ganglioside Antibodies in Rats and
Monkeys After Intrathecal Administration. The Journal of Pharmacology and Experimental Therapeutics 284(1), 111-115 (1998)
Bitra A, Doukov T, Wang J, Picarda G, Benedict CA, Croft M, Zajonc DM. Crystal structure of murine 4-1BB and its interaction with 4-1BBL support a role for galectin-9 in 4-1BB signaling. J Biol Chem. 293(4):1317-1329 (2017).
Brown MH, Barclay AN. Expression of immunoglobulin and scavenger receptor superfamily domains as chimeric proteins with domains 3 and 4 of CD4+ for ligand analysis. Protein Eng. 7(4), 515-21 (1994).
Bruhns P, Iannascoli B, England P, Mancardi DA, Fernandez N, Jorieux S, Daeron M. Specificity and affinity of human Fcgamma receptors and their polymorphic variants for human IgG subclasses. Blood. 113(16):3716-25 (2009).
Chacon JA1, Wu RC, Sukhumalchandra P, Molldrem JJ, Sarnaik A, Pilon-Thomas S, Weber J, Hwu P, Radvanyi L. Co-stimulation through 4-1BB/CD137 improves the expansion and function of CD8(+) melanoma tumor-infiltrating lymphocytes for adoptive T-cell therapy. PLoS One. 8(4):e60031 (2013).
Chapple SD, Crofts AM, Shadbolt SP, McCafferty J, Dyson MR. Multiplexed expression and screening for recombinant protein production in mammalian cells. BMC Biotechnol. 6:49 (2006).
Chester C, Ambulkar S, Kohrt HE. 4-1BB agonism: adding the accelerator to cancer
immunotherapy. Cancer Immunol Immunother. 65(10):1243-8 (2016).
Chester C, Sanmamed MF, Wang J, Melero I. Immunotherapy targeting 4-1BB: mechanistic rationale, clinical results, and future strategies. Blood. 131(1):49-57 (2018).
Claus C et al. A novel tumor-targeted 4-1BB agonist and its combination with T-cell bispecific antibodies: an off-the-shelf cancer immunotherapy alternative to CAR T-cells [abstract]. In: Proceedings of the American Association for Cancer Research Annual Meeting 2017. Cancer Res. 77 (2017).
Croft M. Co-stimulatory members of the TNFR family: keys to effective T-cell immunity? Nat Rev Immunol. 3(8):609-20 (2003).
Curran MA, Geiger TL, Montalvo W, Kim M, Reiner SL, Al-Shamkhani A, Sun JC, Allison J. P. Systemic 4-1BB activation induces a novel T cell phenotype driven by high expression of Eomesodermin. J. Exp.Med. 210(4): 743-755 (2013).
Dubrot J et al. Treatment with anti-CD137 mAbs causes intense accumulations of liver T cells without selective antitumor immunotherapeutic effects in this organ. Cancer Immunol Immunother. 59(8):1223-1233 (2010).
Dyson MR, Zheng Y, Zhang C, Colwill K, Pershad K, Kay BK, Pawson T, McCafferty J: Mapping protein interactions by combining antibody affinity maturation and mass spectrometry. Anal. Biochem. 417(1), 25-35 (2011).
Fisher TS et al. Targeting of 4-1BB by monoclonal antibody PF-05082566 enhances
T-cell function and promotes anti-tumor activity. Cancer Immunol Immunother. 61(10):1721-33 (2012).
Grosso J, Inzunza D, Wu Q, Simon J, Singh P, Zhang X, Phillips T, Simmons P, Cogswell J. Programmed death-ligand 1 (PD-L1) expression in various tumor types. Journal for Immunotherapy of Cancer. 1(Suppl 1):P53. (2013).
Hasenhindl C, Traxlmayr MW, Wozniak-Knopp G, Jones PC, Stadlmayr G, Rueker F, Obinger C. Stability assessment on a library scale: a rapid method for the evaluation of the commutability and insertion of residues in C-terminal loops of the CH3 domains of IgG1-Fc. Protein Eng. Des. Sel., 26(10), 675-82 (2013).
Hezareh M, Hessell AJ, Jensen RC, van de Winkel JG, Parren PW. Effector function
activities of a panel of mutants of a broadly neutralizing antibody against human immunodeficiency virus type 1. J Virol. 75(24):12161-8. (2001).
Hinner MJ, Aiba, RSB., Wiedenmann A, Schlosser C, Allersdorfer A, Matschiner G, Rothe C, Moebius U, Kohrt HE, Olwill SA. Costimulatory T cell engagement via a novel bispecific anti-CD137 /anti-HER2 protein. J. Immunotherapy Cancer 3 (Suppl 2): P187. (2015).
Holliger P, Hudson PJ. Engineered antibody fragments and the rise of single domains. Nat Biotechnol. 23(9):1126-36 (2005).
Hu S, Shively L, Raubitschek A, Sherman M, Williams LE, Wong JY, Shively JE, Wu AM. Minibody: A novel engineered anti-carcinoembryonic antigen antibody fragment
(single-chain Fv-CH3) which exhibits rapid, high-level targeting of xenografts.
Cancer Res. 56(13):3055-61 (1996).
Hurtado JC, Kim YJ, Kwon BS. Signals through 4-1BB are costimulatory to previously activated splenic T cells and inhibit activation-induced cell death. J Immunol. 15;158(6):2600-9 (1997).
Idusogie EE, Presta LG, Gazzano-Santoro H, Totpal K, Wong PY, Ultsch M, Meng YG,
Mulkerrin MG. Mapping of the C1q binding site on rituxan, a chimeric antibody with a human IgG1 Fc. J Immunol. 164(8), 4178-84 (2000).
Jain T et al. Biophysical properties of the clinical-stage antibody landscape. PNAS 114 (5), 944-949 (2017).
Jefferis R, Reimer CB, Skvaril F, de Lange G, Ling NR, Lowe J, Walker MR, Phillips DJ, Aloisio CH, Wells TW. Evaluation of monoclonal antibodies having specificity for human IgG sub-classes: results of an IUIS/WHO collaborative study. Immunol. Lett.1, 223-52 (1985).
Jefferis R, Reimer CB, Skvaril F, de Lange GG, Goodall DM, Bentley TL, Phillips DJ, Vlug A, Harada S, Radl J. Evaluation of monoclonal antibodies having specificity for human IgG subclasses: results of the 2nd IUIS/WHO collaborative study. Immunol. Lett. 31(2),143-68 (1992).
Juneja VR, McGuire KA, Manguso RT, LaFleur MW, Collins N, Haining WN, Freeman GJ, Sharpe AH. PD-L1 on tumor cells is sufficient for immune evasion in immunogenic tumors and inhibits CD8+ T cell cytotoxicity. J Exp Med. 214(4), 895-904 (2017).
Kabat EA, Wu TT, Perry HM, Gottesman KS, Foeller C. Sequences of Proteins of Immunological Interest, 5th ed. NIH Publication No. 91-3242. Washington, D.C.: U.S.
Department of Health and Human Services (1991).
Kim YH, Choi BK, Kim KH, Kang SW, Kwon BS. Combination Therapy with Cisplatin and Anti-4-1BB. Cancer Res. 68(18), 7264-7269 (2009).
Klein C, Schaefer W, Regula JT. The use of CrossMAb technology for the generation of bi- and multispecific antibodies. MAbs 8(6), 1010-20 (2016).
Kleinovink JW, Marijt KA, Schoonderwoerd MJA, Hall T, Ossendorp F, Fransen MF. P
D-L1 expression on malignant cells is no prerequisite for checkpoint therapy. Oncoimmunology. 6(4), e1294299 (2017).
Kocak E et al. Combination therapy with anti-CTL antigen-4 and anti-4-1BB antibodies enhances cancer immunity and reduces autoimmunity. Cancer Res. 15;66(14), 7276-84 (2006).
Lechner MG et al. Immunogenicity of murine solid tumor models as a defining feature of in vivo behavior and response to immunotherapy. J Immunother. 36(9), 477-89 (2013).
Ledermann JA, Begent RH, Massof C, Kelly AM, Adam T, Bagshawe KD. A phase-I study of repeated therapy with radiolabelled antibody to carcinoembryonic antigen using intermittent or continuous administration of cyclosporin A to supress the immune response. Int. J. Cancer 47(5), 659-64 (1991).
Lefranc MP et al. IMGT(登録商標), the international ImMunoGeneTics information
system(登録商標)25 years on. Nucleic Acids Res. 43(Database issue):D413-22 (2015).
Lefranc MP et al. IMGT unique numbering for immunoglobulin and T cell receptor constant domains and Ig superfamily C-like domains. Dev. Comp. Immunol. 29(3), 185-203 (2005).
Li F. and Ravetech JV. Antitumor activities of agonistic anti-TNFR antibodies require differential FcγRIIB coengagement in vivo. Proc Natl Acad Sci U S A, 110(48), 19501-6 (2013).
Link A et al. Preclinical pharmacology of MP0310: a 4-1BB/FAP bispecific DARPin drug candidate promoting tumor-restricted T cell co-stimulation [abstract]. In: Proceedings of the Annual Meeting of the American Association for Cancer Research; 2018 Apr 14-18; Chicago (IL) Abstract nr 3752 (2018).
Makkouk A, Chester C, Kohrt HE. Rationale for anti-CD137 cancer immunotherapy. Eur J Cancer. 54, 112-119 (2016).
Martins JP, Kennedy PJ, Santos HA, Barrias C, Sarmento B. A comprehensive review
of the neonatal Fc receptor and its application in drug delivery. Pharmcol. Ther. 161, 22-39 (2016).
Niu L et al. Cytokine- mediated disruption of lymphocyte trafficking, hemopoiesis, and induction of lymphopenia, anemia, and thrombocytopenia in anti-CD137-treated mice. J Immunol. 178(7), 4194-4213 (2007).
Perez-Ruiz E, Etxeberria I, Rodriguez-Ruiz, Melero I. Anti-CD137 and PD-1/PD-L1 Antibodies En Route toward Clinical Synergy. Clin. Cancer Res. 23, (18) (2017)
Reichen C et al. FAP-mediated tumor accumulation of a T-cell agonistic FAP/4-1BB
DARPin drug candidate analyzed by SPECT/CT and quantitative biodistribution [abstract]. In: Proceedings of the Annual Meeting of the American Association for Cancer Research; 2018 Apr 14-18; Chicago (IL) Abstract nr 3029 (2018).
Schofield DJ et al. Application of phage display to high throughput antibody generation and characterization. Genome Biol. 8(11), R254 (2007).
Segal NH et al. Phase I Study of Single-Agent Utomilumab (PF-05082566), a 4-1BB/CD137 Agonist, in Patients with Advanced Cancer. Clin Cancer Res. 24(8):1816-1823 (2018).
Segal NH et al. Results from an Integrated Safety Analysis of Urelumab, an Agonist Anti-CD137 Monoclonal Antibody. Clin Cancer Res. 23(8):1929-1936 (2017).
Shuford WW et al.l 4-1BB costimulatory signals preferentially induce CD8+ T cell
proliferation and lead to the amplification in vivo of cytotoxic T cell responses. J Exp Med. 186(1), 47-55 (1997).
Smith TF, Waterman MS. Identification of common molecular subsequences. J. Mol.
Biol. 147(1), 195-7 (1981).
Taraban VY et al. Expression and costimulatory effects of the TNF receptor superfamily members CD134 (OX40) and CD137 (4-1BB), and their role in the generation of anti-tumor immune responses. Eur. J. Immunol. 32, 3617-3627 (2002).
Tello, D, Goldbaum, FA, Mariuzza, RA, Ysern, X, Schwarz, FP, Poljak, RJ. Three-dimensional structure and thermodynamics of antigen binding by anti-lysozyme antibodies, Biochem Soc. Trans., 21(4), 943-6 (1993).
Tolcher AW et al. Phase Ib Study of Utomilumab (PF-05082566), a 4-1BB/CD137 Agonist, in Combination with Pembrolizumab (MK-3475) in Patients with Advanced Solid
Tumors. Clin. Cancer Res. 23, 5349-57 (2017)
Wang X, Mathieu M, Brezski RJ. IgG Fc engineering to modulate antibody effector functions. Protein Cell 9(1), 63-73 (2018).
Wen T, Bukczynski J, Watts TH. 4-1BB ligand-mediated costimulation of human T cells induces CD4+ and CD8+ T cell expansion, cytokine production, and the development of cytolytic effector function. J Immunol. 168(10), 4897-906 (2002).
Wolfl M, Kuball J, Ho WY, Nguyen H, Manley TJ, Bleakley M, Greenberg PD. Activation-induced expression of CD137 permits detection, isolation, and expansion of the full repertoire of CD8+ T cells responding to antigen without requiring knowledge of epitope specificities. Blood. 110(1):201-10 (2007).
Won EY, Cha K, Byun JS, Kim DU, Shin S, Ahn B, Kim YH, Rice AJ, Walz T, Kwon BS,
Cho HS. The structure of the trimer of human 4-1BB ligand is unique among members of the tumor necrosis factor superfamily. J Biol Chem.285(12), 9202-10 (2010).
Wozniak-Knopp G et al. Introducing antigen-binding sites in structural loops of immunoglobulin constant domains: Fc fragments with engineered HER2/neu-binding sites and antibody properties. Protein Eng Des Sel. 23(4), 289-97 (2010).
Ye Q, Song DG, Poussin M, Yamamoto T, Best A, Li C, Coukos G, Powell DJ Jr. CD137 accurately identifies and enriches for naturally occurring tumor-reactive T cells in tumor. Clin Cancer Res. 20(1):44-55 (2014).
Yu X, Anasetti C. CH 10 - T-cell costimulation in graft-versus-host disease and graft-versus-leukemia effect. Immune Biology of Allogeneic Hematopoietic Stem Cell Transplantation. 195-222 (2013).
Zanetti M. Tapping CD4 T Cells for Cancer Immunotherapy: The Choice of Personalized Genomics. J Immunol. 194:2049-2056 (2015).
Claims (16)
- プログラム死リガンド1(PD-L1)及びCD137に結合する抗体分子であって、
(a)PD-L1の相補性決定領域(CDR)ベースの抗原結合部位;及び
(b)前記抗体分子のCH3ドメインに位置するCD137抗原結合部位
を含み、前記CDRベースの抗原結合部位が、Kabat番号付けにより、
(i)それぞれ配列番号1、2、3、4、5及び6[E12v2];
(ii)それぞれ配列番号1、2、3、18、19及び20[E05v2];又は
(iii)それぞれ配列番号1、2、3、18、19及び29[G12v2];
に記載のVH CDR1、VH CDR2、VH CDR3、VL CDR1、VL CDR2及びVL CDR3を含むか、又は
前記CDRベースの抗原結合部位が、ImMunoGeneTics(IMGT)番号付けにより、
(iv)それぞれ配列番号7、8、9、10、11及び6[E12v2];
(v)それぞれ配列番号21、8、9、22、11及び20[E05v2];又は
(vi)それぞれ配列番号21、8、9、22、11及び29[G12v2];
に記載のVH CDR1、VH CDR2、VH CDR3、VL CDR1、VL CDR2及びVL CDR3を含み、
前記CD137抗原結合部位が、前記CH3ドメインのAB及びEF構造ループに位置する第1及び第2の配列を含み、前記第1の配列が、PPY配列(配列番号78)を含み、前記PPY配列が、前記抗体分子の前記CH3ドメインの15位と17位の間に位置しており、前記アミノ酸残基の番号付けが、IMGT番号付けスキームに従う、
抗体分子。 - 前記第1及び第2の配列が、
(i)それぞれ配列番号79及び83[FS22-053-009];
(ii)それぞれ配列番号79及び86[FS22-053-011];
(iii)それぞれ配列番号79及び89[FS22-053-017];
(iv)それぞれ配列番号79及び92[FS22-053-014];
(v)それぞれ配列番号79及び95[FS22-053-010];
(vi)それぞれ配列番号79及び98[FS22-053-012];
(vii)それぞれ配列番号79及び101[FS22-053-013];
(viii)それぞれ配列番号79及び104[FS22-053-015];
(ix)それぞれ配列番号79及び107[FS22-053-016];
(x)それぞれ配列番号79及び110[FS22-053];
(xi)それぞれ配列番号117及び114[FS22-172-002];
(xii)それぞれ配列番号120及び114[FS22-172-004];
(xiii)それぞれ配列番号123及び114[FS22-172-001];
(xiv)それぞれ配列番号126及び114[FS22-172-005];
(xv)それぞれ配列番号129及び114[FS22-172-006];又は
(xvi)それぞれ配列番号129及び114[FS22-172];
に記載の配列を有する、請求項1に記載の抗体分子。 - 前記抗体分子が、
(i)それぞれ配列番号12及び14[E12v2];
(ii)それぞれ配列番号23及び25[E05v2];又は
(iii)それぞれ配列番号23及び30[G12v2]
に記載のVHドメイン及びVLドメインを含む、請求項1又は2に記載の抗体分子。 - 前記抗体分子が、
(i)Kabat番号付けスキームにより、それぞれ配列番号1、2、3、4、5及び6に記載のVH CDR1、VH CDR2、VH CDR3、VL CDR1、VL CDR2及びVL CDR3[E12v2];
(ii)IMGT番号付けスキームにより、それぞれ配列番号7、8、9、10、11及び6に記載のVH CDR1、VH CDR2、VH CDR3、VL CDR1、VL CDR2及びVL CDR3[E12v2];及び/又は
(iii)それぞれ配列番号12及び14に記載のVHドメイン及びVLドメイン[E12v2]
を含む、請求項1から3のいずれか一項に記載の抗体分子。 - (i)前記第1の配列が、前記抗体分子の前記CH3ドメインの14位と17位の間に位置している;及び/又は
(ii)前記第2の配列が、前記抗体分子の前記CH3ドメインの91位と99位の間に位置しており;並びに
アミノ酸残基の番号付けが、IMGT番号付けスキームに従う、
請求項1から4のいずれか一項に記載の抗体分子。 - 前記抗体分子が、配列番号84[FS22-053-009]、配列番号87[FS22-053-011]、配列番号90[FS22-053-017]、配列番号93[FS22-053-014]、配列番号96[FS22-053-010]、配列番号99[FS22-053-012]、配列番号102[FS22-053-013]、配列番号105[FS22-053-015]、配列番号108[FS22-053-016]、配列番号111[FS22-053]、配列番号118[FS22-172-002]、配列番号121[FS22-172-004]、配列番号124[FS22-172-001]、配列番号127[FS22-172-005]、配列番号130[FS22-172-006]及び配列番号132[FS22-172]に記載のCH3ドメインを含む、請求項1から5のいずれか一項に記載の抗体分子。
- 前記CH3ドメイン配列が、当該CH3ドメイン配列のC末端のすぐ隣にリジン残基(K)をさらに含む、請求項6に記載の抗体分子。
- 前記抗体分子が、抗体:
(i)それぞれ配列番号152及び17に記載のFS22-053-017-AA/E12v2;
(ii)それぞれ配列番号153及び28に記載のFS22-053-017-AA/E05v2;又は
(iii)それぞれ配列番号154及び33に記載のFS22-053-017-AA/G12v2;
の重鎖及び軽鎖を含む、請求項1から7のいずれか一項に記載の抗体分子。 - 前記重鎖配列の前記CH3ドメイン配列が、当該CH3ドメイン配列のC末端のすぐ隣にリジン残基(K)をさらに含む、請求項8に記載の抗体分子。
- 前記抗体分子が、CH2ドメインを含み、
(i)前記抗体分子が、1つ以上のFcγ受容体への前記抗体分子の前記CH2ドメインの結合を低減又は抑制するように修飾されている、
(ii)前記抗体分子が、1つ以上のFcγ受容体に結合しない、及び/又は
(iii)免疫細胞上のCD137への及び腫瘍細胞表面に結合したPD-L1への前記抗体分子の結合が、前記免疫細胞上のCD137のクラスター化を引き起こす、
請求項1から9のいずれか一項に記載の抗体分子。 - 請求項1から10のいずれか一項に記載の抗体分子をコードする、1つ又は複数の核酸分子。
- 請求項11に記載の1つ又は複数の核酸分子を含む、1つ又は複数のベクター。
- 請求項11に記載の1つ又は複数の核酸分子、又は請求項12に記載の1つ又は複数のベクターを含む、組換え宿主細胞。
- 前記抗体分子の産生条件下で請求項13の組換え宿主細胞を培養することを含み、任意で、前記抗体分子を単離及び/又は精製することをさらに含む、請求項1から10のいずれか一項に記載の抗体分子を産生する方法。
- 請求項1から10のいずれか一項に記載の抗体分子と、薬学的に許容される賦形剤とを含む、医薬組成物。
- 個体における癌の治療のための医薬組成物であって、請求項1から10のいずれか一項に記載の抗体分子を含む、医薬組成物。
Applications Claiming Priority (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB1811405.8A GB201811405D0 (en) | 2018-07-12 | 2018-07-12 | Antibody molecules that bind PD-L1 and CD137 |
| GB1811405.8 | 2018-07-12 | ||
| GB1818283.2 | 2018-11-09 | ||
| GBGB1818283.2A GB201818283D0 (en) | 2018-11-09 | 2018-11-09 | Antibody molecules that bind PD-L1 and CD137 |
| GBGB1902594.9A GB201902594D0 (en) | 2019-02-26 | 2019-02-26 | Antibody molecules that bind pd-l1 and cd137 |
| GB1902594.9 | 2019-02-26 | ||
| JP2021500385A JP7360440B2 (ja) | 2018-07-12 | 2019-07-12 | Pd-l1及びcd137に結合する抗体分子 |
| PCT/EP2019/068793 WO2020011964A1 (en) | 2018-07-12 | 2019-07-12 | Antibody molecules that bind pd-l1 and cd137 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021500385A Division JP7360440B2 (ja) | 2018-07-12 | 2019-07-12 | Pd-l1及びcd137に結合する抗体分子 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023181176A JP2023181176A (ja) | 2023-12-21 |
| JP7587656B2 true JP7587656B2 (ja) | 2024-11-20 |
Family
ID=67303457
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021500385A Active JP7360440B2 (ja) | 2018-07-12 | 2019-07-12 | Pd-l1及びcd137に結合する抗体分子 |
| JP2023169756A Active JP7587656B2 (ja) | 2018-07-12 | 2023-09-29 | Pd-l1及びcd137に結合する抗体分子 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021500385A Active JP7360440B2 (ja) | 2018-07-12 | 2019-07-12 | Pd-l1及びcd137に結合する抗体分子 |
Country Status (18)
| Country | Link |
|---|---|
| US (2) | US12344672B2 (ja) |
| EP (2) | EP4512417A3 (ja) |
| JP (2) | JP7360440B2 (ja) |
| KR (1) | KR20210030956A (ja) |
| CN (1) | CN112423845B (ja) |
| AU (1) | AU2019301204B2 (ja) |
| BR (1) | BR112021000394A2 (ja) |
| CA (1) | CA3106046A1 (ja) |
| DK (1) | DK3820569T3 (ja) |
| ES (1) | ES3006183T3 (ja) |
| IL (1) | IL280004A (ja) |
| MX (1) | MX2021000398A (ja) |
| PL (1) | PL3820569T3 (ja) |
| PT (1) | PT3820569T (ja) |
| SG (1) | SG11202100170RA (ja) |
| TW (1) | TWI861005B (ja) |
| WO (1) | WO2020011964A1 (ja) |
| ZA (1) | ZA202100717B (ja) |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11214618B2 (en) | 2016-06-20 | 2022-01-04 | F-Star Therapeutics Limited | LAG-3 binding members |
| GB201612520D0 (en) | 2016-07-19 | 2016-08-31 | F-Star Beta Ltd | Binding molecules |
| JP7489316B2 (ja) | 2017-12-19 | 2024-05-23 | エフ-スター セラピューティクス リミテッド | Pd-li抗原結合部位を有するfc結合断片 |
| KR102763158B1 (ko) | 2018-04-25 | 2025-02-04 | 프로메테우스 바이오사이언시즈, 인크. | 최적화된 항tl1a 항체 |
| GB201811415D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | Anti-Mesothelin Anti bodies |
| GB201811450D0 (en) | 2018-07-12 | 2018-08-29 | F Star Delta Ltd | Mesothelin and CD137 binding molecules |
| GB201811410D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | OX40 Binding molecules |
| GB201811403D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | Antibody molecules |
| IL280002B2 (en) | 2018-07-12 | 2025-05-01 | F Star Beta Ltd | Antibody molecules that bind CD137 and OX40 |
| GB201811408D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | CD137 Binding Molecules |
| MX2021001431A (es) | 2018-08-10 | 2021-05-12 | Chugai Pharmaceutical Co Ltd | Molecula de union al antigeno anti grupo de diferenciacion 137 (cd137) y su uso. |
| KR20220103721A (ko) | 2019-10-24 | 2022-07-22 | 프로메테우스 바이오사이언시즈, 인크. | Tnf 유사 리간드 1a(tl1a)에 대한 인간화 항체 및 그의 용도 |
| EP4100059A1 (en) * | 2020-02-04 | 2022-12-14 | Genmab A/S | Antibodies for use in therapy |
| TWI895351B (zh) * | 2020-02-12 | 2025-09-01 | 日商中外製藥股份有限公司 | 用於癌症之治療的抗cd137抗原結合分子 |
| EP4134377A4 (en) * | 2020-05-06 | 2024-05-15 | Korea University Research and Business Foundation | PD-1 VARIANTS WITH INCREASED PD-L1 AFFINITY |
| AU2021271695A1 (en) * | 2020-05-14 | 2022-08-18 | Elixiron Immunotherapeutics (hong Kong) Limited | Anti-PD-L1 antibodies and anti-PD-L1/IL10 fusion proteins |
| IL304295B2 (en) * | 2021-01-08 | 2025-07-01 | Beijing Hanmi Pharmaceutical Co Ltd | Anti-pd-l1/anti-4-1bb natural antibody structure-like heterodimeric form bispecific antibody and preparation thereof |
| CA3230742A1 (en) * | 2021-09-03 | 2023-03-09 | Novarock Biotherapeutics, Ltd. | Bispecific and trispecific binding proteins to pd-l1, cd137, and/or tgf.beta. and uses thereof |
| CN114702569B (zh) * | 2022-05-25 | 2023-01-10 | 深圳吉诺因生物科技有限公司 | Pd-l1相关疫苗及其应用 |
| WO2024040195A1 (en) | 2022-08-17 | 2024-02-22 | Capstan Therapeutics, Inc. | Conditioning for in vivo immune cell engineering |
| WO2024249954A1 (en) | 2023-05-31 | 2024-12-05 | Capstan Therapeutics, Inc. | Lipid nanoparticle formulations and compositions |
| TW202519547A (zh) * | 2023-07-10 | 2025-05-16 | 美商再生元醫藥公司 | 雙特異性PD-L1x4-1BB抗體及其使用方法 |
| WO2025076113A1 (en) | 2023-10-05 | 2025-04-10 | Capstan Therapeutics, Inc. | Ionizable cationic lipids with conserved spacing and lipid nanoparticles |
| US20250127728A1 (en) | 2023-10-05 | 2025-04-24 | Capstan Therapeutics, Inc. | Constrained Ionizable Cationic Lipids and Lipid Nanoparticles |
| US20250302763A1 (en) | 2024-02-22 | 2025-10-02 | Capstan Therapeutics, Inc. | Immune engineering amplification |
| WO2025217452A1 (en) | 2024-04-11 | 2025-10-16 | Capstan Therapeutics, Inc. | Constrained ionizable cationic lipids and lipid nanoparticles |
| WO2025242842A1 (en) | 2024-05-22 | 2025-11-27 | Invox Pharma Limited | Dosage regimes for the administration of an anti-cd137/pd-l1 antigen-binding protein |
| WO2025242843A1 (en) | 2024-05-22 | 2025-11-27 | Invox Pharma Limited | Dosage regimes for the administration of an anti-cd137/pd-l1 antigen-binding protein |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018056821A1 (en) | 2016-09-23 | 2018-03-29 | Merus N.V. | Binding molecules that modulate a biological activity expressed by a cell |
Family Cites Families (111)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2245404C3 (de) | 1972-09-15 | 1978-08-31 | Robert Bosch Gmbh, 7000 Stuttgart | Massewiderstand, insbesondere für Zündkerzen, sowie Verfahren zur Herstellung desselben |
| JPS531908B2 (ja) | 1973-11-12 | 1978-01-23 | ||
| JPS5746634B2 (ja) | 1974-05-10 | 1982-10-04 | ||
| JPS5146628A (ja) | 1974-10-17 | 1976-04-21 | Nippon Denso Co | Teikoirisupaakupuragu |
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| JPS61134325A (ja) | 1984-12-04 | 1986-06-21 | Teijin Ltd | ハイブリツド抗体遺伝子の発現方法 |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| WO1994016730A1 (en) | 1993-01-28 | 1994-08-04 | Sandoz Pharmaceutical Corporation | Human monoclonal antibodies to cytomegalovirus |
| US5595756A (en) | 1993-12-22 | 1997-01-21 | Inex Pharmaceuticals Corporation | Liposomal compositions for enhanced retention of bioactive agents |
| CA2318576C (en) | 1997-12-01 | 2009-04-14 | The Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Antibodies, including fv molecules, and immunoconjugates having high binding affinity for mesothelin and methods for their use |
| DE19818214A1 (de) | 1998-04-24 | 1999-10-28 | Bosch Gmbh Robert | Zündkerze für eine Brennkraftmaschine |
| MXPA01011950A (es) | 1999-05-27 | 2002-05-06 | Gov Health & Human Serv | Inmunoconjugados que tienen alta afinidad de enlace. |
| PT2857516T (pt) | 2000-04-11 | 2017-08-28 | Genentech Inc | Anticorpos multivalentes e utilizações dos mesmos |
| JP4578025B2 (ja) | 2001-07-06 | 2010-11-10 | 日本特殊陶業株式会社 | スパークプラグ |
| US7288638B2 (en) | 2003-10-10 | 2007-10-30 | Bristol-Myers Squibb Company | Fully human antibodies against human 4-1BB |
| ATE414718T1 (de) | 2005-01-05 | 2008-12-15 | F Star Biotech Forsch & Entw | Synthetische immunoglobulindomänen mit in regionen des moleküls, die sich von den die komplementarität bestimmenden bereichen unterscheiden, modifizierten bindeeigenschaften |
| WO2006088447A1 (en) | 2005-02-15 | 2006-08-24 | Gtc Biotherapeutics, Inc. | An anti-cd137 antibody as an agent in the treatement of cancer and glycosylation variants thereof |
| ES2429340T3 (es) | 2005-03-10 | 2013-11-14 | Morphotek, Inc. | Anticuerpos anti-mesotelina |
| KR101888321B1 (ko) | 2005-07-01 | 2018-08-13 | 이. 알. 스퀴부 앤드 선즈, 엘.엘.씨. | 예정 사멸 리간드 1 (피디-엘1)에 대한 인간 모노클로날 항체 |
| US7612181B2 (en) | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| AT503889B1 (de) | 2006-07-05 | 2011-12-15 | Star Biotechnologische Forschungs Und Entwicklungsges M B H F | Multivalente immunglobuline |
| GB0624500D0 (en) | 2006-12-07 | 2007-01-17 | Istituto Superiore Di Sanito | A novel passive vaccine for candida infections |
| HUE066143T2 (hu) | 2007-06-26 | 2024-07-28 | F Star Therapeutics Ltd | Kötõágensek megjelenítése |
| PL2215121T3 (pl) | 2007-11-26 | 2016-07-29 | Bayer Ip Gmbh | Przeciwciała przeciwko mezotelinie i ich zastosowania |
| EP2242771B1 (en) | 2007-12-14 | 2013-07-17 | Bristol-Myers Squibb Company | Binding molecules to the human ox40 receptor |
| RS51975B (sr) | 2008-04-11 | 2012-02-29 | Emergent Product Development Seattle Llc. | Cd37 imunoterapeutski proizvod i njegova kombinacija sa bifunkcionalnim hemoterapeutskim sredstvom |
| EP2113255A1 (en) | 2008-05-02 | 2009-11-04 | f-star Biotechnologische Forschungs- und Entwicklungsges.m.b.H. | Cytotoxic immunoglobulin |
| AR072999A1 (es) | 2008-08-11 | 2010-10-06 | Medarex Inc | Anticuerpos humanos que se unen al gen 3 de activacion linfocitaria (lag-3) y los usos de estos |
| EP2358390A1 (en) | 2008-11-13 | 2011-08-24 | Emergent Product Development Seattle, LLC | Cd37 immunotherapeutic combination therapies and uses thereof |
| US8217149B2 (en) | 2008-12-09 | 2012-07-10 | Genentech, Inc. | Anti-PD-L1 antibodies, compositions and articles of manufacture |
| US8460660B2 (en) | 2009-03-24 | 2013-06-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Anti-mesothelin antibodies |
| AR076284A1 (es) | 2009-04-29 | 2011-06-01 | Bayer Schering Pharma Ag | Inmunoconjugados de antimesotelina y usos de los mismos |
| LT3279215T (lt) | 2009-11-24 | 2020-04-10 | Medimmune Limited | Tiksliniai surišantys agentai prieš b7-h1 |
| EP2407487A1 (en) | 2010-07-14 | 2012-01-18 | F-Star Biotechnologische Forschungs - und Entwicklungsges. M.B.H. | Multispecific modular antibody |
| CA2810359C (en) | 2010-09-09 | 2021-06-22 | Pfizer Inc. | 4-1bb binding molecules |
| TWI477513B (zh) | 2010-12-20 | 2015-03-21 | 建南德克公司 | 抗間皮素(mesothelin)抗體及免疫接合物 |
| SI2691417T2 (sl) | 2011-03-29 | 2025-05-30 | Roche Glycart Ag | FC variante protitelesa |
| EP2546268A1 (en) | 2011-07-13 | 2013-01-16 | F-Star Biotechnologische Forschungs - und Entwicklungsges. M.B.H. | Internalising immunoglobulin |
| LT2785375T (lt) | 2011-11-28 | 2020-11-10 | Merck Patent Gmbh | Anti-pd-l1 antikūnai ir jų panaudojimas |
| US9175082B2 (en) | 2012-05-31 | 2015-11-03 | Sorrento Therapeutics, Inc. | Antigen binding proteins that bind PD-L1 |
| US20140004121A1 (en) | 2012-06-27 | 2014-01-02 | Amgen Inc. | Anti-mesothelin binding proteins |
| UY34887A (es) | 2012-07-02 | 2013-12-31 | Bristol Myers Squibb Company Una Corporacion Del Estado De Delaware | Optimización de anticuerpos que se fijan al gen de activación de linfocitos 3 (lag-3) y sus usos |
| JP5276742B1 (ja) | 2012-08-09 | 2013-08-28 | 日本特殊陶業株式会社 | 点火プラグ |
| WO2014052064A1 (en) | 2012-09-27 | 2014-04-03 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Mesothelin antibodies and methods for eliciting potent antitumor activity |
| SMT201900242T1 (it) | 2012-12-03 | 2019-05-10 | Bristol Myers Squibb Co | Incremento dell'attivita' anti-cancro di proteine di fuzione a fc immunomodulatrici |
| SI2970464T1 (sl) | 2013-03-15 | 2020-08-31 | Glaxosmithkline Intellectual Propety Development Limited | Anti-LAG-3 vezavni proteini |
| EP2970484B2 (en) | 2013-03-15 | 2022-09-21 | Amgen Inc. | Heterodimeric bispecific antibodies |
| EP3049442A4 (en) | 2013-09-26 | 2017-06-28 | Costim Pharmaceuticals Inc. | Methods for treating hematologic cancers |
| GB201317622D0 (en) | 2013-10-04 | 2013-11-20 | Star Biotechnology Ltd F | Cancer biomarkers and uses thereof |
| US10899840B2 (en) | 2014-02-04 | 2021-01-26 | Pfizer Inc. | Combination of a PD-1 antagonist and a 4-1BB agonist for treating cancer |
| CA2936962C (en) | 2014-03-14 | 2024-03-05 | Novartis Ag | Antibody molecules to lag-3 and uses thereof |
| US20150307620A1 (en) | 2014-04-16 | 2015-10-29 | University Of Connecticut | Linked immunotherapeutic agonists that costimulate multiple pathways |
| JP5902757B2 (ja) | 2014-06-24 | 2016-04-13 | 日本特殊陶業株式会社 | スパークプラグ |
| WO2015198312A1 (en) | 2014-06-24 | 2015-12-30 | Ccam Therapeutics Ltd. | Compositions comprising antibodies to ceacam-1 and lag-3 for cancer therapy |
| TWI693232B (zh) | 2014-06-26 | 2020-05-11 | 美商宏觀基因股份有限公司 | 與pd-1和lag-3具有免疫反應性的共價結合的雙抗體和其使用方法 |
| JP6665160B2 (ja) | 2014-08-10 | 2020-03-13 | フェデラル−モーグル・イグニション・リミテッド・ライアビリティ・カンパニーFederal−Mogul Ignition Llc | 改良されたシールを有するスパークプラグ |
| JO3663B1 (ar) | 2014-08-19 | 2020-08-27 | Merck Sharp & Dohme | الأجسام المضادة لمضاد lag3 وأجزاء ربط الأنتيجين |
| CA2960824A1 (en) | 2014-09-13 | 2016-03-17 | Novartis Ag | Combination therapies of alk inhibitors |
| TW201619200A (zh) | 2014-10-10 | 2016-06-01 | 麥迪紐有限責任公司 | 人類化抗-ox40抗體及其用途 |
| CA2874083C (en) | 2014-12-05 | 2024-01-02 | Universite Laval | Tdp-43-binding polypeptides useful for the treatment of neurodegenerative diseases |
| CN117843799A (zh) | 2015-01-08 | 2024-04-09 | 生物技术公司 | 激动性tnf受体结合剂 |
| GB201500319D0 (en) | 2015-01-09 | 2015-02-25 | Agency Science Tech & Res | Anti-PD-L1 antibodies |
| US10259881B2 (en) | 2015-02-22 | 2019-04-16 | Sorrento Therapeutics, Inc. | Antibody therapeutics that bind CD137 |
| TW201642897A (zh) | 2015-04-08 | 2016-12-16 | F 星生物科技有限公司 | Her2結合劑治療 |
| AU2016258977C1 (en) | 2015-05-04 | 2022-07-14 | Pieris Pharmaceuticals Gmbh | Anti-cancer fusion polypeptide |
| CN107709367A (zh) | 2015-05-21 | 2018-02-16 | 鳄鱼生物科学公司 | 新型多肽 |
| TWI773646B (zh) | 2015-06-08 | 2022-08-11 | 美商宏觀基因股份有限公司 | 結合lag-3的分子和其使用方法 |
| JP6025921B1 (ja) | 2015-06-22 | 2016-11-16 | 日本特殊陶業株式会社 | スパークプラグ |
| AU2016293101B2 (en) | 2015-07-15 | 2022-06-16 | Pieris Pharmaceuticals Gmbh | Novel proteins specific for LAG-3 |
| CA2993177A1 (en) | 2015-07-22 | 2017-01-26 | Sorrento Therapeutics, Inc. | Antibody therapeutics that bind lag3 |
| SI3328419T1 (sl) * | 2015-07-30 | 2021-11-30 | Macrogenics, Inc. | PD-1-vezavne molekule in postopki uporabe le-teh |
| CA2994631A1 (en) | 2015-08-07 | 2017-02-16 | Pieris Pharmaceuticals Gmbh | Novel fusion polypeptide specific for lag-3 and pd-1 |
| CN108026169B (zh) | 2015-09-22 | 2021-05-28 | 苏州丁孚靶点生物技术有限公司 | 抗人cd137的完全人抗体及其应用 |
| KR101782487B1 (ko) | 2015-09-24 | 2017-09-27 | 재단법인 목암생명과학연구소 | 신규 항-메소텔린 항체 및 이를 포함하는 조성물 |
| KR20180053674A (ko) | 2015-10-02 | 2018-05-23 | 에프. 호프만-라 로슈 아게 | 공자극 tnf 수용체에 특이적인 이중특이성 항체 |
| TWI756187B (zh) | 2015-10-09 | 2022-03-01 | 美商再生元醫藥公司 | 抗lag3抗體及其用途 |
| GB201519481D0 (en) | 2015-11-04 | 2015-12-16 | Cancer Rec Tech Ltd | Immunomodulatory antibodies |
| CA3132021C (en) | 2015-11-18 | 2024-03-12 | Merck Sharp & Dohme Corp. | Pd1 and/or lag3 binders |
| WO2017087901A2 (en) | 2015-11-19 | 2017-05-26 | Sutro Biopharma, Inc. | Anti-lag3 antibodies, compositions comprising anti-lag3 antibodies and methods of making and using anti-lag3 antibodies |
| SG10201912405TA (en) | 2016-01-11 | 2020-02-27 | Inhibrx Inc | Multivalent and multispecific 41bb-binding fusion proteins |
| CN108602371B (zh) | 2016-03-18 | 2020-03-24 | 大日本印刷株式会社 | 中间转印介质、中间转印介质与热转印片的组合、以及印刷物的形成方法 |
| AU2017252233A1 (en) | 2016-04-22 | 2018-11-15 | Alligator Bioscience Ab | Novel bispecific polypeptides against CD137 |
| AR108377A1 (es) | 2016-05-06 | 2018-08-15 | Medimmune Llc | Proteínas de unión biespecíficas y sus usos |
| CA3025345A1 (en) | 2016-05-27 | 2017-11-30 | Abbvie Biotherapeutics Inc. | Bispecific binding proteins binding an immunomodulatory protein and a tumor antigen |
| US20190106494A1 (en) | 2016-06-13 | 2019-04-11 | Askgene Pharma Inc. | PD-L1 Specific Monoclonal Antibodies for Disease Treatment and Diagnosis |
| CN107523546A (zh) | 2016-06-20 | 2017-12-29 | 上海细胞治疗研究院 | 一种高效稳定表达抗体的nk细胞及其用途 |
| US9567399B1 (en) * | 2016-06-20 | 2017-02-14 | Kymab Limited | Antibodies and immunocytokines |
| WO2017220989A1 (en) | 2016-06-20 | 2017-12-28 | Kymab Limited | Anti-pd-l1 and il-2 cytokines |
| US11214618B2 (en) | 2016-06-20 | 2022-01-04 | F-Star Therapeutics Limited | LAG-3 binding members |
| CN109563171B (zh) | 2016-06-20 | 2023-09-19 | F-星治疗有限公司 | 结合pd-l1和lag-3的结合分子 |
| GB201612520D0 (en) | 2016-07-19 | 2016-08-31 | F-Star Beta Ltd | Binding molecules |
| US11746152B2 (en) | 2016-07-20 | 2023-09-05 | Stcube, Inc. | Methods of cancer treatment and therapy using a combination of antibodies that bind glycosylated PD-L1 |
| GB201616699D0 (en) | 2016-09-30 | 2016-11-16 | Mab Designs Ltd | Antibodies |
| GB201619648D0 (en) | 2016-11-21 | 2017-01-04 | Alligator Bioscience Ab | Novel antibodies and uses thereof |
| WO2018115859A1 (en) | 2016-12-20 | 2018-06-28 | Kymab Limited | Multispecific antibody with combination therapy for immuno-oncology |
| GB201700345D0 (en) | 2017-01-09 | 2017-02-22 | F-Star Beta Ltd | Conditional agonists of immune responses |
| EP3630167A1 (en) | 2017-05-26 | 2020-04-08 | NovImmune SA | Anti-cd47 x anti-mesothelin antibodies and methods of use thereof |
| EP3630842A2 (en) | 2017-05-30 | 2020-04-08 | Bristol-Myers Squibb Company | Compositions comprising a combination of an anti-lag-3 antibody, a pd-1 pathway inhibitor, and an immunotherapeutic agent |
| AU2018309339C1 (en) | 2017-08-04 | 2025-08-21 | BioNTech SE | Binding agents binding to PD-L1 and CD137 and use thereof |
| EP3470426A1 (en) | 2017-10-10 | 2019-04-17 | Numab Therapeutics AG | Multispecific antibody |
| WO2019122882A1 (en) | 2017-12-19 | 2019-06-27 | Kymab Limited | Bispecific antibody for icos and pd-l1 |
| JP7489316B2 (ja) | 2017-12-19 | 2024-05-23 | エフ-スター セラピューティクス リミテッド | Pd-li抗原結合部位を有するfc結合断片 |
| GB201811403D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | Antibody molecules |
| GB201811415D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | Anti-Mesothelin Anti bodies |
| IL280002B2 (en) | 2018-07-12 | 2025-05-01 | F Star Beta Ltd | Antibody molecules that bind CD137 and OX40 |
| GB201811404D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | Anti-CD137 Antibodies |
| GB201811408D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | CD137 Binding Molecules |
| GB201811410D0 (en) | 2018-07-12 | 2018-08-29 | F Star Beta Ltd | OX40 Binding molecules |
| GB201811450D0 (en) | 2018-07-12 | 2018-08-29 | F Star Delta Ltd | Mesothelin and CD137 binding molecules |
| WO2020229626A1 (en) | 2019-05-14 | 2020-11-19 | F-Star Delta Limited | Dosage regimes for the administration of a lag-3/pd-l1 bispecific antibody |
-
2019
- 2019-07-12 TW TW108124754A patent/TWI861005B/zh active
- 2019-07-12 CN CN201980046597.4A patent/CN112423845B/zh active Active
- 2019-07-12 DK DK19740347.0T patent/DK3820569T3/da active
- 2019-07-12 KR KR1020217003611A patent/KR20210030956A/ko active Pending
- 2019-07-12 WO PCT/EP2019/068793 patent/WO2020011964A1/en not_active Ceased
- 2019-07-12 JP JP2021500385A patent/JP7360440B2/ja active Active
- 2019-07-12 BR BR112021000394-0A patent/BR112021000394A2/pt unknown
- 2019-07-12 EP EP24213991.3A patent/EP4512417A3/en active Pending
- 2019-07-12 CA CA3106046A patent/CA3106046A1/en active Pending
- 2019-07-12 PL PL19740347.0T patent/PL3820569T3/pl unknown
- 2019-07-12 PT PT197403470T patent/PT3820569T/pt unknown
- 2019-07-12 MX MX2021000398A patent/MX2021000398A/es unknown
- 2019-07-12 SG SG11202100170RA patent/SG11202100170RA/en unknown
- 2019-07-12 EP EP19740347.0A patent/EP3820569B1/en active Active
- 2019-07-12 ES ES19740347T patent/ES3006183T3/es active Active
- 2019-07-12 AU AU2019301204A patent/AU2019301204B2/en active Active
- 2019-07-12 US US17/259,791 patent/US12344672B2/en active Active
-
2021
- 2021-01-07 IL IL280004A patent/IL280004A/en unknown
- 2021-02-02 ZA ZA2021/00717A patent/ZA202100717B/en unknown
-
2023
- 2023-09-29 JP JP2023169756A patent/JP7587656B2/ja active Active
-
2025
- 2025-05-23 US US19/216,878 patent/US20250346679A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018056821A1 (en) | 2016-09-23 | 2018-03-29 | Merus N.V. | Binding molecules that modulate a biological activity expressed by a cell |
Also Published As
| Publication number | Publication date |
|---|---|
| ES3006183T3 (en) | 2025-03-17 |
| JP7360440B2 (ja) | 2023-10-12 |
| EP3820569B1 (en) | 2024-11-20 |
| TWI861005B (zh) | 2024-11-11 |
| ZA202100717B (en) | 2025-09-25 |
| CA3106046A1 (en) | 2020-01-16 |
| CN112423845B (zh) | 2024-07-30 |
| IL280004A (en) | 2021-03-01 |
| AU2019301204B2 (en) | 2025-10-23 |
| JP2023181176A (ja) | 2023-12-21 |
| DK3820569T3 (da) | 2025-01-02 |
| TW202005984A (zh) | 2020-02-01 |
| JP2021524268A (ja) | 2021-09-13 |
| SG11202100170RA (en) | 2021-02-25 |
| PL3820569T3 (pl) | 2025-07-14 |
| US20220049007A1 (en) | 2022-02-17 |
| PT3820569T (pt) | 2025-01-14 |
| US12344672B2 (en) | 2025-07-01 |
| CN112423845A (zh) | 2021-02-26 |
| MX2021000398A (es) | 2021-05-27 |
| US20250346679A1 (en) | 2025-11-13 |
| EP4512417A3 (en) | 2025-09-17 |
| KR20210030956A (ko) | 2021-03-18 |
| BR112021000394A2 (pt) | 2021-04-06 |
| AU2019301204A1 (en) | 2021-02-25 |
| EP3820569A1 (en) | 2021-05-19 |
| EP4512417A2 (en) | 2025-02-26 |
| WO2020011964A1 (en) | 2020-01-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7587656B2 (ja) | Pd-l1及びcd137に結合する抗体分子 | |
| JP7701964B2 (ja) | Cd137及びox40に結合する抗体分子 | |
| TWI839365B (zh) | 間皮素及cd137結合分子 | |
| JP7603205B2 (ja) | 抗体分子 | |
| RU2826084C2 (ru) | МОЛЕКУЛЫ АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ PD-L1 и CD137 | |
| HK40122804A (en) | Antibody molecules that bind pd-l1 and cd137 | |
| RU2815066C2 (ru) | Молекулы, связывающие мезотелин и cd137 | |
| HK40050345A (en) | Antibody molecules that bind pd-l1 and cd137 | |
| HK40050345B (en) | Antibody molecules that bind pd-l1 and cd137 | |
| HK40050917B (en) | Mesothelin and cd137 binding molecules | |
| HK40050917A (en) | Mesothelin and cd137 binding molecules |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231026 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20231026 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20240913 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241011 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241108 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7587656 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |