JP6992033B2 - ソフトコンタクトレンズの変質を抑制する眼科用組成物 - Google Patents
ソフトコンタクトレンズの変質を抑制する眼科用組成物 Download PDFInfo
- Publication number
- JP6992033B2 JP6992033B2 JP2019198581A JP2019198581A JP6992033B2 JP 6992033 B2 JP6992033 B2 JP 6992033B2 JP 2019198581 A JP2019198581 A JP 2019198581A JP 2019198581 A JP2019198581 A JP 2019198581A JP 6992033 B2 JP6992033 B2 JP 6992033B2
- Authority
- JP
- Japan
- Prior art keywords
- salt
- ophthalmic composition
- epinastine
- acid
- soft contact
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/14—Decongestants or antiallergics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- G—PHYSICS
- G02—OPTICS
- G02C—SPECTACLES; SUNGLASSES OR GOGGLES INSOFAR AS THEY HAVE THE SAME FEATURES AS SPECTACLES; CONTACT LENSES
- G02C13/00—Assembling; Repairing; Cleaning
-
- G—PHYSICS
- G02—OPTICS
- G02C—SPECTACLES; SUNGLASSES OR GOGGLES INSOFAR AS THEY HAVE THE SAME FEATURES AS SPECTACLES; CONTACT LENSES
- G02C7/00—Optical parts
- G02C7/02—Lenses; Lens systems ; Methods of designing lenses
- G02C7/04—Contact lenses for the eyes
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Ophthalmology & Optometry (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Optics & Photonics (AREA)
- General Physics & Mathematics (AREA)
- Inorganic Chemistry (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Pulmonology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Eyeglasses (AREA)
Description
(1)ほう酸又はその塩を含有する、ソフトコンタクトレンズの変質を抑制する眼科用組成物であって、エピナスチン又はその塩を含有し、前記ソフトコンタクトレンズは最長1か月装用可能なソフトコンタクトレンズである、眼科用組成物。
(2)エピナスチン又はその塩の濃度が0.1%(w/v)以下である、(1)に記載の眼科用組成物。
(3)エピナスチン又はその塩の濃度が0.05%(w/v)である、(1)又は(2)に記載の眼科用組成物。
(4)ほう酸又はその塩の濃度が、0.01~2%(w/v)である、(1)~(3)のいずれか1つに記載の眼科用組成物。
(5)塩化ベンザルコニウムを含有しない、(1)~(4)のいずれか1つに記載の眼科用組成物。
(6)さらに緩衝剤を含有する、(1)~(5)のいずれか1つに記載の眼科用組成物。
(7)さらに等張化剤を含有する、(1)~(6)のいずれか1つに記載の眼科用組成物。
(8)さらに安定化剤を含有する、(1)~(7)のいずれか1つに記載の眼科用組成物。
(9)安定化剤がエデト酸又はその塩である、(8)に記載の眼科用組成物。
(10)エデト酸又はその塩の濃度が、0.005~0.1%(w/v)である、(9)に記載の眼科用組成物。
(11)点眼剤である、(1)~(10)のいずれか1つに記載の眼科用組成物。
(12)ソフトコンタクトレンズが装用された眼に点眼されるように用いられる、(1)~(11)のいずれか1つに記載の眼科用組成物。
(13)ソフトコンタクトレンズ未装用の眼に点眼されるように用いられる、(1)~(11)のいずれか1つに記載の眼科用組成物。
(14)1眼あたり1滴又は2滴を1回として1日2回~4回点眼されるように用いられる、(1)~(13)のいずれか1つに記載の眼科用組成物。
(15)ソフトコンタクトレンズが、グループI、グループII、グループIII及びグループIVのいずれかに分類されるソフトコンタクトレンズである、(1)~(14)のいずれか1つに記載の眼科用組成物。
(16)0.05~1%(w/v)の濃度のほう酸又はその塩、0.01~0.05%(w/v)の濃度のエデト酸又はその塩、及び等張化剤を含有する、ソフトコンタクトレンズの変質を抑制する眼科用組成物であって、さらに0.05%~0.1(w/v)の濃度のエピナスチン又はその塩を含有し、前記ソフトコンタクトレンズは最長1か月装用可能なソフトコンタクトレンズである、眼科用組成物。
(17)ほう酸又はその塩、及びエピナスチン又はその塩を含有する眼科用組成物をソフトコンタクトレンズが装用された眼に投与することにより、ソフトコンタクトレンズの変質を抑制する方法。
(18)ほう酸又はその塩、及びエピナスチン又はその塩を含有し、前記ほう酸又はその塩の濃度が0.01~2%(w/v)である、花粉破裂抑制剤。
(19)エピナスチン又はその塩の濃度が0.05%(w/v)以上である、(18)に記載の花粉破裂抑制剤。
(20)エピナスチン又はその塩の濃度が0.1%(w/v)である、(18)に記載の花粉破裂抑制剤。
(21)塩化ベンザルコニウムを含有しない、(18)~(20)のいずれか1つに記載の花粉破裂抑制剤。
(22)さらに緩衝剤を含有する、(18)~(21)のいずれか1つに記載の花粉破裂抑制剤。
(23)さらに等張化剤を含有する、(18)~(22)のいずれか1つに記載の花粉破裂抑制剤。
(24)さらにpH調節剤を含有する、(18)~(23)のいずれか1つに記載の花粉破裂抑制剤。
(25)さらに安定化剤を含有する、(18)~(24)のいずれか1つに記載の花粉破裂抑制剤。
(26)点眼用である、(18)~(25)のいずれか1つに記載の花粉破裂抑制剤。
(27)ソフトコンタクトレンズが装用された眼に点眼されるように用いられる、(18)~(26)のいずれか1つに記載の花粉破裂抑制剤。
(28)ソフトコンタクトレンズ未装用の眼に点眼されるように用いられる、(18)~(26)のいずれか1つに記載の花粉破裂抑制剤。
(29)1眼あたり1滴又は2滴を1回として1日2回~4回点眼されるように用いられる、(18)~(28)のいずれか1つに記載の花粉破裂抑制剤。
(30)ほう酸又はその塩、エピナスチン又はその塩、及び等張化剤を含有し、前記ほう酸又はその塩の濃度が0.05~1%(w/v)であり、前記エピナスチン又はその塩の濃度が0.05%~0.1(w/v)である、花粉破裂抑制剤。
(31)エピナスチン又はその塩、及び0.01~2%(w/v)の濃度のほう酸又はその塩を含有する眼科用組成物を、花粉と接触させることを特徴とする、花粉の破裂を抑制する方法。
(32)ほう酸又はその塩、及びエピナスチン又はその塩を含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)以下であり、ソフトコンタクトレンズが装用された眼に点眼されるように用いられることを特徴とする、眼科用組成物。
(33)エピナスチン又はその塩の濃度が0.1%(w/v)である、(32)に記載の眼科用組成物。
(34)エピナスチン又はその塩の濃度が0.05%(w/v)である、(32)に記載の眼科用組成物。
(35)ほう酸又はその塩の濃度が、0.01~2%(w/v)である、(32)~(34)のいずれか1つに記載の眼科用組成物。
(36)塩化ベンザルコニウムを含有しない、(32)~(35)のいずれか1つに記載の眼科用組成物。
(37)さらに緩衝剤を含有する、(32)~(36)のいずれか1つに記載の眼科用組成物。
(38)さらに等張化剤を含有する、(32)~(37)のいずれか1つに記載の眼科用組成物。
(39)さらに安定化剤を含有する、(32)~(38)のいずれか1つに記載の眼科用組成物。
(40)安定化剤がエデト酸又はその塩である、(39)に記載の眼科用組成物。
(41)エデト酸又はその塩の濃度が、0.005~0.1%(w/v)である、(40)に記載の眼科用組成物。
(42)点眼剤である、(32)~(41)のいずれか1つに記載の眼科用組成物。
(43)ソフトコンタクトレンズが、最長1か月装用可能なソフトコンタクトレンズである、(32)~(42)のいずれか1つに記載の眼科用組成物。
(44)ほう酸又はその塩、及びエピナスチン又はその塩を含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)以下である、眼科用組成物。
(45)エピナスチン又はその塩の濃度が0.1%(w/v)である、(44)に記載の眼科用組成物。
(46)エピナスチン又はその塩の濃度が0.05%(w/v)である、(44)に記載の眼科用組成物。
(47)ほう酸又はその塩の濃度が、0.01~2%(w/v)である、(44)~(46)のいずれか1つに記載の眼科用組成物。
(48)塩化ベンザルコニウムを含有しない、(44)~(47)のいずれか1つに記載の眼科用組成物。
(49)さらに緩衝剤を含有する、(44)~(48)のいずれか1つに記載の眼科用組成物。
(50)さらに等張化剤を含有する、(44)~(49)のいずれか1つに記載の眼科用組成物。
(51)さらに安定化剤を含有する、(44)~(50)のいずれか1つに記載の眼科用組成物。
(52)安定化剤がエデト酸又はその塩である、(51)に記載の眼科用組成物。
(53)エデト酸又はその塩の濃度が、0.005~0.1%(w/v)である、(52)に記載の眼科用組成物。
(54)点眼剤である、(44)~(53)のいずれか1つに記載の眼科用組成物。
(55)ほう酸又はその塩、及びエピナスチン又はその塩を含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)である、眼科用組成物。
(56)ほう酸又はその塩の濃度が、0.01~2%(w/v)である、(55)に記載の眼科用組成物。
(57)緩衝剤としてほう酸又はその塩を含有する、(55)または(56)に記載の眼科用組成物。
(58)緩衝剤としてほう酸又はその塩のみを含有する、(55)~(57)のいずれか1つに記載の眼科用組成物。
(59)塩化ベンザルコニウムを含有しない、(55)~(58)のいずれか1つに記載の眼科用組成物。
(60)リン酸又はその塩を含有しない、(55)~(59)のいずれか1つに記載の眼科用組成物。
(61)点眼剤である、(55)~(60)のいずれか1つに記載の眼科用組成物。
(62)アレルギー性結膜炎を治療するための、(55)~(61)のいずれか1つに記載の眼科用組成物。
(63)1眼あたり1滴又は2滴を1回として1日2回点眼されるように用いられることを特徴とする、(55)~(62)のいずれか1つに記載の眼科用組成物。
なお、前記(1)から(63)の各構成は、任意に2以上を選択して組み合わせることができる。
(64)治療が必要な患者に、治療上の有効量の(18)~(30)のいずれか1つに記載の花粉破裂抑制剤を投与することを特徴とする、アレルギー性疾患を治療および/または予防する方法。
(65)アレルギー性疾患の治療および/または予防に使用する、(18)~(30)のいずれか1つに記載の花粉破裂抑制剤。
(66)アレルギー性疾患を治療および/または予防するための医薬を製造するための、(18)~(30)のいずれか1つに記載の花粉破裂抑制剤の使用。
(67)アレルギー性疾患がアレルギー性結膜炎である、(64)に記載の方法、(65)に記載の花粉破裂抑制剤または(66)に記載の使用。
(68)治療が必要な患者に、治療上の有効量の(1)~(16)および(32)~(61)のいずれか1つに記載の眼科用組成物を投与することを特徴とする、アレルギー性疾患を治療および/または予防する方法。
(69)アレルギー性疾患の治療および/または予防に使用する、(1)~(16)および(32)~(61)のいずれか1つに記載の眼科用組成物。
(70)アレルギー性疾患を治療および/または予防するための医薬を製造するための、(1)~(16)および(32)~(61)のいずれか1つに記載の眼科用組成物の使用。
(71)アレルギー性疾患がアレルギー性結膜炎である、(68)に記載の方法、(69)に記載の眼科用組成物または(70)に記載の使用。
(72)1眼あたり1滴又は2滴を1回として1日2回点眼されるように用いられることを特徴とする、(68)に記載の方法、(69)に記載の眼科用組成物または(70)に記載の使用。
無機酸との塩としては、塩酸、臭化水素酸、ヨウ化水素酸、硝酸、硫酸、リン酸等との塩が挙げられる。
有機酸との塩としては、酢酸、シュウ酸、フマル酸、マレイン酸、コハク酸、リンゴ酸、クエン酸、酒石酸、アジピン酸、グルコン酸、グルコヘプト酸、グルクロン酸、テレフタル酸、メタンスルホン酸、アラニン、乳酸、馬尿酸、1,2-エタンジスルホン酸、イセチオン酸、ラクトビオン酸、オレイン酸、没食子酸、パモ酸、ポリガラクツロン酸、ステアリン酸、タンニン酸、トリフルオロメタンスルホン酸、ベンゼンスルホン酸、p-トルエンスルホン酸、硫酸ラウリル、硫酸メチル、ナフタレンスルホン酸、スルホサリチル酸等との塩が挙げられる。
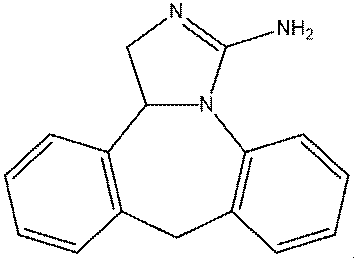
エピナスチンの塩としては、一塩酸塩(エピナスチン塩酸塩)が特に好ましい。
なお、本発明において、「%(w/v)」は、本発明の眼科用組成物100mL中に含まれる対象成分の質量(g)を意味する。本発明において、エピナスチンの塩が含有される場合、その値はエピナスチンの塩の含有量である。また、本発明において、エピナスチン又はその塩が水和物又は溶媒和物の形態をとって配合される場合、その値はエピナスチン又はその塩の、水和物又は溶媒和物の含有量である。以下、特に断りがない限り同様とする。
本発明の眼科用組成物に緩衝剤を配合する場合、緩衝剤を2種以上一緒に用いてもよい。
本発明の眼科用組成物に等張化剤を配合する場合、等張化剤を2種以上一緒に用いてもよい。
本発明の眼科用組成物に粘稠化剤を配合する場合、粘稠化剤を2種以上一緒に用いてもよい。
本発明の眼科用組成物に界面活性化剤を配合する場合、界面活性化剤を2種以上一緒に用いてもよい。
エデト酸又はその塩としては、エデト酸、エデト酸二ナトリウム、エデト酸四ナトリウム等が挙げられる。
本発明の眼科用組成物に安定化剤を配合する場合、安定化剤を2種以上一緒に用いてもよい。
本発明の眼科用組成物に抗酸化剤を配合する場合、抗酸化剤を2種以上一緒に用いてもよい。
以下に本発明の代表的な製剤例を示す。なお、下記製剤例において各成分の配合量は製剤100mL中の含量である。
エピナスチン塩酸塩 0.05g
ほう酸 0.05g
リン酸二水素ナトリウム2水和物 1.0g
塩化ナトリウム 0.5g
希塩酸 適量
水酸化ナトリウム 適量
精製水 適量
pH 7.0
エピナスチン塩酸塩 0.1g
ほう酸 0.1g
リン酸二水素ナトリウム2水和物 0.3g
リン酸水素ナトリウム12水和物 1.0g
塩化ナトリウム 0.5g
希塩酸 適量
水酸化ナトリウム 適量
精製水 適量
pH 7.0
エピナスチン塩酸塩 0.1g
ほう酸 0.1g
リン酸二水素ナトリウム2水和物 0.3g
リン酸水素ナトリウム12水和物 1.0g
エデト酸ナトリウム 0.01g
塩化ナトリウム 0.5g
希塩酸 適量
水酸化ナトリウム 適量
精製水 適量
pH 7.0
エピナスチン塩酸塩 0.1g
ほう酸 1.0g
塩化ナトリウム 0.5g
希塩酸 適量
水酸化ナトリウム 適量
精製水 適量
pH 7.0
1.滴下によるソフトコンタクトレンズ(SCL)変形試験
(1)被験製剤の調製
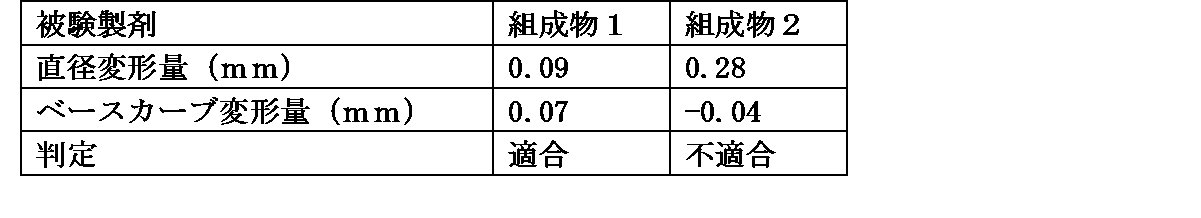
含有するエピナスチン塩酸塩の濃度が0.1%(w/v)となるように、エピナスチン塩酸塩、リン酸塩、塩化ナトリウムを水に溶解し、pH調節剤(塩酸および/または水酸化ナトリウム)と水を加えて全量を10mLとし、濾過滅菌を行うことにより、組成物1の被験製剤(pH7.0)を調製した。また、エピナスチン塩酸塩の濃度を0.15%(w/v)にすること以外は、組成物1の被験製剤と同様の方法で、組成物2の被験製剤(pH7.0)を調製した。なお、組成物2の被験製剤中に含有されるリン酸塩及び塩化ナトリウムの量は、組成物1の被験製剤と同量である。
ソフトコンタクトレンズの凸面に各被験製剤1滴を滴下し、ソフトコンタクトレンズ全体に行き渡らせた。余りを振り落とし、4分後に生理食塩水ですすいで洗浄した。これを1サイクルとして、7サイクル繰り返した。ソフトコンタクトレンズの直径およびベースカーブを測定し、直径変形量及びベースカーブ変形量が-0.20~+0.20の範囲を適合とした。なお、使用したソフトコンタクトレンズはグループIVに分類される2ウィークアキュビュー(登録商標)(ジョンソン・エンド・ジョンソン株式会社)である。
直径変形量及びベースカーブ変形量は以下の計算式より算出した。
直径変形量(mm)=(7サイクル後の直径)-(使用前の直径)
ベースカーブ変形量(mm)=(7サイクル後のベースカーブ)-(使用前のベースカーブ)
(1)被験製剤の調製
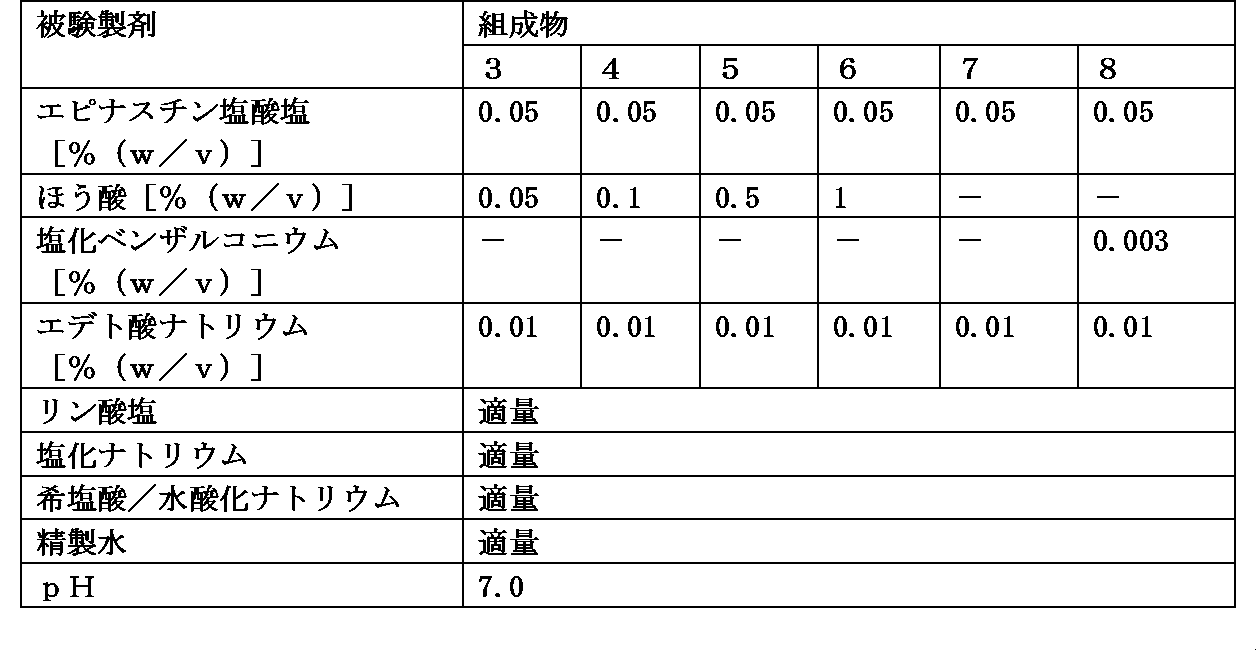
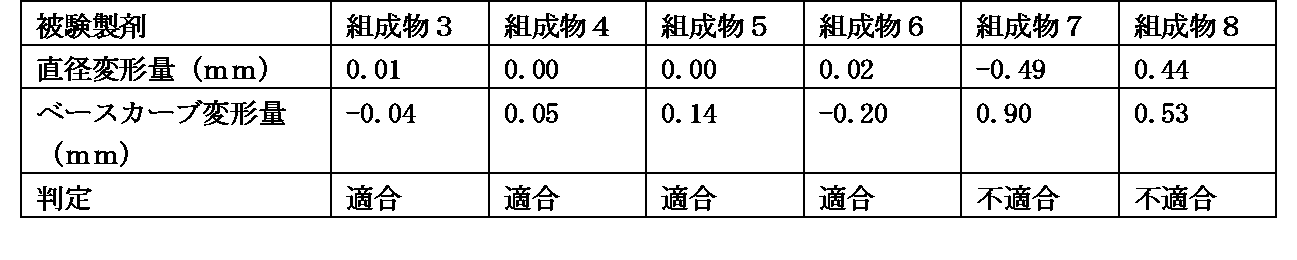
組成物1の調製方法と同様の方法にて、組成物3~8の被験製剤を調製した。各被験製剤中に含まれる各成分の濃度は、表2に示す通りである。なお、各被験製剤中に含有されるリン酸塩及び塩化ナトリウムの量は、各被験製剤間に差は無く同量含有される。
各被験製剤中にソフトコンタクトレンズを室温で10分間浸漬し、取り出した。ソフトコンタクトレンズの直径およびベースカーブを測定し、直径変形量及びベースカーブ変形量が-0.20~+0.20の範囲を適合とした。なお、使用したソフトコンタクトレンズはグループIVに分類される2ウィークアキュビュー(登録商標)(ジョンソン・エンド・ジョンソン株式会社)である。
直径変形量及びベースカーブ変形量は以下の計算式より算出した。
直径変形量(mm)=(浸漬後の直径)-(浸漬前の直径)
ベースカーブ変形量(mm)=(浸漬後のベースカーブ)-(浸漬前のベースカーブ)
(1)被験製剤の調製
被験製剤として、上記の「2.浸漬によるソフトコンタクトレンズ(SCL)変形試験」で使用した組成物5~7の被験製剤を使用した。
スギ花粉粒子を約3μLずつ採取し、96ウェルマイクロプレートに播種した。その後、各ウェルに被験製剤50μLを滴下し、直後に血球計算盤を用いて光学顕微鏡下でトータルの花粉数を計測した。さらに、経時的に滴下5分後および10分後に破裂した花粉数を同様に顕微鏡下で計測した。
花粉破裂率は以下の計算式より算出した。
花粉破裂率(%)=(滴下5分後または10分後までに破裂した花粉数)/(被験製剤滴下直後のトータル花粉数)×100
(1)被験製剤の調製
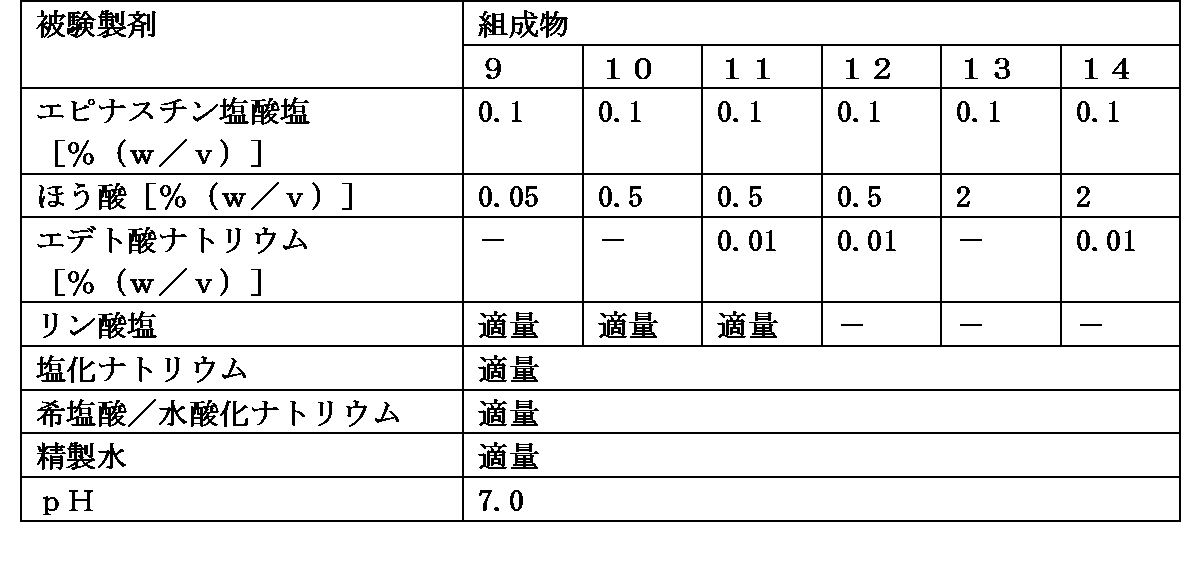
組成物1の調製方法と同様の方法にて、組成物9~14の被験製剤を調製した。各被験製剤中に含まれる各成分の濃度は、表5に示す通りである。なお、各被験製剤中に含有されるリン酸塩及び塩化ナトリウムの量は、各被験製剤間に差は無く同量含有される。
前述の「3.花粉外壁の破裂抑制試験(1)」と同様の方法を用いて、花粉破裂率を算出した。
また、表4および表6より、0.1%(w/v)の濃度のエピナスチン又はその塩、およびほう酸又はその塩を含有する組成物は、0.05%(w/v)の濃度のエピナスチン又はその塩、およびほう酸又はその塩を含有する組成物に比べて、花粉外壁の破裂を抑制することが示された。
Claims (15)
- ほう酸又はその塩、及びエピナスチン又はその塩を含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)であり、リン酸又はその塩を含有しない、pH4.0~7.5である、眼科用組成物(但し、プラノプロフェンを含む眼科用組成物及びl-メントールを含む眼科用組成物を除く)。
- ほう酸又はその塩の濃度が、0.001~5%(w/v)である、請求項1に記載の眼科用組成物。
- ほう酸又はその塩の濃度が、0.01~2%(w/v)である、請求項1に記載の眼科用組成物。
- さらに等張化剤を含有する、請求項1~3のいずれか1項に記載の眼科用組成物。
- 点眼剤である、請求項1~4のいずれか1項に記載の眼科用組成物。
- ソフトコンタクトレンズが装用された眼に点眼されるように用いられる、請求項1~5のいずれか1項に記載の眼科用組成物。
- アレルギー性結膜炎を治療するための、請求項1~6のいずれか1項に記載の眼科用組成物。
- 1眼あたり1滴又は2滴を1回として1日2回点眼されるように用いられることを特徴とする、請求項1~7のいずれか1項に記載の眼科用組成物。
- ほう酸又はその塩、等張化剤及びエピナスチン又はその塩を含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)であり、リン酸又はその塩を含有しない、pH4.0~7.5である、眼科用組成物(但し、プラノプロフェンを含む眼科用組成物及びl-メントールを含む眼科用組成物を除く)。
- ほう酸又はその塩、塩化ナトリウム及びエピナスチン又はその塩を含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)であり、リン酸又はその塩を含有しない、pH4.0~7.5である、眼科用組成物(但し、プラノプロフェンを含む眼科用組成物及びl-メントールを含む眼科用組成物を除く)。
- ほう酸又はその塩、等張化剤、安定化剤、pH調節剤、水及びエピナスチン又はその塩のみを含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)である、眼科用組成物。
- ほう酸又はその塩、等張化剤、pH調節剤、水及びエピナスチン又はその塩のみを含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)であり、pH4.0~7.5である、眼科用組成物。
- ほう酸又はその塩が、ほう酸、ほう酸ナトリウム、ほう酸カリウム及びこれらの水和物からなる群より選択される少なくとも1種である、請求項1~12のいずれか1項に記載の眼科用組成物。
- ほう酸又はその水和物、等張化剤、pH調節剤、水及びエピナスチン又はその塩のみを含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)である、眼科用組成物。
- ほう酸ナトリウム又はその水和物、等張化剤、pH調節剤、水及びエピナスチン又はその塩のみを含有する眼科用組成物であって、エピナスチン又はその塩の濃度が0.1%(w/v)である、眼科用組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021199543A JP7429681B2 (ja) | 2018-10-31 | 2021-12-08 | ソフトコンタクトレンズの変質を抑制する眼科用組成物 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2018205215A JP2019108320A (ja) | 2018-10-31 | 2018-10-31 | ソフトコンタクトレンズの変質を抑制する眼科用組成物 |
| JP2018205215 | 2018-10-31 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021199543A Division JP7429681B2 (ja) | 2018-10-31 | 2021-12-08 | ソフトコンタクトレンズの変質を抑制する眼科用組成物 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020070301A JP2020070301A (ja) | 2020-05-07 |
| JP2020070301A5 JP2020070301A5 (ja) | 2021-06-10 |
| JP6992033B2 true JP6992033B2 (ja) | 2022-01-13 |
Family
ID=67178967
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018205215A Pending JP2019108320A (ja) | 2018-10-31 | 2018-10-31 | ソフトコンタクトレンズの変質を抑制する眼科用組成物 |
| JP2019198581A Active JP6992033B2 (ja) | 2018-10-31 | 2019-10-31 | ソフトコンタクトレンズの変質を抑制する眼科用組成物 |
| JP2021199543A Active JP7429681B2 (ja) | 2018-10-31 | 2021-12-08 | ソフトコンタクトレンズの変質を抑制する眼科用組成物 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018205215A Pending JP2019108320A (ja) | 2018-10-31 | 2018-10-31 | ソフトコンタクトレンズの変質を抑制する眼科用組成物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021199543A Active JP7429681B2 (ja) | 2018-10-31 | 2021-12-08 | ソフトコンタクトレンズの変質を抑制する眼科用組成物 |
Country Status (4)
| Country | Link |
|---|---|
| JP (3) | JP2019108320A (ja) |
| CN (3) | CN119236081A (ja) |
| TW (1) | TWI832920B (ja) |
| WO (1) | WO2020090895A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7118579B1 (ja) | 2020-04-16 | 2022-08-16 | 参天製薬株式会社 | エピナスチン又はその塩を含有する水性組成物 |
| JP6963651B2 (ja) * | 2020-04-16 | 2021-11-10 | 参天製薬株式会社 | エピナスチン又はその塩を含有する水性組成物 |
| JP7114668B2 (ja) * | 2020-10-08 | 2022-08-08 | 参天製薬株式会社 | エピナスチン又はその塩を含有する花粉破裂抑制剤 |
| EP4268825A4 (en) * | 2020-12-24 | 2024-12-11 | Santen Pharmaceutical Co., Ltd. | PHARMACEUTICAL COMPOSITION FOR TRANSDERMAL ADMINISTRATION CONTAINING EPINASTIN OR SALT THEREOF WITH SULPHUR-BASED ANTIOXIDANT |
| CN113608363B (zh) * | 2021-08-24 | 2023-04-14 | 江苏康耐特光学有限公司 | 一种制备高折射率树脂镜片的前弯弯度设计方法 |
| JP2023166315A (ja) * | 2022-05-09 | 2023-11-21 | ロート製薬株式会社 | 眼科組成物 |
| KR20250126761A (ko) | 2022-12-23 | 2025-08-25 | 산텐 세이야꾸 가부시키가이샤 | 조직 이행성 및 방부 효력을 향상시키는 에피나스틴 함유 수성 조성물 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007088783A1 (ja) | 2006-02-02 | 2007-08-09 | Menicon Co., Ltd. | ソフトコンタクトレンズ用点眼・装着液 |
| WO2015152155A1 (ja) | 2014-03-31 | 2015-10-08 | ロート製薬株式会社 | 眼科用又は耳鼻科用水性組成物 |
| JP2018102534A (ja) | 2016-12-26 | 2018-07-05 | 小林製薬株式会社 | 花粉破裂抑制剤 |
| JP2018102535A (ja) | 2016-12-26 | 2018-07-05 | 小林製薬株式会社 | 花粉破裂抑制剤 |
| JP2019189606A (ja) | 2018-04-23 | 2019-10-31 | ロート製薬株式会社 | 眼科組成物 |
| JP2019189607A (ja) | 2018-04-23 | 2019-10-31 | ロート製薬株式会社 | 眼科組成物 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19954516A1 (de) * | 1999-11-12 | 2001-05-17 | Boehringer Ingelheim Int | Epinastin-haltige Lösungen |
| WO2016190306A1 (ja) * | 2015-05-28 | 2016-12-01 | ロート製薬株式会社 | 水性眼科組成物 |
| JP6134853B1 (ja) * | 2016-10-28 | 2017-05-24 | 参天製薬株式会社 | エピナスチン含有点眼液 |
| JP7355539B2 (ja) * | 2018-07-20 | 2023-10-03 | ロート製薬株式会社 | 眼科組成物 |
| JP7458159B2 (ja) * | 2018-09-28 | 2024-03-29 | ロート製薬株式会社 | 眼科組成物 |
-
2018
- 2018-10-31 JP JP2018205215A patent/JP2019108320A/ja active Pending
-
2019
- 2019-10-30 CN CN202411383513.5A patent/CN119236081A/zh active Pending
- 2019-10-30 CN CN201980071142.8A patent/CN112969465B/zh active Active
- 2019-10-30 WO PCT/JP2019/042590 patent/WO2020090895A1/ja not_active Ceased
- 2019-10-30 TW TW108139295A patent/TWI832920B/zh active
- 2019-10-30 CN CN202411382579.2A patent/CN119258073A/zh active Pending
- 2019-10-31 JP JP2019198581A patent/JP6992033B2/ja active Active
-
2021
- 2021-12-08 JP JP2021199543A patent/JP7429681B2/ja active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007088783A1 (ja) | 2006-02-02 | 2007-08-09 | Menicon Co., Ltd. | ソフトコンタクトレンズ用点眼・装着液 |
| WO2015152155A1 (ja) | 2014-03-31 | 2015-10-08 | ロート製薬株式会社 | 眼科用又は耳鼻科用水性組成物 |
| JP2018102534A (ja) | 2016-12-26 | 2018-07-05 | 小林製薬株式会社 | 花粉破裂抑制剤 |
| JP2018102535A (ja) | 2016-12-26 | 2018-07-05 | 小林製薬株式会社 | 花粉破裂抑制剤 |
| JP2019189606A (ja) | 2018-04-23 | 2019-10-31 | ロート製薬株式会社 | 眼科組成物 |
| JP2019189607A (ja) | 2018-04-23 | 2019-10-31 | ロート製薬株式会社 | 眼科組成物 |
Non-Patent Citations (3)
| Title |
|---|
| アレルギー・免疫,2016年,Vol.23, No.10,pages 64-71 |
| 抗アレルギー点眼剤 アレジオン(登録商標)点眼液0.05%,2017年,第5版,pages 1-4 |
| 杉尾嘉宏、石田成弘,エピナスチン塩酸塩点眼液の薬理作用と臨床成績,アレルギーの臨床,2016年,Vol.36, No.8,p. 43-51 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2019108320A (ja) | 2019-07-04 |
| CN112969465B (zh) | 2024-10-25 |
| TW202031263A (zh) | 2020-09-01 |
| CN119236081A (zh) | 2025-01-03 |
| CN112969465A (zh) | 2021-06-15 |
| JP2022022379A (ja) | 2022-02-03 |
| CN119258073A (zh) | 2025-01-07 |
| TWI832920B (zh) | 2024-02-21 |
| JP2020070301A (ja) | 2020-05-07 |
| JP7429681B2 (ja) | 2024-02-08 |
| WO2020090895A1 (ja) | 2020-05-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6992033B2 (ja) | ソフトコンタクトレンズの変質を抑制する眼科用組成物 | |
| JP2024116303A (ja) | 点眼剤 | |
| MX2014012158A (es) | Composicion farmaceutica de ibuprofeno y tramadol para uso oftalmico. | |
| TW201442710A (zh) | 用以避免或治療乾眼症之含瑞巴派特或其前藥之口服藥物組成 | |
| JP2013534527A (ja) | コンタクトレンズ乳頭結膜炎及びアレルギー性眼疾患の予防及び処置のための組成物 | |
| JP2018508545A (ja) | ブリモニジン及びチモロールの固定用量合剤 | |
| KR20230041692A (ko) | 고안압증 및 녹내장의 치료 및 예방을 위한 히알루론산계 제제 | |
| JP7247278B2 (ja) | 水性医薬組成物 | |
| JP7346305B2 (ja) | ピリジルアミノ酢酸化合物を含有する医薬製剤 | |
| RU2670100C2 (ru) | Офтальмическая композиция для цвиттерионных мягких контактных линз | |
| JP7628098B2 (ja) | エピナスチン又はその塩を含有する花粉破裂抑制剤 | |
| JP2020070297A (ja) | ソフトコンタクトレンズの変質を抑制する眼科用組成物 | |
| JP2024508706A (ja) | 近視の治療 | |
| RU2669570C2 (ru) | Офтальмологическая композиция для цвиттерионных мягких контактных линз | |
| WO2024212857A1 (en) | Methods for treating corneal injuries | |
| KR102901189B1 (ko) | 피리딜아미노아세트산 화합물을 함유하는 의약 제제 | |
| WO2024034592A1 (ja) | Udcaまたはその塩を含有する水性医薬組成物 | |
| KR20240083180A (ko) | 안과용 조성물 및 이의 사용 방법 | |
| JP2016034936A (ja) | 角膜上皮障害治療剤の組み合わせ | |
| KR20120137640A (ko) | 일회용 안과 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210325 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210325 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20210325 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210615 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210812 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211004 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211207 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211208 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6992033 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |