JP6856074B2 - 測定方法、測定装置および測定システム - Google Patents
測定方法、測定装置および測定システム Download PDFInfo
- Publication number
- JP6856074B2 JP6856074B2 JP2018534326A JP2018534326A JP6856074B2 JP 6856074 B2 JP6856074 B2 JP 6856074B2 JP 2018534326 A JP2018534326 A JP 2018534326A JP 2018534326 A JP2018534326 A JP 2018534326A JP 6856074 B2 JP6856074 B2 JP 6856074B2
- Authority
- JP
- Japan
- Prior art keywords
- light
- flow path
- sample
- unit
- measured
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000034 method Methods 0.000 title claims description 53
- 239000007788 liquid Substances 0.000 claims description 155
- 229910052751 metal Inorganic materials 0.000 claims description 137
- 239000002184 metal Substances 0.000 claims description 137
- 239000000126 substance Substances 0.000 claims description 107
- 238000012545 processing Methods 0.000 claims description 106
- 238000005534 hematocrit Methods 0.000 claims description 104
- 238000005259 measurement Methods 0.000 claims description 100
- 230000003287 optical effect Effects 0.000 claims description 85
- 238000001514 detection method Methods 0.000 claims description 68
- 210000004369 blood Anatomy 0.000 claims description 28
- 239000008280 blood Substances 0.000 claims description 28
- 238000000691 measurement method Methods 0.000 claims description 18
- 210000003743 erythrocyte Anatomy 0.000 claims description 12
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 claims description 12
- 230000008569 process Effects 0.000 claims description 4
- 239000010408 film Substances 0.000 description 155
- 239000000523 sample Substances 0.000 description 123
- 230000005284 excitation Effects 0.000 description 83
- 230000007246 mechanism Effects 0.000 description 26
- 238000006243 chemical reaction Methods 0.000 description 20
- 238000002835 absorbance Methods 0.000 description 18
- 238000003860 storage Methods 0.000 description 17
- 238000012986 modification Methods 0.000 description 16
- 230000004048 modification Effects 0.000 description 16
- 238000012546 transfer Methods 0.000 description 16
- 239000011248 coating agent Substances 0.000 description 14
- 238000000576 coating method Methods 0.000 description 14
- 239000000463 material Substances 0.000 description 14
- 238000010521 absorption reaction Methods 0.000 description 12
- 239000007924 injection Substances 0.000 description 11
- 238000002347 injection Methods 0.000 description 11
- 238000012360 testing method Methods 0.000 description 10
- 239000000975 dye Substances 0.000 description 9
- 230000008859 change Effects 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 230000035945 sensitivity Effects 0.000 description 7
- 238000009434 installation Methods 0.000 description 6
- 239000011347 resin Substances 0.000 description 6
- 229920005989 resin Polymers 0.000 description 6
- 238000010517 secondary reaction Methods 0.000 description 6
- 210000002966 serum Anatomy 0.000 description 6
- 230000003416 augmentation Effects 0.000 description 5
- 239000007853 buffer solution Substances 0.000 description 5
- 238000012937 correction Methods 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 238000010790 dilution Methods 0.000 description 5
- 239000012895 dilution Substances 0.000 description 5
- 238000002372 labelling Methods 0.000 description 5
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 4
- 229910052737 gold Inorganic materials 0.000 description 4
- 239000010931 gold Substances 0.000 description 4
- 239000012535 impurity Substances 0.000 description 4
- 230000001678 irradiating effect Effects 0.000 description 4
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 4
- 239000004926 polymethyl methacrylate Substances 0.000 description 4
- 102000001554 Hemoglobins Human genes 0.000 description 3
- 108010054147 Hemoglobins Proteins 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 3
- 238000011088 calibration curve Methods 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 230000012447 hatching Effects 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 238000007493 shaping process Methods 0.000 description 3
- 229910052709 silver Inorganic materials 0.000 description 3
- 239000004332 silver Substances 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- 229910045601 alloy Inorganic materials 0.000 description 2
- 239000000956 alloy Substances 0.000 description 2
- 238000000149 argon plasma sintering Methods 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- CVSVTCORWBXHQV-UHFFFAOYSA-N creatine Chemical compound NC(=[NH2+])N(C)CC([O-])=O CVSVTCORWBXHQV-UHFFFAOYSA-N 0.000 description 2
- 238000000151 deposition Methods 0.000 description 2
- 230000008021 deposition Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 239000003989 dielectric material Substances 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 238000001215 fluorescent labelling Methods 0.000 description 2
- 239000003219 hemolytic agent Substances 0.000 description 2
- 230000031700 light absorption Effects 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 2
- 229910052753 mercury Inorganic materials 0.000 description 2
- 238000007747 plating Methods 0.000 description 2
- 239000012088 reference solution Substances 0.000 description 2
- 239000012488 sample solution Substances 0.000 description 2
- 229910052710 silicon Inorganic materials 0.000 description 2
- 239000010703 silicon Substances 0.000 description 2
- 238000004544 sputter deposition Methods 0.000 description 2
- 239000010409 thin film Substances 0.000 description 2
- 238000007740 vapor deposition Methods 0.000 description 2
- 238000009423 ventilation Methods 0.000 description 2
- 238000003466 welding Methods 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 206010018910 Haemolysis Diseases 0.000 description 1
- 102000036675 Myoglobin Human genes 0.000 description 1
- 108010062374 Myoglobin Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000002313 adhesive film Substances 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 230000003190 augmentative effect Effects 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 229960003624 creatine Drugs 0.000 description 1
- 239000006046 creatine Substances 0.000 description 1
- 238000002788 crimping Methods 0.000 description 1
- 150000001925 cycloalkenes Chemical class 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 238000001917 fluorescence detection Methods 0.000 description 1
- 238000001506 fluorescence spectroscopy Methods 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- -1 for example Substances 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 239000003574 free electron Substances 0.000 description 1
- 230000008588 hemolysis Effects 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/41—Refractivity; Phase-affecting properties, e.g. optical path length
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/648—Specially adapted constructive features of fluorimeters using evanescent coupling or surface plasmon coupling for the excitation of fluorescence
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
- G01N33/49—Blood
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
- G01N33/49—Blood
- G01N33/4915—Blood using flow cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/551—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being inorganic
- G01N33/553—Metal or metal coated
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0663—Whole sensors
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0877—Flow chambers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/12—Specific details about materials
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/16—Surface properties and coatings
- B01L2300/168—Specific optical properties, e.g. reflective coatings
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/55—Specular reflectivity
- G01N21/552—Attenuated total reflection
- G01N21/553—Attenuated total reflection and using surface plasmons
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Physics & Mathematics (AREA)
- General Health & Medical Sciences (AREA)
- Analytical Chemistry (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Biochemistry (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Biotechnology (AREA)
- Cell Biology (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Inorganic Chemistry (AREA)
- Ecology (AREA)
- Clinical Laboratory Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Description
(測定システム)
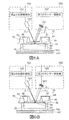
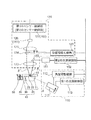
図1は、実施の形態1に係る測定システム1の構成の一例を示す模式図である。本実施の形態に係る測定システム1は、測定チップ10およびSPFS装置100を有する。測定システム1は、血液を含む検体中の被測定物質の量を測定するためのシステムである。
測定チップ10は、プリズム20、金属膜30および流路蓋40を有する。本実施の形態では、測定チップ10の流路蓋40は、後述の液体チップ50と一体化されている。
次に、SPFS装置100の各構成要素について説明する。前述のとおり、SPFS装置100は、励起光出射部110、シグナル検出部120、送液部130、搬送部140、光出射部150、光検出部160および制御処理部(処理部)170を有する。
図1に示されるように、励起光αは、入射面21からプリズム20内に入射する。プリズム20内に入射した励起光αは、金属膜30に全反射角度(SPRが生じる角度)で入射する。このように、金属膜30に対して励起光αをSPRが生じる角度で照射することで、金属膜30上に局在場光を発生させることができる。この局在場光により、金属膜30上に存在する被測定物質を標識する蛍光物質が励起され、蛍光βが放出される。SPFS装置100は、蛍光物質から放出された蛍光βの光量(強度)を検出する。なお、特に図示していないが、金属膜30での励起光αの反射光は、出射面23でプリズム20外に出射する。
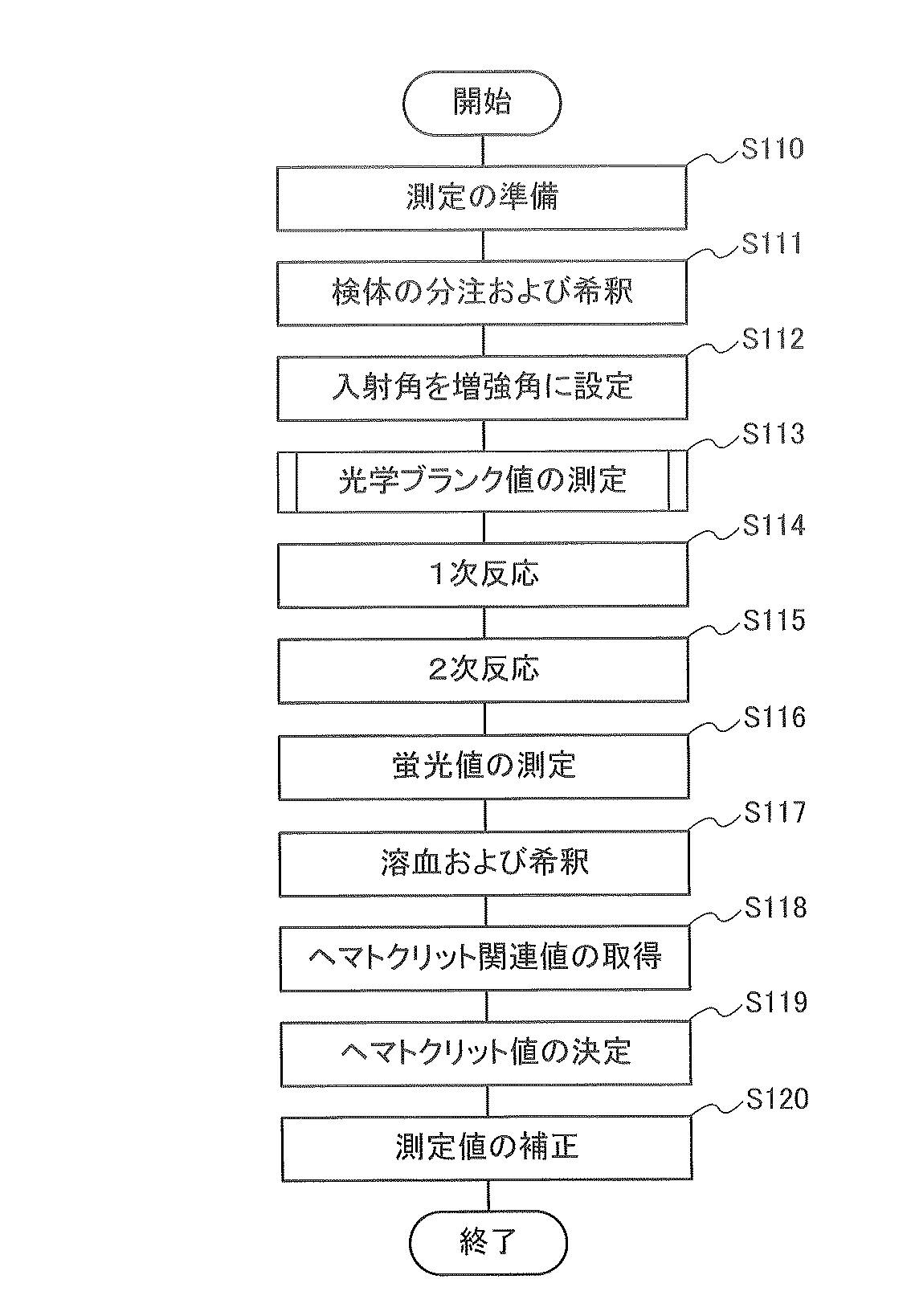
次に、実施の形態1に係る測定システム1の動作手順(実施の形態1に係る測定方法)について説明する。図3は、測定システム1の動作手順の一例を示すフローチャートである。図4は、図3に示される光学ブランク値の測定工程(工程S113)内の工程を示すフローチャートである。本実施の形態では、検体中の被測定物質の量を示す測定値として、蛍光βの光量である蛍光値が測定される。
本実施の形態では、液体を収容するための流路41が空洞となっている。このため、本実施の形態に係る測定方法では、検体を試験紙に吸収させた状態で光学測定を行う従来の測定方法のように、試験紙による光の散乱が生じない。また、本実施の形態に係る測定方法では、色素による呈色反応を利用している従来の測定方法のように、色素による光の吸収も生じない。これらの結果として、本実施の形態に係る測定方法では、検体のヘマトクリット値を高精度に測定することができ、血漿中の被測定物質の量を高精度に決定することができる。
実施の形態2では、流路の高さに基づいてヘマトクリット値を補正する。実施の形態2に係る測定システムおよび測定装置の構成は、光検出部を除いて実施の形態1に係る測定システムおよび測定装置と同じ構成であるため、同じ構成要素については、同じ符号を付してその説明を省略する。
図1は、実施の形態2に係る測定システム2の構成を示す模式図である。図1に示されるように、測定システム2は、測定チップ10およびSPFS装置200を有する。SPFS装置200は、励起光出射部110、シグナル検出部120、送液部130、搬送部140、光出射部150、光検出部260および制御処理部(処理部)270を有する。実施の形態2では、光出射部150および光検出部260は、検体のヘマトクリット値を取得するためのヘマトクリット値取得部を構成する。
次に、実施の形態2に係る測定システム2の動作手順(実施の形態2に係る測定方法)について説明する。図5は、測定システム2の動作手順の一例を示すフローチャートである。
実施の形態2では、実施の形態1の効果に加えて、より高精度にヘマトクリット値を測定し、より高精度に血漿中の被測定物質の量を決定することができる。実施の形態2では、流路41の高さに基づいてヘマトクリット値を補正することで、測定チップ10の製造時における寸法誤差の影響を取り除くことができる。これにより、測定チップ10に要求される寸法精度を低減することができる。
実施の形態3でも、流路の高さに基づいてヘマトクリット値を補正する。実施の形態3に係る測定システムおよび測定装置は、測定装置の動作手順(測定方法)を除いて、実施の形態1に係る測定システムおよび測定装置と同じであるため、同じ構成要素については、同じ符号を付してその説明を省略する。
図1は、実施の形態3に係る測定システム3の構成を示す模式図である。図1に示されるように、測定システム3は、測定チップ10およびSPFS装置300を有する。SPFS装置300は、励起光出射部110、シグナル検出部120、送液部130、搬送部140、光出射部150、光検出部160および制御処理部(処理部)370を有する。
実施の形態3に係る測定システム3の動作手順(実施の形態3に係る測定方法)について説明する。図7は、測定システム3の動作手順の一例を示すフローチャートである。
実施の形態3では、実施の形態2と同様の効果を得られる。
(変形例1)
上記実施の形態1〜3では、金属膜である金属膜30において、第1の光δ1を鏡面反射させるとともに、表面プラズモン共鳴を生じさせる態様について説明したが、本発明はこの態様に限定されない。図8は、変形例1に係る測定システムにおけるヘマトクリット値取得部の構成を示す模式図である。図8においては、測定チップ10’内の光路を示すために、測定チップ10’の断面へのハッチングを省略している。図8に示されるように、第1の光δ1を鏡面反射させるための反射部30’と、表面プラズモンを生じさせる金属膜30とが別体として形成されていてもよい。なお、変形例1に係る測定チップ10’のプリズム20は、励起光αおよび第1の光δ1(および第1の光δ1と同じ波長の光δ’)に対して透明な誘電体からなる。
上記実施の形態1〜3では、測定値取得部とヘマトクリット値測定部とが別体である態様について説明したが、本発明はこの態様に限定されない。図9は、変形例2に係る測定システムにおける測定値取得部およびヘマトクリット値取得部の構成を示す模式図である。図9に示されるように、測定値取得部およびヘマトクリット値取得部は、一体として構成されていてもよい。変形例2に係るSPFS装置は、必要に応じて、他の光学素子を有していてもよい。変形例2に係るSPFS装置は、第2の光源ユニット151からの第1の光δ1を反射するためのミラー153を有する。
10、10’ 測定チップ
20 プリズム
21 入射面
22 成膜面
23 出射面
30 金属膜
30’ 反射部
40 流路蓋
41 流路
42 枠体
43 液体注入部被膜フィルム
44 液体貯蔵部被膜フィルム
45 液体注入部
46 液体貯蔵部
47 通気孔
48 ピペットチップ用貫通孔
50 液体チップ
100、200、300 SPFS装置
110 励起光出射部(第2の光出射部)
111 第1の光源ユニット
112 角度調整機構
113 第1の光源制御部
120 シグナル検出部
121 受光光学系ユニット
122 位置切替え機構
123 第1のレンズ
124 光学フィルター
125 第2のレンズ
126 第1の受光センサー
127 第1のセンサー制御部
130 送液部
131 ピペット
132 シリンジポンプ
133 ノズルユニット
134 ピペットチップ
135 ピペット制御部
140 搬送部
141 搬送ステージ
142 チップホルダー
150 光出射部
151 第2の光源ユニット
152 第2の光源制御部
153 ミラー
160、260 光検出部
161、261 第2の受光センサー
162 第2のセンサー制御部
170、270、370 制御処理部
α 励起光(第8の光)
β 蛍光
γ プラズモン散乱光
δ1 第1の光
δ’ 測定チップ内での第1の光の反射光
δ2 第2の光
δ3 第3の光
δ4 第4の光
δ5 第5の光
δ7 第7の光
δ9 第9の光
Claims (21)
- 血液を含む検体中の被測定物質の量を測定するための測定方法であって、
液体を収容するための空洞である流路と、前記流路内を通過した光を、前記流路内を再度通過するように鏡面反射させるための反射部と、を有する測定チップの前記流路内に、前記被測定物質を含む前記検体を導入し、前記検体中の前記被測定物質の量を示す測定値を取得する工程と、
前記検体が前記流路内に存在する状態で、赤血球が吸収する波長の光を含む第1の光が前記流路内の前記検体を透過し、前記反射部で反射し、かつ前記流路内の前記検体を再度透過することで得られる第2の光を検出する工程と、
前記第2の光の検出結果、並びに、前記第2の光となる光の前記流路内の光路長、前記流路の高さ、および前記第1の光の波長の少なくとも1つに基づいて、前記検体のヘマトクリット値を決定する工程と、
前記ヘマトクリット値に基づいて前記測定値を補正する工程と、
を含む、測定方法。 - 前記流路内が空洞である第1の状態で、前記第1の光が前記流路内を通過し、前記反射部で反射し、かつ前記流路内を再度通過することで得られる第3の光と、前記第1の光が前記流路の、前記反射部に対向する面で反射することで得られる第4の光とをアレイセンサーにより検出する工程と、
前記第1の光に対して透明な第1の液で、前記流路内が満たされている第2の状態で、前記第1の光が前記流路内の前記第1の液を透過し、前記反射部で反射し、かつ前記流路内の前記第1の液を再度透過することで得られる第5の光をアレイセンサーにより検出する工程と、
前記第3の光、前記第4の光および前記第5の光の検出結果に基づいて、前記第2の光となる光の前記流路内の光路長または前記流路の高さを決定する工程と、
をさらに含む、請求項1に記載の測定方法。 - 前記第1の光の少なくとも一部の波長の光を吸収する色素を含む第2の液で、前記流路内が満たされている状態で、前記第1の光が前記流路内の前記第2の液を透過し、前記反射部で反射し、かつ前記流路内の前記第2の液を再度透過することで得られる第6の光を検出する工程と、
前記第6の光の検出結果に基づいて、前記第2の光となる光の前記流路内の光路長または前記流路の高さを決定する工程と、
をさらに含む、請求項1に記載の測定方法。 - 前記ヘマトクリット値を決定する工程では、血液が溶血した状態の前記検体を透過した前記第2の光の検出結果を用いる、請求項1〜3のいずれか一項に記載の測定方法。
- 前記第1の光に対して透明な参照液が前記流路内に存在する状態で、前記第1の光が前記流路内の前記参照液を透過し、前記反射部で反射し、かつ前記流路内の前記参照液を透過することで得られる第7の光を検出する工程をさらに含み、
前記ヘマトクリット値を決定する工程では、前記第2の光の検出結果、前記第7の光の検出結果、並びに、前記第2の光となる光の前記流路内の光路長、前記流路の高さ、および前記第1の光の波長の少なくとも1つに基づいて、前記ヘマトクリット値を決定する、
請求項1〜4のいずれか一項に記載の測定方法。 - 前記第2の光を検出する工程では、前記第1の光の光軸と前記第2の光の光軸とを含む平面が前記流路の長手方向に沿うように、前記第1の光を前記反射部に照射する、請求項1〜5のいずれか一項に記載の測定方法。
- 前記測定チップは、プリズムと、前記プリズム上に配置されている金属膜と、前記金属膜上に配置されている前記流路と、前記流路を挟んで前記プリズムと対向するように配置されている前記反射部と、を有し、
前記測定値を取得する工程では、前記金属膜上に、前記検体中に含まれていた前記被測定物質が固定化され、かつ前記検体が存在しない状態で、前記プリズムを介して前記金属膜に、表面プラズモン共鳴が生じる入射角で第8の光を照射したときに生じる、前記被測定物質の量を示すシグナルを検出して、前記測定値を取得し、
前記第2の光を検出する工程では、前記検体が前記流路内に存在する状態で、前記プリズム側から前記反射部に前記第1の光を照射する、
請求項1〜6のいずれか一項に記載の測定方法。 - 前記反射部は、金属膜である、請求項1〜7のいずれか一項に記載の測定方法。
- 前記測定チップは、プリズムと、前記プリズム上に配置されている金属膜である前記反射部と、前記反射部上に配置されている前記流路と、を有し、
前記測定値を取得する工程では、前記反射部上に、前記検体中に含まれていた前記被測定物質が固定化され、かつ前記検体が存在しない状態で、前記プリズムを介して前記反射部に、表面プラズモン共鳴が生じる入射角で第8の光を照射したときに生じる、前記被測定物質の量を示すシグナルを検出して、前記測定値を取得し、
前記第2の光を検出する工程では、前記検体が前記流路内に存在する状態で、前記流路側から前記反射部に前記第1の光を照射する、
請求項1〜6のいずれか一項に記載の測定方法。 - 血液を含む検体中の被測定物質の量を測定するための測定装置であって、
液体を収容するための空洞である流路と、前記流路内を通過した光を、前記流路内を再度通過するように鏡面反射させるための反射部と、を有する測定チップを保持するためのチップホルダーと、
前記チップホルダーに保持された前記測定チップの前記流路内に、前記検体中の前記被測定物質が存在する状態で、前記検体中の前記被測定物質の量を示す測定値を取得するための測定値取得部と、
赤血球が吸収する波長の光を含む第1の光を出射するための光出射部と、
前記検体が前記流路内に存在する状態で、前記光出射部が前記反射部に向けて前記第1の光を出射したときに、前記第1の光が前記流路内の前記検体を透過し、前記反射部で反射し、かつ前記流路内の前記検体を再度透過することで得られる第2の光を検出するための光検出部と、
前記光検出部による前記第2の光の検出結果、並びに、前記第2の光となる光の前記流路内の光路長、前記流路の高さ、および前記第1の光の波長の少なくとも1つに基づいて前記検体のヘマトクリット値を決定するとともに、前記ヘマトクリット値に基づいて前記測定値を補正する処理部と、
を有する、測定装置。 - 前記光検出部は、前記第2の光を受光するためのアレイセンサーを有し、
前記光検出部は、
前記流路内が空洞である状態で、前記光出射部が前記反射部に向けて前記第1の光を出射したときに、前記第1の光が前記流路内を通過し、前記反射部で反射し、かつ前記流路内を再度通過することで得られる第3の光と、前記第1の光が、前記流路の、前記反射部に対向する面で反射することで得られる第4の光とを検出し、かつ
前記第1の光に対して透明な第1の液で前記流路内が満たされている状態で、前記光出射部が前記反射部に向けて前記第1の光を出射したときに、前記第1の光が前記流路内の前記第1の液を透過し、前記反射部で反射し、かつ前記流路内の前記第1の液を再度透過することで得られる第5の光を検出し、
前記処理部は、前記アレイセンサーによる前記第3の光、前記第4の光および前記第5の光の検出結果に基づいて、前記第2の光となる光の前記流路内の光路長または前記流路の高さを決定する、
請求項10に記載の測定装置。 - 前記光検出部は、前記第1の光の少なくとも一部の波長の光を吸収する色素を含む第2の液で、前記流路内が満たされている状態で、前記光出射部が前記反射部に向けて前記第1の光を出射したときに、前記第1の光が前記流路内の前記第2の液を透過し、前記反射部で反射し、かつ前記流路内の前記第2の液を再度透過することで得られる第6の光を検出し、
前記処理部は、前記光検出部による前記第6の光の検出結果に基づいて、前記第2の光となる光の前記流路内の光路長または前記流路の高さを決定する、
請求項10に記載の測定装置。 - 前記処理部は、前記流路の高さに関する情報をあらかじめ記憶している、請求項10に記載の測定装置。
- 前記処理部は、血液が溶血した状態の前記検体を透過した前記第2の光の検出結果を用いる、請求項10〜13のいずれか一項に記載の測定装置。
- 前記光検出部は、前記第1の光に対して透明な参照液が前記流路内に存在する状態で、前記光出射部が前記反射部に向けて前記第1の光を出射したときに、前記第1の光が前記流路内の前記参照液を透過し、前記反射部で反射し、かつ前記流路内の前記参照液を再度透過することで得られる第7の光を検出し、
前記処理部は、前記第2の光の検出結果、前記第7の光の検出結果、並びに、前記第2の光となる光の前記流路内の光路長、前記流路の高さ、および前記第1の光の波長の少なくとも1つに基づいて、前記ヘマトクリット値を決定する、
請求項10〜14のいずれか一項に記載の測定装置。 - 前記光出射部および前記光検出部は、前記第1の光の光軸と前記第2の光の光軸とを含む平面が前記流路の長手方向に沿うように配置されている、請求項10〜15のいずれか一項に記載の測定装置。
- 前記測定チップは、プリズムと、前記プリズム上に配置されている金属膜と、前記金属膜上に配置されている前記流路と、前記流路を挟んで前記プリズムと対向するように配置されている前記反射部とを有し、
前記測定値取得部は、
第8の光を出射するための第2の光出射部と、
前記金属膜上に、前記検体に含まれていた前記被測定物質が固定化され、かつ前記検体が存在しない状態で、前記第2の光出射部が前記プリズムを介して前記金属膜に向けて、表面プラズモン共鳴が生じる入射角で前記第8の光を出射したときに生じる、前記被測定物質の量を示すシグナルを検出するためのシグナル検出部と、
を有し、
前記光出射部は、前記プリズム側から前記反射部に向けて前記第1の光を出射し、
前記処理部は、前記シグナル検出部の検出結果に基づいて前記測定値を取得する、
請求項10〜16のいずれか一項に記載の測定装置。 - 前記反射部は、金属膜である、請求項10〜17のいずれか一項に記載の測定装置。
- 前記測定チップは、プリズムと、前記プリズム上に配置されている金属膜である前記反射部と、前記反射部上に配置されている前記流路と、を有し、
前記測定値取得部は、
第8の光を出射するための第2の光出射部と、
前記金属膜上に、前記検体に含まれていた前記被測定物質が固定化され、かつ前記検体が存在しない状態で、前記第2の光出射部が前記プリズムを介して前記金属膜に向けて、表面プラズモン共鳴が生じる入射角で前記第8の光を出射したときに生じる、前記被測定物質の量を示すシグナルを検出するためのシグナル検出部と、
を有し、
前記光出射部は、前記流路側から前記反射部に向けて前記第1の光を出射し、
前記処理部は、前記シグナル検出部の検出結果に基づいて前記測定値を取得する、
請求項10〜16のいずれか一項に記載の測定装置。 - 前記シグナル検出部は、前記シグナルを集光するための光学レンズと、前記シグナルを受光するための受光素子とを有し、
前記光学レンズは、前記第1の光を前記反射部に導くとともに、前記第2の光を前記受光素子に導く光学レンズとしても機能し、
前記受光素子は、前記第2の光を受光するための受光素子としても機能する、
請求項19に記載の測定装置。 - 血液を含む検体中の被測定物質の量を測定するための測定システムであって、
液体を収容するための空洞である流路と、前記流路内を通過した光を、前記流路内を再度通過するように鏡面反射させるための反射部と、を有する測定チップと、
前記流路内に、前記検体中の前記被測定物質が存在する状態で、前記検体中の前記被測定物質の量を示す測定値を取得するための測定値取得部と、
赤血球が吸収する波長の光を含む第1の光を出射するための光出射部と、
前記検体が前記流路内に存在する状態で、前記光出射部が前記反射部に向けて前記第1の光を出射したときに、前記第1の光が前記流路内の前記検体を透過し、前記反射部で反射し、かつ前記流路内の前記検体を再度透過することで得られる第2の光を検出するための光検出部と、
前記光検出部による前記第2の光の検出結果、並びに、前記第2の光となる光の前記流路内の光路長、前記流路の高さ、および前記第1の光の波長の少なくとも1つに基づいて前記検体のヘマトクリット値を決定するとともに、前記ヘマトクリット値に基づいて前記測定値を補正する処理部と、
を有する、測定システム。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016160753 | 2016-08-18 | ||
| JP2016160753 | 2016-08-18 | ||
| PCT/JP2017/027868 WO2018034143A1 (ja) | 2016-08-18 | 2017-08-01 | 測定方法、測定装置および測定システム |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2018034143A1 JPWO2018034143A1 (ja) | 2019-06-13 |
| JP6856074B2 true JP6856074B2 (ja) | 2021-04-07 |
Family
ID=61196502
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018534326A Expired - Fee Related JP6856074B2 (ja) | 2016-08-18 | 2017-08-01 | 測定方法、測定装置および測定システム |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US11047798B2 (ja) |
| EP (1) | EP3505913A1 (ja) |
| JP (1) | JP6856074B2 (ja) |
| WO (1) | WO2018034143A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018051863A1 (ja) * | 2016-09-14 | 2018-03-22 | コニカミノルタ株式会社 | 測定方法 |
| EP3655162A4 (en) * | 2017-07-18 | 2021-04-21 | Molecular Devices, LLC | OBJECT RECORDING DEVICE WITH IMAGE-BASED LOCALIZATION OF THE PIPETTE TIP |
| WO2020036010A1 (ja) * | 2018-08-13 | 2020-02-20 | コニカミノルタ株式会社 | 表面プラズモン共鳴蛍光分析装置及び表面プラズモン共鳴蛍光分析方法 |
| CN112485438B (zh) * | 2020-11-10 | 2022-07-22 | 深圳市科曼医疗设备有限公司 | 一种特定蛋白反应检测方法和装置 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH01104114A (ja) | 1987-10-19 | 1989-04-21 | Fuji Giken Kk | キノコの培養基 |
| US5331958A (en) * | 1992-03-31 | 1994-07-26 | University Of Manitoba | Spectrophotometric blood analysis |
| JP3586743B2 (ja) | 1995-10-09 | 2004-11-10 | アークレイ株式会社 | ヘマトクリット値を補正した測定方法 |
| JPH11104114A (ja) * | 1997-09-30 | 1999-04-20 | Terumo Corp | 血液特性の計測装置 |
| US6064474A (en) * | 1998-02-06 | 2000-05-16 | Optical Sensors, Inc. | Optical measurement of blood hematocrit incorporating a self-calibration algorithm |
| JP4129867B2 (ja) * | 2002-07-18 | 2008-08-06 | 日機装株式会社 | ヘマトクリットセンサ |
| US7271912B2 (en) * | 2003-04-15 | 2007-09-18 | Optiscan Biomedical Corporation | Method of determining analyte concentration in a sample using infrared transmission data |
| JP5427362B2 (ja) | 2008-03-25 | 2014-02-26 | テルモ株式会社 | ヘマトクリット値または血液成分濃度の測定方法および測定装置 |
| EP2136210B1 (en) | 2008-06-18 | 2018-08-15 | Horiba, Ltd. | Body fluid sample analyzer |
| JP5806884B2 (ja) * | 2010-09-24 | 2015-11-10 | 株式会社堀場製作所 | 全血免疫測定装置及び全血免疫測定方法 |
| WO2014049704A1 (ja) * | 2012-09-26 | 2014-04-03 | テルモ株式会社 | 測定用チップ |
| WO2015129615A1 (ja) | 2014-02-25 | 2015-09-03 | コニカミノルタ株式会社 | 測定方法および測定装置 |
| WO2016039149A1 (ja) * | 2014-09-10 | 2016-03-17 | コニカミノルタ株式会社 | 検出方法および検出装置 |
| JP2016160753A (ja) | 2015-02-26 | 2016-09-05 | 尼寺空圧工業株式会社 | エンジン付きエアコンプレッサ |
-
2017
- 2017-08-01 WO PCT/JP2017/027868 patent/WO2018034143A1/ja not_active Ceased
- 2017-08-01 US US16/322,832 patent/US11047798B2/en not_active Expired - Fee Related
- 2017-08-01 JP JP2018534326A patent/JP6856074B2/ja not_active Expired - Fee Related
- 2017-08-01 EP EP17841370.4A patent/EP3505913A1/en not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| EP3505913A4 (en) | 2019-07-03 |
| JPWO2018034143A1 (ja) | 2019-06-13 |
| WO2018034143A1 (ja) | 2018-02-22 |
| EP3505913A1 (en) | 2019-07-03 |
| US20200182784A1 (en) | 2020-06-11 |
| US11047798B2 (en) | 2021-06-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6369533B2 (ja) | 測定方法および測定装置 | |
| JP6635168B2 (ja) | 表面プラズモン共鳴蛍光分析方法 | |
| US9535004B2 (en) | Surface plasmon resonance fluorescence analysis method and surface plasmon resonance fluorescence analysis device | |
| JP6424890B2 (ja) | 表面プラズモン増強蛍光測定方法、表面プラズモン増強蛍光測定装置および分析チップ | |
| JP6777090B2 (ja) | 表面プラズモン共鳴蛍光分析方法および表面プラズモン共鳴蛍光分析装置 | |
| JP6856074B2 (ja) | 測定方法、測定装置および測定システム | |
| JP6791248B2 (ja) | 検出方法および検出装置 | |
| JP6848975B2 (ja) | 測定方法 | |
| JP6888548B2 (ja) | 測定方法 | |
| JP6760384B2 (ja) | 測定方法 | |
| JP6805637B2 (ja) | ヘマトクリット値の測定方法、ヘマトクリット値の測定装置、被測定物質の量の測定方法、および被測定物質の量の測定装置 | |
| WO2017057136A1 (ja) | 表面プラズモン励起増強蛍光分光測定方法、および測定用キット | |
| JP6954116B2 (ja) | 測定方法、測定装置および測定チップ | |
| JP7405846B2 (ja) | 測定方法および測定装置 | |
| JP6702046B2 (ja) | 検出方法および検出装置 | |
| JP7469309B2 (ja) | 測定方法および測定装置 | |
| JPWO2016072307A1 (ja) | 検出装置および検出方法 | |
| WO2016147774A1 (ja) | 測定方法および測定装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20190708 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20191016 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200318 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200908 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201106 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210216 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210301 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6856074 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |