JP6594898B2 - 処置的血管手技のためのデバイス - Google Patents
処置的血管手技のためのデバイス Download PDFInfo
- Publication number
- JP6594898B2 JP6594898B2 JP2016562548A JP2016562548A JP6594898B2 JP 6594898 B2 JP6594898 B2 JP 6594898B2 JP 2016562548 A JP2016562548 A JP 2016562548A JP 2016562548 A JP2016562548 A JP 2016562548A JP 6594898 B2 JP6594898 B2 JP 6594898B2
- Authority
- JP
- Japan
- Prior art keywords
- filaments
- permeable shell
- distal
- item
- proximal
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12099—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder
- A61B17/12109—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder in a blood vessel
- A61B17/12113—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder in a blood vessel within an aneurysm
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12027—Type of occlusion
- A61B17/12031—Type of occlusion complete occlusion
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/1214—Coils or wires
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/1214—Coils or wires
- A61B17/12145—Coils or wires having a pre-set deployed three-dimensional shape
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/1214—Coils or wires
- A61B17/1215—Coils or wires comprising additional materials, e.g. thrombogenic, having filaments, having fibers, being coated
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/12168—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure
- A61B17/12172—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure having a pre-set deployed three-dimensional shape
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/12168—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure
- A61B17/12177—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure comprising additional materials, e.g. thrombogenic, having filaments, having fibers or being coated
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00526—Methods of manufacturing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/00867—Material properties shape memory effect
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/00893—Material properties pharmaceutically effective
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/00898—Material properties expandable upon contact with fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B2017/1205—Introduction devices
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B2017/1205—Introduction devices
- A61B2017/12054—Details concerning the detachment of the occluding device from the introduction device
- A61B2017/12068—Details concerning the detachment of the occluding device from the introduction device detachable by heat
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B90/00—Instruments, implements or accessories specially adapted for surgery or diagnosis and not covered by any of the groups A61B1/00 - A61B50/00, e.g. for luxation treatment or for protecting wound edges
- A61B90/39—Markers, e.g. radio-opaque or breast lesions markers
- A61B2090/3966—Radiopaque markers visible in an X-ray image
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2310/00—Prostheses classified in A61F2/28 or A61F2/30 - A61F2/44 being constructed from or coated with a particular material
- A61F2310/00005—The prosthesis being constructed from a particular material
- A61F2310/00011—Metals or alloys
- A61F2310/00035—Other metals or alloys
- A61F2310/00149—Platinum or Pt-based alloys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/0021—Catheters; Hollow probes characterised by the form of the tubing
- A61M2025/0042—Microcatheters, cannula or the like having outside diameters around 1 mm or less
Description
この出願は、2015年4月10日に出願された米国出願番号第14/684,212号の国際出願であり、この米国出願は、2014年4月14日に出願された米国仮出願番号第61/979,416号および2014年12月17日に出願された米国仮出願番号第62/093,313号に基づく優先権を主張しており、これらのすべての開示は、すべての目的のためにそれらの全体が参考として本明細書中に援用される。
本明細書のデバイスおよび方法の実施形態は、哺乳動物の体内で、管状血管を通るか、または嚢状空洞もしくは血管欠陥の小さな内部チャンバの中への流体の流れの遮断を対象とする。より具体的には、本明細書の実施形態は、具体的には患者の脳動脈瘤の処置を対象とする、いくつかの実施形態を含む、患者の血管欠陥の処置のためのデバイスおよび方法を対象とする。
哺乳動物の循環系は、ポンプとして働く心臓と、体内の様々なポイントに血液を輸送する血管系とから成る。血管に対して流れる血液によって及ぼされる力により、血管は種々の血管欠陥を発症する場合がある。動脈瘤として知られる1つの一般的な血管欠陥は、血管の異常な拡大に起因する。典型的には、血管動脈瘤は、血管の壁が弱まり、続いて血管壁が膨張および拡張した結果として、形成される。例えば、動脈瘤が脳の動脈内に存在し、動脈瘤は結果として脳出血を引き起こして破裂することとなった場合、死亡も起こり得る。
本発明の一実施形態では、血管からの血栓の除去のためのデバイスが、説明される。本デバイスは、近位端および遠位端を有し、複数のワイヤから形成される、拡張可能円筒構造を含み、隣接ワイヤは、複数の捻転によって相互に係合させられる。複数のワイヤは、円筒構造の遠位端および近位端においてともに固着される。円筒構造は、半径方向に拘束された状態と、拡張した弛緩状態とを有する。本デバイスはまた、近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルも含む。自己拡張型弾性透過シェルは、複数の開口部を伴う編組構造を有する、複数の伸長弾性フィラメントを含み、複数のフィラメントは、近位端および遠位端において固着される。自己拡張型透過シェルは、半径方向に拘束された伸長状態と、半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張した弛緩状態とを有する。自己拡張型透過シェルは、拡張可能円筒構造内に封入され、拡張可能円筒構造の遠位端に位置付けられる。
本発明は、例えば、以下を提供する。
(項目1)
近位端および遠位端を有し、複数のワイヤから形成される、拡張可能円筒構造であって、隣接ワイヤは、複数の捻転によって相互に係合させられ、前記複数のワイヤは、前記円筒構造の前記遠位端および前記近位端においてともに固着され、前記円筒構造は、半径方向に拘束された状態と、拡張した弛緩状態とを有する、拡張可能円筒構造と、
近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記自己拡張型弾性透過シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、近位および遠位端において固着され、前記自己拡張型透過シェルは、半径方向に拘束された伸長状態と、前記半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張した弛緩状態とを有し、前記自己拡張型透過シェルは、前記編組構造内に複数の開口部を有する、自己拡張型弾性透過シェルと、
を備え、前記自己拡張型透過シェルは、前記拡張可能円筒構造内に封入され、前記拡張可能円筒構造の前記遠位端に位置付けられる、血管からの血栓の除去のためのデバイス。
(項目2)
前記拡張可能円筒構造は、約10〜約18本のワイヤから形成される、項目1に記載のデバイス。
(項目3)
前記拡張可能円筒構造は、約12本のワイヤから形成される、項目1に記載のデバイス。
(項目4)
前記複数のワイヤは、ニチノールワイヤから形成される、項目1に記載のデバイス。
(項目5)
前記複数のワイヤは、ニチノール、コバルトクロム合金、ステンレス鋼、およびそれらの混合物から成る群から選択される材料から形成される、項目1に記載のデバイス。
(項目6)
前記複数のワイヤの中のワイヤの直径は、約0008インチ〜0.0035インチである、項目1に記載のデバイス。
(項目7)
前記複数のワイヤは、ハブによって前記遠位端においてともに固着される、項目1に記載のデバイス。
(項目8)
前記複数のワイヤは、バンドによって前記近位端においてともに固着される、項目1に記載のデバイス。
(項目9)
前記複数の捻転のうちの各捻転は、長さを有する、項目1に記載のデバイス。
(項目10)
各捻転の前記長さは、約0.25mm〜約3mmである、項目9に記載のデバイス。
(項目11)
前記複数の捻転のうちの各捻転は、1つの完全な巻目を有する、項目1に記載のデバイス。
(項目12)
前記複数の捻転のうちの前記捻転の少なくともいくつかは、1つの完全な巻目を有する、項目1に記載のデバイス
(項目13)
前記複数の捻転のうちの各捻転は、2つの完全な巻目を有する、項目1に記載のデバイス。
(項目14)
前記複数の捻転のうちの前記捻転の少なくともいくつかは、2つの完全な巻目を有する、項目1に記載のデバイス。
(項目15)
前記複数の捻転のうちの前記捻転の少なくともいくつかは、1つと半分の巻目を有する、項目1に記載のデバイス。
(項目16)
自己拡張型弾性透過シェルは、前記拡張可能円筒構造内で血栓を維持するために十分な編組密度を有する、項目1に記載のデバイス。
(項目17)
血管から近位および遠位端を有する血栓を除去するための方法であって、
血栓除去デバイスであって、
近位端、中央部分、および遠位端を有し、複数のワイヤから形成される、拡張可能円筒構造であって、隣接ワイヤは、複数の捻転によって相互に係合させられ、前記複数のワイヤは、遠位端においてともに固着され、かつ近位端においてともに固着され、前記円筒構造は、半径方向に拘束された状態と、拡張した弛緩状態とを有する、拡張可能円筒構造と、近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記自己拡張型弾性透過シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、近位端および遠位端において固着され、前記自己拡張型透過シェルは、半径方向に拘束された伸長状態と、前記半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張した弛緩状態とを有し、前記自己拡張型透過シェルは、前記編組構造内に複数の開口部を有する、自己拡張型弾性透過シェルと、
を備え、前記自己拡張型透過シェルは、前記拡張可能円筒構造内に封入され、前記拡張可能円筒構造の前記遠位端に位置付けられる、
血栓除去デバイスを取得するステップと、
マイクロカテーテル内に摺動可能に位置付けられた前記血栓除去デバイスを患者に挿入するステップであって、前記マイクロカテーテルは、遠位端を有し、前記拡張可能円筒構造および自己拡張型弾性透過シェルは両方とも、前記マイクロカテーテル内で前記半径方向に拘束された状態にある、ステップと、
前記血栓の遠位端に隣接して前記マイクロカテーテルの前記遠位端を位置付けるステップと、
前記拡張可能円筒構造内に位置する前記自己拡張型弾性透過シェルの前記近位端が、前記血栓の遠位に位置し、前記拡張可能円筒構造の前記中央部分が前記血栓の前記近位端および前記遠位端に重複するように、前記血栓除去デバイスおよび前記マイクロカテーテルの相対変位によって前記マイクロカテーテルから前記血栓除去デバイスを展開するステップであって、一旦、前記血栓除去デバイスが前記マイクロカテーテルから外へ前進させられると、前記自己拡張型弾性透過シェルおよび前記拡張可能円筒構造は、それらの拡張状態に向かって移行する、ステップと、
前記円筒構造の前記遠位端に前記自己拡張型弾性透過シェルを伴って前記拡張した円筒構造を近位方向に移動させ、それによって、血管の管腔内表面から前記血栓を着脱し、前記拡張可能円筒構造内で前記血栓を捕捉するステップと、
前記血管から前記血栓除去デバイスおよび前記捕捉された血栓を除去するステップと、
を含む、方法。
(項目18)
前記血栓除去デバイスおよび前記マイクロカテーテルは、ともに前記血管から除去される、項目17に記載の方法。
(項目19)
前記血栓除去デバイスは、前記マイクロカテーテルが前記血管内で定位置に残された状態で前記マイクロカテーテルから除去される、項目17に記載の方法。
(項目20)
前記血栓除去デバイスおよび前記マイクロカテーテルは、ともに前記患者から除去される、項目17に記載の方法。
(項目21)
前記血栓除去デバイスは、前記マイクロカテーテルが前記患者内で定位置に残された状態で前記マイクロカテーテルから除去される、項目17に記載の方法。
(項目22)
前記自己拡張型透過シェルは、前記円筒構造内で前記血栓を維持し、また、血液が前記自己拡張型透過シェルを通って流れることを可能にするために十分に高い編組密度を有する、項目17に記載の方法。
(項目23)
近位端、遠位端、および長手軸を有する、遠位自己拡張型弾性透過シェルであって、前記遠位透過シェルは、編組フィラメントの間に形成された複数の開口部を伴う編組構造を有する、複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくともその近位端において集合させられ、前記遠位透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態と、前記半径方向に拘束された状態に対して軸方向に短縮された構成を伴う拡張状態とを有し、前記遠位透過シェルの前記拡張状態は、前記遠位透過シェルの前記遠位端に凸形状を有する、遠位自己拡張型弾性透過シェルと、
近位端、遠位端、および長手軸を有する、近位自己拡張型弾性透過シェルであって、前記近位透過シェルは、編組フィラメントの間に形成された複数の開口部を伴う編組構造を有する、複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくともその近位端において集合させられ、前記近位透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態と、前記半径方向に拘束された状態に対して軸方向に短縮された構成を伴う拡張状態とを有し、前記近位透過シェルの前記拡張状態は、前記近位透過シェルの前記近位端に略凸形状を有する、近位自己拡張型弾性透過シェルと、
近位端および遠位端を有する、伸長支持部材であって、前記遠位および近位透過シェルの間に位置付けられる、伸長支持部材と、
を備え、前記遠位および近位透過シェルの前記拡張状態は、それを通って前記伸長支持部材が延在する、トロイダル空洞を画定する、
患者の血管系内の動脈瘤の処置のためのデバイス。
(項目24)
前記遠位透過シェル内の前記複数の開口部の平均サイズは、前記近位透過シェル内の前記複数の開口部の平均サイズより大きい、項目23に記載のデバイス。
(項目25)
前記遠位透過シェル内の前記複数の開口部の前記平均サイズは、約300μm〜約900μmである、項目24に記載のデバイス。
(項目26)
前記遠位透過シェル内の前記複数の開口部の前記平均サイズは、約300μm〜約900μm、約300μm〜約700μm、および300μm〜約500μmから成る群から選択される、項目24に記載のデバイス。
(項目27)
前記近位透過シェル内の前記複数の開口部の前記平均サイズは、約50μm〜約200μmである、項目24に記載のデバイス。
(項目28)
前記近位透過シェル内の前記複数の開口部の前記平均サイズは、約50μm〜約200μm、約100μm〜約200μm、および50μm〜約150μmから成る群から選択される、項目24に記載のデバイス。
(項目29)
前記遠位透過シェルの前記編組構造は、第1の編組密度を有し、前記近位透過シェルの前記編組構造は、第2の編組密度を有し、前記第1の編組密度は、前記第2の編組密度より大きい、項目23に記載のデバイス。
(項目30)
前記第1の編組密度は、約0.10〜0.20である、項目29に記載のデバイス。
(項目31)
前記第1の編組密度は、約0.10〜0.15である、項目29に記載のデバイス。
(項目32)
前記第2の編組密度は、約0.15〜0.40である、項目29に記載のデバイス。
(項目33)
前記第2の編組密度は、約0.17〜0.30である、項目29に記載のデバイス。
(項目34)
前記伸長支持部材は、剛性である、項目23に記載のデバイス。
(項目35)
前記伸長支持部材は、ハイポチューブである、項目23に記載のデバイス。
(項目36)
前記伸長支持部材は、コイルである、項目23に記載のデバイス。
(項目37)
前記コイルは、拡張ばねである、項目36に記載のデバイス。
(項目38)
前記コイルが静止しているとき、前記コイルは、より小さい長さまで圧縮可能ではない、項目36に記載のデバイス。
(項目39)
前記遠位透過シェルの前記複数のフィラメントは、前記遠位透過シェルの前記遠位端において集合させられる、項目23に記載のデバイス。
(項目40)
前記遠位透過シェルの前記複数のフィラメントのそれぞれは、第1の端部および第2の端部を有し、前記遠位透過シェルの前記複数のフィラメントの前記第1のおよび第2の端部は、前記遠位透過シェルの前記近位端において集合させられる、項目23に記載のデバイス。
(項目41)
前記遠位透過シェルの前記伸長弾性フィラメントは、延伸充填管を含む、項目23に記載のデバイス。
(項目42)
前記近位透過シェルの前記伸長弾性フィラメントは、延伸充填管を含む、項目23に記載のデバイス。
(項目43)
前記遠位透過シェルの前記伸長弾性フィラメントは、ニチノールワイヤと、延伸充填管とを含む、項目23に記載のデバイス。
(項目44)
前記近位透過シェルの前記伸長弾性フィラメントは、ニチノールワイヤと、延伸充填管とを含む、項目23に記載のデバイス。
(項目45)
前記遠位透過シェルの前記伸長弾性フィラメントは、ニチノールワイヤを含む、項目23に記載のデバイス。
(項目46)
前記近位透過シェルの前記伸長弾性フィラメントは、ニチノールワイヤを含む、項目23に記載のデバイス。
(項目47)
前記遠位透過シェルの前記拡張形状は、前記近位透過シェルの前記拡張形状に接触する、項目23に記載のデバイス。
(項目48)
前記遠位透過シェルの前記拡張形状および前記近位透過シェルの前記拡張形状は、実質的に球状の形状を形成する、項目23に記載のデバイス。
(項目49)
前記複数のフィラメントは、ハブによって前記近位透過シェルの前記近位端において集合させられる、項目23に記載のデバイス。
(項目50)
前記ハブは、前記近位透過シェルの前記近位端の拡張した周囲の下方で陥凹状である、項目49に記載のデバイス。
(項目51)
前記伸長支持部材は、約2mm〜約10mmの長さを有する、項目23に記載のデバイス。
(項目52)
前記伸長支持部材は、約3mm〜約8mmの長さを有するコイルである、項目51に記載のデバイス。
(項目53)
前記伸長支持部材は、約3.5mm〜約5.5mmの長さを有するハイポチューブである、項目51に記載のデバイス。
(項目54)
インプラントであって、
近位端、遠位端、および長手軸を有する、遠位自己拡張型弾性透過シェルであって、前記遠位透過シェルは、編組フィラメントの間に形成された複数の開口部を伴う編組構造を有する、複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくともその近位端において集合させられ、前記遠位透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態と、前記半径方向に拘束された状態に対して軸方向に短縮された構成を伴う拡張状態とを有し、前記遠位透過シェルの前記拡張状態は、前記遠位透過シェルの前記遠位端に凸形状を有する、遠位自己拡張型弾性透過シェルと、
近位端、遠位端、および長手軸を有する、近位自己拡張型弾性透過シェルであって、前記近位透過シェルは、編組フィラメントの間に形成された複数の開口部を伴う編組構造を有する、複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくともその近位端において集合させられ、前記近位透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態と、前記半径方向に拘束された状態に対して軸方向に短縮された構成を伴う拡張状態とを有し、前記近位透過シェルの前記拡張状態は、前記近位透過シェルの前記近位端に略凸形状を有する、近位自己拡張型弾性透過シェルと、
近位端および遠位端を有する、伸長支持部材であって、前記遠位および近位透過シェルの間に位置付けられる、伸長支持部材と、
を有し、前記遠位および近位透過シェルの前記拡張状態は、それを通って前記伸長支持部材が延在する、トロイダル空洞を画定する、
インプラントを提供するステップと、
マイクロカテーテル内で前記薄型の半径方向に拘束された状態における前記インプラントを脳動脈内の着目領域まで前進させるステップと、
前記脳の動脈瘤内で前記インプラントを展開するステップであって、前記遠位および近位透過シェルは、それらの拡張形状まで拡張する、ステップと、
前記インプラントを展開した後に、前記着目領域から前記マイクロカテーテルを引き抜くステップと、を含む、脳動脈瘤を処置するための方法。
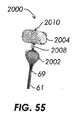
(項目55)
前記遠位透過シェルの前記拡張形状および前記近位透過シェルの前記拡張形状は、実質的に球状の形状を形成する、項目54に記載の方法。
(項目56)
前記遠位透過シェルの前記拡張形状および前記近位透過シェルの前記拡張形状は、前記脳の動脈瘤を実質的に充填する、実質的に球状の形状を形成する、項目54に記載の方法。
(項目57)
前記遠位透過シェル内の前記複数の開口部の平均サイズは、前記近位透過シェル内の前記複数の開口部の平均サイズより大きい、項目54に記載の方法。
(項目58)
前記遠位透過シェル内の前記複数の開口部の前記平均サイズは、約300μm〜約900μmである、項目57に記載の方法。
(項目59)
前記遠位透過シェル内の前記複数の開口部の前記平均サイズは、約300μm〜約900μm、約300μm〜約700μm、および300μm〜約500μmから成る群から選択される、項目57に記載の方法。
(項目60)
前記近位透過シェル内の前記複数の開口部の前記平均サイズは、約50μm〜約200μmである、項目57に記載の方法。
(項目61)
前記近位透過シェル内の前記複数の開口部の前記平均サイズは、約50μm〜約200μm、約100μm〜約200μm、および50μm〜約150μmから成る群から選択される、項目57に記載の方法。
(項目62)
前記遠位透過シェルの前記編組構造は、第1の編組密度を有し、前記近位透過シェルの前記編組構造は、第2の編組密度を有し、前記第1の編組密度は、前記第2の編組密度より大きい、項目54に記載の方法。
(項目63)
前記第1の編組密度は、約0.10〜0.20である、項目62に記載の方法。
(項目64)
前記第1の編組密度は、約0.10〜0.15である、項目62に記載の方法。
(項目65)
前記第2の編組密度は、約0.15〜0.40である、項目62に記載の方法。
(項目66)
前記第2の編組密度は、約0.17〜0.30である、項目62に記載の方法。
(項目67)
前記伸長支持部材は、ハイポチューブである、項目54に記載の方法。
(項目68)
前記第1の遠位透過シェルの前記複数のフィラメントは、前記遠位透過シェルの前記遠位端において集合させられる、項目54に記載の方法。
(項目69)
前記遠位透過シェルの前記複数のフィラメントのそれぞれは、第1の端部および第2の端部を有し、前記遠位透過シェルの前記複数のフィラメントの前記第1のおよび第2の端部は、前記遠位透過シェルの前記近位端において集合させられる、項目54に記載の方法。
(項目70)
前記遠位透過シェルの前記伸長弾性フィラメントは、延伸充填管を含む、項目54に記載の方法。
(項目71)
前記近位透過シェルの前記伸長弾性フィラメントは、延伸充填管を含む、項目54に記載の方法。
(項目72)
前記遠位透過シェルの前記伸長弾性フィラメントは、ニチノールワイヤと、延伸充填管とを含む、項目54に記載の方法。
(項目73)
前記近位透過シェルの前記伸長弾性フィラメントは、ニチノールワイヤと、延伸充填管とを含む、項目54に記載の方法。
(項目74)
前記遠位透過シェルの前記伸長弾性フィラメントは、ニチノールワイヤを含む、項目54に記載の方法。
(項目75)
前記近位透過シェルの前記伸長弾性フィラメントは、ニチノールワイヤを含む、項目54に記載の方法。
(項目76)
前記遠位透過シェルの前記拡張形状は、前記近位透過シェルの前記拡張形状に接触する、項目54に記載の方法。
(項目77)
前記伸長支持部材は、剛性である、項目54に記載の方法。
(項目78)
前記伸長支持部材は、ハイポチューブである、項目54に記載の方法。
(項目79)
前記伸長支持部材は、コイルである、項目54に記載の方法。
(項目80)
前記コイルは、拡張ばねである、項目79に記載の方法。
(項目81)
前記コイルが静止しているとき、前記コイルは、より小さい長さまで圧縮可能ではない、項目79に記載の方法。
(項目82)
近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくとも、その前記近位端または前記遠位端のうちの1つにおいて固着される、自己拡張型弾性透過シェルと、
第1の直径を有するワイヤから形成される、金属コイルであって、前記金属コイルは、前記自己拡張型弾性透過シェルの前記遠位端において固着される、金属コイルと、
を備え、
前記透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態を有し、かつ前記半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張状態を有し、前記透過シェルは、編組フィラメントの間に形成された複数の開口部を有し、
前記金属コイルは、マイクロカテーテル内での送達のために構成される、直線状の真っすぐな形状と、二次直径を有する少なくとも1つのループを有する、拡張状態とを有する、患者の血管系内の動脈瘤の処置のためのデバイス。
(項目83)
前記金属コイルは、前記透過シェルが動脈瘤内で前記拡張状態であるときに、前記透過シェルに付勢力を加えるように構成される、項目82に記載のデバイス。
(項目84)
前記金属コイルは、軸方向に少なくとも部分的に圧縮されたときに、少なくとも0.27グラムの軸方向付勢力を印加する、項目82に記載のデバイス。
(項目85)
前記金属コイルは、軸方向に少なくとも部分的に圧縮されたときに、少なくとも2.67グラムの軸方向付勢力を印加する、項目82に記載のデバイス。
(項目86)
前記金属コイルは、軸方向に少なくとも部分的に圧縮されたときに、少なくとも16.6グラムの軸方向付勢力を印加する、項目82に記載のデバイス。
(項目87)
前記金属コイルは、3次元フレーミング形状に順応するように構成される、項目82に記載のデバイス。
(項目88)
前記金属コイルは、白金を含むワイヤから形成される、項目82に記載のデバイス。
(項目89)
脳動脈瘤を処置するための方法であって、
インプラント構造であって、
近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくとも、その前記近位端または前記遠位端のうちの少なくとも1つにおいて固着される、自己拡張型弾性透過シェルと、
第1の直径を有するワイヤから形成される、金属コイルであって、前記金属コイルは、前記自己拡張型弾性透過シェルの前記遠位端において固着される、金属コイルと、
を備え、
前記透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態を有し、かつ前記半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張状態を有し、前記透過シェルは、編組フィラメントの間に形成された複数の開口部を有し、
前記金属コイルは、マイクロカテーテル内での送達のために構成される、直線状の真っすぐな形状と、二次直径を有する少なくとも1つのループを有する、拡張状態とを有する、インプラント構造を提供するステップと、
マイクロカテーテル内の前記インプラントを前記脳動脈瘤近傍の領域まで前進させるステップと、
前記脳動脈瘤内で前記インプラントを展開するステップであって、前記金属コイルは、前記脳動脈瘤のドーム近傍に位置付けられ、前記拡張状態を成し、前記透過シェルは、前記脳動脈瘤内で前記拡張した展開状態を成す、ステップと、
前記インプラントを展開した後に、前記脳動脈瘤近傍の前記領域から前記マイクロカテーテルを引き抜くステップと、を含む、方法。
(項目90)
前記金属コイルは、前記脳動脈瘤の開口部に前記透過シェルを押し付ける、項目89に記載の方法。
(項目91)
前記金属コイルは、前記脳動脈瘤の直径の周囲を追跡する、項目89に記載の方法。
(項目92)
前記金属コイルの前記二次直径は、前記透過シェルの直径にほぼ等しい、項目89に記載の方法。
(項目93)
前記金属コイルは、軸方向に少なくとも部分的に圧縮されたときに、少なくとも0.27グラムの軸方向付勢力を印加する、項目89に記載の方法。
(項目94)
前記金属コイルは、軸方向に少なくとも部分的に圧縮されたときに、少なくとも2.67グラムの軸方向付勢力を印加する、項目89に記載の方法。
(項目95)
前記金属コイルは、軸方向に少なくとも部分的に圧縮されたときに、少なくとも16.6グラムの軸方向付勢力を印加する、項目89に記載の方法。
(項目96)
近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくとも、その前記近位端または前記遠位端のうち1つにおいて固着される、自己拡張型弾性透過シェルと、
前記自己拡張型弾性透過シェルの前記遠位端において固着される、力付勢部材と、
を備え、
前記透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態を有し、かつ前記半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張状態を有し、前記透過シェルは、編組フィラメントの間に形成された複数の開口部を有し、
前記力付勢部材は、マイクロカテーテル内での送達のために構成される、直線状の真っすぐな形状と、前記マイクロカテーテルからの送達後の拡張状態とを有する、
患者の血管系内の動脈瘤の処置のためのデバイス。
(項目97)
前記力付勢部材は、前記透過シェルが動脈瘤内で前記拡張状態であるときに、前記透過シェルに付勢力を加えるように構成される、項目96に記載のデバイス。
(項目98)
前記力付勢部材は、軸方向に少なくとも部分的に圧縮されたときに、少なくとも0.27グラムの軸方向付勢力を印加する、項目96に記載のデバイス。
(項目99)
前記力付勢部材は、軸方向に少なくとも部分的に圧縮されたときに、少なくとも2.67グラムの軸方向付勢力を印加する、項目96に記載のデバイス。
(項目100)
前記力付勢部材は、軸方向に少なくとも部分的に圧縮されたときに、少なくとも16.6グラムの軸方向付勢力を印加する、項目96に記載のデバイス。
(項目101)
前記力付勢部材は、3次元フレーミング形状に順応するように構成される、項目96に記載のデバイス。
(項目102)
前記力付勢部材は、白金を含むワイヤから形成される、項目96に記載のデバイス。
(項目103)
前記複数のフィラメントは、前記透過シェルの前記遠位端において固着され、前記複数のフィラメントのうちの少なくともいくつかの遠位領域は、前記透過シェルの前記遠位端を超えて延在し、略円形を有する拡張部を形成し、前記力付勢部材は、拡張されたときに前記略円形を有する、前記拡張部を備える、項目96に記載のデバイス。
(項目104)
前記複数のフィラメントは、近位および遠位端を有する、円筒ハブによって固着され、前記拡張部は、前記円筒ハブの前記遠位端から延在する、項目103に記載のデバイス。
(項目105)
前記拡張部を形成する、前記複数のフィラメントのうちの少なくともいくつかの前記遠位領域は、編組される、項目103に記載のデバイス。
(項目106)
前記拡張部を形成する、前記複数のフィラメントのうちの少なくともいくつかの前記遠位領域は、部分的に編組される、項目103に記載のデバイス。
(項目107)
前記編組遠位領域は、少なくとも部分的に解かれる、項目105に記載のデバイス。
(項目108)
脳動脈瘤を処置するための方法であって、
インプラント構造であって、
近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくとも、その前記近位端または前記遠位端のうち1つにおいて固着される、自己拡張型弾性透過シェルと、
前記自己拡張型弾性透過シェルの前記遠位端において固着される、力付勢部材と、
を備え、
前記透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態を有し、かつ前記半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張状態を有し、前記透過シェルは、編組フィラメントの間に形成された複数の開口部を有し、
前記力付勢部材は、マイクロカテーテル内での送達のために構成される、直線状の真っすぐな形状と、前記マイクロカテーテルからの送達後の拡張状態とを有する、
インプラント構造を提供するステップと、
マイクロカテーテル内の前記インプラントを前記脳動脈瘤近傍の領域まで前進させるステップと、
前記脳動脈瘤内で前記インプラントを展開するステップであって、前記力付勢部材は、前記脳動脈瘤のドーム近傍に位置付けられ、前記拡張状態を成し、前記透過シェルは、前記脳動脈瘤内で前記拡張した展開状態を成す、ステップと、
前記インプラントを展開した後に、前記脳動脈瘤近傍の前記領域から前記マイクロカテーテルを引き抜くステップと、を含む、方法。
(項目109)
前記力付勢部材は、前記脳動脈瘤の開口部に前記透過シェルを押し付ける、項目108に記載の方法。
(項目110)
前記力付勢部材は、前記透過シェルが動脈瘤内で前記拡張状態であるときに、前記透過シェルに付勢力を加えるように構成される、項目108に記載の方法。
(項目111)
前記力付勢部材は、軸方向に少なくとも部分的に圧縮されたときに、少なくとも0.27グラムの軸方向付勢力を印加する、項目108に記載の方法。
(項目112)
前記力付勢部材は、軸方向に少なくとも部分的に圧縮されたときに、少なくとも2.67グラムの軸方向付勢力を印加する、項目108に記載の方法。
(項目113)
前記力付勢部材は、軸方向に少なくとも部分的に圧縮されたときに、少なくとも16.6グラムの軸方向付勢力を印加する、項目108に記載の方法。
(項目114)
前記力付勢部材は、3次元フレーミング形状に順応するように構成される、項目108に記載の方法。
(項目115)
前記力付勢部材は、白金を含むワイヤから形成される、項目108に記載の方法。
(項目116)
前記複数のフィラメントは、前記透過シェルの前記遠位端において固着され、前記複数のフィラメントのうちの少なくともいくつかの遠位領域は、前記透過性シェルの前記遠位端を超えて延在し、略円形を有する拡張部を形成し、前記力付勢部材は、拡張されたときに前記略円形を有する、前記拡張部を備える、項目108に記載の方法。
(項目117)
前記複数のフィラメントは、近位および遠位端を有する、円筒ハブによって固着され、前記拡張部は、前記円筒ハブの前記遠位端から延在する、項目116に記載の方法。
(項目118)
前記複数のフィラメントは、近位および遠位端を有する、円筒ハブによって固着され、前記拡張部は、前記円筒ハブの前記遠位端から延在する、項目116に記載の方法。
(項目119)
前記拡張部を形成する、前記複数のフィラメントのうちの少なくともいくつかの前記遠位領域は、編組される、項目116に記載の方法。
(項目120)
前記拡張部を形成する、前記複数のフィラメントのうちの少なくともいくつかの前記遠位領域は、部分的に編組される、項目116に記載の方法。
(項目121)
前記編組遠位領域は、少なくとも部分的に解かれる、項目119に記載の方法。
(項目122)
近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、その前記遠位端において固着され、前記複数のフィラメントのうちの少なくともいくつかの遠位領域は、前記透過シェルの前記遠位端を超えて延在し、拡張されたときに略円形を有する拡張部を形成する、自己拡張型弾性透過シェルを備え、
前記透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態を有し、かつ前記半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張状態を有し、前記透過シェルは、編組フィラメントの間に形成された複数の開口部を有する、
患者の血管系内の動脈瘤の処置のためのデバイス。
(項目123)
前記複数のフィラメントは、近位および遠位端を有する、円筒ハブによって固着され、前記拡張部は、前記円筒ハブの前記遠位端から延在する、項目122に記載のデバイス。
(項目124)
前記拡張部を形成する、前記複数のフィラメントのうちの少なくともいくつかの前記遠位領域は、編組される、項目122に記載のデバイス。
(項目125)
前記拡張部を形成する、前記複数のフィラメントのうちの少なくともいくつかの前記遠位領域は、部分的に編組される、項目122に記載のデバイス。
(項目126)
前記編組遠位領域は、少なくとも部分的に解かれる、項目124に記載のデバイス。
(項目127)
脳動脈瘤を処置するための方法であって、
インプラント構造であって、
近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、その前記遠位端において固着され、前記複数のフィラメントのうちの少なくともいくつかの遠位領域は、前記透過シェルの前記遠位端を超えて延在し、拡張されたときに略円形を有する拡張部を形成する、自己拡張型弾性透過シェルを備え、
前記透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態を有し、かつ前記半径方向に拘束された状態に対して球状の軸方向に短縮された構成を伴う拡張状態を有し、前記透過シェルは、編組フィラメントの間に形成された複数の開口部を有する、
インプラント構造を提供するステップと、
マイクロカテーテル内の前記インプラントを前記脳動脈瘤近傍の領域まで前進させるステップと、
前記脳動脈瘤内で前記インプラントを展開するステップであって、前記拡張部は、前記脳動脈瘤のドーム近傍に位置付けられ、前記略円形を成し、前記透過シェルは、前記脳動脈瘤内で前記拡張した展開状態を成す、ステップと、
前記インプラントを展開した後に、前記脳動脈瘤近傍の前記領域から前記マイクロカテーテルを引き抜くステップと、を含む、方法。
(項目128)
前記複数のフィラメントは、近位および遠位端を有する、円筒ハブによって固着され、前記拡張部は、前記円筒ハブの前記遠位端から延在する、項目127に記載の方法。
(項目129)
前記拡張部を形成する、前記複数のフィラメントのうちの少なくともいくつかの前記遠位領域は、編組される、項目127に記載の方法。
(項目130)
前記拡張部を形成する、前記複数のフィラメントのうちの少なくともいくつかの前記遠位領域は、部分的に編組される、項目127に記載の方法。
(項目131)
前記編組遠位領域は、少なくとも部分的に解かれる、項目129に記載の方法。
本明細書では、患者の血管系内、特に患者の脳血管系内での最小侵襲展開に好適である、血管欠陥の処置のためのデバイスおよび方法が述べられる。望ましい処置部位へ安全で効率的に送達し、かつ効果的に展開するためのそのような実施形態に関して、いくつかのデバイスの実施形態は、マイクロカテーテルの内側管腔を通した送達、およびその遠位端からの展開に好適な横寸法を伴う、低プロフィール拘束状態への折り畳みのために構成されてもよい。これらのデバイスの実施形態はまた、一旦、患者の血管系内で経時的に動的な力に耐えるように展開されると、そうでなければ展開されたデバイスの圧縮という結果になり得る、十分な機械的一体性を伴う臨床的に有効な構成を維持し得る。処置する医師に処置の成功に関して、より即時的なフィードバックを提供するために、いくつかのデバイスの実施形態が、手技の経過の間に患者の血管欠陥を急性的に閉塞させることが望ましい場合もある。特に指定のない限り、種々の実施形態の特徴、寸法、もしくは材料のうちの1つまたはそれを上回るものは、本明細書で論議される他の同様の実施形態で使用されてもよい。
Sradial=(1.2×106lbf/D4)(Nldl4+Nsds 4)
式中、Sradialは、重量ポンド(lbf)単位の半径方向剛性であり、
Dは、デバイスの直径(横寸法)であり、
Nlは、大きなフィラメントの数であり、
Nsは、小さなフィラメントの数であり、
dlは、インチ単位の大きなフィラメントの直径であり、
dsは、インチ単位の小さなフィラメントの直径である。
Pmax=(1.7/NT)(πD−(NTdW/2))
式中、Pmaxは、平均細孔サイズであり、
Dは、デバイスの直径(横寸法)であり、
NTは、全フィラメントの総数であり、
dWは、インチ単位のフィラメント(最小)の直径である。
Pc=1.48((Nldl 2+Nsds 2))1/2
式中、Pcは、デバイスの折り畳みプロフィールであり、
Nlは、大きなフィラメントの数であり、
Nsは、小さなフィラメントの数であり、
dlは、インチ単位の大きなフィラメントの直径であり、
dsは、インチ単位の小さなフィラメントの直径である。
ビームの偏向=5FL4/384EI
式中、F=力、
L=ビームの長さ、
E=ヤング率、
I=慣性モーメントである。
I=πd4/64
式中、dは、ワイヤまたはフィラメントの直径である。
いくつかの実施形態では、近位葉1802は、約108〜約180本のフィラメント1814から構築されてもよい。いくつかの実施形態では、近位葉1802は、約54〜約90本のニチノールフィラメントおよび約54〜約90本の延伸充填管(DFT)フィラメントから構築されてもよい。いくつかの実施形態では、DFTフィラメントは、ニチノール等の外側の高強度材料と、白金、90%白金/10%イリジウム等の白金合金、または金、もしくはタンタル等の高度に放射線不透過性の材料の内側コアとを備えてもよい。いくつかの実施形態では、DFTフィラメントは、高度に放射線不透過性の材料の約10%〜約50%の断面充填面積比を備えてもよい。いくつかの実施形態では、DFTフィラメントは、高度に放射線不透過性の材料の約20%〜約40%の断面充填面積比を備えてもよい。いくつかの実施形態では、DFTフィラメントは、高度に放射線不透過性の材料の約25%〜約35%の断面充填面積比を備えてもよい。いくつかの実施形態では、近位葉1802は、約0.0004インチ〜約0.0006インチの横寸法または直径を有する、ニチノールフィラメントと、約0.0006インチ〜約0.0009インチの横寸法を有する、DFTフィラメントとを備えてもよい。いくつかの実施形態では、近位葉1802は、約0.0005インチの横寸法を有する、約72本のニチノールフィラメントと、約0.00075インチの横寸法を有する、約72本のDFTフィラメントとを備えてもよい。
BDM=(AM−AO)/AM
式中、AMは、菱形のモジュールの面積であり、
AOは、菱形の開口部の面積である。
BDC=Σ(AMk−AOk)/Σ(AMk)
k=1,2,3,….,n
式中、AMは、菱形のモジュールの面積であり、
AOは、菱形の開口部の面積である。
DH=(4XAO)/PO
式中、AOは、菱形の開口部の面積であり、
POは、菱形の開口部の周辺である。
編組密度(BD)は、編組管状部材の1つの部分を編組管状部材の別部分と比較するために使用されてもよい。編組密度(BD)はまた、編組管状部材の長手軸ZLに隣接する部分を編組管状部材の同一部分内の最も拡張した区分と比較するために使用されてもよい。編組密度(BD)は、編組管状部材から構築されたメッシュデバイスの1つの部分を編組管状部材から構築されたメッシュデバイスの別の部分と、例えば、第1の部分の最も拡張した区分を第2の部分の最も拡張した区分と比較するために使用されてもよい。記述されるように、(例えば、動脈瘤の頸部において)流れを妨害することを意図している部分の最も拡張した区分は、最悪の場合の高流量場所で流れを妨害することの有効性を予測することに関連する。編組密度はまた、編組管状部材から作製されたメッシュデバイスの編組管状部材のいくつかの異なる部分の平均(すなわち、平均値、中央値)として表されてもよい。編組密度はまた、いくつかの編組管状部材または編組管状部材から構築されたメッシュデバイスの同一部分の測定の平均として表されてもよい。
図62および63は、その遠位端2404に自己拡張型構造2402を有する、血栓除去デバイス2400を図示する。虚血性脳卒中を呈する患者は、多くの場合、脳の部分への血流を遮断する血栓を有する。これらの血栓の除去は、症状の回復を可能にすることができ、生命を救うことさえできる。自己拡張型構造2402は、伸長シャフト2406に固着され、マイクロカテーテルまたはシースを通した送達のための半径方向に拘束された構成と、(図62および63に示されるような)拡張構成とを有する。自己拡張型構造2402は、円筒係合構造2408と、捕獲構造2410とを含む。円筒係合構造2408は、その境界内で血栓に係合するように構成され、捕獲構造2410は、円筒係合構造2410の遠位端に位置し、血栓除去デバイス2400が患者から除去されると、円筒係合構造2408内で捕捉された血栓を維持するように構成される。
Claims (12)
- 近位端、遠位端、および長手軸を有する、自己拡張型弾性透過シェルであって、前記シェルは、編組構造を有する複数の伸長弾性フィラメントを備え、前記複数のフィラメントは、少なくとも、前記自己拡張型弾性透過シェルの前記近位端または前記遠位端のうちの1つにおいて固着される、自己拡張型弾性透過シェルと、
第1の直径を有するワイヤから形成される、金属コイルであって、前記金属コイルは、前記自己拡張型弾性透過シェルの前記遠位端において固着される、金属コイルと、
を備え、
前記透過シェルは、マイクロカテーテル内での送達のために構成される、半径方向に拘束された伸長状態を有し、かつ前記半径方向に拘束された状態に対して軸方向に短縮された構成を伴う拡張状態を有し、前記透過シェルは、編組フィラメントの間に形成された複数の開口部を有し、
前記金属コイルは、マイクロカテーテル内での送達のために構成される、直線状の真っすぐな形状を有し、
前記金属コイルは、二次直径を有する少なくとも1つのループを有する拡張状態を有し、
前記金属コイルの前記二次直径は、第1の二次直径および第2の二次直径を含み、前記金属コイルは、前記第1の二次直径を有する1つ以上のループと、前記第2の二次直径を有する1つ以上の遠位に位置するループとを備え、前記第2の二次直径は、前記第1の二次直径よりも小さい、患者の血管系内の動脈瘤の処置のためのデバイス。 - 前記金属コイルは、前記透過シェルが動脈瘤内で前記拡張状態であるときに、前記透過シェルに付勢力を加えるように構成される、請求項1に記載のデバイス。
- 前記金属コイルは、3次元フレーミング形状に順応するように構成される、請求項1に記載のデバイス。
- 前記金属コイルは、白金を含むワイヤから形成される、請求項1に記載のデバイス。
- 前記金属コイルは、白金、白金合金、金、または、タンタルから成るリストから選択される材料から形成される、請求項1に記載のデバイス。
- 前記金属コイルの拡張状態は、1つより多いループを有する、請求項1に記載のデバイス。
- 前記複数のフィラメントのうちの少なくともいくつかは、白金を含む、請求項1に記載のデバイス。
- 前記複数のフィラメントのうちの少なくともいくつかは、放射線不透過性である、請求項1に記載のデバイス。
- 前記複数のフィラメントのうちの少なくともいくつかは、放射線不透過性のコアと、超弾性の外側シェルとを有する複合ワイヤを備える、請求項1に記載のデバイス。
- 前記放射線不透過性のコアは、白金を含む、請求項9に記載のデバイス。
- 前記超弾性の外側シェルは、ニチノールを含む、請求項9に記載のデバイス。
- 前記透過性シェルは、その拡張状態において、拡張直径を有し、前記金属コイルの前記二次直径は、その拡張状態において、前記透過性シェルの前記拡張直径よりも小さい、請求項1に記載のデバイス。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461979416P | 2014-04-14 | 2014-04-14 | |
| US61/979,416 | 2014-04-14 | ||
| US201462093313P | 2014-12-17 | 2014-12-17 | |
| US62/093,313 | 2014-12-17 | ||
| US14/684,212 US9629635B2 (en) | 2014-04-14 | 2015-04-10 | Devices for therapeutic vascular procedures |
| US14/684,212 | 2015-04-10 | ||
| PCT/US2015/025609 WO2015160721A1 (en) | 2014-04-14 | 2015-04-13 | Devices for therapeutic vascular procedures |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017511202A JP2017511202A (ja) | 2017-04-20 |
| JP2017511202A5 JP2017511202A5 (ja) | 2018-05-10 |
| JP6594898B2 true JP6594898B2 (ja) | 2019-10-23 |
Family
ID=56798559
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016562548A Active JP6594898B2 (ja) | 2014-04-14 | 2015-04-13 | 処置的血管手技のためのデバイス |
Country Status (4)
| Country | Link |
|---|---|
| US (4) | US9629635B2 (ja) |
| EP (1) | EP3131515A4 (ja) |
| JP (1) | JP6594898B2 (ja) |
| CN (1) | CN106456422A (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023281537A1 (en) * | 2021-07-08 | 2023-01-12 | Dr. Remedies Biologicals Pvt Ltd | Versatile absorbable flow regulating device and method to develop balloon based stent delivery system |
Families Citing this family (76)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060155323A1 (en) * | 2005-01-07 | 2006-07-13 | Porter Stephen C | Intra-aneurysm devices |
| US11583289B2 (en) | 2008-05-01 | 2023-02-21 | Aneuclose Llc | Aneurysm-occluding mesh ribbon with a series of loops or segments having distal-to-proximal variation in size, shape, and/or orientation |
| US11471164B2 (en) | 2008-05-01 | 2022-10-18 | Aneuclose Llc | Methods of occluding a cerebral aneurysm by inserting embolic members or material into an intrasacular implant |
| US11357511B2 (en) | 2008-05-01 | 2022-06-14 | Aneuclose Llc | Intrasacular aneurysm occlusion device with globular first configuration and bowl-shaped second configuration |
| US10716573B2 (en) | 2008-05-01 | 2020-07-21 | Aneuclose | Janjua aneurysm net with a resilient neck-bridging portion for occluding a cerebral aneurysm |
| US11484322B2 (en) | 2018-01-03 | 2022-11-01 | Aneuclose Llc | Aneurysm neck bridge with a closeable opening or lumen through which embolic material is inserted into the aneurysm sac |
| US20230042637A1 (en) * | 2010-10-21 | 2023-02-09 | Aneuclose Llc | Intrasacular Aneurysm Occlusion Device with a Proximal-to-Distal Stack of Shape-Changing Embolic Structures |
| US11464518B2 (en) | 2008-05-01 | 2022-10-11 | Aneuclose Llc | Proximal concave neck bridge with central lumen and distal net for occluding cerebral aneurysms |
| US11471163B2 (en) | 2008-05-01 | 2022-10-18 | Aneuclose Llc | Intrasaccular aneurysm occlusion device with net or mesh expanded by string-of-pearls embolies |
| US20180049731A1 (en) * | 2010-04-29 | 2018-02-22 | Muffin Incorporated | Closing device for tissue openings |
| US10568628B2 (en) * | 2017-05-23 | 2020-02-25 | Muffin Incorporated | Closing device for tissue openings |
| US20140135811A1 (en) | 2012-11-13 | 2014-05-15 | Covidien Lp | Occlusive devices |
| US9078658B2 (en) | 2013-08-16 | 2015-07-14 | Sequent Medical, Inc. | Filamentary devices for treatment of vascular defects |
| US11154302B2 (en) | 2014-03-31 | 2021-10-26 | DePuy Synthes Products, Inc. | Aneurysm occlusion device |
| US11076860B2 (en) | 2014-03-31 | 2021-08-03 | DePuy Synthes Products, Inc. | Aneurysm occlusion device |
| US9713475B2 (en) * | 2014-04-18 | 2017-07-25 | Covidien Lp | Embolic medical devices |
| JP6571760B2 (ja) | 2014-04-30 | 2019-09-04 | シーラス エンドバスキュラー リミテッド | 閉塞デバイス |
| US10595875B2 (en) | 2014-12-31 | 2020-03-24 | Endostream Medical Ltd. | Device for restricting blood flow to aneurysms |
| EP3261703A4 (en) | 2015-02-25 | 2018-10-24 | Galaxy Therapeutics, LLC | System for and method of treating aneurysms |
| US10569071B2 (en) | 2015-08-31 | 2020-02-25 | Ethicon Llc | Medicant eluting adjuncts and methods of using medicant eluting adjuncts |
| CA3005686A1 (en) | 2015-12-07 | 2017-06-15 | Cerus Endovascular Limited | Occlusion device |
| EP3426181B1 (en) | 2016-03-11 | 2020-10-21 | Cerus Endovascular Limited | Occlusion device |
| EP3463109A4 (en) | 2016-05-26 | 2020-01-08 | Nanostructures, Inc. | SYSTEM AND METHODS FOR EMBOLISED OCCLUSION OF NEUROVASCULAR ANEVRISMS |
| WO2017214431A2 (en) * | 2016-06-10 | 2017-12-14 | Stryker Corporation | Braided medical devices |
| US10966728B2 (en) | 2016-06-21 | 2021-04-06 | Endostream Medical Ltd. | Medical device for treating vascular malformations |
| US10576099B2 (en) | 2016-10-21 | 2020-03-03 | Covidien Lp | Injectable scaffold for treatment of intracranial aneurysms and related technology |
| US11090078B2 (en) | 2016-12-05 | 2021-08-17 | Daniel E. Walzman | Alternative use for hydrogel intrasaccular occlusion device with vertically oriented reinforcement members for structural support |
| JP7139346B2 (ja) | 2017-02-23 | 2022-09-20 | デピュイ・シンセス・プロダクツ・インコーポレイテッド | 動脈瘤装置及び送達システム |
| KR101959898B1 (ko) * | 2017-07-06 | 2019-03-19 | 전북대학교산학협력단 | 뇌혈관 혈전제거용 스텐트 모듈 |
| WO2019038293A1 (en) * | 2017-08-21 | 2019-02-28 | Cerus Endovascular Limited | OCCLUSION DEVICE |
| US10806462B2 (en) * | 2017-12-21 | 2020-10-20 | DePuy Synthes Products, Inc. | Implantable medical device detachment system with split tube and cylindrical coupling |
| US10894167B2 (en) * | 2017-12-22 | 2021-01-19 | Cardiac Pacemakers, Inc. | Implantable medical device for vascular deployment |
| US11185335B2 (en) | 2018-01-19 | 2021-11-30 | Galaxy Therapeutics Inc. | System for and method of treating aneurysms |
| US10905430B2 (en) | 2018-01-24 | 2021-02-02 | DePuy Synthes Products, Inc. | Aneurysm device and delivery system |
| CN111936063A (zh) * | 2018-01-31 | 2020-11-13 | 纳米结构公司 | 利用薄膜镍钛诺箔的血管闭塞装置 |
| US11065009B2 (en) | 2018-02-08 | 2021-07-20 | Covidien Lp | Vascular expandable devices |
| US11065136B2 (en) | 2018-02-08 | 2021-07-20 | Covidien Lp | Vascular expandable devices |
| US11813413B2 (en) * | 2018-03-27 | 2023-11-14 | St. Jude Medical, Cardiology Division, Inc. | Radiopaque outer cuff for transcatheter valve |
| WO2019222382A1 (en) * | 2018-05-15 | 2019-11-21 | Boston Scientific Scimed, Inc. | Occlusive medical device with charged polymer coating |
| US11596412B2 (en) | 2018-05-25 | 2023-03-07 | DePuy Synthes Products, Inc. | Aneurysm device and delivery system |
| US11058430B2 (en) | 2018-05-25 | 2021-07-13 | DePuy Synthes Products, Inc. | Aneurysm device and delivery system |
| US11051825B2 (en) | 2018-08-08 | 2021-07-06 | DePuy Synthes Products, Inc. | Delivery system for embolic braid |
| US11123077B2 (en) | 2018-09-25 | 2021-09-21 | DePuy Synthes Products, Inc. | Intrasaccular device positioning and deployment system |
| US11076861B2 (en) | 2018-10-12 | 2021-08-03 | DePuy Synthes Products, Inc. | Folded aneurysm treatment device and delivery method |
| CN113164173A (zh) * | 2018-12-10 | 2021-07-23 | 波士顿科学医学有限公司 | 带密封囊袋的左心耳植入物 |
| US11406392B2 (en) | 2018-12-12 | 2022-08-09 | DePuy Synthes Products, Inc. | Aneurysm occluding device for use with coagulating agents |
| US11272939B2 (en) | 2018-12-18 | 2022-03-15 | DePuy Synthes Products, Inc. | Intrasaccular flow diverter for treating cerebral aneurysms |
| EP3911252A1 (en) | 2019-01-17 | 2021-11-24 | Endostream Medical Ltd. | Vascular-malformation implant system |
| US11134953B2 (en) | 2019-02-06 | 2021-10-05 | DePuy Synthes Products, Inc. | Adhesive cover occluding device for aneurysm treatment |
| EP3908208A4 (en) | 2019-03-15 | 2022-10-19 | Sequent Medical, Inc. | FILAMENTARY DEVICES WITH A FLEXIBLE JOINT FOR THE TREATMENT OF VASCULAR ABNORMALITIES |
| CN113556985A (zh) * | 2019-03-15 | 2021-10-26 | 后续医疗股份有限公司 | 用于治疗血管缺陷的丝装置 |
| CN113573765A (zh) | 2019-03-15 | 2021-10-29 | 后续医疗股份有限公司 | 用于治疗血管缺陷的丝装置 |
| US11337706B2 (en) | 2019-03-27 | 2022-05-24 | DePuy Synthes Products, Inc. | Aneurysm treatment device |
| US11413046B2 (en) | 2019-05-21 | 2022-08-16 | DePuy Synthes Products, Inc. | Layered braided aneurysm treatment device |
| US11278292B2 (en) | 2019-05-21 | 2022-03-22 | DePuy Synthes Products, Inc. | Inverting braided aneurysm treatment system and method |
| US11497504B2 (en) | 2019-05-21 | 2022-11-15 | DePuy Synthes Products, Inc. | Aneurysm treatment with pushable implanted braid |
| US10653425B1 (en) | 2019-05-21 | 2020-05-19 | DePuy Synthes Products, Inc. | Layered braided aneurysm treatment device |
| US11607226B2 (en) | 2019-05-21 | 2023-03-21 | DePuy Synthes Products, Inc. | Layered braided aneurysm treatment device with corrugations |
| US11602350B2 (en) | 2019-12-05 | 2023-03-14 | DePuy Synthes Products, Inc. | Intrasaccular inverting braid with highly flexible fill material |
| US11672542B2 (en) | 2019-05-21 | 2023-06-13 | DePuy Synthes Products, Inc. | Aneurysm treatment with pushable ball segment |
| US10856880B1 (en) | 2019-05-25 | 2020-12-08 | Galaxy Therapeutics, Inc. | Systems and methods for treating aneurysms |
| US20210069397A1 (en) * | 2019-09-05 | 2021-03-11 | Boston Scientific Scimed Inc | Circulatory support device with integrated cannula |
| US11685007B2 (en) * | 2019-11-04 | 2023-06-27 | Covidien Lp | Devices, systems, and methods for treatment of intracranial aneurysms |
| US11457926B2 (en) | 2019-12-18 | 2022-10-04 | DePuy Synthes Products, Inc. | Implant having an intrasaccular section and intravascular section |
| US11406404B2 (en) | 2020-02-20 | 2022-08-09 | Cerus Endovascular Limited | Clot removal distal protection methods |
| US11951026B2 (en) | 2020-06-30 | 2024-04-09 | DePuy Synthes Products, Inc. | Implantable medical device detachment system with flexible braid section |
| CN115670565A (zh) * | 2020-08-12 | 2023-02-03 | 先健科技(深圳)有限公司 | 封堵装置 |
| CA3186828A1 (en) * | 2020-08-12 | 2022-02-17 | Anning Li | Plugging device |
| CN113491556B (zh) * | 2021-06-25 | 2022-07-26 | 四川艾迈思生物医疗科技股份有限公司 | 一种栓塞微导管组件 |
| US11937824B2 (en) | 2021-12-30 | 2024-03-26 | DePuy Synthes Products, Inc. | Implant detachment systems with a modified pull wire |
| WO2023154757A1 (en) * | 2022-02-11 | 2023-08-17 | Stryker Corporation | Vaso-occlusive device and delivery assembly |
| US11937825B2 (en) | 2022-03-02 | 2024-03-26 | DePuy Synthes Products, Inc. | Hook wire for preventing premature embolic implant detachment |
| US11937826B2 (en) | 2022-03-14 | 2024-03-26 | DePuy Synthes Products, Inc. | Proximal link wire for preventing premature implant detachment |
| CN114748123A (zh) * | 2022-03-17 | 2022-07-15 | 上海心玮医疗科技股份有限公司 | 一种血流导向装置输送导丝远端自膨体结构 |
| CN115607221B (zh) * | 2022-12-19 | 2023-03-03 | 上海微密医疗科技有限公司 | 一种动脉瘤瘤内封堵装置及动脉瘤瘤内封堵系统 |
| CN115778467B (zh) * | 2023-02-06 | 2023-05-12 | 北京久事神康医疗科技有限公司 | 一种动脉瘤栓塞装置及系统 |
Family Cites Families (294)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3874388A (en) | 1973-02-12 | 1975-04-01 | Ochsner Med Found Alton | Shunt defect closure system |
| FR2333169A1 (fr) | 1975-11-26 | 1977-06-24 | Gattegno Ets G | Machine pour fabriquer des tire-cables |
| JPS52141092A (en) | 1976-05-20 | 1977-11-25 | Nippon Zeon Co | Blood bessel catheter |
| US4282875A (en) | 1979-01-24 | 1981-08-11 | Serbinenko Fedor A | Occlusive device |
| US4346712A (en) | 1979-04-06 | 1982-08-31 | Kuraray Company, Ltd. | Releasable balloon catheter |
| US4675361A (en) | 1980-02-29 | 1987-06-23 | Thoratec Laboratories Corp. | Polymer systems suitable for blood-contacting surfaces of a biomedical device, and methods for forming |
| US4425908A (en) * | 1981-10-22 | 1984-01-17 | Beth Israel Hospital | Blood clot filter |
| DK151404C (da) | 1984-05-23 | 1988-07-18 | Cook Europ Aps William | Sammenklappeligt filter til implantation i en patients blodkar |
| SE453258B (sv) | 1986-04-21 | 1988-01-25 | Medinvent Sa | Elastisk, sjelvexpanderande protes samt forfarande for dess framstellning |
| US4729278A (en) | 1987-05-04 | 1988-03-08 | Rockwell International Corporation | Vertical rotary braider |
| US5154705A (en) | 1987-09-30 | 1992-10-13 | Lake Region Manufacturing Co., Inc. | Hollow lumen cable apparatus |
| US5165421A (en) | 1987-09-30 | 1992-11-24 | Lake Region Manufacturing Co., Inc. | Hollow lumen cable apparatus |
| FR2624747A1 (fr) | 1987-12-18 | 1989-06-23 | Delsanti Gerard | Dispositifs endo-arteriels amovibles destines a reparer des decollements de parois des arteres |
| US5263963A (en) | 1989-09-08 | 1993-11-23 | Advanced Cardiovascular Systems, Inc. | Expandable cage catheter for repairing a damaged blood vessel |
| US5122136A (en) | 1990-03-13 | 1992-06-16 | The Regents Of The University Of California | Endovascular electrolytically detachable guidewire tip for the electroformation of thrombus in arteries, veins, aneurysms, vascular malformations and arteriovenous fistulas |
| US5569245A (en) | 1990-03-13 | 1996-10-29 | The Regents Of The University Of California | Detachable endovascular occlusion device activated by alternating electric current |
| US5071407A (en) | 1990-04-12 | 1991-12-10 | Schneider (U.S.A.) Inc. | Radially expandable fixation member |
| US5221261A (en) | 1990-04-12 | 1993-06-22 | Schneider (Usa) Inc. | Radially expandable fixation member |
| US5108407A (en) | 1990-06-08 | 1992-04-28 | Rush-Presbyterian St. Luke's Medical Center | Method and apparatus for placement of an embolic coil |
| JPH0447415A (ja) | 1990-06-14 | 1992-02-17 | Amada Co Ltd | ワーク搬送ロボットにおけるリニアモータの制御方法及びその装置 |
| US5158545A (en) | 1991-05-02 | 1992-10-27 | Brigham And Women's Hospital | Diameter expansion cannula |
| JP2961287B2 (ja) | 1991-10-18 | 1999-10-12 | グンゼ株式会社 | 生体管路拡張具、その製造方法およびステント |
| EP0633798B1 (en) | 1992-03-31 | 2003-05-07 | Boston Scientific Corporation | Vascular filter |
| WO1993022986A1 (en) | 1992-05-08 | 1993-11-25 | Schneider (Usa) Inc. | Esophageal stent and delivery tool |
| US5562725A (en) | 1992-09-14 | 1996-10-08 | Meadox Medicals Inc. | Radially self-expanding implantable intraluminal device |
| US5630840A (en) | 1993-01-19 | 1997-05-20 | Schneider (Usa) Inc | Clad composite stent |
| US5334210A (en) | 1993-04-09 | 1994-08-02 | Cook Incorporated | Vascular occlusion assembly |
| US5536247A (en) | 1993-06-10 | 1996-07-16 | Scimed Life Systems, Inc. | Method of treating cardiac conduction defects |
| RU2089131C1 (ru) | 1993-12-28 | 1997-09-10 | Сергей Апполонович Пульнев | Стент |
| JP2880070B2 (ja) | 1994-03-31 | 1999-04-05 | 株式会社カネカメディックス | 生体内留置部材を有する医療用ワイヤー |
| EP0758870A1 (en) | 1994-05-09 | 1997-02-26 | Schneider (Usa) Inc. | Clad composite stent |
| WO1996001591A1 (en) | 1994-07-08 | 1996-01-25 | Microvena Corporation | Method of forming medical devices; intravascular occlusion devices |
| US5725552A (en) | 1994-07-08 | 1998-03-10 | Aga Medical Corporation | Percutaneous catheter directed intravascular occlusion devices |
| US5846261A (en) | 1994-07-08 | 1998-12-08 | Aga Medical Corp. | Percutaneous catheter directed occlusion devices |
| US6123715A (en) | 1994-07-08 | 2000-09-26 | Amplatz; Curtis | Method of forming medical devices; intravascular occlusion devices |
| US5556687A (en) | 1994-10-14 | 1996-09-17 | Acromed Corporation | Composite structure suitable for use as a bone plate and method for making said structure |
| US5601595A (en) | 1994-10-25 | 1997-02-11 | Scimed Life Systems, Inc. | Remobable thrombus filter |
| US5578074A (en) | 1994-12-22 | 1996-11-26 | Target Therapeutics, Inc. | Implant delivery method and assembly |
| USD380266S (en) | 1994-12-30 | 1997-06-24 | Cook Incorporated | Implantable, actively expandable stent |
| US5645558A (en) | 1995-04-20 | 1997-07-08 | Medical University Of South Carolina | Anatomically shaped vasoocclusive device and method of making the same |
| NO962336L (no) | 1995-06-06 | 1996-12-09 | Target Therapeutics Inc | Vaso-okklusiv spiral |
| WO1997001368A1 (en) | 1995-06-26 | 1997-01-16 | Trimedyne, Inc. | Therapeutic appliance releasing device |
| US5749883A (en) | 1995-08-30 | 1998-05-12 | Halpern; David Marcos | Medical instrument |
| US6168622B1 (en) | 1996-01-24 | 2001-01-02 | Microvena Corporation | Method and apparatus for occluding aneurysms |
| WO1997027959A1 (en) | 1996-01-30 | 1997-08-07 | Medtronic, Inc. | Articles for and methods of making stents |
| US5733294A (en) | 1996-02-28 | 1998-03-31 | B. Braun Medical, Inc. | Self expanding cardiovascular occlusion device, method of using and method of making the same |
| US6592617B2 (en) | 1996-04-30 | 2003-07-15 | Boston Scientific Scimed, Inc. | Three-dimensional braided covered stent |
| US5718159A (en) | 1996-04-30 | 1998-02-17 | Schneider (Usa) Inc. | Process for manufacturing three-dimensional braided covered stent |
| US5927345A (en) | 1996-04-30 | 1999-07-27 | Target Therapeutics, Inc. | Super-elastic alloy braid structure |
| US6949116B2 (en) | 1996-05-08 | 2005-09-27 | Carag Ag | Device for plugging an opening such as in a wall of a hollow or tubular organ including biodegradable elements |
| US6190402B1 (en) | 1996-06-21 | 2001-02-20 | Musc Foundation For Research Development | Insitu formable and self-forming intravascular flow modifier (IFM) and IFM assembly for deployment of same |
| US5964797A (en) | 1996-08-30 | 1999-10-12 | Target Therapeutics, Inc. | Electrolytically deployable braided vaso-occlusion device |
| US5980554A (en) * | 1997-05-05 | 1999-11-09 | Micro Therapeutics, Inc. | Wire frame partial flow obstruction for aneurysm treatment |
| US5951599A (en) | 1997-07-09 | 1999-09-14 | Scimed Life Systems, Inc. | Occlusion system for endovascular treatment of an aneurysm |
| US7569066B2 (en) | 1997-07-10 | 2009-08-04 | Boston Scientific Scimed, Inc. | Methods and devices for the treatment of aneurysms |
| US5928260A (en) | 1997-07-10 | 1999-07-27 | Scimed Life Systems, Inc. | Removable occlusion system for aneurysm neck |
| US5944733A (en) | 1997-07-14 | 1999-08-31 | Target Therapeutics, Inc. | Controlled detachable vasoocclusive member using mechanical junction and friction-enhancing member |
| GB9715241D0 (en) | 1997-07-18 | 1997-09-24 | Jeffree Martin A | Device for treating aneurysms |
| DE69835958T2 (de) | 1997-08-04 | 2007-02-15 | Boston Scientific Ltd., Barbados | Okklussionssystem zum ausbessern eines aneurysmas |
| US6063070A (en) | 1997-08-05 | 2000-05-16 | Target Therapeutics, Inc. | Detachable aneurysm neck bridge (II) |
| JP4127960B2 (ja) | 1997-08-05 | 2008-07-30 | ボストン サイエンティフィック リミテッド | 着脱可能な動脈瘤頸部ブリッジ |
| US5916235A (en) | 1997-08-13 | 1999-06-29 | The Regents Of The University Of California | Apparatus and method for the use of detachable coils in vascular aneurysms and body cavities |
| US6086577A (en) | 1997-08-13 | 2000-07-11 | Scimed Life Systems, Inc. | Detachable aneurysm neck bridge (III) |
| US6156061A (en) | 1997-08-29 | 2000-12-05 | Target Therapeutics, Inc. | Fast-detaching electrically insulated implant |
| US5984929A (en) | 1997-08-29 | 1999-11-16 | Target Therapeutics, Inc. | Fast detaching electronically isolated implant |
| US6066149A (en) | 1997-09-30 | 2000-05-23 | Target Therapeutics, Inc. | Mechanical clot treatment device with distal filter |
| US6511468B1 (en) | 1997-10-17 | 2003-01-28 | Micro Therapeutics, Inc. | Device and method for controlling injection of liquid embolic composition |
| EP0948935B1 (en) | 1997-10-30 | 2007-09-05 | Kaneka Medix Corporation | Medical implement for depositing implantable device |
| US6461370B1 (en) | 1998-11-03 | 2002-10-08 | C. R. Bard, Inc. | Temporary vascular filter guide wire |
| US20040260333A1 (en) | 1997-11-12 | 2004-12-23 | Dubrul William R. | Medical device and method |
| US6159165A (en) | 1997-12-05 | 2000-12-12 | Micrus Corporation | Three dimensional spherical micro-coils manufactured from radiopaque nickel-titanium microstrand |
| US5873907A (en) | 1998-01-27 | 1999-02-23 | Endotex Interventional Systems, Inc. | Electrolytic stent delivery system and methods of use |
| US5944738A (en) | 1998-02-06 | 1999-08-31 | Aga Medical Corporation | Percutaneous catheter directed constricting occlusion device |
| ATE454098T1 (de) | 1998-02-10 | 2010-01-15 | Artemis Medical Inc | Okklusions-, verankerungs-, span- oder stromsteuergerät |
| US5925060A (en) | 1998-03-13 | 1999-07-20 | B. Braun Celsa | Covered self-expanding vascular occlusion device |
| US6450989B2 (en) | 1998-04-27 | 2002-09-17 | Artemis Medical, Inc. | Dilating and support apparatus with disease inhibitors and methods for use |
| US6168615B1 (en) * | 1998-05-04 | 2001-01-02 | Micrus Corporation | Method and apparatus for occlusion and reinforcement of aneurysms |
| US6463317B1 (en) | 1998-05-19 | 2002-10-08 | Regents Of The University Of Minnesota | Device and method for the endovascular treatment of aneurysms |
| JP4741728B2 (ja) | 1998-06-04 | 2011-08-10 | ニューヨーク・ユニバーシティ | 血管内薄膜デバイスおよびストロークの予防治療法 |
| US6139564A (en) | 1998-06-16 | 2000-10-31 | Target Therapeutics Inc. | Minimally occlusive flow disruptor stent for bridging aneurysm necks |
| US5935148A (en) | 1998-06-24 | 1999-08-10 | Target Therapeutics, Inc. | Detachable, varying flexibility, aneurysm neck bridge |
| US6096175A (en) | 1998-07-17 | 2000-08-01 | Micro Therapeutics, Inc. | Thin film stent |
| US7004962B2 (en) | 1998-07-27 | 2006-02-28 | Schneider (Usa), Inc. | Neuroaneurysm occlusion and delivery device and method of using same |
| US6093199A (en) | 1998-08-05 | 2000-07-25 | Endovascular Technologies, Inc. | Intra-luminal device for treatment of body cavities and lumens and method of use |
| US6315709B1 (en) | 1998-08-07 | 2001-11-13 | Stereotaxis, Inc. | Magnetic vascular defect treatment system |
| US6478773B1 (en) | 1998-12-21 | 2002-11-12 | Micrus Corporation | Apparatus for deployment of micro-coil using a catheter |
| US6500149B2 (en) | 1998-08-31 | 2002-12-31 | Deepak Gandhi | Apparatus for deployment of micro-coil using a catheter |
| WO2000013593A1 (en) | 1998-09-04 | 2000-03-16 | Boston Scientific Limited (Incorporated In Ireland) | Detachable aneurysm neck closure patch |
| US7410482B2 (en) | 1998-09-04 | 2008-08-12 | Boston Scientific-Scimed, Inc. | Detachable aneurysm neck bridge |
| US6277126B1 (en) | 1998-10-05 | 2001-08-21 | Cordis Neurovascular Inc. | Heated vascular occlusion coil development system |
| US7044134B2 (en) | 1999-11-08 | 2006-05-16 | Ev3 Sunnyvale, Inc | Method of implanting a device in the left atrial appendage |
| US6152144A (en) | 1998-11-06 | 2000-11-28 | Appriva Medical, Inc. | Method and device for left atrial appendage occlusion |
| US6142975A (en) | 1998-12-31 | 2000-11-07 | Advanced Cardiovascular Systems, Inc. | Guidewire having braided wire over drawn tube construction |
| US6368338B1 (en) * | 1999-03-05 | 2002-04-09 | Board Of Regents, The University Of Texas | Occlusion method and apparatus |
| US6428558B1 (en) | 1999-03-10 | 2002-08-06 | Cordis Corporation | Aneurysm embolization device |
| US6613074B1 (en) | 1999-03-10 | 2003-09-02 | Cordis Corporation | Endovascular aneurysm embolization device |
| US6203779B1 (en) | 1999-03-19 | 2001-03-20 | Charlie Ricci | Methods for treating endoleaks during endovascular repair of abdominal aortic aneurysms |
| US20020169473A1 (en) | 1999-06-02 | 2002-11-14 | Concentric Medical, Inc. | Devices and methods for treating vascular malformations |
| US6375668B1 (en) | 1999-06-02 | 2002-04-23 | Hanson S. Gifford | Devices and methods for treating vascular malformations |
| US7052711B2 (en) | 1999-09-02 | 2006-05-30 | Rice University | Nitric oxide-producing hydrogel materials |
| US6325815B1 (en) | 1999-09-21 | 2001-12-04 | Microvena Corporation | Temporary vascular filter |
| US6375670B1 (en) | 1999-10-07 | 2002-04-23 | Prodesco, Inc. | Intraluminal filter |
| US6689150B1 (en) | 1999-10-27 | 2004-02-10 | Atritech, Inc. | Filter apparatus for ostium of left atrial appendage |
| US6551303B1 (en) | 1999-10-27 | 2003-04-22 | Atritech, Inc. | Barrier device for ostium of left atrial appendage |
| US6994092B2 (en) | 1999-11-08 | 2006-02-07 | Ev3 Sunnyvale, Inc. | Device for containing embolic material in the LAA having a plurality of tissue retention structures |
| US6790218B2 (en) | 1999-12-23 | 2004-09-14 | Swaminathan Jayaraman | Occlusive coil manufacture and delivery |
| DE10000137A1 (de) | 2000-01-04 | 2001-07-12 | Pfm Prod Fuer Die Med Ag | Implantat zum Verschließen von Defektöffnungen im menschlichen oder tierischen Körper |
| US6350270B1 (en) | 2000-01-24 | 2002-02-26 | Scimed Life Systems, Inc. | Aneurysm liner |
| US7740637B2 (en) | 2000-02-09 | 2010-06-22 | Micrus Endovascular Corporation | Apparatus and method for deployment of a therapeutic device using a catheter |
| US20020043456A1 (en) | 2000-02-29 | 2002-04-18 | Ho Ken K. | Bimorphic, compositionally-graded, sputter-deposited, thin film shape memory device |
| US6346117B1 (en) | 2000-03-02 | 2002-02-12 | Prodesco, Inc. | Bag for use in the intravascular treatment of saccular aneurysms |
| US6391037B1 (en) | 2000-03-02 | 2002-05-21 | Prodesco, Inc. | Bag for use in the intravascular treatment of saccular aneurysms |
| US6632241B1 (en) | 2000-03-22 | 2003-10-14 | Endovascular Technologies, Inc. | Self-expanding, pseudo-braided intravascular device |
| US6719778B1 (en) | 2000-03-24 | 2004-04-13 | Endovascular Technologies, Inc. | Methods for treatment of aneurysms |
| US20010031981A1 (en) | 2000-03-31 | 2001-10-18 | Evans Michael A. | Method and device for locating guidewire and treating chronic total occlusions |
| WO2001093782A1 (en) | 2000-06-08 | 2001-12-13 | Frantzen John J | Radially expandable stent featuring covering tip primarily for bifurcated artery aneurysms |
| WO2002000139A1 (en) | 2000-06-23 | 2002-01-03 | Frantzen John J | Radially expandable aneurysm treatment stent |
| US6855154B2 (en) | 2000-08-11 | 2005-02-15 | University Of Louisville Research Foundation, Inc. | Endovascular aneurysm treatment device and method |
| US6939377B2 (en) | 2000-08-23 | 2005-09-06 | Thoratec Corporation | Coated vascular grafts and methods of use |
| EP1320390A2 (en) | 2000-09-18 | 2003-06-25 | Organogenesis Inc. | Bioengineered flat sheet graft prosthesis and its use |
| US7691144B2 (en) | 2003-10-01 | 2010-04-06 | Mvrx, Inc. | Devices, systems, and methods for reshaping a heart valve annulus |
| US20050228422A1 (en) | 2002-11-26 | 2005-10-13 | Ample Medical, Inc. | Devices, systems, and methods for reshaping a heart valve annulus, including the use of magnetic tools |
| US20060252984A1 (en) | 2000-09-20 | 2006-11-09 | Ample Medical, Inc. | Devices, systems, and methods for reshaping a heart valve annulus |
| US6730119B1 (en) | 2000-10-06 | 2004-05-04 | Board Of Regents Of The University Of Texas System | Percutaneous implantation of partially covered stents in aneurysmally dilated arterial segments with subsequent embolization and obliteration of the aneurysm cavity |
| US20060135947A1 (en) | 2000-10-27 | 2006-06-22 | Pulmonx | Occlusal stent and methods for its use |
| US6589265B1 (en) | 2000-10-31 | 2003-07-08 | Endovascular Technologies, Inc. | Intrasaccular embolic device |
| US6743251B1 (en) | 2000-11-15 | 2004-06-01 | Scimed Life Systems, Inc. | Implantable devices with polymeric detachment junction |
| US6878384B2 (en) | 2001-03-13 | 2005-04-12 | Microvention, Inc. | Hydrogels that undergo volumetric expansion in response to changes in their environment and their methods of manufacture and use |
| US6818006B2 (en) | 2001-04-03 | 2004-11-16 | Medtronic Vascular, Inc. | Temporary intraluminal filter guidewire |
| US7044958B2 (en) | 2001-04-03 | 2006-05-16 | Medtronic Vascular, Inc. | Temporary device for capturing embolic material |
| US6855153B2 (en) | 2001-05-01 | 2005-02-15 | Vahid Saadat | Embolic balloon |
| US6607539B1 (en) | 2001-05-18 | 2003-08-19 | Endovascular Technologies, Inc. | Electric endovascular implant depolyment system |
| EP2319430B1 (en) | 2001-05-29 | 2013-11-13 | Microvention, Inc. | Vascular embolization device and method of manufacture |
| US7338514B2 (en) | 2001-06-01 | 2008-03-04 | St. Jude Medical, Cardiology Division, Inc. | Closure devices, related delivery methods and tools, and related methods of use |
| US20020187288A1 (en) | 2001-06-11 | 2002-12-12 | Advanced Cardiovascular Systems, Inc. | Medical device formed of silicone-polyurethane |
| US6454780B1 (en) | 2001-06-21 | 2002-09-24 | Scimed Life Systems, Inc. | Aneurysm neck obstruction device |
| US20030100945A1 (en) | 2001-11-23 | 2003-05-29 | Mindguard Ltd. | Implantable intraluminal device and method of using same in treating aneurysms |
| US7011671B2 (en) | 2001-07-18 | 2006-03-14 | Atritech, Inc. | Cardiac implant device tether system and method |
| US8252040B2 (en) | 2001-07-20 | 2012-08-28 | Microvention, Inc. | Aneurysm treatment device and method of use |
| US20030028209A1 (en) | 2001-07-31 | 2003-02-06 | Clifford Teoh | Expandable body cavity liner device |
| US6811560B2 (en) | 2001-09-20 | 2004-11-02 | Cordis Neurovascular, Inc. | Stent aneurysm embolization method and device |
| US20050021075A1 (en) | 2002-12-30 | 2005-01-27 | Bonnette Michael J. | Guidewire having deployable sheathless protective filter |
| JP4429589B2 (ja) | 2001-11-15 | 2010-03-10 | コーディス・ニューロバスキュラー・インコーポレイテッド | 閉塞部材を用いる動脈瘤塞栓装置 |
| JP2003190175A (ja) | 2001-11-15 | 2003-07-08 | Cordis Neurovascular Inc | 動脈瘤を密閉するための動脈瘤頚部プラグ |
| US20040111147A1 (en) | 2002-12-03 | 2004-06-10 | Rabkin Dmitry J. | Temporary, repositionable or retrievable intraluminal devices |
| US6752826B2 (en) | 2001-12-14 | 2004-06-22 | Thoratec Corporation | Layered stent-graft and methods of making the same |
| US6953473B2 (en) | 2001-12-20 | 2005-10-11 | Boston Scientific Scimed, Inc. | Detachable device with electrically responsive element |
| EP1469790B1 (en) | 2002-01-25 | 2016-10-19 | Atritech, Inc. | Atrial appendage blood filtration systems |
| US6638257B2 (en) | 2002-03-01 | 2003-10-28 | Aga Medical Corporation | Intravascular flow restrictor |
| US7695488B2 (en) | 2002-03-27 | 2010-04-13 | Boston Scientific Scimed, Inc. | Expandable body cavity liner device |
| US20050119684A1 (en) | 2002-07-12 | 2005-06-02 | Guterman Lee R. | Aneurysm buttress arrangement |
| US6746890B2 (en) | 2002-07-17 | 2004-06-08 | Tini Alloy Company | Three dimensional thin film devices and methods of fabrication |
| US7001422B2 (en) * | 2002-09-23 | 2006-02-21 | Cordis Neurovascular, Inc | Expandable stent and delivery system |
| US7331973B2 (en) | 2002-09-30 | 2008-02-19 | Avdanced Cardiovascular Systems, Inc. | Guide wire with embolic filtering attachment |
| US6997904B2 (en) | 2002-12-24 | 2006-02-14 | Robert David Sculati | Viscous fluid injection system |
| US7229454B2 (en) | 2003-01-07 | 2007-06-12 | Boston Scientific Scimed, Inc. | Occlusive cinching devices and methods of use |
| US20060116708A1 (en) | 2003-01-10 | 2006-06-01 | Atsushi Ogawa | Indwelling implant for embolization |
| US8377035B2 (en) | 2003-01-17 | 2013-02-19 | Boston Scientific Scimed, Inc. | Unbalanced reinforcement members for medical device |
| US20040158311A1 (en) | 2003-02-06 | 2004-08-12 | Berhow Steven W. | Intravascular stent |
| US20040193208A1 (en) | 2003-03-27 | 2004-09-30 | Scimed Life Systems, Inc. | Radiopaque embolic protection filter membrane |
| US8372112B2 (en) | 2003-04-11 | 2013-02-12 | St. Jude Medical, Cardiology Division, Inc. | Closure devices, related delivery methods, and related methods of use |
| US20040204737A1 (en) | 2003-04-11 | 2004-10-14 | Scimed Life Systems, Inc. | Embolic filter loop fabricated from composite material |
| US7597704B2 (en) | 2003-04-28 | 2009-10-06 | Atritech, Inc. | Left atrial appendage occlusion device with active expansion |
| ES2440654T3 (es) | 2003-05-05 | 2014-01-29 | Ben-Gurion University Of The Negev Research And Development Authority | Preparaciones poliméricas reticuladas inyectables y usos de las mismas |
| DE602004025814D1 (de) | 2003-05-19 | 2010-04-15 | Septrx Inc | Gewebeweitungsvorrichtung und verwandte verfahren für die therapeutische intervention |
| US7101390B2 (en) | 2003-05-27 | 2006-09-05 | Scimed Life Systems, Inc. | Staged deployment endograft |
| US20050053782A1 (en) | 2003-09-04 | 2005-03-10 | Ayusman Sen | Process for forming polymeric micro and nanofibers |
| US6940209B2 (en) | 2003-09-08 | 2005-09-06 | New Scale Technologies | Ultrasonic lead screw motor |
| US7235295B2 (en) | 2003-09-10 | 2007-06-26 | Laurencin Cato T | Polymeric nanofibers for tissue engineering and drug delivery |
| US7020947B2 (en) | 2003-09-23 | 2006-04-04 | Fort Wayne Metals Research Products Corporation | Metal wire with filaments for biomedical applications |
| US7232461B2 (en) | 2003-10-29 | 2007-06-19 | Cordis Neurovascular, Inc. | Neck covering device for an aneurysm |
| AU2004289362A1 (en) | 2003-11-10 | 2005-05-26 | Angiotech International Ag | Intravascular devices and fibrosis-inducing agents |
| WO2005055834A1 (en) | 2003-11-20 | 2005-06-23 | Nmt Medical, Inc. | Device, with electrospun fabric, for a percutaneous transluminal procedure, and methods thereof |
| US20050133046A1 (en) | 2003-12-17 | 2005-06-23 | Becker Timothy A. | Compositions and methods for improved occlusion of vascular defects |
| US7763011B2 (en) | 2003-12-22 | 2010-07-27 | Boston Scientific Scimed, Inc. | Variable density braid stent |
| US7329279B2 (en) | 2003-12-23 | 2008-02-12 | Sadra Medical, Inc. | Methods and apparatus for endovascularly replacing a patient's heart valve |
| US7275471B2 (en) | 2003-12-29 | 2007-10-02 | Surpass Medical Ltd. | Mixed wire braided device with structural integrity |
| US20110208233A1 (en) | 2004-01-22 | 2011-08-25 | Mcguckin Jr James F | Device for preventing clot migration from left atrial appendage |
| WO2005074845A1 (en) | 2004-02-02 | 2005-08-18 | Ams Research Corporation | Enhancing tissue ingrowth for contraception |
| WO2005081681A2 (en) | 2004-02-11 | 2005-09-09 | Fort Wayne Metals Research Products Corporation | Drawn strand filled tubing wire |
| US20050228434A1 (en) | 2004-03-19 | 2005-10-13 | Aga Medical Corporation | Multi-layer braided structures for occluding vascular defects |
| US8777974B2 (en) | 2004-03-19 | 2014-07-15 | Aga Medical Corporation | Multi-layer braided structures for occluding vascular defects |
| US8398670B2 (en) | 2004-03-19 | 2013-03-19 | Aga Medical Corporation | Multi-layer braided structures for occluding vascular defects and for occluding fluid flow through portions of the vasculature of the body |
| US8313505B2 (en) | 2004-03-19 | 2012-11-20 | Aga Medical Corporation | Device for occluding vascular defects |
| US9039724B2 (en) | 2004-03-19 | 2015-05-26 | Aga Medical Corporation | Device for occluding vascular defects |
| US8715340B2 (en) | 2004-03-31 | 2014-05-06 | Merlin Md Pte Ltd. | Endovascular device with membrane |
| AU2005232562B2 (en) | 2004-04-08 | 2009-05-07 | St. Jude Medical, Cardiology Division, Inc. | Flange occlusion devices and methods |
| US20050267516A1 (en) | 2004-06-01 | 2005-12-01 | Farzad Soleimani | Embolic protection device for the prevention of stroke |
| BE1016067A3 (fr) | 2004-06-03 | 2006-02-07 | Frid Noureddine | Endoprothese luminale pour occlusion d'anevrisme et procede de fabrication d'une telle endoprothese. |
| WO2005123171A2 (en) * | 2004-06-09 | 2005-12-29 | Stout Medical Group Lp | Three-dimensional coils for treatment of vascular aneurysms |
| JP5087399B2 (ja) | 2004-08-25 | 2012-12-05 | マイクロベンション インコーポレイテッド | 移植可能なデバイスのための熱離脱システム |
| EP1827250B1 (en) | 2004-08-31 | 2018-05-16 | Cook Medical Technologies LLC | Device for treating an aneurysm |
| EP1788956B1 (en) | 2004-09-17 | 2011-11-09 | Codman & Shurtleff, Inc. | Vascular occlusion device with an embolic mesh ribbon |
| EP1804719A2 (en) | 2004-09-22 | 2007-07-11 | Lee R. Guterman | Cranial aneurysm treatment arrangement |
| US7201918B2 (en) | 2004-11-16 | 2007-04-10 | Microvention, Inc. | Compositions, systems and methods for treatment of defects in blood vessels |
| US20060155323A1 (en) | 2005-01-07 | 2006-07-13 | Porter Stephen C | Intra-aneurysm devices |
| CN101146484B (zh) | 2005-01-25 | 2015-04-08 | 泰科医疗集团有限合伙公司 | 用于永久性闭塞中空解剖结构的结构 |
| WO2006096449A2 (en) | 2005-03-03 | 2006-09-14 | Hines Richard A | Endovascular aneurysm treatment device and delivery system |
| DE102005013547B4 (de) | 2005-03-23 | 2009-02-05 | Admedes Schuessler Gmbh | Aneurysmen-Stent und Verfahren zu seiner Herstellung |
| WO2006116524A1 (en) | 2005-04-25 | 2006-11-02 | Massachusetts Institute Of Technology | Compositions and methods for promoting hemostasis and other physiological activities |
| US7967747B2 (en) * | 2005-05-10 | 2011-06-28 | Boston Scientific Scimed, Inc. | Filtering apparatus and methods of use |
| US8002789B2 (en) | 2005-05-31 | 2011-08-23 | Stryker Corporation | Stretch-resistant vaso-occlusive devices with flexible detachment junctions |
| DE102006020687A1 (de) | 2005-07-19 | 2007-02-08 | Aesculap Ag & Co. Kg | Stentgraft-Prothese |
| US20070021816A1 (en) | 2005-07-21 | 2007-01-25 | The Research Foundation Of State University Of New York | Stent vascular intervention device and methods for treating aneurysms |
| US20070061006A1 (en) | 2005-09-14 | 2007-03-15 | Nathan Desatnik | Methods of making shape memory films by chemical vapor deposition and shape memory devices made thereby |
| JP2009512515A (ja) | 2005-10-19 | 2009-03-26 | パルサー バスキュラー インコーポレイテッド | 脈管内をクリッピングし、腔内および組織欠損を修復するための方法およびシステム。 |
| US8545530B2 (en) | 2005-10-19 | 2013-10-01 | Pulsar Vascular, Inc. | Implantable aneurysm closure systems and methods |
| US20070100414A1 (en) | 2005-11-02 | 2007-05-03 | Cardiomind, Inc. | Indirect-release electrolytic implant delivery systems |
| DE102005052628B4 (de) | 2005-11-04 | 2014-06-05 | Jenavalve Technology Inc. | Selbstexpandierendes, flexibles Drahtgeflecht mit integrierter Klappenprothese für den transvaskulären Herzklappenersatz und ein System mit einer solchen Vorrichtung und einem Einführkatheter |
| US8100938B2 (en) | 2005-11-14 | 2012-01-24 | Occlutech Holding Ag | Occlusion device for occluding an atrial auricula and method for producing same |
| US7665466B2 (en) | 2005-11-14 | 2010-02-23 | Occlutech Gmbh | Self-expanding medical occlusion device |
| US8455088B2 (en) | 2005-12-23 | 2013-06-04 | Boston Scientific Scimed, Inc. | Spun nanofiber, medical devices, and methods |
| US7744652B2 (en) | 2006-01-23 | 2010-06-29 | Hesham Morsi | Aneurysm sealing device |
| WO2007090127A2 (en) | 2006-01-30 | 2007-08-09 | Surgica Corporation | Compressible intravascular embolization particles and related methods and delivery systems |
| WO2007100556A1 (en) | 2006-02-22 | 2007-09-07 | Ev3 Inc. | Embolic protection systems having radiopaque filter mesh |
| GB0603685D0 (en) | 2006-02-23 | 2006-04-05 | Angiomed Ag | Vascular prosthesis for aneurysms, set of vascular prostheses, method for manufacturing a vascular prosthesis and method for inserting a vascular prosthesis |
| CN101049266B (zh) | 2006-04-03 | 2010-11-17 | 孟坚 | 医疗用闭塞器械及其制造方法 |
| DE102006013770A1 (de) | 2006-03-24 | 2007-09-27 | Occlutech Gmbh | Occlusionsinstrument und Verfahren zu dessen Herstellung |
| CN101049268B (zh) * | 2006-04-03 | 2011-09-14 | 孟坚 | 医疗用闭塞器械 |
| CN101049269B (zh) | 2006-04-03 | 2010-12-29 | 孟坚 | 医疗用闭塞器械 |
| US20070288083A1 (en) | 2006-05-12 | 2007-12-13 | Hines Richard A | Exclusion Device and System For Delivery |
| US20080033341A1 (en) | 2006-08-04 | 2008-02-07 | Bay Holdings Ltd. | Methods and devices for reducing or blocking blood flow to a selected blood vessel or part thereof |
| WO2008022327A2 (en) | 2006-08-17 | 2008-02-21 | Nfocus Neuromedical, Inc. | Isolation devices for the treatment of aneurysms |
| GB0616738D0 (en) | 2006-08-23 | 2006-10-04 | Evexar Medical Ltd | Improvements in and relating to medical devices |
| EP2263605A1 (en) | 2006-11-20 | 2010-12-22 | SeptRx, Inc. | Device and method for preventing the undesired passage of emboli from a venous blood pool to an arterial blood pool |
| JP5249249B2 (ja) | 2007-03-13 | 2013-07-31 | コヴィディエン リミテッド パートナーシップ | コイルと耐伸張性部材とが含まれているインプラント |
| US7573382B2 (en) | 2007-04-02 | 2009-08-11 | General Electric Company | System and method to manage movement of assets |
| ES2856081T3 (es) | 2007-04-16 | 2021-09-27 | Occlutech Holding Ag | Oclusor para la oclusión de una orejuela auricular y procedimiento de producción del mismo |
| WO2009017855A2 (en) | 2007-04-27 | 2009-02-05 | Wisconsin Alumni Research Foundation | Aneurysm occlusion device containing bioactive and biocompatible copolymer shell and a liquid embolic agent and a biocompatible metallic frame member |
| WO2008151204A1 (en) | 2007-06-04 | 2008-12-11 | Sequent Medical Inc. | Methods and devices for treatment of vascular defects |
| US8361138B2 (en) | 2007-07-25 | 2013-01-29 | Aga Medical Corporation | Braided occlusion device having repeating expanded volume segments separated by articulation segments |
| WO2010014075A1 (en) | 2007-07-27 | 2010-02-04 | Microvention, Inc. | Detachable coil incorporating stretch resistance |
| EP2324775B1 (en) | 2007-08-02 | 2012-06-20 | Occlutech Holding AG | Method of producing a medical implantable device |
| US20110144669A1 (en) | 2007-09-11 | 2011-06-16 | Nfocus Neuromedical Inc. | Aneurysm cover device for embolic delivery and retention |
| US20090082803A1 (en) | 2007-09-26 | 2009-03-26 | Aga Medical Corporation | Braided vascular devices having no end clamps |
| US9414842B2 (en) | 2007-10-12 | 2016-08-16 | St. Jude Medical, Cardiology Division, Inc. | Multi-component vascular device |
| US8066757B2 (en) | 2007-10-17 | 2011-11-29 | Mindframe, Inc. | Blood flow restoration and thrombus management methods |
| CA2710146C (en) | 2007-12-21 | 2017-03-28 | Microvention, Inc. | System and method for locating detachment zone of a detachable implant |
| AU2008345596B2 (en) | 2007-12-21 | 2013-09-05 | Microvention, Inc. | A system and method of detecting implant detachment |
| WO2009108877A1 (en) | 2008-02-29 | 2009-09-03 | Fort Wayne Metals Research Products Corporation | Alternating core composite wire |
| US20090227976A1 (en) | 2008-03-05 | 2009-09-10 | Calabria Marie F | Multiple biocompatible polymeric strand aneurysm embolization system and method |
| WO2009121006A1 (en) | 2008-03-27 | 2009-10-01 | Nfocus Neuromedical, Inc. | Friction-release distal latch implant delivery system and components |
| US7806919B2 (en) | 2008-04-01 | 2010-10-05 | Medtronic Vascular, Inc. | Double-walled stent system |
| JP2011517424A (ja) | 2008-04-08 | 2011-06-09 | リバース メディカル コーポレイション | 閉塞デバイスおよび使用方法 |
| DK2265193T3 (da) | 2008-04-21 | 2012-01-23 | Nfocus Neuromedical Inc | Emboliske indretninger med flettet kugle og leveringssystemer |
| US20090318948A1 (en) | 2008-04-22 | 2009-12-24 | Coherex Medical, Inc. | Device, system and method for aneurysm embolization |
| JP2011519300A (ja) | 2008-05-01 | 2011-07-07 | アニュクローズ エルエルシー | 動脈瘤閉塞装置 |
| EP2279023B1 (en) | 2008-05-02 | 2020-12-02 | Sequent Medical, Inc. | Filamentary devices for treatment of vascular defects |
| MX2011000857A (es) | 2008-07-22 | 2011-07-28 | Tyco Healthcare | Dispositivo de remodelacion vascular. |
| US9351715B2 (en) | 2008-07-24 | 2016-05-31 | St. Jude Medical, Cardiology Division, Inc. | Multi-layered medical device for treating a target site and associated method |
| US20100069948A1 (en) | 2008-09-12 | 2010-03-18 | Micrus Endovascular Corporation | Self-expandable aneurysm filling device, system and method of placement |
| JP5927405B2 (ja) | 2008-09-19 | 2016-06-01 | フォート ウェイン メタルス リサーチ プロダクツ コーポレーション | 耐疲労損傷性ワイヤおよびその製造方法 |
| US9427304B2 (en) | 2008-10-27 | 2016-08-30 | St. Jude Medical, Cardiology Division, Inc. | Multi-layer device with gap for treating a target site and associated method |
| WO2010051515A1 (en) | 2008-10-31 | 2010-05-06 | Fort Wayne Metals Research Products Corporation | Method for imparting improved fatigue strength to wire made of shape memory alloys, and medical devices made from such wire |
| US20120071911A1 (en) | 2009-05-20 | 2012-03-22 | University Of Miami | Spherical helix embolic coils for the treatment of cerebral aneurysms |
| US20110054515A1 (en) | 2009-08-25 | 2011-03-03 | John Bridgeman | Device and method for occluding the left atrial appendage |
| CA2778639A1 (en) | 2009-11-05 | 2011-05-12 | Sequent Medical Inc. | Multiple layer filamentary devices or treatment of vascular defects |
| US20110202085A1 (en) | 2009-11-09 | 2011-08-18 | Siddharth Loganathan | Braid Ball Embolic Device Features |
| US9814562B2 (en) | 2009-11-09 | 2017-11-14 | Covidien Lp | Interference-relief type delivery detachment systems |
| US8771289B2 (en) | 2009-12-21 | 2014-07-08 | Acist Medical Systems, Inc. | Thrombus removal device and system |
| US8926681B2 (en) * | 2010-01-28 | 2015-01-06 | Covidien Lp | Vascular remodeling device |
| US20110245861A1 (en) * | 2010-04-05 | 2011-10-06 | Boston Scientific Scimed, Inc. | Vaso-occlusive devices |
| US8828051B2 (en) * | 2010-07-02 | 2014-09-09 | Pfm Medical Ag | Left atrial appendage occlusion device |
| US8998947B2 (en) | 2010-09-10 | 2015-04-07 | Medina Medical, Inc. | Devices and methods for the treatment of vascular defects |
| US20130066357A1 (en) | 2010-09-10 | 2013-03-14 | Maria Aboytes | Devices and methods for the treatment of vascular defects |
| EP2648658B1 (en) | 2010-12-06 | 2018-10-24 | Covidien LP | Vascular remodeling device |
| US20120245674A1 (en) * | 2011-03-25 | 2012-09-27 | Tyco Healthcare Group Lp | Vascular remodeling device |
| US20120283768A1 (en) | 2011-05-05 | 2012-11-08 | Sequent Medical Inc. | Method and apparatus for the treatment of large and giant vascular defects |
| US20120296362A1 (en) * | 2011-05-19 | 2012-11-22 | Tyco Healthcare Group Lp | Vascular remodeling device |
| WO2012170448A1 (en) | 2011-06-05 | 2012-12-13 | The Research Foundation Of State University Of New York | System and method for simulating deployment configuration of an expandable device |
| US9198668B2 (en) * | 2011-08-04 | 2015-12-01 | Cook Medical Technologies Llc | Cerebral aneurysm closure device |
| US8261648B1 (en) | 2011-10-17 | 2012-09-11 | Sequent Medical Inc. | Braiding mechanism and methods of use |
| AU2013207123B2 (en) | 2012-01-04 | 2018-03-01 | Rapid Medical Ltd. | Braided devices for assisting medical treatments |
| BR112014016789A8 (pt) | 2012-01-06 | 2017-07-04 | Inceptus Medical LLC | dispositivos de oclusão expansíveis e métodos de uso |
| US9687245B2 (en) * | 2012-03-23 | 2017-06-27 | Covidien Lp | Occlusive devices and methods of use |
| US20150133989A1 (en) * | 2012-04-20 | 2015-05-14 | Inceptus Medical, Llc | Expandable occlusion devices and methods of use |
| US9211132B2 (en) | 2012-06-27 | 2015-12-15 | MicoVention, Inc. | Obstruction removal system |
| EP2872663B1 (en) | 2012-07-10 | 2020-10-14 | Fort Wayne Metals Research Products Corporation | Biodegradable alloy wire for medical devices |
| EP2872051B1 (en) | 2012-07-13 | 2017-03-29 | Boston Scientific Scimed, Inc. | Occlusion device for an atrial appendage |
| CA2880025A1 (en) | 2012-09-12 | 2014-03-20 | Boston Scientific Scimed, Inc. | Fixation anchor design for an occlusion device |
| WO2014074132A1 (en) | 2012-11-09 | 2014-05-15 | Aga Medical Corporation | Devices and methods for delivering vascular implants |
| US20140135817A1 (en) | 2012-11-14 | 2014-05-15 | Boston Scientific Scimed, Inc. | Left atrial appendage closure implant |
| US8597323B1 (en) | 2012-11-16 | 2013-12-03 | Sequent Medical, Inc. | Delivery and detachment systems and methods for vascular implants |
| KR102199098B1 (ko) | 2012-12-05 | 2021-01-07 | 라피드 메디칼 리미티드 | 의학적 치료를 보조하기 위한 장치 |
| US8715315B1 (en) | 2013-03-15 | 2014-05-06 | Insera Therapeutics, Inc. | Vascular treatment systems |
| US8715314B1 (en) | 2013-03-15 | 2014-05-06 | Insera Therapeutics, Inc. | Vascular treatment measurement methods |
| WO2014169261A1 (en) | 2013-04-11 | 2014-10-16 | Blockade Medical, LLC | Radiopaque devices for cerebral aneurysm repair |
| WO2015015314A2 (en) | 2013-07-31 | 2015-02-05 | EMBA Medical Limited | Methods and devices for endovascular embolization |
| US10010328B2 (en) | 2013-07-31 | 2018-07-03 | NeuVT Limited | Endovascular occlusion device with hemodynamically enhanced sealing and anchoring |
| US9078658B2 (en) | 2013-08-16 | 2015-07-14 | Sequent Medical, Inc. | Filamentary devices for treatment of vascular defects |
| US9955976B2 (en) | 2013-08-16 | 2018-05-01 | Sequent Medical, Inc. | Filamentary devices for treatment of vascular defects |
| JP6831242B2 (ja) | 2014-01-06 | 2021-02-17 | コーニンクレッカ フィリップス エヌ ヴェKoninklijke Philips N.V. | 展開モデリング |
| EP3154480A4 (en) | 2014-06-13 | 2018-01-17 | Fort Wayne Metals Research Products Corporation | Biodegradable wire with central filament |
| WO2016118420A1 (en) | 2015-01-20 | 2016-07-28 | Neurogami Medical, Inc. | Micrograft for the treatment of intracranial aneurysms and method for use |
-
2015
- 2015-04-10 US US14/684,212 patent/US9629635B2/en active Active
- 2015-04-13 CN CN201580028714.6A patent/CN106456422A/zh active Pending
- 2015-04-13 EP EP15779810.9A patent/EP3131515A4/en not_active Withdrawn
- 2015-04-13 JP JP2016562548A patent/JP6594898B2/ja active Active
-
2017
- 2017-01-12 US US15/404,492 patent/US20170128077A1/en not_active Abandoned
-
2019
- 2019-04-02 US US16/373,476 patent/US11678886B2/en active Active
-
2023
- 2023-05-08 US US18/144,435 patent/US20230270441A1/en active Pending
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023281537A1 (en) * | 2021-07-08 | 2023-01-12 | Dr. Remedies Biologicals Pvt Ltd | Versatile absorbable flow regulating device and method to develop balloon based stent delivery system |
Also Published As
| Publication number | Publication date |
|---|---|
| US20230270441A1 (en) | 2023-08-31 |
| EP3131515A1 (en) | 2017-02-22 |
| US20160249935A1 (en) | 2016-09-01 |
| US20160367260A9 (en) | 2016-12-22 |
| JP2017511202A (ja) | 2017-04-20 |
| EP3131515A4 (en) | 2017-12-20 |
| US20170128077A1 (en) | 2017-05-11 |
| US9629635B2 (en) | 2017-04-25 |
| US11678886B2 (en) | 2023-06-20 |
| CN106456422A (zh) | 2017-02-22 |
| US20190223881A1 (en) | 2019-07-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6594898B2 (ja) | 処置的血管手技のためのデバイス | |
| JP7327726B2 (ja) | 血管障害の治療のためのフィラメントデバイス | |
| US20210275184A1 (en) | Filamentary devices for treatment of vascular defects | |
| US9492174B2 (en) | Filamentary devices for treatment of vascular defects | |
| JP7469323B2 (ja) | 血管障害の治療のためのフィラメント状デバイス | |
| JP7175638B2 (ja) | 血管の欠陥の処置のためのフィラメントのデバイス | |
| WO2015160721A1 (en) | Devices for therapeutic vascular procedures | |
| US20120283768A1 (en) | Method and apparatus for the treatment of large and giant vascular defects | |
| JP2013509914A (ja) | 複数層フィラメント状デバイスまたは血管障害処置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180326 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180326 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190131 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20190131 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190424 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190920 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190925 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6594898 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: R3D02 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |