JP5658564B2 - ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 - Google Patents
ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 Download PDFInfo
- Publication number
- JP5658564B2 JP5658564B2 JP2010523163A JP2010523163A JP5658564B2 JP 5658564 B2 JP5658564 B2 JP 5658564B2 JP 2010523163 A JP2010523163 A JP 2010523163A JP 2010523163 A JP2010523163 A JP 2010523163A JP 5658564 B2 JP5658564 B2 JP 5658564B2
- Authority
- JP
- Japan
- Prior art keywords
- hla
- composition
- toxin
- staphylococcal
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/085—Staphylococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/12—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria
- C07K16/1267—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria
- C07K16/1271—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria from Micrococcaceae (F), e.g. Staphylococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Pulmonology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Description
本発明は広くは、免疫学、微生物学、感染病および医薬の分野に関する。より具体的な態様において、本発明は、細菌に対する免疫反応を生み出すための、α-溶血素などの、外毒素タンパク質を含む方法および組成物に関する。
黄色ブドウ球菌(S. aureus)性肺炎を処置するための現行の方法は、生物が耐性を獲得する傾向が著しい抗菌薬に依っている。ブドウ球菌感染の病因は、分泌外毒素などの、多くの異なる病毒性因子に依る。過去の研究により、そのような因子をコードする単一の遺伝子を欠失しても、欠損が起こらないか、または病原性の低下がごくわずかにしか起こらないことが明らかにされている。しかしながら、本発明者らが行ったマウスモデル系における黄色ブドウ球菌性肺炎の研究により、意外にも、α毒素としても公知のα-溶血素は、この外毒素を欠く変異株が無病毒性であったことから、この疾患の病因において重要な病毒性因子と考えられた。α-溶血素は、黄色ブドウ球菌により分泌される細菌細胞毒素ファミリーの一員であり、多数の真核細胞の細胞膜に入り込むことができる。このタンパク質は単量体として分泌されるが、真核細胞の表面に7量体環状構造を構築する。構築された毒素は宿主細胞膜に入り込み、膜の完全性を破壊することにより細胞の損傷および死の一因となる細孔を形成する。いくつかの生化学的研究によって、宿主細胞への結合、7量体形成および宿主細胞溶解を促進するα-溶血素単量体内のアミノ酸残基が規定されている。
本発明は、ヒトブドウ球菌性肺炎の動物モデルへの黄色ブドウ球菌由来の弱毒化α-溶血素(Hla)毒素の投与が動物の死を防ぎ、動物の肺から回収できる細菌の数を減らし、かつ病変を感染病巣部位に限定することを示すデータに基づく。さらに、本発明は、ウサギでα-溶血素(α毒素としても公知)に対して作製された抗体をマウスに投与して、ブドウ球菌性肺炎に対する防御効果を与えられることを示すデータに基づく。それゆえ、本発明は、他のブドウ球菌タンパク質および抗体を明確に除く単独療法としてのHla毒素を用いた被験体におけるブドウ球菌性肺炎に対する能動免疫のための方法および組成物、ならびにα-溶血素に特異的な抗体を用いた受動免疫のための方法および組成物に関する。
[請求項1001]
精製組み換えの弱毒化ブドウ球菌(Staphylococcus)α-溶血素(Hla)毒素を含む組成物の有効量を患者に投与する段階を含む、ブドウ球菌肺疾患もしくは状態から患者を防御するおよび/またはブドウ球菌に対する患者の免疫反応を誘発する方法であって、該組成物が他の任意のブドウ球菌タンパク質を混入量しか含有しない、前記方法。
[請求項1002]
患者がブドウ球菌肺疾患または状態のリスクがある、請求項1001記載の方法。
[請求項1003]
患者が入院しているまたは入院する予定がある、請求項1002記載の方法。
[請求項1004]
患者が手術を受ける予定があるおよび/または麻酔される予定がある、請求項1002記載の方法。
[請求項1005]
ブドウ球菌肺疾患または状態のリスクがある患者を特定する段階をさらに含む、請求項1001記載の方法。
[請求項1006]
弱毒化Hla毒素が検出可能な溶血活性を欠く、請求項1001記載の方法。
[請求項1007]
弱毒化Hla毒素が検出可能な致死活性を欠く、請求項1001記載の方法。
[請求項1008]
Hla毒素が、アミノ酸35に、ヒスチジンに代わって置き換えられたロイシンを有する、請求項1001記載の方法。
[請求項1009]
Hla毒素が実質的に変性されない、請求項1001記載の方法。
[請求項1010]
Hla毒素が精製されるまたは単離される、請求項1001記載の方法。
[請求項1011]
Hla毒素が成熟Hla毒素のアミノ酸1〜50しか含まない、請求項1001記載の方法。
[請求項1012]
Hla毒素に対する抗体について患者を試験する段階をさらに含む、請求項1001記載の方法。
[請求項1013]
患者が組成物を複数回投与される、請求項1001記載の方法。
[請求項1014]
組成物が少なくとも一種のアジュバントをさらに含む、請求項1001記載の方法。
[請求項1015]
アジュバントがHla毒素に抱合される、請求項1014記載の方法。
[請求項1016]
組成物が粘膜にまたは筋肉内に投与される、請求項1001記載の方法。
[請求項1017]
組成物が鼻腔内に投与されるまたは吸入される、請求項1001記載の方法。
[請求項1018]
ブドウ球菌肺疾患または状態は肺炎である、請求項1001記載の方法。
[請求項1019]
組み換えの弱毒化ブドウ球菌α-溶血素(Hla)毒素を含む組成物の有効量を患者に投与する段階を含む、患者のブドウ球菌肺疾患または状態を予防するための方法であって、該組成物が他の任意のブドウ球菌タンパク質に対する検出可能な免疫反応を誘発しない、前記方法。
[請求項1020]
患者がブドウ球菌肺疾患または状態のリスクがある、請求項1019記載の方法。
[請求項1021]
患者が入院しているまたは入院する予定がある、請求項1020記載の方法。
[請求項1022]
患者が手術を受ける予定があるおよび/または麻酔される予定がある、請求項1020記載の方法。
[請求項1023]
ブドウ球菌肺疾患または状態のリスクがある患者を特定する段階をさらに含む、請求項1019記載の方法。
[請求項1024]
弱毒化Hla毒素が検出可能な溶血活性を欠く、請求項1019記載の方法。
[請求項1025]
弱毒化Hla毒素が検出可能な致死活性を欠く、請求項1019記載の方法。
[請求項1026]
Hla毒素が、アミノ酸35に、ヒスチジンに代わって置き換えられたロイシンを有する、請求項1019記載の方法。
[請求項1027]
Hla毒素が成熟Hla毒素のアミノ酸1〜50しか含まない、請求項1019記載の方法。
[請求項1028]
Hla毒素が実質的に変性されない、請求項1019記載の方法。
[請求項1029]
Hla毒素が精製されるまたは単離される、請求項1019記載の方法。
[請求項1030]
組成物が患者に複数回投与される、請求項1019記載の方法。
[請求項1031]
組成物が少なくとも一種のアジュバントをさらに含む、請求項1019記載の方法。
[請求項1032]
アジュバントがHla毒素に抱合される、請求項1031記載の方法。
[請求項1033]
Hla毒素に対する抗体について患者を試験する段階をさらに含む、請求項1019記載の方法。
[請求項1034]
組成物が粘膜にまたは筋肉内に投与される、請求項1019記載の方法。
[請求項1035]
組成物が鼻腔内に投与されるまたは吸入される、請求項1019記載の方法。
[請求項1036]
ブドウ球菌肺疾患または状態は肺炎である、請求項1019記載の方法。
[請求項1037]
組み換えの弱毒化ブドウ球菌α-溶血素(Hla)毒素から本質的になる組成物の有効量を患者に投与する段階を含む、ブドウ球菌肺疾患または状態から患者を防御する方法。
[請求項1038]
患者がブドウ球菌肺疾患または状態のリスクがある、請求項1037記載の方法。
[請求項1039]
患者が入院しているまたは入院する予定がある、請求項1038記載の方法。
[請求項1040]
患者が手術を受ける予定があるおよび/または麻酔される予定がある、請求項1038記載の方法。
[請求項1041]
ブドウ球菌肺疾患または状態のリスクがある患者を特定する段階をさらに含む、請求項1037記載の方法。
[請求項1042]
弱毒化Hla毒素が検出可能な溶血活性を欠く、請求項1037記載の方法。
[請求項1043]
弱毒化Hla毒素が検出可能な致死活性を欠く、請求項1037記載の方法。
[請求項1044]
Hla毒素が、アミノ酸35に、ヒスチジンに代わって置き換えられたロイシンを有する、請求項1037記載の方法。
[請求項1045]
Hla毒素が成熟Hla毒素のアミノ酸1〜50しか含まない、請求項1037記載の方法。
[請求項1046]
Hla毒素が実質的に変性されない、請求項1037記載の方法。
[請求項1047]
Hla毒素が精製されるまたは単離される、請求項1037記載の方法。
[請求項1048]
Hla毒素に対する抗体について患者を試験する段階をさらに含む、請求項1037記載の方法。
[請求項1049]
患者が組成物を複数回投与される、請求項1037記載の方法。
[請求項1050]
組成物が少なくとも一種のアジュバントをさらに含む、請求項1037記載の方法。
[請求項1051]
アジュバントがHla毒素に抱合される、請求項1050記載の方法。
[請求項1052]
組成物が粘膜にまたは筋肉内に投与される、請求項1037記載の方法。
[請求項1053]
組成物が鼻腔内に投与されるまたは吸入される、請求項1037記載の方法。
[請求項1054]
ブドウ球菌肺疾患または状態は肺炎である、請求項1037記載の方法。
[請求項1055]
黄色ブドウ球菌(Staphylococcus aureus)α-溶血素(Hla)に対して免疫学的に反応性の抗体を含む組成物の有効量を患者に投与する段階を含む、ブドウ球菌肺疾患または状態から患者を防御する方法。
[請求項1056]
抗体がヒト化抗体である、請求項1055記載の方法。
[請求項1057]
抗体がヒト抗体である、請求項1055記載の方法。
[請求項1058]
抗体がモノクローナル抗体であるまたは抗体の免疫学的部分である、請求項1055記載の方法。
[請求項1059]
患者がブドウ球菌肺疾患または状態のリスクがある、請求項1055記載の方法。
[請求項1060]
患者が入院しているまたは入院する予定がある、請求項1059記載の方法。
[請求項1061]
患者が手術を受ける予定があるおよび/または麻酔される予定がある、請求項1059記載の方法。
[請求項1062]
患者がブドウ球菌肺疾患もしくは状態の症状を有するまたはブドウ球菌肺疾患もしくは状態と診断されている、請求項1055記載の方法。
[請求項1063]
黄色ブドウ球菌肺感染を処置するための抗生物質を患者に投与する段階をさらに含む、請求項1062記載の方法。
[請求項1064]
ブドウ球菌肺疾患または状態のリスクがある患者を特定する段階をさらに含む、請求項1055記載の方法。
[請求項1065]
組成物が静脈内に投与される、請求項1055記載の方法。
[請求項1066]
組成物が患者に複数回投与される、請求項1055記載の方法。
[請求項1067]
ブドウ球菌肺疾患または状態は肺炎である、請求項1055記載の方法。
[請求項1068]
成熟Hla毒素のアミノ酸1〜50に特異的に結合する抗体。
[請求項1069]
成熟Hla毒素がSEQ ID NO:2のアミノ酸配列を有する、請求項1068記載の抗体。
[請求項1070]
SEQ ID NO:2のアミノ酸1〜50を含んだ単離ポリペプチドを含む免疫原性組成物。
[請求項1071]
単離ポリペプチドがSEQ ID NO:2のせいぜいアミノ酸1〜50を含む、請求項1070記載の組成物。
[請求項1072]
単離ポリペプチドが融合タンパク質である、請求項1071記載の組成物。
[請求項1073]
アジュバントをさらに含む、請求項1070記載の組成物。
[請求項1074]
単離ポリペプチドが融合タンパク質である、請求項1070記載の組成物。
[請求項1075]
単離ポリペプチドがリポポリペプチドである、請求項1070記載の組成物。
[請求項1076]
薬学的に許容される処方物、特にエアロゾル処方物に含まれる、請求項1070記載の組成物。
マウスモデル系における黄色ブドウ球菌性肺炎の研究により、α-溶血素(Hla)は、この外毒素を欠く変異株が無病毒性であることから、この疾患の病因において重要な病毒性因子と考えられている。Hlaは、黄色ブドウ球菌により分泌される細菌細胞毒素ファミリーの一員であり、多数の真核細胞の細胞膜に入り込むことができる。このタンパク質は単量体として分泌され、真核細胞の表面に7量体環状構造を構築する。構築された毒素は宿主細胞膜に入り込み、膜の完全性を破壊することにより細胞の損傷および死の一因となる細孔を形成する。いくつかの生化学的研究によって、宿主細胞への結合、7量体形成および宿主細胞溶解を促進するHla単量体内のアミノ酸残基が規定されている。成熟毒素における35位のヒスチジン残基は効率的な7量体形成および細胞溶解に必要であることが知られているが、真核細胞標的への結合に不可欠ではない。本発明者らは、Hlaを中和できるワクチン接種戦略が黄色ブドウ球菌性肺炎に対する免疫防御を与えるものと考える。このために、本発明者らは、ヒスチジン35をロイシンに変換し、かくしてこの毒素の生産的構築(productive assembly)を抑止した、Hlaの変異体型または変種型(HlaH35L)で表される組み換え弱毒化または減毒性Hlaを作出した。
ブドウ球菌α-溶血素(Hlaまたはα-毒素)は、細菌孔形成β-バレル毒素ファミリーの、当初からの成員である(Bhakdi and Tranum-Jensen, 1991; Song et al., 1996)。その構造遺伝子hlaは、293残基の水溶性単量体を分泌する、調べられている全ての黄色ブドウ球菌株の染色体に位置している(O'Reilly et al., 1990; O'Reilly et al., 1986)。Hlaは、感受性宿主細胞の表面受容体に会合し、それによって7量体の前細孔へのそのオリゴマー化および原形質膜への直径2 nmの細孔を有するβ-バレル構造の挿入を促進すると考えられている(Gouaux et al., 1997)。Hlaの細孔はリンパ球、マクロファージ、肺胞上皮細胞、肺内皮および赤血球に生じるが、顆粒球および線維芽細胞は溶解に耐性と思われる(Bhakdi and Tranum-Jensen, 1991; McElroy et al., 1999)。精製Hlaのウサギまたはラット肺組織への注入は血管漏出および肺高血圧を誘発し、これはいくつかのシグナル伝達分子、例えばホスファチジルイノシトール、酸化窒素、プロスタノイド(PGE2、PGI2)およびトロンボキサンA2の放出によるものとされている(McElroy et al., 1999; Seeger et al., 1984; Seeger et al., 1990; Rose et al., 2002; Suttorp and Habben, 1988)。Hlaの生化学的性質に一致して、黄色ブドウ球菌NewmanにおいてHlaの発現を抑止する突然変異は、マウス肺炎モデルにおいて細菌の病毒性を大幅に弱毒化する(Bubeck-Wardenburg et al., 2007)。ここで、本発明者は、黄色ブドウ球菌肺感染に対抗するワクチンまたは免疫治療戦略の開発のための標的としてHlaを調べた。
のコンセンサスな黄色ブドウ球菌前駆体配列
および
の成熟な黄色ブドウ球菌コンセンサス配列
を有する配列を含むことができる。
本明細書において用いられる場合、「細胞」、「細胞株」および「細胞培養物」という用語は互換的に用いることができる。これらの用語の全てが、任意のおよび全ての次世代の、その子孫も含む。故意または偶然の変異により全ての子孫が同一ではないことがあると理解されよう。異種核酸配列を発現するという文脈において、「宿主細胞」とは、原核細胞または真核細胞をいい、これには、ベクターを複製できるまたはベクターによってコードされる異種遺伝子を発現できる、任意の形質転換可能な生物が含まれる。宿主細胞はベクターまたはウイルスのレシピエントとして、使用されることができ、使用されている。宿主細胞は「形質移入」または「形質転換」されてもよく、それらは組み換えタンパク質をコードする配列などの、外因性の核酸が宿主細胞に移入または導入される過程をいう。形質転換細胞には、初代被験細胞およびその子孫が含まれる。
先に論じた組成物の少なくとも一部または全部を含む多数の発現系が存在する。原核生物および/または真核生物に基づく系を本発明で用いるために利用して、核酸配列、またはその同源のポリペプチド、タンパク質およびペプチドを産生することができる。そのような多くの系が市販されており、広く利用可能である。
本発明は、本発明のタンパク質、ポリペプチド、ペプチドをコードする組み換えポリヌクレオチドに関する。野生型Hlaまたはその他任意のそのポリペプチド変種に対する核酸配列が含まれ、その全てが参照により組み入れられる。
先に論じられるように、本発明は、被験体において、Hlaまたはその変種もしくは断片に対する免疫反応を惹起することに関する。一つの態様において、免疫反応は、感染または関連疾患、特にブドウ球菌性肺炎に関連するものを有する、有すると疑われる、または発症するリスクがある被験体を防御するまたは処置することができる。
本発明のいくつかの態様において、タンパク質性組成物は被験体に防御免疫を付与する。防御免疫とは、免疫反応が起こる作用因子を伴った特定の疾患または状態を被験体が発症することを防ぐ特異的な免疫反応を開始する身体の能力をいう。免疫原性上有効な量は、被験体に防御免疫を付与することができる。
本発明の方法は、ブドウ球菌病原菌によって引き起こされる疾患または状態の処置、および病原菌への曝露の程度を抑えるまたは最小限に抑えるように感染の予防または感染の低減を含む。本発明の免疫原性ポリペプチドは、ブドウ球菌に罹患している者、ブドウ球菌に曝されていると疑われる者、またはブドウ球菌への曝露のリスクがある者において免疫反応を誘導するために与えることができる。さらに、本発明の免疫原性ポリペプチドまたはペプチドに特異的な抗体を、ブドウ球菌に罹患している者、ブドウ球菌に曝されていると疑われる者、またはブドウ球菌への曝露のリスクがある者の受動免疫のために投与することもできる。ブドウ球菌への曝露で陽性と判定された個体、または曝露の可能性に基づいて感染のリスクがあると思われる個体について、それらの方法を利用することができる。
A. ワクチン
本発明は、ブドウ球菌感染を予防または改善するための方法を含む。本発明の態様は、ブドウ球菌性肺炎の予防または改善を含む。したがって、本発明は、能動免疫と受動免疫の両方の態様で用いるためのワクチンを企図する。ワクチンとして用いるのに適当であると提唱されている免疫原性組成物は、本明細書において開示する様式で調製される免疫原性Hlaペプチドまたはタンパク質から直接的に最も容易に調製することができる。抗原材料は、望ましくない低分子量分子を除去するために十分に透析され、および/または所望の媒体へのより容易な処方のために凍結乾燥されることが好ましい。本発明は、ブドウ球菌による感染を防ぐおよびそのようなものにより引き起こされる状態または疾患の発症を防ぐために、Hlaペプチドまたはタンパク質に由来するポリペプチドまたはペプチドに対する免疫反応を誘導するために使用できる組成物を含む。ある種の局面において、組成物は粘膜表面に投与するために処方される、例えば、エアロゾル処方される。
所与の組成物はその免疫原性が異なる場合がある。それゆえ、宿主免疫系を追加免疫することが必要になることが多く、これはペプチドまたはポリペプチドを担体にカップリングさせることにより達成することもできる。例示的かつ好適な担体は、キーホールリンペットヘモシアニン(KLH)およびウシ血清アルブミン(BSA)である。卵白アルブミン、マウス血清アルブミンまたはウサギ血清アルブミンなどのその他のアルブミンを担体として用いることもできる。ポリペプチドを担体タンパク質に抱合させるための手段は、当技術分野において周知であり、グルタルアルデヒド、m-マレイミドベンゾイル(maleimidobencoyl)-N-ヒドロキシスクシンイミドエステル、カルボジイミドおよびビス-ジアゾ化(bis-biazotized)ベンジジンを含む。
ポリペプチドまたはペプチド組成物の免疫原性は、アジュバントとして公知の、免疫反応の非特異的刺激物質を用いることによって増強することができる。適当なアジュバントはサイトカイン、毒素または合成組成物などの、許容される全ての免疫刺激性化合物を含む。
ある種の態様において、本発明は、核酸またはポリペプチド/ペプチドと結び付いた一つまたは複数の脂質を含む組成物に関する。脂質は水に不溶な、かつ有機溶媒で抽出可能な物質である。本明細書において具体的に記述するもの以外の化合物は、当業者により脂質と理解され、本発明の組成物および方法によって包含される。脂質成分および非脂質は、共有結合的または非共有結合的に、互いに付着されてもよい。
本発明の組成物および関連する方法、特に、患者/被験体へのHlaタンパク質および/または抗Hla抗体の投与を従来の治療の施行と併せて用いることもできる。これらには、ストレプトマイシン、シプロフロキサシン、ドキシサイクリン、ゲンタマイシン、クロラムフェニコール、トリメトプリム、スルファメトキサゾール、アンピシリン、テトラサイクリン、オキサシリン、バンコマイシンまたは抗生物質の各種組み合わせなどの抗生物質の投与が含まれるが、これらに限定されることはない。さらに、患者/被験体へのHlaタンパク質または抗Hla抗体の投与を、RIPなどの、抗病毒性剤の投与と併せて用いることもできる。
いくつかの態様において、薬学的組成物が被験体に投与される。本発明の種々の局面では、被験体に組成物の有効量を投与することを伴う。本発明のいくつかの態様において、Hlaポリペプチドまたはペプチドを患者に投与して、一種または複数種のブドウ球菌病原菌による感染を防ぐことができる。本発明の他の態様において、Hlaポリペプチドまたはペプチドに特異的な抗体を患者に投与して、一種または複数種のブドウ球菌病原菌による感染を処置または予防することができる。あるいは、一つまたは複数のそのようなポリペプチドまたはペプチドをコードする発現ベクターを、予防的処置として患者に与えることもできる。さらに、そのような化合物を抗生物質および/または抗病毒性剤と併せて投与することもできる。そのような組成物は一般に、薬学的に許容される担体または水媒体中に溶解または分散される。
本明細書において用いられる場合、インビトロ投与という用語は、培養細胞を含むが、これに限定されない、動物から取り出されたまたは動物の体外の細胞に対して行われる操作をいう。エクスビボ投与という用語は、インビトロにおいて操作されており、その後で、生きている細胞に投与される細胞をいう。インビボ投与という用語は、動物の体内で行われる全ての操作を含む。
以下の実施例は、本発明のさまざまな態様を例証する目的で与えられており、いかなる形においても本発明を限定することを意図するものではない。本発明は本明細書の中にある目標、目的および利点のほかに、言及されている、目標を実行するために、かつ目的および利点を得るために十分に適していることを当業者は容易に理解するであろう。本実施例は、本明細書において記述される方法とともに、目下、好ましい態様を代表するものであり、例示するものであり、本発明の範囲に対する限定と意図するものではない。その変更および特許請求の範囲によって定義される本発明の趣旨のなかに包含されるその他の用途が、当業者には思い浮かぶであろう。
黄色ブドウ球菌に対するワクチン媒介性の防御
A. 方法
細菌株および培養
黄色ブドウ球菌Newman、LACおよびMW2をトリプティックソイブロス(TSB)中またはトリプティックソイ寒天(TSA)上で増殖させた。PVL変換性のファージを得るため、黄色ブドウ球菌MW2培養物でのφSa2mwの溶解的複製を1 μg/mlのマイトマイシンCで誘導した。溶解物を0.22 μmの膜に通してろ過し、ろ液を黄色ブドウ球菌RN4220でのプラーク形成に供した(Bae et al., 2006)。ファージ懸濁液を、5 mM CaCl2 (HIBCa5)を補充したハートインフュージョンブロス中で増殖させた菌株RN4220の対数増殖期中期の培養物1 mlと混合し、次いで終夜37℃でのインキュベーションによって増幅させた。増幅されたファージ粒子からフェノール/クロロホルム抽出によってDNAを精製した。φSa2mwをプライマーcctcctgttgatggaccact (SEQ ID NO:3)およびggcgctgaggtagtcaaaag (SEQ ID NO:4)でのlukS-PV DNAのPCR増幅によって検出した。φSa2mwファージ溶液を、HIBCa5中で増殖させた菌株Newmanの対数増殖期中期の培養物と混合し、振盪(150 rpm)させながら37℃で終夜インキュベートし、次いでTSA上にプレーティングした。コロニーをTSA上で増殖させて混入ファージ粒子を除去した。φSa2mw溶原菌をTSB 5 ml中37℃で終夜増殖させ、染色体DNAを精製し、lukS-PV DNAを増幅させた。変種のNewman φSa2mw hla::erm、Newman hla::ermおよびLAC hla::ermを菌株ΦNΞ11568からのブルサアウレアリス(bursa aurealis)挿入突然変異の形質導入によって作出し、PCRおよびDNA配列決定によりスクリーニングして、hla遺伝子座の破壊を確認した(Bae et al., 2004)。100 μg/mlのエリスロマイシンを加えて増殖させたLAC hla::ermを除き、10 μg/mlのエリスロマイシンを含むTSA上にて形質導入株を維持した。補完試験のため、ブドウ球菌にプラスミドpOS1 (ベクター)、phlaまたはppvlを形質転換し、10 μg/mlのクロラムフェニコールを含むTSA上にて増殖させた。マウス肺感染を確立するため、細菌の終夜培養物を新鮮なTSB中で100倍希釈(1:100)し、37℃で回転させながらOD660 0.5まで増殖させた。培養のアリコット50 ml中のブドウ球菌を遠心分離によって沈降し、PBS中で洗浄し、死亡率の試験の場合PBS 750 μlに懸濁し(容量30 μlあたり3〜4×108のCFU)、または細菌負荷および組織病理学的実験の場合1250 μlに懸濁した(容量30 μlあたり2×108のCFU)。細胞毒性試験の場合、ブドウ球菌株をOD660 0.5まで増殖させた。培養のアリコット5 ml中のブドウ球菌を遠心分離によって沈降し、PBS中で洗浄し、F12培地(Gibco) 10 mlに懸濁した。
鋳型として黄色ブドウ球菌Newman DNAを用いてプライマー
によりhla遺伝子およびプロモーターをPCR増幅した。プライマー
によりpvl遺伝子座およびプロモーターをPCR増幅した。PCR産物をBamHIおよびEcoRIで消化し、pOS1の対応部位にクローニングした。
pOS1-HlaH35L鋳型DNAとプライマー
とを用いて、成熟HlaH35LをコードするPCR産物を作出した。USA300ゲノム鋳型DNAとプライマー
ならびに
により、成熟LukS-PVおよびLukF-PVをコードするPCR産物を作出した。PCR産物をBamHIおよびEcoRIで消化し、pGEX-6P-1 (Amersham Biosciences)の対応部位にクローニングし、大腸菌に形質転換した。GST-HlaH35L、GST-LukF-PVおよびGST-LukS-PV融合タンパク質をアフィニティークロマトグラフィーによって精製した。精製タンパク質(0.5 mg)をフロイントの完全アジュバント(CFA)またはフロイントの不完全アジュバント(IFA)で乳化し、初回免疫のため雌性のNew Zealand Whiteウサギの肩甲骨下に注射し、その後、21日の間隔をあけて2回の追加免疫を行った。
能動免疫のため、GST-HlaH35L融合タンパク質を、製造元の使用説明書(Amersham Biosciences)にしたがってPrecissionプロテアーゼ切断に供した。Triton X-114抽出による混入内毒素の除去後、HlaH35Lタンパク質をCFAまたはIFA中で乳化した。4週齢のC57B1/6Jマウス(Jackson Laboratories)に0日目にCFA中20 μgのHlaH35Lタンパク質を与え、引き続いて10日目にIFA中20 μgのHlaH35Lタンパク質の追加免疫を行った。次いで20日目に動物を黄色ブドウ球菌で攻撃した。0日目の免疫の前に、また、特異的な血清抗体の産生を評価するため21日目に動物から血清を回収した。
6週齢の雌性C57B1/6Jマウス(Jackson Laboratories)を感染前の1週間、シカゴ大学の動物施設内で飼育した。動物をケタミンおよびキシラジンで麻酔した。適切な場合には麻酔の記録を残し、ブドウ球菌の懸濁液30 μlを左鼻孔に植菌した。動物を植菌後1分間、真っすぐ立たせ、その後、回復のため背臥位でおりの中に入れておいた。全ての動物に飼料および水を適宜与え、それらを72時間にわたって継続的に観察した。少数の割合の動物が、おそらく誤嚥および麻酔の複合的影響から、植菌後の最初の6時間内にいつも決まって死亡した。これらの動物はその後の分析から除外した。
感染動物を、両肺の除去前に、シカゴ大学の動物実験委員会(Institute of Animal Care and Use Committee)のガイドラインにしたがってCO2強制吸入により殺処理した。右肺を、連続希釈および寒天プレート上でのコロニー形成の前に、滅菌PBS 1 mlの中に入れてホモジナイズした。組織病理試験のため、左肺を解剖し、1%ホルマリンの中に入れた。ヘマトキシリンエオシン染色および光学顕微鏡検査の前に、ホルマリン固定組織を包埋し、薄片にした。
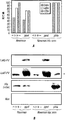
マウス血清抗体の力価分析は、1 μg/mlの組み換えHlaH35L、LukF-PV、またはLukS-PVでコーティングしたNunc MaxiSorp Immunoプレートを用いて行った。血清希釈液を適切なプレート中でインキュベートし、Tecan GENios分光光度計上で、HRP標識二次抗体およびOpti-EIA (BD Biosciences)により発色させた。
TSB中で増殖させたブドウ球菌培養物を同等の光学密度に調整し、培養上清中のタンパク質をトリクロロ酢酸で沈殿し、アセトン中で洗浄し、サンプル用緩衝液中で可溶化した。15% SDS-PAGE上で分離されたタンパク質を、特異的抗血清(α-LukS-PV、α-LukF-PVまたはα-nuclease)およびHRP標識ヤギ抗ウサギ二次抗体での免疫ブロッティングにより、さらに強化された化学発光検出を用いて分析した。Toxin Technology, Inc. (Sarasota, FL)から西洋ワサビペルオキシダーゼ標識抗Hla抗体を購入した。
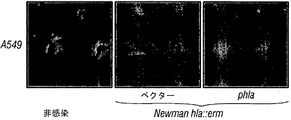
10%ウシ胎仔血清およびノルモシン(normocin) (100 μg/ml, InvivoGen, SanDiego, CA)を補充したF12培地中の培養でA549細胞を維持した。A549細胞を完全F12培地中にて洗浄し、96ウェルプレートに1ウェルあたり細胞1.5×104個の密度でプレーティングした。1ウェルごとにブドウ球菌懸濁液100 μlを加える前に、補充物を含まないF12培地でA549細胞を1回洗浄した。37℃の加湿インキュベータ中4時間のインキュベーションの後、LDH活性を三つ組で測定した(Roche Applied Science, Mannheim, Germany)。細胞損傷の顕微鏡的評価のため、感染から3時間後にNikon Eclipse TE2000U顕微鏡を用いて細胞の画像を得た。
実験動物から感染後24時間で回収された血清を比率1:4で希釈し、Bioplex Mouse 8-Plex Aアッセイ(Bio-Rad)によりサイトカイン含量についてアッセイした。サイトカイン濃度をBio-Plex WorkstationにてBio-Plex Managerソフトウェアにより定量化した。
死亡率試験の統計的有意性の解析は、フィッシャーの直接確率検定を用いて行った。細菌回収試験およびA549 LDH放出の統計的有意性は、両側スチューデントのt-検定を用いて計算した。
ブドウ球菌α-溶血素(Hlaまたはα-毒素)は、細菌孔形成β-バレル毒素の、当初からの成員である(Bhakdi and Tranum-Jensen, 1991; Song et al., 1996)。その構造遺伝子hlaは、293残基の水溶性単量体を分泌する、調べられている全ての黄色ブドウ球菌株の染色体に位置している(O'Reilly et al., 1990; O'Reilly et al., 1986)。Hlaは、感受性宿主細胞の表面受容体に会合し、それによって7量体の前細孔へのそのオリゴマー化および原形質膜への直径2 nmの細孔を有するβ-バレル構造の挿入を促進すると考えられている(Gouaux et al., 1997)。Hlaの細孔はリンパ球、マクロファージ、肺胞上皮細胞、肺内皮および赤血球に生じるが、顆粒球および線維芽細胞は溶解に耐性と思われる(Bhakdi and Tranum-Jensen, 1991; McElroy et al., 1999)。精製Hlaのウサギまたはラット肺組織への注入は血管漏出および肺高血圧を誘発し、これはいくつかのシグナル伝達分子、例えばホスファチジルイノシトール、酸化窒素、プロスタノイド(PGE2、PGI2)およびトロンボキサンA2の放出によるものとされている(McElroy et al., 1999; Seeger et al., 1984; Seeger et al., 1990; Rose et al., 2002; Suttorp and Habben, 1988)。Hlaの生化学的性質に一致して、黄色ブドウ球菌NewmanにおいてHlaの発現を抑止する突然変異は、マウス肺炎モデルにおいて病毒性を大幅に弱毒化する(Bubeck-Wardenburg et al., 2007)。ここで、本発明者は、黄色ブドウ球菌肺感染に対抗するワクチンまたは免疫治療戦略の開発のための標的としてα-溶血素を調べた。
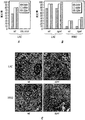
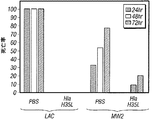
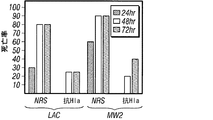
現在の臨床分離株によって表されるようにPVLが肺感染の発病の寄与体であるかどうかを試験するため、黄色ブドウ球菌株LACおよびMW2ならびにPVL遺伝子を欠いたその同質遺伝子的な変種をマウス肺炎モデルにおいて分析した。野生型および同質遺伝子的なΔpvl変異株によって引き起こされた感染の対分析によっては、黄色ブドウ球菌性肺炎を有する動物の全死亡率の有意差が認められなかった(図1B)。二種のCA-MRSA株のどちらでlukS/F-PVを欠失(Δpvl)させてもマウス肺での細菌の増殖に影響がなかった。感染動物由来のヘマトキシリンエオシン染色済み薄片肺サンプルから、免疫細胞浸潤、肺実質の硬化を伴う肺胞構造の喪失および細菌浸潤物に見られるように、肺炎の病理学的証拠が明らかになった; これらの特徴は、PVLを分泌する菌株またはPVLを分泌しない菌株を感染させた動物で区別ができなかった(図1C)。
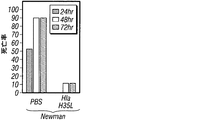
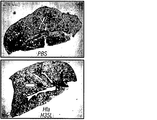
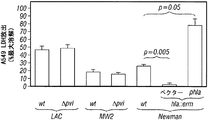
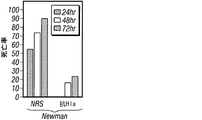
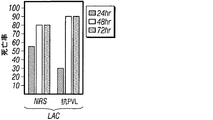
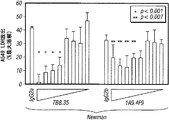
Hla特異的な免疫反応がブドウ球菌性肺炎の発病に影響を及ぼすかどうかを試験するため、リン酸緩衝生理食塩水(PBS)または20 μgの精製HlaH35L、つまり宿主標的細胞への毒素の結合に影響を与えずに孔形成を阻止する一アミノ酸置換を持ったα-溶血素の変種のどちらかの筋肉内注射によりマウスを免疫した(Gouaux et al., 1997)。免疫によって1:5,601 (±2,789)のHlaH35L特異抗体の平均力価に上昇した。黄色ブドウ球菌Newmanでの攻撃により、HlaH35L免疫動物において動物死亡率の顕著な減少が観察された(図5A)。この減少は、感染後24時間の時点で肺から回収された黄色ブドウ球菌のコロニー形成単位の低下と一致していた(図5B)。感染肺組織の肉眼的病態分析により、模擬免疫動物において観察された広範性の硬化とは対照的に、HlaH35L免疫動物では局所域のみの硬化が明らかになった(図5C)。α-溶血素免疫動物における疾患の局所的性質は、感染肺組織の病理組織学的切片においても明白であった。HlaH35L免疫動物の損傷は離散的であり、重要なことには、影響を受けていない肺の領域によって囲まれていた(図5D)。逆に、模擬免疫動物において肺胞腔の大部分が消失した。臨床的に関連する黄色ブドウ球菌分離株によって引き起こされる肺感染の発病に及ぼすα-溶血素のワクチン接種の影響について調べるため、HlaH35L免疫動物に黄色ブドウ球菌LACまたは黄色ブドウ球菌MW2を感染させた。これらの菌株によって引き起こされる絶対死亡率は互いに異なっていたが、HlaH35Lを免疫した動物の全群で顕著な死亡防御が達成された(図5E)。
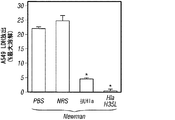
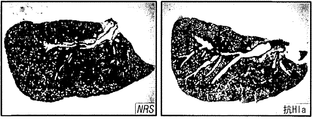
α-溶血素特異的な抗体がブドウ球菌肺疾患を防御できるかどうかを試験するため、実験動物を、黄色ブドウ球菌Newmanで攻撃する24時間前に、腹腔内注射によって正常ウサギ血清または抗Hla血清のどちらかで受動免疫した[HlaH35L特異的抗体の平均力価1:480 (±179)] (図7)。肺炎誘導性の死亡率の調査から、抗Hla血清での受動免疫による防御が示されたが、対照血清では示されなかった(図7A)。この防御は、疾患の肉眼的特徴(図7C)および病理組織学的特徴(図7D)の改善と相関していた。さらに、抗Hlaで免疫した動物の肺から得られたコロニー形成単位の顕著な減少も観察された(図7B)。受動免疫防御は、黄色ブドウ球菌Newmanで攻撃された動物においてだけでなく、黄色ブドウ球菌LACまたはMW2を感染させた動物においても有効であった(図7E)。対照的に、抗PVL血清[特異的抗体の平均力価LukS-PV=1:894 (±80)およびLukF-PV=1:3,689 (±186)]による受動免疫では、ブドウ球菌性肺炎の結果に影響がなかった(図7F)。
Claims (13)
- ブドウ球菌肺疾患もしくは状態から患者を防御するまたは治療するための方法における使用のための単一成分のワクチン組成物であって、該組成物が、アミノ酸35に、ヒスチジンに代わって置き換えられたロイシンを有する、組み換えのブドウ球菌(Staphylococcus)α-溶血素(Hla)毒素を含み、かつHlaの全部またはセグメントを含むペプチド以外のタンパク質、ポリペプチドまたはペプチドを1を上回る重量百分率で含有しない、前記組成物。
- 患者がブドウ球菌肺疾患または状態のリスクがある、患者が入院しているまたは入院する予定がある、患者が手術を受ける予定がある、および/または麻酔される予定がある、請求項1記載の使用のための組成物。
- ブドウ球菌肺疾患または状態が肺炎である、請求項1記載の使用のための組成物。
- 患者がブドウ球菌肺疾患または状態のリスクがあると確認された、請求項1記載の使用のための組成物。
- 組成物が患者に複数回投与される、請求項1記載の使用のための組成物。
- 前記組成物を使った治療が、一つまたは複数の抗生物質を併用するものである、請求項1記載の使用のための組成物。
- 弱毒化Hla毒素が検出可能な溶血活性を欠く、請求項1記載の使用のための組成物。
- 弱毒化Hla毒素が、SEQ ID NO:2の24、35、66、70、110および/または152のアミノ酸で変異を有する、請求項1記載の使用のための組成物。
- 弱毒化Hla毒素がSEQ ID NO:2の連続した少なくとも10アミノ酸を含み、かつ最大でSEQ ID NO:2のアミノ酸1〜50を含む、請求項1記載の使用のための組成物。
- 組成物が粘膜に、筋肉内に、鼻腔内に投与される、または吸入される請求項1記載の使用のための組成物。
- Hla毒素が、90〜100%の純度まで精製されている、請求項1記載の使用のための組成物。
- Hla毒素がSEQ ID NO:2の1〜50アミノ酸しか含まない、請求項1記載の使用のための組成物。
- 一種または複数種の抗生物質をさらに含む、請求項1記載の使用のための組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US96951407P | 2007-08-31 | 2007-08-31 | |
| US60/969,514 | 2007-08-31 | ||
| PCT/US2008/074849 WO2009029831A1 (en) | 2007-08-31 | 2008-08-29 | Methods and compositions related to immunizing against staphylococcal lung diseases and conditions |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014157658A Division JP6018140B2 (ja) | 2007-08-31 | 2014-08-01 | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010538015A JP2010538015A (ja) | 2010-12-09 |
| JP2010538015A5 JP2010538015A5 (ja) | 2011-12-08 |
| JP5658564B2 true JP5658564B2 (ja) | 2015-01-28 |
Family
ID=39952242
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010523163A Expired - Fee Related JP5658564B2 (ja) | 2007-08-31 | 2008-08-29 | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 |
| JP2014157658A Active JP6018140B2 (ja) | 2007-08-31 | 2014-08-01 | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 |
| JP2016190589A Expired - Fee Related JP6437975B2 (ja) | 2007-08-31 | 2016-09-29 | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014157658A Active JP6018140B2 (ja) | 2007-08-31 | 2014-08-01 | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 |
| JP2016190589A Expired - Fee Related JP6437975B2 (ja) | 2007-08-31 | 2016-09-29 | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8840906B2 (ja) |
| EP (2) | EP2185190B1 (ja) |
| JP (3) | JP5658564B2 (ja) |
| KR (2) | KR20100072228A (ja) |
| CN (2) | CN101951948B (ja) |
| AU (2) | AU2008292897B2 (ja) |
| CA (1) | CA2697538C (ja) |
| WO (1) | WO2009029831A1 (ja) |
Families Citing this family (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20180221466A9 (en) * | 2006-06-12 | 2018-08-09 | Glaxosmithkline Biologicals S.A. | Use of alpha-toxin for treating and preventing staphylococcus infections |
| US9181329B2 (en) * | 2007-08-31 | 2015-11-10 | The University Of Chicago | Methods and compositions related to immunizing against Staphylococcal lung diseases and conditions |
| CN101951948B (zh) * | 2007-08-31 | 2015-12-09 | 芝加哥大学 | 与针对葡萄球菌性肺部疾病和病症进行免疫相关的方法和组合物 |
| CA3154626A1 (en) | 2009-04-14 | 2010-10-21 | Glaxosmithkline Biologicals S.A. | Compositions for immunising against staphylococcus aureus |
| EP2284193A1 (en) * | 2009-08-10 | 2011-02-16 | Kenta Biotech AG | Human monoclonal antibody against S. aureus derived apha-toxin and its use in treating or preventing abscess formation |
| AU2010352695B2 (en) | 2009-09-30 | 2014-08-21 | Glaxosmithkline Biologicals S.A. | Conjugation of Staphylococcus aureus type 5 and type 8 capsular polysaccharides |
| BR112012010223A2 (pt) | 2009-10-30 | 2016-12-06 | Novartis Ag | purificação de staphylococcus aureus tipo 5 e tipo 8 sacarídeos capsulares |
| BR112012029521A2 (pt) * | 2010-05-05 | 2018-03-06 | New York University | leucocidinas do staphylococcus aureus, composições terapêuticas, e aplicações das mesmas. |
| BR112013000097B1 (pt) | 2010-07-02 | 2022-02-01 | The University Of Chicago | Polipeptídeo imunogênico isolado, composição imunogênica e seu uso |
| AU2012214677B2 (en) | 2011-02-08 | 2016-11-10 | Abvacc, Inc. | Immunogenic composition comprising alpha-hemolysin oligopeptides |
| MX375113B (es) * | 2011-02-08 | 2025-03-04 | Medimmune Llc | Anticuerpos que se unen específicamente a la toxina alfa de staphylococcus aureus y métodos de uso. |
| WO2012170097A2 (en) | 2011-03-16 | 2012-12-13 | Regents Of The University Of Minnesota | Compositions and methods for inducing immune responses against bacteria in the genus staphylococcus |
| JP6366501B2 (ja) | 2011-05-11 | 2018-08-01 | ザ チルドレンズ メディカル センター コーポレーション | 修飾ビオチン結合タンパク質、その融合タンパク質、および用途 |
| JP2014525429A (ja) | 2011-09-01 | 2014-09-29 | ノバルティス アーゲー | Staphylococcusaureus抗原のアジュバント添加処方物 |
| WO2013093693A1 (en) | 2011-12-22 | 2013-06-27 | Rinat Neuroscience Corp. | Staphylococcus aureus specific antibodies and uses thereof |
| EP2793939A1 (en) | 2011-12-23 | 2014-10-29 | Novartis AG | Stable compositions for immunising against staphylococcus aureus |
| CN104703622B (zh) | 2012-04-26 | 2017-05-24 | 芝加哥大学 | 与金黄色葡萄球菌疾病期间抵消凝固酶活性的抗体相关的组合物和方法 |
| CN102977214B (zh) * | 2012-09-29 | 2014-03-12 | 重庆原伦生物科技有限公司 | 用于耐甲氧西林金黄色葡萄球菌(mrsa)疫苗的重组蛋白hf2及制备方法和应用 |
| CN112316135A (zh) | 2012-11-06 | 2021-02-05 | 米迪缪尼有限公司 | 治疗金黄色葡萄球菌相关疾病的方法 |
| ES2959258T3 (es) | 2013-02-07 | 2024-02-22 | Childrens Medical Center | Antígenos proteicos que proporcionan protección contra la colonización y/o la enfermedad neumocócicas |
| CA2916231C (en) * | 2013-06-19 | 2024-02-06 | Integrated Biotherapeutics, Inc. | Toxoid peptides derived from phenol soluble modulin, delta toxin, superantigens, and fusions thereof |
| SG11201606887WA (en) | 2014-03-26 | 2016-09-29 | Glaxosmithkline Biolog Sa | Mutant staphylococcal antigens |
| WO2016044588A1 (en) | 2014-09-19 | 2016-03-24 | The Regents Of The University Of Michigan | Staphylococcus aureus materials and methods |
| JP6889701B2 (ja) | 2015-09-24 | 2021-06-18 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | アルファ溶血素バリアント |
| JP6441244B2 (ja) * | 2016-02-02 | 2018-12-19 | 株式会社Kokusai Electric | 基板処理装置 |
| US10738338B2 (en) | 2016-10-18 | 2020-08-11 | The Research Foundation for the State University | Method and composition for biocatalytic protein-oligonucleotide conjugation and protein-oligonucleotide conjugate |
| TW202311284A (zh) | 2017-01-03 | 2023-03-16 | 美商再生元醫藥公司 | 抗金黃色葡萄球菌溶血素a毒素之人類抗體 |
| WO2018183475A1 (en) | 2017-03-28 | 2018-10-04 | Children's Medical Center Corporation | A multiple antigen presenting system (maps)-based staphylococcus aureus vaccine, immunogenic composition, and uses thereof |
| ES2967001T3 (es) | 2017-06-23 | 2024-04-25 | Affinivax Inc | Composiciones inmunogénicas |
| CN110996993B (zh) | 2017-07-27 | 2024-05-31 | Ab疫苗公司 | 包含源自超抗原类毒素的融合肽的免疫原性组合物 |
| CA3107463A1 (en) | 2018-07-24 | 2020-01-30 | Medimmune, Llc | Antibody directed against s. aureus clumping factor a (clfa) |
| WO2020056202A1 (en) | 2018-09-12 | 2020-03-19 | Affinivax, Inc. | Multivalent pneumococcal vaccines |
| JP7535791B2 (ja) | 2018-09-12 | 2024-08-19 | ザ チルドレンズ メディカル センター コーポレーション | 肺炎球菌融合タンパク質ワクチン |
| CN113164602A (zh) | 2018-10-09 | 2021-07-23 | 免疫医疗有限责任公司 | 抗金黄色葡萄球菌抗体的组合 |
| CN109400704B (zh) * | 2018-11-14 | 2020-07-21 | 珠海泰诺麦博生物技术有限公司 | 一种抗金黄色葡萄球菌α-溶血素的抗体及其应用 |
| CN111588841A (zh) * | 2019-02-21 | 2020-08-28 | 中国人民解放军军事科学院军事医学研究院 | 一种可气溶胶化的seb类毒素疫苗干粉吸入剂 |
| CN112538112B (zh) * | 2019-09-20 | 2023-10-27 | 迈威(上海)生物科技股份有限公司 | 抗α-溶血素的抗体及其应用 |
| WO2021127653A1 (en) * | 2019-12-20 | 2021-06-24 | Washington University | Compositions and methods for immunization against staphylococcus aureus |
| KR102528412B1 (ko) * | 2020-09-08 | 2023-05-04 | 클립스비엔씨 주식회사 | 신규한 포도상구균 감염 질환의 예방 또는 치료용 조성물 |
| CN112851770B (zh) * | 2021-02-05 | 2022-10-04 | 中国人民解放军陆军军医大学 | 一种用于诊断或防治金黄色葡萄球菌感染的α溶血素抗原表位肽及其应用 |
| KR20240099160A (ko) | 2021-09-09 | 2024-06-28 | 아피니백스, 인크. | 다가 폐렴구균 백신 |
Family Cites Families (110)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1030145A (en) * | 1964-04-21 | 1966-05-18 | Paul Wittebol | Improvements in or relating to femoral prostheses |
| GB1499035A (en) | 1975-04-10 | 1978-01-25 | Ts Nii Gematologii I Perelivan | Antistaphylococcus human immune globulin and method of preparing same |
| US4327082A (en) | 1979-07-12 | 1982-04-27 | Adcock-Ingram Laboratories Limited | Mastitis vaccination |
| US4338298A (en) | 1980-04-04 | 1982-07-06 | Endowment And Research Foundation At Montana State University | Vaccine for passive immunization against enteric colibacillosis and method of use |
| US4554101A (en) | 1981-01-09 | 1985-11-19 | New York Blood Center, Inc. | Identification and preparation of epitopes on antigens and allergens on the basis of hydrophilicity |
| NL8200523A (nl) | 1982-02-11 | 1983-09-01 | Univ Leiden | Werkwijze voor het in vitro transformeren van planteprotoplasten met plasmide-dna. |
| US4748018A (en) | 1984-02-07 | 1988-05-31 | Stolle Research & Development Corp. | Method of passive immunization of mammals using avian antibody |
| US5189015A (en) | 1984-05-30 | 1993-02-23 | Alfa-Laval Agri International Ab | Method for prophylactic treatment of the colonization of a Staphylococcus aureus bacterial strain by bacterial cell surface protein with fibronectin and fibrinogen binding ability |
| US4690915A (en) | 1985-08-08 | 1987-09-01 | The United States Of America As Represented By The Department Of Health And Human Services | Adoptive immunotherapy as a treatment modality in humans |
| US5320951A (en) | 1987-06-01 | 1994-06-14 | Hoeoek Magnus | Fibronectin binding protein as well as its preparation |
| FR2619122B1 (fr) | 1987-08-03 | 1990-03-09 | Pasteur Institut | Procede d'obtention de polyosides capsulaires de staphylocoques, polyosides obtenus, applications de ces polyosides et souches pour la mise en oeuvre du procede |
| US4952500A (en) | 1988-02-01 | 1990-08-28 | University Of Georgia Research Foundation, Inc. | Cloning systems for Rhodococcus and related bacteria |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| SE8901687D0 (sv) | 1989-05-11 | 1989-05-11 | Alfa Laval Agri Int | Fibronectin binding protein as well as its preparation |
| US5302523A (en) | 1989-06-21 | 1994-04-12 | Zeneca Limited | Transformation of plant cells |
| US5550318A (en) | 1990-04-17 | 1996-08-27 | Dekalb Genetics Corporation | Methods and compositions for the production of stably transformed, fertile monocot plants and cells thereof |
| US7705215B1 (en) | 1990-04-17 | 2010-04-27 | Dekalb Genetics Corporation | Methods and compositions for the production of stably transformed, fertile monocot plants and cells thereof |
| US5322783A (en) | 1989-10-17 | 1994-06-21 | Pioneer Hi-Bred International, Inc. | Soybean transformation by microparticle bombardment |
| GB8928874D0 (en) * | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US5484956A (en) | 1990-01-22 | 1996-01-16 | Dekalb Genetics Corporation | Fertile transgenic Zea mays plant comprising heterologous DNA encoding Bacillus thuringiensis endotoxin |
| US5384253A (en) | 1990-12-28 | 1995-01-24 | Dekalb Genetics Corporation | Genetic transformation of maize cells by electroporation of cells pretreated with pectin degrading enzymes |
| US5199942A (en) | 1991-06-07 | 1993-04-06 | Immunex Corporation | Method for improving autologous transplantation |
| AU2515992A (en) | 1991-08-20 | 1993-03-16 | Genpharm International, Inc. | Gene targeting in animal cells using isogenic dna constructs |
| US5610042A (en) | 1991-10-07 | 1997-03-11 | Ciba-Geigy Corporation | Methods for stable transformation of wheat |
| WO1993018784A1 (en) | 1992-03-26 | 1993-09-30 | Microcarb, Inc. | Monospecific polyclonal antibodies to shiga-like toxins |
| US5591616A (en) | 1992-07-07 | 1997-01-07 | Japan Tobacco, Inc. | Method for transforming monocotyledons |
| US5702932A (en) | 1992-07-20 | 1997-12-30 | University Of Florida | Microinjection methods to transform arthropods with exogenous DNA |
| WO1994002620A2 (en) | 1992-07-27 | 1994-02-03 | Pioneer Hi-Bred International, Inc. | An improved method of agrobacterium-mediated transformation of cultured soybean cells |
| US9340577B2 (en) * | 1992-08-07 | 2016-05-17 | Epimmune Inc. | HLA binding motifs and peptides and their uses |
| ATE214942T1 (de) | 1992-09-21 | 2002-04-15 | Alfa Laval Agri Internat Ab | Fibrinogen-bildungsprotein |
| GB9222888D0 (en) | 1992-10-30 | 1992-12-16 | British Tech Group | Tomography |
| US5648240A (en) | 1994-05-24 | 1997-07-15 | Texas A&M University | MHC II analog from Staphylococcus aureus |
| US5656610A (en) | 1994-06-21 | 1997-08-12 | University Of Southern California | Producing a protein in a mammal by injection of a DNA-sequence into the tongue |
| US6008341A (en) | 1994-08-22 | 1999-12-28 | The Provost, Fellows And Scholars Of The College Of The Holy And Undivided Trinity Of Queen Elizabeth Near Dublin | S. aureus fibrinogen binding protein gene |
| US5736524A (en) | 1994-11-14 | 1998-04-07 | Merck & Co.,. Inc. | Polynucleotide tuberculosis vaccine |
| US5548066A (en) | 1994-12-02 | 1996-08-20 | Central Biomedia, Inc. | Failure of passive transfer immune serum and method of making same |
| US6770278B1 (en) | 1994-12-02 | 2004-08-03 | Central Biomedia, Inc. | Methods of making and using immunoglobulin (Ig) compositions |
| WO1997014800A1 (en) | 1995-10-16 | 1997-04-24 | Smithkline Beecham Plc | Novel saliva binding protein |
| US5780448A (en) | 1995-11-07 | 1998-07-14 | Ottawa Civic Hospital Loeb Research | DNA-based vaccination of fish |
| US6833253B2 (en) | 1996-01-05 | 2004-12-21 | Human Genome Sciences, Inc. | Staphylococcus aureus polynucleotides and polypeptides |
| US6737248B2 (en) | 1996-01-05 | 2004-05-18 | Human Genome Sciences, Inc. | Staphylococcus aureus polynucleotides and sequences |
| DK0950068T3 (da) | 1996-05-16 | 2006-02-13 | Texas A & M Univ Sys | Kollagen-bindende proteinsammensatninger og fremgangsmade til anvendelse |
| US5945100A (en) | 1996-07-31 | 1999-08-31 | Fbp Corporation | Tumor delivery vehicles |
| US6294177B1 (en) | 1996-09-11 | 2001-09-25 | Nabi | Staphylococcus aureus antigen-containing whole cell vaccine |
| US5981274A (en) | 1996-09-18 | 1999-11-09 | Tyrrell; D. Lorne J. | Recombinant hepatitis virus vectors |
| US6610293B1 (en) | 1997-06-16 | 2003-08-26 | The Henry M. Jackson Foundation For The Advancement Of Military Medicine | Opsonic and protective monoclonal and chimeric antibodies specific for lipoteichoic acid of gram positive bacteria |
| US6756361B1 (en) | 1997-10-14 | 2004-06-29 | Nabi | Enterococcus antigens and vaccines |
| US5994624A (en) | 1997-10-20 | 1999-11-30 | Cotton Incorporated | In planta method for the production of transgenic plants |
| EP1034277B1 (en) | 1997-11-26 | 2012-06-27 | Inhibitex, Inc. | Extracellular matrix-binding proteins from Staphylococcus aureus |
| US6680195B1 (en) | 1997-11-26 | 2004-01-20 | Inhibitex, Inc. | Extracellular matrix-binding proteins from staphylococcus aureus |
| WO2000002523A2 (en) | 1998-07-10 | 2000-01-20 | U.S. Medical Research Institute Of Infectious Diseases Department Of The Army | Vaccine against staphylococcus intoxication |
| US6703025B1 (en) | 1998-08-31 | 2004-03-09 | Inhibitex, Inc. | Multicomponent vaccines |
| WO2000012132A1 (en) | 1998-08-31 | 2000-03-09 | Inhibitex, Inc. | Staphylococcal immunotherapeutics via donor selection and donor stimulation |
| US6692739B1 (en) | 1998-08-31 | 2004-02-17 | Inhibitex, Inc. | Staphylococcal immunotherapeutics via donor selection and donor stimulation |
| JP4714342B2 (ja) | 1998-08-31 | 2011-06-29 | ザ プラヴアスト フエロウス アンド スカラース オブ ザ カレツヂ オブ ザ ハリー アンド アンデイヴアイデツド トリニテイ オブ クイーン エリザベス ニヤー ダブリン | コアグラーゼ陰性スタフィロコカス菌に由来のポリペプチド及びポリヌクレオチド |
| WO2000012131A1 (en) | 1998-08-31 | 2000-03-09 | Inhibitex, Inc. | Multicomponent vaccines |
| AU6131999A (en) | 1998-09-01 | 2000-03-21 | Human Genome Sciences, Inc. | (staphylococcus aureus) genes and polypeptides |
| US6936258B1 (en) | 1999-03-19 | 2005-08-30 | Nabi Biopharmaceuticals | Staphylococcus antigen and vaccine |
| CA2367830A1 (en) | 1999-04-28 | 2000-11-02 | The Texas A & M University System | Method of inhibiting leukocyte adhesion to fibrinogen |
| WO2001034809A2 (en) | 1999-11-09 | 2001-05-17 | Glaxo Group Limited | Staphylococcus epidermidis nucleic acids and proteins |
| SE0000514D0 (sv) | 2000-02-17 | 2000-02-17 | Biostapro Ab | A 52 kDa protein from coagulase negative staphylococci and fragments |
| AU2001256958A1 (en) | 2000-03-17 | 2001-10-03 | Inhibitex, Inc. | Cross-reactive displacing antibodies from collagen-binding proteins and method of identification and use |
| US20020061569A1 (en) | 2000-03-21 | 2002-05-23 | Robert Haselbeck | Identification of essential genes in prokaryotes |
| GB0014907D0 (en) | 2000-06-20 | 2000-08-09 | Univ Sheffield | Antigenic polypeptides |
| AT410798B (de) | 2001-01-26 | 2003-07-25 | Cistem Biotechnologies Gmbh | Verfahren zur identifizierung, isolierung und herstellung von antigenen gegen ein spezifisches pathogen |
| US20020169288A1 (en) | 2001-03-15 | 2002-11-14 | Magnus Hook | Collagen-binding adhesin from staphylococcus epidermidis and method of use |
| GB0107661D0 (en) * | 2001-03-27 | 2001-05-16 | Chiron Spa | Staphylococcus aureus |
| WO2002090502A2 (en) | 2001-05-08 | 2002-11-14 | The Texas A & M University System | Highly conserved proteins from gram-positive bacteria |
| WO2002102829A2 (en) | 2001-06-15 | 2002-12-27 | Inhibitex, Inc. | Cross-reactive monoclonal and polyclonal antibodies which recognize surface proteins from coagulase-negative staphylococci and staphylococcus aureus |
| CA2351018A1 (en) | 2001-07-09 | 2003-01-09 | Universite De Sherbrooke | Dna vaccine against staphylococcus aureus |
| JP4404627B2 (ja) | 2001-08-02 | 2010-01-27 | ユニヴァーシティー オヴ シェフィールド | 抗原性ポリペプチド |
| US20030113350A1 (en) | 2001-09-19 | 2003-06-19 | Fattom Ali I. | Glycoconjugate vaccines for use in immune-compromised populations |
| US7115264B2 (en) | 2001-11-05 | 2006-10-03 | Inhibitex | Monoclonal antibodies to the fibronectin binding protein and method of use in treating or preventing infections |
| WO2003041726A1 (en) | 2001-11-16 | 2003-05-22 | Biostapro Ab | Use of an extracellular adherence protein for the manufacture of an anti-inflammatory drug |
| WO2003076470A1 (en) | 2002-03-05 | 2003-09-18 | Inhibitex, Inc. | Monoclonal and polyclonal antibodies recognizing coagulase-negative staphylococcal proteins |
| US6984381B2 (en) | 2002-07-05 | 2006-01-10 | The United States Of America As Represented By The Secretary Of Agriculture | Vaccine for the prevention of bacterial infection of the bovine mammary gland |
| US7615616B2 (en) | 2002-09-13 | 2009-11-10 | The Texas A&M University System | Bioinformatic method for identifying surface-anchored proteins from gram-positive bacteria and proteins obtained thereby |
| AU2003249851A1 (en) | 2002-10-03 | 2004-04-23 | Intercell Ag | Use of molecules which interact with the haptoglobin receptor ligand binding |
| US20040247605A1 (en) * | 2002-12-02 | 2004-12-09 | Kokai-Kun John Fitzgerald | Wall teichoic acid as a target for anti-staphylococcal therapies and vaccines |
| US6703625B1 (en) * | 2002-12-31 | 2004-03-09 | Intel Corporation | Methods and apparatus for off-axis lithographic illumination |
| EP1601381A2 (en) * | 2003-03-07 | 2005-12-07 | Wyeth Holdings Corporation | Polysaccharide - staphylococcal surface adhesin carrier protein conjugates for immunization against nosocomial infections |
| WO2004094600A2 (en) | 2003-04-16 | 2004-11-04 | The Texas A & M University System | Staphylococcus aureus efb protein and c3 binding region which inhibit complement activation |
| HRP20100240T1 (hr) | 2003-07-24 | 2010-09-30 | Merck Sharp & Dohme Corp. | Polipeptidi za indukciju zaštitnog imunitetnog odgovora protiv staphylococcus aureus |
| WO2005009378A2 (en) | 2003-07-24 | 2005-02-03 | Merck & Co., Inc. | Polypeptides for inducing a protective immune response against staphylococcus aureus |
| JP2007528217A (ja) | 2004-02-18 | 2007-10-11 | メルク エンド カムパニー インコーポレーテッド | スタヒロコッカス・アウレウスに対する防御免疫応答を誘導するためのポリペプチド |
| US7284284B2 (en) * | 2004-06-15 | 2007-10-23 | James Wysopal | Headgear article incorporating a bottle opener |
| US20080095792A1 (en) | 2004-09-17 | 2008-04-24 | Anderson Annaliesa S | Polypeptides For Inducing A Protective Immune Response Against Staphylococcus Aureus |
| AU2005287505A1 (en) * | 2004-09-22 | 2006-03-30 | Biosynexus Incorporated | Staphylococcal immunogenic compositions |
| KR20070085457A (ko) | 2004-10-25 | 2007-08-27 | 더 유니버시티 오브 웨스턴 온타리오 | 스태필로코쿠스 아우레우스의 철에 의해 조절되는 표면결정인자 IsdA, IsdB, 및 IsdC 기재 백신,조성물 및 방법 |
| US20060134141A1 (en) * | 2004-12-14 | 2006-06-22 | Nabi Biopharmaceuticals | Glycoconjugate vaccines containing peptidoglycan |
| PL1838341T3 (pl) | 2005-01-20 | 2014-04-30 | Isconova Ab | Kompozycja szczepionki obejmująca białko wiążące fibronektynę lub peptyd wiążący fibronektynę |
| US20060228368A1 (en) | 2005-04-07 | 2006-10-12 | Nabi Biopharmaceuticals | Method of protecting against staphylococcal infection |
| US8398991B2 (en) | 2005-06-22 | 2013-03-19 | Institut Pasteur | Modified ESAT-6 molecules and improved vaccine strains of Mycobacterium bovis BCG |
| EP2368570A3 (en) | 2006-01-18 | 2012-05-02 | University Of Chicago | Compositions and methods related to staphylococcal bacterium proteins |
| EP1982185A4 (en) | 2006-01-27 | 2010-04-28 | Merck Sharp & Dohme | ON S. AUREUS ORF0657N OBJECTIVE ANTIGEN-BINDING PROTEINS |
| WO2007095057A2 (en) | 2006-02-10 | 2007-08-23 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Use of eap protein for treating and preventing autoimmune neuroinflammatory diseases |
| EP1996231A4 (en) | 2006-02-22 | 2010-09-15 | Texas A & M Univ Sys | ANTIBODIES WITH STRONG EXPRESSED PUTATIVE ANTIGEN DETECTION OF CA-MRSA AND METHOD OF USE |
| EA015833B1 (ru) | 2006-03-30 | 2011-12-30 | Глаксосмитклайн Байолоджикалс С.А. | Иммуногенная композиция |
| AR060187A1 (es) | 2006-03-30 | 2008-05-28 | Glaxosmithkline Biolog Sa | Composicion inmunogenica |
| CN101466406B (zh) | 2006-06-12 | 2012-06-27 | 葛兰素史密斯克蓝生物品公司 | α-毒素在治疗和预防葡萄球菌感染上的用途 |
| WO2008152447A2 (en) | 2006-10-30 | 2008-12-18 | The University Of Western Ontario | Staphylococcus aureus specific anti-infectives |
| GB0700136D0 (en) | 2007-01-04 | 2007-02-14 | Glaxosmithkline Biolog Sa | Process for manufacturing vaccines |
| RU2009149294A (ru) | 2007-05-31 | 2011-07-10 | Мерк энд Ко., Инк. (US) | Антиген-связывающие белки, нацеленные на orf0657n s.aureus |
| CN101951948B (zh) * | 2007-08-31 | 2015-12-09 | 芝加哥大学 | 与针对葡萄球菌性肺部疾病和病症进行免疫相关的方法和组合物 |
| US8758765B2 (en) * | 2008-07-29 | 2014-06-24 | The University Of Chicago | Compositions and methods related to Staphylococcal bacterium proteins |
| WO2010042481A1 (en) * | 2008-10-06 | 2010-04-15 | University Of Chicago | Compositions and methods related to bacterial eap, emp, and/or adsa proteins |
| ES2784957T3 (es) | 2009-04-03 | 2020-10-02 | Univ Chicago | Composiciones y métodos relacionados con variantes de la proteína A (SPA) |
| EP2555794A4 (en) | 2010-04-05 | 2014-01-15 | Univ Chicago | COMPOSITIONS AND METHODS RELATING TO PROTEIN A (SPA) ANTIBODIES AS IMMUNE REACTION AMPLIFIERS |
| EP2614074A1 (en) | 2010-09-09 | 2013-07-17 | The University of Chicago | Methods and compositions involving protective staphylococcal antigens |
| US8945588B2 (en) * | 2011-05-06 | 2015-02-03 | The University Of Chicago | Methods and compositions involving protective staphylococcal antigens, such as EBH polypeptides |
-
2008
- 2008-08-29 CN CN200880113312.6A patent/CN101951948B/zh active Active
- 2008-08-29 CN CN201510736991.4A patent/CN105367656A/zh active Pending
- 2008-08-29 KR KR1020107007030A patent/KR20100072228A/ko not_active Abandoned
- 2008-08-29 JP JP2010523163A patent/JP5658564B2/ja not_active Expired - Fee Related
- 2008-08-29 CA CA2697538A patent/CA2697538C/en active Active
- 2008-08-29 EP EP08828277.7A patent/EP2185190B1/en active Active
- 2008-08-29 KR KR1020157009851A patent/KR101661946B1/ko active Active
- 2008-08-29 EP EP13160878.8A patent/EP2666784B1/en active Active
- 2008-08-29 WO PCT/US2008/074849 patent/WO2009029831A1/en not_active Ceased
- 2008-08-29 US US12/675,597 patent/US8840906B2/en active Active
- 2008-08-29 AU AU2008292897A patent/AU2008292897B2/en active Active
-
2014
- 2014-08-01 JP JP2014157658A patent/JP6018140B2/ja active Active
-
2015
- 2015-02-24 AU AU2015200932A patent/AU2015200932B2/en active Active
-
2016
- 2016-09-29 JP JP2016190589A patent/JP6437975B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| CA2697538A1 (en) | 2009-03-05 |
| WO2009029831A1 (en) | 2009-03-05 |
| EP2666784A3 (en) | 2014-04-09 |
| CN105367656A (zh) | 2016-03-02 |
| CN101951948B (zh) | 2015-12-09 |
| EP2666784B1 (en) | 2017-04-05 |
| CA2697538C (en) | 2019-02-12 |
| KR20150047640A (ko) | 2015-05-04 |
| US20110027265A1 (en) | 2011-02-03 |
| JP2014237687A (ja) | 2014-12-18 |
| AU2008292897A1 (en) | 2009-03-05 |
| KR101661946B1 (ko) | 2016-10-05 |
| US8840906B2 (en) | 2014-09-23 |
| AU2008292897B2 (en) | 2015-01-22 |
| KR20100072228A (ko) | 2010-06-30 |
| EP2185190B1 (en) | 2015-06-24 |
| CN101951948A (zh) | 2011-01-19 |
| AU2015200932B2 (en) | 2017-03-02 |
| EP2185190A1 (en) | 2010-05-19 |
| JP2010538015A (ja) | 2010-12-09 |
| JP6437975B2 (ja) | 2018-12-12 |
| JP2017002080A (ja) | 2017-01-05 |
| JP6018140B2 (ja) | 2016-11-02 |
| EP2666784A2 (en) | 2013-11-27 |
| AU2015200932A1 (en) | 2015-03-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6437975B2 (ja) | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 | |
| US11639379B2 (en) | Methods and compositions related to immunizing against Staphylococcal lung diseases and conditions | |
| JP6002128B2 (ja) | プロテインA(SpA)変種に関連する組成物および方法 | |
| JP5793194B2 (ja) | 感染防御ブドウ球菌抗原が関与する方法および組成物 | |
| JP5789250B2 (ja) | プロテインA(SpA)変種に関連する組成物および方法 | |
| JP6042574B2 (ja) | 免疫反応のエンハンサーとしてのプロテインA(SpA)抗体に関連する組成物および方法 | |
| JP2018121640A (ja) | ブドウ球菌コアグラーゼ抗原およびその使用方法 | |
| JP7643730B2 (ja) | ブドウ球菌(Staphylococcus)プロテインA(SpA)変種を含む方法および組成物 | |
| JP7117244B2 (ja) | 黄色ブドウ球菌疾患の間にコアグラーゼ活性を中和する抗体に関連した組成物および方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110629 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110629 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111018 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130304 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130531 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130607 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130903 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140402 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140801 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140820 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140912 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20140919 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20141117 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20141128 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5658564 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |