JP5476544B2 - ノロウイルスワクチン製剤 - Google Patents
ノロウイルスワクチン製剤 Download PDFInfo
- Publication number
- JP5476544B2 JP5476544B2 JP2009530639A JP2009530639A JP5476544B2 JP 5476544 B2 JP5476544 B2 JP 5476544B2 JP 2009530639 A JP2009530639 A JP 2009530639A JP 2009530639 A JP2009530639 A JP 2009530639A JP 5476544 B2 JP5476544 B2 JP 5476544B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- formulation
- dry powder
- norovirus
- vlp
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 241001263478 Norovirus Species 0.000 title claims description 162
- 229960005486 vaccine Drugs 0.000 title claims description 73
- 238000002360 preparation method Methods 0.000 title claims description 19
- 239000000203 mixture Substances 0.000 claims description 274
- 102000036639 antigens Human genes 0.000 claims description 164
- 108091007433 antigens Proteins 0.000 claims description 164
- 239000000427 antigen Substances 0.000 claims description 162
- 238000009472 formulation Methods 0.000 claims description 131
- 239000000843 powder Substances 0.000 claims description 88
- 229920001661 Chitosan Polymers 0.000 claims description 60
- 108090000623 proteins and genes Proteins 0.000 claims description 60
- 102000004169 proteins and genes Human genes 0.000 claims description 55
- 239000002671 adjuvant Substances 0.000 claims description 43
- 230000028993 immune response Effects 0.000 claims description 39
- 238000000034 method Methods 0.000 claims description 31
- 102100023321 Ceruloplasmin Human genes 0.000 claims description 30
- 108090000565 Capsid Proteins Proteins 0.000 claims description 29
- 241000700605 Viruses Species 0.000 claims description 23
- 229940124447 delivery agent Drugs 0.000 claims description 23
- 229920001282 polysaccharide Polymers 0.000 claims description 21
- 239000002245 particle Substances 0.000 claims description 18
- 239000003795 chemical substances by application Substances 0.000 claims description 17
- 230000000694 effects Effects 0.000 claims description 15
- 150000004676 glycans Chemical class 0.000 claims description 15
- 239000005017 polysaccharide Substances 0.000 claims description 15
- 230000003232 mucoadhesive effect Effects 0.000 claims description 13
- 208000006339 Caliciviridae Infections Diseases 0.000 claims description 11
- 229920002683 Glycosaminoglycan Polymers 0.000 claims description 11
- 108020004414 DNA Proteins 0.000 claims description 10
- 229920002678 cellulose Polymers 0.000 claims description 10
- 239000001913 cellulose Substances 0.000 claims description 10
- 235000010980 cellulose Nutrition 0.000 claims description 10
- 238000007918 intramuscular administration Methods 0.000 claims description 10
- 150000007523 nucleic acids Chemical group 0.000 claims description 10
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 claims description 9
- 239000012669 liquid formulation Substances 0.000 claims description 9
- 239000000227 bioadhesive Substances 0.000 claims description 8
- 239000007922 nasal spray Substances 0.000 claims description 8
- 229940097496 nasal spray Drugs 0.000 claims description 7
- 238000003860 storage Methods 0.000 claims description 7
- -1 unilin Polymers 0.000 claims description 7
- 241000238631 Hexapoda Species 0.000 claims description 6
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 6
- 231100000776 exotoxin Toxicity 0.000 claims description 6
- 239000002095 exotoxin Substances 0.000 claims description 6
- 150000003839 salts Chemical class 0.000 claims description 6
- 229920002101 Chitin Polymers 0.000 claims description 5
- 102000053602 DNA Human genes 0.000 claims description 5
- 240000004808 Saccharomyces cerevisiae Species 0.000 claims description 5
- 229940123384 Toll-like receptor (TLR) agonist Drugs 0.000 claims description 5
- 230000006870 function Effects 0.000 claims description 5
- 238000001990 intravenous administration Methods 0.000 claims description 5
- 238000007920 subcutaneous administration Methods 0.000 claims description 5
- OTLLEIBWKHEHGU-UHFFFAOYSA-N 2-[5-[[5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methoxy]-3,4-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-4-phosphonooxyhexanedioic acid Chemical compound C1=NC=2C(N)=NC=NC=2N1C(C(C1O)O)OC1COC1C(CO)OC(OC(C(O)C(OP(O)(O)=O)C(O)C(O)=O)C(O)=O)C(O)C1O OTLLEIBWKHEHGU-UHFFFAOYSA-N 0.000 claims description 4
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 claims description 4
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 claims description 4
- 239000004382 Amylase Substances 0.000 claims description 4
- 102000013142 Amylases Human genes 0.000 claims description 4
- 108010065511 Amylases Proteins 0.000 claims description 4
- 229920000945 Amylopectin Polymers 0.000 claims description 4
- 229920002134 Carboxymethyl cellulose Polymers 0.000 claims description 4
- 229920002567 Chondroitin Polymers 0.000 claims description 4
- 229920001287 Chondroitin sulfate Polymers 0.000 claims description 4
- 229920000045 Dermatan sulfate Polymers 0.000 claims description 4
- 229920002307 Dextran Polymers 0.000 claims description 4
- 229920001353 Dextrin Polymers 0.000 claims description 4
- 239000004375 Dextrin Substances 0.000 claims description 4
- 229920002527 Glycogen Polymers 0.000 claims description 4
- 229920002971 Heparan sulfate Polymers 0.000 claims description 4
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 claims description 4
- 229920000288 Keratan sulfate Polymers 0.000 claims description 4
- 102000004856 Lectins Human genes 0.000 claims description 4
- 108090001090 Lectins Proteins 0.000 claims description 4
- 239000004372 Polyvinyl alcohol Substances 0.000 claims description 4
- UQZIYBXSHAGNOE-USOSMYMVSA-N Stachyose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@H](CO[C@@H]2[C@@H](O)[C@@H](O)[C@@H](O)[C@H](CO)O2)O1 UQZIYBXSHAGNOE-USOSMYMVSA-N 0.000 claims description 4
- 229940072056 alginate Drugs 0.000 claims description 4
- 235000010443 alginic acid Nutrition 0.000 claims description 4
- 229920000615 alginic acid Polymers 0.000 claims description 4
- 235000019418 amylase Nutrition 0.000 claims description 4
- 239000001768 carboxy methyl cellulose Substances 0.000 claims description 4
- 235000010948 carboxy methyl cellulose Nutrition 0.000 claims description 4
- 239000008112 carboxymethyl-cellulose Substances 0.000 claims description 4
- DLGJWSVWTWEWBJ-HGGSSLSASA-N chondroitin Chemical compound CC(O)=N[C@@H]1[C@H](O)O[C@H](CO)[C@H](O)[C@@H]1OC1[C@H](O)[C@H](O)C=C(C(O)=O)O1 DLGJWSVWTWEWBJ-HGGSSLSASA-N 0.000 claims description 4
- 229940059329 chondroitin sulfate Drugs 0.000 claims description 4
- 230000008021 deposition Effects 0.000 claims description 4
- AVJBPWGFOQAPRH-FWMKGIEWSA-L dermatan sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@H](OS([O-])(=O)=O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](C([O-])=O)O1 AVJBPWGFOQAPRH-FWMKGIEWSA-L 0.000 claims description 4
- 229940051593 dermatan sulfate Drugs 0.000 claims description 4
- 235000019425 dextrin Nutrition 0.000 claims description 4
- 229940096919 glycogen Drugs 0.000 claims description 4
- 229920000669 heparin Polymers 0.000 claims description 4
- 229960002897 heparin Drugs 0.000 claims description 4
- 229920002674 hyaluronan Polymers 0.000 claims description 4
- 229940099552 hyaluronan Drugs 0.000 claims description 4
- KIUKXJAPPMFGSW-MNSSHETKSA-N hyaluronan Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)C1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H](C(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-MNSSHETKSA-N 0.000 claims description 4
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 claims description 4
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 claims description 4
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 claims description 4
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 claims description 4
- KXCLCNHUUKTANI-RBIYJLQWSA-N keratan Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@H](COS(O)(=O)=O)O[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@H](O[C@@H](O[C@H]3[C@H]([C@@H](COS(O)(=O)=O)O[C@@H](O)[C@@H]3O)O)[C@H](NC(C)=O)[C@H]2O)COS(O)(=O)=O)O[C@H](COS(O)(=O)=O)[C@@H]1O KXCLCNHUUKTANI-RBIYJLQWSA-N 0.000 claims description 4
- 239000002523 lectin Substances 0.000 claims description 4
- 230000014759 maintenance of location Effects 0.000 claims description 4
- 210000002850 nasal mucosa Anatomy 0.000 claims description 4
- 239000001814 pectin Substances 0.000 claims description 4
- 229920001277 pectin Polymers 0.000 claims description 4
- 235000010987 pectin Nutrition 0.000 claims description 4
- 229960000292 pectin Drugs 0.000 claims description 4
- 229920002451 polyvinyl alcohol Polymers 0.000 claims description 4
- 229920000036 polyvinylpyrrolidone Polymers 0.000 claims description 4
- 239000001267 polyvinylpyrrolidone Substances 0.000 claims description 4
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 claims description 4
- UQZIYBXSHAGNOE-XNSRJBNMSA-N stachyose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO[C@@H]3[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O3)O)O2)O)O1 UQZIYBXSHAGNOE-XNSRJBNMSA-N 0.000 claims description 4
- 241000894006 Bacteria Species 0.000 claims description 3
- 229920002125 Sokalan® Polymers 0.000 claims description 3
- 229940037003 alum Drugs 0.000 claims description 3
- 230000001939 inductive effect Effects 0.000 claims description 3
- 239000000463 material Substances 0.000 claims description 3
- 230000001225 therapeutic effect Effects 0.000 claims description 3
- 238000004587 chromatography analysis Methods 0.000 claims 2
- 229920000831 ionic polymer Polymers 0.000 claims 2
- 229920000058 polyacrylate Polymers 0.000 claims 1
- 210000004027 cell Anatomy 0.000 description 61
- 241000283973 Oryctolagus cuniculus Species 0.000 description 42
- 210000001806 memory b lymphocyte Anatomy 0.000 description 40
- 230000003053 immunization Effects 0.000 description 38
- 238000002649 immunization Methods 0.000 description 37
- 241000699670 Mus sp. Species 0.000 description 33
- 210000002966 serum Anatomy 0.000 description 26
- 210000000628 antibody-producing cell Anatomy 0.000 description 25
- 101710132601 Capsid protein Proteins 0.000 description 24
- 101710197658 Capsid protein VP1 Proteins 0.000 description 24
- 101710118046 RNA-directed RNA polymerase Proteins 0.000 description 24
- 101710108545 Viral protein 1 Proteins 0.000 description 24
- 210000001165 lymph node Anatomy 0.000 description 22
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 21
- 229930006000 Sucrose Natural products 0.000 description 20
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 20
- 239000005720 sucrose Substances 0.000 description 20
- 210000001519 tissue Anatomy 0.000 description 20
- 238000003556 assay Methods 0.000 description 19
- 210000002809 long lived plasma cell Anatomy 0.000 description 19
- 238000011510 Elispot assay Methods 0.000 description 18
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 17
- 229930195725 Mannitol Natural products 0.000 description 17
- 208000015181 infectious disease Diseases 0.000 description 17
- 239000000594 mannitol Substances 0.000 description 17
- 235000010355 mannitol Nutrition 0.000 description 17
- 230000004044 response Effects 0.000 description 16
- 210000004988 splenocyte Anatomy 0.000 description 16
- 230000002776 aggregation Effects 0.000 description 15
- 238000004220 aggregation Methods 0.000 description 15
- 230000003248 secreting effect Effects 0.000 description 15
- 101710081079 Minor spike protein H Proteins 0.000 description 14
- GZQKNULLWNGMCW-PWQABINMSA-N lipid A (E. coli) Chemical class O1[C@H](CO)[C@@H](OP(O)(O)=O)[C@H](OC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCCCC)[C@@H](NC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCC)[C@@H]1OC[C@@H]1[C@@H](O)[C@H](OC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](NC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](OP(O)(O)=O)O1 GZQKNULLWNGMCW-PWQABINMSA-N 0.000 description 14
- 239000000243 solution Substances 0.000 description 13
- 230000000890 antigenic effect Effects 0.000 description 12
- 239000007788 liquid Substances 0.000 description 12
- 241001465754 Metazoa Species 0.000 description 11
- 210000000234 capsid Anatomy 0.000 description 11
- 238000004108 freeze drying Methods 0.000 description 11
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 11
- 210000000952 spleen Anatomy 0.000 description 11
- 238000002965 ELISA Methods 0.000 description 10
- 238000000338 in vitro Methods 0.000 description 10
- 241000714209 Norwalk virus Species 0.000 description 9
- 210000001185 bone marrow Anatomy 0.000 description 9
- 238000002474 experimental method Methods 0.000 description 9
- 239000012634 fragment Substances 0.000 description 9
- 238000002703 mutagenesis Methods 0.000 description 9
- 231100000350 mutagenesis Toxicity 0.000 description 9
- 208000024891 symptom Diseases 0.000 description 9
- 150000001413 amino acids Chemical group 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 230000036755 cellular response Effects 0.000 description 8
- 238000007912 intraperitoneal administration Methods 0.000 description 8
- 210000002798 bone marrow cell Anatomy 0.000 description 7
- 239000004067 bulking agent Substances 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 230000002458 infectious effect Effects 0.000 description 7
- 210000004180 plasmocyte Anatomy 0.000 description 7
- 108090000765 processed proteins & peptides Proteins 0.000 description 7
- 230000003612 virological effect Effects 0.000 description 7
- 241000056533 Houston virus Species 0.000 description 6
- 238000001516 cell proliferation assay Methods 0.000 description 6
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 6
- 238000001542 size-exclusion chromatography Methods 0.000 description 6
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 6
- 239000013598 vector Substances 0.000 description 6
- 210000003719 b-lymphocyte Anatomy 0.000 description 5
- 239000006285 cell suspension Substances 0.000 description 5
- 230000007717 exclusion Effects 0.000 description 5
- 230000015788 innate immune response Effects 0.000 description 5
- 238000011084 recovery Methods 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 230000003442 weekly effect Effects 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 4
- 102000002689 Toll-like receptor Human genes 0.000 description 4
- 108020000411 Toll-like receptor Proteins 0.000 description 4
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 4
- 239000000556 agonist Substances 0.000 description 4
- 229940024606 amino acid Drugs 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 239000002158 endotoxin Substances 0.000 description 4
- 230000036039 immunity Effects 0.000 description 4
- 230000002163 immunogen Effects 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 229920006008 lipopolysaccharide Polymers 0.000 description 4
- 210000003563 lymphoid tissue Anatomy 0.000 description 4
- 239000011859 microparticle Substances 0.000 description 4
- 239000000178 monomer Substances 0.000 description 4
- 230000016379 mucosal immune response Effects 0.000 description 4
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 4
- 102000004196 processed proteins & peptides Human genes 0.000 description 4
- 210000004989 spleen cell Anatomy 0.000 description 4
- 241000701447 unidentified baculovirus Species 0.000 description 4
- 108091035707 Consensus sequence Proteins 0.000 description 3
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 3
- 241001529936 Murinae Species 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 108091034117 Oligonucleotide Proteins 0.000 description 3
- 101710159752 Poly(3-hydroxyalkanoate) polymerase subunit PhaE Proteins 0.000 description 3
- 101710130262 Probable Vpr-like protein Proteins 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 210000000988 bone and bone Anatomy 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 238000000151 deposition Methods 0.000 description 3
- 210000003743 erythrocyte Anatomy 0.000 description 3
- 229930195712 glutamate Natural products 0.000 description 3
- 239000012678 infectious agent Substances 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 238000011587 new zealand white rabbit Methods 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 229920002627 poly(phosphazenes) Polymers 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 230000002269 spontaneous effect Effects 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- 210000002303 tibia Anatomy 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- 210000002845 virion Anatomy 0.000 description 3
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- 101100282617 Bovine herpesvirus 1.1 (strain Cooper) gC gene Proteins 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 206010015548 Euthanasia Diseases 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 241000235058 Komagataella pastoris Species 0.000 description 2
- 102000015728 Mucins Human genes 0.000 description 2
- 108010063954 Mucins Proteins 0.000 description 2
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 2
- 201000005702 Pertussis Diseases 0.000 description 2
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 2
- 241000509413 Snow Mountain virus Species 0.000 description 2
- 230000006052 T cell proliferation Effects 0.000 description 2
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 2
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 239000012615 aggregate Substances 0.000 description 2
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 229940126534 drug product Drugs 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- 230000028996 humoral immune response Effects 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000009851 immunogenic response Effects 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 230000021633 leukocyte mediated immunity Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000006194 liquid suspension Substances 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 238000012792 lyophilization process Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 230000003278 mimic effect Effects 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 229940051875 mucins Drugs 0.000 description 2
- 210000004877 mucosa Anatomy 0.000 description 2
- 210000003097 mucus Anatomy 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 229960000502 poloxamer Drugs 0.000 description 2
- 229920001983 poloxamer Polymers 0.000 description 2
- 230000037452 priming Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000003259 recombinant expression Methods 0.000 description 2
- 238000010188 recombinant method Methods 0.000 description 2
- 230000000241 respiratory effect Effects 0.000 description 2
- 229930182490 saponin Natural products 0.000 description 2
- 150000007949 saponins Chemical class 0.000 description 2
- 235000017709 saponins Nutrition 0.000 description 2
- 238000001338 self-assembly Methods 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- 239000000277 virosome Substances 0.000 description 2
- 239000004034 viscosity adjusting agent Substances 0.000 description 2
- IQFYYKKMVGJFEH-OFKYTIFKSA-N 1-[(2r,4s,5r)-4-hydroxy-5-(tritiooxymethyl)oxolan-2-yl]-5-methylpyrimidine-2,4-dione Chemical compound C1[C@H](O)[C@@H](CO[3H])O[C@H]1N1C(=O)NC(=O)C(C)=C1 IQFYYKKMVGJFEH-OFKYTIFKSA-N 0.000 description 1
- FHJATBIERQTCTN-UHFFFAOYSA-N 1-[4-amino-2-(ethylaminomethyl)imidazo[4,5-c]quinolin-1-yl]-2-methylpropan-2-ol Chemical compound C1=CC=CC2=C(N(C(CNCC)=N3)CC(C)(C)O)C3=C(N)N=C21 FHJATBIERQTCTN-UHFFFAOYSA-N 0.000 description 1
- 101150029062 15 gene Proteins 0.000 description 1
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- 108010042708 Acetylmuramyl-Alanyl-Isoglutamine Proteins 0.000 description 1
- 101000768957 Acholeplasma phage L2 Uncharacterized 37.2 kDa protein Proteins 0.000 description 1
- 101000823746 Acidianus ambivalens Uncharacterized 17.7 kDa protein in bps2 3'region Proteins 0.000 description 1
- 101000916369 Acidianus ambivalens Uncharacterized protein in sor 5'region Proteins 0.000 description 1
- 101000769342 Acinetobacter guillouiae Uncharacterized protein in rpoN-murA intergenic region Proteins 0.000 description 1
- 101000823696 Actinobacillus pleuropneumoniae Uncharacterized glycosyltransferase in aroQ 3'region Proteins 0.000 description 1
- 101000786513 Agrobacterium tumefaciens (strain 15955) Uncharacterized protein outside the virF region Proteins 0.000 description 1
- 101000618005 Alkalihalobacillus pseudofirmus (strain ATCC BAA-2126 / JCM 17055 / OF4) Uncharacterized protein BpOF4_00885 Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 102100020724 Ankyrin repeat, SAM and basic leucine zipper domain-containing protein 1 Human genes 0.000 description 1
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 1
- 101000967489 Azorhizobium caulinodans (strain ATCC 43989 / DSM 5975 / JCM 20966 / LMG 6465 / NBRC 14845 / NCIMB 13405 / ORS 571) Uncharacterized protein AZC_3924 Proteins 0.000 description 1
- 101000823761 Bacillus licheniformis Uncharacterized 9.4 kDa protein in flaL 3'region Proteins 0.000 description 1
- 101000819719 Bacillus methanolicus Uncharacterized N-acetyltransferase in lysA 3'region Proteins 0.000 description 1
- 101000789586 Bacillus subtilis (strain 168) UPF0702 transmembrane protein YkjA Proteins 0.000 description 1
- 101000792624 Bacillus subtilis (strain 168) Uncharacterized protein YbxH Proteins 0.000 description 1
- 101000790792 Bacillus subtilis (strain 168) Uncharacterized protein YckC Proteins 0.000 description 1
- 101000819705 Bacillus subtilis (strain 168) Uncharacterized protein YlxR Proteins 0.000 description 1
- 101000948218 Bacillus subtilis (strain 168) Uncharacterized protein YtxJ Proteins 0.000 description 1
- 101000718627 Bacillus thuringiensis subsp. kurstaki Putative RNA polymerase sigma-G factor Proteins 0.000 description 1
- 101000641200 Bombyx mori densovirus Putative non-structural protein Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 101000947633 Claviceps purpurea Uncharacterized 13.8 kDa protein Proteins 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 241000759568 Corixa Species 0.000 description 1
- 241000238424 Crustacea Species 0.000 description 1
- 241001466947 Desert Shield virus Species 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 101000948901 Enterobacteria phage T4 Uncharacterized 16.0 kDa protein in segB-ipI intergenic region Proteins 0.000 description 1
- 101000805958 Equine herpesvirus 4 (strain 1942) Virion protein US10 homolog Proteins 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 101000790442 Escherichia coli Insertion element IS2 uncharacterized 11.1 kDa protein Proteins 0.000 description 1
- 101000788354 Escherichia phage P2 Uncharacterized 8.2 kDa protein in gpA 5'region Proteins 0.000 description 1
- 241000192125 Firmicutes Species 0.000 description 1
- 101000770304 Frankia alni UPF0460 protein in nifX-nifW intergenic region Proteins 0.000 description 1
- 208000005577 Gastroenteritis Diseases 0.000 description 1
- 206010061166 Gastroenteritis bacterial Diseases 0.000 description 1
- 101000797344 Geobacillus stearothermophilus Putative tRNA (cytidine(34)-2'-O)-methyltransferase Proteins 0.000 description 1
- 101000748410 Geobacillus stearothermophilus Uncharacterized protein in fumA 3'region Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 101000772675 Haemophilus influenzae (strain ATCC 51907 / DSM 11121 / KW20 / Rd) UPF0438 protein HI_0847 Proteins 0.000 description 1
- 101000631019 Haemophilus influenzae (strain ATCC 51907 / DSM 11121 / KW20 / Rd) Uncharacterized protein HI_0350 Proteins 0.000 description 1
- 101000768938 Haemophilus phage HP1 (strain HP1c1) Uncharacterized 8.9 kDa protein in int-C1 intergenic region Proteins 0.000 description 1
- 241001466963 Hawaii calicivirus Species 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 101000785414 Homo sapiens Ankyrin repeat, SAM and basic leucine zipper domain-containing protein 1 Proteins 0.000 description 1
- 101000833492 Homo sapiens Jouberin Proteins 0.000 description 1
- 101000651236 Homo sapiens NCK-interacting protein with SH3 domain Proteins 0.000 description 1
- 102100024407 Jouberin Human genes 0.000 description 1
- 101000782488 Junonia coenia densovirus (isolate pBRJ/1990) Putative non-structural protein NS2 Proteins 0.000 description 1
- 101000811523 Klebsiella pneumoniae Uncharacterized 55.8 kDa protein in cps region Proteins 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 101000818409 Lactococcus lactis subsp. lactis Uncharacterized HTH-type transcriptional regulator in lacX 3'region Proteins 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 101000878851 Leptolyngbya boryana Putative Fe(2+) transport protein A Proteins 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 101000758828 Methanosarcina barkeri (strain Fusaro / DSM 804) Uncharacterized protein Mbar_A1602 Proteins 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 101001122401 Middle East respiratory syndrome-related coronavirus (isolate United Kingdom/H123990006/2012) Non-structural protein ORF3 Proteins 0.000 description 1
- 241000551546 Minerva Species 0.000 description 1
- 208000007101 Muscle Cramp Diseases 0.000 description 1
- 206010049565 Muscle fatigue Diseases 0.000 description 1
- 208000000112 Myalgia Diseases 0.000 description 1
- 101001055788 Mycolicibacterium smegmatis (strain ATCC 700084 / mc(2)155) Pentapeptide repeat protein MfpA Proteins 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 241001617329 Norovirus isolates Species 0.000 description 1
- 101900322896 Norwalk virus Capsid protein VP1 Proteins 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 101000740670 Orgyia pseudotsugata multicapsid polyhedrosis virus Protein C42 Proteins 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 241000025414 Pentalagus furnessi Species 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 101000769182 Photorhabdus luminescens Uncharacterized protein in pnp 3'region Proteins 0.000 description 1
- 241000235648 Pichia Species 0.000 description 1
- 101000961392 Pseudescherichia vulneris Uncharacterized 29.9 kDa protein in crtE 3'region Proteins 0.000 description 1
- 101000731030 Pseudomonas oleovorans Poly(3-hydroxyalkanoate) polymerase 2 Proteins 0.000 description 1
- 101001065485 Pseudomonas putida Probable fatty acid methyltransferase Proteins 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 101000711023 Rhizobium leguminosarum bv. trifolii Uncharacterized protein in tfuA 3'region Proteins 0.000 description 1
- 101000948156 Rhodococcus erythropolis Uncharacterized 47.3 kDa protein in thcA 5'region Proteins 0.000 description 1
- 101000917565 Rhodococcus fascians Uncharacterized 33.6 kDa protein in fasciation locus Proteins 0.000 description 1
- 101000790284 Saimiriine herpesvirus 2 (strain 488) Uncharacterized 9.5 kDa protein in DHFR 3'region Proteins 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 241000235347 Schizosaccharomyces pombe Species 0.000 description 1
- 241001502514 Small round structured virus Species 0.000 description 1
- 241000714208 Southampton virus Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 101000936719 Streptococcus gordonii Accessory Sec system protein Asp3 Proteins 0.000 description 1
- 101000788499 Streptomyces coelicolor Uncharacterized oxidoreductase in mprA 5'region Proteins 0.000 description 1
- 101001102841 Streptomyces griseus Purine nucleoside phosphorylase ORF3 Proteins 0.000 description 1
- 101000708557 Streptomyces lincolnensis Uncharacterized 17.2 kDa protein in melC2-rnhH intergenic region Proteins 0.000 description 1
- 101710172711 Structural protein Proteins 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 230000005867 T cell response Effects 0.000 description 1
- 101000649826 Thermotoga neapolitana Putative anti-sigma factor antagonist TM1081 homolog Proteins 0.000 description 1
- 108010060804 Toll-Like Receptor 4 Proteins 0.000 description 1
- 102000008233 Toll-Like Receptor 4 Human genes 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 101000827562 Vibrio alginolyticus Uncharacterized protein in proC 3'region Proteins 0.000 description 1
- 101000778915 Vibrio parahaemolyticus serotype O3:K6 (strain RIMD 2210633) Uncharacterized membrane protein VP2115 Proteins 0.000 description 1
- 108020000999 Viral RNA Proteins 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- UZQJVUCHXGYFLQ-AYDHOLPZSA-N [(2s,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-4-[(2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-6-(hydroxymethyl)-4-[(2s,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-6-(hy Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1CC[C@]2(C)[C@H]3CC=C4[C@@]([C@@]3(CC[C@H]2[C@@]1(C=O)C)C)(C)CC(O)[C@]1(CCC(CC14)(C)C)C(=O)O[C@H]1[C@@H]([C@@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O[C@H]4[C@@H]([C@@H](O[C@H]5[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O5)O)[C@H](O)[C@@H](CO)O4)O)[C@H](O)[C@@H](CO)O3)O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O UZQJVUCHXGYFLQ-AYDHOLPZSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 208000012873 acute gastroenteritis Diseases 0.000 description 1
- 230000004721 adaptive immunity Effects 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 229940024545 aluminum hydroxide Drugs 0.000 description 1
- 229940024546 aluminum hydroxide gel Drugs 0.000 description 1
- SMYKVLBUSSNXMV-UHFFFAOYSA-K aluminum;trihydroxide;hydrate Chemical compound O.[OH-].[OH-].[OH-].[Al+3] SMYKVLBUSSNXMV-UHFFFAOYSA-K 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 229940126600 bulk drug product Drugs 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 230000035602 clotting Effects 0.000 description 1
- 230000002301 combined effect Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000000287 crude extract Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 238000000326 densiometry Methods 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 230000001687 destabilization Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- 230000012361 double-strand break repair Effects 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 230000002550 fecal effect Effects 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 229940124670 gardiquimod Drugs 0.000 description 1
- 210000004837 gut-associated lymphoid tissue Anatomy 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000005745 host immune response Effects 0.000 description 1
- 230000008348 humoral response Effects 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000010324 immunological assay Methods 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 238000002356 laser light scattering Methods 0.000 description 1
- 210000001699 lower leg Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 210000003071 memory t lymphocyte Anatomy 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 230000033607 mismatch repair Effects 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- BSOQXXWZTUDTEL-ZUYCGGNHSA-N muramyl dipeptide Chemical compound OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)O[C@@H](O)[C@@H]1NC(C)=O BSOQXXWZTUDTEL-ZUYCGGNHSA-N 0.000 description 1
- 208000013465 muscle pain Diseases 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 244000309711 non-enveloped viruses Species 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000003836 peripheral circulation Effects 0.000 description 1
- 238000009520 phase I clinical trial Methods 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000004845 protein aggregation Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- SYUHGPGVQRZVTB-UHFFFAOYSA-N radon atom Chemical compound [Rn] SYUHGPGVQRZVTB-UHFFFAOYSA-N 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000000611 regression analysis Methods 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000004513 sizing Methods 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 230000003393 splenic effect Effects 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000001694 spray drying Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 238000012876 topography Methods 0.000 description 1
- 238000004627 transmission electron microscopy Methods 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 125000001493 tyrosinyl group Chemical class [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- 239000012646 vaccine adjuvant Substances 0.000 description 1
- 229940124931 vaccine adjuvant Drugs 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/125—Picornaviridae, e.g. calicivirus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/42—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum viral
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/10—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from RNA viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5258—Virus-like particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
- A61K2039/543—Mucosal route intranasal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55572—Lipopolysaccharides; Lipid A; Monophosphoryl lipid A
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/70—Multivalent vaccine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/16011—Caliciviridae
- C12N2770/16023—Virus like particles [VLP]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/16011—Caliciviridae
- C12N2770/16034—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Organic Chemistry (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Genetics & Genomics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Vascular Medicine (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
Description
本出願は、その全文が本明細書に参照として組み入れられる、2006年9月29日出願の米国特許出願第60/847,912号、および2007年9月18日出願の米国特許出願第60/973,392号の優先権を主張するものである。
本発明は、契約番号DAMD17−01−C−0400およびW81XWH−05−0135の下で、米国陸軍医学研究及び材料司令(United States Army Medical Research and Material Command)からの政府支援を受けてもたらされたものである。政府は、本発明に対してある種の権利を有し得る。
本発明は、1つ以上のノロウイルス抗原を含む組成物を提供する。「ノロウイルス(Norovirus)」、「ノロウイルス(NOR)」、「ノロウイルス(norovirus)」、および本明細書における文法上の同等物は、カリシウイルス科ノロウイルス属のメンバーを意味する。いくつかの実施形態では、ノロウイルスは、ヒトまたは非ヒトの哺乳動物の種に感染し得る、関連するポシティブセンス1本鎖RNAの非エンベロープ(nonenveloped)ウイルスの群を含むことができる。いくつかの実施形態では、ノロウイルスはヒトに急性胃腸炎を引き起こすことができる。ノロウイルスは、電子顕微鏡で観察した場合に明確な表面構造またはデコボコの変縁を有する、小型球形ウイルス(SRSV)と称することもできる。ノロウイルス内には、15の遺伝子群を含む、核酸およびアミノ酸配列によって定義される少なくとも4つの遺伝子型(GI〜IV)が含まれる。主な遺伝子型はGIおよびGIIである。GIIIおよびGIVは提唱されているが、一般に認められている。代表的なGIIIは、ウシのイエナ(Jena)株である。GIVは、現時点では1つのウイルスであるアルファトロン型を含んでいる。ノロウイルスのさらなる記載は、Vinjeら、J.Clin.Micro.、41巻、1423〜1433頁(2003年)を参照されたい。「ノロウイルス」は、本明細書における組換えのノロウイルスウイルス様粒子(rNOR VLP)も意味する。いくつかの実施形態では、組換えのノロウイルスVLPは、少なくとも1つのカプシドタンパク質またはそのフラグメントをコードするノロウイルス核酸配列を用いた発現系において生成される。他の実施形態では、細胞におけるORF2によってコードされる少なくともノロウイルスのカプシドタンパク質の組換えの発現、例えばSf9細胞においてバキュロウイルスのベクターからの発現は、カプシドタンパク質のVLPへの自発的な自己集合をもたらすことができる。さらに他の実施形態では、ORF1およびORF2によってコードされる少なくともノロウイルスのタンパク質の組換えの発現、例えばSf9細胞においてバキュロウイルスのベクターからの発現は、カプシドタンパク質のVLPへの自発的な自己集合をもたらすことができる。ノロウイルス核酸配列は、様々なノロウイルス株、あるいは収量もしくは安定性を増強するように、またはコードされる抗原の抗原性もしくは免疫原性の性質を改善するように改変された合成構築物を含むコンセンサス配列であってもよい。VLPは、構造的にノロウイルスに類似しているが、ウイルスのRNAゲノムを欠いており、それゆえ感染性ではない。したがって、「ノロウイルス」は、不完全な粒子を含む、感染性または非感染性の粒子であり得るビリオンを含む。
本発明の抗原分子を、それらが天然に存在する生物体から単離および精製することによって調製することもでき、またはそれらを組換え技術によって調製することもできる。ノロウイルスVLP抗原を、Sf9またはH5細胞などの昆虫細胞から調製することが好ましいが、大腸菌または酵母菌の細胞(例えば、出芽酵母(S.cerevisiae)、分裂酵母(S.pombe)、ピキアパストリ(Pichia pastori)、もしくは他のピキアの発現系)などのあらゆる好適な細胞、CHOもしくはHEKなどの哺乳動物細胞の発現系も用いてもよい。組換え法によって、または合成によって調製する場合は、ペプチドを構成するアミノ酸の1つ以上の挿入、欠失、逆位、または置換がなされていてよい。上述の抗原は各々、実質的に純粋な状態で用いることが好ましい。
本発明は、ノロウイルス抗原と使用するためのアジュバントを含む組成物をさらに提供する。殆どのアジュバントは、抗原を速やかな異化作用から保護するように設計されている物質(例えば、水酸化アルミニウムまたは鉱油)、および免疫反応の刺激薬(例えば、百日咳菌(Bordatella pertussis)または結核菌(Mycobacterium tuberculosis)由来のタンパク質)を含んでいる。好適なアジュバントは、例えば、フロイントの不完全アジュバントおよび完全アジュバント(Pifco Laboratories、Detroit、Mich)、Merckアジュバント65(Merck and Company,Inc.、Rahway、N.J.)、水酸化アルミニウムゲル(ミョウバン)またはリン酸アルミニウムなどのアルミニウム塩、カルシウム、鉄、または亜鉛の塩、アシル化したチロシンの不溶性懸濁液、アシル化した糖、陽イオン性または陰イオン性に誘導体化した多糖、ポリホスファゼン、生分解性ミクロスフェア、ならびにQuil Aなどが市販されている。
本発明は、限定するものではないが、宿主のムコ多糖の部分的脱水の単一効果または組合せ効果、送達剤の物理的性質、または送達剤と貯蔵効果をもたらす暴露部位の宿主の組織との間のイオン性の相互作用による液体の粘性の増大に基づく、抗原の取込みを増強するように機能する送達剤を含む組成物も提供する。あるいは、送達剤は、送達部位の抗原保持時間を増大することができる(例えば、抗原の排出を遅らせる)。このような送達剤は、生物付着剤であってよい。特に、生物付着剤は、グリコサミノグリカン(例えば、コンドロイチン硫酸、デルマタン硫酸コンドロイチン、ケラタン硫酸、ヘパリン、ヘパラン硫酸、ヒアルロナン)、炭水化物ポリマー(例えば、ペクチン、アルギン酸塩、グリコーゲン、アミラーゼ、アミロペクチン、セルロース、キチン、スタキオース、ウヌリン(unulin)、デキストリン、デキストラン)、ポリ(アクリル酸)の架橋誘導体、ポリビニルアルコール、ポリビニルピロリドン、多糖(ムチン、および他のムコ多糖を含む)セルロース誘導体(例えば、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロース)、タンパク質(例えば、レクチン、線毛タンパク質)、およびデオキシリボ核酸からなる群から選択される粘膜付着剤であってよい。粘膜付着剤が、キトサン、キトサン塩、またはキトサン塩基(例えば、キトサングルタメート)などの多糖であることが好ましい。
本発明の組成物を、ワクチンまたは抗原製剤として投与するために製剤化することができる。本明細書で用いられる場合、「ワクチン」という用語は、上記に記載したような本発明のノロウイルスVLPまたは他のノロウイルス抗原を含む製剤、脊椎動物に投与するのが可能である形態における製剤、および感染を軽減するために、かつ/または感染の少なくとも1つの症状を低減するために、かつ/または別の投与量のVLPもしくは抗原の有効性を増強するために治療上の免疫を誘発するのに十分な免疫反応を誘発する製剤を意味する。本明細書で用いられる「抗原製剤(antigenic formulation)」または「抗原組成物」という用語は、哺乳動物などの脊椎動物に投与した場合に免疫反応を誘発する製剤を意味する。本明細書で用いられる「免疫反応」という用語は、体液性免疫反応および細胞媒介性免疫反応の両方を意味する。体液性免疫反応は、例えば、感染性物質を中和し、感染性物質が細胞に入るのを阻止し、前記感染性物質の複製を阻止し、かつ/または宿主細胞を感染および破壊から保護するBリンパ球による抗体の生成の刺激を伴う。細胞媒介性免疫反応は、脊椎動物(例えばヒト)が表す、感染を防止もしくは軽減し、または少なくとも1つのその症状を低減する、Tリンパ球および/またはマクロファージなどの他の細胞によって媒介される感染性物質に対する免疫反応を意味する。ワクチン製剤は、Vaccine Design(「The subunit and adjuvant approach」(Powell M.F.およびNewman M.J.編集)(1995年)Plenum Press New York)に概ね記載されている。本発明の組成物は、例えば、経口の、胃腸の、および呼吸器(例えば、鼻の)粘膜の1つ以上に送達するために製剤化することができる。
各々の抗原またはワクチン製剤の投与量における抗原の量は、重大な、有害な副作用なしに強力な免疫反応を誘発する量として選択される。このような量は、どの特異的な抗原を使用するか、投与経路、および用いるアジュバントに応じて変化する。一般には、本発明の状況では、患者に投与する投与量は、長時間にわたって患者に有益な治療反応をもたらすのに十分でなければならず、または抗原に特異的な抗体の生成を誘発するのに十分でなければならない。したがって、特異的な抗原に対する免疫反応を誘発するのに、かつ/または疾患もしくは感染症からの症状および/もしくは合併症を軽減し、低減し、もしくは治療するのに十分な量の組成物を患者に投与する。これを遂行するのに十分な量を、「治療上有効な投与量」と定義する。
(様々なノロウイルス抗原形態に対する免疫反応についての調査)
ワクチン製剤の有効性を調査するために、マイクロピペットによって液体懸濁液ワクチン製剤でマウスを鼻腔内(i.n.)免疫化した。マウスに、単回のワクチン投与量のみを与えた(初回抗原刺激)。
(in vitro抗原特異的増殖アッセイ)
ワクチン製剤の効力をさらに調査するために、マウスを、液体懸濁液ワクチン製剤で腹腔内(i.p.)免疫化した。マウスに、単回のみのワクチンの投与量を与えた(初回抗原刺激)。
(VLP特異的ELISPOTアッセイ)
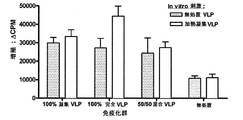
VLP特異的抗体分泌細胞(ASC)の反応を、実施例2に記載した様々なNV−VLP製剤で腹腔内免疫化したマウスから測定した。マウスの群(1群あたり5匹)を、表2に示した(実施例2)再水和した乾燥粉末製剤で1回i.p.ワクチン接種した。VLP含有製剤でワクチン接種した動物に、同量のタンパク質を投与した。100%凝集(100%凝集したVLPタンパク質)、100%完全(100%天然、完全なVLP)、50/50混合(完全および凝集のVLPの1:1混合物)、無処置(VLPタンパク質なし)。14日目にマウスを安楽死させ、頸部リンパ節を回収した。頸部リンパ節細胞を、天然の完全なVLPでコーティングしたELISPOTプレート上で一夜培養し、適当なHRPコンジュゲートした2次抗体を用いて、IgGまたはIgAいずれかに特異的なELISPOT用に発色させた(図4)。これらのデータは、3つのVLP抗原製剤は全て、抗原特異的なB細胞反応を誘発することを示している。100%凝集VLPで免疫化した群は最大の免疫反応を表した。
(VLP特異的ELISA)
血清IgGレベルを、様々なNV−VLP製剤でi.p.免疫化したマウスから測定した。マウスの群(1群あたり5匹)に、表2に示した(実施例2)再水和した乾燥粉末製剤を1回i.p.ワクチン接種した。VLP含有製剤でワクチン接種した動物に、同量の全タンパク質を投与した。100%凝集(100%凝集したVLPタンパク質)、100%完全(100%天然の、完全なVLP)、50/50混合(完全および凝集のVLPの1:1混合物)、無処置(VLPタンパク質なし)。14日目に血清を回収し、抗VLP特異的血清IgGに対してELISAによってアッセイした(図5)。これらのデータは、実施例3に示した結果と相関しており、3つのVLP抗原製剤は全て、抗原特異的なB細胞反応を誘発することを示している。繰り返すと、100%凝集VLPで免疫化した群は最大の免疫反応を表した。
(ウサギにおけるワクチン製剤)
Valois Monopowder Nasal Administration Deviceを用いて、ウサギに製剤を鼻腔内(i.n.)投与した。乾燥粉末製剤を、表3および4に示す。
(マウスにおけるノロウイルスワクチン製剤の効力のアッセイ)
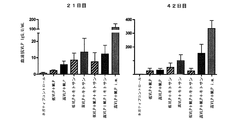
C57B16メスマウスを、0日目に、様々な希釈の再構成したノーウォークVLP乾燥粉末ワクチン(ノーウォークVLP、MPL、およびキトサンを含む)で腹腔内(i.p.)免疫化した。各動物に、示した製剤100μLを注射した。血清を毎週回収し、血清抗VLP IgGをELISAによって測定した。免疫化後3週間回収した血清に対する値を図6に示す。
(マウスにおける、液体対再構成したノロウイルス製剤の効力)
C57B16メスマウスを、0日目に、体積100μLの、キトサン、マンニトール、MPL、および様々な濃度のノーウォークVLP(表5)を含む製剤でi.p.免疫化した。乾燥粉末マトリックス(マンニトール、MPL、およびキトサン)10mg/mLを純水に可溶化し、特定の量の液体ノーウォークVLPを加えることによって、内部検量線を作成した(群1〜5)。一方、GMP VLPのロットを予め凍結乾燥し、次いで純水1.0mlに可溶化した(群6〜8)。14、21、および30日目にマウスから血清を回収し、血清抗ノーウォークVLP IgIをELISAによって測定した。
(ウサギにおける乾燥粉末製剤の効力)
ニュージーランドシロウサギのメス43羽に、乾燥粉末中に製剤化したノーウォークVLP5μg(低)または25μg(高)のいずれか±MLPおよび±キトサンで、Valois monopowder Nasal Administration Deviceを用いて鼻腔内(i.n.)免疫化した。1群には、液体として製剤化した高投与量のVLPおよびMPLを投与し、筋肉内投与した(i.m.)。0日目および21日目に、ウサギにワクチン接種した。MLPを用いる場合は、VLPと同じ投与量を用いた(すなわち、ノーウォークVLP5μgおよびMPL5μg)。キトサンを用いる場合は、7mg/投与量であった。
(ウサギに鼻腔内投与した液体対乾燥ノロウイルス製剤の効力)
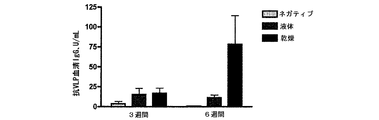
ニュージーランドシロウサギのメスに、乾燥粉末または液体のいずれかに製剤化したノーウォークVLP50μg+MLP50μg+キトサン14mgで、Valois monopowder Nasal Administration Deviceを用いて鼻腔内免疫化した。ワクチンの内容は、物理的状態以外は同一であった。0日目および21日目(0週目および3週目)に免疫化し、最初のワクチン接種後3週間および6週間に再び、追加免疫前に血清を回収した。ノーウォークVLPに特異的な血清IgGをELISAによって測定し、結果を図9に示す。
(ノロウイルス乾燥粉末製剤の安定性)
乾燥粉末VLP製剤の安定性を調査するために、(薬物生成物10mgあたり)遺伝子型IのVLP25μgの溶液を、MPL25μg、キトサングルタメート700μg、マンニトール1.475mg、およびショ糖1.475mgと混合することによってバルクの薬物生成物を調製した。溶液を凍結乾燥し、さらなるキトサングルタメート6.3mg(薬物生成物10mgあたり)と混和し、名目上10mgの乾燥粉末でBespak unidose装置中に充填し、乾燥剤のカプセルとともに密封したホイル袋に貯蔵した。全VLP含量をImperial染色したSDS−PAGEおよびスキャニングデンシトメトリーを用いて測定し、サイズ排除クロマトグラフィー(SEC)を用いて完全なVLP含量を定量した。これらの測定値は、実験誤差内では、12カ月の期間にわたって全VLPまたは完全なVLPのいずれかにおいて変化が検出されなかったことを示していた(図10)。SDS−PAGEの結果と比べた場合、SECによるVLPタンパク質の回復が低いのは凝集のためであったと仮定すると、%凝集の計算値は時間とともに増大せず、むしろ12カ月の貯蔵を通して一定のまま、または低減した。タンパク質にいっそう一般的な安定性の問題の一つは、貯蔵での凝集の増大である。図10における結果に基づくと、製剤は、完全なVLPの安定な百分率をもたらし、生成物を製造し、少なくとも1年間にわたって使用することができると結論付けることができる。
(複数のノロウイルス抗原)
C57B1/6マウス(メス、9週齢)8匹を、キトサン0.7mg、MPL2.5μg、およびマンニトール0.3mgを水で0.1mLにして製剤化したノーウォークVLP2.5μgで、0日目および14日目に腹腔内(IP)免疫化した。コントロールのマウス2匹を食塩水で免疫化した。28日目および49日目に、これらを、キトサン0.7mg、MPL2.5μg、およびマンニトール0.3mgを水で0.1mLにして製剤化したノーウォークVLP2.5μg+ヒューストンVLP2.5μgで再びIP免疫化した。コントロールのマウスには再び食塩水を与えた。血清サンプルを、5週目(35日目)に開始して毎週回収し、ノーウォークVLPまたはヒューストンVLPとの反応性に対してELISAによって分析した。ノーウォークだけの混合物で追加免疫した時間を、細矢印によって示し、ノーウォーク+ヒューストンVLP混合物で追加免疫した時間を太矢印で示す。U/mL(1UをIgG1μgに近似させる)における、ノーウォークVLP(上パネル)およびヒューストンVLP(下パネル)に特異的な個々の血清IgG反応を示す。平均値をバーによって示す。抗ノーウォーク反応は、0日目および14日目(0週目および2週目)の先の2回の免疫化によって非常に強力であったので、Y軸のスケールが異なることに留意されたい。しかし、ヒューストンVLPに対する反応は極めて強力であり、追加免疫後2週目に大幅な増大が出現している。これらのデータは、同じ免疫化混合物におけるノロウイルスVLPの様々な抗原株に対して特異的な免疫反応が産生され得ることを実証するものである(図11)。
(様々なノロウイルス抗原に対する免疫反応)
C57B16メスマウスを、0日目および14日目に、ノーウォークVLP25μg、ヒューストンVLP25μg、またはノーウォークおよびヒューストンVLP各25μgの組合せで、腹腔内(IP)免疫化した。血清を毎週回収し、血清抗VLP IgGをELISAによって測定した。免疫化後4週に回収した血清に対する値を図12に示す。
(ショ糖およびキトサンの混合物は乾燥粉末製剤においてノロウイルスVLP構造を保存する)
以下の実験は、凍結乾燥前溶液における、ショ糖、キトサン、およびマンニトールの、単独または組合せの、凍結乾燥中の天然のノーウォークVLPの4次構造に対する作用を調べたものである。表6は、対象の成分の凍結乾燥前溶液濃度、混合物の全体積、および対応する重量比を示すいくつかの実験の複合である。溶液は全て手操作で回転し、穏やかにボルテックスして均一にし、次いで液体窒素中シェル凍結し、約30から60時間までの範囲の時間サイドアーム付き容器を用いてユニットの外側に凍結乾燥した。
(鼻腔内免疫化したマウスにおけるノロウイルス特異的長寿命形質細胞および記憶B細胞の誘発)
A.ノーウォークVLP特異的長寿命形質細胞
BALB/cマウスを、ノロウイルスVLPおよびアジュバントで鼻腔内免疫化した。無処置のコントロールにはアジュバント単独を投与した。免疫化114日後、両群のマウスから脾臓、頸部リンパ節、および骨髄を収集した。組織を収集した日(0日目)、細胞を、ELISPOTアッセイを用いて抗原特異的な抗体分泌細胞(ASC)の存在に対してアッセイした。結果を、様々な組織に対して図13A〜Cに表す。これらの組織において免疫グロブリン(IgG、IgA、およびIgM)が検出されると、ノロウイルス特異的長寿命形質細胞の存在が示される。
ノーウォークVLPで鼻腔内免疫化したマウスからノーウォークVLP特異的記憶B細胞の存在を検出するためのin vitroのアッセイを開発した。様々なリンパ組織、または全血(末梢血単核細胞、脾細胞、リンパ節細胞など)を、このアッセイを用いて記憶B細胞の存在に対してアッセイすることができる細胞の供給源として使用することができる。
(ウサギにおけるノロウイルス記憶B細胞反応)
ニュージーランドシロウサギのメス2羽を、Valois Mark4鼻腔内送達装置中に充填した乾燥粉末10mgあたりノーウォークVLP25μg、MPL25μg、マンニトール1.5mg、ショ糖1.5mg、およびキトサン7.0mgからなる乾燥粉末製剤で鼻腔内免疫化した。ウサギ2羽には、14日間隔で全3回の免疫化を与えた。この実験では、非免疫化のメスウサギを無処置のコントロールとして用いた。
末梢血単核細胞(PBMC):凝固を防ぐためにEDTAを含む採血管に、ウサギから全血(〜50mL)を得た。全血を滅菌D−PBSで1:3に希釈し、希釈した全血〜35mLを、50mL滅菌遠心管中のリンパ球分離液15mL上に重層した。管を室温で20分間、800×gで遠心分離した。PBMCを含むバフィーコート層を、5mL滅菌ピペットを用いて注意深く除去し、細胞をD−PBSで2回洗浄した。必要に応じて、汚染性の赤血球をACK溶解によって除去した。細胞を、RPMI−1640−10%FBS(1640−C)に再懸濁し、トリパン排除法を用いて血球計算機で計数した。
96ウェルのMillipore PVDFフィルタープレートを予め湿潤し、洗浄した後、40μg/mlの濃度の天然ノーウォークVLPの滅菌溶液で最終体積50μl/ウェルにコーティングした。プレートを4℃で一夜インキュベートし、D−PBSで洗浄し、1640−Cを添加してブロックした。免疫化したウサギからの、および無処置のコントロールのウサギからの、腸間膜リンパ節細胞、脾細胞、および骨髄細胞を、様々な濃度で(1×106、5×105、2×105、および1×105細胞/ウェル)ウェルに加え、プレートを37℃で一夜インキュベートした。プレートをPBS−Tweenで徹底的に洗浄し、ウサギIgGおよびIgAに特異的な2次試薬をウェルに加え、室温でさらに2時間インキュベートした。広範に洗浄した後、プレートをDABクロマゲン(chromagen)/基質で発色させ、ELISPOTプレートリーダーで読み取った。無処置のコントロールの動物からのウェル上に表れたスポットを、実験群から差し引いた。データを、ノーウォークVLP特異的抗体分泌細胞(ASC)として表し、1×106細胞あたりで標準化した。
上記に記載した様々な組織から単離したリンパ細胞を、ノーウォークVLP(10μg/mL)存在下、1640−C培地に1mLあたり5×106細胞の密度で再懸濁した。細胞を1mLの体積で24ウェルプレート中、37℃で4日間インキュベートした。VLP特異的ELISPOTアッセイを、培養時にこれらの細胞に対して行った。培養4日後、細胞を収集し、1640−NS培地で2回洗浄し、1640−完全培地に再懸濁し、トリパンブルー排除法を用いて血球計算機で計数した。細胞を、ノーウォークVLP特異的ELISPOTアッセイでもう1回試験した。組織収集日に行ったELISPOTアッセイから得たデータを、0日目(バックグラウンド)のASC活性と呼ぶ。0日目の時間点に検出されたあらゆるスポットを、活発に分泌している形質細胞または長寿命形質細胞(LLPC)と仮定した。4日間培養細胞に対して行ったELISPOTアッセイから得られたデータを4日目ASC活性と呼び、記憶B細胞の活性を、4日目ASC活性と0日目ASC活性との間の違いによって表す。
上記に記載したノーウォークVLPを含む乾燥粉末製剤ワクチンで、3回鼻腔内免疫化した最後の141日後、免疫化したウサギ(RB735、RB1411)2羽から全血を得た。非免疫化の無処置のウサギからも血液を得た。血液を処理して、末梢血単核細胞(PBMC)を得、PBMCをノーウォークVLP特異的記憶B細胞アッセイ(上記セクションC)に配置した。結果を図15に示す。左パネルは、組織収集時(0日目ASC)の最初のELISPOTアッセイの結果を示す。右パネルは、ノーウォークVLPと培養4日後のELISPOTアッセイの結果を示す(4日目ASC)。
ワクチン免疫化した2羽のウサギ、および非免疫化のコントロールのウサギの脾臓から脾細胞を得た。ノーウォークVLP特異的記憶B細胞アッセイ(上記に記載)を、これらの細胞に対して行い、結果を図16に示す。PBMCの集団に観察されるように、0日目のELISPOTアッセイでは、抗原特異的な形質細胞が脾臓には存在しないことが示された(図16、左パネル)。しかし、ノーウォークVLPとin vitroで4日インキュベート後は、IgG分泌性ノーウォークVLP特異的記憶B細胞が脾細胞集団において明らかである。このように、脾臓は、鼻腔内免疫化後の記憶B細胞の遊走に対する一部位を代表している。
実験用ウサギの脛骨から骨髄細胞を得、長寿命形質細胞および記憶B細胞の存在に対してアッセイした。結果を図17に表す。図17の左パネルは、ウサギ1411は、骨髄に著しい集団の抗原特異的形質細胞を有していたことを示している。免疫化後、骨髄に遊走し、そこに長期間存在する形質細胞を、長寿命形質細胞(LLPC)と呼ぶ。ウサギ735は、高数値のLLPCを示さなかった。無処置のウサギの骨髄にはLLPCは見出されなかった。骨髄細胞を記憶B細胞アッセイで培養し、記憶B細胞の存在に対して再試験した。図17の右パネルは、骨髄には抗原特異的記憶B細胞が本質的に存在しないことを示している。このように、長寿命形質細胞は骨髄に遊走するが、記憶B細胞はそこに見出されない。
実験用ウサギ全てから腸間膜リンパ節を得て、単離した細胞をLLPCおよび記憶B細胞に対してアッセイした。このアッセイからの結果を図18Aに示す。骨髄以外の、分析した殆どのリンパ組織と同様、腸間膜節にLLPCは見出されなかった(図18A、左パネル)。ノーウォークVLPとのin vitroのインキュベート後に、非常に高い数値のIgG分泌性VLP特異的記憶B細胞が、腸間膜リンパ節の集団に明らかであった(図18A、右パネル)。腸間膜リンパ節に観察された記憶B細胞の数は、アッセイした他のリンパ組織に観察されたものよりも有意に高かった。
免疫化したウサギから収集した脾細胞を、完全なノーウォークVLPで再刺激し、細胞の増殖の度合いを、縦軸上に示すように(CPM)トリチウム標識したチミジンの取り組みによって測定した(図19)。左パネルは、脾細胞の非分画化集団の細胞の増殖を示し、右パネルはCD4+T細胞の細胞集団を示す。
1. Glass, RI, JS Noel, T Ando, RL Fankhauser, G Belloit, A Mounts, UD Parasher, JS Bresee and SS Monroe. The Epidemiology of Enteric Caliciviruses from Human: A Reassessment Using New Diagnostics. J Infect Dis 2000; 181 (Sup 2): S254-S261.
2. Hardy, ME. Norwalk and "Norwalk-like Viruses" in Epidemic Gastroenteritis. Clin Lab Med 1999;19(3): 675-90.
3. Jiang, X, DY Graham, KN Wang, and MK Estes. Noralk Virus Genome Cloning and Characterization. Science 1990; 250: 1580-1583.
4. Jiang, X, M Want, DY Graham, and MK Estes. Expression, Self-Assembly, and
Antigenicity of the Norwalk Virus Capsid Protein. J Virol 1992; 66: 6527-6532.
5. Glass, P, LJ White, JM Ball, I Leparc-Goffart, ME Hardy, and MK Estes. Norwalk Virus Open Reading Frame 3 Encodes a Minor Structural Protein. J Virol 2000; 74: 6581-6591.
6. Lindesmith, L, C Moe, S Marionneau, N Ruvoen, X Jiang, L Lindblad, P Stewart, J LePendu, and R Baric. Human Susceptiblity and Resistance to Norwalk Virus Infection. Nat Med 2003; 9: 548-553.
7. Parrino, TA, DS Schreiber, JS Trier, AZ Kapikian, and NR Blacklow. Clinical Immunity in Acute Gastroenteritis Caused by Norwalk Agent. N Engl J Med 1977; 297: 86-89.
8. Wyatt, RG, R Dolin, NR Blacklow, HL DuPont, RF Buscho, TS Thornhill, AZ Kapikian, and RM Chanock. Comparison of Three Agents of Acute Infectious Nonbacterial Gastroenteritis by Cross-challenge in Volunteers. J Infect Dis 1974; 129: 709.
9. Ball, JM, DY Graham, AR Opekum, MA Gilger, RA Guerrero, and MK Estes.
Recombinant Norwalk Virus-like Particles Given Orally to Volunteers: Phase I Study. Gastroenterology 1999; 117: 40-48.
10. Tacket, CO, MB Sztein, GA Losonky, SS Wasserman, and MK Estes. Humoral, Mucosal, and Cellular Immune Responses to Oral Nowalk Virus-like Particles in Volunteers. Clin Immunol 2003; 108: 241.
11. Guerrero, RA, JM Ball, SS Krater, SE Pacheco, JD Clements, and MK Estes. Recombinant Norwalk Virus-like Particles Administered Intranasally to Mice Induce Systemic and Mucosal (Fecal and Vaginal) Immune Responses. J Virol 2001; 75: 9713.
12. Nicollier-Jamot, B, A Ogier, L Piroth, P Pothier, and E Kohli. Recombinant Virus-like Particles of a Norovirus (Genogroup II Strain) Administered Intranasally and Orally with Mucosal Adjuvants LT and LT(R192G) in BALE/c Mice Induce Specific Humoral and Cellular Th1/Th2-like Immune Responses. Vaccine 2004; 22:1079-1086.
13. Periwal, SB, KR Kourie, N Ramachandaran, SJ Blakeney, S DeBruin, D Zhu, TJ Zamb, L Smith, S Udem, JH Eldridge, KE Shroff, and PA Reilly. A Modified Cholera Holotoxin CT-E29H Enhances Systemic and Mucosal Immune Responses to Recombinant Norwalk Virus- like Particle Vaccine. Vaccine 2003; 21: 376-385.
14. Isaka, M, Y Yasuda, S Kozuka, T Taniguchi, K Matano, J Maeyama, T Komiya, K Ohkuma, N Goto, and K Tochikubo. Induction of systemic and mucosal antibody responses in mice immunized intranasally with aluminium-non-adsorbed diphtheria toxoid together with recombinant cholera toxin B subunit as an adjuvant. Vaccine 1999; 18: 743-751.
15. Kozlowski, PA, S Cu-Uvin, MR Neutra, and TP Flanigan. Comparison of the oral, rectal, and vaginal immunization routes for induction of antibodies in rectal and genital tract secretions of women. Infect Immun 1997; 65: 1387-1394.
16. Mestecky, J, SM Michalek, Z Moldoveanu, and MW Russell. Routes of immunization and antigen delivery systems for optimal mucosal immune responses in humans. Behring Inst Mitt 1997; 33-43.
17. Wu, HY, and MW Russell. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunal Res 1997; 16: 187-201.
18. Evans, JT, CW Cluff, DA Johnson, MJ Lacy, DH Persing, and JR Baldridge. Enhancement of antigen-specific immunity via the TLR4 ligands MPL adjuvant and Ribi 529. Expert Rev Vaccines 2003; 2: 219-229.
19. Baldridge, JR, Y Yorgensen, JR Ward, and JT Ulrich. Monophosphoryl lipid A enhances mucosal and systemic immunity to vaccine antigens following intranasal administration [In Process Citation]. Vaccine 2000; 18: 2416-2425.
20. Yang, QB, M Martin, SM Michalek, and J Katz. Mechanisms of monophosphoryl lipid A augmentation of host responses to recombinant HagB from Porphyromonas gingivalis. Infect Immun 2002; 70: 3557-3565.
21. Baldrick, P, D Richardson, G Elliott, and AW Wheeler. Safety evaluation of monophosphoryl lipid A (MPL): an immunostimulatory adjuvant. Regul Toxicol Pharmacol 2002; 35: 398-413.
22. Baldridge, JR, P McGowan, JT Evans, C Cluff, S Mossman, D Johnson, and D Persing. Taking a toll on human disease: Toll-like receptor 4 agonists as vaccine adjuvants and monotherapeutic agents. Expert Opin Biol Ther 2004; 4: 1129-1138.
23. Persing, DH, RN Coler, MJ Lacy, DA Johnson, JR Baldridge, RM Hershberg, and SG Reed. Taking toll: lipid A mimetics as adjuvants and immunomodulators. Trends Microbiol 2002; 10: S32-37.
24. Illum, L. Nasal drug delivery--possibilities, problems and solutions. J Control Release 2003; 87: 187-198.
25. Illum, L, I Jabbal-Gill, M Hinchcliffe, AN Fisher, and SS Davis. Chitosan as a novel nasal delivery system for vaccines. Adv Drug Deliv Rev 2001; 51: 81-96.
26. Davis, SS. Delivery of peptide and non-peptide drugs through the respiratory tract. Pharm Sci Technol Today 1999; 2: 450-456.
27. Bacon, A, J Makin, P J Sizer, I Jabbal-Gill, M Hinchcliffe, L Illum, S Chatfield, and M Roberts. Carbohydrate biopolymers enhance antibody responses to mucosally delivered vaccine antigens. Infect Immun 2000; 68: 5764-5770.
28. van der Lubben, IM, JC Verhoef, G Borchard, and HE Junginger. Chitosan for mucosal vaccination. Adv Drug Deliv Rev 2001; 52: 139-144.
29. van der Lubben, IM, JC Verhoef, G Borchard, and HE Junginger. Chitosan and its derivatives in mucosal drug and vaccine delivery. Eur J Pharm Sci 2001; 14: 201-207.
30. Lim, S T, B Forbes, GP Martin, and MB Brown. In vivo and in vitro characterization of novel microparticulates based on hyaluronan and chitosan hydroglutamate. AAPS Pharm Sci Tech 2001; 2: 20.
31. Jabbal-Gill, I, AN Fisher, R Rappuoli, SS Davis, and L Illum. Stimulation of mucosal and systemic antibody responses against Bordetella pertussis filamentous haemagglutinin and recombinant pertussis toxin after nasal administration with chitosan in mice. Vaccine 1998; 16: 2039-2046.
32. Mills, KB, C Cosgrove, EA McNeela, A Sexton, R Giemza, I Jabbal-Gill, A Church, W Lin, L Illum, A Podda, R Rappuoli, M Pizza, GE Griffin, and DJ Lewis. Protective levels of diphtheria-neutralizing antibody induced in healthy volunteers by unilateral priming-boosting intranasal immunization associated with restricted ipsilateral mucosal secretory immunoglobulin. A Infect Immun 2003; 71: 726-732.
33. McNeela, EA., I Jabbal-Gill, L Illum, M Pizza, R Rappuoli, A Podda, DJ Lewis, and KH Mills. Intranasal immunization with genetically detoxified diphtheria toxin induces T cell responses in humans: enhancement of Th2 responses and toxin-neutralizing antibodies by formulation with chitosan. Vaccine 2004; 22: 909-914.
34. Mikszta, JA., VJ Sullivan, C Dean, AM Waterston, JB Alarcon, JP Dekker, 3rd, JM Brittingham, J Huang, CR Hwang, M Ferriter, G Jiang, K Mar, KU Saikh, BG Stiles, CJ Roy, RG Ulrich, and NG Harvey. Protective immunization against inhalational anthrax: a comparison of minimally invasive delivery platforms. J Infect Dis 2005; 191: 278-288.
35. Huang, J, RJ Garmise, TM Crowder, K Mar, CR Hwang, AJ Hickey, JA Mikszta, and VJ Sullivan. A novel dry powder influenza vaccine and intranasal delivery technology: induction of systemic and mucosal immune responses in rats. Vaccine 2004; 23: 794-801.
36. GSK Press Room. www.gsk.com/media/archive.htm
37. Corixa Press Room. www.corixa.com/default.asp?pid= release_ detail&id=248&year=2004
38. BioMira Web Site. http://www.biomira.com/business/outLicensing/
39. Centers for Disease Control, Morbidity and Mortality Weekly Report 2007; 56(33):842-846.
Claims (92)
- 少なくとも1つの単離されたノロウイルス抗原および少なくとも1つのアジュバントを含み、該アジュバントがトール様受容体(TLR)作用薬であって、且つ細菌由来の外毒素ではなく、該抗原がノロウイルスウイルス様粒子(VLP)を含む、ノロウイルス感染に対する免疫反応を誘発する組成物。
- 前記ノロウイルス抗原がノロウイルス遺伝子型Iおよび遺伝子型IIウイルス株からなる群から選択される、請求項1に記載の組成物。
- 前記ノロウイルスVLPが、ノロウイルス核酸配列を用いた発現系で生成される組換えVLPである、請求項1に記載の組成物。
- 前記核酸配列がカプシドタンパク質をコードする、請求項3に記載の組成物。
- 前記カプシドタンパク質がVP1およびVP2からなる群から選択される、請求項4に記載の組成物。
- 前記VLPが1価VLPである、請求項1に記載の組成物。
- 前記VLPが多価VLPである、請求項1に記載の組成物。
- 前記多価VLPが遺伝子型Iおよび遺伝子型IIのノロウイルスからなる群から選択される、請求項7に記載の組成物。
- 前記発現系が組換え細胞発現系またはバキュロウイルス感染細胞発現系である、請求項3に記載の組成物。
- 前記細胞発現系が、酵母、細菌、昆虫、および哺乳動物の発現系からなる群から選択される、請求項9に記載の組成物。
- 第2のノロウイルス抗原をさらに含む、請求項1に記載の組成物。
- 前記第1および第2のノロウイルス抗原が、異なる遺伝子型由来の1価VLPである、請求項11に記載の組成物。
- 送達剤をさらに含む、請求項1に記載の組成物。
- 前記送達剤が、抗原の取込みを増強し、貯蔵効果をもたらし、または送達部位で抗原保持時間を増大するように機能する、請求項13に記載の組成物。
- 前記送達剤が生物付着剤である、請求項13に記載の組成物。
- 前記生物付着剤が粘膜付着剤である、請求項15に記載の組成物。
- 前記粘膜付着剤が、グリコサミノグリカン、炭水化物ポリマー、ポリ(アクリル酸)の架橋誘導体、ポリビニルアルコール、ポリビニルピロリドン、多糖、ポリイオン、セルロース誘導体、タンパク質、およびデオキシリボ核酸からなる群から選択される、請求項16に記載の組成物。
- 前記グリコサミノグリカンが、コンドロイチン硫酸、デルマタン硫酸コンドロイチン、ケラタン硫酸、ヘパリン、ヘパラン硫酸、及びヒアルロナンからなる群より選択され、前記炭水化物ポリマーが、ペクチン、アルギン酸塩、グリコーゲン、アミラーゼ、アミロペクチン、セルロース、キチン、スタキオース、ウヌリン、デキストリン、及びデキストランからなる群より選択され、前記多糖が、ムチン、および他のムコ多糖からなる群より選択され、前記セルロース誘導体が、ヒドロキシプロピルメチルセルロース、及びカルボキシメチルセルロースからなる群より選択され、前記タンパク質が、レクチン、及び線毛タンパク質からなる群より選択される、請求項17に記載の組成物。
- 前記粘膜付着剤が多糖である、請求項16に記載の組成物。
- 前記多糖が、キトサン、キトサン塩、またはキトサン塩基である、請求項19に記載の組成物。
- 前記アジュバントがMPLであって、前記送達剤がキトサン、キトサン塩、またはキトサン塩基である、請求項13に記載の組成物。
- 前記アジュバントが、さらにアルミニウム塩を含む、請求項1に記載の組成物。
- 前記アジュバントがMPLである、請求項1に記載の組成物。
- 前記組成物が液体製剤である、請求項1に記載の組成物。
- 前記組成物が粉末製剤である、請求項1に記載の組成物。
- 前記組成物が直径約10から500マイクロメートルまでの平均粒子サイズを有する、請求項25に記載の組成物。
- 1つ以上の投与量の前記組成物を投与するための1つ以上の装置と組み合わせた、請求項25に記載の乾燥粉末組成物。
- 前記1つ以上の投与量が単位投与量である、請求項27に記載の乾燥粉末組成物。
- 前記装置が単回使用経鼻投与装置である、請求項27に記載の乾燥粉末組成物。
- 前記組成物が前記装置に貯えられている、請求項27に記載の乾燥粉末組成物。
- 請求項1に記載の組成物を含む抗原製剤。
- 請求項1に記載の組成物を含むワクチン製剤。
- 前記製剤を、粘膜、筋肉内、静脈内、皮下、皮内、真皮下、および経皮の投与経路からなる群から選択される経路によって対象に投与する、請求項31または32に記載の製剤。
- 前記投与経路が筋肉内である、請求項33に記載の製剤。
- 前記粘膜の投与経路が、鼻腔内、経口、または膣内である、請求項33に記載の製剤。
- 前記製剤が、鼻内噴霧、点鼻薬、または乾燥粉末の形態である、請求項35に記載の製剤。
- 鼻の通路に近接して保持されまたは鼻の通路中に挿入される製剤の装置から鼻の通路内に速やかに沈着させることによって製剤を鼻粘膜に投与する、請求項36に記載の製剤。
- 前記製剤を一方または両方の鼻孔に投与する、請求項37に記載の製剤。
- 前記ノロウイルス抗原が約0.01%(w/w)から約80%(w/w)までの濃度で存在する、請求項31または32に記載の製剤。
- 前記ノロウイルス抗原の投与量が、投与1回あたり約1μgから約100mgまでの量で存在する、請求項31または32に記載の製剤。
- 前記ノロウイルス抗原の投与量が、投与1回あたり約1μgから約1mgまでである、請求項40に記載の製剤。
- 前記ノロウイルス抗原の投与量が、投与1回あたり約1μgから約500μgまでである、請求項40に記載の製剤。
- 前記ノロウイルス抗原の投与量が、投与1回あたり約1μgから約100μgまでである、請求項40に記載の製剤。
- 請求項31に記載の抗原製剤を非ヒト対象に投与することを含む、ノロウイルス抗原に対する抗体を産生する方法。
- ノロウイルス感染を経験している非ヒト対象における免疫反応を誘発する方法であって、請求項32に記載のワクチン製剤を対象に投与することを含み、前記免疫反応が治療的である、方法。
- トール様受容体(TLR)作用薬と、アルミニウム塩とを含む、請求項1に記載の組成物。
- 前記アルミニウム塩が、ミョウバンである、請求項46に記載の組成物。
- 少なくとも1つの単離されたノロウイルス抗原および少なくとも1つのアジュバントを含み、該アジュバントがトール様受容体(TLR)作用薬であって、且つ細菌由来の外毒素ではなく、該抗原がノロウイルスウイルス様粒子(VLP)を含む、乾燥粉末組成物。
- 前記ノロウイルス抗原がノロウイルス遺伝子型Iおよび遺伝子型IIウイルス株からなる群から選択される、請求項48に記載の乾燥粉末組成物。
- 前記ノロウイルスVLPが、ノロウイルス核酸配列を用いた発現系で生成される組換えVLPである、請求項48に記載の乾燥粉末組成物。
- 前記核酸配列がカプシドタンパク質をコードする、請求項50に記載の乾燥粉末組成物。
- 前記カプシドタンパク質がVP1およびVP2からなる群から選択される、請求項51に記載の乾燥粉末組成物。
- 前記VLPが1価VLPである、請求項48に記載の乾燥粉末組成物。
- 前記VLPが多価VLPである、請求項48に記載の乾燥粉末組成物。
- 前記多価VLPが遺伝子型Iおよび遺伝子型IIのノロウイルスからなる群から選択される、請求項54に記載の乾燥粉末組成物。
- 前記発現系が組換え細胞発現系またはバキュロウイルス感染細胞発現系である、請求項50に記載の乾燥粉末組成物。
- 前記細胞発現系が、酵母、細菌、昆虫、および哺乳動物の発現系からなる群から選択される、請求項56に記載の乾燥粉末組成物。
- 第2のノロウイルス抗原をさらに含む、請求項48に記載の乾燥粉末組成物。
- 前記第1および第2のノロウイルス抗原が、異なる遺伝子型由来の1価VLPである、請求項58に記載の乾燥粉末組成物。
- 送達剤をさらに含む、請求項48に記載の乾燥粉末組成物。
- 前記送達剤が、抗原の取込みを増強し、貯蔵効果をもたらし、または送達部位で抗原保持時間を増大するように機能する、請求項60に記載の乾燥粉末組成物。
- 前記送達剤が生物付着剤である、請求項60に記載の乾燥粉末組成物。
- 前記生物付着剤が粘膜付着剤である、請求項62に記載の乾燥粉末組成物。
- 前記粘膜付着剤が、グリコサミノグリカン、炭水化物ポリマー、ポリ(アクリル酸)の架橋誘導体、ポリビニルアルコール、ポリビニルピロリドン、多糖、ポリイオン、セルロース誘導体、タンパク質、およびデオキシリボ核酸からなる群から選択される、請求項63に記載の乾燥粉末組成物。
- 前記グリコサミノグリカンが、コンドロイチン硫酸、デルマタン硫酸コンドロイチン、ケラタン硫酸、ヘパリン、ヘパラン硫酸、及びヒアルロナンからなる群より選択され、前記炭水化物ポリマーが、ペクチン、アルギン酸塩、グリコーゲン、アミラーゼ、アミロペクチン、セルロース、キチン、スタキオース、ウヌリン、デキストリン、及びデキストランからなる群より選択され、前記多糖が、ムチン、および他のムコ多糖からなる群より選択され、前記セルロース誘導体が、ヒドロキシプロピルメチルセルロース、及びカルボキシメチルセルロースからなる群より選択され、前記タンパク質が、レクチン、及び線毛タンパク質からなる群より選択される、請求項64に記載の乾燥粉末組成物。
- 前記粘膜付着剤が多糖である、請求項63に記載の乾燥粉末組成物。
- 前記多糖が、キトサン、キトサン塩、またはキトサン塩基である、請求項66に記載の乾燥粉末組成物。
- 前記アジュバントがMPLであって、前記送達剤がキトサン、キトサン塩、またはキトサン塩基である、請求項60に記載の乾燥粉末組成物。
- 前記アジュバントが、さらにアルミニウム塩を含む、請求項48に記載の乾燥粉末組成物。
- 前記アジュバントがMPLである、請求項48に記載の乾燥粉末組成物。
- 前記乾燥粉末組成物が直径約10から500マイクロメートルまでの平均粒子サイズを有する、請求項48に記載の乾燥粉末組成物。
- 1つ以上の投与量の前記乾燥粉末組成物を投与するための1つ以上の装置と組み合わせた、請求項48に記載の乾燥粉末組成物。
- 前記1つ以上の投与量が単位投与量である、請求項72に記載の乾燥粉末組成物。
- 前記装置が単回使用経鼻投与装置である、請求項72に記載の乾燥粉末組成物。
- 前記乾燥粉末組成物が前記装置に貯えられている、請求項72に記載の乾燥粉末組成物。
- 請求項48に記載の乾燥粉末組成物を含む抗原製剤。
- 請求項48に記載の乾燥粉末組成物を含むワクチン製剤。
- 前記製剤を、粘膜、筋肉内、静脈内、皮下、皮内、真皮下、および経皮の投与経路からなる群から選択される経路によって対象に投与する、請求項76または77に記載の製剤。
- 前記投与経路が筋肉内である、請求項78に記載の製剤。
- 前記粘膜の投与経路が、鼻腔内、経口、または膣内である、請求項78に記載の製剤。
- 前記製剤が、鼻内噴霧、点鼻薬、または乾燥粉末の形態である、請求項80に記載の製剤。
- 鼻の通路に近接して保持されまたは鼻の通路中に挿入される製剤の装置から鼻の通路内に速やかに沈着させることによって製剤を鼻粘膜に投与する、請求項81に記載の製剤。
- 前記製剤を一方または両方の鼻孔に投与する、請求項82に記載の製剤。
- 前記ノロウイルス抗原が約0.01%(w/w)から約80%(w/w)までの濃度で存在する、請求項76または77に記載の製剤。
- 前記ノロウイルス抗原の投与量が、投与1回あたり約1μgから約100mgまでの量で存在する、請求項76または77に記載の製剤。
- 前記ノロウイルス抗原の投与量が、投与1回あたり約1μgから約1mgまでである、請求項85に記載の製剤。
- 前記ノロウイルス抗原の投与量が、投与1回あたり約1μgから約500μgまでである、請求項85に記載の製剤。
- 前記ノロウイルス抗原の投与量が、投与1回あたり約1μgから約100μgまでである、請求項85に記載の製剤。
- 請求項76に記載の抗原製剤を非ヒト対象に投与することを含む、ノロウイルス抗原に対する抗体を産生する方法。
- ノロウイルス感染を経験している非ヒト対象における免疫反応を誘発する方法であって、請求項77に記載のワクチン製剤を対象に投与することを含み、前記免疫反応が治療的である、方法。
- トール様受容体(TLR)作用薬と、アルミニウム塩とを含む、請求項48に記載の乾燥粉末組成物。
- 前記アルミニウム塩が、ミョウバンである、請求項91に記載の乾燥粉末組成物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US84791206P | 2006-09-29 | 2006-09-29 | |
| US60/847,912 | 2006-09-29 | ||
| US97339207P | 2007-09-18 | 2007-09-18 | |
| US60/973,392 | 2007-09-18 | ||
| PCT/US2007/079929 WO2008042789A1 (en) | 2006-09-29 | 2007-09-28 | Norovirus vaccine formulations |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013131559A Division JP5898133B2 (ja) | 2006-09-29 | 2013-06-24 | ノロウイルスワクチン製剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010505766A JP2010505766A (ja) | 2010-02-25 |
| JP5476544B2 true JP5476544B2 (ja) | 2014-04-23 |
Family
ID=39268804
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009530639A Active JP5476544B2 (ja) | 2006-09-29 | 2007-09-28 | ノロウイルスワクチン製剤 |
| JP2013131559A Active JP5898133B2 (ja) | 2006-09-29 | 2013-06-24 | ノロウイルスワクチン製剤 |
| JP2015197633A Active JP6134364B2 (ja) | 2006-09-29 | 2015-10-05 | ノロウイルスワクチン製剤 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013131559A Active JP5898133B2 (ja) | 2006-09-29 | 2013-06-24 | ノロウイルスワクチン製剤 |
| JP2015197633A Active JP6134364B2 (ja) | 2006-09-29 | 2015-10-05 | ノロウイルスワクチン製剤 |
Country Status (17)
| Country | Link |
|---|---|
| US (8) | US7955603B2 (ja) |
| EP (4) | EP2601969B1 (ja) |
| JP (3) | JP5476544B2 (ja) |
| KR (1) | KR101515489B1 (ja) |
| AU (1) | AU2007303608B2 (ja) |
| CA (1) | CA2664157C (ja) |
| CY (1) | CY1118492T1 (ja) |
| DK (3) | DK2601970T3 (ja) |
| ES (3) | ES2420136T3 (ja) |
| HK (1) | HK1184057A1 (ja) |
| HU (2) | HUE032422T2 (ja) |
| LT (1) | LT2601970T (ja) |
| PL (2) | PL2601969T3 (ja) |
| PT (1) | PT2601970T (ja) |
| SG (3) | SG174845A1 (ja) |
| SI (1) | SI2601970T1 (ja) |
| WO (1) | WO2008042789A1 (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013234188A (ja) * | 2006-09-29 | 2013-11-21 | Takeda Vaccines (Montana) Inc | ノロウイルスワクチン製剤 |
| US9801934B2 (en) | 2011-07-11 | 2017-10-31 | Takeda Vaccines, Inc. | Parenteral norovirus vaccine formulations |
| US9821049B2 (en) | 2007-09-18 | 2017-11-21 | Takeda Vaccines, Inc. | Method of conferring a protective immune response to Norovirus |
| US10130696B2 (en) | 2007-09-18 | 2018-11-20 | Takeda Vaccines, Inc. | Method of conferring a protective immune response to norovirus |
Families Citing this family (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150098681A (ko) * | 2007-03-14 | 2015-08-28 | 다케다 백신즈 인코포레이티드 | 바이러스 유사 입자 정제 |
| DK2324113T3 (en) * | 2008-08-08 | 2018-04-16 | Takeda Vaccines Inc | VIRUS-LIKE PARTICLES INCLUDING COMPOSITE CAPSID AMINO ACID SEQUENCES FOR INCREASED CRYSTAL REACTIVITY |
| WO2010111586A2 (en) * | 2009-03-27 | 2010-09-30 | Arizona Board Of Regents Acting For And On Behalf Of Arizona State University | Mucosal immunization |
| US20110070260A1 (en) * | 2009-09-09 | 2011-03-24 | Baric Ralph S | Multivalent Immunogenic Compositions Against Noroviruses and Methods of Use |
| US9439958B2 (en) * | 2009-12-23 | 2016-09-13 | Arizona Board Of Regents Acting For And On Behalf Of Arizona State University | Stabilized virus like particles having enhanced mucosal immunogenicity |
| CN102791286B (zh) * | 2010-01-21 | 2017-08-08 | 莱戈赛特医药股份有限公司 | 杯状病毒病毒样颗粒上靶定异源抗原的呈递 |
| AU2012244074B2 (en) * | 2010-04-15 | 2015-01-15 | Km Biologics Co., Ltd. | Methods and compositions for intranasal delivery |
| ES2874817T3 (es) * | 2010-04-15 | 2021-11-05 | Shin Nippon Biomedical Laboratories Ltd | Procedimiento para generar una formulación de vacuna en polvo seco para suministro intranasal |
| JOP20130186B1 (ar) * | 2012-06-22 | 2021-08-17 | Takeda Vaccines Montana Inc | تنقية الجزيئات الشبيهة بالفيروسات |
| US20140017257A1 (en) * | 2012-07-11 | 2014-01-16 | Xi Jiang | IgY From Norovirus P Particles And Their Derivatives |
| EP3745128A1 (en) * | 2012-12-28 | 2020-12-02 | Cellestis Limited | A cell mediated immune response assay |
| US9975923B2 (en) | 2013-03-15 | 2018-05-22 | The University Of North Carolina At Chapel Hill | Methods and compositions for norovirus blockade epitopes |
| WO2014145245A2 (en) * | 2013-03-15 | 2014-09-18 | The University Of North Carolina At Chapel Hill | Methods and compositions for norovirus blockade epitopes |
| JP2015015931A (ja) | 2013-07-12 | 2015-01-29 | 株式会社Umnファーマ | ウイルス様粒子を含む培養物の製造方法 |
| JP2015017065A (ja) * | 2013-07-12 | 2015-01-29 | 株式会社Umnファーマ | ノロウイルスのウイルス様粒子を含む医薬組成物 |
| JP6479305B2 (ja) | 2013-07-12 | 2019-03-06 | 株式会社Umnファーマ | ウイルス様粒子の精製方法 |
| US9937258B2 (en) | 2013-07-17 | 2018-04-10 | Dow Global Technologies Llc | Composition for application to a nasal mucosa comprising a methylcellulose |
| SG11201602585XA (en) | 2013-10-03 | 2016-05-30 | Takeda Vaccines Inc | Methods of detection and removal of rhabdoviruses from cell lines |
| JP6556632B2 (ja) * | 2013-12-16 | 2019-08-07 | 武田薬品工業株式会社 | マイクロニードル |
| CN108430502A (zh) | 2015-08-28 | 2018-08-21 | 科学生物技术公司 | 诺瓦克病毒疫苗 |
| KR101914779B1 (ko) * | 2016-03-18 | 2018-11-02 | (주)인테라 | 노로 바이러스 백신을 생산하기 위한 재조합 발현 벡터 |
| CN107184970A (zh) * | 2017-02-16 | 2017-09-22 | 北京生物制品研究所有限责任公司 | 口服诺如病毒亚单位疫苗及lt作为该疫苗佐剂的用途 |
| JP2020515531A (ja) | 2017-03-28 | 2020-05-28 | チルドレンズ ホスピタル メディカル センター | ノロウイルスs粒子ベースのワクチンならびにその作製および使用方法 |
| MX2020005530A (es) | 2017-11-30 | 2021-01-15 | Medicago Inc | Proteinas vp1 de norovirus modificadas y psv que comprenden proteinas vp1 de norovirus modificadas. |
| JP2021514391A (ja) | 2018-02-15 | 2021-06-10 | アイコン ジェネティクス ゲーエムベーハー | ノロウイルスに対する免疫応答を生成するための免疫原性組成物及びワクチン |
| JP6713013B2 (ja) * | 2018-03-06 | 2020-06-24 | 株式会社イーダブルニュートリション・ジャパン | 貝類のノロウイルス不活化方法 |
| WO2020010428A1 (en) | 2018-07-13 | 2020-01-16 | Medicago Inc. | Modified norovirus vp1 proteins and vlps comprising modified norovirus vp1 proteins |
| JP2021534074A (ja) | 2018-08-20 | 2021-12-09 | タケダ ワクチン, インコーポレイテッドTakeda Vaccines, Inc. | Vlp製剤 |
| CA3113691A1 (en) * | 2018-09-17 | 2020-03-26 | Board Of Regents, The University Of Texas System | Compositions and methods for treating bone injury |
| US11523988B2 (en) * | 2018-11-29 | 2022-12-13 | Catalent U.K. Swindon Zydis Limited | Oral dispersible vaccine comprising virosomes |
| EP3698773A1 (en) | 2019-02-21 | 2020-08-26 | Università degli Studi di Parma | Composition and manufacturing of powders containing nanoadjuvants for mucosal vaccination |
| JP7536031B2 (ja) | 2019-03-12 | 2024-08-19 | アイコン ジェネティクス ゲーエムベーハー | 安定性が改善されたノロウイルス様粒子 |
| JP2022544414A (ja) * | 2019-08-13 | 2022-10-18 | アルティミューン インコーポレーティッド | 治療剤の有効性及びその投与の経路 |
| JP2024519800A (ja) | 2021-05-21 | 2024-05-21 | タケダ ワクチン,インコーポレイテッド | 固体組成物、フリーズドライ方法およびガラスバイアル |
| JPWO2023176206A1 (ja) | 2022-03-18 | 2023-09-21 | ||
| CN117330750A (zh) * | 2023-12-01 | 2024-01-02 | 北京生物制品研究所有限责任公司 | 一种筛选新冠病毒早期毒种的方法和制造疫苗的方法 |
Family Cites Families (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6572862B1 (en) | 1989-11-08 | 2003-06-03 | Baylor College Of Medicine | Methods and reagents to detect and characterize Norwalk and related viruses |
| WO1992016543A1 (en) * | 1991-03-25 | 1992-10-01 | Genelabs Incorporated | NORWALK VIRUS HUMAN GASTROENTERITIS AGENT AND MOLECULAR CLONING OF CORRESPONDING cDNAs |
| WO1993021325A1 (en) | 1992-04-08 | 1993-10-28 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Wild-type measles virus glycoproteins: vaccine and detection method therefor |
| SG48309A1 (en) | 1993-03-23 | 1998-04-17 | Smithkline Beecham Biolog | Vaccine compositions containing 3-0 deacylated monophosphoryl lipid a |
| US5788970A (en) | 1994-03-29 | 1998-08-04 | The University Of Maryland College Park | Chimeric infectious bursal disease virus CDNA clones, expression products and vaccines based thereon |
| CN1152935A (zh) | 1994-05-16 | 1997-06-25 | 麦克公司 | 乳头状瘤病毒疫苗 |
| US5645051A (en) | 1995-04-21 | 1997-07-08 | Dura Pharmaceuticals, Inc. | Unit dose dry powder inhaler |
| US5861241A (en) * | 1995-08-16 | 1999-01-19 | University Of Massachusetts | Monoclonal antibodies for detecting Norwalk virus |
| GB9525083D0 (en) * | 1995-12-07 | 1996-02-07 | Danbiosyst Uk | Vaccine compositions |
| US5834015A (en) | 1996-09-11 | 1998-11-10 | Albany Medical College | Protein-lipid vesicles and autogenous vaccine comprising the same |
| US5953727A (en) | 1996-10-10 | 1999-09-14 | Incyte Pharmaceuticals, Inc. | Project-based full-length biomolecular sequence database |
| US6491919B2 (en) | 1997-04-01 | 2002-12-10 | Corixa Corporation | Aqueous immunologic adjuvant compostions of monophosphoryl lipid A |
| ES2216280T3 (es) | 1997-04-08 | 2004-10-16 | MERCK & CO., INC. | Formulaciones estabilizadas de papilomavirus humano. |
| WO1998050071A1 (en) | 1997-05-01 | 1998-11-12 | Chiron Corporation | Use of virus-like particles as adjuvants |
| US20040265377A1 (en) | 1997-10-27 | 2004-12-30 | Harry Seager | Solid dispersing vaccine composition for oral delivery |
| SI1105466T1 (sl) | 1998-08-14 | 2006-08-31 | Merck & Co Inc | Postopek za ciscenje virusu podobnih delcev humanega papilomskega virusa |
| AU770809B2 (en) | 1998-12-17 | 2004-03-04 | Merck Sharp & Dohme Corp. | Synthetic virus-like particles with heterologous epitopes |
| SI1150712T1 (sl) | 1999-02-05 | 2009-02-28 | Merck & Co Inc | Pripravek cepiva proti humanem papiloma virusu |
| CA2375337C (en) * | 1999-06-22 | 2012-09-25 | Naokazu Takeda | Srsv detection kit |
| US20040063188A1 (en) | 2002-02-14 | 2004-04-01 | Novavax, Inc. | Kit for treating gastrointestinal tract |
| GB0206360D0 (en) | 2002-03-18 | 2002-05-01 | Glaxosmithkline Biolog Sa | Viral antigens |
| GB0206359D0 (en) | 2002-03-18 | 2002-05-01 | Glaxosmithkline Biolog Sa | Viral antigens |
| EP2591771A1 (en) | 2002-04-11 | 2013-05-15 | MedImmune, LLC | Preservation of bioactive materials by freeze dried foam |
| GB0302218D0 (en) | 2003-01-30 | 2003-03-05 | Chiron Sri | Vaccine formulation & Mucosal delivery |
| ATE521367T1 (de) | 2002-06-07 | 2011-09-15 | Kentucky Bioproc Llc | Flexlibler aufbau- und darreichungs-plattform von impfstoffen |
| EP1513552B1 (en) | 2002-06-20 | 2010-12-01 | Cytos Biotechnology AG | Packaged virus-like particles in combination with cpg for use as adjuvants with allergens : method of preparation and use |
| EP1594536B1 (en) | 2003-01-30 | 2009-03-25 | Novartis Vaccines and Diagnostics, Inc. | Adjuvanted influenza vaccine |
| WO2004073652A2 (en) | 2003-02-20 | 2004-09-02 | Becton Dickinson And Company | Powder formulations of recombinant staphylococcal enterotoxin b (rseb) made by atmospheric spray-freeze drying for improved vaccination |
| US8592197B2 (en) | 2003-07-11 | 2013-11-26 | Novavax, Inc. | Functional influenza virus-like particles (VLPs) |
| WO2005032457A2 (en) | 2003-07-21 | 2005-04-14 | Boyce Thompson Institute For Plant Research, Inc. | Vectors and methods for immunization against norwalk virus using transgenic plants |
| WO2005030806A2 (en) | 2003-09-24 | 2005-04-07 | Montana State University | Norovirus monoclonal antibodies and peptides |
| US7795242B2 (en) | 2003-10-15 | 2010-09-14 | The Brigham And Women's Hospital, Inc. | Methods and compositions for immunomodulation |
| US20050215501A1 (en) | 2003-10-24 | 2005-09-29 | Coley Pharmaceutical Group, Inc. | Methods and products for enhancing epitope spreading |
| FR2863890B1 (fr) | 2003-12-19 | 2006-03-24 | Aventis Pasteur | Composition immunostimulante |
| US7481997B1 (en) * | 2004-02-12 | 2009-01-27 | Montana State University | Snow mountain virus genome sequence, virus-like particles and methods of use |
| US20050260225A1 (en) | 2004-05-18 | 2005-11-24 | Goldberg Joanna B | Intranasal recombinant Salmonella vaccine encoding heterologous polysaccharide antigens |
| CU23496A1 (es) | 2004-09-03 | 2010-02-23 | Ct Ingenieria Genetica Biotech | Composición vacunal contra el virus de la hepatitis c |
| JP4993301B2 (ja) | 2004-10-20 | 2012-08-08 | サノフィ パスツール バイオロジクス リミテッド ライアビリティ カンパニー | 日本脳炎ウイルスおよび西ナイルウイルスに対するワクチン |
| GB0428394D0 (en) | 2004-12-24 | 2005-02-02 | Chiron Srl | Saccharide conjugate vaccines |
| CA2593176A1 (en) | 2005-01-05 | 2006-07-13 | Peter D. Katsikis | Delivery vehicles, bioactive substances and viral vaccines |
| WO2006086188A2 (en) | 2005-01-31 | 2006-08-17 | The Johns Hopkins University | Use of consensus sequence as vaccine antigen to enhance recognition of virulent viral variants |
| ES2385045T3 (es) | 2005-02-18 | 2012-07-17 | Novartis Vaccines And Diagnostics, Inc. | Inmunógenos de Escherichia coli uropatogénica |
| US7767212B2 (en) | 2005-03-18 | 2010-08-03 | Cytos Biotechnology Ag | CAT allergen conjugates and uses thereof |
| JP2009501001A (ja) | 2005-06-01 | 2009-01-15 | ダウ グローバル テクノロジーズ インコーポレイティド | 多価ウイルス様粒子の製造 |
| EP1736538A1 (en) | 2005-06-21 | 2006-12-27 | Cytos Biotechnology AG | Process for the preparative purification of virus-like-particles (VLPs) |
| EP2360175B1 (en) | 2005-11-22 | 2014-07-16 | Novartis Vaccines and Diagnostics, Inc. | Norovirus and Sapovirus virus-like particles (VLPs) |
| JP2007145775A (ja) | 2005-11-29 | 2007-06-14 | Falco Life Science:Kk | ノロウイルスgiの高感度検出方法 |
| AU2008302276B2 (en) * | 2006-09-29 | 2013-10-10 | Takeda Vaccines, Inc. | Method of conferring a protective immune response to norovirus |
| SG174845A1 (en) | 2006-09-29 | 2011-10-28 | Ligocyte Pharmaceuticals Inc | Norovirus vaccine formulations |
| JP2011506264A (ja) | 2006-12-06 | 2011-03-03 | ノバルティス アーゲー | インフルエンザウイルスの4つの株に由来する抗原を含むワクチン |
| US8474614B2 (en) * | 2007-03-14 | 2013-07-02 | BBY Solutions | Protective container for a flat screen monitor |
| KR20150098681A (ko) | 2007-03-14 | 2015-08-28 | 다케다 백신즈 인코포레이티드 | 바이러스 유사 입자 정제 |
| US20100266636A1 (en) | 2007-09-18 | 2010-10-21 | Ligocyte Pharmaceuticals, Inc. | Method of conferring a protective immune response to norovirus |
| DK2324113T3 (en) | 2008-08-08 | 2018-04-16 | Takeda Vaccines Inc | VIRUS-LIKE PARTICLES INCLUDING COMPOSITE CAPSID AMINO ACID SEQUENCES FOR INCREASED CRYSTAL REACTIVITY |
| EP2381959A1 (en) | 2009-01-22 | 2011-11-02 | Pharmathene Inc. | Stable vaccine compositions and methods of use |
| CN102438651A (zh) | 2009-02-10 | 2012-05-02 | 诺华有限公司 | 用于大流行相关毒株的流感疫苗方案 |
| US20110070260A1 (en) | 2009-09-09 | 2011-03-24 | Baric Ralph S | Multivalent Immunogenic Compositions Against Noroviruses and Methods of Use |
| CN102791286B (zh) | 2010-01-21 | 2017-08-08 | 莱戈赛特医药股份有限公司 | 杯状病毒病毒样颗粒上靶定异源抗原的呈递 |
| US20110293701A1 (en) | 2010-05-26 | 2011-12-01 | Selecta Biosciences, Inc. | Multivalent synthetic nanocarrier vaccines |
| WO2013009849A1 (en) | 2011-07-11 | 2013-01-17 | Ligocyte Pharmaceuticals, Inc. | Parenteral norovirus vaccine formulations |
| JOP20130186B1 (ar) | 2012-06-22 | 2021-08-17 | Takeda Vaccines Montana Inc | تنقية الجزيئات الشبيهة بالفيروسات |
-
2007
- 2007-09-28 SG SG2011071123A patent/SG174845A1/en unknown
- 2007-09-28 AU AU2007303608A patent/AU2007303608B2/en active Active
- 2007-09-28 EP EP13157572.2A patent/EP2601969B1/en active Active
- 2007-09-28 LT LTEP13157573.0T patent/LT2601970T/lt unknown
- 2007-09-28 SG SG10202012986SA patent/SG10202012986SA/en unknown
- 2007-09-28 DK DK13157573.0T patent/DK2601970T3/en active
- 2007-09-28 PT PT131575730T patent/PT2601970T/pt unknown
- 2007-09-28 JP JP2009530639A patent/JP5476544B2/ja active Active
- 2007-09-28 PL PL13157572.2T patent/PL2601969T3/pl unknown
- 2007-09-28 DK DK13157572.2T patent/DK2601969T3/en active
- 2007-09-28 ES ES07853688T patent/ES2420136T3/es active Active
- 2007-09-28 US US12/093,921 patent/US7955603B2/en active Active
- 2007-09-28 ES ES13157573.0T patent/ES2618885T3/es active Active
- 2007-09-28 HU HUE13157573A patent/HUE032422T2/en unknown
- 2007-09-28 ES ES13157572.2T patent/ES2577833T3/es active Active
- 2007-09-28 SG SG10201502490YA patent/SG10201502490YA/en unknown
- 2007-09-28 PL PL13157573T patent/PL2601970T3/pl unknown
- 2007-09-28 CA CA2664157A patent/CA2664157C/en active Active
- 2007-09-28 DK DK07853688.5T patent/DK2066354T3/da active
- 2007-09-28 SI SI200731885A patent/SI2601970T1/sl unknown
- 2007-09-28 KR KR1020097008725A patent/KR101515489B1/ko active IP Right Grant
- 2007-09-28 EP EP13173005.3A patent/EP2641613A1/en not_active Withdrawn
- 2007-09-28 HU HUE13157572A patent/HUE028978T2/en unknown
- 2007-09-28 WO PCT/US2007/079929 patent/WO2008042789A1/en active Application Filing
- 2007-09-28 EP EP13157573.0A patent/EP2601970B1/en not_active Revoked
- 2007-09-28 EP EP07853688.5A patent/EP2066354B1/en active Active
-
2010
- 2010-06-16 US US12/816,495 patent/US8431116B2/en active Active
-
2011
- 2011-12-20 US US13/330,854 patent/US20120093861A1/en not_active Abandoned
-
2013
- 2013-03-15 US US13/837,653 patent/US9308249B2/en active Active
- 2013-03-15 US US13/837,885 patent/US9272028B2/en active Active
- 2013-03-15 US US13/836,446 patent/US10010599B2/en active Active
- 2013-06-24 JP JP2013131559A patent/JP5898133B2/ja active Active
- 2013-10-14 HK HK13111536.3A patent/HK1184057A1/zh unknown
-
2015
- 2015-07-10 US US14/796,714 patent/US9861691B2/en active Active
- 2015-10-05 JP JP2015197633A patent/JP6134364B2/ja active Active
-
2017
- 2017-01-25 CY CY20171100109T patent/CY1118492T1/el unknown
-
2018
- 2018-05-31 US US15/994,887 patent/US10512682B2/en active Active
Cited By (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10010599B2 (en) | 2006-09-29 | 2018-07-03 | Takeda Vaccines, Inc. | Norovirus vaccine formulations |
| JP2016020378A (ja) * | 2006-09-29 | 2016-02-04 | タケダ ワクチン,インコーポレイテッド | ノロウイルスワクチン製剤 |
| US10512682B2 (en) | 2006-09-29 | 2019-12-24 | Takeda Vaccines, Inc. | Norovirus vaccine formulations |
| JP2013234188A (ja) * | 2006-09-29 | 2013-11-21 | Takeda Vaccines (Montana) Inc | ノロウイルスワクチン製剤 |
| US9861691B2 (en) | 2006-09-29 | 2018-01-09 | Takeda Vaccines, Inc. | Norovirus vaccine formulations |
| US9821049B2 (en) | 2007-09-18 | 2017-11-21 | Takeda Vaccines, Inc. | Method of conferring a protective immune response to Norovirus |
| US10130696B2 (en) | 2007-09-18 | 2018-11-20 | Takeda Vaccines, Inc. | Method of conferring a protective immune response to norovirus |
| US10688174B2 (en) | 2007-09-18 | 2020-06-23 | Takeda Vaccines, Inc. | Method of conferring a protective immune response to norovirus |
| US11040097B2 (en) | 2007-09-18 | 2021-06-22 | Takeda Vaccines, Inc. | Method of conferring a protective immune response to norovirus |
| US11826415B2 (en) | 2007-09-18 | 2023-11-28 | Takeda Vaccines, Inc. | Method of conferring a protective immune response to Norovirus |
| US9867876B2 (en) | 2011-07-11 | 2018-01-16 | Takeda Vaccines, Inc. | Parenteral norovirus vaccine formulations |
| US9801934B2 (en) | 2011-07-11 | 2017-10-31 | Takeda Vaccines, Inc. | Parenteral norovirus vaccine formulations |
| US10675341B2 (en) | 2011-07-11 | 2020-06-09 | Takeda Vaccines, Inc. | Parenteral norovirus vaccine formulations |
| US11701420B2 (en) | 2011-07-11 | 2023-07-18 | Takeda Vaccines, Inc. | Parenteral norovirus vaccine formulations |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6134364B2 (ja) | ノロウイルスワクチン製剤 | |
| JP6615063B2 (ja) | ノロウイルスに対して防御免疫応答を付与する方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100608 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120626 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120918 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120925 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20121016 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20121023 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20121126 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20121203 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121225 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130222 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130624 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20130624 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20130911 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131017 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131126 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20131219 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140114 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5476544 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |