JP5437148B2 - フローサイトメータおよびセルソータ - Google Patents
フローサイトメータおよびセルソータ Download PDFInfo
- Publication number
- JP5437148B2 JP5437148B2 JP2010099608A JP2010099608A JP5437148B2 JP 5437148 B2 JP5437148 B2 JP 5437148B2 JP 2010099608 A JP2010099608 A JP 2010099608A JP 2010099608 A JP2010099608 A JP 2010099608A JP 5437148 B2 JP5437148 B2 JP 5437148B2
- Authority
- JP
- Japan
- Prior art keywords
- block
- fluid flow
- flow
- forming block
- channel
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000012530 fluid Substances 0.000 claims description 84
- 239000002245 particle Substances 0.000 claims description 72
- 239000007788 liquid Substances 0.000 claims description 50
- 238000003384 imaging method Methods 0.000 claims description 7
- 238000004891 communication Methods 0.000 claims description 6
- 239000013307 optical fiber Substances 0.000 claims description 5
- 235000012489 doughnuts Nutrition 0.000 claims description 3
- 230000001678 irradiating effect Effects 0.000 claims description 3
- 230000005284 excitation Effects 0.000 claims description 2
- 210000004027 cell Anatomy 0.000 description 99
- 239000000523 sample Substances 0.000 description 47
- 239000000443 aerosol Substances 0.000 description 9
- 230000003287 optical effect Effects 0.000 description 9
- 239000012488 sample solution Substances 0.000 description 9
- 238000000926 separation method Methods 0.000 description 8
- 208000015181 infectious disease Diseases 0.000 description 6
- 241000700605 Viruses Species 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 208000035473 Communicable disease Diseases 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 238000004140 cleaning Methods 0.000 description 3
- 239000000835 fiber Substances 0.000 description 3
- 239000007850 fluorescent dye Substances 0.000 description 3
- 238000001215 fluorescent labelling Methods 0.000 description 3
- 238000000034 method Methods 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 238000006073 displacement reaction Methods 0.000 description 2
- 230000005684 electric field Effects 0.000 description 2
- 208000006454 hepatitis Diseases 0.000 description 2
- 231100000283 hepatitis Toxicity 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000012827 research and development Methods 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 239000004696 Poly ether ether ketone Substances 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- JUPQTSLXMOCDHR-UHFFFAOYSA-N benzene-1,4-diol;bis(4-fluorophenyl)methanone Chemical compound OC1=CC=C(O)C=C1.C1=CC(F)=CC=C1C(=O)C1=CC=C(F)C=C1 JUPQTSLXMOCDHR-UHFFFAOYSA-N 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- HGAZMNJKRQFZKS-UHFFFAOYSA-N chloroethene;ethenyl acetate Chemical compound ClC=C.CC(=O)OC=C HGAZMNJKRQFZKS-UHFFFAOYSA-N 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 239000012212 insulator Substances 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 239000007769 metal material Substances 0.000 description 1
- 231100000989 no adverse effect Toxicity 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 229920002530 polyetherether ketone Polymers 0.000 description 1
- 229920002379 silicone rubber Polymers 0.000 description 1
- 239000004945 silicone rubber Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Optical investigation techniques, e.g. flow cytometry
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Optical investigation techniques, e.g. flow cytometry
- G01N15/149—Optical investigation techniques, e.g. flow cytometry specially adapted for sorting particles, e.g. by their size or optical properties
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Optical investigation techniques, e.g. flow cytometry
- G01N15/1404—Handling flow, e.g. hydrodynamic focusing
- G01N2015/1406—Control of droplet point
Landscapes
- Chemical & Material Sciences (AREA)
- Dispersion Chemistry (AREA)
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Optical Measuring Cells (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Sampling And Sample Adjustment (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
Description
フローサイトメータは、概略、生体(血液など)から採取された数多くの細胞粒子を蛍光標識試薬などで染色し、これらの細胞粒子を含むサンプル液をシース液で取り囲むシースフローを形成し、フローセル内で一列に配列した個々の細胞粒子にレーザ光を照射して、細胞粒子から生じる散乱光(前方散乱光および側方散乱光)と蛍光標識試薬に依存するさまざまな多色蛍光を測定することにより、細胞を分析するものである。
またフローサイトメータは、個々の細胞粒子から収集された散乱光および蛍光を細胞粒子に固有の識別情報として収集・分析し、サンプルから採取された大量の細胞粒子について統計的に評価することにより、生体の細胞レベルで認知される病変などを診断することを可能にするものである。
さらにセルソータは、個々の細胞粒子からの散乱光と蛍光(固有の識別情報)に基づいて、フローセルから噴出される個々の細胞粒子を含む液滴に選択的に電荷を与え、この液滴が落下する経路上に直流電場を形成することにより、特定の細胞粒子を分取・分別することを可能にするものである。
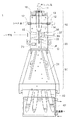
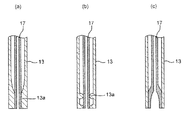
流体フロー形成ブロック10は、サンプル液インレット11およびシース液インレット12を有し、サンプル液インレット11に液密に固定されたステンレスなどの硬い金属材料からなるサンプル液導管13を収容する。流体フロー形成ブロック10は、サンプル液導管13を介してサンプル液をフローチャンバ14内に案内し、シース液インレット12からシース液をフローチャンバ14内に案内するものである。このときフローチャンバ14内に案内されたサンプル液は、シース液に包囲されるように流れ、流体フロー形成ブロック10のフローチャンネル15においては、その中心軸CF(図5)に沿って、サンプル液に含まれる蛍光標識された個々の細胞粒子Pが一列に配列される。
また、流体フロー形成ブロック10が光学的機構に対して図1の紙面の奥行き方向および上下方向の位置ずれが生じた場合、第1の集光レンズ35により補正されるので、同様に位置ずれに対する許容度を実質的に増大させることができる。
このように流体フロー形成ブロック10を光学的機構に対して着脱した際において、光軸調整の必要性を排除することができる。また、流体フロー形成ブロック10を光学的機構に対して着脱しない従来式のセルソータ1についても同様に適用することができる。
なお、光学的機構の詳細については、当業者に広く知られた任意のものを採用することができるので、ここではさらなる詳細な説明を省略する。
本願発明に係るストローブブロック20は、レール・ロック機構(図示せず)を用いて、図2に示すように上下方向に移動させることにより、流体フロー形成ブロック10に着脱自在に固定することができる。
ストローブブロック20は、固定的な撮像領域におけるジェットフローJFおよびこれより分離される液滴Dの画像をCCD等の撮像装置21を用いて撮像し、液滴間距離等を計測するものである。このとき撮像装置21は、振動器16の周波数に同期して断続的に(ストロボのように)点滅するLEDを光源としてジェットフローJFおよび液滴Dを撮像するため、静止したように見える画像を得ることができる。このとき制御装置(図示せず)は、撮像機構で得られた液滴間距離等を用いて、分別すべき所望の細胞粒子Pを含む液滴DがジェットフローJFから分離する直前のタイミングを算出し、そのタイミングで、光学的機構で検知されたその液滴Dに含まれる細胞粒子Pの識別情報に応じた極性を有する電圧をノズルプレート22に選択的に印加する。
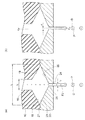
一方本願発明に係るノズルプレート22は、同様に図示したように、受容口23とノズル24との間に延びるノズルチャンネル25を有し、ノズルチャンネル25の少なくとも一部が、フロー方向に垂直な断面(水平断面)がノズル24に向かって縮小するように構成されている。すなわち本願発明に係るノズルプレート22のノズルチャンネル25は、チャンネル縮小部26を有する。
そして本願発明に係る流体フロー形成ブロック10の吐出口18およびノズルプレート22の受容口23のフロー方向に垂直な断面(水平断面)における開口距離(L、たとえば1mm)は実質的に同じとなるように構成されている。
ソートチャンバ30は、たとえば7000Vの高電圧を印加した一対の偏向板31を有し、ノズルプレート22を介して各細胞粒子Pの識別情報に応じた極性を有する電圧が選択的に印加された、その細胞粒子Pを含む液滴Dが一対の偏向板31の間を自由落下するとき、偏向板31間の電場により偏向するように構成されている。
本願発明によれば、ソートチャンバ30の偏向板31は、ソートチャンバ30から自在に着脱することができる。またソートチャンバ30自体も流体フロー形成ブロック10およびストローブブロック20に対し、たとえばねじ機構および位置決めピン(ともに図示せず)を用いて精度よく着脱自在に固定することができる。好適には、ソートチャンバ30は、偏向板31を取り外した後に取り外される。
またソートチャンバ30は、前扉(図示せず)を有する密閉式の筐体であってもよく、偏向板31とともに、EOG(エチレンオキサイドガス)による滅菌処理を行うことができる。択一的には、偏向板31のみをソートチャンバ30から取り外して流水等で洗浄した後、再びソートチャンバ30に取り付けるようにしてもよい。
複数のコレクションチューブ40を保持するコレクションチューブホルダ42は、ソートチャンバ30内に着脱可能に固定することができる。コレクションチューブ40は、細胞粒子Pの識別情報に基づいて、ソートチャンバ30の偏向板31により偏向された液滴Dを受容し、回収するものである。なお、コレクションチューブホルダ42は、図示しない保温器との間で循環する保温水を収容し、回収された液滴Dを一定温度に維持するように構成される。必要であれば、回収された液滴Dを所定の温度に冷却するようにしてもよい。
10:流体フロー形成ブロック、11:サンプル液インレット、12:シース液インレット、13:サンプル液導管、14:フローチャンバ、15:フローチャンネル、16:振動器、17:サンプルチューブ、18:吐出口、19:チャンネル拡大部、
20:ストローブブロック、21:撮像装置、22:ノズルプレート、23:受容口、24:ノズル、25:ノズルチャンネル、26:チャンネル縮小部、27:Oリング、28:ブロックホルダ、29:連通路、
30:ソートチャンバ、31:偏向板、35:第1の集光レンズ、36:第2の集光レンズ、37:光ファイバ(ファイバユニット)、
40:コレクションチューブ、42:コレクションチューブホルダ、
JF:ジェットフロー、D:液滴、CF:フローチャンネル中心軸、CJ:ジェットフロー中心軸。
Claims (13)
- 液体フローに含まれる細胞粒子を分析するシステムであって、
サンプル液導管を受容するフローチャンバ、およびフローチャンネルを含むフローセルを構成する流体フロー形成ブロックと、
流体フロー形成ブロックから噴出されるジェットフローおよび複数の液滴の所定領域における画像を撮像する撮像部を有するストローブブロックとを備え、
流体フロー形成ブロックおよびストローブブロックは、着脱自在に固定され、
ストローブブロックは、受容口とノズルとの間に延びるノズルチャンネルを含むノズルプレートを有し、
フローチャンネルは、受容口に対向する吐出口と、フロー方向に垂直な所定の断面が該吐出口に向かって拡大するチャンネル拡大部とを有し、
フローチャンネルの吐出口およびノズルプレートの受容口の前記所定断面における開口距離(L)が実質的に同じであり、
ノズルチャンネルは、フロー方向に垂直な所定の断面が受容口からノズルに向かって縮小するチャンネル縮小部を有することを特徴とするシステム。 - ノズルプレートが流体フロー形成ブロックに着脱可能に固定されるとき、流体フロー形成ブロックの吐出口がノズルプレートの受容口に対して所定の公差(d)内で位置合わせされ、
開口距離(L)は、前記公差(d)の10倍以上であることを特徴とする請求項1に記載のシステム。 - 開口距離(L)は約0.3mm以上であることを特徴とする請求項1に記載のシステム。
- サンプル液導管は、フローチャンネル中心軸に沿って配置され、その内部に延びる着脱可能に固定されるサンプルチューブを有することを特徴とする請求項1に記載のシステム。
- 流体フロー形成ブロックを着脱自在に保持し、ストローブブロックに着脱自在に固定されるブロックホルダを有し、
ブロックホルダはフローチャンネルの吐出口とストローブブロックの受容口との間に延びる連通路を有し、該連通路は所定断面における開口距離(L)が吐出口および受容口と実質的に同じであることを特徴とする請求項1に記載のシステム。 - フローチャンネルに流れる液体フローに含まれる細胞粒子に励起光を照射する光源を有し、
流体フロー形成ブロックは、フローチャンネルに対向するように配置された半球面状または半非球面状の第1の集光レンズを有し、第1の集光レンズは細胞粒子からの蛍光を平行光に変換することを特徴とする請求項1に記載のシステム。 - 流体フロー形成ブロックは、第1の集光レンズにより平行光に変換された蛍光を光ファイバに集光する第2の集光レンズを有し、
第2の集光レンズは、第1の集光レンズより大きい直径を有することを特徴とする請求項6に記載のシステム。 - 流体フロー形成ブロックに着脱自在に固定され、流体フロー形成ブロックに所定の周波数の振動を与える振動器を有することを特徴とする請求項1に記載のシステム。
- 振動器は、ドーナツ形状を有することを特徴とする請求項8に記載のシステム。
- 直流電圧が印加される一対の偏向板を含むソートチャンバをさらに備え、
ソートチャンバは、流体フロー形成ブロックおよびストローブブロックに対して着脱自在に固定されることを特徴とする請求項1に記載のシステム。 - 一対の偏向板は、ソートチャンバに対して着脱自在に固定されることを特徴とする請求項10に記載のシステム。
- ソートチャンバは、偏向板をソートチャンバから取り外した後にストローブブロックに対して取り外されることを特徴とする請求項10に記載のシステム。
- ストローブブロックは、ソートチャンバに取り付けられたときに、これらの間の隙間を埋めるために配置された袴状カバーを有することを特徴とする請求項10に記載のシステム。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010099608A JP5437148B2 (ja) | 2010-04-23 | 2010-04-23 | フローサイトメータおよびセルソータ |
| US13/064,837 US9034259B2 (en) | 2010-04-23 | 2011-04-20 | Flow cytometer and flow cytometry |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010099608A JP5437148B2 (ja) | 2010-04-23 | 2010-04-23 | フローサイトメータおよびセルソータ |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011232033A JP2011232033A (ja) | 2011-11-17 |
| JP2011232033A5 JP2011232033A5 (ja) | 2012-11-29 |
| JP5437148B2 true JP5437148B2 (ja) | 2014-03-12 |
Family
ID=44814866
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010099608A Expired - Fee Related JP5437148B2 (ja) | 2010-04-23 | 2010-04-23 | フローサイトメータおよびセルソータ |
Country Status (2)
| Country | Link |
|---|---|
| US (1) | US9034259B2 (ja) |
| JP (1) | JP5437148B2 (ja) |
Families Citing this family (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013145905A1 (ja) * | 2012-03-30 | 2013-10-03 | ソニー株式会社 | 微小粒子分取装置及び該装置における流体ストリーム最適化方法 |
| JP5994337B2 (ja) | 2012-03-30 | 2016-09-21 | ソニー株式会社 | 微小粒子分取装置及びディレイタイム決定方法 |
| CN104204766B (zh) | 2012-03-30 | 2016-08-31 | 索尼公司 | 微芯片型光学测量装置及其光学位置调整方法 |
| JP5924077B2 (ja) | 2012-03-30 | 2016-05-25 | ソニー株式会社 | 微小粒子分取装置及び微小粒子分取装置における軌道方向判定方法 |
| US9162229B2 (en) * | 2012-06-07 | 2015-10-20 | Bio-Rad Laboratories, Inc. | Multi-directional sorting with reduced contamination in a flow cytometer |
| WO2014047206A1 (en) * | 2012-09-18 | 2014-03-27 | Cytonome/St, Llc | Flow cell for particle sorting |
| US11668640B2 (en) | 2015-03-06 | 2023-06-06 | Inguran, Llc | Nozzle assembly for a flow cytometry system and methods of manufacture |
| WO2014047358A1 (en) | 2012-09-19 | 2014-03-27 | Inguran, Llc | Flow cytometer nozzle tip |
| HK1212446A1 (en) * | 2012-09-19 | 2016-06-10 | Inguran, Llc | Nozzle assembly for a flow cytometer system and methods of manufacture |
| WO2014115409A1 (ja) | 2013-01-28 | 2014-07-31 | ソニー株式会社 | 微小粒子分取装置、微小粒子分取方法及びプログラム |
| JP2016521362A (ja) * | 2013-04-12 | 2016-07-21 | ベクトン・ディキンソン・アンド・カンパニーBecton, Dickinson And Company | 細胞分取のための自動セットアップ |
| WO2015056516A1 (ja) | 2013-10-16 | 2015-04-23 | ソニー株式会社 | 粒子分取装置、粒子分取方法及びプログラム |
| EP3106857B1 (en) | 2014-02-13 | 2020-04-22 | Sony Corporation | Particle sorting apparatus, particle sorting method, program, and particle sorting system |
| JP2015222202A (ja) * | 2014-05-22 | 2015-12-10 | ソニー株式会社 | 粒子分析装置 |
| FR3022998B1 (fr) * | 2014-06-30 | 2016-07-15 | Alain Rousseau Techniques & Innovations Arteion | Systeme et ensemble de cytometrie en flux, dispositif d’analyse comprenant un tel ensemble de cytometrie et ensemble comprenant un tel systeme de cytometrie |
| JP6657625B2 (ja) | 2014-09-05 | 2020-03-04 | ソニー株式会社 | 液滴分取装置、液滴分取方法及びプログラム |
| WO2016182034A1 (ja) * | 2015-05-12 | 2016-11-17 | 株式会社オンチップ・バイオテクノロジーズ | 単一粒子解析方法およびその解析のためのシステム |
| CN106335710B (zh) * | 2015-07-08 | 2019-09-03 | 深圳迈瑞生物医疗电子股份有限公司 | 样本分析仪及其试剂低温存储装置 |
| JP6729597B2 (ja) | 2015-10-19 | 2020-07-22 | ソニー株式会社 | 画像処理装置、微小粒子分取装置及び画像処理方法 |
| CN109564151B (zh) | 2016-03-17 | 2023-01-24 | 贝克顿·迪金森公司 | 使用高通量荧光流式细胞仪进行细胞分选 |
| US11609177B2 (en) * | 2016-04-15 | 2023-03-21 | Becton, Dickinson And Company | Enclosed droplet sorter and methods of using the same |
| JP6707257B2 (ja) | 2016-05-06 | 2020-06-10 | アライドフロー株式会社 | 処理装置 |
| JP6975480B2 (ja) * | 2016-05-06 | 2021-12-01 | アライドフロー株式会社 | 処理装置及び処理装置の滅菌処理方法 |
| JP6805560B2 (ja) | 2016-06-10 | 2020-12-23 | ソニー株式会社 | 接続部材及び微小粒子測定装置 |
| JP6783153B2 (ja) * | 2017-01-13 | 2020-11-11 | アークレイ株式会社 | フローセル及び測定装置 |
| US10466158B2 (en) * | 2017-04-11 | 2019-11-05 | Sony Corporation | Microparticle sorting apparatus and delay time determination method |
| US10914671B2 (en) * | 2018-04-27 | 2021-02-09 | Becton, Dickinson And Company | Flow cytometers having enclosed droplet sorters with controlled aerosol content and methods of using the same |
| WO2020039540A1 (ja) * | 2018-08-23 | 2020-02-27 | アライドフロー株式会社 | フローセル、フローチャンバ、粒子分別装置及び粒子分別装置用カートリッジ |
| CN112805548B (zh) * | 2018-10-30 | 2025-03-11 | 贝克顿·迪金森公司 | 具有对准窗口的颗粒分选模块、系统及其使用方法 |
| WO2020197787A1 (en) | 2019-03-22 | 2020-10-01 | Becton, Dickinson And Company | Spectral unmixing of fluorescence imaging using radiofrequency-multiplexed excitation data |
| CN112730408B (zh) * | 2020-12-24 | 2024-07-09 | 贝克曼库尔特生物科技(苏州)有限公司 | 液流检测系统和液流检测方法以及分选装置 |
| CN214895849U (zh) | 2021-01-28 | 2021-11-26 | 贝克曼库尔特生物科技(苏州)有限公司 | 气泡检测装置和样本处理仪 |
| US11858008B2 (en) * | 2021-03-26 | 2024-01-02 | Cytonome/St, Llc | Systems and methods for particle sorting with automated adjustment of operational parameters |
| CN113376080A (zh) * | 2021-06-11 | 2021-09-10 | 宋卓 | 液流装置及包含该装置的分析分选设备 |
| CN118475821A (zh) * | 2021-09-14 | 2024-08-09 | 贝克顿·迪金森公司 | 自动化细胞分选台及其使用方法 |
| WO2025057738A1 (ja) * | 2023-09-11 | 2025-03-20 | ソニーグループ株式会社 | 粒子分取システム、オリフィス部品及びプレート |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3499003B2 (ja) * | 1994-07-05 | 2004-02-23 | シスメックス株式会社 | 粒度分布測定装置 |
| US5641457A (en) * | 1995-04-25 | 1997-06-24 | Systemix | Sterile flow cytometer and sorter with mechanical isolation between flow chamber and sterile enclosure |
| US6880414B2 (en) | 2002-08-08 | 2005-04-19 | Becton Dickinson And Company | Sort block and liquid collection device for sorting flow cytometer |
| US7201875B2 (en) * | 2002-09-27 | 2007-04-10 | Becton Dickinson And Company | Fixed mounted sorting cuvette with user replaceable nozzle |
| JP3891925B2 (ja) | 2002-12-03 | 2007-03-14 | ベイバイオサイエンス株式会社 | 生物学的粒子の情報を得る装置 |
| ES2930062T3 (es) * | 2003-03-28 | 2022-12-05 | Inguran Llc | Aparato para detectar el punto de rotura de un sistema de generación de gotitas |
| JP4304120B2 (ja) * | 2004-04-30 | 2009-07-29 | ベイバイオサイエンス株式会社 | 生物学的粒子をソーティングする装置及び方法 |
| JP4756948B2 (ja) | 2005-08-08 | 2011-08-24 | ベイバイオサイエンス株式会社 | フローサイトメータおよびフローサイトメトリ方法 |
| JP4990746B2 (ja) * | 2007-12-14 | 2012-08-01 | ベイバイオサイエンス株式会社 | 液体フローに含まれる生物学的粒子を分別する装置ならびにその方法 |
| AU2010326180B2 (en) * | 2009-12-04 | 2015-06-18 | Life Technologies Corporation | Apparatuses, systems, methods, and computer readable media for acoustic flow cytometry |
-
2010
- 2010-04-23 JP JP2010099608A patent/JP5437148B2/ja not_active Expired - Fee Related
-
2011
- 2011-04-20 US US13/064,837 patent/US9034259B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2011232033A (ja) | 2011-11-17 |
| US9034259B2 (en) | 2015-05-19 |
| US20110259749A1 (en) | 2011-10-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5437148B2 (ja) | フローサイトメータおよびセルソータ | |
| JP7354368B2 (ja) | マイクロ流体チャネルを使用してマイクロ粒子のバルク選別を行う方法及び装置 | |
| JP2011232033A5 (ja) | ||
| KR101683066B1 (ko) | 미소 입자 분취를 위한 장치 및 마이크로칩 | |
| US9109197B2 (en) | Device for concentrating and separating cells | |
| JP2022050698A (ja) | 微粒子分注装置、微粒子解析装置、及び反応検出装置、並びにそれらを用いる方法 | |
| US7880108B2 (en) | Deflection plate | |
| JP2023104940A (ja) | 単一粒子解析方法およびその解析のためのシステム | |
| US11192113B2 (en) | Treatment apparatus and sterilization treatment method for treatment apparatus | |
| CN105980059A (zh) | 颗粒分选装置、颗粒分选方法和存储程序的非临时性计算机可读存储介质 | |
| JPH0640061B2 (ja) | フローサイトメータ用の捕獲管分類装置及びその方法 | |
| JP6207815B2 (ja) | フィルタリング部材及びフィルタリング方法 | |
| JPWO2011077765A1 (ja) | 検体識別分取装置および検体識別分取方法 | |
| US11738339B2 (en) | Microfluidic devices and method for sampling and analysis of cells using optical forces and Raman spectroscopy | |
| ES2980804T3 (es) | Sistema fluídico de inmovilización y recogida de partículas en línea y método para usar el mismo | |
| Van Den Engh | High‐speed cell sorting | |
| US11169072B1 (en) | Flow cell, flow chamber, particle sorting apparatus, and particle sorting apparatus cartridge | |
| JP6490755B2 (ja) | フィルタリング部材 | |
| US20220323959A1 (en) | Cartridge and particle sorting apparatus | |
| JP6975480B2 (ja) | 処理装置及び処理装置の滅菌処理方法 | |
| JP7528950B2 (ja) | マイクロチップ、サンプル分取キット及び微小粒子分取装置 | |
| WO2023058401A1 (ja) | 生体試料分析装置及び異常判定方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121015 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20121015 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20130827 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130910 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130918 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20131112 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20131211 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5437148 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |