JP5200288B2 - 胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 - Google Patents
胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 Download PDFInfo
- Publication number
- JP5200288B2 JP5200288B2 JP2006549435A JP2006549435A JP5200288B2 JP 5200288 B2 JP5200288 B2 JP 5200288B2 JP 2006549435 A JP2006549435 A JP 2006549435A JP 2006549435 A JP2006549435 A JP 2006549435A JP 5200288 B2 JP5200288 B2 JP 5200288B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- compound
- amino
- aza
- bicyclo
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 0 C*N(C(CCN(CCCCCC(*)=O)C1)C1OC)C(C1=CC=C*(*)C=C1)=O Chemical compound C*N(C(CCN(CCCCCC(*)=O)C1)C1OC)C(C1=CC=C*(*)C=C1)=O 0.000 description 5
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D453/00—Heterocyclic compounds containing quinuclidine or iso-quinuclidine ring systems, e.g. quinine alkaloids
- C07D453/02—Heterocyclic compounds containing quinuclidine or iso-quinuclidine ring systems, e.g. quinine alkaloids containing not further condensed quinuclidine ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4468—Non condensed piperidines, e.g. piperocaine having a nitrogen directly attached in position 4, e.g. clebopride, fentanyl
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4738—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4745—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems condensed with ring systems having nitrogen as a ring hetero atom, e.g. phenantrolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/14—Prodigestives, e.g. acids, enzymes, appetite stimulants, antidyspeptics, tonics, antiflatulents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/92—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with a hetero atom directly attached to the ring nitrogen atom
- C07D211/94—Oxygen atom, e.g. piperidine N-oxide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D451/00—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof
- C07D451/02—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof
- C07D451/04—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof with hetero atoms directly attached in position 3 of the 8-azabicyclo [3.2.1] octane or in position 7 of the 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring system
- C07D451/06—Oxygen atoms
- C07D451/10—Oxygen atoms acylated by aliphatic or araliphatic carboxylic acids, e.g. atropine, scopolamine
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Otolaryngology (AREA)
- Hospice & Palliative Care (AREA)
- Nutrition Science (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Hydrogenated Pyridines (AREA)
- Plural Heterocyclic Compounds (AREA)
- Fats And Perfumes (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
シサプリド(cisapride)はベンザミド誘導体として知られている化合物の1つで、その親化合物はメトクロプラミド(metoclopramide)である。米国特許番号4,962,115および5,057,525(Van Daele[バン・ディール]と総称し、全体をそのまま参照としてここに組み入れた)は、N−(3−ヒドロキシ−4−ピペリジニル)ベンザミドであるシサプリドを開示した。Van Daeleは、これらの化合物のほか製薬学的に容認できるそれらの酸付加塩およびそれらの立体異性体が胃腸管系の運動を刺激することを開示している。
発明の化合物は化学式(X):
の化合物および製薬学的に容認できるその塩からなり、ここで
位置3および位置4の結合は互いにシス(cis)の相対関係にあり、
Lは、−(C1−C6アルキル)−(1つの局面では−(C3−C5アルキル)−)、−(C1−C6アルキル)−C(O)−、または−C(O)−(C1−C6アルキル)−であり、ここでアルキル基のそれぞれは独立してハロゲン、C1−C4アルコキシ、またはOHの1基または2基で置換されていてもよく、ここでLのアルキル部分の炭素1個がN(R9)−で置換されていてもよく;
R1はハロゲン;
R2は、アミノ、NH(C1−C4アルキル)またはN(C1−C4アルキル)(C1−C4アルキル);
R3は、OHまたはC1−C4アルコキシ;
R4は、Hまたはメチル;そして
R5は、−O−C3−C8シクロアルキル、−O−ヘテロシクロアルキル、ヘテロシクロアルキル、アリール、−O−アリール、−N(R9)−(C0−C6アルキル)−C(O)−アリール、または−N(R9)−C0−C6アルキル−アリール、−O−ヘテロアリール、−N(R9)−C1−C6(O)−ヘテロアリール、または−N(R9)−C0−C6アルキル−ヘテロアリールであり、ここで環状構造のそれぞれは置換基がないか、または置換されてもよい位置の1個または複数がC1−C6アルキル、C1−C6アルコキシ、ハロゲン、C1−C6ハロアルキル、C1−C6ハロアルコキシ、ヒドロキシル、ヒドロキシ−C1−C4−アルキル、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−(C0−C6アルキル)−C(O)R11、または−O−(C0−C6アルキル)−C(O)R11、メチルスルホン、C0−C6−スルホンアミド、またはNO2で置換されており;ここで
R9は、存在するごとに独立してHまたはC1−C4アルキルであり;
R11はC1−C6アルキル、OH、または
R11はC1−C6アルコキシであり、独立してC1−C4アルコキシ、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−(C0−C6アルキル)−C(O)N(R9)−ヘテロシクロアルキル、−O−ヘテロシクロアルキル、−C1−C6(O)N(R9)−ヘテロアリール、またはヘテロアリールの1基または2基で置換されていてもよく、ここで
ヘテロアリール基は、独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよく;または
R11は−O−ヘテロシクロアルキルで、ここでヘテロシクロアルキルは独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよく;そして
R20はC1−C6アルコキシ(好ましくはC1−C4アルコキシ、さらに好ましくはメトキシ)、またはOHである。
R5は−O−C3−C8シクロアルキル、−O−ヘテロシクロアルキル、ヘテロシクロアルキルであり、ここでヘテロシクロアルキル基はピペリジニル、ピペラジニル、ピロリジニル、アザ−ビシクロ−オクチル、ある実施形態ではアザ−ビシクロ[2.2.2]オクチル、アザ−ビシクロ[3.2.1]オクチル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシル、インドリニル、モルフォリニル、チオモルフォリニル、S,S−ジオキソチオモルフォリニル、およびイミダゾリジニル、−O−アリール、−N(R9)−C(O)−アリール、または−N(R9)−C0−C6アルキル−アリールから選択され、ここで環基のそれぞれは置換基がないか、または置換されてもよい位置の1個または複数がC1−C6アルキル、C1−C6アルコキシ、ハロゲン、C1−C6ハロアルキル、C1−C6ハロアルコキシ、ヒドロキシル、ヒドロキシ−C1−C4−アルキル、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−C(O)R11、またはNO2で置換されており;ここで
R9は存在するごとに独立してHまたはC1−C4アルキルであり;そして
R11はC1−C6アルキル、OH、または
R11はC1−C6アルコキシであり、独立してC1−C4アルコキシ、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−C(O)N(R9)−ヘテロシクロアルキル、ヘテロシクロアルキル、またはヘテロアリールの1基または2基で置換されていてもよく、ここで
ヘテロシクロアルキル基はピロリジニル、ピペリジニル、ピペラジニル、モルフォリニル、アザ−ビシクロ−オクチル、ある実施形態ではアザ−ビシクロ[2.2.2]オクチル、アザ−ビシクロ[3.2.1]オクチル、アザ−ビシクロ−ノニル、およびアザ−ビシクロ−デシルから選択され、ここでヘテロシクロアルキル基は独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよく、
ヘテロアリール基はピリジル、ピリミジル、キノリニル、イソキノリニル、およびインドリルから選択され、ここでヘテロアリール基は独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよく;または
R11は−O−ヘテロシクロアルキルであり、ここでヘテロシクロアルキル基はピペリジニル、ピロリジニル、イミダゾリジニル、モルフォリニル、アザ−ビシクロ−オクチル、ある実施形態ではアザ−ビシクロ[2.2.2]オクチル、アザ−ビシクロ[3.2.1]オクチル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシル、およびテトラヒドロフラニルから選択され、そしてここで各ヘテロシクロアルキル基は独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよい。
さらに別の局面で、本発明は化学式(X)の化合物を提供し、ここでR2はアミノである。
さらに別の局面で、本発明は化学式(X)の化合物を提供し、ここでR3はメトキシである。
さらに別の局面で、本発明は化学式(X)の化合物を提供し、ここでR1はクロロ、R2はアミノ、R3はメトキシ、およびR4はHまたはメチルである。
さらに別の局面で、本発明は化学式(X)の化合物を提供し、ここでR1はクロロ、R2はアミノ、R3はメトキシ、R4はH、およびLは−(C4−C6アルキル)−C(O)−である。
さらに別の局面で、本発明は化学式(XI)の化合物を提供し、ここでR1はクロロ、R2はアミノ、R3はメトキシ、およびR4はHまたはメチルである。
さらに別の局面で、本発明は化学式(XI)の化合物を提供し、ここでR5は−O−ヘテロシクロアルキルであり、ここでヘテロシクロアルキル基はアザ−ビシクロ−オクチル、ある実施形態では1−アザ−ビシクロ[2.2.2]オクト−3−イルまたは8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルから選択され、ここでアザの窒素はメチルまたはエチルで置換されていてもよく、R4はHまたはメチルである。
またさらに別の局面で、本発明は化学式(XI)の化合物を提供し、ここでR5は−O−ヘテロシクロアルキルであり、ここでヘテロシクロアルキル基はピペリジニル、ピペラジニル、またはピロリジニルから選択され、そのそれぞれは置換基がないか、または1個または2個の位置が独立してC1−C4アルキル、C1−C4アルコキシ、ハロゲン、C1−C4ハロアルキル(1つの局面ではCF3)、C1−C4ハロアルコキシ(1つの局面ではOCF3)、ヒドロキシル、ヒドロキシ−C1−C4−アルキル、アミノ、−NH(C1−C4アルキル)、−N(C1−C4アルキル)(C1−C4アルキル)、−(C0−C6アルキル)−C(O)R11、またはNO2で置換されており、R4はHまたはメチルである。
さらに別の局面で、本発明は化学式(XI)の化合物を提供し、ここでR5は−O−ヘテロシクロアルキルであり、ここでヘテロシクロアルキル基はインドリニル、モルフォリニル、チオモルフォリニル、S,S−ジオキソチオモルフォリニル、およびイミダゾリジニルから選択され、そのそれぞれは置換基がないか、または1個または2個の位置が独立してC1−C4アルキル、C1−C4アルコキシ、ハロゲン、C1−C4ハロアルキル(1つの局面ではCF3)、C1−C4ハロアルコキシ(1つの局面ではOCF3)、ヒドロキシル、ヒドロキシ−C1−C4−アルキル、アミノ、−NH(C1−C4アルキル)、−N(C1−C4アルキル)(C1−C4アルキル)、−(C0−C6アルキル)−C(O)R11、またはNO2で置換されており、R4はHまたはメチルである。
さらに別の局面で、本発明は化学式(XI)の化合物を提供し、ここでR5は−O−フェニル、N(R9)−(C0−C6アルキル)−C(O)−フェニル、または−N(R9)−C0−C4アルキル−フェニルであり、ここでフェニル基は独立してC1−C4アルキル、C1−C4アルコキシ、ハロゲン、C1−C4ハロアルキル(1つの局面ではCF3)、C1−C4ハロアルコキシ(1つの局面ではOCF3)、ヒドロキシル、ヒドロキシ−C1−C4−アルキル、アミノ、−NH(C1−C4アルキル)、−N(C1−C4アルキル)(C1−C4アルキル)、−(C1−C6アルキル)−C(O)R11、またはNO2で置換されており、R4およびR9は独立してHまたはメチルである
さらに別の局面で、本発明は化学式(XI)の化合物を提供し、ここでR11はC1−C6アルコキシであり、独立してC1−C4アルコキシ、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−(C0−C6アルキル)−C(O)N(R9)−ヘテロシクロアルキル、またはヘテロシクロアルキルの1基または2基で置換されていてもよく、ここでヘテロシクロアルキル基はピロリジニル、ピペリジニル、ピペラジニル、およびモルフォリニルから選択され、ここで、ヘテロシクロアルキル基は独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよい。
ここで、R15はH、C1−C6アルキル、C1−C6アルコキシ、ハロゲン、C1−C6ハロアルキル(1つの局面ではCF3)、C1−C6ハロアルコキシ(1つの局面ではOCF3)、ヒドロキシル、ヒドロキシC1−C4アルキル、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、メチルスルホン、C0−C6−スルホンアミド、またはNO2、およびR16はHまたは−O−(C0−C6アルキル)−C(O)R11である。別の局面で、R15はHである。
さらに別の局面で、本発明は化学式(XII)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はOHである。
またさらに別の局面で、本発明は化学式(XII)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はC1−C6アルコキシであり、独立してC1−C4アルコキシ、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−(C0−C6アルキル)−C(O)N(R9)−ヘテロシクロアルキル、またはヘテロシクロアルキルの1基または2基で置換されていてもよく、ここでヘテロシクロアルキル基はアザ−ビシクロ−オクチル、ある実施形態では1−アザ−ビシクロ[2.2.2]オクト−3−イルまたは8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルから選択され、ここでアザの窒素はメチルまたはエチル、ピロリジニル、ピペリジニル、ピペラジニル、およびモルフォリニルで置換されていてもよく、ここでヘテロシクロアルキル基は独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよく、R4およびR9は独立してHまたはメチルである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R15はH、R1はクロロ、R2はアミノ、およびR3はメトキシである。
またさらに別の局面で、本発明は化学式(XII)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、R11はC1−C6アルコキシであり、独立してC1−C4アルコキシ、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、またはヘテロアリールの1基または2基で置換されていてもよく、ここでヘテロアリール基はピリジル、ピリミジル、キノリニル、イソキノリニル、およびインドリルから選択され、ここでヘテロアリール基は、独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよく、R4およびR9は独立してHまたはメチルである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R15はH、R1はクロロ、R2はアミノ、およびR3はメトキシである。
ここで、R15はH、C1−C6アルキル、C1−C6アルコキシ、ハロゲン、C1−C6ハロアルキル(1つの局面ではCF3)、C1−C6ハロアルコキシ(1つの局面ではOCF3)、ヒドロキシル、ヒドロキシC1−C4アルキル、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、またはメチルスルホン、C0−C6−スルホンアミド、NO2、およびR16はHまたは−O−(C0−C6アルキル)−C(O)R11である。別の局面ではR15はHである。
さらに別の局面で、本発明は化学式(XIII)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はOH、C1−C4アルコキシ(別の局面ではC1−C3アルコキシ)、またはC1−C2アルコキシ−C1−C3アルコキシ−である。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
またさらに別の局面で、本発明は化学式(XIII)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はアミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、アザ−ビシクロ−オクチル、ある実施形態では1−アザ−ビシクロ[2.2.2]オクト−3−イルまたは8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルで置換されたC1−C4アルコキシであり、ここでアザの窒素はメチルまたはエチルで置換されていてもよく、R4はHまたはメチル、ピロリジニル、ピペリジニル、モルフォリニル、ピリジル、または−(C0−C6アルキル)−C(O)NH−ピリド−4−イルである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらに別の局面で、本発明は化学式(XIII)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はアミノ、−NH(C1−C6アルキル)、または−N(C1−C6アルキル)(C1−C6アルキル)で置換されたC1−C4アルコキシである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらに別の局面で、本発明は化学式(XIII)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はピロリジニル、ピペリジニル、モルフォリニル、ピリジル、または−(C0−C6アルキル)−C(O)NH−ピリド−4−イルで置換されたC1−C4アルコキシである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらに別の局面で、本発明は化学式(XIII)の化合物を提供し、ここでR4およびR9の少なくとも1つはHである。
ここで、R15はH、C1−C6アルキル、C1−C6アルコキシ、ハロゲン、C1−C6ハロアルキル(1つの局面ではCF3)、C1−C6ハロアルコキシ(1つの局面ではOCF3)、ヒドロキシル、ヒドロキシC1−C4アルキル、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、メチルスルホン、C0−C6−スルホンアミド、またはNO2、およびR16はHまたは−O−(C0−C6アルキル)−C(O)R11である。別の局面ではR15はHである。
さらに別の局面で、本発明は化学式(XIV)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はOH、C1−C4アルコキシ(別の局面ではC1−C3アルコキシ)、またはC1−C2アルコキシ−C1−C3アルコキシ−である。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。さらに別の局面で、R4およびR9の少なくとも1つはHである。
またさらに別の局面で、本発明は化学式(XIV)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はアミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、アザ−ビシクロ−オクチル、ある実施形態では1−アザ−ビシクロ[2.2.2]オクト−3−イルまたは8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルで置換されたC1−C4アルコキシであり、ここでアザの窒素はメチルまたはエチルで置換されていてもよく、R4はHまたはメチル、ピロリジニル、ピペリジニル、モルフォリニル、ピリジル、または−(C0−C6アルキル)−C(O)NH−ピリド−4−イルである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらに別の局面で、本発明は化学式(XIV)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はアミノ、−NH(C1−C6アルキル)、または−N(C1−C6アルキル)(C1−C6アルキル)で置換されたC1−C4アルコキシである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらなる局面で、本発明は化学式(XIV)の化合物を提供する。ここでR4およびR9は独立してHまたはメチル、およびR11はピロリジニル、ピペリジニル、モルフォリニル、ピリジル、または−(C0−C6アルキル)−C(O)NH−ピリド−4−イルで置換されたC1−C4アルコキシである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
R4およびR9は独立してHまたはメチル、およびR11はピロリジニル、ピペリジニル、モルフォリニル、ピリジル、または−(C0−C6アルキル)−C(O)NH−ピリド−4−イルで置換されたC1−C4アルコキシである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらに別の局面で、本発明は化学式(XIV)の化合物を提供し、ここでR4およびR9の少なくとも1つはHである。
ここでnは1または2である。
さらに別の局面で、本発明は化学式(XV)の化合物を提供し、ここでR4はHまたはメチル、およびR11はOH、C1−C4アルコキシ(別の局面ではC1−C3アルコキシ)、またはC1−C2アルコキシ−C1−C3アルコキシ−である。別の局面で、R4およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。さらに別の局面で、R4およびR9の少なくとも1つはHである。
またさらに別の局面で、本発明は化学式(XV)の化合物を提供し、ここでR4およびR9は独立してHまたはメチル、およびR11はアミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、アザ−ビシクロ−オクチル、ある実施形態では1−アザ−ビシクロ[2.2.2]オクト−3−イルまたは8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルで置換されたC1−C4アルコキシであり、ここでアザの窒素はメチルまたはエチルで置換されていてもよく、R4はHまたはメチル、ピロリジニル、ピペリジニル、モルフォリニル、ピリジル、または−C(O)NH−ピリド−4−イルである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらなる別の局面で、本発明は化学式(XV)の化合物を提供する。ここでR4およびR9は独立してHまたはメチル、およびR11はアミノ、−NH(C1−C6アルキル)、またはN(C1−C6アルキル)(C1−C6アルキル)で置換されたC1−C4アルコキシである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらに別の局面で、本発明は化学式(XV)の化合物を提供し、ここでR4はHまたはメチル、およびR11はアザ−ビシクロ−オクチル、ある実施形態では1−アザ−ビシクロ[2.2.2]オクト−3−イルまたは8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルで置換されたC1−C4アルコキシであり、ここでアザの窒素はメチルまたはエチルで置換されていてもよく、R4はHまたはメチル、ピロリジニル、ピペリジニル、モルフォリニル、ピリジル、または−(C0−C6アルキル)−C(O)NH−ピリド−4−イルである。別の局面で、R4、R9、およびR11は以前に定義されたとおりであり、R1はクロロ、R2はアミノ、およびR3はメトキシである。
さらに別の局面で、本発明は化学式(X)、(XI)、(XII)、(XIII)、(XIV)または(XV)の何れか1つに準拠した化合物を提供し、ここでR1、R2、およびR3は以下のようにフェニル環に付いている。
そして結合の手3は“S”構造を持ち、結合の手4は“R”構造を持つ。
そして結合の手3は“R”構造を持ち、結合の手4は“S”構造を持つ。
さらに別の局面で、本発明は化学式(X)の化合物を提供し、ここでR1はクロロ、R2はアミノ、R3はメトキシ、R4はH、およびR1、R2、およびR3は以下のようにフェニル環に付いている。
Lは−(C3−C5アルキル)−で、ここで炭素1個が−N(R9)−、または−(C2−C6アルキル)−C(O)−で置き換えられる。さらに別の局面で、R1、R2、およびR3は前出のように定義されフェニル環に付いており、R4は前出のように定義され、およびR5は−O−ヘテロシクロアルキルで、ここでヘテロシクロアルキル基はアザ−ビシクロ−オクチル、ある実施形態ではアザ−ビシクロ[2.2.2]オクト−3−イル、または8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルから選択され、ここでアザの窒素はメチルまたはエチル、ピペリジニル、ピペラジニル、またはピロリジニルで置換されていてもよく、ここでピペリジニル、ピペラジニル、およびピロリジニル基は置換基がないか、または独立してC1−C4アルキル、C1−C4アルコキシ、ハロゲン、C1−C4ハロアルキル、C1−C4ハロアルコキシ、ヒドロキシル、ヒドロキシ−C1−C4−アルキル、アミノ、−NH(C1−C4アルキル)、−N(C1−C4アルキル)(C1−C4アルキル)、−(C0−C6アルキル)−C(O)R11、またはNO2の1基または2基で置換されており、ここで
R11はC1−C6アルコキシであり、独立してC1−C4アルコキシ、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−(C0−C6アルキル)−C(O)N(R9)−ヘテロシクロアルキル、またはヘテロシクロアルキルの1基または2基で置換されていてもよく、ここでヘテロシクロアルキル基はアザ−ビシクロ−オクチル、ある実施形態では1−アザ−ビシクロ[2.2.2]オクト−3−イルまたは8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルから選択され、ここでアザの窒素はメチルまたはエチルで置換されていてもよく、R4はHまたはメチル、ピロリジニル、ピペリジニル、ピペラジニル、およびモルフォリニルであり、ここでヘテロシクロアルキル基は独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよい。
またさらに別の局面で、本発明は化学式(X)の化合物を提供し、ここでR1はクロロ、R2はアミノ、R3はメトキシ、R4はH、およびR1、R2、およびR3は以下のようにフェニル環に付いている。
Lは−(C3−C5アルキル)−で、ここで炭素1個が−N(R9)−、または−(C2−C6アルキル)−C(O)−で置き換えられる。さらに別の局面で、R1、R2、およびR3は前出のように定義されフェニル環に付いており、R4は前出のように定義され、およびR5はヘテロシクロアルキルで、これはアザ−ビシクロ−オクチル、ある実施形態では1−アザ−ビシクロ[2.2.2]オクト−3−イル、または8−アザ−ビシクロ[3.2.1]オクト−3−イル、アザ−ビシクロ−ノニル、アザ−ビシクロ−デシルから選択され、ここでアザの窒素はメチルまたはエチルで置換されていてもよい。
またさらに別の局面で、本発明は化学式(X)の化合物を提供し、ここでR1はクロロ、R2はアミノ、R3はメトキシ、R4はH、およびR1、R2、およびR3は以下のようにフェニル環に付いている。
Lは−(C3−C5アルキル)−で、ここで炭素1個が−N(R9)−、または−(C2−C6アルキル)−C(O)−で置き換えられる。また別の局面で、R1、R2、およびR3は前出のように定義されフェニル環に付いており、R4は前出のように定義され、およびR5は−N(R9)−C0−C4アルキル−アリール、または−N(R9)−(C0−C6アルキル)−C(O)−アリールで、ここでアリール基は置換基がないか、または置換されてもよい位置の1個または複数がC1−C6アルキル、C1−C6アルコキシ、ハロゲン、C1−C6ハロアルキル、C1−C6ハロアルコキシ、ヒドロキシル、ヒドロキシアルキル、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−(C0−C6アルキル)−C(O)R11、またはNO2で置換されている。さらに別の局面で、アリール基は−(C0−C6アルキル)−C(O)R11で置換されたフェニルで、C1−C6アルキル、C1−C6アルコキシ、ハロゲン、CF3、OCF3、ヒドロキシル、ヒドロキシアルキル、アミノ、−NH(C1−C4アルキル)、−N(C1−C4アルキル)(C1−C4アルキル)、またはNO2から独立して選択された1基または2基で置換されていてもよく、ここで
R11はC1−C6アルコキシであり、独立してC1−C4アルコキシ、アミノ、−NH(C1−C6アルキル)、−N(C1−C6アルキル)(C1−C6アルキル)、−(C0−C6アルキル)−C(O)N(R9)−ヘテロシクロアルキル、またはヘテロシクロアルキルの1基または2基で置換されていてもよく、ここでヘテロシクロアルキル基はピロリジニル、ピペリジニル、ピペラジニル、およびモルフォリニルから選択され、ここでヘテロシクロアルキル基は独立してハロゲン、C1−C6アルキル、C1−C6アルコキシ、ヒドロキシ、ヒドロキシC1−C6アルキル、C1−C6アルコキシカルボニル、−CO2H、CF3、またはOCF3の1基、2基、または3基で置換されていてもよい。好ましい局面では、−(C0−C6アルキル)−C(O)R11基はフェニル環の位置4に付ける。
さらに別の局面で、結合の手3および結合の手4の取り付けは以下の通りである。
好ましい局面では、結合の手3および結合の手4の取り付けは以下の通りである。
当該発明のさらなる局面は、この当該発明の治療用化合物にエステラーゼが作用すると産生される分解産物(好ましくは代謝分解産物すなわち代謝物で、通常親エステル化合物の酸)に関連する。これらの分解産物の尿中や血清中の存在は、この治療用化合物の患者からの除去率のモニターに使用することができる。
当該発明はさらに、治療が必要な患者に少なくとも1つのシサプリドの構造的および/または機能的立体異性類似物の治療的に有効な量の投与からなる胃食道逆流症のような疾患の治療方法を提供する。特異的な局面で、当該発明はシサプリドの構造的および/または機能的立体異性類似物およびこれらエステル化化合物の製薬学的組成を提供する。
当該発明はさらに、シサプリドの投与に随伴する有害作用を十分に低減しながら、嘔吐および消化不良、胃不全麻痺、便秘、および腸管偽閉塞を含みこれらに限定されない他の状態の治療のための物質と方法を提供する。
当該発明はさらに、ユニークで有利な当該発明の化合物の合成法を提供する。特に、そのような立体異性体化合物の産生と精製の方法を教えるものである。そのようなエステル分子を付け加え立体異性体を産生し精製する方法は熟練した者によく知られており、ここに示すガイダンスを利用してすぐに実行できるものである。
好ましい局面で、当該発明は3つのキラル中心を有する化合物Iの分離した立体異性体を提供する。
化合物I
シサプリドおよびノルシサプリドに存在するキラル中心の2つは活性化体ではシス(cis)構造である。
このように、例えば製薬学的に活性のあるノルシサプリドは2つのシス鏡像異性体のラセミック混合物である。
1つの局面で、この発明は特にキヌクリジノール分子にある3番目のキラル中心の構造に関する。この部分はこれ以降±化合物IIと呼ぶ酸代謝物への変換過程で除去される。
化合物II
この発明の好ましい化合物I立体異性体は、RまたはSキヌクリドゾルを(+)−またはインリドクに抱合して作られ、化合物III、IV、Vおよびlg.が得られる。
化合物III:(−)(R)−化合物I
化合物IV:(+)(R)−化合物I
化合物V:(−)(S)−化合物
化合物VI:(+)(S)−化合物I
ここでの使用では、「アルキル」の用語に設計された数の炭素原子からなるアルキル基を含める。アルキル基は直鎖型あるいは分岐鎖型である。「アルキル」の例には、メチル、エチル、プロピル、イソプロピル、ブチル、iso−ブチル、sec−ブチル、tert−ブチル、ペンチル、へキシル、ヘプチル、3−エチルブチルなどが含まれる。炭素原子の数が特定されていない場合、「アルキル」分子は1−6結合の炭素を持っている。
「治療的有効量」とは、以下のような治療効果が得られるのに必要な用量を意味する。1)逆流症を軽減するのに十分な量、2)嘔気と嘔吐を軽減するのに十分な量、3)胃腸管運動不全に起因する状態を軽減するのに十分な量。シサプリドの構造的および/または機能的類似体の治療的有効量は、上記の用量および投与頻度により達成される。
ここで使用される「機能的類似体」とは、対象化合物の機能的特徴が親化合物と似ていることを意味する。例えば、シサプリドの機能的類似体は、たとえあったとしてもわずかしかシサプリドと構造的特徴が似ていないが、例えば5−HT4作動性など同様の機能も発揮する。
シサプリドの様々な類似体の化学合成は、1983年4月13日に発行されたヨーロッパ特許登録番号0,076,530 A2、米国特許番号4,962,115および5,057,525、およびバン・ディールらの論文(Van Daele et al.,Drug Development Res.8:225−232,1986)に記載されている方法により実施することができ、それらの開示は参照として全体がそのまま、および開示された化合物の合成の適切な位置にエステル基を導入することにより改変してここに編入されている。例証的に、当該発明のある種のエステル化されたシサプリド類似体の無制限な合成スキームがWO 01/093849に提供されている。
(−)−ジベンゾイル−L−タルタル酸((−)−DBT、約1重量部)をエタノールに溶解しフィルターで残余粒状物を濾し取った。それとは別に、ラセミックノルシサプリド(約0.8重量部)をエタノールと水の混合液に溶解し、次いで濾過した。濾過液を75℃に加熱してから(−)−DBT溶液を添加した。この温度で約30分間撹拌してから、混合液を数時間かけて約5℃までゆっくり冷却し、生じた塩を吸引濾過にて収集し、EtOH/H2O混合液で洗浄した。約79℃に加熱してウェットケーキ状物をEtOH/H2O液から再結晶化し、前述のように約5℃までゆっくり冷却した。生成物を吸引濾過にて収集し、EtOH/H2O液で洗浄してウェットケーキ状物を得た。
ウェットケーキ状物を水に懸濁し、7%(W/W)NaOH水溶液にてpH12に調整した。得られた懸濁液を室温にて約3時間撹拌してから吸引濾過し、固形物を水で洗浄し吸引下で乾燥させた。次いで上記と同じ一般的手順で生成物を(−)−DBTで再処理して塩を生成した、次いで分離した塩は上記のようにNaOH水溶液で中和した。生成物をフィルターで濾し取り、前述のように乾燥させて(+)−ノルシサプリドベース(約0.25重量部)を得た。キラルHPLC分析によるe.e.は約100%(+)−ノルシサプリドであった。旋光度は約+5°(メタノール、25℃、589nm)であり、ノルシサプリドの陽性異性体であることを確認した。
(+)−ノルシサプリド(約1重量部)、炭酸カリウム(約0.48重量部)、およびヨウ化カリウム(約0.063重量部)をUSP無水エタノールに懸濁した。6−ブロモヘキサン酸エチル(約0.76重量部)を懸濁液に室温でゆっくり添加した。反応が完了するまで混合液を加熱還流した。続いて反応液を室温まで冷却し、濾過にて例えば無機固形物を除去し、濾過液を約半量になるまで減圧下で濃縮した。高速で撹拌しながら粗製物質を冷水(約13重量部)にゆっくり添加して生成物を沈殿させた。沈殿物を吸引濾過し水で洗浄し、次いで前述のように無水エタノールに溶解したあと冷水にゆっくり添加してさらに2回沈殿させた。得られたウェットケーキ状物をn−ヘプタンで洗浄し、酢酸エチルとn−ヘプタンの混合液(1:9、v/v)に懸濁し、約1時間撹拌してから濾過し吸引下で乾燥させて、白色固形として約0.73重量部のカップリング生成物を得た。
エステル(1重量部)および(R)−3−キヌクリジノール(約1.12重量部)をトルエンに懸濁し、懸濁液を撹拌しながらチタン(IV)エトキシド(約0.5重量部)をゆっくり添加した。窒素流の中で混合液を約91℃まで加熱し、共沸混合的にエタノールを除去するために蒸留装置を通してフラスコに部分的な吸引を施した。必要に応じてトルエンを追加してフラスコ内の最小溶剤量を維持した。反応は約33時間後に完了したと見なされた。
混合液をおよそ室温まで冷却し水で5回抽出した。有機層を減圧下で濃縮して得られた残渣をEtOH/iPrOH(約1:1、v/v)に溶解し、次いで0.45μmの膜フィルターで濾過して粒状物を除去した。濾過液を撹拌しながら濃塩酸をゆっくり添加して目的の化合物を二塩酸塩として沈殿させた。得られた懸濁液を室温で数時間撹拌し、吸引下で濾過して収集し、EtOH/iPrOH(1:1、v/v)で洗浄して、約0.53重量部の粗製化合物塩を得た。
粗製二塩酸塩をエタノールに再懸濁して加熱還流してから約1時間かけて室温まで冷却した。生成物は吸引濾過にて収集しエタノールで洗浄した後、空気乾燥させた。固形物はエタノールに再懸濁して約55℃に温めて透明な溶液を得てから温めたイソプロパノールを添加し、室温までゆっくり冷却して生成物を沈殿させた。得られた懸濁液を数時間撹拌し、吸引濾過して例えばイソプロパノールで洗浄した。生成物をまず室温で数時間、次いで約55℃で重量が一定になるまで、吸引しながら乾燥させた。
ラセミックな4−アミノ−3−メトキシピペリジン−l−カルボキシル酸エチル(1モル部)のDMF溶液に、臭化ベンジル(約2.2モル部)、炭酸カリウム(約2.4モル部)、およびヨウ化カリウム(約0.2モル部)をそれぞれ添加した。反応液を約80℃に加熱した。約6時間後、反応液を水でゆっくり希釈(約12ボリューム部)して、例えば酢酸エチルで抽出した。有機層を塩水で洗浄してから無水Na2SO4で乾燥させた。続いて濾過し溶剤を濃縮して、化合物1を黄褐色のオイル(1モル部)として得た。
化合物1の溶液にNaOH(約10モル部)のイソプロパノール溶液を添加し、混合液を撹拌して過熱還流した。約3から約5時間後、反応液を室温まで冷却し、回転蒸発にてアルコール溶剤を除去した。混合液を水で希釈して酢酸エチルで抽出した。有機層を塩水で洗浄してから無水Na2SO4で乾燥させた。続いて濾過し溶剤を濃縮して得られた粗製オイルをSiO2(CH2C12:MeOH:NH4OH;(約)15:1:0.01)で精製して化合物2を得た。
(−)−ジベンゾイル−L−タルタル酸(約1.2重量部)をエタノールに溶解した後、それに化合物2(約1重量部)をゆっくり添加する。溶液を穏やかに温めた後、室温まで冷却するに任せて塩生成物を結晶化させる。この塩を濾過しEtOH/H2Oで洗浄した後水に懸濁し、pHが約12になるまで無水NaOH(7%、wt/wt)を添加して塩基性にする。懸濁液を室温で激しく撹拌し固形物をフィルターで濾し取り水で洗浄し吸引乾燥させて、シス異性体の化合物3を得る。
化合物3(1モル部)のDMF溶液に、ブロモヘキサン酸エチル(約1.2モル部)、炭酸カリウム(約1.4モル部)、およびヨウ化カリウム(約0.2モル部)をそれぞれ添加する。次いで反応液を約80℃に加熱する。約8時間後、反応液を水でゆっくり希釈(約12ボリューム部)して、酢酸エチルで抽出する。有機層を塩水で洗浄してから無水Na2SO4で乾燥させる。続いて濾過し溶剤を濃縮して、粗製化合物を得る。SiO2で精製してアルキル化された物質4を得る。
チタンテトラエトキシドを化合物4(1モル部)と(R)−(−)−3−キヌクリジノール(1モル部)のトルエン混合液に添加する。反応混合液をディーン・スターク装置に載せて約90℃に加熱し、次いで部分的に吸引する(必要に応じてトルエンを追加してフラスコ内の必要溶剤量を維持する)。混合液を室温まで冷却し、反応液を酢酸エチルで希釈し、次いで得られた混合液に水を加える。有機層を分離し塩水で洗浄し無水Na2SO4で乾燥させ濾過し濃縮する。SiO2で精製して鏡像異性体に富む化合物5を得る。
化合物5(1モル部)のEtOH溶液を、炭素上にパラジウム(約0.2モル部)を入れた反応フラスコに添加する。混合液から脱気した後、H2環境の水素化分解条件下に置く。反応が終了したら、セライトのパッドにてパラジウムを濾過した後、EtOHで洗浄する。濾過液を回転蒸発にて濃縮し、化合物6を得る。
酸性条件下で、1−ベンジルピペリジン−4−ワン(1)と臭化水素酸を酢酸の存在下で反応させ、N−ベンジル−3−ブロモピペリジン−4−ワン(2)を産生する。化合物2をナトリウムメトキシドとメタノール溶液で処理すると、1−ベンジル−4,4−ジメトキシピペリジン−3−オール(3)が得られる。[βアミノ基が存在するとファヴォルスキー型反応の可能性がなくなる。]水素化物ベースを用いてヒドロキシ基のメチル化を実施した後、溶剤としてDMF存在下でヨードメタンで処理し化合物4を得る。
続いて加熱産物のピペリジン化合物5の存在下で1%硫酸を用いて酢酸の加水分解を行い、次いで例えばシアノ水素化ホウ素ナトリウムおよび酢酸アンモニウムのメタノール溶液を用いて還元アミン化反応を実施し1−ベンジル−3−メトキシピペリジン−4−アミン(6)を得る。この段階で、化合物6にキラル分離テクニックを施すことができる。これは、非対称性に極めて純粋な化合物7を手に入れるために、例えば適当な溶剤存在下で(−)−DBTまたはその他のタルタル酸変異体を用いて実施することができる。Boc(ブトキシカルボニル)基による化合物7の主要アミンの保護をTHF溶剤存在下でBoc無水物を用いて達成し、化合物8を得ることができる。水素ガス環境下でPd/Cのメタノール溶液を用いた水素化分解による脱ベンジル反応がアルキル化段階の環境を整える。弱塩基性物質とDMF存在下で6−ブロモヘキサンニトリルを処理することにより、化合物10が得られる。希釈した酸の存在下で(R)−キヌクリジノールを用いてニトリルからエステルへ変換することにより化合物11が生成される。続いてTFAを用いたBoc基の除去により遊離アミンが得られ、この遊離アミンはクロロギ酸エチルなどのカップリング物質の存在下で必須の安息香酸とカップリング反応して鏡像異性体的に純粋な物質としてATI−7505が得られる。
それとは別に、化合物9は弱塩基物質の存在下で6−ブロモヘキサン酸エチルを用いてアルキル化することができる。続いてBoc基を除去して化合物13が得られる。(R)−キヌクリジノールとチタンテトラエトキシドのトルエン溶液を用いてチタンを触媒とした化合物13からのエステル転位を行いATI−7505が生成される。カールスバーグのエステラーゼにより、R構造のエステルを無傷のまま残しながらS構造のエステルを加水分解する。したがって、化合物14の鏡像異性体混合物のカールスバーグ・エステラーゼ処理によってもATI−7505が得られる。
この4つの異性体は、調製カラムクロマトグラフィーを用い、続いて溶剤を蒸発させることにより数mgだけ得られた。この方法は分析および特性解明を目的として少量を調製するのに有用である。これは、代謝物を分離し分析するために日常的に検査室で使用される標準的な分離法である。
化合物IV、化合物VI、(+)−化合物IIの可能性のある合成経路を、(+)−ノルシサプリドを開始物質に用いて以下に記載する。化合物III、化合物V、および(−)−化合物IIの合成経路は、(−)−ノルシサプリドを開始物質として使用する以外は同じである。
(+)−ノルシサプリドと6−ブロモヘキサン酸エチルの等量混合液(1等量ずつ)、触媒用量のKI、およびK2CO3(2等量)のDMF溶液を数時間、またはTLC分析で反応が終了したことが分るまで約60℃に加熱する。室温まで冷却した後、水を加え、混合液をEtOAcで抽出する。有機抽出液を1つにまとめて、水、10% LiCl(aq)、塩水で順次洗浄し、次いでNa2SO4で乾燥させる。濃縮すると(+)−化合物II、エチルエステルが得られる。
(+)−化合物IIの生成
上記の粗製(+)−化合物II エチルエステル(1等量)、KOH(2M、5等量)のMeOH溶液、およびTHF(溶けるのに十分な量)の混合液を室温で約1〜2時間撹拌する。MeOHとTHFを吸引下で除去し、残渣を水に溶解する。EtOAcのような有機溶剤で洗浄する。水性層をHC1でpH5に酸性化する。沈殿物をフィルターで越し取り乾燥させて(+)−化合物IIを得る。
化合物IVおよび化合物VIの生成
(+)−化合物II(1等量)、(R)−(−)−3−キヌクリジノールHCl塩(1等量)、EDAC(1等量)およびDMAP(1等量)のDMF混合溶液を一晩約50℃に加熱する。冷却し水で希釈した後、混合液をクロマトグラフィまたは再結晶化により精製して化合物IVを得る。同様に、(S)−(+)−キヌクリジノールを用いて化合物VIを得る。
以下の化合物は本質的に上述の方法と手順に従って調製する。化合物名はCambridgesoft Corporationから手に入るChemDraw Ultraのバージョン8.03、またはACD Namepro ソフトウェアのバージョン6.0のいずれかを用いて命名した。
6−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}ヘキサン酸(3S)−1−アザビシクロ[2.2.2]オクト−3−イル;
6−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}ヘキサン酸(3S)−1−アザビシクロ[2.2.2]オクト−3−イル;
6−{(3R,4S)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}ヘキサン酸(3R)−1−アザビシクロ[2.2.2]オクト−3−イル;
6−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}ヘキサン酸8−メチル−8−アザビシクロ[3.2.1]オクト−3−イル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸メチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸メチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸メチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸エチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸イソプロピル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸2−メトキシエチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸2−ピロリジン−1−イルエチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸1−メチルピペリジン−4−イル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸2−ピリジン−2−イルエチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸2−(ジメチルアミノ)エチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸1−メチルピペリジン−3−イル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸2−モルフォリン−4−イルエチル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸1,4−ジメチルピペリジン−4−イル;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸;
4−[({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)アミノ]安息香酸2−オキソ−2−(ピペリジン−4−イルアミノ)エチル;
1−({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)ピペリジン−4−カルボキシル酸;
1−({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)ピペリジン−4−カルボキシル酸メチル;
1−({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)ピペリジン−4−カルボキシル酸メチル;
1−({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)ピペリジン−4−カルボキシル酸メチル;
1−({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)ピペリジン−4−カルボキシル酸エチル;
1−({(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}アセチル)ピペリジン−4−カルボキシル酸2−メトキシエチル;
4−{[(2−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}エチル)(メチル)アミノ]メチル}安息香酸;
4−[(2−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}エチル)(メチル)アミノ]メチル}安息香酸メチル;
4−[(2−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}エチル)アミノ]メチル}安息香酸メチル;
4−[(2−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}エチル)アミノ]メチル}安息香酸イソプロピル;
4−{[(2−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}エチル)アミノ]メチル}安息香酸 二塩酸エチル;
4−{[(2−{(3S,4R)−4−[(4−アミノ−5−クロロ−2−メトキシベンゾイル)アミノ]−3−メトキシピペリジン−l−イル}エチル)アミノ]カルボニル}安息香酸(3R)−1−アザビシクロ[2.2.2]オクト−3−イル;
6−((3S,4R)−4−(4−アミノ−5−クロロ−2−メトキシベンザミド)−3−メトキシピペリジン−l−イル)ヘキサン酸(R)−キヌクリジン−3−イル;または
6−((3S,4R)−4−(4−アミノ−5−クロロ−2−メトキシベンザミド)−3−メトキシピペリジン−l−イル)ヘキサン酸
開示された化合物の投与経路と投与回数は、すでに実地で使用され熟練した職人に知られているものと同様である(例については、Physicians’ Desk Reference,54th Ed.,Medical Economics Company,Montvale,NJ,2000を参照のこと)。
当該発明のさらに別の局面は、シサプリドの投与に随伴して同時に発生する有害作用を十分低下させながら、哺乳類で制吐作用を発揮する方法を提供することであり、それはシサプリドの構造的および/または機能的類似体または製薬学的に容認できるその塩を、そのような制吐治療を必要とする哺乳類に治療的に有効な用量で投与することからなる。好ましくは哺乳類はヒトである。
本発明のさらなる局面は、哺乳類で胃腸管運動不全により引き起こされる状態を治療する方法が含まれ、それはシサプリドの構造的および/または機能的類似体または製薬学的に容認できるその塩を、胃腸管運動不全の治療を必要とする哺乳類に治療的に有効な用量で投与することからなる。胃腸管運動不全により引き起こされる状態には、消化不良、胃不全麻痺、便秘、術後イレウス、腸管偽閉塞が含まれるが、これらに限定されない。好ましくは哺乳類はヒトである。
それゆえに本発明はまた、シサプリドの構造的および/または機能的類似体または製薬学的に容認できるその塩の治療的に有効な量を投与することからなる、哺乳類の認知、行動、気分、または自律神経失調障害の治療方法を提供する。好ましくは哺乳類はヒトである。
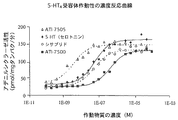
5−HT4受容体は腸管におけるシサプリドのプロキネティック活性に関与する主要な受容体サブタイプとして知られている。ATI−7505は低いナノモルレベルのIC50で、5−HT4受容体と高い結合親和性を有する。表1に示すように、ATI−7505の5−HT4受容体に対する親和性はシサプリドより18倍高く、ATI−7505の主要な代謝物であるATI−7500より少なくとも360倍高かった。
ARYxは、ヒト5−HT4受容体を安定して発現するように工夫された細胞のアデニリルシクラーゼ刺激に基づくインビトロ(in vitro)アッセイを実施した。ATI−7505は極めて強力な5−HT4受容体作動物質であるのに対し、その主要な代謝物質であるATI−7500は比較的弱いことが証明された(図1および表2)。ATI−7505(4nM)の推定EC50は、シサプリド(49nM)のそれより約10倍低く、ATI−7500(395nM)のそれより約100倍低かった。その推定Emax値に基づくと、ATI−7505は5−HT(セロトニン)(表2)の効力の85%を有し、ATI−7505はHT4受容体の部分的な作動物質であることが示された。
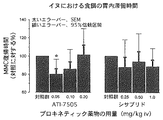
ATI−7505の胃を空にする作用を調べるために、胃と小腸に伸展計トランスデューサーを設置した意識のあるイヌの食後モデルで実験を行った。この実験の目的は、固形飼料を経口投与した後、移動性収縮運動(MMC)がベースラインに復帰するまでに要する時間を測定することであった。薬物によるMMC復帰時間の短縮は、胃を空にすることが促進されたために消化期間が早く終了したことを意味する。小腸中央部のMMCが終了した直後に、様々な用量のテスト薬物(溶媒、ATI−7505、またはシサプリド)を20分かけて静脈内(IV)に注入した。薬物の注入が済んだ時点でイヌに食餌を与えた。空腹時の状態を確認し十二指腸のMMCの開始を同定するために、薬物の注入を開始する前に最低60分間、さらに十二指腸にMMCが復帰してから少なくとも30分間、腸の収縮を記録した。処置の量的比較は、固形飼料の摂取後の胃が空になることの指標としてのMMC復帰時間に基づいた。図2にまとめたように、ATI−7505はMMC復帰時間を有意に短縮し、飼料を摂取した正常のイヌにおいて胃を空にするのを促進することを示した。シサプリドは同様の作用パターンを示した。
意識のある空腹時のイヌを用いて、胃、小腸、大腸に対するATI−7505の運動活性をシサプリドと比較する実験を行った。その特定の目的は、シサプリドのイヌにおける典型的な治療用量(0.5mg/kg IV、1mg/kg PO)により惹起される収縮活性に最も近いパターンと程度を示すATI−7505(IVおよびPO)の用量の決定であった。
静脈内(IV)および経口(PO)で投与したとき、ATI−7505とシサプリドはともにイヌの腸にプロキネティックな作用を示した。作用の発現は通常、IVで投与後1〜2分以内、POで投与後25〜30分以内に起こった。ATI−7505の胃と小腸の運動活性に対する作用はシサプリドによく似ていた。シサプリドのように、ATI−7505は用量依存性の幽門洞と小腸の収縮刺激作用を示し、大腸の運動活性に対する作用は比較的小さかった。上部消化管においてATI−7505によって引き起こされたプロキネティックな作用は、大きな移動性収縮(GMC)の頻度の軽度の、しかし有意な(p<0.05)上昇を伴っていた。
ATI−7505には逆行性の大きな移動性収縮(RGC)は伴っていなかった。シサプリドと同様に、ATI−7505は幽門洞のほか小腸の近位、中間、遠位においても、移動性運動コンプレックス(MMC)の特性に対する影響は最小限であった。MMCの頻度と第III相の長さに関しては、ただ1つだけ有意な相違が見られた。それはATI−7505の経口投与において、近位小腸のMMCの頻度が対照群に比較して増加したことである。イヌはATI−7505のIVおよびPO投与に忍容性を示し、下痢、食欲不振、体重減少などの副作用を示さなかった。
全体的に、この結果はmg/kgベースで、ATI−7505がシサプリドより約2倍強力なことを示したさらに、ATI−7505の作用はシサプリドと同様、平滑筋に対する直接的な作用よりも腸管神経からのアセチルコリンの遊離促進が関係したメカニズムに一致していた。結論として、ATI−7505はシサプリドと同じような仕方で胃と小腸の運動活性を上昇させ、大腸に対する作用は最小限である。
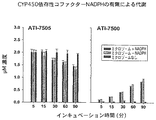
プールしたヒト・ミクロゾームから得られたデータによると、ATI−7505は1つの代謝物、ATI−7500に生体内変換され、ATI−7500はそれ以上代謝されないと思われる。ATI−7505のATI−7500への変換はNADPHの存在に依存していなかった。このように、ATI−7505の体内での主要代謝経路はCYP450の酵素とは無関係である。
ATI−7505および/またはその主要代謝物ATI−7500がCYP450阻害物質として作用する効力をテストするため、この2つの物質をGentest SupersomesTMを用いてスクリーニングした。公表されている報告と一致して、シサプリドにはCYP450の分子種、CYP3A4、2D6に対して有意な阻害作用があり、2C9に対してそれより小さな阻害作用があった。ATI−7505とその主要代謝物ATI−7500のいずれにも3つのCYP450分子種に対する有意な阻害作用は認められず、薬物代謝を担うことが知られている一連の他の分子種に対しても有意な阻害作用は認められなかった。
ヒトにおいて急速に活性化する遅延整流型カリウム(K+)電流(ヒトIKr)は、ヒトのether−a−go−go(エーテルでゴーゴー)に関連した遺伝子(hERG)によりコードされているK+チャンネルである。シサプリドはIKrを遮断することによりQT間隔を延長させることが知られていることから、ATI−7505およびATI−7500がヒトIKrに重要な阻害作用を有するかを判定することが注目された。このテストシステムはhERG K+チャンネルを発現している哺乳動物のHEK−293細胞を使用しており、このシステムでカリウム電流を細胞全体パッチクランプ法により測定した。IC50値のランキングは、シサプリド(9.5nM)>ATI−7505(24,521nM)>ATI−7500(204,080nM)であった(表3)。全体として、この所見はATI−7505の不整脈誘発性がシサプリドより有意に低いことを示し、ATI−7505とATI−7500の両方がヒトIKrチャンネルにほとんど親和性を持っていないことを示唆している。
ATI−7505の心臓への電気生理学的な影響をモルモットの摘出灌流心臓で検討した。この試験では、ATI−7505、ATI−7500、シサプリドを10,000nMまでの濃度でテストした。最大無作用量(NOEL)は、ベースラインから有意差(p<0.05)のある反応を示さない被験物質の最も高い濃度と定義された。以下の6つの心臓パラメータについてテストした。(1)QT間隔、(2)MAPD90、(3)SA間隔、(4)QRS間隔、(5)AH間隔、および(6)HVである。ATI−7505は心臓の電気生理学的パラメータを極めて弱く修飾し、その代謝物であるATI−7500は電気生理学的な活性を全く示さなかった(表4)。ATI−7505の6つの心臓血管パラメータのセットすべてでNOELは>10,000nMであった。テストした6つの心臓パラメータを総合するとシサプリドのNOELは10nMであるのに対し、ATI−7505の総合したNOELが1,000nMであることから、ATI−7505は心臓の電気生理学的パラメータの修飾においてシサプリドのような影響力を持たないと思われる。全体として所見は、重大な心臓の電気生理学的変動の誘発性に関して、ATI−7505はシサプリドよりも有意に安全であることを示している。
ヒト・ミクロゾーム存在下での代謝
これらの化合物の代謝をチトクロームP−450 コファクターNADPHの存在下、非存在下で、プールしたヒト・ミクロゾームを加えて試験し、親化合物の消失と対応する酸性代謝産物、すなわち対応する化合物II異性体の出現の両方を経時的にモニターした。
表5に示すように、化合物IIIと化合物IVはエステラーゼによりそれぞれの代謝物である(+)および(−)−化合物IIにすぐに加水分解された。加水分解の速度がCYP450が機能するのに必要なコファクターであるNADPHの存在に左右されなかったことから、代謝はCYP450に依存していなかった。それとは対照的に、(±)−S化合物Vおよび(±)−S化合物VIは同じ条件下で経時的に極めて安定しているように思われた。この実験で、5、60、90分後に反応液に残っていた基質(化合物III、IV、V、VI)の量をタンデムHPLC−MS法にて評価した。この残存量は代謝化合物IIの出現と相関していた。残存している基質と化合物IIを合わせた量は経時的に一定で、時間ゼロ時の開始物質の量と同じであり、したがって加水分解が唯一の代謝経路であることが示された。
テスト化合物をDMSOに溶解して12.5mMの保存液を作製し、水で最終濃度2.5mM(DMSO/H20=20/80)に希釈した。新鮮血を3人の提供者からヘパリン入りチューブに採取し、インキュベーションの時まで氷上に保管した。各提供者からの血液を1.5mLの遠心管に等分に分注し、チューブを37℃の恒温漕で震盪しながら5分間インキュベートした。反応は10μLの適切な被験化合物の保存液を各チューブに添加する(最終濃度=100μM)ことによって開始された。インキュベーションは0、5、15、30、および60分後にアセトニトリル(750mL)を加えることにより終了し、12,000rpmで2分間遠心し、上清をAgilent 1100 HPLC システムで分析した。分離はKeystone Intersil ODS2、250X4.6mrn、5mカラムで実施した。水性可動相は20mM酢酸アンモニウム緩衝液(pH5.7)および有機相アセトニトリルから構成されていた。グラディエーションを用い、最初の条件は20%アセトニトリルで1分間であった。アセトニトリルの濃度は次の8分間に直線的に90%まで上昇させ、続く1分間それを維持した。次いでシステムは1分間の時間をかけて最初の条件に戻り、次の注入の前に4分間その状態を維持した。親化合物のピークのピーク面積が240、254、および290nMでの吸収度をモニターすることにより決定された。その結果は当初化合物の残余量として表現され、データはWinNonLinを用いたキネティック分析に使用した。個々の化合物の半減期を表6に示す。
Claims (7)
-
からなる群から選択される、化合物又はその製薬学的に容認できる塩。 - 2塩酸塩である、請求項1に記載の塩。
- 請求項1又は2に記載の化合物又は塩を含む複数の立体異性体の混合物であって、前記化合物又は塩が少なくとも90%の立体異性体過剰率(stereoisomeric excess)で存在する混合物。
- 請求項1又は2に記載の化合物又は塩、或いは請求項3に記載の混合物を含む医薬組成物。
- 請求項1又は2に記載の化合物又は塩、或いは請求項3に記載の混合物と、製薬学的に容認できる少なくとも1つの担体、溶剤、補助剤又は賦形剤とを含む医薬組成物。
- 嘔吐、消化不良、胃不全麻痺、便秘、腸管偽閉塞、胃食道逆流症、又は術後イレウスを治療するための、請求項4又は5に記載する医薬組成物。
- 静脈内投与用である、請求項4〜6の何れか1項に記載の医薬組成物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US53489204P | 2004-01-07 | 2004-01-07 | |
| US60/534,892 | 2004-01-07 | ||
| US56093804P | 2004-04-09 | 2004-04-09 | |
| US60/560,938 | 2004-04-09 | ||
| PCT/US2005/000510 WO2005068461A1 (en) | 2004-01-07 | 2005-01-07 | Stereoisomeric compounds and methods for the treatment of gastrointestinal and central nervous system disorders |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011261145A Division JP5524939B2 (ja) | 2004-01-07 | 2011-11-30 | 胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2007517891A JP2007517891A (ja) | 2007-07-05 |
| JP2007517891A5 JP2007517891A5 (ja) | 2012-11-01 |
| JP5200288B2 true JP5200288B2 (ja) | 2013-06-05 |
Family
ID=34798839
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006549435A Expired - Lifetime JP5200288B2 (ja) | 2004-01-07 | 2005-01-07 | 胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 |
| JP2011261145A Expired - Lifetime JP5524939B2 (ja) | 2004-01-07 | 2011-11-30 | 胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011261145A Expired - Lifetime JP5524939B2 (ja) | 2004-01-07 | 2011-11-30 | 胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US7176218B2 (ja) |
| EP (2) | EP2194053B1 (ja) |
| JP (2) | JP5200288B2 (ja) |
| KR (1) | KR101240464B1 (ja) |
| CN (1) | CN101824033B (ja) |
| AT (1) | ATE464308T1 (ja) |
| AU (2) | AU2005205531B2 (ja) |
| BR (1) | BRPI0506736B1 (ja) |
| CA (1) | CA2551686C (ja) |
| CY (1) | CY1110901T1 (ja) |
| DE (1) | DE602005020580D1 (ja) |
| DK (2) | DK2194053T3 (ja) |
| ES (2) | ES2415830T3 (ja) |
| IL (1) | IL176569A (ja) |
| MX (1) | MXPA06007853A (ja) |
| NO (1) | NO337741B1 (ja) |
| PT (2) | PT1704146E (ja) |
| RU (1) | RU2374244C2 (ja) |
| WO (1) | WO2005068461A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012102102A (ja) * | 2004-01-07 | 2012-05-31 | Aryx Therapeutics | 胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0211230D0 (en) | 2002-05-16 | 2002-06-26 | Medinnova Sf | Treatment of heart failure |
| US8138204B2 (en) * | 2004-01-07 | 2012-03-20 | Aryx Therapeutics, Inc. | Stereoisomeric compounds and methods for the treatment of gastrointestinal and central nervous system disorders |
| US8524736B2 (en) | 2004-01-07 | 2013-09-03 | Armetheon, Inc. | Stereoisomeric compounds and methods for the treatment of gastrointestinal and central nervous system disorders |
| MY150958A (en) | 2005-06-16 | 2014-03-31 | Astrazeneca Ab | Compounds for the treatment of multi-drug resistant bacterial infections |
| WO2007028073A2 (en) * | 2005-08-31 | 2007-03-08 | Aryx Therapeutics, Inc. | Synthetic methods and intermediates for stereoisomeric compounds useful for the treatment of gastrointestinal and central nervous system disorders |
| CN101258151B (zh) * | 2005-08-31 | 2012-10-10 | ARYx医疗有限公司 | 用于治疗胃肠系统和中枢神经系统疾病的立体异构化合物的合成方法及中间体 |
| GB0525068D0 (en) | 2005-12-08 | 2006-01-18 | Novartis Ag | Organic compounds |
| KR20080080214A (ko) * | 2005-12-23 | 2008-09-02 | 아스트라제네카 아베 | 헤테로시클릭 gaba-b 조절제 |
| US20080085915A1 (en) * | 2006-06-23 | 2008-04-10 | Cyrus Becker | Compounds and methods for the treatment of gastrointestinal and central nervous system disorders |
| CN101402633A (zh) | 2007-09-11 | 2009-04-08 | 上海恒瑞医药有限公司 | 苯甲酰胺类衍生物、其制备方法及其在医药上的用途 |
| WO2010062959A1 (en) * | 2008-11-26 | 2010-06-03 | Aryx Therapeutics, Inc. | 5-ht4 receptor agonists for treating irritable bowel syndrome and colonic hypersensitivity |
| US8349852B2 (en) | 2009-01-13 | 2013-01-08 | Novartis Ag | Quinazolinone derivatives useful as vanilloid antagonists |
| CN102762572A (zh) | 2010-02-01 | 2012-10-31 | 诺瓦提斯公司 | 作为CRF-1受体拮抗剂的吡唑并[5,1b]*唑衍生物 |
| WO2011092293A2 (en) | 2010-02-01 | 2011-08-04 | Novartis Ag | Cyclohexyl amide derivatives as crf receptor antagonists |
| CN102753527B (zh) | 2010-02-02 | 2014-12-24 | 诺华股份有限公司 | 用作crf受体拮抗剂的环己基酰胺衍生物 |
| UY34094A (es) | 2011-05-27 | 2013-01-03 | Novartis Ag | Derivados de la piperidina 3-espirocíclica como agonistas de receptores de la ghrelina |
| PL395470A1 (pl) * | 2011-06-29 | 2013-01-07 | Adamed Spólka Z Ograniczona Odpowiedzialnoscia | Sulfonamidowe pochodne amin alicyklicznych do leczenia chorób osrodkowego ukladu nerwowego |
| EA201491990A1 (ru) | 2012-05-03 | 2015-02-27 | Новартис Аг | L-малатная соль 2,7-диазаспиро[4.5]дец-7-иловых производных и их кристаллические формы в качестве агонистов грелиновых рецепторов |
| TWI710372B (zh) * | 2014-05-16 | 2020-11-21 | 日商拉夸里亞創藥股份有限公司 | 用於胃輕癱之5-ht4受體激動劑 |
| US10335302B2 (en) | 2015-02-24 | 2019-07-02 | Elira, Inc. | Systems and methods for using transcutaneous electrical stimulation to enable dietary interventions |
| WO2016138176A1 (en) | 2015-02-24 | 2016-09-01 | Elira Therapeutics Llc | Systems and methods for enabling appetite modulation and/or improving dietary compliance using an electro-dermal patch |
| US10376145B2 (en) | 2015-02-24 | 2019-08-13 | Elira, Inc. | Systems and methods for enabling a patient to achieve a weight loss objective using an electrical dermal patch |
| US9956393B2 (en) | 2015-02-24 | 2018-05-01 | Elira, Inc. | Systems for increasing a delay in the gastric emptying time for a patient using a transcutaneous electro-dermal patch |
| US10765863B2 (en) | 2015-02-24 | 2020-09-08 | Elira, Inc. | Systems and methods for using a transcutaneous electrical stimulation device to deliver titrated therapy |
| US10864367B2 (en) | 2015-02-24 | 2020-12-15 | Elira, Inc. | Methods for using an electrical dermal patch in a manner that reduces adverse patient reactions |
| US20220062621A1 (en) | 2015-02-24 | 2022-03-03 | Elira, Inc. | Electrical Stimulation-Based Weight Management System |
| US11495028B2 (en) * | 2018-09-28 | 2022-11-08 | Intel Corporation | Obstacle analyzer, vehicle control system, and methods thereof |
| TW202024081A (zh) * | 2018-11-05 | 2020-07-01 | 美商瑞內克松有限公司 | 生產三水合那羅普來得(naronapride)之方法 |
| US10570127B1 (en) * | 2018-11-05 | 2020-02-25 | Renexxion, Llc | Material and methods for the treatment of gastro-intestinal disorders |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3536809A (en) | 1969-02-17 | 1970-10-27 | Alza Corp | Medication method |
| US3598123A (en) * | 1969-04-01 | 1971-08-10 | Alza Corp | Bandage for administering drugs |
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| GB1425706A (en) | 1972-06-30 | 1976-02-18 | Wyeth John & Brother Ltd | Piperidine derivatives |
| US3916899A (en) * | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| US4008719A (en) * | 1976-02-02 | 1977-02-22 | Alza Corporation | Osmotic system having laminar arrangement for programming delivery of active agent |
| US4962115A (en) * | 1981-10-01 | 1990-10-09 | Janssen Pharmaceutica N.V. | Novel N-(3-hydroxy-4-piperidinyl)benzamide derivatives |
| CA1183847A (en) | 1981-10-01 | 1985-03-12 | Georges Van Daele | N-(3-hydroxy-4-piperidinyl)benzamide derivatives |
| US5057525A (en) * | 1981-10-01 | 1991-10-15 | Janssen Pharmaceutica N.V. | Novel N-(3-hydroxy-4-piperidinyl) benzamide derivatives |
| US5137896A (en) * | 1981-10-01 | 1992-08-11 | Janssen Pharmaceutica N.V. | N-(3-hydroxy-4-piperidinyl)benzamide derivatives |
| GB8519707D0 (en) * | 1985-08-06 | 1985-09-11 | Fordonal Sa | Chemical compounds |
| SK289787A3 (en) * | 1986-04-30 | 1998-06-03 | Dainippon Pharmaceutical Co | Substituted n-£(2-morpholinyl)alkyl|benzamide derivative, method of producing the same and a pharmaceutical composition on its base |
| NZ225152A (en) * | 1987-07-17 | 1990-04-26 | Janssen Pharmaceutica Nv | Heterocyclically substituted piperidinyl benzamides as pharmaceuticals |
| CA1317940C (en) * | 1987-09-25 | 1993-05-18 | Georges H. P. Van Daele | Substituted n-(1-alkyl-3-hydroxy-4-piperidinyl)benzamides |
| US4975439A (en) * | 1987-09-25 | 1990-12-04 | Janssen Pharmaceutical N.V. | Novel substituted N-(1-alkyl-3-hydroxy-4-piperidinyl)benzamides |
| US5041454A (en) * | 1987-09-25 | 1991-08-20 | Janssen Pharmaceutica N.V. | Novel substituted N-(1-alkyl-3-hydroxy-4-piperidinyl)benzamides |
| JP3104142B2 (ja) * | 1991-02-15 | 2000-10-30 | 北陸製薬株式会社 | ベンズアミド誘導体 |
| TW213460B (ja) * | 1991-02-15 | 1993-09-21 | Hokuriku Pharmaceutical | |
| US5395832A (en) * | 1991-02-15 | 1995-03-07 | Hokuriku Seiyaku Co., Ltd. | Benzamide derivatives |
| IT1260485B (it) * | 1992-05-29 | 1996-04-09 | Procedimento e dispositivo per il trattamento dell'obesita' di un paziente | |
| EP0649307A4 (en) * | 1992-07-07 | 1996-06-26 | Sepracor Inc | METHOD FOR USING (-) - CISAPRIDE FOR TREATING GASTIC EYE ELEMENTS AND OTHER DISEASES. |
| WO1994001111A1 (en) * | 1992-07-07 | 1994-01-20 | Sepracor Inc. | Methods of using (+) cisapride for the treatment of gastro-esophageal reflux disease and other disorders |
| AU680453B2 (en) | 1992-11-05 | 1997-07-31 | Smithkline Beecham Plc | Piperidine derivatives as 5-HT4 receptor antagonists |
| US5472866A (en) * | 1992-12-24 | 1995-12-05 | Synaptic Pharmaceutical Corporation | DNA encoding 5-HT4A serotonin receptors |
| US5705798A (en) * | 1994-12-16 | 1998-01-06 | Mastercard International Inc. | System and method for processing a customized financial transaction card |
| US5712293A (en) * | 1995-06-07 | 1998-01-27 | Sepracor, Inc. | Methods for treating gastro-esophageal reflux disease and other disorders associated with the digestive tract using optically pure (-) norcisapride |
| US5739151A (en) * | 1996-07-19 | 1998-04-14 | Sepracor Inc. | Method for treating emesis and central nervous system disorders using optically pure (+) norcisapride |
| US6147093A (en) * | 1996-07-19 | 2000-11-14 | Sepracor Inc. | Methods for treating gastroesophageal reflux disease |
| PL190296B1 (pl) | 1997-07-11 | 2005-11-30 | Janssen Pharmaceutica Nv | Zastosowanie (+)-norcyzaprydu |
| JPH11292846A (ja) | 1998-02-10 | 1999-10-26 | Hokuriku Seiyaku Co Ltd | ベンズアミド誘導体及びそれを含有する医薬 |
| AR022338A1 (es) | 1999-02-04 | 2002-09-04 | Hokuriku Pharmaceutical | Un compuesto de benzamida, medicamento que lo contiene, y uso para la manufactura de un medicamento para el tratamiento o prevencion de una enfermedad digestiva o para mejorar la movilidad del tracto gastrointestinal. |
| DE19933926A1 (de) | 1999-07-20 | 2001-01-25 | Boehringer Ingelheim Pharma | Biphenylderivate, ihre Herstellung und ihre Verwendung als Arzneimittel |
| US20040092511A1 (en) * | 1999-12-10 | 2004-05-13 | Billstein Stephan Anthony | Pharmaceutical combinations and their use in treating gastrointestinal and abdominal viscera disorders |
| JP2004513071A (ja) | 2000-05-23 | 2004-04-30 | ザ・トラスティーズ・オブ・コロンビア・ユニバーシティ・イン・ザ・シティ・オブ・ニューヨーク | 肺の弾性繊維損傷に関連した呼吸器疾患の治療方法 |
| WO2001093849A2 (en) | 2000-06-07 | 2001-12-13 | Aryx Therapeutics | Treatment of gastroesophageal reflux disease using piperidine derivatives |
| MXPA03000145A (es) * | 2002-01-07 | 2003-07-15 | Pfizer | Compuestos de oxo u oxi-piridina como moduladores de receptores 5-ht4. |
| ES2415830T3 (es) * | 2004-01-07 | 2013-07-29 | Armetheon, Inc. | Derivados de metoxipiperidina para la utilización en el tratamiento de los trastornos gastrointestinales y del sistema nervioso central |
-
2005
- 2005-01-07 ES ES10153093T patent/ES2415830T3/es not_active Expired - Lifetime
- 2005-01-07 PT PT05705267T patent/PT1704146E/pt unknown
- 2005-01-07 CA CA2551686A patent/CA2551686C/en not_active Expired - Lifetime
- 2005-01-07 MX MXPA06007853A patent/MXPA06007853A/es active IP Right Grant
- 2005-01-07 BR BRPI0506736-7A patent/BRPI0506736B1/pt active IP Right Grant
- 2005-01-07 RU RU2006128589/04A patent/RU2374244C2/ru active
- 2005-01-07 KR KR1020067015208A patent/KR101240464B1/ko not_active Expired - Lifetime
- 2005-01-07 DE DE602005020580T patent/DE602005020580D1/de not_active Expired - Lifetime
- 2005-01-07 EP EP10153093A patent/EP2194053B1/en not_active Expired - Lifetime
- 2005-01-07 PT PT101530939T patent/PT2194053E/pt unknown
- 2005-01-07 AT AT05705267T patent/ATE464308T1/de active
- 2005-01-07 DK DK10153093.9T patent/DK2194053T3/da active
- 2005-01-07 CN CN2010101640045A patent/CN101824033B/zh not_active Expired - Lifetime
- 2005-01-07 WO PCT/US2005/000510 patent/WO2005068461A1/en not_active Ceased
- 2005-01-07 EP EP05705267A patent/EP1704146B1/en not_active Expired - Lifetime
- 2005-01-07 US US11/031,623 patent/US7176218B2/en not_active Expired - Lifetime
- 2005-01-07 DK DK05705267.2T patent/DK1704146T3/da active
- 2005-01-07 AU AU2005205531A patent/AU2005205531B2/en not_active Expired
- 2005-01-07 JP JP2006549435A patent/JP5200288B2/ja not_active Expired - Lifetime
- 2005-01-07 ES ES05705267T patent/ES2344568T3/es not_active Expired - Lifetime
- 2005-03-23 US US11/087,167 patent/US7282509B2/en not_active Expired - Lifetime
-
2006
- 2006-06-26 IL IL176569A patent/IL176569A/en active IP Right Grant
- 2006-08-07 NO NO20063568A patent/NO337741B1/no unknown
-
2008
- 2008-11-13 AU AU2008243243A patent/AU2008243243B2/en not_active Expired
-
2010
- 2010-07-05 CY CY20101100615T patent/CY1110901T1/el unknown
-
2011
- 2011-11-30 JP JP2011261145A patent/JP5524939B2/ja not_active Expired - Lifetime
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012102102A (ja) * | 2004-01-07 | 2012-05-31 | Aryx Therapeutics | 胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5524939B2 (ja) | 胃腸疾患および中枢神経系疾患の治療のための立体異性体化合物と方法 | |
| US8524736B2 (en) | Stereoisomeric compounds and methods for the treatment of gastrointestinal and central nervous system disorders | |
| US7629466B2 (en) | Synthetic methods and intermediates for steroisomeric compounds useful for the treatment of gastrointestinal and central nervous system disorders | |
| US8138204B2 (en) | Stereoisomeric compounds and methods for the treatment of gastrointestinal and central nervous system disorders | |
| WO2007005951A2 (en) | Stereoisomeric pyridyl and pyridonyl compounds and methods for the treatment of gastrointestinal and central nervous system disorders | |
| CN1918157B (zh) | 立体异构化合物及治疗胃肠道和中枢神经系统紊乱的方法 | |
| HK1180680A (en) | Synthetic methods and intermediates for stereoisomeric compounds useful for the treatment of gastrointestinal and central nervous system disorders | |
| CN101258151A (zh) | 用于治疗胃肠系统和中枢神经系统疾病的立体异构化合物的合成方法及中间体 | |
| HK1121762B (en) | Synthetic methods and intermediates for stereoisomeric compounds useful for the treatment of gastrointestinal and central nervous system disorders |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20071213 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110531 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110831 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110907 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110928 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20111005 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20111026 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20111102 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20111130 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120508 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120801 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120808 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20120910 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20121225 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20130124 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130124 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20130124 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5200288 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20160222 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |