JP4980437B2 - フラーレン誘導体とその製造方法、並びにこれを用いたアレルゲン吸着剤 - Google Patents
フラーレン誘導体とその製造方法、並びにこれを用いたアレルゲン吸着剤 Download PDFInfo
- Publication number
- JP4980437B2 JP4980437B2 JP2010025303A JP2010025303A JP4980437B2 JP 4980437 B2 JP4980437 B2 JP 4980437B2 JP 2010025303 A JP2010025303 A JP 2010025303A JP 2010025303 A JP2010025303 A JP 2010025303A JP 4980437 B2 JP4980437 B2 JP 4980437B2
- Authority
- JP
- Japan
- Prior art keywords
- fullerene
- halogen group
- producing
- hydroxylated
- chlorinated
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- VKLVOHPABGBAPA-UHFFFAOYSA-N CCCC[N](C)(=C)(=C)=C Chemical compound CCCC[N](C)(=C)(=C)=C VKLVOHPABGBAPA-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/22—Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof comprising organic material
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y30/00—Nanotechnology for materials or surface science, e.g. nanocomposites
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y40/00—Manufacture or treatment of nanostructures
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B32/00—Carbon; Compounds thereof
- C01B32/15—Nano-sized carbon materials
- C01B32/152—Fullerenes
- C01B32/156—After-treatment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C17/00—Preparation of halogenated hydrocarbons
- C07C17/013—Preparation of halogenated hydrocarbons by addition of halogens
- C07C17/02—Preparation of halogenated hydrocarbons by addition of halogens to unsaturated hydrocarbons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C25/00—Compounds containing at least one halogen atom bound to a six-membered aromatic ring
- C07C25/18—Polycyclic aromatic halogenated hydrocarbons
- C07C25/22—Polycyclic aromatic halogenated hydrocarbons with condensed rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/09—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrolysis
- C07C29/12—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrolysis of esters of mineral acids
- C07C29/124—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrolysis of esters of mineral acids of halides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/48—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by oxidation reactions with formation of hydroxy groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/62—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by introduction of halogen; by substitution of halogen atoms by other halogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C35/00—Compounds having at least one hydroxy or O-metal group bound to a carbon atom of a ring other than a six-membered aromatic ring
- C07C35/48—Halogenated derivatives
- C07C35/52—Alcohols with a condensed ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2604/00—Fullerenes, e.g. C60 buckminsterfullerene or C70
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S977/00—Nanotechnology
- Y10S977/70—Nanostructure
- Y10S977/734—Fullerenes, i.e. graphene-based structures, such as nanohorns, nanococoons, nanoscrolls or fullerene-like structures, e.g. WS2 or MoS2 chalcogenide nanotubes, planar C3N4, etc.
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S977/00—Nanotechnology
- Y10S977/70—Nanostructure
- Y10S977/734—Fullerenes, i.e. graphene-based structures, such as nanohorns, nanococoons, nanoscrolls or fullerene-like structures, e.g. WS2 or MoS2 chalcogenide nanotubes, planar C3N4, etc.
- Y10S977/735—Carbon buckyball
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S977/00—Nanotechnology
- Y10S977/70—Nanostructure
- Y10S977/734—Fullerenes, i.e. graphene-based structures, such as nanohorns, nanococoons, nanoscrolls or fullerene-like structures, e.g. WS2 or MoS2 chalcogenide nanotubes, planar C3N4, etc.
- Y10S977/735—Carbon buckyball
- Y10S977/736—Carbon buckyball having atoms interior to the carbon cage
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S977/00—Nanotechnology
- Y10S977/70—Nanostructure
- Y10S977/734—Fullerenes, i.e. graphene-based structures, such as nanohorns, nanococoons, nanoscrolls or fullerene-like structures, e.g. WS2 or MoS2 chalcogenide nanotubes, planar C3N4, etc.
- Y10S977/735—Carbon buckyball
- Y10S977/737—Carbon buckyball having a modified surface
- Y10S977/74—Modified with atoms or molecules bonded to the surface
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Nanotechnology (AREA)
- General Physics & Mathematics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Physics & Mathematics (AREA)
- Crystallography & Structural Chemistry (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- Materials Engineering (AREA)
- Analytical Chemistry (AREA)
- Composite Materials (AREA)
- Manufacturing & Machinery (AREA)
- Inorganic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Carbon And Carbon Compounds (AREA)
Description
〔非特許文献1〕J.Am.Chem.Soc.,1991,113,9900
〔非特許文献2〕J.Chem.Soc.,Chem.Commun.,1993,1230
〔非特許文献3〕Eur.J.Org.Chem.,2005,4951
フッ素化フラーレン、塩素化フラーレンおよび臭素化フラーレンの製造方法が下記特許文献4に開示されている。
〔特許文献4〕 特開2002−193861号公報
下記非特許文献4にはフッ素化フラーレンC60F48の製造方法が開示されている。
〔非特許文献4〕Angew.Chem.Int.Ed.2001,40,2285
下記非特許文献5には臭素化フラーレンC60Br16の製造方法が開示されている。
〔非特許文献5〕Science,1992,256,822
なお、本発明のフラーレン誘導体の製造方法において、出発原料となるハロゲン化フラーレンは、どのような方法で製造したものであってもよい。
〔特許文献5〕 特開平7−48302号公報
〔特許文献6〕 国際公開WO2008/096763号公報
〔非特許文献6〕J.Org.Chem.,1994,59,3960
〔非特許文献7〕Synth.Commun.,2005,35,1803
〔非特許文献8〕ACS Nano,2008,2,327
などに開示されている方法により製造することができる。
〔特許文献4〕 特開2002−193861号公報
〔非特許文献9〕Fullerenes,Nanotubes,and Carbon Nanostructures, 2005,13,331
上記のように従来からハロゲン化フラーレンや水酸化フラーレンは知られているが、本発明のフラーレン誘導体のようにハロゲン基と水酸基が共存した部分ハロゲン化水酸化フラーレン誘導体はこれまでに知られていない。
塩素化フラーレンを部分水酸化(method A)する場合、導入される塩素置換基の数nは出発原料の塩素化フラーレン中の塩素置換基数n’と同じか、または水酸基への置換反応により減少している。部分水酸化の方法は、水酸化ナトリウムや水酸化カリウムなどの塩基触媒を用いた一般的な加水分解反応や、過酸化水素水を用いる水酸化反応があるが、これら手法に特に限定されるものではない。例えば、部分水酸化するための水酸化試薬としては、水酸化ナトリウムや水酸化カリウムの他に、LiOH、RbOH、CsOH、Ca(OH)2、Sr(OH)2、Ba(OH)2、TlOH、nBuN(OH)、Triton Bなどが挙げられる。
o−ジクロロベンゼン、クロロベンゼン、トリメチルベンゼン、キシレン、トルエン、ベンゼンなどの芳香族溶媒、
塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、テトラクロロエタンなどのハロゲン溶媒、
THF、エーテル、酢酸エチル、ジオキサン、DMF、DMSOなどの非プロトン性極性溶媒、
その他、二硫化炭素、アセトニトリルなどが考えられる。
特許文献6に開示された方法により合成した。すなわち、C60(市販品:商品名「nanom purple」フロンティアカーボン社製)100mgをトルエン(50mL)に溶解させ、30%過酸化水素水5mLおよび相間移動触媒として水酸化テトラn−ブチルアンモニウム(40%水溶液、500μL)を加え、60℃で16時間攪拌した。この溶液から無色になったトルエン層を除去した。トルエン層除去後の水層を、ヘキサン、ジエチルエーテル、2−プロパノールをそれぞれ5:5:7の割合で混合した溶液85mLに超音波照射しながら滴下し、淡黄色固体を析出させた。生じた沈殿を遠心分離により沈降させた後、デカンテーションにより上澄み液を除いた。この固体を60mLのジエチルエーテルを用いて洗浄し、再沈降させた後、上澄み液を除き、室温で終夜真空乾燥した。これにより反応粗生成物の水酸化フラーレンを淡黄色粉末として得た。
上記の方法により得たC60(OH)44・8H2O(200mg)をテトラヒドロフラン(THF)2.5mL中に超音波を5分間照射することでよく分散させて、ICl(0.5mL)を加え、室温(rt)で2.5時間反応を行った(下記化2)。固体が消失し、赤褐色のクリアな溶液になったことを確認した後、減圧下においてTHF、IClを、エバポレータを用いて留去した。更に、残渣中に黒紫色固体として含まれる副生したヨウ素を除去するため、ヘキサンを用いて約20回洗浄することを繰り返し、ろ液の色が薄い赤色になったところで褐色固体を遠心分離により取り出し、室温で終夜真空乾燥を行った(収量208mg、収率100%)。
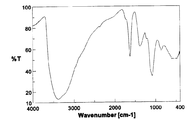
このようにして得られた生成物の赤外線吸収(IR)スペクトルを図2に示した。図2に示すIRスペクトルは、出発原料として用いた水酸化フラーレンC60(OH)44・8H2Oのスペクトル(図1)とは若干異なっており、反応が進行したことを示唆するとともに、水酸化フラーレンのスペクトルの特徴(水酸基のO−H伸縮に基づく3400cm-1付近の大きなブロードな吸収とともに、C−CおよびC−O伸縮に基づく1620、1380、1080cm-1付近にブロードな吸収)を残していた。また、この生成物の熱重量分析において、室温から100℃付近まで加熱する間に重量減少が5.0wt%見られた。この重量減少分を生成物に含まれる二次結合水の量と見積もった。元素分析の値はC;41.87%,H;3.00%,Cl;21.84%となり、C60Cl10(OH)30・5H2Oの計算値(C;43.01%,H;2.41%,Cl;21.16%,水;5.4wt%)とよく一致した。
実施例1の方法により得た水酸化フラーレンC60(OH)44・8H2Oの(200mg)をICl(1mL)と、室温で24時間反応を行った(下記化3)。黒色の粘性の高いスラリー状残渣をヘキサンにて約15回洗浄することを繰り返し、メタノールに溶解させ、減圧下においてメタノールを、エバポレータを用いて留去した。この茶色固体をエタノール中に加え、超音波照射することでよく分散させ、これにヘキサンを加えた。析出した黄色固体を遠心分離により取り出し、ジエチルエーテルで洗浄後、室温で終夜真空乾燥を行った(収量120mg、収率63%)。
このようにして得られた生成物のIRスペクトルを図3に示した。図3のIRスペクトルは、出発原料として用いた水酸化フラーレンC60(OH)44・8H2Oの図1に示したIRスペクトルとは若干異なっており、反応が進行したことを示唆するとともに、水酸化フラーレンのスペクトルの特徴を残していた。また、この生成物の熱重量分析によれば、室温から120℃付近まで加熱する間に重量減少が7.4wt%見られた。この重量減少分を生成物に含まれる二次結合水の量と見積もった。元素分析の値はC;46.73%,H;2.56%,Cl;4.76%となり、C60Cl2(OH)38・6H2Oの計算値(C;46.61%,H;3.26%,Cl;4.59%,水;7.0wt%)とよく一致した。
非特許文献6に開示された方法により合成した。すなわち、C60(10g)と60%発煙硫酸(150mL)を窒素雰囲気下に55〜60℃で3日間攪拌した。得られた反応混合物を氷浴中のジエチルエーテル中に激しく攪拌しながら滴下し、生成した沈殿物を遠心分離にて分離した。得られた沈殿物をジエチルエーテルで洗浄し、遠心分離にて分離した後、更に、ジエチルエーテル/アセトニトリル混合溶媒で洗浄し、遠心分離にて分離し、これを40℃で真空乾燥して、ポリシクロ硫酸化フラーレン13gを赤橙色粉末として得た。このポリシクロ硫酸化フラーレン(5.0g)と蒸留水(100mL)を窒素雰囲気下、85℃で10時間攪拌し、生成した沈殿物を遠心分離にて分離した。得られた沈殿物を水で洗浄し、遠心分離した後、40℃で真空乾燥して、水酸化フラーレンC60(OH)12・5H2Oを茶褐色粉末として得た(収量4.5g)。得られた生成物のIRスペクトルを図4に示す。
上記の方法により得たC60(OH)12・5H2O(100mg)をICl(1mL)と室温で24時間反応を行った(下記化4)。黒色の粘性の高いスラリー状残渣をヘキサンにて約15回洗浄することを繰り返し、THFを加え、超音波照射することでよく分散させ、これにヘキサンを加えた。ヘキサンを加えたことにより析出した黄色固体を遠心分離により取り出し、室温で終夜真空乾燥を行った(収量117mg、収率71%)。
この生成物のIRスペクトルを図5に示した。図5に示したIRスペクトルは、出発原料として用いた水酸化フラーレンC60(OH)12・5H2OのIRスペクトル(図4参照)とは若干異なっており、反応が進行したことを示唆するとともに、水酸化フラーレンのスペクトルの特徴を残していた。また、その熱重量分析において、室温から110℃付近まで加熱する間に重量減少が9.7wt%見られたことから、この重量減少分を生成物に含まれる二次結合水の量と見積もった。元素分析の値はC;42.68%,H;1.60%,Cl;32.57%となり、C60Cl15(OH)15・9H2Oの計算値(C;42.68%,H;1.99%,Cl;31.85%,水;9.7wt%)とよく一致した。
実施例1の方法により得た水酸化フラーレンC60(OH)12・5H2O(100mg)をTHF2.5mL中に超音波を5分間照射することでよく分散させ、ICl(0.5mL)を加え、室温で24時間反応を行った(下記化5)。反応終了後、減圧下においてTHF、ヨウ素を留去した。残渣をヘキサンにて約10回洗浄することを繰り返し、酢酸エチルを加え、超音波照射することでよく分散させた。得られた橙色固体にさらにヘキサンを加えて超音波照射しながら、3回洗浄した。その後、橙色固体を遠心分離により取り出し、室温で終夜真空乾燥を行った(収量123mg、収率100%)。
生成物のIRスペクトルを図6に示した。図6のIRスペクトルは、出発原料として用いた水酸化フラーレンC60(OH)12・5H2Oのスペクトル(図4参照)とは若干異なっており、反応が進行したことを示唆するとともに、水酸化フラーレンのスペクトルの特徴を残していた。また、生成物の熱重量分析によれば、室温から110℃付近まで加熱する間に重量減少が7.9wt%見られた。この重量減少分を生成物に含まれる二次結合水の量と見積もった。元素分析の値はC;58.89%,H;3.86%,Cl;15.22%となり、C60Cl5(OH)15・5H2Oの計算値(C;57.97%,H;2.03%,Cl;14.26%,水;7.2wt%)とよく一致した。
非特許文献2に開示された方法により合成した。すなわち、C60(2.33g)のo−ジクロロベンゼン(ODCB)溶液60mLに、アルゴン雰囲気下、ICl(7.5g)のo−ジクロロベンゼン溶液20mLを滴下し、室温にて6時間反応を行った(下記化6)。反応が終了したことを高速液体クロマトグラフィー(HPLC)にて確認した後、o−ジクロロベンゼンおよび副生するヨウ素を、エバポレータを用いて留去した。残渣をヘキサンで洗浄後、遠心分離にて固体を取り出し、さらにもう一度ペンタンで洗浄後、遠心分離によりオレンジ色の固体を取り出した。これを室温で終夜真空乾燥を行った(収量2.53g、収率78%)。
液体クロマトグラフィー質量分析(LCMS)測定により、ほぼ1本の大きな生成物ピークの中に、C60Cl5(M=895)に相当すると思われるM=897のフラグメントピークを得た。生成物のIRスペクトルを図7に示した。図7のIRスペクトルは、非特許文献2に記載の塩素化フラーレンC60Cl6のIRスペクトルとよく類似していた。元素分析の値はC;72.53%,Cl;28.24%となり、C60Cl8の計算値(C;71.76%,Cl;28.55%)とよく一致した。
上記で作成したC60Cl8(1g)を1,3,4−トリメチルベンゼン(TMB)50mLに溶解させ、相間移動触媒として水酸化テトラn−ブチルアンモニウム(TBAH)の40%水溶液(5mL)存在下、30%の過酸化水素水溶液(H2O2aq)(30mL)と70℃で20時間反応を行った(下記化7)。上層の有機相の赤色がほぼ消失したことを確認した後、下層の黄褐色水溶液(約30mL)を取り出した。これに2−プロパノール、酢酸エチル、ヘキサンをそれぞれ加えた。沈殿させた黄色固体を遠心分離により取り出し、室温で終夜真空乾燥を行った(収量980mg、収率66%)。
この生成物のIRスペクトルを図8に示した。図8のIRスペクトルは、出発原料として用いた塩素化フラーレンC60Cl8のIRスペクトル(図7参照)と大きく異なっており、反応が進行したことを示唆するとともに、水酸化フラーレンのスペクトルの特徴を残していた。また、その熱重量分析において、室温から100℃付近まで加熱する間に重量減少が9.8wt%見られた。この重量減少分を生成物に含まれる二次結合水の量と見積もった。元素分析の値はC;48.29%,H;3.10%,Cl;1.06%となり、C60Cl0.5(OH)35.5・8H2Oの計算値(C;48.49%,H;3.49%,Cl;1.19%,水;9.7wt%)とよく一致した。
非特許文献3に開示された方法により合成した。すなわち、C60(400mg)にICl(2mL)を加え、アルゴン雰囲気下、120℃にて40時間反応を行った(下記化8)。反応終了後、反応器上部に析出した黒紫色のヨウ素の結晶を除去し、得られた茶色固体を室温で終夜真空乾燥を行った(収量931mg、収率98%)。
上記で作成したC60Cl28(50mg)に、フラーレン核に対し14当量の濃度となるよう調製した水酸化ナトリウム水溶液(40.8mM、10mL)を加え、超音波照射により水に分散させ、60℃で1時間反応を行った(下記化9)。pH試験紙を用いて溶液が中性になったことを確認した後、メタノールを加えて沈殿させた茶色固体を遠心分離により取り出し、エーテルで洗浄した。その後、室温で終夜真空乾燥を行った(収量31.4mg、収率79%)。
非特許文献5に開示された方法により合成した。すなわち、C60(700mg)にBr2(12mL)を加え、アルゴン雰囲気下、室温にて10日間反応を行った(下記化10)。反応終了後、ヘキサン中に反応溶液を加えて、生じた茶色固体を遠心分離により取り出し、少量のクロロホルムに溶解させた。その後、ヘキサンを加えて再沈殿させた。更に、エーテルで洗浄した後、室温で終夜真空乾燥を行った(収量1587mg、収率82%)。
上記で作成したC60Br16(50mg)に、フラーレン核に対し8当量の濃度となるよう調製した水酸化ナトリウムの水溶液(20.0mM、10mL)を加え、超音波照射により水に分散させ、60℃で30分反応を行った(下記化11)。pH試験紙を用いて溶液が中性になったことを確認した後、これに水の体積に対して5:6:7の比でヘキサン、ジエチルエーテル、2−プロパノールを加えて沈殿させた茶色固体を遠心分離により取り出した。これをエーテルで洗浄した後、室温で終夜真空乾燥を行った(収量32.4mg、収率99%)。
<スギ花粉アレルゲン(Cry j 1)に対する試料の反応試験>
実施例1〜5で合成した化合物の1%(w/v)溶液試料を調製し、リン酸緩衝液に溶解したアレルゲン(Cry j 1)を100ng/mLとなるよう加え、ボルテックスで混合後、4℃で振とうしながら反応させた。所定時間(5分および30分後)毎に溶液を回収し、遠心処理をした上清について、サンドイッチELISA法(酵素免疫測定法Enzyme-Linked Immunosorbent Assay)を用いてアレルゲン濃度(A)を測定した。比較としてフラーレン試料を加えなかったアレルゲン溶液の濃度(B)を用い、下記の式からアレルゲン減少率(%)を求めた。
実施例1で合成した水酸化フラーレンC60(OH)44・8H2Oを用いて、上記試験例1と同じアレルゲン吸着試験を同条件下で行った。結果は、60分後でも6.2%の減少に止まった。
Claims (8)
- フラーレン核にハロゲン基が結合しているハロゲン化フラーレンを、一部のハロゲン基を残したまま、水酸基をフラーレン核に結合させて、部分ハロゲン化水酸化フラーレンを生成することを特徴とするフラーレン誘導体の製造方法。
- ハロゲン基が塩素である塩素化フラーレンと過酸化水素とを反応させることを特徴とする請求項1記載のフラーレン誘導体の製造方法。
- ハロゲン基が塩素である塩素化フラーレンと水酸化ナトリウムとを反応させることを特徴とする請求項1記載のフラーレン誘導体の製造方法。
- ハロゲン基が塩素である塩素化フラーレンと水酸化カリウムとを反応させることを特徴とする請求項1記載のフラーレン誘導体の製造方法。
- ハロゲン基が臭素である臭素化フラーレンと水酸化ナトリウムとを反応させることを特徴とする請求項1記載のフラーレン誘導体の製造方法。
- ハロゲン基が臭素である臭素化フラーレンと水酸化カリウムとを反応させることを特徴とする請求項1記載のフラーレン誘導体の製造方法。
- フラーレン核に水酸基が結合している水酸化フラーレンを、一部の水酸基を残したまま、ハロゲン基をフラーレン核に結合させて、部分ハロゲン化水酸化フラーレンを生成することを特徴とするフラーレン誘導体の製造方法。
- フラーレン核に水酸基が結合している水酸化フラーレンを、塩化ヨウ素と反応させて、一部の水酸基を残したまま、塩素をフラーレン核に結合させて、部分塩素化水酸化フラーレンを生成することを特徴とするフラーレン誘導体の製造方法。
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010025303A JP4980437B2 (ja) | 2010-02-08 | 2010-02-08 | フラーレン誘導体とその製造方法、並びにこれを用いたアレルゲン吸着剤 |
| CN201180006254.9A CN102858686B (zh) | 2010-02-08 | 2011-01-31 | 富勒烯衍生物及其制备方法、以及使用其的变应原吸附剂 |
| EP11739697.8A EP2535313B1 (en) | 2010-02-08 | 2011-01-31 | Fullerene derivative, process for production of same, and allergen adsorbent comprising same |
| PCT/JP2011/051864 WO2011096349A1 (ja) | 2010-02-08 | 2011-01-31 | フラーレン誘導体とその製造方法、並びにこれを用いたアレルゲン吸着剤 |
| US13/577,868 US8957261B2 (en) | 2010-02-08 | 2011-01-31 | Method for producing partially halogenated, hydroxylated fullerene |
| US14/495,438 US8987526B2 (en) | 2010-02-08 | 2014-09-24 | Partially halogenated, hydroxylated fullerene and allergen adsorbent using the same |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010025303A JP4980437B2 (ja) | 2010-02-08 | 2010-02-08 | フラーレン誘導体とその製造方法、並びにこれを用いたアレルゲン吸着剤 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011162468A JP2011162468A (ja) | 2011-08-25 |
| JP2011162468A5 JP2011162468A5 (ja) | 2012-04-19 |
| JP4980437B2 true JP4980437B2 (ja) | 2012-07-18 |
Family
ID=44355347
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010025303A Active JP4980437B2 (ja) | 2010-02-08 | 2010-02-08 | フラーレン誘導体とその製造方法、並びにこれを用いたアレルゲン吸着剤 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US8957261B2 (ja) |
| EP (1) | EP2535313B1 (ja) |
| JP (1) | JP4980437B2 (ja) |
| CN (1) | CN102858686B (ja) |
| WO (1) | WO2011096349A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013026155A (ja) | 2011-07-25 | 2013-02-04 | Yazaki Corp | 防水コネクタ用端子 |
| JP5806077B2 (ja) * | 2011-10-11 | 2015-11-10 | 本荘ケミカル株式会社 | フラーレン内包シリカゲルの製造方法 |
| US20150333124A1 (en) * | 2012-12-20 | 2015-11-19 | Basf Se | Edge halogenation of graphene materials |
| JP2016017063A (ja) * | 2014-07-10 | 2016-02-01 | 国立大学法人大阪大学 | 長鎖アルキルエーテル化フラーレン誘導体およびその製造方法、並びにそれを用いた樹脂組成物 |
| KR20200010806A (ko) | 2018-07-23 | 2020-01-31 | 삼성전자주식회사 | 연마 슬러리 및 그 제조 방법과 반도체 소자의 제조 방법 |
| KR102653892B1 (ko) | 2018-08-30 | 2024-04-02 | 삼성전자주식회사 | 화학적 기계적 연마용 슬러리 조성물, 그의 제조 방법, 및 그를 이용한 반도체 소자의 제조 방법 |
| CN110963480A (zh) * | 2018-09-29 | 2020-04-07 | 蔡蓼芸 | 一种富勒烯衍生物、制备方法及其应用 |
| US10934168B1 (en) * | 2020-04-21 | 2021-03-02 | Terry Earl Brady | Synthetic, multifaceted halogenated, functionalized fullerenes engineered for microbicidal effects employing controlled contact for safe therapeutic and environmental utility |
| US11638720B1 (en) * | 2022-08-15 | 2023-05-02 | Terry Earl Brady | Risk mitigation of infectious disease transmission from incidental and intimate contact using atomic scale molecular disruption and biocidal halo-fullerenes delivered via topical, flushing and enteral mechanisms |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0748302A (ja) | 1993-07-30 | 1995-02-21 | Tokyo Gas Co Ltd | フラロールの合成方法 |
| JP2000005531A (ja) | 1998-06-19 | 2000-01-11 | Matsushita Seiko Co Ltd | 抗アレルゲンフィルターと該フィルターを設けた空気清浄機および換気装置およびマスク |
| JP2002167332A (ja) | 2000-11-30 | 2002-06-11 | Lion Corp | アレルゲン吸着組成物 |
| JP4848585B2 (ja) * | 2000-12-25 | 2011-12-28 | ソニー株式会社 | フラーレン誘導体の製造方法及びそのフラーレン誘導体、プロトン伝導体、並びに電気化学デバイス |
| JP3886893B2 (ja) | 2002-12-26 | 2007-02-28 | 株式会社荏原製作所 | 花粉吸着材 |
| JP4596764B2 (ja) * | 2003-09-30 | 2010-12-15 | 株式会社ネオス | 含フッ素フラレノール誘導体及びその製造方法 |
| CN1874981A (zh) * | 2003-10-28 | 2006-12-06 | 理想星株式会社 | 内含式富勒烯衍生物、质子导体和燃料电池 |
| US20070145352A1 (en) * | 2003-10-28 | 2007-06-28 | Ideal Star Inc. | Endohedral fullerene derivative, proton conductor and fuel cell |
| JP2007254246A (ja) * | 2006-03-27 | 2007-10-04 | Central Glass Co Ltd | フッ化フラーレンを含有する溶解液、または分散液 |
| JP5032089B2 (ja) * | 2006-10-11 | 2012-09-26 | 一般財団法人 化学物質評価研究機構 | フラーレン類の水分散方法 |
| JP5250433B2 (ja) | 2007-02-09 | 2013-07-31 | 国立大学法人大阪大学 | 相間移動触媒およびポリ水酸化フラーレンの製造方法 |
| JP5119732B2 (ja) * | 2007-05-10 | 2013-01-16 | 三菱化学株式会社 | フラーレン誘導体及びその製造方法 |
-
2010
- 2010-02-08 JP JP2010025303A patent/JP4980437B2/ja active Active
-
2011
- 2011-01-31 CN CN201180006254.9A patent/CN102858686B/zh active Active
- 2011-01-31 WO PCT/JP2011/051864 patent/WO2011096349A1/ja active Application Filing
- 2011-01-31 EP EP11739697.8A patent/EP2535313B1/en not_active Not-in-force
- 2011-01-31 US US13/577,868 patent/US8957261B2/en active Active
-
2014
- 2014-09-24 US US14/495,438 patent/US8987526B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| US20130041185A1 (en) | 2013-02-14 |
| US8957261B2 (en) | 2015-02-17 |
| CN102858686A (zh) | 2013-01-02 |
| US8987526B2 (en) | 2015-03-24 |
| US20150011802A1 (en) | 2015-01-08 |
| EP2535313A1 (en) | 2012-12-19 |
| WO2011096349A1 (ja) | 2011-08-11 |
| CN102858686B (zh) | 2016-01-20 |
| EP2535313B1 (en) | 2017-11-29 |
| JP2011162468A (ja) | 2011-08-25 |
| EP2535313A4 (en) | 2014-05-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4980437B2 (ja) | フラーレン誘導体とその製造方法、並びにこれを用いたアレルゲン吸着剤 | |
| Zhang et al. | Orthogonal, convergent syntheses of dendrimers based on melamine with one or two unique surface sites for manipulation | |
| Pontón et al. | The effects of the chemical composition of titanate nanotubes and solvent type on 3-aminopropyltriethoxysilane grafting efficiency | |
| US8410196B2 (en) | Surface-modified nanodiamond and its producing method | |
| Abukhadra et al. | Insight into the antimicrobial and photocatalytic properties of NiO impregnated MCM-48 for effective removal of pathogenic bacteria and toxic levofloxacin residuals | |
| Prabu et al. | Non-covalent polyhedral oligomeric silsesquioxane-polyoxometalates as inorganic–organic–inorganic hybrid materials for visible-light photocatalytic splitting of water | |
| Vashurin et al. | Sulfonated octa‐substituted Co (II) phthalocyanines immobilized on silica matrix as catalyst for Thiuram E synthesis | |
| CN114524813A (zh) | 对沙林具有荧光响应的一维有机半导体纳米材料及其制备方法和应用 | |
| CN113173575A (zh) | 一种铜纳米颗粒/富勒醇纳米复合材料及其制备方法和应用 | |
| Epelde-Elezcano et al. | Adapting BODIPYs to singlet oxygen production on silica nanoparticles | |
| Ziarani et al. | 2-Chloroquinoline-3-carbaldehyde modified nanoporous SBA-15-propylamine (SBA-Pr-NCQ) as a selective and sensitive Ag+ ion sensor in aqueous media | |
| JP6910602B2 (ja) | 表面修飾ナノダイヤモンドの製造方法、及び表面修飾ナノダイヤモンド | |
| JP2014172781A (ja) | 表面修飾グラフェン | |
| Radi et al. | Synthesis and characterization of novel silica gel supported N-pyrazole ligand for selective elimination of Hg (II) | |
| Jamasbi et al. | Highly silver-selective fluorescent sensor based on functionalized nanoporous silica (SBA-Pr-NMP) in aqueous media | |
| RU2548971C2 (ru) | Способ получения водных нанодисперсий фуллерена | |
| JP2005239863A (ja) | キラル配向構造を有する有機/無機複合体及びその製造法 | |
| Farahani et al. | Adsorptive Removal of Methylene Blue from Aqueous Medium by a Triazine-Based Covalent Organic Framework | |
| Radi et al. | New polysiloxane‐chemically immobilized C, C‐bipyrazolic receptor for heavy metals adsorption | |
| Calhau et al. | One‐Pot Intercalation Strategy for the Encapsulation of a CO‐Releasing Organometallic Molecule in a Layered Double Hydroxide | |
| KR101870321B1 (ko) | 금속 이온의 고선택적 광학센싱을 위한 유기-무기 하이브리드 나노 세공 실리카 물질과 이의 제조방법 | |
| JPH0770470A (ja) | 無機化合物の製造方法 | |
| Nosach et al. | Gas-phase crosslinking of the lignin on the nanoscale fumed silica surface | |
| Sabran et al. | Systematic Study of Calcination Temperature on Photocatalytic Activity of Luminescent Copper (I) Pyrazolate Complex/Titanium Oxide Composites | |
| KR100840544B1 (ko) | 작용기로 치환된 알킬기, 또는 페닐기를 함유한트리알콕시실란을 이용한 실리카 입자의 표면개질방법 및그 실리카 입자 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120222 Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20120222 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120222 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20120222 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20120321 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120410 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120418 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150427 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4980437 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |