JP4891908B2 - 4−(3−メタンスルホニルフェニル)−1−n−プロピルピペリジンの合成方法 - Google Patents
4−(3−メタンスルホニルフェニル)−1−n−プロピルピペリジンの合成方法 Download PDFInfo
- Publication number
- JP4891908B2 JP4891908B2 JP2007536091A JP2007536091A JP4891908B2 JP 4891908 B2 JP4891908 B2 JP 4891908B2 JP 2007536091 A JP2007536091 A JP 2007536091A JP 2007536091 A JP2007536091 A JP 2007536091A JP 4891908 B2 JP4891908 B2 JP 4891908B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- acid
- compound
- oxidant
- formula iii
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000034 method Methods 0.000 title claims description 24
- YGKUEOZJFIXDGI-UHFFFAOYSA-N pridopidine Chemical compound C1CN(CCC)CCC1C1=CC=CC(S(C)(=O)=O)=C1 YGKUEOZJFIXDGI-UHFFFAOYSA-N 0.000 title description 9
- 230000002194 synthesizing effect Effects 0.000 title 1
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 28
- 150000001875 compounds Chemical class 0.000 claims description 26
- 230000001590 oxidative effect Effects 0.000 claims description 26
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 19
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 16
- 238000010531 catalytic reduction reaction Methods 0.000 claims description 16
- 239000007800 oxidant agent Substances 0.000 claims description 16
- 239000002253 acid Substances 0.000 claims description 13
- 150000003839 salts Chemical class 0.000 claims description 13
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 claims description 12
- 239000003054 catalyst Substances 0.000 claims description 12
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 10
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 claims description 10
- 229910052763 palladium Inorganic materials 0.000 claims description 10
- 238000009903 catalytic hydrogenation reaction Methods 0.000 claims description 9
- 150000002978 peroxides Chemical group 0.000 claims description 7
- 230000008569 process Effects 0.000 claims description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 7
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 claims description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 5
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 claims description 5
- 239000007864 aqueous solution Substances 0.000 claims description 5
- 229910052799 carbon Inorganic materials 0.000 claims description 5
- 230000003197 catalytic effect Effects 0.000 claims description 5
- 229910052707 ruthenium Inorganic materials 0.000 claims description 5
- 239000002904 solvent Substances 0.000 claims description 5
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical group [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 claims description 5
- 229910052721 tungsten Inorganic materials 0.000 claims description 5
- 239000010937 tungsten Substances 0.000 claims description 5
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 claims description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 claims description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 4
- PFUVRDFDKPNGAV-UHFFFAOYSA-N sodium peroxide Chemical group [Na+].[Na+].[O-][O-] PFUVRDFDKPNGAV-UHFFFAOYSA-N 0.000 claims description 4
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 claims description 3
- 230000018044 dehydration Effects 0.000 claims description 3
- 238000006297 dehydration reaction Methods 0.000 claims description 3
- 229910017604 nitric acid Inorganic materials 0.000 claims description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 claims description 2
- 229910052697 platinum Inorganic materials 0.000 claims description 2
- XMVONEAAOPAGAO-UHFFFAOYSA-N sodium tungstate Chemical group [Na+].[Na+].[O-][W]([O-])(=O)=O XMVONEAAOPAGAO-UHFFFAOYSA-N 0.000 claims description 2
- 239000008096 xylene Substances 0.000 claims description 2
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 18
- 238000006243 chemical reaction Methods 0.000 description 11
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 8
- 239000012071 phase Substances 0.000 description 8
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 7
- 239000002002 slurry Substances 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 6
- 238000007792 addition Methods 0.000 description 6
- 239000008346 aqueous phase Substances 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000011734 sodium Substances 0.000 description 6
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 4
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 4
- 229910052708 sodium Inorganic materials 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 239000012065 filter cake Substances 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 239000000203 mixture Substances 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 2
- NKYFJZAKUPSUSH-UHFFFAOYSA-N 1-bromo-3-methylsulfanylbenzene Chemical compound CSC1=CC=CC(Br)=C1 NKYFJZAKUPSUSH-UHFFFAOYSA-N 0.000 description 2
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- KFSLWBXXFJQRDL-UHFFFAOYSA-N Peracetic acid Chemical compound CC(=O)OO KFSLWBXXFJQRDL-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 2
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 2
- 229940092714 benzenesulfonic acid Drugs 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 239000012267 brine Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 239000001530 fumaric acid Substances 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 229910052703 rhodium Inorganic materials 0.000 description 2
- 239000010948 rhodium Substances 0.000 description 2
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 2
- -1 sodium alkoxide Chemical class 0.000 description 2
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 2
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000011975 tartaric acid Substances 0.000 description 2
- 235000002906 tartaric acid Nutrition 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 125000003944 tolyl group Chemical group 0.000 description 2
- 238000009901 transfer hydrogenation reaction Methods 0.000 description 2
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- YGDZKYYCJUNORF-UHFFFAOYSA-N 1-propylpiperidin-4-one Chemical compound CCCN1CCC(=O)CC1 YGDZKYYCJUNORF-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- FJISPRHDUCZULL-UHFFFAOYSA-L C(C)(C)C1=CC=C(C[Ru](Cl)Cl)C=C1 Chemical compound C(C)(C)C1=CC=C(C[Ru](Cl)Cl)C=C1 FJISPRHDUCZULL-UHFFFAOYSA-L 0.000 description 1
- PKHAHMGOSZSDOV-UHFFFAOYSA-L C1(C=CC=C1)[Rh](Cl)Cl Chemical compound C1(C=CC=C1)[Rh](Cl)Cl PKHAHMGOSZSDOV-UHFFFAOYSA-L 0.000 description 1
- AGVSQJVNKWEDDW-UHFFFAOYSA-L C1(C=CC=C1)[Ru](Cl)Cl Chemical compound C1(C=CC=C1)[Ru](Cl)Cl AGVSQJVNKWEDDW-UHFFFAOYSA-L 0.000 description 1
- SCFMBSPOJRWZHC-UHFFFAOYSA-M CC1=C(C(=C(C1(C)[Rh](C1(C(=C(C(=C1C)C)C)C)C)Cl)C)C)C Chemical compound CC1=C(C(=C(C1(C)[Rh](C1(C(=C(C(=C1C)C)C)C)C)Cl)C)C)C SCFMBSPOJRWZHC-UHFFFAOYSA-M 0.000 description 1
- GHOKWGTUZJEAQD-UHFFFAOYSA-N Chick antidermatitis factor Natural products OCC(C)(C)C(O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-UHFFFAOYSA-N 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 239000005708 Sodium hypochlorite Substances 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 238000010533 azeotropic distillation Methods 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 230000020169 heat generation Effects 0.000 description 1
- 229960000443 hydrochloric acid Drugs 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 229940045996 isethionic acid Drugs 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229960000448 lactic acid Drugs 0.000 description 1
- CETVQRFGPOGIQJ-UHFFFAOYSA-N lithium;hexane Chemical compound [Li+].CCCCC[CH2-] CETVQRFGPOGIQJ-UHFFFAOYSA-N 0.000 description 1
- 229940098895 maleic acid Drugs 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229940099690 malic acid Drugs 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 239000011733 molybdenum Substances 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 229910052762 osmium Inorganic materials 0.000 description 1
- SYQBFIAQOQZEGI-UHFFFAOYSA-N osmium atom Chemical compound [Os] SYQBFIAQOQZEGI-UHFFFAOYSA-N 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- 229940055726 pantothenic acid Drugs 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- XCRBXWCUXJNEFX-UHFFFAOYSA-N peroxybenzoic acid Chemical compound OOC(=O)C1=CC=CC=C1 XCRBXWCUXJNEFX-UHFFFAOYSA-N 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 239000011736 potassium bicarbonate Substances 0.000 description 1
- 235000015497 potassium bicarbonate Nutrition 0.000 description 1
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 235000011181 potassium carbonates Nutrition 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 150000003138 primary alcohols Chemical class 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 201000000980 schizophrenia Diseases 0.000 description 1
- 150000003333 secondary alcohols Chemical class 0.000 description 1
- XUXNAKZDHHEHPC-UHFFFAOYSA-M sodium bromate Chemical compound [Na+].[O-]Br(=O)=O XUXNAKZDHHEHPC-UHFFFAOYSA-M 0.000 description 1
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 230000005062 synaptic transmission Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 description 1
- 150000003509 tertiary alcohols Chemical class 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/18—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D211/20—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms
- C07D211/24—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by singly bound oxygen or sulphur atoms by sulfur atoms to which a second hetero atom is attached
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Hydrogenated Pyridines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本発明は,医薬品製剤として有用な4−(3−メタンスルホニルフェニル)−1−n−プロピルピペリジンの製造方法に関する。
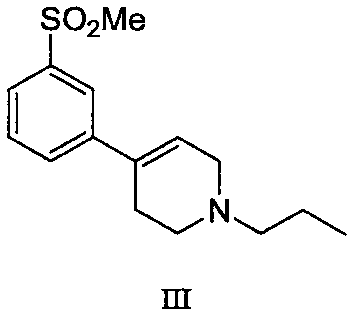
のスルフィドを接触酸化剤及びオキシダントで酸化し,式III:
の化合物を与え,続いてこの式IIIの化合物を接触還元して,式I:
の化合物またはその薬学的に許容され得る塩を与えることを含む,式I:
の4−(3−メタンスルホニルフェニル)−1−n−プロピルピペリジンまたはその薬学的に許容され得る塩の製造方法に関する。
のアルコールを強酸で脱水し,式II:
のスルフィドを与え,この式IIのスルフィドを接触酸化剤及びオキシダントで酸化して,式III:
の化合物を与え,続いてこの式IIIの化合物を接触還元して式I:
の化合物またはその薬学的に許容され得る塩を与えることを含む,式I:
の4−(3−メタンスルホニルフェニル)−1−n−プロピルピペリジンまたはその薬学的に許容され得る塩の製造方法に関する。
実施例2
実施例3
実施例4
Claims (15)
- 前記強酸が硫酸,塩酸,フッ化水素酸,硝酸及びトリフルオロ酢酸から選択される請求項2記載の方法。
- 前記強酸による前記式Iaの前記アルコールの脱水が,トルエン,キシレン,ヘキサン及び水から選択される溶媒中で行われる請求項3記載の方法。
- 前記接触酸化剤が,タングステン酸化剤である請求項1記載の方法。
- 前記タングステン酸化剤がタングステン酸ナトリウムである請求項5記載の方法。
- 前記オキシダントが過酸化物である請求項1記載の方法。
- 前記過酸化物が過酸化ナトリウムである請求項7記載の方法。
- 前記式IIの前記スルフィドを酸化する工程が2未満のpHで行われる請求項1記載の方法。
- 前記式IIの前記スルフィドを酸化する工程が4O℃〜60℃の温度で行われる請求項1記載の方法。
- 前記式IIIの前記化合物の前記接触還元がパラジウム触媒,白金触媒またはルテニウム触媒による接触水素化を含む請求項1記載の方法。
- 前記式IIIの前記化合物の前記接触還元がパラジウム触媒による接触水素化を含む請求項11記載の方法。
- 前記式IIIの前記化合物の前記接触還元が炭素触媒上のパラジウムによる接触水素化を含む請求項12記載の方法。
- 前記式IIIの前記化合物の前記接触還元が炭素触媒上の10%のパラジウムによる接触水素化を含む請求項13記載の方法。
- 前記式IIIの前記化合物の前記接触還元の工程がアルコールを含む水溶液中で行われる請求項14記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US61819604P | 2004-10-13 | 2004-10-13 | |
| US60/618,196 | 2004-10-13 | ||
| PCT/EP2005/011020 WO2006040155A1 (en) | 2004-10-13 | 2005-10-13 | Process for the synthesis of 4-(3-methanesulfonylphenyl)-1-n-propyl-piperidine |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008515951A JP2008515951A (ja) | 2008-05-15 |
| JP4891908B2 true JP4891908B2 (ja) | 2012-03-07 |
Family
ID=35478927
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007536091A Expired - Fee Related JP4891908B2 (ja) | 2004-10-13 | 2005-10-13 | 4−(3−メタンスルホニルフェニル)−1−n−プロピルピペリジンの合成方法 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US7923459B2 (ja) |
| EP (1) | EP1802573B1 (ja) |
| JP (1) | JP4891908B2 (ja) |
| KR (1) | KR101319235B1 (ja) |
| CN (1) | CN101056854B (ja) |
| AU (1) | AU2005293754B2 (ja) |
| CA (1) | CA2584831C (ja) |
| DK (1) | DK1802573T3 (ja) |
| ES (1) | ES2659577T3 (ja) |
| HU (1) | HUE029790T2 (ja) |
| MX (1) | MX2007004215A (ja) |
| NZ (1) | NZ555094A (ja) |
| PL (1) | PL1802573T3 (ja) |
| WO (1) | WO2006040155A1 (ja) |
Families Citing this family (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| USRE46117E1 (en) | 1999-12-22 | 2016-08-23 | Teva Pharmaceuticals International Gmbh | Modulators of dopamine neurotransmission |
| SE0401465D0 (sv) | 2004-06-08 | 2004-06-08 | Carlsson A Research Ab | New substituted piperdines as modulators of dopamine neurotransmission |
| MXPA06013941A (es) | 2004-06-08 | 2007-12-10 | Neurosearch Sweden Ab | Fenilpiperidinas disustituidas, novedosas, como moduladores de la neurotransmision de dopamina y serotonina. |
| MX2007004216A (es) * | 2004-10-13 | 2007-10-10 | Neurosearch Sweden Ab | Proceso para la sintesis de 4-(3-sulfonil)-piperidinas. |
| AU2005293754B2 (en) | 2004-10-13 | 2011-07-21 | Teva Pharmaceuticals International Gmbh | Process for the synthesis of 4-(3-methanesulfonylphenyl)-1-N-propyl-piperidine |
| BRPI0810161A2 (pt) * | 2007-04-12 | 2014-12-30 | Nsab Af Neurosearch Sweden Ab | Composto, preparação farmacêutica, composição farmacêutica, e, uso de um composto |
| WO2011107583A1 (en) | 2010-03-04 | 2011-09-09 | Nsab, Filial Af Neurosearch Sweden Ab, Sverige | Substituted 4-phenyl-n-alkyl-piperidines for preventing onset or slowing progression of neurodegenerative disorders |
| NZ608120A (en) | 2010-09-03 | 2014-12-24 | Ivax Int Gmbh | Deuterated analogs of pridopidine useful as dopaminergic stabilizers |
| CA2847736A1 (en) * | 2011-09-07 | 2013-03-14 | IVAX International GmbH | A new polymorphic form of pridopidine hydrochloride |
| TWI579272B (zh) * | 2011-12-08 | 2017-04-21 | 梯瓦製藥國際有限責任公司 | 普多比啶(pridopidine)之氫溴酸鹽 |
| EA027748B1 (ru) | 2012-04-04 | 2017-08-31 | Тева Фармасьютикалз Интернэшнл Гмбх | Применение придопидина в комбинации с тетрабеназином для лечения двигательных нарушений и ожирения |
| US11090297B2 (en) | 2013-06-21 | 2021-08-17 | Prilenia Neurotherapeutics Ltd. | Pridopidine for treating huntington's disease |
| HUE054783T2 (hu) | 2013-06-21 | 2021-09-28 | Prilenia Neurotherapeutics Ltd | Pridopidin Huntington-kór kezelésében |
| EP4049657A1 (en) | 2014-01-22 | 2022-08-31 | Prilenia Neurotherapeutics Ltd. | Modified release formulations of pridopidine |
| TW201613859A (en) | 2014-06-30 | 2016-04-16 | Teva Pharma | Analogs of PRIDOPIDINE, their preparation and use |
| EP3236964A4 (en) | 2014-12-22 | 2018-09-19 | Teva Pharmaceuticals International GmbH | L-tartrate salt of pridopidine |
| WO2016138130A1 (en) | 2015-02-25 | 2016-09-01 | Teva Pharmaceuticals International Gmbh | Use of pridopidine to improve cognitive function and for treating alzheimer's disease |
| US11471449B2 (en) | 2015-02-25 | 2022-10-18 | Prilenia Neurotherapeutics Ltd. | Use of pridopidine to improve cognitive function and for treating Alzheimer's disease |
| AR105434A1 (es) * | 2015-07-22 | 2017-10-04 | Teva Pharmaceuticals Int Gmbh | Proceso para preparar pridopidina |
| WO2017147366A1 (en) | 2016-02-24 | 2017-08-31 | Teva Pharmaceuticals International Gmbh | Treatment of neurodegenerative eye disease using pridopidine |
| BR112019003731A2 (pt) | 2016-08-24 | 2019-07-16 | Prilenia Therapeutics Dev Ltd | aplicação de pridopidina para tratamento de distonias |
| ES3025836T3 (en) | 2016-08-24 | 2025-06-09 | Prilenia Neurotherapeutics Ltd | Use of pridopidine for treating functional decline |
| DK3512517T3 (da) | 2016-09-15 | 2025-06-10 | Prilenia Neurotherapeutics Ltd | Anvendelse af pridopidin til behandling af angst og depression |
| US12102627B2 (en) | 2016-09-16 | 2024-10-01 | Prilenia Neurotherapeutics Ltd. | Use of pridopidine for treating rett syndrome |
| CA3036984C (en) | 2016-09-16 | 2023-07-18 | Prilenia Therapeutics Development Ltd. | Use of pridopidine for treating rett syndrome |
| IL268125B2 (en) | 2017-01-20 | 2023-04-01 | Prilenia Neurotherapeutics Ltd | Pridopidine for the treatment of fragile x syndrome |
| EP3357909A1 (en) | 2017-02-02 | 2018-08-08 | Sandoz AG | Crystalline 4-[3-(methylsulfonyl)phenyl]-1-propyl-piperidine |
| MX2020001836A (es) | 2017-08-14 | 2020-08-10 | Prilenia Neurotherapeutics Ltd | Metodo para tratar esclerosis lateral amiotrofica con pridopidina. |
| EP3675830A1 (en) | 2017-08-30 | 2020-07-08 | Prilenia Neurotherapeutics Ltd. | High concentration dosage forms of pridopidine |
| US12036213B2 (en) | 2017-09-08 | 2024-07-16 | Prilenia Neurotherapeutics Ltd. | Pridopidine for treating drug induced dyskinesias |
| AU2018329628B2 (en) | 2017-09-08 | 2021-04-22 | Prilenia Neurotherapeutics Ltd. | Pridopidine for treating drug induced dyskinesias |
| AU2020218158B2 (en) | 2019-02-04 | 2023-08-03 | Prilenia Neurotherapeutics Ltd. | Low dose pridopidine for Parkinson's Disease and other diseases associated with parkinsonism |
| MX2022010006A (es) | 2020-02-13 | 2022-09-19 | Prilenia Neurotherapeutics Ltd | Terapia combinada para el tratamiento de la amiotrofica lateral con pridopidina y otro agente activo. |
| AU2023263835A1 (en) * | 2022-05-03 | 2024-11-14 | Prilenia Neurotherapeutics Ltd. | Processes and intermediates for the preparation of pridopidine |
Family Cites Families (46)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB850662A (en) | 1956-10-22 | 1960-10-05 | Parke Davis & Co | Substituted piperazines and processes for their production |
| BE662455A (ja) * | 1964-04-14 | |||
| GB1060160A (en) | 1964-08-05 | 1967-03-01 | Allen & Hanburys Ltd | 4-phenylpiperidine derivatives |
| FR1459013A (fr) | 1964-08-05 | 1966-04-29 | Allen & Hanburys Ltd | Procédé de préparation de dérivés de la 4-phényl-pipéridine |
| US3539573A (en) * | 1967-03-22 | 1970-11-10 | Jean Schmutz | 11-basic substituted dibenzodiazepines and dibenzothiazepines |
| US4048314A (en) * | 1974-12-17 | 1977-09-13 | Delmar Chemicals Limited | Morpholino containing 4-arylpiperidine derivatives |
| GB1560271A (en) | 1977-01-14 | 1980-02-06 | Joullie International Sa | Therapeutically useful m-trifluoromethylphenylpiperazine derivatives |
| US4202898A (en) * | 1978-06-05 | 1980-05-13 | Synthelabo | Method of treating anxiety and depression |
| FR2459797A2 (fr) | 1978-08-01 | 1981-01-16 | Synthelabo | Derives de phenyl-1 piperazine et leur application en therapeutique |
| US4333942A (en) * | 1979-08-03 | 1982-06-08 | Byk Gulden Lomberg Chemische Fabrik Gmbh | Anti-depressant and analgesic 4-phenoxypiperidines |
| US4518712A (en) | 1980-06-30 | 1985-05-21 | Taiho Pharmaceutical Company Limited | Piperazine derivative and analgesic composition containing the same |
| GB2083476B (en) | 1980-09-12 | 1984-02-08 | Wyeth John & Brother Ltd | Heterocyclic compounds |
| FR2501506A1 (fr) | 1981-03-11 | 1982-09-17 | Sanofi Sa | Compositions pharmaceutiques a action anorexigene contenant des derives de la tetrahydropyridine |
| US4415736A (en) * | 1981-12-28 | 1983-11-15 | E. I. Du Pont De Nemours & Co. | Certain tetrahydropyridine intermediates |
| US4485109A (en) * | 1982-05-07 | 1984-11-27 | E. I. Du Pont De Nemours And Company | 4-Aryl-4-piperidinecarbinols |
| EP0094159B1 (en) | 1982-05-10 | 1990-03-14 | Takeda Chemical Industries, Ltd. | Dihydropyridine derivatives, their production and use |
| US4504660A (en) * | 1982-07-06 | 1985-03-12 | American Home Products Corporation | Process for the production of 2,6-diaminobenzonitrile derivatives |
| HU198454B (en) | 1987-12-14 | 1989-10-30 | Richter Gedeon Vegyeszet | Process for production of new derivatives of tetrahydrospiridin and medical compositions containing these compounds |
| FR2639226B1 (fr) | 1988-11-18 | 1993-11-05 | Sanofi | Utilisation de trifluoromethylphenyltetrahydropyridines pour la preparation de medicaments destines a combattre les troubles anxio-depressifs |
| WO1991009594A1 (en) | 1989-12-28 | 1991-07-11 | Virginia Commonwealth University | Sigma receptor ligands and the use thereof |
| EP0641320B1 (en) | 1991-04-17 | 2001-05-30 | PHARMACIA & UPJOHN COMPANY | Substituted (s)-3-phenylpiperidine derivatives, their preparation and their use as dopamine autoreceptor antagonists |
| WO1993000313A2 (en) | 1991-06-27 | 1993-01-07 | Virginia Commonwealth University | Sigma receptor ligands and the use thereof |
| NZ240863A (en) | 1991-09-11 | 1995-04-27 | Mcneilab Inc | Substituted 4-aryl piperidine and 4-aryl piperazine derivatives, preparation and pharmaceutical compositions thereof |
| EP0533268B1 (en) | 1991-09-18 | 2001-08-16 | Glaxo Group Limited | Benzanilide derivatives as 5-HT1D antagonists |
| GB9119932D0 (en) | 1991-09-18 | 1991-10-30 | Glaxo Group Ltd | Chemical compounds |
| GB9119920D0 (en) | 1991-09-18 | 1991-10-30 | Glaxo Group Ltd | Chemical compounds |
| US5502050A (en) * | 1993-11-29 | 1996-03-26 | Cornell Research Foundation, Inc. | Blocking utilization of tetrahydrobiopterin to block induction of nitric oxide synthesis |
| CA2144669A1 (en) | 1994-03-29 | 1995-09-30 | Kozo Akasaka | Biphenyl derivatives |
| EP0867183B1 (en) * | 1996-07-22 | 2004-10-06 | Daiichi Suntory Pharma Co., Ltd. | Arylpiperidinol and arylpiperidine derivatives and drugs containing the same |
| US5892041A (en) * | 1996-08-12 | 1999-04-06 | Neurogen Corporation | Fused indolecarboxamides: dopamine receptor subtype specific ligands |
| DE19637237A1 (de) | 1996-09-13 | 1998-03-19 | Merck Patent Gmbh | Piperazin-Derivate |
| US6232326B1 (en) | 1998-07-14 | 2001-05-15 | Jodi A. Nelson | Treatment for schizophrenia and other dopamine system dysfunctions |
| DE60025604T2 (de) | 1999-06-22 | 2006-07-27 | Neurosearch A/S | Benzimidazol-derivate und diese enthaltende pharmazeutische zusammensetzungen |
| SE9904724D0 (sv) * | 1999-12-22 | 1999-12-22 | Carlsson A Research Ab | New modulators of dopamine neurotransmission I |
| SE9904723D0 (sv) | 1999-12-22 | 1999-12-22 | Carlsson A Research Ab | New modulators of dopamine neurotransmission II |
| AU2001280599A1 (en) | 2000-07-15 | 2002-01-30 | Smith Kline Beecham Corporation | Compounds and methods |
| EP1368340B1 (en) | 2001-01-23 | 2005-08-10 | Eli Lilly And Company | Piperazine derivatives as melanocortin receptor agonists |
| US20050004164A1 (en) | 2003-04-30 | 2005-01-06 | Caggiano Thomas J. | 2-Cyanopropanoic acid amide and ester derivatives and methods of their use |
| US7160888B2 (en) | 2003-08-22 | 2007-01-09 | Warner Lambert Company Llc | [1,8]naphthyridin-2-ones and related compounds for the treatment of schizophrenia |
| AU2005251909A1 (en) | 2004-06-08 | 2005-12-22 | Nsab, Filial Af Neurosearch Sweden Ab, Sverige | New disubstituted phenylpiperidines as modulators of dopamine and serotonin neurotransmission |
| SE0401465D0 (sv) | 2004-06-08 | 2004-06-08 | Carlsson A Research Ab | New substituted piperdines as modulators of dopamine neurotransmission |
| US7884104B2 (en) | 2004-10-01 | 2011-02-08 | Merck Sharp & Dohme Corp. | Aminopiperidines as dipeptidyl peptidase-IV inhibitors for the treatment or prevention of diabetes |
| MX2007004216A (es) | 2004-10-13 | 2007-10-10 | Neurosearch Sweden Ab | Proceso para la sintesis de 4-(3-sulfonil)-piperidinas. |
| AU2005293754B2 (en) | 2004-10-13 | 2011-07-21 | Teva Pharmaceuticals International Gmbh | Process for the synthesis of 4-(3-methanesulfonylphenyl)-1-N-propyl-piperidine |
| SE529246C2 (sv) | 2005-10-13 | 2007-06-12 | Neurosearch Sweden Ab | Nya disubstituerade fenyl-piperidiner som modulatorer för dopaminneurotransmission |
| US20080269286A1 (en) | 2005-12-07 | 2008-10-30 | Clas Sonesson | Disubstituted Phenylpiperidines as Modulators of Cortical Catecholaminergic Neurotransmission |
-
2005
- 2005-10-13 AU AU2005293754A patent/AU2005293754B2/en not_active Ceased
- 2005-10-13 MX MX2007004215A patent/MX2007004215A/es active IP Right Grant
- 2005-10-13 JP JP2007536091A patent/JP4891908B2/ja not_active Expired - Fee Related
- 2005-10-13 ES ES05793645.2T patent/ES2659577T3/es not_active Expired - Lifetime
- 2005-10-13 CA CA2584831A patent/CA2584831C/en not_active Expired - Lifetime
- 2005-10-13 EP EP05793645.2A patent/EP1802573B1/en not_active Expired - Lifetime
- 2005-10-13 KR KR1020077010900A patent/KR101319235B1/ko not_active Expired - Fee Related
- 2005-10-13 CN CN2005800385910A patent/CN101056854B/zh not_active Expired - Fee Related
- 2005-10-13 WO PCT/EP2005/011020 patent/WO2006040155A1/en not_active Ceased
- 2005-10-13 DK DK05793645.2T patent/DK1802573T3/en active
- 2005-10-13 HU HUE05793645A patent/HUE029790T2/hu unknown
- 2005-10-13 PL PL05793645T patent/PL1802573T3/pl unknown
- 2005-10-13 NZ NZ555094A patent/NZ555094A/en not_active IP Right Cessation
-
2007
- 2007-04-10 US US11/733,512 patent/US7923459B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| EP1802573B1 (en) | 2016-09-28 |
| KR20070065911A (ko) | 2007-06-25 |
| JP2008515951A (ja) | 2008-05-15 |
| CA2584831A1 (en) | 2006-04-20 |
| ES2659577T3 (es) | 2018-03-16 |
| HK1105195A1 (zh) | 2008-02-06 |
| AU2005293754A1 (en) | 2006-04-20 |
| CN101056854B (zh) | 2013-06-05 |
| KR101319235B1 (ko) | 2013-10-16 |
| EP1802573A1 (en) | 2007-07-04 |
| NZ555094A (en) | 2009-07-31 |
| HUE029790T2 (hu) | 2017-04-28 |
| MX2007004215A (es) | 2007-12-12 |
| AU2005293754B2 (en) | 2011-07-21 |
| US20070238879A1 (en) | 2007-10-11 |
| WO2006040155A1 (en) | 2006-04-20 |
| DK1802573T3 (en) | 2016-12-19 |
| CN101056854A (zh) | 2007-10-17 |
| PL1802573T3 (pl) | 2017-03-31 |
| CA2584831C (en) | 2013-09-17 |
| US7923459B2 (en) | 2011-04-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4891908B2 (ja) | 4−(3−メタンスルホニルフェニル)−1−n−プロピルピペリジンの合成方法 | |
| JP2008509211A (ja) | 塩酸イリノテカン三水和物の改良された製造方法 | |
| AU2001278094B2 (en) | Novel crystalline forms of 4-[4-[4-(hydroxydiphenylmethyl)-1-piperindinyl]-1-hydroxybutyl]-alpha, alpha-dimethylbenzene acetic acid and its hydrochloride | |
| JP2008515952A (ja) | 4−(3−スルホニルフェニル)−ピペリジンの合成方法 | |
| JP2011515453A (ja) | 塩酸ドネペジルの製造方法 | |
| WO2017094031A2 (en) | Novel process for preparation of apremilast | |
| JP2009515945A (ja) | 塩酸ドネペジルの調製に有用な中間体およびその新規な多形の改善された合成および調製 | |
| EP1608371A1 (en) | Process for the preparation of donepezil and derivatives thereof | |
| WO2023082839A1 (zh) | 一种Filgotinib的制备方法 | |
| JP2015526507A (ja) | フルボキサミン遊離塩基の精製方法およびそれを用いた高純度フルボキサミンマレイン酸塩の製造方法 | |
| CN109369618B (zh) | 一锅烩制备2-氯-5-((2-(硝基亚甲基)咪唑啉-1-基)甲基)吡啶的方法 | |
| JP4980242B2 (ja) | 新規の中間体を介する1−ベンジル−4−[(5,6−ジメトキシ−1−インダノン−2−イル)メチル]ピペリジンまたはその塩の製造方法 | |
| CN1989097A (zh) | 用于制备非对映异构体富集的化合物的方法 | |
| CN101263117B (zh) | 制备1-苄基-4-[(5,6-二甲氧基-1-二氢茚酮)-2-基]甲基哌啶或其盐酸盐的方法 | |
| CN117964546B (zh) | 一种尼拉帕利中间体的制备方法 | |
| JP2016511761A (ja) | 4−ピペリジン−4−イル−ベンゼン−1,3−ジオール及びその塩の合成方法、並びに新規化合物tert−ブチル4−(2,4−ジヒドロキシ−フェニル)−4−ヒドロキシ−ピペリジン−1−カルボキシレート | |
| CN111100062A (zh) | 一种盐酸多奈哌齐的合成方法 | |
| JP2002371060A (ja) | 光学活性アミノピペリジン誘導体の製造方法 | |
| HK1105195B (en) | Process for the synthesis of 4-(3-methanesulfonylphenyl)-1-n-propyl-piperidine | |
| JP2003137835A (ja) | (r)−3−ヒドロキシ−3−(2−フェニルエチル)ヘキサン酸の製造方法 | |
| WO2022269643A1 (en) | An improved process for the preparation of intermediate for paroxetine | |
| JP2003342259A (ja) | 光学活性シスピペリジン誘導体の製造法 | |
| CN116041249A (zh) | 一种盐酸替罗非班的制备方法 | |
| CN121318660A (zh) | 一种八氟环戊烯的合成方法 | |
| JP2013040150A (ja) | ドネペジルの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080926 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20081202 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20111117 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20111216 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4891908 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20141222 Year of fee payment: 3 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S634 | Written request for registration of reclamation of nationality |
Free format text: JAPANESE INTERMEDIATE CODE: R313634 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| R371 | Transfer withdrawn |
Free format text: JAPANESE INTERMEDIATE CODE: R371 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |