JP4472351B2 - インターナライジング抗cd74抗体およびその使用方法 - Google Patents
インターナライジング抗cd74抗体およびその使用方法 Download PDFInfo
- Publication number
- JP4472351B2 JP4472351B2 JP2003573032A JP2003573032A JP4472351B2 JP 4472351 B2 JP4472351 B2 JP 4472351B2 JP 2003573032 A JP2003573032 A JP 2003573032A JP 2003573032 A JP2003573032 A JP 2003573032A JP 4472351 B2 JP4472351 B2 JP 4472351B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- antigen
- binding fragment
- humanized
- mab
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/10—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody
- A61K51/1027—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody against receptors, cell-surface antigens or cell-surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2833—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2896—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against molecules with a "CD"-designation, not provided for elsewhere
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
Description
本発明は、ヒト化、キメラおよびヒト抗CD74抗体もしくはそのフラグメント、または少なくとも一種のCD74抗体、特にモノクローナル抗体(mAb)を含んでなる抗体融合タンパク質、ヒト化、キメラおよびヒト抗CD74 mAbまたはそのフラグメントの治療および診断複合体、ならびにB細胞リンパ腫および白血病、細胞がCD74抗原に関して陽性であるリンパ腫および白血病以外の悪性腫瘍、および種々の自己免疫疾患および免疫不全症を、これらのヒト化、キメラおよびヒト抗CD74 mAbまたはそのフラグメントを用いて治療および診断する方法に関する。本発明は、抗CD74 mAbまたはそのフラグメントの少なくとも一方の腕と、病原性生物、癌細胞、寄生虫または感染性病原体などの有害なものに対して多重特異性のmAbの少なくとも一方の腕とを含んでなる多価かつ/または多重特異性抗CD74 mAbまたはそのフラグメントに関する。本発明はさらに、抗原ペプチドに結合された抗CD74 mAbまたはそのフラグメントに関する。このヒト化、キメラおよびヒト抗CD74 mAb、そのフラグメントおよびその複合体は単独で投与してもよいし、多様式治療計画の一部として投与してもよい。本発明はヒト化、キメラおよびヒト抗CD74抗体をコードするDNA配列、ならびに多価かつ/または多重特性抗CD74 mAbおよびそのフラグメント、その治療用複合体、診断用複合体および抗原複合体、そのDNA配列を含むベクターおよび宿主細胞、ならびにヒト化、キメラおよびヒト抗CD74抗体を作製する方法に関する。
免疫療法の主要な目標の一つは腫瘍細胞または感染性生物に対して患者の免疫系を協調させることである。癌療法に関しては、患者の免疫系を腫瘍細胞へ向けることが対象となる。非ホジキンリンパ腫(NHL)、多発性骨髄腫、ならびに急性および慢性リンパ球性白血病は、なお癌の死亡率に大きく影響しているB細胞悪性腫瘍である。種々の形態の処置に対するこれら悪性腫瘍の応答は複合型である。
本発明は、ヒト化、キメラおよびヒト抗CD74 mAb、そのフラグメント、および抗体融合タンパク質、ならびに単独で、または他の裸の抗体および多様式治療計画の一部としての抗体治療用複合体をはじめとする他の治療薬との複合体としての、またはそれらと組み合わせて投与される、哺乳類被験体、ヒトおよび家庭内動物の治療に有用なその治療用および診断用複合体を提供する。B細胞悪性腫瘍、その他のCD74陽性悪性腫瘍および自己免疫疾患の治療および診断方法が開示される。
以下の説明において、多数の専門用語が使用されており、以下、本発明の理解を容易にするために定義を示す。
モノクローナル抗体(MAb)は特定の抗原に対する抗体の均質な集団であり、その抗体はただ一種の抗原結合部位を含んでなり、抗原決定基上のただ一つのエピトープに結合する。特定の抗原に対する齧歯類モノクローナル抗体は、当業者に公知の方法により得ることができる。例えば、Kohler and Milstein, Nature 256:495(1975), and Coligan et al.(eds.), CURRENT PROTOCOLS IN IMMUNOLOGY, VOL. 1, pages 2.5.1-2.6.7(John Wiley & Sons 1991)[以下「Coligan」]を参照されたい。要するに、マウスに抗原を含む組成物を注射し、血清サンプルを採取して抗体産生を確認し、脾臓を摘出してBリンパ球を採取し、そのBリンパ球と骨髄腫細胞を融合させてハイブリドーマを作製し、そのハイブリドーマをクローニングし、抗原に対する抗体を産生する陽性クローンを選択し、抗原に対する抗体を産生するクローンを培養して、その抗体をハイブリドーマ培養物から単離することによりモノクローナル抗体を得ることができる。
特定のエピトープを認識する抗体フラグメントは、公知の技術により作製し得る。抗体フラグメントは、F(ab')2、Fab'、Fab、Fv、sFvなどの抗体の抗原結合部分である。他の抗体フラグメントとしては、限定されるものではないが、抗体分子のペプシン消化により作製できるF(ab)'2フラグメント、およびF(ab')2フラグメントのジスルフィド結合を還元することにより作製できるFab'フラグメントが挙げられる。あるいは、所望の特異性を有するモノクローナルFab’フラグメントの迅速で容易な同定を可能にするFab’発現ライブラリーを構築することができる(Huse et al., 1989, Science, 246:1274-1281)。本発明は抗体および抗体フラグメントを包含する。
単鎖Fv分子(scFv)は、VLドメインおよびVHドメインを含んでなる。このVLおよびVHドメインは組み合わさって標的結合部位を形成している。これらの二つのドメインはペプチドリンカー(L)によりさらに共有結合されている。scFv分子は、VLドメインがscFv分子のN末端部である場合、VL−L−VH、またはVHドメインがscFv分子のN末端部である場合、VH−L−VLと表される。scFv分子の作製方法、および好適なペプチドリンカーの設計方法は、米国特許第4,704,692号、同第4,946,778号、R. Raag and M. Whitlow,"Single Chain Fvs."FASEB Vol 9:73-80(1995)およびR. E. Bird and B. W. Walker,"Single Chain Antibody Variable Regions,"TIBTECH, Vol 9:132-137(1991)を参照されたい。これらの参照文献は引用することにより本明細書の一部とされる。
本発明の抗CD74 mAbはCD74抗原に対して特異性を有する特定のマウスCDRを含む。本発明の抗CD74 mAbはヒト化、キメラまたはヒトmAbであり、それらはマウス抗CD74 mAbであるマウスLL1mAbのCDRのアミノ酸を含む。ヒト化抗CD74モノクローナル抗体(mAb)またはそのフラグメントは、アミノ酸配列RSSQSLVHRNGNTYLHを含むCDR1、アミノ酸配列TVSNRFSを含むCDR2、およびアミノ酸配列SQSSHVPPTを含むCDR3を含んでなるマウス抗CD74 mAbのL鎖可変領域のCDRを含んでなる。さらに、このヒト化抗CD74モノクローナル抗体またはそのフラグメントは、アミノ酸配列NYGVNを含むCDR1、アミノ酸配列WINPNTGEPTFDDDFKGを含むCDR2、およびアミノ酸配列SRGKNEAWFAYを含むCDR3を含んでなるマウス抗CD74 mAbのH鎖可変領域のCDRを含んでなる、ヒト化mAbのH鎖可変領域を含んでなる。さらに、このヒト化mAbはCD74に対する特異性を実質的に保持しており、すなわち、Bリンパ球、単球および組織球、ならびにB細胞リンパ腫および白血病、ならびに骨髄腫細胞などの細胞の表面上に存在するクラスII MHC不変鎖IiはこれらのmAb、そのフラグメントまたはmAb複合体の 迅速なインターナリゼーションと異化作用をもたらす。
組み合わせ療法で使用するための本明細書に記載の抗CD74抗体、ならびに異なる特異性を有する他の抗体はまた、多重特異性抗体(CD74エピトープまたは抗原に対して少なくとも一つの結合部位、およびCD74上の別のエピトープまたは別の抗原に対して少なくとも一つの結合部位を含んでなる)、ならびに多価抗体(同じエピトープまたは抗原に対して複数の結合部位を含んでなる)としても作製することができ、あるいは抗体は多価および多重特異性の双方とすることもできる。
本発明による抗CD74抗体はまた、ダイアボディーとも呼ばれる、機能性二重特異性単鎖抗体(bscAb)の調製に使用でき、組換え法により哺乳類細胞中で作製できる。例えば、引用することにより本明細書の一部とされる、Mack et al., Proc. Natl. Acad. Sci., 92:7021-7025,1995を参照されたい。例えば、bscAbは組換え法によりグリシン−セリンリンカーを介して二つの単鎖Fvフラグメントを結合することで作製する。問題の二つの抗体のVL鎖(VL)およびVH鎖(VH)ドメインは、標準的PCR法により単離される。次に、それぞれのハイブリドーマから得られたcDNAのVLおよびVHは二段階の融合PCRにおいて結合されて単鎖フラグメントを形成する。第一のPCRステップでは(Gly4−Ser1)3リンカーを導入し、第二のステップではVLおよびVHアンプリコンを結合させる。次いでそれぞれの単鎖分子を細菌発現ベクターへクローニングする。増幅後に単鎖分子の一つを切り出して問題の第二の単鎖分子を含む他のベクターへサブクローニングする。得られたbscAbフラグメントを真核細胞発現ベクターへサブクローニングする。機能性タンパク質の発現は、そのベクターをチャイニーズハムスター卵巣細胞へトランスフェクトすることにより得られる。二重特異性融合タンパク質も同様の方法で調製される。二重特異性単鎖抗体および二重特異性融合タンパク質は本発明の範囲内に含まれる。
本発明による他の態様は、結合多価抗CD74抗体である。第一または第二のポリペプチドのN末端またはC末端のいずれかに、さらなるアミノ酸残基を付加してもよい。このさらなるアミノ酸残基は、ペプチドタグ、シグナルペプチド、サイトカイン、酵素(例えば、プロドラッグ活性化酵素)、ホルモン、シュードモナス外毒素のようなペプチド毒素、ペプチド薬、細胞傷害性タンパク質または他の機能性タンパク質を含んでよい。本明細書において機能性タンパク質とは、生物学的機能を有するタンパク質である。
本明細書に記載の本発明のヒト化、キメラおよびヒトモノクローナル抗体、すなわち抗CD74 mAbおよび他のMAbは、治療法および診断法での使用に好適である。従って本発明は、本発明によるヒト化、キメラおよびヒト抗体の裸の抗体としての単独投与、または多様式療法として、治療薬とは結合させないが、投与計画に従った一時的投与を意図する。免疫複合体は、診断薬または治療薬と結合された、CD74と結合する本発明に記載のヒト化、キメラ、またはヒトCD74 mAbの少なくとも一つのmAbもしくはそのフラグメント、またはその融合タンパク質を含んでなる抗体成分を含んでなる複合体である。
本発明のいずれの抗体または抗体融合タンパク質も、一種以上の治療薬または診断薬と結合させることができる。一般に、一種の治療薬または診断薬を各々抗体または抗体フラグメントに結合させるが、二種以上の治療薬または診断薬を同じ抗体または抗体フラグメントに結合させることもできる。本発明による抗体融合タンパク質は二以上の抗体またはそのフラグメントを含んでなり、この融合タンパク質を含んでなる抗体各々が治療薬または診断薬を含みうる。また、一以上の抗体融合タンパク質の抗体には、二種以上の治療薬または診断薬を結合させることができる。さらに、この治療薬は同じである必要はなく、異なる治療薬であってもよい。例えば、同じ融合タンパク質に薬物と放射性同位元素を結合させることができる。特に、IgGは131Iで放射性標識し、薬物に結合させることができる。この131Iは、IgGのチロシンに組み込むことができ、薬物はIgGリジンのεアミノ酸に結合させることができる。治療薬および診断薬はいずれも、還元SH基および炭化水素側鎖に結合させることもできる。
被検体に送達されるヒト化、キメラおよびヒト抗CD74 mAbは、mAb単独、免疫複合体、融合タンパク質から構成されるか、または一以上の医薬上好適な賦形剤、一以上の付加的成分またはこれらのある組み合わせを含みうる。
本発明による免疫複合体または裸の抗体は、医薬上有用な組成物を調製するための公知の方法に従って調剤され、この免疫複合体または裸の抗体は混合物中で医薬上好適な賦形剤と結合する。滅菌リン酸緩衝生理食塩水は医薬上好適な賦形剤の一例である。他の好適な賦形剤は当業者に周知である。例えば、Ansel et al., PHARMACEUTICAL DOSAGE FORMS AND DRUG DELIVERY SYSTEMS, 5th Edition (Lea & Febiger 1990)、およびGennaro(ed.), REMINGTON'S PHARMACEUTICAL SCIENCES, 18th Edition (Mack Publishing Company 1990)およびそれらの改訂版を参照されたい。
治療目的では、治療上有効な量の免疫複合体、融合タンパク質または裸の抗体を哺乳類に投与する。ヒト以外の動物被検体もまた意図されるが、本発明の好適な被検体は通常ヒトである。抗体製剤は、投与される量が生理学上有意であれば、「治療上有効量」で投与されると言われる。薬物は、その存在が受容哺乳類の生理に検出可能な変化をもたらす場合に、生理学上有意である。特に、本発明の抗体製剤は、その存在が抗腫瘍応答を誘起するか、または自己免疫疾患の徴候および症候を緩和する場合に、生理学上有意である。また、生理学上有意な効果は、受容哺乳類における体液性および/または細胞性免疫応答を誘起することでありうる。
本発明はCD74発現悪性腫瘍の治療のための基本組成物としての本発明の裸の抗CD74抗体の使用を意図し、これらの疾病または疾患は免疫調節障害症、自己免疫疾患、臓器移植拒絶症、および移植片対宿主病からなる群から選択される。CD74発現悪性腫瘍は固形腫瘍、非ホジキンリンパ腫、ホジキンリンパ腫、多発性骨髄腫、その他のB細胞悪性腫瘍およびT細胞悪性腫瘍からなる群から選択される。固形腫瘍は黒色腫、癌腫および肉腫からなる群から選択され、癌腫は腎臓癌、肺癌、腸癌、胃癌および黒色腫からなる群から選択される。B細胞悪性腫瘍は非ホジキンリンパ腫、ホジキンリンパ腫、無痛性B細胞リンパ腫、急速進行性B細胞リンパ腫、慢性リンパ性白血病、急性リンパ性白血病、および多発性骨髄腫、B細胞疾患、およびその他の疾患からなる群から選択される。特に本明細書に記載の組成物は、種々の自己免疫性ならびに無痛性B細胞リンパ腫、急速進行性B細胞リンパ腫、慢性リンパ性白血病、急性リンパ性白血病、多発性骨髄腫、およびワルデンシュトレームマクログロブリン血症の治療に特に有用である。例えば、ヒト化抗CD74抗体成分および免疫複合体を用いて無痛性および急速進行性非ホジキンリンパ腫の双方を治療することができる。
本発明ではまた、リンパ腫、白血病、骨髄腫、その他のCD74発現悪性腫瘍、免疫不全症、自己免疫疾患、およびそれらの組み合わせからなる群から選択される少なくとも一つの疾病を有するかどうか診断される、または疑いのある被験体の疾病を診断する方法を提供し、その方法は医薬上許容される担体と少なくとも一種の抗CD74 mAbまたはそのフラグメントまたはその抗体融合タンパク質を含んでなる、診断上有効量の診断用複合体を該被験体に投与すること(ここで、診断薬は化学結合によりmAbもしくはそのフラグメント、またはその抗体融合タンパク質のFvもしくはFabと結合されている)、およびその診断薬を検出することを含んでなる。本発明に有用な診断薬は、放射性同位元素(この放射性同位元素の光量子はラジオシンチグラフィーまたはPETにより検出される)、またはMRIにより検出できる金属、またはリポソームもしくはガス充填リポソームである(このリポソームは超音波走査装置により検出することができる)。
DNA配列はヒト化、キメラまたはヒト抗CD74 mAbをコードしているものである。より具体的には、このDNA配列は、(a)本明細書に記載の抗CD74mAbまたはそのフラグメント、(b)本明細書に記載の抗CD74 mAbまたはそのフラグメントのいずれか一つを含んでなる免疫複合体、(c)本明細書に記載の少なくとも二種の抗CD74mAbまたはそのフラグメントを含んでなる抗体融合タンパク質またはそのフラグメント、(d)本明細書に記載の抗体融合タンパク質またはそのフラグメント、(e)本明細書に記載のワクチン、および(f)本明細書に記載の二重特異性または多重特異性抗体からなる群から選択されるmAbまたはそのフラグメントをコードする核酸を含んでなる。本発明によるDNA配列はいずれも、核酸の複製をもたらす種々の既知の宿主ベクター中へ組換え操作することができる。これらのベクターは公知の方法を用い、核酸が送達される細胞内で核酸の転写、翻訳またはその双方を命令するために必要なエレメントを含むよう設計することができる。既知の方法論を用い、適当な転写/翻訳制御シグナルと作動可能なように連結されたタンパク質コード配列を有する発現構築物を作製することができる。これらの方法としてはin vitro組換えDNA技術および合成技術を含む。例えば、Sambrook et al., 1989, MOLECULAR CLONING: A LABORATORY MANUAL, Cold Spring Harbor Laboratory (New York); Ausubel et al., 1997, CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons (New York)を参照されたい。また、本発明では、ベクターと会合していないポリヌクレオチドの送達も提供する。
キメラまたはヒト化抗CD74 mAbのVKおよびVH配列は、引用することによりその全開示内容を本明細書の一部とするOrlandi et al., (Proc. Natl. Acad. Sci., USA, 86:3833 (1989))が記載しているようなPCRにより増幅することができる。VK配列はプライマーCK3BHおよびVK5−3を用いて増幅することができ(引用することによりその全開示内容を本明細書の一部とするLeung et al., BioTechniques, 15:286 (1993))、VH配列はマウスIgGのCH1領域へアニーリングするプライマーCH1BおよびVHIBACK(Orlandi et al., 1989, 前掲)を用いて増幅することができる。10μlの第一鎖cDNA産物、9μLの10X PCRバッファー[500mM KCl、100mM Tris−HCl(pH8.3)、15mM MgCl2、および0.01%(w/v)ゼラチン](Perkin Elmer Cetus, Norwalk, CT)を含有するPCR反応混合物に対して30サイクルのPCRを行うことができる。各PCRサイクルは好ましくは94℃で1分間の変性、50℃で1.5分間のアニーリングおよび72℃で1.5分間の重合からなる。増幅されたVKおよびVHフラグメントは2%アガロース(BioRad, Richmond, CA)上で精製することができる。ヒト化V遺伝子を構築する際に用いる自動Cyclone Plus DNAシンセサイザー(Milligan-Biosearch)でのオリゴA(149マー)およびオリゴB(140マー)の合成方法については実施例3を参照されたい。
それぞれLeung et al. 1993およびOrlandi et al. (PNAS 86:3833-3837 (1989))が記載しているようにVK5’−4およびVK1FORプライマーを用いたRT−PCRによりmLL1のVK遺伝子を得、pCR2.1 AT−クローニングベクター(Invitrogen)中へクローニングした。PCR反応から生じたエラーを排除するため、複数のクローンを配列決定した。大多数のクローン(6)は同じマウスVK配列を含んでおり、これをLL1 VKと名づけ、その配列が図1Bに示されている。他のマウスVk配列と比較したところ、LL1VkはκL鎖サブクラスIIに属するものであることが明らかになった。
クローニングされたLL1のFvの忠実性を評価するため、キメラLL1(cLL1)を構築し、発現させた。LL1 Vkのヌクレオチド残基7〜12を、プライマーLL1VK−PvuIIおよびVK1FORを用いたPCRによりPvuII制限部位CAGCTGへと改変した。得られたPCR産物をPvuIIおよびBgIIIで消化(Vkの内部BgIII部位の存在により部分的)し、pBR327に基づく足場ベクター(PvuIIおよびBcIIで消化)VKpBR2へ強制的にクローニングしたところ、同じIgプロモーター、シグナルペプチド配列およびOrlandi et al., 1989およびLeung et al., 1994により用いられているようなVK PCR産物のフレーム内連結を容易にするのに便宜な制限部位を含んでいた。
LL1VK-PvuII 5'-GAT GTT CAG CTG ACC CAA ACT CCA CTC TCC-3'
LL1B-1 5'-CAG ATC CAG CTG CAG CAG TCT GGA CCT GAG-3'
LL1F-1 5'-GA GAC GGT GAC CAG AGT CCC TTG GCC CCA A-3'
約30μgのcLL1pdHL2をSalで消化することにより線状化し、エレクトロポレーションによりSp2/0−Agl4細胞にトランスフェクトした。トランスフェクト細胞を96ウェルプレートで2日間平板培養した後、MTX耐性に関して選択した。選択に生き残ったコロニーの上清をELISAアッセイによりキメラ抗体分泌に関してモニタリングした。陽性細胞クローンを拡張し、細胞培養上清から、Aタンパク質カラムでのアフィニティークロマトグラフィーによりcLL1を精製した。
親mLL1と比較してcLL1の免疫反応性を評価するため、競合細胞結合アッセイを行った。一定量の125I標識mLL1(100,000cpm)を4℃で1〜2時間、種々の濃度のcLL1またはmLL1の存在下でRaji細胞とともにインキュベートした。洗浄後、細胞と結びついた放射活性を測定した。図5に示されているように、cLL2抗体はmLL1に匹敵する結合活性を示し、クローニングされたV遺伝子の忠実性が確認された。
KabatデータベースにてcLL1の可変(V)領域フレームワーク(FR)配列とヒト抗体のそれを比較することにより、cLL1VHおよびVkのFRがそれぞれヒト抗体RF−TS3 VHおよびHF−21/28 Vkのそれと最も高い程度の配列ホモロジーを示すことが分かった。これらのアミノ酸配列は図3Aおよび3Bに示されており、cLL1VHおよびVk配列と比較させてある。よって、RF−TS3 VHおよびHF−21/28 VkのFRおよびFRは、それぞれLL1 VHおよびVkのCDRがグラフトされるヒトフレームワークとして選択された。しかし、RF−TS3のFR配列ではなくNEWMのFR配列を用いて、LL1H鎖のヒト化のためにRF−TS3 FR4配列を置換した。図3Aを参照されたい。hLL1では、これまでに記載されている指針(Qu et al., Clin. Cancer Rec. 5:3095s-3100s (1990))に基づき、推定CDRに近接するLL1 FRの数個のアミノ酸残基を維持した。これらの残基はVkのL46、F87およびQ100(図3B)、ならびにVHのI36、K37、Q46、A68、F91およびS93(図3A)である。図3Aおよび3Bはヒト、キメラおよびヒト化VHおよびVkアミノ酸配列を比較したものである。点線はヒトVHおよびVk配列における対応する残基と同一であるcLL1およびhLL1の残基を示す。hLL1VHおよびVkのDNAおよびアミノ酸配列はそれじれ図4Aおよび4Bに示されている。
Leung et al. (Leung et al., 1994)が記載しているような改変戦略を用い、図5で示されているように、長いオリゴヌクレオチド合成とPCRの組み合わせを用い、hLL1のデザインされたVkおよびVH遺伝子を構築した。hLL1VHドメインを構築する場合には、自動DNAシンセサイザー(Applied Biosystem)で二つの長いオリゴヌクレオチドhLL1VHA(176マー)およびhLL1VHB(165マー)を合成した。hLL1VHA配列はhLL1VHドメインのnt20〜195に相当する。
hLL1VHBACK 5'-GTG GTG CTG CAG CAA TCT GGG TCT GAG TTC AAG AAG CC-3'
HLL1VHFOR 5'-AAG TGG ATC CTA TAA TCA TTC CTA GGA TTA ATG-3'
hLL1VKFOR 5'-G TTA GAT CTC CAG TCG TGT CCC AGC ACC GAA CG-3'
hLL1の発現および結合アッセイの方法はcLL1に関して記載したものと同じである。
hLL1の免疫反応性を評価するため、Raji細胞膜抽出物をコーティングしたプレートを用いるELISA競合結合アッセイを開発した。Raji細胞膜画分を音波処理と遠心分離により調製した。粗膜抽出物を遠心分離により96ウェル平底PVCプレートにコーティングし、0.1%グルタルアルデヒドで固定した。種々の濃度のmLL1またはcLL1と混合した一定量のビオチニル化mLL1をこの膜コートウェルに加え、室温で1〜2時間インキュベートした。洗浄後、HRP結合ストレプトアビジンを加え、室温で1時間インキュベートした。膜結合ビオチニル化mLL1に結合したHRP結合ストレプトアビジンの量は、4mMオルトフェニレンジアミン二塩酸塩および0.04%H2O2を含む基質溶液を加えた後、A490nmを読みとることによって明らかにした。図6の競合アッセイによって示されるように、mLL1およびcLL1抗体は同等の結合活性を示した。同様に、図7の競合アッセイでは、hLL1およびcLL1抗体は同等の結合活性を示した。
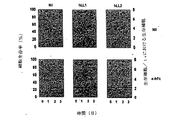
標準的な抗体プロセシングアッセイを用いて、Raji細胞のインターナリゼーションおよび異化作用を評価した(Hansen et al., 1996)。細胞(107)を、125I標識hLL1またはLL1(107cpm)を含む組織培養培地1mL中で、37℃にて1時間インキュベートした。Ab結合の特異性を評価するため、過剰量(最終濃度100μg/mL)の非標識Abを含む、また含まない総ての実験で1/10サンプルサイズ(細胞、放射活性および培地)の対照を設けた。結合インキュベーションの後、結合しなかった放射活性を洗浄により除去した。特異性対照を計数した。総ての実験で、細胞に対する放射活性の結合は非標識Abのよって少なくとも90%ブロックされた。次にこれらの細胞を30mlの新鮮培地に再懸濁させ、24ウェルプレートに1.5mL/ウェルで分注した。サンプル1.5mLを放射活性の測定のために用い、これを最初の結合cpmとした。プレートをCO2インキュベーターでインキュベートした。3、24、48および72時間の時点で、細胞を次のように回収した。細胞を繰り返しピペットで吸い取って懸濁させ、コニカル試験管へ移した。ウェルおよびピペットを1mLの新鮮培地ですすぎ、最初の細胞懸濁液回収物に加えた。この試験管を600xgで10分間遠心分離し、上清1mLを注意深く採取し(全上清の40%)、放射活性を計数した。担体タンパク質としてBSAを最終濃度1%まで加え、このタンパク質を冷10%(w/v)トリクロロ酢酸(TCA)5mlで沈降させた。4℃で30分間インキュベートし、5000xgで15分間遠心分離した後、上清を廃棄し、沈降したタンパク質の放射活性を計数した。TCAにより沈降しなかった放射性標識タンパク質は分解していたものとし、沈降した放射性タンパク質は完全であるとみなした。この細胞ペレットについて、洗浄した後、細胞に残留している放射活性を計数した。各画分の放射活性を最初に結合していたものに対する割合(%)として表した。図8Aに示されているように、hLL1は、Raji細胞の表面に結合した後のマウスLL1と同様の迅速なインターナリゼーションと異化作用を示し、すなわち、結合していた放射活性はほとんど総て3時間内に異化作用を受け、上清中に放出された。これは抗CD22や抗CD19などの他のインターナライジングAbの場合よりもはるかに速い(Hansen et al., 1996)。これらの試験の最初の時点では、hLL1およびmLL1は同じプロセシングパターンが確認された。1時間内に最大異化作用に達した(図8B)。
hLL1の細胞傷害性をヒトリンパ腫細胞系統のRaji細胞にて、mLL1およびcLL1のものと比較した。hLL1およびcLL1の架橋剤としてヤギ抗ヒトIgG Fcフラグメント特異的Ab(α−hFc)を用い、mLL1についてはヤギ抗マウスIgG Fc特異的Ab(α−mFc)を用いた。0日目、5μg/mLのLL1 Abおよび50μg/mlの適当な架橋剤を含む1mLの培地に5×105のRaji細胞を播種した。全細胞および生存細胞の数を3日間毎日計数した。図9に示されているように、通常のRaji細胞の総数は3日間で4〜5倍増え、3日目の終わりには細胞生存率が80%を超えるまでに留まっていた。架橋剤単独、LL1 Ab単独、またはLL1 Abと同等でない架橋剤(例えば、hLL1およびヤギ抗マウスIgG Fc特異的Ab)で処理した細胞は通常のRaji細胞とは区別できなかった。しかし、hLL1と抗ヒトIgG Fc特異的Abの組み合わせは効果的に細胞死をもたらし、一日のうちに細胞生存率に40%を超える減少と、3日目にほとんど全細胞の死滅をもたらした。hLL1の有効性はmLL1およびcLL1に匹敵するものであった。Daudi細胞を用いた場合にも同様の結果が認められた(図10)。別のインターナライジングAb、hLL2(ヒト化抗CD22 Ab)ではこのような結果は見られなかった。これらの結果から、リンパ腫細胞系統に対するhLL1の細胞傷害作用は細胞表面上のAbの架橋に特異的に依存することが証明された。
Claims (36)
- CD74と、マウス抗CD74抗体LL1との結合をブロックする、ヒト化またはキメラ抗CD74抗体、またはそのCD74抗原結合フラグメントであって、
前記マウス抗CD74抗体が、L鎖可変領域の相補性決定領域(CDR)の配列として、RSSQSLVHRNGNTYLH(CDR1)、TVSNRFS(CDR2)およびSQSSHVPPT(CDR3)を含んでなり、かつH鎖可変領域の相補性決定領域(CDR)の配列として、NYGVN(CDR1)、WINPNTGEPTFDDDFKG(CDR2)およびSRGKNEAWFAY(CDR3)を含んでなり、
前記ヒト化またはキメラ抗CD74抗体またはそのCD74抗原結合フラグメントが、L鎖可変領域の相補性決定領域(CDR)の配列として、RSSQSLVHRNGNTYLH(CDR1)、TVSNRFS(CDR2)およびSQSSHVPPT(CDR3)を含んでなり、かつH鎖可変領域の相補性決定領域(CDR)の配列として、NYGVN(CDR1)、WINPNTGEPTFDDDFKG(CDR2)およびSRGKNEAWFAY(CDR3)を含んでなる、ヒト化またはキメラ抗CD74抗体、またはその抗原結合フラグメント。 - 非結合抗体またはそのフラグメントである、請求項1に記載のヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント。
- 少なくとも一つの診断薬または治療薬と結合している、請求項1に記載のヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント。
- 前記抗CD74抗体またはCD74抗原結合フラグメントが、ヒト化抗体であって、マウス抗CD74抗体の相補性決定領域(CDR)と、ヒト抗体のフレームワーク(FR)とを含んでなる、請求項1〜3のいずれか一項に記載のヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント。
- 前記ヒト化抗体のL鎖およびH鎖可変領域のFRが、これに対応する前記マウス抗体のFRから置換した少なくとも一つのアミノ酸を含んでなる、請求項4に記載のヒト化抗CD74抗体またはその抗原結合フラグメント。
- H鎖可変領域およびL鎖可変領域を含んでなる、請求項4に記載のヒト化抗CD74mAbまたはその抗原結合フラグメント。
- ヒト抗体のL鎖およびH鎖定常領域またはその一部をさらに含んでなる、請求項4に記載のヒト化抗CD74抗体またはその抗原結合フラグメント。
- ヒト化IgG1である、請求項4に記載のヒト化抗CD74抗体またはその抗原結合フラグメント。
- キメラ抗体またはその抗原結合フラグメントである、請求項1〜3のいずれか一項に記載のヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント。
- ヒトの定常領域の配列に結合した、マウスLL1抗体の可変領域の配列を含んでなる、請求項10に記載のキメラ抗CD74抗体またはその抗原結合フラグメント。
- 少なくとも一つの診断薬または治療薬と結合している、請求項10に記載のキメラ抗CD74mAbまたはその抗原結合フラグメント。
- H鎖可変領域およびL鎖可変領域を含んでなる、請求項12に記載のキメラ抗CD74mAbまたはその抗原結合フラグメント。
- キメラIgG1である、請求項12に記載のキメラ抗CD74抗体またはその抗原結合フラグメント。
- 以下の少なくとも一つの特性を示す、請求項1に記載のヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント:
(a)CD74に対する前記抗体またはその抗原結合フラグメントの結合が、CD74に特異的な抗体またはそのフラグメントによってブロッキングされること、
(b)前記抗体またはその抗原結合フラグメントが、Rajiリンパ腫培養細胞によってインターナライズされること、および
(c)前記抗体またはその抗原結合フラグメントが、マウスIgG1 抗体のFcと反応性を有するヤギ抗血清と架橋させた場合、Raji培養細胞のアポトーシスを誘導すること。 - 前記抗原結合フラグメントが、F(ab’)2、Fab、scFv、Fvであるか、またはF(ab’)2、Fab、scFvもしくはFvを含んでなる融合構築物である、請求項1に記載のヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント。
- 前記融合構築物が、融合タンパク質であり、かつ多価であるかまたは多価かつ多重特異性である、請求項16に記載のヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント。
- ヒトIgG2a、IgG3、またはIgG4のヒト定常領域で置換された、IgG1の定常領域を含んでなる、請求項1に記載のヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント。
- マウス抗CD74モノクローナル抗体(mAb)またはその抗原結合フラグメントであって、(a)RSSQSLVHRNGNTYLH(CDR1)、TVSNRFS(CDR2)およびSQSSHVPPT(CDR3)を含んでなるマウス抗CD74mAbのL鎖可変領域のCDR、(b)NYGVN(CDR1)、WINPNTGEPTFDDDFKG(CDR2)およびSRGKNEAWFAY(CDR3)を含んでなるマウス抗CD74mAbのH鎖可変領域のCDR、および(c)マウス抗CD74抗体のフレームワーク(FR)領域を含んでなる、マウス抗CD74mAbまたはその抗原結合フラグメント。
- 請求項16に記載の抗体またはその抗原結合フラグメントの4以上のFvまたはFabを含んでなる、抗体融合タンパク質。
- 前記治療薬が、ドキソルビシンである、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、RNアーゼである、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、放射性核種である、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、免疫調節剤である、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、インターフェロンである、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、毒素である、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、薬物である、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、ビンカアルカロイド、アントラサイクリン、エピトフィロトキシン、タキサン、抗代謝剤、アルキル化剤、抗生物質、Cox−2阻害剤、抗有糸分裂剤、抗脈管形成剤、アポトーシス剤、ドキソルビシン、メトトレキサート、タキソール、CPT−11、カンプトテカン、ナイトロジェンマスタード、アルキルスルホネート、ニトロソウレア、トリアゼン、葉酸類似体、ピリミジン類似体、プリン類似体、プラチナ錯体およびホルモンからなる群から選択される薬物である、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、リシン、アブリン、リボヌクレアーゼ(RNアーゼ)、DNアーゼ I、ブドウ球菌内毒素−A、アメリカヤマゴボウ抗ウイルスタンパク質、ゲロニン、ジフテリア毒、シュードモナス外毒素、およびシュードモナス内毒素からなる群から選択される毒物である、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- 前記治療薬が、サイトカインである、請求項3に記載の抗CD74抗体またはその抗原結合フラグメント。
- キメラである、請求項21〜30のいずれか一項に記載の抗CD74抗体またはその抗原結合フラグメント。
- ヒト化されている、請求項21〜30のいずれか一項に記載の抗CD74抗体またはその抗原結合フラグメント。
- 患者におけるCD74陽性癌の治療用組成物であって、
少なくとも一つのヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント、または、ヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメントを含んでなる融合タンパク質を含んでなり、ここで、
前記ヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメントが、L鎖可変領域の相補性決定領域(CDR)の配列として、RSSQSLVHRNGNTYLH(CDR1)、TVSNRFS(CDR2)およびSQSSHVPPT(CDR3)を含んでなり、かつH鎖可変領域の相補性決定領域(CDR)の配列として、NYGVN(CDR1)、WINPNTGEPTFDDDFKG(CDR2)およびSRGKNEAWFAY(CDR3)を含んでなる、治療用組成物。 - 非結合抗CD74抗体を含んでなる、請求項33に記載の治療用組成物。
- 前記非結合抗CD74抗体が、ヒト化抗CD74抗体である、請求項34に記載の治療用組成物。
- L鎖可変領域の相補性決定領域(CDR)の配列として、RSSQSLVHRNGNTYLH(CDR1)、TVSNRFS(CDR2)およびSQSSHVPPT(CDR3)を含んでなり、かつH鎖可変領域の相補性決定領域(CDR)の配列として、NYGVN(CDR1)、WINPNTGEPTFDDDFKG(CDR2)およびSRGKNEAWFAY(CDR3)を含んでなり、以下の少なくとも一つの特性を示す、ヒト化またはキメラ抗CD74抗体またはその抗原結合フラグメント:
(a)前記抗体またはその抗原結合フラグメントが、Rajiリンパ腫培養細胞によってインターナライズされること、および
(b)前記抗体またはその抗原結合フラグメントが、マウスIgG1 抗体のFcと反応性を有するヤギ抗血清と架橋させた場合、Raji培養細胞のアポトーシスを誘導すること。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US36025902P | 2002-03-01 | 2002-03-01 | |
| PCT/GB2003/000890 WO2003074567A2 (en) | 2002-03-01 | 2003-03-03 | Internalizing anti-cd74 antibodies and methods of use |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009272476A Division JP5335651B2 (ja) | 2002-03-01 | 2009-11-30 | インターナライジング抗cd74抗体およびその使用方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2006502699A JP2006502699A (ja) | 2006-01-26 |
| JP2006502699A5 JP2006502699A5 (ja) | 2006-04-20 |
| JP4472351B2 true JP4472351B2 (ja) | 2010-06-02 |
Family
ID=27788972
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003573032A Expired - Lifetime JP4472351B2 (ja) | 2002-03-01 | 2003-03-03 | インターナライジング抗cd74抗体およびその使用方法 |
| JP2009272476A Expired - Lifetime JP5335651B2 (ja) | 2002-03-01 | 2009-11-30 | インターナライジング抗cd74抗体およびその使用方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009272476A Expired - Lifetime JP5335651B2 (ja) | 2002-03-01 | 2009-11-30 | インターナライジング抗cd74抗体およびその使用方法 |
Country Status (14)
| Country | Link |
|---|---|
| US (8) | US7312318B2 (ja) |
| EP (3) | EP2865688A1 (ja) |
| JP (2) | JP4472351B2 (ja) |
| KR (1) | KR101017732B1 (ja) |
| CN (2) | CN1649902B (ja) |
| AT (1) | ATE477276T1 (ja) |
| AU (2) | AU2003215732B2 (ja) |
| CA (1) | CA2478012C (ja) |
| DE (1) | DE60333732D1 (ja) |
| DK (1) | DK1483294T3 (ja) |
| ES (1) | ES2350477T5 (ja) |
| HK (1) | HK1071576A1 (ja) |
| IL (2) | IL163851A0 (ja) |
| WO (1) | WO2003074567A2 (ja) |
Families Citing this family (173)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0757213A (ja) * | 1993-08-13 | 1995-03-03 | Matsushita Electric Ind Co Ltd | 磁気ヘッド |
| US6183744B1 (en) * | 1997-03-24 | 2001-02-06 | Immunomedics, Inc. | Immunotherapy of B-cell malignancies using anti-CD22 antibodies |
| US7829064B2 (en) * | 1999-05-10 | 2010-11-09 | Immunomedics, Inc. | Anti-CD74 immunoconjugates and methods |
| US8383081B2 (en) | 1999-05-10 | 2013-02-26 | Immunomedics, Inc. | Anti-CD74 immunoconjugates and methods of use |
| ES2331644T3 (es) * | 1999-06-09 | 2010-01-12 | Immunomedics, Inc. | Inmunoterapia de trastornos autoinmunes usando anticuerpos cuya diana son celulas b. |
| US20110045005A1 (en) | 2001-10-19 | 2011-02-24 | Craig Crowley | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US7591994B2 (en) | 2002-12-13 | 2009-09-22 | Immunomedics, Inc. | Camptothecin-binding moiety conjugates |
| US8435529B2 (en) * | 2002-06-14 | 2013-05-07 | Immunomedics, Inc. | Combining radioimmunotherapy and antibody-drug conjugates for improved cancer therapy |
| US20160279239A1 (en) * | 2011-05-02 | 2016-09-29 | Immunomedics, Inc. | Subcutaneous administration of anti-cd74 antibody for systemic lupus erythematosus and autoimmune disease |
| US9770517B2 (en) | 2002-03-01 | 2017-09-26 | Immunomedics, Inc. | Anti-Trop-2 antibody-drug conjugates and uses thereof |
| CN1649902B (zh) * | 2002-03-01 | 2011-04-13 | 免疫医疗公司 | 内在化抗-cd74抗体和使用方法 |
| US8361464B2 (en) | 2002-03-01 | 2013-01-29 | Immunomedics, Inc. | Anthracycline-Antibody Conjugates for Cancer Therapy |
| US7906118B2 (en) | 2005-04-06 | 2011-03-15 | Ibc Pharmaceuticals, Inc. | Modular method to prepare tetrameric cytokines with improved pharmacokinetics by the dock-and-lock (DNL) technology |
| JP5695287B2 (ja) | 2002-10-02 | 2015-04-01 | カリフォルニア インスティテュート オブ テクノロジー | 微小流体の核酸解析 |
| AU2003288467A1 (en) | 2002-12-13 | 2004-07-09 | Immunomedics, Inc. | Immunoconjugates with an intracellularly-cleavable linkage |
| US8420086B2 (en) | 2002-12-13 | 2013-04-16 | Immunomedics, Inc. | Camptothecin conjugates of anti-CD22 antibodies for treatment of B cell diseases |
| US7534427B2 (en) * | 2002-12-31 | 2009-05-19 | Immunomedics, Inc. | Immunotherapy of B cell malignancies and autoimmune diseases using unconjugated antibodies and conjugated antibodies and antibody combinations and fusion proteins |
| US20040202666A1 (en) * | 2003-01-24 | 2004-10-14 | Immunomedics, Inc. | Anti-cancer anthracycline drug-antibody conjugates |
| ATE517638T1 (de) * | 2003-01-31 | 2011-08-15 | Immunomedics Inc | Verfahren und zubereitungen zum verabreichen von therapeutischen und diagnostischen mitteln |
| KR100930353B1 (ko) | 2003-03-06 | 2009-12-08 | 엘지전자 주식회사 | 디스크 플레이어의 접속요청 처리방법 |
| US7902338B2 (en) | 2003-07-31 | 2011-03-08 | Immunomedics, Inc. | Anti-CD19 antibodies |
| WO2005014618A2 (en) | 2003-08-08 | 2005-02-17 | Immunomedics, Inc. | Bispecific antibodies for inducing apoptosis of tumor and diseased cells |
| US20060228331A1 (en) | 2003-10-10 | 2006-10-12 | Novo Nordisk A/S | IL-21 Derivatives and variants |
| WO2005037306A1 (en) * | 2003-10-17 | 2005-04-28 | Novo Nordisk A/S | Combination therapy |
| NZ596981A (en) * | 2003-11-17 | 2013-10-25 | Genentech Inc | Compositions and methods for the treatment of tumor of hematopoietic origin |
| US8551480B2 (en) | 2004-02-13 | 2013-10-08 | Immunomedics, Inc. | Compositions and methods of use of immunotoxins comprising ranpirnase (Rap) show potent cytotoxic activity |
| US8883160B2 (en) * | 2004-02-13 | 2014-11-11 | Ibc Pharmaceuticals, Inc. | Dock-and-lock (DNL) complexes for therapeutic and diagnostic use |
| US8652484B2 (en) | 2004-02-13 | 2014-02-18 | Immunomedics, Inc. | Delivery system for cytotoxic drugs by bispecific antibody pretargeting |
| US20110064754A1 (en) * | 2005-03-03 | 2011-03-17 | Center For Molecular Medicine And Immunology | Immunoconjugates Comprising Poxvirus-Derived Peptides and Antibodies Against Antigen-Presenting Cells for Subunit-Based Poxvirus Vaccines |
| US9550838B2 (en) | 2004-02-13 | 2017-01-24 | Ibc Pharmaceuticals, Inc. | Dock-and-lock (DNL) complexes for therapeutic and diagnostic use |
| US9481878B2 (en) | 2004-02-13 | 2016-11-01 | Immunomedics, Inc. | Compositions and methods of use of immunotoxins comprising ranpirnase (Rap) show potent cytotoxic activity |
| US20110020273A1 (en) * | 2005-04-06 | 2011-01-27 | Ibc Pharmaceuticals, Inc. | Bispecific Immunocytokine Dock-and-Lock (DNL) Complexes and Therapeutic Use Thereof |
| US8435539B2 (en) * | 2004-02-13 | 2013-05-07 | Immunomedics, Inc. | Delivery system for cytotoxic drugs by bispecific antibody pretargeting |
| US8562988B2 (en) * | 2005-10-19 | 2013-10-22 | Ibc Pharmaceuticals, Inc. | Strategies for improved cancer vaccines |
| US8491914B2 (en) * | 2004-02-13 | 2013-07-23 | Ibc Pharmaceuticals, Inc. | Dock-and-lock (DNL) complexes for delivery of interference RNA |
| US7589063B2 (en) | 2004-12-14 | 2009-09-15 | Aplagen Gmbh | Molecules which promote hematopoiesis |
| EP1853313B1 (en) | 2005-03-03 | 2018-01-24 | Immunomedics Inc. | Humanized l243 antibodies |
| US9707302B2 (en) | 2013-07-23 | 2017-07-18 | Immunomedics, Inc. | Combining anti-HLA-DR or anti-Trop-2 antibodies with microtubule inhibitors, PARP inhibitors, bruton kinase inhibitors or phosphoinositide 3-kinase inhibitors significantly improves therapeutic outcome in cancer |
| US20160355591A1 (en) | 2011-05-02 | 2016-12-08 | Immunomedics, Inc. | Subcutaneous anti-hla-dr monoclonal antibody for treatment of hematologic malignancies |
| US10058621B2 (en) | 2015-06-25 | 2018-08-28 | Immunomedics, Inc. | Combination therapy with anti-HLA-DR antibodies and kinase inhibitors in hematopoietic cancers |
| JP2006248978A (ja) * | 2005-03-10 | 2006-09-21 | Mebiopharm Co Ltd | 新規なリポソーム製剤 |
| US8349332B2 (en) | 2005-04-06 | 2013-01-08 | Ibc Pharmaceuticals, Inc. | Multiple signaling pathways induced by hexavalent, monospecific and bispecific antibodies for enhanced toxicity to B-cell lymphomas and other diseases |
| US8475794B2 (en) | 2005-04-06 | 2013-07-02 | Ibc Pharmaceuticals, Inc. | Combination therapy with anti-CD74 antibodies provides enhanced toxicity to malignancies, Autoimmune disease and other diseases |
| ES2417065T3 (es) | 2005-04-26 | 2013-08-05 | Trion Pharma Gmbh | Combinación de anticuerpos con glucocorticoides para el tratamiento del cáncer |
| CN101198624B (zh) * | 2005-05-06 | 2012-10-10 | 津莫吉尼蒂克斯公司 | Il-31单克隆抗体及使用方法 |
| BRPI0709014A2 (pt) * | 2006-03-09 | 2011-06-21 | Aplagen Gmbh | moléculas modifcadas que promovem hematopoise |
| WO2007140371A2 (en) | 2006-05-30 | 2007-12-06 | Genentech, Inc. | Antibodies and immunoconjugates and uses therefor |
| BRPI0717902A2 (pt) | 2006-12-01 | 2013-10-29 | Medarex Inc | "anticorpo monoclonal humano isolado, composição, conjugado anticorpo-molécula parceria, imunoconjugado, molécula de ácido nucléico isolada, vetor de expressão, célula hospedeira, método para prepar um anticorpo anti-cd22, método para inibir o desenvolvimento de uma célula tumoral que expressa cd22 e método para tratar uma doença inflamatória ou autoimuneem um indivíduo" |
| AU2011292178B8 (en) * | 2006-12-05 | 2016-01-21 | Ibc Pharmaceuticals, Inc. | Compositions and methods of use comprising combinations of anti-CD74 antibodies with a therapeutic agent. the therapeutic agent may be attached to the anti-CD74 antibody or may be separately administered, either before, simultaneously with or after the anti-CD74 antibody |
| CA2676129A1 (en) * | 2007-01-26 | 2008-08-07 | The Regents Of The University Of Colorado | Methods of modulating immune function |
| CA2692819A1 (en) | 2007-07-16 | 2009-01-22 | Genentech, Inc. | Humanized anti-cd79b antibodies and immunoconjugates and methods of use |
| PE20140614A1 (es) | 2007-07-16 | 2014-05-28 | Genentech Inc | Anticuerpos anti-cd79b e inmunoconjugados |
| JP2011502964A (ja) | 2007-10-23 | 2011-01-27 | ザ レジェンツ オブ ザ ユニバーシティ オブ コロラド | インバリアント鎖発現および/または異所性clip結合の競合的阻害剤 |
| CA2711807A1 (en) | 2008-01-08 | 2009-07-16 | Akthelia Pharmaceuticals | Agonists for antimicrobial peptide systems |
| US11072655B2 (en) | 2008-01-15 | 2021-07-27 | The Board Of Trustees Of The Leland Stanford Junior University | Markers of acute myeloid leukemia stem cells |
| JP2011518313A (ja) | 2008-01-15 | 2011-06-23 | ボード オブ トラスティーズ オブ ザ レランド スタンフォード ジュニア ユニバーシティ | 急性骨髄性白血病幹細胞のマーカー |
| ES2740823T3 (es) | 2008-01-15 | 2020-02-06 | Univ Leland Stanford Junior | Métodos para manipular fagocitosis mediada por CD47 |
| SI2247620T1 (sl) | 2008-01-31 | 2016-09-30 | Genentech, Inc. | Protitelesa proti CD79b in imunokonjugati in postopki za uporabo |
| EP2254597A4 (en) * | 2008-03-20 | 2012-04-18 | Carolus Therapeutics Inc | TREATMENT PROCEDURE WITH ANTI-MIF ANTIBODIES |
| WO2009120186A1 (en) * | 2008-03-24 | 2009-10-01 | Carolus Therapeutics, Inc. | Methods and compositions for treating atherosclerosis and related conditions |
| CN102186499B (zh) * | 2008-08-20 | 2015-05-20 | Ibc医药公司 | 用于癌症治疗的对接和锁定(dnl)疫苗 |
| US20100183598A1 (en) * | 2008-11-12 | 2010-07-22 | Carolus Therapeutics, Inc. | Methods of treating cardiovascular disorders |
| PE20120341A1 (es) | 2008-12-09 | 2012-04-24 | Genentech Inc | Anticuerpos anti-pd-l1 y su uso para mejorar la funcion de celulas t |
| EP2198879A1 (en) * | 2008-12-11 | 2010-06-23 | Institut Curie | CD74 modulator agent for regulating dendritic cell migration and device for studying the motility capacity of a cell |
| PT3903829T (pt) | 2009-02-13 | 2023-06-02 | Immunomedics Inc | Imunoconjugados com uma ligação intracelular clivável |
| US20160095939A1 (en) | 2014-10-07 | 2016-04-07 | Immunomedics, Inc. | Neoadjuvant use of antibody-drug conjugates |
| CA2774260C (en) | 2009-09-16 | 2018-10-09 | Immunomedics, Inc. | Class i anti-cea antibodies and uses thereof |
| WO2011038149A2 (en) * | 2009-09-23 | 2011-03-31 | Carolus Therapeutics, Inc. | Methods of treating inflammation |
| CN102573902A (zh) * | 2009-11-05 | 2012-07-11 | 分子医学和免疫学中心 | 用于基于亚单位的痘病毒疫苗的包含痘病毒衍生肽和针对抗原呈递细胞的抗体的免疫偶联物 |
| CA2782194C (en) | 2009-12-02 | 2018-01-16 | Immunomedics, Inc. | Combination of radiolabelled antibodies (rait) and antibody-drug conjugates (adc) for treatment of pancreatic cancer |
| WO2011085354A1 (en) * | 2010-01-11 | 2011-07-14 | Center For Molecular Medicine And Immunology | Enhanced cytotoxicity of anti-cd74 and anti-hla-dr antibodies with interferon-gamma |
| EP2552483A4 (en) * | 2010-04-01 | 2013-09-25 | Immunomedics Inc | USE OF ANTIBODIES TO REDUCE THE NUMBER OF CELLS CONTAINING ANTIGENS AND DENDRITIC CELLS |
| DE102010026064A1 (de) * | 2010-06-30 | 2012-01-05 | Siemens Aktiengesellschaft | 11C-markiertes Peptid zur Detektion eines krankhaften Gewebes |
| DE102010026063A1 (de) * | 2010-06-30 | 2012-01-05 | Siemens Aktiengesellschaft | 11C-markiertes Peptid zur Detektion eines krankhaften Gewebes |
| WO2012031273A2 (en) | 2010-09-03 | 2012-03-08 | Stem Centrx, Inc. | Novel modulators and methods of use |
| WO2012094495A2 (en) | 2011-01-05 | 2012-07-12 | The Texas A&M University System | Clip modulation for the treatment of mucosal diseases |
| SG191977A1 (en) * | 2011-02-01 | 2013-08-30 | Genmab As | Human antibodies and antibody-drug conjugates against cd74 |
| US8673308B2 (en) * | 2011-02-23 | 2014-03-18 | Als Therapy Development Institute | Targeting of CD8+ T-lymphocytes to treat neurodegenerative diseases |
| WO2012151199A1 (en) | 2011-05-02 | 2012-11-08 | Immunomedics, Inc. | Ultrafiltration concentration of allotype selected antibodies for small-volume administration |
| US8591892B2 (en) | 2011-07-18 | 2013-11-26 | The Ohio State University | FTY720 increases CD74 expression and sensitizes cancer cells to anti-CD74 antibody-mediated cell death |
| EP3378489A1 (en) | 2011-10-26 | 2018-09-26 | Elanco Tiergesundheit AG | Monoclonal antibodies and methods of use |
| KR102037541B1 (ko) | 2011-10-28 | 2019-10-29 | 테바 파마슈티컬즈 오스트레일리아 피티와이 엘티디 | 폴리펩티드 구축물 및 이의 용도 |
| US9757458B2 (en) | 2011-12-05 | 2017-09-12 | Immunomedics, Inc. | Crosslinking of CD22 by epratuzumab triggers BCR signaling and caspase-dependent apoptosis in hematopoietic cancer cells |
| CA2853138A1 (en) | 2011-12-05 | 2013-06-13 | Immunomedics, Inc. | Therapeutic use of anti-cd22 antibodies for inducing trogocytosis |
| US9856320B2 (en) | 2012-05-15 | 2018-01-02 | Bristol-Myers Squibb Company | Cancer immunotherapy by disrupting PD-1/PD-L1 signaling |
| CN104619350A (zh) | 2012-06-14 | 2015-05-13 | Ambrx公司 | 结合到核受体配体多肽的抗psma抗体 |
| US9382329B2 (en) | 2012-08-14 | 2016-07-05 | Ibc Pharmaceuticals, Inc. | Disease therapy by inducing immune response to Trop-2 expressing cells |
| US20150231241A1 (en) | 2012-08-14 | 2015-08-20 | Ibc Pharmaceuticals, Inc. | Combination therapy for inducing immune response to disease |
| EP3586874A1 (en) | 2012-08-14 | 2020-01-01 | IBC Pharmaceuticals, Inc. | T-cell redirecting bispecific antibodies for treatment of disease |
| US9682143B2 (en) | 2012-08-14 | 2017-06-20 | Ibc Pharmaceuticals, Inc. | Combination therapy for inducing immune response to disease |
| GB201216649D0 (en) * | 2012-09-18 | 2012-10-31 | Univ Birmingham | Agents and methods |
| US9714291B2 (en) | 2012-10-05 | 2017-07-25 | Kyowa Hakko Kirin Co., Ltd | Heterodimer protein composition |
| RS53818B1 (en) | 2012-10-12 | 2015-06-30 | Spirogen Sàrl | PIROLOBENZODIAZEPINI I NJIHOVI conjugated |
| US9492566B2 (en) | 2012-12-13 | 2016-11-15 | Immunomedics, Inc. | Antibody-drug conjugates and uses thereof |
| US10137196B2 (en) | 2012-12-13 | 2018-11-27 | Immunomedics, Inc. | Dosages of immunoconjugates of antibodies and SN-38 for improved efficacy and decreased toxicity |
| US9107960B2 (en) | 2012-12-13 | 2015-08-18 | Immunimedics, Inc. | Antibody-SN-38 immunoconjugates with a CL2A linker |
| US9931417B2 (en) | 2012-12-13 | 2018-04-03 | Immunomedics, Inc. | Antibody-SN-38 immunoconjugates with a CL2A linker |
| US10413539B2 (en) | 2012-12-13 | 2019-09-17 | Immunomedics, Inc. | Therapy for metastatic urothelial cancer with the antibody-drug conjugate, sacituzumab govitecan (IMMU-132) |
| EP4035689A1 (en) | 2012-12-13 | 2022-08-03 | Immunomedics Inc. | Dosages of immunoconjugates of antibodies and sn-38 for improved efficacy and decreased toxicity |
| US10744129B2 (en) | 2012-12-13 | 2020-08-18 | Immunomedics, Inc. | Therapy of small-cell lung cancer (SCLC) with a topoisomerase-I inhibiting antibody-drug conjugate (ADC) targeting Trop-2 |
| US10206918B2 (en) | 2012-12-13 | 2019-02-19 | Immunomedics, Inc. | Efficacy of anti-HLA-DR antiboddy drug conjugate IMMU-140 (hL243-CL2A-SN-38) in HLA-DR positive cancers |
| CA2895284A1 (en) | 2013-02-07 | 2014-08-14 | Immunomedics, Inc. | Pro-drug form (p2pdox) of the highly potent 2-pyrrolinodoxorubicin conjugated to antibodies for targeted therapy of cancer |
| WO2014127200A1 (en) | 2013-02-15 | 2014-08-21 | Immunomedics, Inc. | Chimeric and humanized anti-histone antibodies |
| EP2774930A1 (en) | 2013-03-07 | 2014-09-10 | Aptenia S.R.L. | Metallocene compounds and labeled molecules comprising the same for in vivo imaging. |
| CA2905181C (en) | 2013-03-13 | 2020-06-02 | Medimmune Limited | Pyrrolobenzodiazepines and conjugates thereof for providing targeted therapy |
| CN103207277B (zh) * | 2013-03-28 | 2015-04-15 | 中国人民解放军第二军医大学 | 一种人源性可溶型cd74蛋白的elisa检测试剂盒及检测方法 |
| US11117975B2 (en) | 2013-04-29 | 2021-09-14 | Teva Pharmaceuticals Australia Pty Ltd | Anti-CD38 antibodies and fusions to attenuated interferon alpha-2B |
| EA033115B1 (ru) | 2013-04-29 | 2019-08-30 | Тева Фармасьютикалз Острэйлиа Пти Лтд. | АНТИТЕЛА ПРОТИВ CD38 И СЛИТЫЕ БЕЛКИ С ОСЛАБЛЕННЫМ ИНТЕРФЕРОНОМ АЛЬФА-2b |
| US11253606B2 (en) | 2013-07-23 | 2022-02-22 | Immunomedics, Inc. | Combining anti-HLA-DR or anti-Trop-2 antibodies with microtubule inhibitors, PARP inhibitors, Bruton kinase inhibitors or phosphoinositide 3-kinase inhibitors significantly improves therapeutic outcome in cancer |
| WO2015067277A1 (en) | 2013-11-07 | 2015-05-14 | University Of Copenhagen | Timp-1 binding partner |
| KR102535900B1 (ko) * | 2013-12-25 | 2023-05-26 | 다이이찌 산쿄 가부시키가이샤 | 항 trop2 항체-약물 컨쥬게이트 |
| EP3099704B1 (en) | 2014-01-27 | 2021-03-17 | Molecular Templates, Inc. | Mhc class i epitope delivering polypeptides |
| AU2015219495B2 (en) | 2014-02-21 | 2019-11-21 | Ibc Pharmaceuticals, Inc. | Disease therapy by inducing immune response to Trop-2 expressing cells |
| CN106029098A (zh) | 2014-02-25 | 2016-10-12 | 免疫医疗公司 | 人源化rfb4抗cd22抗体 |
| EP3872090A1 (en) * | 2014-03-11 | 2021-09-01 | Molecular Templates, Inc. | Proteins comprising amino-terminal proximal shiga toxin a subunit effector regions and cell-targeting immunoglobulin-type binding regions |
| DK3126383T3 (en) | 2014-04-03 | 2019-04-01 | Igm Biosciences Inc | MODIFIED J-CHAIN |
| UA119352C2 (uk) | 2014-05-01 | 2019-06-10 | Тева Фармасьютикалз Острейліа Пті Лтд | Комбінація леналідоміду або помалідоміду і конструкції анти-cd38 антитіло-атенуйований інтерферон альфа-2b та спосіб лікування суб'єкта, який має cd38-експресуючу пухлину |
| US10351621B2 (en) | 2014-06-24 | 2019-07-16 | Immunomedics, Inc. | Anti-histone therapy in acute kidney injury |
| EP3160504B1 (en) | 2014-06-24 | 2020-09-16 | Immunomedics, Inc. | Anti-histone therapy for vascular necrosis in severe glomerulonephritis |
| WO2016037985A1 (en) | 2014-09-08 | 2016-03-17 | Ruprecht-Karls-Universität Heidelberg | Construct for the delivery of a molecule into the cytoplasm of a cell |
| WO2016037644A1 (en) | 2014-09-10 | 2016-03-17 | Medimmune Limited | Pyrrolobenzodiazepines and conjugates thereof |
| CN104280553B (zh) * | 2014-09-22 | 2016-06-08 | 中国人民解放军第二军医大学 | 一种小鼠源性可溶型cd74蛋白的elisa检测试剂盒及检测方法 |
| EP3689910A3 (en) | 2014-09-23 | 2020-12-02 | F. Hoffmann-La Roche AG | Method of using anti-cd79b immunoconjugates |
| IL251822B2 (en) | 2014-10-29 | 2023-03-01 | Teva Pharmaceuticals Australia Pty Ltd | Variants of interferon alpha-2-b |
| US11596652B2 (en) | 2015-02-18 | 2023-03-07 | Enlivex Therapeutics R&D Ltd | Early apoptotic cells for use in treating sepsis |
| US11318163B2 (en) | 2015-02-18 | 2022-05-03 | Enlivex Therapeutics Ltd | Combination immune therapy and cytokine control therapy for cancer treatment |
| US11304976B2 (en) | 2015-02-18 | 2022-04-19 | Enlivex Therapeutics Ltd | Combination immune therapy and cytokine control therapy for cancer treatment |
| US11512289B2 (en) | 2015-02-18 | 2022-11-29 | Enlivex Therapeutics Rdo Ltd | Combination immune therapy and cytokine control therapy for cancer treatment |
| WO2017141243A1 (en) | 2016-02-18 | 2017-08-24 | Enlivex Therapeutics Ltd. | Combination immune therapy and cytokine control therapy for cancer treatment |
| RU2746021C2 (ru) * | 2015-02-18 | 2021-04-06 | Ф.Хоффманн-Ля Рош Аг | Иммуноконъюгаты для специфической индукции цитотоксичности т-клеток против клеток-мишеней |
| US11497767B2 (en) | 2015-02-18 | 2022-11-15 | Enlivex Therapeutics R&D Ltd | Combination immune therapy and cytokine control therapy for cancer treatment |
| US11000548B2 (en) | 2015-02-18 | 2021-05-11 | Enlivex Therapeutics Ltd | Combination immune therapy and cytokine control therapy for cancer treatment |
| DK3265575T3 (da) | 2015-03-04 | 2021-05-31 | Igm Biosciences Inc | Cd20-bindende molekyler og anvendelser deraf |
| CN113106053A (zh) | 2015-04-21 | 2021-07-13 | 恩立夫克治疗有限责任公司 | 治疗性汇集的血液凋亡细胞制剂与其用途 |
| CN107428837A (zh) | 2015-04-22 | 2017-12-01 | 免疫医疗公司 | 循环trop‑2阳性癌细胞的分离、检测、诊断和/或鉴定 |
| KR20240038121A (ko) | 2015-05-30 | 2024-03-22 | 몰레큘러 템플레이츠, 인코퍼레이션. | 탈면역된 시가 독소 a 서브유닛 스캐폴드 및 이를 포함하는 세포-표적화 분자 |
| US10195175B2 (en) | 2015-06-25 | 2019-02-05 | Immunomedics, Inc. | Synergistic effect of anti-Trop-2 antibody-drug conjugate in combination therapy for triple-negative breast cancer when used with microtubule inhibitors or PARP inhibitors |
| GB201511191D0 (en) * | 2015-06-25 | 2015-08-12 | Immatics Biotechnologies Gmbh | T-cell epitopes for the immunotherapy of myeloma |
| PT3313443T (pt) | 2015-06-25 | 2023-08-30 | Immunomedics Inc | Combinação de anticorpos anti-hla-dr ou anti-trop-2 com inibidores de microtúbulos, inibidores de parp, inibidores de bruton quinase ou inibidores de fosfoinositídeo 3-quinase melhora significativamente o resultado terapêutico no cancro |
| SI3316885T1 (sl) | 2015-07-01 | 2021-09-30 | Immunomedics, Inc. | Imunokonjugati protitelo-SN-38 z linkerjem CL2A |
| CN115960230A (zh) | 2015-08-07 | 2023-04-14 | 伊麦吉纳博公司 | 靶向分子的抗原结合构建体 |
| DK3356401T3 (da) | 2015-09-30 | 2020-09-07 | Igm Biosciences Inc | Bindingsmolekyler med modificeret j-kæde |
| AU2016329197B2 (en) | 2015-09-30 | 2021-01-21 | Igm Biosciences, Inc. | Binding molecules with modified J-chain |
| JP2019506844A (ja) * | 2015-12-18 | 2019-03-14 | ノバルティス アーゲー | CD32bを標的とする抗体およびその使用方法 |
| WO2017132103A2 (en) | 2016-01-29 | 2017-08-03 | Merck Sharp & Dohme Corp. | Phosphonate linkers and their use to facilitate cellular retention of compounds |
| US20170224837A1 (en) | 2016-02-10 | 2017-08-10 | Immunomedics, Inc. | Combination of abcg2 inhibitors with sacituzumab govitecan (immu-132) overcomes resistance to sn-38 in trop-2 expressing cancers |
| WO2017189279A1 (en) | 2016-04-27 | 2017-11-02 | Immunomedics, Inc. | Efficacy of anti-trop-2-sn-38 antibody drug conjugates for therapy of tumors relapsed/refractory to checkpoint inhibitors |
| DK3491384T3 (da) * | 2016-08-01 | 2021-06-28 | Health Research Inc | Sammensætninger og fremgangsmåder til hurtig kloning af t-celle-receptorer |
| WO2018069289A1 (en) | 2016-10-11 | 2018-04-19 | Medimmune Limited | Antibody-drug conjugates with immune-mediated therapy agents |
| KR102557126B1 (ko) | 2016-12-07 | 2023-07-18 | 몰레큘러 템플레이츠, 인코퍼레이션. | 부위 특이적 접합을 위한 시가 독소 a 서브유닛 작동체 폴리펩타이드, 시가 독소 작동체 스캐폴드, 및 세포-표적화 분자 |
| IL267990B2 (en) | 2017-01-25 | 2024-04-01 | Molecular Templates Inc | Cell-targeted molecules containing Shiga toxin A subunit activators and nonimmune CD8 T-cell epitopes |
| RU2758234C2 (ru) | 2017-03-27 | 2021-10-26 | Иммьюномедикс, Инк. | ЛЕЧЕНИЕ ТРИЖДЫ НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, ХАРАКТЕРИЗУЮЩЕГОСЯ ЭКСПРЕССИЕЙ Trop-2, С ПОМОЩЬЮ САЦИТУЗУМАБА ГОВИТЕКАНА И ИНГИБИТОРА Rad51 |
| EP3606964A4 (en) | 2017-04-03 | 2020-12-09 | Immunomedics, Inc. | SUBCUTANE ADMINISTRATION OF ANTIBODY DRUG CONJUGATES FOR CANCER THERAPY |
| BR112019024556A2 (pt) * | 2017-05-24 | 2020-06-23 | Novartis Ag | Proteínas enxertadas com citocina de anticorpo e métodos para uso no tratamento de câncer |
| WO2019224275A1 (en) | 2018-05-23 | 2019-11-28 | Adc Therapeutics Sa | Molecular adjuvant |
| SG11202101982RA (en) | 2018-09-26 | 2021-03-30 | Ascendis Pharma As | Degradable hyaluronic acid hydrogels |
| CN111303293B (zh) * | 2018-11-14 | 2022-08-30 | 杭州尚健生物技术有限公司 | 一种融合蛋白及其用途 |
| WO2020236825A2 (en) | 2019-05-20 | 2020-11-26 | Novartis Ag | Mcl-1 inhibitor antibody-drug conjugates and methods of use |
| CA3158206A1 (en) * | 2019-11-15 | 2021-05-20 | Jonathan S. Wall | Modified immunoglobulins for targeting amyloid deposits cross-reference to related applications |
| EP4178624A2 (en) | 2020-07-07 | 2023-05-17 | Bionecure Therapeutics, Inc. | Maytansinoids as adc payloads and their use for the treatment of cancer |
| WO2022008699A1 (en) | 2020-07-09 | 2022-01-13 | F. Hoffmann-La Roche Ag | Concentrated compositions of proteins, their preparation and use thereof |
| CA3187272A1 (en) | 2020-10-08 | 2022-04-14 | Thorsten Ross | Trispecific binders |
| WO2022079211A1 (en) | 2020-10-16 | 2022-04-21 | Adc Therapeutics Sa | Glycoconjugates |
| US11883432B2 (en) | 2020-12-18 | 2024-01-30 | Century Therapeutics, Inc. | Chimeric antigen receptor system with adaptable receptor specificity |
| GB202102396D0 (en) | 2021-02-19 | 2021-04-07 | Adc Therapeutics Sa | Molecular adjuvant |
| EP4342497A1 (en) | 2021-05-10 | 2024-03-27 | Kawasaki Institute of Industrial Promotion | Antibody having reduced binding affinity for antigen |
| CN113238061B (zh) * | 2021-07-09 | 2021-10-01 | 中南大学湘雅医院 | 以cd180阴性b细胞指示重症肌无力病情的试剂盒及应用 |
| CA3216098A1 (en) | 2021-07-30 | 2023-02-02 | Uwe Reusch | Duplexbodies |
| WO2023016488A1 (zh) | 2021-08-13 | 2023-02-16 | 昆山新蕴达生物科技有限公司 | 一种基于微管抑制剂的抗体偶联药物 |
| CN117881431A (zh) | 2021-08-24 | 2024-04-12 | 昆山新蕴达生物科技有限公司 | 一种由可断裂连接子偶联的抗体偶联药物 |
| AU2022382368A1 (en) | 2021-11-03 | 2024-05-02 | Affimed Gmbh | Bispecific cd16a binders |
| WO2023225359A1 (en) | 2022-05-20 | 2023-11-23 | Novartis Ag | Antibody-drug conjugates of antineoplastic compounds and methods of use thereof |
| CN116139267A (zh) * | 2023-01-28 | 2023-05-23 | 华中科技大学同济医学院附属同济医院 | 小鼠cd74单克隆抗体在制备治疗肿瘤药物中的应用 |
Family Cites Families (72)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1541435A (en) | 1975-02-04 | 1979-02-28 | Searle & Co | Immunological materials |
| US4036945A (en) | 1976-05-03 | 1977-07-19 | The Massachusetts General Hospital | Composition and method for determining the size and location of myocardial infarcts |
| US4331647A (en) | 1980-03-03 | 1982-05-25 | Goldenberg Milton David | Tumor localization and therapy with labeled antibody fragments specific to tumor-associated markers |
| US5204095A (en) | 1980-04-09 | 1993-04-20 | National Research Development Corporation | Monoclonal antibodies against hepatitis B virus |
| US4925922A (en) | 1983-02-22 | 1990-05-15 | Xoma Corporation | Potentiation of cytotoxic conjugates |
| US4916213A (en) | 1983-02-22 | 1990-04-10 | Xoma Corporation | Ribosomal inhibiting protein-immunoglobulin conjugates with specificity for tumor cell surface antigens, and mixtures thereof |
| US4816567A (en) * | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5672347A (en) * | 1984-07-05 | 1997-09-30 | Genentech, Inc. | Tumor necrosis factor antagonists and their use |
| US4824659A (en) | 1985-06-07 | 1989-04-25 | Immunomedics, Inc. | Antibody conjugates |
| US5776093A (en) | 1985-07-05 | 1998-07-07 | Immunomedics, Inc. | Method for imaging and treating organs and tissues |
| US4918163A (en) | 1985-09-27 | 1990-04-17 | Pfizer Inc. | Monoclonal antibodies specific for lipid-A determinants of gram negative bacteria |
| US5618920A (en) * | 1985-11-01 | 1997-04-08 | Xoma Corporation | Modular assembly of antibody genes, antibodies prepared thereby and use |
| US4699784A (en) | 1986-02-25 | 1987-10-13 | Center For Molecular Medicine & Immunology | Tumoricidal methotrexate-antibody conjugate |
| US5057313A (en) | 1986-02-25 | 1991-10-15 | The Center For Molecular Medicine And Immunology | Diagnostic and therapeutic antibody conjugates |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US4704692A (en) | 1986-09-02 | 1987-11-03 | Ladner Robert C | Computer based system and method for determining and displaying possible chemical structures for converting double- or multiple-chain polypeptides to single-chain polypeptides |
| US5567610A (en) | 1986-09-04 | 1996-10-22 | Bioinvent International Ab | Method of producing human monoclonal antibodies and kit therefor |
| US5258498A (en) * | 1987-05-21 | 1993-11-02 | Creative Biomolecules, Inc. | Polypeptide linkers for production of biosynthetic proteins |
| US5846534A (en) * | 1988-02-12 | 1998-12-08 | British Technology Group Limited | Antibodies to the antigen campath-1 |
| US5530101A (en) * | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5134075A (en) | 1989-02-17 | 1992-07-28 | Oncogen Limited Partnership | Monoclonal antibody to novel antigen associated with human tumors |
| US5171665A (en) | 1989-04-17 | 1992-12-15 | Oncogen | Monoclonal antibody to novel antigen associated with human tumors |
| JPH02283294A (ja) | 1989-04-24 | 1990-11-20 | Sumitomo Chem Co Ltd | ヒトモノクローナル抗体 |
| US5229275A (en) | 1990-04-26 | 1993-07-20 | Akzo N.V. | In-vitro method for producing antigen-specific human monoclonal antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5665595A (en) * | 1991-06-07 | 1997-09-09 | Dowelanco | Immunoglobulins against insect tissue |
| US5965132A (en) * | 1992-03-05 | 1999-10-12 | Board Of Regents, The University Of Texas System | Methods and compositions for targeting the vasculature of solid tumors |
| US5686072A (en) * | 1992-06-17 | 1997-11-11 | Board Of Regents, The University Of Texas | Epitope-specific monoclonal antibodies and immunotoxins and uses thereof |
| EP0752248B1 (en) * | 1992-11-13 | 2000-09-27 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| US5736137A (en) * | 1992-11-13 | 1998-04-07 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| US6030615A (en) * | 1993-05-17 | 2000-02-29 | The Picower Institute For Medical Research | Combination method for treating diseases caused by cytokine-mediated toxicity |
| US5484892A (en) * | 1993-05-21 | 1996-01-16 | Dana-Farber Cancer Institute, Inc. | Monoclonal antibodies that block ligand binding to the CD22 receptor in mature B cells |
| US6084067A (en) * | 1993-07-26 | 2000-07-04 | Dana-Farber Cancer Institute | CTLA4/CD28 ligands and uses therefor |
| US5417972A (en) * | 1993-08-02 | 1995-05-23 | The Board Of Trustees Of The Leland Stanford Junior University | Method of killing B-cells in a complement independent and an ADCC independent manner using antibodies which specifically bind CDIM |
| US5443953A (en) | 1993-12-08 | 1995-08-22 | Immunomedics, Inc. | Preparation and use of immunoconjugates |
| US5827690A (en) | 1993-12-20 | 1998-10-27 | Genzyme Transgenics Corporatiion | Transgenic production of antibodies in milk |
| AU3272695A (en) | 1994-08-12 | 1996-03-07 | Immunomedics Inc. | Immunoconjugates and humanized antibodies specific for b-cell lymphoma and leukemia cells |
| US5728369A (en) * | 1994-10-05 | 1998-03-17 | Immunomedics, Inc. | Radioactive phosphorus labeling of proteins for targeted radiotherapy |
| US5874540A (en) | 1994-10-05 | 1999-02-23 | Immunomedics, Inc. | CDR-grafted type III anti-CEA humanized mouse monoclonal antibodies |
| US5798554A (en) | 1995-02-24 | 1998-08-25 | Consorzio Per La Ricerca Sulla Microelettronica Nel Mezzogiorno | MOS-technology power device integrated structure and manufacturing process thereof |
| AUPO591797A0 (en) * | 1997-03-27 | 1997-04-24 | Commonwealth Scientific And Industrial Research Organisation | High avidity polyvalent and polyspecific reagents |
| CA2249320C (en) | 1996-03-20 | 2008-12-23 | Immunomedics, Inc. | Glycosylated humanized b-cell specific antibodies |
| WO1997041898A1 (en) | 1996-05-03 | 1997-11-13 | Immunomedics, Inc. | Targeted combination immunotherapy of cancer |
| US7521531B2 (en) * | 1996-08-28 | 2009-04-21 | Immunomedics, Inc. | Methods for the purification of stable radioiodine conjugates |
| US6653104B2 (en) * | 1996-10-17 | 2003-11-25 | Immunomedics, Inc. | Immunotoxins, comprising an internalizing antibody, directed against malignant and normal cells |
| US6306393B1 (en) | 1997-03-24 | 2001-10-23 | Immunomedics, Inc. | Immunotherapy of B-cell malignancies using anti-CD22 antibodies |
| JP3835827B2 (ja) * | 1997-05-02 | 2006-10-18 | ザ ガバメント オブ ザ ユナイテッド ステイツ オブ アメリカ,アズ リプレゼンティッド バイ ザ セクレタリーオブ ザ デパートメント オブ ヘルス アンド ヒューマン サービシーズ | 悪性細胞に対する、oncタンパク質を含む、免疫毒素 |
| US6051228A (en) * | 1998-02-19 | 2000-04-18 | Bristol-Myers Squibb Co. | Antibodies against human CD40 |
| ES2301254T3 (es) | 1998-11-18 | 2008-06-16 | Genentech, Inc. | Variantes de anticuerpos con una afinidad de union mayor en comparacion con los anticuerpos parentales. |
| ATE447617T1 (de) | 1999-04-15 | 2009-11-15 | Crucell Holland Bv | Verwendung von rekombinanten proteinen in menschlichen zellen |
| PL200134B1 (pl) * | 1999-05-07 | 2008-12-31 | Genentech Inc | Zastosowanie przeciwciała anty-CD20 |
| US7829064B2 (en) * | 1999-05-10 | 2010-11-09 | Immunomedics, Inc. | Anti-CD74 immunoconjugates and methods |
| US8383081B2 (en) * | 1999-05-10 | 2013-02-26 | Immunomedics, Inc. | Anti-CD74 immunoconjugates and methods of use |
| US7527787B2 (en) * | 2005-10-19 | 2009-05-05 | Ibc Pharmaceuticals, Inc. | Multivalent immunoglobulin-based bioactive assemblies |
| US7534866B2 (en) * | 2005-10-19 | 2009-05-19 | Ibc Pharmaceuticals, Inc. | Methods and compositions for generating bioactive assemblies of increased complexity and uses |
| ES2331644T3 (es) | 1999-06-09 | 2010-01-12 | Immunomedics, Inc. | Inmunoterapia de trastornos autoinmunes usando anticuerpos cuya diana son celulas b. |
| KR20020091170A (ko) * | 2000-03-31 | 2002-12-05 | 아이덱 파마슈티칼즈 코포레이션 | B 세포 림프종의 치료를 위한 항-사이토카인 항체 또는길항제 및 항-cd20의 조합된 사용 |
| US6629995B1 (en) * | 2000-03-31 | 2003-10-07 | Super Gen, Inc. | Camptothecin conjugates |
| EP2052742A1 (en) * | 2000-06-20 | 2009-04-29 | Biogen Idec Inc. | Treatment of B-cell associated diseases such as malignancies and autoimmune diseases using a cold anti-CD20 antibody/radiolabeled anti-CD22 antibody combination |
| AU2002243905B2 (en) * | 2001-01-26 | 2007-11-08 | Emory University | Methods of inducing organ transplant tolerance and correcting hemoglobinopathies |
| CA2455915C (en) * | 2001-03-29 | 2013-05-14 | Cytokine Pharmasciences, Inc. | Methods and compositions for using mhc class ii invariant chain polypeptide as a receptor for macrophage migration inhibitory factor |
| US8287864B2 (en) * | 2002-02-14 | 2012-10-16 | Immunomedics, Inc. | Structural variants of antibodies for improved therapeutic characteristics |
| US7591994B2 (en) * | 2002-12-13 | 2009-09-22 | Immunomedics, Inc. | Camptothecin-binding moiety conjugates |
| CN1649902B (zh) * | 2002-03-01 | 2011-04-13 | 免疫医疗公司 | 内在化抗-cd74抗体和使用方法 |
| US8361464B2 (en) * | 2002-03-01 | 2013-01-29 | Immunomedics, Inc. | Anthracycline-Antibody Conjugates for Cancer Therapy |
| US7563433B2 (en) * | 2007-01-11 | 2009-07-21 | Immunomedics, Inc. | Methods and compositions for F-18 labeling of proteins, peptides and other molecules |
| AU2003288467A1 (en) * | 2002-12-13 | 2004-07-09 | Immunomedics, Inc. | Immunoconjugates with an intracellularly-cleavable linkage |
| ATE517638T1 (de) * | 2003-01-31 | 2011-08-15 | Immunomedics Inc | Verfahren und zubereitungen zum verabreichen von therapeutischen und diagnostischen mitteln |
| US8067006B2 (en) * | 2005-04-06 | 2011-11-29 | Immunomedics, Inc. | Polymeric carriers of therapeutic agents and recognition moieties for antibody-based targeting of disease sites |
| EP1874824A4 (en) * | 2005-04-06 | 2009-12-30 | Ibc Pharmaceuticals Inc | METHODS OF GENERATING STABLE COMPOUND RELATED COMPLEXES OF HOMODIMERS, HOMOTRATEERS OR DIMER SIZES AND USES THEREOF |
| CN102186499B (zh) * | 2008-08-20 | 2015-05-20 | Ibc医药公司 | 用于癌症治疗的对接和锁定(dnl)疫苗 |
| KR102188537B1 (ko) | 2019-08-14 | 2020-12-08 | 라인플러스 주식회사 | 유니캐스트 및 멀티캐스트를 이용한 그룹 통화 방법 및 시스템 |
-
2003
- 2003-03-03 CN CN038098636A patent/CN1649902B/zh not_active Expired - Lifetime
- 2003-03-03 DE DE60333732T patent/DE60333732D1/de not_active Expired - Lifetime
- 2003-03-03 EP EP20150000046 patent/EP2865688A1/en not_active Withdrawn
- 2003-03-03 US US10/377,122 patent/US7312318B2/en active Active
- 2003-03-03 KR KR1020047013665A patent/KR101017732B1/ko active IP Right Grant
- 2003-03-03 AU AU2003215732A patent/AU2003215732B2/en not_active Expired
- 2003-03-03 AT AT03743421T patent/ATE477276T1/de not_active IP Right Cessation
- 2003-03-03 IL IL16385103A patent/IL163851A0/xx unknown
- 2003-03-03 DK DK03743421.4T patent/DK1483294T3/da active
- 2003-03-03 EP EP03743421.4A patent/EP1483294B2/en not_active Expired - Lifetime
- 2003-03-03 WO PCT/GB2003/000890 patent/WO2003074567A2/en active Application Filing
- 2003-03-03 CA CA2478012A patent/CA2478012C/en not_active Expired - Lifetime
- 2003-03-03 EP EP10009396.2A patent/EP2308898B1/en not_active Expired - Lifetime
- 2003-03-03 ES ES03743421T patent/ES2350477T5/es not_active Expired - Lifetime
- 2003-03-03 CN CN201110042106.4A patent/CN102174108B/zh not_active Expired - Lifetime
- 2003-03-03 JP JP2003573032A patent/JP4472351B2/ja not_active Expired - Lifetime
-
2004
- 2004-08-31 IL IL163851A patent/IL163851A/en active IP Right Grant
-
2005
- 2005-06-07 HK HK05104748.2A patent/HK1071576A1/xx not_active IP Right Cessation
-
2007
- 2007-05-29 US US11/754,902 patent/US7919087B2/en not_active Expired - Lifetime
- 2007-10-05 US US11/867,775 patent/US7772373B2/en not_active Expired - Lifetime
-
2009
- 2009-09-03 US US12/553,566 patent/US20100015048A1/en not_active Abandoned
- 2009-11-30 JP JP2009272476A patent/JP5335651B2/ja not_active Expired - Lifetime
- 2009-12-02 AU AU2009243494A patent/AU2009243494B2/en not_active Expired
-
2010
- 2010-06-01 US US12/791,418 patent/US20100284906A1/en not_active Abandoned
- 2010-06-07 US US12/794,823 patent/US7931903B2/en not_active Expired - Lifetime
-
2011
- 2011-03-14 US US13/047,515 patent/US20110195023A1/en not_active Abandoned
- 2011-05-24 US US13/114,122 patent/US20110244546A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4472351B2 (ja) | インターナライジング抗cd74抗体およびその使用方法 | |
| JP4498746B2 (ja) | 抗cd20抗体およびその融合タンパク質ならびに使用法 | |
| JP5951850B2 (ja) | 改良された抗cd19抗体 | |
| JP4733635B2 (ja) | 抗cd19抗体 | |
| AU2015201433B2 (en) | Internalizing anti-cd74 antibodies and methods of use | |
| AU2012216518B2 (en) | Internalizing Anti-CD74 Antibodies and Methods of Use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060303 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060303 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081212 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090312 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090319 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090413 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090420 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090511 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090518 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090612 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090731 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20091030 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20091109 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091130 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100205 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100303 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130312 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4472351 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140312 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |