JP4466855B2 - ポジ型レジスト組成物 - Google Patents
ポジ型レジスト組成物 Download PDFInfo
- Publication number
- JP4466855B2 JP4466855B2 JP2005083940A JP2005083940A JP4466855B2 JP 4466855 B2 JP4466855 B2 JP 4466855B2 JP 2005083940 A JP2005083940 A JP 2005083940A JP 2005083940 A JP2005083940 A JP 2005083940A JP 4466855 B2 JP4466855 B2 JP 4466855B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- poly
- glycerin
- resist composition
- positive resist
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/027—Non-macromolecular photopolymerisable compounds having carbon-to-carbon double bonds, e.g. ethylenic compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F290/00—Macromolecular compounds obtained by polymerising monomers on to polymers modified by introduction of aliphatic unsaturated end or side groups
- C08F290/02—Macromolecular compounds obtained by polymerising monomers on to polymers modified by introduction of aliphatic unsaturated end or side groups on to polymers modified by introduction of unsaturated end groups
- C08F290/06—Polymers provided for in subclass C08G
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L79/00—Compositions of macromolecular compounds obtained by reactions forming in the main chain of the macromolecule a linkage containing nitrogen with or without oxygen or carbon only, not provided for in groups C08L61/00 - C08L77/00
- C08L79/04—Polycondensates having nitrogen-containing heterocyclic rings in the main chain; Polyhydrazides; Polyamide acids or similar polyimide precursors
- C08L79/08—Polyimides; Polyester-imides; Polyamide-imides; Polyamide acids or similar polyimide precursors
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/022—Quinonediazides
- G03F7/023—Macromolecular quinonediazides; Macromolecular additives, e.g. binders
- G03F7/0233—Macromolecular quinonediazides; Macromolecular additives, e.g. binders characterised by the polymeric binders or the macromolecular additives other than the macromolecular quinonediazides
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/027—Non-macromolecular photopolymerisable compounds having carbon-to-carbon double bonds, e.g. ethylenic compounds
- G03F7/028—Non-macromolecular photopolymerisable compounds having carbon-to-carbon double bonds, e.g. ethylenic compounds with photosensitivity-increasing substances, e.g. photoinitiators
- G03F7/029—Inorganic compounds; Onium compounds; Organic compounds having hetero atoms other than oxygen, nitrogen or sulfur
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/027—Non-macromolecular photopolymerisable compounds having carbon-to-carbon double bonds, e.g. ethylenic compounds
- G03F7/028—Non-macromolecular photopolymerisable compounds having carbon-to-carbon double bonds, e.g. ethylenic compounds with photosensitivity-increasing substances, e.g. photoinitiators
- G03F7/031—Organic compounds not covered by group G03F7/029
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/039—Macromolecular compounds which are photodegradable, e.g. positive electron resists
- G03F7/0392—Macromolecular compounds which are photodegradable, e.g. positive electron resists the macromolecular compound being present in a chemically amplified positive photoresist composition
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
- G03F7/075—Silicon-containing compounds
- G03F7/0757—Macromolecular compounds containing Si-O, Si-C or Si-N bonds
Landscapes
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- General Physics & Mathematics (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Polymers & Plastics (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Inorganic Chemistry (AREA)
- Silicon Polymers (AREA)
- Materials For Photolithography (AREA)
- Polyethers (AREA)
- Other Resins Obtained By Reactions Not Involving Carbon-To-Carbon Unsaturated Bonds (AREA)
- Compositions Of Macromolecular Compounds (AREA)
Description
関連する技術文献を挙げると、例えば、特許文献1には、アルコキシレート系、脂肪酸エステル系、アミド系等の非イオン性界面活性剤を含有するレジストパターン平滑化材料が記載されている。
また、特許文献2には、シリコーン系界面活性剤、フッ素系界面活性剤及びフッ素原子を有するシリコーン系界面活性剤から選択される界面活性剤を含む感光性樹脂組成物が記載されている。
そのため、これらに代わる感光性樹脂組成物用レベリング剤として、フッ素ポリエーテル共変性シリコーンが使用されるが、これはフッ素置換アルキル基の安全性に問題があることから、代替品が求められていた。
そこで、本発明は、ポジ型レジスト組成物用の溶剤との相溶性に優れ、表面張力低下能、表面平滑能が高く、かつ、安全性の高いポジ型レジスト組成物用レベリング剤を含有したポジ型レジスト組成物、すなわち、基材上に広がりやすく展延性に優れ、塗布ムラを発生することなく均一に塗布することができ、かつ、安全性の高いポジ型レジスト組成物を提供することを課題とする。
すなわち、本発明は、下記式(1)で表されるオルガノポリシロキサン残基である構成単位Aと、下記式(2)で表される(ポリ)グリセリン誘導体残基である構成単位Bが、A-B-Aで結合されてなる(ポリ)グリセリン変性シリコーンを0.01〜20重量%含有するポジ型レジスト組成物である。
[但し、式(1)中、R1は、互いに独立に、ハロゲンで置換されていてもよい炭素数1〜10の、アルキル基、シクロアルキル基、アリール基もしくはアラルキル基であり、Xは0〜100の整数であり、αは1又は2である。また、式(2)中、R2は、互いに独立に、炭素数2〜11のアルキレン基であり、sは1〜11の整数である。]
この構成単位Aのオルガノポリシロキサン残基は、ABA型(ポリ)グリセリン変性シリコーンの製法に関して後述するように、例えば、片末端にヒドロシリル基(Si-H基)を有するα−オルガノハイドロジェンポリシロキサンから誘導することができる。
前記式(2)において、R2は、互いに独立に、炭素数2〜11のアルキレン基であり、例えば、エチレン基、トリメチレン基、テトラメチレン基、ペンタメチレン基、ヘキサメチレン基、ヘプタメチレン基、オクタメチレン基等の直鎖アルキレン基;プロピレン基、エチルエチレン基、2−メチルトリメチレン基、2−メチルテトラメチレン基等の分岐鎖アルキレン基が挙げられ、感光性樹脂組成物用レベリング剤としての効果、製造容易性等の理由から、好ましくは炭素数2〜5の直鎖アルキレン基であり、より好ましくは3、即ち、トリメチレン基である。
また、sは1〜11の整数であり、好ましくは1〜8の整数、さらに好ましくは2〜4の整数である。
しかしながら、ポジ型レジスト組成物用レベリング剤としての効果、製造容易性等を考慮すると、構成単位B は、特に下記式(3)で表される直鎖状の(ポリ)ポリグリセリン誘導体残基であることが好ましい。なお、式(3)において、R2はトリメチレン基であり、sは1〜8の整数である。
具体的には、1分子中に2個のアルケニル基を有する(ポリ)グリセリン誘導体として、下記式(10)(sは1〜11の整数)で表される(ポリ)グリセリン誘導体、並びに、下記式(11)及び下記式(12)で表されるジグリセリン骨格及びトリグリセリン骨格を有するものを好ましく使用することができる。
上記樹脂成分としては、特に限定されるものではなく、ノボラック樹脂、ポリイミドシリコーン樹脂、ポリアクリレート、ポリメタクリレート、ポリオレフィンスルホン、ポリビニルフェノール、ポリビニルアセテート等、従来公知のものから適宜選択して使用することができる。
上記光開始剤、増感剤としては、特に限定されるものではなく、アントラキノン系化合物、ベンゾフェノン、アセトフェノン系化合物、ベンゾイン系化合物、チオキサントン系化合物、クマリン系化合物、安息香酸エステル類等、従来公知のものから適宜選択して使用することができる。
本発明のポジ型レジスト組成物を使用してレジストパターンを形成するには、公知のリソグラフィー技術を採用して行うことができる。その1例を挙げると、まず、シリコンウェハーあるいはスパッタやメッキによって金属膜を形成したシリコンウェハー等の基板上に、有機溶剤に溶かした本発明のポジ型レジスト組成物をスピンコーティング等の手法で塗布し、80〜130℃、50〜600秒程度の条件でプリベークし、厚さ1〜50μm、好ましくは5〜30μm、さらに好ましくは10〜25μmのレジスト膜を形成する。
次いで、目的のパターンを形成するためのマスクを上記のレジスト膜上にかざし、i線、g線等の波長500nm以下の高エネルギー線もしくは電子線を露光量1〜5,000mJ/cm2程度、好ましくは100〜2,000mJ/cm2程度となるように照射する。その後、必要に応じて、ホットプレート上で60〜150℃、1〜10分間、好ましくは80〜120℃、1〜5分間、レジスト膜に対して、ポストエクスポージャベーク(PEB)を行ってもよい。
次いで、0.1〜5重量%、好ましくは2〜3重量%テトラメチルアンモニウムヒドロキシド(TMAH)等のアルカリ水溶液の現像液を用い、0.5〜20分間、好ましくは1〜10分間、浸漬(dip法)、パドル(puddle)法、スプレー(spray)法等の常法で現像することにより、基板上に目的のレジストパターンが形成される。なお、現像後は50〜100℃、10〜600秒程度のポストベークを加えてもよい。
上述の方法により、1分子中に2個のアリル基を有するポリグリセリン誘導体(以下、ジアリル化ポリグリセリンという。)を調製した。すなわち、水酸化カリウム触媒の存在下、モノグリセリン1mlとアリルグリシジルエーテル2mlとを60〜120℃で反応させ、次いで、上記触媒を中和した後、低沸分を留去することにより、下記式(13)で表される1分子中に2個のアリル基を有するトリグリセリンジアリルエーテルを調製した。
また、モノグリセリンの代わりにジグリセリンを用いた以外は、上記と同様にして、下記式(14)で表される1分子中に2個のアリル基を有するテトラグリセリンジアリルエーテルを調製した。得られたテトラグリセリンジアリルエーテルは、粘度1,397mm2/sであり、水酸基価533KOHmg/g、不飽和度5.05meq/gの淡黄色液状物であった。
調製したジアリル化ポリグリセリンを用いて、表1に示すNo.1〜11のABA型ポリグリセリン変性シリコーンを調製した。その調製は、撹拌機、温度計及び還流管を備えた反応器に、α−オルガノハイドロジェンポリシロキサンのヒドロシリル基とジアリル化ポリグリセリン誘導体のアリル基のモル比(SiH基/アリル基)が1.0となる量のジアリル化ポリグリセリンと、溶剤(イソプロピルアルコール)と、有効量の触媒(塩化白金酸)を入れ、表1に示した各α−オルガノハイドロジェンポリシロキサンを滴下しながら付加反応させた後、反応液を減圧下100℃にて蒸留し、溶剤を留去して行った。なお、調製したABA型ポリグリセリン変性シリコーンNo.1〜11において、それぞれの構成単位Aは表1に示した各α−オルガノハイドロジェンポリシロキサンから水素1原子を失って生ずる1価の基であり、構成単位Bは、No.1〜7は下記式(15)で表される基、No.8〜11は下記式(16)で表される基である。
また、1H-NMRにて分析を行ったところ、−CH2Me2SiO−基による0.5ppmシグナルの積分値2Hに対するMe3SiO−基及び−Me2SiO−基による0.1ppmシグナルの積分値は33Hであることから、アリル基1モルに対してMD3MH1モルが結合していることが確認された。
また、−CH2Me2SiO−基による0.5ppmシグナルの積分値2Hに対する水酸基の水素を含めたポリグリセリン鎖のシグナル(m、3.3〜3.9ppm)の積分値は11Hであることから、ポリグリセリン鎖に対して2モルのシロキサンが結合していることが確認された。
No.3以外のNo.のABA型ポリグリセリン変性シリコーンについても同様に分析した結果、シロキサン構造は、表1に示した各α−オルガノハイドロジェンポリシロキサンから水素1原子を失って生ずる1価の基であり、各α−オルガノハイドロジェンポリシロキサンは、アリル基1モルに対して1モルが結合しており、また、ポリグリセリン鎖に対して2モルのシロキサンが結合していることが確認された。
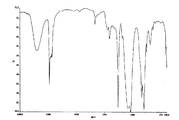
さらに、KBr板法によるIR測定の結果、3,400cm-1付近にOH伸縮振動による強い吸収が見られたことから、調製したABA型ポリグリセリン変性シリコーンNo.3がポリグリセリン基を有する化合物であることが確認された(図1参照)。No.3以外のNo.のABA型ポリグリセリン変性シリコーンについても、ポリグリセリン基を有する化合物であることが同様に確認された。
調製した11種類のABA型ポリグリセリン変性シリコーンの特性を測定した結果を表1に示す。
なお、動粘度はキャノンフェンスケ粘度計により、比重は浮きばかり法により、屈折率はAbbe屈折計により、それぞれ測定した。
得られたABA型ポリグリセリン変性シリコーンの表面張力低下能を調べるため、レジスト用溶剤として使用されるソルファイン−MP(3−メトキシプロピオン酸メチル、商品名、昭和電工社製)に、表2に示した量(0.1重量%、1重量%、10重量%)の前記ABA型ポリグリセリン変性シリコーンNo.1、No.4、No.8、No.10を添加した場合の25℃における表面張力を、ウィルヘルミー式表面張力計にて測定した(協和界面化学社製、全自動界面張力系CBVP−Z型)。
また、ABA型ポリグリセリン変性シリコーンのレジスト用溶剤との相溶性を調べるため、レジスト用溶剤として使用される乳酸エチル中に、前記ABA型ポリグリセリン変性シリコーンNo.1、No.4、No.8、No.10をそれぞれ20重量%添加して、乳酸エチルに対する溶解性を目視で判定した。なお、比較化合物1として、フッ素ポリエーテル共変性シリコーン:X−70−193(信越化学工業社製、商品名)、比較化合物2として、下記式(17)で表される化合物を用いて、同様の条件で測定を行った。結果を表2に示す。
[1,2−ナフトキノンジアジドスルホニルエステル基で置換されたノボラック樹脂(X)の合成]
撹拌機、コンデンサー、温度計を装着した3つ口フラスコに、p−クレゾール75.7g(0.7モル)、m−クレゾール32.5g(0.3モル)、37重量%ホルムアルデヒド水溶液52.3g(0.59モル)及び重縮合触媒であるシュウ酸2水和物0.30g(2.4×10-3モル)を仕込み、該フラスコをオイルバスに浸し、内温を100℃に保持し、1時間重縮合を行った。反応終了後、500mlのメチルイソブチルケトンを加え、30分間撹拌した後、水層を分離し、メチルイソブチルケトン層に抽出された生成物を300mlの純水で5回水洗、分液し、エバポレーターにて4mmHgで150℃の減圧ストリップを行い、重量平均分子量(Mw)6,200のノボラック樹脂(X)(87g)を得た。
なお、重量平均分子量の測定は、GPCカラム(東ソー社製、G−2000H6・2本、G−3000H6・1本、G−4000H6・1本)を用い、流量1.5ml/分、溶出溶媒THF、カラム温度40℃で行った。
得られたノボラック樹脂(Y)は、NMRの分析結果から、ノボラック樹脂における水酸基の水素原子の10%が、1,2−ナフトキノンジアジドスルホニルエステル化されていることを確認した。
撹拌機、滴下ロート、コンデンサー、温度計を装着した3つ口フラスコに、重量平均分子量(Mw)約150,000のメチルビニルエーテル/無水マレイン酸共重合体:Gantrez(ISP社製、商品名)100gをメタノール4,000gに溶解させた後、60〜65℃で還流下約2時間反応させた。反応後、メタノールを蒸去して、重量平均分子量(Mw)約200,000のメチルビニルエーテル−マレイン酸モノメチルエステル共重合体(Z)135gを得た。
1,2−ナフトキノンジアジドスルホニルエステル基で置換されたノボラック樹脂(Y)10gを乳酸エチル40gに溶解させ、次いで、重量平均分子量(Mw)約200,000のメチルビニルエーテル−マレイン酸モノメチルエステル共重合体(Z)を2g、及びレベリング剤として、表3に示すレベリング剤を0.05g混合し、溶解させた後、0.2μmの孔径のメンブレンフィルターにて濾過し、レジスト溶液を調製した。
この結果から、ABA型ポリグリセリン変性シリコーンを用いたレジスト膜は、良好な平坦性(膜厚均一性)を示した。
撹拌機、温度計及び窒素置換装置を備えたフラスコ内に3,3’,4,4’−ジフェニルスルホンテトラカルボン酸二無水物35.8g(0.1モル)及びn−メチル−2−ピロリドン300gを仕込んだ。次いで、下記式(18)で表されるジアミノシロキサン(但し、bの平均は64)14.7g(0.003モル)及び2,2−ビス[4−(4−アミノフェノキシ)フェニル]プロパン39.8g(0.097モル)を反応系の温度が50℃を超えないように調節しながら、上記フラスコ内に加えた。添加後、さらに室温で10時間撹拌した。
得られたポリイミドシリコーン樹脂10gをシクロヘキサノン30gに溶解させ、次いで、表4に示したレベリング剤を0.04g添加して混合し、0.2μmの孔径のメンブランフィルターにて濾過し、レジスト溶液を調製した。なお、表4中、KF−643(信越化学工業社製、商品名)はポリエーテル変性トリシロキサン、X−70−193(信越化学工業社製、商品名)はフッ素ポリエーテル共変性シリコーンである。
次に、6インチシリコンウェハー上に、上記レジスト溶液を1,500rpm/60秒の条件でスピンコーターを用いて塗布し、ホットプレート上で120℃/120秒にて熱処理することにより、厚さ約9μmのレジスト膜を形成した。
Claims (4)
- 請求項1記載のポジ型レジスト組成物を塗布してなる基板。
- 請求項1記載の(ポリ)グリセリン変性シリコーンを成分とするポジ型レジスト組成物用レベリング剤。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005083940A JP4466855B2 (ja) | 2005-03-23 | 2005-03-23 | ポジ型レジスト組成物 |
| TW095109885A TW200702925A (en) | 2005-03-23 | 2006-03-22 | Photosensitive resin composition |
| KR1020060025991A KR101258704B1 (ko) | 2005-03-23 | 2006-03-22 | 감광성 수지 조성물 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005083940A JP4466855B2 (ja) | 2005-03-23 | 2005-03-23 | ポジ型レジスト組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006267401A JP2006267401A (ja) | 2006-10-05 |
| JP4466855B2 true JP4466855B2 (ja) | 2010-05-26 |
Family
ID=37203478
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005083940A Active JP4466855B2 (ja) | 2005-03-23 | 2005-03-23 | ポジ型レジスト組成物 |
Country Status (3)
| Country | Link |
|---|---|
| JP (1) | JP4466855B2 (ja) |
| KR (1) | KR101258704B1 (ja) |
| TW (1) | TW200702925A (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4967687B2 (ja) * | 2007-01-29 | 2012-07-04 | 東レ株式会社 | 感光性シロキサン組成物、それから形成された硬化膜、および硬化膜を有する素子 |
| JP5795212B2 (ja) * | 2011-07-29 | 2015-10-14 | 信越化学工業株式会社 | 新規なブロック型オルガノポリシロキサン及びこれを含有する化粧料 |
| JP6371666B2 (ja) * | 2014-10-10 | 2018-08-08 | 株式会社カネカ | ポジ型感光性組成物 |
| EP3450480A4 (en) * | 2016-04-26 | 2019-12-04 | Shin-Etsu Chemical Co., Ltd. | SILANOL GROUP-POLYOXYALKYLENE COMPOUND COMPOSITION AND METHOD OF PREPARING THEREOF, IN ROOM TEMPERATURE, CURABLE COMPOSITION, SEALING MATERIAL AND ARTICLES |
| JP6870657B2 (ja) * | 2018-05-17 | 2021-05-12 | 信越化学工業株式会社 | 感光性樹脂組成物、感光性ドライフィルム、及びパターン形成方法 |
| JP7335217B2 (ja) | 2020-09-24 | 2023-08-29 | 信越化学工業株式会社 | 感光性樹脂組成物、パターン形成方法、硬化被膜形成方法、層間絶縁膜、表面保護膜、及び電子部品 |
| WO2022244859A1 (ja) * | 2021-05-20 | 2022-11-24 | 阪本薬品工業株式会社 | ガラス成分 |
| WO2024203259A1 (ja) * | 2023-03-27 | 2024-10-03 | 信越化学工業株式会社 | オルガノポリシロキサン、分散体及び化粧料 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1550687B1 (en) * | 2002-09-12 | 2012-05-23 | Shin-Etsu Chemical Company, Ltd. | Novel organopolysiloxane polymer, pasty composition, and cosmetic preparation containing the composition |
| JP4429812B2 (ja) * | 2004-06-07 | 2010-03-10 | 信越化学工業株式会社 | Aba型グリセリン変性シリコーン |
| JP4567584B2 (ja) * | 2005-01-17 | 2010-10-20 | 株式会社資生堂 | 粉体分散安定剤及びこれを配合した粉体分散組成物 |
-
2005
- 2005-03-23 JP JP2005083940A patent/JP4466855B2/ja active Active
-
2006
- 2006-03-22 TW TW095109885A patent/TW200702925A/zh unknown
- 2006-03-22 KR KR1020060025991A patent/KR101258704B1/ko active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| KR20060103132A (ko) | 2006-09-28 |
| JP2006267401A (ja) | 2006-10-05 |
| KR101258704B1 (ko) | 2013-04-26 |
| TWI374335B (ja) | 2012-10-11 |
| TW200702925A (en) | 2007-01-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4466855B2 (ja) | ポジ型レジスト組成物 | |
| JP6323225B2 (ja) | ポジ型感光性樹脂組成物、それを用いた膜の製造方法および電子部品 | |
| JP4687250B2 (ja) | 感光性樹脂組成物 | |
| JP5246607B2 (ja) | ポジ型感光性樹脂組成物、硬化膜、保護膜及び絶縁膜、並びにそれを用いた半導体装置及び表示体装置 | |
| JP4400695B2 (ja) | 感光性樹脂組成物、硬化膜、保護膜、絶縁膜およびそれを用いた半導体装置、表示体装置 | |
| TW200948900A (en) | Silsesquioxane resins | |
| CN104093784B (zh) | 低介电可光致成像组合物以及由其制得的电子器件 | |
| JP5413105B2 (ja) | レジストパターン形成方法及びメッキパターン形成方法 | |
| KR100591663B1 (ko) | 오르가노실록산계 고분자 화합물, 광경화성 수지 조성물,패턴 형성 방법 및 기판 보호용 피막 | |
| JP4541944B2 (ja) | 感光性ポリイミド樹脂組成物 | |
| JP4885205B2 (ja) | ポジティブ型感光性樹脂組成物、パターン形成方法および半導体素子 | |
| TWI460232B (zh) | 倍半矽氧烷樹脂 | |
| KR101067090B1 (ko) | 포지티브형 감광성 수지 조성물, 경화막, 보호막, 절연막 및 그것을 이용한 반도체 장치, 표시체 장치 | |
| JP2007293160A (ja) | 感光性かご状シルセスキオキサン化合物 | |
| JP6003855B2 (ja) | ポジ型レジスト材料及びパターン形成方法 | |
| TWI820137B (zh) | 附圖案膜之基板之製造方法 | |
| JPH05323611A (ja) | 放射線感応性樹脂組成物 | |
| JP2009175651A (ja) | ポジ型感光性樹脂組成物、硬化膜、保護膜、絶縁膜およびそれを用いた半導体装置、表示体装置。 | |
| JP5218762B2 (ja) | レジストパターンの形成方法 | |
| CN112731764A (zh) | 负性光刻胶组合物和形成光刻胶图案的方法 | |
| US6790581B2 (en) | Hybrid compound, resist, and patterning process | |
| JP2003302761A (ja) | ポジ型感光性樹脂組成物及び半導体装置 | |
| KR100576477B1 (ko) | 포토레지스트 세정액 조성물 및 이를 이용한 패턴 형성방법 | |
| JP6710903B2 (ja) | 感光性樹脂組成物 | |
| KR101590862B1 (ko) | 렌즈의 형성 방법 및 네거티브형 감광성 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070423 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20091105 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A132 Effective date: 20091111 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100106 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100209 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100216 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4466855 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130305 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20160305 Year of fee payment: 6 |