JP4301589B2 - 複合酸化錫粉末及びその製造方法 - Google Patents
複合酸化錫粉末及びその製造方法 Download PDFInfo
- Publication number
- JP4301589B2 JP4301589B2 JP10860898A JP10860898A JP4301589B2 JP 4301589 B2 JP4301589 B2 JP 4301589B2 JP 10860898 A JP10860898 A JP 10860898A JP 10860898 A JP10860898 A JP 10860898A JP 4301589 B2 JP4301589 B2 JP 4301589B2
- Authority
- JP
- Japan
- Prior art keywords
- tin
- composite
- tin oxide
- particles
- organic solvent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Battery Electrode And Active Subsutance (AREA)
Description
【発明の属する技術分野】
本発明は、複合酸化錫粉末およびその製造方法に関する。さらに詳しくは、エレクトロクロミック表示素子材料、リチウムイオン電池等の非水電解液二次電池の負極活物質、ガスセンサ素子、あるいは触媒として好適に使用できる、複合酸化錫粉末の製造方法に関する。
【0002】
【従来の技術】
酸化錫はリチウムイオンを吸蔵・放出するという性質を有するため、エレクトロクロミック表示素子用電極やリチウムイオン電池等の非水電解液二次電池の負極活物質、さらにはガスセンサ素子や触媒として使用することが検討されている。
【0003】
上記エレクトロクロミック表示素子においては、酸化・還元に伴い多くのリチウムイオンを吸蔵・放出できる材料(例えば酸化タングステン、酸化イリジウム、プルシアンブルー等)ほど色調が大きく変化するので表示材料として好ましく、更に長寿命な素子とするためには、吸蔵・放出を繰り返しても吸蔵・放出量が変化しない材料が望まれている。そして、該エレクトロクロミック表示素子用電極の材料として、多くのリチウムイオンを吸蔵・放出し、さらに吸蔵・放出を繰り返しても吸蔵・放出量が変化しない材料が望まれている。しかしながら、従来のSnO、SnO2等の酸化錫電極においては、リチウムイオンの吸蔵・放出特性が経時的に劣化することが明らかになり、酸化錫をエレクトロクロミック表示素子用電極として使用するためには上記劣化を防止する必要がある。このリチウムイオン吸蔵・放出特性の低下は、後述するように、酸化錫リチウムイオン電池の負極活物質として使用した場合におけるサイクル特性の低下の要因の一つでもある。該特性の低下は、酸化錫を複合酸化物化することにより改良することができると考えられるが、複合酸化錫をエレクトロクロミック素子材料として用いた例は知られていない。
【0004】
一方、非水電解液二次電池であるリチウムイオン電池は、リチウムイオンを吸蔵・放出することが可能な正極活物質と集電体などからなる正極、リチウムイオンを吸蔵・放出することが可能な負極活物質と集電体などからなる負極、リチウム塩を非水溶媒に溶解してなる電解液、セパレータ、及び電池容器などから構成されるものであるが、高エネルギー密度という優れた特長を有するため、近年その需要が急激に高まっている。
【0005】
該リチウムイオン電池においては、充電時には正極活物質中から放出されたリチウムイオンは負極活物質中に吸蔵され、放電時には負極活物質中に吸蔵されたリチウムイオンが放出されて正極活物質中に吸蔵される。このため、リチウムイオン電池の重要な特性の一つである充放電容量は、使用する負極活物質の影響を強く受ける。現在実用化されているリチウムイオン電池は、負極活物質としてカーボンを使用しており、その充放電容量も600mAh/gという値を示すことが報告されているが、カーボンはその比重が小さいため体積当たりの容量では充放電容量が十分ではなく、より高い充放電容量を達成するために、さらに高いリチウムイオン吸蔵能及び放出能を有する負極活物質が検討されている。
【0006】
前述したように、酸化錫にはリチウムイオンを吸蔵・放出する性質があることが知られており、古くから該性質を利用して酸化錫をリチウムイオン電池の電極活物質として使用することが検討されている(DEJAN.P.ILICら、J.Serb.Chem.Soc.,51巻、489−495頁、1986年)。そして、近年、SnO、SnO2等の酸化錫を負極活物質として使用したリチウムイオン電池の充放電容量が500〜600mAh/gと高いことが報告され(特開平6−275268号公報、特開平7−122274号公報など)、該酸化錫はカーボンに比べて比重が約2〜4倍高いため体積当たりの充放電容量が高いリチウムイオン電池を与える負極活物質として注目され始めている。
【0007】
しかしながら、負極活物質としてSnOあるいはSnO2を用いた場合には、初期の充放電容量は高いが充放電を繰り返すにつれて充放電容量が低下することが判明し、その後、この安定性(サイクル特性)を改良したり充放電容量を更に高めたりする目的で、酸化錫に第二元素を添加した種々の複合酸化錫について検討が行われている。これまでSn−Li−O系材料(特開平7−201318号公報)、Sn−Si−O系材料(特開平7−230800号公報)、あるいはSn−M−O系材料(ここでMはアルカリ土類金属、周期律表13、14、15族元素又は亜鉛である。特開平7−288123号公報)といった複合酸化錫について検討されているが、いずれの材料を使用した場合も充放電容量はSnOあるいはSnO2と同等以下に留まり、しかも充放電容量のばらつきがかなり大きくサイクル特性も不充分であるという問題があった。
【0008】
また、珪素等の第二元素を含有する複合酸化錫粉末の製造方法として、酸化珪素粉末と酸化錫粉末の混合物を原料粉末として用い、該原料粉末を高温で溶融させてガラス化させ、冷却した後にガラス化した塊状物を破砕して粉末化するという方法(溶融法)が検討されており(特開平7−288123号公報)、該溶融法で得られた複合酸化錫粉末は、リチウムイオン電池の負極活物質として使用した場合に充放電容量が高く、サイクル特性も向上すると言われている。
【0009】
しかしながら、上記溶融法においては混合原料粉末中の珪素と錫の原子数比が1対1からずれると融点が非常に高くなってガラス化させることができず、その組成が厳しく限定されるという問題があった。また、上記溶融法では得られた塊状物を破砕することにより粉末化しているため、不純物が混入しやすいばかりでなく、粉末を構成する粒子の形状や大きさが不均一化することが避けられない。そしてこのことは、溶融法で得られた粉末をリチウムイオン電池の負極活物質として使用したときの性能にバラツキが生じる原因となっていた。
【0010】
【発明が解決しようとする課題】
このように、リチウムイオンの吸蔵・放出を繰り返し行った後でもその高いリチウムイオン吸蔵・放出能が低下しない複合酸化錫粉末を、破砕工程を経ることなしに与えるような複合酸化錫粉末の製造方法はこれまで知られていなかった。
【0011】
本発明は、上記の優れた性質を有する、エレクトロクロミック表示素子電極やリチウムイオン電池の負極活物質材料として好適に使用できる複合酸化錫粉末の製造方法を提供することを目的とする。
【0012】
【課題を解決するための手段】
本発明者等は、上記課題を解決するためには複合酸化錫粉末を構成する粒子を均質化することが重要であると考え、破砕工程を経ずに均質な複合酸化錫粒子を得るために所謂ゾルゲル法について検討を行った。その結果、均質な複合酸化錫粒子からなる粉末を得ることはできたが、得られた粉末のリチウムイオン吸蔵・放出量とサイクル特性は満足の行くものではなかった。
【0013】
そこで、ゾルゲル法の反応条件について種々検討を行い、得られた様々な複合酸化錫粉末についてリチウムイオンの吸蔵・放出量とサイクル特性を調べたところ、該性能は粒子の均質性に加えて複合酸化錫粉末を構成する粒子の平均粒子径等の性状に影響を受けるという知見を得た。そして、特定の方法を採用することにより、従来のゾルゲル法では得られなかった大きな平均粒子径と特定の嵩密度(粒子の細孔径等と関連する)を有する複合酸化錫の一次粒子を得ることに成功し、更に検討を行った。その結果、錫と複合酸化物を形成し得る第二元素であって、珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種と、錫と、を含む複合酸化錫からなる独立粒子で構成される複合酸化錫粉末であって、前記複合酸化錫における錫と第二元素との合計量に対する錫の割合は30原子%以上であり、前記複合酸化錫における錫の60原子%以上が2価の錫であり、40原子%以下が4価の錫であり、前記独立粒子は、「前記複合酸化錫からなる略球状の粒子であって、その平均粒子径が0.2〜10μmである複合酸化錫粒子」(以下、単に本複合酸化錫粒子ともいう。)からなる一次粒子及び/又は該一次粒子の凝集粒子からなると共に該凝集粒子を含み、該複合酸化錫粉末の比表面積は8〜30m2/gであることを特徴とする複合酸化錫粉末以下、単に本複合酸化錫粉末ともいう。)は、多くのリチウムイオンを繰り返し再現性良く吸蔵・放出することを見いだした。
【0014】
なお、本複合酸化錫粒子と同じ組成の複合酸化錫からなる略球状の粒子でその一次粒子の平均粒子径が0.2μm以上と大きなものはこれまで知られていない。また、このような本複合酸化錫粒子及び/又は該複合酸化錫粒子を一次粒子とする凝集粒子からなる独立粒子で構成される複合酸化錫粉末もこれまで知られていないものである。本複合酸化錫粉末は、特に粉砕工程を経ることなく極めて均質な、例えばその平均独立粒子径が0.2〜30μmで比較的狭い粒度分布を有する粉末であり、エレクトロクロミック表示素子用電極やリチウムイオン電池の負極活物質材料として好適に使用できる。
【0015】
そして、本発明者等は、上記本複合酸化錫粉末を効率よく得る方法について検討を行った結果、前記本複合酸化錫粉末を効率よく製造する方法を見出し、本発明を完成させるに至った。
【0016】
即ち、第一の本発明の製造方法は、本複合酸化錫粉末を製造する方法であって、錫換算で60〜90モル%の2価の錫化合物及び錫換算で10〜40モル%の4価の錫化合物からなる有機溶媒可溶性錫化合物、並びに珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素を含む有機溶媒可溶性化合物を、錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で有機溶媒に溶解させて有機溶媒溶液を調製し、得られた該有機溶媒溶液と、塩基性水溶液とを、同時にアルコールに添加して反応させて粒子を形成し、次いで形成された粒子を200〜600℃で熱処理することを特徴とする方法(以下、本発明の製法1ともいう。)である。
【0017】
また、第二の本発明の製造方法は、本複合酸化錫粉末を製造する方法であって、錫換算で90モル%以上の2価の錫化合物及び錫換算で10モル%以下の4価の錫化合物からなる有機溶媒可溶性錫化合物、並びに珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素を含む有機溶媒可溶性化合物を、錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で有機溶媒に溶解させて有機溶媒溶液を調製し、得られた該有機溶媒溶液と、塩基性水溶液とを、同時にアルコールに添加して反応させて粒子を形成し、次いで形成された粒子を200〜600℃で熱処理することを特徴とする方法(以下、本発明の製法2ともいう。)である。
【0018】
また、第三の発明の製造方法は、本複合酸化錫粉末を製造する方法であって、錫金属及び/又は錫化合物、並びに珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素の単体及び/又は該第二元素を含む化合物を、錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で溶解させて塩基性水溶液を調製し、得られた該塩基性水溶液と、有機酸の水溶液とを、同時に水に添加して反応させて粒子を形成し、次いで形成された粒子を200〜600℃で熱処理することを特徴とする方法(以下、本発明の製法3ともいう。)である。
【0019】
本発明の製法1、2及び本発明の製法3によれば、それぞれ破砕工程を経ることなく、任意の組成(但し、錫と第二元素との合計量に対する錫の割合が30原子%以上である範囲内である)の複合酸化錫粒子からなる、本複合酸化錫粉末を効率的に得ることができる。
【0020】
また、本発明の製法1、2及び3において、それぞれ熱処理条件を制御することにより複合酸化錫が非晶質のものが得られ、特に該熱処理における加熱温度が複合酸化錫の融点未満の場合には、複合酸化錫が非ガラス質(ここで、ガラス質とは溶融によって作られたものという意である。)のものとなる。
【0021】
なお、第二元素が珪素である本発明の複合酸化錫粉末を製造する場合には、本発明の製法1及び2では、それぞれ第二元素供給源として有機溶媒可溶性珪素化合物を有機溶媒に溶解させたものを使用すれば良く、本発明の製法3では金属珪素及び/又は珪素化合物を塩基性水溶液に溶解させたものを使用すればよい。
【0022】
また、本発明の製法1では、後述するように錫の価数を調整する目的で酸化性ガスを意図的に使用する以外の全工程を非酸化性雰囲気下で行えば、複合酸化錫中の錫が、2価の錫約60〜90原子%及び4価の錫約10〜40原子%からなるものが得られ、本発明の製法2では全工程を非酸化性雰囲気下で行えば、複合酸化錫中の錫が、2価の錫約90原子%以上及び4価の錫約10原子%以下からなるものが得られる(ここで、約とは±5%程度の変動があることを意味する。以下も同じ。)。
【0023】
また、本発明の製法3において有機酸と同時に添加する塩基性溶液中の錫の90原子%以上が2価の錫であり10原子%以下が4価の錫である場合には、反応の全工程をアルゴン等の非酸化性雰囲気下行うと、複合酸化錫中の錫が2価の錫約90原子%以上及び4価の約錫10原子%以下からなる複合酸化錫粉末が得られる。
【0024】
【発明の実施の形態】
先ず、本複合酸化錫粉末について詳しく説明する。本複合酸化錫粉末は特定の独立した(孤立した)粒子からなる複合酸化錫粉末である。ここで、上記特定の独立した粒子とは、前記の本複合酸化錫粒子及び/又は該本複合酸化錫粒子を一次粒子とする凝集粒子からなる独立粒子であり、該凝集粒子を含む。また、該本複合酸化錫粒子とは、錫および錫と複合酸化物を形成し得る第二元素の複合酸化物であって第二元素として珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種を含む複合酸化物からなる粒子であり、該複合酸化物中の錫と第二元素との合計量に対する錫の割合は、30原子%以上である。該本複合酸化錫粒子とは、錫と、珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素との複合酸化物からなる粒子であり、該複合酸化物中の錫と第二元素との合計量に対する錫の割合は、30原子%以上である。
【0025】
ここで、第二元素とは、錫と複合酸化物を形成し得る元素を意味し、該第二元素としては、Ca、Sr、Ba等のアルカリ土類金属元素;La、Ce、Pr、Nd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu等の希土類元素;Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、Y、Zr、Nb、Mo、Ru、Cd、Hf、Ta、W、Re、Os、Ir、Pt、Au、Hg等の遷移元素;B、Al、Ga、In、Tl等の周期律表13族元素;Ge、Si、Pb等の炭素及び錫を除く周期律表14族元素;P、As、Sb、Bi等の周期律表15族元素;並びにS、Se、Te等のカルコゲン元素がある。ここで、周期律表14族元素から炭素が除外されるのは、炭素は錫と酸素を介した複合酸化物を形成し難いという理由による。
【0026】
本複合酸化錫粒子中には、何れも錫と複合酸化物を形成し得る第二元素である、珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種が含まれる。錫−第二元素の組み合わせとして好適なものとしては、Sn−Si、Sn−Si−Al、Sn−Si−Zr、Sn−Si−B、Sn−Si−P、Sn−Si−Ti、Sn−Si−Al−B、Sn−Si−Zr−B、Sn−Si−B−P、Sn−Al、Sn−Al−B、Sn−Al−P、Sn−Al−Zr、Sn−Al−B−P、Sn−Zr、Sn−Zr−B、Sn−Zr−P、Sn−Zr−B−P、Sn−B−P、Sn−Ti、Sn−Ti−Al、Sn−Ti−B、Sn−Ti−P、Sn−Ti−B−P、Sn−Ti−Zr等が挙げられる。これらの中でも該第二元素が珪素若しくは珪素と他の第二元素との組み合わせである場合には、エレクトロクロミック表示素子用電極やリチウムイオン電池等の非水電解液二次電池用負極用活物質として用いた場合、リチウムイオンの吸蔵・放出量が多くさらにサイクル特性も特に優れたものになるので好ましい。
【0027】
また、本複合酸化錫粒子中の錫と第二元素との合計量に対する錫の割合は、30原子%以上である。該割合が30原子%未満のときには、放電容量が小さくなる。上記割合が30〜70原子%のときには、リチウムイオンの吸蔵・放出量が多くて経時変化も小さく、エレクトロクロミック表示素子用電極や非水電解液二次電池用負極用活物質として使用するのに特に好適である。
【0028】
本複合酸化錫粒子は、前記したように錫と前記第二元素との複合酸化物の粒子であるため、該粒子中には当然のこととして酸素原子が含まれる。該酸素原子は、錫および第二元素と結合して存在するため、その含有量は錫原子の含有量及びその価数並びに第二元素の種類、含有量及びその価数によってほぼ一義的に決定される。但し、錫および第二元素の一部は未結合手(いわゆるダングリングボンド)を有していても良く、酸素原子の10原子%程度はフッ素、塩素、臭素、ヨウ素等のハロゲン原子で置換されていても良い。
【0029】
なお、本複合酸化錫粒子中の錫及び第二元素の価数は特に限定されないが、本複合酸化錫粉末をエレクトロクロミック表示素子用電極や非水電解液二次電池用負極用活物質として使用する場合、錫に関しては2価の錫の含有量が高い方が酸化錫中にトラップされて放出できなくなるリチウムイオン量が小さくなると言う理由から好ましい。具体的には本複合酸化錫粒子中の錫は、約60原子%以上が2価の錫であり約40原子%以下が4価の錫であるのが、特に90原子%以上が2価の錫であり10原子%以下が4価の錫であるのが好適である。なお、錫はその安定性から2価のものと4価のものが殆どであるが、周囲の環境によっては、0価〜2価の間あるいは2価〜4価の間の価数を一部とることもあり得る。
【0030】
本複合酸化錫粉末を構成する前記本複合酸化錫粒子は、上記のような組成を有するものであればその結晶状態は特に限定されないが、酸素原子を介して錫と結合する元素は錫原子よりも第二元素である方がサイクル特性がより向上するため、SnOやSnO2等の酸化錫の結晶が存在しない方が好ましく、その意味で結晶質よりも非晶質の方が好ましい。また、非晶質である場合にも、いっそうリチウムイオンの吸蔵・放出量が多くさらにサイクル特性も特に優れたものにするためには溶融させて製造した緻密なガラス質(ここで、ガラス質とは溶融によって作られたものという意である。)でない方が好ましい。
【0031】
即ち、溶融させて緻密なガラス質としない場合には、粒子に微細な空孔等が多数存在し、該空孔等の存在が、リチウムイオンを吸蔵したり放出したりする際に起こる体積変化に基づく応力を吸収(緩和)することができる。その結果、リチウムイオンの吸蔵・放出を繰り返しても粒子が割れたりすることがなく、さらに良好なサイクル特性を示す。
【0032】
前記本複合酸化錫粒子中に含まれる各元素の種類および含有量は、通常の化学分析や蛍光エックス線分析などにより同定、定量することができる。また、該複合酸化錫粒子の結晶状態は、本複合酸化錫粉末を粉末エックス線回折測定あるいは電子線回折測定することにより判定することができる。即ち、粉末エックス線回折のスペクトルが明瞭な回折パターンを示すか否かによって該複合酸化錫粒子が結晶性であるか非晶性であるかが容易に判断され、該複合酸化錫粒子が結晶を含む場合には、その回折スペクトルに示される各回折ピークの位置と強度により含まれる結晶の結晶構造及び該結晶の量を決定することができる。
【0033】
また、本複合酸化錫粒子が非ガラス質であるかどうかは、製造過程で粒子を融点以上に加熱したか否かによって容易に判るが、製造方法が不明の場合にも本複合酸化錫粉末を走査型電子顕微鏡(SEM)により観察したり、BET法等により比表面積を測定したり、或いは水銀圧入法等により細孔分布関数D(r)を求めることにより確認することができる。即ち、粒子が非ガラス質の場合には、SEM観察によりその表面に微細な孔が存在するかどうかにより確認できる。また、この時の本複合酸化錫粉末の比表面積は比較的大きく例えば8〜30m2/gであり、さらに、その細孔分布は、例えば細孔の平均細孔半径が0.05〜25nmの範囲にある細孔の容積が0.1〜0.5cm3/gであり、かつそのような細孔の容積が全細孔容積の70%以上を占めるような細孔分布となる。
【0034】
本複合酸化錫粉末を構成する本複合酸化錫粒子は、前記した特定の組成を有するばかりでなく、その形状が略球状であるという特長を有する。ここで、略球状とは、その粒子の表面がほぼなめらかな曲面(但し、細孔或いは多少の凹凸を有していても良い)で構成され、粒子の最短径(以下、短径ともいう)と該短径に対して垂直方向の最大長径(以下、長径ともいう)の比、即ち短径/長径が1〜0.3程度の異方性が比較的低い全体的に丸みを帯びた形状であって、破砕粒に一般的に見られるような鋭いエッジ(峰部や綾部)を有さない形状の意である。該粒子の形状は、本複合酸化錫粉末をSEMにより観察することにより確認できる。
【0035】
本複合酸化錫粒子は、前記の特定の組成及び特定の形状を有するばかりでなく、その平均粒子径が0.2〜10μmであるという特徴を有する。ここで、平均粒子径とは本発明の複合酸化錫粉末をSEMで観察したときに観察される各独立粒子を構成する一次粒子の長径の平均値であり、具体的には本複合酸化錫粉末について撮影されたSEM写真中の任意の一次粒子50個について長径を測定したときの平均値を表す。なお、本複合酸化錫粒子にあっては、その均質性は極めて高く、各粒子の長径の変化係数は0.5以下である。ここで、長径の変化係数とは、長径の標準偏差を平均粒径で除した値である。
【0036】
上記本複合酸化錫粒子の具体的な態様としては、下記A〜Dに示すようなものが挙げられる。
【0037】
A:複合酸化錫が非晶質である前記本複合酸化錫粒子(以下、複合酸化錫粒子Aともいう。)。
【0038】
B:第二元素が珪素である前記本複合酸化錫粒子(以下、複合酸化錫粒子Bともいう。)。
【0039】
C:第二元素が珪素であり、且つ複合酸化錫が非晶質である前記本複合酸化錫粒子(以下、複合酸化錫粒子Cともいう。)。
【0040】
D:錫が2価の錫約60〜90原子%及び4価の錫約10〜40原子%からなる前記本複合酸化錫粒子(以下、複合酸化錫粒子Dともいう。)。
【0041】
E:複合酸化錫が非晶質であり、且つ錫が2価の錫約約60〜90原子%及び4価の錫約10〜40原子%からなる前記本複合酸化錫粒子(以下、複合酸化錫粒子Eともいう。)。
【0042】
F:第二元素が珪素であり、且つ錫が2価の錫約60〜90原子%及び4価の錫約10〜40原子%からなる前記本複合酸化錫粒子(以下、複合酸化錫粒子Fともいう。)。
【0043】
G:第二元素が珪素であり、複合酸化錫が非晶質であり、且つ錫が2価の錫約60〜90原子%及び4価の錫約10〜40原子%からなる前記本複合酸化錫粒子(以下、複合酸化錫粒子Gともいう。)。
【0044】
H:錫が2価の錫90原子%以上及び4価の錫10原子%以下からなる前記本複合酸化錫粒子(以下、複合酸化錫粒子Hともいう。)。
【0045】
I:複合酸化錫が非晶質であり、且つ錫が2価の錫90原子%以上及び4価の錫10原子%以下からなる前記本複合酸化錫粒子(以下、複合酸化錫粒子Iともいう。)。
【0046】
J:第二元素が珪素であり、且つ錫が2価の錫90原子%以上及び4価の錫10原子%以下からなる前記本複合酸化錫粒子(以下、複合酸化錫粒子Jともいう。)。
【0047】
K:第二元素が珪素であり、複合酸化錫が非晶質であり、且つ錫が2価の錫90原子%以上及び4価の錫10原子%以下からなる前記本複合酸化錫粒子(以下、複合酸化錫粒子Kともいう。)。
【0048】
L:複合酸化錫が非ガラス質である前記本複合酸化錫粒子(以下、複合酸化錫粒子Lともいう。)。ここで非ガラス質とは、融点以上で熔融させた後冷却してガラスとしたものではないことを意味する。
【0049】
M:複合酸化錫が非ガラス質である前記複合酸化錫粒子A乃至複合酸化錫粒子Kの何れか一の複合酸化錫粒子(以下、それぞれ複合酸化錫粒子MA乃至MKともいう。)。
【0050】
また、本複合酸化錫粉末を構成する前記独立粒子(即ち、本複合酸化錫粒子及び/又は該本複合酸化錫粒子を一次粒子とする凝集粒子)は、その均質性が高く、その平均独立粒子径は約0.2〜30μmであり、その変化係数も小さく、例えば約0.5以下である。なお、該平均粒子径および変化係数も本複合酸化錫粒子の平均粒子径と同様にして求めたものである。
【0051】
本複合酸化錫粉末の具体的態様としては、単独で又は凝集して独立粒子を構成する本複合酸化錫粒子が前記複合酸化錫粒子A〜L及びMA〜MKの何れかの一の複合酸化錫粒子である複合酸化錫粉末、並びに独立粒子の平均粒子径が0.2〜30μmでその変化係数が0.5以下であるこれらの複合酸化錫粉末等が挙げられる。
【0052】
本複合酸化錫粉末においては、組成、形状及び粒子径の点で特殊な性状を有する前記本複合酸化錫粒子が単独で又は凝集して独立粒子を構成しているため、非水電解液二次電池負極活物質やエレクトロクロミック表示素子用電極等に応用した時に、リチウムイオンの吸蔵・放出量が高くなるばかりでなく、サイクル特性も良好となる。また、該独立粒子は均質性が高く、本複合酸化錫粉末のタップ密度(嵩密度)が適度に高く、負極活物質の高密度充填が可能になり、結果として高い吸蔵・放出量が達成される。
【0053】
なお、本複合酸化錫粉末のうち、本複合酸化錫粒子が非晶質、特に非ガラス質の複合酸化錫からなるもの(前記複合酸化錫粒子A、E及びI、特にL、MA、ME、及びMI)は、リチウムイオンが吸蔵されても結晶構造が変化せず、崩壊し難いという特長を有する。また、本複合酸化錫粉末のうち、本複合酸化錫粒子がその複合酸化錫中の第二元素が珪素であるもの(前記複合酸化錫粒子B、F及びJ)は、充放電を繰り返しても放電容量の径時変化が小さいという特長を有する。また、本複合酸化錫粉末のうち、本複合酸化錫粒子がその複合酸化錫中の第二元素が珪素で且つ複合酸化錫が非晶質のもの(前記複合酸化錫粒子C、G及びK、特にMC、MG及びMK)は上記の両特長を兼ね備えたものとなる。また、本複合酸化錫粉末を構成する独立粒子の平均粒子径が0.2〜30μmで、リチウムイオンを吸蔵・放出するサイクル特性が特に高い。
【0054】
本複合酸化錫粉末の製造方法は、特に限定されずどの様な方法で製造しても良いが、前記した本発明の製法1、2又は本発明の製法3により好適に製造することができる。以下、それぞれの製法について説明する。
【0055】
本発明の製法1では、錫及び第二元素を含む特定の有機溶媒溶液と塩基性水溶液とを、それぞれ独立に同時にアルコールに添加して反応させて粒子を形成させ、次いで形成された粒子を熱処理することを特徴とする。
【0056】
ここで、上記の有機溶媒溶液とは、錫換算で60〜90モル%の2価の錫化合物及び錫換算で10〜40モル%の4価の錫化合物からなる有機溶媒可溶性錫化合物、並びに珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素を含む有機溶媒可溶性化合物を、錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で有機溶媒に溶解させてなる有機溶媒溶液である。なお、上記第二元素とは、本複合酸化錫粒子のところで説明した第二元素と同じであり、その具体的元素もそこで例示したものと同じである。
【0057】
本発明の製法1で最終的に得られる複合酸化錫粉末を構成する粒子の組成は、基本的に該有機溶媒溶液中に含まれる錫の量及び価数状態、並びに第二元素の種類(価数状態も含む)及び量により決定される。このため、該有機溶媒中に含まれる錫の量、並びに第二元素の種類(価数状態も含む)及び量は、錫と第二元素との合計量に対する錫の割合が30原子%以上となる範囲内で、得ようとする複合酸化錫粒子の組成に応じて適宜決定すれば良い。また、反応の全工程を非酸化性雰囲気下で行えば、本発明の製法1によって得られる本複合酸化錫粉末は、該粉末を構成する複合酸化錫粒子中の錫が2価の錫60〜90原子%及び4価の錫10〜40原子%のものとなる。但し、反応を空気中などの酸化雰囲気下で行うと、2価の錫が4価に酸化されて、仕込み組成よりも2価の割合が低下し、2価の錫の割合が5原子%のものが得られることもある。しかし、複合酸化錫中にトラップされて放出されなくなるリチウム量を少なくするためには、最終的に得られる複合酸化錫中の4価の錫は少ないほうが好ましい。
【0058】
上記有機溶媒溶液は均一溶液であるのが好ましく、そのためには、該溶液の調製は有機溶媒可溶性錫及び第二元素を含む有機溶媒可溶性化合物を有機溶媒に溶解させて行う必要がある。この時使用される有機溶媒としては、錫化合物及び第二元素を含む化合物を溶解する有機溶媒が何等制限無く使用できるが、溶解可能な錫化合物及び第二元素を含む化合物の種類の多さ、及びその溶解力の高さの観点からアルコール、アセトン、アセチルアセトン、アセトニトリル等を使用するのが好適である。これら有機溶媒の中でもアルコールが特に好ましい。
【0059】
好適に使用できるアルコールを具体的に例示すれば、メタノール(メチルアルコールともいう)、エタノール(エチルアルコールともいう)、プロパノール(プロピルアルコールともいう)、ブタノール(ブチルアルコールともいう)、オクタノール(オクチルアルコール)、2−メトキシエタノール、2−エトキシエタノール、エチレングリコール、1−メトキシ−2−プロピルアルコール、メトキシエトキシエタノール、2−フェニルエチルアルコール、ベンジルアルコール、アリルアルコール、2−メチル−2−プロペン−1−オール、3−メチル−3−ブテン−1−オールなどを挙げることができる。中でもメタノール、エタノールは、有機溶媒可溶性化合物の溶解度が高いため、好ましく、特にメタノールは安価で手に入りやすいという理由もあり、より好ましい。上記アルコールは通常単独で用いられるが、有機溶媒可溶性化合物との反応性や溶解性などを制御するために2種類以上のアルコールの混合物を用いることもできる。
【0060】
上記有機溶媒に溶解される有機溶媒可溶性錫としては、上記有機溶媒に可溶な錫を含む化合物が何等制限無く使用できる。この様な有機溶媒可溶性錫を例示すれば、ハロゲン化錫、有機錫、錫のアルコキシドなどが挙げられる。ハロゲン化錫のハロゲンは、Cl、Br、I、F原子である。また水和物でも構わない。これらの化合物のうち価格、安定性の点からハロゲン化錫を用いることが更に好ましい。又、ハロゲン化錫のなかでも、塩化錫、臭化錫が特に好ましい。具体的には、SnCl2、SnCl2・2H20、SnBr2、SnI2、SnF2などが挙げられ、特に、SnCl2、SnBr2、SnCl2・2H2Oが好ましく用いられる。また該ハロゲン化錫化合物において有機化合物で修飾したもの、例えばSn(CH3)2Cl2なども使用できる。有機錫化合物としては、(CH3)2Sn、(C2H5)2Sn、(C3H7)4Snなどが溶解する範囲で使用または添加することができる。錫のアルコキシドとしては、Sn(OC2H5)2、Sn(OC3H7)2、Sn(OC4H9)2、Sn(OC2H5)4、Sn(OC3H7)4、Sn(OC4H9)4などを挙げることができる。また上記可溶性錫化合物は2種類以上の混合物を用いることもできる。なお、金属錫もハロゲン化錫等の存在下に有機溶媒を還流させることにより、その正確な構造は不明であるが、有機溶媒可溶性錫化合物とすることもできる。
【0061】
なお、前記有機溶媒溶液中に溶解される有機溶媒可溶性錫は、錫換算で60〜90モル%の2価の錫化合物及び錫換算で10〜40モル%の4価の錫化合物からなるものである必要がある。有機溶媒溶液中の錫化合物における2価の錫化合物が60モル%未満で4価の錫化合物が40モル%を越えるときには、粒子径が0.2μmより遥かに小さい粒子径のものしか得られず、平均粒子径0.2μm以上の粉末を得ることができず、複合酸化錫中にSnO等の結晶性成分が生成することが多い。また、2価の錫化合物が90モル%を越え4価の錫化合物が10モル%未満のときには、第二元素の種類によっては、平均粒子径が0.2μm以上の粉末を得ることができない場合がある。
【0062】
有機溶媒溶液中の2価の錫化合物と4価の錫化合物の割合を上記範囲内とするためには、溶解させる有機溶媒可溶性錫として2価の錫化合物を錫換算で60〜90モル%及び4価の錫化合物を錫換算で10〜40モル%含むものを使用すればよい。また、所定量の2価の錫化合物のみを溶解させた溶液に酸素等の酸化性物質を導入しその全部を酸化させて4価の錫とした後、所定量の2価の錫化合物を溶解させる方法、又は所期値よりは多めの2価の錫化合物を溶解させた溶液について上記と同様な酸化を行い2価の錫の一部を酸化させる方法により2価の錫と4価の錫が上記範囲になるようにしても良い。この時、後者の方法に於いては、酸化により生成する4価の錫の量は、予備的な酸化実験を行って、所期の生成量が得られる反応条件を予め把握しておくのが好ましい。溶液中で粒子が生成した後は、酸化性雰囲気中で2価の錫を4価に酸化させて、あるいは還元性雰囲気下で4価の錫を2価に還元して、2価と4価の錫の割合を変えても構わない。但し、エレクトロクロミック表示素子電極やリチウムイオン二次電池負極として使用する場合、複合酸化錫中にトラップされて放出されなくなるリチウム量を少なくするためには、最終的に得られる複合酸化錫中の4価の錫を少なくし、2価の錫を多くするほうが好ましい。
【0063】
また、上記有機溶媒に溶解される第二元素を含む有機溶媒可溶性化合物としては、上記有機溶媒に可溶な第二元素を含む化合物が何等制限無く使用できる。一般に、第二元素のハロゲン化物、アルコキシド化合物、硝酸塩、硫酸塩等は有機溶媒に対して何らかの溶解性を示すものが多く、化合物の選定に当たっては、これら化合物の中から溶媒の種類に応じて溶解度の高いものを適宜選択して使用すればよい。好適に使用できる第二元素を含む有機溶媒可溶性化合物を具体的に例示すれば、可溶性第2成分元素化合物がアルカリ土類金属の化合物である場合には、アルカリ土類金属のハロゲン化物およびその水和物、硝酸塩およびその水和物、アルコキシドなどより、特に制限されることなく用いることができる。具体的な化合物として、CaCl2、CaBr2、CaI2、CaCl2・6H2O、CaBr2・6H2O、CaI2・6H2O、Ca(NO3)2・4H2O、Ca(NO3)2・xH2O、Ca(OCH3)2、Ca(OC2H5)2、Ca(OC3H7)2、Ca(OC4H9)2、SrCl2、SrBr2、SrI2、SrCl2・6H2O、SrBr2・6H2O、SrI2・6H2O、Sr(NO3)2、Sr(OCH3)2、Sr(OC2H5)2、Sr(OC3H7)2、Sr(OC4H9)2、BaCl2、BaBr2、BaI2、BaCl2・2H2O、BaBr2・2H2O、BaI2・2H2O、Ba(NO3)2、Ba(OCH3)2、Ba(OC2H5)2、Ba(OC3H7)2、Ba(OC4H9)2、などを例示することができる。
【0064】
可溶性第2成分元素化合物が希土類元素の化合物である場合には、希土類元素のハロゲン化物およびその水和物、硝酸塩およびその水和物、アルコキシドなどより、特に制限されることなく用いることができる。具体的な化合物として、LaCl3、LaBr3、LaI3、LaCl3・7H2O、La(NO3)3・6H2O、La(OCH3)3、La(OC2H5)3、La(OC3H7)3、CeCl3、CeBr3、CeI3、CeCl3・6H2O、Ce(NO3)3・6H2O、PrCl3、PrCl3・7H2O、Pr(NO3)3・6H2O、Pr(OC3H7)3、NdCl3、NdBr3、NdCl3・6H2O、Nd(NO3)3・5H2O、SmCl3・xH2O、Sm(NO3)3・xH2O、Sm(OC3H7)3、EuCl3・6H2O、Eu(NO3)3・6H2O、GdCl3、GdCl3・6H2O、Gd(NO3)3・5H2O、TbCl3、TbCl3・xH2O、Tb(NO3)3・xH2O、DyCl3、DyCl3・xH2O、Dy(NO3)3・5H2O、Dy(OC3H7)3、HoCl3、HoCl3・6H2O、Ho(NO3)3・5H2O、ErCl3・6H2O、Er(NO3)3・5H2O、Er(OC3H7)3、TmCl3・6H2O、Tm(NO3)3・5H2O、YbBr3、YbI3、YbCl3・6H2O、Yb(NO3)3・xH2O、LuCl3、Lu(NO3)3・xH2Oなどを例示することができる。
【0065】
可溶性第2成分元素化合物が遷移元素の化合物である場合には、遷移元素のハロゲン化物およびその水和物、オキシハロゲン化物、酢酸塩、硝酸塩およびその水和物、硫酸塩およびその水和物、アンモニウム塩、遷移元素のアルコキシドなどより、特に制限されることなく用いることができる。具体的な化合物として、ScCl3、ScCl3・xH2O、Sc(NO3)3・xH2O、TiCl4、TiBr4、Ti(OCH3)2、Ti(OC2H5)2、Ti(OC3H7)2、Ti(OC4H9)2、VBr3、VCl2、VCl3、VCl4、VOBr2、VOBr3、VOCl3、VF3、VF4、VF5、VI3・6H2O、VO(OCH3)3、VO(OC2H5)3、VO(OC3H7)3、VO(OC4H9)3、CrCl3、CrBr3、CrCl3・xH2O、CrBr3・6H2O、CrI3・xH2O、Cr(CH3COO)3・xH2O、MnCl2、MnBr2、MnI2、MnCl2・4H2O、MnBr2・4H2O、MnI2・4H2O、Mn(NO3)2・6H2O、Mn(OC3H7)2、Mn(OC2H5)2、FeBr2、Fe2Br・6H2O、FeBr3、FeBr3・6H2O、Fe(OH)(CH3COO)2、FeCl2、FeCl3・6H2O、FeCl3、FeI2、Fe(NO3)3・9H2O、(NH4)2Fe(SO4)2・xH2O、(NH4)Fe(SO4)2・xH2O、Fe(OCH3)3、Fe(OC2H5)3、Fe(OC3H7)3、Fe(OC4H9)3、CoBr2、CoBr2・6H2O、Co(C2H3O2)2・4H2O、CoCl2、CoCl2・6H2O、CoI2、Co(NO3)2・6H2O、Co(OC3H7)2、NiBr2、NiBr2・xH2O、Ni(CH3COO)2・xH2O、NiCl2、NiCl2・6H2O、NiI2、NiI2・6H2O、Ni(NO3)2・6H2O、CuBr、CuBr2、Cu(CH3COO)2、CuCl、CuCl2、CuCl2・2H2O、Cu(NO3)2・3H2O、ZnBr2、Zn(CH3COO)2・2H2O、ZnCl2、ZnI2、Zn(NO3)2・6H2O,Zn(OCH3)2、Zn(OC2H5)2、Zn(OC3H7)2、Zn(OC4H9)2、YBr3、YCl3・6H2O、YCl3、Y(NO3)3・6H2O、Y(OCH3)3、Y(OC2H5)3、Y(OC3H7)3、ZrBr4、ZrCl4、ZrI4、ZrO(CH3COO)2、ZrOCl2・8H2O、ZrI2・xH2O、ZrO(NO3)2・2H2O、Zr(SO4)2・4H2O、Zr(OCH3)4、Zr(OC2H5)4、Zr(OC3H7)4、Zr(OC4H9)4、NbCl5、NbOCl3、NbBr5、NbF5、Nb(OCH3)5、Nb(OC2H5)5、Nb(OC3H7)5、Nb(OC4H9)5、MoBr2、MoBr3、MoCl5、(NH4)6Mo7O24・4H2O、Mo(OC2H5)5、RuCl3・H2O、PdCl2・2H2O、AgNO3、CdBr2・4H2O、CdBr2、CdCl2・5/2H2O、CdCl2、CdF2、CdI2、Cd(NO3)2・4H2O、HfCl4、HfOCl2・8H2O、Hf(OCH3)4、Hf(OC2H5)4、Hf(OC3H7)4、Hf(OC4H9)4、TaCl5、TaBr5、Ta(OCH3)5、Ta(OC2H5)5、Ta(OC3H7)5、Ta(OC4H9)5、WCl5、WCl6、WBr6、W(OC2H5)5、W(OC3H7)5、ReCl3、ReCl5、OsCl3、IrCl3・3H2O、IrCl3、IrCl4、PtCl4・5H2O、H2PtCl6・nH2O、AuBr3・xH2O、AuCl3・xH2O、AuHCl4・4H2O、Hg2Br2、HgCl2、Hg(NO3)2・2H2O、HgSO4などを例示することができる。
【0066】
可溶性第2成分元素化合物が周期律表13族元素の化合物である場合には、周期律表13族元素のハロゲン化物およびその水和物、アンモニウム塩、硫酸塩、有機酸塩、アルコキシドなどより、特に制限されることなく用いることができる。具体的な化合物として、B2O3、(NH4)2O・5B2O3・8H2O、BCl3、BBr3、BI3、H3BO3、B(OCH3)3、B(OC2H5)3、B(OC3H7)3、B(OC4H9)3、AlBr3、AlCl3・6H2O、AlCl3、AlI3、Al(NO3)3・9H2O、Al2(SO4)3、Al2(SO4)3・nH2O、Al(OCH3)3、Al(OC2H5)3、Al(OC3H7)3、Al(OC4H9)3、GaBr3、GaCl3、GaI3、Ga(NO3)3・xH2O、Ga2(SO4)3、Ga2(SO4)3・xH2O、Ga(OCH3)3、Ga(OC2H5)3、Ga(OC3H7)3、Ga(OC4H9)3、InBr3、InCl3、InCl3・xH2O、InI3、In(NO3)3・xH2O、In2(SO4)3、In2(SO4)3・xH2O、In(OCH3)3、In(OC2H5)3、In(OC3H7)3、In(OC4H9)3、CH2(COOTl)2、TlOOCHなどを例示することができる。
【0067】
可溶性第2成分元素化合物が周期律表14族元素の化合物である場合には、周期律表14族元素のハロゲン化物およびその水和物、アンモニウム塩、硫酸塩、有機酸塩、アルコキシドなどより、特に制限されることなく用いることができる。具体的な化合物として、GeBr4、GeCl4、GeI4、Ge(OCH3)4、Ge(OC2H5)4、Ge(OC3H7)4、Ge(OC4H9)4などを例示することができる。また、可溶性第2成分元素化合物として珪素の化合物を添加する場合には、一般式Si(ORA)4、RBSi(ORA)3、RBRCSi(ORA)2で表される珪素アルコキシドが用いられる。ここで、RA、RB、RCは、各々、メチル基、エチル基、プロピル基、ブチル基、ペンチル基などの直鎖状または分岐状アルキル基;エテニル基、プロペニル基、ブテニル基、ペンテニル基などの直鎖状または分岐状アルケニル基、フェニル基などのアリール基を示す。珪素アルコキシドを具体的に例示すると、テトラメトキシシラン、テトラエトキシシラン、テトラプロポキシシラン、テトラブトキシシラン、メチルトリメトキシシラン、エチルトリメトキシシラン、フェニルトリメトキシシラン、プロピルトリメトキシシラン、n−ブチルトリメトキシシラン、イソブチルトリメトキシシラン、n−ヘキシルトリメトキシシラン、n−オクタデシルトリメトキシシラン、メチルトリエトキシシラン、エチルトリエトキシシラン、アミルトリエトキシシラン、フェニルトリエトキシシラン、n−オクチルトリエトキシシラン、n−オクタデシルトリエトキシシラン、n−ドデシルトリエトキシシラン、メチルトリブトキシシラン、エチルトリブトキシシラン、エチルトリプロポキシシラン、ビニルトリエトキシシラン、アリルトリエトキシシラン、ジフェニルジメトキシシラン、ジメチルジエトキシシラン、ビニルメチルジエトキシシラン、ジエチルジメトキシシラン、エチルメチルジエトキシシランなどが挙げられる。ハロゲン化珪素としては、SiCl4、SiHCl3、SiH2Cl2などが挙げられる。
【0068】
可溶性第2成分元素化合物が周期律表15族元素の化合物である場合には、周期律表15族元素のハロゲン化物およびその水和物、アンモニウム塩、硫酸塩、有機酸塩、アルコキシドなどより、特に制限されることなく用いることができる。具体的な化合物として、P2O5、PBr3、PCl3、POBr3、POCl3、PO(OCH3)3、PO(OC2H5)3、PO(OC3H7)3、PO(OC4H9)3、P(OCH3)3、P(OC2H5)3、AsBr3、AsCl3、AsI3、As(OCH3)3、As(OC2H5)3、As(OC3H7)3、SbBr3、SbCl3、SbCl5、SbOCl,Sb2(SO4)3、Sb(OCH3)3、Sb(OC2H5)3、Sb(OC3H7)3、Sb(OC4H9)3、BiBr3、BiCl3、BiI3、Bi(NO3)3・xH2O、BiOCl、Bi(OC3H7)3などを例示することができる。
【0069】
可溶性第2成分元素化合物がカルコゲン元素の化合物である場合には、カルコゲン元素のハロゲン化物およびその水和物、アンモニウム塩、硫酸塩、有機酸塩、アルコキシドなどより、特に制限されることなく用いることができる。具体的な化合物として、S2Cl2、SCl2、SeBr4、SeCl4、SeI4、TeBr4、TeCl4、TeO4H2・xH2Oなどを例示することができる。
【0070】
前記有機溶媒中への有機溶媒可溶性錫化合物および第二元素を含む有機溶媒可溶性化合物の溶解方法は、特に限定されない。例えば、撹拌下、有機溶媒可溶性錫化合物および第二元素を含む有機溶媒可溶性化合物からなる混合物に有機溶媒を滴下する方法、あるいは撹拌下、有機媒に有機溶媒可溶性錫化合物および第二元素を含む有機溶媒可溶性化合物を同時に、または順次溶解させる方法などを用いることができる。その後、リフラックスさせるなど充分反応させることにより、錫原子と第二元素との間に酸素原子を介した結合を有する化合物などが生成し、その結果最終的に得られる複合酸化錫において酸素原子を介して錫と結合する元素が第二元素である確率が高くなり、リチウムイオンの吸蔵・放出のサイクル特性がより向上することにもなる。
【0071】
なお、第二元素を含む有機溶媒可溶性化合物として、前記の有機溶媒可溶性珪素化合物を選択した場合には、第二元素として珪素を含む本複合酸化錫粒子が得られる。
【0072】
また、該有機溶媒溶液には溶解度、加水分解速度、及び重縮合反応速度等を制御するため、アセチルアセトン、アセト酢酸エチル、マロン酸ジエチル、あるいはギ酸、酢酸、シュウ酸、酒石酸、乳酸、コハク酸、クエン酸、酪酸、プロピオン酸、フマル酸、マレイン酸、フタル酸等の有機酸、ポリエチレングリコール、セルロース、界面活性剤等を任意成分として加えても良い。
【0073】
本発明の製法1で使用する上記有機溶媒溶液は上述した各条件を満足するものであれば、その濃度及び保存状態等は特に限定されない。しかしながら、一旦溶解した錫化合物や第二元素を含む化合物が析出して組成が変化するのを防止するため、その濃度は溶解している有機溶媒可溶性錫化合物及び第二元素を含む有機溶媒可溶性化合物全ての合計のモル濃度で表して、0.1〜20mol%であるのが好適である。また、溶解している錫の価数が変化するのを避けるために、錫の価数を調整した後は、該有機溶媒溶液は反応させるまでアルゴン、窒素等の非酸化性ガス雰囲気下で保存しておくのが好適である。
【0074】
本発明の製法1では、前記有機溶媒溶液と塩基性水溶液とを、アルコールに同時に添加して反応させて粒子を形成させる。前記有機溶媒溶液と塩基性水溶液とを同時に添加しない場合には、平均粒子径が小さい粉末が得られたり、粒度分布の広いバラツキの大きい粒子が得られる傾向がある。但し、前記有機溶媒溶液と塩基性水溶液とは、予め混合しないでそれぞれ独立に添加する必要がある。両液を予め混合した場合には、アルコールに添加する前に反応が起こってしまい、本複合酸化錫粉末が得られ難い。
【0075】
この時上記有機溶媒と同時に添加される塩基性水溶液は、そのpHが7を越える水溶液であれば特に限定されず、アンモニア水、水酸化ナトリウム、水酸化カリウム、水酸化リチウム等のアルカリ金属又はアルカリ土類金属の水酸化物の水溶液、テトラメチルアンモニウムヒドロキシド等の四級アンモニウム水酸化物の水溶液等の公知の塩基性水溶液が何等制限なく使用できる。しかしながら、添加時に局所的にpHが高くなる部分が発生することを避けて粒子形成反応が均一に行えるという観点から、該塩基性水溶液のpHは10〜13.5であるのが好ましく、更に好ましくは11.0〜13.5である。また、該塩基性水溶液中の金属イオンが複合酸化錫中に取り込まれたりして得られる複合酸化錫粒子の組成が前記有機溶媒溶液の組成と変わったりすることを避けるために、該塩基性水溶液はpH11.5〜13.5のアンモニア水であることが特に好適である。また、急激あるいは局所的な反応を緩和するために、これらの塩基性水溶液に水溶性のアルコールを添加しておくこともできる。
【0076】
また、前記有機溶媒溶液と上記塩基性水溶液とが添加されるアルコールは特に限定されないが、水溶性のアルコールであることが好ましく、好適に使用できるアルコールを例示すると、メタノール、エタノール、イソプロピルアルコール等が挙げられる。
【0077】
なお、該アルコールは前記有機溶媒溶液と前記塩基性水溶液とを添加した後に起こる反応の媒体として機能するものであり、該アルコールは添加される両溶液に対して親和性が高いため反応が均質的に起こり、本複合酸化錫粉末を構成する均質な粒子が形成される。本発明の製法1では、上記反応媒体としてアルコールを使用することを必須としているが、同様の作用を有する溶媒であれば該溶媒を使用しても差し支えない。例えば、アルコールに塩基性水溶液を加えた混合液を反応媒体として用いる態様は、良好な均質性を有する粒子からなる本複合酸化物粉末が得られるため、好適である。この時使用できる塩基性水溶液は、そのpHが7を越える水溶液であり、塩基性水溶液としては前記有機溶媒溶液と同時に添加される塩基性水溶液として例示したものが制限無く使用できる。
【0078】
これらアルコールの種類及び必要に応じて塩基性水溶液と混合溶液とするときに使用する塩基性水溶液の種類は特に限定されるものではないが、粒子形成反応を均一に行うという観点から、前記有機溶媒溶液の溶媒としてアルコールを使用した場合には該アルコールと同種のアルコールを選択し、また、塩基性水溶液としては前記有機溶媒溶液と同時に添加される塩基性水溶液と同種の塩基性水溶液を選択するのが好適である。塩基性水溶液との混合溶液として使用する場合に於けるアルコールと塩基性水溶液の量比は特に限定されないが、アルコール1リットルに対し塩基性水溶液0.01〜5.0リットルとなる量比が好適である。
【0079】
また、アルコール若しくは上記混合液の使用量は撹拌が可能でほぼ均一な反応場を与えるような量であれば特に限定されないが、一般的には最終的に添加される前記有機溶媒溶液と前記塩基性水溶液の合計体積の0.02〜0.2倍の体積となる量使用すればよい。
【0080】
該混合溶液に前記有機溶媒溶液と前記塩基性水溶液を同時に添加し、反応させるときの条件は特に限定されないが、撹拌下で、前記有機溶媒溶液及び前記塩基性水溶液の添加速度を制御して行うのが好ましい。添加の方法は特に限定されず、アルコールの液面に滴下しても良いし、アルコール中に添加しても良い。また、この時起こる反応は発熱反応であるため、反応は温度を制御して行うことが好ましい。これら反応条件は、使用する前記有機溶媒溶液の溶液組成、前記塩基性水溶液の種類及び濃度等によって変化するため一概に決定することは出来ないが、一般的な撹拌速度は25〜1000rpmの範囲であり、前記有機溶媒溶液及び前記塩基性水溶液の該混合溶液1リットルに対する添加速度は、それぞれ1〜500ml/分及び0.1〜50ml/分であり、反応温度は0〜80℃の範囲である。このような反応条件下で反応を行うことにより、錫原子と第二元素との間に酸素原子を介した結合をもつ粒子(以下、粗粒子ともいう。)が形成される。
【0081】
このようにして形成された粗粒子は、濾過等により分離された後、洗浄乾燥を行った後に熱処理することにより複合酸化錫の粒子となり、本複合酸化錫粉末が得られる。この時、2価の錫が4価に酸化されないようにアルゴンや窒素等の非酸化性雰囲気にしておくとより好ましい。
【0082】
このときの熱処理条件は、分離された祖粒子に含まれている水や溶媒等を除去しSn−O−M(ここでMは第二元素である)の結合形成を促進し、表面水酸基等を除去できる条件であれば特に制限されない。しかし、得られる複合酸化錫粉末のリチウムイオンの吸蔵・放出量の高さ及びサイクル特性の良さの観点から、熱処理温度としては200〜600℃が好ましく、300〜500℃がより好ましい。
【0083】
焼成時間は、焼成温度、雰囲気などによっても異なるが、焼成時間は0.03〜24時間であることが好ましい。焼成時の昇温速度は特に制限されないが、0.1〜100℃/分であることが好ましい。
【0084】
焼成時の雰囲気は、2価の錫が4価に酸化されない雰囲気であれば、特に限定されない。例えば、窒素、あるいはアルゴン、ヘリウム、ネオンなどの不活性雰囲気、あるいはこれらの混合雰囲気が挙げられ、場合によっては錫の価数を0〜2の間、あるいは0〜4の間に調整するため、水素、一酸化炭素などの還元性ガス雰囲気などを併用してもよいが、還元性ガス雰囲気の場合には、酸化錫が還元されて内部に多量の金属錫が生成したり有機物が多く残存してサイクル特性が低下したりする場合があるので精密な制御が必要になる。
【0085】
本発明の製法2は、本発明の製法1よりも錫化合物のなかでの2価の錫化合物の割合を多くする方法であり、錫換算で90モル%以上の2価の錫化合物及び錫換算で10モル%以下の4価の錫化合物からなる有機溶媒可溶性錫化合物、並びに珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素を含む有機溶媒可溶性化合物を、錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で有機溶媒に溶解させてなる有機溶媒溶液と塩基性水溶液とを、それぞれ独立に同時にアルコールに添加して反応させて粒子を形成させ、次いで形成された粒子を熱処理することを特徴とする。
【0086】
製法2においては、有機溶媒溶液中の錫化合物のなかで2価の錫化合物の割合が高くて、4価の錫化合物の割合が低くても平均一次粒子径が0.2μm以上で、SnO等の結晶性成分が生成しない非晶質の粉末が得られる。第二元素のなかでも、Si−Zr、Si−Ti、Si−Hf、Si−Al、Si−B−Pの組み合わせが好ましく、この中でもSi−Zrを基本とする組み合わせが、2価の錫90原子%以上4価の錫10原子%以下で錫と第二元素との合計量に対する錫の割合が30原子%以上で、平均一次粒子径が0.2μm以上で、且つ非晶質となる粒子を得るために好ましい。さらに特性を改良するためにこの該基本元素の組み合わせに加えて他の元素を含有させることができる。他は、製法1と同様の方法を採用することができ、第二元素の具体な化合物は、製法1に記載の珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素の化合物を、鉛化合物としては酢酸鉛、硝酸鉛、塩化鉛等を用いることができる。
【0087】
本発明の製法2で最終的に得られる複合酸化錫粉末を構成する粒子の組成は、基本的に該有機溶媒溶液中に含まれる錫の量及び価数状態、並びに第二元素の種類(価数状態も含む)及び量により決定される。このため、該有機溶媒中に含まれる錫の量、並びに第二元素の種類(価数状態も含む)及び量は、錫と第二元素との合計量に対する錫の割合が30原子%以上となる範囲内で、得ようとする複合酸化錫粒子の組成に応じて適宜決定すれば良い。また、反応の全工程を非酸化性雰囲気下で行えば、本発明の製法2によって得られる本複合酸化錫粉末は、該粉末を構成する複合酸化錫粒子中の錫が2価の錫90原子%以上及び4価の錫10原子%以下のものとなる。
【0088】
次に本発明の製法3について説明する。
【0089】
本発明の製法3は、錫及び第二元素を含む特定の塩基性水溶液と有機酸の水溶液とを、同時に水に添加して反応させて粒子を形成し、次いで形成された粒子を熱処理することを特徴とする。
【0090】
ここで、上記特定の塩基性水溶液とは、錫金属及び/又は錫化合物並びに錫と複合酸化物を形成し得る第二元素の単体及び/又は該第二元素を含む化合物を錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で溶解させてなる塩基性水溶液である。なお、上記第二元素とは、本複合酸化錫粉末のところで説明した第二元素と同じであり、その具体的元素もそこで例示したものと同じである。
【0091】
本発明の製法3において最終的に得られる本複合酸化錫粉末を構成する粒子の組成は、基本的に該塩基性水溶液中に含まれる錫の量及び価数状態、並びに第二元素の種類(価数状態も含む)及び量により決定される。このため、該塩基性水溶液中に含まれる錫の量、並びに第二元素の種類(価数状態も含む)及び量は、錫と第二元素との合計量に対する錫の割合が30原子%以上となる範囲内で、得ようとする複合酸化錫粒子の組成に応じて適宜決定すれば良い。
【0092】
該塩基性水溶液の調製は、それぞれ所期量の錫金属及び/又は錫化合物並びに第二元素の単体及び/又は第二元素を含む化合物を塩基性水溶液に溶解することにより行う。このとき溶媒として使用される塩基性水溶液(以下、溶媒塩基性水溶液ともいう。)は、そのpHが7を越える水溶液であれば特に限定されず、アンモニア水、水酸化ナトリウム、水酸化カリウム、水酸化リチウム等のアルカリ金属又はアルカリ土類金属の水酸化物の水溶液、テトラメチルアンモニウムヒドロキシド等の四級アンモニウム水酸化物の水溶液等の公知の塩基性水溶液が何等制限なく使用できる。
【0093】
錫金属及び/又は錫化合物並びに錫と複合酸化物を形成し得る第二元素の単体及び/又は該第二元素を含む化合物の溶解方法は、特に限定されない。例えば、撹拌下、錫金属及び/又は錫化合物並びに錫と複合酸化物を形成し得る第二元素の単体及び/又は該第二元素を含む化合物に塩基性水溶液を滴下する方法、あるいは撹拌下、塩基性水溶液に錫金属及び/又は錫化合物並びに錫と複合酸化物を形成し得る第二元素の単体及び/又は該第二元素を含む化合物を同時に、または順次溶解させる方法などを用いることができる。その後、リフラックスさせるなど充分反応させることにより、錫原子と第二元素との間に酸素原子を介した結合を有する化合物などが生成し、その結果最終的に得られる複合酸化錫において酸素原子を介して錫と結合する元素が第二元素である確率が高くなり、リチウムイオンの吸蔵・放出のサイクル特性がより向上することにもなる。
【0094】
また、該溶媒塩基性水溶液に溶解される錫金属及び/又は錫化合物並びに第二元素の単体及び/又は第二元素を含む化合物は、塩基性水溶液に溶解するものであれば特に限定されず、公知の物質が制限なく使用できる。このような物質を例示すれば、錫を含むものとして、金属錫、塩化錫等のハロゲン化錫、硫酸錫、酢酸錫等が挙げられる。また第二元素を含むものとして、金属珪素、金属アルミニウム等の第二元素単体、メタ珪酸ナトリウム、二珪酸ナトリウム、四珪酸ナトリウム、オルト珪酸ナトリウム、塩化アルミニウム、硝酸アルミニウム、オキシ塩化ジルコニウム、塩化ジルコニウム、ほう酸、四ほう酸ナトリウム及びその水和物などのほう酸塩、りん酸三ナトリウム及びその水和物などのリン酸塩、リン化合物等が挙げられ、前記製法1において用いられる化合物の中から塩基性水溶液に溶解するものを適宜選択することができる。
【0095】
なお、前記特定の塩基性水溶液中の錫原子の価数は特に限定されないが、該塩基性水溶液中の錫の90原子%以上が2価の錫であり10原子%以下が4価の錫である場合には、リチウムイオンの吸蔵・放出量が大きくてサイクル特性も良好であるので、好適である。この時、塩基性水溶液中の錫の価数の調整は、本発明の製法1の有機溶媒溶液中の錫の価数を調整するのと同様にして行うことができる。また、この時、錫金属及び/又は錫化合物としてハロゲン化錫を選択し、第二元素の単体及び/又は第二元素を含む化合物として、オルト珪酸ナトリウム、メタ珪酸ナトリウム、二珪酸ナトリウム、四珪酸ナトリウム等の塩基性水溶液可溶性の珪酸塩を選択した場合には、第二元素として珪素を含む本発明の複合酸化錫粒子が好適に得られる。
【0096】
また、該溶液塩基性水溶液には、2価の錫の酸化を防止する目的でβーナフトキノン等を加えても良い。
【0097】
本発明の製法3で水に添加される前記の塩基性水溶液は上述した各条件を満足するものであれば、その濃度及び保存状態等は特に限定されない。しかしながら、一旦溶解した錫化合物や第二元素を含む化合物等が析出して組成が変化するのを防止するため、その濃度は溶解している錫金属及び/又は錫化合物並びに第二元素の単体及び/又は第二元素を含む化合物全ての合計で、塩基性水溶液1リットル当たり0.01〜1mol%であるのが好適である。また、溶解している錫の価数が変化するのを避けるために、錫の価数を調整した後は、該塩基性水溶液は反応させるまでアルゴン、窒素等の非酸化性ガス雰囲気下で保存しておくのが好適である。
【0098】
本発明の製法3では、前記塩基性水溶液と有機酸の水溶液とを、同時に水に添加して反応させて粒子を形成させる。前記塩基性水溶液と有機酸の水溶液とを同時に添加しない場合には、平均粒子径が小さい粉末が得られたり、粒度分布の広いバラツキの大きい粒子が得られる傾向がある。但し、前記塩基性水溶液と有機酸とは、予め混合しないでそれぞれ独立に添加する必要がある。両液を予め混合した場合には、水に添加する前に反応が起こってしまい、本複合酸化錫粉末が得られ難い。なお、添加の方法は、水の表面に滴下しても良く、水中に添加しても良い。
【0099】
この時使用される有機酸の水溶液は特に限定されず、公知の有機酸の水溶液が何等制限無く使用できる。好適に使用できる有機酸を例示すれば、蟻酸、酢酸、蓚酸、マロン酸、フタル酸等が挙げられるが、これら有機酸の中でも蓚酸等の多価のカルボン酸を使用するのが好適である。このような多価のカルボン酸の水溶液を使用した場合には、一次粒子の平均粒子径を大きくしやすい。該有機酸の水溶液の濃度は特に限定されないが、反応効率および反応の均一性の観点から0.1〜10mol/リットルの範囲であるのが好適である。
【0100】
また、上記有機酸の水溶液と前記塩基性水溶液とが添加される水は特に限定されないが、蒸留水もしくはイオン交換水を使用するのが好適である。なお、該水の使用量は撹拌が可能でほぼ均一な反応場を与えるような量であれば特に限定されないが、一般的には最終的に滴下される前記有機酸の水溶液と前記塩基性水溶液の合計体積の0.1〜10倍の体積となる量使用すればよい。また、上記水には得られる本複合酸化錫粉末の細孔分布を制御する目的で、界面活性剤を添加しても良い。
【0101】
該水に前記塩基性水溶液と前記有機溶媒の水溶液とを同時に添加し、反応させるときの条件は特に限定されないが、撹拌下で、これら水溶液の添加速度を制御して行うのが好ましい。これら反応条件は、使用する前記有機溶媒溶液の溶液組成、前記塩基性水溶液の種類及び濃度等によって変化するため一概に決定することは出来ないが、一般的な撹拌速度は25〜1000rpmの範囲であり、水1リットルに対する前記塩基性水溶液および前記有機溶媒の水溶液添加速度は、それぞれ0.1〜500ml/分及び0.1〜500ml/分である。また、反応温度は特に限定されないが、60〜95℃の範囲に制御するのが好適である。この様な反応温度に制御することにより、より平均粒子径が大きな本複合酸化錫粉末を得ることができる。
【0102】
このような反応条件下で反応を行うことにより、錫原子と第二元素との間に酸素原子を介した結合が生じる反応が起こり、粗粒子が形成される。
【0103】
このようにして形成された粗粒子は、本発明の製法1と同様にして必要に応じて分離、洗浄、乾燥等の処理を受けた後、本発明の製法1と同様にして熱処理することにより本発明の複合酸化錫粉末となる。
【0104】
本発明の製法1、2或いは3によって得られた本複合酸化錫粉末は、リチウムイオン二次電池用負極活物質等として使用したときの初期の充電容量と放電容量の差(以下、不可逆容量ともいう)を小さくするために、複合酸化錫中に予めリチウムを吸蔵させておくこともできる。この方法として複合酸化錫粉末を製造する際に、不可逆容量に相当するだけのLiCl、LiOR等のリチウムアルコキシドなどのリチウム化合物を同時に添加して複合酸化錫中に化合物の形でLiを含有させておく方法、あるいはリチウム塩を溶解させた有機電解液中でリチウム金属、あるいはリチウム合金等を対極とし、本複合酸化錫粉末を作用極として電気化学的にリチウムを複合酸化錫中に吸蔵させる方法等が採用できる。
【0105】
また、不可逆容量を低減するために本複合酸化錫粉末の表面を改質することも可能である。例えば、本複合酸化錫粉末中の独立粒子の表面をSnOやSnに変化させたり、炭素被覆を行ったりすることもできる。
【0106】
上述の本複合酸化錫粉末は、エレクトロクロミック表示素子用電極や非水電解液二次電池用負極活物質に用いることができる。例えば、本複合酸化錫粉末からなる負極活物質を用いた非水電解液二次電池の構成及び製造は、公知の方法で実施することができ、次のような方法で作製することができる。
【0107】
まず混練機、混合機などを用いて、本複合酸化錫粉末をN−メチルピロリドンなどの溶媒と混練し、ペーストを製造する。このとき黒鉛やアセチレンブラックなどの導電性付与剤、あるいはポリテトラフルオロエチレン、ポリフッ化ビニリデンなどの結着剤を適宜添加しても構わない。
【0108】
ペースト製造後、集電体にペーストを塗布、充填あるいは含浸させ、溶媒を乾燥、除去した後、加圧、切断などを行って所望の形状に加工して負極とする。該負極と、同様にして製造した正極をセパレータを介して帯状に重ね、円筒型非水電解液二次電池であれば円柱状に巻回し、また角型非水電解液二次電池であれば折り重ねて、電極部分を製造する。その後、この電極部分を所望の電池容器に挿入し、非水電解液を注入後、安全装置などを挿入し、封缶する。
【0109】
正極、集電体、非水電解液、セパレータなどは、従来の非水電解液二次電池に用いられている材料が何ら問題なく使用される。
【0110】
正極活物質としては、TiS2、MoS2、FeS2などの硫化物、NbSe3などのセレン化物などのカルコゲン化合物、あるいはCr2O5、Cr3O8、V3O8、V2O5、V6O13などの遷移金属の酸化物、LiMn2O4、LiMnO2、LiV3O5、LiNiO2、LiCoO2などのリチウムと遷移金属との複合酸化物、あるいはポリアニリン、ポリアセチレン、ポリパラフェニリン、ポリフェニレンビニレン、ポリピロール、ポリチオフェンなどの共役系高分子、ジスルフィド結合を有する架橋高分子などのリチウムを吸蔵、放出することが可能な材料を使用することができる。
【0111】
集電体としては、銅、アルミニウムなどからなる帯形状の薄板あるいはメッシュなどを用いることができる。
【0112】
非水電解液としては、プロピレンカーボネート、エチレンカーボネート、1,2−ジメトキシエタン、1,2−ジエトキシエタン、γ−ブチロラクトン、テトラヒドロフラン、1,3−ジオキソラン、4−メチル−1,3−ジオキソラン、ジエチルエーテル、スルホラン、メチルスルホラン、アセトニトリル、プロピオニトリルなどの単独あるいは2種類以上の混合非水溶媒に、LiClO4、LiPF6、LiAsF6、LiBF4、LiB(C6H5)4、LiCl、LiBr、CH3SO3Li、CF3SO3Liなどのリチウム塩が溶解してなる非水電解液がいずれの組合せにおいても使用可能である。
【0113】
セパレータとしては、イオンの移動に対して低抵抗であり、かつ溶液保持性に優れたものを用いればよい。例えば、ポリプロピレン、ポリエチレン、ポリエステルなどからなる高分子ポアフィルター、ガラス繊維フィルター、不織布、あるいはガラス繊維とこれらの上記高分子からなる不織布が使用可能である。更に、電池内部が高温になったとき、溶融して細孔をふさぎ、正極及び負極のショートを防ぐ材料が好ましい。
【0114】
【実施例】
以下、本発明について実施例及び比較例を挙げてより具体的に説明するが、本発明はこれら実施例に限定されるものではない。
【0115】
実施例1
メタノール920mlにテトラエトキシシラン41.93g(0.2モル)およびSnCl27.59g(0.04モル)を加え、攪はん下溶解させて透明な均一溶液を得た。攪はん下、この溶液中に毎分500mlの酸素を30分間供給して液中の錫を4価に酸化し、次いで毎分500mlのアルゴンを50分間供給した後、SnCl230.34g(0.16モル)を溶解させて、透明な均一溶液(以下、A液ともいう)を調製した。A液中の2価の錫を酸化還元滴定で、又、A液中の全ての錫(2価及び4価の錫)をICP発光分光分析により測定したところ、全ての錫中の2価の錫の割合は80原子%で、仕込み比にほぼ一致した。又、A液中の珪素をICP発光分光分析により定量したところ、錫と珪素の原子数比(Sn/Si)はほぼ1であった。
【0116】
一方、メタノール50.5mlに28%アンモニア水34.28gを加え均一溶液(以下、B液ともいう)を得た。
【0117】
2つの側管それぞれにA液滴下用とB液滴下用の一対のノズルを設置した1リットルの三口フラスコに、メタノール80ml及び28%アンモニア水0.4mlを仕込み、マグネティックスターラーを用いて毎分750回転で攪はんしながら毎分500mlのアルゴンを三口フラスコ中管よりメタノール中に10分間供給した。次いで、攪はん及び窒素供給を続けながら、ふたつの側管に設けた2対のノズルより、チューブポンプを用いてA液とB液を各々ノズル当たり2.0ml/分および0.18ml/分の滴下速度で三口フラスコ内のメタノールに滴下した。この時、水浴を用いて三口フラスコ内の溶液の温度は20℃とした。A液、B液の滴下とともに沈澱が生成し、三口フラスコ内の溶液は白濁した。A液及びB液の滴下が終了した後、攪はん及びアルゴン供給を更に30分間続け、次いで生成した白色沈澱を、濾別、水洗した。水洗した沈澱を、真空下、100℃に加熱して乾燥し、更に、アルゴン雰囲気下、400℃で1時間焼成して淡黄色の粉末を得た。なお、該焼成中に粉末は溶融していなかった。
【0118】
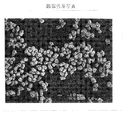
得られた粉末について組成分析、錫の価数分析、SEM観察、比表面積測定および結晶状態分析を行った結果、該粉末の一次粒子の平均粒子径及び変化係数は0.3μm、0.41であり、独立粒子の平均粒経及び変化係数は7.8μm、0.25であった(図1及び図2参照)。この粉末の比表面積は11.2m3/gであった。また、該一次粒子の形状は略球状(図2参照)であり、粉末のタップ密度は1.36g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素の原子数比Sn/Siは1.03であり、その中の錫は、2価の錫が78原子%であり4価の錫が22原子%であった。さらに該粒子の結晶状態は非晶質であった。また、該粒子表面には細孔等が多数観察された。
【0119】
なお、上記各測定は次のようにして行った。
【0120】
組成分析:蛍光X線分析により行った。
【0121】
比表面積:BET法により測定した。
【0122】
錫の価数分析:試料を溶解した溶液について、酸化還元滴定を行い2価の錫の含有量を測定した。
【0123】
SEM観察:試料の拡大SEM像を写真に撮影し、粒子の形状を観察するとともに、写真内の無作為に選んだ一次粒子および独立粒子各々各50個について長径を測定し、それぞれの平均粒子径、変化係数を求めた。
【0124】
結晶状態分析:粉末X線回折(対陰極は銅)により2Θが10〜40°の範囲における試料からの回折を測定し、測定された結晶性のピークから試料中の結晶相を同定した。結晶性のピークが観測されない場合、その試料の結晶性は非晶質とした。
【0125】
タップ密度分析:一定重量の試料を円筒容器に入れ、5回タップした後の体積を測定し、タップ密度を求めた。
【0126】
実施例2
メタノール920mlにテトラエトキシシラン41.93g(0.2モル)およびSnCl215.18g(0.08モル)を加え、攪はん下溶解させて透明な均一溶液を得た。攪はん下、この溶液中に毎分500mlの酸素を30分間供給して液中の錫を4価に酸化し、次いで毎分500mlのアルゴンを50分間供給した後、SnCl222.75g(0.12モル)を溶解させて、透明な均一溶液(以下、A液ともいう)を調製した。A液中の2価の錫を酸化還元滴定で、又、A液中の全ての錫(2価及び4価の錫)をICP発光分光分析により測定したところ、全ての錫中の2価の錫の割合は60原子%で、仕込み比にほぼ一致した。又、A液中の珪素をICP発光分光分析により定量したところ、錫と珪素の原子数比(Sn/Si)はほぼ1であった。
【0127】
一方、メタノール50.5mlに28%アンモニア水34.28gを加え均一溶液(以下、B液ともいう)を得た。
【0128】
2つの側管それぞれにA液滴下用とB液滴下用の一対のノズルを設置した1リットルの三口フラスコに、メタノール80ml及び28%アンモニア水0.4mlを仕込み、マグネティックスターラーを用いて毎分750回転で攪はんしながら毎分500mlのアルゴンを三口フラスコ中管よりメタノール中に10分間供給した。次いで、攪はん及び窒素供給を続けながら、ふたつの側管に設けた2対のノズルより、チューブポンプを用いてA液とB液を各々ノズル当たり2.0ml/分および0.18ml/分の滴下速度で三口フラスコ内のメタノールに滴下した。この時、水浴を用いて三口フラスコ内の溶液の温度は20℃とした。A液、B液の滴下とともに沈澱が生成し、三口フラスコ内の溶液は白濁した。A液及びB液の滴下が終了した後、攪はん及びアルゴン供給を更に30分間続け、次いで生成した白色沈澱を、濾別、水洗した。水洗した沈澱を、真空下、100℃に加熱して乾燥し、更に、アルゴン雰囲気下、400℃で1時間焼成して淡黄色の粉末を得た。なお、該焼成中に粉末は溶融していなかった。
【0129】
得られた粉末について組成分析、錫の価数分析、SEM観察、比表面積測定および結晶状態分析を行った結果、該粉末の一次粒子の平均粒子径及び変化係数は0.3μm、0.43であり、独立粒子の平均粒経及び変化係数は7.6μm、0.28であった。この粉末の比表面積は11.5m3/gであった。また、該一次粒子の形状は略球状であり、粉末のタップ密度は1.34g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素の原子数比Sn/Siは1.03であり、その中の錫は、2価の錫が57原子%であり4価の錫が43原子%であった。さらに該粒子の結晶状態は非晶質であった。また、該粒子表面には細孔等が多数観察された。
【0130】
実施例3
実施例1においてテトラエトキシシラン41.93g(0.2モル)をテトラエトキシシラン20.97g(0.1モル)、B(OCH3)3 5.20g(0.05モル)および、PO(OC2H5)3 9.11g(0.05モル)に変える他は実施例1と同様にして複合酸化錫粉末を得た。
【0131】
実施例1と同様にして各物性を測定した結果、該粉末の一次粒子の平均粒子径及び変化係数は0.3μm、0.39であり、独立粒子の平均粒経及び変化係数は8.2μm、0.18であった。この粉末の比表面積は10.8m3/gであった。また、該一次粒子の形状は略球状であり、粉末のタップ密度は1.25g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素、ほう素及びりんとの原子数比Sn:Si:B:Pは1:0.49:0.27:0.25であり、その中の錫は、2価の錫が78原子%であり4価の錫が22原子%であった。さらに該粒子の結晶状態は非晶質であった。
【0132】
実施例4
先端にガラスフィルターを備えた管を配置した50ミリリットルのガラス製フラスコに50mlの水を仕込みこれに水酸化ナトリウム3.20g(0.08モル)を、該ガラス管を通してアルゴンガスをバブリングさせながら撹拌下溶解させた。次に上記と同様にしてオルト珪酸ナトリウム水和物2.80g(珪素0.01モル)とSnCl21.90g(0.01モル)を順次溶解させ溶液(以下、A溶液という。)を調製した。
【0133】
一方、先端にガラスフィルターを備えた管を配置した50ミリリットルのガラス製フラスコに50mlの水を仕込みこれにシュウ酸4.50g(0.05モル)を、該ガラス管を通してアルゴンガスをバブリングさせながら撹拌下溶解させて溶液(以下B溶液という。)を調製した。
【0134】
次に、先端にガラスフィルターを備えた管を配置した500ミリリットルのガラス製三口フラスコに100mlのイオン交換水を仕込み、その温度を80℃に上げた後、該ガラス管を通じてアルゴンガスをバブリングさせた。次いで、この80℃の水に、アルゴンガスをバブリングしながら撹拌下(マグネティックスターラーにて700rpm)に前記A溶液及びB溶液をそれぞれ1ml/minの速度で同時に滴下して反応を行い、粒子の沈殿を得た。その後、アルゴン雰囲気下で生成した白色沈殿をろ過し、メタノールおよび水で洗浄した後真空乾燥した。その後、乾燥物をアルゴン雰囲気下400℃で1時間焼成し粉末を得た。
【0135】
得られた粉末について実施例1と同様にして各物性を測定した結果、該粉末の一次粒子の平均粒子径及び変化係数は0.5μm、0.39であり、独立粒子の平均粒経及び変化係数は12.1μm、0.40であった(図3及び図4参照)。この粉末の比表面積は10.5m3/gであった。また、該一次粒子の形状は略球状(図4参照)であり、粉末のタップ密度は.0.87g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素の原子数比Sn/Siは1.11であり、その中の錫は、2価の錫が93原子%であり4価の錫が7原子%であった。さらに該粒子の結晶状態は非晶質であった。
【0136】
実施例5
実施例4においてSnCl21.90g(0.01モル)を1.27g(0.0067モル)、又、シュウ酸4.50g(0.05モル)を3.63g(0.04モル)に変える他は実施例4と同様にして複合酸化錫粉末を得た。
【0137】
得られた粉末について実施例1と同様にして各物性を測定した結果、該粉末の一次粒子の平均粒子径及び変化係数は0.4μm、0.45であり、独立粒子の平均粒経及び変化係数は12.8μm、0.35であった。この粉末の比表面積は10.2m3/gであった。また、該一次粒子の形状は略球状であり、粉末のタップ密度は.0.92g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素の原子数比Sn/Siは0.68であり、その中の錫は、2価の錫が94原子%であり4価の錫が6原子%であった。さらに該粒子の結晶状態は非晶質であった。
【0138】
実施例6
実施例4においてSnCl21.90g(0.01モル)を2.84g(0.015モル)、又、シュウ酸4.50g(0.05モル)を5.85g(0.065モル)に変える他は実施例4と同様にして複合酸化錫粉末を得た。
【0139】
得られた粉末について実施例1と同様にして各物性を測定した結果、該粉末の一次粒子の平均粒子径及び変化係数は0.5μm、0.44であり、独立粒子の平均粒経及び変化係数は11.2μm、0.43であった。この粉末の比表面積は11.5m3/gであった。また、該一次粒子の形状は略球状であり、粉末のタップ密度は.0.85g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素の原子数比Sn/Siは1.51であり、その中の錫は、2価の錫が92原子%であり4価の錫が8原子%であった。さらに該粒子の結晶状態は非晶質であった。
【0140】
実施例7
実施例4においてオルト珪酸ナトリウム水和物2.80g(珪素0.01モル)をオルト珪酸ナトリウム水和物1.40g(珪素0.005モル)、四ほう酸ナトリウム(無水)0.50g(0.0025モル)およびりん酸ナトリウム12水和物0.95g(0.0025モル)に変える他は実施例4と同様にして複合酸化錫粉末を得た。
【0141】
得られた粉末について実施例1と同様にして各物性を測定した結果、該粉末の一次粒子の平均粒子径及び変化係数は0.3μm、0.47であり、独立粒子の平均粒経及び変化係数は12.5μm、0.34であった。この粉末の比表面積は10.7m3/gであった。また、該一次粒子の形状は略球状であり、粉末のタップ密度は.0.88g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素、ほう素及びりんとの原子数比Sn:Si:B:Pは1:0.51:0.26:0.25であり、その中の錫は、2価の錫が93原子%であり4価の錫が7原子%であった。さらに該粒子の結晶状態は非晶質であった。
【0142】
実施例8
メタノール920mlにアルゴンガスを毎分500mlの割合でバブリングさせながら、撹拌下テトラエトキシシラン29.17g(0.14モル)、オキシ塩化ジルコニウム8水和物19.34g(0.06モル)およびSnCl237.92g(0.20モル)を加えて溶解させて透明な均一溶液(以下、A液ともいう)を調製した。A液中の2価の錫を酸化還元滴定で、又、A液中の全ての錫(2価及び4価の錫)をICP発光分光分析により測定したところ、全ての錫中の2価の錫の割合は99原子%であった。又、A液中の珪素とジルコニウムをICP発光分光分析により定量したところ、錫と珪素及びジルコニウムの原子数比Sn/(Si+Zr)はほぼ1であった。
【0143】
一方、メタノール50.5mlに28%アンモニア水30.48gを加え均一溶液(以下、B液ともいう)を得た。
【0144】
2つの側管それぞれにA液滴下用とB液滴下用の一対のノズルを設置した1lの三口フラスコに、メタノール80ml及び28%アンモニア水0.4mlを仕込み、マグネティックスターラーを用いて毎分750回転で攪はんしながら毎分500mlの窒素を三口フラスコ中管よりメタノール中に10分間供給した。次いで、攪はん及び窒素供給を続けながら、ふたつの側管に設けた2対のノズルより、チューブポンプを用いてA液とB液を各々ノズル当たり2.0ml/分および0.18ml/分の滴下速度で三口フラスコ内のメタノールに滴下した。この時、水浴を用いて三口フラスコ内の溶液の温度は20℃とした。A液、B液の滴下とともに沈澱が生成し、三口フラスコ内の溶液は白濁した。A液及びB液の滴下が終了した後、攪はん及び窒素供給を更に30分間続け、次いで生成した白色沈澱を、濾別、水洗した。水洗した沈澱を、真空下、100℃に加熱して乾燥し、更に、アルゴン雰囲気下、400℃で1時間焼成して白色の粉末を得た。なお、該焼成中に粉末は溶融していなかった。
【0145】
得られた粉末について組成分析、錫の価数分析、SEM観察、比表面積測定および結晶状態分析を行った結果、該粉末の一次粒子の平均粒子径及び変化係数は0.3μm、0.41であり、独立粒子の平均粒経及び変化係数は10.3μm、0.45であった。この粉末の比表面積は11.9m3/gであった。また、該一次粒子の形状は略球状であり、粉末のタップ密度は0.81g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素の原子数比Sn/(Si+Zr)は1.03であり、その中の錫は、2価の錫が97原子%であり4価の錫3原子%であった。さらに該粒子の結晶状態は非晶質であった。また、該粒子表面には細孔等が多数観察された。
【0146】
比較例1
市販の一酸化錫(SnO)粉末4.58g(0.034モル)と、二酸化珪素粉末(SiO2)2.04g(0.034モル)を回転ボールミルにて8時間混合した。この混合粉末をアルミナ製坩堝に入れてアルゴン雰囲気中、700℃で2時間焼成し粉末を得た。
【0147】
得られた粉末について実施例1と同様にして粉末X線回折により結晶状態を分析したところ、原料のSnOが不均化反応によりほぼ完全にSn(錫は0価)とSnO2に変化していることが確認され、複合酸化錫は得られなかった。
【0148】
比較例2
水1リットルにSnCl275.8g(0.4モル)を加えアルゴンガスをバブリングさせながら撹拌した。このとき溶液は白濁していた。その後、該懸濁液にテトラエトキシシラン83.33g(0.4モル)をアルゴンガスをバブリングさせながら撹拌下に添加した。テトラエトキシシランを添加した直後、溶液は2相に分離しており、その後撹拌するにしたがって沈殿物が生成し、その量が増加した。24時間撹拌した後、2規定の水酸化ナトリウム水溶液440mlを徐々に加え、さらに沈殿物を生成させた。その後、沈殿物を濾過して乾燥した後、乾燥物をアルゴン雰囲気中、400℃で2時間焼成し粉末を得た。
【0149】
得られた粉末について実施例1と同様にして各物性を測定した結果、該粉末の一次粒子の平均粒子径及び変化係数は0.03μm、0.39であり、この一次粒子が不規則に凝集して数十μmの不定形粗粒を形成していた。この粉末の比表面積は82.3m3/gであった。粉末のタップ密度は.0.36g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素の原子数比Sn/Siは1.01であり、その中の錫は、2価の錫が48原子%であり4価の錫が52原子%であった。さらに該粒子の粉末X線回折により金属Snと結晶質SnO2の存在が確認された。
【0150】
比較例3
市販の一酸化錫(SnO)粉末6.73g(0.05モル)と、二酸化珪素粉末(SiO2)3.00g(0.05モル)を乳鉢で混合した。この混合粉末をアルミナ製坩堝に入れてアルゴン雰囲気下1100℃で12時間加熱後、冷却してガラス状の凝固物を得た。得られた凝固物をスタンプミルで粗粉砕した後、ジェットミルを用いて更に粉砕した。粉砕された粉末を風力分級機で分級、捕集した。
【0151】
得られた粉末について実施例1と同様にして各物性を測定した結果、該粉末の粒子は粉砕により生じた鋭いエッジを有する不定形粒子で、且つ、緻密で極めて平滑な表面を有しており表面には細孔等は観察されなかった。平均粒子径及び変化係数は9.5μm、0.73であった。この粉末の比表面積は1.3m3/g、タップ密度は.0.83g/mlあった。また、該粉末を構成する複合酸化錫中の錫と珪素の原子数比Sn/Siは1.01であり、その中の錫は、2価の錫が91原子%であり4価の錫が9原子%であった。さらに該粒子の結晶状態は非晶質であった。
【0152】
実施例9〜12
上記各実施例1〜8で得られた各複合酸化錫粉末を負極活物質として用い、リチウム電池を作製し、得られたリチウム電池の充放電容量、サイクル特性について評価をおこなった。
【0153】
なお、リチウム電池の作製、並びに初期充放電容量及びサイクル特性の評価は次のようにして行った。
【0154】
リチウム電池の作成: 各実施例の複合酸化錫粉末、ポリフッ化ビニリデン(結着剤)およびアセチレンブラック(導電性付与剤)を80/5/15(重量比)の割合で混合し、この混合物500mgに対し、N−メチルピロリドン1mlを添加して混練し、ペーストを作製した。このペーストを100℃の真空乾燥器にて24時間乾燥した。乾燥したペースト6mgをニッケル箔に塗布して負極とした。非水電解液には、LiCl04(1モル/リットルの濃度)をエチレンカーボネートとジエチルカーボネートの等体積混合溶媒に溶解したものを使用した。また電池容器にはガラス製の円筒容器を使用し、負極1個の両側に正極(リチウムを使用)2個、また負極の近傍に参照電極(リチウムを使用)1個を配置するように、上部蓋からクリップ付きのニッケル線(ガラス管被覆)で吊り下げて簡易型のリチウム電池を作製した。
【0155】
初期充放電容量の測定: 充放電装置(北斗電工製)を用いて、上記簡易型リチウム電池の充放電サイクル試験を行い、放電時間t(単位;時間)を測定することにより負極活物質の第1サイクル目の充放電容量を測定した。充放電サイクル試験は、30mA/gに相当する電流値(一定)で行い、充放電は参照電極に対して、0〜1.99Vの範囲内で行った。また、充放電1サイクル目の放電容量(C1)と10サイクル目の放電容量(C10)より容量維持率を計算し、充放電サイクル特性を評価した。なお、充放電容量および容量維持率は次の式に従って求めた。
【0156】
充放電容量=30×t (単位;mAh/g)
容量維持率=C10/C1×100 (単位;%)
実施例1〜6の複合酸化錫粉末についての評価結果を表1に示す。
【0157】
【表1】
比較例4及び5
実施例9において、負極活物質として用る粉末を比較例2及び3で得られた粉末に変える他は実施例9と同様にしてリチウム電池を作製し、実施例9と同様にして得られたリチウム電池の評価を行った。その結果を表1に併せて示す
【0158】
【効果】
例えば本発明の製法1、2及び/又は製法3で得られる本複合酸化錫粉末は、リチウム電池等の非水電解液二次電池用負極用活物質として使用したときに、再現性良く高い充放電容量を与え、その時のサイクル特性も良好である。また、該粉末は、タップ密度が高いため負極に高密度充填することが可能であり、より高い充放電容量を得ることもできる。
【0159】
また、これまで知られていた溶融法では得られる複合酸化錫粉末の組成が厳しく限定されていたのに対し、本発明の製造1、2および3によれば広い組成の複合酸化錫を容易に得ることができる。また、これら方法では破砕工程を要さずに均質な粒子から成る粉末を得ることができるため、該工程に起因する不確定性を排除することができ、これら方法で得られた本複合酸化錫粉末は、極めて信頼性の高い非水電解液二次電池用負極用活物質となる。
【図面の簡単な説明】
【図1】 実施例1で得られた本発明の複合酸化錫粉末のSEM写真である。
【図2】 図1のSEM写真における独立粒子の拡大写真である。
【図3】 実施例4で得られた本発明の複合酸化錫粉末のSEM写真である。
【図4】 図3のSEM写真における独立粒子の拡大写真である。
Claims (7)
- 錫と複合酸化物を形成し得る第二元素であって、珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種と、錫と、を含む複合酸化錫からなる独立粒子で構成される複合酸化錫粉末であって、
前記複合酸化錫における錫と第二元素との合計量に対する錫の割合は30原子%以上であり、
前記複合酸化錫における錫の60原子%以上が2価の錫であり、40原子%以下が4価の錫であり、
前記独立粒子は、「前記複合酸化錫からなる略球状の粒子であって、その平均粒子径が0.2〜10μmである複合酸化錫粒子」からなる一次粒子及び/又は該一次粒子の凝集粒子からなると共に該凝集粒子を含み、
該複合酸化錫粉末の比表面積は8〜30m2/gである
ことを特徴とする複合酸化錫粉末。 - 前記独立粒子の平均粒子径が0.2〜30μmである請求項1に記載の複合酸化錫粉末。
- 前記独立粒子の一次粒子の長径の標準偏差を一次粒子の平均粒子径で除した値として定義される変化係数が0.5以下であることを特徴とする請求項1又は2に記載の複合酸化錫粉末。
- 請求項1乃至3の何れか一に記載の複合酸化錫粉末の製造方法であって、
錫換算で60〜90モル%の2価の錫化合物及び錫換算で10〜40モル%の4価の錫化合物からなる有機溶媒可溶性錫化合物、並びに珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素を含む有機溶媒可溶性化合物を、錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で有機溶媒に溶解させて有機溶媒溶液を調製し、
得られた該有機溶媒溶液と、塩基性水溶液とを、同時にアルコールに添加して反応させて粒子を形成し、次いで形成された粒子を200〜600℃で熱処理することを特徴とする方法。 - 請求項1乃至3の何れか一に記載の複合酸化錫粉末の製造方法であって、
錫換算で90モル%以上の2価の錫化合物及び錫換算で10モル%以下の4価の錫化合物からなる有機溶媒可溶性錫化合物、並びに珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素を含む有機溶媒可溶性化合物を、錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で有機溶媒に溶解させて有機溶媒溶液を調製し、
得られた該有機溶媒溶液と、塩基性水溶液とを、同時にアルコールに添加して反応させて粒子を形成し、次いで形成された粒子を200〜600℃で熱処理することを特徴とする方法。 - 請求項1乃至3の何れか一に記載の複合酸化錫粉末の製造方法であって、
錫金属及び/又は錫化合物、並びに珪素、ゲルマニウム、ジルコニウム、チタン、ハフニウム、アルミニウム、リン、ホウ素、及び鉛から選ばれる少なくとも1種の第二元素の単体及び/又は該第二元素を含む化合物を、錫と第二元素との合計量に対する錫の割合が30原子%以上となる割合で溶解させて塩基性水溶液を調製し、
得られた該塩基性水溶液と、有機酸の水溶液とを、同時に水に添加して反応させて粒子を形成し、次いで形成された粒子を200〜600℃で熱処理することを特徴とする方法。 - 塩基性水溶液と有機酸の水溶液とを同時に水に添加して反応させる際の反応温度が60〜95℃である請求項6に記載の複合酸化錫粉末の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP10860898A JP4301589B2 (ja) | 1998-04-03 | 1998-04-03 | 複合酸化錫粉末及びその製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP10860898A JP4301589B2 (ja) | 1998-04-03 | 1998-04-03 | 複合酸化錫粉末及びその製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH11292535A JPH11292535A (ja) | 1999-10-26 |
| JP4301589B2 true JP4301589B2 (ja) | 2009-07-22 |
Family
ID=14489123
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP10860898A Expired - Fee Related JP4301589B2 (ja) | 1998-04-03 | 1998-04-03 | 複合酸化錫粉末及びその製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4301589B2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9772569B2 (en) | 2015-06-24 | 2017-09-26 | Canon Kabushiki Kaisha | Electrophotographic photosensitive member, process cartridge, and electrophotographic apparatus |
| US9904188B2 (en) | 2013-12-26 | 2018-02-27 | Canon Kabushiki Kaisha | Electrophotographic photosensitive member, process cartridge, and electrophotographic apparatus |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3620703B2 (ja) * | 1998-09-18 | 2005-02-16 | キヤノン株式会社 | 二次電池用負極電極材、電極構造体、二次電池、及びこれらの製造方法 |
| JP5330918B2 (ja) * | 2009-07-27 | 2013-10-30 | 三井金属鉱業株式会社 | 酸化スズ粒子及び酸化スズゾルの製造方法 |
| JP5774444B2 (ja) * | 2011-10-27 | 2015-09-09 | 株式会社豊田自動織機 | リチウムイオン二次電池用負極活物質およびその製造方法ならびにリチウムイオン二次電池 |
| JP6282138B2 (ja) | 2014-02-24 | 2018-02-21 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジ及び電子写真装置 |
| WO2015186573A1 (ja) * | 2014-06-02 | 2015-12-10 | 富士フイルム株式会社 | 酸化物粒子及びその製造方法、酸化物粒子分散液、酸化物粒子薄膜の形成方法、薄膜トランジスタ、並びに電子素子 |
| JP6776510B2 (ja) * | 2015-06-11 | 2020-10-28 | 株式会社リコー | エレクトロクロミック表示素子、表示装置、情報機器、エレクトロクロミック表示素子の製造方法、エレクトロクロミック調光レンズ |
| CN110171842B (zh) * | 2019-04-17 | 2021-08-31 | 华中科技大学 | 一种混合价态锡基氧化物半导体材料的制备方法及应用 |
-
1998
- 1998-04-03 JP JP10860898A patent/JP4301589B2/ja not_active Expired - Fee Related
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9904188B2 (en) | 2013-12-26 | 2018-02-27 | Canon Kabushiki Kaisha | Electrophotographic photosensitive member, process cartridge, and electrophotographic apparatus |
| US9772569B2 (en) | 2015-06-24 | 2017-09-26 | Canon Kabushiki Kaisha | Electrophotographic photosensitive member, process cartridge, and electrophotographic apparatus |
Also Published As
| Publication number | Publication date |
|---|---|
| JPH11292535A (ja) | 1999-10-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6217945B2 (ja) | 非水電解質二次電池用活物質、その活物質の製造方法、非水電解質二次電池用電極及び非水電解質二次電池 | |
| JP6914483B2 (ja) | リチウム二次電池用正極活物質、前駆体の製造方法、リチウム二次電池用正極及びリチウム二次電池 | |
| JP5257272B2 (ja) | リチウム二次電池用正極材料およびそれを用いた二次電池ならびにリチウム二次電池用正極材料の製造方法 | |
| KR102012304B1 (ko) | 비수 전해질 2차 전지용 활물질, 그 활물질의 제조 방법, 비수 전해질 2차 전지용 전극 및 비수 전해질 2차 전지 | |
| KR102013757B1 (ko) | 리튬 2차 전지용 양극 활물질, 그 제조 방법, 리튬 2차 전지용 전극, 리튬 2차 전지 | |
| KR20130132847A (ko) | 비수 전해질 2차 전지용 양극 활물질, 그 양극 활물질의 제조 방법, 비수 전해질 2차 전지용 전극, 비수 전해질 2차 전지및 그 2차 전지의 제조 방법 | |
| CN105813981A (zh) | 改进的锂金属氧化物阴极材料及其制备方法 | |
| KR20140018092A (ko) | 리튬 2차 전지용 양극 활물질, 그 제조 방법, 리튬 2차 전지용 전극, 및 리튬 2차 전지 | |
| JP6844156B2 (ja) | リチウム二次電池用正極活物質、その製造方法、リチウム二次電池用電極、及びリチウム二次電池 | |
| WO2010046629A1 (en) | Synthesis of metal compounds | |
| JP6271588B2 (ja) | 非水電解質二次電池用正極活物質及び非水電解質二次電池 | |
| JPH10316425A (ja) | 球状複合酸化錫粉末の製造方法 | |
| JPH10316426A (ja) | 被覆酸化錫 | |
| JP4301589B2 (ja) | 複合酸化錫粉末及びその製造方法 | |
| JP5813972B2 (ja) | リチウム−遷移金属複合酸化物粉末及びその製造方法並びに該粉末を用いた全固体リチウム電池用正極活物質 | |
| JP4655453B2 (ja) | リチウム二次電池用正極材料およびそれを用いた二次電池ならびにリチウム二次電池用正極材料の製造方法 | |
| JPH10233211A (ja) | 非水電解液二次電池用負極活物質および非水電解液二次電池 | |
| CN112771695B (zh) | 正极活性物质、正极、非水电解质二次电池及其使用方法 | |
| JP2020035693A (ja) | 遷移金属複合水酸化物、遷移金属複合水酸化物の製造方法、リチウム遷移金属複合酸化物活物質及びリチウムイオン二次電池 | |
| JP4329434B2 (ja) | リチウム二次電池用正極及びそれを用いたリチウム二次電池 | |
| JP6139573B2 (ja) | リチウム二次電池用正極活物質の製造方法、及びそれを含むリチウム二次電池 | |
| CN110165207A (zh) | 用于锂离子电池的硅(Si)改性正极材料 | |
| JPH10312803A (ja) | 非水電解液二次電池用負極活物質および非水電解液二次電池 | |
| JP2002121023A (ja) | 錫系複合酸化物 | |
| CN109616648B (zh) | 一种含有内禀空位的二次电池电极材料及电池 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050120 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050201 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20080307 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080324 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080509 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20081104 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081225 |
|
| A911 | Transfer of reconsideration by examiner before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20090114 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090330 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090421 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120501 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120501 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150501 Year of fee payment: 6 |
|
| LAPS | Cancellation because of no payment of annual fees |