JP4284635B2 - ポリカーボネートの製造法 - Google Patents
ポリカーボネートの製造法 Download PDFInfo
- Publication number
- JP4284635B2 JP4284635B2 JP2000602698A JP2000602698A JP4284635B2 JP 4284635 B2 JP4284635 B2 JP 4284635B2 JP 2000602698 A JP2000602698 A JP 2000602698A JP 2000602698 A JP2000602698 A JP 2000602698A JP 4284635 B2 JP4284635 B2 JP 4284635B2
- Authority
- JP
- Japan
- Prior art keywords
- reaction
- oxalate
- compound
- phenol
- polycarbonate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/20—General preparatory processes
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/20—General preparatory processes
- C08G64/30—General preparatory processes using carbonates
- C08G64/307—General preparatory processes using carbonates and phenols
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C68/00—Preparation of esters of carbonic or haloformic acids
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Polyesters Or Polycarbonates (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
【発明の属する技術分野】
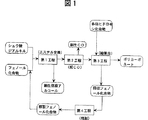
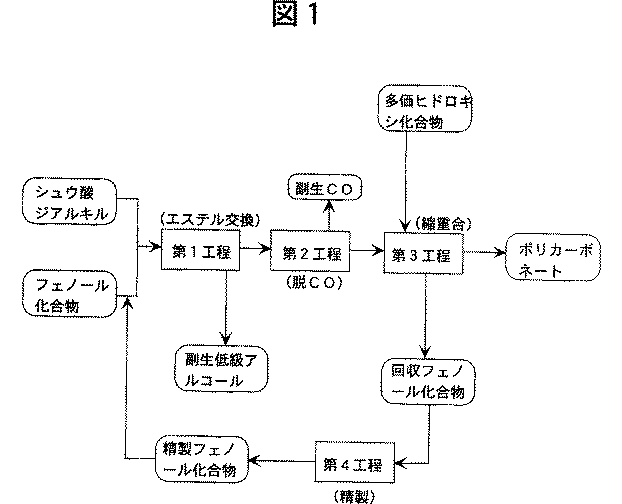
本願の第1の発明は、概略、出発原料としてシュウ酸ジアルキルとフェノール化合物とを使用して、第1工程のエステル交換反応(本発明では、後述のように通常のエステル交換反応及び不均化反応を含む。)によりシュウ酸ジアリールを合成し、第2工程のシュウ酸ジアリールの脱CO反応により炭酸ジアリールを合成し、第3工程での炭酸ジアリールと多価ヒドロキシ化合物との縮重合反応によりポリカーボネートを製造し、そして、第4工程で縮重合反応で得られる回収フェノール化合物を精製して、縮重合反応に由来する特定の不純物が低い含有率となっている精製フェノール化合物を得て、第1工程のエステル交換反応に循環・使用するというポリカーボネートの製造法に係わる。
【0002】
即ち、第1の発明は、シュウ酸ジアルキルとフェノール化合物とを、エステル交換反応させてシュウ酸ジアリールを合成し、この反応で得られたシュウ酸ジアリールを脱CO反応させて炭酸ジアリールを合成し、更に、縮重合反応で副生するフェノール化合物を他の不純物と共に分離・除去し回収しながら、その脱CO反応で得られたジフェニルカーボネートなどの炭酸ジアリールとビスフェノールAなどの多価ヒドロキシ化合物とを特定の縮重合触媒の存在下に縮重合反応させてポリカーボネートを製造し、一方、前記の回収フェノール化合物を充分に精製して、特定の不純物(沸点がフェノール化合物よりも低いアミン化合物)が特定の低い含有率となった精製フェノール化合物を得て、前述のエステル交換反応の原料として循環・使用するという工業的に優れたポリカーボネートの製造法に係わる。
【0003】
また、本願の第2の発明は、概略、出発原料として、ポリカーボネート製造の縮重合反応における回収フェノール化合物を精製して得られた、縮重合反応に由来する不純物(沸点がフェノール化合物よりも低いアミン化合物)が特定の低い含有率である精製フェノール化合物と、シュウ酸ジアルキルとを使用して、第1工程のエステル交換反応によりシュウ酸ジアリールを合成し、第2工程のシュウ酸ジアリールの脱CO反応により炭酸ジアリールを合成して、最後に、第3工程での炭酸ジアリールと多価ヒドロキシ化合物との縮重合反応によりポリカーボネートを製造する方法に係わる。
【0004】
【従来の技術】
出発原料としてシュウ酸ジアルキルとフェノール化合物とを使用して、第1工程のエステル交換反応によりシュウ酸ジアリールを合成し、第2工程のシュウ酸ジアリールの脱CO反応により炭酸ジアリールを合成して、更に、第3工程での炭酸ジアリールと多価ヒドロキシ化合物との縮重合反応によりポリカーボネートを製造する方法、及び、その縮重合反応で得られる回収フェノール化合物を、第1工程のエステル交換反応において循環・使用することについては、既に、特開平10−152552号公報などにおいて開示されている。
【0005】
前記の公知のポリカーボネートの製造法は、炭酸ジアリールがホスゲンを全く使用しない製法で得られるものであり、高い純度を有するものであるので、この炭酸ジアリールを用いて、縮重合反応させて、重合度、透明性などにおける高い品質を示すポリカーボネートを容易に得ることができる極めて優れた新しいポリカーボネートの製法として注目されている。
【0006】
また、ジフェニルカーボネートなどの炭酸ジアリールとビスフェノールAなどの多価ヒドロキシ化合物とを縮重合反応させてポリカーボネートを製造する際に縮重合触媒としてテトラメチルアンモニウムヒドロキシド、テトラブチルアンモニウムヒドロキシド、トリブチルアミンなどを含む触媒が用いられることは、よく知られていた。これらの縮重合触媒は高温下での縮重合条件では一部分解し、トリメチルアミンやトリブチルアミンなどのアミン化合物を生じて、縮重合反応で得られる回収フェノール化合物中に含まれることがある。
【0007】
前述の縮重合反応において副生した前記不純物を含有するフェノール化合物を使用して、シュウ酸ジアルキルとエステル交換反応させてシュウ酸ジアリールを製造するための反応を行う場合、回収フェノール化合物中に含まれる上記アミン化合物などの不純物が、第1工程のエステル交換反応でシュウ酸ジアリールを製造する工程及び/又は第2工程の脱CO反応によって炭酸ジアリールを製造する工程にどのような影響があるかの点については、実質的に知られていなかった。ポリカーボネート製造の縮重合反応で得られる回収フェノール化合物が前述の第1工程の原料として使用することができるかどうかは、前述の公知のポリカーボネートの製造法において極めて重要な問題である。
【0008】
【発明が解決しようとする課題】
本発明者らは、特定の縮重合触媒を用いてポリカーボネートを製造する際に得られた回収フェノール化合物(特に回収フェノール化合物中の沸点がフェノール化合物よりも低いアミン化合物)がシュウ酸ジアリールの製造などに多大な悪影響を及ぼすことを見出した。
【0009】
すなわち、ポリカーボネート製造の縮重合反応に由来する不純物であるトリメチルアミン、トリエチルアミンなどの沸点がフェノール化合物よりも低いアミン化合物がその縮重合反応からの回収フェノール化合物と共にシュウ酸ジアリール製造のエステル交換反応に持ち込まれると、エステル交換反応に用いる触媒を著しく活性低下させるため、この問題を回避するために何らかの手段が必要となる。
【0010】
【課題を解決するための手段】
本発明の発明者らは、特定の縮重合触媒を用いてポリカーボネートを製造する際に得られる回収フェノール化合物を原料として用い、シュウ酸ジアルキルとエステル交換反応させてシュウ酸ジアリールを製造する際に、前述の種々の問題を生じないようにすることを鋭意研究した結果、前述のエステル交換反応に使用する前に、沸点がフェノール化合物よりも低いアミン化合物などの不純物を回収フェノール化合物から充分に除去した精製フェノール化合物を、エステル交換反応に原料として使用することによって、前述のエステル交換反応などが支障なく行われることを見出し、本発明を完成したのである。
【0011】
本願の第1の発明は、第1工程で、シュウ酸ジアルキル(ジアルキルオキサレート)とフェノール化合物とをエステル交換反応させてシュウ酸ジアリール(ジアリールオキサレート)を合成し、次いで、第2工程で、エステル交換反応で得られたシュウ酸ジアリールを脱CO反応させて炭酸ジアリール(ジアリールカーボネート)を合成し、更に、第3工程で、前記脱CO反応で得られた炭酸ジアリールと多価ヒドロキシ化合物とを、メチルアミンもしくはエチルアミンである一級アミン、ジメチルアミンもしくはジエチルアミンである二級アミン、あるいは炭素原子数が1〜3のアルキル基を有する三級アミン又はアンモニウム化合物を含む縮重合触媒を使用して、副生するフェノール化合物を不純物と共に除去し回収しながら縮重合反応させてポリカーボネートを製造し、一方、第4工程で、前記縮重合反応における回収フェノール化合物を充分に精製して、前記縮重合反応に由来する不純物のフェノール化合物より低沸点であるアミンの含有率が100ppm以下である精製フェノール化合物を得て、第1工程のエステル交換反応で循環・使用することを特徴とするポリカーボネートの製造法にある。
【0012】
本願の第2の発明は、第1工程で、ポリカーボネート製造の縮重合反応において副生したフェノール化合物を回収し精製して得られた、縮重合反応に由来する不純物のフェノール化合物より低沸点であるメチルアミンもしくはエチルアミンである一級アミン、ジメチルアミンもしくはジエチルアミンである二級アミン、あるいは炭素原子数が1〜3のアルキル基を有する三級アミンの含有率が100ppm以下である精製フェノール化合物と、シュウ酸ジアルキルとをエステル交換反応させてシュウ酸ジアリールを合成し、次いで、第2工程で、エステル交換反応で得られたシュウ酸ジアリールを脱CO反応させて炭酸ジアリールを合成し、さらに、第3工程で、前記の脱CO反応で得られた炭酸ジアリールを多価ヒドロキシ化合物と縮重合反応させてポリカーボネートを製造することを特徴とするポリカーボネートの製造法にある。
【0013】
【発明の実施の形態】
以下、本発明について更に詳しく説明する。本願の第1の発明では、図1に各工程の概略を示すように、例えば、シュウ酸ジアルキルとフェノール化合物とのエステル交換反応によるシュウ酸ジアリール合成の第1工程、シュウ酸ジアリールの脱CO反応による炭酸ジアリール合成の第2工程、炭酸ジアリールと多価ヒドロキシ化合物との縮重合反応によるポリカーボネート製造の第3工程、及び、前記の縮重合反応で副生するフェノール化合物を回収し精製して精製フェノール化合物を得る第4工程が、それぞれ図1に示すラインで連結している連続的なプロセスに従って行われる。
【0014】
本発明において、前記のエステル交換反応とは、エステル化合物のエステルを形成しているヒドロキシ化合物の残基が他のヒドロキシ化合物の残基と入れ替る全ての反応を含む。即ち本発明では、エステル交換反応とは、例えば、シュウ酸ジアルキルがシュウ酸アルキルアリールとなる通常のエステル交換反応、及び、シュウ酸アルキルアリールがシュウ酸ジアリールとシュウ酸ジアルキルに不均化する不均化反応のいずれをも含むのである。
【0015】
第1の発明は、例えば、第1工程でシュウ酸ジアルキル(特にシュウ酸ジメチル)とフェノール化合物(特にフェノール)とをエステル交換反応用の触媒の存在下に液相でエステル交換反応及び不均化反応させて、シュウ酸ジアリール(特にシュウ酸ジアリール)と副生物の低級アルコール(特にメタノール)とを生成させ、そのシュウ酸ジアリールを分離・精製して回収すると共に、低級アルコールを分離・回収し、そして、第2工程で、そのシュウ酸ジアリールを脱CO触媒の存在下に液相で脱CO反応させて炭酸ジアリール(特にジフェニルカーボネート:DPC)と副生物の一酸化炭素を生成させ、一酸化炭素ガスを反応系外へ排出させながら、反応混合物から炭酸ジアリールを分離・精製し回収し、次いで、第3工程で、炭酸ジアリールと多価ヒドロキシ化合物とを、アミン化合物又はアンモニウム化合物などの適当な縮重合触媒の存在下に、副生するフェノール化合物を分離・除去し回収しながら、縮重合反応させてポリカーボネートを製造し、更に、第4工程で、前記の縮重合反応から得られた回収フェノール化合物を精製して精製フェノール化合物を得て、その精製フェノールを第1工程のエステル交換反応に再利用する方法を好適に挙げることができる。
【0016】
前記の第1工程で用いるシュウ酸ジアルキルとしては、例えば、シュウ酸ジメチル、シュウ酸ジエチル、シュウ酸ジプロピル、シュウ酸ジブチル、シュウ酸ジペンチル、シュウ酸ジヘキシル等のシュウ酸のジ−低級アルキルエステルを挙げることができる。シュウ酸ジ(低級アルキル)は、二つの低級アルキル基が異なっていても全く同じであってもよく、炭素原子数1〜6の直鎖状又は分岐状アルキル基を有するものが好ましく、特に、炭素原子数1〜4の直鎖状アルキル基を有するものが好ましい。
【0017】
前記のシュウ酸ジアルキルは、一酸化炭素(CO)と亜硝酸アルキル(一般式:RONOで示される。この一般式で、Rは低級アルキル基である)とを、白金金属、パラジウム金属などの白金族金属、もしくはそれらの金属の塩類又は錯体からなる白金族金属系触媒、或いは、その白金族金属系触媒成分が活性炭、アルミナ、スピネル、シリカ、珪藻土、ゼオライト等の担体に0.01〜5重量%担持された触媒の存在下に、2〜200気圧(特に2〜100気圧)及び10〜200℃(特に20〜150℃)の反応条件で気相又は液相で反応させ、副生する一酸化窒素(NO)と共にシュウ酸ジアルキル(例えばシュウ酸ジメチル)を生成させるという公知の製法などにより得ることができる。上記亜硝酸アルキルの一般式中のRは、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基などの炭素原子数1〜4の低級アルキル基であることが好ましいが、特にメチル基が好ましい。
【0018】
前記の一酸化窒素は、必要であれば、分子状酸素の存在下に低級アルコールと反応させて亜硝酸アルキルを再生し、前記のシュウ酸ジアルキルの合成反応に再利用することができる。また、シュウ酸ジアルキル製造において使用される一酸化炭素(CO)は、本発明の第2工程の脱CO反応において副生する一酸化炭素(ガス)を、その一部として使用することもできる。
【0019】
第1工程で用いるフェノール化合物は、1個のヒドロキシル基が置換基を有していてもよいベンゼン環を形成している炭素原子に直接に結合しており、フェノールを除く他のフェノール化合物のヒドロキシル基がフェノールのヒドロキシル基と同様の性質を有するものであればよい。前記の置換基としては、炭素原子数1〜6(特に1〜4)の低級アルキル基、炭素原子1〜6(特に1〜4)のアルコキシ基、ハロゲンのような種々の置換基を挙げることができる。本発明において、フェノール化合物としては、フェノール、低級アルキルフェノール(特に、4−メチルフェノール、4−エチルフェノール、3,4−ジメチルフェノールなど)が好適であり、フェノールが最も好ましい。
【0020】
第1の発明における第1工程は、概略、シュウ酸ジアルキルとフェノール化合物とを、エステル交換触媒の存在下、反応温度約50〜300℃(特に100〜250℃)で、生成する低級アルコールを反応系外へ除去しながら液相で反応させて、シュウ酸ジアリールを生成させ、分離・精製し、回収する工程により実施されることが好ましい。
【0021】
更に詳しくは、第1工程は、例えば、シュウ酸ジアルキルとフェノール化合物とを使用して、エステル交換触媒の存在下、反応温度約50〜300℃(特に100〜250℃)で、生成する低級アルコールを反応系外へ除去しながら液相で通常のエステル交換反応をさせて、シュウ酸アルキルアリールを生成させ、次いで、該シュウ酸アルキルアリールを、前記触媒の存在下、上記と同様の反応温度で、生成するシュウ酸ジアルキルを除去しながら液相で不均化反応させて、シュウ酸ジアリールを生成させて分離・精製し回収するのである。なお、第1工程のエステル交換反応に際しては、反応速度を高くするため、常圧乃至は加圧で行なうことが望ましく、一方、不均化反応に際しては、副生物の生成を防ぐため、減圧とすることが望ましい。ただし、これらのエステル交換反応及び不均化反応における反応圧については特に限定はない。
【0022】
第1工程では、例えば、第1反応蒸留塔及び第2反応蒸留塔を連結させて用いて、前述の通常のエステル交換反応及び不均化反応を順次行う方法により、目的物のシュウ酸ジアリールを連続的に製造することが好ましい。前記の反応蒸留塔としては、多数の棚段を有する蒸留塔からなる反応蒸留塔、又は充填材が内部に充填されている反応蒸留塔であることが好ましく、例えば、理論段数が2段以上、特に5〜100段、更には7〜50段である多段蒸留塔型の反応蒸留塔であることが好ましい。前記の多段蒸留塔型の反応蒸留塔としては、例えば、泡鐘トレイ、多孔板トレイ、バルブトレイなどを用いた棚段式蒸留塔形式のもの、或いは、ラシヒリング、レッシングリング、ポールリングなどの各種の充填材を充填した充填式蒸留塔形式のものを使用することができ、更に、棚段式及び充填式を併せ持つ形式の反応蒸留塔であってもよい。
【0023】
即ち、第1工程における具体例としては、シュウ酸ジアルキル、フェノール化合物及びエステル交換触媒を第1反応蒸留塔へ供給し、副生する低級アルコール(蒸気)を蒸留操作により蒸留してその塔頂部から抜き出して反応系外へ除去しながら、エステル交換触媒の存在下にシュウ酸ジアルキルとフェノール化合物との通常のエステル交換反応を主体とする反応を行わせてシュウ酸アルキルアリールを主に生成させ、次いで、第1反応蒸留塔の底部の反応液(缶液:シュウ酸アルキルアリールを含有する)を抜き出して第2反応蒸留塔へ供給して、副生するシュウ酸ジアルキルやフェノール化合物(蒸気)を蒸留操作によって蒸留してその塔頂部から抜き出して除去しながら、同様の触媒の存在下にシュウ酸アルキルアリールの不均化反応を主体とする反応を行わせて、シュウ酸ジアリールを生成させ、最後に、第2反応蒸留塔の底部からその反応液(缶液:シュウ酸ジアリールを含有する)を抜き出して、エステル交換触媒を分離した後に、或いは、該触媒を含有したままで、その反応液を蒸留操作などして第1工程の目的物であるシュウ酸ジアリールを得ることが好ましい。
【0024】
第1工程で使用するエステル交換反応用の触媒としては、例えば、カドミウム化合物、ジルコニウム化合物、鉛化合物、鉄化合物、銅族金属の化合物、亜鉛化合物、有機スズ化合物、アルミニウムのルイス酸化合物、チタンのルイス酸化合物、及び、バナジウムのルイス酸化合物から選ばれた少なくとも一種の可溶性のエステル交換触媒であることが好ましい。本発明では、前記のエステル交換反応用の触媒としては、特に、ジルコニウム化合物、有機スズ化合物、チタンのルイス酸化合物が好ましく、なかでも、有機スズ化合物、或いはチタンのルイス酸化合物が最適である。
【0025】
第1工程で使用されるシュウ酸ジアルキルとフェノール化合物との使用量の割合は、触媒の種類や反応条件によって異なるが、例えば、フェノール化合物が、供給原料中のシュウ酸ジアルキルに対して0.01〜1000倍モル、特に0.1〜100倍モル、更には0.5〜20倍モル程度であることが好ましい。また、第1工程で使用されるエステル交換反応用の触媒の使用量は、特に限定されるものではなく、種々の反応条件によって異なるけれども、シュウ酸ジアルキルとフェノール化合物の合計量に対する割合で表して、約0.0001〜50重量%、特に約0.001〜30重量%程度であることが好ましい。
【0026】
第1の発明における第2工程は、概略、第1工程で得られたシュウ酸ジアリールを、有機リン系化合物などからなるリン化合物系触媒の存在下に、脱CO反応させて、炭酸ジアリールと副生物の一酸化炭素を生成させ、その反応混合液から炭酸ジアリールを分離・精製し回収すると共に、副生した一酸化炭素の気体を反応系外へ排出することによって実施されるのである。
【0027】
リン化合物系触媒としてはホスフィン系化合物〔P(R1)(R2)(R3)〕、ホスフィンオキシド系化合物〔O=P(R4)(R5)(R6)〕、ホスフィンジハライド系化合物〔(Y1)(Y2)P(R7)(R8)(R9)〕およびホスホニウム塩系化合物[(R10)(R11)(R12)P R13・X - 〕から選択された少なくとも一種の有機リン系化合物を好適に挙げることができる。
なお、上記の化学式において、R1〜R13は、水素原子、炭素原子数1〜16のアルキル基、炭素原子数6〜20のアリール基、および炭素原子数7〜25のアラルキル基から選ばれた少なくとも一種の置換基を示し、Xは対イオンを形成しうる原子又は原子団を示し、Y1およびY2は独立して、塩素原子、臭素原子、ヨウ素原子などのハロゲン原子をそれぞれ示す。上記の化学式で示される有機リン化合物は、少なくとも一つが水素原子以外の前述の置換基を有している。この有機リン系化合物では、それぞれが有する各置換基(R1〜R13)の全てがアリール基(特にフェニル基)であることが好ましいが、前記の有機リン系化合物の置換基の1〜2個がアリール基(特にフェニル基)であって、残部の置換基がアルキル基又はアラルキル基であってもよい。
【0028】
第2工程における脱CO反応を実施するための具体例としては、シュウ酸ジアリールを、必要であれば有機リン系化合物を主成分とする触媒と共に脱CO反応装置に供給して、反応温度100〜450℃(特に160〜400℃、更には180〜350℃)および反応圧10mmHg〜10kg/cm2の反応条件で、副生する一酸化炭素ガスを除去しながら、シュウ酸ジアリールを脱CO反応させることによって、炭酸ジアリールを生成させることが好ましい。
【0029】
第2工程における脱CO反応装置は、シュウ酸ジアリールを、必要であれば脱CO触媒の存在下に、脱CO反応させて、COガスと共に炭酸ジアリールを生成させることができれば、どのような形式の反応装置であっても使用することができる。その第2工程の反応装置(反応器)としては、例えば、一槽又は多槽式の完全混合型反応器(攪拌槽)、多管式熱交換式の管型反応器、塔型反応器などを挙げることができる。
【0030】
第2工程における脱CO反応で得られる反応液には、第2工程の目的物である炭酸ジアリールと共に未反応のシュウ酸ジアリールや脱CO触媒が含有されているので、この反応液から炭酸ジアリールを分離し精製して回収するには、濃縮缶、薄膜蒸発器などの蒸発装置で触媒をまず分離し、充填式蒸留塔、棚段式蒸留塔などの蒸留装置を用いて蒸留する一般的な方法を用いることが好ましく、そのような蒸留精製によって純度の高い炭酸ジアリールを得ることができる。
【0031】
第2工程における脱CO反応において使用される触媒は、有機リン系化合物単独であっても、また、二種以上の混合物であってもよい。また、その触媒はこの反応液中に均一に溶解および/または懸濁されていてもよい。第2工程において使用される触媒の使用量は、シュウ酸ジアリールに対して0.001〜50モル%(特に0.01〜20モル%)であることが好ましい。
【0032】
第3工程では、第1工程および第2工程によって得られた炭酸ジアリールと多価ヒドロキシ化合物を縮重合反応させて、副生物であるフェノール化合物を分離し除去して回収しながら、ポリカーボネートを生成させるのである。この多価ヒドロキシ化合物は、芳香族系化合物の芳香環に複数(特に2個)のヒドロキシル基が直接に結合している芳香族系多価ヒドロキシ化合物を主成分とするものである。多価ヒドロキシ化合物は、全て2価の芳香族系ヒドロキシ化合物であるか、或いは、2価の芳香族系ヒドロキシ化合物を60モル%以上(特に80モル%以上)の割合で含有しているものであってもよい。
【0033】
前記の多価ヒドロキシ化合物としては、ビス(4−ヒドロキシフェニル)メタン、1,1−ビス(4−ヒドロキシフェニル)エタン、2,2−ビス(4−ヒドロキシフェニル)プロパン、2,2−ビス(4−ヒドロキシフェニル)ブタン、2,2−ビス(4−ヒドロキシ−2−メチルフェニル)プロパンなどのビス(ヒドロキシアリール)アルカン、4,4’−ジヒドロキシジフェニルエーテル、4,4’−ジヒドロキシ−3,3’−ジメチルジフェニルエーテルなどのジヒドロキシジアリールエーテルなどを挙げることができ、特に、2,2−ビス(4−ヒドロキシフェニル)プロパンが80〜100モル%の割合で配合されている多価ヒドロキシ化合物が好適である。
【0034】
前記の炭酸ジアリールとしては、例えば、炭酸ジフェニル、炭酸ジトリル、炭酸ジ(p−クロロフェニル)、炭酸ジ(m−クレジル)などを挙げることができる。これらの炭酸ジアリールの中では、炭素数が13〜20である炭酸ジアリールが好ましく、特に炭酸ジフェニルが最適である。
【0035】
第3工程において、ポリカーボネートを製造する場合に、上記のような炭酸ジアリールは、多価ヒドロキシ化合物(2価のヒドロキシ化合物、特に2価の芳香族ヒドロキシ化合物)1モルに対して、1.001〜1.5モル、特に1.01〜1.3モルの量で用いられることが好ましい。また、第3工程において、前記の炭酸ジアリールと多価ヒドロキシ化合物の他に、適当な重合度調節剤、末端変性剤、モノフェノール類などが併用されていてもよい。
【0036】
第3工程においては、炭酸ジアリールと多価ヒドロキシ化合物とを、メチルアミンもしくはエチルアミンである一級アミン、ジメチルアミンもしくはジエチルアミンである二級アミン、あるいは炭素原子数が1〜3のアルキル基を有する三級アミン又はアンモニウム化合物を含む縮重合触媒の存在下において、約80〜350℃の温度で、副生するフェノール化合物を蒸発させ除去しながら、そして、次第に重合温度を上昇させ減圧度を高めながら、1段又は2段以上で溶融縮重合してポリカーボネートを製造することが好ましい。
【0037】
前記の縮重合触媒としては、特に、テトラ置換アンモニウムヒドロキシド、或いは、メチルアミンもしくはエチルアミンである一級アミン、ジメチルアミンもしくはジエチルアミンである二級アミン、あるいは炭素原子数が1〜3のアルキル基を有する三級アミンなどのアンモニウム化合物が含有されている塩基性触媒(例えば、アルカリ金属又はアルカリ土類金属の有機酸塩、無機酸塩、水酸化物、水素化物、アルコラートなどの少なくとも一種と、アミン化合物、アンモニウム化合物などの少なくとも一種とを含む触媒)を好適に挙げることができる。縮重合触媒としては、特に、アルカリ金属の無機酸塩、有機酸塩、水酸化物、水素化物、アルコラートなどのアルカリ金属系触媒成分と、前記アミン化合物又はアンモニウム化合物とが併用されている塩基性触媒が最適である。塩基性触媒の使用量は、縮重合反応に用いる多価ヒドロキシ化合物1モルに対して10-5〜10-4モルであることが好ましい。なお、アルカリ金属又はアルカリ土類金属系触媒成分は、多価ヒドロキシ化合物1モルに対して10-7〜10-4モル、前記のアミン化合物又はアンモニウム化合物は、多価ヒドロキシ化合物1モルに対して10-5〜10-4モル使用することが好ましい。
【0038】
第3工程の縮重合反応は、従来知られているポリカーボネートの製法における縮重合反応条件(特に溶融縮重合反応)と同様な条件下で行うことができるが、具体例として、例えば、第1段目の縮重合反応で、多価ヒドロキシ化合物と炭酸ジアリールとの縮重合反応を80〜240℃の温度で、0.01〜5時間、常圧附近又は減圧下で行ない、次いで、第2段目の縮重合反応において、重合温度および減圧度を更に高めて(最終的に1mmHg以下の減圧下となるように)、240〜320℃の温度で行うことが好ましい。
【0039】
前記の縮重合触媒に含まれるアミン化合物としては、例えばトリメチルアミン、トリエチルアミンなどの三級アミン、ジメチルアミン、ジエチルアミンなどの二級アミン、メチルアミン、エチルアミンなどの一級アミンを挙げることができる。縮重合触媒に含まれるアミン化合物としては、炭素原子数1〜3(特に1〜2)のアルキル基を有する三級アミン(トリアルキルアミン)が好ましい。
【0040】
前記の縮重合触媒に含まれるアンモニウム化合物としては、例えば、アルキル基を有するアンモニウムヒドロキシド類(例えば、テトラメチルアンモニウムヒドロキシド、テトラエチルアンモニウムヒドロキシド等のテトラ置換アンモニウムヒドロキシド)、テトラメチルアンモニウムボロハイドライド等のテトラ置換アンモニウムボロハイドライド)などを挙げることができる。縮重合触媒に含まれるアンモニウム化合物としては、炭素原子数1〜3(特に1〜2)のアルキル基を有するテトラ−N−アルキル置換アンモニウムヒドロキシドが特に好ましい。
【0041】
縮重合触媒において、前記アミン化合物又はアンモニウム化合物と併用されうるアルカリ金属系触媒成分としては、水酸化ナトリウム、水酸化カリウム、水酸化リチウムなどのアルカリ金属の水酸化物、炭酸水素ナトリウム、炭酸水素カリウム、炭酸水素リチウム、炭酸ナトリウム、炭酸カリウム、炭酸リチウム、リン酸二水素ナトリウム、リン酸二水素カリウム、リン酸二水素リチウム、亜リン酸二水素ナトリウム、亜リン酸二水素カリウム、リン酸水素二カリウム、リン酸水素二リチウムなどのアルカリ金属の無機酸塩、酢酸ナトリウム、酢酸カリウム、酢酸リチウム、ステアリン酸ナトリウム、安息香酸ナトリウムなどのアルカリ金属の有機酸塩などを好適に挙げることができる。また、アルカリ土類金属系触媒成分として、これらアルカリ金属化合物に対応する、マグネシウム、カルシウム、バリウム等のアルカリ土類金属の化合物が好適に挙げられる。
【0042】
前記の縮重合反応は連続式で行なっても、バッチ式で行なってもよく、また、上記の縮重合反応に用いられる重合装置は、槽型反応装置であっても、管状反応装置(特に第2段目の縮重合反応ではセルフクリーニング型反応装置がよい)であっても、塔型反応装置であってもよい。
【0043】
第4工程では、前記の第3工程の縮重合反応において蒸発・分離され除去された回収フェノール化合物を、例えば、精製装置(蒸発装置、蒸留装置など)によって精製して、前記第3工程の縮重合反応に由来する不純物であるアミン化合物の含有率が100ppm以下である精製フェノール化合物を得る。なお、精製フェノール化合物中の不純物の含有率は重量基準(即ち、重量ppm)である。
【0044】
回収フェノール化合物の精製方法としては、例えば、通常用いられる充填塔や棚段塔などの蒸留装置を用いて蒸留により精製することが好ましく、特に回収フェノール化合物に含まれる縮重合反応に由来する不純物がフェノール化合物(特にフェノール)に対し低沸点のもののみである場合は、前記の蒸留装置の塔頂より低沸分を抜出しながら塔底またはサイドカットにより高純度の精製フェノール化合物を取り出すことが好ましく、また、フェノール化合物(特にフェノール)より高沸点の不純物が含まれる場合には、塔頂より高純度の精製フェノール化合物を取り出し、塔底に濃縮される高沸点不純物は適宜抜出されることが好ましい。
【0045】
また、低沸点不純物と高沸点不純物の両方が含まれる場合は、塔頂より低沸点不純物を、塔底より高沸点不純物を抜出して除去し、連続で行なう場合は、サイドカットにより高純度の精製フェノール化合物を取り出すことが好ましい。
【0046】
前述の第3工程における縮重合反応に由来する不純物であるアミン化合物としては、一般式R3N(Rは炭素原子数が1〜3のアルキル基である)で示されるトリ置換体の三級アミン(例えば、トリメチルアミン、トリエチルアミンなど)を挙げることができる。縮重合触媒として前記の特に好ましいトリアルキルアミンやテトラ−N−アルキル置換アンモニウムヒドロキシドを用いる場合、縮重合反応に由来する不純物であるアミン化合物としては、トリ置換体のアミン化合物の中でもフェノール化合物より低沸点のアミン化合物が特に挙げられる。
【0047】
また、本発明では、アニソールやフェニルエーテル等のエーテル化合物が生成して縮重合反応で得られる回収フェノール化合物に含まれることがあるため、アミン化合物と共に、エーテル化合物も回収フェノール化合物から抜き出して除去することが好ましい。このエーテル化合物は、シュウ酸ジアリール製造のエステル交換反応自体には直接的に影響しないが、例えば、シュウ酸ジメチルを原料として用いる場合にはアニソールなどがエステル交換反応系内に蓄積してしまい、前述のエステル交換反応(第1工程)に支障をきたすこともある。
【0048】
即ち、縮重合反応の回収フェノールがアニソールをかなり含有する場合には、エステル交換反応液の蒸留によって系外にアニソールを除去しようとしても、アニソールと未反応のシュウ酸ジメチルの沸点が近いために、エステル交換反応の原料として再利用できるような、アニソールが完全に除去された高い純度のシュウ酸ジメチルを回収することが困難であり、例えば、回収シュウ酸ジメチルの蒸留・精製において多大のエネルギーを要するか、または、ある程度、アニソールにシュウ酸ジメチルを同伴させてアニソールを反応系から完全に除去するというシュウ酸ジメチルのロスを許容しなくてはならない。
【0049】
また、ポリカーボネート製造の縮重合反応に由来する不純物であるジフェニルエーテルやフェニルブチルエーテル、フェネトール等については、第1工程の目的物であるシュウ酸ジアリール自体が、かなりの高沸点であるために、原料のシュウ酸ジメチルと製品のシュウ酸ジアリールとの中間の沸点を有しており、特に連続的なリサイクルプロセスである場合には次第にエステル交換反応系内に蓄積していくことになる。
【0050】
前述の第3工程における縮重合反応に由来する不純物であるエーテル化合物としては、一般式ArOR(Arは、置換基を有してもよいフェニル基などのアリール基を示し、Rはアルキル基、アリール基、アラルキル基などである。)で示されるフェニルエーテル化合物、例えば、アニソール、エチルフェニルエーテル、プロピルフェニルエーテル、ブチルフェニルエーテルなどのアルキルフェニルエーテル、ジフェニルエーテル、ジフェニルエーテル、メチルフェニルフェニルエーテル、フェノキシフェノールなどのジアリールエーテル、ベンジルフェニルエーテル、ジメチルベンジルエーテルなどを挙げることができる。エーテル化合物は前記の回収フェノール化合物の精製方法により、不純物であるアミン化合物と共に除去される。
【0051】
前記の第4工程で得られて、第1工程のエステル交換反応に使用される精製フェノール化合物は、前記の縮重合反応に由来する不純物であるフェノール化合物より低沸点の炭素原子数が1〜3のアルキル基を有するアミン化合物及びエーテル化合物(特にフェニルエーテル化合物)の含有率がそれぞれ100ppm以下及び600ppm以下である高い純度の精製フェノール化合物であることが更に好ましい。
【0052】
そして、前記のように縮重合反応に由来する不純物が少ない精製フェノール化合物は、第1工程のエステル交換反応におけるフェノール化合物の全使用量に対して、精製フェノール化合物が約20〜100重量%、特に約50〜90重量%の割合となるような供給量にて、適当な輸送手段(例えば、精製フェノール化合物の中継タンク、輸送ポンプ、第4工程と第1工程を連結する配管など)によって、第1工程のエステル交換反応用の反応装置(例えば、反応蒸留塔)へ、断続的又は連続的に供給して、第1工程のエステル交換反応に循環・使用することが好ましい。
【0053】
本願の第2の発明では、第1工程で、ポリカーボネート製造の縮重合反応における回収フェノール化合物(特にフェノール)を精製して得られた、縮重合反応に由来する不純物であるトリアルキルアミンなどの、フェノール化合物より低沸点の炭素原子数が1〜3のアルキル基を有するアミン化合物の含有率が100ppm以下である精製フェノール化合物(特に精製フェノール)と、シュウ酸ジアルキル(特にシュウ酸ジメチル)とをエステル交換反応させてシュウ酸ジアリール(特にシュウ酸ジフェニル)を合成し、次いで、第2工程で、エステル交換反応で得られたシュウ酸ジアリールを脱CO反応させて炭酸ジアリール(特に炭酸ジフェニル)を合成し、更に第3工程で、前記の脱CO反応で得られた炭酸ジアリール(特に炭酸ジフェニル)を多価ヒドロキシ化合物(特にビスフェノールA)と縮重合反応させてポリカーボネートを製造する。
【0054】
本願の第2の発明においては、第1工程(エステル交換反応)、第2工程(脱CO)及び第3工程(縮重合反応)における各反応の条件などは、前述したように、本願の第1の発明における各反応条件における反応条件などをそのまま採用することができる。なお、本願の第1及び第2の発明では、精製フェノール化合物中の不純物である前記アミン化合物の含有率は、精製効率(フェノール化合物のロス、精製エネルギー、精製装置など)の面も併せて考慮すれば、0.02〜100ppmであることが特に好ましい。エーテル化合物についても同様に0.02〜100ppmであることが特に好ましい。
【0055】
本発明の製造法では、縮重合反応に由来する不純物が極めて少ない精製フェノール化合物(縮重合反応の回収フェノール化合物の精製品)を含むフェノール化合物とシュウ酸ジアルキルとを用いて、前述の第1工程及び第2工程からなる非ホスゲン法である新しい合成法で得られた、高い純度のジアリールカーボネート(特に、ジフェニルカーボネート)を使用しており、そして、該ジアリールカーボネートと多価ヒドロキシ化合物との縮重合反応(特に溶融縮重合反応)によって、高いレベルの分子量(約10000〜80000、特に15000〜60000)を有すると共に、着色がほとんど無い優れた性能のポリカーボネートを容易に製造することができるという工業的に有用なプロセスであることに特長がある。
【0056】
【実施例】
[実施例1]
〔第1工程:ジフェニルオキサレートの製造〕
図1に示すような製造プロセスを使用し、まず、ジメチルオキサレート(DMO:シュウ酸ジメチル)を用いて、以下のように反応させてジフェニルオキサレート(DPO:シュウ酸ジフェニル)を合成した。
【0057】
1リットル容量のボトムフラスコを備えた、内径32mm、50段のオールダーショー(第一反応蒸留塔)の上から12段目に、フェノール(PhOH)54.1重量%、ジメチルオキサレート45.3重量%、テトラフェノキシチタン(TPT)0.5重量%を含有する混合液を600mL/hで供給すると共に、ボトムフラスコをマントルヒーターで190℃に加熱し、塔頂部からの蒸気を冷却器で凝縮して、還流比を2として抜出しながら、反応(通常のエステル交換反応)を行った。
【0058】
第一反応蒸留塔の状態が安定した時点で(供給を開始してから4時間後)、塔底液の組成は、ジフェニルオキサレート6.23重量%、メチルフェニルオキサレート(MPO:シュウ酸メチルフェニル)29.95重量%、ジメチルオキサレート23.88重量%、フェノール39.41重量%であり、その抜出し量は約603g/hであった。また、このとき、塔頂からは、メタノール99.7重量%、ジメチルオキサレート0.3重量%の組成の凝縮液を約44g/hで抜出した。
【0059】
このエステル交換反応の塔底液を、前記と同様の形式のオールダーショー(第2反応蒸留塔)の上から12段目に、200mmHgの減圧下、600mL/hで供給するとともにボトムフラスコをマントルヒーターで200℃に加熱し、塔頂部からの蒸気を冷却器で凝縮して、還流することなく抜出しながら、反応(不均化反応)を行った。
【0060】
第2反応蒸留塔の状態が安定した時点で(供給を開始して4時間後)、塔底液(缶液)の組成は、ジフェニルオキサレート65.27重量%、メチルフェニルオキサレート18.43重量%、ジメチルオキサレート1.02重量%、フェノール13.93重量%であり、その抜出し量は約268g/hであった。また、このとき塔頂からは、メタノール1.57重量%、ジメチルオキサレート46.53重量%、フェノール48.51重量%、メチルフェニルオキサレート2.97重量%、ジフェニルオキサレート0.42重量%の組成の凝縮液を約371g/hで抜出した。
【0061】
この不均化反応の塔底液(缶液)を、伝熱面積0.1m2の回転式薄膜蒸発器に、15mmHgの減圧下、200mL/hにて供給するとともに、蒸発器を熱媒で200℃に加熱して、ジメチルオキサレート、フェノール、メチルフェニルオキサレートおよびジフェニルオキサレートを連続で蒸発させた。得られた蒸気を、5×5mmのヘリパックを充填した、内径30mm,長さ2mのガラス製の蒸留塔の上から80cmの位置に供給して、連続的に蒸留を行った。
【0062】
そして、蒸留塔の塔頂部から、ジメチルオキサレート3.05重量%、フェノール41.73重量%、メチルフェニルオキサレート55.21重量%の組成の凝縮液を約68mL/hで抜出し、塔底液を約120g/hで抜出した。さらにこの塔底液を、同様の蒸留塔(30φ×2mガラス製充填塔、5×5mmヘリパック)で蒸留して、フェノール0.02重量%、メチルフェニルオキサレート0.01重量%を含む純度99.95重量%のジフェニルオキサレートを約120g/hで得た。また、蒸発器の底部からは約1.1重量%(金属換算)のチタンを含む液を約23g/hで抜出した。
【0063】
〔第2工程:ジフェニルカーボネートの製造〕
前述の反応で得られたジフェニルオキサレートを用いて、以下のようにジフェニルカーボネート(DPC:炭酸ジフェニル)を製造した。ジフェニルオキサレートにテトラフェニルホスホニウムクロライドを1モル%加え、150℃に加熱して溶解した。この液を、温度計、攪拌機及びオーバーフロー管を備えた内容積1リットルのガラス製反応器2個を直列に連結した反応器に、定量ポンプを用いて300mL/hにて供給すると共に、2個の反応器をマントルヒーターで加熱して230℃に保持してジフェニルオキサレートの脱CO反応を行なった。
【0064】
なお、各反応器のオーバーフロー位置は600mLとした。原料の供給開始から20時間後における、第2反応器のオーバーフロー液(脱CO反応の反応液)の組成は、ジフェニルオキサレート14.6重量%、ジフェニルカーボネート84.0重量%、フェノール0.08重量%であり、その抜出し量は約270mL/hであった。また、各反応器から発生するガスの組成は一酸化炭素約100%であり、その一酸化炭素の回収量の合計は25リットル(標準状態)/hであった。
【0065】
この脱CO反応の反応液を第1工程の反応液の分離・精製と同様の回転式薄膜式蒸発器(ガラス製、可動部ハステロイCR)に20mmHgの減圧下、250mL/hで供給すると共に、該蒸発器を熱媒で200℃に加熱して、テトラフェニルホスホニウムクロライドを分離した。得られた留出液(組成:ジフェニルカーボネート92.2重量%、ジフェニルオキサレート7.7重量%)を、第1工程の反応液の分離・精製と同様のガラス製蒸留塔に供給して連続的に蒸留し(塔頂圧力:20トール,還流比:5)、純度99.9%のジフェニルカーボネートを約220mL/hで得た。
【0066】
〔第3工程:ポリカーボネートの製造〕
ビスフェノールA400gを、トルエン800mLおよびエタノール36mL(容量比:22/1)の混合溶媒から再結晶して、ビスフェノールAの精製品を得た。ジフェニルカーボネートは前記のようにして得られたものをそのまま使用した。
【0067】
ステンレス製(SUS316L製)の100mL反応器に、ビスフェノールA(精製品)22.85g(0.1モル)、ジフェニルカーボネート22.68g(0.106モル)、及び触媒としてリン酸二水素ナトリウム20mgおよびテトラメチルアンモニウムヒドロキシド5mgを加えて、室温で反応器内の真空脱気を0.5時間行い、次いで窒素ガスを導入して反応系を常圧に戻した後、反応器を加熱して縮重合反応を行わせた。
【0068】
すなわち、200℃で10分間、そして230℃で10分間加熱した後、230℃で減圧を始め、230℃、100mmHgでフェノールの留出が始まって1時間、次いで、240℃、100mmHgで0.5時間反応させ、更に255℃において、100mmHgで10分間維持し、そして100mmHgから50mmHgまで15分間で減圧しその状態で15分間維持して反応させ、更に270℃において50mmHgから0.1mmHgまで30分間で減圧しその状態で1時間維持して反応させた。その結果、ポリカーボネート25.43g(収率:100%)を得た。
【0069】
得られたポリカーボネートは、その対数粘度(単位:dl/g,濃度0.5g/100mL、溶媒:CHCl3,測定温度:30℃)が0.497dl/gであり、その重量平均分子量(ポリスチレン換算法)が53,000であった。また、ポリカーボネートは目視によりほぼ無色透明であった。
【0070】
上記の縮重合反応において、合計で17.6mLのフェノールが回収された。その回収フェノールをガスクロマトグラフィーにより分析したところ、トリメチルアミンが150ppm、アニソールが280ppm含まれていることが判った。
この回収フェノールを、第2工程の精製で使用したガラス製蒸留装置を用い、200mmHgの減圧下、還流比を2として蒸留し、回収フェノールの3%を塔頂留出分として除去して精製フェノールを得た。この精製フェノールを同様に分析したところ、トリメチルアミンが2ppm、アニソールが5ppmであった。
【0071】
この精製フェノールをそのまま前述の第1工程の第1反応蒸留塔へ供給して他の新鮮なフェノールとともに使用したが、新鮮なフェノールのみを使用した場合と全く同様にジフェニルオキサレートの製造を行うことができた。
【0072】
[比較例1]
フィード液(フェノール:54.1重量%,DMO:45.3重量%,TPT:0.5重量%)中に、トリメチルアミンが270ppm(精製フェノール基準で555ppm)含まれているものを使用して、実施例1と同様にジフェニルオキサレートの製造を行った。
【0073】
第一反応蒸留塔の状態が安定した時点で(供給を開始して4時間後)、塔底液の組成はジフェニルオキサレート6.05重量%,メチルフェニルオキサレート27.21重量%,ジメチルオキサレート25.07重量%,フェノール41.13重量%であり、その抜出し量は約608g/hであった。また、この時、塔頂からは、メタノール99.7重量%,ジメチルオキサレート0.3重量%の組成の凝縮液を約39g/hで抜出した。
【0074】
[実施例2〜3及び比較例2]
不純物として含まれるアミン化合物の量・種類を変えて上記の実施例1と同様の実験を行った。なお、アミン化合物がトリエチルアミンの場合、テトラメチルアンモニウムヒドロキシドをテトラエチルアンモニウムヒドロキシドに代えて縮重合反応を行った。
【0075】
【表1】
【0076】
[比較例3]
フィード液(フェノール:54.1重量%,DMO:45.3重量%,TPT:0.5重量%)中に、トリメチルアミンが1000ppm(精製フェノール基準で2000ppm)含まれているものを使用して、実施例1と同様にジフェニルオキサレートの製造を行った。
【0077】
第一反応蒸留塔の状態が安定した時点で(供給を開始して4時間後)、塔底液の組成はジフェニルオキサレート4.21重量%、メチルフェニルオキサレート23.42重量%、ジメチルオキサレート28.43重量%、そしてフェノール43.39重量%であり、その抜出し量は約613g/hであった。また、この時、塔頂からは、メタノール99.7重量%とジメチルオキサレート0.3重量%の組成の凝縮液を約34g/hで抜出した。
【0078】
[比較例4]
フィールドする混合液中にトリメチルアミンが350ppm(精製フェノール基準で700ppm)含まれているものを使用して、比較例1と同様にジフェニルオキサレートの製造を行った。
【0079】
第一反応蒸留塔の状態が安定した時点で(供給を開始して4時間後)、塔底液の組成はジフェニルオキサレート4.21重量%、メチルフェニルオキサレート23.82重量%、ジメチルオキサレート28.30重量%、フェノール43.10重量%であり、その抜き出し量は約612g/hであった。塔頂からは、メタノール99.7重量%、ジメチルオキサレート0.3重量%の組成の凝縮液を約35g/hで抜き出した。
【0080】
[実施例4]
実施例1と同じであるが、第1反応蒸留塔と第2反応蒸留塔を連結して、連続リサイクル系としてジフェニルオキサレートの製造を行った。
【0081】
1リットル容量のボトムフラスコを備えた、内径32mm、50段のオールダーショー(第1反応蒸留塔)の上から12段目に、フェノール54.1重量%、ジメチルオキサレート45.3重量%、テトラフェノキシチタン0.5重量%を含有する混合液を600mL/hで供給すると共に、ボトムフラスコをマントルヒーターで190℃に加熱し、塔頂部からの蒸気を冷却器で凝縮して還流比2で抜出しながら、反応(エステル交換反応)を行った。
【0082】
第1反応蒸留塔の状態が安定した時点で(供給を開始して4時間後)塔底液の組成は、ジフェニルオキサレート6.19重量%、メチルフェニルオキサレート(MPO)30.02重量%、ジメチルオキサレート25.74重量%、そしてフェノール37.38重量%であり、その抜出し量は約603g/hであった。また、この時、塔頂からは、メタノール99.7重量%そしてジメチルオキサレート0.3重量%の組成の凝縮液を約44g/hで抜出した。
【0083】
第1反応蒸留塔のボトム液約603g/hを第1反応蒸留塔と同じ形式のオールダーショー(第2反応蒸留塔)の上から12段目に、200mmHgの減圧下でフィードした。ボトムフラスコをマントルヒーターで200℃に加熱し、塔頂部からの蒸気を冷却器で凝縮して、還流することなく抜き出しながら、反応(不均化反応)を行った。第2反応蒸留塔の状態が安定した時点で(供給を開始して4時間後)、塔底液(缶液)の組成は、ジフェニルオキサレート65.13重量%、メチルフェニルオキサレート18.39重量%、ジメチルオキサレート1.21重量%、フェノール13.18重量%であり、その抜出し量は213g/hであった。
【0084】
また、この時、塔頂からは、メタノール1.57重量%、ジメチルオキサレート41.81重量%、フェノール53.23重量%、メチルフェニルオキサレート2.95重量%、ジフェニルオキサレート0.43重量%の組成の凝縮液を約390g/hで抜出した。
【0085】
第2反応蒸留塔の塔頂液は、一旦3Lガラス容器に溜めて、第2反応蒸留塔から抜出される量(約390g/h)に見合う量を第一反応蒸留塔の原料フィード位置(上から12段目)に連続でリサイクルを行った。このフィードを開始した時点から、第1反応蒸留塔にフィードしていた原料(DMO:45.3重量%、フェノール:54.1重量%、TPT:0.5重量%,約600mL/h)のフィードをリサイクルでフィードされるジメチルオキサレートとフェノール分を減じた量に変更して、反応を継続した。
【0086】
第2反応蒸留塔の塔底液は、伝熱面積0.1m2の回転式薄膜式蒸発器に、15mmHgの減圧下、200mL/hで供給するとともに、蒸発器を熱媒で200℃に加熱して、ジメチルオキサレート、フェノール、メチルフェニルオキサレート及びジフェニルオキサレートを連続で蒸発させた。
【0087】
得られた蒸気を、5×5mmのヘリパックを充填した、内径30mm、長さ2mのガラス製の蒸留塔(MPO回収塔)の上から80cmの位置に供給して、連続的に蒸留を行なった。そして、蒸留塔の塔頂部から、ジメチルオキサレート3.05重量%、フェノール41.73重量%、メチルフェニルオキサレート55.21重量%の組成の凝縮液を約68mL/hで抜出し、塔底液を約120g/h(DPO:99.9重量%の速度で抜出した。塔頂部から抜出された液は、一旦3Lガラス容器に溜め、塔から抜出される量に見合う量を第2反応蒸留塔の上から30段目に連続でフィードした。塔底液はMPO回収塔と同様の蒸留塔で蒸留を行い、フェノール0.02重量%、メチルフェニルオキサレート0.01重量%を含む純度99.95重量%のジフェニルオキサレートを約120g/hで得た。
【0088】
蒸発器の底部からは約1.1重量%(金属換算)のチタンを含む液を約23g/hで抜出し、第一反応蒸留塔の原料フィード位置に循環させた。触媒のリサイクルを開始した時点から原料を触媒の含まないものに変更した。そして、実施例1と同様に、第2工程及び第3工程を行うと共に、回収フェノールを精製してその精製フェノール(トリメチルアミン2ppm、アニソール5ppmを含む)を第1工程の第1反応蒸留塔に供給した。
【0089】
エステル交換反応、不均化反応に伴い少量の高沸不純物の副生が見られたが、触媒回収液(薄膜蒸発器缶液)中の不純物濃度が50重量%以上にならないように、触媒回収液の一部をパージした。パージする際に、パージ液に含まれる触媒に見合う量だけ、原料中に触媒を添加して補給した。このリサイクルプロセスを連続で100時間行ったが、反応率および各部の液組成に変動なく安定してジフェニルオキサレートの製造を実施することができた。
【0090】
【発明の効果】
本発明は、シュウ酸ジアルキルとフェノール化合物とをエステル交換反応させてシュウ酸ジアリールを合成し、次いでシュウ酸ジアリールを脱CO反応させて炭酸ジアリールを合成し、更に、その炭酸ジアリールと多価ヒドロキシ化合物とを特定の縮重合触媒の存在下に縮重合反応させてポリカーボネートを製造すると共に、一方で縮重合反応で副生するフェノール化合物を分離・除去して得られる回収フェノール化合物を充分に精製して、他の不純物(沸点がフェノール化合物よりも低いアミン化合物)が特定の低い含有率となっている精製フェノール化合物を得て、前述のエステル交換反応の原料として循環・使用するというポリカーボネートの製造法であり、ポリカーボネート製造の縮重合反応において副生したフェノール化合物をシュウ酸ジアリールの合成において再使用することができる工業的に優れたポリカーボネートの製造プロセスである。
【図面の簡単な説明】
【図1】 本発明のポリカーボネート製造法の一例を示すプロセス図である。
Claims (6)
- 第1工程で、シュウ酸ジアルキルとフェノール化合物とをエステル交換反応させてシュウ酸ジアリールを合成し、次いで、第2工程で、前記エステル交換反応で得られたシュウ酸ジアリールを脱CO反応させて炭酸ジアリールを合成し、更に、第3工程で、前記脱CO反応で得られた炭酸ジアリールと多価ヒドロキシ化合物とを、メチルアミンもしくはエチルアミンである一級アミン、ジメチルアミンもしくはジエチルアミンである二級アミン、あるいは炭素原子数が1〜3のアルキル基を有する三級アミン又はアンモニウム化合物を含む縮重合触媒を使用して、副生するフェノール化合物を不純物と共に除去し回収しながら縮重合反応させてポリカーボネートを製造し、一方、第4工程で、前記縮重合反応における回収フェノール化合物を精製して、前記縮重合反応に由来する不純物のフェノール化合物より低沸点であるアミンの含有率が100ppm以下である精製フェノール化合物を得て、これを第1工程のエステル交換反応に循環・使用することを特徴とするポリカーボネートの製造法。
- 第4工程で得られた精製フェノール化合物に、更に、不純物であるエーテル化合物が600ppm以下の含有率で含まれている、請求項1に記載のポリカーボネートの製造法。
- 縮重合触媒が、炭素原子数が1〜3のアルキル基を有する三級アミン又はアンモニウム化合物と、アルカリ金属系触媒成分又はアルカリ土類金属系触媒成分とを含有する触媒である、請求項1に記載のポリカーボネートの製造法。
- フェノール化合物がフェノールである、請求項1に記載のポリカーボネートの製造法。
- 第4工程で得られた回収フェノール化合物の精製を蒸留によって行う、請求項1に記載のポリカーボネートの製造法。
- 第1工程で、ポリカーボネート製造の縮重合反応において副生したフェノール化合物を回収し精製して得られた、縮重合反応に由来する不純物のフェノール化合物より低沸点であるメチルアミンもしくはエチルアミンである一級アミン、ジメチルアミンもしくはジエチルアミンである二級アミン、あるいは炭素原子数が1〜3のアルキル基を有する三級アミンの含有率が100ppm以下である精製フェノール化合物と、シュウ酸ジアルキルとをエステル交換反応させてシュウ酸ジアリールを合成し、次いで、第2工程で、前記エステル交換反応で得られたシュウ酸ジアリールを脱CO反応させて炭酸ジアリールを合成し、更に、第3工程で、前記脱CO反応で得られた炭酸ジアリールと多価ヒドロキシ化合物とを縮重合反応させてポリカーボネートを製造することを特徴とするポリカーボネートの製造法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP5493699 | 1999-03-03 | ||
| JP11-54936 | 1999-03-03 | ||
| PCT/JP2000/001279 WO2000052077A1 (en) | 1999-03-03 | 2000-03-03 | Process for producing polycarbonate |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2000052077A1 JPWO2000052077A1 (ja) | 2002-06-18 |
| JP4284635B2 true JP4284635B2 (ja) | 2009-06-24 |
Family
ID=12984531
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000602698A Expired - Lifetime JP4284635B2 (ja) | 1999-03-03 | 2000-03-03 | ポリカーボネートの製造法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US6740729B1 (ja) |
| EP (1) | EP1081174B1 (ja) |
| JP (1) | JP4284635B2 (ja) |
| KR (1) | KR100613641B1 (ja) |
| CN (1) | CN1163537C (ja) |
| AT (1) | ATE295387T1 (ja) |
| DE (1) | DE60020034T2 (ja) |
| ES (1) | ES2239590T3 (ja) |
| WO (1) | WO2000052077A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4686826B2 (ja) * | 2000-08-04 | 2011-05-25 | 宇部興産株式会社 | ポリカーボネートの製法 |
| DE102005017427A1 (de) * | 2005-04-15 | 2006-10-19 | Zimmer Ag | Verfahren zur Aufbereitung von Kondensaten aus der Polykondensation |
| US7189869B2 (en) * | 2004-11-01 | 2007-03-13 | General Electric Company | Method for making polycarbonate |
| US7183371B2 (en) * | 2004-11-01 | 2007-02-27 | General Electric Company | Method for making polycarbonate |
| US20070208159A1 (en) * | 2006-03-02 | 2007-09-06 | General Electric Company | Poly(arylene ether) block copolymer compositions, methods, and articles |
| WO2011090138A1 (ja) * | 2010-01-20 | 2011-07-28 | 宇部興産株式会社 | シュウ酸ジアリールの製造方法 |
| JP6245097B2 (ja) * | 2014-07-14 | 2017-12-13 | 三菱ケミカル株式会社 | 炭酸ジフェニルの製造方法およびポリカーボネートの製造方法 |
| CN105315445B (zh) * | 2015-11-20 | 2017-06-16 | 宁波浙铁大风化工有限公司 | 一种聚草酸酯合成工艺 |
| CN106117534B (zh) * | 2016-05-19 | 2017-11-17 | 福建盈科百创电子有限公司 | 一种安防用阻燃聚碳酸酯材料及其生产工艺 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH072736A (ja) * | 1993-06-16 | 1995-01-06 | Dainippon Ink & Chem Inc | 二塩基酸エステルの製造方法 |
| TW322471B (ja) * | 1995-04-04 | 1997-12-11 | Ube Industries | |
| US5567829A (en) * | 1995-04-17 | 1996-10-22 | General Electric Company | Method for recovering phenol and xanthene values from waste polycarbonate |
| US5922827A (en) * | 1996-09-27 | 1999-07-13 | Ube Industries, Ltd. | Process for producing a polycarbonate |
| MY115698A (en) * | 1996-10-04 | 2003-08-30 | Ube Industries | Preparation of diaryl carbonate |
| KR100343828B1 (ko) * | 1996-10-04 | 2003-01-24 | 우베 고산 가부시키가이샤 | 디아릴카르보네이트의제조방법 |
-
2000
- 2000-03-03 JP JP2000602698A patent/JP4284635B2/ja not_active Expired - Lifetime
- 2000-03-03 EP EP00906671A patent/EP1081174B1/en not_active Expired - Lifetime
- 2000-03-03 KR KR1020007012264A patent/KR100613641B1/ko not_active Expired - Lifetime
- 2000-03-03 WO PCT/JP2000/001279 patent/WO2000052077A1/ja not_active Ceased
- 2000-03-03 AT AT00906671T patent/ATE295387T1/de not_active IP Right Cessation
- 2000-03-03 CN CNB008007632A patent/CN1163537C/zh not_active Expired - Lifetime
- 2000-03-03 ES ES00906671T patent/ES2239590T3/es not_active Expired - Lifetime
- 2000-03-03 DE DE60020034T patent/DE60020034T2/de not_active Expired - Lifetime
- 2000-03-03 US US09/674,725 patent/US6740729B1/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| US6740729B1 (en) | 2004-05-25 |
| KR100613641B1 (ko) | 2006-08-17 |
| DE60020034T2 (de) | 2006-03-16 |
| CN1163537C (zh) | 2004-08-25 |
| EP1081174A1 (en) | 2001-03-07 |
| CN1302311A (zh) | 2001-07-04 |
| ES2239590T3 (es) | 2005-10-01 |
| EP1081174A4 (en) | 2002-10-30 |
| DE60020034D1 (de) | 2005-06-16 |
| KR20010052304A (ko) | 2001-06-25 |
| EP1081174B1 (en) | 2005-05-11 |
| WO2000052077A1 (en) | 2000-09-08 |
| ATE295387T1 (de) | 2005-05-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9174918B2 (en) | Process for preparing diaryl oxalate | |
| JP4284635B2 (ja) | ポリカーボネートの製造法 | |
| JP3724905B2 (ja) | 芳香族ポリカーボネートの製造方法 | |
| JPWO2000052077A1 (ja) | ポリカーボネートの製造法 | |
| EP0832910B1 (en) | Process for producing a polycarbonate | |
| JP3724724B2 (ja) | 高純度炭酸ジフェニル組成物とポリカーボネートの製法 | |
| JP4686826B2 (ja) | ポリカーボネートの製法 | |
| KR101976886B1 (ko) | 디아릴 카르보네이트의 제조 방법 | |
| EP1178033B1 (en) | Process for the purification of diaryl carbonate and process for the production of polycarbonate | |
| JP3412475B2 (ja) | ポリカーボネートの製法 | |
| JP3412476B2 (ja) | ポリカーボネートの製造法 | |
| KR101980394B1 (ko) | 디아릴 카르보네이트의 제조 방법 | |
| JP2002047251A (ja) | 炭酸ジアリールの精製法及び製法 | |
| JPH09301920A (ja) | シュウ酸ジアリールの製法 | |
| EP2215045B1 (en) | Method of preparing a purified ester-substituted phenol stream |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050908 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080912 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081111 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081205 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090203 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090227 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090312 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120403 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 4284635 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120403 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120403 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130403 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130403 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130403 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140403 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |