JP4222676B2 - オキシ水酸化バナジウム水和物の製造方法 - Google Patents
オキシ水酸化バナジウム水和物の製造方法 Download PDFInfo
- Publication number
- JP4222676B2 JP4222676B2 JP09268399A JP9268399A JP4222676B2 JP 4222676 B2 JP4222676 B2 JP 4222676B2 JP 09268399 A JP09268399 A JP 09268399A JP 9268399 A JP9268399 A JP 9268399A JP 4222676 B2 JP4222676 B2 JP 4222676B2
- Authority
- JP
- Japan
- Prior art keywords
- vanadium
- solution
- aqueous
- hydrate
- ammonia
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- AHXITOFIFGLUQZ-UHFFFAOYSA-N O.O(O)O.[V] Chemical compound O.O(O)O.[V] AHXITOFIFGLUQZ-UHFFFAOYSA-N 0.000 title claims description 54
- 238000004519 manufacturing process Methods 0.000 title claims description 19
- 229910052720 vanadium Inorganic materials 0.000 claims description 63
- LEONUFNNVUYDNQ-UHFFFAOYSA-N vanadium atom Chemical compound [V] LEONUFNNVUYDNQ-UHFFFAOYSA-N 0.000 claims description 63
- 239000000243 solution Substances 0.000 claims description 53
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 claims description 38
- 238000001914 filtration Methods 0.000 claims description 35
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 34
- 238000000034 method Methods 0.000 claims description 27
- 239000007864 aqueous solution Substances 0.000 claims description 25
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 claims description 24
- 238000002485 combustion reaction Methods 0.000 claims description 21
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 claims description 19
- 239000000706 filtrate Substances 0.000 claims description 18
- 239000002994 raw material Substances 0.000 claims description 18
- 239000002244 precipitate Substances 0.000 claims description 17
- 239000004071 soot Substances 0.000 claims description 15
- 229910021529 ammonia Inorganic materials 0.000 claims description 13
- 239000003638 chemical reducing agent Substances 0.000 claims description 13
- UUUGYDOQQLOJQA-UHFFFAOYSA-L vanadyl sulfate Chemical compound [V+2]=O.[O-]S([O-])(=O)=O UUUGYDOQQLOJQA-UHFFFAOYSA-L 0.000 claims description 12
- 229940041260 vanadyl sulfate Drugs 0.000 claims description 12
- 229910000352 vanadyl sulfate Inorganic materials 0.000 claims description 12
- 239000002803 fossil fuel Substances 0.000 claims description 11
- 238000005406 washing Methods 0.000 claims description 11
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 claims description 10
- DKCWBFMZNUOFEM-UHFFFAOYSA-L oxovanadium(2+);sulfate;hydrate Chemical compound O.[V+2]=O.[O-]S([O-])(=O)=O DKCWBFMZNUOFEM-UHFFFAOYSA-L 0.000 claims description 8
- 229910000377 hydrazine sulfate Inorganic materials 0.000 claims description 7
- 239000012493 hydrazine sulfate Substances 0.000 claims description 7
- FUSNOPLQVRUIIM-UHFFFAOYSA-N 4-amino-2-(4,4-dimethyl-2-oxoimidazolidin-1-yl)-n-[3-(trifluoromethyl)phenyl]pyrimidine-5-carboxamide Chemical compound O=C1NC(C)(C)CN1C(N=C1N)=NC=C1C(=O)NC1=CC=CC(C(F)(F)F)=C1 FUSNOPLQVRUIIM-UHFFFAOYSA-N 0.000 claims description 6
- 238000001556 precipitation Methods 0.000 claims description 6
- PQUCIEFHOVEZAU-UHFFFAOYSA-N Diammonium sulfite Chemical compound [NH4+].[NH4+].[O-]S([O-])=O PQUCIEFHOVEZAU-UHFFFAOYSA-N 0.000 claims description 5
- 238000001816 cooling Methods 0.000 claims description 4
- 239000008151 electrolyte solution Substances 0.000 claims description 3
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 17
- 235000011114 ammonium hydroxide Nutrition 0.000 description 16
- 239000007788 liquid Substances 0.000 description 16
- 239000000725 suspension Substances 0.000 description 15
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 12
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 11
- 229910001873 dinitrogen Inorganic materials 0.000 description 11
- 229910021645 metal ion Inorganic materials 0.000 description 11
- 239000000047 product Substances 0.000 description 11
- 229910001456 vanadium ion Inorganic materials 0.000 description 11
- 239000000428 dust Substances 0.000 description 10
- 229910052742 iron Inorganic materials 0.000 description 10
- 238000003756 stirring Methods 0.000 description 10
- GNTDGMZSJNCJKK-UHFFFAOYSA-N divanadium pentaoxide Chemical compound O=[V](=O)O[V](=O)=O GNTDGMZSJNCJKK-UHFFFAOYSA-N 0.000 description 8
- 239000007789 gas Substances 0.000 description 8
- 229910052759 nickel Inorganic materials 0.000 description 8
- 150000003682 vanadium compounds Chemical class 0.000 description 8
- 229910052804 chromium Inorganic materials 0.000 description 7
- 239000011651 chromium Substances 0.000 description 7
- 239000012535 impurity Substances 0.000 description 7
- 229910052751 metal Inorganic materials 0.000 description 7
- 239000002184 metal Substances 0.000 description 7
- 150000002739 metals Chemical class 0.000 description 7
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 239000003792 electrolyte Substances 0.000 description 6
- 239000013078 crystal Substances 0.000 description 5
- BAUYGSIQEAFULO-UHFFFAOYSA-L iron(2+) sulfate (anhydrous) Chemical compound [Fe+2].[O-]S([O-])(=O)=O BAUYGSIQEAFULO-UHFFFAOYSA-L 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 4
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 3
- 239000003929 acidic solution Substances 0.000 description 3
- 239000003513 alkali Substances 0.000 description 3
- 230000000052 comparative effect Effects 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 239000000295 fuel oil Substances 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- -1 vanadyl sulfates Chemical class 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- NNLCYUIKYSRIHF-UHFFFAOYSA-N [V].O(O)O Chemical compound [V].O(O)O NNLCYUIKYSRIHF-UHFFFAOYSA-N 0.000 description 2
- 150000003863 ammonium salts Chemical class 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- UNTBPXHCXVWYOI-UHFFFAOYSA-O azanium;oxido(dioxo)vanadium Chemical compound [NH4+].[O-][V](=O)=O UNTBPXHCXVWYOI-UHFFFAOYSA-O 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 239000011790 ferrous sulphate Substances 0.000 description 2
- 235000003891 ferrous sulphate Nutrition 0.000 description 2
- 239000011261 inert gas Substances 0.000 description 2
- 229910021506 iron(II) hydroxide Inorganic materials 0.000 description 2
- 229910000359 iron(II) sulfate Inorganic materials 0.000 description 2
- NCNCGGDMXMBVIA-UHFFFAOYSA-L iron(ii) hydroxide Chemical compound [OH-].[OH-].[Fe+2] NCNCGGDMXMBVIA-UHFFFAOYSA-L 0.000 description 2
- 239000011259 mixed solution Substances 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L sodium carbonate Substances [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 235000010265 sodium sulphite Nutrition 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229910017741 MH2O Inorganic materials 0.000 description 1
- XJGFPZSLFVYTNQ-UHFFFAOYSA-D O.[V+5].[V+5].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O Chemical compound O.[V+5].[V+5].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O XJGFPZSLFVYTNQ-UHFFFAOYSA-D 0.000 description 1
- VAMDAQWKFUWFEH-UHFFFAOYSA-D S(=O)(=O)([O-])[O-].[V+5].S(O)(O)(=O)=O.S(=O)(=O)([O-])[O-].S(=O)(=O)([O-])[O-].S(=O)(=O)([O-])[O-].S(=O)(=O)([O-])[O-].[V+5] Chemical compound S(=O)(=O)([O-])[O-].[V+5].S(O)(O)(=O)=O.S(=O)(=O)([O-])[O-].S(=O)(=O)([O-])[O-].S(=O)(=O)([O-])[O-].S(=O)(=O)([O-])[O-].[V+5] VAMDAQWKFUWFEH-UHFFFAOYSA-D 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- QKDGGEBMABOMMW-UHFFFAOYSA-I [OH-].[OH-].[OH-].[OH-].[OH-].[V+5] Chemical compound [OH-].[OH-].[OH-].[OH-].[OH-].[V+5] QKDGGEBMABOMMW-UHFFFAOYSA-I 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000003957 anion exchange resin Substances 0.000 description 1
- 239000010426 asphalt Substances 0.000 description 1
- ASPXBYAQZVXSNS-UHFFFAOYSA-N azane;sulfurous acid;hydrate Chemical compound N.N.O.OS(O)=O ASPXBYAQZVXSNS-UHFFFAOYSA-N 0.000 description 1
- 238000007664 blowing Methods 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- BRPQOXSCLDDYGP-UHFFFAOYSA-N calcium oxide Chemical compound [O-2].[Ca+2] BRPQOXSCLDDYGP-UHFFFAOYSA-N 0.000 description 1
- 239000000292 calcium oxide Substances 0.000 description 1
- ODINCKMPIJJUCX-UHFFFAOYSA-N calcium oxide Inorganic materials [Ca]=O ODINCKMPIJJUCX-UHFFFAOYSA-N 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000006477 desulfuration reaction Methods 0.000 description 1
- 230000023556 desulfurization Effects 0.000 description 1
- 238000001784 detoxification Methods 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- ZGCHATBSUIJLRL-UHFFFAOYSA-N hydrazine sulfate Chemical compound NN.OS(O)(=O)=O ZGCHATBSUIJLRL-UHFFFAOYSA-N 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 238000007670 refining Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000002893 slag Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 150000003388 sodium compounds Chemical class 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000000967 suction filtration Methods 0.000 description 1
- 230000001360 synchronised effect Effects 0.000 description 1
- 239000011269 tar Substances 0.000 description 1
- WQEVDHBJGNOKKO-UHFFFAOYSA-K vanadic acid Chemical compound O[V](O)(O)=O WQEVDHBJGNOKKO-UHFFFAOYSA-K 0.000 description 1
- 239000002351 wastewater Substances 0.000 description 1
Landscapes
- Processing Of Solid Wastes (AREA)
- Inorganic Compounds Of Heavy Metals (AREA)
Description
【発明の属する技術分野】
本発明は、4価バナジウム化合物およびその溶液の製造方法に関する。さらに詳しくは、バナジウムレドックスフロー電池の正極電解液に好適に使用しうるオキシ水酸化バナジウム水和物の製造方法、ならびに該オキシ水酸化バナジウム水和物を用いたバナジウムレドックスフロー電池の正極電解液の製造方法および硫酸バナジウム水和物の製造方法に関する。
【0002】
【従来の技術】
従来、バナジウム化合物は、バナジウム含有原料から製造したメタバナジン酸アンモニウム〔NH4 VO3 〕などのバナジン酸塩、またはこれを焙焼して得られた五酸化バナジウム(V2 O5 )を原料として製造されている。例えば、硫酸バナジル〔VOSO4 〕は、原料として五酸化バナジウム〔V2 O5 〕を使用し、これを硫酸中でSO2 ガスで還元することによって製造されている。
【0003】
また、近年、バナジウムレドックスフロー電池が脚光を浴びるに伴い、その電解液の原料として硫酸バナジル〔VOSO4 〕の需要が高まりつつあることから、種々の硫酸バナジル〔VOSO4 〕の製造方法が研究されており、その原料として、五酸化バナジウム(V2 O5 )が使用されている。
【0004】
バナジウム化合物の原料として、5価のバナジウムが使用された五酸化バナジウム(V2 O5 )以外にも、4価のバナジウムイオンを含む水溶液を使用する方法も考えられている。しかし、この方法には、前記水溶液には、一般に、夾雑する他の金属イオンの含有量が多いため、この金属イオンを除去するために、アルカリ性の下で該4価のバナジウムイオンを酸化させ、一旦、溶解した5価のバナジウムイオンを含む溶液を生成し、その溶液に含まれている夾雑金属イオンの大半をアルカリにより不溶解分として濾過により除去したのち、さらにアンモニウム塩類を添加し、バナジン酸塩類を析出させ、これを前記溶液から濾別することにより、残存している夾雑金属イオンを濾液に含有させて分離・除去するという煩雑な工程を有するため、工業的生産性の面で劣るという欠点がある。
【0005】
バナジウム化合物を取得する他の方法として、種々の不純物を含むバナジウムの酸性溶液に多量の第一鉄塩または鉄屑を添加し、該酸性溶液中のバナジウムを還元させてその全部を4価のバナジウムにさせるとともに、該酸性溶液中に第一鉄塩を含有させ、これにアルカリ剤としてアンモニア、水酸化ナトリウム、炭酸ナトリウムなどを用いて中和し、水酸化第一鉄の沈澱を生成沈降させるととともに、同時に生成するバナジウムの水酸化物を水酸化第一鉄の生成沈降作用に同調させ、その全てを沈降させる不純物を含む溶液中のバナジウムを捕集する方法が提案されている(特公昭46−12609号公報)。しかし、この方法では、バナジウムを高収率で捕集することができるものの、多量の不純物が含有されるので、商品的価値を有する製品を製造する場合には、捕集後に煩雑な精製工程を必要とするという欠点がある。
【0006】
また、前記以外にも、バナジウム化合物を製造する方法として、重質油を燃焼した際に生成した集塵機灰や冷却除塵塔から排出される灰と、湿式脱硫装置から発生する排水とを混合し、生成した混合液を処理する方法が提案されている(特開平8−117552号公報、特開平10−99639号公報、特開平10−99640号公報、特開平10−174946号公報、特開平10−174947号公報など)。これらの方法で生成した混合液には、未燃カーボン、4価のバナジウムイオン、5価のバナジウムイオン、その他の金属イオンが含まれ、そのpHは3以下である。この混合液の処理は、該混合液に、硫酸第一鉄などの還元剤を添加し、5価のバナジウムイオンを4価のバナジウムイオンに還元し、バナジウムをできるだけ完全に溶解させ、次にこの溶液を濾過して未燃カーボンを除去し、その濾液のpHをアンモニア水または水酸化マグネシウムで3〜9とし、生成した高濃度のバナジウム含有沈澱物を固液分離して回収し、その濾液に酸化カルシウムまたは水酸化カルシウムを添加し、pHを9〜12に調整して蒸留し、アンモニアを回収することによって行なわれる。
【0007】
この方法よれば、高濃度のバナジウム含有沈澱物は、式:
VO(OH)2
〔この式は、本発明者らの研究によれば、厳密には、式:
VO(OH)2 ・nH2 O
(式中、nは約1を示す)である〕であり、その中には原料煤中のカルシウムがもたらされないことが前記文献に示されている。
【0008】
しかし、原料として用いられている集塵機などで捕捉された灰類の中には、カルシウム以外にも鉄、ニッケル、クロムなどが著量で含有されているので、未燃カーボンを除去した濾液には、これらの金属イオンが含有されており、また、還元剤として硫酸第一鉄を用いると、その鉄含有量がより一層多くなる。従って、この濾液のpHを通常の3〜9に調整することによってVO(OH)2 を沈澱させ、固液分離して該VO(OH)2 を取得すると、該VO(OH)2 の中には鉄、ニッケル、クロムなどが著量で含有されるので、該VO(OH)2 を高純度で得ることができないという欠点がある。また、VO(OH)2 を不活性雰囲気中で脱水、焙焼することによってVO2 が得られ、また該VO(OH)2 を脱水、焙焼、酸化することによってV2 O5 が得られるが、これらに含まれる不純物量が非常に多く、市販の並級品よりも純度に劣るという欠点がある。さらに、pHが3近辺であるとき、鉄、ニッケルおよびクロムが沈澱しないものの、バナジウムも殆ど沈澱しないため、その収率が非常に低いという欠点がある。
【0009】
また、この他にも、化石燃料を燃焼させることによって得られる集塵機灰を水に懸濁し、その懸濁液のpHを6〜9に調整した後、固液分離する方法が提案されている(特開平9−192628号公報)。しかし、この方法によれば、該集塵機灰に含有されていたバナジウムの殆どが固形分に含有され、溶液側には僅かしか含有されず、またこの工程に先立って亜硫酸ナトリウム、亜硫酸ガスなどで懸濁液中のV5+をV4+に還元した場合には、さらに効率よくバナジウムを固形分に含有させることができるという利点がある。しかし、この方法では、原料灰である集塵機灰に夾雑しているバナジウム以外の金属がバナジウムとともに固形分に含有されるため、この夾雑金属を除去するための煩雑な後処理工程を要するという欠点がある。
【0010】
前記したように、従来のバナジウム化合物の製造方法では、例えば、化石燃料の燃焼煤、バナジウム含有精錬スラグなどをバナジウム含有原料とし、この原料から、電力貯蔵用電池の電解液に有用な硫酸バナジルなどの目的化合物に至るまでの製造経路が複雑で長いため、該目的化合物が必然的に高価とならざるを得ず、この目的化合物の高価格化が、バナジウムレドックスフロー電池を開発するうえでの大きな阻害要因となっている。
【0011】
【発明が解決しようとする課題】
本発明は、前記従来技術に鑑みてなされたものであり、化石燃料の燃焼煤などから、4価バナジウム化合物の重要な製造中間体であるオキシ水酸化バナジウム水和物を高純度で容易に、かつ簡便に製造しうる方法を提供し、これにより、4価バナジウム化合物を従来技術と対比して、格段に経済的に供給することを目的とする。
【0012】
【課題を解決するための手段】
すなわち、本発明の要旨は、
〔1〕(a)化石燃料の燃焼の際に発生した燃焼煤をpHを1〜3に調整した水中に懸濁した状態で、SO 2 ガス、亜硫酸アンモニウム、水和ヒドラジンおよび硫酸ヒドラジンからなる群より選ばれた少なくとも1種の還元剤を作用させた後、濾過して不溶性残渣を除去し、4価のバナジウムを含有する水溶液を得る工程、
(b)得られた4価のバナジウムを含有する水溶液に、アンモニアまたはアンモニア水を添加し、該水溶液のpHを4.2〜4.8に調整し、オキシ水酸化バナジウム水和物を析出させる工程、
(c)析出したオキシ水酸化バナジウム水和物を濾過し、取得する工程、および
(d)前記工程(c)で得られた濾液および洗浄液に、アンモニアまたはアンモニア水を添加し、該液のpHを6±0.3に調整し、生成した析出物を回収し、該析出物を前記工程(a)または(b)でバナジウム含有原料として使用する工程
からなるオキシ水酸化バナジウム水和物の製造方法、
〔2〕前記〔1〕の工程(c)で得られたオキシ水酸化バナジウム水和物を硫酸水溶液に溶解させるバナジウムレドックスフロー電池の正極電解液の製造方法、
〔3〕前記〔1〕の工程(c)で得られたオキシ水酸化バナジウム水和物を硫酸水溶液に溶解させ、得られた硫酸バナジル水溶液を濃縮、冷却、析出および濾過の各工程に供する硫酸バナジル水和物の製造方法、並びに
〔4〕(a)化石燃料の燃焼の際に発生した燃焼煤をpHを1〜3に調整した水中に懸濁した状態で、SO 2 ガス、亜硫酸アンモニウム、水和ヒドラジンおよび硫酸ヒドラジンからなる群より選ばれた少なくとも1種の還元剤を作用させた後、濾過して不溶性残渣を除去し、4価のバナジウムを含有する水溶液を得る工程、
(b)得られた4価のバナジウムを含有する水溶液に、アンモニアまたはアンモニア水を添加し、該水溶液のpHを4.2〜4.8に調整し、オキシ水酸化バナジウム水和物を析出させる工程、および
(c)析出したオキシ水酸化バナジウム水和物を濾過し、取得する工程
からなるオキシ水酸化バナジウム水和物の製造方法の、前記工程(c)で得られたオキシ水酸化バナジウム水和物を硫酸水溶液に溶解させ、得られた硫酸バナジル水溶液を濃縮、冷却、析出および濾過の各工程に供する硫酸バナジル水和物の製造方法
に関する。
【0013】
【発明の実施の形態】
本発明のオキシ水酸化バナジウム水和物の製造方法は、前記したように
(a)化石燃料の燃焼の際に発生した燃焼煤をpHを1〜3に調整した水中に懸濁した状態で還元剤を作用させた後、濾過して不溶性残渣を除去し、4価のバナジウムを含有する水溶液を得る工程、
(b)得られた4価のバナジウムを含有する水溶液に、アンモニアまたはアンモニア水を添加し、該水溶液のpHを4.2〜4.8に調整し、オキシ水酸化バナジウム水和物を析出させる工程、および
(c)析出したオキシ水酸化バナジウム水和物を濾過し、取得する工程
からなる。
【0014】
また、本発明の製造方法には、前記工程(c)に引き続いて工程(d)として、前記工程(c)で得られた濾液および洗浄液に、アンモニアまたはアンモニア水を添加し、該液のpHを6±0.3に調整し、生成した析出物を回収し、前記工程(a)または(b)でバナジウム含有原料として使用することができる。
【0015】
まず、前記工程(a)について説明する。
本発明に使用される化石燃料としては、例えば、瀝青質鉱物、重油、タール、アスファルトなどをはじめ、これらをエマルジョン化した燃料などが挙げられる。また、燃焼煤は、これらの化石燃料を燃焼することによって発生したものであればよく、特に限定がない。この燃焼煤を水中に懸濁すると、4価のバナジウムイオンおよび5価のバナジウムイオン、Fe、Ni、Cr、Mg、Naなどの金属イオン、ならびに珪酸イオンを含有する、pH1〜3の水不溶性物質の懸濁液が得られる。燃焼煤の量は、水中に懸濁させることができる量であればよく、特に限定がない。該懸濁液のpHは、4価のバナジウムイオンを高濃度でかつ安定して得ることができるようにするために、1〜3とされる。
【0016】
なお、燃焼煤を水中に懸濁させる際には、還元剤が使用される。かかる還元剤としては、例えば、SO2 ガス、亜硫酸アンモニウム、水和ヒドラジンおよび硫酸ヒドラジンの少なくとも1種が挙げられる。該還元剤の使用量は、操作中に大気に含まれている酸素による酸化消耗を考慮して化学量論量の1.1〜1.2倍とすることが好ましい。
【0017】
水中に燃焼煤を添加し、攪拌などを行なうことにより、この水中に燃焼煤を懸濁させて懸濁液を得ることができる。その後、該懸濁液に、例えば、還元剤の添加などにより、還元剤を作用させることができる。これにより、5価のバナジウムが迅速に4価のバナジウムに還元され、不溶性物質に含まれている殆どのバナジウムもこの懸濁液中に溶解する。
【0018】
次に、この懸濁液を濾過することにより、不溶性残渣を濾別、除去することができる。この濾過により、4価のバナジウムを含有する水溶液が得られる。得られた4価のバナジウムを含有する水溶液は、次に、工程(b)で使用される。
【0019】
工程(b)では、4価のバナジウムを含有する水溶液に、アンモニアまたはアンモニア水を添加し、該水溶液のpHを4.2〜4.8に調整し、オキシ水酸化バナジウム水和物を析出させる。
【0020】
本発明においては、このpHを4.2〜4.8に調整する点に1つの大きな特徴があり、このようにpHを調整した場合には、水溶液中のバナジウムイオンをオキシ水酸化バナジウム水和物として効率よく、例えば、70〜80%の収率で析出させることができるという、格別顕著に優れた効果が発現される。このpHは、4.0であってもオキシ水酸化バナジウム水和物の析出があるが、これを濾過し、取得したとしても、その収率は、バナジウムに対して高々30%程度である。また、例えば、このpHを5.0とすると、バナジウムに対する収率は、90%程度に向上するものの、析出したオキシ水酸化バナジウム水和物には、Fe、Niなどの金属の含量が著しく増加し、さらに該pHが6.0を超えると、バナジウムに対する収率が殆ど定量的になるが、析出したオキシ水酸化バナジウム水和物におけるFe、Niなどの金属の含量がより一層著しくなる。しかし、本発明においては、前記pHが4.2〜4.8とされているので、驚くべきことに、これらの欠点を解消し、不純物たるFe、Ni、Cr、Mg、Naなどの金属イオンや、珪酸イオンからの析出物などの含量の低減を図り、しかも高収率でオキシ水酸化バナジウム水和物を得ることができるという、格別顕著に優れた効果が奏されるのである。
【0021】
また、析出したオキシ水酸化バナジウム水和物は、式:
VO(OH)2 ・nH2 O
(式中、nは約1を示す)
で表される化合物であり、その濾過性が良好であるという利点もある。
【0022】
このようにして工程(b)で析出させて得られたオキシ水酸化バナジウム水和物は、次に、工程(c)で使用される。
【0023】
工程(c)では、オキシ水酸化バナジウム水和物を濾過することにより、オキシ水酸化バナジウム水和物が得られる。
【0024】
オキシ水酸化バナジウム水和物の濾過は、例えば、吸引濾過などの通常の濾過方法によって行なうことができる。その洗浄の際には、pHが高い水を使用すると、取得したケーキ状のオキシ水酸化バナジウム水和物に含まれている夾雑金属イオンから析出物が生じ、他方pHが低い水を使用すると、析出物の一部が溶解するようになる。従って、洗浄の際に使用する洗浄水のpHは、濾過時と同じ範囲内にあることが好ましい。
【0025】
以上のようにして、オキシ水酸化バナジウム水和物を濾過し、洗浄すると、式:
VO(OH)2 ・nH2 O
(式中、nは約1を示す)
で表されるケーキ状のオキシ水酸化バナジウム水和物を高純度で得ることができる。
【0026】
前記工程(c)で析出したオキシ水酸化バナジウムを得る際に生じた濾液および洗浄液には、該工程(c)で析出しなかったバナジウムの残余と夾雑金属イオンが存在している。
【0027】
この濾液および洗浄液を公知の方法で加熱下、アルカリ性で酸化した後、熱時に濾過して夾雑金属に由来する不溶物を除去し、次にアンモニウム塩を添加して冷却し、メタバナジン酸アンモニウムを析出させ、濾過・取得することが可能である。しかしながら、これは、必ずしも経済的であるとはいえない。
【0028】
本発明者らは、この濾液および洗浄液の有効利用および無害化処理について鋭意研究を重ね結果、前記工程(d)に到達した。すなわち、前記工程(c)で得られた濾液および洗浄液に、アンモニアまたはアンモニア水を添加し、該液のpHを6±0.3に調整したところ、工程(c)で析出しなかった残余しているバナジウムの殆どが析出し、その液中には原料煤中の含量の3〜5%程度を残すだけとなり、この析出物を濾過して取得すると、純度がやや劣るオキシ水酸化バナジウム水和物が得られることが見出された。そのオキシ水酸化バナジウム水和物における夾雑金属の含有率は、原料煤のそれよりもむしろ高いが、量的には5%以下であり、その大半が濾液側に行き、この製造プロセスの系外に除去することができる。
【0029】
このことから、前記工程(c)で得られた濾液および洗浄液に、アンモニアまたはアンモニア水を添加し、該液のpHを6±0.3に調整して生成した析出物は、工程(a)または工程(b)でバナジウム含有原料として好適に使用することができる。
【0030】
得られたオキシ水酸化バナジウム水和物を所望濃度の硫酸水溶液に溶解させることにより、所望硫酸濃度を有する所望V4+濃度の硫酸バナジル水溶液が得られる。この硫酸バナジル水溶液は、例えば、バナジウムレドックスフロー電池の正極電解液として好適に使用することができる。なお、本発明によれば、広範囲の組成からなる電解液を調製することができるが、電池的性能、結晶の析出に対する経時的安定性などの観点から、最も好ましい組成は、H2 SO4 濃度が2mol/l程度であり、V4+濃度が2mol/l程度であることである。
【0031】
また、前記オキシ水酸化バナジウム水和物を不活性ガス雰囲気中で硫酸水溶液中に添加し、溶解させて硫酸バナジル水溶液を得る。この際、硫酸バナジルの加水分解を抑制するために、硫酸は、バナジウムに対して当量よりも5〜20%程度過剰に使用することが好ましい。
【0032】
この硫酸バナジル水溶液を適宜、加熱濃縮した後、冷却して硫酸バナジル水和物を析出させ、固液分離して硫酸バナジル水和物〔VOSO4 ・mH2 O〕の結晶を得ることができる。前記mは、冷却温度および析出温度によって異なるが、それらの温度を20〜25℃とした場合、mが5の結晶を得ることが結晶状態の観点から好ましい。
【0033】
以上の各工程において、オキシ水酸化バナジウム水和物は酸化されやすいので、各工程において操作を行う際には、極力酸素との接触を避けるか、あるいは還元性または不活性ガスの雰囲気中でその操作を行うことが好ましい。
【0034】
なお、本発明の工程で使用される還元剤として亜硫酸ナトリウムを使用し、また、アルカリとして水酸化ナトリウムを使用することができる。しかし、最終製品の中にはナトリウムの含有を忌避するものが多いので、これらナトリウム化合物の使用を回避することが好ましい。
【0035】
【実施例】
次に、本発明を実施例に基づいてさらに詳細に説明するが、本発明はかかる実施例のみに限定されるものではない。
【0036】
実施例1〜3(参考例)および比較例1〜4
瀝青質混合物(ベネズエラ産)の燃焼の際に得られた集塵機灰〔湿潤重量:1878g〕(水分含量:18.85%、乾燥品の重量:1600g、乾燥品の分析値:V2.51%、N15.80%、S22.57%、C0.29%、Fe0.11%、Ni0.46%、Cr0.01%、Mg6.11%)〔V含量:40.16g(0.789mol)〕を40℃の水8000mlに添加し、攪拌して懸濁させた。得られた懸濁液のpHは2.27であり、溶液中のV5+含量/総V含量(モル比)は0.414であった。
【0037】
この懸濁液に40℃でSO2 ガス4.39リットルを20分間吹き込み、微量の酸およびアルカリでpHを2〜2.3に調整し、30分間保持した。
【0038】
濾過した後、濾過残渣(主成分:カーボン)を水50mlで2回洗浄した。残渣の乾燥重量は、8.90gであった。
【0039】
次に、濾液に水を添加し、総量を10000gとし、この溶液を窒素ガス置換した容器中に保存した。この溶液を分析すると、V含量が0.381重量%、即ち38.1gであることから、原料灰からのVの収率は94.9%であり、溶液は4価バナジウムの存在を示す青色であった。
【0040】
この溶液を1/10(容量)ずつ、窒素ガス置換した4つ口フラスコ内に添加し、また攪拌下で50±3℃でアンモニア水を該4つ口フラスコ内に徐々に添加し、種々のpHに保持し、30分間経過後、析出したオキシ水酸化バナジウム水和物を濾過し、得られたケーキを濾過時と同じpHに調整した水90mlずつで3回洗浄し、減圧下に乾燥した。その結果を表1に示す。
【0041】
【表1】
【0042】
表1に示された結果から、実施例1〜3の方法によれば、不純物含量が少ないオキシ水酸化バナジウム水和物を効率よく得ることができることがわかる。
【0043】
実施例4
実施例2で得られた濾液と洗浄液の混合液1000mlを50±3℃に保持し、これにアンモニア水を徐々に添加し、pHを6.0±0.3とし、30分間保持した。析出したオキシ水酸化バナジウム水和物を濾過し、得られたケーキを、pHを6.0±0.3に調整した水10mlずつで3回洗浄し、減圧下に乾燥した。その結果を表2に示す。
【0044】
【表2】
【0045】
次に、このオキシ水酸化バナジウム水和物をそのまま製品とするには、夾雑金属類の含量が多いので、原料集塵機灰の仕込み工程に、バナジウムを高濃度で含有するリサイクル原料として使用したところ、問題なく使用できた。
【0046】
一方、濾液には、原料中の夾雑金属の大部分が含まれている。従って、これを系外に出す必要があるため、pH11〜13のアルカリ性で空気酸化させ、なお微量溶存しているバナジウムを5価とした後、析出物を濾過し、pHを2〜3に調整し、塩基性アニオン交換樹脂塔に通じてバナジウムを回収した。該交換樹脂塔を通過した液は、そのpHを5.0〜9.0に調整して放流可能な排水とした。
【0047】
実施例5(参考例)
実施例1〜3および比較例1〜4と全く同様の懸濁液を調製し、SO2 ガス4.39リットルを20分間吹き込む代わりに、硫酸ヒドラジン12.75gを添加し、40±2℃の温度に30分間保持した。
【0048】
濾過した後、水50mlで濾過残渣(主成分:カーボン)を2回洗浄した。残渣の乾燥重量は8.30gであった。
【0049】
濾液に水を添加し、総量を10000gとし、その溶液を窒素ガス置換した容器中に保存した。その溶液を分析するとV含量0.385重量%、即ち38.50gであり、原料灰からのV収率は95.87%であり、またその溶液は4価バナジウムの存在を示す青色であった。
【0050】
この溶液のうち1000gを使用し、窒素ガス置換した4つ口フラスコ中で攪拌下に50℃±3℃でアンモニア水を徐々に添加し、pHを4.5±0.1に保持し、30分間経過後、析出したオキシ水酸化バナジウム水和物を濾過し、得られたケーキを濾過時と同じpH4.5±0.1に調整した水90mlずつで3回洗浄し、減圧下に乾燥した。その結果を表3に示す。
【0051】
実施例6(参考例)
実施例1〜3および比較例1〜4と全く同様の懸濁液を調製し、硫酸ヒドラジンを添加するかわりに、亜硫酸アンモニウム一水和物26.3gを添加し、40±2℃の温度に30分間保持した。
【0052】
濾過した後、得られた濾過残渣(主成分:カーボン)を水50mlで2回洗浄した。残渣の乾燥重量は7.90gであった。
【0053】
次に、濾液に水を添加して10000gとし、得られた溶液を窒素ガス置換した容器中に保存した。得られた溶液を分析するとV含量0.383重量%、即ち38.30gで原料灰からのV収率は95.37%であり、その溶液は4価バナジウムの存在を示す青色であった。
【0054】
この溶液のうち1000gを使用し、窒素ガス置換した4つ口フラスコ中で攪拌下に50℃±3℃の温度でアンモニア水を徐々に添加し、pH4.5±0.1に保持し、30分間経過後、析出したオキシ水酸化バナジウム水和物を濾過し、得られたケーキを濾過時と同じpH4.5±0.1に調整した水90mlずつで3回洗浄し、減圧下に乾燥した。その結果を表3に示す。
【0055】
実施例7(参考例)
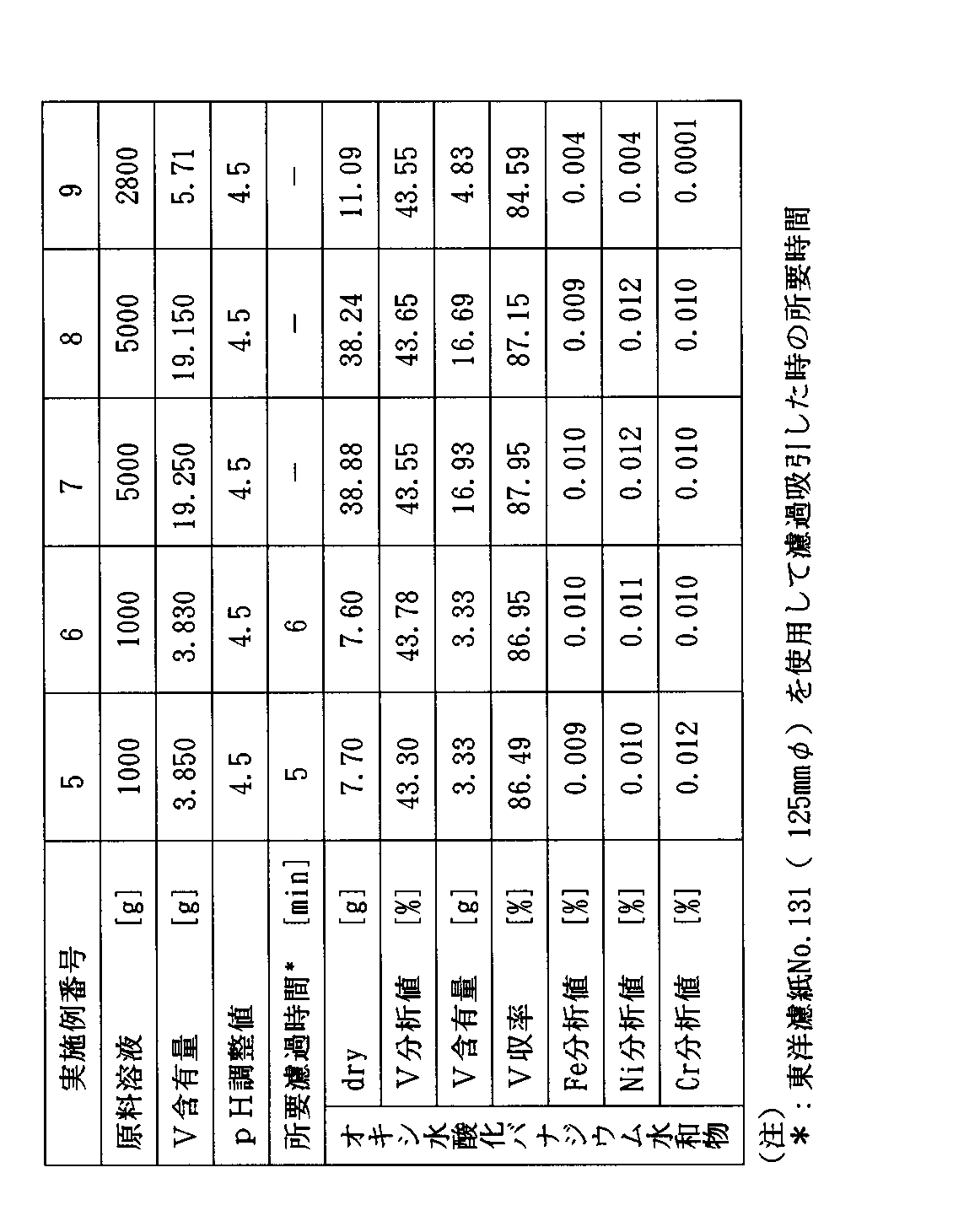
実施例5で準備した4価バナジウム溶液の10000gのうち5000gを窒素ガス置換した4つ口フラスコ内に添加し、これに攪拌下で50℃±3℃でアンモニア水を徐々に添加し、pH4.5±0.1に保持し、30分間経過後、析出したオキシ水酸化バナジウム水和物を濾過し、得られたケーキを濾過時と同じpH4.5±0.1に調整した水300mlずつで3回洗浄し、減圧下に乾燥した。その結果を表3に示す。
【0056】
実施例7で得られたオキシ水酸化バナジウム水和物38.88g(乾燥重量、V含量:43.55%)のうち23.38g〔V含量:10.18g(0.2mol)〕を窒素ガス置換した4つ口フラスコ中で攪拌下に65重量%H2 SO4 水溶液30.15g〔100%換算19.6g(0.2mol)〕中に添加し、溶解し、水で希釈して100mlとした。その結果、V濃度2mol/l、H2 SO4 濃度2mol/lの溶液100mlが得られた。この溶液は、バナジウムレドックス電池の正極電解液として好適に使用しうるものであった。
【0057】
実施例8(参考例)
実施例6で準備した4価バナジウム溶液の10000gのうち5000gを窒素ガス置換した4つ口フラスコ内に添加し、これに攪拌下に50℃±3℃でアンモニア水を徐々に添加して、pHを4.5±0.1に保持し、30分間経過後、析出したオキシ水酸化バナジウム水和物を濾過し、得られたケーキを濾過時と同じpHを4.5±0.1に調整した水300mlずつで3回洗浄し、減圧下に乾燥した。その結果を表3に示す。
【0058】
実施例8で得られたオキシ水酸化バナジウム水和物(乾燥重量:38.24g、V含量:43.65%)のうち23.32g〔V含量:10.18g(0.2mol)〕を窒素ガス置換した4つ口フラスコ中で攪拌下に30重量%H2 SO4 水溶液39.2g〔100%換算量:11.76g(0.12mol)〕中に添加して60±3℃で溶解した。この溶液を30±3℃の温度に冷却し、析出した結晶を遠心濾過器で振り切って、硫酸バナジル水和物(VOSO4 としての含量:65.5%、VOSO4 ・mH2 O、mは約5に相当)41.0gを得た。この製品の鉄(Fe)含有率は0.004%であった。
【0059】
実施例9(参考例)
重油燃焼の際の集塵機灰880g(湿潤重量)〔水分含量:45.5%、V含量:6.00g(0.118mol)〕(乾燥品の重量:480g、乾燥品の分析値:V1.25%、N9.5%、S11.9%、C46.5%、Fe0.13%、Ni0.22%、Cr<0.01%、Mg0.11%)を40℃の水2000mlに仕込み、攪拌して懸濁させた。得られた懸濁液のpHは2.8を呈し、溶液中のV5+含量/総V含量(モル比)は0.310であった。
【0060】
この懸濁液に、SO2 ガス500mlを20分間で吹き込み、40±2℃の温度に30分間保持した。
【0061】
この懸濁液を濾過した後、濾過残渣(主成分:カーボン)を水300mlずつで2回洗浄した。残渣の乾燥重量は230gであった。
【0062】
濾液に水を添加し、総量を2800gとし、得られた溶液を窒素ガス置換した容器中に保存した。この溶液を分析するとV含量0.204重量%、即ち5.71gで原料灰からのV収率は95.2%であり、溶液は4価バナジウムの存在を示す青色であった。
【0063】
この溶液を窒素ガス置換した4つ口フラスコ内に添加し、これに攪拌下で40℃±3℃でアンモニア水を徐々に添加して、pHを4.5±0.1に保持し、30分間経過後、析出したオキシ水酸化バナジウム水和物を濾過し、得られたケーキを濾過時と同じpHを4.5±0.1に調整した水50mlずつで3回洗浄し、減圧下に乾燥した。その結果を表3に示す。
【0064】
【表3】
【0065】
【発明の効果】
本発明の方法によれば、化石燃料の燃焼の際に生じる集塵灰などを水に懸濁し、還元して得られるFe、Niなどの夾雑金属イオンを含有する4価バナジウムの溶液からFe、Niなどの含有量が極めて少ないオキシ水酸化バナジウム水和物を容易に取得することができる。
【0066】
このオキシ水酸化バナジウム水和物と硫酸とを反応させることにより、バナジウム含有原料から非常に短い経路でバナジウムレドックスフロー電池の電解液として有用な硫酸バナジウムの硫酸溶液および硫酸バナジル水和物の結晶を経済的に製造することができる。
Claims (4)
- (a)化石燃料の燃焼の際に発生した燃焼煤をpHを1〜3に調整した水中に懸濁した状態で、SO 2 ガス、亜硫酸アンモニウム、水和ヒドラジンおよび硫酸ヒドラジンからなる群より選ばれた少なくとも1種の還元剤を作用させた後、濾過して不溶性残渣を除去し、4価のバナジウムを含有する水溶液を得る工程、
(b)得られた4価のバナジウムを含有する水溶液に、アンモニアまたはアンモニア水を添加し、該水溶液のpHを4.2〜4.8に調整し、オキシ水酸化バナジウム水和物を析出させる工程、
(c)析出したオキシ水酸化バナジウム水和物を濾過し、取得する工程、および
(d)前記工程(c)で得られた濾液および洗浄液に、アンモニアまたはアンモニア水を添加し、該液のpHを6±0.3に調整し、生成した析出物を回収し、該析出物を前記工程(a)または(b)でバナジウム含有原料として使用する工程
からなるオキシ水酸化バナジウム水和物の製造方法。 - 請求項1の工程(c)で得られたオキシ水酸化バナジウム水和物を硫酸水溶液に溶解させるバナジウムレドックスフロー電池の正極電解液の製造方法。
- 請求項1の工程(c)で得られたオキシ水酸化バナジウム水和物を硫酸水溶液に溶解させ、得られた硫酸バナジル水溶液を濃縮、冷却、析出および濾過の各工程に供する硫酸バナジル水和物の製造方法。
- (a)化石燃料の燃焼の際に発生した燃焼煤をpHを1〜3に調整した水中に懸濁した状態で、SO 2 ガス、亜硫酸アンモニウム、水和ヒドラジンおよび硫酸ヒドラジンからなる群より選ばれた少なくとも1種の還元剤を作用させた後、濾過して不溶性残渣を除去し、4価のバナジウムを含有する水溶液を得る工程、
(b)得られた4価のバナジウムを含有する水溶液に、アンモニアまたはアンモニア水を添加し、該水溶液のpHを4.2〜4.8に調整し、オキシ水酸化バナジウム水和物を析出させる工程、および
(c)析出したオキシ水酸化バナジウム水和物を濾過し、取得する工程
からなるオキシ水酸化バナジウム水和物の製造方法の、前記工程(c)で得られたオキシ水酸化バナジウム水和物を硫酸水溶液に溶解させ、得られた硫酸バナジル水溶液を濃縮、冷却、析出および濾過の各工程に供する硫酸バナジル水和物の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP09268399A JP4222676B2 (ja) | 1999-03-31 | 1999-03-31 | オキシ水酸化バナジウム水和物の製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP09268399A JP4222676B2 (ja) | 1999-03-31 | 1999-03-31 | オキシ水酸化バナジウム水和物の製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2000281345A JP2000281345A (ja) | 2000-10-10 |
| JP4222676B2 true JP4222676B2 (ja) | 2009-02-12 |
Family
ID=14061299
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP09268399A Expired - Lifetime JP4222676B2 (ja) | 1999-03-31 | 1999-03-31 | オキシ水酸化バナジウム水和物の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4222676B2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110911722A (zh) * | 2019-10-29 | 2020-03-24 | 大连博融新材料有限公司 | 一种全钒液流电池电解液容量恢复剂、制备方法及用途 |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4768116B2 (ja) * | 2000-12-15 | 2011-09-07 | 千代田化工建設株式会社 | バナジウムを含有する炭素質残渣から高純度のバナジウム化合物を製造する方法 |
| JP2015148198A (ja) * | 2014-02-07 | 2015-08-20 | 三菱電機株式会社 | 圧縮機、及び、冷凍サイクル装置 |
| JPWO2017069223A1 (ja) * | 2015-10-20 | 2019-01-17 | Leシステム株式会社 | レドックスフロー電池用のバナジウム電解液の製造方法 |
| JP6535696B2 (ja) * | 2017-04-20 | 2019-06-26 | Leシステム株式会社 | オキシ水酸化バナジウム及びバナジウム電解液の製造方法 |
| CN109841885B (zh) * | 2017-11-28 | 2021-06-29 | 中国科学院大连化学物理研究所 | 提高全钒液流电池运行时高浓度负极电解液稳定性的方法 |
| CN108336426A (zh) * | 2018-02-07 | 2018-07-27 | 四川星明能源环保科技有限公司 | 一种硫酸氧钒的制备方法及其制得的硫酸氧钒晶体 |
-
1999
- 1999-03-31 JP JP09268399A patent/JP4222676B2/ja not_active Expired - Lifetime
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110911722A (zh) * | 2019-10-29 | 2020-03-24 | 大连博融新材料有限公司 | 一种全钒液流电池电解液容量恢复剂、制备方法及用途 |
| CN110911722B (zh) * | 2019-10-29 | 2021-06-15 | 大连博融新材料有限公司 | 一种全钒液流电池电解液容量恢复剂、制备方法及用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2000281345A (ja) | 2000-10-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN110093511B (zh) | 一种处理危险废物—钨渣并回收有价金属的全封闭工艺 | |
| CN102531054A (zh) | 偏钒酸铵的提纯方法以及高纯度五氧化二钒的制备方法 | |
| US7498007B2 (en) | Process to recover vanadium contained in acid solutions | |
| RU2247788C1 (ru) | Способ получения оксида скандия из красного шлама | |
| CN113120975A (zh) | 一种废旧三元锂电池正极材料的回收方法 | |
| JP4222676B2 (ja) | オキシ水酸化バナジウム水和物の製造方法 | |
| CN101709376B (zh) | 碱性钒浸出液的净化方法 | |
| CA1214382A (en) | Method for regenerating pickling acids | |
| CN114212828B (zh) | 一种硫酸锰溶液除杂方法 | |
| US5759503A (en) | Method for the further purification of zinc oxide | |
| CN102337410A (zh) | 一种回收除磷底流渣中钒的方法 | |
| JP2020200227A (ja) | バナジウム化合物の製造方法、及びレドックス・フロー電池用電解液の製造方法、並びにバナジウム化合物の製造装置、及びレドックス・フロー電池用電解液の製造装置 | |
| US6783744B2 (en) | Method for the purification of zinc oxide controlling particle size | |
| JP3955130B2 (ja) | 硫酸バナジウム(iii)の製造方法 | |
| JP2002175831A (ja) | バナジウムレドックスフロー電池用電解液の製造方法 | |
| JP4414048B2 (ja) | 酸化バナジウム(iii)の製造方法 | |
| CN116199201A (zh) | 一种废旧磷酸铁锂极片粉末除铝及综合回收方法 | |
| CN111573736B (zh) | 一种利用氯化铜锰液制备工业级碳酸锰的方法 | |
| CN103121716A (zh) | 一种由钒溶液制备五氧化二钒的方法 | |
| WO2020138137A1 (ja) | バナジウム酸化物の精製方法 | |
| CN114455631B (zh) | 一种环保的偏钛酸净化脱硫除铁的方法 | |
| JP4567254B2 (ja) | バナジウムレドックスフロー電池用電解液の製造方法 | |
| JP4013171B2 (ja) | 重質油系燃焼灰の処理方法 | |
| JPH09192628A (ja) | 集塵機灰の処理方法 | |
| RU2046099C1 (ru) | Способ получения соли кобальта (ii) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20051004 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20080814 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080818 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081016 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20081107 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20081118 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111128 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111128 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121128 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131128 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |