JP4195089B2 - 亜酸化物単位から製造される巨大環式化合物 - Google Patents
亜酸化物単位から製造される巨大環式化合物 Download PDFInfo
- Publication number
- JP4195089B2 JP4195089B2 JP52482597A JP52482597A JP4195089B2 JP 4195089 B2 JP4195089 B2 JP 4195089B2 JP 52482597 A JP52482597 A JP 52482597A JP 52482597 A JP52482597 A JP 52482597A JP 4195089 B2 JP4195089 B2 JP 4195089B2
- Authority
- JP
- Japan
- Prior art keywords
- macrocyclic
- com
- active substance
- present
- substance according
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/564—Immunoassay; Biospecific binding assay; Materials therefor for pre-existing immune complex or autoimmune disease, i.e. systemic lupus erythematosus, rheumatoid arthritis, multiple sclerosis, rheumatoid factors or complement components C1-C9
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/365—Lactones
- A61K31/366—Lactones having six-membered rings, e.g. delta-lactones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D493/00—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system
- C07D493/22—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system in which the condensed system contains four or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P17/00—Preparation of heterocyclic carbon compounds with only O, N, S, Se or Te as ring hetero atoms
- C12P17/18—Preparation of heterocyclic carbon compounds with only O, N, S, Se or Te as ring hetero atoms containing at least two hetero rings condensed among themselves or condensed with a common carbocyclic ring system, e.g. rifamycin
- C12P17/181—Heterocyclic compounds containing oxygen atoms as the only ring heteroatoms in the condensed system, e.g. Salinomycin, Septamycin
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Hematology (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Urology & Nephrology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- Rheumatology (AREA)
- General Engineering & Computer Science (AREA)
- Physics & Mathematics (AREA)
- Rehabilitation Therapy (AREA)
- Cell Biology (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Food Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Inorganic Chemistry (AREA)
- Cardiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
Description
本発明は、生体調節活性のある巨大環状物質、ならびに該巨大環状物質を合成する方法および種々の出発原料から該巨大環状物質を単離する方法に関する。また、これらの活性物質をそれ自体でまたは他の活性物質と組合せて使用し、酵素調節および生体調節を行うことについても記載する。
発明の背景
生化学過程の適切な経路および生物学的免疫機構の最適な機能は、多数の生体調節活性物質により確保されている(Rompp Lexikon,p.3826,″Regulation″)。化学的立場から見ると、これまでに明らかにされた生体調節活性物質は、ペプチド、炭水化物、ステロイド、または脂質であるが、これらの構造要素は、一緒に存在する場合もある(例えば、糖ペプチド、リポタンパク質)。さらに、これらの調節機構のうちの1つ以上の機能が障害を受けることによって生じる疾患を治療するために、生体調節活性物質を適用することは、周知である。ステロイドホルモン、コルチコステロイド、および強心配糖体、ならびに成長ホルモンまたは血液凝固因子を治療に使用することは、これに該当する多くの事例の一部である。しかしながら、このタイプの物質を用いた薬物療法では、有害な副作用を起こすことが非常に多いため、かなりの制約を受ける。こうした側面に対する詳細な考察については、Goodman and Gilman著、″The Pharmacological Basis of Therapeutics″,8th Ed.,New York,1991を参照されたい。例えば、強心配糖体を用いた場合、治療上有用な正の変力作用が心毒性副作用によって抑えられるめ、治療用量を非常に大きく制限しなければならない。更なる例としてコルチコステロイドの適用が挙げられるが、この場合、筋障害、骨粗鬆症、精神障害、感染症に対する感受性の増大などの非常に強い一連の副作用を伴うため、非常に重症の患者に対してだけ、しかも限られた期間だけ、治療に利用することが推奨される。
免疫学的な原因で起こる疾患症候群を、免疫調節活性物質を用いて治療するために、多大な努力が払われてきたが、従来の臨床試験は、納得のいくものではない。このような免疫療法を適用する目的は、特に、慢性関節リウマチや多発性硬化症などの自己免疫疾患に対する基本的治療法を確立することであるが、現在までのところ、こうした治療法は見出されていない。E.Sercarz and S.K.Datta,″Autoimmunity″,Current Biology 6,875-881(1995)によれば、これらの自己免疫疾患のほとんどは、免疫調節障害が原因であった。免疫系の大きな機能低下を特徴とする重度疾患症候群(例えば、癌腫症またはAIDS)に対処するために、従来、免疫調節物質が治療に利用されてきたが、ほとんど効果は得られなかった。
M.J.Clemens,″Cytokines″,Oxford 1991の研究報告に記載されているように、数種の生体調節ペプチドおよび生体調節タンパク質の特性決定が行われた。また、様々な癌腫症、自己免疫疾患、およびウイルス感染症(AIDSを含む)において、サイトカインが重要な役割を果たすことが、数回、既に報告されている。これにもかかわらず、これらのおよび他の生体調節タンパク質および生体調節ペプチドのより広範な治療への適用は、依然としてかなり不足している。こうした原因の1つは、非常に労力のかかることの多い製造技術:すなわち、ヒトまたは動物の組織液からの生体調節活性物質の抽出およびそれに続く精製、にあることは確かである。この組織液中には、生体調節活性物質が極僅かの量で存在するため、治療に必要な量を確保するにはまったく不適当である。アレルギー性副作用および/またはアナフィラキシー反応の危険は、発生することは稀であるが、ヒトの治療に対してかなりの危険因子となる恐れがあり、こうした危険は、遺伝子工学的に製造された生体調節ポリペプチドまたは生体調節糖タンパク質を用いる場合にも依然として存在する。「in vitro」においていくつかの高活性であるポリペプチド因子を治療に使用する際の基本的な問題は、これらの因子が、「in vivo」においてはまったく異なり、ほとんどが非常に弱い活性を呈するという事実が存在することである。一方、多数の物理的バリアおよび酵素的バリアによって、外部から投与されたペプチドおよびタンパク質は、病理的事象の位置(炎症の病巣、癌性潰瘍などの位置)まで到達するのを妨害される。一方、内在性酵素およびそこに存在する他の因子によって、これらは迅速に中和および代謝される。ペプチド、糖ペプチド、およびグリコシドの性質を有する活性物質を経口投与した場合、これらの物質は、数種の分解過程を経て、胃腸系で実際上無効化されてしまう。
しかしながら、「経口的」送達を行う場合、ペプチドおよび糖ペプチドの性質を有する生体調節活性物質の比較的速い分解についても、考慮に入れなければならない。病理的事象または症状発現の位置(例えば、炎症の病巣または癌性潰瘍の位置)に対して治療上有効な濃度を完全に標的化するために、例えば、活性物質のマスク型送達が行われてきた。R.Collier and D.Kaplan,″Immuntoxine″,Heidelberg 1988に、所定の目的に利用可能な毒素をモノクロナール抗体に結合させて使用することに関連して、類似の報告がなされた(薬物ターゲッティング)。しかしながら、この治療技術は、依然として非常に複雑であり、特定の場合に対してのみ、制限的に適用可能な状態である。調節活性物質に関しては、その生体内利用率は、安定性に依存するだけではなく、純物理的過程(例えば、溶解性および膜透過性)にも依存する。このことは、親油性物質に水溶性を持たせて血漿中への溶解を可能にすること、またはNa+イオンもしくはK+イオンなどの親水性活性成分の膜透過を可能にすること、と関連がある。例えば、ミトコンドリアの膜は、通常、カリウムイオンを透過しない。ノナクチンまたはバリノマイシンなどの巨大環状抗生物質は、対応するイオンを有機的に包容することにより、こうした透過を可能にする。
「クラウンエーテル」の発見された年である1967年以来、巨大環構造を有し、無機イオンまたはより小さい分子にクラウン様またはクリプタート様被覆を施す多数の新しい化合物が製造されてきた。しかしながら、このようなクリプタート形成性巨大環状物質を治療に直接適用するためには、低い毒性および良好な生体同化作用を有することが重要な前提条件であるにもかかわらず、合成により製造されたクリプタンド試薬がこうした前提条件を満足することは極稀である。
多くの基本的な生体調節機構は、いわゆるナトリウムポンプにより制御されている。この酵素は、ナトリウムイオンを細胞の内側から外側へ輸送すると同時に、カリウムイオンを反対方向に輸送する能力を有する。エネルギー消費は、アデノシン三リン酸(ATP)の共役加水分解により賄われる。このポンプは、Na+,K+-ATPアーゼと呼ばれる酵素と同じであり、いたるところに分布している。数種の重要な細胞の機能は、このNa+,K+-ATPアーゼにより制御されている。例えば、細胞の容積、熱の生成、細胞内遊離Ca2+イオン濃度、ニューロン伝達、筋収縮、または膜電位は、こうした制御の対象となっている。
また、多数の免疫調節過程の中で、重要な段階が、Na+,K+-ATPアーゼにより制御されている。従って、ナトリウムポンプは、免疫調節においても基本的な役割を担っている。このようにいたるところに分布し、その重要性が分かっているにもかかわらず、この酵素の調節機構については、未だに明らかにされていない。この酵素のいわゆる「強心配糖体受容体部位」は、ナトリウムポンプの生体調節に対する機能的な位置であると考えられる。数種の植物種中に存在する強心配糖体は、この部位と大きな親和性をもって結合し、強心性作用や心毒性作用を示す。しかしながら、強心配糖体は、それらの毒性から、この酵素の内在性リガンドとは同じでないことが分かっている。Progressin Drug Research,41,249-291(1993)に記載のW.Schonerの論文「内在性ジギタリス様因子」の中には、これらの内在性生体調節物質の化学的性質や構造については、研究に多くの努力が払われてきたにもかかわらず、未だに確定できていないと報告されている。現在までのところ、正確な特性決定や構造決定を可能にするのに十分な量のこうした内在性因子は、動物の組織や体液から単離できていない。Na+,K+-ATPアーゼの活性およびNa+,K+-ATPアーゼが関与する数種の生体調節機構は、これらの内在性リガンドと同じかまたは構造的に類似した因子を用いて効果的に制御することが可能であろう。
最近、生体調節過程に関与する数種の単純な無機物質が見出された。しかしながら、これらの無機物質はすべて、単純なメッセンジャー物質またはエフェクターとして使用されるにすぎないことに注意することが重要である。これらの物質は、基本的に、生体調節作用を示すのに必要な三次元構造を持たず、更に、それと関連した構造特異性作用を示す能力に欠ける。Scientific American,1992(5)22-29に記載のS.Snyder and D.Bredtの論文「酸化窒素の生物学的役割」の中には、この気体状化合物は非特異的免疫応答の制御における機能性エフェクターであると報告されている。生物体中では、酸化窒素は、局所的な作用(ほとんどが毒性作用)を示すように非常に短い寿命を有し、常に、「in situ」で産生される。免疫系の食細胞(いわゆるマクロファージ)が、細菌毒素またはサイトカインにより活性化された場合、食細胞は、数時間のうちに比較的大量の酸化窒素を産生することができ、この酸化窒素は免疫学的な攻撃手段(immunological weapon)として利用される。この他の単純な気体状化合物も生体調節過程に関与していると推定される。例えば、エチレンは、植物生態学上、重要な因子であることが分かっている。A.Verma,Science,259,381(1993)に報告されたように、一酸化炭素は、グアノシン一リン酸(GMP)の環化の生理学的制御に関与する。
現在までのところ、他の酸化炭素の生物学的作用に関する報告は極僅かであり、C3O2に関する報告は更に少なくほとんど見られない。これについては、室温で気体であり(bp 7℃)、粘膜を刺激し、ならびに、マスタード油およびアクロレインの臭いがする化合物が関係していることが知られているにすぎない。亜酸化炭素は、比較的強い血液毒素となり、ヘモグロビンと不可逆的に結合する。マウスにおけるこの物質の許容限界は、乾燥空気中で0.2%〜0.4% C3O2である。C3O2は水と反応してマロン酸を形成する。しかしながら、この反応は、微量の鉱酸が存在しない場合、既に報告されている程迅速に進行しない。始源的還元性地球雰囲気下では、かなりの量のC3O2が含まれていたと推定され、最近、W.Huntress et al.,Nature,352,316-318(1991)に報告されたように、星間空間中にこの物質が存在する可能性があるという証拠が見つかった。しかしながら、現在までのところ、生体液中にC3O2が存在する可能性があるという確固とした証拠はない。単量体ガスおよび非晶質重合体の感水性を考慮して、可能性のある生物学的役割のほとんどが先験的に除外された。この水反応性非晶質重合体は、単純な有機化合物の初期合成に対する出発原料であった可能性があるというPrecambrian Research,14,75(1981)に記載のH.YanagawaおよびF.Egamiの仮説は、基本的に可能性があると考えられてきた。
気体のC3O2は、多少は、速やかに非晶質重合体を形成するが、この重合体の色は、黄色〜濃い赤褐色である。これらの重合体の構造に関する明確な知見は、極僅かである。一般的には、これらは、非均一非晶質塊として記載されており、以前は「赤色炭素(red carbon)」と呼ばれていた。亜酸化炭素(carbon suboxide)およびその重合体の化学的性質に関する概説は、T.KappeおよびE.Zieglerの論文〔Agnew.Chem.,86,529(1974)〕に記載されている。重合生成物は、水または希薄アルカリ溶液に部分的に溶解し、濃い黄色〜暗褐色の溶液を生成する。これらの非晶質不規則性重合体の構造に対する数種の仮説的な式が提案されたが、これらはいずれも実験的に確認されていない。最も可能性が高いと考えられるのは、黒鉛様の六方格子構造であるが、周辺部が不飽和であるため、相応じて不安定なはずである。この仮説については、Inorganic Chemistry 2,829(1963)に記載のN.S.SmithおよびD.A.Youngの論文に詳しく説明された。
更に、血漿中にある数種の生物学的に有効性の高い物質は、そのままの状態としてではなく、複合体(conjugate)として見出されることが知られている。例えば、ステロイドホルモンは、血漿中でスルフェートまたはグルクロネートと複合体を形成して存在し、その分解生成物もまた、こうした複合体として脱離される。米国特許第2,565,115号および米国特許第2,720,483号に係る複合体化エストロゲンステロイドまたはデヒドロエピアンドロステロンスルフェート(DHEAS)に対して報告されているように、これらの複合体化ステロイドは、純活性物質よりも更に良好な治療特性を示すことが時々ある。上述の複合体形成は、こうしたステロイド活性物質の生物学的利用率および同化作用を調節し、このことから改善された治療特性を説明することができる。ポリペプチド型活性物質の生体内利用率の調節を、対応する複合体の形成によって行うことについては、あまり知られていない。また、Trends Biochemical Sciences 15,195(1990)に報告されたように、タンパク質とユビキチンとの酵素的複合体化にも、調節機能がある。ポリペプチド型物質の好適な複合体化によって、こうした活性物質の治療用途における突破口が見出された。公知の例として、遅延作用型インシュリンの探索について述べる。インシュリンの治療上の機能時間は、亜鉛塩またはプロタミンスルフェートの添加により、かなり長期化することがわかっている。しかしながら、これらの添加物は様々な副作用を引き起こす可能性がある。インシュリンの遅延放出を確実に行う好適な複合体を得る試みが、多数の発明家によってなされたが、現在までのところ、実現していない。
発明の説明
発明の分野
本発明の目的は、生体調節活性を有する新しい巨大環状物質を提供することである。ただし、この巨大環状物質は、上述の欠点を持たず、かつ疾患において障害を受けた生体調節機構を回復させる物質である。この他、この活性物質は、公知の薬剤の治療効果および生体内利用率を明らかに改良しなければならな。
この目的は、本発明に従って、請求項1〜39に記載の39個の特徴により達成される。
【図面の簡単な説明】
図1:水中でのcom-(C3O2)6の電子イオン化質量スペクトル
図2:アミン複合体com-(C3O2)6・(NH3)2およびcom-(C3O2)6・(NH3)6のエレクトロスプレー質量スペクトル
図3:com-(C3O2)n〔n=558〕の多電荷単位のLC-結合エレクトロスプレー質量スペクトル
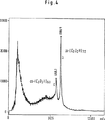
図4:com-(C3O2H)60およびcom-(C3O2H)72のMALDI-質量スペクトル
図5:KBrペレット中のcom-(C3O2)10の赤外スペクトル
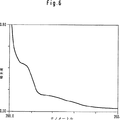
図6:水中でのcom-(C3O2)6のUV-VIS吸収スペクトル
図7:活性物質混合物のHP-ゲル浸透クロマトグラムおよびカラムの分子量標準曲線
構造の説明
本発明に係る物質は、骨格構造が環状オリゴマー化により単純な無機亜酸化炭素C3O2によって構成される化学的化合物である。亜酸化炭素O=C=C=C=O自体およびそれから形成された非晶質重合体は、反応性かつ感水性の物質であるが、驚くべきことに、本発明者は、水に安定な環状オリゴマーである特定の亜酸化炭素構造体を得ることができた。これらが水に安定であるための基本的な前提条件は、これらの構造体がもはや亜酸化炭素の反応性集積C=CおよびC=O二重結合を含まないことである。これは、本発明に従って次のように解決される。すなわち、数個の(好ましくは、4個、6個、8個、または10個の)亜酸化炭素分子を環化し、縮合4-ピロン環または縮合2-ピロン環を形成するとともに、更に、これらの構造体を、以下のような二重歪型(double-strained)巨大環の形で閉環する。
基本的には、環状オリゴマー性亜酸化炭素から形成されたこれらの骨格構造体(frames)は、有機化合物ではなく、亜酸化炭素自体と同じように無機化合物に属すると考えられる。
環状オリゴマー亜酸化炭素骨格が閉環して巨大環を形成したときの化学式は、次の通りである:
com-(C3O2)n
〔式中、nはC3O2の環状オリゴマー化度を表し、comは、これらの単位の結合のタイプ、すなわち、上記の特定した環状オリゴマー性巨大環タイプ(cyclooligomeric and macroring type)を示す記号である〕。
更に、本発明者は、環状オリゴマー性亜酸化炭素の原理的に可能な構造体を際限なく多数閉環して巨大環を形成した場合、所定のn値をもつ極僅かの巨大環だけが安定であることを見出した。これらの環状オリゴマー性巨大環状骨格構造体の中で、次式:
com-(C3O2)n
の数値nが、4、6、もしくは10に等しいか、または4、6、もしくは10の倍数であるものが好ましい。また、より大きい好ましいn値を有する本発明に係る活性物質は、より小さい環状オリゴマー性亜酸化炭素単位を複数結合した式com-(C3O2)nで表される物質であると考えられる。本明細書中で規定されたこのような一連の環状オリゴマー性巨大環型閉環亜酸化炭素の最初のメンバーは、特に重要であり、これについては、以下で詳細に説明する。
環状六量体亜酸化炭素com-(C3O2)6
マススペクトロメトリーにより実験的に決定されたモル質量M=408.19は、式C18O12に対応するとともに、亜酸化炭素のモル質量M=68.032の6倍に相当する。この構造に対して、数種の異性体が存在する可能性があると考えられる。例えば、縮合2-ピロン環もしくは頭-頭縮合4-ピロン環、または6個が交互に頭-尾縮合した4-ピロン環を有する以下に示された構造(スペクトル特性および他の性質に基づいて、この構造が最も可能性が高いと推定される)が考えられる。
実際の電子分布は、おそらくはピロンおよびピリリウムと記された上記の限界構造(limit structure)の間にあるが、溶剤および溶媒依存性の他の多少分極した互変異性型電子構造をとる可能性もある。
ヒドロキシ-ピラン誘導体およびピリリウム塩誘導体
この他に、一般式(C3O2)6・H1〜6で表される閉環六量体亜酸化炭素のいくつかの還元型誘導体の存在することが、質量スペクトルに現れている(図1)。水溶液中では、本発明に係る活性物質はまた、ヒドロキシ-ピラン誘導体として存在することもできる。水素が数個付加することにより生成する還元型ヒドロキシ-ピラン誘導体の一般式は、次の通りである:
com-(C3O2)n・Hm
〔式中、結合水素原子の数mは、環外酸素原子の数nによる制約を受けるため、mは≦nとなる〕。
完全還元型ヒドロキシ-ピラン誘導体は、閉環六量体(cyclohexamer)の場合、次式:
com-(C3O2H)6
で表され、モル質量M=414.24を有し、更に、無機または有機の誘導体を形成する上で特に重要であり、com-(C3O2H)6と共に、閉環六量体系列中の基本単位となって、自己会合体および異なる誘導体の形成に利用される。閉環六量体亜酸化炭素の4-ヒドロキシ-ピランcom-(C3O2H)6の推定構造は、次のように表される。
一般的には、酸または塩基ならびに数種の容易に解離する塩などの強イオン性薬剤の存在下で、アニオンAnおよびカチオンKaを含むピリリウム塩化合物が生成すると考えられる。本発明に係る活性物質と、酸、塩基、または一般式Ka・Anの塩化合物とから形成されるピリリウム塩誘導体の化学式は、次の通りである:
com-(C3O2)n・Ka n An n
〔式中、KaおよびAnは、ピリリウム骨格の双性イオン電荷の合計2nを中和するカチオンおよびアニオンの対イオンである〕。ピリリウム塩化合物の構造は、次のように表すことができる。ただし、対イオンは、水溶液中において厳密に局在化されるわけではない。
アニオンAnおよびカチオンKaの対イオンは、次のような形態で存在することができる:
− 個々の一様な無機または有機のカチオンおよびアニオンとして存在する場合、例えば、すべてのKa=Na+かつすべてのAn=Cl−の場合;
− 無機または有機のカチオンおよびアニオンの混合物として存在する場合、例えば、これらのイオンの生理学的濃度に対応した関係で存在する場合;
− 両方の対イオンを含有する双性イオン化合物自体として存在する場合、例えば、アミノ酸、ベタイン、イオン性石鹸などとして存在する場合。
本発明に係る活性物質のピリリウム塩誘導体のほとんどは、水に非常によく溶ける。クロリドまたはスルフェートなどのアニオンを有するピリリウム塩のアセトンまたはエタノールに対する溶解性は少し低いが、本発明では、このことを利用して、本明細書中に記載の活性物質の単離を行う。生理学的な液体中では、活性物質の双性イオン電荷は、周りに存在するアニオンおよびカチオンによって中和される。従って、特定のイオンが化学的に結合した塩化合物であると言うよりも、対イオンが統計的に分布した状態にあると言う方が、より適切である。
金属イオン、好ましくは、Fe(IIII)、Sb(III)、Cd(II)、Pt(II)、Au(III)、Pb(IV)などの遷移金属イオン、を用いて形成された特定の複合体を使用して、本発明に係る活性物質の単離および検出を行うことができる。また、複雑な無機または有機のアニオン、例えば、SCN−、BF4-、Cr2O7 2-、MnO4-、ピクレート、ライネケートなど、を用いて形成された化合物を使用して、単離および検出を行うこともできる。
付加物、複合体
無機元素または有機化合物との分子付加物の形成は、本発明に係る環状オリゴマー巨大環型環化亜酸化炭素(cyclooligomeric and macroring closed carbon suboxide)の強い会合力によって促進される。有機化合物との化学量論的または非化学量論的付加物は、複合体と呼ばれる。環状オリゴマー巨大環型環化亜酸化炭素は、アンモニア、有機アミン、アミノ酸、ペプチド、またはアミン官能性を有する他の物質、の数個の分子(六量体の場合、好ましくは2個〜6個の分子)と安定な付加物を形成することができる。天然アミノ酸、生体アミン、およびアミン官能性を有するそれらの誘導体は、特に、本発明の範囲内に含まれる。これらのアミン付加物の一般式は、次の通りである:
com-(C3O2)n・(R1R2R3N)m
〔式中、R1、R2、およびR3はそれぞれ、水素原子または有機残基であり、mは1〜nの数であるが、nには先に規定した意味が含まれる〕。
式com-(C3O2H)6・(NH3)2で表される閉環六量体のジアミン付加物のモル質量は、ESマススペクトロメトリーを用いて実験的に求めたところ、M=442.2であり、式com-(C3O2H)6・(NH3)6で表されるヘキサミン付加物については、M=510.4であった(図2)。ジアミン付加物の場合、2個のアンモニア分子またはアミン分子が、恐らくピロン環のカルボニル基に水素結合によって結合する。ヘキサミン複合体の場合、巨大環構造の内部空隙は既に利用されているので、これらはまた、ホスト-ゲスト複合体とも考えられる。
ホスト-ゲスト複合体
本発明に係る活性物質の第2の特に重要な構造特性は、縮合ピロン環または縮合ヒドロキシピラン環が更に、本発明に係る巨大環、好ましくは円筒状の巨大環、を形成することによって得られる。この環構造の分子サイズは、本発明に係るホスト-ゲスト複合体を本発明に従って形成するのに好適な大きさである。「ゲスト」としては、円筒状の空隙中へ立体的に嵌入するかおよび/または特定の結合力によりその周りに結合する元素、小さい分子、または分子断片が考えられる。閉環六量体亜酸化炭素の円筒状巨大環構造の形状および寸法は、次の図から得られる。
カリウム、アンモニウム、銀、もしくはルビジウムなどのカチオン、またはフルオリド、クロリド、ホルメート、もしくはロダネートなどのアニオンは、内径2.9Å〜3.2Å、高さ4.9Å〜5.2Åの閉環六量体の巨大環の円筒状内部空隙中にうまく嵌入する。本発明に従って適用する場合、イオンまたは中性の元素または分子は、com-(C3O2H)6単位の円筒状巨大環構造の空隙中に存在し、かつこれにより包容される。マススペクトロメトリーにより測定されたモル質量は、各成分の合計に対応するが、これによって、これらのホスト-ゲスト複合体は独立した化合物であることが実証される。本発明者は、閉環六量体亜酸化炭素と、より小さい無機または有機の化合物(一般にYで表す)〔例えば、アンモニア、ヒドロキシルアミン、メタノール、エタノール、プロパノール、アセトン、ジクロロメタン、クロロホルム、アセチルクロリン、蟻酸、酢酸、ならびに数種のアミノ酸および炭水化物〕とのホスト-ゲスト複合体が存在することを、実験的に確かめた。本発明によれば、物質Yまたはその構造の一部分は、本発明に係る活性物質の内部空隙中に「ゲスト」として存在する。これは、次の図のように考えられる。
この「包容」を介して、物質Yの特定の性質が「マスク」され、本発明により新たに得られた性質(例えば、改良された膜輸送や生体内利用能)が利用可能となる。
様々なモル質量の活性物質
M≦2,000ダルトン
式com-(C3O2)n〔式中、nは、4、6、10、12、または18である〕を有する上述の環状オリゴマー亜酸化炭素、もしくは式com-(C 3 O 2 H)nを有するヒドロキシ-ピラン型の環状オリゴマー亜酸化炭素、およびモル質量がこの限界未満であるこれらの誘導体、付加物、ホスト-ゲスト複合体は、この低モル質量の範疇に属する。また、2個〜4個の閉環六量体単位から形成された自己会合体も、低モル質量活性物質と見なされる。モル質量M=816Dのcom-(C3O2)12およびモル質量M=1,224Dのcom-(C3O2)18が存在することが本発明者により確認されたが、これらについても同じように説明できる。
M>2,000
まず最初に、この範疇に分類される活性物質は、不均一なモル質量を有する化合物の混合物として現れる。しかしながら、より詳細な分析を行ったところ、原理的には無限に多くの候補化合物が考えられるが、極僅かの化合物(すなわち、特定の分子サイズを有する化合物)だけが調製および同定できることが分かった。
水-アセトニトリル溶液中の活性物質のLC-MSエレクトロスプレー質量スペクトル(図3)は、一連の多電荷イオン(m/z)が存在することを示している。強度の最も大きい成分A31のm/z測定値=1,225.7Dalは、式com-(C3O2)18のプロトン付加分子に正確に一致する。対応する重合体のモル質量の実験値を、式M=n[m/z-1](J.R.Chapmann著、Practical Mass Spectrometry,J.Wiley,New York,1993の202ページ)を用いて求めると、M=31×1,224.6=37,962.5Dalとなる。
同定されたいくつかの化合物のモル質量は、次の表から選ぶことができる。
測定は、MALDIマススペクトロメトリー(MS)、ゲル浸透クロマトグラフィー(GP)、またはポリアクリルアミドゲル電気泳動(PAGE)を用いて行った。MALDIマススペクトロメトリーから明らかなように、n=60および特にn=72に対応する化合物が、他のすべての化合物よりも明らかに高濃度で存在する。この方法で測定されたモル質量は、ヒドロキシ-ピランオリゴマーの式com-(C3O2H)nにおけるn=60およびn=72と非常に良い精度で一致する。これらの化合物は、n=60またはn=72の環状オリゴマーであるか、または閉環六量体の基本単位{com-(C 3 O 2 H)6}sのs=10倍量またはs=12倍量の自己会合体であると考えられる。これらの化合物com-(C3O2H)60およびcom-(C3O2H)72の物理化学的性質および分光学的性質は、構造の対称性が高いことを示唆しており、例えば、10個、12個、またはそれ以上のcom-(C3O2H)6単位が球状に配置されたものとして説明することが可能である。また、五角形または六角形の対称性を有するサンドイッチ型配置により、多数の双性イオンの電荷の中和を説明することができる。
ポリアクリルアミドゲル電気泳動(PAGE)による測定では、M〜5kDの領域に強いバンドが現れ、場合により更に、モル質量値約10kD、12.5kD、15kD、30kD、60kD、および120kDの位置にラインが現れた。これらの数値は、オリゴマー化度n=72、144、180、216、432、864、および1,728と許容しうる精度で一致する。大変不思議なことに、これらの数値は、数値6および12の特定の倍数になっている。ゲルのポリアクリルアミド濃度が16.5%の場合、際だって強いバンドがM〜5kDの領域に存在する。しかしながら、同じサンプルを異なるゲル(例えば、ポリアクリルアミドの含有量がより少ないゲル)に適用すると、主バンドは、2倍の大きさの領域(〜10kDの領域に)に現れることがある。この異常は、活性物質に特異的な会合-解離平衡により説明される。
会合平衡および膜輸送
この他、本発明者は、より大きい分子量をもつ化合物の透析および限外濾過においても、特定の異常を観測した。所定の時間透析を行った後、大きな活性物質(通常は膜非透過性である活性物質)が膜の両側に検出された。これについては次のように説明される。すなわち、次の式1に従って、より大きい会合体が解離して、より小さい膜透過性の形態になり、これらが外側の透析液中で再び合体して、より大きな自己会合体を形成する。透析時間を長くすると、膜の両側で平衡が進行する。
{com-(C3O2)n}s⇔{com-(C3O2)n}s-p+{com-(C3O2)n}p (1)
式中、s=2、3、4、5、6、10、または12、あるいはこれらの数の倍数であり、p<sである。単純な環状オリゴマーと、それらが複数会合したより大きいモル質量を有する誘導体との平衡は、多数の要因に依存し、例えば、溶剤の性質、pH値、アルカリ金属イオンおよび他のイオンの濃度、温度、ならびに溶液中に存在する他の物質との複合体により影響を受けることがある。平衡(1)により、本発明に係るより大きいモル質量の活性物質が、通常は侵入が阻害される細胞空間中へ浸透することが可能となる。膜の外側の空間において、本発明に係る活性物質は、より大きなcom-(C3O2)n化合物として存在できる。式(1)による解離を介して、これらの活性物質は、膜を通過することができ、従って、膜の内側の空間に到達し、そこで会合により再び形を変えてより大きな化合物になることができる。
安定性にもよるが、より大きな自己会合体はまた、活性物質の生理学的貯蔵および輸送を行う働きするため、病状発現場所まで到達することができる。これらの自己会合体は、到達場所において、それ自体としてまたは他の活性物質との複合体として、生体調節による治療効果を呈する。膜非透過性物質Yの「マスク型」膜輸送は、本発明に従って、この物質を活性物質の円筒状内部空隙中に「隠蔽」することによって行うことができる。
分光学的特性決定
一般的には、本発明に係る活性物質の分子スペクトルは、バンドが比較的少なく、対応する構造の対称性が高いことと一致する。KBrペレット中で測定された赤外スペクトル(図5)は、3500〜3000cm-1、1680〜1620cm-1、1400〜1385cm-1、1210cm-1、1100cm-1、および830〜600cm-1に数種の特徴的な吸収バンドを示すが、このうちの1660cm-1の強いバンドは、4-ピロン環の「環呼吸振動」と解釈される。1720cm-1にIR吸収バンドが存在しないことから、2-ピロン構造である可能性はない。
UV-VISスペクトルの最も強い吸収極大は、約190nmにあり、約220nmおよび265nmに肩を有する(図6)。明らかなように、共役二重結合から期待される約320nmの強い吸収の代わりに、240nm〜400nmの非特異的ななだらかな吸収が存在する。しかしながら、本発明者は、いくつかの付加物に対して310nm〜340nmの励起放射線を照射すると400nm〜450nmの領域に蛍光が発せられるのを見出した。このことは、より強い遷移(ただし、対称性に関しては禁制遷移)が存在することを示唆する。
分析反応
式com-(C3O2)nで表される活性物質は、薄層クロマトグラフィーにおいて五塩化アンチモンまたはリーベルマン-ブルヒアルト試薬による陽性反応から同定することができる。すぐ使用できるシリカゲル-60プレート(Merck)および1-プロパノール:エチルアセテート:20%酢酸の比が60:10:30である溶離混合液を用いて分離を行う。スプレー試薬として、四塩化炭素を溶剤とした五塩化アンチモンの飽和溶液、または2mlの無水酢酸および2mlの濃硫酸を20mlの無水エタノールに溶解した混合液を使用する。スプレーの後、120℃において約10分間、プレートを加熱し、λ=365nmのUV光を用いて調べる。蛍光を発するスポットは、本発明に係る活性物質が存在することを示す。
アミン付加物の形態の活性物質は、陽性のニンヒドリン反応を呈するが、この反応を利用して、分析的検出または分光学的アッセイを行うことができる。この反応はまた、ほとんどのアミノ酸およびペプチドによっても起こるので、分析に利用する場合は、クロマトグラフィーによる分離を行った後でのみ有効である。薄層クロマトグラフィーの場合、すぐ使用できるシリカゲル-60プレート(Merck)および溶離剤として1-ブタノール:エタノール:水の比が50:30:20(v/v)である混合液を使用する。スプレー試薬として、エタノールを溶剤とした0.1%ニンヒドリン溶液(ただし、この他に、2%(v/v)の氷酢酸および0.5%(v/v)のsym-コリジンを含有する)を使用する。Rf領域0.32〜0.45の黄色のスポットは、本発明に係るいくつかの活性物質が存在することを示す。
本発明に係る活性物質のヒドロキシ-ピラン基は、フォリン-チオカルト試薬により僅かに陽性のフェノール反応を呈するが、この反応を利用して、同定を行うことができる。タンパク質測定のための既知のローリー法も、この反応に基づいているため、クロマトグラフィーによるタンパク質またはフェノール性物質からの分離を最初に行わなければならない。
本発明に係る物質の分子サイズにより分析的分離を行うために、HP-GP法(高性能ゲル浸透クロマトグラフィー)を使用する。この分離は、好ましくは、TSK G-2000 SW(Toso-Haas)カラム600×7.5mm中で、50mMホウ酸緩衝溶液(pH=8.1)を溶離剤として用いて行う。混合物中の活性物質成分のモル質量は、保持体積の測定値(図7)を用いて検量図(図7A)から求める。既知の分子量のポリエチレングリコール標準を用いて検量線を作成する。
成分の極性によりクロマトグラフィー分離を行うために、逆相のHPLC法を利用するが、好ましくは、固相としてNucleosil 5 C 18カラム(Macherey Nagel)を使用し、好ましくは、溶離剤として10%〜90%の濃度勾配をもつアセトニトリルの水溶液を使用する。
本発明に係るピリリウム塩誘導体は、対イオンの既知の分析反応(例えば、銀イオンによるハロゲン化物イオンの沈殿、またはバリウムイオンによるスルフェートイオンの沈殿)を呈することが特徴である。
本発明に係る活性物質は、ウワバイン、ジゴキシンなどの強心性ステロイド配糖体の抗体との高感度の交差反応を呈する。これらの有機化合物はこのままでは免疫原性がないので、最初に、BSAまたはアビジンなどのより大きなタンパク質分子と化学的に結合させる。これらの複合体をウサギに数回投与すると、特異的な抗ウワバイン抗体または抗ジゴキシン抗体が得られる。これらの抗体と本発明に係る活性物質との交差反応は、酵素様イムノアッセイELISAまたはラジオイムノアッセイ(RIA)の方法を用いて調べられる。これらの技法を用いると、非常に少量の活性物質のアッセイを高感度で行うことができる(pg領域)。ヒト体液のアッセイは、心臓疾患に特異的な内科療法においてのみ利用される強心配糖体の存在により妨害を受けることがある。
より大きなモル質量(M>2.0kD)を有する本発明に係る活性物質は、免疫グロブリンとの顕著な特異反応を示す。ヒトまたは動物の免疫グロブリンとのこうした免疫特異的沈殿は、分光測光、およびアガロースゲル中でのオクタロニー法またはLaurellによる免疫電気泳動法によって調べられる。正常な血清または病理的血清から得られた免疫グロブリンとの反応に顕著な差異があれば、種々の免疫疾患の診断にこうした反応を適用することができる。
O-アルキルおよびO-アシル誘導体
Rで表される残基の無機または有機の分子と、基本骨格の酸素原子との結合を介して、一般式:
com-(C3O2)n・Rm
で表される無機および/または有機の誘導体または複合体が形成される。ただし、R=無機または有機の分子、および/または有機の残基、好ましくは、メチル、エチル、アセチル、ベンジル、ならびにm≦2nである。
製造
本発明によれば、亜酸化炭素(これに関するかぎり、公知の方法で製造することができる)を出発原料として使用し、本発明に係る巨大環状物質を合成により製造することができる。
本発明によれば、分別蒸留により精製されたC3O2を、光化学的にまたは好適な助剤を用いて環状オリゴマー誘導体へ転化する。亜酸化炭素の合成は、従来の方法を用いて、五酸化リンの存在下でおよび/または加熱により、マロン酸またはその誘導体などのより小さいジカルボン酸から2倍量の水を除去することにより行う。しかしながら、この方法では、望ましからぬ非晶質重合体亜酸化炭素の生成が進行する。これとは対照的に、本発明者は、非プロトン性溶剤中で酸またはそのエステルの熱的脱水を行う方が、本発明の活性物質の形成にははるかに好適であることを見出した。本発明によれば、酸または対応する誘導体を、加熱および攪拌を行いながら、非プロトン性溶剤(好ましくは、ジメチルホルムアミドまたは無水酢酸)に溶解する。この混合物を120℃〜150℃まで加熱するが、この際、数分で、既にC3O2の生成が見られる。このようにして得られた亜酸化炭素を、本発明に係る環状オリゴマー活性物質に変換するために、本発明では、光化学的活性化を行うかおよび/または好適な助剤の添加を行う。巨大環構造の形成のための一種の鋳型として働く物質が、効果的な助剤であることが分かった。好ましい助剤は、巨大環com-(C3O2)6の内部空隙(内径2.9Å〜3.1Å)に対応した半径を有するイオンの安定な塩化合物である。好ましいイオンは、ルビジウム(2.94Å)、カリウム(2.66Å)、アンモニア(2.86Å)、およびフッ化物(2.72Å)である。
本発明者は、いくつかの酵素(好ましくは、「ポリケチドシンターゼ」(PHS)のクラスに属する酵素)を利用して、本発明に係る亜酸化炭素の環状オリゴマー巨大環型環化誘導体を合成できることを見出した。数種のカルボン酸誘導体(好ましくはマロン酸、好ましくはマロニル-補酵素Aとして)を利用した。このマロニル補酵素Aは、ビオチンの存在下で、アセチル-補酵素AおよびCO2から容易に調製することができる。
本発明によれば、本発明に係る生体調節活性物質はまた、一酸化炭素を出発原料として得られるいくつかの大量生成物の副産物から単離できる。本発明者は、驚くべきことに、一酸化炭素または合成ガスを出発原料として工業的に製造される数種の既知の有機合成生成物の中に、本発明に係る活性物質が少量(ただし、検出可能な量)含まれる場合があることを見出した。このことは、COおよび合成ガス中に少量の亜酸化炭素が含まれると考えることにより説明できる。これらの大量生成物中に含まれる本発明に係る極めて少量の活性物質を増量するために、分別蒸留を適用する。2部〜60部(他に記載のない限り、「部」は「重量部」である)、好ましくは20部、の水または水性緩衝溶液を、100部の出発原料(好ましくは、合成ガスから製造された工業用メタノール)に添加し、蒸留塔に通してこの混合物から最初にメタノールを留去する。残りの水相では、本発明に係る活性物質の含有量が増大する。新しいメタノール相を添加して蒸留を多数回繰り返すことにより、本発明に係る活性物質がかなりの濃度で得られる。本発明に係る活性物質は、分別蒸留を行うか、または固相への吸着(好ましくは木炭または逆相シリカ)および溶剤混合液(好ましくは、水-エタノール)を用いた脱離を行うことにより、この溶液から単離される。
本発明によれば、本発明に係る活性物質はまた、植物抽出液、植物細胞培養液、または細菌培養液から単離することもできる。多数の植物種を調べたが、こうした植物種の中では、本発明に係る活性物質はそのままでは存在せず、その代わりに、他の未定義の複合体(好ましくは、毒性の植物成分)として存在する。好ましい粗製原料の供給源は、アルカロイドまたは心毒性配糖体などの毒性成分を含有する植物種である。また、比較的高含有量のサポニンまたはタンニンを含む植物種も、本発明に係る活性物質の単離に好適な出発原料を提供する。根、根茎、茎、葉、樹皮、もしくは種子、またはこれらに対応した植物細胞培養液(既知の方法を用いてカルス生成により開始される)は、植物供給源として好適である。
分子の小さい亜酸化炭素誘導体分子、好ましくはcom-(C 3 O 2)n、の製造が望まれる場合、本発明に従って以下の方法を適用する。すなわち、10部の抽出剤(好ましくは、30%のアルコール-水混合液)を、ヘキサンで脱脂した乾燥植物材料1部に添加し、更に、軽く加熱しながら24時間組織解離する。この処理を数回(好ましくは、2〜3回)繰返し、アルコール性抽出液を合わせて濃縮する。濃縮されたチンキに、チンキを基準に0.01%〜5%、好ましくは1%の量の酸(好ましくは、酢酸または塩酸)を添加し、その後、煮沸し、短時間(好ましくは、10分間〜30分間)、80℃〜100℃に保つ。冷却した溶液を、塩基(好ましくは、NH 4 OH)で中和し、液体100部あたり1部〜20部、好ましくは5部〜10部の木炭で処理する。濾過した木炭を再び水で洗浄し、更に濾過する。減圧下で乾燥した木炭を、沸騰させた抽出剤(好ましくは、1:1エタノール-水)で処理する。この処理を2回繰り返す。このようにして得られた本発明に係る活性物質の溶液は、安定であり、長期間の保存に適す。また、溶液を合わせて濃縮し、凍結乾燥させてもよい。固体残渣の精製は、再結晶(好ましくは、アルコール-エーテル混合液から)を繰り返すことにより行う。このようにして単離された付加物は、長期間保存しても安定である。
高分子環状オリゴマー亜酸化炭素化合物の製造が望まれる場合、本発明に従って以下の方法を適用する。すなわち、5部〜20部、好ましくは8部のメタノールを、石油エーテルで脱脂した乾燥植物材料1重量部に添加し、更に、軽く加熱しながら1時間〜36時間、好ましくは16時間組織解離する。この処理を数回(好ましくは、2回)繰返し、抽出液を合わせて濃縮する。濃縮した溶液を、水と混和する有機溶剤(好ましくはアセトンまたはエタノール)に、1:20〜1:2、好ましくは1:8の比で添加する。生成した沈殿を濾過または遠心により分離し、最小量の水または緩衝溶液に溶解する。これらの全処理を1回〜5回(好ましくは2回)繰り返す。こうして得られた粗生成物を最小量の水(pH9〜10.5の緩衝液でアルカリ性にしたもの)に溶解し、膜(好ましくは、排除限界が3kDの膜)を使用して、蒸留水(pH9〜10.5の緩衝液でアルカリ性にしたもの)に対する透析を行う。膜の外側の水を数回交換しながら、より長い透析を行った後(好ましくは3日間〜4日間の透析を行った後)、膜の内側の溶液を濾過し、注意深く濃縮し、更に、凍結乾燥した。
本発明によれば、イオン交換機能を有する樹脂、ゲル、または改質多糖などの中性吸収剤またはイオン性固体相を利用して、様々なモル質量を有する本発明に係る活性物質の単離を行う。本発明に係る活性物質が双性イオンの特性を有するため、アニオン交換相−ならびにカチオン交換相−または混合床交換相を適用できる。最初に、野菜または他の材料の抽出物をイオン交換相で処理する。成分が固体相に結合した後、溶出液中に通常の内容物(炭水化物、アミノ酸)が検出されなくなるまで、過剰の中性または弱酸性の溶離剤(好ましくは、水または緩衝溶液)を用いてカラムをよく洗浄する。カチオン交換相からの脱離は、希鉱酸(好ましくは、希塩酸)または希有機酸(好ましくは、希蟻酸または希酢酸)を用いて行う。アニオン交換相に結合した本発明に係る活性物質の放出は、希アルカリ(好ましくは、0.1モル〜0.3モルの水酸化アンモニウム溶液または水酸化カリウム溶液)を用いて行う。逆相シリカからの脱離は、溶剤(好ましくはメタノールまたは水性アセトニトリル)を用いて行う。
本発明によれば、中性相(例えば、シリカゲル、ポリアミド、または種々の多糖)からの脱離は、0.2%〜5%、好ましくは1.2%のドデシル硫酸ナトリウム(SDS)溶液または1モル〜12モル、好ましくは8モルの尿素溶液を用いて行う。
本発明によれば、本発明に係る様々なモル質量を有する活性物質の分離および精製は、ゲル濾過によりまたは膜透析および限外濾過により行う。本発明に係る活性物質をそれらの分子サイズにより分離するために、合成固相(好ましくは、Sephacryl 200、Sephadex LH-20、またはTSK HW-60)を用いてゲルクロマトグラフィーを行う。溶離剤として、弱塩基性の緩衝溶液(好ましくは、酢酸アンモニウムもしくは重炭酸アンモニウム)または0.01モル〜0.3モル(好ましくは0.15モル)のNaCl溶液もしくはKCl溶液を使用する。これらの分離方法では、分子量のより大きい化合物が最初に溶離し、com-(C3O2)6またはcom-(C3O2)10などのより小さい化合物は遅れてカラムから流出する。
本発明によれば、野菜の成分を含む本発明に係る活性物質から形成された数種の複合体も、直接単離することができる。ほとんどが粘着性で黄褐色のこれらの複合体は、有機溶剤(好ましくは、ジエチルエーテルを含むアセトン)を利用して、濃縮されたメタノール性植物抽出液から沈殿させることができる。数回(好ましくは、3回〜5回)の沈殿を繰返すことにより、こうして得られた複合体は比較的均一なものとなる。本発明によれば、次のような塩析法を用いて、本発明に係る複合体の切断を行うことができる。複合体を水に溶解し、更に、最終溶液を基準に、5%〜50%(w/w)、好ましくは15%の量の無機塩、好ましくは硫酸アンモニウムを添加する。この溶液に、有機溶剤、好ましくはn-ブタノールまたは2-プロパノール、を添加し、これを強く振盪する。相を分離させ、この処理を2回〜5回、好ましくは3回繰り返す。ただし、この際、水性相のpH値を酸を用いて1に調節する。本発明に係る切断処理を更に行った後、複合体を水に溶解し、アンモニアを用いてpH値を調節してpH10とし、次いで、攪拌しながら、この溶液を塩素化溶剤(好ましくはジクロロメタンまたはクロロホルム)に1:0.5〜1:6、好ましくは1:2の比で添加する。強力に振盪することにより生成した非常に安定で泡の多いエマルションを分離し、減圧下でエマルションから有機溶剤を除去する。
この他、本発明に係る活性物質は、細菌に由来する出発原料から単離することもできる。このために、種々のタイプの細菌培養液、好ましくはBCG
Corynebacterium parvum、またはEscherichia coliを、本発明に従って使用することができる。最初に、物理的処理(好ましくは、超音波処理)および希鉱酸(好ましくは希塩酸)を利用した加水分解処理を行う。濾過された加水分解物を必要に応じて中和し、固相(好ましくは順相または逆相のシリカゲル)に通す。アミノ酸、炭水化物、および他の単純な加水分解生成物が溶出液中に検出されくなくなるまで、種々の中性溶離剤を用いて固相を処理する。本発明に係る活性物質の脱離は、希アルカリ(好ましくは、0.1モルから0.2モルの水酸化アンモニウム)を用いて、または逆相の場合は、メタノールもしくは水性エタノールもしくはアセトニトリルを用いて行う。
動物の組織および組織液には、未定義の複合体として本発明に係る活性物質が少量含まれる場合がある。本発明によれば、注意深く凍結乾燥された有機液体(好ましくは尿)の組織の有機抽出を最初に行う。本発明に係る活性物質は、選択的アフィニティークロマトグラフィー法を用いて、濃縮された有機抽出液から単離および精製する。この目的のために、既知の強心配糖体(好ましくは、ウワバインまたはヘレブリン(hellebrin))を、固相(好ましくはSepharose)に共有結合させる。このアフィニティー相は、濃縮された粗製材料溶液からの本発明に係る活性物質を保持する。弱酸性または中性の緩衝溶液を用いてカラムを多数回洗浄した後、酸性またはアルカリ性の緩衝溶液を用いて本発明に係る化合物を放出させる。
生体調節用途
本発明者は、本発明に係る活性物質がナトリウムポンプとしても知られるNa+,K+-ATPアーゼ酵素の活性を効果的に制御することを見出した。広範に分布するこの酵素は、いわゆる能動膜輸送により、最も重要なアルカリ金属イオンの細胞外および細胞内の濃度を制御する。このために必要なエネルギーは、この酵素の活性と直接的に結びついたATPの加水分解によって供給される。本発明に係る活性物質は、この酵素の複合体の活性を制御することができる。この制御の方向および強さは、本発明に係る活性物質の濃度およびモル質量に依存する。存在するアルカリ金属イオンおよび他の無機イオンの性質および濃度は、この制御作用に実質的な影響を与える可能性がある。本発明に係る活性物質を赤血球懸濁液に添加したところ、細胞外Na濃度の増大、すなわち、ナトリウムポンプの活性化が観測された。これとは対照的に、本発明に係るより小さいモル質量の活性物質が特定の濃度にあるときに、Na+,K+-ATPアーゼ酵素の抑制がin vitroで観測された。
ウワバインまたは他の強心配糖体の中毒性副作用の軽減は、本発明に係る活性物質をこれらの配糖体と併用した場合にも観測された。本発明に係る活性物質を、0.02〜2モル/配糖体1モルのモル比、好ましくは1:1のモル比で添加すると、ヘレブリンのLD50値が著しく高くなるが、これは急性毒性の低下を意味する。更に、本発明に係る活性物質は、経験的に確立されたものであるが、数種の他の必須酵素(例えば、コラゲナーゼ、ヒアルロニダーゼ、ホスホキナーゼ、および他の酵素)の活性を制御することができる。いずれの場合からも示唆されるように、本発明に係る活性物質は、Na+,K+-ATPアーゼ酵素の内在性リガンドとして利用可能である。
免疫調節
本発明者は、本発明に係る活性物質に対して数種の免疫調節作用を見出した。これらの機構はまた、部分的には、上述したNa+,K+-ATPアーゼの制御により説明することができる。なぜなら、この酵素は、多数の免疫学的過程に実質的に関与するからである。
更に、本発明に係る活性物質の新しい免疫調節作用は、これらの物質がFc受容体に対して特異的な親和性を有するという点にも見られる。これらの受容体は、種々の免疫細胞に係留されており、それらの占有状態または非占有状態が、これらの細胞の活性を制御するうえで基本的な役割を果たしている。臨床試験において、本発明に係る活性物質は、抗体依存性細胞障害作用(ADCC)に関して、病理学的に活性化されたキラー細胞(K細胞)および他のリンパ球の活性を著しく抑制した。これとは対照的に、自発的細胞障害作用(SCMC)に関するナチュラルキラー細胞(NK細胞)の活性は、本発明に係る活性物質により、様々な影響を受けた。例えば、リウマチ性疾患の患者では、病理学的に過剰刺激された自発的細胞障害作用は、明らかに抑制される。健康診断の被検者では、自発的細胞障害作用は、極僅かに影響を受けるにすぎない。こうした臨床データから、本発明に係る活性物質は、病理学的な自己攻撃過程を抑制するため、リウマチ疾患の原因療法、または組織もしくは器官移植拒絶反応の防止に好適であることが分かる。ここで特筆すべき重要な点は、これらの効果のすべてが、μg/kg程度の極めて少量の活性物質を用いて得られることである。一方、本発明に係る化合物の毒性は、極めて低い。従って、本発明をヒトの治療に適用するにあたり、最も重要な薬物毒性学上の前提条件が満たされる。本発明に係る活性物質をリウマチ疾患の治療に使用すると、この他にも明らかな利点が得られる。小さい環状オリゴマーcom-(C 3 O 2)n(好ましくはn=6)およびその付加物は、極めて強い鎮痛作用および鎮痙作用を呈する。この鎮痛作用および鎮痙作用は、局所投与を行った直後に現れ、リウマチ疾患の治療に適用するうえで重要な利点となる。痛みや痙攣を迅速に軽減する働きは、通常の免疫調節を回復させれば、長期間持続する。本発明に係るより大きい分子質量の活性物質は、免疫刺激作用とそっくりの顕著な非特異的作用を示すことができる。このことは、細菌感染に関する動物実験において確認されており、疑う余地はない。活性物質で処理された動物は、致死量のPseudomonas aeruginosaを投与した場合、対照グループの動物よりも生存率がかなり長い。
本発明に係る生体調節活性物質は、純粋な物質としてまたは物質の混合物として別々に投与することもできるし、あるいは医薬品組成物の形態で投与することもできる。ただし、後者の組成物には、医薬品として安全な1種および/または数種のアジュバント、および/または本発明に係る物質以外の担体、が含まれていてもよい。こうした物質としては、0.9%塩化ナトリウム溶液、1%〜5%グルコースまたはフルクトース溶液、カルボキシメチルセルロース、ジャガイモデンプン、ラクトース、ラノリン、マンニット、ステアリン酸マグネシウム、1,2-プロピレングリコール、グリセリン、セチルステアリルアルコール、ニパギン(nipagin)、ラウリル硫酸ナトリウム、およびタルクが挙げられる。場合に応じて、こうして製造された組成物へ、医薬品として有効な他の物質またはアジュバントを更に添加することができる。これらのガレノス製剤としては、非経口注射、筋肉内注射、静脈注射、皮下注射、関節周囲もしくは関節内注射;錠剤、カプセル剤、もしくは滴剤などによる経口投与;または軟膏、クリーム、ゲル剤、もしくは坐薬などによる外用施用、に好適な製剤すべてが含まれる。
以下の実施例の中で本発明を更に説明する。
実施例1
亜酸化炭素からの合成による製造
水冷式還流冷却器を備えたガラス反応器中で、油浴(80℃)を用いて加熱し、更に攪拌を行うことにより、マロン酸15部を無水酢酸80部に溶解する。還流冷却器から延長して2つのドライアイス冷却トラップを連結し、発生する揮発性化合物を回収する。全量の酸が溶解した後、フッ化ルビジウム0.2部を添加し、250W太陽灯を用いて光化学線を照射する。油浴温度は130℃〜150℃まで上昇し、反応混合物は暗褐色になる。高減圧下で揮発性である亜酸化炭素およびその誘導体を、ドライアイスおよびアセトンで冷却されたトラップ中で凝縮させる。分別減圧蒸留により凝縮物を精製する。こうして得られた活性成分の精製および分析を、既知のクロマトグラフィー法を用いて行う。
実施例2
工業用メタノールからの単離
pH9の0.1モル酢酸アンモニウム緩衝溶液250部を、合成ガスから製造されたメタノール1000部に添加し、蒸留カラムを利用して、この混合物から最初にメタノールを除去する。残存する水相にメタノール1000部を再び添加し、メタノールの蒸留を3回〜4回繰り返す。最終的に残存する水相を注意深く濃縮し、木炭で処理する。濾別および空気乾燥された木炭50部を、80%(v/v)エタノールを含む水400部を用いて80℃〜90℃で処理し、30分間温浸を行った後、熱時濾過する。抽出を2回繰り返す。エタノール性抽出液を合わせて、注意深く濃縮および凍結乾燥を行う。
実施例3
Helleborus種からの単離
Helleborus purpurascens(Ranunculaceae科)の根および根茎を乾燥させて粗く刻んだものを、ヘキサン120部で脱脂し、続いて、塩化メチレン80部で予備抽出する。抽出剤を除去した後、残渣を乾燥させ、30%(v/v)エタノールを含む水200部を用いて、室温において24時間浸溶を行う。抽出を2回繰り返し、続いて、抽出物を合わせて濾過し、減圧下で濃縮する。こうして得られた抽出物250部を濃塩酸3部に添加し、95℃において20分間加熱する。中和後、少量の木炭で処理し、濾過する。濾液を減圧下で濃縮して8倍容量のアセトン中に注ぎ、沈殿物を遠心して最小量の水で溶解し、更に、アセトンを用いて2回〜3回繰返し沈殿させる。沈殿物を最小量の0.1モル塩化ナトリウム溶液に溶解し、TSK HW-60を充填したゲルカラム上へ供給する。0.125モルアンモニア水(10%(v/v)2-プロパノールも含まれる)を用いて、5cm/時の流量で溶離させる。230nmにおける光学濃度を測定することにより、検出を行う。
実施例4
Vitis viniferaの種子からの活性物質の単離
Vitis vineferaの種子を乾燥および粉砕したもの25部を、pH=9.6の0.5モルホウ酸緩衝液150部に添加し、加熱して90℃において30分間温浸する。濾液を濃縮して、8倍量の冷却されたエタノール中に攪拌しながら注ぐ。その際に生じた沈殿を遠心し、最小量の水に溶解し、それぞれ6倍量の冷却されたエタノールを用いて2回沈殿させる。最小量の酢酸アンモニウム緩衝溶液(僅かにアルカリ性のpHを有する)に溶解された沈殿物を、限外濾過による分離処理にかける。ただし、30kD、10kD、3kD、1kDの分子排除限界を有する膜を使用する。こうして分離された画分のpHを調節して弱酸性pH値をとるようにし、次いで凍結乾燥する。
実施例5
Phytolacca americanaからの活性物質の単離
Phytolacca americanaの根の乾燥物100部を刻んで粒子サイズを0.5mm〜1.2mmにし、ヘキサン600部を用いて24時間かけて脱脂処理した。最初に、押圧してヘキサンを除去し、次いで、ヘキサンの臭いがしなくなるまで植物材料を空気乾燥する。乾燥された植物材料を、室温において、5%(v/v)酢酸の含まれた水800部を用いて4時間温浸し、更に、この処理を2回繰り返す。抽出物を合わせて濾過し、減圧下で濃縮する。この水溶液100部に、硫酸アンモニウム15部〜50部を滴下し、溶解させる。塩析により沈殿させたタンパク質を、遠心および濾過により除去する。1-ブタノール50部を上澄み50部に加え、これを強力に振盪する。しばらくしてから、有機相を分離し、更に、ブタノールによる抽出を2回繰り返す。ブタノール溶液を合わせて、0.1%アンモニアの含まれた水で逆抽出する。水相を減圧下で濃縮し、ゲル濾過により精製する。
実施例6
Escerichia coliからの製造
トリプロトン20部、酵母抽出物10部、NaCl 20部、および寒天30部を含有し、更に、好適な栄養添加剤が補充されてなる高圧滅菌培地2000容量部に、Escherichia coli株K-12を1:100の希釈比で接種する。細胞数2×109個/mlの飽和濃度に達するまで、培養株を37℃に保持する。反応混合物に超音波処理を施し、90℃において1.0N酢酸と共に20分間加熱し、冷却後、濾過し、更に、減圧下で濃縮する。濃縮された溶液150部を、カラムクロマトグラフィー用の逆相シリカ(RP18)(Merck)上に吸収させ、最初に、2%(v/v)酢酸を含む水で固相を洗浄し、その後、n-プロパノール:酢酸エチル:20mMホウ砂/ホウ酸緩衝液を600%:100%:300%(v/v)の比で含んでなる緩衝混合液1000部で洗浄し、最後に水で洗浄する。アミノ酸、炭水化物、および他の単純な加水分解生成物が溶出液中に検出されなくなるまで十分な時間をかけて、これらの中性溶離剤を用いて固相を洗浄する。本発明に係る活性物質の脱離は、アセトニトリルを用いて行い、過剰のアセトニトリルは減圧下で濃縮することにより除去する。こうして得られた本発明に係る活性物質の溶液を、濃縮する。
実施例7
動物体液からの単離
ブタ尿10,000部を凍結乾燥し、固形残渣をメタノール600部で3回抽出する。メタノール抽出物を20部まで濃縮する。臭化シアン活性化Sepharose 4B 100部を、適切に活性化されたヘレブリンの溶液を用いて、使用される配糖体の80%が固相に共有結合されるまで90分間処理する。こうして調製されたアフィニティークロマトグラフィーカラムに、濃縮されたメタノール溶液10部を注ぎ、化合物が溶出液中に検出されなくなるまで十分な時間をかけて溶離する。本発明に係る活性物質を、0.5モル〜0.2モルの蟻酸を用いて濃度勾配溶離によりカラムから溶離させ、凍結乾燥する。Sephadex LH-20(Pharmacia)が充填されたカラムを用いて、活性物質の精製を行う。最初に、活性物質をカラム上に吸収させ、次いで、20〜60(v/v)%の濃度勾配を有するアセトンの水溶液を用いて溶離する。
実施例8
免疫調節への適用
100/1〜10/1のエフェクター細胞/標的細胞比においてK562標的細胞から放出される51Cr同位体のアッセイを行うことにより、NK細胞の自発的細胞媒介性細胞障害(SCMC)を測定した。健常な被検者10人中8人について、本発明に係る活性物質を評価したところ、平均15%の細胞溶解活性を呈した。病理学的に平均141%まで増大した16人のリウマチ病患者の病理学的SCMC活性は、本発明に係る活性物質の投与により、明らかに正常化された。抗体依存性細胞障害(ADCC)のエフェクター細胞は、本発明に係る活性物質により、更に一様な影響を受ける。次のダイアグラム1から明らかなように、ADCC活性は、健常人においても、更に、リウマチ病患者においも低下する。
ダイアグラム1 活性物質処理を行った場合と行わなかった場合における健常人およびリウマチ病患者の細胞障害
こうした活性の正常化は、Fc受容体に対する活性物質の特異的親和性により説明することができる。
実施例9
臓器移植のための免疫抑制への適用
本発明に係る活性物質の免疫抑制作用により、臓器移植において、移植片拒絶反応が明らかに軽減された。このことは、マウスにおける一連の心臓移植実験を利用して実験的に証明された。
病原体を含まない週齢5〜6週のSprague Dawley DBA/2系統のマウスをドナーとし、C57BL/6系統のマウスをレシピエントとして、Corry,R.,Winn,H.and Ressel,P.,Transplantation 16,343(1973)に記載の同種心臓移植法を適用した。
ドナーとして使用される動物の静脈内ヘパリン化を行った後、それらの心臓を取出して、C57BL/6レシピエント動物の準備ができるまで、氷冷乳酸リンゲル液中に保持した。ドナーの大動脈および肺動脈と、レシピエントの腹大動脈および大静脈と、の吻合は、顕微手術法により行った。
血液の流れが回復した後、心拍動の頻度および強度を観測し、0〜+4の等級付けを行った。脈が停止した後、拒絶が成立したとみなし、開腹して調べた。試験グループのマウスに、以下の量の活性物質を皮下投与により与えた。
− 2.0mg/kg 移植3日前
− 3.0mg/kg 手術当日
− 2.5mg/kg 手術後3日目
− 1.5mg/kg その後、3日ごと
対照グループの動物は、プラセボとしてクエン酸緩衝液だけを用いて処理した。
これらの移植実験において、次の結果が得られた。
プラセボで処理した動物の平均生存日数は、8.2日であった。活性物質で処理した動物は、平均値が22.7日であり、プラセボで処理した動物の生存期間の明らかにほぼ3倍の生存期間を呈した。この効果は、Tリンパ球の引き起こす拒絶反応が特異的に抑制されることから説明される。
実施例10
マクロファージの刺激
HEPESで緩衝され、かつ10%ウシ胎児血清が補充されたRPMI1640培地中に、10匹の健常マウスから得られた脾臓リンパ球を懸濁した。この懸濁液を1時間、37℃に保ち、マクロファージを付着させた。試験グループでは、5mg/kgの活性物質を用いてマウスに腹腔内処理を施し、その後、24時間にわたり活性物質の作用時間を確保した。対照グループの動物には、活性物質を全く与えなかった。両方のグループから得られたリンパ球を、5×105個の付着性マクロファージの入った管中で培養した。
明らかなように、活性物質で処理された動物では、LPS(リポ多糖)およびPHA(フィトヘマグルチニン)により得られる刺激指数(SI)が、有意に大きくなる。
実験11
見掛けの免疫刺激への適用
致死量のPseudomonas aeruginosaを感染させた動物の生存率を測定することにより、非特異的な見掛けの免疫刺激を調べた。
それぞれ30匹〜100匹のマウスから成る3つの試験グループにおいて、各動物に致死量のPseudomonas aeruginosaを投与した。
I.Pseudomonas致死感染を行う7日前、14日前、および28日前に、2μgの活性物質を第1のグループに投与し、21日前に0.25mlの生理的NaCl溶液を投与した;
II.第2のグループでは、第1のグループと同じ活性物質の用量を使用したが、ただし、21日前に0.06mgのシクロホスファミドを投与した;
III.対照グループでは、活性物質を全く投与しなかった。
本発明に係る活性物質は、明らかに生存率を増大させた。既に知られているシクロホスファミドの免疫抑制作用により生存率が低下したが、活性物質によって、明らかに対照グループの値よりも大きい値が保持される。この相互作用は、本発明に係る活性物質の非特異的な見掛けの免疫刺激を示しているが、これまでのところ、新規な免疫機構についての報告はなく、想像の域を出ない。最近、致死量のPseudomonasを投与した直後にサイトカインが爆発的に放出されることが実証された。これにより引き起こされるサイトカインショック状態は、突然死の直接の原因になると推定される。本発明による免疫抑制作用は、このサイトカインショックを防ぐことができ、真の免疫刺激が行われないでも、生存率が驚くほど増大する。
実施例12
競合ELISA法を利用した活性物質のアッセイ
アッセイを行うために、本発明に係る活性物質と抗ウワバイン(a-OU)抗血清との交差反応を使用する。Harris et al.,Hypertension 17,930(1991)に記載の方法に従って、分析用ウワバイン(Sigma)およびアビジン(Fluka)からウワバイン-アビジン複合体(OU-con)を合成した。対応する抗ウワバイン血清の調製において、V.DiBartolo et al.,Life Sciences,57,1417(1995)に記載の改良法を適用した。
最初に、ELISAマイクロタイタープレートを、それぞれ0.1μg/50μl OU-con複合体溶液を用いて4℃で一晩インキュベートした。リン酸緩衝液(PBS,pH=7.4)を用いて非結合複合体を洗い流し、非占有結合部位を1%ゼラチン溶液でブロックした。
未知量の活性物質を含むサンプル溶液から50μlを採取し、ポリプロピレン管中において、一定量の抗ウワバイン血清(0.5μg/50μl)と共に混合し、室温で2時間保持した。その後、各活性物質抗血清サンプルから50μlを採取してプレートに注ぎ、更に3時間インキュベートした。PBSを用いて非結合抗血清を洗い流した後、プロテインAアルカリ性ホスファターゼ(Sigma)の1:500溶液を用いて室温で2時間プレートを処理した。非結合酵素を除去した後、プレートをそれぞれ50μlのp-ニトロフェニルホスフェート溶液(1mg/ml)で処理し、30分間のインキュベーションを行った後、405nmにおける吸光度(A)を自動で読み取った。
検量線を作成するために、5ng/ml〜0.1mg/mlの既知量の活性物質を一定量の抗血清と混合し、上述の方法に従って処理し、吸光度の測定値を、対応する濃度の関数として表した。
Claims (13)
- 前記巨大環状物質が、骨格の環外酸素原子に水素が付加することにより形成される一般式:
com-(C 3 O 2 H) n
〔式中、Hは水素原子であり;comおよびnは先に記載した通りである〕
で表されるヒドロキシ-ピラン誘導体として存在することを特徴とする請求項1記載の巨大環状物質。 - 前記巨大環状物質が、式:
com-(C 3 O 2 ) n ・(NH 3 ) m
〔式中、nは6であり、mは2または6である〕
で表されるアミン付加物の形態で存在することを特徴とする請求項1記載の巨大環状物質。 - 前記巨大環状物質が、式:
{com-(C3O2)n}sまたは{com-(C3O2H)n}s
〔式中、n=6であり、s=10もしくは12である〕
で表される安定な自己会合体の形態で存在することを特徴とする請求項1または2のいずれか1項記載の巨大環状物質。 - −毒性のあるグリコシド、アルカロイド、もしくはタンニンを含有する植物、または植物細胞の培養体を、粗原料として使用すること、
−該粗原料中に含まれる化学的に未定義のコンジュゲートを、水性溶液で抽出すること、
−該コンジュゲートを加水分解により切断すること、および/または該複合体を、アセトン、アルコール、もしくは他の溶剤を用いて沈殿させること、
−得られた混合物をイオン交換体または中性吸収剤に結合させ、他の成分を洗い流すこと、
−塩基性緩衝液または選択的に機能する溶剤混合物により、活性物質を脱離すること、ならびに
−透析、膜濾過、ゲルクロマトグラフィー、または他の方法により、該活性物質を精製すること、更に、場合に応じて、分子サイズに従って該活性物質を分別すること、
を特徴とする請求項1〜4のいずれか1項記載の生体調節活性を有する巨大環状物質の単離方法。 - 免疫系を刺激するための治療薬としての、請求項1〜4のいずれか1項記載の巨大環状物質の使用。
- 炎症性疾患、リウマチ性疾患、および自己免疫性疾患を治療するための、請求項1〜4のいずれか1項記載の巨大環状物質の使用。
- 器官または組織の移植時の移植片拒絶反応を抑制するための、請求項1〜4のいずれか1項記載の巨大環状物質の使用。
- 急性的または慢性的に衰弱した免疫防御またはサイトカイン媒介性ショック現象により引き起こされる疾患を治療するための、請求項1〜4のいずれか1項記載の巨大環状物質の使用。
- 請求項1〜4のいずれか1項記載の巨大環状物質と、生理学的に許容しうる担体とを共に含むことを特徴とする製剤。
- 前記製剤を、経口投与、局所投与、静脈内投与、または動脈内投与することを特徴とする請求項10記載の製剤。
- 前記製剤を、錠剤、カプセル剤、軟膏、ゲル剤、または注射剤により投与することを特徴とする請求項10または11記載の製剤。
- 前記製剤が、他のアジュバントを含むことを特徴とする請求項10〜12のいずれか1項記載の製剤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19600301A DE19600301C2 (de) | 1996-01-05 | 1996-01-05 | Durch Cyclooligomerisierung des einfachen Kohlensuboxids C¶3¶O¶2¶ aufgebaute makrocyclische Verbindungen, Verfahren zu deren Herstellung und Gewinnung sowie deren Verwendung |
| DE19600301.6 | 1996-01-05 | ||
| PCT/EP1996/005867 WO1997025333A2 (en) | 1996-01-05 | 1996-12-30 | Macrocyclic compounds made from suboxide units |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2000503015A JP2000503015A (ja) | 2000-03-14 |
| JP2000503015A5 JP2000503015A5 (ja) | 2008-08-21 |
| JP4195089B2 true JP4195089B2 (ja) | 2008-12-10 |
Family
ID=7782233
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP52482597A Expired - Fee Related JP4195089B2 (ja) | 1996-01-05 | 1996-12-30 | 亜酸化物単位から製造される巨大環式化合物 |
Country Status (26)
| Country | Link |
|---|---|
| US (1) | US6187810B1 (ja) |
| EP (1) | EP0874851B1 (ja) |
| JP (1) | JP4195089B2 (ja) |
| KR (1) | KR19990077000A (ja) |
| CN (1) | CN1209132A (ja) |
| AR (1) | AR005350A1 (ja) |
| AT (1) | ATE233768T1 (ja) |
| AU (1) | AU1307497A (ja) |
| BG (1) | BG102599A (ja) |
| BR (1) | BR9612430A (ja) |
| CA (1) | CA2241870A1 (ja) |
| CZ (1) | CZ208898A3 (ja) |
| DE (2) | DE19600301C2 (ja) |
| EE (1) | EE9800211A (ja) |
| ES (1) | ES2194128T3 (ja) |
| HR (1) | HRP970002A2 (ja) |
| HU (1) | HUP9904191A2 (ja) |
| IL (1) | IL125165A0 (ja) |
| JO (1) | JO1945B1 (ja) |
| PL (1) | PL327657A1 (ja) |
| SI (1) | SI0874851T1 (ja) |
| SK (1) | SK88598A3 (ja) |
| TR (1) | TR199801288T2 (ja) |
| TW (1) | TW376386B (ja) |
| WO (1) | WO1997025333A2 (ja) |
| ZA (1) | ZA9714B (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AUPO280796A0 (en) * | 1996-10-07 | 1996-10-31 | Austin Research Institute, The | Methods of activating or enhancing FC receptors |
| DE10260537A1 (de) | 2002-12-21 | 2004-07-15 | Kerek, Franz, Dr. | Peptide mit hohem Cysteingehalt |
| US20080007890A1 (en) * | 2004-09-30 | 2008-01-10 | Harmon Julianne P | Thermally conductive composite and uses for microelectronic packaging |
| US20060067055A1 (en) * | 2004-09-30 | 2006-03-30 | Heffner Kenneth H | Thermally conductive composite and uses for microelectronic packaging |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2565115A (en) | 1948-10-28 | 1951-08-21 | Squibb & Sons Inc | Method of obtaining a conjugated estrogen preparation |
| US2720483A (en) | 1951-02-21 | 1955-10-11 | Olin Mathieson | Method of obtaining a conjugatedestrogen preparation |
-
1996
- 1996-01-05 DE DE19600301A patent/DE19600301C2/de not_active Expired - Fee Related
- 1996-12-18 TW TW085115731A patent/TW376386B/zh active
- 1996-12-23 JO JO19961945A patent/JO1945B1/en active
- 1996-12-30 KR KR1019980705130A patent/KR19990077000A/ko not_active Application Discontinuation
- 1996-12-30 SI SI9630605T patent/SI0874851T1/xx unknown
- 1996-12-30 US US09/101,401 patent/US6187810B1/en not_active Expired - Fee Related
- 1996-12-30 JP JP52482597A patent/JP4195089B2/ja not_active Expired - Fee Related
- 1996-12-30 WO PCT/EP1996/005867 patent/WO1997025333A2/en not_active Application Discontinuation
- 1996-12-30 CN CN96180086A patent/CN1209132A/zh active Pending
- 1996-12-30 CZ CZ982088A patent/CZ208898A3/cs unknown
- 1996-12-30 HU HU9904191A patent/HUP9904191A2/hu unknown
- 1996-12-30 BR BR9612430-0A patent/BR9612430A/pt unknown
- 1996-12-30 DE DE69626548T patent/DE69626548T2/de not_active Expired - Lifetime
- 1996-12-30 AU AU13074/97A patent/AU1307497A/en not_active Abandoned
- 1996-12-30 IL IL12516596A patent/IL125165A0/xx unknown
- 1996-12-30 PL PL96327657A patent/PL327657A1/xx unknown
- 1996-12-30 EP EP96944678A patent/EP0874851B1/en not_active Expired - Lifetime
- 1996-12-30 AT AT96944678T patent/ATE233768T1/de not_active IP Right Cessation
- 1996-12-30 EE EE9800211A patent/EE9800211A/xx unknown
- 1996-12-30 ES ES96944678T patent/ES2194128T3/es not_active Expired - Lifetime
- 1996-12-30 CA CA002241870A patent/CA2241870A1/en not_active Abandoned
- 1996-12-30 TR TR1998/01288T patent/TR199801288T2/xx unknown
- 1996-12-30 SK SK885-98A patent/SK88598A3/sk unknown
-
1997
- 1997-01-02 ZA ZA9714A patent/ZA9714B/xx unknown
- 1997-01-03 HR HR19600301.6A patent/HRP970002A2/hr not_active Application Discontinuation
- 1997-01-03 AR ARP970100019A patent/AR005350A1/es unknown
-
1998
- 1998-07-03 BG BG102599A patent/BG102599A/xx unknown
Also Published As
| Publication number | Publication date |
|---|---|
| DE19600301C2 (de) | 1999-12-09 |
| ZA9714B (en) | 1997-07-23 |
| AR005350A1 (es) | 1999-04-28 |
| DE69626548T2 (de) | 2003-12-24 |
| EP0874851B1 (en) | 2003-03-05 |
| JO1945B1 (en) | 1997-12-15 |
| SI0874851T1 (en) | 2003-10-31 |
| ES2194128T3 (es) | 2003-11-16 |
| EP0874851A2 (en) | 1998-11-04 |
| AU1307497A (en) | 1997-08-01 |
| BG102599A (en) | 1999-03-31 |
| KR19990077000A (ko) | 1999-10-25 |
| CN1209132A (zh) | 1999-02-24 |
| HRP970002A2 (en) | 1998-04-30 |
| CA2241870A1 (en) | 1997-07-17 |
| CZ208898A3 (cs) | 1998-10-14 |
| IL125165A0 (en) | 1999-01-26 |
| HUP9904191A2 (hu) | 2000-05-28 |
| US6187810B1 (en) | 2001-02-13 |
| WO1997025333A2 (en) | 1997-07-17 |
| TW376386B (en) | 1999-12-11 |
| EE9800211A (et) | 1998-12-15 |
| TR199801288T2 (xx) | 1998-11-23 |
| DE69626548D1 (de) | 2003-04-10 |
| ATE233768T1 (de) | 2003-03-15 |
| PL327657A1 (en) | 1998-12-21 |
| BR9612430A (pt) | 1999-12-28 |
| WO1997025333A3 (en) | 1997-12-24 |
| JP2000503015A (ja) | 2000-03-14 |
| DE19600301A1 (de) | 1997-07-10 |
| SK88598A3 (en) | 1998-12-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE3836006C2 (de) | Monophosphoryllipid-A-Derivate, Verfahren zur Herstellung von Monophosphoryllipid-A-Derivaten und Verwendung von Monophosphoryllipid-A-Derivaten | |
| Oltz et al. | The tunichromes. A class of reducing blood pigments from sea squirts: isolation, structures, and vanadium chemistry | |
| IKEKAwA et al. | Antitumor activity of Hypsizigus marmoreus. I. Antitumor activity of extracts and polysaccharides | |
| JP3286321B2 (ja) | 新規なアミノステロール抗生物質 | |
| US6444706B2 (en) | Guanidine derivatives, processes for preparing them and their use as pharmaceutical compositions | |
| AU773038B2 (en) | Aminosterol compounds and uses thereof | |
| Agrahari et al. | Click inspired synthesis of hexa and octadecavalent peripheral galactosylated glycodendrimers and their possible therapeutic applications | |
| JP4195089B2 (ja) | 亜酸化物単位から製造される巨大環式化合物 | |
| EP0792886A1 (en) | Novel peptide and therapeutic agent | |
| WO1991004258A1 (en) | Inositol derivative and production thereof | |
| Baltina et al. | Synthesis and anti-HIV-1 activity of new conjugates of 18 β-and 18 α-glycyrrhizic acids with aspartic acid esters | |
| WO2001049308A1 (fr) | Nouvelles compositions de renforcement de l'immunité | |
| WO2020119773A1 (zh) | 两性霉素b肽衍生物 | |
| MANABE et al. | Age-related Accumulation of 1-methyl-1, 2, 3, 4-tetrahydro-β carboline-3-carboxylic acid in Human Lens | |
| CN113121627A (zh) | 两性霉素b甲酯肽衍生物及其制备方法 | |
| JP3035846B2 (ja) | プロポリス由来のベンゾピラン誘導体の生理活性 | |
| JP2001316398A (ja) | 抗アレルギー剤 | |
| JPH09104693A (ja) | グリコシド類、グリコシドの無糖分解産物およびその誘導体 | |
| JPH0761993A (ja) | 茶葉サポニン類の製造法及び茶葉サポニン類を含む薬剤 | |
| JP2531487B2 (ja) | 抗hiv活性を有する新規な抽出物 | |
| JPH0686379B2 (ja) | グルコ−ス耐性因子およびその製造方法 | |
| JPH06219974A (ja) | 抗ウイルス性化合物 | |
| JP2000212196A (ja) | 生理活性物質dm9809およびこれを有効成分とする医薬 | |
| JPH09143179A (ja) | プロポリス由来のベンゾピラン誘導体 | |
| JPS63307875A (ja) | ハロサイアミンおよびその製造法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20031226 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070619 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070912 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20071022 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20080212 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080611 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20080611 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20080704 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20080814 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080826 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080925 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111003 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121003 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131003 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |