JP2016190847A - Fgf23融合ポリペプチドを使用する方法および組成物 - Google Patents
Fgf23融合ポリペプチドを使用する方法および組成物 Download PDFInfo
- Publication number
- JP2016190847A JP2016190847A JP2016087432A JP2016087432A JP2016190847A JP 2016190847 A JP2016190847 A JP 2016190847A JP 2016087432 A JP2016087432 A JP 2016087432A JP 2016087432 A JP2016087432 A JP 2016087432A JP 2016190847 A JP2016190847 A JP 2016190847A
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- klotho
- seq
- fusion polypeptide
- fusion
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 638
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 613
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 610
- 230000004927 fusion Effects 0.000 title claims abstract description 379
- 238000000034 method Methods 0.000 title claims abstract description 76
- 239000000203 mixture Substances 0.000 title abstract description 40
- 102100024802 Fibroblast growth factor 23 Human genes 0.000 title description 109
- 101001051973 Homo sapiens Fibroblast growth factor 23 Proteins 0.000 title 1
- 102000015834 Klotho Human genes 0.000 claims abstract description 395
- 108050004036 Klotho Proteins 0.000 claims abstract description 393
- 108090000569 Fibroblast Growth Factor-23 Proteins 0.000 claims abstract description 137
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 claims abstract description 78
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 claims abstract description 78
- 230000001965 increasing effect Effects 0.000 claims abstract description 59
- 210000002966 serum Anatomy 0.000 claims abstract description 51
- 208000030159 metabolic disease Diseases 0.000 claims abstract description 39
- 230000035772 mutation Effects 0.000 claims abstract description 33
- 102000004042 Fibroblast Growth Factor-23 Human genes 0.000 claims abstract 29
- 108050007372 Fibroblast Growth Factor Proteins 0.000 claims description 163
- 102000018233 Fibroblast Growth Factor Human genes 0.000 claims description 161
- 229940126864 fibroblast growth factor Drugs 0.000 claims description 146
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 138
- 150000007523 nucleic acids Chemical class 0.000 claims description 78
- 210000004027 cell Anatomy 0.000 claims description 71
- 108010076504 Protein Sorting Signals Proteins 0.000 claims description 63
- 239000008194 pharmaceutical composition Substances 0.000 claims description 63
- 230000002829 reductive effect Effects 0.000 claims description 60
- 238000011282 treatment Methods 0.000 claims description 57
- 102000037865 fusion proteins Human genes 0.000 claims description 52
- 108020001507 fusion proteins Proteins 0.000 claims description 52
- 102000039446 nucleic acids Human genes 0.000 claims description 51
- 108020004707 nucleic acids Proteins 0.000 claims description 51
- 101001139093 Homo sapiens Klotho Proteins 0.000 claims description 40
- 208000024827 Alzheimer disease Diseases 0.000 claims description 35
- 108091008794 FGF receptors Proteins 0.000 claims description 33
- 102000044168 Fibroblast Growth Factor Receptor Human genes 0.000 claims description 33
- 102100020686 Klotho Human genes 0.000 claims description 33
- 102100020683 Beta-klotho Human genes 0.000 claims description 28
- 101710104526 Beta-klotho Proteins 0.000 claims description 28
- 206010028980 Neoplasm Diseases 0.000 claims description 28
- 102100031734 Fibroblast growth factor 19 Human genes 0.000 claims description 27
- 108090000376 Fibroblast growth factor 21 Proteins 0.000 claims description 26
- 102000003973 Fibroblast growth factor 21 Human genes 0.000 claims description 26
- 208000020832 chronic kidney disease Diseases 0.000 claims description 26
- 230000032683 aging Effects 0.000 claims description 25
- 201000011510 cancer Diseases 0.000 claims description 22
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims description 20
- 206010028289 Muscle atrophy Diseases 0.000 claims description 19
- 230000020763 muscle atrophy Effects 0.000 claims description 19
- 201000000585 muscular atrophy Diseases 0.000 claims description 19
- 239000013598 vector Substances 0.000 claims description 19
- 102000005962 receptors Human genes 0.000 claims description 18
- 108020003175 receptors Proteins 0.000 claims description 18
- 208000023105 Huntington disease Diseases 0.000 claims description 17
- 230000002265 prevention Effects 0.000 claims description 17
- 230000002308 calcification Effects 0.000 claims description 14
- 208000022831 chronic renal failure syndrome Diseases 0.000 claims description 13
- 201000005991 hyperphosphatemia Diseases 0.000 claims description 13
- 206010006187 Breast cancer Diseases 0.000 claims description 12
- 208000026310 Breast neoplasm Diseases 0.000 claims description 12
- 206010049565 Muscle fatigue Diseases 0.000 claims description 12
- 208000008589 Obesity Diseases 0.000 claims description 11
- 235000020824 obesity Nutrition 0.000 claims description 11
- 208000001132 Osteoporosis Diseases 0.000 claims description 9
- 208000024806 Brain atrophy Diseases 0.000 claims description 8
- 206010012289 Dementia Diseases 0.000 claims description 8
- 206010040799 Skin atrophy Diseases 0.000 claims description 8
- 206010064930 age-related macular degeneration Diseases 0.000 claims description 8
- 206010003210 Arteriosclerosis Diseases 0.000 claims description 7
- 201000001320 Atherosclerosis Diseases 0.000 claims description 7
- 206010014561 Emphysema Diseases 0.000 claims description 7
- 101710153349 Fibroblast growth factor 19 Proteins 0.000 claims description 7
- 206010060862 Prostate cancer Diseases 0.000 claims description 7
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 7
- 208000011775 arteriosclerosis disease Diseases 0.000 claims description 7
- 201000001421 hyperglycemia Diseases 0.000 claims description 7
- 208000002780 macular degeneration Diseases 0.000 claims description 7
- 208000002177 Cataract Diseases 0.000 claims description 6
- 206010020772 Hypertension Diseases 0.000 claims description 6
- 208000001145 Metabolic Syndrome Diseases 0.000 claims description 6
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 claims description 6
- 230000010370 hearing loss Effects 0.000 claims description 6
- 231100000888 hearing loss Toxicity 0.000 claims description 6
- 208000016354 hearing loss disease Diseases 0.000 claims description 6
- 206010027175 memory impairment Diseases 0.000 claims description 6
- 201000008482 osteoarthritis Diseases 0.000 claims description 6
- 230000008085 renal dysfunction Effects 0.000 claims description 6
- 208000001076 sarcopenia Diseases 0.000 claims description 6
- 230000037303 wrinkles Effects 0.000 claims description 6
- 206010061598 Immunodeficiency Diseases 0.000 claims description 5
- 208000029462 Immunodeficiency disease Diseases 0.000 claims description 5
- 208000006011 Stroke Diseases 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 230000007813 immunodeficiency Effects 0.000 claims description 5
- 206010011878 Deafness Diseases 0.000 claims description 4
- 102000009490 IgG Receptors Human genes 0.000 abstract description 33
- 108010073807 IgG Receptors Proteins 0.000 abstract description 33
- 230000003247 decreasing effect Effects 0.000 abstract description 9
- 235000001014 amino acid Nutrition 0.000 description 137
- 108090000623 proteins and genes Proteins 0.000 description 94
- 229940024606 amino acid Drugs 0.000 description 85
- 150000001413 amino acids Chemical class 0.000 description 82
- 125000005647 linker group Chemical group 0.000 description 75
- 102000004169 proteins and genes Human genes 0.000 description 70
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 66
- 235000018102 proteins Nutrition 0.000 description 66
- 238000006467 substitution reaction Methods 0.000 description 59
- 239000012634 fragment Substances 0.000 description 48
- 230000000694 effects Effects 0.000 description 46
- 125000000539 amino acid group Chemical group 0.000 description 38
- 241001465754 Metazoa Species 0.000 description 37
- 201000010099 disease Diseases 0.000 description 36
- 230000027455 binding Effects 0.000 description 34
- 241000282414 Homo sapiens Species 0.000 description 30
- 208000035475 disorder Diseases 0.000 description 30
- 230000014509 gene expression Effects 0.000 description 29
- 238000012217 deletion Methods 0.000 description 25
- 230000037430 deletion Effects 0.000 description 25
- 208000024891 symptom Diseases 0.000 description 24
- 239000003636 conditioned culture medium Substances 0.000 description 22
- 241000699670 Mus sp. Species 0.000 description 21
- 101000846394 Homo sapiens Fibroblast growth factor 19 Proteins 0.000 description 20
- 239000003814 drug Substances 0.000 description 19
- 238000012360 testing method Methods 0.000 description 19
- 239000005089 Luciferase Substances 0.000 description 18
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 17
- 238000010171 animal model Methods 0.000 description 17
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 16
- 238000003556 assay Methods 0.000 description 16
- 229960002897 heparin Drugs 0.000 description 16
- 229920000669 heparin Polymers 0.000 description 16
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 16
- 241000700159 Rattus Species 0.000 description 15
- 230000004071 biological effect Effects 0.000 description 15
- 230000004913 activation Effects 0.000 description 14
- 208000004434 Calcinosis Diseases 0.000 description 13
- 108091028043 Nucleic acid sequence Proteins 0.000 description 13
- 229940096437 Protein S Drugs 0.000 description 13
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 12
- 239000007788 liquid Substances 0.000 description 12
- 239000002609 medium Substances 0.000 description 12
- 230000001105 regulatory effect Effects 0.000 description 12
- 210000001519 tissue Anatomy 0.000 description 12
- 108700008625 Reporter Genes Proteins 0.000 description 11
- 210000004556 brain Anatomy 0.000 description 11
- 230000001575 pathological effect Effects 0.000 description 11
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 10
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 10
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 10
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 10
- 108060001084 Luciferase Proteins 0.000 description 10
- 101100444898 Mus musculus Egr1 gene Proteins 0.000 description 10
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- 230000026731 phosphorylation Effects 0.000 description 10
- 238000006366 phosphorylation reaction Methods 0.000 description 10
- 238000002560 therapeutic procedure Methods 0.000 description 10
- 108020004414 DNA Proteins 0.000 description 9
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 9
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 9
- 241000699666 Mus <mouse, genus> Species 0.000 description 9
- 230000000750 progressive effect Effects 0.000 description 9
- 241000894007 species Species 0.000 description 9
- 238000001890 transfection Methods 0.000 description 9
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 8
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 8
- 102000004877 Insulin Human genes 0.000 description 8
- 108090001061 Insulin Proteins 0.000 description 8
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 8
- 208000018737 Parkinson disease Diseases 0.000 description 8
- 239000004480 active ingredient Substances 0.000 description 8
- 238000002474 experimental method Methods 0.000 description 8
- 239000008103 glucose Substances 0.000 description 8
- 229940125396 insulin Drugs 0.000 description 8
- 230000009261 transgenic effect Effects 0.000 description 8
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 7
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 7
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 7
- 238000013270 controlled release Methods 0.000 description 7
- 206010012601 diabetes mellitus Diseases 0.000 description 7
- 230000000670 limiting effect Effects 0.000 description 7
- 201000001119 neuropathy Diseases 0.000 description 7
- 230000007823 neuropathy Effects 0.000 description 7
- 208000033808 peripheral neuropathy Diseases 0.000 description 7
- 230000011664 signaling Effects 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 238000011830 transgenic mouse model Methods 0.000 description 7
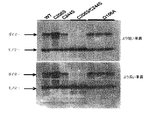
- 238000001262 western blot Methods 0.000 description 7
- 101001030705 Homo sapiens Huntingtin Proteins 0.000 description 6
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 6
- 241000699660 Mus musculus Species 0.000 description 6
- 208000012902 Nervous system disease Diseases 0.000 description 6
- 108091005804 Peptidases Proteins 0.000 description 6
- 239000004365 Protease Substances 0.000 description 6
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 210000004899 c-terminal region Anatomy 0.000 description 6
- 238000003776 cleavage reaction Methods 0.000 description 6
- 230000000295 complement effect Effects 0.000 description 6
- 230000002950 deficient Effects 0.000 description 6
- 239000013604 expression vector Substances 0.000 description 6
- 230000013632 homeostatic process Effects 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 235000005772 leucine Nutrition 0.000 description 6
- 230000002503 metabolic effect Effects 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 238000012986 modification Methods 0.000 description 6
- 230000004770 neurodegeneration Effects 0.000 description 6
- 210000002569 neuron Anatomy 0.000 description 6
- 239000002773 nucleotide Substances 0.000 description 6
- 125000003729 nucleotide group Chemical group 0.000 description 6
- 229920001223 polyethylene glycol Polymers 0.000 description 6
- 230000000069 prophylactic effect Effects 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 230000007017 scission Effects 0.000 description 6
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 5
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 5
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 5
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 5
- 208000025966 Neurological disease Diseases 0.000 description 5
- 229910019142 PO4 Inorganic materials 0.000 description 5
- 239000002202 Polyethylene glycol Substances 0.000 description 5
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 5
- 230000037396 body weight Effects 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 229960003957 dexamethasone Drugs 0.000 description 5
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 5
- 230000004069 differentiation Effects 0.000 description 5
- 229960003638 dopamine Drugs 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 238000003468 luciferase reporter gene assay Methods 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 5
- 239000010452 phosphate Substances 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 108091033319 polynucleotide Proteins 0.000 description 5
- 102000040430 polynucleotide Human genes 0.000 description 5
- 239000002157 polynucleotide Substances 0.000 description 5
- 230000019491 signal transduction Effects 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 238000011285 therapeutic regimen Methods 0.000 description 5
- 208000037259 Amyloid Plaque Diseases 0.000 description 4
- -1 FRS2 Proteins 0.000 description 4
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 4
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 4
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 4
- 102000019149 MAP kinase activity proteins Human genes 0.000 description 4
- 108040008097 MAP kinase activity proteins Proteins 0.000 description 4
- 241000288906 Primates Species 0.000 description 4
- 208000026214 Skeletal muscle atrophy Diseases 0.000 description 4
- 239000000443 aerosol Substances 0.000 description 4
- 230000002776 aggregation Effects 0.000 description 4
- 238000004220 aggregation Methods 0.000 description 4
- 235000004279 alanine Nutrition 0.000 description 4
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 4
- 230000006907 apoptotic process Effects 0.000 description 4
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 4
- 230000033228 biological regulation Effects 0.000 description 4
- 230000036755 cellular response Effects 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 4
- 235000004554 glutamine Nutrition 0.000 description 4
- 230000013595 glycosylation Effects 0.000 description 4
- 238000006206 glycosylation reaction Methods 0.000 description 4
- 102000054185 human HTT Human genes 0.000 description 4
- 238000009396 hybridization Methods 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 4
- 229960000310 isoleucine Drugs 0.000 description 4
- 210000003141 lower extremity Anatomy 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 238000010369 molecular cloning Methods 0.000 description 4
- 210000003205 muscle Anatomy 0.000 description 4
- 210000003098 myoblast Anatomy 0.000 description 4
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 4
- 230000002062 proliferating effect Effects 0.000 description 4
- 230000025185 skeletal muscle atrophy Effects 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 108091005703 transmembrane proteins Proteins 0.000 description 4
- 102000035160 transmembrane proteins Human genes 0.000 description 4
- 239000004474 valine Substances 0.000 description 4
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 3
- 206010003694 Atrophy Diseases 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 238000011537 Coomassie blue staining Methods 0.000 description 3
- 101001031598 Dictyostelium discoideum Probable serine/threonine-protein kinase fhkC Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 101150021185 FGF gene Proteins 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 206010022489 Insulin Resistance Diseases 0.000 description 3
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- 208000016285 Movement disease Diseases 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 108010029485 Protein Isoforms Proteins 0.000 description 3
- 102000001708 Protein Isoforms Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 206010039491 Sarcoma Diseases 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 108010022394 Threonine synthase Proteins 0.000 description 3
- 230000005856 abnormality Effects 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 230000003321 amplification Effects 0.000 description 3
- 239000003963 antioxidant agent Substances 0.000 description 3
- 230000037444 atrophy Effects 0.000 description 3
- 239000003613 bile acid Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 210000005013 brain tissue Anatomy 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 235000020934 caloric restriction Nutrition 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 230000001149 cognitive effect Effects 0.000 description 3
- 239000003086 colorant Substances 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 102000004419 dihydrofolate reductase Human genes 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 230000001605 fetal effect Effects 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 235000013922 glutamic acid Nutrition 0.000 description 3
- 239000004220 glutamic acid Substances 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 239000006204 intramuscular dosage form Substances 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 208000017169 kidney disease Diseases 0.000 description 3
- 238000011813 knockout mouse model Methods 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 235000018977 lysine Nutrition 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 230000007659 motor function Effects 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 210000000663 muscle cell Anatomy 0.000 description 3
- 208000015122 neurodegenerative disease Diseases 0.000 description 3
- 210000002682 neurofibrillary tangle Anatomy 0.000 description 3
- 238000003199 nucleic acid amplification method Methods 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 230000035790 physiological processes and functions Effects 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 230000004481 post-translational protein modification Effects 0.000 description 3
- 230000004853 protein function Effects 0.000 description 3
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 3
- 229960002930 sirolimus Drugs 0.000 description 3
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 3
- 210000002027 skeletal muscle Anatomy 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 238000013268 sustained release Methods 0.000 description 3
- 239000012730 sustained-release form Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- QFVHZQCOUORWEI-UHFFFAOYSA-N 4-[(4-anilino-5-sulfonaphthalen-1-yl)diazenyl]-5-hydroxynaphthalene-2,7-disulfonic acid Chemical compound C=12C(O)=CC(S(O)(=O)=O)=CC2=CC(S(O)(=O)=O)=CC=1N=NC(C1=CC=CC(=C11)S(O)(=O)=O)=CC=C1NC1=CC=CC=C1 QFVHZQCOUORWEI-UHFFFAOYSA-N 0.000 description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 2
- 101710137189 Amyloid-beta A4 protein Proteins 0.000 description 2
- 102100022704 Amyloid-beta precursor protein Human genes 0.000 description 2
- 101710151993 Amyloid-beta precursor protein Proteins 0.000 description 2
- 241000024188 Andala Species 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 201000004569 Blindness Diseases 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- 206010008748 Chorea Diseases 0.000 description 2
- 229920000858 Cyclodextrin Polymers 0.000 description 2
- KDXKERNSBIXSRK-RXMQYKEDSA-N D-lysine Chemical compound NCCCC[C@@H](N)C(O)=O KDXKERNSBIXSRK-RXMQYKEDSA-N 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 241000252212 Danio rerio Species 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 108091006020 Fc-tagged proteins Proteins 0.000 description 2
- 241000287828 Gallus gallus Species 0.000 description 2
- 206010018341 Gliosis Diseases 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Polymers OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 229920002971 Heparan sulfate Polymers 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 208000017604 Hodgkin disease Diseases 0.000 description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 2
- 206010020880 Hypertrophy Diseases 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 241000282553 Macaca Species 0.000 description 2
- 241000282560 Macaca mulatta Species 0.000 description 2
- 101100390675 Mus musculus Fgf15 gene Proteins 0.000 description 2
- 206010052904 Musculoskeletal stiffness Diseases 0.000 description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 2
- 241000244206 Nematoda Species 0.000 description 2
- 102000004108 Neurotransmitter Receptors Human genes 0.000 description 2
- 108090000590 Neurotransmitter Receptors Proteins 0.000 description 2
- 241000289371 Ornithorhynchus anatinus Species 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 241000282577 Pan troglodytes Species 0.000 description 2
- 229920000954 Polyglycolide Polymers 0.000 description 2
- 101710092489 Protein kinase 2 Proteins 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 206010044565 Tremor Diseases 0.000 description 2
- 102000006275 Ubiquitin-Protein Ligases Human genes 0.000 description 2
- 108010083111 Ubiquitin-Protein Ligases Proteins 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 229930003316 Vitamin D Natural products 0.000 description 2
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 2
- 241000269370 Xenopus <genus> Species 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 208000009956 adenocarcinoma Diseases 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- DZHSAHHDTRWUTF-SIQRNXPUSA-N amyloid-beta polypeptide 42 Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(O)=O)[C@@H](C)CC)C(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C(C)C)C1=CC=CC=C1 DZHSAHHDTRWUTF-SIQRNXPUSA-N 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 2
- 230000003078 antioxidant effect Effects 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 230000035578 autophosphorylation Effects 0.000 description 2
- 230000006399 behavior Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 2
- 235000013330 chicken meat Nutrition 0.000 description 2
- 208000012601 choreatic disease Diseases 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000001054 cortical effect Effects 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 230000002638 denervation Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 230000003511 endothelial effect Effects 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 235000019197 fats Nutrition 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 230000007387 gliosis Effects 0.000 description 2
- YMAWOPBAYDPSLA-UHFFFAOYSA-N glycylglycine Chemical compound [NH3+]CC(=O)NCC([O-])=O YMAWOPBAYDPSLA-UHFFFAOYSA-N 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 150000002466 imines Chemical class 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 238000000099 in vitro assay Methods 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 208000028867 ischemia Diseases 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 230000037356 lipid metabolism Effects 0.000 description 2
- 230000004130 lipolysis Effects 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 210000001161 mammalian embryo Anatomy 0.000 description 2
- 238000007726 management method Methods 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- OSWPMRLSEDHDFF-UHFFFAOYSA-N methyl salicylate Chemical compound COC(=O)C1=CC=CC=C1O OSWPMRLSEDHDFF-UHFFFAOYSA-N 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 230000001613 neoplastic effect Effects 0.000 description 2
- 210000001577 neostriatum Anatomy 0.000 description 2
- 230000002232 neuromuscular Effects 0.000 description 2
- 230000002981 neuropathic effect Effects 0.000 description 2
- 238000011580 nude mouse model Methods 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 230000036542 oxidative stress Effects 0.000 description 2
- FIKAKWIAUPDISJ-UHFFFAOYSA-L paraquat dichloride Chemical compound [Cl-].[Cl-].C1=C[N+](C)=CC=C1C1=CC=[N+](C)C=C1 FIKAKWIAUPDISJ-UHFFFAOYSA-L 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000006320 pegylation Effects 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 230000036470 plasma concentration Effects 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 239000013014 purified material Substances 0.000 description 2
- 238000001525 receptor binding assay Methods 0.000 description 2
- 238000010188 recombinant method Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000011514 reflex Effects 0.000 description 2
- 230000008458 response to injury Effects 0.000 description 2
- 230000004434 saccadic eye movement Effects 0.000 description 2
- 238000007423 screening assay Methods 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 230000001953 sensory effect Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000002741 site-directed mutagenesis Methods 0.000 description 2
- 239000008247 solid mixture Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 2
- 230000035882 stress Effects 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 102000013498 tau Proteins Human genes 0.000 description 2
- 108010026424 tau Proteins Proteins 0.000 description 2
- 230000017423 tissue regeneration Effects 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 230000014616 translation Effects 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 210000001364 upper extremity Anatomy 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- 230000004393 visual impairment Effects 0.000 description 2
- 235000019166 vitamin D Nutrition 0.000 description 2
- 239000011710 vitamin D Substances 0.000 description 2
- 150000003710 vitamin D derivatives Chemical class 0.000 description 2
- 229940046008 vitamin d Drugs 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- 210000005253 yeast cell Anatomy 0.000 description 2
- SBUKSNPHYWXCDG-CYBMUJFWSA-N (3r)-3-(fluoromethyl)-7-(thiomorpholin-4-ylsulfonyl)-1,2,3,4-tetrahydroisoquinoline Chemical compound C([C@@H](NCC1=C2)CF)C1=CC=C2S(=O)(=O)N1CCSCC1 SBUKSNPHYWXCDG-CYBMUJFWSA-N 0.000 description 1
- VRYALKFFQXWPIH-PBXRRBTRSA-N (3r,4s,5r)-3,4,5,6-tetrahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)CC=O VRYALKFFQXWPIH-PBXRRBTRSA-N 0.000 description 1
- OYHQOLUKZRVURQ-NTGFUMLPSA-N (9Z,12Z)-9,10,12,13-tetratritiooctadeca-9,12-dienoic acid Chemical compound C(CCCCCCC\C(=C(/C\C(=C(/CCCCC)\[3H])\[3H])\[3H])\[3H])(=O)O OYHQOLUKZRVURQ-NTGFUMLPSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- PLRACCBDVIHHLZ-UHFFFAOYSA-N 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine Chemical compound C1N(C)CCC(C=2C=CC=CC=2)=C1 PLRACCBDVIHHLZ-UHFFFAOYSA-N 0.000 description 1
- CZMRCDWAGMRECN-UHFFFAOYSA-N 2-{[3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]oxy}-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound OCC1OC(CO)(OC2OC(CO)C(O)C(O)C2O)C(O)C1O CZMRCDWAGMRECN-UHFFFAOYSA-N 0.000 description 1
- BRMWTNUJHUMWMS-UHFFFAOYSA-N 3-Methylhistidine Natural products CN1C=NC(CC(N)C(O)=O)=C1 BRMWTNUJHUMWMS-UHFFFAOYSA-N 0.000 description 1
- 101150037123 APOE gene Proteins 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 206010000830 Acute leukaemia Diseases 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 206010000871 Acute monocytic leukaemia Diseases 0.000 description 1
- 206010000890 Acute myelomonocytic leukaemia Diseases 0.000 description 1
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 201000003076 Angiosarcoma Diseases 0.000 description 1
- 206010002942 Apathy Diseases 0.000 description 1
- 102100029470 Apolipoprotein E Human genes 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 102000003823 Aromatic-L-amino-acid decarboxylases Human genes 0.000 description 1
- 108090000121 Aromatic-L-amino-acid decarboxylases Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 206010003591 Ataxia Diseases 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 206010061666 Autonomic neuropathy Diseases 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 208000020084 Bone disease Diseases 0.000 description 1
- 241000701822 Bovine papillomavirus Species 0.000 description 1
- 206010006417 Bronchial carcinoma Diseases 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 102100032616 Caspase-2 Human genes 0.000 description 1
- 108090000552 Caspase-2 Proteins 0.000 description 1
- 102000003908 Cathepsin D Human genes 0.000 description 1
- 108090000258 Cathepsin D Proteins 0.000 description 1
- 102000005575 Cellulases Human genes 0.000 description 1
- 108010084185 Cellulases Proteins 0.000 description 1
- PTHCMJGKKRQCBF-UHFFFAOYSA-N Cellulose, microcrystalline Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC)C(CO)O1 PTHCMJGKKRQCBF-UHFFFAOYSA-N 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 206010008635 Cholestasis Diseases 0.000 description 1
- 108090000943 Cholesterol 7-alpha-monooxygenases Proteins 0.000 description 1
- 102000004410 Cholesterol 7-alpha-monooxygenases Human genes 0.000 description 1
- 208000005243 Chondrosarcoma Diseases 0.000 description 1
- 201000009047 Chordoma Diseases 0.000 description 1
- 208000006332 Choriocarcinoma Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 208000028698 Cognitive impairment Diseases 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102100033780 Collagen alpha-3(IV) chain Human genes 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 208000009798 Craniopharyngioma Diseases 0.000 description 1
- 102000004420 Creatine Kinase Human genes 0.000 description 1
- 108010042126 Creatine kinase Proteins 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 102100038637 Cytochrome P450 7A1 Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 102000012410 DNA Ligases Human genes 0.000 description 1
- 108010061982 DNA Ligases Proteins 0.000 description 1
- 239000003155 DNA primer Substances 0.000 description 1
- 108010093668 Deubiquitinating Enzymes Proteins 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 206010013887 Dysarthria Diseases 0.000 description 1
- 208000014094 Dystonic disease Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 206010014967 Ependymoma Diseases 0.000 description 1
- 208000031637 Erythroblastic Acute Leukemia Diseases 0.000 description 1
- 208000036566 Erythroleukaemia Diseases 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 208000009386 Experimental Arthritis Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100037362 Fibronectin Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 201000008808 Fibrosarcoma Diseases 0.000 description 1
- 206010017577 Gait disturbance Diseases 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- BCCRXDTUTZHDEU-VKHMYHEASA-N Gly-Ser Chemical compound NCC(=O)N[C@@H](CO)C(O)=O BCCRXDTUTZHDEU-VKHMYHEASA-N 0.000 description 1
- 206010053759 Growth retardation Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 208000001258 Hemangiosarcoma Diseases 0.000 description 1
- 102000008055 Heparan Sulfate Proteoglycans Human genes 0.000 description 1
- 102000018802 High Mobility Group Proteins Human genes 0.000 description 1
- 101710176246 High mobility group protein Proteins 0.000 description 1
- 108700014808 Homeobox Protein Nkx-2.2 Proteins 0.000 description 1
- 101000710873 Homo sapiens Collagen alpha-3(IV) chain Proteins 0.000 description 1
- 101000957672 Homo sapiens Cytochrome P450 7A1 Proteins 0.000 description 1
- 101000619542 Homo sapiens E3 ubiquitin-protein ligase parkin Proteins 0.000 description 1
- 101100120051 Homo sapiens FGF1 gene Proteins 0.000 description 1
- 102000016252 Huntingtin Human genes 0.000 description 1
- 108050004784 Huntingtin Proteins 0.000 description 1
- 108010031794 IGF Type 1 Receptor Proteins 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 208000012659 Joint disease Diseases 0.000 description 1
- 240000007049 Juglans regia Species 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 1
- 208000018142 Leiomyosarcoma Diseases 0.000 description 1
- 239000012097 Lipofectamine 2000 Substances 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 102000009151 Luteinizing Hormone Human genes 0.000 description 1
- 108010073521 Luteinizing Hormone Proteins 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 108091077621 MAPRE family Proteins 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- 208000007054 Medullary Carcinoma Diseases 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 102000009664 Microtubule-Associated Proteins Human genes 0.000 description 1
- 208000034819 Mobility Limitation Diseases 0.000 description 1
- 208000035489 Monocytic Acute Leukemia Diseases 0.000 description 1
- 206010061296 Motor dysfunction Diseases 0.000 description 1
- 101100281002 Mus musculus Fgf23 gene Proteins 0.000 description 1
- 101100460498 Mus musculus Nkx2-2 gene Proteins 0.000 description 1
- 101001135571 Mus musculus Tyrosine-protein phosphatase non-receptor type 2 Proteins 0.000 description 1
- 208000021642 Muscular disease Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033835 Myelomonocytic Acute Leukemia Diseases 0.000 description 1
- 201000009623 Myopathy Diseases 0.000 description 1
- 102000003505 Myosin Human genes 0.000 description 1
- 108060008487 Myosin Proteins 0.000 description 1
- JDHILDINMRGULE-LURJTMIESA-N N(pros)-methyl-L-histidine Chemical compound CN1C=NC=C1C[C@H](N)C(O)=O JDHILDINMRGULE-LURJTMIESA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- OTCCIMWXFLJLIA-UHFFFAOYSA-N N-acetyl-DL-aspartic acid Natural products CC(=O)NC(C(O)=O)CC(O)=O OTCCIMWXFLJLIA-UHFFFAOYSA-N 0.000 description 1
- OTCCIMWXFLJLIA-BYPYZUCNSA-N N-acetyl-L-aspartic acid Chemical compound CC(=O)N[C@H](C(O)=O)CC(O)=O OTCCIMWXFLJLIA-BYPYZUCNSA-N 0.000 description 1
- 208000028389 Nerve injury Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 101710138657 Neurotoxin Proteins 0.000 description 1
- 201000010133 Oligodendroglioma Diseases 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 239000012124 Opti-MEM Substances 0.000 description 1
- 206010031127 Orthostatic hypotension Diseases 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 208000007641 Pinealoma Diseases 0.000 description 1
- 229920001054 Poly(ethylene‐co‐vinyl acetate) Polymers 0.000 description 1
- 229920002845 Poly(methacrylic acid) Polymers 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 206010063493 Premature ageing Diseases 0.000 description 1
- 208000032038 Premature aging Diseases 0.000 description 1
- 102000003946 Prolactin Human genes 0.000 description 1
- 108010057464 Prolactin Proteins 0.000 description 1
- 208000033826 Promyelocytic Acute Leukemia Diseases 0.000 description 1
- 102000016611 Proteoglycans Human genes 0.000 description 1
- 108010067787 Proteoglycans Proteins 0.000 description 1
- 206010037211 Psychomotor hyperactivity Diseases 0.000 description 1
- 239000012083 RIPA buffer Substances 0.000 description 1
- 101100281003 Rattus norvegicus Fgf23 gene Proteins 0.000 description 1
- 102000004278 Receptor Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000873 Receptor Protein-Tyrosine Kinases Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 108010052090 Renilla Luciferases Proteins 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 208000032023 Signs and Symptoms Diseases 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- 108090000054 Syndecan-2 Proteins 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- 206010043458 Thirst Diseases 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 102000011923 Thyrotropin Human genes 0.000 description 1
- 108010061174 Thyrotropin Proteins 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 208000005475 Vascular calcification Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 208000014070 Vestibular schwannoma Diseases 0.000 description 1
- 206010047571 Visual impairment Diseases 0.000 description 1
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 208000004064 acoustic neuroma Diseases 0.000 description 1
- 208000017733 acquired polycythemia vera Diseases 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000021841 acute erythroid leukemia Diseases 0.000 description 1
- 208000011912 acute myelomonocytic leukemia M4 Diseases 0.000 description 1
- 238000011374 additional therapy Methods 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 102000003802 alpha-Synuclein Human genes 0.000 description 1
- 108090000185 alpha-Synuclein Proteins 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 108010064539 amyloid beta-protein (1-42) Proteins 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- 210000000544 articulatio talocruralis Anatomy 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 208000020538 atrophic muscular disease Diseases 0.000 description 1
- 210000000467 autonomic pathway Anatomy 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 238000005452 bending Methods 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 210000000941 bile Anatomy 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 238000010170 biological method Methods 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 201000001531 bladder carcinoma Diseases 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 201000010983 breast ductal carcinoma Diseases 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 208000003362 bronchogenic carcinoma Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 235000019577 caloric intake Nutrition 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 230000023852 carbohydrate metabolic process Effects 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 235000015218 chewing gum Nutrition 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 230000007870 cholestasis Effects 0.000 description 1
- 231100000359 cholestasis Toxicity 0.000 description 1
- 210000002987 choroid plexus Anatomy 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 208000024207 chronic leukemia Diseases 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 238000012761 co-transfection Methods 0.000 description 1
- 230000019771 cognition Effects 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 238000010835 comparative analysis Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000012875 competitive assay Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 239000007891 compressed tablet Substances 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 239000000599 controlled substance Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 229940097362 cyclodextrins Drugs 0.000 description 1
- 208000002445 cystadenocarcinoma Diseases 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 239000007857 degradation product Substances 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 201000001981 dermatomyositis Diseases 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 230000003292 diminished effect Effects 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000011833 dog model Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 229940126534 drug product Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 208000010118 dystonia Diseases 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 230000013931 endocrine signaling Effects 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 208000037828 epithelial carcinoma Diseases 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 208000028327 extreme fatigue Diseases 0.000 description 1
- 230000004424 eye movement Effects 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000010685 fatty oil Substances 0.000 description 1
- 230000035558 fertility Effects 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000002073 fluorescence micrograph Methods 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 210000002683 foot Anatomy 0.000 description 1
- 101150046266 foxo gene Proteins 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 231100000024 genotoxic Toxicity 0.000 description 1
- 230000001738 genotoxic effect Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 230000004153 glucose metabolism Effects 0.000 description 1
- 230000004190 glucose uptake Effects 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 231100000001 growth retardation Toxicity 0.000 description 1
- 210000004247 hand Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000025750 heavy chain disease Diseases 0.000 description 1
- 201000002222 hemangioblastoma Diseases 0.000 description 1
- 238000005734 heterodimerization reaction Methods 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 235000003642 hunger Nutrition 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 230000003553 hypophosphatemic effect Effects 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000003914 insulin secretion Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 210000004347 intestinal mucosa Anatomy 0.000 description 1
- 238000000185 intracerebroventricular administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 150000002519 isoleucine derivatives Chemical class 0.000 description 1
- 239000012633 leachable Substances 0.000 description 1
- 210000002414 leg Anatomy 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 150000002614 leucines Chemical class 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 206010024627 liposarcoma Diseases 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 230000004777 loss-of-function mutation Effects 0.000 description 1
- 201000005296 lung carcinoma Diseases 0.000 description 1
- 239000003580 lung surfactant Substances 0.000 description 1
- 229940040129 luteinizing hormone Drugs 0.000 description 1
- 208000012804 lymphangiosarcoma Diseases 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 150000002669 lysines Chemical class 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 206010027191 meningioma Diseases 0.000 description 1
- 230000003340 mental effect Effects 0.000 description 1
- 230000006609 metabolic stress Effects 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- STZCRXQWRGQSJD-GEEYTBSJSA-M methyl orange Chemical compound [Na+].C1=CC(N(C)C)=CC=C1\N=N\C1=CC=C(S([O-])(=O)=O)C=C1 STZCRXQWRGQSJD-GEEYTBSJSA-M 0.000 description 1
- 229940012189 methyl orange Drugs 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960001047 methyl salicylate Drugs 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 230000027939 micturition Effects 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000002200 mouth mucosa Anatomy 0.000 description 1
- 230000037257 muscle growth Effects 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- 208000001611 myxosarcoma Diseases 0.000 description 1
- 201000008026 nephroblastoma Diseases 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000008764 nerve damage Effects 0.000 description 1
- 208000007538 neurilemmoma Diseases 0.000 description 1
- 230000001722 neurochemical effect Effects 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 208000018360 neuromuscular disease Diseases 0.000 description 1
- 230000016273 neuron death Effects 0.000 description 1
- 239000002581 neurotoxin Substances 0.000 description 1
- 231100000618 neurotoxin Toxicity 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 231100000862 numbness Toxicity 0.000 description 1
- 235000018343 nutrient deficiency Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 210000000287 oocyte Anatomy 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 229940043515 other immunoglobulins in atc Drugs 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 208000004019 papillary adenocarcinoma Diseases 0.000 description 1
- 201000010198 papillary carcinoma Diseases 0.000 description 1
- 210000002990 parathyroid gland Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 208000035824 paresthesia Diseases 0.000 description 1
- 102000045222 parkin Human genes 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 210000000578 peripheral nerve Anatomy 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000037081 physical activity Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 208000024724 pineal body neoplasm Diseases 0.000 description 1
- 201000004123 pineal gland cancer Diseases 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920000191 poly(N-vinyl pyrrolidone) Polymers 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 208000037244 polycythemia vera Diseases 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 108010040003 polyglutamine Proteins 0.000 description 1
- 229920000155 polyglutamine Polymers 0.000 description 1
- 108010094020 polyglycine Proteins 0.000 description 1
- 229920000232 polyglycine polymer Polymers 0.000 description 1
- 229920002338 polyhydroxyethylmethacrylate Polymers 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 239000013615 primer Substances 0.000 description 1
- 239000002987 primer (paints) Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 229940097325 prolactin Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 238000002731 protein assay Methods 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 230000012846 protein folding Effects 0.000 description 1
- 230000009822 protein phosphorylation Effects 0.000 description 1
- 210000001938 protoplast Anatomy 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 239000000790 retinal pigment Substances 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 150000003839 salts Chemical group 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 206010039667 schwannoma Diseases 0.000 description 1
- 210000003497 sciatic nerve Anatomy 0.000 description 1
- 201000008407 sebaceous adenocarcinoma Diseases 0.000 description 1
- 201000007321 sebaceous carcinoma Diseases 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 210000001741 seminiferous epithelium Anatomy 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 108091006024 signal transducing proteins Proteins 0.000 description 1
- 102000034285 signal transducing proteins Human genes 0.000 description 1
- 230000007727 signaling mechanism Effects 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 235000020183 skimmed milk Nutrition 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- RYYKJJJTJZKILX-UHFFFAOYSA-M sodium octadecanoate Chemical compound [Na+].CCCCCCCCCCCCCCCCCC([O-])=O RYYKJJJTJZKILX-UHFFFAOYSA-M 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 230000037351 starvation Effects 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 210000003523 substantia nigra Anatomy 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 201000010965 sweat gland carcinoma Diseases 0.000 description 1
- 201000008753 synovium neoplasm Diseases 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- 230000002992 thymic effect Effects 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000011820 transgenic animal model Methods 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- 230000001228 trophic effect Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 208000010570 urinary bladder carcinoma Diseases 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 208000029257 vision disease Diseases 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 235000012431 wafers Nutrition 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/50—Fibroblast growth factor [FGF]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/12—Ophthalmic agents for cataracts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/08—Plasma substitutes; Perfusion solutions; Dialytics or haemodialytics; Drugs for electrolytic or acid-base disorders, e.g. hypovolemic shock
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/24—Hydrolases (3) acting on glycosyl compounds (3.2)
- C12N9/2402—Hydrolases (3) acting on glycosyl compounds (3.2) hydrolysing O- and S- glycosyl compounds (3.2.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/24—Hydrolases (3) acting on glycosyl compounds (3.2)
- C12N9/2402—Hydrolases (3) acting on glycosyl compounds (3.2) hydrolysing O- and S- glycosyl compounds (3.2.1)
- C12N9/2405—Glucanases
- C12N9/2434—Glucanases acting on beta-1,4-glucosidic bonds
- C12N9/2445—Beta-glucosidase (3.2.1.21)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/93—Ligases (6)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/01021—Beta-glucosidase (3.2.1.21)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/01031—Beta-glucuronidase (3.2.1.31)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y602/00—Ligases forming carbon-sulfur bonds (6.2)
- C12Y602/01—Acid-Thiol Ligases (6.2.1)
- C12Y602/01003—Long-chain-fatty-acid-CoA ligase (6.2.1.3)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/32—Fusion polypeptide fusions with soluble part of a cell surface receptor, "decoy receptors"
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Wood Science & Technology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Physical Education & Sports Medicine (AREA)
- Diabetes (AREA)
- Neurology (AREA)
- Toxicology (AREA)
- Neurosurgery (AREA)
- Hematology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Ophthalmology & Optometry (AREA)
- Heart & Thoracic Surgery (AREA)
- Physics & Mathematics (AREA)
- Cardiology (AREA)
Abstract
【課題】加齢関連状態または代謝障害の予防または処置するための方法、キットおよび組成物の提供。【解決手段】(a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしくは誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、またはクロトー(Klotho)タンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所望により(c)リンカーを含む、融合ポリペプチド。該融合ポリペプチドを有効成分とする加齢関連状態または代謝障害の予防または処置するための方法、キットおよび組成物。【選択図】なし
Description
本出願は、2010年1月29日付け米国出願シリアル番号12/696693(この
内容を出典明示によりその全体を本明細書に包含させる)の優先権を主張する。
内容を出典明示によりその全体を本明細書に包含させる)の優先権を主張する。
1.背景
線維芽細胞増殖因子(FGF)は、多数の生物体において発現される相同ポリペプチド
増殖因子のファミリーを構成する(Ornitz and Itoh, Genome Biol. 2: reviews, 3005.1
-3005.12 (2001))。脊椎動物種において、FGFは、遺伝子構造およびアミノ酸配列の
両方において高度に保存されており、互いに13−71%のアミノ酸同一性を有する。ヒ
トにおいて、22の既知のFGFファミリーメンバーがある(FGF15はヒトFGF1
9のマウスオルソログであり、したがってヒトFGF15はない)。初期の発達において
、FGFは細胞増殖、移動および分化を調節するが、成体において、FGFはホメオスタ
シス、組織修復機能および損傷応答を維持する。
線維芽細胞増殖因子(FGF)は、多数の生物体において発現される相同ポリペプチド
増殖因子のファミリーを構成する(Ornitz and Itoh, Genome Biol. 2: reviews, 3005.1
-3005.12 (2001))。脊椎動物種において、FGFは、遺伝子構造およびアミノ酸配列の
両方において高度に保存されており、互いに13−71%のアミノ酸同一性を有する。ヒ
トにおいて、22の既知のFGFファミリーメンバーがある(FGF15はヒトFGF1
9のマウスオルソログであり、したがってヒトFGF15はない)。初期の発達において
、FGFは細胞増殖、移動および分化を調節するが、成体において、FGFはホメオスタ
シス、組織修復機能および損傷応答を維持する。
FGFは、細胞表面FGF受容体に結合し、それにより活性化されることにより増殖因
子として機能する。FGF受容体(FGFR)は、FGFRの自己リン酸化、FRS2(
FGF受容体基質2)およびERK1/2(細胞外シグナル−調節タンパク質キナーゼ1
/2)のリン酸化を介してシグナル伝達を活性化する、およびEgr−1(初期増殖応答
−1)を活性化する、チロシンキナーゼ受容体である。FGFは、また、へパラン硫酸プ
ロテオグリカンに対して高親和性を有する。FGFに結合するとき、へパラン硫酸はFG
FRの活性化を高める。
子として機能する。FGF受容体(FGFR)は、FGFRの自己リン酸化、FRS2(
FGF受容体基質2)およびERK1/2(細胞外シグナル−調節タンパク質キナーゼ1
/2)のリン酸化を介してシグナル伝達を活性化する、およびEgr−1(初期増殖応答
−1)を活性化する、チロシンキナーゼ受容体である。FGFは、また、へパラン硫酸プ
ロテオグリカンに対して高親和性を有する。FGFに結合するとき、へパラン硫酸はFG
FRの活性化を高める。
アルファ−クロトー(Klotho)遺伝子は、細胞外ドメインおよび短い細胞質ドメインを有
する130kDaのI型の1回膜貫通タンパク質をコードする。アルファ−クロトータン
パク質の細胞外ドメインは、KL−D1およびKL−D2と称される2つのサブドメイン
を含む。これらの2つのサブドメインは、細菌および植物のβ−グルコシダーゼと配列相
同性を共有している。アルファ−クロトータンパク質の細胞外ドメインは、膜貫通ドメイ
ンにより細胞表面に結合しているか、または開裂し、細胞外環境へ放出され得る。細胞外
ドメインの開裂は、その場の低い細胞外Ca2+濃度によって、促進されるようである。
する130kDaのI型の1回膜貫通タンパク質をコードする。アルファ−クロトータン
パク質の細胞外ドメインは、KL−D1およびKL−D2と称される2つのサブドメイン
を含む。これらの2つのサブドメインは、細菌および植物のβ−グルコシダーゼと配列相
同性を共有している。アルファ−クロトータンパク質の細胞外ドメインは、膜貫通ドメイ
ンにより細胞表面に結合しているか、または開裂し、細胞外環境へ放出され得る。細胞外
ドメインの開裂は、その場の低い細胞外Ca2+濃度によって、促進されるようである。
アルファ−クロトーに加えて、アルファ−クロトーのホモログであるベータ−クロトー
が同定されている(Itoら Mech. Dev. 98:115-9 (2000))。ベータ−クロトーも、細胞外
KL−D1およびKL−D2サブドメインを有するI型の1回膜貫通タンパク質である。
が同定されている(Itoら Mech. Dev. 98:115-9 (2000))。ベータ−クロトーも、細胞外
KL−D1およびKL−D2サブドメインを有するI型の1回膜貫通タンパク質である。
アルファ−クロトー発現の調節によって、哺乳動物における老化関連特性を生産するこ
とが証明されている。アルファ−クロトー遺伝子において機能喪失変異のマウスホモ接合
体は、寿命の短縮、皮膚萎縮、筋肉疲労、動脈硬化症、肺気腫および骨粗鬆症を含むヒト
の老化に類似した特性を発生させる(Kuro-oら Nature, 390:45-51 (1997))。対照的に
、マウスにおけるアルファ−クロトー遺伝子の過剰発現は、寿命を延長させ、野生型マウ
スと比較して酸化ストレスに対する抵抗性を増加させる(Kurosuら Science 309:1829-18
33 (2005); Yamamotoら J. Biol. Chem. 280:38029-38034 (2005))。
とが証明されている。アルファ−クロトー遺伝子において機能喪失変異のマウスホモ接合
体は、寿命の短縮、皮膚萎縮、筋肉疲労、動脈硬化症、肺気腫および骨粗鬆症を含むヒト
の老化に類似した特性を発生させる(Kuro-oら Nature, 390:45-51 (1997))。対照的に
、マウスにおけるアルファ−クロトー遺伝子の過剰発現は、寿命を延長させ、野生型マウ
スと比較して酸化ストレスに対する抵抗性を増加させる(Kurosuら Science 309:1829-18
33 (2005); Yamamotoら J. Biol. Chem. 280:38029-38034 (2005))。
最近の研究によって、FGF23およびアルファ−クロトー間の機能的なクロストーク
を示すFGF23−欠損マウスおよびアルファ−クロトー−欠損マウス間で著しく類似の
生物学的特性が証明された(Shimadaら J. Clin. Invest. 113:561-568 (2004); Yoshida
ら Endocrinology 143:683-689 (2002))。これらの研究では、FGF23と相同のFG
F受容体を介する結合およびシグナル伝達の両方に関して、FGF23の必須のパートナ
ーとしてアルファ−クロトーの同定に至った(Urakawaら Nature 22:1524-6 (2007))。
アルファ−クロトー遺伝子は、主に腎臓、副甲状腺および脈絡叢において発現する。アル
ファ−クロトーの組織特異的発現は、これらの組織におけるFGF23シグナル伝達の活
性化を限定するという仮説が立てられている。
を示すFGF23−欠損マウスおよびアルファ−クロトー−欠損マウス間で著しく類似の
生物学的特性が証明された(Shimadaら J. Clin. Invest. 113:561-568 (2004); Yoshida
ら Endocrinology 143:683-689 (2002))。これらの研究では、FGF23と相同のFG
F受容体を介する結合およびシグナル伝達の両方に関して、FGF23の必須のパートナ
ーとしてアルファ−クロトーの同定に至った(Urakawaら Nature 22:1524-6 (2007))。
アルファ−クロトー遺伝子は、主に腎臓、副甲状腺および脈絡叢において発現する。アル
ファ−クロトーの組織特異的発現は、これらの組織におけるFGF23シグナル伝達の活
性化を限定するという仮説が立てられている。
FGF23/アルファ−クロトーと同様に、ベータ−クロトーは、FGF19およびF
GF21それぞれの相同のFGF受容体を介する結合およびシグナル伝達の両方に関して
、FGF19およびFGF21の必須のパートナーである(Ogawaら Proc. Natl. Acad.
Sci. USA 104:7432-7 (2007); Linら J. Biol Chem. 282:27227-84 (2007);およびWuら J
. Biol. Chem. 282:29069-72 (2007))。このような研究は、また、組織特異的な代謝活
性の調節におけるベータ−クロトーの関与を証明した。ベータ−クロトーは、脂肪組織に
おける炭水化物および脂質代謝を調節するための補因子として、FGF21と共に作用す
ることが最初に示された。FGF19とともにベータ−クロトーは、肝臓における胆汁酸
代謝を調節し、したがって、ベータ−クロトー欠損マウスにおける胆汁合成の増加を説明
する(Itoら J Clin Invest. 2005 Aug;115(8):2202-8)。
GF21それぞれの相同のFGF受容体を介する結合およびシグナル伝達の両方に関して
、FGF19およびFGF21の必須のパートナーである(Ogawaら Proc. Natl. Acad.
Sci. USA 104:7432-7 (2007); Linら J. Biol Chem. 282:27227-84 (2007);およびWuら J
. Biol. Chem. 282:29069-72 (2007))。このような研究は、また、組織特異的な代謝活
性の調節におけるベータ−クロトーの関与を証明した。ベータ−クロトーは、脂肪組織に
おける炭水化物および脂質代謝を調節するための補因子として、FGF21と共に作用す
ることが最初に示された。FGF19とともにベータ−クロトーは、肝臓における胆汁酸
代謝を調節し、したがって、ベータ−クロトー欠損マウスにおける胆汁合成の増加を説明
する(Itoら J Clin Invest. 2005 Aug;115(8):2202-8)。
米国特許第6,579,850号は、アルファ−クロトーポリペプチドを含むポリペプ
チドおよび組成物を記載している。ヒトおよびマウスアルファ−クロトーポリペプチドを
記載している。該特許は、該ポリペプチドを含む組成物が早期老化に類似した症候群の処
置、成人疾患の処置および老化の抑制において有用であることも記載している。
チドおよび組成物を記載している。ヒトおよびマウスアルファ−クロトーポリペプチドを
記載している。該特許は、該ポリペプチドを含む組成物が早期老化に類似した症候群の処
置、成人疾患の処置および老化の抑制において有用であることも記載している。
米国特許第7,223,563号は、FGF23ポリペプチド配列をコードする単離さ
れた核酸またはこのような単離された核酸を含む組換え細胞を記載している。該特許はさ
らに、低リン酸血症性および高リン酸血症性障害、骨粗鬆症、皮膚筋炎および冠動脈疾患
を診断および処置する方法に関する。
れた核酸またはこのような単離された核酸を含む組換え細胞を記載している。該特許はさ
らに、低リン酸血症性および高リン酸血症性障害、骨粗鬆症、皮膚筋炎および冠動脈疾患
を診断および処置する方法に関する。
米国特許第7,259,248号は、FGF21ポリペプチド配列をコードする単離さ
れた核酸を記載している。該特許はさらに、肝臓疾患、胸腺機能関連状態を診断および処
置する方法ならびに精巣の状態を処置する方法に関する。
れた核酸を記載している。該特許はさらに、肝臓疾患、胸腺機能関連状態を診断および処
置する方法ならびに精巣の状態を処置する方法に関する。
2.発明の概要
本明細書は、融合ポリペプチドまたは可溶性ポリペプチドでの加齢関連状態または代謝
障害を予防または処置するための方法、使用、キットおよび組成物に関する。本明細書の
融合ポリペプチドは、FGF(例えば、FGF23)、およびクロトータンパク質または
その活性なフラグメント(例えば、sクロトー)および/またはFcフラグメント(例え
ば、FcLALA)のいずれか、および、所望により、リンカーから形成される。いくつ
かの態様において、FGF23は変異される。いくつかの態様において、本明細書は、ク
ロトータンパク質またはその活性なフラグメントおよび線維芽細胞増殖因子またはその活
性なフラグメントを含むクロトー融合ポリペプチドを提供する。いくつかの態様において
、融合ポリペプチドは、クロトーポリペプチド、FGF(例えば、FGF23)および修
飾されたFcフラグメントを含む。Fcフラグメントは、例えば、減少したFc−ガンマ
−受容体への結合および増加した血清半減期を有することができる。sクロトー、FGF
23およびFcLALA(減少したFc−ガンマ−受容体に対する親和性および/もしく
は増加した血清半減期を有する修飾されたFcフラグメント)を含む融合タンパク質は、
配列番号46、47、48および49に記載されている。いくつかの態様において、融合
ポリペプチドまたはタンパク質は、FGF(例えば、FGF23)またはその機能的に活
性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または
1つのアミノ酸欠失を含む変異体)、および修飾されたFcフラグメントまたはその機能
的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/
または1つのアミノ酸欠失を含む変異体)を含む。FGF23およびFcLALAを含む
融合タンパク質は、配列番号50、51、52および53に記載されている。いくつかの
態様において、融合ポリペプチドは、凝集および/もしくはプロテアーゼ介在開裂を減少
させるFGF23において1つ以上の変異を有する。
本明細書は、融合ポリペプチドまたは可溶性ポリペプチドでの加齢関連状態または代謝
障害を予防または処置するための方法、使用、キットおよび組成物に関する。本明細書の
融合ポリペプチドは、FGF(例えば、FGF23)、およびクロトータンパク質または
その活性なフラグメント(例えば、sクロトー)および/またはFcフラグメント(例え
ば、FcLALA)のいずれか、および、所望により、リンカーから形成される。いくつ
かの態様において、FGF23は変異される。いくつかの態様において、本明細書は、ク
ロトータンパク質またはその活性なフラグメントおよび線維芽細胞増殖因子またはその活
性なフラグメントを含むクロトー融合ポリペプチドを提供する。いくつかの態様において
、融合ポリペプチドは、クロトーポリペプチド、FGF(例えば、FGF23)および修
飾されたFcフラグメントを含む。Fcフラグメントは、例えば、減少したFc−ガンマ
−受容体への結合および増加した血清半減期を有することができる。sクロトー、FGF
23およびFcLALA(減少したFc−ガンマ−受容体に対する親和性および/もしく
は増加した血清半減期を有する修飾されたFcフラグメント)を含む融合タンパク質は、
配列番号46、47、48および49に記載されている。いくつかの態様において、融合
ポリペプチドまたはタンパク質は、FGF(例えば、FGF23)またはその機能的に活
性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または
1つのアミノ酸欠失を含む変異体)、および修飾されたFcフラグメントまたはその機能
的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/
または1つのアミノ酸欠失を含む変異体)を含む。FGF23およびFcLALAを含む
融合タンパク質は、配列番号50、51、52および53に記載されている。いくつかの
態様において、融合ポリペプチドは、凝集および/もしくはプロテアーゼ介在開裂を減少
させるFGF23において1つ以上の変異を有する。
第1の局面において、本明細書は、クロトータンパク質の少なくとも1つの細胞外サブ
ドメインおよび線維芽細胞増殖因子またはそれらの活性なフラグメントを有する融合ポリ
ペプチドを提供する。いくつかの態様において、融合ポリペプチドは、減少したFc−ガ
ンマ−受容体に対する親和性(例えば、減少したKaまたは増加したKd)および/また
は増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。クロトー細胞
外ドメインは、アルファまたはベータクロトーアイソフォームのいずれか由来であり得る
。さらに、クロトー融合ポリペプチドのFGF成分は、線維芽細胞増殖因子−19、線維
芽細胞増殖因子−21および線維芽細胞増殖因子−23に関して主に記載されているが、
任意の23個の既知のFGFを本明細書の実施において使用することができると考慮され
る。本出願の読者は、それぞれのヒトFGFタンパク質またはそれらの活性なフラグメン
トとアルファまたはベータ細胞外ドメインとのそれぞれの全ての組合せを、個々におよび
具体的に考慮すると想定し得る。
ドメインおよび線維芽細胞増殖因子またはそれらの活性なフラグメントを有する融合ポリ
ペプチドを提供する。いくつかの態様において、融合ポリペプチドは、減少したFc−ガ
ンマ−受容体に対する親和性(例えば、減少したKaまたは増加したKd)および/また
は増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。クロトー細胞
外ドメインは、アルファまたはベータクロトーアイソフォームのいずれか由来であり得る
。さらに、クロトー融合ポリペプチドのFGF成分は、線維芽細胞増殖因子−19、線維
芽細胞増殖因子−21および線維芽細胞増殖因子−23に関して主に記載されているが、
任意の23個の既知のFGFを本明細書の実施において使用することができると考慮され
る。本出願の読者は、それぞれのヒトFGFタンパク質またはそれらの活性なフラグメン
トとアルファまたはベータ細胞外ドメインとのそれぞれの全ての組合せを、個々におよび
具体的に考慮すると想定し得る。
本明細書において、クロトータンパク質の細胞外ドメインは、クロトータンパク質のK
L−D1およびKL−D2ドメインまたはそれらの機能的に活性な変異体もしくは誘導体
(例えば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む
変異体)の1つまたは両方を含むことができる。いくつかの態様において、本明細書のク
ロトー融合ポリペプチドは、クロトータンパク質の少なくとも2つの細胞外サブドメイン
またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ
酸置換および/または1つのアミノ酸欠失を含む変異体)を有する。例えば、少なくとも
2つの細胞外サブドメインは、タンデムリピートにおける少なくとも2つのKL−D1ド
メイン、タンデムリピートにおける少なくとも2つのKL−D2ドメイン、または少なく
とも1つのKL−D1ドメインおよび少なくとも1つのKL−D2ドメインであり得る。
種々の態様において、本明細書の融合ポリペプチドは、全長アルファクロトータンパク質
のアミノ酸28−292またはアミノ酸28−982(配列番号:7)を含む。別の態様
において、本明細書の融合ポリペプチドは、全長ベータクロトータンパク質のアミノ酸5
2−997を含む。
L−D1およびKL−D2ドメインまたはそれらの機能的に活性な変異体もしくは誘導体
(例えば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む
変異体)の1つまたは両方を含むことができる。いくつかの態様において、本明細書のク
ロトー融合ポリペプチドは、クロトータンパク質の少なくとも2つの細胞外サブドメイン
またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ
酸置換および/または1つのアミノ酸欠失を含む変異体)を有する。例えば、少なくとも
2つの細胞外サブドメインは、タンデムリピートにおける少なくとも2つのKL−D1ド
メイン、タンデムリピートにおける少なくとも2つのKL−D2ドメイン、または少なく
とも1つのKL−D1ドメインおよび少なくとも1つのKL−D2ドメインであり得る。
種々の態様において、本明細書の融合ポリペプチドは、全長アルファクロトータンパク質
のアミノ酸28−292またはアミノ酸28−982(配列番号:7)を含む。別の態様
において、本明細書の融合ポリペプチドは、全長ベータクロトータンパク質のアミノ酸5
2−997を含む。
本明細書の1つの態様において、融合ポリペプチドの成分は、(a)線維芽細胞増殖因
子23(FGF23)またはその機能的に活性な変異体もしくは誘導体(例えば、少なく
とも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)を含むポ
リペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位
置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親
和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、または
クロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれ
か、またはそれらの機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保
存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、および、所望により
(c)リンカーを含む。成分は、例えば、ペプチド結合によりインフレームにて化学的に
連結または融合され得る。それらはまた、リンカーを介して連結され得る。ポリペプチド
リンカーの非限定的な例は、配列番号:11、12、13、14、15、16、17およ
び18である。このようなリンカーは、少なくとも1個、最大約30個の繰り返しの配列
番号:11、12、13、14、15、16、17および18を含み得る。別の非限定的
な態様において、融合ポリペプチドは、(2)FGFまたはその活性なフラグメントおよ
び(3)修飾されたFcフラグメントを含む。融合ポリペプチドの種々の成分は、任意の
順に作動可能に連結され得る。(1)のポリペプチドは、(2)または(3)のポリペプ
チドのN−末端に作動可能に連結され得る、(2)のポリペプチドは、(1)または(3
)のポリペプチドのN−末端に作動可能に連結され得る、(3)のポリペプチドは、(1
)または(2)のポリペプチドのN−末端に作動可能に連結され得る。
子23(FGF23)またはその機能的に活性な変異体もしくは誘導体(例えば、少なく
とも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)を含むポ
リペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位
置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親
和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、または
クロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれ
か、またはそれらの機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保
存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、および、所望により
(c)リンカーを含む。成分は、例えば、ペプチド結合によりインフレームにて化学的に
連結または融合され得る。それらはまた、リンカーを介して連結され得る。ポリペプチド
リンカーの非限定的な例は、配列番号:11、12、13、14、15、16、17およ
び18である。このようなリンカーは、少なくとも1個、最大約30個の繰り返しの配列
番号:11、12、13、14、15、16、17および18を含み得る。別の非限定的
な態様において、融合ポリペプチドは、(2)FGFまたはその活性なフラグメントおよ
び(3)修飾されたFcフラグメントを含む。融合ポリペプチドの種々の成分は、任意の
順に作動可能に連結され得る。(1)のポリペプチドは、(2)または(3)のポリペプ
チドのN−末端に作動可能に連結され得る、(2)のポリペプチドは、(1)または(3
)のポリペプチドのN−末端に作動可能に連結され得る、(3)のポリペプチドは、(1
)または(2)のポリペプチドのN−末端に作動可能に連結され得る。
本明細書において、クロトータンパク質の細胞外サブドメイン、線維芽細胞増殖因子お
よび減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期
を有する(任意の)修飾されたFcフラグメントは、種々の方向および方法において互い
に作動可能に連結され得る。例えば、クロトータンパク質の細胞外サブドメインは、線維
芽細胞増殖因子のN−末端に作動可能に連結することができ、あるいは、線維芽細胞増殖
因子は、クロトータンパク質の細胞外サブドメインのN−末端に作動可能に連結すること
ができる。
よび減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期
を有する(任意の)修飾されたFcフラグメントは、種々の方向および方法において互い
に作動可能に連結され得る。例えば、クロトータンパク質の細胞外サブドメインは、線維
芽細胞増殖因子のN−末端に作動可能に連結することができ、あるいは、線維芽細胞増殖
因子は、クロトータンパク質の細胞外サブドメインのN−末端に作動可能に連結すること
ができる。
1つの態様において、本明細書は、クロトータンパク質のsクロトーおよびリンカーを
含む融合ポリペプチドを提供する。別の態様において、本明細書は、アルファクロトータ
ンパク質のsクロトーおよびリンカーを含む融合ポリペプチドを提供する。別の態様にお
いて、本明細書は、ベータクロトータンパク質のsクロトーおよびリンカーを含む融合ポ
リペプチドを提供する。さらに別の態様において、本明細書は、ヒトFGFタンパク質ま
たはその活性なフラグメント(例えば、シグナルペプチドを有さない)およびリンカーを
提供する。1つの態様において、本明細書は、病理学的疾患の治療における使用のための
、または処置における使用のための医薬としての、融合タンパク質、核酸分子または医薬
組成物を提供する。加齢関連状態または代謝障害を処置または予防するための、本明細書
の融合タンパク質を含む医薬組成物およびその使用はまた、本明細書により包含される。
いくつかの態様において、融合タンパク質は、減少したFc−ガンマ−受容体に対する親
和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに
含む。
含む融合ポリペプチドを提供する。別の態様において、本明細書は、アルファクロトータ
ンパク質のsクロトーおよびリンカーを含む融合ポリペプチドを提供する。別の態様にお
いて、本明細書は、ベータクロトータンパク質のsクロトーおよびリンカーを含む融合ポ
リペプチドを提供する。さらに別の態様において、本明細書は、ヒトFGFタンパク質ま
たはその活性なフラグメント(例えば、シグナルペプチドを有さない)およびリンカーを
提供する。1つの態様において、本明細書は、病理学的疾患の治療における使用のための
、または処置における使用のための医薬としての、融合タンパク質、核酸分子または医薬
組成物を提供する。加齢関連状態または代謝障害を処置または予防するための、本明細書
の融合タンパク質を含む医薬組成物およびその使用はまた、本明細書により包含される。
いくつかの態様において、融合タンパク質は、減少したFc−ガンマ−受容体に対する親
和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに
含む。
1つの態様において、本明細書は、FGF−23に(リンカーを介して直接的または間
接的に)融合されたシグナルペプチドを有するアルファクロトータンパク質のsクロトー
を含む融合ポリペプチドを提供する。別の態様において、本明細書は、FGF−23に(
リンカーを介して直接的または間接的に)融合されたシグナルペプチドを有さないアルフ
ァクロトータンパク質のsクロトーを含む融合ポリペプチドを提供する。別の態様におい
て、本明細書は、シグナルペプチドを有さないFGF−23に(リンカーを介して直接的
または間接的に)融合されたシグナルペプチドを有するアルファクロトータンパク質のs
クロトーを提供する。別の態様において、本明細書は、シグナルペプチドを有さないFG
F−23に(リンカーを介して直接的または間接的に)融合されたシグナルペプチドを有
さないアルファクロトータンパク質のsクロトーを含む融合ポリペプチドを提供する。い
くつかの態様において、融合タンパク質は、減少したFc−ガンマ−受容体に対する親和
性および/もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含
む。
接的に)融合されたシグナルペプチドを有するアルファクロトータンパク質のsクロトー
を含む融合ポリペプチドを提供する。別の態様において、本明細書は、FGF−23に(
リンカーを介して直接的または間接的に)融合されたシグナルペプチドを有さないアルフ
ァクロトータンパク質のsクロトーを含む融合ポリペプチドを提供する。別の態様におい
て、本明細書は、シグナルペプチドを有さないFGF−23に(リンカーを介して直接的
または間接的に)融合されたシグナルペプチドを有するアルファクロトータンパク質のs
クロトーを提供する。別の態様において、本明細書は、シグナルペプチドを有さないFG
F−23に(リンカーを介して直接的または間接的に)融合されたシグナルペプチドを有
さないアルファクロトータンパク質のsクロトーを含む融合ポリペプチドを提供する。い
くつかの態様において、融合タンパク質は、減少したFc−ガンマ−受容体に対する親和
性および/もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含
む。
1つの態様において、本明細書は、FGF−23(R179Q)変異体に(リンカーを
介して直接的または間接的に)融合されたシグナルペプチドを有するアルファクロトータ
ンパク質のsクロトーを含む融合ポリペプチドを提供する。別の態様において、本明細書
は、FGF−23(R179Q)変異体に(リンカーを介して直接的または間接的に)融
合されたシグナルペプチドを有さないアルファクロトータンパク質のsクロトーを含む融
合ポリペプチドを提供する。別の態様において、本明細書は、シグナルペプチドを有さな
いFGF−23(R179Q)変異体に(リンカーを介して直接的または間接的に)融合
されたシグナルペプチドを有するアルファクロトータンパク質のsクロトーを提供する。
別の態様において、本明細書は、シグナルペプチドを有さないFGF−23(R179Q
)変異体に(リンカーを介して直接的または間接的に)融合されたシグナルペプチドを有
さないアルファクロトータンパク質のsクロトーを含む融合ポリペプチドを提供する。い
くつかの態様において、融合タンパク質は、減少したFc−ガンマ−受容体に対する親和
性および/もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含
む。
介して直接的または間接的に)融合されたシグナルペプチドを有するアルファクロトータ
ンパク質のsクロトーを含む融合ポリペプチドを提供する。別の態様において、本明細書
は、FGF−23(R179Q)変異体に(リンカーを介して直接的または間接的に)融
合されたシグナルペプチドを有さないアルファクロトータンパク質のsクロトーを含む融
合ポリペプチドを提供する。別の態様において、本明細書は、シグナルペプチドを有さな
いFGF−23(R179Q)変異体に(リンカーを介して直接的または間接的に)融合
されたシグナルペプチドを有するアルファクロトータンパク質のsクロトーを提供する。
別の態様において、本明細書は、シグナルペプチドを有さないFGF−23(R179Q
)変異体に(リンカーを介して直接的または間接的に)融合されたシグナルペプチドを有
さないアルファクロトータンパク質のsクロトーを含む融合ポリペプチドを提供する。い
くつかの態様において、融合タンパク質は、減少したFc−ガンマ−受容体に対する親和
性および/もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含
む。
1つの態様において、本明細書は、(a)線維芽細胞増殖因子23(FGF23)また
はその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置
換および/または1つのアミノ酸欠失を含む変異体)を含むポリペプチドであって、FG
F23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプ
チド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加
した血清半減期を有する修飾されたFcフラグメント、またはクロトータンパク質の少な
くとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的
に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/ま
たは1つのアミノ酸欠失を含む変異体)、および、所望により(c)リンカーを含む融合
ポリペプチドを提供する。このような融合ポリペプチドは、配列番号:54、55、56
、57、58、59、60、61、62、63、64、65、66、67および68に記
載されている。
はその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置
換および/または1つのアミノ酸欠失を含む変異体)を含むポリペプチドであって、FG
F23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプ
チド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加
した血清半減期を有する修飾されたFcフラグメント、またはクロトータンパク質の少な
くとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的
に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/ま
たは1つのアミノ酸欠失を含む変異体)、および、所望により(c)リンカーを含む融合
ポリペプチドを提供する。このような融合ポリペプチドは、配列番号:54、55、56
、57、58、59、60、61、62、63、64、65、66、67および68に記
載されている。
1つの態様において、本明細書は、(1)シグナルペプチドを有するアルファクロトー
タンパク質のsクロトーまたはその機能的に活性な変異体もしくは誘導体(例えば、少な
くとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、(2
)リンカー、および(3)シグナルペプチドを有さないFGF−23(R179Q)変異
体またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミ
ノ酸置換および/または1つのアミノ酸欠失を含む変異体)を含む融合ポリペプチドを提
供する。別の態様において、本明細書は、(1)シグナルペプチドを有さないアルファク
ロトータンパク質のsクロトー、またはその機能的に活性な変異体もしくは誘導体(例え
ば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体
)、(2)リンカー、および(3)シグナルペプチドを有さないFGF−23(R179
Q)変異体、またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つ
の保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)を含む融合ポリペ
プチドを提供する。いくつかの態様において、本明細書の融合ポリペプチドは、グリコシ
ル化される。いくつかの態様において、融合タンパク質は、減少したFc−ガンマ−受容
体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメ
ントをさらに含む。
タンパク質のsクロトーまたはその機能的に活性な変異体もしくは誘導体(例えば、少な
くとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、(2
)リンカー、および(3)シグナルペプチドを有さないFGF−23(R179Q)変異
体またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミ
ノ酸置換および/または1つのアミノ酸欠失を含む変異体)を含む融合ポリペプチドを提
供する。別の態様において、本明細書は、(1)シグナルペプチドを有さないアルファク
ロトータンパク質のsクロトー、またはその機能的に活性な変異体もしくは誘導体(例え
ば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体
)、(2)リンカー、および(3)シグナルペプチドを有さないFGF−23(R179
Q)変異体、またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つ
の保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)を含む融合ポリペ
プチドを提供する。いくつかの態様において、本明細書の融合ポリペプチドは、グリコシ
ル化される。いくつかの態様において、融合タンパク質は、減少したFc−ガンマ−受容
体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメ
ントをさらに含む。
1つの態様において、本明細書は、(1)シグナルペプチドを有するアルファクロトー
タンパク質のsクロトー(配列番号:44または配列番号:45)またはその機能的に活
性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または
1つのアミノ酸欠失を含む変異体)、(2)配列番号:11を含むリンカー、および(3
)シグナルペプチドを有さないFGF−23(R179Q)変異体(配列番号:43)ま
たはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸
置換および/または1つのアミノ酸欠失を含む変異体)を含む融合ポリペプチドを提供す
る。別の態様において、本明細書は、(1)シグナルペプチドを有さないアルファクロト
ータンパク質のsクロトー(配列番号:7)またはその機能的に活性な変異体もしくは誘
導体(例えば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を
含む変異体)、(2)配列番号:11を含むリンカー、および(3)シグナルペプチドを
有さないFGF−23(R179Q)変異体(配列番号:43)またはその機能的に活性
な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または1
つのアミノ酸欠失を含む変異体)を含む融合ポリペプチドを提供する。1つの態様におい
て、本明細書は、配列番号:19、20、40または41のアミノ酸配列を含む融合ポリ
ペプチドを提供する。いくつかの態様において、本明細書の融合ポリペプチドは、グリコ
シル化される。
タンパク質のsクロトー(配列番号:44または配列番号:45)またはその機能的に活
性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または
1つのアミノ酸欠失を含む変異体)、(2)配列番号:11を含むリンカー、および(3
)シグナルペプチドを有さないFGF−23(R179Q)変異体(配列番号:43)ま
たはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸
置換および/または1つのアミノ酸欠失を含む変異体)を含む融合ポリペプチドを提供す
る。別の態様において、本明細書は、(1)シグナルペプチドを有さないアルファクロト
ータンパク質のsクロトー(配列番号:7)またはその機能的に活性な変異体もしくは誘
導体(例えば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を
含む変異体)、(2)配列番号:11を含むリンカー、および(3)シグナルペプチドを
有さないFGF−23(R179Q)変異体(配列番号:43)またはその機能的に活性
な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または1
つのアミノ酸欠失を含む変異体)を含む融合ポリペプチドを提供する。1つの態様におい
て、本明細書は、配列番号:19、20、40または41のアミノ酸配列を含む融合ポリ
ペプチドを提供する。いくつかの態様において、本明細書の融合ポリペプチドは、グリコ
シル化される。
1つの態様において、本明細書は、シグナルペプチドを有するアルファクロトータンパ
ク質のsクロトー(配列番号:44または配列番号:45)またはその機能的に活性な変
異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または1つの
アミノ酸欠失を含む変異体)、および配列番号:11を含むリンカーを含む融合ポリペプ
チドを提供する。別の態様において、本明細書は、シグナルペプチドを有さないアルファ
クロトータンパク質のsクロトー(配列番号:7)、および配列番号:11を含むリンカ
ーを含む融合ポリペプチドを提供する。いくつかの態様において、本明細書の融合ポリペ
プチドは、グリコシル化される。いくつかの態様において、融合タンパク質は、減少した
Fc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾
されたFcフラグメントをさらに含む。
ク質のsクロトー(配列番号:44または配列番号:45)またはその機能的に活性な変
異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または1つの
アミノ酸欠失を含む変異体)、および配列番号:11を含むリンカーを含む融合ポリペプ
チドを提供する。別の態様において、本明細書は、シグナルペプチドを有さないアルファ
クロトータンパク質のsクロトー(配列番号:7)、および配列番号:11を含むリンカ
ーを含む融合ポリペプチドを提供する。いくつかの態様において、本明細書の融合ポリペ
プチドは、グリコシル化される。いくつかの態様において、融合タンパク質は、減少した
Fc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾
されたFcフラグメントをさらに含む。
1つの態様において、本明細書は、ヒトFGFタンパク質またはその活性なフラグメン
ト(例えば、シグナルペプチドを有さない)、および配列番号:11を含むリンカーを含
む融合ポリペプチドを提供する。いくつかの態様において、本明細書の融合ポリペプチド
は、グリコシル化される。いくつかの態様において、融合タンパク質は、減少したFc−
ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾された
Fcフラグメントをさらに含む。
ト(例えば、シグナルペプチドを有さない)、および配列番号:11を含むリンカーを含
む融合ポリペプチドを提供する。いくつかの態様において、本明細書の融合ポリペプチド
は、グリコシル化される。いくつかの態様において、融合タンパク質は、減少したFc−
ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾された
Fcフラグメントをさらに含む。
1つの態様において、本明細書は、ヒトFGFタンパク質(例えば、FGF23)また
はその活性なフラグメント(例えば、シグナルペプチドを有さない)、リンカー(例えば
、配列番号:11を含むリンカー)、およびsクロトー(シグナルペプチドを有するか、
または有さない)またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも
1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体))またはFc
−ガンマ−受容体(例えば、FcLALA)を含む融合ポリペプチドであって、FGF(
例えば、FGF23)がこれらの残基で1つ以上の変異:R179、Q156、C206
、および/またはC244を有する融合ポリペプチドを提供する。種々の態様において、
変異は、R179Q、Q156A、C206Sおよび/またはC244Sである。これら
の変異は、ヒト、アカゲザル、ウシ、マウスおよびラットFGF23において保存されて
いるにもかかわらず、それらの変異はFGF23活性を防止しない。むしろ、これらのア
ミノ酸の変異は、凝集を減少させること、望ましくないプロテアーゼ誘導開裂を減少させ
ること、および細胞からのタンパク質生産を増加させることにより、タンパク質の質を予
想外に増強する。種々の態様において、1つ以上のFGF23変異を含む融合タンパク質
は、グリコシル化される。
はその活性なフラグメント(例えば、シグナルペプチドを有さない)、リンカー(例えば
、配列番号:11を含むリンカー)、およびsクロトー(シグナルペプチドを有するか、
または有さない)またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも
1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体))またはFc
−ガンマ−受容体(例えば、FcLALA)を含む融合ポリペプチドであって、FGF(
例えば、FGF23)がこれらの残基で1つ以上の変異:R179、Q156、C206
、および/またはC244を有する融合ポリペプチドを提供する。種々の態様において、
変異は、R179Q、Q156A、C206Sおよび/またはC244Sである。これら
の変異は、ヒト、アカゲザル、ウシ、マウスおよびラットFGF23において保存されて
いるにもかかわらず、それらの変異はFGF23活性を防止しない。むしろ、これらのア
ミノ酸の変異は、凝集を減少させること、望ましくないプロテアーゼ誘導開裂を減少させ
ること、および細胞からのタンパク質生産を増加させることにより、タンパク質の質を予
想外に増強する。種々の態様において、1つ以上のFGF23変異を含む融合タンパク質
は、グリコシル化される。
1つの態様において、本明細書は、(1)シグナルペプチドを有さないFGF−23(
R179Q)変異体(配列番号:43)、または凝集および/もしくはプロテアーゼ介在
開裂を減少させるさらなる変異を含む変異体、またはその機能的に活性な変異体もしくは
誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失
を含む変異体)、(2)所望により、配列番号:11を含むリンカー、および(3)シグ
ナルペプチドを有するアルファクロトータンパク質のsクロトー(配列番号:44または
配列番号:45)またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも
1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、または減少
したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する
修飾されたFcフラグメントを含む、融合ポリペプチド(例えば、グリコシル化された、
またはグリコシル化されていない)を含む(例えば、単一の薬学的に活性な成分として)
医薬組成物(例えば、筋肉内投与形態における)、ならびに病理学的疾患の処置、例えば
、加齢関連状態、例えば、筋萎縮の処置および/または予防のための治療における、また
は医薬としての、該医薬組成物の使用を提供する。別の態様において、本明細書は、(1
)シグナルペプチドを有さないFGF−23(R179Q)変異体(配列番号:43)、
または凝集および/もしくはプロテアーゼ介在開裂を減少させるさらなる変異を含む変異
体、またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存ア
ミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、(2)配列番号:11を
含むリンカー、および(3)シグナルペプチドを有さないアルファクロトータンパク質の
sクロトー(配列番号:7)またはその機能的に活性な変異体もしくは誘導体(例えば、
少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、
または減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減
期を有する修飾されたFcフラグメントまたはその機能的に活性な変異体もしくは誘導体
(例えば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む
変異体)を含む、融合ポリペプチド(例えば、グリコシル化された、またはグリコシル化
されていない)を含む(例えば、単一の薬学的に活性な成分として)医薬組成物(例えば
、筋肉内投与形態における)、ならびに病理学的疾患の処置、例えば、加齢関連状態、例
えば、筋萎縮の処置および/または予防のための治療における、または医薬としての医薬
組成物の使用を提供する。1つの態様において、本明細書は、配列番号:19、20、4
0または41のアミノ酸配列を含む融合ポリペプチド(例えば、グリコシル化された、ま
たはグリコシル化されていない)を含む(例えば、単一の薬学的に活性な成分として)医
薬組成物(例えば、筋肉内投与形態における)、ならびに病理学的疾患の処置、例えば、
加齢関連状態、例えば、筋萎縮の処置および/または予防のための治療における、または
医薬としての医薬組成物の使用を提供する。
R179Q)変異体(配列番号:43)、または凝集および/もしくはプロテアーゼ介在
開裂を減少させるさらなる変異を含む変異体、またはその機能的に活性な変異体もしくは
誘導体(例えば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失
を含む変異体)、(2)所望により、配列番号:11を含むリンカー、および(3)シグ
ナルペプチドを有するアルファクロトータンパク質のsクロトー(配列番号:44または
配列番号:45)またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも
1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、または減少
したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する
修飾されたFcフラグメントを含む、融合ポリペプチド(例えば、グリコシル化された、
またはグリコシル化されていない)を含む(例えば、単一の薬学的に活性な成分として)
医薬組成物(例えば、筋肉内投与形態における)、ならびに病理学的疾患の処置、例えば
、加齢関連状態、例えば、筋萎縮の処置および/または予防のための治療における、また
は医薬としての、該医薬組成物の使用を提供する。別の態様において、本明細書は、(1
)シグナルペプチドを有さないFGF−23(R179Q)変異体(配列番号:43)、
または凝集および/もしくはプロテアーゼ介在開裂を減少させるさらなる変異を含む変異
体、またはその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存ア
ミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、(2)配列番号:11を
含むリンカー、および(3)シグナルペプチドを有さないアルファクロトータンパク質の
sクロトー(配列番号:7)またはその機能的に活性な変異体もしくは誘導体(例えば、
少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体)、
または減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減
期を有する修飾されたFcフラグメントまたはその機能的に活性な変異体もしくは誘導体
(例えば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む
変異体)を含む、融合ポリペプチド(例えば、グリコシル化された、またはグリコシル化
されていない)を含む(例えば、単一の薬学的に活性な成分として)医薬組成物(例えば
、筋肉内投与形態における)、ならびに病理学的疾患の処置、例えば、加齢関連状態、例
えば、筋萎縮の処置および/または予防のための治療における、または医薬としての医薬
組成物の使用を提供する。1つの態様において、本明細書は、配列番号:19、20、4
0または41のアミノ酸配列を含む融合ポリペプチド(例えば、グリコシル化された、ま
たはグリコシル化されていない)を含む(例えば、単一の薬学的に活性な成分として)医
薬組成物(例えば、筋肉内投与形態における)、ならびに病理学的疾患の処置、例えば、
加齢関連状態、例えば、筋萎縮の処置および/または予防のための治療における、または
医薬としての医薬組成物の使用を提供する。
1つの態様において、本明細書は、シグナルペプチドを有するアルファクロトータンパ
ク質のsクロトー(配列番号:44または配列番号:45)および配列番号:11を含む
リンカーを含む、融合ポリペプチド(例えば、グリコシル化された、またはグリコシル化
されていない)を含む(例えば、単一の薬学的に活性な成分として)医薬組成物(例えば
、筋肉内投与形態における)、ならびに加齢関連状態、例えば、筋萎縮を処置および/ま
たは予防するための医薬組成物の使用を提供する。別の態様において、本明細書は、シグ
ナルペプチドを有さないアルファクロトータンパク質のsクロトー(配列番号:7)およ
び配列番号:11を含むリンカーを含む、融合ポリペプチド(例えば、グリコシル化され
た、またはグリコシル化されていない)を含む(例えば、単一の薬学的に活性な成分とし
て)医薬組成物(例えば、筋肉内投与形態における)、ならびに病理学的疾患の処置、例
えば、加齢関連状態、例えば、筋萎縮の処置および/または予防のための治療における、
または医薬としての医薬組成物の使用を提供する。いくつかの態様において、融合タンパ
ク質は、修飾されたFcフラグメントをさらに含む。
ク質のsクロトー(配列番号:44または配列番号:45)および配列番号:11を含む
リンカーを含む、融合ポリペプチド(例えば、グリコシル化された、またはグリコシル化
されていない)を含む(例えば、単一の薬学的に活性な成分として)医薬組成物(例えば
、筋肉内投与形態における)、ならびに加齢関連状態、例えば、筋萎縮を処置および/ま
たは予防するための医薬組成物の使用を提供する。別の態様において、本明細書は、シグ
ナルペプチドを有さないアルファクロトータンパク質のsクロトー(配列番号:7)およ
び配列番号:11を含むリンカーを含む、融合ポリペプチド(例えば、グリコシル化され
た、またはグリコシル化されていない)を含む(例えば、単一の薬学的に活性な成分とし
て)医薬組成物(例えば、筋肉内投与形態における)、ならびに病理学的疾患の処置、例
えば、加齢関連状態、例えば、筋萎縮の処置および/または予防のための治療における、
または医薬としての医薬組成物の使用を提供する。いくつかの態様において、融合タンパ
ク質は、修飾されたFcフラグメントをさらに含む。
1つの態様において、本明細書は、ヒトFGFタンパク質またはその活性なフラグメン
ト(例えば、シグナルペプチドを有さない)および配列番号:11を含むリンカーを含む
、融合ポリペプチド(例えば、グリコシル化された、またはグリコシル化されていない)
を含む(例えば、単一の薬学的に活性な成分として)医薬組成物を提供する。
ト(例えば、シグナルペプチドを有さない)および配列番号:11を含むリンカーを含む
、融合ポリペプチド(例えば、グリコシル化された、またはグリコシル化されていない)
を含む(例えば、単一の薬学的に活性な成分として)医薬組成物を提供する。
本明細書の融合タンパク質を含む医薬組成物および病理学的疾患の処置、例えば、加齢
関連状態(例えば、筋萎縮)または代謝障害(例えば、糖尿病)の処置のための治療にお
ける、または医薬としてのその使用もまた、本明細書により包含される。
関連状態(例えば、筋萎縮)または代謝障害(例えば、糖尿病)の処置のための治療にお
ける、または医薬としてのその使用もまた、本明細書により包含される。
1つの態様において、本明細書は、配列番号:19と少なくとも85%、少なくとも9
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%同一である融合ポリペプチドを提供する。別の態様において、
本明細書は、配列番号:20と少なくとも85%、少なくとも90%、少なくとも91%
、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なく
とも96%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99
%同一である融合ポリペプチドを提供する。
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%同一である融合ポリペプチドを提供する。別の態様において、
本明細書は、配列番号:20と少なくとも85%、少なくとも90%、少なくとも91%
、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なく
とも96%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99
%同一である融合ポリペプチドを提供する。
1つの態様において、本明細書は、配列番号:40と少なくとも85%、少なくとも9
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%同一である融合ポリペプチドを提供する。別の態様において、
本明細書は、配列番号:41と少なくとも85%、少なくとも90%、少なくとも91%
、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なく
とも96%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99
%同一である融合ポリペプチドを提供する。
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%同一である融合ポリペプチドを提供する。別の態様において、
本明細書は、配列番号:41と少なくとも85%、少なくとも90%、少なくとも91%
、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なく
とも96%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99
%同一である融合ポリペプチドを提供する。
1つの態様において、本明細書は、配列番号:46と少なくとも85%、少なくとも9
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%または100%同一である融合ポリペプチドを提供する。別の
態様において、本明細書は、配列番号:47と少なくとも85%、少なくとも90%、少
なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも
95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも98%、
少なくとも99%または100%同一である融合ポリペプチドを提供する。
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%または100%同一である融合ポリペプチドを提供する。別の
態様において、本明細書は、配列番号:47と少なくとも85%、少なくとも90%、少
なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも
95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも98%、
少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:48と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。別の態
様において、本明細書は、配列番号:49と少なくとも85%、少なくとも90%、少な
くとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも9
5%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも98%、少
なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。別の態
様において、本明細書は、配列番号:49と少なくとも85%、少なくとも90%、少な
くとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも9
5%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも98%、少
なくとも99%または100%同一である融合ポリペプチドを提供する。
1つの態様において、本明細書は、配列番号:50と少なくとも85%、少なくとも9
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%または100%同一である融合ポリペプチドを提供する。別の
態様において、本明細書は、配列番号:51と少なくとも85%、少なくとも90%、少
なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも
95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも98%、
少なくとも99%または100%同一である融合ポリペプチドを提供する。
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%または100%同一である融合ポリペプチドを提供する。別の
態様において、本明細書は、配列番号:51と少なくとも85%、少なくとも90%、少
なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも
95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも98%、
少なくとも99%または100%同一である融合ポリペプチドを提供する。
1つの態様において、本明細書は、配列番号:52と少なくとも85%、少なくとも9
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%または100%同一である融合ポリペプチドを提供する。別の
態様において、本明細書は、配列番号:53と少なくとも85%、少なくとも90%、少
なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも
95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも98%、
少なくとも99%または100%同一である融合ポリペプチドを提供する。
0%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少
なくとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも
98%、少なくとも99%または100%同一である融合ポリペプチドを提供する。別の
態様において、本明細書は、配列番号:53と少なくとも85%、少なくとも90%、少
なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも
95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも98%、
少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:54と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:55と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:56と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:57と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:58と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:59と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:60と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:61と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:62と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:63と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:64と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:65と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:66と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:67と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:68と少なくとも85%、少なくとも90
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少な
くとも95%、少なくとも96%、少なくとも96%、少なくとも97%、少なくとも9
8%、少なくとも99%または100%同一である融合ポリペプチドを提供する。
1つの態様において、本明細書は、FGF−19またはその活性なフラグメントに融合
した(リンカーを介して直接的または間接的に)シグナルペプチドを有するベータクロト
ータンパク質のsクロトーを含む融合ポリペプチドを提供する。いくつかの態様において
、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは
増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。別の態様におい
て、本明細書は、FGF−19またはその活性なフラグメントに融合した(リンカーを介
して直接的または間接的に)シグナルペプチドを有さないベータクロトータンパク質のs
クロトーを含む融合ポリペプチドを提供する。別の態様において、本明細書は、FGF−
21またはその活性なフラグメントに融合した(リンカーを介して直接的または間接的に
)シグナルペプチドを有するベータクロトータンパク質のsクロトーを含む融合ポリペプ
チドを提供する。別の態様において、本明細書は、FGF−21またはその活性なフラグ
メントに融合した(リンカーを介して直接的または間接的に)シグナルペプチドを有さな
いベータクロトータンパク質のsクロトーを含む融合ポリペプチドを提供する。
した(リンカーを介して直接的または間接的に)シグナルペプチドを有するベータクロト
ータンパク質のsクロトーを含む融合ポリペプチドを提供する。いくつかの態様において
、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは
増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。別の態様におい
て、本明細書は、FGF−19またはその活性なフラグメントに融合した(リンカーを介
して直接的または間接的に)シグナルペプチドを有さないベータクロトータンパク質のs
クロトーを含む融合ポリペプチドを提供する。別の態様において、本明細書は、FGF−
21またはその活性なフラグメントに融合した(リンカーを介して直接的または間接的に
)シグナルペプチドを有するベータクロトータンパク質のsクロトーを含む融合ポリペプ
チドを提供する。別の態様において、本明細書は、FGF−21またはその活性なフラグ
メントに融合した(リンカーを介して直接的または間接的に)シグナルペプチドを有さな
いベータクロトータンパク質のsクロトーを含む融合ポリペプチドを提供する。
本明細書は、本明細書に記載されているクロトー融合ポリペプチドのいずれかをコード
する核酸配列および該核酸を含む宿主細胞を提供する。いくつかの態様において、融合ポ
リペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した
血清半減期を有する修飾されたFcフラグメントをさらに含む。
する核酸配列および該核酸を含む宿主細胞を提供する。いくつかの態様において、融合ポ
リペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した
血清半減期を有する修飾されたFcフラグメントをさらに含む。
本明細書はまた、本明細書において考慮されるクロトー融合ポリペプチドのいずれかを
有する組成物を提供する。本明細書の組成物は、ヘパリンをさらに含み得る。いくつかの
態様において、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性およ
び/もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。
有する組成物を提供する。本明細書の組成物は、ヘパリンをさらに含み得る。いくつかの
態様において、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性およ
び/もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。
本明細書はまた、個体における加齢関連状態を処置または予防するための方法を提供す
る。個体(例えば、ヒト)に、加齢関連状態を処置または予防するように、クロトータン
パク質の少なくとも1つの細胞外サブドメイン(例えば、アルファクロトータンパク質)
および線維芽細胞増殖因子またはその活性なフラグメントを有するクロトー融合ポリペプ
チドを含む治療有効用量の医薬組成物を投与する。いくつかの態様において、融合ポリペ
プチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清
半減期を有する修飾されたFcフラグメントをさらに含む。特に、本明細書は、アルファ
クロトータンパク質の少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖因子(
またはその活性なフラグメント)を有する治療有効量の融合ポリペプチドを個体(例えば
、ヒト)に投与することを含む、筋肉疲労を処置または予防する方法を提供する。
る。個体(例えば、ヒト)に、加齢関連状態を処置または予防するように、クロトータン
パク質の少なくとも1つの細胞外サブドメイン(例えば、アルファクロトータンパク質)
および線維芽細胞増殖因子またはその活性なフラグメントを有するクロトー融合ポリペプ
チドを含む治療有効用量の医薬組成物を投与する。いくつかの態様において、融合ポリペ
プチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清
半減期を有する修飾されたFcフラグメントをさらに含む。特に、本明細書は、アルファ
クロトータンパク質の少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖因子(
またはその活性なフラグメント)を有する治療有効量の融合ポリペプチドを個体(例えば
、ヒト)に投与することを含む、筋肉疲労を処置または予防する方法を提供する。
さらに、本明細書は、個体における代謝障害を処置または予防するための方法を提供す
る。個体に、代謝障害を処置するように、クロトータンパク質の少なくとも1つの細胞外
サブドメインおよび線維芽細胞増殖因子(またはその活性なフラグメント)を有する本明
細書の融合ポリペプチドを含む治療有効用量の医薬組成物を投与する。いくつかの態様に
おいて、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/も
しくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。特に、ベ
ータ−クロトータンパク質の少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖
因子21を有する本明細書の融合ポリペプチドは、代謝障害を処置するために有用である
。
る。個体に、代謝障害を処置するように、クロトータンパク質の少なくとも1つの細胞外
サブドメインおよび線維芽細胞増殖因子(またはその活性なフラグメント)を有する本明
細書の融合ポリペプチドを含む治療有効用量の医薬組成物を投与する。いくつかの態様に
おいて、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/も
しくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。特に、ベ
ータ−クロトータンパク質の少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖
因子21を有する本明細書の融合ポリペプチドは、代謝障害を処置するために有用である
。
本明細書のクロトー−FGF23融合ポリペプチドは、個体における高リン血症または
石灰沈着症を処置または予防するために使用することができる。いくつかの態様において
、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは
増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。クロトータンパ
ク質の少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖因子を有する本明細書
のクロトー融合ポリペプチドを含む薬理学的有効用量の医薬組成物を、高リン血症または
石灰沈着症を処置または予防するために投与する。特に、アルファクロトータンパク質の
少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖因子23を有する本明細書の
クロトー融合ポリペプチドは、高リン血症または石灰沈着症を処置するために有用である
。
石灰沈着症を処置または予防するために使用することができる。いくつかの態様において
、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは
増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。クロトータンパ
ク質の少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖因子を有する本明細書
のクロトー融合ポリペプチドを含む薬理学的有効用量の医薬組成物を、高リン血症または
石灰沈着症を処置または予防するために投与する。特に、アルファクロトータンパク質の
少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖因子23を有する本明細書の
クロトー融合ポリペプチドは、高リン血症または石灰沈着症を処置するために有用である
。
本明細書のクロトー−FGF23融合ポリペプチドは、個体における慢性腎臓疾患また
は慢性腎不全を処置または予防するために使用することができる。いくつかの態様におい
て、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしく
は増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。クロトータン
パク質(例えば、アルファクロトータンパク質)の少なくとも1つの細胞外サブドメイン
および線維芽細胞増殖因子を有する本明細書のクロトー融合ポリペプチドを含む治療有効
用量の医薬組成物を、慢性腎臓疾患または慢性腎不全を処置または予防するために投与す
る。
は慢性腎不全を処置または予防するために使用することができる。いくつかの態様におい
て、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしく
は増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。クロトータン
パク質(例えば、アルファクロトータンパク質)の少なくとも1つの細胞外サブドメイン
および線維芽細胞増殖因子を有する本明細書のクロトー融合ポリペプチドを含む治療有効
用量の医薬組成物を、慢性腎臓疾患または慢性腎不全を処置または予防するために投与す
る。
本明細書のクロトー−FGF23融合ポリペプチドは、個体における癌(例えば、乳癌
)を処置または予防するために使用することができる。いくつかの態様において、融合ポ
リペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した
血清半減期を有する修飾されたFcフラグメントをさらに含む。クロトータンパク質(例
えば、アルファクロトータンパク質)の少なくとも1つの細胞外サブドメインおよび線維
芽細胞増殖因子を有する本明細書のクロトー融合ポリペプチドを含む治療有効用量の医薬
組成物を、癌または乳癌を処置または予防するために投与する。
)を処置または予防するために使用することができる。いくつかの態様において、融合ポ
リペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した
血清半減期を有する修飾されたFcフラグメントをさらに含む。クロトータンパク質(例
えば、アルファクロトータンパク質)の少なくとも1つの細胞外サブドメインおよび線維
芽細胞増殖因子を有する本明細書のクロトー融合ポリペプチドを含む治療有効用量の医薬
組成物を、癌または乳癌を処置または予防するために投与する。
本明細書は、医薬における使用のためのクロトータンパク質の少なくとも1つの細胞外
サブドメインおよびFGFまたはそれらの活性なフラグメントを含む融合ポリペプチドを
提供する。いくつかの態様において、融合ポリペプチドは、減少したFc−ガンマ−受容
体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメ
ントをさらに含む。1つの態様において、本明細書は、筋萎縮の処置または予防における
使用のためのクロトータンパク質の少なくとも1つの細胞外サブドメインおよびFGFま
たはそれらの活性なフラグメントを含む融合ポリペプチドを提供する。本明細書はまた、
可溶性クロトータンパク質を含む治療有効用量の医薬組成物を必要とする個体に投与する
ことを含む、加齢関連状態(例えば、筋萎縮)を処置または予防する方法を提供する。
サブドメインおよびFGFまたはそれらの活性なフラグメントを含む融合ポリペプチドを
提供する。いくつかの態様において、融合ポリペプチドは、減少したFc−ガンマ−受容
体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメ
ントをさらに含む。1つの態様において、本明細書は、筋萎縮の処置または予防における
使用のためのクロトータンパク質の少なくとも1つの細胞外サブドメインおよびFGFま
たはそれらの活性なフラグメントを含む融合ポリペプチドを提供する。本明細書はまた、
可溶性クロトータンパク質を含む治療有効用量の医薬組成物を必要とする個体に投与する
ことを含む、加齢関連状態(例えば、筋萎縮)を処置または予防する方法を提供する。
本明細書は、さらに、個体における病理学的疾患、例えば、加齢関連状態、代謝障害、
高リン血症または石灰沈着症、慢性腎臓疾患または慢性腎不全の医薬としての治療におけ
る使用のための、または処置における使用のための、または癌または乳癌を予防するため
の、上記ペプチドおよび融合ポリペプチドまたは該ペプチドを含む医薬組成物を提供する
。さらに、本明細書は、病理学的疾患の処置、特に上記障害、好ましくは加齢関連状態、
例えば、筋萎縮の処置のための医薬の製造における、本発明のポリペプチド、核酸または
医薬組成物の使用をさらに提供する。
高リン血症または石灰沈着症、慢性腎臓疾患または慢性腎不全の医薬としての治療におけ
る使用のための、または処置における使用のための、または癌または乳癌を予防するため
の、上記ペプチドおよび融合ポリペプチドまたは該ペプチドを含む医薬組成物を提供する
。さらに、本明細書は、病理学的疾患の処置、特に上記障害、好ましくは加齢関連状態、
例えば、筋萎縮の処置のための医薬の製造における、本発明のポリペプチド、核酸または
医薬組成物の使用をさらに提供する。
本明細書はまた、個体における加齢関連状態または代謝障害を処置または予防するため
のキットを含む。キットは、使用のための指示書およびクロトータンパク質の少なくとも
1つの細胞外サブドメインおよび線維芽細胞増殖因子を有する精製されたクロトー融合ポ
リペプチドを含む。いくつかの態様において、融合ポリペプチドは、減少したFc−ガン
マ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFc
フラグメントをさらに含む。
のキットを含む。キットは、使用のための指示書およびクロトータンパク質の少なくとも
1つの細胞外サブドメインおよび線維芽細胞増殖因子を有する精製されたクロトー融合ポ
リペプチドを含む。いくつかの態様において、融合ポリペプチドは、減少したFc−ガン
マ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFc
フラグメントをさらに含む。
本明細書はまた、本明細書のクロトー融合ポリペプチドを生産するためのキットを提供
する。本明細書のキットは、使用のための指示書およびクロトータンパク質の少なくとも
1つの細胞外サブドメインおよび線維芽細胞増殖因子を有するクロトー融合ポリペプチド
をコードする核酸を含む。いくつかの態様において、融合ポリペプチドは、減少したFc
−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾され
たFcフラグメントをさらに含む。
する。本明細書のキットは、使用のための指示書およびクロトータンパク質の少なくとも
1つの細胞外サブドメインおよび線維芽細胞増殖因子を有するクロトー融合ポリペプチド
をコードする核酸を含む。いくつかの態様において、融合ポリペプチドは、減少したFc
−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾され
たFcフラグメントをさらに含む。
本明細書の1つの態様において、融合ポリペプチドは、(a)線維芽細胞増殖因子また
はその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置
換および/または1つのアミノ酸欠失を含む変異体)を含むポリペプチド、および(b)
減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有
する修飾されたFcフラグメントまたはその機能的に活性な変異体もしくは誘導体(例え
ば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体
)を含む。
はその機能的に活性な変異体もしくは誘導体(例えば、少なくとも1つの保存アミノ酸置
換および/または1つのアミノ酸欠失を含む変異体)を含むポリペプチド、および(b)
減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有
する修飾されたFcフラグメントまたはその機能的に活性な変異体もしくは誘導体(例え
ば、少なくとも1つの保存アミノ酸置換および/または1つのアミノ酸欠失を含む変異体
)を含む。
本明細書の1つの態様において、(a)のポリペプチドおよび(b)のポリペプチドは
、ポリペプチドリンカーにより連結される。リンカーは、1から30回またはそれ以上繰
り返し得る。
、ポリペプチドリンカーにより連結される。リンカーは、1から30回またはそれ以上繰
り返し得る。
本明細書の1つの態様において、ポリペプチドリンカーは、配列番号:11、配列番号
:12、配列番号:13、配列番号:14、配列番号:15、配列番号:16、配列番号
:17および配列番号:18からなる群から選択されるアミノ酸配列を含む
:12、配列番号:13、配列番号:14、配列番号:15、配列番号:16、配列番号
:17および配列番号:18からなる群から選択されるアミノ酸配列を含む
本明細書の1つの態様において、(a)のポリペプチドは該ポリペプチドリンカーのN
−末端にペプチド結合により連結されており、(b)のポリペプチドは該ポリペプチドリ
ンカーのC−末端にペプチド結合により連結されている。
−末端にペプチド結合により連結されており、(b)のポリペプチドは該ポリペプチドリ
ンカーのC−末端にペプチド結合により連結されている。
本明細書の1つの態様において、融合ポリペプチドはシグナルペプチドをさらに含む。
本明細書の1つの態様において、シグナルペプチドはIgGシグナルペプチドである。
本明細書の1つの態様において、シグナルペプチドはIgGシグナルペプチドである。
本明細書の1つの態様において、線維芽細胞増殖因子は、線維芽細胞増殖因子−23ま
たは線維芽細胞増殖因子−23変異体(R179Q)である。
本明細書の1つの態様において、線維芽細胞増殖因子は、線維芽細胞増殖因子−19ま
たは線維芽細胞増殖因子−21である。
たは線維芽細胞増殖因子−23変異体(R179Q)である。
本明細書の1つの態様において、線維芽細胞増殖因子は、線維芽細胞増殖因子−19ま
たは線維芽細胞増殖因子−21である。
本明細書の1つの態様において、融合ポリペプチドは、配列番号:51または配列番号
:53のアミノ酸配列と95%以上同一であるアミノ酸配列を含む。
本明細書の1つの態様において、融合ポリペプチドは配列番号:51または配列番号:
53のアミノ酸配列を含む。
本明細書の1つの態様において、融合ポリペプチドはFcLALAを含む。
3.図面の簡単な説明
:53のアミノ酸配列と95%以上同一であるアミノ酸配列を含む。
本明細書の1つの態様において、融合ポリペプチドは配列番号:51または配列番号:
53のアミノ酸配列を含む。
本明細書の1つの態様において、融合ポリペプチドはFcLALAを含む。
3.図面の簡単な説明
4.詳細な説明
本明細書は、加齢関連状態および代謝障害を予防または処置するための方法、キットお
よび組成物、ならびに病理学的疾患の治療における該組成物の医薬としての使用または処
置における使用に関する。本明細書の融合ポリペプチドは、クロトータンパク質またはそ
の活性なフラグメントを含む。いくつかの態様において、本明細書の融合ポリペプチドは
、線維芽細胞増殖因子ポリペプチドまたはその活性なフラグメントに作動可能に連結した
クロトータンパク質またはその活性なフラグメントを含む。いくつかの態様において、融
合ポリペプチドは、減少したFcRnへの結合する能力および/または増加した血清にお
ける安定性を有する修飾されたFcフラグメントをさらに含む。別の態様において、融合
ポリペプチドは、FGF(例えば、FGF23)および減少したFcRnへの結合する能
力および/または増加した血清における安定性を有する修飾されたFcフラグメントを含
む。
本明細書は、加齢関連状態および代謝障害を予防または処置するための方法、キットお
よび組成物、ならびに病理学的疾患の治療における該組成物の医薬としての使用または処
置における使用に関する。本明細書の融合ポリペプチドは、クロトータンパク質またはそ
の活性なフラグメントを含む。いくつかの態様において、本明細書の融合ポリペプチドは
、線維芽細胞増殖因子ポリペプチドまたはその活性なフラグメントに作動可能に連結した
クロトータンパク質またはその活性なフラグメントを含む。いくつかの態様において、融
合ポリペプチドは、減少したFcRnへの結合する能力および/または増加した血清にお
ける安定性を有する修飾されたFcフラグメントをさらに含む。別の態様において、融合
ポリペプチドは、FGF(例えば、FGF23)および減少したFcRnへの結合する能
力および/または増加した血清における安定性を有する修飾されたFcフラグメントを含
む。
本明細書の融合タンパク質またはsクロトーは、種々の加齢関連状態、例えば、サルコ
ペニア、皮膚萎縮、筋肉疲労、脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、
骨粗鬆症、骨関節症、免疫不全、高血圧、認知症、ハンチントン病、アルツハイマー病、
白内障、加齢黄斑変性症、前立腺癌、卒中、期待寿命の低下(diminished life expectanc
y)、記憶障害、しわ、腎機能障害および加齢性難聴、ならびに代謝障害、例えば、II型
糖尿病、メタボリック・シンドローム、高血糖および肥満の処置および予防において有用
である。
ペニア、皮膚萎縮、筋肉疲労、脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、
骨粗鬆症、骨関節症、免疫不全、高血圧、認知症、ハンチントン病、アルツハイマー病、
白内障、加齢黄斑変性症、前立腺癌、卒中、期待寿命の低下(diminished life expectanc
y)、記憶障害、しわ、腎機能障害および加齢性難聴、ならびに代謝障害、例えば、II型
糖尿病、メタボリック・シンドローム、高血糖および肥満の処置および予防において有用
である。
本発明は、少なくとも一部分において、物理的制約条件(例えば、クロトーおよびFG
Fポリペプチド両方の大きいサイズ)にもかかわらず、クロトー−FGF融合ポリペプチ
ドがFGF受容体の活性化において非常に有効である発見に基づく。これらの2つのタン
パク質の融合物がヘテロ二量化、したがってタンパク質の活性化を妨げるであろう;例え
ば、タンパク質の結合ドメインが融合物により乱され得るか、例えば、タンパク質の結合
ドメインが融合物により乱され得るか、または「シス」構造を構築するとき、タンパク質
が空間的に間違った方向に向けられ得ることを考慮すると、この発見は予期されないもの
である。
Fポリペプチド両方の大きいサイズ)にもかかわらず、クロトー−FGF融合ポリペプチ
ドがFGF受容体の活性化において非常に有効である発見に基づく。これらの2つのタン
パク質の融合物がヘテロ二量化、したがってタンパク質の活性化を妨げるであろう;例え
ば、タンパク質の結合ドメインが融合物により乱され得るか、例えば、タンパク質の結合
ドメインが融合物により乱され得るか、または「シス」構造を構築するとき、タンパク質
が空間的に間違った方向に向けられ得ることを考慮すると、この発見は予期されないもの
である。
単独で、または別のポリペプチドと一緒に投与されるクロトーまたはFGFと比較して
活性を増強させる、単一の治療タンパク質の投与を可能にするため、本明細書に記載され
ている融合ポリペプチドには利点がある。2つの別々のポリペプチド(すなわち、クロト
ーポリペプチドおよび別のFGFポリペプチド)よりもむしろ単一の融合ポリペプチドと
してのクロトーおよびFGFの使用が、FGF受容体の活性化にさらに有効である。
活性を増強させる、単一の治療タンパク質の投与を可能にするため、本明細書に記載され
ている融合ポリペプチドには利点がある。2つの別々のポリペプチド(すなわち、クロト
ーポリペプチドおよび別のFGFポリペプチド)よりもむしろ単一の融合ポリペプチドと
してのクロトーおよびFGFの使用が、FGF受容体の活性化にさらに有効である。
定義
本明細書において使用される「クロトーポリペプチド」、「クロトータンパク質」また
は「クロトー」は、野生型「クロトー」の活性なフラグメント、誘導体、模倣物、変異体
および化学的に修飾された化合物またはそれらのハイブリッドを含む。活性なクロトーフ
ラグメントは、FGFポリペプチドに結合する能力を有する。一般的に、活性なクロトー
ポリペプチドは少なくとも1つのクロトーサブドメイン(例えば、KL−D1およびKL
−D2)を含む。野生型クロトーは天然で見出されたとおりのアミノ酸配列を有する。本
明細書において使用するために適当な例のクロトーポリペプチドは、アルファ−クロトー
(配列番号:2)およびベータ−クロトー(配列番号:4)を含む。アルファ−クロトー
およびベータ−クロトーのヌクレオチドおよびアミノ酸配列は、GenBankデータベ
ースにおいてそれぞれ受入番号NM_004795、NP_004786およびNM_1
75737、NP_783864において見出せる。クロトーポリペプチドは米国特許第
6,579,850号(この内容をその全体において出典明示により本明細書に包含させ
る)において記載されているものを含む。クロトーポリペプチドは、マウス(NP_03
8851)、ラット(NP_112626)、ウサギ(NP_001075692)のア
ルファ−クロトーおよびマウス(NP_112457)のベータ−クロトーを含むヒト以
外の他の種のものを含む。アルファ−クロトーを有することが予測される種は、チンパン
ジー(XP_522655)、マカク(XP_001101127)、ウマ(XP_00
1495662)、ウシ(XP_001252500)、カモノハシ(XP_00151
0981)およびニワトリ(XP_417105)を含む。ベータ−クロトーを有するこ
とが予測される種は、チンパンジー(XP_526550)、マカク(XP_00109
1413)、ウマ(XP_001495248)、イヌ(XP_536257)、ラット
(XP_001078178)、カモノハシ(XP_001512722)およびニワト
リ(XP_423224)を含む。クロトーポリペプチドは、配列番号:2または配列番
号:4のアミノ酸配列と実質的に同一である。すなわち、配列番号:2または配列番号:
4のアミノ酸配列と少なくとも70%、75%、80%、85%、90%、95%、96
%、97%、98%、99%またはそれ以上同一であるアミノ酸配列またはそれらの活性
なフラグメントを有する。
本明細書において使用される「クロトーポリペプチド」、「クロトータンパク質」また
は「クロトー」は、野生型「クロトー」の活性なフラグメント、誘導体、模倣物、変異体
および化学的に修飾された化合物またはそれらのハイブリッドを含む。活性なクロトーフ
ラグメントは、FGFポリペプチドに結合する能力を有する。一般的に、活性なクロトー
ポリペプチドは少なくとも1つのクロトーサブドメイン(例えば、KL−D1およびKL
−D2)を含む。野生型クロトーは天然で見出されたとおりのアミノ酸配列を有する。本
明細書において使用するために適当な例のクロトーポリペプチドは、アルファ−クロトー
(配列番号:2)およびベータ−クロトー(配列番号:4)を含む。アルファ−クロトー
およびベータ−クロトーのヌクレオチドおよびアミノ酸配列は、GenBankデータベ
ースにおいてそれぞれ受入番号NM_004795、NP_004786およびNM_1
75737、NP_783864において見出せる。クロトーポリペプチドは米国特許第
6,579,850号(この内容をその全体において出典明示により本明細書に包含させ
る)において記載されているものを含む。クロトーポリペプチドは、マウス(NP_03
8851)、ラット(NP_112626)、ウサギ(NP_001075692)のア
ルファ−クロトーおよびマウス(NP_112457)のベータ−クロトーを含むヒト以
外の他の種のものを含む。アルファ−クロトーを有することが予測される種は、チンパン
ジー(XP_522655)、マカク(XP_001101127)、ウマ(XP_00
1495662)、ウシ(XP_001252500)、カモノハシ(XP_00151
0981)およびニワトリ(XP_417105)を含む。ベータ−クロトーを有するこ
とが予測される種は、チンパンジー(XP_526550)、マカク(XP_00109
1413)、ウマ(XP_001495248)、イヌ(XP_536257)、ラット
(XP_001078178)、カモノハシ(XP_001512722)およびニワト
リ(XP_423224)を含む。クロトーポリペプチドは、配列番号:2または配列番
号:4のアミノ酸配列と実質的に同一である。すなわち、配列番号:2または配列番号:
4のアミノ酸配列と少なくとも70%、75%、80%、85%、90%、95%、96
%、97%、98%、99%またはそれ以上同一であるアミノ酸配列またはそれらの活性
なフラグメントを有する。
本明細書において使用される「融合ポリペプチド」または「融合タンパク質」は、天然
に同じポリペプチドに存在しない2つ以上の別々のポリペプチドまたはそれらの活性なフ
ラグメントを含むポリペプチドを意味する。いくつかの態様において、2つ以上の別々の
ポリペプチドは、ペプチド結合によりインフレームで、互いに作動可能に共有結合、例え
ば、化学的に結合または融合されている。本明細書において使用される「クロトー融合ポ
リペプチド」は、クロトーポリペプチドのアミノ酸配列またはその活性なフラグメントを
含む融合ポリペプチドである。融合ポリペプチドは、非限定的な例として、クロトー(例
えば、sクロトー)、FGF(例えば、FG23)、および減少したFC−ガンマ−受容
体に対する結合親和性および/もしくは増加した血清半減期)を有する(所望により)修
飾されたFcフラグメント(例えば、修飾されたFcフラグメントを含み得る。融合ポリ
ペプチドのこの型の例は、配列番号46から49にに示される。別の態様において、融合
タンパク質は、FGF(例えば、FGF23)および修飾されたFc(例えば、FcLA
LA)を含む。FGF23およびFcLALAを含む融合タンパク質は、配列番号50、
51、52および53に記載されている。FcLALAは、効率低下でADCCを誘導し
、弱くヒト補体に結合し、活性化するLALA変異(L234A、L235A)を有する
Fcフラグメントである。Hessellら 2007 Nature 449:101-104。
に同じポリペプチドに存在しない2つ以上の別々のポリペプチドまたはそれらの活性なフ
ラグメントを含むポリペプチドを意味する。いくつかの態様において、2つ以上の別々の
ポリペプチドは、ペプチド結合によりインフレームで、互いに作動可能に共有結合、例え
ば、化学的に結合または融合されている。本明細書において使用される「クロトー融合ポ
リペプチド」は、クロトーポリペプチドのアミノ酸配列またはその活性なフラグメントを
含む融合ポリペプチドである。融合ポリペプチドは、非限定的な例として、クロトー(例
えば、sクロトー)、FGF(例えば、FG23)、および減少したFC−ガンマ−受容
体に対する結合親和性および/もしくは増加した血清半減期)を有する(所望により)修
飾されたFcフラグメント(例えば、修飾されたFcフラグメントを含み得る。融合ポリ
ペプチドのこの型の例は、配列番号46から49にに示される。別の態様において、融合
タンパク質は、FGF(例えば、FGF23)および修飾されたFc(例えば、FcLA
LA)を含む。FGF23およびFcLALAを含む融合タンパク質は、配列番号50、
51、52および53に記載されている。FcLALAは、効率低下でADCCを誘導し
、弱くヒト補体に結合し、活性化するLALA変異(L234A、L235A)を有する
Fcフラグメントである。Hessellら 2007 Nature 449:101-104。
「繊維芽細胞増殖因子」および「FGF」は、本明細書において互換的に使用され、ヒ
ト対象を含む動物における細胞増殖、移動、分化、ホメオスタシス、組織修復および損傷
応答を調節するポリペプチドを示す。FGFは、繊維芽細胞増殖因子受容体に結合し、F
GFRの自己リン酸化、FRS2(FGF受容体基質2)およびERK1/2(細胞外シ
グナル−調節タンパク質キナーゼ1/2)のリン酸化およびEgr−1(初期増殖応答−
1)の活性化を含む活性を調節する能力を有する。「FGF」なる用語は、例えば、当分
野で既知である、ならびに米国特許第7,223,563号および米国特許第7,259
,248号(これらの内容をその全体において出典明示により本明細書に包含させる)に
おいて記載されている、野生型「FGF」の活性なフラグメント、誘導体、模倣物、変異
体および化学的に修飾された化合物またはそれらのハイブリッドを含む。野生型FGFは
天然で見出されたとおりのアミノ酸配列を有する。本発明において使用するために適当な
例の繊維芽細胞増殖因子は、繊維芽細胞増殖因子−19(FGF19;配列番号:31)
、繊維芽細胞増殖因子−21(FGF21;配列番号:33)および繊維芽細胞増殖因子
−23(FGF23;配列番号:35)を含む。FGFポリペプチドは、マウスFGFを
含むヒト以外の他の種のものを含む。一般的に、FGFポリペプチドは、配列番号:31
、配列番号:33または配列番号:35のアミノ酸配列と実質的に同一である。すなわち
、配列番号:31、配列番号:33または配列番号:35のアミノ酸配列と少なくとも7
0%、75%、80%、85%、90%、95%、96%、97%、98%、99%また
はそれ以上または100%同一であるアミノ酸配列を有するアミノ酸配列またはそれらの
活性なフラグメントを有する。FGF、特にFGF23のさらなる非限定的な例は、配列
番号:47のaa1002−1228、配列番号:49のaa1002−1228、配列
番号:51のaa1−251および配列番号:53のaa1−251、ならびに、これら
の配列と少なくとも70%、75%、80%、85%、90%、95%、96%、97%
、98%、99%またはそれ以上または100%同一である配列で提供される。これらの
配列をコードするヌクレオチドは、配列番号:46、48、50および52において提供
される。
ト対象を含む動物における細胞増殖、移動、分化、ホメオスタシス、組織修復および損傷
応答を調節するポリペプチドを示す。FGFは、繊維芽細胞増殖因子受容体に結合し、F
GFRの自己リン酸化、FRS2(FGF受容体基質2)およびERK1/2(細胞外シ
グナル−調節タンパク質キナーゼ1/2)のリン酸化およびEgr−1(初期増殖応答−
1)の活性化を含む活性を調節する能力を有する。「FGF」なる用語は、例えば、当分
野で既知である、ならびに米国特許第7,223,563号および米国特許第7,259
,248号(これらの内容をその全体において出典明示により本明細書に包含させる)に
おいて記載されている、野生型「FGF」の活性なフラグメント、誘導体、模倣物、変異
体および化学的に修飾された化合物またはそれらのハイブリッドを含む。野生型FGFは
天然で見出されたとおりのアミノ酸配列を有する。本発明において使用するために適当な
例の繊維芽細胞増殖因子は、繊維芽細胞増殖因子−19(FGF19;配列番号:31)
、繊維芽細胞増殖因子−21(FGF21;配列番号:33)および繊維芽細胞増殖因子
−23(FGF23;配列番号:35)を含む。FGFポリペプチドは、マウスFGFを
含むヒト以外の他の種のものを含む。一般的に、FGFポリペプチドは、配列番号:31
、配列番号:33または配列番号:35のアミノ酸配列と実質的に同一である。すなわち
、配列番号:31、配列番号:33または配列番号:35のアミノ酸配列と少なくとも7
0%、75%、80%、85%、90%、95%、96%、97%、98%、99%また
はそれ以上または100%同一であるアミノ酸配列を有するアミノ酸配列またはそれらの
活性なフラグメントを有する。FGF、特にFGF23のさらなる非限定的な例は、配列
番号:47のaa1002−1228、配列番号:49のaa1002−1228、配列
番号:51のaa1−251および配列番号:53のaa1−251、ならびに、これら
の配列と少なくとも70%、75%、80%、85%、90%、95%、96%、97%
、98%、99%またはそれ以上または100%同一である配列で提供される。これらの
配列をコードするヌクレオチドは、配列番号:46、48、50および52において提供
される。
「FGF」なる用語は完全長ポリペプチドの活性なフラグメントを含む。対応するFG
F受容体に結合することができる活性なFGFフラグメントは、当分野で既知であり、本
明細書の使用において考慮される。本明細書に記載されている配列に基づいて、FGFの
重複フラグメントが、例えば、Sambrookら (1989, Molecular Cloning: A Laboratory Ma
nual, Cold Spring Harbor Laboratory Press, New York)およびAusubelら (1997, Curre
nt Protocols in Molecular Biology, Green & Wiley, New York)に記載されている標準
組換え技術を使用して生産することができることは、当業者に理解される。本明細書に存
在する記載に基づいて、FGFフラグメントの生物学的活性がFGF受容体への結合を含
む当分野で既知の、および本明細書に記載されている方法により試験することができるこ
とは、当業者に理解される。同様に、必要なFGFシグナル伝達機構(すなわちFGF受
容体)を有する細胞培養モデルは、FGFフラグメントでトランスフェクトされ、次に野
生型FGFと比較してFGFシグナル伝達における変化に関して試験され得る。
F受容体に結合することができる活性なFGFフラグメントは、当分野で既知であり、本
明細書の使用において考慮される。本明細書に記載されている配列に基づいて、FGFの
重複フラグメントが、例えば、Sambrookら (1989, Molecular Cloning: A Laboratory Ma
nual, Cold Spring Harbor Laboratory Press, New York)およびAusubelら (1997, Curre
nt Protocols in Molecular Biology, Green & Wiley, New York)に記載されている標準
組換え技術を使用して生産することができることは、当業者に理解される。本明細書に存
在する記載に基づいて、FGFフラグメントの生物学的活性がFGF受容体への結合を含
む当分野で既知の、および本明細書に記載されている方法により試験することができるこ
とは、当業者に理解される。同様に、必要なFGFシグナル伝達機構(すなわちFGF受
容体)を有する細胞培養モデルは、FGFフラグメントでトランスフェクトされ、次に野
生型FGFと比較してFGFシグナル伝達における変化に関して試験され得る。
FGFは、特に異なるFGFサブファミリー中で、長さおよび一次配列両方において高
度に異なるN−およびC−末端配列の横に配置されている、FGF核相同性ドメイン(約
120アミノ酸長)の相同性に基づいて7つのサブファミリーに分類される(Goetzら Mo
lecular and Cellular Biology, 2007, Vol 27, 3417-3428)。FGF活性ポリペプチド
は、一般的に少なくとも1つのFGF核相同性ドメインを含む。いくつかの態様において
、FGF活性ポリペプチドは、FGF核相同性ドメインに加えて、結合FGF受容体にお
いてさらなる特異性を与え得るフランキング配列を含み得る。リガンドの核領域が他のF
GFと比較して高い配列同一性を共有するため(FGF19対FGF21:38%同一性
、FGF19対FGF23:36%同一性)、FGF19、FGF21およびFGF23
はFGF19サブファミリーに分類される。FGF19サブファミリーメンバーは内分泌
腺系のシグナル伝達分子と同様に作用し、古典的なFGFに珍しくない異なる生理学的プ
ロセスを調節する(例えば、FGF19:エネルギーおよび胆汁酸ホメオスタシス、FG
F21、グルコースおよび脂質代謝、およびFGF23、リン酸塩およびビタミンDホメ
オスタシス)。
度に異なるN−およびC−末端配列の横に配置されている、FGF核相同性ドメイン(約
120アミノ酸長)の相同性に基づいて7つのサブファミリーに分類される(Goetzら Mo
lecular and Cellular Biology, 2007, Vol 27, 3417-3428)。FGF活性ポリペプチド
は、一般的に少なくとも1つのFGF核相同性ドメインを含む。いくつかの態様において
、FGF活性ポリペプチドは、FGF核相同性ドメインに加えて、結合FGF受容体にお
いてさらなる特異性を与え得るフランキング配列を含み得る。リガンドの核領域が他のF
GFと比較して高い配列同一性を共有するため(FGF19対FGF21:38%同一性
、FGF19対FGF23:36%同一性)、FGF19、FGF21およびFGF23
はFGF19サブファミリーに分類される。FGF19サブファミリーメンバーは内分泌
腺系のシグナル伝達分子と同様に作用し、古典的なFGFに珍しくない異なる生理学的プ
ロセスを調節する(例えば、FGF19:エネルギーおよび胆汁酸ホメオスタシス、FG
F21、グルコースおよび脂質代謝、およびFGF23、リン酸塩およびビタミンDホメ
オスタシス)。
本明細書において使用される「繊維芽細胞増殖因子受容体」および「FGFR」は、当
分野で既知のFGFR1−4のいずれか、またはそれらのスプライス変異体(例えば、F
GFR1c)を示す。本明細書において使用するために適当な例の繊維芽細胞増殖因子受
容体は、繊維芽細胞増殖因子受容体−19(例えば、FGFR4−ベータクロトー)、繊
維芽細胞増殖因子受容体−21(例えば、FGFR1c−アルファクロトー)および繊維
芽細胞増殖因子受容体−23(例えば、FGFR1c−アルファクロトー、FGFR3−
アルファクロトー、FGFR4−アルファクロトー)を含む。
分野で既知のFGFR1−4のいずれか、またはそれらのスプライス変異体(例えば、F
GFR1c)を示す。本明細書において使用するために適当な例の繊維芽細胞増殖因子受
容体は、繊維芽細胞増殖因子受容体−19(例えば、FGFR4−ベータクロトー)、繊
維芽細胞増殖因子受容体−21(例えば、FGFR1c−アルファクロトー)および繊維
芽細胞増殖因子受容体−23(例えば、FGFR1c−アルファクロトー、FGFR3−
アルファクロトー、FGFR4−アルファクロトー)を含む。
本明細書において使用される「細胞外ドメイン」は、細胞の外側に存在する(例えば、
細胞内または膜貫通領域を含まない)膜貫通タンパク質のフラグメントを示す。「クロト
ータンパク質の細胞外ドメイン」、「可溶性クロトー」または「sクロトー」(例えば、
配列番号:7;配列番号:39)は、繊維芽細胞増殖因子に結合することができる、およ
び/または繊維芽細胞増殖因子に結合することにより繊維芽細胞増殖因子が繊維芽細胞増
殖因子受容体に結合することを可能にすることができるクロトーポリペプチドの細胞外ド
メインを示す。クロトー細胞外ドメインは、全長アルファクロトー配列(配列番号:2)
のアミノ酸残基28−982および全長ベータクロトー配列(配列番号:4)のアミノ酸
残基52−997に対応する。
細胞内または膜貫通領域を含まない)膜貫通タンパク質のフラグメントを示す。「クロト
ータンパク質の細胞外ドメイン」、「可溶性クロトー」または「sクロトー」(例えば、
配列番号:7;配列番号:39)は、繊維芽細胞増殖因子に結合することができる、およ
び/または繊維芽細胞増殖因子に結合することにより繊維芽細胞増殖因子が繊維芽細胞増
殖因子受容体に結合することを可能にすることができるクロトーポリペプチドの細胞外ド
メインを示す。クロトー細胞外ドメインは、全長アルファクロトー配列(配列番号:2)
のアミノ酸残基28−982および全長ベータクロトー配列(配列番号:4)のアミノ酸
残基52−997に対応する。
「クロトータンパク質の細胞外サブドメイン」は、繊維芽細胞増殖因子を結合すること
ができる、および/または繊維芽細胞増殖因子への結合により繊維芽細胞増殖因子の繊維
芽細胞増殖因子受容体への結合を可能にすることができる、クロトーポリペプチドの細胞
外ドメインの領域を示す。種々の態様において、融合ポリペプチドは、クロトータンパク
質の少なくとも1つの細胞外サブドメインを含むポリペプチド、線維芽細胞増殖因子を含
むポリペプチド、および、所望により、減少したFc−ガンマ−受容体に対する親和性お
よび/もしくは増加した血清半減期を有する修飾されたFcフラグメントを含む。クロト
ー細胞外ドメインは、繰り返されている2つの相同サブドメイン、すなわち、KL−D1
(配列番号:5)およびKL−D2(配列番号:6)を有する。KL−D1およびKL−
D2は、それぞれ、全長アルファクロトーポリペプチド(配列番号:2)のアミノ酸残基
58−506および517−953、ならびに、それぞれ、全長ベータクロトーポリペプ
チド(配列番号:4)のアミノ酸残基77−508および571−967に対応し、本明
細書において使用するために適当である。一般的に、少なくとも1つのクロトーサブドメ
インを含むポリペプチドは活性なクロトーポリペプチドである。本明細書のポリペプチド
において使用するためのクロトー細胞外サブドメインは、それぞれ配列番号:5または配
列番号:37のアミノ酸配列と実質的に同一であるアミノ酸配列を有するアルファクロト
ーまたはベータクロトーKL−D1ドメインであり得る。さらに、クロトーKL−D1ド
メインは、配列番号:5または配列番号:37のアミノ酸配列と少なくとも70%、75
%、80%、85%、90%、95%、96%、97%、98%、99%またはそれ以上
同一であるアミノ酸配列を有し得る。クロトー細胞外サブドメインは、また、それぞれ配
列番号:6または配列番号:38のアミノ酸配列と実質的に同一であるアルファまたはベ
ータクロトーポリペプチドKL−D2ドメインであり得る。さらなる態様において、KL
−D2ドメインは、配列番号:6または配列番号:38のアミノ酸配列と少なくとも70
%、75%、80%、85%、90%、95%、96%、97%、98%、99%または
それ以上同一であるアミノ酸配列を有する。いくつかの態様において、融合ポリペプチド
は、クロトータンパク質の少なくとも2つの細胞外サブドメイン(例えば、KL−D1お
よびKL−D2、タンデムリピートにおけるKL−D1およびKL−D1、タンデムリピ
ートにおけるKL−D2およびKL−D2など)を含む。
ができる、および/または繊維芽細胞増殖因子への結合により繊維芽細胞増殖因子の繊維
芽細胞増殖因子受容体への結合を可能にすることができる、クロトーポリペプチドの細胞
外ドメインの領域を示す。種々の態様において、融合ポリペプチドは、クロトータンパク
質の少なくとも1つの細胞外サブドメインを含むポリペプチド、線維芽細胞増殖因子を含
むポリペプチド、および、所望により、減少したFc−ガンマ−受容体に対する親和性お
よび/もしくは増加した血清半減期を有する修飾されたFcフラグメントを含む。クロト
ー細胞外ドメインは、繰り返されている2つの相同サブドメイン、すなわち、KL−D1
(配列番号:5)およびKL−D2(配列番号:6)を有する。KL−D1およびKL−
D2は、それぞれ、全長アルファクロトーポリペプチド(配列番号:2)のアミノ酸残基
58−506および517−953、ならびに、それぞれ、全長ベータクロトーポリペプ
チド(配列番号:4)のアミノ酸残基77−508および571−967に対応し、本明
細書において使用するために適当である。一般的に、少なくとも1つのクロトーサブドメ
インを含むポリペプチドは活性なクロトーポリペプチドである。本明細書のポリペプチド
において使用するためのクロトー細胞外サブドメインは、それぞれ配列番号:5または配
列番号:37のアミノ酸配列と実質的に同一であるアミノ酸配列を有するアルファクロト
ーまたはベータクロトーKL−D1ドメインであり得る。さらに、クロトーKL−D1ド
メインは、配列番号:5または配列番号:37のアミノ酸配列と少なくとも70%、75
%、80%、85%、90%、95%、96%、97%、98%、99%またはそれ以上
同一であるアミノ酸配列を有し得る。クロトー細胞外サブドメインは、また、それぞれ配
列番号:6または配列番号:38のアミノ酸配列と実質的に同一であるアルファまたはベ
ータクロトーポリペプチドKL−D2ドメインであり得る。さらなる態様において、KL
−D2ドメインは、配列番号:6または配列番号:38のアミノ酸配列と少なくとも70
%、75%、80%、85%、90%、95%、96%、97%、98%、99%または
それ以上同一であるアミノ酸配列を有する。いくつかの態様において、融合ポリペプチド
は、クロトータンパク質の少なくとも2つの細胞外サブドメイン(例えば、KL−D1お
よびKL−D2、タンデムリピートにおけるKL−D1およびKL−D1、タンデムリピ
ートにおけるKL−D2およびKL−D2など)を含む。
本明細書において使用される「修飾されたFcフラグメント」は、修飾された配列を含
む抗体のFcフラグメントを意味する。Fcフラグメントは、CH2、CH3およびヒン
ジ領域の部分を含む抗体の一部である。修飾されたFcフラグメントは、例えば、IgG
1、IgG2、IgG3またはIgG4由来であり得る。FcLALAは、効率低下でA
DCCを誘導し、弱くヒト補体に結合し、活性化するLALA変異(L234A、L23
5A)を有する修飾されたFcフラグメントであるHessellら 2007 Nature 449:101-104
。Fcフラグメントに対するさらなる修飾は、例えば、米国特許第7,217,798号
に記載されている。例えば、種々の修飾されたFcフラグメントにおいて、(a)アミノ
酸残基250はグルタミン酸であり、アミノ酸残基428はフェニルアラニンである、ま
たは(b)アミノ酸残基250はグルタミンであり、アミノ酸残基428はフェニルアラ
ニンである、または(c)アミノ酸残基250はグルタミンであり、アミノ酸残基428
はロイシンである。いくつかの態様において、アミノ酸残基250および428は、アミ
ノ酸残基250がグルタミン酸またはグルタミンであり、アミノ酸残基428がロイシン
またはフェニルアラニンである修飾されていないFc融合タンパク質において存在する残
基が異なっており、アミノ酸残基は米国特許第7,217,798号に記載されているE
U番号制により番号付けされる。いくつかの態様において、修飾されたFc−融合タンパ
ク質は、pH8.0でよりもpH6.0でFcRnに対するより高い親和性を有する。好
ましくは、修飾されたFcフラグメントは、減少したFcRnに対する親和性および/も
しくは増加した血清半減期を有する。修飾されたFcフラグメントの非限定的な例は、配
列番号:47のaa(アミノ酸)1234−1459、配列番号:49のaa1234か
ら1450、配列番号:51のaa257から482および配列番号:53のaa257
から473、ならびに、これらの配列と少なくとも70%、75%、80%、85%、9
0%、95%、96%、97%、98%、99%またはそれ以上または100%同一であ
る配列を含む。これらの配列をコードするヌクレオチドは、配列番号:46、48、50
および52において提供される。
む抗体のFcフラグメントを意味する。Fcフラグメントは、CH2、CH3およびヒン
ジ領域の部分を含む抗体の一部である。修飾されたFcフラグメントは、例えば、IgG
1、IgG2、IgG3またはIgG4由来であり得る。FcLALAは、効率低下でA
DCCを誘導し、弱くヒト補体に結合し、活性化するLALA変異(L234A、L23
5A)を有する修飾されたFcフラグメントであるHessellら 2007 Nature 449:101-104
。Fcフラグメントに対するさらなる修飾は、例えば、米国特許第7,217,798号
に記載されている。例えば、種々の修飾されたFcフラグメントにおいて、(a)アミノ
酸残基250はグルタミン酸であり、アミノ酸残基428はフェニルアラニンである、ま
たは(b)アミノ酸残基250はグルタミンであり、アミノ酸残基428はフェニルアラ
ニンである、または(c)アミノ酸残基250はグルタミンであり、アミノ酸残基428
はロイシンである。いくつかの態様において、アミノ酸残基250および428は、アミ
ノ酸残基250がグルタミン酸またはグルタミンであり、アミノ酸残基428がロイシン
またはフェニルアラニンである修飾されていないFc融合タンパク質において存在する残
基が異なっており、アミノ酸残基は米国特許第7,217,798号に記載されているE
U番号制により番号付けされる。いくつかの態様において、修飾されたFc−融合タンパ
ク質は、pH8.0でよりもpH6.0でFcRnに対するより高い親和性を有する。好
ましくは、修飾されたFcフラグメントは、減少したFcRnに対する親和性および/も
しくは増加した血清半減期を有する。修飾されたFcフラグメントの非限定的な例は、配
列番号:47のaa(アミノ酸)1234−1459、配列番号:49のaa1234か
ら1450、配列番号:51のaa257から482および配列番号:53のaa257
から473、ならびに、これらの配列と少なくとも70%、75%、80%、85%、9
0%、95%、96%、97%、98%、99%またはそれ以上または100%同一であ
る配列を含む。これらの配列をコードするヌクレオチドは、配列番号:46、48、50
および52において提供される。
本明細書において使用される「シグナルペプチド」は、小胞体へのタンパク質の翻訳後
輸送を指向して、切断され得るペプチド鎖(3−60アミノ酸長)を意味する。本明細書
において使用するために例の典型的なシグナルペプチドはクロトーシグナルペプチド(配
列番号:19)およびIgGシグナルペプチド(配列番号:20)を含む。産生細胞系に
より分泌および開裂されると、シグナルペプチド(例えば、配列番号:19および配列番
号:20に対応するペプチドの)は開裂されることに注意すること。したがって、産生細
胞系によるシグナルペプチドの分泌および開裂後、配列番号:19のペプチドは配列番号
:41のペプチドを産生する。
輸送を指向して、切断され得るペプチド鎖(3−60アミノ酸長)を意味する。本明細書
において使用するために例の典型的なシグナルペプチドはクロトーシグナルペプチド(配
列番号:19)およびIgGシグナルペプチド(配列番号:20)を含む。産生細胞系に
より分泌および開裂されると、シグナルペプチド(例えば、配列番号:19および配列番
号:20に対応するペプチドの)は開裂されることに注意すること。したがって、産生細
胞系によるシグナルペプチドの分泌および開裂後、配列番号:19のペプチドは配列番号
:41のペプチドを産生する。
本明細書において使用される「リンカー」は、互いに結合することができるように、共
有結合が2つ以上のポリペプチドまたは核酸を結合する機能の基(例えば、化学物質また
はポリペプチド)を意味する。本明細書において使用される「ペプチドリンカー」は、2
つのタンパク質を互いに結合する(例えば、クロトーの細胞外ドメインおよび繊維芽細胞
増殖因子−23を結合する)ために使用される1つ以上のアミノ酸を意味する。本明細書
において使用するために適当なペプチドリンカーは、配列番号:8、配列番号:9、配列
番号:10、配列番号:11、配列番号:12、配列番号:13、配列番号:14、配列
番号:15、配列番号:16、配列番号:17および配列番号:18により示されている
アミノ酸配列を有するポリペプチドを含むが、これらに限定されない。ポリペプチドリン
カーは、これらのアミノ酸配列のいずれかの少なくとも1、最大約30の繰り返しを含み
得る。
有結合が2つ以上のポリペプチドまたは核酸を結合する機能の基(例えば、化学物質また
はポリペプチド)を意味する。本明細書において使用される「ペプチドリンカー」は、2
つのタンパク質を互いに結合する(例えば、クロトーの細胞外ドメインおよび繊維芽細胞
増殖因子−23を結合する)ために使用される1つ以上のアミノ酸を意味する。本明細書
において使用するために適当なペプチドリンカーは、配列番号:8、配列番号:9、配列
番号:10、配列番号:11、配列番号:12、配列番号:13、配列番号:14、配列
番号:15、配列番号:16、配列番号:17および配列番号:18により示されている
アミノ酸配列を有するポリペプチドを含むが、これらに限定されない。ポリペプチドリン
カーは、これらのアミノ酸配列のいずれかの少なくとも1、最大約30の繰り返しを含み
得る。
本明細書において使用される「作動可能に連結している」は、生体分子と関連する生物
学的機能、活性および/または構造を少なくとも保持することができるような2つ以上の
生体分子の結合を意味する。ポリペプチドに関して、該用語は、2つ以上のポリペプチド
の結合がそれぞれのポリペプチド成分の少なくともいくつかのそれぞれの個々の活性を保
持する融合ポリペプチドとなることを意味する。2つ以上のポリペプチドは直接、または
リンカーを介して結合し得る。核酸に関して、該用語は、適当な分子(例えば、転写活性
化タンパク質)が第2のポリヌクレオチドに結合しているとき、第1のポリヌクレオチド
が第1のポリヌクレオチドの転写を指向する第2のポリヌクレオチドに隣接して配置され
ることを意味する。
学的機能、活性および/または構造を少なくとも保持することができるような2つ以上の
生体分子の結合を意味する。ポリペプチドに関して、該用語は、2つ以上のポリペプチド
の結合がそれぞれのポリペプチド成分の少なくともいくつかのそれぞれの個々の活性を保
持する融合ポリペプチドとなることを意味する。2つ以上のポリペプチドは直接、または
リンカーを介して結合し得る。核酸に関して、該用語は、適当な分子(例えば、転写活性
化タンパク質)が第2のポリヌクレオチドに結合しているとき、第1のポリヌクレオチド
が第1のポリヌクレオチドの転写を指向する第2のポリヌクレオチドに隣接して配置され
ることを意味する。
本明細書において使用される「特異的に結合する」は、第1の分子がそれ自体と他の標
的分子間の非共有相互作用の形成をもたらす特定の構造を取ることができるため、第1の
分子が暴露され得る多くの異なる型の分子の中から1つの標的分子に結合することができ
ることを示す。第1の分子は安定な複合体を形成する標的に結合するが、他の何らかの非
特異的な分子に対して、実質的にあまり、認識せず、接触せず、または第1の分子と複合
体を形成しない。
的分子間の非共有相互作用の形成をもたらす特定の構造を取ることができるため、第1の
分子が暴露され得る多くの異なる型の分子の中から1つの標的分子に結合することができ
ることを示す。第1の分子は安定な複合体を形成する標的に結合するが、他の何らかの非
特異的な分子に対して、実質的にあまり、認識せず、接触せず、または第1の分子と複合
体を形成しない。
本明細書において使用される「ポリペプチド変異体」または「タンパク質変異体」は、
1つ以上のアミノ酸が参照配列から異なるアミノ酸により置換されているポリペプチドを
示す。いくつかのアミノ酸が、以下に記載されているポリペプチド(保存的置換)の活性
の性質を変化することなく広範に同様の性質を有して、他のものにより置換され得ること
は当分野で理解されている。これらの用語は、また、1つ以上のアミノ酸が付加されたか
、もしくは欠失されたか、または異なるアミノ酸で置換されたポリペプチド、例えば、タ
ンパク質アイソフォームを包含する。本明細書において使用するために適当な繊維芽細胞
増殖因子−23の変異体の例は、繊維芽細胞増殖因子−23変異体(R179Q)である
。
1つ以上のアミノ酸が参照配列から異なるアミノ酸により置換されているポリペプチドを
示す。いくつかのアミノ酸が、以下に記載されているポリペプチド(保存的置換)の活性
の性質を変化することなく広範に同様の性質を有して、他のものにより置換され得ること
は当分野で理解されている。これらの用語は、また、1つ以上のアミノ酸が付加されたか
、もしくは欠失されたか、または異なるアミノ酸で置換されたポリペプチド、例えば、タ
ンパク質アイソフォームを包含する。本明細書において使用するために適当な繊維芽細胞
増殖因子−23の変異体の例は、繊維芽細胞増殖因子−23変異体(R179Q)である
。
本明細書において使用される「医薬組成物」は、個体における疾患または障害を処置ま
たは予防するために投与され得る化合物(例えば、本明細書の融合ポリペプチド)を含む
組成物を意味する。
たは予防するために投与され得る化合物(例えば、本明細書の融合ポリペプチド)を含む
組成物を意味する。
本明細書において使用される「個体」または「対象」は、ヒトまたは非ヒト哺乳動物、
例えば、ウシ、ウマ、イヌ、ヒツジまたはネコを含むが、これらに限定されない哺乳動物
を示す。
例えば、ウシ、ウマ、イヌ、ヒツジまたはネコを含むが、これらに限定されない哺乳動物
を示す。
本明細書において使用される「処置」は、疾患の発症または進行を減少、抑制、減衰、
軽減、阻止または安定させることを意味する。本明細書との関係において、本明細書のポ
リペプチドの投与は、サルコペニア、皮膚萎縮、筋肉疲労、脳萎縮、アテローム性動脈硬
化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症、免疫不全、高血圧、認知症、ハンチン
トン病、アルツハイマー病、白内障、加齢黄斑変性症、前立腺癌、卒中、期待寿命の低下
、記憶障害、しわ、腎機能障害および加齢関連難聴を含む加齢関連状態、ならびにII型
糖尿病、メタボリック・シンドローム、高血糖および肥満を含む代謝障害を処置するため
に使用され得る。
軽減、阻止または安定させることを意味する。本明細書との関係において、本明細書のポ
リペプチドの投与は、サルコペニア、皮膚萎縮、筋肉疲労、脳萎縮、アテローム性動脈硬
化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症、免疫不全、高血圧、認知症、ハンチン
トン病、アルツハイマー病、白内障、加齢黄斑変性症、前立腺癌、卒中、期待寿命の低下
、記憶障害、しわ、腎機能障害および加齢関連難聴を含む加齢関連状態、ならびにII型
糖尿病、メタボリック・シンドローム、高血糖および肥満を含む代謝障害を処置するため
に使用され得る。
本明細書において使用される「予防」は、対象における障害の発症を減少させる、また
は障害またはそれに関連する症状を有する危険性を減少させることを意味する。本明細書
との関係において、本明細書のポリペプチドの投与は、サルコペニア、皮膚萎縮、筋肉疲
労、脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症、免疫
不全、高血圧、認知症、ハンチントン病、アルツハイマー病、白内障、加齢黄斑変性症、
前立腺癌、卒中、期待寿命の低下、記憶障害、しわ、腎機能障害および加齢関連難聴を含
む加齢関連状態、ならびにII型糖尿病、メタボリック・シンドローム、高血糖および肥
満を含む代謝障害を予防するために使用され得る。予防は、加齢関連状態または代謝障害
の完全な、例えば、全体の欠如であり得る。予防は、また、対象における加齢関連状態ま
たは代謝障害の発症の可能性が本明細書を受けていない対象よりも発症する可能性を低く
するような、部分的なものであり得る。
は障害またはそれに関連する症状を有する危険性を減少させることを意味する。本明細書
との関係において、本明細書のポリペプチドの投与は、サルコペニア、皮膚萎縮、筋肉疲
労、脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症、免疫
不全、高血圧、認知症、ハンチントン病、アルツハイマー病、白内障、加齢黄斑変性症、
前立腺癌、卒中、期待寿命の低下、記憶障害、しわ、腎機能障害および加齢関連難聴を含
む加齢関連状態、ならびにII型糖尿病、メタボリック・シンドローム、高血糖および肥
満を含む代謝障害を予防するために使用され得る。予防は、加齢関連状態または代謝障害
の完全な、例えば、全体の欠如であり得る。予防は、また、対象における加齢関連状態ま
たは代謝障害の発症の可能性が本明細書を受けていない対象よりも発症する可能性を低く
するような、部分的なものであり得る。
本明細書において使用される「疾患」は、細胞、組織または臓器の正常機能を損なう、
または妨げるすべての状態または障害を意味する。
または妨げるすべての状態または障害を意味する。
本明細書において使用される「加齢関連状態」は、母集団における発生率または個体に
おける重症度が年齢の進行と関連があるすべての疾患または障害を意味する。1つの態様
において、加齢関連状態は、100,000個体以上の選択された母集団中で、30−4
0歳のヒト個体と比較して60歳以上のヒト個体中で発生率が少なくとも1.5倍である
疾患または障害である。本明細書に関連する加齢関連状態は、サルコペニア、皮膚萎縮、
筋肉疲労、脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症
、免疫不全、高血圧、認知症、ハンチントン病、アルツハイマー病、白内障、加齢黄斑変
性症、前立腺癌、卒中、期待寿命の低下、記憶障害、しわ、腎機能障害および加齢関連難
聴を含むが、これらに限定されない。
おける重症度が年齢の進行と関連があるすべての疾患または障害を意味する。1つの態様
において、加齢関連状態は、100,000個体以上の選択された母集団中で、30−4
0歳のヒト個体と比較して60歳以上のヒト個体中で発生率が少なくとも1.5倍である
疾患または障害である。本明細書に関連する加齢関連状態は、サルコペニア、皮膚萎縮、
筋肉疲労、脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症
、免疫不全、高血圧、認知症、ハンチントン病、アルツハイマー病、白内障、加齢黄斑変
性症、前立腺癌、卒中、期待寿命の低下、記憶障害、しわ、腎機能障害および加齢関連難
聴を含むが、これらに限定されない。
本明細書において使用される「代謝障害」は、細胞におけるエネルギー生産または細胞
、組織、臓器もしくは個体における毒素の蓄積に影響することにより、細胞、組織または
臓器における正常機能を損なう、または妨げるすべての疾患または障害を意味する。本明
細書に関連する代謝障害は、II型糖尿病、メタボリック・シンドローム、高血糖および
肥満を含むが、これらに限定されない。
、組織、臓器もしくは個体における毒素の蓄積に影響することにより、細胞、組織または
臓器における正常機能を損なう、または妨げるすべての疾患または障害を意味する。本明
細書に関連する代謝障害は、II型糖尿病、メタボリック・シンドローム、高血糖および
肥満を含むが、これらに限定されない。
「有効用量」または「有効量」は、有益な、または望ましい臨床結果をもたらすために
十分な量である。本明細書との関係において、それは、意図された薬理学的、治療または
予防結果を引き起こすために十分なクロトー融合ポリペプチドまたはsクロトーの量であ
る。治療有効用量は、障害または障害の1つ以上の症状(例えば、加齢関連状態または代
謝障害)の予防または改善をもたらす。治療有効用量は、対象および処置される疾患状態
、対象の体重および年齢、疾患状態の重症度、投与様式などに依存して変化し、当業者に
よって容易に決定することができる。
十分な量である。本明細書との関係において、それは、意図された薬理学的、治療または
予防結果を引き起こすために十分なクロトー融合ポリペプチドまたはsクロトーの量であ
る。治療有効用量は、障害または障害の1つ以上の症状(例えば、加齢関連状態または代
謝障害)の予防または改善をもたらす。治療有効用量は、対象および処置される疾患状態
、対象の体重および年齢、疾患状態の重症度、投与様式などに依存して変化し、当業者に
よって容易に決定することができる。
本明細書において使用される「クロトー核酸分子」は、クロトータンパク質をコードす
る遺伝子である。例のヒトクロトー遺伝子は、GenBank受入番号NM_00479
5(配列番号:1)で提供される。クロトーのさらなる非限定的な例は、配列番号:47
のaa1−982および配列番号:49のaa1−982、ならびに、これらの配列と少
なくとも70%、75%、80%、85%、90%、95%、96%、97%、98%、
99%またはそれ以上または100%同一である配列で提供される。
る遺伝子である。例のヒトクロトー遺伝子は、GenBank受入番号NM_00479
5(配列番号:1)で提供される。クロトーのさらなる非限定的な例は、配列番号:47
のaa1−982および配列番号:49のaa1−982、ならびに、これらの配列と少
なくとも70%、75%、80%、85%、90%、95%、96%、97%、98%、
99%またはそれ以上または100%同一である配列で提供される。
本明細書において使用される「フラグメント」は、ポリペプチドまたは核酸分子の一部
を示す。この一部は、好ましくは、参照核酸分子またはポリペプチドの全長の少なくとも
10%、20%、30%、40%、50%、60%、70%、80%、90%またはそれ
以上を含む。フラグメントは10、20、30、40、50、60、70、80、90ま
たは100、200、300、400、500、600、700、800、900、10
00または最大3000ヌクレオチドまたはアミノ酸を含み得る。
を示す。この一部は、好ましくは、参照核酸分子またはポリペプチドの全長の少なくとも
10%、20%、30%、40%、50%、60%、70%、80%、90%またはそれ
以上を含む。フラグメントは10、20、30、40、50、60、70、80、90ま
たは100、200、300、400、500、600、700、800、900、10
00または最大3000ヌクレオチドまたはアミノ酸を含み得る。
「実質的に同一」なる用語は、参照アミノ酸配列(例えば、本明細書に記載されている
アミノ酸配列のいずれか1つ)または核酸配列(例えば、本明細書に記載されている核酸
配列のいずれか1つ)と少なくとも50%同一性を示すポリペプチドまたは核酸分子を示
す。好ましくは、このような配列は、アミノ酸レベルまたは核酸において、比較のために
使用される配列と少なくとも60%、70%、75%、80%または85%、90%、9
1%、92%、93%、94%、95%、96%、97%、98%、99%またはそれ以
上同一である。
アミノ酸配列のいずれか1つ)または核酸配列(例えば、本明細書に記載されている核酸
配列のいずれか1つ)と少なくとも50%同一性を示すポリペプチドまたは核酸分子を示
す。好ましくは、このような配列は、アミノ酸レベルまたは核酸において、比較のために
使用される配列と少なくとも60%、70%、75%、80%または85%、90%、9
1%、92%、93%、94%、95%、96%、97%、98%、99%またはそれ以
上同一である。
本明細書は、加齢関連状態および代謝障害を予防または処置するための方法、キットお
よび組成物、および病理学的疾患の治療における使用のための、または、処置における使
用のための医薬としての、該組成物の使用に関する。いくつかの態様において、本明細書
は、クロトータンパク質の少なくとも1つの細胞外サブドメインを有する融合ポリペプチ
ドを提供する。いくつかの態様において、融合ポリペプチドは、線維芽細胞増殖因子また
はその活性なフラグメントをさらに含む。いくつかの態様において、融合ポリペプチドは
、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を
有する修飾されたFcフラグメントをさらに含む。他の態様において、融合ポリペプチド
は、修飾されたFc(例えば、FcLALA)に融合したFGF(例えば、FGF19、
FGF21、FGF23またはFGF23変異体R179Q)を含む。FcLALAは、
効率低下でADCCを誘導し、弱くヒト補体に結合し、活性化するLALA変異(L23
4A、L235A)を有するFcフラグメントである。クロトー細胞外ドメインはアルフ
ァまたはベータクロトーアイソフォームのいずれか由来であり得る。さらに、クロトー融
合ポリペプチドのFGF成分は繊維芽細胞増殖因子−19、繊維芽細胞増殖因子−21お
よび繊維芽細胞増殖因子−23に関して主に記載されているが、23の既知のFGFまた
はそれらの活性なフラグメントのすべてが本明細書の実施において使用することができる
と考えられる。
よび組成物、および病理学的疾患の治療における使用のための、または、処置における使
用のための医薬としての、該組成物の使用に関する。いくつかの態様において、本明細書
は、クロトータンパク質の少なくとも1つの細胞外サブドメインを有する融合ポリペプチ
ドを提供する。いくつかの態様において、融合ポリペプチドは、線維芽細胞増殖因子また
はその活性なフラグメントをさらに含む。いくつかの態様において、融合ポリペプチドは
、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を
有する修飾されたFcフラグメントをさらに含む。他の態様において、融合ポリペプチド
は、修飾されたFc(例えば、FcLALA)に融合したFGF(例えば、FGF19、
FGF21、FGF23またはFGF23変異体R179Q)を含む。FcLALAは、
効率低下でADCCを誘導し、弱くヒト補体に結合し、活性化するLALA変異(L23
4A、L235A)を有するFcフラグメントである。クロトー細胞外ドメインはアルフ
ァまたはベータクロトーアイソフォームのいずれか由来であり得る。さらに、クロトー融
合ポリペプチドのFGF成分は繊維芽細胞増殖因子−19、繊維芽細胞増殖因子−21お
よび繊維芽細胞増殖因子−23に関して主に記載されているが、23の既知のFGFまた
はそれらの活性なフラグメントのすべてが本明細書の実施において使用することができる
と考えられる。
クロトータンパク質の細胞外ドメインは、クロトータンパク質のKL−D1およびKL
−D2ドメインの1つまたは両方を含むことができる。いくつかの態様において、クロト
ー融合ポリペプチドは、クロトータンパク質の少なくとも2つの細胞外サブドメインを有
する。例えば、少なくとも2つの細胞外サブドメインは、タンデムリピートにおける少な
くとも2つのKL−D1ドメイン、タンデムリピートにおける少なくとも2つのKL−D
2ドメイン、または少なくとも1つのKL−D1ドメインおよび少なくとも1つのKL−
D2ドメインであり得る。
−D2ドメインの1つまたは両方を含むことができる。いくつかの態様において、クロト
ー融合ポリペプチドは、クロトータンパク質の少なくとも2つの細胞外サブドメインを有
する。例えば、少なくとも2つの細胞外サブドメインは、タンデムリピートにおける少な
くとも2つのKL−D1ドメイン、タンデムリピートにおける少なくとも2つのKL−D
2ドメイン、または少なくとも1つのKL−D1ドメインおよび少なくとも1つのKL−
D2ドメインであり得る。
クロトータンパク質の細胞外サブドメインおよび繊維芽細胞増殖因子(またはそれらの
活性なフラグメント)は、種々の方向および様式において互いに作動可能に連結すること
ができる。例えば、クロトータンパク質の細胞外サブドメインは繊維芽細胞増殖因子のN
−末端に作動可能に連結されていてよく、あるいは繊維芽細胞増殖因子はクロトータンパ
ク質の少なくとも1つの細胞外サブドメインのN−末端に作動可能に連結されていてもよ
い。
活性なフラグメント)は、種々の方向および様式において互いに作動可能に連結すること
ができる。例えば、クロトータンパク質の細胞外サブドメインは繊維芽細胞増殖因子のN
−末端に作動可能に連結されていてよく、あるいは繊維芽細胞増殖因子はクロトータンパ
ク質の少なくとも1つの細胞外サブドメインのN−末端に作動可能に連結されていてもよ
い。
本明細書の融合ポリペプチドは、クロトー細胞外ドメイン、すなわち、KL−D1(配
列番号:5)およびKL−D2(配列番号:6)の1つまたは両方を含み得る。KL−D
1およびKL−D2は、それぞれ全長アルファクロトーポリペプチド(配列番号:2)の
アミノ酸残基58−506および517−953ならびに全長ベータクロトーポリペプチ
ド(配列番号:4)のアミノ酸残基77−508および571−967に対応し、本明細
書において使用するために適当である。クロトー融合ポリペプチドは、配列番号:5のア
ミノ酸配列と実質的に同一であるアミノ酸配列を有するアルファクロトーポリペプチドま
たは配列番号:37のアミノ酸配列と実質的に同一であるアミノ酸配列を有するベータク
ロトーポリペプチドのKL−D1ドメインを有し得る。具体的には、クロトー融合ポリペ
プチドは、配列番号:5または配列番号:37と少なくとも70%、75%、80%、8
5%、90%、95%、96%、97%、98%、99%またはそれ以上同一であるアミ
ノ酸配列を有し得る。クロトー融合ポリペプチドは、配列番号:6のアミノ酸配列と実質
的に同一であるアミノ酸配列を有するアルファクロトーポリペプチドまたは配列番号:3
8のアミノ酸配列と実質的に同一であるアミノ酸配列を有するベータクロトーポリペプチ
ドのKL−D2ドメインを有し得る。具体的には、クロトー融合ポリペプチドは、それぞ
れ配列番号:6または配列番号:38と少なくとも70%、75%、80%、85%、9
0%、95%、96%、97%、98%、99%またはそれ以上同一であるアミノ酸配列
を有し得る。
列番号:5)およびKL−D2(配列番号:6)の1つまたは両方を含み得る。KL−D
1およびKL−D2は、それぞれ全長アルファクロトーポリペプチド(配列番号:2)の
アミノ酸残基58−506および517−953ならびに全長ベータクロトーポリペプチ
ド(配列番号:4)のアミノ酸残基77−508および571−967に対応し、本明細
書において使用するために適当である。クロトー融合ポリペプチドは、配列番号:5のア
ミノ酸配列と実質的に同一であるアミノ酸配列を有するアルファクロトーポリペプチドま
たは配列番号:37のアミノ酸配列と実質的に同一であるアミノ酸配列を有するベータク
ロトーポリペプチドのKL−D1ドメインを有し得る。具体的には、クロトー融合ポリペ
プチドは、配列番号:5または配列番号:37と少なくとも70%、75%、80%、8
5%、90%、95%、96%、97%、98%、99%またはそれ以上同一であるアミ
ノ酸配列を有し得る。クロトー融合ポリペプチドは、配列番号:6のアミノ酸配列と実質
的に同一であるアミノ酸配列を有するアルファクロトーポリペプチドまたは配列番号:3
8のアミノ酸配列と実質的に同一であるアミノ酸配列を有するベータクロトーポリペプチ
ドのKL−D2ドメインを有し得る。具体的には、クロトー融合ポリペプチドは、それぞ
れ配列番号:6または配列番号:38と少なくとも70%、75%、80%、85%、9
0%、95%、96%、97%、98%、99%またはそれ以上同一であるアミノ酸配列
を有し得る。
いくつかの態様において、本明細書のクロトー融合ポリペプチドは可溶性であり、FG
F受容体に結合することができる。
F受容体に結合することができる。
本明細書のクロトー融合ポリペプチドは、クロトータンパク質の少なくとも1つの細胞
外サブドメインを有するポリペプチドおよび繊維芽細胞増殖因子および(任意の)修飾さ
れたFcフラグメントを接続するポリペプチドリンカーを含むことができる。適当なリン
カーは当分野で既知であり、一般的にいくつかのGlyおよびいくつかのSer残基、例
えば、(Gly4 Ser)3(配列番号:11)、Gly4 Serポリペプチド(配
列番号:12)、Gly(配列番号:13)、Gly Gly(配列番号:14)、Gl
y Ser(配列番号:15)、Gly2 Ser(配列番号:16)、Ala(配列番
号:17)およびAla Ala(配列番号:18)を含む。いくつかの態様において、
リンカーは配列番号:12、配列番号:13、配列番号:14、配列番号:15、配列番
号:16、配列番号:17または配列番号:18のいずれかに記載されているアミノ酸配
列の少なくとも2から最大約30までの繰り返しを有する。
外サブドメインを有するポリペプチドおよび繊維芽細胞増殖因子および(任意の)修飾さ
れたFcフラグメントを接続するポリペプチドリンカーを含むことができる。適当なリン
カーは当分野で既知であり、一般的にいくつかのGlyおよびいくつかのSer残基、例
えば、(Gly4 Ser)3(配列番号:11)、Gly4 Serポリペプチド(配
列番号:12)、Gly(配列番号:13)、Gly Gly(配列番号:14)、Gl
y Ser(配列番号:15)、Gly2 Ser(配列番号:16)、Ala(配列番
号:17)およびAla Ala(配列番号:18)を含む。いくつかの態様において、
リンカーは配列番号:12、配列番号:13、配列番号:14、配列番号:15、配列番
号:16、配列番号:17または配列番号:18のいずれかに記載されているアミノ酸配
列の少なくとも2から最大約30までの繰り返しを有する。
ポリペプチドリンカーが本明細書のクロトー融合ポリペプチドに存在するとき、クロト
ータンパク質の少なくとも1つの細胞外サブドメインを有するポリペプチドは、ポリペプ
チドリンカーのC−末端にペプチド結合により接続されているFGFと、リンカーポリペ
プチドのN−末端にペプチド結合により接続されていてもよい。あるいは、FGFは、ポ
リペプチドリンカーのC−末端にペプチド結合により接続されている、クロトーの少なく
とも1つの細胞外サブドメインを有するポリペプチドと、リンカーポリペプチドのN−末
端にペプチド結合により接続されていてもよい。化学的リンカーが、また、2つのポリペ
プチドを連結するために使用することができる。
ータンパク質の少なくとも1つの細胞外サブドメインを有するポリペプチドは、ポリペプ
チドリンカーのC−末端にペプチド結合により接続されているFGFと、リンカーポリペ
プチドのN−末端にペプチド結合により接続されていてもよい。あるいは、FGFは、ポ
リペプチドリンカーのC−末端にペプチド結合により接続されている、クロトーの少なく
とも1つの細胞外サブドメインを有するポリペプチドと、リンカーポリペプチドのN−末
端にペプチド結合により接続されていてもよい。化学的リンカーが、また、2つのポリペ
プチドを連結するために使用することができる。
本明細書のクロトー融合ポリペプチドはシグナルペプチドを含み得る。クロトー融合ポ
リペプチドにおいて使用するためのシグナルペプチドの例は、クロトーシグナルペプチド
(配列番号:8)およびIgGシグナルペプチド(配列番号:9)を含むが、これらに限
定されない。
リペプチドにおいて使用するためのシグナルペプチドの例は、クロトーシグナルペプチド
(配列番号:8)およびIgGシグナルペプチド(配列番号:9)を含むが、これらに限
定されない。
いくつかの態様において、本明細書は、FGF(例えば、FGF19、FGF21、F
GF23またはFGF23変異体R179Q)および修飾されたFc(例えば、FcLA
LA)間の融合ポリペプチドを提供する。融合ポリペプチドはまた、所望によりFGFお
よびFc部分間のリンカーを含み得る。融合ポリペプチドはまた、所望によりシグナルペ
プチドを含み得る。種々の態様において、本明細書は、これらの融合ポリペプチドをコー
ドする核酸、これらの核酸を含むベクターおよびこれらの核酸を含む宿主細胞を含む。
GF23またはFGF23変異体R179Q)および修飾されたFc(例えば、FcLA
LA)間の融合ポリペプチドを提供する。融合ポリペプチドはまた、所望によりFGFお
よびFc部分間のリンカーを含み得る。融合ポリペプチドはまた、所望によりシグナルペ
プチドを含み得る。種々の態様において、本明細書は、これらの融合ポリペプチドをコー
ドする核酸、これらの核酸を含むベクターおよびこれらの核酸を含む宿主細胞を含む。
4.1.クロトーおよび繊維芽細胞増殖因子ポリペプチド
本明細書のクロトー融合ポリペプチドは、天然のFGFに相当する生物学的活性を示す
、例えば、FGF受容体に結合し、FGF受容体、FRS2(FGF受容体基質2)およ
びERK1/2(細胞外シグナル−調節タンパク質キナーゼ1/2)のリン酸化を誘導し
、Egr−1(初期増殖応答−1)遺伝子を活性化させることが期待される。FGFは、
FGF受容体に結合する分泌ペプチド増殖因子である。FGFのアミノ酸および核酸配列
は、当業者が容易に利用することができる。例えば、例のFGF19、FGF21および
FGF23の核酸配列(配列番号:30、32および34として本明細書に記載されてい
る)は、GenBankデータベースにおいて、それぞれアクセッションナンバー:NM
_005117、NM_019113およびNM_020638の下に見出すことができ
る。例のFGF19、FGF21およびFGF23のアミノ配列(配列番号:31、33
および35として本明細書に記載されている)は、GenBankデータベースにおいて
、それぞれアクセッションナンバー:NP_005108、NP_061986およびN
P_065689の下に見出すことができる。さらに、FGFはタンパク質の発現に役立
つ1つ以上の変化を含み得る(例えば、FGF23(R179Q)変異体(配列番号:3
6))。
本明細書のクロトー融合ポリペプチドは、天然のFGFに相当する生物学的活性を示す
、例えば、FGF受容体に結合し、FGF受容体、FRS2(FGF受容体基質2)およ
びERK1/2(細胞外シグナル−調節タンパク質キナーゼ1/2)のリン酸化を誘導し
、Egr−1(初期増殖応答−1)遺伝子を活性化させることが期待される。FGFは、
FGF受容体に結合する分泌ペプチド増殖因子である。FGFのアミノ酸および核酸配列
は、当業者が容易に利用することができる。例えば、例のFGF19、FGF21および
FGF23の核酸配列(配列番号:30、32および34として本明細書に記載されてい
る)は、GenBankデータベースにおいて、それぞれアクセッションナンバー:NM
_005117、NM_019113およびNM_020638の下に見出すことができ
る。例のFGF19、FGF21およびFGF23のアミノ配列(配列番号:31、33
および35として本明細書に記載されている)は、GenBankデータベースにおいて
、それぞれアクセッションナンバー:NP_005108、NP_061986およびN
P_065689の下に見出すことができる。さらに、FGFはタンパク質の発現に役立
つ1つ以上の変化を含み得る(例えば、FGF23(R179Q)変異体(配列番号:3
6))。
クロトータンパク質は、細胞外ドメインおよび短い細胞質ドメインを有する130kD
aの1回膜貫通型タンパク質である。クロトーのアミノ酸および核酸配列は、当業者が容
易に利用することができる。例えば、例のアルファ−クロトーおよびベータ−クロトーの
核酸配列(配列番号:7および8として本明細書に記載されている)は、GenBank
データベースにおいて、それぞれアクセッションナンバー:NM_004795およびN
M_175737の下に見出すことができる。例のアルファ−クロトーおよびベータ−ク
ロトーのアミノ酸配列(配列番号:2および4として本明細書に記載されている)は、G
enBankデータベースにおいて、それぞれアクセッションナンバー:NP_0047
86およびNP_783864の下に見出すことができる。
aの1回膜貫通型タンパク質である。クロトーのアミノ酸および核酸配列は、当業者が容
易に利用することができる。例えば、例のアルファ−クロトーおよびベータ−クロトーの
核酸配列(配列番号:7および8として本明細書に記載されている)は、GenBank
データベースにおいて、それぞれアクセッションナンバー:NM_004795およびN
M_175737の下に見出すことができる。例のアルファ−クロトーおよびベータ−ク
ロトーのアミノ酸配列(配列番号:2および4として本明細書に記載されている)は、G
enBankデータベースにおいて、それぞれアクセッションナンバー:NP_0047
86およびNP_783864の下に見出すことができる。
本明細書のクロトー融合ポリペプチドは、繊維芽細胞増殖因子受容体に結合することが
でき、繊維芽細胞増殖因子−19(配列番号:31)、繊維芽細胞増殖因子−21(配列
番号:33)、繊維芽細胞増殖因子−23(配列番号:35)またはそれらの変異体(繊
維芽細胞増殖因子−23変異体(R179Q)(配列番号:36)を含む)のいずれかに
作動可能に連結しているアルファ−クロトーまたはベータ−クロトー細胞外ドメインを有
する。
でき、繊維芽細胞増殖因子−19(配列番号:31)、繊維芽細胞増殖因子−21(配列
番号:33)、繊維芽細胞増殖因子−23(配列番号:35)またはそれらの変異体(繊
維芽細胞増殖因子−23変異体(R179Q)(配列番号:36)を含む)のいずれかに
作動可能に連結しているアルファ−クロトーまたはベータ−クロトー細胞外ドメインを有
する。
具体的には、本明細書のクロトー融合ポリペプチドは、繊維芽細胞増殖因子−23(配
列番号:35)または繊維芽細胞増殖因子−23変異体(R179Q)(配列番号:36
)に作動可能に連結しているアルファ−クロトー(配列番号:2)を含み得る。さらに、
本明細書のクロトー融合ポリペプチドは、繊維芽細胞増殖因子−19(配列番号:31)
に作動可能に連結しているベータ−クロトー(配列番号:4)を有し得る。本明細書のク
ロトー融合ポリペプチドは、繊維芽細胞増殖因子−21(配列番号:33)に作動可能に
連結しているベータ−クロトー(配列番号:4)を含み得る。
列番号:35)または繊維芽細胞増殖因子−23変異体(R179Q)(配列番号:36
)に作動可能に連結しているアルファ−クロトー(配列番号:2)を含み得る。さらに、
本明細書のクロトー融合ポリペプチドは、繊維芽細胞増殖因子−19(配列番号:31)
に作動可能に連結しているベータ−クロトー(配列番号:4)を有し得る。本明細書のク
ロトー融合ポリペプチドは、繊維芽細胞増殖因子−21(配列番号:33)に作動可能に
連結しているベータ−クロトー(配列番号:4)を含み得る。
本明細書は、種々のクロトーおよびFGF遺伝子およびこれらの遺伝子によってコード
されるタンパク質のホモログを含む。遺伝子に関して、「ホモログ」は、遺伝子の少なく
とも一部と実質的に同一である核酸配列もしくはその相補鎖またはそれらの一部を意味す
る、ただし、核酸配列が遺伝子によってコードされるタンパク質と実質的に同じ活性/機
能を有するタンパク質をコードする。本明細書に記載されている遺伝子のホモログは、推
定ホモログのアミノ酸または核酸配列と遺伝子またはそれらによってコードされるタンパ
ク質配列間の同一性パーセントにより同定することができる(例えば、クロトーおよびF
GFをコードする遺伝子に対する核酸配列またはそれらの相補鎖)。同一性パーセントは
、例えば、視覚的検査により、または当分野で既知の、または本明細書に記載されている
種々のコンピュータープログラムを使用することにより測定され得る。配列同一性は、一
般的に、配列分析ソフトウェア(例えば、Sequence Analysis Software Package of the
Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 Univ
ersity Avenue, Madison, Wis. 53705, BLAST, BESTFIT, GAPまたはPILEUP/PRETTYBOXプ
ログラム)を使用して測定される。このようなソフトウェアは、種々の置換、欠失および
/または他の修飾に関して相同性の程度を割り当てることにより、同一または同様の配列
を合わせる。保存アミノ酸置換は、一般的に、以下のグループ内の置換を含む。
グリシンおよびアラニン、
バリン、イソロイシンおよびロイシン、
アスパラギン酸、グルタミン酸、アスパラギンおよびグルタミン、
セリンおよびスレオニン、
リジンおよびアルギニン、ならびに
フェニルアラニンおよびチロシン。
されるタンパク質のホモログを含む。遺伝子に関して、「ホモログ」は、遺伝子の少なく
とも一部と実質的に同一である核酸配列もしくはその相補鎖またはそれらの一部を意味す
る、ただし、核酸配列が遺伝子によってコードされるタンパク質と実質的に同じ活性/機
能を有するタンパク質をコードする。本明細書に記載されている遺伝子のホモログは、推
定ホモログのアミノ酸または核酸配列と遺伝子またはそれらによってコードされるタンパ
ク質配列間の同一性パーセントにより同定することができる(例えば、クロトーおよびF
GFをコードする遺伝子に対する核酸配列またはそれらの相補鎖)。同一性パーセントは
、例えば、視覚的検査により、または当分野で既知の、または本明細書に記載されている
種々のコンピュータープログラムを使用することにより測定され得る。配列同一性は、一
般的に、配列分析ソフトウェア(例えば、Sequence Analysis Software Package of the
Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 Univ
ersity Avenue, Madison, Wis. 53705, BLAST, BESTFIT, GAPまたはPILEUP/PRETTYBOXプ
ログラム)を使用して測定される。このようなソフトウェアは、種々の置換、欠失および
/または他の修飾に関して相同性の程度を割り当てることにより、同一または同様の配列
を合わせる。保存アミノ酸置換は、一般的に、以下のグループ内の置換を含む。
グリシンおよびアラニン、
バリン、イソロイシンおよびロイシン、
アスパラギン酸、グルタミン酸、アスパラギンおよびグルタミン、
セリンおよびスレオニン、
リジンおよびアルギニン、ならびに
フェニルアラニンおよびチロシン。
したがって、アラニンへのグリシンの変異、グリシンへのアラニンの変異、イソロイシ
ンまたはロイシンへのバリンの変異、イソロイシンのバリンまたはロイシンでの置換、ロ
イシンのバリンまたはイソロイシンでの置換などは、保存アミノ酸置換である。本明細書
は、少なくとも1つの保存アミノ酸置換を有する本明細書に記載されている全てのアミノ
酸配列の変異体を提供する。
ンまたはロイシンへのバリンの変異、イソロイシンのバリンまたはロイシンでの置換、ロ
イシンのバリンまたはイソロイシンでの置換などは、保存アミノ酸置換である。本明細書
は、少なくとも1つの保存アミノ酸置換を有する本明細書に記載されている全てのアミノ
酸配列の変異体を提供する。
同一性の程度を測定するための手段の例において、密接な関連配列を示すプロバビリテ
ィスコアe−3からe−100を使用するBLASTプログラムが使用され得る。
ィスコアe−3からe−100を使用するBLASTプログラムが使用され得る。
1つの態様において、本明細書は、配列番号:19の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:20の融合ポリペプチドを提供する。
1つの態様において、本明細書は、配列番号:40の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:41の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
1つの態様において、本明細書は、配列番号:46の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:47の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:48の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:49の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する
1つの態様において、本明細書は、配列番号:50の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:51の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
1つの態様において、本明細書は、配列番号:52の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:53の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:54の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:20の融合ポリペプチドを提供する。
1つの態様において、本明細書は、配列番号:40の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:41の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
1つの態様において、本明細書は、配列番号:46の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:47の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:48の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:49の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する
1つの態様において、本明細書は、配列番号:50の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:51の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
1つの態様において、本明細書は、配列番号:52の融合ポリペプチドを提供する。
別の態様において、本明細書は、配列番号:53の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:54の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:55の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:56の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:57の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:58の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:59の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:60の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:61の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:62の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:63の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:56の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:57の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:58の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:59の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:60の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:61の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:62の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:63の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:64の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:65の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:66の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:67の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:68の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:65の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:66の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:67の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
別の態様において、本明細書は、配列番号:68の融合ポリペプチドまたは少なくとも
1つの保存アミノ酸置換を含むその変異体を提供する。
本明細書において使用される「相同性」および「相同」なる用語は、理論上共通の遺伝
的先祖を有するタンパク質を示すことに限定せず、進化した遺伝的に関連し得ないが、そ
れにもかかわらず、同様の機能を行い、および/または同様の構造を有するようなタンパ
ク質を含む。本明細書に記載されている機能的相同性の種々のタンパク質は、また、ホモ
ログである対応するタンパク質の活性を有するタンパク質を含む。機能的相同性を有する
タンパク質に関して、それらがそれらのアミノ酸配列において有意な同一性を有する必要
はなく、むしろ、機能的相同性を有するタンパク質は同様の、または同一の活性を有する
ことにより定義される。例えば、クロトー分子に関して、ポリペプチドはFGFポリペプ
チドへの結合の機能的特徴と有し、FGFRへのFGFの結合が可能であるべきである。
FGF分子に関して、ポリペプチドはFGFRに結合し、FGFRの活性化(例えば、リ
ン酸化)を引き起こす機能的特徴を有するべきである。FGF受容体へのFGF結合およ
び/またはFGFシグナル伝達経路の活性化を評価するためのアッセイは、当分野で既知
であるか、または本明細書に記載されている(実施例2参照)。クロトー活性を評価する
ためのアッセイも、当分野で既知であるか、本明細書に記載されている(例えば、FGF
ポリペプチドへの結合)。構造的相同性を有するタンパク質は、類似の三次(または四次
)構造を有するものとして定義されるが、それらをコードする遺伝子に対するアミノ酸同
一性または核酸同一性は必ずしも必要ではない。ある特定の状況では、構造的ホモログは
タンパク質の活性部位または結合部位のみで構造的相同性を維持するタンパク質を含み得
る。
的先祖を有するタンパク質を示すことに限定せず、進化した遺伝的に関連し得ないが、そ
れにもかかわらず、同様の機能を行い、および/または同様の構造を有するようなタンパ
ク質を含む。本明細書に記載されている機能的相同性の種々のタンパク質は、また、ホモ
ログである対応するタンパク質の活性を有するタンパク質を含む。機能的相同性を有する
タンパク質に関して、それらがそれらのアミノ酸配列において有意な同一性を有する必要
はなく、むしろ、機能的相同性を有するタンパク質は同様の、または同一の活性を有する
ことにより定義される。例えば、クロトー分子に関して、ポリペプチドはFGFポリペプ
チドへの結合の機能的特徴と有し、FGFRへのFGFの結合が可能であるべきである。
FGF分子に関して、ポリペプチドはFGFRに結合し、FGFRの活性化(例えば、リ
ン酸化)を引き起こす機能的特徴を有するべきである。FGF受容体へのFGF結合およ
び/またはFGFシグナル伝達経路の活性化を評価するためのアッセイは、当分野で既知
であるか、または本明細書に記載されている(実施例2参照)。クロトー活性を評価する
ためのアッセイも、当分野で既知であるか、本明細書に記載されている(例えば、FGF
ポリペプチドへの結合)。構造的相同性を有するタンパク質は、類似の三次(または四次
)構造を有するものとして定義されるが、それらをコードする遺伝子に対するアミノ酸同
一性または核酸同一性は必ずしも必要ではない。ある特定の状況では、構造的ホモログは
タンパク質の活性部位または結合部位のみで構造的相同性を維持するタンパク質を含み得
る。
構造的および機能的相同性に加えて、本明細書は、さらに本明細書に記載されている種
々のクロトーおよびFGFアミノ酸配列とアミノ酸同一性を有するタンパク質を包含する
。2つのアミノ酸配列の同一性/相同性パーセントを決定するために、該2つの配列を最
適な比較目的のために並べる(例えば、一方のタンパク質のアミノ酸配列と最適なアライ
メントのために、ギャップをもう一方のタンパク質のアミノ酸配列に導入することができ
る)。次に、対応するアミノ酸位置のアミノ酸残基を比較する。一方の配列の位置がもう
一方の配列の対応する位置に同じアミノ酸残基が存在するとき、それらの分子はその位置
で同一である。2つの配列間の同一性パーセントは、配列において共有される同一の位置
の数の関数である(すなわち、%同一性=同一の位置の#/位置の全#×100)。
々のクロトーおよびFGFアミノ酸配列とアミノ酸同一性を有するタンパク質を包含する
。2つのアミノ酸配列の同一性/相同性パーセントを決定するために、該2つの配列を最
適な比較目的のために並べる(例えば、一方のタンパク質のアミノ酸配列と最適なアライ
メントのために、ギャップをもう一方のタンパク質のアミノ酸配列に導入することができ
る)。次に、対応するアミノ酸位置のアミノ酸残基を比較する。一方の配列の位置がもう
一方の配列の対応する位置に同じアミノ酸残基が存在するとき、それらの分子はその位置
で同一である。2つの配列間の同一性パーセントは、配列において共有される同一の位置
の数の関数である(すなわち、%同一性=同一の位置の#/位置の全#×100)。
本明細書に記載されている本明細書の分子のアミノ酸配列は、本明細書に記載されてい
るアミノ酸配列と少なくとも約60%、70%、80%、90%、95%、96%、97
%、98%、99%またはそれ以上同一または相同であるアミノ酸配列を有する。
るアミノ酸配列と少なくとも約60%、70%、80%、90%、95%、96%、97
%、98%、99%またはそれ以上同一または相同であるアミノ酸配列を有する。
本明細書に記載されている本明細書の分子の核酸配列は、本明細書に記載されている核
酸配列とハイブリダイズするか、または本明細書に記載されている核酸配列と少なくとも
約60%、70%、80%、90%、95%、96%、97%、98%、99%またはそ
れ以上同一または相同である核酸配列を有する。
酸配列とハイブリダイズするか、または本明細書に記載されている核酸配列と少なくとも
約60%、70%、80%、90%、95%、96%、97%、98%、99%またはそ
れ以上同一または相同である核酸配列を有する。
本明細書の融合ポリペプチドにおいて使用するために適当な核酸分子は、ストリンジェ
ント条件下で、クロトーまたはFGFをコードする核酸分子の相補体にハイブリダイズす
るクロトーまたはFGF核酸配列を有し得る。本明細書において使用される「ストリンジ
ェント条件下でハイブリダイズする」なる用語は、互いに少なくとも約70%、80%、
85%、90%以上相同である核酸配列が一般的に互いにハイブリダイズの維持下にて、
ハイブリダイゼーションおよび洗浄する条件を表すことを意図する。このようなストリン
ジェント条件は当業者に既知であり、Ausubelら Current Protocols in Molecular Biolo
gy, Wiley Interscience, New York (2001), 6.3.1-6.3.6において見出すことができる。
特定の非限定的な例のストリンジェントハイブリダイゼーション条件は、6×塩化ナトリ
ウム/クエン酸ナトリウム(SSC)中で約45℃でハイブリダイゼーション、次に0.
2×SSC、0.1%のSDS中で50−65℃での1回以上の洗浄である。
ント条件下で、クロトーまたはFGFをコードする核酸分子の相補体にハイブリダイズす
るクロトーまたはFGF核酸配列を有し得る。本明細書において使用される「ストリンジ
ェント条件下でハイブリダイズする」なる用語は、互いに少なくとも約70%、80%、
85%、90%以上相同である核酸配列が一般的に互いにハイブリダイズの維持下にて、
ハイブリダイゼーションおよび洗浄する条件を表すことを意図する。このようなストリン
ジェント条件は当業者に既知であり、Ausubelら Current Protocols in Molecular Biolo
gy, Wiley Interscience, New York (2001), 6.3.1-6.3.6において見出すことができる。
特定の非限定的な例のストリンジェントハイブリダイゼーション条件は、6×塩化ナトリ
ウム/クエン酸ナトリウム(SSC)中で約45℃でハイブリダイゼーション、次に0.
2×SSC、0.1%のSDS中で50−65℃での1回以上の洗浄である。
4.2.本明細書のクロトー−FGF融合ポリペプチド
本明細書のいくつかの態様において、クロトー融合ポリペプチドは、クロトーポリペプ
チドの第1のポリペプチド配列またはそれらの活性なフラグメントおよびFGFをコード
する第2のポリペプチド配列またはそれらの活性なフラグメントを有するポリペプチド鎖
を有する。いくつかの態様において、融合ポリペプチドは、減少したFc−ガンマ−受容
体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメ
ントをさらに含む。
本明細書のいくつかの態様において、クロトー融合ポリペプチドは、クロトーポリペプ
チドの第1のポリペプチド配列またはそれらの活性なフラグメントおよびFGFをコード
する第2のポリペプチド配列またはそれらの活性なフラグメントを有するポリペプチド鎖
を有する。いくつかの態様において、融合ポリペプチドは、減少したFc−ガンマ−受容
体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメ
ントをさらに含む。
本明細書は、配列番号:19−28に存在するアミノ酸配列と少なくとも約95%以上
相同である融合ポリペプチドを含む。配列番号:19のアミノ酸配列は、FGF23(R
179Q)変異体(配列番号:36)のN−末端に結合しているクロトー細胞外ドメイン
を有するクロトー融合ポリペプチドをコードする。配列番号:20のアミノ酸配列は、F
GF23(R179Q)変異体のN−末端に結合しているシグナルペプチドを欠いている
クロトー細胞外ドメインのN−末端に結合しているIgGシグナルペプチドを有するクロ
トー融合ポリペプチドをコードする。配列番号:21のアミノ酸配列は、FGF23(R
179Q)変異体のN−末端に結合しているKL−D1細胞外サブドメインを有するクロ
トー融合ポリペプチドをコードする。配列番号:22のアミノ酸配列は、FGF23(R
179Q)変異体のN−末端に結合しているKL−D2細胞外サブドメインを有するクロ
トー融合ポリペプチドをコードする。配列番号:23のアミノ酸配列は、FGF23(R
179Q)変異体のN−末端に結合している2つのKL−D1細胞外サブドメインを有す
るクロトー融合ポリペプチドをコードする。配列番号:24のアミノ酸配列は、FGF2
3(R179Q)変異体のN−末端に結合している2つのKL−D2細胞外サブドメイン
を有するクロトー融合ポリペプチドをコードする。配列番号:25のアミノ酸配列は、ク
ロトー細胞外ドメインのN−末端に結合しているFGF23(R179Q)変異体を有す
るクロトー融合ポリペプチドをコードする。配列番号:26のアミノ酸配列は、KL−D
1細胞外サブドメインのN−末端に結合しているFGF23(R179Q)変異体を有す
るクロトー融合ポリペプチドをコードする。配列番号:27のアミノ酸配列は、KL−D
2細胞外サブドメインのN−末端に結合しているFGF23(R179Q)変異体を有す
るクロトー融合ポリペプチドをコードする。配列番号:28のアミノ酸配列は、2つのK
L−D1細胞外サブドメインのN−末端に結合しているFGF23(R179Q)変異体
を有するクロトー融合ポリペプチドをコードする。配列番号:29のアミノ酸配列は、2
つのKL−D2細胞外サブドメインのN−末端に結合しているFGF23(R179Q)
変異体を有するクロトー融合ポリペプチドをコードする。いくつかの態様において、融合
ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加し
た血清半減期を有する修飾されたFcフラグメントをさらに含む。
相同である融合ポリペプチドを含む。配列番号:19のアミノ酸配列は、FGF23(R
179Q)変異体(配列番号:36)のN−末端に結合しているクロトー細胞外ドメイン
を有するクロトー融合ポリペプチドをコードする。配列番号:20のアミノ酸配列は、F
GF23(R179Q)変異体のN−末端に結合しているシグナルペプチドを欠いている
クロトー細胞外ドメインのN−末端に結合しているIgGシグナルペプチドを有するクロ
トー融合ポリペプチドをコードする。配列番号:21のアミノ酸配列は、FGF23(R
179Q)変異体のN−末端に結合しているKL−D1細胞外サブドメインを有するクロ
トー融合ポリペプチドをコードする。配列番号:22のアミノ酸配列は、FGF23(R
179Q)変異体のN−末端に結合しているKL−D2細胞外サブドメインを有するクロ
トー融合ポリペプチドをコードする。配列番号:23のアミノ酸配列は、FGF23(R
179Q)変異体のN−末端に結合している2つのKL−D1細胞外サブドメインを有す
るクロトー融合ポリペプチドをコードする。配列番号:24のアミノ酸配列は、FGF2
3(R179Q)変異体のN−末端に結合している2つのKL−D2細胞外サブドメイン
を有するクロトー融合ポリペプチドをコードする。配列番号:25のアミノ酸配列は、ク
ロトー細胞外ドメインのN−末端に結合しているFGF23(R179Q)変異体を有す
るクロトー融合ポリペプチドをコードする。配列番号:26のアミノ酸配列は、KL−D
1細胞外サブドメインのN−末端に結合しているFGF23(R179Q)変異体を有す
るクロトー融合ポリペプチドをコードする。配列番号:27のアミノ酸配列は、KL−D
2細胞外サブドメインのN−末端に結合しているFGF23(R179Q)変異体を有す
るクロトー融合ポリペプチドをコードする。配列番号:28のアミノ酸配列は、2つのK
L−D1細胞外サブドメインのN−末端に結合しているFGF23(R179Q)変異体
を有するクロトー融合ポリペプチドをコードする。配列番号:29のアミノ酸配列は、2
つのKL−D2細胞外サブドメインのN−末端に結合しているFGF23(R179Q)
変異体を有するクロトー融合ポリペプチドをコードする。いくつかの態様において、融合
ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/もしくは増加し
た血清半減期を有する修飾されたFcフラグメントをさらに含む。
本明細書のクロトー融合ポリペプチドは、配列番号:7に記載されているアミノ酸配列
と少なくとも約95%同一であるアミノ酸配列を含み得る。配列番号:7のアミノ酸配列
はシグナルペプチドを欠いているクロトー細胞外ドメインをコードする。いくつかの態様
において、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/
もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。
と少なくとも約95%同一であるアミノ酸配列を含み得る。配列番号:7のアミノ酸配列
はシグナルペプチドを欠いているクロトー細胞外ドメインをコードする。いくつかの態様
において、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/
もしくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。
対象融合タンパク質は本明細書に記載されており、当分野で既知の方法を使用して製造
することができる。例えば、本明細書の融合ポリペプチドは、米国特許第6,194,1
77号に記載されているとおりに構築され得る。クロトーポリペプチドの使用は、米国特
許第6,579,850号に記載されている。FGF核酸分子の使用は、米国特許第7,
223,563号に記載されている。
することができる。例えば、本明細書の融合ポリペプチドは、米国特許第6,194,1
77号に記載されているとおりに構築され得る。クロトーポリペプチドの使用は、米国特
許第6,579,850号に記載されている。FGF核酸分子の使用は、米国特許第7,
223,563号に記載されている。
いくつかの態様において、クロトーをコードする核酸分子は、PCRによりクローニン
グされ、インフレームで、FGFをコードする核酸分子と結合される。いくつかの態様に
おいて、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/も
しくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。融合ポリ
ペプチドをコードする核酸は、発現を可能にするプロモーターに作動可能に連結している
。次に、融合ポリペプチドをコードする核酸分子を発現のための宿主細胞にトランスフェ
クトする。最終構築物の配列はシーケンシングにより確認することができる。
グされ、インフレームで、FGFをコードする核酸分子と結合される。いくつかの態様に
おいて、融合ポリペプチドは、減少したFc−ガンマ−受容体に対する親和性および/も
しくは増加した血清半減期を有する修飾されたFcフラグメントをさらに含む。融合ポリ
ペプチドをコードする核酸は、発現を可能にするプロモーターに作動可能に連結している
。次に、融合ポリペプチドをコードする核酸分子を発現のための宿主細胞にトランスフェ
クトする。最終構築物の配列はシーケンシングにより確認することができる。
本明細書の融合タンパク質を製造するとき、クロトーの細胞外サブドメインをコードす
る核酸分子を、インフレームでFGFをコードする核酸分子および修飾されたFcフラグ
メントをコードする(任意の)核酸に融合する。得られた核酸分子の発現は、FGFポリ
ペプチドに関してN−末端で融合しているクロトーの細胞外サブドメインを生じる。融合
物は、クロトーの細胞外サブドメインがFGFポリペプチドに関してC−末端で融合して
いるものも可能である。融合タンパク質を製造するための方法は当分野で既知である。
る核酸分子を、インフレームでFGFをコードする核酸分子および修飾されたFcフラグ
メントをコードする(任意の)核酸に融合する。得られた核酸分子の発現は、FGFポリ
ペプチドに関してN−末端で融合しているクロトーの細胞外サブドメインを生じる。融合
物は、クロトーの細胞外サブドメインがFGFポリペプチドに関してC−末端で融合して
いるものも可能である。融合タンパク質を製造するための方法は当分野で既知である。
本明細書の融合ポリペプチドは、一方のポリペプチドが1つのタンパク質配列またはド
メイン、例えばクロトー由来であり、そして、もう一方のポリペプチドが別のタンパク質
配列またはドメイン、例えばFGF由来である、共有結合されてた少なくとも2つのポリ
ペプチドを有する。いくつかの態様において、融合ポリペプチドは、減少したFc−ガン
マ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFc
フラグメントをさらに含む。別の態様において、本明細書は、修飾されたFcフラグメン
トに融合したFGFを含む。本明細書の融合ポリペプチドのクロトーおよび/またはFG
Fおよび/または(任意の)修飾されたFcフラグメントは、当業者によく知られている
方法により連結することができる。これらの方法は化学的および組換え方法両方を含む。
メイン、例えばクロトー由来であり、そして、もう一方のポリペプチドが別のタンパク質
配列またはドメイン、例えばFGF由来である、共有結合されてた少なくとも2つのポリ
ペプチドを有する。いくつかの態様において、融合ポリペプチドは、減少したFc−ガン
マ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFc
フラグメントをさらに含む。別の態様において、本明細書は、修飾されたFcフラグメン
トに融合したFGFを含む。本明細書の融合ポリペプチドのクロトーおよび/またはFG
Fおよび/または(任意の)修飾されたFcフラグメントは、当業者によく知られている
方法により連結することができる。これらの方法は化学的および組換え方法両方を含む。
本明細書の融合ポリペプチドに組み込まれるドメインをコードする核酸は、組換え遺伝
の分野における通常の技術を使用して得ることができる。本明細書において使用される一
般的な方法を記載している基本的な文献は、Sambrook and Russell, Molecular Cloning,
A Laboratory Manual (3rd ed. 2001); Kriegler, Gene Transfer and Expression: A L
aboratory Manual (1990);およびCurrent Protocols in Molecular Biology (Ausubelら
eds., 1994-1999)を含む。本明細書のクロトー融合ポリペプチドをコードする核酸におい
て、配列番号:1および配列番号:3それぞれにより示されているアルファ−クロトーま
たはベータ−クロトーをコードする核酸配列が使用され得る。クロトー融合ポリペプチド
をコードする核酸において、配列番号:30、配列番号:32および配列番号:34それ
ぞれにより示されているFGF19、FGF21またはFGF23をコードする核酸配列
が使用され得る。本明細書に記載されている本明細書の分子の核酸配列は、配列番号:1
、配列番号:3、配列番号:30、配列番号:32または配列番号:34とハイブリダイ
ズするか、または少なくとも約60%、70%、80%、90%、95%、96%、97
%、98%、99%またはそれ以上同一または相同である核酸配列を含む。
の分野における通常の技術を使用して得ることができる。本明細書において使用される一
般的な方法を記載している基本的な文献は、Sambrook and Russell, Molecular Cloning,
A Laboratory Manual (3rd ed. 2001); Kriegler, Gene Transfer and Expression: A L
aboratory Manual (1990);およびCurrent Protocols in Molecular Biology (Ausubelら
eds., 1994-1999)を含む。本明細書のクロトー融合ポリペプチドをコードする核酸におい
て、配列番号:1および配列番号:3それぞれにより示されているアルファ−クロトーま
たはベータ−クロトーをコードする核酸配列が使用され得る。クロトー融合ポリペプチド
をコードする核酸において、配列番号:30、配列番号:32および配列番号:34それ
ぞれにより示されているFGF19、FGF21またはFGF23をコードする核酸配列
が使用され得る。本明細書に記載されている本明細書の分子の核酸配列は、配列番号:1
、配列番号:3、配列番号:30、配列番号:32または配列番号:34とハイブリダイ
ズするか、または少なくとも約60%、70%、80%、90%、95%、96%、97
%、98%、99%またはそれ以上同一または相同である核酸配列を含む。
融合物の種々の成分[クロトーおよび/またはFGFペプチドおよび/または(任意の
)修飾されたFcフラグメント]をコードする核酸配列は、種々の方法のいずれかを使用
して得ることができる。例えば、ポリペプチドをコードする核酸配列は、プローブとのハ
イブリダイゼーションによりcDNAおよびゲノムDNAライブラリーからクローニング
されるか、またはオリゴヌクレオチドプライマーとの増幅技術を使用して単離され得る。
より一般的には、増幅技術はDNAまたはRNA鋳型を使用してクロトーおよびFGF配
列を増幅および単離するために使用される(例えば、Dieffenfach & Dveksler, PCR Prim
ers: A Laboratory Manual (1995)、参照)。あるいは、重複オリゴヌクレオチドは合成
的に生産し、1つ以上のドメインを生産して連結することができる。クロトーまたはFG
Fをコードする核酸は、また、プローブとして抗体を使用して発現ライブラリーから単離
することができる。
)修飾されたFcフラグメント]をコードする核酸配列は、種々の方法のいずれかを使用
して得ることができる。例えば、ポリペプチドをコードする核酸配列は、プローブとのハ
イブリダイゼーションによりcDNAおよびゲノムDNAライブラリーからクローニング
されるか、またはオリゴヌクレオチドプライマーとの増幅技術を使用して単離され得る。
より一般的には、増幅技術はDNAまたはRNA鋳型を使用してクロトーおよびFGF配
列を増幅および単離するために使用される(例えば、Dieffenfach & Dveksler, PCR Prim
ers: A Laboratory Manual (1995)、参照)。あるいは、重複オリゴヌクレオチドは合成
的に生産し、1つ以上のドメインを生産して連結することができる。クロトーまたはFG
Fをコードする核酸は、また、プローブとして抗体を使用して発現ライブラリーから単離
することができる。
本明細書において、融合物の種々の成分[クロトー、および/またはFGFおよび/ま
たは(任意の)修飾されたFcフラグメント]は、アミノ酸リンカーを含む共有結合リン
カー、例えば、ポリグリシンリンカー、または炭水化物リンカー、脂質リンカー、脂肪酸
リンカー、ポリエーテルリンカーを含む別のタイプの化学リンカー、例えば、PEGなど
で直接、または、それらを介してのいずれかで連結することができる(例えば、Hermanso
n, Bioconjugate techniques (1996)、参照)。融合物/融合ポリペプチドを形成するポ
リペプチドは、一般的に、C−末端からN−末端に連結するが、それらは、C−末端から
C−末端、N−末端からN−末端またはN−末端からC−末端に連結することもできる。
1つ以上のポリペプチドドメインが、本明細書の融合ポリペプチド内の内部の位置に挿入
され得る。融合タンパク質のポリペプチドは任意の順番であり得る。融合ポリペプチドは
、隣接して融合タンパク質をコードする組換えポリヌクレオチドを製造することにより、
1つのタンパク質配列からのアミノ酸鎖、例えば、クロトーの細胞外サブドメインと別の
タンパク質配列からのアミノ酸鎖、例えば、FGFの共有結合により生産され得る。融合
タンパク質におけるアミノ酸の異なる鎖は、互いに直接的にスプライシングされるか、化
学結合基またはアミノ酸結合基を介して互いに間接的にスプライシングされ得る。アミノ
酸結合基は、約200以上のアミノ酸長または一般的に1から100アミノ酸長であり得
る。いくつかの態様において、プロリン残基がリンカーに組み込まれ、リンカーによる重
要な二次構造成分の構成を妨げる。リンカーは、しばしば、組換え融合タンパク質の一部
として合成されるフレキシブルなアミノ酸部分配列であり得る。このようなフレキシブル
なリンカーは当業者に既知である。
たは(任意の)修飾されたFcフラグメント]は、アミノ酸リンカーを含む共有結合リン
カー、例えば、ポリグリシンリンカー、または炭水化物リンカー、脂質リンカー、脂肪酸
リンカー、ポリエーテルリンカーを含む別のタイプの化学リンカー、例えば、PEGなど
で直接、または、それらを介してのいずれかで連結することができる(例えば、Hermanso
n, Bioconjugate techniques (1996)、参照)。融合物/融合ポリペプチドを形成するポ
リペプチドは、一般的に、C−末端からN−末端に連結するが、それらは、C−末端から
C−末端、N−末端からN−末端またはN−末端からC−末端に連結することもできる。
1つ以上のポリペプチドドメインが、本明細書の融合ポリペプチド内の内部の位置に挿入
され得る。融合タンパク質のポリペプチドは任意の順番であり得る。融合ポリペプチドは
、隣接して融合タンパク質をコードする組換えポリヌクレオチドを製造することにより、
1つのタンパク質配列からのアミノ酸鎖、例えば、クロトーの細胞外サブドメインと別の
タンパク質配列からのアミノ酸鎖、例えば、FGFの共有結合により生産され得る。融合
タンパク質におけるアミノ酸の異なる鎖は、互いに直接的にスプライシングされるか、化
学結合基またはアミノ酸結合基を介して互いに間接的にスプライシングされ得る。アミノ
酸結合基は、約200以上のアミノ酸長または一般的に1から100アミノ酸長であり得
る。いくつかの態様において、プロリン残基がリンカーに組み込まれ、リンカーによる重
要な二次構造成分の構成を妨げる。リンカーは、しばしば、組換え融合タンパク質の一部
として合成されるフレキシブルなアミノ酸部分配列であり得る。このようなフレキシブル
なリンカーは当業者に既知である。
本明細書において、融合物[クロトーの細胞外サブドメインおよび/またはFGFおよ
び/または(任意の)修飾されたFcフラグメント]のアミノ酸配列は、ペプチドリンカ
ーを介して連結されていてもよい。例のペプチドリンカーは当分野で既知であり、本明細
書に記載されている。例えば、ペプチドリンカーは、一般的に、いくつかのGlyおよび
いくつかのSer残基、例えば:(Gly4 Ser)3(配列番号:11)、Gly4
Serポリペプチド(配列番号:12)、Gly(配列番号:13)、Gly Gly
(配列番号:14)、Gly Ser(配列番号:15)、Gly2 Ser(配列番号
:16)、Ala(配列番号:17)およびAla Ala(配列番号:18)を含む。
特に、本明細書の融合タンパク質において使用するためのペプチドリンカーは、フレキシ
ブルなヒンジとして作用し得る。
び/または(任意の)修飾されたFcフラグメント]のアミノ酸配列は、ペプチドリンカ
ーを介して連結されていてもよい。例のペプチドリンカーは当分野で既知であり、本明細
書に記載されている。例えば、ペプチドリンカーは、一般的に、いくつかのGlyおよび
いくつかのSer残基、例えば:(Gly4 Ser)3(配列番号:11)、Gly4
Serポリペプチド(配列番号:12)、Gly(配列番号:13)、Gly Gly
(配列番号:14)、Gly Ser(配列番号:15)、Gly2 Ser(配列番号
:16)、Ala(配列番号:17)およびAla Ala(配列番号:18)を含む。
特に、本明細書の融合タンパク質において使用するためのペプチドリンカーは、フレキシ
ブルなヒンジとして作用し得る。
クロトーまたはFGFのシグナル配列は、本明細書の融合タンパク質へのクロトーの導
入前に、除去され得る。融合タンパク質のクロトーまたはFGFに対するシグナル配列は
、例えば、配列番号:19により示されているポリペプチドを含み得る。しかしながら、
このような配列は、また、除去されるか、または異なるタンパク質のシグナル配列、例え
ば、IgGシグナル配列(配列番号:9)で置き換えられ得る。一般的に、本明細書の医
薬組成物はクロトーおよびFGFの成熟形態を含む。
入前に、除去され得る。融合タンパク質のクロトーまたはFGFに対するシグナル配列は
、例えば、配列番号:19により示されているポリペプチドを含み得る。しかしながら、
このような配列は、また、除去されるか、または異なるタンパク質のシグナル配列、例え
ば、IgGシグナル配列(配列番号:9)で置き換えられ得る。一般的に、本明細書の医
薬組成物はクロトーおよびFGFの成熟形態を含む。
一般的に、イントロンは、融合ポリペプチドへの導入の前に、クロトーまたはFGF部
分のいずれか1つまたは両方から除外される。
分のいずれか1つまたは両方から除外される。
本明細書の融合ポリペプチドは、1つ以上の活性アミノ酸側鎖に共有結合した1つ以上
のポリマーを含み得る。非限定的な例として、このようなポリマーは、1つ以上の遊離の
システインスルフヒドリル残基と結合することができるポリエチレングリコール(PEG
)を含み、それにより、タンパク質が酸化条件に暴露されたとき、ジスルフィド結合およ
び凝集の形成をブロックすることができる。加えて、本明細書の融合ポリペプチドのペグ
化は、半減期、溶解度およびプロテアーゼ抵抗性の増加のようなこのような改良された特
性を提供することが期待される。あるいは、本明細書の融合ポリペプチドは、遊離アミノ
基、例えば、リシンイプシロンまたはN−末端アミノ基へのポリマーの共有結合的付加に
より修飾され得る。共有結合修飾に対して特定の特異的なシステインおよびリシンは、受
容体結合、ヘパリン結合または適当なタンパク質フォールディングに関連しないものある
。特定のアミノ酸残基の修飾が望ましいタンパク質の活性に影響するか否かを測定するた
めに、融合ポリペプチドの生化学的および/または生物学的活性をアッセイするための方
法が使用され得ることは、当業者に明らかである。他の同様の適当な修飾が考えられ、当
分野で既知である。
のポリマーを含み得る。非限定的な例として、このようなポリマーは、1つ以上の遊離の
システインスルフヒドリル残基と結合することができるポリエチレングリコール(PEG
)を含み、それにより、タンパク質が酸化条件に暴露されたとき、ジスルフィド結合およ
び凝集の形成をブロックすることができる。加えて、本明細書の融合ポリペプチドのペグ
化は、半減期、溶解度およびプロテアーゼ抵抗性の増加のようなこのような改良された特
性を提供することが期待される。あるいは、本明細書の融合ポリペプチドは、遊離アミノ
基、例えば、リシンイプシロンまたはN−末端アミノ基へのポリマーの共有結合的付加に
より修飾され得る。共有結合修飾に対して特定の特異的なシステインおよびリシンは、受
容体結合、ヘパリン結合または適当なタンパク質フォールディングに関連しないものある
。特定のアミノ酸残基の修飾が望ましいタンパク質の活性に影響するか否かを測定するた
めに、融合ポリペプチドの生化学的および/または生物学的活性をアッセイするための方
法が使用され得ることは、当業者に明らかである。他の同様の適当な修飾が考えられ、当
分野で既知である。
本明細書は、また、配列番号:19−28に存在するアミノ酸配列と少なくとも約95
%以上相同である融合ポリペプチドの発現に関する。
%以上相同である融合ポリペプチドの発現に関する。
本明細書は、(a)クロトータンパク質の少なくとも1つの細胞外サブドメインまたは
それらの機能的に活性な変異体もしくは誘導体を含むポリペプチド、(b)線維芽細胞増
殖因子またはそれらの機能的に活性な変異体もしくは誘導体を含むポリペプチド、および
(c)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減
期を有する修飾されたFcフラグメントを含む融合ポリペプチドを含む。「それらの機能
的に活性な変異体もしくは誘導体」は、生物学的活性を保持するが、対応する野生型ポリ
ペプチドよりもより長い、より短いまたは改変されたアミノ酸配列を含む変異体もしくは
誘導体を意味する。したがって、クロトータンパク質の細胞外サブドメインまたは線維芽
細胞増殖因子の「機能的に活性な変異体もしくは誘導体」は、野生型ポリペプチド配列の
少なくとも1つの生物学的活性を保持するが、野生型クロトータンパク質の細胞外サブド
メインまたは線維芽細胞増殖因子よりもより少ない、より多いまたは改変されたアミノ酸
配列を含む。本明細書に記載されているポリペプチドの機能的に活性な変異体もしくは誘
導体はまた、翻訳後修飾(例えば、ペグ化、メチル化および/またはグリコシル化)にお
いて変化しているか、またはそれに加えられたさらなる部分または因子を有するが、本明
細書に記載されているポリペプチドの同じアミノ酸配列を含み得る。種々の態様において
、FGF23の変異体もしくは誘導体は、R179Qを含むか、または含まない。
それらの機能的に活性な変異体もしくは誘導体を含むポリペプチド、(b)線維芽細胞増
殖因子またはそれらの機能的に活性な変異体もしくは誘導体を含むポリペプチド、および
(c)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減
期を有する修飾されたFcフラグメントを含む融合ポリペプチドを含む。「それらの機能
的に活性な変異体もしくは誘導体」は、生物学的活性を保持するが、対応する野生型ポリ
ペプチドよりもより長い、より短いまたは改変されたアミノ酸配列を含む変異体もしくは
誘導体を意味する。したがって、クロトータンパク質の細胞外サブドメインまたは線維芽
細胞増殖因子の「機能的に活性な変異体もしくは誘導体」は、野生型ポリペプチド配列の
少なくとも1つの生物学的活性を保持するが、野生型クロトータンパク質の細胞外サブド
メインまたは線維芽細胞増殖因子よりもより少ない、より多いまたは改変されたアミノ酸
配列を含む。本明細書に記載されているポリペプチドの機能的に活性な変異体もしくは誘
導体はまた、翻訳後修飾(例えば、ペグ化、メチル化および/またはグリコシル化)にお
いて変化しているか、またはそれに加えられたさらなる部分または因子を有するが、本明
細書に記載されているポリペプチドの同じアミノ酸配列を含み得る。種々の態様において
、FGF23の変異体もしくは誘導体は、R179Qを含むか、または含まない。
1つの態様において、機能的に活性な変異体もしくは誘導体ポリペプチドは、本明細書
に記載されている配列(例えば、クロトータンパク質の少なくとも1つの細胞外ドメイン
または線維芽細胞増殖因子)と少なくとも約60%同一であるアミノ酸配列を含む。好ま
しくは、ポリペプチドは、本明細書に記載されている配列と少なくとも55%、60%、
65%、70%、75%、80%、85%、90%、95%、98%、99%またはそれ
以上同一である。
に記載されている配列(例えば、クロトータンパク質の少なくとも1つの細胞外ドメイン
または線維芽細胞増殖因子)と少なくとも約60%同一であるアミノ酸配列を含む。好ま
しくは、ポリペプチドは、本明細書に記載されている配列と少なくとも55%、60%、
65%、70%、75%、80%、85%、90%、95%、98%、99%またはそれ
以上同一である。
本明細書において使用される2つのアミノ酸配列(または2つの核酸配列)の同一性パ
ーセントは、KarlinおよびAltschul(PNAS USA 87:2264-2268, 1990)の
アルゴリズムを使用して決定され、Karlin and Altschul, PNAS USA 90:5873-5877, 1993
)において修飾される。このようなアルゴリズムは、Altschulら(J. Mol. Biol
. 215:403-410, 1990)のNBLASTおよびXBLASTプログラムに組み込まれる。
BLASTヌクレオチド検索は、NBLASTプログラム、スコア=100、ワード長=
12で行われる。BLASTタンパク質検索は、XBLASTプログラム、スコア=50
、ワード長=3で行われる。比較目的のためのギャップアラインメントを取得するために
、GappedBLASTを、Altschulら(Nucleic Acids Res. 25:3389-3402,
1997)に記載されているとおりに利用し得る。BLASTおよびGappedBLAS
Tプログラムを利用するとき、それぞれのプログラム(例えば、XBLASTおよびNB
LAST)のデフォルトパラメーターを、本発明の核酸分子に対して相同のヌクレオチド
配列を得るために使用し得る。
ーセントは、KarlinおよびAltschul(PNAS USA 87:2264-2268, 1990)の
アルゴリズムを使用して決定され、Karlin and Altschul, PNAS USA 90:5873-5877, 1993
)において修飾される。このようなアルゴリズムは、Altschulら(J. Mol. Biol
. 215:403-410, 1990)のNBLASTおよびXBLASTプログラムに組み込まれる。
BLASTヌクレオチド検索は、NBLASTプログラム、スコア=100、ワード長=
12で行われる。BLASTタンパク質検索は、XBLASTプログラム、スコア=50
、ワード長=3で行われる。比較目的のためのギャップアラインメントを取得するために
、GappedBLASTを、Altschulら(Nucleic Acids Res. 25:3389-3402,
1997)に記載されているとおりに利用し得る。BLASTおよびGappedBLAS
Tプログラムを利用するとき、それぞれのプログラム(例えば、XBLASTおよびNB
LAST)のデフォルトパラメーターを、本発明の核酸分子に対して相同のヌクレオチド
配列を得るために使用し得る。
同一性または同一は、アミノ酸配列(または核酸配列)類似性を意味し、当分野で認識
される意味を有する。同一性を有する配列は、同一の、または同様のアミノ酸(または核
酸)を共有する。したがって、参照配列と85%のアミノ酸配列同一性を共有する候補配
列が、参照配列と候補配列の以下のアラインメントの後に、候補配列における85%のア
ミノ酸が、参照配列における対応するアミノ酸と同一であり、そして/または保存アミノ
酸変化を構成することを必要とする。
される意味を有する。同一性を有する配列は、同一の、または同様のアミノ酸(または核
酸)を共有する。したがって、参照配列と85%のアミノ酸配列同一性を共有する候補配
列が、参照配列と候補配列の以下のアラインメントの後に、候補配列における85%のア
ミノ酸が、参照配列における対応するアミノ酸と同一であり、そして/または保存アミノ
酸変化を構成することを必要とする。
本明細書に記載されているポリペプチドの機能的に活性な変異体は、元のポリペプチド
またはフラグメントの実質的に同じ機能活性を保持する。天然機能的に活性な変異体、例
えば、対立遺伝子変異体および種変異体および非天然機能的に活性な変異体は、本発明に
おいて含まれ、例えば、変異誘発技術または直接合成により生産することができる。
またはフラグメントの実質的に同じ機能活性を保持する。天然機能的に活性な変異体、例
えば、対立遺伝子変異体および種変異体および非天然機能的に活性な変異体は、本発明に
おいて含まれ、例えば、変異誘発技術または直接合成により生産することができる。
機能的に活性な変異体もしくは誘導体は、本明細書に記載されているポリペプチドから
約または少なくとも、例えば、1、2、3、4、5、6、7、8、9、10、11、12
、13、14、15、16、17、18、19、20、25、30、35、40、45、
50、55、60またはそれ以上のアミノ酸残基で異なっている。この比較がアラインメ
ントを必要とするとき、配列は最大相同性となるようにアラインされる。変異部位は、本
明細書に記載されているポリペプチドと実質的に同様の活性を有する限り、ポリペプチド
中どこでも起こり得る。
約または少なくとも、例えば、1、2、3、4、5、6、7、8、9、10、11、12
、13、14、15、16、17、18、19、20、25、30、35、40、45、
50、55、60またはそれ以上のアミノ酸残基で異なっている。この比較がアラインメ
ントを必要とするとき、配列は最大相同性となるようにアラインされる。変異部位は、本
明細書に記載されているポリペプチドと実質的に同様の活性を有する限り、ポリペプチド
中どこでも起こり得る。
表現型でサイレントアミノ酸置換を有する変異体および誘導体を作製する方法について
の案内は、Bowieら Science, 247:1306-1310 (1990)において提供され、これは、アミノ
酸配列の変化への耐用性を研究するための2つの主な戦略があることを教示している。
の案内は、Bowieら Science, 247:1306-1310 (1990)において提供され、これは、アミノ
酸配列の変化への耐用性を研究するための2つの主な戦略があることを教示している。
第1の戦略は、進化の過程の自然選択によるアミノ酸置換の耐用性を利用する。異なる
種中のアミノ酸配列を比較することにより、種間で保存されているアミノ酸位置を同定す
ることができる。例えば、図5参照。これらの保存されたアミノ酸は、タンパク質機能の
ために重要であろう。対照的に、置換が自然選択によって耐用性であるアミノ酸位置は、
タンパク質機能に重要でない位置を示す。したがって、アミノ酸置換に耐用性である位置
は修飾することができるが、ポリペプチドの特定の結合活性を維持している。
種中のアミノ酸配列を比較することにより、種間で保存されているアミノ酸位置を同定す
ることができる。例えば、図5参照。これらの保存されたアミノ酸は、タンパク質機能の
ために重要であろう。対照的に、置換が自然選択によって耐用性であるアミノ酸位置は、
タンパク質機能に重要でない位置を示す。したがって、アミノ酸置換に耐用性である位置
は修飾することができるが、ポリペプチドの特定の結合活性を維持している。
第2の戦略は、タンパク質機能に重要である領域を同定するために、クローン遺伝子の
特定の位置にアミノ酸変化を導入する遺伝子操作を使用する。例えば、部位特異的変異誘
発またはアラニン−スキャン変異誘発(分子中の全ての残基において単一のアラニン変異
の導入)を使用することができる(Cunninghamら Science, 244:1081-1085 (1989))。
特定の位置にアミノ酸変化を導入する遺伝子操作を使用する。例えば、部位特異的変異誘
発またはアラニン−スキャン変異誘発(分子中の全ての残基において単一のアラニン変異
の導入)を使用することができる(Cunninghamら Science, 244:1081-1085 (1989))。
タンパク質のアミノ酸に変異を導入する方法は、当業者によく知られている。例えば、
Ausubel (ed.), Current Protocols in Molecular Biology, John Wiley and Sons, Inc.
(1994); T. Maniatis, E. F. Fritsch and J. Sambrook, Molecular Cloning: A Labora
tory Manual, Cold Spring Harbor laboratory, Cold Spring Harbor, N.Y. (1989))参
照。変異もまた、市販のキット、例えば、「QuikChange.TM. Site-Directed Mutagenesis
Kit」(Stratagene)を使用して導入することができる。ポリペプチドに対してポリペプチ
ドの機能に影響しないアミノ酸を置換することによるポリペプチドの機能的に活性な変異
体もしくは誘導体の産生は、当業者により成し遂げることができる。
Ausubel (ed.), Current Protocols in Molecular Biology, John Wiley and Sons, Inc.
(1994); T. Maniatis, E. F. Fritsch and J. Sambrook, Molecular Cloning: A Labora
tory Manual, Cold Spring Harbor laboratory, Cold Spring Harbor, N.Y. (1989))参
照。変異もまた、市販のキット、例えば、「QuikChange.TM. Site-Directed Mutagenesis
Kit」(Stratagene)を使用して導入することができる。ポリペプチドに対してポリペプチ
ドの機能に影響しないアミノ酸を置換することによるポリペプチドの機能的に活性な変異
体もしくは誘導体の産生は、当業者により成し遂げることができる。
変異体または誘導体は、例えば、少なくとも1つの生物学的活性を保持する1つ以上の
保存的置換を有し得る。保存的置換は、ペプチド化学の当業者が、ポリペプチドの二次構
造および水に対する性質が実質的に変化しないと予期されるように、アミノ酸を同様の特
性を有する別のアミノ酸に置換された置換である。一般的に、アミノ酸の以下のグループ
は保存変化を示す:(1)ala、pro、gly、glu、asp、gln、asn、
ser、thr、(2)cys、ser、tyr、thr、(3)val、ile、le
u、met、ala、phe、(4)lys、arg、his、および(5)phe、t
yr、trp、his。
保存的置換を有し得る。保存的置換は、ペプチド化学の当業者が、ポリペプチドの二次構
造および水に対する性質が実質的に変化しないと予期されるように、アミノ酸を同様の特
性を有する別のアミノ酸に置換された置換である。一般的に、アミノ酸の以下のグループ
は保存変化を示す:(1)ala、pro、gly、glu、asp、gln、asn、
ser、thr、(2)cys、ser、tyr、thr、(3)val、ile、le
u、met、ala、phe、(4)lys、arg、his、および(5)phe、t
yr、trp、his。
変異体および誘導体の特定の例は、限定はしないが、クロトータンパク質の少なくとも
1つの細胞外サブドメインを含むポリペプチドの機能的に活性な変異体および誘導体、例
えば、野生型配列(配列番号:5または6に記載されている)とわずか約1、2、3、4
、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19
、20、25、30、35、40、45、50、55、60またはそれ以上のアミノ酸残
基の違いを有する、少なくとも約100、150、200、250、300、350、3
75、400または425個の隣接するクロトーの細胞外ドメインのアミノ酸(例えば、
配列番号:5または6)を含み、野生型ポリペプチドの少なくとも1つの生物学的活性を
保持しているポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞
外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約
100個のアミノ酸残基の違いを有する少なくとも約400個の隣接する配列番号:5ま
たは6のアミノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも
1つの細胞外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は
、わずか約50個のアミノ酸残基の違いを有する少なくとも約400個の隣接する配列番
号:5または6のアミノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少
なくとも1つの細胞外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは
誘導体は、わずか約25個のアミノ酸残基の違いを有する少なくとも約425個の隣接す
る配列番号:5または6のアミノ酸を含むポリペプチドを含む。例えば、クロトータンパ
ク質の少なくとも1つの細胞外サブドメインを含むポリペプチドの機能的に活性な変異体
もしくは誘導体は、わずか約10個のアミノ酸残基の違いを有する少なくとも約425個
の隣接する配列番号:5または6のアミノ酸を含むポリペプチドを含む。別の例において
クロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドの機能的
に活性な変異体もしくは誘導体は、野生型配列とわずか約1、2、3、4、5、6、7、
8、9、10、11、12、13、14、15、16、17、18、19、20、25、
30、35、40、45、50、55、60、70、75、80、85、90、95、1
00、110、120、140、150、160、170、180、190または200
個のアミノ酸残基の違いを有する少なくとも約100、150、200、250、300
、350、400、450、500、550、600、650、700、750、800
、850、900、925、950または982個の隣接する配列番号:7のアミノ酸を
含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞外サブド
メインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約100個
のアミノ酸残基の違いを有する少なくとも約500個の隣接する配列番号:7のアミノ酸
を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞外サブ
ドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約100
個のアミノ酸残基の違いを有する少なくとも約600個の隣接する配列番号:7のアミノ
酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞外サ
ブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約10
0個のアミノ酸残基の違いを有する少なくとも約700個の隣接する配列番号:7のアミ
ノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞外
サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約1
00個のアミノ酸残基の違いを有する少なくとも約800個の隣接する配列番号:7のア
ミノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞
外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約
100個のアミノ酸残基の違いを有する少なくとも約900個の隣接する配列番号:7の
アミノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細
胞外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか
約50個のアミノ酸残基の違いを有する少なくとも約900個の隣接する配列番号:7の
アミノ酸を含むポリペプチドを含む。
1つの細胞外サブドメインを含むポリペプチドの機能的に活性な変異体および誘導体、例
えば、野生型配列(配列番号:5または6に記載されている)とわずか約1、2、3、4
、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19
、20、25、30、35、40、45、50、55、60またはそれ以上のアミノ酸残
基の違いを有する、少なくとも約100、150、200、250、300、350、3
75、400または425個の隣接するクロトーの細胞外ドメインのアミノ酸(例えば、
配列番号:5または6)を含み、野生型ポリペプチドの少なくとも1つの生物学的活性を
保持しているポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞
外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約
100個のアミノ酸残基の違いを有する少なくとも約400個の隣接する配列番号:5ま
たは6のアミノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも
1つの細胞外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は
、わずか約50個のアミノ酸残基の違いを有する少なくとも約400個の隣接する配列番
号:5または6のアミノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少
なくとも1つの細胞外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは
誘導体は、わずか約25個のアミノ酸残基の違いを有する少なくとも約425個の隣接す
る配列番号:5または6のアミノ酸を含むポリペプチドを含む。例えば、クロトータンパ
ク質の少なくとも1つの細胞外サブドメインを含むポリペプチドの機能的に活性な変異体
もしくは誘導体は、わずか約10個のアミノ酸残基の違いを有する少なくとも約425個
の隣接する配列番号:5または6のアミノ酸を含むポリペプチドを含む。別の例において
クロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドの機能的
に活性な変異体もしくは誘導体は、野生型配列とわずか約1、2、3、4、5、6、7、
8、9、10、11、12、13、14、15、16、17、18、19、20、25、
30、35、40、45、50、55、60、70、75、80、85、90、95、1
00、110、120、140、150、160、170、180、190または200
個のアミノ酸残基の違いを有する少なくとも約100、150、200、250、300
、350、400、450、500、550、600、650、700、750、800
、850、900、925、950または982個の隣接する配列番号:7のアミノ酸を
含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞外サブド
メインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約100個
のアミノ酸残基の違いを有する少なくとも約500個の隣接する配列番号:7のアミノ酸
を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞外サブ
ドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約100
個のアミノ酸残基の違いを有する少なくとも約600個の隣接する配列番号:7のアミノ
酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞外サ
ブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約10
0個のアミノ酸残基の違いを有する少なくとも約700個の隣接する配列番号:7のアミ
ノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞外
サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約1
00個のアミノ酸残基の違いを有する少なくとも約800個の隣接する配列番号:7のア
ミノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細胞
外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約
100個のアミノ酸残基の違いを有する少なくとも約900個の隣接する配列番号:7の
アミノ酸を含むポリペプチドを含む。例えば、クロトータンパク質の少なくとも1つの細
胞外サブドメインを含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか
約50個のアミノ酸残基の違いを有する少なくとも約900個の隣接する配列番号:7の
アミノ酸を含むポリペプチドを含む。
変異体および誘導体の特定の例は、限定はしないが、線維芽細胞増殖因子を含むポリペ
プチドの機能的に活性な変異体および誘導体、例えば、野生型配列(配列番号:31、3
3または35に記載されている)とわずか約1、2、3、4、5、6、7、8、9、10
、11、12、13、14、15、16、17、18、19、20、25、30、35、
40、45、50、55、60またはそれ以上のアミノ酸残基の違いを有する少なくとも
約100、125、150、150、175、200、225または250個の隣接する
線維芽細胞増殖因子のアミノ酸、例えば、FGF19(配列番号:31)、FGF21(
配列番号:33)またはFGF23(配列番号:35)を含み、野生型ポリペプチドの少
なくとも1つの生物学的活性を保持しているポリペプチドを含む。種々の態様において、
変異体または誘導体は、R179Q変異を含み得るか、または含むことができない。例え
ば、線維芽細胞増殖因子を含むポリペプチドの機能的に活性な変異体もしくは誘導体は、
わずか約25個のアミノ酸残基の違いを有する少なくとも約150個の隣接する配列番号
:31、33または35のアミノ酸を含むポリペプチドを含む。例えば、線維芽細胞増殖
因子を含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約25個のア
ミノ酸残基の違いを有する少なくとも約175個の隣接する配列番号:31、33または
35のアミノ酸を含むポリペプチドを含む。例えば、線維芽細胞増殖因子を含むポリペプ
チドの機能的に活性な変異体もしくは誘導体は、わずか約25個のアミノ酸残基の違いを
有する少なくとも約200個の隣接する配列番号:31、33または35のアミノ酸を含
むポリペプチドを含む。例えば、線維芽細胞増殖因子を含むポリペプチドの機能的に活性
な変異体もしくは誘導体は、わずか約50個のアミノ酸残基の違いを有する少なくとも約
225個の隣接する配列番号:35のアミノ酸を含むポリペプチドを含む。例えば、線維
芽細胞増殖因子を含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約
25個のアミノ酸残基の違いを有する少なくとも約225個の隣接する配列番号:35の
アミノ酸を含むポリペプチドを含む。
プチドの機能的に活性な変異体および誘導体、例えば、野生型配列(配列番号:31、3
3または35に記載されている)とわずか約1、2、3、4、5、6、7、8、9、10
、11、12、13、14、15、16、17、18、19、20、25、30、35、
40、45、50、55、60またはそれ以上のアミノ酸残基の違いを有する少なくとも
約100、125、150、150、175、200、225または250個の隣接する
線維芽細胞増殖因子のアミノ酸、例えば、FGF19(配列番号:31)、FGF21(
配列番号:33)またはFGF23(配列番号:35)を含み、野生型ポリペプチドの少
なくとも1つの生物学的活性を保持しているポリペプチドを含む。種々の態様において、
変異体または誘導体は、R179Q変異を含み得るか、または含むことができない。例え
ば、線維芽細胞増殖因子を含むポリペプチドの機能的に活性な変異体もしくは誘導体は、
わずか約25個のアミノ酸残基の違いを有する少なくとも約150個の隣接する配列番号
:31、33または35のアミノ酸を含むポリペプチドを含む。例えば、線維芽細胞増殖
因子を含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約25個のア
ミノ酸残基の違いを有する少なくとも約175個の隣接する配列番号:31、33または
35のアミノ酸を含むポリペプチドを含む。例えば、線維芽細胞増殖因子を含むポリペプ
チドの機能的に活性な変異体もしくは誘導体は、わずか約25個のアミノ酸残基の違いを
有する少なくとも約200個の隣接する配列番号:31、33または35のアミノ酸を含
むポリペプチドを含む。例えば、線維芽細胞増殖因子を含むポリペプチドの機能的に活性
な変異体もしくは誘導体は、わずか約50個のアミノ酸残基の違いを有する少なくとも約
225個の隣接する配列番号:35のアミノ酸を含むポリペプチドを含む。例えば、線維
芽細胞増殖因子を含むポリペプチドの機能的に活性な変異体もしくは誘導体は、わずか約
25個のアミノ酸残基の違いを有する少なくとも約225個の隣接する配列番号:35の
アミノ酸を含むポリペプチドを含む。
4.3.本明細書の融合ポリペプチドの発現
本明細書の融合タンパク質を発現するために、本明細書に記載されているいずれかの方
法または当分野で既知である方法により得られるDNA分子を、当分野で既知の技術によ
り適当な発現ベクターに挿入することができる。例えば、二本鎖cDNAは、ホモポリマ
ーの付加または合成DNAリンカーの使用に関連する制限酵素結合または平滑末端ライゲ
ーションにより、適当なベクターにクローニングすることができる。DNAリガーゼは、
通常、DNA分子をライゲートするために使用され、望ましくない結合はアルカリホスフ
ァターゼでの処理により避けることができる。
本明細書の融合タンパク質を発現するために、本明細書に記載されているいずれかの方
法または当分野で既知である方法により得られるDNA分子を、当分野で既知の技術によ
り適当な発現ベクターに挿入することができる。例えば、二本鎖cDNAは、ホモポリマ
ーの付加または合成DNAリンカーの使用に関連する制限酵素結合または平滑末端ライゲ
ーションにより、適当なベクターにクローニングすることができる。DNAリガーゼは、
通常、DNA分子をライゲートするために使用され、望ましくない結合はアルカリホスフ
ァターゼでの処理により避けることができる。
したがって、本明細書は、本明細書に記載されている核酸分子(例えば、遺伝子または
遺伝子をコードする組換え核酸分子)を含むベクター(例えば、組換えプラスミドおよび
バクテリオファージ)を含む。「組換えベクター」なる用語は、組換えベクターが由来す
る天然または非人工の核酸分子において含まれる核酸配列よりも、より多い、より少ない
、または異なる核酸配列を含むように、変化、修飾または加工されたベクター(例えば、
プラスミド、ファージ、ファスミド、ウイルス、コスミド、フォスミドまたは他の精製さ
れた核酸ベクター)を含む。例えば、組換えベクターは、本明細書において定義されてい
る調節配列、例えば、プロモーター配列、終結配列および/または人工リボソーム結合部
位(RBS)に作動可能に連結しているクロトー−FGF23融合物をコードする核酸配
列を含み得る。ベクターに包含されている遺伝子または核酸の発現が可能である組換えベ
クターを「発現ベクター」と称する。
遺伝子をコードする組換え核酸分子)を含むベクター(例えば、組換えプラスミドおよび
バクテリオファージ)を含む。「組換えベクター」なる用語は、組換えベクターが由来す
る天然または非人工の核酸分子において含まれる核酸配列よりも、より多い、より少ない
、または異なる核酸配列を含むように、変化、修飾または加工されたベクター(例えば、
プラスミド、ファージ、ファスミド、ウイルス、コスミド、フォスミドまたは他の精製さ
れた核酸ベクター)を含む。例えば、組換えベクターは、本明細書において定義されてい
る調節配列、例えば、プロモーター配列、終結配列および/または人工リボソーム結合部
位(RBS)に作動可能に連結しているクロトー−FGF23融合物をコードする核酸配
列を含み得る。ベクターに包含されている遺伝子または核酸の発現が可能である組換えベ
クターを「発現ベクター」と称する。
真核生物宿主において、異なる転写および翻訳調節配列は、宿主の性質に依存して使用
され得る。それらはアデノウイルス、ウシパピローマ・ウイルス、シミアン・ウイルスな
どのウイルス源由来であり得、調節シグナルは高レベルの発現を有する特定の遺伝子と関
連している。例えば、ヘルペスウイルスのTKプロモーター、SV40早期プロモーター
、酵母菌ga14遺伝子プロモーターなどを含むが、これらに限定されない。転写開始調
節シグナルは、遺伝子の発現を調節することができるように抑制または活性化することが
できるものを選択され得る。
され得る。それらはアデノウイルス、ウシパピローマ・ウイルス、シミアン・ウイルスな
どのウイルス源由来であり得、調節シグナルは高レベルの発現を有する特定の遺伝子と関
連している。例えば、ヘルペスウイルスのTKプロモーター、SV40早期プロモーター
、酵母菌ga14遺伝子プロモーターなどを含むが、これらに限定されない。転写開始調
節シグナルは、遺伝子の発現を調節することができるように抑制または活性化することが
できるものを選択され得る。
本明細書に記載されているいくつかの本明細書の分子において、融合ポリペプチドの1
つ以上のポリペプチド鎖をコードする核酸配列を有する1つ以上のDNA分子は、望まし
いDNA分子を宿主細胞に組み込むことができる1つ以上の調節配列に作動可能に連結し
ている。導入されたDNAにより安定に形質転換された細胞は、例えば、発現ベクターを
含む宿主細胞の選択を可能にする1つ以上のマーカーを導入することにより、選択するこ
とができる。選択可能なマーカー遺伝子は、発現する核酸配列に直接結合するか、または
共トランスフェクションにより同じ細胞に導入することができる。さらなる因子が、また
、本明細書に記載されているタンパク質の最適な合成のために必要であり得る。使用する
さらなる因子がどれであるかは、当業者に明白である。
つ以上のポリペプチド鎖をコードする核酸配列を有する1つ以上のDNA分子は、望まし
いDNA分子を宿主細胞に組み込むことができる1つ以上の調節配列に作動可能に連結し
ている。導入されたDNAにより安定に形質転換された細胞は、例えば、発現ベクターを
含む宿主細胞の選択を可能にする1つ以上のマーカーを導入することにより、選択するこ
とができる。選択可能なマーカー遺伝子は、発現する核酸配列に直接結合するか、または
共トランスフェクションにより同じ細胞に導入することができる。さらなる因子が、また
、本明細書に記載されているタンパク質の最適な合成のために必要であり得る。使用する
さらなる因子がどれであるかは、当業者に明白である。
特定のプラスミドまたはウイルスベクターの選択において重要な因子は、ベクターを含
む受容細胞が認識され、ベクターを含まない受容細胞から選択される容易さ、特定の宿主
において望ましいベクターのコピーの数、および、異なる種の宿主細胞間のベクターを「
往復する」ことができることが望ましいかどうかを含むが、これらに限定されない。
む受容細胞が認識され、ベクターを含まない受容細胞から選択される容易さ、特定の宿主
において望ましいベクターのコピーの数、および、異なる種の宿主細胞間のベクターを「
往復する」ことができることが望ましいかどうかを含むが、これらに限定されない。
発現に関するDNA配列を含むようにベクターを構築するとき、例えば、形質転換、ト
ランスフェクション、コンジュゲーション(conjugation)、プロトプラスト融合、エレク
トロポレーション、リン酸カルシウム−沈降、直接マイクロインジェクションなどを含む
が、これらに限定されない、当分野で既知の1つ以上の種々の適当な方法により、適当な
宿主細胞に導入され得る。
ランスフェクション、コンジュゲーション(conjugation)、プロトプラスト融合、エレク
トロポレーション、リン酸カルシウム−沈降、直接マイクロインジェクションなどを含む
が、これらに限定されない、当分野で既知の1つ以上の種々の適当な方法により、適当な
宿主細胞に導入され得る。
宿主細胞は、原核生物または真核生物のいずれかであり得る。真核生物宿主細胞の例は
、例えば、哺乳動物細胞、例えば、ヒト、サル、マウスおよびチャイニーズハムスター(
CHO)細胞を含む。このような細胞は、例えば、正しいフォールディングまたはグリコ
シル化を含むタンパク質の翻訳後修飾を容易にする。さらに、酵母細胞も本明細書の融合
ポリペプチドを発現するために使用することができる。多くの哺乳動物細胞のように、酵
母細胞も、例えば、グリコシル化を含むタンパク質の翻訳後修飾を可能にする。酵母菌に
おけるタンパク質の生産のために利用することができる強いプロモーター配列および高コ
ピー数プラスミドのどれを利用するかにおいては、多くの組換えDNA戦略が存在する。
酵母菌の転写および翻訳機構は、クローニングされた哺乳動物の遺伝子産物におけるリー
ダー配列を認識することができ、それによりリーダー配列を有するペプチド(すなわち、
前ペプチド)の分泌を可能にする。本明細書の融合ポリペプチドの高収率生産の特定の方
法は、DHFR−欠損CHO細胞におけるジヒドロ葉酸還元酵素(DHFR)増幅の使用
を介して、米国特許第4,889,803号に記載されているメトトレキサートのレベル
の連続的な増加の使用によるものである。得られたポリペプチドをグリコシル化してもよ
い。
、例えば、哺乳動物細胞、例えば、ヒト、サル、マウスおよびチャイニーズハムスター(
CHO)細胞を含む。このような細胞は、例えば、正しいフォールディングまたはグリコ
シル化を含むタンパク質の翻訳後修飾を容易にする。さらに、酵母細胞も本明細書の融合
ポリペプチドを発現するために使用することができる。多くの哺乳動物細胞のように、酵
母細胞も、例えば、グリコシル化を含むタンパク質の翻訳後修飾を可能にする。酵母菌に
おけるタンパク質の生産のために利用することができる強いプロモーター配列および高コ
ピー数プラスミドのどれを利用するかにおいては、多くの組換えDNA戦略が存在する。
酵母菌の転写および翻訳機構は、クローニングされた哺乳動物の遺伝子産物におけるリー
ダー配列を認識することができ、それによりリーダー配列を有するペプチド(すなわち、
前ペプチド)の分泌を可能にする。本明細書の融合ポリペプチドの高収率生産の特定の方
法は、DHFR−欠損CHO細胞におけるジヒドロ葉酸還元酵素(DHFR)増幅の使用
を介して、米国特許第4,889,803号に記載されているメトトレキサートのレベル
の連続的な増加の使用によるものである。得られたポリペプチドをグリコシル化してもよ
い。
1つ以上のベクターの導入後、宿主細胞を、通常、ベクター含有細胞の増殖を選択する
選択培地中で増殖させる。組換えタンパク質の精製は、当分野で既知の、または本明細書
に記載されているいずれかの方法、例えば、抽出、沈降、クロマトグラフィーおよび電気
泳動法に関するいずれかの慣用の方法により実施することができる。タンパク質を精製す
るために使用され得るさらなる精製方法は、標的タンパク質を結合するモノクローナル抗
体を使用するアフィニティークロマトグラフィーである。一般的に、組換えタンパク質を
含む粗製造物を、適当なモノクローナル抗体が固定されているカラムに通過させる。不純
物は通過するが、タンパク質は、通常、特異的な抗体を介してカラムに結合する。カラム
を洗浄後、タンパク質を、例えば、pHまたはイオン強度を変化させることにより、ゲル
から溶離する。
選択培地中で増殖させる。組換えタンパク質の精製は、当分野で既知の、または本明細書
に記載されているいずれかの方法、例えば、抽出、沈降、クロマトグラフィーおよび電気
泳動法に関するいずれかの慣用の方法により実施することができる。タンパク質を精製す
るために使用され得るさらなる精製方法は、標的タンパク質を結合するモノクローナル抗
体を使用するアフィニティークロマトグラフィーである。一般的に、組換えタンパク質を
含む粗製造物を、適当なモノクローナル抗体が固定されているカラムに通過させる。不純
物は通過するが、タンパク質は、通常、特異的な抗体を介してカラムに結合する。カラム
を洗浄後、タンパク質を、例えば、pHまたはイオン強度を変化させることにより、ゲル
から溶離する。
4.4.融合ポリペプチド活性を評価するためのアッセイ
本明細書に記載されているアッセイ(実施例2、参照)および当分野で既知のものを、
本明細書の融合ポリペプチドのクロトーまたはFGF活性を検出するために使用すること
ができる。適当な活性アッセイは、受容体結合アッセイ、細胞増殖アッセイおよび細胞シ
グナル伝達アッセイを含む。例えば、融合ポリペプチドがクロトーまたはFGF活性を有
するか否かを測定するために使用され得る結合アッセイは、融合ポリペプチドのFGF受
容体への結合をアッセイすることを含む。FGF受容体結合アッセイは、競合および非競
合アッセイ両方を含むが、これらに限定されない。例えば、FGF受容体結合は、FGF
受容体を発現する細胞を標識FGF(例えば、放射性標識)と接触させ、非標識クロトー
−FGF融合ポリペプチドの濃度を増加させることにより検出することができる。同じ受
容体への結合に対して競合する2つのリガンドを、細胞を含む反応混合物に加える。次に
細胞を洗浄し、標識FGFを測定する。非標識融合ポリペプチドの存在下で受容体に対す
る標識FGFの量の減少は、受容体へのクロトー−FGF融合ポリペプチドの結合を示す
。あるいは、クロトー−FGF融合ポリペプチドを標識し、細胞への融合ポリペプチドの
直接結合を検出してもよい。
本明細書に記載されているアッセイ(実施例2、参照)および当分野で既知のものを、
本明細書の融合ポリペプチドのクロトーまたはFGF活性を検出するために使用すること
ができる。適当な活性アッセイは、受容体結合アッセイ、細胞増殖アッセイおよび細胞シ
グナル伝達アッセイを含む。例えば、融合ポリペプチドがクロトーまたはFGF活性を有
するか否かを測定するために使用され得る結合アッセイは、融合ポリペプチドのFGF受
容体への結合をアッセイすることを含む。FGF受容体結合アッセイは、競合および非競
合アッセイ両方を含むが、これらに限定されない。例えば、FGF受容体結合は、FGF
受容体を発現する細胞を標識FGF(例えば、放射性標識)と接触させ、非標識クロトー
−FGF融合ポリペプチドの濃度を増加させることにより検出することができる。同じ受
容体への結合に対して競合する2つのリガンドを、細胞を含む反応混合物に加える。次に
細胞を洗浄し、標識FGFを測定する。非標識融合ポリペプチドの存在下で受容体に対す
る標識FGFの量の減少は、受容体へのクロトー−FGF融合ポリペプチドの結合を示す
。あるいは、クロトー−FGF融合ポリペプチドを標識し、細胞への融合ポリペプチドの
直接結合を検出してもよい。
クロトーまたはFGF活性は、また、融合ポリペプチドが細胞応答を誘導するか否かを
決定することにより測定することができる。例えば、いくつかの態様において、クロトー
−FGF融合ポリペプチドの生物学的活性を検出するためのアッセイは、FGF受容体を
発現する細胞を融合ポリペプチドと接触させ、細胞応答、例えば、細胞増殖またはEgr
−1活性化、C2C12細胞における筋管直径をアッセイし、融合ポリペプチドの存在お
よび非存在下で細胞応答を比較することを含む。融合ポリペプチド複合体の非存在下と比
較して融合ポリペプチド複合体の存在下での細胞応答の増加は、融合ポリペプチドが生物
学的活性を有することを示す。また、受容体からの下流シグナル伝達事象の増加も、生物
学的活性(例えば、FGFR、FRS2、ERK1/2、p70S6Kのリン酸化など)
の証拠として、測定することができる。
決定することにより測定することができる。例えば、いくつかの態様において、クロトー
−FGF融合ポリペプチドの生物学的活性を検出するためのアッセイは、FGF受容体を
発現する細胞を融合ポリペプチドと接触させ、細胞応答、例えば、細胞増殖またはEgr
−1活性化、C2C12細胞における筋管直径をアッセイし、融合ポリペプチドの存在お
よび非存在下で細胞応答を比較することを含む。融合ポリペプチド複合体の非存在下と比
較して融合ポリペプチド複合体の存在下での細胞応答の増加は、融合ポリペプチドが生物
学的活性を有することを示す。また、受容体からの下流シグナル伝達事象の増加も、生物
学的活性(例えば、FGFR、FRS2、ERK1/2、p70S6Kのリン酸化など)
の証拠として、測定することができる。
4.5.医薬組成物および処置法
本明細書は、また、1つ以上の本明細書の融合ポリペプチドおよび薬学的に許容される
希釈剤または担体を含む医薬組成物に関する。該医薬組成物は薬学的有効用量のヘパリン
をさらに含むことができる。このような医薬組成物はキットまたは容器に含まれ得る。こ
のようなキットまたは容器には、融合ポリペプチドのインビボ半減期またはインビトロ寿
命の延長に関する指示書と共にパッケージされていてもよい。所望により、このようなキ
ットまたは容器には、医薬または生物学的製剤の製造、使用または販売を規制する行政機
関により指示されている形での通知を添付することができ、この通知は、ヒト投与のため
の製造、使用または販売の行政機関による承認を反映する。このような組成物は、医薬組
成物を患者に投与することにより、患者、好ましくは哺乳動物、より好ましくはヒトにお
ける疾患または疾患症状(例えば、加齢関連状態または代謝障害)を処置、予防または改
善する方法において使用され得る。
本明細書は、また、1つ以上の本明細書の融合ポリペプチドおよび薬学的に許容される
希釈剤または担体を含む医薬組成物に関する。該医薬組成物は薬学的有効用量のヘパリン
をさらに含むことができる。このような医薬組成物はキットまたは容器に含まれ得る。こ
のようなキットまたは容器には、融合ポリペプチドのインビボ半減期またはインビトロ寿
命の延長に関する指示書と共にパッケージされていてもよい。所望により、このようなキ
ットまたは容器には、医薬または生物学的製剤の製造、使用または販売を規制する行政機
関により指示されている形での通知を添付することができ、この通知は、ヒト投与のため
の製造、使用または販売の行政機関による承認を反映する。このような組成物は、医薬組
成物を患者に投与することにより、患者、好ましくは哺乳動物、より好ましくはヒトにお
ける疾患または疾患症状(例えば、加齢関連状態または代謝障害)を処置、予防または改
善する方法において使用され得る。
一般的に、本明細書の医薬組成物の治療有効量は、約0.0001mg/kgから0.
001mg/kg、0.001mg/kgから約10mg/kg体重または約0.02m
g/kgから約5mg/kg体重である。一般的に、融合ポリペプチドの治療有効量は、
例えば、約0.001mgから約0.01mg、約0.01mgから約100mgまたは
約100mgから約1000mgである。好ましくは、融合ポリペプチドの治療有効量は
、約0.001mg/kgから2mg/kgである。
001mg/kg、0.001mg/kgから約10mg/kg体重または約0.02m
g/kgから約5mg/kg体重である。一般的に、融合ポリペプチドの治療有効量は、
例えば、約0.001mgから約0.01mg、約0.01mgから約100mgまたは
約100mgから約1000mgである。好ましくは、融合ポリペプチドの治療有効量は
、約0.001mg/kgから2mg/kgである。
融合ポリペプチドに関する最適な医薬製剤は、投与経路および望ましい用量に依存して
当業者により決定することができる(例えば、Remington's Pharmaceutical Sciences, 1
8th Ed. (1990), Mack Publishing Co., Easton, Pa.、参照、この文献の全体を出典明示
により本明細書に包含させる)。
当業者により決定することができる(例えば、Remington's Pharmaceutical Sciences, 1
8th Ed. (1990), Mack Publishing Co., Easton, Pa.、参照、この文献の全体を出典明示
により本明細書に包含させる)。
本明細書の融合ポリペプチドは、固体、液体または気体(エアロゾル)の形態であって
よい医薬組成物として投与され得る。典型的な投与経路は、経口、局所、非経腸、舌下、
経直腸、膣、皮内および鼻腔内を含むが、これらに限定されない。非経腸投与は、皮下注
射、静脈内、筋肉内、腹膜内、胸膜内、胸骨内注射または注入技術を含む。好ましくは、
組成物は非経腸的に投与される。さらに好ましくは、組成物は静脈内に投与される。本明
細書のポリペプチドが対象への組成物の投与時に生物学的に利用可能にするように、本明
細書の医薬組成物を処方することができる。例えば、錠剤が単一の投与単位であり、エア
ロゾル形態の本明細書のポリペプチドの容器が複数の投与単位を入れることができるとき
、組成物は1つ以上の投与単位の形態を取ることができる。
よい医薬組成物として投与され得る。典型的な投与経路は、経口、局所、非経腸、舌下、
経直腸、膣、皮内および鼻腔内を含むが、これらに限定されない。非経腸投与は、皮下注
射、静脈内、筋肉内、腹膜内、胸膜内、胸骨内注射または注入技術を含む。好ましくは、
組成物は非経腸的に投与される。さらに好ましくは、組成物は静脈内に投与される。本明
細書のポリペプチドが対象への組成物の投与時に生物学的に利用可能にするように、本明
細書の医薬組成物を処方することができる。例えば、錠剤が単一の投与単位であり、エア
ロゾル形態の本明細書のポリペプチドの容器が複数の投与単位を入れることができるとき
、組成物は1つ以上の投与単位の形態を取ることができる。
医薬組成物の製造において使用される物質は使用される量において非毒性であり得る。
医薬組成物における活性成分の最適な用量が種々の因子に依存することは当業者に明らか
である。関連因子は、対象の型(例えば、ヒト)、対象の健康全般、処置の必要な対象の
加齢関連状態または代謝障害の型、多剤レジメンの一部としての組成物の使用、本明細書
のポリペプチドの特定の形態、投与様式および使用される組成物を含むが、これらに限定
されない。
医薬組成物における活性成分の最適な用量が種々の因子に依存することは当業者に明らか
である。関連因子は、対象の型(例えば、ヒト)、対象の健康全般、処置の必要な対象の
加齢関連状態または代謝障害の型、多剤レジメンの一部としての組成物の使用、本明細書
のポリペプチドの特定の形態、投与様式および使用される組成物を含むが、これらに限定
されない。
薬学的に許容される担体またはビヒクルは、組成物が、例えば、錠剤または粉末形態で
存在できるような粒子であり得る。担体は、例えば、経口シロップまたは注射可能な液体
である組成物と共に液体であり得る。加えて、担体は、例えば、吸入投与に有用なエアロ
ゾル組成物を提供するために気体であり得る。
存在できるような粒子であり得る。担体は、例えば、経口シロップまたは注射可能な液体
である組成物と共に液体であり得る。加えて、担体は、例えば、吸入投与に有用なエアロ
ゾル組成物を提供するために気体であり得る。
「担体」なる用語は、本明細書のポリペプチドと一緒に投与される希釈剤、アジュバン
トまたは賦形剤を示す。このような医薬担体は、液体、例えば、水および油(石油、動物
性、植物性または合成のものを含む)、例えば、ピーナッツ油、ダイズ油、鉱油、ゴマ油
などであり得る。担体は、塩水、アカシア・ゴム、ゼラチン、デンプンペースト、タルク
、ケラチン、コロイダルシリカ、ウレアなどであり得る。加えて、補助剤、安定剤、増粘
剤、潤滑剤および着色剤を使用することができる。1つの態様において、対象に投与され
るとき、本明細書のポリペプチドおよび薬学的に許容される担体は滅菌される。本明細書
のポリペプチドが静脈内投与されるとき、水は特定の担体である。塩水および水性デキス
トロースおよびグリセロール溶液は、また、液体担体、特に注射可能溶液として使用され
得る。適当な医薬担体は、また、賦形剤、例えば、デンプン、グルコース、ラクトース、
スクロース、ゼラチン、モルト、ライス、小麦粉、チョーク、シリカゲル、ステアリン酸
ナトリウム、モノステアリン酸グリセロール、タルク、塩化ナトリウム、乾燥スキムミル
ク、グリセロール、プロピレン、グリコール、水、エタノールなどを含む。望ましいとき
、本組成物は少量の湿潤剤もしくは乳化剤またはpH緩衝剤を含み得る。
トまたは賦形剤を示す。このような医薬担体は、液体、例えば、水および油(石油、動物
性、植物性または合成のものを含む)、例えば、ピーナッツ油、ダイズ油、鉱油、ゴマ油
などであり得る。担体は、塩水、アカシア・ゴム、ゼラチン、デンプンペースト、タルク
、ケラチン、コロイダルシリカ、ウレアなどであり得る。加えて、補助剤、安定剤、増粘
剤、潤滑剤および着色剤を使用することができる。1つの態様において、対象に投与され
るとき、本明細書のポリペプチドおよび薬学的に許容される担体は滅菌される。本明細書
のポリペプチドが静脈内投与されるとき、水は特定の担体である。塩水および水性デキス
トロースおよびグリセロール溶液は、また、液体担体、特に注射可能溶液として使用され
得る。適当な医薬担体は、また、賦形剤、例えば、デンプン、グルコース、ラクトース、
スクロース、ゼラチン、モルト、ライス、小麦粉、チョーク、シリカゲル、ステアリン酸
ナトリウム、モノステアリン酸グリセロール、タルク、塩化ナトリウム、乾燥スキムミル
ク、グリセロール、プロピレン、グリコール、水、エタノールなどを含む。望ましいとき
、本組成物は少量の湿潤剤もしくは乳化剤またはpH緩衝剤を含み得る。
組成物は、経口投与用であり得、そのとき、組成物は好ましくは固体または液体形態で
あり、半固体、半液体、懸濁液およびゲル形態が本明細書において固体または液体のいず
れかとして考慮される形態内に含まれる。
あり、半固体、半液体、懸濁液およびゲル形態が本明細書において固体または液体のいず
れかとして考慮される形態内に含まれる。
経口投与用の固体組成物として、組成物は、粉末、顆粒、圧縮錠剤、錠剤、カプセル、
チューインガム、ウエハースなどの形態に製剤化することができる。このような固体組成
物は一般的に1つ以上の不活性な希釈剤を含む。加えて、1つ以上の以下のものが存在し
得る、結合剤、例えば、エチルセルロース、カルボキシメチルセルロース、微結晶性セル
ロースまたはゼラチン、賦形剤、例えば、デンプン、ラクトースまたはデキストリン、崩
壊剤、例えば、アルギン酸、アルギン酸ナトリウム、プリモゲル、コーンデンプンなど、
滑剤、例えば、ステアリン酸マグネシウムまたはステロテックス、流動促進剤、例えば、
コロイド状二酸化ケイ素、甘味剤、例えば、スクロースまたはサッカリン、香味剤、例え
ば、ペパーミント、サルチル酸メチルまたはオレンジ香味剤、ならびに着色剤。
チューインガム、ウエハースなどの形態に製剤化することができる。このような固体組成
物は一般的に1つ以上の不活性な希釈剤を含む。加えて、1つ以上の以下のものが存在し
得る、結合剤、例えば、エチルセルロース、カルボキシメチルセルロース、微結晶性セル
ロースまたはゼラチン、賦形剤、例えば、デンプン、ラクトースまたはデキストリン、崩
壊剤、例えば、アルギン酸、アルギン酸ナトリウム、プリモゲル、コーンデンプンなど、
滑剤、例えば、ステアリン酸マグネシウムまたはステロテックス、流動促進剤、例えば、
コロイド状二酸化ケイ素、甘味剤、例えば、スクロースまたはサッカリン、香味剤、例え
ば、ペパーミント、サルチル酸メチルまたはオレンジ香味剤、ならびに着色剤。
医薬組成物がカプセル、例えば、ゼラチンカプセルの形態であるとき、医薬組成物は、
上記の型の物質に加えて、液体担体、例えば、ポリエチレングリコール、シクロデキスト
リンまたは脂肪油を含むことができる。
上記の型の物質に加えて、液体担体、例えば、ポリエチレングリコール、シクロデキスト
リンまたは脂肪油を含むことができる。
医薬組成物は液体の形態、例えば、エリキシル、シロップ、溶液、エマルジョンまたは
懸濁液であり得る。液体は経口投与または注射による送達のために有用であり得る。経口
投与用のとき、組成物は1つ以上の甘味剤、防腐剤、色素/着色料および香味料を含み得
る。注射による投与用の組成物において、また、1つ以上の界面活性剤、保存剤、湿潤剤
、分散剤、懸濁剤、緩衝剤、安定剤および等張剤を含み得る。
懸濁液であり得る。液体は経口投与または注射による送達のために有用であり得る。経口
投与用のとき、組成物は1つ以上の甘味剤、防腐剤、色素/着色料および香味料を含み得
る。注射による投与用の組成物において、また、1つ以上の界面活性剤、保存剤、湿潤剤
、分散剤、懸濁剤、緩衝剤、安定剤および等張剤を含み得る。
溶液、懸濁液または他の形態であろうとなかろうと、本明細書の液体組成物は、また、
1つ以上の以下のものを含むことができる、滅菌希釈剤、例えば、注射用水、塩水溶液、
好ましくは生理食塩水、リンガー溶液、等張塩化ナトリウム、固定油、例えば、溶媒また
は懸濁媒体として働くことができる合成モノもしくはジグリセリド、ポリエチレングリコ
ール、グリセリン、シクロデキストリン、プロピレングリコールまたは他の溶媒、抗菌剤
、例えば、ベンジルアルコールまたはメチルパラベン、抗酸化剤、例えば、アスコルビン
酸または亜硫酸水素ナトリウム、キレート剤、例えば、エチレンジアミンテトラ酢酸、緩
衝剤、例えば、酢酸塩、クエン酸塩またはリン酸塩および等張化剤、例えば、塩化ナトリ
ウムまたはデキストロース。非経腸用の組成物は、ガラス、プラスチックまたは他の物質
製であるアンプル、使い捨て注射器または複数回バイアルに包まれていてもよい。生理食
塩水は特定の好ましいアジュバントである。注射可能な組成物は好ましくは滅菌である。
1つ以上の以下のものを含むことができる、滅菌希釈剤、例えば、注射用水、塩水溶液、
好ましくは生理食塩水、リンガー溶液、等張塩化ナトリウム、固定油、例えば、溶媒また
は懸濁媒体として働くことができる合成モノもしくはジグリセリド、ポリエチレングリコ
ール、グリセリン、シクロデキストリン、プロピレングリコールまたは他の溶媒、抗菌剤
、例えば、ベンジルアルコールまたはメチルパラベン、抗酸化剤、例えば、アスコルビン
酸または亜硫酸水素ナトリウム、キレート剤、例えば、エチレンジアミンテトラ酢酸、緩
衝剤、例えば、酢酸塩、クエン酸塩またはリン酸塩および等張化剤、例えば、塩化ナトリ
ウムまたはデキストロース。非経腸用の組成物は、ガラス、プラスチックまたは他の物質
製であるアンプル、使い捨て注射器または複数回バイアルに包まれていてもよい。生理食
塩水は特定の好ましいアジュバントである。注射可能な組成物は好ましくは滅菌である。
医薬組成物は、適当な用量が得られる有効量の本明細書の化合物(例えば、融合ポリペ
プチド)を含む。医薬組成物は、それぞれの障害に対して現在処方されている既知の有効
量の化合物を含み得る。
プチド)を含む。医薬組成物は、それぞれの障害に対して現在処方されている既知の有効
量の化合物を含み得る。
加齢関連状態または代謝障害の予防、処置および/または管理において有効である予防
および/または治療レジメンにおいて使用される本明細書のポリペプチドの投与経路は、
当分野で既知の他の治療に対して現在処方されている投与形路に基づくことができる。本
明細書のポリペプチドは、任意の便利な経路、例えば、注入またはボーラス注射により、
上皮性または皮膚粘膜裏当てを介する吸収(例えば、経口粘膜、経直腸および腸粘膜など
)により投与することができる。投与は全身的または局所的であり得る。種々の送達系は
、例えば、マイクロ粒子、マイクロカプセル、カプセルなどが知られており、本明細書の
ポリペプチドを投与するために有用であり得る。1つ以上の本明細書のポリペプチドが対
象に投与され得る。投与の方法は、経口投与および非経腸投与、皮内、筋肉内、腹膜内、
静脈内、皮下、鼻腔内、硬膜外、舌下、鼻腔内、大脳内、脳室内、髄腔内、膣内、経皮を
含むが、これらに限定されない非経腸投与、経直腸的、吸入による、または、眼、鼻、耳
または皮膚への局所的を含むが、これらに限定されない。
および/または治療レジメンにおいて使用される本明細書のポリペプチドの投与経路は、
当分野で既知の他の治療に対して現在処方されている投与形路に基づくことができる。本
明細書のポリペプチドは、任意の便利な経路、例えば、注入またはボーラス注射により、
上皮性または皮膚粘膜裏当てを介する吸収(例えば、経口粘膜、経直腸および腸粘膜など
)により投与することができる。投与は全身的または局所的であり得る。種々の送達系は
、例えば、マイクロ粒子、マイクロカプセル、カプセルなどが知られており、本明細書の
ポリペプチドを投与するために有用であり得る。1つ以上の本明細書のポリペプチドが対
象に投与され得る。投与の方法は、経口投与および非経腸投与、皮内、筋肉内、腹膜内、
静脈内、皮下、鼻腔内、硬膜外、舌下、鼻腔内、大脳内、脳室内、髄腔内、膣内、経皮を
含むが、これらに限定されない非経腸投与、経直腸的、吸入による、または、眼、鼻、耳
または皮膚への局所的を含むが、これらに限定されない。
本明細書のポリペプチドは非経腸的に投与され得る。具体的には、本明細書のポリペプ
チドは静脈内に投与され得る。
チドは静脈内に投与され得る。
肺投与は、また、例えば、吸入器または噴霧器、およびエアロゾル剤との製剤の使用に
より、またはフルオロ炭素または合成肺界面活性剤でのかん流を介して、使用することが
できる。本明細書のポリペプチドは、また、伝統的な結合剤および担体、例えば、トリグ
リセリドと一緒に坐薬として製剤化することができる。
より、またはフルオロ炭素または合成肺界面活性剤でのかん流を介して、使用することが
できる。本明細書のポリペプチドは、また、伝統的な結合剤および担体、例えば、トリグ
リセリドと一緒に坐薬として製剤化することができる。
本明細書のポリペプチドは制御放出系において送達することができる。例えば、ポンプ
を使用することができる(Sefton, CRC Crit. Ref. Biomed. Eng. 1987, 14, 201; Buchw
aldら Surgery 1980, 88: 507; Saudekら N. Engl. J. Med. 1989, 321: 574、参照)。
ポリマー物質も、本明細書のポリペプチドの制御放出のために使用することができる(Me
dical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boc
a Raton, FL, 1974; Controlled Drug Bioavailability, Drug Product Design and Perf
ormance, Smolen and Ball (eds.), Wiley, New York, 1984; Ranger and Peppas, J. Ma
cromol. Sci. Rev. Macromol. Chem. 1983, 23, 61、参照;Levyら Science 1985, 228,
190; Duringら Ann. Neurol., 1989, 25, 351; Howardら J. Neurosurg., 1989, 71, 105
も参照)。具体的には、制御放出系を、本明細書のポリペプチドの標的、例えば、脳の近
接に置くことができ、したがって、全身投与量に対してほんのわずかしか必要としない(
例えば、Goodson, in Medical Applications of Controlled Release, supra, vol. 2, 1
984, pp. 115-138、参照)。Langerによる文献(Science 1990, 249, 1527-1533)
において論じられている他の制御放出系を使用することができる。
を使用することができる(Sefton, CRC Crit. Ref. Biomed. Eng. 1987, 14, 201; Buchw
aldら Surgery 1980, 88: 507; Saudekら N. Engl. J. Med. 1989, 321: 574、参照)。
ポリマー物質も、本明細書のポリペプチドの制御放出のために使用することができる(Me
dical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boc
a Raton, FL, 1974; Controlled Drug Bioavailability, Drug Product Design and Perf
ormance, Smolen and Ball (eds.), Wiley, New York, 1984; Ranger and Peppas, J. Ma
cromol. Sci. Rev. Macromol. Chem. 1983, 23, 61、参照;Levyら Science 1985, 228,
190; Duringら Ann. Neurol., 1989, 25, 351; Howardら J. Neurosurg., 1989, 71, 105
も参照)。具体的には、制御放出系を、本明細書のポリペプチドの標的、例えば、脳の近
接に置くことができ、したがって、全身投与量に対してほんのわずかしか必要としない(
例えば、Goodson, in Medical Applications of Controlled Release, supra, vol. 2, 1
984, pp. 115-138、参照)。Langerによる文献(Science 1990, 249, 1527-1533)
において論じられている他の制御放出系を使用することができる。
本明細書のポリペプチドの制御または持続放出を達成するために使用されるポリマー物
質は、例えば、米国特許第5,679,377号、米国特許第5,916,597号、米
国特許第5,912,015号、米国特許第5,989,463号、米国特許第5,12
8,326号、PCT公開WO99/15154およびPCT公開WO99/20253
において記載されている。持続放出製剤において使用されるポリマーの例は、ポリ(2−
ヒドロキシエチルメタクリレート)、ポリ(メチルメタクリレート)、ポリ(アクリル酸
)、ポリ(エチレン−コ−ビニルアセテート)、ポリ(メタクリル酸)、ポリグリコリド
(PLG)、ポリ酸無水物、ポリ(N−ビニルピロリドン)、ポリ(ビニルアルコール)
、ポリアクリルアミド、ポリ(エチレングリコール)、ポリラクチド(PLA)、ポリ(
ラクチド−コ−グリコリド)(PLGA)およびポリオルトエステルを含むが、これらに
限定されない。好ましくは、持続放出製剤において使用されるポリマーは、不活性で、浸
出される不純物を含まず、保存安定性、滅菌性かつ生分解性である。
質は、例えば、米国特許第5,679,377号、米国特許第5,916,597号、米
国特許第5,912,015号、米国特許第5,989,463号、米国特許第5,12
8,326号、PCT公開WO99/15154およびPCT公開WO99/20253
において記載されている。持続放出製剤において使用されるポリマーの例は、ポリ(2−
ヒドロキシエチルメタクリレート)、ポリ(メチルメタクリレート)、ポリ(アクリル酸
)、ポリ(エチレン−コ−ビニルアセテート)、ポリ(メタクリル酸)、ポリグリコリド
(PLG)、ポリ酸無水物、ポリ(N−ビニルピロリドン)、ポリ(ビニルアルコール)
、ポリアクリルアミド、ポリ(エチレングリコール)、ポリラクチド(PLA)、ポリ(
ラクチド−コ−グリコリド)(PLGA)およびポリオルトエステルを含むが、これらに
限定されない。好ましくは、持続放出製剤において使用されるポリマーは、不活性で、浸
出される不純物を含まず、保存安定性、滅菌性かつ生分解性である。
一般的に、本明細書の医薬組成物の治療有効量は、約0.0001mg/kgから0.
001mg/kg、0.001mg/kgから約10mg/kg体重または約0.02m
g/kgから約5mg/kg体重である。
001mg/kg、0.001mg/kgから約10mg/kg体重または約0.02m
g/kgから約5mg/kg体重である。
他の態様において、予防および/または治療レジメンは、少なくとも0.01μg/m
Lから少なくとも400μg/mLの本明細書のポリペプチドの血漿レベルを達成する、
有効量の本明細書のポリペプチドを患者に1回以上投与することを含む。
Lから少なくとも400μg/mLの本明細書のポリペプチドの血漿レベルを達成する、
有効量の本明細書のポリペプチドを患者に1回以上投与することを含む。
予防および/または治療レジメンは、少なくとも0.01μg/mLから400μg/
mLの本明細書のポリペプチドの血漿レベルを維持する、有効量の本明細書のポリペプチ
ドを患者へ複数回投与することを含み得る。予防および/または治療レジメンにて、少な
くとも1日、1ヶ月、2ヶ月、3ヶ月、4ヶ月、5ヶ月、6ヶ月、7ヶ月、8ヶ月または
9ヶ月間投与され得る。
mLの本明細書のポリペプチドの血漿レベルを維持する、有効量の本明細書のポリペプチ
ドを患者へ複数回投与することを含み得る。予防および/または治療レジメンにて、少な
くとも1日、1ヶ月、2ヶ月、3ヶ月、4ヶ月、5ヶ月、6ヶ月、7ヶ月、8ヶ月または
9ヶ月間投与され得る。
予防および/または治療レジメンは、1つ以上のさらなる治療と組み合わせての本明細
書のポリペプチドの投与を含み得る。加齢関連状態または代謝障害の予防、処置および/
または管理のために現在使用されている1つ以上の治療の推奨される用量は、Hardmanら
eds., Goodman & Gilman's The Pharmacological Basis Of Basis Of Therapeutics, 10t
h ed., Mc-Graw-Hill, New York, 2001; Physician’s Desk Reference (60th ed., 2006
)(この内容を出典明示により本明細書に包含させる)を含むが、これらに限定されない
当分野の参考文献から得ることができる。
書のポリペプチドの投与を含み得る。加齢関連状態または代謝障害の予防、処置および/
または管理のために現在使用されている1つ以上の治療の推奨される用量は、Hardmanら
eds., Goodman & Gilman's The Pharmacological Basis Of Basis Of Therapeutics, 10t
h ed., Mc-Graw-Hill, New York, 2001; Physician’s Desk Reference (60th ed., 2006
)(この内容を出典明示により本明細書に包含させる)を含むが、これらに限定されない
当分野の参考文献から得ることができる。
本発明は、クロトータンパク質およびFGFのアゴニスト活性が望ましい障害を処置す
るための方法を含む。本明細書は、クロトータンパク質およびFGFのアゴニスト活性が
望ましい病理学的疾患の治療における、または処置のための医薬としての記載されている
タンパク質、融合タンパク質、核酸分子または医薬組成物の使用をさらに含む。本明細書
のこのような方法または使用の例は、加齢関連状態または代謝障害を含むが、これらに限
定されない。
るための方法を含む。本明細書は、クロトータンパク質およびFGFのアゴニスト活性が
望ましい病理学的疾患の治療における、または処置のための医薬としての記載されている
タンパク質、融合タンパク質、核酸分子または医薬組成物の使用をさらに含む。本明細書
のこのような方法または使用の例は、加齢関連状態または代謝障害を含むが、これらに限
定されない。
本明細書は、個体における加齢関連状態を処置または予防するための方法、および個体
における加齢関連状態を処置または予防するための治療における、または医薬としての記
載されているタンパク質、融合タンパク質、核酸分子または医薬組成物の使用を含む。処
置の必要な対象は、加齢関連状態を処置または予防するように、クロトータンパク質の少
なくとも1つの細胞外サブドメインおよび繊維芽細胞増殖因子および(任意の)修飾され
たFcフラグメントを有する、クロトー融合ポリペプチドを含む薬理学的有効用量の医薬
組成物を投与される。いくつかの態様において、クロトー融合ポリペプチドは薬理学的有
効用量のヘパリンと共投与される。加齢関連状態はサルコペニア、皮膚萎縮、筋肉疲労、
脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症、免疫不全
、高血圧、認知症、ハンチントン病、アルツハイマー病、白内障、加齢黄斑変性症、前立
腺癌、卒中、期待寿命の低下、記憶障害、しわ、腎機能障害および加齢関連難聴を含む。
いくつかの態様において、クロトー融合ポリペプチドはアルファクロトータンパク質の少
なくとも1つの細胞外ドメインを含む。特定の態様において、アルファクロトータンパク
質の少なくとも1つの細胞外ドメインおよび繊維芽細胞増殖因子23を含むクロトー融合
タンパク質は、筋肉疲労に対して処置の必要な対象に投与される。
における加齢関連状態を処置または予防するための治療における、または医薬としての記
載されているタンパク質、融合タンパク質、核酸分子または医薬組成物の使用を含む。処
置の必要な対象は、加齢関連状態を処置または予防するように、クロトータンパク質の少
なくとも1つの細胞外サブドメインおよび繊維芽細胞増殖因子および(任意の)修飾され
たFcフラグメントを有する、クロトー融合ポリペプチドを含む薬理学的有効用量の医薬
組成物を投与される。いくつかの態様において、クロトー融合ポリペプチドは薬理学的有
効用量のヘパリンと共投与される。加齢関連状態はサルコペニア、皮膚萎縮、筋肉疲労、
脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症、免疫不全
、高血圧、認知症、ハンチントン病、アルツハイマー病、白内障、加齢黄斑変性症、前立
腺癌、卒中、期待寿命の低下、記憶障害、しわ、腎機能障害および加齢関連難聴を含む。
いくつかの態様において、クロトー融合ポリペプチドはアルファクロトータンパク質の少
なくとも1つの細胞外ドメインを含む。特定の態様において、アルファクロトータンパク
質の少なくとも1つの細胞外ドメインおよび繊維芽細胞増殖因子23を含むクロトー融合
タンパク質は、筋肉疲労に対して処置の必要な対象に投与される。
本発明は、また、個体における代謝障害を処置または予防するための方法、および個体
における代謝障害を処置または予防するための治療における、または医薬としての記載さ
れているタンパク質、融合タンパク質、核酸分子または医薬組成物の使用に関する。処置
の必要な個体は、代謝障害を処置するように、クロトータンパク質の少なくとも1つの細
胞外サブドメインおよび繊維芽細胞増殖因子およびFcRnへの減少した結合および/ま
たは増加した血清半減期および/または安定性を有する(任意の)修飾されたFcフラグ
メントを有する、クロトー融合ポリペプチドを含む薬理学的有効用量の医薬組成物を投与
される。いくつかの態様において、クロトー融合ポリペプチドは薬理学的有効用量のヘパ
リンと共投与される。該方法はII型糖尿病、メタボリック・シンドローム、高血糖およ
び肥満の処置または予防において使用され得る。特定の態様において、ベータ−クロトー
タンパク質の少なくとも1つの細胞外ドメインおよび繊維芽細胞増殖因子21を含むクロ
トー融合タンパク質は、代謝障害に対して処置の必要な対象に投与される。
における代謝障害を処置または予防するための治療における、または医薬としての記載さ
れているタンパク質、融合タンパク質、核酸分子または医薬組成物の使用に関する。処置
の必要な個体は、代謝障害を処置するように、クロトータンパク質の少なくとも1つの細
胞外サブドメインおよび繊維芽細胞増殖因子およびFcRnへの減少した結合および/ま
たは増加した血清半減期および/または安定性を有する(任意の)修飾されたFcフラグ
メントを有する、クロトー融合ポリペプチドを含む薬理学的有効用量の医薬組成物を投与
される。いくつかの態様において、クロトー融合ポリペプチドは薬理学的有効用量のヘパ
リンと共投与される。該方法はII型糖尿病、メタボリック・シンドローム、高血糖およ
び肥満の処置または予防において使用され得る。特定の態様において、ベータ−クロトー
タンパク質の少なくとも1つの細胞外ドメインおよび繊維芽細胞増殖因子21を含むクロ
トー融合タンパク質は、代謝障害に対して処置の必要な対象に投与される。
本明細書はまた、個体における高リン血症または石灰沈着症を処置または予防するため
の方法、および個体における高リン血症または石灰沈着症を処置または予防するための治
療における、または医薬としての記載されているタンパク質、融合タンパク質、核酸分子
または医薬組成物の使用を提供する。処置の必要な個体は、高リン血症または石灰沈着症
を処置するように、クロトータンパク質の少なくとも1つの細胞外サブドメイン、繊維芽
細胞増殖因子および(任意の)修飾されたFcフラグメントを有する、クロトー融合ポリ
ペプチドを含む薬理学的有効用量の医薬組成物を投与される。いくつかの態様において、
クロトー融合ポリペプチドは薬理学的有効用量のヘパリンと共投与される。特定の態様に
おいて、アルファクロトータンパク質の少なくとも1つの細胞外ドメインおよび線維芽細
胞増殖因子23および(任意の)修飾されたFcフラグメントを含むクロトー融合タンパ
ク質は、高リン血症または石灰沈着症に対して処置の必要な個体に投与される。
の方法、および個体における高リン血症または石灰沈着症を処置または予防するための治
療における、または医薬としての記載されているタンパク質、融合タンパク質、核酸分子
または医薬組成物の使用を提供する。処置の必要な個体は、高リン血症または石灰沈着症
を処置するように、クロトータンパク質の少なくとも1つの細胞外サブドメイン、繊維芽
細胞増殖因子および(任意の)修飾されたFcフラグメントを有する、クロトー融合ポリ
ペプチドを含む薬理学的有効用量の医薬組成物を投与される。いくつかの態様において、
クロトー融合ポリペプチドは薬理学的有効用量のヘパリンと共投与される。特定の態様に
おいて、アルファクロトータンパク質の少なくとも1つの細胞外ドメインおよび線維芽細
胞増殖因子23および(任意の)修飾されたFcフラグメントを含むクロトー融合タンパ
ク質は、高リン血症または石灰沈着症に対して処置の必要な個体に投与される。
本明細書は、また、個体における慢性腎臓疾患または慢性腎不全を処置または予防する
ための方法、および個体における慢性腎臓疾患または慢性腎不全を処置または予防するた
めの治療における、または医薬としての記載されているタンパク質、融合タンパク質、核
酸分子または医薬組成物の使用を提供する。処置の必要な個体は、慢性腎臓疾患または慢
性腎不全を処置するように、クロトータンパク質の少なくとも1つの細胞外サブドメイン
、繊維芽細胞増殖因子および(任意の)修飾されたFcフラグメントを有する、クロトー
融合ポリペプチドを含む薬理学的有効用量の医薬組成物を投与される。いくつかの態様に
おいて、クロトー融合ポリペプチドは薬理学的有効用量のヘパリンと共投与される。いく
つかの態様において、アルファクロトータンパク質の少なくとも1つの細胞外ドメインを
含むクロトー融合タンパク質は、慢性腎臓疾患または慢性腎不全に対して処置の必要な個
体に投与される。
ための方法、および個体における慢性腎臓疾患または慢性腎不全を処置または予防するた
めの治療における、または医薬としての記載されているタンパク質、融合タンパク質、核
酸分子または医薬組成物の使用を提供する。処置の必要な個体は、慢性腎臓疾患または慢
性腎不全を処置するように、クロトータンパク質の少なくとも1つの細胞外サブドメイン
、繊維芽細胞増殖因子および(任意の)修飾されたFcフラグメントを有する、クロトー
融合ポリペプチドを含む薬理学的有効用量の医薬組成物を投与される。いくつかの態様に
おいて、クロトー融合ポリペプチドは薬理学的有効用量のヘパリンと共投与される。いく
つかの態様において、アルファクロトータンパク質の少なくとも1つの細胞外ドメインを
含むクロトー融合タンパク質は、慢性腎臓疾患または慢性腎不全に対して処置の必要な個
体に投与される。
本明細書はまた、個体における癌を処置または予防するための方法、個体における癌を
処置または予防するための治療における、または医薬としての記載されているタンパク質
、融合タンパク質、核酸分子または医薬組成物の使用を含む。処置の必要な個体は、癌を
処置するように、クロトータンパク質の少なくとも1つの細胞外サブドメイン、繊維芽細
胞増殖因子および(任意の)修飾されたFcフラグメントを有する、クロトー融合ポリペ
プチドを含む薬理学的有効用量の医薬組成物を投与される。該方法は乳癌の処置または予
防において使用され得る。いくつかの態様において、クロトー融合ポリペプチドは薬理学
的有効用量のヘパリンと共投与される。いくつかの態様において、アルファクロトータン
パク質の少なくとも1つの細胞外ドメインを含むクロトー融合タンパク質は、癌に対して
処置の必要な個体に投与される。
処置または予防するための治療における、または医薬としての記載されているタンパク質
、融合タンパク質、核酸分子または医薬組成物の使用を含む。処置の必要な個体は、癌を
処置するように、クロトータンパク質の少なくとも1つの細胞外サブドメイン、繊維芽細
胞増殖因子および(任意の)修飾されたFcフラグメントを有する、クロトー融合ポリペ
プチドを含む薬理学的有効用量の医薬組成物を投与される。該方法は乳癌の処置または予
防において使用され得る。いくつかの態様において、クロトー融合ポリペプチドは薬理学
的有効用量のヘパリンと共投与される。いくつかの態様において、アルファクロトータン
パク質の少なくとも1つの細胞外ドメインを含むクロトー融合タンパク質は、癌に対して
処置の必要な個体に投与される。
クロトー融合ポリペプチドを含む医薬組成物を投与することにより障害を処置する方法
において、または、治療においてクロトー融合ポリペプチドを含む医薬組成物を使用する
とき、クロトー融合ポリペプチドおよび(任意の)修飾されたFcフラグメントはクロト
ータンパク質の少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖因子を有する
。特定の態様において、クロトー融合タンパク質は、ベータクロトータンパク質の少なく
とも1つの細胞外ドメインおよび繊維芽細胞増殖因子21を含む。
において、または、治療においてクロトー融合ポリペプチドを含む医薬組成物を使用する
とき、クロトー融合ポリペプチドおよび(任意の)修飾されたFcフラグメントはクロト
ータンパク質の少なくとも1つの細胞外サブドメインおよび線維芽細胞増殖因子を有する
。特定の態様において、クロトー融合タンパク質は、ベータクロトータンパク質の少なく
とも1つの細胞外ドメインおよび繊維芽細胞増殖因子21を含む。
別の態様において、融合ポリペプチドは、FGF(例えば、FGF19、FGF21、
FGF23またはFGF23変異体)および減少したFcRnへの結合および/または増
加した血清安定性を有する修飾されたFcフラグメントを含む。この型の融合ポリペプチ
ドを、上記種々の疾患において使用することができる、または当分野で知られているあら
ゆるFGF関連疾患を処置または予防するために使用することができる。融合ポリペプチ
ドをそれを必要とする個体に投与することができる。
FGF23またはFGF23変異体)および減少したFcRnへの結合および/または増
加した血清安定性を有する修飾されたFcフラグメントを含む。この型の融合ポリペプチ
ドを、上記種々の疾患において使用することができる、または当分野で知られているあら
ゆるFGF関連疾患を処置または予防するために使用することができる。融合ポリペプチ
ドをそれを必要とする個体に投与することができる。
融合ポリペプチド組成物は、当業者に知られている、および本明細書に記載されている
投与方法にしたがって投与することができる。投与の特定の方法は皮下または静脈内を含
む。他の有効な投与様式は本明細書に記載されている。
投与方法にしたがって投与することができる。投与の特定の方法は皮下または静脈内を含
む。他の有効な投与様式は本明細書に記載されている。
4.6.処置法および有効性を評価するためのアッセイ方法
本明細書に記載されている融合ポリペプチドを個体に投与することを提供する本明細書
の方法または使用は、加齢関連状態または代謝障害を含む種々の障害を処置するために使
用することができる。何らかの特定の理論に限定されることなく、融合ポリペプチドは、
クロトーまたはFGFの調節異常がある障害を処置するために使用され得る。例の障害は
代謝障害および加齢関連状態を含む。例えば、FGF23またはクロトーノックアウトマ
ウス両方は、低い物理的活性、成長遅延、筋肉疲労、皮膚萎縮、アテローム性動脈硬化症
、寿命の短縮などを含む種々の同様の表現型を示す(Razzaque and Lanske, J. of Endro
crinology, 194:1-10 (2007)、参照(これを出典明示により本明細書に包含させる))。
本明細書に記載されている融合ポリペプチドを個体に投与することを提供する本明細書
の方法または使用は、加齢関連状態または代謝障害を含む種々の障害を処置するために使
用することができる。何らかの特定の理論に限定されることなく、融合ポリペプチドは、
クロトーまたはFGFの調節異常がある障害を処置するために使用され得る。例の障害は
代謝障害および加齢関連状態を含む。例えば、FGF23またはクロトーノックアウトマ
ウス両方は、低い物理的活性、成長遅延、筋肉疲労、皮膚萎縮、アテローム性動脈硬化症
、寿命の短縮などを含む種々の同様の表現型を示す(Razzaque and Lanske, J. of Endro
crinology, 194:1-10 (2007)、参照(これを出典明示により本明細書に包含させる))。
特に、本明細書の融合ポリペプチドは、筋肉疲労を含む老化関連障害の処置において特
に有用である。理論に束縛されることなく、ミネラル(例えば、リン酸塩およびカルシウ
ム)およびビタミンDホメオスタシスをコントロールするクロトーおよびFGF23の能
力は、これらのタンパク質が老化および筋萎縮を調節することを意味し得る。
に有用である。理論に束縛されることなく、ミネラル(例えば、リン酸塩およびカルシウ
ム)およびビタミンDホメオスタシスをコントロールするクロトーおよびFGF23の能
力は、これらのタンパク質が老化および筋萎縮を調節することを意味し得る。
他方では、本明細書の融合ポリペプチドは、代謝障害を処置するために使用され得る。
例えば、ベータ−クロトーおよびFGF19は、コレステロール7−α−ヒドロキシラー
ゼ(CYP7A1)を調節することにより、胆汁酸ホメオスタシスをコントロールするこ
とが示されている。胆汁ホメオスタシス障害の非限定的な例は胆汁うっ滞である。ベータ
−クロトーおよびFGF21は、脂肪細胞における脂肪分解を誘導し、したがって、脂肪
貯蔵を減少させ、グルコース摂取を増加させることが示されている。脂肪分解/脂肪貯蔵
障害の非限定的な例は代謝関連肥満および心臓血管疾患である。
例えば、ベータ−クロトーおよびFGF19は、コレステロール7−α−ヒドロキシラー
ゼ(CYP7A1)を調節することにより、胆汁酸ホメオスタシスをコントロールするこ
とが示されている。胆汁ホメオスタシス障害の非限定的な例は胆汁うっ滞である。ベータ
−クロトーおよびFGF21は、脂肪細胞における脂肪分解を誘導し、したがって、脂肪
貯蔵を減少させ、グルコース摂取を増加させることが示されている。脂肪分解/脂肪貯蔵
障害の非限定的な例は代謝関連肥満および心臓血管疾患である。
少なくとも、FGF23が尿におけるリン酸塩の排出を刺激することができ、それによ
り血清中のリン酸塩レベルを減少させる発見の一部に基づいて、本明細書のクロトー−F
GF23融合ポリペプチドは、個体における高リン血症または石灰沈着症を処置または予
防するために使用することができる。例えば、患者におけるクロトーの欠損となるクロト
ーにおけるホモ接合型ミスセンス変異が深刻な腫瘍性石灰沈着症および動脈石灰化を引き
起こし得ることが示されている(Ichikawaら J. Clin. Invest. 117:2684-2691 (2007)(
これを出典明示により本明細書に包含させる))。個体は、高リン血症または石灰沈着症
を処置または予防するように、クロトータンパク質の少なくとも1つの細胞外サブドメイ
ン、線維芽細胞増殖因子および(任意の)修飾されたFcフラグメントを有するクロトー
融合ポリペプチドを含む薬理学的有効用量の医薬組成物を投与される。特に、アルファク
ロトータンパク質の少なくとも1つの細胞外ドメイン、繊維芽細胞増殖因子および(任意
の)修飾されたFcフラグメントを含むクロトー融合ポリペプチドは、高リン血症または
石灰沈着症を処置するために有用である。
り血清中のリン酸塩レベルを減少させる発見の一部に基づいて、本明細書のクロトー−F
GF23融合ポリペプチドは、個体における高リン血症または石灰沈着症を処置または予
防するために使用することができる。例えば、患者におけるクロトーの欠損となるクロト
ーにおけるホモ接合型ミスセンス変異が深刻な腫瘍性石灰沈着症および動脈石灰化を引き
起こし得ることが示されている(Ichikawaら J. Clin. Invest. 117:2684-2691 (2007)(
これを出典明示により本明細書に包含させる))。個体は、高リン血症または石灰沈着症
を処置または予防するように、クロトータンパク質の少なくとも1つの細胞外サブドメイ
ン、線維芽細胞増殖因子および(任意の)修飾されたFcフラグメントを有するクロトー
融合ポリペプチドを含む薬理学的有効用量の医薬組成物を投与される。特に、アルファク
ロトータンパク質の少なくとも1つの細胞外ドメイン、繊維芽細胞増殖因子および(任意
の)修飾されたFcフラグメントを含むクロトー融合ポリペプチドは、高リン血症または
石灰沈着症を処置するために有用である。
本明細書のクロトー融合ポリペプチドはまた、個体における慢性腎臓疾患または慢性腎
不全を処置または予防するために使用され得る。例えば、クロトー発現が、慢性腎不全を
有さない患者の腎臓と比較して、慢性腎不全を有する患者の腎臓において減少しているこ
とが示されている(Kohら Biochem. Biophys. Res. Comm. 280:1015-1020 (2001)(これ
を出典明示により本明細書に包含させる))。個体は、慢性腎臓疾患または慢性腎不全を
処置または予防するように、クロトータンパク質の少なくとも1つの細胞外サブドメイン
、繊維芽細胞増殖因子および(任意の)修飾されたFcフラグメントを有する、クロトー
融合ポリペプチドを含む薬理学的有効用量の医薬組成物を投与される。特に、アルファク
ロトータンパク質の少なくとも1つの細胞外ドメインを含むクロトー融合ポリペプチドは
慢性腎臓疾患または慢性腎不全を処置するために有用である。
不全を処置または予防するために使用され得る。例えば、クロトー発現が、慢性腎不全を
有さない患者の腎臓と比較して、慢性腎不全を有する患者の腎臓において減少しているこ
とが示されている(Kohら Biochem. Biophys. Res. Comm. 280:1015-1020 (2001)(これ
を出典明示により本明細書に包含させる))。個体は、慢性腎臓疾患または慢性腎不全を
処置または予防するように、クロトータンパク質の少なくとも1つの細胞外サブドメイン
、繊維芽細胞増殖因子および(任意の)修飾されたFcフラグメントを有する、クロトー
融合ポリペプチドを含む薬理学的有効用量の医薬組成物を投与される。特に、アルファク
ロトータンパク質の少なくとも1つの細胞外ドメインを含むクロトー融合ポリペプチドは
慢性腎臓疾患または慢性腎不全を処置するために有用である。
本明細書のクロトー融合ポリペプチドはまた、個体における癌を処置または予防するた
めに使用され得る。例えば、クロトー発現が、正常乳癌組織と比較して、乳癌組織におい
て減少していることが示されている(Wolfら Oncogene (2008)オンライン先行出版(これ
を出典明示により包含させる))。個体は、癌または乳癌を処置または予防するように、
クロトータンパク質の少なくとも1つの細胞外サブドメイン、繊維芽細胞増殖因子および
(任意の)修飾されたFcフラグメントを有する、クロトー融合ポリペプチドを含む薬理
学的有効用量の医薬組成物を投与される。特に、アルファクロトータンパク質の少なくと
も1つの細胞外ドメインを含むクロトー融合タンパク質は癌または乳癌を処置するために
有用である。
めに使用され得る。例えば、クロトー発現が、正常乳癌組織と比較して、乳癌組織におい
て減少していることが示されている(Wolfら Oncogene (2008)オンライン先行出版(これ
を出典明示により包含させる))。個体は、癌または乳癌を処置または予防するように、
クロトータンパク質の少なくとも1つの細胞外サブドメイン、繊維芽細胞増殖因子および
(任意の)修飾されたFcフラグメントを有する、クロトー融合ポリペプチドを含む薬理
学的有効用量の医薬組成物を投与される。特に、アルファクロトータンパク質の少なくと
も1つの細胞外ドメインを含むクロトー融合タンパク質は癌または乳癌を処置するために
有用である。
加齢関連状態または代謝障害における本明細書のクロトー融合ポリペプチドの有効性を
評価する、および/または有効用量を決定するための方法は、例えば、哺乳動物(例えば
、マウス、ラット、霊長類またはいくつかの他の非ヒト)または他の動物(例えば、アフ
リカツメガエル、ゼブラフィッシュまたは無脊椎動物、例えば、昆虫または線虫)を使用
する生物ベースアッセイを含む。クロトー融合ポリペプチドは、1回またはレジメン(定
期的または不規則的)のとおりに生物体に投与することができる。次に生物体のパラメー
ター、例えば、加齢関連パラメーターを評価する。興味あるクロトー融合ポリペプチドは
、参照、例えば、コントロール生物体のパラメーターと比較して、パラメーターにおける
変化をもたらす。他のパラメーター(例えば、毒性、クリアランスおよび薬物動態学に関
連する)も評価され得る。
評価する、および/または有効用量を決定するための方法は、例えば、哺乳動物(例えば
、マウス、ラット、霊長類またはいくつかの他の非ヒト)または他の動物(例えば、アフ
リカツメガエル、ゼブラフィッシュまたは無脊椎動物、例えば、昆虫または線虫)を使用
する生物ベースアッセイを含む。クロトー融合ポリペプチドは、1回またはレジメン(定
期的または不規則的)のとおりに生物体に投与することができる。次に生物体のパラメー
ター、例えば、加齢関連パラメーターを評価する。興味あるクロトー融合ポリペプチドは
、参照、例えば、コントロール生物体のパラメーターと比較して、パラメーターにおける
変化をもたらす。他のパラメーター(例えば、毒性、クリアランスおよび薬物動態学に関
連する)も評価され得る。
本明細書のクロトー融合ポリペプチドは、特定の障害、例えば、本明細書に記載されて
いる障害、例えば、加齢関連障害、代謝障害を有する動物を使用して、評価され得る。こ
れらの障害は、また、生理学における試験ポリペプチドの効果を観察することができる感
受性の系を提供することができる。例の障害は、脱神経、廃用性萎縮、代謝障害(例えば
、肥満および/または糖尿病動物、例えば、db/dbマウスおよびob/obマウスの
障害)、脳、肝臓虚血、シスプラチン/タキソール/ビンクリスチンモデル、種々の組織
(異種移植)移植物、トランスジェニック骨モデル、疼痛症候群(炎症性および神経障害
を含む)、パラコート、遺伝毒性および酸化ストレスモデル、および腫瘍Iモデルを含む
。
いる障害、例えば、加齢関連障害、代謝障害を有する動物を使用して、評価され得る。こ
れらの障害は、また、生理学における試験ポリペプチドの効果を観察することができる感
受性の系を提供することができる。例の障害は、脱神経、廃用性萎縮、代謝障害(例えば
、肥満および/または糖尿病動物、例えば、db/dbマウスおよびob/obマウスの
障害)、脳、肝臓虚血、シスプラチン/タキソール/ビンクリスチンモデル、種々の組織
(異種移植)移植物、トランスジェニック骨モデル、疼痛症候群(炎症性および神経障害
を含む)、パラコート、遺伝毒性および酸化ストレスモデル、および腫瘍Iモデルを含む
。
加齢関連状態を測定するために、動物モデルはカロリー制限されたときに変化した表現
型を有する動物であり得る。例えば、F344ラットは、クロトー融合ポリペプチドを評
価するために有用なアッセイ系を提供する。カロリー制限されたとき、F344ラットは
ネフロパシーに対して0から10%の発生率を有する。しかしながら、自由食餌のとき、
それらはネフロパシーに対して60から100%の発生率を有する。
型を有する動物であり得る。例えば、F344ラットは、クロトー融合ポリペプチドを評
価するために有用なアッセイ系を提供する。カロリー制限されたとき、F344ラットは
ネフロパシーに対して0から10%の発生率を有する。しかしながら、自由食餌のとき、
それらはネフロパシーに対して60から100%の発生率を有する。
本明細書のクロトー融合ポリペプチドを評価するために、それを動物(例えば、F34
4ラットまたは他の適当な動物)に投与し、動物のパラメーターを、例えば、期間後に評
価する。動物は自由食餌または通常であり得る(例えば、カロリー制限下ではないが、い
くつかのパラメーターはこのような条件下で評価することができる)。一般的に、このよ
うな動物のコホートはアッセイのために使用される。一般的に、試験ポリペプチドがカロ
リー制限と同様の動物対象の表現型の方向におけるパラメーターに作用するとき、試験ポ
リペプチドは動物における寿命調節を好ましく変化させるものとして示すことができる。
このような試験ポリペプチドは、生物体からカロリー摂取を奪うことなく、少なくともい
くつかのカロリー制限の寿命調節効果、例えば、このような効果の一部をもたらし得る。
4ラットまたは他の適当な動物)に投与し、動物のパラメーターを、例えば、期間後に評
価する。動物は自由食餌または通常であり得る(例えば、カロリー制限下ではないが、い
くつかのパラメーターはこのような条件下で評価することができる)。一般的に、このよ
うな動物のコホートはアッセイのために使用される。一般的に、試験ポリペプチドがカロ
リー制限と同様の動物対象の表現型の方向におけるパラメーターに作用するとき、試験ポ
リペプチドは動物における寿命調節を好ましく変化させるものとして示すことができる。
このような試験ポリペプチドは、生物体からカロリー摂取を奪うことなく、少なくともい
くつかのカロリー制限の寿命調節効果、例えば、このような効果の一部をもたらし得る。
試験すべきパラメーターは、年齢関連または疾患関連パラメーター、例えば、動物モデ
ルと関連する障害の症状であり得る。例えば、試験ポリペプチドをSHラットに投与する
ことができ、血圧をモニタリングする。好ましいと示される試験ポリペプチドは、該ポリ
ペプチドで処理されていない同様の参照動物と比較して、症状の改善を引き起こすことが
できる。障害または老化に関連する他のパラメーターは、抗酸化レベル(例えば、抗酸化
酵素レベルまたは活性)、ストレス抵抗性(例えば、パラコート抵抗性)、中核温、グル
コースレベル、インスリンレベル、甲状腺−刺激ホルモンレベル、プロラクチンレベルお
よび黄体形成ホルモンレベルを含み得る。
ルと関連する障害の症状であり得る。例えば、試験ポリペプチドをSHラットに投与する
ことができ、血圧をモニタリングする。好ましいと示される試験ポリペプチドは、該ポリ
ペプチドで処理されていない同様の参照動物と比較して、症状の改善を引き起こすことが
できる。障害または老化に関連する他のパラメーターは、抗酸化レベル(例えば、抗酸化
酵素レベルまたは活性)、ストレス抵抗性(例えば、パラコート抵抗性)、中核温、グル
コースレベル、インスリンレベル、甲状腺−刺激ホルモンレベル、プロラクチンレベルお
よび黄体形成ホルモンレベルを含み得る。
加齢関連状態を処置するための本明細書のポリペプチドの有効性を測定するために、減
少したクロトー発現を有する動物が使用され得る、例えば、変異クロトーを有するマウス
;Kurooら Nature, 390; 45 (1997)および米国出願番号第2003/0119910号、参照(これら
両方をそれら全体において出典明示により本明細書に包含させる)。例えば、試験ポリペ
プチドを変異マウスに投与し、加齢関連パラメーターをモニタリングする。好ましいと示
される試験ポリペプチドは、該ポリペプチドで処理されていない同様の参照動物と比較し
て、症状の改善を引き起こすことができる。代謝障害または老化に関連するパラメーター
は、体重の測定、生殖能力の獲得の検査、血糖レベルの測定、寿命の観察、皮膚の観察、
歩行のような運動機能の観察などにより評価することができる。評価は、また、胸腺体重
の測定、胸腔の内面上に形成された石灰化結節のサイズの観察などにより作ることができ
る。さらに、クロトー遺伝子またはクロトータンパク質に対するmRNAの定量も評価の
ために有用である。
少したクロトー発現を有する動物が使用され得る、例えば、変異クロトーを有するマウス
;Kurooら Nature, 390; 45 (1997)および米国出願番号第2003/0119910号、参照(これら
両方をそれら全体において出典明示により本明細書に包含させる)。例えば、試験ポリペ
プチドを変異マウスに投与し、加齢関連パラメーターをモニタリングする。好ましいと示
される試験ポリペプチドは、該ポリペプチドで処理されていない同様の参照動物と比較し
て、症状の改善を引き起こすことができる。代謝障害または老化に関連するパラメーター
は、体重の測定、生殖能力の獲得の検査、血糖レベルの測定、寿命の観察、皮膚の観察、
歩行のような運動機能の観察などにより評価することができる。評価は、また、胸腺体重
の測定、胸腔の内面上に形成された石灰化結節のサイズの観察などにより作ることができ
る。さらに、クロトー遺伝子またはクロトータンパク質に対するmRNAの定量も評価の
ために有用である。
さらに、他のインビボモデルおよび生物アッセイは、代謝パラメーター、例えば、イン
スリン障害、II型糖尿病に関連するパラメーターに対して動物を評価することを含む。
例の代謝パラメーターは、グルコース濃度、インスリン濃度およびインスリン感受性を含
む。
スリン障害、II型糖尿病に関連するパラメーターに対して動物を評価することを含む。
例の代謝パラメーターは、グルコース濃度、インスリン濃度およびインスリン感受性を含
む。
別の系の例は、例えば、動物モデルにおける腫瘍を特徴とする。腫瘍は自発的なものま
たは誘導されたものであり得る。例えば、腫瘍は例えば、p53+またはp53−であり
得る種々の遺伝的構成を有する細胞から発生し得る。自己免疫疾患である生物体、例えば
、SLEにかかりやすいNZBマウスを使用することも可能である。骨疾患の特徴を評価
するために、例えば、骨粗鬆症におけるモデルとして卵巣摘出した動物を使用することが
可能である。同様に、関節疾患において、モデルはアジュバント関節炎に基づき(例えば
、マウスが軟骨プロテオグリカン、高移動度グループタンパク質、連鎖球菌細胞壁物質ま
たはコラーゲンの免疫を有し得る)、腎臓疾患において、kd/kdマウスを使用するこ
とができる。認知、特に学習および記憶の動物モデルも利用することができる。糖尿病お
よびその合併症の動物モデル、例えば、ストレプトゾトシンモデルも利用することができ
る。イヌモデルを、例えば、卒中および虚血を評価するために使用することができる。
たは誘導されたものであり得る。例えば、腫瘍は例えば、p53+またはp53−であり
得る種々の遺伝的構成を有する細胞から発生し得る。自己免疫疾患である生物体、例えば
、SLEにかかりやすいNZBマウスを使用することも可能である。骨疾患の特徴を評価
するために、例えば、骨粗鬆症におけるモデルとして卵巣摘出した動物を使用することが
可能である。同様に、関節疾患において、モデルはアジュバント関節炎に基づき(例えば
、マウスが軟骨プロテオグリカン、高移動度グループタンパク質、連鎖球菌細胞壁物質ま
たはコラーゲンの免疫を有し得る)、腎臓疾患において、kd/kdマウスを使用するこ
とができる。認知、特に学習および記憶の動物モデルも利用することができる。糖尿病お
よびその合併症の動物モデル、例えば、ストレプトゾトシンモデルも利用することができ
る。イヌモデルを、例えば、卒中および虚血を評価するために使用することができる。
試験ポリペプチドが寿命調節を変化することができるか否かの評価において、多くの加
齢関連パラメーターまたはバイオマーカーをモニタリングまたは評価することができる。
例の加齢関連パラメーターは、(i)細胞または生物体の寿命、(ii)生物学的加齢依
存発現パターンを有する細胞または生物体における遺伝子転写物または遺伝子産物の存在
または不存在、(iii)ストレスに対する細胞または生物体の抵抗性、(iv)細胞ま
たは生物体の1つ以上の代謝パラメーター(例のパラメーターは循環インスリンレベル、
血中グルコースレベル、脂肪含有量、中核温などを含む)、(v)細胞または生物体に存
在する複数の細胞の増殖能、および(vi)細胞または生物体の外見または挙動を含む。
齢関連パラメーターまたはバイオマーカーをモニタリングまたは評価することができる。
例の加齢関連パラメーターは、(i)細胞または生物体の寿命、(ii)生物学的加齢依
存発現パターンを有する細胞または生物体における遺伝子転写物または遺伝子産物の存在
または不存在、(iii)ストレスに対する細胞または生物体の抵抗性、(iv)細胞ま
たは生物体の1つ以上の代謝パラメーター(例のパラメーターは循環インスリンレベル、
血中グルコースレベル、脂肪含有量、中核温などを含む)、(v)細胞または生物体に存
在する複数の細胞の増殖能、および(vi)細胞または生物体の外見または挙動を含む。
「平均寿命」なる用語は、生物体のコホートの死の年齢の平均を意味する。いくつかの
場合において、「平均寿命」は、コントロール環境条件下で、遺伝的に同一の生物体のコ
ホートを使用して評価される。事故による死は除外される。平均寿命がコントロール環境
条件下で決定できないとき(例えば、ヒト)、十分に大きな母集団に対する信頼性のある
統計情報(例えば、保険数理表から)を平均寿命として使用することができる。
場合において、「平均寿命」は、コントロール環境条件下で、遺伝的に同一の生物体のコ
ホートを使用して評価される。事故による死は除外される。平均寿命がコントロール環境
条件下で決定できないとき(例えば、ヒト)、十分に大きな母集団に対する信頼性のある
統計情報(例えば、保険数理表から)を平均寿命として使用することができる。
2つのこのような生物体、例えば、1つの参照生物体およびクロトー融合ポリペプチド
で処理された1つの生物体間の分子差の特性化は、生物体の生理学的状態における違いを
示すことができる。参照生物体および処理された生物体は、一般的に同じ実年齢である。
本明細書において使用される「実年齢」なる用語は、あらかじめ選択された事象、例えば
、受胎、定義されている胎生または胎児期、または、さらに好ましくは、出生からの経過
時間を示す。生物体が比較分析のための「同じ」実年齢であるかどうかを決定するために
、種々の基準が使用することができる。一般的に、必要とされる精度の程度は、野生型生
物体の平均寿命と相関関係である。例えば、実験室野生型株N2がいくつかのコントロー
ル条件下で平均約16日間生存する線虫シー・エレガンスにおいて、同じ年齢の生物体は
同じ日数の生存であってよい。マウスに関して、同じ年齢の生物体は、同じ週または月数
、霊長類またはヒトに関して、同じ年数(または2、3または5年以内)などの生存であ
ってよい。一般的に、同じ実年齢の生物体は、その種の野生型生物体の平均寿命の15、
10、5、3、2または1%以内の時間の生存であってよい。好ましくは、生物体は成体
であり、例えば、生物体は、少なくとも平均野生型生物体が繁殖能を有する齢に成熟する
時間生存している。
で処理された1つの生物体間の分子差の特性化は、生物体の生理学的状態における違いを
示すことができる。参照生物体および処理された生物体は、一般的に同じ実年齢である。
本明細書において使用される「実年齢」なる用語は、あらかじめ選択された事象、例えば
、受胎、定義されている胎生または胎児期、または、さらに好ましくは、出生からの経過
時間を示す。生物体が比較分析のための「同じ」実年齢であるかどうかを決定するために
、種々の基準が使用することができる。一般的に、必要とされる精度の程度は、野生型生
物体の平均寿命と相関関係である。例えば、実験室野生型株N2がいくつかのコントロー
ル条件下で平均約16日間生存する線虫シー・エレガンスにおいて、同じ年齢の生物体は
同じ日数の生存であってよい。マウスに関して、同じ年齢の生物体は、同じ週または月数
、霊長類またはヒトに関して、同じ年数(または2、3または5年以内)などの生存であ
ってよい。一般的に、同じ実年齢の生物体は、その種の野生型生物体の平均寿命の15、
10、5、3、2または1%以内の時間の生存であってよい。好ましくは、生物体は成体
であり、例えば、生物体は、少なくとも平均野生型生物体が繁殖能を有する齢に成熟する
時間生存している。
生物スクリーニングアッセイは、生物体が老化の明白な物理的特徴を示す前に実施する
ことができる。例えば、生物体は、同じ種の野生型生物体の平均寿命の10、30、40
、50、60または70%だけ生存した成体であり得る。代謝、免疫能力および染色体構
造における加齢関連変化が報告されている。あらゆるこれらの変化を、試験対象(例えば
、生物体ベースアッセイにおける)または患者(例えば、本明細書に記載されている治療
処置の前、中または後)のいずれかに対して評価することができる。
ことができる。例えば、生物体は、同じ種の野生型生物体の平均寿命の10、30、40
、50、60または70%だけ生存した成体であり得る。代謝、免疫能力および染色体構
造における加齢関連変化が報告されている。あらゆるこれらの変化を、試験対象(例えば
、生物体ベースアッセイにおける)または患者(例えば、本明細書に記載されている治療
処置の前、中または後)のいずれかに対して評価することができる。
カロリー制限と関連するマーカーは、また、スクリーニングアッセイの対象生物体(ま
たは処置される対象)を評価することができる。これらのマーカーは加齢関連ではないか
もしれないが、それらはクロトー経路が調節されるとき、変化する生理学的状態を示し得
る。マーカーはmRNAまたはタンパク質であってよく、これらの多くはカロリー制限さ
れた動物において変化する。WO01/12851および米国特許第6,406、853
号は例のマーカーを記載している。本明細書に記載されている動物細胞由来の細胞モデル
または本明細書に記載されている動物モデルの類似物を細胞ベースアッセイのために使用
することができる。
たは処置される対象)を評価することができる。これらのマーカーは加齢関連ではないか
もしれないが、それらはクロトー経路が調節されるとき、変化する生理学的状態を示し得
る。マーカーはmRNAまたはタンパク質であってよく、これらの多くはカロリー制限さ
れた動物において変化する。WO01/12851および米国特許第6,406、853
号は例のマーカーを記載している。本明細書に記載されている動物細胞由来の細胞モデル
または本明細書に記載されている動物モデルの類似物を細胞ベースアッセイのために使用
することができる。
筋萎縮における試験ポリペプチドの効果を評価するためのモデルは、1)例えば、中部
の腿で右坐骨神経を切断することによる脱神経から生じるラット内側腓腹筋の筋肉量喪失
、2)固定、例えば、90度の屈曲で固定された右足関節から生じるラット内側腓腹筋の
筋肉量喪失、3)後肢懸垂から生じるラット内側腓腹筋の筋肉量喪失(例えば、米国20
03−0129686、参照)、4)悪液質サイトカイン、インターロイキン−1(IL
−1)での処理から生じる骨格筋萎縮(R. N. Cooney, S. R. Kimball, T. C. Vary, Sho
ck 7, 1-16 (1997))、および5)グルココルチコイド、デキサメタゾンでの処理から生
じる骨格筋萎縮(A. L. Goldberg, J Biol Chem 244, 3223-9 (1969))を含む。
の腿で右坐骨神経を切断することによる脱神経から生じるラット内側腓腹筋の筋肉量喪失
、2)固定、例えば、90度の屈曲で固定された右足関節から生じるラット内側腓腹筋の
筋肉量喪失、3)後肢懸垂から生じるラット内側腓腹筋の筋肉量喪失(例えば、米国20
03−0129686、参照)、4)悪液質サイトカイン、インターロイキン−1(IL
−1)での処理から生じる骨格筋萎縮(R. N. Cooney, S. R. Kimball, T. C. Vary, Sho
ck 7, 1-16 (1997))、および5)グルココルチコイド、デキサメタゾンでの処理から生
じる骨格筋萎縮(A. L. Goldberg, J Biol Chem 244, 3223-9 (1969))を含む。
AMDに対する例の動物モデルは、滲出性(湿性)黄斑変性症を模倣するレーザー−誘
導マウスモデル Boraら Proc. Natl. Acad. Sci. U S A., 100:2679-84 (2003)、AMD
の「地図状萎縮」型と関連する特徴となるカテプシンDの変異型を発現するトランスジェ
ニックマウス(Rakoczyら Am. J. Pathol., 161:1515-24 (2002))、およびCNVとなる
網膜色素上皮においてVEGFを過剰発現するトランスジェニックマウスSchwesingerら
Am. J. Pathol. 158:1161-72 (2001)を含む。
導マウスモデル Boraら Proc. Natl. Acad. Sci. U S A., 100:2679-84 (2003)、AMD
の「地図状萎縮」型と関連する特徴となるカテプシンDの変異型を発現するトランスジェ
ニックマウス(Rakoczyら Am. J. Pathol., 161:1515-24 (2002))、およびCNVとなる
網膜色素上皮においてVEGFを過剰発現するトランスジェニックマウスSchwesingerら
Am. J. Pathol. 158:1161-72 (2001)を含む。
パーキンソン病の動物モデルの例は、ドーパミン神経毒1−メチル−4フェニル1,2
,3,6−テトラヒドロピリジン(MPTP)での処理によりパーキンソン病になった霊
長類(以下参照、例えば、米国特許公開第20030055231号およびWichmannら A
nn. N.Y. Acad. Sci., 991:199-213 (2003)、6−ヒドロキシドーパミン−障害ラット(
例えば、Lab. Anim. Sci.,49:363-71 (1999))、およびトランスジェニック無脊椎動物モ
デル(例えば、Laksoら J. Neurochem. 86:165-72 (2003)およびLink, Mech. Ageing Dev
., 122:1639-49 (2001))を含む。
,3,6−テトラヒドロピリジン(MPTP)での処理によりパーキンソン病になった霊
長類(以下参照、例えば、米国特許公開第20030055231号およびWichmannら A
nn. N.Y. Acad. Sci., 991:199-213 (2003)、6−ヒドロキシドーパミン−障害ラット(
例えば、Lab. Anim. Sci.,49:363-71 (1999))、およびトランスジェニック無脊椎動物モ
デル(例えば、Laksoら J. Neurochem. 86:165-72 (2003)およびLink, Mech. Ageing Dev
., 122:1639-49 (2001))を含む。
II型糖尿病の分子モデルの例は、欠損Nkx−2.2またはNkx−6.1を有する
トランスジェニックマウス、(米国特許第6,127,598号)、ズッカー糖尿病肥満
fa/fa(ZDF)ラット(米国特許第6,569,832号)、および自発的に肥満
を発症し、次に頻繁に明白な2型糖尿病に進行するアカゲザル(Hottaら Diabets, 50:11
26-33 (2001)、および2型糖尿病−様インスリン抵抗性を有するドミナント・ネガティブ
IGF−I受容体(KR−IGF−IR)を有するトランスジェニックマウスを含む。
トランスジェニックマウス、(米国特許第6,127,598号)、ズッカー糖尿病肥満
fa/fa(ZDF)ラット(米国特許第6,569,832号)、および自発的に肥満
を発症し、次に頻繁に明白な2型糖尿病に進行するアカゲザル(Hottaら Diabets, 50:11
26-33 (2001)、および2型糖尿病−様インスリン抵抗性を有するドミナント・ネガティブ
IGF−I受容体(KR−IGF−IR)を有するトランスジェニックマウスを含む。
ニューロパシーに対する例の動物および細胞モデルは、マウス(米国特許第5,420
,112号)またはウサギ(Ogawaら Neurotoxicology, 21:501-11 (2000))におけるビ
ンクリスチン誘導感覚運動ニューロパシー、自律性ニューロパシーの試験のためのストレ
プトゾトシン(STZ)−糖尿病ラット(Schmidtら Am. J. Pathol., 163:21-8 (2003)
)、および進行性運動ニューロパシー(pmn)マウス(Martinら genomics, 75:9-16 (
2001))を含む。
,112号)またはウサギ(Ogawaら Neurotoxicology, 21:501-11 (2000))におけるビ
ンクリスチン誘導感覚運動ニューロパシー、自律性ニューロパシーの試験のためのストレ
プトゾトシン(STZ)−糖尿病ラット(Schmidtら Am. J. Pathol., 163:21-8 (2003)
)、および進行性運動ニューロパシー(pmn)マウス(Martinら genomics, 75:9-16 (
2001))を含む。
高リン血症または腫瘍性石灰沈着症の動物モデルの例は、クロトーノックアウトマウス
およびFGF23ノックアウトマウス(Yoshidaら Endocrinology 143:683-689 (2002))
を含む。
およびFGF23ノックアウトマウス(Yoshidaら Endocrinology 143:683-689 (2002))
を含む。
慢性腎臓疾患または慢性腎不全の動物モデルの例は、COL4A3+/−マウス(Beir
owskiら J. Am. Soc. Nephrol. 17:1986-1994 (2006))を含む。
owskiら J. Am. Soc. Nephrol. 17:1986-1994 (2006))を含む。
癌の動物モデルの例は、当分野で既知であるヌードマウスへの癌細胞または組織の移植
または注入を含む(Giovanellaら Adv. Cancer Res. 44:69-120 (1985))。例えば、乳癌
の動物モデルは、乳癌細胞または組織を移植または注入されたヌードマウスを含む(例え
ば、Yueら Cancer Res. 54:5092-5095 (1994); Glinskyら Cancer Res. 56:5319-5324 (1
996); Visonneau Am. J. Path. 152:1299-1311 (1998))。
または注入を含む(Giovanellaら Adv. Cancer Res. 44:69-120 (1985))。例えば、乳癌
の動物モデルは、乳癌細胞または組織を移植または注入されたヌードマウスを含む(例え
ば、Yueら Cancer Res. 54:5092-5095 (1994); Glinskyら Cancer Res. 56:5319-5324 (1
996); Visonneau Am. J. Path. 152:1299-1311 (1998))。
当該組成物は、対象、例えば、成体対象、特に健常成体対象または加齢関連疾患を有す
る対象に投与することができる。後者の場合、当該方法は、例えば、加齢関連疾患の症状
または他の疾患のマーカーを特徴付けるために対象を評価し、それにより神経変性疾患、
例えば、アルツハイマー病または加齢関連疾患を有するか、またはこのような疾患になり
やすい対象を同定することができる。
る対象に投与することができる。後者の場合、当該方法は、例えば、加齢関連疾患の症状
または他の疾患のマーカーを特徴付けるために対象を評価し、それにより神経変性疾患、
例えば、アルツハイマー病または加齢関連疾患を有するか、またはこのような疾患になり
やすい対象を同定することができる。
骨格筋萎縮
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、骨格筋萎縮を処置するために使用することができる。筋萎縮は、多数の神経筋、代謝
、免疫および神経障害および疾患ならびに飢餓、栄養欠損、代謝ストレス、糖尿病、老化
、筋ジストロフィーまたはミオパシーを含む。筋萎縮は老化プロセス中に起こる。筋萎縮
は、また、筋肉の使用の減少または不使用による。症状は骨格筋組織量の減少で引き起こ
される。ヒト男性において、筋肉量は50から80齢の間に1/3に減少する。筋萎縮の
いくつかの分子特徴は、ユビキチンリガーゼの上方調節および筋原線維タンパク質の喪失
を含む(Furunoら J. Biol. Chem., 265:8550-8557, 1990)。これらのタンパク質の崩壊
は、例えば、アクチンの特異的成分であり、ミオシンの特定の筋肉中の3−メチル−ヒス
チジン生産を測定することによって追跡することができる(Goodman, Biochem. J. 241:1
21-12, 1987 and Lowellら Metabolism, 35:1121-112, 1986; Stein and Schluter, Am.
J. Physiol. Endocrinol.Metab. 272: E688-E696, 1997)。クレアチンキナーゼの放出(
細胞損傷マーカー)(Jacksonら Neurology, 41: 101 104, 1991)も示され得る。
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、骨格筋萎縮を処置するために使用することができる。筋萎縮は、多数の神経筋、代謝
、免疫および神経障害および疾患ならびに飢餓、栄養欠損、代謝ストレス、糖尿病、老化
、筋ジストロフィーまたはミオパシーを含む。筋萎縮は老化プロセス中に起こる。筋萎縮
は、また、筋肉の使用の減少または不使用による。症状は骨格筋組織量の減少で引き起こ
される。ヒト男性において、筋肉量は50から80齢の間に1/3に減少する。筋萎縮の
いくつかの分子特徴は、ユビキチンリガーゼの上方調節および筋原線維タンパク質の喪失
を含む(Furunoら J. Biol. Chem., 265:8550-8557, 1990)。これらのタンパク質の崩壊
は、例えば、アクチンの特異的成分であり、ミオシンの特定の筋肉中の3−メチル−ヒス
チジン生産を測定することによって追跡することができる(Goodman, Biochem. J. 241:1
21-12, 1987 and Lowellら Metabolism, 35:1121-112, 1986; Stein and Schluter, Am.
J. Physiol. Endocrinol.Metab. 272: E688-E696, 1997)。クレアチンキナーゼの放出(
細胞損傷マーカー)(Jacksonら Neurology, 41: 101 104, 1991)も示され得る。
非インスリン依存糖尿病
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、非−インスリン−依存糖尿病を処置するために使用することができる。非−インスリ
ン−依存糖尿病は、「成人発症型」糖尿病および2型糖尿病とも呼ばれる。2型糖尿病は
、また、「非−2型肥満」および「2型肥満」を含む。II型糖尿病は、(1)血中グル
コースレベルバランスを維持するために必要な量未満のインスリンが生産される、膵臓−
ベータ−島−細胞のインスリンの分泌の減少、および/または(2)体がインスリンに正
常に応答しない「インスリン抵抗性」(米国特許第5,266,561号および米国特許
第6,518,069号)により特徴付けることができる。例えば、グルコース−刺激イ
ンスリンレベルは、一般的に4.0nmol/L以上に上がらない(米国特許第5,26
6,561号)。例のII型糖尿病の症状は、空腹時の高血糖(米国特許第5,266,
561号)、疲労、過度の口渇、頻尿、視力障害および感染率の増加を含む。II型糖尿
病の指標は膵島のアミロイド沈着を含む。
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、非−インスリン−依存糖尿病を処置するために使用することができる。非−インスリ
ン−依存糖尿病は、「成人発症型」糖尿病および2型糖尿病とも呼ばれる。2型糖尿病は
、また、「非−2型肥満」および「2型肥満」を含む。II型糖尿病は、(1)血中グル
コースレベルバランスを維持するために必要な量未満のインスリンが生産される、膵臓−
ベータ−島−細胞のインスリンの分泌の減少、および/または(2)体がインスリンに正
常に応答しない「インスリン抵抗性」(米国特許第5,266,561号および米国特許
第6,518,069号)により特徴付けることができる。例えば、グルコース−刺激イ
ンスリンレベルは、一般的に4.0nmol/L以上に上がらない(米国特許第5,26
6,561号)。例のII型糖尿病の症状は、空腹時の高血糖(米国特許第5,266,
561号)、疲労、過度の口渇、頻尿、視力障害および感染率の増加を含む。II型糖尿
病の指標は膵島のアミロイド沈着を含む。
ニューロパシー
ニューロパシーは、運動、感覚、感覚運動または自律神経を冒す全身性疾患、遺伝性疾
患または毒物により引き起こされる中枢および/または末梢神経機能障害を含み得る(例
えば、米国特許出願第20030013771号、参照)。症状は神経損傷の原因および
冒されている神経の特定の型に依存して変化し得る。例えば、運動ニューロパシーの症状
は、肉体作業の実施におけるぎこちなさまたは筋力低下、軽い運動後の極度の疲労、立位
または歩行の困難および神経筋反射の減衰または欠損を含む(米国特許出願第20030
013771号)。自律性ニューロパシーの症状は便秘、心臓の不規則性および姿勢低血
圧反射の減衰を含む(米国特許出願第20030013771号)。感覚ニューロパシー
の症状は疼痛および無感覚、手、脚または足のチクチク感、ならびに接触に対する極端な
感度を含み、網膜症の症状は視力障害、突然の失明、黒斑および閃光を含む。
ニューロパシーは、運動、感覚、感覚運動または自律神経を冒す全身性疾患、遺伝性疾
患または毒物により引き起こされる中枢および/または末梢神経機能障害を含み得る(例
えば、米国特許出願第20030013771号、参照)。症状は神経損傷の原因および
冒されている神経の特定の型に依存して変化し得る。例えば、運動ニューロパシーの症状
は、肉体作業の実施におけるぎこちなさまたは筋力低下、軽い運動後の極度の疲労、立位
または歩行の困難および神経筋反射の減衰または欠損を含む(米国特許出願第20030
013771号)。自律性ニューロパシーの症状は便秘、心臓の不規則性および姿勢低血
圧反射の減衰を含む(米国特許出願第20030013771号)。感覚ニューロパシー
の症状は疼痛および無感覚、手、脚または足のチクチク感、ならびに接触に対する極端な
感度を含み、網膜症の症状は視力障害、突然の失明、黒斑および閃光を含む。
アルツハイマー病
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、アルツハイマー病(AD)を処置するために使用することができる。アルツハイマー
病は、ニューロンの不可逆性喪失を引き起こす複雑な神経変性疾患である。それは、加齢
関連状態でもある神経変性疾患の単に1つの例を提供する。アルツハイマー病の臨床的特
徴は、記憶、判断、物理的周囲に対する見当識、および言語における進行性の障害を含む
。ADの神経病理学的特徴は領域特異的なニューロン脱落、アミロイド斑および神経原線
維変化を含む。アミロイド斑は、8−アミロイド前駆タンパク質(APPとしても既知)
の分解産物であるアミロイドペプチド(ApまたはAp42としても既知)を含む細胞外
の斑である。神経原線維変化は異常に高リン酸化された微小管関連タンパク質のフィラメ
ントから構成される不溶性細胞内凝集体であり、tautアミロイド斑および神経原線維
変化はアポトーシスによりニューロン脱落となる二次事象に寄与し得る(Clark and Karl
awish, Ann. Intern. Med. 138(5):400-410 (2003))。例えば、p−アミロイドは培養さ
れたニューロンにおいてカスパーゼ−2−依存アポトーシスを誘導する(TroyらJ Neuros
ci. 20(4):1386-1392)。斑の沈着は、in vivaで、同様の様式において近位ニューロンの
アポトーシスを誘導し得る。
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、アルツハイマー病(AD)を処置するために使用することができる。アルツハイマー
病は、ニューロンの不可逆性喪失を引き起こす複雑な神経変性疾患である。それは、加齢
関連状態でもある神経変性疾患の単に1つの例を提供する。アルツハイマー病の臨床的特
徴は、記憶、判断、物理的周囲に対する見当識、および言語における進行性の障害を含む
。ADの神経病理学的特徴は領域特異的なニューロン脱落、アミロイド斑および神経原線
維変化を含む。アミロイド斑は、8−アミロイド前駆タンパク質(APPとしても既知)
の分解産物であるアミロイドペプチド(ApまたはAp42としても既知)を含む細胞外
の斑である。神経原線維変化は異常に高リン酸化された微小管関連タンパク質のフィラメ
ントから構成される不溶性細胞内凝集体であり、tautアミロイド斑および神経原線維
変化はアポトーシスによりニューロン脱落となる二次事象に寄与し得る(Clark and Karl
awish, Ann. Intern. Med. 138(5):400-410 (2003))。例えば、p−アミロイドは培養さ
れたニューロンにおいてカスパーゼ−2−依存アポトーシスを誘導する(TroyらJ Neuros
ci. 20(4):1386-1392)。斑の沈着は、in vivaで、同様の様式において近位ニューロンの
アポトーシスを誘導し得る。
遺伝学、生化学、生理学的および認知基準を含む種々の基準を、対象におけるADを評
価するために使用することができる。ADの症状および診断は医師に知られている。AD
のいくつかの症状およびマーカーの例は以下のものである。これらの徴候およびADと関
連することが知られている他の徴候についての情報を、「AD関連パラメーター」として
使用することができる。AD関連パラメーターは定性的または定量的情報を含むことがで
きる。定量的情報の例は、1つ以上の特徴の数値、例えば、タンパク質の濃度または断層
マップである。定性的情報は評価、例えば、医師のコメントまたは二者択一(「イエス」
/「ノー」)などを含むことができる。AD−関連パラメーターは、対象がADと診断さ
れないか、またはADの特定の徴候を有さないことを示す情報、例えば、典型的なADの
典型ではない認知試験結果、またはADと関連しない遺伝的なAPOE多型を含む。
価するために使用することができる。ADの症状および診断は医師に知られている。AD
のいくつかの症状およびマーカーの例は以下のものである。これらの徴候およびADと関
連することが知られている他の徴候についての情報を、「AD関連パラメーター」として
使用することができる。AD関連パラメーターは定性的または定量的情報を含むことがで
きる。定量的情報の例は、1つ以上の特徴の数値、例えば、タンパク質の濃度または断層
マップである。定性的情報は評価、例えば、医師のコメントまたは二者択一(「イエス」
/「ノー」)などを含むことができる。AD−関連パラメーターは、対象がADと診断さ
れないか、またはADの特定の徴候を有さないことを示す情報、例えば、典型的なADの
典型ではない認知試験結果、またはADと関連しない遺伝的なAPOE多型を含む。
進行性の認識機能障害はADの特徴である。この障害は、記憶、判断、意思決定、周り
の物理的方向および言語の減衰として現れ得る(Nussbaum and Ellis, New Eng J. Med.
348(14):1356 35 1364 (2003))。他の型の認知症の排除はADの診断に役立てることが
できる。神経細胞死は、AD患者における進行性の脳萎縮を引き起こす。映像技術(例え
ば、磁気共鳴映像法またはコンピューター断層撮影)は、脳におけるAD関連病変および
/または脳萎縮を検出するために使用することができる。
の物理的方向および言語の減衰として現れ得る(Nussbaum and Ellis, New Eng J. Med.
348(14):1356 35 1364 (2003))。他の型の認知症の排除はADの診断に役立てることが
できる。神経細胞死は、AD患者における進行性の脳萎縮を引き起こす。映像技術(例え
ば、磁気共鳴映像法またはコンピューター断層撮影)は、脳におけるAD関連病変および
/または脳萎縮を検出するために使用することができる。
AD患者は疾患の病状によって生じる生化学的異常を示し得る。例えば、脳脊髄液にお
けるタウタンパク質のレベルはAD患者において高まる(Andreasen, Nら Arch Neurol.
58:349-350 (2001))。
けるタウタンパク質のレベルはAD患者において高まる(Andreasen, Nら Arch Neurol.
58:349-350 (2001))。
アミロイドベータ42(A,B42)ペプチドのレベルは、AD患者のCSFにおいて
減少し得る。Ap42のレベルはAD患者の血漿において増加し得る(Ertekein-Taner,
Nら Science 290:2303 2304 (2000))。対象からのサンプルにおいて生化学異常を検出す
るための技術は、当分野で既知の細胞、免疫および他の生物学的方法を含む。一般的なア
ドバイスのために、例えば、Sambrook & Russell, Molecular Cloning: A Laboratory Ma
nual, 3r Edition, Cold Spring Harbor Laboratory, N.Y. (2001), Ausubelら Current
Protocols in Molecular Biology (Greene Publishing Associates and Wiley Interscie
nce, N.Y. (1989), (Harrow, E. and Lane, D. (1988)Antibodies: A Laboratory Manua
l, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY)ならびにそれらの
最新版に記載されている技術、参照。
減少し得る。Ap42のレベルはAD患者の血漿において増加し得る(Ertekein-Taner,
Nら Science 290:2303 2304 (2000))。対象からのサンプルにおいて生化学異常を検出す
るための技術は、当分野で既知の細胞、免疫および他の生物学的方法を含む。一般的なア
ドバイスのために、例えば、Sambrook & Russell, Molecular Cloning: A Laboratory Ma
nual, 3r Edition, Cold Spring Harbor Laboratory, N.Y. (2001), Ausubelら Current
Protocols in Molecular Biology (Greene Publishing Associates and Wiley Interscie
nce, N.Y. (1989), (Harrow, E. and Lane, D. (1988)Antibodies: A Laboratory Manua
l, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY)ならびにそれらの
最新版に記載されている技術、参照。
例えば、抗体、他の免疫グロブリンおよび他の特異的結合リガンドを、ADと関連する
生体分子、例えば、タンパク質または他の抗原を検出するために使用することができる。
例えば、1つ以上の特異抗体を、サンプルを調べるために使用することができる。種々の
方法、例えば、ELISA、蛍光−ベースアッセイ、ウエスタンブロットおよびタンパク
質アッセイが可能である。ポリペプチドアレイを生産する方法は、当分野において、例え
ば、De Wildtら (2000). Nature Biotech. 18, 989-994; Luckingら (1999). Anal. Bioc
hem. 270, 103-111; Ge, H. (2000). Nucleic Acids Res. 28, e3, I-VII; MacBeath, G.
, and Schreiber, S.L. (2000). Science 289, 1760 to 1 763;およびWO99/5 1
773A1において記載されている。
生体分子、例えば、タンパク質または他の抗原を検出するために使用することができる。
例えば、1つ以上の特異抗体を、サンプルを調べるために使用することができる。種々の
方法、例えば、ELISA、蛍光−ベースアッセイ、ウエスタンブロットおよびタンパク
質アッセイが可能である。ポリペプチドアレイを生産する方法は、当分野において、例え
ば、De Wildtら (2000). Nature Biotech. 18, 989-994; Luckingら (1999). Anal. Bioc
hem. 270, 103-111; Ge, H. (2000). Nucleic Acids Res. 28, e3, I-VII; MacBeath, G.
, and Schreiber, S.L. (2000). Science 289, 1760 to 1 763;およびWO99/5 1
773A1において記載されている。
1つのアッセイにおいて、ADの非ヒト動物モデル(例えば、マウスモデル)が、例え
ば、ポリペプチドまたは治療レジメンを評価するために使用される。例えば、米国特許第
6,509,515号は、天然に学習および記憶試験で使用することができる1つのこの
ようなモデル動物を記載している。該動物は、該動物が誕生から短期間内、一般的に誕生
から1年以内、好ましくは誕生から2から6月以内に進行性の神経障害を発症するような
レベルで脳組織においてアミロイド前駆タンパク質(APP)配列を発現する。APPタ
ンパク質配列を胚形成期の動物または動物の原細胞、好ましくは1つの細胞または受精卵
母細胞期および一般的に約8細胞期より遅くない細胞に導入する。次に受精卵または胚を
、里親のメスとして擬似−妊娠期に発達させる。アミロイド前駆タンパク質遺伝子を、脳
の皮質辺縁領域、進行性の神経疾患状態、例えばADにおいて顕著に影響される脳の領域
において、アミロイド前駆タンパク質の過剰な内因性発現および進行性の神経疾患の発症
を引き起こす状態において、染色体に組み込まれるように動物胚に導入する。グリオーシ
スおよび臨床症状が、トランスジェニック動物モデルにおいて神経疾患を起こす。神経疾
患の進行性の局面は、探索および/または運動行動の減少およびデオキシグルコース摂取
/利用の減少および脳の皮質辺縁領域における異常肥大グリオーシスにより特徴付けられ
る。さらに、見られる変化は、いくつかの老化動物において見られるものと同様である。
他の動物モデルは、また、US5,387,742、5,877,399、6,358,
752および6,187,992に記載されている。
ば、ポリペプチドまたは治療レジメンを評価するために使用される。例えば、米国特許第
6,509,515号は、天然に学習および記憶試験で使用することができる1つのこの
ようなモデル動物を記載している。該動物は、該動物が誕生から短期間内、一般的に誕生
から1年以内、好ましくは誕生から2から6月以内に進行性の神経障害を発症するような
レベルで脳組織においてアミロイド前駆タンパク質(APP)配列を発現する。APPタ
ンパク質配列を胚形成期の動物または動物の原細胞、好ましくは1つの細胞または受精卵
母細胞期および一般的に約8細胞期より遅くない細胞に導入する。次に受精卵または胚を
、里親のメスとして擬似−妊娠期に発達させる。アミロイド前駆タンパク質遺伝子を、脳
の皮質辺縁領域、進行性の神経疾患状態、例えばADにおいて顕著に影響される脳の領域
において、アミロイド前駆タンパク質の過剰な内因性発現および進行性の神経疾患の発症
を引き起こす状態において、染色体に組み込まれるように動物胚に導入する。グリオーシ
スおよび臨床症状が、トランスジェニック動物モデルにおいて神経疾患を起こす。神経疾
患の進行性の局面は、探索および/または運動行動の減少およびデオキシグルコース摂取
/利用の減少および脳の皮質辺縁領域における異常肥大グリオーシスにより特徴付けられ
る。さらに、見られる変化は、いくつかの老化動物において見られるものと同様である。
他の動物モデルは、また、US5,387,742、5,877,399、6,358,
752および6,187,992に記載されている。
パーキンソン病
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、パーキンソン病を処置するために使用することができる。パーキンソン病は、運動機
能を調節する黒質線条体ドーパミン系の変性となる、黒質におけるドーパミンニューロン
の神経変性を含む。この病状は、同様に、運動機能障害を引き起こす(例えば、Lothariu
sら Nat. Rev. Neurosci., 3:932-42 (2002)、参照)。例の運動症状は、無動症、前屈姿
勢、歩行困難、姿勢の不安定、強硬症、筋硬直および振戦を含む。例の非運動症状は、鬱
病、意欲の欠如、消極的な態度、認知症および消化器機能障害を含む(例えば、Fahn, An
n. N.Y. Acad. Sci., 991:1-14 (2003)およびPfeiffer, Lancet Neurol., 2:107-16 (200
3)、参照)。パーキンソン病は65から69歳の個体の0.5から1パーセントおよび8
0歳以上の個体の1から3パーセントで観察された(例えば、Nussbaumら N. Engl. J. M
ed., 348:1356-64 (2003)、参照)。パーキンソン病の分子マーカーは、芳香族性Lアミ
ノ酸デカルボキシラーゼ(AADC)の減少(例えば、米国出願第2002017266
4号、参照)、および黒質線条体におけるドーパミン含量の喪失(例えば、Fahn, Ann. N
.Y. Acad. Sci., 991:1-14 (2003)およびLothariusら Nat. Rev. Neurosci., 3:932-42 (
2002)、参照)を含む。いくつかの家族性症例において、PDはアルファ−シヌクレイン
およびパーキン(E3ユビキチンリガーゼ)タンパク質をコードする単一の遺伝子の変異
に関連する(例えば、Riessら J. Neurol. 250 Suppl 1:I3 10 (2003)およびNussbaumら
N. Engl. J. Med., 348:1356-64 (2003))。ニューロン特異的C−末端ユビキチンヒドロ
ラーゼ遺伝子におけるミスセンス変異もパーキンソン病と関連する(例えば、Nussbaumら
N. Engl. J. Med., 348:1356-64 (2003))。
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、パーキンソン病を処置するために使用することができる。パーキンソン病は、運動機
能を調節する黒質線条体ドーパミン系の変性となる、黒質におけるドーパミンニューロン
の神経変性を含む。この病状は、同様に、運動機能障害を引き起こす(例えば、Lothariu
sら Nat. Rev. Neurosci., 3:932-42 (2002)、参照)。例の運動症状は、無動症、前屈姿
勢、歩行困難、姿勢の不安定、強硬症、筋硬直および振戦を含む。例の非運動症状は、鬱
病、意欲の欠如、消極的な態度、認知症および消化器機能障害を含む(例えば、Fahn, An
n. N.Y. Acad. Sci., 991:1-14 (2003)およびPfeiffer, Lancet Neurol., 2:107-16 (200
3)、参照)。パーキンソン病は65から69歳の個体の0.5から1パーセントおよび8
0歳以上の個体の1から3パーセントで観察された(例えば、Nussbaumら N. Engl. J. M
ed., 348:1356-64 (2003)、参照)。パーキンソン病の分子マーカーは、芳香族性Lアミ
ノ酸デカルボキシラーゼ(AADC)の減少(例えば、米国出願第2002017266
4号、参照)、および黒質線条体におけるドーパミン含量の喪失(例えば、Fahn, Ann. N
.Y. Acad. Sci., 991:1-14 (2003)およびLothariusら Nat. Rev. Neurosci., 3:932-42 (
2002)、参照)を含む。いくつかの家族性症例において、PDはアルファ−シヌクレイン
およびパーキン(E3ユビキチンリガーゼ)タンパク質をコードする単一の遺伝子の変異
に関連する(例えば、Riessら J. Neurol. 250 Suppl 1:I3 10 (2003)およびNussbaumら
N. Engl. J. Med., 348:1356-64 (2003))。ニューロン特異的C−末端ユビキチンヒドロ
ラーゼ遺伝子におけるミスセンス変異もパーキンソン病と関連する(例えば、Nussbaumら
N. Engl. J. Med., 348:1356-64 (2003))。
ハンチントン病
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、ハンチントン病を処置するために使用することができる。ハンチントン病におけるク
ロトー融合ポリペプチドの有効性を評価および/または有効用量を決定するための方法は
、例えば、哺乳動物(例えば、マウス、ラット、霊長類または他の何らかの非ヒト)また
は他の動物(例えば、アフリカツメガエル、ゼブラフィッシュまたは無脊椎動物、例えば
、昆虫または線虫)を使用する生物ベースアッセイを含む。ハンチントン病において多く
の動物モデル系が利用できる。例えば、Brouillet, Functional Neurology 15(4): 239-2
51 (2000); Onaら Nature 399: 263-267 (1999), Batesら Hum Mol Genet. 6(10):1633-7
(1997); Hanssonら J. of Neurochemistry 78: 694-703;およびRubinsztein, D. C., Tr
ends in Genetics, Vol. 1S, No. 4, pp. 202-209(HDの種々の動物および非ヒトモデ
ルにおける確認)、参照。
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、ハンチントン病を処置するために使用することができる。ハンチントン病におけるク
ロトー融合ポリペプチドの有効性を評価および/または有効用量を決定するための方法は
、例えば、哺乳動物(例えば、マウス、ラット、霊長類または他の何らかの非ヒト)また
は他の動物(例えば、アフリカツメガエル、ゼブラフィッシュまたは無脊椎動物、例えば
、昆虫または線虫)を使用する生物ベースアッセイを含む。ハンチントン病において多く
の動物モデル系が利用できる。例えば、Brouillet, Functional Neurology 15(4): 239-2
51 (2000); Onaら Nature 399: 263-267 (1999), Batesら Hum Mol Genet. 6(10):1633-7
(1997); Hanssonら J. of Neurochemistry 78: 694-703;およびRubinsztein, D. C., Tr
ends in Genetics, Vol. 1S, No. 4, pp. 202-209(HDの種々の動物および非ヒトモデ
ルにおける確認)、参照。
このような動物モデルの例は、R6/2系のトランスジェニックマウス系である(Mang
iariniらCell 87: 493-506 (1996))。R6/2マウスはヒトHD遺伝子のエクソン1を
過剰発現する(内因性プロモーターのコントロール下)トランスジェニックハンチントン
病マウスである。R6/2ヒトHD遺伝子のエクソン1は広範なCAG/ポリグルタミン
繰り返し(平均で150のCAG繰り返し)を有する。これらのマウスは、ヒトハンチン
トン病の多くの特徴を有する進行性の最終的に致命的な神経疾患を発症する。ハンチンチ
ン(HDエクソン1によってコードされる)のN末端部分により構成される異常凝集体が
、R6/2マウスにおいて、細胞質および細胞の核において両方とも45で観察される(
Daviesら Cell 90: 537-548 (1997))。例えば、トランスジェニック動物におけるヒトハ
ンチンチンタンパク質は、少なくとも55のCAG繰り返しおよびさらに好ましくは約1
50のCAG繰り返しを含む遺伝子によってコードされる。これらのトランスジェニック
動物はハンチントン病様表現型を発現することができる。
iariniらCell 87: 493-506 (1996))。R6/2マウスはヒトHD遺伝子のエクソン1を
過剰発現する(内因性プロモーターのコントロール下)トランスジェニックハンチントン
病マウスである。R6/2ヒトHD遺伝子のエクソン1は広範なCAG/ポリグルタミン
繰り返し(平均で150のCAG繰り返し)を有する。これらのマウスは、ヒトハンチン
トン病の多くの特徴を有する進行性の最終的に致命的な神経疾患を発症する。ハンチンチ
ン(HDエクソン1によってコードされる)のN末端部分により構成される異常凝集体が
、R6/2マウスにおいて、細胞質および細胞の核において両方とも45で観察される(
Daviesら Cell 90: 537-548 (1997))。例えば、トランスジェニック動物におけるヒトハ
ンチンチンタンパク質は、少なくとも55のCAG繰り返しおよびさらに好ましくは約1
50のCAG繰り返しを含む遺伝子によってコードされる。これらのトランスジェニック
動物はハンチントン病様表現型を発現することができる。
これらのトランスジェニックマウスは、誕生後8から10週の体重増加の減少、寿命の
減少および異常な足取りにより特徴付けられる運動障害、静止振戦、後肢抱擁および過活
動により特徴付けられる(例えば、R6/2系;Mangiariniら Cell 87: 493-506 (1996)
、参照)。表現型は運動機能低下の方向へ悪化する。これらのトランスジェニックマウス
の脳は、神経化学的および組織学的異常、例えば、神経伝達物質受容体(グルタミン酸塩
、ドーパミン)の変化、N−アセチルアスパラギン酸(完全なニューロンのマーカー)の
濃度の減少ならびに線条体および脳サイズの減少を示す。したがって、評価は、神経伝達
物質レベル、神経伝達物質受容体レベル、脳サイズおよび線条体サイズに関連するパラメ
ーターを評価することを含むことができる。加えて、部分または完全長のトランスジェニ
ック・ヒトハンチンチンタンパク質を含む異常凝集体は、これらの動物(例えば、R6/
2トランスジェニックマウス系)の脳組織において存在する。例えば、Mangiariniら Cel
l 87: 493-506 (1996), Daviesら Cell 90: 537-548 (1997), Brouillet, Functional Ne
urology 15(4): 239-251 (2000)およびChaら Proc. Natl. Acad. Sci. USA 95: 6480-648
5 (1998)、参照。
減少および異常な足取りにより特徴付けられる運動障害、静止振戦、後肢抱擁および過活
動により特徴付けられる(例えば、R6/2系;Mangiariniら Cell 87: 493-506 (1996)
、参照)。表現型は運動機能低下の方向へ悪化する。これらのトランスジェニックマウス
の脳は、神経化学的および組織学的異常、例えば、神経伝達物質受容体(グルタミン酸塩
、ドーパミン)の変化、N−アセチルアスパラギン酸(完全なニューロンのマーカー)の
濃度の減少ならびに線条体および脳サイズの減少を示す。したがって、評価は、神経伝達
物質レベル、神経伝達物質受容体レベル、脳サイズおよび線条体サイズに関連するパラメ
ーターを評価することを含むことができる。加えて、部分または完全長のトランスジェニ
ック・ヒトハンチンチンタンパク質を含む異常凝集体は、これらの動物(例えば、R6/
2トランスジェニックマウス系)の脳組織において存在する。例えば、Mangiariniら Cel
l 87: 493-506 (1996), Daviesら Cell 90: 537-548 (1997), Brouillet, Functional Ne
urology 15(4): 239-251 (2000)およびChaら Proc. Natl. Acad. Sci. USA 95: 6480-648
5 (1998)、参照。
動物モデルにおける本明細書に記載されている試験ポリペプチドまたは既知のポリペプ
チドの効果を試験するため、異なる濃度の試験ポリペプチドを、例えば、試験ポリペプチ
ドを動物の循環系に注射することにより、トランスジェニック動物に投与する。ハンチン
トン病のような症状が動物において評価され得る。次に、例えば、マウスモデルに関して
上記されているハンチントン病のような症状の進行を、試験ポリペプチドでの処理が症状
の軽減または遅延をもたらすか否かを決定するためにモニタリングする。他のアッセイに
おいて、これらの動物におけるハンチンチンタンパク質凝集体の分離をモニタリングする
。次に動物を殺し、脳スライスを得ることができる。次に脳スライスを、トランスジェニ
ックヒトハンチンチンタンパク質、その一部、またはヒトハンチンチンタンパク質もしく
はその一部を含む融合タンパク質を含む凝集体の存在に関して分析する。この分析は、例
えば、脳組織のスライスを抗−ハンチンチン抗体で染色し、抗−ハンチントン抗体を認識
するFITCを結合させた二次抗体を加え(例えば、抗−ハンチンチン抗体はマウス抗−
ヒト抗体であり、二次抗体はヒト抗体に特異的である)、蛍光顕微鏡法によりタンパク質
凝集体を視覚化することを含むことができる。
チドの効果を試験するため、異なる濃度の試験ポリペプチドを、例えば、試験ポリペプチ
ドを動物の循環系に注射することにより、トランスジェニック動物に投与する。ハンチン
トン病のような症状が動物において評価され得る。次に、例えば、マウスモデルに関して
上記されているハンチントン病のような症状の進行を、試験ポリペプチドでの処理が症状
の軽減または遅延をもたらすか否かを決定するためにモニタリングする。他のアッセイに
おいて、これらの動物におけるハンチンチンタンパク質凝集体の分離をモニタリングする
。次に動物を殺し、脳スライスを得ることができる。次に脳スライスを、トランスジェニ
ックヒトハンチンチンタンパク質、その一部、またはヒトハンチンチンタンパク質もしく
はその一部を含む融合タンパク質を含む凝集体の存在に関して分析する。この分析は、例
えば、脳組織のスライスを抗−ハンチンチン抗体で染色し、抗−ハンチントン抗体を認識
するFITCを結合させた二次抗体を加え(例えば、抗−ハンチンチン抗体はマウス抗−
ヒト抗体であり、二次抗体はヒト抗体に特異的である)、蛍光顕微鏡法によりタンパク質
凝集体を視覚化することを含むことができる。
種々の方法がハンチントン病を評価および/またはモニタリングするために利用できる
。該疾患に対する種々の臨床的症状および兆候は知られている。ハンチントン病は、運動
障害、精神問題および認知変化を引き起こす。これらの症状の程度、発症年齢および症状
は変化し得る。運動障害は速いランダムなダンスのような動きを含むことができ、舞踏病
と呼ばれる。
。該疾患に対する種々の臨床的症状および兆候は知られている。ハンチントン病は、運動
障害、精神問題および認知変化を引き起こす。これらの症状の程度、発症年齢および症状
は変化し得る。運動障害は速いランダムなダンスのような動きを含むことができ、舞踏病
と呼ばれる。
例の運動評価は、追跡眼球運動、サッカード開始、サッカード速度、構音障害、挺舌、
指をたたく能力、回内/回外、げんこつ−手−手のひらの反復(a lo fist-hand-palm)、
腕の硬直、動作緩慢、最大のジストニア(体幹、上および下肢)、最大の舞踏病(例えば
、体幹、顔、上および下肢)、足取り、タンデム歩行および後方突進を含む。例の処置は
、例えば、1年間にわたって、Total Motor Score 4(TMS−4)、UHDRSの下位
尺度を変化させることである。
指をたたく能力、回内/回外、げんこつ−手−手のひらの反復(a lo fist-hand-palm)、
腕の硬直、動作緩慢、最大のジストニア(体幹、上および下肢)、最大の舞踏病(例えば
、体幹、顔、上および下肢)、足取り、タンデム歩行および後方突進を含む。例の処置は
、例えば、1年間にわたって、Total Motor Score 4(TMS−4)、UHDRSの下位
尺度を変化させることである。
癌
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、癌を処置するために使用することができる。癌は、不適当に高レベルの細胞分裂、不
適当に低いレベルのアポトーシスまたはその両方により誘導されるか、または引き起こさ
れるすべての疾患を含む。癌の例は、白血病(例えば、急性白血病、急性リンパ性白血病
、急性骨髄性白血病、急性骨髄芽球性白血病、急性前骨髄球性白血病、急性骨髄単球性白
血病、急性単球性白血病、急性赤白血病、慢性白血病、慢性骨髄性白血病、慢性リンパ性
白血病)、真性赤血球増加症、リンパ腫(ホジキン病、非ホジキン病)、ワルデンシュト
レームマクログロブリン血症、重鎖病、および固形腫瘍、例えば、肉腫および癌腫(例え
ば、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨肉腫、脊索腫、血管肉腫、内皮肉腫(e
ndotheliosarcoma)、リンパ管肉腫、リンパ管内皮肉腫、滑液腫瘍、中皮腫、ユーイング
腫瘍、平滑筋肉腫、横紋筋肉腫、大腸癌腫、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮
癌腫、基底細胞癌腫、腺癌、汗腺癌腫、皮脂腺癌腫、乳頭癌、乳頭腺癌、嚢胞腺癌、髄様
癌、気管支癌腫、腎細胞癌腫、肝臓癌、胆管(nile duct)癌、絨毛癌、精上皮腫、胎生期
癌、ウィルムス腫瘍、子宮頸癌、子宮癌、精巣癌、肺癌腫、小細胞肺癌腫、膀胱癌腫、上
皮性癌腫、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞
腫、聴神経腫、乏突起膠腫、神経鞘腫、髄膜腫、黒色腫、神経芽腫および網膜芽腫)を含
むが、これらに限定されない。リンパ組織増殖性障害も増殖性疾患と考慮される。
クロトー融合ポリペプチドを個体に投与することを提供する本明細書の方法または使用
は、癌を処置するために使用することができる。癌は、不適当に高レベルの細胞分裂、不
適当に低いレベルのアポトーシスまたはその両方により誘導されるか、または引き起こさ
れるすべての疾患を含む。癌の例は、白血病(例えば、急性白血病、急性リンパ性白血病
、急性骨髄性白血病、急性骨髄芽球性白血病、急性前骨髄球性白血病、急性骨髄単球性白
血病、急性単球性白血病、急性赤白血病、慢性白血病、慢性骨髄性白血病、慢性リンパ性
白血病)、真性赤血球増加症、リンパ腫(ホジキン病、非ホジキン病)、ワルデンシュト
レームマクログロブリン血症、重鎖病、および固形腫瘍、例えば、肉腫および癌腫(例え
ば、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨肉腫、脊索腫、血管肉腫、内皮肉腫(e
ndotheliosarcoma)、リンパ管肉腫、リンパ管内皮肉腫、滑液腫瘍、中皮腫、ユーイング
腫瘍、平滑筋肉腫、横紋筋肉腫、大腸癌腫、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮
癌腫、基底細胞癌腫、腺癌、汗腺癌腫、皮脂腺癌腫、乳頭癌、乳頭腺癌、嚢胞腺癌、髄様
癌、気管支癌腫、腎細胞癌腫、肝臓癌、胆管(nile duct)癌、絨毛癌、精上皮腫、胎生期
癌、ウィルムス腫瘍、子宮頸癌、子宮癌、精巣癌、肺癌腫、小細胞肺癌腫、膀胱癌腫、上
皮性癌腫、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽細胞
腫、聴神経腫、乏突起膠腫、神経鞘腫、髄膜腫、黒色腫、神経芽腫および網膜芽腫)を含
むが、これらに限定されない。リンパ組織増殖性障害も増殖性疾患と考慮される。
本明細書で引用するすべての特許、特許出願および刊行物は、出典明示によりそれらの
全体を本明細書に包含する。本明細書はその態様について具体的に示され、記載されてい
るが、本明細書の範囲から逸脱することなく、形態における種々の変化および詳細が添付
の特許請求の範囲内に包含されることは理解される得ることは当業者に明らかである。
全体を本明細書に包含する。本明細書はその態様について具体的に示され、記載されてい
るが、本明細書の範囲から逸脱することなく、形態における種々の変化および詳細が添付
の特許請求の範囲内に包含されることは理解される得ることは当業者に明らかである。
5.実施例
実施例1.クロトー融合ポリペプチドの発現および精製
クロトー融合ポリペプチドの発現
本明細書のポリペプチドは、HEK293T細胞をアルファクロトーの細胞外ドメイン
およびFGF23(R179Q)変異体を有する、クロトー融合ポリペプチドをコードす
る発現ベクターで一時的にトランスフェクトすることにより作った。発現したポリペプチ
ドを含む条件培地を、クロトー、FGF23およびクロトー−FGF23(R179Q)
融合タンパク質のそれぞれの発現プラスミドの一時的なトランスフェクションにより製造
した。トランスフェクションを、リポフェクタミン2000(Invitrogen, Cat # 11668-
019)を使用して6−ウェルプレートにて行った。トランスフェクションの5時間後、ト
ランスフェクション混合物を、3mlのDMEMプラス1%のFBSで置き換えた。条件
培地を、3mlのDMEMプラス1%のFBSの添加72時間後に回収した。種々の一時
的にトランスフェクトされたHEK293T細胞の条件培地のサンプルをSDS−ポリア
クリルアミドゲル電気泳動法(SDS−PAGE)により分離し、ウエスタンブロットに
より分析するか(図3A)、またはクマシーブルーで染色した(図3B)。
実施例1.クロトー融合ポリペプチドの発現および精製
クロトー融合ポリペプチドの発現
本明細書のポリペプチドは、HEK293T細胞をアルファクロトーの細胞外ドメイン
およびFGF23(R179Q)変異体を有する、クロトー融合ポリペプチドをコードす
る発現ベクターで一時的にトランスフェクトすることにより作った。発現したポリペプチ
ドを含む条件培地を、クロトー、FGF23およびクロトー−FGF23(R179Q)
融合タンパク質のそれぞれの発現プラスミドの一時的なトランスフェクションにより製造
した。トランスフェクションを、リポフェクタミン2000(Invitrogen, Cat # 11668-
019)を使用して6−ウェルプレートにて行った。トランスフェクションの5時間後、ト
ランスフェクション混合物を、3mlのDMEMプラス1%のFBSで置き換えた。条件
培地を、3mlのDMEMプラス1%のFBSの添加72時間後に回収した。種々の一時
的にトランスフェクトされたHEK293T細胞の条件培地のサンプルをSDS−ポリア
クリルアミドゲル電気泳動法(SDS−PAGE)により分離し、ウエスタンブロットに
より分析するか(図3A)、またはクマシーブルーで染色した(図3B)。
SDS−ポリアクリルアミドゲル電気泳動法を種々のサンプルで実施した(レーン1、
コントロール;レーン2、FGF23;レーン3、sクロトー;レーン4−6、sクロト
ー−FGF23)。クマシーブルー染色は、クロトー融合ポリペプチドをコードするベク
ターでトランスフェクトされていないサンプルを含むレーン1−3において存在しない、
>180kDaバンド(図3B、右側に矢印で示されている)の高い発現を示した。培地
に分泌されたクロトー融合ポリペプチドの質をウエスタンブロットにより評価した(図3
A)。抗−FGF23ラットモノクローナルIgG2A(R&D Systems, Cat# MAB26291)
を、ウエスタンブロットによるクロトー融合ポリペプチドを検出するための一次抗体とし
て使用した。クマシー染色ゲルにおいて観察されたさらなるバンドがクロトー融合ポリペ
プチドであることをウエスタンブロットで確認した。クロトー融合ポリペプチドがクロト
ー融合ポリペプチドの期待された分子量を有することをウエスタンブロットで確認した。
この分析はクロトー−FGF23(R179Q)融合タンパク質の発現を示す。
コントロール;レーン2、FGF23;レーン3、sクロトー;レーン4−6、sクロト
ー−FGF23)。クマシーブルー染色は、クロトー融合ポリペプチドをコードするベク
ターでトランスフェクトされていないサンプルを含むレーン1−3において存在しない、
>180kDaバンド(図3B、右側に矢印で示されている)の高い発現を示した。培地
に分泌されたクロトー融合ポリペプチドの質をウエスタンブロットにより評価した(図3
A)。抗−FGF23ラットモノクローナルIgG2A(R&D Systems, Cat# MAB26291)
を、ウエスタンブロットによるクロトー融合ポリペプチドを検出するための一次抗体とし
て使用した。クマシー染色ゲルにおいて観察されたさらなるバンドがクロトー融合ポリペ
プチドであることをウエスタンブロットで確認した。クロトー融合ポリペプチドがクロト
ー融合ポリペプチドの期待された分子量を有することをウエスタンブロットで確認した。
この分析はクロトー−FGF23(R179Q)融合タンパク質の発現を示す。
クロトー融合ポリペプチドの精製
本明細書のポリペプチドを、アルファクロトーの細胞外ドメインおよびFGF23 R
179Q変異体を有するクロトー融合ポリペプチドをコードする発現ベクターで一時的に
トランスフェクトされたHEK293T細胞の培養した条件培地から精製した。条件培地
を製造するために、sクロトー−FGF23−6×Hisをコードする発現ベクターを、
発現培地(Freestype 293発現培地(GIBCO, Cat #12338)中で106細胞
/mlで464mlのHEK293T細胞)で懸濁液中で培養されたHEK293細胞に
トランスフェクトした(18mlの2μg/mlのポリエチレンイミン(PEI)と混合
された18mlのOptiMEM 1(GIBCO, Cat #11058)中で500μgのDNA)。
トランスフェクション後、培養物を増殖させた(120時間、37℃ 5%CO2インキ
ュベーター中、125rpmで振とう)。インキュベーション終了後、条件培地を遠心分
離(1000rpmで5分)により回収した。次に条件培地をニッケル−アガロースカラ
ムに付した。sクロトー−FGF23−6×Hisがカラムにしっかりと結合し、50m
Mのイミダゾールで溶離した。次に得られた精製された物質をPBS中で透析し、イミダ
ゾールと取り除いた。精製されたsクロトー−FGF23−6×HisのサンプルをSD
S−PAGEにより分離し(レーン1、精製されたsクロトー−FGF23−6×His
;レーン2、分子量マーカー)、クマシーブルーでの染色により分析した(図3C)。精
製されたsクロトー−FGF23−6×Hisが期待された分子量を有することを染色さ
れたSDS−PAGEゲルで確認した。精製された物質で負荷されたレーンにおける完全
長sクロトー−FGF23−6×His以外のタンパク質に対応するバンドを検出しない
ということは、sクロトー−FGF23−6×Hisが精製されたことを示すものであっ
た。
本明細書のポリペプチドを、アルファクロトーの細胞外ドメインおよびFGF23 R
179Q変異体を有するクロトー融合ポリペプチドをコードする発現ベクターで一時的に
トランスフェクトされたHEK293T細胞の培養した条件培地から精製した。条件培地
を製造するために、sクロトー−FGF23−6×Hisをコードする発現ベクターを、
発現培地(Freestype 293発現培地(GIBCO, Cat #12338)中で106細胞
/mlで464mlのHEK293T細胞)で懸濁液中で培養されたHEK293細胞に
トランスフェクトした(18mlの2μg/mlのポリエチレンイミン(PEI)と混合
された18mlのOptiMEM 1(GIBCO, Cat #11058)中で500μgのDNA)。
トランスフェクション後、培養物を増殖させた(120時間、37℃ 5%CO2インキ
ュベーター中、125rpmで振とう)。インキュベーション終了後、条件培地を遠心分
離(1000rpmで5分)により回収した。次に条件培地をニッケル−アガロースカラ
ムに付した。sクロトー−FGF23−6×Hisがカラムにしっかりと結合し、50m
Mのイミダゾールで溶離した。次に得られた精製された物質をPBS中で透析し、イミダ
ゾールと取り除いた。精製されたsクロトー−FGF23−6×HisのサンプルをSD
S−PAGEにより分離し(レーン1、精製されたsクロトー−FGF23−6×His
;レーン2、分子量マーカー)、クマシーブルーでの染色により分析した(図3C)。精
製されたsクロトー−FGF23−6×Hisが期待された分子量を有することを染色さ
れたSDS−PAGEゲルで確認した。精製された物質で負荷されたレーンにおける完全
長sクロトー−FGF23−6×His以外のタンパク質に対応するバンドを検出しない
ということは、sクロトー−FGF23−6×Hisが精製されたことを示すものであっ
た。
実施例2.クロトー融合ポリペプチドの活性を評価するインビトロアッセイ
Egr−1−ルシフェラーゼ
発現したアルファクロトー融合ポリペプチドの生物学的活性を、Egr−1−ルシフェ
ラーゼレポーターアッセイで試験した。FGF23受容体へのクロトー融合ポリペプチド
の結合により、Egr−1プロモーターにより調節される、Egr−1の下流活性化およ
びルシフェラーゼレポーターの発現を引き起こした。Egr−1−ルシフェラーゼレポー
ター遺伝子はUrakawaら(Nature, 2006, Vol 444, 770-774)の報告に基づいて構築した。
48−ウェル ポリ−D−リシン プレートに播種したHEK293T細胞を、トランス
フェクション正規化レポーター遺伝子(ウミシイタケルシフェラーゼ)と一緒にEgr−
1−ルシフェラーゼレポーター遺伝子でトランスフェクトした。Egr−1ルシフェラー
ゼレポーター遺伝子のトランスフェクションの5時間後、トランスフェクション混合物を
3mlのDMEMプラス1%のFBSで置き換えた。条件培地を、3mlのDMEMプラ
ス1%のFBSの添加72時間後に回収した。5時間後、トランスフェクション混合物を
活性を試験するサンプルと置き換えた。最初の実験において、20μg/mlのヘパリン
(Sigma, Cat#H8537;2mg/mlの貯蔵物としてDMEMに溶解されている)の存在ま
たは非存在下で、50%の条件培地(クロトー、FGF23、クロトーおよびFGF23
、ならびにクロトー−FGF23(R179Q)融合タンパク質を含む)および1%のF
BSを有する50%のDMEMを、Egr−1−ルシフェラーゼレポーターアッセイにお
いて試験した(図4)。さらなる実験では、定義された量の精製されたポリペプチドを使
用した(図5Aおよび5B)。細胞を不活性な溶解緩衝剤(Promega, Cat #E194A)中で
20時間で溶解し、ルシフェラーゼ活性をDual−Gloルシフェラーゼアッセイ系(
Promega, Cat #E2940)を使用して決定した。
Egr−1−ルシフェラーゼ
発現したアルファクロトー融合ポリペプチドの生物学的活性を、Egr−1−ルシフェ
ラーゼレポーターアッセイで試験した。FGF23受容体へのクロトー融合ポリペプチド
の結合により、Egr−1プロモーターにより調節される、Egr−1の下流活性化およ
びルシフェラーゼレポーターの発現を引き起こした。Egr−1−ルシフェラーゼレポー
ター遺伝子はUrakawaら(Nature, 2006, Vol 444, 770-774)の報告に基づいて構築した。
48−ウェル ポリ−D−リシン プレートに播種したHEK293T細胞を、トランス
フェクション正規化レポーター遺伝子(ウミシイタケルシフェラーゼ)と一緒にEgr−
1−ルシフェラーゼレポーター遺伝子でトランスフェクトした。Egr−1ルシフェラー
ゼレポーター遺伝子のトランスフェクションの5時間後、トランスフェクション混合物を
3mlのDMEMプラス1%のFBSで置き換えた。条件培地を、3mlのDMEMプラ
ス1%のFBSの添加72時間後に回収した。5時間後、トランスフェクション混合物を
活性を試験するサンプルと置き換えた。最初の実験において、20μg/mlのヘパリン
(Sigma, Cat#H8537;2mg/mlの貯蔵物としてDMEMに溶解されている)の存在ま
たは非存在下で、50%の条件培地(クロトー、FGF23、クロトーおよびFGF23
、ならびにクロトー−FGF23(R179Q)融合タンパク質を含む)および1%のF
BSを有する50%のDMEMを、Egr−1−ルシフェラーゼレポーターアッセイにお
いて試験した(図4)。さらなる実験では、定義された量の精製されたポリペプチドを使
用した(図5Aおよび5B)。細胞を不活性な溶解緩衝剤(Promega, Cat #E194A)中で
20時間で溶解し、ルシフェラーゼ活性をDual−Gloルシフェラーゼアッセイ系(
Promega, Cat #E2940)を使用して決定した。
最初の実験において、クロトー融合ポリペプチド活性を非分画条件培地中で実施した。
Egr−1−ルシフェラーゼレポーター遺伝子を使用して、これらの実験ではルシフェラ
ーゼレポーターの発現における倍数変化を定量した(図4)。FGF23およびクロトー
タンパク質の細胞外ドメインの組合せを含む条件培地はEgr−1−ルシフェラーゼを活
性化させたが、FGF23のみを含む条件培地またはクロトーの細胞外ドメインのみを含
む条件培地ではEgr−1−ルシフェラーゼを活性化させなかった。融合タンパク質sク
ロトー−FGF23(R179Q)を含む条件培地は、FGF23またはクロトーのいず
れか単独を含む条件培地と対照的に、Egr−1−ルシフェラーゼレポーター遺伝子を活
性化した。これらの実験において、融合タンパク質sクロトー−FGF23(R179Q
)を含む条件培地は、FGF23およびクロトーの組合せを含む条件培地よりも有意に良
くEgr−1−ルシフェラーゼレポーター遺伝子を活性化した。ヘパリンの存在下で、融
合タンパク質sクロトー−FGF23(R179Q)を含む条件培地およびFGF23お
よびクロトーの組合せを含む条件培地による誘導ではわずかに高まった。表1は、Egr
−1−ルシフェラーゼレポーターアッセイにおける、条件培地における種々のFGF−ク
ロトー融合ポリペプチドの相対発現、および種々のFGF−クロトー融合ポリペプチドに
対応する非分画条件培地の相対活性を示す。
Egr−1−ルシフェラーゼレポーター遺伝子を使用して、これらの実験ではルシフェラ
ーゼレポーターの発現における倍数変化を定量した(図4)。FGF23およびクロトー
タンパク質の細胞外ドメインの組合せを含む条件培地はEgr−1−ルシフェラーゼを活
性化させたが、FGF23のみを含む条件培地またはクロトーの細胞外ドメインのみを含
む条件培地ではEgr−1−ルシフェラーゼを活性化させなかった。融合タンパク質sク
ロトー−FGF23(R179Q)を含む条件培地は、FGF23またはクロトーのいず
れか単独を含む条件培地と対照的に、Egr−1−ルシフェラーゼレポーター遺伝子を活
性化した。これらの実験において、融合タンパク質sクロトー−FGF23(R179Q
)を含む条件培地は、FGF23およびクロトーの組合せを含む条件培地よりも有意に良
くEgr−1−ルシフェラーゼレポーター遺伝子を活性化した。ヘパリンの存在下で、融
合タンパク質sクロトー−FGF23(R179Q)を含む条件培地およびFGF23お
よびクロトーの組合せを含む条件培地による誘導ではわずかに高まった。表1は、Egr
−1−ルシフェラーゼレポーターアッセイにおける、条件培地における種々のFGF−ク
ロトー融合ポリペプチドの相対発現、および種々のFGF−クロトー融合ポリペプチドに
対応する非分画条件培地の相対活性を示す。
Egr−1−ルシフェラーゼレポーターアッセイは、また、実施例1に記載されている
精製方法を使用して、条件培地から精製された定義された量のタンパク質を使用して行っ
た。発現したポリペプチドを含む非分画条件培地を使用する以前の結果と一致して、精製
されたFGF23およびsクロトーの組合せでの処理ではルシフェラーゼレポーター活性
が得られたが、精製されたFGF23単独での処理では得られなかった(図5A)。精製
されたFGF23およびsクロトーの組合せによるルシフェラーゼレポーター活性は、さ
らに精製されたsクロトーの用量に依存し、該効果はヘパリンの存在(20μg/ml)
により高められた。ルシフェラーゼ活性におけるsクロトー−FGF23−6×His融
合ポリペプチドの効果は、Egr−1−ルシフェラーゼレポーターアッセイにおいて、約
1.21nM程度の低濃度(1.2倍変化)および少なくとも最大約19.3nMまで(
2.4倍変化)で検出することができた(図5B)。ルシフェラーゼ活性におけるsクロ
トー−FGF23−6×His融合ポリペプチドの活性は、ヘパリン(20μg/ml)
の存在下で有意に高まった。ヘパリンの存在下で、ルシフェラーゼ活性におけるsクロト
ー−FGF23−6×His融合ポリペプチドの効果は、約0.6nM程度の低濃度(2
.0倍変化)で検出することができた。該結果は、精製されたsクロトー−FGF23−
6×Hisが用量依存的にEGR−1−lucレポーター遺伝子を誘導したこと、および
sクロトー−FGF23−6×Hisにおける処置を示した。
精製方法を使用して、条件培地から精製された定義された量のタンパク質を使用して行っ
た。発現したポリペプチドを含む非分画条件培地を使用する以前の結果と一致して、精製
されたFGF23およびsクロトーの組合せでの処理ではルシフェラーゼレポーター活性
が得られたが、精製されたFGF23単独での処理では得られなかった(図5A)。精製
されたFGF23およびsクロトーの組合せによるルシフェラーゼレポーター活性は、さ
らに精製されたsクロトーの用量に依存し、該効果はヘパリンの存在(20μg/ml)
により高められた。ルシフェラーゼ活性におけるsクロトー−FGF23−6×His融
合ポリペプチドの効果は、Egr−1−ルシフェラーゼレポーターアッセイにおいて、約
1.21nM程度の低濃度(1.2倍変化)および少なくとも最大約19.3nMまで(
2.4倍変化)で検出することができた(図5B)。ルシフェラーゼ活性におけるsクロ
トー−FGF23−6×His融合ポリペプチドの活性は、ヘパリン(20μg/ml)
の存在下で有意に高まった。ヘパリンの存在下で、ルシフェラーゼ活性におけるsクロト
ー−FGF23−6×His融合ポリペプチドの効果は、約0.6nM程度の低濃度(2
.0倍変化)で検出することができた。該結果は、精製されたsクロトー−FGF23−
6×Hisが用量依存的にEGR−1−lucレポーター遺伝子を誘導したこと、および
sクロトー−FGF23−6×Hisにおける処置を示した。
実施例3.筋肉細胞におけるクロトー融合ポリペプチドの効果を評価するインビトロアッ
セイ
発現したクロトー融合ポリペプチドの生物学的効果をC2C12筋芽細胞で試験した。
C2C12筋芽細胞をIGF−1、FGF2またはsクロトー−FGF23で処理するこ
とにより、筋管増殖およびシグナル伝達タンパク質のリン酸化を引き起こした。C2C1
2筋芽細胞を、6ウェルのポリ−D−リシンおよびフィブロネクチン被覆プレートにおい
て40,000細胞/ウェルの密度で、増殖培地中に(DMEMおよびF12、3対1)
、10%のFBS、1%のGlut、1%のP/S、1%のリノール酸、0.1%のIT
S:[インスリン(10mg/ml)、トランスフェリン(5.5mg/ml)およびセ
レン(5ng/ml)]播種した。筋芽細胞がコンフルエンスに達した後(3日間)、培
地を分化培地に変えた(2%のウマ血清、1%のGlut、1%のP/Sを有するDME
D)。
セイ
発現したクロトー融合ポリペプチドの生物学的効果をC2C12筋芽細胞で試験した。
C2C12筋芽細胞をIGF−1、FGF2またはsクロトー−FGF23で処理するこ
とにより、筋管増殖およびシグナル伝達タンパク質のリン酸化を引き起こした。C2C1
2筋芽細胞を、6ウェルのポリ−D−リシンおよびフィブロネクチン被覆プレートにおい
て40,000細胞/ウェルの密度で、増殖培地中に(DMEMおよびF12、3対1)
、10%のFBS、1%のGlut、1%のP/S、1%のリノール酸、0.1%のIT
S:[インスリン(10mg/ml)、トランスフェリン(5.5mg/ml)およびセ
レン(5ng/ml)]播種した。筋芽細胞がコンフルエンスに達した後(3日間)、培
地を分化培地に変えた(2%のウマ血清、1%のGlut、1%のP/Sを有するDME
D)。
筋管直径実験のために、コンフルエント3日後、培地を分化培地に変え、細胞を、分化
培地中でデキサメタゾン(100μM)の存在または非存在下で、IGF−1(10nM
)、FGF2(20ng/ml)またはsクロトー−FGF23(20nM)で24時間
処理した。処置終了後、細胞をグルタルアルデヒド(PBS中で5%)で固定し、多重蛍
光像を回収した。筋管直径をPipeline Pilotプログラムを使用して測定し
、肥大または萎縮を測定した。
培地中でデキサメタゾン(100μM)の存在または非存在下で、IGF−1(10nM
)、FGF2(20ng/ml)またはsクロトー−FGF23(20nM)で24時間
処理した。処置終了後、細胞をグルタルアルデヒド(PBS中で5%)で固定し、多重蛍
光像を回収した。筋管直径をPipeline Pilotプログラムを使用して測定し
、肥大または萎縮を測定した。
シグナル伝達タンパク質リン酸化実験のために、コンフルエント3日後、培地を分化培
地に変え、細胞を、FBSなしのDMEMで4時間飢餓にし、次にラパマイシン(40n
M)の存在または非存在下で、IGF−1(10nM)、FGF2(20ng/ml)ま
たはsクロトー−FGF23(20nM)で30分処理した。細胞をプロテアーゼおよび
ホスファターゼ阻害剤の存在下でRIPA緩衝剤中で溶解した。ウエスタンブロット分析
を行い、膜を図で示されるように異なる抗体で探査し、スキャンしたX線フィルムを現像
した。
地に変え、細胞を、FBSなしのDMEMで4時間飢餓にし、次にラパマイシン(40n
M)の存在または非存在下で、IGF−1(10nM)、FGF2(20ng/ml)ま
たはsクロトー−FGF23(20nM)で30分処理した。細胞をプロテアーゼおよび
ホスファターゼ阻害剤の存在下でRIPA緩衝剤中で溶解した。ウエスタンブロット分析
を行い、膜を図で示されるように異なる抗体で探査し、スキャンしたX線フィルムを現像
した。
この試験の結果は、sクロトー−FGF23が、コントロールと比較して筋管直径の増
加を引き起こし、IGF−1およびFGF2の結果と同様にC2C12筋管肥大を誘導す
ることを示した(図5A)。加えて、sクロトー−FGF23、IGF−1およびFGF
2での処理は、筋管直径の測定に基づいて、デキサメタゾンにより誘導された筋管萎縮を
部分的に逆転させることができた。デキサメタゾンの存在または非存在下で、筋管形態に
おける(筋管の厚さにより測定される)sクロトー−FGF23とFGF2間での差は、
観察されなかった。sクロトー−FGF23、IGF−1およびFGF2の栄養作用は統
計学的に有意であった。
加を引き起こし、IGF−1およびFGF2の結果と同様にC2C12筋管肥大を誘導す
ることを示した(図5A)。加えて、sクロトー−FGF23、IGF−1およびFGF
2での処理は、筋管直径の測定に基づいて、デキサメタゾンにより誘導された筋管萎縮を
部分的に逆転させることができた。デキサメタゾンの存在または非存在下で、筋管形態に
おける(筋管の厚さにより測定される)sクロトー−FGF23とFGF2間での差は、
観察されなかった。sクロトー−FGF23、IGF−1およびFGF2の栄養作用は統
計学的に有意であった。
C2C12筋管における効果と一致して、sクロトー−FGF23融合タンパク質シグ
ナル伝達はp70S6KおよびERKのリン酸化を誘導したが、C2C12筋管における
AKTまたはFオキソにおいて誘導しなかった(図5B)。シグナル伝達におけるsクロ
トー−FGF23の効果はFGF2と同様であったが、IGF−1と異なっていた。sク
ロトー−FGF23によるERKリン酸化の程度は、IGF−1またはFGF2未満であ
ることが観察された。sクロトー−FGF23によるp70S6Kのリン酸化は、ラパマ
イシン感受性であった。C2C12細胞に関する実験において、ヘパリンはシグナル伝達
を活性化するために必要ではなかった。これらの結果は、sクロトー−FGF23融合ポ
リペプチドがC2C12筋管においてシグナル伝達を活性化させたことを示す。
ナル伝達はp70S6KおよびERKのリン酸化を誘導したが、C2C12筋管における
AKTまたはFオキソにおいて誘導しなかった(図5B)。シグナル伝達におけるsクロ
トー−FGF23の効果はFGF2と同様であったが、IGF−1と異なっていた。sク
ロトー−FGF23によるERKリン酸化の程度は、IGF−1またはFGF2未満であ
ることが観察された。sクロトー−FGF23によるp70S6Kのリン酸化は、ラパマ
イシン感受性であった。C2C12細胞に関する実験において、ヘパリンはシグナル伝達
を活性化するために必要ではなかった。これらの結果は、sクロトー−FGF23融合ポ
リペプチドがC2C12筋管においてシグナル伝達を活性化させたことを示す。
実施例4.sクロトー、FGF23およびFcLALAを含む融合ポリペプチド
種々の融合ポリペプチドは、sクロトー、FGF23および抗体の修飾されたFcフラ
グメントを使用して構築される。これらの修飾されたFc分子は、改変された(減少した
)FcRnへの結合、したがって増加した血清半減期を有する。それらはまた、修飾され
たバイオアベイラビリティならびに改変された粘膜表面および体内の他の標的への輸送を
有する。本実施例において、FGF23およびsクロトーは、米国特許第7,217,7
98号およびHessellら 2007 Nature 449:101-104に記載されているFcLALAに融合
される。これらの融合ポリペプチドの種々の成分間の仲介は、Lodeら 1998 Proc. Natl.
Acad. Sci. USA 95: 2475-2480に記載されているリンカーである。これらの融合物は、構
築物、例えば、pcDNA3.1(Invitrogen, Carlsbad, CA)に挿入され、HEK29
3細胞において発現される。
種々の融合ポリペプチドは、sクロトー、FGF23および抗体の修飾されたFcフラ
グメントを使用して構築される。これらの修飾されたFc分子は、改変された(減少した
)FcRnへの結合、したがって増加した血清半減期を有する。それらはまた、修飾され
たバイオアベイラビリティならびに改変された粘膜表面および体内の他の標的への輸送を
有する。本実施例において、FGF23およびsクロトーは、米国特許第7,217,7
98号およびHessellら 2007 Nature 449:101-104に記載されているFcLALAに融合
される。これらの融合ポリペプチドの種々の成分間の仲介は、Lodeら 1998 Proc. Natl.
Acad. Sci. USA 95: 2475-2480に記載されているリンカーである。これらの融合物は、構
築物、例えば、pcDNA3.1(Invitrogen, Carlsbad, CA)に挿入され、HEK29
3細胞において発現される。
A.sクロトー−FGF23−FcLALA v1
sクロトー、リンカー、FGF23、別のリンカーおよびFcLALAを含む融合物を
構築する。この態様は、sクロトー−FGF23−FcLALA v1と称され、以下の
配列番号:46および47に示される。
sクロトー−FGF23−FcLALA v1のヌクレオチド配列(1として開始AT
G)は配列番号:46に示されている。
sクロトー−FGF23−FcLALA v1のアミノ酸配列は、配列番号:47とし
て以下に記載されている。
この配列において、融合物の種々の成分は以下のとおりである:
sクロトー:1−982;リンカー1:983−1001;FGF23:1002−12
28;リンカー2;1229−1233;FcLALA:1234−1459。
sクロトー、リンカー、FGF23、別のリンカーおよびFcLALAを含む融合物を
構築する。この態様は、sクロトー−FGF23−FcLALA v1と称され、以下の
配列番号:46および47に示される。
sクロトー−FGF23−FcLALA v1のヌクレオチド配列(1として開始AT
G)は配列番号:46に示されている。
sクロトー−FGF23−FcLALA v1のアミノ酸配列は、配列番号:47とし
て以下に記載されている。
この配列において、融合物の種々の成分は以下のとおりである:
sクロトー:1−982;リンカー1:983−1001;FGF23:1002−12
28;リンカー2;1229−1233;FcLALA:1234−1459。
B.sクロトー−FGF23−FcLALA v2
sクロトー、リンカー、FGF23、別のリンカーおよびFcLALAを含む融合物を
構築する。この態様は、sクロトー−FGF23−FcLALA v2と称され、以下の
配列番号:48および49に示される。
sクロトー−FGF23−FcLALA v2のヌクレオチド配列(1として開始AT
G)は配列番号:48に示されている。
sクロトー−FGF23−FcLALA v2のアミノ酸配列は、配列番号:49とし
て以下に記載されている。
この配列において、融合物の種々の成分は以下のとおりである:
sクロトー:(aaまたはアミノ酸)1−982;リンカー1:983−1001;FG
F23:1002−1228;リンカー2;1229−1233;FcLALA:123
4−1450。
sクロトー、リンカー、FGF23、別のリンカーおよびFcLALAを含む融合物を
構築する。この態様は、sクロトー−FGF23−FcLALA v2と称され、以下の
配列番号:48および49に示される。
sクロトー−FGF23−FcLALA v2のヌクレオチド配列(1として開始AT
G)は配列番号:48に示されている。
sクロトー−FGF23−FcLALA v2のアミノ酸配列は、配列番号:49とし
て以下に記載されている。
この配列において、融合物の種々の成分は以下のとおりである:
sクロトー:(aaまたはアミノ酸)1−982;リンカー1:983−1001;FG
F23:1002−1228;リンカー2;1229−1233;FcLALA:123
4−1450。
他の融合ポリペプチドならびにその変異体および誘導体を、本明細書に記載されている
、または当分野で知られているとおりに、種々の組合せにおいて、FGF、クロトー、修
飾されたFcフラグメントおよび(所望により)リンカー配列を組み合わせることにより
構築することができる。
、または当分野で知られているとおりに、種々の組合せにおいて、FGF、クロトー、修
飾されたFcフラグメントおよび(所望により)リンカー配列を組み合わせることにより
構築することができる。
実施例5.FGF23およびFcLALAを含む融合ポリペプチド
種々の融合ポリペプチドは、米国特許第7,217,798号に記載されているとおり
に、FGF23および抗体の修飾されたFcフラグメントを使用して構築される。これら
の修飾されたFc分子は、改変された(減少した)FcRnへの結合、したがって増加し
た血清半減期を有する。それらはまた、修飾されたバイオアベイラビリティならびに改変
された粘膜表面および体内の他の標的への輸送を有する。本実施例において、FGF23
は、FcLALAに融合される。これらの融合ポリペプチドの種々の成分間の仲介は、Lo
deら 1998 Proc. Natl. Acad. Sci. USA 95: 2475-2480に記載されているリンカーである
。これらの融合物は、例えば、pcDNA3.1(Invitrogen, Carlsbad, CA)に挿入さ
れ、HEK293細胞において発現される。
種々の融合ポリペプチドは、米国特許第7,217,798号に記載されているとおり
に、FGF23および抗体の修飾されたFcフラグメントを使用して構築される。これら
の修飾されたFc分子は、改変された(減少した)FcRnへの結合、したがって増加し
た血清半減期を有する。それらはまた、修飾されたバイオアベイラビリティならびに改変
された粘膜表面および体内の他の標的への輸送を有する。本実施例において、FGF23
は、FcLALAに融合される。これらの融合ポリペプチドの種々の成分間の仲介は、Lo
deら 1998 Proc. Natl. Acad. Sci. USA 95: 2475-2480に記載されているリンカーである
。これらの融合物は、例えば、pcDNA3.1(Invitrogen, Carlsbad, CA)に挿入さ
れ、HEK293細胞において発現される。
C.FGF23−FcLALA v1
FGF23、リンカーおよびFcLALAを含む融合物を構築する。この構築物は、F
GF23−FcLALA v1と称され、以下の配列番号:50および51に示される。
FGF23−FcLALA v1のヌクレオチド配列(1として開始ATG)は配列番
号:50に示されている。
FGF23(R179Q)−FcLALAv1のアミノ酸配列は、配列番号:51とし
て以下に記載されている。
この配列において、融合物の種々の成分は以下のとおりである:
FGF23:(aa)1−251;リンカー:252−256;FcLALA:257−
482。
FGF23、リンカーおよびFcLALAを含む融合物を構築する。この構築物は、F
GF23−FcLALA v1と称され、以下の配列番号:50および51に示される。
FGF23−FcLALA v1のヌクレオチド配列(1として開始ATG)は配列番
号:50に示されている。
FGF23(R179Q)−FcLALAv1のアミノ酸配列は、配列番号:51とし
て以下に記載されている。
この配列において、融合物の種々の成分は以下のとおりである:
FGF23:(aa)1−251;リンカー:252−256;FcLALA:257−
482。
D.FGF23−FcLALA v2
FGF23およびFcLALAを含むFGF23−FcLALA v2を含む融合物を
構築する。
FGF23−FcLALA v2のヌクレオチド配列(1として開始ATG)は配列番
号:52に示されている。
FGF23(R179Q)−FcLALAv2のアミノ酸配列は、配列番号:53とし
て以下に記載されている。
この配列において、融合物の種々の成分は以下のとおりである:
FGF23:1−251;リンカー:252−256;FcLALA:257−473。
FGF23およびFcLALAを含むFGF23−FcLALA v2を含む融合物を
構築する。
FGF23−FcLALA v2のヌクレオチド配列(1として開始ATG)は配列番
号:52に示されている。
FGF23(R179Q)−FcLALAv2のアミノ酸配列は、配列番号:53とし
て以下に記載されている。
この配列において、融合物の種々の成分は以下のとおりである:
FGF23:1−251;リンカー:252−256;FcLALA:257−473。
他の融合ポリペプチドを、本明細書に記載されている、または当分野で知られていると
おりに、種々の組合せにおいて、FGF配列、修飾されたFcフラグメントおよび(所望
により)リンカー、およびそれらの変異体および誘導体を組み合わせることにより構築す
ることができる。
おりに、種々の組合せにおいて、FGF配列、修飾されたFcフラグメントおよび(所望
により)リンカー、およびそれらの変異体および誘導体を組み合わせることにより構築す
ることができる。
E.sクロトー−FGF23(R179Q)−FcLALA融合タンパク質によるEgr
−1−lucレポーター遺伝子の活性化、FGF23(R179Q)−FcLALAタン
パク質によるEgr−1−lucレポーター遺伝子の活性化、およびFGF23(R17
9Q) 対 FGF23(R179Q)−FcLaLav2の薬物動態学プロフィールを
決定する。
−1−lucレポーター遺伝子の活性化、FGF23(R179Q)−FcLALAタン
パク質によるEgr−1−lucレポーター遺伝子の活性化、およびFGF23(R17
9Q) 対 FGF23(R179Q)−FcLaLav2の薬物動態学プロフィールを
決定する。
図7は、sクロトー−FGF23(R179Q)−FcLALA融合タンパク質による
Egr−1−lucレポーター遺伝子の活性化を示す。HEK293T細胞を、Egr−
1−lucレポーター遺伝子で一過性にトランスフェクトし、20μg/mlのヘパリン
の非存在または存在下で示されている馴化培地でインキュベートする。次に、ルシフェラ
ーゼ活性を18時間後に決定する。結果は、sクロトー−FGF23−FcLALA融合
タンパク質がレポーター遺伝子活性を誘導することを示す。これらの誘導は、ヘパリンの
存在において有意に増強される。sKF−Fcv1:sクロトー−FGF23−FcLA
LAv1;sKF−Fcv2:sクロトー−FGF23−FcLALAv2。
Egr−1−lucレポーター遺伝子の活性化を示す。HEK293T細胞を、Egr−
1−lucレポーター遺伝子で一過性にトランスフェクトし、20μg/mlのヘパリン
の非存在または存在下で示されている馴化培地でインキュベートする。次に、ルシフェラ
ーゼ活性を18時間後に決定する。結果は、sクロトー−FGF23−FcLALA融合
タンパク質がレポーター遺伝子活性を誘導することを示す。これらの誘導は、ヘパリンの
存在において有意に増強される。sKF−Fcv1:sクロトー−FGF23−FcLA
LAv1;sKF−Fcv2:sクロトー−FGF23−FcLALAv2。
図8は、FGF23(R179Q)−FcLALAタンパク質によるEgr−1−lu
cレポーター遺伝子の活性化を示す。HEK293T細胞を、クロトーの全長膜貫通形態
と共にEgr−1−lucレポーター遺伝子で一過性にトランスフェクトし、示されてい
る30%の馴化培地でインキュベートする。次に、ルシフェラーゼ活性を18時間後に決
定する。結果は、FGF23−FcLALA融合タンパク質がFGF23と同様の様式に
おいてレポーター遺伝子活性を誘導することを示す。
cレポーター遺伝子の活性化を示す。HEK293T細胞を、クロトーの全長膜貫通形態
と共にEgr−1−lucレポーター遺伝子で一過性にトランスフェクトし、示されてい
る30%の馴化培地でインキュベートする。次に、ルシフェラーゼ活性を18時間後に決
定する。結果は、FGF23−FcLALA融合タンパク質がFGF23と同様の様式に
おいてレポーター遺伝子活性を誘導することを示す。
図9は、FGF23(R179Q) 対 FGF23(R179Q)−FcLALAv
2の薬物動態学プロフィールを示す。グループあたり4匹のマウスに、FGF23(R1
79Q)−6×HisまたはFGF23(R179Q)−FcLALAv2を2mg/k
gで皮下注射する。示されている時間に、血清サンプルを回収し、ELISAによりFG
F23について分析する。血清中のFGF23(R179Q)−FcLALA濃度は、2
4時間時点で上昇を維持するが、FGF23(R179Q)−6×Hisは基底レベルに
戻る。結果は、FcLALAの添加で、FGF23(R179Q)のインビボ半減期が有
意に改善されることを示す。
2の薬物動態学プロフィールを示す。グループあたり4匹のマウスに、FGF23(R1
79Q)−6×HisまたはFGF23(R179Q)−FcLALAv2を2mg/k
gで皮下注射する。示されている時間に、血清サンプルを回収し、ELISAによりFG
F23について分析する。血清中のFGF23(R179Q)−FcLALA濃度は、2
4時間時点で上昇を維持するが、FGF23(R179Q)−6×Hisは基底レベルに
戻る。結果は、FcLALAの添加で、FGF23(R179Q)のインビボ半減期が有
意に改善されることを示す。
実施例6.デキサメタゾン誘導筋萎縮後の筋肉成長の増強におけるsクロトー−FGF2
3融合物のインビボ有効性
実験データは、sクロトー−FGF23の筋肉内注射は、デキサメタゾン誘導筋萎縮後
の筋肉量の成長を有意に増強することを示す。この実験において、配列番号:41に対応
するペプチドを使用する。
3融合物のインビボ有効性
実験データは、sクロトー−FGF23の筋肉内注射は、デキサメタゾン誘導筋萎縮後
の筋肉量の成長を有意に増強することを示す。この実験において、配列番号:41に対応
するペプチドを使用する。
図10は、腓腹筋−ヒラメ筋−足底筋(GSP)筋肉の絶対重量(A)および重量変化
パーセント(B)を示し、sクロトー−FGF23(KLOFGF)の筋肉内注射は、s
クロトー(sKLO)またはリン酸緩衝生理食塩水(PBS)の筋肉内注射と比較して、
デキサメタゾン(DEX)−誘導筋萎縮後の筋肉量の再成長を有意に増強することを示す
。
パーセント(B)を示し、sクロトー−FGF23(KLOFGF)の筋肉内注射は、s
クロトー(sKLO)またはリン酸緩衝生理食塩水(PBS)の筋肉内注射と比較して、
デキサメタゾン(DEX)−誘導筋萎縮後の筋肉量の再成長を有意に増強することを示す
。
80匹の15週齢のオスC57BL/6マウスを、それぞれ10匹のマウスで8つのグ
ループに体重においてランダム化する。2.4mg/kg/日で3週間、4つのグループ
にDEXなしの水を与え(W21d)、他の4つのグループにDEXありの飲料水を与え
る(D21d)。3週間後、DEX処置を停止し、1つのW21dおよび1つのD21d
グループを即座に殺し、DEX処置により誘導される筋萎縮の程度を確立する。残りの3
つのグループのW21dまたはD21dマウスは、右側の腓腹筋−ヒラメ筋−足底筋の筋
肉複合体に1日おきに、2×50μlのPBS、sクロトー−FGF23(KLOFGF
;1.6mg/ml)またはsクロトー(sKLO;1.6mg/ml)のいずれかを筋
肉内注射で与える別の14日間(R14d)中に回復することができる。マウスを最後の
筋肉内注射24時間後に殺し、筋肉体重を決定し、絶対重量(A)またはW21d+PB
Sグループと比較しての変化パーセントとして示す。
ループに体重においてランダム化する。2.4mg/kg/日で3週間、4つのグループ
にDEXなしの水を与え(W21d)、他の4つのグループにDEXありの飲料水を与え
る(D21d)。3週間後、DEX処置を停止し、1つのW21dおよび1つのD21d
グループを即座に殺し、DEX処置により誘導される筋萎縮の程度を確立する。残りの3
つのグループのW21dまたはD21dマウスは、右側の腓腹筋−ヒラメ筋−足底筋の筋
肉複合体に1日おきに、2×50μlのPBS、sクロトー−FGF23(KLOFGF
;1.6mg/ml)またはsクロトー(sKLO;1.6mg/ml)のいずれかを筋
肉内注射で与える別の14日間(R14d)中に回復することができる。マウスを最後の
筋肉内注射24時間後に殺し、筋肉体重を決定し、絶対重量(A)またはW21d+PB
Sグループと比較しての変化パーセントとして示す。
これらのデータは、デキサメタゾン誘導筋萎縮後の筋肉成長の増強におけるsクロトー
−FGF23融合物のインビボ有効性を示す。
−FGF23融合物のインビボ有効性を示す。
実施例7.凝集を減少させる、望ましくないプロテアーゼ誘導開裂を減少させる、および
生産を増加させる融合タンパク質のFGF23部分におけるさらなる変異
いくつかの変異を、sクロトー−FGF23およびFGF23−FcLaLa融合ポリ
ペプチドのFGF23部分内で試験する。これらは、Q156、C206およびC244
(数字はFGF23アミノ酸配列に基づく)を含む。実施例の個々の変異は、Q156A
、C206SおよびC244Sを含み、これらの部位のいずれかでの変異は、R179(
例えば、R179Q)での変異と組み合わせることができる。実施例の配列は、図2の配
列番号:54から68において提供される。
生産を増加させる融合タンパク質のFGF23部分におけるさらなる変異
いくつかの変異を、sクロトー−FGF23およびFGF23−FcLaLa融合ポリ
ペプチドのFGF23部分内で試験する。これらは、Q156、C206およびC244
(数字はFGF23アミノ酸配列に基づく)を含む。実施例の個々の変異は、Q156A
、C206SおよびC244Sを含み、これらの部位のいずれかでの変異は、R179(
例えば、R179Q)での変異と組み合わせることができる。実施例の配列は、図2の配
列番号:54から68において提供される。
C206およびC244は、二量化に関与することと考えられ、Q156は、プロテア
ーゼ感受性部位として本発明者らにより同定された部位である。他の任意のアミノ酸への
これらのアミノ酸の変異は、FGF23活性を妨害することなく、凝集を減少させること
、望ましくないプロテアーゼ誘導開裂を減少させること、および細胞からのタンパク質生
産を増加させることによりタンパク質の質を増強する。これは、これらの3つの位置がヒ
ト、アカゲザル、ウシ、マウスおよびラットにおいて見出されるFGF23タンパク質に
おいて保存されているため、予期し得ない結果である。この保存は、太字で下線のQ15
6、C206およびC244にて、配列番号:69、70、71、72および73間の比
較において以下に示される。
ーゼ感受性部位として本発明者らにより同定された部位である。他の任意のアミノ酸への
これらのアミノ酸の変異は、FGF23活性を妨害することなく、凝集を減少させること
、望ましくないプロテアーゼ誘導開裂を減少させること、および細胞からのタンパク質生
産を増加させることによりタンパク質の質を増強する。これは、これらの3つの位置がヒ
ト、アカゲザル、ウシ、マウスおよびラットにおいて見出されるFGF23タンパク質に
おいて保存されているため、予期し得ない結果である。この保存は、太字で下線のQ15
6、C206およびC244にて、配列番号:69、70、71、72および73間の比
較において以下に示される。
これらの3つの変異がFGF23活性を妨害しないという事実は、図11に示される。
この図は、FGF23(R179Q)−FcLALAならびにQ156A、C206S、
C244SおよびC206S/C244S変異体によるEgr−1−lucレポーター遺
伝子の活性化を示す。
この図は、FGF23(R179Q)−FcLALAならびにQ156A、C206S、
C244SおよびC206S/C244S変異体によるEgr−1−lucレポーター遺
伝子の活性化を示す。
HEK293T細胞を、HEK293T細胞を、クロトーの全長膜貫通形態と共にEG
R−1−lucレポーター遺伝子で一過性にトランスフェクトし、FGF23−FcLa
La変異体を示す。次に、ルシフェラーゼ活性を18時間後に決定する。結果は、C20
6S、C244S、C206S/C244S(3つの独立したクローン)およびQ156
A(3つの独立したクローン)変異体が、EGR−1−Lucレポーター遺伝子活性の活
性化において、FGF23−FcLALA融合タンパク質と同等に有効であることを示す
。
R−1−lucレポーター遺伝子で一過性にトランスフェクトし、FGF23−FcLa
La変異体を示す。次に、ルシフェラーゼ活性を18時間後に決定する。結果は、C20
6S、C244S、C206S/C244S(3つの独立したクローン)およびQ156
A(3つの独立したクローン)変異体が、EGR−1−Lucレポーター遺伝子活性の活
性化において、FGF23−FcLALA融合タンパク質と同等に有効であることを示す
。
C244およびC206の変異がFGF23の二量化および凝集を変化させることを示
すデータは、図12に示される。この図は、FGF23(R179Q)−FcLaLaの
WT、Q156A、C206S、C244SおよびC206S/C244S変異体のタン
パク質の質を示す。示されるFGF23−FcLaLa発現ベクターで一過性にトランス
フェクトされたHEK293T細胞由来の馴化培地を、FGF23抗体を使用してウェス
タンブロットにより分析する。結果は、C206S/C244S変異がタンパク質二量化
を妨害し、Q156A変異が減少したタンパク質分解フラグメントを有することを示す。
すデータは、図12に示される。この図は、FGF23(R179Q)−FcLaLaの
WT、Q156A、C206S、C244SおよびC206S/C244S変異体のタン
パク質の質を示す。示されるFGF23−FcLaLa発現ベクターで一過性にトランス
フェクトされたHEK293T細胞由来の馴化培地を、FGF23抗体を使用してウェス
タンブロットにより分析する。結果は、C206S/C244S変異がタンパク質二量化
を妨害し、Q156A変異が減少したタンパク質分解フラグメントを有することを示す。
したがって、驚くべきことに、これらのQ156、C206およびC244残基が種間
で保存されているにもかかわらず、それらは、FGF23活性を減少させることなく変異
させることができ、凝集および開裂を減少させること、および生産を改善することにより
、タンパク質の質を増強することができる。
で保存されているにもかかわらず、それらは、FGF23活性を減少させることなく変異
させることができ、凝集および開裂を減少させること、および生産を改善することにより
、タンパク質の質を増強することができる。
他に定義がない限り、本明細書において使用されている技術的および科学的用語は、本
明細書が属する分野でよく知っている専門家により通常理解されるのと同じ意味を有する
。
明細書が属する分野でよく知っている専門家により通常理解されるのと同じ意味を有する
。
他に示されていない限り、具体的に詳細に記載されていないすべての方法、工程、技術
および操作は、当業者に明らかであるため、それ自体既知の方法で行うことができるか、
または行われている。例えば、標準ハンドブックおよび本明細書に記載されている一般的
な背景技術および本明細書で引用されているさらなる文献も参照されたい。
および操作は、当業者に明らかであるため、それ自体既知の方法で行うことができるか、
または行われている。例えば、標準ハンドブックおよび本明細書に記載されている一般的
な背景技術および本明細書で引用されているさらなる文献も参照されたい。
特許請求の範囲は、非限定的であり、以下で提供される。
特定の態様および特許請求の範囲は、本明細書に詳細に記載されているが、これは、説
明の目的のためのほんの一例としてであり、特許請求の範囲、または、あらゆる対応する
さらなる出願の特許請求の範囲の対象の範囲に対して限定することを意図しない。特に、
種々の置換、変化および修飾が、特許請求の範囲により定義されている記載の精神および
範囲から逸脱することなく、本記載から作られ得ると本発明者らは考える。核酸出発物質
、興味あるクローンの選択は、本明細書に記載されている態様の知識を有する当業者に対
して日常的な事柄であると考えられる。他の局面、有利なものおよび修飾は、特許請求の
範囲内であると考える。後に出願された対応する出願における特許請求の範囲の補正は、
種々の国の特許法による限定のためであって、特許請求の範囲の対象を放棄すると解釈さ
れるべきではない。
特定の態様および特許請求の範囲は、本明細書に詳細に記載されているが、これは、説
明の目的のためのほんの一例としてであり、特許請求の範囲、または、あらゆる対応する
さらなる出願の特許請求の範囲の対象の範囲に対して限定することを意図しない。特に、
種々の置換、変化および修飾が、特許請求の範囲により定義されている記載の精神および
範囲から逸脱することなく、本記載から作られ得ると本発明者らは考える。核酸出発物質
、興味あるクローンの選択は、本明細書に記載されている態様の知識を有する当業者に対
して日常的な事柄であると考えられる。他の局面、有利なものおよび修飾は、特許請求の
範囲内であると考える。後に出願された対応する出願における特許請求の範囲の補正は、
種々の国の特許法による限定のためであって、特許請求の範囲の対象を放棄すると解釈さ
れるべきではない。
[1]
(a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしくは誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、またはクロトー(Klotho)タンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所望により(c)リンカーを含む、融合ポリペプチド。
[2]
(a)のポリペプチドが、(b)のポリペプチドのN−末端に作動可能に連結している、[1]に記載の融合ポリペプチド。
[3]
(b)のポリペプチドが、(a)のポリペプチドのN−末端に作動可能に連結している、[1]に記載の融合ポリペプチド。
[4]
(a)のポリペプチドおよび(b)のポリペプチドが、ポリペプチドリンカーにより連結している、[1]に記載の融合ポリペプチド。
[5]
ポリペプチドリンカーが、配列番号:11、配列番号:12、配列番号:13、配列番号:14、配列番号:15、配列番号:16、配列番号:17および配列番号:18からなる群から選択されるアミノ酸配列を含む、[4]に記載の融合ポリペプチド。
[6]
ポリペプチドリンカーが、配列番号:12、配列番号:13、配列番号:14、配列番号:15、配列番号:16、配列番号:17および配列番号:18からなる群から選択されるアミノ酸配列の少なくとも1、最大約30の繰り返しを含む、[4]に記載の融合ポリペプチド。
[7]
(a)のポリペプチドが、該ポリペプチドリンカーのN−末端にペプチド結合により連結しており、(b)のポリペプチドが、該ポリペプチドリンカーのC−末端にペプチド結合により連結している、[4]に記載の融合ポリペプチド。
[8]
(a)のポリペプチドが、該ポリペプチドリンカーのC−末端にペプチド結合により連結しており、(b)のポリペプチドが、該ポリペプチドリンカーのN−末端にペプチド結合により連結している、[4]に記載の融合ポリペプチド。
[9]
クロトータンパク質の細胞外サブドメインが、KL−D1ドメインまたはKL−D2ドメインである、[1]に記載の融合ポリペプチド。
[10]
(a)のポリペプチドが、クロトータンパク質の少なくとも2つの細胞外サブドメインを含む、[1]に記載の融合ポリペプチド。
[11]
クロトータンパク質の少なくとも2つの細胞外サブドメインが、タンデムリピートにおける少なくとも2つのKL−D1ドメインである、[10]に記載の融合ポリペプチド。
[12]
クロトータンパク質の少なくとも2つの細胞外サブドメインが、タンデムリピートにおける少なくとも2つのKL−D2ドメインである、[10]に記載の融合ポリペプチド。
[13]
クロトータンパク質の少なくとも2つの細胞外サブドメインが、KL−D1ドメインおよびKL−D2ドメインを含む、[10]に記載の融合ポリペプチド。
[14]
(a)のポリペプチドが、クロトータンパク質の細胞外ドメインである、[1]に記載の融合ポリペプチド
[15]
シグナルペプチドをさらに含む、[1]に記載の融合ポリペプチド。
[16]
シグナルペプチドがクロトーシグナルペプチドである、[15]に記載の融合ポリペプチド。
[17]
シグナルペプチドがIgGシグナルペプチドである、[15]に記載の融合ポリペプチド。
[18]
線維芽細胞増殖因子受容体に特異的に結合する、[1]に記載の融合ポリペプチド。
[19]
クロトータンパク質がアルファ−クロトーである、[1]に記載の融合ポリペプチド。
[20]
クロトータンパク質がベータ−クロトーである、[1]に記載の融合ポリペプチド。
[21]
線維芽細胞増殖因子が、線維芽細胞増殖因子−23(FGF23)または線維芽細胞増殖因子−23変異体(R179Q)である、[19]に記載の融合ポリペプチド。
[22]
線維芽細胞増殖因子が、線維芽細胞増殖因子−19または線維芽細胞増殖因子−21である、[20]に記載の融合ポリペプチド。
[23]
配列番号:54、55、56、57、58、59、60、61、62、63、64、65、66、67または68のアミノ酸配列と95%以上同一であるアミノ酸配列を含む、[1]に記載の融合ポリペプチド。
[24]
配列番号:58または配列番号:68のアミノ酸配列を有する、[1]に記載の融合ポリペプチド。
[25]
FcLALAを含む、[1]に記載の融合ポリペプチド。
[26]
[1]に記載の融合ポリペプチドおよび薬学的に許容される担体を含む医薬組成物。
[27]
[1]に記載の融合ポリペプチドをコードする配列を含む核酸。
[28]
[27]に記載の核酸を含む宿主細胞。
[29]
[27]に記載の核酸を含むベクター。
[30]
(a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしくは誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必要とする個体に投与することを含む、個体における加齢関連状態を処置または予防するための方法。
[31]
加齢関連状態が、サルコペニア、皮膚萎縮、筋肉疲労、脳萎縮、アテローム性動脈硬化症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症、免疫不全、高血圧、認知症、ハンチントン病、アルツハイマー病、白内障、加齢黄斑変性症、前立腺癌、卒中、期待寿命の低下(diminished life expectancy)、記憶障害、しわ、腎機能障害および加齢性難聴からなる群から選択される、[30]に記載の方法。
[32]
クロトータンパク質がアルファクロトータンパク質である、[30]に記載の方法。
[33]
加齢関連状態が筋肉疲労であり、クロトータンパク質がアルファクロトータンパク質であり、線維芽細胞増殖因子が線維芽細胞増殖因子23である、[31]に記載の方法。
[34]
(a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしくは誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必要とする個体に投与することを含む、個体における代謝障害を処置または予防するための方法。
[35]
代謝障害が、II型糖尿病、メタボリック・シンドローム、高血糖および肥満からなる群から選択される、[34]に記載の方法。
[36]
融合ポリペプチドが、(a)ベータ−クロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチド、および(b)線維芽細胞増殖因子21を含むポリペプチドを含む、[34]に記載の方法。
[37]
(a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしくは誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必要とする個体に投与することを含む、個体における高リン血症または石灰沈着症を処置または予防するための方法。
[38]
融合ポリペプチドが、(a)アルファクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチド、および(b)線維芽細胞増殖因子23を含むポリペプチドを含む、[37]に記載の方法。
[39]
(a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしくは誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必要とする個体に投与することを含む、個体における慢性腎臓疾患または慢性腎不全を処置または予防するための方法。
[40]
クロトータンパク質がアルファクロトータンパク質である、[39]に記載の方法。
[41]
(a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしくは誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必要とする個体に投与することを含む、個体における癌を処置または予防するための方法。[42]
癌が乳癌である、[41]に記載の方法。
[43]
クロトータンパク質がアルファクロトータンパク質である、[41]に記載の方法。
[44]
クロトータンパク質がヒトクロトータンパク質である、[1]に記載の融合ポリペプチド。
[45]
筋萎縮の処置または予防における使用のための、[1]に記載の融合ポリペプチド。
[46]
配列番号:47または配列番号:49の可溶性クロトー融合タンパク質を含む治療有効用量の医薬組成物を必要とする個体に投与することを含む(本質的にからなる、またはからなる)、筋萎縮を処置または予防する方法。
[47]
(a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしくは誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC244の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラグメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所望により(c)リンカーを含む、治療有効用量の医薬組成物を必要とする個体に投与することを含む(本質的にからなる、またはからなる)、筋萎縮を処置または予防する方法。
Claims (47)
- (a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしく
は誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC24
4の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−
受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラ
グメント、またはクロトー(Klotho)タンパク質の少なくとも1つの細胞外サブドメインを
含むポリペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、お
よび、所望により(c)リンカーを含む、融合ポリペプチド。 - (a)のポリペプチドが、(b)のポリペプチドのN−末端に作動可能に連結している
、請求項1に記載の融合ポリペプチド。 - (b)のポリペプチドが、(a)のポリペプチドのN−末端に作動可能に連結している
、請求項1に記載の融合ポリペプチド。 - (a)のポリペプチドおよび(b)のポリペプチドが、ポリペプチドリンカーにより連
結している、請求項1に記載の融合ポリペプチド。 - ポリペプチドリンカーが、配列番号:11、配列番号:12、配列番号:13、配列番
号:14、配列番号:15、配列番号:16、配列番号:17および配列番号:18から
なる群から選択されるアミノ酸配列を含む、請求項4に記載の融合ポリペプチド。 - ポリペプチドリンカーが、配列番号:12、配列番号:13、配列番号:14、配列番
号:15、配列番号:16、配列番号:17および配列番号:18からなる群から選択さ
れるアミノ酸配列の少なくとも1、最大約30の繰り返しを含む、請求項4に記載の融合
ポリペプチド。 - (a)のポリペプチドが、該ポリペプチドリンカーのN−末端にペプチド結合により連
結しており、(b)のポリペプチドが、該ポリペプチドリンカーのC−末端にペプチド結
合により連結している、請求項4に記載の融合ポリペプチド。 - (a)のポリペプチドが、該ポリペプチドリンカーのC−末端にペプチド結合により連
結しており、(b)のポリペプチドが、該ポリペプチドリンカーのN−末端にペプチド結
合により連結している、請求項4に記載の融合ポリペプチド。 - クロトータンパク質の細胞外サブドメインが、KL−D1ドメインまたはKL−D2ド
メインである、請求項1に記載の融合ポリペプチド。 - (a)のポリペプチドが、クロトータンパク質の少なくとも2つの細胞外サブドメイン
を含む、請求項1に記載の融合ポリペプチド。 - クロトータンパク質の少なくとも2つの細胞外サブドメインが、タンデムリピートにお
ける少なくとも2つのKL−D1ドメインである、請求項10に記載の融合ポリペプチド
。 - クロトータンパク質の少なくとも2つの細胞外サブドメインが、タンデムリピートにお
ける少なくとも2つのKL−D2ドメインである、請求項10に記載の融合ポリペプチド
。 - クロトータンパク質の少なくとも2つの細胞外サブドメインが、KL−D1ドメインお
よびKL−D2ドメインを含む、請求項10に記載の融合ポリペプチド。 - (a)のポリペプチドが、クロトータンパク質の細胞外ドメインである、請求項1に記
載の融合ポリペプチド - シグナルペプチドをさらに含む、請求項1に記載の融合ポリペプチド。
- シグナルペプチドがクロトーシグナルペプチドである、請求項15に記載の融合ポリペ
プチド。 - シグナルペプチドがIgGシグナルペプチドである、請求項15に記載の融合ポリペプ
チド。 - 線維芽細胞増殖因子受容体に特異的に結合する、請求項1に記載の融合ポリペプチド。
- クロトータンパク質がアルファ−クロトーである、請求項1に記載の融合ポリペプチド
。 - クロトータンパク質がベータ−クロトーである、請求項1に記載の融合ポリペプチド。
- 線維芽細胞増殖因子が、線維芽細胞増殖因子−23(FGF23)または線維芽細胞増
殖因子−23変異体(R179Q)である、請求項19に記載の融合ポリペプチド。 - 線維芽細胞増殖因子が、線維芽細胞増殖因子−19または線維芽細胞増殖因子−21で
ある、請求項20に記載の融合ポリペプチド。 - 配列番号:54、55、56、57、58、59、60、61、62、63、64、6
5、66、67または68のアミノ酸配列と95%以上同一であるアミノ酸配列を含む、
請求項1に記載の融合ポリペプチド。 - 配列番号:58または配列番号:68のアミノ酸配列を有する、請求項1に記載の融合
ポリペプチド。 - FcLALAを含む、請求項1に記載の融合ポリペプチド。
- 請求項1に記載の融合ポリペプチドおよび薬学的に許容される担体を含む医薬組成物。
- 請求項1に記載の融合ポリペプチドをコードする配列を含む核酸。
- 請求項27に記載の核酸を含む宿主細胞。
- 請求項27に記載の核酸を含むベクター。
- (a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしく
は誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC24
4の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−
受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラ
グメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリ
ペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所
望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必
要とする個体に投与することを含む、個体における加齢関連状態を処置または予防するた
めの方法。 - 加齢関連状態が、サルコペニア、皮膚萎縮、筋肉疲労、脳萎縮、アテローム性動脈硬化
症、動脈硬化症、肺気腫、骨粗鬆症、骨関節症、免疫不全、高血圧、認知症、ハンチント
ン病、アルツハイマー病、白内障、加齢黄斑変性症、前立腺癌、卒中、期待寿命の低下(d
iminished life expectancy)、記憶障害、しわ、腎機能障害および加齢性難聴からなる群
から選択される、請求項30に記載の方法。 - クロトータンパク質がアルファクロトータンパク質である、請求項30に記載の方法。
- 加齢関連状態が筋肉疲労であり、クロトータンパク質がアルファクロトータンパク質で
あり、線維芽細胞増殖因子が線維芽細胞増殖因子23である、請求項31に記載の方法。 - (a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしく
は誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC24
4の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−
受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラ
グメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリ
ペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所
望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必
要とする個体に投与することを含む、個体における代謝障害を処置または予防するための
方法。 - 代謝障害が、II型糖尿病、メタボリック・シンドローム、高血糖および肥満からなる
群から選択される、請求項34に記載の方法。 - 融合ポリペプチドが、(a)ベータ−クロトータンパク質の少なくとも1つの細胞外サ
ブドメインを含むポリペプチド、および(b)線維芽細胞増殖因子21を含むポリペプチ
ドを含む、請求項34に記載の方法。 - (a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしく
は誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC24
4の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−
受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラ
グメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリ
ペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所
望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必
要とする個体に投与することを含む、個体における高リン血症または石灰沈着症を処置ま
たは予防するための方法。 - 融合ポリペプチドが、(a)アルファクロトータンパク質の少なくとも1つの細胞外サ
ブドメインを含むポリペプチド、および(b)線維芽細胞増殖因子23を含むポリペプチ
ドを含む、請求項37に記載の方法。 - (a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしく
は誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC24
4の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−
受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラ
グメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリ
ペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所
望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必
要とする個体に投与することを含む、個体における慢性腎臓疾患または慢性腎不全を処置
または予防するための方法。 - クロトータンパク質がアルファクロトータンパク質である、請求項39に記載の方法。
- (a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしく
は誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC24
4の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−
受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラ
グメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリ
ペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所
望により(c)リンカーを含む、融合ポリペプチドを含む治療有効用量の医薬組成物を必
要とする個体に投与することを含む、個体における癌を処置または予防するための方法。 - 癌が乳癌である、請求項41に記載の方法。
- クロトータンパク質がアルファクロトータンパク質である、請求項41に記載の方法。
- クロトータンパク質がヒトクロトータンパク質である、請求項1に記載の融合ポリペプ
チド。 - 筋萎縮の処置または予防における使用のための、請求項1に記載の融合ポリペプチド。
- 配列番号:47または配列番号:49の可溶性クロトー融合タンパク質を含む治療有効
用量の医薬組成物を必要とする個体に投与することを含む(本質的にからなる、またはか
らなる)、筋萎縮を処置または予防する方法。 - (a)線維芽細胞増殖因子23(FGF23)またはその機能的に活性な変異体もしく
は誘導体を含むポリペプチドであって、FGF23が、Q156、C206およびC24
4の1つ以上の位置で変異を有するポリペプチド、および(b)減少したFc−ガンマ−
受容体に対する親和性および/もしくは増加した血清半減期を有する修飾されたFcフラ
グメント、またはクロトータンパク質の少なくとも1つの細胞外サブドメインを含むポリ
ペプチドのいずれか、またはそれらの機能的に活性な変異体もしくは誘導体、および、所
望により(c)リンカーを含む、治療有効用量の医薬組成物を必要とする個体に投与する
ことを含む(本質的にからなる、またはからなる)、筋萎縮を処置または予防する方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/696,693 | 2010-01-29 | ||
| US12/696,693 US8420088B2 (en) | 2008-01-28 | 2010-01-29 | Methods and compositions using FGF23 fusion polypeptides |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012550437A Division JP5964243B2 (ja) | 2010-01-29 | 2011-01-27 | Fgf23融合ポリペプチドを使用する方法および組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016190847A true JP2016190847A (ja) | 2016-11-10 |
| JP2016190847A5 JP2016190847A5 (ja) | 2017-01-19 |
Family
ID=43828141
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012550437A Expired - Fee Related JP5964243B2 (ja) | 2010-01-29 | 2011-01-27 | Fgf23融合ポリペプチドを使用する方法および組成物 |
| JP2016087432A Pending JP2016190847A (ja) | 2010-01-29 | 2016-04-25 | Fgf23融合ポリペプチドを使用する方法および組成物 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012550437A Expired - Fee Related JP5964243B2 (ja) | 2010-01-29 | 2011-01-27 | Fgf23融合ポリペプチドを使用する方法および組成物 |
Country Status (16)
| Country | Link |
|---|---|
| US (3) | US8420088B2 (ja) |
| EP (2) | EP3124612A1 (ja) |
| JP (2) | JP5964243B2 (ja) |
| KR (1) | KR20130032296A (ja) |
| CN (3) | CN103204941B (ja) |
| AR (1) | AR080043A1 (ja) |
| AU (1) | AU2011209380B2 (ja) |
| CA (1) | CA2787285A1 (ja) |
| EA (1) | EA201201047A1 (ja) |
| ES (1) | ES2605302T3 (ja) |
| MX (1) | MX336391B (ja) |
| PL (1) | PL2529016T3 (ja) |
| PT (1) | PT2529016T (ja) |
| TW (2) | TWI569805B (ja) |
| UY (1) | UY33204A (ja) |
| WO (1) | WO2011092234A1 (ja) |
Families Citing this family (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW200936156A (en) | 2008-01-28 | 2009-09-01 | Novartis Ag | Methods and compositions using Klotho-FGF fusion polypeptides |
| US8420088B2 (en) | 2008-01-28 | 2013-04-16 | Novartis Ag | Methods and compositions using FGF23 fusion polypeptides |
| ES2748038T3 (es) | 2011-07-01 | 2020-03-12 | Ngm Biopharmaceuticals Inc | Composiciones, usos y métodos para el tratamiento de trastornos y enfermedades metabólicos |
| US9290557B2 (en) | 2012-11-28 | 2016-03-22 | Ngm Biopharmaceuticals, Inc. | Compositions comprising variants and fusions of FGF19 polypeptides |
| EP2925775B1 (en) | 2012-11-28 | 2020-09-16 | NGM Biopharmaceuticals, Inc. | Compositions and methods for treatment of metabolic disorders and diseases |
| CN102961739A (zh) * | 2012-12-12 | 2013-03-13 | 黄曙 | Klotho蛋白的用途 |
| US9273107B2 (en) | 2012-12-27 | 2016-03-01 | Ngm Biopharmaceuticals, Inc. | Uses and methods for modulating bile acid homeostasis and treatment of bile acid disorders and diseases |
| EP2938740B1 (en) | 2012-12-27 | 2022-04-20 | NGM Biopharmaceuticals, Inc. | Chimeric fgf19 peptides for use in treating bile acid disorders |
| WO2014152993A1 (en) * | 2013-03-14 | 2014-09-25 | The Board Of Regents Of The University Of Oklahoma | Use of klotho nucleic acids or proteins for treatment of diabetes and diabetes-related conditions |
| KR101492710B1 (ko) * | 2013-04-03 | 2015-02-13 | 중앙대학교 산학협력단 | Fgf23 유전자를 이용한 전립선암 진단용 마커 및 이를 이용한 전립선암 예측 및 진단 방법 |
| ES2714127T3 (es) | 2013-10-24 | 2019-05-27 | Tokyo Metropolitan Geriatric Hospital And Inst Of Gerontology | Células madre musculares o mioblastos, procedimiento de cribado de sustancias que participan en la conversión metabólica usando las mismas, y composición farmacéutica que comprende la sustancia obtenida de dicho procedimiento del cribado |
| KR102178945B1 (ko) | 2013-10-28 | 2020-11-13 | 엔지엠 바이오파마슈티컬스, 아이엔씨. | 암 모델 및 관련 방법 |
| US20150140036A1 (en) | 2013-11-13 | 2015-05-21 | Novartis Institutes For Biomedical Research, Inc. | Low, immune enhancing, dose mtor inhibitors and uses thereof |
| PE20170256A1 (es) | 2014-01-24 | 2017-04-22 | Ngm Biopharmaceuticals Inc | Proteinas de union y sus metodos de uso |
| JP6370577B2 (ja) * | 2014-03-26 | 2018-08-08 | 国立大学法人京都工芸繊維大学 | 抗老化物質のスクリーニング方法 |
| US10398758B2 (en) | 2014-05-28 | 2019-09-03 | Ngm Biopharmaceuticals, Inc. | Compositions comprising variants of FGF19 polypeptides and uses thereof for the treatment of hyperglycemic conditions |
| WO2015195509A2 (en) | 2014-06-16 | 2015-12-23 | Ngm Biopharmaceuticals, Inc. | Methods and uses for modulating bile acid homeostasis and treatment of bile acid disorders and diseases |
| US10588980B2 (en) | 2014-06-23 | 2020-03-17 | Novartis Ag | Fatty acids and their use in conjugation to biomolecules |
| IL251834B2 (en) | 2014-10-23 | 2023-09-01 | Ngm Biopharmaceuticals Inc | Pharmaceutical compositions containing peptide variants and methods of using them |
| US10434144B2 (en) | 2014-11-07 | 2019-10-08 | Ngm Biopharmaceuticals, Inc. | Methods for treatment of bile acid-related disorders and prediction of clinical sensitivity to treatment of bile acid-related disorders |
| KR20170084332A (ko) * | 2014-12-04 | 2017-07-19 | 노파르티스 아게 | Klotho 변이체 폴리펩티드를 사용하는 방법 및 조성물 |
| AU2016215080B2 (en) | 2015-02-06 | 2020-12-24 | The Regents Of The University Of California | Methods and compositions for improved cognition |
| WO2017019957A2 (en) | 2015-07-29 | 2017-02-02 | Ngm Biopharmaceuticals, Inc. | Binding proteins and methods of use thereof |
| ES2871036T3 (es) | 2015-11-09 | 2021-10-28 | Ngm Biopharmaceuticals Inc | Método para el tratamiento de trastornos relacionados con ácidos biliares |
| EP3464608A4 (en) * | 2016-06-02 | 2020-01-29 | Klotho Therapeutics, Inc. | THERAPEUTIC RECOMBINANT KLOTHO PROTEINS, COMPOSITIONS AND METHODS THEREFOR |
| EA037848B1 (ru) * | 2016-07-14 | 2021-05-27 | Общество С Ограниченной Ответственностью "Биохимический Агент" | Гибридный белок, полинуклеотид, генетическая конструкция, продуцент, препарат для регенерации хряща (варианты) |
| US11123438B2 (en) | 2016-08-19 | 2021-09-21 | Ampsource Biopharma Shanghai Inc. | Linker peptide for constructing fusion protein |
| CN107759697B (zh) * | 2016-08-19 | 2023-03-24 | 安源医药科技(上海)有限公司 | 制备融合蛋白的方法 |
| CN106279437B (zh) | 2016-08-19 | 2017-10-31 | 安源医药科技(上海)有限公司 | 高糖基化人凝血因子viii融合蛋白及其制备方法与用途 |
| WO2018039557A1 (en) | 2016-08-26 | 2018-03-01 | Ngm Biopharmaceuticals, Inc. | Methods of treating fibroblast growth factor 19-mediated cancers and tumors |
| CN113692411A (zh) * | 2019-04-19 | 2021-11-23 | 吉尼松公司 | 成纤维细胞生长因子23相关的低磷酸盐血症的基因治疗 |
| WO2021128065A1 (zh) * | 2019-12-25 | 2021-07-01 | 广州菲康生物技术有限公司 | 人fgf-23的荧光免疫层析试纸和人fgf-23的荧光免疫层析检测试剂盒 |
| US11028132B1 (en) | 2020-04-07 | 2021-06-08 | Yitzhak Rosen | Half-life optimized linker composition |
| US11981718B2 (en) | 2020-05-27 | 2024-05-14 | Ampsource Biopharma Shanghai Inc. | Dual-function protein for lipid and blood glucose regulation |
| US20250154487A1 (en) * | 2023-11-10 | 2025-05-15 | Regeneron Pharmaceuticals, Inc. | Engineered alpha klotho polypeptides and uses thereof |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004201691A (ja) * | 2002-12-23 | 2004-07-22 | Chugai Pharmaceut Co Ltd | II型Na/Pi共輸送体発現調節因子 |
| JP2004527253A (ja) * | 2001-04-26 | 2004-09-09 | ジーンプロット・インコーポレイテッド | 線維芽細胞成長因子−23分子およびその使用 |
| JP2006238894A (ja) * | 2000-02-15 | 2006-09-14 | Amgen Inc | 線維芽細胞成長因子−23分子およびその使用 |
| JP2008194039A (ja) * | 2000-07-19 | 2008-08-28 | Advanced Research & Technology Inst | 新規線維芽細胞増殖因子(fgf23)および使用方法 |
| WO2009095372A1 (en) * | 2008-01-28 | 2009-08-06 | Novartis Ag | Methods and compositions using klotho-fgf fusion polypeptides |
| WO2009117622A2 (en) * | 2008-03-19 | 2009-09-24 | Ambrx, Inc. | Modified fgf-23 polypeptides and their uses |
Family Cites Families (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL71691A (en) | 1984-04-27 | 1991-04-15 | Yeda Res & Dev | Production of interferon-ypsilon |
| US5128326A (en) | 1984-12-06 | 1992-07-07 | Biomatrix, Inc. | Drug delivery systems based on hyaluronans derivatives thereof and their salts and methods of producing same |
| US5266561A (en) | 1988-01-11 | 1993-11-30 | Amylin Pharmaceuticals, Inc. | Treatment of type 2 diabetes mellitus |
| EP0550436A1 (en) | 1989-11-06 | 1993-07-14 | Alkermes Controlled Therapeutics, Inc. | Protein microspheres and methods of using them |
| AU646877B2 (en) | 1990-06-15 | 1994-03-10 | Scios Nova Inc. | Transgenic non-human mammal displaying the amyloid-forming pathology of alzheimer's disease |
| US5408038A (en) * | 1991-10-09 | 1995-04-18 | The Scripps Research Institute | Nonnatural apolipoprotein B-100 peptides and apolipoprotein B-100-apolipoprotein A-I fusion peptides |
| US5912015A (en) | 1992-03-12 | 1999-06-15 | Alkermes Controlled Therapeutics, Inc. | Modulated release from biocompatible polymers |
| US5420112A (en) | 1992-06-12 | 1995-05-30 | Lewis; Michael E. | Prevention and treatment of peripheral neuropathy |
| US5541094A (en) * | 1992-09-25 | 1996-07-30 | E. I. Du Pont De Nemours And Company | Glyoxylic acid/aminomethylphosphonic acid mixtures prepared using a microbial transformant |
| US5877399A (en) | 1994-01-27 | 1999-03-02 | Johns Hopkins University | Transgenic mice expressing APP-Swedish mutation develop progressive neurologic disease |
| US6187992B1 (en) | 1994-12-05 | 2001-02-13 | Merck & Co., Inc. | Transgenic mouse having a disrupted amyloid precursor protein gene |
| CA2230494A1 (en) | 1995-08-31 | 1997-03-06 | Alkermes Controlled Therapeutics Inc. | Composition for sustained release of an agent |
| US6194177B1 (en) | 1996-02-20 | 2001-02-27 | Applied Research Systems Ars Holding N.V. | DNA encoding a hybrid heterodimeric protein |
| WO1997033572A1 (en) | 1996-03-15 | 1997-09-18 | Somerset Pharmaceuticals, Inc. | Method for preventing and treating peripheral neurophathy by administering selegiline |
| US6358752B1 (en) | 1996-09-27 | 2002-03-19 | Cornell Research Foundation, Inc. | Liposome-enhanced test device and method |
| KR20000062345A (ko) | 1996-12-26 | 2000-10-25 | 히라타 다다시 | 신규 폴리펩타이드, 신규 dna 및 신규 항체 |
| US6127598A (en) | 1997-07-25 | 2000-10-03 | The Regents Of The University Of California | NKX-2.2 and NKX-6.1 transgenic mouse models for diabetes, depression, and obesity |
| US5989463A (en) | 1997-09-24 | 1999-11-23 | Alkermes Controlled Therapeutics, Inc. | Methods for fabricating polymer-based controlled release devices |
| SE512663C2 (sv) | 1997-10-23 | 2000-04-17 | Biogram Ab | Inkapslingsförfarande för aktiv substans i en bionedbrytbar polymer |
| WO1999051773A1 (en) | 1998-04-03 | 1999-10-14 | Phylos, Inc. | Addressable protein arrays |
| US7060479B2 (en) * | 1999-12-08 | 2006-06-13 | Serono Genetics Institute, S.A. | Full-length human cDNAs encoding potentially secreted proteins |
| US20030055231A1 (en) | 1998-10-28 | 2003-03-20 | Jian Ni | 12 human secreted proteins |
| US6518069B1 (en) | 1999-04-22 | 2003-02-11 | Liposcience, Inc. | Methods and computer program products for determining risk of developing type 2 diabetes and other insulin resistance related disorders |
| WO2001012851A2 (en) | 1999-08-12 | 2001-02-22 | Wisconsin Alumni Research Foundation | Identification of genetic markers of biological age and metabolism |
| US6569832B1 (en) | 1999-11-12 | 2003-05-27 | Novo Nordisk A/S | Inhibition of beta cell degeneration |
| US6716626B1 (en) | 1999-11-18 | 2004-04-06 | Chiron Corporation | Human FGF-21 nucleic acids |
| US6406853B1 (en) | 1999-12-23 | 2002-06-18 | The Regents Of The University Of California | Interventions to mimic the effects of calorie restriction |
| US20060160181A1 (en) * | 2000-02-15 | 2006-07-20 | Amgen Inc. | Fibroblast Growth Factor-23 molecules and uses thereof |
| EP1261638A2 (en) | 2000-03-08 | 2002-12-04 | Chiron Corporation | Human fgf-23 gene and gene expression products |
| WO2002061046A2 (en) | 2001-01-30 | 2002-08-08 | Regeneron Pharmaceuticals, Inc. | Novel nucleic acid and polypeptide molecules |
| US7588757B2 (en) | 2001-03-14 | 2009-09-15 | Genzyme Corporation | Methods of treating Parkinson's disease using recombinant adeno-associated virus virions |
| EP1327443A1 (en) | 2001-12-21 | 2003-07-16 | Kyowa Hakko Kogyo Co., Ltd. | Therapeutic or preventing agent for the diseases caused by a decrease in the expression level of the klotho protein |
| JP2007531707A (ja) | 2003-10-15 | 2007-11-08 | ピーディーエル バイオファーマ, インコーポレイテッド | IGの重鎖定常領域の位置250、314および/または428の変異誘発によるFc融合タンパク質血清半減期の改変 |
| US8420088B2 (en) | 2008-01-28 | 2013-04-16 | Novartis Ag | Methods and compositions using FGF23 fusion polypeptides |
| EA201990619A1 (ru) | 2008-10-10 | 2019-07-31 | Амген Инк. | Fgf21 мутанты и их применение |
| US20120052069A1 (en) | 2009-05-05 | 2012-03-01 | Amgen Inc | Fgf21 mutants and uses thereof |
| US8461111B2 (en) | 2009-05-20 | 2013-06-11 | Florida State University Research Foundation | Fibroblast growth factor mutants having improved functional half-life and methods of their use |
| US20110195077A1 (en) | 2010-01-29 | 2011-08-11 | Novartis Ag | Methods and compositions using fgf23 fusion ppolypeptides |
| US10588980B2 (en) | 2014-06-23 | 2020-03-17 | Novartis Ag | Fatty acids and their use in conjugation to biomolecules |
-
2010
- 2010-01-29 US US12/696,693 patent/US8420088B2/en not_active Expired - Fee Related
-
2011
- 2011-01-27 EA EA201201047A patent/EA201201047A1/ru unknown
- 2011-01-27 CN CN201310049110.2A patent/CN103204941B/zh active Active
- 2011-01-27 CN CN201610245160.1A patent/CN105968208A/zh not_active Withdrawn
- 2011-01-27 EP EP16184724.9A patent/EP3124612A1/en not_active Withdrawn
- 2011-01-27 PL PL11705830T patent/PL2529016T3/pl unknown
- 2011-01-27 PT PT117058305T patent/PT2529016T/pt unknown
- 2011-01-27 ES ES11705830.5T patent/ES2605302T3/es active Active
- 2011-01-27 UY UY0001033204A patent/UY33204A/es not_active Application Discontinuation
- 2011-01-27 MX MX2012008780A patent/MX336391B/es unknown
- 2011-01-27 KR KR1020127022498A patent/KR20130032296A/ko not_active Withdrawn
- 2011-01-27 AR ARP110100273A patent/AR080043A1/es unknown
- 2011-01-27 CA CA2787285A patent/CA2787285A1/en not_active Withdrawn
- 2011-01-27 AU AU2011209380A patent/AU2011209380B2/en not_active Ceased
- 2011-01-27 CN CN201180007622.1A patent/CN102725413B/zh active Active
- 2011-01-27 WO PCT/EP2011/051112 patent/WO2011092234A1/en not_active Ceased
- 2011-01-27 EP EP11705830.5A patent/EP2529016B1/en active Active
- 2011-01-27 JP JP2012550437A patent/JP5964243B2/ja not_active Expired - Fee Related
- 2011-01-28 TW TW103100421A patent/TWI569805B/zh not_active IP Right Cessation
- 2011-01-28 TW TW100103508A patent/TWI430805B/zh active
-
2013
- 2013-03-12 US US13/796,711 patent/US8932589B2/en not_active Expired - Fee Related
-
2014
- 2014-11-03 US US14/531,620 patent/US9475857B2/en active Active
-
2016
- 2016-04-25 JP JP2016087432A patent/JP2016190847A/ja active Pending
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006238894A (ja) * | 2000-02-15 | 2006-09-14 | Amgen Inc | 線維芽細胞成長因子−23分子およびその使用 |
| JP2008194039A (ja) * | 2000-07-19 | 2008-08-28 | Advanced Research & Technology Inst | 新規線維芽細胞増殖因子(fgf23)および使用方法 |
| JP2004527253A (ja) * | 2001-04-26 | 2004-09-09 | ジーンプロット・インコーポレイテッド | 線維芽細胞成長因子−23分子およびその使用 |
| JP2004201691A (ja) * | 2002-12-23 | 2004-07-22 | Chugai Pharmaceut Co Ltd | II型Na/Pi共輸送体発現調節因子 |
| WO2009095372A1 (en) * | 2008-01-28 | 2009-08-06 | Novartis Ag | Methods and compositions using klotho-fgf fusion polypeptides |
| WO2009117622A2 (en) * | 2008-03-19 | 2009-09-24 | Ambrx, Inc. | Modified fgf-23 polypeptides and their uses |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3124612A1 (en) | 2017-02-01 |
| CN103204941B (zh) | 2016-05-04 |
| PT2529016T (pt) | 2016-12-12 |
| JP5964243B2 (ja) | 2016-08-03 |
| CN105968208A (zh) | 2016-09-28 |
| US8420088B2 (en) | 2013-04-16 |
| PL2529016T3 (pl) | 2017-02-28 |
| MX336391B (es) | 2016-01-18 |
| EP2529016B1 (en) | 2016-08-24 |
| US8932589B2 (en) | 2015-01-13 |
| TW201414488A (zh) | 2014-04-16 |
| AR080043A1 (es) | 2012-03-07 |
| US20160031961A1 (en) | 2016-02-04 |
| TW201129373A (en) | 2011-09-01 |
| AU2011209380A1 (en) | 2012-08-09 |
| TWI569805B (zh) | 2017-02-11 |
| AU2011209380B2 (en) | 2013-09-12 |
| US20130224196A1 (en) | 2013-08-29 |
| JP2013517781A (ja) | 2013-05-20 |
| CN102725413B (zh) | 2016-05-11 |
| ES2605302T3 (es) | 2017-03-13 |
| WO2011092234A1 (en) | 2011-08-04 |
| UY33204A (es) | 2011-08-31 |
| KR20130032296A (ko) | 2013-04-01 |
| CN102725413A (zh) | 2012-10-10 |
| US9475857B2 (en) | 2016-10-25 |
| US20100215657A1 (en) | 2010-08-26 |
| CA2787285A1 (en) | 2011-08-04 |
| MX2012008780A (es) | 2012-12-17 |
| TWI430805B (zh) | 2014-03-21 |
| CN103204941A (zh) | 2013-07-17 |
| EA201201047A1 (ru) | 2013-02-28 |
| EP2529016A1 (en) | 2012-12-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5964243B2 (ja) | Fgf23融合ポリペプチドを使用する方法および組成物 | |
| JP5627469B2 (ja) | クロトー−fgf融合ポリペプチドを使用する方法および組成物 | |
| US9139631B2 (en) | Methods and compositions using FGF23 variant polypeptides with reduced aggregation and cleavage | |
| EP3227319B1 (en) | Methods and compositions using klotho variant polypeptides | |
| JP2019523637A (ja) | Gdf15融合タンパク質及びその使用 | |
| US20170233446A1 (en) | Methods and compositions using klotho-fgf fusion polypeptides |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170328 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20171031 |