JP2015166370A - 中枢神経系疾患および障害の治療に有効な新規化合物 - Google Patents
中枢神経系疾患および障害の治療に有効な新規化合物 Download PDFInfo
- Publication number
- JP2015166370A JP2015166370A JP2015095429A JP2015095429A JP2015166370A JP 2015166370 A JP2015166370 A JP 2015166370A JP 2015095429 A JP2015095429 A JP 2015095429A JP 2015095429 A JP2015095429 A JP 2015095429A JP 2015166370 A JP2015166370 A JP 2015166370A
- Authority
- JP
- Japan
- Prior art keywords
- patient
- solution
- alkyl
- cycloalkyl
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 C=*C(CC1)=C*=C1Cl Chemical compound C=*C(CC1)=C*=C1Cl 0.000 description 14
- YZJMKUGLRVJAAQ-UHFFFAOYSA-N CC(C)(CC(N)=O)Oc1cc2ccccc2cc1 Chemical compound CC(C)(CC(N)=O)Oc1cc2ccccc2cc1 YZJMKUGLRVJAAQ-UHFFFAOYSA-N 0.000 description 1
- IAAKRKYNJJZPKH-UHFFFAOYSA-N CC(C)(CC(N)=O)c(cc1)cc(cc2)c1cc2OC Chemical compound CC(C)(CC(N)=O)c(cc1)cc(cc2)c1cc2OC IAAKRKYNJJZPKH-UHFFFAOYSA-N 0.000 description 1
- UQPPSVWHCCOUIB-UHFFFAOYSA-N CC(C)(CC(N)=O)c(cc1)ccc1Cl Chemical compound CC(C)(CC(N)=O)c(cc1)ccc1Cl UQPPSVWHCCOUIB-UHFFFAOYSA-N 0.000 description 1
- ZLTCYFXKOGUWON-UHFFFAOYSA-N CC(C)(CC(N)=O)c(cc1)ccc1N Chemical compound CC(C)(CC(N)=O)c(cc1)ccc1N ZLTCYFXKOGUWON-UHFFFAOYSA-N 0.000 description 1
- HARNWLZJQFHBLN-UHFFFAOYSA-N CC(C)(CC(NC)=O)c(cc1)ccc1Cl Chemical compound CC(C)(CC(NC)=O)c(cc1)ccc1Cl HARNWLZJQFHBLN-UHFFFAOYSA-N 0.000 description 1
- FAVPPLZVRVZYPY-UHFFFAOYSA-N CC(C)(CC(O)=O)c(cc1)ccc1N Chemical compound CC(C)(CC(O)=O)c(cc1)ccc1N FAVPPLZVRVZYPY-UHFFFAOYSA-N 0.000 description 1
- IVDOHSYTZNZIJT-UHFFFAOYSA-N CC(C)Cc1ccc(C(C)CC(N)=O)cc1 Chemical compound CC(C)Cc1ccc(C(C)CC(N)=O)cc1 IVDOHSYTZNZIJT-UHFFFAOYSA-N 0.000 description 1
- KJAJWYWBYJPAMX-UHFFFAOYSA-N CC(C1(CCC1)c(cc1)ccc1Cl)=O Chemical compound CC(C1(CCC1)c(cc1)ccc1Cl)=O KJAJWYWBYJPAMX-UHFFFAOYSA-N 0.000 description 1
- XQKZZUKNOVBDNE-UHFFFAOYSA-N CC(CC(N)=O)c(cc1)ccc1N1CCOCC1 Chemical compound CC(CC(N)=O)c(cc1)ccc1N1CCOCC1 XQKZZUKNOVBDNE-UHFFFAOYSA-N 0.000 description 1
- DEUZMNKVWXDFFZ-UHFFFAOYSA-N CC(CC(N)=O)c1ccc(-c2ccccc2)c(F)c1 Chemical compound CC(CC(N)=O)c1ccc(-c2ccccc2)c(F)c1 DEUZMNKVWXDFFZ-UHFFFAOYSA-N 0.000 description 1
- SSURWSJLUIXJNS-UHFFFAOYSA-N CC(CC(N)O)c(cc1)ccc1S Chemical compound CC(CC(N)O)c(cc1)ccc1S SSURWSJLUIXJNS-UHFFFAOYSA-N 0.000 description 1
- MUELTBNGZNEDQY-UHFFFAOYSA-N CCC#CCC1(CCC1)c(cc1)ccc1Cl Chemical compound CCC#CCC1(CCC1)c(cc1)ccc1Cl MUELTBNGZNEDQY-UHFFFAOYSA-N 0.000 description 1
- MFSPQEHGIDHZOZ-UHFFFAOYSA-N CCC(CC(N)=O)c(cc1)ccc1F Chemical compound CCC(CC(N)=O)c(cc1)ccc1F MFSPQEHGIDHZOZ-UHFFFAOYSA-N 0.000 description 1
- HONMYGHPNOOCEF-UHFFFAOYSA-N CCCC(CC(N)=O)c(cc1)ccc1OC(F)(F)F Chemical compound CCCC(CC(N)=O)c(cc1)ccc1OC(F)(F)F HONMYGHPNOOCEF-UHFFFAOYSA-N 0.000 description 1
- IJWIQYYZWBISGY-UHFFFAOYSA-N COC(CC(C(CC1)=CCC1OC(F)(F)F)SC)O Chemical compound COC(CC(C(CC1)=CCC1OC(F)(F)F)SC)O IJWIQYYZWBISGY-UHFFFAOYSA-N 0.000 description 1
- PUHLEHCHEONKCL-UHFFFAOYSA-N COC(CC=C)N Chemical compound COC(CC=C)N PUHLEHCHEONKCL-UHFFFAOYSA-N 0.000 description 1
- UQROCNYEWHBLME-UHFFFAOYSA-N COc1ccc(C2(CC(N)=O)CCCC2)cc1 Chemical compound COc1ccc(C2(CC(N)=O)CCCC2)cc1 UQROCNYEWHBLME-UHFFFAOYSA-N 0.000 description 1
- HTXJSSHXBOQYAJ-UHFFFAOYSA-N COc1ccc(C2(CC(N)=O)CCCCC2)cc1 Chemical compound COc1ccc(C2(CC(N)=O)CCCCC2)cc1 HTXJSSHXBOQYAJ-UHFFFAOYSA-N 0.000 description 1
- JUVMQASSLFSYIO-MRVPVSSYSA-N C[C@H](CC(N)=O)c1ccccc1 Chemical compound C[C@H](CC(N)=O)c1ccccc1 JUVMQASSLFSYIO-MRVPVSSYSA-N 0.000 description 1
- DUCAPIRTKKFSOA-MFKMUULPSA-N C[C@H](C[C@@H](CC(N)=O)c(cc1)ccc1Cl)C1CC1 Chemical compound C[C@H](C[C@@H](CC(N)=O)c(cc1)ccc1Cl)C1CC1 DUCAPIRTKKFSOA-MFKMUULPSA-N 0.000 description 1
- FKXWZHPVJGJLIS-UHFFFAOYSA-N Cc1ccc2OC(CC(N)=O)Cc2c1 Chemical compound Cc1ccc2OC(CC(N)=O)Cc2c1 FKXWZHPVJGJLIS-UHFFFAOYSA-N 0.000 description 1
- NRSCDUSVDGFPCR-UHFFFAOYSA-N NC(CC(Cc1c2)Oc1ccc2Cl)=O Chemical compound NC(CC(Cc1c2)Oc1ccc2Cl)=O NRSCDUSVDGFPCR-UHFFFAOYSA-N 0.000 description 1
- ZOLPWHBJYVGCAL-UHFFFAOYSA-N NC(CC1(CC1)c(cc1)ccc1Cl)=O Chemical compound NC(CC1(CC1)c(cc1)ccc1Cl)=O ZOLPWHBJYVGCAL-UHFFFAOYSA-N 0.000 description 1
- YQEOEGUEVTUCDQ-UHFFFAOYSA-N NC(CC1(CC1)c1ccc(C(F)(F)F)cc1)=O Chemical compound NC(CC1(CC1)c1ccc(C(F)(F)F)cc1)=O YQEOEGUEVTUCDQ-UHFFFAOYSA-N 0.000 description 1
- ZFKXPUXSRFICFK-UHFFFAOYSA-N NC(CC1(CCC1)c(cc1)ccc1Cl)=O Chemical compound NC(CC1(CCC1)c(cc1)ccc1Cl)=O ZFKXPUXSRFICFK-UHFFFAOYSA-N 0.000 description 1
- LGPSNFAHEJQARC-UHFFFAOYSA-N NC(CC1(CCCCC1)c(cc1)ccc1Cl)=O Chemical compound NC(CC1(CCCCC1)c(cc1)ccc1Cl)=O LGPSNFAHEJQARC-UHFFFAOYSA-N 0.000 description 1
- BGTOWKSIORTVQH-UHFFFAOYSA-N O=C1CCCC1 Chemical compound O=C1CCCC1 BGTOWKSIORTVQH-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/14—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D295/155—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals with the ring nitrogen atoms and the carbon atoms with three bonds to hetero atoms separated by carbocyclic rings or by carbon chains interrupted by carbocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/34—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide
- A61K31/343—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide condensed with a carbocyclic ring, e.g. coumaran, bufuralol, befunolol, clobenfurol, amiodarone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/357—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having two or more oxygen atoms in the same ring, e.g. crown ethers, guanadrel
- A61K31/36—Compounds containing methylenedioxyphenyl groups, e.g. sesamin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
- A61P25/10—Antiepileptics; Anticonvulsants for petit-mal
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/01—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to acyclic carbon atoms
- C07C211/26—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to acyclic carbon atoms of an unsaturated carbon skeleton containing at least one six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/01—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to acyclic carbon atoms
- C07C211/26—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to acyclic carbon atoms of an unsaturated carbon skeleton containing at least one six-membered aromatic ring
- C07C211/28—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to acyclic carbon atoms of an unsaturated carbon skeleton containing at least one six-membered aromatic ring having amino groups linked to the six-membered aromatic ring by unsaturated carbon chains
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/02—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having nitrogen atoms of carboxamide groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals
- C07C233/11—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having nitrogen atoms of carboxamide groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals with carbon atoms of carboxamide groups bound to carbon atoms of an unsaturated carbon skeleton containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/12—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by halogen atoms or by nitro or nitroso groups
- C07C233/13—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by halogen atoms or by nitro or nitroso groups with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by an acyclic carbon atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/57—Carboxylic acid amides having carbon atoms of carboxamide groups bound to carbon atoms of rings other than six-membered aromatic rings
- C07C233/58—Carboxylic acid amides having carbon atoms of carboxamide groups bound to carbon atoms of rings other than six-membered aromatic rings having the nitrogen atoms of the carboxamide groups bound to hydrogen atoms or to carbon atoms of unsubstituted hydrocarbon radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C235/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms
- C07C235/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to acyclic carbon atoms and singly-bound oxygen atoms bound to the same carbon skeleton
- C07C235/04—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to acyclic carbon atoms and singly-bound oxygen atoms bound to the same carbon skeleton the carbon skeleton being acyclic and saturated
- C07C235/18—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to acyclic carbon atoms and singly-bound oxygen atoms bound to the same carbon skeleton the carbon skeleton being acyclic and saturated having at least one of the singly-bound oxygen atoms further bound to a carbon atom of a six-membered aromatic ring, e.g. phenoxyacetamides
- C07C235/20—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to acyclic carbon atoms and singly-bound oxygen atoms bound to the same carbon skeleton the carbon skeleton being acyclic and saturated having at least one of the singly-bound oxygen atoms further bound to a carbon atom of a six-membered aromatic ring, e.g. phenoxyacetamides having the nitrogen atoms of the carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C235/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms
- C07C235/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to acyclic carbon atoms and singly-bound oxygen atoms bound to the same carbon skeleton
- C07C235/32—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to acyclic carbon atoms and singly-bound oxygen atoms bound to the same carbon skeleton the carbon skeleton containing six-membered aromatic rings
- C07C235/34—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to acyclic carbon atoms and singly-bound oxygen atoms bound to the same carbon skeleton the carbon skeleton containing six-membered aromatic rings having the nitrogen atoms of the carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton
- C07C237/22—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton having nitrogen atoms of amino groups bound to the carbon skeleton of the acid part, further acylated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C255/00—Carboxylic acid nitriles
- C07C255/49—Carboxylic acid nitriles having cyano groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C255/54—Carboxylic acid nitriles having cyano groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton containing cyano groups and etherified hydroxy groups bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C317/00—Sulfones; Sulfoxides
- C07C317/44—Sulfones; Sulfoxides having sulfone or sulfoxide groups and carboxyl groups bound to the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/78—Benzo [b] furans; Hydrogenated benzo [b] furans
- C07D307/79—Benzo [b] furans; Hydrogenated benzo [b] furans with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to carbon atoms of the hetero ring
- C07D307/81—Radicals substituted by nitrogen atoms not forming part of a nitro radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D317/00—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D317/08—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3
- C07D317/44—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D317/46—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems condensed with one six-membered ring
- C07D317/48—Methylenedioxybenzenes or hydrogenated methylenedioxybenzenes, unsubstituted on the hetero ring
- C07D317/50—Methylenedioxybenzenes or hydrogenated methylenedioxybenzenes, unsubstituted on the hetero ring with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to atoms of the carbocyclic ring
- C07D317/60—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/10—1,4-Dioxanes; Hydrogenated 1,4-dioxanes
- C07D319/14—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems
- C07D319/16—1,4-Dioxanes; Hydrogenated 1,4-dioxanes condensed with carbocyclic rings or ring systems condensed with one six-membered ring
- C07D319/18—Ethylenedioxybenzenes, not substituted on the hetero ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/02—Systems containing only non-condensed rings with a three-membered ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/04—Systems containing only non-condensed rings with a four-membered ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/06—Systems containing only non-condensed rings with a five-membered ring
- C07C2601/08—Systems containing only non-condensed rings with a five-membered ring the ring being saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Neurology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Epidemiology (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Psychology (AREA)
- Physical Education & Sports Medicine (AREA)
- Rheumatology (AREA)
- Anesthesiology (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Heterocyclic Compounds That Contain Two Or More Ring Oxygen Atoms (AREA)
- Furan Compounds (AREA)
Abstract
【解決手段】図1に代表される新規アミド類化合物。この医薬活性化合物は、不安、抑鬱、不眠、片頭痛、統合失調症、パーキンソン病、痙性、アルツハイマー病や双極性障害等の中枢神経系(CNS)疾患や障害の治療、鎮痛剤(例えば、慢性或いは神経因性頭痛の為の)として、脳卒中、慢性神経変性性疾患(アルツハイマー病及びハンチントン病等)、脳や脊髄の損傷の治療において有用な神経保護薬、更に、癲癇重積状態の治療、そして又は化学的対応策としても有用な可能性がある。
【選択図】図1
Description
本出願は2008年3月19日に出願の米国特許仮出願番号 61/037,987 の「中枢神経系疾患
および障害の治療に有効な新規化合物」の利益を主張し、当該出願の内容を引用することによりその全てがここに組み込まれることとする。
1. 発明の技術分野
本発明は、実験動物の中枢神経系(CNS)に作用を示す新規化合物に関連する。さらに
具体的には、本発明は、現存する中枢神経系(CNS)治療薬に比べて、同等あるいはより
優れた生物学的作用(すなわち有効性)を発揮しながら、毒性学的安全性の増大/改善(すなわち毒性の低減)、代謝安定性の増大/改善、半減期の延長および/または優れた副作用プロファイルと抗痙攣作用を示す新規化合物に関連する。
数多くの病理学的症状(例えば、癲癇、脳卒中、双極性感情障害、片頭痛、不安、抑鬱、不眠、統合失調症、慢性または神経因性疼痛、痙性、脊椎損傷および慢性神経変性障害など)および疾患(例えば、パーキンソン病、ハンチントン病およびアルツハイマー病など)は、中枢神経系(CNS)の正常な機能の異常として特徴づけられる。これらの症状や
疾患は、一般的にはCNSの正常な機能を調節する化合物や物質による薬理学的治療に対し
て反応する。そのような活性を有する化合物には、癲癇などのCNSの異常を治療するため
に本明細書に開示される本発明の化合物が含まれる。現在利用できる治療薬はしばしば良好なCNS活性を有するが、慢性毒性、重度の、および/または不快な副作用、短い薬理学的半減期のような不十分な薬物動態特性などその他の好ましくない特性を示すものが多い。例えば、CNS治療薬の短い半減期は、有害事象を発現させずに治療濃度を維持するために
は、頻回の入院を必要とし、頻繁な投与スケジュールが必要となり治療コストが増加する可能性がある。さらに、必要とされる投与回数が増加すると患者の服薬コンプライアンスが低下する傾向がある。従って、現在利用できる治療薬に比べて、例えば半減期の延長、活性の増大(すなわち有効性の改善)および/または代謝安定性の向上(例えば、毒性代
謝物の低減など)などの優れた特性を有し、CNS活性を調節できる新たな化合物の提供が
望まれている。さらに、より幅広く多くの患者人口に本発明の有効な化合物の提供を可能にする、改善された、より簡単な/簡略化された、合成および化学的製造工程を開発する
ことも可能である。
するフェニルアルコールアミド類」(Phenyl alcohol amides having anticonvulsant activity))、WO9941229 (Carvajal Sandoval ら、「抗痙攣作用を有するハロゲ
ン化フェニルアルコールアミド類(GABAB受容体のリガンド)」(Halogenated phenyl alcohol amides (ligands of GABAB receptor) having an anticonvulsant activity))、WO03091201(Carvajal Sandovalら、「抗痙攣作用を有するDL-ヒドロキシーアルキルーフェニルアミド類」(DL−Hydroxy−alkyl−
phenylamides having anticonvulsive activity))、WO2005085182 (Meza Toledo、「抗痙攣作用を有するDL-ヒドロキシベンズアミド類」(DL−Hydroxybenzamides ha
ving anticonvulsive activity))および米国特許出願番
号第20060287397号 (Meza Toledo、「抗痙攣作用を有するDL-ヒ
ドロキシーアルキルーフェニルアミド類」(Dl−Hydroxy−alkyl−phenylamides having anticonvulsive activity))に記載されている。上述の先行技術および本発明の技術の重要な違いは、先行技術はγヒドロキシ酪酸(γヒドロキシ酪酸塩またはGHB)と構造上関連する化合物を含む、ま
たは関連するのに対し、本発明の化合物は、3-メチル酪酸アミドに構造上関連することである。
本明細書では、抗痙攣作用を有する一連の新規アミド類を開示するが、その多くは、短い、多様に分岐/置換された脂肪族リンカーを介してフェニル基がアミド部分へ結合して
いる。本発明のその他の化合物(以下に示す)は、アラニン (Z = CH3 以下)、バリン [Z
= CH(CH3)2]、ロイシン [Z = CH2CH(CH3)2]、イソロイシン [Z = CH(CH3)CH2CH3]またはフェニルアラニン (Z = CH2C6H5)などの光学的に活性なアミノ酸(例えば、 DまたはL)
の、あるいはグリシン(Z=H)またはタウリン [R2 = (CH2)2SO3H、 以下に示す] などの
光学的に不活性なアミノ酸の誘導体であるアミド類である。そのような化合物は以下の式で例示される:
式Iを有するCNS活性化合物:
換されたテトラヒドロナフチル、任意に置換されたインダンであって良く、あるいは任意に置換されたヘテロサイクリックアリルでも良く、ここで5つまでの置換基を含んでも良い。Ar上の各置換基は、アルキル、シクロアルキル、ハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキル、アルキレンジオキシ、ハロアルキル、
ハロアルコキシ、OH、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、ベンジル、ベンジロキシ、α,α-ジメチルベンジル、 NO2、CHO、CH3CH(OH)、アセチル、OCH2COOHから成る群から独立して選ばれてもよく、またはそれらの組み合わせであっても良い。また、Ar
には、Arの1個または2個の原子に結合する任意に置換された芳香環系が含まれても良く
、そのような芳香環系は、フェニル、フェノキシ、ヘテロサイクリックアリルから選択されるか、またはその組み合わせである。上記のArおよび/またはその置換基は、5個までの置換基を含んで良く、各置換基は、アルキル、シクロアルキル、ハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキル、アルキレンジオキシ、ハロ
アルキル、ハロアルコキシ、OH、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、NO2、CHO、CH3CH(OH)、アセチル、およびOCH2COOHからなる群から独立に選択される基であって
良い。さらに、Arおよび/または芳香環基は、Arおよび/または芳香環基と芳香環を構成する二官能置換基を含んで良く、該二官能置換基は、アルキル、シクロアルキル、メチレンジオキシ、エチレンジオキシまたは他のアルキレンジオキシの任意の置換基またはそれらの組み合わせでも良い。
チルからなる群から選択される基である(Wが共にエチルにはならない限り)。5個までの置換基がフェニル基に含まれて良く、各置換基は、ハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、スルホニルアルキル、ハロアルキル、ハロアルコキシ、CONH2、CN、アセトキシ、N(アルキル)2、NO2 およびアセチルからなる群から独立して選択される
。
別の実施態様では、R1は H であり、R2 は(CH2)2SO3HまたはCHZCOOHであり、Zは、H、 CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2および CH(CH3)CH2CH3からなる群から独立して選択
される。任意に、R1 および R2が共にシクロアルキルである。
式Iにおいて、R3は、ヒドロキシ、置換されたあるいは置換されていないアルキル、置換
されたあるいは置換されていないシクロアルキルのいずれかであるか、あるいはR4も共にシクロアルキルである。任意に、R3 が OHの場合には R4 はエチルではない。
いは置換されていないシクロアルキルのうちの一つであるか、またはR3も共にシクロアルキルである。
式IIを有するCNS活性化合物:
置換されていないアルキル、置換されたあるいは置換されていないシクロアルキル、CW2
フェニルのうちの少なくとも一つ、またはそれらの組み合わせである。Wは独立してH、メチルおよびエチルから選択されるが、Wが共にエチルであることはできない。フェニル基
またはシクロアルキル基には5個までの置換基が含まれて良く、各置換基は、ハロゲン、
アルコキシ、チオアルキル、スルホキシアルキル、スルホニルアルキル、ハロアルキル、ハロアルコキシ、CONH2、CN、アセトキシ、N(アルキル)2、NO2 およびアセチルからなる
群から独立して選択される。任意に、R1は H およびR2 は(CH2)2SO3HまたはCHZCOOHを含
み、ZはH、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2および CH(CH3)CH2CH3からなる群のう
ちの1つである。また別の選択として、R1 およびR2は共にシクロアルキルである。
ロサイクリックアリルのいずれかであり、ここで5個までの置換基があっても良く、各置
換基はハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキ
ル、ハロアルキル、ハロアルコキシ、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、NO2、アセチルおよび OCH2COOHからなる群から独立して選択される。
れたあるいは置換されていないアルキレンのいずれかである。
実施態様の一つにおいては、本発明は以下の式のうちの一つを有するCNS活性化合物を
含む:
れたあるいは置換されていないアルキル、置換されたあるいは置換されていないシクロアルキル、CW2フェニルのうちのの少なくとも一つであるか、またはそれらの組み合わせで
ある。WはH、メチルおよびエチルからなる群から独立して選択されるが、Wが共にエチル
であることはできない。フェニル基またはシクロアルキル基には5個までの置換基が含ま
れて良く、各置換基はハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、スルホニルアルキル、ハロアルキル、ハロアルコキシ、CONH2、CN、アセトキシ、N(アルキル)2、NO2 およびアセチルからなる群からから独立して選択される。任意にR1が H でありR2
が(CH2)2SO3HまたはCHZCOOHであって、ここで、Zは、H、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2および CH(CH3)CH2CH3 からなる群のうちの一つである。また別の選択としては、R1 およびR2が共にシクロアルキルである。
、ここでZはH、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2および CH(CH3)CH2CH3 からなる群のうちの一つである。任意に、R1 および R2は共にシクロアルキルである。
共にシクロアルキルである。
である。
レン、メチレン、ケトン、CHOH、酸素、NR1、硫黄、スルホンまたはスルホキシドのうち
の一つである。
実施態様の一つにおいては、式1〜8のいずれも以下の特長を有しても良い:R1 は H、CH3、(CH2)2SO3Hまたは CHZCOOHのうちの一つであり、ここでZは、H、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2および CH(CH3)CH2CH3、これらの組み合わせまたはこれらの誘導体からなる群のうちの一つであり;R2、R3およびR4 は、独立してH、CH3、置換または未置換
のアルキル、OH、OCH3、置換または未置換のアルコキシ、それらの組み合わせまたはそれらの誘導体のうちの一つであり;R5は、H、Cl、F、CF3、CN、C1-C5 置換または未置換の
アルキル、C1-C5 置換または未置換のアルコキシ、OCF3CONR1R2、またはこれらの組み合
わせあるいはこれらの誘導体のうちの一つであり;nは1〜5、好ましくは1〜3であり;および X は、O、NR1、無置換、C=O、S、SO2、これらの組み合わせまたはこれらの誘導体のうちの一つである。
1. 概観
本発明者は、本発明の化合物および薬理学活性のある化合物類似体および同類のあるものは、in vivoの投与によってCNS活性の調節に有効であることを発見した。すなわち、これらの薬剤は神経系の活性の全てを完全に抑制することなく、中枢神経系の神経伝達の抑制の増強または興奮の抑制によってCNS活性を調節する。従って、本発明に準じて、この
薬剤を投与される患者は、例えば、癲癇発作の緩和(無麻酔で)、筋緊張の緩和(麻痺を起こさないで)、静穏化作用(鎮静作用なしで)または痙性のような歩行系症状の改善(虚弱化、あるいは弛緩状態にすることなく)のような状況下において、過度な鎮静、麻酔、あるいは麻痺をもたらされない。
の調節によって緩和できる少なくとも一つの症状を有する。従って、このような病変に悩む個人は、本発明に準じて、主要な活性成分として、本発明の化合物、あるいはその構造関連化合物類または同類を含む医薬製剤処方または組成の投与を受ける治療の候補者である。
痙攣:癲癇は、多くの原因による一般的な疾患であり、臨床上の管理が非常に困難な場合があり、発作を管理するために何年もの治療を必要とすることが多い。研究者達は、現時点では、患者の多くにとって有効な癲癇の治療法は存在しないと述べている。臨床試験において、患者が同様な種類の癲癇を有し、薬剤が同様な作用機序を有していても、他の薬剤よりもある薬剤に良好に反応する患者があることが示された。副作用の頻度及び重症度にも大きな差が存在する。このように癲癇の治療には、癲癇の治癒が可能となるか、あるいは、広範な活性を持った強力で安全な新薬が発見および開発されるまで、異なる作用機序と異なる副作用を持った複数の薬剤による治療が必要であろう。Dichter ら、 Drug Therapy 334:1583 (1996)。
患者においては癲癇は現存の抗癲癇薬で管理が可能であるが、患者の25〜30パーセントは最適な治療を実施しても癲癇を抑えることができず、また患者の多くは容認できない副作用を経験している。」Dichter ら(1996) 同上。
痙性:痙性は、伸張反射の過剰興奮による過剰な腱反射を伴う緊張性反射(筋緊張)の増強を特長とする障害である。Lance、シンポジウム抄録、「痙性-運動制御障害」(SPASTICITY--DISORDERED MOTOR CONTROL)、Feldman ら(Eds.)(1980). 痙性に付随する主要な
疾患及び症状には、多発性硬化症、脳性麻痺、脳卒中、脊髄の外傷または損傷および頭部外傷がある。痙性に起こる症状には疼痛を伴う屈筋および伸筋痙攣、亢進したあるいは過剰の深部腱反射、クローヌス、筋肉の虚弱化、疲労、器用さの損失、全般的な運動機能の様々な程度の損失、麻痺及び睡眠障害などが含まれる。
たは末梢における症状、とは生理学的レベルで基本的に異なる。これらの病理学的症状はまた血管痙縮、膀胱痙縮および気管支痙縮のような比較的一般的に起こる不随意の平滑筋の痙縮とも異なる。このような非痙縮性(non-spastic, CNS性でない)、末梢性のま
たは局所性の症状は通常、いわゆる「鎮痙薬」または「痙縮緩解薬」によって治療されるが、これらの薬剤は一般的に痙性の治療には有効ではない。GOODMAN AND GILMAN'S「治療薬の薬理学的基礎」(THE PHARMACOLOGICAL BASIS OF THERAPEUTICS)、第8版、「パー
キンソン病、痙性および急性痙攣の治療薬(Drugs for Parkinson's Disease, Spasticity and Acute Muscle Spasms)」Cedarbaum および Schleifer。(以降GOODMAN AND GILMAN'Sと掲載)、ページ 463-484 ページ(Pergamon Press 1990年)。
情緒障害:情緒障害には、例えば、躁病、総合失調感情障害、脳外傷性攻撃性、心的外傷
後ストレス障害、双極性感情障害、パニック症状および行動調整不良症候群のような抑鬱症から不機嫌躁病まで含まれる。「J.感情障害」(J. Affective Disorders) 8:243-250 (1985)、 Emrich ら、 および 「感情性障害における抗痙攣剤(ANTICONVULSANTS IN AFFECTIVE DISORDERS)」 14-32 ページ、Bernasconi ら (Excerpta Medica 1984)。本発明による新規化合物および医薬製剤処方および組成は、これらの疾患、障害及び症状の治療に有効であり、またこの治療薬分類における現存の治療薬に比較して改善された副作用プロフィールを示す。
頭痛:片頭痛 [Hering と Kuritzky, Cephalagia 12: 81-84 (1992)]、群発性頭痛 [Hering とKuritzky, loc. cit. 9:195-198 (1989)]および慢性頭痛といった頭痛 [Mathew とSabiha, Headache 31: 71-74 (1991)] は抗痙攣剤によって治療されてきた。従って本発
明の組成物および医薬製剤処方は、これらのタイプの頭痛の症状の緩和に、現存の治療にみられる有害な副作用なしで使用することが可能である。
学的障害:経過と治療(NEUROLOGICAL DISORDERS: COURSE AND TREATMENT)」、819-823 ページ (Academic Press 1996); Mellick や Mellick、Neurology 45(補足): 285-286 (1995)を参照。本発明は、最低限の副作用の静止不能症候群の有効な治療を提供する。
「神経障害または疾患」とは、これらに限定されないが、癲癇、不安症、多発性硬化症、脳卒中、頭部外傷、脊髄傷害およびパーキンソン病およびハンチントン病、アルツハイマー病および筋萎縮性側索硬化症のような慢性神経変性疾患を含む神経系の障害および疾患を意味する。さらに「神経障害または疾患とは、抗痙性剤または抗痙攣剤による治療が適用され、有効性を示し、推奨されるおよび/または処方される疾患または症状を意味する
。
「抗痙攣剤」とは全身性強直・間代発作、欠神発作、単純部分発作、複雑部分発作、二次性全般性部分発作、癲癇重積状態および頭部外傷や外科手術後の外傷起因性痙攣などの症状に発症し、観察され、見られる痙攣の重症度、回数や期間を軽減することのできる化合物を意味する。
る。
(RまたはS)(あるいはジアステレオマー)として、好ましい生物学的活性を示す場合がある。 ある純粋なエナンチオマーが好ましい生物学的活性を示す場合、この好ましいエナンチオマーはユートマーと呼ばれ、より好ましくない、生物学的活性がより低いエナンチオマーはジストマーと呼ばれる。
科学(REMINGTON'S PHARMACEUTICAL SCIENCES)」、第18版 (Mack Publishing Co., Easton, PA, 1990) および「グッドマンとギルマンの治療薬の薬理学的基礎(GOODMAN AND GILMAN'S THE PHARMACOLOGICAL BASIS OF THERAPEUTICS)」を参照のこと。化合物および/または組成は、投与される患者が認容できる場合には「医薬品として許容できる担体」
中に含まれるべきであるとされる。滅菌リン酸緩衝生理食塩水は医薬品として許容できる担体の1例である。その他の適切な担体(例えば、生理食塩水およびリンガー液)は、当
業者には周知である(以下を参照)。
たは補助剤が含まれる。先行技術にて既知の医薬品として許容な担体には、カルボン酸カルシウム、リン酸カルシウム、硫酸カルシウム、ショ糖、デキシトロース、ラクトース、フルクトース、キシリトール、ソルビトール、デンプン、デンプンペースト、セルロース誘導体、ゼラチン、ポリビニルピロリドン、塩化ナトリウム、デキストリン、ステアリン酸、ステアリン酸マグネシウム、ステアリン酸カルシウム、植物オイル、ポリエチレングリコール、滅菌リン酸緩衝生理食塩水、生理食塩水、リンガー液およびこれらの混合物が含まれるがこれらに限定されるものではない。例えば、「レミントンの薬理学的科学(REMINGTON'S PHARMACEUTICAL SCIENCES)」、同上、を参照。
アミノ酸など)の塩には、ナトリウム、カリウム、リチウム、亜鉛、アルミニウム、カルシウムおよびマグネシウムの塩が含まれる。「レミントンの薬理学的科学(REMINGTON'S PHARMACEUTICAL SCIENCES)」、 第18版、1445ページ (Mack Publishing Co. 1990) を参照。
は生理学的に有意である。さらに、用量およびおそらく投与回数も各患者の年齢、体重および反応に応じて異なってくる。上記に考察されたような同等の計画は獣医学的薬剤においても用いることが可能である。
剤もまた、1回の投与用量あたり小さじ1〜2杯となる量の活性成分が含まれるようにす
ることが可能である。さらに、相当する低用量の小児用の咀嚼可能および液体経口投与剤形を調製し投与することも可能である。これらの化合物は、経口投与用に、滴剤(「濃縮」調剤の滴下用から)を食品や飲料へ添加することも可能である。さらに、本発明の上記化合物を経口送達と吸収を促進させるためにチューイングガムに入れた剤形で調剤することも可能である。本発明の処方や組成に使用される各化合物の適切な用量は、当業者には前述の説明で明らかとなり得る。
与経路によって投与されることも可能である。その他の投与経路(例えば、獣医学的適用に有用な)には、腸内や非経口投与があり、筋肉内、皮下および/または脊髄内投与ばか
りでなくクモ膜下腔内、脳室内、静脈内、腹腔内、鼻腔内または眼内注射などが含まれる。しかしながら、経口投与が非常に便利であるために好ましい。
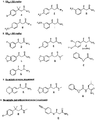
実施例1 化合物A[3−(4−クロロフェニル)−3−メチルブチルアミド]の調製
。
45mmol)を使って0℃窒素静圧下で処理した。反応液を窒素下で1晩室温で撹拌した。減圧下で過剰なジクロロメタンを除去した。入手した残渣をトルエン(50mL)で共沸
蒸留した。
クロロフェニル)−3メチルブチリルクロリド]溶液に5℃で15分間通した。反応混合
物を静圧窒素下で1晩室温で撹拌した。
リウム飽和溶液および塩水で洗浄した。次にエチルアセテート溶液を硫酸マグネシウム上で乾燥させ、濾過し、減圧下で蒸発させた。その結果得られた白色固体を冷却したジエチルエーテルおよびヘキサン(50:50)溶液を加えて粉末にした。この結果4.22gの白色の剥片[3−(4−クロロフェニル)−3−メチルブチルアミド]が得られた(収率
69%)。GC/MS分析によりこの物質は100%純粋であった。1H NMR 分光法によって生成物の構造と一致するシグナルが得られ、98%以上の純度が示された。
留した。
mL、84mmol)で5℃で処理した。反応混合物を静圧窒素下で1晩室温で撹拌した。
白色沈殿物を濾過しTHF(100mL)で洗浄した。濾過物および洗浄液を合わせて減圧下で蒸発させた。その結果入手した白色固体をジエチルエーテル中で再溶解させた(300mL)。エーテル層をH2O、1.0M HCL、炭酸水素ナトリウム飽和溶液および塩水で洗浄した。次にエーテル溶液を硫酸マグネシウム上で乾燥させ、濾過し、減圧下で蒸発させた。その結果得られた白色固体を冷却したジエチルエーテルおよびヘキサン(50:50)溶液を加えて粉末とした。この結果5.46gの白色の剥片[3−(4−クロロフェニル
)−3,N−ジメチルブチルアミド]が得られた(収率86%)。 GC/MS分析によりこの物
質は100%純粋であった。 1H NMR 分光法によって生成物の構造と一致するシグナルが得られ、98%以上の純度が示された。
の無水THF(100mL)溶液に5℃で15分間通した。反応混合物を静圧窒素下で1晩室
温で撹拌した。
光法によって生成物の構造と一致するシグナルが得られ、98%以上の純度が示された。
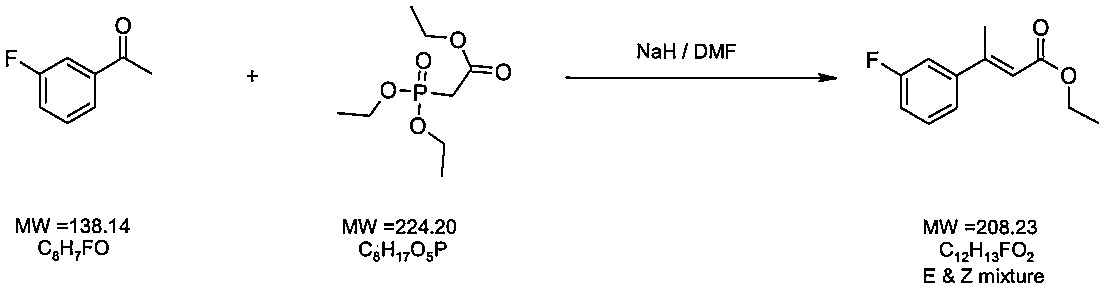
1.1eq.80mmol、3.20g)をN,N-ジメチルホルムアミド(DMF、100mL)に懸濁させ、、窒素下でトリエチルホスホノアセテートのDMF(50 mL)溶液(1.2eq.87mmol、19.50g)を滴下して処理した。添加後に反応混合液を水素化ナトリウ
ムが目視で確認できなくなるまで水浴(100℃)を使って加熱した(30分間)。混合液を室温まで冷却し、次に3’−フルオロアセトフェノン(1.0eq.72.4mmol、1
0g)のDMF溶液(50mL)で処理した。反応混合液を室温で2時間撹拌し、1mLの
分画を取り出し水中(〜2mL)で冷却した。ここへジエチルエーテル(〜2mL)を添加し、混合液を平衡化させた。GC/MS分析によって有機層を分析したところ、最初のベンゾ
フェノンは完全に消費されていた。その結果として、反応混合液に水を添加して冷却した。混合液を大きな丸底フラスコへ移し回転蒸発装置で溶媒のほとんどを除去した。混合液を冷却し[a]ジエチルエーテル(500mL)および水(250mL)を使用して分液ロ
ートへ移した。混合液を平衡化させ水層を除去した。有機層をさらに3回水で洗浄した(3x250mL)。この溶液のGC/MS分析により単一の生成物が得られたことが示された(ホスホノアセテートの残留は無かった)。有機溶液を無水MgSO4上で乾燥させ、濾過およ
び濃縮により18.09gの粗物質(水素化ナトリウムからのオイルを含む)を入手した。
3−フルオロフェニル)酪酸エチルエステル]10.1gを入手した。GC/MS分析によっ
てこの物質が94%純粋であることを確認した。本生成物を精製(鉱物油をの除去のための)しないで使用した。
た。混合液を平衡化させ、エーテル層を除去した。HCL溶液(pH〜2)を使って、水層を酸性化しジエチルエーテル(300mL)で抽出した。次に有機層を硫酸マグネシウム上で乾燥させ、濾過し、減圧下で濃縮した。この結果、橙色の粘性オイルである3−(3−フルオロフェニル)酪酸8.1gを入手した(収率92.6%)。GC/MS分析により
、この物質は100%純粋であった。
00mL)とDMF(0.7mL)との溶液を塩化オキサリル(5.43mL、7.9mmol)で0℃窒素静圧下で処理した。反応液を窒素下で1晩室温で撹拌した。減圧下で過剰なジクロロメタンを除去した。入手した残渣をトルエン(70mL)を使って共沸蒸留した。
窒素下で1晩室温で撹拌した。
浄液を合わせて減圧下で蒸発させた。その結果入手した白色固体をエチルアセテートに再溶解させた(350mL)。エチルアセテート層をH2O、1.0M HCL、炭酸水素ナトリウム飽和溶液および塩水で洗浄した。次にエチルアセテート溶液を硫酸マグネシウム上で乾燥させ、濾過し、減圧下で蒸発させた。その結果得られた白色固体を冷却したジエチルエー
テルおよびヘキサン(50:50)溶液を用いて粉末にした。この結果、乳白色の粉末3−(3−フルオロフェニル)ブチルアミド 6.8gを入手した(収率84%)。GC/MS分析によりこの物質は100%純粋であった(RおよびSの鏡像異性体の混合物)。 1H−NMR
分光法によって生成物の構造と一致するシグナルが得られ98%以上の純度が示された
。
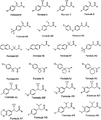
対応するアセトフェノン(以下の表1)から上述の実施例4の化合物Dの調製方法を使って化合物E−Nを調製した。さらに、化合物M(実施例13)および化合物N(実施例14)を対応するアミン、すなわち各々メチルアミンおよびジメチルアミン、から調製した。すべての最終生成物はGC/MS分析により100%純粋であった。1H−NMR 分光法によ
って各々の最終生成物の構造と一致するシグナルが得られ98%以上の純度が示された。
シアノフェノール11.9g(0.1mol)を還流させ15分間加熱した。βブチロラク
トン(8.6g 0.1mol)を還流液へ15時間以上にわたって添加した。次に反応液を室温に冷却した。反応液をジエチルエーテル(200mL)および水(200mL)を使って分液ロートへ移した。混合液を平衡化し、エーテル層を除去した。HCL溶液(pH−2)を使って、水層を酸性化しエチルアセテート(300mL)で抽出した。エチルアセテート層を硫酸マグネシウム上で乾燥させ、濾過し、減圧下で濃縮し粗生成物10.78gを入手した。
さらに精製しないで使用した。
窒素下で1晩室温で撹拌した。
過液および洗浄液を合わせて減圧下で蒸発させた。その結果入手した白色固体をエーテルに再溶解させた(250mL)。エーテル層をH2O、HCL 1.0M、炭酸水素ナトリウム飽和溶液および塩水で洗浄した。次にエーテル溶液を硫酸マグネシウム上で乾燥させ、濾過し、減圧下で蒸発させた。粗物質をBiostage SP4システム(カラムSi 40+M034
4−1,95:5, CH2Cl2: MeOH) を使用して精製した。 この結果、灰色がかった白色
の固体3−(4−シアノフェノキシ)ブチルアミド 2.987gを入手した(収率29%)
。 GC/MS分析によりこの物質は97%純粋であった。 1H NMR 分光法によって製品の構造と一致するシグナルが得られ98%以上の純度が示された。
ルシクロプロパン−1−カルボン酸クロライド]の無水CH2Cl2溶液に5℃で15分
間通した。反応混合液を室温で一夜、窒素下に攪拌した。
液中に再溶解させた。混合液をエチルアセテート(100mL)および水(60mL)を使用し
て分液ロートへ移した。混合液を平衡化し水層を除去した。有機層を1.0 M のHCl (10 mL)、H2O (70 mL)および塩水で連続して洗浄した。 有機層を無水硫酸マグネシウム上で乾燥させ、濾過し、減圧下で余剰な溶媒を蒸発させた。その結果入手した薄茶色の固体をBiostage SP4システム(カラムSi 40+S 90:10 CH2Cl2: MeOH) を使用して精製し
、白色粉末[(1R,2R)-トランス−2−フェニルシクロプロパン−1−カルボキシアミド]1.127gを入手した(54%の収率)。GC/MS分析によりこの物質は100%純
粋であった。1H−NMR 分光法によって製品の構造と一致するシグナルが得られ98%以上の純度が示された。
の溶液中で塩化オキサリル(0.65mL、7.23 mmol)で0℃窒素静圧下で処理した。反応液を窒素下で1晩室温で撹拌した。減圧下で過剰なジクロロメタンを除去した。
クロライド]のCH2Cl2 (50mL)溶液 を H−Leu−NH2[L−ロイシンアミド
、(S)―2−アミノー4―メチル−n―バレルアミド](0.761g、5.8mmol)およびトリエチレンアミン(1.13g、11.1mmol)のCH2Cl2(60mL)溶
液に0℃で滴下して加えた。反応混合物を窒素下で1晩室温で撹拌した。
液に再溶解させた。混合液をエチルアセテート(80mL)および水(50mL)を使用して分液ロートへ移した。混合液を平衡化し水層を除去した。有機層を1.0 M HCl(20 mL)、H2O(90 mL)および塩水(120mL)で連続して洗浄した。次に有機層を無水硫酸マグネ
シウム上で乾燥させ、濾過し、減圧下で余剰な溶媒を蒸発させた。その結果入手した橙茶色の固体をBiostage SP4システム(カラムSi 40+M 90:10 CH2Cl2: MeOH) を使用して精製し、白色粉末[(1R,2R)−2−フェニルシクロプロパンカルボン酸((S)−1−カルバモイル−3−メチルブチル)−アミド]0.365gを入手した(24%の収率)。GC/MS分析によりこの物質は100%純粋であった。1H−NMR 分光法によって
製品の構造と一致するシグナルが得られ98%以上の純度が示された。
拌した懸濁液を1−(4−メトキシフェニル)−1−シクロプロパンカルボン酸(0.1406mol)で0℃でエーテル100mL中で処理する。次に反応混合物を窒素下で1晩
室温で撹拌する。反応混合液を脱イオン水100mLを滴下し冷却する。混合液を濾過し、ケーキ状の固体をジエチルエーテル(1L)で洗浄する。濾過した混合液(エーテルおよび水)を分液ロートへ移す。有機層を水層から分離し塩水で洗浄する。次にエーテル層を硫酸マグネシウム上で乾燥させ、濾過し、室温減圧下で濃縮させる。その結果、[1−(
4−メトキシフェニル)シクロプロピル]‐メタノールを入手する。
未希釈液を三臭化リン(0.081mol)を静圧窒素下に0℃で滴下して処理する。反応
液を130℃まで加熱し、その温度を6時間維持する。反応混合液を室温まで冷却し橙色の沈殿物を濾過する。橙色の沈殿物をジエチルエーテル200mLで洗浄する。水150mLおよびジエチルエーテル200mLを使用して濾液を分液ロートへ移す。混合液を平衡化し水層をジエチルエーテル200mLでもう1回抽出する。エーテル抽出物およびエーテル洗浄液を合わせて、炭酸水素ナトリウム飽和溶液および食塩水で洗浄する。次にエーテル抽出物を硫酸マグネシウム上で乾燥させ、余剰のジエチルエーテルを30℃減圧下で除去する。この結果、1−(1−ブロモメチル−シクロプロピル)−4−メトキシベンゼンを入手する。この粗物質をさらに精製しないで対応するニトリルへ変換させる。
l)のジメチルスルホキシド(60mL)粗溶液をシアン化ナトリウム(180.7mmol
)で処理する。反応混合液を、窒素下で1晩95℃で加熱する。反応液を塩水(150mL)およびクロロホルム(300mL)を使用して分液ロートへ移す。反応混合液を平衡化し水層を除去する。さらに2回クロロホルム(2x300mL)を使って水層を抽出する。有機抽出液を合わせて無水硫酸マグネシウム上で乾燥させ、濾過し、減圧下で濃縮させ[1−(4−メトキシフェニル)シクロプロピル]アセトニトリルを入手する。この粗物質をさらに精製しないで次の段階で(ニトリルの対応するアミドへの加水分解)使用する。[または、本物質から、酸加水分解(例えば、 硫酸を使用)によって対応するカルボン酸を入手できる。]
[1−(4−メトキシ−フェニル)シクロプロピル)アセトニトリル(60.4mmol)
のDMSO(75mL)溶液をH2O2(50%w/w)(434mmol)および炭酸カリウム(121mmol)を使って0°Cで処理する。反応混合液を室温で週末中、撹拌する。反応混合液を水(100mL)およびCH2Cl2(200mL)を使用して分液ロートへ移す。反応混合液を平衡化しCH2Cl2層を除去する。水層をさらに2回CH2Cl2(2x300mL)で抽出する。CH2Cl2抽出液を合わせて、水で5回連続して洗浄した後(5x200mL)、塩水(500mL)で洗浄し、無水硫酸マグネシウム上で乾燥させ、濾過し、減圧下で濃縮して、2−[1−(4−メトキシフェニル)−シクロプロピル]―アセトアミドを入手する。
拌した懸濁液を2−(4−クロロフェノキシ)−2−メチルプロパン酸(0.1406mol)を使って0℃エーテル100mL中で処理する。反応混合物を窒素下で1晩室温で撹拌する。反応混合液を脱イオン水100mLを滴下し冷却する。混合液を濾過し、ケーキ状固体をジエチルエーテル(1L)で洗浄する。濾過した混合液(エーテルおよび水)を分液ロートへ移す。有機層を水層から分離し塩水で洗浄する。次にエーテル層を硫酸マグネシウム上で乾燥させ、濾過し、室温減圧下で濃縮させる。この結果、2−(4−クロロフェノキシ)−2−メチルプロパン−1−オールを入手する。
応液を130℃まで加熱しその温度を6時間維持する。反応混合液を室温へ冷却し橙色の沈殿物を濾過する。橙色の沈殿物をジエチルエーテル200mLで洗浄する。水150m
Lおよびジエチルエーテル200mLを使用して濾液を分液ロートへ移す。混合液を平衡化し、水層をジエチルエーテル200mLでもう1回抽出する。エーテル抽出液およびエーテル洗浄液を合わせて、炭酸水素ナトリウム飽和溶液および塩水で洗浄する。次にエーテル抽出物を硫酸マグネシウム上で乾燥させ、余剰のジエチルエーテルを30℃、減圧下で除去する。この結果、1−(2−ブロモ−1,1−ジメチルエトキシ)−4−クロロベンゼンを入手する。1−(2−ブロモ−1,1−ジメチルエトキシ)−4−クロロベンゼンの粗生成物をさらに精製しないで対応するニトリルへ変換する。
(4−クロロフェノキシ)−3−メチルブチロニトリルを入手する。この粗物質をさらに精製しないで次の段階で(ニトリルの対応するアミドへの加水分解)使用する。[または、本物質から、酸加水分解(例えば、 硫酸を使用)によって対応するカルボン酸を入手できる。]
(3−(4−クロロフェノキシ)−3−メチルブチロニトリル(60.4mmol)のDM
SO(75mL)溶液をH2O2(50%w/w)(434mmol)および炭酸カリウム(121mmol)を使って0°Cで処理する。反応混合液を室温で週末の間、撹拌する。反応混合液を水(100mL)およびCH2Cl2(200mL)を使用して分液ロートへ移す。反応混合液を平衡化しCH2Cl2層を除去する。さらに水層を2回CH2Cl2(2x300mL)を使って抽出する。CH2Cl2抽出液を合わせて水で5回連続して洗浄した後(5x200mL)、塩水(500mL)で洗浄し、無水硫酸マグネシウム上で乾燥させ、濾過し、減圧下で濃縮し、3
−(4−クロロフェノキシ)−3−メチルブチルアミドを入手する。
]の調製。
還流冷却器のある25mL丸底フラスコへ加える。フラスコをアルゴンでフラッシュし、1,4−ジオキサン(3mL)および脱イオン水(0.5mL)で充填する。得られた反応混合液を100℃で16時間攪拌する。(R)−3−(4−トリフルオロメチルフェニル)ブチルアミドをエチルアセテートで抽出し、塩水で洗浄し無水硫酸マグネシウム上で乾燥させる。シリカゲル上のクロマトグラフィーによって所望の生成物が得られる。
アセテート(2x100mL)で抽出した。有機層を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濾液をヘキサン/エチルアセテートから白色固体が再結晶するまで濃縮
し、5.42gの3−(4−トリフルオロメチルフェニル)ペント−2−エン酸メチルエ
ステル中間体を得た(85%の収率)。
/Cを追加(500mg)し懸濁液をさらに24時間振盪した。懸濁液を濾過し、濾液を濃縮し半固体を入手した(4.97g)。固体をCH2Cl2(30mL)に溶解し、その結果得られた溶液を0℃まで冷却した。この溶液へ塩化オキサリルを加え、9インチ使い捨てピペットを使ってDMFを1滴添加した。この溶液を8時間撹拌し、濃縮して固体とし、追加のCH2Cl2(30mL)に溶解させた。この溶液を再度濃縮して半固体を得、追加のCH2Cl2(50mL)に溶解させ、得られた溶液を、機械的に撹拌させた冷却(5℃)NH4OH
(10 mL) 溶液へ約5分間かけて滴下した。次に懸濁液を濃縮し、粘性のある混合液を
入手しエチルアセテート(2x100mL)で抽出した。エチルアセテート抽出液を合わ
せて、硫酸マグネシウム上で乾燥させ、濾過し、濾液を濃縮し、琥珀色の粗固体を入手しCH2Cl2/THFを使用してシリカゲル(50g)へ吸収させた。この固体をシリカゲル(EtOAc/ヘキサン)のクロマトグラフィーで処理し、2.25gの灰色がかった白色の固体を
入手した(37%の収率)。この物質はLC/MSにより100%純粋であった。H-NMR によ
り、物質の構造と一致するシグナルが得られ98%以上の純度が示された。
、エチルアセテート(2x100mL)で抽出した。有機層を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濾液を濃縮して白色固体(4.98g)を得、さらにそれをヘキサン/エチルアセテートから再結晶させて、5.93gの3−(4−イソブチルフェニル)ブタ−2−エン酸メチルエステル中間体を得た(85%の収率)。
抽出液を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濃縮させて固体(4.98g)を入手し、MeOH/THF(2:1,50mL)に溶解させ10%Pd/Cと水素圧下50psiで24時間振盪した。TLCにより反応が不完全であったことが示された。10%Pd
/Cを追加(500mg)し懸濁液をさらに24時間振盪した。この懸濁液を濾過し、濾液を濃縮し固体を入手した(4.75g)。この固体をCH2Cl2(30mL)に溶解し、その結果得られた溶液を0℃に冷却した。この溶液に塩化オキサリルを加えた後、9インチ使い捨てピペットを使ってDMFを1滴添加した。この溶液を6時間撹拌し、濃縮して固体を得、追加のCH2Cl2(30mL)に溶解させた。この溶液を再度濃縮して半固体を得、追加のCH2Cl2(50mL)に溶解させ、得られた溶液を、機械的に撹拌しながら冷却した(5℃)NH4OH (10 mL) 溶液へ約5分間かけて滴下した。次にこの懸濁液を濃縮し、
固体/水の混合物を入手しエチルアセテート(2x100mL)で抽出した。エチルアセテート抽出液を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濾液を濃縮し、粗固体を入手しCH2Cl2/THFを使用してシリカゲル(50g)へ吸収させた。この固体をシリカゲル(EtOAc/ヘキサン)を使ったクロマトグラフィーで処理し、2.5gの灰色がかった
白色の固体を入手した(40%の収率)。この物質はLC/MSにより100%純粋であった
。. H-NMR により、物質の構造と一致するシグナルが得られ98%以上の純度が示された。
製。
セテート(2x100mL)で抽出した。有機層を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濾液を濃縮し白色固体を得、ヘキサン/エチルアセテートから再結晶して
、5.88gの3−(6−メトキシナフタレン−2−イル)ブタ−2−エン酸メチルエステル中間体を得た(92%の収率)。
/MeOH溶液に水酸化ナトリウム水溶液(15mL)を加えた。その結果得られた水溶液を室温で12時間撹拌し、酢酸(3g)を添加した。この溶液を濃縮し固体残渣を入手した。この固体を酢酸エチル(150mL)に溶解させ水(3x100mL)で洗浄した。
酢酸エチル抽出液を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濃縮させて固体を入手し、MeOH/THF(2:1,50mL)に溶解させ10%Pd/Cと水素圧下50psi
で24時間振盪した。TLCにより反応が不完全であったことが示された。10%Pd/Cを追加(500mg)し懸濁液をさらに24時間振盪した。この懸濁液を濾過し、濾液を濃縮し半固体を入手した(4.97g)。この固体をCH2Cl2(30mL)に溶解し、その結果得られた溶液を0℃まで冷却した。この溶液へ塩化オキサリルを加えた後、9インチ使い捨てピペットを使ってDMFを一度に加えた。この溶液を6時間撹拌し、濃縮して固体を得、追加のCH2Cl2(30mL)に溶解させた。この溶液を再度濃縮して半固体を得、追加のCH2Cl2(50mL)に溶解させ、得られた溶液を、機械的に撹拌した冷却(5℃)NH4OH (10 mL) 溶液へ約15分間かけて滴下した。次にこの懸濁液を濃縮し、粘性物
質と水の混合液を入手しエチルアセテート(2x100mL)で抽出した。エチルアセテ
ート抽出液を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濾液を濃縮し、粗固体を入手しCH2Cl2/THFを使用してシリカゲル(50g)に吸収させた。この固体をシリカゲル(EtOAc/ヘキサン)を使ったクロマトグラフィーにより処理し、1.87gの灰色が
かった白色の固体を入手した(32%の収率)。LC/MSによりこの物質は100%純粋で
あった。H-NMR により、物質の構造と一致するシグナルが得られ98%以上の純度が示された。
製。
にイソブチルクロロホルメートを加え、TEAを滴下した。その結果得られた白色のスラリ
ーを1時間撹拌しTHF(50mL)で希釈して濾過した。濾過したケーキ状固体を追加のTHF(50mL)で洗浄し、濾液を回転式蒸発器で約50mLまで濃縮した。濃縮された濾液を−20℃で撹拌し、 NaBH4 水溶液(20mL)を15分間かけて滴下した。その結果得
られた懸濁液を0℃で2時間撹拌し、水(200mL)で希釈し、エチルアセテート(2
x100mL)で抽出した。エチルアセテート層を合わせて、1.0N HCl溶液(100mL)で洗浄し5%炭酸水素塩溶液で洗浄した(100mL)。このエチルアセテート溶液を濃縮しオイル状の残渣である2−(2−フルオロービフェニル−4−イル)プロパノールを入手した(4.47g、95%の収率)。
白色のスラリーを1時間撹拌し水(200mL)で希釈した。この懸濁液をCH2Cl2 (2 x 100 mL)で抽出した。CH2Cl2層を合わせて、水(2x100mL)および5%NH4OH (100mL)を加えた。CH2Cl2 層を追加の水(200mL)で洗浄し、硫酸マグネシウム上で乾燥
させた。CH2Cl2層を濃縮しオイル状の残渣を入手し無水DMF(50mL)に溶解させた。この溶液をNaCNで処理し60℃で14時間撹拌した。TLCにより1個の主要な、より極性の
低い溶出生成物(メシレートに比較して)と複数の微量の極性が主要生成物およびメシレートに比較して、より低い溶出生成物が示された。反応を室温まで冷却し水(100mL
)で希釈した。この溶液をエチルアセテート(2x100mL)で抽出し、硫酸マグネシ
ウム上で乾燥させ濃縮しオイル状残渣を入手し、シリカゲルを使ったクロマトグラフィー(90% Hex、10%EtOAc)により3−(2−フルオロ−ビフェニル−4−イル)ブチロニトリルをオイルとして入手したが、これはゆっくりと室温で固化した(2.05g、49%の収率)。
溶液に水酸化カリウムの微粉末1.87gを添加した。その結果得られた懸濁液を撹拌し、70℃まで温め、2.5時間加熱し室温まで冷却した。反応懸濁液を1.0N HCl溶液(100mL)で希釈しエチルアセテート(2x100mL)で抽出した。エチルアセテート抽出液を合わせて5%炭酸水素塩溶液(100mL)で、続いて水(100mL)で洗浄した。次に有機物を硫酸マグネシウム上で乾燥させ濃縮して白色固体を得、EtOAc/Hexで数
回再結晶させ白色の剥片状のプリズム結晶を入手した(1.62g、75%収率)。
調製。
ート(2x100mL)で抽出した。有機層を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濾液を濃縮して白色固体を得、ヘキサン/エチルアセテートから再結晶させて
、3.33gの3−(4−モルホリノフェニル)ブタ−2−エン酸メチルエステル中間体
を得た(69.9%の収率)。
溶液を濃縮しオイルを入手した。オイルを酢酸エチル(150mL)に溶解させ水(3x1
00mL)で洗浄した。酢酸エチル抽出液を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濃縮して不定形の固体を入手し、MeOH(50mL)に溶解させ10%Pd/Cを加
えて水素圧下50psiで8時間振盪した。TLCにより反応が完了したことが示された。
この懸濁液を濾過し、濾液を濃縮し半固体を入手した(2.77g)。この半固体をCH2Cl2(30mL)に溶解させ、その結果得られた溶液を0℃に冷却した。この溶液に塩化オキサリルを加えた後、9インチ使い捨てピペットを使ってDMFを1滴添加した。この溶液を4時間撹拌し、濃縮して固体を得、追加のCH2Cl2(30mL)に溶解させた。この溶液を再度濃縮して半固体を得、、追加のCH2Cl2(50mL)に溶解させ、得られた溶液を、機械的に撹拌させた冷却(5℃)NH4OH (15mL) 溶液へ約5分間かけて滴下した。次にこの溶液を濃縮し、固体/水の混合物を入手しエチルアセテート(2x100mL)で抽出した。エチルアセテート抽出液を合わせて、硫酸マグネシウム上で乾燥させ、濾過し、濾液を濃縮し、粗固体を入手しCH2Cl2/THFを使用してシリカゲル(50g)に吸収させた。この固体をシリカゲル(EtOAc/ヘキサン)のクロマトグラフィーで処理し、2.
1gのベージュ色の平板状固体を入手した(46%の収率)。LC/MSにより、この物質は
100%純粋であった。. H-NMR で測定し、物質の構造と一致するシグナルが得られ98%以上の純度が示された。
S)−1―カルバモイル−プロピル)アミド]の調製。
よびトリエチレンアミン(3.36g、33.2mmol)のCH2Cl2 (60mL)溶液中に、0℃で滴下した。反応混合物を窒素下で1晩室温で撹拌した。
合液に再溶解させた。この混合液をエチルアセテート(80mL)および水(50mL)を使用して分液ロートへ移した。混合液を平衡化し水層を除去した。有機層をHCl 1.0 M(20
mL)、 H2O (90 mL)および塩水(120mL)で連続して洗浄した。この有機層を無水
硫酸マグネシウム上で乾燥、濾過し、減圧下で余剰な溶媒を蒸発させた。その結果入手した橙茶色の固体をBiostage SP4システム(カラムSi 40+M 90:10 CH2Cl2/ MeOH)を使用して精製し、白色粉末0.365gを入手した(24%の収率)。GC/MSによりこの物質は100%純粋であった。. 1H-NMRで測定し、物質の構造と一致するシ
グナルが得られ98%以上の純度が示された。
1−15)の合成の追加の実施例を示し、それらから当業者は本発明のさまざまな追加化合物の調製について想像することが可能である。
本発明の多様な化合物の抗痙攣作用は、多種の齧歯類(マウスおよびラット)癲癇モデルにおいてin vivoで証明された。動物実験をWhite ら、「抗癲癇薬の発見と非臨床試験
による開発」(Discovery and preclinical development of antiepileptic drugs), in
Antiepileptic Drugs, 5th ed., Levy et al.(Eds.), Lippincott Williams and Wilkins, Philadelphia, PA, 2002 (968 pp.), pp. 36-48 の記載に従って実施し、参照により
その全体が本明細書に組み込まれる。化合物A、G、H、IおよびFの結果を以下の表2お
よび3に要約して示す。
本発明のさまざまな化合物の抗痙攣活性はまた、2つのラットの癲癇重積状態モデルにおいてin vivoで証明された。米国国立衛生研究所(NIH)の米国国立神経疾患脳卒中研究所(NINDS)の抗痙攣剤スクリーニングプログラム(ASP)で開発されたプロトコルに従って動物実験を実施した。表4に結果の要約を示す。
化合物A、I、HおよびFについてStem Cell Innovations, Inc. (Houston, TX) のヒト肝細胞に基づくアッセイACTIVTox(R)(C3A肝細胞を使用)で試験を実施した。 具体的には、試験化合物を多種類の濃度で、乳酸脱水素酵素LDHの放出を測るLDH放出アッセイ(細胞死の指標)で試験した。
よりも非常に高い。従って100μM量の標準試験濃度(比較の目的で)を使用して、陰
性対照群の吸光度に対する試験化合物存在下での吸光度(LDH放出レベルの測定)の比は
、「平均倍数」(平均倍数=平均吸光度/陰性対照の平均吸光度)値として知られている
。1.75以下のAVFは、LDH放出アッセイでは試験化合物は、細胞毒性または肝毒性作用が無いことを意味する。
< 100 μM)では細胞毒性または肝毒性がないことを示す。
1.15および1.25であった100μM濃度では増殖中の細胞に対する毒性がないこ
とが示された。
本発明の開示に以下の発明の記載が含まれる。
[1]式Iを有するCNS活性化合物であって、
該任意に置換された芳香環系は、フェニル、フェノキシ、およびヘテロサイクリックアリルからなる群から選択され、ここで5個までの置換基が任意に芳香環上にあってもよく、各置換基は水素、アルキル、シクロアルキル、ハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキル、アルキレンジオキシ、ハロアルキル、ハロアルコキシ、OH、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、NO2、CHO、CH3CH(OH)、アセチル、およびOCH2COOHからなる群から独立して選択され
R1およびR2は各々独立して、H、任意に置換されたアルキル、任意に置換されたシクロアルキル、または任意に置換されたCW2フェニルであり、ここで各Wは両方のWがエチルでないという条件で、H、メチルおよびエチルからからなる群から独立して選択され、さらにここで、フェニル基またはシクロアルキル基には5個までの置換基が任意に含まれ、各置換基は独立してハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、スルホニルアルキル、ハロアルキル、ハロアルコキシ、CONH2、CN、アセトキシ、N(アルキル)2、NO2およびアセチルからなる群から選択され、R1またはR2の一方がHの場合には、他方のR1またはR2は、(CH2)2SO3Hまたは CHZCOOHであり、ここでZはH、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2およびCH(CH3)CH2CH3からなる群の一つであり、またはR1およびR2が共にシクロアルキル基であり、
R3は、ヒドロキシ、アルキル、シクロアルキルのうちの一つであるか、またはR4も共に、R3またはR4の一方がOHの場合には他方のR3またはR4がエチルでないという条件で、シクロアルキルであり、
R4がアルキル、シクロアルキルのうちのひとつであり、またはR3も共にシクロアルキルであり、そして
Xが、無置換、メチレン、ケトン、CHOH、酸素、NR1、硫黄、スルホンまたはスルホキシドのうちの1つである化合物。
[2]式IIを有するCNS活性化合物であって、
R4およびR5は、各々独立して任意に置換されたフェニルまたは任意に置換されたヘテロサイクリックアリル基であり、ここで5個までの置換基を含んでも良く、各置換基はハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキル、ハロアルコキシ、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、NO2、アセチルおよびOCH2COOHからなる群から独立して選択され、
Yは無置換またはメチレンのいずれかである化合物。
[3]式1〜9のうちの一つを有するCNS活性化合物であって
Zは、H、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2またはCH(CH3)CH2CH3のうちの一つであり、
R2およびR3は、独立してHまたはCH3のうちの一つであり、
R4は、H、CH3、OH、またはOCH3のうちの一つであり、
R5は、H、Cl、F、CF3、CN、C1-C5 アルキル、C1-C5アルコキシ、OCF3または CONR1R2のうちの1つであり、
n=1〜5、
Q=O、NR2、C=O、S、SO、またはSO2であり、そして
X = O、NR2、または無置換、C=O、S、SO、またはSO2である化合物。
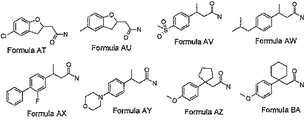
[4]式A〜BA:
[5]CNS活性を調節する医薬組成物であって、該組成物が、
医薬上許容できる担体および
前記担体と結合させた[1]〜[4]のうちの一つに記載されたCNSに活性のある化合物を含む医薬組成物。
[6]さらに医薬品添加物を含む[5]に記載の医薬組成物。
[7][5]に記載の医薬組成物であって、CNS活性化合物のCNS活性調節の治療有効量を含む医薬組成物。
[8][7]に記載の医薬組成物であって、
患者に抗痙攣作用を提供する、
患者の痙攣を治療および/または予防する、
患者のてんかん発作を治療および/または予防する、
患者の痙性を治療および/または予防する、
患者の感情障害を治療および/または予防する、
患者の双極性感情障害を治療および/または予防する、
患者の慢性頭痛を治療および/または予防する、
患者の群発性頭痛を治療および/または予防する、
患者の片頭痛を治療および/または予防する、
患者の静止不能症候群を治療および/または予防する、
患者の神経因性疼痛を治療および/または予防する、あるいは
患者の運動障害を治療および/または予防する、
ための治療の少なくとも一つに充分な治療有効量を含む医薬組成物。
[9]CNS活性を調節する方法であって
[1]〜[4]のいずれか一つに記載のCNS活性化合物を患者に投与することを含む方法。
[10]CNS活性化合物が医薬上許容できる担体に結合された、[9]に記載の方法。
[11]CNS活性化合物の、患者のCNS活性を調節する治療有効量が患者に投与される[9]に記載の方法。
[12][11]に記載の方法であって、
患者に抗痙攣作用を提供する、
患者の痙攣を治療および/または予防する、
患者の癲癇発作を治療および/または予防する、
患者の痙性を治療および/または予防する、
患者の感情障害を治療および/または予防する、
患者の双極性感情障害を治療および/または予防する、
患者の慢性頭痛を治療および/または予防する、
患者の群発性頭痛を治療および/または予防する、
患者の片頭痛を治療および/または予防する、
患者の静止不能症候群を治療および/または予防する、
患者の神経因性疼痛を治療および/または予防する、あるいは
患者の運動障害を治療および/または予防する、
治療のうちの少なくとも一つについて十分な治療有効量が患者に投与される[11に記載の方法。
[13][11]に記載の方法であって、前記の治療有効量が不安、抑鬱、不眠、片頭痛、統合失調症、パーキンソン病、痙性、アルツハイマー病、双極性障害、慢性または神経因性疼痛、脳卒中、慢性神経変性疾患、ハンチントン病、脳損傷、脊髄損傷または癲癇重積状態の少なくとも1つの治療および/または予防に十分である方法。
[14][11]に記載の方法であって、前記の治療有効量が化学的対応策として十分な方法。
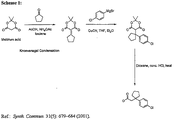
[15]CNS活性化合物[3−(4−シアノフェノキシ)ブチルアミド]を製造する方法であって、
[16][15]に記載の方法であって、さらに、
塩基性溶液中で4−シアノフェノ−ルを還流しながら加熱する方法と、
β-ブチロラクトンを還流溶液へ添加する方法と、
該溶液を室温に冷却する方法と、
水およびジエチルエ―テルを添加して該溶液の二相混合液を調製する方法と、
形成後にジエチルエーテル相を除去する方法と、
形成後に水相にpH〜2のHCl溶液を添加して酸性化する方法と、
酸性化した水相をエチルアセテートで抽出する方法と、
エチルアセテート層を乾燥させ3−(4−シアノフェノキシ)酪酸を生成する方法と、
有機溶媒で3−(4−シアノフェノキシ)酪酸の溶液を調製する方法と、
塩化オキサリルで該溶液を処理して[3−(4−シアノフェノキシ)ブチリルクロライド]を得る方法と、
3−(4−シアノフェノキシ)ブチリルクロライド溶液へアンモニアガスを発泡により通す方法と、そして
該溶液から[3−(4−シアノフェノキシ)ブチルアミド]を入手する方法
を含む製造方法。
本発明の開示に以下の発明の記載が含まれる。
[1]式Iを有するCNS活性化合物であって、
該任意に置換された芳香環系は、フェニル、フェノキシ、およびヘテロサイクリックアリルからなる群から選択され、ここで5個までの置換基が任意に芳香環上にあってもよく、各置換基は水素、アルキル、シクロアルキル、ハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキル、アルキレンジオキシ、ハロアルキル、ハロアルコキシ、OH、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、NO2、CHO、CH3CH(OH)、アセチル、およびOCH2COOHからなる群から独立して選択され
R1およびR2は各々独立して、H、任意に置換されたアルキル、任意に置換されたシクロアルキル、または任意に置換されたCW2フェニルであり、ここで各Wは両方のWがエチルでないという条件で、H、メチルおよびエチルからからなる群から独立して選択され、さらにここで、フェニル基またはシクロアルキル基には5個までの置換基が任意に含まれ、各置換基は独立してハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、スルホニルアルキル、ハロアルキル、ハロアルコキシ、CONH2、CN、アセトキシ、N(アルキル)2、NO2およびアセチルからなる群から選択され、R1またはR2の一方がHの場合には、他方のR1またはR2は、(CH2)2SO3Hまたは CHZCOOHであり、ここでZはH、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2およびCH(CH3)CH2CH3からなる群の一つであり、またはR1およびR2が共にシクロアルキル基であり、
R3は、ヒドロキシ、アルキル、シクロアルキルのうちの一つであるか、またはR4も共に、R3またはR4の一方がOHの場合には他方のR3またはR4がエチルでないという条件で、シクロアルキルであり、
R4がアルキル、シクロアルキルのうちのひとつであり、またはR3も共にシクロアルキルであり、そして
Xが、無置換、メチレン、ケトン、CHOH、酸素、NR1、硫黄、スルホンまたはスルホキシドのうちの1つである化合物。
[2]式IIを有するCNS活性化合物であって、
R4およびR5は、各々独立して任意に置換されたフェニルまたは任意に置換されたヘテロサイクリックアリル基であり、ここで5個までの置換基を含んでも良く、各置換基はハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキル、ハロアルコキシ、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、NO2、アセチルおよびOCH2COOHからなる群から独立して選択され、
Yは無置換またはメチレンのいずれかである化合物。
[3]式1〜9のうちの一つを有するCNS活性化合物であって
Zは、H、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2またはCH(CH3)CH2CH3のうちの一つであり、
R2およびR3は、独立してHまたはCH3のうちの一つであり、
R4は、H、CH3、OH、またはOCH3のうちの一つであり、
R5は、H、Cl、F、CF3、CN、C1−C5 アルキル、C1−C5アルコキシ、OCF3または CONR1R2のうちの1つであり、
n=1〜5、
Q=O、NR2、C=O、S、SO、またはSO2であり、そして
X = O、NR2、または無置換、C=O、S、SO、またはSO2である化合物。
[4]式A〜BA:
[5]CNS活性を調節する医薬組成物であって、該組成物が、
医薬上許容できる担体および
前記担体と結合させた[1]〜[4]のうちの一つに記載されたCNSに活性のある化合物を含む医薬組成物。
[6]さらに医薬品添加物を含む[5]に記載の医薬組成物。
[7][5]に記載の医薬組成物であって、CNS活性化合物のCNS活性調節の治療有効量を含む医薬組成物。
[8][7]に記載の医薬組成物であって、
患者に抗痙攣作用を提供する、
患者の痙攣を治療および/または予防する、
患者のてんかん発作を治療および/または予防する、
患者の痙性を治療および/または予防する、
患者の感情障害を治療および/または予防する、
患者の双極性感情障害を治療および/または予防する、
患者の慢性頭痛を治療および/または予防する、
患者の群発性頭痛を治療および/または予防する、
患者の片頭痛を治療および/または予防する、
患者の静止不能症候群を治療および/または予防する、
患者の神経因性疼痛を治療および/または予防する、あるいは
患者の運動障害を治療および/または予防する、
ための治療の少なくとも一つに充分な治療有効量を含む医薬組成物。
[9]CNS活性を調節する方法であって
[1]〜[4]のいずれか一つに記載のCNS活性化合物を患者に投与することを含む方法。
[10]CNS活性化合物が医薬上許容できる担体に結合された、[9]に記載の方法。
[11]CNS活性化合物の、患者のCNS活性を調節する治療有効量が患者に投与される[9]に記載の方法。
[12][11]に記載の方法であって、
患者に抗痙攣作用を提供する、
患者の痙攣を治療および/または予防する、
患者の癲癇発作を治療および/または予防する、
患者の痙性を治療および/または予防する、
患者の感情障害を治療および/または予防する、
患者の双極性感情障害を治療および/または予防する、
患者の慢性頭痛を治療および/または予防する、
患者の群発性頭痛を治療および/または予防する、
患者の片頭痛を治療および/または予防する、
患者の静止不能症候群を治療および/または予防する、
患者の神経因性疼痛を治療および/または予防する、あるいは
患者の運動障害を治療および/または予防する、
治療のうちの少なくとも一つについて十分な治療有効量が患者に投与される[11に記載の方法。
[13][11]に記載の方法であって、前記の治療有効量が不安、抑鬱、不眠、片頭痛、統合失調症、パーキンソン病、痙性、アルツハイマー病、双極性障害、慢性または神経因性疼痛、脳卒中、慢性神経変性疾患、ハンチントン病、脳損傷、脊髄損傷または癲癇重積状態の少なくとも1つの治療および/または予防に十分である方法。
[14][11]に記載の方法であって、前記の治療有効量が化学的対応策として十分な方法。
[15]CNS活性化合物[3−(4−シアノフェノキシ)ブチルアミド]を製造する方法であって、
[16][15]に記載の方法であって、さらに、
塩基性溶液中で4−シアノフェノ−ルを還流しながら加熱する方法と、
β−ブチロラクトンを還流溶液へ添加する方法と、
該溶液を室温に冷却する方法と、
水およびジエチルエ―テルを添加して該溶液の二相混合液を調製する方法と、
形成後にジエチルエーテル相を除去する方法と、
形成後に水相にpH〜2のHCl溶液を添加して酸性化する方法と、
酸性化した水相をエチルアセテートで抽出する方法と、
エチルアセテート層を乾燥させ3−(4−シアノフェノキシ)酪酸を生成する方法と、
有機溶媒で3−(4−シアノフェノキシ)酪酸の溶液を調製する方法と、
塩化オキサリルで該溶液を処理して[3−(4−シアノフェノキシ)ブチリルクロライド]を得る方法と、
3−(4−シアノフェノキシ)ブチリルクロライド溶液へアンモニアガスを発泡により通す方法と、そして
該溶液から[3−(4−シアノフェノキシ)ブチルアミド]を入手する方法
を含む製造方法。
Claims (16)
- 式Iを有するCNS活性化合物であって、
れたテトラヒドロナフチル、任意に置換されたインダンまたは任意に置換されたヘテロサイクリックアリルであり、ここでArには最高5個までの置換基が任意に存在して良く、各置換基は独立して、水素、アルキル、シクロアルキル、ハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、スルホニルアルキル、アルキレンジオキシ、ハロアルキル、ハロアルコキシ、OH、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、ベンジル、ベンジロキシ、α,α-ジメチルベンジル、NO2、CHO、CH3CH(OH)、アセチル、OCH2COOHおよび任
意に置換された芳香環系からなる群から選択され、
該任意に置換された芳香環系は、フェニル、フェノキシ、およびヘテロサイクリックアリルからなる群から選択され、ここで5個までの置換基が任意に芳香環上にあってもよく、各置換基は水素、アルキル、シクロアルキル、ハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキル、アルキレンジオキシ、ハロアルキル、ハロ
アルコキシ、OH、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、NO2、CHO、CH3CH(OH)
、アセチル、およびOCH2COOHからなる群から独立して選択され
R1およびR2は各々独立して、H、任意に置換されたアルキル、任意に置換されたシクロ
アルキル、または任意に置換されたCW2フェニルであり、ここで各Wは両方のWがエチルで
ないという条件で、H、メチルおよびエチルからからなる群から独立して選択され、さら
にここで、フェニル基またはシクロアルキル基には5個までの置換基が任意に含まれ、各置換基は独立してハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、スルホニルアルキル、ハロアルキル、ハロアルコキシ、CONH2、CN、アセトキシ、N(アルキル)2、NO2およびアセチルからなる群から選択され、R1 または R2の一方がHの場合には、他方のR1またはR2は、(CH2)2SO3Hまたは CHZCOOHであり、ここでZはH、CH3、CH(CH3)2、CH2C6H5
、CH2CH(CH3)2およびCH(CH3)CH2CH3からなる群の一つであり、またはR1およびR2が共にシクロアルキル基であり、
R3は、ヒドロキシ、アルキル、シクロアルキルのうちの一つであるか、またはR4も共に、R3またはR4の一方がOHの場合には他方のR3またはR4がエチルでないという条件で、シクロアルキルであり、
R4がアルキル、シクロアルキルのうちのひとつであり、またはR3も共にシクロアルキルであり、そして
Xが、無置換、メチレン、ケトン、CHOH、酸素、NR1、硫黄、スルホンまたはスルホキシドのうちの1つである化合物。 - 式IIを有するCNS活性化合物であって、
メチルおよびエチルからなる群から独立して選択され、そしてここでフェニル基またはシクロアルキル基には5個までの置換基が含まれても良く、各置換基は独立してハロゲン、アルコキシ、チオアルキル、スルホキシアルキル、スルホニルアルキル、ハロアルキル、ハロアルコキシ、CONH2、CN、アセトキシ、N(アルキル)2、NO2 およびアセチルからなる
群から選択され、R1またはR2の一方がHの場合には、他方のR1 または R2は、(CH2)2SO3H
またはCHZCOOHであり、ここでZはH、CH3、 CH(CH3)2、CH2C6H5、CH2CH(CH3)2およびCH(CH3)CH2CH3からなる群のうちの1つであるか、またはR1およびR2は共にシクロアルキル基であり、
R4およびR5は、各々独立して任意に置換されたフェニルまたは任意に置換されたヘテロサイクリックアリル基であり、ここで5個までの置換基を含んでも良く、各置換基はハロ
ゲン、アルコキシ、チオアルキル、スルホキシアルキル、 スルホニルアルキル、ハロア
ルコキシ、CH2OH、CONH2、CN、アセトキシ、N(アルキル)2、NO2、アセチルおよびOCH2COOHからなる群から独立して選択され、
Yは無置換またはメチレンのいずれかである化合物。 - 式1〜9のうちの一つを有するCNS活性化合物であって
Zは、H、CH3、CH(CH3)2、CH2C6H5、CH2CH(CH3)2またはCH(CH3)CH2CH3のうちの一つであり、
R2およびR3は、独立してHまたはCH3のうちの一つであり、
R4は、H、CH3、OH、またはOCH3のうちの一つであり、
R5は、H、Cl、F、CF3、CN、C1-C5 アルキル、C1-C5アルコキシ、OCF3または CONR1R2の
うちの1つであり、
n=1〜5、
Q=O、NR2、C=O、S、SO、またはSO2であり、そして
X = O、NR2、または無置換、C=O、S、SO、またはSO2である化合物。 - CNS活性を調節する医薬組成物であって、該組成物が、
医薬上許容できる担体および
前記担体と結合させた請求項1〜4のうちの一つに記載されたCNSに活性のある化合物を
含む医薬組成物。 - さらに医薬品添加物を含む請求項5に記載の医薬組成物。
- 請求項5に記載の医薬組成物であって、CNS活性化合物のCNS活性調節の治療有効量を含む医薬組成物。
- 請求項7に記載の医薬組成物であって、
患者に抗痙攣作用を提供する、
患者の痙攣を治療および/または予防する、
患者のてんかん発作を治療および/または予防する、
患者の痙性を治療および/または予防する、
患者の感情障害を治療および/または予防する、
患者の双極性感情障害を治療および/または予防する、
患者の慢性頭痛を治療および/または予防する、
患者の群発性頭痛を治療および/または予防する、
患者の片頭痛を治療および/または予防する、
患者の静止不能症候群を治療および/または予防する、
患者の神経因性疼痛を治療および/または予防する、あるいは
患者の運動障害を治療および/または予防する、
ための治療の少なくとも一つに充分な治療有効量を含む医薬組成物。 - CNS活性を調節する方法であって
請求項1〜4のいずれか一つに記載のCNS活性化合物を患者に投与することを含む方法
。 - CNS活性化合物が医薬上許容できる担体に結合された、請求項9に記載の方法。
- CNS活性化合物の、患者のCNS活性を調節する治療有効量が患者に投与される請求項9に
記載の方法。 - 請求項11に記載の方法であって、
患者に抗痙攣作用を提供する、
患者の痙攣を治療および/または予防する、
患者の癲癇発作を治療および/または予防する、
患者の痙性を治療および/または予防する、
患者の感情障害を治療および/または予防する、
患者の双極性感情障害を治療および/または予防する、
患者の慢性頭痛を治療および/または予防する、
患者の群発性頭痛を治療および/または予防する、
患者の片頭痛を治療および/または予防する、
患者の静止不能症候群を治療および/または予防する、
患者の神経因性疼痛を治療および/または予防する、あるいは
患者の運動障害を治療および/または予防する、
治療のうちの少なくとも一つについて十分な治療有効量が患者に投与される請求項11に記載の方法。 - 請求項11に記載の方法であって、前記の治療有効量が不安、抑鬱、不眠、片頭痛、統合失調症、パーキンソン病、痙性、アルツハイマー病、双極性障害、慢性または神経因性疼痛、脳卒中、慢性神経変性疾患、ハンチントン病、脳損傷、脊髄損傷または癲癇重積状態の少なくとも1つの治療および/または予防に十分である方法。
- 請求項11に記載の方法であって、前記の治療有効量が化学的対応策として十分な方法。
- 請求項15に記載の方法であって、さらに、
塩基性溶液中で4−シアノフェノ−ルを還流しながら加熱する方法と、
β-ブチロラクトンを還流溶液へ添加する方法と、
該溶液を室温に冷却する方法と、
水およびジエチルエ―テルを添加して該溶液の二相混合液を調製する方法と、
形成後にジエチルエーテル相を除去する方法と、
形成後に水相にpH〜2のHCl溶液を添加して酸性化する方法と、
酸性化した水相をエチルアセテートで抽出する方法と、
エチルアセテート層を乾燥させ3−(4−シアノフェノキシ)酪酸を生成する方法と、
有機溶媒で3−(4−シアノフェノキシ)酪酸の溶液を調製する方法と、
塩化オキサリルで該溶液を処理して[3−(4−シアノフェノキシ)ブチリルクロライド]を得る方法と、
3−(4−シアノフェノキシ)ブチリルクロライド溶液へアンモニアガスを発泡により通す方法と、そして
該溶液から[3−(4−シアノフェノキシ)ブチルアミド]を入手する方法
を含む製造方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US3798608P | 2008-03-19 | 2008-03-19 | |
| US61/037,986 | 2008-03-19 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011500935A Division JP5746612B2 (ja) | 2008-03-19 | 2009-03-18 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017130627A Division JP2017214399A (ja) | 2008-03-19 | 2017-07-03 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2015166370A true JP2015166370A (ja) | 2015-09-24 |
Family
ID=43570200
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011500935A Active JP5746612B2 (ja) | 2008-03-19 | 2009-03-18 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
| JP2015095429A Pending JP2015166370A (ja) | 2008-03-19 | 2015-05-08 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
| JP2017130627A Pending JP2017214399A (ja) | 2008-03-19 | 2017-07-03 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
| JP2019211576A Pending JP2020055824A (ja) | 2008-03-19 | 2019-11-22 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011500935A Active JP5746612B2 (ja) | 2008-03-19 | 2009-03-18 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017130627A Pending JP2017214399A (ja) | 2008-03-19 | 2017-07-03 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
| JP2019211576A Pending JP2020055824A (ja) | 2008-03-19 | 2019-11-22 | 中枢神経系疾患および障害の治療に有効な新規化合物 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US9206143B2 (ja) |
| EP (1) | EP2268140B1 (ja) |
| JP (4) | JP5746612B2 (ja) |
| KR (2) | KR101672884B1 (ja) |
| CN (1) | CN102164488B (ja) |
| AU (1) | AU2009225647C1 (ja) |
| CA (1) | CA2718723C (ja) |
| IL (1) | IL208180B (ja) |
| RU (1) | RU2010142655A (ja) |
| WO (1) | WO2009117515A2 (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017214399A (ja) * | 2008-03-19 | 2017-12-07 | オーリムメッド・ファルマ・インコーポレーテッド | 中枢神経系疾患および障害の治療に有効な新規化合物 |
| US10793515B2 (en) | 2008-03-19 | 2020-10-06 | Aurimmed Pharma, Inc. | Compounds advantageous in the treatment of central nervous system diseases and disorders |
| JP2024521282A (ja) * | 2021-05-28 | 2024-05-31 | 天士力医薬集団股分有限公司 | 抗うつ・抗不安の置換桂皮アミド化合物 |
| US12486218B2 (en) | 2008-03-19 | 2025-12-02 | Aurimmed Pharma, Inc. | Compounds advantageous in the treatment of central nervous system diseases and disorders |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9212155B2 (en) | 2008-03-19 | 2015-12-15 | Aurimmed Pharma, Inc. | Compounds advantageous in the treatment of central nervous system diseases and disorders |
| WO2010043721A1 (en) | 2008-10-17 | 2010-04-22 | Oryzon Genomics, S.A. | Oxidase inhibitors and their use |
| WO2010084160A1 (en) | 2009-01-21 | 2010-07-29 | Oryzon Genomics S.A. | Phenylcyclopropylamine derivatives and their medical use |
| KR101736218B1 (ko) | 2009-09-25 | 2017-05-16 | 오리존 지노믹스 에스.에이. | 라이신 특이적 디메틸라아제-1 억제제 및 이의 용도 |
| WO2011042217A1 (en) | 2009-10-09 | 2011-04-14 | Oryzon Genomics S.A. | Substituted heteroaryl- and aryl- cyclopropylamine acetamides and their use |
| WO2011106105A2 (en) | 2010-02-24 | 2011-09-01 | Oryzon Genomics, S.A. | Inhibitors for antiviral use |
| WO2011106106A2 (en) | 2010-02-24 | 2011-09-01 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for diseases and disorders associated with hepadnaviridae |
| JP5868948B2 (ja) | 2010-04-19 | 2016-02-24 | オリゾン・ジェノミックス・ソシエダッド・アノニマOryzon Genomics S.A. | リジン特異的脱メチル化酵素1阻害薬およびその使用 |
| EP2598480B1 (en) | 2010-07-29 | 2019-04-24 | Oryzon Genomics, S.A. | Cyclopropylamine derivatives useful as lsd1 inhibitors |
| EP3375775A1 (en) | 2010-07-29 | 2018-09-19 | Oryzon Genomics, S.A. | Arylcyclopropylamine based demethylase inhibitors of lsd1 and their medical use |
| US9061966B2 (en) | 2010-10-08 | 2015-06-23 | Oryzon Genomics S.A. | Cyclopropylamine inhibitors of oxidases |
| WO2012072713A2 (en) | 2010-11-30 | 2012-06-07 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for diseases and disorders associated with flaviviridae |
| EP2712315B1 (en) | 2011-02-08 | 2021-11-24 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for myeloproliferative disorders |
| US9487512B2 (en) | 2011-10-20 | 2016-11-08 | Oryzon Genomics S.A. | (Hetero)aryl cyclopropylamine compounds as LSD1 inhibitors |
| IL264982B (en) | 2011-10-20 | 2022-08-01 | Oryzon Genomics Sa | Hetero(aryl)cyclopropylamine compounds as lsd1 inhibitors |
| US11806333B2 (en) * | 2017-11-16 | 2023-11-07 | University Of Houston System | Aryl-substituted acetamide and pyrrolidin-2-one derivatives and their use for the treatment of seizures |
| FI4122923T3 (fi) * | 2020-03-17 | 2025-11-12 | Sumitomo Pharma Co Ltd | Oksadiatsolijohdannainen |
| CN114249652A (zh) * | 2020-09-25 | 2022-03-29 | 天地恒一制药股份有限公司 | 苯酚衍生物及其在医药上的应用 |
Citations (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5049262A (ja) * | 1973-08-16 | 1975-05-01 | Thomae Gmbh Dr K | |
| JPS57181043A (en) * | 1981-04-06 | 1982-11-08 | Boots Co Ltd | Arylcyclobutylamine derivative as medicine and manufacture |
| WO1995009634A1 (en) * | 1993-10-07 | 1995-04-13 | The Du Pont Merck Pharmaceutical Company | Electrophilic peptide analogs as inhibitors of trypsin-like enzymes |
| US5463125A (en) * | 1991-09-06 | 1995-10-31 | Sandoval; Guillermo C. | Phenyl alcohol amides having anticonvulsant activity |
| WO1999041229A1 (es) * | 1998-02-11 | 1999-08-19 | Guillermo Carvajal Sandoval | Fenil alcohol amidas halogenadas (ligandos del receptor gabab) que presentan actividad anticonvulsionante |
| US6172262B1 (en) * | 1999-01-27 | 2001-01-09 | Wisconsin Alumni Research Foundation | Amphiphilic agents for membrane protein solubilization |
| JP2001525390A (ja) * | 1997-12-10 | 2001-12-11 | エヌピーエス ファーマシューティカルズ インコーポレーテッド | 抗痙攣薬および中枢神経系活性ビス(フルオロフェニル)アルキルアミド類 |
| JP2002528537A (ja) * | 1998-10-30 | 2002-09-03 | フアルマシア・エ・アツプジヨン・エツセ・ピー・アー | 2−アミノ−チアゾール誘導体類、それらの製造方法および抗癌剤としてのそれらの使用 |
| JP2003506364A (ja) * | 1999-07-30 | 2003-02-18 | ベーリンガー インゲルハイム ファーマシューティカルズ インコーポレイテッド | システインプロテアーゼインヒビターとして有益な新規スクシネート誘導体化合物 |
| JP2003160549A (ja) * | 2001-09-12 | 2003-06-03 | Mitsubishi Rayon Co Ltd | 光学活性β−アリールアミドの合成法 |
| WO2005085182A1 (es) * | 2004-03-03 | 2005-09-15 | Sergio Enrique Meza Toledo | Dl-hidroxibencenamidas que presentan actividad anticonvulsionante |
| JP2006501188A (ja) * | 2002-07-03 | 2006-01-12 | ハー・ルンドベック・アクティーゼルスカブ | Mch1アンタゴニストとしてのスピロ環式ピペリジンおよびその使用 |
| WO2006012603A2 (en) * | 2004-07-22 | 2006-02-02 | Nps Pharmaceuticals, Inc. | Analogs of isovaleramide, a pharmaceutical composition including the same, and a method of treating central nervous system conditions or diseases |
| JP2006515618A (ja) * | 2003-01-14 | 2006-06-01 | ハー・ルンドベック・アクティーゼルスカブ | 置換アルキルアミドピペリジン類 |
| US20060287397A1 (en) * | 2002-04-26 | 2006-12-21 | Meza Toledo Sergio E | Dl-hydroxy-alkyl-phenylamides having anticonvulsive activity |
| WO2007025144A1 (en) * | 2005-08-24 | 2007-03-01 | University Of Illinois - Chicago | 5-ht2c receptor agonists as anorectic agents |
| WO2007087585A1 (en) * | 2006-01-27 | 2007-08-02 | Bristol-Myers Squibb Company | Piperazinyl derivatives as modulators of chemokine receptor activity |
| JP2007530579A (ja) * | 2004-06-10 | 2007-11-01 | スリーエム イノベイティブ プロパティズ カンパニー | アミド置換イミダゾピリジン、イミダゾキノリン、およびイミダゾナフチリジン |
| WO2010054763A1 (de) * | 2008-11-14 | 2010-05-20 | Bayer Schering Pharma Aktiengesellschaft | Heterocyclisch substituierte aryl-verbindungen als hif-inhibitoren |
Family Cites Families (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5187157A (en) | 1987-06-05 | 1993-02-16 | Du Pont Merck Pharmaceutical Company | Peptide boronic acid inhibitors of trypsin-like proteases |
| EP0315574A3 (de) | 1987-11-05 | 1990-08-22 | Hoechst Aktiengesellschaft | Renin-Inhibitoren |
| IL94466A (en) | 1989-05-25 | 1995-01-24 | Erba Carlo Spa | Pharmaceutical preparations containing the history of A-amino carboxamide N-phenylalkyl are converted into such new compounds and their preparation |
| US5576187A (en) | 1993-09-28 | 1996-11-19 | Ohmicron Technology, Inc. | Standards for phosphorothioate insecticide immunoassays |
| US6589994B1 (en) | 1996-08-30 | 2003-07-08 | Nps Pharmaceuticals, Inc. | Treating a variety of pathological conditions, including spasticity and convulsions, by effecting a modulation of CNS activity with isovaleramide, isovaleric acid, or a related compound |
| US6200860B1 (en) | 1999-05-03 | 2001-03-13 | Taiwan Semiconductor Manufacturing Company | Process for preventing the reverse tunneling during programming in split gate flash |
| DE19931116A1 (de) * | 1999-07-06 | 2001-01-11 | Bayer Ag | Verfahren zur Herstellung von Phenethylaminen und neue chemische Verbindungen |
| US20010041700A1 (en) * | 1999-07-30 | 2001-11-15 | Younes Bekkali | Novel succinate derivative compounds useful as cysteine protease inhibitors |
| JP4517454B2 (ja) | 2000-06-01 | 2010-08-04 | 宇部興産株式会社 | 4−(1−フルオロエチル)チアゾール−5−カルボン酸アミド誘導体及び農園芸用の有害生物防除剤 |
| JP4378854B2 (ja) | 2000-06-05 | 2009-12-09 | 宇部興産株式会社 | 3−(1−フルオロエチル)−1−メチルピラゾール−4−カルボン酸アミド誘導体及び農園芸用の有害生物防除剤 |
| JP4378855B2 (ja) | 2000-06-05 | 2009-12-09 | 宇部興産株式会社 | 5−(1−フルオロエチル)−1−メチルピラゾール−4−カルボン酸アミド誘導体及び農園芸用の有害生物防除剤 |
| EP1451160B1 (en) | 2001-11-01 | 2010-01-13 | Icagen, Inc. | Pyrazole-amides for use in the treatment of pain |
| CA2474168A1 (en) * | 2002-02-01 | 2003-08-14 | Merck & Co., Inc. | 11-beta-hydroxysteroid dehydrogenase 1 inhibitors useful for the treatment of diabetes, obesity and dyslipidemia |
| US20040209858A1 (en) | 2002-10-22 | 2004-10-21 | Bennani Youssef L. | Cycloalkylamides and their therapeutic applications |
| CA2559863A1 (en) * | 2004-03-24 | 2005-10-13 | 3M Innovative Properties Company | Amide substituted imidazopyridines, imidazoquinolines, and imidazonaphthyridines |
| WO2006008193A1 (en) | 2004-07-23 | 2006-01-26 | Bayer Cropscience Sa | 4-pyridinylethylcarboxamide derivatives useful as fungicides |
| JP2008507494A (ja) | 2004-07-23 | 2008-03-13 | バイエル・クロツプサイエンス・エス・アー | 殺菌剤としての3−ピリジニルエチルカルボキサミド誘導体 |
| EP1792901A1 (en) | 2005-11-22 | 2007-06-06 | Bayer CropScience S.A. | N-(1-alkyl-2-phenylethyl)-carboxamide derivatives and use thereof as fungicides |
| EP1787981A1 (en) | 2005-11-22 | 2007-05-23 | Bayer CropScience S.A. | New N-phenethylcarboxamide derivatives |
| MX2008015246A (es) * | 2006-06-08 | 2008-12-17 | Syngenta Participations Ag | Derivados de n-(1-alquil-2-feniletil)-carboxamida y uso de los mismos como fungicidas. |
| US7727978B2 (en) * | 2006-08-24 | 2010-06-01 | Bristol-Myers Squibb Company | Cyclic 11-beta hydroxysteroid dehydrogenase type I inhibitors |
| US9212155B2 (en) | 2008-03-19 | 2015-12-15 | Aurimmed Pharma, Inc. | Compounds advantageous in the treatment of central nervous system diseases and disorders |
| SG188916A1 (en) | 2008-03-19 | 2013-04-30 | Aurimmed Pharma Inc | Novel compounds advantageous in the treatment of central nervous system diseases and disorders |
| US9206143B2 (en) | 2008-03-19 | 2015-12-08 | Aurimmed Pharma, Inc. | Compounds advantageous in the treatment of central nervous system diseases and disorders |
| EP2224045A1 (en) | 2009-02-27 | 2010-09-01 | Basf Se | Process for producing carbon nanofibres and/or carbon nanotubes |
-
2009
- 2009-03-18 US US12/922,068 patent/US9206143B2/en active Active
- 2009-03-18 WO PCT/US2009/037558 patent/WO2009117515A2/en not_active Ceased
- 2009-03-18 AU AU2009225647A patent/AU2009225647C1/en active Active
- 2009-03-18 KR KR1020107023275A patent/KR101672884B1/ko not_active Expired - Fee Related
- 2009-03-18 JP JP2011500935A patent/JP5746612B2/ja active Active
- 2009-03-18 EP EP09722677.3A patent/EP2268140B1/en active Active
- 2009-03-18 RU RU2010142655/04A patent/RU2010142655A/ru not_active Application Discontinuation
- 2009-03-18 CA CA2718723A patent/CA2718723C/en active Active
- 2009-03-18 CN CN200980117334.4A patent/CN102164488B/zh active Active
- 2009-03-18 KR KR1020167030471A patent/KR101922949B1/ko not_active Expired - Fee Related
-
2010
- 2010-09-16 IL IL208180A patent/IL208180B/en active IP Right Grant
-
2015
- 2015-05-08 JP JP2015095429A patent/JP2015166370A/ja active Pending
-
2017
- 2017-07-03 JP JP2017130627A patent/JP2017214399A/ja active Pending
-
2019
- 2019-11-22 JP JP2019211576A patent/JP2020055824A/ja active Pending
Patent Citations (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5049262A (ja) * | 1973-08-16 | 1975-05-01 | Thomae Gmbh Dr K | |
| JPS57181043A (en) * | 1981-04-06 | 1982-11-08 | Boots Co Ltd | Arylcyclobutylamine derivative as medicine and manufacture |
| US5463125A (en) * | 1991-09-06 | 1995-10-31 | Sandoval; Guillermo C. | Phenyl alcohol amides having anticonvulsant activity |
| WO1995009634A1 (en) * | 1993-10-07 | 1995-04-13 | The Du Pont Merck Pharmaceutical Company | Electrophilic peptide analogs as inhibitors of trypsin-like enzymes |
| JP2001525390A (ja) * | 1997-12-10 | 2001-12-11 | エヌピーエス ファーマシューティカルズ インコーポレーテッド | 抗痙攣薬および中枢神経系活性ビス(フルオロフェニル)アルキルアミド類 |
| WO1999041229A1 (es) * | 1998-02-11 | 1999-08-19 | Guillermo Carvajal Sandoval | Fenil alcohol amidas halogenadas (ligandos del receptor gabab) que presentan actividad anticonvulsionante |
| JP2002528537A (ja) * | 1998-10-30 | 2002-09-03 | フアルマシア・エ・アツプジヨン・エツセ・ピー・アー | 2−アミノ−チアゾール誘導体類、それらの製造方法および抗癌剤としてのそれらの使用 |
| US6172262B1 (en) * | 1999-01-27 | 2001-01-09 | Wisconsin Alumni Research Foundation | Amphiphilic agents for membrane protein solubilization |
| JP2003506364A (ja) * | 1999-07-30 | 2003-02-18 | ベーリンガー インゲルハイム ファーマシューティカルズ インコーポレイテッド | システインプロテアーゼインヒビターとして有益な新規スクシネート誘導体化合物 |
| JP2003160549A (ja) * | 2001-09-12 | 2003-06-03 | Mitsubishi Rayon Co Ltd | 光学活性β−アリールアミドの合成法 |
| US20060287397A1 (en) * | 2002-04-26 | 2006-12-21 | Meza Toledo Sergio E | Dl-hydroxy-alkyl-phenylamides having anticonvulsive activity |
| JP2006501188A (ja) * | 2002-07-03 | 2006-01-12 | ハー・ルンドベック・アクティーゼルスカブ | Mch1アンタゴニストとしてのスピロ環式ピペリジンおよびその使用 |
| JP2006515618A (ja) * | 2003-01-14 | 2006-06-01 | ハー・ルンドベック・アクティーゼルスカブ | 置換アルキルアミドピペリジン類 |
| WO2005085182A1 (es) * | 2004-03-03 | 2005-09-15 | Sergio Enrique Meza Toledo | Dl-hidroxibencenamidas que presentan actividad anticonvulsionante |
| JP2007530579A (ja) * | 2004-06-10 | 2007-11-01 | スリーエム イノベイティブ プロパティズ カンパニー | アミド置換イミダゾピリジン、イミダゾキノリン、およびイミダゾナフチリジン |
| WO2006012603A2 (en) * | 2004-07-22 | 2006-02-02 | Nps Pharmaceuticals, Inc. | Analogs of isovaleramide, a pharmaceutical composition including the same, and a method of treating central nervous system conditions or diseases |
| WO2007025144A1 (en) * | 2005-08-24 | 2007-03-01 | University Of Illinois - Chicago | 5-ht2c receptor agonists as anorectic agents |
| WO2007087585A1 (en) * | 2006-01-27 | 2007-08-02 | Bristol-Myers Squibb Company | Piperazinyl derivatives as modulators of chemokine receptor activity |
| WO2010054763A1 (de) * | 2008-11-14 | 2010-05-20 | Bayer Schering Pharma Aktiengesellschaft | Heterocyclisch substituierte aryl-verbindungen als hif-inhibitoren |
Non-Patent Citations (11)
| Title |
|---|
| BEHRENS, OTTO K. ET AL.: "Biosynthesis of penicillins. III. Preparation and evaluation of precursors for new penicillins", JOURNAL OF BIOLOGICAL CHEMISTRY, vol. 175, JPN6016013693, 1948, pages 771 - 92, ISSN: 0003297488 * |
| CHEM. ABSTR., vol. 82, JPN7016000936, 1975, pages 486 - 82, ISSN: 0003297480 * |
| CHEM. ABSTR., vol. 87, JPN7016000935, 1977, pages 597 - 87, ISSN: 0003297479 * |
| JOURNAL OF ORGANIC CHEMISTRY, vol. 61(14), JPN6016013689, 1996, pages 4542 - 4554, ISSN: 0003297482 * |
| JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, vol. 73, JPN6013048393, 1951, pages 5443 - 5444, ISSN: 0003297484 * |
| MULLER, ALEXANDER ET AL.: "Dimeric propenyl phenol ethers. XIII. On metanethole and its tetralin isomers", JOURNAL OF ORGANIC CHEMISTRY, vol. 16, JPN6016013690, 1951, pages 1003 - 24, ISSN: 0003297485 * |
| PAWLOWSKI, MICHAL ET AL.: "The Thorpe-Ingold effect in cyclic imides. Part III", HETEROCYCLES, vol. 71(8), JPN6016013692, 2007, pages 1743 - 1754, ISSN: 0003297487 * |
| RUECHARDT, CHRISTOPH; EICHLER, SIEGLINDE: "Radical rearrangements. IV. Additional relative migration rates ofsubstituted phenyl groups in the d", CHEMISCHE BERICHTE, vol. 95, JPN6016013691, 1962, pages 1921 - 42, ISSN: 0003297486 * |
| RYABUKHIN, SERGEY V. ET AL.: "One-pot synthesis of β-imidazolylpropionamides", TETRAHEDRON LETTERS, vol. 49(25), JPN6016013695, 2008, pages 3997 - 4002, ISSN: 0003297489 * |
| THE JOURNAL OF ORGANIC CHEMISTRY, vol. 66, JPN6013048392, 2001, pages 8944 - 8946, ISSN: 0003297483 * |
| WINTERNITZ, F.; MOUSSERON, M.; ROUZIER, G.: "Synthesis of polycyclic compounds. VII. Some arylcycloalkaneacetic acids", BULLETIN DE LA SOCIETE CHIMIQUE DE FRANCE, JPN6016013696, 1954, pages 316 - 20, ISSN: 0003297481 * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017214399A (ja) * | 2008-03-19 | 2017-12-07 | オーリムメッド・ファルマ・インコーポレーテッド | 中枢神経系疾患および障害の治療に有効な新規化合物 |
| US10793515B2 (en) | 2008-03-19 | 2020-10-06 | Aurimmed Pharma, Inc. | Compounds advantageous in the treatment of central nervous system diseases and disorders |
| US12486218B2 (en) | 2008-03-19 | 2025-12-02 | Aurimmed Pharma, Inc. | Compounds advantageous in the treatment of central nervous system diseases and disorders |
| JP2024521282A (ja) * | 2021-05-28 | 2024-05-31 | 天士力医薬集団股分有限公司 | 抗うつ・抗不安の置換桂皮アミド化合物 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR101672884B1 (ko) | 2016-11-04 |
| KR101922949B1 (ko) | 2018-11-28 |
| AU2009225647A2 (en) | 2010-12-23 |
| CA2718723C (en) | 2018-05-08 |
| EP2268140A4 (en) | 2012-03-21 |
| EP2268140A2 (en) | 2011-01-05 |
| JP2011529022A (ja) | 2011-12-01 |
| JP2020055824A (ja) | 2020-04-09 |
| WO2009117515A2 (en) | 2009-09-24 |
| WO2009117515A8 (en) | 2010-10-28 |
| KR20110025734A (ko) | 2011-03-11 |
| AU2009225647C1 (en) | 2015-11-19 |
| JP5746612B2 (ja) | 2015-07-08 |
| JP2017214399A (ja) | 2017-12-07 |
| AU2009225647B2 (en) | 2015-01-29 |
| EP2268140B1 (en) | 2020-11-11 |
| IL208180B (en) | 2020-07-30 |
| CN102164488A (zh) | 2011-08-24 |
| KR20160129112A (ko) | 2016-11-08 |
| CN102164488B (zh) | 2015-02-25 |
| CA2718723A1 (en) | 2009-09-24 |
| IL208180A0 (en) | 2010-12-30 |
| WO2009117515A3 (en) | 2010-03-04 |
| US9206143B2 (en) | 2015-12-08 |
| RU2010142655A (ru) | 2012-04-27 |
| AU2009225647A1 (en) | 2009-09-24 |
| US20110046138A1 (en) | 2011-02-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5746612B2 (ja) | 中枢神経系疾患および障害の治療に有効な新規化合物 | |
| US9212155B2 (en) | Compounds advantageous in the treatment of central nervous system diseases and disorders | |
| US9687459B2 (en) | Aminocyclobutane derivatives, method for preparing same and the use thereof as drugs | |
| JP2010519287A (ja) | α−ハロシクロプロピルカルボキシ化合物およびα−アルキルシクロプロピルカルボキシ化合物ならびにそれらの使用 | |
| CN104710327B (zh) | 有益于治疗中枢神经系统疾病和病症的化合物 | |
| EP1042275B1 (en) | Anticonvulsant and central nervous system-active bis(fluorophenyl)alkylamides | |
| EP1640359A2 (en) | Anticonvulsant and central nervous system-active bis(fluorophenyl)alkylamides | |
| JP2025510388A (ja) | ベンズアミドエナミノン誘導体及びその使用方法 | |
| HK1240927A1 (en) | Aminocyclobutane derivatives, method for preparing same and the use thereof as drugs | |
| HK1212968B (en) | Aminocyclobutane derivatives, method for preparing same and the use thereof as drugs | |
| MXPA00005543A (en) | Anticonvulsant and central nervous system-active bis(fluorophenyl)alkylamides |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20160317 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160412 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160712 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160912 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161012 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20170302 |