JP2011222494A - 蓄電装置 - Google Patents
蓄電装置 Download PDFInfo
- Publication number
- JP2011222494A JP2011222494A JP2011060302A JP2011060302A JP2011222494A JP 2011222494 A JP2011222494 A JP 2011222494A JP 2011060302 A JP2011060302 A JP 2011060302A JP 2011060302 A JP2011060302 A JP 2011060302A JP 2011222494 A JP2011222494 A JP 2011222494A
- Authority
- JP
- Japan
- Prior art keywords
- positive electrode
- active material
- lithium
- iron
- electrode active
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/58—Selection of substances as active materials, active masses, active liquids of inorganic compounds other than oxides or hydroxides, e.g. sulfides, selenides, tellurides, halogenides or LiCoFy; of polyanionic structures, e.g. phosphates, silicates or borates
- H01M4/5825—Oxygenated metallic salts or polyanionic structures, e.g. borates, phosphates, silicates, olivines
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/362—Composites
- H01M4/366—Composites as layered products
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/62—Selection of inactive substances as ingredients for active masses, e.g. binders, fillers
- H01M4/624—Electric conductive fillers
- H01M4/625—Carbon or graphite
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Composite Materials (AREA)
- Crystallography & Structural Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Battery Electrode And Active Subsutance (AREA)
- Secondary Cells (AREA)
Abstract
【解決手段】オリビン構造であって、構造式LiFexMe1−xPO4(Me=Mn,Ni,Co)(xは0より大きく1より小さい)で表され、且つ導電率が、1×10−9S/cm以上6×10−9S/cm以下である正極活物質正極に有する蓄電装置、または、正極集電体と、該正極活物質を正極集電体上に有する正極と、正極と電解質を介して対向する負極とを有する蓄電装置に関する。また、正極集電体と、当該正極活物質を当該正極集電体上に有する正極と、当該正極と電解質を介して対向する負極とを有し、放電容量が150mAh/g以上であり、且つエネルギー密度が500mWh/gより大きい蓄電装置に関する。
【選択図】図1
Description
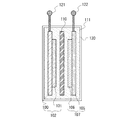
101 正極活物質層
102 正極
105 負極集電体
106 負極活物質層
107 負極
110 セパレータ
111 電解液
120 筐体
121 電極
122 電極
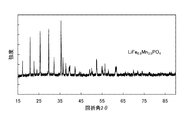
201 曲線
203 曲線
205 曲線
207 曲線
209 曲線
211 曲線
213 曲線
215 曲線
Claims (9)
- オリビン構造であって、構造式LiFexMe1−xPO4(Me=Mn,Ni,Co)(xは0より大きく1より小さい)で表され、且つ導電率が、1×10−9S/cm以上6×10−9S/cm以下である正極活物質を正極に有することを特徴とする蓄電装置。
- 正極集電体と、
オリビン構造であって、構造式LiFexMe1−xPO4(Me=Mn,Ni,Co)(xは0より大きく1より小さい)で表され、且つ導電率が1×10−9S/cm以上6×10−9S/cm以下である正極活物質を前記正極集電体上に有する正極と、
前記正極と電解質を介して対向する負極と、
を有することを特徴とする蓄電装置。 - 請求項1又は請求項2において、
前記正極活物質は、放電容量が、150mAh/g以上であり、かつ、エネルギー密度が、550mWh/g以上であることを特徴する蓄電装置。 - 正極集電体と、
オリビン構造であって、構造式LiFexMe1−xPO4(Me=Mn,Ni,Co)(xは0より大きく1より小さい)で表される正極活物質を前記正極集電体上に有する正極と、
前記正極と電解質を介して対向する負極と、
を有し、
放電容量が150mAh/g以上であり、且つエネルギー密度が500mWh/gより大きいことを特徴とする蓄電装置。 - 正極集電体と、
オリビン構造であって、構造式LiFexMe1−xPO4(Me=Mn,Ni,Co)(xは0より大きく1より小さい)で表される正極活物質を前記正極集電体上に有する正極と、
前記正極と電解質を介して対向する負極と、
を有し、
放電容量が150mAh/g以上であり、且つエネルギー密度が550mWh/g以上であることを特徴とする蓄電装置。 - 請求項1乃至請求項5のいずれか一項において、
前記正極活物質は複数の粒子で形成され、前記粒子の粒径は、10nm以上100nm以下であることを特徴とする蓄電装置。 - 請求項6において、
前記粒子は炭素層で覆われ、前記炭素層の厚さは0より大きく100nm以下であることを特徴とする蓄電装置。 - 請求項2乃至請求項7のいずれか一項において、
前記負極は、黒鉛、シリコン、アルミニウムのうち、いずれか1つ以上を含むことを特徴とする蓄電装置。 - 請求項2乃至請求項8のいずれか一項において、
前記電解質は、リチウムイオンを含む電解液であることを特徴とする蓄電装置。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011060302A JP2011222494A (ja) | 2010-03-26 | 2011-03-18 | 蓄電装置 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2010073727 | 2010-03-26 | ||
| JP2010073404 | 2010-03-26 | ||
| JP2010073404 | 2010-03-26 | ||
| JP2010073727 | 2010-03-26 | ||
| JP2011060302A JP2011222494A (ja) | 2010-03-26 | 2011-03-18 | 蓄電装置 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015099202A Division JP6050429B2 (ja) | 2010-03-26 | 2015-05-14 | オリビン型リン酸鉄化合物の作製方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2011222494A true JP2011222494A (ja) | 2011-11-04 |
| JP2011222494A5 JP2011222494A5 (ja) | 2014-04-17 |
Family
ID=44656857
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011060302A Withdrawn JP2011222494A (ja) | 2010-03-26 | 2011-03-18 | 蓄電装置 |
| JP2015099202A Expired - Fee Related JP6050429B2 (ja) | 2010-03-26 | 2015-05-14 | オリビン型リン酸鉄化合物の作製方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015099202A Expired - Fee Related JP6050429B2 (ja) | 2010-03-26 | 2015-05-14 | オリビン型リン酸鉄化合物の作製方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20110236752A1 (ja) |
| JP (2) | JP2011222494A (ja) |
| TW (1) | TWI555262B (ja) |
| WO (1) | WO2011118350A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9577261B2 (en) | 2011-03-18 | 2017-02-21 | Semiconductor Energy Laboratory Co., Ltd. | Lithium ion secondary battery and method for manufacturing the same |
| US20130224581A1 (en) | 2011-08-31 | 2013-08-29 | Semiconductor Energy Laboratory Co., Ltd. | Negative electrode of power storage device and power storage device |
| US10298043B2 (en) | 2011-12-23 | 2019-05-21 | Semiconductor Energy Laboratory Co., Ltd. | Method for charging lithium ion secondary battery and battery charger |
| JP5813800B2 (ja) | 2013-03-26 | 2015-11-17 | 株式会社東芝 | 非水電解質電池および電池パック |
| US10483526B2 (en) | 2013-03-26 | 2019-11-19 | Kabushiki Kaisha Toshiba | Positive electrode active material, nonaqueous electrolyte battery, and battery pack |
| JP6079696B2 (ja) * | 2014-05-19 | 2017-02-15 | トヨタ自動車株式会社 | 非水電解液二次電池 |
| US9865871B2 (en) | 2014-12-26 | 2018-01-09 | Semiconductor Energy Laboratory Co., Ltd. | Silicon oxide and storage battery |
| CN107978743B (zh) * | 2017-11-20 | 2020-07-24 | 中南大学 | 一种钠离子电池正极材料及其制备方法、钠离子电池 |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002027824A1 (fr) * | 2000-09-26 | 2002-04-04 | HYDRO-QUéBEC | Procédé de synthèse de matériau à base de lixm1-ym'y(xo4)n |
| JP2003203628A (ja) * | 2001-12-28 | 2003-07-18 | Sanyo Electric Co Ltd | 非水電解質電池及びその製造方法 |
| WO2007030816A2 (en) * | 2005-09-09 | 2007-03-15 | A123 Systems, Inc. | Lithium secondary cell with high charge and discharge rate capability and low impedance growth |
| WO2008077448A1 (en) * | 2006-12-22 | 2008-07-03 | Umicore | SYNTHESIS OF CRYSTALLINE NANOMETRIC LiFeMPO4 |
| WO2008113570A1 (en) * | 2007-03-19 | 2008-09-25 | Umicore | Room temperature single phase li insertion/extraction material for use in li-based battery |
| WO2009009758A2 (en) * | 2007-07-12 | 2009-01-15 | A123 Systems, Inc. | Multifunctional mixed metal olivines for lithium ion batteries |
| JP2009087933A (ja) * | 2007-09-11 | 2009-04-23 | Nagaoka Univ Of Technology | リチウムイオン二次電池用正極材料およびその製造方法 |
| JP2009110967A (ja) * | 1996-04-23 | 2009-05-21 | Board Of Regents Univ Of Texas System | 2次(再充電)リチウム電池用正極材料 |
| WO2009144600A2 (en) * | 2008-04-14 | 2009-12-03 | High Power Lithium S.A. | Lithium manganese phosphate/carbon nanocomposites as cathode active materials for secondary lithium batteries |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH1125983A (ja) * | 1997-07-04 | 1999-01-29 | Japan Storage Battery Co Ltd | リチウム電池用活物質 |
| US6528033B1 (en) * | 2000-01-18 | 2003-03-04 | Valence Technology, Inc. | Method of making lithium-containing materials |
| JP4491949B2 (ja) * | 2000-10-06 | 2010-06-30 | ソニー株式会社 | 正極活物質の製造方法及び非水電解質電池の製造方法 |
| EP1603177B1 (en) * | 2003-01-31 | 2015-07-22 | Mitsui Engineering and Shipbuilding Co, Ltd. | Positive electrode material for a secondary battery and process for producing the same |
| JP4225859B2 (ja) * | 2003-07-29 | 2009-02-18 | 日本化学工業株式会社 | Mn原子を含有するリチウム鉄リン系複合酸化物炭素複合体の製造方法 |
| JP4794833B2 (ja) * | 2004-07-21 | 2011-10-19 | 日本コークス工業株式会社 | リチウムイオン二次電池用正極材料、その製造方法、及びリチウムイオン二次電池 |
| JP5344452B2 (ja) * | 2005-09-21 | 2013-11-20 | 関東電化工業株式会社 | 正極活物質及びその製造方法並びに正極活物質を含む正極を有する非水電解質電池 |
| JP4691711B2 (ja) * | 2006-03-20 | 2011-06-01 | 独立行政法人産業技術総合研究所 | リチウムマンガン系複合酸化物およびその製造方法 |
| CA2566906A1 (en) * | 2006-10-30 | 2008-04-30 | Nathalie Ravet | Carbon-coated lifepo4 storage and handling |
| US7824802B2 (en) * | 2007-01-17 | 2010-11-02 | The United States Of America As Represented By The Secretary Of The Army | Method of preparing a composite cathode active material for rechargeable electrochemical cell |
| JP4983356B2 (ja) * | 2007-04-10 | 2012-07-25 | 株式会社豊田中央研究所 | 水系リチウム二次電池 |
| JP2009129179A (ja) * | 2007-11-22 | 2009-06-11 | Toshiba Corp | プログラム並列化支援装置およびプログラム並列化支援方法 |
| EP2065887A1 (en) * | 2007-11-30 | 2009-06-03 | Hitachi Global Storage Technologies Netherlands B.V. | Method for manufacturing magnetic disk unit |
| JP4662183B2 (ja) * | 2008-04-16 | 2011-03-30 | カシオ計算機株式会社 | 光源装置及びプロジェクタ |
| JP5436896B2 (ja) * | 2009-03-17 | 2014-03-05 | 日本化学工業株式会社 | リチウムリン系複合酸化物炭素複合体、その製造方法、リチウム二次電池用正極活物質及びリチウム二次電池 |
| JP5287593B2 (ja) * | 2009-08-12 | 2013-09-11 | ソニー株式会社 | 正極活物質の製造方法。 |
| JP2011076820A (ja) * | 2009-09-30 | 2011-04-14 | Hitachi Vehicle Energy Ltd | リチウム二次電池及びリチウム二次電池用正極 |
-
2011
- 2011-02-24 WO PCT/JP2011/054834 patent/WO2011118350A1/en active Application Filing
- 2011-03-18 JP JP2011060302A patent/JP2011222494A/ja not_active Withdrawn
- 2011-03-21 US US13/052,746 patent/US20110236752A1/en not_active Abandoned
- 2011-03-24 TW TW100110175A patent/TWI555262B/zh not_active IP Right Cessation
-
2015
- 2015-05-14 JP JP2015099202A patent/JP6050429B2/ja not_active Expired - Fee Related
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009110967A (ja) * | 1996-04-23 | 2009-05-21 | Board Of Regents Univ Of Texas System | 2次(再充電)リチウム電池用正極材料 |
| WO2002027824A1 (fr) * | 2000-09-26 | 2002-04-04 | HYDRO-QUéBEC | Procédé de synthèse de matériau à base de lixm1-ym'y(xo4)n |
| JP2003203628A (ja) * | 2001-12-28 | 2003-07-18 | Sanyo Electric Co Ltd | 非水電解質電池及びその製造方法 |
| WO2007030816A2 (en) * | 2005-09-09 | 2007-03-15 | A123 Systems, Inc. | Lithium secondary cell with high charge and discharge rate capability and low impedance growth |
| WO2008077448A1 (en) * | 2006-12-22 | 2008-07-03 | Umicore | SYNTHESIS OF CRYSTALLINE NANOMETRIC LiFeMPO4 |
| WO2008113570A1 (en) * | 2007-03-19 | 2008-09-25 | Umicore | Room temperature single phase li insertion/extraction material for use in li-based battery |
| WO2009009758A2 (en) * | 2007-07-12 | 2009-01-15 | A123 Systems, Inc. | Multifunctional mixed metal olivines for lithium ion batteries |
| JP2009087933A (ja) * | 2007-09-11 | 2009-04-23 | Nagaoka Univ Of Technology | リチウムイオン二次電池用正極材料およびその製造方法 |
| WO2009144600A2 (en) * | 2008-04-14 | 2009-12-03 | High Power Lithium S.A. | Lithium manganese phosphate/carbon nanocomposites as cathode active materials for secondary lithium batteries |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6050429B2 (ja) | 2016-12-21 |
| TW201203670A (en) | 2012-01-16 |
| US20110236752A1 (en) | 2011-09-29 |
| JP2015178451A (ja) | 2015-10-08 |
| WO2011118350A1 (en) | 2011-09-29 |
| TWI555262B (zh) | 2016-10-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7282838B2 (ja) | 蓄電装置 | |
| JP6290312B2 (ja) | リチウム二次電池用正極の作製方法 | |
| JP6050429B2 (ja) | オリビン型リン酸鉄化合物の作製方法 | |
| JP6836612B2 (ja) | リン酸マンガンリチウムの作製方法 | |
| JP5155498B2 (ja) | リチウム二次電池用正極活物質の製造方法 | |
| JP6378718B2 (ja) | 蓄電装置用正極活物質の作製方法 | |
| JP2011216477A (ja) | 蓄電装置及びその作製方法 | |
| JP2021193674A (ja) | 蓄電装置の製造方法 | |
| JP6296682B2 (ja) | 正極活物質およびリチウム2次電池 | |
| JP2012234833A (ja) | リチウムイオン電池およびその製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140304 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140304 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20141126 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141224 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150414 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20150522 |